Worminfecties
Kernboodschappen
Naar Samenvatting ›- Deze richtlijn behandelt de diagnostiek en het beleid bij enterobiasis (‘wormpjes’), spoel-, zweep- en lintwormen en geeft uitleg over honden- en kattenspoelwormen en de in Nederland meest voorkomende importworminfecties.
- De plakbandtest heeft voor het aantonen van enterobiasis de voorkeur boven het insturen van een fecesmonster.
- Stuur de worm of -delen op als er onzekerheid bestaat bij determinatie: regelmatig treedt verwarring op tussen spoel- of zweepwormen en bijvoorbeeld voedseldelen of aardwormen.
- Stuur bij het vermoeden van een lintworm altijd de worm(delen) (of feces) op om vast te stellen dat het de onschuldige runderlintworm betreft en niet de zeer zeldzame maar gevaarlijke varkenslintworm.
- Bij enterobiasis zijn wormeitjes direct besmettelijk voor huisgenoten. Geef daarom hygiënische adviezen. Bij spoel-, zweep- en runderlintwormen zijn hygiënische adviezen niet nodig.
- Omdat bij enterobiasis de infectie zonder herbesmetting na 4 tot 6 weken verdwijnt, kunnen patiënten met hygiënische maatregelen het natuurlijk herstel afwachten.
- Als er 1 persoon in een gezin klachten heeft van enterobiasis, hoeven andere gezinsleden niet te worden behandeld.
Inleiding
Naar Samenvatting ›Scope
Naar Samenvatting ›- Richtlijnen voor endemische infecties met Enterobius vermicularis (‘wormpjes’), spoel-, zweep- en lintwormen (zie tabel 1)
- Infecties met honden- en kattenspoelwormen
- Importworminfecties
Wormen worden ingedeeld in rondwormen (nematoden) en platwormen (platyhelminthes). Platwormen worden onderverdeeld in lintwormen (cestoden) en zuigwormen of botten (trematoden). Bij nematoden wordt gesproken over darmnematoden als het volwassen stadium van de worm bij de mens in de darm voorkomt. Deze benaming kan tot verwarring leiden, omdat sommige darmnematoden ook een fase buiten de darm doormaken, waarbij weefselinvasie klachten kan geven. Het spreken van darmnematoden heeft voor de huisarts geen praktische waarde. Daarom wordt deze benaming hier verder niet gebruikt.
Nematoden
Nematoden die alleen in de darm leven, zijn Enterobius vermicularis (oude naam: aarsmaden of oxyuren) en worden ook wel ‘wormpjes’ genoemd, en zweepwormen (Trichuris trichiura).
Een nematode die als volwassen vorm in de darm voorkomt, maar ook een fase met weefselinvasie kent, is de spoelworm (Ascaris lumbricoides en Ascaris suum, de laatste wordt ook wel varkensspoelworm genoemd).
Andere nematoden die als volwassen vorm in de darm voorkomen en ook een fase met weefselinvasie kennen, zijn mijnwormen (Ancylostoma duodenale en Necator americanus) en Strongyloides stercoralis (zie detail 'Strongyloides stercoralis' bij Importwormen). Deze infecties komen in Nederland alleen voor als importziekte.
Ook de haringworm (Anisakis spp.) is een nematode, maar wordt in Nederland niet (of nauwelijks) meer gevonden vanwege verplichte preventieve maatregelen die humane besmetting voorkomen: vers gevangen haring wordt sinds 1968 direct na de vangst gedurende 24 uur ingevroren. Menselijke besmetting met haringworm komt daardoor in Nederland niet of nauwelijks voor. Daarentegen wordt dit nog wel gezien in landen waar rauwe, niet ingevroren vis wordt geconsumeerd.
Nematoden die bij de mens niet als volwassen vorm in de darm voorkomen zijn de hondenspoelworm (Toxocara canis) en de kattenspoelworm (Toxocara cati), en importziekten zoals lymfatische filariasis (Wuchereria bancrofti en Brugia species), rivierblindheid (Onchocerca volvulus), loiasis (Loa loa), trichinose of trichinellosis (Trichinella spiralis) en Dracunculus medinensis (Guineaworm). Ook de cutane larva migrans (creeping eruption) is een importziekte die vaak veroorzaakt wordt door mijnwormen van honden of katten (Ancylostoma braziliense of Ancylostoma caninum), ook wel kruipworm genoemd.
Cestoden
Hieronder vallen de runderlintworm (Taenia saginata), de varkenslintworm (Taenia solium), de brede vissenlintworm (Diphyllobothrium latum), de hondenlintworm (Echinococcus granulosus), de vossenlintworm (Echinococcus multilocularis) en de dwerglintworm (Hymenolepis nana).
Trematoden
Leverbotten worden door voedsel overgedragen, zoals Fasciola hepatica, Fasciola gigantica, Opisthorchis viverrini, Opisthorchus felineus en Clonorchis sinensis of dringen door de huid, zoals Schistosoma. De in Europa voorkomende infectie met leverbot (Fasciola hepatica) is in Nederland erg zeldzaam. Schistosomiasis (oude naam: bilharzia) is een importziekte.
Ingangsklachten bij endemische worminfecties
Naar Samenvatting ›- Wormen of wormdelen in de ontlasting/onderbroek
- Jeuk perianaal of pervulvair (bij enterobiasis)
Achtergronden
Naar Samenvatting ›Epidemiologie
Naar Samenvatting ›- De incidentie van wormen/oxyuren/andere parasieten (ICPC-code D22) in de huisartsenpraktijk is 2,1 per 1000 patiëntjaren.
- De prevalentie is 2,0 per 1000 patiëntjaren.
- Deze gegevens zijn niet uitgesplitst naar soort parasiet, zodat ze niet inzichtelijk maken hoe vaak uiteenlopende worminfecties voorkomen. Uit ervaring is bekend dat het vooral om enterobiasis gaat.
Het betreft NIVEL-cijfers over 2017 (www.nivel.nl/nl/NZR/incidenties-en-prevalenties).
De in de ICPC-codes D22 en D22.01 gebruikte namen ‘oxyuren’ en ‘oxyuriasis’ zijn verouderd. De werkgroep heeft gevraagd de naam ‘oxyuren’ in de code D22 te laten vervallen en de naam ‘oxyuriasis’ in de code D22.01 te wijzigen in ‘enterobiasis’.
Klinisch beeld en beloop
Naar Samenvatting ›Enterobius vermicularis
Naar Samenvatting ›De mens is de enige gastheer voor de ‘wormpjes’ (Enterobius vermicularis).
Wormkenmerken
Naar Samenvatting ›Wormpjes zijn klein en bleekgeel/wit. Het mannetje is 2 tot 5 mm lang en 0,1-0,2 mm dik, het vrouwtje 8 tot 13 mm lang en tot 0,5 mm dik. Afzonderlijke eitjes zijn alleen met een microscoop te zien.
Besmetting
Naar Samenvatting ›Ingeslikte eitjes rijpen in het duodenum en de larven verplaatsen zich naar het coecum of de appendix, waar zij zich aan de darmwand hechten en zich ontwikkelen tot volwassen wormen. Na bevruchting door het mannetje verplaatst het vrouwtje zich (’s nachts) naar de anus en het perineum, waar de kleverige eitjes worden gelegd. Dit veroorzaakt de nachtelijke, soms heftige, jeuk. Daarna blijft er van het vrouwtje slechts een dun transparant velletje over dat moeilijk meer te herkennen is als wormpje.
In de eitjes ontwikkelen zich binnen enkele uren infectieuze larven. Onwillekeurig wordt er gekrabd en via de handen kan herbesmetting plaatsvinden. De eitjes worden ook via vingers en de lucht verspreid (deurknoppen, speelgoed, beddengoed) en kunnen zo anderen besmetten. De eitjes kunnen buiten het lichaam lang besmettelijk blijven.
Klachten en jeuk
Naar Samenvatting ›De meeste patiënten hebben geen klachten, maar soms zien zij wormpjes of is er jeuk. Bij meisjes kan vulvitis of vaginitis met afscheiding ontstaan.
Een relatie tussen besmetting met E. vermicularis (Engels: pin- of seatworm) en gewichtsverlies is niet goed aangetoond. Soms kunnen deze wormpjes in de appendix aanleiding geven tot een beeld van appendicitis acuta. Zelden trekken de wormen via de uterus tot in de buikholte en ontstaan eosinofiele granulomen met pijn onder in de buik. In handboeken en overzichtsartikelen wordt vermeld dat jeuk niet alleen rond de anus, maar ook rond de vagina gelokaliseerd kan zijn en soms een oorzaak van vulvovaginitis kan zijn.
Diagnostiek
Naar Samenvatting ›Omdat de eitjes zeer onregelmatig in de feces verdeeld zijn, wordt bij fecesonderzoek een infectie makkelijk gemist. Onderzoek naar eitjes op de plaats waar zij worden afgezet (de plakbandtest) is veel betrouwbaarder als methode om een infectie vast te stellen.
Beloop
Naar Samenvatting ›Zonder herbesmetting verdwijnt de infectie na 4 tot 6 weken meestal vanzelf, omdat de worm geen langere levensduur heeft. Soms treedt in gezin, school of crèche geregeld herbesmetting op en is de infectie moeilijk uitroeibaar.
Spoelwormen
Naar Samenvatting ›De mens is de enige gastheer voor de (mensen)spoelworm (Ascaris lumbricoides). Bij dieren worden ook spoelwormen gevonden; bij het varken worden deze aangeduid als Ascaris suum. Recent uitgevoerd moleculair onderzoek laat zien dat bepaalde genotypen van Ascaris suum ook de mens kunnen infecteren. Morfologisch zijn Ascaris lumbricoides en Ascaris suum niet van elkaar te onderscheiden. Het onderscheid heeft geen consequentie voor de medicamenteuze therapie.
Uit twee Nederlandse crossectionele onderzoeken in 1995/1996 en in 2006/2007 naar de seroprevalentie van toxocara en ascaris bij de mens bleek dat de toxocara seroprevalentie significant verminderde van 10,7% (n = 1159) naar 8,0% (n = 3683) en de ascaris seroprevalentie significant toenam van 30,4% (n = 1159) naar 41,6 (n = 3675). De auteurs vermoeden dat de toxocaraseroprevalentieafname komt door toegenomen huisdierhygiëne en de ascarisseroprevalentietoename door een toegenomen blootstelling aan met besmette varkenspoep bewerkte grond. De discrepantie tussen het hoge percentage seropositieven en de zeldzaamheid van patiënten die klachten hebben van een besmetting doet vermoeden dat de meeste mensen kennelijk geen klachten hebben van deze infecties.
Wormkenmerken
Naar Samenvatting ›Het mannetje is 10-30 cm lang en 2 tot 4 mm dik, het vrouwtje is 20-40 cm lang en 2 tot 6 mm dik. Beide zijn enigszins roze tot crèmewit van kleur. Eitjes zijn alleen met een microscoop te zien.
Besmetting
Naar Samenvatting ›Infectie vindt plaats door orale opname van infectieuze eitjes. Die komen in het maag-darmkanaal uit, waarna de larven door de darmwand dringen. Zij migreren vervolgens via lever of hart naar de longen, worden opgehoest en dan opnieuw ingeslikt.
De larven ontwikkelen zich in het maag-darmkanaal tot geslachtrijpe wormen ongeveer 10 weken na het inslikken van de eitjes. De wormen leven ongeveer 1 jaar en produceren (zeer veel) eitjes, die met de ontlasting worden uitgescheiden. De eitjes rijpen 1 maand in de grond en worden daarna pas infectieus. Besmette varkens scheiden grote aantallen eitjes uit die jaren in de grond kunnen overleven.
De mens wordt besmet via grondcontact (of compost) of via voedsel (groente of fruit) dat tijdens de teelt is besmet met uitwerpselen (van mens of varken). Besmetting door direct feco-oraal contact (van mens naar mens of van varken naar mens) is daarom niet mogelijk. De kans op een besmetting van de mens in Nederland door Ascaris lumbricoides is klein door goede rioleringsvoorzieningen, waardoor er weinig kans is dat eitjes in het milieu komen. De kans op besmetting van de mens met Ascaris suum is mogelijk groter, omdat veel varkens daarmee besmet zijn en varkensfeces makkelijker in het milieu komt.
Klachten
Naar Samenvatting ›In Nederland is bij besmetting de hoeveelheid eitjes vaak klein en zal het aantal wormen in de darm laag zijn, waardoor er meestal geen klachten zijn. Als de infectie ontdekt wordt, zal dit vaak zijn door het zien van een worm.
Bij langdurig bestaande zwaardere infecties van de darm kan groeivertraging, vitamine-A-malabsorptie, lactose-intolerantie en darmobstructie optreden. Bij besmetting met veel larven kan bij longmigratie een pneumonie ontstaan met forse eosinofilie (löfflersyndroom). Behandeling daarvan vindt in (overleg met) de tweede lijn plaats.
De wormen hebben de neiging om kleine openingen op te zoeken (appendix, ductus choledochus) en dit kan leiden tot een ontsteking van die organen. Geprikkelde wormen (door bijvoorbeeld koorts of anthelminthicagebruik) kunnen gaan zwerven en in uitzonderingsgevallen via mond, neus of anus naar buiten komen. Zelden perforeert de worm de darmwand, en dan vooral langs verse operatienaden.
Uit twee Nederlandse crossectionele onderzoeken in 1995/1996 en in 2006/2007 naar de seroprevalentie van toxocara en ascaris bij de mens bleek dat de toxocara seroprevalentie significant verminderde van 10,7% (n = 1159) naar 8,0% (n = 3683) en de ascaris seroprevalentie significant toenam van 30,4% (n = 1159) naar 41,6 (n = 3675). De auteurs vermoeden dat de toxocaraseroprevalentieafname komt door toegenomen huisdierhygiëne en de ascarisseroprevalentietoename door een toegenomen blootstelling aan met besmette varkenspoep bewerkte grond. De discrepantie tussen het hoge percentage seropositieven en de zeldzaamheid van patiënten die klachten hebben van een besmetting doet vermoeden dat de meeste mensen kennelijk geen klachten hebben van deze infecties.
Zweepwormen
Naar Samenvatting ›De mens is de enige gastheer voor de zweepwormen (Trichuris trichiura).
Wormkenmerken
Naar Samenvatting ›Zweepwormen zijn lichtgele/witte wormen en 3 tot 5 cm lang. Het voorste deel is dun, het achterste deel dikker. Eitjes zijn alleen met een microscoop te zien.
Besmetting
Naar Samenvatting ›Besmette mensen scheiden eitjes uit in hun feces. Die eitjes moeten ongeveer 3 weken in de grond rijpen voordat ze infectieus worden. De parasiet kan daarom niet direct van mens tot mens worden overgedragen.
Mensen raken besmet doordat ze na grondcontact infectieuze eitjes inslikken of besmette rauwe groenten eten. Uit de eitjes komen in de darmen larven vrij die zich aan de wand van de dikke darm bevestigen en in ongeveer 12 weken uitgroeien tot volwassen wormen. De dunne kop zit in de darmwand en zuigt weinig bloed. Het dikkere achterlijf bungelt (als het handvat van een zweep) in het lumen van de darm. Zweepwormen worden enkele jaren oud.
Klachten
Naar Samenvatting ›Infecties worden ontdekt doordat de patiënt een worm ziet, maar geven verder zelden klachten. Bij infectie met grote aantallen wormen kan een colitisbeeld, anemie of rectumprolaps voorkomen.
Lintwormen
Naar Samenvatting ›De mens is de enige eindgastheer van de runderlintworm (Taenia saginata).
Wormkenmerken
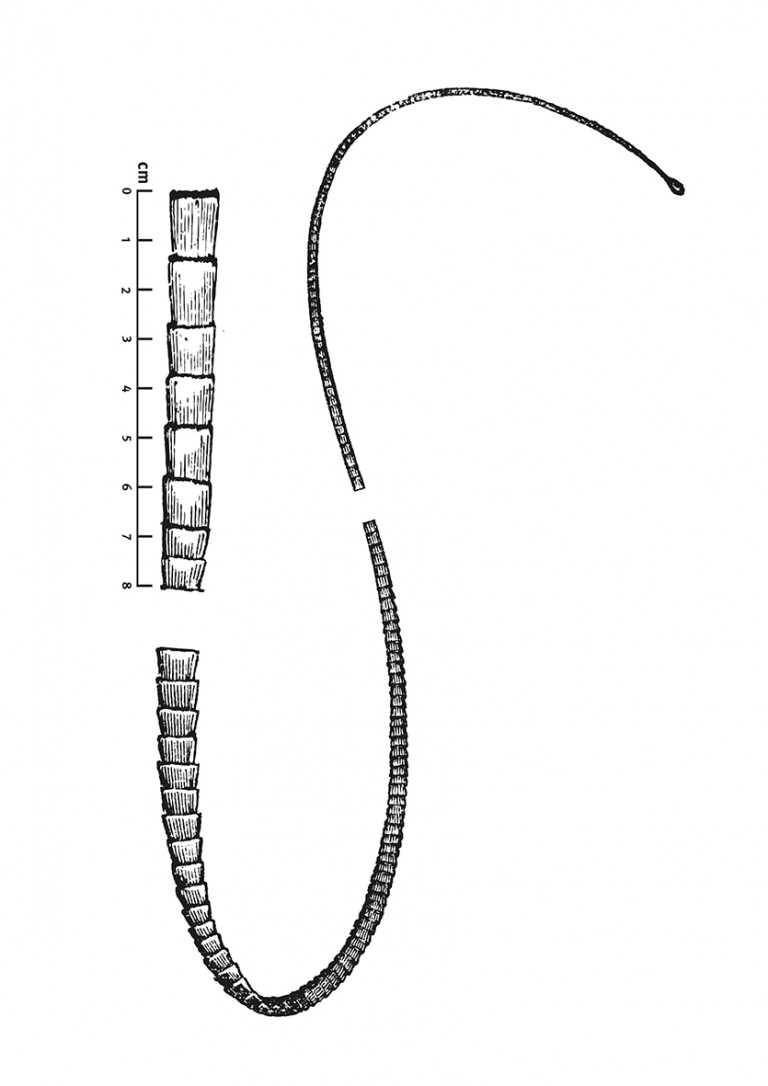
Naar Samenvatting ›Deze worm bestaat uit platte segmenten (proglottiden of geledingen), en heeft een lengte variërend van enkele millimeters tot enkele (soms 12) meters. De kop (scolex) is ongeveer 2 mm groot. De segmenten daarachter kunnen veel breder worden. Een lintwormsegment is rechthoekig van vorm, kan 12-20 mm lang zijn en is lichtgeel van kleur.
Besmetting
Naar Samenvatting ›Besmetting vindt plaats door het eten van rauw of onvoldoende verhit rundvlees (gehakt, filet americain) waarin zich cysten gevuld met de onrijpe lintwormkop bevinden. De kop hecht zich aan het slijmvlies van de dunne darm en ontwikkelt zich in ongeveer 3 maanden tot volwassen lintworm. Een lintworm kan 25 jaar oud worden. Meestal is de mens maar met 1 lintworm besmet. Dagelijks worden proglottiden (stukjes uterus) gevuld met eitjes afgestoten die met de feces worden uitgescheiden. De proglottide zet microscopisch kleine eitjes af op de huid rond de anus of desintegreert, waarna de eitjes vrijkomen. In de grond kunnen ze jarenlang infectieus blijven.
De runderlintworm kan niet van mens tot mens worden overgedragen, omdat de eitjes zich alleen bij de tussengastheer, het rund, ontwikkelen. Runderen nemen de eitjes oraal op, waarna deze in de maag uitkomen en de vrijgekomen larven door de darmwand migreren. De larven kunnen (alleen in het rund) in spierweefsel of in andere organen een cyste-achtige structuur van ongeveer 8 x 5 mm groot vormen (cysticercus of blaaswormstadium), waarin zich een onrijpe lintwormkop bevindt. De cysten kunnen jaren overleven.
Klachten
Naar Samenvatting ›De infectie verloopt vaak asymptomatisch maar kan aanleiding geven tot algemene malaise, buikklachten, diarree, gewichtsverlies en perianale jeuk. De patiënt merkt de infectie vaak op doordat een of enkele proglottiden per dag uit de anus kruipen of op de ontlasting zichtbaar zijn.
Onderscheid runder- en varkenslintworm
Naar Samenvatting ›De runderlintworm ziet er macroscopisch hetzelfde uit als de varkens- of gewapende lintworm (Taenia solium). Een infectie met een runderlintworm is bij de mens beperkt tot de darm en daarom ongevaarlijk. De varkenslintworm is wel gevaarlijk omdat deze bij de mens buiten de darm treedt en overal in het lichaam cysten kan vormen (cysticercosis). Ook kan de varkenslintworm van mens tot mens worden overgedragen. Daarom is altijd aanvullend onderzoek nodig om het onderscheid tussen beide soorten te kunnen maken.
De varkenslintworm is zeldzaam in Nederland en komt alleen als importziekte voor.
De term ‘gewapend’ duidt op de aanwezigheid van een hakenkrans op de kop (scolex) van de varkenslintworm. Deze hakenkrans is afwezig bij de runderlintworm. Dit onderscheid is alleen microscopisch te maken, macroscopisch zien beide lintwormen er hetzelfde uit.
De varkenslintworm is een zeer zeldzame importziekte. De mens is de enige eindgastheer van de varkenslintworm, het varken de tussengastheer. De cyclus van de varkenslintworm is hetzelfde als van de runderlintworm met als cruciale verschil dat de eitjes van de varkenslintworm na orale opname door de mens wel via de menselijke darm naar organen kunnen migreren om daar cysten te vormen. De mens is dan tevens tussengastheer. De varkenslintworm kan wel van mens tot mens worden overgedragen als men in contact komt met de eitjes die een ander mens uitscheidt (bijvoorbeeld door eitjes onder de nagels na onvoldoende toilethygiëne, die bij het bereiden van een maaltijd worden overgedragen). Een besmet mens kan zo ook zichzelf weer besmetten. De drager van een varkenslintworm is daarmee een gevaar voor zichzelf en voor anderen.
In de fase met weefselinvasie door de larven kunnen deze zich op verschillende plaatsen in het lichaam nestelen, zoals hersenen, spieren en subcutis, en leiden tot cystevorming (‘cysticerciën’). Jaren na infectie kunnen ze daar symptomen veroorzaken, door cysten in de hersenen (neurocysticercosis, zoals epilepsie, focale neurologische uitvalsverschijnselen en intracraniële drukverhoging).
Klinisch beeld
Naar Samenvatting ›- Spoel-, zweep- en runderlintwormen geven doorgaans geen klachten. De patiënt komt meestal omdat hij wormen of wormdelen in de ontlasting heeft gezien.
- In Nederland komt besmetting met grote aantallen van deze wormen in het maag-darmkanaal bijna niet voor, zodat algemene verschijnselen, zoals anemie, groeivertraging, darmklachten of vage buikklachten door deze worminfecties zeldzaam zijn.
- Bij enterobiasis kunnen de wormpjes worden gezien maar vaak zijn het klachten zoals (peri)anale jeuk die tot vermoeden van enterobiasis leiden. Bij kinderen kan jeuk zich ook uiten als nachtelijke onrust. Enterobiasis kan ook in de vagina zitten en (peri)vulvaire jeuk of vaginale afscheiding geven.
Richtlijnen diagnostiek
Naar Samenvatting ›Anamnese
Naar Samenvatting ›Vraag naar:
- klachten
- bij waargenomen wormen/wormdelen: grootte en vorm (vraag de patiënt wormen te verzamelen en mee te nemen in een afgesloten potje of op een stukje plakband)
- bij jeuk: lokalisatie ((peri)anaal/vaginaal/vulvair), vaginale afscheiding, gestoorde slaap (door jeuk) of nachtelijke onrust (bij kinderen)
- soortgelijke klachten bij huisgenoten
- recente wormbesmettingen of behandelingen bij de patiënt of bij huisgenoten, waaronder zelfmedicatie (mebendazol is zonder recept verkrijgbaar)
Lichamelijk onderzoek
Naar Samenvatting ›- Inspecteer de anus en vulva bij perianale/vaginale/vulvaire jeuk.
- Kijk, eventueel met een vergrootglas, naar zichtbare ‘wormpjes’ rond de anus en vulva.
- Voor het onderzoek bij vaginale jeuk/afscheiding: zie de NHG-Standaard Fluor vaginalis.
- Inspecteer een meegebrachte worm.
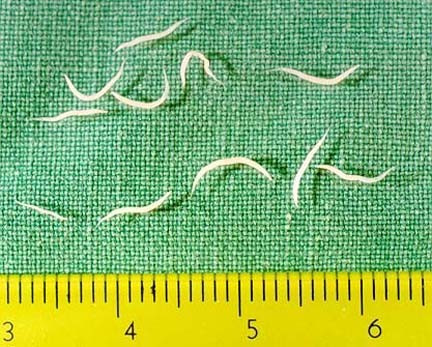
- E. vermicularis (‘wormpjes’) is ongeveer 5-10 mm lang.
- Een spoelworm is 10-40 cm lang, 2-6 mm dik en in doorsnee rond met een gladde huid.
- Een zweepworm is 3-5 cm lang en heeft een kenmerkend dun draadvormig voorste deel dat tamelijk abrupt overgaat in een dikker achterste gedeelte met een gladde huid.
- Een rijpe proglottide is geheel uitgestrekt 12-20 mm lang en enigszins afgeplat; bij een (stukje van de) lintworm zijn de ketens van proglottide herkenbaar (segmentatie).
- Identificeer de worm en wees er alert op dat een worm iets anders kan zijn.
- Voedseldelen zoals vezels, een aardworm (regenworm) die via het riool in de wc-pot kan komen of een stukje elastiek worden weleens verward met spoelwormen.
- Een aardworm heeft over de gehele lengte een opeenvolgende ringenstructuur in de huid; spoel- en zweepwormen hebben een gladde huid.
- Een aardworm kan over een klein deel van zijn lengte een verdikking rondom hebben.
- Een voedingsvezel is met een pincet vaak makkelijk te pletten of uit elkaar te trekken.
Aanvullend onderzoek
Naar Samenvatting ›Opsturen van worm(del)en
Naar Samenvatting ›- Stuur onbekende worm(del)en altijd op.
- Stuur worm(del)en op bij elke onzekerheid bij (visuele) determinatie van een structuur die op een spoel- of zweepworminfectie lijkt.
- Stuur een lintworm of proglottide altijd op voor parasitologisch onderzoek om onderscheid te maken tussen een runder- en varkenslintworm. Stuur feces in als er geen worm(deel) beschikbaar is maar wel een vermoeden van een lintworm is.
Plakbandproef
Naar Samenvatting ›Verricht de plakbandproef bij diagnostische twijfel over enterobiasis. Als de patiënt zelf de wormpjes heeft geïdentificeerd is er geen diagnostische twijfel. Fecesonderzoek is veel minder betrouwbaar dan de plakbandproef.
Uitvoering plakbandproef
Naar Samenvatting ›- Geef de patiënt een objectglaasje en transportcontainer mee.
- Instrueer de patiënt om direct na het opstaan en voor het baden een stuk doorzichtig plakband met ongeveer de lengte van het objectglaasje te nemen en de plakkant daarvan goed op de huid rond de anus te drukken. Trek daarna het plakband los en druk hetzelfde stukje plakband op een ander stukje huid rond de anus. Plak het plakband daarna op een objectglaasje met de plakkant naar beneden, doe dit in de container en lever dit af bij de praktijk.
- Stuur dit objectglaasje met daarop het plakband naar het laboratorium of bekijk dit zelf met 40 keer en eventueel 100 keer vergroting.
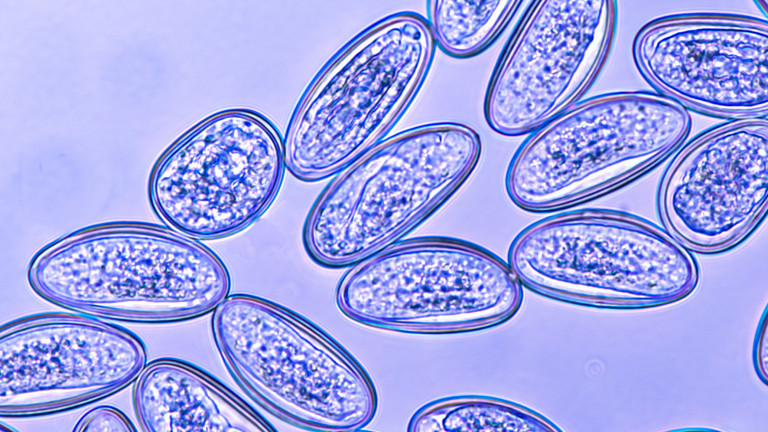
- Enterobiuseitjes zijn kleurloos en eenzijdig afgeplat en 50-60 keer 20-30 micrometer groot. Ze hebben een dubbele eischaal. Na ongeveer 6 uur bevat het een volledig ontwikkelde larve.
- Herhaal de plakbandtest nog tweemaal als geen wormeitjes worden gezien bij de eerste test: herhaalde testen vergroten de kans om eitjes te vinden aanzienlijk.
De volgende gegevens uit de beschreven onderzoeken komen overeen met de handboeken:
- De plakbandtest geldt als voorkeursmethode om enterobiuseitjes vast te stellen.
- Het nut om deze test (minimaal 3 keer) te herhalen bij een negatief resultaat.
De plakbandtest is eenvoudig uit te voeren. Om de kans op het vinden van eitjes te vergroten is het aan te bevelen ’s ochtends direct na het ontwaken en voor het wassen de test uit te voeren. Het advies van de Nederlandse Vereniging voor Parasitologie om het plakband op verschillende plaatsen tegen de perianale huid te drukken voordat het plakband op het objectglaasje wordt geplakt, wordt overgenomen, omdat dit waarschijnlijk de kans om de eitjes te vinden vergroot.
Over de vaardigheid van de huisarts in het herkennen van de typische enterobiuseitjes zijn geen praktijkgegevens bekend. Aangenomen wordt dat een huisarts de eitjes kan herkennen aan de hand van voorbeeldplaatjes vanwege de typische vorm.
Omdat veel huisartsen geen microscoop meer in gebruik hebben, is ervoor gekozen om dit onderzoek als facultatief voor de huisarts op te nemen.
Aanbeveling
Voor het aantonen van enterobiuseitjes kan de plakbandtest worden gebruikt. Laat de patiënt het plakband plakken direct na het ontwaken en voor het wassen, en op 2 plaatsen op de perianale huid. Indien er geen eitjes worden gevonden is het zinvol de test tenminste 2 keer te herhalen. De geïnteresseerde huisarts kan het plakbandpreparaat (facultatief) zelf beoordelen; anders moet het preparaat hiervoor naar het huisartsenlaboratorium worden gestuurd.
Achtergrond
Enterobius vermicularis zetten hun eitjes af rond de anus of soms aan de buitenkant van de ontlasting, waardoor in grote delen van de ontlasting geen eitjes te vinden zijn. Fecesonderzoek naar deze eitjes is daardoor onbetrouwbaar. De wormpjes en direct na de ontlasting geproduceerde witte eipakketjes kunnen met het blote oog worden herkend op de feces. Overblijfselen van de vrouwelijke wormpjes zijn na het afzetten van de eipakketjes slechts met grote moeite te herkennen. Losse eitjes zijn te klein om met het blote oog te zien. Als er geen wormpjes worden gezien adviseren leerboeken de plakbandtest als methode om wormeitjes te vinden. Daarbij wordt een stuk doorzichtig plakband een aantal malen op de huid rond de anus gedrukt; het liefst direct na het ontwaken en voor het wassen, waarna dit plakband op een objectglaasje wordt geplakt en onder de microscoop bekeken wordt. Deze eitjes hebben een karakteristiek aspect (ovaal met een dubbele en aan een kant afgeplatte eischaal. Verwarring met andere eieren is nauwelijks mogelijk. Verondersteld wordt daarom dat zij ook in de eerste lijn makkelijk te herkennen zijn.
Uitgangsvraag
Wat zijn de testeigenschappen van de plakbandproef bij verdenking op E. vermicularis?
P patiënt met vermoeden van E. vermicularis
I plakbandproef
C gouden standaard (microscopisch onderzoek feces/mogelijk andere gouden standaard)
O specificiteit, sensitiviteit
Methode
We verrichtten een breed geformuleerd systematisch literatuuronderzoek naar de uitgangsvraag. Een zoekstrategie met zoekdatum vanaf oprichting tot en met 14 juni 2018 gaf 37 treffers in PubMed. Omdat een mogelijk relevant artikel waarvan de titel was gevonden in de literatuurverwijzingen van een van deze 37 treffers niet zichtbaar was, werd de zoekstrategie uitgebreid. Dit leverde 17 nieuwe treffers in PubMed op en 20 nieuwe treffers in Embase. De search leverde uiteindelijk twee verschillende soorten onderzoeksgegevens op. De eerste soort betrof prevalentie-onderzoek waarin naast de plakbandtest ook een andere diagnostische methode werd gebruikt, zodat de opbrengst van beide diagnostische methoden kan worden vergeleken. De andere soort betrof onderzoek naar de waarde van de plakbandtest gerelateerd aan een referentietest.
Resultaten
Onderzoeken naar prevalentie
- Celiksöz e.a. (2005) onderzocht bij 1864 Turkse patiënten in 3 regio’s de feces op wormen, waaronder Enterobius. Een plakbandtest werd gedaan en de feces werd onderzocht door een direct saline smear preparation, die lichtmicroscopisch werd bekeken. Indien met het laatstgenoemde onderzoek geen parasiet werd gezien, werd in de feces met de zinksulfaatflotatiemethode verder gezocht naar parasieten.
Met de plakbandtest werden eitjes gevonden bij 229 patiënten (12,3%). Het fecesonderzoek leverde slechts 3 positieven op (alle ook positief in de plakbandtest). In alle 3 de regio’s was er een statistisch significant verschil (alle p < 0,05) tussen de resultaten van de plakbandtest en het fecesonderzoek in het ontdekken van enterobius in het voordeel van de plakbandtest.
- Saksirisampant e.a. (2004) onderzocht bij 781 schoolgaande kinderen van het Karenvolk in Thailand de feces op parasieten, waaronder enterobius, met de formaline-ethertechniek en daarnaast de plakbandproef.
In de ontlasting (n = 542) werden enterobius-infecties bij 1 (0,18%) en bij de plakbandproef (n = 781) bij 121 kinderen (15,49%) gevonden. Het verschil was statistisch significant (p < 0,001).
Onderzoeken waarin de waarde van de plakbandtest wordt vergeleken met een referentietest
- Cho e.a. (1975) vergeleek bij 158 Koreanen in 3 dorpen het resultaat van een plakbandproef met het onderzoek van alle feces in de 2 dagen nadat een kuur met pyrantel (een anthelminthicum) was gegeven. Bij 141 Koreanen was het resultaat van beide testen bekend zie tabel 2.
|
|
Enterobius in feces: + |
Enterobius in feces - |
Totaal |
|
|
Plakbandtest: + |
70 |
7 |
77 |
PVW = 70/77 = 0,91 |
|
Plakbandtest: - |
52 |
12 |
64 |
NVW = 12/64 = 0,19 |
|
Totaal |
122 |
19 |
141 |
|
|
|
Sens. = 70/122 = 0,57 |
Spec. = 12/19 = 0,63 |
|
|
- Jeandron e.a. (2010) vergeleek bij kinderen uit Kirgizië het resultaat van een plakbandproef (naar wormeitjes) met fecesonderzoek naar wormeitjes volgens de FLOTAC-techniek (een flotatie-centrifugatiemethode). Voor 64 van de 163 geïncludeerde kinderen waren 3 plakbandstroken beschikbaar en minimaal 1 FLOTAC. De gouden standaard was een aangetoonde infectie in 1 van de 3 methoden. Met de plakbandtest werden 13 besmette kinderen gevonden: 4 na 1 plakbandtest, 4 bij de 2e en 5 na de 3e. 2 kinderen hadden een positieve FLOTAC, waarvan 1 was gevonden met de plakbandtest zie tabel 3.
|
|
Sensitiviteit (95%-BI) |
NVW (95%-BI) |
P-waarde |
|
1 x plakband |
28,6 (9,6–58,0) |
83,3 (71,0 91,3) |
|
|
2 x plakband |
57,1 (29,6–81,2) |
89,3 ( 77,4–95,6) |
|
|
3 x plakband |
92,9 (64,2–99,6) |
98,0 (88,2–99,9) |
0,006 (versus 1 x FLOTAC) |
|
1 x FLOTAC |
14,3 (2,5–43,8) |
80,7 (68,3–89,2) |
|
Kwaliteit van bewijs
Onderzoeken naar prevalentie
Alle onderzoeken zijn gedaan buiten Nederland in gebieden met een zeer hoge prevalentie van enterobiasis waarin zorgverleners waarschijnlijk meer ervaring hebben in het herkennen van wormen en wormeitjes.
Onderzoeken naar waarde plakbandtest
Een gouden standaard voor het vaststellen van enterobiuswormpjes in de ontlasting is niet bekend. De onderzoeksopzet van Cho lijkt het meest geschikt om de waarde van de plakbandtest vast te stellen, omdat de resultaten daarvan werden vergeleken met onderzoek van de volledige ontlasting waarmee alle worminfecties ontdekt kunnen worden. Hoewel de groep zonder wormpjes in de feces niet groot is, gaven de onderzoekers toch aan dat er enige twijfel is of alle wormpjes zijn gevonden.
Het onderzoek van Jeandron laat vooral zien dat herhaling van de plakbandtest de opbrengst vergroot. De referentietest die in dit onderzoek gehanteerd werd, lijkt geen goede gouden standaard, omdat er alleen werd gekeken naar de aanwezigheid van eitjes en niet van wormen. Omdat het waarschijnlijk is dat verdere herhaling van de test gaat leiden tot de ontdekking van meer gevallen, is hun berekening van de sensitiviteit en specificiteit weinig zinvol.
Conclusie
De prevalentie-onderzoeken laten zien dat wormeitjes veel vaker met de plakbandtest dan met fecesonderzoek worden gevonden. De gegevens uit het onderzoek naar de waarde van de plakbandtest met als gouden standaard het aantal wormen in de ontlasting na een anthelminthicum laat een relatief hoge PVW (0,91) zien; de NVW is echter laag (0,19). Herhaalde plakbandtesten vergroten de opbrengst aanzienlijk.
Fecesonderzoek op wormeieren
Naar Samenvatting ›- Verricht fecesonderzoek bij een patiënt die een worm heeft gezien, maar deze niet goed kan omschrijven en niet heeft meegebracht. Bij een vermoeden van enterobiasis is de plakbandproef betrouwbaarder dan fecesonderzoek.
- Stuur een monster ongefixeerde ontlasting op naar het laboratorium.
- Eenmalig negatief fecesonderzoek sluit een infectie niet uit.
- Spoelwormen en zweepwormen produceren veel eitjes die makkelijk in de feces detecteerbaar zijn. Bij tweemaal negatief fecesonderzoek is een zware infectie met deze wormen daarom onwaarschijnlijk.
- Lintwormeitjes kunnen ook in de feces worden gedetecteerd, maar deze zitten meestal vooral in de proglottiden. Bij een reëel vermoeden van een lintworm (en geen wormdeel dat onderzocht kan worden) is daarom vaker dan twee keer fecesonderzoek nodig om een infectie met enige zekerheid te kunnen uitsluiten.
Macro- en microscopie
In het laboratorium wordt in feces gezocht naar soortspecifieke eitjes die bewijzend zijn voor een infectie met een bepaalde worm, waaronder E. vermicularis, spoel-, zweep- en runderlintworm.
Spoelwormen produceren vaak grote aantallen eitjes die bij een infectie meestal makkelijk in feces worden ontdekt.
Zweepworm produceren minder eitjes, zodat zij bij een infectie minder snel worden gevonden in de feces.
Eitjes van de E. vermicularis worden in feces moeilijk gevonden: zie ook Uitvoering plakbandproef.
Lintworm-eitjes zitten vooral in de proglottiden, zodat in de feces vaak geen eitjes worden gevonden.
Bij lintwormen kan het microscopische aspect van de proglottiden differentiëren tussen runder- en varkenslintworm: zie ook Onderscheid runder- en varkenslintworm.
Antigeentesten op feces
Indien microscopisch onderzoek niet mogelijk is, bestaat de mogelijkheid om door DNA-onderzoek van wormmateriaal (zoals proglottide of eieren) uit feces door middel van een Polymerase Chain Reaction (PCR) uitsluitsel te geven over het type lintworm. PCR-diagnostiek is ook mogelijk bij zweep- en spoelwormen. Dit onderzoek wordt niet in alle laboratoria uitgevoerd en wordt voornamelijk gebruikt voor epidemiologisch onderzoek in endemische gebieden.
Ook zijn soms antigeentesten in bloed of cyste-inhoud (bij de varkenslintworm) mogelijk waarin wormspecifiek materiaal wordt aangetoond. Deze hebben geen plaats in de eerste lijn en bestaan niet voor E. vermicularis, spoel- en zweepworm.
Bloedonderzoek
Naar Samenvatting ›- Serologie naar specifieke wormantistoffen heeft geen plaats bij een vermoeden van infectie met E. vermicularis, spoel-, zweep- en lintwormen in de darm.
- Onderzoek naar eosinofilie heeft geen plaats bij een patiënt die komt met het vermoeden van een worminfectie. De sensitiviteit en specificiteit van deze bepaling zijn te laag.
Het aantonen van antilichamen tegen een bepaalde worm speelt geen rol in de diagnostiek van Enterobius , de zweep- en de runderlintworm. Deze wormen komen bij de mens alleen in de darm voor en antilichamen worden (vooral) opgewekt door een fase met weefselinvasie.
Spoelwormen maken wel een fase met weefselinvasie door. In een beperkt aantal laboratoria is serologie mogelijk tegen Ascaris species (spoelwormen als soort). Deze diagnostiek heeft echter geen plaats in de 1e lijn, omdat daar (bijna) nooit vermoeden van klachten door de fase met weefselinvasie (vooral longpassage) zal bestaan en besmetting in de darm wordt aangetoond door wormdeterminatie of door fecesonderzoek naar eitjes. Serologisch onderzoek kan wel een plaats hebben in de 2e lijn bij vermoeden van weefselinvasie.
Voor de varkenslintworm bestaan verschillende serologische methoden. Deze vorm van diagnostiek heeft geen plaats bij de diagnostiek van een lintworminfectie in de 1e lijn of bij het onderscheid tussen varkens- en runderlintworm in het laboratorium. Dat gebeurt door microscopisch onderzoek van proglottiden/worm(del)en of indien dat onvoldoende duidelijk is door moleculaire methoden waarbij specifiek DNA wordt aangetoond. Bij een aangetoonde infectie zal de patiënt verwezen worden en kan serologisch onderzoek een plaats hebben bij het vaststellen of vervolgen van weefselinfectie (cysten).
Bij de honden- en kattenspoelworm is serologie mogelijk, maar de aanwezigheid van antistoffen differentieert niet tussen een oude of een actieve infectie. Het onderzoek wordt daarom niet geadviseerd in de 1e lijn.
Eosinofilie bij worminfectiesontstaat vooral bij weefselinvasie van wormen, maar kan afwezig zijn, bijvoorbeeld bij afgegrensde infecties. Het aantal eosinofielen per mm3 bij een worminfectie is afhankelijk van verschillende factoren, zoals het soort worm, de totale parasietenlast, de vraag of het de 1e of een herinfectie betreft en de tijd verstreken sinds de infectie begon. Het aantal eosinofielen differentieert echter niet tussen de verschillende soorten wormen.
Eosinofilie kan een toevalsbevinding zijn bij het aanvragen van een differentiatie van witte bloedcellen, waarbij een van de mogelijke oorzaken een worminfectie is. Eosinofilie kan vele oorzaken hebben, zodat andere oorzaken ook dienen te worden uitgesloten. Een worminfectie wordt aangetoond door worm- of eideterminatie, of door het aantonen van specifieke antistoffen.
Screenen op eosinofilie als test op worminfecties
Soms wordt eosinofilie gebruikt als screening voor het bestaan van een worminfectie, maar de waarde daarvan is niet duidelijk. In een prospectief onderzoek (2008-2011) onder Nederlanders die gedurende 12 tot 52 weken reisden naar (sub)tropische landen (n = 604) was het mediane aantal eosinofielen 150 per mm3 en had 5% eosinofilie (≥ 450 eosinofielen per mm3) voorafgaand aan de reis. Bij de 13 personen die voorafgaand aan de reis antistoffen tegen wormen hadden, was het mediane aantal eosinofielen 130 per mm3 en had niemand eosinofilie. Na terugkomst was het mediane aantal eosinofielen 170 per mm3 en had 38 (6%) eosinofilie. De 9 reizigers met een recente worminfectie (schistosomiasis, S. stercoralis en filariasis) hadden een mediaan aantal eosinofielen van 190 per mm3, echter niemand had eosinofilie.
Conclusie
Dit onderzoek bevestigt het idee dat routinematige bepaling van eosinofilie geen diagnostische waarde lijkt te hebben.
Aanbeveling
Onderzoek naar eosinofilie als test voor het vaststellen van worminfecties wordt niet geadviseerd.
Evaluatie en differentiaaldiagnose
Naar Samenvatting ›De diagnose wordt gesteld door determinatie van de worm of wormdelen, of door determinatie van de eieren door middel van een plakbandtest of fecesonderzoek (zie tabel 1).
Als de patiënt perianale/vaginale/vulvaire jeuk heeft zonder dat er wormen of wormeitjes zijn gezien, denk dan aan lokale huidafwijkingen (bijvoorbeeld eczeem), vaginale aandoeningen, psychogene klachten of (bij kinderen) mogelijk mishandeling.
Richtlijnen beleid
Naar Samenvatting ›Voorlichting algemeen
Naar Samenvatting ›Leg uit dat:
- bij enterobiasis de eitjes die het lichaam verlaten direct infectieus zijn. Eitjes van spoel- en zweepwormen zijn pas besmettelijk nadat zij een maand in de grond hebben kunnen rijpen. Eitjes van de runderlintworm kunnen alleen uitrijpen in het rund
- alleen bij enterobiasis herbesmetting in huis kan plaatsvinden. Daardoor zijn hygiënische maatregelen in huis ter preventie van herbesmetting alleen bij enterobiasis relevant
Thuisarts
Naar Samenvatting ›Verwijs naar de informatie op Thuisarts. De informatie op thuisarts.nl is gebaseerd op deze NHG‑Behandelrichtlijn.
Medicamenteuze behandeling en adviezen
Naar Samenvatting ›Enterobiasis
Naar Samenvatting ›- De infectie geeft vaak geen klachten, maar de jeuk kan lastig zijn. Complicaties zijn zeer zeldzaam. Zonder herbesmetting verdwijnt de infectie na 4 tot 6 weken vanzelf. Daarom kunnen patiënten met hygiënische maatregelen het natuurlijk herstel afwachten (vooral als er geen klachten zijn).
- Licht de patiënt voor over het belang van hygiënische maatregelen om herbesmetting te voorkomen. Leg uit dat iedereen in het gezin geïnstrueerd moet worden om de hygiënische maatregelen succesvol te kunnen laten zijn.
- De hygiënische maatregelen zijn:
- niet rond de anus krabben
- vaak handen wassen (altijd na toiletbezoek en voor het eten)
- nagels kort knippen
- kleding (vooral onderbroek, slaapkleding en handdoeken: elke dag) en beddengoed vaak verschonen en wassen op minimaal 60 °C
- elke dag slaapkamer en leefruimten stofzuigen
- voorwerpen waar vaak handcontact mee is frequent schoonmaken, zoals deurknoppen, kastdeuren, speelgoed en toiletrand, -bril, -kraan en -waterspoelknop
- Medicatie kan geïndiceerd zijn als de infectie gepaard gaat met klachten:
- behandel als er 1 gezinslid is met klachten alleen hem/haar
- overweeg behandeling van het hele gezin als meerdere gezinsleden besmet zijn of als de infectie na behandeling recidiveert
- Medicamenteuze therapie bij volwassenen en kinderen ≥ 2 jaar:
- 1 gift mebendazol 100 mg; herhaal na 14 dagen
- mebendazol werkt alleen op de volwassen worm
- de 2e gift na 14 dagen is bedoeld om de wormen te bestrijden die zich hebben ontwikkeld uit de eitjes die tijdens de 1e gift aanwezig waren
- neem de tabletten geheel of gekauwd in, met een ruime hoeveelheid water
- Medicamenteuze therapie bij kinderen van 1 maand tot en met 2 jaar:
- mebendazol (in dezelfde dosering) is alleen geïndiceerd als de infectie niet overgaat met uitsluitend hygiënische maatregelen vanwege onvoldoende gegevens over veiligheid
- bespreek met de ouders de goedaardigheid van de aandoening, waardoor het natuurlijk beloop met hygiënische maatregelen kan worden afgewacht en de kans op zeldzame ernstige bijwerkingen van mebendazol (convulsies).
- Bij zwangerschap en borstvoeding kan mebendazol worden gebruikt.
- De kuur kan herhaald worden als geen genezing optreedt na de 1e kuur.
Het advies om het natuurlijk herstel af te wachten bij enterobiasis is gebaseerd op consensus. Onderzoeken naar het effect van alleen hygiënische maatregelen bij enterobiasis zijn niet bekend. Het advies is gebaseerd op het feit dat de levensduur van E. vermicularis ongeveer 6 weken bedraagt in combinatie met de overwegingen dat enterobiasis vaak geen klachten geeft en complicaties van enterobiasis zeer zeldzaam zijn in Nederland. Dit beleid is ook beschreven in de boeken Kleine kwalen in de huisartsenpraktijk en Kleine kwalen bij kinderen.
Achtergrond
In Nederland zijn mebendazol, albendazol, praziquantel, ivermectine en niclosamide geregistreerd als anthelminthica. Voor behandeling van enterobius, spoel- en zweepwormen is echter alleen mebendazol geregistreerd. Onbekend is wat de effectiviteit is van mebendazol en de andere antihelminthica bij deze infecties.
Uitgangsvraag
Wat is de effectiviteit van in Nederland beschikbare anthelminthica bij enterobius, spoel- en zweepwormen?
Uitkomstmaten
Genezing (geen wormei in de feces). Bij enterobius, spoel- en zweepwormen is de afwezigheid van eitjes in de ontlasting een teken dat er geen eitjesproducerende worm meer aanwezig is in het maag-darmkanaal.
Met de systematische zoekstrategie werd geen enkel onderzoek gevonden naar het effect van antiwormmiddelen op enterobius. Evenmin werd onderzoek gevonden met de in Nederland gangbare doseerschema’s in Nederlandse populaties. Bijna al het onderzoek betrof eenmalige giften van anthelminthica in het kader van massale ontwormingsprogramma’s in tropische gebieden.
De zoekstrategie vond 3 systematische reviews. Een review betrof alleen een eenmalige gift albendazol bij infectie met zweepwormen en was van lage kwaliteit (AMSTAR 3/11). De tweede meta-analyse was in opzet hetzelfde als de 3e, maar van oudere datum en bevatte minder RCT’s. Daarom diende de 3e systematische review naar het effect van eenmalig anthelminthica tegen onder andere spoel- en zweepwormen als uitgangspunt bij de beantwoording van de vraag. De gebruikte anthelminthica waren: albendazol, mebendazol, levamisol en pyrantelpamoaat. De effectiviteit van levamisol en pyrantelpamoaat wordt buiten beschouwing gelaten omdat deze middelen in Nederland niet verkrijgbaar zijn.
Omdat bekend is dat bij massale ontwormingsprogramma’s in tropische gebieden het effect van eenmalige giften albendazol of mebendazol laag is bij infectie met zweepwormen, zijn de laatste jaren onderzoeken gestart naar het effect van combinaties van anthelminthica of van meerdaagse giften. De zoekstrategie vond 4 RCT’s die het effect beschrijven van meerdaagse doseringen of combinaties van (in Nederland verkrijgbare) middelen op infectie met zweepwormen.
Resultaten meta-analyse van Moser
Beschrijving
De meta-analyse includeerde alleen onderzoek naar een eenmalige dosis albendazol 400 mg of mebendazol 500 mg, waarin de follow up tussen de 1 en 6 weken werd verricht. Er zijn 44 RCT’s (n = 7273) ingesloten naar het effect tegen spoelwormen en 38 RCT’s (n = 8841) naar het effect tegen zweepwormen.
Kwaliteit van bewijs
De kwaliteit van de meta-analyse was matig met een AMSTAR-score van 6/11. De kwaliteit van de geïncludeerde RCT’s gemeten met de Jadad-score (schaal: 0 tot maximale score van 5) was gemiddeld 2,5 (spoelwormen) en 2,6 (zweepwormen). Geen enkele RCT is verricht in Europa, bijna alle waren uitgevoerd in Afrika en het verre en Midden-Oosten.
Effectiviteit
Het gemiddelde percentage van spoelwormen genezen patiënten met albendazol was 95,7% (95%-BI 93,2% tot 97,3%), met mebendazol 96,2% (95%-BI 92,3% tot 98,1%) versus 12,7% (95%-BI 6,7% tot 22,7%) genezing bij gebruik van placebo. Beide middelen waren daarmee significant beter (beide p < 0,001) dan placebo. Er was geen statistisch significant verschil tussen beide middelen.
Het gemiddelde percentage van zweepwormen genezen patiënten met albendazol was 30,7% (95%-BI 21,0% tot 42,5%) en met mebendazol 42,1% (95%-BI 25,9% tot 60,2%) versus 8,6% (95%-BI 4,1% tot 17,1%) genezing met placebo. Beide middelen waren significant beter (beide p < 0,001) dan placebo. Er was geen statistisch significant verschil tussen beide middelen.
Conclusie
- Een eenmalige gift albendazol 400 mg of mebendazol 500 mg geneest waarschijnlijk ongeveer 96% van de besmettingen met spoelwormen.
- Een eenmalige gift albendazol 400 mg of mebendazol 500 mg geneest waarschijnlijk respectievelijk circa 30 en 42% van de besmettingen met zweepwormen.
- Er is geen bewijs gevonden voor het effect van mebendazol tegen enterobius.
Resultaten vier RCT’s
Beschrijving en effectiviteit
- In de RCT van Adegnika werden 175 kinderen in Gabon die besmet waren met spoel-, mijn- of zweepwormen verdeeld in 3 groepen die 1, 2 of 3 dagen 1 dd 400 mg albendazol kregen. De effectmaat genezing werd beoordeeld na follow-up van 6 weken door controle van een fecesmonster. Het genezingspercentage was respectievelijk 40% (95%-BI 26 tot 54%), 67% (95%-BI 52 tot 82%) en 83% (95%-BI 73 tot 93%).
- In de RCT van Mekonnen werden 425 (waarvan 10% uitviel) kinderen in Ethiopië die zwaar besmet waren met zweepwormen (> 1000 wormeitjes/g ontlasting) verdeeld in 4 groepen: 1 of 2 dagen mebendazol 1 dd 500 mg of albendazol 1 dd 400 mg. Het gemiddelde aantal eitjes per gram ontlasting in deze 4 groepen varieerde vooraf tussen de 1075 en 1262, maar dit verschil was niet significant. De effectmaat was reductie van het gemiddelde aantal wormeitjes per groep na follow-up van 2 weken door controle van een fecesmonster. De resultaten met albendazol waren slechter dan van mebendazol. Alleen de gegevens over mebendazol worden hier gegeven. Mebendazol eenmalig gaf 60% reductie (95%-BI 48,5 tot 70,9). Mebendazol gedurende twee dagen gaf 87,1% reductie (95%-BI 81,4 tot 91,2). Dit verschil (27,1%) was significant.
- In de RCT van Steinmann werden 378 (uitval 17%) kinderen uit China die besmet waren met mijnwormen verdeeld in 4 groepen: 1 of 3 dagen 1 dd mebendazol 500 mg of albendazol 400 mg. De effectmaat was genezing na 3 tot 4 weken. Ook de effectiviteit tegen zweepwormen (n = 234) werd beoordeeld. Genezing in deze 4 groepen trad op in respectievelijk 39,7% (95%-BI 27,6 tot 52,8), 70,7% (95%-BI 57,3 tot 81,9), 33,8% (95%-BI 22,6 tot 46,6) en 56,2% (95%-BI 41,2 tot 70,5). De meest effectieve therapie tegen zweepwormen was mebendazol gedurende 3 dagen. Het verschil tussen 1 dd en 3 dd behandelen met hetzelfde middel is bij beide middelen significant (albendazol: 22,4%; 95%-BI 4,3 tot 40,5 (p = 0,05); mebendazol: 31,0%; 95%-BI 14,2 tot 47,8 (p < 0,001)). Het verschil van 14,4% tussen behandeling gedurende 3 dagen met albendazol of mebendazol is niet significant (95%-BI 32,7 tot - 3,8).
- In de RCT van Namwanje werden 611 (uitval 18% na 1 week en 13% na 4 weken) kinderen uit Uganda die besmet waren met zweepwormen verdeeld in 6 groepen. Drie groepen kregen een eenmalige dosis mebendazol 500 mg (n = 90), albendazol 400 mg (n = 94) of de combinatie van beide middelen (n = 68). 3 andere groepen kregen tweemaal op een dag dezelfde middelen (n = respectievelijk 91, 78 en 80). De effectmaat was genezing na 1, 2, 3 en 4 weken. Na 1 week waren de genezingspercentage 25,6% (eenmalig mebendazol), 36,2 (eenmalig albendazol), 50,0% (eenmaal de combinatie), 31,9% (tweemaal mebendazol), 50,0% (tweemaal albendazol) en 57,5% (tweemaal daags de combinatie). Genezingspercentages na 2 en 3 weken waren alle lager dan na een week. Na 4 weken waren de genezingspercentages 20,4% (eenmalig mebendazol), 15,4 (eenmalig albendazol), 54,2% (eenmaal de combinatie), 41,9% (tweemaal mebendazol), 43,4% (tweemaal albendazol) en 56,5% (tweemaal daags de combinatie). Genezing trad significant vaker op in de tweemaal daags doseergroep dan in de eenmaal daags doseergroep als werd vergeleken tussen dezelfde middelen (p < 0,0005). De combinatie van middelen gaf ook een significant hoger genezingspercentage dan 1 van beide middelen apart in zowel de een- als in de tweemalige doseergroep (p < 0,0005). In alle groepen was het genezingspercentage echter laag.
Kwaliteit van bewijs
De kwaliteit van bewijs van alle 4 RCT’s wordt afgewaardeerd vanwege twijfel over de blindering, twijfel over de methode om genezing vast te stellen (slechts 1 fecesmonster werd bekeken; bij beoordeling van meerdaagse fecesmonsters worden meer infecties ontdekt) en indirect bewijs (populatie in endemisch wormbesmettingsgebied in ander continent met mogelijk andere resistentie, andere voedingsstatus en dieet en comorbiditeit).
Conclusie
Uit deze 4 RCT’s komt het beeld naar voren dat meerdaagse regimes effectiever zijn dan eendaagse kuren, dat mebendazol 500 mg effectiever is tegen zweepwormen dan albendazol 400 mg, maar dat ook een driedaagse kuur geen volledige genezing geeft.
Van bewijs naar aanbeveling
Bijwerkingen mebendazol
De systematische review geeft geen informatie over bijwerkingen. Bijwerkingen van mebendazol zijn: zeer zelden (< 0,01%): diarree, buikpijn. Verder: overgevoeligheidsreacties zoals huiduitslag, urticaria, angio-oedeem, anafylactische en anafylactoïde reacties, exantheem, Stevens-Johnsonsyndroom (SJS), toxische epidermale necrolyse (TEN), en bij zuigelingen: koorts, convulsies en erythema multiforme (Farmacotherapeutisch Kompas, geraadpleegd 20-11-2017). Zie detail 'Mebendazol en kinderen < 2 jaar' bij Spoel- en zweepwormen voor meer informatie over bijwerkingen bij kinderen.
Enterobiasis
- Bij gebrek aan bewijs conformeert deze behandelrichtlijn zich aan het enige in Nederland geregistreerde middel tegen infectie met enterobius (mebendazol) en aan de doseeradviezen uit de registratietekst. Dit is conform de eerste keus uit de therapierichtlijn Parasitaire infecties van de Nederlandse Vereniging voor Parasitologie.
- Mebendazol wordt minder uit de darm opgenomen dan albendazol met minder kans op systemische bijwerkingen en heeft daarom ook de voorkeur boven albendazol.
- De adviesdosering in de registratietekst voor volwassenen en kinderen ouder dan een maand: 100 mg en na 14 dagen opnieuw 100 mg. Indien geen genezing wordt verkregen, wordt aanbevolen deze kuur (2 tabletten met 14 dagen tussenpoos) te herhalen.
- De rationale achter het herhalen van de kuur na 14 dagen is dat mebendazol beperkt effectief is tegen het larvale stadium. Larven die mogelijk niet zijn gedood door de eerste gift zijn 14 dagen daarna uitgegroeid tot wormpjes, maar hebben nog geen nieuwe larven voortgebracht.
- In de registratietekst van mebendazol (SmPC) staat in paragraaf 4.4 (‘Bijzondere waarschuwingen en voorzorgen bij gebruik’): ‘Om herinfectie na behandeling te voorkomen dient bij enterobiasis het hele gezin te worden behandeld.’ Er is echter geen onderzoek bekend dat dit advies ondersteunt. Gezien de goedaardigheid van de infectie is een beleid waarin alleen het besmette gezinslid wordt behandeld voldoende. Zo wordt onnodig anthelminthicumgebruik voorkomen. Vaak betreft de infectie kinderen. Het lijkt erop dat volwassenen enige weerstand hebben opgebouwd, wat de noodzaak om het hele gezin te behandelen ook beperkt. Ook het Farmacotherapeutisch Kompas heeft de tekst onder de indicatie worminfecties in 2018 minder stringent geformuleerd, namelijk: ‘Wanneer in een gezin meer dan 1 persoon besmet is en/of wanneer de besmetting frequent terugkomt, is het te overwegen alle gezinsleden te behandelen. In de praktijk treft de besmetting voornamelijk de kinderen binnen een gezin.’
- Daarom wordt dit advies niet overgenomen.
- Vanwege de hoge besmettelijkheid van de eitjes adviseert deze behandelrichtlijn om als meerdere gezinsleden besmet zijn of als een herhaling van een kuur nodig is, wel te overwegen om alle gezinsleden te behandelen. Aanvullend moet dan nog steeds instructie over niet-medicamenteuze adviezen om besmetting te voorkomen worden gegeven.
Spoelwormen
- Uit de meta-analyse van Moser blijkt dat mebendazol 400 mg als eenmalige gift effectief is.
- In Nederland is het gebruikelijk om spoelwormen conform de registratietekst te behandelen met 2 dd 100 mg gedurende 3 dagen en als er na 3 weken geen volledige genezing is verkregen, de behandeling te herhalen.
- Gegevens over de effectiviteit van dit doseerschema zijn niet gevonden in de systematische zoekstrategie.
- Deze behandelrichtlijn overweegt dat uit de praktijk geen problemen van therapiefalen bekend zijn bij gebruik van de geregistreerde doseringen en conformeert zich aan de registratietekst. Dit is conform de eerste keus uit de therapierichtlijn Parasitaire infecties van de Nederlandse Vereniging voor Parasitologie.
Zweepwormen
- Een genezingspercentage van een eenmalige gift albendazol en mebendazol tegen zweepwormen in de 4 beschreven onderzoeken is ruwweg 50% of minder, wat onvoldoende is.
- Moser meldt dat de gevoeligheid van zweepwormen voor albendazol en mebendazol in 2017 lager is dan in 1995 en vraagt zich af of dit het gevolg is van resistentieontwikkeling.
- In Nederland is het gebruikelijk om bij aangetoonde besmetting met zweepwormen te behandelen met 2 dd 100 mg gedurende 3 dagen en als er na 3 weken geen volledige genezing is verkregen, de behandeling te herhalen. Dit advies is conform de registratietekst en de eerste keus uit de therapierichtlijn Parasitaire infecties van de Nederlandse Vereniging voor Parasitologie.
- De resultaten uit de 4 RCT’s roepen de vraag op of de geregistreerde adviesdosis (2 dd 100 mg gedurende 3 dagen) voldoende effectief is. Omdat er geen aanwijzingen uit de Nederlandse praktijk zijn dat deze dosis niet effectief is, conformeert deze behandelrichtlijn zich aan de geregistreerde dosering conform de therapierichtlijn van de NVP.
- Uit ander onderzoek blijkt dat een combinatie van albendazol met oxantelpamoaat effectiever is dan albendazol met ivermectine, albendazol met mebendazol of mebendazol alleen. De combinatie van albendazol met oxantelpamoaat wordt niet overwogen omdat oxantelpamoaat niet in Nederland is geregistreerd.
Aanbevelingen
- Geef, als geneesmiddelgebruik geïndiceerd is, bij enterobiasis een tablet mebendazol 100 mg en na 14 dagen nog een tablet (een kuur). Herhaal deze kuur met 2 tabletten zo nodig indien geen genezing optreedt. Overweeg als meerdere gezinsleden besmet zijn of als een herhaling van een kuur nodig is om alle gezinsleden te behandelen. Geef altijd niet-medicamenteuze adviezen om besmetting te voorkomen.
- Geef bij spoel- en zweepwormen 2 dd 100 mg mebendazol gedurende 3 dagen en herhaal dat na 3 weken als er geen volledige genezing is.
De tijdsduur van 14 dagen is overgenomen uit de registratietekst van mebendazol, waaraan deze behandelrichtlijn zich conformeert. Omdat de ontwikkeling van larve naar volwassen worm minder lang duurt dan 14 dagen adviseren sommige parasitologen een kortere termijn tussen 2 giften (10 dagen, soms 1 week bij persisterende infecties), bijvoorbeeld als enterobiasis niet geneest nadat 2 giften mebendazol met 14 dagen tussenpoos van 14 dagen, gevolgd door nogmaals 2 giften mebendazol met een tussenpoos van 14 dagen niet hebben geleid tot het verdwijnen van de infectie.
De registratietekst van mebendazol geeft aan dat de dosis ervan bij kinderen gelijk is aan die bij volwassenen, en dat er bij kinderen < 2 jaar onvoldoende gegevens over de benodigde dosisaanpassingen zijn.
Het Kinderformularium hanteert ook dezelfde dosis bij kinderen als bij volwassenen, maar geeft geen dosis aan voor kinderen < 1 maand, omdat het begrip ‘kinderen’ wordt geïnterpreteerd als ‘een leeftijd ≥ 1 maand’, aangezien een neonaat enorm verschilt van oudere kinderen.
Het Farmacotherapeutisch Kompas raadt gebruik van mebendazol af bij een leeftijd < 2 jaar vanwege de geringe ervaring en het ontbreken van voldoende gegevens over de eventueel benodigde dosisaanpassingen en benoemt als bijwerkingen bij zuigelingen: koorts, convulsies en erythema multiforme.
De registratietekst vermeldt dat convulsies bij kinderen zeer zelden werden gerapporteerd tijdens post-marketing ervaring met mebendazol. De registratietekst stelt verder dat mebendazol enkel aan jonge kinderen mag worden toegediend als de worminfectie duidelijk een invloed heeft op de voedingstoestand en fysieke ontwikkeling van het kind. Dit betekent dat mebendazolgebruik buiten deze voorwaarde offlabel gebruik betreft. Ook het Kinderformularium geeft aan bij kinderen < 2 jaar alleen te behandelen indien de infectie niet overgaat met uitsluitend hygiënische maatregelen.
Mebendazol wordt vrij verkocht in apotheken en drogisterijen. In de bijsluiter is opgenomen om het niet bij kinderen < 2 jaar te gebruiken zonder advies van arts of apotheker.
Overige gegevens over bijwerkingen
De WHO publiceerde in 2002 een rapport over een informele consultatie over onder andere het gebruik van mebendazol bij kinderen < 24 maanden. De informatie was gebaseerd op een prospectief, niet-gerandomiseerd, niet-geblindeerd placebogecontroleerd onderzoek naar mebendazol 500 mg bij Tanzaniaanse kinderen < 24 maanden, waarvan 114 tussen de 6-12 maanden bij het begin van het onderzoek (317 mebendazol; 336 placebo). In beide groepen kwamen bijwerkingen, waaronder koorts en toevallen, in gelijke mate voor in de week na toediening. Het WHO-rapport geeft aan dat enzymen verantwoordelijk voor het metabolisme en de afbraak van mebendazol volwassen niveaus bereiken tussen de 10 en 24 maanden. Het rapport concludeert dat er gebrek aan veiligheidsgegevens bij kinderen < 12 maanden is.
Na het WHO-rapport verscheen nog een RCT bij 1760 Peruaanse kinderen van 12 maanden oud. Groep 1 kreeg mebendazol 500 mg op 12 maanden en placebo op 18 maanden, groep 2 in omgekeerde volgorde, groep 3 mebendazol 500 mg op 12 maanden en op 18 maanden, groep 4 placebo op 12 en op 18 maanden. Er waren 1686 mebendazoltoedieningen en 1676 placebotoedieningen. Er bleek geen associatie tussen mebendazol en het optreden van een ernstige bijwerking (OR 1,21; 95%-BI 0,47 tot 3,09), waaronder 13 doden (4 keer dehydratie of multi-orgaanfalen, 4 keer longproblemen, 1 keer pyelonefritis, 1 keer onbekend en 1 keer diarree) en 5 opnames (2 keer longprobleem, trombocytopenie, cervicale neuropathie, convulsie, dysenterie, acute infectieziekte). De convulsie deed zich voor in groep 3.
Bij het Lareb zijn 3 meldingen van bijwerkingen bij kinderen < 2 jaar gedaan en 11 bij kinderen van 2 tot 4 jaar. Geen van deze meldingen betrof een ernstige bijwerking.
Conclusie bijwerkingen
De registratietekst meldt zeldzame, maar ernstige complicaties (convulsies) bij jonge kinderen. Uit de beschreven onderzoeken blijkt niet dat bij kinderen < 2 jaar meer bijwerkingen optreden dan in de placebogroep. De aantallen zijn echter te klein en de opzet te veel verschillend van de Nederlandse situatie om veilig gebruik goed te onderbouwen. Bij het Lareb zijn nooit ernstige bijwerkingen gemeld bij jonge kinderen.
Overweging
Mebendazol wordt na orale toediening voor minder dan 10% geabsorbeerd, de Cmax wordt na 2-4 uur bereikt, maar bij jonge kinderen is er mogelijk een ander metabolisme. Gebruik van mebendazol bij kinderen < 2 jaar is offlabel als de worminfectie geen duidelijke invloed heeft op de voedingstoestand en fysieke ontwikkeling van het kind. Offlabel gebruik wordt alleen opgenomen in NHG-richtlijnen als er voldoende onderzoek beschikbaar is. Aan de effectiviteit wordt niet getwijfeld, maar over de veiligheid zijn weinig gegevens beschikbaar.
Infecties met enterobius, spoel- en zweepwormen zijn over het algemeen onschuldige aandoeningen in Nederland (zonder groeiachterstand of ondervoeding), zodat een absolute noodzaak om te behandelen vaak ontbreekt. Toch zullen ouders vaak aandringen op behandeling, en is de dosis bij enterobiasis (100 mg, herhalen na 14 dagen) en bij infectie met spoel- of zweepwormen (200 mg/dag, gedurende 3 dagen) lager dan de dosis van 500 mg die in het Tanzaniaanse en Peruaanse onderzoek werd gebruikt. Ook zijn er geen ernstige bijwerkingen gerapporteerd, terwijl het middel al jaren op de markt is. Het risico op bijwerkingen wordt daarom niet groot geacht.
Besloten is om het advies van de registratietekst en het Kinderformularium bij enterobiasis bij kinderen vanaf de leeftijd van 1 maand te volgen (namelijk: alleen behandelen als de infectie niet overgaat met uitsluitend hygiënische maatregelen), en daarnaast om de ouders te informeren over de goedaardigheid van de worminfectie (en dus het gebrek aan noodzaak om met medicijnen te behandelen) en de bijwerkingen, zodat een bewuste afweging samen met de ouders wordt gemaakt.
Voor kinderen < 1 maand wordt geen advies gegeven omdat het off-labelgebruik betreft, het Kinderformularium er geen advies over heeft geformuleerd, en het zelden zal voorkomen. Vooral bij kinderen < 1 maand is de mogelijkheid van een ander metabolisme en daardoor de mogelijkheid van zeldzame bijwerkingen waarschijnlijker. Deze argumenten zouden ervoor pleiten om, als een infectie al voorkomt voor de leeftijd van 1 maand, bij een onschuldige infectie eventuele behandeling uit te stellen tot na de eerste maand.
Een infectie met enterobius verschilt van een infectie met spoel- of zweepwormen, omdat de levensduur van enterobius veel korter is dan van spoel- en zweepwormen. Ook komen infecties met spoel- en zweepwormen waarschijnlijk veel minder voor dan infecties met enterobius. Daarom wordt het terughoudende advies voor mebendazol bij kinderen < 2jaar niet gegeven bij spoel- en zweepwormen.
Aanbeveling
Geef mebendazol voor infecties met enterobius alleen aan kinderen van 1 maand tot en met 2 jaar als de infectie niet overgaat met uitsluitend hygiënische maatregelen. Bespreek met de ouders de goedaardigheid van de aandoening, het kunnen afwachten van het natuurlijk beloop en de kans op zeldzame bijwerkingen (convulsies).
Zwangerschap
De registratietekst geeft aan dat er tijdens de zwangerschap geen schadelijke effecten bleken bij 400 zwangeren die het in het eerste trimester en bij 3500 vrouwen die het tijdens het tweede en derde trimester gebruikten. In dierexperimenteel onderzoek is mebendazol wel foeto- en embryotoxisch gebleken (registratietekst Mebendazol RV 114282, versie 2017-09). De Teratologie Informatie Service (TIS) van het Lareb meldt dat ruime ervaring met mebendazol bij zwangerschap geen verhoogd risico op aangeboren afwijkingen laat zien (www.lareb.nl/teratologie-nl/zwangerschap/#TOC_Anthelminthica1, geraadpleegd d.d. 03-07-18). De TIS baseert zich daarbij op gepubliceerde ervaring tijdens het eerste trimester bij 1700 zwangerschappen en tijdens het tweede en derde trimester is nog ruimer: meer dan 6000 zwangerschappen (www.reprotox.org, geraadpleegd d.d. 11-09-18). Daarnaast overweegt de TIS dat de absorptie van mebendazol uit het maag-darmkanaal beperkt is (KNMP kennisbank: na orale toediening minder dan 10%), de eiwitbinding in plasma is hoog, rond 95% en de halfwaardetijd kort (1 tot 2 uur). Deze eigenschappen maken dat de intrauterine blootstelling van de foetus na gebruik van mebendazol door de zwangere vrouw zeer gering zal zijn.
Borstvoeding
De registratietekst van mebendazol meldt dat bij gebruik ervan in therapeutische doseringen geen ongewenste effecten zijn te verwachten voor het kind. Het middel mag gegeven worden tijdens de lactatieperiode. De TIS meldt dat mebendazol bij borstvoeding slechts in geringe mate wordt geresorbeerd en tijdens de borstvoeding goed wordt verdragen door de zuigeling. Mebendazol wordt tijdens borstvoeding als ‘waarschijnlijk veilig’ geclassificeerd (www.lareb.nl/teratologie-nl/borstvoeding/#TOC_Anthelminthica2, geraadpleegd d.d. 03-07-18).
Overwegingen
Het NHG volgt het TIS in de adviezen bij zwangerschap en borstvoeding.
Conclusie
Mebendazol kan tijdens de zwangerschap en bij borstvoeding worden voorgeschreven bij een aangetoonde infectie.
Spoel- en zweepwormen
Naar Samenvatting ›- Geef bij een leeftijd vanaf 1 maand mebendazol 2 dd 100 mg gedurende 3 dagen. Neem de tabletten geheel of gekauwd in, met een ruime hoeveelheid water.
- Bij zwangerschap en borstvoeding kan mebendazol worden gebruikt.
- Informeer de patiënt over preventie van besmetting: voorkom het eten van grond (bij kinderen), was handen na buiten spelen of grondcontact en maak groente en fruit goed schoon. Deze adviezen zijn vooral relevant in gebieden of landen met een groterebesmettingskans, zoals in gebieden met intensieve varkenshouderij of hobbyvarkensboerderijen en landen met slechte hygiënische/sanitaire situatie.
De registratietekst van mebendazol geeft aan dat de dosis ervan bij kinderen gelijk is aan die bij volwassenen, en dat er bij kinderen < 2 jaar onvoldoende gegevens over de benodigde dosisaanpassingen zijn.
Het Kinderformularium hanteert ook dezelfde dosis bij kinderen als bij volwassenen, maar geeft geen dosis aan voor kinderen < 1 maand, omdat het begrip ‘kinderen’ wordt geïnterpreteerd als ‘een leeftijd ≥ 1 maand’, aangezien een neonaat enorm verschilt van oudere kinderen.
Het Farmacotherapeutisch Kompas raadt gebruik van mebendazol af bij een leeftijd < 2 jaar vanwege de geringe ervaring en het ontbreken van voldoende gegevens over de eventueel benodigde dosisaanpassingen en benoemt als bijwerkingen bij zuigelingen: koorts, convulsies en erythema multiforme.
De registratietekst vermeldt dat convulsies bij kinderen zeer zelden werden gerapporteerd tijdens post-marketing ervaring met mebendazol. De registratietekst stelt verder dat mebendazol enkel aan jonge kinderen mag worden toegediend als de worminfectie duidelijk een invloed heeft op de voedingstoestand en fysieke ontwikkeling van het kind. Dit betekent dat mebendazolgebruik buiten deze voorwaarde offlabel gebruik betreft. Ook het Kinderformularium geeft aan bij kinderen < 2 jaar alleen te behandelen indien de infectie niet overgaat met uitsluitend hygiënische maatregelen.
Mebendazol wordt vrij verkocht in apotheken en drogisterijen. In de bijsluiter is opgenomen om het niet bij kinderen < 2 jaar te gebruiken zonder advies van arts of apotheker.
Overige gegevens over bijwerkingen
De WHO publiceerde in 2002 een rapport over een informele consultatie over onder andere het gebruik van mebendazol bij kinderen < 24 maanden. De informatie was gebaseerd op een prospectief, niet-gerandomiseerd, niet-geblindeerd placebogecontroleerd onderzoek naar mebendazol 500 mg bij Tanzaniaanse kinderen < 24 maanden, waarvan 114 tussen de 6-12 maanden bij het begin van het onderzoek (317 mebendazol; 336 placebo). In beide groepen kwamen bijwerkingen, waaronder koorts en toevallen, in gelijke mate voor in de week na toediening. Het WHO-rapport geeft aan dat enzymen verantwoordelijk voor het metabolisme en de afbraak van mebendazol volwassen niveaus bereiken tussen de 10 en 24 maanden. Het rapport concludeert dat er gebrek aan veiligheidsgegevens bij kinderen < 12 maanden is.
Na het WHO-rapport verscheen nog een RCT bij 1760 Peruaanse kinderen van 12 maanden oud. Groep 1 kreeg mebendazol 500 mg op 12 maanden en placebo op 18 maanden, groep 2 in omgekeerde volgorde, groep 3 mebendazol 500 mg op 12 maanden en op 18 maanden, groep 4 placebo op 12 en op 18 maanden. Er waren 1686 mebendazoltoedieningen en 1676 placebotoedieningen. Er bleek geen associatie tussen mebendazol en het optreden van een ernstige bijwerking (OR 1,21; 95%-BI 0,47 tot 3,09), waaronder 13 doden (4 keer dehydratie of multi-orgaanfalen, 4 keer longproblemen, 1 keer pyelonefritis, 1 keer onbekend en 1 keer diarree) en 5 opnames (2 keer longprobleem, trombocytopenie, cervicale neuropathie, convulsie, dysenterie, acute infectieziekte). De convulsie deed zich voor in groep 3.
Bij het Lareb zijn 3 meldingen van bijwerkingen bij kinderen < 2 jaar gedaan en 11 bij kinderen van 2 tot 4 jaar. Geen van deze meldingen betrof een ernstige bijwerking.
Conclusie bijwerkingen
De registratietekst meldt zeldzame, maar ernstige complicaties (convulsies) bij jonge kinderen. Uit de beschreven onderzoeken blijkt niet dat bij kinderen < 2 jaar meer bijwerkingen optreden dan in de placebogroep. De aantallen zijn echter te klein en de opzet te veel verschillend van de Nederlandse situatie om veilig gebruik goed te onderbouwen. Bij het Lareb zijn nooit ernstige bijwerkingen gemeld bij jonge kinderen.
Overweging
Mebendazol wordt na orale toediening voor minder dan 10% geabsorbeerd, de Cmax wordt na 2-4 uur bereikt, maar bij jonge kinderen is er mogelijk een ander metabolisme. Gebruik van mebendazol bij kinderen < 2 jaar is offlabel als de worminfectie geen duidelijke invloed heeft op de voedingstoestand en fysieke ontwikkeling van het kind. Offlabel gebruik wordt alleen opgenomen in NHG-richtlijnen als er voldoende onderzoek beschikbaar is. Aan de effectiviteit wordt niet getwijfeld, maar over de veiligheid zijn weinig gegevens beschikbaar.
Infecties met enterobius, spoel- en zweepwormen zijn over het algemeen onschuldige aandoeningen in Nederland (zonder groeiachterstand of ondervoeding), zodat een absolute noodzaak om te behandelen vaak ontbreekt. Toch zullen ouders vaak aandringen op behandeling, en is de dosis bij enterobiasis (100 mg, herhalen na 14 dagen) en bij infectie met spoel- of zweepwormen (200 mg/dag, gedurende 3 dagen) lager dan de dosis van 500 mg die in het Tanzaniaanse en Peruaanse onderzoek werd gebruikt. Ook zijn er geen ernstige bijwerkingen gerapporteerd, terwijl het middel al jaren op de markt is. Het risico op bijwerkingen wordt daarom niet groot geacht.
Besloten is om het advies van de registratietekst en het Kinderformularium bij enterobiasis bij kinderen vanaf de leeftijd van 1 maand te volgen (namelijk: alleen behandelen als de infectie niet overgaat met uitsluitend hygiënische maatregelen), en daarnaast om de ouders te informeren over de goedaardigheid van de worminfectie (en dus het gebrek aan noodzaak om met medicijnen te behandelen) en de bijwerkingen, zodat een bewuste afweging samen met de ouders wordt gemaakt.
Voor kinderen < 1 maand wordt geen advies gegeven omdat het off-labelgebruik betreft, het Kinderformularium er geen advies over heeft geformuleerd, en het zelden zal voorkomen. Vooral bij kinderen < 1 maand is de mogelijkheid van een ander metabolisme en daardoor de mogelijkheid van zeldzame bijwerkingen waarschijnlijker. Deze argumenten zouden ervoor pleiten om, als een infectie al voorkomt voor de leeftijd van 1 maand, bij een onschuldige infectie eventuele behandeling uit te stellen tot na de eerste maand.
Een infectie met enterobius verschilt van een infectie met spoel- of zweepwormen, omdat de levensduur van enterobius veel korter is dan van spoel- en zweepwormen. Ook komen infecties met spoel- en zweepwormen waarschijnlijk veel minder voor dan infecties met enterobius. Daarom wordt het terughoudende advies voor mebendazol bij kinderen < 2jaar niet gegeven bij spoel- en zweepwormen.
Aanbeveling
Geef mebendazol voor infecties met enterobius alleen aan kinderen van 1 maand tot en met 2 jaar als de infectie niet overgaat met uitsluitend hygiënische maatregelen. Bespreek met de ouders de goedaardigheid van de aandoening, het kunnen afwachten van het natuurlijk beloop en de kans op zeldzame bijwerkingen (convulsies).
Zwangerschap
De registratietekst geeft aan dat er tijdens de zwangerschap geen schadelijke effecten bleken bij 400 zwangeren die het in het eerste trimester en bij 3500 vrouwen die het tijdens het tweede en derde trimester gebruikten. In dierexperimenteel onderzoek is mebendazol wel foeto- en embryotoxisch gebleken (registratietekst Mebendazol RV 114282, versie 2017-09). De Teratologie Informatie Service (TIS) van het Lareb meldt dat ruime ervaring met mebendazol bij zwangerschap geen verhoogd risico op aangeboren afwijkingen laat zien (www.lareb.nl/teratologie-nl/zwangerschap/#TOC_Anthelminthica1, geraadpleegd d.d. 03-07-18). De TIS baseert zich daarbij op gepubliceerde ervaring tijdens het eerste trimester bij 1700 zwangerschappen en tijdens het tweede en derde trimester is nog ruimer: meer dan 6000 zwangerschappen (www.reprotox.org, geraadpleegd d.d. 11-09-18). Daarnaast overweegt de TIS dat de absorptie van mebendazol uit het maag-darmkanaal beperkt is (KNMP kennisbank: na orale toediening minder dan 10%), de eiwitbinding in plasma is hoog, rond 95% en de halfwaardetijd kort (1 tot 2 uur). Deze eigenschappen maken dat de intrauterine blootstelling van de foetus na gebruik van mebendazol door de zwangere vrouw zeer gering zal zijn.
Borstvoeding
De registratietekst van mebendazol meldt dat bij gebruik ervan in therapeutische doseringen geen ongewenste effecten zijn te verwachten voor het kind. Het middel mag gegeven worden tijdens de lactatieperiode. De TIS meldt dat mebendazol bij borstvoeding slechts in geringe mate wordt geresorbeerd en tijdens de borstvoeding goed wordt verdragen door de zuigeling. Mebendazol wordt tijdens borstvoeding als ‘waarschijnlijk veilig’ geclassificeerd (www.lareb.nl/teratologie-nl/borstvoeding/#TOC_Anthelminthica2, geraadpleegd d.d. 03-07-18).
Overwegingen
Het NHG volgt het TIS in de adviezen bij zwangerschap en borstvoeding.
Conclusie
Mebendazol kan tijdens de zwangerschap en bij borstvoeding worden voorgeschreven bij een aangetoonde infectie.
Runderlintworm
Naar Samenvatting ›- Geef eenmalig niclosamide: vanaf 6 jaar 2 gram; 2 tot 6 jaar: 1 gram; 0 tot 2 jaar: 500 mg.
- Neem de niclosamide in 1 keer in na het ontbijt. Kauw de kauwtabletten tot een fijne brij en slik deze met een kleine hoeveelheid water door of laat de tabletten in weinig water uiteenvallen en maak ze daarna fijn en neem ze dan in (bij kinderen).
- Neem niet gelijktijdig met alcohol in.
- Licht de patiënt voor over het belang van het verhitten van vlees om infectie te voorkomen.
- Bij zwangerschap tijdens het 2e en 3e trimester en bij borstvoeding kan niclosamide worden gebruikt. Bespreek bij een infectie in het 1e trimester uitstel van behandeling tot het 2e trimester vanwege onzekerheid over de veiligheid voor de foetus.
Niclosamide is het enige in Nederland geregistreerde geneesmiddel tegen lintwormen. De keuze voor niclosamide is conform de eerste keus uit de therapierichtlijn Parasitaire infecties van de Nederlandse Vereniging voor Parasitologie (NVP).
De geadviseerde dosering is conform de officiële productinformatie van niclosamide (zie: www.geneesmiddeleninformatiebank.nl/smpc/h00886_smpc.pdf, geraadpleegd d.d. 03-07-2018) en het Kinderformularium en verschilt iets van de therapierichtlijn Parasitaire infecties die bij kinderen eenmalig niclosamide 50 mg/kg oraal adviseert. Omdat de NVP geen onderbouwing daarvoor geeft, volgt deze richtlijn de officiële productinformatie, namelijk bij een leeftijd vanaf 6 jaar: 2 gram, bij een leeftijd van 2 tot 6 jaar: 1 gram en bij een leeftijd van 0 tot 2 jaar: 500 mg.
Zwangerschap
De registratietekst (registratietekst niclosamide RVG 00886 geraadpleegd d.d. 03-07-2018) meldt dat er onvoldoende gegevens bekend zijn over gebruik ervan tijdens zwangerschap en dat het vooral gedurende de eerste 3 maanden alleen op strikte indicatie gebruikt dient te worden.
De Teratologie Informatie Service (TIS) van het Lareb meldt dat bij lintwormbesmetting niclosamide ook tijdens zwangerschap de eerste keus is, ondanks het feit dat epidemiologische gegevens over gebruik tijdens de zwangerschap ontbreken.
Borstvoeding
De registratietekst meldt dat het niet bekend is of het middel overgaat in de moedermelk. Niclosamide mag alleen worden gebruikt door vrouwen die borstvoeding geven na afweging van de risico’s en voordelen door een arts.
De TIS (website geraadpleegd d.d. 25-01-2018) stelt dat niclosamide waarschijnlijk veilig is tijdens borstvoeding. Niclosamide wordt slechts in geringe mate geabsorbeerd en tijdens de borstvoeding goed verdragen door de zuigeling.
Overwegingen
Gezien de onzekerheid over de veiligheid en voorzichtigheid in de registratietekst van niclosamide tijdens gebruik in het eerste trimester is er aanleiding om terughoudend te zijn met niclosamide.
Een runderlintwormbesmetting manifesteert zich alleen in de darm en is ongevaarlijk. De geïnfecteerde vrouw kan anderen niet besmetten. Daarom kan worden overwogen behandeling uit te stellen tot het tweede zwangerschapstrimester.
Bij borstvoeding lijkt er geen reden te zijn om bij een aangetoonde infectie geen niclosamide te geven.
Conclusie
- Niclosamide kan tijdens de zwangerschap in het tweede en derde trimester en bij borstvoeding veilig worden voorgeschreven bij een aangetoonde infectie.
- Bespreek bij een runderlintworminfectie in het eerste zwangerschapstrimester om behandeling uit te stellen tot het tweede trimester vanwege onvoldoende gegevens over de veiligheid.
Meldingsplicht
Naar Samenvatting ›- Er bestaat geen meldingsplicht bij een enkele geïnfecteerde patiënt.
- Als worminfecties als voedselinfectie bij 2 of meer personen voorkomen met een onderlinge relatie wijzend op hetzelfde voedsel als bron geldt wel een meldingsplicht bij het GGD.
Worminfecties waarvoor meldingsplicht bestaat zijn trichinose (een importworminfectie) en in zijn algemeenheid alle voedselinfecties (door in dit geval wormen) voor zover vastgesteld bij twee of meer patiënten met een onderlinge relatie wijzend op voedsel als bron (zie: www.rivm.nl/Onderwerpen/M/Meldingsplicht_infectieziekten/Welke_infectieziekten_zijn_meldingsplichtig, geraadpleegd d.d. 25-09-25). Zo kan het eten van (besmet) vlees of vis dat aan de binnenkant niet gaar is, of rauwe schelpdieren, een voedselinfectie veroorzaken.
Controle
Naar Samenvatting ›- Instrueer de patiënt (telefonisch) contact op te nemen als spoel-, zweep- of runderlintworm na medicamenteuze therapie toch weer zichtbaar zijn.
- Instrueer een patiënt met enterobiasis die na een kuur jeukklachten houdt en bij wie nog geen lichamelijk onderzoek plaatsvond en de worm niet was geïdentificeerd om op het spreekuur te komen voor lichamelijk onderzoek en een plakbandproef.
Consultatie en verwijzing
Naar Samenvatting ›- Verwijs naar een internist bij een aangetoonde infectie met varkenslintworm (T. solium) om mogelijke weefselinfestatie vast te stellen en voor behandeling van gezinsleden.
- Overleg met een parasitoloog/arts-microbioloog als een worminfectie persisteert na een volledige kuur (bij enterobiasis na 2 kuren). Bespreekpunten:
- op basis van welke bevindingen is de diagnose gesteld
- mogelijke besmettingsbron
- aanvullende hygiënische maatregelen
- mogelijke, aanvullende medicamenteuze (off-label) adviezen
|
Wormsoort |
Enterobius vermicularis |
Spoelworm |
Zweepworm |
Runderlintworm: |
|---|---|---|---|---|
|
Uiterlijke kenmerken |
|
|
|
|
|
Belangrijkste klacht |
jeuk rond anus/vulva |
zien van worm |
zien van worm |
zien van wormsegment(en) |
|
Diagnostiek |
visuele identificatie worm(deel): bij twijfel door laboratorium |
|||
|
Diagnostiek (eitjes) als er geen worm gezien is |
plakbandproef |
fecesonderzoek |
fecesonderzoek |
fecesonderzoek |
|
Let op |
|
|
|
altijd worm(deel) insturen ter uitsluiting varkenslintworm |
|
(Her)besmetting in gezin |
Ja |
nee |
Nee |
Nee |
|
Voorkomen van besmetting |
|
|
vlees goed gaar maken |
|
|
Medicamenteuze behandeling |
mebendazol ≥ 2 jaar: 100 mg en nogmaals na 14 dagen |
mebendazol > 1 maand: 2 dd 100 mg, gedurende 3 dagen |
mebendazol > 1 maand: 2 dd 100 mg, gedurende 3 dagen |
niclosamide: |
Iemand die besmet is met de varkenslintworm kan andere huisgenoten besmetten, in tegenstelling tot iemand die besmet is met de runderlintworm. Daarom zijn bij varkenslintworminfecties preventieve maatregelen belangrijk om feco-orale overdracht tegen te gaan, zoals:
- handen wassen na elke toiletgang
- dagelijks reinigen van wc (bril en overal waar men met de handen aan zit)
- dagelijks billen en anus wassen
- dagelijks schoon ondergoed en handdoeken gebruiken en wassen op 60 °C
- beddengoed frequent verschonen en wassen op 60 °C
Deze maatregelen dienen te worden geadviseerd in aanvulling op de medicamenteuze therapie totdat deze succesvol is. Omdat deze therapie bij een varkenslintworm door de specialist wordt gestart, zal de specialist deze adviezen geven.
Een belangrijke maatregelen om een (volgende) infectie door besmet varkensvlees te voorkomen is om alleen varkensvlees te eten als het goed verhit is geweest.
Honden- of kattenspoelworm
Naar Samenvatting ›Toxocara-infecties zijn endemische worminfecties, waarbij de mens als toevallige gastheer fungeert en bij wie de larven niet volwassen worden. Een infectie geeft zelden klachten. Als die er zijn, worden ze veroorzaakt door weefselmigratie. Dan is verwijzing geïndiceerd. Preventieve maatregelen zijn zinvol.
Besmetting
- Honden- en kattenspoelwormen (Toxocara canis en -cati) komen voor bij bijna alle jonge honden en katten.
- De eieren komen met de feces van dieren in het milieu. Na 2 tot 4 weken uitrijpen in de grond worden de eitjes infectieus. Directe overdracht van honden en katten naar de mens vindt daarom niet plaats en de infectie kan niet van mens tot mens worden overgedragen.
- De mens wordt besmet door ingestie van besmette grond (spelen in zandbak, tuinieren, slecht gewassen groente) of (zeldzaam) door het eten van met larven besmet vlees (zoals van het konijn).
- Na ingestie migreren de larven door de darmwand en via de bloedbaan naar diverse organen. De larven zijn echter niet goed aangepast aan de mens en ze sterven na enige tijd. De worm of de eitjes komen dus niet voor in menselijke feces en de infectie kan bij de mens alleen serologisch worden aangetoond.
Klachten
- Een infectie (toxocariasis) bij de mens verloopt vaak asymptomatisch of soms met milde en aspecifieke voorbijgaande griepachtige verschijnselen.
- In Nederland was in 2007 8% van de bevolking seropositief. De discrepantie tussen het hoge percentage seropositieven en de zeldzaamheid van patiënten met een actieve infectie maakt het waarschijnlijk dat de meeste mensen geen last hebben van toxocara.
- Bij massale besmetting kan het beeld van een ‘viscerale larva migrans’-syndroom optreden als migratie van de larven plaatsvindt naar diverse organen, zoals longen, lever en hersenen (soms ogen). Deze fase kan lang duren. In de huisartsenpraktijk is dit zeer zeldzaam.
- Vermoeden van het ‘viscerale larva migrans’-syndroom ontstaat bijvoorbeeld als bij klachten en koorts een leukocytenbepaling met leukocytendifferentiatie is aangevraagd en deze eosinofilie laat zien of bij longklachten zoals piepen en hoesten (en soms buikpijnklachten met hepato-/splenomegalie) die niet reageren op therapie. Vaak betreft het een kind van 2 tot 4 jaar.
Diagnostiek en verwijzing
- Serologisch onderzoek in de eerste lijn wordt niet geadviseerd.
- Bij asymptomatische patiënten is er geen reden om diagnostiek te doen, omdat seropositiviteit niet tussen een vroegere en een actieve infectie differentieert en omdat er bij asymptomatische patiënten geen behandeladvies is.
- Bij symptomatische patiënten is de interpretatie van de uitslag van serologisch onderzoek in relatie tot de klachten moeilijk en hoort daarom thuis in de tweede lijn, net zoals eventuele behandeling.
- Verwijs bij vermoeden van het viscerale larva migrans-symdroom.
Preventieve maatregelen
Hiermee kan massale besmetting voorkomen worden. De effectiviteit hiervan is echter niet aangetoond.
- Handenwassen na buitenspelen of na grondcontact
- Tegengaan van het eten van aarde (geofagie) bij kinderen
- Afdekken van zandbakken als deze niet in gebruik zijn
- Weghouden van huisdieren bij speelvelden
- Routinematig ontwormen van honden, katten en adequate afvoer van dierenfeces
- Eitjes zijn niet gevoelig voor huishouddesinfectantia.
Aan de informatie over honden- en kattenspoelwormen liggen verschillende publicaties ten grondslag: seropositiviteit in de bevolking, onbekendheid over actieve besmetting, preventieve maatregelen, de veronderstelling dat de besmettingslast van eitjes laag is en bijdraagt aan het kleine aantal besmettingen waarbij symptomen optreden, het ontbreken van een aanbeveling voor de behandeling van asymptomatische patiënten die serologisch positief zijn en de gevoeligheid van eitjes voor huishouddesinfectantia. Zie voor preventieve adviezen www.rivm.nl/Onderwerpen/Z/Ziek_door_dier:Pf53FOlkT1K_YoCjhiaZwA/Besmettingsroutes/Wandelen_en_kamperen, geraadpleegd 17-09-18. Zie voor meer informatie Toxocara, de site van de Nederlandse Vereniging voor Parasitologie (NVP): http://oud.parasitologie.nl/index.php?id=200.
Importworminfecties
Naar Samenvatting ›Diverse worminfecties zijn in Nederland alleen als importziekte aanwezig. Enkele daarvan komen met enige regelmaat voor, met name infecties met Schistosoma-soorten, Strongyloides stercoralis, Echinococcus en mijnwormen. Zie voor meer informatie over importworminfecties de website www.huisarts-migrant.nl.
Migranten, reizigers en adoptiekinderen uit de (sub)tropen kunnen klachten hebben die veroorzaakt worden door lokaal opgelopen worminfecties. Voor adoptiekinderen bestaat een screeningsprogramma door de kinderarts.
Klachten
Denk aan importworminfecties als klachten optreden in aansluiting op een bezoek aan de (sub)tropen, zoals:
- een migrerende huidafwijking
- ‘Larva migrans’, veroorzaakt door honden- of kattenmijnwormen.
Er is een grillige jeukende erythemateuze uitslag op plaatsen die met de grond in contact zijn geweest, de infectie blijft beperkt tot de huid. De behandeling is expectatief, bij ernstige klachten wordt ivermectine of als alternatief albendazol gegeven. - Strongyloides stercoralis
- Mijnwormen
Deze worm veroorzaakt vaker een kortdurende jeukende dermatitis.
- ‘Larva migrans’, veroorzaakt door honden- of kattenmijnwormen.
- griepklachten of koorts 2 tot 6 weken na een zoetwatercontact in de (sub)tropen en/of een swimmers itch. Hierbij moet gedacht worden aan schistosomiasis.
- het zien van een worm(deel) of larve. Stuur de worm samen met ontlasting voor determinatie in alvorens, in geval van een tropische worminfectie, te verwijzen.
Klachten kunnen ook pas langere tijd na een bezoek aan de (sub)tropen optreden. Deze klachten kunnen afhankelijk zijn van het orgaan waarin de worm of larve zich manifesteert.
- Diverse importwormen kunnen maag-darmklachten geven, maar een aantal van deze infecties wordt niet ontdekt door fecesdiagnostiek.
- Echinococcus kan de oorzaak zijn van leverfunctiestoornissen en levercysten
- Schistosomiasis kan de oorzaak zijn van hematurie, bloederig semen en nierfunctiestoornissen of vergroting van lever of milt.
- Denk bij epilepsie na tropenbezoek ook aan worminfecties (bijvoorbeeld door cysticercosis bij de varkenslintworm of bij bepaalde schistosomasoorten).
Eosinofilie
Eosinofilie wordt soms door een importworminfectie veroorzaakt, maar kan ook vele andere verklaringen hebben. Eosinofilie toont een worminfectie niet aan; het ontbreken van eosinofilie sluit een worminfectie niet uit. Daarom is het niet zinvol om na een tropenreis een onderzoek te doen naar eosinofilie.
Rauwe vis of rauw vlees
Klachten na het eten van rauwe of niet goed verhitte vis (haringworm, brede vissenlintworm of leverbot) of vlees of vleesproducten van wild of niet gekeurd vlees of worst (trichinose), of besmette bosvruchten (vossen- of hondenlintworm) kan doen denken aan een worminfectie. Subtropen moet daarbij soms ruim worden geïnterpreteerd: in de ons omringende landen en de grensstreken komen onder andere vossen- en hondenlintwormen voor.
Verwijzing
In de meeste huisartsenpraktijken zullen vragen over importworminfecties zeldzaam zijn. Bij een vermoeden van importworminfecties is de diagnostiek ingewikkeld en meestal niet het kennisgebied van de huisarts. Verwijs daarom, al dan niet na consultatie met de arts-microbioloog of parasitoloog van het laboratorium, naar de tweede- of derde lijn (internist-infectioloog of kinderarts-infectioloog) voor diagnostiek en behandeling.
In een prospectief onderzoek (2008-2011) onder Nederlanders die gedurende 12 tot 52 weken reisden naar (sub)tropische landen (n = 604) bleken vooraf bij 13 personen antistoffen tegen schistosomasoorten (n = 5), Strongyloides stercoralis (n = 3), filariasis (n = 4) of toxocara-soorten (n = 1) aanwezig. Na terugkomst werden titerstijgingen gevonden, wijzend op een opgedane infectie bij 10 personen: schistosomasoorten (n = 3), S. stercoralis (n = 1), filariasis (n = 6).
Conclusie
Circa 2% van de mensen die gedurende langere tijd in de (sub)tropen verblijft loopt daar een worminfectie op.
Schistosoma (oude naam: bilharzia) kent een aantal subspecies met alle een verschillend verspreidingsgebied. Besmetting vindt plaats doordat Schistosoma -larven uit zoet water waarin met Schistosoma -larven geïnfecteerde zoetwaterslakken leven (meertjes, rivieren, rijstakkers) met de huid van de mens in contact komen en deze doordringen. Via de bloedbaan verspreiden de larven zich in het menselijk lichaam naar darmen, lever of urinewegen, waar ze eitjes leggen. Een deel wordt uitgescheiden met feces of urine en ontwikkelt zich in zoet water tot een larve, die de slak penetreren. Een ander deel blijft in het lichaam en geeft klachten. De klachten kunnen wisselen en worden ingedeeld naar stadium van infectie: de swimmers itch of zwemmersjeuk, waarbij snel na besmetting jeuk en een papulaire huiduitslag optreedt op de plaats waar de parasieten de huid binnendringen, een acuut stadium 2 tot 6 weken na infectie met koorts, malaise, droge hoest en gelaatsoedeem, soms klierzwelling en hepatosplenomegalie en vaak eosinofilie (katayamasyndroom) en de gevestigde infectie met darmschistosomiasis (buikpijn, diarree, met bloed/slijm) of blaasschistosomiasis (pijnloze hematurie, dysurie, pollakisurie). Ook in Nederland kan men zwemmersjeuk oplopen door contact met besmet oppervlaktewater met larven van vogelschistosoma. Deze larven geven dermatitis na contact, maar kunnen zich in de mens niet verder ontwikkelen en geven afgezien van de zwemmersjeuk geen ziekteverschijnselen. Voor meer informatie zie de site huisarts-migrant (www.huisarts-migrant.nl/schistosomiasis-of-bilharziose/) of de site van de Nederlandse Vereniging voor Parasitologie (http://oud.parasitologie.nl/index.php?id=152).
S. stercoralis is gebonden aan (sub)tropische gebieden met gebrekkige sanitaire omstandigheden. Larven uit feces komen op de grond en worden binnen 2 dagen besmettelijk. Zij dringen de huid binnen en na een longpassage en migratie naar de darm ontwikkelen zij zich tot een volwassen worm van 2 tot 3 mm lang in het slijmvlies van duodenum/jejunum.
De verschijnselen kunnen lang na bezoek aan de tropen optreden. Het dermatitisbeeld bij S. stercoralis wordt net zoals bij (dieren)mijnwormen vaak cutane larva migrans genoemd, maar de typische klinische beelden verschillen onderling. Bij S. stercoralis is er vaker een symptoomloze lineaire, brede huiduitslag, soms intermitterend voor enkele uren aanwezig, waarbij de migratiesnelheid van de afwijking veel hoger kan zijn dan bij dierenmijnworm. Ook migrerende urticariële strepen (larva currens) komen voor, waarschijnlijk een reactie op voortkruipende larven. Longpassage kan longklachten geven zoals hoesten, astma-achtige klachten of het löfflersyndroom (pneumonie met infiltraten op de X-thorax en bloedeosinofilie). Wormen in de darm kunnen leiden tot pijn in de bovenbuik en chronische of intermitterende diarree. Veel infecties verlopen zonder klachten. Vaak is er sterke bloedeosinofilie.
Deze worm heeft als bijzonderheid dat de infectie zichzelf kan onderhouden, doordat eitjes zich al in de darm ontwikkelen tot infectieuze larven, die via de darmwand of rond de anus opnieuw het lichaam kunnen binnendringen. Bij ex-krijgsgevangenen uit Nederlands-Indië werd de worm na 40 jaar soms nog gevonden. Bij immunosuppressie kunnen larven in alle organen binnendringen en een zeer ernstige infectie veroorzaken. Dit heeft als consequentie dat het raadzaam is om bij mensen die afkomstig zijn uit een endemisch gebied onderzoek te doen naar strongyloidiasis alvorens immunosuppressieve therapie te starten. Als infectie met S. stercoralis wordt vastgesteld is behandeling altijd nodig. Ivermectine is het middel van voorkeur, alternatief is albendazol (in Nederland offlabel): zie de richtlijn van de NVP.
Voor meer informatie de site huisarts-migrant (www.huisarts-migrant.nl/strongyloides-stercoralis) of de site van de Nederlandse Vereniging voor Parasitologie (http://oud.parasitologie.nl/index.php?id=198).
Mijnwormen (Ancylostoma duodenale en Necator americanus , Engels: hookworm) kwamen vroeger in Nederland voor in warme en vochtige mijnen. Nu de mijnen zijn gesloten is mijnworminfectie een importziekte geworden uit (sub)tropische gebieden. Infectieuze larven van mijnwormen penetreren de huid, vaak de voetzool, en migreren via de longen en trachea naar het maag-darmkanaal. Daar ontwikkelen de wormen die zich hechten aan het slijmvlies van de dunne darm. Mijnwormen zijn ongeveer 1 centimeter lang. De wormen scheiden eitjes af die via de feces het lichaam verlaten en op de grond terechtkomen. Na ongeveer 1 week buiten het lichaam ontwikkelen de eitjes zich tot infectieuze larven. De infectie kan daarom niet rechtstreeks van mens tot mens worden overgedragen.
Lichte infecties verlopen asymptomatisch. Larven die de huid infecteren kunnen een dermatitis veroorzaken of onderhuidse gangetjes veroorzaken (cutane larva migrans). Longpassage kan een (milde) pneumonie geven. Ook kunnen epigastrische pijn, inflammatoire diarree of andere buikklachten optreden. Eosinofilie treedt meestal op. Bij massale infectie is (ijzergebreks)anemie het voornaamste symptoom.
De infectie kan worden aangetoond door onderzoek van ongefixeerde ontlasting naar eitjes.
De therapie voor volwassenen en kinderen > 6 jaar bestaat uit albendazol als eerste keus, 1 dd 400 mg gedurende 3 dagen conform de therapierichtlijn Parasitaire infecties van de Nederlandse Vereniging voor Parasitologie.
Voor meer informatie over mijnwormen zie de site huisarts-migrant (www.huisarts-migrant.nl/mijnwormen-ancylostoma/) of de site van de Nederlandse Vereniging voor Parasitologie (http://oud.parasitologie.nl/index.php?id=186, respectievelijk http://oud.parasitologie.nl/index.php?id=187).
Eitjes van dierenmijnwormen worden via de feces van honden en katten uitgescheiden en groeien in de grond uit tot larven. De dierenmijnwormlarven kunnen de intacte huid van de mens penetreren, maar omdat de mens niet de natuurlijke gastheer is, overlijden de larven binnen enkele weken tot maanden. Zij kunnen een heftig jeukende serpigineuze of grillige erythemateuze huiduitslag geven, soms met bullae direct na tropenbezoek. De afwijking migreert met enkele millimeters tot centimeters per dag. Dit wordt cutane larva migrans (creeping eruption) genoemd. Behandeling is niet noodzakelijk, vanwege het zelflimiterende karakter, maar kan geïndiceerd zijn bij veel jeuk of cosmetisch storende plekken. De infectie kan worden voorkomen door in tropische gebieden niet op blote voeten te lopen en niet zonder handdoek op het strand te liggen. Voor meer informatie zie de website van huisarts-migrant (http://www.huisarts-migrant.nl/cutane-larva-migrans/).
Zowel de site huisarts migrant (https://www.huisarts-migrant.nl/cutane-larva-migrans/) als de Nederlandse Vereniging voor Parasitologie noemen dezelfde middelen. Bij albendazol adviseert de NVP echter een iets langere behandelduur.
Dit standpunt berust op consensus en is overgenomen van de NVP en de NVMM.
Eosinofilie bij worminfectiesontstaat vooral bij weefselinvasie van wormen, maar kan afwezig zijn, bijvoorbeeld bij afgegrensde infecties. Het aantal eosinofielen per mm3 bij een worminfectie is afhankelijk van verschillende factoren, zoals het soort worm, de totale parasietenlast, de vraag of het de 1e of een herinfectie betreft en de tijd verstreken sinds de infectie begon. Het aantal eosinofielen differentieert echter niet tussen de verschillende soorten wormen.
Eosinofilie kan een toevalsbevinding zijn bij het aanvragen van een differentiatie van witte bloedcellen, waarbij een van de mogelijke oorzaken een worminfectie is. Eosinofilie kan vele oorzaken hebben, zodat andere oorzaken ook dienen te worden uitgesloten. Een worminfectie wordt aangetoond door worm- of eideterminatie, of door het aantonen van specifieke antistoffen.
Referenties
- Stehouwer CDA, Koopmans RP. Leerboek interne geneeskunde. Houten: Bohn Stafleu van Loghum, 2017.
- Nederlandse Vereniging voor Parasitologie. Medische parasitologie. Handleiding bij de laboratoriumdiagnostiek. Utrecht: Syntax Media, 2017.
- Stricker T, Navratil F, Sennhauser FH. Vulvovaginitis in prepubertal girls. Arch Dis Child 2003;88:324-6.
- Mughini-Gras L, Harms M, Van Pelt W, Pinelli E, Kortbeek T. Seroepidemiology of human toxocara and ascaris infections in the Netherlands. Parasitol Res 2016;115:3779-94.
- Brooker SJ, Bundy DAP. Soil-transmitted helminths (geohelminths). Manson's tropical diseases, London: Saunders, 2014: 766-69.
- Graham CF. A device for the diagnosis of enterobius infection. Am J Trop Med Hyg 1941;s1-21:159-61.
- Kucik CJ, Martin GL, Sortor BV. Common intestinal parasites. Am Fam Physician 2004;69:1161-8.
- Shoup B. Diagnosis and management of pinworm infection. Primary Care Update for OB/GYNS 2001;8:240-3.
- Celiksoz A, Guler N, Guler G, Oztop AY, Degerli S. Prevalence of intestinal parasites in three socioeconomically-different regions of Sivas, Turkey. J Health Popul Nutr 2005;23:184-91.
- Saksirisampant W, Prownebon J, Kanmarnee P, Thaisom S, Yenthakam S, Nuchprayoon S. Prevalence of parasitism among students of the Karen hill-tribe in Mae Chame district, Chiang Mai province, Thailand. J Med Assoc Thai 2004;87 Suppl 2:S278-83.
- Cho SY, Kang SY. Significance of Scotch-tape anal swab technique in diagnosis of Enterobius vermicularis infection. Kisaengchunghak Chapchi 1975;13:102-14.
- Jeandron A, Abdyldaieva G, Usubalieva J, Ensink JH, Cox J, Matthys B, et al. Accuracy of the Kato-Katz, adhesive tape and FLOTAC techniques for helminth diagnosis among children in Kyrgyzstan. Acta Trop 2010;116:185-92.
- Hoepelman AIM, Kroes ACM, Sauerwein RW, Verbrugh HA, Nouwen JL. Leerboek microbiologie en infectieziekten. Kernboek. Houten: Bohn Stafleu van Loghum, 2016.
- Kuipers EJ. Leerboek maag-, darm- en leverziekten. Utrecht: De Tijdstroom, 2014.
- Ustianowski A, Zumla A. Eosinophilia in the returning traveler. Infect Dis Clin North Am 2012;26:781-9.
- Overbosch FW, Van Gool T, Matser A, Sonder GJB. Low incidence of helminth infections (schistosomiasis, strongyloidiasis, filariasis, toxocariasis) among Dutch long-term travelers: a prospective study, 2008-2011. PLoS One 2018;13:e0197770.
- Van Hellemond JJ, Van Genderen P, Hekker TAM, Kortbeek T, Mank T, Visser LG, et al. Therapierichtlijn parasitaire infecties 2016. Ga naar bron: Van Hellemond JJ, Van Genderen P, Hekker TAM, Kortbeek T, Mank T, Visser LG, et al. Therapierichtlijn parasitaire infecties 2016.
- Speich B, Moser W, Ali SM, Ame SM, Albonico M, Hattendorf J, et al. Efficacy and reinfection with soil-transmitted helminths 18-weeks post-treatment with albendazole-ivermectin, albendazole-mebendazole, albendazole-oxantel pamoate and mebendazole. Parasit Vectors 2016;9:123.
- Speich B, Ame SM, Ali SM, Alles R, Huwyler J, Hattendorf J, et al. Oxantel pamoate-albendazole for trichuris trichiura infection. N Engl J Med 2014;370:610-20.
- Speich B, Ali SM, Ame SM, Bogoch II, Alles R, Huwyler J, et al. Efficacy and safety of albendazole plus ivermectin, albendazole plus mebendazole, albendazole plus oxantel pamoate, and mebendazole alone against Trichuris trichiura and concomitant soil-transmitted helminth infections: A four-arm, randomised controlled trial. Lancet Infect Dis 2015;15:277-84.
- Ahmadi Jouybari T, Najaf Ghobadi K, Lotfi B, Alavi Majd H, Ahmadi NA, Rostami-Nejad M, et al. Evaluating effect of albendazole on trichuris trichiura infection: a systematic review article. Iran J Parasitol 2016;11:441-7.
- Keiser J, Utzinger J. Efficacy of current drugs against soil-transmitted helminth infections: systematic review and meta-analysis. JAMA 2008;299:1937-48.
- Moser W, Schindler C, Keiser J. Efficacy of recommended drugs against soil transmitted helminths: systematic review and network meta-analysis. BMJ 2017;358:j4307.
- Adegnika AA, Zinsou JF, Issifou S, Ateba-Ngoa U, Kassa RF, Feugap EN, et al. Randomized, controlled, assessor-blind clinical trial to assess the efficacy of single- versus repeated-dose albendazole to treat ascaris lumbricoides, trichuris trichiura, and hookworm infection. Antimicrob Agents Chemother 2014;58:2535-40.
- Mekonnen Z, Levecke B, Boulet G, Bogers JP, Vercruysse J. Efficacy of different albendazole and mebendazole regimens against heavy-intensity trichuris Trichiura infections in school children, Jimma Town, Ethiopia. Pathog Glob Health 2013;107:207-9.
- Namwanje H, Kabatereine NB, Olsen A. Efficacy of single and double doses of albendazole and mebendazole alone and in combination in the treatment of Trichuris trichiura in school-age children in Uganda. Trans R Soc Trop Med Hyg 2011;105:586-90.
- Steinmann P, Utzinger J, Du ZW, Jiang JY, Chen JX, Hattendorf J, et al. Efficacy of single-dose and triple-dose albendazole and mebendazole against soil-transmitted helminths and Taenia spp.: A randomized controlled trial. PLoS One 2011;6:e25003.
- WHO. Report of the WHO informal consultation on the use of praziquantel during pregnancy/lactation and albendazole/mebendazole in children under 24 months (2003). Ga naar bron: WHO. Report of the WHO informal consultation on the use of praziquantel during pregnancy/lactation and albendazole/mebendazole in children under 24 months (2003).
- Joseph SA, Montresor A, Casapia M, Pezo L, Gyorkos TW. Adverse events from a randomized, multi-arm, placebo-controlled trial of mebendazole in children 12-24 months of age. Am J Trop Med Hyg 2016;95:83-7.
- Woodhall D, Jones JL, Cantey PT, Wilkins PP, Montgomery SP. Neglected parasitic infections: what every family physician needs to know. Am Fam Physician 2014;89:803-11.
- Kortbeek LM, Mank TG. Epidemiologie van parasieten in Nederland Ned Tijdschr Klin Chem 1999;24:11-7.
- Schellekens JWG. Toxocara: wat moet ik daarmee? Tijdschr Huisartsgeneeskunde 1993;10:523-25.
-
De Vries T, Bakker A, Duijvestijn Y, Weel J, Wolthuis A. Laboratoriumdiagnostiek bij kinderen. Een praktische handleiding. Houten: Prelum Uitgevers, 2015. - Wetsteyn JC. Anthelminthica. Ned Tijdschr Geneeskd 1987;131:1379-84.