Fractuurpreventie
Begrippen
Naar Volledige tekst ›Osteoporose
Naar Volledige tekst ›Botontkalking waarbij de botmineraaldichtheid afneemt en de kans op fracturen toeneemt.
Secundaire osteoporose
Naar Volledige tekst ›Osteoporose als gevolg van een ziekte, vitamine D-gebrek of medicatie die leidt tot afname van de botmineraaldichtheid.
Osteomalacie
Naar Volledige tekst ›Vorm van secundaire osteoporose met als hoofdoorzaak een verminderde absorptie van calcium uit voedsel, ten gevolge van ernstig vitamine D-tekort. De resulterende secundaire hyper(para)thyreoïdie leidt tot verhoogde botombouw en botverlies.
Richtlijnen diagnostiek
Naar Volledige tekst ›Schat het risico op fracturen in bij:
- risicogroep 1: patiënten ≥ 50 jaar met een (wervel)fractuur < 2 jaar geleden
- risicogroep 2: patiënten ≥ 40 jaar met ≥ 4 stootkuren per jaar of systemisch gebruik van glucocorticoïden ≥ 3 maanden
- risicogroep 3: patiënten ≥ 60 jaar met vragen/risicofactoren voor een fractuur
Anamnese
Naar Volledige tekst ›Inventariseer het fractuurrisico (zie ook tabel h1):
- heupfractuur bij 1 van de ouders
- intoxicaties: roken en alcohol
- medicatie (vooral langdurig gebruik van systemische glucocorticoïden)
- aantal keren gevallen in het afgelopen jaar
Inventariseer het valrisico bij patiënten die het afgelopen jaar ≥ 2 keer gevallen zijn:
- fracturen in de afgelopen 2 jaar
- beperking van de mobiliteit
- angst om te vallen
- alcoholgebruik
- valrisicoverhogende medicatie
- somatische comorbiditeit (brilgebruik/verminderde visus, gehoorstoornissen, duizeligheid, voetproblemen (zoals neuropathie), urine-incontinentie, stemmingsstoornissen, cognitieve problemen
Lichamelijk onderzoek
Naar Volledige tekst ›- Beoordeel of er aanwijzingen zijn voor wervelfracturen.
- Bepaal de BMI.
- Beoordeel de mobiliteit bij verhoogd valrisico (bij twijfel: overweeg of verwijs voor een mobiliteitstest, zie Consultatie en verwijzing).
Aanvullend onderzoek
Naar Volledige tekst ›Voer een botdichtheidsmeting en beeldvormend onderzoek van de wervelkolom (DXA/VFA) uit bij 3 risicogroepen (zie Indicaties voor DXA en VFA).
- Bij indicatie voor medicamenteuze fractuurpreventie: bepaal vitamine D, calcium, TSH, creatinine, eGFR.
- Overweeg of overleg met de tweede lijn (zie Consultatie en verwijzing) voor aanvullend laboratoriumonderzoek bij verdenking op secundaire osteoporose:
- klachten passend bij hyper(para)thyreoïdie
- vermoeden van een maligniteit
- aanwezigheid van meerdere wervelfracturen
- aanwijzingen voor hypogonadisme
Evaluatie
Naar Volledige tekst ›- Beoordeel de aanwezigheid van behandelbare risicofactoren bij verhoogd valrisico.
- Bepaal of er een indicatie is voor medicamenteuze fractuurpreventie (zie tabel h2).
- Kijk apart naar behandelindicaties bij ≥ 4 stootkuren per jaar of ≥ 3 maanden gebruik van systemische glucocorticoïden (zie tabel h3).
- Als er sprake is van vitamine D < 30 nmol/l maak onderscheid tussen:
- bij verlaagd calcium: verwijs naar internist voor verder onderzoek naar osteomalacie
- bij klachten passend bij osteomalacie: overleg met internist
- bij normaal calcium en geen klachten passend bij osteomalacie: geef eerst vitamine D3 800IE/dag gedurende 6 weken alvorens te starten met medicamenteuze fractuurpreventie.
Richtlijnen beleid
Naar Volledige tekst ›Voorlichting en advies
Naar Volledige tekst ›- Geef leefstijladvies (zie Praktijkhandleiding Leefstijl).
- Geef voorlichting bij verhoogd valrisico, zoals relatie met alcoholgebruik, verminderde visus en verminderde balans.
- Adviseer gezonde voeding met een calciuminname van 1000-1100 mg/dag.
- Adviseer geen alcohol te drinken of maximaal 1 glas per dag en adviseer te stoppen met roken, indien relevant.
- Adviseer ≥ 2,5 uur per week te bewegen en regelmatig naar buiten te gaan met blootstelling van de huid aan buitenlicht.
- Ga na of valrisicoverhogende medicatie gestopt, aangepast of vervangen kan worden.
Vitamine D3
Naar Volledige tekst ›- Adviseer bij een indicatie voor medicamenteuze behandeling voor fractuurpreventie vitamine D 1 dd 800 IE (= 20 microg).
- Bij een vitamine D-spiegel < 30 nmol/l met normaal calcium en geen klachten: geef eerst vitamine D3 800IE/dag gedurende 6 weken alvorens te starten met medicatie voor fractuurpreventie.
Calcium
Naar Volledige tekst ›Adviseer calciumcarbonaat:
- 1000 mg/dag bij inname van < 2 standaard zuivelproducten per dag
- 500 mg/dag bij inname van 2-3 zuivelproducten per dag en bij kwetsbare ouderen
Medicamenteuze behandeling
Naar Volledige tekst ›Bij een indicatie voor medicamenteuze behandeling voor fractuurpreventie na uitsluiting van secundaire osteoporose (zie ook het laboratoriumonderzoek in de paragraaf Aanvullend onderzoek):
- besluit gezamenlijk over het instellen van medicamenteuze behandeling (zie tabel h2 en tabel h3).
- Eerste keus is een bisfosfonaat: alendroninezuur oraal wekelijks 70 mg of risedroninezuur oraal wekelijks 35 mg:
- ’s ochtends nuchter innemen met groot glas water, daarna 30 minuten rechtop en nuchter blijven
- bij eGFR < 30, leeftijd ≥ 75 jaar of beperkte levensverwachting: facultatief denosumab 60 mg s.c. 2 × per jaar
- bij gebitsklachten: adviseer gebitssanering (zie Gebitssanering).
Controles
Naar Volledige tekst ›- Controleer de therapietrouw 3 maanden na start bisfosfonaat, daarna jaarlijks.
- Evalueer orale bisfosfonaten na de standaard behandelingsduur van 5 jaar. Vervolg eventueel met een tweede cyclus van 5 jaar (voor behandelopties en vervolgbeleid zie tabel h4).
Consultatie en verwijzing
Naar Volledige tekst ›Internist
Naar Volledige tekst ›- Risicogroep 1 (patiënten ≥ 50 jaar met wervelfractuur), afhankelijk van aantal en ernst van de wervelfracturen gevonden bij aanvullend onderzoek (zie tabel h4).
- Risicogroep 2 (patiënten ≥ 40 jaar met ≥ 4 stootkuren per jaar of > 3 maanden systemisch glucocorticoïdengebruik) in verband met een zeer hoog fractuurrisico (zie tabel h3).
- Bij vermoeden van secundaire osteoporose met uitzondering van systemische glucocorticoïden die zijn gestart door de huisarts of vitamine D-deficiëntie.
- Bij een indicatie voor denosumab (zie Denosumab) of intraveneus zoledroninezuur of (zie Bisfosfonaten).
- Bij (vermoeden van) zeldzame bijwerkingen (osteonecrose van de kaak, spontane femurfracturen) door orale bisfosfonaten of denosumab.
- Bij overwegen te stoppen met denosumab.
- Bij osteoporose na de standaard behandelingsduur van orale bisfosfonaten (2 behandelcycli van 5 jaar, zie tabel h4).
Geriater of specialist ouderengeneeskunde (valpoli)
Naar Volledige tekst ›- Verwijs patiënten ≥ 65 jaar voor multifactoriële valrisicobeoordeling bij meerdere valrisicofactoren, herhaaldelijk vallen, val met bewustzijnsverlies en/of polyfarmacie, ernstige comorbiditeit.
- Verwijs patiënten met onvoldoende baat bij interventie door eerstelijns beweegspecialist (fysiotherapie of ergotherapie).
Fysio- of oefentherapeut
Naar Volledige tekst ›Verwijs voor uitbreiding van de lichaamsbeweging, begeleiding bij complexe comorbiditeit, mobiliteitstest, balans- en krachttraining.
Belangrijkste wijzigingen
Naar Samenvatting ›- De identificatie van risicogroepen is vereenvoudigd:
- risicogroep 1: patiënten ≥ 50 jaar met een fractuur < 2 jaar geleden
- risicogroep 2: patiënten ≥ 40 jaar met > 3 maanden gebruik van systemische glucocorticoïden
- risicogroep 3: patiënten ≥ 60 jaar met vragen/risicofactoren voor een fractuur
- De indicaties voor medicamenteuze behandeling en verwijzing naar de tweede lijn voor fractuurpreventie bij wervelfracturen zijn herzien (zie tabel h2 en tabel h3 ).
- Toegevoegd zijn aanbevelingen over controlebeleid na 5 en na 10 jaar gebruik van bisfosfonaten (zie tabel h4).
- Voortaan zijn bij langdurig gebruik van systemische glucocorticoïden een hoge leeftijd (≥ 75 jaar), hoge ziekteactiviteit en/of een hoge dosering (≥ 15 mg/dag) een indicatie voor verwijzing (zie tabel h3).
Kernboodschappen
Naar Samenvatting ›- Verricht op indicatie aanvullend onderzoek bij de 3 risicogroepen.
- Aanvullend onderzoek bestaat uit een botdichtsheidsmeting (dual-energy X-ray-absorptiometrie, DXA), een wervelhoogtemeting (vertebral fracture assessment, VFA), laboratoriumonderzoek en bepaling van het valrisico. Op basis van de uitslag van DXA en VFA wordt beoordeeld of er een indicatie is voor medicamenteuze behandeling.
- Verricht alleen laboratoriumonderzoek bij een indicatie voor medicamenteuze behandeling en bij vermoeden van secundaire osteoporose (of verwijs in dat geval).
- Bij een indicatie voor medicamenteuze behandeling zijn orale bisfosfonaten eerste keus. Geef alendroninezuur in drankvorm indien bisfosfonaten in tabletvorm niet verdragen worden.
- Overweeg zoledroninezuur i.v. of denosumab s.c. indien orale bisfosfonaten niet verdragen worden.
- Overweeg behandeling met denosumab (facultatief) in de huisartsenpraktijk alleen bij patiënten > 75 jaar of met een beperkte levensverwachting, bij wie te verwachten valt dat ze de medicatie levenslang zullen gebruiken.
- Bij stoppen van denosumab is nabehandeling met bisfosfonaten noodzakelijk.
Inleiding
Naar Samenvatting ›Scope
Naar Samenvatting ›De aanbevelingen in deze standaard hebben betrekking op 3 risicogroepen.
- Risicogroep 1: patiënten ≥ 50 jaar met een recente fractuur (< 2 jaar geleden) anders dan een fractuur van gelaat, schedel, vingers, tenen en cervicale wervelkolom. Doorgaans zullen dit mensen zijn met een door de huisarts gediagnosticeerde wervelfractuur. In deze standaard wordt risicogroep 1 aangeduid als ‘patiënten ≥ 50 jaar met een fractuur < 2 jaar geleden’.
- Risicogroep 2: patiënten ≥ 40 jaar aan wie een huisarts ≥ 4 stootkuren per jaar of langdurig (≥ 3 maanden) systemische glucocorticoïden heeft voorgeschreven (bijvoorbeeld vanwege polymyalgia rheumatica). In deze standaard wordt risicogroep 2 aangeduid als ‘patiënten ≥ 40 jaar met systemisch gebruik van glucocorticoïden ≥ 3 maanden’.
- Risicogroep 3: patiënten ≥ 60 jaar met vragen over osteoporose of fractuurrisico (bijvoorbeeld postmenopauzale vrouwen of mensen met osteoporose in de familie), of met een aanleiding om het fractuurrisico in kaart te brengen (laag lichaamsgewicht, roken, lengtevermindering, postuurverandering). In deze standaard wordt risicogroep 3 aangeduid als ‘patiënten ≥ 60 jaar met vragen/risicofactoren voor een fractuur’.
Deze standaard heeft betrekking op de preventie van fracturen bij patiënten ≥ 40 jaar bij wie het risico op fracturen ten minste verdubbeld is ten opzichte van de fractuurkans in de algemene bevolking.
Er was in de werkgroep discussie over de leeftijdsgrens van risicogroep 3: moest deze ≥ 50 of ≥ 60 jaar zijn? De scorelijst van risicofactoren (zie tabel h1) kent alleen punten toe aan patiënten ≥ 60 jaar. Maar huisartsen zien ook patiënten van 50-60 jaar op het spreekuur met vragen over hun fractuurrisico. Ook al heeft deze groep geen indicatie voor aanvullend onderzoek, toch kan de huisarts al wel leefstijladviezen geven, eventueel een valrisicoanalyse uitvoeren en vitamine D-suppletie voorschrijven.
Aangezien deze NHG-Standaard zich richt op risicogroepen met een indicatie voor aanvullend onderzoek is bij risicogroep 3 gekozen voor een leeftijdsgrens ≥ 60 jaar. De scorelijst van risicofactoren geeft aan wanneer patiënten in deze groep in aanmerking komen voor aanvullend onderzoek. Met name een wervelfractuur is een indicatie voor medicamenteuze behandeling (zie Medicamenteuze behandeling).
In deze standaard gaat het om de volgende fractuurlocaties: sternum/ribben, wervelkolom, clavicula, scapula, humerus, olecranon, radius/onderarm/pols, carpus, metacarpalia, bekken, acetabulum, femur proximaal/femur overig, patella, fibula, tibiaplateau, tibia (met of zonder fibula), enkel, calcaneus, talus, tarsusschacht, metatarsalia.
Niet meegenomen worden fractuurlocaties in aangezicht, schedel, vingers, tenen en cervicale wervelkolom, alsmede pathologische fracturen en fracturen na ernstig ongeval (multitrauma, val van grote hoogte).
Buiten de scope
Naar Samenvatting ›- Fractuurpreventie bij patiënten jonger dan benoemd bij de groepen van de Scope.
- Behandeling van patiënten met secundaire osteoporose door andere oorzaken dan systemische glucocorticoïdengebruik voorgeschreven door de huisarts (zie detail).
- Vrouwen met vroege menopauze. Deze vrouwen hebben op jongere leeftijd een hogere kans op een periode van versneld botverlies (zie NHG-Standaard De overgang).
Secundaire osteoporose: andere oorzaken
Het begrip secundaire osteoporose verwijst naar de aanwezigheid van aandoeningen en behandelingen van aandoeningen die osteoporose kunnen veroorzaken. De meeste van deze aandoeningen worden in de tweede lijn behandeld. Omdat er vaak sprake is van comorbiditeit waarbij fractuurrisicofactoren een rol spelen, is het moeilijk om bij deze patiënten een goede schatting van het fractuurrisico te maken.
Het is niet altijd duidelijk in welke mate aandoeningen en behandelingen onafhankelijk van elkaar en onafhankelijk van andere risicofactoren de kans op fracturen vergroten. Zo zal voor een patiënt die wegens ernstige COPD langdurig met glucocorticosteroïden wordt behandeld, het risico op een fractuur niet alleen worden bepaald door de medicatie, maar ook door verminderde mobiliteit ten gevolge van de COPD.
Aandoeningen waarvan bekend is dat ze een sterk verhoogd fractuurrisico geven en die (gedeeltelijk) in de eerste lijn behandeld worden, zijn diabetes mellitus type 1, diabetes mellitus type 2 met insulinebehandeling, COPD met ≥ 3 stootkuren per jaar, polymyalgia rheumatica, reumatische aandoeningen, ongecorrigeerde hyperthyreoïdie, inflammatoire darmziekten en coeliakie.
Zie Overzicht van aandoeningen met kans op secundaire osteoporose.
De preventie van fracturen bij secundaire osteoporose komt, met uitzondering van vitamine D-gebrek, polymyalgia rheumatica en COPD met frequente longaanvallen, in de huisartsenpraktijk weinig voor en is een taak van de behandelend medisch specialist, tenzij daarover andere lokale afspraken gemaakt zijn. Bij verwacht langdurig gebruik van hoge doses glucocorticosteroïden of ernstige COPD met frequente longaanvallen kan men aanvullend onderzoek naar osteoporose overwegen.
Overzicht van aandoeningen met kans op secundaire osteoporose
- Chronische ondervoeding of malabsorptie, coeliakie
- Inflammatoire darmziekten: ziekte van Crohn en colitis ulcerosa
- Orgaantransplantatie
- Diabetes mellitus type 1 (onafhankelijke risicofactor, ook indien onder controle)
- Diabetes mellitus type 2 met insulinebehandeling
- Schildklieraandoeningen: chronisch overgesubstitueerde hypothyreoïdie of onbehandelde hyperthyreoïdie
- Onbehandelde primaire hyperparathyreoïdie
- COPD met ≥ 3 stootkuren per jaar
- Reumatoïde artritis
- Andere chronische inflammatoire aandoeningen zoals spondylartropathie (ziekte van Bechterew), systemische lupus erythematodes en sarcoïdose
- Onbehandelde hypogonadisme bij mannen en vrouwen in het kader van behandeling van borstkanker en prostaatcarcinoom, bilaterale orchidectomie en ovariëctomie, anorexia nervosa, hypopituïtarisme
- Gebruik van anti-epileptica
- Syndroom van Cushing
- Vitamine D-gebrek
Samenwerking en afstemming
Naar Samenvatting ›Deze standaard sluit aan bij de Multidisciplinaire richtlijn Osteoporose en fractuurpreventie (2022).
Achtergronden
Naar Samenvatting ›Begrippen
Naar Samenvatting ›Botmineraaldichtheid (BMD)
Naar Samenvatting ›- De BMD is de dichtheid (g/cm2) van een gegeven stuk bot, dat wil zeggen de massa van het botmineraal gedeeld door de oppervlakte of area.
- Een lage BMD is een onafhankelijke risicofactor voor een fractuur.
- De BMD wordt bepaald met DXA.
- De BMD wordt uitgedrukt in een T-score:
- een T-score ≤ –2,5 duidt op osteoporose
- een T-score –1,0 tot –2,5 duidt op osteopenie
- een T-score ≥ –1,0 duidt op een normale BMD.
Medicatie voor fractuurpreventie
Naar Samenvatting ›Men onderscheidt medicatie die de botafbraak remt en medicatie die de botaanmaak stimuleert.
- Botafbraakremmende medicatie:
- bisfosfonaten (alendroninezuur en risedroninezuur oraal, zoledroninezuur i.v.)
- denosumab s.c. (facultatief voor de huisarts)
- raloxifeen (in de tweede lijn)
- Botaanmaakstimulerende medicatie (in de tweede lijn)
- teriparatide
- romosozumab
Osteomalacie
Naar Samenvatting ›Vorm van secundaire osteoporose, met als hoofdoorzaak verminderde absorptie van calcium uit voedsel ten gevolge van ernstig vitamine D-tekort. De resulterende secundaire hyper(para)thyreoïdie leidt tot verhoogde botombouw en botverlies (zie ook Vitamine D3). Symptomen van osteomalacie zijn bot- en gewrichtspijn, spierzwakte, stijfheid, moeite met lopen, fracturen en problemen met het gebit.
Osteoporose
Naar Samenvatting ›Botontkalking waarbij de botmineraaldichtheid afneemt en de stevigheid van het bot verloren gaat, waardoor de kans op fracturen toeneemt
Osteoporotische fractuur
Naar Samenvatting ›Alle fracturen die verband houden met een lage botdichtheid en waarvan de incidentie stijgt bij leeftijd > 50 jaar.
Recente niet-wervelfractuur
Naar Samenvatting ›Fractuur anders dan een wervelfractuur < 2 jaar geleden.
Secundaire osteoporose
Naar Samenvatting ›Osteoporose die (in belangrijke mate) het gevolg is van een ziekte (bijvoorbeeld hyperthyreoïdie), vitamine D-gebrek of medicatie die aanleiding geeft tot afname van de botmineraaldichtheid.
Vertebral fracture assessment (VFA)
Naar Samenvatting ›- VFA is een röntgenonderzoek waarbij de hoogte van de wervels (Th4-L5) wordt gemeten.
- Een VFA wordt gelijktijdig met DXA gemaakt.
- De wervels worden beoordeeld volgens de methode van Genant:
- graad 1 wervelfractuur (mild): hoogteverlies 20-24%
- graad 2 wervelfractuur (matig): hoogteverlies 25-39%
- graad 3 wervelfractuur (ernstig): hoogteverlies ≥ 40%
Wervelfractuur
Naar Samenvatting ›In het kader van fractuurpreventie is een wervelfractuur een fractuur van het onderste deel van de wervelkolom (Th4-L5) met een hoogteverlies ≥ 25% (≥ graad 2, zie verder Vertebral fracture assessment (VFA)). Deze standaard maakt geen onderscheid tussen symptomatische en asymptomatische wervelfracturen.
Epidemiologie
Naar Samenvatting ›- Van de mensen ≥ 50 jaar met een fractuur heeft 1 op de 3 osteoporose.
- Het aantal patiënten met osteoporose in de huisartsenpraktijk bedroeg in 2020 op basis van huisartsenregistraties naar schatting 507.200. De prevalentie wordt voor een groot deel bepaald door leeftijd en geslacht: er waren ongeveer 5 keer zoveel vrouwen als mannen met osteoporose (81.700 mannen versus 425.000 vrouwen).
- Zowel bij mannen als bij vrouwen neemt de prevalentie sterk toe met de leeftijd.
- Het aantal patiënten dat medicatie voor fractuurpreventie gebruikt, daalde in Nederland van 270.000 in 2012 tot 220.000 in 2021 (zie detail).
Dalende incidentie en zorgprevalentie van osteoporose
In 2020 waren bij de huisarts naar schatting 507.200 patiënten met osteoporose bekend, 81.700 mannen en 425.400 vrouwen (Osteoporose | leeftijd en geslacht, geraadpleegd 18 januari 2024). Er zijn dus veel meer vrouwen dan mannen met osteoporose: 48,5 per 1000 vrouwen versus 9,4 per 1000 mannen. De zorgprevalentie was echter veel lager: in 2020 waren voor osteoporose naar schatting 117.600 mensen onder behandeling bij de huisarts, of met medeweten van de huisarts in de tweede lijn: 17.400 mannen en 100.300 vrouwen (Nivel zorgregistraties eerste lijn, geraadpleegd 18 januari 2024). In de periode 2011-2020 is het aantal door de huisarts nieuw gediagnosticeerde vrouwen met osteoporose bijna gehalveerd en nam het aantal mannen af met ruim 20%. Deze trends zijn gecorrigeerd voor veranderingen in de omvang en leeftijdsopbouw van de bevolking.
Een van de belangrijkste bevindingen van het Verbetersignalement osteoporose van Zorginstituut Nederland en Zinnige Zorg (2020)
is dat osteoporose niet (tijdig) wordt gediagnosticeerd. Slechts iets meer dan een kwart van de patiënten ≥ 50 jaar kreeg na een fractuur een DXA (zie tabel d1). Onderzoek naar botdichtheid gebeurt dus onvoldoende.
| DXA gehad tussen 1 jaar voor en 1 jaar na fractuur | Aantal patiënten | % |
|---|---|---|
| Wel DXA | 31.750 | 26,3 |
| Geen DXA | 88.759 | 73,7 |
| Bron: Analyse van declaratiegegevens van zorgaanbieders, verstrekt door de NZa. Diemen: Zorginstituut Nederland 2019. | ||
In een andere onderzoeken werd bij ongeveer 40% van de 50-plussers met een fractuur die DXA/VFA ondergingen, een verminderde botkwaliteit vastgesteld: zij hadden osteoporose of osteopenie in combinatie met een wervelfractuur.
Van deze groep kreeg 39% aanvullend laboratoriumonderzoek. Dat bij zoveel patiënten geen diagnostiek plaatsvindt, heeft verschillende oorzaken. Die liggen enerzijds bij zorgverleners en anderzijds bij patiënten (zie Verbetersignalement osteoporose).
Onderbehandeling van osteoporose
Naast onderdiagnostiek bij 50-plussers is er ook sprake van onderbehandeling van osteoporose. Het aantal patiënten in Nederland dat medicatie voor fractuurpreventie gebruikt, daalt al enige jaren gestaag: van 270.000 in 2012 tot 220.000 in 2021. Gezien de demografische ontwikkeling en de daarmee samenhangende toename van het geschatte aantal patiënten met osteoporose is dit een aanwijzing voor toenemende onderbehandeling. Voor een deel kan dit komen doordat patiënten zelf geen medicatie voor fractuurpreventie willen gebruiken. Volgens een Nederlands onderzoek in huisartsenpraktijken in 2019 kwamen ruim 1400 patiënten in aanmerking voor botsparende medicatie, maar was ruim 30% niet gestart met de medicatie . In andere onderzoeken is gebleken dat de volgende oorzaken een rol kunnen spelen:
- bij patiënten:
- afkeer van medicijnen in het algemeen
- angst voor bijwerkingen
- lage inschatting van het fractuurrisico
- onvoldoende of onduidelijke informatie van de arts
- het gevoel dat de arts hun beslissing gemakkelijk accepteerde en daarmee instemde
- bij zorgverleners:
- twijfel over de effectiviteit van botsparende medicatie
- gebrek aan kennis over en bewustzijn van de urgentie van osteoporosezorg
Uit huisartsendossiers blijkt dat bij slechts 27% van de patiënten ≥ 50 jaar die een DXA kregen ook melding werd gemaakt van aanvullend onderzoek van de wervelkolom (zie Verbetersignalement osteoporose). Ongeveer de helft van deze patiënten kreeg een röntgenfoto van de wervelkolom, een kwart een VFA (zie figuur d1). Als er een VFA verricht was, was dit nagenoeg altijd (96%) tegelijkertijd met de DXA gedaan.
Figuur d1: Diagnostiek van de wervelkolom in eerstelijns patiënten ≥ 50 jaar met een DXA-scan (n = 8135)
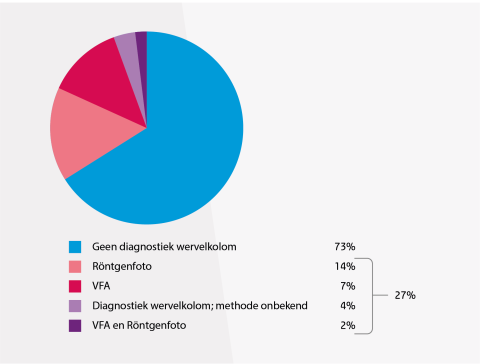
Beeldvormend onderzoek van de wervelkolom is om de volgende redenen belangrijk (zie MDR Osteoporose en fractuurpreventie, module Meerwaarde van aanvullende VFA bij diagnostiek met DXA (2022)).
- Wervelfracturen zijn bij mensen ≥ 50 jaar de meest frequente fracturen en hoogfrequent aanwezig bij patiënten met comorbiditeit.
- De meeste wervelfracturen (ongeveer 70%) geven geen klachten/symptomen en zijn aanwezig zonder uitlokkend trauma. Ook wervelfracturen ontstaan door een trauma met hoge impact geven een groter toekomstig fractuurrisico.
- De meeste wervelfracturen worden vastgesteld met beeldvormend onderzoek.
- Wervelfracturen zijn een onafhankelijke voorspeller van toekomstige fracturen en leveren dus relevante informatie op over het risicoprofiel inzake fracturen.
- Aanwezigheid van een wervelfractuur kan het verschil maken tussen wel of niet behandelen. Dit geldt vooral voor patiënten wij wie BMD en risicofactoren nog geen indicatie vormen voor medicamenteuze fractuurpreventie, bijvoorbeeld patiënten met osteopenie.
- Bij de follow-up van de behandeling is het van belang om vast te stellen of er nieuwe fracturen ontstaan onder medicatie. Dit kan beschouwd worden als therapiefalen.
Etiologie en pathofysiologie
Naar Samenvatting ›Osteoporose
Naar Samenvatting ›- Osteoporose is het gevolg van een verstoorde balans tussen botafbraak en botaanmaak:
- onvoldoende botaanmaak tijdens de groei
- excessieve botafbraak
- onvoldoende botaanmaak in relatie tot botafbraak
- Vooral met het toenemen van de leeftijd wordt meer bot afgebroken dan aangemaakt en kan osteoporose ontstaan. Mogelijke oorzaken:
- onvoldoende lichaamsbeweging
- te weinig calcium in de voeding
- onvoldoende blootstelling aan buitenlicht (met als gevolg onvoldoende aanmaak van vitamine D)
- hormonale veranderingen bij vrouwen in de overgang
Osteoporose
De belangrijkste materiaaleigenschappen van het bot worden gevormd door de organische matrix, die hoofdzakelijk bestaat uit collageen en de daarin ingebedde mineralen. Het collageen is verantwoordelijk voor de elastische eigenschappen van het bot, terwijl de minerale component voor stijfheid zorgt. De collageen-mineraalratio bepaalt de kwaliteit van het botweefsel. Het botweefsel wordt continu onderhouden en geremodelleerd door osteoclasten (botafbraak) en osteoblasten (botformatie). De snelheid van botombouw draagt bij aan de botkwaliteit: een te hoge botombouw veroorzaakt toegenomen botafbraak en minder goed gemineraliseerd bot, waardoor de stevigheid afneemt.
Fracturen
Fracturen als gevolg van osteoporose zijn voornamelijk gelokaliseerd in wervelkolom, heup en bovenarm. Osteoporotische fracturen zijn alle fracturen die samenhangen met een lage botdichtheid en waarvan de incidentie stijgt na de leeftijd van 50 jaar (dus onafhankelijk van de gevolgen van trauma).
Wervelfracturen
Een veelvoorkomende osteoporotische fractuur is de wervelfractuur. De prevalentie van wervelfracturen neemt toe met de leeftijd, vooral bij patiënten met comorbiditeit. Geriatrische patiënten hebben een kans van 50% op ≥ 1 wervelfractuur. Van deze patiënten had 35% een matige of ernstige wervelfractuur (graad 2 of 3).
Risicofactoren en prognose
Naar Samenvatting ›Risicofactoren
Naar Samenvatting ›- Osteoporose geeft geen klachten, maar vergroot wel de kans op fracturen.
- Andere risicofactoren voor een fractuur zijn: vrouwelijk geslacht, eerdere fracturen, hogere leeftijd, lagere BMD, lage BMI, langdurig systemisch glucocorticoïdgebruik, roken, alcoholgebruik, lage SES, positieve familieanamnese voor heupfracturen, suboptimale behandeling bij ernstige aandoeningen met verhoogd fractuurrisico, immobiliteit en valrisico.
Fractuurrisico
Naar Samenvatting ›Het risico op fracturen is verhoogd bij 3 groepen patiënten.
Risicogroep 1: patiënten ≥ 50 jaar met een fractuur < 2 jaar geleden
Het risico op een nieuwe fractuur is vooral in de eerste 2 jaar verhoogd (3-12 keer ten opzichte van patiënten zonder fracturen). Het risico neemt in de daaropvolgende 10 jaar geleidelijk af, maar blijft 2 keer zo hoog.
Risicogroep 2: patiënten ≥ 40 jaar met systemisch gebruik van glucocorticoïden ≥ 3 maanden
Het absolute risico op met name wervelfracturen is verhoogd tijdens ≥ 4 stootkuren per jaar of langdurige behandeling (≥ 3 maanden) met systemische glucocorticoïden. Het fractuurrisico neemt toe bij:
- hogere dosering (zie tabel d2)
- hogere leeftijd
- lagere BMD
- recente fractuur
- hoge ziekteactiviteit van een onderliggende aandoening waarvoor systemische glucocorticoïden gebruikt worden
Risicogroep 3: patiënten ≥ 60 jaar met vragen/risicofactoren voor een fractuur
Het absolute tienjaarsrisico op een fractuur is 5-8% voor patiënten ≥ 60 jaar. Dit risico neemt toe met de leeftijd: het is 11-31% voor patiënten ≥ 70 jaar (zie tabel d3). Het betreft vooral wervelfracturen.
Prognose
Fractuurrisico in groep 1, patiënten ≥ 50 jaar met een fractuur < 2 jaar geleden
Het absolute risico op een nieuwe fractuur voor deze groep (data afkomstig van postmenopauzale vrouwen) is 6% in het eerste jaar, 16% in de eerste 5 jaar en 27% in de 10 jaar na een eerdere fractuur. Het absolute risico op een nieuwe fractuur is hoger naarmate de patiënt ouder is. Een opgetreden fractuur bij een persoon ≥ 50 jaar is een belangrijk signaal omdat het risico op nieuwe fracturen hiermee verdubbeld is ten opzichte van personen zonder eerdere fractuur, onafhankelijk van leeftijd, BMD en fractuurlocatie. Het risico op een nieuwe fractuur is echter niet constant in de tijd, maar is 3 tot 12 keer verhoogd in de eerste 2 jaar na een fractuur en neemt geleidelijk af in de daaropvolgende 10 jaar maar blijft ook dan nog tweevoudig verhoogd.
Fractuurrisico in groep 2, patiënten ≥ 40 jaar met systemisch gebruik van glucocorticoïden ≥ 3 maanden
Met name het risico op wervelfracturen is verhoogd in deze groep.
Bij postmenopauzale vrouwen van gemiddeld 65 jaar die gedurende > 6 maanden ≥ 7,5 mg systemische glucocorticoïden per dag gebruikten, bleek de eenjaarsincidentie van wervelfracturen ongeveer 16%. Deze incidentie was ruim 2 keer zo hoog als bij postmenopauzale vrouwen die geen systemische glucocorticoïden gebruikten (7%); deze vrouwen waren bovendien gemiddeld bijna 10 jaar ouder.
Het risico neemt ook toe bij een hogere dosis (zie tabel d2).
Het berekenen van een NNT is lastig omdat de absolute risicoreductie niet goed bekend is. In een netwerkmeta-analyse werden bij gebruikers van orale glucocorticoïden reducties in wervelfracturen gevonden voor risedroninezuur (HR 0,33; 95%-BI 0,19 tot 0,58), teriparatide (HR 0,11; 95%-BI 0,03 tot 0,47) en denosumab (HR 0,21; 95%-BI 0,09 tot 0,49) ten opzichte van placebo.
Bij niet-wervelfracturen en heupfracturen werden voor bovengenoemde medicamenten geen klinische verschillen gevonden.
| RR (95%-BI ) | RR (95%-BI ) | RR (95%-BI ) | |
|---|---|---|---|
| Prednisondosis | < 2,5 mg/dag | 2,5-7,5 mg/dag | ≥ 7,5 mg/dag |
| Wervelfractuur | 1,55 (1,20 tot 2,01) | 2,59 (2,16-3,10) | 5,18 (4,25 tot 6,31) |
| Heupfractuur | Niet verhoogd | 1,77 (1,55 tot 2,02) | 2,27 (1,94 tot 2,66) |
| Data uit retrospectief cohortonderzoek in het Verenigd Koninkrijk van patiënten die de huisarts bezochten (gemiddelde leeftijd 57 jaar, ongeveer 60% vrouw). | |||
Fractuurrisico in groep 3, patiënten ≥ 60 jaar met vragen/risicofactoren voor een fractuur
Bij patiënten ≥ 70 jaar en een risicoscore ≥ 4 punten is het tienjaarsrisico op een fractuur ≥ 29% (tabel d3).
Dit risico neemt toe bij het ontstaan van meerdere fracturen. Dit is een onderschatting van het werkelijke risico, omdat het onderzoek in kwestie geen data bevatte over BMD en aanwezigheid van prevalente wervelfracturen (op basis van VFA). Naast BMD speelt een prevalente wervelfractuur wel degelijk een rol (zie tabel h2). De prevalentie van wervelfracturen neemt toe met de leeftijd, vooral bij patiënten met comorbiditeit. Dit bleek ook uit ander onderzoek: de helft van de geriatrische patiënten had ≥ 1 wervelfractuur
en 35% had zelfs matige of ernstige wervelfracturen (graad 2 of 3).
Het meewegen van prevalente wervelfracturen is belangrijk om de volgende redenen.
- Het is een onafhankelijke predictor van toekomstige fracturen.
- Het aantonen van een wervelfractuur bepaalt het verschil tussen wel of niet behandelen: een wervelfractuur ≥ graad 2, onafhankelijk van de BMD, is een indicatie om medicatie te starten (zie ook tabel h2).
- De aanwezigheid van wervelfracturen graad 2 en 3 is een indicatie voor een behandeling met medicatie in de tweede lijn.
| Aantal risicofactoren* | ||||
|---|---|---|---|---|
| 0 | 1 | 2 | 3 of 4 | |
| 60-69 jaar | 5% | 6% | 8% | NB |
| 70-79 jaar | 11% | 12% | 20% | 29% |
| ≥ 80 jaar | 12% | 24% | 35% | 31% |
NB = niet beschikbaar vanwege te lage power. Grijs gearceerde cijfers zijn de risico’s overeenkomend met risicoscore ≥ 4. * Fractuur in de voorgeschiedenis vanaf 50e levensjaar, lichaamsgewicht < 64 kg, gebruik van hulpmiddel bij het lopen, roken. Bron: 2 Nederlandse cohortonderzoeken onder vrouwen ≥ 60 jaar uit de algemene bevolking (LASA Amsterdam en ERGO Rotterdam). | ||||
Beloop
Kwaliteit van leven en mortaliteit na een fractuur
Er zijn 4 onderzoeken die aantonen dat de kwaliteit van leven verminderd is bij mensen na een wervelfractuur of een niet-wervelfractuur.
- Salaffi 2007. In een Italiaans onderzoek (n = 478) bleek bij mensen met een wervelfractuur de kwaliteit van leven, gemeten met de SF-36, significant verminderd op de domeinen lichamelijke pijn (p < 0,05), lichamelijk functioneren (p < 0,05) en rolbeperkingen door fysiek probleem (p < 0,01).
- Tosteson 2001. In een Amerikaans onderzoek gaven postmenopauzale vrouwen met ≥ 1 wervelfractuur (n = 114), een heupfractuur (n = 67) of geen fractuur (n = 201) de eigen perceptie van de gezondheidstoestand met de time trade-off-methode (0 = dood; 1 = perfecte gezondheid) aan als respectievelijk 0,82, 0,63 en 0,91.
- Lips 2005. In een Nederlands onderzoek bleek de kwaliteit van leven sterk gedaald zowel bij patiënten met een (klinische of subklinische) wervelfractuur als bij patiënten met een heupfractuur. Meerdere wervelfracturen en lumbale wervelfracturen hadden een grotere impact.
- Brenneman 2006. Een Amerikaans onderzoek bij postmenopauzale vrouwen (n = 86.128) toonde aan dat de kwaliteit van leven, gemeten met de SF-12, significant verminderd was (fysieke component p < 0,001, geestelijke component p < 0,004) na een osteoporosegerelateerde wervel, rib- of heupfractuur bij zowel oudere als jongere vrouwen.
In 2 prospectieve cohortonderzoeken bleek de mortaliteit verhoogd na een wervelfractuur of een niet-wervelfractuur.
- Bliuc 2009. In een Australisch cohortonderzoek (2245 vrouwen, 1760 mannen) was de standardized mortality rate (SMR) in vergelijking met de algemene bevolking bij heupfracturen 2,43 (95%-BI 2,02 tot 2,93) voor vrouwen en 3,51 (95%-BI 2,65 tot 4,66) voor mannen, en bij wervelfracturen 1,82 (95%-BI 1,52 tot 2,17) voor vrouwen en 2,12 (95%-BI 1,66 tot 2,72) voor mannen. Voor grotere fracturen (bekken, distale femur, proximale tibia, meerdere ribfracturen, proximale humerus) was SMR 1,65 (95%-BI 1,31 tot 2,08) voor vrouwen en 1,70 (95%-BI 1,23 tot 3,36) voor mannen. Voor kleinere fracturen (alle overige osteoporotische fracturen) werden wel significant verschillen gevonden bij vrouwen (1,42; 95%-BI 1,19 tot 1,70), maar niet bij mannen (1,33; 95%-BI 0,99 tot 1,80).
- Ioannidis 2009. Een Canadees cohortonderzoek bij mensen ≥ 50 jaar (n = 7753) met een follow-up van 5 jaar vond verhoogde mortaliteit zowel na een wervelfractuur (RR 2,7; 95%-BI 1,1 tot 6,6) als na een heupfractuur (RR 3,2; 95%-BI 1,4 tot 7,4).
Prognose
Naar Samenvatting ›- Vooral na een heupfractuur en bij meerdere wervelfracturen is de kwaliteit van leven duidelijk verminderd.
- De kans op overlijden is sterk verhoogd na een heupfractuur en bij meerdere wervelfracturen.
Richtlijnen diagnostiek
Naar Samenvatting ›Doel van de diagnostiek is het inschatten van het risico op fracturen bij 3 risicogroepen.
- risicogroep 1: patiënten ≥ 50 jaar met een (wervel)fractuur < 2 jaar geleden
- risicogroep 2: patiënten ≥ 40 jaar met systemisch gebruik van glucocorticoïden ≥ 3 maanden
- risicogroep 3: patiënten ≥ 60 jaar met vragen/risicofactoren voor een fractuur
Waarom deze aanbeveling?
De MDR Osteoporose en fractuurpreventie identificeert op basis van literatuuronderzoek 3 risicogroepen met een verhoogd absoluut risico op een fractuur, bij wie aanvullend onderzoek geïndiceerd is (zie MDR Osteoporose en fractuurpreventie, module Identificatie van personen met een verhoogd fractuurrisico (2022)).
Anamnese
Naar Samenvatting ›Inventariseer risicofactoren voor fracturen (zie ook tabel h1):
- heupfractuur bij 1 van de ouders (voor andere dan heupfracturen bij de ouders is een verhoogd risico niet aangetoond)
- intoxicaties: roken en alcohol
- medicatie (vooral langdurig gebruik van systemische glucocorticoïden)
- aantal keren gevallen in het afgelopen jaar
Inventariseer het valrisico bij patiënten die in het afgelopen jaar ≥ 2 keer gevallen zijn:
- fracturen in de afgelopen 2 jaar
- beperking van de mobiliteit (balans, lopen (met hulpmiddel), spierkracht)
- angst om te vallen
- alcoholgebruik
- valrisicoverhogende medicatie, zoals benzodiazepinen, bloeddrukverlagende middelen, opioïden en tricyclische antidepressiva (zie ook detail Inschatting van het valrisico)
- somatische comorbiditeit:
- brilgebruik/verminderde visus, gehoorstoornissen
- duizeligheid (orthostatische hypotensie, vestibulaire duizeligheid)
- voetproblemen, zoals neuropathie
- urine-incontinentie
- stemmingsstoornissen
- cognitieve problemen
Lichamelijk onderzoek
Naar Samenvatting ›- Beoordeel of er aanwijzingen zijn voor wervelfracturen: (verandering in) postuur, versterkte thoracale kyfose.
- Meet gewicht en lengte (zie detail), bepaal BMI.
- Beoordeel bij verhoogd valrisico de mobiliteit: evenwicht bij opstaan, looppatroon, kracht, balans, transfers. Bij vermoeden van verminderde mobiliteit kan een mobiliteitstest worden afgenomen (zie detail Inschatting van het valrisico).
Lengteverlies ≥ 5 cm is een onafhankelijke voorspeller voor zowel wervel- als niet-wervelfracturen.
De meest betrouwbare manier van meten is het gebruik van verschillende metingen in de tijd. Recent lengteverlies op hogere leeftijd blijkt de beste voorspeller. Bij het ontbreken van historische lengtegegevens kan lengteverlies bepaald worden door de maximaal bereikte lengte na te vragen en de gemeten lengte daarvan af te trekken.
Lengteverlies ≥ 5 cm is eveneens een onafhankelijke voorspeller voor fracturen en overlijden als gecorrigeerd wordt voor wervelfracturen. Waarschijnlijk is het ook een maat voor kwetsbaarheid (frailty) .
Lengteverlies ≥ 3 cm geeft een 3 maal zo hoge kans op een wervelfractuur.
Ook lengteverlies ≥ 2 cm binnen 3-4 jaar is een voorspeller voor fracturen.
Een lengteverlies van 1 cm verdubbelt de kans op een fractuur (HR voor alle fracturen 1,86 (95%-BI 1,28 tot 2,72); HR voor heupfracturen 2,24 (95%-BI 1,23 tot 4,09)).
Lengteverlies van 1 cm per jaar geeft een vergelijkbaar risico op een nieuwe fractuur als een fractuur in de voorgeschiedenis of 14 jaar ouder zijn.
Inschatting van het valrisico
Naar Samenvatting ›Bij vermoeden van verminderde mobiliteit: overweeg (of verwijs voor) een mobiliteitstest, bijvoorbeeld de 4 meter looptest, de stoeltest of de Short Physical Performance Battery (SPPB).
Waarom deze aanbeveling?
Medicijnen kunnen op meerdere manieren een val veroorzaken: als gevolg van een bijwerking of als gevolg van (relatieve) overdosering. Juist bij ouderen spelen bijwerkingen een belangrijke rol bij het vallen, onder andere door polyfarmacie en kans op interacties. Bij ouderen speelt daarnaast de toegenomen gevoeligheid voor bijwerkingen een rol, door veranderingen in lichaamssamenstelling en receptorgevoeligheid, en door de verminderde reservecapaciteit van organen. Er is eenduidig bewijs dat psychofarmaca, en met name benzodiazepines, de kans op vallen vergroten. Voor cardiovasculaire medicatie (waaronder diuretica) en analgetica (zoals opioïden) is het bewijs echter wisselend: zie MDR Preventie van valincidenten bij ouderen (2024).
De werkgroep heeft de anamnestische vragen voor het inschatten van het valrisico in deze standaard opgesteld op basis van de eigen klinische expertise en de MDR Osteoporose en fractuurpreventie, module Inschatting valrisico en interventies (2022).
Aanvullend onderzoek
Naar Samenvatting ›Scorelijst van risicofactoren
Naar Samenvatting ›- We bevelen bij risicogroep 3 (patiënten ≥ 60 jaar met vragen/risicofactoren voor een fractuur) aan de scorelijst van risicofactoren (tabel h1) te gebruiken.
- Deze scorelijst bevat 7 items waarvan aangetoond is dat ze het fractuurrisico ten minste verdubbelen.
- Verricht geen verder aanvullend onderzoek bij een risicoscore < 4.
| Kenmerk | Score | |
| BMI < 20 | 1 | |
| Leeftijd | ≥ 60 jaar | 1 |
| ≥ 70 jaar | 2 | |
| Niet-recente fracturen (> 2 jaar geleden) na het 50e levensjaar* | 1 | |
| Ouder(s) met heupfractuur | 1 | |
| > 1 keer vallen in laatste jaar en/of immobiliteit | 1 | |
| Roken en/of alcohol ≥ 3 eenheden /dag | 1 | |
| Gebruik van medicatie† en/of chronische aandoening die onvoldoende onder controle is‡ | 1 | |
| Totaalscore | < 4 of ≥ 4 | |
* Bij recente fracturen (≤ 2 jaar) na het 50e levensjaar valt patiënt in risicogroep 1 en is DXA/VFA geïndiceerd. † Voorbeeld van medicatie: anti-epileptica (voor volledige lijst, zie eventueel detail Buiten de scope). ‡ Voorbeelden van chronische aandoeningen: ondervoeding, inflammatoire darmziekte (met malabsorptie), diabetes mellitus type 1 (onafhankelijke risicofactor, ook indien onder controle), diabetes mellitus type 2 met insulinebehandeling, schildklieraandoeningen (onbehandelde hyperthyreoïdie), reumatoïde artritis. | ||
De werkgroep heeft de scorelijst van risicofactoren (zie tabel h1) opnieuw samengesteld na beoordeling van 14 fractuurrisicocalculatoren die gebruikt zijn in de meta-analyse van Beaudoin (2019). De nieuwe scorelijst bevat 7 risicofactoren waarvan aangetoond is dat ze het fractuurrisico ten minste verdubbelen. Zie ook MDR Osteoporose en fractuurpreventie, module Identificatie van personen met een verhoogd fractuurrisico (2022)
Roken en alcoholgebruik zijn opgenomen als risicofactoren
Van de in tabel h1 genoemde risicofactoren is aangetoond dat ze het fractuurrisico ten minste verdubbelen. Roken en alcoholgebruik verhogen het risico echter net iets minder dan 2 keer. De voorgaande versie van deze NHG-Standaard (2012) vermeldde over roken en alcohol:
‘Roken verhoogt als onafhankelijke risicofactor van BMD het risico op een heupfractuur en op fracturen in het algemeen (RR 1,8; 95%-BI 1,5 tot 2,2). […] Het risico op een heupfractuur is verhoogd bij gebruik van meer dan 3 eenheden alcohol gemiddeld per dag (RR 1,4; 95%-BI 1,1 tot 1,8)’.
Daarom heeft de werkgroep voor roken en/of alcoholgebruik samen 1 punt toegekend en niet 2 punten.
Heupfractuur bij ouder(s) is een risicofactor, andere fracturen niet
Uit onderzoek is gebleken dat alleen een heupfractuur bij 1 van de ouders een onafhankelijke risicofactor is voor het optreden van een fractuur bij de patiënt.
Dit onderzoek laat zien dat het risico verhoogd is indien 1 van de ouders een heupfractuur heeft gehad (zie tabel h1) en wel vooral voor vrouwen (dat wil zeggen dochters). Het is daarom alleen nodig om te vragen naar een heupfractuur bij 1 van beide ouders.
Botdichtheidsmeting (DXA) en beoordeling van de wervelkolom (VFA)
Naar Samenvatting ›- We bevelen een botdichtheidsmeting van de lumbale wervelkolom, heuphals en totale heup door middel van een DXA aan
- Beoordeel de aanwezigheid van wervelfracturen door beeldvormend onderzoek van de wervelkolom (Th4-L5), bij voorkeur met een VFA.
- Alternatief is een röntgenfoto (niet geïndiceerd indien een recente röntgenfoto beschikbaar is).
Waarom deze aanbeveling?
Wervelfracturen zijn bij mensen ≥ 50 jaar de meest frequente fracturen. Bovendien zijn wervelfracturen frequent aanwezig bij hoogrisicopatiënten, zoals patiënten met glucocorticoïdgebruik, COPD of reumatoïde artritis. De meeste wervelfracturen (ongeveer 70%) geven geen klachten en er is geen oorzakelijk trauma. Zij zijn alleen vast te stellen met beeldvormend onderzoek. Omdat een wervelfractuur onafhankelijk van de BMD een risicofactor is voor toekomstige fracturen, is het in beeld brengen van de wervelkolom essentieel voor het bepalen van het fractuurrisico. Dit kan door middel van VFA (ook wel ‘laterale DXA’ of ‘IVA’ genoemd), bij voorkeur op DXA-beelden en indien deze niet beschikbaar zijn op een conventionele röntgenopname.
Een wervelfractuur ≥ graad 2 en een T-score ≤ –1,0 is, onafhankelijk van de BMD, een reden om medicatie te starten. Ook bij de follow-up van de medicamenteuze behandeling is het verrichten van een DXA/VFA van belang bij vermoeden wervelfractuur: indien bij follow-up ≥ 1 jaar een nieuwe wervelfractuur wordt gevonden, kan dit beschouwd worden als therapiefalen en is er een indicatie om fractuurpreventie te starten in de tweede lijn.
Voor meer informatie zie MDR Osteoporose en fractuurpreventie, module Meerwaarde van aanvullende VFA bij diagnostiek met DXA (2022).
Indicaties voor DXA en VFA
Naar Samenvatting ›- Risicogroep 1: patiënten ≥ 50 jaar met een fractuur < 2 jaar geleden
- Risicogroep 2: patiënten ≥ 40 jaar met systemisch gebruik van glucocorticoïden ≥ 3 maanden
- leeftijd 40-50 jaar en ≥ 3 maanden gebruik van prednison ≥ 2,5 mg per dag
- leeftijd ≥ 50 jaar en:
− ≥ 3 maanden gebruik van prednison 2,5-7,5 mg per dag
− ≥ 3 maanden gebruik van prednison ≥ 7,5 mg per dag is altijd een behandelindicatie. Maak bij de start van de medicamenteuze behandeling een DXA/VFA ter bepaling van de uitgangswaarde bij controles (zie Controles).
− ≥ 4 stootkuren per jaar (zie detail Medicatie voor fractuurpreventie bij systemische glucocorticoïden). - Bij gebruik van andere systemische glucocorticoïden dan prednison gelden bovenstaande aanbevelingen conform de equivalente dosering van het gebruikte middel.
- Risicogroep 3: patiënten ≥ 60 jaar met vragen/risicofactoren voor een fractuur
- bij risicoscore ≥ 4 (zie tabel h1).
- We bevelen bij patiënten van 50-59 jaar geen DXA/VFA aan omdat het risico op fracturen meestal laag is en leefstijladviezen volstaan. Verwijs bij een vermoeden van secundaire osteoporose en dus een hoge kans op fracturen naar de tweede lijn voor verder onderzoek.
Röntgenfoto van de thoracale en lumbale wervelkolom
Naar Samenvatting ›Vraag een röntgenfoto van thoracale en lumbale wervelkolom aan indien een VFA niet beschikbaar of niet goed te beoordelen is.
Laboratoriumonderzoek
Naar Samenvatting ›- Vraag de volgende bepalingen alleen aan bij patiënten met een indicatie voor medicamenteuze fractuurpreventie (zie Evaluatie).
- vitamine D
- calcium gecorrigeerd voor albumine (en indien verhoogd: PTH voor onderzoek naar hyperparathyreoïdie)
- TSH (en indien afwijkend: vrij T4 voor onderzoek naar hyperthyreoïdie)
- creatinine en eGFR (tenzij er een waarde van < 1 jaar geleden bekend is)
- Overweeg aanvullend laboratoriumonderzoek bij vermoeden van secundaire osteoporose, of overleg hierover met de tweede lijn:
- hyperthyreoïdie (TSH en indien afwijkend: vrij T4)
- hyperparathyreoïdie (calcium gecorrigeerd voor albumine en indien verhoogd: PTH)
- Bij vermoeden van maligniteit
- BSE
- alkalische fosfatase
- Bij aanwezigheid van meerdere wervelfracturen:
- eiwitspectrum of M-proteïne
- Bij mannen < 70 jaar met duidelijke aanwijzingen voor hypogonadisme (zie NHG-Standaard Seksuele klachten):
- serumtestosteron
Waarom deze aanbeveling?
Het opsporen van secundaire osteoporose is belangrijk. Hoewel hyperthyreoïdie en primaire hypoparathyreoïdie heel zeldzaam zijn, is laboratoriumonderzoek (TSH en eventueel bepaling van vrij T4)naar deze aandoeningen nodig om dat ze niet gemist mogen worden. Patiënten ≥ 50 jaar met onderliggende aandoeningen zoals hyperthyreoïdie of primaire hyperparathyreoïdie hebben een hogere botfragiliteit en dus een hoger fractuurrisico ten gevolge van de bijkomende ziekte(n) of behandeling. Het diagnosticeren en vervolgens behandelen van deze aandoeningen verlaagt het fractuurrisico. Een deel van deze aandoeningen kan via de anamnese en lichamelijk onderzoek gevonden worden, maar meestal is aanvullend bloedonderzoek nodig.
Bepaling van albumine is nodig voor de gecorrigeerde calciumspiegel. Bij een (gecorrigeerd) verhoogd serumcalcium is een PTH-bepaling nodig in verband met mogelijke hyperparathyreoïdie. Vaak geeft een verhoogd calcium in het bloed weinig klachten, maar eventuele klachten kunnen zijn: moeheid, veel plassen, dorst, misselijkheid, braken, uitdrogingsverschijnselen, een trage stoelgang of psychische klachten.
Voor meer informatie zie MDR Osteoporose en fractuurpreventie, module Welk laboratoriumonderzoek bij verhoogd fractuurrisico (2022).
Evaluatie
Naar Samenvatting ›Beoordeel of de patiënt tot 1 van de 3 groepen met een verhoogd risico op fracturen behoort:
- risicogroep 1: patiënten ≥ 50 jaar met een fractuur < 2 jaar geleden
- risicogroep 2: patiënten ≥ 40 jaar met systemisch gebruik van glucocorticoïden ≥ 3 maanden
- risicogroep 3: patiënten ≥ 60 jaar met vragen/risicofactoren voor een fractuur, bij risicoscore ≥ 4
Verhoogd valrisico
Naar Samenvatting ›- Beoordeel of er sprake is van een verhoogd valrisico en beoordeel of er beïnvloedbare factoren zijn (bijvoorbeeld visusstoornissen, medicatiegebruik, kracht- en balansstoornissen).
- Dit geldt bij uitstek voor patiënten die te kennen hebben gegeven dat ze zijn gevallen of die moeite hebben met bewegen, lopen of balans houden.
Aanwijzingen voor secundaire osteoporose
Naar Samenvatting ›Beoordeel of er aanwijzingen voor secundaire osteoporose zijn (zie Laboratoriumonderzoek). Dit betekent meestal een verwijsindicatie, tenzij de oorzaak vitamine D-gebrek is, er ook geen aanwijzingen zijn voor osteomalacie (zie Begrippen) en de calciumspiegel normaal is (zie Richtlijnen beleid).
Indicaties voor medicamenteuze behandeling
Naar Samenvatting ›De indicaties voor het (overwegen van) medicamenteuze behandeling voor fractuurpreventie op basis van de DXA/VFA-uitslagen zijn als volgt.
- Risicogroep 1: patiënten ≥ 50 jaar met een recente fractuur:
- wervelfractuur ≥ graad 2 in combinatie met een laagste T-score ≤ –1 (zie tabel h2)
- recente (< 2 jaar) niet-wervelfractuur in combinatie met een laagste T-score van heup of wervelkolom ≤ –2,5. Deze patiënten worden doorgaans behandeld in de tweede lijn
- Risicogroep 2: patiënten ≥ 40 jaar met systemisch gebruik van glucocorticoïden ≥ 3 maanden. De behandeling is afhankelijk van leeftijd, dosering en botdichtheid (zie tabel h3).
- Risicogroep 3: patiënten ≥ 60 jaar met vragen/risicofactoren voor een fractuur en risicoscore ≥ 4 (zie ook tabel h2):
- zonder wervelfractuur (bij VFA):
- ≥ 70 jaar en laagste T-score van heup of wervelkolom ≤ –2,5
- 60-70 jaar en laagste T-score van heup of wervelkolom ≤ –2,5 (overweeg medicatie)
- met wervelfractuur (bij VFA):
- wervelfractuur ≥ graad 2 in combinatie met een laagste T-score < -1
- wervelfractuur graad 1: als onder risicogroep 3 zonder wervelfractuur
- zonder wervelfractuur (bij VFA):
Lage vitamine D-spiegel
Naar Samenvatting ›- Bij < 30 nmol/L in combinatie met klachten passend bij osteomalacie (zoals bot- en gewrichtspijn, spierzwakte, stijfheid, moeite met lopen of problemen met het gebit): overleg met de internist of er sprake kan zijn van osteomalacie.
- Bij < 30 nmol/L zonder klachten passend bij osteomalacie en met een normaal calcium (gecorrigeerd voor albumine): geef dagelijks 800 IE vitamine D3 en start pas na 6 weken medicatie voor fractuurpreventie. Controle van de vitamine D-spiegel is niet nodig.
- Bij < 30 nmol/L in combinatie met een verlaagd calcium (gecorrigeerd voor albumine): verwijs naar de tweede lijn voor verder onderzoek naar osteomalacie. Start geen medicatie voor fractuurpreventie.
Richtlijnen beleid
Naar Samenvatting ›Voorlichting en advies
Naar Samenvatting ›- Geef leefstijladviezen aan alle patiënten die binnen de scope vallen (zie ook Praktijkhandleiding Leefstijl)
- Geef bij patiënten met een verhoogd valrisico aanvullende voorlichting en adviezen (zie ook detail Inschatting van het valrisico).
Gezonde voeding
Naar Samenvatting ›- Adviseer gezonde voeding met voldoende bouwstoffen voor de botaanmaak volgens de aanwijzingen van thuisarts.nl en het Voedingscentrum.
- Herhaal de adviezen voor een blijvende aanpassing van het voedingspatroon.
Vitamine D3
Naar Samenvatting ›Praktische toepassing van vitamine D-suppletie
Naar Samenvatting ›- Dosering: dagelijks 800 IE (20 microg/dag).
- Vanwege de kosten gaat de voorkeur uit naar vitamine D3-tabletten à 400 of 800 IE. Deze zijn zonder recept verkrijgbaar bij apotheek, drogist of supermarkt. Overweeg het doseeradvies in IE en microg voor de patiënt op te schrijven.
- Weekdoseringen zijn een gelijkwaardig, maar aanzienlijk duurder alternatief. Geef bij keuze voor weekdosering: vitamine D3-capsules 5600 IE, gebruik 1 keer per week, of colecalciferoldrank 50.000 IE/ml (dosering 2 druppels à 2500 IE 1 keer per week).
- Dagdoseringen vitamine D3 ≥ 3000 IE/dag en periodieke hoge doseringen vitamine D3 (‘bolusregimes’ van ≥ 60.000 IE vitamine D3 per maand) worden afgeraden omdat zij door een tijdelijk negatief effect op de spierfunctie een verhoogd valrisico kunnen geven (zie ook detail Vitamine D-suppletie).
- Adviseer de suppletie in principe levenslang voort te zetten (zie Stoppen of minderen met botafbraakremmende medicatie).
Lage vitamine D-spiegel
Naar Samenvatting ›Bij een vitamine D-spiegel < 30 nmol/L: zie adviezen bij Evaluatie.
Waarom deze aanbeveling?
Een verlaagde vitamine D-spiegel (< 50 nmol/L) komt veel voor en kan zonder klinische verschijnselen aanleiding geven tot versneld botverlies. Bij osteoporose bestaat er een directe indicatie voor suppletie van vitamine D zonder bepaling van de vitamine D-spiegel. Het is nog steeds onduidelijk hoe hoog de vitamine D-spiegel zou moeten zijn voor een optimaal effect op het skelet. Als optimale concentratie wordt 50-125 nmol/L aangehouden. In Nederland is er sprake van seizoensvariatie in vitamine D-spiegels, met een dieptepunt in de winter. Omdat deze variatie individueel sterk kan verschillen en moeilijk te voorspellen is, is het advies om 50 nmol/L aan te houden als ondergrens om medicamenteuze behandeling voor fractuurpreventie te starten. Bij een lagere vitamine D-spiegel (< 50 nmol/L) gelden aanvullende adviezen ten aanzien van vitamine D-suppletie (zie hieronder; zie ook Evaluatie) alvorens gestart kan worden met medicamenteuze fractuurpreventie.
Vitamine D-spiegel en osteomalacie
In de leeftijdsgroep 55-85 jaar heeft 17,5% een vitamine D-spiegel (serum 25(OH)D < 30 nmol/L). Dit kan tot osteomalacie en botverlies leiden (bij ongeveer de helft van de patiënten). Osteomalacie wordt gekenmerkt door hypomineralisatie van de botten. Biochemisch kan er, behalve een lage vitamine D-spiegel, sprake zijn van hypocalciëmie, hypofosfatemie, verhoogd alkalische fosfatase of secundaire hypoparathyreoïdie. Vaak echter ontbreken klinische symptomen en duidelijke biochemische afwijkingen, en een fractuur (met name van de heup) kan de eerste presentatie zijn. Overleg of verwijs bij klachten en/of een afwijkende laboratoriumuitslag naar de tweede lijn bij vitamine D-spiegel < 30 nmol/L.
Hoge vitamine D-spiegel en valrisico
Verondersteld wordt dat een zeer hoge vitamine D-inname toxische effecten kan hebben op de spiercellen waardoor de spierfunctie tijdelijk verslechtert. Bij hoge doseringen wordt vitamine D omgezet in inactieve vitamine D, waardoor een (relatieve) vitamine D-deficiëntie ontstaat met alle gevolgen van dien (zie hierboven).
Een zeer hoge jaarlijkse dosis vitamine D, van 7500 microgram intramusculair of 12.500 microgram oraal, leidde in 2 interventieonderzoeken tot een verhoogd risico op vallen en botbreuken.
Minderen en stoppen met vitamine D
Overweeg stoppen met calcium en vitamine D bij een gering geschatte resterende levensverwachting. De verwachte meerwaarde van de behandeling, die een langetermijneffect beoogt, is minimaal. Stoppen met vitamine D bij mensen met een gering geschatte resterende levensverwachting heeft naar verwachting geen direct negatief effect.
Zie ook kennisdocument Calcium en vitamine D bij de MDR Polyfarmacie bij ouderen, module Minderen en stoppen van medicatie (2020). Voor meer informatie zie MDR Osteoporose en fractuurpreventie, module Inname calcium en vitamine D bij verhoogd fractuurrisico (2022).
Calcium
Naar Samenvatting ›- Adviseer een dagelijkse calciuminname van 1000-1100 mg via de voeding. Dit komt neer op 4 standaard zuivelproducten (bijvoorbeeld 150 ml melk, kwark of yoghurt, of 20 g kaas, of equivalenten daarvan bij gebruik van een calciumbevattende zuivelvervanger).
- Adviseer gebruik van een calciumsupplement als voldoende inname via de voeding niet haalbaar is.
Praktische toepassing calciumsuppletie
Naar Samenvatting ›- Adviseer calciumcarbonaat (kauw)tabletten met 500 of 1000 mg calcium:
- 1000 mg/dag bij inname van < 2 standaard zuivelproducten of calciumbevattende zuivelvervangers
- 500 mg/dag bij inname van 2-3 standaard zuivelproducten of calciumbevattende zuivelvervangers.
- bij kwetsbare ouderen maximaal 500 mg/dag.
- Vanwege de kosten gaat de voorkeur uit naar een preparaat dat zonder recept verkrijgbaar is bij apotheek, drogist of supermarkt. Overweeg de dosering op te schrijven voor de patiënt.
- Adviseer de patiënt de suppletie te staken zodra het lukt om voldoende calcium via de voeding binnen te krijgen.
Waarom deze aanbeveling?
Het advies is om bij een verhoogd fractuurrisico ruim voldoende vitamine D en calcium in te nemen of te suppleren. Medicamenteuze behandeling tegen osteoporose is effectief bij adequate inname of suppletie van vitamine D en calcium. Calciumsuppletie zonder vitamine D verbetert wel de botdichtheid, maar geeft nauwelijks vermindering van de fractuurincidentie of de daarmee samenhangende sterfte. Calciumsuppletie zonder rekening te houden met de gebruikelijke voedingsgewoonten kan resulteren in een totale calciuminname die ver boven de geadviseerde inname ligt.
Calciumsuppletie geeft geregeld bijwerkingen, met name darmklachten komen vaker voor. Een voedingsanamnese is niet eenvoudig en kost tijd. Daarnaast hebben veel patiënten een eigen visie op zuivelconsumptie en mogelijke allergieën, al dan niet bewezen. Ook milieuoverwegingen en vegetarisme of veganisme kunnen een belangrijke rol spelen. Laagdrempelige consultatie van een diëtiste kan een belangrijke bijdrage leveren.
Minderen en stoppen met calcium
Overweeg te stoppen met calcium in de volgende situaties.
- Gering geschatte resterende levensverwachting. De verwachte meerwaarde van de behandeling, die een langetermijneffect beoogt, is minimaal bij mensen met een gering geschatte resterende levensverwachting en stoppen heeft naar verwachting geen direct negatief effect.
- Voldoende inname met de voeding.
- Obstipatie of gastro-intestinale bijwerkingen:
- calciumzouten kunnen leiden tot obstipatie of andere gastro-intestinale bijwerkingen
- overweeg stoppen bij mogelijke relatie met obstipatie of gastro-intestinale klachten
- adviseer voldoende calciuminname met de voeding
- ga na enkele weken na of de klachten verminderd zijn en of de calciuminname met de voeding voldoende is
Verlaag de dosering calcium bij kwetsbare ouderen. Calciumsuppletie verhoogt mogelijk dosisafhankelijk het risico op hart- en herseninfarcten. Daarom heeft inname via de voeding de voorkeur en wordt bij kwetsbare ouderen geadviseerd te kiezen voor maximaal 500 mg suppletie.
Voor meer informatie zie MDR Osteoporose en fractuurpreventie , module Inname calcium en vitamine D bij verhoogd fractuurrisico (2022) en kennisdocument Calcium en vitamine D bij de MDR Polyfarmacie bij ouderen, module Minderen en stoppen van medicatie (2020).
Magnesium en vitamine K
Naar Samenvatting ›Adviseer geen magnesium en vitamine K2-supplementen. Met een gevarieerd voedingspatroon zijn er in Nederland geen tekorten aan deze stoffen te verwachten.
Bij een gezond voedingspatroon komen tekorten in de algemene bevolking nauwelijks voor, behalve bij de hieronder genoemde risicofactoren.
Waarom deze aanbeveling?
Magnesium
Risicofactoren voor een magnesiumdeficiëntie in de algemene bevolking zijn:
- Ondervoeding (onder andere alcoholisme)
- Nierinsufficiëntie met dieetbeperkingen
- Malabsorptie
- Langdurige diarree
- Langdurig gebruik van protonpompremmers
Drinkwater bevat magnesium en het mineraal is ruim aanwezig in groenten, noten en fruit. Aangezien bewijs ontbreekt en de kans op een magnesiumdeficiëntie bij gezonde voeding erg klein is, is het adviseren van magnesiumsupplementen aan patiënten met een verhoogd fractuurrisico niet nodig.
Vitamine K
In diverse onderzoeken zijn associaties gevonden tussen de vitamine K-status BMD en fracturen. Ook zijn er suppletieonderzoeken gedaan met onder andere vitamine K. Dit gaf verschillende aanbieders van voedingssupplementen aanleiding tot het claimen van een positief effect van vitamine K op het skelet. Volgens het RIVM is de gemiddelde vitamine K-inname in Nederland adequaat en is het risico op vitamine K-gebrek bij volwassenen laag bij een gezonde voeding.
Risicofactoren voor een vitamine K-deficiëntie zijn, zie eventueel voor meer informatie MSD Manuel 2024.
- ondervoeding
- malabsorptie
- levercirrose
- langdurig antibioticagebruik
- gebruik van coumarinederivaten
Gezien de afwezigheid van een relatie met de BMD, de lage kwaliteit van de meta-analyse van placebogecontroleerde onderzoeken en de geringe kans op een vitamine K-deficiëntie bij gezonde voeding wordt vitamine K-suppletie niet geadviseerd. Meer aandacht voor een gezonde voeding in het algemeen is belangrijker.
Voor meer informatie zie MDR Osteoporose en fractuurpreventie, module Behandeling met vitamine K2 en magnesium (2022).
Lichaamsbeweging
Naar Samenvatting ›Stimuleer een actieve leefstijl en bepaal gezamenlijk wat voor de patiënt haalbaar is.
- Adviseer ≥ 2,5 uur per week te bewegen verdeeld over verschillende dagen. Een combinatie van balanstraining en training van spierkracht, mobiliteit en houding verlaagt het valrisico en verhoogt de botdichtheid.
- Kies voor botbelastende, dus gewichtdragende activiteiten, eventueel onder begeleiding van een fysiotherapeut. Goede voorbeelden zijn stevig doorlopen, hardlopen, tennissen en dansen.
Beweging heeft invloed op balans, spierkracht, uithoudingsvermogen en botsterkte, en vermindert de kans op vallen. Het ligt daarmee voor de hand dat bewegen invloed heeft op het fractuurrisico. Het is op dit moment niet duidelijk welke vormen van beweging een positief effect hebben op (verlagen van) het fractuurrisico en of bepaalde bewegingen het fractuurrisico verhogen en daarom vermeden moeten worden. Zeer belangrijk is dat het bewegen bij voorkeur botbelastend moet zijn om de botaanmaak te stimuleren.
De beweeginterventie zou moeten bestaan uit:
- functionele oefentherapie gericht op spierkracht en balans, uithoudingsvermogen en looptraining
- voorlichting over het belang van een actieve leefstijl eventueel onder begeleiding van een fysio-of oefentherapeut.
Goede voorbeelden zijn volleybal en tennis, steppen, dansen en aerobics. De patiënt kan zelf thuis traplopen, boodschappen dragen en wandelen met een rugzak. Het is onduidelijk of het fractuurrisico hierdoor afneemt.
Uit de beschikbare literatuur is geen eenduidige conclusie te trekken, behalve dat door bewegen de BMD niet afneemt en er vaker een positief effect is dan geen effect. Mogelijk zijn beweeginterventies gebaseerd op kracht- en looptraining het meest effectief, met name als er botbelasting is en de training ≥ 2,5 uur per week duurt gedurende ≥ 1 jaar.
Een groot deel van de patiënten haalt de huidige beweegnorm niet. Het CBS berekende dat maar ongeveer 30% van de 65-plussers voldoet aan de norm. Voor meer informatie zie MDR Osteoporose en fractuurpreventie, module Beweegadviezen bij verhoogd fractuurrisico (2022).
Intoxicaties
Naar Samenvatting ›Alcoholgebruik
Naar Samenvatting ›Adviseer conform het advies van de Gezondheidsraad om geen alcohol te drinken of maximaal 1 eenheid per dag (zie Praktijkhandleiding Leefstijl, onderdeel alcohol, en NHG-Standaard Problematisch alcoholgebruik).
Stoppen met roken
Naar Samenvatting ›Adviseer te stoppen met roken (zie Praktijkhandleiding Leefstijl, onderdeel roken, en NHG-Behandelrichtlijn Stoppen met roken).
Verhoogd valrisico
Naar Samenvatting ›- Bij patiënten met verhoogd valrisico kunnen de volgende adviezen en maatregelen relevant zijn.
- Leg de relatie uit tussen vallen, moeite met bewegen, lopen of balans en alcoholgebruik.
- Bij gebruik van valrisicoverhogende medicatie: ga na of deze medicatie gestopt, aangepast of vervangen kan worden. Overleg hierover zo nodig met apotheker of voorschrijvend medisch specialist.
- Bij verminderde visus of bij gebruik van multifocale brillen: zie NHG-Standaard Visusklachten.
- Bij verminderde balans: adviseer balans- en krachttraining of verwijs naar de fysiotherapeut.
- Overweeg bij patiënten ≥ 65 jaar met verhoogd valrisico verwijzing naar de geriater of specialist ouderengeneeskunde voor uitgebreide multifactoriële valrisicobeoordeling (voor de indicaties, zie Consultatie en verwijzing).
- Zie ook detail Inschatting van het valrisico.
Thuisarts
Naar Samenvatting ›Verwijs naar de informatie over fractuurpreventie op thuisarts.nl. De informatie op Thuisarts is gebaseerd op deze NHG-Standaard.
Gezamenlijke besluitvorming
Naar Samenvatting ›- Kom tot gezamenlijke besluitvorming over het instellen van medicamenteuze behandeling (zie tabel h2 en tabel h3 voor behandelindicaties.)
- Bespreek met de patiënt:
- voordelen: minder kans op fracturen en daarmee gepaard gaande invaliditeit
- nadelen: jarenlang gebruik, voorzorgsmaatregelen bij inname (1x per week, nuchter zijn, half uur rechtop blijven), vaak voorkomende bijwerkingen zoals maagdarmklachten of musculoskeletale pijn, en zeldzame maar ernstige bijwerkingen zoals kaaknecrose (voorzorgsmaatregelen nodig met betrekking tot het gebit) en spontane femurfracturen
- bespreek of de patiënt gemotiveerd is om de inname van de medicatie goed uit te voeren en het belang van langdurige therapietrouw om de kans op fracturen daadwerkelijk te reduceren
Waarom deze aanbeveling?
Medicamenteuze behandeling heeft een gunstig effect bij patiënten met een dubbel verhoogd fractuurrisico (zie tabellen h2 en h3). De indicaties voor medicamenteuze behandeling in deze risicogroepen zijn gebaseerd op onderzoeken naar screening in de eerste lijn. De onderzoeken lieten een gunstig effect zien van medicamenteuze behandeling op risicoreductie van osteoporotische fracturen bij deze patiëntengroepen.
Bij patiënten ≥ 50 jaar met een verlaagde BMD dient met name gekeken te worden naar wel of geen fractuur, het soort fractuur (heup, wervel, niet-heup of wervel) en de leeftijd. Bij alle patiënten moet gezamenlijke besluitvorming plaatsvinden tussen behandelaar en de individuele patiënt. In dit overleg wordt de behandelopties besproken en worden de NNT en de voor- en nadelen van elke optie samen afgewogen. Voor meer informatie zie MDR Osteoporose en fractuurpreventie, module Indicatiestelling medicatie fractuurpreventie (2022).
Waarom deze aanbeveling?
Bij starten met medicamenteuze fractuurpreventie is het de vraag welke medicatie bij welke patiënt de voorkeur heeft. Uitgangspunt is dat fractuurreductie door deze medicatie moet zijn aangetoond, bij voorkeur van wervel- en niet-wervelfracturen, inclusief heupfracturen. De medicatie wordt meestal gedurende een aantal jaren voorgeschreven; veiligheid en kosten spelen ook een rol.
Patiënten met een verhoogd fractuurrisico die een behandelindicatie hebben en orale bisfosfonaten (alendroninezuur (in drankvorm) en/of risedroninezuur) niet verdragen, bijvoorbeeld vanwege gastro-intestinale bovenbuikklachten of contra-indicaties, hebben een indicatie voor een tweedekeusmiddel: denosumab 2 × per jaar 60 mg s.c. (facultatief voor de huisarts) of zoledroninezuur 1 × per jaar 5 mg i.v. (in de tweede lijn).
Indien er sprake is van een fractuur bij patiënten die ≥ 1 jaar behandeld worden met alendroninezuur of risedroninezuur, dient eerst geëvalueerd te worden of er sprake is van ‘therapiefalen’ (zie Controles) op basis van suboptimale therapie (therapietrouw?), nieuwe risicofactoren of een (nieuwe) onderliggende aandoening waarbij een nieuwe DXA/VFA overwogen moet worden. Afhankelijk hiervan kan een tweedekeusmiddel overwogen worden, eventueel in de tweede lijn.
Therapieën met tweedekeusmiddelen zoals denosumab, romosozumab, teriparatide en zoledroninezuur i.v. worden veelal in de tweede lijn gegeven, maar afhankelijk van lokale afspraken kan de behandeling ook plaatsvinden in de eerste lijn. Deze middelen hebben over het algemeen een beter effect op het fractuurrisico dan orale bisfosfonaten (blijkt uit onderzoeken bij postmenopauzale vrouwen), maar omdat de kostprijs hoger ligt dan die van orale bisfosfonaten zijn zij vooral geïndiceerd voor patiënten in de tweede lijn, met uitzondering van denosumab.
Heupfractuur
Patiënten met een heupfractuur vormen een aparte categorie omdat heupfracturen gepaard gaan met ernstige morbiditeit en mortaliteit, en vrijwel altijd tot ziekenhuisopname leiden. Van zoledroninezuur, wanneer toegediend < 90 dagen na heupfractuur, is aangetoond dat het de kans op nieuwe wervelfracturen vermindert met 46% en de kans op nieuwe niet-wervelfracturen vermindert met 27%. In de groep die zoledroninezuur i.v. gebruikte nam ook de mortaliteit onafhankelijk van elke oorzaak af met 28% ten opzichte van placebo.
Gezien de sterk verhoogde kans op nieuwe fracturen na een initiële heupfractuur is er een heupfractuur bij alle patiënten ≥ 75 jaar een indicatie om, bij voorkeur binnen 3 maanden, te starten met zoledroninezuur onafhankelijk van de BMD, in afwachting van DXA maar desnoods ook zonder DXA.
Voor meer informatie zie MDR Osteoporose en fractuurpreventie, module Starten medicatie voor fractuurpreventie (2022).
NNT van bisfosfonaten in risicogroep 3
Behandeling met bisfosfonaten reduceert het risico op een fractuur met ≤ 40% (tabel d4). Bij een uitgangsrisico van 15% (zie Detail Prognose en beloop) betekent dit dat behandeling gedurende 5 jaar met bisfosfonaten een absolute risicoreductie (ARR) geeft van 6% met een bijbehorend NNT van 17 (1 gedeeld door 6%). Bisfosfonaten geven de hoogste risicoreductie voor wervelfracturen (gemiddeld 40%; NNT 17) en heupfracturen (gemiddeld 33%; NNT 20). Het effect is minder groot voor niet-wervelfracturen (gemiddeld 18,5%; NNT 36). Tabel d4 geeft de effectgroottes weer van respectievelijk alendroninezuur en risedroninezuur.
| RR (95% tot BI) | NNT* | |
|---|---|---|
| Alendroninezuur versus placebo† | ||
| 0,60 (0,39 tot 0,92) | 17 |
| 0,56 (0,46 tot 0,67) | 15 |
| 0,83 (0,74 tot 0,93) | 39 |
| Risedroninezuur versus placebo† | ||
| 0,74 (0,59 tot 0,94) | 26 |
| 0,64 (0,53 tot 0,77) | 18,5 |
| 0,80 (0,72 tot 0,89) | 33 |
* Uitgaande van een vijfjaarsrisico van 15% op fracturen. † Mediane behandelingsduur 27,7 maanden (uitersten 3-120). ‡ Elke fractuur anders dan een wervelfractuur. | ||
Fractuurrisicoreductie door medicamenteuze behandeling
De werkgroep acht het risico op fracturen voor en de risicoreductie door medicamenteuze behandeling groot genoeg om in samenspraak met de patiënt behandeling te overwegen.
Een systematische review van onderzoeken uit de eerste lijn (SOS, ROSE en SCOOP) die screenden op een hoog fractuurrisico gevolgd door een medicamenteuze behandeling voor osteoporose ondersteunt dit.
Uit het systematische literatuuronderzoek van de MDR Osteoporose en fractuurpreventie blijkt dat screening en medicamenteuze behandeling bij ouderen ≥ 65 jaar op populatieniveau leidt tot minder osteoporotische fracturen (met name minder heupfracturen). Op mortaliteit werd geen effect van screening gezien. De bewijskracht van alle conclusies is echter laag. Bovendien is de medicamenteuze behandeling minder goed onderbouwd voor mannen – er zijn geen RCT’s gevonden die betrekking hadden op mannen in de algemene bevolking (zie MDR Osteoporose en fractuurpreventie, module Indicatiestelling medicatie fractuurpreventie (2022)).
Keuze van medicatie
Naar Samenvatting ›- We bevelen orale bisfosfonaten aan als eerste keus in verband met de bewezen reductie van een breed spectrum fracturen (wervel, niet-wervel en heup), de veiligheid, de langdurige ervaring en de lage kostprijs.
- Bij een eGFR < 30 ml/min/1,73 m2 (contra-indicatie voor bisfosfonaten) gaat de voorkeur uit naar denosumab s.c. (facultatief voor de huisarts, zie hieronder).
- Kies bij gebleken intolerantie voor orale bisfosfonaten ondanks juiste voorzorgsmaatregelen uit:
- bisfosfonaat i.v. (zoledroninezuur i.v., tweede lijn). Dit bisfosfonaat is even effectief en veilig als orale bisfosfonaten, maar geeft de eerste 3 dagen na toediening een griepachtig syndroom. De kosten zijn hoger.
- denosumab s.c. (facultatief voor huisarts, anders in tweede lijn). Dit middel is even effectief als orale bisfosfonaten en er is > 10 jaar ervaring met gebruik in de praktijk. Nadeel is dat na beëindiging van de behandeling een episode volgt van versnelde botontkalking (rebound effect) en een belangrijke toename van de kans op (soms multipele) wervelfracturen. Bij staken is nabehandeling met bisfosfonaten, veelal in de tweede lijn, aangewezen. De kosten zijn hoger.
- Zie verder tabel h2 en tabel h3.
- We bevelen het voorschrijven van botaanmaakstimulerende medicatie (teriparatide en romosozumab) in de eerste lijn niet aan.
Gebitssanering
Naar Samenvatting ›- Een zeer zeldzame bijwerking van medicatie voor fractuurpreventie is osteonecrose van de kaak (zie details). Dit is vooral aan de orde bij patiënten met parodontitis en een slecht gebit.
- Verwijs bij klachten van het gebit naar de eigen tandarts voor tandheelkundige evaluatie en eventueel sanering voorafgaand aan start van de behandeling.
- Gebitssanering wordt aanbevolen bij:
| Wie? Indicaties voor medicamenteuze behandeling | ||
| Leeftijd | Wervelfractuur | Laagste T-score heup of wervelkolom |
| Risicogroep 1 | ||
| ≥ 50 jaar | 1 × graad 2 | –1,0 tot –2,5 |
| ≥ 50 jaar | 2 × graad 2 of 1 × graad 3 | –1,0 tot –1,5 |
| Risicogroep 3 | ||
| 60-70 jaar | Geen | ≤ –2,5 (overweeg medicatie) |
| ≥ 70 jaar | Geen | ≤ –2,5 |
| ≥ 60 jaar | ≥ graad 2 | Zie indicaties voor risicogroep 1 |
| Waarmee? Medicatie voor fractuurpreventie | ||
| ||
| Verwijzen? | ||
| Leeftijd | Wervelfractuur | Laagste T-score heup of wervelkolom |
| ≥ 50 jaar | 1 × ≥ graad 2 | ≤ –2,5 |
| ≥ 50 jaar | 2 × graad 2 | ≤ –1,5 |
| ≥ 50 jaar | 1 × graad 3 | ≤ –1,5 |
| ||
| Wie? Indicaties voor medicamenteuze behandeling | ||
| Leeftijd | Dosering prednison ≥ 3 maanden | Behandelindicatie |
| ≥ 40 jaar | ≥2,5- <7,5 mg/dag of ≥ 4 stootkuren/jaar | Laagste T-score heup of wervelkolom ≤ –2,0 |
| 40-50 jaar | ≥ 7,5-15 mg/dag | Laagste T-score heup of wervelkolom ≤ –2,0 |
| ≥ 40 jaar | ≥ 2,5 mg/dag of ≥ 4 stootkuren/jaar | Bij wervelfractuur ≥ graad 2, zie indicaties voor risicogroep 1 (tabel h2) |
| ≥ 50 jaar | ≥ 7,5-15 mg/dag | Behandeling altijd geïndiceerd |
| Waarmee? Medicatie voor fractuurpreventie | ||
| ||
| Verwijzen? | ||
Bij de volgende patiënten met een zeer hoog fractuurrisico is behandeling in de tweede lijn geïndiceerd:
| ||
Praktische toepassing medicamenteuze behandeling
Naar Samenvatting ›Bisfosfonaten
Naar Samenvatting ›Orale bisfosfonaten als tablet
Naar Samenvatting ›Geef een oraal bisfosfonaat, behalve bij een eGFR < 30 ml/min/1,73 m2 (zie in dat geval onder Denosumab (facultatief)
Naar Samenvatting ›- Toepassing van denosumab is facultatief voor de huisarts)
- Dosering
- alendroninezuur: tablet 70 mg wekelijks of
- risedroninezuur: tablet 35 mg wekelijks
- Geef instructies over inname om beschadiging van de slokdarm te voorkomen: ’s ochtends nuchter innemen met een groot glas leidingkraanwater; daarna 30 minuten rechtop en nuchter blijven. Controleer of patiënt de instructies heeft begrepen.
- Bij klachten van het gebit zie Gebitssanering voor verder beleid.
- De behandelduur is 5 jaar, eventueel te verlengen met nog eens 5 jaar (zie Controles)
- Veelvoorkomende bijwerkingen zijn botpijn, spierpijn, gewrichtspijn en (boven)buikklachten.
- Wees alert op nieuw ontstane kaakklachten of pijn in de heupregio, vanwege de zeer zeldzame maar ernstige bijwerkingen: aseptische kaaknecrose en spontane femurfracturen. Informeer de patiënt hierover en geef aan dat de patiënt zich bij dergelijke klachten moet melden. Benadruk dat deze bijwerkingen zeer zeldzaam zijn en dat de voordelen vele malen groter zijn dan het kleine risico.
- Bij lage vitamine D3-spiegel (< 30 nmol/L): start pas bisfosfonaten na 6 weken vitamine D-suppletie (gelijktijdige aanwezigheid van een lage calciumspiegel en/of klachten passend bij osteomalacie zijn een indicatie voor verwijzing of consultatie, zie Consultatie en verwijzing).
- Zorg bij bisfosfonaatgebruik voor suppletie van vitamine D en voldoende inname van calcium (zie Voorlichting en advies).
Alendroninezuur als drank
Naar Samenvatting ›Patiënten die alendroninezuur en/of risedroninezuur niet verdragen (bijvoorbeeld vanwege bovenbuikklachten)
- Controleer of inname van het bisfosfonaat volgens de instructies verloopt.
- Bij gebruik volgens de instructies: switch van alendroninezuur naar risedroninezuur en andersom.
- Bij aanhoudende klachten: vervang het orale bisfosfonaat door alendroninezuur in drankvorm (0,7 mg/ml, 100 ml 1 keer per week).
- Een protonpompremmer wordt niet aanbevolen.
- Indien de drankvorm niet leidt tot klachtenvermindering, overweeg zoledroninezuur i.v. (tweede lijn, zie Consultatie en verwijzing) of denosumab s.c. (zie hierna).
Waarom deze aanbeveling?
Alendroninezuur en risedroninezuur remmen de botafbraak en zijn eerste keus voor de medicamenteuze behandeling bij een verhoogd fractuurrisico. Dit vanwege de bewezen breedspectrumfractuurreductie (wervel, niet-wervel en heup), de veiligheid, de langdurige ervaring en de lage kostprijs. De behandelduur is normaliter 5 jaar (zie MDR Osteoporose en fractuurpreventie, module Strategieën tijdens behandeling en op lange termijn (2022)).
Switchen van alendroninezuur naar risedroninezuur is bewezen zinvol bij gastro-intestinale klachten, maar andersom niet.
Aangezien alendroninezuur veelal als eerste wordt voorgeschreven, kan switchen naar risedroninezuur zinvol zijn, evenals een switch naar alendroninezuur in drankvorm.
Aangezien orale bisfosfonaten effectief en goedkoper zijn dan alendroninezuur in drankvorm, wordt door de werkgroep ook de switch van risdroninezuur naar alendroninezuur aanbevolen.
Zie ook voor meer informatie MDR Osteoporose en fractuurpreventie , module Starten medicatie voor fractuurpreventie (2022) en Detail Starten van medicatie voor fractuurpreventie.
Denosumab (facultatief)
Naar Samenvatting ›- Toepassing van denosumab is facultatief voor de huisarts. Overweeg denosumab in de huisartsenpraktijk alleen bij patiënten > 75 jaar of met een beperkte levensverwachting, bij wie te verwachten valt dat zij de medicatie levenslang zullen gebruiken.
- Verwijs overige patiënten naar de tweede lijn, omdat bij stoppen van de behandeling met denosumab nabehandeling met een bisfosfonaat, veelal zoledroninezuur i.v., nodig is.
Praktische toepassing van denosumab
Naar Samenvatting ›- Geef denosumab injectievloeistof 60 mg/ml, 2 keer per jaar 1 ml subcutaan.
- Bespreek de bijwerkingen (vooral spier- en skeletpijn) en de veiligheid (zelfde ernstige bijwerkingen als bisfosfonaten).
- Aanvullend: bespreek het belang om het gebruik niet te onderbreken vanwege reboundeffect.
- Bij klachten van het gebit: zie Gebitssanering voor verder beleid.
- Waarborg de continuïteit van de injecties, met name ook bij eventuele verhuizing naar een verpleeghuis.
- Bij starten van denosumab bij patiënten ≥ 75 jaar met een beperkte levensverwachting:
- stop de behandeling niet tussentijds
- bespreek of inname van vitamine D en calcium adequaat is
- controle met DXA/VFA is niet nodig
Stoppen met denosumab
Naar Samenvatting ›Voor patiënten < 75 jaar die al denosumab gebruiken of vanuit de tweede lijn denosumab hebben gekregen gelden de volgende adviezen.
- Verricht na 3 jaar een standaard evaluatie met DXA/VFA.
- Stop denosumab bij:
- T-score van heup en wervelkolom > –2,5 en
- geen nieuwe wervelfracturen
- Bij stoppen na een behandelduur ≤ 3 jaar (≤ 6 injecties): start 6 maanden na de laatste denosumabtoediening nabehandeling met een bisfosfonaat. Dit kan in de vorm van alendroninezuur 70 mg 1 keer per week gedurende ≥ 12 maanden. Verricht als beëindiging van het gebruik van alendroninezuur wordt overwogen een nieuwe standaardevaluatie en continueer het gebruik als de T-score van heup of wervelkolom < - 2,5 is. Bij een contra-indicatie voor alendroninezuur: verwijs naar de tweede lijn.
- Bij stoppen na een behandelduur > 3 jaar (≥ 7 injecties): verwijs patiënt naar de tweede lijn voor nabehandeling met zoledroninezuur i.v. 6 en 12 maanden na de laatste denosumabtoediening.
- Continueer denosumab maximaal 10 jaar, inclusief driejaarlijkse evaluatie met DXA/VFA, bij:
- T-score van heup of wervelkolom≤ –2,5 en
- geen nieuwe wervelfracturen
- Verwijs naar de tweede lijn bij:
- Bij overwegen te stoppen met denosumab na maximaal 10 jaar (voor nabehandeling met zoledroninezuur i.v.)
- nieuwe wervelfracturen: 1 graad 3-fractuur of 2 graad 2-fracturen
Waarom deze aanbeveling?
Patiënten met osteoporose en een verhoogd fractuurrisico die orale bisfosfonaten (alendroninezuur en/of risedroninezuur) niet verdragen, bijvoorbeeld vanwege gastro-intestinale bovenbuikklachten en/of gastro-intestinale contra-indicaties, hebben een indicatie voor tweedekeusbehandeling met denosumab (2 × per jaar 60 mg s.c.). De botdichtheid neemt bij gebruik van denosumab de eerste jaren fors toe, daarna nog steeds een beetje. De totale toename kan oplopen tot 20%.
Toch is denosumab geen eerste keus omdat dit middel niet zonder meer gestopt kan worden. Bij het staken kan een zogeheten ‘reboundeffect’ optreden, een sterke stijging van de botafbraak waarbij het door denosumab gewonnen bot tot onder de uitgangswaarde daalt, met verhoogde kans op multipele wervelfracturen. Om verhoogde botafbraak te voorkomen is aanvullende medicamenteuze behandeling nodig met intraveneus bisfosfonaat (zoledroninezuur). Deze behandeling vindt veelal plaats in de tweede lijn. Het heeft daarom de voorkeur om met name oudere patiënten (vanaf ongeveer 75 jaar) met een hoog risicoprofiel levenslang te behandelen. Overweeg de behandeling met denosumab niet meer te staken en behandel eventueel wat langer door bij een verkeerde inschatting.
Er zijn voorzorgsmaatregelen geboden voordat gestart kan worden met denosumab. De behandeling geeft een verhoogde kans op aseptische botnecrose van de kaak (ongeveer 1 : 100.000). Gebitssanering voorafgaand aan de start van de therapie kan dit risico verminderen, evenals regelmatige controle op drukplekken bij eventuele gebitsprothesen. Het advies is verwijzing naar de eigen tandarts of MKA-chirurg voor tandheelkundige evaluatie en eventueel sanering indien het gebit in slechte toestand verkeert, zoals bij parodontitis (zie ook Detail Strategieën tijdens de behandeling en op lange termijn). Voor invasieve behandelingen, zoals extracties en het plaatsen van implantaten, wordt overleg met een MKA-chirurg geadviseerd (zie ook de MKA-richtlijnen).
Voor meer informatie zie MDR Osteoporose en fractuurpreventie, module Starten medicatie voor fractuurpreventie (2022) en het bijbehorende flowdiagram Evaluatie patiënt op therapie denosumab na 3 jaar (diagram 4 van 5).
Waarom deze aanbeveling?
Bij de meeste patiënten met een hoog fractuurrisico is fractuurpreventie op lange termijn nodig. Maar er zijn vragen: hoe lang behandelen, welke follow-uptermijn, wanneer mag de therapie onderbroken worden en voor hoelang, en wat zijn daarvan de gevolgen met betrekking tot efficiëntie en veiligheid? Langetermijndata over efficiëntie en veiligheid zijn beperkt beschikbaar en zijn beperkt tot ≤ 10 jaar follow-up . Suboptimale therapietrouw voor zowel orale als parenterale middelen speelt daarbij een verstorende rol.
Duur van de behandeling met bisfosfonaten
De aanbevolen duur van behandeling met alendroninezuur en risedroninezuur is 5 jaar, omdat voor deze termijn veiligheid en gunstige effecten op het fractuurrisico zijn aangetoond. Bovendien is het risico op ernstige bijwerkingen zoals atypische femurfracturen en osteonecrose van de kaak dan laag. Osteonecrose van de kaak wordt het vaakst gezien bij hooggedoseerde intraveneuze bisfosfonaten bij patiënten met maligniteiten (geschatte incidentie 3-10%).
Bij (lager gedoseerde) orale bisfosfonaten is de incidentie veel lager (1 : 100.000). Alleen als het gebit in slechte staat is, zoals bij parodontitis, of als er een invasieve behandeling gepland staat, is gebitssanering nodig voordat het orale bisfosfonaat gestart wordt. Dit geldt ook voor denosumab.
Na 5 jaar behandeling met bisfosfonaten is herevaluatie nodig alvorens te beslissen over stoppen, continueren of veranderen van behandeling.
Zie ook het kennisdocument Bisfosfonaten bij de MDR Polyfarmacie bij ouderen, module Minderen en stoppen van medicatie (2020).
Minderen en stoppen met bisfosfonaten
Het kennisdocument Bisfosfonaten kan gebruikt worden bij de overweging voor het continueren of stoppen van bisfosfonaten bij patiënten ≥ 70 jaar in de context van fractuurpreventie (zie kennisdocument Bisfosfonaten bij de MDR Polyfarmacie bij ouderen, module Minderen en stoppen van medicatie (2020)).
Overweeg te stoppen met bisfosfonaten bij:
- volledige bedlegerigheid; in deze situatie is het valrisico laag en zijn bisfosfonaten minder zinvol, bovendien moet bij bedlegerigheid rekening gehouden worden met innameproblemen van orale preparaten
- verminderde nierfunctie; bisfosfonaten zijn gecontra-indiceerd bij een eGFR < 30 ml/min/1,73 m2 wegens afgenomen klaring
Duur van de behandeling met denosumab
Dit middel is vooral geschikt voor ouderen vanaf ongeveer 75 jaar, zodat het levenslang gebruikt kan worden. Na een behandeling van 3 jaar (maximaal 6 injecties) wordt het bereikte resultaat geëvalueerd en wordt besloten of continueren of veranderen van behandeling (in de tweede lijn) geïndiceerd is. Doel van deze evaluatie is na de standaard therapieduur de hoogte van het fractuurrisico in te schatten en de vervolgbehandeling daarop af te stemmen.
Verlenging van de behandeling is in principe altijd nodig (bij voorkeur levenslang). Verleng dan met steeds 3 jaar tot een maximum van ongeveer 10 jaar (behandel iets langer door bij verkeerde inschatting). Zie ook hierboven onder Duur van de behandeling met bisfosfonaten.
Voor indicaties voor gebitssanering zie Detail Denosumab (facultatief voor de huisarts).
Voor meer informatie zie MDR Osteoporose en fractuurpreventie, module Strategieën tijdens behandeling en op lange termijn (2022).
Follow up met DXA na standaardbehandeling met bisfosfonaten
Na een standaardbehandeling van 5 jaar bisfosfonaten volgt een uitgebreide DXA/VFA-meting om het nut en de noodzaak van de behandeling te evalueren. In tabel h4 worden de behandelopties besproken op basis van aantal (wervel)fracturen en de laagste T-score van heup of wervelkolom.
De MDR Osteoporose en fractuurpreventie (2022) neemt hierbij ook het percentage botverlies in aanmerking. De meetfout in DXA apparatuur is echter zodanig dat het verschil in BMD bij 2 longitudinale metingen > 5% moet zijn (voor exacte percentages zie ‘Precision assessment’ in de Indications for bone mineral density (BMD) testing van de International Society For Clinical Densitometry (2019)). Alles binnen deze marge is dus niet te interpreteren als ‘toename’ of ‘afname’. De werkgroep heeft besloten deze parameter niet mee te nemen voor het follow-upbeleid, aangezien het percentage botverlies tussen 2 metingen in de praktijk voor huisartsen niet te achterhalen is omdat het niet altijd wordt gerapporteerd in het verslag van de radioloog.
Denosumab kan niet zomaar gestaakt worden vanwege het verhoogde risico op multipele wervelfracturen door verhoogde botafbraak (reboundeffect, zie Detail Denosumab (facultatief voor de huisarts)).
Stop daarom bij voorkeur niet met deze behandeling.
Denosumab is het meest geschikt voor patiënten vanaf ongeveer 75 jaar of met een beperkte levensverwachting (ongeveer 10 jaar). Behandel eventueel wat langer door bij een verkeerde inschatting. Na stoppen met denosumab moet de therapie met intraveneuze bisfosfonaten worden voortgezet (veelal in de tweede lijn).
Controles
Naar Samenvatting ›Controles bij bisfosfonaten
Naar Samenvatting ›- Indien bisfosfonaten voorgeschreven zijn in de tweede lijn vinden de eerste controles in het ziekenhuis plaats. Afhankelijk van regionale afspraken kan dit ook bij de huisarts.
- Plan een eerste controleconsult (eventueel door de POH-somatiek of de POH-ouderen) na 3 maanden en daarna jaarlijks:
- bespreek tolerantie, therapietrouw en motivatie.
- bespreek bij problemen met therapietrouw de mogelijkheid om over te stappen naar een ander middel (zie paragraaf Keuze van medicatie).
- bespreek of de inname van vitamine D en calcium adequaat is
- blijf nagaan of het middel juist wordt ingenomen; neem bij bijwerkingen de inname-instructies nogmaals door.
- stap bij maagklachten door alendroninezuur of risedroninezuur in tabletvorm over op alendroninezuur in drankvorm (70 mg per week).
- ga na of er nieuwe fracturen en/of nieuwe risicofactoren ontstaan.
- Meet jaarlijks de lichaamslengte. Vraag bij een vermoeden van nieuwe wervelfractuur een VFA aan of, indien deze niet beschikbaar is, röntgenonderzoek van de thoracale en de lumbale wervelkolom (X-ThWK en X-LWK) (zie detail Lengteverlies)
- Evalueer de behandeling na 5 jaar bisfosfonaatgebruik of, als het bisfosfonaat werd voorgeschreven vanwege corticosteroïdgebruik, bij beëindiging van het corticosteroïdgebruik. Verricht hierbij een nieuwe DXA/VFA (zie tabel h4).
Controles bij denosumab
Naar Samenvatting ›Voor controles bij denosumab, zie Stoppen met denosumab.
| Evaluatie | Behandeloptie | Vervolgbeleid |
| Stop bisfosfonaat |
|
| Continueer bisfosfonaat gedurende 5 jaar |
|
| Overleg met of verwijs naar tweede lijn |
Waarom deze aanbeveling?
Patiënten die systemische glucocorticoïden gebruiken hebben een verhoogd fractuurrisico, vooral bij langdurig hogere doseringen maar ook bij sequentieel gebruik van hoge doseringen, bijvoorbeeld patiënten met COPD die ≥ 4 stootkuren per jaar krijgen. De werkgroep heeft deze afkapwaarde bepaald door terug te rekenen naar een equivalente dagdosering ≥ 2,5 mg, wat correleert met een verhoogd fractuurrisico. De berekening luidt: 4 × per jaar 40 mg/dag gedurende 5 dagen = 800 mg per jaar, gedeeld door 365 dagen is 2,2 mg/dag. Bij ≥ 4 stootkuren per jaar komt de equivalente dagdosis dus grofweg uit op 2,5-7,5 mg/dag.
Glucocorticoïden hebben een negatieve invloed op de botsterkte en de drempelwaarde voor het optreden van fracturen is daardoor verlaagd. Bij alle glucocorticoïdengebruikers zijn algemene maatregelen ter preventie van glucocorticoïdengeassocieerde fracturen van belang: voldoende calcium en vitamine D, lichaamsbeweging, stoppen met roken, beperkt alcoholgebruik, het zo kort mogelijk voorschrijven van glucocorticoïden in een zo laag mogelijke dosis, en optimale behandeling van onderliggende ziekten.
Uit het Verbetersignalement osteoporose van Zorginstituut Nederland en Zinnige Zorg (2020) blijkt dat in Nederland slechts ongeveer 27% van de patiënten die gedurende ≥ 3 maanden ≥ 7,5 mg prednison gebruiken medicatie voor fractuurpreventie krijgt. Het percentage patiënten dat deze medicatie krijgt, verschilt substantieel per specialisme (23-65%), er is dus sprake van onderbehandeling.
Prednison ≥ 7,5 mg/dag
Start direct met medicamenteuze fractuurpreventie, onafhankelijk van de uitslag van DXA/VFA, bij alle patiënten ≥ 50 jaar die ≥ 3 maanden prednison ≥ 7,5 mg/dag gebruiken (zie ook tabel h3). Alendroninezuur en risedroninezuur zijn de middelen van eerste keuze vanwege hun bewezen effectiviteit (in geval van risedroninezuur ook verlaagde kans op wervelfracturen) en relatieve veiligheid, de ervaring en de lage kostprijs. Continueer het bisfosfonaat gedurende de hele periode van glucocorticoïdengebruik, herevalueer het gebruik (onder andere met DXA/VFA) wanneer de glucocorticoïden volledig zijn afgebouwd en bepaal aan de hand daarvan of het bisfosfonaat wordt voortgezet of gestaakt (zie ook Detail Strategieën tijdens de behandeling en op lange termijn).
Medicamenteuze fractuurpreventie met denosumab, teriparatide of intraveneus zoledroninezuur (verwijs zo nodig naar de tweede lijn) is een optie in de volgende situaties:
- dosering ≥ 15 mg glucocorticoïden per dag
- leeftijd ≥ 75 jaar
- recente fractuur
- wervelfractuur ≥ graad 2
- T-score ≤ -2
- hoge ziekteactiviteit van de aandoening die met glucocorticoïden behandeld wordt
Prednison 2,5-7,5 mg/dag
Bij gebruik van prednison ≥ 2,5 mg/dag is het risico op botbreuken al (licht) verhoogd, maar lager dan bij ≥ 7,5 mg/dag.
Daarom is bij patiënten ≥ 40 jaar eerst aanvullend een DXA/VFA nodig om het fractuurrisico te beoordelen.
Patiënten < 40 jaar die prednison 2,5-7,5 mg/dag gebruiken, hebben vanwege hun jonge leeftijd en vanwege de lage prednisondosering geen nadere diagnostiek en/of behandeling nodig.
Prednison < 2,5 mg/dag
Indien patiënten < 2,5 mg prednison per dag gebruiken, is er ongeacht de leeftijd zonder bijkomende risicofactoren geen verhoogd fractuurrisico. Alleen als naast het glucocorticoïdgebruik ook andere risicofactoren een rol spelen, kan er een indicatie zijn voor aanvullend onderzoek en/of therapie (zie detail Identificatie van personen met een verhoogd fractuurrisico en Detail Indicatiestelling van medicatie voor fractuurpreventie).
Voor meer informatie zie MDR Osteoporose en fractuurpreventie, module Medicatie voor fractuurpreventie bij glucocorticoïden (2022).
Stoppen of minderen met botafbraakremmende medicatie, vitamine D en calcium
Naar Samenvatting ›- Stoppen met bisfosfonaat, calcium en vitamine D kan in 1 keer.
- Overweeg stoppen met bisfosfonaat bij:
- gering geschatte resterende levensverwachting
- volledige bedlegerigheid
- achteruitgang van de nierfunctie (eGFR < 30 ml/min/1,73 m2)
- Overweeg dosisverlaging of stoppen met calcium en vitamine D bij gering geschatte resterende levensverwachting.
- Overweeg stoppen met calcium bij voldoende inname met de voeding en/of obstipatie of gastro-intestinale bijwerkingen.
- Stimuleer bij bijwerkingen van calciumsuppletie voldoende inname via de voeding. Verlaag de dosering calcium bij kwetsbare ouderen tot maximaal 500 mg (zie ook detail Bisfosfonaten, detail Vitamine D-suppletie en detail Calciumsuppletie).
Organisatie van zorg
Naar Samenvatting ›- De meeste fracturen worden gediagnosticeerd en behandeld in het ziekenhuis. De behandelend specialist is dan verantwoordelijk voor de inventarisatie van het fractuurrisico. Indien de specialist een behandeling initieert, kunnen de controles plaatsvinden in de eerste lijn, afhankelijk van lokale afspraken. De huisarts heeft vooral een rol bij patiënten bij wie de huisarts zelf een wervelfractuur diagnosticeert.
- Indien bij patiënten met chronisch systemisch corticosteroïdgebruik en hoge ziekteactiviteit de behandeling in de tweede lijn plaatsvindt, dan is de medicamenteuze fractuurpreventie ook geïndiceerd in de tweede lijn.
- Overweeg de (jaarlijkse) controles gestructureerd vorm te geven, bijvoorbeeld door inzet van de praktijkondersteuner, zodat de patiënt daadwerkelijk op controle komt en de medicatie en eventuele suppletie niet voortijdig staakt.
- Het is wenselijk dat de apotheker het juiste medicatiegebruik begeleidt en afwijkend gebruik signaleert. Ook kan de apotheker bij het gebruik van systemische glucocorticoïden en het niet gelijktijdig voorschrijven van medicatie voor fractuurpreventie signaleren en terugkoppelen aan de voorschrijvend arts.
Consultatie en verwijzing
Naar Samenvatting ›Internist
Naar Samenvatting ›- Risicogroep 1 (patiënten ≥ 50 jaar met een recente fractuur), afhankelijk van aantal en ernst van de wervelfracturen gevonden bij aanvullend onderzoek:
- 1 wervelfractuur graad 2 met een laagste T-score van heup of wervelkolom ≤ –2,5, of
- 2 wervelfracturen graad 2 met een laagste T-score van heup of wervelkolom ≤ –1,5, of
- 1 wervelfractuur graad 3 met een laagste T-score van heup of wervelkolom ≤ –1,5
- Risicogroep 2 (patiënten ≥ 40 jaar met > 3 maanden systemisch gebruik van glucocorticoïden):
- ≥ 75 jaar
- ongeacht leeftijd bij systemisch corticosteroïdgebruik ≥ 15 mg/dag
- hoge ziekteactiviteit
- Bij vermoeden van secundaire osteoporose (met uitzondering van osteoporose door vitamine D-deficiëntie < 30 nmol/L), zonder klachten passend bij osteomalacie en met een normaal calcium
- Bij indicatie voor zoledroninezuur i.v. of denosumab s.c. (zie paragraaf Keuze van medicatie)
- Bij (vermoeden van) zeer zeldzame bijwerkingen door orale bisfosfonaten of denosumab, zoals osteonecrose van de kaak of spontane femurfractuur
- Bij overwegen te stoppen met denosumab
- Bij osteoporose na de maximale behandelingsduur van orale bisfosfonaten (2 behandelcycli van 5 jaar, zie tabel h4)
Geriater of specialist ouderengeneeskunde (valpoli)
Naar Samenvatting ›Verwijs ouderen met een verhoogd valrisico naar de geriater/specialist ouderengeneeskunde (valpoli) voor multifactoriële valrisicobeoordeling bij:
- aanwezigheid van meerdere valrisicofactoren
- vallen door onduidelijke oorzaak of herhaaldelijk vallen
- val met bewustzijnsverlies en/of polyfarmacie (gebruik van ≥ 5 medicijnen)
- complexe problematiek door ernstige comorbiditeit
- onvoldoende resultaat van interventie door eerstelijns beweegspecialist (fysio- of oefentherapeut)
Fysio- of oefentherapeut
Naar Samenvatting ›Overweeg verwijzing voor:
- begeleiding bij uitbreiding van de lichaamsbeweging
- begeleiding bij complexe comorbiditeit of voor beoordeling van de mobiliteit (mobiliteitstest)
- balans- en krachttraining bij verhoogd valrisico
Referenties
- Vestergaard P, Mosekilde L. Fracture risk in patients with celiac disease, crohn's disease, and ulcerative colitis: a nationwide follow-up study of 16,416 patients in Denmark. Am J Epidemiol 2002;156:1-10.
- Espallargues M, Sampietro-Colom L, Estrada MD, Solà M, del Rio L, Setoain J, Granados A. Identifying bone-mass-related risk factors for fracture to guide bone densitometry measurements: a systematic review of the literature. Osteoporos Int 2001;12:811-22.
- Van Staa TP, Cooper C, Brusse LS, Leufkens H, Javaid MK, Arden NK. Inflammatory bowel disease and the risk of fracture. Gastroenterology 2003a;125:1591-7.
- Lötters FJ, Van den Bergh JP, De Vries F, Rutten-van Mölken MP. Current and future incidence and costs of osteoporosis-related fractures in the Netherlands: combining claims data with BMD measurements. Calcif Tissue Int 2016;98:235-43.
- Huntjens KM, Van Geel TA, Blonk MC, Hegeman JH, Van der Elst M, Willems P, et al. Implementation of osteoporosis guidelines: a survey of five large fracture liaison services in the Netherlands. Osteoporos Int 2011;22:2129-35.
- Van Helden S, Van Geel AC, Geusens PP, Kessels A, Nieuwenhuijzen Kruseman AC, Brink PR. Bone and fall-related fracture risks in women and men with a recent clinical fracture. J Bone Joint Surg Am 2008;90:241-8.
- Van der Velde RY, Bours SPG, Wyers CE, Lems WF, Geusens P, Van den Bergh JPW. Effect of implementation of guidelines on assessment and diagnosis of vertebral fractures in patients older than 50 years with a recent non-vertebral fracture. Osteoporos Int 2017;28:3017-22.
- ZINL. Verbetersignalement osteoporose: Zinnige Zorg | ICD-10- hoofdstuk XIII, M80-85 (2020). Ga naar bron: ZINL. Verbetersignalement osteoporose: Zinnige Zorg | ICD-10- hoofdstuk XIII, M80-85 (2020).
- Merlijn T, Swart KM, Van Schoor NM, Heymans MW, Van der Zwaard BC, Van der Heijden AA, et al. The Effect of a screening and treatment program for the prevention of fractures in older women: a randomized pragmatic trial. J Bone Miner Res 2019;34:1993-2000.
- Swart KMA, Van Vilsteren M, Van Hout W, Draak E, Van der Zwaard BC, Van der Horst HE, et al. Factors related to intentional non-initiation of bisphosphonate treatment in patients with a high fracture risk in primary care: a qualitative study. BMC Fam Pract 2018;19:141.
- Alami S, Hervouet L, Poiraudeau S, Briot K, Roux C. Barriers to effective postmenopausal osteoporosis treatment: a qualitative study of patients' and practitioners' views. PLoS One 2016;11:e0158365.
- Claesson A, Toth-Pal E, Piispanen P, Salminen H. District nurses' perceptions of osteoporosis management: a qualitative study. Osteoporos Int 2015;26:1911-8.
- Otmar R, Reventlow SD, Nicholson GC, Kotowicz MA, Pasco JA. General medical practitioners' knowledge and beliefs about osteoporosis and its investigation and management. Arch Osteoporos 2012;7:107-14.
- Salminen H, Piispanen P, Toth-Pal E. Primary care physicians' views on osteoporosis management: a qualitative study. Arch Osteoporos 2019;14.
- Lancee J, Van den Bout J, Sorbi MJ, Van Straten A. Motivational support provided via email improves the effectiveness of internet-delivered self-help treatment for insomnia: a randomized trial. Behav Res Ther 2013;51:797-805.
- Lems WF, Van den Bergh JP, Elders PJM, Van Oostwaard M. Osteoporose en fractuurpreventie: van evidence-based medicine naar spreekkamer. Hoofdstuk 1. Botstructuur en botkwaliteit. Heemstede2016a.
- Van der Jagt-Willems HC, Van Hengel M, Vis M, Van Munster BC, Van Campen JP, Tulner LR, Lems WF. Why do geriatric outpatients have so many moderate and severe vertebral fractures? Exploring prevalence and risk factors. Age Ageing 2012;41:200-6.
- Van Geel TA, Van Helden S, Geusens PP, Winkens B, Dinant GJ. Clinical subsequent fractures cluster in time after first fractures. Ann Rheum Dis 2009;68:99-102.
- Gehlbach S, Saag KG, Adachi JD, Hooven FH, Flahive J, Boonen S, et al. Previous fractures at multiple sites increase the risk for subsequent fractures: the Global Longitudinal Study of Osteoporosis in Women. J Bone Miner Res 2012;27:645-53.
- Kanis JA, Johansson H, Odén A, Harvey NC, Gudnason V, Sanders KM, et al. Characteristics of recurrent fractures. Osteoporos Int 2018;29:1747-57.
- Klotzbuecher CM, Ross PD, Landsman PB, Abbott TA, 3rd, Berger M. Patients with prior fractures have an increased risk of future fractures: a summary of the literature and statistical synthesis. J Bone Miner Res 2000;15:721-39.
- Kanis JA, Johnell O, De Laet C, Johansson H, Oden A, Delmas P, et al. A meta-analysis of previous fracture and subsequent fracture risk. Bone 2004;35:375-82.
- Center JR, Bliuc D, Nguyen TV, Eisman JA. Risk of subsequent fracture after low-trauma fracture in men and women. JAMA 2007;297:387-94.
- Van Staa TP, Laan RF, Barton IP, Cohen S, Reid DM, Cooper C. Bone density threshold and other predictors of vertebral fracture in patients receiving oral glucocorticoid therapy. Arthritis Rheum 2003b;48:3224-9.
- Van Staa TP, Leufkens HG, Abenhaim L, Zhang B, Cooper C. Oral corticosteroids and fracture risk: relationship to daily and cumulative doses. Rheumatology (Oxford) 2000a;39:1383-9.
- Van Staa TP, Leufkens HG, Abenhaim L, Zhang B, Cooper C. Use of oral corticosteroids and risk of fractures. J Bone Miner Res 2000b;15:993-1000.
- Abu Hashim H, Elaraby S, Fouda AA, Rakhawy ME. The prevalence of adenomyosis in an infertile population: a cross-sectional study. Reprod Biomed Online 2020;40:842-50.
- Pluijm SM, Koes B, De Laet C, Van Schoor NM, Kuchuk NO, Rivadeneira F, et al. A simple risk score for the assessment of absolute fracture risk in general practice based on two longitudinal studies. J Bone Miner Res 2009;24:768-74.
- Tosteson AN, Gabriel SE, Grove MR, Moncur MM, Kneeland TS, Melton LJ, 3rd. Impact of hip and vertebral fractures on quality-adjusted life years. Osteoporos Int 2001;12:1042-9.
- Salaffi F, Cimmino MA, Malavolta N, Carotti M, Di Matteo L, Scendoni P, Grassi W. The burden of prevalent fractures on health-related quality of life in postmenopausal women with osteoporosis: the IMOF study. J Rheumatol 2007;34:1551-60.
- Lips P, Van Schoor NM. Quality of life in patients with osteoporosis. Osteoporos Int 2005;16:447-55.
- Brenneman SK, Barrett-Connor E, Sajjan S, Markson LE, Siris ES. Impact of recent fracture on health-related quality of life in postmenopausal women. J Bone Miner Res 2006;21:809-16.
- Ioannidis G, Papaioannou A, Hopman WM, Akhtar-Danesh N, Anastassiades T, Pickard L, et al. Relation between fractures and mortality: results from the Canadian Multicentre Osteoporosis Study. CMAJ 2009;181:265-71.
- Bliuc D, Nguyen ND, Milch VE, Nguyen TV, Eisman JA, Center JR. Mortality risk associated with low-trauma osteoporotic fracture and subsequent fracture in men and women. Jama 2009;301:513-21.
- Hannan MT, Broe KE, Cupples LA, Dufour AB, Rockwell M, Kiel DP. Height loss predicts subsequent hip fracture in men and women of the Framingham Study. J Bone Miner Res 2012;27:146-52.
- Vokes TJ, Gillen DL. Using clinical risk factors and bone mineral density to determine who among patients undergoing bone densitometry should have vertebral fracture assessment. Osteoporos Int 2010;21:2083-91.
- Hillier TA, Lui LY, Kado DM, LeBlanc ES, Vesco KK, Bauer DC, et al. Height loss in older women: risk of hip fracture and mortality independent of vertebral fractures. J Bone Miner Res 2012;27:153-9.
- Krege JH, Siminoski K, Adachi JD, Misurski DA, Chen P. A simple method for determining the probability a new vertebral fracture is present in postmenopausal women with osteoporosis. Osteoporos Int 2006;17:379-86.
- Moayyeri A, Luben RN, Bingham SA, Welch AA, Wareham NJ, Khaw KT. Measured height loss predicts fractures in middle-aged and older men and women: the EPIC-Norfolk prospective population study. J Bone Miner Res 2008;23:425-32.
- Siminoski K, Jiang G, Adachi JD, Hanley DA, Cline G, Ioannidis G, et al. Accuracy of height loss during prospective monitoring for detection of incident vertebral fractures. Osteoporos Int 2005;16:403-10.
- Beaudoin C, Moore L, Gagné M, Bessette L, Ste-Marie LG, Brown JP, Jean S. Performance of predictive tools to identify individuals at risk of non-traumatic fracture: a systematic review, meta-analysis, and meta-regression. Osteoporos Int 2019;30:721-40.
- Kocevska D, Lysen TS, Dotinga A, Koopman-Verhoeff ME, Luijk M, Antypa N, et al. Sleep characteristics across the lifespan in 1.1 million people from the Netherlands, United Kingdom and United States: a systematic review and meta-analysis. Nat Hum Behav 2021;5:113-22.
- Lems WF, Van den Bergh JP, Elders PJM, Van Oostwaard M. Osteoporose en fractuurpreventie van evidence-based medicine naar spreekkamer. Hoofdstuk 9. Het belang van vitamine D voor botten en spieren. 2016b.
- Alli O, Smith C, Hoffman M, Amanullah S, Katz P, Amanullah AM. Incidence, predictors, and outcomes of gastrointestinal bleeding in patients on dual antiplatelet therapy with aspirin and clopidogrel. J Clin Gastroenterol 2011;45:410-4.
- Sanders KM, Stuart AL, Williamson EJ, Simpson JA, Kotowicz MA, Young D, Nicholson GC. Annual high-dose oral vitamin D and falls and fractures in older women: a randomized controlled trial. Jama 2010;303:1815-22.
- Bolland MJ, Leung W, Tai V, Bastin S, Gamble GD, Grey A, Reid IR. Calcium intake and risk of fracture: systematic review. BMJ 2015;351:h4580.
- Silva de Lima M, Hotopf M. Pharmacotherapy for dysthymia. Cochrane Database Syst Rev 2003.
- Doornebal J, Bijlsma R, Brouwer RM. Een onbekende, maar potentieel ernstige bijwerking van protonpompremmers: hypomagnesiëmie. Ned Tijdschr Geneeskd 2009;153:A711.
- Groeneveld GH, Van 't Wout JW, Aarts NJ, Van Rooden CJ, Verheij TJM, Cobbaert CM, et al. Prediction model for pneumonia in primary care patients with an acute respiratory tract infection: role of symptoms, signs, and biomarkers. BMC Infect Dis 2019;19:976.
- Lyles KW, Colón-Emeric CS, Magaziner JS, Adachi JD, Pieper CF, Mautalen C, et al. Zoledronic acid and clinical fractures and mortality after hip fracture. N Engl J Med 2007;357:1799-809.
- Barrionuevo P, Kapoor E, Asi N, Alahdab F, Mohammed K, Benkhadra K, et al. Efficacy of pharmacological therapies for the prevention of fractures in postmenopausal women: a network meta-analysis. J Clin Endocrinol Metab 2019;104:1623-30.
- Merlijn T, Swart KMA, Van der Horst HE, Netelenbos JC, Elders PJM. Fracture prevention by screening for high fracture risk: a systematic review and meta-analysis. Osteoporos Int 2020;31:251-7.
- Ralston SH, Kou TD, Wick-Urban B, Steinbuch M, Masud T. Risk of upper gastrointestinal tract events in risedronate users switched to alendronate. Calcif Tissue Int 2010;87:298-304.
- Brandi ML, Black D. A drinkable formulation of alendronate: potential to increase compliance and decrease upper GI irritation. Clin Cases Miner Bone Metab 2013;10:187-90.
- Koller G, Goetz V, Vandermeer B, Homik J, McAlister FA, Kendler D, Ye C. Persistence and adherence to parenteral osteoporosis therapies: a systematic review. Osteoporos Int 2020;31:2093-102.
- Imaz I, Zegarra P, González-Enríquez J, Rubio B, Alcazar R, Amate JM. Poor bisphosphonate adherence for treatment of osteoporosis increases fracture risk: systematic review and meta-analysis. Osteoporos Int 2010;21:1943-51.
- Franken AA, Van Blijderveen NJ, Witjes MJ, Netelenbos CJ. Bisfosfonaatgerelateerde osteonecrose van de kaak. Ned Tijdschr Geneeskd 2011;155:A3077.
- Van Oostwaard MM, Van den Bergh JP, Maartens LW. Fractuurpreventie met denosumab. Huisarts Wet 2019:41-3.