De overgang
Begrippen
Naar Volledige tekst ›- Overgang: de periode van een veranderend menstruatiepatroon en de eerste menstruatievrije jaren, waarin een vrouw klachten en symptomen kan ervaren die een relatie hebben met een veranderende ovariële functie
- Menopauze: de laatste menstruatie in het leven van een vrouw
- Perimenopauze: de periode voor de menopauze waarin de menstruaties veranderen, tot 1 jaar na de laatste menstruatie
- Postmenopauze: de periode vanaf 1 jaar na de laatste menstruatie
- Vroegtijdige overgang: menopauze op een leeftijd < 40 jaar
Richtlijnen diagnostiek
Naar Volledige tekst ›Overweeg een relatie met de overgang bij vrouwen ≥ 40 jaar met de volgende klachten:
- menstruatieveranderingen
- vasomotorische klachten (opvliegers, nachtelijke zweetaanvallen)
- vulvovaginale klachten ten gevolge van vaginale atrofie
Anamnese
Naar Volledige tekst ›Vaststellen van de overgang
Vraag naar:
- cyclus: regelmaat, verandering in cycluslengte en hoeveelheid bloedverlies, laatste menstruatie
- vasomotorische klachten (opvliegers en nachtelijke zweetaanvallen): aard, frequentie, tijdstippen en beloop
- vulvovaginale klachten: irritatie, jeuk, droogheid, dyspareunie, afscheiding
- andere klachten of symptomen die de vrouw aan de overgang toeschrijft
- anticonceptie
- voorgeschiedenis: operaties aan uterus en/of adnexa, endometriose, hormoongevoelige tumoren
Ten behoeve van de differentiaaldiagnose
Vraag naar:
- aanwijzingen voor problematisch alcoholgebruik, angst- of paniekstoornis, hyperthyreoïdie
- medicatie die vasomotorische klachten kan veroorzaken, zoals vaatverwijders, tamoxifen, selectieve aromataseremmers en antidepressiva
Gevolgen voor de vrouw
Vraag naar:
- hinder en invloed klachten op functioneren en seksualiteit
- zelfzorg en zelfmedicatie
- psychosociale factoren zoals stress, werk, zorgtaken, steun omgeving, betekenis afsluiten vruchtbare levensfase
Bij overwegen van medicamenteuze behandeling
Vraag naar:
- voorgeschiedenis: veneuze trombo-embolieën (VTE), borstkanker en eventuele antihormonale nabehandeling, ischemische hart- en vaatziekten
- risicofactoren voor VTE, zoals trombofilie, belaste eerstegraadsfamilieanamnese
- risicofactoren voor ischemische hart- en vaatziekten, zoals roken, belaste familieanamnese, migraine
- risicofactoren voor borstkanker, zoals belaste familieanamnese, eerdere thoraxbestraling
Lichamelijk onderzoek
Naar Volledige tekst ›- Meet de bloeddruk indien medicamenteuze behandeling van vasomotorische klachten wordt overwogen (voor het beleid bij verhoogde bloeddruk, zie NHG-Standaard Cardiovasculair risicomanagement).
- Inspecteer bij vulvovaginale klachten de vulva. Let daarbij op de kleur, het aspect en de kwetsbaarheid van het slijmvlies (atrofie) en eventuele fluor (bacteriële vaginose).
- Speculumonderzoek kan achterwege blijven bij vulvovaginale atrofie.
- Verricht speculumonderzoek bij spotting, contactbloedingen of postmenopauzaal vaginaal bloedverlies (zie NHG-Standaard Vaginaal bloedverlies), en bij fluorklachten (zie NHG-Standaard Fluor vaginalis).
Aanvullend onderzoek
Naar Volledige tekst ›Verricht op indicatie:
- zwangerschapstest
- bepaling van hemoglobine (bij langdurig overvloedig bloedverlies)
- bepaling van TSH
- diagnostiek voor cardiovasculair risicomanagement (zie NHG-Standaard Cardiovasculair risicomanagement)
Evaluatie
Naar Volledige tekst ›Stel de diagnose ‘overgangsklachten’ wanneer bij een vrouw ≥ 40 jaar sprake is van vasomotorische klachten (opvliegers en/of nachtelijke zweetaanvallen) of klachten van vaginale atrofie bij een veranderd menstruatiepatroon of amenorroe, indien andere oorzaken zijn uitgesloten.
Differentiaaldiagnostische overwegingen
Naar Volledige tekst ›- Bij vasomotorische klachten: bijwerking van medicatie, overmatig alcoholgebruik, angst- of paniekstoornis, hyperthyreoïdie of andere zeldzame oorzaken
- Bij vulvovaginale klachten: lichen sclerosus, seksuele problematiek, vaginale infecties (zie NHG-Standaard Fluor vaginalis)
- Bij onregelmatig vaginaal bloedverlies: zwangerschapscomplicaties (zie NHG-Standaard Miskraam), cervixpathologie, endometriumafwijkingen (zie NHG-Standaard Vaginaal bloedverlies)
Richtlijnen beleid
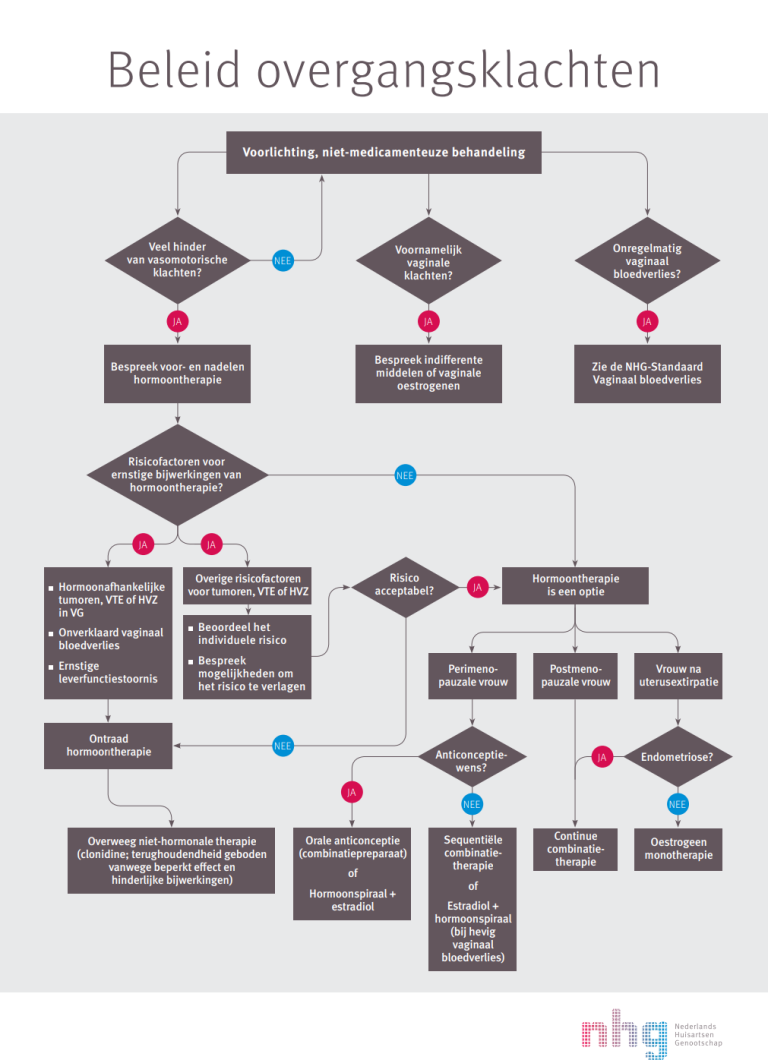
Naar Volledige tekst ›Het beleid is samengevat in een stroomschema (zie figuur).
Voorlichting
Naar Volledige tekst ›- De overgang is een fysiologisch proces met een onvoorspelbaar beloop (gemiddelde duur 4-6 jaar) en grote variatie in hinder van klachten.
- Opvliegers en nachtelijke zweetaanvallen komen het meest voor in het eerste jaar na de menopauze en houden doorgaans 3-7 jaar aan.
- Opvliegers ’s nachts kunnen moeheid, sombere gevoelens en slapeloosheid veroorzaken.
- In principe kan anticonceptie op de leeftijd van 52 jaar worden gestaakt (zie NHG-Standaard Anticonceptie).
- Bij dyspareunie: adequate stimulatie en opwinding zijn belangrijk voor voldoende lubricatie.
Niet-medicamenteuze behandeling
Naar Volledige tekst ›- Gewichtsreductie en lichaamsbeweging hebben een algemeen positief gezondheidseffect, maar dragen niet bij aan het verminderen van opvliegers of nachtelijke zweetaanvallen.
- Van mindfulness en stressreducerende psychologische interventies is enig effect aangetoond.
- Van vrij verkrijgbare preparaten tegen overgangsklachten is niet aangetoond dat deze de klachten verminderen. Ze kunnen wel ernstige bijwerkingen geven.
Medicamenteuze behandeling
Naar Volledige tekst ›Hormoontherapie algemeen
Naar Volledige tekst ›- Overweeg hormoontherapie voor vasomotorische klachten bij vrouwen met hinderlijke beperkingen in het dagelijks leven. Weeg samen met de vrouw het effect van hormoontherapie (vermindering van hinderlijke klachten) af tegen mogelijke bijwerkingen (relatief zeldzaam, maar potentieel levensbedreigend) zoals VTE, myocardinfarct, beroerte, borstkanker, endometriumcarcinoom.
- Ontraad hormoontherapie bij:
- eerder vastgestelde hormoonafhankelijke tumoren zoals borstkanker of endometriumcarcinoom;
- eerder vastgestelde VTE, met of zonder trombofilie (dit geldt niet voor vrouwen die antistolling gebruiken);
- eerder vastgestelde hart- en vaatziekten;
- onverklaard vaginaal bloedverlies;
- ernstige leverfunctiestoornissen.
- Bespreek bij overige situaties het aantal, de aard en de ernst van de risicofactoren bij de beoordeling van het individuele risico op hart- en vaatziekten, VTE en borstkanker en weeg samen met de vrouw de voor- en nadelen van de behandeling af. Bespreek ook de mogelijkheden om het individuele risico te verlagen, zoals stoppen met roken, minderen van alcohol, meer bewegen en afvallen.
- Bij keuze voor hormoontherapie: kies met de vrouw tussen orale of transdermale toediening van estradiol. Beide zijn even effectief en veilig. Bij vrouwen met een uterus moet altijd ook een progestageen gebruikt worden (alleen in tabletvorm beschikbaar). Zie tabel 1 voor middelen en doseringen per patiëntengroep.
|
Perimenopauzaal, geen anticonceptiewens |
Combinatietherapie estradiol met progestageen sequentieel (onttrekkingsbloeding maandelijks) |
|
|---|---|---|
| Estradiol oraal |
Combinatiepreparaat (kalenderverpakking met 14 tabletten met estradiol 1 mg en 14 tabletten met estradiol 1 mg + dydrogesteron 10 mg): 1 dd 1 tablet |
|
|
Tweede keuze: estradiol tablet 1 dd 1 mg + gedurende 14 opeenvolgende dagen per maand progesteron tablet 100 mg 1 dd 2 voor de nacht |
||
| Estradiol transdermaal |
Estradiol pleister 50 microg/24 uur 2 x per week vervangen*+ gedurende 14 opeenvolgende dagen per maand dydrogesteron tablet 1 dd 10 mg |
|
|
Tweede keuze: estradiol pleister 50 microg/24 uur 2 × per week vervangen*+ gedurende 14 opeenvolgende dagen per maand progesteron tablet 100 mg 1 dd 2 voor de nacht |
||
| Combinatietherapie estradiol met hormoonspiraal (bij gelijktijdige klachten van hevig bloedverlies) | ||
| Zie Perimenopauzaal met anticonceptiewens | ||
|
Perimenopauzaal met anticonceptiewens |
Combinatietherapie estradiol met hormoonspiraal |
|
|
Estradiol oraal |
Estradiol tablet 1 dd 1 mg + hormoonspiraal 52 mg levonorgestrel† |
|
|
Estradiol transdermaal |
Estradiol pleister 50 microg/24 uur, 2 × per week vervangen* + hormoonspiraal 52 mg levonorgestrel† |
|
|
Orale anticonceptie (combinatiepreparaat)‡ |
||
|
Zie NHG-Standaard Anticonceptie voor voorkeursmiddelen |
||
|
Postmenopauzaal |
Combinatietherapie estradiol met progestageen continu (bloedverlies op termijn afwezig) |
|
|
Estradiol oraal |
Combinatiepreparaat met estradiol 1 mg + dydrogesteron 5 mg: 1 dd 1 tablet |
|
|
Tweede keuze: estradiol tablet 1 dd 1 mg + progesteron tablet 100 mg 1 dd 1 voor de nacht |
||
|
Optie lage dosering:§ combinatiepreparaat met estradiol 0,5 mg + dydrogesteron 2,5 mg: 1 dd 1 tablet |
||
|
Estradiol transdermaal |
Estradiol pleister 50 microg/24 uur, 2 × per week vervangen*+ dydrogesteron tablet 1 dd 10 mg |
|
|
Tweede keuze: estradiol pleister 50 microg/24 uur, 2 × per week vervangen*+ progesteron tablet 100 mg 1 dd 1 voor de nacht |
||
|
Optie lage dosering:§ estradiol pleister 25 microg/24 uur (= halve pleister, offlabel), 2 × per week vervangen* + dydrogesteron tablet 1 dd 10 mg |
||
|
Na uterusextirpatie (zonder endometriose) |
Monotherapie estradiol |
|
|
Estradiol oraal |
Estradiol tablet 1 dd 1 mg |
|
|
Estradiol transdermaal |
Estradiol pleister 50 microg/24 uur, 2 × per week vervangen* |
|
|
Na uterusextirpatie (met endometriose) |
Combinatietherapie estradiol met progestageen continu |
|
| Zie Postmenopauzaal | ||
|
* Pleister op droge, onbeschadigde huid plakken: buik, bovenbeen, bil, lage rugstreek, niet borsten. Toedieningsplaats afwisselen. Pleister mag nat worden, tijdens douchen, baden. Huiddeel met pleister niet blootstellen aan direct zonlicht. † Gebruikstermijn voor deze indicatie 3 jaar. Zie NHG-Standaard Anticonceptie voor meer informatie over de hormoonspiraal. ‡ Houd rekening met contra-indicaties en weeg hierbij het vanwege de leeftijd hogere uitgangsrisico op VTE, borstkanker en hart- en vaatziekten mee (zie NHG-Standaard Anticonceptie). Bespreek bij keuze voor orale anticonceptie het algemene advies om op de leeftijd van 52 jaar te stoppen met hormonale anticonceptie. Vanaf deze leeftijd geldt bij aanhoudende vasomotorische klachten het beleid voor postmenopauzale vrouwen (tenzij er nog een cyclus is). § Als de vrouw hierom vraagt. |
||
Niet-hormonale behandeling
Naar Volledige tekst ›Clonidine
Bij vrouwen met een contra-indicatie voor hormoontherapie kan eventueel clonidine worden overwogen:
- Start met clonidine tablet 2 dd 0,05-0,075 mg.
- Evalueer het effect na 4 weken, stop bij onvoldoende effect en/of bijwerkingen.
- Bouw bij stoppen de dosering in enkele dagen af.
Vaginale klachten
Naar Volledige tekst ›Kies in overleg met de vrouw tussen een indifferent middel of vaginaal oestrogeen.
- Indifferente middelen: vochtinbrengende gel, crème met hyaluronzuur
- Bij keuze voor vaginaal oestrogeen:
- estriol vaginale ovules of crème 1 dd 0,5 mg gedurende 2 weken, daarna 2 × per week 0,5 mg, of
- estradiol tablet voor vaginaal gebruik 1 dd 10 microg, bouw na 2 weken af tot maximaal 10 microg 2 x per week
- instrueer de vrouw contact op te nemen bij vaginaal bloedverlies
Controles
Naar Volledige tekst ›Hormoontherapie vanwege vasomotorische klachten
- Evalueer na 3 maanden.
- Verhoging van de dosering wordt niet aanbevolen.
- Bepaal de frequentie van vervolgcontacten in samenspraak met de vrouw (ten minste jaarlijks).
- Evalueer daarbij het gebruik en bespreek het al dan niet continueren van de behandeling;
- Streef naar gebruik < 5 jaar vanwege de geleidelijk oplopende risico’s.
Medicamenteuze therapie vanwege vaginale atrofie
- Evalueer na 3 maanden.
- Bepaal de frequentie van vervolgcontacten in samenspraak met de vrouw (ten minste jaarlijks).
- Evalueer daarbij het gebruik en bespreek het al dan niet continueren van de behandeling.
Consultatie en verwijzing
Naar Volledige tekst ›- Consulteer of verwijs naar een gynaecoloog voor advies bij (heel) hinderlijke vasomotorische klachten en contra-indicaties voor medicamenteuze behandeling.
- Adviseer contact met de bedrijfsarts bij functioneringsproblemen op het werk.
- Verwijs bij vroegtijdige overgang voor diagnostiek naar oorzaak en advies.
- Verwijs bij onregelmatig vaginaal bloedverlies > 3 maanden bij continue combinatietherapie voor beoordeling endometrium (transvaginale echografie is in deze situatie niet betrouwbaar).
- Verwijs bij onverklaard vaginaal bloedverlies bij gebruik van vaginaal oestrogeen.
Belangrijkste wijzigingen
Naar Samenvatting ›- De behandelduur van hinderlijke vasomotorische klachten is verruimd en daarmee is het advies vervallen om hormonale medicatie op proef te staken na 6 maanden.
- Bij hormonale behandeling van hinderlijke vasomotorische klachten heeft transdermale toediening van oestrogeen een wat prominentere plaats gekregen dan in de vorige versie van deze standaard.
- Dydrogesteron heeft de voorkeur als progestageen bij behandeling van vasomotorische klachten vanwege het laagste risico op ernstige bijwerkingen; norethisteron wordt niet meer aanbevolen.
- Bij vulvovaginale klachten is behandeling met indifferente middelen een gelijkwaardige optie geworden aan lokale behandeling met een oestrogeen.
Kernboodschappen
Naar Samenvatting ›- Informeer de vrouw over de (fysiologie van de) overgang en bespreek dat vasomotorische klachten fluctueren en het beloop individueel niet goed te voorspellen is.
- Alleen bij vasomotorische klachten is er een indicatie voor hormoontherapie.
- De hinder van vasomotorische klachten en het individuele risicoprofiel bepalen of er, in samenspraak met de vrouw, gekozen wordt voor hormoontherapie.
- Maak, indien gekozen wordt voor hormoontherapie, in samenspraak met de vrouw een keuze tussen orale of transdermale toediening van oestrogeen.
- Combineer bij vrouwen met een uterus oraal of transdermaal oestrogeen altijd met een progestageen ter voorkoming van endometriumcarcinoom.
- Evalueer bij hormoontherapie jaarlijks de effectiviteit, veiligheid (risicofactoren voor veneuze trombo-embolie (VTE), hart- en vaatziekten en borstkanker) en bijwerkingen.
Inleiding
Naar Samenvatting ›Scope
Naar Samenvatting ›Richtlijnen voor diagnostiek en beleid bij klachten, vragen en problemen tijdens de overgang.
Buiten de scope
Naar Samenvatting ›- Richtlijnen voor het beleid ten aanzien van het bepalen of actualiseren van het cardiovasculaire risico (zie NHG-Standaard Cardiovasculair risicomanagement)
- Richtlijnen voor de diagnostiek en het beleid bij osteoporose (zie NHG-Standaard Fractuurpreventie)
- Richtlijnen voor het beleid bij menstruatieveranderingen (zie NHG-Standaard Vaginaal bloedverlies en NHG-Standaard Amenorroe)
- Diagnostiek van vroegtijdige overgang en beleid bij zwangerschapswens bij vermoeden van vroegtijdige overgang (zie NHG-Standaard Amenorroe)
- Klachten en beleid bij iatrogene overgang
Afstemming
Naar Samenvatting ›Deze standaard sluit aan bij de NHG-Standaard Anticonceptie en de NHG-Standaard Seksuele klachten.
De standaard is ontwikkeld in samenwerking met de Nederlandse Vereniging voor Obstetrie en Gynaecologie.
Achtergronden
Naar Samenvatting ›Begrippen
Naar Samenvatting ›- Overgang: de periode van een veranderend menstruatiepatroon en de eerste menstruatievrije jaren, waarin een vrouw klachten en symptomen kan ervaren die een relatie hebben met een veranderende ovariële functie
- Menopauze: de laatste menstruatie in het leven van een vrouw; het tijdstip van de menopauze wordt retrospectief bepaald 1 jaar na de laatste menstruatie
- Perimenopauze: de periode voor de menopauze waarin de menstruaties veranderen, tot 1 jaar na de laatste menstruatie
- Postmenopauze: de periode vanaf 1 jaar na de laatste menstruatie
- Vroegtijdige overgang: menopauze op een leeftijd < 40 jaar
De overgang is de periode met een veranderend menstruatiepatroon en de eerste menstruatievrije jaren, waarin een vrouw symptomen en klachten kan ervaren die een relatie hebben met een veranderende ovariële functie. Het einde van de overgang is het moment waarop de vrouw geen overgangssymptomen meer heeft, of er geen hinder meer van heeft.
De omschrijving van de begrippen menopauze, peri- en postmenopauze is conform de definities van de World Health Organisation.
In de internationale literatuur wordt vaak de term ‘menopauzale overgang’ gebruikt in plaats van perimenopauze.
In 2001 is een model ontwikkeld voor reproductieve veroudering (STRAW-model), gebaseerd op cyclusregelmaat en FSH-spiegels. De reproductieve fase is ingedeeld in 3 fasen (vroege, piek en late), de perimenopauze en de postmenopauze beide in 2 fasen (vroege en late). In de late reproductieve fase is de cyclus nog regelmatig, maar is het FSH al gestegen (een teken van ovariële veroudering). De vroege perimenopauze is de fase met een variabele cycluslengte (> 7 dagen verschillend van normaal). De late perimenopauze wordt gekenmerkt door ≥ 2 overgeslagen cycli en zestig of meer dagen amenorroe. De vroege postmenopauzale fase is de periode < 5 jaar na laatste menstruatie; de late fase is de periode ≥ 5 jaar na laatste menstruatie. In de peri- en postmenopauze is het FSH verhoogd.
Het STRAW-model heeft voor de huisartsenpraktijk beperkte waarde, omdat er grote individuele variatie bestaat in de duur en het beloop van de verschillende fasen. Vrouwen kunnen fasen overslaan of heen en weer gaan tussen verschillende fasen.
Van een vroegtijdige menopauze wordt gesproken wanneer deze optreedt voor de leeftijd van 40 jaar. Dit afkappunt heeft een statistische achtergrond. De leeftijd bij de menopauze is normaal verdeeld en ongeveer 1% van de verdeling (> 2 SD) ligt onder de leeftijd van 40 jaar.
Epidemiologie
Naar Samenvatting ›- De gemiddelde leeftijd waarop vrouwen in Nederland de menopauze bereiken, is 50-51 jaar.
- Voor vrouwen die roken ligt de gemiddelde leeftijd lager.
- Het is niet bekend of de gemiddelde leeftijd verschilt bij vrouwen met verschillende etnische achtergronden.
- Ongeveer 80% van de vrouwen heeft vasomotorische symptomen (opvliegers en nachtelijke zweetaanvallen) tijdens de overgang. Het eerste jaar na de menopauze worden deze symptomen het vaakst gemeld; de duur loopt uiteen en bedraagt doorgaans 3-7 jaar, soms langer.
- De prevalentie van klachten van vaginale atrofie neemt toe na de menopauze en is 4-5 jaar postmenopauzaal het hoogst. Ongeveer 15% van de perimenopauzale vrouwen en 30% van de postmenopauzale vrouwen ervaart klachten van vaginale atrofie.
- De incidentie van overgangsklachten (ICPC-code X11) in de huisartsenpraktijk is 26 per 1000 vrouwen per jaar in de leeftijd 45-64 jaar.
Leeftijd bij de menopauze
In een Nederlands cohortonderzoek naar borstkanker werd aan een steekproef van 3384 deelnemers gevraagd naar hun leeftijd ten tijde van hun laatste menstruatie. Al deze vrouwen waren ooit zwanger geweest. De leeftijd bij de menopauze was gemiddeld 50,4 jaar (SD 4,1) en normaal verdeeld, met een lichte asymmetrie naar links.
Een menopauze tussen de 40 en 45 jaar is relatief vroeg.
In een ander onderzoek (n = 2393), waarbij ook gegevens uit het bovengenoemde cohortonderzoek werden gebruikt, bedroeg de leeftijd bij de menopauze gemiddeld 49,9 jaar (SD 4,5 jaar). In deze groep was 79% van de vrouwen ooit zwanger geweest. In het onderzoek was subfertiliteit geassocieerd met een eerder optredende menopauze. Daarnaast had 97,8% van alle vrouwen uit het oorspronkelijke cohort op de leeftijd van 58 jaar de menopauze bereikt.
In een Nederlands cross-sectioneel onderzoek in de open populatie (n = 1343) was de mediane leeftijd 50,5 jaar.
Een systematische review (SR) naar de associatie tussen roken en de leeftijd bij de menopauze toonde dat rokende vrouwen eerder de menopauze bereiken dan niet-rokende vrouwen. In 13 prospectieve cohorten varieerde het verschil tussen 2,5 maanden en 2,5 jaar.
In een cross-sectioneel Amerikaans onderzoek (n = 14.620) werd op basis van zelfrapportage de leeftijd bij de menopauze en de beïnvloedende factoren bepaald in verschillende etnische groepen (Afro-Amerikaans, Kaukasisch, Japans, Chinees, Latijns-Amerikaans).
De gemiddelde leeftijd bij de menopauze was 51,4 jaar. Japanse afkomst was geassocieerd met een menopauze op latere leeftijd. Andere associaties werden niet gevonden.
Conclusie
De gemiddelde leeftijd waarop vrouwen in Nederland de menopauze bereiken, is 50 tot 51 jaar. Rokende vrouwen bereiken eerder de menopauze. Subfertiliteit is geassocieerd met een vroegere leeftijd bij de menopauze. Het is onbekend of de leeftijd ten tijde van de menopauze varieert onder de verschillende etnische groepen in Nederland.
Beloop van vasomotorische symptomen
Uit verschillende populatieonderzoeken blijkt dat ongeveer 80% van de vrouwen meldt vasomotorische symptomen te hebben op enig moment tijdens de overgang. Het meest frequent wordt dit gemeld tijdens het eerste jaar na de menopauze.
In deze periode worden, nadat de cycli aanvankelijk wat onregelmatiger zijn geworden, menstruaties overgeslagen en krijgt de vrouw te maken met periodes van amenorroe.
De duur van de vasomotorische symptomen is in verschillende langlopende cohortonderzoeken onderzocht.
In een Australisch prospectief cohortonderzoek (n = 205, gemiddelde leeftijd 49 jaar, follow-up 13 jaar) was de gemiddelde duur van hinderlijke vasomotorische symptomen tijdens de overgang 5,2 jaar (SD 3,8). Hinder van vasomotorische symptomen werd bepaald op basis van zelfrapportage in de voorgaande 2 weken. Gedurende de follow-up meldde 20% van de vrouwen geen vasomotorische symptomen te hebben. Factoren zoals roken, BMI, stemming en opleidingsniveau waren niet significant geassocieerd met de duur van de vasomotorische symptomen.
In een Amerikaans prospectief cohortonderzoek (n = 1449 vrouwen met een verschillende etnische achtergrond, gemiddelde leeftijd 50 jaar, mediane follow-up 13 jaar) was de gemiddelde duur van frequente vasomotorische symptomen 7,4 jaar en na de laatste menstruatie 4,5 jaar. Frequent werd gedefinieerd als vasomotorische symptomen op > 6 dagen in de voorgaande 2 weken, op basis van jaarlijkse zelfrapportage. Vasomotorische symptomen duurden het langst (mediaan > 11 jaar) als vrouwen premenopauzaal of vroeg perimenopauzaal waren tijdens de eerste melding. Bij vrouwen die postmenopauzaal waren op het moment dat de symptomen begonnen, duurden de symptomen het kortst (mediaan 3,4 jaar na de laatste menstruatie). Vrouwen van Afro-Amerikaanse afkomst meldden de langste duur (mediaan 10,1 jaar), vrouwen van ‘non-Hispanic’ afkomst meldden een mediane duur van 6,5 jaar. Kortere duur was geassocieerd met het hebben van een levenspartner, een hoger opleidingsniveau, weinig financiële zorgen en meer sociale steun. Langere duur was geassocieerd met ooit hebben gerookt, hogere BMI, hogere symptoomgevoeligheid, depressieve of angstklachten en stress.
Analyse van het individuele beloop van vasomotorische symptomen leverde globaal 4 patronen op, met in elke groep ongeveer eenzelfde percentage vrouwen. Een early onset-groep had symptomen vroeg in de overgang tot na laatste menstruatie en deze namen dan af. Een late onset-groep had de piek van symptomen rond de laatste menstruatie en deze namen daarna geleidelijk af. Een derde groep (low) had weinig tot geen symptomen en bij een vierde groep (high) begonnen de symptomen vroeg in de overgang en hielden lang aan na de laatste menstruatie. Geassocieerde factoren in de high-groep (n = 383), vergeleken met de low-groep (n = 393) waren Afro-Amerikaanse afkomst, alcoholgebruik, matige algemene gezondheid, lagere opleiding en angstklachten.
In een ander Amerikaans prospectief cohortonderzoek (n = 255, gemiddelde leeftijd bij start 42 jaar, follow-up 16 jaar) werd de prevalentie van vasomotorische symptomen onderzocht in relatie tot de laatste menstruatie. Ongeveer de helft van de vrouwen was van Afro-Afrikaanse afkomst en de andere helft was van ‘witte afkomst’.
De piekprevalentie van matige tot ernstige vasomotorische symptomen (op een vierpuntsschaal: 0 = geen, 1= mild, 2 =matig, 3 = ernstig) was 46% tijdens de eerste 2 jaar na de laatste menstruatie. De piekprevalentie van aanwezigheid van alle vasomotorische symptomen (mild tot ernstig) was 74% in deze periode. In een subgroep (n =182) met matige tot ernstige opvliegers was de gemiddelde duur na de laatste menstruatie 4,6 jaar (SD 2,9). De gemiddelde duur van vasomotorische symptomen (mild tot ernstig, n = 230) na de laatste menstruatie was 4,9 jaar (SD 3,1). De totale gemiddelde duur van matige tot ernstige vasomotorische symptomen was 8,8 jaar (SD 4,4). Bij Afro-Amerikaanse vrouwen was de totale gemiddelde duur 9,5 jaar (SD 4,3), versus 8,1 jaar (SD 4) bij niet-Afro-Amerikaanse vrouwen.
Angstklachten waren geassocieerd met een grotere kans op het melden van vasomotorische symptomen. Een hoger opleidingsniveau was geassocieerd met een lagere kans.
Conclusie
Ongeveer 80% van de vrouwen heeft vasomotorische symptomen tijdens de overgang. Deze zijn het meest frequent tijdens het eerste jaar na de menopauze en houden ongeveer 3-7 jaar aan. Het individuele beloop van vasomotorische symptomen varieert en is niet goed te voorspellen.
Prevalentie van vaginale droogheid
Vaginale droogheid is een van de klachten bij vaginale atrofie. Een systematische review (SR) naar klachten tijdens de overgang in de open populatie toonde een associatie tussen vaginale droogheid en de menopauze. In 13 dwarsdoorsnede-onderzoeken had 4 tot 22% van de premenopauzale vrouwen vaginale droogheid. Peri- en vroegpostmenopauzaal varieerde dit percentage tussen 7 en 39%, respectievelijk 17 en 30%. In het Nederlandse onderzoek uit deze review bedroegen de percentages van vaginale droogheid premenopauzaal 4%, perimenopauzaal 14 tot 18% en postmenopauzaal 30%.
Overgangsklachten in de huisartsenpraktijk
In 2019 was de incidentie van opvliegers en atrofische vaginitis (ICPC-code X11, climacteriële symptomen/klachten) in de huisartsenpraktijk 26,1 per 1000 vrouwen per jaar in de leeftijdsgroep 45-64 jaar. De prevalentie bedroeg 50,6 per 1000 vrouwen per jaar. In de leeftijdsgroep 65-74 jaar was de incidentie 7,1 en de prevalentie 16,2 per 1000 vrouwen per jaar.
Etiologie, prognose en beloop
Naar Samenvatting ›Tijdens de overgang wordt de vruchtbare levensfase van een vrouw afgesloten doordat de ovariële functie vermindert. Door veroudering nemen de eicelvoorraad en de kwaliteit van de nog overgebleven eicellen af. Uiteindelijk reageren deze eicellen niet meer op gonadotrope hormonen en stopt de uitrijping van de eicellen.
Follikelstimulerend hormoon
Naar Samenvatting ›Al voordat de menstruaties veranderen, stijgt de concentratie follikelstimulerend hormoon (FSH), een teken van ovariële veroudering. Tijdens de perimenopauze stijgt het FSH verder en kunnen zowel ovulatoire als anovulatoire cycli optreden. Door de afname van de eicelvoorraad neemt de oestrogeenproductie af en is er minder negatieve terugkoppeling naar de hypofyse, waardoor het FSH stijgt. De FSH-spiegel kan in de perimenopauze sterk wisselen en heeft geen voorspellende waarde voor het tijdstip van de menopauze. Kort voor de menopauze dalen de oestrogeenspiegels. Het FSH blijft verhoogd.
FSH, Anti-Müllerian hormone (AMH) en inhibine A en B zijn hormonen waarvan de spiegels veranderen, voordat de menstruaties onregelmatig worden. Het FSH stijgt aanvankelijk alleen vroeg in de cyclus. In de perimenopauze stijgt FSH verder en begint ook LH te stijgen. In de luteale fase daalt het progesteron en varieert het oestradiol. In deze fase worden de cycli anovulatoir, omdat de follikels niet meer adequaat reageren en er geen goede oestriolproductie is (ondanks hoge FSH-stimulatie) voor een voldoende LH-piek. In de late perimenopauze stijgen FSH en LH en heeft oestradiol minder hoge pieken. Uiteindelijk reageren de follikels nauwelijks meer op FSH-stimulatie en daalt de oestradiolspiegel waardoor het endometrium niet meer opgebouwd wordt. Na de menopauze stijgen het FSH en LH, en is het oestradiol variabel laag.
Na de menopauze, wanneer de follikels niet meer actief zijn, blijft het stroma van ovarium onder invloed van hoge LH-spiegels actief en produceert het nog lange tijd androsteendion en vooral testosteron. Androsteendion wordt in het vetweefsel omgezet in oestron. Adipeuze vrouwen kunnen zo nog langere tijd een aanzienlijke oestrogeenproductie hebben.
Klachten tijdens de overgang
Naar Samenvatting ›- De overgang is een complex, deels nog onopgehelderd fysiologisch proces dat vaak samengaat met andere verouderingsverschijnselen en met sociale veranderingen.
- Biologische en sociaal-culturele factoren zijn van invloed op de klachten tijdens de overgang.
- Veel vrouwen hebben tijdens de overgang last van nachtelijke zweetaanvallen. Deze kunnen leiden tot slaapproblemen. Onduidelijk is of etniciteit en leefstijlfactoren (zoals roken) het optreden van vasomotorische symptomen beïnvloeden.
- Vaginale atrofie kan klachten geven zoals vaginale irritatie, droogheid, jeuk, afscheiding en dyspareunie. Deze klachten beïnvloeden de seksualiteit, maar ook andere, leeftijdsgebonden, factoren spelen daarbij een rol: verslechtering van de eigen gezondheid en die van de partner, en voorafgaande seksualiteitsbeleving. Bij postmenopauzale vrouwen duurt het bij seksuele opwinding langer voordat lubricatie optreedt. Adequate seksuele stimulatie verhoogt de vaginale doorbloeding, waardoor de lubricatie voldoende kan zijn en er geen dyspareunie hoeft op te treden.
- Er bestaat geen duidelijke associatie tussen de overgang en depressie, angst en andere psychische klachten. Wel zouden vrouwen met een eerdere depressie een verhoogd risico hebben op depressieve klachten tijdens de overgang.
- Ook is er onduidelijkheid over een associatie tussen de overgang en gewrichtsklachten of artrose.
- Gebruik van hormonale anticonceptie kan de symptomen en klachten van de overgang maskeren.
Overgangsklachten en biologische en sociaal-culturele factoren
In een systematische review (SR) (1 cohortonderzoek en 12 cross-sectionele onderzoeken) werd de relatie tussen attitude met betrekking tot de overgang en symptoombeleving in de open populatie onderzocht.
In 10 onderzoeken werd gevonden dat vrouwen met meer negatieve attitude ten opzichte van de overgang meer symptomen meldden tijdens de overgang, in 3 onderzoeken werd geen significant verband gevonden.
Uit 6 onderzoeken bleek dat als vrouwen de overgang als een natuurlijk fenomeen beschouwen, zij over het algemeen positief gestemd zijn ten opzichte van de overgang. Jongere perimenopauzale vrouwen hebben vaker een negatieve houding. Uit één onderzoek bleek dat vrouwen met een lagere score op algemeen welbevinden (bijvoorbeeld met depressieve klachten) een negatievere houding hebben ten opzichte van de overgang; mogelijk beïnvloedt de stemming voorafgaand aan de menopauze de houding ten opzichte en de beleving van de overgang. Vrouwen van Kaukasische afkomst stonden negatiever tegenover de overgang dan vrouwen van andere afkomst. Vrouwen met een hogere opleiding en vrouwen met een sterkere sociale steun hadden een positievere houding ten opzichte van de overgang.
Conclusie
De klachten tijdens de overgang worden beïnvloed door biologische en sociaal-culturele factoren.
Slaapproblemen tijdens de overgang
In een systematisch literatuuroverzicht (3 cohortonderzoeken, 18 cross-sectionele onderzoeken) werd de associatie tussen de overgang en slaapproblemen onderzocht. De resultaten van de geïncludeerde onderzoeken waren erg heterogeen. Twee van de 3 cohortonderzoeken toonden dat 40-60% van de peri- en postmenopauzale vrouwen moeite met slapen hadden tijdens de overgang, mogelijk ten gevolge van vasomotorische symptomen. Ook in een nadien gepubliceerd Australisch prospectief cohortonderzoek (n = 8649) hadden vrouwen in de perimenopauze meer slaapproblemen dan voordat zij in de overgang kwamen (OR 1,4; 95%-BI 1,2 tot 1,6). In een Amerikaans prospectief cohortonderzoek (n = 346) naar slaapkwaliteit bij vrouwen in de overgang bleek de aanwezigheid van vasomotorische symptomen een onafhankelijke voorspeller te zijn voor verminderde slaapkwaliteit.
Conclusie
Veel vrouwen hebben tijdens de overgang last van nachtelijke zweetaanvallen, die ook kunnen leiden tot slaapproblemen.
Vasomotorische klachten en beïnvloedende factoren
In een systematisch literatuuroverzicht werd onder andere de invloed van etniciteit, BMI en roken op vasomotorische klachten onderzocht. Een Amerikaanse cohortonderzoek met vrouwen uit verschillende etnische groepen toonde dat, vergeleken met vrouwen van Kaukasische afkomst, Afro-Afrikaanse vrouwen meer en Latijns-Amerikaanse, Japanse en Chinese vrouwen minder vasomotorische klachten meldden. De invloed van BMI en van roken op vasomotorische klachten waren niet eenduidig.
Conclusie
Of etniciteit en leefstijlfactoren (zoals roken) het optreden van vasomotorische symptomen beïnvloeden, is niet duidelijk.
Seksualiteit
Uit meerdere onderzoeken blijkt dat met de leeftijd de seksuele activiteit van vrouwen geleidelijk afneemt. Belangrijkste redenen om geen seks te hebben is het wegvallen van de partner of seksuele problemen bij de partner. Daarnaast zijn de voorafgaande seksualiteitsbeleving, evenals gezondheid geassocieerd met seksueel functioneren. Vijftig tot 70% van de vrouwen is postmenopauzaal seksueel actief. Ofschoon alle postmenopauzale vrouwen in meerdere of mindere mate vaginale atrofie hebben, heeft slechts 20 tot 30% van deze vrouwen klachten van vaginale droogheid en dyspareunie. Dit suggereert dat oestrogeendeficiëntie niet de directe oorzaak is van seksuele problematiek, maar dat deze deficiëntie postmenopauzale vrouwen kwetsbaarder maakt voor bij deze levensfase passende seksuele problematiek. In een vergelijkend onderzoek tussen 42 postmenopauzale en 8 premenopauzale vrouwen werd het verband tussen seksualiteit en hormonen onderzocht via vragenlijsten, hormoonspiegels en psychofysiologische metingen (verandering van vaginale doorbloeding als maat voor seksuele opwinding). Er werd weliswaar een significant lagere vaginale doorbloeding gevonden bij postmenopauzale vrouwen, maar dit verschil verdween na erotische prikkeling. Een toename in vaginale doorbloeding geeft een verhoogde lubricatie. De veronderstelling van de onderzoekers luidt dat alleen de basale vaginale doorbloeding als gevolg van de lagere oestrogeenspiegels afneemt. Bij vrouwen die na de menopauze last krijgen van dyspareunie en vaginale droogheid tijdens het vrijen, is dat waarschijnlijk toe te schrijven aan te weinig opwinding. Voor de menopauze wordt dat door de hogere basale vaginale doorbloeding en de daarmee samenhangende hogere basale lubricatie gecompenseerd.
Conclusie
Voor voldoende seksuele lubricatie in de postmenopauze is een adequate seksuele stimulatie noodzakelijk.
Stemming tijdens de overgang
In een systematisch literatuuroverzicht (9 prospectieve openpopulatie-cohortonderzoeken) werd de associatie tussen de overgang en stemming (depressie, angst en andere psychische klachten) beschreven. De onderzoeken varieerden aanzienlijk in opzet, uitkomstmaten en correctie voor confounders. In 5 onderzoeken werd geen associatie gevonden. Drie onderzoeken toonden echter dat vrouwen in de peri- en postmenopauze een groter risico hadden op depressieve klachten dan premenopauzale vrouwen. Een eerdere depressie of depressieve klachten tijdens de start van het onderzoek vergrootte het risico op een depressie of depressieve klachten. In één onderzoek nam het welbevinden juist toe tijdens de overgang.
Conclusie
Er bestaat geen duidelijke associatie tussen de overgang en depressie, angst en andere psychische klachten. Wel zouden vrouwen met een eerdere depressie een verhoogd risico hebben op depressieve klachten tijdens de overgang.
Gewrichtsklachten en artrose tijdens de overgang
In een systematisch literatuuroverzicht (3 open-populatiecohorten, 18 cross-sectionele onderzoeken) werd de associatie tussen lichamelijke klachten, waaronder gewrichtsklachten, en de overgang beschreven.
In de meeste onderzoeken werd geen associatie gevonden. In 1 cohortonderzoek en 2 cross-sectionele onderzoeken werd een toename van lichamelijke klachten vonden bij perimenopauze vrouwen vergeleken met premenopauzale vrouwen.
In een systematische review (SR) kon geen onafhankelijke relatie tussen veranderde hormoonspiegels en de aanwezigheid van artrose (klinisch en radiologisch) worden vastgesteld.
Conclusie
Er is onduidelijkheid over een associatie tussen de overgang en gewrichtsklachten of artrose.
Opvliegers
Naar Samenvatting ›- Een opvlieger is een spontane aanval van perifere vasodilatatie, samengaand met een gevoel van hitte, blozen en (hevig) transpireren, een toegenomen hartslag en rillingen. Niet alle symptomen zijn altijd aanwezig.
- Opvliegers kunnen ook ’s nachts optreden (nachtelijke zweetaanvallen).
- De meeste opvliegers duren 3-5 minuten; de frequentie varieert van een paar per maand tot enkele per uur.
- De precieze oorzaak van opvliegers is onbekend.
- Onduidelijk is in welke mate vasomotorische symptomen het risico op hart- en vaatziekten beïnvloeden.
Vasomotorische symptomen
Veel vrouwen voelen opvliegers aankomen. Vrouwen kunnen dit gevoel omschrijven als ‘een toenemende druk in het hoofd’, hoewel veel vrouwen moeite hebben om het gevoel te omschrijven. Een opvlieger begint met het gevoel van een golf van hitte, vaak in het bovenlijf of de rug, die zich vervolgens verspreidt over het gehele lichaam. De toegenomen perifere bloedtoevoer gaat minimaal 1 minuut vooraf aan het subjectieve gevoel van hitte, houdt minuten lang aan en neemt geleidelijk af samen met de temperatuur. De grootste temperatuurveranderingen tijdens opvliegers zijn aan de handen en voeten. Het blozen wordt meestal alleen ervaren in het gezicht, de nek en het bovenlijf. Het subjectieve gevoel van hitte lijkt niet in verhouding met de actuele (daadwerkelijke) temperatuurstijging. De temperatuurstijging houdt vaak enkele minuten aan, nadat het gevoel van hitte al verdwenen is. De hevigheid van het gevoel van hitte is mogelijk meer gerelateerd aan de snelheid van temperatuursverandering dan de echte temperatuurtoename. Verdamping van zweet resulteert in een temperatuurdaling. De opvlieger kan gevolgd worden door een gevoel van kou. Het is onbekend waarom vrouwen een deel of alle symptomen ervaren. Een typische opvlieger duurt 3 tot 5 minuten, maar kan ook een half uur duren. De frequentie van opvliegers varieert van een paar per maand tot enkele per uur.
Oorzaak opvliegers
De precieze oorzaak van opvliegers is onbekend. Bij vrouwen zonder opvliegers is er een thermoneutrale zone (ongeveer 0,4 °C), waarbinnen fluctuaties van de lichaamskerntemperatuur geen compensatiemechanisme triggeren, zoals zweten en blozen. Bij vrouwen met opvliegers is deze thermoneutrale zone versmald, zodat ook bij heel kleine veranderingen in lichaamstemperatuur de grens van de zone al overschreven wordt en een warmteregulerende respons optreedt. De versmalling van de zone is mogelijk het gevolg van een verhoogde centrale noradrenerge activiteit en wordt waarschijnlijk vooraf gegaan door veranderingen in oestrogeenspiegels.
Vasomotorische symptomen, cardiovasculair risico en hart- en vaatziekten
De aanwezigheid van vasomotorische symptomen tijdens de overgang lijkt geassocieerd met cardiovasculaire risicofactoren (hogere bloeddruk, hoger totaal cholesterol en hogere BMI) vergeleken met vrouwen zonder vasomotorische symptomen.
Er is echter weinig onderzoek naar de associatie tussen vasomotorische symptomen (waaronder duur, frequentie en ernst) en het optreden van hart- en vaatziekten, en de resultaten zijn tegenstrijdig.
In een Australisch cohortonderzoek (n = 8881, 20 jaar follow-up, 925 events) was de gecorrigeerde hazard ratio (HR) voor hart- en vaatziekten bij vrouwen met vasomotorische symptomen 1,07 (95%-BI 0,92 tot 1,24).
Een analyse van 6 gepoolde prospectieve cohorten uit het Verenigd Koninkrijk, Australië en de Verenigde Staten (n = 23.365, gemiddelde leeftijd bij inclusie 48 jaar, bij follow-up 59 jaar, 1947 events) toonde geen verhoogd risico op hart- en vaatziekten bij aanwezigheid van opvliegers, vergeleken met vrouwen zonder opvliegers. Dit was wel het geval bij vrouwen die aangaven frequent aanvallen van nachtzweten te hebben (gecorrigeerde HR 1,29; 95%-BI 1,05 tot 1,58). Ook bij vrouwen met ernstige opvliegers, aanvallen van nachtzweten of allebei was het risico op hart -en vaatziekten verhoogd, met respectievelijk HR 1,83 (95%-BI 1,22 tot 2,73), 1,59 (95%-BI 1,07 tot 2,37) en 2,11 (95%-BI 1,62 tot 2,76).
Een andere analyse van 1 van deze cohorten, SWAN (n = 3083 vrouwen met verschillende etnische achtergronden, mediane leeftijd bij inclusie 46 jaar, mediane follow-up 19 jaar, 231 events), liet een verhoogd risico op hart- en vaatziekten zien bij vrouwen die bij aanvang frequente vasomotorische symptomen meldden (≥ 6 dagen per 2 weken), vergeleken met vrouwen die geen vasomotorische symptomen meldden (gecorrigeerde HR 1,51; 95%-BI 1,05 tot 2,17). Bij vrouwen die minder frequent vasomotorische symptomen meldden (1-5 dagen per 2 weken) was het risico niet verhoogd (gecorrigeerde HR 1,02; 95%-BI 0,75 tot 1,39). Bij vrouwen die bij > 1/3 van de meetmomenten frequente vasomotorische symptomen meldden was het risico ook verhoogd, vergeleken met vrouwen die deze klachten meldden bij ≤ 1/3 van de meetmomenten (HR 1,77; 95%-BI 1,33 tot 2,35).
Conclusie
Het is onduidelijk in welke mate aanwezigheid, duur, frequentie of ernst van vasomotorische symptomen het risico op het optreden van hart- en vaatziekten beïnvloeden.
Vulvovaginale atrofie
Naar Samenvatting ›- Door lagere oestrogeenspiegels na de menopauze wordt het slijmvlies van de vagina dunner en bleker. Soms zijn er ecchymosen. Er is minder glycogeen beschikbaar voor de vaginale melkzuurproducerende lactobacillen, waardoor deze in aantal afnemen. Daling van melkzuur maakt het milieu in de vagina basisch, waardoor gemakkelijker overgroei van andere bacteriën kan ontstaan.
- Lagere oestrogeenspiegels veroorzaken ook:
- verminderde vaginale doorbloeding
- langzamere lubricatie (meer aandacht voor stimulering nodig)
- weefselveranderingen of atrofie
Beloop
Naar Samenvatting ›- Cyclusveranderingen tijdens de overgang vertonen een grote individuele variatie. Het menstruatiepatroon wordt bij de meeste vrouwen voorafgaand aan de menopauze onregelmatig. Meestal worden de cycli eerst korter en daarna langer, om uiteindelijk helemaal te verdwijnen.
- De perimenopauze duurt gemiddeld ongeveer 4-6 jaar. Vrouwen kunnen echter ook na een korte periode van onregelmatige cycli de menopauze bereiken.
- Het individuele beloop en de hinder van vasomotorische symptomen varieert en is niet goed te voorspellen (zie Epidemiologie).
In een Amerikaans prospectief cohortonderzoek (n = 100, open populatie, gegevensverzameling op basis van zelfrapportage) werd het menstruatiepatroon tot aan de menopauze geanalyseerd. Er werden verschillende patronen waargenomen. Bij de meerderheid van de vrouwen waren de cycli aanvankelijk regelmatig en vervolgens onregelmatig tot aan de menopauze. Het patroon kon ook wisselen van onregelmatig naar regelmatig en vice versa, of regelmatig zijn tot aan de menopauze.
Een Amerikaans prospectief cohortonderzoek (5 jaar follow-up) toonde dat bij ongeveer 10% van de vrouwen de menopauze door slechts een korte periode van onregelmatigheid werd voorafgegaan. In dit onderzoek werd de mediane duur van de perimenopauze op 3,8 jaar geschat. In een ander prospectief cohortonderzoek naar het menstruatiepatroon was de gemiddelde duur van de perimenopauze 6,3 jaar. De follow-up duurde in dit onderzoek 30 jaar. Een longitudinaal populatieonderzoek toonde dat een cyclusduur van > 42 dagen bij vrouwen ouder dan 45 jaar een kans geeft van 93% dat er nog ≤ 20 cycli te gaan zijn tot de menopauze.
Richtlijnen diagnostiek
Naar Samenvatting ›Overweeg een relatie met de overgang bij vrouwen ≥ 40 jaar met de volgende klachten:
- menstruatieveranderingen
- vasomotorische klachten (opvliegers, nachtelijke zweetaanvallen)
- vulvovaginale klachten ten gevolge van vaginale atrofie
Anamnese
Naar Samenvatting ›Vaststellen van de overgang
Vraag naar:
- de menstruele cyclus: regelmatig of onregelmatig, verandering in cycluslengte en hoeveelheid bloedverlies, tijdstip van de laatste menstruatie en mogelijke zwangerschap, spotting
- vasomotorische klachten (opvliegers en nachtelijke zweetaanvallen): aard, frequentie, tijdstippen en beloop
- klachten door vulvovaginale atrofie: irritatie, jeuk, droge vagina, dyspareunie, afscheiding
Vraag verder naar:
- andere klachten of symptomen, die vaak in verband worden gebracht met de overgang, zoals moeheid, slaapstoornissen, stemmingsklachten (actueel en eerder), gewrichts- en/of spierklachten
- wat de vrouw weet over de overgang
- anticonceptiegebruik
- de voorgeschiedenis: operaties aan uterus en/of adnexa, endometriose, hormoongevoelige tumoren
Ten behoeve van de differentiaaldiagnose
Naar Samenvatting ›Vraag naar:
- aanwijzingen voor aandoeningen die ook vasomotorische klachten en (nachtelijk) transpireren kunnen geven, zoals problematisch alcoholgebruik, angst- of paniekstoornis en hyperthyreoïdie
- medicatie die vasomotorische klachten kan veroorzaken, vooral vaatverwijders (nitraten, calciumantagonisten, ACE-remmers), tamoxifen, selectieve aromataseremmers en antidepressiva (zowel tricyclische antidepressiva als selectieve serotonineheropnameremmers)
Alcohol, al dan niet gecombineerd met medicijnen (zoals sulfonylureumderivaten, cotrimoxazol, nitroglycerine, calciumantagonisten, ACE-remmers en tamoxifen), en voedingsadditiva kunnen vasomotorische verschijnselen induceren. Verschillende systemische aandoeningen kunnen ook vasomotorische symptomen geven, zoals hyperthyreoïdie. De kans op hyperthyreoïdie bij een perimenopauzale vrouw met vasomotorische klachten is laag. Faughnan vond in een menopauzekliniek onder 500 vrouwen dat slechts 3 vrouwen hyperthyreoïdie hadden. In een Nederlandse huisartsenregistratie bedroeg de incidentie van hyperthyreoïdie 1,4 per 1000 vrouwen per jaar in de leeftijd 45 jaar tot 64 jaar. Andere zeldzaam voorkomende aandoeningen die vasomotorische symptomen geven zijn carcinoïd, mastocytosis, pheochromocytoom, medullair schildkliercarcinoom, hyperparathyreoïdie en adenocarcinoom van de nier. Daarnaast kunnen neurologische aandoeningen zoals migraine, de ziekte van Parkinson, multipele sclerose en hersentumoren door vasodilatatie en autonome disfunctie vasomotorische symptomen geven. Ook bij paniekstoornissen kunnen vasomotorische verschijnselen voorkomen.
Gevolgen voor de vrouw
Naar Samenvatting ›Vraag naar:
- hinder en invloed van vasomotorische klachten op het dagelijks functioneren thuis, op het werk of in de vrije tijd
- invloed van de klachten op de seksualiteit
- aanpak van de klachten door de vrouw zelf en zelfmedicatie
- psychosociale factoren, zoals stress, werk, zorgtaken, steun uit de omgeving en de betekenis van het afsluiten van de vruchtbare levensfase
Bij overwegen van medicamenteuze behandeling
Vraag naar:
- voorgeschiedenis: veneuze trombo-embolieën (VTE), borstkanker en eventuele antihormonale nabehandeling, ischemische hart- en vaatziekten)
- risicofactoren voor VTE, zoals trombofilie, belaste eerstegraadsfamilieanamnese (zie NHG-Standaard Diepveneuze trombose en longembolie)
- risicofactoren voor ischemische hart- en vaatziekten, zoals roken, belaste familieanamnese, migraine (zie NHG-Standaard Cardiovasculair risicomanagement en NHG-Standaard Hoofdpijn)
- risicofactoren voor borstkanker, zoals belaste familieanamnese, eerdere thoraxbestraling (zie NHG-Standaard Borstkanker)
Lichamelijk onderzoek
Naar Samenvatting ›- Meet de bloeddruk indien medicamenteuze behandeling van vasomotorische klachten wordt overwogen (voor het beleid bij verhoogde bloeddruk, zie NHG-Standaard Cardiovasculair risicomanagement).
- Inspecteer bij vulvovaginale klachten de vulva. Let daarbij op de kleur, het aspect en de kwetsbaarheid van het slijmvlies (atrofie) en eventuele fluor (bacteriële vaginose).
- Speculumonderzoek kan achterwege blijven bij vulvovaginale atrofie. Dit onderzoek heeft geen toegevoegde waarde in afwezigheid van fluor of bloedverlies en wordt doorgaans als pijnlijk en belastend ervaren.
- Voer wel speculumonderzoek uit bij spotting, contactbloedingen of postmenopauzaal vaginaal bloedverlies (zie NHG-Standaard Vaginaal bloedverlies), en bij fluorklachten (zie NHG-Standaard Fluor vaginalis).
Aanvullend onderzoek
Naar Samenvatting ›Verricht op indicatie:
- zwangerschapstest
- bepaling van hemoglobine
- bepaling van TSH
- diagnostiek voor cardiovasculair risicomanagement (zie NHG-Standaard Cardiovasculair risicomanagement)
Bepaling FSH, LH en oestradiol
Naar Samenvatting ›We bevelen bepaling van FSH, LH en oestradiol niet aan; het heeft geen meerwaarde in de diagnostiek of voorspelling van de menopauzeleeftijd.
Het follikelstimulerend hormoon (FSH) begint ongeveer 10 jaar voor de menopauze geleidelijk te stijgen. Hoge FSH-waarden duiden er op dat er veranderingen optreden in de ovaria en door middel van verhoogde FSH-productie van de hypofyse worden de ovaria gestimuleerd meer oestrogeen te produceren. FSH-spiegels kunnen op individueel niveau gedurende de perimenopauze echter sterk wisselen, zoals er ook ovulatoire cycli mogelijk zijn. Bepaling van FSH is dan ook niet te gebruiken als zekere diagnostische test om vast te stellen dat een vrouw postmenopauzaal is. De sensitiviteit van een verhoogd FSH varieert van 0,65 tot 0,74 en de specificiteit van 0,79 tot 0,94. Daardoor kan een lage FSH een op korte termijn naderende menopauze niet uitsluiten en kan een hoge FSH ook voorkomen bij nog ovulerende vrouwen. Veranderingen in serumspiegels van oestradiol, progesteron, luteïniserend hormoon (LH) zijn geen betrouwbare voorspellers voor het tijdstip van de menopauze. Het is niet mogelijk om een vrouw met voldoende betrouwbaarheid aan te geven wanneer zij de menopauze (laatste menstruatie) zal hebben gehad na een periode van enige maanden amenorroe in de perimenopauze. Slechts wanneer een vrouw een jaar niet heeft gemenstrueerd kan gezegd worden dat zij postmenopauzaal is.
Mammografie
Naar Samenvatting ›We bevelen mammografie voor het starten met hormoontherapie niet aan.
Wat betreft screening sluit de werkgroep zich aan bij de landelijke Richtlijn Borstkanker, waarin screening op borstkanker bij gebruik van hormoontherapie buiten het kader van het bevolkingsonderzoek niet wordt geadviseerd. Dit is ook in overeenstemming met de NHG-Standaard Borstkanker.
Evaluatie
Naar Samenvatting ›Stel de diagnose ‘overgangsklachten’ wanneer bij een vrouw ≥ 40 jaar sprake is van vasomotorische klachten (opvliegers en/of nachtelijke zweetaanvallen) of klachten van vaginale atrofie bij een veranderd menstruatiepatroon of amenorroe, indien andere oorzaken zijn uitgesloten.
Differentiaaldiagnostische overwegingen
- Bij vasomotorische klachten: bijwerking van medicatie (nitraten, calciumantagonisten, ACE-remmers, tamoxifen, selectieve aromataseremmers, antidepressiva), overmatig alcoholgebruik, angst- of paniekstoornis, hyperthyreoïdie of andere zeldzame oorzaken (zie Anamnese)
- Bij vulvovaginale klachten: lichen sclerosus, seksuele problematiek, vaginale infecties (zie NHG-Standaard Fluor vaginalis)
- Bij onregelmatig vaginaal bloedverlies: zwangerschapscomplicaties (miskraam, extra-uteriene graviditeit; zie NHG-Standaard Miskraam), cervixpathologie, endometriumafwijkingen (zie NHG-Standaard Vaginaal bloedverlies)
Differentiaaldiagnose bij vaginale klachten
Vaginale klachten ten gevolge van de overgang komen deels overeen met de klachten bij lichen sclerosus (jeuk, irritatie). Op basis van tweedelijnsonderzoeken is de geschatte prevalentie van lichen sclerosus 1 per 300 tot 1 per 1000 vrouwen. Lichen sclerosus komt vooral voor bij postmenopauzale vrouwen. Vaak is de vulva (labia majora en minora) aangedaan. Andere oorzaken van vaginale klachten tijdens de overgang kunnen zijn: bacteriële vaginose, contacteczeem, vulvacarcinoom, uterusprolaps, recto- en cystocele.
Richtlijnen beleid
Naar Samenvatting ›Het beleid is samengevat in een stroomschema (zie figuur).
Voorlichting
Naar Samenvatting ›Geef voorlichting over de volgende aspecten van de overgang.
- De overgang is een fysiologisch proces met grote variaties in het beloop en de hinder van klachten, dat vaak samengaat met andere verouderingsverschijnselen en met sociale veranderingen.
- Door hormonale veranderingen verandert de menstruatie. Bij de meeste vrouwen treden opvliegers en nachtelijke zweetaanvallen op. Ook kunnen vaginale klachten optreden.
- Het duurt gemiddeld 4-6 jaar voordat de menstruatie definitief wegblijft.
- Het valt niet te voorspellen in welke mate een vrouw klachten van de overgang zal krijgen.
- De duur van de opvliegers en/of nachtelijke zweetaanvallen kan variëren van 3-7 jaar. Het beloop varieert per persoon en is niet goed te voorspellen.
- Klachten van moeheid, sombere gevoelens en slapeloosheid kunnen een gevolg zijn van nachtelijke zweetaanvallen. Ook andere omstandigheden of veranderingen in het leven kunnen deze klachten veroorzaken.
- Het algemene advies is om op de leeftijd van 52 jaar te stoppen met hormonale anticonceptie. De kans op zwangerschap is na deze leeftijd erg klein. Afhankelijk van de situatie kan men afwachten of na het staken de cyclus nog terugkeert en of er vasomotorische klachten optreden (zie NHG-Standaard Anticonceptie).
- Bespreek bij klachten van dyspareunie het belang van adequate stimulatie en opwinding voor voldoende lubricatie (zie Klachten tijdens de overgang en NHG-Standaard Seksuele klachten).
Thuisarts en keuzekaarten
Naar Samenvatting ›- Verwijs naar de informatie over de overgang op thuisarts.nl. De informatie op Thuisarts is gebaseerd op deze NHG-Standaard.
- Voor een overzicht van de opties ter ondersteuning zie de keuzekaarten die gebruikt kunnen worden bij gezamenlijke besluitvorming over de meest passende optie voor vrouwen die niet meer ongesteld worden; voor vrouwen in de overgang die nog wel ongesteld worden en een voorbehoedmiddel willen gebruiken; voor vrouwen in de overgang die nog wel ongesteld worden maar geen voorbehoedmiddel meer willen gebruiken.
Er zijn allerlei zelfhulpmogelijkheden voor vrouwen in de overgang, waaronder internetplatforms voor contact met andere vrouwen in de overgang. Ook zijn er overgangsconsulenten, vaak verpleegkundigen of bijvoorbeeld fysiotherapeuten, die vrouwen adviseren hoe om te gaan met de overgang. Overgangsconsulent is geen wettelijk beschermde titel. Een deel van de overgangsconsulenten is aangesloten bij de Vereniging Verpleegkundige Overgangsconsulenten(geraadpleegd april 2022).
Niet-medicamenteuze behandeling
Naar Samenvatting ›Niet-medicamenteuze behandeling bij opvliegers en/of nachtzweten heeft in het algemeen geen tot matig effect.
Gewichtsreductie
Naar Samenvatting ›Gewichtsreductie kan een positief gezondheidseffect hebben bij vrouwen met overgewicht of obesitas, maar het is niet aangetoond dat gewichtsreductie bijdraagt aan het verminderen van opvliegers of nachtelijke zweetaanvallen (zie NHG-Standaard Obesitas, NHG-Standaard Cardiovasculair risicomanagement en Praktijkhandleiding Leefstijl).
Er is onvoldoende aangetoond dat gewichtsreductie effect heeft op overgangsklachten. Wel heeft gewichtsreductie een algemeen gezondheidsbevorderend effect bij vrouwen met overgewicht of obesitas. De vrouw kan na uitleg zelf haar keuze bepalen. Dit moment kan aangegrepen worden om het cardiovasculaire risicoprofiel in kaart te brengen.
Voor- en nadelen
We zijn onzeker over een effect van gewichtsreductie op overgangsklachten bij vrouwen met overgewicht. Wel is er een algemeen gezondheidsbevorderend effect.
Kwaliteit van bewijs
De kwaliteit van bewijs is zeer laag.
Waarden en voorkeuren van patiënten
Voor gewichtsreductie is een grote inspanning nodig met onzekere kans op effect op overgangsklachten. Veel vrouwen zullen dat er niet voor over hebben.
Kosten
Gewichtsreductie op zich heeft geen kosten, begeleiding hierbij wel.
Aanvaardbaarheid
Afvallen voor algemene gezondheidswinst is aanvaardbaar, maar de meeste mensen zullen slecht te motiveren zijn om af te vallen voor het verminderen van overgangsklachten als het effect onzeker is.
Haalbaarheid
Voor veel vrouwen is het moeilijk om af te vallen.
Uitgangsvraag
Is gewichtsreductie aan te bevelen aan vrouwen met opvliegers en/of nachtelijke zweetaanvallen? Zie de PICO-tabel.
|
Patiënten |
Vrouwen met opvliegers en/of nachtelijke zweetaanvallen |
|---|---|
|
Interventie |
Gewichtsreductie |
|
Vergelijking |
Geen gewichtsreductie (gebruikelijke zorg, alleen voorlichting, placebo-interventie) |
|
Uitkomstmaten |
Cruciaal
Belangrijk
|
Achtergrond
Observationeel onderzoek laat zien dat een hogere body-mass index (BMI) geassocieerd is met het vaker voorkomen van vasomotorische symptomen, waaronder opvliegers en nachtelijke zweetaanvallen, tijdens de (vroege) menopauze. Maar is gewichtsreductie ook aan te bevelen voor het verminderen van vasomotorische symptomen?
Methoden
Er is een systematische literatuurzoekactie naar systematische reviews en RCT’s uitgevoerd in PubMed in december 2019, met een update in september 2021.
Resultaten
Resultaat zoekactie
De zoekactie leverde 3 RCT’s op naar gewichtsreductie en opvliegers. De update in september 2021 leverde geen nieuwe RCT’s op.
Onderzoekskarakteristieken
- Huang 2010: RCT onder 338 vrouwen met overgewicht (gemiddelde BMI 36, gemiddelde leeftijd 53 jaar) en urine-incontinentie; een subgroep (n = 241, gemiddelde leeftijd 53 jaar) had ook last van opvliegers. De vrouwen werden geworven in een ziekenhuis en een universiteit, en volgden gedurende 6 maanden óf een intensief gewichtsreductieprogramma óf een gestructureerd gezondheidseducatieprogramma met alleen voorlichting (randomisatie 2:1). Deze subgroepanalyse lijkt van tevoren bepaald, omdat voor en na de interventie de hinder van opvliegers werd gerapporteerd in vragenlijsten. Deze uitkomstmaat en de subgroepanalyse worden niet genoemd in de hoofdanalyse. Voor de uitkomstmaat ‘stemming’ werd de mentale-componentscore van de 36-Item Short Form Health Survey (SF-36) gebruikt, gebaseerd op de onderdelen vitaliteit, sociaal functioneren, emoties en mentale gezondheid.
- Thurston 2015: deze RCT includeerde 40 vrouwen (gemiddelde leeftijd 55 jaar) met overgewicht (BMI 25-40) en ≥ 4 opvliegers per dag, en randomiseerde die 1 : 1 over een (pilot)interventiegroep en een wachtlijstcontrolegroep. De vrouwen werden geworven via ziekenhuizen, flyers en online berichten. De interventie bestond uit 20 groepssessies gedurende 6 maanden, waarin eet- en beweeggewoontes werden besproken. Opvliegers (ernst, hinder en aantal) werden voor en na de interventie gerapporteerd met behulp van een fysiologische monitor, dagboek en vragenlijst.
- Kroenke 2012: deze RCT includeerde 17.473 vrouwen in de overgang (leeftijd 50-79 jaar) die geen hormoontherapie gebruikten. Van deze vrouwen werd 40% gerandomiseerd naar de interventiegroep en 60% naar de controlegroep. De interventie bestond uit een low fat-dieet (≤ 20% van de energie-inname uit vet, daarnaast veel fruit en groente en 6 × per dag een meergranenproduct). Gewichtsverlies werd uitgedrukt als percentage van het aanvangsgewicht in 4 klassen (0-3, 3-7, 7-10, > 10%); opvliegers en/of nachtelijke zweetaanvallen in de laatste 4 weken werden gescoord van 0 (geen) tot 3 (ernstig). De follow-up was 1 jaar. Analyses werden gedaan met data van 6104 vrouwen die opvliegers en/of nachtelijke zweetaanvallen hadden bij de start van het onderzoek.
Effectiviteit en bijwerkingen
Zie tabellen Gewichtsreductieprogramma vergeleken met gezondheidsvoorlichting, Gewichtsreductie vergeleken met wachtlijstcontrole en Dieet vergeleken met controlegroep voor de samenvatting van de resultaten.
Er werden geen onderzoeken gevonden met de uitkomstmaten ‘kwaliteit van leven’, ‘seksuele klachten’, ‘spier- en gewrichtsklachten’ en ‘bijwerkingen’.
Conclusies
- We zijn onzeker of gewichtsreductie het aantal opvliegers en de ernst en hinder van opvliegers vermindert (kwaliteit van bewijs zeer laag).
- Het volgen van een dieet geeft mogelijk niet of nauwelijks vermindering van opvliegers en nachtelijke zweetaanvallen (kwaliteit van bewijs laag).
- We zijn onzeker of gewichtsreductie een verandering in stemming geeft (kwaliteit van bewijs zeer laag).
- Kwaliteit van leven, seksuele klachten, spier- en gewrichtsklachten en bijwerkingen zijn niet onderzocht.
Lichaamsbeweging
Naar Samenvatting ›Lichaamsbeweging heeft een algemeen positief gezondheidseffect, maar draagt niet bij aan het verminderen van opvliegers of nachtelijke zweetaanvallen (zie NHG-Standaard Cardiovasculair risicomanagement en Praktijkhandleiding Leefstijl).
Het is niet aangetoond dat lichaamsbeweging vermindering geeft van het aantal en de hinder van opvliegers en/of nachtelijke zweetaanvallen. Ook lijkt er geen invloed te zijn op stemmingsklachten en seksuele klachten in het kader van de overgang. Daarom is het niet zinvol om lichaamsbeweging te adviseren specifiek met het oog op vermindering van overgangsklachten. Dit moment kan wel aangegrepen worden om het cardiovasculaire risicoprofiel in kaart te brengen. De vrouw kan na uitleg zelf haar keuze maken.
Voor- en nadelen
Er zijn mogelijk niet of nauwelijks effecten van lichaamsbeweging op overgangsklachten. Wel is er een algemeen gezondheidsbevorderend effect van lichaamsbeweging.
Kwaliteit van bewijs
De kwaliteit van bewijs is over het algemeen laag.
Waarden en voorkeuren van patiënten
Er is een grote inspanning nodig, met niet of nauwelijks effect op overgangsklachten. Veel vrouwen zullen dat er niet voor over hebben.
Kosten
Lichaamsbeweging op zich hoeft niets te kosten, begeleiding hierbij wel.
Aanvaardbaarheid
Lichaamsbeweging voor algemene gezondheidswinst is aanvaardbaar, maar met betrekking tot het verminderen van overgangsklachten zullen de meeste vrouwen slecht te motiveren zijn om meer te bewegen, gezien het minimale effect daarop.
Haalbaarheid
Voor veel vrouwen is het moeilijk om meer te gaan bewegen.
Uitgangsvraag
Is lichaamsbeweging aan te bevelen aan vrouwen met opvliegers en/of nachtelijke zweetaanvallen? Zie de PICO-tabel.
|
Patiënten |
Vrouwen met opvliegers en/of nachtelijke zweetaanvallen |
|---|---|
|
Interventie |
Lichaamsbeweging |
|
Vergelijking |
Geen/minder lichaamsbeweging (of gebruikelijke activiteit, alleen voorlichting of placebo-interventie) |
|
Uitkomstmaten |
Cruciaal
Belangrijk
|
Methoden
Er is een systematische literatuurzoekactie naar SR’s en RCT’s uitgevoerd in PubMed in december 2019, met een update in september 2021.
Resultaten
Resultaat zoekactie
De zoekactie leverde 1 systematische review (SR) op naar lichaamsbeweging en aan de overgang gerelateerde uitkomsten.
Een aanvullende zoekactie na de zoekdatum van het literatuuronderzoek van Daley (maart 2014) leverde 3 aanvullende RCT’s op.
Verder werd er 1 RCT gevonden met betrekking tot lichaamsbeweging bij vrouwen met borstkanker en opvliegers/nachtelijke zweetaanvallen.
Tijdens de update werden er 3 SR’s en 2 RCT's gevonden die onderstaande resultaten bevestigen.
Onderzoekskarakteristieken
- Daley 2014: SR met 3 RCT’s (n = 454 vrouwen; leeftijd 40-63 jaar) waarin een interventie met lichaamsbeweging vergeleken werd met een controlegroep (geen interventie of gebruikelijke activiteit). De interventies betroffen wandelen (3 × per week 1 uur), aerobic (4 × per week 50 min) en cardiovasculaire training (3 × per week 50 min), met een follow-up van respectievelijk 4, 6 en 3 maanden. Uitkomstmaat was verandering in opvliegers/nachtelijke zweetaanvallen. Eén RCT nam ook bijwerkingen mee als uitkomstmaat.
- Reed 2014a: RCT onder 335 (post)menopauzale vrouwen (gemiddelde leeftijd 55 jaar), geworven via ‘massa-mailing’ en gerandomiseerd over 3 onderzoeksarmen: yoga (n = 107), lichaamsbeweging (n = 106) en gebruikelijke activiteit als controleconditie (n = 142). De yoga-arm wordt voor dit detail buiten beschouwing gelaten. De interventie ‘lichaamsbeweging’ bestond uit 3 × per week een cardiovasculaire training, ongeveer 50 minuten per keer gedurende 12 weken. Uitkomstmaten waren hinder van opvliegers en/of nachtelijke zweetaanvallen, kwaliteit van leven en seksuele activiteit.
- Daley 2015: RCT onder 261 menopauzale vrouwen (leeftijd 48-57 jaar) die geworven werden via hun huisarts. Er waren 2 interventiegroepen en 1 controlegroep. In de interventiegroepen kregen de vrouwen 2 thuisconsulten van 1 uur waarin ze aangemoedigd werden om te sporten of te bewegen. Eén interventiegroep kreeg daarnaast nog een dvd met tips plus daarna 5 reminders, de andere interventiegroep had de mogelijkheid zich aan te sluiten bij een sportgroep (sociale ondersteuning). In de eerste 12 weken moesten de deelnemers uiteindelijk 3 × per week 30 min. sporten; in de volgende 12 weken moest dat 3-5 × per week worden. De controlegroep kreeg de mogelijkheid voor 1 beweegconsult. Uitkomstmaten waren aantal en ernst/hinder van opvliegers/nachtelijke zweetaanvallen na 6 en na 12 maanden. Ook werd een vragenlijst afgenomen met onder andere de subschalen depressieve stemming, angst(en) en seksuele activiteit.
- Asghari 2017: RCT onder 108 vrouwen die gerandomiseerd werden over 4 onderzoeksarmen van elk 27 personen: voedingseducatie, aerobic, lichaamsbeweging plus voedingseducatie, en een controlegroep zonder interventie. Menopauzesymptomen en kwaliteit van leven waren de uitkomstmaten (follow-up 12 weken). Voor dit detail worden de aerobic- en de controlegroep meegenomen.
- Duijts 2012: RCT onder 422 vrouwen met borstkanker en menopauzale symptomen, geworven via ziekenhuisregisters. Deze vrouwen werden gerandomiseerd over 4 onderzoeksarmen: cognitieve gedragstherapie (CGT), lichaamsbeweging (3 uur per week zwemmen, hardlopen of fietsen gedurende 12 weken), CGT plus lichaamsbeweging en een wachtlijstcontrolegroep. De uitkomstmaten, waaronder ernst/hinder van opvliegers/nachtelijke zweetaanvallen en seksuele activiteit, werden na 12 weken gerapporteerd. Voor dit detail worden de lichaamsbeweging- en de controlegroep meegenomen.
Effectiviteit en bijwerkingen
Zie tabellen Lichaamsbeweging vergeleken met gebruikelijke activiteit en Lichaamsbeweging vergeleken met gebruikelijke activiteit bij vrouwen met borstkanker voor de samenvatting van de resultaten.
Er werden geen onderzoeken gevonden met als uitkomstmaat ‘spier- en gewrichtsklachten’.
Bijwerkingen werden alleen bijgehouden door Sternfield (1 van de 3 RCT’s in Daley 2014) en Daley 2015. Beide onderzoeken vonden geen verschil in bijwerkingen tussen de interventiegroep en de controlegroep (Sternfield vond bij 17% lichte bijwerkingen in de lichaamsbeweginggroep en 18% in de controlegroep met gebruikelijke activiteit; Daley vond geen bijwerkingen).
Conclusie
- Lichaamsbeweging geeft mogelijk niet of nauwelijks verschil in aantal of hinder van opvliegers/nachtelijke zweetaanvallen, kwaliteit van leven, stemming en seksuele activiteit ten opzichte van gebruikelijke activiteit (kwaliteit van bewijs laag).
- Lichaamsbeweging geeft mogelijk niet meer bijwerkingen dan gebruikelijke activiteit (kwaliteit van bewijs laag).
- Spier- en gewrichtsklachten zijn niet onderzocht.
Stressreducerende psychologische interventie
Naar Samenvatting ›- Overweeg op mindfulness gebaseerde therapie of verwijzing voor een stressreducerende psychologische interventie (zoals cognitieve gedragstherapie) bij vrouwen met opvliegers en/of nachtelijke zweetaanvallen die openstaan voor een psychologische interventie en die geen hormoontherapie kunnen of willen gebruiken.
- Het globaal te verwachten effect van een stressreducerende psychologische interventie bij een vrouw met 8 opvliegers per dag is ongeveer 3 opvliegers minder per dag (ter vergelijking: in de controlegroepen was dit ongeveer 1 opvlieger minder per dag).
Een stressreducerende psychologische interventie, zoals cognitieve gedragstherapie (CGT) of op mindfulness gebaseerde therapie, kan een positief effect hebben op het aantal opvliegers, hoewel er op andere uitkomstmaten geen klinisch relevant effect wordt gezien. Van de interventie zijn geen bijwerkingen te verwachten. Voor vrouwen die openstaan voor een psychologische interventie en die geen hormoontherapie kunnen of willen gebruiken, kan dit een geschikte interventie zijn.
Voor- en nadelen
Mogelijk vermindert een stressreducerende psychologische interventie het aantal opvliegers. In ongeveer een half jaar tijd verminderde dit in de interventiegroepen van gemiddeld 8 per dag tot 5 per dag, terwijl het in de controlegroepen verminderde van 8 per dag tot 7 per dag. Op andere uitkomsten (hinder van opvliegers, kwaliteit van leven, stemming, seksuele klachten en slaap) zijn echter slechts kleine verbeteringen te zien, die niet klinisch relevant zijn. Er zijn geen bijwerkingen te verwachten. De interventie kan ook worden toegepast bij vrouwen met een contra-indicatie voor hormoontherapie.
Kwaliteit van bewijs
De kwaliteit van bewijs is redelijk tot laag.
Waarden en voorkeuren van patiënten
Vrouwen moeten openstaan voor een psychologische interventie, zoals mindfulness of CGT. Er is wat dat betreft vermoedelijk veel variatie in voorkeuren tussen vrouwen. In de onderzoeken was er een vrij grote uitval, vooral in de groepen die de psychologische interventie kregen, wat kan wijzen op een grote belasting voor de vrouw, bijvoorbeeld in te investeren tijd.
Kosten
Niet bepaald.
Aanvaardbaarheid
Voor huisartsen zal de interventie aanvaardbaar zijn.
Haalbaarheid
De haalbaarheid is afhankelijk van beschikbare eerstelijns GGZ-zorg.
Uitgangsvraag
Is een stressreducerende psychologische interventie, zoals cognitieve gedragstherapie (CGT) of op mindfulness gebaseerde therapie, aan te bevelen aan vrouwen met opvliegers en/of nachtelijke zweetaanvallen? Zie de PICO-tabel.
|
Patiënten |
Vrouwen met opvliegers en/of nachtelijke zweetaanvallen |
|---|---|
|
Interventie |
Stressreducerende psychologische interventies, waaronder
|
|
Vergelijking |
Voorlichting, gebruikelijke zorg of andere controle |
|
Uitkomstmaten |
Cruciaal
Belangrijk
|
Achtergrond
Mogelijk zijn stressreducerende psychologische interventies een niet-hormonale optie om de frequentie en hinder van opvliegers en andere overgangsklachten te verminderen. Hieronder vallen bijvoorbeeld CGT en op mindfulness gebaseerde therapieën. Mindfulness wordt ook vaak geïntegreerd in cognitieve therapie (mindfulness-based cognitive therapy). Een mogelijk mechanisme van deze interventies is het reduceren van stress; daarnaast verlaagt de therapie mogelijk de hinder van opvliegers door niet-helpende cognities, emoties en gedrag te beïnvloeden.
Methoden
Er is een systematische literatuurzoekactie naar systematische reviews (SR’s) en RCT’s uitgevoerd in PubMed in december 2019, met een update in september 2021. De onderzoeksresultaten zijn gepoold in Review Manager versie 5.4.1. Hierbij is uitgegaan van de resultaten zoals gerapporteerd in de gevonden SR, aangevuld met resultaten uit de recentere onderzoeken.
Resultaten
Resultaat zoekactie
De zoekactie leverde 1 SR op naar stressreducerende psychologische interventies bij overgangsklachten. Een aanvullende zoekactie na de zoekdatum van deze SR leverde 3 aanvullende RCT’s op. Bij de update in september 2021 werd een RCT gevonden die in lijn is met onderstaande resultaten en daarom de aanbeveling niet zal veranderen.
Onderzoekskarakteristieken
In de review werden 12 RCT’s geïncludeerd (n = 1016) naar de effecten en bijwerkingen van stressreducerende psychologische interventies bij overgangsklachten. Daarvan onderzochten 3 RCT’s op mindfulness gebaseerde therapie, 5 CGT en 4 gedragstherapie; 6 RCT’s werden uitgevoerd bij vrouwen met borstkanker van wie de overgangsklachten door behandeling waren ontstaan. Als controleconditie had 1 RCT ‘gebruikelijke zorg’, 1 RCT lezen als placebo-activiteit, 1 RCT een ‘aandachtsinterventie’ waarbij deelnemers hun klachten konden bespreken met een verpleegkundige en 9 RCT’s een wachtlijstcontrolegroep.
In de aanvullende zoekactie werden 3 recentere RCT’s gevonden:
- Hardy 2018: RCT (n = 124; leeftijd 45-60 jaar) onder werkende vrouwen in het Verenigd Koninkrijk met overgangsklachten (≥ 10 opvliegers of aanvallen van nachtzweten per week). Deelnemers werden gerandomiseerd naar een interventiegroep met zelfhulp-CGT (n = 60) of een wachtlijstcontrolegroep (n = 64). De interventie duurde 4 weken en gegevens werden verzameld bij aanvang en na 6 en 20 weken.
- Wong 2018: RCT (n = 197, leeftijd 40-60 jaar) in de algemene populatie en eerste lijn in Hong Kong. Vrouwen met overgangsklachten (Greene Climacteric Symptom Score ≥ 6) werden gerandomiseerd naar een mindfulness-based stressreductieprogramma (MBSR; n = 98) of naar een controlegroep die educatie over de overgang kreeg (n = 99). De interventie duurde 8 weken en gegevens werden verzameld bij aanvang en na 2, 5 en 8 maanden.
- Atema 2019: RCT (n = 254) in Nederland onder vrouwen met overgangsklachten door behandeling van borstkanker. Deelnemers werden gerandomiseerd naar een groep die zelfhulp-CGT via internet kreeg (n = 85), een groep die dezelfde CGT kreeg maar daarbij ook telefonische en schriftelijke feedback van een therapeut (n = 85) of een wachtlijstcontrolegroep (n = 84). De interventie duurde 6 weken en gegevens werden verzameld bij aanvang en na 10 en 24 weken.
Effectiviteit en bijwerkingen
Zie tabel Stressreducerende psychologische interventie vergeleken met controle voor de samenvatting van de resultaten op middellange termijn (≥ 20 weken). De gegevens na korte termijn (< 12 weken) komen hiermee in grote lijnen overeen. De uitkomstmaat ‘spier- en gewrichtsklachten’ is niet onderzocht.
Conclusies
- Mogelijk vermindert een stressreducerende psychologische interventie het aantal opvliegers (kwaliteit van bewijs laag).
- Waarschijnlijk heeft een stressreducerende psychologische interventie niet of nauwelijks effect op de hinder van opvliegers, kwaliteit van leven, de stemming en het seksueel functioneren (kwaliteit van bewijs redelijk).
- Mogelijk heeft een stressreducerende psychologische interventie niet of nauwelijks effect op slaap (kwaliteit van bewijs laag).
- Waarschijnlijk treden er geen bijwerkingen op (kwaliteit van bewijs redelijk).
- Spier- en gewrichtsklachten zijn niet onderzocht.
Vrij verkrijgbare preparaten
Naar Samenvatting ›Er zijn veel vrij verkrijgbare preparaten tegen overgangsklachten, waaronder plantaardige middelen en supplementen, maar het is niet aangetoond dat deze de klachten verminderen. Ze kunnen wel ernstige bijwerkingen geven.
Zilverkaars
Naar Samenvatting ›We bevelen zilverkaars (black cohosh) niet aan bij vrouwen met opvliegers en/of nachtelijke zweetaanvallen.
Positieve effecten van zilverkaars ontbreken mogelijk. Ook is er onzekerheid over de bijwerkingen. Daarnaast varieert de samenstelling en kwaliteit van de preparaten en wordt deze niet gecontroleerd. Deze overwegingen hebben geleid tot een sterke aanbeveling tegen zilverkaars.
Voor- en nadelen
Er lijkt niet of nauwelijks verschil te zijn in aantal of ernst van opvliegers tussen de groepen die zilverkaars gebruikten en de placebogroepen. In onderzoek waarin zilverkaars werd vergeleken met hormoontherapie leken aantal en ernst van opvliegers minder te zijn in de groepen die hormoontherapie kregen. Op andere uitkomstmaten werden geen klinisch relevante voordelen van zilverkaars gevonden.
Bijwerkingen zijn nauwelijks onderzocht, de beperkte gegevens uit de RCT's geven geen aanwijzingen voor verschillen tussen de groepen. Bijwerkingen die gerapporteerd werden bij gebruik van zilverkaars waren pijnlijke of vergrote borsten, infectie, vaginaal bloedverlies of spotting, klachten van het bewegingsapparaat en gastro-intestinale klachten. Vrouwen die hormoontherapie kregen rapporteerden pijnlijke of vergrote borsten, vaginaal bloedverlies of spotting, vaginale afscheiding, buikpijn, gastro-intestinale klachten en menstruele klachten. Vrouwen in de placebogroep rapporteerden infectie, gastro-intestinale klachten, menstruele klachten, klachten van het bewegingsapparaat en hoofdpijn.
In de literatuur worden gevallen van hepatotoxiciteit genoemd. Dit kwam niet terug in de RCT’s, maar de aantallen zouden daarvoor ook te klein zijn. Eén RCT onderzocht de leverfunctie en vond daarin geen veranderingen (of verschillen tussen zilverkaars en placebo) gedurende 12 weken gebruik. Ook kan geen uitspraak worden gedaan over interacties met geneesmiddelen (waaronder die gemedieerd door cytochroom-P450-enzymen).
Kwaliteit van bewijs
Voor de effecten is de kwaliteit van bewijs over het algemeen laag, voor de bijwerkingen zeer laag.
Waarden en voorkeuren van patiënten
De werkgroep vermoedt dat vrouwen verschillende ideeën hebben over het gebruik van zilverkaars. Sommige vrouwen zullen dit willen proberen omdat ze het idee hebben dat een natuurlijk product zoals zilverkaars minder schadelijk is dan het gebruik van oestrogenen, anderen zullen dit niet willen gebruiken vanwege bijvoorbeeld onzekerheid over de samenstelling en over mogelijke bijwerkingen.
Kosten
Kosten komen voor rekening van de vrouw.
Aanvaardbaarheid
De samenstelling van de preparaten varieert en wordt niet gecontroleerd. Verder staan ook de beperkte werkzaamheid en de onzekerheid over bijwerkingen op de korte en lange termijn en over interacties met andere geneesmiddelen de aanvaardbaarheid in de weg.
Haalbaarheid
Zilverkaarspreparaten zijn vrij verkrijgbaar, bijvoorbeeld bij een drogisterij.
Uitgangsvraag
Uitgangsvraag
Is zilverkaars aan te bevelen aan vrouwen met opvliegers en/of nachtelijke zweetaanvallen? Zie de PICO-tabel.
|
Patiënten |
Vrouwen met opvliegers en/of nachtelijke zweetaanvallen |
|---|---|
|
Interventie |
Zilverkaars (black cohosh) |
|
Vergelijking |
|
|
Uitkomstmaten |
Cruciaal
Belangrijk
|
Achtergrond
Er is een breed scala aan alternatieve therapieën voor overgangsklachten beschikbaar, waarvan zilverkaars een veel gebruikte is. Zilverkaars (Cimicifuga racemosa), beter bekend als black cohosh, is een plant afkomstig uit de bossen van Noord-Amerika (actief bestanddeel uit de wortelstok, ook aanwezig in handverkoopproducten). De werkzame stof zou invloed hebben op de thermoregulatie via inhibitie van serotoninereceptorbinding.
Methoden
Er is een systematische literatuurzoekactie naar systematische reviews (SR’s) en RCT’s uitgevoerd in PubMed in december 2019, met een update in september 2021.
Resultaten
Resultaat zoekactie
De zoekactie leverde een geschikte SR (Cochrane-review) op naar zilverkaars bij overgangsklachten. Een aanvullende zoekactie na de zoekdatum van dit literatuuronderzoek leverde 2 aanvullende RCT’s. De update in september 2021 leverde geen nieuwe RCT’s op.
Onderzoekskarakteristieken
In de Cochrane-review werden 16 RCT’s geïncludeerd (n = 2027) naar de effecten en bijwerkingen van zilverkaars bij overgangsklachten. In alle trials werden orale ‘monopreparaten’ van zilverkaarsextract gegeven, in tablet- of capsulevorm, met een mediane dosering van 40 mg per dag (variërend van 8 tot 160 mg) en een gemiddelde duur van 23,4 weken. In 11 RCT’s werd zilverkaars vergeleken met placebo, in 6 met hormoontherapie.
Er werden in de aanvullende zoekactie 2 recentere RCT’s gevonden:
- Shahnazi 2013: RCT onder 84 postmenopauzale vrouwen met overgangsklachten in Iran, waarin gedroogd extract van de zilverkaarswortel (tabletten à 6,5 mg; n = 42) werd vergeleken met placebo (n = 42) gedurende 8 weken.
- Tanmahasamut 2015: RCT onder 54 vrouwen met overgangsklachten in Thailand, waarin 50% ethanolic extract of black cohosh (1 dd 1 tablet à 40 mg; n = 27) werd vergeleken met placebo (n = 27) gedurende 12 weken.
Effectiviteit en bijwerkingen
De tabellen Zilverkaars vergeleken met placebo en Zilverkaars vergeleken met hormoontherapie presenteren de relatieve en absolute effecten met de kwaliteit van het bewijs op basis van GRADE. De uitkomstmaten ‘stemming’, ‘spier- en gewrichtsklachten’ en ‘specifieke bijwerkingen’ zijn niet onderzocht. Voor de vergelijking met hormoontherapie is daarnaast de uitkomstmaat ‘kwaliteit van leven’ niet onderzocht.
Een punt van aandacht is het optreden van leverschade. Er zijn in de literatuur gevallen beschreven van levertoxiciteit na het gebruik van zilverkaars.
Of hier sprake is van een causaal verband is niet na te gaan. De RCT’s zijn te klein om hierover een uitspraak te doen.
Daarnaast zijn er zorgen over interacties van zilverkaarsextract met medicatie, met name gemedieerd door cytochroom-P450-enzymen. Ook hierover is te weinig onderzoek beschikbaar om er een betrouwbare uitspraak over te doen.
Conclusies
Zilverkaars vergeleken met placebo
- Er is mogelijk niet of nauwelijks verschil in aantal en ernst van opvliegers of nachtelijke zweetaanvallen (kwaliteit van bewijs laag).
- We zijn onzeker over kwaliteit van leven, seksuele klachten en bijwerkingen (kwaliteit van bewijs zeer laag of niet te bepalen).
- Stemming, spier- en gewrichtsklachten en specifieke bijwerkingen zijn niet onderzocht.
Zilverkaars vergeleken met hormoontherapie
- Mogelijk is het aantal en de ernst van opvliegers of nachtelijke zweetaanvallen hoger bij gebruik van zilverkaars dan bij gebruik van hormoontherapie (kwaliteit van bewijs laag).
- We zijn onzeker over seksuele klachten en bijwerkingen (kwaliteit van bewijs zeer laag of niet te bepalen).
- Kwaliteit van leven, stemming, spier- en gewrichtsklachten en specifieke bijwerkingen zijn niet onderzocht.
Fyto-oestrogenen
Naar Samenvatting ›We bevelen fyto-oestrogenen niet aan bij vrouwen met opvliegers en/of nachtelijke zweetaanvallen.
Fyto-oestrogenen verlagen mogelijk het aantal opvliegers enigszins, maar zouden voor (ernstige) bijwerkingen kunnen zorgen. Er is weinig onderzoek naar langdurig gebruik van specifieke fyto-oestrogenen, zodat de effectiviteit en de bijwerkingen ervan onzeker blijven. Daarnaast varieert de samenstelling en kwaliteit van de preparaten en wordt deze niet gecontroleerd. Deze overwegingen hebben geleid tot een sterke aanbeveling tegen fyto-oestrogenen.
Voor- en nadelen
- Voordeel: fyto-oestrogenen verminderen mogelijk het aantal opvliegers vergeleken met placebo of geen interventie.
- Nadeel: er zijn veel verschillende fyto-oestrogenen op de markt in veel verschillende doseringen. Bijwerkingen zijn nauwelijks onderzocht (de RCT’s zijn daarvoor niet geschikt), maar uit case-reports en meldingen bij Lareb zijn er aanwijzingen dat deze wel degelijk kunnen optreden. We zijn onzeker over het effect op borstkanker, endometriumhyperplasie en cardiovasculair risico. In theorie kan het risico verhoogd zijn, omdat het toch om oestrogenen (zonder toegevoegd progestageen) gaat.
Kwaliteit van bewijs
De kwaliteit van bewijs was over het algemeen zeer laag.
Waarden en voorkeuren van patiënten
De werkgroep vermoedt dat vrouwen verschillende ideeën hebben over het gebruik van fyto-oestrogenen. Sommige vrouwen zullen fyto-oestrogenen willen proberen vanwege mogelijke klachtenvermindering, anderen zullen liever geen middelen nemen waarvan ze de precieze samenstelling, werking en bijwerkingen niet kennen.
Kosten
Fyto-oestrogenen zijn als zelfzorgmiddelen bij de drogisterij te koop. De kosten liggen grofweg rond € 1 per dag, afhankelijk van merk en drogisterij. Deze kosten komen voor rekening van de vrouw.
Aanvaardbaarheid
Fyto-oestrogenen zijn verkrijgbaar in veel verschillende soorten en doseringen. De middelen zoals gevonden in de onderzoeken zijn niet in precies dezelfde samenstelling en doseringen verkrijgbaar in Nederland. De samenstelling van de preparaten varieert en wordt niet gecontroleerd. Verder staan ook de beperkte werkzaamheid en de onzekerheid over bijwerkingen op de korte en lange termijn de aanvaardbaarheid in de weg.
Haalbaarheid
Fyto-oestrogenen zijn vrij verkrijgbaar, bijvoorbeeld bij een drogisterij.
Uitgangsvraag
Zijn fyto-oestrogenen aan te bevelen aan vrouwen met opvliegers en/of nachtelijke zweetaanvallen? Zie de PICO-tabel.
|
Patiënten |
Vrouwen met opvliegers en/of nachtelijke zweetaanvallen |
|---|---|
|
Interventie |
Fyto-oestrogenen |
|
Vergelijking |
Placebo |
|
Uitkomstmaten |
Cruciaal
Belangrijk
|
Methoden
Er is een systematische literatuurzoekactie naar systematische reviews (SR’s) en RCT’s uitgevoerd in PubMed in december 2019, met een update in september 2021.
Resultaten
Resultaat zoekactie
De zoekactie leverde 3 SR’s met meta-analyse op naar het effect van fyto-oestrogenen op aan de overgang gerelateerde uitkomsten.
Najaf Najafi focust vooral op 1 uitkomstmaat: seksuele functie. Franco kijkt naar menopauzale symptomen in het algemeen en Perna naar langetermijnuitkomsten: (voorstadia of markers van) borstkanker, endometriumhyperplasie en hart- en vaatziekten.
Een aanvullende zoekactie na de zoekdatum van de SR van Franco (maart 2016) leverde 1 aanvullende RCT op.
Bij de update in september 2021 werden 1 SR en 2 RCT's gevonden die onderstaande resultaten bevestigen.
Onderzoekskarakteristieken
- Franco 2016 includeerde 36 RCT’s (n = 3762; gemiddelde leeftijd 53 jaar, follow-up 12-16 weken) naar het effect van therapieën met plant(extracten) op overgangsklachten. De deelnemers in de interventiegroep kregen per dag 10-200 mg fyto-oestrogenen (onder andere soja, isoflavonen, equol, genistine, daidzeïne, rode klaver). De controlegroep kreeg over het algemeen een placebopreparaat. Uitkomstmaten waren onder andere verandering van het aantal opvliegers per 24 uur en verandering van het aantal nachtelijke zweetaanvallen per 24 uur.
- Najaf Najafi 2018 includeerde 16 RCT’s (n = 1444; leeftijd 40-65 jaar) met betrekking tot het effect van fyto-oestrogenen op de seksuele functie in menopauzale vrouwen. De deelnemers in de interventiegroep kregen per dag 40-1000 mg fyto-oestrogenen (soja, isoflavonen, fenegriek, rode klaver, lijnzaad) en de controlegroep kreeg placebo of melk. De duur van de verschillende onderzoeken varieerde van 6 weken tot 12 maanden. De uitkomstmaat was seksuele activiteit, gemeten met de Menopause-Specific Quality of Life-questionnaire (seksuele domein).
- Perna 2016 includeerde 43 RCT’s naar de effecten van soja-isoflavonen bij menopauzale vrouwen. Voor dit detail worden gebruikt: 6 onderzoeken met betrekking tot (voorstadia van) borstkanker en endometeriumhyperplasie (n = 3622; leeftijd onbekend; follow-up 10 maanden tot 3 jaar; dosis 50-154 mg per dag) en 12 onderzoeken met betrekking tot cardiovasculaire problemen (n = 1407; leeftijd onbekend; follow-up 6 weken tot 5 jaar; dosis 17,5-154 mg per dag).
- Jenabi 2018: RCT waarin postmenopauzale vrouwen (n = 60; gemiddelde leeftijd 45-55 jaar; geworven via 2 gezondheidscentra in Iran) gerandomiseerd werden over 2 onderzoeksarmen: valeriaan (530 mg 2 dd gedurende 2 maanden; n = 30) en placebo (n = 30). Uitkomstmaten waren ernst en frequentie van opvliegers, gemeten met de kuppermanindex.
Effectiviteit en bijwerkingen
Zie tabel Fyto-oestrogenen vergeleken met placebo of geen behandeling voor de samenvatting van de resultaten.
Er werden geen onderzoeken gevonden met de uitkomstmaten ‘kwaliteit van leven’, ‘stemming’, ‘spier- en gewrichtsklachten’, ‘onregelmatig vaginaal bloedverlies’ en ‘diepe veneuze trombose’.
Een punt van aandacht is het optreden van bijwerkingen. Er zijn in de literatuur gevallen beschreven van bijwerkingen na het gebruik van fyto-oestrogenen, waaronder vaginaal bloedverlies, endometriumhyperplasie en stollingsstoornissen, en ook zijn er meldingen bij Lareb gedaan. Of hier sprake is van een causaal verband is niet na te gaan. De RCT’s zijn te klein om hierover een uitspraak te doen.
Conclusies
- Fyto-oestrogenen verlagen mogelijk het aantal opvliegers vergeleken met placebo of geen interventie (kwaliteit van bewijs laag).
- We zijn onzeker over het effect van fyto-oestrogenen op het aantal nachtelijke zweetaanvallen, seksuele functie, borstkanker, endometriumhyperplasie of hart- en vaatziekten (kwaliteit van bewijs zeer laag).
- Kwaliteit van leven, stemming, spier- en gewrichtsklachten, onregelmatig bloedverlies en diepe veneuze trombose zijn niet onderzocht.
Medicamenteuze behandeling
Naar Samenvatting ›Hormoontherapie algemeen
Naar Samenvatting ›- Overweeg hormoontherapie voor vasomotorische klachten bij vrouwen met hinderlijke beperkingen in het dagelijks leven.
- Hormoontherapie van vasomotorische klachten bestaat uit:
- estradiol ter vermindering van de vasomotorische klachten
- progestageen ter verlaging van het risico op endometriumhyperplasie of -carcinoom bij estradiolgebruik (niet nodig bij vrouwen zonder uterus, tenzij zij in het verleden endometriose hadden; zie Monotherapie estradiol of combinatietherapie estradiol met progestageen)
Hormoontherapie leidt tot klachtenvermindering, maar kan ook leiden tot een kleine (soms onzekere) risicoverhoging van zeldzame, maar ernstige aandoeningen (borstkanker, myocardinfarct, beroerte, endometriumcarcinoom, VTE). Dit heeft geleid tot een zwakke aanbeveling voor hormoontherapie bij vrouwen met hinderlijke overgangsklachten.
In aparte details wordt verder ingegaan op de keuze voor toedieningsvorm van oestrogeen en type progestageen.
Voor- en nadelen
- Het voordeel van hormoontherapie (oestrogeen, al dan niet gecombineerd met progestageen) is dat deze waarschijnlijk vasomotorische overgangsklachten (opvliegers en nachtelijke zweetaanvallen) vermindert en de kwaliteit van leven verbetert. Dit effect is iets sterker bij de dosering van 1 mg oraal estradiol per dag (of equivalent), maar ook bij de lagere dosering van 0,5 mg oraal estradiol per dag is het effect mogelijk nog klinisch relevant. De stemming en het seksueel functioneren worden door hormoontherapie niet of nauwelijks beïnvloed.
- Ongeveer 1-10% van de gebruikers heeft last van niet-ernstige bijwerkingen, zoals onregelmatig bloedverlies, hoofdpijn, maagdarmklachten, pijnlijke en gespannen borsten. Hormoontherapie heeft daarnaast mogelijk zeldzame, maar ernstige bijwerkingen. Het risico hierop kan enigszins verschillen, afhankelijk van de methode (oestrogeen monotherapie, sequentiële combinatietherapie of continue combinatietherapie), het type progestageen en de toedieningsvorm van het oestrogeen (oraal of transdermaal).
- Omdat oestrogeen monotherapie het risico op endometriumcarcinoom sterk verhoogt, komen de meeste vrouwen in aanmerking voor combinatietherapie van een oestrogeen met een progestageen. Combinatietherapie leidt vermoedelijk niet tot een verhoogd risico op endometriumcarcinoom. Het progestageen kan sequentieel (gedurende 14 dagen per maand) of continu (alle dagen) worden toegediend. Bij perimenopauzale vrouwen leidt continu toegediend progestageen frequent tot onregelmatig vaginaal bloedverlies, waardoor hiervoor alleen postmenopauzale vrouwen in aanmerking komen.
- Combinatietherapie leidt mogelijk tot een verhoogd risico op borstkanker; dit risico loopt geleidelijk op als de combinatietherapie langer wordt gebruikt. Het risico hangt af van het type progestageen dat wordt toegevoegd (zie Type progestageen).
- Daarnaast leidt combinatietherapie mogelijk tot een verhoogd risico op coronaire hartziekten en beroerte (beide met name bij continue combinatietherapie; bij sequentiële combinatietherapie lijkt het risico minder verhoogd) en VTE (met name bij oraal oestrogeen, zie Estradiol oraal of transdermaal). Dit zijn in deze leeftijdsgroep relatief weinig voorkomende, maar ernstige bijwerkingen.
- Vrouwen zonder uterus komen in aanmerking voor oestrogeen monotherapie. Ook dit leidt mogelijk tot een verhoogd risico op beroerte en VTE (bij oraal oestrogeen, zie Estradiol oraal of transdermaal). Deze bijwerkingen komen relatief weinig voor in deze leeftijdsgroep, maar zijn wel ernstig. Op het risico op borstkanker en hart- en vaatziekten heeft oestrogeen monotherapie niet of nauwelijks invloed.
Kwaliteit van bewijs
De kwaliteit van bewijs voor de effectiviteit was redelijk tot laag. De kwaliteit van bewijs voor de bijwerkingen was laag tot zeer laag, alleen redelijk voor de bijwerking ‘coronaire hartziekten’ bij oestrogeen monotherapie.
Waarden en voorkeuren van patiënten
Veel vrouwen zullen het aanvaardbaar vinden om medicijnen te gebruiken voor hinderlijke overgangsklachten. Bij ernstige klachten zal een deel van de vrouwen de klachtenvermindering belangrijker vinden dan het kleine (en soms onduidelijke) risico op zeldzame, maar ernstige bijwerkingen op de lange termijn. Een ander deel van de vrouwen zal het kleine risico op ernstige bijwerkingen op de lange termijn echter belangrijker vinden dan de klachtenvermindering. Daarom is het belangrijk om deze risico’s te bespreken.
Kosten
Zie Estradiol oraal of transdermaal en Type progestageen.
Aanvaardbaarheid
Vrouwen zullen samen met de huisarts een individuele afweging maken of de voordelen opwegen tegen eventuele nadelen. Afhankelijk van eventuele andere risicofactoren zal per individu bekeken worden of de behandeling aanvaardbaar is.
Haalbaarheid
Hormoontherapie is goed verkrijgbaar in Nederland, de haalbaarheid lijkt geen probleem.
Uitgangsvraag
Is hormoontherapie aan te bevelen aan vrouwen met opvliegers en/of nachtelijke zweetaanvallen? Deze uitgangsvraag is beantwoord door twee PICO’s, zie de PICO-tabellen.
|
Patiënten |
Vrouwen met opvliegers en/of nachtelijke zweetaanvallen |
|---|---|
|
Interventie |
Hormoontherapie met oestrogeen (alle toedieningsvormen), al dan niet gecombineerd met progestageen (alle soorten) |
|
Vergelijking |
Placebo |
|
Uitkomstmaten |
Cruciaal
Belangrijk
|
|
Patiënten |
Vrouwen met opvliegers en/of nachtelijke zweetaanvallen |
|---|---|
|
Interventie |
Hormoontherapie
|
|
Vergelijking |
Placebo of geen hormoontherapie |
|
Uitkomstmaten |
Cruciaal
|
Achtergrond
Hormoontherapie kan worden voorgeschreven bij overgangsklachten. Oestrogeen vermindert de klachten, progestageen wordt toegevoegd om het risico op endometriumhyperplasie en -carcinoom te beperken bij oestrogeengebruik.
Oestrogeen wordt continu gegeven. Het toevoegen van progestageen kan op 2 manieren gebeuren: sequentieel (progestageen wordt gedurende ≥ 14 dagen per maand toegevoegd aan het oestrogeen; als gevolg hiervan vindt maandelijks een onttrekkingsbloeding plaats) of continu (oestrogeen met progestageen wordt continu gegeven; bij deze methode vindt geen onttrekkingsbloeding plaats). Continue combinatietherapie geeft bij perimenopauzale vrouwen langdurig en frequent onregelmatig bloedverlies, daarom komen alleen postmenopauzale vrouwen in aanmerking voor deze methode.
In dit detail onderbouwen we de effectiviteit en bijwerkingen van hormoontherapie, ten behoeve van de keuze om wel of niet hormoontherapie te gebruiken. Omdat de effectiviteit wordt bepaald door het oestrogeen is voor de onderbouwing van de effectiviteit geen onderscheid gemaakt naar methode (oestrogeen als monotherapie, sequentiële combinatietherapie of continue combinatietherapie). Wel is er onderscheid gemaakt tussen de dosering oestrogeen (vergelijkbaar met 1 mg estradiol of vergelijkbaar met 0,5 mg estradiol), omdat hiertussen mogelijk verschillen te verwachten zijn.
De ernstige bijwerkingen zijn wél apart weergegeven per methode, omdat deze mogelijk beïnvloed worden door het al dan niet toevoegen van progestageen. Ook het type progestageen en de toedieningsvorm van het oestrogeen zijn soms van invloed op het optreden van ernstige bijwerkingen. Dit komt niet tot uiting in deze uitgangsvraag en daarom verwijzen wij voor deze nuance naar de betreffende details.
Methoden
Er is een systematische literatuurzoekactie naar systematische reviews (SR’s), RCT’s en observationele onderzoeken uitgevoerd in PubMed en Embase in april 2020, met een update in september 2021.
Resultaten
Resultaat zoekactie
- De SR’s die voor deze uitgangsvraag gebruikt zijn, zijn die van Grant et al. voor de effectiviteit op korte termijn, Sarri et al. voor de uitkomstmaat vaginaal bloedverlies, Marjoribanks et al. voor diverse ernstige bijwerkingen uit RCT’s, de Collaborative Group on Hormonal Factors in Breast Cancer voor de uitkomstmaat borstkanker uit cohortonderzoek, Brinton et al. voor de uitkomstmaat endometriumcarcinoom uit observationeel onderzoek en Rovinski et al. voor de uitkomst VTE uit observationeel onderzoek.
- Apart beschreven zijn cohortonderzoeken en patiënt-controleonderzoeken (bij voorkeur genest binnen een cohort) indien de betreffende interventies (oestrogeen als monotherapie, sequentiële combinatietherapie of continue combinatietherapie) of uitkomsten niet in een SR waren bepaald: de Nurses’ Health Study, de E3N-studie, de Dahors-studie, de Clinical Practice Research Datalink en een patiënt-controleonderzoek genest binnen de totale Finse bevolking.
De update in september 2021 leverde geen nieuwe onderzoeken op.
Onderzoekskarakteristieken
- Grant 2015: SR naar de effecten en veiligheid van behandelingen voor vrouwen met klachten gerelateerd aan natuurlijke of chirurgisch geïnduceerde overgang. Geïncludeerd werden 283 trials (n = 53.000), waaronder 101 RCT’s (n = 22.000; gemiddelde leeftijd 43,8-63,5 jaar) naar het effect van ≥ 12 weken hormoontherapie in vergelijking met placebo. In 39 RCT’s (n = 9316) werd een dosering oestrogeen equivalent aan 1 mg estradiol per dag, al dan niet gecombineerd met progestageen, vergeleken met placebo; in 53 RCT’s (n = 11.694) werd een dosering oestrogeen equivalent aan ≤ 0,5 mg estradiol per dag, al dan niet gecombineerd met progestageen, vergeleken met placebo.
- Sarri 2017: SR naar de effecten en bijwerkingen van diverse behandelingen voor overgangsklachten. Geïncludeerd werden 5 RCT’s (n = 1367, leeftijd 45-65 jaar, follow-up 8-26 weken) die de uitkomstmaat onregelmatig vaginaal bloedverlies bepaalden. In 2 hiervan werd oraal oestrogeen plus progesteron vergeleken met placebo (1 daarvan had ook een controlegroep met venlafaxine), in 2 RCT’s werd oraal oestrogeen plus progesteron vergeleken met tibolon en in 1 RCT werd gabapentine vergeleken met placebo. Met behulp van een netwerkmeta-analyse werd onder andere het effect van orale combinatietherapie op vaginale bloedingen bepaald ten opzichte van placebo.
- Marjoribanks 2017: SR (Cochrane-review) naar de effecten van langdurige hormoontherapie (≥ 1 jaar) op onder andere hart- en vaatziekten en kanker bij peri- en postmenopauzale vrouwen. Geïncludeerd werden 22 RCT’s (n = 43.637) waarin hormoontherapie met oestrogeen (alle toedieningsroutes), al dan niet gecombineerd met progestageen, werd vergeleken met placebo. De geïncludeerde vrouwen waren grotendeels postmenopauzaal, spontaan of chirurgisch. De leeftijd was 26-91 jaar, de gemiddelde of mediane leeftijd was 48-76 jaar, in meer dan de helft van de onderzoeken > 60 jaar. Het grootste gedeelte van de RCT’s onderzocht oestrogeen monotherapie of oestrogeen gecombineerd met medroxyprogesteron.
- Brinton 2014: SR naar de effecten van hormoontherapie op endometriumcarcinoom, waarin 11 patiënt-controleonderzoeken en 6 cohortonderzoeken werden geïncludeerd. Er is geen gedetailleerde informatie gegeven over deelnemeraantallen en leeftijd. We hebben alleen de resultaten van de meta-analyse van cohortonderzoeken gerapporteerd; de resultaten uit patiënt-controleonderzoek kwamen hiermee echter in grote lijnen overeen.
- Rovinski 2018: SR naar de effecten van hormoontherapie op VTE. Geïncludeerd werden 9 patiënt-controleonderzoeken, 9 cohortonderzoeken en 4 RCT’s (aantallen deelnemers niet gerapporteerd). De gemiddelde leeftijd in de onderzoeken was 48-66 jaar. De deelnemers hadden niet eerder een VTE doorgemaakt.
- Collaborative Group 2019: meta-analyse met individuele patiëntendata (IPD) naar de associatie tussen verschillende regimes en behandelduren van hormoontherapie en borstkanker. Zowel prospectieve als retrospectieve onderzoeken werden geïncludeerd als daarin bij ≥ 1000 deelnemers borstkanker was opgetreden. Geïncludeerd werden 568.859 patiënten uit 58 onderzoeken (24 prospectieve en 34 retrospectieve). Voor de hoofdanalyses zijn alleen de prospectieve onderzoeken gebruikt (n = 490.994, van wie 108.647 borstkanker ontwikkelden). De gemiddelde leeftijd waarop borstkanker werd gediagnosticeerd was 65 jaar. Er konden geen RCT’s geïncludeerd worden omdat er niet genoeg patiënten met borstkanker waren opgenomen.
- Bhupathiraju 2017: data-analyses uit de Nurses’ Health Study, een langlopend prospectief cohortonderzoek in de Verenigde Staten waarin onder andere het verband tussen hormoontherapie en diverse aandoeningen wordt onderzocht. Geïncludeerd werden vrouwen van 50-79 jaar die óf geen hormoontherapie hadden gebruikt óf 0,625 mg geconjugeerd oestrogeen per dag gebruikten (bij vrouwen met een uterus gecombineerd met dagelijks < 10 mg medroxyprogesteron). Deze vrouwen zijn geïncludeerd tussen 1980 en 1994 en gevolgd tot 2002. Van de geïncludeerde vrouwen hadden er 10.047 geen uterus; van deze vrouwen hadden er 6136 geen hormoontherapie gebruikt en 3911 wel. Van de 38.338 vrouwen met intacte uterus hadden er 34.622 geen hormoontherapie gebruikt en 3716 wel. De duur van het gebruik van hormoontherapie is niet gerapporteerd. Er werd onder andere gekeken naar het verband tussen hormoontherapie en myocardinfarct, beroerte en longembolie. Daarbij is een subgroepanalyse gedaan naar vrouwen van 50-59 jaar.
- Fournier 2005 en Fournier 2008: E3N, een Frans prospectief cohortonderzoek met 98.995 vrouwen van 40-65 jaar, waarin het verband tussen diverse risicofactoren, waaronder hormoontherapie, en diverse uitkomsten, waaronder kanker en trombose, werd onderzocht. In beide analyses werd het risico op borstkanker onderzocht. Fournier 2005 analyseerde 54.548 postmenopauzale vrouwen (gemiddelde leeftijd 52,8 jaar, gemiddelde follow-up 5,8 jaar); Fournier 2008 analyseerde 80.377 vrouwen (gemiddelde leeftijd 53,1 jaar, gemiddelde follow-up 8,1 jaar).
- Løkkegaard 2008, Mørch 2016 en Løkkegaard 2017: Danish Sex Hormone Register Study (Dahors), cohortonderzoek waarin alle Deense vrouwen van 15-79 jaar werden geïncludeerd in de periode 1995-2001 of 1995-2009.
- Løkkegaard 2008 onderzocht het verband tussen hormoontherapie en myocardinfarct. Geïncludeerd werden 698.098 vrouwen van 51-70 jaar. De vrouwen werden gemiddeld 4,2 jaar gevolgd; 36% heeft in die periode een vorm van hormoontherapie gebruikt en bij 4947 vrouwen trad een myocardinfarct op.
- Mørch 2016 onderzocht het verband tussen hormoontherapie en endometriumcarcinoom. Geïncludeerd werden 914.595 vrouwen(leeftijd 50-79 jaar, gemiddeld ongeveer 63 jaar aan het eind van de follow-up, gemiddelde follow-up 9,8 jaar). Bij 6202 vrouwen trad endometriumcarcinoom op. De gemiddelde duur van het gebruik van hormoontherapie is niet gerapporteerd, maar 35% had ≥ 10 jaar hormoontherapie gebruikt.
- Løkkegaard 2017 onderzocht het verband tussen hormoontherapie en beroerte. Geïncludeerd werden 980.003 vrouwen van 51-70 jaar. De vrouwen werden gemiddeld 7,9 jaar gevolgd, 36,1% heeft in die periode een vorm van hormoontherapie gebruikt en bij 20.199 vrouwen trad een beroerte op.
- Schneider 2009a: Brits genest patiënt-controleonderzoek binnen de UK General Practice Research Database (tegenwoordig Clinical Practice Research Datalink). Geïncludeerd werden 34.706 vrouwen die nooit hormoontherapie hadden gebruikt en 34.706 gematchte vrouwen die gecombineerde hormoontherapie (oestrogeen plus progestageen) hadden gebruikt. De vrouwen werden gevolgd vanaf het eerste voorschrift van hormoontherapie na 1987 (voor de vrouwen die hormoontherapie hadden gebruikt) of vanaf een willekeurige datum na 1987 (voor de vrouwen die geen hormoontherapie hadden gebruikt), tot 2007. Binnen deze groep werden vrouwen met myocardinfarct, beroerte en VTE geïdentificeerd, die elk vervolgens gematcht werden met ≤ 6 controlepersonen. Van de deelnemers was 38,7% < 50 jaar bij de start van de follow-up, 53,4% was 50-59 jaar en 7,9% was 60-69 jaar. Gemiddeld werden gebruikers 6 jaar gevolgd en niet-gebruikers 5,7 jaar.
- Vinogradova 2019: genest patiënt-controleonderzoek naar de relatie tussen hormoontherapie en VTE binnen 2 Britse databases: de Clinical Practice Research Datalink en QResearch. Als patiënt werden vrouwen geïncludeerd van 40-79 jaar die tussen 1998 en 2017 geregistreerd waren bij een deelnemende praktijk, en die in deze periode een eerste diagnose van VTE hadden. Elke patiënt werd vervolgens gematcht met ≤ 5 controlepersonen. In totaal werden 80.396 patiënten en 391.494 controlepersonen geïncludeerd.
- Vinogradova 2020: genest patiënt-controleonderzoek naar de relatie tussen hormoontherapie en borstkanker binnen 2 Britse databases: de Clinical Practice Research Datalink en QResearch. Als patiënt werden vrouwen geïncludeerd van 50-79 jaar die tussen 1998 en 2018 geregistreerd waren bij een deelnemende praktijk, en die in deze periode een eerste diagnose van borstkanker hadden. Elke patiënt werd vervolgens gematcht met ≤ 5 controlepersonen. In totaal werden er 98.611 patiënten en 457.498 controlepersonen geïncludeerd.
- Lyytinen 2010: Fins patiënt-controleonderzoek naar het verband tussen hormoontherapie en borstkanker, genest binnen de totale Finse bevolking. Geïncludeerd werden alle Finse vrouwen van 50-62 jaar die met borstkanker waren gediagnosticeerd tussen 1995-2007 (n = 9956). Elke deelnemer werd gematcht met 3 controlepersonen uit het Finse bevolkingsregister (n = 29.868).
Effectiviteit en bijwerkingen
Zie de tabellen voor de samenvatting van de resultaten.
- Effectiviteit van hormoontherapie (alle toedieningsvormen en soorten van oestrogeen, al dan niet gecombineerd met progestageen) vergeleken met placebo
- Ernstige bijwerkingen van continue combinatietherapie (alle toedieningsvormen en soorten oestrogeen met alle soorten van continu toegevoegd progestageen) vergeleken met controle (placebo of geen hormoontherapie)
- Ernstige bijwerkingen van sequentiële combinatietherapie (alle toedieningsvormen en soorten oestrogeen met alle soorten van sequentieel toegevoegd progestageen) vergeleken met controle (placebo of geen hormoontherapie)
- Ernstige bijwerkingen van oestrogeen monotherapie (alle toedieningsvormen en soorten) vergeleken met controle (placebo of geen hormoontherapie)
Niet-ernstige bijwerkingen, met uitzondering van onregelmatig bloedverlies, werden in de meta-analyse niet onderzocht. Hiervoor werd uitgegaan van de KNMP Kennisbank (KNMP Kennisbank, geraadpleegd april 2021). Zie tabel 1.
|
Gegevens uit onderzoek |
|||
|---|---|---|---|
|
Uitkomst Follow-up termijn |
Onderzoeksresultaten en metingen |
Kwaliteit van bewijs (zekerheid van het effect) |
Samenvatting |
|
Onregelmatig vaginaal bloedverlies1 12 weken |
Odds ratio: 2,76 (95%-BI 0,68 tot 12,06) Gebaseerd op data van 555 patiënten in 2 onderzoeken Follow-up: 8-12 weken |
Laag door ernstig indirect bewijs, door ernstige onnauwkeurigheid2 |
Hormoontherapie (combinatietherapie, geen onderscheid gemaakt naar continu of sequentieel) leidt mogelijk tot toename van onregelmatig vaginaal bloedverlies |
|
Gegevens uit KNMP Kennisbank |
|||
|
Middel |
Belangrijkste bijwerkingen |
||
|
Estradiol oraal |
1-10%: toe- of afname lichaamsgewicht, hoofdpijn, maag-darmklachten, jeuk, onregelmatig bloedverlies < 1%: onder andere depressie, duizeligheid, pijnlijke of gespannen borsten |
||
|
Estradiol transdermaal |
1-10%: jeuk en huiduitslag op de toedieningsplaats, verder vergelijkbaar met oraal |
||
|
Dydrogesteron (als voorbeeld voor alle progestagenen) |
> 10%: vaginaal bloedverlies 1-10%: hoofdpijn, maag-darmklachten, pijnlijke of gevoelige borsten < 1%: onder andere depressie, duizeligheid, verminderde leverfunctie, gewichtstoename, huidreacties |
||
|
|||
Milieu-impact van hormoontherapie
Medicijnresten kunnen in het oppervlaktewater terechtkomen, zo ook oestrogene stoffen. Er zijn hormoonverstoringen, zoals vervrouwelijking en problemen met de reproductie, beschreven bij vissen, kreeften en mosselen in de buurt van rioolwaterzuiveringsinstallaties.
Het is niet uit te sluiten dat oestrogene medicijnresten hierop van invloed zijn geweest: zowel estradiol als ethinylestradiol overschrijden in het oppervlaktewater waarschijnlijk regelmatig risicogrenzen. In hoeverre hormoontherapie voor overgangsklachten hierin een rol speelt, is niet duidelijk.
De combinatiepreparaten voor overgangsklachten bevatten naast estradiol het progestageen dydrogesteron. Dit progestageen is nog niet onderzocht met betrekking tot milieu-effecten.
Conclusies
Effectiviteit
- Hormoontherapie vermindert waarschijnlijk aantal en ernst van opvliegers (kwaliteit van bewijs redelijk).
- Hormoontherapie verbetert mogelijk de kwaliteit van leven (kwaliteit van bewijs laag).
- Hormoontherapie beïnvloedt de stemming en het seksueel functioneren waarschijnlijk niet of nauwelijks (kwaliteit van bewijs redelijk).
- Er waren geen onderzoeken beschikbaar met de uitkomst ‘spier- en gewrichtsklachten’.
Ernstige bijwerkingen van combinatietherapie (alle typen progestageen samengenomen)
- Mogelijk leidt combinatietherapie tot een verhoogd risico op borstkanker, vooral na langduriger gebruik (kwaliteit van bewijs laag; geen duidelijk verschil tussen continu en sequentieel, maar het risico hangt af van het gebruikte type progestageen).
- Mogelijk heeft combinatietherapie niet of nauwelijks effect op het risico op endometriumcarcinoom (kwaliteit van bewijs laag; geen duidelijk verschil tussen continu en sequentieel).
- Mogelijk leidt continue combinatietherapie tot een verhoogd risico op coronaire hartziekten, maar sequentiële combinatietherapie niet (kwaliteit van bewijs laag, zowel voor continue als sequentiële combinatietherapie).
- Mogelijk leidt combinatietherapie tot een verhoogd risico op beroerte (kwaliteit van bewijs laag; vooral continue combinatietherapie; door sequentiële combinatietherapie lijkt het risico minder verhoogd).
- Mogelijk leidt combinatietherapie met oraal toegediend oestrogeen tot een verhoogd risico op VTE, maar is er niet of nauwelijks effect op het risico op VTE bij transdermaal toegediend oestrogeen (kwaliteit van bewijs laag; geen duidelijk verschil tussen continu en sequentieel).
Ernstige bijwerkingen van oestrogeen monotherapie
- Mogelijk heeft oestrogeen monotherapie niet of nauwelijks effect op het risico op borstkanker (kwaliteit van bewijs laag).
- Waarschijnlijk heeft oestrogeen monotherapie niet of nauwelijks effect op het risico op coronaire hartziekten (kwaliteit van bewijs redelijk).
- Mogelijk leidt oestrogeen monotherapie tot een verhoogd risico op beroerte (kwaliteit van bewijs laag).
- Mogelijk leidt oestrogeen monotherapie met oraal toegediend oestrogeen tot een verhoogd risico op VTE, maar is er niet of nauwelijks effect op het risico op VTE bij transdermaal toegediend oestrogeen (kwaliteit van bewijs laag).
Niet-ernstige bijwerkingen van hormoontherapie
- Combinatietherapie leidt mogelijk tot een toename van het risico op onregelmatig vaginaal bloedverlies (kwaliteit van bewijs laag). Dit geldt vooral voor continue therapie bij perimenopauzale vrouwen.
- Bij vrouwen die hormoontherapie gebruiken zijn de meest voorkomende/belangrijkste niet-ernstige bijwerkingen onregelmatig vaginaal bloedverlies, hoofdpijn en pijnlijke en gespannen borsten.
Voor- en nadelen
Naar Samenvatting ›Bespreek de voor- en nadelen van hormoontherapie.
- Na 3 maanden hormoontherapie is het globaal te verwachten effect op het aantal opvliegers en/of nachtelijke zweetaanvallen, als een vrouw bij aanvang ongeveer 10 opvliegers en/of nachtelijke zweetaanvallen per dag heeft:
- met placebobehandeling: ongeveer 5 opvliegers/nachtelijke zweetaanvallen minder per dag
- met hormoontherapie: ongeveer 8 opvliegers/nachtelijke zweetaanvallen minder per dag
- Hormoontherapie verbetert mogelijk de kwaliteit van leven.
- Hormoontherapie beïnvloedt de stemming en het seksueel functioneren waarschijnlijk niet of nauwelijks.
- Hormoontherapie kan leiden tot een kleine toename van het risico op in deze leeftijdsgroep weinig voorkomende, maar ernstige aandoeningen (VTE, myocardinfarct, beroerte, borstkanker, endometriumcarcinoom). Het absolute risico op deze ernstige bijwerkingen is afhankelijk van het individuele risico en neemt toe met de duur van het gebruik.
- De belangrijkste en meest voorkomende niet-ernstige bijwerkingen zijn onregelmatig vaginaal bloedverlies, hoofdpijn en pijnlijke en gespannen borsten.
Zie ook de 3 keuzekaarten op Thuisarts, die te gebruiken zijn als onderlegger bij gedeelde besluitvorming hierover: voor vrouwen die niet meer ongesteld worden; voor vrouwen in de overgang die nog wel ongesteld worden en een voorbehoedmiddel willen gebruiken; voor vrouwen in de overgang die nog wel ongesteld worden maar geen voorbehoedmiddel meer willen gebruiken.
In tabel 2 staan de belangrijkste absolute risicotoenames bij gebruik van hormoontherapie voor vasomotorische klachten. Zie de betreffende details voor de bijbehorende kwaliteit van bewijs.
| Bijwerking | Aantal ziektegevallen (globaal bij vrouwen 45-64 jaar) in 3 jaar zonder hormoontherapie | Type hormoontherapie | Relatieve risicoschatting (95%-BI) | Aantal extra ziektegevallen per 1000 vrouwen(95%-BI) bij 3 jaar hormoontherapie |
|---|---|---|---|---|
| Veneuze trombo-embolie | 4/1000 | Oestrogeen monotherapie oraal* | 1,4 (1,3 tot 1,5) | 2 meer (1 tot 2 meer) |
| Oestrogeen monotherapie transdermaal | 1,0 (0,8 tot 1,1) | 0 (1 minder tot 0) | ||
| Oestrogeen plus dydrogesteron | Onbekend (zeer lage kwaliteit van bewijs) | |||
| Oestrogeen plus progesteron | Onbekend (zeer lage kwaliteit van bewijs) | |||
| Borstkanker | 9/1000 | Oestrogeen monotherapie† | 1,2 (1,1 tot 1,3) | 2 meer (1 tot 2 meer) |
| Oestrogeen plus dydrogesteron | 1,0 (0,9 tot 1,1) | 0 (1 minder tot 1 meer) | ||
| Oestrogeen plus progesteron | 0,9 (0,7 tot 1,2) | 1 minder (5 minder tot 7 meer) | ||
| Coronaire hartziekten | 8/1000 | Oestrogeen monotherapie† | 0,9 (0,8 tot 1,1) | 0 (2 minder tot 1 meer) |
| Oestrogeen plus dydrogesteron | Onbekend (zeer lage kwaliteit van bewijs) | |||
| Oestrogeen plus progesteron | Onbekend (zeer lage kwaliteit van bewijs) | |||
| Beroerte | 6/1000 | Oestrogeen monotherapie† | 1,3 (1,1 tot 1,7) | 2 meer (0 tot 4 meer) |
| Oestrogeen plus dydrogesteron | Onbekend (zeer lage kwaliteit van bewijs) | |||
| Oestrogeen plus progesteron | Onbekend (zeer lage kwaliteit van bewijs) | |||
| Endometriumcarcinoom | 1,5/1000 | Oestrogeen monotherapie | n.v.t. | n.v.t. |
| Oestrogeen plus dydrogesteron | 0,9 (0,6 tot 1,3) | 0 (1 minder tot 0) | ||
| Oestrogeen plus progesteron | 1,4 (1,0 tot 2,0) | 1 meer (0 tot 1 meer) | ||
* Verschillende typen oestrogeen, met name potenter geconjugeerd oestrogeen, wat in Nederland niet meer gebruikt wordt. † Geen verschil bekend tussen orale of transdermale toediening. | ||||
Vrouwen met risicofactoren
Naar Samenvatting ›- Ontraad hormoontherapie bij:
- eerder vastgestelde hormoonafhankelijke tumoren, zoals borstkanker of endometriumcarcinoom
- eerder vastgestelde VTE, met of zonder trombofilie (dit geldt niet voor vrouwen die antistolling gebruiken)
- eerder vastgestelde hart- en vaatziekten
- onverklaard vaginaal bloedverlies (verricht aanvullende diagnostiek alvorens te starten, zie NHG-Standaard Vaginaal bloedverlies)
- ernstige leverfunctiestoornissen
- Bespreek bij overige situaties het aantal, de aard en de ernst van de risicofactoren bij de beoordeling van het individuele risico op:
- hart- en vaatziekten (zie NHG-Standaard Cardiovasculair risicomanagement)
- VTE (zie NHG-Standaard Diepveneuze trombose en longembolie)
- borstkanker (zie NHG-Standaard Borstkanker). Bij familiaire belasting met borstkanker is de toename van het risico door hormoontherapie onvoldoende onderzocht.
- Weeg samen met de vrouw de voor- en nadelen van de behandeling af (zie Voor- en nadelen hormoontherapie.
- Bespreek ook mogelijkheden om het individuele risico te verlagen, zoals stoppen met roken, minderen met alcoholgebruik, meer bewegen en afvallen. Matigen van het gebruik van alcohol kan ook een gunstig effect hebben op het aantal opvliegers.
Borstkanker of verhoogd risico hierop
Bij eerder vastgestelde borstkanker geldt een absolute contra-indicatie voor hormoontherapie bij overgangsklachten. Dit sluit aan op de aanbeveling in de Richtlijn Borstkanker.
Er is vrijwel geen onderzoek naar hormoontherapie bij vrouwen met een verhoogd risico op borstkanker. In een cohort van vrouwen met een BRCA1- of BRCA2-mutatie is het risico op borstkanker bij gebruik van hormoontherapie onderzocht.
Een deel van de vrouwen onderging een bilaterale preventieve oöforectomie (BPO) om het risico op borstkanker te verlagen. De vrouwen werden 3,6 jaar gevolgd. De hazard ratio op borstkanker in de groep die BPO onderging en daarna geen hormoontherapie gebruikte, was 0,38 (95%-BI 0,09 tot 1,59) ten opzichte van de groep die geen BPO onderging en geen hormoontherapie gebruikte. In de groep die BPO onderging en daarna wel hormoontherapie gebruikte, werd het risico niet veranderd: HR 0,37 (95%-BI 0,14 tot 0,96). Er waren te weinig vrouwen die geen BPO ondergingen maar wel hormoontherapie gebruikten om hiervoor een HR te kunnen berekenen. De auteurs concludeerden dat hormoontherapie het beschermende effect van BPO op het borstkankerrisico niet tenietdoet.
Verhoogd cardiovasculair risico, roken en hart- en vaatziekten
- De Richtlijn Management rondom menopauze stelt in de module over vrouwen met een verhoogd uitgangsrisico dat hormoontherapie voor overgangsklachten een bescheiden plaats heeft bij vrouwen met cardiovasculaire risicofactoren, gezien het ontbreken van goede evidence over de veiligheid. Transdermale toediening heeft de voorkeur als er een indicatie is (zeer lage kwaliteit van bewijs, op basis van 1 observationeel onderzoek naar beroerte). Als voorwaarde wordt genoemd dat de betreffende cardiovasculaire risicofactoren behandeld worden. Er werd geen onderzoek gevonden naar het effect van transdermale toediening op ischemische hartziekten bij vrouwen met een verhoogd cardiovasculair risico.
- In een recente narratieve review wordt op basis van internationale richtlijnen geadviseerd geen hormoontherapie voor overgangsklachten voor te schrijven aan vrouwen met eerder vastgestelde hart- en vaatziekten of een hoog cardiovasculair risico, vanwege een negatief effect van oestrogeen op beschadigd endotheel.
Trombofilie en diepe veneuze trombose/longembolie
- De Richtlijn Antitrombotisch beleid ontraadt orale hormoontherapie voor overgangsklachten aan vrouwen met eerdere VTE of met een positieve eerstegraadsfamilieanamnese voor VTE – met of zonder trombofilie. Vrouwen met een eerdere VTE hebben een sterk verhoogd risico op een recidief als zij orale hormoontherapie gebruiken.
- De Richtlijn Management rondom menopauze sluit aan bij de NIV-richtlijn. Hormoontherapie kan worden overwogen bij aanhoudende ernstige overgangsklachten die niet verbeteren met een niet-hormonale behandeling. Bij vrouwen met BMI > 30 kan transdermale toediening overwogen worden (zeer lage kwaliteit van bewijs: 1 observationeel onderzoek, beperkt aantal cases). Transdermale therapie kan eveneens worden overwogen bij vrouwen met een protrombinemutatie (zeer lage kwaliteit van bewijs: observationeel onderzoek, beperkt aantal cases). Bij goede instelling op antistolling is het risico op VTE niet verhoogd.
Conclusie
Het effect van hormoontherapie op overgangsklachten bij vrouwen met een verhoogd uitgangsrisico op hart -en vaatziekten, VTE of borstkanker is weinig onderzocht. Het effect van transdermale toediening van estradiol op veiligheid bij vrouwen met een verhoogd uitgangsrisico is onzeker.
Overwegingen
De werkgroep adviseert terughoudend te zijn met hormonale behandeling van overgangsklachten bij vrouwen met een verhoogd risico op hart- en vaatziekten, VTE of borstkanker vanwege gebrek aan bewijs voor de veiligheid, en sluit zich voor de contra-indicaties aan bij de richtlijnen van de NVOG en NIV.
Hormoontherapie, keuze van medicatie
Naar Samenvatting ›Estradiol oraal of transdermaal
Naar Samenvatting ›Bespreek de respectievelijke voor- en nadelen van orale en transdermale toediening van estradiol, en maak samen met de vrouw de keuze.
- Er lijkt geen verschil in effectiviteit te zijn tussen orale en transdermale toediening
- Mogelijk is het risico op VTE lager bij transdermale toediening, maar robuust bewijs hiervoor ontbreekt vooralsnog.
- Er lijken geen relevante verschillen te zijn in andere ernstige bijwerkingen.
- Progestagenen zijn niet beschikbaar in transdermale vorm. Mogelijk zijn gebruiksgemak en therapietrouw bij een oraal combinatiepreparaat hoger dan bij een combinatie van transdermaal estradiol met oraal progestageen.
- Transdermale toediening kan specifieke bijwerkingen veroorzaken, zoals huidirritatie.
- Er lijkt geen verschil in effectiviteit tussen orale of transdermale toediening van oestrogenen. Transdermale toediening geeft echter wel lokale niet-ernstige bijwerkingen. Mogelijk geven transdermale oestrogenen een lager risico op VTE dan oraal toegediende oestrogenen. Dit verschil in risico is echter gebaseerd op lage kwaliteit van bewijs; de werkgroep vindt dit een te zwak argument om een voorkeur voor transdermale toediening op te baseren. Een aanvullend argument daarbij is dat in de onderzoeken verschillende typen oraal oestrogeen (met name het in Nederland niet meer gebruikte, potentere geconjugeerd oestrogeen) werden vergeleken met transdermaal estradiol. Een directe vergelijking tussen de combinatie transdermaal estradiol met dydrogesteron en de combinatie oraal estradiol met dydrogesteron werd niet gevonden. Dit geldt overigens ook voor de onderzoeken naar de andere ernstige bijwerkingen.
- Het verschil in andere ernstige bijwerkingen is onzeker.
- De meeste vrouwen zullen het oestrogeen combineren met een progestageen (met uitzondering van vrouwen zonder uterus). Er zijn in Nederland geen transdermale combinatiepreparaten geregistreerd. Dit betekent dat bij keuze voor transdermale toediening van oestrogeen een oraal progestageen zal moeten worden genomen. Er zijn wel orale combinatiepreparaten (oestrogeen plus progestageen) beschikbaar. De werkgroep vindt het gebruiksgemak van een oraal combinatiepreparaat een relevante meewegende factor.
Voor- en nadelen
Er lijkt geen verschil te zijn in effectiviteit tussen transdermale en orale toediening van oestrogenen, maar hierover is slechts beperkt direct vergelijkend onderzoek beschikbaar. Bij transdermale toediening lijken de niet-ernstige bijwerkingen globaal vergelijkbaar, maar daarnaast komt bij transdermale toediening frequent jeuk en huiduitslag op de toedieningsplaats voor. Over de meeste ernstige bijwerkingen zijn we onzeker, maar mogelijk is het risico op VTE lager bij transdermale toediening dan bij orale toediening.
Kwaliteit van bewijs
De kwaliteit van bewijs was laag tot zeer laag.
Waarden en voorkeuren van patiënten
De werkgroep schat in dat er veel variatie is in de waarden en voorkeuren van vrouwen. Sommige vrouwen vinden het eenvoudiger om een tablet te slikken, vooral als het gaat om combinatietherapie, waarbij de oestrogenen en progestagenen in 1 tablet gecombineerd kunnen worden. Anderen geven de voorkeur aan transdermale toediening omdat ze het eenvoudiger vinden om een pleister te plakken of gel of spray te gebruiken. Ook vrouwen die moeite hebben met tabletten slikken of vrouwen met een gastric bypass (verminderde opname bij orale toediening) zullen de voorkeur geven aan een transdermale toedieningsvorm.
Kosten
De kosten voor transdermaal estradiol, vooral de gel, zijn hoger dan voor oraal estradiol. De kosten voor oraal estradiol 1 mg per dag bedragen € 4,20 per maand, de kosten voor transdermaal estradiol zijn € 4,60-8,18. Voor de volledigheid: de kosten van dydrogesteron 10 mg 14 dagen per maand als toevoeging aan estradiol bedragen € 3,50 per maand. De kosten van estradiol/dydrogesteron 1/10 mg sequentieel bedragen € 7,03 per maand (Medicijnkosten.nl, geraadpleegd september 2021).
Aanvaardbaarheid
Zowel orale als transdermale oestrogenen zijn aanvaardbaar voor artsen en patiënten.
Bij vrouwen met een uterus (de meeste vrouwen) moet het oestrogeen gecombineerd worden met een progestageen. Er zijn in Nederland geen transdermale combinatiepreparaten geregistreerd. De werkgroep vindt het gebruiksgemak van een oraal combinatiepreparaat een relevante meewegende factor. Een combinatiepreparaat zal ook de therapietrouw verhogen.
Haalbaarheid
Zowel orale als transdermale oestrogenen zijn goed verkrijgbaar in Nederland, dus de haalbaarheid is geen probleem.
UItgangsvraag
Is transdermale of orale toediening van oestrogeen, al dan niet in combinatie met progestageen, aan te bevelen aan vrouwen met opvliegers en/of nachtelijke zweetaanvallen? Zie de PICO-tabel.
|
Patiënten |
Vrouwen met opvliegers en/of nachtelijke zweetaanvallen |
|---|---|
|
Interventie |
Transdermaal oestrogeen |
|
Vergelijking |
Oraal oestrogeen |
|
Uitkomstmaten |
Cruciaal
Belangrijk
|
Achtergrond
Oestrogenen voor hormoontherapie bij overgangsklachten kunnen oraal of transdermaal toegediend worden. In Nederland zijn voor transdermale toediening een pleister, gel en spray beschikbaar. Er zijn (nog) geen transdermale combinatiepreparaten voor overgangsklachten in Nederland geregistreerd. Progestageen moet daarom oraal bijgegeven worden om het risico op endometriumhyperplasie en -carcinoom te verlagen, tenzij een vrouw geen uterus heeft.
Bij transdermale toediening wordt het first pass-effect in de lever vermeden. Het is de vraag of er relevante verschillen in effecten en bijwerkingen zijn in vergelijking met orale toediening. De mate van het risico op ernstige bijwerkingen is daarnaast waarschijnlijk mede afhankelijk van het type progestageen (zie Type progestageen).
In dit detail worden de effectiviteit en bijwerkingen van transdermaal oestrogeen vergeleken met oraal oestrogeen, al dan niet in combinatie met verschillende progestagenen.
Methoden
Er is een systematische literatuurzoekactie naar systematische reviews (SR’s) en RCT’s uitgevoerd in PubMed en Embase in april 2020, met een update in september 2021.
Resultaten
Resultaat zoekactie
De zoekactie leverde een SR op naar de effecten van verschillende oestrogenen voor overgangsklachten, waarbij ook de vergelijking tussen transdermaal estradiol en oraal geconjugeerd oestrogeen werd onderzocht. Daarnaast werden 3 SR’s gevonden die onder andere ernstige bijwerkingen van transdermale en orale oestrogenen beschreven. Een zoekactie na de zoekdata van Rovinski en Bezwada leverde een observationeel onderzoek op naar hormoontherapie en VTE en een observationeel onderzoek naar hormoontherapie en beroerte. De update in september 2021 leverde geen nieuwe onderzoeken op.
Onderzoekskarakteristieken
- Gaudard 2016: SR naar de effectiviteit en veiligheid van hormonen voor vasomotorische symptomen, vergeleken met placebo of andere hormonen. Geïncludeerd werden 23 RCT’s, waarvan er 2 (n = 711, leeftijd niet gerapporteerd) bèta-estradiolpleisters vergeleken met geconjugeerd oestrogeen in tabletvorm.
- Bezwada 2017: SR naar het effect van oestrogeenpleisters op cardiovasculaire uitkomsten. Geïncludeerd werden 6 onderzoeken: 3 cohortonderzoeken (n = 870.649, follow-up 5-10,4 jaar) en 3 patiënt-controleonderzoeken (n = 1.066.812, onderzoeksduur 5-7 jaar). Het enige onderzoek dat direct orale met transdermale toediening vergeleek, was de WHI-Observational Study, een cohortonderzoek in de Verenigde Staten waarbij 93.676 postmenopauzale vrouwen (50-79 jaar) gemiddeld 10,4 jaar werden gevolgd. De gemiddelde leeftijd van de vrouwen in dit cohortonderzoek is niet gerapporteerd, maar varieerde in de verschillende groepen tussen 60,1 en 65,3 jaar.
- Rovinski 2018: SR naar het effect van orale versus niet-orale hormoontherapie op het risico van VTE bij postmenopauzale vrouwen. Geïncludeerd werden 9 patiënt-controleonderzoeken, 9 cohortonderzoeken en 4 RCT’s. De gemiddelde leeftijd van de vrouwen is niet gerapporteerd, de leeftijd in de geïncludeerde onderzoeken was 35-79 jaar.
- Collaborative Group 2019: meta-analyse van individuele patiëntendata uit 58 cohortonderzoeken om de associatie tussen hormoontherapie en borstkanker te onderzoeken. Er werden gegevens geïncludeerd van 143.887 postmenopauzale vrouwen met borstkanker en 424.972 postmenopauzale vrouwen zonder borstkanker. De gemiddelde leeftijd waarop borstkanker werd gediagnosticeerd was 65 jaar.
- Vinogradova 2019: genest patiënt-controleonderzoek naar de relatie tussen hormoontherapie en VTE binnen 2 Britse databases: de Clinical Practice Research Datalink en QResearch. Als patiënt werden vrouwen geïncludeerd van 40-79 jaar die tussen 1998 en 2017 geregistreerd waren bij een deelnemende praktijk en die in deze periode een eerste diagnose van VTE hadden. Elke patiënt werd gematcht met ≤ 5 controlepersonen. In totaal werden er 80.396 patiënten en 391.494 controlepersonen geïncludeerd.
- Canonico 2016: genest patiënt-controleonderzoek naar de relatie tussen hormoontherapie en beroerte binnen de Franse bevolking. Als patiënt werden vrouwen geïncludeerd van 51-62 jaar die tussen 2009 en 2011 voor het eerst werden opgenomen met een beroerte. Elke patiënt werd gematcht met ≤ 4 controlepersonen. In totaal werden er 3144 patiënten en 12.158 controlepersonen geïncludeerd.
Effectiviteit en bijwerkingen
Zie tabel Transdermaal oestrogeen vergeleken met oraal oestrogeen voor de samenvatting van de resultaten.
Relevante niet-ernstige bijwerkingen van estradiol zijn onder andere onregelmatig bloedverlies, gevoelige borsten, maag-darm klachten, hoofdpijn, migraine, stemmingsstoornis. Dit geldt voor zowel orale als transdermale toediening. Bij transdermale toediening treedt bij > 10% van de patiënten jeuk en huiduitslag op de toedieningsplaats op (KNMP Kennisbank, geraadpleegd juli 2021).
Conclusies
- Er is mogelijk niet of nauwelijks verschil in het aantal opvliegers per dag tussen transdermale of orale toediening van oestrogenen (kwaliteit van bewijs laag).
- Er is mogelijk niet of nauwelijks verschil in het risico op borstkanker tussen transdermale of orale toediening van oestrogenen (kwaliteit van bewijs laag).
- Mogelijk is het risico op VTE lager bij transdermale toediening dan bij orale toediening (kwaliteit van bewijs laag).
- We zijn onzeker over verschillen in het risico op coronaire hartziekten en beroerte (kwaliteit van bewijs zeer laag).
- Hinder/ernst van opvliegers en aanvallen van nachtzweten, kwaliteit van leven, stemming, seksuele klachten, spier- en gewrichtsklachten, het risico op endometriumcarcinoom en bijwerkingen zijn niet onderzocht.
Voorkeurstoedieningsvorm transdermaal estradiol
Naar Samenvatting ›- Estradiolpleisters hebben de voorkeur.
- Andere toedieningsvormen, zoals transdermale estradiolgel of estradiolspray, zijn beperkt onderzocht.
Achtergrond
Naast estradiolpleisters is transdermaal estradiol ook beschikbaar als gel en als spray. De vraag is welke vorm de voorkeur verdient.
Effectiviteit
De in Estradiol oraal of transdermaal beschreven onderzoeken zijn voornamelijk uitgevoerd met estradiolpleisters. Of de bevindingen ook gelden voor andere transdermale toedieningsvormen (gel, spray) is niet duidelijk. Er is geen direct vergelijkend onderzoek gevonden naar de klinische effectiviteit tussen deze verschillende toedieningsvormen. Op basis van farmacokinetische gegevens worden met de gel globaal wat hogere en met de spray wat lagere serumspiegels bereikt dan met een estradiolpleister 50 microg (Geneesmiddeleninformatiebank, geraadpleegd september 2021):
- estradiol pleister 50 microg: gemiddelde estradiolconcentratie 44-55 pg/ml
- estradiol gel, applicatie met 1,5 mg estradiol, 2 applicaties: gemiddelde estradiolconcentratie 68,1 pg/ml. Geen informatie over 1 applicatie
- estradiol spray: gemiddelde estradiolconcentratie 17,8 pg/ml (1 spray), 28,2 pg/ml (2 sprays), 29,5 pg/ml (3 sprays)
Veiligheid/bijwerkingen
Er zijn geen gegevens bekend over de frequentie van (ernstige) bijwerkingen bij gebruik van gel en spray vergeleken met de pleister.
Toepasbaarheid
De contra-indicaties zijn voor alle vormen hetzelfde (KNMP Kennisbank, geraadpleegd september 2021).
Gebruiksgemak
Er zijn kleine verschillen in gebruiksgemak. De weging daarvan zal per vrouw verschillen. Een pleister bijvoorbeeld draagt de vrouw continu op het lichaam. De pleister mag nat worden, maar mag niet blootgesteld worden aan zonlicht. De spray en de gel zijn enkele minuten na het aanbrengen opgedroogd. De huid mag binnen 1 uur na aanbrengen niet in contact komen met water, dus niet baden, douchen of zwemmen. Ook wordt afgeraden binnen 1 uur huid-op-huidcontact te hebben met anderen.
Kosten
De kosten voor transdermale pleisters zijn in het algemeen lager dan voor de gel en de spray. De kosten per maand bedragen voor de estradiol pleister 50 microg/24 uur € 5,76, voor estradiol gel 0,6 mg/g bij benadering € 8-16 (uitgaande van de adviesdosering van 1-2 doseringen per dag en 64 doseringen à 1,25 g per pompje à 80 g) en voor estradiol spray bij benadering € 5-10 (uitgaande van 1-2 doseringen per dag en 56 doseringen per flacon).
Voor de volledigheid: de kosten van 14 dagen per maand dydrogesteron 10 mg bedragen € 3,50 per maand. De kosten van estradiol/dydrogesteron 1/10 sequentieel bedragen € 7,03 per maand (Medicijnkosten.nl, geraadpleegd maart 2022).
Conclusie
Van de transdermale toedieningsvormen is de estradiolpleister het best onderzocht. Op grond van gegevens over de bereikte serumspiegels lijkt de gelvorm eveneens effectief. Voor wat betreft de sprays is dat minder duidelijk. Bij keuze voor transdermale oestrogeentoediening heeft een estradiolpleister de voorkeur.
Monotherapie estradiol of combinatietherapie estradiol met progestageen
Naar Samenvatting ›- Geef vrouwen met uterus combinatietherapie, ter vermindering van het risico op endometriumcarcinoom.
- Geef vrouwen zonder uterus en zonder endometriose monotherapie estradiol.
- Geef vrouwen zonder uterus, maar met endometriose, ook combinatietherapie.
Om het risico op endometriumcarcinoom te verminderen is bij vrouwen met uterus toevoeging van een progestageen aan oestrogeen noodzakelijk.
Hormoontherapie kan endometriose beïnvloeden. Oestrogeen monotherapie wordt ontraden bij postmenopauzale vrouwen met uterusextirpatie en endometriose in de voorgeschiedenis.
Type progestageen
Naar Samenvatting ›- Dydrogesteron heeft de voorkeur omdat dit het kleinste risico op ernstige bijwerkingen geeft.
- Progesteron is tweede keuze.
- Overweeg bij gelijktijdige klachten van hevig menstrueel bloedverlies (bij perimenopauzale vrouwen) de hormoonspiraal met 52 mg levonorgestrel (zie NHG-Standaard Vaginaal bloedverlies). Voor toepassing van de hormoonspiraal bij perimenopauzale vrouwen met anticonceptiewens, zie Perimenopauzale vrouwen met anticonceptiewens.
- Van de in Nederland verkrijgbare progestagenen die voor endometriumprotectie kunnen worden gecombineerd met oestrogeen, lijkt dydrogesteron over het geheel van de onderzochte ernstige bijwerkingen het gunstigst, gevolgd door progesteron. De kosten van progesteron zijn wel hoger dan die van andere progestagenen.
- Dydrogesteron is verkrijgbaar als monopreparaat (te combineren met transdermaal oestrogeen) maar ook in orale combinatiepreparaten met estradiol, zowel voor continue als voor sequentiële toediening.
- Bovenstaande overwegingen maken dat de werkgroep een voorkeur heeft voor dydrogesteron. Als tweede keuze kan progesteron overwogen worden.
- Alleen bij gelijktijdige klachten van hevig menstrueel bloedverlies (bij perimenopauzale vrouwen) kan de hormoonspiraal met levonorgestrel overwogen worden (zie NHG-Standaard Vaginaal bloedverlies). Deze geeft mogelijk een verhoogd risico op borstkanker.
Voor- en nadelen
- Progestagenen verlagen het risico op endometriumcarcinoom bij gebruik van oestrogeen. De verschillende progestagenen verschillen echter enigszins in zowel het risico op endometriumcarcinoom als het risico op andere ernstige bijwerkingen.
- Progesteron lijkt het risico op endometriumcarcinoom enigszins te verhogen, maar omdat endometriumcarcinoom relatief weinig voorkomt, is de absolute risicotoename beperkt bij gebruik < 5 jaar. Progesteron lijkt het risico op borstkanker niet te verhogen. We zijn onzeker over het risico op coronaire hartziekten, beroerte en VTE.
- Dydrogesteron lijkt het risico op endometriumcarcinoom niet te verhogen, en leidt daarnaast mogelijk tot een niet of nauwelijks verhoogd risico op borstkanker bij gebruik < 5 jaar. Over het risico op coronaire hartziekten, beroerte en VTE zijn we onzeker (al lijkt het weinige beschikbare onderzoek niet op een verhoogd risico te wijzen).
- Ook medroxyprogesteron en norethisteron lijken het risico op endometriumcarcinoom tot een gebruik van 5 jaar niet of nauwelijks te verhogen, maar leiden mogelijk tot een verhoogd risico op borstkanker en VTE; daarnaast verhoogt norethisteron mogelijk het risico op coronaire hartziekten en beroerte (over medroxyprogesteron zijn we onzeker).
- De hormoonspiraal met levonorgestrel leidt mogelijk tot een verhoogd risico op borstkanker. Over het risico op endometriumcarcinoom zijn we onzeker, al wijzen de zeer beperkte resultaten niet op een verhoogd risico. Andere uitkomstmaten zijn niet onderzocht.
- Er is geen onderzoek gevonden naar ernstige bijwerkingen van drospirenon en lynestrenol.
- De niet-ernstige bijwerkingen van de verschillende progestagenen komen globaal overeen, maar verschillen enigszins in frequentie van voorkomen.
Kwaliteit van bewijs
De kwaliteit van bewijs is laag tot zeer laag.
Waarden en voorkeuren van patiënten
- De meeste vrouwen zullen een voorkeur hebben voor het progestageen met de minste ernstige bijwerkingen. Wat dat betreft lijkt dydrogesteron het meest gunstig, gevolgd door progesteron. Medroxyprogesteron, norethisteron en de hormoonspiraal met levonorgestrel lijken minder gunstig, vooral omdat ze mogelijk een verhoogd risico geven op trombose (geen gegevens over hormoonspiraal) en op borstkanker.
- Hoewel er niet veel relevante verschillen in niet-ernstige bijwerkingen zijn, kan het zijn dat een vrouw bijwerkingen ervaart van een bepaald type progestageen. In dat geval ligt het voor de hand een ander type progestageen te proberen.
Kosten
De kosten van progestagenen verschillen. Progesteron monopreparaat onderscheidt zich in negatieve zin door wat hogere kosten (€ 0,40-0,70 per dag). Dydrogesteron kost € 0,26 per dag, andere progestagenen kosten € 0,13 per dag (Medicijnkosten.nl, geraadpleegd september 2021).
Aanvaardbaarheid
- In combinatie met een transdermaal oestrogeen zal de vrouw een apart progestageen moeten innemen. Progesteron, dydrogesteron, medroxyprogesteron, lynestrenol en de hormoonspiraal met levonorgestrel hebben als voordeel dat ze als los preparaat verkrijgbaar zijn.
- In combinatie met een oraal oestrogeen zullen de meeste vrouwen voorkeur hebben voor een combinatiepreparaat: dit is het eenvoudigst in te nemen en vergroot de therapietrouw. Dydrogesteron, norethisteron en drospirenon hebben als voordeel dat ze verkrijgbaar zijn als combinatietablet met estradiol, voor continue (alle 3 de typen) of sequentiële (alleen dydrogesteron en norethisteron) toediening.
Haalbaarheid
De beschreven progestagenen zijn goed verkrijgbaar: de haalbaarheid lijkt geen probleem.
Uitgangsvraag
Welk type progestageen is aan te bevelen in combinatie met oestrogeen aan vrouwen met een uterus die hormoontherapie willen vanwege opvliegers en/of nachtelijke zweetaanvallen? Zie de PICO-tabel.
|
Patiënten |
Vrouwen met opvliegers en/of nachtelijke zweetaanvallen |
|---|---|
|
Interventie |
Hormoontherapie
|
|
Vergelijking |
Placebo of geen hormoontherapie |
|
Uitkomstmaten |
Cruciaal
|
Achtergrond
Vrouwen met een uterus die hormoontherapie willen voor het verminderen van overgangsklachten, krijgen oestrogenen gecombineerd met progestagenen. De progestagenen zijn nodig om het risico op endometriumcarcinoom terug te dringen. Mogelijk verschillen de progestagenen onderling in het risico op zeldzame, maar ernstige bijwerkingen. We hebben daarover de evidence uitgezocht, om de keuze voor een bepaald type progestageen te ondersteunen. Hierbij hebben we ons gericht op de in Nederland op dit moment (juni 2021) verkrijgbare progestagenen die voor deze indicatie geregistreerd zijn: progesteron, dydrogesteron, medroxyprogesteron, norethisteron, drospirenon en lynestrenol. Dydrogesteron, norethisteron en drosperinon zijn als oraal combinatiepreparaat met estradiol verkrijgbaar, voor continue (alle 3 de typen) of sequentiële (alleen dydrogesteron en norethisteron) toediening. Progesteron, dydrogesteron, medroxyprogesteron en lynestrenol zijn als los preparaat verkrijgbaar. Ook de hormoonspiraal met levonorgestrel is geregistreerd voor deze indicatie.
Methoden
Er is een systematische literatuurzoekactie naar systematische reviews (SR’s), RCT’s en observationele onderzoeken uitgevoerd in PubMed en Embase in april 2020, met een update in september 2021.
Resultaten
Resultaat zoekactie
De zoekactie leverde verschillende SR’s op naar de effecten van hormoontherapie bij postmenopauzale vrouwen. De SR’s die voor deze uitgangsvraag gebruikt zijn, zijn die van Marjoribanks et al. voor diverse ernstige bijwerkingen uit RCT’s, Furness et al. voor de uitkomstmaat endometriumhyperplasie uit RCT’s en de Collaborative Group on Hormonal Factors in Breast Cancer voor de uitkomst borstkanker uit cohortonderzoek.
Daarnaast zijn cohortonderzoeken en patiënt-controleonderzoeken (bij voorkeur genest binnen een cohort) apart beschreven, als de betreffende interventies (oestrogeen gecombineerd met een type progestageen) of uitkomsten niet in een SR waren bepaald: de Million Women Study,
de Nurses’ Health Study,
E3N,
Dahors,
EPIC,
de Clinical Practice Research Datalin,
MISSION,
en 2 patiënt-controleonderzoeken genest binnen de totale Finse bevolking.
De update in september 2021 leverde geen nieuwe onderzoeken op.
Onderzoekskarakteristieken
- Marjoribanks 2017: SR (Cochrane-review) naar de effecten van langdurige hormoontherapie (≥ 1 jaar) op onder andere hart- en vaatziekten en kanker bij peri- en postmenopauzale vrouwen. Geïncludeerd werden 22 RCT’s (n = 43.637) waarin hormoontherapie met oestrogeen (alle toedieningsroutes), al dan niet gecombineerd met progestagenen, werd vergeleken met placebo. De geïncludeerde vrouwen waren grotendeels postmenopauzaal, spontaan of chirurgisch. De leeftijd was 26-91 jaar, de gemiddelde of mediane leeftijd was 48-76 jaar en in meer dan de helft van de onderzoeken > 60 jaar. De meeste RCT’s onderzochten oestrogeen monotherapie of oestrogeen gecombineerd met medroxyprogesteron.
- Furness 2012: SR (Cochrane-review) naar de effecten van hormoontherapie (≥ 1 jaar) op endometriumhyperplasie of -carcinoom bij peri- en postmenopauzale vrouwen. Er werden 46 RCT’s (n = 39.409) geïncludeerd waarin hormoontherapie met oestrogeen (alle toedieningsroutes), al dan niet gecombineerd met progestagenen, werd vergeleken met een ander regime van hormoontherapie of met placebo. De geïncludeerde vrouwen waren grotendeels postmenopauzaal. De leeftijd was 40-75 jaar, waarbij de meeste RCT’s als inclusiecriterium hadden dat de laatste spontane menstruele bloeding < 5 jaar geleden was.
- Collaborative Group 2019: meta-analyse met individuele patiëntendata (IPD) naar de associatie tussen verschillende regimes en behandelduren van hormoontherapie en borstkanker. Zowel prospectieve als retrospectieve onderzoeken werden geïncludeerd als daarin bij ≥ 1000 deelnemers borstkanker was opgetreden. Er werden 568.859 vrouwen uit 58 onderzoeken (24 prospectieve en 34 retrospectieve) geïncludeerd. Voor de hoofdanalyses zijn alleen de prospectieve onderzoeken gebruikt (n = 490.994, waarvan 108.647 borstkanker ontwikkelden). De gemiddelde leeftijd waarop borstkanker werd gediagnosticeerd was 65 jaar. Er konden geen RCT’s geïncludeerd worden omdat hierin niet genoeg vrouwen met borstkanker waren opgenomen.
- Beral 2005 en Sweetland 2012: prospectief cohortonderzoek (Million Women Study) uit het Verenigd Koninkrijk.
- Beral 2005 onderzocht het verband tussen hormoontherapie en endometriumcarcinoom. Tussen 1996 en 2001 werden 716.738 postmenopauzale vrouwen met een gemiddelde leeftijd van 57 jaar geïncludeerd, die gemiddeld 3,4 jaar gevolgd werden (tot december 2002). Bij in totaal 1320 vrouwen trad endometriumcarcinoom op.
- Sweetland 2012 onderzocht het verband tussen hormoontherapie en VTE. Geïncludeerd werden 1.058.259 postmenopauzale vrouwen (gemiddelde leeftijd 56,7 jaar) met gemiddeld 3,1 jaar follow-up. Bij in totaal 2200 vrouwen trad VTE op.
- Bhupathiraju 2017: data-analyses uit de Nurses’ Health Study, een langlopend prospectief cohortonderzoek in de Verenigde Staten waarin onder andere het verband tussen hormoontherapie en diverse aandoeningen wordt onderzocht. Geïncludeerd werden vrouwen van 50-79 jaar die óf geen hormoontherapie hadden gebruikt óf 0,625 mg geconjugeerd oestrogeen per dag, bij vrouwen met een uterus gecombineerd met dagelijks < 10 mg medroxyprogesteron. Deze vrouwen zijn geïncludeerd tussen 1980 en 1994 en gevolgd tot 2002. Van de 10.047 vrouwen zonder uterus hadden er 6136 geen hormoontherapie gebruikt en 3911 wel. Van de 38.338 vrouwen met een intacte uterus hadden er 34.622 geen hormoontherapie gebruikt en 3716 wel. De duur van het gebruik van hormoontherapie is niet gerapporteerd. Er werd onder andere gekeken naar het verband tussen hormoontherapie en myocardinfarct, beroerte en longembolie. Daarbij is een subgroepanalyse gedaan van vrouwen die 50-59 jaar waren.
- Fournier 2005, Fournier 2008, Canonico 2010 en Fournier 2014a: Frans prospectief cohortonderzoek (E3N) waarin onder 98.995 vrouwen van 40-65 jaar het verband is onderzocht tussen diverse risicofactoren, waaronder hormoontherapie, en diverse uitkomsten, waaronder kanker en trombose.
- Fournier 2005 en Fournier 2008 analyseerden het risico op borstkanker. Fournier 2005 includeerde 54.548 postmenopauzale vrouwen met een gemiddelde leeftijd van 52,8 jaar en gemiddelde follow-up van 5,8 jaar. Fournier 2008 includeerde 80.377 vrouwen met een gemiddelde leeftijd van 53,1 jaar en een gemiddelde follow-up van 8,1 jaar.
- Canonico 2010 onderzocht het risico op VTE en includeerde 80.308 vrouwen met een gemiddelde leeftijd van 54 jaar, die gemiddeld 10,1 jaar werden gevolgd. Bij 549 vrouwen werd VTE vastgesteld.
- Fournier 2014a analyseerde het risico op endometriumcarcinoom. Geïncludeerd werden 65.630 postmenopauzale vrouwen, van wie er 301 endometriumcarcinoom ontwikkelden gedurende een gemiddelde follow-up van 10,8 jaar.
- Mørch 2016 en Løkkegaard 2017: Danish Sex Hormone Register Study (Dahors), cohortonderzoek waarin alle Deense vrouwen van 15-79 jaar werden geïncludeerd in de periode 1995-2009.
- Mørch 2016 analyseerde het verband tussen hormoontherapie en endometriumcarcinoom. Geïncludeerd werden 914.595 vrouwen van 50-79 jaar (gemiddelde leeftijd ongeveer 63 jaar aan het eind van de follow-up). De gemiddelde follow-up was 9,8 jaar en bij 6202 vrouwen trad endometriumcarcinoom op. De gemiddelde duur van het gebruik van hormoontherapie is niet gerapporteerd, maar 35% van de vrouwen had ≥ 10 jaar hormoontherapie gebruikt.
- Løkkegaard 2017 onderzocht het verband tussen hormoontherapie en beroerte bij 980.003 vrouwen van 51-70 jaar. De vrouwen werden gemiddeld 7,9 jaar gevolgd; 36,1% gebruikte in die periode een vorm van hormoontherapie en bij 20.199 vrouwen trad een beroerte op.
- Allen 2010: publicatie uit de European Prospective Investigation into Cancer and Nutrition (EPIC) waarin het verband tussen hormoontherapie en endometriumcarcinoom werd onderzocht. Tussen 1992 en 2000 werden 115.474 postmenopauzale vrouwen geïncludeerd uit 8 landen (Denemarken, Frankrijk, Duitsland, Italië, Nederland, Noorwegen, Spanje en het Verenigd Koninkrijk), met een gemiddelde leeftijd van ongeveer 57 jaar. Na een gemiddelde follow-up van 9 jaar trad bij 601 vrouwen endometriumcarcinoom op. De gemiddelde duur van de hormoontherapie was 3,8 jaar.
- Schneider 2009a en Schneider 2009b: genest patiënt-controleonderzoek binnen de UK General Practice Research Database (tegenwoordig Clinical Practice Research Datalink). Geïncludeerd werden 34.706 vrouwen die nooit hormoontherapie hadden gebruikt en 34.706 gematchte vrouwen die gecombineerde hormoontherapie (oestrogeen plus progestageen) hadden gebruikt. De vrouwen werden gevolgd vanaf het eerste voorschrift van hormoontherapie na 1987 (vrouwen die hormoontherapie hadden gebruikt), of vanaf een willekeurige datum na 1987 (vrouwen die geen hormoontherapie hadden gebruikt), tot 2007. Binnen deze groep werden patiënten met myocardinfarct, beroerte en VTE geïdentificeerd en vervolgens gematcht met ≤ 6 controlepersonen. Van de deelnemers was 38,7% < 50 jaar bij de start van de follow-up, 53,4% was 50-59 jaar en 7,9% was 60-69 jaar. Gemiddeld werden gebruikers 6 jaar gevolgd en niet-gebruikers 5,7 jaar.
- Vinogradova 2019: genest patiënt-controleonderzoek naar de relatie tussen hormoontherapie en VTE binnen 2 Britse databases: de Clinical Practice Research Datalink en Qresearch. Geïncludeerd werden vrouwen van 40-79 jaar die tussen 1998 en 2017 geregistreerd waren bij een deelnemende praktijk en in deze periode een eerste diagnose ‘VTE’ hadden. Elke patiënt werd vervolgens gematcht met ≤ 5 controlepersonen. In totaal werden 80.396 patiënten en 391.494 controlepersonen geïncludeerd.
- Vinogradova 2020: genest patiënt-controleonderzoek naar de relatie tussen hormoontherapie en borstkanker binnen 2 Britse databases: de Clinical Practice Research Datalink en Qresearch. Geïncludeerd werden vrouwen van 50-79 jaar die tussen 1998 en 2018 geregistreerd waren bij een deelnemende praktijk en in deze periode een eerste diagnose ‘borstkanker’ hadden. Elke patiënt werd vervolgens gematcht met ≤ 5 controlepersonen. In totaal werden 98.611 patiënten en 457.498 controlepersonen geïncludeerd.
- Espié 2007: Frans cohortonderzoek naar de relatie tussen hormoontherapie en borstkanker. Geïncludeerd werden 4949 vrouwen, van wie er 2693 hormoontherapie gebruikten (gemiddelde leeftijd 60,6 jaar, gemiddelde duur gebruik 8,3 jaar) en 2256 niet (gemiddelde leeftijd 64,2 jaar). In de groep die hormoontherapie gebruikte trad bij 17 vrouwen borstkanker op, versus 14 in de groep die geen hormoontherapie gebruikte.
- Lyytinen 2010: Fins patiënt-controleonderzoek naar het verband tussen hormoontherapie en borstkanker, genest binnen de totale Finse bevolking. Geïncludeerd werden alle Finse vrouwen van 50-62 jaar die met borstkanker gediagnosticeerd waren in 1995-2007 (n = 9956). Elke patiënt werd gematcht met 3 controlepersonen uit het Finse bevolkingsregister (n = 29.868).
- Jaakkola 2011: Fins patiënt-controleonderzoek naar het verband tussen hormoontherapie en endometriumcarcinoom, genest binnen de totale Finse bevolking. Alle Finse vrouwen van 50-80 jaar, met endometriumcarcinoom gediagnosticeerd tussen 1995-2007, werden geïncludeerd (n = 7261). Elke patiënt werd gematcht met 3 controlepersonen uit het Finse bevolkingsregister (n = 21.783).
Bijwerkingen
- De ernstige bijwerkingen (borstkanker, endometriumcarcinoom, coronaire hartziekten, beroerte en trombose) zijn samengevat in de tabellen Oestrogeen plus progesteron vergeleken met geen hormoontherapie, Oestrogeen plus dydrogesteron vergeleken met geen hormoontherapie, Oestrogeen plus medroxyprogesteron vergeleken met geen hormoontherapie, Oestrogeen plus norethisteron vergeleken met geen hormoontherapie en Oestrogeen plus levonorgestrelspiraal vergeleken met geen hormoontherapie.
- Omdat geen enkel onderzoek de directe vergelijking tussen verschillende progestagenen maakte, is steeds combinatietherapie met oestrogeen (alle toedieningsvormen en typen) en een bepaald progestageen (progesteron, dydrogesteron, medroxyprogesteron, norethisteron, levonorgestrelspiraal) vergeleken met geen hormoontherapie. Er werden geen onderzoeken gevonden die keken naar ernstige bijwerkingen bij het gebruik van combinatietherapie van oestrogeen met drospirenon of met lynestrenol.
- De meest relevante niet-ernstige bijwerkingen van progestagenen in het algemeen zijn: ‘spotting’ en doorbraakbloedingen, gevoelige borsten, maag-darmklachten, gewichtstoename, verminderd seksueel verlangen, hoofdpijn of migraine, chloasma (hyperpigmentatie in het gezicht) en stemmingsstoornis (KNMP Kennisbank, geraadpleegd juli 2021).
- De niet-ernstige bijwerkingen van de verschillende progestagenen komen globaal overeen, al verschillen de frequenties van voorkomen enigszins. Zo wordt kortdurende duizeligheid en slaperigheid 1-4 uur na inname vaker gemeld bij progesteron (zonder vermelding van frequentie van voorkomen); dat is reden om het middel ’s avonds voor het slapen in te nemen. Bij andere progestagenen lijkt deze bijwerking minder vaak voor te komen (KNMP Kennisbank, geraadpleegd juli 2021).
Conclusies
Oestrogeen plus progesteron vergeleken met geen hormoontherapie
- Mogelijk leidt hormoontherapie met oestrogeen en progesteron tot een niet of nauwelijks verhoogd risico op borstkanker bij gebruik < 5 jaar (kwaliteit van bewijs laag); bij gebruik ≥ 5 jaar is het risico onzeker (kwaliteit van bewijs zeer laag).
- Mogelijk leidt hormoontherapie met oestrogeen en progesteron tot een verhoogd risico op endometriumcarcinoom, zowel bij gebruik < 5 jaar als bij gebruik ≥ 5 jaar (kwaliteit van bewijs laag).
- We zijn onzeker over een verschil in coronaire hartziekten, beroerte en VTE (kwaliteit van bewijs zeer laag).
Oestrogeen plus dydrogesteron vergeleken met geen hormoontherapie
- Mogelijk leidt hormoontherapie met oestrogeen en dydrogesteron tot een niet of nauwelijks verhoogd risico op borstkanker bij gebruik < 5 jaar, maar tot een verhoogd risico bij gebruik ≥ 5 jaar (kwaliteit van bewijs laag).
- Mogelijk leidt hormoontherapie met oestrogeen en dydrogesteron tot een niet of nauwelijks verhoogd risico op endometriumcarcinoom bij gebruik < 5 jaar (kwaliteit van bewijs laag); bij gebruik ≥ 5 jaar is het risico onzeker (kwaliteit van bewijs zeer laag).
- We zijn onzeker over een verschil in coronaire hartziekten, beroerte en VTE (kwaliteit van bewijs zeer laag).
Oestrogeen plus medroxyprogesteron vergeleken met geen hormoontherapie
- Mogelijk leidt hormoontherapie met oestrogeen en medroxyprogesteron tot een verhoogd risico op borstkanker, zowel bij gebruik < 5 jaar als bij gebruik ≥ 5 jaar (kwaliteit van bewijs laag).
- Mogelijk leidt hormoontherapie met oestrogeen en medroxyprogesteron tot een niet of nauwelijks verhoogd risico op endometriumcarcinoom bij gebruik < 5 jaar (kwaliteit van bewijs laag); bij gebruik ≥ 5 jaar is het risico onzeker (kwaliteit van bewijs zeer laag).
- We zijn onzeker over een verschil in coronaire hartziekten en beroerte (kwaliteit van bewijs zeer laag).
- Mogelijk leidt hormoontherapie met (oraal) oestrogeen en medroxyprogesteron tot een verhoogd risico op VTE (kwaliteit van bewijs laag).
Oestrogeen plus norethisteron vergeleken met geen hormoontherapie
- Mogelijk leidt hormoontherapie met oestrogeen en norethisteron tot een verhoogd risico op borstkanker, zowel bij gebruik < 5 jaar als bij gebruik ≥ 5 jaar (kwaliteit van bewijs laag).
- Mogelijk leidt hormoontherapie met oestrogeen en continu toegevoegd norethisteron tot een niet of nauwelijks verhoogd risico op endometriumcarcinoom (kwaliteit van bewijs laag); bij gebruik van oestrogeen en sequentieel toegevoegd norethisteron is het risico onzeker (kwaliteit van bewijs zeer laag).
- Mogelijk leidt hormoontherapie met oestrogeen en continu toegevoegd norethisteron tot een verhoogd risico op coronaire hartziekten (kwaliteit van bewijs laag); bij gebruik van oestrogeen en sequentieel toegevoegd norethisteron is het risico mogelijk niet of nauwelijks verhoogd (kwaliteit van bewijs laag).
- Mogelijk leidt hormoontherapie met oestrogeen en norethisteron tot een verhoogd risico op beroerte (kwaliteit van bewijs laag).
- Mogelijk leidt hormoontherapie met (oraal) oestrogeen en norethisteron tot een verhoogd risico op VTE (kwaliteit van bewijs laag).
Oestrogeen plus levonorgestrelspiraal vergeleken met geen hormoontherapie
- Mogelijk leidt hormoontherapie met oestrogeen en levonorgestrelspiraal tot een verhoogd risico op borstkanker, zowel bij gebruik < 5 jaar als bij gebruik ≥ 5 jaar (kwaliteit van bewijs laag).
- We zijn onzeker over een verschil in endometriumcarcinoom (kwaliteit van bewijs zeer laag).
- Coronaire hartziekten, beroerte en VTE zijn niet onderzocht.
Oestrogeen plus drospirenon vergeleken met geen hormoontherapie
Geen onderzoek gevonden.
Oestrogeen plus lynestrenol vergeleken met geen hormoontherapie
Geen onderzoek gevonden.
Progestageen continu of sequentieel
Naar Samenvatting ›- Bij postmenopauzale vrouwen heeft continue (dagelijkse) toediening van progestageen de voorkeur. De eerste maanden is er kans op onregelmatig bloedverlies en spotting, maar doorgaans blijft bloedverlies op termijn achterwege bij continu gebruik.
- Bij perimenopauzale vrouwen geeft sequentiële toediening van progestageen (14 dagen per maand) maandelijks een onttrekkingsbloeding en geeft continue (dagelijkse) toediening van progestageen frequent en langdurig bloedverlies. Daarom ligt sequentiële toediening voor deze groep het meest voor de hand. Overigens is hormoontherapie offlabel bij vrouwen bij wie de laatste menstruatie <6 maanden geleden is.
- Bij vrouwen zonder uterus, maar met endometriose, ongeacht menopauzale status, heeft continue toediening van progestageen de voorkeur.
Bloedverlies bij continue gecombineerde hormoontherapie
Om het risico op endometriumcarcinoom te verminderen is bij vrouwen met uterus toevoeging van een progestageen aan oestrogeen noodzakelijk. Hierbij is keuze tussen sequentiële of continue toediening. Bij continue gecombineerde hormoontherapie zal gemiddeld na 3 tot 8 maanden een atrofisch endometrium ontstaan. Bij 12 tot 22% van de vrouwen die continue combinatietherapie gebruikten trad onregelmatig bloedverlies op bij gebruik gedurende een jaar.
Hormoontherapie bij laatste menstruatie < 6 maanden geleden
- Uit productinformatie van geregistreerde hormoonpreparaten (zoals dydrogesteron/estradiol continu en cyclisch) volgt dat deze zijn onderzocht bij, en geregistreerd voor gebruik door (Geneesmiddeleninformatiebank, geraadpleegd maart 2022):
- vrouwen die ≥ 6 maanden geleden hun laatste menstruatie hebben gehad (in de productinformatie benoemd als ‘vrouwen die tenminste 6 maanden in de menopauze zijn’)
- vrouwen die ≥ 12 maanden geleden hun laatste menstruatie hebben gehad, dat wil zegen postmenopauzale vrouwen
- Hieruit volgt dat hormoontherapie niet is onderzocht bij, en geregistreerd voor gebruik door, perimenopauzale vrouwen bij wie de laatste menstruatie < 6 maanden geleden was. Hormoontherapie is dus offlabel voor deze vrouwen; effectiviteit, veiligheid en bijwerkingen zijn in deze groep niet onderzocht.
- Het is niet bekend of endometriumprotectie bij deze groep vrouwen, die een hoger niveau van eigen aanmaak van oestrogeen hebben dan de hierboven genoemde groepen vrouwen, afdoende is. De werkgroep verwacht niet dat dit in de praktijk de toepassing van hormoontherapie bij deze groep vrouwen in de weg hoeft te staan.
Perimenopauzale vrouwen met anticonceptiewens
Naar Samenvatting ›- Hormoontherapie voor overgangsklachten heeft onvoldoende anticonceptieve werking.
- Bij vasomotorische klachten én anticonceptiewens zijn er 2 opties:
- hormoonspiraal met 52 mg levonorgestrel in combinatie met transdermaal of oraal estradiol
- orale anticonceptie (combinatiepreparaat)
- Houd bij de keuze rekening met contra-indicaties en weeg hierbij het vanwege de leeftijd hogere uitgangsrisico op VTE, borstkanker en hart- en vaatziekten mee (zie NHG-Standaard Anticonceptie).
- Bespreek bij keuze voor orale anticonceptie het algemene advies om op de leeftijd van 52 jaar te stoppen met hormonale anticonceptie (zie NHG-Standaard Anticonceptie). Vanaf deze leeftijd geldt bij aanhoudende vasomotorische klachten het beleid voor postmenopauzale vrouwen (tenzij er nog een cyclus is).
- De werkgroep is van mening dat estradiol in combinatie met een hormoonspiraal overwogen kan worden bij perimenopauzale vrouwen met anticonceptiewens en hinderlijke vasomotorische klachten.
- Dit is een vorm van continue combinatietherapie die langdurig onregelmatig bloedverlies en/of spotting kan geven. Ook is het risico op borstkanker mogelijk verhoogd. Bespreek dit met de vrouw. Het is onbekend in welke mate deze combinatie van oestrogeen en progestageen het risico op VTE en hart- en vaatziekten verhoogt. Gebruik van een hormoonspiraal > 3 jaar anders dan als anticonceptivum (dus als progestageenadjuvans) is in Nederland offlabel. Het advies is (vooralsnog) de hormoonspiraal te vervangen na die termijn.
- Orale anticonceptiva (combinatiepreparaten) kunnen eveneens overwogen worden bij perimenopauzale vrouwen met anticonceptiewens en hinderlijke vasomotorische klachten.
- Bespreek met de vrouw het algemene advies om op de leeftijd van 52 jaar te stoppen met hormonale anticonceptie.
Voor- en nadelen
Estradiol in combinatie met een hormoonspiraal
- Voordelen: de hormoonspiraal met estradiol (oraal of transdermaal) is een vorm van continue combinatietherapie met anticonceptieve werking (zie Hormoontherapie algemeen voor het effect van estradiol op vasomotorische klachten). De combinatie hormoonspiraal en transdermaal estradiol kan eventueel gebruikt worden na een gastric bypass.
- Nadelen: continue combinatietherapie kan langdurig (3-12 maanden) onregelmatig bloedverlies of spotting veroorzaken. Mogelijk verhoogt estradiol in combinatie met een hormoonspiraal als vorm van continue combinatietherapie het risico op borstkanker. Onbekend is in welke mate gebruik van estradiol in combinatie met een hormoonspiraal als vorm van continue combinatietherapie het risico op VTE en hart- en vaatziekten verhoogt. De gebruikstermijn van een hormoonspiraal als progestageenadjuvans > 3 jaar is in Nederland offlabel.
Orale anticonceptie (combinatiepreparaten)
- Voordelen: anticonceptieve werking. Het effect op opvliegers en/of aanvallen van nachtzweten is nauwelijks onderzocht, een gunstig effect is wel aannemelijk. Gebruik leidt in de regel na 3 maanden tot gereguleerd, voorspelbaar bloedverlies.
- Nadelen: mogelijk vasomotorische klachten tijdens de stopweek. Gebruik verhoogt het risico op VTE, hart- en vaatziekten en borstkanker. Bij vrouwen rond de menopauze of bij contra-indicaties is het absolute risico mogelijk groter. Gebruik voor vasomotorische klachten alleen is offlabel. Het continueren van hormonale anticonceptie (combinatiepreparaten) na de leeftijd van 52 jaar voor overgangsklachten alleen wordt ontraden (zie NHG-Standaard Anticonceptie).
Kwaliteit van bewijs
Vergelijkend onderzoek werd niet gevonden. Er is nauwelijks onderzoek gedaan naar estradiol in combinatie met een hormoonspiraal ter behandeling van vasomotorische klachten en naar gebruik van hormonale anticonceptie (combinatiepreparaten) voor deze indicatie.
Waarden en voorkeuren van patiënten
- We verwachten dat de meeste perimenopauzale vrouwen met hinderlijke vasomotorische klachten die een hormoonspiraal gebruiken, behandeling met estradiol (oraal of transdermaal) in overweging willen nemen om minder hinder te hebben.
- We verwachten dat de meeste perimenopauzale vrouwen met hinderlijke opvliegers en/of aanvallen van nachtzweten die anticonceptiewens hebben, behandeling met een oraal anticonceptivum (combinatiepreparaat) in overweging willen nemen om minder hinder te hebben.
Kosten
- De hormoonspiraal kost € 130 voor 3 jaar; hier komen de kosten van estradiol bij.
- Orale anticonceptie (combinatiepreparaat) kost bij benadering € 3-30 per 3 maanden (zie NHG-Standaard Anticonceptie).
Aanvaardbaarheid en haalbaarheid
Estradiol en de hormoonspiraal zijn te verkrijgen via een recept van de huisarts. De hormoonspiraal moet geplaatst worden door de huisarts. Bij ander gebruik dan als anticonceptivum (dus als progestageenadjuvans) moet een hormoonspiraal na 3 jaar vervangen worden.
Orale anticonceptiva (combinatiepreparaten) zijn na een eerste recept van de huisarts te verkrijgen. Er is geen herhaalrecept nodig.
Uitgangsvraag
Is een hormoonspiraal in combinatie met estradiol of orale anticonceptie aan te bevelen aan vrouwen met opvliegers en/of nachtelijke zweetaanvallen en anticonceptiewens? Zie de PICO-tabel.
|
Patiënten |
Vrouwen met opvliegers en/of nachtelijke zweetaanvallen en anticonceptiebehoefte |
|---|---|
|
Interventie |
Hormoonspiraal plus oestrogeen |
|
Vergelijking |
Orale anticonceptie |
|
Uitkomstmaten |
Cruciaal
Belangrijk
|
Achtergrond
- De NHG-Standaard Anticonceptie geeft als algemeen advies om op de leeftijd van 52 jaar te stoppen met hormonale anticonceptie (inclusief hormoonspiraal). Continueren van combinatiepreparaten na de leeftijd van 52 jaar voor overgangsklachten alleen wordt ontraden. Argument tegen voortgezet gebruik is dat niet zeker is of de vrouw daadwerkelijk vasomotorische klachten zal ervaren en hoe ernstig en hinderlijk die zijn.
- Perimenopauzale vrouwen met vasomotorische klachten kunnen naast anticonceptiewens ook hevig menstrueel bloedverlies als reden hebben om hormonale anticonceptie te gebruiken (zie NHG-Standaard Anticonceptie en NHG-Standaard Vaginaal bloedverlies).
- De hormoonspiraal (52 mg levonorgestrel) is geregistreerd als progestageenadjuvans ter voorkoming van endometriumhyperplasie en endometriumcarcinoom bij gebruik van oestrogeen voor opvliegers en/of aanvallen van nachtzweten. In Nederland is de hormoonspiraal als progestageenadjuvans nog niet geregisteerd voor gebruik > 3 jaar. In het Verenigd Koninkrijk is de hormoonspiraal voor deze indicatie geregistreerd voor 4 jaar, maar stelt de richtlijn over anticonceptie bij vrouwen > 40 jaar dat de hormoonspiraal voor endometriumbescherming offlabel tot 5 jaar gebruikt kan worden. De onderbouwing voor dit advies is echter gebaseerd op 4 RCT’s, 1 prospectief cohortonderzoek met een korte follow-up van 1 jaar en 1 klein prospectief cohortonderzoek (n = 40) met een follow-up van 5 jaar.
- De overige anticonceptiemiddelen met alleen progestageen (pil met alleen progestageen, implantatiestaafje en prikpil) zijn niet geregistreerd als progestageenadjuvans.
- Combinatiepreparaten voor orale anticonceptie zijn niet geregistreerd ter behandeling van opvliegers en/of nachtzweten. Het oestrogeen ethinylestradiol in de combinatiepil is krachtiger en werkt minder selectief dan estradiol. Het progestageen levonorgestrel is een sterker werkend progestageen dan dydrogesteron.
- Het is onzeker welke vorm van hormoontherapie aan te bevelen is aan perimenopauzale vrouwen met opvliegers en/of aanvallen van nachtzweten en anticonceptiewens.
Methoden
Er is een systematische literatuurzoekactie naar SR’s en RCT’s uitgevoerd in PubMed in oktober 2020, met een update in september 2021.
Resultaten
Resultaat zoekactie
De zoekactie leverde geen geschikte SR’s of RCT’s op. Daarom heeft de werkgroep aanbevelingen geformuleerd op basis van consensus. Hierbij sluiten we aan bij de NHG-Standaard Anticonceptie en maken we gebruik van de Britse richtlijn Contraception for women aged over 40 years. Zie ook Hormoontherapie algemeen en Type progestageen.
Effectiviteit
- Estradiol in combinatie met een hormoonspiraal: estradiol is effectief voor het verminderen van vasomotorische klachten, zie Hormoontherapie algemeen.
- Orale anticonceptie (combinatiepreparaten): er is weinig onderzoek gedaan naar het effect op (hinder van) vasomotorische klachten. Een gunstig effect is wel aannemelijk. In de stopweek kunnen vasomotorische klachten optreden.
Niet-ernstige bijwerkingen
- Estradiol in combinatie met een hormoonspiraal is een vorm van continue combinatietherapie. Bij perimenopauzale vrouwen kan langdurig (3-12 maanden) onregelmatig bloedverlies of spotting optreden naast andere niet-ernstige bijwerkingen (zie Type progestageen). Bij postmenopauzale vrouwen is langdurig irregulair bloedverlies een indicatie voor endometriumdiagnostiek (zie NVOG-richtlijn Postmenopauzaal bloedverlies). Bij gebruik van een hormoonspiraal is de menopauze echter vaak niet vast te stellen.
- De niet-ernstige bijwerkingen van orale anticonceptie (combinatiepreparaten) worden beschreven in tabel 3 van de NHG-Standaard Anticonceptie.
Ernstige bijwerkingen
- Estradiol in combinatie met een hormoonspiraal: het is onbekend in welke mate gebruik van estradiol in combinatie met een hormoonspiraal het risico op VTE, hart- en vaatziekten en borstkanker verhoogt. Mogelijk is het risico op borstkanker verhoogd vergeleken met geen gebruik van hormoontherapie.
- In tabel 3 van de NHG-Standaard Anticonceptie worden de ernstige bijwerkingen van orale anticonceptie (combinatiepreparaten) beschreven. De kwaliteit van bewijs varieert van zeer laag tot redelijk. Het absolute risico op VTE, ischemische hart- en vaatziekten en borstkanker neemt toe naarmate de vrouw ouder is. Rond de menopauze is de risicotoename relevanter omdat het uitgangsrisico hoger is.
Conclusie
Er is geen onderzoek gevonden waarin estradiol in combinatie met een hormoonspiraal is vergeleken met orale anticonceptie. Er is nauwelijks onderzoek naar ernstige bijwerkingen van estradiol in combinatie met een hormoonspiraal.
Tibolon
Naar Samenvatting ›We bevelen het voorschrijven van tibolon voor overgangsklachten niet aan.
Tibolon lijkt niet effectiever te zijn in het verminderen van overgangsklachten dan hormoontherapie met oestrogeen. Daarnaast lijkt tibolon op de lange termijn ongunstige bijwerkingen te hebben en zich hiermee niet te onderscheiden van hormoontherapie met oestrogeen. We bevelen het voorschrijven van tibolon dan ook niet aan.
Voor- en nadelen
- Er lijkt niet of nauwelijks verschil te zijn in de effectiviteit van tibolon vergeleken met hormoontherapie met oestrogeen, al geeft tibolon mogelijk minder kans op onregelmatig bloedverlies. Ook bij gebruik van tibolon kunnen er ernstige bijwerkingen op de lange termijn optreden, zoals borstkanker en endometriumcarcinoom; deze zijn minder goed onderzocht dan die van hormoontherapie met oestrogeen.
- Voor tibolon gelden dezelfde contra-indicaties als voor hormoontherapie, dus het is niet breder toepasbaar dan hormoontherapie (KNMP Kennisbank, geraadpleegd juli 2020).
Kwaliteit van bewijs
De kwaliteit van bewijs is laag tot zeer laag.
Waarden en voorkeuren van patiënten
Sommige vrouwen willen liever geen hormonen slikken. Tibolon is echter ook een middel met hormonale werking en kan op de lange termijn leiden tot ernstige bijwerkingen die vergelijkbaar zijn met die van oestrogeen. Daarom verwacht de werkgroep dat de meeste vrouwen ook niet voor tibolon zullen kiezen.
Kosten
Tibolon kost ongeveer € 0,57 per dag bij een dosering van 1 dd 2,5mg (Medicijnkosten.nl, geraadpleegd juli 2020).
Aanvaardbaarheid
Medicatie nemen tijdens de overgang is voor veel vrouwen aanvaardbaar. Vanwege het mogelijk optreden van ernstige bijwerkingen en de onzekerheid hierover, zal tibolon echter voor de meeste huisartsen en patiënten niet aanvaardbaar zijn.
Haalbaarheid
Tibolon is goed verkrijgbaar: de haalbaarheid lijkt geen probleem.
Uitgangsvraag
Is tibolon aan te bevelen aan vrouwen met opvliegers en/of nachtelijke zweetaanvallen? Zie de PICO-tabel.
|
Patiënten |
Vrouwen met opvliegers en/of nachtelijke zweetaanvallen |
|---|---|
|
Interventie |
Tibolon |
|
Vergelijking |
Hormoontherapie |
|
Uitkomstmaten |
Cruciaal
Belangrijk
|
Achtergrond
Tibolon werd een aantal jaren geleden in Nederland voorgeschreven als alternatief voor hormoontherapie (met name in tweede lijn). Tibolon is een steroïd met oestrogene, progestagene en androgene activiteit. Later bleken langetermijneffecten mogelijk niet gunstig en onderzoeken met tibolon onder vrouwen met borstkanker zijn voortijdig beëindigd. De NVOG had tibolon als optie staan in haar Praktische handleiding HST (versie 2018), maar in de recente versie van 2020 niet meer. In dit detail worden de effecten van tibolon vergeleken met hormoontherapie. Daarnaast worden ernstige bijwerkingen op de lange termijn beschreven.
Methoden
Er is een systematische literatuurzoekactie naar systematische reviews (SR’s), RCT’s en observationele onderzoeken uitgevoerd in PubMed en Embase in april 2020, met een update in september 2021.
Resultaten
Resultaat zoekactie
De zoekactie leverde 1 SR op van RCT’s met betrekking tot de korte- en langetermijneffecten van tibolon op uitkomsten die aan de overgang gerelateerd zijn.
Een aanvullende zoekactie na de zoekdatum van dit literatuuronderzoek (oktober 2015) leverde geen nieuwe RCT’s op die tibolon met hormoontherapie vergeleken.
Daarnaast zijn de volgende observationele onderzoeken gebruikt: de Clinical Practice Research Datalink,
de IPD-meta-analyse van de Collaborative Group on Hormonal Factors in Breast Cancer,
E3N,
Dahors,
de Million Women Study,
EPIC,
en 2 patiënt-controleonderzoeken genest binnen de totale Finse bevolking.
De update in september 2021 leverde geen nieuwe onderzoeken op.
Onderzoekskarakteristieken
- Formoso 2016: SR van RCT’s (n = 19.976) die oraal tibolon vergeleken met placebo (17 RCT’s), met oestrogeen monotherapie (0,625 mg geconjugeerd oestrogeen of 2-4 mg estriol of 50 microg estradiolpleister; 3 RCT’s) of met gecombineerde hormoontherapie (geconjugeerd oestrogeen 0,625 mg of estradiol 2 mg + norethisteron 0,25-5 mg of medroxyprogesteron 2,5-5 mg; 28 RCT’s). De dosis tibolon was meestal 2,5 mg/dag (range: 0,625-5 mg per dag). De gemiddelde leeftijd van de geïncludeerde vrouwen was 52-55 jaar. De follow-up was 2 weken tot 4 jaar.
- Vinogradova 2019: genest patiënt-controleonderzoek naar de relatie tussen hormoontherapie en VTE binnen 2 Britse databases: de Clinical Practice Research Datalink en QResearch. Geïncludeerd werden vrouwen van 40-79 jaar die tussen 1998 en 2017 geregistreerd waren bij een deelnemende praktijk en die in deze periode een eerste diagnose van VTE hadden. Elke patiënt werd vervolgens gematcht met ≤ 5 controlepersonen. In totaal werden er 80.396 patiënten en 391.494 controlepersonen geïncludeerd.
- Vinogradova 2020: genest patiënt-controleonderzoek naar de relatie tussen hormoontherapie en borstkanker binnen 2 Britse databases: de Clinical Practice Research Datalink en QResearch. Geïncludeerd werden vrouwen van 50-79 jaar die tussen 1998 en 2018 geregistreerd waren bij een deelnemende praktijk en die in deze periode een eerste diagnose van borstkanker hadden. Elke patiënt werd vervolgens gematcht met ≤ 5 controlepersonen. In totaal werden er 98.611 patiënten en 457.498 controlepersonen geïncludeerd.
- Collaborative Group 2019: meta-analyse met individuele patiëntendata (IPD) naar de associatie tussen verschillende regimes en behandelduren van hormoontherapie en borstkanker. Zowel prospectieve als retrospectieve onderzoeken werden geïncludeerd als daarin bij ≥ 1000 deelnemers borstkanker was opgetreden. Geïncludeerd werden 568.859 vrouwen uit 58 onderzoeken (24 prospectieve en 34 retrospectieve). Voor de hoofdanalyses zijn alleen de prospectieve onderzoeken gebruikt (n = 490.994, van wie 108.647 borstkanker ontwikkelden). De gemiddelde leeftijd waarop borstkanker werd gediagnosticeerd was 65 jaar. Er konden geen RCT’s geïncludeerd worden omdat hierin niet genoeg vrouwen met borstkanker waren opgenomen.
- Fournier 2014b: E3N, een Frans prospectief cohortonderzoek met 98.995 vrouwen van 40-65 jaar, waarin het verband tussen diverse risicofactoren, waaronder hormoontherapie, en diverse uitkomsten, waaronder kanker en trombose, werd onderzocht. Ook het risico op borstkanker werd onderzocht. Geïncludeerd werden 78.353 postmenopauzale vrouwen, van wie er 3678 borstkanker ontwikkelden gedurende een follow-up van gemiddeld 10,8 jaar.
- Løkkegaard 2008, Mørch 2016 en Løkkegaard 2017: Danish Sex Hormone Register Study (Dahors), cohortonderzoek waarin alle Deense vrouwen van 15-79 jaar werden geïncludeerd in de periode 1995-2001,
en in de periode 1995-2009.
- Løkkegaard 2008 onderzocht het verband tussen hormoontherapie en myocardinfarct. Geïncludeerd werden 698.098 vrouwen van 51-70 jaar. De vrouwen werden gemiddeld 4,2 jaar gevolgd; in die periode gebruikte 36% een vorm van hormoontherapie en trad bij 4947 deelnemers een myocardinfarct op.
- Mørch 2016 onderzocht het verband tusen hormoontherapie en endometriumcarcinoom. Geïncludeerd werden 914.595 vrouwen van 50-79 jaar (gemiddelde leeftijd ongeveer 63 jaar aan het eind van de follow-up). De gemiddelde follow-up was 9,8 jaar en bij 6202 deelnemers trad endometriumcarcinoom op. De gemiddelde duur van het gebruik van hormoontherapie is niet gerapporteerd, maar 35% van de vrouwen had dit ≥ 10 jaar gebruikt.
- Løkkegaard 2017 onderzocht het verband tussen hormoontherapie en beroerte. Geïncludeerd werden 980.003 vrouwen van 51-70 jaar. De vrouwen werden gemiddeld 7,9 jaar gevolgd; in die periode gebruikte 36,1% een vorm van hormoontherapie en trad bij 20.199 deelnemers een beroerte op.
- Beral 2005 en Sweetland 2012: prospectief cohortonderzoek (Million Women Study) uit het Verenigd Koninkrijk.
- Beral 2005 onderzocht het verband tussen hormoontherapie en endometriumcarcinoom. Tussen 1996 en 2001 werden 716.738 postmenopauzale vrouwen geïncludeerd met een gemiddelde leeftijd van 57 jaar, die gemiddeld 3,4 jaar gevolgd werden (tot december 2002). Bij in totaal 1320 deelnemers trad endometriumcarcinoom op.
- Sweetland 2012 onderzocht het verband tussen hormoontherapie en VTE. Geïncludeerd werden 1.058.259 postmenopauzale vrouwen (gemiddelde leeftijd 56,7 jaar), met een follow-up van gemiddeld 3,1 jaar. Bij in totaal 2200 deelnemers trad een VTE op.
- Allen 2010: in de European Prospective Investigation into Cancer and Nutrition (EPIC) werd het verband tussen hormoontherapie en endometriumcarcinoom onderzocht. Tussen 1992 en 2000 werden 115.474 postmenopauzale vrouwen geïncludeerd uit 8 landen (Denemarken, Frankrijk, Duitsland, Italië, Nederland, Noorwegen, Spanje en het Verenigd Koninkrijk) en met een gemiddelde leeftijd van ongeveer 57 jaar. Na een follow-up van gemiddeld 9 jaar trad bij 601 deelnemers endometriumcarcinoom op. De gemiddelde duur van hormoontherapie was 3,8 jaar.
- Lyytinen 2010: Fins patiënt-controleonderzoek naar het verband tussen hormoontherapie en borstkanker, genest binnen de totale Finse bevolking. Geïncludeerd werden alle Finse vrouwen van 50-62 jaar die met borstkanker waren gediagnosticeerd tussen 1995 en 2007 (n = 9956). Elke patiënt werd gematcht met 3 controlepersonen uit het Finse bevolkingsregister (n = 29.868).
- Jaakkola 2011: Fins patiënt-controleonderzoek naar het verband tussen hormoontherapie en endometriumcarcinoom, genest binnen de totale Finse bevolking. Geïncludeerd werden alle Finse vrouwen van 50-80 jaar die met endometriumcarcinoom waren gediagnosticeerd tussen 1995 en 2007 (n = 7261). Elke patiënt werd gematcht met 3 controlepersonen uit het Finse bevolkingsregister (n = 21.783).
Effectiviteit en bijwerkingen
- Zie tabel Tibolon vergeleken met hormoontherapie voor de resultaten van RCT’s waarin tibolon met gecombineerde hormoontherapie werd vergeleken. Er waren geen onderzoeken beschikbaar met de uitkomstmaten ‘kwaliteit van leven’, ‘stemming’ en ‘spier- en gewrichtsklachten’.
- Zie tabel Ernstige bijwerkingen van tibolon voor de ernstige bijwerkingen uit observationeel onderzoek (tibolon vergeleken met geen hormoontherapie).
Conclusies
Tibolon vergeleken met gecombineerde hormoontherapie
- Er is mogelijk niet of nauwelijks verschil in opvliegers tussen tibolon en hormoontherapie (kwaliteit van bewijs laag).
- Er is mogelijk niet of nauwelijks verschil in seksuele klachten tussen tibolon en hormoontherapie (kwaliteit van bewijs laag).
- Tibolon geeft mogelijk minder onregelmatig bloedverlies dan hormoontherapie (kwaliteit van bewijs laag).
- We zijn onzeker over het effect van tibolon op borstkanker, endometriumhyperplasie en -carcinoom, VTE, coronaire hartziekten en beroerte (kwaliteit van bewijs zeer laag).
- Er waren geen onderzoeken beschikbaar met de uitkomstmaten kwaliteit van leven, stemming en spier- en gewrichtsklachten.
Ernstige bijwerkingen van tibolon vergeleken met geen hormoontherapie
- Mogelijk leidt tibolon tot verhoogd risico op borstkanker bij gebruik ≥ 5 jaar (kwaliteit van bewijs laag); bij gebruik < 5 jaar is het risico onzeker (kwaliteit van bewijs zeer laag).
- Mogelijk leidt tibolon tot een verhoogd risico op endometriumcarcinoom (kwaliteit van bewijs laag).
- We zijn onzeker over een verschil in coronaire hartziekten en beroerte (kwaliteit van bewijs zeer laag).
- Mogelijk leidt tibolon tot een niet of nauwelijks verhoogd risico op VTE (kwaliteit van bewijs laag).
Hormoontherapie, praktische uitwerking
Naar Samenvatting ›Bovenstaande adviezen om te komen tot een behandelkeuze zijn in tabel 3 uitgewerkt tot middelen en doseringen per patiëntengroep.
|
Perimenopauzaal, geen anticonceptiewens |
Combinatietherapie estradiol met progestageen sequentieel (onttrekkingsbloeding maandelijks) |
|
|---|---|---|
|
Estradiol oraal |
Combinatiepreparaat (kalenderverpakking met 14 tabletten met estradiol 1 mg en 14 tabletten met estradiol 1 mg + dydrogesteron 10 mg): 1 dd 1 tablet |
|
|
Tweede keuze: estradiol tablet 1 dd 1 mg + gedurende 14 opeenvolgende dagen per maand progesteron tablet 100 mg 1 dd 2 voor de nacht |
||
|
Estradiol transdermaal |
Estradiol pleister 50 microg/24 uur 2 x per week vervangen*+ gedurende 14 opeenvolgende dagen per maand dydrogesteron tablet 1 dd 10 mg |
|
|
Tweede keuze: estradiol pleister 50 microg/24 uur 2 × per week vervangen*+ gedurende 14 opeenvolgende dagen per maand progesteron tablet 100 mg 1 dd 2 voor de nacht |
||
|
Combinatietherapie estradiol met hormoonspiraal (bij gelijktijdige klachten van hevig bloedverlies) |
||
|
Zie Perimenopauzaal met anticonceptiewens |
||
|
Perimenopauzaal met anticonceptiewens |
Combinatietherapie estradiol met hormoonspiraal |
|
|
Estradiol oraal |
Estradiol tablet 1 dd 1 mg + hormoonspiraal 52 mg levonorgestrel† |
|
|
Estradiol transdermaal |
Estradiol pleister 50 microg/24 uur, 2 × per week vervangen* + hormoonspiraal 52 mg levonorgestrel† |
|
|
Orale anticonceptie (combinatiepreparaat)‡ |
||
|
Zie NHG-Standaard Anticonceptie voor voorkeursmiddelen |
||
|
Postmenopauzaal |
Combinatietherapie estradiol met progestageen continu (bloedverlies op termijn afwezig) |
|
|
Estradiol oraal |
Combinatiepreparaat met estradiol 1 mg + dydrogesteron 5 mg: 1dd 1 tablet |
|
|
Tweede keuze: estradiol tablet 1 dd 1 mg + progesteron tablet 100 mg 1 dd 1 voor de nacht |
||
|
Optie lage dosering:§ combinatiepreparaat met estradiol 0,5 mg + dydrogesteron 2,5 mg: 1 dd 1 tablet |
||
|
Estradiol transdermaal |
Estradiol pleister 50 microg/24 uur, 2 × per week vervangen*+ dydrogesteron tablet 1 dd 10 mg |
|
|
Tweede keuze: estradiol pleister 50 microg/24 uur, 2 × per week vervangen*+ progesteron tablet 100 mg 1 dd 1 voor de nacht |
||
|
Optie lage dosering:§ estradiol pleister 25 microg/24 uur (= halve pleister, offlabel), 2 × per week vervangen* + dydrogesteron tablet 1 dd 10 mg |
||
|
Na uterusextirpatie (zonder endometriose) |
Monotherapie estradiol |
|
|
Estradiol oraal |
Estradiol tablet 1 dd 1 mg |
|
|
Estradiol transdermaal |
Estradiol pleister 50 microg/24 uur, 2 × per week vervangen* |
|
|
Na uterusextirpatie (met endometriose) |
Combinatietherapie estradiol met progestageen continu |
|
| Zie Postmenopauzaal | ||
|
* Pleister op droge, onbeschadigde huid plakken: buik, bovenbeen, bil, lage rugstreek, niet borsten. Toedieningsplaats afwisselen. Pleister mag nat worden, tijdens douchen, baden. Huiddeel met pleister niet blootstellen aan direct zonlicht. † Gebruikstermijn voor deze indicatie 3 jaar. Zie NHG-Standaard Anticonceptie voor meer informatie over de hormoonspiraal. ‡ Houd rekening met contra-indicaties en weeg hierbij het vanwege de leeftijd hogere uitgangsrisico op VTE, borstkanker en hart- en vaatziekten mee (zie NHG-Standaard Anticonceptie). Bespreek bij keuze voor orale anticonceptie het algemene advies om op de leeftijd van 52 jaar te stoppen met hormonale anticonceptie. Vanaf deze leeftijd geldt bij aanhoudende vasomotorische klachten het beleid voor postmenopauzale vrouwen (tenzij er nog een cyclus is). § Als de vrouw hierom vraagt. |
||
Niet-hormonale behandeling
Naar Samenvatting ›Clonidine
Naar Samenvatting ›- Wees terughoudend met het voorschrijven van clonidine voor overgangsklachten. Overweeg clonidine alleen bij vrouwen met een contra-indicatie voor hormoontherapie.
- Bespreek de voor- en nadelen met de vrouw:
- het effect op vasomotorische klachten is beperkt; vergeleken met placebo is het verschil ongeveer 1 opvlieger per dag.
- veelvoorkomende bijwerkingen zijn slaapproblemen, angstsymptomen, orthostatische hypotensie, duizeligheid, droge mond, hoofdpijn, misselijkheid en braken.
- bij plotseling staken van het gebruik is er een risico op een reboundeffect met onder andere bloeddrukstijging, hartkloppingen en rusteloosheid.
- clonidine heeft een licht tot matig negatieve invloed op de rijvaardigheid. De eerste dagen van gebruik is autorijden niet toegestaan.
- Behandeling:
- start met clonidine tablet 2 dd 0,05-0,075 mg
- evalueer het effect na 4 weken, stop bij onvoldoende effect en/of bijwerkingen
- bouw bij stoppen de dosering in enkele dagen af, bijvoorbeeld 2 dd 0,025 mg en vervolgens 1 dd 0,025 mg
- Gebruik van clonidine kan mogelijk zorgen voor minder (ernstige) opvliegers. Het verschil ten opzichte van placebo is echter klein en mogelijk niet klinisch relevant. Daarnaast is de kwaliteit van het bewijs laag.
- De huisarts dient de voor- en nadelen van het gebruiken van clonidine af te wegen met de vrouw. Er zijn mogelijk meer bijwerkingen, zoals angstsymptomen, slaapproblemen, duizeligheid, droge mond, misselijkheid en braken. Over cardiovasculaire bijwerkingen is op basis van het bewijs moeilijk uitspraak te doen door de zeer lage kwaliteit van bewijs.
- Aangezien clonidine een centraal werkend antihypertensivum is, valt verlaging van de bloeddruk te verwachten.
- Dit alles leidt tot een zwakke aanbeveling tegen clonidine voor overgangsklachten. Alleen bij een contra-indicatie voor hormoontherapie is clonidine te overwegen.
Voor- en nadelen
- Voordeel: clonidine lijkt voor minder (ernstige) opvliegers te zorgen dan placebo, al is het effect mogelijk niet klinisch relevant. In de clonidinegroep nam het aantal opvliegers per dag af met ongeveer 2, terwijl dit in de placebogroepen met ongeveer 1 afnam (bij aanvang 6 per dag). Omdat clonidine een centraal werkend antihypertensivum is, verlaagt het de bloeddruk.
- Nadeel: clonidine geeft mogelijk bijwerkingen, zoals slaapproblemen, angstsymptomen, duizeligheid, droge mond, hoofdpijn, misselijkheid en braken. Clonidine heeft een licht tot matig negatieve invloed op de rijvaardigheid. De eerste week dat een patiënt clonidine gebruikt, mag deze niet autorijden.
Kwaliteit van bewijs
De kwaliteit van bewijs is over het algemeen laag.
Waarden en voorkeuren van patiënten
Vrouwen willen graag van hun klachten af en zijn bereid daarvoor medicatie te nemen, liefst met zo min mogelijk bijwerkingen. Vrouwen met een contra-indicatie voor hormoontherapie zullen wellicht bereid zijn een iets minder effectief middel te proberen om hun klachten te verminderen.
Kosten
Clonidine kost ongeveer € 0,35 per dag bij een dosering van 2 dd 0,05 mg (Medicijnkosten.nl, geraadpleegd juli 2020).
Aanvaardbaarheid
Het lijkt algemeen aanvaard om medicatie voor te schrijven bij overgangsklachten. Omdat clonidine echter slechts een bescheiden effect heeft en er onzekerheid is over bijwerkingen is dit middel eigenlijk alleen aanvaardbaar voor vrouwen die een contra-indicatie voor hormoontherapie hebben.
Haalbaarheid
Het gebruiken van deze medicatie lijkt haalbaar.
Uitgangsvraag
Is clonidine aan te bevelen aan vrouwen met opvliegers en/of nachtelijke zweetaanvallen, die geen hormoontherapie willen of daarvoor een contra-indicatie hebben? Zie de PICO-tabel.
|
Patiënten |
Vrouwen met opvliegers en/of nachtelijke zweetaanvallen |
|---|---|
|
Interventie |
Clonidine |
|
Vergelijking |
Placebo |
|
Uitkomstmaten |
Cruciaal
Belangrijk
|
Achtergrond
Clonidine is een centraal werkend antihypertensivum. Clonidine is het enige antihypertensivum dat voor de indicatie opvliegers is geregistreerd. Het is de vraag of dit aan te bevelen is aan vrouwen met opvliegers die een contra-indicatie voor hormoontherapie hebben, of om een andere reden geen hormoontherapie willen of kunnen gebruiken.
Methoden
Er is een systematische literatuurzoekactie naar systematische reviews (SR’s) en RCT’s uitgevoerd in PubMed in april 2020, met een update in september 2021.
Resultaten
Resultaat zoekactie
De zoekactie leverde een SR op naar het effect van niet-hormonale interventies, waaronder oraal clonidine, op uitkomsten gerelateerd aan de overgang. Daarnaast nemen we een SR over cardiovasculaire bijwerkingen mee. Na de zoekdatum van de SR van L’Espérance (december 2011) werd er één nieuwe RCT gevonden. De update leverde geen nieuwe RCT’s op.
Onderzoekskarakteristieken
- L’Espérance 2013 includeerde 2 RCT’s bij vrouwen die borstkanker hebben (gehad) (n = 259; gemiddelde leeftijd 52 jaar; gemiddelde opvliegerscore 16) waarin clonidine (0,1 mg per dag) vergeleken werd met placebo gedurende 8 of 12 weken. Uitkomstmaten waren frequentie en/of score van opvliegers (combinatie van aantal en ernst van opvliegers), kwaliteit van leven en bijwerkingen.
- Mareti 2019 includeerde onderzoeken (niet verder gespecificeerd) naar niet-hormonale behandelingen tijdens de menopauze en cardiovasculair risico. Daarbij was 1 RCT over clonidinegebruik tijdens de menopauze bij vrouwen zonder borstkanker in de voorgeschiedenis (n = 28).
- Sassarini 2012: RCT bij vrouwen met opvliegers zonder borstkanker in de voorgeschiedenis (n = 32; gemiddeld 56 jaar; gemiddeld 6 opvliegers per dag; gemiddelde opvliegerscore 12). Deelnemers kregen óf clonidine (0,1 mg per dag) óf placebo gedurende 4 weken. Uitkomstmaten waren onder andere het aantal opvliegers per dag en opvliegerscore.
Effectiviteit en bijwerkingen
Zie tabel Clonidine vergeleken met placebo voor de samenvatting van de resultaten.
Er werden geen onderzoeken gevonden met de uitkomstmaten ‘stemming’, ‘spier- en gewrichtsklachten’ en ‘onregelmatig vaginaal bloedverlies’. Ook werden geen onderzoeken gevonden die clonidine met hormoontherapie vergeleken.
Naast de bijwerkingen die in de onderzoeken werden gevonden (angstsymptomen en slaapstoornissen) komen duizeligheid, sedatie, orthostatische hypotensie en droge mond (> 10%) en depressie, hoofdpijn, misselijkheid, braken, obstipatie, pijn in de speekselklieren (1-10%) vaak voor.
Clonidine heeft een licht tot matig negatieve invloed op de rijvaardigheid. De eerste week dat een patiënt clonidine gebruikt, mag deze niet autorijden (Rij veilig met medicijnen.nl, geraadpleegd juli 2021).
Conclusies
- Clonidine verlaagt mogelijk de frequentie en hinder van opvliegers meer dan placebo (kwaliteit van bewijs laag).
- Clonidine verandert de kwaliteit van leven mogelijk niet (kwaliteit van bewijs laag).
- Clonidine geeft mogelijk meer bijwerkingen dan placebo (kwaliteit van bewijs laag).
- We zijn onzeker over cardiovasculaire bijwerkingen van clonidine zoals bloeddrukdaling (kwaliteit van bewijs zeer laag), maar omdat clonidine een antihypertensivum is, is te verwachten dat het de bloeddruk verlaagt.
- Er is geen onderzoek gedaan naar stemming, spier- en gewrichtsklachten en onregelmatig vaginaal bloedverlies.
Antidepressiva
Naar Samenvatting ›We bevelen het voorschrijven van antidepressiva voor overgangsklachten niet aan.
- SSRI’s of SNRI’s zijn waarschijnlijk niet of nauwelijks beter dan placebo in het verminderen van aantal en ernst van de opvliegers, al hebben ze mogelijk een positief effect op stemmingsklachten. Daarnaast kunnen antidepressiva bijwerkingen veroorzaken, waaronder ook opvliegers en transpireren.
- Bovendien zijn antidepressiva niet geregistreerd (offlabel) voor alleen overgangsklachten en kunnen er problemen ontstaan met afbouwen.
- Door deze argumenten worden antidepressiva bij overgangsklachten niet aanbevolen.
Voor- en nadelen
Antidepressiva (SSRI’s en SNRI’s) verminderen het aantal en de hinder van opvliegers waarschijnlijk niet klinisch relevant, maar hebben mogelijk wel een positieve invloed op de stemming. De hulpvraag is echter meestal vermindering van opvliegers. Er kunnen wel bijwerkingen optreden en na langdurig gebruik kunnen er problemen met afbouwen ontstaan.
Kwaliteit van bewijs
De kwaliteit van bewijs is redelijk tot zeer laag.
Waarden en voorkeuren van patiënten
Sommige vrouwen willen liever geen hormonen gebruiken of hebben een contra-indicatie en kiezen daarom voor een niet-hormonaal middel. Andere vrouwen hebben geen voorkeur. Vanwege het onzekere effect op overgangsklachten en mogelijke bijwerkingen verwacht de werkgroep echter dat de meeste vrouwen niet voor SSRI’s of SNRI’s zullen kiezen.
Kosten
De kosten voor de verschillende SSRI’s of SNRI’s variëren van enkele centen tot € 1 per dag (Medicijnkosten.nl, geraadpleegd oktober 2020).
Aanvaardbaarheid
Afhankelijk van de mate van overgangsklachten kan medicatie voor vrouwen aanvaardbaar zijn. Antidepressiva zijn echter niet geregistreerd voor de indicatie ‘overgangsklachten’, daarom is het voorschrijven voor deze indicatie niet aanvaardbaar voor de meeste huisartsen. Daarnaast wordt de aanvaardbaarheid beperkt door het onzekere effect, mogelijke bijwerkingen en te verwachten problemen met afbouwen na langdurig gebruik.
Haalbaarheid
Antidepressiva zijn goed verkrijgbaar: de haalbaarheid lijkt geen probleem.
Uitgangsvraag
Zijn antidepressiva (selectieve serotonineheropnameremmers (SSRI’s) en serotonine-norepinefrineheropnameremmers (SNRI’s)) aan te bevelen aan vrouwen met opvliegers en/of nachtelijke zweetaanvallen die geen hormoontherapie willen of een contra-indicatie hebben? Zie de PICO-tabel.
|
Patiënten |
Vrouwen met opvliegers en/of nachtelijke zweetaanvallen |
|---|---|
|
Interventie |
Antidepressiva (SSRI’s, SNRI’s) |
|
Vergelijking |
|
|
Uitkomstmaten |
Cruciaal
Belangrijk
|
Achtergrond
Hoewel het werkingsmechanisme onbekend is, zijn er aanwijzingen dat antidepressiva (SSRI’s en SNRI’s) een gunstig effect kunnen hebben op overgangsklachten, zoals opvliegers en stemmingsklachten.
Methoden
Er is een systematische literatuurzoekactie naar systematische reviews (SR’s) en RCT’s uitgevoerd in PubMed en Embase in juni 2020, met een update in september 2021.
Resultaten
Resultaat zoekactie
De zoekactie leverde een SR op met netwerkmeta-analyse naar de effecten van verschillende behandelingen voor overgangsklachten. Een aanvullende zoekactie na de zoekdatum van dit literatuuronderzoek (januari 2014) leverde 3 aanvullende RCT’s op.
Onderzoekskarakteristieken
- Grant 2015: SR met 283 trials (n = 53.000) over welke behandeling het effectiefst en het veiligst is bij klachten gerelateerd aan natuurlijke of chirurgisch geïnduceerde overgang. Daaronder waren 16 RCT’s (n = 7017; gemiddelde leeftijd 52,2-56,2 jaar) waarin het effect van 4-52 weken antidepressiva werd vergeleken met placebo. De vergelijkingen betroffen de SSRI’s fluoxetine (10-30 mg per dag, 1 RCT), citalopram (10-40 mg per dag, 2 RCT’s), escitalopram (10-20 mg per dag, 2 RCT’s), paroxetine (7,5-25 mg per dag, 3 RCT’s) en sertraline (50 mg per dag, 1 RCT), en de SNRI’s venlafaxine (75 mg per dag, 1 RCT) en desvenlafaxine (50-200 mg per dag, meestal 100 mg, 7 RCT’s). In 2 onderzoeken werden alleen vrouwen met uterus geïncludeerd, de overige hadden een gemengde populatie (59,5-81,7% met uterus).
- De resultaten uit de recentere RCT’s zijn in overeenstemming met de resultaten uit de netwerkmeta-analyse en zijn daarom niet apart beschreven.
- Onderzoeken die antidepressiva direct met hormoontherapie vergeleken waren er niet.
Effectiviteit en bijwerkingen
Zie tabel Antidepressiva vergeleken met placebo voor de samenvatting van de resultaten.
De bijwerkingen op de lange termijn van antidepressiva bij overgangsklachten zijn niet of nauwelijks onderzocht. Volgens de KNMP zijn de meest voorkomende bekende bijwerkingen van SSRI’s en SNRI’s op de korte termijn: slapeloosheid, duizeligheid, hoofdpijn, droge mond, sedatie, misselijkheid, obstipatie, (nachtelijke) transpiratie, opvliegers, hartkloppingen, diarree, vermoeidheid en seksuele disfunctie (KNMP Kennisbank, geraadpleegd oktober 2020).
Bij gelijktijdig gebruik met een ander middel met serotonerge werking geldt een contra-indicatie vanwege risico op het potentieel dodelijke serotoninesyndroom. Daarnaast remmen SSRI’s en SNRI’s CYP2D6 en daarom wordt gelijktijdig gebruik met tamoxifen afgeraden.
Conclusies
Antidepressiva vergeleken met placebo:
- Er is waarschijnlijk niet of nauwelijks verschil in aantal en hinder van opvliegers (kwaliteit van bewijs redelijk).
- Antidepressiva verminderen depressieve symptomen mogelijk (kwaliteit van bewijs laag).
- We zijn onzeker over een verschil in kwaliteit van leven en seksueel functioneren (kwaliteit van bewijs zeer laag).
- Het effect op spier- en gewrichtsklachten en bijwerkingen is niet onderzocht.
Gabapentine
Naar Samenvatting ›We bevelen het voorschrijven van gabapentine voor overgangsklachten niet aan.
- Gabapentine is mogelijk niet of nauwelijks beter dan placebo in het verminderen van vasomotorische symptomen. Daarnaast kan gabapentine bijwerkingen veroorzaken. Op de korte termijn zijn dat onder andere duizeligheid, vermoeidheid, slaperigheid en misselijkheid; op de lange termijn is het niet bekend.
- Bovendien is gabapentine niet geregistreerd (offlabel) voor overgangsklachten.
- Dit leidt tot een sterke aanbeveling tegen het gebruik van gabapentine voor overgangsklachten, ook als er een contra-indicatie voor hormoontherapie is.
Voor- en nadelen
- Gabapentine vermindert vasomotorische symptomen mogelijk niet of nauwelijks. Daarnaast zijn de bijwerkingen van gabapentine op de lange termijn niet of nauwelijks onderzocht. De meest genoemde bijwerkingen van gabapentine op de korte termijn zijn duizeligheid, vermoeidheid, slaperigheid en misselijkheid.
- Gabapentine heeft een licht tot matig negatieve invloed op de rijvaardigheid. De eerste week dat een patiënt gabapentine gebruikt, mag deze niet autorijden.
Kwaliteit van bewijs
De kwaliteit van bewijs is laag tot zeer laag.
Waarden en voorkeuren van patiënten
Sommige vrouwen willen liever geen hormonen slikken of hebben een contra-indicatie en kiezen daarom voor een niet-hormonaal middel, andere vrouwen hebben geen voorkeur voor een bepaald middel. Vanwege het onzekere effect op overgangsklachten en mogelijke bijwerkingen verwacht de werkgroep echter dat de meeste vrouwen niet voor gabapentine zullen kiezen.
Kosten
De kosten van gabapentine 800 mg (deze dosering zit het dichtst bij de meest gebruikte dosering in de onderzoeken) zijn € 0,33-1,08 per dag. De kosten van gabapentine 300 mg 3 dd zijn € 0,90-3,90 per dag (Medicijnkosten.nl, geraadpleegd november 2020).
Aanvaardbaarheid
Medicatie nemen tijdens de overgang is voor de meeste vrouwen aanvaardbaar. Gabapentine is echter niet geregistreerd voor de indicatie ‘overgangsklachten’, waardoor het voor sommige huisartsen niet aanvaardbaar is om het voor deze indicatie (offlabel) voor te schrijven. Daarnaast wordt de aanvaardbaarheid beperkt door het onzekere effect en mogelijke bijwerkingen.
Haalbaarheid
Gabapentine is goed verkrijgbaar: de haalbaarheid lijkt geen probleem.
Uitgangsvraag
Is gabapentine aan te bevelen aan vrouwen met opvliegers en/of nachtelijke zweetaanvallen (die geen hormoontherapie willen of een contra-indicatie hebben)? Zie de PICO-tabel.
|
Patiënten |
Vrouwen met opvliegers en/of nachtelijke zweetaanvallen |
|---|---|
|
Interventie |
Gabapentine |
|
Vergelijking |
|
|
Uitkomstmaten |
Cruciaal
Belangrijk
|
Achtergrond
Hoewel het werkingsmechanisme onbekend is, zijn er aanwijzingen dat gabapentine een gunstig effect kan hebben op overgangsklachten, zoals opvliegers en stemmingsklachten.
Methoden
Er is een systematische literatuurzoekactie naar systematische reviews (SR’s) en RCT’s uitgevoerd in PubMed en Embase in juni 2020, met een update in september 2021.
Resultaten
Resultaat zoekactie
De zoekactie leverde 1 SR met meta-analyse op naar de effecten van gabapentine en pregabaline op overgangsklachten.
Een aanvullende search na de zoekdatum van dit literatuuronderzoek (juni 2019) leverde geen aanvullende RCT’s op. Ook de update in september 2021 leverde geen nieuwe RCT’s op.
Omdat de SR van Shan et al. de uitkomstmaat ‘stemming’ niet had gepoold, is voor deze uitkomstmaat gebruik gemaakt van een oudere review.
De nieuwere RCT’s die in de SR van Shan zijn geïncludeerd hadden stemming niet hadden onderzocht, dus de resultaten uit Grant voor deze uitkomstmaat zijn nog actueel.
Onderzoekskarakteristieken
In de SR werden 21 RCT’s (n = 3519) geïncludeerd, waarvan 14 (n = 2921) in deze resultaten zijn meegenomen; 11 RCT’s (n = 2721) daarvan vergeleken gabapentine met placebo, 1 (n = 61) met vitamine E (dit onderzoek is gepoold met de placebogecontroleerde onderzoeken) en 3 (n = 199) met oestrogenen (waarvan 1 ook placebogecontroleerd): tweemaal geconjugeerd oestrogeen in een dosering van 0,625 mg/dag en eenmaal transdermaal estradiol in een dosering van 25 microg/dag. Gabapentine werd het meest voorgeschreven in een dosering van 900 mg/dag (range 100 tot 3000 mg/dag). De behandelduur was 4-24 weken, waarbij 12 weken het meest voorkwam. De gemiddelde leeftijd van de deelnemers was 49-56 jaar. In 3 RCT’s werden vrouwen geïncludeerd met overgangsklachten die veroorzaakt werden door behandeling voor borstkanker, in de overige met natuurlijke overgang.
Effectiviteit en bijwerkingen
Zie tabellen Gabapentine vergeleken met placebo en Gabapentine vergeleken met oestrogeen voor de samenvatting van de resultaten.
De uitkomsten ‘kwaliteit van leven’, ‘seksuele klachten’ en ‘spier- en gewrichtsklachten’ zijn niet onderzocht. ‘Stemming’ is niet onderzocht in de vergelijking tussen gabapentine en oestrogeen.
Gabapentine heeft een licht tot matig negatieve invloed op de rijvaardigheid. De eerste week dat een vrouw gabapentine gebruikt, mag ze niet autorijden (Rijveiligmetmedicijnen.nl, geraadpleegd juli 2021).
Conclusies
Vergelijking gabapentine met placebo
- Er is mogelijk niet of nauwelijks verschil in aantal en ernst van opvliegers (kwaliteit van bewijs laag).
- Bij gebruik van gabapentine stoppen mogelijk meer personen met medicatie dan bij gebruik van placebo (kwaliteit van bewijs laag). Bijwerkingen die voorkomen, zijn duizeligheid, vermoeidheid, slaperigheid en misselijkheid.
- We zijn onzeker over een verschil in stemming (kwaliteit van bewijs zeer laag).
- Kwaliteit van leven, seksuele klachten en spier- en gewrichtsklachten zijn niet onderzocht.
Vergelijking gabapentine met oestrogeen
- We zijn onzeker over een verschil in aantal en ernst van opvliegers en bijwerkingen (kwaliteit van bewijs zeer laag).
- Kwaliteit van leven, stemming, seksuele klachten en spier- en gewrichtsklachten zijn niet onderzocht.
Vaginale klachten
Naar Samenvatting ›- Bij klachten van vaginale atrofie kunnen zowel indifferente middelen (vochtinbrengende gel, crème met hyaluronzuur) als vaginaal oestrogeen overwogen worden.
- Indifferente middelen geven een directe, maar kortdurende klachtenvermindering.
- Bij vaginaal oestrogeen kan het tot 2 maanden duren voordat het effect optimaal is. Vaginaal oestrogeen kan de eerste dagen een branderig gevoel veroorzaken.
Bij keuze voor vaginaal oestrogeen
- Er zijn 2 gelijkwaardige keuzes:
- estriol vaginale ovules of crème 1 dd 0,5 mg gedurende 2 weken. Ga daarna over op 2 × per week 0,5 mg.
- estradiol tablet voor vaginaal gebruik 1 dd 10 microg. Bouw na 2 weken af tot maximaal 10 microgram 2 × per week.
- Instrueer de vrouw contact op te nemen bij vaginaal bloedverlies.
- De contra-indicaties voor vaginale oestrogenen zijn dezelfde als voor systemische oestrogenen (zie Medicamenteuze behandeling, hormoontherapie algemeen, vrouwen met risicofactoren). Er is echter geen bewijs dat vaginale oestrogenen bij gebruik < 10 jaar meer kans op borstkanker geven. Voor VTE en HVZ is dit onbekend. Bespreek dit met de patiënt.
Onregelmatig vaginaal bloedverlies
Voor de behandeling van onregelmatig vaginaal bloedverlies, zie NHG-Standaard Vaginaal bloedverlies.
Zowel vaginale oestrogenen als indifferente middelen (zoals vochtinbrengende gel, crème met hyaluronzuur) leiden tot een vermindering van klachten van vaginale atrofie. Bij beide zijn we onzeker over de bijwerkingen, maar op theoretische gronden is niet te verwachten dat er ernstige bijwerkingen optreden.
Voor- en nadelen
- Het voordeel van oestrogeentherapie is dat deze mogelijk bij een groter percentage van de vrouwen (ongeveer 80-90%) leidt tot subjectieve verbetering van de vaginale klachten dan placebo of niet-hormonale therapie. Het percentage vrouwen dat een verbetering aangeeft varieert echter aanzienlijk tussen de groepen die geen hormonale therapie kregen: van ongeveer 30% bij vaginale placebotabletten tot ongeveer 60-80% voor de verschillende vaginale crèmes en gels (placebo, met hyaluronzuur of vochtinbrengend). Dit betreft klachten zoals een schrijnend gevoel. Behandeling van vaginale atrofie heeft geen effect op seksuele klachten. Bij indifferente middelen is er een directe, maar kortdurende klachtenvermindering. Bij vaginale oestrogenen kan het tot 2 maanden duren voordat het effect optimaal is.
- Over de nadelen zijn we onzeker, maar er zijn geen aanwijzingen dat het risico op borstkanker na langdurig gebruik verhoogd is. Overige bijwerkingen zijn niet goed onderzocht, maar in de meeste onderzoeken kwamen op de korte termijn (8-12 weken, voor sommige onderzoeken 52 weken) alleen lichte bijwerkingen voor in beide groepen. Vaginaal toegediende oestrogenen kunnen de eerste nachten van het gebruik een pijnlijk en branderig gevoel geven. In 1 onderzoek werd na 1 jaar gebruik geen verschil in endometriumdikte gevonden tussen oestrogeentabletten en placebotabletten. Geen enkel onderzoek keek naar het optreden van bijwerkingen over een periode > 1 jaar. Omdat vaginaal toegediende oestrogenen bij de gebruikelijke doseringen en toedieningsvormen niet tot suprafysiologische spiegels leiden (≤ 120 pmol/l) is er op theoretische gronden weinig reden om aan te nemen dat de veiligheid in het geding is (CBG. Geneesmiddeleninformatiebank, geraadpleegd 23-2-2023).
Kwaliteit van bewijs
De kwaliteit van bewijs is over het algemeen laag.
Waarden en voorkeuren van patiënten
De werkgroep schat in dat veel vrouwen voorkeur hebben voor een middel zonder hormonen en daarom liever een indifferent middel gebruiken, zoals hyaluronzuur of een vochtinbrengende gel. Als dit onvoldoende helpt, kan alsnog een vaginaal oestrogeen geprobeerd worden.
Vaginale oestrogenen worden vergoed, indifferente middelen niet. Voor sommige vrouwen kan dat een drempel zijn om een indifferent middel te gebruiken.
Kosten
Geen bijzonderheden.
Aanvaardbaarheid
Zowel lokale toepassing van oestrogenen (als crème, ovule of tablet) als indifferente crème of gel is aanvaardbaar voor huisartsen en patiënten. Voor vaginale oestrogenen gelden dezelfde contra-indicaties als voor systemisch toegediende oestrogenen, zoals eerder vastgestelde hormoonafhankelijke tumoren zoals mammacarcinoom, of eerder vastgestelde VTE of HVZ. Uit de in dit detail beschreven onderzoeken en SmPC-tekst blijkt echter dat er geen bewijs is voor toename van het risico op mammacarcinoom door vaginaal oestrogeen. Verder zijn alleen voor systemische oestrogenen verhoogde risico’s gevonden op VTE en HVZ. Over vaginale oestrogenen wordt niets vermeld in de SmPC-tekst (CBG. Geneesmiddeleninformatiebank, geraadpleegd 23-2-2023).
Haalbaarheid
Geen bijzonderheden, alle middelen zijn goed verkrijgbaar in Nederland.
Uitgangsvraag
Is vaginaal oestrogeen (vergeleken met geen behandeling of niet-hormonale vaginale behandeling) aan te bevelen aan vrouwen met vaginale klachten in de overgang? Zie de PICO-tabel.
|
Patiënten |
Vrouwen met vaginale klachten in de overgang |
|---|---|
|
Interventie |
Vaginaal oestrogeen |
|
Vergelijking |
|
|
Uitkomstmaten |
Cruciaal
Belangrijk
|
Achtergrond
In de overgang kunnen vaginale klachten optreden, zoals irritatie, droogheid, jeuk, afscheiding en dyspareunie. Verschillende oestrogenen kunnen vaginaal worden toegediend, bijvoorbeeld estradiol (als tablet) of estriol (als ovule of crème). Daarnaast zijn er niet-hormonale vaginale behandelingen beschikbaar. In dit detail beschrijven we de effecten en bijwerkingen van deze middelen.
Methoden
Er is een systematische literatuurzoekactie naar systematische reviews (SR’s) en RCT’s uitgevoerd in PubMed en Embase in september 2020, met een update in september 2021.
Resultaten
Resultaat zoekactie
De zoekactie leverde een SR op naar de effecten van lokale oestrogenen voor vaginale atrofie bij postmenopauzale vrouwen. Een tweede SR onderzocht specifiek de effecten en bijwerkingen van hyaluronzuur op vaginale klachten bij de overgang. Daarnaast vonden we een SR over het risico op endometriumhyperplasie of -carcinoom bij gebruik van vaginale oestrogenen en een meta-analyse van individuele patiëntendata (IPD) over postmenopauzaal hormoongebruik (waaronder vaginaal gebruik) en borstkanker. Een aanvullende zoekactie na de zoekdatum van deze SR’s en de update in september 2021 leverden 2 aanvullende RCT’s op.
Onderzoekskarakteristieken
- Lethaby 2016: SR (Cochrane-review) waarin 30 RCT’s naar vaginaal toegediende oestrogenen voor vaginale atrofie bij postmenopauzale vrouwen werden geïncludeerd, met een minimale onderzoeksduur van 12 weken.
Drie vergelijkingen uit deze SR zijn relevant voor de uitgangsvraag.
- Vaginale estradioltabletten of -ovules vergeleken met placebotabletten of -ovules: 8 RCT’s, waarvan er 2 (n = 1638) gepoold konden worden voor de uitkomstmaat ‘hinder van vaginale klachten’ en waarvan er 1 bijwerkingen rapporteerde (n = 309). De overige uitkomstmaten werden niet gerapporteerd.
- Vaginale oestrogeencrème (geconjugeerd oestrogeen) of estriolgel vergeleken met placebocrème of -gel: 4 RCT’s, waarvan er 2 (n = 198) gepoold konden worden voor de uitkomstmaat ‘hinder van vaginale klachten’ en waarvan er 1 bijwerkingen rapporteerde (n = 50). De overige uitkomstmaten werden niet gerapporteerd.
- Vaginale oestrogeencrème vergeleken met niet-hormonale bio-adhesieve vochtinbrengende gel: 2 RCT’s die geen van de cruciale uitkomstmaten rapporteerden.
- Najjarzadeh 2019: SR waarin 5 RCT’s werden geïncludeerd naar de effecten en bijwerkingen van vaginaal toegediend hyaluronzuur bij vaginale atrofie in postmenopauzale vrouwen, waarvan er 3 (n = 242) hyaluronzuur vergeleken met vaginaal toegediende oestrogenen. Omdat in de SR alleen narratieve resultaten werden gepresenteerd, hebben we de oorspronkelijke artikelen uit deze SR gebruikt.
- Constantine 2019: SR waarin RCT’s en observationele onderzoeken werden geïncludeerd naar het optreden van endometriumhyperplasie of -carcinoom bij vrouwen die vaginale oestrogenen gebruikten zonder toegevoegde progestagenen. Geïncludeerd werden 20 RCT’s, 8 niet-gerandomiseerde trials en 10 observationele onderzoeken.
- Collaborative Group 2019: IPD-meta-analyse naar de associatie tussen verschillende regimes en behandelduren van hormoontherapie en borstkanker. Zowel prospectieve als retrospectieve onderzoeken werden geïncludeerd als daarin bij ≥ 1000 vrouwen borstkanker was opgetreden. Geïncludeerd werden 568.859 vrouwen uit 58 onderzoeken (24 prospectieve en 34 retrospectieve). Voor de hoofdanalyses zijn alleen de prospectieve onderzoeken gebruikt (n = 490.994, van wie 108.647 borstkanker ontwikkelden). De gemiddelde leeftijd waarop borstkanker werd gediagnosticeerd was 65 jaar.
- Mitchell 2018: RCT waarin 302 postmenopauzale vrouwen met klachten van vaginale atrofie (jeuk, pijn, droogheid, irritatie of pijn bij penetratie) werden geïncludeerd. De vrouwen werden gerandomiseerd naar 3 onderzoeksarmen: vaginale estradioltablet van 10 microg plus vaginale placebocrème; vaginale niet-hormonale bio-adhesieve vochtinbrengende gel plus vaginale placebotablet; placebotablet plus placebocrème. Het onderzoek duurde 12 weken. Voor dit detail hebben we de vaginale estradioltablet (n = 102) vergeleken met de vochtinbrengende gel (n = 100).
- Bumphenkiatikul 2020: RCT waarin 67 postmenopauzale vrouwen met seksuele klachten werden geïncludeerd. De vrouwen werden gerandomiseerd naar een tablet met 0,625 mg geconjugeerd oestrogeen, dagelijks in te brengen gedurende 3 weken en daarna tweemaal per week gedurende 9 weken (n = 33), of een placebotablet, in te brengen volgens hetzelfde schema (n = 34). De primaire uitkomstmaat was de Female Sexual Function Index (FSFI).
Effectiviteit en bijwerkingen
Zie tabellen Vaginale oestrogeencrème vergeleken met placebocrème en Vaginale oestrogeentablet vergeleken met placebotablet voor de samenvatting van de resultaten van vaginaal toegediende oestrogenen vergeleken met placebo. We hebben de resultaten voor vaginale tabletten en vaginale crème apart gepresenteerd, omdat het placebo-effect tussen deze toedieningsvormen varieerde. De vaginale ring hebben we buiten beschouwing gelaten, omdat deze in Nederland niet verkrijgbaar is.
De niet-hormonale behandelingen die werden onderzocht, zijn hyaluronzuur en vochtinbrengende gel; beide zijn vergeleken met oestrogeencrème of -gel (zie tabellen Vaginaal toegediend oestrogeen vergeleken met hyaluronzuur en Vaginale oestrogeentablet vergeleken met vochtinbrengende gel).
Het optreden van endometriumhyperplasie of -carcinoom bij gebruik van vaginale oestrogenen werd onderzocht in de SR van Constantine, maar dit trad te weinig op om er duidelijke conclusies aan te verbinden en het was niet mogelijk om deze uitkomstmaat te poolen. Het beperkte bewijs wees niet op een verhoogd risico op endometriumhyperplasie of -carcinoom bij gebruik van vaginale oestrogenen zonder progesteron, maar de kwaliteit van bewijs was zeer laag.
Het optreden van borstkanker werd onderzocht in de IPD-meta-analyse van de Collaborative Group on Hormonal Factors in Breast Cancer. Alleen resultaten bij gebruik van 5 tot 14 jaar zijn gerapporteerd. Hierbij is geen onderscheid gemaakt naar crèmes of tabletten. Mogelijk leidt 5-14 jaar gebruik van vaginale oestrogenen niet tot een verhoogd risico op borstkanker (RR 1,09, 95%-BI 0,97 tot 1,23, kwaliteit van bewijs laag). Het is aannemelijk dat ook een korter gebruik niet tot een verhoogd risico op borstkanker leidt.
Conclusies
Vaginale oestrogeencrème vergeleken met placebocrème
- Mogelijk geeft oestrogeencrème bij meer vrouwen verbetering van de klachten dan placebocrème (kwaliteit van bewijs laag).
- Mogelijk leidt oestrogeencrème niet tot een verhoogd risico op borstkanker (kwaliteit van bewijs laag).
- We zijn onzeker over endometriumdikte, endometriumhyperplasie of -carcinoom en overige bijwerkingen (kwaliteit van bewijs zeer laag).
- Kwaliteit van leven, seksuele klachten en onregelmatig vaginaal bloedverlies zijn niet onderzocht.
Vaginale oestrogeentablet vergeleken met placebotablet
- Waarschijnlijk geven oestrogeentabletten bij meer vrouwen verbetering van de klachten dan placebotabletten (kwaliteit van bewijs redelijk).
- Mogelijk is er niet of nauwelijks verschil in seksuele klachten (kwaliteit van bewijs laag).
- Mogelijk leiden oestrogeentabletten niet tot een verhoogd risico op borstkanker (kwaliteit van bewijs laag).
- Waarschijnlijk is er niet of nauwelijks verschil in endometriumdikte (kwaliteit van bewijs redelijk).
- We zijn onzeker over endometriumhyperplasie of -carcinoom en overige bijwerkingen (kwaliteit van bewijs zeer laag).
- Kwaliteit van leven en onregelmatig vaginaal bloedverlies zijn niet onderzocht.
Oestrogeen vergeleken met hyaluronzuur
- Mogelijk is er niet of nauwelijks verschil in verbetering van de klachten, verbetering van dyspareunie en endometriumdikte (kwaliteit van bewijs laag).
- We zijn onzeker over bijwerkingen (kwaliteit van bewijs zeer laag).
- Kwaliteit van leven, seksuele klachten, onregelmatig vaginaal bloedverlies, borstkanker en endometriumhyperplasie of -carcinoom zijn niet onderzocht.
Oestrogeentablet vergeleken met vochtinbrengende gel
- Mogelijk geeft oestrogeentablet bij meer vrouwen verbetering van de klachten dan vochtinbrengende gel (kwaliteit van bewijs laag).
- Waarschijnlijk is er niet of nauwelijks verschil in kwaliteit van leven (kwaliteit van bewijs redelijk).
- Mogelijk is er niet of nauwelijks verschil in seksueel functioneren, vaginaal bloedverlies en andere bijwerkingen (kwaliteit van bewijs laag).
- Borstkanker en endometriumhyperplasie of -carcinoom zijn niet onderzocht.
Controles
Naar Samenvatting ›Hormoontherapie vanwege vasomotorische klachten
- Evalueer na 3 maanden het effect van behandeling op vasomotorische klachten en kwaliteit van leven.
- Vraag naar:
- (hinder van) vasomotorische klachten bij het dagelijks functioneren thuis, op het werk of in de vrije tijd
- bijwerkingen: onregelmatig, onverwacht vaginaal bloedverlies dat optreedt of aanhoudt > 3 maanden na de start van de behandeling (zie Verwijzing)
- therapietrouw: met name bij gebruik van transdermaal estradiol in combinatie met oraal dydrogesteron
- Ophogen van de dosering estradiol wordt niet aanbevolen.
- Controleer de behandeling in ieder geval jaarlijks. Spreek eventueel in samenspraak met de vrouw een hogere frequentie af afhankelijk van de klachten, bijvoorbeeld halfjaarlijks.
- Evalueer jaarlijks het gebruik en het al dan niet continueren van de behandeling, de risicofactoren voor VTE, hart- en vaatziekten en borstkanker. Bespreek, als hierin verandering is opgetreden, de consequenties voor het vervolgbeleid.
- Streef naar gebruik < 5 jaar vanwege de geleidelijk oplopende risico’s.
- Hormoontherapie hoeft niet te worden afgebouwd.
Medicamenteuze therapie vanwege vaginale atrofie
- Evalueer na 3 maanden het resultaat van de behandeling.
- Instrueer de vrouw contact op te nemen bij vaginaal bloedverlies.
- Controleer de behandeling in ieder geval jaarlijks bij gebruik van vaginaal oestrogeen. Spreek eventueel in samenspraak met de vrouw een hogere frequentie af afhankelijk van de klachten, bijvoorbeeld halfjaarlijks.
- Bespreek en overweeg stoppen in samenspraak met de vrouw.
Ophogen dosering hormoontherapie
Bij onvoldoende werking dient te worden nagegaan of er opnameverminderende medicatie wordt gebruikt, zoals anti-epileptica of Sint-Janskruid. Overwogen kan worden een ander middel te proberen. Ophogen van de dosering wordt niet aanbevolen.
Stoppen met hormoontherapie
Er is weinig bekend over wat de beste manier van stoppen van hormoontherapie is: direct stoppen of afbouwen.
- In een systematisch literatuuronderzoek werd het afbouwen en direct stoppen van hormoontherapie voor vasomotorische klachten onderzocht. Cruciale uitkomstmaten waren terugkeer van vasomotorische klachten, gezondheidsgerelateerde kwaliteit van leven, herstarten van de behandeling of een andere behandeling, en aanvaardbaarheid van de manier van stoppen. Geïncludeerd werden 4 RCT’s (n = 308, gemiddelde duur hormoontherapie 4,8-9,2 jaar). De manier van afbouwen verschilde per RCT: 1 tablet minder per week; tablet om de dag gedurende 2 weken; 2 maanden of 4 maanden lage dosering; tablet om de dag gedurende 4 weken. Er was geen verschil in terugkeer van vasomotorische klachten of gezondheidsgerelateerde kwaliteit van leven na direct stoppen of afbouwen. De kwaliteit van bewijs was laag tot zeer laag. Onderzoek met als uitkomstmaten herstarten van de behandeling en aanvaardbaarheid werd niet gevonden.
- Een Fins observationeel onderzoek over de periode 1994-2009 (n = 332.202, gemiddelde gebruiksduur hormoontherapie 6,2 jaar, gemiddelde follow-up 5,5 jaar) keek naar het risico op overlijden door cardiale oorzaak of beroerte na stoppen met hormoontherapie. De gestandaardiseerde mortaliteitsratio (SMR) voor overlijden in het eerste jaar na stoppen ongeacht oorzaak was 2,28 (95%-BI 2,23 tot 2,34) ten opzichte van vrouwen in de algemene bevolking. Zowel de SMR voor sterfte aan coronaire hartziekten (1,26; 95%-BI 1,16 tot 1,37) als die voor sterfte aan beroerte (1,63;95%-BI 1,47 tot 1,79) was in het eerste jaar na stoppen verhoogd. Bij vrouwen < 60 jaar waren deze risico’s hoger. Na > 1 jaar was het risico niet meer verhoogd. Gegevens over aanwezige cardiovasculaire risicofactoren, zoals eerder vastgestelde hart- en vaatziekten en roken, ontbraken. De kwaliteit van bewijs was zeer laag.
Conclusie
Er is mogelijk geen verschil in effect op terugkeer van vasomotorische klachten na direct stoppen of afbouwen van hormonale therapie bij vrouwen die langdurig hormonale therapie gebruiken. Er zijn zeer beperkte aanwijzingen dat in het eerste jaar na stoppen met hormoontherapie de risico’s op sterfte aan coronaire hartziekten en beroerte verhoogd zijn.
Overwegingen
De duur en het beloop van vasomotorische klachten is vooraf niet goed in te schatten en varieert. Het effect van stoppen met hormoontherapie op het risico op hart- en vaatziekten is onduidelijk, maar wellicht is frequent stoppen en starten minder wenselijk. De manier waarop men stopt met hormonale therapie lijkt geen effect te hebben op de terugkeer van vasomotorische klachten.
Aanbeveling
Hormoontherapie hoeft niet te worden afgebouwd.
Consultatie en verwijzing
Naar Samenvatting ›- Bij veel hinder van vasomotorische klachten en contra-indicaties voor medicamenteuze behandeling: consulteer of verwijs naar een gynaecoloog.
- Bij problemen op het werk door overgangsklachten: adviseer contact op te nemen met de bedrijfsarts.
- Verwijs bij vroegtijdige overgang (menopauze < 40 jaar) voor diagnostiek naar oorzaak (auto-immuunziekte, genetische afwijking) en advies.
Vroegtijdige overgang
- Vroegtijdige overgang (premature ovariële insufficiëntie) komt weinig voor. Ongeveer 1% van de vrouwen heeft de laatste menstruatie op een leeftijd < 40 jaar. Er zijn globaal 3 oorzaken van vroegtijdige overgang aan te geven: aanleg (genetische oorzaken, zoals dragerschap van het fragiele-X-syndroom, turnersyndroom, galactosemie), auto-immuun (zoals ziekte van Addison) en iatrogeen (eerdere chemotherapie, radiotherapie of oöforectomie). Meestal is de oorzaak onbekend. Waarschijnlijk is er dan sprake van vroege uitputting van de eicelvoorraad of zijn de nog aanwezige follikels ongevoelig voor hormonale stimulatie.
- De diagnostiek van vroegtijdige overgang staat beschreven in de NHG-Standaard Amenorroe: overweeg FSH- en oestradiolbepaling bij vermoeden van een vroegtijdige overgang bij vrouwen < 40 jaar. Bij vrouwen < 40 jaar met amenorroe en FSH > 40 IE/L in combinatie met oestradiol < 100 pmol/l is de diagnose ‘vroegtijdige overgang’ in grote mate zeker. Bij FSH > 20 IE/l in combinatie met serumoestradiol < 100 pmol/l is een vroegtijdige overgang waarschijnlijk.
- De werkgroep ziet het als kwaliteit van zorg om patiënten bij vroegtijdige overgang te verwijzen voor aanvullende diagnostiek naar de oorzaak en eventueel behandelingsadviezen.
Vaginaal bloedverlies
Naar Samenvatting ›- Verwijs naar een gynaecoloog voor beoordeling van het endometrium bij onregelmatig vaginaal bloedverlies dat optreedt of aanhoudt > 3 maanden na de start van continue combinatietherapie terwijl cervixpathologie en een chlamydia-infectie uitgesloten zijn.
- Transvaginale echografie in eigen beheer volstaat in deze situatie niet, want de endometriumdikte bij hormoontherapie is vaak > 4 mm
- Verwijs naar een gynaecoloog bij onverklaard vaginaal bloedverlies bij gebruik van vaginaal oestrogeen.
- Bij combinatietherapie in de postmenopauze wordt onregelmatig onverwacht bloedverlies dat optreedt of aanhoudt > 3 maanden na de start van de behandeling beschouwd als abnormaal vaginaal bloedverlies. De termijn van 3 maanden voor verwijzing voor aanvullende diagnostiek is enigszins arbitrair.
- Als aanvullend onderzoek dient er bij postmenopauzale vrouwen die onregelmatig bloedverlies hebben bij gebruik van combinatietherapie altijd een cervixuitstrijkje te worden verricht en dient een chlamydia-infectie te zijn uitgesloten, zie LTA Vaginaal bloedverlies in de postmenopauze.
Referenties
- Heineman MJ, Evers JLH, Massuger LFAG, Steegers EAP. Obstetrie en gynaecologie. De voortplanting van de mens. 6e dr. Maarssen: Elsevier Gezondheidszorg, 2007.
- WHO. Research on the menopause in the 1990s. Report of WHO Scientific Group (1996). Geraadpleegd juni 2022. Ga naar bron: WHO. Research on the menopause in the 1990s. Report of WHO Scientific Group (1996). Geraadpleegd juni 2022.
- Hale GE, Burger HG. Hormonal changes and biomarkers in late reproductive age, menopausal transition and menopause. Best Pract Res Clin Obstet Gynaecol 2009;23:7-23.
- Soules MR, Sherman S, Parrott E, Rebar R, Santoro N, Utian W et al. Executive summary: Stages of Reproductive Aging Workshop (STRAW). Fertil Steril 2001;76:874-8.
- Nelson HD. Menopause. Lancet 2008;371:760-70.
- De Vos M, Devroey P, Fauser BC. Primary ovarian insufficiency. Lancet 2010;376:911-21.
- Van Disseldorp J, Faddy MJ, Themmen AP, De Jong FH, Peeters PH, Van der Schouw YT et al. Relationship of serum antimullerian hormone concentration to age at menopause. J Clin Endocrinol Metab 2008;93:2129-34.
- Kok HS, Van Asselt KM, Van der Schouw YT, Grobbee DE, Te Velde ER, Pearson PL et al. Subfertility reflects accelerated ovarian ageing. Hum Reprod 2003;18:644-8.
- Groeneveld FP, Bareman FP, Barentsen R, Dokter HJ, Drogendijk AC, Hoes AW. The climacteric and well-being. J Psychosom Obstet Gynaecol 1993;14:127-43.
- Parente RC, Faerstein E, Celeste RK, Werneck GL. The relationship between smoking and age at the menopause: A systematic review. Maturitas 2008;61:287-98.
- Gold EB, Bromberger J, Crawford S, Samuels S, Greendale GA, Harlow SD, Skurnick J. Factors associated with age at natural menopause in a multiethnic sample of midlife women. Am J Epidemiol 2001;153:865-74.
- Gold EB, Colvin A, Avis N, Bromberger J, Greendale GA, Powell L, et al. Longitudinal analysis of the association between vasomotor symptoms and race/ethnicity across the menopausal transition: study of women's health across the nation. Am J Public Health 2006;96:1226-35.
- Oldenhave A, Jaszmann LJ, Haspels AA, Everaerd WT. Impact of climacteric on well-being. A survey based on 5213 women 39 to 60 years old. Am J Obstet Gynecol 1993;168(3 Pt 1):772-80.
- Groeneveld FP, Bareman FP, Barentsen R, Dokter HJ, Drogendijk AC, Hoes AW. Vasomotor symptoms and well-being in the climacteric years. Maturitas 1996;23(3):293-9.
- El Khoudary SR, Greendale G, Crawford SL, Avis NE, Brooks MM, Thurston RC, et al. The menopause transition and women's health at midlife: a progress report from the Study of Women's Health Across the Nation (SWAN). Menopause 2019;26(10):1213-27.
- Col NF, Guthrie JR, Politi, Dennerstein L. Duration of vasomotor symptoms in middle-aged women: a longitudinal study. Menopause 2009;16:453-7.
- Avis NE, Crawford SL, Greendale G, Bromberger JT, Everson-Rose SA, Gold EB, et al. Duration of menopausal vasomotor symptoms over the menopause transition. JAMA Intern Med 2015;175(4):531-9.
- Tepper PG, Brooks MM, Randolph Jr JF, Sybil L. Crawford SL, El Khoudary SR, et al. Characterizing the trajectories of vasomotor symptoms across the menopausal transition. Menopause 2016;23:1067-74.
- Freeman EW, Sammel MD, Richard J. Sanders RJ. Risk of long term hot flashes after natural menopause: evidence from the Penn Ovarian Aging cohort. Menopause 2014;21:924-32.
- Nelson HD, Haney E, Humphrey L, Miller J, Nedrow A, Nicolaidis C et al. Management of menopause-related symptoms. 120, 1-916. 2005. Rockville, Agency for Healthcare Research and Quality.
- Nielen MM, Hek K, Schermer TR. Jaarcijfers aandoeningen: incidenties en prevalenties. Uit: NIVEL Zorgregistraties Eerste Lijn. Utrecht: NIVEL 2020. Geraadpleegd augustus 2021 Ga naar bron: Nielen MM, Hek K, Schermer TR. Jaarcijfers aandoeningen: incidenties en prevalenties. Uit: NIVEL Zorgregistraties Eerste Lijn. Utrecht: NIVEL 2020. Geraadpleegd augustus 2021
- Burger H. The menopausal transition-endocrinology. J Sex Med 2008;5:2266-73.
- Rebbeck TR, Su HI, Sammel MD, Lin H, Tran TV, Gracia CR et al. Effect of hormone metabolism genotypes on steroid hormone levels and menopausal symptoms in a prospective population-based cohort of women experiencing the menopausal transition. Menopause 2010;17:1026-34.
- Ayers B, Forshaw M, Hunter MS. The impact of attitudes towards the menopause on women's symptom experience: a systematic review. Maturitas 2010;65:28-36.
- Berecki-Gisolf J, Begum N, Dobson AJ. Symptoms reported by women in midlife: menopausal transition or aging? Menopause 2009;16:1021-29.
- Pien GW, Sammel MD, Freeman EW, Lin H, DeBlasis TL. Predictors of sleep quality in women in the menopausal transition. Sleep 2008;31:991-9.
- DeLamater J, Karraker A. Sexual functioning in older adults. Curr Psychiatry Rep 2009;11:6-11.
- Lindau ST, Gavrilova N. Sex, health, and years of sexually active life gained due to good health: evidence from two US population based cross sectional surveys of ageing. BMJ 2010;340:c810.
- Van Lunsen RH, Laan E. Genital vascular responsiveness and sexual feelings in midlife women: psychophysiologic, brain, and genital imaging studies. Menopause 2004;11:741-8.
- Avis NE, Brockwell S, Randolph JF, Jr., Shen S, Cain VS, Ory M et al. Longitudinal changes in sexual functioning as women transition through menopause: results from the Study of Women's Health Across the Nation. Menopause 2009;16:442-52.
- Laan E, Van Lunsen RH. Hormones and sexuality in postmenopausal women: a psychophysiological study. J Psychosom Obstet Gynaecol 1997;18:126-33.
- Laan E, Van Driel E, Van Lunsen RHW. Seksuele reacties van vrouwen met een seksuele opwindingsstoornis op visuele seksuele stimuli. Tijdschr Seksuol 2003;27:1-13.
- Potter JE. A 60-year-old woman with sexual difficulties. JAMA 2007;297:620-33.
- Vesco KK, Haney EM, Humphrey L, Fu R, Nelson HD. Influence of menopause on mood: a systematic review of cohort studies. Climacteric 2007;10:448-65.
- De Klerk BM, Schiphof D, Groeneveld FP, Koes BW, Van Osch GJ, Van Meurs JB et al. No clear association between female hormonal aspects and osteoarthritis of the hand, hip and knee: a systematic review. Rheumatology (Oxford) 2009;48:1160-5.
- Kronenberg F. Hot flashes: phenomenology, quality of life, and search for treatment options. Exp Gerontol 1994;29:319-36.
- Sturdee DW. The menopausal hot flush-anything new? Maturitas 2008;60:42-9.
- Franco OH, Muka T, Colpani V, Kunutsor S, Chowdhury S, Chowdhury R, et al, Vasomotor symptoms in women and cardiovascular risk markers: systematic review and meta-analysis. Maturitas 2015;81:353-61.
- Dam V, Dobson AJ, Onland-Moret NC, Van der Schouw YT , Mishra GD. Vasomotor menopausal symptoms and cardiovascular disease risk in midlife: a longitudinal study. Maturitas 2020;133:32-41.
- Zhu D, Chung HF, Dobson AJ, Pandeya N, Debra J. Anderson DJ, et al. Vasomotor menopausal symptoms and risk of cardiovascular disease: a pooled analysis of six prospective studies. Am J Obstet Gynecol 2020;223(6):898.
- Thurston RC, Aslanidou Vlachos HE, Derby CA, Jackson EA, Brooks MM, Mattews KA, et al. Menopausal vasomotor symptoms and risk of incident cardiovascular disease events in SWAN. J Am Heart Assoc 2021;10:e017416.
- Mansfield PK, Carey M, Anderson A, Barsom SH, Koch PB. Staging the menopausal transition: data from the TREMIN Research Program on Women's Health. Womens Health Issues 2004;14:220-6.
- McKinlay SM, Brambilla DJ, Posner JG. The normal menopause transition. Maturitas 1992;14:103-15.
- Treloar AE, Boynton RE, Behn BG, Brown BW. Variation of the human menstrual cycle through reproductive life. Int J Fertil 1967;12:77-126.
- Taffe J, Dennerstein L. Time to the final menstrual period. Fertil Steril 2002;78:397-403.
- Mohyi D, Tabassi K, Simon J. Differential diagnosis of hot flashes. Maturitas 1997;27:203-14.
- Faughnan M, Lepage R, Fugere P, Bissonnette F, Brossard JH, D'Amour P. Screening for thyroid disease at the menopausal clinic. Clin Invest Med 1995;18:11-8.
- Van der Linden MW, Westert GP, De Bakker DH, Schellevis FG. Tweede Nationale Studie naar ziekten en verrichtingen in de huisartspraktijk: klachten en aandoeningen in de bevolking en in de huisartspraktijk. Utrecht/Bilthoven: NIVEL/RIVM, 2004.
- Van der Feltz-Cornelis CM. Therapieresistentie opvliegers bij vrouwen in de overgang: paniekstoornis? Ned Tijdschr Geneeskd 2001;281-4.
- Bastian LA, Smith CM, Nanda K. Is this woman perimenopausal? JAMA 2003;289:895-902.
- Kahwati LC, Haigler L, Rideout S, Markova T. What is the best way to diagnose menopause? J Fam Pract 2005;54:1000-2.
- Lambalk CB, Van Disseldorp J, De Koning CH, Broekmans FJ. Testing ovarian reserve to predict age at menopause. Maturitas 2009;63:280-91.
- NABON/NIV. Richtlijn Borstkanker. Utrecht: NABON/NIV 2020. Geraadpleegd december 2021. Ga naar bron: NABON/NIV. Richtlijn Borstkanker. Utrecht: NABON/NIV 2020. Geraadpleegd december 2021.
- Van Rossum MM, van der Avoort IAM, de Hoop D, Dukel L, van der Vleuten CJM, de Hullu JA. Lichen sclerosus. Ned Tijdschr Geneeskd 2007;151:1225-31.
- Smith YR, Haefner HK. Vulvar lichen sclerosus : pathophysiology and treatment. Am J Clin Dermatol 2004;5:105-25.
- Gold EB, Crawford SL, Shelton JF, Tepper PG, Crandall CJ, Greendale GA, et al. Longitudinal analysis of changes in weight and waist circumference in relation to incident vasomotor symptoms: the study of women' health across the nation (SWAN). Menopause 2017;24(1):9-26.
- Huang AJ, Subak LL, Wing R, West DS, Hernandez AL, Macer J, et al. An intensive behavioral weight loss intervention and hot flushes in women. Arch Intern Med 2010;170:1161-7.
- Kroenke CH, Caan BJ, Stefanick ML, Anderson G, Brzyski R, Johnson KC, et al. Effects of a dietary intervention and weight change on vasomotor symptoms in the Women's Health Initiative. Menopause 2012;19(9):980-8.
- Thurston RC, Ewing LJ, Low CA, Christie AJ, Levine MD. Behavioral weight loss for the management of menopausal hot flashes: a pilot study. Menopause 2015;22(1):59-65.
- Subak LL, Wing R, West DL, Franklin F, Vittinghoff E, Creasman JM, et al. Weight loss to treat urinary incontinence in overweight and obese women. N Eng J Med 2009;360(5):481-90.
- Daley A, Stokes-Lampard H, Thomas A, MacArthur C. Exercise for vasomotor menopausal symptoms. Cochrane Database Syst Rev 2014:CD006108.
- Reed SD, Guthrie KA, Newton KM, Anderson GL, Booth-LaForce C, Caan B, et al. Menopausal quality of life: RCT of yoga, exercise and omega-3 supplements. Am J Obstet Gynecol 2014a;210:244.
- Daley A, Thomas A, Roalfe AK, Stokes-Lampard H, Coleman S, Rees M, et al. The effectiveness of exercise as treatment for vasomotor menopausal symptoms: randomised controlled trial. BJOG 2015;122:565-75.
- Asghari M, Mirghafourvand M, Charandabi SMA, Nedjat S. Effect of aerobic exercise and nutrition education on quality of life and early menopause symptoms: a randomized controlled trial. Women Health 2017;57(2):173-88.
- Duijts SFA, Van Beurden M, Oldenburg HSA, Hunter MS, Kieffer JM, Stuiver MM, et al. Efficacy of cognitive behavioral therapy and physical exercise in alleviating treatment-induced menopausal symptoms in patients with breast cancer: results of a randomized, controlled, multicenter trial. J Clin Oncol 2012;30(33):4124-33.
- Tran S, Hickey M, Saunders C, Ramage L, Cohen PA. Nonpharmacological therapies for the management of menopausal vasomotor symptoms in breast cancer survivors. Support Care Cancer 2021;29(3):1183-93.
- Carcelén-Fraile MD, Aibar-Almazán A, Martínez-Amat A, Cruz-Díaz D, Díaz-Mohedo E, Redecillas-Peiró MT, et al. Effects of physical exercise on sexual function and quality of sexual life related to menopausal symptoms in peri- and postmenopausal women: a systematic review. Int J Environ Res Public Health 2020;17(8):2680.
- Nguyen TM, Do TTT, Tran TN, Kim JH. Exercise and quality of life in women with menopausal symptoms: a systematic review and meta-analysis of randomized controlled trials. Int J Environ Res Public Health 2020;17:7049.
- Javadivala Z, Allahverdipour H, Jafarabadi MA, Emami A. An interventional strategy of physical activity promotion for reduction of menopause symptoms. Health Promot Perspect 2020;10(4):383-92.
- Berin E, Hammar M, Lindblom H, Lindh-Åstrand L, Spetz Holm AC. Effects of resistance training on quality of life in postmenopausal women with vasomotor symptoms. Climacteric 2022;25(3):264-70.
- Van Driel CM, Stuursma A, Schroevers MJ, Mourits MJ, de Bock GH. Mindfulness, cognitive behavioural and behaviour-based therapy for natural and treatment-induced menopausal symptoms: a systematic review and meta-analysis. BJOG 2019;126(3):330-9.
- Hardy C, Griffiths A, Norton S, Hunter MS. Self-help cognitive behavior therapy for working women with problematic hot flushes and night sweats (MENOS@Work): a multicenter randomized controlled trial. Menopause 2018;25(5):508-19.
- Wong C, Yip BH, Gao T, Lam KYY, Woo DMS, Yip ALK, et al. Mindfulness-based stress reduction (MBSR) or psychoeducation for the reduction of menopausal symptoms: a randomized, controlled clinical trial. Sci Rep 2018;8(1):6609.
- Atema V, Van Leeuwen M, Kieffer JM, Oldenburg HSA, Van Beurden M, Gerritsma MA, et al. Efficacy of internet-based cognitive behavioral therapy for treatment-Induced menopausal symptoms in breast cancer survivors: results of a randomized controlled trial. J Clin Oncol 2019;37(10):809-22.
- Fenlon D, Maishman T, Day L, Nuttall J, May C, Ellis M, et al. Effectiveness of nurse-led group CBT for hot flushes and night sweats in women with breast cancer: Results of the MENOS4 randomised controlled trial. Psychooncology 2020;29(10):1514-23.
- Leach MJ, Moore V. Black cohosh (Cimicifuga spp.) for menopausal symptoms. Cochrane Database Syst Rev 2012:CD007244.
- Shahnazi M, Nahaee J, Charandabi SMA, Bayatipayan S. Effect of black cohosh (cimicifuga racemosa) on vasomotor symptoms in postmenopausal women: a randomized clinical trial. J Caring Sci 2013;2(2):105-13.
- Tanmahasamut P, Vichinsartvichai P, Rattanachaiyanont M, Techatraisak K, Dangrat C, Sardod P. Cimicifuga racemosa extract for relieving menopausal symptoms: a randomized controlled trial. Climacteric 2015;18(1):79-85.
- Lareb. Herbal preparations with phytoestrogens- overview of the adverse drug reactions (2019). (10 december 2019; geraadpleegd september 2020) Ga naar bron: Lareb. Herbal preparations with phytoestrogens- overview of the adverse drug reactions (2019). (10 december 2019; geraadpleegd september 2020)
- NVWA. Advies over de gezondheidsrisico's van voedingssupplementen die zilverkaars bevatten (2020). Geraadpleegd september 2020. Ga naar bron: NVWA. Advies over de gezondheidsrisico's van voedingssupplementen die zilverkaars bevatten (2020). Geraadpleegd september 2020.
- Najaf Najafi M, Ghazanfarpour M. Effect of phytoestrogens on sexual function in menopausal women: a systematic review and meta-analysis. Climacteric 2018;21(5):427-45.
- Franco OH, Chowdhury R, Troup J, Voortman T, Kunutsor S, Kavousi M, et al. Use of plant-based therapies and menopausal symptoms: a systematic review and meta-analysis. JAMA 2016;315(23):2554-63.
- Perna S, Peroni G, Miccono A, Riva A, Morazzoni P. Allegrini P, et al. Multidimensional effects of soy isoflavone by food or supplements in menopause women: a systematic review and bibliometric analysis. Nat Prod Commun 2016;11(11):1733-40.
- Jenabi E, Shobeiri F, Hazavehei SMM, Roshanaei G. The effect of valerian on the severity and frequency of hot flashes: a triple-blind randomized clinical trial. Women Health 2018;58(3):297-304.
- Li J, Li H, Yan P, Gio L, Li J, Han J, et al. Efficacy and safety of phytoestrogens in the treatment of perimenopausal and postmenopausal depressive disorders: a systematic review and meta-analysis. Int J Clin Pract 2021;75(10):e14360.
- Wang Y, Hernandez G, Mack WJ, Schneider LS, Yin F, Brinton RD. Retrospective analysis of phytoSERM for management of menopause-associated vasomotor symptoms and cognitive decline: a pilot study on pharmacogenomic effects of mitochondrial haplogroup and APOE genotype on therapeutic efficacy. Menopause 2020;27(1):57-65.
- Frigo M, De Barros E, Dos Santos PC, Peres GL, Weber J, Zanelatto C, et al. Effects of a cereal bar with a combination of phytoestrogens on the climacteric symptoms: a placebo-controlled, randomized trial. J Am Nutr Assoc 2022;41(3)325-332.
- Furness S, Roberts H, Marjoribanks J, Lethaby A. Hormone therapy in postmenopausal women and risk of endometrial hyperplasia. Cochrane Database Syst Rev 2012:CD000402.
- Archer DF, Pickar JH, Bottiglioni F. Bleeding patterns in postmenopausal women taking continuous combined or sequential regimens of conjugated estrogens with medroxyprogesterone acetate. Menopause Study Group. Obstet Gynecol 1994;83:686-92.
- Lethaby A, Farquhar C, Sarkis A, Roberts H, Jepson R, Barlow D. Hormone replacement therapy in postmenopausal women: endometrial hyperplasia and irregular bleeding. Cochrane Database Syst Rev 2004;CD000402.
- Grant MD, Marbella A, Wang AT, Pines E, Hoag J, Bonnell C, et al. Menopausal symptoms: comparative effectiveness of therapies [Internet]. Rockville (MD): agency for healthcare research and quality (US); 2015 Mar. Report No.: 15-EHC005-EF.
- Sarri G, Pedder H, Dias S, Guo Y, Lumsden MA. Vasomotor symptoms resulting from natural menopause: a systematic review and network meta-analysis of treatment effects from the National Institute for Health and Care Excellence guideline on menopause. BJOG 2017;124(10):1514-23.
- Marjoribanks J, Farquhar C, Roberts H, Lethaby A, Lee J. Long-term hormone therapy for perimenopausal and postmenopausal women. Cochrane Database Syst Rev.2017:CD004143.
- Collaborative Group on Hormonal Factors in Breast Cancer. Type and timing of menopausal hormone therapy and breast cancer risk: individual participant meta-analysis of the worldwide epidemiological evidence. Lancet 2019;394(10204):1159-68.
- Brinton LA, Felix AS. Menopausal hormone therapy and risk of endometrial cancer. J Steroid Biochem Mol Biol 2014;142:83-9.
- Rovinski D, Ramos RB, Fighera TM, Casanova GK, Spritzer PM. Risk of venous thromboembolism events in postmenopausal women using oral versus non-oral hormone therapy: a systematic review and meta-analysis. Thromb Res 2018;168:83-95.
- Bhupathiraju SN, Grodstein F, Rosner BA, Stampfer MJ, Hu FB, Willett WC, et al. Hormone therapy use and risk of chronic disease in the nurses' health study: a comparative analysis with the women's health initiative. Am J Epidemiol 2017;186(6):696-708.
- Fournier A, Berrino F, Riboli E, Avenel V, Clavel-Chapelon F. Breast cancer risk in relation to different types of hormone replacement therapy in the E3N-EPIC cohort. Int J Cancer 2005;114(3):448-54.
- Fournier A, Berrino F, Clavel-Chapelon F. Unequal risks for breast cancer associated with different hormone replacement therapies: results from the E3N cohort study. Breast Cancer Res Treat 2008;107(1):103-11.
- Løkkegaard E, Andreasen AH, Jacobsen RK, Nielsen LH, Agger C, Lidegaard Ø. Hormone therapy and risk of myocardial infarction: a national register study. Eur Heart J 2008;29(21):2660-8.
- Mørch LS, Kjaer SK, Keiding N, Løkkegaard E, Lidegaard Ø. The influence of hormone therapies on type I and II endometrial cancer: a nationwide cohort study. Int J Cancer 2016;138(6):1506-15.
- Løkkegaard E, Nielsen LH, Keiding N. Risk of stroke with various types of menopausal hormone therapies: a national cohort study. Stroke 2017;48(8):2266-9.
- Schneider C, Jick SS, Meier CR. Risk of cardiovascular outcomes in users of estradiol/dydrogesterone or other HRT preparations. Climacteric 2009a;12(5):445-53.
- Vinogradova Y, Coupland C, Hippisley-Cox J. Use of hormone replacement therapy and risk of venous thromboembolism: nested case-control studies using the QResearch and CPRD databases. BMJ 2019 9;364:k4810.
- Vinogradova Y, Coupland C, Hippisley-Cox J. Use of hormone replacement therapy and risk of breast cancer: nested case-control studies using the QResearch and CPRD databases. BMJ 2020;371:m3873.
- Lyytinen HK, Dyba T, Ylikorkala O, Pukkala EI. A case-control study on hormone therapy as a risk factor for breast cancer in Finland: Intrauterine system carries a risk as well. Int J Cancer 2010;126:483-9.
- Moermond CTA et al. Rijksinstituut voor Volksgezondheid en Milieu. Medicijnresten en waterkwaliteit: een update. 2020.
- Rebbeck TR, Friebel T, Wagner T, Lynch HT, Garber JE, Daly MB, et al ; PROSE Study Group. Effect of short-term hormone replacement therapy on breast cancer risk reduction after bilateral prophylactic oophorectomy in BRCA1 and BRCA2 mutation carriers: the PROSE Study Group. J Clin Oncol 2005;23(31):7804-10.
- NVOG. Richtlijn Management rondom de menopauze (2018). Module Overgangsklachten bij hoog risicoprofiel. Geraadpleegd december 2021. Ga naar bron: NVOG. Richtlijn Management rondom de menopauze (2018). Module Overgangsklachten bij hoog risicoprofiel. Geraadpleegd december 2021.
- Maas AHEM, Rosano G, Cifkova R, Chieffo A, Van Dijken D, Hamoda H, et al. Cardiovascular health after menopause transition, pregnancy disorders, and other gynaecologic conditions: a consensus document from European cardiologists, gynaecologists, and endocrinologists. Eur Heart J 2021;42:967-84.
- NIV. Richtlijn Antitrombotisch beleid 2016. Module Hormonale suppletie therapie en veneuze trombose. Geraadpleegd december 2021. Ga naar bron: NIV. Richtlijn Antitrombotisch beleid 2016. Module Hormonale suppletie therapie en veneuze trombose. Geraadpleegd december 2021.
- Gaudard AM, Silva de Souza S, Puga ME, Marjoribanks J, da Silva EM, Torloni MR. Bioidentical hormones for women with vasomotor symptoms. Cochrane Database Syst Rev 2016:CD010407.
- Bezwada P, Shaikh A, Misra D. The effect of transdermal estrogen patch use on cardiovascular outcomes: a systematic review. J Womens Health (Larchmt) 2017;26(12):1319-25.
- Canonico M, Carcaillon L, Plu-Bureau G, Oger E, Singh-Manoux A, Tubert-Bitter P, et al. Postmenopausal hormone therapy and risk of stroke: impact of the route of estrogen administration and type of progestogen. Stroke 2016;47(7):1734-41.
- Shufelt CL, Merz CN, Prentice RL, Pettinger MB, Rossouw JE, Aroda VR, et al. Hormone therapy dose, formulation, route of delivery, and risk of cardiovascular events in women: findings from the women's health initiative observational study. Menopause 2014;21(3):260-6.
- ESHRE Guideline endometriosis 2022. Geraadpleegd april 2022. Ga naar bron: ESHRE Guideline endometriosis 2022. Geraadpleegd april 2022.
- Beral V, Bull D, Reeves G. Endometrial cancer and hormone-replacement therapy in the Million Women Study. Lancet 2005;365:1543-51.
- Sweetland S, Beral V, Balkwill A, Liu B, Benson VS, Canonico M, et al; million women study collaborators. Venous thromboembolism risk in relation to use of different types of postmenopausal hormone therapy in a large prospective study. J Thromb Haemost 2012;10(11):2277-86.
- Canonico M, Fournier A, Carcaillon L, Olié V, Plu-Bureau G, Oger E, et al. Postmenopausal hormone therapy and risk of idiopathic venous thromboembolism: results from the E3N cohort study. Arterioscler Thromb Vasc Biol 2010;30(2):340-5.
- Fournier A, Dossus L, Mesrine S, Vilier A, Boutron-Ruault MC, Clavel-Chapelon F, et al. Risks of endometrial cancer associated with different hormone replacement therapies in the E3N cohort, 1992-2008. Am J Epidemiol 2014a;180(5):508-17.
- Allen NE, Tsilidis KK, Key TJ, Dossus L, Kaaks R, Lund E, et al. Menopausal hormone therapy and risk of endometrial carcinoma among postmenopausal women in the European Prospective Investigation Into Cancer and Nutrition. Am J Epidemiol 2010 15;172(12):1394-403.
- Schneider C, Jick SS, Meier CR. Risk of gynecological cancers in users of estradiol/dydrogesterone or other HRT preparations. Climacteric 2009b;12(6):514-24
- Espié M, Daures JP, Chevallier T, Mares P, Micheletti MC, De Reilhac P. Breast cancer incidence and hormone replacement therapy: results from the MISSION study, prospective phase. Gynecol Endocrinol 2007;23(7):391-7.
- Jaakkola S, Lyytinen HK, Dyba T, Ylikorkala O, Pukkala E. Endometrial cancer associated with various forms of postmenopausal hormone therapy: a case control study. Int J Cancer. 2011;128(7):1644-51.
- FSRH. Clinical guideline: Contraception for women aged over 40 years. 2019. Faculty of Sexual and Reproductive Healthcare (FSRH, UK). Geraadpleegd december 2021. Ga naar bron: FSRH. Clinical guideline: Contraception for women aged over 40 years. 2019. Faculty of Sexual and Reproductive Healthcare (FSRH, UK). Geraadpleegd december 2021.
- NVOG. Richtlijn Postmenopauzaal bloedverlies (PMB) 2015. Geraadpleegd augustus 2021. Ga naar bron: NVOG. Richtlijn Postmenopauzaal bloedverlies (PMB) 2015. Geraadpleegd augustus 2021.
- NICE. Menopause: diagnosis and management – NICE guideline [NG23] (2015). Geraadpleegd augustus 2021. Ga naar bron: NICE. Menopause: diagnosis and management – NICE guideline [NG23] (2015). Geraadpleegd augustus 2021.
- Løkkegaard ECL, Mørch LS. Tibolone and risk of gynecological hormone sensitive cancer. Int J Cancer 2018;142:2435-40.
- Formoso G, Perrone E, Maltoni S, Balduzzi S, Wilkinson J, Basevi V, et al. Short-term and long-term effects of tibolone in postmenopausal women. Cochrane Database Syst Rev 2016:CD008536.
- Fournier A, Mesrine S, Dossus L, Boutron-Ruault MC, Clavel-Chapelon F, Chabbert-Buffet N. Risk of breast cancer after stopping menopausal hormone therapy in the E3N cohort. Breast Cancer Res Treat 2014b;145(2):535-43.
- L'Espérance S, Frenette S, Dionne A, Dionne JY; Comité de l'évolution des pratiques en oncologie (CEPO). Pharmacological and non-hormonal treatment of hot flashes in breast cancer survivors: CEPO review and recommendations. Support Care Cancer 2013;21(5):1461-74.
- Mareti E, Ampatzi C, Paschou SA, Voziki E, Goulis DG. Non-hormonal replacement therapy regimens: do they have an effect on cardiovascular risk? Curr Vasc Pharmacol 2019;17(6):573-8.
- Sassarini J, Fox H, Ferrell W, Sattar N, Lumsden MA. Hot flushes, vascular reactivity and the role of the α-adrenergic system. Climacteri. 2012;15(4):332-8.
- Boekhout AH, Vincent AD, Dalesio OB, Van den Bosch J, Foekema-Töns JH, Adriaansz S, et al. Management of hot flashes in patients who have breast cancer with venlafaxine and clonidine: a randomized, double-blind, placebo-controlled trial. J Clin Oncol 2011;29(29):3862-8.
- Pandya KJ, Raubertas RF, Flynn PJ, Hynes HE, Rosenbluth RJ, Kirshner JJ, et al. Oral clonidine in postmenopausal patients with breast cancer experiencing tamoxifen-induced hot flashes: a University of Rochester Cancer Center Community Clinical Oncology Program study. Ann Intern Med 2000;132(10):788-93.
- Del Rio G, Menozzi R, Della Casa L, Venneri MG, Zizzo G, Marrama P, et al. Alpha-2 adrenergic activity in perimenopausal women. J Endocrinol Invest 1997;20(10):603-10.
- Reed SD, Mitchell CM, Joffe H, Cohen L, Shifren JL, Newton KM, et al. Sexual function in women on estradiol or venlafaxine for hot flushes: a randomized controlled trial. Obstet Gynecol 2014b;124(2 Pt 1):233-41.
- Joffe H, Guthrie KA, LaCroix AZ, Reed SD, Ensrud KE, Manson JE, et al. Low-dose estradiol and the serotonin-norepinephrine reuptake inhibitor venlafaxine for vasomotor symptoms: a randomized clinical trial. JAMA Intern Med 2014;174(7):1058-66.
- Capriglione S, Plotti F, Montera R, Luvero D, Lopez S, Scaletta G, et al. Role of paroxetine in the management of hot flashes in gynecological cancer survivors: results of the first randomized single-center controlled trial. Gynecol Oncol 2016;143(3):584-8.
- Shan D, Zou L, Liu X, Shen Y, Cai Y, Zhang J. Efficacy and safety of gabapentin and pregabalin in patients with vasomotor symptoms: a systematic review and meta-analysis. Am J Obstet Gynecol 2020;222(6):564-79.
- Lethaby A, Ayeleke RO, Roberts H. Local oestrogen for vaginal atrophy in postmenopausal women. Cochrane Database Syst Rev 2016:CD001500.
- Najjarzadeh M, Charandabi SMA, Mohammadi M, Mirghafourvand M. Comparison of the effect of hyaluronic acid and estrogen on atrophic vaginitis in menopausal women: a systematic review. Post Reprod Health 2019;25(2):100-8.
- Constantine GD, Graham S, Lapane K, Ohleth K, Bernick B, Liu J, et al. Endometrial safety of low-dose vaginal estrogens in menopausal women: a systematic evidence review. Menopause. 2019;26(7):800-7.
- Mitchell CM, Reed SD, Diem S, Larson JC, Newton KM, Ensrud KE, et al. Efficacy of vaginal estradiol or vaginal moisturizer vs placebo for treating postmenopausal vulvovaginal symptoms: a randomized clinical trial. JAMA Intern Med 2018;178(5):681-90.
- Bumphenkiatikul T, Panyakhamlerd K, Chatsuwan T, Ariyasriwatana C, Suwan A, Taweepolcharoen C, et al. Effects of vaginal administration of conjugated estrogens tablet on sexual function in postmenopausal women with sexual dysfunction: a double-blind, randomized, placebo-controlled trial. BMC Womens Health 2020;20(1):173.
- Jokar A, Davari T, Asadi N, Ahmadi F, Foruhari S. Comparison of the hyaluronic acid vaginal cream and conjugated estrogen used in treatment of vaginal atrophy of menopause women: a randomized controlled clinical trial. Int J Community Based Nurs Midwifery 2016;4(1):69-78.
- Chen J, Geng L, Song X, Li H, Giordan N, Liao Q. Evaluation of the efficacy and safety of hyaluronic acid vaginal gel to ease vaginal dryness: a multicenter, randomized, controlled, open-label, parallel-group, clinical trial. J Sex Med 2013;10(6):1575-84.
- Ekin M, Yaşar L, Savan K, Temur M, Uhri M, Gencer I, et al. The comparison of hyaluronic acid vaginal tablets with estradiol vaginal tablets in the treatment of atrophic vaginitis: a randomized controlled trial. Arch Gynecol Obstet 2011;283(3):539-43.
- Mikkola, J Tuomikoski P, Lyytinen H, Korhonen P, Hoti F, Vattulainen P, et al. Increased cardiovascular mortality risk in women discontinuing postmenopausal hormone therapy. Clin Endocrinol Metab 2015;100(12):4588-94.
- NVOG. Richtlijn Prematuur ovarieel falen, diagnostiek en behandeling 1.0 (2001), Geraadpleegd augustus 2021. Ga naar bron: NVOG. Richtlijn Prematuur ovarieel falen, diagnostiek en behandeling 1.0 (2001), Geraadpleegd augustus 2021.