Diepveneuze trombose en longembolie
Richtlijnen diagnostiek
Naar Volledige tekst ›Anamnese
Naar Volledige tekst ›Vraag naar:
- Aard van de klachten:
- passend bij DVT: een pijnlijk, gezwollen (onder)been soms met roodheid of uitgezette venen
- passend bij longembolie: (sub)acute kortademigheid, pijn op de borst of pijn vastzittend aan de ademhaling, hoesten, bloed ophoesten, collaps(neiging)
- Ontstaanswijze, acuut of geleidelijk begin, duur en beloop van de klachten
- Koorts
- Risicofactoren, waaronder: recente operatie, trauma van het been, immobilisatie, oestrogeengebruik (anticonceptie en hormoontherapie), zwangerschap of kraamperiode, eerdere DVT of longembolie, > 4 uur durende auto-, bus- of vliegreis, bekende trombofilie of stollingsproblemen in de familie (zie verder: Risicofactoren)
Lichamelijk onderzoek
Naar Volledige tekst ›Bij klachten die wijzen op DVT
- Inspecteer beide benen en let op links-rechtsverschillen:
- huid, kleurverschil en oedeem
- uitgezette venen bij een liggende patiënt
- Palpeer het aangedane been:
- drukpijn over het verloop van een vene
- drukpijn diep in de kuit
- Meet het verschil (cm) in de maximale kuitomvang.
- Meet op indicatie de temperatuur.
Bij klachten die wijzen op een longembolie
- Bepaal vitale functies: bloeddruk, zuurstofsaturatie, pols- en ademhalingsfrequentie, en op indicatie temperatuur.
- Ausculteer longen. Let op: bij longembolie meestal geen afwijkingen.
- Inspecteer beide benen op aanwijzingen voor DVT.
Aanvullend onderzoek
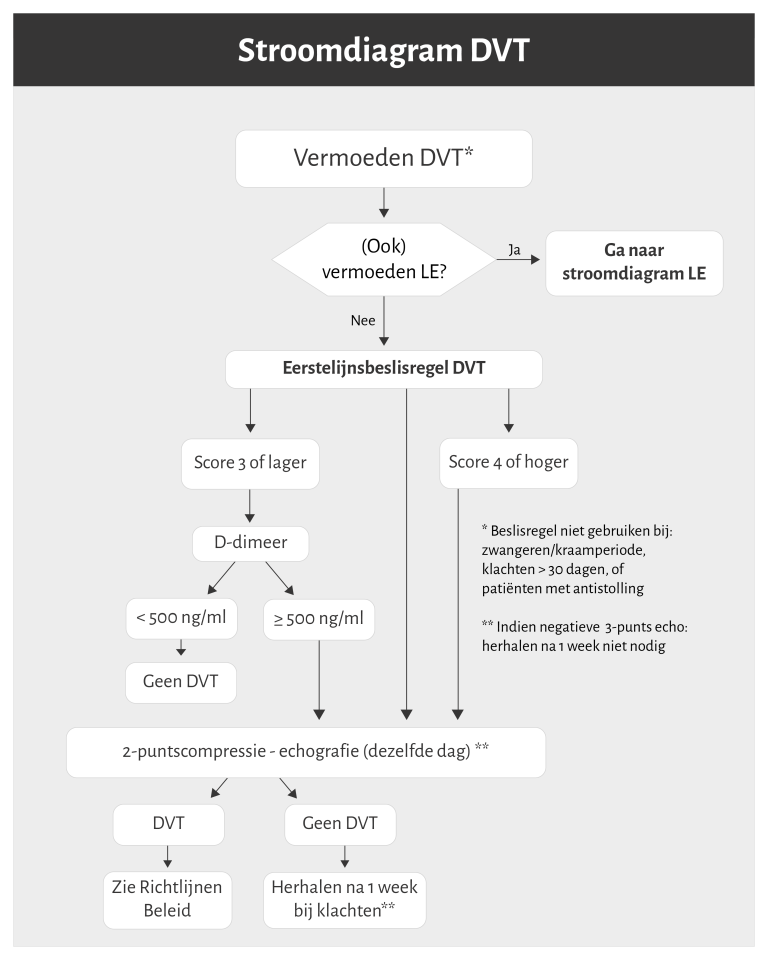
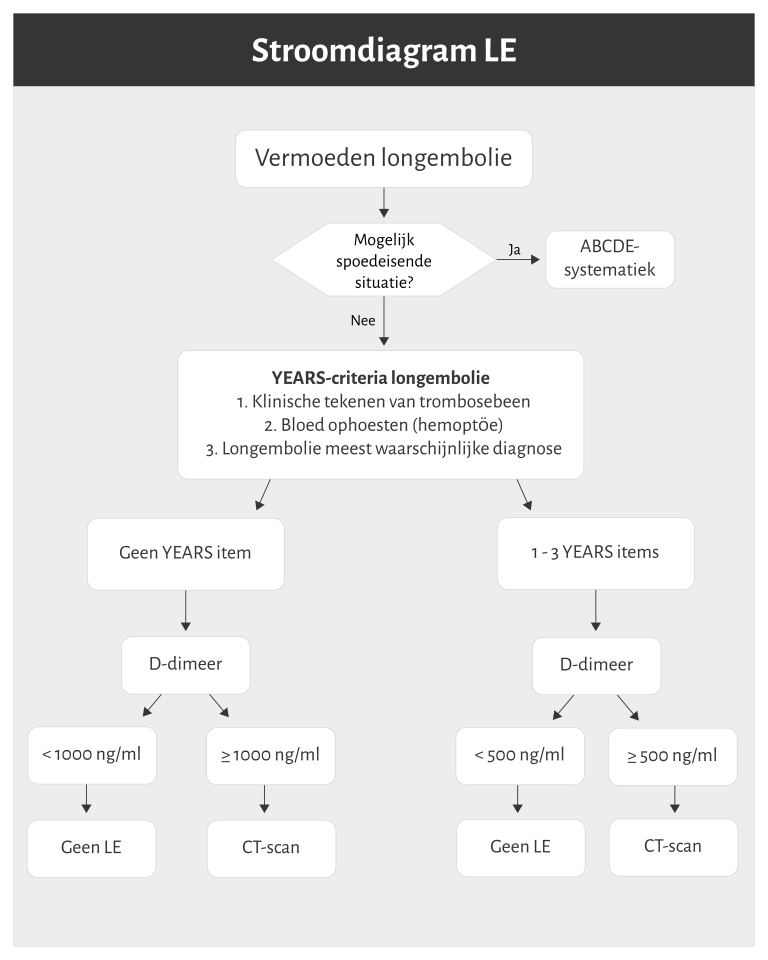
Naar Volledige tekst ›- Bij klachten wijzend op een DVT of longembolie, zie ook de stroomdiagrammen in figuur 2 en figuur 3.
- Bepaal de risicoscore volgens de beslisregels voor DVT (zie tabel 1) of voor longembolie (zie tabel 2).
- Bepaal een D-dimeer (voor DVT afhankelijk van de risicoscore)
- Zorg dat de uitslag dezelfde dag wordt teruggekoppeld; draag dit zo nodig over aan de huisartsenpost.
- Gebruik de beslisregels niet bij zwangeren, in de kraamperiode, bij klachten > 30 dagen en bij anticoagulantiagebruik (dit zijn verwijsindicaties). Gebruik de beslisregels ook niet bij spoedeisende bevindingen (volg ABCDE-benadering).
Compressie-echografie bij verdenking op een DVT
Na doorlopen Eerstelijnsbeslisregel:
- Bij beslisregelscore ≥ 4: vraag een compressie-echografie aan.
- Bij vermoeden van een recidief-DVT in hetzelfde been: overleg met een radioloog of noteer dit duidelijk op de aanvraag (tenzij reeds antistolling, dan consultatie internist).
Evaluatie
Naar Volledige tekst ›DVT: Eerstelijnsbeslisregel en D-dimeerbepaling (zie figuur 2)
- Een DVT is voldoende uitgesloten bij:
- score ≤ 3 én D-dimeerbepaling negatief (< 500 ng/ml of < 0,5 mg/L)
- negatieve 2-puntscompressie-echografie
- Herhaal een negatieve 2-puntscompressie-echo bij aanhoudende klachten na 5 tot 7 dagen. Is de echo wederom negatief, dan is DVT uitgesloten.
- Bij een negatieve 3-puntscompressie-echografie (waarbij dus ook geen geïsoleerde kuitvenetrombose is vastgesteld) is herhaling na 5-7 dagen niet nodig.
- Overleg met radioloog of internist bij een niet-afwijkende echo en evidente zwelling van het gehele been over de mogelijkheid van een (geïsoleerde) bekkenvenetrombose.
- Zie verder: Differentiaaldiagnose.
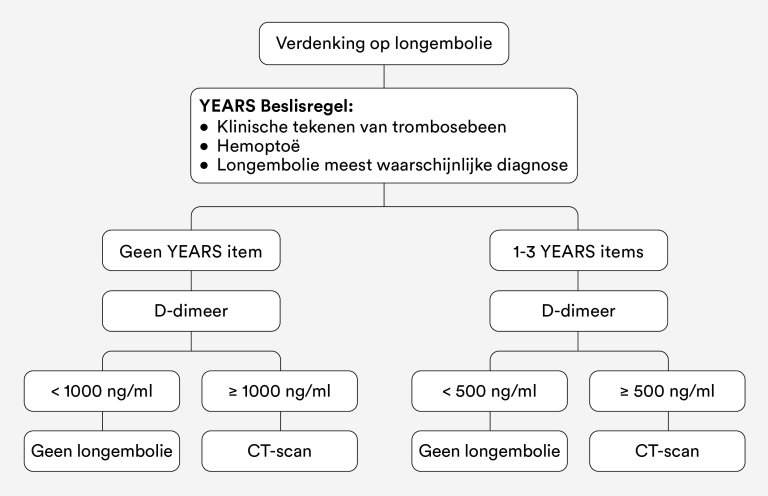
Longembolie: YEARS-algoritme en D-dimeerbepaling (zie figuur 3)
- Een longembolie is voldoende uitgesloten bij:
- 0 YEARS-items en D-dimeerbepaling < 1000 ng/ml (< 1,0 mg/L)
- 1-3 YEARS-items en D-dimeerbepaling < 500 ng/ml (< 0,5 mg/L)
- Verwijs direct naar internist of longarts voor beeldvormend onderzoek bij:
- 0 YEARS-items en D-dimeerbepaling ≥ 1000 ng/ml (≥ 1,0 mg/L)
- 1-3 YEARS-items en D-dimeerbepaling ≥ 500 ng/ml (≥ 0,5 mg/L)
Richtlijnen beleid
Naar Volledige tekst ›- Een DVT van de onderste extremiteiten is meestal in de huisartsenpraktijk te behandelen, mits er geen redenen zijn voor behandeling in de tweede lijn (zie Consultatie en verwijzing).
- Bij geïsoleerde kuitvenetrombose: kies met de patiënt voor medicamenteuze behandeling (gelijk aan proximale DVT) of alléén echografisch vervolgen (na 1 én na 2 weken).
- Bij longembolie: behandeling wordt gestart in de tweede lijn.
Voorlichting en advies
Naar Volledige tekst ›- Bespreek de oorzaak van DVT en de aanwezige risicofactoren.
- Bespreek de noodzaak en werking van medicamenteuze behandeling en veelvoorkomende bijwerkingen (blauwe plekken, langer bloeden).
- Stimuleer om te mobiliseren (indien mogelijk).
Niet-medicamenteuze behandeling
Naar Volledige tekst ›- Compressief zwachtelen:
- Overweeg dit alleen ter bestrijding van de zwelling in overleg met de patiënt.
- Wees terughoudend met compressief zwachtelen ter voorkoming van PTS.
- Steunkousen:
- Overweeg deze in overleg met de patiënt ter bestrijding van de zwelling (pas de gebruiksduur aan op basis van klachten en verschijnselen).
- Wees terughoudend met steunkousen ter voorkoming van PTS of recidief-DVT.
Medicamenteuze behandeling
Naar Volledige tekst ›- Bepaal creatinine en eGFR, tenzij < 3 maanden geleden bepaald.
- Start direct de behandeling met een DOAC of VKA. Let bij de keuze op contra-indicaties en interacties (zie Keuze tussen DOAC of VKA).
- Een DOAC heeft de voorkeur vanwege het gebruiksgemak en een lager risico op bloedingen.
- Anticonceptie: bespreek bij vrouwen in de vruchtbare leeftijd de noodzaak voor adequate anticonceptie tijdens en na antistollingsmedicatie (zie Anticonceptie en hormoontherapie en Adviezen bij anticonceptie en de NHG-Standaard Anticonceptie)
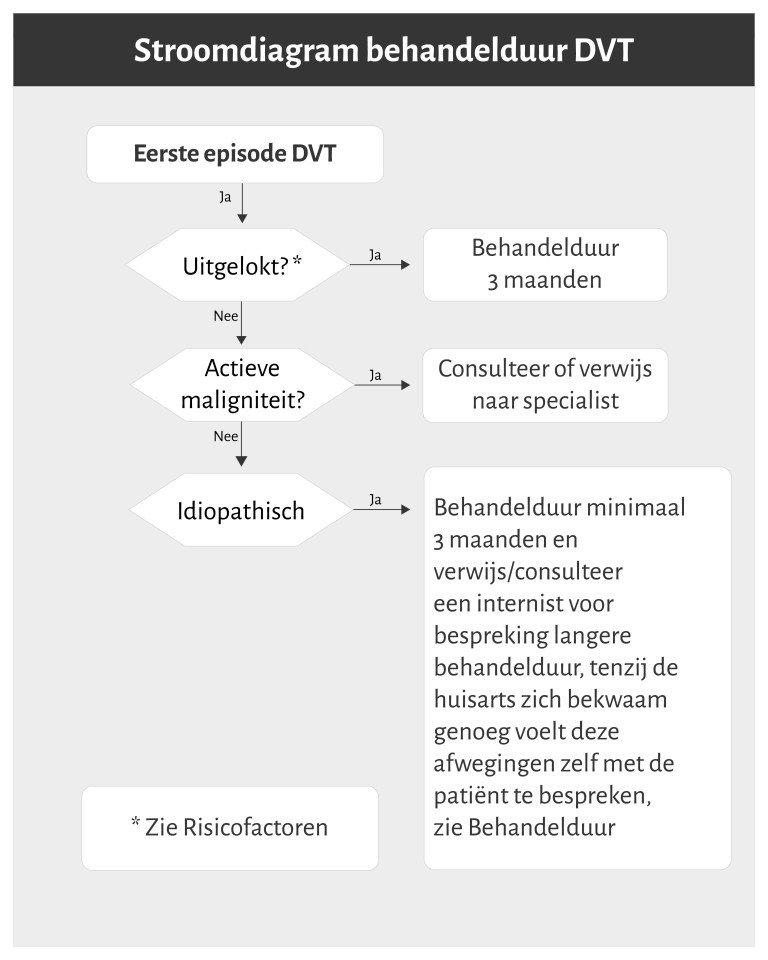
- Behandelduur:
- bij een geïsoleerde kuitvenetrombose: 3 maanden
- bij een eerste DVT: zie figuur 4
- bij een recidief-DVT: verwijs na start behandeling naar de internist
DOAC's
- Maak met de patiënt de keuze voor een DOAC op basis van contra-indicaties en patiëntvoorkeur. Zie tabel 3 voor doseringen, dosisaanpassingen en toepasbaarheid.
- Voor interacties en contra-indicaties, zie DOAC's
- Benadruk het belang van therapietrouw.
VKA's
Controles
Naar Volledige tekst ›Bij behandeling door de huisarts:
- Eerste controle (na 1 week): bespreek staken LMWH (indien van toepassing), starten van antistolling door de trombosedienst (indien van toepassing), klachten been, bijwerkingen antistollingsmedicatie, risicofactoren, vangnetadvies
- Tweede controle (na 2-3 weken): bij gebruik DOAC: bespreek bijwerkingen en therapietrouw (en indien van toepassing anticonceptie (zie Anticonceptie en hormoontherapie en Adviezen bij anticonceptie))
- Derde controle (na 3 maanden): bespreek beëindiging antistolling (en indien van toepassing anticonceptie) en overweeg verlenging bij idiopathische DVT (zie Behandelduur).
- Zie Onderzoek naar oorzaken van VTE (maligniteit/trombofilie).
Consultatie en verwijzing
Naar Volledige tekst ›Internist of longarts
Verwijs direct:
- bij vermoeden van longembolie op basis van YEARS-algoritme en D-dimeerbepaling
Internist
Verwijs bij:
- verdenking DVT tijdens zwangerschap en kraamperiode
- bewezen DVT bij een patiënt met kanker
- bewezen recidief-DVT
- verdenking bekkenvenetrombose (of consulteer radioloog)
- progressie van de DVT ondanks antistolling
- een verhoogd risico op ernstige bloeding
- verdenking antifosfolipidensyndroom (zie: Diagnostiek naar trombofilie)
- bij afweging inzake langdurige antistollingsbehandeling na eerste idiopathische DVT (tenzij de huisarts dit zelf met patiënt afweegt)
Consulteer:
- bij nierinsufficiëntie (eGFR < 30 ml/min), diastolische bloeddruk > 120 mmHg, gewicht < 50 kg, gewicht > 150 kg of BMI > 50.
- na bariatrische chirurgie, als behandeling met VKA niet mogelijk is
- bij familiaire VTE (counseling voor vrouwelijke familieleden)
- bij actieve zwangerschapswens en geïndiceerde langdurige antistolling
- bij vermoeden van een recidief-DVT onder adequaat ingestelde antistolling
Diagnostiek en beleid bij oppervlakkige tromboflebitis
Naar Volledige tekst ›Belangrijkste wijzigingen
Naar Samenvatting ›- Er geldt een nieuwe beslisregel (YEARS-algoritme) voor het uitsluiten van een longembolie.
- Het gebruik van een point-of-care test (POCT D-dimeerbepaling) wordt niet aanbevolen, tenzij de uitvoering aan strikte randvoorwaarden voldoet.
- Compressief zwachtelen en steunkousen bij een diepveneuze trombose (DVT) kunnen helpen bij zwelling, maar worden niet langer standaard aanbevolen ter preventie van het posttrombotisch syndroom (PTS).
- Een direct werkend oraal anticoagulans (DOAC) heeft de voorkeur boven een vitamine K-antagonist (VKA), met bepaalde uitzonderingen.
- De geschatte grootte van een tromboflebitis is losgelaten als criterium voor het risico op uitbreiding naar een DVT.
Kernboodschappen
Naar Samenvatting ›- Gebruik bij verdenking op een DVT of longembolie altijd een beslisregel en een negatieve D-dimeerbepaling om deze uit te sluiten. DVT en longembolie hebben elk een eigen beslisregel.
- Verwijs alle patiënten met een verhoogde score op de beslisregel voor DVT of longembolie en/of een positieve D-dimeerbepaling nog dezelfde dag voor beeldvormend onderzoek (bij longembolie via de longarts/internist).
- Bij een DVT kan de behandeling meestal gestart worden in de eerste lijn. Bij een longembolie vindt behandeling geheel plaats in de tweede lijn.
- De behandeling van een DVT bestaat uit een DOAC, soms voorafgegaan door laagmoleculairgewicht heparine (LMWH), of uit een VKA in combinatie met ≥ 5 dagen LMWH.
- Compressief zwachtelen en steunkousen bij een DVT kunnen helpen bij zwelling, maar worden niet langer standaard aanbevolen ter preventie van het posttrombotisch syndroom of recidief-DVT.
- Oppervlakkige tromboflebitis is in principe een klinische diagnose, de behandeling bestaat meestal uit pijnstilling. Echografie is vaak niet nodig.
- Verwijs na 3 maanden gebruik van antistolling bij idiopathische DVT naar de internist voor het voortzetten daarvan. Alternatieven zijn overleg met de internist, dan wel deze afweging samen met de patiënt te maken.
Inleiding
Naar Samenvatting ›Scope
Naar Samenvatting ›- Aanbevelingen voor de diagnostiek en behandeling van een DVT van de onderste extremiteiten en longembolie bij volwassenen. Omdat DVT en longembolie eenzelfde pathofysiologie hebben en vaak samen voorkomen, worden ze in deze standaard gezamenlijk behandeld.
- Aanbevelingen voor het beleid bij latere complicaties zoals PTS en pulmonale hypertensie.
- Aanbevelingen voor de diagnostiek en behandeling van oppervlakkige tromboflebitis van de onderste extremiteiten.
Buiten de scope
Naar Samenvatting ›- Alle DVT op andere locaties dan de onderste extremiteiten, waaronder zeldzamere typen zoals cerebrale sinustrombose of buikvenetrombose.
- De preventie van trombose na een operatie of bij immobilisatie.
Achtergronden
Naar Samenvatting ›Begrippen
Naar Samenvatting ›Veneuze trombo-embolie (VTE)
Een overkoepelend begrip dat zowel DVT als longembolie omvat.
Diepveneuze trombose (DVT)
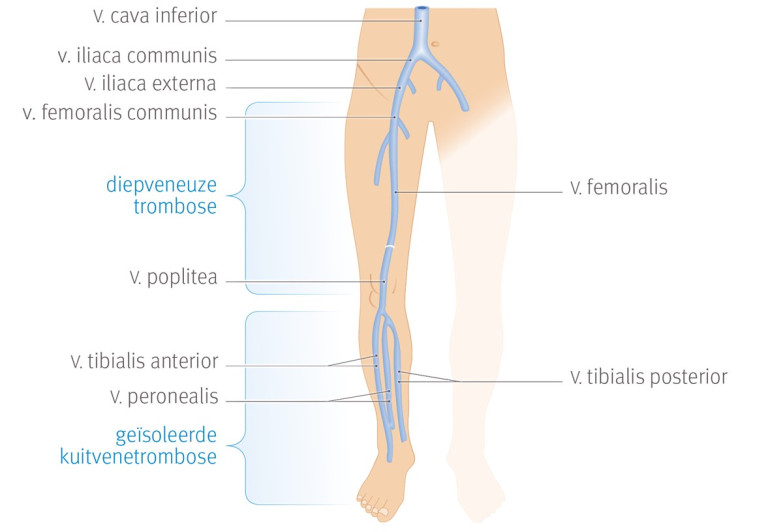
Een DVT is een trombus in het diepveneuze systeem. In deze NHG-Standaard bedoelen we met een DVT een trombose in het proximale diepveneuze systeem van de onderste extremiteiten en waarvoor antistolling nodig is. Proximaal wil zeggen vanaf de trifurcatie van de vena poplitea (knieholte) tot de vena femoralis communis (lies) (zie figuur 1).
Geïsoleerde kuitvenetrombose
Een DVT in het distale diepveneuze systeem van de onderste extremiteiten (vena peroneus, vena tibialis posterior of vena tibialis anterior). Daarnaast is er de geïsoleerde (distale) kuitspiervenetrombose (vena gastrocnemius of vena soleus). Distaal wil zeggen onder het niveau van de knie (zie figuur 1). Dit is een DVT die meestal vanzelf weer oplost, zonder antistolling. Omdat het onzeker is of behandeling zinvol is, bespreken we dit type DVT apart.
Longembolie
Een (gedeeltelijke) afsluiting van een longslagader door een embolus, waardoor een deel van de long niet of slechts gedeeltelijk van bloed wordt voorzien.
Uitgelokte VTE
VTE die is uitgelokt door een recente operatie, trauma, immobilisatie, oestrogeengebruik, zwangerschap of kraamperiode.
Idiopathische VTE
VTE die niet is uitgelokt door een recente operatie, trauma, immobilisatie, oestrogeengebruik, zwangerschap of kraamperiode.
Oppervlakkige tromboflebitis
Trombus in een oppervlakkige vene, in deze NHG-Standaard alleen van de onderste extremiteiten (onder andere vena saphena magna en vena saphena parva).
Trombofilie
Erfelijke of verworven aanleg tot het ontwikkelen van een VTE.
Posttrombotisch syndroom (PTS)
Veneuze insufficiëntie als gevolg van een doorgemaakte DVT, gekenmerkt door een zwaar gevoel, pijn, zwelling, roodheid en/of hyperpigmentatie, soms tot en met de ontwikkeling van een ulcus cruris.
Epidemiologie
Naar Samenvatting ›- De gezamenlijke incidentie van DVT en oppervlakkige tromboflebitis in de huisartsenpraktijk is 2,8 per 1000 patiënten per jaar en is bij vrouwen hoger dan bij mannen. De incidentie neemt toe met de leeftijd.
- De incidentie van longembolie in de huisartsenpraktijk is 1,4 per 1000 patiënten per jaar.
- Huisartsen zien per jaar per normpraktijk circa 10 patiënten met klachten die doen denken aan een DVT van het been en 4 patiënten met vermoeden van een longembolie. Bij circa 2 van de 10 patiënten met een vermoedelijke DVT wordt ook daadwerkelijk de diagnose DVT gesteld en bij 1 van de 8 patiënten met een vermoedelijke longembolie, de diagnose longembolie.
- Een recidief-DVT of longembolie binnen 5 jaar komt voor bij circa 30% van de patiënten met een idiopathische VTE; het individuele risico hangt af van de patiëntkenmerken. Bij een uitgelokte VTE zoals na een operatie, maar ook bijvoorbeeld na pilgebruik, is het recidiefrisico binnen 5 jaar veel lager, namelijk 3%.
- Bij 15-50% van de patiënten met een DVT treedt het PTS op. Dit gebeurt vaak binnen 1-2 jaar na de DVT, soms pas jaren later. De kans lijkt het grootst na een recidief-DVT in hetzelfde been of bij een uitgebreide proximale DVT.
Incidentie VTE
Het NIVEL presenteert jaarcijfers over de prevalentie en incidentie van geregistreerde gezondheidsproblemen aan de hand van de geregistreerde huisartsenbezoeken van patiënten (nivel.nl, geraadpleegd juni 2023). In 2021 was de incidentie van ICPC-code K94 (Tromboflebitis/flebotrombose) in de huisartsenpraktijk 2,8 per 1000 patiënten per jaar (mannen 2,4, vrouwen 3,3). De incidentie stijgt met de leeftijd: bij mannen van 0,3 (19-24 jaar) tot 5,6 (> 85 jaar), bij vrouwen van 0,6 (19-24 jaar) tot 8,3 (> 85 jaar) per 1000 patiënten per jaar. De incidentiecijfers van de subcodes K94.01 (Diepe veneuze trombose) en K94.02 (Oppervlakkige veneuze trombose) zijn niet bekend.
De incidentie van ICPC-code K93 (Longembolie/longinfarct) was 1,4 per 1000 patiënten per jaar (mannen 1,3, vrouwen 1,5). Ook de incidentie van longembolie stijgt met de leeftijd: bij mannen van 0,1 (19-24 jaar) tot 3,5 (> 85 jaar), bij vrouwen van 0,4 (19-24 jaar) tot 4,2 (> 85 jaar) per 1000 patiënten per jaar.
Vermoeden van VTE
In een Nederlands onderzoek in de eerste lijn werden 1295 patiënten met vermoeden van DVT verwezen voor echografie. Bij 289 patiënten (22%) bleek DVT aanwezig. In een ander Nederlands onderzoek in de eerste lijn werden 598 patiënten met vermoeden van longembolie verwezen voor nadere diagnostiek. Bij 73 patiënten (12%) bleek een longembolie aanwezig. Uit deze percentages kan worden afgeleid dat de huisarts een DVT ongeveer 5 keer vaker vermoedt dan deze wordt vastgesteld, voor een longembolie is dat ongeveer 8 maal zo vaak.
Recidiefkans VTE
In een meta-analyse van 18 onderzoeken met in totaal 3186 patiënten vond men dat de frequentie van recidief-VTE direct na het staken van de behandeling relatief hoog was, om daarna snel af te nemen en na 9 maanden te stabiliseren. De richtlijn van het American College of Chest Physicians (ACCP) baseerde de kansen op een recidief-VTE na het stoppen van anticoagulantia op een systematische review van 15 onderzoeken. Er werd onderscheid gemaakt tussen idiopathische VTE, VTE geprovoceerd door chirurgie en VTE als gevolg van een niet-chirurgische risicofactor, zoals oestrogenen, zwangerschap, trauma van het been, vliegreis > 8 uur. Patiënten met een maligniteit werden geëxcludeerd. In de ACCP-richtlijn worden de volgende geschatte cumulatieve risico’s vermeld: indien de VTE een gevolg was van een operatie: 1% na 1 jaar en 3% na 5 jaar; bij niet-chirurgische reversibele factoren: 5% na 1 jaar en 15% na 5 jaar; bij idiopathische VTE 10% na 1 jaar en 30% na 5 jaar.
Incidentie posttrombotisch syndroom (PTS)
Er bestaat geen consensus over de precieze incidentie en het moment waarop de eerste symptomen van PTS zich manifesteren. Dit heeft voornamelijk te maken met de verschillende patiëntengroepen die in diverse onderzoeken worden ingesloten, het ontbreken van een gematchte controlegroep, variaties in follow-upduur en het hanteren van verschillende definities van PTS. Vaak wordt PTS gedefinieerd als een Villalta-score > 4, ernstige PTS als een Villalta-score > 14.
In een review werden 13 prospectieve onderzoeken naar PTS na een symptomatische DVT besproken. De cumulatieve incidenties liepen uiteen van 15 tot 50%. PTS ontwikkelt zich vaak binnen 1-2 jaar na een DVT , maar kan zich ook nog 10 jaar later ontwikkelen. Onderzoek laat een incidentie van 30% zien na 6 jaar. PTS werd gedefinieerd als een Villalta-score > 4, ernstige PTS als een Villalta-score > 14. Het ontstaan van een recidief aan hetzelfde been was sterk geassocieerd met het risico op PTS. Ook een meer uitgebreide DVT, pre-existente veneuze insufficiëntie, obesitas, kwaliteit van antistollingsbehandeling, residuale veneuze obstructie en hogere leeftijd zijn geassocieerd met het risico op PTS. Een review (2018) noemt een uitgebreide proximale DVT en recidief aan hetzelfde been als de 2 belangrijkste voorspellers.
Etiologie
Naar Samenvatting ›Algemene etiologie
Naar Samenvatting ›- Het risico op trombose is sterk leeftijdsgebonden. Het is laag op jonge leeftijd (0,03% met 18 jaar) en neemt toe met het ouder worden; de mediane leeftijd waarop een DVT optreedt is circa 60 jaar. Bijkomende risicofactoren gedurende het leven kunnen ervoor zorgen dat een zogeheten ‘trombosedrempel’ bereikt wordt en iemand daadwerkelijk een trombose ontwikkelt.
- Er is steeds meer bewijs dat het ontstaan van VTE een complex samenspel is van stolling en ontsteking. De stollingscascade activeert het immuunsysteem en immuuncellen dragen op hun beurt weer bij aan trombusvorming. Na de vorming van een stolsel komt de fibrinolyse op gang, waarbij D-dimeren vrijkomen.
VTE is een multicausale ziekte, waarvoor een bepaalde drempelwaarde bereikt moet worden om de ziekte te ontwikkelen. De combinatie van iemands basisrisico (risico op basis van leeftijd in combinatie met eventuele erfelijke risicofactoren) en verworven risicofactoren of omstandigheden in de loop van het leven bepalen of die drempelwaarde van de thrombosis threshold wordt bereikt. Het ontstaan van een veneuze trombus is een samenspel van stolling en ontsteking. De activatie van de stollingscascade zou leiden tot het aanwakkeren van het immuunsysteem dat mede bijdraagt aan de trombusvorming; dit proces wordt ook wel ‘immunotrombose’ genoemd.
Risicofactoren
Naar Samenvatting ›- Circa 20% van alle VTE’s zijn uitgelokte VTE’s. Sterke risicofactoren zijn:
- recente operatie
- trauma van het been
- immobilisatie
- oestrogeengebruik (hormonale anticonceptie en hormoontherapie)
- zwangerschap en kraamperiode
- Een andere sterke risicofactor is een actieve maligniteit. Circa 20% van alle VTE’s is kankergeassocieerd.
- In alle andere gevallen is er sprake van een of meer zwakke risicofactoren, of is er geen duidelijk aanwijsbare risicofactor. Zwakke bijdragende risicofactoren zijn:
- trombofilie (zie hieronder)
- recente oppervlakkige tromboflebitis
- eerder doorgemaakte VTE
- positieve familieanamnese voor VTE (≥ 1 eerstegraads familielid met een VTE, ongeacht oorzaak)
- oudere leeftijd
- BMI ≥ 29
- roken
- chronische (inflammatoire) ziekten zoals ziekte van Crohn
- (vlieg)reizen
- bepaalde medicatie (diverse antipsychotica, systemische corticosteroïden).
- werkgerelateerde factoren (lang staan of zitten)
- er zijn nog veel meer mogelijk bijdragende risicofactoren
- Trombofilie betekent een verhoogde neiging tot het krijgen van trombose. Dit kan erfelijk zijn (bijvoorbeeld factor-V-Leiden) of verworven (bijvoorbeeld antisfosfolipidensyndroom). Erfelijke factoren worden tegenwoordig zelden bepaald, omdat het bijna nooit consequenties heeft voor de behandelduur. Een positieve familieanamnese voor VTE heeft wel consequenties voor familieleden met betrekking tot advies over anticonceptie of maatregelen tijdens de zwangerschap en kraamperiode (zie NHG-Standaard Anticonceptie en NHG-Standaard Zwangerschap en kraamperiode.
DVT en longembolie hebben gemeenschappelijke risicofactoren. Het risico op een VTE neemt toe met de leeftijd. In een Nederlands onderzoek (2008-2012) werd een mediane leeftijd van 61 jaar gevonden onder patiënten met een eerste VTE.
Daarnaast spelen blijvende risicofactoren (zoals een erfelijke trombofilie) en tijdelijke risicofactoren (zoals een operatie of zwangerschap) een rol bij het ontstaan van een VTE. De aanwezigheid van een blijvende risicofactor verhoogt ook het risico op een recidief-VTE.
Een systematisch literatuuronderzoek (2021) beschrijft dat circa 20% van de sterk uitlokkende factoren tijdelijke risicofactoren zijn (zoals operatie en trauma). Een andere circa 20% wordt veroorzaakt door de aanwezigheid van een actieve maligniteit. Circa 60% van de VTE’s wordt veroorzaakt door een of meer zwakke risicofactoren of heeft geen duidelijk aanwijsbare risicofactor.
In een genest patiëntcontroleonderzoek in de eerste en tweede lijn in de Verenigde Staten met circa 106.000 inwoners werden in de periode 1976-1990 625 patiënten geïdentificeerd met een eerste VTE. Deze patiënten werden vergeleken met 625 patiënten zonder VTE. Verblijf in een ziekenhuis of verpleeghuis, operatie, maligniteit, chemotherapie, neurologische aandoeningen met parese, varices en oppervlakkige tromboflebitis bleken belangrijke en onafhankelijke risicofactoren voor VTE. Zwangerschap en kraamperiode, gebruik van oestrogeengebruik werden in dit onderzoek, in tegenstelling tot andere onderzoeken, niet als risicofactor geïdentificeerd, waarschijnlijk door het lage aantal patiënten in de onderzochte populatie.
In een tweede onderzoek werden gegevens van 2 cohorten (n = 21.680, leeftijd > 45 jaar) uit verschillende regio’s in de Verenigde Staten samengevoegd. De cohorten werden 7,6 jaar gevolgd om de incidentie van DVT en longembolie vast te stellen. Er werden 267 gevallen van DVT geïdentificeerd, 58 gevallen van longembolie en 41 gevallen van DVT met longembolie. Van de DVT’s was 91% in de onderste extremiteiten gelokaliseerd, 7% in de bovenste extremiteiten. In 48% van de gevallen was de trombose idiopathisch, 52% was uitgelokt.
Bij het merendeel van de patiënten met uitgelokte trombose was > 1 onderliggende risicofactor aanwezig; de meest voorkomende risicofactoren waren maligniteit (48%), ziekenhuisopname (52%), operatie (42%) en groot trauma (6%). Maligniteit bleek de enige onafhankelijke voorspeller van een recidief-DVT (RR 9,2; 95%-BI 2 tot 41,7) en was de enige onafhankelijke factor die geassocieerd was met toegenomen sterfte (RR 5,2; 95%-BI 1,4 tot 19,9).
De volgende definities van risicofactoren kunnen gebruikt worden:
- immobilisatie: > 3 dagen, bijvoorbeeld bij gips rond been.
- kraamperiode: tot 3 maanden na bevalling.
- recente oppervlakkige tromboflebitis: in ieder geval het eerste half jaar.
- positieve familieanamnese voor VTE: ≥ 1 eerstegraads familielid met een VTE, ongeacht oorzaak
- overgewicht en obesitas: BMI ≥ 29. Obesitas is een risicofactor voor VTE: een BMI ≥ 29 geeft een 2-3 × zo grote kans op longembolie en DVT. De impact van obesitas was het grootst bij patiënten < 40 jaar (RR 5,2).
- (vlieg)reizen: > 4 uur.
Kanker
Verhoogd risico op VTE
Kanker verhoogt het risico op het krijgen van een VTE met een factor 4-6. Verondersteld wordt dat dit een gevolg is van zowel de maligniteit zelf als van de behandeling (chemotherapie, centraal veneuze lijnen, chirurgie). Ook het risico op het krijgen van een VTE is groter bij kankerpatiënten die geopereerd worden dan bij patiënten zonder maligniteit die geopereerd worden.
Risico op recidief-VTE, overlijden en bloedingen bij VTE en kanker
Patiënten met kanker die daarbij een VTE krijgen, hebben een groter overlijdensrisico dan patiënten met alléén een maligniteit of alléén een VTE. Kankerpatiënten met VTE hebben gedurende de behandeling met anticoagulantia zowel een grotere kans op een recidief dan VTE-patiënten zonder maligniteit (27,1 versus 9,0 per 100 patiëntjaren) als een grotere kans op een ernstige bloeding (13,3 versus 2,2 per 100 patiëntjaren).
Trombofilie
De groep erfelijke trombofilieën bestaat uit de volgende aandoeningen: antitrombine-, proteïne C- of proteïne S-deficiëntie, factor-V-Leiden en protrombine 20210A mutatie. Daarnaast kan er ook sprake zijn van een verworven trombofilie, namelijk het antifosfolipidensyndroom, waarbij er antistoffen tegen fosfolipiden/cardiolipine en lupus anticoagulans aanwezig zijn.
Zwangerschap en kraamperiode
Zie ook NHG-Standaard Zwangerschap en kraamperiode en NHG-Standaard Preconceptiezorg. Tijdens de zwangerschap en de kraamperiode is de incidentie van VTE sterk verhoogd, vooral door veranderingen in de bloedstolling (met ook een D-dimeerstijging). De Richtlijn Antitrombotisch beleid stelt het volgende: ‘De incidentie van VTE in de zwangerschap wordt geschat op 0,5-1 per 1000 zwangerschappen en is ongeveer 5 × hoger dan bij niet-zwangere vrouwen van dezelfde leeftijd. Het risico op VTE is in elk trimester even hoog; ongeveer 90% van de veneuze tromboses komt in het linkerbeen voor. In de 3 maanden postpartum is het absolute risico ongeveer 1-2 per 1000, het hoogst na een secundaire sectio caesarea.’
Hormonale anticonceptie en hormoontherapie
Zie ook NHG-Standaard Anticonceptie. Het risico op DVT en longembolie wordt verhoogd door gebruik van een combinatiepreparaat (oestrogeen met progestageen; pil, ring of pleister). Van de combinatiepillen heeft de sub-50 combinatiepil (met 20 of 30 microg ethinylestradiol in combinatie met levonorgestrel) het minst verhoogde risico (3 tot 7 op 10.000 gebruiksters per jaar, niet-gebruiksters ongeveer 2 per 10.000 per jaar). De overige combinatiepillen veroorzaken waarschijnlijk een significant grotere risicotoename (ongeveer van 3 naar 10 per 10.000 vrouwen per jaar). Het risico op veneuze trombose is vooral in het eerste jaar van het gebruik verhoogd.
Er zijn aanwijzingen dat de prikpil het risico op VTE verhoogd en daarom geldt een relatieve contra-indicatie. We zijn onzeker over de invloed op het risico op VTE van de overige methodes met alleen progestageen, zoals de pil met alleen progestageen, het hormoonspiraal en het implantatiestaafje.
Zie voor meer uitleg NHG-Standaard De overgang. Zowel oestrogeenmonotherapie als combinatietherapie (oestrogeen plus progestageen) geeft een verhoogd risico op VTE.
Roken
Het risico op een VTE door roken werd nagegaan in een meta-analyse van 13 cohort- en 19 patiëntcontroleonderzoeken met in totaal 3.966.184 patiënten van wie 35.151 een VTE kregen. De follow-up was 5-20 jaar, bij 27 onderzoeken > 10 jaar. Het gepoolde RR op VTE voor mensen die ooit hadden gerookt of dat nog steeds deden was 1,17 (95%-BI 1,09 tot 1,25) ten opzichte van mensen die nooit hadden gerookt. Het gepoolde RR voor mensen die nog steeds rookten was 1,23 (95%-BI 1,14 tot 1,33) ten opzichte van mensen die nooit hadden gerookt. Roken geeft dus een geringe verhoging van het risico op VTE.
Reizen
In een meta-analyse uit 2009 werd het risico op (symptomatische) VTE bij vliegreizen nagegaan. Er werden 14 onderzoeken geïncludeerd (11 patiëntcontroleonderzoeken, 2 cohortonderzoeken en 1 case-crossover), in totaal waren er 4055 VTE-patiënten. Het gepoolde RR op VTE voor reizigers van alle onderzoeken samen was 2,0 (95%-BI 1,5 tot 2,7) vergeleken met mensen die geen reis maakten. Er was forse heterogeniteit tussen de onderzoeken. Als 6 onderzoeken werden weggelaten waarbij de controlegroep bestond uit patiënten die van VTE werden verdacht maar dat vervolgens niet bleken te hebben, was er geen significante heterogeniteit en was het RR 2,8 (95%-BI 2,2 tot 3,7). Een eerdere meta-analyse vond een vergelijkbare verhoging van het risico van 2-4 keer. Het risico op VTE lijkt gerelateerd aan de duur van de vlucht; iedere 2 uur vliegen stijgt het risico met 18%.
Het absolute risico op een symptomatische VTE werd nagegaan in een cohortonderzoek onder 27.496 werknemers van internationale ondernemingen die gevolgd werden tussen 2000 en 2005. Dit onderzoek werd ook in de hiervoor beschreven review geïncludeerd. De werknemers werd per e-mail gevraagd een vragenlijst in te vullen, waarin gevraagd werd of ze een VTE hadden gehad. Zo ja, dan werd (na verkregen toestemming) het medisch dossier bekeken. Als expositie gold een vlucht van > 4 uur, maximaal 8 weken voorafgaand aan de diagnose. De respons was 8755 (32%) en het totaal aantal vluchten was 315.762, waarvan 100.208 meer dan 4 uur. De totale follow-uptijd bedroeg 38.910 persoonsjaren, gemiddeld 4,4 jaar per werknemer. In de follow-upperiode waren er 53 symptomatische VTE’s (34 DVT’s, 9 longembolieën, 8 beide en 2 tromboses van de arm), waarvan 22 binnen 8 weken na een vlucht van > 4 uur, dit was 3,2 per 1000 persoonsjaren na expositie, vergeleken met 1 per 1000 persoonsjaren zonder expositie (RR 3,2; 95%-BI 1,8 tot 5,6). Dit komt overeen met 1 VTE per 4656 vluchten van > 4 uur. Het risico nam toe met méér vluchten in korte tijd en met de duur van de vluchten. Het risico was het hoogst in de eerste 2 weken na een vlucht om dan in 8 weken geleidelijk tot baselineniveau te dalen.
Specifieke groepen
Het risico voor verschillende subgroepen werd onderzocht in een patiëntcontroleonderzoek met 1906 volwassenen die zich bij 6 trombosediensten presenteerden met een eerste episode VTE. Hun partners dienden als controlegroep. Er hadden 233 patiënten meer dan 4 uur gereisd in de 8 weken voorafgaand aan de VTE. De OR was 2,1 (95%-BI 1,5 tot 3,0). Het risico bij vliegreizen was even groot als bij auto-, bus- of treinreizen. Het risico was het hoogst in de eerste week na het reizen. Het risico op trombose bij vliegreizen was groter bij:
- vrouwen die orale anticonceptiva of oestrogenen gebruikten (geschatte OR 40, geschatte auto/bus/trein OR 20; geen betrouwbaarheidsintervallen vermeld)
- BMI > 30 (OR 2,6; 95%-BI 1,0 tot 6,4; auto/bus/trein OR 9,9; 95%-BI 3,6 tot 27,6)
- lengte > 1,90 m (OR 6,8; 95%-BI 0,8 tot 60,6; auto/bus/trein OR 4,7; 95%-BI 1,4 tot 15,4)
- lengte < 1,60 m (OR 4,9; 95%-BI 0,9 tot 25,6; auto/bus/trein OR 1,0; 95%-BI 0,3 tot 2,8)
- trombofilie (factor V Leiden) (OR 13,6; 95%-BI 2,9 tot 64,2; auto/bus/trein OR 8,1; 95%-BI 2,7 tot 24,7)
- protrombine 20210A (OR 7,9; 95%-BI 9,9 tot 67,2; auto/bus/trein OR 3,1; 95%-BI 0,3 tot 36,6)
In een cohortonderzoek onder bijna 9000 werknemers van internationale organisaties kwam ook leeftijd < 30 jaar als risicofactor naar voren (incidence rate ratio (IRR) 7,7; 95%-BI 1,6 tot 38,4), evenals orale anticonceptie, overgewicht en grote of kleine lengte.
Pathogenese en prognose
Naar Samenvatting ›DVT
- Een DVT ontstaat meestal in de kuitvenen. Circa 92% van de geïsoleerde kuitvenetromboses lost vanzelf weer op; de kans op het ontstaan van een longembolie is klein.
- Als de trombose doorgroeit tot voorbij de trifurcatie van de vena poplitea spreekt men van een proximale DVT; deze stolsels lossen niet vanzelf op zonder antistolling.
- Sporadisch ontstaat een DVT eerst in een bekkenvene, waarbij de trombus zich naar distaal kan uitbreiden. Dit treedt vooral op bij tumoren in het kleine bekken en soms in de zwangerschap.
- PTS ontstaat in geval van restobstructie, vaatwandschade of veneuze klepinsufficiëntie. Hierdoor schiet de kuitspierpomp tekort en blijft er in het onderbeen voortdurend een hoge veneuze druk bestaan, met als gevolg oedeem en een stoornis in de (micro)circulatie.
Longembolie
- Een longembolie ontstaat als er een stolsel losbreekt van een trombose in de onderste extremiteit, dat via het hart een longarterie bereikt en deze vervolgens afsluit. Soms ontstaan stolsels primair in de longen (bijvoorbeeld bij een COVID-19-infectie).
- De meeste longembolieën zijn multipel. Het beeld kan progressief zijn, soms met fatale gevolgen; bij ambulante, onbehandelde patiënten naar schatting circa 5%.
- Bij circa 70% van de patiënten met longembolie wordt ook een DVT gevonden; bij de rest wordt verondersteld dat het stolsel in de beenvenen volledig heeft losgelaten en niet meer traceerbaar is, of dat het stolsel toch primair in de longen is ontstaan.
- Bij 30-60% van de patiënten met een DVT zijn asymptomatische longembolieën gevonden (soms als toevalsbevinding).
- Na een longembolie kunnen chronische klachten optreden. Na 2 jaar kan tot de helft van de patiënten nog klachten ervaren van vermoeidheid, kortademigheid en verminderd functioneren. Een zeldzame complicatie van longembolie is chronische trombo-embolische pulmonale hypertensie (CTEPH), veroorzaakt door blijvende obstructie van de longarteriën, met pulmonale hypertensie en hartfalen tot gevolg. Dit behoeft specialistische zorg, vaak in een tertiaire setting.
DVT en longembolie – natuurlijk beloop
DVT komt het meest voor in de onderste extremiteiten. De gedachte dat trombose meestal in de kuit begint en kan opstijgen, wordt doorgaans bevestigd in onderzoek.
In retrospectief onderzoek werd de distributie van de veneuze trombi bekeken bij patiënten die waren opgenomen met de diagnose longembolie (n = 38) of DVT van de onderste extremiteiten (n = 191). De verdeling van de lokalisatie van de trombi was: vena poplitea 77%, vena femoralis superficialis 76%, vena femoralis communis 65%, vena tibialis posterior 23%, vena iliaca externa 21%, vena iliaca communis 9%, vena saphena magna 7% en vena cava inferior 2%. Bij slechts 22% van de patiënten was er sprake van 1 lokalisatie van de trombus. Bij 14% van de patiënten werd ook in het asymptomatische been DVT vastgesteld. In een cohortonderzoek (n = 21.680; leeftijd > 45 jaar; follow-up 7,6 jaar) werden 267 gevallen van DVT geïdentificeerd, 58 gevallen van longembolie en 41 gevallen van DVT met longembolie. Van de DVT was 91% gelokaliseerd in de onderste extremiteiten.
DVT van de beenvenen is de meest frequente oorzaak van longembolieën. Beide aandoeningen worden beschouwd als uitingen van hetzelfde ziektebeeld en worden daarom ook wel aangeduid met de overkoepelende term ‘veneuze trombo-embolie’ (VTE). Een DVT ontstaat meestal in de kuitvenen. Het merendeel van deze geïsoleerde kuitvenetromboses lost vanzelf weer op. Bij een trombose die zich beperkt tot de kuitvenen is de kans op een longembolie klein. Een deel (8%) van de symptomatische kuitvenetromboses groeit door naar een proximaal gelegen vene en kan dan aanleiding geven tot een longembolie. De mortaliteit van DVT hangt nauw samen met het ontstaan van longembolieën. DVT kan bij zo’n 70% van de patiënten met longembolie worden gevonden bij de overige patiënten wordt verondersteld dat het volledige stolsel heeft losgelaten. Omgekeerd werden bij 30-60% van de patiënten met een symptomatische proximale DVT asymptomatische longembolieën gevonden. Het natuurlijke beloop van een symptomatische longembolie is niet goed bekend, omdat het sinds de introductie van heparine onethisch is dergelijk onderzoek te verrichten.
Mortaliteit van longembolie bij ambulante patiënten
De kans op overlijden aan een longembolie is niet exact bekend. De literatuur noemt percentages van wel 18-35%, maar deze zijn gebaseerd op oud onderzoek met kleine patiëntenaantallen en methodologische tekortkomingen. Een analyse van gemiste of onbehandelde longembolieën bij ambulante patiënten gaf een geschatte mortaliteit van ongeveer 5%.
Geïsoleerde kuitvenetrombose – natuurlijk beloop
In een systematisch literatuuronderzoek (2012) naar het natuurlijke beloop van een trombose onder het niveau van de knie, een ‘geïsoleerde kuitvenetrombose’, werden 31 onderzoeken vergeleken: 6 RCT’s en 25 cohortonderzoeken. De kwaliteit van de onderzoeken liep sterk uiteen. Het gemiddelde percentage progressie was 15% bij niet-behandelde patiënten; als de analyse werd gedaan met de kwalitatief betere onderzoeken 8%. Bij 8% trad progressie van de trombose binnen de kuitvenen op, bij 4% naar de vena poplitea en bij 3% naar de vena femoralis. Bij 0,4% van de patiënten waren er longembolieën. Volgens de reviewers moet dit met terughoudendheid worden gerapporteerd vanwege de matige kwaliteit van de onderzoeken. Mogelijk is het percentage (veel) lager in laagrisicogroepen (uitgelokte trombose).
Richtlijnen diagnostiek
Naar Samenvatting ›- Het klinische beeld van een DVT varieert van acuut ontstane zwelling, roodheid, vaattekening en pijn tot slechts een van deze symptomen.
- Hetzelfde geldt voor longembolieën. Alle bij Anamnese genoemde klachten zoals kortademigheid en hoesten kunnen aanwezig zijn, maar soms zijn er slechts weinig of geen klachten.
- Het is niet mogelijk om een vermoeden van DVT of longembolie alleen op basis van anamnese en lichamelijk onderzoek te bevestigen of uit te sluiten.
- Bij een groot deel van de patiënten is een VTE met grote waarschijnlijkheid uit te sluiten met behulp van een beslisregel en een D-dimeerbepaling. Hiermee kan voor ongeveer de helft van de patiënten verwijzing voor beeldvormend onderzoek vermeden worden.
Spoed
Naar Samenvatting ›- Gebruik bij twijfel over de klinische stabiliteit van de patiënt de ABCDE-systematiek.
- Bij een ABCDE-instabiele patiënt: zie NHG-Behandelrichtlijn Geneesmiddelen en zuurstof in spoedeisende situaties; verwijs zo nodig (A1-urgentie).
Anamnese
Naar Samenvatting ›Vraag naar de volgende klachten en verschijnselen:
- duur en beloop van de klachten
- aard en lokalisatie van de klachten
- kortademigheid (bij inspanning), pijn op de borst of pijn vastzittend aan de ademhaling, hoesten, bloed ophoesten, collaps(neiging)
- pijn, zwelling en/of roodheid (minder goed te herkennen op een donker huidtype) van het been
- vraag bij klachten van het been en vermoeden van DVT ook actief naar klachten van de luchtwegen zoals kortademigheid en hoesten
Vraag verder naar:
- andere (begeleidende) klachten met het oog op de differentiaaldiagnose, zoals koorts, hartkloppingen, drukkende pijn op de borst, pijn bij inspanning, houdingsafhankelijke pijn, scheurende pijn tussen de schouderbladen, ontstaan na zware inspanning of recent trauma, sputum ophoesten
- risicofactoren voor VTE, zoals positieve familieanamnese (zie Risicofactoren)
Klachten en bevindingen bij DVT
In een meta-analyse van 54 diagnostische cohortonderzoeken bij patiënten met het vermoeden van DVT (n = 6000) werden de positieve en negatieve likelihood ratio’s (LR) van individuele anamnestische gegevens en symptomen, het klinische oordeel van de arts en de Wells-regel bekeken. Vrijwel alle onderzoeken werden uitgevoerd in de tweede lijn. Met geen enkel afzonderlijk anamnestisch gegeven of symptoom kon betrouwbaar een DVT worden aangetoond of uitgesloten. In de analyse werden de volgende kenmerken bekeken: pijn in de kuit, zwelling van de kuit, DVT in de voorgeschiedenis, maligniteit, recente immobilisatie, recente chirurgische ingreep, obesitas, verschil in omtrek van de kuit, teken van Homans, warmte, gespannenheid van de kuit, erytheem, oedeem, Wells-regel en klinisch oordeel van de arts. Enige waarde hadden de volgende bevindingen: DVT in de voorgeschiedenis, maligniteit, recente immobilisatie, verschil in kuitomtrek en recente chirurgie hadden een gepoolde positieve LR van respectievelijk 2,25 (95%-BI 1,57 tot 3,23), 2,71 (95%-BI 2,16 tot 3,39), 1,98 (95%-BI 1,70 tot 2,30), 1,8 (95%-BI 1,48 tot 2,19) en 1,76 (95%-BI 1,40 tot 2,20). De afwezigheid van zwelling van de kuit en verschil in kuitomtrek hadden een gepoolde negatieve LR van 0,67 (95%-BI 0,58 tot 0,78), respectievelijk 0,57 (95%-BI 0,44 tot 0,72). Het teken van Homans had een positieve LR van 1,40 (95%-BI 1,18 tot 1,66) en een negatieve LR van 0,87 (95%-BI 0,79 tot 0,96). De positieve LR van een verhoogde risicoscore op de Wells-regel was aanzienlijk hoger (5,2; 95%-BI 4,0 tot 6,0). Bij een niet-verhoogde risicoscore was de negatieve LR 0,25 (95%-BI 0,21 tot 0,29).
Klachten en bevindingen bij longembolie
In een cohortonderzoek van 192 patiënten bij wie een acute longembolie was aangetoond met een CT-scan werd nagegaan welke symptomen en klachten patiënten met een longembolie hebben. Anamnestisch had 79% van de patiënten last van dyspneu, 16% alleen bij inspanning. De dyspneu ontstond in seconden (41%), minuten (26%), uren (14%) of dagen (19%). Thoracale pijn vastzittend aan de ademhaling trad op bij 47% van de patiënten, hoesten bij 43%. 47% van de patiënten had óók klachten van de kuit of het dijbeen.
Bij lichamelijk onderzoek werd bij 54% van de patiënten een tachypneu (> 20/min) gevonden, bij 24% tachycardie (> 100/min), verminderd ademgeruis (12%) en crepitaties (14%). Bij 47% van de patiënten werden tekenen van DVT aan kuit of dijbeen gevonden. Circulatoire collaps trad bij 8% van de patiënten op.
In het AMUSE-2-cohortonderzoek werd bij 73 van de 598 geïncludeerde patiënten (12%) een longembolie geconstateerd. Bij hen werd een vergelijkbare symptomatologie gevonden: pijn vastzittend aan de ademhaling (66%), acute dyspneu (56%), acuut begin van de klachten (77%), hoesten (34%), eenzijdige pijn in het been (40%), hemoptoë (7%). De gemiddelde duur van de klachten was 6 dagen. Bij lichamelijk onderzoek vond de huisarts bij 34% van de patiënten tachycardie, bij 29% tachypneu en bij 36% tekenen van DVT.
Bij 965 patiënten met een vermoeden van een longembolie op de SEH werd nagegaan hoe vaak er thoracale drukpijn aanwezig was. Thoracale drukpijn was aanwezig bij 38 van de 222 patiënten met een longembolie (sensitiviteit 17%; 95%-BI 13 tot 23%) en afwezig bij 590 van de 743 patiënten zonder longembolie (specificiteit 79%; 95%-BI 76% tot 82%). De positieve LR was 0,83 (95%-BI 0,60 tot 1,14) en de negatieve LR was 1,04 (95%-BI 0,97 tot 1,12). Ondanks de vele methodologische beperkingen van dit onderzoek kan worden geconcludeerd dat met de aanwezigheid van lokale drukpijn een longembolie niet kan worden uitgesloten.
Lichamelijk onderzoek
Naar Samenvatting ›Bij klachten die wijzen op DVT
Verricht het volgende lichamelijk onderzoek:
- inspecteer beide benen en let op links-rechtsverschillen:
- huid, let op kleurverschil en oedeem
- uitgezette venen bij liggende patiënt
- palpeer het aangedane been:
- drukpijn over het verloop van een vene
- drukpijn diep in de kuit
- meet het verschil (in cm) in de maximale kuitomvang op 10 cm distaal vanaf de onderrand van de tuberositas tibiae
- meet op indicatie de temperatuur
Bij klachten die wijzen op longembolie
Verricht het volgende lichamelijk onderzoek:
- vitale functies: bloeddruk, zuurstofsaturatie, pols- en ademhalingsfrequentie, en op indicatie temperatuur. Let op: een goede zuurstofsaturatie sluit een longembolie niet uit.
- auscultatie: crepitaties, verminderd ademgeruis. Let op: bij auscultatie meestal geen afwijkingen.
- inspectie en palpatie van beide benen (zie Bij klachten die wijzen op DVT)
Zuurstofsaturatiemeting
Omdat tegenwoordig bijna alle huisartsen(posten) de beschikking hebben over een saturatiemeter, heeft de saturatiemeting in de vorige herziening al een plaats gekregen in deze standaard. Hoewel een goede saturatie niet een longembolie uitsluit, geeft het wel een indicatie met name voor eventuele instabiliteit van de patiënt waarop gehandeld moet worden.
In een onderzoek uitgevoerd op 12 Amerikaanse SEH’s en 1 SEH in Nieuw-Zeeland onder 8138 patiënten bij wie een longembolie werd overwogen, werd onder andere de waarde van saturatiemeting geëvalueerd. Bij 1666 patiënten onder de 50 jaar was er een lage klinische vermoeden van (gebaseerd op het klinische oordeel van de arts en niet gebaseerd op een klinische beslisregel) en bleek een saturatie > 95%, in combinatie met een pols < 100/min, geen oestrogeengebruik, geen hemoptoë, geen operatie afgelopen 4 weken, geen eerdere VTE en geen zwelling van het been een longembolie veilig uit te sluiten. Na 45 dagen follow-up bleken 15 patiënten toch een VTE te hebben en 1 was overleden (1,0%; 95%-BI 0,6 tot 1,6%); de oorzaak van het overlijden wordt niet vermeld. Deze bevindingen zijn niet afkomstig uit de eerste lijn en er is dus onvoldoende bewijs om een longembolie op grond van een normale saturatie uit te sluiten. Een lage zuurstofsaturatie zal echter de vermoeden van relevante pathologie vergroten en in veel gevallen tot handelen leiden, al is deze bevinding niet specifiek voor een longembolie.
Meting lichaamstemperatuur
Het meten van de lichaamstemperatuur heeft vooral differentieel diagnostische betekenis. Bij roodheid van het been in combinatie met koorts is erysipelas waarschijnlijker, en bij kortademigheid, hoesten en koorts wordt een pneumonie waarschijnlijker. Om deze redenen wordt het meten van de lichaamstemperatuur in de standaard geadviseerd; al sluit de aanwezigheid van koorts zowel DVT als longembolie niet volledig uit.
Aanvullend onderzoek
Naar Samenvatting ›Beslisregel en D-dimeer bij vermoeden van DVT
Naar Samenvatting ›We bevelen bij het vermoeden van een DVT het gebruik van de Eerstelijnsbeslisregel DVT aan, afhankelijk van de score in combinatie met een D-dimeerbepaling met een vaste afkapwaarde, om de diagnose uit te sluiten (zie tabel 1).
De Eerstelijnsbeslisregel heeft een lage failure rate en voldoende efficiëntie en huisartsen zijn goed bekend met deze regel. Op basis van het beschikbare onderzoek kan niet bepaald worden of de Wells-regel (met vaste afkapwaarde, leeftijdsafhankelijke afkapwaarde of afkapwaarde gebaseerd op de score) beter presteert dan de Eerstelijnsbeslisregel wat betreft failure rate en efficiëntie. Bovendien moeten er voor de Wells-regel meer items worden verzameld en is er daardoor potentieel meer risico op foute scoring. Daarom heeft de werkgroep een voorkeur voor de huidige Eerstelijnsbeslisregel. De afkapwaarde van D-dimeer wordt aangehouden zoals in het oorspronkelijke onderzoek (0,4-0,5 mg/L, afhankelijk van het laboratorium). Er is geen onderzoek gedaan met de Eerstelijnsbeslisregel in combinatie met een afkapwaarde gebaseerd op leeftijd of op de score van de beslisregel.
Gewenste en ongewenste effecten
Het voordeel van het gebruik van een klinische beslisregel als diagnostische strategie is dat bij een aanmerkelijk deel van de patiënten DVT veilig kan worden uitgesloten en geen aanvullende diagnostiek nodig is. Nadeel van deze strategie is dat bij een kleine deel van de patiënten de diagnose DVT wordt gemist. Deze voor- en nadelen gelden zowel in de eerste als in de tweede lijn. De Eerstelijnsbeslisregel en de Wells-regel hebben een failure rate onder de algemeen geaccepteerde drempel van 2%. Een voordeel van de Eerstelijnsbeslisregel is dat deze in de eerste lijn in Nederland is onderzocht en inmiddels is geïmplementeerd. De regel wordt ook gehanteerd in de huidige NHG-Standaard.
Kwaliteit van bewijs
Een voordeel is dat de gebruikte onderzoeken allemaal cross-sectioneel of prospectief zijn opgezet. Een nadeel zijn de kleine patiëntenaantallen, waardoor de betrouwbaarheidsintervallen relatief breed zijn en de marge van 2% overschrijden. De overall kwaliteit van bewijs hebben we beoordeeld als redelijk tot laag.
Waarden en voorkeuren van patiënten
Patiënten zullen een voorkeur hebben voor het veilig uitsluiten van DVT zonder verwijzing voor vervolgdiagnostiek. Daarbij zal het niet uitmaken welke beslisregel wordt toegepast en hoe de D-dimeerwaarde wordt geïnterpreteerd, zo lang dit leidt tot een aanvaardbaar laag risico op gemiste DVT-diagnoses en een aanvaardbaar laag aantal verwijzingen. Een gemiste diagnose zal daarbij voor de meeste patiënten zwaarder wegen dan een onnodige verwijzing (inschatting van de werkgroep).
Kosten
Niet bepaald.
Aanvaardbaarheid
Diagnostiek van DVT op basis van beslisregel en D-dimeerbepaling wordt al geruime tijd uitgevoerd in de huisartsenpraktijk en is voor huisartsen en patiënten een aanvaardbare methode. Dit is niet verschillend voor de verschillende beslisregels of afkapwaarden van D-dimeer, hoewel er wel meer items verzameld moeten worden voor de Wells-regel (10 items) dan voor de Eerstelijnsbeslisregel (7 items) (inschatting van de werkgroep).
Haalbaarheid
Zowel de Wells-regel als de Eerstelijnsbeslisregel is goed uit te voeren in de dagelijkse praktijk. Veel huisartsen zijn inmiddels bekend met de Eerstelijnsbeslisregel. De items van de regel zijn gemakkelijk te verzamelen tijdens het consult. Bij veel laboratoria is een cito D-dimeerbepaling mogelijk. Hoewel de tijdige terugkoppeling van D-dimeeruitslagen een punt van aandacht blijft, wordt er in steeds meer regio’s goed geanticipeerd op een uitslag in de ANW-uren of zijn daar afspraken over gemaakt. Uit onderzoek blijkt dat de klinische beslisregel regelmatig niet wordt toegepast voorafgaand aan een D-dimeerbepaling. Dit heeft niet geleid tot een hogere failure rate. Het blijft belangrijk dat huisartsen de regel juist toepassen, zodat er niet meer patiënten dan noodzakelijk worden verwezen voor compressie-echografie.
Uitgangsvraag
Welke diagnostische strategie (beslisregel in combinatie met D-dimeerbepaling) is aan te bevelen voor het uitsluiten van DVT in de huisartsenpraktijk? Zie de PICO-tabel.
|
Patiënten |
Patiënten in de huisartsenpraktijk met een vermoeden van DVT |
|---|---|
|
Interventie |
Combinatie van:
|
|
Vergelijking |
Eerstelijnsbeslisregel met vaste D-dimeerafkapwaarde |
|
Uitkomstmaten |
Failure rate (foutnegatieve testuitslagen/negatieve testuitslagen) Efficiëntie (negatieve testuitslagen/totaal) |
Achtergrond
Het doel van een beslisregel, gecombineerd met een D-dimeerbepaling, is om een DVT veilig uit te kunnen sluiten bij patiënten in de eerste lijn met een vermoeden van DVT. Daarbij zijn 2 uitkomsten van belang: de failure rate (aantal foutnegatieve testuitslagen gedeeld door het totaal aantal negatieve testuitslagen) en de efficiëntie (aantal negatieve testuitslagen gedeeld door het totaal aantal patiënten). De failure rate moet zo laag mogelijk zijn om zo weinig mogelijk gevallen van DVT te missen. Vaak wordt hiervoor een maximale failure rate van 2% aangehouden. De efficiëntie, en dan vooral het aantal terecht-negatieve testuitslagen, moet echter zo hoog mogelijk zijn, want dat betekent dat het aantal verwijzingen voor onnodige diagnostiek zo laag mogelijk is. In de voorgaande versie van deze NHG-Standaard werd gebruikgemaakt van de Eerstelijnsbeslisregel in combinatie met een D-dimeerbepaling om DVT uit te sluiten. De vraag is of er een nieuwe of andere beslisregel is met een betere failure rate en efficiëntie.
Voor de D-dimeerbepaling werd voorheen een vaste afkapwaarde gebruikt (0,4-0,5 mg/L afhankelijk van het type kwantitatieve test, of positieve/negatieve uitslag bij gebruik van een kwalitatieve test). Om de efficiëntie van de test te verhogen zijn er verschillende andere manieren voorgesteld om de D-dimeerwaarde te interpreteren. De 2 meest onderzochte zijn een leeftijdsafhankelijke afkapwaarde (waarbij voor hogere leeftijd een hogere afkapwaarde wordt gehanteerd, bijvoorbeeld leeftijd/100 mg/L) en een afkapwaarde die afhangt van de inschatting van de kans op DVT door de beslisregel (waarbij bij een lagere voorafkans op DVT een hogere afkapwaarde wordt gehanteerd). De vraag is of een aangepaste afkapwaarde in de eerste lijn ook tot efficiënt, maar veilig uitsluiten van DVT leidt.
Methoden
Er is een systematische literatuurzoekactie naar SR’s, RCT’s en observationeel onderzoek uitgevoerd in PubMed en Embase. In mei 2021 is een zoekactie uitgevoerd naar beslisregels, in januari 2022 naar de afkapwaarde van D-dimeer. In december 2022 is een update van de searches gedaan.
Resultaten
Resultaat zoekactie
Beslisregels
De zoekactie naar beslisregels leverde een systematisch literatuuronderzoek op naar beslisregels voor DVT, waarin ook specifiek onderzoek in eerstelijnspopulaties is beschreven. Ook vonden we een individuele patiëntendata–meta-analyse (IPD-MA) naar de Wells-regel; dit onderzoek werd overigens ook geïncludeerd door Kafeza et al. Een aanvullende search na de zoekdatum van de SR van Kafeza (november 2015) leverde geen aanvullende onderzoeken naar nieuwe beslisregels voor de eerste lijn op, maar wel een onderzoek waarin het toepassen van de Eerstelijnsbeslisregel met D-dimeerbepaling in de eerstelijnspopulatie werd onderzocht. De update van de search leverde geen nieuw onderzoek op.
Kafeza et al. includeerden 102 artikelen in de SR, waarin 8 beslisregels werden beschreven. Daarvan zijn er 2 ontwikkeld en/of gevalideerd in eerstelijnspopulaties en worden gecombineerd met een D-dimeerbepaling. Dit zijn de Wells-regel en de Eerstelijnsbeslisregel, beide voor DVT. De overige 6 zijn alleen in de tweede lijn gevalideerd en laten we daarom buiten beschouwing.
Voor validatie van de Wells-regel in de eerste lijn hebben Kafeza et al. een IPD-MA geïncludeerd. Hierin werden 13 onderzoeken naar de Wells-regel geïncludeerd, waarvan 3 in eerstelijnspopulaties. Daarnaast hebben Kafeza et al. een Duits eerstelijnsonderzoek geïncludeerd. In alle onderzoeken werd de gemodificeerde en gedichotomiseerde Wells-regel in combinatie met een D-dimeerbepaling onderzocht. Voor validatie van de Eerstelijnsbeslisregel hebben Kafeza et al. dezelfde 3 onderzoeken geïncludeerd als Geersing et al.
Afkapwaarde D-dimeer
De zoekactie naar de afkapwaarde van D-dimeer leverde een IPD-MA op naar de interpretatie van de D-dimeerbepaling voor de diagnose van DVT en een SR naar de op leeftijd gebaseerde afkapwaarde van D-dimeer voor de diagnose van DVT. Een aanvullende search na de zoekdatum van deze IPD-MA (november 2016) leverde geen aanvullende onderzoeken naar interpretatie van D-dimeer in de eerste lijn op; ook de update van de search leverde geen nieuw onderzoek op. In de IPD-MA van Parpia et al. werden 4 onderzoeken geïncludeerd. 1 van deze onderzoeken is uitgevoerd in een eerstelijnspopulatie en gebruiken we als basis voor de aanbeveling over de interpretatie van de D-dimeerbepaling. In de SR van Nybo et al. werden 8 onderzoeken geïncludeerd, die geen van alle in de eerste lijn zijn uitgevoerd. Daarom laten we deze SR verder buiten beschouwing.
Onderzoekskarakteristieken
- Kafeza 2017: SR naar beslisregels voor DVT. Er werden 2 beslisregels beschreven die zijn ontwikkeld en/of gevalideerd in eerstelijnspopulaties en worden gecombineerd met een D-dimeerbepaling: de Wells-regel en de Eerstelijnsbeslisregel, beide voor DVT. Deze worden beschreven op basis van de onderstaande artikelen.
- Geersing 2014: IPD-MA naar de Wells-regel, waarbij een subgroepanalyse in de eerste lijn is uitgevoerd. Hierin werden 13 onderzoeken naar de Wells-regel geïncludeerd, waarvan 3 in Nederlandse eerstelijnspopulaties met in totaal 2855 patiënten.
- Parpia 2020: IPD-MA naar de interpretatie van D-dimeer voor de diagnose van DVT. Er werden 4 onderzoeken geïncludeerd. 1 daarvan is uitgevoerd in een eerstelijnspopulatie.
- Oudega 2005: in dit onderzoek is de Eerstelijnsbeslisregel ontwikkeld. Het is een cross-sectioneel onderzoek in huisartsenpraktijken gelieerd aan 3 niet-academische ziekenhuizen in Nederland. 110 huisartsen hebben 1295 opeenvolgende patiënten (gemiddelde leeftijd 60 ± 18 jaar, 64% vrouw) met een vermoeden van DVT geïncludeerd, tussen 1 januari 2002 en 1 juni 2003. De huisartsen namen bij elke patiënt een anamnese en lichamelijk onderzoek af, waarin potentiële diagnostische determinanten systematisch werden gedocumenteerd. Vervolgens werd in het ziekenhuis bloed afgenomen voor de bepaling van D-dimeer met een ELISA-methode (Vidas®) of een latex assay-methode (Tinaquant®) en werd een compressie-echografie uitgevoerd voor het vaststellen van DVT. Bij patiënten bij wie op de compressie-echografie geen DVT werd gezien, werd de compressie-echografie na 7 dagen herhaald. 22% van de patiënten had een DVT. Met de gegevens uit anamnese en lichamelijk onderzoek werd een zo goed mogelijk voorspellend model voor de kans op DVT samengesteld, waarna als laatste stap D-dimeer aan het model werd toegevoegd. Dit model werd vervolgens vereenvoudigd om gebruik in de dagelijkse huisartsenpraktijk te faciliteren.
- Toll 2006: cross-sectioneel onderzoek om de Eerstelijnsbeslisregel te valideren. Het onderzoek is uitgevoerd in dezelfde huisartsenpraktijken en volgens exact dezelfde opzet als het onderzoek van Oudega et al. Tussen 1 juni 2003 en 1 juni 2005 werden 532 opeenvolgende patiënten (gemiddelde leeftijd 60 ± 17 jaar, 60% vrouw) geïncludeerd. 18% van de patiënten had een DVT.
- Büller 2009: prospectief onderzoek om de Eerstelijnsbeslisregel te valideren, maar dan met gebruik van een POCT voor D-dimeer. Het onderzoek werd uitgevoerd in 300 huisartsenpraktijken gelieerd aan 3 academische ziekenhuizen in Nederland. Er werden 1028 patiënten met een vermoeden van DVT (gemiddelde leeftijd 58 ± 17 jaar, 63% vrouw) geïncludeerd bij wie alle items van de Eerstelijnsbeslisregel werden gedocumenteerd. D-dimeer werd bepaald met een POCT (Clearview Simplify®). Patiënten die op de Eerstelijnsbeslisregel ≤ 3 scoorden werden niet verwezen voor compressie-echografie, patiënten met een score ≥ 4 werden verwezen voor compressie-echografie. Alle patiënten werden na 5-9 dagen nogmaals gezien door de huisarts. Na 3 maanden ontvingen de patiënten een vragenlijst over symptomen van VTE. Als er op basis hiervan een vermoeden van VTE was, werd via de huisarts extra informatie opgevraagd, inclusief brieven van medisch specialisten, om het optreden van VTE binnen 3 maanden vast te stellen. Bij 125 (13%) van de patiënten was een DVT vastgesteld na de eerste compressie-echografie; na de 3 maanden follow-up kwamen er 11 gevallen bij (7 in de groep die initieel niet was verwezen voor echografie, 4 in de groep die wel al een compressie-echografie had gehad; totaal percentage 14%).
- El Tabei 2012: prospectief onderzoek om de Wells-regel voor DVT te valideren. Het onderzoek werd uitgevoerd in huisartsenpraktijken in Duitsland. Er werden 395 patiënten met een vermoeden van DVT (gemiddelde leeftijd 61 jaar, 51% vrouw) geïncludeerd. Bij deze patiënten werd de Wells-regel voor DVT bepaald. Bij een score ≤ 1 werd D-dimeer bepaald met een POCT (Clearview Simplify®) en vervolgens een compressie-echografie uitgevoerd als de D-dimeeruitslag positief was. Bij patiënten met een score > 1 werd een compressie-echografie uitgevoerd. Na 6 weken werd er een vragenlijst verstuurd om na te gaan of er een DVT was opgetreden en wat het klinisch beloop was. 18% van de patiënten had een DVT.
- Van Maanen 2020: cohortonderzoek naar het uitvoeren van de diagnostische strategie voor het uitsluiten van DVT (Eerstelijnsbeslisregel in combinatie met D-dimeerbepaling) in de praktijk. Huisartsen kregen een korte instructie over de strategie, waarna zij patiënten met een vermoeden van DVT (n = 1017) includeerden en beschreven wat bij deze patiënten het diagnostisch traject was. Bij niet-verwezen patiënten werd na 3 maanden nagegaan of er een DVT was opgetreden, om de failure rate en efficiëntie van de strategie in de praktijk te bepalen.
Omschrijving onderzochte beslisregels en interpretatie D-dimeerbepaling
Wells-regel
Van de Wells-regel bestaan meerdere versies. In eerstelijnspopulaties is de gemodificeerde en gedichotomiseerde Wells-regel voor DVT in combinatie met een D-dimeerbepaling gevalideerd. Deze regel bestaat uit 10 items om de kans op DVT in te schatten. Een score ≤ 1 geeft een laag risico op DVT aan, een score ≥ 2 een hoog risico (zie tabel d1). Bij alle patiënten met een hoge score wordt vervolgens compressie-echografie uitgevoerd. Bij een lage score wordt eerst een D-dimeerbepaling gedaan om patiënten te identificeren bij wie DVT veilig kan worden uitgesloten, en bij wie geen compressie-echografie hoeft plaats te vinden. Bij een kwalitatieve D-dimeertest is dit het geval bij een negatieve uitslag; bij een kwantitatieve D-dimeertest is dit een waarde onder een bepaald afkappunt.
|
Item |
Score |
|
Active cancer (patient receiving treatment for cancer within the previous 6 months or currently receiving palliative treatment) |
1 |
|
Paralysis, paresis, or recent plaster immobilization of the lower extremities |
1 |
|
Recently bedridden for 3 days or more, or major surgery within the previous 12 weeks requiring general or regional anesthesia |
1 |
|
Localized tenderness along the distribution of the deep venous system |
1 |
|
Entire leg swollen |
1 |
|
Calf swelling at least 3 cm larger than that on the asymptomatic side (measured 10 cm below tibial tuberosity) |
1 |
|
Pitting edema confined to the symptomatic leg |
1 |
|
Collateral superficial veins (nonvaricose) |
1 |
|
Previously documented deep-vein thrombosis |
1 |
|
Alternative diagnosis at least as likely as deep-vein thrombosis |
–2 |
|
* A score ≥ 2 indicates that the probability of deep-vein thrombosis is likely; a score < 2 indicates that the probability of deep-vein thrombosis is unlikely. In patients with symptoms in both legs, the more symptomatic leg is used. |
|
Eerstelijnsbeslisregel
De Eerstelijnsbeslisregel bestaat uit 7 items om de kans op DVT in te schatten. Een score ≤ 3 punten geef een laag risico op DVT aan, een score ≥ 4 een hoog risico (zie tabel d2). De vervolgdiagnostiek (D-dimeerbepaling en/of compressie-echografie) is hetzelfde als bij de Wells-regel.
|
Item |
Score |
|
Mannelijk geslacht |
1 |
|
Gebruik systemische oestrogenen of prikpil |
1 |
|
Aanwezigheid maligniteit |
1 |
|
Operatie ondergaan in de laatste maand |
1 |
|
Afwezigheid van trauma dat zwelling in kuit verklaart |
1 |
|
Uitgezette venen van het been |
1 |
|
Verschil maximale kuitomvang ≥ 3 cm |
2 |
Interpretatie van D-dimeerbepaling
De D-dimeerwaarde wordt geïnterpreteerd als een positieve of een negatieve uitslag. Een kwantitatieve D-dimeertest is negatief bij een waarde onder een vooraf vastgestelde afkapwaarde en positief bij een waarde gelijk aan of groter dan die afkapwaarde. De afkapwaarde kan op verschillende manieren worden bepaald:
- Vaste afkapwaarde, meestal 0,5 mg/L.
- Leeftijdsafhankelijke afkapwaarde, namelijk 0,5 mg/L voor patiënten ≤ 50 jaar en leeftijd/100 mg/L voor patiënten > 50 jaar (bijvoorbeeld 0,65 ml/L voor een patiënt van 65 jaar en 0,8 mg/L voor een patiënt van 80 jaar).
- Afkapwaarde die afhangt van de inschatting van de kans op DVT door de beslisregel, namelijk 1 mg/L bij een lage voorafkans (Wells-score ≤ 1) en 0,5 mg/L bij een verhoogde voorafkans (Wells-score ≥ 2).
Uitkomsten
Zie tabel d3 voor de resultaten van de Eerstelijnsbeslisregel (alleen in combinatie met een vaste afkapwaarde van D-dimeer) en de Wells-regel (in combinatie met vaste afkapwaarde van D-dimeer, afkapwaarde gebaseerd op leeftijd en afkapwaarde gebaseerd op ingeschatte voorafkans op DVT).
|
Auteur, jaartal |
D-dimeer |
Aantal deelnemers/negatieve testuitslagen/foutnegatieve testuitslagen |
Failure rate (95%-BI) |
Efficiëntie (95%-BI) |
|
Eerstelijnsbeslisregel met D-dimeerbepaling |
||||
|
Oudega 2005 (derivatie) |
Vast, kwantitatief; Latex assay (Tinaquant®), drempelwaarde 0,4 mg/L of ELISA (Vidas®), drempelwaarde 0,5 mg/L |
1295/293/2 |
0,7% (0,1 tot 2,4%) |
23% (20 tot 25%) |
|
Toll 2006 (validatie) |
Vast, kwantitatief; Latex assay (Tinaquant®), drempelwaarde 0,4 mg/L of ELISA (Vidas®), drempelwaarde 0,5 mg/L |
532/112/0 |
0% (0 tot 3,2%) |
21% (18 tot 25%) |
|
Büller 2009 (validatie + POCT) |
Kwalitatief; POCT (Clearview Simplify®) |
1028/500/7 |
1,4% (0,6 tot 2,9%) |
49% (46 tot 52%) |
|
Wells-regel met D-dimeerbepaling |
||||
|
Geersing 2014 (IPD Oudega 2005, Toll en Büller) |
Diverse, vast of kwalitatief |
2855/ niet gerapporteerd, schatting 950/ niet gerapporteerd, schatting 13 |
1,4% (0,9 tot 2,3%) |
33% (22 tot 46%) |
|
El Tabei 2012 |
Kwalitatief; POCT (Clearview Simplify®) |
370/193/2 |
1,0% (0,1 tot 3,7%) |
52% (47 tot 57%) |
|
Parpia 2020 (gegevens Toll 2006) |
Gebaseerd op Wells-score, kwantitatief; Latex assay (Tinaquant®) of ELISA (Vidas®) |
532/176/1 |
0,6% (0 tot 3,1%) |
33% (29 tot 37%) |
|
Parpia 2020 (gegevens Toll) 2006 |
Gebaseerd op leeftijd, kwantitatief; Latex assay (Tinaquant®) of ELISA (Vidas®) |
532/180/1 |
0,6% (0 tot 3,1%) |
34% (30 tot 38%) |
Eerstelijnsbeslisregel in de praktijk
Van Maanen et al onderzochten de Eerstelijnsbeslisregel in de praktijk. In de totale populatie met vermoeden van DVT (n = 993) werden 465 patiënten niet verwezen (efficiëntie 46,8%) en 12 van hen hadden een VTE (failure rate 2,6%, 95%-BI niet gerapporteerd maar zelf berekend 1,3 tot 4,5%). Bij 787 (79,3%) van de patiënten met vermoeden van DVT was de diagnostische strategie correct uitgevoerd. Van deze patiënten werden er 408 niet verwezen (efficiëntie 51,8%) en 8 van hen hadden VTE (failure rate 1,96%; 95%-BI 0,91 tot 3,98%). Bij 206 patiënten (20,7%) was de diagnostische strategie niet goed toegepast. Van deze patiënten werden er 57 niet verwezen (efficiëntie 27,7%) en hadden er 4 een VTE (failure rate 7,02%, 95%-BI 2,27-17,83%).
De gemaakte fouten waren:
- het onterecht aanvragen (bij score ≥ 4) of achterwege laten (bij score ≤ 3) van een D-dimeerbepaling (in 50,5% van de gevallen)
- het toepassen van de beslisregel bij patiënten bij wie dit niet geïndiceerd is (28,6%)
- het verkeerd optellen van de score (10,7%)
- het onterecht verwijzen (bij score ≤ 3 en/of negatieve D-dimeer) of niet verwijzen (bij score ≥ 4 of positieve D-dimeer) (8,7%)
- het gebruiken van de verkeerde score, namelijk die voor longembolie (1,5%)
De belangrijkste determinanten voor het verkeerd toepassen van de score (voor DVT en longembolie samen, geen onderscheid gemaakt) waren hartfalen (OR 3,26; 95%-BI 1,47 tot 7,21), recente operatie of immobiliteit (OR 1,57; 95%-BI 1,00 tot 2,47), mannelijk geslacht (OR 1,45; 95%-BI 1,12 tot 1,85) en leeftijd ≤ 50 jaar (OR vergeleken met 50-75 jaar 1,41; 95%-BI 1,06 tot 1,85).
Contra-indicaties gebruik beslisregels
De beslisregels en D-dimeerbepaling zijn in de eerste lijn onvoldoende onderzocht bij zwangeren en vrouwen in de kraamperiode, en bij klachten > 30 dagen. Daarnaast is de D-dimeerwaarde niet goed te beoordelen bij bestaand gebruik van antistollingsmedicatie. Daarom is het advies bij deze groepen de beslisregels en D-dimeerbepaling niet te gebruiken maar direct aanvullend onderzoek of overleg met de tweede lijn te hebben.
Conclusies
- De Wells-regel en de Eerstelijnsbeslisregel leiden beide tot een failure rate < 2%, maar de 95%-BI overschrijdt in beide gevallen de vaak in de literatuur aangehouden maximale failure rate van 2%. De efficiëntie van beide regels ligt grofweg tussen de 20 en 50%.
- Ook de strategie met een D-dimeerafkapwaarde gebaseerd op leeftijd of op score (alleen onderzocht in combinatie met de Wells-regel) lijkt niet tot andere resultaten te leiden. Het is niet mogelijk op basis van het beschikbare onderzoek te bepalen welke strategie beter is.
- De veiligheid van de beslisregel hangt af van de juiste toepassing in de praktijk.
Combinatie oestrogeen en progesteron
Bij het ontwikkelen en valideren van de Eerstelijnsbeslisregel DVT is alleen ‘orale anticonceptie’ als diagnostische variabele geïdentificeerd en in de beslisregel opgenomen. Omdat de pleister en de vaginale ring werken door systemische afgifte van oestrogenen (en progestagenen), en omdat beide methoden geassocieerd zijn met een verhoogde kans op trombose (zie NHG-Standaard Anticonceptie), worden deze beschouwd als vergelijkbaar met orale anticonceptie en ook op de beslisregel gescoord. Het item is daarmee verruimd en veranderd in ‘Gebruik systemische oestrogenen’. Op grond van dezelfde redenering wordt het item ook gescoord bij hormoontherapie voor overgangsklachten.
Alleen progesteron
Er zijn op basis van een patiëntcontroleonderzoek aanwijzingen dat gebruik van een depot-medroxyprogesteronacetaat geassocieerd is met een verhoogd risico op veneuze trombose (OR 3,6; 95%-BI 1,8 tot 7,1) (zie NHG-Standaard Anticonceptie). Om deze reden is ‘gebruik van de prikpil’ aan het item toegevoegd. Over de risico’s van het implantatiestaafje kon geen uitspraak gedaan worden. Het risico bij een hormoonspiraal was niet verhoogd (OR 0,3; 95%-BI 0,1 tot 1,1). 32 Ook het risico bij gebruik van de pil met alleen progestageen (desogestrel 75 microg) was niet verhoogd (RR 1,10; 95%-BI 0,35 tot 3,41). De kwaliteit van dit bewijs is laag.
Overweging
Het scoren van het item ‘gebruik systemische oestrogenen of prikpil’ bij anticonceptie door middel van pleister of vaginale ring en hormoontherapie bij overgangsklachten berust op pathofysiologische overwegingen. De consequenties van deze verruiming beperken zich tot een eventuele extra verwijzing voor echografie.
Advies
Bij de volgende situaties wordt het item op de beslisregel ‘gebruik hormonale anticonceptie of prikpil’ gescoord: combinatiepreparaten met oestrogeen en progestageen; de pil, vaginale ring, pleister, of de prikpil. Methodes met alleen progestagenen (behalve de prikpil) en hormoonspiraal vallen hierbuiten.
Beslisregel en D-dimeer bij vermoeden van longembolie
Naar Samenvatting ›We bevelen bij het vermoeden van een longembolie het gebruik van het YEARS-algoritme (beslisregel en D-dimeerbepaling) aan om de diagnose uit te sluiten (zie tabel 2).
Zowel het YEARS-algoritme als de Wells-regel met afkapwaarde gebaseerd op voorafkans (score beslisregel) zijn veilig en efficiënt (het zijn de 2 veiligste en efficiëntste van alle onderzochte strategieën). Steeds meer ziekenhuizen gebruiken het YEARS-algoritme. Op basis van een IPD-MA acht de werkgroep de kans zeer groot dat het YEARS-algoritme ook in de eerste lijn veilig is (zeer lage failure rate). Ook heeft het YEARS-algoritme een hoge efficiëntie: ruim de helft van de patiënten met vermoeden van longembolie hoeft niet voor nadere diagnostiek verwezen te worden. Het YEARS-algoritme bestaat uit slechts 3 criteria, waardoor de kans op scoringsfouten verkleind wordt. Kortom, het YEARS-algoritme is het eenvoudigst toe te passen met naar verwachting de kleinste kans op fouten.
Gewenste en ongewenste effecten
Het voordeel van een diagnostische strategie is dat een deel van de patiënten niet verwezen hoeft te worden voor vervolgdiagnostiek. Het nadeel is dat bij een deel van de patiënten een diagnose van VTE kan worden gemist. Ook bij een CT-scan wordt echter een percentage (tot ongeveer 2%) gemist. Bij de Wells-regel in combinatie met een afkapwaarde van D-dimeer gebaseerd op de voorafkans op longembolie en bij het YEARS-algoritme lijkt de balans tussen de voor- en nadelen het beste: de efficiëntie is hoog en er worden weinig gevallen van longembolie gemist.
Kwaliteit van bewijs
Een voordeel is dat de gebruikte onderzoeken allemaal cross-sectioneel of prospectief zijn opgezet. Een nadeel zijn de kleine patiëntenaantallen bij de validatie van de regels die niet in de IPD-MA zijn meegenomen, waardoor de betrouwbaarheidsintervallen hiervan breed zijn. De overall kwaliteit van bewijs hebben we beoordeeld als redelijk tot laag.
Waarden en voorkeuren van patiënten
Patiënten zullen een voorkeur hebben voor het veilig uitsluiten van longembolie zonder verwijzing voor vervolgdiagnostiek. Daarbij zal het niet uitmaken welke beslisregel wordt toegepast en hoe de D-dimeerwaarde wordt geïnterpreteerd, zo lang dit leidt tot een aanvaardbaar laag risico op gemiste diagnoses en een aanvaardbaar laag aantal verwijzingen. Omdat ook bij een CT-scan een klein percentage (tot 2%) wordt gemist, zal dat aanvaardbare risico op ongeveer 2% liggen. Overdiagnostiek kan ook belastend zijn, zowel voor de tweede lijn als voor de patiënt (stralingsbelasting, contrastvloeistof, overmatige antistolling bij subsegmentele longembolieën die wel bloedingen kunnen geven, vooral bij oudere patiënten).
Kosten
Niet bepaald.
Aanvaardbaarheid
Diagnostiek van longembolie op basis van beslisregel en D-dimeerbepaling wordt al geruime tijd uitgevoerd in de huisartsenpraktijk en is voor huisartsen en patiënten een aanvaardbare methode. Dit is niet verschillend voor de verschillende beslisregels of afkapwaarden van D-dimeer (inschatting van de werkgroep).
Haalbaarheid
Het is belangrijk dat huisartsen de regel op de juiste manier toepassen, omdat dit anders ten koste gaat van de efficiëntie en de veiligheid. De onderzochte beslisregels zijn goed uit te voeren in de dagelijkse praktijk. Veel huisartsen zijn inmiddels bekend met de Wells-regel, die in de vorige versie van de standaard werd gebruikt. De items van de regel zijn gemakkelijk te verzamelen tijdens het consult. Het toepassen van het YEARS-algoritme is nog eenvoudiger, omdat huisartsen hiervoor slechts 3 factoren hoeven te scoren.
Laboratoria zijn goed bekend met een cito bepaling van de D-dimeer dezelfde dag en in steeds meer regio’s wordt er goed geanticipeerd op een uitslag in de diensturen of zijn daar afspraken over gemaakt.
Uitgangsvraag
Welke diagnostische strategie (beslisregel in combinatie met D-dimeerbepaling) is aan te bevelen voor het uitsluiten van longembolie in de huisartsenpraktijk? Zie de PICO-tabel.
|
Patiënten |
Patiënten in de huisartsenpraktijk met een vermoeden van longembolie |
|---|---|
|
Interventie |
Combinatie van:
|
|
Vergelijking |
Wells-regel met vaste D-dimeerafkapwaarde (zoals aanbevolen in vorige versie van de NHG-standaard) |
|
Uitkomstmaten |
Failure rate (foutnegatieve testuitslagen/negatieve testuitslagen) Efficiëntie (negatieve testuitslagen/totaal) |
Achtergrond
Het doel van een beslisregel, gecombineerd met een D-dimeerbepaling, is om een longembolie veilig uit te kunnen sluiten bij patiënten in de eerste lijn met een vermoeden van longembolie. Daarbij zijn 2 uitkomsten van belang: de failure rate (aantal foutnegatieve testuitslagen gedeeld door het totaal aantal negatieve testuitslagen) en de efficiëntie (aantal negatieve testuitslagen gedeeld door het totaal aantal patiënten). De failure rate moet zo laag mogelijk zijn om zo weinig mogelijk gevallen van longembolie te missen. Vaak wordt hiervoor een maximale failure rate van 2% aangehouden. Ook bij een CT-scan wordt een klein percentage (tot 2%) gemist. De efficiëntie, en dan vooral het aantal terecht-negatieve testuitslagen, moet echter zo hoog mogelijk zijn, want dat betekent dat het aantal verwijzingen voor onnodige diagnostiek zo laag mogelijk is. In de voorgaande versie van deze NHG-Standaard werd gebruikgemaakt van de Wells-regel voor longembolie, in combinatie met een D-dimeerbepaling om longembolie uit te sluiten. De vraag is of er een nieuwe of andere beslisregel is met een betere failure rate en efficiëntie.
Voor de D-dimeerbepaling werd voorheen een vaste afkapwaarde gebruikt (meestal 0,4-0,5 mg/L in geval van een kwantitatieve test, of positieve/negatieve uitslag bij gebruik van een kwalitatieve test). Om de efficiëntie van de test te verhogen, zijn er verschillende andere manieren voorgesteld om de D-dimeerwaarde te interpreteren. De 2 meest onderzochte zijn een leeftijdsafhankelijke afkapwaarde (waarbij voor hogere leeftijd een hogere afkapwaarde wordt gehanteerd, bijvoorbeeld leeftijd/100 mg/L) en een afkapwaarde die afhangt van de inschatting van de kans op longembolie door de beslisregel (waarbij een hogere afkapwaarde wordt gehanteerd bij een lagere voorafkans op longembolie). De vraag is of zo’n aangepaste afkapwaarde in de eerste lijn ook tot een efficiëntere, maar veilig uitsluiten van longembolie leidt.
Methoden
Er is een systematische literatuurzoekactie naar SR’s, RCT’s en observationele onderzoeken uitgevoerd in PubMed en Embase. In mei 2021 is een zoekactie uitgevoerd naar beslisregels, in januari 2022 naar de afkapwaarde van D-dimeer. In december 2022 is een update van de searches gedaan.
Resultaten
Resultaat zoekactie
De zoekactie leverde een systematisch literatuuronderzoek op naar beslisregels voor longembolie, waarin voor de eerste lijn geschikte beslisregels ook werden gevalideerd in een eerstelijnspopulatie. De eerstelijnspopulatie die hiervoor werd gebruikt, is het AMUSE-2-cohort. Ook vonden we een IPD-MA naar diagnostische strategieën om longembolie uit te sluiten in verschillende settings binnen de gezondheidszorg. Een aanvullende search na de zoekdatum van de SR van Hendriksen (oktober 2014) leverde geen aanvullende onderzoeken naar nieuwe Eerstelijnsbeslisregels of interpretatie van D-dimeer in de eerste lijn op, maar wel een onderzoek waarin de Wells-regel werd vergeleken met ‘gestalt’ (oftewel klinische blik) en een onderzoek waarin het toepassen van de Wells-regel met D-dimeerbepaling in de eerstelijnspraktijk werd onderzocht. De update van de search leverde geen nieuw onderzoek op.
Onderzoekskarakteristieken
- Hendriksen 2015: meta-analyse naar beschikbare beslisregels voor longembolie. Vervolgens hebben zij beoordeeld welke van deze regels uit te voeren zijn in de eerste lijn en deze regels gevalideerd in een eerstelijns cohort (AMUSE-2).
- In de SR van Hendriksen et al. werden 11 artikelen geïncludeerd, waarin 10 beslisregels werden beschreven.
3 daarvan zijn niet toe te passen in de eerste lijn (de oorspronkelijke Geneva-regel, de Pisa-regel en de gereviseerde Pisa-regel), 2 regels konden niet worden gevalideerd omdat niet alle beschikbare gegevens beschikbaar waren in de dataset (de Charlotte-regel en de PERC-criteria). 5 regels zijn daarom gevalideerd in het eerstelijns AMUSE-2-cohort:
- oorspronkelijke Wells-regel
- vereenvoudigde Wells-regel
- gemodificeerde Wells-regel
- oorspronkelijke gereviseerde Geneva-regel
- vereenvoudigde gereviseerde Geneva-regel
- Geersing 2012: prospectief cohortonderzoek (AMUSE-2), opgezet om de Wells-regel voor longembolie, in combinatie met een POCT voor D-dimeer (Clearview Simplify®), te valideren in de eerste lijn. Het onderzoek werd uitgevoerd in ruim 300 huisartsenpraktijken in 3 regio’s in Nederland (Amsterdam, Maastricht en Utrecht). Geïncludeerd werden 598 patiënten met een vermoeden van longembolie (gemiddelde leeftijd 48 ± 16 jaar, 71% vrouw) bij wie anamnese en lichamelijk onderzoek werden uitgevoerd, inclusief de Wells-regel met behulp van een standaard formulier. Alle patiënten werden vervolgens naar het ziekenhuis verwezen voor vervolgonderzoek volgens de daar geldende protocollen. Hierbij werd meestal gebruikgemaakt van spiraal-CT, ventilatie-perfusiescan, CT-angiografie, compressie-echografie van het been en/of klinische beslisregels met of zonder D-dimeerbepaling. Ook werden patiënten 3 maanden gevolgd om het optreden van VTE vast te stellen. Bij 68 patiënten werd direct na verwijzing een longembolie vastgesteld; na 3 maanden follow-up kwamen er 4 gevallen van longembolie en 1 van DVT bij. In totaal hadden er dus 73 patiënten (12,2%) een diagnose van VTE.
- Hendriksen 2016: analyse binnen het hierboven beschreven AMUSE-2-onderzoek. Aan de deelnemende huisartsen werd gevraagd om per patiënt een inschatting te maken van de aanwezigheid van longembolie op een visuele analoge schaal van 0-100% (Gestalt). Een waarde < 20% werd beschouwd als een laag risico op longembolie, een waarde ≥ 20% als een verhoogd risico.
- Geersing 2022: IPD-MA naar verschillende diagnostische strategieën, bestaande uit het toepassen van een beslisregel en een D-dimeerbepaling, voor het uitsluiten van longembolie in verschillende settings binnen de gezondheidszorg. Er werden 23 onderzoeken geïncludeerd, waarvan er 4 (n = 3174) zijn uitgevoerd in een eerstelijnspopulatie. In deze populatie konden de failure rate en efficiëntie van de Wells-regel met verschillende interpretaties van D-dimeer (vast; vast en/of kwalitatief; leeftijdsafhankelijk; op voorafkans gebaseerd) en het YEARS-algoritme worden bepaald.
- Van Maanen 2020: cohortonderzoek naar het uitvoeren van de diagnostische strategie voor het uitsluiten van longembolie (Wells-regel in combinatie met D-dimeerbepaling) in de praktijk. Huisartsen kregen een korte instructie over de strategie, waarna zij patiënten met een vermoeden van longembolie (n = 492) includeerden en beschreven wat bij deze patiënten het diagnostisch traject was. Bij niet-verwezen patiënten werd na 3 maanden nagegaan of er een VTE was opgetreden, om de failure rate en efficiëntie van de strategie in de praktijk te bepalen.
Omschrijving onderzochte beslisregels en interpretatie D-dimeer
Wells-regel
De oorspronkelijke, vereenvoudigde en gemodificeerde Wells-regel zijn weergegeven in tabel d4. De oorspronkelijke Wells-regel bestaat uit 7 items om de kans op longembolie in te schatten. Een score van maximaal 4 punten geeft aan dat longembolie onwaarschijnlijk is, een score van 4,5 punten of meer geeft aan dat het risico op longembolie verhoogd is. Gibson et al. hebben de regel op 2 manieren aangepast. Voor de gemodificeerde versie worden 2 punten toegekend in plaats van 3 voor de factoren ‘klinische tekenen van DVT’ en ‘longembolie waarschijnlijker dan andere diagnose’; voor de overige factoren wordt 1 punt toegekend. De afkapwaarde van de score is hierbij 2 punten (in plaats van 4 bij de oorspronkelijke regel). Voor de vereenvoudigde regel wordt voor alle factoren 1 punt toegekend en hierbij geldt een afkapwaarde van 1 punt.
|
Item |
Score |
||
|
Origineel |
Gemodificeerd |
Vereenvoudigd |
|
|
Clinical signs and symptoms DVT |
3 |
2 |
1 |
|
Tachycardia (> 100/min) |
1,5 |
1 |
1 |
|
Immobilization or surgery in the previous 4 weeks |
1,5 |
1 |
1 |
|
Previous DVT/PE |
1,5 |
1 |
1 |
|
Hemoptysis |
1 |
1 |
1 |
|
Malignancy |
1 |
1 |
1 |
|
An alternative diagnosis is less likely than PE |
3 |
2 |
1 |
Geneva-regel
De oorspronkelijke en vereenvoudigde gemodificeerde Geneva-regel zijn weergegeven in tabel d5. De oorspronkelijke gemodificeerde Geneva-regel bestaat uit 8 items om de kans op longembolie in te schatten. Elk aanwezige item krijgt een score van 1-4 punten. Een totale score ≤ 5 geeft aan dat longembolie onwaarschijnlijk is, een score ≥ 6 geeft aan dat het risico op longembolie verhoogd is. Klok et al. hebben de regel vereenvoudigd door voor elk aanwezig item 1 punt te scoren. De gedichotomiseerde afkapwaarde van de vereenvoudigde score is 2 punten (in plaats van 5).
|
Item |
Score |
|
|
Oorspronkelijk |
Vereenvoudigd |
|
|
Age > 65 years |
1 |
1 |
|
Previous DVT or PE |
3 |
1 |
|
Surgery (under general anesthesia) or fracture (of lower limbs) within 1 month |
2 |
1 |
|
Active malignant condition (solid or hematologic, currently active or considered cured < 1 year) |
2 |
1 |
|
Unilateral lower-limb pain |
3 |
1 |
|
Hemoptysis |
2 |
1 |
|
Heart rate |
|
|
|
3 |
1 |
|
2 |
1 |
|
Pain on lower-limb deep venous palpation and unilateral edema |
4 |
1 |
YEARS-algoritme
Het YEARS-algoritme is een combinatie van de YEARS-beslisregel met een D-dimeerbepaling. De YEARS-beslisregel is een verdere vereenvoudiging van de Wells-regel en bestaat uit 3 factoren (klinische tekenen van DVT, hemoptoë en longembolie waarschijnlijker dan andere diagnose). Deze regel wordt gecombineerd met een D-dimeerbepaling die afhangt van het aantal gescoorde factoren: bij patiënten zonder deze factoren en met een D-dimeerwaarde < 1000 ng/ml, of bij patiënten met ≥ 1 factor en een D-dimeerwaarde < 500 ng/ml, wordt verondersteld dat longembolie uitgesloten kan worden (zie figuur d1).
Uitkomsten
Zie tabel d6 voor de resultaten van de verschillende beslisregels in combinatie met een D-dimeerbepaling voor het uitsluiten van longembolie.
|
Auteur, jaartal |
D-dimeer |
Aantal deelnemers |
Failure rate (95%-BI) |
Efficiëntie (95%-BI) |
|
Originele Wells-regel (≤ 4) met D-dimeerbepaling |
||||
|
Hendriksen 2015a |
Kwalitatief; POCT (Clearview Simplify®) |
598 |
1,5% (0,4 tot 3,7%) |
46% (41 tot 50%) |
|
Geersing 2022 |
Vast, kwantitatief of kwalitatief |
3174 |
0,7% (0,3 tot 1,5%) |
42% (35 tot 49%) |
|
Geersing 2022 |
Vast, kwantitatief |
2181 |
0,1% (0,0 tot 0,6%) |
38% (25 tot 52%) |
|
Geersing 2022 |
Gebaseerd op voorafkans (score Wells-regel), kwantitatief |
2181 |
0,4% (0,2 tot 1,2%) |
62% (48 tot 74%) |
|
Geersing 2022 |
Gebaseerd op leeftijd, kwantitatief |
2181 |
0,5% (0,2 tot 1,2%) |
44% (29 tot 59%) |
|
Gemodificeerde Wells-regel (≤ 2) met D-dimeerbepaling |
||||
|
Hendriksen 2015a |
Kwalitatief; POCT (Clearview Simplify®) |
598 |
1,5% (0,4 tot 3,8%) |
45% (41 tot 49%) |
|
Vereenvoudigde Wells-regel (≤ 1) met D-dimeerbepaling |
||||
|
Hendriksen 2015a |
Kwalitatief; POCT (Clearview Simplify®) |
598 |
1,2% (0,2 tot 3,3%) |
43% (39 tot 48%) |
|
Originele gemodificeerde Geneva-regel (≤ 5) met D-dimeerbepaling |
||||
|
Hendriksen 2015a |
Kwalitatief; POCT (Clearview Simplify®) |
598 |
2,7% (1,1 tot 5,4%) |
44% (40 tot 48%) |
|
Vereenvoudigde gemodificeerde Geneva-regel (≤ 2) met D-dimeerbepaling |
||||
|
Hendriksen 2015a |
Kwalitatief; POCT (Clearview Simplify®) |
598 |
3,1% (1,4 tot 5,9%) |
48% (44 tot 52%) |
|
YEARS-regel met D-dimeerbepaling (YEARS-algoritme) |
||||
|
Geersing 2022 |
Gebaseerd op voorafkans (score YEARS), kwantitatief |
2181 |
0,3% (0,1 tot 0,9%) |
55% (43 tot 66%) |
|
Gestalt (klinische blik, door dokter geschatte kans op longembolie < 20%) met D-dimeerbepaling |
||||
|
Hendriksen 2016 |
Kwalitatief; POCT (Clearview Simplify®) |
598 |
3,6% (1,5 tot 7,2%) |
33% (29 tot 37%) |
Wells-regel in de praktijk
Van Maanen et al. onderzochten de Wells-regel in de praktijk. In de totale populatie met vermoeden van longembolie (n = 484) werden 317 patiënten niet verwezen (efficiëntie 65,5%) en 2 van hen hadden VTE (failure rate 0,6%, 95%-BI niet gerapporteerd, maar zelf berekend: 0,1-2,3%). Bij 351 (72,5%) van de patiënten met vermoeden van longembolie was de beslisregel correct uitgevoerd. Van deze patiënten werden er 253 niet verwezen (efficiëntie 72,1%) en 2 van hen hadden VTE (failure rate 0,79%; 95%-BI 0,14 tot 3,13%). Bij 133 patiënten (27,5%) was de beslisregel niet correct toegepast. Van deze patiënten werden er 64 niet verwezen (efficiëntie 48,1%); geen van deze patiënten had een VTE (failure rate 0%, 95%-BI niet gerapporteerd, maar zelf berekend: 0-5,6%).
De gemaakte fouten waren:
- het gebruiken van de verkeerde score, namelijk die voor DVT (in 38,3%van de gevallen);
- het onterecht aanvragen (bij score ≥ 4,5) of achterwege laten (bij score ≤ 4) van een D-dimeerbepaling (28,6%);
- het toepassen van de beslisregel bij patiënten bij wie dit niet geïndiceerd is (19,6%);
- het onterecht verwijzen (bij score ≤ 4 en/of negatieve D-dimeer) of niet verwijzen (bij score ≥ 4,5 of positieve D-dimeer) (13,5%).
De belangrijkste determinant voor het verkeerd toepassen van de regel bij patiënten met vermoeden van longembolie was een eerdere VTE (OR 4,45, 95%-BI 2,73 tot 7,25), en bij patiënten met DVT en longembolie samen (geen onderscheid gemaakt) waren de belangrijkste determinanten hartfalen (OR 3,26 (95%-BI 1,47 tot 7,21), recente operatie of immobiliteit (OR 1,57, 95%-BI 1,00 tot 2,47), mannelijk geslacht (OR 1,45, 95%-BI 1,12 tot 1,85) en leeftijd 50 jaar of jonger (OR vergeleken met leeftijd 50-75 1,41, 95%-BI 1,06 tot 1,85).
Contra-indicaties gebruik beslisregels
De beslisregels en D-dimeer zijn in de eerste lijn onvoldoende onderzocht bij zwangeren en vrouwen in de kraamperiode en bij klachten > 30 dagen. Daarnaast is de D-dimeer waarde niet goed te beoordelen bij reeds gebruik van antistollingsmedicatie (VKA, DOAC, of heparine). Daarom is het advies bij deze groepen de beslisregels en D-dimeer niet te gebruiken maar direct aanvullend onderzoek of overleg met de tweede lijn te hebben.
Conclusies
- De Geneva-regel en ‘Gestalt’ leidden tot een failure rate > 2% en lijken daarmee niet geschikt om longembolie veilig uit te sluiten in de eerste lijn. Alle versies van de Wells-regel gecombineerd met een D-dimeerbepaling en het YEARS-algoritme leidden tot een failure rate < 2%. Als de Wells-regel werd gecombineerd met een kwalitatieve D-dimeerbepaling, overlapte het 95%-BI de grens van 2%. In combinatie met een kwantitatieve D-dimeerbepaling lag het gehele 95%-BI onder de grens van 2%.
- De efficiëntie van de Wells-regel in combinatie met een vaste of op leeftijd gebaseerde D-dimeerafkapwaarde ligt rond de 40%. In combinatie met een afkapwaarde die gebaseerd is op de voorafkans op longembolie lijkt de efficiëntie iets hoger (62%, 95%-BI 48 tot 74%). Ook bij het YEARS-algoritme wordt de afkapwaarde bepaald door de voorafkans op longembolie en is de efficiëntie wat hoger (55%, 95%-BI 43 tot 66%).
Bij het toepassen van de Wells-regel of het YEARS-algoritme en de D-dimeerbepaling wordt (ook in de tweede lijn) 1-2% van de longembolieën gemist. Een groot Nederlands tweedelijnsonderzoek naar de veiligheid van het toepassen van de Wells-regel in combinatie met een D-dimeertest beschouwde een longembolie veilig uitgesloten als de bovengrens van het 95%-BI niet de 2,7% overschreed. In het verleden werd ook wel een bovengrens van 4% aangehouden. Deze grens is met name gebaseerd op een review naar de waarde van pulmonaire angiografie. In deze review werden 8 onderzoeken geïncludeerd met in totaal 1050 patiënten met vermoeden van longembolie die op grond van een negatief pulmonair angiogram geen behandeling met antistolling kregen. Angiografie wordt – nog steeds – gezien als de beste referentietest (‘gouden standaard’). In de follow-upperiode van 3 maanden kregen 18 patiënten een VTE (1,7%; 95%-BI 1,0 tot 2,7%). Kortom, zelfs bij patiënten bij wie met de best mogelijke diagnostiek longembolie wordt uitgesloten, wordt bij 1,7% van de patiënten nadien alsnog een longembolie vastgesteld.
Randvoorwaarden bij het gebruik van beslisregels
Naar Samenvatting ›- Een beslisregel vervangt niet het klinisch redeneren. Gebruik een beslisregel alleen bij ABCDE-stabiele patiënten.
- Gebruik de beslisregels en de D-dimeerbepaling niet bij zwangeren en vrouwen in de kraamperiode, bij klachten > 30 dagen of bij reeds gebruik van antistollingsmedicatie (VKA, DOAC, of heparine). Vraag voor deze patiënten direct een echografie aan (DVT) of verwijs naar de betreffende specialist (longembolie).
- De afkapwaarde van de D-dimeerbepaling verschilt per beslisregel:
- Eerstelijnsbeslisregel DVT: 500 ng/ml of 0,5 mg/L
- YEARS-algoritme longembolie: 500 óf 1000 ng/ml, of 0,5 óf 1,0 mg/L)
- Bepaal de D-dimeer dezelfde dag (cito). Bepaal ook creatinine en eGFR (tenzij < 3 maanden geleden bepaald) met het oog op eventuele vervolgdiagnostiek en behandeling.
- Beslis op basis van de score op de beslisregel en de eventuele D-dimeerbepaling of beeldvormend onderzoek nodig is. Bij een vermoeden van DVT en een beslisregelscore ≥ 4 kan direct echografie aangevraagd worden.
|
|
Score |
|
Mannelijk geslacht |
1 |
|
Gebruik systemische oestrogenen of prikpil* |
1 |
|
Aanwezigheid maligniteit |
1 |
|
Operatie ondergaan in de laatste maand |
1 |
|
Afwezigheid van trauma dat zwelling in kuit verklaart |
1 |
|
Uitgezette venen van het been |
1 |
|
Verschil maximale kuitomvang ≥ 3 cm† |
2 |
|
Score ≤ 3: niet verhoogd, doe D-dimeerbepaling. |
|
|
|
Score |
|
Klinische tekenen van trombosebeen* |
1 |
|
Hemoptöe |
1 |
|
Longembolie meest waarschijnlijke diagnose |
1 |
|
0 YEARS-items: afkapwaarde D-dimeerbepaling 1000 ng/ml (1,0 mg/L) |
|
Randvoorwaarden bij gebruik D-dimeerbepaling
Naar Samenvatting ›- Vraag een D-dimeerbepaling alleen aan na het doorlopen van de beslisregel.
- Zorg dat de uitslag dezelfde dag wordt teruggekoppeld en draag dit zo nodig over aan de huisartsenpost.
- Spreek met de patiënt af dat deze (telefonisch) bereikbaar moet blijven en instrueer wat te doen als er geen telefonisch contact is geweest en hoe te handelen bij (toename van) klachten.
- Laboratoria gebruiken verschillende D-dimeerbepalingen met soms andere rapportage van eenheden; de meeste hanteren een afkapwaarde van 500 ng/ml, sommige 0,5 mg/L.
- Het interpreteren van de D-dimeeruitslag is voorbehouden aan de huisarts, omdat voor DVT en longembolie verschillende beslisregels worden gebruikt.
- Een leeftijdsafhankelijke afkapwaarde wordt niet geadviseerd (onvoldoende bewijs dat dit beter is dan de huidige afkapwaarde, eerstelijnsonderzoek ontbreekt).
- Een waarde boven de afkapwaarde kan wijzen op een VTE, maar ook aanwezig zijn bij een maligniteit, infectie, zwangerschap, na een operatie of als fysiologische variatie.
D-dimeer en D-dimeerbepalingen
D-dimeer is een product dat wordt gevormd bij de afbraak van fibrine. Bij het ontstaan van trombose zijn D-dimeren al snel in het bloed aantoonbaar. Ook bij ontstekingen en maligniteiten komen D-dimeren vrij. Bij het uitsluiten van een DVT of longembolie wordt gebruikt gemaakt van de D-dimeerbepaling in combinatie met een beslisregel. De sensitiviteit en de specificiteit zijn sterk afhankelijk van de gebruikte D-dimeertest en het afkapwaarde. Laboratoria hanteren verschillende D-dimeerbepalingen met soms andere rapportage van eenheden; de meeste hanteren een afkapwaarde van 500ng/ml, sommige 0,5 mg/L.
Bij de interpretatie van de D-dimeerbepaling kunnen diverse aandoeningen of omstandigheden tot een foutpositieve of foutnegatieve uitslag leiden: ontstekingen, maligniteit, zwangerschap, recent trauma, recente operatie of grote hematomen kunnen oorzaken van een foutpositieve uitslag zijn.
De duur van de D-dimeerstijging na een DVT is beperkt. De D-dimeerconcentratie daalt mogelijk binnen 15-20 dagen na het ontstaan van symptomen.
De plaats en de uitgebreidheid van de trombus hebben invloed op de sensitiviteit van de D-dimeerbepaling. De sensitiviteit voor een proximale DVT is hoger dan voor kuitvenetrombose.
De D-dimeerconcentratie daalt na behandeling met heparine of LMWH en daarom wordt het gebruik van de beslisregel en D-dimeerbepaling niet aanbevolen.
Het gebruik van VKA’s kan de D-dimeerconcentratie verlagen; doordat gegevens over de betrouwbaarheid van de D-dimeerbepaling bij mensen bij wie een recidief-DVT wordt vermoed schaars zijn, is het onduidelijk wat de waarde is van de test bij deze populatie en wordt het gebruik van de beslisregel en D-dimeerbepaling niet aanbevolen.
De laatste jaren zijn diverse D-dimeerbepalingen in de tweede lijn op hun testeigenschappen voor het aantonen of uitsluiten van trombose onderzocht. Omdat het testprincipe niet gelijk is voor alle bepalingen en omdat gebruik wordt gemaakt van verschillende D-dimeerantilichamen, kunnen de testuitslagen niet onderling worden vergeleken. De fabrikanten geven aan dat de door hen opgegeven afkapwaarde voor een normale/afwijkende uitslag gevalideerd moet worden door het laboratorium dat de test gebruikt. De meestgebruikte tests in Nederland (Vidas® en Tinaquant®) hebben een hoge sensitiviteit van 96% voor DVT. Ook het Innovance®-reagens wordt in Nederland tegenwoordig veel gebruikt.
Een normale D-dimeeruitslag (lager dan de afkapwaarde) draagt in belangrijke mate bij aan het uitsluiten van de diagnose DVT. Een D-dimeerbepaling zonder beslisregel geeft onvoldoende zekerheid om een VTE uit te sluiten.
POCT D-dimeerbepaling
Naar Samenvatting ›We bevelen het gebruik van een POCT D-dimeerbepaling niet aan voor de diagnostiek van een DVT of longembolie in de huisartsenpraktijk, tenzij hier regionale afspraken over zijn gemaakt met een laboratorium en dit onder strikte voorwaarden plaatsvindt (onder andere zorgvuldige afname, kwaliteitscontroles, klinisch chemicus betrokken).
- Een kwalitatieve POCT D-dimeerbepaling is niet langer leverbaar.
- De nieuwe generatie POCT D-dimeerbepalingen voldoet op dit moment nog niet aan alle voorwaarden voor een veilige introductie.
Een kwalitatieve POCT die met vingerprik en zonder verdere apparatuur kon worden uitgevoerd, is vanwege kwaliteitsproblemen niet meer beschikbaar. Op dit moment zijn er verschillende nieuwe generatie POCT D-dimeer testen beschikbaar. Enkele hiervan lijken het analytisch goed te doen in vergelijking met een laboratorium D-dimeer en hebben daarmee potentie. Er is op dit moment echter geen klinische validatieonderzoek in de eerste lijn. Het is dus onduidelijk wat de veiligheid en effectiviteit is in de dagelijkse praktijk van de huisarts. Op dit moment moeten we vaststellen dat de nieuwe generatie POCT D-dimeerbepalingen nog niet aan alle voorwaarden voldoet voor een veilige introductie. Daarom bevelen wij op dit moment het gebruik van een POCT D-dimeerbepaling niet aan in de huisartsenpraktijk. Gebruik dus bij voorkeur een D-dimeerwaarde die is bepaald door het laboratorium. Tegelijkertijd is er wel behoefte aan POCT D-dimeerbepalingen en is dit ook in het rapport Zinnige Zorg – Verbetersignalement Diepe veneuze trombose en longembolie van het Zorginstituut Nederland als een belangrijk verbeterpunt genoemd. De huidige POCT D-dimeerbepalingen zijn op de markt toegelaten, maar gebruik in de huisartsen setting is alleen mogelijk als voldaan wordt aan de voorwaarden van de NHG-Richtlijn Point of care testing (POCT) in de huisartsenzorg. Dat kan dus alleen in lokale initiatieven worden bewerkstelligd in samenwerking met klinisch chemici en lokale ziekenhuizen. Als het de wens is toch een POCT D-dimeerbepaling te gaan invoeren, zal dus een klinisch chemicus betrokken moeten zijn bij de keuze voor het type apparaat, de implementatie in de praktijk en daarna de monitoring van het gebruik. Het is uiteindelijk de verantwoordelijkheid van de gebruiker dat veiligheid en juist gebruik gewaarborgd zijn.
Uitgangsvraag
Uitgangsvraag
Is een POCT voor het bepalen van D-dimeer voor de diagnostiek van een DVT of longembolie aan te bevelen in de huisartsenpraktijk? Zie de PICO-tabel.
|
Patiënten |
Patiënten in de huisartsenpraktijk met een vermoeden van DVT of longembolie |
|---|---|
|
Interventie |
Point-of-care-test D-dimeerbepaling |
|
Vergelijking |
D-dimeerbepaling in (ziekenhuis)laboratorium |
|
Uitkomstmaten |
Diagnostische accuratesse in de huisartsenpraktijk |
Achtergrond
Het doel van een D-dimeerbepaling, in combinatie met een beslisregel, is om een DVT of longembolie veilig uit te kunnen sluiten bij patiënten in de eerste lijn. Naast de centrale bepalingen in een (ziekenhuis)laboratorium zijn er decentrale bepalingen mogelijk in de vorm van een point-of-care test (POCT) D-dimeerbepaling. POCT D-dimeerbepalingen hebben een duidelijke praktische meerwaarde, omdat het beleid direct in de spreekkamer of bij de patiënt thuis is te bepalen en wachten op de uitslag van het laboratorium niet nodig is. Voorheen was er een goedkope kwalitatieve bepaling beschikbaar waarvoor geen apparatuur nodig was (Clearview Simplify®). Hierbij bleken echter dusdanig veel problemen te bestaan in de consistente kwaliteit van het product en in de correcte toepassing, dat de fabrikant heeft besloten het product niet meer te leveren.
Technische ontwikkelingen hebben het mogelijk gemaakt dat handzame apparatuur voorhanden is waarmee onder andere een kwantitatieve D-dimeerbepaling in de huisartsenpraktijk zou kunnen worden gedaan. Enkele van deze tests laten goede resultaten zien als ze direct met een laboratoriumtest worden vergeleken. Voordat zulke tests echter op grote schaal kunnen worden toegepast, moeten ze in de huisartsenpraktijk worden gevalideerd.
Methoden
Er is een systematische literatuurzoekactie naar SR’s, RCT’s en observationeel onderzoek uitgevoerd in PubMed en Embase in mei 2021 met een update in december 2022.
Resultaten
Resultaat zoekactie
De zoekactie naar beslisregels leverde een SR op naar POCT D-dimeerbepalingen voor het uitsluiten van DVT die in theorie in de eerste lijn toepasbaar zouden kunnen zijn. In deze SR werd echter geen enkel onderzoek gevonden naar de validatie van deze tests in de klinische eerstelijnspraktijk. Ook werden er bij de literatuurzoekactie (zowel in de oorspronkelijke search als in de update) geen afzonderlijke eerstelijns validatieonderzoeken naar kwantitatieve POCT D-dimeerbepalingen gevonden.
Conclusie
Er is geen validatieonderzoek in de huisartsenpraktijk beschikbaar naar POCT D-dimeerbepalingen.
Compressie-echografie bij vermoeden van een DVT
Naar Samenvatting ›- Vraag een compressie-echografie aan. Bij voorkeur wordt in het ziekenhuis een 2-puntsecho gemaakt. Bij een 3-puntsecho worden namelijk ook de kuitvenen onderzocht, terwijl niet is vastgesteld dat een kuitvenetrombose altijd behandeld moet worden (zie Geïsoleerde kuitvenetrombose).
- Bij het vermoeden van een recidief-DVT in hetzelfde been: overleg met een radioloog of vermeld op de aanvraag, omdat echografie dan minder betrouwbaar is en vergelijking met eerdere echo nodig is.
- Geef eenmalig subcutaan LMWH (zie tabel 4) of een oplaaddosering apixaban of rivaroxaban (zie tabel 3) als echografie niet dezelfde dag mogelijk is. Zorg dat de echo de volgende dag kan plaatsvinden.
- Draag er zorg voor dat de uitslag van de echografie direct aan u wordt teruggekoppeld, zodat u dezelfde dag kunt starten met behandeling.
Echografie en flebografie
In een systematisch literatuuronderzoek van 100 diagnostische cohortonderzoeken (n = 10.323) is gekeken naar de waarde van echografie in vergelijking met flebografie (contrastvenografie) bij patiënten bij wie DVT werd vermoed. Beschreven zijn de (gepoolde) sensitiviteit en de specificiteit bij verschillende onderzoekstechnieken proximaal en distaal in de onderste extremiteit (zie tabel d7). Compressie-echografie blijkt vooral geschikt voor het opsporen van proximale DVT. De interwaarnemervariatie bij de diagnostiek van DVT is laag; in een onderzoek bij patiënten (n = 101) bij wie DVT werd vermoed, bleek kappa 1 voor proximale vaten en 0,9 (95%-BI 0,79 tot 1) voor kuitvenen.
Flebografie was formeel lange tijd de gouden standaard voor de diagnostiek van DVT. Omdat dit onderzoek invasief is en omdat het contrastmiddel chemische flebitis kan veroorzaken, is het inmiddels obsoleet.
|
Sensitiviteit alle DVT (95%-BI) |
Sensitiviteit proximale DVT (95%-BI) |
Sensitiviteit distale DVT (95%-BI) |
Specificiteit (95%-BI) |
|
|
Compressie-echografie |
90,3% (88,4 tot 92,0) |
93,8% (92,0 tot 95,3) |
56,8% (49,0 tot 66,4) |
97,8% (97,0 tot 98,4) |
|
Kleurendoppleronderzoek |
81,7% (77,4 tot 85,5) |
95,8% (85,7 tot 99,5) |
43,5% (23,2 tot 66,5) |
92,7% (89,7 tot 95,1) |
|
Duplexechografie (echodoppleronderzoek) |
92,1% (90,7 tot 93,5) |
96,5% (95,1 tot 97,6) |
71,2% (64,6 tot 77,2) |
94,0% (92,8 tot 95,1) |
Compressie-echografie
Bij een compressie-echografie van de benen voor het uitsluiten van een DVT worden de venen gecomprimeerd. Zijn de venen niet-comprimeerbaar, dan wijst dit op een trombus ter plaatse.
- Bij 2-puntscompressie-echografie worden de vena poplitea in de knieholte en de vena femoralis communis in de lies gecomprimeerd. Deze methode is geschikt voor het aantonen van symptomatische proximale trombose tot de bekkenvenen.
- Een geïsoleerde bekkenvenetrombose kan bij de gebruikelijke compressie-echografie gemist worden, omdat het iliacale traject van de beenvaten niet in beeld wordt gebracht. Dit traject wordt alleen op speciaal verzoek beoordeeld. Aan een geïsoleerde bekkenvenetrombose kan gedacht worden bij een omvangverschil van de benen en klachten passend bij een DVT, zoals onmogelijkheid te lopen/pijn, en eventueel ook rugpijn. Mocht er geen expertise zijn om een abdominale duplex te verrichten, kan er een CT-scan met contrast verricht worden. Ook bij patiënten met overgewicht kan een betrouwbare interpretatie moeilijk zijn. Indien de vena femoralis communis een trombus bevat, dienen ook altijd de bekkenvenen bekeken te worden om de bovengrens van een trombus vast te stellen.
- In enkele ziekenhuizen wordt voor het uitsluiten van een DVT nog een 3-punts compressie-echografie verricht. Hierbij wordt de vena femoralis communis in de lies, de vena poplitea in de knieholte en de oppervlakkige venen in de kuit gecomprimeerd.
- Bij een echografie van het hele been of complete echografie worden de venen op meer dan de 3-punten beoordeeld. Volgens de Nederlandse Vereniging voor Radiologie (geraadpleegd mei 2023) wordt compressie-echografie van het hele been nooit meer verricht voor het uitsluiten van een DVT. Vaak wordt met ‘complete echografie’ ten onrechte een 3-punts compressie-echografie bedoeld.
Kans op VTE na negatieve 2-punts versus 3-punts compressie-echografie
Er werd een literatuurzoekactie verricht om te onderzoeken of een eenmalige, niet-afwijkende 3-punts compressie-echografie even goed (of beter) in staat is VTE uit te sluiten dan een 2-puntsecho, die vaak na een week herhaald wordt als er geen afwijkingen worden gevonden. De zoekactie leverde alleen onderzoeken op waarbij de 2-punts compressie-echografie werd vergeleken met een compressie-echografie van het gehele been.
In een meta-analyse van het risico op VTE na een negatieve (eenmalige) echo van het hele been werden 6 prospectieve cohortonderzoeken en 1 RCT geïncludeerd. In deze 7 onderzoeken werd bij patiënten bij wie een DVT werd vermoed echografie van het hele been verricht. Als deze negatief was, kregen ze géén anticoagulantia. De follow-up bedroeg ≥ 3 maanden en bestond meestal uit telefonische interviews en onderzoek van medische dossiers. Pooling van de resultaten van in totaal 4731 patiënten liet zien dat bij 25 patiënten VTE (0,5%) of VTE gerelateerd overlijden (9 patiënten; 0,2%) optrad. De gewogen, gepoolde VTE incidentie bij 3 maanden was 0,57% (95%-BI 0,25 tot 0,89%). De onderzoekspopulaties waren onderling niet geheel vergelijkbaar. Zo werden in één van de besproken onderzoeken patiënten met een hoge kans op DVT op basis van de Wells-regel geëxcludeerd. Mogelijk was er publicatiebias (op basis van een funnel plot).
In de RCT die in deze meta-analyse was geïncludeerd werd een 2-puntsecho direct vergeleken met een echo van het hele been. Er werden 2098 vanuit de eerste lijn of via een SEH verwezen patiënten geïncludeerd. Van hen kregen er 1054 een 2-puntsecho, bij negatieve uitslag gevolgd door een D-dimeertest, en 1023 kregen een echo van het hele been. Alleen als de D-dimeer na een negatieve 2-puntsecho verhoogd was, werd de echo na een week herhaald (n = 256). Dit diagnostisch traject verschilt dus met het gangbare, de D-dimeer werd bepaald ná de negatieve echo. Uiteindelijk werden 814 patiënten met 1 of 2 negatieve 2-puntsecho(’s) vergeleken met 775 patiënten met 1 negatieve echo van het hele been. Symptomatische VTE werd onafhankelijk vastgesteld en alleen op grond van beeldvormend onderzoek of autopsie. Gedurende de 3 maanden follow-up werd bij 7 van de 801 (uitval n = 13) patiënten in de 2-puntsecho/D-dimeergroep een VTE vastgesteld (0,9%; 95%-BI 0,3 tot 1,8%) en bij 9 van de 763 patiënten (uitval n = 12) in de groep met een echo van het hele been (1,2%; 95%-BI 0,5 tot 2,2%). Het verschil tussen beide groepen was niet significant.
Een andere RCT (gepubliceerd na het zoektijdframe van de meta-analyse), waarin een 2-puntsecho vergeleken wordt met een echo van het hele been, gaf vergelijkbare resultaten. Van de 1002 patiënten met klinische vermoeden van DVT werden er 521 gerandomiseerd; deze patiënten hadden een score > 2 op de dichotome Wells-regel, of een verhoogde D-dimeer. Ze kregen ofwel 2-puntsechografie (n = 257), die indien negatief (n = 198) na een week werd herhaald, ofwel echografie van het hele been (n = 264, negatief n = 165). Het aantal VTE onafhankelijk vastgesteld op basis van beeldvorming, gedurende de 3 maanden follow-up was 4 (2,0%; 95%-BI 0,6 tot 5,1%) in de negatieve 2-puntsechografiegroep versus 2 in de groep met een negatieve echo van het hele been (1,2%; 95%-BI 0,2 tot 4,3%).
Conclusie
Om een DVT uit te sluiten is een eenmalige echo van het hele been ongeveer even geschikt als een 2-puntsecho met herhaling na een week.
Overwegingen
Door echografie van het hele been worden meer geïsoleerde kuitvenetromboses gevonden. Dit leidt mogelijk tot overbehandeling, omdat het merendeel van deze kuitvenetromboses een goede prognose heeft, ten koste van een groter aantal bloedingen door antistollingsbehandeling. Omdat veel ervaring is opgedaan met 2-puntsechografie en veel minder met echografie van het hele been, heeft 2-puntsechografie de voorkeur.
Advies
Vraag bij voorkeur een 2-puntscompressie-echografie aan.
Diagnostiek bij recidief-DVT in hetzelfde been
De diagnose recidief-DVT is vaak lastig doordat na een eerste episode van DVT vaak restafwijkingen in het diepe veneuze systeem aanwezig zijn. Zo is bijvoorbeeld echografie een jaar na de eerste presentatie bij 30% van de patiënten nog steeds afwijkend. Het feit dat een veneus segment niet-comprimeerbaar is, is bij deze patiënten geen bewijs voor een nieuwe trombose. Pas bij aanwijzingen voor recente nieuwe trombusvorming kan gesproken worden van recidief-DVT. Een vergelijking met eerder vervaardigde echo’s is daarom noodzakelijk. Wanneer er sprake is van een nieuw niet-comprimeerbaar veneus segment of wanneer de dikte van de trombus met meer dan 4 mm is toegenomen, gaat het vrijwel zeker om een recidieftrombose.
Eenmalige gift LMWH in afwachting van een echografie
In veel regio’s blijkt het niet mogelijk te zijn ’s avonds of ’s nachts een echografie te laten maken met de vraagstelling of er een DVT aanwezig is. In dat geval is het niet bezwaarlijk eenmalig een therapeutische dosis LMWH te geven, zodat de avond en nacht overbrugd worden en de echo de volgende dag gemaakt kan worden. Als alternatief kan eenmalig een startdosering apixaban of rivaroxaban worden gegeven. De praktische voordelen van deze aanpak wegen op tegen de geringe kans op een bloeding bij patiënten die door deze aanpak eenmalig LMWH of een DOAC krijgen maar bij wie vervolgens geen DVT gevonden wordt.
Het onmiddellijk maken van een echo heeft stellig de voorkeur. Meerdere LMWH-giften om een langere periode te overbruggen (bijvoorbeeld een heel weekend) acht de werkgroep onnodig en wordt afgeraden.
Evaluatie
Naar Samenvatting ›De differentiaaldiagnose bij deze klachten is breed. Zie Differentiaaldiagnose.
DVT: Eerstelijnsbeslisregel en D-dimeerbepaling (zie figuur 2)
Naar Samenvatting ›- Een DVT is voldoende uitgesloten bij:
- score ≤ 3 én D-dimeerbepaling negatief (< 500 ng/ml of < 0,5 mg/L)
- negatieve 2-puntscompressie-echografie
- Herhaal een negatieve 2-puntscompressie-echografie bij aanhoudende klachten en verhoogde D-dimeerbepaling na 5-7 dagen. Is de echo wederom negatief, dan is DVT uitgesloten.
- Bij een negatieve 3-puntscompressie-echografie (waarbij dus ook geen geïsoleerde kuitvenetrombose is vastgesteld) is herhaling bij aanhoudende klachten na 5-7 dagen niet nodig.
- Overleg met internist of radioloog bij een niet-afwijkende echo en evidente zwelling van het gehele been, erg veel pijn of bedreigd been (vermoeden van zeldzame bekkenvenentrombose).
- Overleg met een internist bij een sterk vermoeden van DVT ondanks een tweede negatieve 2-puntscompressie-echografie.
- De diagnose DVT wordt gesteld op basis van de echografie. Maak daarna onderscheid tussen uitgelokte en idiopathische DVT, want dit heeft consequenties voor de behandelduur na 3 maanden (zie Behandelduur).
- Overweeg behandeling indien na een 3-puntscompressie-echografie een geïsoleerde kuitvenetrombose is vastgesteld (zie Geïsoleerde kuitvenetrombose).
Longembolie: YEARS-algoritme en D-dimeerbepaling (zie figuur 3)
Naar Samenvatting ›- Een longembolie is voldoende uitgesloten bij:
- 0 YEARS items en D-dimeer < 1000 ng (< 1,0 mg/L)
- 1-3 YEARS items en D-dimeer < 500 ng/ml (< 0,5 mg/L)
- Verwijs direct naar een internist of longarts voor beeldvormend onderzoek bij:
- 0 YEARS items en D-dimeer ≥ 1000 ng/ml (≥ 1,0 mg/L)
- 1-3 YEARS items en D-dimeer ≥ 500 ng/ml (≥ 0,5 mg/L)
Differentiaaldiagnose
Naar Samenvatting ›- Differentiaaldiagnose bij DVT: oppervlakkige tromboflebitis, cellulitis/erysipelas, spierscheur/spierhematoom, lymfangitis, artritis, (geruptureerde) bakerse cyste, PTS.
- Differentiaaldiagnose bij longembolie
- acuut levensbedreigende aandoeningen zoals acuut coronair syndroom, thoracale aortadissectie, pneumothorax
- andere aandoeningen: pneumonie, astma of exacerbatie COPD, paniekaanval, syndroom van Tietze, myogene pijn, ribcontusie, hartfalen, aortaklepstenose, pleuritis, pericarditis, bronchuscarcinoom, metabole acidose, refluxziekte, herpes zoster.
Richtlijnen beleid
Naar Samenvatting ›- Het doel van de behandeling van DVT is uitbreiding van de trombose te voorkomen.
- Een DVT is meestal in de huisartsenpraktijk te behandelen, zeker in de opstartfase met antistollingsmedicatie. Maak onderscheid tussen een uitgelokte en idiopathische DVT om de behandelduur te bepalen.
- De behandeling van longembolie wordt altijd gestart in de tweede lijn en komt hier niet aan bod.
Behandeling DVT door de huisarts
Naar Samenvatting ›- Zie Checklist Behandeling DVT door de huisarts.
- Een DVT van de onderste extremiteiten is meestal in de huisartsenpraktijk te behandelen, mits er geen redenen zijn voor behandeling in de tweede lijn (zie Consultatie en verwijzing). De keuze voor zelf behandelen kan afhangen van regionale afspraken of van de eigen voorkeur.
- Betrek de patiënt actief bij de keuzes voor behandeling.
- De medicamenteuze behandeling bestaat ófwel uit een DOAC, afhankelijk van het DOAC voorafgegaan door 5 dagen LWMH, ófwel uit een VKA met initieel een LMWH (dit laatste in samenwerking met de trombosedienst).
- Steunkousen kunnen helpen bij de zwelling maar worden niet meer standaard voorgeschreven, want er is geen bewijs dat dit een PTS of recidief-DVT voorkomt.
Geïsoleerde kuitvenetrombose
Naar Samenvatting ›- Het risico op uitbreiding van de trombose en/of ontstaan van een longembolie bij een geïsoleerde kuitvenetrombose is gering (circa 92% lost vanzelf op, zonder antistolling) en bestaat vooral in de eerste 2 weken.
- Bespreek het beleid met de patiënt en besluit samen: bij een geïsoleerde kuitvenetrombose is er geen duidelijke voorkeur voor medicamenteuze behandeling dan wel alleen echografisch vervolgen:
- bij keuze voor behandeling: deze is gelijk aan die van proximale DVT (zie Richtlijnen beleid en Behandelduur).
- bij keuze voor echografie: herhaal de echo na 1 én na 2 weken, of eerder bij toename van klachten. Als er bij herhaalde echo’s geen uitbreiding is, instrueer de patiënt dan terug te komen bij klachten die kunnen passen bij een DVT en/of longembolie. Start bij proximale uitbreiding op de echo alsnog behandeling zoals bij proximale DVT (zie Richtlijnen beleid).
- Overleg laagdrempelig met een internist bij twijfel over het beleid.
Behandeling geïsoleerde kuitvenetrombose
Er is discussie over de noodzaak van de behandeling van een geïsoleerde kuitvenetrombose. De vraag is of behandeling progressie tot in de vena poplitea of hoger en een recidief-DVT kan voorkómen en de kans op longembolie en PTS kan verkleinen.
Bewijs
In een meta-analyse uit 2012, waarin de veiligheid en effectiviteit van anticoagulantia in therapeutische dosering bij geïsoleerde kuitvenetrombose werd nagegaan, werden 8 artikelen geïncludeerd: 2 RCT’s en 6 cohortonderzoeken waarin historische controlegroepen werden gebruikt. In deze meta-analyse werden gepoolde resultaten van behandeling gepresenteerd, al werd in de meeste onderzoeken niet met een placebogroep of een groep zonder behandeling vergeleken. In totaal kregen 126 patiënten anticoagulantia in therapeutische dosering (VKA: 1 onderzoek, alleen ongefractioneerde heparine: 1 onderzoek of een combinatie: 6 onderzoeken). De in totaal 328 controlepatiënten kregen heparine gedurende 5 dagen, compressietherapie, phenylbutazon gedurende 9 dagen, acetylsalicylzuur, dipyridamol, clopidogrel, en/of profylactische dosering dextran, heparine of warfarine, of een combinatie. De follow-up varieerde van 1 tot 12 maanden. Longembolieën traden significant minder vaak op bij patiënten met anticoagulantia in therapeutische dosering (gepoolde OR 0,12; 95%-BI 0,02 tot 0,77) evenals progressie van de trombus (gepoolde OR 0,29; 95%-BI 0,14 tot 0,62). De sterfte (OR 0,57; 95%-BI 0,06 tot 5,66) en het aantal bloedingen (gepoolde OR 1,60; 95%-BI 0,2 tot 12,36) verschilden niet significant tussen beide groepen, mogelijk als gevolg van een gebrek aan power door het relatief kleine aantal patiënten. De kwaliteit van het bewijs is zeer laag vanwege beperkingen in onderzoeksopzet en uitvoering, inconsistentie en imprecisie.
Conclusie
Er is bewijs van zeer lage kwaliteit dat behandeling van een geïsoleerde kuitvenetrombose leidt tot vermindering van de kans op progressie van de trombus en longembolie.
Overwegingen
De kans op progressie of longembolie bij een geïsoleerde kuitvenetrombose is klein. Het nut van behandeling met anticoagulantia, dat wil zeggen het voorkómen van VTE afgewogen tegen de kans op bloedingen, staat onvoldoende vast. Bij het maken van een afweging tussen wel of niet behandelen met anticoagulantia spelen voorkeuren van de patiënt en arts en kostenaspecten een rol.
Advies
Er is geen duidelijke voorkeur voor behandeling met anticoagulantia of echografisch vervolgen van een geïsoleerde kuitvenetrombose. Maak hierover regionale afspraken of bespreek met de patiënt de voor- en nadelen van behandeling met anticoagulantia en de onzekerheid die hierover bestaat en maak in samenspraak een keuze. Er is geen bewijs voor de frequentie en duur van echografische controles. Een praktisch advies is na één en na 2 weken de echo te herhalen en daarna alleen bij toename van klachten. Als de trombose dan doorgroeit tot in de proximale venen, wordt deze als proximale DVT gezien en dus (alsnog) behandeld.
Behandelduur van geïsoleerde kuitvenetrombose bij de keuze voor behandeling met anticoagulantia
Indien bij de behandeling van een geïsoleerde kuitvenetrombose wordt gekozen voor een behandeling met anticoagulantia is de vraag hoelang zou moeten worden behandeld. Uit de gepoolde analyse van 7 RCT’s. bleek bij behandeling met anticoagulantia van secundaire geïsoleerde kuitvenetrombose gedurende 4 tot 6 weken de kans op een (recidief)-VTE in 24 maanden follow-up 1,2 per 100 patiëntjaren (95%-BI 0,4 tot 3,8). Bij behandeling gedurende 3 maanden was dit 1,5 VTE per 100 patiëntjaren (95%-BI 0,2 tot 10,8). Bij 6 maanden behandeling was dit 3,5 VTE per 100 patiëntjaren (95%-BI 1,5 tot 8,4). De betrouwbaarheidsintervallen overlappen. De HR voor de kans op recidief-VTE bij 4 tot 6 weken behandeling ten opzichte van 3 maanden of langer was 0,36 (95%-BI 0,09 tot 1,54). Deze vergelijking is gebaseerd op slechts 9 recidief-VTE.
Behandeling van idiopathische geïsoleerde kuitvenetrombose gedurende 4 tot 6 weken gaf 11,2 VTE per 100 patiëntjaren (95%-BI 7,3 tot 17,1). Behandeling gedurende 3 maanden gaf 7,9 per 100 patiëntjaren (95%-BI 2,0 tot 31,6). Behandeling gedurende 6 maanden gaf 4,5 per 100 patiëntjaren (95%-BI 2,2 tot 9,5). De HR voor recidief-VTE bij 4 tot 6 weken behandeling ten opzichte van 3 maanden behandeling of langer was 2,3 (95%-BI 1,1 tot 5,0).
Conclusie
Zowel bij uitgelokt als idiopathische kuitvenetrombose geeft 3 maanden behandeling minder recidieven dan 4 tot 6 weken behandeling, behandeling gedurende 6 maanden heeft geen evident betere uitkomst.
Advies
Indien men bij een geïsoleerde kuitvenetrombose kiest voor behandeling met anticoagulantia (en niet voor echografisch vervolgen), is de behandelduur zowel bij uitgelokt als idiopathische kuitvenetrombose 3 maanden.
Voorlichting en advies
Naar Samenvatting ›- Geef uitleg over de ontstaanswijze van DVT.
- Bespreek de noodzaak van de behandeling (voorkomen van longembolie en overlijden) en de werking van de antistollingsmedicatie (het bloed wordt dun gehouden zodat het lichaam het stolsel kan opruimen).
- Bespreek veelvoorkomende bijwerkingen van antistollingsmedicatie (snel blauwe plekken en langer bloedende wondjes), gedragsaanpassingen (voorkom situaties met verhoogd risico op een ongeluk en/of val op het hoofd) en vraag het gebruik van zelfzorgmiddelen te melden.
- Bespreek bij welke klachten of situaties de patiënt direct contact moet opnemen:
- toename van klachten van het been
- kortademigheid, pijn vastzittend aan de ademhaling, bloed ophoesten
- matige of ernstige bloedingen (bloedbraken, zwarte ontlasting, aanhoudend bloedende wonden) of verhoogd risico hierop (val op het hoofd, ongeluk)
- Mogelijk helpen zwachtelen en steunkousen tegen zwelling van het been, met name in de acute fase. Bespreek dat het niet bewezen is dat zwachtelen en steunkousen langdurige klachten (PTS) kunnen helpen voorkomen.
- Leg uit hoe de (thuis)behandeling praktisch vorm krijgt:
- Bedrust is niet nodig. De patiënt mag juist mobiliseren, met wandelen, om zo de veneuze doorstroom te bevorderen.
Thuisarts
Bied voorlichtingsmateriaal aan en verwijs naar de informatie op thuisarts.nl. De informatie op Thuisarts is gebaseerd op deze NHG-Standaard.
Mobiliteit versus bedrust
Een belangrijke controverse over leefregels voor patiënten met DVT betreft het risico op longembolie bij direct of vroeg mobiliseren van patiënten met een DVT. De gedachte is dat een stuk trombus door beweging in het been los zou raken en vervolgens een longembolie kan veroorzaken. Aan de andere kant versterkt bedrust de stase van de veneuze bloedstroom, wat mogelijk ongunstig is; immobilisatie is immers een risicofactor voor het ontwikkelen van DVT. In een meta-analyse waarin bedrust bij patiënten met VTE (dus DVT en longembolie) met directe mobilisatie werd vergeleken, werden 5 onderzoeken geïncludeerd met in totaal 3048 patiënten. Het waren 4 RCT’s en 1 groot (n = 2650) prospectief niet-gerandomiseerd cohortonderzoek. Patiënten kregen minimaal 3 en maximaal 9 dagen bedrust, patiënten in de ambulante groep mochten binnen 2 dagen beginnen met lopen, waarvan een deel direct. Alle patiënten werden behandeld met LMWH. De follow-up varieerde tussen 4 en 15 dagen, waarna een echo, CT- en/of perfusiescan werd gemaakt; ook asymptomatische longembolieën konden worden gevonden. Bij pooling van de resultaten bleek geen verschil in de kans op het krijgen van een longembolie tussen de groep die bedrust kreeg en de vroeg gemobiliseerde groep (RR 1,03; 95%-BI 0,65 tot 1,63). De kans op de gecombineerde uitkomst longembolie, progressie van de DVT of een nieuwe DVT was iets kleiner in de vroeg gemobiliseerde groep (RR 0,79; 95%-BI 0,55 tot 1,14) evenals de kans op de gecombineerde uitkomst longembolie en totale sterfte (RR 0,79; 95%-BI 0,40 tot 1,56). De resultaten veranderden niet in belangrijke mate als in de analyse het grote, niet-gerandomiseerde onderzoek werd weggelaten. De kans op de uitkomst nieuwe longembolie of DVT of uitbreiding van de DVT was 0,87 (95%-BI 0,58 tot 1,31); het RR op de uitkomst longembolie/totale sterfte wees dan in de andere richting (gepoolde RR 1,12; 95%-BI 0,69 tot 1,82). In een tweede meta-analyse werden dezelfde onderzoeken minus het cohortonderzoek geïncludeerd en er werden iets andere (completere) resultaten van één van de RCT’s gebruikt (Aissaoui gebruikte een interim-analyse). Ook in deze meta-analyse werden geen significante verschillen gevonden tussen bedrust en mobilisatie voor de kans op longembolie of progressie van de DVT.
Conclusie
Vroege mobilisatie bij een DVT geeft geen verhoogd risico op het ontstaan van longembolie of progressie van de DVT.
Advies
Bedrust bij DVT is niet nodig. De patiënt mag juist mobiliseren, met bijvoorbeeld wandelen, om zo de veneuze doorstroom te bevorderen en de vorming van collateralen te bevorderen.
Niet-medicamenteuze behandeling
Naar Samenvatting ›Compressief zwachtelen
Naar Samenvatting ›Overweeg een methode van compressief zwachtelen bij het bestrijden van de zwelling. Wees terughoudend met compressief zwachtelen ter voorkoming van PTS.
Bij keuze voor compressie
- Methodes van compressie bij wens voor symptoomverlichting: compressief zwachtelen of klasse 3 steunkous (klasse 2 als klasse 3 niet verdragen wordt). Er zijn alternatieven beschikbaar met verschillende materialen en prijzen, zoals een tijdelijke oedeemcompressiekous.
- Start compressie bij voorkeur binnen 24 uur voor een maximaal effect op de zwelling. Zie voor techniek NHG-Standaard Ulcus cruris venosum, paragraaf Ambulante compressietherapie. Voor een goede compressie moet het verband aanvankelijk tweemaal per week worden verwisseld (vaker als het verband afzakt) tot de zwelling voldoende is afgenomen, en daarna eenmaal per week. Het verband blijft dag en nacht zitten.
- De belangrijkste contra-indicaties voor elke vorm van compressietherapie zijn ernstige arteriële insufficiëntie, neuropathie en decompensatio cordis.
Direct compressief zwachtelen in de acute fase van DVT lijkt niet of nauwelijks effect te hebben op het ontstaan van PTS. Het effect op recidief-DVT is niet onderzocht. Wel kan het in de eerste week de zwelling van het been verminderen. Dit kan comfortabel zijn voor patiënten met veel zwelling. We zijn onzeker of compressie ook effectief is tegen de pijn. Als besloten wordt tot aangemeten steunkousen (na de acute fase), kan het ook nodig zijn een vorm van compressietherapie toe te passen. De behandeling is belastend voor de patiënt, maar verder zitten er weinig nadelen aan zwachtelen. Dit heeft geleid tot een zwakke aanbeveling tegen compressief zwachtelen ter voorkoming van een PTS, en een zwakke aanbeveling voor compressief zwachtelen ter bestrijding van de zwelling. Als besloten wordt te starten met compressie, is het goed dat bij voorkeur binnen 24 uur te doen voor een maximaal effect op de zwelling.
Gewenste en ongewenste effecten
Direct compressief zwachtelen in de acute fase van DVT lijkt de zwelling van het been te verminderen. Op het optreden van PTS binnen één jaar lijkt zwachtelen in de acute fase echter geen effect te hebben. Over andere voor- en nadelen zijn er geen gegevens bekend.
Kwaliteit van bewijs
De kwaliteit van bewijs was laag. Er is slechts 1 onderzoek gedaan met een klein aantal deelnemers en een beperkt aantal uitkomstmaten, dat bovendien methodologische gebreken had. Zo is de randomisatieprocedure niet goed beschreven en waren de patiënten niet geblindeerd.
Waarden en voorkeuren van patiënten
Zwachtelen in de acute fase van DVT kan de zwelling van het been verminderen. Patiënten bij wie de zwelling matig tot ernstig is, zullen hier daarom waarschijnlijk de voorkeur aan geven. Dit geldt ook voor patiënten bij wie besloten is tot het aanmeten van steunkousen.
Omdat zwachtelen echter een belastende behandeling is, die geen effect lijkt te hebben op het voorkomen van PTS, zal een groot deel van de patiënten hier niet voor kiezen, met name als er niet tot nauwelijks zwelling of pijn is.
Kosten
Niet bepaald.
Aanvaardbaarheid
Geen bijzonderheden, voor zowel patiënten als huisartsen is direct compressief zwachtelen aanvaardbaar.
Haalbaarheid
Het zwachtelen kan uitgevoerd worden door een thuiszorgmedewerker, een geschoolde assistente van de huisarts of een huid- en oedeemtherapeut. Een knelpunt is de beschikbaarheid van personeel. Er kan ook gebruik worden gemaakt van een aan- en uittrekhulpmiddel.
Uitgangsvraag
Is compressief zwachtelen (vergeleken met placebo/niet zwachtelen) aan te bevelen bij patiënten met een diepveneuze trombose (DVT) in de acute fase? Zie de PICO-tabel.
|
Patiënten |
Patiënten met DVT |
|---|---|
|
Interventie |
Compressief zwachtelen |
|
Vergelijking |
Placebo of niet zwachtelen |
|
Uitkomstmaten |
Cruciaal:
Belangrijk:
|
De NHG-werkgroep heeft de volgende grenzen voor klinisch relevante verschillen vastgesteld:
- optreden van PTS: absoluut risicoverschil van 7,5% (dus 75 per 1000 patiënten; conform de door Ten Cate-Hoek et al. voorgestelde non-inferiority margin.)
- overige dichotome uitkomstmaten (recidief-DVT, bijwerkingen, gebruiksgemak): relatief risicoverschil van 25% (dus RR < 0,75 of RR > 1,25) (conform de door GRADE voorgestelde standaardgrenzen)
- continue uitkomstmaten (pijn, kwaliteit van leven, zwelling): een verschil van 20% op de gebruikte schaal
Achtergrond
PTS is een langetermijncomplicatie van DVT. PTS ontwikkelt zich bij 15-50% van de patiënten en dat gebeurt vaak binnen 1-2 jaar na een DVT, al kan het een enkele maal ook jaren later nog ontstaan. Een op dit moment veel toegepaste, niet-invasieve behandeloptie ter preventie van PTS is compressietherapie, bestaande uit compressief zwachtelen of tijdelijke steunkousen zolang er oedeem is, gevolgd door het dragen van steunkousen. Dit detail gaat over de toepassing van compressief zwachtelen in de acute fase.
Methoden
Er is een systematische literatuurzoekactie naar SR’s en RCT’s uitgevoerd in PubMed en Embase in mei 2021, met een update in december 2022.
Resultaten
Resultaat zoekactie
De zoekactie leverde 1 systematische cochranereview op naar de effectiviteit van compressietherapie ter preventie van PTS bij patiënten met DVT. Een aanvullende search na de zoekdatum van deze review en de update van de search in december 2022 leverden geen aanvullende RCT’s op.
Onderzoekskarakteristieken
De review includeerde 10 RCT’s (n = 2361) waarin compressietherapie bij patiënten met DVT werd onderzocht. In 1 RCT (n = 69) werd compressief zwachtelen in de acute fase vergeleken met niet zwachtelen. De patiënten werden poliklinisch behandeld met LMWH en acenocoumarol. Elke 3-4 dagen (of eerder als ze te los kwamen te zitten) werden de zwachtels opnieuw aangebracht door gespecialiseerde verpleegkundigen. Na 7-14 dagen (als eventueel oedeem voldoende verminderd was) kregen alle deelnemers steunkousen aangemeten. Patiënten uit de controlegroep bij wie het oedeem na 10 dagen niet voldoende verminderd was, werden alsnog gezwachteld. De patiënten werden gevolgd gedurende een jaar, met metingen na 7, 30 en 90 dagen en na één jaar.
Effectiviteit en bijwerkingen
Zie tabel Compressief zwachtelen versus niet zwachtelen voor de samenvatting van de resultaten.
Conclusies
- Mogelijk vermindert direct compressief zwachtelen in de acute fase van DVT de zwelling van het been (kwaliteit van bewijs is laag);
- Mogelijk heeft direct compressief zwachtelen in de acute fase van DVT niet of nauwelijks effect op de incidentie van PTS (kwaliteit van bewijs is laag);
- We zijn onzeker over het effect op pijn (kwaliteit van bewijs is zeer laag);
- Kwaliteit van leven, recidief-DVT, gebruiksgemak en bijwerkingen zijn niet onderzocht.
Steunkousen
Naar Samenvatting ›Overweeg ter bestrijding van de zwelling in overleg met de patiënt steunkousen, voorafgegaan door compressief zwachtelen. Wees terughoudend met steunkousen ter voorkoming van PTS of recidief-DVT.
Er is onvoldoende bewijs om patiënten te behandelen met steunkousen ter voorkoming van PTS en recidief-DVT. Er is wel enig bewijs dat het helpt tegen de zwelling. Er is niet of nauwelijks effect op pijn in de acute fase, en over pijn na de acute fase is geen onderzoek. In overleg met de patiënt kan bij zwelling dus wel gekozen worden voor steunkousen. We weten niet of patiënten met veel klachten een hoger risico hebben op het ontwikkelen van PTS en of steunkousen een effect op de klachten hebben. Dit heeft geleid tot een zwakke aanbeveling tegen steunkousen voor de uitkomst ‘PTS en recidief-DVT’ en een zwakke aanbeveling voor steunkousen voor de uitkomst ‘zwelling’.
Gewenste en ongewenste effecten
We zijn onzeker over het effect van steunkousen op het risico op PTS en op ernstige PTS. Steunkousen verlagen niet of nauwelijks het risico op recidief-DVT en hebben mogelijk ook niet of nauwelijks effect op pijn in de acute fase of kwaliteit van leven. Compressietherapie leidt mogelijk tot geringe bijwerkingen (voornamelijk jeuk), er traden geen ernstige bijwerkingen op.
Kwaliteit van bewijs
De kwaliteit van het bewijs was redelijk (1 uitkomst), laag (3 uitkomsten) tot zeer laag (4 uitkomsten). De onderzoeken zijn uitgevoerd in Westerse landen. Er werd afgewaardeerd voor risico op vertekening (geen placebo steunkous), heterogeniteit in bewijs (onderzoeken lieten verschillende richtingen van resultaten zien) en onnauwkeurigheid (brede betrouwbaarheidsintervallen).
Waarden en voorkeuren van patiënten
Gebruiksgemak en patiënttevredenheid worden niet beschreven in de onderzoeken. Compliance varieert van matig tot goed (zeer lage kwaliteit van bewijs). Er treden mogelijk geringe bijwerkingen op die tot gebruiksongemak kunnen leiden.
Kosten
De directe kosten van steunkousen (en indirecte kosten door eventuele hulp bij aan- en uittrekken) zijn niet gerapporteerd in de onderzoeken. Op internet worden steunkousen aangeboden tussen de 60 en 100 euro, waarbij 1 steunkous een half jaar gedragen kan worden. De directe en indirecte kosten samen werden in Nederland in 2011 op 20 miljoen euro geschat (zie Zorgvisie: ‘Steunkousen kosten jaarlijks 20 miljoen’). Er zijn verschillend geprijsde alternatieven beschikbaar met verschillende materialen, zoals oedeemkousen of klittenbandsystemen voor niet-elastische compressiebandage, maar wij hebben niet specifiek gekeken of deze vergelijkbare effecten geven.
Aanvaardbaarheid
Een deel van de patiënten heeft hulp nodig bij het aan- en uittrekken van de kousen (door thuiszorg of steunkousen aantrekhulpmiddel). Zij moeten dan thuis wachten op de thuiszorg. Een alternatief is een aan- en uittrekhulpmiddel, als patiënten daartoe bekwaam zijn. Ook kunnen patiënten het als vervelend ervaren om een steunkous te dragen.
Haalbaarheid
- Steunkousen zijn gemakkelijk verkrijgbaar via thuiszorg(winkels) en thuiszorg is vaak al betrokken bij een deel van de patiënten die steunkousen krijgen. Met het huidige personeelstekort is er mogelijk geen thuiszorg beschikbaar hiervoor. Een alternatief is een aan- en uittrekhulpmiddel.
- Er moet voorlichting gegeven worden over het gebruik van steunkousen. Een steunkous moet na een half jaar vervangen worden.
Uitgangsvraag
Zijn steunkousen (vergeleken met placebo) aan te bevelen bij patiënten met een DVT? Zie de PICO-tabel.
|
Patiënten |
Patiënten met op echo bewezen DVT |
|---|---|
|
Interventie |
Steunkousen |
|
Vergelijking |
Placebo of tubigrip of geen behandeling |
|
Uitkomstmaten |
Cruciaal:
Belangrijk:
|
De NHG-werkgroep heeft de volgende grenzen voor klinisch relevante verschillen vastgesteld:
- optreden van PTS: absoluut risicoverschil van 7,5% (dus 75 per 1000 patiënten; conform de door Ten Cate-Hoek et al. voorgestelde non-inferiority margin.)
- overige dichotome uitkomstmaten (recidief-DVT, bijwerkingen, compliance): relatief risicoverschil van 25% (dus RR < 0,75 of RR > 1,25) (conform de door GRADE voorgestelde standaardgrenzen)
- continue uitkomstmaten (pijn, kwaliteit van leven): een verschil van 20% op de gebruikte schaal
Achtergrond
PTS is een langetermijncomplicatie van DVT. PTS ontwikkelt zich bij 15-50% van de patiënten en dat gebeurt vaak binnen 1-2 jaar na een DVT, al kan het een enkele maal ook jaren later nog ontstaan. Er zijn 2 bekende non-invasieve behandelopties ter preventie van PTS, namelijk compressief zwachtelen in de acute fase en het dragen van steunkousen. Dit detail gaat over de toepassing van steunkousen.
Methoden
Er is een systematische literatuurzoekactie naar SR’s en RCT’s uitgevoerd in PubMed en Embase in mei 2021 met een update in december 2022.
Resultaten
Resultaat zoekactie
De zoekactie leverde 2 SR’s (waarvan 1 cochranereview) op naar effectiviteit en bijwerkingen van steunkousen (vergeleken met een placebo kous of geen kous) ter preventie van PTS. Een aanvullende search na de zoekdatum van deze review leverde geen aanvullende RCT’s op. In de update in december 2022 vonden we 1 extra RCT. Omdat de resultaten van dit onderzoek in overeenstemming waren met die uit de SR’s en het toevoegen hiervan dus geen invloed zou hebben op de aanbeveling, hebben we dit onderzoek buiten beschouwing gelaten.
Onderzoekskarakteristieken
Voor de meeste uitkomstmaten hebben we de cochranereview als uitgangspunt genomen. Deze includeerde 5 RCT’s (n = 1393, 703 (steunkousen)/690 (placebo)) waarin steunkousen werden vergeleken met placebo (2 onderzoeken, n = 803 + 47) of geen behandeling (3 onderzoeken, n = 169 + 194 + 180). Er werd primair gekeken naar de uitkomst cumulatieve incidentie van PTS en cumulatieve incidentie van ernstige PTS. Ook werd er gekeken naar secundaire uitkomsten: incidentie ernstige PTS, recidief-DVT (4 onderzoeken), tevredenheid/kwaliteit van leven (3 onderzoeken), bijwerkingen (4 onderzoeken) en compliance (8 onderzoeken). Follow-up tijd was 2-6.3 jaar. De onderzoeken werden gepubliceerd tussen 1997 en 2014 en uitgevoerd in Nederland (1), Zwitserland (1), Canada (2)/USA (1) en Italië (1). Het grootste onderzoek (n = 806) werd in Canada/USA uitgevoerd.
Omdat de cochranereview pijn niet als uitkomstmaat had meegenomen, gebruiken we daarvoor de SR.
Effectiviteit en bijwerkingen
Zie tabel Steunkousen vergeleken met placebo of geen behandeling voor de samenvatting van de resultaten. De belangrijkste uitkomst ‘incidentie van PTS’ heeft een gepoold relatief risico van 0,62 (95%-BI 0,38-1,01), niet significant, hoewel de richting en grootte van de puntschatter wel richting een effect lijken te gaan. Bij de uitkomsten incidentie ernstige PTS en recidief-DVT ligt de puntschatter dichter bij de 1.
Over sommige vooraf door de werkgroep gescoorde uitkomstmaten is geen bewijsgevonden, of deze uitkomsten komen overeen met andere uitkomstmaten. De uitkomst compliance en/of bijwerkingen suggereert iets over gebruiksgemak. Zwelling/oedeem speelt vooral in de acute fase en wordt besproken als uitkomst in het detail over compressief zwachtelen. De uitkomst pijn hebben we ingedeeld in pijn in de acute fase, welke ook wordt besproken in het detail over compressief zwachtelen; en pijn op de langere termijn (> 60 dagen).
Conclusies
- We zijn onzeker over een effect van steunkousen op de incidentie van PTS en ernstige PTS (kwaliteit van bewijs zeer laag)
- Steunkousen hebben mogelijk niet of nauwelijks effect op recidief-DVT (kwaliteit van bewijs laag).
- Steunkousen beïnvloeden pijn in de acute fase mogelijk niet of nauwelijks (kwaliteit van bewijs laag).
- Er is geen onderzoek over pijn na de acute fase.
- Waarschijnlijk is er niet of nauwelijks verschil in kwaliteit van leven (kwaliteit van bewijs redelijk).
- Er zijn geen aanwijzingen voor ernstige bijwerkingen (kwaliteit van bewijs laag).
- Mildere bijwerkingen (tolerantie; jeuk, huidirritatie) kunnen optreden, maar we zijn onzeker over hoe vaak (kwaliteit van bewijs zeer laag).
- We zijn onzeker over therapietrouw en het gebruiksgemak (kwaliteit van bewijs zeer laag).
Bij keuze voor steunkousen
Naar Samenvatting ›- Laat zodra er geen zwelling (meer) aanwezig is, steunkousen aanmeten tot aan de knie (klasse 3 = 34-46 mmHg op enkelniveau; eventueel klasse 2 als 3 niet verdragen wordt).
- Als gekozen wordt voor steunkousen, kan de duur van steunkousen geïndividualiseerd worden op basis van klachten en verschijnselen bij lichamelijk onderzoek. Stop de steunkousen na 6 maanden als de patiënt geen klachten meer ervaart; verleng de duur tot 2 jaar bij persisterende klachten (langere duur is niet onderzocht).
- Steunkousen worden aangemeten door een gediplomeerd leverancier, dermatoloog of fleboloog. Steunkousen worden alleen overdag gedragen. De steunkousen worden alleen voorgeschreven ter verlichting van klachten: benadruk dat therapietrouw en goede pasvorm essentieel zijn.
- Bijwerkingen die patiënten ervaren zijn jeuk, ongemak en huidirritatie. Ook is er vaak moeite met aantrekken.
We vinden geen aanwijzingen dat eerder stoppen met het dragen van steunkousen een hoger risico geeft op PTS, ernstige PTS of recidief-DVT. Daarom is de werkgroep gekomen tot een zwakke aanbeveling voor het geïndividualiseerd aanpassen van de duur van het dragen van steunkousen. In de 2 onderzoeken is geen controle- of placebogroep opgenomen. De effectiviteit van de steunkousen zelf op belangrijke uitkomstmaten is daardoor niet te beoordelen. Als er gekozen wordt voor het dragen van steunkousen ter symptoombestrijding, kan de duur van steunkousen geïndividualiseerd worden op basis van de klachten van de patiënt. Geïndividualiseerde duur betekent dat steunkousen regelmatig geëvalueerd worden op 6 en 12 maanden.
Gewenste en ongewenste effecten
Geïndividualiseerde duur (6 of 12 maanden) op basis van klinisch beeld en Villalta-score vergeleken met gestandaardiseerde duur van 24 maanden geeft mogelijk niet of nauwelijks verschil in incidentie van PTS. Stoppen na 1 jaar zonder te kijken naar het klinisch beeld verhoogt mogelijk de incidentie van PTS mogelijk niet of nauwelijks in vergelijking met 2 jaar gebruik. Over het effect op ernstige PTS of recidief-DVT zijn we onzeker.
Kwaliteit van bewijs
Het betreft 2 relatief grote en recente Nederlandse RCT’s met een non-inferiority design (totaal n = 1383), met redelijke (2 uitkomsten), laag (1 uitkomst) en zeer lage (2 uitkomsten) kwaliteit van bewijs. Er is afgewaardeerd op risico op vertekening (geen placebo kous), en risico op onnauwkeurigheid (brede betrouwbaarheidsintervallen en/of klein aantal events).
Waarden en voorkeuren van patiënten
Gebruiksgemak en patiënttevredenheid worden niet beschreven in de onderzoeken. Compliance varieert van matig tot goed (zeer lage kwaliteit van bewijs). In de praktijk is er variatie tussen patiënten hoe vaak steunkousen gedragen worden, en hoe dit wordt ervaren. Mogelijk hangt dit samen met het ervaren van symptomen. Er treden mogelijk geringe bijwerkingen op die tot gebruiksongemak kunnen leiden. Waarschijnlijk is het voor een patiënt prettiger als de steunkous slechts 6 maanden of 1 jaar gedragen hoeft te worden.
Kosten
De directe kosten van steunkousen (en eventuele hulp bij aan- en uittrekken) zijn niet bekend. Kosten zullen minder zijn als patiënt na 6 maanden of 12 maanden al kan stoppen met het dragen van steunkousen.
Aanvaardbaarheid
Een deel van de patiënten heeft hulp nodig bij het aan- en uittrekken van de kousen (door thuiszorg of aan- en uittrekuittrek hulpmiddel). Geïndividualiseerde duur betekent dat het gebruik van steunkousen regelmatig geëvalueerd moet worden (bijvoorbeeld op 3, 6 en 12 maanden). Het is niet duidelijk of dit door de huisarts gedaan moet worden.
Haalbaarheid
Steunkousen zijn gemakkelijk verkrijgbaar via thuiszorg(winkels) en thuiszorg is vaak al betrokken bij een deel van de patiënten die steunkousen krijgen. Het betreft wel een extra handeling voor de thuiszorg. Met de huidige personeelstekort mogelijk geen thuiszorg beschikbaar hiervoor. Een alternatief is een aan- en uittrekhulpmiddel. Er moet voorlichting gegeven worden over het gebruik van steunkousen. Een steunkous moet na een half jaar vervangen worden.
Uitgangsvraag
Welke duur van dragen van steunkousen is aan te bevelen bij patiënten met een DVT? Zie de PICO-tabel.
|
Patiënten |
Patiënten met op echo bewezen DVT |
|---|---|
|
Interventie |
Steunkousen gedragen gedurende 6-12 maanden |
|
Vergelijking |
Steunkousen gedragen gedurende 2 jaar |
|
Uitkomstmaten |
Cruciaal:
Belangrijk:
|
De NHG-werkgroep heeft de volgende grenzen voor klinisch relevante verschillen vastgesteld:
- optreden van PTS: absoluut risicoverschil van 7,5% (dus 75 per 1000 patiënten; conform de door Ten Cate-Hoek et al. voorgestelde non-inferiority margin.)
- overige dichotome uitkomstmaten (recidief-DVT, bijwerkingen, compliance): relatief risicoverschil van 25% (dus RR < 0,75 of RR > 1,25) (conform de door GRADE voorgestelde standaardgrenzen)
- continue uitkomstmaten (pijn, kwaliteit van leven): een verschil van 20% op de gebruikte schaal
Achtergrond
PTS is een langetermijncomplicatie van DVT. PTS ontwikkelt zich bij 15-50% van de patiënten en dat gebeurt vaak binnen 1-2 jaar na een DVT. Er zijn 2 bekende non-invasieve behandelopties ter preventie van PTS, namelijk compressief zwachtelen in de acute fase en het dragen van steunkousen. Dit detail gaat over de toepassing van steunkousen, specifiek over de meest wenselijke duur van dragen.
Methoden
Er is een systematische literatuurzoekactie naar SR’s en RCT’s uitgevoerd in PubMed en Embase in mei 2021 met een update in december 2022.
Resultaten
Resultaat zoekactie
De zoekactie leverde 1 systematische cochranereview op naar effectiviteit van steunkousen (vergeleken met een placebo kous of geen kous) ter preventie van PTS. Hierin wordt ook gerapporteerd over de duur van dragen in 1 RCT. Een aanvullende search na de zoekdatum van deze review leverde 1 aanvullende RCT op. De update van de search leverde geen nieuw onderzoek op.
Onderzoekskarakteristieken
De review includeerde 1 Nederlandse RCT, het OCTAVIA-onderzoek (n = 518; 256 patiënten voor 1 jaar, 262 patiënten voor 2 jaar). Primaire uitkomst was incidentie PTS na 24 maanden. Secundaire uitkomstmaten waren compliance (≥ 6 dagen per week), recidief-DVT, dood, kwaliteit van leven.
De aanvullende RCT (IDEAL-DVT, uitgevoerd in non-inferiority, in Nederland en Italië) is verschenen na het uitkomen van de cochranereview (n = 865). 437 patiënten kregen geïndividualiseerde duur (6 of 12 maanden), en 428 patiënten standaard duur (24 maanden). De geïndividualiseerde duur werd bepaald door het klinische beeld en de Villalta-score te bepalen. Primaire uitkomst was incidentie PTS na 24 maanden. Secundaire uitkomsten waren Villalta-scores, been ulcus, recidief-DVT, incidentie longembolie, kwaliteit van leven, en dood.
Effectiviteit en bijwerkingen
Zie tabel Steunkousen gedurende 6 of 12 maanden vergeleken met 2 jaar en tabel Steunkousen gedurende 1 jaar vergeleken met 2 jaar. Over sommige vooraf door de werkgroep gescoorde uitkomstmaten is geen literatuur gevonden, of deze uitkomsten komen overeen met andere uitkomstmaten. Over pijn en bijwerkingen wordt niets beschreven.
Conclusie
- Geïndividualiseerde duur van steunkousen (6, 12 of 24 maanden) is mogelijk even effectief als de gestandaardiseerde duur van 24 maanden. Stoppen na 12 maanden zonder naar de Villalta-score te kijken verhoogt mogelijk de incidentie van PTS niet of nauwelijks (kwaliteit van bewijs laag).
- We zijn onzeker of kortere behandelduur van steunkousen het risico op ernstige PTS verlaagt (kwaliteit van bewijs zeer laag).
- Kortere behandelduur van steunkousen beïnvloedt het risico op recidief-DVT mogelijk niet of nauwelijks (kwaliteit van bewijs zeer laag).
- De duur van de steunkousen heeft mogelijk niet of nauwelijks invloed op de kwaliteit van leven (kwaliteit van bewijs redelijk).
- Er is waarschijnlijk niet of nauwelijks verschil in adherence/compliance. Mogelijk doet het íets op adherence als patiënten geïndividualiseerde duur krijgen. De compliance neemt na verloop van tijd af, maar blijft hoog (kwaliteit van bewijs redelijk).
Medicamenteuze behandeling
Naar Samenvatting ›Algemene overwegingen bij antistollingsmedicatie
Naar Samenvatting ›- Behandel een DVT met een DOAC of een VKA om longembolie of uitbreiding van de trombose te voorkomen (zie Keuze tussen DOAC of VKA).
- Let op bij patiënten met contra-indicaties of met een verhoogd bloedingsrisico (zie ook Consultatie en verwijzing).
- Bepaal creatinine en eGFR, tenzij deze < 3 maanden geleden bepaald zijn.
- Behandeling met anticoagulantia gaat gepaard met een verhoogd risico op bloedingen. Wees dus alert op wijzigingen in de gezondheidssituatie van de patiënt.
- Bij patiënten die trombocytenaggregatieremmers gebruiken: bespreek dit met de behandelaar (cardioloog, neuroloog). Vaak worden deze tijdelijk gestaakt (en daarna dus weer gestart).
- Beoordeel of maagbescherming is geïndiceerd (zie NHG-Behandelrichtlijn Preventie van maagcomplicaties door geneesmiddelgebruik).
- Informeer de patiënt over factoren die van invloed zijn op de werkzaamheid van orale antistolling, zoals (zelfzorg)medicatie, infecties en alcoholgebruik. Adviseer bij voorkeur geen NSAID’s te gebruiken.
- De contra-indicaties voor orale anticoagulantia hebben vooral betrekking op het risico op bloedingen. Bij een relatieve contra-indicatie moet het voordeel van de antistollingsbehandeling worden afgewogen tegen het verhoogde bloedingsrisico.
- De belangrijkste relatieve contra-indicaties voor orale anticoagulantia zijn hoge leeftijd, kwetsbaarheid, verhoogd valrisico, verminderde nierfunctie, leverinsufficiëntie (afhankelijk van het gekozen middel), alcoholmisbruik, ongecontroleerde hypertensie, recent doorgemaakte ernstige bloeding, verhoogd risico op klinisch relevante bloedingen, bijvoorbeeld door ulcus pepticum, bekende oesofagusvarices en hematologisch verhoogde bloedingsneiging.
Keuze tussen DOAC of VKA
Naar Samenvatting ›- DOAC’s en VKA’s zijn gelijkwaardig wat betreft effectiviteit, maar er is een voorkeur voor een DOAC vanwege het gebruiksgemak en een lager risico op bloedingen.
- Let op contra-indicaties en interacties. DOAC’s hebben meer absolute contra-indicaties dan VKA’s. Geef een VKA in de volgende situaties:
- na bariatrische chirurgie of bij morbide obesitas (BMI ≥ 40) (effectiviteit van DOAC’s nog onvoldoende onderzocht)
- antifosfolipidensyndroom (VKA effectiever)
- mitralisklepstenose
- klepprothese
- gebruik van krachtige CYP3A4-inductoren, zoals anti-epileptica
Het lijkt bij de behandeling van DVT voor de uitkomsten recidief-VTE of sterfte niet of nauwelijks uit te maken of daarbij een DOAC of een VKA wordt voorgeschreven. Maar mogelijk leidt gebruik van sommige DOAC’s tot een kleiner risico op ernstige bloedingen dan bij een VKA, waardoor er een voorkeur voor een DOAC is. Ook andere zaken als gebruiksgemak (geen INR-controle) spelen mee in een mogelijke keuze. Er zijn verschillende redenen waarom men toch voor een VKA kan kiezen, zoals wanneer de therapietrouw niet gewaarborgd kan worden of na bariatrische chirurgie (zie tabel 3).
Gewenste en ongewenste effecten
Het lijkt bij de behandeling van DVT niet of nauwelijks uit te maken of je een DOAC of VKA voorschrijft wat betreft de uitkomsten recidief-VTE of sterfte. Mogelijk leidt een DOAC tot een kleiner risico op bloedingen dan een VKA.
Kwaliteit van bewijs
De kwaliteit van bewijs voor recidief-VTE en sterfte was laag tot zeer laag. De kwaliteit van bewijs voor ernstige bloedingen en voor niet-ernstige, klinisch relevante bloedingen was redelijk tot laag. Er werd afgewaardeerd voor (ernstige) onnauwkeurigheid, uitvoering van de RCT’s door de industrie en in een enkel geval risico op bias.
Waarden en voorkeuren van patiënten
Als het om de effectiviteit en bijwerkingen gaat, zullen de meeste patiënten kiezen voor een DOAC: sommige DOAC’s leiden mogelijk tot een kleiner risico op bloedingen dan een VKA, terwijl er in de effectiviteit (voorkomen van een recidief-VTE) en de kans op sterfte niet of nauwelijks verschillen lijken te zijn tussen beide middelen.
Kosten
VKA’s zijn aanzienlijk goedkoper dan DOAC’s (medicijnkosten.nl, geraadpleegd mei 2022). De totale kosten van de behandeling (zeker voor de behandelduur van 3 maanden) zullen elkaar waarschijnlijk niet veel ontlopen, door de extra kosten van de begeleiding door de trombosedienst bij VKA’s.
Aanvaardbaarheid
Het is voor patiënten en huisartsen aanvaardbaar om te behandelen met beide geneesmiddelgroepen. Er zijn een aantal overwegingen.
- Bij een VKA moet de INR gecontroleerd worden door middel van een bloedafname door de trombosedienst of door zelfafname, voor een DOAC is dit niet nodig. Voor veel patiënten is het een belasting om onder controle te zijn bij de trombosedienst of om bloed af te (laten) nemen. Er zullen echter ook patiënten zijn die de INR-controles door de trombosedienst prefereren, bijvoorbeeld omdat dit een veilig gevoel geeft. Dit weegt mogelijk zwaarder zodra er een grotere kans is dat men langdurig behandeld moet worden met het geneesmiddel.
- Een voordeel van een DOAC is dat er een vaste dosering is. De dosering van de VKA’s is afhankelijk van de INR en kan in de tijd, maar ook in combinatie met andere geneesmiddelen wisselen. Een vaste dosering bevordert de therapietrouw, maar met INR-controles kan de therapietrouw gemonitord worden.
- Een nadeel is dat bij een VKA en bij 2 van de 4 DOAC’s (dabigatran en edoxaban) gestart moet worden met 5 dagen spuiten van LMWH. Bij de overige 2 DOAC’s (apixaban en rivaroxaban) is dit niet nodig. Bij langdurige behandeling zal dit mogelijk minder zwaar wegen.
- Een voordeel van een VKA is dat er jarenlange ervaring is bij ouderen en bij patiënten met verminderde nierfunctie. Voor de paar uitkomstmaten en DOAC’s waarvoor een subgroepanalyse is gedaan in de groep patiënten ≥ 65 jaar, leken de DOAC’s echter even effectief en veilig als in de totale groep (alle leeftijden). Inmiddels is er ook met DOAC’s meer ervaring opgedaan.
- Er zijn verschillende interacties met andere medicatie, voor DOAC’s mogelijk minder dan voor VKA’s.
Haalbaarheid
- De huisarts is inmiddels goed bekend met beide geneesmiddelgroepen en er zijn genoeg instructies voor dosisaanpassingen of contra-indicaties. De trombosedienst levert de zorg voor de controle van de INR, dit is goed haalbaar gebleken.
- Milieu-impact: bij de beoordeling van de milieu-impact van geneesmiddelen worden de CO2-uitstoot, risico’s voor het oppervlaktewater en afgifte van microplastics bekeken. Er zijn geen gegevens over de CO2-uitstoot van de verschillende anticoagulantia beschikbaar. VKA’s, laagmoleculairgewicht heparinen, pentasachariden en rivaroxaban worden goed afgebroken en er zijn geen aanwijzingen voor risico’s voor het oppervlaktewater. Voor apixaban en dabigatran is nog onvoldoende onderzoek beschikbaar om een zekere uitspraak te kunnen doen. Van edoxaban zijn geen onderzoeken naar risico’s voor het oppervlaktewater beschikbaar. Geen van de anticoagulantia geeft microplastics af na toediening.
Uitgangsvraag
Is een direct-werkend oraal anticogulans (DOAC) of een vitamine K-antagonist (VKA) aan te bevelen bij patiënten met een diepveneuze trombose (DVT) in de huisartsenpraktijk? Zie de PICO-tabel.
|
Patiënten |
Patiënten met een diepveneuze trombose |
|---|---|
|
Interventie |
DOAC:
|
|
Vergelijking |
VKA |
|
Uitkomstmaten |
Cruciaal:
Belangrijk:
|
De NHG-werkgroep sluit voor de grenzen van klinisch relevante verschillen aan bij de door GRADE voorgestelde standaardgrenzen: relatief risicoverschil van 25% (dus RR < 0,75 of RR > 1,25).
Algemene opmerking: de meeste onderzoeken vergelijken een DOAC met de VKA warfarine. In Nederland wordt meestal fenprocoumon of acenocoumarol gebruikt. Er is niet afgewaardeerd vanwege het feit dat de DOAC’s vergeleken zijn met warfarine.
Achtergrond
Antistollingsmedicatie is een effectieve behandeling van patiënten met een DVT om een longembolie of uitbreiding van de trombose te voorkomen. Antistollingsbehandeling gaat echter gepaard met een verhoogd risico op bloedingen. De 2 meest gebruikte vormen van antistollingsmedicatie voor DVT zijn een VKA (fenprocoumon of acenocoumarol) en een DOAC (apixaban, dabigatran, edoxaban of rivaroxaban). Bij de VKA’s en bij dabigatran en edoxaban is gecombineerd gebruik met LMWH gedurende enkele dagen (voorafgaand aan of tegelijkertijd) noodzakelijk.
Methoden
Voor het beantwoorden van deze vraag hebben wij gebruikgemaakt van de Britse NICE-richtlijn Venous thromboembolic diseases: diagnosis, management and thrombophilia testing (geraadpleegd april 2022). Voor het ontwikkelen van deze richtlijn is een SR uitgevoerd. De NHG-werkgroep heeft de bewijstabellen en conclusies uit deze SR besproken en een aanbeveling geformuleerd.
Daarnaast is een systematische literatuurzoekactie naar RCT’s uitgevoerd in PubMed en Embase vanaf de zoekdatum van de NICE-richtlijn (april 2019) in december 2021, met een update in december 2022.
Resultaten
Resultaat zoekactie
Een aanvullende search na de zoekdatum van de NICE-richtlijn leverde 2 aanvullende RCT’s op. Bij de update werden geen nieuwe RCT’s gevonden.
Onderzoekskarakteristieken
De NICE-richtlijn includeerde 34 RCT’s naar de initiële behandeling van VTE (n = 39.278). Hiervan vergeleken er 9 een DOAC met een VKA: 2 RCT’s vergeleken apixaban met VKA voorafgegaan door LMWH; 3 vergeleken rivaroxaban met VKA voorafgegaan door LMWH; 2 vergeleken edoxaban met VKA voorafgegaan door LMWH, 1 daarvan startte edoxaban na eerst een periode van parenterale anticoagulantia en de andere niet; 2 vergeleken dabigatran plus LMWH bij de start van de behandeling met VKA voorafgegaan door LMWH. Zie bijlage 7 in de Totstandkoming en methoden voor de beschrijving van de onderzoeken.
Er waren te weinig onderzoeksgegevens beschikbaar om onderscheid te maken naar longembolie of DVT, als index-gebeurtenis én als uitkomstmaat. Daarom zijn de resultaten voor alle veneuze trombo-embolieën samengenomen. De RCT’s uit de aanvullende zoekactie waren te klein om betrouwbare resultaten op de cruciale uitkomstmaten te geven en zijn daarom verder buiten beschouwing gelaten.
Effectiviteit en bijwerkingen
Zie tabel Apixaban vergeleken met VKA, tabel Dabigatran vergeleken met VKA, tabel Edoxaban vergeleken met VKA en tabel Rivaroxaban vergeleken met VKA.
- Bijwerkingen DOAC’s volgens KNMP Kennisbank (geraadpleegd mei 2022): belangrijkste veel voorkomende bijwerkingen zijn niet-ernstige bloedingen, buikklachten waaronder dyspepsie en misselijkheid, en jeuk. Ernstige, zeldzame, bijwerkingen zijn ernstige, potentieel levensbedreigende bloedingen en anafylactische reacties.
- Bijwerkingen VKA’s volgens KNMP Kennisbank (geraadpleegd mei 2022): belangrijkste veel voorkomende bijwerkingen zijn niet-ernstige bloedingen. Ernstige, zeldzame, bijwerkingen zijn ernstige, potentieel levensbedreigende, bloedingen.
Conclusies
- Er lijkt niet of nauwelijks verschil tussen een DOAC en een VKA in het risico op een recidief-VTE of sterfte (kwaliteit van bewijs voor de afzonderlijke DOAC’s varieert van laag tot zeer laag).
- Sommige DOAC’s leiden mogelijk tot een kleiner risico op een ernstige bloeding en een klinisch relevante, niet-ernstige bloeding dan een VKA (kwaliteit van bewijs voor de afzonderlijke DOAC’s varieert van redelijk tot laag). Bij andere DOAC’s is er mogelijk niet of nauwelijks verschil.
- Er is beperkt bewijs dat bij patiënten boven de 65 jaar DOAC’s veilig en effectief zijn (zie extra uitkomstmaat 65+ in tabel Apixaban vergeleken met VKA, tabel Dabigatran vergeleken met VKA en tabel Rivaroxaban vergeleken met VKA, sommige DOAC’s lijken het even goed te doen, andere zelfs beter ten opzichte van VKA in de groep ≥ 65 jaar).
DOAC’s
Naar Samenvatting ›- Er is op basis van de huidige literatuur geen voorkeur voor een bepaalde DOAC in de behandeling van een DVT. Maak een keuze op basis van contra-indicaties en patiëntvoorkeur (zie tabel 3).
- Aandachtspunten:
- Leg uit dat therapietrouw (met daarbij strikte inname op vaste tijdstippen) belangrijk is in verband met het risico op onderbehandeling, omdat er geen stollingscontrole plaatsvindt.
- Let op bij kwetsbare ouderen (voor definitie zie Bijlage 1 van NHG-Standaard Cardiovasculair risicomanagement) en bij patiënten met een verminderde nierfunctie (zie tabel 3).
- Per DOAC verschillen interacties en contra-indicaties, zie ook Algemene overwegingen antistollingsmedicatie.
- Vermijd combinatie met CYP3A4-/P-gp-inductoren (anti-epileptica).
- Wees daarnaast alert op de per DOAC wisselende interacties met CYP3A4-/P-gp-remmers (ciclosporine, claritromycine, erytromycine, ketoconazol, itraconazol, verapamil). Voor een aantal DOAC’s geldt een advies voor dosisaanpassing bij combinatie met specifieke P-gp-remmers (zie tabel 3).
- Als bijwerkingen van DOAC’s worden vooral buikklachten genoemd, zoals misselijkheid en dyspepsie (vooral bij dabigatran).
- Er zijn antidota beschikbaar voor dabigatran, apixaban en rivaroxaban, voor edoxaban op dit moment alleen off-label. De halfwaardetijd van DOAC’s is echter kort en bij een bloeding kan de bloedingsneiging tegengegaan worden met stollingsconcentraten. Door een gemiddeld kortere halfwaardetijd zijn DOAC’s sneller uitgewerkt dan VKA’s, wat voordeel biedt rondom geplande hoogrisico-ingrepen.
- DOAC’s bereiken sneller een antitrombotisch effect dan VKA’s (uren versus dagen).
Er zijn geen onderzoeken gevonden in de huidige literatuur die DOAC’s onderling met elkaar vergelijken. Er is dus geen direct bewijs dat een bepaalde DOAC beter is dan de andere. Op basis van een aantal klinische kenmerken kan er wel een voorkeur zijn, bijvoorbeeld comorbiditeit, leeftijd, wel of niet LMWH opladen, wel of geen oplaaddosis, frequentie dagdosering, mogelijkheid tot couperen, comedicatie en milieuoverwegingen.
Gewenste en ongewenste effecten
Er zijn op grond van de netwerkmeta-analyse weinig aanwijzingen voor klinisch relevante verschillen in effectiviteit tussen de DOAC’s, al lijkt dabigatran iets minder effectief in het voorkomen van een recidief-VTE. Apixaban en daarna rivaroxaban komen wat betreft het optreden van ernstige bloedingen het gunstigst uit de vergelijking. Dabigatran scoort het meest gunstig op het risico op niet-ernstige bloedingen, maar deze uitkomstmaat weegt minder zwaar dan de overige uitkomstmaten.
Kwaliteit van bewijs
De kwaliteit van bewijs varieert van redelijk tot zeer laag, maar is in de meeste gevallen zeer laag. We hebben afgewaardeerd voor indirect bewijs omdat de populaties niet goed met elkaar vergelijkbaar zijn en er geen enkele RCT beschikbaar is die verschillende DOAC’s direct met elkaar vergelijkt. Daarnaast hebben we in de meeste gevallen afgewaardeerd voor onnauwkeurigheid.
Waarden en voorkeuren van patiënten
Patiënten geven de voorkeur aan de DOAC die het meest effectief en veilig is. Wat effectiviteit betreft zijn er geen grote verschillen tussen de DOAC’s. Wat de veiligheid betreft lijkt apixaban het gunstigst: dit gaat mogelijk gepaard met een lager risico op ernstige bloedingen dan de andere DOAC’s. Op de tweede plaats qua risico op ernstige bloedingen komt rivaroxaban. In het risico op sterfte lijken er geen klinisch relevante verschillen tussen de DOAC’s te zijn. Ook in overige bijwerkingen zijn er niet veel verschillen. Alle resultaten zijn echter van lage tot zeer lage kwaliteit, voornamelijk omdat er geen direct vergelijkend onderzoek beschikbaar is, dus we zijn hier onzeker over.
Kosten
De kosten voor 3 maanden behandeling met een DOAC van een gemiddelde patiënt van 70 kg verschillen onderling niet veel (€ 209-239), indien van toepassing met LMWH (www.medicijnkosten.nl, geraadpleegd mei 2022).
Aanvaardbaarheid
Het is voor patiënten en huisarts aanvaardbaar om te behandelen met alle 4 de DOAC’s, er zijn wel enkele aandachtspunten.
- Het kan een belasting zijn voor patiënten dat bij 2 van de 4 DOAC’s (dabigatran en edoxaban) 5 dagen een LMWH gespoten moet worden. Bij de andere 2 DOAC’s (apixaban en rivaroxaban) is de eerste dagen een oplaaddosering nodig.
- Apixaban en dabigatran worden tweemaal daags gedoseerd, edoxaban en rivaroxaban eenmaal daags. Dit kan bij een deel van de patiënten invloed hebben op de therapietrouw.
- Er zijn verschillen in de beschikbaarheid van een antidotum bij het couperen van een bloeding of bij een spoedingreep. Voor dabigatran is als antidotum idarucizumab beschikbaar. Als antidotum voor apixaban en rivaroxaban is in theorie andexanet alfa beschikbaar, maar de toediening is complex en dit middel is vaak niet op voorraad in het ziekenhuis. Voor edoxaban is alleen offlabel een antidotum beschikbaar. Bij alle middelen kan een bloeding gecoupeerd worden met protrombinecomplex.
- De DOAC’s worden op verschillende wijze gemetaboliseerd, daarom kunnen de interacties per DOAC verschillend zijn. Bij dabigatran en bij edoxaban is er daarnaast in sommige gevallen een dosisaanpassing nodig, zoals bij verminderde nierfunctie, hogere leeftijd of laag lichaamsgewicht (KNMP Kennisbank, geraadpleegd mei 2022).
Haalbaarheid
- De 4 DOAC’s zijn goed verkrijgbaar in Nederland en er zijn voldoende instructies beschikbaar over contra-indicaties en dosisaanpassingen.
- Milieu-impact: bij de beoordeling van de milieu-impact van geneesmiddelen worden de CO2-uitstoot, risico’s voor het oppervlaktewater en afgifte van microplastics bekeken. Er zijn geen gegevens over de CO2-uitstoot van de verschillende DOAC’s beschikbaar. Bij rivaroxaban zijn er geen aanwijzingen voor risico’s voor het oppervlaktewater. Voor apixaban en dabigatran is nog onvolledig onderzoek beschikbaar om een zekere uitspraak te kunnen doen. Van edoxaban zijn geen onderzoeken naar effecten op het oppervlaktewater beschikbaar. Geen van de DOAC’s bevat microplastics.
Uitgangsvraag
Welke DOAC is aan te bevelen bij patiënten met een DVT in de huisartsenpraktijk? Zie de PICO-tabel.
|
Patiënten |
Patiënten met een diepveneuze trombose |
|---|---|
|
Onderlinge vergelijking |
Apixaban |
|
Uitkomstmaten |
Cruciaal:
Belangrijk:
|
De NHG-werkgroep sluit voor de grenzen voor klinisch relevante verschillen aan bij de door GRADE voorgestelde standaardgrenzen: relatief risicoverschil van 25% (dus RR < 0,75 of RR > 1,25).
Achtergrond
Antistollingsbehandeling met een DOAC is een effectieve en veilige behandeling van patiënten met een DVT om een longembolie of uitbreiding van de trombose te voorkomen. In de eerste helft van 2021 slikte ongeveer 2/3 van de gebruikers van orale antistollingsmiddelen een DOAC. Van de DOAC’s werd op dat moment in Nederland rivaroxaban het meest voorgeschreven (152.000 gebruikers), gevolgd door apixaban (136.000 gebruikers), dabigatran (55.000 gebruikers) en edoxaban (40.000 gebruikers) (zie Rivaroxaban stoot acenocoumarol van de troon, 29 juli 2021).
Een artikel in GeBu suggereerde dat apixaban wellicht veiliger en effectiever zou zijn dan rivaroxaban. Deze uitspraak is echter gebaseerd op slechts 1 cohortonderzoek bij patiënten met DVT.
In dit detail worden de effectiviteit, veiligheid, bijwerkingen en overige kenmerken van de verschillende DOAC’s met elkaar vergeleken, gebaseerd op een systematische review, met het doel om voorkeursmiddelen te selecteren.
Methoden
Voor het beantwoorden van deze vraag hebben wij gebruikgemaakt van de Britse NICE-richtlijn Venous thromboembolic diseases: diagnosis, management and thrombophilia testing (geraadpleegd april 2022). In het kader van deze richtlijn is een SR met netwerkmeta-analyse uitgevoerd. De NHG-werkgroep heeft de bewijstabellen en conclusies uit deze netwerkmeta-analyse besproken en een aanbeveling geformuleerd. Daarnaast is een systematische literatuurzoekactie naar RCT’s uitgevoerd in PubMed en Embase vanaf de zoekdatum van de NICE-richtlijn (april 2019) in december 2021, met een update in december 2022.
Resultaten
Resultaat zoekactie
Een aanvullende search na de zoekdatum van de NICE-richtlijn leverde geen aanvullende RCT’s op die de verschillende DOAC’s direct met elkaar vergeleken. Ook bij de update werden geen nieuwe RCT’s gevonden.
Onderzoekskarakteristieken
De NICE-richtlijn includeerde 34 unieke RCT’s naar de initiële behandeling van VTE (n = 39.278). Hiervan vergeleken er 9 een DOAC met een VKA: 2 RCT’s vergeleken apixaban met VKA voorafgegaan door LMWH; 3 vergeleken rivaroxaban met VKA voorafgegaan door LMWH; ; 2 vergeleken edoxaban met VKA voorafgegaan door LMWH, 1 daarvan combineerde edoxaban met parenterale anticoagulantia bij de start van de behandeling, de andere niet; 2 vergeleken dabigatran plus LMWH bij de start van de behandeling met VKA voorafgegaan door LMWH. Er werden geen RCT’s gevonden die 2 verschillende DOAC’s direct met elkaar vergeleken. Zie bijlage 7 in de Totstandkoming en methoden voor de beschrijving van de onderzoeken. Er waren te weinig onderzoeksgegevens beschikbaar om onderscheid te maken naar longembolie of DVT, als indexgebeurtenis én als uitkomstmaat. Daarom zijn de resultaten voor alle veneuze trombo-embolieën samengenomen.
Effectiviteit en bijwerkingen
Zie tabel d8 voor de samenvatting van de resultaten. Omdat er geen RCT’s werden gevonden die verschillende DOAC’s rechtstreeks met elkaar vergeleken, betreft dit alleen indirecte vergelijkingen.
Bijwerkingen zijn in grote lijnen vergelijkbaar tussen de verschillende DOAC’s, echter echte vergelijking is niet mogelijk omdat er geen direct vergelijkend onderzoek is geweest. Veel voorkomende bijwerkingen (naast bloedingen) zijn maag-darmklachten en anemie; in zeldzame gevallen treedt een anafylactische reactie op (KNMP Kennisbank, geraadpleegd mei 2022).
|
Uitkomstmaat → |
Veneuze trombo-embolie (uitbreiding of recidief) |
Sterfte (aan alle oorzaken) |
Ernstige bloeding |
Klinisch relevante, niet-ernstige bloeding |
|
Vergelijking ↓ |
HR (95%-BI) Kwaliteit van bewijs |
HR (95%-BI) Kwaliteit van bewijs |
HR (95%-BI) Kwaliteit van bewijs |
HR (95%-BI) Kwaliteit van bewijs |
|
Conclusie |
Conclusie |
Conclusie |
Conclusie |
|
|
Apixaban vs. dabigatran |
0,76 (0,46 tot 1,25) Laag |
0,85 (0,48 tot 1,52) Zeer laag |
0,41 (0,20 tot 0,83) Laag |
0,83 (0,59 tot 1,16) Laag |
|
Mogelijk lager risico dan dabigatran |
Onzeker (neigt naar geen verschil) |
Mogelijk lager risico dan dabigatran |
Mogelijk geen verschil (maar neigt naar geen hoger risico dan dabigatran) |
|
|
Apixaban vs. edoxaban |
1,01 (0,64 tot 1,61) Zeer laag |
0,81 (0,50 tot 1,30) Zeer laag |
0,37 (0,19 tot 0,71) Redelijk |
0,61 (0,47 tot 0,80) Redelijk |
|
Onzeker (neigt naar geen verschil) |
Onzeker (neigt naar geen verschil) |
Waarschijnlijk lager risico dan edoxaban |
Waarschijnlijk lager risico dan edoxaban |
|
|
Apixaban vs. rivaroxaban |
0,93 (0,60 tot 1,47) Zeer laag |
0,95 (0,58 tot 1,54) Zeer laag |
0,58 (0,32 tot 1,12) Laag |
0,49 (0,37 tot 0,64) Redelijk |
|
Onzeker (neigt naar geen verschil) |
Onzeker (neigt naar geen verschil) |
Mogelijk lager risico dan rivaroxaban |
Waarschijnlijk lager risico dan rivaroxaban |
|
|
Rivaroxaban vs. dabigatran |
0,81 (0,51 tot 1,30) Zeer laag |
0,90 (0,55 tot 1,48) Zeer laag |
0,71 (0,39 tot 1,27) Zeer laag |
1,69 (1,27 tot 2,26) Redelijk |
|
Onzeker (neigt naar geen verschil) |
Onzeker (neigt naar geen verschil) |
Onzeker (neigt naar lager risico dan dabigatran) |
Waarschijnlijk hoger risico dan dabigatran |
|
|
Rivaroxaban vs. edoxaban |
1,08 (0,70 tot 1,67) Zeer laag |
0,85 (0,59 tot 1,25) Laag |
0,64 (0,38 tot 1,08) Laag |
1,25 (1,00 tot 1,55) Laag |
|
Onzeker (neigt naar geen verschil) |
Mogelijk geen verschil (maar neigt naar geen hoger risico dan edoxaban) |
Mogelijk lager risico dan edoxaban |
Mogelijk hoger risico dan edoxaban |
|
|
Dabigatran vs. edoxaban |
1,33 (0,82 tot 2,17) Laag |
0,94 (0,59 tot 1,54) Zeer laag |
0,90 (0,51 tot 1,59) Zeer laag |
0,74 (0,55 tot 0,99) Laag |
|
Mogelijk hoger risico dan edoxaban |
Onzeker (neigt naar geen verschil) |
Onzeker (neigt naar geen verschil) |
Mogelijk lager risico dan edoxaban |
|
|
Voor de originele tabellen (per uitkomstmaat) zie Totstandkoming en methoden, bijlage 8. In alle gevallen is afgewaardeerd voor indirect bewijs: er is geen enkele RCT die de DOAC’s direct met elkaar vergelijkt, de populaties uit de verschillende onderzoeken zijn niet goed met elkaar vergelijkbaar en de definities van de uitkomstmaten in de verschillende onderzoeken zijn niet gelijk. Daarnaast is afgewaardeerd voor onnauwkeurigheid: met 1 niveau als de grens van een klinisch relevant voordeel (HR = 0,8) of nadeel (HR = 1,25) is overschreden en met 2 niveaus als beide grenzen zijn overschreden. |
||||
Conclusies
DOAC’s onderling vergeleken – conclusies per uitkomstmaat
Recidief VTE
- Gebruik van apixaban en edoxaban gaat mogelijk gepaard met een kleiner risico op VTE dan dabigatran (kwaliteit van bewijs laag).
- Over andere verschillen tussen de verschillende DOAC’s zijn we onzeker (kwaliteit van bewijs zeer laag).
Sterfte
- Er is mogelijk geen klinisch relevant verschil tussen rivaroxaban en edoxaban (kwaliteit van bewijs laag).
- Over andere verschillen tussen de verschillende DOAC’s zijn we onzeker (kwaliteit van bewijs zeer laag).
Ernstige bloeding
- Gebruik van apixaban gaat waarschijnlijk gepaard met een kleiner risico dan edoxaban en mogelijk dan dabigatran en rivaroxaban (kwaliteit van bewijs redelijk).
- Gebruik van rivaroxaban gaat mogelijk gepaard met een kleiner risico dan edoxaban (kwaliteit van bewijs laag).
- Over andere verschillen tussen de verschillende DOAC’s zijn we onzeker (kwaliteit van bewijs zeer laag).
Klinisch relevante, niet-ernstige bloeding
- Gebruik van apixaban gaat waarschijnlijk gepaard met een kleiner risico dan edoxaban en rivaroxaban.
- Mogelijk is er geen verschil tussen apixaban en dabigatran.
- Gebruik van rivaroxaban gaat waarschijnlijk gepaard met een groter risico dan dabigatran en mogelijk dan edoxaban.
- Gebruik van dabigatran gaat mogelijk gepaard met een groter risico dan edoxaban.
DOAC’s onderling vergeleken – overall conclusie
- Apixaban en edoxaban zijn mogelijk iets effectiever dan dabigatran (kleiner risico op VTE) (kwaliteit van bewijs laag).
- Apixaban en mogelijk rivaroxaban geven mogelijk een kleiner risico op ernstige bloedingen dan edoxaban en dabigatran (kwaliteit van bewijs laag).
- Apixaban en dabigatran geven mogelijk een kleiner risico op niet-ernstige, maar wel klinisch relevante bloedingen dan edoxaban en rivaroxaban (kwaliteit van bewijs laag).
- We zijn onzeker over verschillen in het risico op sterfte, maar er lijken geen klinisch relevante verschillen tussen de DOAC’s te zijn (kwaliteit van bewijs zeer laag).
| DOAC* | Dosering | Dosisaanpassing** | Niet toepassen bij | |
|---|---|---|---|---|
| Oplaad | Onderhoud | |||
Apixaban tablet 2,5 en 5 mg | 2 dd 10 mg gedurende 7 dagen | 2 dd 5 mg | Niet van toepassing | |
Dabigatran capsule 75, 110 en 150 mg | Monotherapie met een LMWH eerste 5 dagen† | 2 dd 150 mg, na inname lichaam 30 minuten rechtop houden | 2 dd 110 mg bij:
|
|
Edoxaban tablet 15, 30 en 60 mg | Monotherapie met een LMWH eerste 5 dagen† | 1 dd 60 mg | 1 dd 30 mg bij:
| |
Rivaroxaban tablet 2,5, 10, 15 en 20 mg | 2 dd 15 mg gedurende 3 weken, inname met voedsel | 1 dd 20 mg, inname met voedsel | Niet van toepassing |
|
* De doseringen kunnen wijzigen bij behandeling van onbepaalde duur. ** Bij dialyse: overleg met de behandelend specialist. † Zie tabel 4 voor doseringen LMWH. | ||||
VKA’s (in combinatie met LMWH)
Naar Samenvatting ›- Voor welke VKA wordt gekozen, wordt mede bepaald door regionale afspraken. Er is een keuze tussen het kortwerkende acenocoumarol en het langwerkende fenprocoumon.
- Start met een oplaaddosis van een VKA (zie tabel 5) en geef gelijktijdig eenmaal per dag LMWH in een therapeutische dosering (afhankelijk van het lichaamsgewicht, zie tabel 4).
- Continueer de LMWH minstens 5 dagen en staak als de international normalized ratio (INR) stabiel en minstens 2 dagen > 2,0 is. De INR-streefwaarde is 2,5 (therapeutische breedte 2,0-3,0).
- Meld de patiënt aan bij de trombosedienst en vermeld daarbij de nierfunctie, (relatieve) contra-indicaties en indien mogelijk een stopdatum (zie Behandelduur).
- Er bestaat ook de mogelijkheid tot zelfmeting onder begeleiding-op-afstand door de trombosedienst. Doorgaans zijn patiënten (zeker bij behandeling van onbepaalde duur) dan stabieler ingesteld.
- Aandachtspunten:
- Instrueer de patiënt de VKA ’s avonds in te nemen, zodat bij een sterk afwijkende INR de dosering nog dezelfde dag kan worden aangepast (zie ook LTA Antistollingszorg).
- Het gebruik van antibiotica moet worden gemeld aan de trombosedienst in verband met de interacties. Cotrimoxazol is absoluut gecontra-indiceerd, evenals miconazol (alle toedieningsvormen).
Laagmoleculairgewicht heparines (LMWH)
- Gewone (ongefractioneerde) heparine activeert antitrombine, dat geactiveerde stollingsfactoren remt, met name trombine en geactiveerde factor Xa. Daardoor wordt de omzetting van fibrinogeen in fibrine geremd. LMWH bevatten fragmenten van heparine met een laag moleculair gewicht. Ze hebben een 2-3 × hogere antifactor-Xa-activiteit en een zwakkere activiteit ten opzichte van trombine dan gewone (ongefractioneerde) heparine.
- LMWH hebben een betere voorspelbare farmacokinetiek en biologische beschikbaarheid dan ongefractioneerde heparine. Een meta-analyse van 23 gerandomiseerde onderzoeken (n = 9587) waarin LMWH werden vergeleken met intraveneuze ongefractioneerde heparine, toonde aan dat behandeling met LMWH resulteerde in minder recidieven van trombo-embolische complicaties (OR 0,70; 95%-BI 0,57 tot 0,85) en minder ernstige bloedingen (OR 0,58; 95%-BI 0,40 tot 0,83).
- Op grond van de huidige gegevens is geen uitspraak mogelijk over een eventueel verschil tussen de verschillende LMWH-preparaten. In de 2 gerandomiseerde onderzoeken, waarin diverse LMWH-preparaten met elkaar zijn vergeleken, werd geen verschil aangetoond.
- Een van de grote voordelen van LMWH is dat ze ook eenvoudig (geen controles, vaste dosering) en veilig in de thuissituatie kunnen worden toegepast bij patiënten met een acute DVT. Dit heeft belangrijke voordelen voor de patiënt die niet in het ziekenhuis hoeft te worden opgenomen. Dat levert ook een aanzienlijke kostenbesparing op. De therapeutische dosering wordt bepaald op basis van het lichaamsgewicht van de patiënt. LMWH kunnen zowel een- als tweemaal daags worden toegediend.
- In een meta-analyse van 5 gerandomiseerde onderzoeken werd een statistisch niet-significant verschil gevonden tussen een een- of tweemaal daags behandelingsregime bij een recidief-VTE (OR 0,82; 95%-BI 0,49 tot 1,39 in het voordeel van een eenmaal daagse dosering) en ernstige bloedingen (OR 0,77; 95%-BI 0,40 tot 1,45 in het voordeel van een eenmaal daagse dosering). Er werd ook geen verschil in sterfte gevonden tussen een een- of tweemaal daagse LMWH-dosis (OR 1,14; 95%-BI 0,62 tot 2,08 in het voordeel van een eenmaal daagse dosering). Op basis hiervan kan geen uitspraak worden gedaan over een voorkeur voor een een- of tweemaal daagse dosering van LMWH. Vanuit het oogpunt van gemak voor de patiënt geeft de werkgroep de voorkeur aan een eenmaal daagse dosering.
- Op grond van het verschil in kosten ging in de voorgaande versie van deze NHG-Standaard de voorkeur uit naar enoxaparine en nadroparine (prijspeil 6 maart 2014, bij dosering eenmaal daags gedurende 10 dagen bij een patiënt van 75 kg). Enoxaparine was opgenomen in de vorige versie, maar is niet meer leverbaar in Nederland. We hebben ervoor gekozen om in huidige standaard 3 LMWH’s op te nemen, zodat huisartsen keuze hebben als een bepaalde LMWH niet leverbaar is. De kosten ontlopen elkaar niet veel (prijspeil 31 mei 2022: € 49-54 bij dosering eenmaal daags gedurende 10 dagen bij een patiënt van 75 kg).
Doseringen per gewichtsklasse van 10 of van 20 kg
De KNMP Kennisbank (geraadpleegd mei 2022) adviseert bij de dosering van nadroparine 19.000 IE/ml een dosering per gewichtsklasse van 10 kg (bijvoorbeeld 60-69 kg). Bij morbide obesitas is er beperkt bewijs dat gedoseerd kan worden op geleide van het totaal lichaamsgewicht (tinzaparine tot maximaal 28.000 IE per gift). Voor zover kon worden nagegaan is er geen bewijs dat een per 10 kg nauwkeurige dosering betere uitkomsten geeft dan een dosering per 20 kg gewichtsklasse. Doseren per 10 kg betekent dat de standaardwegwerpspuit niet altijd volledig leeg kan worden gedrukt (bijvoorbeeld 0,7 ml uit een wegwerpspuit van 0,8 ml). Dit is bezwaarlijk omdat hierdoor juist doseringsfouten kunnen ontstaan, mede omdat vaak getracht zal worden de patiënt zelf (of een mantelzorger) te laten injecteren. Ook in de tweede lijn wordt veelal met gewichtsklassen van 20 kg of ruimer gewerkt. Om deze redenen is gekozen voor een dosering per 20 kg.
Initiële behandeling met heparine (LMWH), DOAC of VKA’s voor de lange termijn
Het gedurende enkele dagen toevoegen van heparine aan de behandeling met VKA’s verlaagt het risico op uitbreiding van de trombus en recidief-DVT, omdat VKA’s pas na enkele dagen effectief zijn. Voor de langetermijnbehandeling wordt om verschillende redenen gekozen voor VKA’s of DOAC: toediening van LMWH kan pijnlijk zijn, is moeilijker uitvoerbaar en is duurder dan gebruik van VKA’s.
|
Gewicht |
Nadroparine 19.000 IE/ml |
Dalteparine 25.000 IE/ml |
Tinzaparine 20.000 IE/ml† |
|
50-55 kg |
1 dd 0,6 ml (11.400 IE) |
1 dd 0,4 ml (10.000 IE)* |
1 dd 0,5 ml (10.000 IE) |
|
55-70 kg |
1 dd 0,6 ml (11.400 IE) |
1 dd 0,5 ml (12.500 IE)* |
1 dd 0,5 ml (10.000 IE) |
|
70-85 kg |
1 dd 0,8 ml (15.200 IE) |
1 dd 0,6 ml (15.000 IE)* |
1 dd 0,7 ml (14.000 IE) |
|
85-90 kg |
1 dd 0,8 ml (15.200 IE) |
1 dd 0,72 ml (18.000 IE) |
1 dd 0,7 ml (14.000 IE) |
|
90-110 kg |
1 dd 0,8 ml (15.200 IE) |
1 dd 0,72 ml (18.000 IE) |
1 dd 0,9 ml (18.000 IE) |
|
* Bij verhoogd risico op bloedingen (zie Algemene overwegingen bij antistollingsmedicatie): 2 dd 100 IE/kg |
|||
|
|
Acenocoumarol 1 mg |
Fenprocoumon 3 mg |
||
|
< 70 jaar |
≥ 70 jaar of relatieve contra-indicatie* |
< 70 jaar |
≥ 70 jaar of relatieve contra-indicatie |
|
|
Dag 1 |
6 mg (6 tabletten) |
4 mg (4 tabletten) |
12 mg (4 tabletten) |
6 mg (2 tabletten) |
|
Dag 2 |
4 mg (4 tabletten) |
2 mg (2 tabletten) |
6 mg (2 tabletten) |
3 mg (1 tablet) |
|
Dag 3 |
2 mg (2 tabletten) |
1 mg (1 tablet) |
3 mg (1 tablet) |
1,5 mg (0,5 tablet) |
Anticonceptie en hormoontherapie
Naar Samenvatting ›- Bespreek met vrouwen in de vruchtbare leeftijd de wenselijkheid of noodzaak van anticonceptie tijdens en na de antistollingsbehandeling.
- Zwangerschap moet voorkomen worden bij gebruik van VKA’s (teratogeen) en DOAC’s (veiligheid onbekend) (zie Lareb: Diverse antistollingsmiddelen tijdens de zwangerschap).
- Een oraal combinatiepreparaat, pleister of vaginale ring kan worden voortgezet tijdens de antistollingsbehandeling. Het is zelfs onverstandig om direct te stoppen in verband met het doorgaans optreden van een onttrekkingsbloeding met risico op hypermenorroe. De genoemde anticonceptiva moeten echter wel worden gestaakt na beëindiging van de antistollingsbehandeling vanwege het verhoogde risico op VTE. Bespreek dit tijdig. Het wordt aanbevolen de antistolling na het staken van anticonceptie nog 2 weken te continueren.
- Bij vrouwen die nog geen anticonceptie gebruiken gaat de voorkeur uit naar de hormoonspiraal, de koperspiraal (let op: reële kans op hypermenorroe) of de pil met alleen progestageen (zie Adviezen bij anticonceptie en NHG-Standaard Anticonceptie).
- Hormoontherapie bij de overgang is gecontra-indiceerd, zie voor alternatieven NHG-Standaard De overgang. De contra-indicaties voor vaginale oestrogenen zijn dezelfde als voor systemische oestrogenen. Het is onbekend of vaginale oestrogenen meer kans op VTE geven. Bespreek dit met de patiënt.
Behandelduur
Naar Samenvatting ›Maak voor het bepalen van de behandelduur onderscheid tussen uitgelokte en idiopathische DVT, want het risico op een recidief-DVT verschilt. Bij een idiopathische DVT is dit risico hoger, waardoor na 3 maanden antistollingsbehandeling overwogen kan worden om voor onbepaalde duur door te gaan met een preventieve dosering antistolling.
- Een uitgelokte DVT is een DVT die optreedt tijdens of na:
- een recente operatie
- trauma van het been
- immobilisatie (> 3 dagen, bijvoorbeeld bij gips rond been)
- oestrogeengebruik (hormonale anticonceptie en hormoontherapie)
- zwangerschap of kraamperiode (< 3 maanden postpartum)
- In alle overige gevallen is er sprake van een idiopathische DVT. Zie voor uitgebreidere uitleg, terminologie en definities Risicofactoren.
- Een bijzondere vorm van een uitgelokte DVT is een kankergeassocieerde trombose, een DVT in het kader van een actieve maligniteit. Consulteer of verwijs hierbij altijd naar de behandelend arts (zie Consultatie en verwijzing).
Behandelduur per ziektebeeld (zie figuur 4)
- Geïsoleerde kuitvenetrombose, indien behandeling gewenst: behandel gedurende 3 maanden.
- Recidief-DVT: start behandeling en verwijs naar een internist voor vaststelling behandelduur en noodzaak onderzoek naar onderliggende risicofactoren.
- Eerste uitgelokte DVT: behandel gedurende 3 maanden met antistolling.
- Eerste idiopathische DVT:
- behandel minimaal 3 maanden met antistolling
- verwijs na deze 3 maanden naar de internist (of overleg) om preventieve antistolling voor onbepaalde duur te bespreken, tenzij u zich voldoende bekwaam acht de overwegingen zelf te bespreken met de patiënt (zie hieronder)
Overwegingen bij preventieve antistolling voor onbepaalde duur dan wel stoppen met antistolling
- Het cumulatief risico op recidief-VTE loopt op van 16% 2 jaar na de DVT tot 30% na 5 jaar; dit risico hangt ook samen met andere patiëntkenmerken.
- Doorgaan met antistolling beschermt effectief tegen een recidief-DVT.
- Het risico op ernstige bloedingen bij VKA-gebruik is circa 2-3% per jaar. Bij DOAC-gebruik is het risico op bloedingen waarschijnlijk lager, hoewel langetermijnonderzoek ontbreekt.
- Als het risico op een bloeding laag wordt ingeschat, zal de afweging uitvallen in het voordeel van behandeling voor onbepaalde duur. Als het risico op een bloeding hoger is, bijvoorbeeld bij een kwetsbare, oudere patiënt, zijn de nadelen mogelijk groter dan de voordelen (zie ook Richtlijn Antitrombotisch beleid).
- Als gekozen wordt voor doorgaan met antistolling, is de behandelduur in principe levenslang. Heroverweeg de behandeling jaarlijks, want door bijkomende comorbiditeit kan de risicoafweging veranderen. De LTA Antistollingszorg geeft handvatten voor deze jaarlijkse evaluatie.
- Bij behandeling van onbepaalde duur gelden lagere doseringen. Deze verschillen per DOAC.
- Bepaal bij DOAC-gebruik van onbepaalde duur jaarlijks de nierfunctie en zo nodig vaker (zie NHG-Standaard Chronische nierschade en LTA Antistollingszorg)
De duur van de behandeling van DVT met anticoagulantia wordt bepaald door de balans tussen het voorkomen van een recidief-DVT en/of complicaties (longembolie, PTS) versus het risico van de behandeling, vooral bloedingen. Ook het ongemak van de behandeling en de kosten moeten worden meegewogen.
Het risico op een recidief-VTE wordt bepaald door de aan- of afwezigheid van ‘sterke’ risicofactoren (zie ook Risicofactoren):
- een recente operatie
- trauma van het been
- immobilisatie (> 3 dagen, bijvoorbeeld bij gips rond been)
- oestrogeengebruik (hormonale anticonceptie en hormoontherapie)
- zwangerschap of kraamperiode (tot 3 maanden postpartum)
Als deze sterke risicofactoren aanwezig zijn, is er sprake van een uitgelokte DVT.
Van een idiopathische DVT wordt gesproken als bovenstaande risicofactoren afwezig zijn. ‘idiopathisch’ is een wat ongelukkige term, omdat er bij een idiopathische DVT vaak wel andere risicofactoren aanwezig kunnen zijn. In de Engelse literatuur wordt gesproken van unprovoked (idiopathisch) versus provoked (uitgelokt door een tijdelijke risicofactor).
Risico op recidief-VTE
De cumulatieve incidentie van recidief-VTE na een eerste uitgelokte DVT wordt geschat op 1% na 1 jaar en 3% na 5 jaar indien de VTE een gevolg was van een operatie. De cumulatieve incidentie bij niet-chirurgische reversibele factoren wordt geschat op 5% na 1 jaar en 15% na 5 jaar. De cumulatieve incidentie van recidief-VTE na een eerste idiopathische DVT loopt op van 16% na 2 jaar tot 36% na 10 jaar. Zie ook Epidemiologie.
Initiële behandelduur DVT
In de literatuur is een behandelduur onderzocht van 4-6 weken en van 3, 6 en 12 maanden of langer.
Eerste episode DVT: 4-6 weken versus 3 maanden antistolling
In de ACCP-richtlijn worden 5 trials met 2185 patiënten beoordeeld waarin 4-6 weken behandeling van VTE werd vergeleken met 3 of 6 maanden behandeling met anticoagulantia. De follow-up was in 4 onderzoeken 1 jaar, in 1 onderzoek 2 jaar. De kwaliteit van de onderzoeken werd als goed beoordeeld. Het RR voor een recidief-VTE bij behandeling gedurende 6 weken was 1,83 (95%-BI 1,39 tot 2,42) ten opzichte van behandeling gedurende 3 maanden. Het RR op een ernstige bloeding was 0,54 (95%-BI 0,22 tot 1,32), en het RR van de sterfte was 0,97 (95%-BI 0,68 tot 1,38). Dit komt overeen met de resultaten van een IPD-MA van 2925 patiënten uit 7 RCT’s uit 2012 met deels dezelfde onderzoeken. Hier bleek het risico op recidief bij idiopathische trombose tot 24 maanden na de behandeling in de 4 tot 6 weken groep hoger dan bij behandeling gedurende 3 maanden (HR 1,52; 95%-BI 1,14 tot 2,02). Ook een cochranereview uit 2011, waarin de behandelduur van VTE werd geëvalueerd in 8 geïncludeerde onderzoeken met in totaal 2994 patiënten, vond men minder recidieven bij 3 maanden behandeling dan bij 4 tot 6 weken behandeling (OR 0,23; 95%-BI 0,06 tot 0,70).
Conclusie
De kans op recidief is groter bij 4 tot 6 weken behandeling dan bij 3 maanden behandeling, het risico op ernstige bloedingen is niet evident groter (puntschatter wijst er wel op, niet significant) bij 3 maanden behandeling.
Eerste episode DVT: 3 versus 6-12 maanden antistolling
In een meta-analyse voor de ACCP-richtlijn werden 6 RCT’s beoordeeld (5 publicaties, 1 beschrijft 2 RCT’s) met in totaal 2061 patiënten waarbij behandeling gedurende 6-12 maanden werd vergeleken met 3 maanden. De follow-up was 1-3 jaar. Het RR op recidief-VTE was niet significant lager bij 6-12 maanden: 0,89 (95%-BI 0,69 tot 1,14). De kwaliteit werd als matig beoordeeld en verlaagd vanwege imprecisie. Het RR op ernstige bloedingen was hoger bij 6-12 maanden: 2,49 (95%-BI 1,2 tot 5,16; hoge kwaliteit). Het RR van de sterfte was 1,3 (95%-BI 0,81 tot 2,08). Deze resultaten komen overeen met die in de bovengenoemde meta-analyse : de HR voor recidief in de 2 jaar na 3 maanden behandeling ten opzichte van 6 maanden of langer (tot 27 maanden) behandeling was 1,19 (0,86 tot 1,65) voor alle patiënten en 1,39 (95%-BI 0,96 tot 2,01) bij idiopathische VTE.
In een meta-analyse voor de Britse NICE-richtlijn Venous thromboembolic diseases: diagnosis, management and thrombophilia testing werd 3 maanden met 6 maanden behandeling vergeleken. Uit 2 RCT’s met in totaal 789 patiënten bleek dat de kans op recidief na 3 maanden behandeling (32 recidieven bij 389 patiënten; 8%) na 1 jaar follow-up even groot is als na 6 maanden behandeling (28 recidieven bij 400 patiënten; 7%; RR 0,85; 95%-BI 0,52 tot 1,39). De kwaliteit werd als laag beoordeeld vanwege beperkingen in onderzoeksopzet en uitvoering en imprecisie. Er was geen verschil in VTE-gerelateerde sterfte bij 6 of bij 3 maanden behandeling: respectievelijk 3 (0,8%) van de 400 patiënten versus 3 (0,8%) van de 389 patiënten (RR 1,02; 95%-BI 0,22 tot 4,8). Er was evenmin verschil in totale sterfte: 21 (5,3%) van de 400 versus 17 (4,4%) van de 389 patiënten (RR 1,2; 95%-BI 0,64 tot 2,24). In 1 van de genoemde RCT’s met 749 patiënten werd een grotere kans op ernstige bloedingen bij 6 maanden behandeling gevonden (8 van de 380 patiënten; 2,1%) ten opzichte van 3 maanden behandeling (0 van de 369 patiënten; RR 16,5; 95%-BI 0,96 tot 285).
Conclusie
6-12 maanden behandeling biedt geen vermindering van het aantal recidieven VTE ten opzichte van 3 maanden behandeling, maar geeft een groter aantal ernstige bloedingen.
Advies
De werkgroep adviseert een behandeling van drie maanden bij patiënten met een eerste uitgelokte DVT.
Waarom deze aanbeveling?
Er is geen overtuigend bewijs dat 6 maanden antistolling effectiever is dan 3 maanden bij patiënten met een eerste idiopathische DVT, terwijl langere behandeling wel een grotere belasting, mogelijk een grotere kans op bijwerkingen en hogere kosten met zich meebrengt. Bovendien wordt in de tweede lijn al meerdere jaren slechts 3 maanden behandeld, waarna een afweging kan worden gemaakt de behandeling onbepaalde tijd voort te zetten om recidieven te voorkomen. Dit heeft geleid tot een sterke aanbeveling voor 3 maanden behandeling.
Van bewijs naar aanbeveling
Gewenste en ongewenste effecten
Op grond van de evidence lijkt er geen verschil tussen behandeling gedurende 3 dan wel 6 maanden wat betreft het optreden van een recidief-VTE. Een behandelduur van 6 maanden lijkt daarom niet effectiever dan 3 maanden. In het algemeen is een kortere behandelduur te verkiezen vanwege het risico op bijwerkingen. Het risico op ernstige bloedingen en sterfte is mogelijk groter bij 6 maanden behandeling, maar er is te weinig evidence om hier een gefundeerde uitspraak over te doen.
Kwaliteit van bewijs
De kwaliteit van bewijs is laag.
Waarden en voorkeuren van patiënten
Gebruik van antistolling is belastend, kan ernstige en minder ernstige bijwerkingen hebben (die niet zijn onderzocht) en brengt kosten met zich mee.
Kosten
Bij een DOAC zijn de kosten van 6 maanden behandeling ongeveer 2 × zo hoog als die van 3 maanden behandeling. Bij een VKA is dit verschil minder groot omdat de kosten vooral zitten in het opstarten en monitoren van de behandeling en minder in de kosten van het geneesmiddel zelf.
Aanvaardbaarheid
Lange tijd was de aanbevolen behandelperiode bij idiopathische DVT 6 maanden. Omdat de trombose spontaan ontstond, wilde men een veilig lange behandelperiode vanuit de gedachte dat er een onderhoudende trombogene factor aanwezig is die langer behandelen noodzakelijk maakt dan bij secundaire trombose, waarbij de oorzaak in de regel snel weggenomen kan worden. Op grond van de beschreven evidence is 6 maanden antistolling niet evident effectiever dan 3 maanden en leidt mogelijk tot meer bloedingen en sterfte. In algemene zin duurt een behandeling zo lang als nodig, en zo kort mogelijk. Mede omdat 3 maanden antistolling al enige jaren de aanbevolen behandeling is in de tweede lijn, zal deze aanpassing voor de meeste huisartsen aanvaardbaar zijn.
Haalbaarheid
De interventie is haalbaar. Door de behandelduur voor zowel idiopathische als secundaire trombose op 3 maanden te stellen is er een vereenvoudiging en minder risico op fouten.
Samenvatting van bewijs
Uitgangsvraag
Is 6 maanden of 3 maanden antistolling aan te bevelen bij volwassen patiënten met een eerste idiopathische DVT? Zie de PICO-tabel.
|
Patiënten |
Volwassen patiënten met een eerste idiopathische (unprovoked) DVT |
|---|---|
|
Interventie |
6 maanden antistolling |
|
Controle |
3 maanden antistolling |
|
Uitkomstmaten |
Cruciaal:
Belangrijk:
|
De NHG-werkgroep sluit voor de grenzen voor klinisch relevante verschillen aan bij de door GRADE voorgestelde standaardgrenzen: relatief risicoverschil van 25% (dus RR,HR < 0,75 of RR,HR > 1,25).
Achtergrond
De duur van de antistollingsbehandeling bij DVT wordt bepaald door de balans tussen preventie van een recidief of van complicaties van de DVT (longembolie, PTS) enerzijds, en het risico op complicaties van de behandeling (vooral bloedingen) anderzijds. Ook het ongemak van de behandeling en de kosten moeten worden meegewogen. Ten tijde van de ontwikkeling van de vorige standaard (versie 3.0, 2017) is de behandelduur voor idiopathische DVT gehandhaafd op 6 maanden op basis van het toenmalige bewijs. In de nadien verschenen Richtlijn Antitrombotisch beleid werd de behandelduur echter op 3 maanden gesteld. De publicatie van de LTA Antistollingszorg noopt tot actualisering van de behandelduur omdat een verschil in aanbevelingen tussen de eerste versus de tweede lijn niet wenselijk is.
Methoden
In PubMed en Embase is in oktober 2020 een systematische literatuurzoekactie uitgevoerd naar SR’s en RCT’s.
Resultaten
Resultaat zoekactie
De zoekactie leverde geen geschikte SR op, maar wel 4 RCT’s waarin patiënten werden gerandomiseerd naar 3 of 6 maanden antistolling. Daarnaast werd een IPD-MA gevonden waarin verschillende duren van antistolling met elkaar werden vergeleken. Deze patiëntendata waren verkregen via een samenwerkingsverband tussen de auteurs van 7 onderzoeken (en dus niet door een systematische review).
Onderzoekskarakteristieken
- Schulman 1985: RCT naar de duur van antistolling na een DVT, uitgevoerd in 1 ziekenhuis in Zweden. In 1 tak van het onderzoek werden patiënten met een eerste DVT van onbekende of permanente oorzaak (n = 40) gerandomiseerd naar 3 maanden (n = 20) of 6 maanden (n = 20) antistolling met warfarine (INR 2,5-4,8). Bij alle patiënten werd veneuze-occlusieplethysmografie uitgevoerd ten tijde van de diagnose, aan het eind van de antistollingsbehandeling en 3, 6, 9 en 12 maanden na het eind van de antistolling. Op deze tijdstippen werden ook bloedingen en andere bijwerkingen nagevraagd. Daarna werden de patiënten klinisch vervolgd (minder intensief, niet in het kader van het onderzoek) gedurende 3-15 maanden.
- Pinede 2001: RCT naar de duur van antistolling na een eerste VTE, uitgevoerd in ziekenhuizen in Frankrijk. In 1 tak van het onderzoek werden patiënten met een symptomatische proximale DVT of een longembolie gerandomiseerd naar 12 weken (n = 270) of 24 weken (n = 269) antistolling met de VKA fluindione (INR 2,0-3,0). Van de deelnemers had 45% een idiopathische VTE; 55% had ≥ 1 permanente of tijdelijke risicofactor. De patiënten werden 15 maanden gevolgd, met meetmomenten op 1,5, 3, 6 en 15 maanden na randomisatie. Uitkomstmaten waren recidief-VTE en bloeding (ernstig, niet-ernstig of fataal).
- Agnelli 2003: RCT naar de duur van antistolling na een eerste longembolie, uitgevoerd in ziekenhuizen in Italië. In 1 tak van het onderzoek werden patiënten met een symptomatische longembolie die geassocieerd was met een tijdelijke risicofactor, na 3 maanden antistolling met warfarine of acenocoumarol (INR 2,0-3,0), gerandomiseerd naar stoppen (n = 70) of verlenging van de antistolling met nog eens 3 maanden (n = 75). De patiënten werden gemiddeld 33,8 maanden gevolgd, met meetmomenten op 3, 6 en 12 maanden na randomisatie, en vervolgens elke 6 maanden. Uitkomstmaten waren recidief-VTE, sterfte en ernstige bloeding.
- Campbell 2007: RCT naar de duur van antistolling na een VTE, bij voorkeur (maar niet noodzakelijk) bevestigd met aanvullend onderzoek. Het onderzoek werd uitgevoerd in ziekenhuizen in het Verenigd Koninkrijk bij patiënten met een DVT of longembolie zonder permanente risicofactoren. De patiënten werden gerandomiseerd naar 3 maanden (n = 369) of 6 maanden (n = 380) antistolling (in principe warfarine, maar een ander VKA was ook mogelijk, INR 2,0-3,5). De patiënten werden 1 jaar gevolgd met meetmomenten op 3, 6 en 12 maanden. Uitkomsten waren sterfte aan VTE, falen van behandeling (inclusief recidief tijdens behandeling), recidief na behandeling en ernstige bloeding.
- Boutitie 2011: meta-analyse van gepoolde individuele patiëntendata uit 7 RCT’s naar verschillende duren van antistolling bij VTE. Geïncludeerd werden patiënten met een objectief bevestigde (idiopathische of secundaire) VTE zonder maligniteit (n = 2925), die antistolling kregen met een VKA (INR 2,0-3,0 of 2,0-2,85). De deelnemers werden gerandomiseerd over 2 verschillende behandelduren en enige tijd prospectief gevolgd, waarbij een eventueel recidief ook objectief werd vastgelegd. Daarnaast werd in 1 onderzoek een cohort geïncludeerd waarin de patiënten 3 maanden werden behandeld. In totaal werden 2925 patiënten geïncludeerd; 1046 patiënten 3 maanden behandeld en 776 patiënten 6 maanden (idiopathisch en secundair bij elkaar genomen).. In een deel van de analyses is onderscheid gemaakt naar provoked VTE (met tijdelijke risicofactor) en unprovoked VTE (zonder tijdelijke risicofactor; aanwezigheid van een chronische medische conditie anders dan kanker viel hier ook onder), en naar locatie van de initiële VTE (longembolie, proximale DVT, distale DVT). De grootste van de door ons geïncludeerde RCT’s Campbell 2007 werd in Boutitie uitgesloten en ook Schulman 1985 is niet gebruikt.
Effectiviteit en bijwerkingen
Zie tabel Duur antistolling bij patiënten met een eerste idiopathische DVT: 6 maanden versus 3 maanden.
Conclusies
- Mogelijk is er niet of nauwelijks verschil in het risico op recidief-VTE tussen 3 of 6 maanden behandeling met antistolling (kwaliteit van bewijs is laag).
- Mogelijk leidt 6 maanden behandeling met antistolling tot een hoger risico op ernstige bloedingen en sterfte dan 3 maanden behandeling (kwaliteit van bewijs is laag).
- Een SR en meta-analyse van 18 onderzoeken met 1715 patiënten laat een cumulatieve incidentie zien op een recidief-DVT die met de jaren oploopt van 16% na 2 jaar via 30% na 5 jaar tot 36% na 10 jaar. Het onderliggende risico hangt af van patiëntkenmerken zoals leeftijd, geslacht en aanwezigheid van risicofactoren.
- Tijdens behandeling met orale antistollingsmedicatie is het optreden van een recidief erg laag. Daartegenover staat het risico op bloedingen. De geschatte kansen zijn onzeker; het risico op ernstige bloedingen tijdens gebruik van VKA is 3% per jaar ; bij DOAC’s is dit risico lager.
- In een SR en meta-analyse met 14 RCT’s en 13 cohortonderzoeken is de incidentiedichtheid bij VKA’s (n = 9982) 1,74 per 100 persoonsjaren (95%-BI 1,34 tot 2,20), bij DOAC’s (n = 7220) 1,12 per 100 persoonsjaren (95%-BI 0,72 tot 1,62). De cumulatieve incidentie is bij VKA’s 6,3% (95%-BI 3,6 tot 10,0%); bij DOAC’s zijn die kansen onzeker (er zijn maar zeer beperkt data voorbij 1 jaar follow-up). Ook hier hangt het risico af van allerlei patiëntkenmerken, zoals oudere leeftijd, verminderde nierfunctie, voorgeschiedenis van bloedingen, gelijktijdig gebruik van een trombocytenaggregatieremmer of laag Hb. De case-fatality rate van ernstige bloedingen was bij VKA’s 8,3% (95%-BI 5,1 tot 12,2%) en bij DOAC’s 9,7% (95%-BI 3,2 tot 19,2%).
Conclusie
Langdurige of levenslange behandeling geeft minder recidieven dan behandeling gedurende 3 maanden, maar tegelijkertijd een groter aantal ernstige bloedingen.
Overwegingen
De optimale behandelduur is een afweging tussen de recidiefkans en de kans op bloedingen, en moet individueel worden bepaald. Internationale richtlijnen adviseren langdurige behandeling te overwegen op grond van een individuele risicostratificatie. Deze afweging kan, voornamelijk bij idiopathische DVT, resulteren in het advies tot langdurige behandeling voor onbepaalde tijd als het bloedingsrisico laag is. Er zijn meerdere risicostratificatiemogelijkheden voorgesteld. Geen enkele daarvan is onafhankelijk gevalideerd.
Acetylsalicylzuur
Naar Samenvatting ›We bevelen acetylsalicylzuur ter preventie van een recidief VTE niet aan.
Preventie recidief met acetylsalicylzuur bij idiopathische VTE
Er zijn 2 RCT’s gedaan naar de effectiviteit van acetylsalicylzuur ter preventie van recidief-VTE ná de behandeling met VKA’s. De designs werden op voorhand op elkaar afgestemd om eenvoudig een meta-analyse te kunnen doen. In totaal kregen 616 patiënten met een idiopathische VTE na behandeling met LMWH en VKA’s dagelijks 100 mg acetylsalicylzuur. Patiënten in de controlegroepen (n = 608) kregen een placebo. In 1 RCT bedroeg de follow-up ongeveer 2 jaar en in de andere 4 jaar. In totaal waren er 116 recidief-VTE’s in de placebogroep (19%) en 85 in de acetylsalicylzuurgroep (14%), de HR was 0,68 (95%-BI 0,51 tot 0,90). Het aantal ernstige bloedingen was 12 in de placebogroep en 18 in de acetylsalicylzuurgroep (HR 1,47; 95%-BI 0,70 tot 3,08).
Conclusie
Acetylsalicylzuur lijkt het aantal recidieven bij idiopathische VTE’s te verminderen, maar de kans op een ernstige bloeding is mogelijk iets groter.
Overwegingen
De aantallen patiënten en het aantal recidief-VTE waren te klein om te concluderen dat acetylsalicylzuur bij idiopathische VTE-patiënten moet worden geadviseerd.
Advies
Acetylsalicylzuur ter preventie van een recidief-VTE bij idiopathische VTE wordt niet aanbevolen.
Controles
Naar Samenvatting ›Eerste controle tijdens behandeling van DVT door de huisarts
Naar Samenvatting ›- Eerste controle: zie de patiënt uiterlijk 1 week na de diagnose terug (zie ook Checklist Behandeling DVT door de huisarts. Bespreek:
- bij VKA-gebruik het staken van LMWH bij een INR > 2,0 gedurende 2 dagen
- bij gebruik van edoxaban of dabigatran het staken van LMWH na 5 dagen
- klachten van het been
- bijwerkingen van de antistollingsmedicatie (hevig menstrueel bloedverlies bij vrouwen)
- risicofactoren bij de patiënt en of deze kunnen worden weggenomen (zie Risicofactoren)
- Instrueer de patiënt contact op te nemen bij een bloeding en bij klachten wijzend op een longembolie.
- Voor informatie over (niet-ernstige en ernstige) bloedingen onder orale anticoagulantia en periprocedureel beleid of tandheelkundige ingrepen, zie LTA Antistollingszorg.
- Noteer in het dossier wanneer de patiënt weer moet stoppen indien van toepassing.
Tweede en derde controle tijdens behandeling van DVT door de huisarts
Naar Samenvatting ›- Tweede controle: spreek een tweede controle af na 2-3 weken gebruik van een DOAC en informeer naar bijwerkingen en therapietrouw. Overweeg bij onvoldoende therapietrouw de patiënt op een VKA over te zetten. Bespreek anticonceptie, indien van toepassing.
- Zie voor overstappen van VKA naar DOAC en andersom: NHG-Standaard Atriumfibrilleren.
- Derde controle: zie de patiënt tenslotte na 3 maanden terug voor beëindigen van de antistolling (en de anticonceptie, indien van toepassing), of voor het bespreken van langdurige preventieve antistolling in lagere dosering bij idiopathische DVT.
Controle na het staken van de antistollingsbehandeling
Naar Samenvatting ›Wees alert op recidieven en instrueer de patiënt bij klachten contact op te nemen.
Onderzoek naar oorzaken van VTE
Naar Samenvatting ›Diagnostiek naar trombofilie
Naar Samenvatting ›- Bij patiënten met VTE zonder positieve familieanamnese is onderzoek naar erfelijke of verworven trombofilie (ook op antifosfolipide antilichamen) niet geïndiceerd, omdat de uitslag geen gevolgen heeft voor het therapeutisch beleid. Bij een (anamnestisch) vermoeden op bijvoorbeeld antifosfolipidensyndroom, zie Consultatie en verwijzing.
- Bij patiënten met familiaire VTE: overleg (bijvoorbeeld via teleconsultatie) met een internist over counseling van vrouwelijke familieleden in de vruchtbare leeftijd over anticonceptie, zwangerschap en kraamperiode (bijvoorbeeld tromboprofylaxe).
Diagnostiek naar trombofilie
Soorten trombofilie
Trombofilie is een verworven of erfelijke aanleg tot het ontwikkelen van VTE. De enige belangrijke verworven trombofilie is de aanwezigheid van antifosfolipide antilichamen (gedetecteerd in het bloed als lupus anticoagulans of door antilichamen tegen cardiolipine of B2-glycoproteïne 1). De prevalentie in de bevolking ligt tussen de 1 en 8%. Er zijn meerdere erfelijke trombofilieën, de voornaamste zijn deficiënties van anticoagulantia die van nature in het lichaam aanwezig zijn: antitrombine-III (AT-III), proteïne C en proteïne S. De prevalentie in de bevolking is 0,1 tot 0,4%. Daarnaast worden de factor V Leiden (prevalentie 3 tot 7%) en protrombine G20210A-mutaties (0,7 tot 4%) als trombogeen beschouwd.
Kans op een (recidief-)VTE bij patiënten met trombofilie
Het risico op VTE bij trombofilie wordt op grond van de resultaten van enkele retrospectieve onderzoeken geschat tussen 0,5 en 3,1% per jaar en op grond van enkele prospectieve onderzoeken tussen de 0,7 en 4,0% per jaar.
Proteïne-C-, proteïne-S- of AT-III-deficiëntie
In een prospectief cohortonderzoek werden 1600 opeenvolgende VTE-patiënten getest op proteïne-C-, proteïne-S- of AT-III-deficiëntie. Van hen bleken 91 drager van een erfelijke trombofilie; van 84 van hen werden eerste- of tweedelijnsfamilieleden zonder VTE gezocht en geïncludeerd. Ook zij werden getest op dragerschap van proteïne-C-, proteïne-S- of AT-III-deficiëntie. In totaal werden er 149 familieleden mét een deficiëntie en 233 zonder deficiëntie geanalyseerd. Follow-up vond plaats gedurende gemiddeld ruim 9 jaar. In de groep met een deficiëntie kregen 21 mensen een VTE. De jaarlijkse incidentie in deze groep was 1,53% (95%-BI 1,00 tot 2,34%). In de groep zonder deficiëntie waren er 6 VTE’s (jaarlijkse incidentie 0,29%; 95%-BI 0,13 tot 0,64%). Het betrof 19 × een DVT (70%) en 8 × (30%) een longembolie. Uit een multivariate Cox-analyse waarbij werd gecorrigeerd voor leeftijd, geslacht en andere stollingsafwijkingen (onder andere factor V Leiden) bleek de HR voor VTE bij het hebben van 1 van de deficiënties 7,0 (95%-BI 2,7 tot 18,0) ten opzichte van niet-deficiënten. Uitgesplitst naar soort deficiëntie was dit voor proteïne S 9,6 (95%-BI 3,0 tot 30,10); voor proteïne C 4,1 (95%-BI 1,2 tot 13,9) en voor AT-III 10,2 (95%-BI 3,3 tot 31,6). De kans op een eerste VTE en recidief werd niet uitgesplitst. Gedurende risicovolle periodes, zoals operatie, trauma, immobilisatie of kraambed, bleken mensen met een deficiëntie meer dan 2 × zo vaak tromboprofylaxe te hebben gekregen als patiënten zonder deficiëntie (respectievelijk 51% en 22% van de geïncludeerden). Toch was het aantal VTE groter in de groep met een deficiëntie (respectievelijk 6,6% en 3,5% per risicovolle periode). VTE bij een deficiëntie trad alleen op als er geen profylaxe was gegeven.
Protrombine G20210A en factor V Leiden
In een meta-analyse van 46 artikelen werd de recidiefkans bij (behandelde) VTE-patiënten met factor V Leiden of de protrombine-G20210A-mutatie nagegaan. De follow-up was 99 maanden. De recidiefkans was groter bij heterozygote dragers van factor V Leiden vergeleken met VTE-patiënten zonder factor V Leiden. In totaal kregen 161 van de 979 heterozygote patiënten een recidief-VTE tegenover 473 recidieven bij 3751 patiënten zonder mutatie. De gepoolde OR was 1,56 (95%-BI 1,14 tot 2,12). Van de 49 homozygote patiënten kregen 7 een recidief tegenover 225 recidieven bij 2333 patiënten zonder mutatie. De gepoolde OR was 2,65 (95%-BI 1,2 tot 6,0). Heterozygoot dragerschap van de protrombine-G20210A-mutatie gaf geen verhoogde kans op recidief ten opzichte van patiënten zonder mutatie: er waren 38 recidieven bij 281 patiënten tegenover 385 recidieven bij 3355 patiënten zonder mutatie; OR 1,45 (95%-BI 0,96 tot 2,2). Voor analyse van homozygoot protrombine-G20210A-dragerschap waren onvoldoende gegevens.
Andere factoren
In een eerder cohortonderzoek werden 474 opeenvolgende patiënten met VTE getest op factor V Leiden, protrombine G20210A, proteïne-C-, proteïne-S-, AT-III-deficiëntie, hoge levels factor VIII, IX of XI, hyperfibrinogenemie en hyperhomocysteïnemie. In totaal bleken 319 patiënten één of meer afwijkende labwaarden te hebben (67%). De gemiddelde follow-up was 7,2 jaar en bedroeg 3477 patiëntjaren. In totaal kregen 90 patiënten een recidief-VTE (73 DVT in het been, 4 in de arm, 12 longembolie, 1 Budd-Chiarisyndroom). Het aantal recidief-VTE’s was 25,9 per 1000 patiëntjaren (95%-BI 20,8 tot 31,8). De HR voor recidief-VTE was voor geen enkele afwijkende laboratoriumwaarde statistisch significant verhoogd ten opzichte van patiënten zonder afwijkende laboratoriumwaarden. Bij > 1 afwijkende laboratoriumwaarde was de kans op recidief na correctie voor leeftijd, geslacht en anticoagulantiagebruik (RR) 1,6 (95%-BI 1,0 tot 2,7).
Conclusie
Of, en in welke mate het risico op VTE of een recidief-VTE bij trombofilie verhoogd is, is op grond van de gevonden onderzoeken niet eenduidig. Het risico op recidief bij patiënten met een proteïne-C-, proteïne-S-, of AT-III-deficiëntie, factor V Leiden en protrombine-G20210A-mutatie is waarschijnlijk licht verhoogd.
Nut van diagnostiek naar trombofilie bij VTE
Diagnostiek naar onderliggende trombofilie zou zinvol kunnen zijn indien dit behandeling verandert, en/of als VTE bij familieleden kan worden voorkomen. Afgezien van een voortijdig afgebroken RCT (Nederlands Trial Register 784) zijn er geen RCT’s waarin de recidiefkans bij onderzoek naar trombofilie bij patiënten met VTE gevolgd door aangepast antistollingsbeleid wordt vergeleken met het achterwege laten van dergelijk onderzoek en beleid. In een patiëntcontroleonderzoek werden 197 patiënten met een recidief-VTE gematcht met 324 VTE-patiënten zonder recidief. Alle patiënten waren afkomstig uit een groot cohortonderzoek naar VTE. Van de patiënten met een recidief was 35% na de eerste VTE-episode onderzocht op trombofilie, van de patiënten zonder recidief was dat 30%. De OR voor een recidief-VTE van patiënten waarbij diagnostiek naar trombofilie was verricht versus patiënten waarbij dat niet was gedaan was 1,2 (95%-BI 0,8 tot 1,8). In dit onderzoek verschilden de patiëntkarakteristieken tussen cases en controlepatiënten overigens fors.
Conclusie
Er is geen bewijs dat diagnostiek naar trombofilie bij patiënten met een eerste episode VTE bijdraagt aan verlaging van de kans op een recidief.
Overwegingen
Op dit moment is terughoudendheid met betrekking tot diagnostiek naar trombofilie bij VTE gerechtvaardigd, omdat duidelijke voordelen voor de patiënt ontbreken.
Advies
Routineonderzoek naar erfelijke of verworven trombofilie bij patiënten met VTE wordt niet aanbevolen, omdat de uitslag in het algemeen geen gevolgen heeft voor het therapeutisch beleid.
Onderzoek naar trombofilie (in de tweede lijn) wordt wel overwogen bij patiënten met familiaire VTE of bij patiënten met recidiverende VTE.
Zie ook het Vademecum Hematologie. Bij patiënten met een vermoeden van verhoogd risico (leeftijd < 50 jaar, spontane arteriële of veneuze trombose, trombose op een ongebruikelijke plaats, recidiverende tromboses of trombotische-/zwangerschapscomplicaties met en zonder onderliggende systemische auto-immuun ziekte) en een vermoeden van een antifosfolipidensyndroom is er een indicatie voor testen op antifosfolipide antistoffen. Het lastige hierbij is dat de antistofbepaling moeilijk te interpreteren is. Bij vermoeden van wordt patiënt verwezen naar de tweede lijn.
Diagnostiek naar maligniteit
Naar Samenvatting ›- Routinematige diagnostiek naar de aanwezigheid van een maligniteit bij patiënten met VTE is niet geïndiceerd, tenzij er aanwijzingen zijn in anamnese of lichamelijk onderzoek.
- Alertheid op een maligniteit als onderliggende oorzaak kan daarom verstandig zijn, vooral bij oudere patiënten met een idiopathische DVT (arbitrair > 60 jaar).
Risico op maligniteit bij een VTE
VTE is geassocieerd met een verhoogd risico op een maligniteit, zoals onder meer bleek in een Zweeds cohortonderzoek, waarbij gebruik werd gemaakt van een centrale ziekenhuis-patiëntenregistratie. Bij 61.998 patiënten van 18 jaar en ouder zonder bekende maligniteit die tussen 1965 en 1983 werden behandeld voor VTE (inclusief tromboflebitis) werden in het jaar volgend op de DVT 2509 maligniteiten gevonden (gestandaardiseerd incident risico (SIR) 3,2; 95%-BI 3,1 tot 3,4). De SIR is gestandaardiseerd naar observatiejaren en de verhouding kanker bij VTE versus patiënten zonder VTE. De SIR voor polycythaemia vera was 12,9 (95%-BI 8,6 tot 18,7) en de SIR voor lever-, pancreas-, ovariumkanker hersentumoren en Hodgkinlymfoom was eveneens boven de 5,0. Niet zeker is of trombose een gevolg is van de maligniteit of dat beide een gemeenschappelijke oorzaak hebben. In een patiëntcontroleonderzoek bij 430 DVT-patiënten in Nederlandse huisartsenpraktijken werden vergelijkbaar verhoogde risico’s gevonden. Opeenvolgende patiënten in de eerste lijn met DVT (n = 430) zonder bekende maligniteit werden vergeleken met een controlegroep uit de algemene bevolking, gematcht naar leeftijd en geslacht. De tweejaars incidentie bij idiopathische DVT (n = 162) was 7,4% (95%-BI 3,4 tot 11,4%) en bij secundaire DVT (n = 268) 2,6% (95%-BI 0,7 tot 4,5%) ten opzichte van 2,0% (95%-BI 0,1 tot 3,9%) in de controlegroep (n = 442).
Conclusie
Het aantal patiënten dat een maligniteit blijkt te hebben als een DVT wordt geconstateerd is vooral verhoogd bij idiopathische trombose.
Nut van aanvullend onderzoek gericht op nog niet bekende maligniteit
Er is discussie over de vraag of er bij een trombose aanvullend onderzoek naar nog onbekende maligniteiten moet plaatsvinden, of dit zowel bij idiopathische als bij uitgelokte trombose zou moeten, en over de uitgebreidheid van het eventuele diagnostisch onderzoek. Het vinden van een maligniteit heeft consequenties voor de behandeling en recidiefkans van VTE, en de kans op genezing (van de kanker) zou bij ontdekking in een behandelbaar stadium groter kunnen zijn. Er is één RCT uit 2004 naar het nut van uitgebreid onderzoek naar de aanwezigheid van tumoren bestaande uit echo én CT-scan van het abdomen en pelvis; gastroscopie of barium maagfoto; coloscopie of sigmoïdoscopie en coloninloop; hemocculttest; sputumcytologie en bloedonderzoek naar tumormarkers. Vrouwelijke patiënten ondergingen ook een mammografie en cervixcytologie, mannelijke patiënten een abdominale echo van de prostaat en een PSA-bepaling. De interventiegroep werd vergeleken met een controlegroep die niet op de hoogte was van het onderzoek (het zogenaamde Zelen-design) en bij wie ook geen aanvullend onderzoek werd gedaan. Het Zelen-design werd noodzakelijk geacht omdat het onethisch werd gevonden om patiënten allereerst te informeren over een verhoogd risico op kanker en dan vervolgens geen aanvullend onderzoek aan te bieden. De inclusie verliep moeizaam omdat slechts 5 van de 40 centra wilden meedoen in verband met de keus voor het Zelen-design. Het onderzoek werd voortijdig afgebroken toen bleek dat de artsen bij de patiënten in de controlegroep meer diagnostiek deden dan volgens het onderzoeksprotocol was afgesproken. Uiteindelijk werden 201 patiënten geïncludeerd. Bij 13 van de 99 patiënten in de screeningsgroep (13,1%) werd een maligniteit vastgesteld en gedurende de 2 jaar follow-up bij nog 1 patiënt (1,0%). In de controlegroep werd in 2 jaar follow-up bij 10 van de 102 patiënten (9,8%) een maligniteit gevonden, het RR tijdens de follow-up was 9,7 (95%-BI 1,3 tot 36,8; p < 0,01). De kankergerelateerde sterfte gedurende de 2 jaar follow-up was 2% in de gescreende groep versus 3,9% (4 van de 102) in de controlegroep (absolute risicoreductie 1,9%; 95%-BI -5,5 tot 10,9; niet significant). De patiëntenaantallen waren te klein en de follow-up was te kort om uitspraken te kunnen doen over de vraag of routinematig aanvullend onderzoek leidt tot minder morbiditeit en mortaliteit.
Een Nederlands onderzoek uit 2010 (het Trousseau-onderzoek) vergeleek het nut van beperkte screening met uitgebreide screening bij patiënten ouder dan 40 jaar met een eerste presentatie van een idiopathische DVT en/of longembolie in 2 gelijktijdige cohorten. De 10 deelnemende ziekenhuizen werden verdeeld en deden ófwel een beperkte baseline screening (n = 288) bestaande uit anamnese, lichamelijk onderzoek, bloedonderzoek en een thoraxfoto, ofwel een uitgebreide screening (n = 342) waarbij de baseline screening werd uitgebreid met een CT van het abdomen en thorax, en een mammografie bij vrouwen. Het onderzoek werd gestaakt op grond van een interim-analyse waaruit bleek dat het percentage aangetroffen maligniteiten lager was dan was verwacht en de meeropbrengst van uitgebreide screening ten opzichte van de baseline screening veel kleiner was dan verwacht. In de beperkt gescreende groep werd bij 7 patiënten (2,4%) een maligniteit gevonden, in de uitgebreid gescreende groep werd bij 12 patiënten (3,5%) al in de baseline screening een maligniteit geconstateerd. Uitgebreide screening voegde daar nog 6 patiënten met een maligniteit (2,0%) aan toe. Dat was veel lager dan het verwachte percentage (8%) waarop de inclusietargets waren gebaseerd. Van deze 6 extra gevonden patiënten zouden er volgens de onderzoekers potentieel 3 te genezen zijn. Het aantal patiënten bij wie gedurende de gehele looptijd van het onderzoek een maligniteit werd gevonden was 30 van de 342 (8,8%; mediane follow-up 2,5 jaar) in de uitgebreid gescreende groep versus 21 van de 288 (7,3%; mediane follow-up 2,6 jaar) in de beperkt gescreende groep (OR 1,25; 95%-BI 0,66 tot 2,38). De sterfte bedroeg 26 (7,6%) waarvan 17 aan een maligniteit in de uitgebreid gescreende groep, 24 (8,3%; 8 aan een maligniteit) in de beperkt gescreende groep, gecorrigeerde hazard ratio 1,22 (95%-BI 0,69 tot 2,22).
In een SR uit 2008 werd de prevalentie van maligniteiten na een VTE 1, 6 en 12 maanden na de diagnose nagegaan. Om de prevalentie te bepalen werden 34 onderzoeken geïncludeerd met in totaal 9516 patiënten met VTE, van wie 3286 idiopathisch, 3297 uitgelokt en 2933 niet-gespecificeerd. Direct na de VTE-diagnose (baseline) was de prevalentie maligniteiten van alle patiënten 4,1% (95%-BI 3,6 tot 4,6%), bij idiopathische VTE was dit 6,1% (5,0 tot 7,1%) en bij uitgelokte VTE 1,9% (95%-BI 1,3 tot 2,5%). De totale prevalentie 12 maanden na de diagnose was 6,3% (95%-BI 5,6 tot 6,9%). De prevalentie na 12 maanden was hoger bij idiopathische trombose (10,0%; 95%-BI 8,6 tot 11,3%) dan bij uitgelokte trombose (2,6%; 95%-BI 1,6 tot 3,6%).
In dezelfde review werd het effect vergeleken van beperkt onderzoek (meestal anamnese, lichamelijk onderzoek, bloedonderzoek, thoraxfoto) met uitgebreid onderzoek (meestal CT-scan van het abdomen en thorax) in 14 artikelen en 1 abstract (van het hierboven genoemde Trousseau-onderzoek). Pooling van de resultaten van verschillende onderzoeken (4378 patiënten) toonde dat met uitgebreide screening meer maligniteiten worden ontdekt. Met beperkt screenen vond men 49,4% (95%-BI 40,2 tot 8,5%) van het totaal aantal maligniteiten aan het eind van de follow-upperiodes, versus 69,7% (95%-BI 61,1 tot 77,8%) bij uitgebreide screening.
Van de geïncludeerde onderzoeken rapporteerden er 4 een verschil in tumorstadium, 2 van deze onderzoeken vonden een voordeel van uitgebreide screening, de 2 andere niet. In de 4 onderzoeken werden gedurende de follow-up 123 maligniteiten bij totaal 1540 patiënten ontdekt. Met beperkt screenen werden 17 tumoren in een vroeg stadium ontdekt (13,8%; 95%-BI 8,8 tot 21,0%) met uitgebreid screenen 27 (22,0%; 95%-BI 15,6 tot 30,1%). Ook in deze review komt men tot de conclusie dat gunstige effecten van routinematig aanvullend onderzoek naar maligniteiten op morbiditeit en mortaliteit niet zijn aangetoond.
Conclusie
Diagnostiek naar een maligniteit in geval van DVT leidt waarschijnlijk tot de ontdekking van iets meer maligniteiten. Het is niet duidelijk of routinematige aanvullend onderzoek resulteert in overlevingsvoordeel.
Overwegingen
De meerwaarde van uitgebreid routinematig aanvullend onderzoek ten opzichte van beperkt screenen met anamnese, lichamelijk onderzoek, bloedonderzoek en een X-thorax is beperkt. Over de gevolgen op de kwaliteit van leven en de kosteneffectiviteit zijn geen onderzoeken beschikbaar. Soms is een VTE een eerste teken van een nog niet ontdekte maligniteit, met name bij oudere patiënten. Omdat echter het aantal mogelijke maligniteiten dermate divers is, en zelfs bij ouderen het risico hierop nog altijd relatief laag is (maximaal circa 5%).
Advies
Routinematig aanvullend onderzoek op de aanwezigheid van een maligniteit wordt bij patiënten met DVT niet aanbevolen. Bij een klinisch vermoeden van een onderliggende maligniteit wordt gerichte nadere diagnostiek uitgevoerd.
Adviezen bij anticonceptie
Naar Samenvatting ›- Bij vrouwen die een VTE hebben gehad is gebruik van systemische oestrogenen gecontra-indiceerd: ontraad een oraal combinatiepreparaat, pleister en vaginale ring. Het risico op trombose is mogelijk ook verhoogd bij gebruik van de prikpil. Over de risico’s van het implantatiestaafje zijn onvoldoende gegevens bekend, maar het risico lijkt niet verhoogd.
- Zoals eerder gesteld is tijdens de initiële antistollingsbehandeling bij een pilgerelateerde VTE het continueren van anticonceptie nog wel mogelijk en zelfs gewenst om de anders optredende menorragie te voorkomen (zie Anticonceptie en hormoontherapie). Na het staken van de antistollingsbehandeling (na 3 maanden) moet ook de anticonceptie gestaakt worden. Overleg tijdig met de patiënt over een alternatieve vorm van anticonceptie.
- Overweeg een hormoon- of koperspiraal of een pil met alleen progestageen voor te schrijven. Bij vrouwen zonder kinderwens is ook sterilisatie, bij henzelf of hun mannelijke partners, te overwegen (zie NHG-Standaard Anticonceptie).
Adviezen bij reizen
Naar Samenvatting ›- Adviseer reizigers die > 4 uur vliegen en ≥ 1 risicofactor op VTE hebben (zoals een doorgemaakte VTE), frequent de kuitspier te bewegen, regelmatig te lopen, voldoende vocht te drinken en alcohol te vermijden (overigens is het nut van deze adviezen niet bewezen).
- Extra maatregelen die mogelijk effectief zijn, indien gewenst: steunkous tot aan de knie (klasse 2, enkeldruk 15-30 mmHg) of een LMWH. Van acetylsalicylzuur is het effect niet aangetoond.
Preventie van VTE bij (vlieg)reizen
In een cochranereview naar het preventief gebruik van steunkousen bij passagiers die een vliegreis van meer dan 4 uur maakten werden 9 onderzoeken geïncludeerd. Steunkousen werden gedragen enkele uren voorafgaand en tijdens de vlucht. Pooling van de resultaten liet zien dat het gebruik van steunkousen (15 tot 30 mmHg) het risico op asymptomatische DVT, ontdekt door screening met behulp van echografie, vermindert van 3,6% (47 van de 1323 controlepatiënten) naar 0,2% (3 van de 1314 steunkousgebruikers); RR 0,10 (95%-BI 0,04 tot 0,25).
In de ACCP-richtlijn wordt aan de hand van de gegevens uit de cochranereview berekend dat het absolute risico bij steunkousgebruik 4,5 minder symptomatische DVT’s per 10.000 (95%-BI 4 tot 5 minder) is en 24 longembolieën minder per 1.000.000 (95%-BI 20 tot 26) bij een laag risico. Bij hoog risico (eerdere DVT, trombofilie, ernstige obesitas, verminderde mobiliteit, als gevolg van bot of gewrichtsproblemen, maligniteit binnen afgelopen 2 jaar, of uitgebreide varices) is dit 16,2 minder symptomatische DVT’s per 10.000 (95%-BI 14,0 tot 17,5 minder) en 87 longembolie, 1 minder per 1.000.000 (95%-BI 76 tot 94 minder). Deze getallen zijn berekend op grond van een surrogaatuitkomst; namelijk asymptomatische DVT. Op grond hiervan werd de kwaliteit als matig beoordeeld (verlaagd in verband met indirectheid).
Een probleem met de geïncludeerde trials was dat ze op één na allemaal van dezelfde onderzoekers waren. Daarnaast waren er bij alle trials methodologische beperkingen (LONFLIT-onderzoeken, onduidelijke beschrijving methode, overlappende in- en exclusiecriteria, onduidelijke inclusiecriteria, niet-geblindeerde effectbeoordelaars). Het UK General Medical Council’s Fitness to Practice Panel schrapte de principal investigator van de General Medical Council toen bleek dat in de onderzoeken coauteurs werden genoemd die de artikelen niet hadden geaccordeerd.
Bovenstaande problemen hebben ertoe geleid dat in sommige systematische reviews en richtlijnen de LONFLIT-onderzoeken buiten beschouwing worden gehouden. In andere worden ze wel meegenomen omdat er geen aanwijzingen voor vervalsing zouden zijn.
Een meta-analyse (2005) komt tot vergelijkbare conclusies als genoemde cochranereview. Een van de LONFLIT-onderzoeken betreft een RCT naar het gebruik van enoxaparine en acetylsalicylzuur ter preventie van VTE tijdens vliegreizen. In dit kleine onderzoek werden 300 personen met een hoog risico (eerdere DVT-episode, stollingsstoornissen, ernstige obesitas, maligniteit binnen 2 jaar voorafgaand, uitgebreide varices) op trombose in 3 groepen verdeeld: geen profylaxe, acetylsalicylzuur 400 mg gedurende 3 dagen, vanaf 12 uur vóór de vlucht, eenmalige hoge dosis enoxaparine (1 mg/kg = 1000 IU/10 kg) 2 tot 4 uur voor de vlucht. De uitval was 17% als gevolg van compliance en reisgerelateerde problemen. In de groep die geen profylaxe kreeg, hadden 4 van de 83 participanten (4,8%) een asymptomatische DVT, in de acetylsalicylzuurgroep 3 van de 84 (3,6%), in de enoxaparinegroep 0 van de 82 (p < 0,002 vergeleken met de andere 2 groepen). Er waren geen symptomatische VTE’s en de follow-up stopte zodra de deelnemer het vliegveld had verlaten.
Conclusies
Vliegen leidt tot een verhoogd risico op VTE, dat toeneemt met de duur van de vlucht. Het risico is eveneens verhoogd bij lange auto-, bus- en treinreizen. Risicogroepen zijn vrouwen die oestrogenen (anticonceptie) gebruiken, adipositas (BMI > 30), mensen langer dan 1,90 of kleiner dan 1,60, bekende trombofilie. Steunkousen (enkeldruk 15 tot 30 mmHg) zijn effectief ter preventie van (asymptomatische) trombose bij vliegreizen. Enoxaparine zou mogelijk een VTE kunnen voorkomen; van acetylsalicylzuur is dat niet aangetoond. Deze bevindingen zijn gebaseerd op een klein onderzoek met een asymptomatische DVT als uitkomstmaat.
Overwegingen
Het risico op VTE bij maligniteiten en bij recente chirurgie of trauma aan het been wordt door vliegreizen zeer waarschijnlijk vergroot. In de literatuur worden deze factoren niet expliciet genoemd, trombofilie wel.
Advies
Reizigers die langer dan 4 uur reizen en een verhoogd risico op VTE hebben (één of meer risicofactoren) moeten indien mogelijk aan het gangpad zitten, frequent kuitspieroefeningen doen, regelmatig lopen en dehydratie vermijden door tijdens de reis veel te drinken, hoewel het nut van deze adviezen niet bewezen is.
Een steunkous tot aan de knie (enkeldruk 15 tot 30 mmHg) is effectief in het verlagen van het risico op trombose en kan worden geadviseerd. Een LMWH kan een optie zijn als een steunkous niet tot de mogelijkheden behoort of als er een zeer hoog risico op VTE aanwezig is, hoewel de effectiviteit in deze setting niet overtuigend is aangetoond. Hiervoor kan een consult bij een internist worden overwogen.
Consultatie en verwijzing
Naar Samenvatting ›Internist of longarts
Verwijs direct naar de internist of longarts:
- bij vermoeden van longembolie op basis van YEARS-algoritme en D-dimeerbepaling
Internist
Verwijs naar een internist bij:
- vermoeden van DVT tijdens zwangerschap en kraamperiode
- kankergeassocieerde trombose (kanker en een bewezen DVT)
- recidief-DVT (voor onderzoek naar risicofactoren en vaststelling behandelduur)
- vermoeden van bekkenvenetrombose (evidente zwelling van het gehele been, erg veel pijn of bedreigd been: eventuele indicatie voor trombolyse); of overleg met radioloog
- mogelijke progressie van de DVT ondanks antistolling (aanhoudende pijn, toename zwelling; komt zelden voor, behalve bij maligniteit)
- verhoogd risico op ernstige bloeding (bijvoorbeeld recente gastro-intestinale of cerebrale bloeding, of ernstige leverinsufficiëntie)
- vermoeden van antifosfolipidensyndroom (bijvoorbeeld jonge patiënt zonder aanwijsbare risicofactoren of patiënt met auto-immuunziekte in voorgeschiedenis)
- bij afweging inzake langdurige antistollingsbehandeling na eerste idiopathische DVT (tenzij de huisarts dit zelf met patiënt afweegt, zie Behandelduur)
- andere redenen of afspraken over diagnostiek en behandeling in de tweede lijn
Consulteer een internist:
- wanneer aanpassing nodig is van de antistollingsmedicatie vanwege verhoogd bloedingsrisico:
- nierinsufficiëntie (eGFR < 30 ml/min)
- diastolische bloeddruk herhaaldelijk > 120 mmHg
- gewicht < 50 kg
- (extreem) overgewicht ( > 150 kg of BMI > 50, of >110 kg als het dosering LMWH betreft)
- na bariatrische chirurgie, als behandeling met een VKA niet mogelijk is
- bij familiaire VTE voor counseling voor vrouwelijke familieleden in de reproductieve fase
- bij bewezen DVT bij reeds antistollingsgebruik voor andere indicatie
- bij actieve zwangerschapswens en geïndiceerde langdurige antistolling
- bij vermoeden van een recidief-DVT onder adequaat ingestelde antistolling
Dermatoloog/expertisecentrum (vaatchirurg en interventieradioloog)
Verwijs naar een dermatoloog/expertisecentrum bij:
- vermoeden op het ontstaan van (ernstig) PTS (op basis van klinisch beeld bij anamnese en lichamelijk onderzoek)
Longarts
Consulteer een longarts bij:
- vermoeden van chronische postlongembolieklachten (kortademigheid, vermoeidheid, verminderd functioneren) voor diagnostiek naar chronische trombo-embolische pulmonale hypertensie (CTEPH)
Redenen voor behandeling van DVT in de tweede lijn
Redenen voor behandeling van DVT in de tweede lijn worden vooral bepaald door het risico dat de patiënt loopt op een bloeding of andere complicatie, de noodzaak DVT te behandelen met ongefractioneerde heparine, of een indicatie voor veneuze stenting.
Na bariatrie en morbide obesitas
Bij deze patiënten groepen is er een voorkeur voor een VKA omdat gebruik van DOAC onvoldoende onderzocht is. Als dit niet mogelijk is, dan kan apixaban overwogen worden onder voorwaarden van een anti-Xa-bepaling. Dit is specialistische zorg en patiënten worden hiervoor verwezen naar de tweede lijn.
Vermoeden van PTS
In een SR naar de waarde van verschillende scoringssytemen voor het stellen van de diagnose en het bepalen van de ernst van het PTS werden 37 publicaties geïncludeerd. Er werden 6 scoringssystemen geïdentificeerd: de Widmer-, Ginsberg-, Brandjes-, Villalta- en CEAP-scores, en de Venous Clinical Severity Score (VCSS). Deze scoringssystemen werden op 6 criteria beoordeeld: interwaarnemerbetrouwbaarheid, associatie met ambulante veneuze drukmeting, associatie met kwaliteit van leven, validiteit, vermogen de ernst van PTS te bepalen en vermogen om veranderingen in de tijd te bepalen. De Villalta-score, waarover verreweg de meeste literatuur is, kreeg als enige een positief oordeel op alle criteria. Een nadeel van de Villalta-score is dat hij grotendeels berust op subjectieve klachten van patiënten; dit zou de betrouwbaarheid kunnen verminderen. De International Society on Thrombosis and Haemostasis (ISTH) heeft in 2009 voorgesteld om de Villalta-schaal te gebruiken voor standaardisering van zowel de diagnostische criteria als het vaststellen van de ernst van PTS.
Overweging
PTS is een vorm van veneuze insufficiëntie. Waarschijnlijk kan de huisarts de diagnose in de meeste gevallen stellen op basis van klachten en verschijnselen bij lichamelijk onderzoek, zonder gebruik te maken van een scoringssysteem. Sterk voor PTS pleit veneuze insufficiëntie in één been waarin de patiënt in het verleden een DVT heeft gehad. Gebruik van een scoringssysteem heeft geen duidelijke meerwaarde voor de huisarts.
Advies
Stel de diagnose PTS op basis van klachten en verschijnselen bij lichamelijk onderzoek zonder een scoringssysteem te gebruiken.
Diagnostiek en beleid bij oppervlakkige tromboflebitis
Naar Samenvatting ›- Een oppervlakkige tromboflebitis is een lokale, door een trombus veroorzaakte, niet-infectieuze ontsteking van een oppervlakkige vene.
- Oppervlakkige tromboflebitis geeft waarschijnlijk een risico van enkele procenten op uitbreiding naar DVT (eerstelijnsonderzoek is zeer beperkt).
Diagnostiek
Naar Samenvatting ›- Stel de diagnose oppervlakkige tromboflebitis op het klinische beeld, namelijk bij pijn, roodheid en zwelling ter plaatse van een oppervlakkige vene die bij palpatie vast aanvoelt, als een koord of een streng. Let op: op een donkere huid is roodheid minder goed te herkennen.
- Een oppervlakkige tromboflebitis moet niet verward worden met een geïsoleerde kuitvenetrombose (zie Geïsoleerde kuitvenetrombose).
- Gebruik geen D-dimeerbepaling of beslisregel, omdat deze niet onderzocht zijn.
- Verwijs laagdrempelig voor een compressie-echografie om een DVT uit te sluiten. Overweeg sneller een echografie bij patiënten met een verhoogd risico op een DVT (oudere leeftijd, man, actieve kanker, afwezigheid van recent trauma, afwezigheid van zwangerschap, afwezigheid van varices).
- Zorg ervoor dat de uitslag u bereikt en geef bij de aanvraag aan dat u de patiënt zelf wilt behandelen. Vertel dit ook aan de patiënt zelf.
Er is geen prospectief onderzoek in de eerste lijn gedaan naar het tegelijktijdig voorkomen van DVT bij oppervlakkige tromboflebitis. Een retrospectief Nederlands onderzoek laat een incidentie van 2,5% zien. Onderzoek in de tweede lijn laat grote verschillen in incidentie zien (3-66%), waarbij onduidelijk is hoe deze resultaten zich vertalen naar de eerste lijn.
Er is geen gevalideerde klinische beslisregel voor oppervlakkige tromboflebitis en de D-dimeerbepaling is vaak verhoogd. In een metaregressieanalyse voorspelden oudere leeftijd, mannelijk geslacht, afwezigheid van recent trauma en afwezigheid van zwangerschap een hogere kans op aanwezigheid van DVT of longembolie in patiënten met een oppervlakkige tromboflebitis. In Nederlands retrospectief onderzoek kwamen actieve maligniteit en afwezigheid van varices naar voren als mogelijke risicofactoren.
Uit de huidige literatuur komt niet naar voren dat een bepaalde lokalisatie of grootte van de oppervlakkige tromboflebitis een risicofactor zou zijn voor uitbreiding naar een DVT. De werkgroep heeft daarom besloten deze criteria van lengte of locatie niet mee te nemen in de lijst met mogelijke redenen om een echo te maken.
De werkgroep concludeert daarnaast dat er op dit moment op basis van de huidige literatuur waarschijnlijk een klein risico van een paar procent bestaat op een DVT bij een diagnose oppervlakkige tromboflebitis die gesteld wordt op basis van het klinische beeld.
Gewenste en ongewenste effecten
Het voordeel van echografie bij een oppervlakkige tromboflebitis is dat met meer zekerheid uitgesloten kan worden dat er sprake is van een onderliggende DVT. Ook bij twijfel tussen een oppervlakkige tromboflebitis of toch een DVT kan de echo meer zekerheid bieden.
Kwaliteit van bewijs
De in de SR meegenomen onderzoeken zijn niet beoordeeld op kwaliteit van bewijs.
Waarden en voorkeuren van patiënten
Voor de patiënt is het belangrijk om te weten of er sprake is van een DVT. Het onderzoek is niet-invasief en het duurt kort, maar de patiënt moet er wel voor naar het ziekenhuis.
Kosten
De kosten van een echo zijn beperkt tot matig (gemiddeld € 85). Dit komt ten laste van het eigen risico. Kostenbesparingen zijn mogelijk wanneer door de vroegere detectie van DVT minder complicaties optreden.
Aanvaardbaarheid
Het onderzoek is niet-invasief. De patiënt moet wel naar het ziekenhuis, wat als belastend kan worden ervaren. Anderzijds kan het achterwege blijven van aanvullende diagnostiek de patiënt onzeker maken.
Haalbaarheid
Er zijn voldoende mogelijkheden om echografie in een ziekenhuis aan te bieden. Dit kan mogelijk een extra belasting voor de afdeling Radiologie zijn.
Uitgangsvraag
Hoe vaak is er sprake van het gelijktijdig voorkomen van een DVT bij een patiënt bij wie op klinische gronden een oppervlakkige tromboflebitis wordt vermoed?
Achtergrond
Oppervlakkige tromboflebitis is een lokale, door een trombus veroorzaakte, niet-infectieuze ontsteking van een oppervlakkige vene. De literatuur geeft wisselende incidentiecijfers voor de uitbreiding naar een DVT. Er zijn onderzoeken uitgevoerd in de tweede lijn of in een outpatient setting zoals een vasculair laboratorium, vaak met (zeer) kleine patiëntenaantallen, en deze komen uit op percentages van 6-53%. Deze getallen zijn waarschijnlijk aan de hoge kant, gebaseerd als ze zijn op retrospectieve onderzoeken met kleine aantallen patiënten, van wie de meesten waren verwezen om een DVT uit te sluiten. De cijfers in de huisartsenpraktijk liggen waarschijnlijk aan de onderkant van deze range.
De voorgaande versie van deze NHG-Standaard stelde dat echografie alleen geïndiceerd is ‘bij een (fors) grotere tromboflebitis of bij uitbreiding van de tromboflebitis en/of indien deze in de buurt van de verbinding met het diepe systeem komt (lies of knie)’. En verder: ‘De precieze grootte van de tromboflebitis waarbij de huisarts een echo zou moeten overwegen is niet goed aan te geven. De grootte van de uitwendig zichtbare afwijkingen corresponderen waarschijnlijk niet, of niet altijd, met de grootte van de tromboflebitis bij echografie. De huisarts dient dus een inschatting te maken van de grootte.’
De ACCP-richtlijn (2021) en de NIV-richtlijn Antitrombotisch beleid (geraadpleegd mei 2022) noemen als mogelijke risicofactoren (indicaties voor antistolling) wel extensieve tromboflebitis (arbitrair echografisch ≥ 5 cm), lokalisatie boven de knie (≤ 3 cm van de saphenofemorale inmonding), ernstige symptomen, betrokkenheid van de vena saphena magna of parva, eerder doorgemaakte VTE of oppervlakkige tromboflebitis, actieve maligniteit en recente operatie; maar helaas wordt in geen van beide documenten verwezen naar een bron.
De precieze grootte van de oppervlakkige tromboflebitis waarbij een echo is geïndiceerd, is dus niet goed aan te geven. Toch wil je geen onderliggende DVT missen. Kunnen we aangeven in hoeveel gevallen er sprake is van een onderliggende DVT bij vermoeden van oppervlakkige tromboflebitis?
Methoden
Er is een systematische literatuurzoekactie naar SR’s, RCT’s en observationeel onderzoek uitgevoerd in PubMed en Embase in januari 2022.
Resultaten
Resultaat zoekactie
De zoekactie leverde een systematische review op naar het gelijktijdig voorkomen van VTE bij de diagnose oppervlakkige tromboflebitis. Een aanvullende search na de zoekdatum van de SR leverde 1 retrospectief eerstelijns onderzoek op.
Onderzoekskarakteristieken
In de SR van Di Minno et al. werden 21 artikelen geïncludeerd, waarin 4358 patiënten met vermoeden van tromboflebitis werden bekeken. Het betrof in bijna alle gevallen geen eerstelijnspopulatie maar een outpatient-populatie, vaak van een vasculair laboratorium, waarbij niet duidelijk was of de patiënten waren verwezen door een huisarts of poortwachter of via een andere route. Ook waren in sommige onderzoeken alleen patiënten met een echografisch bewezen oppervlakkige tromboflebitis meegenomen in de verdere analyses. Het onderzoek van Geersing et al. betreft een retrospectief onderzoek over de jaren 2010-2016 bij circa 240.000 patiënten in 140 Nederlandse huisartsenpraktijken.
Uitkomsten
- In de SR van Di Minno et al. varieerde de prevalentie van DVT tijdens oppervlakkige tromboflebitis tussen 3,1% en 65,6%, met een gepoolde weighted mean prevalence (WMP) van 18,1% (95%-BI 13,9 tot 23,3. Er was sprake van significante heterogeniteit tussen de onderzoeken (I2 91,8%; p < 0,001). Wanneer de 6 onderzoeken met ziekenhuispatiënten werden geëxcludeerd bleef de gemiddelde schatter hetzelfde (WMP 18,2%; 95%-BI 12,2 tot 26,3%; I2 91,6%; p < 0,001). Het is niet helemaal duidelijk welke patiëntengroepen mogelijk een hoger risico hebben en dus (nog) meer reden voor een echo. In een metaregressieanalyse voorspelden jongere leeftijd, vrouwelijk geslacht, recent trauma en zwangerschap een lagere kans op de aanwezigheid van DVT of longembolie tijdens oppervlakkige tromboflebitis. De reviewers hebben de onderzoeken niet beoordeeld op kwaliteit.
- In het onderzoek van Geersing et al. werd bij 2008 patiënten een oppervlakkige tromboflebitis vastgesteld op basis van klinische kenmerken, wat neerkomt op een incidentierate van 1,31 (95%-BI 1,25 tot 1,37) per 1000 persoonsjaren follow-up. Een diagnose VTE tijdens of na de diagnose oppervlakkige tromboflebitis kwam voor bij 83 patiënten (51 tijdens de oppervlakkige tromboflebitis, 32 erna). De cumulatieve incidentie bedroeg 4,1% (95%-BI 3,3% tot 5,1%). De incidentie van DVT tijdens oppervlakkige tromboflebitis (51 patiënten) in een populatie met klinisch vastgestelde tromboflebitis (2008 patiënten) is 2,5%. Omdat dit een retrospectief onderzoek was, kan er sprake zijn van onderschatting doordat niet alle patiënten met een tromboflebitis ook een echo hebben gekregen en door mogelijke loss to follow-up na > 3 maanden. Omdat dit onderzoek het tot nog toe enige eerstelijnsonderzoek is, heeft de werkgroep besloten het te includeren.
Conclusie
Op basis van de huidige literatuur is er een grote variatie (3-66%), met een gewogen gemiddelde van 18%. Prospectief eerstelijnsonderzoek ontbreekt. Het enige retrospectieve onderzoek in de eerste lijn laat een incidentie zien van 2,5%.
Beleid
Naar Samenvatting ›- De behandeling van tromboflebitis is (anders dan de behandeling van DVT) veel meer gericht op het verminderen van de pijn en het voorkomen van uitbreiding of recidief van de tromboflebitis.
- Behandeling is zelden nodig, maar kan wenselijk zijn bij veel pijn of bij bepaalde risicofactoren voor uitbreiding.
Pijnbehandeling
Naar Samenvatting ›Adviseer eventueel pijnbehandeling volgens de NHG-Standaard Pijn.
Keuze wel of geen antistolling
Naar Samenvatting ›- Wees terughoudend met antistollingsbehandeling van een oppervlakkige tromboflebitis om een DVT te voorkomen. Weeg de voordelen (enkele procenten risicoreductie op een DVT) af tegen de nadelen (risico op bloedingen).
- Overweeg te starten met antistolling bij bepaalde risicofactoren voor uitbreiding (oudere leeftijd, man, actieve kanker, afwezigheid van recent trauma, afwezigheid van zwangerschap, afwezigheid van varices).
Waarom deze aanbeveling?
Er is geen prospectief onderzoek in de eerste lijn gedaan naar het gelijktijdig voorkomen van DVT bij een oppervlakkige tromboflebitis. Retrospectief Nederlands onderzoek laat een incidentie van 2,5% zien. Een systematische review van onderzoek uit de tweede lijn laat een grote variatie aan incidenties zien (3-66%). Daarbij is onduidelijk hoe deze resultaten zich vertalen naar de eerste lijn, omdat het mogelijk een hele andere patiëntenpopulatie betreft.
In een metaregressieanalyse voorspelden oudere leeftijd, mannelijk geslacht, afwezigheid van recent trauma en afwezigheid van zwangerschap een hogere kans op aanwezigheid van DVT of longembolie in patiënten met een oppervlakkige tromboflebitis. In Nederlands retrospectief onderzoek kwamen actieve maligniteit en afwezigheid van varices naar voren als mogelijke risicofactoren.
De ACCP-richtlijn (2021) en de NIV-richtlijn Antitrombotisch beleid (geraadpleegd mei 2022) noemen wel als mogelijke indicaties voor antistolling extensieve tromboflebitis (arbitrair echografisch ≥ 5 cm). De grens van 5 cm is een inclusiecriterium bij de CALISTO-trial naar behandeling van oppervlakkige tromboflebitis. De richtlijnen noemen verder lokalisatie boven de knie, dicht bij de saphenofemorale inmonding (≤ 3 cm), ernstige symptomen, betrokkenheid van de vena saphena magna of parva, eerder doorgemaakte VTE of oppervlakkige tromboflebitis, actieve maligniteit en recente operatie; maar helaas verwijst geen van beide documenten naar een bron.
Al met al concludeert de werkgroep op basis van de huidige literatuur dat er waarschijnlijk een klein risico is van een paar procenten op een DVT bij een oppervlakkige tromboflebitis. Uit de huidige literatuur komt niet eenduidig naar voren dat een bepaalde lokalisatie of grootte van de oppervlakkige tromboflebitis een risicofactor zou zijn voor uitbreiding naar een DVT. De werkgroep heeft daarom besloten deze niet mee te nemen in de lijst met mogelijke redenen om te behandelen.
Bij keuze voor behandeling met antistolling
Naar Samenvatting ›- Behandel patiënten met tromboflebitis bij wie besloten is tot behandeling met antistolling met fondaparinux (eerste keuze).
- De dosering van fondaparinux is 1 dd 2,5 mg gedurende 45 dagen. Reduceer de dosering bij nierinsufficiëntie (eGFR 20-50 ml/min) tot 1 dd 1,5 mg.
- Let bij fondaparinux op mogelijke contra-indicaties (onder andere ernstige nierinsufficiëntie (eGFR < 20 ml/min)) en interacties (onder andere trombocytenaggregatieremmers en NSAID’s).
- Alleen in geval van ernstige bezwaren of contra-indicaties is behandeling met rivaroxaban 1 dd 10 mg gedurende 45 dagen te overwegen als redelijk alternatief.
Fondaparinux leidt tot de grootste risicoreductie van VTE en uitbreiding of recidief van tromboflebitis, is ook het best onderzocht en is het enige middel dat is geregistreerd voor deze indicatie. Daarom beveelt de werkgroep dit middel aan als eerste keuze bij de behandeling van tromboflebitis. Nadelen van fondaparinux zijn dat hiervoor subcutane injecties nodig zijn en dat er soms leveringsproblemen in Nederland zijn. Daarom vindt de werkgroep het belangrijk om een alternatief te noemen. Voor patiënten die niet met fondaparinux kunnen of willen worden behandeld, beveelt de werkgroep rivaroxaban aan. Het beperkte onderzoek dat hiervoor beschikbaar is suggereert dat dit niet inferieur is ten opzichte van fondaparinux. Dit bouwt bovendien voort op het bewijs dat er is voor DOAC’s bij de behandeling van VTE.
Wat pijnbehandeling betreft is er nauwelijks onderzoek beschikbaar bij patiënten met tromboflebitis. Diclofenacgel lijkt vermindering van de pijn te geven ten opzichte van placebo, maar de kwaliteit van bewijs is laag en andere pijnmedicatie, zoals paracetamol, is niet onderzocht. Daarom verwijst de werkgroep voor de pijnbehandeling van tromboflebitis naar de NHG-Standaard Pijn. Lokale behandeling met diclofenacgel is een mogelijkheid bij patiënten die geen orale pijnmedicatie willen gebruiken of bij contra-indicaties.
Gewenste en ongewenste effecten
Het gewenste effect van behandeling is vermindering van het risico op VTE en op uitbreiding of recidief van tromboflebitis. Deze risicoreductie is het grootst (en het best onderzocht) voor fondaparinux. Ook LMWH geeft mogelijk een klinisch relevante risicoreductie van uitbreiding en/of recidief van tromboflebitis, maar niet of nauwelijks op het VTE-risico.
Een ander gewenst effect van behandeling is vermindering van de pijn. Dit is echter alleen onderzocht in 2 zeer kleine RCT’s. Diclofenacgel leek de pijn te verminderen vergeleken met placebo. Tussen rivaroxaban en placebo leek er niet of nauwelijks verschil te zijn in pijnvermindering. Ongewenste effecten, zoals sterfte en het optreden van bloedingen of andere (ernstige) bijwerkingen, zijn echter onzeker of niet onderzocht. Bovendien is de absolute risicoreductie zeer laag.
Kwaliteit van bewijs
De kwaliteit van bewijs varieerde van redelijk tot zeer laag. Voor de meeste interventies en uitkomsten was de kwaliteit van bewijs laag of zeer laag, of zelfs afwezig. Alleen bij fondaparinux is er voor enkele uitkomsten een redelijke kwaliteit van bewijs.
Waarden en voorkeuren van patiënten
We verwachten substantiële variatie onder de patiënten. Behandeling heeft het risico van bijwerkingen, zoals bloedingen (bij gebruik van fondaparinux zijn deze moeilijk te couperen).
Een deel van de patiënten zal het risico van uitbreiding van de tromboflebitis of ontstaan van VTE willen voorkomen en heeft de nadelen van behandeling daarvoor over. Een deel van de patiënten zal wellicht alleen behoefte hebben aan pijnvermindering.
Kosten
Kosten per 45 dagen (medicijnkosten.nl, geraadpleegd december 2021):
- fondaparinux 2,5 mg: € 157,95
- LMWH nadroparine 19.000IE/ml, 0,8 ml (therapeutisch): € 442,35
- LMWH enoxaparine 40 mg (profylaxe): € 118,35
- rivaroxaban 10 mg: € 96,75
Aanvaardbaarheid
Voor behandeling met fondaparinux en LMWH zijn dagelijkse subcutane injecties nodig, wat voor sommige patiënten een nadeel zal zijn. Rivaroxaban kent dit nadeel niet. Toepassing van LMWH en rivaroxaban bij de behandeling van tromboflebitis is offlabel, wat de aanvaardbaarheid in de weg kan staan.
Haalbaarheid
Er zijn kunnen leveringsproblemen zijn met fondaparinux. De overige beschreven middelen zijn goed verkrijgbaar in Nederland.
Uitgangsvraag
Als besloten wordt tot behandeling, welke behandeling (DOAC, LMWH, fondaparinux of NSAID) is dan aan te bevelen bij patiënten met oppervlakkige tromboflebitis in het been? Zie de PICO-tabel.
|
Patiënten |
Patiënten met oppervlakkige tromboflebitis in het been |
|---|---|
|
Interventie |
DOAC |
|
Vergelijking |
Onderlinge vergelijking tussen interventies |
|
Uitkomstmaten |
Cruciaal:
Belangrijk:
|
De NHG-werkgroep heeft de volgende grenzen voor klinisch relevante verschillen vastgesteld:
- dichotome uitkomstmaten (sterfte, ontwikkeling van DVT/LE, recidief of uitbreiding tromboflebitis, bloeding): relatief risicoverschil van 25% (dus RR < 0,75 of RR > 1,25) (conform de door GRADE voorgestelde standaardgrenzen);
- continue uitkomstmaten (pijn, kwaliteit van leven): verschil van 20% op de gebruikte schaal.
Achtergrond
Tromboflebitis in het been kan in de meeste gevallen symptomatisch behandeld worden. In enkele gevallen kan er echter een DVT ontstaan. Om dit te voorkomen is bij bepaalde patiënten behandeling met antistollingsmedicatie te overwegen. Welke behandeling is aan te bevelen bij deze patiënten?
Methoden
Er is een systematische literatuurzoekactie naar SR’s en RCT’s uitgevoerd in PubMed en Embase in mei 2021, met een update in december 2022.
Resultaten
Resultaat zoekactie
De zoekactie leverde een SR (cochranereview) op naar de behandeling van tromboflebitis in het been. Een aanvullende search na de zoekdatum van deze SR leverde 1 aanvullende RCT op. De update van de search leverde geen nieuw onderzoek op.
Onderzoekskarakteristieken
De review van Di Nisio et al. is een cochranereview naar de effectiviteit en veiligheid van behandelingen (medicamenteus of chirurgisch) van tromboflebitis in het been. Er werden 33 RCT’s ingesloten, met in totaal 7296 patiënten met tromboflebitis.
Voor deze uitgangsvraag is gebruikgemaakt van de volgende vergelijkingen:
- LMWH vergeleken met placebo: 1 RCT (het STENOX-onderzoek) met 427 deelnemers met een echografisch vastgestelde tromboflebitis in het been van ten minste 5 cm. Als bij de echo een DVT werd vastgesteld, werd de patiënt geëxcludeerd. De deelnemers waren gemiddeld 62 jaar oud en 63% was vrouw. De deelnemers werden gerandomiseerd naar een therapeutische dosering LMWH van 1,5 mg/kg per dag subcutaan (n = 106), een profylactische dosering LMWH van 40 mg per dag subcutaan (n = 110), het NSAID tenoxicam (n = 99) of placebo (n = 112) gedurende 8-12 dagen. Zij werden 3 maanden gevolgd. Omdat tenoxicam niet in Nederland beschikbaar is, is deze onderzoeksarm buiten beschouwing gelaten.
- Fondaparinux vergeleken met placebo: 1 RCT (het CALISTO-onderzoek) met 3002 deelnemers met een echografisch vastgestelde acute tromboflebitis in het been van ≥ 5 cm. De deelnemers waren gemiddeld 57 jaar oud en 64% was vrouw. De deelnemers werden gerandomiseerd naar fondaparinux (een pentasaccharide die specifiek factor Xa remt via selectieve binding aan antitrombine III) in een profylactische dosering van 2,5 mg subcutaan per dag (n = 1502) of placebo (n = 1500) gedurende 45 dagen en werden gevolgd gedurende gemiddeld 77 dagen.
- Fondaparinux vergeleken met DOAC: 1 open-label RCT (het SURPRISE-onderzoek) met 472 deelnemers met tromboflebitis in het bovenbeen van ≥ 5 cm en daarnaast ≥ 1 risicofactor voor trombo-embolische complicaties (≥ 65 jaar, mannelijk geslacht, eerdere VTE, kanker, auto-immuunziekte, tromboflebitis niet in een spatader). De deelnemers werden gerandomiseerd naar rivaroxaban 1 dd 10 mg oraal of fondaparinux 1 dd 2,5 mg subcutaan. De behandeling duurde 45 dagen en de deelnemers werden 90 dagen gevolgd.
- Transdermaal NSAID vergeleken met placebo: 1 RCT met 30 deelnemers met eenzijdige tromboflebitis in het onderbeen, verwezen door de huisarts. De deelnemers werden gerandomiseerd naar diclofenacgel 1% 3 dd (n = 10) of placebogel 3 dd (n = 10) gedurende 3 weken. De deelnemers in de diclofenacgroep waren gemiddeld 60 jaar, in de placebogroep gemiddeld 55 jaar. In beide groepen waren 6 vrouwen en 4 mannen geïncludeerd. Daarnaast werden er 10 patiënten behandeld met heparinegel (niet gerandomiseerd). Deze arm laten we buiten beschouwing, omdat heparinegel in Nederland niet verkrijgbaar is.
Naast de cochranereview is 1 recentere RCT geïncludeerd:
- DOAC vergeleken met placebo: 1 RCT met 85 deelnemers met tromboflebitis in het been van ≥ 5 cm, die was vastgesteld op klinische gronden en al dan niet met echografie bevestigd. De deelnemers werden gerandomiseerd naar rivaroxaban 10 mg oraal eenmaal daags (n = 43) of placebo (n = 42). De interventie duurde 45 dagen en de deelnemers werden 3 maanden gevolgd. De gemiddelde leeftijd van de deelnemers was 59 jaar en 49% was vrouw.
Effectiviteit en bijwerkingen
DOAC vergeleken met placebo
In de RCT traden te weinig gevallen van de dichotome uitkomstmaten op om hier conclusies aan te verbinden (zie tabel d9). Over alle dichotome uitkomstmaten zijn we onzeker vanwege zeer ernstige onnauwkeurigheid (zeer weinig events) en mogelijke publicatiebias (het onderzoek was gesponsord door de fabrikant). De kwaliteit van bewijs voor de continue uitkomstmaten hebben we beoordeeld als laag vanwege ernstige onnauwkeurigheid en mogelijke publicatiebias. Mogelijk zijn is er niet of nauwelijks verschil in pijn en kwaliteit van leven tussen een DOAC en placebo.
Bijwerkingen van rivaroxaban (KNMP Kennisbank, geraadpleegd december 2021):
- vaak voorkomend (1-10%): bloedingen, anemie, verminderde nierfunctie, duizeligheid, hoofdpijn, hypotensie, jeuk, huiduitslag, ecchymose, dyspepsie, buikpijn, misselijkheid, braken, diarree, obstipatie, pijn in de extremiteiten, perifeer oedeem, koorts, vermoeidheid, asthenie en stijging van leverenzymen
- soms (0,1-1%): wijzigingen bloedbeeld, syncope, tachycardie, allergische reacties en stijging van leverenzymen
- zelden (< 0,1%): anafylactische reacties, stevens-johnsonsyndroom, toxische epidermale necrolyse, DRESS-syndroom, geelzucht, cholestase, hepatitis
|
Uitkomst |
Rivaroxaban* |
Placebo* |
Kwaliteit van bewijs |
|
Sterfte |
0 |
0 |
– |
|
DVT of LE |
0 |
0 |
– |
|
Ernstige bloeding |
0 |
0 |
– |
|
Uitbreiding tromboflebitis |
0/43 |
2/42 |
Zeer laag |
|
Recidief tromboflebitis |
0/43 |
1/42 |
Zeer laag |
|
Ernstige bijwerkingen (niet gespecificeerd) |
0 |
0 |
– |
|
Klinisch relevante, niet-ernstige bloeding |
1/43 |
0/42 |
Zeer laag |
|
Pijn na 7 dagen† |
2,51 (0,17) |
2,68 (0,21) |
Laag |
|
Pijn na 45 dagen† |
1,67 (0,19) |
1,69 (0,19) |
Laag |
|
Pijn na 90 dagen† |
1,30 (0,09) |
1,93 (0,23) |
Laag |
|
VEINES-QoL na 45 dagen‡ |
70,5 (3,00) |
70,5 (3,61) |
Laag |
|
* Cijfers zijn n/N of gemiddelde (standard error (SE)). † Pijn was bij aanvang in de rivaroxabangroep gemiddeld 3,95 (SE 0,20) op een likertschaal van 0-7, en in de placebogroep 3,64 (SE 0,22). ‡ VEINES-QoL was bij aanvang in de rivaroxabangroep gemiddeld 52,8 (SE 2,92) op een schaal van 0-100, en in de placebogroep 55,7 (SE 3,51). Ook in algemene kwaliteit van leven (SF-36) was er geen verschil tussen de groepen. |
|||
LMWH vergeleken met placebo
Zie tabel LMWH vergeleken met placebo voor de samenvatting van de resultaten.
Bijwerkingen van LMWH (KNMP Kennisbank, geraadpleegd december 2021):
- zeer vaak voorkomend (> 10%): bloedingen en stijging van leverenzymen
- vaak voorkomend (1-10%): trombocytose, trombocytopenie, overgevoeligheidsreacties, jeuk, urticaria, erytheem, pijn en reacties op de toedieningsplaats
- soms (0,1-1%): bulleuze dermatitis
- zelden (< 0,1%): heparinegeïnduceerde trombocytopenie (HIT type II), hyperkaliëmie, anafylactische shock
Fondaparinux vergeleken met placebo
Zie tabel Fondaparinux vergeleken met placebo.
Bijwerkingen van fondaparinux (KNMP Kennisbank, geraadpleegd december 2021):
- vaak voorkomend (1-10%): anemie
- soms (0,1-1%): bloeding, misselijkheid, braken, huiduitslag, jeuk, oedeem, koorts, stijging van leverenzymwaarden
- zelden (< 0,1%): HIT-type II (causaal verband is niet vastgesteld), hypokaliëmie en allergische reacties
Fondaparinux vergeleken met DOAC
In de RCT traden te weinig gevallen van de uitkomstmaten op om hier conclusies aan te verbinden (zie tabel d10). Pijn en kwaliteit van leven zijn niet onderzocht.
Over alle uitkomstmaten zijn we onzeker, vanwege kans op vertekening (het onderzoek was niet geblindeerd), zeer ernstige onnauwkeurigheid (zeer weinig events) en mogelijk publicatiebias (het onderzoek was gedeeltelijk gesponsord door de fabrikant van rivaroxaban).
|
Uitkomst |
Fondaparinux (n/N) |
Rivaroxaban (n/N) |
Kwaliteit van bewijs |
|
Sterfte |
0/236 |
1/236 |
Zeer laag |
|
DVT (longembolie kwam niet voor) |
1/236 |
3/236 |
Zeer laag |
|
Ernstige bloeding |
0 |
0 |
– |
|
Uitbreiding tromboflebitis |
0 |
0 |
– |
|
Recidief tromboflebitis |
3/236 |
4/236 |
Zeer laag |
|
Bijwerkingen (niet gespecificeerd) |
0/235 |
3/236 |
Zeer laag |
|
Klinisch relevante, niet-ernstige bloeding |
1/235 |
6/236 |
Zeer laag |
Oraal NSAID vergeleken met placebo of LMWH
Het enige orale NSAID dat onderzocht is, is tenoxicam. Dit middel is in Nederland niet verkrijgbaar. Het is niet mogelijk om de resultaten uit het onderzoek te extrapoleren naar andere, wel in Nederland verkrijgbare NSAID’s, omdat de verschillende NSAID’s een verschillende antitrombotische werking hebben, die vaak farmacologisch niet te verklaren is.
Transdermaal NSAID vergeleken met placebo
De resultaten voor pijn zijn vermeld in tabel d11. De kwaliteit van bewijs voor deze uitkomst is laag vanwege zeer ernstige onnauwkeurigheid. De overige cruciale en belangrijke uitkomstmaten zijn niet bepaald. Mogelijk is er na ≥ 2 weken behandeling met diclofenacgel (zie de uitkomsten Pijn na 15 dagen en Pijn na 22 dagen in tabel d11) een klinisch relevant grotere afname van de pijn dan met placebo (≥ 20 punten verschil op een visuele analoge schaal 0-100).
Bijwerkingen van diclofenacgel (KNMP Kennisbank, geraadpleegd december 2021):
- vaak voorkomend (1-10%): huiduitslag, eczeem, erytheem, (contact)dermatitis en jeuk
- zelden (< 0,1%): overgevoeligheidsreacties, bulleuze dermatitis (inclusief stevens-johnsonsyndroom en toxische epidermale necrolyse), fotosensibilisatie, pustulaire huiduitslag, blozen en astma
|
Uitkomst |
Diclofenacgel |
Placebo |
Kwaliteit van bewijs |
|
Pijn na 8 dagen* |
43 |
55 |
Laag |
|
Pijn na 15 dagen* |
30 |
52 |
Laag |
|
Pijn na 22 dagen* |
15 |
47 |
Laag |
|
* Gemiddelde pijn op een visuele analoge schaal van 0-100. De pijn bij aanvang was gemiddeld 55,6 ± 9,0 0 in de diclofenacgroep en 55,9 ± 8,3 in de placebogroep. |
|||
Conclusies
DOAC vergeleken met placebo
- We zijn onzeker over een verschil in het risico op uitbreiding en/of recidief van de tromboflebitis en klinisch relevante, niet-ernstige bloedingen (kwaliteit van bewijs zeer laag).
- Mogelijk is er niet of nauwelijks verschil in pijn en kwaliteit van leven (kwaliteit van bewijs zeer laag).
- De overige uitkomstmaten (sterfte, VTE, ernstige bloedingen en ernstige bijwerkingen) traden niet op in het onderzoek.
LMWH vergeleken met placebo
- Mogelijk is er niet of nauwelijks verschil in het risico op VTE (kwaliteit van bewijs laag).
- Mogelijk leidt behandeling met LMWH tot afname van het risico op recidief en/of uitbreiding van tromboflebitis (kwaliteit van bewijs laag).
- De overige uitkomstmaten traden niet op in het onderzoek (ernstige bloedingen, ernstige bijwerkingen) of zijn niet onderzocht (sterfte, pijn, klinisch relevante niet-ernstige bloedingen en kwaliteit van leven).
Fondaparinux vergeleken met placebo
- Waarschijnlijk leidt fondaparinux tot een afname van het risico op VTE en uitbreiding en/of recidief van tromboflebitis (kwaliteit van bewijs redelijk).
- We zijn onzeker over een verschil in sterfte en bloedingen, zowel ernstige als klinisch relevante niet-ernstige, en in bijwerkingen (kwaliteit van bewijs zeer laag).
- Pijn en kwaliteit van leven zijn niet onderzocht.
Fondaparinux vergeleken met DOAC
- We zijn onzeker over een verschil in het risico op sterfte, VTE, recidief van de tromboflebitis, bijwerkingen en klinisch relevante, niet-ernstige bloedingen (kwaliteit van bewijs zeer laag);
- De overige uitkomstmaten traden niet op in het onderzoek (ernstige bloedingen, uitbreiding van de tromboflebitis) of zijn niet onderzocht (pijn en kwaliteit van leven).
Transdermaal NSAID vergeleken met placebo
- Mogelijk leidt een transdermaal NSAID tot een afname van de pijn (kwaliteit van bewijs laag);
- De overige uitkomstmaten zijn niet onderzocht (sterfte, VTE, bloedingen, recidief of uitbreiding van tromboflebitis, bijwerkingen en kwaliteit van leven).
Controle en verwijzing
Naar Samenvatting ›- Zie de patiënt na 1 week terug voor controle (ongeacht behandeling), vanwege risico op uitbreiding en om eventuele behandeling te monitoren.
- Verwijs naar een internist bij herhaald optredende oppervlakkige tromboflebitis (arbitrair: < 6 maanden) ter uitsluiting van onderliggend lijden, zoals een maligniteit.
Referenties
- Oudega R, Moons KG, Hoes AW. Ruling out deep venous thrombosis in primary care. A simple diagnostic algorithm including D-dimer testing. Thromb Haemost 2005;94:200-5.
- Geersing GJ, Erkens PM, Lucassen WA, Buller HR, Cate HT, Hoes AW, et al. Safe exclusion of pulmonary embolism using the Wells rule and qualitative D-dimer testing in primary care: prospective cohort study. BMJ 2012;345:e6564.
- Van Dongen CJ, Vink R, Hutten BA, Buller HR, Prins MH. The incidence of recurrent venous thromboembolism after treatment with vitamin K antagonists in relation to time since first event: a meta-analysis. Arch Intern Med 2003;163:1285-93.
- Kearon C, Akl EA, Comerota AJ, Prandoni P, Bounameaux H, Goldhaber SZ, et al. Antithrombotic therapy for VTE disease: antithrombotic therapy and prevention of thrombosis, 9th ed: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines. Chest 2012;141:e419S-e494S.
- Iorio A, Kearon C, Filippucci E, Marcucci M, Macura A, Pengo V, et al. Risk of recurrence after a first episode of symptomatic venous thromboembolism provoked by a transient risk factor: a systematic review. Arch Intern Med 2010;170:1710-6.
- Kahn SR, Ginsberg JS. Relationship between deep venous thrombosis and the postthrombotic syndrome. Arch Intern Med 2004;164:17-26.
- Prandoni P, Lensing AW, Cogo A, Cuppini S, Villalta S, Carta M, et al. The long-term clinical course of acute deep venous thrombosis. Ann Intern Med 1996;125:1-7.
- Galanaud JP, Righini M, Le Collen L, Douillard A, Robert-Ebadi H, Pontal D, et al. Long-term risk of postthrombotic syndrome after symptomatic distal deep vein thrombosis: The CACTUS-PTS study. J Thromb Haemost 2020;18:857-64.
- Galanaud JP, Monreal M, Kahn SR. Epidemiology of the post-thrombotic syndrome. Thromb Res 2018;164:100-9.
- Rosendaal FR. Venous thrombosis: a multicausal disease. Lancet 1999;353:1167-73.
- Khan F, Tritschler T, Kahn SR, Rodger MA. Venous thromboembolism. Lancet 2021a;398:64-77.
- Kort D, Van Rein N, Van der Meer FJM, Vermaas HW, Wiersma N, Cannegieter SC, et al. Relationship between neighborhood socioeconomic status and venous thromboembolism: results from a population-based study. J Thromb Haemost 2017;15: 2352-60.
- White H, Murin S. Is the current classification of venous thromboembolism acceptable? No. J Thromb Haemost 2004;2:2262-3.
- Heit JA, Silverstein MD, Mohr DN, Petterson TM, O’Fallon WM, Melton LJ, III. Risk factors for deep vein thrombosis and pulmonary embolism: a population-based case-control study. Arch Intern Med 2000;160:809-15.
- Cushman M, Tsai AW, White RH, Heckbert SR, Rosamond WD, Enright P, et al. Deep vein thrombosis and pulmonary embolism in two cohorts: the longitudinal investigation of thromboembolism etiology. Am J Med 2004;117:19-25.
- Greer IA. Thrombosis in pregnancy: maternal and fetal issues. Lancet 1999;353:1258-65.
- Van Weert H, Dolan G, Wichers I, De Vries C, Ter Riet G, Buller H. Spontaneous superficial venous thrombophlebitis: does it increase risk for thromboembolism? A historic follow-up study in primary care. J Fam Pract 2006;55:52-7.
- Goldhaber SZ, Grodstein F, Stampfer MJ, Manson JE, Colditz GA, Speizer FE, et al. A prospective study of risk factors for pulmonary embolism in women. JAMA 1997 26;277:642-5.
- Stein PD, Beemath A, Olson RE. Obesity as a risk factor in venous thromboembolism. Am J Med 2005;118:978-80.
- Akl EA, Labedi N, Barba M, Terrenato I, Sperati F, Muti P, et al. Anticoagulation for the long-term treatment of venous thromboembolism in patiënts with cancer. Cochrane Database Syst Rev 2014:CD006650.
- Hutten BA, Prins MH, Gent M, Ginsberg J, Tijssen JG, Buller HR. Incidence of recurrent thromboembolic and bleeding complications among patiënts with venous thromboembolism in relation to both malignancy and achieved international normalized ratio: a retrospective analysis. J Clin Oncol 2000;18:3078-83.
- Melis F, Vandenbrouke JP, Büller HR, Colly LP, Bloemenkamp KW. Estimates of risk of venous thrombosis during pregnancy and puerperium are not influenced by diagnostic suspicion and referral basis. Am J Obstet Gynecol 2004;191:825-9.
- Ginsberg JS, Brill-Edwards P, Burrows RF, Bona R, Prandoni P, Büller HR, et al. Venous thrombosis during pregnancy: leg and trimester of presentation. Thromb Haemost 1992;67:519-20.
- Cheng YJ, Liu ZH, Yao FJ, Zeng WT, Zheng DD, Dong YG, et al. Current and former smoking and risk for venous thromboembolism: a systematic review and meta-analysis. PLoS Med 2013;10:e1001515.
- Chandra D, Parisini E, Mozaffarian D. Meta-analysis: travel and risk for venous thromboembolism. Ann Intern Med 2009;151:180-90.
- Kuipers S, Schreijer AJ, Cannegieter SC, Buller HR, Rosendaal FR, Middeldorp S. Travel and venous thrombosis: a systematic review. J Intern Med 2007b;262:615-34.
- Kuipers S, Cannegieter SC, Middeldorp S, Robyn L, Buller HR, Rosendaal FR. The absolute risk of venous thrombosis after air travel: a cohort study of 8,755 employees of international organisations. PLoS Med 2007a;4:e290.
- Cannegieter SC, Doggen CJ, Van Houwelingen HC, Rosendaal FR. Travel-related venous thrombosis: results from a large population-based case control study (MEGA study). PLoS Med 2006;3:e307.
- Philbrick JT, Becker DM. Calf deep venous thrombosis. A wolf in sheep’s clothing? Arch Intern Med 1988;148:2131-8.
- Fard MN, Mostaan M, Anaraki MR. Utility of lower-extremity duplex sonography in patiënts with venous thromboembolism. J Clin Ultrasound 2001;29:92-8.
- Riedel M. Acute pulmonary embolism 1: pathophysiology, clinical presentation, and diagnosis. Heart 2001;229-40.
- Stein PD, Matta F, Musani MH, Diaczok B. Silent pulmonary embolism in patients with deep venous thrombosis: a systematic review. Am J Med 2010;123:426-31.
- Calder KK, Herbert M, Henderson SO. The mortality of untreated pulmonary embolism in emergency department patiënts. Ann Emerg Med 2005;45:302-10
- Masuda EM, Kistner RL, Musikasinthorn C, Liquido F, Geling O, He Q. The controversy of managing calf vein thrombosis. J Vasc Surg 2012;55:550-61.
- Goodacre S, Sutton AJ, Sampson FC. Meta-analysis: The value of clinical assessment in the diagnosis of deep venous thrombosis. Ann Intern Med 2005a;143:129-39.
- Stein PD, Henry JW. Clinical characteristics of patiënts with acute pulmonary embolism stratified according to their presenting syndromes. Chest 1997;112:974-9.
- Le Gal G, Testuz A, Righini M, Bounameaux H, Perrier A. Reproduction of chest pain by palpation: diagnostic accuracy in suspected pulmonary embolism. BMJ 2005;330:452-3.
- Kline JA, Courtney DM, Kabrhel C, Moore CL, Smithline HA, Plewa MC, et al. Prospective multicenter evaluation of the pulmonary embolism rule-out criteria. J Thromb Haemost 2008;6:772-80.
- Geersing GJ, Zuithoff NP, Kearon C, Anderson DR, Ten Cate-Hoek AJ, Elf JL, et al. Exclusion of deep vein thrombosis using the wells rule in clinically important subgroups: individual patient data meta-analysis. BMJ 2014;348:g1340.
- Kafeza M, Shalhoub J, Salooja N, Bingham L, Spagou K, Davies AH. A systematic review of clinical prediction scores for deep vein thrombosis. Phlebology 2017;32:516-31.
- Van Maanen R, Kingma AEC, Oudega R, Rutten FH, Moons K, Geersing GJ. Real-life impact of clinical prediction rules for venous thromboembolism in primary care: a cross-sectional cohort study. BMJ Open 2020 28;10:e039913.
- Toll DB, Oudega R, Bulten RJ, Hoes AW, Moons KG. Excluding deep vein thrombosis safely in primary care. J Fam Pract 2006;55:613-8.
- Büller HR, Ten Cate-Hoek AJ, Hoes AW, Joore MA, Moons KG, Oudega R, et al. Safely ruling out deep venous thrombosis in primary care. Ann Intern Med 2009;150:229-35.
- El Tabei L, Holtz G, Schürer-Maly C, Abholz HH. Accuracy in diagnosing deep and pelvic vein thrombosis in primary care: an analysis of 395 cases seen by 58 primary care physicians. Dtsch Arztebl Int 2012;109:761-6.
- Parpia S, Takach Lapner S, Schutgens R, Elf J, Geersing GJ, Kearon C. Clinical pre-test probability adjusted versus age-adjusted d-dimer interpretation strategy for DVT diagnosis: a diagnostic individual patient data meta-analysis. J Thromb Haemost 2020;18:669-75.
- Nybo M, Hvas AM. Age-adjusted d-dimer cut-off in the diagnostic strategy for deep vein thrombosis: a systematic review. Scand J Clin Lab Invest 2017;77:568-573.
- Wells PS, Anderson DR, Rodger M, Forgie M, Kearon C, Dreyer J, et al. Evaluation of d-dimer in the diagnosis of suspected deep-vein thrombosis. N Engl J Med 2003;349:1227-35.
- Lidegaard O, Lokkegaard E, Svendsen AL, Agger C. Hormonal contraception and risk of venous thromboembolism: national follow-up study. BMJ 2009;339:b2890.
- Geersing GJ, Takada T, Klok FA, Büller HR, Courtney DM, Freund Y, et al. Ruling out pulmonary embolism across different healthcare settings: a systematic review and individual patient data meta-analysis. PLoS Med 2022 25;19:e1003905.
- Hendriksen JM, Geersing GJ, Lucassen WA, Erkens PM, Stoffers HE, Van Weert HC, et al. Diagnostic prediction models for suspected pulmonary embolism: systematic review and independent external validation in primary care. BMJ 2015a;351:h4438.
- Hendriksen JM, Lucassen WA, Erkens PM, Stoffers HE, Van Weert HC, Büller HR, et al. Ruling out pulmonary embolism in primary care: comparison of the diagnostic performance of "gestalt" and the wells Rule. Ann Fam Med 2016;14:227-34.
- Wells PS, Anderson DR, Rodger M, Ginsberg JS, Kearon C, Gent M, et al. Derivation of a simple clinical model to categorize patients probability of pulmonary embolism: increasing the models utility with the SimpliRED D-dimer. Thromb Haemost 2000;83:416-20.
- Gibson NS, Sohne M, Kruip MJ, Tick LW, Gerdes VE, Bossuyt PM, et al. Christopher study investigators. Further validation and simplification of the wells clinical decision rule in pulmonary embolism. Thromb Haemost 2008;99:229-34.
- Le Gal G, Righini M, Roy PM, Sanchez O, Aujesky D, Bounameaux H, et al. Prediction of pulmonary embolism in the emergency department: the revised Geneva score. Ann Intern Med 2006;144:165-71.
- Klok FA, Mos IC, Nijkeuter M, Righini M, Perrier A, Le Gal G, et al. Simplification of the revised Geneva score for assessing clinical probability of pulmonary embolism. Arch Intern Med 2008;168:2131-6.
- Van der Hulle T, Cheung WY, Kooij S, Beenen LFM, Van Bemmel T, Van Es J, et al. YEARS study group. Simplified diagnostic management of suspected pulmonary embolism (the YEARS study): a prospective, multicentre, cohort study. Lancet 2017;390:289-97.
- Van Belle A, Buller HR, Huisman MV, Huisman PM, Kaasjager K, Kamphuisen PW, et al. Effectiveness of managing suspected pulmonary embolism using an algorithm combining clinical probability, D-dimer testing, and computed tomography. JAMA 2006;295:172-9.
- Goekoop RJ, Steeghs N, Niessen RW, Jonkers GJ, Dik H, Castel A, et al. Simple and safe exclusion of pulmonary embolism in outpatiënts using quantitative D-dimer and Wells’ simplified decision rule. Thromb Haemost 2007;97:146-50.
- Perrier A, Roy PM, Sanchez O, Le GG, Meyer G, Gourdier AL, et al. Multidetector-row computed tomography in suspected pulmonary embolism. N Engl J Med 2005;352:1760-8.
- Van Beek EJ, Brouwerst EM, Song B, Stein PD, Oudkerk M. Clinical validity of a normal pulmonary angiogram in patients with suspected pulmonary embolism-a critical review. Clin Radiol 2001;56:838-42.
- Heerink JS, Gemen E, Oudega R, Hopstaken R, Geersing GJ, Kusters R. Analytical performance and user-friendliness of five novel point-of-care d-dimer assays. Scand J Clin Lab Invest 2020;80:433-440.
- Hendriksen JM, Geersing GJ, Van Voorthuizen SC, Oudega R, Ten Cate-Hoek AJ, Joore MA, et al. The cost-effectiveness of point-of-care d-dimer tests compared with a laboratory test to rule out deep venous thrombosis in primary care. Expert Rev Mol Diagn 2015b;15:125-36.
- Schwarz T, Schmidt B, Schmidt B, Schellong SM. Interobserver agreement of complete compression ultrasound for clinically suspected deep vein thrombosis. Clin Appl Thromb Hemost 2002;8:45-9.
- Goodacre S, Sampson F, Thomas S, Van Beek E, Sutton A. Systematic review and meta-analysis of the diagnostic accuracy of ultrasonography for deep vein thrombosis. BMC Med Imaging 2005b;5:6.
- Johnson SA, Stevens SM, Woller SC, Lake E, Donadini M, Cheng J, et al. Risk of deep vein thrombosis following a single negative whole-leg compression ultrasound: a systematic review and meta-analysis. JAMA 2010;303:438-45.
- Bernardi E, Camporese G, Buller HR, Siragusa S, Imberti D, Berchio A, et al. Serial 2-point ultrasonography plus D-dimer vs whole-leg color-coded Doppler ultrasonography for diagnosing suspected symptomatic deep vein thrombosis: a randomized controlled trial. JAMA 2008;300:1653-9.
- Gibson NS, Schellong SM, Kheir DY, Beyer-Westendorf J, Gallus AS, McRae S, et al. Safety and sensitivity of two ultrasound strategies in patiënts with clinically suspected deep venous thrombosis: a prospective management study. J Thromb Haemost 2009;7:2035-41.
- Kearon C, Ginsberg JS, Hirsh J. The role of venous ultrasonography in the diagnosis of suspected deep venous thrombosis and pulmonary embolism. Ann Intern Med 1998;129:1044-9.
- De Martino RR, Wallaert JB, Rossi AP, Zbehlik AJ, Suckow B, Walsh DB. A meta-analysis of anticoagulation for calf deep venous thrombosis. J Vasc Surg 2012;56:228-37.
- Boutitie F, Pinede L, Schulman S, Agnelli G, Raskob G, Julian J, et al. Influence of preceding length of anticoagulant treatment and initial presentation of venous thromboembolism on risk of recurrence after stopping treatment: analysis of individual participants’ data from seven trials. BMJ 2011;342:d3036.
- Aissaoui N, Martins E, Mouly S, Weber S, Meune C. A meta-analysis of bed rest versus early ambulation in the management of pulmonary embolism, deep vein thrombosis, or both. Int J Cardiol 2009;137:37-41.
- Trujillo-Santos J, Perea-Milla E, Jimenez-Puente A, Sanchez-Cantalejo E, Del Toro J, Grau E, et al. Bed rest or ambulation in the initial treatment of patiënts with acute deep vein thrombosis or pulmonary embolism: findings from the RIETE registry. Chest 2005;127:1631-6.
- Anderson CM, Overend TJ, Godwin J, Sealy C, Sunderji A. Ambulation after deep vein thrombosis: a systematic review. Physiother Can 2009;61:133-40.
- Lam Y, Rook B, Jansma I, Kruip M, Van Rijn MJ, Van Montfrans C. Nut van compressietherapie na diepe veneuze trombose. Ned Tijdschr Geneeskd 2020;164.
- Ten Cate-Hoek AJ, Amin EE, Bouman AC, Meijer K, Tick LW, Middeldorp S, et al. IDEAL DVT investigators. Individualised versus standard duration of elastic compression therapy for prevention of post-thrombotic syndrome (IDEAL DVT): a multicentre, randomised, single-blind, allocation-concealed, non-inferiority trial. Lancet Haematol 2018;5:e25-e33.
- Appelen D, Van Loo E, Prins MH, Neumann MH, Kolbach DN. Compression therapy for prevention of post-thrombotic syndrome. Cochrane Database Syst Rev 2017:CD004174.
- Roumen-Klappe EM, Den Heijer M, Van Rossum J, Wollersheim H, Van der Vleuten C, Thien T, et al. Multilayer compression bandaging in the acute phase of deep-vein thrombosis has no effect on the development of the post-thrombotic syndrome. J Thromb Thrombolysis 2009;27:400-5.
- Berntsen CF, Kristiansen A, Akl EA, Sandset PM, Jacobsen EM, Guyatt G, et al. Compression stockings for preventing the postthrombotic syndrome in patients with deep vein thrombosis. Am J Med 2016;129:447.
- Yang X, Zhang X, Yin M, Wang R, Lu X, Ye K. Elastic compression stockings to prevent post-thrombotic syndrome in proximal deep venous thrombosis patients without thrombus removal. J Vasc Surg Venous Lymphat Disord 2022;10:293-9.
- Mol GC, Van de Ree MA, Klok FA, Tegelberg MJ, Sanders FB, Koppen S, et al. One versus two years of elastic compression stockings for prevention of post-thrombotic syndrome (OCTAVIA study): randomised controlled trial. BMJ 2016;353:i2691.
- RIVM. Medicijnresten en waterkwaliteit: een update. Rijksinstituut voor Volksgezondheid en Milieu (2020).
- De Athayde Soares R, Matielo MF, Brochado Neto FC, Nogueira MP, Almeida RD, Sacilotto R. Comparison of the recanalization rate and postthrombotic syndrome in patients with deep venous thrombosis treated with rivaroxaban or warfarin. Surgery 2019;166:1076-1083.
- Farhan A, Bukhari M, Umar J, Raza MA. Oral rivaroxaban in symptomatic deep vein thrombosis. J Coll Physicians Surg Pak 2019;29:814-8.
- Agnelli G, Buller HR, Cohen A, Curto M, Gallus AS, Johnson M, et al. AMPLIFY-EXT Investigators. Apixaban for extended treatment of venous thromboembolism. N Engl J Med 2013;368:699-708.
- Buller H, Deitchman D, Prins M, Segers A. Botticelli Investigators, Writing Committee. Efficacy and safety of the oral direct factor Xa inhibitor apixaban for symptomatic deep vein thrombosis. The Botticelli DVT dose-ranging study. J Thromb Haemost. 2008;6(8):1313-8.
- Bauersachs R, Berkowitz SD, Brenner B, Buller HR, Decousus H, Gallus AS, et al. EINSTEIN Investigators. Oral rivaroxaban for symptomatic venous thromboembolism. N Engl J Med 2010;363:2499-510.
- Büller HR, Prins MH, Lensin AW, Decousus H, Jacobson BF, Minar E, et al. EINSTEIN–PE Investigators. Oral rivaroxaban for the treatment of symptomatic pulmonary embolism. N Engl J Med 2012;366:1287-97.
- Yamada N, Hirayama A, Maeda H, Sakagami S, Shikata H, Prins MH, et al. Oral rivaroxaban for Japanese patients with symptomatic venous thromboembolism – the J-EINSTEIN DVT and PE program. Thromb J 2015;13:2. Erratum in: Thromb J 2016;14:11.
- Büller HR, Décousus H, Grosso MA, Mercuri M, Middeldorp S, et al. Hokusai-VTE Investigators. Edoxaban versus warfarin for the treatment of symptomatic venous thromboembolism. N Engl J Med 2013;369:1406-15. Erratum in: N Engl J Med 2014 23;370:390.
- Piazza G, Mani V, Goldhaber SZ, Grosso MA, Mercuri M, Lanz HJ, et al. Edoxaban Thrombus Reduction Imaging Study (eTRIS) Investigators. Magnetic resonance venography to assess thrombus resolution with edoxaban monotherapy versus parenteral anticoagulation/warfarin for symptomatic deep vein thrombosis: a multicenter feasibility study. Vasc Med 2016;21:361-8.
- Schulman S, Kearon C, Kakkar AK, Mismetti P, Schellong S, Eriksson H, et al. RE-COVER Study Group. Dabigatran versus warfarin in the treatment of acute venous thromboembolism. N Engl J Med. 2009;361:2342-52.
- Schulman S, Kakkar AK, Goldhaber SZ, Schellong S, Eriksson H, Mismetti P, et al. RE-COVER II Trial Investigators. Treatment of acute venous thromboembolism with dabigatran or warfarin and pooled analysis. Circulation 2014;129:764-72.
- Middelburg RA. Is apixaban effectiever en veiliger dan rivaroxaban? Resultaten van twee grote new-user-cohorten. GeBu 2022;56:45-9.
- Dawwas GK, Leonard CE, Lewis JD, Cuker A. Risk for recurrent venous thromboembolism and bleeding with apixaban compared with rivaroxaban: an analysis of real-world data. Ann Intern Med 2022;175:20-8.
- Hirsh J, Raschke R. Heparin and low-molecular-weight heparin: the Seventh ACCP Conference on Antithrombotic and Thrombolytic Therapy. Chest 2004;126:188S-203S.
- Erkens PM, Prins MH. Fixed dose subcutaneous low molecular weight heparins versus adjusted dose unfractionated heparin for venous thromboembolism. Cochrane Database Syst Rev 2010:CD001100.
- Van den Belt AG, Prins MH, Lensing AW, Castro AA, Clark OA, Atallah AN, et al. Fixed dose subcutaneous low molecular weight heparins versus adjusted dose unfractionated heparin for venous thromboembolism. Cochrane Database Syst Rev 2000:CD001100.
- White RH, Ginsberg JS. Low-molecular-weight heparins: are they all the same? Br J Haematol 2003;121:12-20.
- Bhutia S, Wong PF. Once versus twice daily low molecular weight heparin for the initial treatment of venous thromboembolism. Cochrane Database Syst Rev 2013;7:CD003074.
- Brandjes DP, Heijboer H, Buller HR, De Rijk M, Jagt H, Ten Cate JW. Acenocoumarol and heparin compared with acenocoumarol alone in the initial treatment of proximal-vein thrombosis. N Engl J Med 1992;327:1485-9.
- Hutten BA, Prins MH. Duration of treatment with vitamin K antagonists in symptomatic venous thromboembolism. Cochrane Database Syst Rev 2006:CD001367.
- Campbell IA, Bentley DP, Prescott RJ, Routledge PA, Shetty HG, Williamson IJ. Anticoagulation for three versus six months in patiënts with deep vein thrombosis or pulmonary embolism, or both: randomised trial. BMJ 2007;334:674.
- Schulman S, Lockner D, Juhlin-Dannfelt A. The duration of oral anticoagulation after deep vein thrombosis. A randomized study. Acta Med Scand 1985;217:547-52.
- Pinede L, Ninet J, Duhaut P, Chabaud S, Demolombe-Rague S, Durieu I, et al; investigators of the ‘Durée Optimale du Traitement AntiVitamines K’ (DOTAVK) Study. Comparison of 3 and 6 months of oral anticoagulant therapy after a first episode of proximal deep vein thrombosis or pulmonary embolism and comparison of 6 and 12 weeks of therapy after isolated calf deep vein thrombosis. Circulation 2001;103:2453-60.
- Agnelli G, Prandoni P, Becattini C, Silingardi M, Taliani MR, Miccio M, et al. Warfarin optimal duration italian trial investigators. Extended oral anticoagulant therapy after a first episode of pulmonary embolism. Ann Intern Med 2003;139:19-25.
- Khan F, Rahman A, Carrier M, Kearon C, Weitz JI, Schulman S, et al. MARVELOUS Collaborators. Long term risk of symptomatic recurrent venous thromboembolism after discontinuation of anticoagulant treatment for first unprovoked venous thromboembolism event: systematic review and meta-analysis. BMJ 2019;366:l4363.
- Van der Hulle T, Kooiman J, Den Exter PL, Dekkers OM, Klok FA, Huisman MV. Effectiveness and safety of novel oral anticoagulants as compared with vitamin K antagonists in the treatment of acute symptomatic venous thromboembolism: a systematic review and meta-analysis. J Thromb Haemost 2014;12:320-8.
- Khan F, Tritschler T, Kimpton M, Wells PS, Kearon C, Weitz JI, et al. MAJESTIC Collaborators. Long-Term risk for major bleeding during extended oral anticoagulant therapy for first unprovoked venous thromboembolism: a systematic review and meta-analysis. Ann Intern Med 2021b;174:1420-9.
- Becattini C, Agnelli G, Schenone A, Eichinger S, Bucherini E, Silingardi M, et al. Aspirin for preventing the recurrence of venous thromboembolism. N Engl J Med 2012;366:1959-67.
- Brighton TA, Eikelboom JW, Mann K, Mister R, Gallus A, Ockelford P, et al. Low-dose aspirin for preventing recurrent venous thromboembolism. N Engl J Med 2012;367:1979-87.
- Mahmoodi BK, Brouwer JL, Ten Kate MK, Lijfering WM, Veeger NJ, Mulder AB, et al. A prospective cohort study on the absolute risks of venous thromboembolism and predictive value of screening asymptomatic relatives of patiënts with hereditary deficiencies of protein S, protein C or antithrombin. J Thromb Haemost 2010;8:1193-200.
- Middeldorp S. Is thrombophilia testing useful? Hematology Am Soc Hematol Educ Program 2011a;2011:150-5.
- Middeldorp S. Evidence-based approach to thrombophilia testing. J Thromb Thrombolysis 2011b;31:275-81.
- Segal JB, Brotman DJ, Necochea AJ, Emadi A, Samal L, Wilson LM, et al. Predictive value of factor V Leiden and prothrombin G20210A in adults with venous thromboembolism and in family members of those with a mutation: a systematic review. JAMA 2009;301:2472-85.
- Christiansen SC, Cannegieter SC, Koster T, Vandenbroucke JP, Rosendaal FR. Thrombophilia, clinical factors, and recurrent venous thrombotic events. JAMA 2005;293:2352-61.
- Coppens M, Reijnders JH, Middeldorp S, Doggen CJ, Rosendaal FR. Testing for inherited thrombophilia does not reduce the recurrence of venous thrombosis. J Thromb Haemost 2008;6:1474-7.
- Baron JA, Gridley G, Weiderpass E, Nyren O, Linet M. Venous thromboembolism and cancer. Lancet 1998;351:1077-80.
- Oudega R, Moons KG, Karel NH, Van Nierop FL, Hoes AW. Deep vein thrombosis in primary care: possible malignancy? Br J Gen Pract 2006;56:693-6.
- Piccioli A, Lensing AW, Prins MH, Falanga A, Scannapieco GL, Ieran M, et al. Extensive screening for occult malignant disease in idiopathic venous thromboembolism: a prospective randomized clinical trial. J Thromb Haemost 2004;2:884-9.
- Van Doormaal FF, Terpstra W, Van Der Griend R, Prins MH, Nijziel MR, Van De Ree MA, et al. Is extensive screening for cancer in idiopathic venous thromboembolism warranted? J Thromb Haemost 2011;9:79-84
- Carrier M, Le Gal G, Wells PS, Fergusson D, Ramsay T, Rodger MA. Systematic review: the Trousseau syndrome revisited: should we screen extensively for cancer in patiënts with venous thromboembolism? Ann Intern Med 2008;149:323-33.
- Clarke M, Hopewell S, Juszczak E, Eisinga A, Kjeldstrom M. Compression stockings for preventing deep vein thrombosis in airline passengers. Cochrane Database Syst Rev 2010:CD004002.
- Kahn SR, Lim W, Dunn AS, Cushman M, Dentali F, Akl EA, et al. Prevention of VTE in nonsurgical patiënts: Antithrombotic Therapy and Prevention of Thrombosis, 9th ed: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines. Chest 2012;141:e195S-e226S.
- Hsieh HF, Lee FP. Graduated compression stockings as prophylaxis for flight-related venous thrombosis: systematic literature review. J Adv Nurs 2005;51:83-98.
- Cesarone MR, Belcaro G, Nicolaides AN, Incandela L, De Sanctis MT, Geroulakos G, et al. Venous thrombosis from air travel: the LONFLIT3 study--prevention with aspirin vs low-molecular-weight heparin (LMWH) in high-risk subjects: a randomized trial. Angiology 2002;53:1-6.
- Soosainathan A, Moore HM, Gohel MS, Davies AH. Scoring systems for the post-thrombotic syndrome. J Vasc Surg 2013;57:254-61.
- Kahn SR, Partsch H, Vedantham S, Prandoni P, Kearon C. Definition of post-thrombotic syndrome of the leg for use in clinical investigations: a recommendation for standardization. J Thromb Haemost 2009;7:879-83.
- Di Minno MND, Ambrosino P, Ambrosini F, Tremoli E, Di Minno G, Dentali F. Prevalence of deep vein thrombosis and pulmonary embolism in patients with superficial vein thrombosis: a systematic review and meta-analysis. J Thromb Haemost 2016; 14: 964-72.
- Geersing GJ, Cazemier S, Rutten F, Fitzmaurice DA, Hoes AW. Incidence of superficial venous thrombosis in primary care and risk of subsequent venous thromboembolic sequelae: a retrospective cohort study performed with routine healthcare data from the Netherlands. BMJ Open 2018;8:e019967.
- Leon L, Giannoukas AD, Dodd D, Chan P, Labropoulos N. Clinical significance of superficial vein thrombosis. Eur J Vasc Endovasc Surg 2005:10-7.
- Stevens SM, Woller SC, Kreuziger LB, Bounameaux H, Doerschug K, Geersing GJ, et al. Antithrombotic therapy for VTE Disease: second update of the CHEST guideline and expert panel report. Chest 2021;160:e545-e608. Erratum in: Chest 2022;162:269.
- Di Nisio M, Wichers IM, Middeldorp S. Treatment for superficial thrombophlebitis of the leg. Cochrane Database Syst Rev 2018:CD004982.
- Kearon C, Carrier M, Gu CS, Schulman S, Bates SM, Kahn SR, et al. Rivaroxaban compared to placebo for the treatment of leg superficial vein thrombosis: a randomized trial. Semin Thromb Hemost 2020;46:977-985.
- Stenox Group (Superficial Thrombophlebitis Treated By Enoxaparin Study Group). A pilot randomized double-blind comparison of a low-molecular-weight heparin, a nonsteroidal anti-inflammatory agent, and placebo in the treatment of superficial vein thrombosis. Arch Intern Med 2003;163:1657-63.
- Decousus H, Prandoni P, Mismetti P, Bauersachs RM, Boda Z, Brenner B, et al. Fondaparinux for the treatment of superficial-vein thrombosis in the legs. N Engl J Med 2010;363:1222-32.
- Beyer-Westendorf J, Schellong SM, Gerlach H, Rabe E, Weitz JI, Jersemann K, et al. SURPRISE investigators. Prevention of thromboembolic complications in patients with superficial-vein thrombosis given rivaroxaban or fondaparinux: the open-label, randomised, non-inferiority SURPRISE phase 3b trial. Lancet Haematol 2017;4:e105-e113.
- Nocker W, Diebschlag W, Lehmacher W. Lokaltherapie bei oberflächlicher Thrombophlebitis. Wirksamkeit eines Diclofenac-Natrium-Gels im Vergleich zu Placebo- und Heparin-Gel. Zeitschrift fur Allgemeinmedizin 1991;67:2214-22.
- Aschwanden M, Jeanneret C, Koller MT, Thalhammer C, Bucher HC, Jaeger KA. Effect of prolonged treatment with compression stockings to prevent post-thrombotic sequelae: a randomized controlled trial. J Vasc Surg 2008;47:1015-21.
- Kahn SR, Shapiro S, Ducruet T, Wells PS, Rodger MA, Kovacs MJ, et al. Graduated compression stockings to treat acute leg pain associated with proximal DVT. A randomised controlled trial. Thromb Haemost 2014;112:1137-41.
- Pharmaceutical Industry Association's Service AB Fass: www.fass.se, geraadpleegd op 29 april 2022.
- Stein PD, Hull RD, Patel KC, Olson RE, Ghali WA, Brant R, et al. D-dimer for the exclusion of acute venous thrombosis and pulmonary embolism: a systematic review. Ann Intern Med 2004;140:589-602.