Atriumfibrilleren
Richtlijnen diagnostiek
Naar Volledige tekst ›Anamnese
Naar Volledige tekst ›- Vraag naar:
- hartkloppingen: duur, continu of in aanvallen, ontstaan en stoppen (plotseling of geleidelijk)
- bij aanvallen: frequentie, duur, regelmatig of onregelmatig
- uitlokkende factoren zoals koorts, lichamelijke inspanning, alcohol, medicatie, drugs
- bijkomende klachten: zoals duizeligheid, wegrakingen of kortademigheid
- klachten die wijzen op trombo-embolische complicaties (TIA of herseninfarct)
- Inventariseer:
- comorbiditeit zoals herseninfarct, hersenbloeding, hartkleplijden, hypertensie, angina pectoris, myocardinfarct, hartfalen, aangeboren hartaandoening, diabetes mellitus, hyperthyreoïdie, COPD, slaapapneu.
- medicijngebruik (bèta-2-sympathicomimetica, levothyroxine, corticosteroïden)
Lichamelijk onderzoek
Naar Volledige tekst ›- Bloeddruk en pols (ritme en frequentie)
- bepaal het hartritme laagdrempelig bij aspecifieke klachten, vooral bij patiënten > 75 jaar
- Auscultatie hart
- Let op klinische tekenen van overvulling (zie NHG-Standaard Hartfalen)
- Doe verder onderzoek bij aanwijzingen voor een onderliggende oorzaak, uitlokkende factoren of trombo-embolische complicaties
Aanvullend onderzoek
Naar Volledige tekst ›- Bij vermoeden atriumfibrilleren: ecg of ritmestrook (≥ 30 seconden)
- Bij vermoeden paroxismaal atriumfibrilleren: holterregistratie (bij ≥ 1 aanval per 24 uur) of eventrecorder (bij minder frequente aanvallen)
- Laboratoriumonderzoek:
- glucose, Hb, TSH, lipidenspectrum
- eGFR, creatinine, kalium
- Echocardiografie:
- eenmalig met de vraagstelling hartfalen en/of kleplijden
- overweeg bij kwetsbare of ernstig zieke patiënten om echocardiografie achterwege te laten
Evaluatie
Naar Volledige tekst ›- Stel de diagnose ‘atriumfibrilleren’ op grond van de uitslag van een ecg, holterregistratie of eventrecorder en maak onderscheid in duur (< 24 uur of > 24 uur)
- Ga na of er beïnvloedbare risicofactoren zijn, zoals hypertensie, hartfalen, diabetes mellitus, obesitas, slaapapneu, alcoholgebruik, hartkleplijden
Richtlijnen beleid
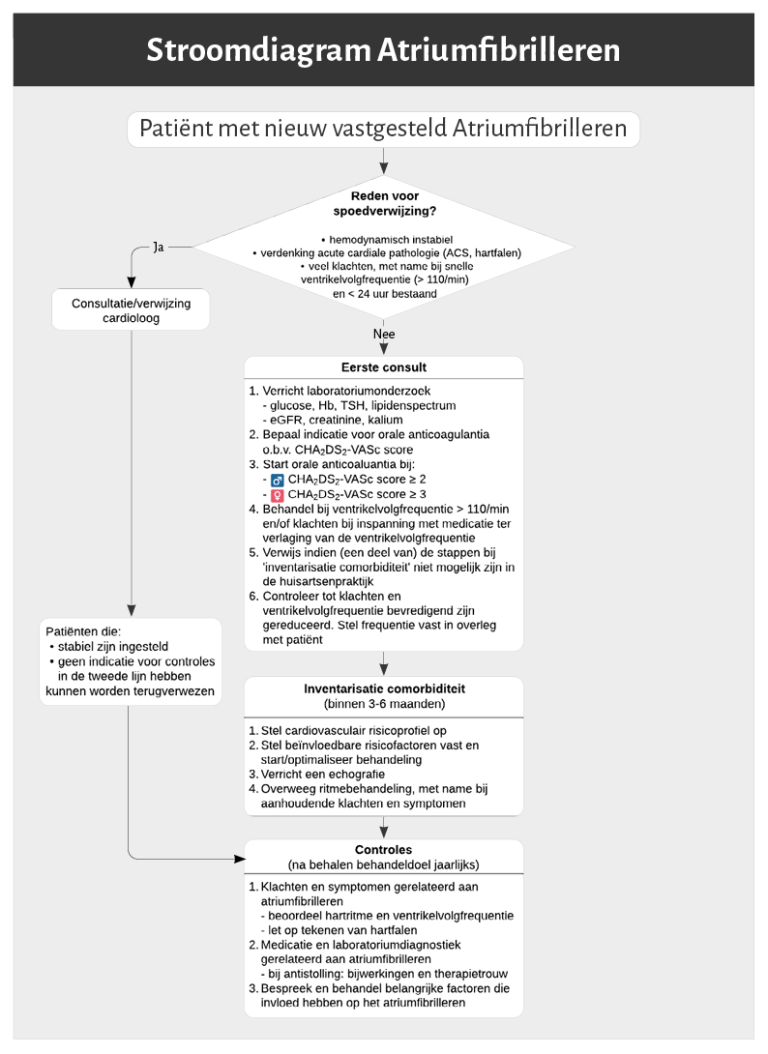
Naar Volledige tekst ›Zie stroomschema 1 voor een overzicht van het beleid
Eerste overwegingen na vaststellen nieuw atriumfibrilleren
Naar Volledige tekst ›Consulteer of verwijs naar de cardioloog bij een patiënt met veel klachten, met name bij een snelle ventrikelvolgfrequentie (> 110/min) en < 24 uur bestaand atriumfibrilleren.
Voorlichting
Naar Volledige tekst ›- Geef uitleg over de aandoening en het te verwachten beloop
- Leg uit dat atriumfibrilleren vaak een uiting is van andere hart- en vaatziekten
- Bespreek het belang van antistolling, de indicatie is afhankelijk van overige risicofactoren voor een herseninfarct.
- Leg uit dat medicijnen ter vertraging van de hartslag zinvol zijn bij een snelle hartslag
- Leg uit wat de verschijnselen zijn van een TIA en een herseninfarct, en instrueer de patiënt bij zulke verschijnselen direct contact op te nemen
Niet-medicamenteuze behandeling
Naar Volledige tekst ›- Bespreek het belang van een gezonde leefstijl
- Adviseer bij een BMI ≥ 25 om voldoende te bewegen en op gezonde wijze af te vallen
- Zie (ook voor overige leefstijladviezen) de Praktijkhandleiding Leefstijl.
Medicamenteuze behandeling
Naar Volledige tekst ›Preventie van trombo-embolie met orale anticoagulantia
Naar Volledige tekst ›- Schat bij (paroxismaal) atriumfibrilleren het risico op een herseninfarct in met de CHA2DS2-VASc-score (zie tabel 1).
- Behandel met orale anticoagulantia :
- vrouwen met CHA2DS2-VASc-score ≥ 3
- mannen met CHA2DS2-VASc-score ≥ 2
- Start met een DOAC, tenzij er goede redenen zijn voor een VKA
- Kies bij kwetsbare ouderen voor een DOAC of een VKA (zie tabel 2).
- Bespreek mogelijke bijwerkingen en schrijf zo nodig maagbescherming voor (zie NHG-Behandelrichtlijn Preventie van maagcomplicaties door geneesmiddelgebruik).
Aandachtspunten bij orale anticoagulantia
Aandachtspunten zijn bloedingen, interacties, nierfunctie en intercurrente ziekten.
DOAC’s
- Er is geen voorkeur voor een bepaalde DOAC.
- Er zijn verschillende redenen om voor een bepaalde DOAC te kiezen (zie tabel 3).
- Pas bij verminderde nierfunctie zo nodig de dosering aan.
VKA’s
- Start met een oplaaddosis acenocoumarol of fenprocoumon (zie tabel 4).
- De INR-streefwaarde is 2,5 (therapeutische breedte 2,0-3,0).
- Informeer de trombosedienst over de nierfunctie en de bestaande (relatieve) contra-indicaties.
Verlaging van de ventrikelvolgfrequentie
Naar Volledige tekst ›- Bij ventrikelvolgfrequentie ≥ 110/min in rust en/of klachten bij inspanning, zie tabel 5.
- Voor een overzicht van het beleid, zie stroomschema 2.
- Bij patiënten zonder klinische tekenen van overvulling wijzend op hartfalen:
- eerste keus bètablokker (bij contra-indicatie calciumantagonist)
- voeg digoxine toe als de ventrikelvolgfrequentie onvoldoende daalt bij maximale dosering van bètablokker of calciumantagonist
- Bij patiënten met klinische tekenen van overvulling wijzend op hartfalen: digoxine.
- Verhoog de dosering stapsgewijs op geleide van klachten en ventrikelvolgfrequentie, bijvoorbeeld elke 1-2 weken.
Controles
Naar Volledige tekst ›- Controleer tot de klachten en ventrikelvolgfrequentie voor de patiënt acceptabel zijn.
- Stel de frequentie van de controles vast in overleg met de patiënt.
- Controleer jaarlijks na behalen behandeldoel:
- beoordeel hartritme en ventrikelvolgfrequentie
- ga na of er tekenen zijn van hartfalen
- bij DOAC’s: eGFR, creatinine; controleer vaker bij reeds verminderde of verder afnemende nierfunctie
- bij geen gebruik van antistolling: bepaal met de CHA2DS2-VASc-score of er een indicatie is voor antistolling
- bij digoxine: eGFR, creatinine en kalium
- behandel beïnvloedbare risicofactoren
- bij cardiovasculaire comorbiditeit: zie NHG-Standaard Cardiovasculair risicomanagement)
Consultatie en verwijzing
Naar Volledige tekst ›Direct overleg met de cardioloog
Bij een patiënt met nieuw atriumfibrilleren dat < 24 uur bestaat en veel klachten door een snelle ventrikelvolgfrequentie (> 110/min).
Overige verwijsindicaties
- Indien bij het eerste consult of bij een vervolgconsult ≥ 1 onderdeel van het beleid (zie stroomschema 1) niet kan worden uitgevoerd in de huisartsenpraktijk.
- Indien een ritmebehandeling wordt overwogen.
- Verhoogd risico op een herseninfarct bij een absolute contra-indicatie voor orale anticoagulantia.
- Ventrikelvolgfrequentie < 50/min (niet veroorzaakt door medicatie)
- Onvoldoende daling van de ventrikelvolgfrequentie ondanks gebruik van 2 frequentieverlagende middelen
- Patiënt met paroxismaal atriumfibrilleren die behandeling wenst ter vermindering van het aantal aanvallen
Belangrijkste wijzigingen
Naar Samenvatting ›- Toegevoegd is het advies om laagdrempelig het hartritme te bepalen door palpatie van de pols bij patiënten met aspecifieke klachten (bijvoorbeeld malaise, duizeligheid of kortademigheid bij inspanning), in het bijzonder bij patiënten ≥ 75 jaar.
- Bepaal niet meer het (NT-pro)BNP bij patiënten met atriumfibrilleren om hartfalen uit te sluiten, maar verricht een echocardiografie.
- Bij nieuwe patiënten met atriumfibrilleren met een indicatie voor orale anticoagulantia gaat voortaan de voorkeur uit naar een DOAC.
- De leeftijdsgrens om patiënten < 65 jaar te verwijzen en daarboven alleen op indicatie te verwijzen is komen te vervallen.
Kernboodschappen
Naar Samenvatting ›- Atriumfibrilleren is vaak een uiting van andere (cardiovasculaire) problematiek en moet niet worden gezien als een geïsoleerde aandoening.
- Bepaal het hartritme door palpatie van de pols bij iedere patiënt bij wie de bloeddruk gemeten wordt, ook in afwezigheid van klachten.
- De diagnose ‘atriumfibrilleren’ wordt gesteld op basis van een 12-kanaals-elektrocardiogram (ecg) of 1-kanaals-ecg van minimaal 30 seconden.
- Atriumfibrilleren verhoogt het risico op een trombo-embolie, vooral een herseninfarct. Het absolute risico neemt toe bij het stijgen van de leeftijd. Bepaal dit risico op basis van de CHA2DS2-VASc-score.
- De behandeling bestaat uit 3 onderdelen: preventie van trombo-embolie, behandeling van symptomen en behandeling van onderliggende comorbiditeit.
- Bij vrijwel alle patiënten > 65 jaar met atriumfibrilleren zijn orale anticoagulantia geïndiceerd. Dit geldt ook voor kwetsbare ouderen.
- Trombocytenaggregatieremmers zijn niet zinvol bij patiënten met atriumfibrilleren.
Inleiding
Naar Samenvatting ›Scope
Naar Samenvatting ›Deze NHG-Standaard geeft richtlijnen voor diagnostiek en beleid bij (een vermoeden van) atriumfibrilleren.
Buiten de scope
Naar Samenvatting ›- Diagnostiek en beleid bij patiënten met andere ritmestoornissen (zoals atriumflutter) vinden plaats bij de cardioloog.
- Voor de secundaire preventie van hart- en vaatziekten zie NHG-Standaard Cardiovasculair risicomanagement.
Achtergronden
Naar Samenvatting ›Begrippen
Naar Samenvatting ›Atriumfibrilleren
Naar Samenvatting ›Hartritmestoornis waarbij het ritme volledig onregelmatig en meestal versneld is, met als gevolg ineffectieve atriale contracties. Atriumfibrilleren kan verschillende klachten veroorzaken, maar klachten kunnen ook ontbreken. De diagnose ‘atriumfibrilleren’ wordt gesteld op basis van een 12-kanaals-ecg of 1-kanaals-ecg van ≥ 30 seconden. Op basis van presentatie, duur en spontane beëindiging van de aanvallen wordt het volgende onderscheid gemaakt.
- Eerste aanval: de diagnose wordt voor het eerst gesteld, onafhankelijk van de duur, aanwezigheid en ernst van atriumfibrillerengerelateerde klachten.
- Paroxismaal: aanval van atriumfibrilleren die ≤ 7 dagen eindigt, spontaan of door een interventie (farmacologische of elektrische cardioversie).
- Persisterend: > 7 dagen continu aanwezig atriumfibrilleren; als het atriumfibrilleren > 12 maanden aanwezig is op het moment dat ritmecontrole wordt overwogen, spreekt men van langdurig persisterend atriumfibrilleren.
- Permanent: > 7 dagen continu aanwezig atriumfibrilleren dat wordt geaccepteerd door patiënt, huisarts en/of cardioloog en waarbij niet langer gestreefd wordt naar sinusritme.
Bovenstaande termen worden regelmatig gebruikt in de communicatie tussen cardiologen en huisartsen. Over het algemeen is atriumfibrilleren progressief. Bij een groot deel van de huisartspatiënten is sprake van permanent atriumfibrilleren en is het beleid gericht op acceptatie van de ritmestoornis. Bij patiënten met paroxismaal of (langdurig) persisterend atriumfibrilleren kan ritmecontrole nog worden overwogen.
De werkgroep sluit aan bij de indeling uit de Nederlandse en Europese richtlijnen over atriumfibrilleren voor cardiologen. Dit bevordert de communicatie tussen huisartsen en cardiologen. Hoewel het onderscheid tussen ‘(langdurig) persisterend’ en ‘permanent’ voor huisartsen geen directe therapeutische consequenties heeft, is deze differentiatie voor cardiologen wel van belang, omdat zij (vooral bij relatief jonge patiënten) vaker interventies zoals cardioversie en ablatie uitvoeren om weer sinusritme te bereiken.
De vroeger gebruikte term lone atrial fibrillation is verlaten. Volgens de huidige inzichten over de pathofysiologie van atriumfibrilleren is er bij elke patiënt met atriumfibrilleren een onderliggende oorzaak aanwezig.
Orale anticoagulantia
Naar Samenvatting ›- Directe orale anticoagulantia (DOAC’s):
- trombineremmers: dabigatran
- directe factor Xa-remmers: apixaban, edoxaban en rivaroxaban
- Vitamine K-antagonisten (VKA’s): acenocoumarol en fenprocoumon
Epidemiologie
Naar Samenvatting ›Incidentie en prevalentie
Naar Samenvatting ›- Atriumfibrilleren is de meest voorkomende hartritmestoornis bij volwassenen.
- De prevalentie in de totale populatie is 1,4%, oplopend van < 0,1% in de leeftijd 25-45 jaar tot bijna 16% bij ≥ 85 jaar. Ruim de helft van de patiënten met atriumfibrilleren is ≥ 75 jaar.
- De prevalentie zal naar verwachting stijgen door de toenemende levensverwachting en een toenemend aantal patiënten met risicofactoren (zie Risicofactoren voor atriumfibrilleren), en door effectievere behandeling en opsporing.
- In alle leeftijdsklassen is de prevalentie hoger onder mannen dan onder vrouwen, maar het totaal aantal vrouwen en mannen met atriumfibrilleren is ongeveer gelijk omdat er meer oudere vrouwen zijn.
Atriumfibrilleren is wereldwijd de meest voorkomende blijvende hartritmestoornis bij volwassenen. De wereldwijd geschatte prevalentie van atriumfibrilleren bij volwassenen is 2-4% en zal naar verwachting tot 2060 blijven stijgen vanwege een hogere leeftijdsverwachting, betere opsporing van patiënten met atriumfibrilleren en betere behandeling van patiënten met myocardinfarct of hartfalen.
Om tot Nederlandse prevalentiecijfers te komen heeft het NIVEL het aantal personen geteld dat een ICPC-code voor atriumfibrilleren heeft in het huisartsendossier (zie tabel d1).
|
|
Man |
Vrouw |
Totaal |
|---|---|---|---|
|
0-18 jaar |
0,1 |
0,1 |
0,1 |
|
19-44 jaar |
0,3 |
0,5 |
1,0 |
|
45-64 jaar |
15,6 |
7,2 |
11,4 |
|
65-74 jaar |
67,1 |
39,2 |
52,9 |
|
75-84 jaar |
134,8 |
99,6 |
115,8 |
|
≥ 85 jaar |
197,3 |
169,6 |
179,7 |
|
Bron: Nielen (2021). Cijfers zijn aantallen per 1000 patiëntjaren |
|||
De prevalentie van atriumfibrilleren in de totale Nederlandse bevolking is gestegen van 0,4% in 2008 tot 1,4% in 2017. Daarbij spelen bovengenoemde factoren een rol. Bij mannen is de prevalentie hoger dan bij vrouwen (respectievelijk 1,6% en 1,3% in 2017). Ruim de helft van de patiënten met atriumfibrilleren is ≥ 75 jaar.
In een meta-analyse is gekeken hoe vaak progressie van atriumfibrilleren naar een andere vorm plaatsvindt (bijvoorbeeld van paroxismaal naar persistent). De incidentie van progressie van paroxismaal naar niet-paroxismaal atriumfibrilleren was 7,1 per 100 patiëntjaren follow-up (95%-BI 6,2 tot 8,0).
Mortaliteit en atriumfibrilleren
In 2020 was het aandeel van atriumfibrilleren in de totale sterfte aan hart- en vaatziekten 4,5% (mannen 3,3%, vrouwen 5,6%). In 2020 overleden 602 mannen en 1032 vrouwen aan atriumfibrilleren; de gemiddelde leeftijd bij overlijden was 84 jaar voor mannen en 88 jaar voor vrouwen. Volgens gegevens van het Centraal Bureau voor de Statistiek nam de absolute sterfte aan atriumfibrilleren toe in de periode 1980-2020. De stijging was het sterkst in de leeftijdsgroep ≥ 85 jaar, bij zowel mannen als vrouwen. Mensen met atriumfibrilleren hebben een 3,5 × verhoogd risico op mortaliteit door alle oorzaken vergeleken met mensen zonder atriumfibrilleren.
Comorbiditeit
Naar Samenvatting ›- Atriumfibrilleren is vaak een uiting van andere cardiovasculaire en niet-cardiovasculaire morbiditeit en moet daarom niet worden gezien als een geïsoleerde aandoening.
- De meeste patiënten met atriumfibrilleren hebben comorbiditeit zoals hartfalen, hypertensie, diabetes mellitus, nierfunctiestoornissen of coronaire hartziekten. Deze comorbiditeit bepaalt mede het beleid bij atriumfibrilleren.
Uit data van het Julius Huisartsen Netwerk (JHN) voor de periode van 1 januari 2008 tot en met 31 december 2017 bleek dat van de 3347 patiënten met atriumfibrilleren die antistolling (VKA of DOAC) gebruikten, 62% bekend was met hypertensie, 23% met hartfalen, 26% met diabetes mellitus, 16% met een TIA of beroerte, 27% met coronair of perifeer vaatlijden en 27% met een nierfunctiestoornis. Bij een deel van de patiënten kwamen meerdere van deze aandoeningen tegelijkertijd voor.
Het JHN-netwerk bestaat uit ongeveer 160 huisartsen en verzamelt ten behoeve van wetenschappelijk onderzoek pseudo-anonieme gegevens over de gezondheid van patiënten in de eerste lijn in Utrecht en omgeving. Eerder onderzoek heeft laten zien dat de JHN-populatie wat betreft leeftijd en geslacht vergelijkbaar is met de Nederlandse populatie.
Pathofysiologie
Naar Samenvatting ›Pathofysiologie van atriumfibrilleren
Naar Samenvatting ›- Bij een normaal hartritme depolariseert de sinusknoop het eerst. Het atriumweefsel contraheert op een gecoördineerde manier door de voortgaande depolarisatiegolf vanuit de sinusknoop. Vervolgens wordt de AV-knoop geactiveerd. Via de bundels van His geeft deze de prikkel met vertraging door aan de ventrikels, zodat die zich gecoördineerd kunnen samentrekken.
- Bij atriumfibrilleren zijn in de atria meerdere kringstroompjes aanwezig die door elkaar heen lopen en elkaar uitdoven of versterken. Dit resulteert in zeer snelle, onregelmatige activering van de atria. Er is geen samenhangende contractie; de atria staan functioneel stil. Tegelijkertijd wordt de AV-knoop zeer snel en onregelmatig geactiveerd.
- Hoewel de AV-knoop niet alle prikkels doorgeeft, is de ventrikelvolgfrequentie meestal hoger (100-160/min) dan bij een sinusritme en volledig onregelmatig.
- Door de combinatie van ontbrekende atriumcontractie en snelle en onregelmatige ventrikelcontractie kunnen klachten ontstaan, zoals hartkloppingen, kortademigheid en een verminderde inspanningstolerantie.
Algemeen wordt aangenomen dat er sprake is van een samenspel van factoren die atriumfibrilleren uitlokken en onderhouden. Door factoren zoals fibrose, hypocontractie, vetinfiltratie, ontsteking, verandering van eigenschappen van de kanalen voor ionentransport en van de spiervezels en vasculaire remodelling ontstaan atriale veranderingen. Deze veranderingen geven een hogere kans op ectopie en geleidingsstoornissen, waardoor atriumfibrilleren kan ontstaan, aanhouden en toenemen. Deze veranderingen en het atriumfibrilleren dragen beide bij aan een verhoogde stollingsneiging.
Risicofactoren voor atriumfibrilleren
Naar Samenvatting ›- Het levenslange risico op atriumfibrilleren is afhankelijk van de leeftijd en wordt beïnvloed door genetische en (sub)klinische factoren. Al deze risicofactoren spelen een rol bij het ontstaan en het onderhouden van atriumfibrilleren.
- Niet-beïnvloedbare risicofactoren zijn leeftijd, geslacht, genetische factoren en etniciteit. Bij vrouwen en bij mensen van niet-Europese afkomst zijn de voor leeftijd gecorrigeerde incidentie, prevalentie en het levenslange risico op atriumfibrilleren lager.
- De belangrijkste beïnvloedbare risicofactoren zijn hypertensie, diabetes mellitus, hartfalen, coronaire hartziekte, hartkleplijden, chronische nierziekte en obesitas. Ook overmatig alcoholgebruik, roken en een zittende leefstijl dragen bij aan het ontstaan en in stand houden van atriumfibrilleren.
- Bij een aantal uitlokkende factoren, zoals koorts/acute infectie, hyperthyreoïdie, na een myocardinfarct of na hartchirurgie, gaat het atriumfibrilleren vaak na het wegnemen van de uitlokkende factor spontaan weer over in een normaal sinusritme.
- Medicatie (bèta-2-sympathicomimetica, overdosering levothyroxine, hoge dosering corticosteroïden) en drugs kunnen atriumfibrilleren uitlokken en onderhouden.
Veel verschillende factoren spelen een rol bij het ontstaan en aanhouden van atriumfibrilleren. Het levenslange risico op het ontstaan van atriumfibrilleren neemt toe bij patiënten met meer risicofactoren (23% bij personen zonder risicofactoren, 38% bij personen met > 1 risicofactor).
Demografische factoren
- Leeftijd: Ruim de helft van de patiënten met atriumfibrilleren is ≥ 75 jaar. Zie Incidentie en prevalentie.
- Mannelijk geslacht: Mannen hebben een hogere prevalentie van atriumfibrilleren dan vrouwen (respectievelijk 1,6% en 1,3% in 2017). Zie Incidentie en prevalentie.
- Europese afkomst: mensen van niet-Europese afkomst hebben een lager risico, RR varieert van 0,35 (95%-BI niet gerapporteerd) tot 0,84 (95%-BI 0,82 tot 0,84).
- Lagere sociaaleconomische status: In 6 onderzoeken lagen de betrouwbaarheidsintervallen rond of net onder de 1.
Gezondheidsgedrag
- Roken: 6 uit 13 onderzoeken toonden een verhoogd risico (RR 1,32 (95%-BI 1,19 tot 1,46) tot 2,00 (95%-BI 1,4 tot 2,80)). Bij de overige 7 onderzoeken lag het betrouwbaarheidsinterval rond de 1.
- Alcoholgebruik: de data van de onderzoeken lopen uiteen, 2 uit 10 onderzoeken lieten een verlaagd risico zien (RR 0,65 (95%-BI 0,45 tot 0,94) tot 0,96 (95%-BI 0,93 tot 0,99)) en 3 een verhoogd risico alleen in de groep met het hoogste alcoholgebruik (RR 1,39 (95%-BI 1,22 tot 1,58) tot 2,90 (95%-BI 1,61 tot 5,23)). Bij de overige 5 onderzoeken lag het betrouwbaarheidsinterval rond de 1.
- Lichamelijke inactiviteit: de data van de onderzoeken lopen uiteen, 3 uit 11 onderzoeken lieten een verlaagd risico zien bij toename van lichamelijke activiteit (RR 0,64 (95%-BI 0,52 tot 0,79) tot 0,90 (95%-BI 0,85 tot 0,96)). Bij de overige 8 onderzoeken lag het betrouwbaarheidsinterval rond de 1.
- Duursport: in een systematische review en meta-analyse van 6 case-controlonderzoeken werd een hoger risico op atriumfibrilleren gevonden bij atleten (OR 5,29; 95%-BI 3,57 tot 7,85).
- Of cafeïne invloed heeft op het optreden van atriumfibrilleren is onzeker, mogelijk vermindert het atriumfibrilleren.
Algemene gezondheidsfactoren
- Hypertensie: 13 uit 17 onderzoeken toonden een verhoogd risico (RR 1,28 (95%-BI 1,08 tot 1,51} tot 2,60 (95%-BI 1,60 tot 4,40)). Bij de overige 4 onderzoeken lag het betrouwbaarheidsinterval rond de 1.
- Cholesterol (totaal cholesterol, LDL, HDL, triglyceriden): bij 9 uit 13 onderzoeken lag het betrouwbaarheidsinterval rond de 1. De overige 4 onderzoeken toonden een lager risico bij een hoger totaal cholesterol (RR 0,76 (95%-BI 0,59 tot 0,98) tot 0,94 (95%-BI 0,90 tot 0,97)).
- Diabetes mellitus (en prediabetes): 6 uit 16 onderzoeken toonden een verhoogd risico (RR 1,17 (95%-BI 1,16 tot 1,19) tot 1,80 (95%-BI 1,30 tot 2,60)). Bij de overige 10 onderzoeken lag het betrouwbaarheidsinterval rond de 1.
- Nierinsufficiëntie of nierziekte: 3 uit 11 onderzoeken toonden een verhoogd risico (RR 1,78 (95%-BI 1,49 tot 2,13) tot 3,41 (95%-BI 1,50 tot 7,76). Bij de overige 8 onderzoeken lag het betrouwbaarheidsinterval rond de 1.
- Obesitas (BMI): alle 19 onderzoeken toonden bij een BMI van 25-30 een verhoogd risico (RR 1,04 (95%-BI 1,02 tot 1,05) tot 2,24 (95%-BI 1,41 tot 3,58)).
- Slaapapneu: patiënten met centrale slaapapneu hebben een hoger risico op het ontwikkelen van atriumfibrilleren (OR 3,00; 95%-BI 1,40 tot 6,44).
- COPD en atriumfibrilleren komen vaak samen voor. In een onderzoek werd atriumfibrilleren vastgesteld bij ruim 22% van de patiënten die werden opgenomen vanwege COPD.
Cardiale factoren
- Cardiovasculaire aandoeningen:
- hartfalen (HR 1,4-7,7; 95%-BI niet gerapporteerd).
- kleplijden (HR 2,2-3,4; 95%-BI niet gerapporteerd).
- coronaire hartziekte (HR 1,4-3,6; 95%-BI niet gerapporteerd).
- aangeboren hartaandoening: volwassenen met een aangeboren hartafwijking hebben een hoger risico op atriumfibrilleren.
- Subklinische atherosclerose van de kransslagaders of halsslagaders.
- Hartritmestoornissen:
- verlengd PR-interval
- sick sinus syndrome
- syndroom van Wolff-Parkison-White
Genetische factoren
- Atriumfibrilleren komt in de familie voor
- Korte-QT-syndroom
- Overige.
Inflammatie
- CRP: 4 uit 8 onderzoeken toonden een licht verhoogd risico (RR 1,11 (95%-BI 1,02 tot 1,20) tot 1,24 (95%-BI 1,11 tot 1,40)). Bij de overige 4 onderzoeken lag het betrouwbaarheidsinterval rond de 1.
- Fibrinogeen: 3 uit 6 onderzoeken toonden een verhoogd risico (RR 1,10 (95%-BI 1,02 tot 1,20) tot 2,30 (95%-BI 1,34 tot 3,95)). Bij de overige 3 onderzoeken lag het betrouwbaarheidsinterval rond de 1.
- Schildklieraandoeningen: voor elke afname van 1,0 mU/l van het thyroïdstimulerend hormoon (TSH) of bij een TSH < 0,10-0,45 mU/l toonden 2 uit 8 onderzoeken een verhoogd risico (RR 1,41 (95%-BI 1,25 tot 1,59) tot 3,10 (95%-BI 1,70 tot 5,50)). Bij de overige 6 onderzoeken lag het betrouwbaarheidsinterval rond de 1.
- Bij 8% van de patiënten met hyperthyreoïdie komt atriumfibrilleren of -flutter voor.
- Naar schatting 1-5% van de patiënten met atriumfibrilleren heeft hyperthyreoïdie.
- Adequate behandeling van hyperthyreoïdie leidt bij 60-75% van de patiënten tot conversie naar sinusritme.
- Auto-immuunziekte: alle 3 de onderzoeken toonden een verhoogd risico (RR 1,22 (95%-BI 1,14 tot 1,30) tot 1,53 (95%-BI 1,23 tot 1,91)).
- Overige biomarkers: mogelijk spelen interleukine-6 en TNF-alfa een rol.
Overige risicofactoren
- Psychologische factoren: mogelijk geeft stress een iets hoger risico op het ontstaan van atriumfibrilleren bij vrouwen (HR 1,22; 95%-BI 1,01 tot 1,47).
- Medicatie: bij hoge doseringen corticosteroïden (prednison vanaf 7,5 mg per dag, of een equivalente dosis van een ander glucocorticoïd) is een ongeveer 6 × verhoogd risico op atriumfibrilleren gevonden (Bron: Kennisbank KNMP, geraadpleegd 29-11-2022).
Voorspellers voor trombo-embolische complicaties
Naar Samenvatting ›- Bij paroxismaal atriumfibrilleren of atriumfibrilleren > 48 uur zonder antitrombotische behandeling loopt het risico op een herseninfarct op van < 1% per jaar bij patiënten < 60 jaar zonder voorspellers tot > 12% per jaar bij patiënten ≥ 75 jaar met meerdere voorspellers.
- Veelvoorkomende voorspellers voor een herseninfarct zijn samengevat in de CHA2DS2-VASc score (zie tabel 1). Sterkste voorspellers zijn een eerder doorgemaakt herseninfarct of TIA en leeftijd ≥ 75 jaar.
- Het risico op trombo-embolische complicaties bij patiënten met een behandelindicatie is onafhankelijk van het type atriumfibrilleren (paroxismaal, persisterend of permanent, zie Begrippen).
- Een reumatische klepafwijking (tegenwoordig zeldzaam) bij atriumfibrilleren verhoogt het risico op trombo-embolische complicaties sterk ten opzichte van het risico in de algemene bevolking.
Atriumfibrilleren en risico op beroerte
Uit prospectief onderzoek naar voorspellende factoren van beroerte bleek dat, gecorrigeerd voor leeftijd, bij onbehandelde patiënten met atriumfibrilleren de kans op het krijgen van een beroerte 4,8 × zo groot is als bij patiënten zonder atriumfibrilleren. Het optreden van een beroerte of TIA bij een patiënt met atriumfibrilleren betekent niet automatisch dat een trombo-embolie de oorzaak is. In 2 onderzoeken bij patiënten met een herseninfarct en atriumfibrilleren werd met behulp van echografie vastgesteld dat waarschijnlijk in 70% van de gevallen sprake was van een cardiale embolie.
Het risico op beroerte is niet homogeen, maar afhankelijk van specifieke risicofactoren. Veel van de risicofactoren voor aan atriumfibrilleren gerelateerde complicaties zijn ook risicofactoren voor het optreden van atriumfibrilleren. Patiënten met paroxismaal atriumfibrilleren hebben een even hoog risico als patiënten met persisterend of permanent atriumfibrilleren.
Veelvoorkomende voorspellers voor een beroerte zijn samengevat in de CHA2DS2-VASc-score (zie tabel 1). Sterkste voorspellers zijn eerder doorgemaakte beroerte of TIA en leeftijd ≥ 75 jaar (deze krijgen score 2). Minder sterke voorspellers zijn leeftijd ≥ 65 jaar, hypertensie, vaatlijden (doorgemaakt myocardinfarct, perifeer arterieel vaatlijden), hartfalen, diabetes mellitus en vrouwelijk geslacht (deze krijgen score 1). De maximale score is 9 punten. Het risico op een herseninfarct zonder antitrombotische behandeling loopt op van < 1% per jaar bij patiënten < 60 jaar zonder voorspellende factoren tot > 12% bij patiënten ≥ 75 jaar met meerdere voorspellende factoren.
Risico op een perifere arteriële trombo-embolie
Ook het risico op een perifere trombo-embolie (een trombo-embolie buiten het coronaire of cerebrale arteriële vaatbed) is bij atriumfibrilleren verhoogd, hoewel een perifere trombo-embolie minder frequent voorkomt dan een herseninfarct. Waarschijnlijk komt dit doordat de meeste cerebrale arteriën functionele eindarteriën zijn, terwijl occlusie van andere arteriën niet tot klinische gevolgen leidt door de bescherming van collateralen. In een Deens cohortonderzoek onder 29.862 patiënten die uit het ziekenhuis ontslagen waren met incident atriumfibrilleren, bleek dat atriumfibrilleren het risico op een perifere trombo-embolie bij mannen verhoogde met gemiddeld een factor 4,0 (95%-BI 3,5 tot 4,6) en bij vrouwen met gemiddeld een factor 5,7 (95%-BI 5,1 tot 6,3) ten opzichte van de incidentiecijfers in de algemene Deense bevolking. De risicotoename was het grootst in de aanwezigheid van perifere atherosclerose, myocardinfarct en beroerte.
Risico op beroerte bij atriumfibrilleren en reumatische klepafwijking
In het, zeer gedateerde, Framingham-onderzoek werd een 17 × verhoogd risico op beroerte gevonden bij atriumfibrilleren in combinatie met een reumatische hartziekte.
Richtlijnen diagnostiek
Naar Samenvatting ›Spoed
Naar Samenvatting ›Maak bij twijfel over de klinische stabiliteit van de patiënt gebruik van de ABCDE-systematiek. Bij ABCDE-instabiele patiënt, zie NHG-Behandelrichtlijn Geneesmiddelen en zuurstof in spoedeisende situaties.
Redenen om atriumfibrilleren te vermoeden
Naar Samenvatting ›- Overweeg atriumfibrilleren bij:
- hartkloppingen
- kortademigheid (bij inspanning)
- verminderde inspanningstolerantie
- duizeligheid (licht in het hoofd)
- (bijna-)wegrakingen
- druk op de borst
- beroerte
- Bepaal laagdrempelig het hartritme door palpatie van de pols bij patiënten met aspecifieke klachten (bijvoorbeeld malaise), in het bijzonder bij patiënten ≥ 75 jaar.
In een onderzoek werden 1820 patiënten ≥ 65 jaar in de eerste lijn, die niet bekend waren met atriumfibrilleren en geen antistolling gebruikten, met behulp van een mobiel 1-kanaals ecg-apparaat (MyDiagnostic®) gescreend op atriumfibrilleren. Atriumfibrilleren werd vastgesteld door middel van een 12-kanaals-ecg. De gevonden prevalentie van atriumfibrilleren in deze populatie was 5,5%. Bij patiënten met milde symptomen was het detectiepercentage 24,1%, bij asymptomatische patiënten 4,0%. Milde symptomen waren bijvoorbeeld hartkloppingen, kortademigheid bij inspanning, duizeligheid of pijn op de borst.
Overwegingen
Atriumfibrilleren komt veel voor, met name bij patiënten ≥ 75 jaar, en geeft regelmatig weinig of geen klachten (zie Achtergronden). Het kan eenvoudig worden opgespoord door beoordeling van het hartritme, bijvoorbeeld palpatie van de pols of auscultatie van het hart.
- Denk bij milde, aspecifieke klachten ook aan atriumfibrilleren en beoordeel bij deze patiënten het hartritme.
- Beoordeel ook bij elke bloeddrukmeting het hartritme.
Screening
Naar Samenvatting ›- Bepaal het hartritme door palpatie van de pols bij iedere patiënt bij wie de bloeddruk gemeten wordt, ook in afwezigheid van klachten.
- We bevelen systematische screening op atriumfibrilleren niet aan.
- Er is onvoldoende bewijs dat er gezondheidswinst te behalen is bij systematische screening op atriumfibrilleren. Op basis hiervan komt de werkgroep tot een sterke aanbeveling tegen systematische screening op atriumfibrilleren.
- In de onderzoeken die we hebben gevonden wordt gezondheidswinst door opportunistisch screenen niet overtuigend aangetoond. Nederlandse onderzoekers vonden geen verschil in detectie van atriumfibrilleren tussen actieve screening en gebruikelijke zorg. Waarschijnlijk komt dit omdat in Nederland de gebruikelijke zorg, waarbij bij iedereen bij de wie de bloeddruk wordt gemeten ook het polsritme wordt bepaald, al dekkend is. De werkgroep handhaaft daarom de aanbeveling om bij iedereen bij wie de bloeddruk wordt gemeten, ook het polsritme te beoordelen.
- Mogelijk zijn er specifieke groepen patiënten bij wie opportunistisch screenen wel gezondheidswinst zou kunnen geven. De werkgroep denkt hierbij aan patiënten ≥ 75 jaar (zie tabel d5) of bijvoorbeeld met specifieke comorbiditeit. Er is echter onvoldoende bewijs beschikbaar om hier een uitspraak over te kunnen doen.
Voor- en nadelen
Voordelen
- Patiënten met atriumfibrilleren worden gediagnosticeerd voordat ze klachten hebben.
- Screening in een hoogrisicopopulatie resulteert waarschijnlijk in een grotere diagnostische opbrengst en kan resulteren in gezondheidswinst, zoals het voorkomen van beroerte, systemische embolie, TIA en sterfte.
Nadelen
- Screening in een laagrisicopopulatie resulteert waarschijnlijk niet of nauwelijks in gezondheidswinst, zoals het voorkomen van beroerte, systemische embolie, TIA en sterfte.
- Overbehandeling kan leiden tot schade door bloedingen. Mortaliteit binnen 28 dagen en invaliditeit na een hersenbloeding zijn fors hoger dan na een herseninfarct (respectievelijk 30 vs. 7% en 50 vs. 33%; zie NHG-Standaard Beroerte).
- Angst bij patiënt door afwijkende resultaten.
- Nevenbevindingen waarvoor verdere (invasieve) diagnostiek enbehandeling noodzakelijk is, met eventuele bijwerkingen.
Kwaliteit van bewijs
De kwaliteit van het bewijs is redelijk. Er werd afgewaardeerd in verband met hoge kans op loss to follow up en reporting bias, en in verband met de (grote) verschillen tussen de populaties.
Waarden en voorkeuren van patiënten
Harteraad heeft de ervaringen en inzichten van mensen met (risico) op atriumfibrilleren geïnventariseerd met betrekking tot hun houding ten opzichte van het vroeger opsporen en het stellen van de diagnose.
- Patiënten denken positief over het vroeger opsporen van atriumfibrilleren. Uit de praktijk blijkt dat er ook patiënten zijn die liever niet gescreend willen worden omdat ze bang zijn dat er ‘iets’ gevonden wordt.
- Heldere en positieve communicatie is van belang om onzekerheid en gevoelens van angst te voorkomen.
- De tijd tussen het opsporen en diagnose van atriumfibrilleren moet kort zijn (niet langer dan een dag, bij voorkeur op hetzelfde moment).
- De patiënten willen graag dat de huisarts de diagnose en aanvullende informatie over risico’s, geruststelling, leefstijl, medicatie en bijwerkingen op dat moment bespreekt.
- Een scenario waarvan zelf meten een onderdeel is, behoort vanuit de patiënt gezien tot de mogelijkheden. Hierbij is het beschikbaar stellen van de juiste informatie van groot belang.
Kosten
De ESC-richtlijn concludeert dat zowel systematische als opportunische screening voor patiënten ≥ 65 jaar kosteneffectief zijn ten opzichte van gebruikelijke zorg, waarbij opportunistische screening waarschijnlijk kosteneffectiever is dan systematisch screening. De uiteindelijke opbrengst van de screeningsinterventie in termen van het aantal vermeden beroertes en hartinfarcten hangt sterk af van de participatiegraad.
Aanvaardbaarheid
Bij de herijking van de kernwaarden en kerntaken van de huisarts in 2019 is vastgesteld dat geïndiceerde en zorggerelateerde individuele preventie een kerntaak is. Geïndiceerde preventie is gericht op individuen die nog geen gediagnosticeerde ziekte hebben, maar wel risicofactoren of symptomen die voorafgaan aan een ziekte. Uitgangspunt bij de kerntaak ‘preventieve zorg’ is het consult in de spreekkamer. Nationale preventieprogramma’s behoren niet tot het basisaanbod en zijn geen kerntaak van de huisarts. Een rol van de huisarts in nieuwe (nationale) preventieprogramma’s is niet vanzelfsprekend (Toekomst huisartsenorg – kerntaken in de praktijk). Voor de huisarts is dus waarschijnlijk zorggerelateerde individuele preventie wel aanvaardbaar (zoals palpatie van de pols bij het meten van de bloeddruk), maar uitgebreidere populatiescreening niet.
Haalbaarheid
Als screeningsmethode is palpatie van de pols het makkelijkst haalbaar. Voor alle overige vormen van screening zijn aparte hulpmiddelen noodzakelijk, die op dit moment niet beschikbaar zijn in alle praktijken. De eventuele aanschaf hiervan brengt kosten met zich mee. In een aantal Nederlandse regio’s zijn programma’s opgezet voor opportunistische screening, diagnostiek en behandeling van atriumfibrilleren, bijvoorbeeld met behulp van innovatiegelden vanuit de zorgverzekeraar.
Er is geen georganiseerde landelijke structuur voor vervolgonderzoek of behandeling na systematische screening op atriumfibrilleren en hiervoor is ook geen vergoeding beschikbaar vanuit de zorgverzekeraar. Gezien de tijdsinvestering is het voor de meeste huisartsen ook niet haalbaar om een systematische screening uit te voeren.
Uitgangsvraag
Is screening (vergeleken met gebruikelijke zorg of niet screenen) op atriumfibrilleren aan te bevelen in de huisartsenpraktijk? Zie de PICO tabel.
| Patiënten | Mensen ≥ 65 jaar in de huisartsenpraktijk |
| Interventie | Screenen met behulp van pols voelen, automatische bloeddrukmeting, 1-kanaals-ecg, app of smartwatch |
| Vergelijking | Gebruikelijke zorg* / niet screenen |
| Uitkomstmaten | Cruciaal:
Belangrijk:
|
| *Bij gebruikelijke zorg wordt niet actief/ systematisch gescreend op atriumfibrilleren, maar bij patiënten waarbij er aanleiding toe is, wordt uiteraard wel diagnostisch onderzoek gedaan. | |
Achtergrond
In 2020 waren in Nederland ongeveer 362.700 mensen bekend met atriumfibrilleren. Daarnaast zijn er naar schatting 80.000 mensen met niet-ontdekt, veelal asymptomatisch atriumfibrilleren (zie Nederlandse Hart Registratie, basiscijfers atriumfibrilleren). Mensen met symptomatisch atriumbrilleren zonder antistolling hebben een verhoogde kans op een herseninfarct. Bij ongeveer 20% van de patiënten met een herseninfarct gerelateerd aan atriumfibrilleren is het herseninfarct het eerste symptoom van het atriumfibrilleren. Het risico op een herseninfarct bij mensen met asymptomatisch atriumfibrilleren, met name bij kortere duur van de periodes van atriumfibrilleren, is echter onduidelijk. Ook het effect van behandeling met antistolling op het verminderen van de risico’s is onduidelijk.
In de vorige versie van deze NHG-Standaard werd aanbevolen om bij iedereen bij wie de bloeddruk wordt gemeten ook het hartritme te beoordelen (door palpatie van de pols of auscultatie van het hart). In dit detail bekijken we of dit voldoende is.
De richtlijn voor atriumfibrilleren van de European Society of Cardiology (ESC) adviseert bij patiënten ≥ 65 jaar opportunistische screening (dat is: screenen van patiënten die om een andere reden op het spreekuur komen) door palpatie van de pols of met een ecg-ritmestrook. De aanbevelingen bij deze screening luiden:
- informeer de patiënt over de significantie en de behandeling
- zorg voor een georganiseerde structuur voor vervolgonderzoek en behandeling
- stel de diagnose ‘atriumfibrilleren’ alleen op basis van gedocumenteerd atriumfibrilleren met een duur ≥ 30 seconden op een standaard 12-kanaals of 1-kanaals ecg-registratie, beoordeeld door een arts
De ESC-richtlijn adviseert systematische screening (dat is: screenen van de algemene bevolking) te overwegen bij mensen ≥ 75 jaar en screening bij mensen met een verhoogd risico op een beroerte. De Nederlandse Vereniging voor Cardiologie (NVVC) heeft de aanbevelingen van de ESC overgenomen in haar Richtlijn Atriumfibrilleren.
Er zijn verschillende manieren voor (vroeg)detectie van atriumfibrilleren. Voor palpatie van de pols is geen aparte screeningstool nodig. Er zijn momenteel > 100.000 apps en > 400 wearables (horloges, polsbanden, bloeddrukmeters) op de markt, die atriumfibrilleren kunnen detecteren met behulp van fotoplethysmografie (PPG), via een 1-kanaals-ecg of via een andere sensor (seismocardiogram, accelerometer, gyroscoop).
De diagnose ‘atriumfibrilleren’ kan alleen vastgesteld worden met een standaard 12-kanaals-ecg of 1-kanaals-ecg waarop atriumfibrilleren ≥ 30 seconden geregistreerd wordt, beoordeeld door een arts. Een goed beoordeelbare registratie door een instrument dat een 1-kanaals-ecg kan maken, is dus voldoende voor het stellen van de diagnose. Bij andere screeningstools (palpatie pols, PPG of andere sensor) moet altijd nog een ecg gemaakt worden voor het stellen van de diagnose.
De ESC-richtlijn geeft een overzicht van de sensitiviteit en specificiteit van de verschillende instrumenten, met als gouden standaard een 12-kanaals-ecg (zie tabel d2).
| Meetmethode | Sensitiviteit | Specificiteit |
|---|---|---|
| Palpatie van de pols | 87-97% | 70-81% |
| Automatische bloeddrukmeting | 93-100% | 86-92% |
| 1-kanaals-ecg | 94-98% | 76-95% |
| Smartphone-app | 91,5-98,5% | 91,4-100% |
| Smartwatch | 97-99% | 83-94% |
Gezien de beschikbaarheid van nieuwere screeningstools en de aanbevelingen in de nieuwe Europese en Nederlandse richtlijnen is het de vraag of screenen op atriumfibrilleren in de huisartsenpraktijk zou moeten plaatsvinden.
Methoden
In maart 2022 is in PubMed en Embase een systematische literatuurzoekactie uitgevoerd naar systematische reviews (SR’s) en randomised controlled trials (RCT’s).
Resultaten
Resultaat zoekactie
De zoekactie leverde 2 SR’s op naar screening op atriumfibrilleren (AF): Kahwati (2022; zoekdatum oktober 2020) en Lowres (2019; zoekdatum februari 2018). Een aanvullende search na de zoekdatum van deze twee reviews leverde 38 aanvullende onderzoeken op. De update van de search in februari 2023 leverde 1 SR en 1 aanvullend onderzoek op waarvan de resultaten in lijn zijn met de beschreven onderzoeken en de aanbeveling ondersteunen.
Onderzoekskarakteristieken
- Kahwati 2022 includeerde 3 RCT’s met betrekking tot de health outcomes (= gezondheidsuitkomsten = vermindering mortaliteit en morbiditeit) van screening van asymptomatische personen ≥ 50 jaar in de huisartsenpraktijk die niet bekend zijn met atriumfibrilleren en geen herseninfarct hebben gehad, en 8 RCT’s met dezelfde populatie over de diagnostic yield (= diagnostische opbrengst = percentage gevonden patiënten met atriumfibrilleren) van screening ten opzichte van gebruikelijke zorg. Informatie met betrekking tot de onderzoeken zijn beschreven in de Totstandkoming. De gouden standaard voor atriumfibrilleren was een bewijs met 12-kanaals-ecg afgelezen door een cardioloog.
Na de zoekdatum van Kahwati zijn nog 3 onderzoeken verschenen met betrekking tot dit onderwerp.
- Lubitz 2022 (Verenigde Staten) randomiseerde 16 huisartsenpraktijken over 2 groepen. De ene groep ging een jaar lang patiënten > 65 jaar die om een willekeurige reden naar de praktijk kwamen te screenen op atriumfibrilleren met een handheld 1-kanaals-ecg, de andere groep verleende gebruikelijke zorg. Werd er tijdens screening iets gevonden, dan werd een 12-kanaals-ecg gemaakt. Totaal aantal patiënten in screeningsgroep: 15.393, gemiddelde leeftijd 74 jaar, 60% vrouw. Totaal aantal patiënten in controlegroep: 15.322, gemiddelde leeftijd 74 jaar, 58% vrouw. Na een jaar werden de nieuw gestelde diagnoses atriumfibrilleren per groep geteld.
- Steinhubl 2021 (Verenigde Staten) includeerde 1718 personen uit een landelijk gezondheidsproject in de screeningsgroep. Men moest gedurende 2 weken een 1-kanaals ecg-patch dragen en na 3 maanden weer. Na 3 jaar werden de klinische uitkomsten vergeleken met 3371 gematchte controlepersonen. Er werd een gecombineerde uitkomstmaat van sterfte, herseninfarct, systemische embolie en myocardinfarct berekend. De gemiddelde leeftijd in de screeningsgroep en in de controlegroep was 74 jaar en 41% was vrouw.
- Stavrakis 2021 (Verenigde Staten) includeerde patiënten ≥ 50 jaar in de eerste lijn. Personen die informed consent tekenden, kregen een 30-seconden-ecg. Gescreend werden 1019 personen (gemiddelde leeftijd 61 jaar, 62% vrouw). De controlegroep bestond uit 1267 patiënten die tijdens dezelfde periode ook bij de eerste lijn kwamen en niet werden gescreend (gemiddelde leeftijd 61 jaar, 62% vrouw). De uitkomstmaat was het percentage gevonden atriumfibrilleren.
Lowres 2019 includeerde 19 onderzoeken naar een eenmalige screening op atriumfibrilleren in de algemene bevolking (> 65 jaar, maar sommige onderzoeken hadden een lagere leeftijdsgrens). De screeningsmethoden waren aangepaste bloeddrukmeter (1 ×), pols voelen (2 ×), 1-kanaals-ecg (12 ×) en 12-kanaals-ecg (4 ×). De onderzochte populaties waren algemene bevolking (7 ×), huisartsenpatiënten (6 ×), tweedelijnspatiënten (3 ×) en bezoekers van apotheken (3 ×). De data van deze onderzoeken werden samengenomen en geanalyseerd (n = 141.220; 44% mannen). De onderzoeken werden uitgevoerd in België, Duitsland, Hong Kong, Spanje, Australië (3 ×), India, China (2 ×), Ierland, Taiwan, Denemarken, Nederland, Canada (2 ×), Spanje, Engeland en de Verenigde Staten. Uitkomstmaten waren screeningsopbrengst in procenten, nieuwe patiënten met atriumfibrilleren en number needed to screen (NNS).
- Voor onderzoeken gepubliceerd na de zoekdatum van Lowres (2018), zie de tabel in Totstandkoming.
Effectiviteit
| RCT (auteur, publ.jaar) | Morbiditeit in de groep met screening | Morbiditeit in de groep met gebruikelijke zorg zonder screening | Samenvattende maat (95%-BI)* |
|---|---|---|---|
| Halcox 2017 | Samengestelde score (herseninfarct, TIA of systemische embolie): 6 op de 500 personen | Samengestelde score (herseninfarct, TIA of systemische embolie): 10 op de 501 personen | HR 0,61 (0,22 tot 1,69) |
| Gladstone 2021 | 2 herseninfarct en 1 TIA (n = 434) | Geen morbiditeit (n = 422) | Niet gerapporteerd |
| Svennberg 2021 | Samengestelde score (herseninfarct, systemische embolie, bloeding, sterfte): 4456 uit 13.979 personen | Samengestelde score (herseninfarct, systemische embolie, bloeding, sterfte): 4616 uit 13.996 personen | HR 0,96 (0,92 tot 1,00) |
| Steinhubl 2021 | Samengestelde score (sterfte, herseninfarct systemische embolie, myocardinfacrct): 3,6 per 100 persoonsjaren | Samengestelde score (sterfte, herseninfarct systemische embolie, myocardinfacrct): 4,5 per 100 persoonsjaren | HR 0,79 (0,66 tot 0,96) |
| RCT (auteur, publ.jaar) | Atriumfibrilleren in de groep met screening | Atriumfibrilleren in de groep met gebruikelijke zorg zonder screening | Samenvattende maat (95%-BI)* |
|---|---|---|---|
| Morgan 2002 | 12 op de 1499 bij ecg-screening (0,8%) | 7 op de 1502 bij pols voelen (0,5%) | RR 1,72 (0,68 tot 4,35) RD 0,3% (–0,23 tot 0,90) |
| Hobbs 2005 | 75 op de 4933 (1,5%) | 47 op de 4936 (1,0%) | RR 1,6 (1,11 tot 2,29) RD 0,5% (0,1 tot 1,0)
Mannen OR 2,33 Vrouwen OR 1,20 |
| Halcox 2017 | 19 op de 500 (3,8%) 12 × paroxismaal AF en 7 × persisterend | 5 op de 501 (1,0%) Geen paroxismaal AF, 5 × persisterend | HR: 3,9 (1,4 tot 10,4) RD 2,8% (0,9 tot 4,7) |
| Steinhubl 2018 en 2021 | Na 4 maanden 53 op de 1366 (3,9%) | Na 4 maanden 12 op de 1293 (0,9%) | RR 4,18 (2,24 tot 7,79) RD 3,0% (1,8 tot 4,1) |
| Na 3 jaar 11,4% | Na 3 jaar 7,7% | RD 3,7% | |
| Kaasenbrood 2020 | Na 1 jaar 123 op de 8581 (1,43%) | Na 1 jaar 117 op de 8526 (1,37%) | RR 1,04 (0,81 tot 1,34) RD 0,06% (–0,29 tot 0,41) |
| Uittenbogaart 2020 | 144 op de 8874 (1,62%) | 139 op de 9102 (1,53%) | aOR: 1,06 (0,84 tot 1,35) RD 0,09%
|
| Gladstone 2021 | Na 6 maanden 23 op de 434 (5,3%) Na 3 maanden 4,6% | Na 6 maanden 2 op de 422 (0,5%) Na 3 maanden 0,2% | Na 6 maanden: RR 11,2 (2,7 tot 47,1) RD 4,8% (2,6 tot 7,0)
Na 3 maanden: RR19,5 (2,6 tot 144,3) RD 4,4% (2,3 tot 6,4) |
| Svennberg 2021 | 1953 op de 13.996 (14,0%) | 1794 op de 13.979 (12,8%) | ARD 1,89 (1,10 tot 2,68) RR 1,16 (1,09 tot 1,23) RD 1,2% |
| Stavrakis 2021 | 15 op de 1019 (1,5%) | 4 op de 1267 (0,3%) | RD 1,2% (0,3 tot 2,2) |
| Lubitz 2022 | 264 op de 15.393 (1,72%) | 243 op de 15.322 (1,59%) | RD 0,13% (–0,16 tot 0,42; uitersten 0,06-4,8%) |
* RR = relative risk; RD = risk difference; OR = odds ratio; aOR = adjusted odds ratio; ARD = absolute risk difference NB. Kahwati heeft geen gemiddelde berekend in de SR, waarschijnlijk omdat de screeningsmethoden zo verschillend zijn. Daarom hebben wij dat zelf ook niet gedaan. | |||
| Eenmalige screening* | Nieuw gevonden patiënten met atriumfibrilleren | NNS* |
|---|---|---|
| < 60 jaar | 0,34% (95%-BI 0,26 tot 0,45) | 294 |
| 60-64 jaar | 0,48% (95%-BI 0,36 tot 0,65) | 208 |
| 65-69 jaar | 0,73% (95%-BI 0,56 tot 0,95) | 137 |
| 70-74 jaar | 1,09% (95%-BI 0,84 tot 1,41) | 92 |
| 75-79 jaar | 1,49% (95%-BI 1,15 tot 1,94) | 67 |
| 80-84 jaar | 1,89% (95%-BI 1,44 tot 2,47) | 53 |
| ≥ 85 jaar | 2,73% (95%-BI 2,08 tot 3,58) | 37 |
Voor de diagnostische opbrengst uit onderzoeken gepubliceerd na de zoekdatum van deze SR (2018), zie Totstandkoming, Bijlage 7. * NNS = number needed to screen. Screening door middel van 12-kanaals-ecg, polspalpatie of 1-kanaals-ecg > 30 sec (onderzoeken met herhaalde, intermitterende of continue screeningsmethoden werden geëxcludeerd) | ||
Conclusies
- Screenen resulteert waarschijnlijk niet of nauwelijks in gezondheidswinst ten opzichte van gebruikelijke zorg (het betrouwbaarheidsinterval ligt rond of net onder de 1). De kwaliteit van bewijs is redelijk (afwaardering in verband met hoge kans op loss to follow up en reporting bias)
- Screenen resulteert waarschijnlijk in een hogere diagnostische opbrengst dan gebruikelijke zorg (meer gevonden patiënten met atriumfibrilleren). De kwaliteit van bewijs is redelijk (afwaardering in verband met indirectheid: (grote) verschillen tussen populaties). Hoe hoger de leeftijd, hoe hoger de prevalentie van atriumfibrilleren, hoe hoger de diagnostische opbrengst.
- Er zijn geen onderzoeken gevonden met als uitkomstmaat kwaliteit van leven.
Anamnese
Naar Samenvatting ›- Vraag naar:
- hartkloppingen: duur, continu of in aanvallen, ontstaan en stoppen (plotseling of geleidelijk)
- bij aanvallen: frequentie, duur, regelmatig of onregelmatig
- uitlokkende factoren zoals koorts, stress, lichamelijke inspanning, alcohol, medicatie, drugs
- bijkomende klachten zoals duizeligheid of een licht gevoel in het hoofd, (bijna-)wegrakingen of kortademigheid
- klachten die wijzen op trombo-embolische complicaties, met name een TIA of herseninfarct (zie NHG-Standaard Beroerte)
- pijn op de borst (zie NHG-Standaard Acuut coronair syndroom en NHG-Standaard Stabiele angina pectoris)
- klachten passend bij hartfalen (zie NHG-Standaard Hartfalen), anemie (zie NHG-Standaard Anemie), hyperthyreoïdie (zie NHG-Standaard Schildklieraandoeningen) of angst (zie NHG-Standaard Angst)
- Inventariseer:
- comorbiditeit zoals herseninfarct, hersenbloeding, hartkleplijden, hypertensie, angina pectoris, myocardinfarct, hartfalen, aangeboren hartaandoening, diabetes mellitus, hyperthyreoïdie, COPD, slaapapneu, vallen en cognitieve stoornissen
- medicijngebruik (met name bèta-2-sympathicomimetica, levothyroxine of corticosteroïden)
Lichamelijk onderzoek
Naar Samenvatting ›- Bloeddruk (automatisch of handmatig). Indien een automatische meting een foutmelding geeft, bepaal deze dan handmatig overnieuw.
- Pols (frequentie en ritme)
- bepaal het hartritme door palpatie van de pols
- bepaal bij een onregelmatig hartritme de ventrikelvolgfrequentie door auscultatie van het hart
- Ausculteer het hart (let op hartgeruisen wijzend op klepafwijkingen)
- Klinische tekenen van overvulling wijzend op hartfalen:
- verhoogde centraalveneuze druk (uitgezette halsvenen)
- hart: palpeer de ictus cordis (passend bij hartfalen indien buiten de midclaviculairlijn in rugligging of heffend/verbreed in linker zijligging)
- longen (crepitaties, demping en verminderd ademgeruis basaal, soms rhonchi en piepen)
- buik (vergrote lever, ascites)
- perifeer oedeem (enkels en sacrum)
- Doe gericht lichamelijk onderzoek bij een vermoeden van trombo-embolische complicaties (TIA, herseninfarct, perifere arteriële vaatafsluiting).
Diagnostische waarde van verschillende meetmethoden voor het vaststellen van atriumfibrilleren
Voor het nagaan van de diagnostische waarde van palpatie van de pols en automatische bloeddrukmeting is gebruik gemaakt van 2 internationale richtlijnen over atriumfibrilleren, die van NICE en die van de ESC.
Resultaten
Voor de NICE-richtlijn is gezocht naar observationeel onderzoek en RCT’s over verschillende testmethoden (waaronder palpatie van de pols en automatische bloeddrukmeters) voor het detecteren van atriumfibrilleren bij patiënten met cardiovasculaire risicofactoren voor atriumfibrilleren en/of klachten die atriumfibrilleren doen vermoeden. De referentietest bestond uit een 12-kanaals-ecg, beoordeeld door een cardioloog, of > 24 uur ambulante registratie. In totaal zijn 70 onderzoeken geïncludeerd. Het bewijs was meestal van lage of zeer lage kwaliteit, waarbij vooral werd afgewaardeerd vanwege risico op bias (niet gelijktijdig uitvoeren van index- en referentietest; geen blindering) en indirectheid (andere populatie, bijvoorbeeld zonder klachten of risicofactoren). Daarnaast zijn de onderzoeken vaak in een kleine populatie uitgevoerd, wat kan leiden tot onnauwkeurigheid (zie tabel d6 voor sensitiviteit en specificiteit).
|
Meetmethode |
Apparaat |
Metingen |
Sensitiviteit (95%-BI) |
Specificiteit (95%-BI) |
|
Palpatie van de pols |
0,92 (0,71 tot 0,99) |
0,81 (0,56- 0,94) |
||
|
Automatische bloeddrukmeting |
Microlife BP3MQ1-2D oscillometrische bloeddrukmeter |
3 uitlezingen |
0,89 (0,75 tot 0,97) |
0,99 (0,96 tot 1,00) |
|
|
|
1 uitlezing |
0,95 (0,92 tot 0,97) |
0,86 (0,84 tot 0,89) |
|
|
Microlife BPA 200 oscillometrische bloeddrukmeter |
3 uitlezingen, meerderheidsregel |
0,92 (0,85 tot 0,97) |
0,97 (0,95 tot 0,98) |
|
Microlife BPA 100 Plus oscillometrische bloeddrukmeter |
3 uitlezingen, meerderheidsregel |
1,00 (0,87 tot 1,00) |
0,89 (0,76 tot 0,96) |
|
|
|
|
3 uitlezingen, minderheidsregel |
1,00 (0,87 tot 1,00) |
0,69 (0,53 tot 0,82) |
|
1 uitlezing |
0,93 (0,76 tot 0,99) |
0,89 (0,76 tot 0,96) |
||
|
2 uitlezingen |
1,00 (0,87 tot 1,00) |
0,76 (0,60 tot 0,87) |
||
|
|
Microlife Watch BP oscillometrische bloeddrukmeter |
≤ 3 meetcycli |
0,95 (0,88 tot 0,99) |
0,90 (0,88 tot 0,92) |
|
Heart Spectrum Blood Pressure Monitor |
Algoritme 1, 1 uitlezing |
0,97 (0,82 tot 1,00) |
0,97 (0,84 tot 1,00) |
|
|
|
|
Algoritme 2, 1 uitlezing |
0,90 (0,73 tot 0,98) |
1,00 (0,89 tot 1,00) |
|
Algoritme 3, 1 uitlezing |
1,00 (0,88 tot 1,00) |
0,94 (0,80 tot 0,99) |
||
|
|
Omron 712C automatische sfygmomanometer |
2 uitlezingen van elk 10-40 sec |
1,00 (0,93 tot 1,00) |
0,91 (0,88 tot 0,94) |
|
Omron M6 Comfort |
1 uitlezing (duur onbekend) |
0,33 (0,17 tot 0,53) |
0,97 (0,93 tot 0,99) |
|
De ESC-richtlijn heeft de diagnostische waarde beschreven van onder andere palpatie van de pols en automatische bloeddrukmeting in het kader van systematische screening (dus bij patiënten zonder klachten of risicofactoren). Over de kwaliteit van het bewijs wordt geen oordeel gegeven, wel dat de onderzoekspopulaties vaak klein waren en dat er risico is op (selectie)bias (zie tabel d7 voor sensitiviteit en specificiteit).
|
Meetmethode |
Sensitiviteit |
Specificiteit |
|
Palpatie van de pols |
87-97% |
70-81% |
|
Automatische bloeddrukmeting |
93-100% |
86-92% |
Overwegingen
De onderzoeken laten zien dat automatische bloeddrukmeting mogelijk een alternatief kan zijn voor palpatie van de pols voor het vaststellen van atriumfibrilleren. De betrouwbaarheidsintervallen van beide methoden overlappen echter en de onderzoeken zijn van lage of zeer lage kwaliteit. Palpatie van de pols is een eenvoudige, snelle, kosteloze basishandeling die uitgevoerd kan worden door elke zorgverlener in de huisartsenpraktijk. Het is onduidelijk of automatische bloeddrukmeters gevalideerd zijn voor het vaststellen van atriumfibrilleren, en zo ja welke dat dan zijn.
Conclusie
Bepaal het hartritme handmatig. Indien er met een (semi-) automatische bloeddrukmeter is gemeten, bepaal het hartritme dan ook handmatig.
Bloeddrukmeting bij patiënten met atriumfibrilleren
Bij patiënten met atriumfibrilleren is er sprake van een variërend tijdsinterval tussen opeenvolgende hartslagen, hierdoor zijn de drukgolven wisselend van sterkte. Dit zou de bloeddrukmeting kunnen beïnvloeden.
Clark (2019) voerde een systematische review en meta-analyse uit naar de nauwkeurigheid van (semi-)automatische bloeddrukmetingen bij patiënten met atriumfibrilleren. Geïncludeerd werden 13 onderzoeken, waarin 14 verschillende bloeddrukmeters werden onderzocht en vergeleken met een standaard handmatige bloeddrukmeter. De verschillen tussen de gemeten gemiddelde systolische en diastolische bloeddruk varieerden van –3,1 tot +6,1 mmHg en van –4,6 tot +9,0 mmHg. Daarnaast was er aanzienlijke heterogeniteit tussen de verschillende meters (I2 80-90%).(Semi-)automatische bloeddrukmeters met ingebouwde algoritmes voor het herkennen van atriumfibrilleren waren niet nauwkeuriger dan bloeddrukmeters zonder deze algoritmes. Concluderend was er onvoldoende bewijs voor de nauwkeurigheid van een meting met een (semi-)automatische bloeddrukmeter bij patiënten met atriumfibrilleren.
Conclusies
- Meet de bloeddruk bij patiënten met atriumfibrilleren automatisch of handmatig. Indien een automatische meting een foutmelding geeft, meet deze dan handmatig overnieuw. Beoordeel bij elke bloeddrukmeting (handmatig en automatisch) het hartritme door palpatie van de pols.
- Bepaal het hartritme door palpatie van de pols bij patiënten bij wie er redenen zijn om aan atriumfibrilleren te denken of bij wie de bloeddruk gemeten wordt.
Aanvullend onderzoek
Naar Samenvatting ›Ecg
Naar Samenvatting ›- Verricht een 12-kanaals-ecg of gedurende ≥ 30 seconden een 1-kanaals-ecg (ritmestrook), desgewenst met interpretatie door een cardioloog.
- Doe dit zo snel mogelijk, zodat de kans om het atriumfibrilleren vast te leggen zo hoog mogelijk is.
Bij een vermoeden van atriumfibrilleren wordt een 12-kanaals- of 1-kanaals-ecg (ritmestrook) uitgevoerd gedurende ≥ 30 seconden.
Gebruik zowel voor een 1-kanaals- als voor een 12-kanaals-ecg alleen ecg-apparaten die voorzien zijn van een geldige CE-markering. Deze gerandeert dat het apparaat veilig is en aan de regelgeving voldoet. De gemaakte ritmestrook moet van voldoende kwaliteit zijn, zowel het atriale signaal (geen duidelijke P-toppen, onregelmatige ‘chaotische’atriale activiteit) als het ventriculaire signaal (onregelmatige R-R-intervallen) moeten goed zichtbaar zijn. Veel (apps op) wearables hebben geen medisch doel zoals bedoeld in artikel 1 van de Wet medische hulpmiddelen en hebben geen CE-markering.
Stel de diagnose ‘atriumfibrilleren’ door middel van een 12-kanaals-ecg of een 1-kanaals-ecg van ≥ 30 seconden, van voldoende kwaliteit en uitgevoerd op een apparaat met een CE-markering. Stel de diagnose niet op basis van een zelfmeting door draagbare technologie, zoals een smartwatch. Let op: bij een patiënt zonder klachten bij wie de draagbare technologie/smartwatch (hele) korte metingen heeft afgegeven die als (mogelijk) atriumfibrilleren geclassificeerd zijn, is er volgens de werkgroep sprake van niet-diagnostische zelfmetingen. Na deze zelfmetingen hoeft in principe geen verdere diagnostiek plaats te vinden. Als de patiënt echter klachten heeft die atriumfibrilleren doen vermoeden, of als er tijdens het lichamelijk onderzoek een onregelmatige pols wordt gevoeld, volg dan de diagnostiek zoals beschreven onder Richtlijnen diagnostiek.
Interpretatie door de huisarts
In een onderzoek onder 86 patiënten ≥ 65 jaar van wie 26 (30%) atriumfibrilleren hadden, kon de huisarts op grond van polspalpatie en het ecg atriumfibrilleren goed diagnosticeren (van een bipolar lead-ecg was de positief voorspellende waarde (PVW) 96% en de negatief voorspellende waarde (NVW) 98%. Van een 12-kanaals-ecg was de PVW 96% en de NVW 100%.
In een ander onderzoek werden de ecg’s van ruim 2500 patiënten ≥ 65 jaar (prevalentie atriumfibrilleren 8,4%) beoordeeld. In dit onderzoek bleek de vaardigheid van huisartsen om atriumfibrilleren op grond van een ecg te diagnosticeren geringer (een ecg met beenafleiding had PVW 40% en NVW 98%; een ecg met thoraxafleiding had PVW 38% en NVW 98%; een 12-kanaals-ecg had PVW 41% en NVW 98%). In combinatie met softwarematige interpretatie nam de diagnostische vaardigheid van de huisartsen aanmerkelijk toe (PVW 96%, NVW 99%). De huisartsen in dit onderzoek waren relatief weinig geschoold en moesten de diagnose stellen zonder klinische informatie en polspalpatie.
Conclusie
Waarschijnlijk kunnen huisartsen atriumfibrilleren goed diagnosticeren of uitsluiten door middel van een ecg, wanneer zij beschikken over de benodigde kennis en ervaring. Desgewenst kan interpretatie door een cardioloog plaatsvinden.
Ambulante ritmeregistratie
Naar Samenvatting ›- Verricht bij een vermoeden van paroxismaal atriumfibrilleren een registratie met behulp van een holterregistratie of een eventrecorder:
- gebruik een holterregistratie bij frequente aanvallen (≥ 1 per 24 uur)
- gebruik een eventrecorder bij minder frequente aanvallen. Overweeg bij ouderen een automatische eventrecorder
- Op regionaal niveau kunnen er afspraken bestaan met een functieafdeling Cardiologie, huisartsenpost of Spoedeisende Hulp dat de patiënt daar tijdens klachten een ecg kan laten maken.
Soorten
- Holterregistratie: door middel van een minimaal 3- tot 5-kanaals-ecg (soms 12-kanaals) wordt gedurende 24-48 uur continu een ecg opgenomen. De patiënt houdt in een dagboek bij wanneer er klachten zijn. Na inleveren worden de registraties uitgelezen en geïnterpreteerd. Er kan onder andere informatie worden verkregen over hartfrequentie, hartritme en aanwezigheid en duur van (episodes van) atriumfibrilleren.
- Eventrecorder: een 1-kanaals-ecg wordt geregistreerd door het apparaatje dat tegen de borstkas gehouden wordt, of via een of meer aan de patiënt gekoppelde leads. Wanneer de patiënt klachten heeft activeert deze de recorder. Enkele opnames kunnen bewaard worden in het geheugen en de opnames moeten worden doorgestuurd voor analyse. Er is geen informatie over asymptomatische periodes. Een automatische eventrecorder hoeft niet door de patiënt zelf te worden geactiveerd. Eventrecorders kunnen voor een periode van 1-4 weken worden gedragen.
Onderzoeksresultaten
- Zimetbaum 1999 vond in een systematisch literatuuronderzoek naar de effectiviteit van 2 verschillende methoden van ambulante registratie van het hartritme (holterregistratie en eventrecorder) 6 onderzoeken naar de diagnostische opbrengst bij patiënten met palpitaties. Holterregistratie leverde een diagnose op bij 35-39% van de patiënten, de eventrecorder bij 66-83%.
- Kinlay 1996 en Kus 1995: 2 van de 6 door Zimetbaum geïncludeerde onderzoeken vergeleken 24-uurs en 48-uurs holterregistratie met een eventrecorder. De eventrecorder registreerde 1,5-2 × zoveel ritmestoornissen als de holterregistratie, mogelijk door de langere periode (tot circa 6 weken) waarin registraties konden worden opgenomen.
- Reiffel 2005 vergeleek de diagnostische opbrengst van een automatisch activerende eventrecorder met een door de patiënt geactiveerde eventrecorder en een holterregistratie. De diagnostische opbrengst was respectievelijk 24, 13 en 5%. De automatische eventrecorder registreerde meer asymptomatische episodes van atriumfibrilleren dan de conventionele eventrecorder.
- Hoefman 2005 is een prospectief gerandomiseerd onderzoek in de Nederlandse huisartsenpraktijk naar de diagnostische opbrengst van een eventrecorder bij 244 patiënten, die met een nieuwe klacht van hartkloppingen of lichtheid in het hoofd hun huisarts consulteerden (gemiddelde leeftijd 50 jaar). In de interventiegroep bleek het aantal patiënten zonder diagnose significant lager dan in de controlegroep (38 vs. 17%; RR 0,5; 95%-BI 0,3 tot 0,7). Bij ongeveer 12% van de patiënten bij wie een diagnose kon worden gesteld ging het om paroxismaal atriumfibrilleren.
Conclusie
Bij het vermoeden van paroxismaal atriumfibrilleren, waarbij de patiënt dagelijks aanvallen of klachten heeft, kan naar de mening van de werkgroep de diagnose met behulp van een holterregistratie worden gesteld. Bij minder frequente aanvallen kan beter gebruikgemaakt worden van een al dan niet automatische eventrecorder.
Laboratoriumonderzoek
Naar Samenvatting ›- Bepaal glucose, Hb, TSH en het lipidenspectrum ter uitsluiting van een andere oorzaak voor de klachten en eventuele comorbiditeit.
- Bepaal alvast eGFR en creatinine en kalium als uitgangswaarde bij het begin van een behandeling. Als er recente (< 3 maanden) waarden bekend zijn, kan dit achterwege blijven.
- We bevelen het bepalen van het B-type natriuretisch peptide (BNP) of het N-terminaal proBNP (NT-proBNP) niet aan om hartfalen aan te tonen dan wel uit te sluiten. Een waarde onder de afkapwaarde geeft onvoldoende zekerheid om hartfalen uit te sluiten bij patiënten met atriumfibrilleren.
Bepaling (NT-pro)BNP bij patiënten met atriumfibrilleren
In een onderzoek met data vanuit 4 eerder verrichte screeningsonderzoeken onder 1941 thuiswonende patiënten met een hoog risico op niet-herkend hartfalen (≥ 60 jaar en diabetes type 2, ≥ 65 jaar en chronische obstructieve longziekte, ≥ 65 jaar en kortademigheid, en ≥ 65 jaar en multimorbiditeit), is de diagnostische waarde van de (NT-pro)BNP-bepaling onderzocht. Aan- of afwezigheid van hartfalen werd in elk onderzoek vastgesteld door een panel van deskundigen volgens de criteria van de ESC. In totaal werd bij 196 (10,1%) van de 1941 patiënten atriumfibrilleren vastgesteld. In de groep met atriumfibrilleren hadden 83 patiënten (43%) ook hartfalen, versus 381 (19,7%) in de groep zonder atriumfibrilleren. De gemiddelde NT-proBNP-waarde in de groep met atriumfibrilleren was 744 pg/ml, versus 211 pg/ml in de groep zonder atriumfibrilleren. Bij de gebruikelijke afkapwaarde van 125 pg/ml had de NT-proBNP-bepaling voor hartfalen een sensitiviteit van 93%, specificiteit 35%, PVW 51% en NVW 86%. In de groep met atriumfibrilleren had 23% een NT-proBNP-waarde < 125 pg/ml-en had 13% hartfalen.
Overwegingen
Niet-herkend hartfalen komt veel voor bij patiënten met atriumfibrilleren. Vanwege de hoge voorafkans op hartfalen en de afwijkende waarden van het (NT-pro)BNP bij patiënten met atriumfibrilleren, helpt een bepaling van het NT-proBNP de huisarts onvoldoende om te bepalen voor welke patiënten een echocardiogram nodig is. Er worden te veel patiënten gemist. Van de patiënten met een NT-proBNP-waarde onder de afkapwaarde heeft namelijk nog steeds een aanzienlijk deel hartfalen.
Echocardiografie
Naar Samenvatting ›- Laat bij patiënten met atriumfibrilleren eenmalig een echocardiografie verrichten met de vraagstelling hartfalen en/of kleplijden.
- Overweeg bij kwetsbare of ernstig zieke patiënten om echocardiografie achterwege te laten.
- Doel is om een mogelijk behandelbare onderliggende oorzaak van het atriumfibrilleren aan te tonen en dit vroegtijdig te behandelen.
- Verwijs voor echografie naar een eerstelijns diagnostisch centrum (met beoordeling door een cardioloog, gevolgd door een advies de patiënt wel of niet te verwijzen) of verwijs hiervoor eenmalig naar de cardioloog.
- Overweeg overleg met de cardioloog bij twijfel over de interpretatie van de echocardiografie. Zie de NHG-Standaard Hartfalen voor meer informatie over de interpretatie van echocardiografie bij hartfalen.
- Het verdere beleid voor patiënten met atriumfibrilleren kan, in afwachting van de echografie, normaal plaatsvinden. Zie hiervoor Richtlijnen beleid en Stroomschema 1. Echocardiografie binnen een termijn van 3-6 maanden na de diagnose ‘atriumfibrilleren’ is wenselijk.
De ESC-richtlijn Atriumfibrilleren adviseert om bij alle patiënten met atriumfibrilleren een echocardiogram te verrichten. De NICE-richtlijn beveelt dit onderzoek aan bij een kleinere groep, namelijk patiënten met een sterk vermoeden op een onderliggende structurele of functionele hartziekte (bijvoorbeeld hartfalen of hartgeruis). Daarnaast kan echocardiografie wordt gebruikt als aanvullend onderzoek om te besluiten over antitrombotische en antiaritmische behandeling. Deze buitenlandse richtlijnen sluiten niet goed aan bij de huidige situatie in de Nederlandse eerste lijn, waar de huisarts de kansen op een onderliggende hartziekte en op trombo-embolie, en de noodzaak van antitrombotische behandeling, bepaalt aan de hand van klinische kenmerken.
Overwegingen
Aanvullend onderzoek in de vorm van echocardiografie is zinvol als de bevindingen tot een ander beleid zouden kunnen leiden. In de huisartsenpraktijk zou dit bijvoorbeeld het geval zijn bij patiënten met atriumfibrilleren én hartfalen (zie NHG-Standaard Hartfalen) en bij patiënten met atriumfibrilleren én de aanwezigheid van kleplijden. Bij patiënten met atriumfibrilleren kan hartfalen onvoldoende uitgesloten worden door de combinatie van een ecg en een (NT-pro)BNP-bepaling (zie Laboratoriumonderzoek). Met behulp van echocardiografie kan hartfalen wél worden aangetoond of uitgesloten. Daarnaast kunnen met echocardiografie eventuele andere onderliggende cardiale aandoeningen worden onderzocht. Bij ernstig zieke of kwetsbare patiënten kan dit onderzoek volgens de werkgroep achterwege gelaten worden en kan pragmatisch gekozen worden voor de best mogelijke behandeling. Voor de behandeling van patiënten met atriumfibrilleren en acuut hartfalen wordt verwezen naar de NHG-Standaard Hartfalen.
Conclusie
De werkgroep adviseert om bij patiënten met atriumfibrilleren eenmalig een echocardiogram te laten verrichten door de cardioloog. Hiermee kan een mogelijk onderliggende behandelbare oorzaak in een vroeg stadium worden aangetoond en behandeld. Bij ernstig zieke of kwetsbare patiënten kan dit onderzoek achterwege gelaten worden en kan pragmatisch gekozen worden voor de best mogelijke behandeling.
Evaluatie
Naar Samenvatting ›- Stel de diagnose ‘atriumfibrilleren’ op grond van een 12-kanaals-ecg of ≥ 30 seconden 1-kanaals-ecg)
- Stel de diagnose ‘paroxismaal atriumfibrilleren’ op grond van:
- een ecg tijdens een aanval
- een holterregistratie
- een eventrecorder
- Stel de duur van het atriumfibrilleren vast: < 24 uur of > 24 uur. Indien geen duidelijk begin kan worden aangegeven, moet worden aangenomen dat het langer bestaat dan 24 uur.
- Ga na of er beïnvloedbare risicofactoren voor atriumfibrilleren aanwezig zijn bij deze patiënt, zodat deze kunnen worden meegenomen in het verdere beleid. Deze factoren zijn bijvoorbeeld (zie ook Risicofactoren voor atriumfibrilleren):
- hypertensie
- hartfalen
- diabetes mellitus
- obesitas
- slaapapneu
- alcoholgebruik
- hartkleplijden
Richtlijnen beleid
Naar Samenvatting ›Uitgangspunten
Naar Samenvatting ›Het beleid bestaat uit 3 onderdelen:
- preventie van trombo-embolie (met antistolling)
- vermindering van symptomen (door middel van normalisering van de ventrikelvolgfrequentie of door conversie naar en behoud van sinusritme).
- controle van comorbiditeit en behandeling van beïnvloedbare risicofactoren, zoals:
- hypertensie
- diabetes mellitus
- obesitas
- slaapapneu
- alcoholgebruik
- hartkleplijden
- Bepaal het beleid aan de hand van de duur van het atriumfibrilleren, de door de patiënt ervaren klachten, het risico op een trombo-embolie en de persoonlijke behandeldoelen van de patiënt (zie stroomdiagram 1).
Eerste overwegingen na vaststellen nieuw atriumfibrilleren
Naar Samenvatting ›- Consulteer of verwijs naar de cardioloog bij een patiënt met veel klachten, met name bij een snelle ventrikelvolgfrequentie (> 110/min) en < 24 uur bestaand atriumfibrilleren. Cardioversie is vaak succesvol, draagt bij aan een snelle vermindering van de klachten en kan nog zonder antistolling plaatsvinden (zie Verwijzing).
- Veel patiënten kunnen goed in de huisartsenpraktijk (mede)behandeld worden. Dit kan, mits:
- relevante comorbiditeit en beïnvloedbare risicofactoren goed in beeld zijn en kunnen worden behandeld
- eventuele klachten en symptomen adequaat kunnen worden behandeld
- Een snelle ventrikelvolgfrequentie (> 110/min) en/of klachten (bij inspanning) worden in eerste instantie behandeld met medicatie ter verlaging van de ventrikelvolgfrequentie.
- Overweeg verwijzing voor ritmebehandeling door de cardioloog bij:
- aanhoudende klachten ondanks adequate verlaging van de ventrikelvolgfrequentie
- contra-indicatie of intolerantie voor frequentieverlagende middelen
- Overwegingen bij een verwijzing voor ritmebehandeling:
- Ritmebehandeling binnen 3 tot 6 maanden na de diagnose geeft betere uitkomsten voor de patiënt.
- Niet-kwetsbare patiënten met korter bestaand atriumfibrilleren en weinig relevante comorbiditeit komen regelmatig in aanmerking voor een ritmebehandeling.
- Bij patiënten met een afwijkende echografie (vergrote atria, hartfalen), relevante comorbiditeit of kwetsbaarheid is doorgaans minder voordeel van ritmebehandeling te verwachten.
Gegevens over de kans op spontaan herstel van het sinusritme komen uit onderzoeken bij verwezen patiënten. In 2 retrospectieve onderzoeken bij patiënten met kort bestaand atriumfibrilleren (< 48 uur (n = 114) respectievelijk < 72 uur (n = 356)) kwam spontane cardioversie voor bij respectievelijk 50 en 68%. In de groepen met spontane conversie duurde het atriumfibrilleren bij 66% < 24 uur, bij 17% 24-48 uur en bij 17% > 48 uur.
In een drietal prospectieve onderzoeken bij patiënten met atriumfibrilleren < 48 uur (respectievelijk n = 357, n = 153 en n = 375) trad spontane cardioversie op bij 67-77%. Bij kort bestaand atriumfibrilleren is de kans op spontaan herstel dus groot.
Voorlichting
Naar Samenvatting ›Laat de voorlichting zoveel mogelijk aansluiten bij de wensen, behoeften, mogelijkheden en persoonlijke behandeldoelen van de patiënt. Vraag zo nodig of een naaste van de patiënt wil meeluisteren, meedenken en meepraten.
Voorlichting over de aandoening
- Leg uit dat er een hartritmestoornis is waarbij het hart onregelmatig en vaak snel klopt, waardoor klachten zoals hartkloppingen, gejaagdheid, vermoeidheid of een verminderd inspanningsvermogen ontstaan. Soms geeft een hartritmestoornis geen klachten.
- Leg uit dat patiënten met atriumfibrilleren of paroxismaal atriumfibrilleren en een indicatie voor orale anticoagulantia gemiddeld een 5 × verhoogd risico hebben op een trombo-embolie.
- Leg uit dat dit risico hoger is naarmate er meer risicofactoren zijn. Bespreek dit bijvoorbeeld aan de hand van de CHA2DS2-VASc-score (zie tabel 1).
- Leg uit dat atriumfibrilleren vaak een uiting van andere hart- en vaatziekten is en bespreek de onderliggende belangrijke factoren die invloed hebben op het atriumfibrilleren bij deze patiënt en of deze te behandelen zijn (zie Risicofactoren voor atriumfibrilleren)
- Bespreek het verwachte beloop.
- Bespreek eventuele angst van de patiënt over de aandoening en (de belemmeringen in) het functioneren/(beroeps)werkzaamheden met de aandoening (zie NHG-Standaard Angst).
Voorlichting over de behandeling
- Bespreek dat een behandeling met antistolling aan te bevelen is bij een CHA2DS2-VASc-score ≥ 2 voor mannen of ≥ 3 voor vrouwen (zie tabel 1).
- Alle soorten antistolling vergroten weliswaar de kans op bloedingen, maar bij deze CHA2DS2-VASc-scores zijn de voordelen groter dan de nadelen.
- Behandeling met antistolling vermindert het risico op een herseninfarct met ongeveer 65%.
- Bespreek mogelijke bijwerkingen en alarmsymptomen (bijvoorbeeld neusbloedingen en gastro-intestinale bloedingen). Leg uit hoe de patiënt dan kan handelen.
- Leg uit dat medicijnen ter vertraging van de hartslag zinvol zijn wanneer er tevens een snelle hartslag is. Eventuele klachten zullen hierdoor verminderen. Bespreek mogelijke bijwerkingen.
- Leg uit hoe de patiënt kan handelen als de klachten van atriumfibrilleren toenemen.
- Bespreek bij paroxismaal atriumfibrilleren met een hoge aanvalsfrequentie en veel klachten de mogelijkheid voor verwijzing naar de cardioloog voor behandeling.
Voorlichting over complicaties
- Leg uit wat de verschijnselen zijn van een TIA en een herseninfarct (zie NHG-Standaard Beroerte)
- Instrueer de patiënt om bij zulke verschijnselen direct contact op te nemen met de (dienstdoende) huisarts.
Thuisarts
- Verwijs naar de informatie over atriumfibrilleren op thuisarts.nl. De informatie op Thuisarts is gebaseerd op deze NHG-Standaard.
- Verwijs de patiënt voor lotgenotencontact en andere informatie over het leven met hart- of vaataandoeningen naar Harteraad.
Niet-medicamenteuze behandeling
Naar Samenvatting ›Leefstijladviezen
Naar Samenvatting ›- Bespreek dat een gezonde leefstijl helpt om de ernst van de symptomen en het risico op hart- en vaatziekten te verminderen.
- Geef personen met overgewicht of obesitas (BMI ≥ 25) het algemene advies om voldoende te bewegen en op gezonde wijze af te vallen, zie NHG-Standaard Cardiovasculair risicomanagement.
- Adviseer regelmatig gematigd-intensief bewegen, geef zo nodig suggesties.
- Zie voor overige leefstijladviezen, zoals omgaan met stressoren, bewegen, roken, voeding, alcoholgebruik en lichaamsgewicht de Praktijkhandleiding Leefstijl.
Medicamenteuze behandeling
Naar Samenvatting ›Preventie van trombo-embolie met orale anticoagulantia
Naar Samenvatting ›- Alle patiënten met atriumfibrilleren hebben een verhoogd risico op trombo-embolische complicaties.
- Schat het risico op een herseninfarct in met de CHA2DS2-VASc-score (zie ook tabel 1) en bepaal aan de hand daarvan of er een indicatie is voor orale anticoagulantia. Dit geldt ook voor patiënten die geen klachten van het atriumfibrilleren ondervinden.
- De indicatie voor orale anticoagulantia is voor alle types atriumfibrilleren (paroxismaal, persisterend of permanent) hetzelfde.
| Letter | Kenmerk | Score |
|---|---|---|
| C | Hartfalen | 1 |
| H | Hypertensie | 1 |
| A2 | Leeftijd ≥ 75 jaar | 2 |
| D | Diabetes mellitus | 1 |
| S2 | Herseninfarct/TIA/trombo-embolie | 2 |
| V | Vaatlijden | 1 |
| A | Leeftijd 65-74 jaar | 1 |
| Sc | Vrouwelijk geslacht | 1 |
Risico op beroerte bij paroxismaal atriumfibrilleren
In het onderzoek van de Atrial Fibrillation Investigators bleek in de subgroep met paroxismaal atriumfibrilleren het risico op een beroerte even groot als bij de patiënten met persisterend of permanent atriumfibrilleren. Bij paroxismaal atriumfibrilleren moet ter preventie van trombo-embolische complicaties daarom hetzelfde beleid worden gevoerd als bij persisterend of permanent atriumfibrilleren.
Keuze van medicatie
Naar Samenvatting ›- Behandel patiënten met atriumfibrilleren en een indicatie voor behandeling met orale anticoagulantia
- Voor een trombocytenaggregatieremmer (TAR: acetylsalicylzuur en overige (zoals clopidogrel)) is geen plaats.
Trombocytenaggregatieremmers (TAR’s) versus VKA’s en DOAC’s
Bij de vorige herziening van deze NHG-Standaard (2013) is een samenvatting van het bewijs gegenereerd over de effectiviteit en risico’s van TAR’s in vergelijking met VKA’s en met DOAC’s (voor de vergelijking tussen DOACs en VKA’s, zie detail Keuze tussen DOAC of VKA). De samenvatting sluit nog steeds aan bij de huidige inzichten, zoals beschreven in de richtlijnen van ESC en NICE over atriumfibrilleren. In deze herziening is daarom besloten de samenvatting van het bewijs ongewijzigd te laten en alleen tekstuele aanpassingen te doen.
Effectiviteit en risico’s van trombocytenaggregatieremmers
Op het gebied van preventie van een trombo-embolie bij patiënten met atriumfibrilleren (zonder klepafwijkingen) zijn meerdere onderzoeken uitgevoerd. Ze zijn samengevat in een meta-analyse, waarvan de resultaten zijn vermeld in tabel d8.
Effectiviteit
Naar de effectiviteit van acetylsalicylzuur (een TAR) zijn 8 gerandomiseerde onderzoeken gepubliceerd (4876 patiënten; 9 gerandomiseerde vergelijkingen): 5 placebogecontroleerde onderzoeken, 2 onderzoeken waarin de controlegroep geen behandeling kreeg, 1 onderzoek waarin de combinatie van acetylsalicylzuur met een lage dosis warfarine (een VKA) werd vergeleken met een groep zonder behandeling, en 1 onderzoek waarin de combinatie van acetylsalicylzuur en dipyridamol (eveneens een TAR) werd vergeleken met placebo. Daarnaast is er een gerandomiseerd placebogecontroleerd onderzoek uitgevoerd naar de effectiviteit van dipyridamol. Gevonden werd een relatieve risicoreductie van een TAR op beroerte (bloedig en niet-bloedig) van 22% (95%-BI 6 tot 35%).
In de meta-analyse waren 6 onderzoeken opgenomen (n = 2900) waarin de effectiviteit van VKA’s zoals warfarine (meeste) en acenocoumarol werd vergeleken met placebo of afwachtend beleid. De relatieve risicoreductie op beroerte (bloedig en niet-bloedig) bleek 64% (95%-BI 49 tot 74%).
In 12 gerandomiseerde onderzoeken (12.963 patiënten) is de effectiviteit van VKA’s vergeleken met de effectiviteit van acetylsalicylzuur, met de effectiviteit van andere TAR’s (indobufen, triflusal en clopidogrel) en met de effectiviteit van acetylsalicylzuur in combinatie met een vaste, lage (ineffectieve) dosis warfarine. Er werd een relatieve risicoreductie op beroerte (bloedig en niet-bloedig) van 39% (95%-BI 22-52%) gevonden.
In tabel d8 zijn de resultaten van de meta-analyse samengevat in absolute risicoreducties per jaar op beroerte en number needed to treat (NNT). De auteurs concluderen dat VKA’s het risico op een beroerte bij patiënten met atriumfibrilleren met 60% verlagen en TAR’s met 20%, en dat VKA’s dus ongeveer 40% effectiever lijken dan TAR’s.
| Vergelijking | Primaire preventie: absolute risicoreductie per jaar op beroerte | Secundaire preventie: absolute risicoreductie per jaar op beroerte | Absolute risicotoename per jaar op ernstige bloeding | Absolute risicoreductie per jaar op totale mortaliteit |
|---|---|---|---|---|
| % (NNT)* | % (NNT)* | % (NNH)†* | % (NNT)* | |
| TAR versus placebo of afwachtend beleid | 0,8% (125) | 3,8% (26) | 0,2% (500) | 0,5% (200) |
| VKA versus placebo of afwachtend beleid | 2,7% (37) | 8,4% (12) | 0,3% (333) | 1,6% (63) |
| VKA versus TAR | 0,9% (111) | 3,9% (26)‡ | 0,2% (500) | 0,5% (200) |
* NNT = number needed to treat: het aantal patiënten dat gedurende een jaar behandeld moet worden om een extra ongewenste uitkomst (beroerte of dood) te voorkomen in vergelijking met het beleid in de controlegroep. † NNH = number needed to harm: het aantal patiënten dat gedurende een jaar behandeld moet worden om een extra bloeding te veroorzaken in vergelijking met het beleid in de controlegroep. ‡ De absolute risicoreductie bleek niet te berekenen; de vermelde absolute risicoreductie en het NNT zijn schattingen. Bron: Hart (2007). | ||||
Risico’s
Ook naar de complicaties van de verschillende antitrombotische behandelingen is een meta-analyse verricht. Dit betrof de gegevens van 5 gerandomiseerde onderzoeken (n = 3762) die TAR’s vergeleken met placebo of afwachtend beleid, 6 gerandomiseerde onderzoeken (n = 2900) die VKA’s vergeleken met placebo of afwachtend beleid en 8 gerandomiseerde onderzoeken (n = 3647) die VKA’s vergeleken met TAR’s. Omdat grote extra- en intracraniële bloedingen beduidend minder frequent voorkwamen dan herseninfarcten, zijn deze schattingen veel minder precies. Bovendien waren de intracraniële bloedingen bij een aantal onderzoeken ook inbegrepen in het totaal aantal beroertes waarvan melding werd gemaakt bij de beoordeling van de effectiviteit.
In de meta-analyse bleken 2 resultaten statistisch significant: het risico op intracraniële bloeding bleek verdubbeld bij gebruik van VKA’s vergeleken met TAR’s (de absolute risicotoename was met 0,2% per jaar echter klein), en de sterfte (door alle oorzaken) was 26% lager bij gebruik van VKA’s vergeleken met placebo. De resultaten van deze meta-analyse zijn eveneens opgenomen in tabel d8.
Omdat ouderen ondervertegenwoordigd waren in de genoemde onderzoeken en onduidelijk was of het risico op bloedingen juist bij hen niet het voordeel van VKA’s teniet zou doen, werd na publicatie van de genoemde meta-analyse het BAFTA-onderzoek uitgevoerd. In dit gerandomiseerde onderzoek in huisartsenpraktijken onder 75-plussers (n = 973; gemiddelde leeftijd 82 jaar; 20% = 85 jaar) werd warfarine vergeleken met acetylsalicylzuur (75 mg per dag). De follow-up bedroeg gemiddeld 2,7 jaar. Het primaire eindpunt (optreden van een invaliderende of fatale beroerte, intracraniële bloeding of een arteriële embolie) werd bereikt door 24 patiënten in de warfarinegroep versus 48 patiënten in de acetylsalicylzuurgroep (jaarlijks risico 1,8 versus 3,8%; RR 0,48; 95%-BI 0,28 tot 0,80; absolute jaarlijkse risicoreductie 2%; 95%-BI 0,7 tot 3,2). Het risico op een ernstige extracraniële bloeding was 1,4% per jaar in de warfarinegroep en 1,6% per jaar in de acetylsalicylzuurgroep. Dit verschil was niet statistisch significant.
Toevoeging clopidogrel
Sommige patiënten met atriumfibrilleren en een verhoogd risico op een trombo-embolie, voor wie een oraal anticoagulans geïndiceerd zou zijn, hebben een contra-indicatie voor orale anticoagulantia. Daarom werd in een gerandomiseerd dubbelblind onderzoek de effectiviteit bepaald van het toevoegen van clopidogrel (75 mg) aan acetylsalicylzuur. Dit onderzoek werd gepubliceerd na de eerder genoemde meta-analyse. In totaal werden 7554 patiënten met atriumfibrilleren en een contra-indicatie voor VKA’s gerandomiseerd over 2 groepen: de ene groep kreeg acetylsalicylzuur/clopidogrel, de andere acetylsalicylzuur/placebo. De primaire uitkomstmaat was het optreden van beroerte/TIA, myocardinfarct, een trombo-embolie buiten het centrale zenuwstelsel of dood door een vasculaire oorzaak. Gedurende de follow-up (mediane duur 3,6 jaar) werd dit primaire eindpunt waargenomen bij 832 patiënten (6,8% per jaar) in de clopidogrelgroep versus 924 patiënten (7,6% per jaar) in de placebogroep (RR 0,89; 95%-BI 0,81 tot 0,98).
Vooral het aantal beroertes droeg bij aan dit verschil (clopidogrelgroep 2,4% per jaar; placebogroep 3,3% per jaar; RR 0,72; 95%-BI 0,62 tot 0,83). Keerzijde was dat er in de clopidogrelgroep significant meer grote bloedingen optraden dan in de placebogroep (clopidogrelgroep 2,0% per jaar; placebogroep 1,3% per jaar; RR 1,57; 95%-BI 1,29 tot 1,92). In een aanvullende analyse van deze onderzoeksgegevens waarin het netto klinisch voordeel werd berekend door ischemische gebeurtenissen (herseninfarct of myocardinfarct) en bloedige gebeurtenissen (intracerebrale bloeding of subdurale of extracraniële bloeding) tegen elkaar af te wegen, bleek dat de combinatie acetylsalicylzuur/clopidogrel niet tot een significant voordeel leidde in vergelijking tot acetylsalicylzuur alleen.
Effectiviteit in relatie tot leeftijd
Daarnaast verscheen een meta-analyse op basis van individuele patiëntgegevens uit onderzoeken waarin patiënten over minimaal 2 van de volgende groepen gerandomiseerd waren: VKA, TAR of placebo/afwachtend beleid (12 onderzoeken, 8932 patiënten, 17.685 patiëntjaren van observatie). Ook de gegevens van de patiënten uit het BAFTA-onderzoek waren in deze meta-analyse opgenomen. In totaal was 19,6% van de patiënten ≥ 80 jaar. Deze meta-analyse leverde een aantal belangrijke bevindingen op.
Ten eerste bleek leeftijd een onafhankelijke risicofactor voor het optreden van een herseninfarct (geadjusteerde HR per 10 jaar toename in leeftijd 1,45; 95%-BI 1,26 tot 1,66), een ernstige bloeding (1,61; 95%-BI 1,47 tot 1,77) en een cardiovasculaire gebeurtenis (1,43; 95%-BI 1,33 tot 1,53).
Ten tweede bleken zowel VKA’s als TAR’s ten opzichte van placebo of afwachtend beleid het risico te reduceren op een herseninfarct (VKA’s 0,36; 95%-BI 0,29 tot 0,45; TAR’s 0,81; 95%-BI 0,72 tot 0,90) en op een cardiovasculaire gebeurtenis (VKA’s 0,59; 95%-BI 0,52 tot 0,66; TAR’s 0,81; 95%-BI 0,75 tot 0,88). VKA’s verhoogden echter ten opzichte van placebo het risico op een ernstige bloeding (1,56; 95%-BI 1,03 tot 2,37).
Ten derde nam de effectiviteit van VKA ter voorkoming van een herseninfarct in vergelijking met placebo slechts iets af met de leeftijd (statistisch niet significant). Het effect van TAR’s daarentegen nam in vergelijking met placebo wel beduidend af met de leeftijd (statistisch significant): vanaf een leeftijd van 77 jaar kon geen significante bescherming door TAR’s meer worden aangetoond ter voorkoming van een herseninfarct. De auteurs schrijven dit toe aan het feit dat TAR’s vooral effectief zijn bij de preventie van beroertes, die niet veroorzaakt worden door een embolie uit het hart maar door atherosclerose van de cerebrale bloedvaten. Naarmate de leeftijd vordert worden echter relatief meer beroertes veroorzaakt door embolieën uit het hart, die beter worden voorkomen door VKA’s dan door TAR’s.
In de meta-analyse bleef het beschermende effect van TAR’s op vasculaire gebeurtenissen echter wel aanwezig. Opgemerkt moet worden dat de uitkomsten in belangrijke mate zijn bepaald door de resultaten van het BAFTA-onderzoek, dat hierboven kritisch werd besproken. Bij toepassing van de CHA2DS2-VASc-score komen alle 75-plussers met atriumfibrilleren in aanmerking voor een oraal anticoagulans, tenzij er sprake is van een contra-indicatie.
Conclusie
VKA’s zijn bij patiënten met atriumfibrilleren effectiever met betrekking tot het voorkómen van een beroerte en mortaliteit dan TAR’s. Dit gunstige effect is groter dan het iets verhoogde risico op intra- en extracraniële bloedingen bij gebruik van VKA’s.
Boven de leeftijd van 75 jaar lijken TAR’s, in tegenstelling tot VKA’s, niet of nauwelijks effectief om een herseninfarct te voorkómen, maar nog wel zinvol ter preventie van overige cardiovasculaire gebeurtenissen en ter reductie van totale mortaliteit.
Effectiviteit van directe orale anticoagulantia in vergelijking met trombocytenaggregatieremmers
Er is 1 onderzoek gepubliceerd waarin een DOAC (apixaban) werd vergeleken met een TAR (acetylsalicylzuur): de AVERROES-trial. In deze dubbelblinde, gerandomiseerde trial werden 5599 patiënten met atriumfibrilleren geïncludeerd voor wie behandeling met VKA’s ongeschikt was (gemiddelde leeftijd 70 jaar, 41,5% vrouwen). De meest voorkomende redenen (meerdere tegelijk mogelijk) waarom de deelnemers niet met VKA’s konden worden behandeld waren de onmogelijkheid om INR op regelmatige basis te bepalen (43%), weigering van de patiënt om VKA’s te gebruiken (38%), een CHADS2-score van 1 (21%), instabiele INR bij gebruik van VKA’s (17%) en zorgen over therapietrouw (15%). De deelnemers werden gerandomiseerd naar behandeling met apixaban (2 × 5 mg per dag; n = 2808) of acetylsalicylzuur (1-4 × 81 mg per dag; n = 2791). De primaire effectiviteitsuitkomst was het optreden van een intracraniële bloeding of herseninfarct of andere trombo-embolie; de primaire veiligheidsuitkomst was het optreden van een ernstige bloeding. Na een gemiddelde follow-upduur van 1,1 jaar werd het onderzoek vroegtijdig beëindigd omdat de effectiviteit van apixaban die van acetylsalicylzuur ruimschoots overtrof. In deze periode trad het primaire eindpunt 51 × op in de apixabangroep (1,6% per jaar) en 113 × in de acetylsalicylzuurgroep (3,7% per jaar; HR 0,44; 95%-BI 0,32 tot 0,62). In de apixabangroep traden 44 ernstige bloedingen op (1,4% per jaar), waarvan 11 intracraniële bloedingen, en in de acetylsalicylzuurgroep traden 39 ernstige bloedingen op (1,2% per jaar; HR 1,13; 95%-BI 0,74 tot 1,75), waarvan 13 intracraniële bloedingen. De sterfte was 3,5% per jaar in de apixabangroep en 4,4% per jaar in de acetylsalicylzuurgroep (HR 0,79; 95%-BI 0,62 tot 1,02).
In een vooraf vastgestelde subgroepanalyse werd onderscheid gemaakt tussen primaire en secundaire preventie. Bij de patiënten met een eerder doorgemaakte beroerte of TIA traden 10 gevallen van beroerte of trombo-embolie op in de apixabangroep (n = 390; 2,39% per jaar) en 33 in de acetylsalicylzuurgroep (n = 374; 9,16% per jaar; HR 0,29; 95%-BI 0,15 tot 0,60). Bij de patiënten die niet eerder een beroerte of TIA hadden doorgemaakt, traden 41 gevallen van de beroerte of systemische trombo-embolie op in de apixabangroep (n = 2417; 1,68% per jaar) en 80 in de acetylsalicylzuurgroep (n = 2415; 3,06% per jaar; HR 0,51; 95%-BI 0,35 tot 0,74). Het verschil in effect van apixaban tussen primaire en secundaire preventie was niet statistisch significant (p voor interactie 0,17). Ernstige bloedingen kwamen ongeveer 3 × zo veel voor bij de patiënten die eerder een beroerte of TIA hadden doorgemaakt als bij de patiënten die niet eerder een beroerte of TIA hadden doorgemaakt, maar dit was niet afhankelijk van de behandeling (apixaban of acetylsalicylzuur).
Conclusie
Apixaban beschermt patiënten met atriumfibrilleren beter tegen een beroerte of trombo-embolie dan acetylsalicylzuur, zonder toename van het risico op ernstige bloedingen. Hoewel van de thans beschikbare DOAC’s alleen apixaban is vergeleken met een trombocytenaggregatieremmer, is het aannemelijk dat het gevonden verschil in effectiviteit ook voor de overige DOAC’s geldt.
Indicaties orale anticoagulantia
Naar Samenvatting ›- Behandel met orale anticoagulantia:
- vrouwen met CHA2DS2-VASc-score ≥ 3
- mannen met CHA2DS2-VASc-score ≥ 2
- Bij vrouwen met CHA2DS2-VASc-score 2 en bij mannen met CHA2DS2-VASc-score 1 is het onduidelijk of het voordeel van orale anticoagulantia (preventie van trombo-embolie) over het algemeen opweegt tegen het risico op bijwerkingen, zoals bloedingen.
- Dit betreft in de huisartsenpraktijk meestal jongere patiënten.
- Bij deze patiënten wordt vaak ook ritmebehandeling overwogen, waarvoor verwijzing naar de cardioloog nodig is.
- Bij verwijzing overweegt de cardioloog de indicatie voor behandeling met orale anticoagulantia in overleg met de patiënt.
- Overweeg consultatie van de cardioloog over de indicatie voor antistolling indien de patiënt niet verwezen wordt voor een ritmebehandeling
- Bij mannen en vrouwen met CHA2DS2-VASc-score 0 en bij vrouwen met CHA2DS2-VASc-score 1 weegt het voordeel van orale anticoagulantia over het algemeen niet op tegen het risico op bijwerkingen.
Indicatie voor antitrombotische behandeling
Het absolute risico op een herseninfarct bepaalt de keuze voor antitrombotische behandeling. Voor de keuze van antitrombotische behandeling heeft de werkgroep gebruikgemaakt van een risicostratificatie op basis van de CHA2DS2-VASc-score (zie ook Voorspellers voor trombo-embolische complicaties). Dit model kent per risicofactor 1 (hartfalen, hypertensie, leeftijd 65-75 jaar, diabetes mellitus, vaatlijden, vrouwelijk geslacht) of 2 (leeftijd > 75 jaar, doorgemaakte beroerte of TIA) punten toe.
- Van Staa (2011) heeft de risico's op een ischemische beroerte afhankelijk van de CHA2DS2-VASc-score in kaart gebracht bij bijna 80.000 patiënten met atriumfibrilleren in de huisartsenpraktijk. Het risico op een herseninfarct liep op van 0,5% per jaar bij CHA2DS2-VASc-score 0 tot > 12% per jaar bij CHA2DS2-VASc scores ≥ 2.
- Olesen (2011) en Friberg (2012): in 2 cohortonderzoeken uit Denemarken en Zweden is het ‘netto klinische voordeel’ berekend van VKA’s in groepen met verschillende CHA2DS2-VASc-scores. Dit netto klinische voordeel werd gedefinieerd als het jaarlijks percentage voorkomen herseninfarcten minus het jaarlijks percentage extra hersenbloedingen door VKA’s, waarbij aan hersenbloedingen een gewicht van 1,5 werd toegekend vanwege de over het algemeen ernstigere uitkomst. Beide cohortonderzoeken lieten zien dat VKA’s bij mensen met CHA2DS2-VASc-score 0 een negatief netto klinisch voordeel (dus nadeel) hadden, bij CHA2DS2-VASc-score 1 een neutraal klinisch voordeel en bij CHA2DS2-VASc-score ≥ 2 een positief klinisch voordeel.
- Coppens (2013): deze analyse van deelnemers aan interventieonderzoeken bevestigt bovenstaande conclusie. Het risico op herseninfarct voor patiënten met CHA2DS2-VASc-score 1 was ongeveer 0,9% per jaar. Hiermee is het onwaarschijnlijk dat deze groep patiënten baat heeft bij behandeling met orale anticoagulantia, gegeven het risico op bloedingen dat met deze behandeling geassocieerd is. Orale antistolling zou het absolute risico op een herseninfarct weliswaar met ongeveer 0,5% (60% relatieve risicoreductie) kunnen verlagen, maar het extra risico op intracraniële bloedingen is in trials echter ongeveer 0,3% en ligt in de praktijk waarschijnlijk hoger. Gegeven het feit dat intracraniële bloedingen meestal ernstiger zijn dan herseninfarcten en aangezien orale anticoagulantia ook andere bijwerkingen hebben (zoals gastro-intestinale bloedingen), is de winst van orale anticoagulantia voor deze patiënten twijfelachtig.
De ESC-richtlijn Atriumfibrilleren beveelt orale anticoagulantia aan bij vrouwen met CHA2DS2-VASc-score ≥ 3 en mannen met CHA2DS2-VASc-score ≥ 2, en raadt orale anticoagulantia af bij vrouwen met CHA2DS2-VASc-score 1 en mannen met CHA2DS2-VASc-score 0. Dit zijn sterke aanbevelingen. Bij vrouwen met CHA2DS2-VASc-score 2 en mannen met CHA2DS2-VASc-score 1 adviseert de ESC-richtlijn om orale anticoagulantia te overwegen en de behandeling in overleg met de patiënt af te stemmen op eventuele individuele voordelen voor de patiënt.
Overwegingen
De werkgroep neemt de aanbevelingen over voor patiënten met een lage CHA2DS2-VASc-score (vrouwen 1, mannen 0) en voor patiënten met een hoge CHA2DS2-VASc-score (vrouwen ≥ 3 en mannen ≥ 2). De werkgroep wijkt af van de zwakke aanbeveling om orale anticoagulantia te overwegen bij vrouwen met CHA2DS2-VASc-score 2 en mannen met CHA2DS2-VASc-score 1. Uit validatieonderzoek van de CHA2DS2-VASc-score blijkt dat er nog discussie is over de daadwerkelijke voorspellende waarde van een lage score voor een herseninfarct. Welke score ook daadwerkelijk een laag risico op herseninfarct voorspelt, blijkt sterk te variëren . Daarnaast blijkt dat patiënten met atriumfibrilleren in de huisartsenpraktijk een klinisch relevant lager risico op een herseninfarct hebben dan de ziekenhuispopulatie. Ten derde maken patiënten met atriumfibrilleren en een lage CHA2DS2-VASc-score maar een heel klein deel uit van alle patiënten met atriumfibrilleren in de huisartsenpraktijk en zal het merendeel van hen op basis van andere kenmerken al naar de cardioloog worden verwezen.
Conclusies
- Bij vrouwen met CHA2DS2-VASc-score ≥ 3 en mannen met CHA2DS2-VASc-score ≥ 2 is er een indicatie voor behandeling met antistolling.
- Het is onduidelijk of bij mannen met CHA2DS2-VASc-score 1 en bij vrouwen met CHA2DS2-VASc-score 2 het voordeel van antistolling (preventie van trombo-embolie) opweegt tegen de nadelen (risico van bloedingen).
- Bij een patiënten met CHA2DS2-VASc-score 0 (patiënten < 65 jaar zonder relevante cardiovasculaire comorbiditeit) en bij vrouwen met CHA2DS2-VASc-score 1 weegt het voordeel van orale anticoagulantia over het algemeen niet op tegen het risico op bijwerkingen.
Contra-indicaties orale anticoagulantia
Naar Samenvatting ›- Een absolute contra-indicatie voor alle orale anticoagulantia is een actuele klinisch relevantie bloeding. Verwijs in dat geval (zie Consultatie en verwijzing).
- De relatieve contra-indicaties van orale anticoagulantia hebben vooral betrekking op het ingeschatte risico op bloedingen. Bij een relatieve contra-indicatie zal het voordeel van de antistollingsbehandeling moeten worden afgewogen tegen het nadeel van het verhoogde bloedingsrisico.
- Bij veruit de meeste patiënten met ≥ 1 relatieve contra-indicatie weegt het voordeel van de antistollingsbehandeling op tegen het nadeel van het verhoogde bloedingsrisico.
- De belangrijkste relatieve contra-indicaties van orale anticoagulantia zijn:
- hoge leeftijd
- verhoogd valrisico
- verminderde nierfunctie
- leverinsufficiëntie (afhankelijk van het gekozen middel)
- alcoholmisbruik
- ongecontroleerde hypertensie
- verhoogd risico op klinisch relevante bloedingen (bijvoorbeeld door ulcus pepticum, bekende oesofagusvarices of een hematologisch verhoogde bloedingsneiging)
- recent doorgemaakte klinisch relevante bloeding.
De contra-indicaties van orale anticoagulantia hebben vooral betrekking op het risico op bloedingen. De hier genoemde contra-indicaties zijn een interpretatie van de per geneesmiddelgroep genoemde contra-indicaties in de KNMP-Kennisbank en van de contra-indicaties zoals beschreven in de leidraad de Kunst van het doseren van de Federatie van Nederlandse Trombosediensten (FNT).
Voor het inschatten van het risico op bloedingen bij het gebruik van orale anticoagulantia is de HAS-BLED-score ontwikkeld:
- Hypertension (1 punt)
- Abnormal renal and liver function (1 punt voor nier, 1 punt voor lever)
- Stroke (1 punt)
- Bleeding (1 punt)
- Labile INRs (1 punt)
- Elderly (1 punt)
- Drugs or alcohol (1 punt voor medicatie, 1 punt voor alcohol).
Hoewel de internationale ESC-richtlijn toepassing van deze score adviseert , raadt de werkgroep toepassing van de HAS-BLED-score door huisartsen niet aan, omdat deze niet gevalideerd is in eerstelijnspopulaties.
Keuze tussen DOAC of VKA
Naar Samenvatting ›- Niet-kwetsbare patiënten met nieuw vastgesteld atriumfibrilleren: we bevelen aan een DOAC voor te schrijven, tenzij er goede redenen zijn voor een VKA (zie tabel 2).
- Kwetsbare ouderen met nieuw vastgesteld atriumfibrilleren: bespreek de voordelen en de nadelen van een DOAC of VKA met de patiënt aan de hand van de onderscheidende kenmerken (zie tabel 2) en maak op individueel niveau een zorgvuldige keuze (zie Aandachtspunten bij kwetsbare ouderen ).
- Patiënten met bestaand atriumfibrilleren die VKA’s gebruiken: overweeg een VKA om te zetten naar een DOAC bij patiënten die minder goed ingesteld zijn of als de trombosedienst of de patiënt daarom vraagt. Bespreek de voordelen en de nadelen met de patiënt (zie tabel 2).
- Let op contra-indicaties en interacties. DOAC’s hebben meer absolute contra-indicaties dan VKA’s (zie tabel 2).
| VKA | DOAC | |||
|---|---|---|---|---|
| Effectiviteit | Bewezen effectiviteit en veel ervaring, ook bij ouderen |
| ||
| Veiligheid | – | Consistent beeld van minder hersenbloedingen dan bij VKA, ook in subgroepen, maar minder onderzoek/ervaring bij kwetsbare ouderen | ||
| Absolute contra-indicaties | – |
| ||
| Relatieve contra-indicaties | – | Antifosfolipidensyndroom (overleg voorafgaand aan de behandeling met de internist) | ||
| Interacties | Relatief veel interacties | Beperkte interacties, per DOAC enigszins verschillend (Zie Praktische uitwerking DOAC’s) | ||
| Bijwerkingen | – | Vaker buikklachten, zoals misselijkheid en dyspepsie | ||
| Beleid bij couperen werking |
|
| ||
| Praktisch |
|
| ||
- Op basis van de beschreven onderzoeken bij patiënten > 65 jaar met nieuw vastgesteld atriumfibrilleren lijken DOAC’s effectiever dan VKA’s (iets lagere kans op een herseninfarct of systemische embolie). Daarnaast lijken DOAC’s veiliger dan VKA’s (iets lagere kans op ernstige bloedingen en intracraniële bloedingen). We vonden geen verschil in gastro-intestinale bloedingen. We bevelen daarom aan een DOAC voor te schrijven bij patiënten met nieuw vastgesteld atriumfibrilleren.
- Bij kwetsbare ouderen met atriumfibrilleren is minder onderzoek voorhanden. De onderzoeken bij deze specifieke groep geven ongeveer dezelfde conclusies als bij de patiënten > 65 jaar. De werkgroep vindt het van belang bij deze kwetsbare groep de voor- en nadelen van DOACs ten opzichte van VKA’s af te wegen en zo een keuze te maken.
- Bij patiënten die vanwege eerder vastgesteld atriumfibrilleren al een VKA gebruiken, vindt de werkgroep het belangrijk om bij de controles het medicatiegebruik te bespreken met de patiënt. Tijdens dit gesprek kunnen voor- en nadelen van VKA’s en DOACs besproken worden (zie tabel 2), zodat de patiënt zelf een afweging en een keuze kan maken. De werkgroep ziet op dit moment onvoldoende redenen om patiënten actief over te zetten op een DOAC.
Voor- en nadelen
- Voordeel: DOAC’s zijn mogelijk effectiever en veiliger dan VKA’s; ook bij mensen met een hogere leeftijd en (meestal) ook bij kwetsbare patiënten.
- Nadeel: DOAC’s hebben als bijwerking regelmatig buikklachten, zoals dyspepsie.
Kwaliteit van bewijs
De kwaliteit van het bewijs is (zeer) laag. Er werd afgewaardeerd in verband met inconsistentie (heterogeniteit) en publicatiebias (commercieel gefinancierde onderzoeken).
Waarden en voorkeuren van patiënten
Patiënten zullen in de eerste plaats effectiviteit, veiligheid en bijwerkingen belangrijk vinden. Voor een patiënt is het lastig in te schatten wat een zoveel keer hoger risico op een bloeding betekent. Hierdoor kan het voor een patiënt moeilijk zijn om een voorkeur aan te geven (zie Voorlichting).
Kosten
De kosten van een DOAC zijn 56-68 euro per maand. De kosten van een VKA zijn een stuk lager: bijvoorbeeld acenocoumarol kost € 0,02 per tablet, bij 60 tabletten per maand zijn de kosten € 1,20 (Medicijnkosten.nl, geraadpleegd februari 2022). Bij VKA’s komen echter de kosten voor de begeleiding door de trombosedienst. Deze kosten variëren per trombosedienst en per verzekeraar. Als de patiënt via zelfcontrole samen met de trombosedienst de INR controleert, kost dit per kwartaal maximaal € 167,50, dat is € 55,83 per maand (Vergoeding trombosezorg). De kosten van volledige controle door de trombosedienst zijn bij de werkgroep niet bekend.
Aanvaardbaarheid
Zowel DOAC’s als VKA’s zijn voor patiënt en huisarts aanvaardbare geneesmiddelen om mee te behandelen. Beiden hebben verschillende voor- en nadelen, afweging hiervan kan per patiënt verschillen (zie tabel 2). Praktische overwegingen kunnen van belang zijn bij de keuze, zoals innamefrequentie en gebruiksgemak, controles door trombosedienst of arts, en interacties met andere geneesmiddelen.
Haalbaarheid
De huisarts kan sinds 2016 DOAC’s voorschrijven en is inmiddels goed bekend met zowel VKA’s als DOAC’s. Er zijn voldoende instructies voorhanden wanneer een dosisaanpassing van een DOAC nodig is of wanneer er contra-indicaties zijn bij VKA’s dan wel DOAC’s. De trombosedienst is een betrouwbare, ervaren instantie die al decennialang zorg levert bij de controle van de INR.
Uitgangsvraag
- Zijn direct-werkende orale anticoagulantia (DOAC’s) aan te bevelen boven VKA’s bij patiënten ≥ 65 jaar met atriumfibrilleren zonder klepafwijking in de huisartsenpraktijk?
- De werkgroep heeft als minimaal klinisch relevant verschil een OR, RR of HR < 0,75 of > 1,25 genomen.
| Patiënten | Patiënten ≥ 65 jaar met atriumfibrilleren zonder klepafwijking in de huisartsenpraktijk Subgroep: kwetsbare patiënten met atriumfibrilleren zonder klepafwijking |
| Interventie | DOAC (apixaban, dabigatran, edoxaban, rivaroxaban) |
| Vergelijking | VKA |
| Uitkomstmaten | Cruciaal:
Belangrijk:
|
Achtergrond
Voor de preventie van ischemische beroerte en systemische trombo-embolieën bij patiënten met atriumfibrilleren zonder klepafwijking worden DOAC’s in deze NHG-Standaard sinds 2017 beschouwd als gelijkwaardig alternatief voor VKA’s. Er was echter weinig bewijs voor gelijkwaardigheid bij kwetsbare ouderen en patiënten met multimorbiditeit voorhanden. Er bestaat geen eenduidige definitie van kwetsbaarheid. We volgen in dit detail de omschrijving van het concept kwetsbaarheid, zoals beschreven in NHG-Standaard CVRM, bijlage 1.
De NVVC-richtlijn en de ESC-richtlijn geven inmiddels voorkeur aan een DOAC boven VKA’s bij patiënten met atriumfibrilleren (ook bij ouderen met atriumfibrilleren), tenzij er een contra-indicatie is voor een DOAC. Deze richtlijnen doen geen duidelijke aanbeveling over een VKA dan wel DOAC bij de groep kwetsbare ouderen. Aangezien er veel onderzoek is verschenen de afgelopen jaren, DOAC’s inmiddels ongeveer 10 jaar in de praktijk worden voorgeschreven en andere bezwaren (bijvoorbeeld het ontbreken van een antidotum) inmiddels opgelost zijn, is de vraag of een DOAC inmiddels ook bij patiënten met atriumfibrilleren in de huisartsenpraktijk de voorkeur verdient boven een VKA. Daarnaast is de vraag of er inmiddels meer onderzoek bekend is over DOACs bij kwetsbare ouderen, zodat er ook voor deze groep een aanbeveling kan worden gegeven.
Methoden
Er is een systematische literatuurzoekactie naar SR’s en RCT’s uitgevoerd in PubMed en Embase in maart 2022.
Resultaten
Resultaat zoekactie
De zoekactie leverde 3 systematische reviews op naar de vergelijking tussen DOAC’s en VKA’s bij atriumfibrilleren: Erdem (2022; zoekdatum 5 november 2019), Bonanad (2021; zoekbandbreedte 2010-2020) en Sun (2019; zoekdatum onbekend). Een aanvullende search na de zoekdatum van deze 3 SR’s leverde 10 aanvullende onderzoeken op: Bang (2020), Coleman (2020), Frappé (2020), Huybrechts (2020), Milentijevic (2021), Pastori (2021), Perreault (2021), Van den Dries (2020a), Van Ganse (2020) en Yamashita (2022). De update van de search in februari 2023 leverde 1 SR en 5 aanvullende onderzoeken op. De resultaten van deze onderzoeken zijn in lijn met de eerder beschreven onderzoeken en ondersteunen de aanbeveling.
Er werden in de literatuurzoekactie geen onderzoeken specifiek over kwetsbare ouderen gevonden; het enige gevonden onderscheid was leeftijd. Met behulp van snowballing aan de hand van een onderzoeksdesign, werden wel 3 artikelen gevonden over kwetsbare ouderen.
Onderzoekskarakteristieken
De werkgroep includeerde 3 SR’s omdat de onderzoekstypes (RCT en observationeel onderzoek), de leeftijdsgrenzen (≥ 65 jaar en ≥ 80 jaar) en de analyse (op groepsniveau of per DOAC apart) per review verschilden. De werkgroep vond het belangrijk al deze resultaten te presenteren.
Na de zoekdata van Erdem en Bonanad zijn nog 10 onderzoeken verschenen met betrekking tot dit onderwerp (zie Totstandkoming, Bijlage 7). Voor de 3 artikelen over kwetsbare ouderen, zie tabel d9.
NB. Vrijwel alle onderzoeken zijn uitgevoerd met warfarine als VKA en niet met het in Nederland veel voorgeschreven acenocoumarol en fenprocoumon. We gaan ervan uit dat de werkzaamheid van deze VKA’s gelijkwaardig is.
- Erdem 2022 includeerde 5 RCT’s met ≥ 1 jaar follow-up waarin een DOAC werd vergeleken met warfarine bij patiënten > 65 jaar met niet-valvulair atriumfibrilleren: RELY (dabigatran 2 dd 150 mg vs. VKA;44 landen over de hele wereld), ARISTOTLE (apixaban 2 dd 5 mg vs. VKA; 39 landen), ENGAGE-AF (edoxaban 1 dd 60 mg/30 mg vs. VKA; 46 landen), ROCKET-AF (rivaroxaban 1 dd 20 mg vs. VKA; 45 landen) en J-ROCKET-AF (rivaroxaban 1 dd 15 mg vs. VKA; Japan). Het totaal aantal patiënten in de meta-analyse was 73.122 (65.787 in tabel d11) De gemiddelde leeftijd van de patiënten in de RCT’s was 70-73 jaar. In alle onderzoeken was het streven om de INR tussen de 2 en 3 te houden (er wordt echter geen informatie gegeven bij hoeveel procent van de deelnemers dit daadwerkelijk het geval was). De follow-upperiode was 1,4-2,8 jaar. (Sponsoring door industrie: zie Totstandkoming, Bijlage 7.) Primaire uitkomstmaten waren herseninfarct of systemische embolie (effectiviteit) en ernstige bloedingen (niet verder gespecificeerd) (veiligheid) (analyses in totaal en voor patiënten onder of boven 75 jaar). NB. Erdem maakte geen onderscheid tussen intracraniële en gastro-intestinale bloedingen.
- Bonanad 2021 includeerde 16 onderzoeken waarin het effect van DOAC’s met VKA’s werd vergeleken in patiënten > 80 jaar met atriumfibrilleren. Het betrof 5 RCT’s (waaronder 2 RCT’s die ook in Erdem zitten: RELY en ARISTOTLE) en 11 observationele onderzoeken. Het totaal aantal patiënten in de uitgevoerde meta-analyse was 147.067. De gemiddelde leeftijd van de patiënten in de onderzoeken was 86 jaar. De follow-up periode varieerde van 0,7 tot 3 jaar. De onderzoeken waren uitgevoerd in Spanje, Taiwan, Verenigde Staten, Frankrijk, Italië, Japan en internationaal. (Sponsoring door industrie: zie Totstandkoming, Bijlage 7) Primaire uitkomsten waren herseninfarct en sterfte door alle oorzaken (effectiviteit) en ernstige bloedingen (niet verder gespecificeerd) en intracraniële bloedingen (veiligheid). NB. Bonanad gaf alleen summiere informatie over gastro-intestinale bloedingen.
- Sun 2019 includeerde 22 onderzoeken (voornamelijk observationeel) over DOAC’s versus warfarine bij atriumfibrilleren: 14 uit de Verenigde Staten, 5 uit Zuid-Oost Azië en 3 uit Europa. (Dit is de enige informatie die Sun geeft over de onderzoeken, er wordt niets geschreven over aantal patiënten, leeftijd of follow-upperiode. De leeftijd is nagezocht: gemiddeld 66-77 jaar.) Bayesiaanse analyses werden uitgevoerd met data uit deze onderzoeken om de hazard ratio’s van DOAC’s te berekenen voor wat betreft effectiviteit (herseninfarct) en veiligheid (ernstige bloeding (niet verder gespecificeerd), intracraniële bloeding, gastro-intestinale bloeding).
| Bron | Land, follow-upduur | Deelnemers | DOAC vs. VKA | Uitkomstmaten* |
|---|---|---|---|---|
| Kim (2021), cohortonderzoek | USA, mediaan 72 dagen | n = 158.712 Gemiddelde leeftijd 77 jaar | DOAC’s vs. warfarine | Samengestelde score (infarct, ernstige bloeding, sterfte) Sterfte Gastro-intestinale bloeding Intracraniële bloeding |
| Kwetsbaarheid gebaseerd op de Claims-based Frailty Index met 93 variabelen waarin diagnoses en medicaties meegenomen worden. | ||||
| Wilkinson (2020), observationeel onderzoek | 46 landen, mediaan 2,8 jaar | n = 20.867
Gemiddelde leeftijd onbekend | Edoxaban (30/60 mg) vs. warfarine† | Samengestelde score (beroerte, systemische embolie, ernstige bloedng, sterfte) Sterfte |
| Kwetsbaarheid gebaseerd op een eigen index met 40 items, onderverdeeld in comorbiditeiten, laboratoriumwaarden, kwaliteit van leven en lichamelijk onderzoek | ||||
| Martinez (2018), post-hocanalyse RCT (ENGAGE-AF) | USA, mediaan 0,9 – 1,8 jaar
| n = 21.508 Gemiddelde leeftijd 86 jaar Allemaal frail | DOAC’s vs. warfarine | Beroerte/systemische embolie Ernstige bloeding Gastro-intestinale bloeding Intracraniële bloeding |
| Kwetsbaarheid gebaseerd op de Johns Hopkins Claims-based Frailty Indicator met 21 items waaronder verminderde mobiliteit, depressie, hartfalen, ziekte van Parkinson, artritis en vergeetachtigheid. | ||||
* Bij variatie in follow-upduur en/of interventieduur wordt vaak met een HR gerekend en niet met een RR, omdat een HR rekening houdt met verschil in follow-upduur en een RR niet. De getallen zijn wel vergelijkbaar. † De HR’s van edoxaban 30 mg zijn nagenoeg gelijk. | ||||
Effectiviteit
zie tabel "Patiënten >65 jaar", "Patiënten 65-75 jaar", "Patiënten >75 of >80 jaar", "Apixaban", "Dabigatran", "Rivaroxaban" voor de samenvatting van de resultaten. Voor de resultaten van de 3 SR’s zie tabellen d10-d15 . Voor de resultaten van de 3 artikelen over kwetsbare ouderen, zie Totstandkoming, Bijlage 7.
- Bijwerkingen DOAC’s volgens Kennisbank KNMP: de belangrijkste veelvoorkomende bijwerkingen zijn niet-ernstige bloedingen, buikklachten, waaronder dyspepsie en misselijkheid, en jeuk. Ernstige, zeldzame, bijwerkingen zijn ernstige, potentieel levensbedreigende bloedingen en anafylactische reacties.
- Bijwerkingen VKA’s volgens Kennisbank KNMP: de belangrijkste veelvoorkomende bijwerkingen zijn niet-ernstige bloedingen. Ernstige, zeldzame bijwerkingen zijn ernstige, potentieel levensbedreigende bloedingen.
- De HR’s gevonden in onderzoeken verschenen na de zoekdatum van de SR’s passen in of rond de 95%-betrouwbaarheidsintervallen (van RR’s) van de reviews (zie Totstandkoming).
- De HR’s gevonden in onderzoeken met betrekking tot kwetsbare ouderen vallen ook in of rond de 95% betrouwbaarheidsintervallen (van RR’s) van de reviews (zie Totstandkoming).
Conclusies
Effectiviteit
- Het gebruik van DOAC’s bij atriumfibrilleren zorgt mogelijk voor een iets lagere kans op een herseninfarct of systemische embolie dan gebruik van VKA’s (voor patiënten > 65 jaar) (kwaliteit van bewijs laag).
- Het verschil in effect op sterfte tussen DOAC's en VKA's is onzeker (kwaliteit van bewijs zeer laag).
Veiligheid
- Het gebruik van DOAC’s bij atriumfibrilleren zorgt mogelijk voor een iets lagere kans op ernstige bloedingen dan gebruik van VKA’s (voor alle leeftijden) (kwaliteit van bewijs laag).
- Het gebruik van DOAC's zorgt mogelijk voor een lager risico op intracraniële bloedingen dan gebruik van VKA’s (kwaliteit van bewijs laag).
- Er is mogelijk geen verschil in gastro-intestinale bloedingen bij gebruik van DOAC's en VKA's (kwaliteit van bewijs laag).
Subgroep ouderen
Bovenstaande conclusies gelden (in meer of mindere mate) ook voor de subgroep ouderen.
Overige
- De resultaten op basis van RCT’s en observationeel onderzoek gaven hetzelfde beeld.
- Er zijn geen onderzoeken gevonden met als uitkomstmaat de bijwerking dyspepsie. Maar uit de gegevens van de KNMP-Kennisbank blijkt dat buikklachten, waaronder dyspepsie en misselijkheid, bij DOAC’s veelvoorkomende bijwerkingen zijn.
- Er zijn geen onderzoeken gevonden met als uitkomstmaat kwaliteit van leven.
Antistolling bij kwetsbare ouderen
Naar Samenvatting ›- Kwetsbare ouderen met atriumfibrilleren zijn een specifieke groep patiënten vanwege:
- de hoge prevalentie van atriumfibrilleren
- de aanwezigheid van comorbiditeit en frequente (niet-cardiale) ziekenhuisopnames
- het hoge risico op trombo-embolie én het hoge risico op bloedingen
- Bij vrijwel alle kwetsbare ouderen heeft het voorschrijven van antistolling de voorkeur boven het onthouden van antistolling.
- Maak op individueel niveau een keuze voor een DOAC of een VKA. Beide opties hebben voor- en nadelen (zie tabel 2).
- Regelmatige controles door de huisarts met als doel ‘veilige antistolling’ zijn bij kwetsbare ouderen van extra belang (zie Controles, zie ook LTA Antistolling). Veelal is de patiënt niet (meer) onder behandeling bij de cardioloog.
- Ook bij kwetsbare ouderen is geen plaats voor een trombocytenaggregatieremmer (niet effectief en hoog risico op bloedingen).
De adviezen over aandachtspunten bij kwetsbare ouderen berusten op consensus binnen de werkgroep en zijn gebaseerd op de ESC-richtlijn Atriumfibrilleren en het onderzoek van Joosten.
Uit onderzoek onder 2068 eerstelijns oudere patiënten met atriumfibrilleren (gemiddelde leeftijd 78 jaar, bandbreedte 69-84) die orale anticoagulantia gebruikten, blijkt dat het risico op ziekenhuisopname en mortaliteit hoog blijven, ondanks dat de orale anticoagulantia het risico op een herseninfarct effectief verlagen. Het incidentierisico (IR) per 100 persoonsjaren was 22,1 voor ziekenhuisopname en 6,7 voor mortaliteit. Hierbij waren niet-cardiale complicaties (zoals infecties) vaker de reden dan cardiale complicaties (IR 15,7 vs. 7,6 per 100 persoonsjaren voor ziekenhuisopnames en 5,0 vs. 1,7 per 100 persoonsjaren voor mortaliteit). De IR’s voor herseninfarct en ernstige bloedingen waren 1,7 en 0,8 per 100 persoonsjaren.
Atriumfibrilleren tijdens intercurrente ziekte
Naar Samenvatting ›- Overweeg behandeling met antistolling op basis van de CHA2DS2-VASc-score (zie Preventie van trombo-embolie) voor een periode van ongeveer 4-6 weken.
- Overweeg om na deze periode de antistolling te stoppen, mits de intercurrente ziekte over is én de patiënt weer sinusritme heeft. Doe dit in overleg met de patiënt en instrueer deze alert te zijn op eventueel opnieuw optredend atriumfibrilleren.
- Daarnaast is het zinvol om bij deze patiënten een cardiovasculair risicoprofiel op te stellen (zie NHG-Standaard Cardiovasculair risicomanagement). Hiermee kunnen eventuele risicofactoren voor een recidief van atriumfibrilleren in de toekomst worden geïnventariseerd en vast worden behandeld.
Er is geen literatuur gevonden met betrekking tot antistolling (lang of kortdurend) bij patiënten bij wie een eerste aanval van niet-valvulair atriumfibrilleren wordt vastgesteld bij een intercurrente ziekte in de eerste lijn. De werkgroep heeft daarom op basis van expert opinion een aanbeveling geformuleerd.
De werkgroep adviseert om ook bij patiënten met een intercurrente ziekte de diagnose ‘atriumfibrilleren’ alleen te stellen op basis van een 12-kanaals-ecg of een 1-kanaals-ecg met een duur ≥ 30 seconden. Het is aannemelijk dat een patiënt tijdens een intercurrente ziekte (infectie/inflammatie in combinatie met verminderde mobiliteit) met daarbij vastgesteld atriumfibrilleren een verhoogd risico op een trombo-embolie heeft. De werkgroep adviseert daarom patiënten met atriumfibrilleren tijdens een intercurrente ziekte te behandelen met antistolling op basis van de CHA2DS2-VASc-score (zie Preventie van trombo-embolie) voor een periode van ongeveer 4-6 weken. Overweeg in overleg met de patiënt om na deze periode de antistolling te stoppen en alert te zijn op eventueel opnieuw optredend atriumfibrilleren. Er is geen wetenschappelijk onderzoek bekend waaruit blijkt dat voorzetting van de antistolling bij deze patiënten een trombo-embolie voorkomt. Daarentegen geeft antistolling een hoger risico op bijwerkingen, zoals bloedingen (zie Preventie van trombo-embolie). Het is aannemelijk dat het risico op het opnieuw optreden van atriumfibrilleren bij deze patiënten verhoogd is (onder meer op basis van onderzoek in de tweede en derde lijn). Bespreek dit met de patiënt en adviseer deze contact op te nemen bij klachten passend bij atriumfibrilleren.
Voor- en nadelen
Er werden geen onderzoeken gevonden met betrekking tot antistolling bij atriumfibrilleren tijdens een intercurrente ziekte, waardoor we op basis van de literatuur hier geen uitspraak over kunnen doen.
Kwaliteit van bewijs
Niet van toepassing
Waarden en voorkeuren van patiënten
De werkgroep verwacht dat de patiënt een voorkeur heeft voor een effectieve en veilige behandeling.
Kosten
De kosten van antistolling zijn vele malen lager dan die van een ziekenhuisopname of van behandeling en verzorging na bijvoorbeeld een infarct.
Aanvaardbaarheid
Zowel DOAC’s, VKA’s als LMWH zijn voor patiënt en huisarts aanvaardbare geneesmiddelen.
Haalbaarheid
De huisarts is goed bekend met zowel VKA’s, DOAC’s als LMWH en kan deze medicatie indien nodig makkelijk voorschrijven.
Uitgangsvraag
- Is antistolling (lang of kortdurend) aan te bevelen bij patiënten bij wie een eerste aanval van niet-valvulair atriumfibrilleren wordt vastgesteld bij een intercurrente ziekte?
- De werkgroep heeft als minimaal klinisch relevant verschil een OR, RR of HR < 0,75 of > 1,25 genomen.
|
Patiënten |
Patiënten bij wie een eerste aanval van atriumfibrilleren is vastgesteld bij een intercurrente ziekte (bijvoorbeeld een infectie) |
|---|---|
|
Interventie |
Antistolling (langdurig (DOAC of VKA) of kortdurend (LMWH, DOAC, VKA)) |
|
Vergelijking |
Geen antistolling |
|
Uitkomstmaten |
Cruciaal:
Belangrijk:
|
Achtergrond
Het is bekend dat een eerste aanval van atriumfibrilleren kan worden uitgelokt door een intercurrente ziekte zoals een infectie of sepsis, of door operaties (bijvoorbeeld cardiothoracale chirurgie). Deze combinaties kunnen leiden tot een hogere kans op ziekenhuisopname en een langere opnameduur vanwege atriumfibrilleren of hartfalen, een infarct, trombo-embolie of sterfte. Het is van belang te weten óf en voor welke tijdsduur de patiënt zou moeten worden behandeld met antistolling om deze risico’s te verminderen. Internationale richtlijnen geven geen aanbeveling over eventuele antistolling bij patiënten met atriumfibrilleren bij intercurrente ziekte in de eerste lijn.
Methoden
Er is een systematische literatuurzoekactie naar SR’s en RCT’s uitgevoerd in PubMed en Embase in mei 2022.
Resultaten
Resultaat zoekactie
De zoekactie leverde geen systematische reviews en RCT’s op met betrekking tot dit onderwerp. Ook de update van de search in februari 2023 leverde niets op.
Onderzoekskarakteristieken
Niet van toepassing
Effectiviteit
Niet van toepassing
Conclusies
Er werden geen onderzoeken gevonden met betrekking tot antistolling bij atriumfibrilleren tijdens een intercurrente ziekte.
Aandachtspunten bij orale anticoagulantia
Naar Samenvatting ›- Behandeling met orale anticoagulantia gaat gepaard met een verhoogd risico op bloedingen. Wees dus alert op wijzigingen in de gezondheidssituatie van de patiënt.
- Vooral neusbloedingen komen frequent voor. Informeer de patiënt hierover en adviseer de orale anticoagulantia niet op eigen initiatief te minderen, maar contact op te nemen met de huisarts.
- Let op interacties zoals met andere antistollingsmedicatie, NSAID’s en trombocytenaggregatieremmers.
- Heroverweeg met de initiële voorschrijver of er nog een indicatie bestaat voor gelijktijdig doorzetten van trombocytenaggregatieremmers; gelijktijdig gebruik gaat gepaard met een aanzienlijk verhoogd bloedingsrisico. Doorgaans kunnen trombocytenaggregatieremmers gestopt worden bij het starten van orale anticoagulantia.
- Heroverweeg de indicatie voor NSAID’s. Bij gelijktijdig gebruik van orale anticoagulantia en NSAID’s neemt het bloedingsrisico toe. Zie voor het beleid ten aanzien van pijn de NHG-Standaard Pijn.
- Bij behandeling met orale anticoagulantia moet een recente (< 3 maanden) nierfunctie van de patiënt bekend zijn. Indien deze niet voorhanden is, kan in afwachting van de laboratoriumuitslag worden gestart met een normale dosering anticoagulantia en kan deze zo nodig op basis van de laboratoriumuitslag worden aangepast.
- Beoordeel of maagbescherming geïndiceerd is (zie de NHG-Behandelrichtlijn Preventie van maagcomplicaties door geneesmiddelgebruik).
- Informeer de patiënt, of laat de patiënt informeren, over de invloed van (zelfzorg)middelen en intercurrente ziekten, zoals diarree en infecties, op de werkzaamheid van orale anticoagulantia.
- Voor informatie over (niet-ernstige en ernstige) bloedingen onder orale anticoagulantia en periprocedureel beleid of tandheelkundige ingrepen, zie LTA Antistolling.
DOAC’s
Naar Samenvatting ›- Er is op basis van de huidige literatuur geen voorkeur voor een bepaalde DOAC bij atriumfibrilleren. Er lijkt geen onderling verschil in effectiviteit.
- Er zijn verschillende redenen waarom voor een bepaalde DOAC kan worden gekozen (zie tabel 3).
- Doe ervaring op met 1 of 2 DOAC’s
- Gebruiksgemak, zoals één of tweemaal daagse dosering of criteria voor dosisaanpassing, kan meespelen bij de keuze.
- Aandachtspunten:
- Wees voorzichtig bij patiënten met een verminderde nierfunctie en bij kwetsbare ouderen (zie tabel 3). Pas de dosering zo nodig aan.
- Vermijd combinatie met CYP3A4-/P-pg-inductoren (anti-epileptica).
- Wees daarnaast alert op de per DOAC wisselende interacties met CYP3A4-/P-gp-remmers (ciclosporine, claritromycine, erytromycine, ketoconazol, itraconazol, verapamil). Voor een aantal DOAC’s geldt een advies voor dosisaanpassing bij combinatie met specifieke P-gp-remmers (zie tabel 3).
- Alle bloedingen ten gevolge van gebruik van DOAC's kunnen gecoupeerd worden met stollingsconcentraten. Voor dabigratran, apixaban en rivaroxaban zijn specifieke antidota beschikbaar, voor edoxaban is off-label een specifiek antidotum beschikbaar.
- Alle DOAC’s kunnen in een medicijnrol.
| DOAC* | Dosering | Dosisaanpassing** | Niet toepassen bij:** |
|---|---|---|---|
| Apixaban, tablet 2,5 en 5 mg | 2 dd 5 mg | 2 dd 2,5mg bij
| |
| Dabigatran, capsule 75, 110 en 150 mg | 2 dd 150 mg | 2 dd 110 mg bij:
|
|
| Edoxaban, tablet 15, 30 en 60 mg | 1 dd 60 mg | 1 dd 30 mg bij:
1 dd 15 mg bij:
| |
| Rivaroxaban, tablet 2,5, 10, 15 en 20 mg | 1 dd 20 mg | 1 dd 15 mg bij:
1dd 10 mg bij:
| |
* Zie Praktische uitwerking – DOAC’s voor interacties ** Bij dialyse: overleg met de behandelend medisch specialist | |||
Effectiviteit en veiligheid van DOAC’s – onderlinge vergelijking
Tijdens de vorige gedeeltelijke herziening van deze NHG-Standaard (2017) is een samenvatting van het bewijs gegenereerd over de effectiviteit en veiligheid van de verschillende DOAC’s onderling bij patiënten met atriumfibrilleren. Deze samenvatting sluit nog steeds aan bij de huidige inzichten. In deze herziening is dus besloten de samenvatting van het bewijs ongewijzigd te laten.
Achtergrond
In dit detail wordt nagegaan of er verschillen zijn in effectiviteit en veiligheid tussen de DOAC’s onderling. Indien dit het geval is, kan dit de huisarts houvast geven bij het maken van een keuze voor een specifieke DOAC.
Uitgangsvraag
Welke DOAC-behandeling is aan te bevelen bij patiënten ≥ 65 jaar met niet-valvulair atriumfibrilleren?
Cruciale uitkomstmaten
- Effectiviteit:
- beroerte en systemische embolie
- ischemische beroerte (herseninfarct)
- sterfte (aan alle oorzaken)
- Veiligheid:
- ernstige bloeding
- gastro-intestinale bloeding
- intracraniële bloeding
- myocardinfarct
- Een belangrijke, maar niet-cruciale uitkomstmaat zijn niet-ernstige bijwerkingen (met name dyspepsie) die tot verminderde therapietrouw kunnen leiden.
Literatuuronderzoek
Een systematisch literatuuronderzoek met netwerkmeta-analyse naar de effecten van orale anticoagulantia bij patiënten met niet-valvulair atriumfibrilleren vormt de basis bij de beantwoording van de uitgangsvraag. Een search uitgevoerd in november 2016 leverde 2 observationele onderzoeken op waarin de effectiviteit en veiligheid van verschillende DOAC’s met elkaar werden vergeleken. Daarnaast werd 1 observationeel onderzoek gevonden waarin gegevens over dyspepsie werden vergeleken tussen de DOAC’s dabigatran, rivaroxaban en apixaban. en 5 onderzoeken waarin het voorkomen van dyspepsie bij dabigatran werd gerapporteerd.
Resultaten
Onderzoekskarakteristieken
Systematisch literatuuronderzoek
- Lin 2015: deze netwerkmeta-analyse includeerde 25 RCT’s en 24 niet-gerandomiseerde cohortonderzoeken (1 prospectief en 23 retrospectieve) naar orale antitrombotica ter preventie van beroerte bij patiënten met atriumfibrilleren . De RCT’s waren gepubliceerd tussen 1989 en 2013 (n = 94.471, waarvan 84.508 geleverd door de 7 grootste RCT’s). De gemiddelde leeftijd was 71 jaar (bandbreedte 65-85) en 62% was man. De CHADS2-score was gemiddeld 2,3 (bandbreedte 1,1-3,5), wat overeenkomt met een gemiddeld tot hoog risico op beroerte. De meeste onderzoeken rapporteerden geen HAS-BLED-score, maar de exclusie van patiënten met risicofactoren voor bloedingen, leveraandoeningen en creatinineklaring < 25-30 mL/min suggereert dat dit een geselecteerde groep met een verlaagd bloedingsrisico betrof. De cohortonderzoeken waren gepubliceerd tussen 2010 en 2015 en bevatten 803.277 patiënten. De gemiddelde leeftijd was 72 jaar (bandbreedte 57-85) en 56% was man. De CHADS2-score was gemiddeld 1,9 (bandbreedte 1,0-4,0), dus iets lager dan in de RCT’s. De meeste patiënten hadden een HAS-BLED-score ≤ 3,dus het betreft een groep met een laag tot matig bloedingsrisico.
Observationele onderzoeken
- Graham 2016 (Verenigde Staten) is een retrospectief cohortonderzoek op basis van de Medicare database, onder patiënten met niet-valvulair atriumfibrilleren die tussen november 2011 en juni 2014 voor het eerst dabigatran of rivaroxaban in de standaarddosering gebruikten (en niet eerder een ander oraal anticoagulans hadden gebruikt. Geïncludeerd werden 52.240 patiënten die dabigatran gebruikten (15.524 patiëntjaren, gemiddelde duur per patiënt 108 dagen, bandbreedte 0-969) en 66.651 patiënten die rivaroxaban gebruikten (20.199 patiëntjaren, gemiddelde duur 111 dagen, bandbreedte 0-923). Analyses werden gedaan met correcties op grond van propensity-scores.
- Gorst-Rasmussen 2016 (Denemarken) is een retrospectief cohortonderzoek op basis van 3 Deense registraties. Geïncludeerd werden patiënten die tussen februari 2012 en augustus 2014 voor het eerst dabigatran, rivaroxaban of warfarine gebruikten. De patiënten hadden gedurende de 2 voorafgaande jaren geen orale antistolling gebruikt. Er werden 22.358 patiënten geïncludeerd: 11.045 op warfarine, 8908 op dabigatran en 2405 op rivaroxaban. Analyses werden gedaan met correcties op grond van propensity-scores. De standaarddosering dabigatran werd vergeleken met de standaarddosering rivaroxaban en beide lage doseringen werden met elkaar vergeleken.
- Vedovati 2017: prospectief cohortonderzoek (n = 1305) waarin gedurende het eerste jaar van voorschrift patiënten werden gevolgd die dabigatran (n = 473), rivaroxaban (n = 425) of apixaban (n = 407) gebruikten. Hierbij werd met name onderzocht hoeveel patiënten binnen dat jaar stopten en vanwege welke redenen.
Kwaliteit van bewijs
- De kwaliteit van het bewijs van de resultaten uit de RCT’s varieerde van redelijk tot zeer laag voor de verschillende uitkomstmaten. Er werd in alle gevallen afgewaardeerd met 1 niveau vanwege indirect bewijs: er was geen directe vergelijking tussen geneesmiddelen beschikbaar, dus alle uitkomsten zijn gebaseerd op indirecte vergelijkingen tussen de RCT’s. Daarnaast is er in de meeste gevallen met één of twee niveaus afgewaardeerd vanwege (zeer) onnauwkeurige resultaten.
- De kwaliteit van het bewijs uit de observationele onderzoeken was laag voor de uitkomstmaat bloeding (afgewaardeerd vanwege observationeel onderzoek) en zeer laag voor de uitkomstmaten beroerte, systemische embolie, sterfte en dyspepsie (afgewaardeerd vanwege observationeel onderzoek en onnauwkeurige resultaten).
Effectiviteit
In de onderstaande beschrijvingen is de puntschatter van de effectmaat als uitgangspunt genomen. Als het betrouwbaarheidsinterval de marges voor klinische relevantie (0,9 tot 1,1) overschrijdt, is het bewijs hiervoor afgewaardeerd (onnauwkeurigheid; zie GRADE-evidenceprofielen).
- Beroerte en systemische embolie: we zijn onzeker over onderlinge verschillen tussen DOAC’s (kwaliteit van bewijs voor alle vergelijkingen zeer laag).
- Ischemische beroerte (herseninfarct): mogelijk vermindert dabigatran het risico op een herseninfarct meer dan apixaban en edoxaban (apixaban ten opzichte van dabigatran RR 1,25; 95%-BI 0,91 tot 1,73; edoxaban ten opzichte van dabigatran RR 1,32; 95%-BI 0,97 tot 1,79; kwaliteit van bewijs laag). Over verschillen tussen de overige DOAC’s zijn we onzeker (kwaliteit van bewijs zeer laag).
- Sterfte aan alle oorzaken: over de meeste verschillen tussen DOAC’s zijn we onzeker (kwaliteit van bewijs zeer laag). Er lijkt geen verschil in sterfte tussen edoxaban en apixaban (edoxaban ten opzichte van apixaban RR 1,04 (95%-BI 0,90 tot 1,20; kwaliteit van bewijs laag).
Veiligheid
Resultaten uit RCT’s
- Ernstige bloeding: waarschijnlijk geeft apixaban een lager risico op een ernstige bloeding dan rivaroxaban (RR 0,67; 95%-BI 0,55 tot 0,82; kwaliteit van bewijs redelijk). Mogelijk geeft rivaroxaban een hoger risico (RR 1,13; 95%-BI 0,93 tot 1,37) en geven apixaban (RR 0,76; 95%-BI 0,62 tot 0,92) en edoxaban (RR 0,87; 95%-BI 0,72 tot 1,05) een lager risico op een ernstige bloeding dan dabigatran (kwaliteit van bewijs laag). Mogelijk geeft edoxaban een lager risico op een ernstige bloeding dan rivaroxaban (RR 0,77; 95%-BI 0,64 tot 0,93) en een hoger risico dan apixaban (RR 1,14; 95%-BI 0,94 tot 1,38) (kwaliteit van bewijs laag).
- Gastro-intestinale bloeding: we zijn onzeker over onderlinge verschillen tussen DOAC’s (kwaliteit van bewijs voor alle vergelijkingen zeer laag).
- Intracraniële bloeding: mogelijk geeft rivaroxaban een hoger risico op een intracraniële bloeding dan dabigatran (RR 1,64; 95%-BI 0,98 tot 2,70), apixaban (apixaban ten opzichte van rivaroxaban RR 0,60; 95%-BI 0,38 tot 0,95) en edoxaban (edoxaban ten opzichte van rivaroxaban RR 0,66; 95%-BI 0,43 tot 1,04) (kwaliteit van bewijs laag). Over overige verschillen tussen DOAC’s zijn we onzeker (kwaliteit van bewijs zeer laag).
- Myocardinfarct: We zijn onzeker over onderlinge verschillen tussen DOAC’s (kwaliteit van bewijs voor alle vergelijkingen zeer laag).
Resultaten uit observationele onderzoeken
- Graham 2016: de HR voor rivaroxaban ten opzichte van dabigatran (beide standaarddosering) voor beroerte en systemische embolie was 0,81 (95%-BI 0,65 tot 1,01; kwaliteit van bewijs zeer laag), mortaliteit 1,15 (95%-BI 1,0 tot 1,32; kwaliteit van bewijs zeer laag), intracraniële bloeding 1,65 (95%-BI 1,20 tot 2,26; kwaliteit van bewijs laag), ernstige extracraniële bloeding 1,48 (95%-BI 1,32 tot 1,67; kwaliteit van bewijs laag) en gastro-intestinale bloeding 1,40 (95%-BI 1,23 tot 1,59; kwaliteit van bewijs laag).
- Gorst-Rasmussen 2016: De HR voor rivaroxaban ten opzichte van dabigatran (beide standaarddosering) voor beroerte en systemische embolie was 0,97 (95%-BI 0,66 tot 1,42; kwaliteit van bewijs zeer laag), voor mortaliteit 1,52 (95%-BI 1,06 tot 2,19; kwaliteit van bewijs zeer laag) en voor (elke) bloeding 1,81 (95%-BI 1,25 tot 2,62; kwaliteit van bewijs laag). Deze resultaten bevestigen de bevindingen in de netwerkmeta-analyse dat dabigatran mogelijk een wat lager bloedingsrisico geeft dan rivaroxaban.
Niet-ernstige bijwerkingen (dyspepsie)
- Connolly 2009b: van de RCT’s heeft alleen de RE-LY-trial (dabigatran) structureel niet-ernstige gastro-intestinale bijwerkingen bijgehouden en gerapporteerd. Dit onderzoek vermeldt dat dyspepsie (abdominal pain upper, abdominal pain, abdominal discomfort, dyspepsia) optrad bij 11,8% van de deelnemers die dabigatran in lage dosering gebruikten, bij 11,3% van de deelnemers die dabigatran in hoge dosering gebruikten, en bij 5,8% van de deelnemers die warfarine gebruikten (p < 0,001 voor de vergelijking tussen elke dosering dabigatran en warfarine).
- Vedovati 2017 rapporteerde dat er van de patiënten met dabigatran 104 (22%) stopten gedurende het eerste jaar, waarvan 37 (35,6%) vanwege dyspepsie. In de rivaroxabangroep stopten 61 patiënten (14,4%), waarvan 1 (1,6%) vanwege dyspepsie. In de apixabangroep stopten 36 patiënten (8,8%), waarvan geen vanwege dyspepsie. De stoppercentages verschilden statistisch significant tussen de groepen.
- De overige observationele onderzoeken bestudeerden alleen dabigatran. Ze rapporteerden een grote variatie in het percentage dyspepsie (1,2-33,0%). In een onderzoek naar het effect van inname van dabigatran tijdens de maaltijd of gebruik van een protonpomremmer (PPI) hadden 92 van de 117 geincludeerde dabigatbandbreedtebruikers (79%) door een van beide interventies géén of aanvaardbare klachten.
Conclusie
Rivaroxaban geeft mogelijk een hoger risico op bloedingen (kwaliteit van bewijs laag tot redelijk) dan de overige DOAC’s. Over andere verschillen in effectiviteit, veiligheid en bijwerkingen tussen de verschillende DOAC’s zijn we onzeker (kwaliteit van bewijs laag of zeer laag).
Van bewijs naar aanbeveling
- Vanwege de overwegend lage tot zeer lage kwaliteit van bewijs is de werkgroep van mening dat er geen reden is om een van de DOAC’s wel of niet aan te bevelen.
- Op dit moment zijn de kosten van de geneesmiddelen onderling nog vergelijkbaar; dit kan veranderen als de middelen generiek verkrijgbaar worden.
- De DOAC’s verschillen onderling enigszins wat betreft doseringsfrequentie en dosisaanpassing bij een verminderde nierfunctie.
Antidota bij DOAC’s
Er zijn in 2022 2 specifieke antidota voor DOAC’s geregistreerd:
- idarucizumab coupeert de werking van de directe trombineremmer dabigatran
- andexanet alfa vermindert de werking van de factor Xa-remmers rivaroxaban en apixaban en edoxaban (off-label)
Bij alle DOAC’s kan een bloeding in de tweede lijn gecoupeerd worden met protrombinecomplex (PCC). Er is beperkt onderzoek naar de effectiviteit en bijwerkingen van deze antidota beschikbaar. Uit de bekende data blijkt dat de antidota de werking van de DOAC’s snel en vrijwel volledig couperen. PCC, het middel van eerste keuze toen de specifieke antidota nog niet waren geregistreerd en nu nog het voorkeursmiddel bij bepaalde indicaties, is eveneens beperkt onderzocht. Vergelijkende onderzoeken tussen PCC en de antidota ontbreken. Aan de Richtlijn Antitrombotisch beleid is begin 2021 het onderdeel Bloeding of ingreep bij DOAC’s toegevoegd, met adviezen bij al dan niet levensbedreigende bloedingen en couperen van de werking van DOAC’s bij spoedingrepen.
Milieuimpact DOAC’s
- Rivaroxaban, dabigatran en apixaban: op basis van normaal gebruik zijn er momenteel geen aanwijzingen dat deze stoffen een risico vormen voor het oppervlaktewater (Pharmaceutical Industry Association's Service AB Fass, geraadpleegd 29 april 2022).
- Edoxaban: geen gegevens beschikbaar.
Toepasbaarheid DOAC’s
De werkgroep heeft ervoor gekozen om als algemene contra-indicatie bij DOAC’s morbide obesitas op te nemen. De werkgroep is zich ervan bewust dat 2 DOAC’s gebruikt kunnen worden bij patiënten tot een gewicht van 175 kg. De werkgroep schat in dat de groep patiënten zonder morbide obesitas met een gewicht in de richting van 175 kg erg klein is. Bij dabigatran heeft de werkgroep ervoor gekozen om specifiek in de tabel te noemen dit niet toe te passen bij een gewicht > 110 kg, omdat hierbij is ingeschat dat hierdoor een groter deel van de te behandelen patiënten niet binnen de groep met morbide obesitas valt. De toevoeging vanuit de KNMP Kennisbank dat 2 DOAC’s wel zouden kunnen worden gegeven bij een gewicht van > 110 kg onder zorgvuldige monitoring van de patiënt, vond de werkgroep niet toepasbaar in de praktijk.
VKA’s
Naar Samenvatting ›- De keuze voor een VKA wordt mede bepaald door afspraken met de plaatselijke trombosedienst. In Nederland heeft men de beschikking over het kortwerkende acenocoumarol en het langwerkende fenprocoumon.
- De trombosedienst begeleidt de behandeling. De huisarts informeert de trombosedienst over de nierfunctie en de bestaande (relatieve) contra-indicaties.
- Wanneer men geneesmiddelen voorschrijft die (zoals veel antibiotica) een farmacokinetische interactie met VKA’s hebben, moet dat worden gemeld aan de trombosedienst. Onder andere cotrimoxazol en miconazol (alle toedieningsvormen) zijn absoluut gecontra-indiceerd tijdens het gebruik van VKA’s (zie VKA-interacties).
- De patiënt kan de behandeling onder begeleiding van de trombosedienst uitvoeren door zelf te meten en zelf te doseren. Zo nodig kan de trombosedienst dit overnemen.
- Opstarten:
- Start met een oplaaddosis (zie tabel 4). Op dag 3 bepaalt de trombosedienst de vervolgdosering op geleide van de international normalized ratio (INR).
- Doseer de tabletten eenmaal per dag, bij voorkeur ’s avonds zodat bij een sterk afwijkende INR de dosering nog op de dag van controle kan worden aangepast (zie LTA Antistollingszorg).
- De INR-streefwaarde is 2,5 (therapeutische breedte 2,0-3,0).
| Acenocoumarol | Fenprocoumon | |||
|---|---|---|---|---|
| < 70 jaar | ≥ 70 jaar of relatieve contra-indicatie* | < 70 jaar | ≥ 70 jaar of relatieve contra-indicatie* | |
| * Voor relatieve contra indicaties, zie Contra-indicaties. | ||||
| Dag 1 | 6 mg (6 tabl) | 4 mg (4 tabl) | 12 mg (4 tabl) | 6 mg (2 tabl) |
| Dag 2 | 4 mg (4 tabl) | 2 mg (2 tabl) | 6 mg (2 tabl) | 3 mg (1 tabl) |
| Dag 3 | 2 mg (2 tabl) | 1 mg (1 tabl) | 3 mg (1 tabl) | 1,5 mg (0,5 tabl) |
Dosering en keuze van VKA’s (acenocoumarol, fenprocoumon)
- Om het bloedingsrisico niet nodeloos te verhogen is het van belang te streven naar de laagste dosis VKA waarbij de patiënt nog voldoende wordt beschermd tegen een beroerte. Dit geldt in nog sterkere mate voor personen > 75 jaar, bij wie het bloedingsrisico sterk stijgt met de intensiteit van de behandeling. In de RCT’s uit de meta-analyse van Hart 2007 blijkt dat een INR van 2-3 beschermt tegen een beroerte.
- In een cohort van 13.559 patiënten met atriumfibrilleren werd vastgesteld dat een INR ≥ 2 niet alleen beschermt tegen het optreden van herseninfarcten, maar ook de ernst en de mortaliteit ten gevolge van een herseninfarct vermindert. Een INR > 2,5 beschermde niet beter dan een INR 2,0-2,5. Daarentegen werd tot INR 3,9 geen duidelijke toename van intracraniële bloedingen waargenomen. Deze analyse was echter gebaseerd op relatief kleine aantallen patiënten.
- Er is een analyse gemaakt van de gegevens van 42.451 patiënten die in Zweden tussen 1990 en 1997 antistolling kregen. Bij 58% was de indicatie atriumfibrilleren. De mortaliteit in deze subgroep was het laagst bij INR 2,2. Een stijging van de INR van 2,5 naar 3,5 resulteerde in een toename van de mortaliteit met een factor 2,1.
- De FNT hanteert voor de INR een streefgebied van 2,0-3,0 bij patiënten met atriumfibrilleren die in aanmerking komen voor antistolling.
Conclusie
Bij behandeling met VKA’s van patiënten met atriumfibrilleren is een streefwaarde van de INR tussen 2,0 en 3,0 effectief en relatief veilig. Deze streefwaarde wordt ook gehanteerd door de FNT.
Milieuimpact VKA’s
VKA’s worden goed afgebroken in het milieu. Er zijn geen aanwijzingen voor schadelijke effecten op het oppervlaktewater (Pharmaceutical Industry Association's Service AB Fass, geraadpleegd 29 april 2022).
Zelfcontrole van INR
In een Brits gerandomiseerd eerstelijnsonderzoek werden patiënten ≥ 18 jaar met een chronische indicatie (> 12 maanden) voor warfarine die dit middel al ≥ 6 maanden gebruikten, getraind in het tweewekelijks zelf meten van hun INR, het interpreteren van de waarde en het bijstellen van hun dosering warfarine. Primaire uitkomst was het percentage tijd met een INR 2,5-3,5 gedurende de follow-up van 12 maanden. Een statistisch significant verschil tussen de interventie- en controlegroep kon niet worden aangetoond (70 vs. 68%). Ook het aantal bijwerkingen was in beide groepen nagenoeg gelijk (2,8 vs. 2,7 per 100 patiënten per jaar in respectievelijk de interventie- en de controlegroep; p = 0,89). Patiënten die voor aanvang van het onderzoek slecht waren ingesteld, lieten in de zelfcontrolegroep een verbetering zien, in de controlegroep niet.
In een meta-analyse waarin 11 trials waren opgenomen waarin zelfcontrole of zelfmanagement van orale antistolling werd vergeleken met standaardcontrole (door bijvoorbeeld arts of antistollingskliniek), was er tussen beide groepen geen verschil in het optreden van ernstige bloedingen (HR 0,88; 95%-BI 0,74 tot 1,06) en sterfte (HR 0,82; 95%-BI 0,62 tot 1,09), en traden in de zelfcontrolegroep minder trombo-embolieën op (HR 0,51; 95%-BI 0,31 tot 0,85). Dit effect was het sterkst bij deelnemers < 55 jaar, maar ook bij deelnemers ≥ 85 jaar (n = 99) waren er geen significante verschillen in bijwerkingen van de interventie.
Conclusie
Zelfcontrole van antistolling is een veilige optie voor patiënten van alle leeftijden.
Omzetten van VKA naar DOAC en andersom
Naar Samenvatting ›Van VKA naar DOAC:
- Overweeg een VKA om te zetten naar een DOAC bij patiënten die minder goed ingesteld zijn of wanneer de trombosedienst of de patiënt daarom vraagt. Bespreek de voordelen en de nadelen met de patiënt (zie tabel 2).
- Overleg over de wijze van omzetting van medicatie met de trombosedienst. De trombosedienst informeert de patiënt wanneer de DOAC gestart kan worden. Zie verder de leidraad de Kunst van het doseren van de FNT.
Van DOAC naar VKA:
- Overweeg om, zo nodig in overleg met de cardioloog, patiënten actief om te zetten van een DOAC naar een VKA als:
- er relevante bijwerkingen zijn
- de therapietrouw onvoldoende blijkt
- de nierfunctie verslechtert naar een eGFR van rond de 10-15 mL/min
- de algehele kwetsbaarheid toeneemt
- de patiënt hierom vraagt
- Overleg over de wijze van omzetting met de trombosedienst. De trombosedienst informeert de patiënt wanneer de DOAC gestopt kan worden (zie verder de Kunst van het doseren).
Verlaging van de ventrikelvolgfrequentie
Naar Samenvatting ›Indicaties verlaging ventrikelfrequentie
Naar Samenvatting ›- Ventrikelvolgfrequentie ≥ 110/min in rust en/of klachten bij inspanning (zoals dyspneu of druk op de borst).
- Bepaal de ventrikelvolgfrequentie door auscultatie van het hart en niet door palpatie aan de pols (vanwege eventueel polsdeficit). Voor klinische tekenen van overvulling wijzend op hartfalen, zie Lichamelijk onderzoek.
- Doel van de behandeling is een ventrikelvolgfrequentie < 110/min in rust en/of vermindering van de klachten. Frequentieverlaging leidt tot betere vulling van de kamers, waardoor de ejectiefractie toeneemt en de inspanningstolerantie verbetert.
- Zie stroomschema 2 voor een overzicht van het beleid
Bij patiënten met atriumfibrilleren verminderen de afwezigheid van atriumcontracties en de irregulaire, vaak hoge, ventrikelfrequentie de cardiac output. Dit kan leiden tot klachten, in het bijzonder bij personen met hartfalen of coronairlijden. Tijdens inspanning neemt bij atriumfibrilleren de ventrikelfrequentie sterker toe dan bij sinusritme, waardoor juist (meer) klachten kunnen ontstaan. Door verlaging van de ventrikelfrequentie verminderen de klachten. Er is geen bewijs dat de morbiditeit of de mortaliteit afneemt door verlaging van de ventrikelfrequentie.
De ventrikelfrequentie bij atriumfibrilleren moet hoger zijn dan de gemiddelde frequentie van 70/min bij sinusritme om de verminderde cardiac output te compenseren. Op grond van observationeel onderzoek werd in de versie van deze NHG-standaard uit 2009 een streefwaarde voor de ventrikelfrequentie van maximaal 90/min geadviseerd. Uit 2 niet-gerandomiseerde vergelijkingen kwamen echter aanwijzingen dat een wat hogere ventrikelfrequentie geen nadelige effecten heeft op cardiovasculaire morbiditeit en mortaliteit.
- Een groot gerandomiseerd open-label non-inferioriteitsonderzoek bevestigde dit. In dit onderzoek werden 614 patiënten, allen fysiek actief en < 80 jaar, met ≤ 12 maanden bestaand permanent atriumfibrilleren en een gemiddelde hartslag > 80/min gerandomiseerd over 2 groepen: in de interventiegroep werd strikte frequentiecontrole nagestreefd (in rust < 80/min, bij matige inspanning < 110/min), terwijl bij patiënten in de controlegroep alleen een rustfrequentie < 110/min werd beoogd. Het primaire eindpunt was cardiovasculaire sterfte, ziekenhuisopname in verband met hartfalen, trombo-embolie, bloeding of levensbedreigende ritmestoornis. Na 3 jaar follow-up bleek dit eindpunt bereikt door 14,9% in de groep met strikte frequentiecontrole en 12,9% in de groep met soepelere frequentiecontrole (absoluut risicoverschil 2%; 95%-BI –7,6 tot 3,5%). Ook de frequenties van optreden van de verschillende componenten (zoals hartfalen) uit het samengestelde eindpunt waren gelijk. Daarmee bleek een wat soepelere frequentiecontrole even effectief als een strenge frequentiecontrole. Zoals verwacht gebruikten patiënten in de groep met strikte frequentiecontrole significant meer medicijnen dan patiënten in de controlegroep om de hen gestelde streefwaarde te bereiken.
- In een subgroepanalyse van dit onderzoek onder 517 patiënten bij wie bij aanvang van het onderzoek een echocardiogram beschikbaar was, bleek een minder strenge frequentiecontrole evenmin van invloed op schadelijke cardiac remodeling, zoals vergroting van het atrium of ventriculaire disfunctie.
- In een tweede subgroepanalyse onder 437 deelnemers met gegevens over kwaliteit van leven (zowel generiek als ziektespecifiek) bleek dat er geen verschillen aantoonbaar waren in kwaliteit van leven tussen de groepen met strikte en gematigde frequentiecontrole. Kwaliteit van leven werd niet beïnvloed door hartfrequentie, maar wel door leeftijd, geslacht, symptomen en ernst van de onderliggende ziekte.
- Tevens is een aanvullende analyse uitgevoerd naar overlijden en ziekenhuisopname wegens cardiovasculaire redenen. Ook op dit gecombineerde eindpunt was er geen verschil tussen de groepen met gematigde en strikte frequentiecontrole.
Conclusie
Het advies om een ventrikelfrequentie te verlagen tot < 110/min in rust geldt ook als er geen evidente klachten of symptomen zijn. Het gaat vaak om oudere mensen die zich hebben aangepast aan een verminderde inspanningstolerantie. In deze gevallen kan verlaging van de ventrikelfrequentie de inspanningstolerantie verbeteren. Een verdere verlaging van de ventrikelfrequentie naar < 80/min wordt in de huisartsenpraktijk niet geadviseerd.
Keuze van medicatie bij patiënten zonder klinische tekenen van overvulling wijzend op hartfalen
Naar Samenvatting ›- Zie tabel 5.
- De eerste keus is een bètablokker, ook bij stabiele angina pectoris of doorgemaakt myocardinfarct.
- Verhoog de dosering stapsgewijs op geleide van klachten en ventrikelvolgfrequentie, bijvoorbeeld elke 1-2 weken. Bij ouderen is een lage dosering vaak afdoende.
- Kies voor een calciumantagonist bij een contra-indicatie voor bètablokkers (bijvoorbeeld ernstig astma).
- Combineer een bètablokker niet met de calciumantagonisten diltiazem en verapamil (vanwege remmende werking op de AV-knoop).
- Voeg digoxine toe als de ventrikelvolgfrequentie onvoldoende daalt bij maximale dosering van de bètablokker of calciumantagonist.
Middelen ter verlaging van de ventrikelfrequentie
- In een systematisch literatuuronderzoek naar de effecten van medicijnen op de ventrikelfrequentie bij atriumfibrilleren werden 45 RCT’s met 6 tot 239 patiënten betrokken. De auteurs kwamen tot de volgende conclusies: calciumantagonisten (verapamil, diltiazem) en bètablokkers (atenolol, metoprolol, pindolol) zijn bij indirecte vergelijking globaal even effectief in het verlagen van de ventrikelfrequentie, zowel in rust als bij inspanning. Digoxine verlaagt wel de ventrikelfrequentie in rust, maar niet bij inspanning. Bij directe vergelijking zijn calciumantagonisten zowel in rust als bij inspanning effectiever dan digoxine, terwijl bètablokkers bij inspanning effectiever zijn dan digoxine.
- Bètablokkers, calciumantagonisten en digoxine verminderen de geleidingssnelheid en vertragen de hartfrequentie. Ze kunnen vooral in hogere doseringen en in combinatie aanleiding geven tot bradycardie. Dat geldt in het bijzonder bij personen met pre-existente geleidingsstoornissen. Deze stoornissen zijn op het ecg van een patiënt met atriumfibrilleren niet goed te herkennen. Wees daarom alert op klinische verschijnselen die in die richting wijzen, zoals (bijna-)wegrakingen, onverklaard vallen of onverklaarde duizeligheid.
- Bètablokkers, calciumantagonisten en digoxine zijn gecontra-indiceerd bij het syndroom van Wolff-Parkinson-White (accessoire verbinding waardoor geleiding tussen atria en ventrikels mogelijk is buiten de AV-knoop om) omdat ze ernstige ventrikeltachycardieën of ventrikelfibrilleren kunnen veroorzaken. Dit syndroom komt voor bij 0,2% van de bevolking.
Hypertensie en atriumfibrilleren
Bij de behandeling van hypertensie zijn zowel bètablokkers als calciumantagonisten (diltiazem, verapamil) een optie (zie NHG-Standaard Cardiovasculair risicomanagement). Wanneer bij een patiënt met hypertensie tevens atriumfibrilleren bestaat, zijn dus beide geneesmiddelgroepen een optie voor frequentiecontrole.
Angina pectoris en atriumfibrilleren
Bij angina pectoris zijn zowel een bètablokker als een dihydropyridine-calciumantagonist (zoals amlodipine) een optie (zie NHG-Standaard Stabiele angina pectoris).
Myocardinfarct in de voorgeschiedenis en atriumfibrilleren
- In een systematisch literatuuronderzoek en meta-analyse is het effect onderzocht van een bètablokker op de morbiditeit en mortaliteit bij patiënten na een myocardinfarct (82 RCT’s; n = 54.234). Uitkomstmaten waren overlijden en recidiefinfarct. In de onderzoeken (follow-up 6 maanden tot 4 jaar) werd bij gebruik van een bètablokker een relatieve sterftereductie waargenomen van 23% (absolute risicoreductie 1,2% per jaar). Om 1 sterfgeval te voorkomen, moesten 84 patiënten gedurende 1 jaar behandeld worden (NNT = 84). Om 1 recidiefinfarct te voorkomen, moesten 107 patiënten 1 jaar lang behandeld worden (NNT = 107).
- Calciumantagonisten, die de hartfrequentie verlagen (verapamil en diltiazem), resulteerden bij patiënten na een myocardinfarct wel in een verlaging van het risico op een recidief infarct, maar niet in een vermindering van de mortaliteit.
Hyperthyroïdie en atriumfibrilleren
Bij atriumfibrilleren op basis van hyperthyroïdie zijn bètablokkers eerste keus (voor het verdere beleid bij hyperthyroïdie zie NHG-Standaard Schildklieraandoeningen).
Combinatie van middelen
- Toevoegen van digoxine aan een bètablokker of diltiazem blijkt de ventrikelfrequentie statistisch significant en klinisch relevant te verlagen.
- De combinatie van een bètablokker met een calciumantagonist voor het regelen van de ventrikelfrequentie bij atriumfibrilleren is nauwelijks onderzocht en is in vergelijking met de combinatie met digoxine gevaarlijk door de negatief inotrope werking. Een combinatie van bètablokker en calciumantagonist wordt dan ook niet geadviseerd.
Conclusie
Bètablokkers kunnen bij het grootste deel van de patiënten met atriumfibrilleren én veel voorkomende comorbiditeit (zoals hypertensie of een coronaire hartziekte) gebruikt worden.
De werkgroep heeft besloten bètablokkers als middel van eerste keus aan te wijzen voor alle patiënten met atriumfibrilleren zonder klinische tekenen van overvulling wijzend op hartfalen. Calciumantagonisten zijn de tweede keus, mede vanwege het negatief-inotrope effect. Digoxine komt, op de derde plaats omdat het middel de ventrikelfrequentie bij inspanning niet verlaagt.
Keuze van medicatie bij patiënten met klinische tekenen van overvulling wijzend op hartfalen
Naar Samenvatting ›- Zie tabel 5.
- Geef bij patiënten met klinische tekenen van overvulling wijzend op hartfalen digoxine ter verlaging van de ventrikelvolgfrequentie.
- Indien hartfalen nog niet eerder is vastgesteld: overweeg een echocardiogram of consultatie van de cardioloog (zie voor verder beleid NHG-Standaard Hartfalen).
- De calciumantagonisten diltiazem en verapamil zijn bij hartfalen gecontra-indiceerd.
Bètablokkers en calciumantagonisten bij hartfalen
- Bètablokkers lijken de prognose te verbeteren bij patiënten < 75 jaar met klinisch stabiel hartfalen. Bij patiënten met hartfalen met verminderde ejectiefractie (HFrEF) geven onderzoeken echter een wisselend beeld van dit prognostische voordeel. In een RCT onder 1376 patiënten met zowel atriumfibrilleren als hartfalen bleek dat controle van de ventrikelvolgfrequentie met bètablokkers (al dan niet in combinatie met digoxine) gedurende een follow-up van gemiddeld 37 maanden even effectief was als ritmecontrole, zonder een verschil tussen beide groepen met betrekking tot verslechtering van het hartfalen.
- Bètablokkers en calciumantagonisten verminderen de contractiekracht en kunnen vooral in hogere doseringen en in combinatie hartfalen veroorzaken. Dat geldt in het bijzonder bij personen met een reeds gestoorde systolische linkerventrikelfunctie (HRrEF).
- Bètablokkers en calciumantagonisten kunnen ook hypotensie veroorzaken. Diltiazem heeft deze eigenschap in mindere mate dan verapamil.
- Bij patiënten met klinische tekenen van overvulling wijzend op hartfalen adviseert de werkgroep te starten met digoxine als eerste keus. Voor het verdere beleid bij hartfalen, zie NHG-Standaard Hartfalen.
Voorkeursmiddelen bètablokkers
Naar Samenvatting ›- De voorkeur gaat uit naar metoprolol met vertraagde afgifte (zie tabel 5).
- Tweede keus is atenolol.
Keuze van bètablokker
- Bètablokkers kunnen hun werking uitoefenen op verschillende receptoren. Selectieve bètablokkers (zoals atenolol en metoprolol) beïnvloeden voornamelijk de bèta-1-receptoren, die vooral gelegen zijn in de pacemakercellen van het hart en die bij prikkeling zorgen voor een toename van de prikkelgeleiding in het hart. Niet-selectieve bètablokkers, zoals carvedilol, propranolol en sotalol, werken daarnaast ook in op de bèta-2-receptoren, die bij prikkeling verwijding van bronchiolen, glycogenolyse en lipolyse stimuleren. Bij patiënten met atriumfibrilleren hebben selectieve bètablokkers de voorkeur.
- In de 3 grote onderzoeken waarin de effecten van controle van de ventrikelvolgfrequentie en ritmecontrole met elkaar vergeleken werden, was de keuze voor het type bètablokker vrij gelaten. Hierdoor was het onmogelijk om een voorkeur voor een bepaalde bètablokker vast te stellen. Evenmin zijn er onderzoeken gepubliceerd waarin verschillende bètablokkers bij patiënten met atriumfibrilleren met elkaar zijn vergeleken. Daarom kan op grond van onderzoek bij patiënten met atriumfibrilleren geen duidelijke voorkeur voor een specifieke bètablokker bij atriumfibrilleren worden gegeven.
- Met metoprolol (de vorm met vertraagde afgifte) is veel ervaring opgedaan bij patiënten met atriumfibrilleren, ook in geval van hartfalen. Omdat het effect van de behandeling gestuurd kan worden aan de hand van de ventrikelvolgfrequentie, ziet de werkgroep geen reden om farmacogenetisch onderzoek een plaats te geven bij de keuze of opbouw van een bètablokker. Om deze redenen geeft de werkgroep de voorkeur aan metoprolol. Tweede keus is atenolol. Ook dit is een selectieve bètablokker, geregistreerd voor verlaging van hartfrequentie bij atriumfibrilleren, maar er is minder ervaring mee opgedaan.
Conclusie
Op basis van het beschikbare onderzoek zijn er binnen de groep bètablokkers geen onderlinge verschillen in effectiviteit bij het verlagen van de ventrikelfrequentie. Vanwege de ruime ervaring met metoprolol (succinaat of tartraat, met vertraagde afgifte) wordt hier de voorkeur aan gegeven. Metoprololsuccinaat bestaat in meerdere sterktes en is hierdoor makkelijker op of af te bouwen. Tweede keus is atenolol.
Sotalol
Sotalol is een niet-selectieve bètablokker met antiaritmische eigenschappen. Het wordt (soms intraveneus) in de tweede lijn gebruikt om ventriculaire tachyaritmieën te couperen en als profylaxe van supraventriculaire tachycardieën. Daarnaast wordt het na conversie van atriumfibrilleren voorgeschreven om het sinusritme te handhaven. Naast de aan bètablokkers inherente bijwerkingen kan sotalol proaritmische effecten hebben, zoals verslechtering of uitlokking van aritmieën (KNMP Kennisbank, geraadpleegd 22 november 2022). Om deze reden wordt het huisartsen ontraden om sotalol te initiëren.
Effectiviteit en bijwerkingen van sotalol
- Preventie van aanvallen van atriumfibrilleren vraagt om het toepassen van antiaritmica, waarvoor specialistische kennis en ervaring noodzakelijk zijn. Dit geldt ook voor het voorschrijven van sotalol, omdat dit tot potentieel levensbedreigende aritmieën kan leiden. In vergelijking met placebo vermindert sotalol het aantal aanvallen; in RCT’s leidt het gebruik meestal niet tot ernstige bijwerkingen. In deze onderzoeken werden personen met een verhoogd risico op aritmie (bijvoorbeeld met hartfalen en een lange QT-tijd) echter uitgesloten.
- In 1 RCT is onder andere het effect van sotalol ten opzichte van placebo onderzocht. Geleidingsstoornissen, hartfalen en een lage ejectiefractie waren enkele van de exclusiecriteria. Na de follow-up van 1 jaar had in de sotalolgroep 73% een sinusritme versus 35% in de placebogroep. Tijdens de behandeling met sotalol kregen 4 van de 106 patiënten een potentieel levensbedreigende aritmie.
- Voordat sotalol voorgeschreven kan worden, moet de cardioloog vaststellen of er een verhoogd risico op aritmie bestaat (met behulp van ecg, maar ook echocardiografie) .
Voorkeursmiddelen calciumantagonisten
Naar Samenvatting ›Diltiazem (off-label) heeft de voorkeur omdat verapamil sterker negatief inotroop werkt (zie tabel 5).
Keuze van calciumantagonist
Calciumantagonisten worden onderverdeeld in:
- dihydropyridineverbindingen oftewel de nifedipinegroep (amlodipine en nifedipine)
- overige calciumantagonisten (verapamil en diltiazem)
De dihydropyridineverbindingen hebben vooral een vaatverwijdende werking en geven geen vertraging in de prikkelgeleiding. Daarom hebben zij geen plaats bij verlaging van de ventrikelfrequentie bij atriumfibrilleren.
Verapamil en diltiazem kunnen bij atriumfibrilleren wél voor een daling van de frequentie zorgen. Nadeel is dat ze een negatief-inotroop effect hebben. Dit effect geldt vooral voor verapamil (KNMP Kennisbank, geraadpleegd 22 november 2022). Daarom heeft diltiazem de voorkeur bij patiënten met atriumfibrilleren.
Toepassing van digoxine
Naar Samenvatting ›- Bepaal voorafgaand aan de start met digoxine de nierfunctie. Controleer deze vervolgens jaarlijks (zie Controles). De renale excretie van digoxine vermindert bij het afnemen van de nierfunctie, waardoor toxische spiegels mogelijk zijn.
- Zie tabel 5 voor oplaaddoseringen en onderhoudsdoseringen.
- Interactie met calciumantagonisten verhoogt de digoxinespiegel. Wees extra alert op verschijnselen van intoxicatie of overdosering en pas de dosis digoxine aan bij de volgende combinaties:
- met diltiazem: 75% van de gebruikelijke dosis digoxine
- met verapamil: 50% van de gebruikelijke dosis digoxine
- De belangrijkste verschijnselen van overdosering zijn eetlustverlies, misselijkheid en braken, diarree, vermoeidheid, verwardheid, duizeligheid, afwijkingen van het kleurenzien (xanthopsie: alles geel zien), hyperkaliëmie, hypotensie en ritmestoornissen (bradycardie, ventriculaire extrasystolen, AV-blok).
- Titreer de onderhoudsdosering op geleide van de ventrikelvolgfrequentie. Let daarbij op het risico van toxiciteit. Verlaag de dosering digoxine bij het bereiken van de leeftijd van 70 jaar en bij de leeftijd van 85 jaar (arbitrair).
- Overweeg een lagere oplaaddosering bij combinatie van digoxine met geneesmiddelen die de digoxinespiegel verhogen, zoals protonpompremmers en macroliden.
- Wees alert op verschijnselen van overdosering, zeker bij de combinatie van digoxine met calciumantagonisten en in situaties waarin de nierfunctie acuut verslechtert, zoals bij dehydratie. Bespreek deze verschijnselen ook met de patiënt.
- Bijwerkingen ontstaan niet alleen als gevolg van overdosering, maar ook door individuele gevoeligheid (leeftijd, zwangerschap, ondervoeding, genetische afwijkingen).
- Het bepalen van de digoxinespiegel is alleen nodig bij een vermoeden van een intoxicatie (zie LESA Laboratoriumdiagnostiek).
| Geneesmiddel | Startdosering | Maximale dosering |
|---|---|---|
| Bètablokkers | ||
| 1 dd 50 mg | 200 mg |
bij eGFR < 30 mL/min | 1 dd 25 mg | 100 mg |
| 1 dd 12,5 mg | 50 mg | |
| Calciumantagonisten | ||
| 1 dd 180 mg | 360 mg |
| 1 dd 120 mg | 360 mg |
| Digoxine | ||
| Dag 1 (oplaad): 1 dd 0,75 mg | |
| Dag 2 e.v.: 1 dd 0,25 mg | ||
| Dag 1 (oplaad): 3 dd 0,125 mg | |
| Dag 2 e.v.: 1 dd 0,125 mg | ||
| Dag 1 (oplaad): 3 dd 0,125 mg | |
| Dag 2 e.v.: 1 dd 0,0625 mg | ||
| * De aangegeven grenzen voor leeftijd en gewicht zijn arbitrair | ||
- Calciumantagonisten verhogen de digoxinespiegel: verapamil met 50-70%, diltiazem met 20-30% (KNMP Kennisbank, geraadpleegd 22 november 2022).
- Het in tabel 5 gegeven overzicht van middelen en doseringen ter verlaging van de ventrikelfrequentie is een praktische interpretatie van de doseeradviezen in de KNMP Kennisbank.
Antiaritmica bij paroxismaal atriumfibrilleren
Naar Samenvatting ›- Door de cardioloog kan een antiaritmicum als aanvalsbehandeling zijn voorgeschreven.
- We raden het initiëren, controleren en aanpassen van de dosering van antiaritmica (zoals flecaïnide of sotalol) door de huisarts af. Antiaritmica verminderen het aantal paroxismale aanvallen en het risico op hernieuwd atriumfibrilleren na cardioversie of ablatie, maar kunnen zelf ook ritmestoornissen veroorzaken.
Bij sommige patiënten met paroxismaal atriumfibrilleren kan bij uitblijven van tijdige spontane conversie tot sinusritme een aanval van atriumfibrilleren gecoupeerd worden door, al dan niet op initiatief van de patiënt, eenmalige inname of dosisverhoging van een antiaritmicum. Dit is alleen voorbehouden aan patiënten bij wie de cardioloog deze medicatie geïnitieerd heeft en een beleid bij aanvallen van atriumfibrilleren heeft afgesproken.
Controles
Naar Samenvatting ›Bij patiënten met nieuw vastgesteld atriumfibrilleren
Naar Samenvatting ›- Controleer patiënten met nieuw vastgesteld atriumfibrilleren tot de klachten en de ventrikelvolgfrequentie tot een bevredigend niveau zijn gereduceerd; bepaal de frequentie van de controles samen met de patiënt.
- Controleer tijdens het instellen van medicatie ter verlaging van de ventrikelvolgfrequentie de patiënt wekelijks tot het behandeldoel is bereikt.
- Besteed bij iedere controle aandacht aan klachten en symptomen gerelateerd aan atriumfibrilleren.
- Wees alert op eventuele andere geneesmiddelen die atriumfibrilleren kunnen uitlokken (met name bèta-2-sympathicomimetica, levothyroxine of corticosteroïden)
Werkwijze controles
Naar Samenvatting ›Controleer, nadat het behandeldoel is bereikt, de patiënt in ieder geval jaarlijks.
Klachten en symptomen gerelateerd aan atriumfibrilleren
- Inventariseer eventuele klachten.
- Beoordeel het hartritme en de ventrikelvolgfrequentie.
- Ga na of er tekenen zijn van hartfalen.
Aan atriumfibrilleren gerelateerde medicatie en laboratoriumonderzoek
- Bespreek antistolling, inclusief eventuele bijwerkingen en therapietrouw (zie LTA antistollingszorg).
- Controleer bij DOAC’s de eGFR en het creatinine. Controleer deze vaker als ze reeds verminderd zijn of verslechteren (zie NHG-Standaard Chronische nierschade). Pas zo nodig de dosering aan op basis van nierfunctie, leeftijd of gewicht.
- Bij patiënten zonder antistolling: bepaal met behulp van de CHA2DS2-VASc-score of er een indicatie is voor antistolling (zie tabel 1).
- Bespreek overige aan atriumfibrilleren gerelateerde medicatie en eventuele bijwerkingen.
- Controleer bij digoxine de eGFR, het creatinine en het kalium. Pas de dosering zo nodig aan op basis van nierfunctie of leeftijd.
- Overweeg bij klachten en een trage pols medicatie ter verlaging van de ventrikelvolgfrequentie te minderen.
Belangrijke factoren die invloed hebben op het atriumfibrilleren
- Bij cardiovasculaire comorbiditeit kunnen aanvullende controles geïndiceerd zijn (zie NHG-Standaard Cardiovasculair risicomanagement).
- Ook niet-cardiovasculaire comorbiditeit, zoals COPD of diabetes, komt veel voor bij patiënten met atriumfibrilleren. Behandeling van deze aandoeningen kan bijdragen aan het verminderen van met atriumfibrilleren geassocieerde morbiditeit.
- Adviseer de patiënt contact op te nemen bij braken, diarree en/of intercurrente infecties. Een (tijdelijk) verminderde nierfunctie kan dosisaanpassing van orale anticoagulantia noodzakelijk maken, vooral van DOAC’s omdat daarbij geen regelmatige INR-controle plaatsvindt (zie tabel 3).
Organisatie van zorg
Naar Samenvatting ›- We bevelen geprotocolleerde zorg aan voor patiënten met atriumfibrilleren bij wie het behandeldoel is bereikt, mits aan de volgende randvoorwaarden wordt voldaan:
- de samenwerking en logistiek tussen de eerste en tweede lijn en binnen de eerste lijn is op orde
- scholing voor praktijkondersteuner (POH) en huisarts is voorhanden
- duurzame financiering is geregeld
- Delegeer controles dan (deels) aan de POH. De inhoud van de controles blijft gelijk (zie Werkwijze controles).
- Een aanzienlijk deel van de patiënten met atriumfibrilleren zal voor een bijkomende aandoening (al) in een programma voor chronische zorg zitten (zoals diabetes mellitus of CVRM).
- Ga na of er op regionaal niveau integrale/protocollaire zorg voor patiënten met atriumfibrilleren voorhanden is die aan de randvoorwaarden voldoet, en overweeg hieraan deel te nemen.
Omdat patiënten met atriumfibrilleren een verhoogd risico hebben op het ontwikkelen van hartfalen en andere metabole aandoeningen, met de bijbehorende sterfte, kan integrale geprotocolleerde zorg met periodieke controle dit sterfterisico mogelijk verlagen. Aangezien er geen onderzoeken zijn gevonden over een deel van de uitkomstmaten (waaronder beroerte of ischemische trombo-embolie en kwaliteit van leven), kan de werkgroep deze uitkomsten niet meewegen. Ook kosteneffectiviteit is een punt waarvoor aandacht nodig blijft. De werkgroep vindt het van belang dat de kwaliteit van zorg gewaarborgd blijft. Mogelijk kan, net als bij andere chronische aandoeningen, een deel van de zorg door zelfmanagement worden gedaan. Voordelen van geprotocolleerde zorg voor de patiënt zouden kunnen zijn: aandacht voor algehele gezondheid, regelmatige controles, tijd om vragen te bespreken, medicatie te controleren en complicaties op te sporen. Daarnaast is het van belang dat de expertise van de huisarts op het gebied van atriumfibrilleren behouden blijft, zorg van de POH en van de huisarts gelijkwaardig zijn en deze niet ten koste gaan van elkaar. Voor de POH is op dit moment aanvullende scholing nodig om patiënten met atriumfibrilleren te kunnen controleren. Daarnaast is er geen landelijke financiering beschikbaar voor deze zorg. Er bestaan wel mogelijkheden op regionaal niveau.
Voor- en nadelen
- Voordelen: patiënten worden frequenter gezien waardoor complicaties en mogelijk ook andere ziekten eerder worden ontdekt en behandeld.
- Nadelen: de verschillen met gebruikelijke zorg zijn niet groot en de integrale geprotocolleerde AF-zorg geeft een extra tijds- en opleidingsinvestering. Daarnaast is over een deel van de cruciale uitkomstmaten (beroerte en ischemische trombo-embolie, kwaliteit van leven) geen onderzoek gevonden.
Kwaliteit van bewijs
De kwaliteit van het bewijs is laag. Er werd afgewaardeerd in verband met inconsistentie (heterogeniteit tussen onderzoeken) en indirectheid (andere populatie dan de uitgangsvraag).
Waarden en voorkeuren van patiënten
Een groot deel van de patiënten vindt het prettig om door de huisarts en/of de POH gecontroleerd te worden, omdat deze meer inzicht heeft in de gehele gezondheid én achtergrond van de patiënt, en mogelijk meer tijd heeft om vragen te beantwoorden. Een ander deel zal ervaren dat zij juist bij de cardioloog alle vragen kunnen stellen en zal zich vertrouwd voelen bij de expertise van de cardioloog.
Kosten
Uit 1 van de 2 onderzoeken over kosteneffectiviteit blijkt dat verpleegkundige zorg kan leiden tot kostenreductie. Het andere onderzoek gaf geen verschil. De werkgroep denkt dat voor vermindering van de kosten een belangrijke voorwaarde is dat de gehele zorg plaatsvindt in de eerste lijn en er bijvoorbeeld geen standaard jaarcontrole is bij de cardioloog.
Aanvaardbaarheid
Het is al breed geaccepteerd om patiënten met chronische aandoeningen periodiek te controleren. De werkgroep verwacht geen probleem bij aanvaardbaarheid onder patiënten. Huisartsen en de andere praktijkmedewerkers hebben mogelijk meer moeite met aanvaarden van een extra taak.
Haalbaarheid
Een deel van de patiënten met atriumfibrilleren zullen voor een bijkomende aandoening al in een programma voor chronische zorg zitten zoals diabetes mellitus of CVRM, en in dat kader geprotocolleerde zorg ontvangen. Omdat het aantal patiënten dat alléén atriumfibrilleren heeft niet hoog zal zijn, is het waarschijnlijk haalbaar om hen op te nemen in de bestaande CVRM-keten. De financiering voor het opnemen van deze extra patiënten in een programma voor chronische zorg is nog niet (landelijk) voorhanden.
Uitgangsvraag
Is integrale geprotocolleerde antifibrillerenzorg (AF-zorg) in de eerste lijn aan te bevelen bij patiënten ≥ 65 jaar met niet-valvulair atriumfibrilleren?
|
Patiënten |
Patiënten ≥ 65 jaar met niet-valvulair atriumfibrilleren |
|---|---|
|
Interventie |
Integrale geprotocolleerde AF-zorg in de eerste lijn |
|
Vergelijking |
Gebruikelijke AF-zorg in de eerste lijn |
|
Uitkomstmaten |
Cruciaal:
Belangrijk:
|
De werkgroep heeft als minimaal klinisch relevant verschil 20% genomen; wat overeenkomt met een OR, RR of HR < 0,75 of > 1,25.
Achtergrond
- De ESC-richtlijn Atriumfibrilleren adviseert geïntegreerde zorg door middel van een gestructureerde multidisciplinaire benadering (class IIa recommendation, level of evidence B). Afhankelijk van de complexiteit zouden meer of minder zorgverleners moet worden betrokken bij de zorg; centraal in deze benadering staat de patiënt. De belangrijkste overweging voor deze aanbeveling is de opvatting dat atriumfibrilleren niet (meer) gezien moet worden als een geïsoleerde aandoening van het hartritme, maar in het geheel van onderliggende risicofactoren en comorbiditeiten. Volgens de ESC-richtlijn is er weinig bewijs voor de effectiviteit van geïntegreerde zorg bij patiënten met atriumfibrilleren. De onderzoeken verschillen in opzet (mate van geïntegreerde zorg, betrokken zorgverleners, veelal uitgevoerd in de tweede lijn) en de resultaten zijn niet consistent.
- De richtlijn beschrijft de Atrial Fibrillation Better Care Pathway (ABC-route) als een manier om geïntegreerde zorg voor patiënten met atriumfibrilleren te stroomlijnen:
- Anticoagulation/avoid stroke
- Better symptom management
- Cardiovascular and comorbidity optimization
- De vraag is of er inmiddels meer onderzoek over geïntegreerde zorg voor patiënten met atriumfibrilleren in de eerste lijn beschikbaar is en wat deze zorg oplevert.
Methoden
- Er is een systematische literatuurzoekactie naar SR’s en RCT’s uitgevoerd in PubMed en Embase in mei 2022.
Resultaten
Resultaat zoekactie
De zoekactie leverde 2 systematische reviews op naar integrale geprotocolleerde zorg bij atriumfibrilleren. Een aanvullende search na de zoekdatum van de systematische reviews leverde 2 aanvullende onderzoeken op. De update van de search in februari 2023 leverde 1 RCT op waarvan de resultaten in lijn zijn met de beschreven onderzoeken en de aanbeveling ondersteunen.
Onderzoekskarakteristieken
- Stevens 2021 includeerde 12 onderzoeken met betrekking tot 7 verschillende cohorten waarin de ABC-route werd onderzocht (voor overzicht zie Totstandkoming, Bijlage 7). De onderzoeken vonden plaats in het Midden Oosten (2), China (2), de Balkan (1), Verenigde Staten en Canada (2), Italië (1), Zuid Korea (3) en Europa (1), en de follow-up bedroeg ≥ 1 jaar (en ≤ 6 jaar). In 3 cohorten werd prospectief informatie verzameld, 2 betroffen retrospectieve post-hocanalyses van prospectief verzamelde data en 2 werden geanalyseerd op basis van landelijke registraties en elektronische gezondheidsdossiers. Het aantal patiënten per onderzoek varieerde van 603 tot 260.000. Voornaamste inclusiecriterium was leeftijd ≥ 18 jaar met atriumfibrilleren, de gemiddelde leeftijd was 57-73 jaar. Het percentage vrouwen in de onderzoeken varieerde van 38-52%. Uitkomstmaten waren beroerte, systemische embolie, sterfte (alle oorzaken), rehospitalisatie (soms met voorgaande uitkomstmaten samengenomen in een samengestelde score) en daarnaast dementie (te gebruiken voor uitkomstmaat ‘cognitie’). NB. Weliswaar werden de meeste onderzoeken in de tweede lijn uitgevoerd, maar we includeren deze review omdat die laat zien of geprotocolleerde zorg (ABC-route) aan te bevelen is boven gebruikelijke of niet-geprotocolleerde zorg (alleen A of AB).
- Rush 2019 includeerde 17 onderzoeken waarin AF-zorg in een ‘nurse-led AF outpatient clinic’ werd beschreven (voor overzicht zie Totstandkoming Bijlage 7). Hieronder werd ambulante of poliklinische zorg voor patiënten met atriumfibrilleren verstaan, waarbij verpleegkundigen verantwoordelijke waren voor de zorg voor atriumfibrilleren patiënten (vaak met supervisie van een cardioloog en/of als onderdeel van een multidisciplinair team). Er werden 4 RCT’s gevonden, 1 quasi-experimenteel onderzoek, 5 prospectieve en 3 retrospectieve onderzoeken, naast 3 kwantitatieve en 1 kwalitatieve beschrijving. De follow-upduur was meestal 1 jaar (bandbreedte 6 weken tot 8 jaar). Geïncludeerd werden patiënten > 18 jaar met atriumfibrilleren (gemiddelde leeftijd 67 jaar), de populatiegrootte was gemiddeld 416 (bandbreedte 4-952). Onderzoeken waren uitgevoerd in Engeland (4), Nederland (5), Australië (2), Denemarken (2), Canada (2), Zweden (1) en de Verenigde Staten (1). Uitkomstmaten waren onder andere kosten, ziekenhuisopname, kwaliteit van leven en sterfte. NB. Weliswaar werden de meeste onderzoeken in de tweede lijn uitgevoerd, maar we includeren deze review omdat die laat zien of AF-zorg door een verpleegkundige (of POH) onder supervisie van een arts aan te bevelen is boven gebruikelijke zorg.
Na de zoekdatum van Stevens en Rush zijn er nog 2 onderzoeken verschenen met betrekking tot dit onderwerp.
- Van den Dries 2020 (Nederland) includeerde in de ALL-IN RCT 26 huisartsenpraktijken die gerandomiseerd werden in een interventiegroep (15 praktijken) en een controlegroep (11 praktijken). De interventiegroep verleende geïntegreerde zorg in de vorm van driemaandelijkse controles door getrainde verpleegkundigen, het monitoren van de anticoagulantia en de mogelijkheid om consult aan te vragen bij cardiologen. De controlegroep verleende de gebruikelijke zorg. Er werden 1240 patiënten geïncludeerd, waarvan 527 in de interventiegroep. Mediane leeftijd was 77 jaar. Uitkomstmaten waren onder andere sterfte (alle oorzaken) na 2 jaar, herseninfarct en ziekenhuisopname.
- Hendriks 2019 (Nederland) beschrijft een post-hocanalyse van een RCT met betrekking tot mortaliteit in geïntegreerde gespecialiseerde AF klinieken. In de RCT werden 712 nieuw gediagnosticeerde patiënten met atriumfibrilleren geïncludeerd (gemiddeld 67 jaar), die gerandomiseerd werden over een interventiegroep of een controlegroep. In de interventiegroep verleende een verpleegkundige onder supervisie van een arts poliklinische of ambulante multidisciplinaire zorg (uitgaande van een universitair ziekenhuis) op basis van de laatste richtlijnen (met software). De controlegroep kreeg de gebruikelijke zorg van een cardioloog. Uitkomstmaat: sterfte (alle oorzaken) na gemiddeld 22 maanden. NB. In de review van Rush (2019) is ook een aantal andere artikelen over deze RCT opgenomen. De resultaten van Hendriks 2019 worden daarom beschreven bij Rush 2019.
Voor de uitkomstmaten cognitie, psychische gezondheid en kosteneffectiviteit werden geen onderzoeken gevonden.
Effectiviteit
Zie tabel d16, d17 en zie tabel "Integrale zorg" voor de samenvatting van de resultaten. NB Stevens 2021 en Rush 2019 hebben geen gepoold gemiddelde berekend omdat de gebruikte definities, criteria en onderzoeksmethoden te verschillend waren. Daarom hebben wij dat ook niet gedaan.
zie tabel "Integrale zorg" voor de samenvatting van de resultaten.
Conclusies
ABC-route versus niet-ABC-zorg
- Er is mogelijk geen klinisch relevant verschil in kans op beroerte en systemische embolie bij wel of geen ABC-route.
- Er is mogelijk geen klinisch relevant verschil in kans op herseninfarct bij wel of geen ABC-route.
- Er is mogelijk minder kans op sterfte bij het volgen van de ABC-route dan bij niet-ABC-zorg.
- Er is mogelijk minder kans op ziekenhuisopname bij het volgen van de ABC-route dan bij niet-ABC-zorg.
- Er is mogelijk een lagere samengestelde score (minder beroerte, sterfte en ziekenhuisopnames) bij het volgen van de ABC-route dan bij niet-ABC-zorg.
- Er is mogelijk minder kans op dementie (passend bij de uitkomstmaat psychische gezondheid) bij het volgen van de ABC-route dan bij niet-ABC-zorg.
- De uitkomstmaten kwaliteit van leven, psychische gezondheid en kosteneffectiviteit werden niet gevonden voor de vergelijking tussen de ABC-route en niet-ABC-zorg.
Verpleegkundige AF-zorg versus gebruikelijke zorg
- Er is mogelijk geen klinisch relevant verschil in kans op sterfte tussen verpleegkundige AF-zorg en gebruikelijke zorg.
- Er is mogelijk geen klinisch relevant verschil in kans op ziekenhuisopname tussen verpleegkundige AF-zorg en gebruikelijke zorg.
- Er is mogelijk een klein of geen verschil in kwaliteit van leven tussen verpleegkundige AF-zorg en gebruikelijke zorg.
- Er is mogelijk een reductie in kosten bij verpleegkundige AF-zorg ten opzichte van gebruikelijke zorg.
- De uitkomstmaten beroerte, cognitie en psychische gezondheid werden niet gevonden voor de vergelijking verpleegkundige AF-zorg en gebruikelijke zorg.
Integrale geprotocolleerde AF-zorg versus gebruikelijke zorg
- Geïntegreerde AF-zorg geeft waarschijnlijk een lagere kans op sterfte dan gebruikelijke zorg.
- Er is waarschijnlijk geen verschil in de kans op een herseninfarct bij geïntegreerde AF-zorg of gebruikelijke zorg.
- Er is waarschijnlijk geen verschil in ziekenhuisopnamen bij geïntegreerde AF-zorg of gebruikelijke zorg.
- De uitkomstmaten beroerte en ischemische embolie, kwaliteit van leven, cognitie, psychische gezondheid en kosteneffectiviteit werden niet gevonden voor de vergelijking tussen geïntegreerde AF-zorg en gebruikelijke zorg.
Minderen en stoppen van medicatie bij kwetsbare ouderen
Naar Samenvatting ›Overweeg te stoppen met antistolling bij een gering geschatte levensverwachting of (ernstige) bloedingscomplicaties.
Bij de herziening van de Multidisciplinaire richtlijn Polyfarmacie bij ouderen in 2020 is de module Minderen en stoppen van medicatie ontwikkeld, inclusief 10 kennisdocumenten die helpen om het minderen en stoppen van veel gebruikte geneesmiddelgroepen uit te voeren. Het primaire doel van minderen en stoppen van medicatie is het optimaliseren van de medicamenteuze behandeling en daarmee het verbeteren van de kwaliteit van leven, gezondheid en welzijn van de patiënt. In deze NHG-Standaard is uit het kennisdocument Anticoagulantia de informatie opgenomen die relevant is bij atriumfibrilleren.
Kennisdocument Minderen en stoppen Anticoagulantia
Wat is bekend over stoppen en minderen van anticoagulantia bij ouderen (met atriumfibrilleren)?
Gering geschatte levensverwachting
Voor patiënten met atriumfibrilleren en een gering geschatte levensverwachting moet de reductie van het aantal cardiovasculaire events afgewogen te worden tegen het toegenomen bloedingsrisico. In het algemeen geldt dat 37 patiënten met atriumfibrilleren zonder eerder doorgemaakte trombo-embolie (primaire preventie) gedurende 1 jaar behandeld moeten worden om 1 beroerte of sterfte te voorkomen. Voor patiënten met atriumfibrilleren en een eerder doorgemaakte trombo-embolie (secundaire preventie) moeten 12 patiënten gedurende 1 jaar behandeld worden. Tegenover preventie van herseninfarct staat een toegenomen kans op een ernstige bloeding.
Een pragmatisch algoritme stelt voor bij patiënten met atriumfibrilleren en een gering geschatte levensverwachting (< 6 maanden) te overwegen actief te stoppen met een anticoagulans. De auteurs onderbouwen de keuze voor een geschatte levensverwachting < 6 maanden echter niet. Continueren zorgt zeer waarschijnlijk niet voor een reductie in mortaliteit, ziekenhuisopnames of invaliditeit. De aanwezigheid van dementie, slechte therapietrouw, hoog valrisico of een slechte instelling op VKA’s (< 60% van de tijd in therapeutische bandbreedte) kunnen meewegen in de beslissing om orale anticoagulantia te staken. Voor overige indicaties moeten de voordelen van continueren (preventie van trombo-embolie) afgewogen worden tegen de nadelen (ernstige bloedingen). Bij deze afweging kan de wens van de patiënt betrokken worden.
(Ernstige) bloedingscomplicaties
De meest voorkomende bijwerking van orale anticoagulantia zijn bloedingen. Bij het optreden van een ernstige bloeding wordt geadviseerd tijdelijk met anticoagulantia te stoppen. Afhankelijk van het type bloeding moeten op individueel niveau het tromboserisico en bloedingsrisico afgewogen worden. In veel gevallen zal dit leiden tot herstarten van het anticoagulans. Hierbij kan op indicatie de streef-INR of de dosering van de DOAC verlaagd worden (zie LTA Antistollingszorg). Het bloedingsrisico is afhankelijk van gedeeltelijk beïnvloedbare individuele patiëntfactoren (onder andere ongecontroleerde hypertensie, comedicatie, ≥ 8 glazen alcohol per week, valrisico). De eerste stap is dan ook altijd deze factoren zo mogelijk te verbeteren.
Effect van stoppen met anticoagulantia
Er zijn geen RCT’s bekend naar het effect van stoppen met anticoagulantia.
In een prospectief cohortonderzoek in verpleeghuizen in verschillende landen is het gebruik van preventieve cardiovasculaire medicatie onderzocht. Het gebruik van anticoagulantia daalde het minst van de onderzochte geneesmiddelgroepen. Hieruit blijkt dat artsen het lastig vinden anticoagulantia te stoppen, ook bij patiënten met een korte levensverwachting. Anticoagulantia zijn niet opgenomen in de expliciete STOPPFrail-criteria. Deelnemende panelleden waren het eens dat anticoagulantia gestaakt kunnen worden bij een groot deel van de kwetsbare ouderen met een gering geschatte levensverwachting, maar niet bij alle. Voor patiënten met een (zeer) hoog risico op een trombo-embolie is doorbehandelen met anticoagulantia gerechtvaardigd.
Aanbeveling anticoagulantia
Overweeg stoppen anticoagulantia bij:
- gering geschatte resterende levensverwachting, weeg hierbij het risico van bloedingen af tegen het risico van een trombo-embolisch event. Bij patiënten met atriumfibrilleren zonder eerder trombo-embolisch event is het risico op een trombo-embolie lager dan bij secundaire preventie.
- (ernstige) bloedingscomplicaties: probeer altijd de risicofactoren voor ernstige bloedingen (ongecontroleerde hypertensie, comedicatie, ≥ 8 glazen alcohol per week, valrisico) te beïnvloeden zodat het bloedingsrisico vermindert.
Aandachtspunten
- Een anticoagulans kan ineens gestopt worden. Er is geen afbouwprocedure nodig.
Consultatie en verwijzing
Naar Samenvatting ›Direct overleg met de cardioloog
Naar Samenvatting ›Overleg direct met de cardioloog bij nieuw vastgesteld atriumfibrilleren dat < 24 uur bestaat en veel klachten geeft door een snelle ventrikelvolgfrequentie (> 110/min). Cardioversie is vaak succesvol, draagt bij aan snelle vermindering van klachten en kan in deze situatie nog zonder antistolling plaatsvinden.
Verwijzing bij nieuw vastgesteld atriumfibrilleren
Naar Samenvatting ›- Indien bij het eerste consult of bij een vervolgconsult ≥ 1 onderdeel van het beleid (zie Stroomschema 1) niet kan worden uitgevoerd in de huisartsenpraktijk.
- Indien een ritmebehandeling wordt overwogen (zie Eerste overwegingen na vaststellen nieuw atriumfibrilleren).
- Verhoogd risico op een herseninfarct bij een absolute contra-indicatie voor orale anticoagulantia (zie Contra-indicaties orale anticoagulantia).
Overige indicaties voor verwijzing
Naar Samenvatting ›- Ventrikelvolgfrequentie < 50/min, niet veroorzaakt door middelen ter verlaging van de ventrikelvolgfrequentie (doel: laten beoordelen of een pacemaker geïndiceerd is)
- Onvoldoende daling van de ventrikelvolgfrequentie ondanks gebruik van 2 frequentieverlagende middelen
- Patiënt met paroxismaal atriumfibrilleren die behandeling wenst ter vermindering van het aantal aanvallen
Behandelopties in de tweedelijn
Naar Samenvatting ›Cardioversie versus verlaging ventrikelvolgfrequentie
Naar Samenvatting ›- Het effect van cardioversie op klinische uitkomsten zoals herseninfarct, systemische trombo-embolie en mortaliteit is vergelijkbaar met verlaging van de ventrikelvolgfrequentie.
- De recidiefkans na cardioversie is groot, ook bij onderhoudstherapie met antiaritmica. Ondanks onderhoudstherapie heeft slechts 30-50% van de patiënten met persisterend atriumfibrilleren 1 jaar na elektrische cardioversie een sinusritme.
- De gebruikte antiaritmica hebben bijwerkingen en zijn potentieel aritmogeen (vooral ventriculaire aritmie).
Cardioversie (ritmecontrole) versus verlaging van de ventrikelvolgfrequentie
- In een meta-analyse uit 2012 naar het effect van ritmebehandeling en verlaging van de ventrikelvolgfrequentie op klinische uitkomsten (mortaliteit alle oorzaken, cardiovasculaire mortaliteit, aritmie/plotse hartdood, herseninfarct, systemische trombo-embolie en ernstige bloeding) werden 8 RCT’s geïncludeerd met in totaal 7499 patiënten ≥ 55 jaar met atriumfibrilleren. De gemiddelde follow-up duur was 2,9 jaar (bandbreedte 1-3,5 jaar). Op geen van de uitkomsten werd verschil gevonden tussen ritmebehandeling en verlaging van de ventrikelvolgfrequentie: mortaliteit alle oorzaken RR 0,95 (95%-BI 0,86 tot 1,05), cardiovasculaire mortaliteit RR 0,99 (95%-BI 0,87 tot 1,13), aritmie/plotse hartdood RR 1,12 (95%-BI 0,91 tot 1,38), herseninfarct RR 0,89 (95%-BI 0,52 tot 1,53), systemische trombo-embolie RR 0,89 (95%-BI 0,69 tot 1,14), ernstige bloeding RR 1,10 (95%-BI 0,89 tot 1,36).
- De ESC-richtlijn Atriumfibrilleren beschrijft dat ritmebehandeling een relevante keuze zou kunnen zijn, aangezien progressie van atriumfibrilleren geassocieerd is met een afname in kwaliteit van leven, onomkeerbaar is en minder op behandeling reageert. Bewijs dat ritmebehandeling ook daadwerkelijk tot een betere uitkomst leidt, is op dit moment onvoldoende voorhanden.
Conclusie
Er is weinig verschil bekend tussen het effect van ritmebehandeling versus verlaging van de ventrikelvolgfrequentie op mortaliteit of andere klinische uitkomsten, met name bij asymptomatische patiënten. Daarom adviseert de werkgroep over het algemeen geen behandeling gericht op herstel van het hartritme op oudere leeftijd (arbitrair > 70 jaar) wanneer er weinig tot geen klachten zijn.
Jongere patiënten (arbitrair < 70 jaar), patiënten met < 24 uur bestaand atriumfibrilleren, patiënten die hemodynamisch instabiel zijn en patiënten die klachten houden ondanks behandeling gericht op verlaging van de ventrikelvolgfrequentie kunnen in principe in aanmerking komen voor ritmecontrole via de cardioloog.
Bij alle nieuwe patiënten met atriumfibrilleren kan (eenmalige) verwijzing naar de cardioloog overwogen worden voor het goed in kaart brengen van de onderliggende hartfunctie middels een echocardiogram, onderzoek naar de aanwezigheid van structurele hartziekte(n) en advies voor verdere (medicamenteuze) behandeling. Klachten en verminderde kwaliteit van leven kunnen dan een indicatie zijn voor herstel van het sinusritme.
Cardioversie
Naar Samenvatting ›- Het sinusritme kan worden hersteld door medicamenteuze of elektrische cardioversie.
- Medicamenteuze cardioversie gebeurt via kortdurende toediening van orale of intraveneuze antiaritmica. Deze zijn vooral werkzaam bij kort bestaand atriumfibrilleren.
- Elektrische cardioversie gebeurt met 1 of enkele elektroshocks onder sedatie of algehele anesthesie.
- Bij atriumfibrilleren dat < 24 uur bestaat, is voorafgaand aan cardioversie vaak geen antistolling nodig.
- Bij atriumfibrilleren > 24 uur is voorafgaand aan cardioversie 3-4 weken antistollingsbehandeling met orale anticoagulantia nodig.
- Bij patiënten met een verhoogde CHA2DS2-VASc-score wordt de antistolling ook na die termijn gecontinueerd.
Voor medicamenteuze cardioversie bestaan verschillende antiaritmica. De kans op herstel van het sinusritme bij atriumfibrilleren < 48 uur is bij gebruik van antiaritmica 40-90%. Bij langer bestaand atriumfibrilleren wordt de kans kleiner. Het initiëren van deze middelen door huisartsen wordt niet aanbevolen wegens het risico op de inductie van gevaarlijke ritmestoornissen (proaritmie). Bij patiënten zonder organisch hartlijden, met een normale kaliumwaarde en een normale nierfunctie zijn deze risico’s overigens gering.
Bij persisterend atriumfibrilleren (zie Begrippen) leidt elektrocardioversie (ECV) bij 70-90% van de patiënten tot een sinusritme. Aansluitend aan cardioversie is voor behoud van het sinusritme vaak medicatie nodig. Ondanks deze medicatie recidiveert bij veel patiënten het atriumfibrilleren. In een aantal prospectieve onderzoeken is gekeken naar het resultaat van ECV met een follow-up van 1 jaar. In een Nederlands onderzoek ondergingen 264 patiënten met persisterend of permanent atriumfibrilleren of atriumflutter ECV. De behandeling was succesvol bij 70% van hen. Na 1 en 2 jaar had respectievelijk 42 en 36% van de patiënten een sinusritme.
In een gerandomiseerd onderzoek bij 90 patiënten met persisterend atriumfibrilleren onderging de ene groep eenmalig ECV, 29% had na 1 jaar een sinusritme. De behandeling in de andere groep bestond uit herhaalde ECV bij een recidief; van deze patiënten had 53% na 1 jaar een sinusritme.
In een prospectief observationeel onderzoek werd bij 96 van de 111 patiënten (86%) die werden verwezen voor ECV een sinusritme verkregen. Nog tijdens de opname en gedurende de eerste maand daarna ontstond bij veel patiënten opnieuw atriumfibrilleren. Na 1 jaar follow-up had 30% nog een sinusritme.
Conclusie
Cardioversie leidt slechts bij een minderheid van de patiënten tot langdurig behoud van sinusritme.
Overige interventies in de tweede lijn
Naar Samenvatting ›- Andere medicamenteuze behandeling, zoals antiaritmica en amiodaron (verlaging van ventrikelvolgfrequentie).
- Percutane of chirurgische interventies kunnen worden overwogen bij patiënten met paroxismaal of persisterend atriumfibrilleren bij wie medicamenteus beleid faalt. Ritmecontrolebehandelingen zoals percutane longvene-isolatie (middels ablatie), chirurgische ablatie of een (mini-)maze-operatie beogen een permanente conversie tot sinusritme. De indicatie voor antistolling blijft afhankelijk van de CHA2DS2-VASc-score.
- Radiofrequente ablatie van de bundel van His of de AV-knoop schakelt de geleidingsstructuren tussen boezems en kamers geheel of gedeeltelijk uit. Bij volledige onderbreking van de AV-geleiding is een pacemaker noodzakelijk. De indicatie voor antitrombotische behandeling blijft bestaan omdat de atria blijven fibrilleren.
In de tweede lijn zijn verschillende behandelingsmogelijkheden beschikbaar.
- Amiodaron verlaagt bij hartfalen de ventrikelfrequentie van atriumfibrilleren en herstelt in sommige gevallen het sinusritme. Behandeling met amiodaron wordt aan de cardioloog overgelaten gezien de bijwerkingen (bradycardie, hyper- en hypothyreoïdie, fotosensibilisatie van de huid, hepatitis, pulmonale toxiciteit en neuromyopathie). Amiodaron kan de plasmaspiegels van digoxine verhogen en de werking van VKA’s versterken. Bij combinatie is extra controle nodig en moet zo nodig de dosering van digoxine of van de VKA worden aangepast. Combinatie van amiodaron met bètablokkers of verapamil wordt ontraden in verband met potentiëring van de remmende werking op het prikkelgeleidingssysteem. Door stapeling in spier- en vetweefsel kan het enkele weken duren voor het middel optimaal werkt (KNMP Kennisbank, geraadpleegd 22 november 2022).
- Bij hisbundelablatie of AV-knoopmodificatie worden de geleidingsstructuren tussen boezems en kamers geheel of gedeeltelijk uitgeschakeld door middel van radiofrequente ablatie (RFA). Bij volledige onderbreking van de AV-geleiding is daarvoor een pacemaker noodzakelijk. De indicatie voor antitrombotische behandeling blijft bestaan omdat de atria blijven fibrilleren.
- Met een percutane longvenekatheterisolatie, chirurgische ablatie of een (mini-)maze-operatie wordt een permanente conversie tot sinusritme beoogd. Bij percutane longvenekatheterisolatie worden de longvenen volledig (circumferentieel) of segmenteel geïsoleerd van het linker atrium, waardoor prikkels die het atriumfibrilleren triggeren, die vaak ontstaan in de manchetten van myocardweefsel rondom de uiteinden van de longvenen, het atrium niet meer bereiken. Het fibrilleren wordt hierdoor beëindigd. Deze techniek lijkt even effectief als de (mini-)maze-operatie, maar is minder invasief. Ook de resultaten op de langere termijn zijn gunstig. Bij een maze-operatie worden in het weefsel van de atria littekens aangebracht die de prikkelgeleiding zodanig veranderen dat het atriumfibrilleren verdwijnt. De gerapporteerde succespercentages zijn 85-95%, onafhankelijk van de toegepaste techniek.
Referenties
- Abdulla J, Nielsen JR. Is the risk of atrial fibrillation higher in athletes than in the general population? A systematic review and meta-analysis. Europace 2009;11:1156-9.
- Acikel S, Bozbas H, Gultekin B, Aydinalp A, Saritas B, Bal U, et al. Comparison of the efficacy of metoprolol and carvedilol for preventing atrial fibrillation after coronary bypass surgery. Int J Cardiol 2008;126:108-13.
- Allan V, Honarbakhsh S, Casas JP, Wallace J, Hunter R, Schilling R, et al. Are cardiovascular risk factors also associated with the incidence of atrial fibrillation? A systematic review and field synopsis of 23 factors in 32 population-based cohorts of 20 million participants. Thromb Haemost 2017;117:837-50.
- Anonymous. Risk factors for stroke and efficacy of antithrombotic therapy in atrial fibrillation. Analysis of pooled data from five randomized controlled trials. Arch Intern Med 1994;154:1449-57.
- Archontakis, Barakakis P, et al. Major hemorrhage risk associated with direct oral anticoagulants in non-valvular atrial fibrillation. Reviews in Cardiovascular Medicine 2022.
- Bang OY, On YK, Lee MY, Jang SW, Han S, Han S, et al. The risk of stroke/systemic embolism and major bleeding in Asian patients with non-valvular atrial fibrillation treated with non-vitamin K oral anticoagulants compared to warfarin: results from a real-world data analysis. PLoS One 2020;15:e0242922.
- Bellandi F, Simonetti I, Leoncini M, Frascarelli F, Giovannini T, Maioli M, et al. Long-term efficacy and safety of propafenone and sotalol for the maintenance of sinus rhythm after conversion of recurrent symptomatic atrial fibrillation. Am.J Cardiol. 2001;88:640-5.
- Benditt DG, Williams JH, Jin J, Deering TF, Zucker R, Browne K, et al. Maintenance of sinus rhythm with oral d,l-sotalol therapy in patients with symptomatic atrial fibrillation and/or atrial flutter. d,l-Sotalol Atrial Fibrillation/Flutter Study Group. Am J Cardiol 1999;84:270-7.
- Benjamin EJ, Muntner P, Alonso A, Bittencourt MS, Callaway CW, Carson AP, et al. Heart disease and stroke statistics-2019 update: a report from the american heart association. Circulation 2019;139:e56-e528.
- Berry C, Stewart S, Payne EM, McArthur JD, McMurray JJ. Electrical cardioversion for atrial fibrillation: outcomes in "real-life" clinical practice. Int.J.Cardiol. 2001;81:29-35.
- Bertaglia E, D'Este D, Zerbo F, Zoppo F, Delise P, Pascotto P. Success of serial external electrical cardioversion of persistent atrial fibrillation in maintaining sinus rhythm; a randomized study. Eur.Heart J. 2002;23:1522-8.
- Blum S, Meyre P, Aeschbacher S, Berger S, Auberson C, Briel M, et al. Incidence and predictors of atrial fibrillation progression: a systematic review and meta-analysis. Heart Rhythm 2019;16:502-10.
- Bogousslavsky J, Van Melle G, Regli F, Kappenberger L. Pathogenesis of anterior circulation stroke in patients with nonvalvular atrial fibrillation: the Lausanne Stroke Registry. Neurology 1990;40:1046-50.
- Bonanad C, García-Blas S, Torres Llergo J, Fernández-Olmo R, Díez-Villanueva P, Ariza-Solé A, et al. Direct oral anticoagulants versus warfarin in octogenarians with nonvalvular atrial fibrillation: a systematic review and meta-analysis. J Clin Med 2021;10.
- Boos CJ. Infection and atrial fibrillation: inflammation begets AF. Eur Heart J 2020;41:1120-2.
- Caldeira D, David C, Sampaio C. Rate versus rhythm control in atrial fibrillation and clinical outcomes: updated systematic review and meta-analysis of randomized controlled trials. Arch Cardiovasc Dis 2012;105:226-38.
- Camm AJ, Savelieva I. Some patients with paroxysmal atrial fibrillation should carry flecainide or propafenone to self treat. BMJ 2007;334:637.
- Carlsson J, Miketic S, Windeler J, Cuneo A, Haun S, Micus S, et al. Randomized trial of rate-control versus rhythm-control in persistent atrial fibrillation: the strategies of treatment of atrial fibrillation (STAF) study. J Am Coll.Cardiol. 2003;41:1690-6.
- Cheng M, Hu Z, Lu X, Huang J, Gu D. Caffeine intake and atrial fibrillation incidence: dose response meta-analysis of prospective cohort studies. Can J Cardiol 2014;30:448-54.
- Clark CE, McDonagh STJ, McManus RJ. Accuracy of automated blood pressure measurements in the presence of atrial fibrillation: systematic review and meta-analysis. J Hum Hypertens 2019;33:352-64.
- Coleman CI, Thompson S, Ashton V, Palladino M, Bunz TJ. Rivaroxaban versus warfarin in African American patients with nonvalvular atrial fibrillation. J Natl Med Assoc 2020;112:395-401.
- Connolly SJ, Pogue J, Hart RG, Hohnloser SH, Pfeffer M, Chrolavicius S, et al. Effect of clopidogrel added to aspirin in patients with atrial fibrillation. N Engl J Med 2009a;360:2066-78.
- Connolly SJ, Ezekowitz MD, Yusuf S, Eikelboom J, Oldgren J, Parekh A, et al. Dabigatran versus warfarin in patients with atrial fibrillation. N Engl J Med 2009b;361:1139-51.
- Connolly SJ, Eikelboom JW, Ng J, Hirsh J, Yusuf S, Pogue J, et al. Net clinical benefit of adding clopidogrel to aspirin therapy in patients with atrial fibrillation for whom vitamin K antagonists are unsuitable. Ann Intern Med 2011a;155:579-86.
- Connolly SJ, Eikelboom J, Joyner C, Diener HC, Hart R, Golitsyn S, et al. Apixaban in patients with atrial fibrillation. N Engl J Med 2011b;364:806-17.
- Coppens M, Eikelboom JW, Hart RG, Yusuf S, Lip GY, Dorian P, et al. The CHA2DS2-VASc score identifies those patients with atrial fibrillation and a CHADS2 score of 1 who are unlikely to benefit from oral anticoagulant therapy. Eur Heart J 2013;34:170-6.
- Danias PG, Caulfield TA, Weigner MJ, Silverman DI, Manning WJ. Likelihood of spontaneous conversion of atrial fibrillation to sinus rhythm. J Am Coll Cardiol 1998;31:588-92.
- Davidson KW, Barry MJ, Mangione CM, Cabana M, Caughey AB, Davis EM, et al. Screening for atrial fibrillation: US Preventive Services Task Force Recommendation Statement. JAMA 2022;327:360-7.
- De Boer RA, Van Dis I, Visseren FLJ, Vaartjes I, Bots ML. Hart- en vaatziekten in Nederland 2019, cijfers over incidentie, prevalentie, ziekte en sterfte. In: Hartstichting, editor. Den Haag: 2019.
- Deedwania PC, Singh BN, Ellenbogen K, Fisher S, Fletcher R, Singh SN. Spontaneous conversion and maintenance of sinus rhythm by amiodarone in patients with heart failure and atrial fibrillation: observations from the veterans affairs congestive heart failure survival trial of antiarrhythmic therapy (CHF-STAT). The Department of Veterans Affairs CHF-STAT Investigators. Circulation 1998;98:2574-9.
- Dell'Orfano JT, Patel H, Wolbrette DL, Luck JC, Naccarelli GV. Acute treatment of atrial fibrillation: spontaneous conversion rates and cost of care. Am J Cardiol 1999;83:788-90, A10.
- Desai R, Patel U, Singh S, Bhuva R, Fong HK, Nunna P, et al. The burden and impact of arrhythmia in chronic obstructive pulmonary disease: insights from the National Inpatient Sample. Int J Cardiol 2019;281:49-55.
- Diener HC, Eikelboom J, Connolly SJ, Joyner CD, Hart RG, Lip GY, et al. Apixaban versus aspirin in patients with atrial fibrillation and previous stroke or transient ischaemic attack: a predefined subgroup analysis from AVERROES, a randomised trial. Lancet Neurol 2012;11:225-31.
- Elbadawi A, Sedhom R, Gad M, Hamed M, Elwagdy A, Barakat AF, et al. Screening for atrial fibrillation in the elderly: a network meta-analysis of randomized trials. Eur J Intern Med 2022;105:38-45.
- Erdem G, Esme M, Doğu BB. Systematic review and meta-analysis of randomized controlled trials on safety and effectiveness of oral anticoagulants for atrial fibrillation in older people. Ir J Med Sci 2022;191:2517-23.
- Farshi R, Kistner D, Sarma JS, Longmate JA, Singh BN. Ventricular rate control in chronic atrial fibrillation during daily activity and programmed exercise: a crossover open-label study of five drug regimens. J Am Coll Cardiol 1999;33:304-10.
- Fitzmaurice DA, Murray ET, McCahon D, Holder R, Raftery JP, Hussain S, et al. Self management of oral anticoagulation: randomised trial. BMJ 2005;331:1057.
- FNT. De kunst van het doseren. (2020). Ga naar bron: FNT. De kunst van het doseren. (2020).
- Frappé P, Cogneau J, Gaboreau Y, Abenhaïm N, Bayen M, Guichard C, et al. Anticoagulants' safety and effectiveness in general practice: a nationwide prospective cohort study. Ann Fam Med 2020;18:131-8.
- Freemantle N, Cleland J, Young P, Mason J, Harrison J. Bèta blockade after myocardial infarction: systematic review and meta regression analysis. BMJ 1999;318:1730-7.
- Friberg L, Rosenqvist M, Lip GY. Net clinical benefit of warfarin in patients with atrial fibrillation: a report from the Swedish atrial fibrillation cohort study. Circulation 2012;125:2298-307.
- Frost L, Engholm G, Johnsen S, Moller H, Henneberg EW, Husted S. Incident thromboembolism in the aorta and the renal, mesenteric, pelvic, and extremity arteries after discharge from the hospital with a diagnosis of atrial fibrillation. Arch Intern Med 2001;161:272-6.
- Frost L, Vestergaard P, Mosekilde L. Hyperthyroidism and risk of atrial fibrillation or flutter: a population-based study. Arch Intern Med 2004;164:1675-8.
- Geijer RMM, Walma EP. Medicamenteuze behandeling van hartfalen. Een herwaardering van bètablokkers, spironolacton en digoxine. Huisarts en Wetenschap 2000;43:163-6.
- Geleris P, Stavrati A, Afthonidis D, Kirpizidis H, Boudoulas H. Spontaneous conversion to sinus rhythm of recent (within 24 hours) atrial fibrillation. J Cardiol 2001;37:103-7.
- Gorst-Rasmussen A, Lip GY, Bjerregaard Larsen T. Rivaroxaban versus warfarin and dabigatran in atrial fibrillation: comparative effectiveness and safety in Danish routine care. Pharmacoepidemiol Drug Saf 2016;25:1236-44.
- Graham DJ, Reichman ME, Wernecke M, Hsueh YH, Izem R, Southworth MR, et al. Stroke, bleeding, and mortality risks in elderly medicare beneficiaries treated with dabigatran or rivaroxaban for nonvalvular atrial fibrillation. JAMA Intern Med 2016;176:1662-71.
- Granziera S, Cohen AT, Nante G, Manzato E, Sergi G. Thromboembolic prevention in frail elderly patients with atrial fibrillation: a practical algorithm. J Am Med Dir Assoc 2015;16:358-64.
- Groenveld HF, Crijns HJ, Rienstra M, Van den Berg MP, Van Veldhuisen DJ, Van Gelder IC. Does intensity of rate control influence outcome in persistent atrial fibrillation? Data of the RACE study. Am Heart J 2009;158:785-91.
- Groenveld HF, Crijns HJ, Van den Berg MP, Van SE, Alings AM, Tijssen JG, et al. The effect of rate control on quality of life in patients with permanent atrial fibrillation: data from the RACE II (Rate Control Efficacy in Permanent Atrial Fibrillation II) study. J Am Coll Cardiol 2011;58:1795-803.
- Groenveld HF. Rate control in atrial fibrillation: all-cause mortality and hospitalizations in patients with permanent atrial fibrillation data of the RACE II study [proefschrift] (2012).
- Gundlund A, Olesen JB, Butt JH, Christensen MA, Gislason GH, Torp-Pedersen C, et al. One-year outcomes in atrial fibrillation presenting during infections: a nationwide registry-based study. Eur Heart J 2020;41:1112-9.
- Guyatt GH, Oxman AD, Kunz R, Brozek J, Alonso-Coello P, Rind D, et al. GRADE guidelines 6. Rating the quality of evidence--imprecision. J Clin Epidemiol 2011;64:1283-93.
- Hart RG, Pearce LA, Aguilar MI. Meta-analysis: antithrombotic therapy to prevent stroke in patients who have nonvalvular atrial fibrillation. Ann Intern Med 2007;146:857-67.
- Hatori Y, Sakai H, Hatori N, Kunishima T, Namiki A, Shimizu M, et al. Long-term outcome and risk factors associated with events in patients with atrial fibrillation treated with oral anticoagulants: The ASSAF-K registry. J Cardiol 2022.
- Hendriks JML, Tieleman RG, Vrijhoef HJM, Wijtvliet P, Gallagher C, Prins MH, et al. Integrated specialized atrial fibrillation clinics reduce all-cause mortality: post hoc analysis of a randomized clinical trial. Europace 2019;21:1785-92.
- Heneghan C, Ward A, Perera R, Bankhead C, Fuller A, Stevens R, et al. Self-monitoring of oral anticoagulation: systematic review and meta-analysis of individual patient data. Lancet 2012;379:322-34.
- Hindricks G, Potpara T, Dagres N, Arbelo E, Bax JJ, Blomström-Lundqvist C, et al. 2020 ESC Guidelines for the diagnosis and management of atrial fibrillation developed in collaboration with the European Association for Cardio-Thoracic Surgery (EACTS): The Task Force for the diagnosis and management of atrial fibrillation of the European Society of Cardiology (ESC) Developed with the special contribution of the European Heart Rhythm Association (EHRA) of the ESC. Eur Heart J 2021;42:373-498.
- Ho MH, Ho CW, Cheung E, Chan PH, Hai JJ, Chan KH, et al. Continuation of dabigatran therapy in "real-world" practice in Hong Kong. PLoS One 2014;9:e101245.
- Hoefman E, Van Weert HC, Reitsma JB, Koster RW, Bindels PJ. De opbrengst van eventrecorders bij de diagnostiek van hartritmestoornissen in de huisartsenpraktijk: een gerandomiseerd effectonderzoek. Huisarts Wet 2005;48:597-602.
- Huisman MV, Teutsch C, Lu S, Diener HC, Dubner SJ, Halperin JL, et al. Dabigatran versus vitamin K antagonists for atrial fibrillation in clinical practice: final outcomes from Phase III of the GLORIA-AF registry. Clin Res Cardiol 2022;111:548-59.
- Huybrechts KF, Gopalakrishnan C, Bartels DB, Zint K, Gurusamy VK, Landon J, et al. Safety and effectiveness of dabigatran and oher direct oral anticoagulants compared with warfarin in patients with atrial fibrillation. Clin Pharmacol Ther 2020;107:1405-19.
- Hylek EM, Go AS, Chang Y, Jensvold NG, Henault LE, Selby JV, et al. Effect of intensity of oral anticoagulation on stroke severity and mortality in atrial fibrillation. N Engl J Med 2003;349:1019-26.
- Induruwa I, Hennebry E, Hennebry J, Thakur M, Warburton EA, Khadjooi K. Sepsis-driven atrial fibrillation and ischaemic stroke. Is there enough evidence to recommend anticoagulation? Eur J Intern Med 2022;98:32-6.
- Joosten LPT, Van Doorn S, Hoes AW, Nierman MC, Wiersma NM, Koek HL, et al. Safety of switching from vitamin K antagonist to non-vitamin K antagonist oral anticoagulant in frail elderly with atrial fibrillation: rationale and design of the FRAIL-AF randomised controlled trial. BMJ Open 2019;9:e032488.
- Joosten LPT, van Doorn S, van de Ven PM, Köhlen BTG, Nierman MC, Koek HL, Hemels MEW, Huisman MV, Kruip M, Faber LM, Wiersma NM, Buding WF, Fijnheer R, Adriaansen HJ, Roes KC, Hoes AW, Rutten FH, Geersing GJ. Safety of Switching from a Vitamin K Antagonist to a Non-Vitamin K Antagonist Oral Anticoagulant in Frail Older Patients with Atrial Fibrillation: Results of the FRAIL-AF Randomized Controlled Trial. Circulation. 2023 Aug 27. PMID: 37634130.
- Joosten LPT, De Boer AR, Van Eerde EJB, Van Doorn S, Hoes AW, Bots ML, et al. Atrial fibrillation: trends in prevalence and antithrombotic prescriptions in the community. Neth Heart J 2022;30:459-65.
- Kaasenbrood F, Hollander M, De Bruijn SH, Dolmans CP, Tieleman RG, Hoes AW, et al. Opportunistic screening versus usual care for diagnosing atrial fibrillation in general practice: a cluster randomised controlled trial. Br J Gen Pract 2020;70:e427-33.
- Kahwati LC, Asher GN, Kadro ZO, Keen S, Ali R, Coker-Schwimmer E, et al. Screening for atrial fibrillation: updated evidence report and systematic review for the US Preventive Services Task Force. JAMA 2022;327:368-83.
- Khargi K, Hutten BA, Lemke B, Deneke T. Surgical treatment of atrial fibrillation: a systematic review. Eur J Cardiothorac Surg 2005;27:258-65.
- Kim DH, Schneeweiss S, Glynn RJ, Lipsitz LA, Rockwood K, Avorn J. Measuring frailty in medicare data: development and validation of a claims-based frailty index. J Gerontol A Biol Sci Med Sci 2018;73:980-7.
- Kim DH, Pawar A, Gagne JJ, Bessette LG, Lee H, Glynn RJ, et al. Frailty and clinical outcomes of direct oral anticoagulants versus warfarin in older adults with atrial fibrillation : a cohort study. Ann Intern Med 2021;174:1214-23.
- Kinlay S, Leitch JW, Neil A, Chapman BL, Hardy DB, Fletcher PJ. Cardiac event recorders yield more diagnoses and are more cost-effective than 48-hour holter monitoring in patients with palpitations. A controlled clinical trial. Ann Intern Med 1996;124:16-20.
- Kirchhof P, Lip GY, Van Gelder IC, Bax J, Hylek E, Kaab S, et al. Comprehensive risk reduction in patients with atrial fibrillation: emerging diagnostic and therapeutic options--a report from the 3rd Atrial Fibrillation Competence NETwork/European Heart Rhythm Association consensus conference. Europace 2012;14:8-27.
- Kirchhof P, Camm AJ, Goette A, Brandes A, Eckardt L, Elvan A, et al. Early rhythm-control therapy in patients with atrial Fibrillation. N Engl J Med 2020;383:1305-16.
- Knol W, Verduijn MM, Lelie-van der Zande ACAM, Van Marum RJ, Brouwers JRBJ, Van der Cammen TJM, et al. Onjuist geneesmiddelgebruik bij ouderen opsporen. Ned Tijdschr Geneeskd 2015.
- Krahn AD, Klein GJ, Kerr CR, Boone J, Sheldon R, Green M, et al. How useful is thyroid function testing in patients with recent-onset atrial fibrillation? The Canadian Registry of Atrial Fibrillation Investigators. Arch Intern Med 1996;156:2221-4.
- Kuhlkamp V, Schirdewan A, Stangl K, Homberg M, Ploch M, Beck OA. Use of metoprolol CR/XL to maintain sinus rhythm after conversion from persistent atrial fibrillation: a randomized, double-blind, placebo-controlled study. J Am Coll Cardiol 2000;36:139-46.
- Kus T, Nadeau R, Costi P, Molin F, Primeau R. Comparison of the diagnostic yield of holter versus transtelephonic monitoring. Can J Cardiol 1995;11:891-4.
- Labaf A, Carlwe M, Svensson PJ. Efficacy and safety of novel oral anticoagulants in clinical practice: a report from three centers in Sweden. Thromb J 2014;12:29.
- Lavan AH, Gallagher P, Parsons C, O’Mahony D. STOPPFrail (Screening tool of older persons prescriptions in frail adults with limited life expectancy) (2017).
- Lechat P, Hulot JS, Escolano S, Mallet A, Leizorovicz A, Werhlen-Grandjean M, et al. Heart rate and cardiac rhythm relationships with bisoprolol benefit in chronic heart failure in CIBIS II Trial. Circulation 2001;103:1428-33.
- Lin L, Lim WS, Zhou HJ, Khoo AL, Tan KT, Chew AP, et al. Clinical and safety outcomes of oral antithrombotics for stroke prevention in atrial fibrillation: a systematic review and network meta-analysis. J Am Med Dir Assoc 2015;16:1103.e1-19.
- Lip GY, Nieuwlaat R, Pisters R, Lane DA, Crijns HJ. Refining clinical risk stratification for predicting stroke and thromboembolism in atrial fibrillation using a novel risk factor-based approach: the euro heart survey on atrial fibrillation. Chest 2010;137:263-72.
- Lowres N, Olivier J, Chao TF, Chen SA, Chen Y, Diederichsen A, et al. Estimated stroke risk, yield, and number needed to screen for atrial fibrillation detected through single time screening: a multicountry patient-level meta-analysis of 141,220 screened individuals. PLoS Med 2019;16:e1002903.
- Lubitz SA, Yin X, Rienstra M, Schnabel RB, Walkey AJ, Magnani JW, et al. Long-term outcomes of secondary atrial fibrillation in the community: the Framingham Heart Study. Circulation 2015;131:1648-55.
- Lubitz SA, Atlas SJ, Ashburner JM, Lipsanopoulos ATT, Borowsky LH, Guan W, et al. Screening for atrial fibrillation in older adults at primary care visits: VITAL-AF randomized controlled trial. Circulation 2022;145:946-54.
- Magnussen C, Niiranen TJ, Ojeda FM, Gianfagna F, Blankenberg S, Njølstad I, et al. Sex differences and similarities in atrial fibrillation epidemiology, risk factors, and mortality in community cohorts: results from the BiomarCaRE Consortium (Biomarker for Cardiovascular Risk Assessment in Europe). Circulation 2017;136:1588-97.
- Malek Makan A, Van Hout H, Onder G, Finne-Soveri H, Van der Roest H, Van Marum R. Prevalence of preventive cardiovascular medication use In nursing home residents. Room for deprescribing? The SHELTER Study. J Am Med Dir Assoc 2017;18:1037-42.
- Mant J, Hobbs FDR, Fletcher K, Roalfe A, Fitzmaurice D, Lip GYH, et al. Warfarin versus aspirin for stroke prevention in an elderly community population with atrial fibrillation (the Birmingham Atrial Fibrillation Treatment of the Aged Study, BAFTA): a randomised controlled trial. Lancet 2007a;370:493-503.
- Mant J, Fitzmaurice DA, Hobbs FDR, Jowett S, Murray ET, Holder R, et al. Accuracy of diagnosing atrial fibrillation on electrocardiogram by primary care practitioners and interpretative diagnostic software: analysis of data from screening for atrial fibrillation in the elderly (SAFE) trial. BMJ 2007b;335:380.
- Martinez BK, Sood NA, Bunz TJ, Coleman CI. Effectiveness and safety of apixaban, dabigatran, and rivaroxaban versus warfarin in frail patients with nonvalvular atrial fibrillation. J Am Heart Assoc 2018;7.
- Martsevich SY, Lukina YV, Kutishenko NP, Kiselev AR, Drapkina OM. Analysis of adverse events in the treatment of patients with non-valvular atrial fibrillation with oral anticoagulants: data from the "ANTEY" observational study. Pharmaceuticals (Basel) 2022;15.
- Mattioli AV, Vivoli D, Borella P, Mattioli G. Clinical, echocardiographic, and hormonal factors influencing spontaneous conversion of recent-onset atrial fibrillation to sinus rhythm. Am J Cardiol 2000;86:351-2.
- Milentijevic D, Lin JH, Connolly N, Chen YW, Kogan E, Shrivastava S, et al. Risk of stroke outcomes in atrial fibrillation patients treated with rivaroxaban and warfarin. J Stroke Cerebrovasc Dis 2021;30:105715.
- Miller VT, Rothrock JF, Pearce LA, Feinberg WM, Hart RG, Anderson DC. Ischemic stroke in patients with atrial fibrillation: effect of aspirin according to stroke mechanism. Stroke Prevention in Atrial Fibrillation Investigators. Neurology 1993;43:32-6.
- Miyazaki S, Miyauchi K, Hayashi H, Yamashiro K, Tanaka R, Nishizaki Y, et al. Trends of anticoagulant use and outcomes of patients with non-valvular atrial fibrillation: findings from the RAFFINE registry. J Cardiol 2022;80:41-8.
- Moermond CTA. Medicijnresten en waterkwaliteit (2020).
- Nakazawa HK, Sakurai K, Hamada N, Momotani N, Ito K. Management of atrial fibrillation in the post-thyrotoxic state. Am J Med 1982;72:903-6.
- Nergardh AK, Rosenqvist M, Nordlander R, Frick M. Maintenance of sinus rhythm with metoprolol CR initiated before cardioversion and repeated cardioversion of atrial fibrillation: a randomized double-blind placebo-controlled study. Eur Heart J 2007;28:1351-7.
- NICE. Atrial fibrillation: diagnosis and management. Evidence review B: accuracy of tests for detection [NG196]. London: National Guideline Centre, Royal College of Physicians, 2021.
- Nielen MMJ, Hek K. Jaarcijfers aandoeningen - Huisartsenregistraties 2021. https://www.nivel.nl/nl/nivel-zorgregistraties-eerste-lijn/jaarcijfers-aandoeningen-huisartsenregistraties.
- Noseworthy PA, Attia ZI, Behnken EM, Giblon RE, Bews KA, Liu S, et al. Artificial intelligence-guided screening for atrial fibrillation using electrocardiogram during sinus rhythm: a prospective non-randomised interventional trial. Lancet 2022;400:1206-12.
- O'Dea D, Whetteckey J, Ting N. A prospective, randomized, open-label study to evaluate two management strategies for gastrointestinal symptoms in patients newly on treatment with dabigatran. Cardiol Ther 2016;5:187-201.
- Oden A, Fahlen M. Oral anticoagulation and risk of death: a medical record linkage study. BMJ 2002;325:1073-5.
- Olesen JB, Lip GY, Lindhardsen J, Lane DA, Ahlehoff O, Hansen ML, et al. Risks of thromboembolism and bleeding with thromboprophylaxis in patients with atrial fibrillation: a net clinical benefit analysis using a 'real world' nationwide cohort study. Thromb Haemost 2011;106:739-49.
- Oral H, Pappone C, Chugh A, Good E, Bogun F, Pelosi F, Jr., et al. Circumferential pulmonary-vein ablation for chronic atrial fibrillation. N Engl J Med 2006;354:934-41.
- Palareti G, Hirsh J, Legnani C, Manotti C, D'Angelo A, Pengo V, et al. Oral anticoagulation treatment in the elderly: a nested, prospective, case-control study. Arch Intern Med 2000;160:470-8.
- Pastori D, Menichelli D, Del Sole F, Pignatelli P, Violi F. Long-term risk of major adverse cardiac events in atrial fibrillation patients on direct oral anticoagulants. Mayo Clin Proc 2021;96:658-65.
- Perreault S, Dragomir A, Côté R, Lenglet A, de Denus S, Dorais M, et al. Comparative effectiveness and safety of low-dose oral anticoagulants in patients with atrial fibrillation. Front Pharmacol 2021;12:812018.
- Pisters R, Lane DA, Nieuwlaat R, De Vos CB, Crijns HJ, Lip GY. A novel user-friendly score (HAS-BLED) to assess 1-year risk of major bleeding in patients with atrial fibrillation: the Euro Heart Survey. Chest 2010;138:1093-100.
- Quinchuela FB, et al. Comprehensive approach to atrial fibrillation in primary care. NeuroQuantology 2022.
- Reiffel JA, Schwarzberg R, Murry M. Comparison of autotriggered memory loop recorders versus standard loop recorders versus 24-hour Holter monitors for arrhythmia detection. Am J Cardiol 2005;95:1055-9.
- Rivezzi F, Vio R, Bilato C, Pagliani L, Pasquetto G, Saccà S, et al. Screening of unknown atrial fibrillation through handheld device in the elderly. J Geriatr Cardiol 2020;17:495-501.
- Rush KL, Burton L, Schaab K, Lukey A. The impact of nurse-led atrial fibrillation clinics on patient and healthcare outcomes: a systematic mixed studies review. Eur J Cardiovasc Nurs 2019;18:526-33.
- Schulman S, Shortt B, Robinson M, Eikelboom JW. Adherence to anticoagulant treatment with dabigatran in a real-world setting. J Thromb Haemost 2013;11:1295-9.
- Seelig J, Hemels MEW. New-onset atrial fibrillation during critical illness: another piece of the puzzle. Europace 2023a;25:249-50.
- Seelig J, Pisters R, Alings AMWM, Hemels MEW. Antistolling zinvol bij kortdurend atriumfibrilleren? Ned Tijdschr Geneeskd. 2023b Feb 8;167:D6811.
- Segal JB, Chang HY, Du Y, Walston JD, Carlson MC, Varadhan R. Development of a claims-based frailty indicator anchored to a well-established frailty phenotype. Med Care 2017;55:716-22.
- Segal JB, McNamara RL, Miller MR, Kim N, Goodman SN, Powe NR, et al. The evidence regarding the drugs used for ventricular rate control. J Fam Pract 2000;49:47-59.
- Shen J, Johnson VM, Sullivan LM, Jacques PF, Magnani JW, Lubitz SA, et al. Dietary factors and incident atrial fibrillation: the Framingham Heart Study. Am J Clin Nutr 2011;93:261-6.
- Smit MD, Crijns HJ, Tijssen JG, Hillege HL, Alings M, Tuininga YS, et al. Effect of lenient versus strict rate control on cardiac remodeling in patients with atrial fibrillation data of the RACE II (RAte Control Efficacy in permanent atrial fibrillation II) study. J Am Coll Cardiol 2011;58:942-9.
- Somerville S, Somerville J, Croft P, Lewis M. Atrial fibrillation: a comparison of methods to identify cases in general practice. Br J Gen Pr 2000;50:727-9.
- Stavrakis S, Elkholey K, Lofgren MM, Asad ZUA, Stephens LD, Freedman B. Screening for Atrial Fibrillation in American Indian Adults in a Tribal Primary Care Clinic. J Am Heart Assoc 2021;10:e020069.
- Steinhubl SR, Waalen J, Sanyal A, Edwards AM, Ariniello LM, Ebner GS, et al. Three year clinical outcomes in a nationwide, observational, siteless clinical trial of atrial fibrillation screening-mHealth Screening to Prevent Strokes (mSToPS). PLoS One 2021;16:e0258276.
- Stevens D, Harrison SL, Kolamunnage-Dona R, Lip GYH, Lane DA. The atrial fibrillation better care pathway for managing atrial fibrillation: a review. Europace 2021;23:1511-27.
- Sun Z, Liu Y, Zhang Y, Guo X, Xu Y. Differences in safety and efficacy of oral anticoagulants in patients with non-valvular atrial fibrillation: a Bayesian analysis. Int J Clin Pract 2019;73:e13308.
- Svensson T, Kitlinski M, Engström G, Melander O. Psychological stress and risk of incident atrial fibrillation in men and women with known atrial fibrillation genetic risk scores. Sci Rep 2017;7:42613.
- Tung P, Levitzky YS, Wang R, Weng J, Quan SF, Gottlieb DJ, et al. Obstructive and central sleep apnea and the risk of incident atrial fibrillation in a community cohort of men and women. J Am Heart Assoc 2017;6.
- Uittenbogaart SB, Verbiest-van Gurp N, Lucassen WA, Winkens B, Nielen M, Erkens PM, et al. Opportunistic screening versus usual care for detection of atrial fibrillation in primary care: cluster randomised controlled trial. BMJ 2020;370:m3208.
- Van den Dries CJ, Van Doorn S, Souverein P, Pajouheshnia R, Moons KGM, Hoes AW, et al. The number of concomitant drugs and the safety of direct oralanticoagulants in routine care patients with atrial fibrillation. TH Open 2020a;4:e417-e26.
- Van den Dries CJ, Van Doorn S, Rutten FH, Oudega R, Van de Leur S, Elvan A, et al. Integrated management of atrial fibrillation in primary care: results of the all-in cluster randomized trial. Eur Heart J 2020b;41:2836-44.
- Van Doorn S, Debray TPA, Kaasenbrood F, Hoes AW, Rutten FH, Moons KGM, et al. Predictive performance of the CHA2DS2-VASc rule in atrial fibrillation: a systematic review and meta-analysis. J Thromb Haemost 2017;15:1065-77.
- Van Doorn S, Geersing GJ, Kievit RF, Van Mourik Y, Bertens LC, Van Riet EES, et al. Opportunistic screening for heart failure with natriuretic peptides in patients with atrial fibrillation: a meta-analysis of individual participant data of four screening studies. Heart 2018;104:1236-7.
- Van Ganse E, Danchin N, Mahé I, Hanon O, Jacoud F, Nolin M, et al. Comparative safety and effectiveness of oral anticoagulants in nonvalvular atrial fibrillation: the NAXOS Study. Stroke 2020;51:2066-75.
- Van Gelder IC, Crijns HJ, Van Gilst WH, Verwer R, Lie KI. Prediction of uneventful cardioversion and maintenance of sinus rhythm from direct-current electrical cardioversion of chronic atrial fibrillation and flutter. Am J Cardiol 1991;68:41-6.
- Van Gelder I, Hagens VE, Bosker HA, Kingma JH, Kamp O, Kingma T, et al. A comparison of rate control and rhythm control in patients with recurrent persistent atrial fibrillation. N Engl J Med 2002;347:1834-40.
- Van Gelder IC. Ritmecontrole als behandeling voor patiënten met medicatieresistent boezemfibrilleren: 'maze'-operatie en percutane longvenekatheterisolatie. Ned Tijdschr Geneeskd 2006a;150:2294-6.
- Van Gelder IC, Wyse DG, Chandler ML, Cooper HA, Olshansky B, Hagens VE, et al. Does intensity of rate-control influence outcome in atrial fibrillation? An analysis of pooled data from the RACE and AFFIRM studies. Europace 2006b;8:935-42.
- Van Gelder IC, Groenveld HF, Crijns HJ, Tuininga YS, Tijssen JG, Alings AM, et al. Lenient versus strict rate control in patients with atrial fibrillation. N Engl J Med 2010;362:1363-73.
- Van Hulst M, Tieleman RG, Zwart LAR, Pomp M, Jacobs MS, Meeder JG, et al. Health economic evaluation of nation-wide screening programmes for atrial fibrillation in the Netherlands. Eur Heart J Qual Care Clin Outcomes 2022.
- Van Rein N, Mettine HA, Bos MHA. Antidota voor direct werkende orale anticoagulantia. 2021;55:83-8.
- Van Staa TP, Setakis E, Di Tanna GL, Lane DA, Lip GY. A comparison of risk stratification schemes for stroke in 79,884 atrial fibrillation patients in general practice. J Thromb Haemost 2011;9:39-48.
- Van Veldhuisen DJ, Aass H, El Allaf D, Dunselman PHJM, Gullestad L, Halinen M, et al. Presence and development of atrial fibrillation in chronic heart failure. Experiences from the MERIT-HF Study. Eur J Heart Fail 2006;8:539-46.
- Van Walraven C, Hart RG, Connolly S, Austin PC, Mant J, Hobbs FDR, et al. Effect of age on stroke prevention therapy in patients with atrial fibrillation: the atrial fibrillation investigators. Stroke 2009;40:1410-6.
- Vedovati MC, Verdecchia P, Giustozzi M, Molini G, Conti S, Pierpaoli L, et al. Permanent discontinuation of non vitamin K oral anticoagulants in real life patients with non-valvular atrial fibrillation. Int J Cardiol 2017;236:363-9.
- Wanless RS, Anderson K, Joy M, Joseph SP. Multicenter comparative study of the efficacy and safety of sotalol in the prophylactic treatment of patients with paroxysmal supraventricular tachyarrhythmias. Am Heart J 1997;133:441-6.
- Weigner MJ, Caulfield TA, Danias PG, Silverman DI, Manning WJ. Risk for clinical thromboembolism associated with conversion to sinus rhythm in patients with atrial fibrillation lasting less than 48 hours. Ann Intern Med 1997;126:615-20.
- Wilkinson C, Wu J, Searle SD, Todd O, Hall M, Kunadian V, et al. Clinical outcomes in patients with atrial fibrillation and frailty: insights from the ENGAGE AF-TIMI 48 trial. BMC Med 2020;18:401.
- Wolf PA, Dawber TR, Thomas HEJ, Kannel WB. Epidemiologic assessment of chronic atrial fibrillation and risk of stroke: the Framingham study. Neurology 1978;28:973-7.
- Wolf PA, Abbott RD, Kannel WB. Atrial fibrillation as an independent risk factor for stroke: the Framingham Study. Stroke 1991;22:983-8.
- Wyse DG, Waldo AL, DiMarco JP, Domanski MJ, Rosenberg Y, Schron EB, et al. A comparison of rate control and rhythm control in patients with atrial fibrillation. N Engl J Med 2002;347:1825-33.
- Yamashita T, Suzuki S, Inoue H, Akao M, Atarashi H, Ikeda T, et al. Two-year outcomes of more than 30 000 elderly patients with atrial fibrillation: results from the All Nippon AF In the Elderly (ANAFIE) Registry. Eur Heart J Qual Care Clin Outcomes 2022;8:202-13.
- Yamashita T, Akao M, Atarashi H, Ikeda T, Koretsune Y, Okumura K, et al. Causes of death in elderly patients with non-valvular atrial fibrillation - results from the ANAFI registry. Circ J 2023.
- Yap LB, Rusani BI, Umadevan D, Muhammad Z, Hussin A, Kaur S, et al. A single centre experience of the efficacy and safety of dabigatran etexilate used for stroke prevention in atrial fibrillation. J Thromb Thrombolysis 2014;38:39-44.
- Yavuz B, Ayturk M, Ozkan S, Ozturk M, Topaloglu C, Aksoy H, et al. A real world data of dabigatran etexilate: multicenter registry of oral anticoagulants in nonvalvular atrial fibrillation. J Thromb Thrombolysis 2016;42:399-404.
- Yusuf S, Held P, Furberg C. Update of effects of calcium antagonists in myocardial infarction or angina in light of the second Danish Verapamil Infarction Trial (DAVIT-II) and other recent studies. Am J Cardiol 1991;67:1295-7.
- Zimetbaum PJ, Josephson ME. The evolving role of ambulatory arrhythmia monitoring in general clinical practice. Ann Intern Med 1999;130:848-56.