Acuut coronair syndroom
Begrippen
Naar Volledige tekst ›Acuut coronair syndroom (ACS): het acute myocardinfarct (AMI) en instabiele angina pectoris (IAP) met klachten in rust.
Richtlijnen diagnostiek
Naar Volledige tekst ›Als ACS waarschijnlijk is: bel onmiddellijk een ambulance met directe inzet (A0/A1-urgentie). Ga vervolgens naar de patiënt, tenzij dat regionaal anders is afgesproken.
Maak een klinische inschatting op basis van de ABCDE-systematiek:
Indien ABCDE instabiel:
- Start bij een circulatiestilstand met reanimeren, in afwachting van de ambulance.
- Zie voor het beleid bij acuut respiratoir falen en/of cardiogene shock, vermoeden van acuut hartfalen of bradycardie de NHG-Behandelrichtlijn Geneesmiddelen en zuurstof in Spoedeisende situaties.
Indien ABCDE stabiel, zie verder Anamnese en Richtlijnen beleid.
Anamnese
Naar Volledige tekst ›Vraag bij vermoeden van ACS naar klachten die hierbij passen:
- duur van de klachten in rust (pijn > 15 minuten)
- aanwezigheid van deze klachten in de afgelopen dagen
- drukkende, scheurende pijn retrosternaal en/of bandgevoel, pijn of doof gevoel in arm(en), schouder(s), nek of kaken, tussen de schouderbladen of in epigastrio
- pijn die volgens de patiënt lijkt op doorgemaakte cardiale ischemie en/of in de afgelopen 24 uur is veranderd van karakter
- vegetatieve verschijnselen, zoals zweten, misselijkheid, braken, bleek of grauw zien
- dyspneu (nieuw of toename)
Vraag verder naar:
- andere klachten, zoals duizeligheid of licht gevoel in het hoofd, syncope, hartkloppingen en/of dyspepsie
- risicofactoren voor hart- en vaatziekten
- medicatiegebruik (trombocytenaggregatieremmers, anticoagulantia, antiaritmica, bètablokkers)
- comorbiditeit COPD
- allergie voor acetylsalicylzuur
- intoxicaties (drugs/lachgas, alcohol)
Lichamelijk onderzoek
Naar Volledige tekst ›Verricht het volgende onderzoek:
- klinische indruk: bleek of grauw zien (beginnende shock), onrust, angst, transpireren
- auscultatie hart (tonen, souffles, pericardwrijven) en longen (reutelgeluiden, crepitaties)
- palpatie borstkas: lokaal opwekbare drukpijn (pleit tegen ACS)
Evaluatie
Naar Volledige tekst ›De volgende klachten maken de diagnose ACS waarschijnlijker:
- retrosternale pijn/druk, al dan niet met uitstraling, vooral indien de pijn gepaard gaat met vegetatieve verschijnselen
- pijn die lijkt op een eerdere episode met angina pectoris
- verandering van momenten en ernst in optreden van pijnklachten in de afgelopen 24 uur
- uitstralende pijn naar 2 armen
Overweeg aanwezige risicofactoren te betrekken bij de beslissing om wel of niet in te sturen (voorafkans hoger bij oudere leeftijd, roken, diabetes mellitus of chronische nierschade), als pijn/druk op de borst niet op de voorgrond staat of afwezig is.
Richtlijnen beleid
Naar Volledige tekst ›Medicamenteuze behandeling
Naar Volledige tekst ›Zie voor doseringen, contra-indicaties en werkingssnelheid/-duur van de aanbevolen geneesmiddelen tabel 11 in de hoofdtekst.
- Geef bij thoracale klachten en een systolische bloeddruk > 90 mmHg nitroglycerinespray of isosorbidedinitraat sublinguaal.
- Breng zo mogelijk een infuusnaald in; spuit de naald door met tenminste 2 ml NaCl 0,9% indien op dat moment geen medicatie wordt gegeven.
- Geef bij matig ernstige pijn en onvoldoende reactie op nitraten of een contra-indicatie voor nitraten: fentanyl of morfine intraveneus of nasaal.
- Bij tekenen van respiratoir falen en/of vastgestelde hypoxie: geef zuurstof indien beschikbaar (zie NHG-Behandelrichtlijn Geneesmiddelen en zuurstof in spoedeisende situaties).
- Geef patiënten een oplaaddosis acetylsalicylzuur oraal. Dit geldt ook voor patiënten die al een trombocytenaggregatieplaatjesremmer, vitamine K-antagonist of DOAC gebruiken.
Overdracht ambulanceverpleegkundigen en verwijzing
Naar Volledige tekst ›- De ambulanceverpleegkundige neemt bij aankomst de behandeling over en is verantwoordelijk voor de keuze tussen een interventiecentrum voor PCI of ander ziekenhuis op basis van het ecg.
- Draag zorg voor een goede mondelinge en bij voorkeur ook schriftelijke overdracht naar de ambulanceverpleegkundige en schriftelijke of digitale overdracht naar de cardioloog.
Behandeling na een ACS
Naar Volledige tekst ›- In het ziekenhuis stelt de cardioloog de patiënt in op medicatie voor de lange termijn.
- Verwijs zo nodig terug naar de cardioloog als blijkt dat de patiënt nog geen hartrevalidatie volgt.
- Indien de patiënt bewust afziet van hartrevalidatie, bespreek dan de mogelijkheden van begeleiding in de eerste lijn.
Controles
Naar Volledige tekst ›- Zie voor de behandeling en streefwaarden van bloeddruk en cholesterolwaarden de NHG-Standaard Cardiovasculair risicomanagement.
- Na 12 maanden kan de patiënt meestal stoppen met het gebruik van een P2Y12-remmer en soms een bètablokker en/of ACE-remmer. Dit staat vermeld in de ontslagbrief van de cardioloog.
- Soms treden psychische klachten en onzekerheden later op. Ga na of er psychische klachten zijn en verwijs zo nodig voor psychische begeleiding of ontspanningstherapie.
Belangrijkste wijzigingen
Naar Samenvatting ›- De oorzaken van een myocardinfarct zonder relevante epicardiale coronaire obstructie worden beschreven.
- De onderdelen Richtlijnen diagnostiek en Richtlijnen beleid zijn aangepast naar de ABCDE-systematiek.
- Er is meer aandacht voor specifieke patiëntgroepen (etnische minderheden, ouderen) en verschillen tussen mannen en vrouwen.
Kernboodschappen
Naar Samenvatting ›- Het leidende symptoom van het acuut coronair syndroom (ACS) is drukkende, scheurende pijn retrosternaal en/of een bandgevoel. Mogelijke andere klachten: dyspneu, pijn in epigastrio, pijn in de linkerarm en vegetatieve verschijnselen.
- Vooral op oudere leeftijd is de klachtenpresentatie bij een ACS vaker minder specifiek (pijn op de borst op de achtergrond of afwezig): wees hierop alert. Veelgenoemde klachten zijn dyspneu en vermoeidheid.
- Klachten en symptomen bij mannen en vrouwen verschillen enigszins in aard en frequentie, maar het onderscheid is minder groot dan dat tussen jongeren en ouderen en het is voor de diagnostiek van ACS in de acute fase van weinig belang. De interpretatie van de arts kan bemoeilijkt worden omdat mannen en vrouwen (identieke) klachten en symptomen verschillend naar voren kunnen brengen en/of interpreteren (vrouwen denken minder vaak aan hartklachten).
- Het gebruik van een diagnostische voorspelregel in de huisartsenpraktijk wordt niet aanbevolen.
- Het gebruik van sneltests voor cardiale schademarkers voor het uitsluiten van een ACS in de huisartsenpraktijk wordt afgeraden.
- Het ecg is niet bruikbaar voor het uitsluiten van ACS in de acute fase vanwege een te lage negatief voorspellende waarde.
- De meeste etnische minderheden hebben een slechtere prognose na een ziekenhuisopname voor een acuut myocardinfarct (AMI) dan gemiddeld door meer (of op jongere leeftijd bestaande) traditionele risicofactoren.
- Een P2Y12-remmer wordt gegeven om een recidief ACS in het eerste jaar zoveel mogelijk te voorkomen. Bij patiënten na een percutane coronaire interventie dient het tevens om het (geringe) risico op de levensbedreigende ‘in-stent trombose’ nog verder te verkleinen.
Scope
Naar Samenvatting ›De NHG-Standaard Acuut coronair syndroom:
- geeft aanbevelingen voor de diagnostiek en het beleid bij (vermoedelijk) ACS. ACS omvat het acuut myocardinfarct (AMI) en instabiele angina pectoris (IAP), die voor de huisarts klinisch niet van elkaar te onderscheiden zijn.
- geeft aanbevelingen voor de voorlichting en (medicamenteuze) adviezen na een vastgesteld ACS.
- beschrijft de rol van de huisarts in de fase direct na ontslag van de patiënt met een vastgesteld ACS uit het ziekenhuis en tijdens de herstelfase.
Buiten de scope
Naar Samenvatting ›- De behandeling van oorzaken van pijn op de borst anders dan door myocardischemie.
- De behandeling van angina pectoris zonder klachten in rust of bij zeer geringe inspanning. Zie hiervoor de NHG-Standaard Stabiele angina pectoris.
- Richtlijnen voor de secundaire preventie van hart- en vaatziekten. Zie hiervoor de NHG-Standaard Cardiovasculair risicomanagement.
Samenwerking en afstemming
Naar Samenvatting ›- Deze standaard is tot stand gekomen in samenwerking met de Nederlandse Vereniging voor Cardiologie (NVVC) en Harteraad.
- Deze standaard is afgestemd op de richtlijnen van de European Society of Cardiology en de NHG-Behandelrichtlijn Geneesmiddelen en zuurstof in spoedeisende situaties.
Achtergronden
Naar Samenvatting ›Afkortingen
Naar Samenvatting ›- ACS = acuut coronair syndroom
- AED = automatische externe defibrillator
- AMI = acuut myocardinfarct
- AP = angina pectoris
- CABG = coronary artery bypass grafting
- ecg = elektrocardiogram
- IAP = instabiele angina pectoris
- MI = myocardinfarct
- MINOCA = myocardinfarct zonder klinisch relevante obstructie in de epicardiale coronaire arteriën bij angiografie
- NSTEMI = non- ST-elevatiemyocardinfarct
- PCI = percutane coronaire interventie
- PTCA = percutane transluminale coronaire angioplastiek
- RCA = rechter coronair arterie
- RCX = ramus circumflex
- RDA = ramus descendens arterie
- STEMI = ST-elevatiemyocardinfarct
- VF = ventrikelfibrilleren
Begrippen
Naar Samenvatting ›Acuut coronair syndroom
Een klinische presentatie met acuut ontstane klachten waarbij acute myocardischemie wordt vermoed. Deze presentatie is breed: van hartstilstand, cardiogene shock door complicaties (zoals ernstige mitralisklepregurgitatie, ventrikelruptuur en (ventriculaire) hartritmestoornissen) tot klachten die alweer verdwenen zijn op het moment van contact met een hulpverlener.
Acuut myocardinfarct
Acute necrose van de hartspier ten gevolge van persisterende myocardiale ischemie. Hierbij worden cardiale schademarkers meetbaar in het bloed. Er dient verder sprake te zijn van ≥ 1 van de volgende items:
- een passende anamnese, zoals acuut thoracaal ongemak, eventueel met vegetatieve verschijnselen
- passende ecg-afwijkingen (ST-elevatie, pathologische Q’s, nieuw compleet LBTB)
- passende afwijkingen bij beeldvorming van de coronairen
- identificatie van een trombus bij coronaire angiografie of autopsie
Instabiele angina pectoris in de setting van ACS
Myocardischemie in rust of bij minimale inspanning zonder acute hartspierschade (en daarbij passende stijging van cardiale schademarkers).
MINOCA
Een AMI zonder aangetoond klinisch relevant obstructief epicardiaal coronairlijden bij coronaire angiografie.
Epicardiale coronaire obstructie
Er is sprake van een klinisch relevante obstructie bij > 70% vernauwing in RCX, RDA of RCA of > 50% in de hoofdstam bij angiografie.
STEMI/NSTEMI
Een AMI met (STEMI) of zonder (NSTEMI) ST-elevaties op het ecg tijdens (of in aansluiting op) klachten.
Acuut coronair syndroom
De definitie is ontleend aan de beschrijving in de richtlijn van de European Society of Cardiology. Elektrocardiografisch zijn er 2 groepen te onderscheiden: ST-elevatiemyocardinfarct (STEMI) en non-ST-elevatie-myocardinfarct (NSTEMI).
Acuut myocardinfarct
De definitie van een acuut myocardinfarct is gebaseerd op de vierde universele definitie van een samenwerking tussen de European Society of Cardiology en het American College of Cardiology. Door de komst van steeds gevoeligere cardiale schademarkers voor het detecteren van cardiale necrose is de definitie in de loop van de jaren een aantal keren herzien.
Volgens deze definitie is er sprake van een myocardinfarct type I als er klinische aanwijzingen voor aanhoudende cardiale ischemie zijn, in combinatie met een acute stijging of daling van het troponine, en daarbij ≥ 1 van de volgende criteria:
- Symptomen passend bij een acuut myocardinfarct, zoals pijn op de borst, dyspneu, zweten
- Nieuwe ischemische ecg-veranderingen, zoals ST-T-veranderingen, nieuw cLBTB
- Ontstaan van pathologische Q’s op het ecg
- Bij beeldvorming vastgesteld verlies van hartspierweefsel of wandbewegingsstoornissen passend bij myocardischemie
- Bij angiografie vastgestelde verse trombus in een van de epicardiale coronairvaten
Er is sprake van een myocardinfarct type II bij een acute stijging of daling van het troponine en bewijs van een onbalans tussen zuurstofbehoefte en toevoer, die niet gerelateerd is aan acute coronaire atherotrombose, met daarbij tenminste 1 van de criteria 1 t/m 4 van hierboven. Oorzaken zijn hypotensie, hypertensie, anemie, aritmie, hypoxemie, coronair vaatspasme, spontane coronaire arteriële dissectie (SCAD), coronaire embolie en coronaire microvasculaire dysfunctie.
Instabiele angina pectoris
De definitie is ontleend aan de beschrijving in de richtlijn van de European Society of Cardiology. Instabiele angina pectoris wordt gedefinieerd als myocardiale ischemie in rust of bij minimale inspanning zonder hartspiernecrose.
Epidemiologie
Naar Samenvatting ›- Coronaire hartziekten zijn verantwoordelijk voor de grootste ziektelast in Nederland. De sterfte neemt af: in 2019 stierven in Nederland 4899 personen door een AMI (2852 mannen en 2047 vrouwen) ten opzichte van 6823 sterfgevallen in 2010. Deze vermindering is reeds begonnen in de zeventiger jaren van de vorige eeuw. De afname is onder andere het gevolg van minder roken, minder meeroken, betere voeding (reductie van transvetten in bewerkt voedsel) en een verbeterde behandeling.
- De incidentie van een AMI in de huisartsenpraktijk is van 2012 tot 2019 licht gestegen van 2,4 naar 2,7 per 1000 vrouwen en van 5,8 naar 6,0 per 1000 mannen. Deze stijging wordt enerzijds veroorzaakt door de vergrijzing van de bevolking (de diagnose komt meer voor) maar anderzijds vooral door toepassing van gevoeligere cardiale schademarkers in het ziekenhuis (de diagnose wordt bij lichtere vormen van hartschade reeds vaker gesteld, met name de diagnose NSTEMI). In 2015 was 59% van alle hartinfarcten een NSTEMI.
- De gemiddelde leeftijd waarop een AMI optreedt, is 67 jaar; 66% van de patiënten is man. De incidentie van een AMI neemt met de leeftijd sterk toe, bij mannen ≥ 55 jaar en bij vrouwen ≥ 65 jaar. Op hogere leeftijd verdwijnt het verschil in incidentie tussen mannen en vrouwen. Onder de leeftijd van 40 jaar is een AMI zeer zeldzaam.
- Verschillen tussen etnische minderheden in incidentie van AMI lijken voornamelijk gebaseerd op verschillen in het voorkomen van risicofactoren, zoals (mee)roken, hoge bloeddruk, verhoogd cholesterol en diabetes mellitus (DM).
- Genetische risicofactoren voor hart- en vaatziekten spelen mogelijk een rol bij bepaalde etnische minderheden, zoals bij mensen van Hindostaanse en Afro-Surinaamse afkomst.
De ziektelast (vroegtijdige sterfte en jaren geleefd met ziekte) is gebaseerd op cijfers van het RIVM; sterftecijfers zijn afkomstig van de CBS Doodsoorzakenstatistiek (http://www.vzinfo.nl/, geraadpleegd op 15 februari 2021).
De incidentiecijfers zijn afkomstig van Nivel registraties.
Het Nivel publiceert geen incidenties van de subcodes, omdat de betrouwbaarheid onvoldoende kan worden gewaarborgd. Voor de incidentie van acuut myocardinfarct (AMI) werd de volgende ICPC-code gebruikt: K75 Acuut myocardinfarct. De ICPC-code K76 Andere/Chronische ischemische hartziekte werd niet gebruikt. De subcodes van deze code zijn namelijk K76.1 Coronairsclerose en K76.2 Vroeger myocardinfarct (> 4 weken geleden). De incidentie van instabiele angina pectoris in de huisartsenpraktijk is onbekend. Er bestaat een subcode Instabiele angina pectoris K74.01. Samen met K74.02 Stabiele angina pectoris is dit een subcode van K74 Angina pectoris. Er bestaat geen ICPC-code voor ACS. Daarom is het onbekend hoe vaak een ACS voorkomt in de huisartsenpraktijk. De incidentie van het AMI (niet gecorrigeerd voor leeftijd) in de huisartsenpraktijk is vanaf 2015 licht gestegen van 5,8 naar 6 per 1000 patiëntjaren voor mannen en van 2,4 naar 2,7 per 1000 patiëntjaren voor vrouwen in 2019.
Cijfers over de verdeling STEMI en NSTEMI zijn gebaseerd op het onderzoek van Ten Have et al..
Cijfers van de gemiddelde leeftijd bij een AMI zijn ontleend aan onderzoek van ziekenhuisregistraties.
Etnische minderheden
Deze paragraaf is gebaseerd op de NHG-Standaard Cardiovasculair risicomanagement.
Bij immigranten uit Turkije, Afrikaanse landen en het Caribisch gebied is er een hogere incidentie van hart- en vaatziekten (HVZ). Bij immigranten uit Marokko is er juist een lagere incidentie van HVZ ten opzichte van de gehele bevolking. Deze verschillen lijken vooral gebaseerd op het voorkomen van meer of minder klassieke risicofactoren, zoals hoge bloeddruk en roken.
Het risico op HVZ is bij een aantal etnische minderheden, waaronder mensen van Hindostaanse en Afro-Surinaamse afkomst, vermoedelijk tenminste gedeeltelijk onafhankelijk van de klassieke risicofactoren erfelijk bepaald. Dit is nog onvoldoende onderzocht om precieze uitspraken over te doen.
Pathogenese
Naar Samenvatting ›- De meest voorkomende oorzaak van een AMI is een acute afname of obstructie van de coronaire doorbloeding.
- Meestal (ruim 90% van de gevallen) is de oorzaak van deze obstructie acute trombusvorming op een atherosclerotische plaque in een van de epicardiale coronairen. Een ruptuur of erosie van een atherosclerotische plaque leidt tot activatie van het stollingssysteem met trombocytenaggregatie als gevolg. Het geleidelijk dichtslibben van de coronairen is in slechts 5% van de gevallen de oorzaak voor een AMI.
- Een zeldzame oorzaak (4% van de gevallen) van een acute coronaire afsluiting is dissectie van een van de coronaire arteriën; meestal de circumflextak (RCX); relatief vaker bij vrouwen dan bij mannen.
- Ook zeldzaam (6% van de gevallen) is een AMI waarbij geen oorzaak wordt gevonden bij angiografie (MINOCA), maar soms wel bij aanvullende beeldvorming (bijvoorbeeld myocarditis, een Takotsubo-cardiomyopathie of indirect aanwijzingen voor microvasculaire disfunctie). Ook dit komt relatief vaker voor bij vrouwen dan bij mannen.
- De grootste risicofactoren voor atherosclerose en daarmee voor hart- en vaatziekten zijn oudere leeftijd en roken. Daarnaast zijn DM, een verhoogde bloeddruk, een verhoogd cholesterol en chronische nierschade onafhankelijke risicofactoren. Zie ook de NHG-Standaard Cardiovasculair risicomanagement.
- Het is niet duidelijk of vrouwspecifieke aandoeningen (pre-eclampsie, zwangerschapsdiabetes, polycysteus ovarium syndroom (PCOS)) een onafhankelijk verhoogd risico geven op hart- en vaatziekten.
- De pathofysiologie bij het ontstaan van een AMI is voor mannen en vrouwen overwegend hetzelfde, met enkele markante verschillen.
Dit onderdeel is gebaseerd op de richtlijnen van de European Society of Cardiology over de behandeling van STEMI en NSTEMI. Risicofactoren voor atherosclerose zijn gebaseerd op de NHG-Standaard Cardiovasculair risicomanagement.
De belangrijkste oorzaak van een AMI is een door een atherotrombus geobstrueerde coronaire arterie (type I MI), veelal bij gevorderd atherosclerosetisch vaatlijden. Daarnaast kan coronair vaatspasme een rol spelen bij het ontstaan van een MI met het beeld van geobstrueerde coronairen bij angiografie. Sympathicomimetica (metamfetamine, cocaïne) kunnen vaatspasme luxeren. Een zeldzame niet-atherosclerotische oorzaak van een AMI is een spontane coronaire arteriële dissectie (SCAD). Meestal wordt een SCAD gevonden bij angiografie. De gemiddelde leeftijd is 50 jaar en het beeld komt overwegend (90%) bij vrouwen voor.
Van alle hartinfarcten wordt in 6% (95%-BI 5%-7%) echter géén obstructie door atherotrombus, spasme of dissectie in de grote, bij angiografie zichtbaar te maken, coronaire vaten gevonden. Er is dan sprake van een zogenaamd myocardinfarct met niet-obstructieve coronaire arteriën (MINOCA). MINOCA is een werkdiagnose, die wordt gesteld als er sprake is van een MI met afwijkende cardiale schademarkers, zonder stenose > 50% bij angiografie en bij afwezigheid van een andere onderliggende oorzaak (bijvoorbeeld dissectie) van de grote coronaire vaten. Patiënten met MINOCA zijn gemiddeld 2,5 jaar jonger, vaker man, hebben iets vaker een hoog cholesterol, en vaker trombofilie (14% van de patiënten). Het voorkomen van risicofactoren, zoals roken, hoge bloeddruk, diabetes mellitus en een positieve familieanamnese voor HVZ, is vergelijkbaar voor MINOCA en het type I MI. De prevalentie van MINOCA is onder jonge patiënten, vrouwen, niet-witte mensen en patiënten met een NSTEMI hoger dan de prevalentie van AMI door coronaire obstructie onder deze patiëntengroepen. Bij aanvullend onderzoek (cardiale MRI) van een MINOCA werd vaak een myocarditis (33%), alsnog een MI (24%), geen oorzaak (21%) of een cardiomyopathie (met name Takotsubo) (20%) gevonden. Bij circa 16% van de patiënten met MINOCA en cardiomyopathie werd een stressgeïnduceerde cardiomyopathie (Takotsubo), in 3% een hypertrofische en in 2% een gedilateerde cardiomyopathie gevonden. Bij ruim een kwart van de patiënten met MINOCA is vaatspasme op te wekken.
Bij coronaire microvasculaire dysfunctie (CMD) ten slotte, is er sprake van een tekortschietende myocardiale perfusie met zuurstofgebrek door een stoornis in de microvasculatuur van de hartspier. Eén van de criteria voor het stellen van de diagnose is het kunnen opwekken van coronair vaatspasme en/of een bewezen verminderde coronaire flowreserve in het aangedane weefsel. CMD komt vaker voor bij postmenopauzale vrouwen, maar lijkt vooral een rol te spelen bij het ontstaan van (stabiele) AP en minder bij het ontstaan van een AMI.
Niet-cardiale oorzaken van een troponinestijging zijn een beroerte, longembolie, sepsis, ARDS of eindstadium nierfalen. Er is in deze gevallen wel hartschade, maar geen onderliggende cardiale ischemie.
Vrouwen met een voorgeschiedenis van (pre-)eclampsie en/of zwangerschapshypertensie hebben een verhoogd risico op het ontwikkelen van een hoge bloeddruk en diabetes mellitus (DM). Vrouwen met het polycysteus-ovariumsyndroom of zwangerschapsdiabetes hebben een verhoogd risico op het ontwikkelen van DM. Het is onduidelijk of een vroegtijdige menopauze een verhoogd risico geeft op het ontwikkelen van DM of hoge bloeddruk. Het is niet opgehelderd of deze vrouwspecifieke aandoeningen een onafhankelijk verhoogd risico geven op HVZ (zie NHG-Standaard Cardiovasculair risicomanagement).
Inleiding
In het afgelopen decennium is er meer aandacht gekomen voor man-vrouwverschillen bij ACS. Pathofysiologische verschillen tussen mannen en vrouwen zouden een rol kunnen spelen bij de diagnostiek.
Uitgangsvraag
Wat zijn de pathofysiologische verschillen tussen mannen en vrouwen met een ACS?
Zoeken en selecteren
Er werd op 9 juli 2020 een literatuuronderzoek verricht naar SR's en observationeel onderzoek in PubMed en Embase vanaf 1 januari 2011. Er werd geen onderzoek gevonden dat voldeed aan de uitgangsvraag. Met behulp van een narratieve review, een systematische review over MINOCA en de NVVC-richtlijn MINOCA (2019) is de uitgangsvraag beantwoord.
Resultaten
Bij het AMI door een atherothrombus spelen 3 vasculaire gebeurtenissen een rol: plaque ruptuur, plaque erosie (27-31%) en calcificaties (2-7%). De meest voorkomende oorzaak is plaque ruptuur met stollingsactivatie en het ontstaan van een occlusieve atherotrombus. Bij een minder voorkomende oorzaak, de plaque erosie, speelt cholesterolophoping in veel mindere mate een rol. Het hechten van microtrombi aan de erosie kunnen uiteindelijk leiden tot occlusie. De ontstaanswijze is onduidelijk. Er zijn tegenstrijdige resultaten over het verschil in voorkomen van plaque ruptuur en plaque erosie tussen mannen en vrouwen met een AMI. Plaque erosie lijkt wel vaker op te treden bij jongere patiënten met een AMI. Plaque ruptuur lijkt vooral zeldzaam bij premenopauzale vrouwen, mogelijk door een beschermend effect van oestrogenen.
Spontane coronaire arteriële dissectie (SCAD) is een zeldzame, niet-obstructieve oorzaak van een type I AMI, die meestal wordt gevonden bij angiografie. De gemiddelde leeftijd is 50 jaar en patiënten zijn overwegend (90%) vrouw.
Coronaire microvasculaire dysfunctie (CMD) is een zeldzame oorzaak van MINOCA. Het komt vaker voor bij postmenopauzale vrouwen. Eén van de criteria van CMD is het kunnen opwekken van coronair vaatspasme en/of het aantonen van een verminderde coronaire flow reserve. CMD komt vaker voor bij postmenopauzale vrouwen. Het lijkt een minder grote rol te spelen bij het ontstaan van een AMI dan bij angina pectoris bij vrouwen.
Conclusie
De meeste myocardinfarcten zijn het gevolg van een plaque ruptuur of erosie. De resultaten over verschillen in pathofysiologie tussen mannen en vrouwen zijn tegenstrijdig. Een veel zeldzamere, spontane coronaire arteriële dissectie komt verreweg het meest bij vrouwen voor. In het algemeen geldt dat er meer overeenkomsten zijn dan verschillen in pathofysiologie bij het ontstaan van een AMI bij mannen en vrouwen, maar er is nog veel onopgehelderd.
Klinische verschijnselen
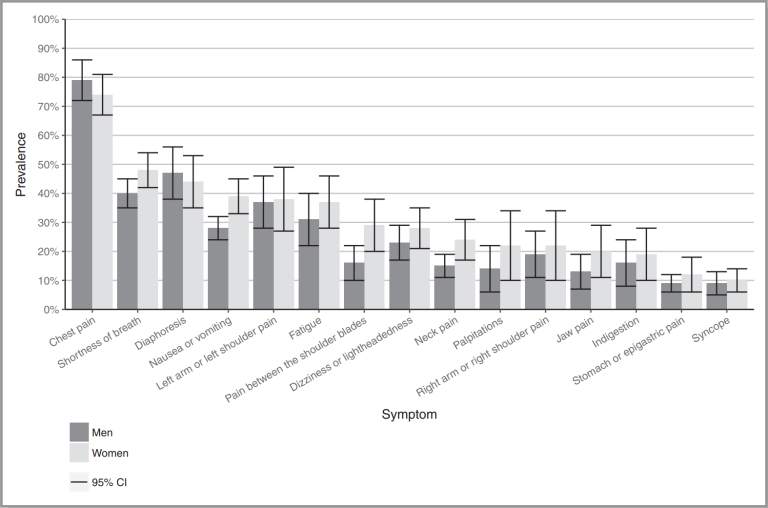
Naar Samenvatting ›Het ACS kan een uiteenlopende combinatie van klachten en verschijnselen veroorzaken, waarbij bijna altijd sprake is van pijn/een benauwd gevoel op de borst.
- Het meest kenmerkende symptoom van een ACS is pijn op de borst (bij 75% van de patiënten), zowel bij mannen als vrouwen. Dit gevoel ontstaat acuut en verdwijnt niet in rust of binnen 5 minuten na toediening van een nitraat onder de tong. De pijn kan gepaard gaan met een gevoel van dreigend onheil/het ‘gevoel dat het serieus is’.
- Andere veelvoorkomende symptomen (30-50%) zijn kortademigheid/gevoel niet goed door te kunnen ademen, zweten, misselijkheid of braken, vermoeidheid en bleek of grauw zien en uitstraling van de pijn naar de linkerschouder of -arm.
- De volgende symptomen komen minder vaak (< 30%) voor: pijn tussen de schouderbladen, duizeligheid of een licht gevoel in het hoofd, pijn in de nek, hartkloppingen, pijn in de rechterschouder of -arm, kaakpijn of dyspepsie. Het minst voorkomend zijn pijn in epigastrio of syncope (beide bij 10% van de patiënten).
- Soms staat de pijn op de achtergrond ten opzichte van andere klachten, zoals plotseling optredende dyspneu, al dan niet in combinatie met vegetatieve verschijnselen, moeheid, duizeligheid, een algeheel gevoel van zwakte of onrust. Deze minder specifieke presentatie wordt vaker gezien op oudere leeftijd (> 65 jaar).
Specifieke groepen
Naar Samenvatting ›- Het is onduidelijk of patiënten met DM en/of een verhoogd nuchter glucose vaker een AMI hebben zonder pijn op de borst (door neuropathie).
- Er bestaan voor zover bekend geen belangrijke verschillen in de klachtenpresentatie bij een ACS tussen verschillende etnische groepen.
- Klachten en symptomen bij mannen en vrouwen verschillen enigszins in aard en frequentie, maar het onderscheid is minder groot dan dat tussen jongeren en ouderen. Het is voor de diagnostiek van het ACS in de acute fase van weinig belang.
- De interpretatie van de arts kan bemoeilijkt worden omdat mannen en vrouwen (identieke) klachten en symptomen verschillend naar voren kunnen brengen en/of interpreteren (vrouwen denken minder vaak aan hartklachten).
- Patiënten met meerdere risicofactoren (oudere leeftijd, roken, DM) voor hart- en vaatziekten dienen goed voorgelicht te worden om bij klachten die mogelijk bij een ACS passen direct medische hulp te zoeken.
Klinische verschijnselen
De klachten en verschijnselen die worden beschreven in het onderdeel Klinische verschijnselen zijn afkomstig uit de meta-analyse naar klachten en symptomen bij een ACS.
Deze meta-analyse wordt verder beschreven in het onderdeel Klachtenpresentatie.
Specifieke groepen
Ouderen
In het internationale GRACE-onderzoek bij patiënten met een doorgemaakt ACS (n = 20.881) werd een vergelijking gemaakt tussen patiënten zonder pijn op de borst en degenen met pijn op de borst. In totaal had slechts 8% van alle patiënten met een doorgemaakt ACS een presentatie zonder pijn op de borst; 42% hiervan was vrouw. Veelvoorkomende klachten in deze groep (zonder pijn op de borst) waren dyspneu (49%), zweten (26%), misselijkheid of braken (24%) en duizeligheid/flauwvallen (19%). De gemiddelde leeftijd van patiënten die zich presenteerden zonder pijn op de borst was 73 jaar tegen 66 jaar bij degenen mét pijn op de borst.
Canto beschrijft in een observationeel, retrospectief onderzoek, gebaseerd op gegevens uit de National Registry of Myocardial Infarction (NRMI), bij patiënten opgenomen in het ziekenhuis met een bevestigd AMI in de periode 1994 tot 2006 voorspellers van een AMI met of zonder pijn op de borst, gedifferentieerd naar leeftijd, geslacht en ziekenhuissterfte. De onderzochte groep bestond uit 1.143.513 patiënten met een hartinfarct, waarvan 42,1% vrouwen. De vrouwen waren gemiddeld ouder dan de mannen: de gemiddelde leeftijd bedroeg 73,9 versus 66,5 jaar. De verschillen tussen mannen en vrouwen worden gestratificeerd voor leeftijd vermeld in tabel 1. Uit dit onderzoek blijkt dat bij ouderen de klacht pijn op de borst minder vaak voorkomt dan bij jongeren (86% bij patiënten < 45 jaar versus 51% bij patiënten van 75 tot 84 jaar).
| Leeftijd | Aantal | Met pijn op de borst | Zonder pijn op de borst | |||
|---|---|---|---|---|---|---|
| Vrouwen | Mannen | Vrouwen (%) | Mannen (%) | Vrouwen (%) | Mannen (%) | |
| < 45 | 15.236 | 51.304 | 81,5 | 87,0 | 18,5 | 13,0 |
| 45-54 | 31.899 | 100.878 | 78,4 | 84,3 | 21,6 | 15,7 |
| 55-64 | 61.164 | 139.855 | 71,1 | 78,2 | 28,9 | 21,8 |
| 65-74 | 107.877 | 159 603 | 62,1 | 67,3 | 37,9 | 32,7 |
| 75-84 | 265.405 | 210.292 | 49,6 | 53,4 | 50,4 | 46,6 |
| Bron Canto 2012. National Registry of Myocardial Infarction, 1994-2006. | ||||||
De presentatie van het ACS is afhankelijk van de leeftijd. Bij ouderen staan benauwdheid/dyspneu en plots afgenomen inspanningsvermogen vaker op de voorgrond, al dan niet in combinatie met pijn op de borst of vegetatieve verschijnselen. Ook kan er sprake zijn van duizeligheid, flauwvallen, zwakte of verwardheid.
Diabetes mellitus
In een Zweeds onderzoek bij 4028 patiënten met een myocardinfarct had 90,1% van de diabetespatiënten een typische presentatie ten opzichte van 91,5% van de niet-diabeten.
Patiënten met diabetes mellitus (DM) hadden dezelfde klachtenpresentatie als patiënten zonder DM, anders dan traditioneel werd gedacht. Er werd ook geen man-vrouwverschil gezien in klachtenpresentatie. Er was wel een verschil in presentatie tussen leeftijd ≥65 jaar en < 65 jaar; bij ouderen was er vaker een atypische presentatie.
In een prospectief Nederlands onderzoek bij 97.203 volwassenen die 5 jaar werden vervolgd bleek DM geen risicofactor te zijn voor een niet-herkend myocardinfarct.
Glucosewaarden bleken wel relatief hoger bij patiënten met een niet-herkend myocardinfarct ten opzichte van patiënten met een herkend myocardinfarct: gecorrigeerde OR 1,36 (95%-BI 1,08-1,72).
In een Amerikaans onderzoek onder 4355 ouderen (leeftijd ≥ 65 jaar) bleek DM met een verhoogd nuchter glucose een risicofactor voor een niet-herkend myocardinfarct: gecorrigeerde OR 1,37 (95%-BI 1,02-1,81).
Etnische minderheden
Het is onduidelijk of er een verschil is in presentatie van het ACS tussen in Nederland woonachtige patiënten van Surinaamse, Antilliaanse, Turkse of Marokkaanse afkomst en autochtone Nederlanders door gebrek aan recent onderzoek. In de NICE-richtlijn Chest pain worden geen grote verschillen gevonden in klachtenpresentatie tussen verschillende etnische groepen.
Conclusie
Bij ouderen met een ACS is benauwdheid of dyspneu vaak de belangrijkste klacht in combinatie met vegetatieve verschijnselen. Het is onduidelijk of DM of een glucose-intolerantie een risicofactor is voor een atypische presentatie van een AMI of stil infarct door tegenstrijdige onderzoeksresultaten. Er bestaan waarschijnlijk geen grote verschillen in de klachtenpresentatie van een ACS tussen verschillende etnische groepen.
Inleiding
Uitgangsvraag
Is er een verschil in klachtenpresentatie tussen mannen en vrouwen met een ACS?
Zoeken en selecteren
Er werd op 10 juli 2020 een literatuuronderzoek verricht naar SR's en observationeel onderzoek in PubMed en Embase vanaf 1 januari 2011. Er werden 2 onderzoeken gevonden die voldeden aan de uitgangsvraag met deelnemers met een vermoeden van een ACS.
Er werd een meta-analyse van goede kwaliteit gevonden, die voldeed aan de uitgangsvraag met deelnemers met een vastgesteld ACS. De review includeerde alle onderzoeken die voor juni 2019 waren gepubliceerd en klachten hadden meegenomen. In de 27 onderzoeken werden gegevens op verschillende manieren verzameld: 10 met behulp van dossiers, 9 met vragenlijsten, 4 met interviews, 2 met audio-opnames en 2 met een combinatie van vragenlijst en interview. Een bevestigd ACS werd gedefinieerd als een myocardinfarct (STEMI of NSTEMI) of IAP volgens de richtlijnen van de American Heart Association. De uitkomstmaten sterfte en niet-cardiale levensbedreigende aandoeningen werden niet meegenomen.
Resultaten
Beschrijving onderzoeken
In een prospectief onderzoek in 150 huisartsenpraktijken werden van 2006 tot 2007 298 opeenvolgende mensen met een vermoeden van een ACS geïncludeerd. Van de 298 deelnemers was 48% man. Mannen waren gemiddeld jonger dan vrouwen (63 versus 68 jaar) oud. Mannen rookten vaker dan vrouwelijke deelnemers (22% versus 10%). Uiteindelijk kregen 38 mannen (13%) en 28 vrouwen (9%) de diagnose ACS bevestigd.
In een groot Nederlands prospectief cohortonderzoek, de Lifelines Cohort Study, werden 97.203 mensen (41% man) geïncludeerd van ≥ 18 jaar met een normaal ecg. Na 5 jaar werden ze opnieuw gezien en volgde een controle-ecg. Tussendoor werd er 2 keer een vragenlijst rondgestuurd. Het doel van het onderzoek was het traceren van stille infarcten en man/vrouw-verschillen. Een niet herkend of stil infarct werd vastgesteld als er ecg-veranderingen passend bij een oud MI werden gezien op het controle-ecg zonder dat er klachten waren gemeld. Deze conclusie over het oude myocardinfarct werd niet met aanvullende beeldvorming geverifieerd.
In de meta-analyse van Van Oosterhout werden 27 onderzoeken geïncludeerd met in totaal 1.226.163 patiënten met een ACS op de spoedeisende hulp. Tien onderzoeken waren uitgevoerd met deelnemers met een bevestigd ACS (STEMI, NSTEMI of instabiele angina pectoris) en 17 onderzoeken met alleen myocardinfarct (STEMI of NSTEMI). De onderzoeken vonden plaats op de spoedeisende hulp en overwegend in Europa of de Verenigde staten in de periode van 1985 tot 2017. De grootte van de onderzoeken varieerde van 82 tot 1.143.513 deelnemers. De gemiddelde leeftijd was 47-78 jaar voor vrouwen en 47-68 jaar voor mannen.
Klachtenpresentatie
In het onderzoek van Bruins Slot waren de klachten waarmee deelnemers met een vermoeden van een ACS (pijn op de borst, uitstraling van pijn en misselijkheid of zweten) zich presenteerden bij de huisarts niet significant verschillend tussen mannen en vrouwen. Pijn op de borst kwam voor bij 91% van de mannen en 96% van de vrouwen, uitstraling van pijn bij 58% van de mannen en 68% van de vrouwen en misselijkheid of zweten bij 59% van de mannen en 57% van de vrouwen.
In het onderzoek van Van der Ende bleken 139 van de 57.276 (0,24%) vrouwen en 305 van de 39.927 (0,76%) mannen gediagnosticeerd te zijn met een hartinfarct gedurende een gemiddelde follow-up van 3,8 jaar. Op basis van ecg-veranderingen bleken er stille infarcten te zijn opgetreden bij 59 (0,10%) vrouwen en 60 (0,15%) mannen. Van de mensen met een myocardinfarct hadden relatief meer vrouwen (30%) een stil infarct dan mannen (16%), met name in de leeftijdscategorie 40-69 jaar. Patiënten met stille infarcten bleken minder vaak symptomen te hebben gemeld dan patiënten met een herkend AMI. Stille infarcten traden vaker op bij mannen en vrouwen met een hoge bloeddruk, roken en hoge glucosewaarden.
Uit de meta-analyse van Van Oosterhout kwam naar voren dat vrouwen zich vaker dan mannen met pijn tussen de schouderbladen (OR 1,89; 95%-BI 1,27-2,82), misselijkheid of braken (OR 1,63; 95%-BI 1,12-2,19), kaakpijn (OR 1,67; 95%-BI 1,01-2,78) en iets vaker met kortademigheid (OR 1,22; 95%-BI 1,01-1,46) presenteerden. Er werd geen man-vrouwverschil gevonden bij alle overige klachten: pijn op de borst, zweten, pijn in de rechter- of linkerarm, nekpijn, hartkloppingen, vermoeidheid, dyspepsie, duizeligheid of licht in het hoofd, syncope, maagpijn of pijn in epigastrio. In deze meta-analyse werd het risico op publicatiebias laag ingeschat voor de symptomen, behalve voor ‘zweten’. Voor het symptoom zweten waren relatief veel kleinere onderzoeken beschikbaar waarin deze klacht was meegenomen.
Tijd tot contact medische hulp (ambulance, huisarts of spoedeisende hulp)
In het onderzoek van Bruins Slot was de mediane duur tot contact met de huisarts 132 minuten (interkwartielrange (IKR) 44 tot 360 minuten). Er was geen significant verschil tussen mannen en vrouwen: 108 minuten (IKR 39 tot 348 minuten) bij vrouwen en 180 minuten (IKR 48 tot 396 minuten) bij mannen (p = 0,20).
In de meta-analyse werd deze uitkomtmaat niet meegenomen.
Conclusie
Er lijkt geen sprake van grote man-vrouwverschillen in klachtenpresentatie bij patiënten die zich bij de arts melden met klachten passend bij een ACS. Bij een achteraf bevestigd ACS blijken vrouwen zich overwegend met dezelfde klachten te hebben gepresenteerd als mannen, maar iets vaker met pijn tussen de schouderbladen en in mindere mate met misselijkheid of braken, kaakpijn en dyspneu dan mannen.
Bij patiënten die zich niet melden met klachten, maar waar na verloop van tijd een hartinfarct op het ecg te zien is, is de vrouw-manratio 2:1. Deze groep is in absolute zin veel kleiner dan de groep die zich wel presenteert met gerichte klachten. Deze mensen zijn mogelijk op basis van specifieke kenmerken beter te identificeren, maar dus niet op basis van gerichte klachten waarmee ze bij de huisarts komen.
Zowel mannen als vrouwen met risicofactoren voor HVZ moeten aangemoedigd worden om bij klachten die kunnen passen bij een ACS medische hulp te zoeken.
Behandelvertraging
Naar Samenvatting ›- Risicofactoren voor het ontstaan van behandelvertraging zijn oudere leeftijd, afgelegen wonen en DM.
- Mogelijke oorzaken voor de vertraging bij patiënten met DM is dat zij zich aanpassen aan hun klachten of de klachten duiden als passend bij hun diabetes.
- In het verleden werden vrouwen met het vermoeden van een ACS later doorverwezen dan mannen. Deze vertraging bestaat niet meer bij telefonische triage op de huisartsenpost (HAP) en ook niet bij het STEMI. Het is onbekend of dit nog bestaat voor NSTEMI in de dagpraktijk.
Risicofactoren voor een behandelvertraging (≥ 2 uur tussen ontstaan klachten en klinische presentatie) bij een ACS zijn oudere leeftijd, afgelegen wonen en diabetes mellitus (DM).
De tijd tussen het begin van de klachten en ziekenhuisopname was bij 64% van de patiënten met diabetes en een AMI ≥ 2 uur in vergelijking met 58% van de patiënten zonder DM. Het betrof een Zweeds onderzoek met 4266 patiënten met een AMI, leeftijd 25-74 jaar, in de periode van 2000 tot 2008. In een ander onderzoek was de duur gemiddeld 2 uur en 24 min bij patiënten met diabetes en ACS en 1 uur en 15 min bij patiënten zonder DM.
Mogelijke oorzaken zijn dat patiënten met DM, net zoals andere chronisch zieken, zich aanpassen aan hun klachten of duiden als klachten passend bij hun DM (bijvoorbeeld zweten of duizeligheid door laag suiker).
Inleiding
Volgens de ESC-richtlijn non-STEMI ACS worden vrouwen minder vaak (30%) verwezen voor aanvullend cardiaal onderzoek en hartkatheterisatie. Verklaringen hiervoor zijn oudere leeftijd, meer comorbiditeit, meer atypische klachten, lagere risico-inschatting door artsen, minder vaak verhoogde cardiale troponines en vaker niet-diagnostische ecg’s.
Uitgangsvraag
Is er een verschil in klachtenherkenning door de huisarts tussen mannen en vrouwen met een ACS?
Zoeken en selecteren
Er werd op 10 juli 2020 een literatuuronderzoek verricht naar SR's en observationeel onderzoek in PubMed en Embase vanaf 1 januari 2011. Er werden 4 onderzoeken gevonden die voldeden aan de uitgangsvraag.
Resultaten
Beschrijving onderzoeken
In een prospectief onderzoek in 150 huisartsenpraktijken werden van 2006 tot 2007 298 opeenvolgende patiënten met een vermoeden van ACS geïncludeerd. Van de 298 deelnemers was 143 man en 155 vrouw met respectievelijk een gemiddelde leeftijd van 63 en 68 jaar oud. Mannen rookten vaker dan vrouwelijke deelnemers: 31/143 mannen versus 16/155 vrouwen. Uiteindelijk kregen 38 mannen (13%) en 28 vrouwen (9%) de diagnose ACS.
In een retrospectief observationeel onderzoek werden 276 vrouwen en 242 mannen die de huisartsenpost consulteerden met borstkasklachten geïncludeerd. Dit was een Nederlands onderzoek in de periode 2013 tot 2014. Uiteindelijk kregen 34 mannen (14%) en 22 vrouwen (8,4%) de diagnose ACS. Selectiebias is mogelijk door het hoge percentage missende data (37,7%.)
In een groot Nederlands prospectief cohortonderzoek, de Lifelines Cohort Study, werden 97.203 patiënten (41% man) geïncludeerd van ≥ 18 jaar met een normaal ecg. Na 5 jaar kregen ze een follow-up visite en een controle-ecg. Tussendoor werd er 2 keer een vragenlijst rondgestuurd. Het doel van het onderzoek was het traceren van stille infarcten en man-vrouwverschillen. Een niet herkend of stil infarct werd vastgesteld als er ecg-veranderingen passend bij een oud MI werden gezien op het controle-ecg zonder dat er klachten waren gemeld.
In een Amsterdams onderzoek werden 787 patiënten (29% vrouw) met een STEMI geïncludeerd in de periode 2015-2016. Vrouwen waren gemiddeld 7 jaar ouder dan mannen (68 versus 61 jaar).
Klachtenherkenning
In het onderzoek van Bruins Slot was de tijd tussen consultatie van de huisarts en het begin van de klachten bij vrouwen met een vermoeden van ACS 45 minuten [IQR 48-348] en bij mannen 33 minuten [IQR 20-55]. Dit verschil bleef bestaan na correctie voor leeftijd.
In het onderzoek van Van der Meer was er geen verschil in het toewijzen van een hoge urgentie (A1 of A2) aan de telefoon bij mannen (157/242) in vergelijking met vrouwen (181/276) met klachten van pijn op de borst (OR 1,11; 95%-BI 0,77-1,61), gecorrigeerd voor ACS en leeftijd. Van alle 23 vrouwen met een vastgesteld ACS kregen 22 (96%) een hoge urgentie in vergelijking met 30 van de 34 mannen (88%) (OR 2,93; 95%-BI 0,31-28,09).
De telefonische triage duurde significant korter bij vrouwen met een ACS in vergelijking met vrouwen zonder ACS, namelijk 5,22 (SD 2,53) versus 7,26 (SD 3,11) minuten. Dit verschil was bij mannen kleiner en niet significant verschillend, namelijk 6,27 (SD 2,59) versus 7,22 (SD 2,51) minuten bij respectievelijk ACS en geen ACS.
In het onderzoek van Van der Ende bleken 139/57276 (0,24%) vrouwen en 305/39927 (0,76%) mannen gediagnosticeerd te zijn met een hartinfarct gedurende een gemiddelde follow-up van 3,8 jaar. Op basis van ecg-veranderingen bleken er stille infarcten te zijn opgetreden bij 59 (0,10%) vrouwen en 60 (0,15%) mannen. Relatief meer vrouwen (59/198, 30%) hadden een stil infarct ten opzichte van mannen (60/365, 16%), met name in de leeftijdscategorie 40-69 jaar. Patiënten met stille infarcten bleken minder vaak symptomen te hebben gemeld dan patiënten met een herkend AMI. Stille infarcten traden vaker op bij mannen en vrouwen met een hoge bloeddruk, roken en hoge glucosewaarden.
Er werd geen verschil gevonden in tijd tot behandeling van een STEMI tussen mannen en vrouwen in de regio Amsterdam. In 85% van de gevallen (87% van de vrouwen en 85% van de mannen) werd de behandeling binnen 90 minuten gestart.
Conclusie
Er is waarschijnlijk geen verschil in klachtenherkenning bij vrouwen in vergelijking met mannen met een STEMI. Onduidelijk is of dit ook het geval is bij het NSTEMI. Laagdrempelige verwijzing van zowel mannen als vrouwen met risicofactoren voor HVZ en atypische klachten die kunnen passen bij een ACS is aan te bevelen.
Er is geen verschil in het toewijzen van een hoge urgentie bij telefonische triage van de huisartsenpost tussen mannen en vrouwen die zich presenteren met pijn op de borst. Of er een verschil is geweest in triage tussen mannen en vrouwen waarbij een ACS werd vastgesteld, is onduidelijk.
Beloop
Naar Samenvatting ›- Een ACS treedt absoluut gezien het vaakst tussen 6 en 12 uur ‘s ochtends op.
- Op de HAP is de kans op een ACS bij patiënten die bellen tussen 24 uur ’s nachts en 9 uur ’s ochtends gemiddeld 2 keer zo hoog dan wanneer ze op een ander moment van de dag bellen met klachten.
- Patiënten met een ACS lopen in de eerste uren na het begin van de klachten kans op een plotse dood ten gevolge van ventrikelfibrilleren.
- Snel herstel van de bloedstroom van de coronaire arterie door middel van medicatie en interventie (PCI of CABG) kan uitgebreide myocardnecrose, verminderde linkerkamerfunctie, ventriculaire ritmestoornissen, mechanische complicaties en overlijden voorkomen.
Dit onderdeel is gebaseerd op de European Society of Cardiology-richtlijnen over de behandeling van STEMI en NSTEMI, een Nederlandse richtlijn over MINOCA en een meta-analyse over MINOCA.
Circadiaans ritme presentatie AMI
In een meta-analyse naar circadiaans ritme van een AMI werden 32 onderzoeken geïncludeerd met 131.235 patiënten uit verschillende populaties uit Azië, Europa en de Verenigde staten. Er vonden meer AMI in de ochtenduren (6 tot 12 uur) ten opzichte van de rest van de dag plaats, de gemiddelde gewogen ratio was 1,56 (95%-BI 1,48-1,65). In een recent Nederlands onderzoek van 1655 telefoonopnames met patiënten die de huisartsenpost belden was het risico op een ACS bij patiënten die tussen 0 en 9 uur belden 2 keer zo hoog.
Psychosociale risicofactoren
Psychosociale factoren (lage sociaal-economische status, werk- en familiestress, sociale isolatie, vijandigheid, psychiatrische aandoeningen) kunnen drempels zijn voor veranderingen in leefstijl en medicatietrouw. Zie ook de NHG-Standaard Cardiovasculair risicomanagement.
Prognose
Naar Samenvatting ›- De prognose van het AMI wordt vooral bepaald door 2 soorten complicaties: hartfalen en hartritmestoornissen.
- De prognose van het AMI verbetert nog steeds. De sterfte binnen 30 dagen na ziekenhuisopname was in 2000 17% en in 2016 4% onder alle patiënten van ≥ 45 jaar met een AMI.
- Een slechte compliance (leefstijl, medicatie) is geassocieerd met een slechtere prognose. Patiënten met psychosociale risicofactoren (lage sociaal-economische status, werk- en familiestress, sociale isolatie, vijandigheid, psychiatrische aandoeningen) hebben een hoger risico op een slechte compliance.
- De meeste etnische minderheden hebben een slechtere prognose na een ziekenhuisopname voor een AMI dan gemiddeld door meer (of op jongere leeftijd bestaande) traditionele risicofactoren, die waarschijnlijk vooral cultureel bepaald zijn.
Cijfers over de prognose van een AMI zijn afkomstig uit de Landelijke Basisregistratie Ziekenhuizen (www.volksgezondheidenzorg.info, geraadpleegd op 7 januari 2021).
De prognose van een AMI wordt vooral bepaald door 2 soorten complicaties: ritmestoornissen en hartfalen.
De meeste patiënten die buiten het ziekenhuis sterven, overlijden aan ventrikelfibrilleren (VF). De kans hierop is het grootst in de eerste uren na het ontstaan van de symptomen. Ongeveer 70% van de hartstilstanden treden op buiten het ziekenhuis. De incidentie van een hartstilstand buiten het ziekenhuis is 67-170 per 100.000 inwoners in Europa. Er werd gestart met reanimatie in gemiddeld 58% (range 13-82%) van de gevallen, waarvan 33% slaagde en 8% (range 0-18%) het ziekenhuis levend verliet.
Etnische minderheden
In een groot onderzoek naar verschillen in incidentie tussen verschillende migrantengroepen en autochtonen werden 213.630 personen geïncludeerd die in de periode 1998-2010 werden opgenomen in het ziekenhuis met een AMI. De definitie van een migrant was geboren zijn buiten Nederland en tenminste 1 ouder hebben die in het land van herkomst geboren is. Personen van wie beide ouders in Nederland waren geboren werden aangeduid als autochtone Nederlanders. De prognose was slechter voor de meeste migrantengroepen ten opzichte van de autochtone groep. Verklaringen zijn het vaker stoppen met voorgeschreven medicatie, ernstiger hartinfarct, meer traditionele risicofactoren en minder participatie aan hartrevalidatie.
Richtlijnen diagnostiek
Naar Samenvatting ›Eerste (telefonische) contact
Naar Samenvatting ›Bel onmiddellijk een ambulance met directe inzet (A0/A1-urgentie), of laat deze bellen, bij een vermoeden van een ACS, tenzij er behandelbeperkingen zijn (door wens, levensverwachting of kwetsbaarheid van de patiënt).
Ga vervolgens direct naar de patiënt, tenzij dat regionaal anders is afgesproken. Maak (telefonisch of bij het eerste fysieke contact) een klinische inschatting op basis van de ABCDE-systematiek:
- Indien ABCDE instabiel: zie onderdeel ABCDE instabiel.
- Indien ABCDE stabiel: zie verder Anamnese en Richtlijnen beleid.
Anamnese
Naar Samenvatting ›Vraag (telefonisch/consult) naar klachten, verschijnselen en/of risicofactoren die de kans op een ACS aanzienlijk vergroten:
- duur van de klachten in rust (pijn > 15 minuten maakt een ACS waarschijnlijker)
- aanwezigheid van deze klachten in de afgelopen dagen
- drukkende, scheurende pijn retrosternaal en/of bandgevoel, pijn of doof gevoel in arm(en), schouder(s), nek of kaken, tussen de schouderbladen of in epigastrio (past bij een ACS)
- pijn die volgens de patiënt lijkt op eerder doorgemaakte cardiale ischemie en/of in de afgelopen 24 uur is veranderd van karakter (maakt een ACS waarschijnlijker)
- vegetatieve verschijnselen, zoals zweten, misselijkheid en braken, maar ook verschijnselen die kunnen wijzen op een (beginnende) shock, zoals bleek of grauw zien (passen bij een ACS)
- kortademigheid of het gevoel niet goed te kunnen doorademen (nieuw of toegenomen past bij een ACS)
Vraag verder naar:
- andere (begeleidende) klachten met het oog op de differentiaaldiagnose, zoals duizeligheid of een licht gevoel in het hoofd, syncope, hartkloppingen en dyspepsie
- risicofactoren:
- leeftijd (mannen > 55 jaar, vrouwen > 65 jaar)
- roken, meeroken
- hypertensie of hypercholesterolemie
- diabetes mellitus of chronische nierschade
- bestaande hart- of vaatziekten
- premature hart- en vaatziekten bij eerstegraadsfamilieleden (man ≤ 55 jaar, vrouw ≤ 65 jaar)
- medicatiegebruik, zoals trombocytenaggregatieremmers, anticoagulantia, antiaritmica, bètablokkers, zelfzorgmedicatie
- comorbiditeit: COPD (in verband met eventuele aanpassing zuurstofbehandeling)
- allergie voor acetylsalicylzuur
- intoxicaties: drugs, zoals cocaïne/lachgas (met name jongere leeftijd), alcohol
Lichamelijk onderzoek
Naar Samenvatting ›Verricht het volgende onderzoek (indien ABCDE instabiel, zie onderdeel ABCDE instabiel):
- klinische indruk: bleek of grauw zien (beginnende shock), onrust, angst, transpireren
- auscultatie van het hart: tonen, souffles (een nieuwe souffle past bij een ACS), pericardwrijven (past bij pericarditis of transmuraal infarct)
- auscultatie van de longen: reutelgeluiden, crepitaties (passend bij longoedeem)
- palpatie van de borstkas: lokaal opwekbare drukpijn (dit pleit tegen een ACS)
Inleiding
De huisarts wordt geconfronteerd met een breed scala aan klachten. Pijn op de borst kan meerdere oorzaken hebben: van spierpijnklachten tot een hartinfarct of longembolie. Naast pijn op de borst zijn er ook andere klachten die kunnen duiden op een ACS. De vraag is of er kenmerken zijn bij anamnese en lichamelijk onderzoek die een hartinfarct meer of minder waarschijnlijk kunnen maken.
Uitgangsvraag
Wat is de diagnostische waarde van kenmerken bij anamnese en/of lichamelijk onderzoek voor het aantonen of uitsluiten van een ACS in de huisartsenpraktijk?
Zoeken en selecteren
Er werd op 10 juli en 11 september 2020 een literatuuronderzoek verricht naar SR's en observationeel onderzoek in PubMed en Embase vanaf 1 januari 2015. Er werden geen systematische reviews gevonden met onderzoeken die plaatsvonden in de huisartsenpraktijk.
Er werd wel een meta-analyse gevonden van onderzoeken op de spoedeisende hulp.
In de meta-analyse werden onderzoeken geïncludeerd met patiënten die zich op de spoedeisende hulp presenteerden met een vermoeden van een ACS en bij wie een anamnese werd afgenomen en lichamelijk onderzoek, ecg en troponinebepalingen werden verricht. Gebruikte uitkomstmaten waren bewezen ACS of andere klinische cardiovasculaire ziekte (cardiovasculair overlijden, MI of revascularisatie) in de 2-6 weken na presentatie.
Resultaten
Beschrijving onderzoeken
In de meta-analyse werden 58 onderzoeken geïncludeerd naar de diagnostische accuratesse van verschillende handelingen bij een vermoeden van een ACS op de spoedeisende hulp. Voor iedere variabele waren gegevens beschikbaar uit 1-12 onderzoeken. Het percentage patiënten met de diagnose ACS in de verschillende onderzoeken was 5-42% (mediaan 14%, IQR 10-20%).
Onderzoeken met alleen een high sensitivity troponinebepaling werden geëxcludeerd, omdat bij het verschijnen van deze meta-analyse deze test nog niet beschikbaar was in de VS. Onderzoeken werden beoordeeld met de QUADAS-criteria en Rational Clinical Examination level of evidence. De aannemelijkheid van de diagnose ACS bij de aanwezigheid van bepaalde symptomen en kenmerken bij lichamelijk onderzoek zijn uitgedrukt in likelihoodratio’s (LR), sensitiviteit en specificiteit. Een LR van > 2 of < 0,50 werd als klinisch relevant beschouwd. In dit detail is alleen gebruik gemaakt van de LR.
Diagnostische waarde
Klinische indruk
Er is 1 Brits onderzoek gedaan naar de klinische inschatting van de arts bij 458 patiënten, bij wie nog geen aanvullend onderzoek was gedaan. Aan de arts werd gevraagd om te kiezen uit 5 mogelijkheden van waarschijnlijkheid van de diagnose ACS.
De LR van een klinische inschatting ‘zeker ACS’ was 4,0 (95%-BI 2,5-6,6), ‘waarschijnlijk ACS’ 1,8 (95%-BI 1,3-2,4), ‘mogelijk ACS’ 0,66 (95%-BI 0,46-0,96), ‘onwaarschijnlijk ACS’ 0,20 (95%-BI 0,09-0,44) en ‘zeker geen ACS’ 0,36 (95%-BI 0,05-2,8) (1 onderzoek, 458 patiënten).
Symptomen
In 10 onderzoeken werd de waarde van symptomen bij ACS bekeken. De volgende symptomen hadden een klinisch relevante LR > 2. Ze kwamen uit 1 Amerikaans onderzoek bij 2718 patiënten:
- Uitstralende pijn naar 2 armen: LR 2,6 (95%-BI 1,8-3,7)
- Pijn die lijkt op eerdere ischemie: LR 2,2 (95%-BI 2,0-2,6)
- Verandering van pijnklachten < 24 uur: LR 2,0 (95%-BI 1,6-2,4)
- Het volgende symptoom had een klinisch relevante LR van < 1; 2 onderzoeken, Amerikaans en Canadees, 3487 patiënten:
- Pleurale pijn (Nederlandse vertaling van pleuritic pain, die gevoeld wordt als scherpe/stekende pijn die vastzit aan de ademhaling): LR-range 0,35-0,61
Lichamelijk onderzoek
Het volgende kenmerk bij lichamelijk onderzoek had een klinisch significante LR van < 1; 1 Canadees onderzoek, 839 patiënten:
- Pijn op te wekken bij palpatie: LR 0,28 (95%-BI 0,14-0,54)
Conclusie
Er is veel onzekerheid over de waarde van kenmerken die worden gevonden bij anamnese en lichamelijk onderzoek. De klinische inschatting door een arts is waarschijnlijk van waarde bij de diagnose wel of geen ACS. Uitstralende pijn naar 2 armen, pijn die lijkt op eerdere ischemie en verandering in pijnklachten in de afgelopen 24 uur zijn symptomen die de diagnose ACS aannemelijker maken. Thoracale pijn die op te wekken is bij palpatie maakt de diagnose ACS mogelijk minder aannemelijk.
Het is onbekend hoe vaak het vermoeden van ACS voorkomt in de huisartsenpraktijk. Op de huisartsenpost hielden 2,1% van de telefonische contacten in 2018 met borstkasklachten. De incidentie van borstkasklachten in de huisartsenpraktijk is 31,7 per 1000 mannen en 40,2 per 1000 vrouwen. Uiteindelijk wordt bij 8,4% van de patiënten met pijn op de borst in de huisartsenpraktijk een levensbedreigende diagnose (waaronder AMI) vastgesteld.
Uit de meta-analyse van Fanaroff bleek dat nitraat sublinguaal niet bruikbaar is als diagnosticum: LR 1,1 (95%-BI 0,9-1,3).
Een longembolie leidt tot thoracale pijn die vastzit aan de ademhaling, soms met dyspneu en tachypneu of hemoptoë. De klachten zijn soms weinig uitgesproken. Het ecg kan niet-specifieke veranderingen tonen. Een CT-scan ‘bevestigt’ de diagnose (zie NHG-Standaard Diepveneuze trombose en longembolie).
Aorta dissecans veroorzaakt een plotseling optredende, hevige, scheurende pijn. De pijn zit thoracaal, vooral op de borst of tussen de schouderbladen, met uitstraling naar de buik of rug, met bloeddrukdaling en/of collaps. Er kan een nog niet eerder vastgestelde aortaklepinsufficiëntie hoorbaar zijn, verschil in pulsaties tussen de carotiden, aa. radiales of femorales, en eventueel focale neurologische verschijnselen. Het ecg is aspecifiek, maar kan ST-T-afwijkingen laten zien.
Bij pericarditis kunnen er houdingsafhankelijke pijn bij (diep) ademen en koorts bestaan. Soms is er pericardwrijven. Op het ecg kan een lichte ST-elevatie te zien zijn.
Een pneumothorax ontstaat plotseling en gaat gepaard met pijn, lateraal in de borst, kortademigheid en vaak een droge hoest.
Aanvullend onderzoek
Naar Samenvatting ›We bevelen geen aanvullend onderzoek aan in de huisartsenpraktijk:
- Het al dan niet verlichten van de pijn na nitraat sublinguaal is onvoldoende om de waarschijnlijkheid van een ACS te beoordelen.
Diagnostische voorspelregel
Naar Samenvatting ›We bevelen het gebruik van een diagnostische voorspelregel voor het uitsluiten van ACS in de acute fase niet aan.
Voor- en nadelen
De gevonden diagnostische voorspelregels zijn ontworpen in een eerstelijnspopulatie. Ten opzichte van het oordeel van de huisarts hebben de voorspelregels geen klinisch relevante toevoegde waarde. Het gebruik van een diagnostische voorspelregel bij patiënten die door de huisarts als laag risico worden ingeschat, vermindert mogelijk het aantal gemiste myocardinfarcten.
Kwaliteit van bewijs
De kwaliteit van het bewijs was laag.
Patiëntvoorkeuren
Patiënten vinden het vooral belangrijk dat er goed naar hun klachten wordt geluisterd. Daarbij is het belangrijk dat er onderscheid kan worden gemaakt tussen wel of geen ACS.
Kosten
Een diagnostisch model zou kunnen leiden tot een aanzienlijke verlaging van de jaarlijkse zorgkosten in vergelijking met de huidige praktijk, als hiermee de triage van patiënten met pijn op de borst in de eerstelijnszorg voor de uitsluiting van ACS verbetert.
Aanvaardbaarheid
Alle belanghebbenden (patiënten, huisarts) beschouwen het inschatten van het risico op een ACS middels een diagnostisch model over het algemeen als goed geaccepteerd.
Haalbaarheid
De benodigde determinanten kunnen gemakkelijk achterhaald worden en het berekenen van de score is eenvoudig. Het uitvoeren van een diagnostisch voorspelmodel of diagnostische score is dan ook haalbaar voor huisartsen.
Uitgangsvraag
Is het gebruik van een diagnostische voorspelregel voor het uitsluiten van een ACS aan te bevelen bij patiënten met een vermoeden van een ACS in de huisartsenpraktijk? Zie de PICO-tabel.
|
Patiënten |
Patiënten met vermoeden van een ACS in de huisartsenpraktijk |
|---|---|
|
Interventie |
Diagnostische voorspelregel, bestaand uit: anamnese, cardiovasculaire risicofactoren, lichamelijk onderzoek en/of aanvullende diagnostiek (ecg/biomarkers) |
|
Vergelijking |
Definitieve diagnose ACS door middel van vertraagde referentiestandaard: patiënten gevolgd voor 30 dagen; artsen gebruikten het klinisch verloop en resultaten van tests om de oorzaak van de pijn op de borst vast te stellen. |
|
Uitkomstmaten |
Oppervlakte onder de ROC-curve (AUC) Sensitiviteit, specificiteit, positief en negatief voorspellende waarde |
Achtergrond
Diagnose of uitsluiting van ACS (AMI en IAP) is een uitdaging voor huisartsen, omdat symptomen en kenmerken bij lichamelijk onderzoek atypisch kunnen zijn en andere diagnostische hulpmiddelen, zoals cardiale biomarkertesten of een ecg, vaak niet direct beschikbaar zijn in de eerstelijnszorg. Momenteel is er geen algemeen aanvaard diagnostische voorspelregel voor het uitsluiten van een ACS.
De werkgroep heeft vooraf bepaald het meeste belang te hechten aan een diagnostische voorspelregel die ACS met voldoende zekerheid kan uitsluiten (zo min mogelijk fout-negatieve testuitslagen). De sensitiviteit van een diagnostische voorspelregel moet dus hoog genoeg zijn en tegelijk moet het aantal verwijzingen binnen de perken blijven.
Methoden
Er is op 7 juli 2020 literatuuronderzoek naar SR’s, RCT’s en cohortstudies uitgevoerd in PubMed en Embase vanaf 1 januari 2011. Om geen recente onderzoeken te missen werd de zoekactie in september 2021 herhaald naar gepubliceerd onderzoek na 7 juli 2020.
Resultaten
Resultaat zoekactie
De zoekactie leverde 1 systematische review over diagnostische voorspelregels bij pijn op de borst in de huisartsenpraktijk op, die voldeed aan de AMSTAR-criteria. Hierin werden 2 diagnostische voorspelregels geïncludeerd voor het uitsluiten van ACS bij patiënten met acuut optredende pijn op de borst. Een aanvullende search na de zoekdatum van dit literatuuronderzoek leverde 2 aanvullende diagnostische voorspelregels in de huisartsenpraktijk op en 1 aanvullende diagnostische voorspelregel in de pre-ziekenhuissetting. Studies met patiënten in de tweede lijn zijn geëxcludeerd. Tijdens de update van de literatuurzoekactie vonden we nog 1 aanvullende diagnostische voorspelregel in de huisartsenpraktijk en 2 aanvullende diagnostische voorspelregels in de pre-ziekenhuissetting. Omdat deze resultaten in lijn zijn met de beschreven resultaten en hoogstwaarschijnlijk geen invloed hebben op onze aanbeveling, worden ze hier verder niet beschreven, maar meegenomen in de volgende update van dit detail.
Onderzoekskarakteristieken
Huisartsenpraktijk
- Grijseels et al. (1995) ontwikkelden de beslisregel van Grijseels bij 1005 patiënten met symptomen van mogelijk cardiale oorsprong en een doorverwijzing naar het ziekenhuis in Nederland (gemiddeld 67 jaar; 54% man; 46% diagnose ACS). De huisartsen namen een gestandaardiseerde anamnese af (klachtenpatroon, medische voorgeschiedenis) en de ambulancedienst maakte een ecg. De beslisregel van Grijseels telt het aantal voorspellers (mannelijk geslacht, uitstraling van pijn op de borst, misselijkheid/zweten, aanwezigheid van eerdere coronaire hartziekte) en combineert dit met de bevindingen op het ecg tot een advies om wel/niet door te verwijzen naar het ziekenhuis (tabel 2).
- Grijseels et al. (1996) valideerden de Grijseels-score bij 977 opeenvolgende patiënten in de huisartsenpraktijk met symptomen van acute hartpathologie (hetzelfde domein als het derivatiecohort van Grijseels; gemiddeld 66 jaar; 53% man; 48% diagnose ACS).
- Bruins Slot et al. (2011) valideerden de Bruins Slot-score bij 298 patiënten met vermoeden van ACS (< 24 uur klachten van acute pijn op de borst of plotselinge benauwdheid) in Nederland (gemiddeld 66 jaar; 48% man; 22% diagnose ACS). De huisartsen namen een gestandaardiseerde anamnese (klachtenpatroon, medische voorgeschiedenis) af. De Bruins Slot-regel bestaat uit voorspellers (overgenomen uit Grijseels, met uitzondering van abnormaal ecg) die zijn gewaardeerd met een puntenscore (tabel 3). De diagnostische accuratesse van de Bruins Slot-regel werd vergeleken met die van het klinische oordeel van de huisarts.
- Schols et al. (2018) valideerden de Marburg Heart Score (tabel 4) bij 258 patiënten met vermoeden van ACS in de huisartsenpraktijk, die werden doorverwezen naar het ziekenhuis (gemiddeld 64 jaar; 52% man; 19% diagnose ACS). De diagnostische accuratesse van de Marburg Heart Score werd vergeleken met die van het klinische oordeel van de huisarts.
- Willemsen et al. (2018) ontwikkelden meerdere beslisregels (tabel 5) bij 303 patiënten met vermoeden van ACS in de huisartsenpraktijk (gemiddeld 58 jaar; 49% man; 11% diagnose ACS). De diagnostische accuratesse van deze beslisregels werd vergeleken met die van het klinische oordeel van de huisarts.
Pre-ziekenhuissetting
- In het FamouS Triage project is een aangepaste HEART-score (tabel 6) gevalideerd bij 700 patiënten die het alarmnummer 112 belden vanwege pijn op de borst en met vermoeden van NSTEMI-ACS naar de spoedeisende hulp werden gebracht (gemiddeld 64 jaar; 57% man; 17% diagnose MACE). Zowel de HEART-score met als zonder troponine werd gevalideerd. Troponine werd bepaald door middel van een troponine-POCT.
- Stopyra et al. (2018) valideerden de aangepaste HEART-score bij 794 patiënten die het alarmnummer 112 belden vanwege pijn op de borst en met vermoeden van NSTEMI-ACS naar de spoedeisende hulp werden gebracht (gemiddeld 58 jaar; 53% man; 11% diagnose MACE). Zowel de HEART-score met als zonder troponine werd gevalideerd. Hiervoor werd de eerste troponinebepaling op de spoedeisende hulp gebruikt.
Effecten
Huisartsenpraktijk
Zie de tabellen 7-9 voor de diagnostische accuratesse van de voorspelregels. Grijseels et al. bekeken de diagnostische accuratesse van verwijzen vs. niet of mogelijk verwijzen volgens de Grijseels-regel. Schols et al. bekeken de diagnostische accuratesse van de aanwezigheid van ACS volgens de Marburg Heart Score bij een afkapwaarde van > 2 punten. Willemsen et al. bekeken de diagnostische accuratesse van de aanwezigheid van ACS bij een afkapwaarde van > 1 punt. De sensitiviteit is redelijk tot hoog, variërend van 75 tot 98%. De diagnostische voorspelregels met een hoge sensitiviteit (> 90%) gaan gepaard met een hoog verwijspercentage (77-92%). De huisarts classificeert mogelijk beter welke patiënt wel of geen ACS heeft dan een diagnostische voorspelregel.
Pre-ziekenhuissetting
Onderzoek laat zien dat een troponinebepaling van toegevoegde diagnostische waarde is in de HEART-score. Een high sensitivity troponine-POCT is vooralsnog niet beschikbaar.
|
Aantal aanwezige voorspellers* |
Normaal ecg |
Mogelijk/klein myocardinfarct op ecg |
Groot myocardinfarct op ecg |
|---|---|---|---|
|
0 |
Naar huis |
Mogelijke verwijzing** |
Altijd verwijzing |
|
1 |
Naar huis |
Verwijzing |
|
|
2 |
Mogelijke verwijzing** |
Verwijzing |
|
|
≥ 3 |
Verwijzing |
Verwijzing |
|
| * Voorgeschiedenis van coronaire hartziekten, mannelijk geslacht, uitstraling van pijn, misselijkheid/zweten. ** Het risico op acute hartpathologie is licht verhoogd dat een huisarts ziekenhuisopname kan (her)overwegen. | |||
|
Predictoren |
Score |
|
|---|---|---|
|
Voorgeschiedenis coronaire hartziekten |
2 |
Totaalscore varieert van 0-20 punten. Afhankelijk van totaalscore indeling in laag, gemiddeld of hoog risico op ACS (afkapwaarden niet gegeven). |
|
Mannelijk geslacht |
5 |
|
|
Uitstraling van pijn |
8 |
|
|
Misselijkheid/zweten |
5 |
|
Predictoren |
Score |
|
|---|---|---|
|
Leeftijd (man > 55 jaar, vrouw > 65 jaar) |
1 |
Totaalscore varieert van 0-5 punten. Laag risico = 0-2 punten Intermediair risico = 3 punten Hoog risico = 4-5 punten |
|
Bekend met cardiovasculaire ziekte* |
1 |
|
|
Toename klachten bij inspanning |
1 |
|
|
Pijn niet te reproduceren bij palpatie |
1 |
|
|
Patiënt vermoedt zelf een cardiale oorzaak van de klachten |
1 |
|
| * Coronaire hartziekte, perifeer vaatlijden of beroerte. | ||
|
Predictoren |
Score |
|
|---|---|---|
|
Mannelijk geslacht |
1 |
Totaalscore varieert van 0-6 punten. Negatief = 0-1 punten Positief = 2-6 punten |
|
Ecg toont ST-depressie |
1 |
|
|
Ecg toont ST-elevatie |
1 |
|
|
Kortademigheid |
1 |
|
|
Gevoel van druk op de borst |
1 |
|
|
Positieve POCT H-FABP |
1 |
|
Predictoren |
|
Score |
|
|---|---|---|---|
|
Geschiedenis |
Erg verdacht (typische pijn) |
2 |
Totaalscore varieert van 0-10 punten. Laag risico = 0-3 punten Intermediair risico = 4-6 punten Hoog risico = 7-10 punten |
|
(Anamnese) |
Matig verdacht (atypische klachten) |
1 | |
|
|
Mild verdacht (aspecifieke klachten) |
0 |
|
|
Ecg |
Significante ST-depressies |
2 |
|
|
|
Niet-specifieke repolarisatiestoornissen |
1 |
|
|
|
Linkerbundeltak blok of pacemaker |
1 |
|
|
|
normaal |
0 |
|
|
Leeftijd |
≥ 65 jaar |
2 |
|
|
|
46-64 jaar |
1 |
|
|
|
≤ 45 jaar |
0 |
|
|
Risicofactoren |
≥ 3 risicofactoren* of voorgeschiedenis van atherosclerotisch lijden |
2 |
|
|
|
1 of 2 risicofactoren |
1 |
|
|
|
Geen risicofactoren |
0 |
|
|
Troponin T |
> 60 ng/L |
2 |
|
|
point of care |
40-60 ng/L |
1 |
|
|
|
< 40 ng/L |
0 |
|
| * Hypercholesterolemie, hypertensie, diabetes mellitus, roken, positieve familieanamnese voor hart- en vaatziekten of obesitas (BMI > 30) | |||
|
|
Totaal |
ACS (%) |
AUC |
Sens |
Spec |
PVW |
NVW |
Verwijzing (%) |
|---|---|---|---|---|---|---|---|---|
|
Grijseels-regel |
|
|
|
|
|
|
|
|
|
Derivatiecohort* |
1005 |
419 (46%) |
0,72 |
- |
- |
- |
- |
- |
|
Validatiecohort |
977 |
467 (48%) |
0,70 |
91% |
37% |
57% |
82% |
77% |
|
Oordeel huisarts + regel |
977 |
467 (48%) |
- |
98% |
21% |
53% |
91% |
90% |
|
Bruins Slot-regel |
|
|
|
|
|
|
|
|
|
Validatiecohort |
298 |
66 (22%) |
0,66 |
97% |
9% |
23% |
92% |
92% |
|
Oordeel huisarts |
298 |
66 (22%) |
0,75 |
94% |
19% |
25% |
92% |
84% |
|
Marburg Heart Score |
|
|
|
|
|
|
|
|
|
Validatiecohort |
258 |
45 (19%) |
0,64 |
75% |
44% |
24% |
88% |
60% |
|
Oordeel huisarts |
258 |
45 (19%) |
0,71 |
87% |
41% |
25% |
93% |
64% |
|
Willemsen-regel |
|
|
|
|
|
|
|
|
|
Derivatiecohort* |
303 |
32 (11%) |
0,78 |
88% |
52% |
18% |
97% |
52% |
|
Oordeel huisarts |
303 |
32 (11%) |
- |
75% |
68% |
21% |
96% |
37% |
| * Dataset waarin het model ontwikkeld is. ACS: acuut coronair syndroom; AUC: oppervlakte onder de ROC-curve; Sens: sensitiviteit; Spec: specificiteit; PVW: positief voorspellende waarde; NVW: negatief voorspellende waarde. | ||||||||
|
Dient de Grijseels-regel gebruikt te worden voor de diagnose ACS bij patiënten met acute pijn op de borst? |
||||
|
Testresultaat |
Number of results per 1000 patients tested (95%-BI) |
Aantal patiënten |
Zekerheid van het bewijs (GRADE) |
|
|---|---|---|---|---|
|
Prevalentie 48% Zoals gezien bij SEH |
Prevalentie 22% Zoals gezien bij huisartsenpraktijk |
|||
|
Terecht-positieven |
437 (427 tot 451) |
200 (196 tot 207) | 467 (1) |
⨁⨁◯◯ LAAGa,b |
|
Fout-negatieven |
43 (29 tot 53) |
20 (13 tot 24) | ||
|
Terecht-negatieven |
192 (166 tot 213) |
289 (250 tot 320) | 510 (1) |
⨁⨁◯◯ LAAGa,b |
|
Fout-positieven |
328 (307 tot 354) |
491 (460 tot 530) | ||
|
BI: betrouwbaarheidsinterval Toelichting a. Grote selectie door beschikbaarheid ecg en vragenlijst (voor overige voorspellers) en gebruik van verouderde uitkomst definities |
||||
| Dient de Marburg Heart Score gebruikt te worden voor de diagnose van ACS bij patiënten met acute pijn op de borst? Patiëntenpopulatie: patiënten met acute pijn op de borst Setting: huisartsenpraktijk New test: Marburg Heart Score Cut-off value : >2 Reference test: ontslagdiagnose cardioloog Threshold : Single study sensitivity : 0.75 (95%-BI: 0,58 tot 0,87) Single study specificity: 0,44 (95%-BI: 0,36 tot 0,52) |
||||
|
Testresultaat |
Number of results per 1000 patients tested (95%-BI) |
Aantal patiënten |
Zekerheid van het bewijs (GRADE) |
|
|---|---|---|---|---|
|
Prevalentie 20% Zoals gezien bij |
||||
|
Terecht-positieven |
150 (116 tot 174) |
36 |
⨁⨁◯◯ |
|
|
Fout-negatieven |
50 (26 tot 84) |
|||
|
Terecht-negatieven |
352 (288 tot 416) |
150 |
⨁⨁◯◯ |
|
|
Fout-positieven |
448 (384 tot 512) |
|||
|
BI: betrouwbaarheidsinterval Toelichting a. inclusie van alleen doorverwezen patiënten |
||||
Conclusie
De gevonden diagnostische voorspelregels zijn mogelijk niet sensitief en specifiek genoeg om een ACS uit te sluiten (kwaliteit van het bewijs: laag). De huisarts classificeert mogelijk beter welke patiënt wel of geen ACS heeft dan een diagnostische voorspelregel. Het gebruik van een diagnostische voorspelregel bij patiënten die de huisarts als laag risico inschat, vermindert mogelijk het aantal gemiste myocardinfarcten.
Bepalen cardiale schademarkers middels POCT
Naar Samenvatting ›Het gebruik van ‘point-of-care’-tests (POCT) wordt afgeraden, omdat de diagnostische waarde van de huidige sneltests (troponine-POCT en H-FABP POCT) onvoldoende is om een ACS in de acute fase uit te sluiten.
Voor- en nadelen
Voordelen: een accurate POCT levert mogelijk een bijdrage aan een veilige uitsluiting van een myocardinfarct. Daarmee zou het hoge aantal mensen met pijn op de borst dat zekerheidshalve via de huisarts of na tussenkomst van ambulancepersoneel verwezen wordt naar de cardioloog voor uitsluiting van myocardinfarct, kunnen dalen.
Nadelen: een accurate, gebruiksvriendelijke, high-sensitivity POCT Trop T is vooralsnog niet beschikbaar. De huidige sneltesten zijn niet accuraat genoeg voor vroegbepaling van cardiale schademarkers. De sensitiviteit is laag, variërend van 21 tot 44%. Het percentage fout-negatieve testuitslagen is hoog, variërend van 4 tot 14%.
Kwaliteit van bewijs
De kwaliteit van het bewijs was redelijk.
Patiëntenvoorkeuren
Een POCT kan snel uitgevoerd worden, dus patiënten zullen hier geen problemen mee hebben. Een deel van de patiënten kan hierdoor snel adequaat behandeld, of juist gerustgesteld, worden.
Kosten
Als door een POCT cardiale schademarkers de triage van patiënten met pijn op de borst in de eerstelijnszorg de uitsluiting van ACS kan verbeteren, zou dit leiden tot een aanzienlijke verlaging van de jaarlijkse zorgkosten in vergelijking met de huidige praktijk.
Aanvaardbaarheid
Alle belanghebbenden (patiënten, huisarts) beschouwen het bepalen van cardiale schademarkers over het algemeen als goed geaccepteerd.
Haalbaarheid
De werkgroep is van mening dat als er middelen beschikbaar zijn voor de implementatie, POCT voor cardiale schademarkers een haalbare optie is om te implementeren. De bewaartermijn van de POCT moet wel lang genoeg zijn.
Uitgangsvraag
Wordt het bepalen van cardiale schademarkers met behulp van een ‘Point Of Care’-test (POCT) (als aanvullend onderzoek na anamnese en lichamelijk onderzoek) aanbevolen voor het uitsluiten van ACS bij mensen met een vermoeden van een ACS in de huisartspraktijk? Zie de PICO-tabel.
|
Patiënten |
Patiënten met vermoeden van ACS in de huisartsenpraktijk |
|---|---|
|
Index-test |
POCT voor cardiale schademarkers |
|
Referentietest |
Klinisch bevestigde ACS |
|
Uitkomstmaten |
|
Achtergrond
Het diagnosticeren van een ACS (AMI en IAP) vormt een dilemma voor huisartsen. Het missen van een ACS heeft een grote negatieve impact, omdat de mortaliteit van onbehandelde ACS hoog is, terwijl vroege adequate behandeling de kans op hartschade vermindert en de prognose verbetert. De diagnose zo vroeg mogelijk stellen is daarom essentieel. Dit is moeilijk en daarom worden bijna alle patiënten ingestuurd naar de spoedeisende hulp.
Sneltests op biomarkers die vroege myocardschade aantonen, zouden erg nuttig kunnen zijn. Troponine is de meest bekende biomarker, maar de concentratie hiervan neemt pas 6 tot 9 uur na de start van de klachten toe, terwijl de meeste mensen met een mogelijk ACS binnen 3 uur na het begin van de klachten zich melden bij de huisarts. Daarnaast is troponine niet verhoogd bij patiënten met IAP, omdat bij dit ziektebeeld geen hartspiercellen afsterven. Heart-type fatty acid-binding protein (H-FABP) en high sensitivity Troponine (hs-Trop) zijn biomarkers die eerder meetbaar zijn (H-FABP < 2 uur en hs-Trop < 1 uur na het begin van de klachten) en lijken daarmee veelbelovend voor de huisartsenpraktijk.
Er is veel onderzoek gedaan naar de diagnostische waarde van laboratoriumbepalingen van H-FABP en hs-Trop. H-FABP lijkt inferieur aan hs-Trop. Ook is de diagnostische waarde van vroege laboratoriumbepalingen van hs-Trop vergeleken met de conventionele Troponine T (Trop T). hs-Trop lijkt superieur aan conventionele Trop T. De diagnostische waarde van laboratoriumbepalingen van H-FABP of hs-Trop lijkt veelbelovend. Onduidelijk is of er voor het bepalen van deze biomarkers een geschikte POCT is waarvan met name de sensitiviteit en negatief voorspellende waarde hoog genoeg zijn voor het veilig uitsluiten van een ACS in de eerste lijn.
Welke scenario’s worden vergeleken?
Bestaande situatie: bij alle mensen met een vermoeden van een ACS belt de huisarts met spoed een ambulance.
Nieuwe situatie (cardiale schademarkers): (een deel van de) mensen met een vermoeden van een ACS en een lagere waarde van de POCT H-FABP, Trop T of hs-Trop dan de normaalwaarden (en een normaal ecg) hoeven niet te worden ingestuurd voor het uitsluiten van een ACS. Afhankelijk van de duur van de klachten is het nodig de POCT na een aantal uren te herhalen. Mensen met typische IAP-klachten zullen ondanks normale cardiale schademarkers worden ingestuurd.
|
Uitkomstmaat |
Gevolgen |
Patiëntrelevante consequenties (gebaseerd op gevolgen) |
|---|---|---|
|
Terechtpositieven |
Vervolgonderzoek in tweede lijn. Wanneer diagnose bevestigd wordt, kan passende zorg ingezet worden. |
Verbetering uitkomstmaten, afhankelijk van de effectiviteit van de behandeling bij in een vroeg stadium gediagnosticeerde ACS. |
|
Foutpositieven |
Onterecht vervolgonderzoek in tweede lijn. |
Onnodige investering van tijd en middelen (coronair angiogram), stress bij patiënt en naasten door ongerustheid. |
|
Terechtnegatieven |
De diagnose ACS wordt verlaten, zoeken naar ander oorzaken van pijn op de borst. |
Eerder op zoek naar andere oorzaak van pijn op de borst en daardoor mogelijk tijdige adequate behandeling. |
|
Foutnegatieven |
Geen vervolgonderzoek. Uitgestelde klinische diagnose.
|
Verslechtering uitkomsten door latere diagnose en mogelijk minder voordeel van behandeling. |
|
Niet eenduidig te interpreteren testuitslagen |
N.v.t. |
|
|
Belasting van de test |
Test is niet/weinig belastend; geen nadelige gevolgen |
|
|
Beslag op middelen |
Kostenbesparing |
|
Gevolgen en consequenties diagnostische testeigenschappen
Een meting naar cardiale schademarkers met een POCT maakt het voor de huisarts of ambulancepersoneel mogelijk om een betere inschatting van het risico op een ACS te maken in een pre-ziekenhuisomgeving. Dit heeft verschillende potentiële voordelen, waaronder vroege herkenning van een ACS en identificatie van hoogrisicopatiënten voor aankomst in het ziekenhuis. Bovendien kan het uitsluiten van een ACS onnodige bezoeken aan de SEH voorkomen. De veiligheid staat echter voorop. De werkgroep heeft daarom vooraf bepaald het meeste belang te hechten aan zo min mogelijk fout-negatieve testuitslagen. De negatief voorspellende waarde moet < 1% zijn.
Methode
Zoeken en selecteren van literatuur
Er is op 6 juli 2020 literatuuronderzoek naar SR’s, RCT’s en cohortstudies uitgevoerd in PubMed en Embase vanaf 1 januari 2011. Om geen recente onderzoeken te missen werd de zoekactie in september herhaald naar gepubliceerd onderzoek na 6 juli 2020.
Resultaten
Resultaat zoekactie
Er werd een systematische review gevonden over cardiale schademarkers (H-FABP en Trop T) bij patiënten met acute cardiopulmonaire symptomen in de huisartsenpraktijk. Na de zoekdatum van de systematische review vonden we nog 1 aanvullend onderzoek over de diagnostische waarde van H-FABP in de huisartsenpraktijk. Er werd geen onderzoek gevonden die de POCT hs-Trop evalueerde in de huisartsenpraktijk. Daarnaast vonden we nog 1 aanvullend onderzoek over de diagnostische waarde van POCT Trop T in de pre-ziekenhuissetting. Tijdens de update van de literatuurzoekactie vonden we nog 1 aanvullend onderzoek over de diagnostische waarde van POCT Trop T in de pre-ziekenhuissetting. Omdat deze resultaten in lijn zijn met de beschreven resultaten en geen invloed hebben op onze aanbeveling, worden ze hier verder niet beschreven, maar meegenomen in de volgende update van dit detail.
Beschrijving onderzoeken
Huisartsenpraktijk
In de systematische review van Schols et al. (2018) werden 3 diagnostische accuratesse-onderzoeken geïncludeerd die POCT Trop T (2 studies) of POCT H-FABP (1 studie) onderzochten bij patiënten met een vermoeden van een ACS in de huisartsenpraktijk. De POCT Trop T-onderzoeken includeerden patiënten met klachten die begonnen of verergerden in de afgelopen week (n = 477; gemiddeld 61 jaar; 57% man; 6% diagnose ACS).
Bruins Slot et al. (2013) onderzochten de diagnostische waarde van POCT H-FABP bij patiënten met klachten < 24 uur (n = 298; gemiddeld 66 jaar; 48% man; 22% diagnose ACS). De gebruikte H-FABP-sneltest detecteerde H-FABP in capillair bloed bij een grenswaarde van 7 ng/ml. Een panel (2 cardiologen + 1 huisarts) bepaalde de uiteindelijke diagnose aan de hand van gegevens uit anamnese, lichamelijk onderzoek, ecg, biomarkers, specialistenbrieven en follow-up gegevens tot 1 maand na de start van de klachten. Willemsen et al. (2018) onderzochten ook de diagnostische waarde van POCT H-FABP bij patiënten met klachten < 24 uur in de huisartsenpraktijk (n = 303; gemiddeld 58 jaar; 49% man; 50% gezien op huisartsenpost; 11% diagnose ACS). De gebruikte H-FABP-sneltest detecteerde H-FABP bij een grenswaarde van 4 ng/ml. Een panel (1 cardioloog + 1 huisarts) bepaalde de uiteindelijke diagnose aan de hand van gegevens uit anamnese, lichamelijk onderzoek, ecg, biomarkers, specialistenbrieven en follow-up gegevens tot 1 maand na start klachten.
Pre-ziekenhuissetting
Rasmussen et al. (2019) onderzochten de diagnostische waarde van POCT Trop T afgenomen door ambulancepersoneel bij patiënten met klachten passend bij een ACS op weg naar het ziekenhuis in Denemarken (n = 15.781; 18.712 metingen; gemiddeld 66 jaar; 59% man; 12% diagnose ACS). De gebruikte POCT detecteerde Trop T bij een grenswaarde van 50 ng/l. De diagnose myocardinfarct werd gehaald uit patiëntenregistraties.
Diagnostische testeigenschappen
Zie tabel 10 voor de samenvatting van de resultaten van de diagnostische accuratesse-onderzoeken in de huisartsenpraktijk en pre-ziekenhuissetting. De sensitiviteit is laag, variërend van 21 tot 44%. Het percentage fout-negatieve testuitslagen is hoog, variërend van 4 tot 14%.
Kwaliteit van bewijs
De kwaliteit van bewijs was redelijk door de kans op vertekening (onvoldoende omschreven selectie van patiënten, niet alle patiënten kregen dezelfde referentiestandaard).
Behandelconsequenties
Het effect van POC-testen op de behandelconsequenties is niet onderzocht.
|
|
Totaal |
ACS (%) |
Sens |
Spec |
PVW |
NVW |
Negatieve test (%) |
Fout-negatieve test (%) |
|---|---|---|---|---|---|---|---|---|
|
Huisartsenpraktijk POCT Trop T |
|
|
|
|
|
|
|
|
|
Planer, 2006 (Israël) |
349 |
24 (7%) |
21% |
100% |
100% |
94% |
344 (99%) |
19 (5%) |
|
Nilsson, 2013 (Zweden) |
128 |
7 (5%) |
29% |
98% |
40% |
96% |
123 (96%) |
5 (4%) |
|
POCT H-FABP (< 24 uur) |
|
|
|
|
|
|
|
|
|
Bruins Slot, 2013 (NL) |
298 |
66 (22%) |
39% |
94% |
65% |
84% |
258 (87%) |
40 (13%) |
|
Willemsen, 2018 (NL) |
291 |
31 (11%) |
26% |
97% |
50% |
92% |
275 (95%) |
23 (8%) |
|
POCT H-FABP (< 6 uur) |
|
|
|
|
|
|
|
|
|
Bruins Slot, 2013 (NL) |
209 |
53 (25%) |
43% |
94% |
72% |
83% |
177 (85%) |
30 (14%) |
|
Pre-ziekenhuissetting |
|
|
|
|
|
|
|
|
|
POCT Trop T |
|
|
|
|
|
|
|
|
|
Rasmussen, 2019 (Denemarken) |
18712 |
2187 (12%) |
44% |
93% |
45% |
93% |
16562 (89%) |
1221 (7%) |
|
ACS: acuut coronair syndroom; Sens: sensitiviteit; Spec: specificiteit; PVW: positief voorspellende waarde; NVW: negatief voorspellende waarde. |
||||||||
Conclusie
Er is waarschijnlijk geen geschikte POCT van cardiale schademarkers voor het uitsluiten van ACS bij patiënten met een vermoeden van een ACS in de huisartsenpraktijk (kwaliteit van het bewijs: redelijk). Een accurate, gebruiksvriendelijke, high-sensitivity POCT Trop T is vooralsnog niet beschikbaar.
Ecg voor het uitsluiten van een ACS
Naar Samenvatting ›Het ecg is niet bruikbaar voor het uitsluiten van een ACS in de acute fase vanwege een te lage negatief voorspellende waarde, zeker in de eerste uren.
De rol van aanvullende diagnostiek bij het vermoeden van een ACS is voor de huisarts gering, gezien de tijd die deze in beslag neemt en vanwege het belang van een veilig beleid. Het maakt vooral onderscheid tussen een STEMI en een NSTEMI of IAP, maar kan een ACS niet met zekerheid uitsluiten, omdat ecg-afwijkingen soms later pas optreden of helemaal niet. Voor het uitsluiten van een ACS is seriële meting van cardiale schademarkers en ecg’s noodzakelijk.
Evaluatie
Naar Samenvatting ›De volgende klachten maken de diagnose ACS waarschijnlijker:
- retrosternale drukkende of scheurende pijn, al dan niet met uitstraling, zeker indien de pijn gepaard gaat met vegetatieve verschijnselen
- uitstralende pijn naar 2 armen, pijn die lijkt op een eerdere episode met angina pectoris (cardiale ischemie) en verandering van momenten en ernst in optreden van pijnklachten in de afgelopen 24 uur
Als retrosternale pijn niet op de voorgrond staat of afwezig is, kan de huisarts aanwezige risicofactoren meewegen in de beslissing om wel of niet in te sturen (de voorafkans is hoger bij oudere leeftijd, roken, diabetes mellitus of chronische nierschade)
- Andere oorzaken van retrosternale pijn:
- pneumonie of longembolie met pleurale prikkeling, (spannings)pneumothorax
- myogene of costosternale aandoeningen
- pericarditis, aortadissectie
- gastro-intestinale aandoeningen, zoals maagperforatie, oesofagusruptuur, gastritis/oesofagitis, reflux, slokdarmspasmen, ulcus pepticum, cholelithiasis, pancreatitis of acute cholecystitis
- angst of paniek
- Een ACS kan zich presenteren met pijn in epigastrio, eventueel met misselijkheid en braken. Dit is vooral zo als de onderwand ischemisch is. Dit kan makkelijk verward worden met gastro-intestinale aandoeningen.
Richtlijnen beleid
Naar Samenvatting ›Behandeling in de acute fase
Naar Samenvatting ›Verwijzing
Naar Samenvatting ›Indien de huisarts als eerste ter plaatse is:
- Bel, indien een ACS waarschijnlijk is en de thoracale klachten op het moment nog aanwezig zijn of indien er thoracale klachten zijn geweest in de afgelopen 12 uur, direct een ambulance met directe inzet (A0/A1-urgentie). De huisarts wacht na inschakeling van een ambulance met directe inzet (A0/A1-urgentie) bij de patiënt tot het arriveren van de ambulance.
- Bel, indien een ACS waarschijnlijk is en de thoracale klachten > 12 uur geleden waren, een ambulance met een A2-indicatie. De huisarts wacht na inschakeling van een ambulance bij een A2-urgentie bij de patiënt tot het arriveren van de ambulance, tenzij de veiligheid van de patiënt op een andere manier kan worden gewaarborgd.
- Overleg met de cardioloog bij een vermoeden van een ACS bij iemand bij wie de pijn langer geleden (bijvoorbeeld > 72 uur) bestond maar verdwenen is, maar er wel tekenen zijn van complicaties, zoals hartfalen.
Stappenplan
Naar Samenvatting ›
- Geef bij thoracale klachten en een systolische bloeddruk > 90 mmHg nitroglycerinespray of isosorbidedinitraat sublinguaal (zie tabel 11). Geef bij een contra-indicatie voor nitraten fentanyl of morfine.
- Breng zo mogelijk een infuusnaald in; spuit de naald door met tenminste 2 ml NaCl 0,9% indien op dat moment geen medicatie wordt gegeven.
- Geef bij matig tot ernstige pijn en onvoldoende reactie op nitraten (of een contra-indicatie): fentanyl of morfine intraveneus of nasaal. Beide middelen worden als gelijkwaardig beschouwd (zie tabel 11).
- Bij tekenen van respiratoir falen en/of vastgestelde hypoxie: geef zuurstof indien beschikbaar (zie NHG-Behandelrichtlijn Geneesmiddelen en zuurstof in spoedeisende situaties).
- Geef patiënten een oplaaddosis acetylsalicylzuur oraal. Dit geldt ook voor patiënten die al een trombocytenaggregatieremmer, vitamine K-antagonist of directe orale anticoagulantia (DOAC) gebruiken (zie tabel 11).
| Geneesmiddel | Dosering en contra-indicaties | Werkingssnelheid/-duur |
|---|---|---|
| Behandeling ACS | ||
Nitroglycerine Spray 0,4 mg/dosis | Sublinguaal 1 spray iedere 5 minuten, maximaal 3 giften Contra-indicatie: bloeddruk < 90 mmHg, inname van fosfodiesterase-5-remmer < 12 uur geleden (avanafil, sildenafil, tadalafil, vardenafil) |
|
Isosorbidedinitraat Tablet 5 mg | Sublinguaal 1 tablet 5 mg iedere 5 minuten, maximaal 3 giften Contra-indicatie: bloeddruk < 90 mmHg, inname van fosfodiesterase-5-remmer < 12 uur geleden (avanafil, sildenafil, tadalafil, vardenafil) |
|
Fentanyl Injectievloeistof 50 microg/ml; ampul 2 ml | Intraveneus in 2 minuten: 50-100 microg (1 microg/kg) |
|
| Neusspray 50 of 100 microg/dosis | Nasaal (eenmalige dosis neusspray) : 50 of 100 microg |
|
Morfine Injectievloeistof 10 mg/ml; ampul 1 ml | Intraveneus in 4-5 minuten: 5-10 mg (0,1 mg/kg). Bij leeftijd > 65 jaar of bij hartfalen: 2,5-5 mg (0,05 mg/kg) intraveneus in 4-5 min |
|
Acetylsalicylzuur Wateroplosbare (dispergeerbare) tablet 80 mg | Oraal eenmalig 160 mg (in water opgelost) Contra-indicatie: actief peptisch ulcus, overgevoeligheid voor salicylaten |
|
Overdracht ambulance
Naar Samenvatting ›- Bij aankomst van de ambulance neemt de ambulanceverpleegkundige de behandeling over. De verpleegkundige beoordeelt zo spoedig mogelijk het ecg en is verantwoordelijk voor de keuze tussen een interventiecentrum voor (spoed) PCI of een algemeen ziekenhuis zonder zo’n voorziening (op basis van het ecg en het Landelijk Protocol Ambulancezorg):
- Klachten in combinatie met een STEMI (ST-elevatie op het ecg): verwijzing naar een interventiecentrum voor spoed PCI. Hier kan weloverwogen van worden afgezien in overleg met het interventiecentrum.
- Overige: spoedverwijzing naar een algemeen ziekenhuis voor nadere diagnostiek.
- Draag zorg voor een goede mondelinge én bij voorkeur tevens schriftelijke overdracht naar de ambulanceverpleegkundige en een schriftelijke of digitale overdracht naar de cardioloog met vermelding van de voorgeschiedenis, nierfunctie, behandelbeperkingen, (toegediende) medicatie en ABCDE.
De overdracht omvat in elk geval de naam en geboortedatum van de patiënt, de aard en duur van de klachten, relevante gegevens uit de voorgeschiedenis, de actuele medicatie van de patiënt, de toegediende medicatie en het resultaat daarvan, gegevens over de klinische toestand van de patiënt (pols, ritme, bloeddruk, bewustzijn, klamme huid, aanwijzingen voor longoedeem) en de (vermoedelijke) diagnose.
Patiënten met alleen ST-depressies, Q-golven en/of T-golfveranderingen, of zelfs met een normaal ecg, hebben mogelijk een NSTEMI of IAP. Het diagnostisch onderzoek bij deze patiënten omvat bepaling van de cardiale schademarkers, op indicatie inspanningsonderzoek al dan niet in combinatie met beeldvormend onderzoek, farmacologisch belastingonderzoek of directe angiografie, zo nodig gevolgd door een interventie (zie figuur 2). De figuur is overgenomen uit de ESC-richtlijn ACS zonder ST elevaties.
ABCDE instabiel
Naar Samenvatting ›Start bij een circulatiestilstand, in afwachting van de ambulance, met reanimeren. Volg, indien de patiënt ABCDE instabiel is, het volgende beleid.
Zie voor reanimatie bij kwetsbare ouderen de richtlijn Besluitvorming bij ouderen.
Eerste beoordeling
Naar Samenvatting ›Acuut respiratoir falen en/of cardiogene shock
Naar Samenvatting ›- Geef zuurstof indien beschikbaar (zie NHG-Behandelrichtlijn Geneesmiddelen en zuurstof in spoedeisende situaties).
- Breng een infuusnaald in.
- Bij vermoeden van een cardiogene shock: een zo dik mogelijke infuusnaald, minimaal groen of wit, eventueel grijs of oranje.
- Spuit indien op dat moment geen medicatie gegeven wordt door met ten minste 2 ml NaCl 0,9%. Bij (vermoeden van) cardiogene of obstructieve shock: 250 ml ringerlactaatoplossing of NaCl 0,9% (indien beschikbaar) intraveneus, tenzij er duidelijke tekenen zijn van ernstig acuut hartfalen: geef dan geen infusievloeistof.
- Probeer rust te creëren en de patiënt gerust te stellen.
- Behandel indien mogelijk de oorzakelijke aandoening. Voor ACS zie het onderdeel Behandeling in de acute fase. Zie voor acuut hartfalen de NHG-Behandelrichtlijn Geneesmiddelen en zuurstof in spoedeisende situaties.
Bij vermoeden acuut hartfalen
Naar Samenvatting ›Zie voor het beleid de NHG-Behandelrichtlijn Geneesmiddelen en zuurstof in spoedeisende situaties.
Bij bradycardie
Naar Samenvatting ›Geef bij een bradycardie (hartfrequentie < 50 slagen per minuut) met ernstige hemodynamische gevolgen, zoals (dreigende) cardiogene shock, eenmalig atropine. Zie tabel 12.
|
Geneesmiddel |
Dosering en contra-indicaties |
Werkingssnelheid/-duur |
|---|---|---|
|
Atropine Injectievloeistof 0,5 mg/ml; ampul 1 ml |
Intraveneus in 2-3 minuten: 0,5 mg (eenmalig) |
|
Behandeling na een ACS
Naar Samenvatting ›In het ziekenhuis stelt de cardioloog de patiënt, na diagnostiek en behandeling tijdens de acute fase (PCI), in op orale medicatie voor de langere termijn. Deze medicatie bestaat uit:
- acetylsalicylzuur 1 dd 80 mg of carbasalaatcalcium 1 dd 100 mg (in principe levenslang)
- P2Y12-remmer (standaard 12 maanden om recidief ACS te voorkomen en, bij patiënten na PCI, om het (geringe) risico op stenttrombose te verkleinen; sommige patiënten worden tegenwoordig korter of juist langer (> 1 jaar) doorbehandeld met P2Y12-remmers), bijvoorbeeld:
- ticagrelor 2 dd 90 mg of prasugrel 1 dd 10 mg (bij leeftijd ≥ 75 jaar of gewicht < 60 kg: 1 dd 5 mg) zijn de middelen van eerste keus; bij intolerantie of bijwerkingen clopidogrel 1 dd 75 mg (cardioloog bepaalt of farmacogenetisch onderzoek nodig is voor start van clopidogrel)
- bij een verhoogde bloedingsneiging gaat de voorkeur uit naar clopidogrel of ticagrelor gedurende tenminste 6 maanden; geef op indicatie maagbescherming (zie NHG-Behandelrichtlijn Preventie van maagcomplicaties door geneesmiddelengebruik)
- cholesterolverlager (in principe levenslang, korter bij oudere leeftijd en kwetsbaarheid) (zie NHG-Standaard Cardiovasculair risicomanagement)
- lipofiele selectieve bètablokker (in ieder geval bij hartfalen en/of verminderde kamerfunctie (LVEF < 50%): metoprolol (succinaat), bisoprolol, carvedilol of nebivolol
- ACE-remmer (bij hartfalen en/of verminderde kamerfunctie (LVEF < 50%), DM en/of chronisch nierfalen): lisinopril, enalapril, captopril, ramipril of trandolapril
- schrijf bij intolerantie voor ACE-remmers een aII-receptorantagonist voor: candesartan, losartan of valsartan
Dit is gebaseerd op de European Society of Cardiology richtlijn STEMI (2018) en NSTEMI (2020) en het ESC addendum ‘Dual antiplatelet therapy in coronary artery disease’ (2017).
De adviezen zijn gebaseerd op het ESC-addendum ‘Dual antiplatelet therapy in coronary artery disease’ (2017).
P2Y12-remmers (ticagrelor, prasugrel en clopidogrel) worden door verschillende cytochroom P450 (CYP)-enzymen omgezet in werkzame metabolieten.
Er bestaan genetische verschillen die voor een tragere of snellere CYP-activiteit kunnen zorgen. Clopidogrel is een prodrug en is voor zijn werkzaamheid afhankelijk van omzetting door voornamelijk CYP2C19 en CYP3A4. Ticragrelor en pasugrel zijn slechts deels afhankelijk van omzetting door CYP enzymen voor hun werkzaamheid, zodat een verminderde of verhoogde CYP-activiteit bij deze middelen geen rol speelt.
De European Society of Cardiology (ESC) raadt standaard farmacogenetisch testen niet aan, vanwege het gebrek aan wetenschappelijk bewijs van een voordeel voor de patiënt. Uitzonderingen zijn patiënten met een electieve PCI en extra risico’s, zoals een eerdere stenttrombose. In dat geval kan farmacogenetisch testen van CYP2C19 voor starten met clopidogrel overwogen worden.
Herstelfase
Naar Samenvatting ›- De aard en intensiteit van de nazorg direct na ontslag uit het ziekenhuis hangen af van de ernst van de medische toestand van de patiënt (grootte van het infarct, complicaties) en diens prognose.
- Een doorgemaakt AMI is een belangrijke gebeurtenis voor de patiënt en diens naasten; betrek hen ook bij de voorlichting.
- Verwijs zo nodig terug naar de cardioloog als blijkt dat de patiënt nog geen hartrevalidatie volgt (alleen de cardioloog kan voor hartrevalidatie verwijzen). Bij hartrevalidatie komen aan bod:
- conditie voor en na event, inspanningsmogelijkheden, seksuele activiteit
- inventarisatie psychische klachten (met eventuele partner)
- werkhervatting
- secundaire cardiovasculaire preventie (CVRM)
- Als de patiënt bewust afziet van hartrevalidatie, bespreek dan de mogelijkheden van begeleiding in de eerste lijn. Bespreek daarnaast met de patiënt (en diens naasten) de volgende punten, naar behoefte:
- Spreek over de ervaringen in het ziekenhuis, onzekerheden, psychosociale problemen of gebrek aan sociale steun.
- Bespreek angst- en somberheidsklachten (voor nadere diagnostiek en beleid, zie NHG-Standaard Angst en NHG-Standaard Depressie).
- Angst kan gepaard gaan met lichamelijke klachten, zoals recidiverende klachten van pijn op de borst of hartkloppingen die soms moeilijk te onderscheiden zijn van een recidief AMI (voor nadere diagnostiek en beleid, zie NHG-Standaard Angst).
- Bewegen/sporten is aan te raden, mits de patiënt zijn grenzen in acht neemt (geen piekbelasting) en het sporten geleidelijk aan opbouwt.
- Seksuele activiteit is geen probleem indien de patiënt zonder pijn op de borst 1 tot 2 trappen kan oplopen. Waarschuw de patiënt echter dat hij geen combinatie van dagelijks nitraten en incidenteel PDE-5-remmers, zoals sildenafil, mag gebruiken.
- Werkhervatting vindt idealiter tijdens de hartrevalidatie plaats en dient onder begeleiding opgebouwd te worden. De bedrijfsarts speelt hierin een belangrijke rol. Zie NVAB-richtlijn Ischemische hartziekten (2020).
- Geef de patiënt voorlichting over wat te doen bij het opnieuw optreden van acute pijn op de borst: wanneer moet de patiënt (met spoed) contact opnemen of ‘112’ bellen. Herhaal deze instructie regelmatig.
- Geef voorlichting over leefstijl en maak samen met de patiënt een plan van aanpak; zie NHG-Standaard Cardiovasculair risicomanagement.
De cardioloog gaat na of er een indicatie bestaat voor hartrevalidatie. Hartrevalidatie is effectief en verlaagt op de langere termijn de kans op sterfte en ziekenhuisopname (zie de NVVC Richtlijn Hartrevalidatie (2011)). In de regel begint de patiënt al in het ziekenhuis met hartrevalidatie en volgt deze een programma gedurende 6 weken tot 6 maanden.
Hartrevalidatie bestaat uit oefentherapie, gecombineerd met psychische en educatieve interventies, waarbij de patiënt leert de gezonde leefstijl te integreren in zijn dagelijks leven en zijn belastbaarheid te vergroten. Daarnaast wordt aandacht besteed aan eventueel aanwezige depressieve of angstklachten en aan copingmechanismen en stressmanagement. Patiënten met ischemische hartziekten hebben een 2 keer verhoogd risico op angst en/of stemmingsklachten. Er wordt nagegaan aan welke barrières voor werkhervatting binnen hartrevalidatie kan worden gewerkt en dit wordt afgestemd met de bedrijfsarts. Het is mogelijk dat de cardioloog of een lid van het hartrevalidatieteam de patiënt moet wijzen op het belang van een afspraak met de bedrijfsarts.
Het doel is dat de patiënt een zo normaal mogelijk leven leidt, zowel in de thuis- als werksituatie. In de praktijk blijkt dat een minderheid van de patiënten na een primaire PCI (39%) deelneemt aan een hartrevalidatieprogramma. Wereldwijd ligt deelname aan hartrevalidatie van patiënten met coronaire hartziekten rond de 15-30%. Dit was een diverse groep, die bestond uit 41% patiënten met een ACS, 39% een ‘indicatie voor hartrevalidatie’, 10% na hartoperatie, 5% na PCI en 5% met hartfalen. Van de patiënten die beginnen aan hartrevalidatie rondt 80% deze af.
Seksuele activiteit is wat betreft inspanning vergelijkbaar met het oplopen van 1 tot 2 trappen, tuinieren, stevig wandelen, een bed opmaken of schrobben. Als de herstelfase van een ongecompliceerd AMI voorbij is, hoeft coïtus niet te worden ontraden indien de patiënt zonder pijn op de borst stevig kan wandelen of bijvoorbeeld tuinieren; wel indien er sprake is van IAP, ernstige angineuze klachten of ernstig hartfalen. Uit prospectief onderzoek bij 258 patiënten die een AMI doormaakten, zonder ernstige complicaties, comorbiditeit of lichamelijke handicaps (leeftijd ≤ 70 jaar, 85% mannen), bleek dat 3 weken na het infarct ruim 50% van de patiënten seksuele activiteiten en activiteiten buitenshuis had hervat. De kans dat de patiënt tijdens de coïtus een hartinfarct krijgt, is erg klein; regelmatige lichamelijke inspanning vermindert het risico.
Mannen met hart- en vaatziekten kunnen last hebben van erectiele disfunctie ten gevolge van vaatlijden, ten gevolge van medicatie en door angst. Eventueel kan de patiënt voor de coïtus een nitraat sublinguaal nemen. Ook vrouwen met een doorgemaakt ACS en partners kunnen angstig zijn voor seksuele activiteit.
Thuisarts
Naar Samenvatting ›- Verwijs naar de informatie over de preventie van hart- en vaatziekten op thuisarts.nl, die is gebaseerd op de NHG‑Standaard Cardiovasculair risicomanagement.
- Verwijs de patiënt voor lotgenotencontact en tips naar Harteraad en de Hartstichting.
Verwijzing
Naar Samenvatting ›Bespreek afhankelijk van de klachten en behoefte verwijzing voor psychologische ondersteuning, ontspanningsoefeningen (bijvoorbeeld ademhalingsontspanningsoefeningen) en fysiotherapie als de patiënt geen hartrevalidatie wil volgen. Het doel van de behandelingen is (indien van toepassing) werkhervatting te bevorderen en secundaire preventie van hart- en vaatziekten.
Controle op de langere termijn bij overdracht aan de huisarts
Naar Samenvatting ›- Een patiënt met een doorgemaakt ACS wordt beschouwd als een patiënt met een zeer hoog risico op hart- en vaatziekten (zie NHG-Standaard Cardiovasculair risicomanagement).
- Bij een stabiele patiënt die alleen een myocardinfarct doormaakte en geen andere risicofactoren heeft waarvoor controle nodig is, vinden de controles jaarlijks plaats. Bij postinfarctpatiënten met risicofactoren bepalen deze risicofactoren de controlefrequentie (2-4 keer per jaar) (zie NHG-Standaard Cardiovasculair risicomanagement).
- Voor de behandeling en streefwaarden van bloeddruk en cholesterolwaarden, zie NHG-Standaard Cardiovasculair risicomanagement.
- De behandeling met een P2Y12-remmer kan meestal gestopt worden na 12 maanden. Dit staat vermeld in de ontslagbrief van de cardioloog.
- De behandeling met een bètablokker kan soms worden gestopt bij afwezigheid van hartfalen en een verminderde kamerfunctie (LVEF < 50%) na 12 maanden. Dit staat vermeld in de ontslagbrief van de cardioloog.
- Een ACE-remmer kan soms worden gestopt na 12 maanden bij afwezigheid van hartfalen en/of een verminderde kamerfunctie (LVEF < 50%), DM en/of chronisch nierfalen. Dit staat vermeld in de ontslagbrief van de cardioloog.
- Soms kunnen psychische klachten en onzekerheden pas later optreden. Ga na of er psychische klachten zijn (zie onderdeel Direct na ontslag) en verwijs zo nodig voor psychische begeleiding of ontspanningstherapie.
Verwijzing naar cardioloog
Naar Samenvatting ›- Bij recidief ACS
- Bij recidief angineuze klachten binnen enkele maanden na een ACS, CABG of PCI
- Bij moeilijk te behandelen angina pectoris, kortademigheid, verminderde inspanningstolerantie en/of tekenen van hartfalen (zie NHG-Standaard Stabiele angina pectoris en NHG-Standaard Hartfalen)
Samenwerkingsafspraken
Naar Samenvatting ›Een deel van de afspraken wordt regionaal bepaald; regionale verschillen zijn dus mogelijk.
Acute fase
Naar Samenvatting ›- Draag zorg voor een goede mondelinge en bij voorkeur tevens schriftelijke overdracht naar de ambulanceverpleegkundige en cardioloog met vermelding van de voorgeschiedenis, nierfunctie, behandelingsbeperkingen, (toegediende) medicatie en ABCDE.
- Bij aankomst van de ambulance: draag de regie over aan de ambulanceverpleegkundige.
- De ambulanceverpleegkundige is verantwoordelijk voor de doorverwijzing naar een interventiecentrum voor PCI (bij een STEMI) of niet-interventiecentrum.
- Troponinebepalingen buiten het ziekenhuis worden momenteel niet aanbevolen.
Bij ontslag uit het ziekenhuis
Naar Samenvatting ›- De cardioloog informeert de huisarts door middel van een voorlopige ontslagbrief.
- De cardioloog is verantwoordelijk voor de herhaalreceptuur totdat de zorg wordt overgedragen aan de huisarts.
- De cardioloog stelt de indicatie voor hartrevalidatie.
- De huisarts spreekt in de fase direct na ontslag met de patiënt over diens ervaringen, vragen, zorgen, bijkomende klachten of problemen (zie ook het onderdeel Direct na ontslag) en over deelname aan hartrevalidatie en leefstijlinterventies.
Bij overdracht aan de huisarts
Naar Samenvatting ›- De cardioloog kan een patiënt met een doorgemaakt ACS terugverwijzen naar de eerste lijn indien de patiënt qua klachten stabiel is en is ingesteld op medicatie.
- De cardioloog informeert de patiënt over terugverwijzing naar de huisarts en vraagt de patiënt zelf een afspraak bij de huisarts te maken na het laatste consult.
- De cardioloog zorgt zo snel mogelijk voor een voorlopige ontslagbrief en binnen 3 maanden voor een definitieve brief aan de huisarts met vermelding van:
- de diagnose, de behandeling, belangrijke nevendiagnosen en het verwachte beloop
- de resultaten van de cardiovasculaire risico-inventarisatie (inclusief linkerventrikelfunctie, uitgebreidheid en ernst van de resterende ischemie)
- een overzicht van de ingezette niet-medicamenteuze behandeling
- een overzicht van de medicatie met de indicatie daarvoor en de gebruiksduur
- eventuele deelname aan hartrevalidatie
- het advies aan de patiënt een afspraak te maken met de huisarts en op welke termijn dit moet gebeuren
- De huisarts verricht na terugverwijzing de controles zoals beschreven in het onderdeel Controle op de lange termijn.
- Terugverwijzing naar de cardioloog: zie het onderdeel Verwijzing naar cardioloog.
Medicatie en gebruiksduur
Naar Samenvatting ›- De cardioloog start en stopt de P2Y12-remmer of informeert de huisarts over de stopdatum. De cardioloog stopt tevens de maagbescherming indien die niet langer geïndiceerd is na het staken van de P2Y12-remmer.
- De cardioloog start behandeling met een bètablokker en/of ACE-remmer indien geïndiceerd en bepaalt het moment dat deze kunnen worden gestopt of adviseert de huisarts hierover bij terugverwijzing.
Tijdelijk stoppen van trombocytenaggregatieremmers bij ingrepen
Naar Samenvatting ›- Bij indicaties om dubbele trombocytenaggregatieremmers (acetylsalicylzuur, P2Y12-remmer) tijdelijk te stoppen (bijvoorbeeld bij (semi)spoedingrepen): overleg altijd eerst met de cardioloog.
- Bij indicaties om acetylsalicylzuur monotherapie tijdelijk te stoppen: raadpleeg de LTA Antistollingszorg.
Referenties
- Collet JP, Thiele H, Barbato E, Barthélémy O, Bauersachs J, Bhatt DL, et al. 2020 ESC Guidelines for the management of acute coronary syndromes in patients presenting without persistent ST-segment elevation. Eur Heart J 2021;42:1289-367.
- Thygesen K, Alpert JS, Jaffe AS, Chaitman BR, Bax JJ, Morrow DA, et al. Fourth universal definition of myocardial infarction (2018). Circulation 2018;138:e618-e51.
- Nielen MMJ, Hek K. Jaarcijfers aandoeningen - Huisartsenregistraties. Jaarcijfers aandoeningen - Huisartsenregistraties. Uit: www.nivel.nl. Laatst gewijzigd op 07-12-2020; geraadpleegd op 11-03-2021. Ga naar bron: Nielen MMJ, Hek K. Jaarcijfers aandoeningen - Huisartsenregistraties. Jaarcijfers aandoeningen - Huisartsenregistraties. Uit: www.nivel.nl. Laatst gewijzigd op 07-12-2020; geraadpleegd op 11-03-2021.
- Ten Have P, Hilt AD, Paalvast H, Eindhoven DC, Schalij MJ, Beeres S. Non-ST-elevation myocardial infarction in the Netherlands: room for improvement! Neth Heart J 2020;28:537-45.
- Eindhoven DC, Wu HW, Kremer SWF, Van Erkelens JA, Cannegieter SC, Schalij MJ, et al. Mortality differences in acute myocardial infarction patients in the Netherlands: the weekend-effect. Am Heart J 2018;205:70-6.
- Ibanez B, James S, Agewall S, Antunes MJ, Bucciarelli-Ducci C, Bueno H, et al. 2017 ESC Guidelines for the management of acute myocardial infarction in patients presenting with ST-segment elevation: The Task Force for the management of acute myocardial infarction in patients presenting with ST-segment elevation of the European Society of Cardiology (ESC). Eur Heart J 2018;39:119-77.
- Pustjens TFS, Appelman Y, Damman P, Ten Berg JM, Jukema JW, De Winter RJ, et al. Guidelines for the management of myocardial infarction/injury with non-obstructive coronary arteries (MINOCA): a position paper from the Dutch ACS working group. Neth Heart J 2020;28:116-30.
- Pasupathy S, Air T, Dreyer RP, Tavella R, Beltrame JF. Systematic review of patients presenting with suspected myocardial infarction and nonobstructive coronary arteries. Circulation 2015;131:861-70.
- Agewall S, Beltrame JF, Reynolds HR, Niessner A, Rosano G, Caforio AL, et al. ESC working group position paper on myocardial infarction with non-obstructive coronary arteries. Eur Heart J 2017;38:143-53.
- Mehta LS, Beckie TM, DeVon HA, Grines CL, Krumholz HM, Johnson MN, et al. Acute myocardial infarction in women: a scientific statement from the american heart association. Circulation 2016;133:916-47.
- Van Oosterhout REM, De Boer AR, Maas A, Rutten FH, Bots ML, Peters SAE. Sex Differences in Symptom Presentation in acute coronary syndromes: a systematic review and meta-analysis. J Am Heart Assoc 2020;9:e014733.
- Brieger D, Eagle KA, Goodman SG, Steg PG, Budaj A, White K, Montalescot G; GRACE Investigators. Acute coronary syndromes without chest pain, an underdiagnosed and undertreated high-risk group: insights from the Global Registry of Acute Coronary Events. Chest 2004;126:461-9.
- Canto JG, Rogers WJ, Goldberg RJ, Peterson ED, Wenger NK, Vaccarino V, et al. NRMI Investigators. Association of age and sex with myocardial infarction symptom presentation and in-hospital mortality. JAMA 2012;307:813-22.
- Ängerud KH, Brulin C, Näslund U, Eliasson M. Longer pre-hospital delay in first myocardial infarction among patients with diabetes: an analysis of 4266 patients in the northern Sweden MONICA Study. BMC Cardiovasc Disord 2013;13:6.
- Van der Ende MY, Juarez-Orozco LE, Waardenburg I, Lipsic E, Schurer RAJ, Van der Werf HW, et al. Sex-based differences in unrecognized myocardial infarction. J Am Heart Assoc 2020;9:e015519.
- Stacey RB, Zgibor J, Leaverton PE, Schocken DD, Peregoy JA, Lyles MF, et al. Abnormal fasting glucose increases risk of unrecognized myocardial infarctions in an elderly cohort. J Am Geriatr Soc 2019;67:43-9.
- NICE. Chest pain of recent onset: assessment and diagnosis of recent onset chest pain or discomfort of suspected cardiac origin (2010). Ga naar bron: NICE. Chest pain of recent onset: assessment and diagnosis of recent onset chest pain or discomfort of suspected cardiac origin (2010).
- Bruins Slot MH, Rutten FH, Van der Heijden GJ, Doevendans PA, Mast EG, Bredero AC, Glatz JF, Hoes AW. Gender differences in pre-hospital time delay and symptom presentation in patients suspected of acute coronary syndrome in primary care. Fam Pract. 2012;29:332-7.
- Nguyen HL, Saczynski JS, Gore JM, Goldberg RJ. Age and sex differences in duration of prehospital delay in patients with acute myocardial infarction: a systematic review. Circ Cardiovasc Qual Outcomes 2010;3:82-92.
- Ängerud KH, Brulin C, Näslund U, Eliasson M. Patients with diabetes are not more likely to have atypical symptoms when seeking care of a first myocardial infarction. An analysis of 4028 patients in the Northern Sweden MONICA Study. Diabet Med 2012;29:e82-7.
- Ängerud KH, Thylén I, Sederholm Lawesson S, Eliasson M, Näslund U, Brulin C. Symptoms and delay times during myocardial infarction in 694 patients with and without diabetes; an explorative cross-sectional study. BMC Cardiovasc Disord 2016;16:108.
- Roffi M, Patrono C, Collet JP, Mueller C, Valgimigli M, Andreotti F, et al. 2015 ESC guidelines for the management of acute coronary syndromes in patients presenting without persistent ST-segment elevation. Kardiol Pol 2015;73:1207-94.
- Van der Meer MG, Appelman Y, Rutten KHG, Van der Graaf Y, Nathoe HM, Doevendans PA, et al. Are there gender disparities in symptom presentation or triage of patients with chest discomfort at primary care out-of-hours services? An observational study. BMJ Open 2019;9:e031613.
- Kerkman T, Ten Brinke LBG, Huybrechts B, Adams R, Amoroso G, De Winter RJ, et al. Evaluation of sex differences in patients with ST-elevated myocardial infarction: an observational cohort study in Amsterdam and surrounding region. Neth Heart J 2020;28:595-603.
- Fabbian F, Bhatia S, De Giorgi A, Maietti E, Bhatia S, Shanbhag A, et al. Circadian periodicity of ischemic heart disease: a systematic review of the literature. Heart Fail Clin 2017;13:673-80.
- Wouters LT, Rutten FH, Erkelens DC, De Groot E, Damoiseaux RA, Zwart DL. Accuracy of telephone triage in primary care patients with chest discomfort: a cross-sectional study. Open Heart 2020;7.
- Gräsner JT, Wnent J, Herlitz J, Perkins GD, Lefering R, et al. Survival after out-of-hospital cardiac arrest in Europe - Results of the EuReCa TWO study. Resuscitation. 2020 Mar 1;148:218-226.
- Van Oeffelen AA, Agyemang C, Stronks K, Bots ML, Vaartjes I. Prognosis after a first hospitalisation for acute myocardial infarction and congestive heart failure by country of birth. Heart 2014;100:1436-43.
- Fanaroff AC, Rymer JA, Goldstein SA, Simel DL, Newby LK. Does this patient with chest pain have acute coronary syndrome?: the rational clinical examination systematic review. JAMA 2015;314:1955-65.
- Jansen T, Hek K, Schellevis FG, Kunst AE, Verheij RA. Socioeconomic inequalities in out-of-hours primary care use: an electronic health records linkage study. Eur J Public Health 2020;30:1049-55.
- Hoorweg BB, Willemsen RT, Cleef LE, Boogaerts T, Buntinx F, Glatz JF, et al. Frequency of chest pain in primary care, diagnostic tests performed and final diagnoses. Heart 2017;103:1727-32.
- Klompas M. Does this patient have an acute thoracic aortic dissection? JAMA 2002;287:2262-72.
- Van Weert HPCM, Bär FWHM, Grundmeijer HGLM. Pijn op de borst. Huisarts Wet 2002;45:259-64.
- Harskamp RE, Laeven SC, Himmelreich JC, Lucassen WAM, Van Weert H. Chest pain in general practice: a systematic review of prediction rules. BMJ Open 2019;9:e027081.
- Grijseels EW, Deckers JW, Hoes AW, Hartman JA, Van der Does E, Van Loenen E, et al. Pre-hospital triage of patients with suspected myocardial infarction. Evaluation of previously developed algorithms and new proposals. Eur Heart J 1995;16:325-32.
- Grijseels EW, Deckers JW, Hoes AW, Boersma E, Hartman JA, Van der Does E, et al. Implementation of a pre-hospital decision rule in general practice. Triage of patients with suspected myocardial infarction. Eur Heart J 1996;17:89-95.
- Schols AMR, Stakenborg JPG, Dinant GJ, Willemsen RTA, Cals JWL. Point-of-care testing in primary care patients with acute cardiopulmonary symptoms: a systematic review. Fam Pract 2018;35:4-12.
- Willemsen RTA, Kip MMA, Koffijberg H, Kusters R, Buntinx F, Glatz JFC, et al. Early health technology assessment of future clinical decision rule aided triage of patients presenting with acute chest pain in primary care. Prim Health Care Res Dev 2018;19:176-88.
- Van Dongen DN, Fokkert MJ, Tolsma RT, Badings EA, Van der Sluis A, Slingerland RJ, et al. Value of prehospital troponin assessment in suspected non-ST-elevation acute coronary syndrome. Am J Cardiol 2018;122:1610-6.
- Stopyra JP, Harper WS, Higgins TJ, Prokesova JV, Winslow JE, Nelson RD, et al. Prehospital modified HEART score predictive of 30-day adverse cardiac events. Prehosp Disaster Med 2018;33:58-62.
- Harskamp RE, Kleton M, Smits IH, Manten A, Himmelreich JCL, Van Weert HCPM, et al. Performance of a simplified HEART score and HEART-GP score for evaluating chest pain in urgent primary care. Neth Heart J 2021;29:338-47.
- Cooper JG, Ferguson J, Donaldson LA, Black KMM, Livock KJ, Horrill JL, et al. The Ambulance Cardiac Chest Pain Evaluation in Scotland Study (ACCESS): a prospective cohort study. Ann Emerg Med 2021;77:575-88.
- Sagel D, Vlaar PJ, van Roosmalen R, Waardenburg I, Nieuwland W, Lettinga R, et al. Prehospital risk stratification in patients with chest pain. Emerg Med J 2021;38:814-9.
- Xu LQ, Yang YM, Tong H, Xu CF. Early diagnostic performance of heart-type fatty acid binding protein in suspected acute myocardial infarction: evidence from a meta-analysis of contemporary studies. Heart Lung Circ 2018;27:503-12.
- Li WJ, Chen XM, Nie XY, Lin XX, Cheng YJ, Hu CH, et al. Early diagnostic and prognostic utility of high-sensitive troponin assays in acute myocardial infarction: a meta-analysis. Intern Med J 2015;45:748-56.
- Rasmussen MB, Stengaard C, Sørensen JT, Riddervold IS, Hansen TM, Giebner M, et al. Predictive value of routine point-of-care cardiac troponin T measurement for prehospital diagnosis and risk-stratification in patients with suspected acute myocardial infarction. Eur Heart J Acute Cardiovasc Care 2019;8:299-308.
- Stopyra JP, Snavely AC, Scheidler JF, Smith LM, Nelson RD, Winslow JE, et al. Point-of-care troponin testing during ambulance transport to detect acute myocardial infarction. Prehosp Emerg Care 2020;24:751-9.
- Planer D, Leibowitz D, Paltiel O, Boukhobza R, Lotan C, Weiss TA. The diagnostic value of troponin T testing in the community setting. Int J Cardiol 2006;107:369-75.
- Nilsson S, Andersson PO, Borgquist L, Grodzinsky E, Janzon M, Kvick M, et al. Point-of-care troponin T testing in the management of patients with chest pain in the Swedish primary care. Int J Family Med 2013;2013:532093.
- Valgimigli M, Bueno H, Byrne RA, Collet JP, Costa F, et al. ESC Scientific Document Group; ESC Committee for Practice Guidelines (CPG); ESC National Cardiac Societies. 2017 ESC focused update on dual antiplatelet therapy in coronary artery disease developed in collaboration with EACTS: The Task Force for dual antiplatelet therapy in coronary artery disease of the European Society of Cardiology (ESC) and of the European Association for Cardio-Thoracic Surgery (EACTS). Eur Heart J. 2018 Jan 14;39(3):213-260.
- KNMP kennisbank, geraadpleegd september 2021.
- Knuuti J, Wijns W, Saraste A, Capodanno D, Barbato E, Funck-Brentano C, et al. ESC Scientific Document Group. 2019 ESC Guidelines for the diagnosis and management of chronic coronary syndromes. Eur Heart J. 2020 Jan 14;41:407-477. Erratum in: Eur Heart J 2020;41:4242.
- Nederlandse Vereniging voor Arbeids- en Bedrijfsgeneeskunde NVAB. Richtlijn Ischemische hartziekten, 2020. Geraadpleegd 14-01-2021. Ga naar bron: Nederlandse Vereniging voor Arbeids- en Bedrijfsgeneeskunde NVAB. Richtlijn Ischemische hartziekten, 2020. Geraadpleegd 14-01-2021.
- Pereira NL, Farkouh ME, So D, Lennon R, Geller N, Mathew V, et al. Effect of genotype-guided oral P2Y12 inhibitor selection vs conventional clopidogrel therapy on ischemic outcomes after percutaneous coronary intervention: the TAILOR-PCI randomized clinical trial. JAMA 2020;324:761-71.