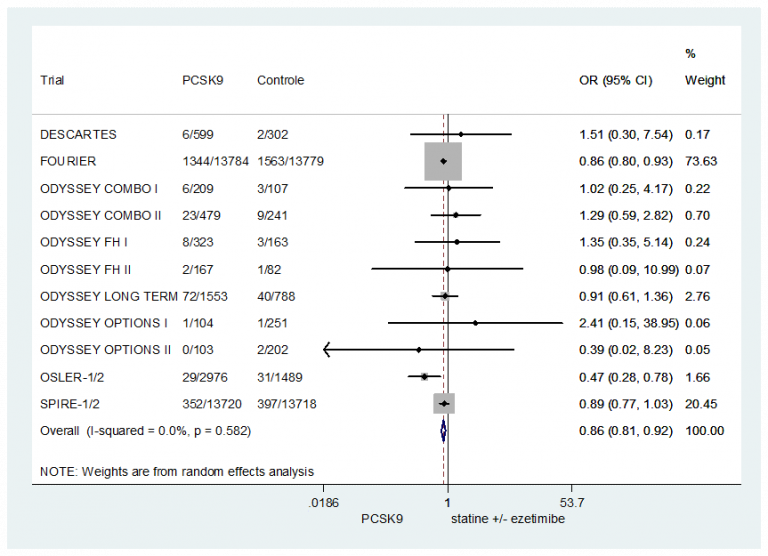
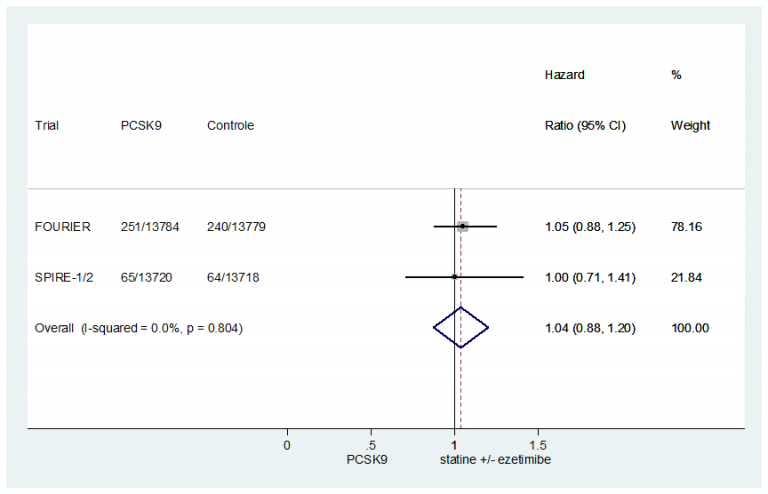
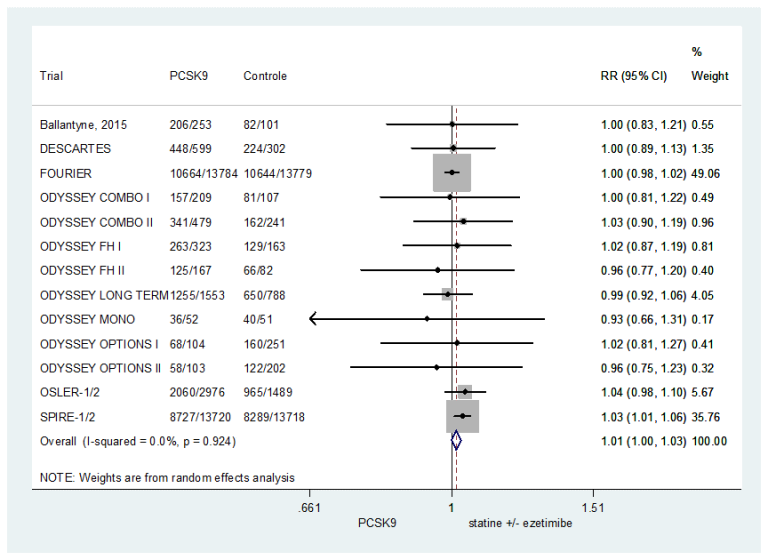
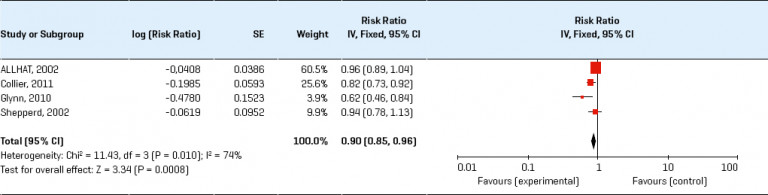
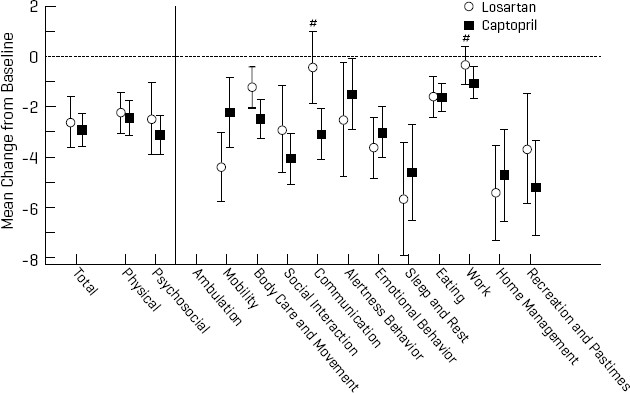
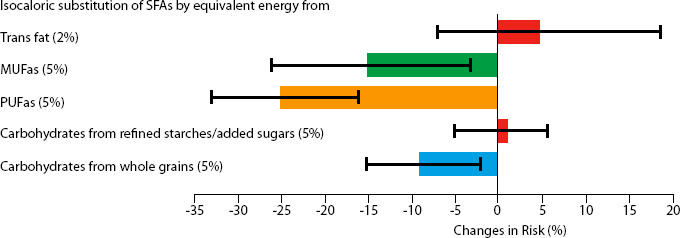Cardiovasculair risicomanagement
Aanvullende informatie over het beleid dat deze richtlijn voorstaat is te vinden in de Praktische handleiding bij deze standaard.
Richtlijnen diagnostiek
Naar Volledige tekst ›Stel een cardiovasculair risicoprofiel op bij patiënten met:
- eerder vastgestelde hart- en vaatziekten
- diabetes mellitus
- chronische nierschade (eGFR <60 ml/min/1,73 m2 en/of albumine-creatinineratio ≥ 3 mg/mmol)
- vermoeden van erfelijke dyslipidemie (zie NHG-Standpunt Diagnostiek en behandeling van familiaire hypercholesterolemie)
- risicofactoren zoals roken, obesitas (BMI ≥ 30), verhoogde bloeddruk of verhoogd cholesterol
- COPD
- reumatoïde artritis
Anamnese
Naar Volledige tekst ›- roken, voeding, alcoholgebruik en lichamelijke activiteit
- bekende hart- en vaatziekten, diabetes mellitus of chronische nierschade
- psychosociale risicofactoren (lage sociaal-economische status, werk- en familiestress, sociale isolatie), psychiatrische aandoening
- aanwijzingen voor secundaire hypertensie: zout, drop, NSAID’s, orale anticonceptiva, drugs (amfetamine, cocaïne), slaapapneusyndroom
Lichamelijk onderzoek
Naar Volledige tekst ›- palpeer de pols (frequentie, regelmaat)
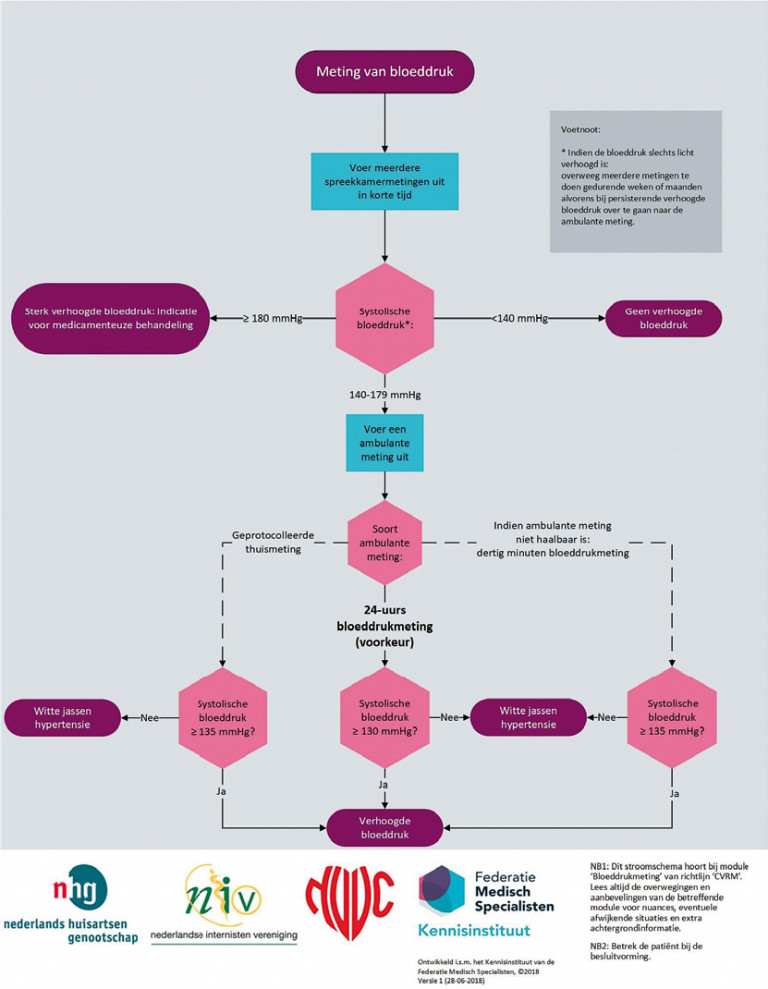
- meet de bloeddruk (meerdere spreekkamermetingen), verricht bij een mogelijke behandelindicatie een 24-uursmeting, geprotocolleerde thuismeting of BP30-meting
- bepaal de BMI
Aanvullend onderzoek
Naar Volledige tekst ›voor de risicoschatting: lipidenprofiel (LDL-cholesterol, HDL-cholesterol, non-HDL-cholesterol, totaal cholesterol, triglyceriden), glucose, creatinine/eGFR, albumine-creatinineratio. bij de start van een diureticum, ACE-remmer of ARB: creatinine/eGFR, natrium en kalium, herhaal deze bepalingen na 2 weken bij afwijkende bevindingen of bij gecombineerde behandeling met diureticum en ACE-remmer/ARB.
| Patiëntengroep | Subgroepen | Risicocategorie |
|---|---|---|
| Patiënten met vastgestelde hart- en vaatziekte | ||
Gedocumenteerde atherosclerotische HVZ, klinisch of ondubbelzinnig met beeldvormend onderzoek aangetoond.
| n.v.t. | Zeer hoog risico |
| Patiënten met diabetes mellitus type 2 | ||
| N.B. Patiënten met type 1 DM ouder dan 40 jaar kunnen ook geclassificeerd worden volgens deze categorieën. |
| Matig verhoogd risico |
| Hoog risico | |
| Zeer hoog risico | |
| Patiënten met chronische nierschade | ||
| CNS zonder diabetes of atherosclerotische HVZ |
| Hoog risico |
| Zeer hoog risico | |
| Personen met een sterk verhoogde bloeddruk | ||
| Bloeddruk ≥ 180 mmHg* | n.v.t. | Hoog risico |
| Familiaire hypercholesterolemie | ||
| Personen met aangetoonde familiaire hypercholesterolemie | n.v.t. | Hoog risico |
ACR = albumine-creatinineratio; ACS = acuut coronair syndroom; AMI = acuut myocardinfarct; CTA = computertomografie-angiografie; CNS = chronische nierschade; DM = diabetes mellitus; eGFR = geschatte glomerulaire filtratiesnelheid; HVZ = hart- en vaatziekten; n.v.t. = niet van toepassing; PAV = perifeer arterieel vaatlijden; TIA = transiënte ischemische aanval. * Voor personen met een bloeddruk van 160-180 mmHg, zie ook 2.3 Bloeddruk. ^DM1 en DM2 zijn totaal verschillende aandoeningen, zeker ook betreft debuutleeftijd. Beide aandoeningen gaan gepaard met een verhoogd cardiovasculair risico. Er zijn betrekkelijk weinig goede actuele gegevens over het cardiovasculair risico bij DM1. De werkgroep vond het niet onredelijk om DM1 patiënten vanaf de leeftijd van 40 jaar gelijk te trekken met DM2 patiënten die uiteraard over het algemeen ouder zijn maar vaak korter met diabetes bekend zijn. | ||
Evaluatie en risicoschatting
Naar Volledige tekst ›- Bepaal de risicocategorie waarin de patiënt valt: zeer hoog, hoog, matig verhoogd of laag.
- Ga na of de patiënt in een van de patiëntgroepen valt waarvoor direct een risicocategorie aan te wijzen is (tabel S1). Dit zijn patiënten met:
- doorgemaakte hart- en vaatziekte
- diabetes mellitus
- matige of ernstige chronische nierschade
- sterk verhoogde bloeddruk ≥ 180 mmHg
- aangetoonde familiaire hypercholesterolemie.
- Gebruik voor overige personen van 40-80 jaar de tabel SCORE2(-OP) om het tienjaarsrisico op hart- en vaatziekte te schatten (tabel S2). Vermenigvuldig de risicoscore met 1,5 bij reumatoïde artritis.
- Ga na of de patiënt in een van de patiëntgroepen valt waarvoor direct een risicocategorie aan te wijzen is (tabel S1). Dit zijn patiënten met:
- Overweeg bij relatief jonge patiënten de cardiovasculaire risicoleeftijd (hartleeftijd) en/of het lifetimerisico (zie Bijlage Lifetimerisico) te bespreken om gezamenlijke besluitvorming te ondersteunen.
- Bij een score in de buurt van de behandelgrens: overweeg indeling in een hogere risicocategorie bij psychosociale risicofactoren of een bekende hoge coronaire kalkscore. Een kalkscore van 0 betekent dat de patiënt in een lagere risicocategorie valt.
- Overweeg de coronaire kalkscore te bepalen bij patiënten van 50-70 jaar als een gesprek over het al dan niet starten van medicamenteuze behandeling geen beslissing oplevert.
- Verricht bij vermoeden van secundaire hypertensie pas een risicoschatting na het wegnemen van de vermoedelijke oorzaak.
- Overweeg familiaire dyslipidemie bij sterk verhoogde lipidenwaarden (LDL-cholesterol > 5 mmol/L of totaal cholesterol > 8 mmol/L).
Richtlijnen beleid
Naar Volledige tekst ›Bepaal het beleid op grond van de risicocategorie (zie tabel S3) in overleg met de patiënt. Het beleid hangt mede af van de leeftijd, kwetsbaarheid, comorbiditeit, motivatie voor leefstijlverandering en het gebruik van medicatie.
| < 50 jaar* | 50-69 jaar* | ≥ 70 jaar | |
| Laag risico | < 2,5% | < 5% | n.v.t. |
| Matig verhoogd risico | 2,5-7,5% | 5-10% | < 15% |
| Hoog risico | ≥ 7,5% | ≥ 10% | ≥ 15% |
| Zeer hoog risico | Zie tabel S1 voor de groepen met een zeer hoog risico | ||
| * Tienjaarsrisico op fatale en niet-fatale hart- en vaatziekten volgens de SCORE2-risicotabel. | |||
- Laag risico (zie tabel S2 en tabel S3): aanbieden van medicamenteuze behandeling is doorgaans niet aangewezen.
- Matig verhoogd risico (zie tabel S2 en tabel S3): aanbieden van medicamenteuze behandeling is doorgaans niet aangewezen. Bij jonge mensen is speciale aandacht gewenst in verband met het hogere lifetimerisico.
- Hoog risico (zie tabel S1, tabel S2 en tabel S3): overweeg medicamenteuze behandeling aan te bieden.
- Zeer hoog risico (zie tabel S1): aanbieden van medicamenteuze behandeling wordt aanbevolen.
Een bloeddruk van 160-180 mmHg kan worden meegewogen bij het opstellen van een behandelplan (zie ook 2.3 Bloeddruk).
Voorlichting
Naar Volledige tekst ›- Geef uitleg over de hoogte van het risico op hart- en vaatziekten.
- Leg uit dat dit risico verlaagd kan worden door leefstijlaanpassing en, indien geïndiceerd, door gebruik van cholesterol- en/of bloeddrukverlagende medicatie.
Niet-medicamenteuze behandeling
Naar Volledige tekst ›Ga met de patiënt na op welke leefstijlfactor(en) de grootste winst te behalen is en wat de meest haalbare aanpak is. Adviseer:
- niet te roken en meeroken te vermijden
- voldoende te bewegen: ten minste 150 minuten per week matig intensieve inspanning, zoals wandelen en fietsen, verspreid over diverse dagen; niet meer dan 8 uur per dag te zitten
- te streven naar een optimaal gewicht: BMI 20-25 kg/m2
- gezond te eten volgens de Schijf van Vijf van het Voedingscentrum
- stress te voorkomen
Medicamenteuze behandeling
Naar Volledige tekst ›Cholesterolverlaging
- Streef naar een LDL-cholesterol < 1,8 mmol/L bij patiënten ≤ 70 jaar met doorgemaakte hart- en vaatziekten.
- Streef naar een LDL-cholesterol < 2,6 mmol/L bij:
- overige patiënten ≤ 70 jaar met een verhoogd risico op hart- en vaatziekten.
- vitale ouderen zonder doorgemaakte hart- en vaatziekten.
- vitale ouderen met doorgemaakte hart- en vaatziekten. Overweeg een lagere streefwaarde als medicatie goed wordt verdragen en bij herhaalde nieuwe uitingen van hartvaatziekten ondanks een LDL-cholesterol < 2,6 mmol/L.
- Gebruik de streefwaarden met enige nuance: een waarde net boven de streefwaarde kan soms geaccepteerd worden.
- De leeftijdsgrens ≤ 70 jaar is geen absolute grens. Kwetsbaarheid of vitaliteit is niet altijd gebonden aan de leeftijd van de patiënt.
- Start niet met lipidenverlagende medicatie bij kwetsbare ouderen zonder hart- en vaatziekten.
Medicatiekeuze
- Kies een cholesterolverlager op basis van de onbehandelde LDL-cholesterolwaarde en de streefwaarde die past bij het risico van de patiënt. Start bij een gewenste LDL-cholesteroldaling van:
- < 40%: atorvastatine, rosuvastatine of simvastatine
- > 40%: atorvastatine of rosuvastatine.
- Start pravastatine bij gebruik van medicatie die invloed heeft op het CYP3A4-enzym (diltiazem, verapamil, itraconazol, hiv-remmers).
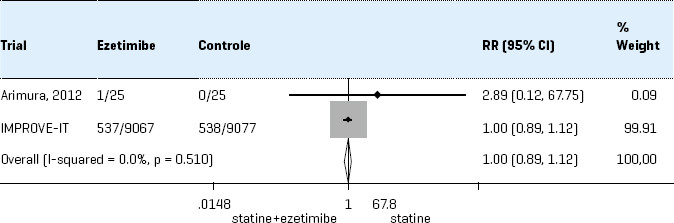
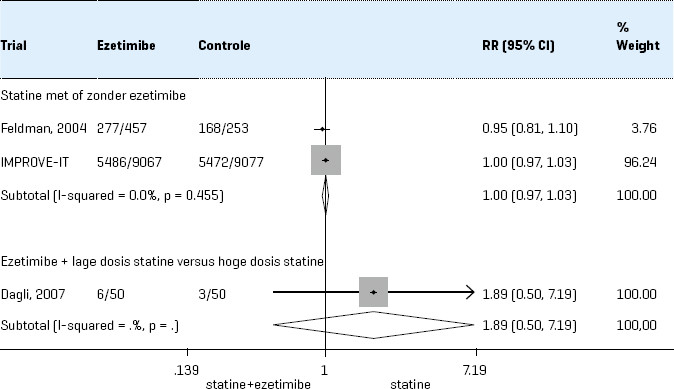
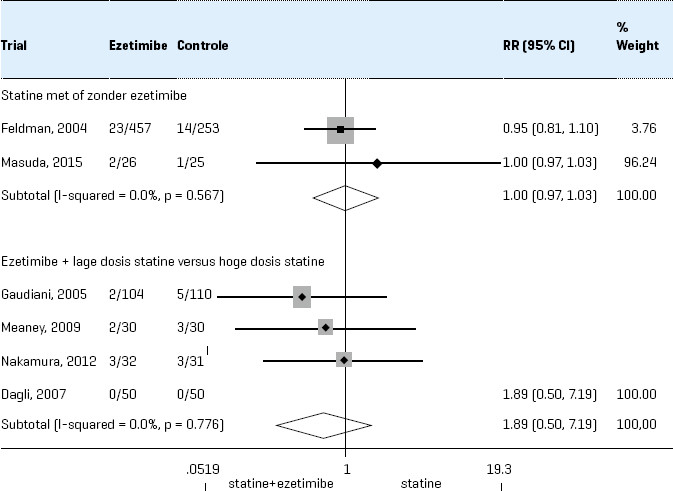
- Bij niet bereiken van de streefwaarde: overweeg een hogere dosis statine (als de maximumdosering nog niet bereikt is) of toevoeging van ezetimib 10 mg.
- Voor details over de keus en dosering van cholesterolverlagers, zie Praktische handleiding bij de NHG-Standaard CVRM.
Bloeddrukverlaging
- Behandel iedereen met een systolische bloeddruk ≥ 180 mmHg met antihypertensiva, ongeacht het risico op hart- en vaatziekten.
- Start met leefstijladviezen bij een systolische bloeddruk van 160-180 mmHg. Overweeg medicamenteuze behandeling indien de bloeddruk na leefstijlverandering niet tot < 160 mmHg daalt. Hierbij kan het risico uit de SCORE2-risicotabel in de overwegingen worden betrokken (zie tabel S2).
- Streef bij patiënten ≤ 70 jaar naar:
- een systolische bloeddruk < 140 mmHg
- een lagere systolische bloeddruk tot < 130 mmHg indien de medicatie goed verdragen wordt, met name bij patiënten met een hoger risico op hart- en vaatziekten (bijvoorbeeld bij chronische nierschade of diabetes mellitus).
- Streef bij vitale ouderen naar:
- een systolische bloeddruk < 150 mmHg
- overweeg verdere verlaging van de bloeddruk tot < 140 mmHg bij afwezigheid van bijwerkingen.
- Streef bij kwetsbare ouderen naar:
- een systolische bloeddruk < 150 mmHg met een diastolische bloeddruk ≥ 70 mmHg onder voorwaarde van voorzichtig titreren.
Medicatiekeuze
- Diuretica, ACE-remmers/ARB’s, calciumantagonisten en bètablokkers hebben een even groot bloeddrukverlagend effect en zijn allen bruikbaar bij bloeddrukbehandeling. Neem cardiovasculaire morbiditeit zoals hartfalen, myocardinfarct of atriumfibrilleren mee in de keuze (zie de desbetreffende NHG-Standaarden).
- Combineer geen bètablokker met diureticum (risico op diabetes) of ACE-remmer met ARB (risico op nierfalen).
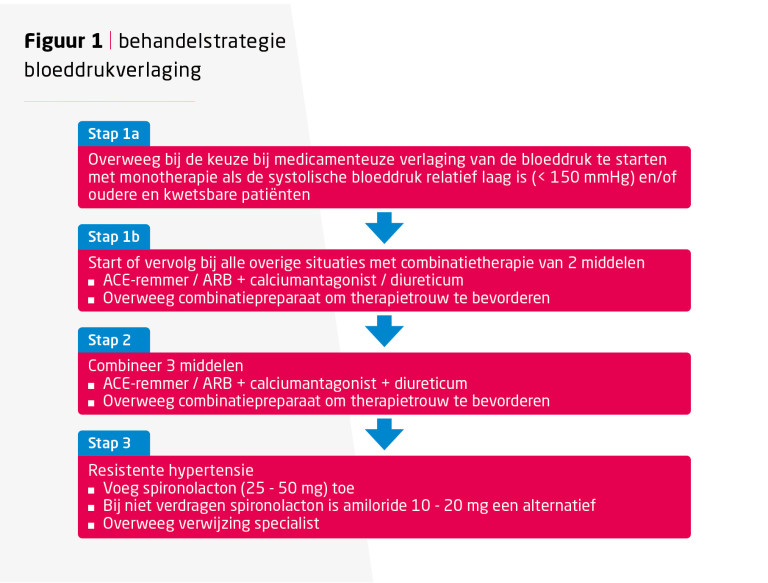
- Overweeg te starten met monotherapie als de systolische bloeddruk relatief laag is (< 150 mmHg) en/of bij oudere en kwetsbare patiënten.
- Start of vervolg in alle overige situaties met een combinatie van 2 middelen.
- Overweeg een combinatiepreparaat om therapietrouw te bevorderen.
- Voeg bij onvoldoende effect een derde middel toe. Verhoog vervolgens bij onvoldoende effect de doseringen stapsgewijs tot de maximale dosering, of tot de dosering die de patiënt verdraagt.
- Bij therapieresistente hypertensie (spreekkamerbloeddruk ≥ 140 mmHg ondanks gebruik van 3 antihypertensiva en voldoende therapietrouw): overweeg toevoeging van spironolacton 25-50 mg 1 dd of verwijzing naar een medisch specialist. Bij niet verdragen spironolacton is amiloride 10-20 mg 1 dd een alternatief.
- Voor details over voorkeursmiddelen, doseringen, controles van nierfunctie en elektrolyten, en beleid bij elektrolytstoornissen, zie Praktische handleiding bij de NHG-Standaard CVRM.
Controles
Naar Volledige tekst ›- Herhaal de risicoschatting op hart- en vaatziekten elke 5 jaar, of vaker indien het geschatte risico dicht bij een grenswaarde ligt.
- Controleer de bloeddruk 1-2 keer per jaar, vaker indien bloeddruk niet goed ingesteld is.
- Laboratoriumonderzoek:
- bij gebruik van een diureticum, ACE-remmer of ARB:
- jaarlijks creatinine/eGFR, natrium en kalium
- bij eGFR < 30 ml/min/1,73m², instabiel hartfalen of kwetsbare oudere: driemaandelijks creatinine/eGFR, natrium en kalium
- bij start of wijziging van cholesterolverlager: na 3 maanden LDL-cholesterol; na het bereiken van de streefwaarde zijn verdere (jaarlijkse) controles niet nodig.
- bij iedereen onder behandeling voor CVRM: driejaarlijks glucose en albumine-creatinineratio; pas dit in de periodieke controles in.
- bij gebruik van een diureticum, ACE-remmer of ARB:
Verwijzing
Naar Volledige tekst ›- Bij overgewicht: naar diëtiste en/of fysio- of oefentherapeut
- Bij onvoldoende bereiken van de streefwaarde LDL-cholesterol en hoge recidiefkans op hart- en vaatziekten (zoals bij uitgebreid progressief vaatlijden of familiaire hypercholesterolemie): naar internist of cardioloog
- Bij aanhoudend lage eGFR bij start van een ACE-remmer, ARB of aldosteronantagonist: naar internist-nefroloog.
- Bij therapieresistente hypertensie: overweeg verwijzing naar internist of cardioloog.
- Bij patiënten met hart- en vaatziekten die moeite hebben om te gaan met hun ziekte of die weerstand ervaren om hun leefstijl te veranderen: overweeg verwijzing naar POH-GGZ of psycholoog.
Aanvullende informatie over het beleid dat deze richtlijn voorstaat is te vinden in de Praktische handleiding bij deze standaard.
Belangrijkste wijzigingen
Naar Samenvatting ›- Er is een nieuwe SCORE-tabel, SCORE2, die tienjaarsrisico’s geeft op cardiovasculaire mortaliteit en morbiditeit. De risicotabel is ook te gebruiken voor mensen die al behandeld worden en bij wie de bloeddruk en het cholesterol al enkele jaren stabiel zijn.
- Het risico op HVZ in SCORE2 wordt niet langer geschat op basis van de totaalcholesterol/HDL-cholesterol ratio, maar op basis van het non-HDL-cholesterol. Non-HDL-cholesterol betreft het totaal cholesterol minus het HDL-cholesterol.
- Bij het kleuren van de vakjes in de tabel en de bijbehorende behandeladviezen is ervoor gekozen om te werken met leeftijdsafhankelijke risicodrempels die lager zijn voor jongeren en hoger bij ouderen.
- Over het geheel genomen vallen de risico’s in de nieuwe SCORE-tabel lager uit dan in de oude, hetgeen tot gevolg heeft dat de tabel geen zeer hoog risicogroepen (rood) meer kent. Mensen bekend met hartvaatziekten, diabetes mellitus met ernstige eindorgaanschade en ernstige chronische nierschade hebben overigens nog wel een zeer hoog risico.
- Er is meer ruimte gecreëerd voor het behandelen van een bloeddruk hoger dan 160 mmHg, ondanks een (nog) laag SCORE-risico.
Inleiding
Naar Samenvatting ›Deze NHG-Standaard geeft aanbevelingen voor cardiovasculair risicomanagement (CVRM). De inhoud van deze standaard is identiek aan die van de richtlijn Cardiovasculair risicomanagement en is opgesteld in samenspraak met medisch specialisten en patiëntvertegenwoordigers. Daarmee wordt geprobeerd te bevorderen dat alle bij cardiovasculair risicomanagement betrokken hulpverleners eenzelfde beleid voeren. De multidisciplinaire ontstaansgeschiedenis van deze standaard is tevens verantwoordelijk voor het afwijkende format. In deze NHG-Standaard zijn de aanbevelingen voor CVRM weergegeven. De wetenschappelijke onderbouwing en andere aanvullende informatie is te vinden in de bijbehorende details en het document Totstandkoming NHG-Standaard CVRM. Tevens is een praktische handleiding toegevoegd, waarin in meer detail wordt ingegaan op geneesmiddelkeus, doseringen, laboratoriumcontroles van nierfunctie en elektrolyten en het beleid als de waarden hiervan afwijkingen vertonen.
Richtlijnen diagnostiek
Naar Samenvatting ›1.1 Bij wie wordt het risico op hart- en vaatziekten geschat?
Naar Samenvatting ›De meeste richtlijnen kiezen voor een combinatie van opportunistische screening (bijvoorbeeld bij personen die de huisarts consulteren) en systematische screening (bijvoorbeeld het oproepen van mannen of vrouwen van een bepaalde leeftijd). Deze richtlijn houdt dit ook aan. Het precies schatten van het risico op hart- en vaatziekten bij personen met een laag risico op hart- en vaatziekten is niet nuttig. In Nederland hebben huisartsen een belangrijke rol bij het opsporen van personen met een verhoogd risico op hart- en vaatziekten, en bij het bepalen of deze in aanmerking komen voor interventies. Het schatten van het risico op hart- en vaatziekten is geen eenmalige gebeurtenis; het moet worden herhaald, bijvoorbeeld elke vijf jaar.
Aanbevelingen
Naar Samenvatting ›- Schat het risico op hart- en vaatziekten bij personen met vermoedelijk een verhoogd risico, bijvoorbeeld bij:
- een belaste familieanamnese voor premature hart- en vaatziekten, vermoeden van erfelijke dyslipidemie;
- de aanwezigheid van risicofactoren, zoals roken, obesitas, verhoogde bloeddruk of cholesterol;
- risicoverhogende comorbiditeit.
- Herhaal de schatting van het risico op hart- en vaatziekten, bijvoorbeeld elke vijf jaar of vaker indien het geschatte risico dicht bij een behandelgrens ligt.
- Een schatting van het risico op hart- en vaatziekten kan overwogen worden bij mannen ≥ 40 jaar en postmenopauzale vrouwen of vrouwen ≥ 50 jaar.
- Zie af van systematische schatting van het risico op hart- en vaatziekten bij mannen < 40 jaar en vrouwen < 50 jaar zonder bekende risicofactoren.
Uitgangsvraag
Bij wie dient het risico op hart- en vaatziekten te worden geschat?
Inleiding
Screenen behelst het identificeren van een niet herkende ziekte of, in dit geval, van een onbekend verhoogd risico op hart- en vaatziekten bij personen zonder symptomen. De risicobeoordeling of screening op hart- en vaatziekten kan opportunistisch of systematisch worden uitgevoerd. Opportunistisch screenen wil zeggen ‘zonder vooraf gedefinieerde strategie’, als de gelegenheid zich voordoet (bijvoorbeeld wanneer de persoon de huisarts om een andere reden bezoekt). Systematisch screenen kan worden gedaan onder de algemene bevolking als onderdeel van een screeningsprogramma of in specifieke subpopulaties, zoals personen vanaf een bepaalde leeftijd.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is gebruikgemaakt van de Europese richtlijn Cardiovascular disease prevention in clinical practice uit 2016.
Overwegingen
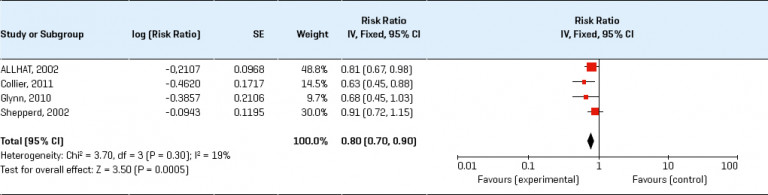
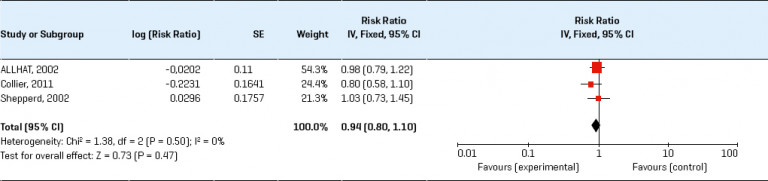
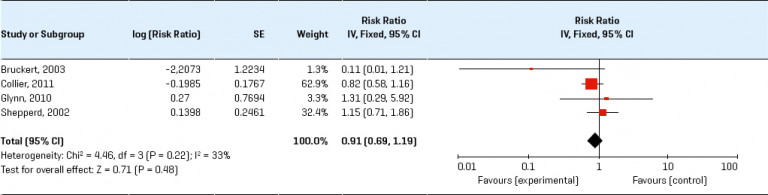
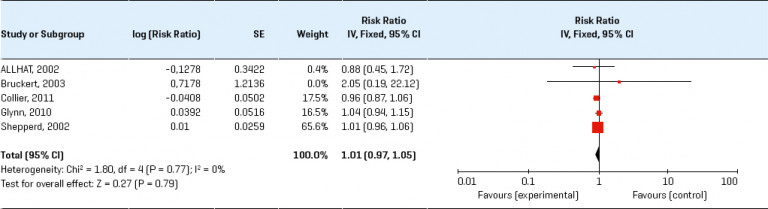
In een meta-analyse bleken gezondheidscontroles door de huisarts naar cholesterol, bloeddruk, body mass index (BMI) en roken effectief bij het verbeteren van risicofactoren, vooral bij patiënten met een verhoogd risico. In een groot onderzoek naar risicobeoordeling op hart- en vaatziekten onder de algemene bevolking bleek dat, hoewel er sprake was van algemene verbetering van de risicofactoren, dit geen invloed had op het optreden van hart- en vaatziekten op populatieniveau. Een Cochrane-review van RCT’s, waarbij gebruik werd gemaakt van begeleiding of voorlichting om risicofactoren voor hart- en vaatziekten onder volwassenen in de algemene bevolking, beroepsgroepen of groepen met specifieke risicofactoren (bijvoorbeeld diabetes mellitus, hypertensie) te verminderen, concludeerde dat de verbeteringen van risicofactoren bescheiden waren en de totale morbiditeit of mortaliteit als gevolg van hart- en vaatziekten in de algemene bevolking niet deden afnemen, behoudens verminderde mortaliteit bij populaties met een verhoogd risico door hypertensie en diabetes mellitus. Hoewel de voordelen van het behandelen van asymptomatische aandoeningen, zoals hypertensie en dyslipidemie, voor morbiditeit en mortaliteit vaststaan, bleek uit een Cochrane-review dat algemene gezondheidscontroles (waaronder het screenen op deze aandoeningen) niet leidden tot een vermindering van totale mortaliteit, noch van mortaliteit of morbiditeit als gevolg van hart- en vaatziekten. De meeste onderzoeken zijn echter dertig tot veertig jaar geleden uitgevoerd en de risicofactorinterventies zijn dus niet actueel. Mogelijk zouden de huidige beschikbare medische behandelingen, naast de veranderingen in leefstijlinterventies die de kern vormden van de meeste onderzoeken, tot een hogere effectiviteit van screening leiden.
De meeste richtlijnen bevelen een combinatie aan van opportunistische en systematische screening. Het screenen van personen met een relatief laag risico op hart- en vaatziekten is niet effectief bij het verlagen van het risico op hart- en vaatziekten. De kosten van een dergelijke screening zijn bovendien hoog. In Nederland hebben huisartsen een unieke rol bij het herkennen van personen met een verhoogd risico op hart- en vaatziekten en bij het beoordelen of zij in aanmerking komen voor interventies. Een modeleringsonderzoek gebaseerd op de cohortgegevens van de European Prospective Investigation of Cancer-Norfolk (EPIC-Norfolk) vergeleek de nationale strategie van de National Health Service (NHS) om alle volwassenen tussen de veertig en 74 jaar te screenen op hun risico op hart- en vaatziekten met de strategie om de 60% van de populatie met het hoogste risico uit te nodigen. De hoogrisicostrategie bleek even effectief en mogelijk kosteneffectiever bij de preventie van nieuwe gevallen van hart- en vaatziekten.
Een van de problemen van screenen, dus ook van risicobeoordeling op hart- en vaatziekten, is dat het ook schadelijke effecten kan hebben. Valspositieve resultaten kunnen tot onnodige bezorgdheid en medische ingrepen leiden. Valsnegatieve resultaten kunnen daarentegen leiden tot onterechte geruststelling en het minder nastreven van gunstige veranderingen in leefstijl. Recente gegevens lijken erop te wijzen dat deelname aan screening op hart- en vaatziekten niet leidt tot bezorgdheid bij degenen die worden gescreend. Er is echter meer onderzoek nodig naar de vraag hoe bepaalde subgroepen, zoals ouderen, sociaal achtergestelde groepen en etnische minderheden, op screening reageren.
Ondanks beperkte beschikbaarheid van ondersteunend bewijs doet deze richtlijn toch een aanbeveling voor systematische aanpak van de risicobeoordeling op hart- en vaatziekten, gericht op populaties met een hoger risico op hart- en vaatziekten, zoals personen met een familiaire voorgeschiedenis van vroegtijdige hart- en vaatziekten. Een systematische risicobeoordeling voor hart- en vaatziekten onder volwassenen < 40 jaar zonder bekende risicofactoren voor hart- en vaatziekten wordt niet aangeraden vanwege de lage kosteneffectiviteit. Systematische screening op hart- en vaatziekten kan worden overwogen voor mannen > 40 jaar en voor vrouwen > 50 jaar of postmenopauzaal zonder bekende risicofactoren voor hart- en vaatziekten. Risicobeoordeling is niet eenmalig; ze moet regelmatig worden herhaald, bijvoorbeeld elke vijf jaar.
Aanbevelingen
- Schat het risico op hart- en vaatziekten bij personen met een verdenking op een verhoogd risico, bijvoorbeeld bij:
- een belaste familieanamnese voor premature hart- en vaatziekten, obesitas, verdenking op erfelijke dyslipidemie;
- bekend aanwezige risicofactoren voor hart- en vaatziekten, zoals roken, verhoogde bloeddruk of verhoogde cholesterol;
- bekend aanwezige risicoverhogende comorbiditeit.
- Herhaal de schatting van het risico op hart- en vaatziekten, bijvoorbeeld elke vijf jaar of vaker, indien het geschatte risico dicht bij een behandelgrens ligt.
- Een schatting van het risico op hart- en vaatziekten kan overwogen worden bij mannen > 40 jaar en postmenopauzale vrouwen of vrouwen > 50 jaar.
- Zie af van systematische schatting van het risico op hart- en vaatziekten bij mannen < 40 jaar en vrouwen < 50 jaar zonder bekende risicofactoren.
1.2 Hoe wordt het cardiovasculair risico geschat en wat zijn de behandelimplicaties?
Naar Samenvatting ›Het risico op hart- en vaatziekten wordt geschat door het meten van een combinatie van de belangrijkste risicofactoren voor atherosclerose (het onderliggende lijden bij hart- en vaatziekten). Het hele concept van interventies ter preventie van hart- en vaatziekten is gebaseerd op het uitgangspunt dat zij zorgen voor een absolute afname van het risico op hart- en vaatziekten ten opzichte van een bepaald uitgangsrisico. In het algemeen geldt: hoe hoger het uitgangsrisico, hoe groter het effect van interventies.
Opstellen van een cardiovasculair risicoprofiel
Naar Samenvatting ›Het cardiovasculair risicoprofiel is een overzicht van de volgende factoren, die worden vastgesteld door middel van anamnese, lichamelijk onderzoek en laboratoriumonderzoek:
- anamnese:
- leeftijd
- geslacht
- roken (in pakjaren)
- voeding
- psychosociale risicofactoren
- alcoholgebruik (in eenheden per dag)
- lichamelijke activiteit
- lichamelijk onderzoek:
- systolische bloeddruk
- body mass index (BMI) (aangevuld met middelomtrek)
- laboratoriumonderzoek:
- lipidenspectrum: totaal cholesterol (TC); HDL-cholesterol; LDL-cholesterol; triglyceriden, non-HDL-cholesterol
- glucose (bij voorkeur nuchter)
- serumcreatinine met (via de CKD-EPI-formule) geschatte glomerulaire filtratiesnelheid (eGFR) en albumine-creatinineratio in urine.
De familieanamnese is geen onafhankelijke risicofactor voor hart- en vaatziekte. Een positieve familieanamnese voor hart- en vaatziekten gaat vaak gepaard met andere risicofactoren, bijvoorbeeld hoog cholesterol. De familieanamnese kan wel aanleiding zijn om laagdrempelig een risicoprofiel op te stellen.
Zeer hoge plasmaconcentraties LDL-cholesterol (> 95e percentiel voor geslacht en leeftijd) in combinatie met een familiaire voorgeschiedenis van vroegtijdige hart- en vaatziekten en/of verhoogd cholesterol, en/of klinische kenmerken (peesxanthomen of arcus lipoides bij een leeftijd < 40 jaar) kunnen verder genetisch onderzoek naar familiaire hypercholesterolemie rechtvaardigen (zie richtlijn Erfelijke dyslipidemie in de 2e en 3e lijn, module Diagnostiek van dyslipidemieën).
Risicocategorieën
Naar Samenvatting ›Voor veel patiënten is een risicocategorie aan te wijzen zonder dat hun risico kwantitatief geschat hoeft te worden met een risicoscore. Dit betreft patiënten met reeds bestaande hart- en vaatziekten, diabetes mellitus, chronische nierschade, sterk verhoogde bloeddruk of bekende familiaire hypercholesterolemie (zie tabel 1).
| Patiëntengroep | Subgroepen | Risicocategorie |
|---|---|---|
| Patiënten met vastgestelde hart- en vaatziekte | ||
Gedocumenteerde atherosclerotische HVZ, klinisch of ondubbelzinnig met beeldvormend onderzoek aangetoond.
| n.v.t. | Zeer hoog risico |
| Patiënten met diabetes mellitus type 2 | ||
| N.B. Patiënten met type 1 DM ouder dan 40 jaar kunnen ook geclassificeerd worden volgens deze categorieën. |
| Matig verhoogd risico |
| Hoog risico | |
| Zeer hoog risico | |
| Patiënten met chronische nierschade | ||
| CNS zonder diabetes of atherosclerotische HVZ |
| Hoog risico |
| Zeer hoog risico | |
| Personen met een sterk verhoogde bloeddruk | ||
| Bloeddruk ≥ 180 mmHg* | n.v.t. | Hoog risico |
| Familiaire hypercholesterolemie | ||
| Personen met aangetoonde familiaire hypercholesterolemie | n.v.t. | Hoog risico |
ACR = albumine-creatinineratio; ACS = acuut coronair syndroom; AMI = acuut myocardinfarct; CTA = computertomografie-angiografie; CNS = chronische nierschade; DM = diabetes mellitus; eGFR = geschatte glomerulaire filtratiesnelheid; HVZ = hart- en vaatziekten; n.v.t. = niet van toepassing; PAV = perifeer arterieel vaatlijden; TIA = transiënte ischemische aanval. * Voor personen met een bloeddruk van 160-180 mmHg, zie ook 2.3 Bloeddruk. ^DM1 en DM2 zijn totaal verschillende aandoeningen, zeker ook betreft debuutleeftijd. Beide aandoeningen gaan gepaard met een verhoogd cardiovasculair risico. Er zijn betrekkelijk weinig goede actuele gegevens over het cardiovasculair risico bij DM1. De werkgroep vond het niet onredelijk om DM1 patiënten vanaf de leeftijd van 40 jaar gelijk te trekken met DM2 patiënten die uiteraard over het algemeen ouder zijn maar vaak korter met diabetes bekend zijn. | ||
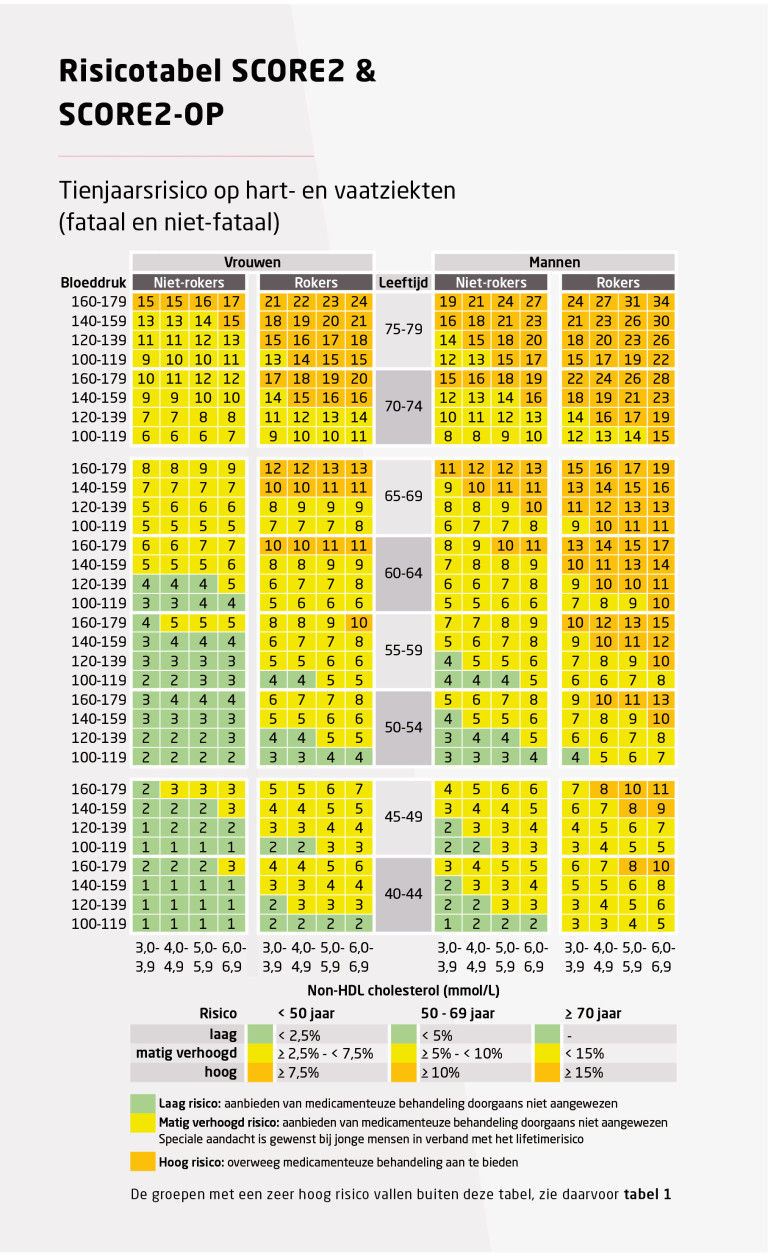
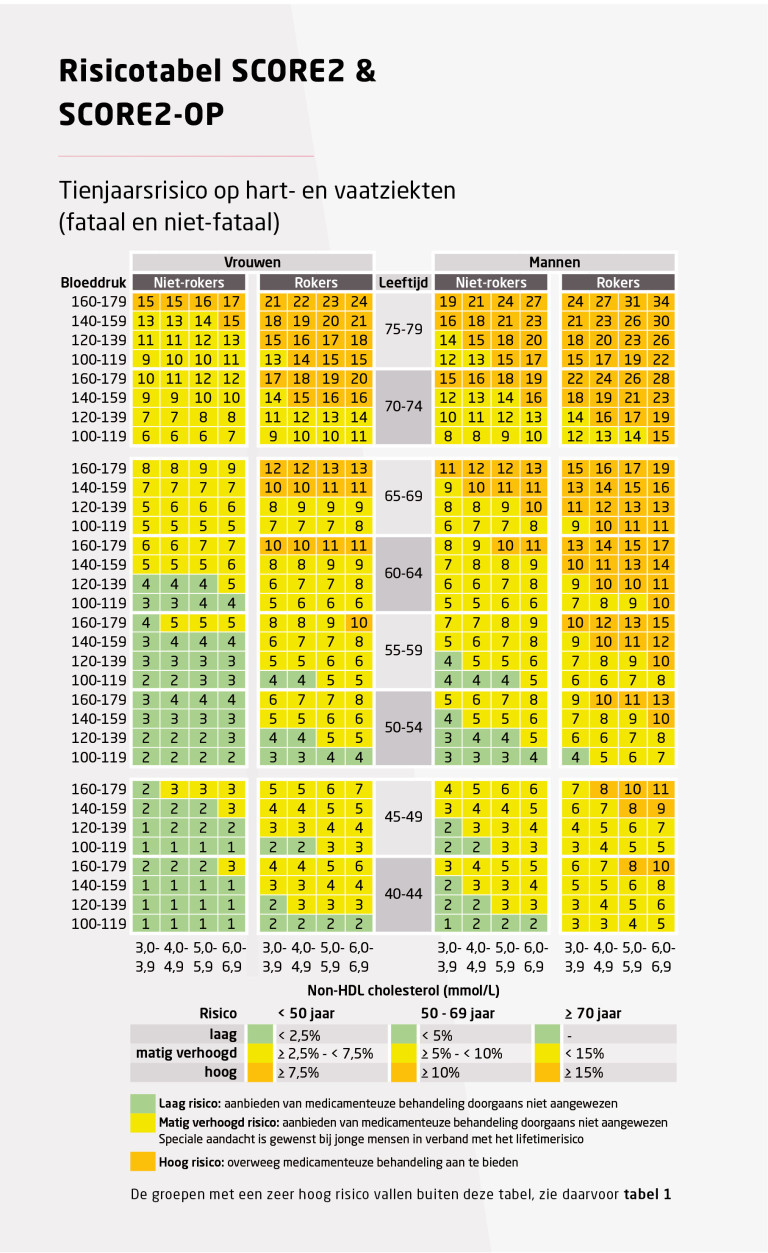
Gebruik van de SCORE2(-OP)-tabel
Naar Samenvatting ›Raadpleeg eerst tabel 1 om tot een classificatie van het risico op een hart- en vaatziekte te komen. Voldoet de patiënt aan geen van de daar genoemde criteria, gebruik dan de SCORE2(-OP)-tabel (zie tabel 2) om het risico te schatten.
- Gebruik SCORE2 om het tienjaarsrisico op hart- en vaatziekten te schatten bij personen van 40-70 jaar zonder hart- en vaatziekte bij wie nog geen behandeling is gestart of bij wie de risicofactoren gedurende meerdere jaren stabiel zijn (zie tabel 2).
- Gebruik SCORE2-OP (Oudere Personen) om het tienjaarsrisico op hart- en vaatziekten te schatten bij personen van 70-90 jaar. In tabel 2 zijn alleen ouderen < 80 jaar opgenomen omdat alle ouderen ≥ 80 jaar een hoog risico hebben.
- De risicotabel is alleen geschikt voor personen die niet in een specifieke risicocategorie vallen volgens tabel 1 (op basis van comorbiditeit of extreme risicofactoren). In de derivatie- en validatiecohorten van SCORE2(-OP) zaten deelnemers met en zonder bloeddruk- en cholesterolverlagende behandeling. De risicoschattingen zijn daarom naar verwachting betrouwbaar wanneer de waarden van bloeddruk of lipidenprofiel over langere tijd (enkele jaren) stabiel zijn. Mensen die recent gestopt zijn met roken hebben niet direct het risico van niet-rokers, maar zullen wel naar die risico’s toe migreren afhankelijk van het aantal jaren roken en de leeftijd waarop zij gestopt zijn met roken.
- Zoek in tabel 2 naar geslacht, rookstatus, leeftijd, systolische bloeddruk en non-HDL-cholesterol voor een schatting van het gecombineerde tienjaarsrisico op een al dan niet fatale hart- en vaatziekte.
- Met behulp van tabel 2 kan alleen voor personen van 40-80 jaar het gecombineerde absolute tienjaarsrisico op een niet-fatale en fatale hart- en vaatziekte worden berekend.
- Gebruik bij personen die recent in Nederland zijn komen wonen de SCORE2-tabellen die gelden voor de herkomstregio. Deze tabellen zijn onder andere te vinden in de app en website U-Prevent.com. Nederland behoort tot de Europese regio’s met een laag risico op hart- en vaatziekten. De risico’s in andere Europese regio’s zijn hoger.
De tabel geeft een schatting van het tienjaarsrisico op hart- en vaatziekten. Deze schatting moet leiden tot een gesprek tussen patiënt en zorgverlener waarin wordt besproken wat het gewenste beleid is. Er geldt geen absolute grens voor het risico op hart- en vaatziekten waarboven intensieve leefstijladviezen en medicamenteuze behandeling van risicofactoren sowieso moeten plaatsvinden. Evenmin zijn er risicodrempels waaronder adviezen of behandelingen zonder meer niet aangewezen zijn.
De SCORE2- en de SCORE2-OP-tabel zijn onder andere te vinden in de app en website U-Prevent.com . De risicoschatting in deze tabel geldt voor Europese landen met een laag risico op hart- en vaatziekten. Voor mensen die afkomstig zijn uit Europese regio’s met een ander risico, zie U-Prevent.com.
De risicomodellen SCORE2 en SCORE2-OP houden rekening met concurrerende risico’s op niet-cardiovasculaire sterfte. Hierdoor wordt voorkomen dat het risico bij met name oudere mensen wordt overschat. Deze modellen gebruiken niet langer de verhouding tussen totaal cholesterol en HDL-cholesterol (TC/HDL-C), maar het non-HDL-cholesterol (TC – HDL-C), omdat hiermee het cholesterol in alle apoB-bevattende, ‘slechte’ lipoproteïnen wordt meegenomen. Non-HDL-cholesterol kan bovendien ook niet-nuchter worden bepaald.
Het voordeel van SCORE2(-OP) ten opzichte van de voorgaande SCORE-tabel is dat zij een schatting geven van het tienjaarsrisico op fatale én niet-fatale (hartinfarct, beroerte) hart- en vaatziekten, in plaats van alleen het risico op sterfte door hart- en vaatziekten. Niet-fatale hart- en vaatziekten komen veel voor, hebben grote impact op het leven van patiënten, zorgen voor ziekenhuisopnames en kosten, en vormen een expliciet preventiedoel in deze CVRM-richtlijn.
De precisie van de schattingen met SCORE2(-OP) is beter en de geschatte uitkomsten relevanter. Daarnaast kunnen de geschatte risico’s met SCORE2(-OP) daadwerkelijk worden uitgelegd als: ‘Dit is uw risico op een (fatale of niet-fatale) hart- en vaatziekte in de komende 10 jaar.’ In het voorgaande SCORE-model was de formele uitleg: ‘Dit is uw tienjaarsrisico om te overlijden aan hart- en vaatziekten als u in die 10 jaar niet aan iets anders bent overleden.’
Het advies is daarom om SCORE2(-OP) te gebruiken voor het schatten en communiceren van het tienjaarsrisico op fatale en niet-fatale hart- en vaatziekten.
Van risico naar behandeladviezen
Zowel voor de risicocategorieën in tabel 1 als voor gezonde personen bij wie het tienjaarsrisico met behulp van tabel 2 wordt geschat, geldt dat er geen absolute grens van het risico op hart- en vaatziekten bestaat waarboven intensieve leefstijladviezen en medicamenteuze behandeling van risicofactoren sowieso moeten plaatsvinden. Evenmin zijn er risicodrempels waaronder adviezen of behandelingen zonder meer niet aangewezen zijn.
Met betrekking tot het berekende risico is gekozen voor indicatieve, leeftijdsspecifieke risicodrempels (zie tabel 3). De achterliggende reden is dat relatief jonge personen weliswaar zelfs bij meerdere (zelfs sterk verhoogde) risicofactoren een laag tienjaarsrisico hebben, maar een heel hoog lifetimerisico. Zou men bij hen dezelfde risicodrempels hanteren als bij mensen van middelbare en hogere leeftijd, dan zou dit hoge lifetimerisico niet herkend worden. Dit zou kunnen leiden tot onderbehandeling van jongere personen die toch een groot risico lopen om tijdens hun leven een hart- en vaatziekte te ontwikkelen. Er bestaat echter geen onomstotelijk bewijs voor het uiteindelijke effect van en de therapietrouw bij het voorschrijven van medicatie gedurende vele decennia bij deze relatief jonge personen.
| < 50 jaar* | 50-69 jaar* | ≥ 70 jaar | |
| Laag risico | < 2,5% | < 5% | n.v.t. |
| Matig verhoogd risico | 2,5-7,5% | 5-10% | < 15% |
| Hoog risico | ≥ 7,5% | ≥ 10% | ≥ 15% |
| Zeer hoog risico | Zie tabel 1 voor de groepen met een zeer hoog risico | ||
| * Tienjaarsrisico op fatale en niet-fatale hart- en vaatziekten volgens de SCORE2-risicotabel. | |||
Het ligt niet voor de hand een risicodrempel te hanteren voor adviezen omtrent een gezonde leefstijl. Risicodrempels voor intensieve leefstijlbegeleidingsprogramma’s kunnen wel opportuun zijn, mede afhankelijk van de kosten van deze programma’s en de moeite die het kost om ze vol te houden. Ga uit van de volgende vertaling van de in tabel 1 en tabel 3 genoemde risico’s naar aanbevelingen voor de medicamenteuze behandeling van bloeddruk en LDL-cholesterol:
- Laag risico (zie tabel 2 en tabel 3): aanbieden van medicamenteuze behandeling is doorgaans niet aangewezen.
- Matig verhoogd risico (zie tabel 1, tabel 2 en tabel 3): aanbieden van medicamenteuze behandeling is doorgaans niet aangewezen. Bij jonge mensen is speciale aandacht gewenst in verband met het lifetimerisico (zie Bijlage Lifetimerisico).
- Hoog risico (zie tabel 1, tabel 2 en tabel 3): overweeg medicamenteuze behandeling aan te bieden.
- Zeer hoog risico (zie tabel 1): aanbieden van medicamenteuze behandeling wordt aanbevolen.
Een bloeddruk van 160-180 mmHg kan worden meegewogen bij het opstellen van een behandelplan (zie ook paragraaf 2.3 Bloeddruk).
Naast de aandoeningen in tabel 1 en de risicofactoren in tabel 2 kan aanvullende informatie relevant zijn voor het risico op hart- en vaatziekten. De werkgroep adviseert aanvullende risicofactoren alleen te overwegen als deze risicofactor de risicoclassificatie aantoonbaar verbetert en als gebruik ervan in de dagelijkse praktijk haalbaar is.
Informatie over psychosociale factoren (vooral mentale gezondheid en socio-economische positie) en over coronaire kalkscore kunnen risicoclassificatie verbeteren en dus bij twijfel helpen een besluit te nemen.
Verder zijn er aandoeningen waarbij het risico verhoogd kan zijn, zoals reumatische ziekten, chronische ontstekingsziekten, respiratoire aandoeningen (COPD, OSAS) en HIV-infectie.
Jongere personen: cardiovasculair risico en behandelimplicaties
Naar Samenvatting ›Het absolute tienjaarsrisico bij relatief jongere personen is doorgaans laag, zelfs in de aanwezigheid van meerdere risicofactoren. Dit zou tot de onjuiste conclusie kunnen leiden dat deze personen een laag lifetimerisico hebben of dat zij vergeleken met mensen van dezelfde leeftijd en geslacht toch ‘gezond’ zijn. Alternatieve manieren van risicoberekening en communicatie kunnen worden overwogen, zoals de cardiovasculaire risicoleeftijd (‘hartleeftijd’) of het lifetimerisico.
Cardiovasculaire risicoleeftijd
De cardiovasculaire risicoleeftijd van iemand met meerdere risicofactoren voor hart- en vaatziekten is de leeftijd die iemand zou hebben van hetzelfde geslacht met hetzelfde risico, maar met optimale waarden van de risicofactoren. Iemand van 40 met ongunstige risicofactoren kan de risicoleeftijd hebben van een 60-jarige met normale risicofactoren (bijvoorbeeld niet-roker, totaal cholesterol 4 mmol/l en systolische bloeddruk 120 mmHg), omdat het tienjaarsrisico gelijk is.
Voor het bepalen van de risicoleeftijd kan dus de standaardrisicotabel gebruikt worden. Risicoleeftijd is een intuïtieve en makkelijk te begrijpen manier om het verhoogde risico op een hart- en vaatziekte van een jong persoon met een laag absoluut maar hoog relatief risico op hart- en vaatziekten uit te leggen. Van de risicoleeftijd is aangetoond dat deze onafhankelijk is van het gebruikte eindpunt (fatale of niet-fatale hart- en vaatziekte). Risicoleeftijd kan worden gebruikt in elke populatie.
Lifetimerisico
Het lifetimerisico is het risico op hart- en vaatziekte gedurende de verwachte levensduur van de persoon, rekening houdend met risico’s op niet-cardiovasculaire (concurrerende) sterfte. Lifetimerisicoscores zijn beschikbaar voor ogenschijnlijk gezonde mensen, mensen met diabetes en patiënten met hart- en vaatziekten. Zie ook de Bijlage Lifetimerisico en U-Prevent.com.
Aan de risicoleeftijd of het lifetimerisico is geen beslisdrempel verbonden. Beide zijn bedoeld om de patiënt meer inzicht te geven in het risico en zo behulpzaam te zijn bij gezamenlijke besluitvorming.
Vooral op relatief jonge leeftijd moet een afweging worden gemaakt tussen enerzijds een reductie van deze risico’s door medicamenteuze behandeling en anderzijds het zeer langdurig gebruik van preventieve medicatie.
Ouderen: cardiovasculair risico en behandelimplicaties
Naar Samenvatting ›Een van de meest controversiële onderdelen van cardiovasculaire preventie is de vraag of ouderen zonder manifeste hart- en vaatziekte die vooral vanwege hun leeftijd – en bijna ongeacht hun overige risicoprofiel – een hoog risico op hart- en vaatziekten hebben, in aanmerking komen voor medicamenteuze preventie. Het stimuleren van een gezonde leefstijl, zoals voldoende lichaamsbeweging en goede voeding, geldt onverkort voor ouderen. Of medicamenteuze behandeling van risicofactoren bij ouderen nuttig en wenselijk is, hangt af van vitaliteit, levensverwachting, comorbiditeit, polyfarmacie, wensen van de patiënt en diens geschat tienjaarsrisico op hart- en vaatziekte volgens SCORE2-OP. Deze factoren samen vormen de ingrediënten voor een proces van gezamenlijke besluitvorming. Dit maakt het onwenselijk een behandeladvies te koppelen aan een specifieke risicodrempel. De richtlijn geeft daarom geen specifieke drempel aan voor het tienjaarsrisico waarboven medicamenteuze behandeling van risicofactoren moet worden overwogen.
Bij personen zonder bekende hart- of vaatziekten wordt het bewijs dat medicamenteuze preventie effectief is steeds minder overtuigend naarmate hun leeftijd stijgt. Vooral bij kwetsbare ouderen is er weinig bewijs. Dit geldt met name voor statines, waarvan het gunstige effect op mortaliteit en morbiditeit door hart- en vaatziekten bij ouderen zonder hart- en vaatziekte als onzeker moet worden beschouwd. Voor antihypertensiva is het bewijs sterker dan voor statines, maar ook hier geldt dat ouderen grotendeels ontbraken in de grote klinische trials, zodat terughoudendheid is aangewezen.
Indien medicamenteus behandelde patiënten met het voortschrijden van hun leeftijd en/of kwetsbaarheid op een zeker moment agressiever worden behandeld dan wat deze richtlijn voor ouderen adviseert, dient te worden overwogen de streefwaarden van behandeling minder stringent te maken. Stoppen met preventieve medicatie is aangewezen bij bijwerkingen die als ernstig ervaren worden. In de overige gevallen moet per patiënt een afweging worden gemaakt, waarin het vermijden van polyfarmacie en de wens van de patiënt belangrijke componenten zijn.
Uitgangsvraag
Hoe kan het risico op hart- en vaatziekten het beste worden geschat?
Deze uitgangsvraag bevat de volgende deelvragen:
- Bij welke personen is kwantitatieve risicoschatting niet noodzakelijk?
- Hoe dient een cardiovasculair risicoprofiel te worden opgesteld?
- Welke methoden zijn er om het risico op hart- en vaatziekten kwantitatief te schatten?
Inleiding
Alle huidige richtlijnen voor de preventie van hart- en vaatziekten bevelen beoordeling van het totale risico op hart- en vaatziekten (HVZ) aan. Preventie van hart- en vaatziekten is gericht op identificeren van personen met een hoog 10-jaars- en/of lifetime-risico: hoe hoger het risico, hoe meer reden intensiever in te grijpen.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is gebruik gemaakt van de Europese richtlijn Cardiovascular Disease Prevention in Clinical Practice uit 2021.
Overwegingen
Update 2023
Belangrijkste veranderingen t.o.v. de vorige versie:
- SCORE is aangepast naar SCORE2. Met deze wijzigingen wordt een schatting gemaakt op basis van fatale en niet-fatale hart- en vaatziekten. Ook is de schatting verbeterd ten opzichte van de vorige tool.
- De indeling in een bepaalde risicoklasse is leeftijdsafhankelijk opgesteld.
- Het gebruik van de kleuren is aangepast in de tabel met risicocategorieën en de SCORE2-tabel.
De richtlijnwerkgroep heeft besloten om ook in Nederland de SCORE2 risicotabel te gebruiken. Deze tabel is deels gebaseerd op Nederlandse data en ligt daarmee dicht bij de Nederlandse situatie. Ook is dit de enige risicotabel die gevalideerd is in Nederland.
Opstellen van een cardiovasculair risicoprofiel
Het cardiovasculair risicoprofiel is een overzicht van de volgende factoren die worden vastgesteld door middel van anamnese, lichamelijk onderzoek en laboratoriumonderzoek:
- Anamnese:
- Leeftijd;
- Geslacht;
- Roken (bij voormalig rokers navragen hoe lang geleden men gestopt is en hoeveel is gerookt: pakjaren);
- Voeding (zie detail Voeding);
- Psycho-sociale risicofactoren (zie detail Psychosociale factoren);
- Alcoholgebruik (in eenheden/dag);
- Lichamelijke activiteit (zie detail Sedentaire leefstijl en lichamelijke activiteit).
- Lichamelijk onderzoek:
- Systolische bloeddruk (zie detail Bloeddrukmeting);
- Body mass index (aangevuld met middelomtrek) (zie detail Body mass index).
- Laboratoriumonderzoek:
- lipidenspectrum (TC, HDL-C, LDL-C, triglyceriden, non-HDL-C; zie detail Wat is het advies ten aanzien van het nuchter of niet nuchter bloedprikken in het kader van dyslipidemieën?);
- bij voorkeur nuchter glucosegehalte;
- serumcreatininegehalte met (via de CKD-EPI-formule) geschatte glomerulaire filtratiesnelheid (eGFR) en albumine/creatinine ratio in de urine.
Familieanamnese voor premature hart- en vaatziekten is geen onafhankelijke risicofactor voor hart- en vaatziekten. Vaak gaat het gepaard met andere risicofactoren, zoals hoog cholesterol. Een positieve familieanamnese van hart- en vaatziekten kan echter wel aanleiding zijn om laagdrempelig een risicoprofiel op te stellen.
Risicocategorieën zonder Kwantitatieve Risicoschatting
Voor veel patiënten kan een risicocategorie worden aangewezen zonder dat hun risico kwantitatief geschat hoeft te worden. Dit betreft patiënten met reeds bestaande hart- en vaatziekten, diabetes mellitus, chronische nieraandoeningen, sterk verhoogde bloeddruk of bekende Familiaire Hypercholesterolemie (zie tabel 9).
| Patiëntencategorie | Subgroepen | Risico-categorieën |
| Patiënten met vastgestelde hart- en vaatziekte | ||
Gedocumenteerde atherosclerotische HVZ, klinisch of ondubbelzinnig op beeld aangetoond. Gedocumenteerde klinische atherosclerotische HVZ omvat eerdere AMI, ACS, coronaire revascularisatie en andere arteriële revascularisatie procedures, beroerte en TIA, aorta aneurysma en PAV. Ondubbelzinnig aangetoonde atherosclerotische HVZ op beeldvorming omvat onder andere plaque op coronaire angiografie of echografie van de halsslagader of op CTA. Dit omvat NIET: enige toename van continue beeldvorming parameters zoals intima-media dikte van de halsslagader of coronaire kalk. | n.v.t. | Zeer hoog risico |
| Patiënten met type 2 diabetes mellitus | ||
| Patiënten met type 1 DM ouder dan 40 jaar kunnen ook geclassificeerd worden volgens deze categorieën. ^ | Patiënten met goed gecontroleerde relatief kort bestaande DM (< 10 jaar), geen bewijs van eindorgaanschade en geen extra atherosclerotische HVZ-risicofactoren | Matig verhoogd risico |
| Patiënten met >10 jaar DM of gebrekkige glycemische regulatie, zonder ernstige (zie onder) eindorgaanschade of HVZ | Hoog risico | |
Patiënten met DM met vastgestelde atherosclerotische HVZ en/of ernstige eindorgaanschade:
| Zeer hoog risico | |
| Patiënten met chronische nierschade (CNS) | ||
| CNS zonder diabetes of atherosclerotische HVZ | Matige CNS (eGFR 30−44 mL/min/1,73 m2 en ACR <3 mg/mmol of eGFR 45−59 mL/min/1,73 m2 en ACR 3−30 mg/mmol of eGFR ≥60 mL/min/1,73 m2 en ACR >30 mg/mmol) | Hoog risico |
| Ernstige CNS (eGFR<29 mL/min/1,73 m2 of eGFR 30−44 mL/min/1,73 m2 en ACR 3-30 mg/mmol of eGFR 45-59 mL/min/1,73 m2 en ACR >30 mg/mmol) | Zeer hoog risico | |
| Personen met een sterk verhoogde bloeddruk | ||
| Bloeddruk ≥ 180 mmHg* | n.v.t. | Hoog risico |
| Familiaire Hypercholesterolemie (FH) | ||
| Personen met aangetoonde FH | n.v.t. | Hoog risico |
ACR, albumine-creatinine ratio; ACS, acuut coronair syndroom; AMI, acuut myocardinfarct; CTA, CT-angiografie; CNS, chronische nierschade; DM, diabetes mellitus; GFR, glomerulaire filtratie snelheid; HVZ, hart- en vaatziekten; n.v.t., niet van toepassing; PAV, perifeer arterieel vaatlijden; TIA, transient ischemische aanval.
* Voor personen met een bloeddruk tussen 160 en 180 mmHg, zie ook module Hoogte van de bloeddruk.
^DM1 en DM2 zijn totaal verschillende aandoeningen, zeker ook betreft debuutleeftijd. Beide aandoeningen gaan gepaard met een verhoogd cardiovasculair risico. Er zijn betrekkelijk weinig goede actuele gegevens over het cardiovasculair risico bij DM1. De werkgroep vond het niet onredelijk om DM1 patiënten vanaf de leeftijd van 40 jaar gelijk te trekken met DM2 patiënten die uiteraard over het algemeen ouder zijn maar vaak korter met diabetes bekend zijn.
Om tot een classificatie van het risico op een HVZ te komen wordt eerst tabel 9 geraadpleegd. Wordt aan geen van de daar genoemde criteria voldaan, dan gebruikt men de SCORE2(-OP)-tabel voor het schatten van het risico.
Het kwantificeren van het 10-jaars risico op hart- en vaatziekten bij personen (40-70 jaar) zonder een hart- en vaatziekte en waar nog geen behandeling is gestart of waar de risicofactoren stabiel zijn voor meerdere jaren geschiedt met de SCORE2-tabel (Tabel 10). Bij personen 70 tot 90 jaar kan het 10-jaars hart- en vaatziekte risico worden geschat met SCORE2-OP (Oudere Personen) tabel (in Tabel 10 zijn alleen personen 70 tot 80 jaar opgenomen omdat preventieve behandelbeslissingen in die leeftijdscategorie in de praktijk het meest relevant zijn).
Tabel 10. De tabel geeft een schatting van het 10-jaarsrisico op hart- en vaatziekten. Deze schatting moet leiden tot een gesprek tussen patiënt en zorgverlener waarin wordt besproken wat het gewenste beleid is. Er geldt geen absolute grens van het risico op hart- en vaatziekten waarbóven intensieve leefstijladviezen en medicamenteuze behandeling van risicofactoren sowieso moeten plaatsvinden. Evenmin zijn er risicodrempels waarónder adviezen of behandelingen zonder meer níet aangewezen zijn.
De SCORE2(-OP)-tabel is te vinden in apps en op websites, zoals www.U-Prevent.com.
* Deze tabel geldt voor Europese landen met een laag risico op hart- en vaatziekten. Voor mensen die afkomstig zijn uit andere risicogebieden in Europa, zie de app en website van U-prevent (www.U-Prevent.com).
De risicoschattingstool SCORE uit de vorige CVRM-richtlijn is geüpdatet en opnieuw gevalideerd. Dat was nodig omdat de oude SCORE het risico in Nederland overschatte. Op basis van recente gegevens uit 45 prospectieve cohortstudies uit 13 landen is een model ontwikkeld, welke in 25 prospectieve cohortstudies uit 15 Europese landen is gevalideerd. Het SCORE2-model schat het 10-jaarsrisico op fatale en niet-fatale hart- en vaatziekten voor een individu in de leeftijd van 40 tot 70 jaar bij wie risicofactoren, behandeld of onbehandeld, de afgelopen jaren ongeveer stabiel zijn geweest. Voor personen tussen 70 en 90 jaar is het SCORE2-OP-model ontwikkeld.
De SCORE2- en SCORE2-OP-modellen houden rekening met concurrerende risico’s op niet-cardiovasculaire sterfte. Hierdoor wordt voorkomen dat het risico bij met name oudere mensen wordt overschat. In deze nieuwe modellen wordt non-HDL-C (totaal cholesterol minus HDL-C) gebruikt in plaats van de ratio van totaal cholesterol en HDL-C, omdat hiermee het cholesterol in alle apoB-houdende, ‘slechte’, lipoproteïnen wordt meegenomen. Non-HDL-C kan bovendien niet-nuchter worden bepaald.
Het voordeel van SCORE2(-OP) ten opzichte van de vorige SCORE-tabel is dat het 10-jaars risico op fatale en niet-fatale (hartinfarct en beroerte) hart- en vaatziekten wordt voorspeld in plaats van alleen het sterfterisico door hart- en vaatziekten. Niet-fatale hart- en vaatziekten komen veel voor, hebben grote impact op het leven van patiënten, zorgen voor ziekenhuisopnames en kosten, en vormen een expliciet preventiedoel in de CVRM-richtlijn.
De precisie van de schattingen met SCORE2(-OP) is beter en de geschatte uitkomsten relevanter. Daarnaast kunnen de geschatte risico’s met SCORE2(-OP) werkelijk worden uitgelegd als ‘dit is uw 10-jaars risico op (fatale en niet-fatale) hart- en vaatziekten in de komende 10 jaar’. Met de oude SCORE was de formele uitleg ‘dit is uw 10-jaars risico om te overlijden aan hart- en vaatziekten als u in die 10 jaar niet aan iets anders bent overleden’. Het advies is daarom om SCORE2(-OP) te gebruiken voor het schatten en communiceren van het 10-jaars risico op fatale en niet-fatale hart- en vaatziekten.
De werkgroep heeft veelvuldig gediscussieerd over het kleurgebruik in de SCORE2-tabel en heeft verschillende opties (onder andere grijs- en groentinten) de revue laten passeren. Uiteindelijk is gekozen voor de kleuren groen, geel, oranje. Behandeldrempels zijn niet absoluut noch imperatief, wat door het gebruik van bepaalde kleuren door gebruikers vaak wel zo geïnterpreteerd werd. Verderop wordt de vertaling van risico naar behandeladviezen besproken.
Gebruik van de SCORE2(-OP)-tabel
- De risicotabel is alleen geschikt voor personen die niet volgens tabel 9 (op basis van comorbiditeit of extreme risicofactoren) in een specifieke risicocategorie vallen. In de derivatie- en validatiecohorten van SCORE2(-OP) zaten deelnemers met en zonder bloeddruk- en cholesterolverlagende behandeling. De risicoschattingen kunnen daarom, bij stabiele waarden over langere tijd (enkele jaren) van bloeddruk of lipidenprofiel naar verwachting betrouwbaar worden geschat. Mensen die recent gestopt zijn met roken, hebben niet direct het risico van niet-rokers, maar zullen wel naar die risico’s toe migreren afhankelijk van het aantal jaren roken en de leeftijd waarop met roken is gestopt.
- Zoek voor een schatting van het gecombineerde 10-jaarsrisico op een niet-fatale en fatale hart- en vaatziekte in de tabel geslacht, rookstatus, leeftijd, systolische bloeddruk en non-HDL-cholesterol.
- Met behulp van de tabel kan alleen het gecombineerde 10-jaars absolute risico op niet-fatale en fatale hart- en vaatziekte worden berekend voor personen tussen de 40 en 80 jaar.
- Gebruik SCORE2 uit de regio van het land van herkomst bij personen die (zeer) recent in Nederland zijn komen wonen. De tabellen uit de andere regio’s zijn te vinden in de app en website van U-prevent (www.U-Prevent.com). Nederland behoort tot de Europese regio met een laag risico op hart- en vaatziekten. De risico’s in de andere Europese regio’s zijn hoger. Hoe langer iemand in een nieuwe HVZ risico regio woont hoe meer deze persoon het risico niveau krijgt van de nieuw risico regio.
Van risico naar behandeladviezen
Wanneer is risicoreductie nu voldoende om tot een behandeladvies over te gaan? De klinische relevantie van risicoreductie wordt bepaald door een combinatie van factoren:
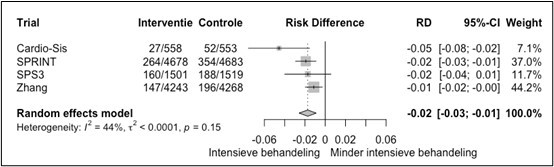
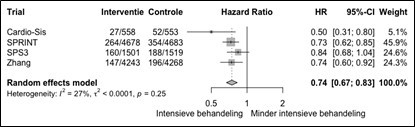
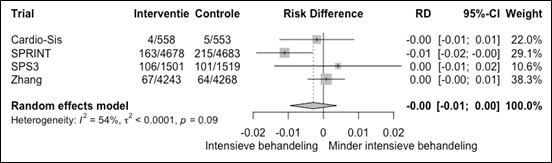
1) Het relatief risico, waarbij een RR < 0.9 bij de totstandkoming van deze richtlijn is beschouwd als mogelijk klinisch relevant.
2) Daarna wordt de relatieve risicoreductie omgezet in een absolute risicoreductie waarbij het basisrisico, zoals die gegeven wordt in de Scoretabellen (en lopend van 10% tot >20% absoluut risico op HVZ in 10 jaar tijd), als leidend beschouwd.
3) Van daaruit kan de NNT over 10 jaar berekend worden (uitgaande van de Scoretabellen gaat het dan om het absolute risico op HVZ over een tijdsperiode van 10 jaar).
Zowel voor de risicocategorieën in tabel 9 als voor gezonde personen bij wie het 10-jaarsrisico met behulp van SCORE2(-OP) wordt geschat, geldt dat er geen absolute grens van het risico op hart- en vaatziekten bestaat waarbóven intensieve leefstijladviezen en medicamenteuze behandeling van risicofactoren sowieso moeten plaatsvinden. Evenmin zijn er risicodrempels waarónder adviezen of behandelingen zonder meer níet aangewezen zijn.
In het algemeen geldt dat de intensiteit van de adviezen toeneemt met toenemend risico. Het effect van interventies neemt toe met toenemend basisrisico; met andere woorden, het aantal personen dat behandeld moet worden om één event/uiting van hart- en vaatziekten te voorkomen (number needed to treat, NNT), neemt af met toenemend basisrisico. Vanzelfsprekend zijn beslissingen over leefstijlveranderingen en het starten van een behandeling mede gebaseerd op de voorkeuren van de patiënten, nadat zij geïnformeerd zijn over het risico op hart- en vaatziekten en het verwachte effect van leefstijlveranderingen en de (medicamenteuze) behandeling van risicofactoren.
Met betrekking tot het berekende risico is gekozen voor leeftijd-specifieke indicatieve risicodrempels (tabel 11). De achterliggende reden is dat relatief jonge personen zelfs bij aanwezigheid van meerdere (zelfs sterk verhoogde) risicofactoren weliswaar een laag 10-jaarsrisico hebben, maar een heel hoog lifetimerisico (zie figuur 9, 10 en 11). Hanteren van dezelfde risicodrempels als op middelbare en hogere leeftijd zou leiden tot het niet herkennen van dit hoge lifetimerisico en dus tot onderbehandeling van jonge personen die toch een groot risico lopen om tijdens hun leven een hart- en vaatziekte te ontwikkelen. Hoewel er geen onomstotelijk bewijs bestaat voor het uiteindelijke effect van medicatie gedurende vele decennia bij deze relatief jonge personen, neemt de werkgroep aan dat het lifetimerisico van jongeren met een vergelijkbaar percentage gereduceerd kan worden.
| < 50 jaar* | 50 - 69 jaar* | ≥ 70 jaar | |
| Laag risico | < 2,5% | < 5% | - |
| Matig verhoogd risico | 2,5 - 7,5% | 5 - 10% | < 15% |
| Hoog risico | ≥ 7,5% | ≥ 10% | ≥ 15% |
| Zeer hoog risico | Zie tabel 9 voor de groepen met een zeer hoog risico | ||
* Risicopercentages zijn 10-jaarsrisico op fatale en niet-fatale hart- en vaatziekten volgens de SCORE-risicotabel.
Bij het vertalen van risicocategorieën naar behandeladviezen is ten slotte rekening gehouden met een vergelijking met de vorige CVRM-richtlijn, zodanig dat er in totaal niet méér personen voor medicamenteuze behandeling in aanmerking komen (SCORE2, 2021) dan in de vorige richtlijn. In vergelijking met de vorige CVRM-richtlijn zal, vanwege meer nadruk op lange-termijnrisico’s, bij jonge personen iets vaker (medicamenteuze) behandeling gestart worden. Daarentegen is het behandeladvies bij mensen ≥70 jaar terughoudender geworden en zal bij hen dientengevolge minder vaak tot (medicamenteuze) behandeling worden overgegaan.
Voor adviezen omtrent een gezonde leefstijl ligt het niet voor de hand een risicodrempel te hanteren. Voor intensieve leefstijlbegeleidingsprogramma’s kunnen risicodrempels wel opportuun zijn, mede afhankelijk van de kosten van deze programma’s en de moeite die het kost om dergelijke intensieve leefstijladviezen vol te houden. Voor medicamenteuze behandeling van bloeddruk en LDL-C om behandeldoelen te bereiken stellen wij de volgende vertaling van de in tabellen 9 en 11 genoemde risico’s naar medicamenteuze behandelaanbevelingen voor:
- Laag risico (zie tabel 9 en tabel 11): aanbieden van medicamenteuze behandeling doorgaans niet aangewezen.
- Matig verhoogd risico (zie tabel 9 en tabel 11): aanbieden van medicamenteuze behandeling doorgaans niet aangewezen. Speciale aandacht is gewenst bij jonge mensen in verband met het lifetimerisico (zie bijlage Tabel Lifetimerisico).
- Hoog risico (zie tabel 9 en 11): overweeg medicamenteuze behandeling aan te bieden.
- Zeer hoog risico (zie tabel 9): aanbieden van medicamenteuze behandeling aanbevolen.
Een bloeddruk tussen de 160 en 180 mmHg kan worden meegewogen bij het opstellen van een behandelplan. Zie ook detail Behandeling bloeddruk bij CVRM.
Drie opmerkingen bij het bovenstaande zijn belangrijk:
- De aanbevelingen betreffen niet het voorschrijven van medicatie, maar het aanbieden van medicatie om bloeddruk- en LDL-C-streefwaarden te bereiken. Dit aanbieden moet gepaard gaan met informatievoorziening en het samen met de patiënt beslissen of medicamenteuze behandeling wordt gestart. Zie voor een toelichting op “Samen beslissen” de teksten verderop in deze module.
- Vooral in de groep met een matig verhoogd risico kan de overweging van de zorgverlener om medicatie wel of niet aan te bieden, alsmede de gezamenlijke besluitvorming over het starten van medicatie, gevoed worden door de af- of aanwezigheid van bepaalde risicomodificatoren (zie volgende paragraaf; met name psychosociale factoren, kalkscore indien beschikbaar, bloeddruk tussen de 160-180 mmHg). Deze risicomodificatoren kunnen het geschatte risico naar boven (bij ongunstig profiel) of naar beneden (bij gunstig profiel) bijstellen en dus ook een rol spelen bij de gezamenlijke beslissing al dan niet medicatie voor te schrijven.
- Bij alle patiënten kunnen andere benaderingen van risico en risicoreductie (bijvoorbeeld lifetime-risico, verwachte winst van medicamenteuze behandeling; in 10-jaarsrisico of verwachtte ziektevrije levensduur; zie figuren A en B) het soms makkelijker maken een beslissing te nemen. Uiteraard spelen ook de wensen van de patiënt en, zeker bij patiënten van 70 jaar of ouder, kwetsbaarheid, polyfarmacie en comorbiditeit een rol bij besluitvorming.
Overige risicofactoren en specifieke risico-verhogende aandoeningen
Tabel 12 vat samen welke aanvullende informatie relevant kan zijn voor risicoschatting. Voor details: zie detail Andere voorspellers van het risico op hart- en vaatziekten.
- Naast de aandoeningen in tabel 9 en de risicofactoren in de SCORE2(-OP) risicoscore kan aanvullende informatie relevant zijn voor het risico op hart- en vaatziekten. De werkgroep adviseert aanvullende risicofactoren alleen te overwegen als deze risicofactor de risicoclassificatie aantoonbaar verbetert en als gebruik ervan in de dagelijkse praktijk haalbaar is. Over het algemeen is aanvullende risico-informatie het nuttigst wanneer het risico van de persoon dicht bij een risicodrempel voor besluitvorming ligt, wat doorgaans het geval zal zijn in de groepen ‘matig verhoogd risico’ of ‘verhoogd risico’. Bij situaties met een zeer hoog of laag risico zal aanvullende risico-informatie meestal niets veranderen aan de aanbevelingen. De aanwezigheid van extra risicofactoren kan het risico voor een persoon verhogen, en afwezigheid van die factoren verlaagt juist het geschatte risico van een persoon. Aanvullende risico-informatie waarvan het best is aangetoond dat deze relevant is, zijn psychosociale factoren en de coronaire kalkscore
:
- Psychosociale factoren: deze risico-informatie omvat componenten van mentale gezondheid (stress, somberheid, eenzaamheid) en socio-economische positie. De exacte operationalisatie is moeilijk, maar in evidente uitersten van dit spectrum zal het met SCORE2 geschatte risico aanmerkelijk lager of hoger zijn dan volgens de berekening/risicotabel.
- Coronaire kalkscore: De kalkscore is vooral geschikt voor mensen in de leeftijdscategorie 50-70 jaar en kan in die groep overwogen worden bij twijfel over wel of geen preventieve behandeling te starten. Zie detail Coronaire kalkscore voor toelichting en aanbevelingen.
- Andere factoren die vaak in de literatuur worden besproken maar nog onbewezen reclassificatie-potentie hebben, worden besproken in andere modules. Bekende voorbeelden hiervan zijn familieanamnese en BMI, die de risicoschatting niet beïnvloeden, maar wel aanleiding kunnen zijn laagdrempelig een risicoprofiel op te stellen omdat ze gepaard gaan met een hogere prevalentie van een ongunstig patroon van de bekende traditionele risicofactoren. Eén zeer recent onderzoek suggereert dat SCORE2 het risico onderschat bij Nederlandse mensen van Surinaamse origine, vooral die met een Zuid-Aziatische achtergrond. Mogelijk kan verdiscontering van socio-economische positie als risicomodificator deze onderschatting (tenminste gedeeltelijk) compenseren.
- Tenslotte zijn er specifieke kenmerken/aandoeningen waarbij het risico op hart- en vaatziekte verhoogd kan zijn. Zie tabel 12 en details Andere voorspellers van het risico op hart- en vaatziekten en Etnische achtergrond.
| Psychosociale factoren (m.n. mentale gezondheid en socio-economische positie) |
| Coronaire-kalkscore |
| Etnische achtergrond |
| Socio-economische positie |
| Reumatische en chronisch inflammatoire aandoeningen, zoals reumatoïde artritis, artritis psoriatica en ankyloserende spondylitis |
| Respiratoire aandoeningen, m.n. OSA en COPD |
| Hiv-infectie |
Risicocommunicatie
Bij het communiceren van het risico op hart- en vaatziekten dat iemand heeft, is het essentieel dat de patiënt begrijpt wat het risico betekent, begrijpt waardoor dit risico wordt bepaald, en inziet wat de consequenties zijn van eventuele (niet-)medicamenteuze behandeling. Door het risico op hart- en vaatziekten en de effecten van leefstijlverandering en risicofactorbehandeling te concretiseren en te individualiseren, en door de communicatie hierover aan te laten sluiten op de voorkeuren en begrip van patiënten, wordt het proces van samen beslissen gefaciliteerd. Tabel 13a geeft adviezen voor onderdelen van risicocommunicatie.
| Wat is de aanleiding om uw risico te schatten? |
| Wat is uw 10-jaarsrisico op basis van SCORE2(-OP) of vanwege het behoren tot een risicogroep uit tabel 9? |
| Overweeg, vooral bij relatief jonge personen, aanvullende risico-perspectieven, zoals het lifetime-risico (LIFE-CVD; www.U-Prevent.com) of de hartleeftijd, te geven. |
| Welke risicofactoren spelen bij u een belangrijke rol bij het bepalen van uw risico? |
| Wat is belangrijk voor u; fysiek functioneren, mentale gezondheid, sociaal functioneren? De voorkeur van de één gaat misschien uit naar leefstijlinterventie, voor de ander is medicatie een meer passende oplossing. |
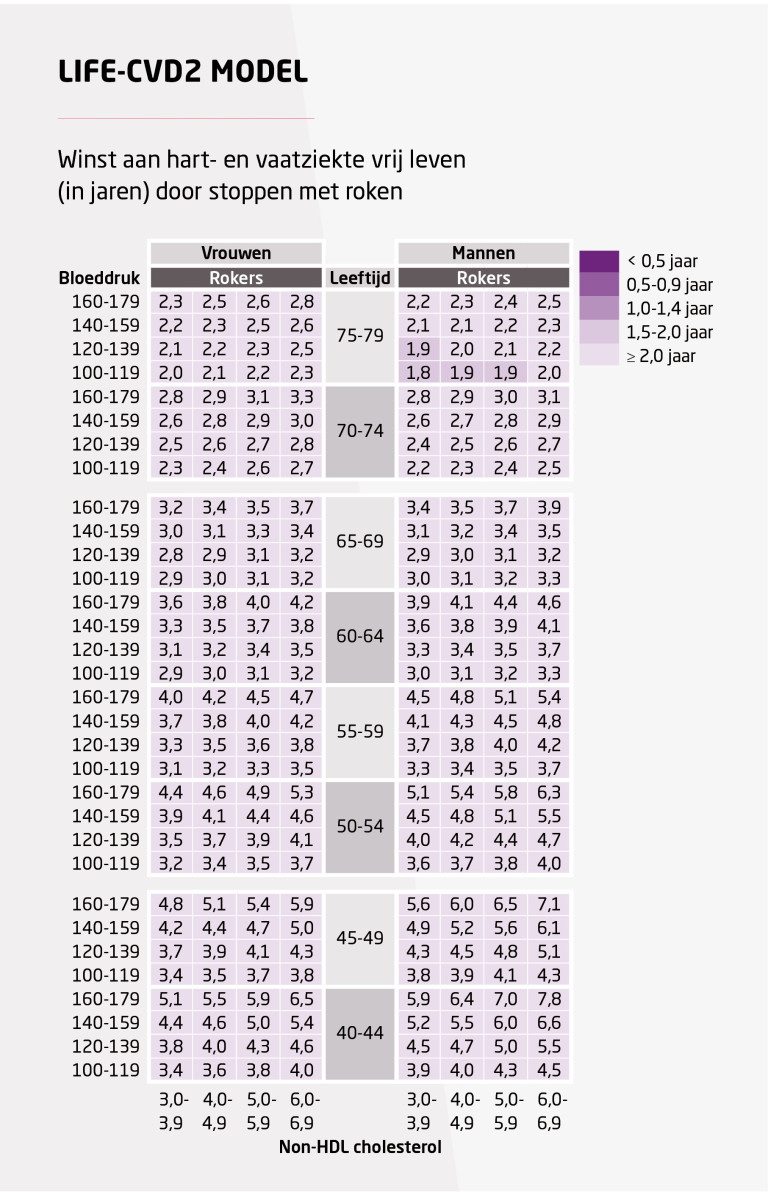
| Wat kunt u qua risico winnen, bijv. door te stoppen met roken of te starten met medicatie. Dit kan worden uitgedrukt in hoeveel extra jaren vrij van hart- en vaatziekten gemiddeld worden gewonnen door te stoppen met roken (figuur A), 1 mmol/l LDL-C verlaging (figuur B) of 10 mmHg systolische bloeddrukdaling (figuur C) (zie voor meer informatie hierover: www.U-Prevent.com). |
Figuur A Lifetime gezondheidswinst door te stoppen met roken bij gezonde personen zonder hart- en of vaatziekten of diabetes. Lifetime gezondheidswinst is te interpreteren als de toename in levensverwachting vrij van hart- en vaatziekten, in vergelijking met de huidige leefstijl en/of medicamenteuze behandeling.
Figuur B Lifetime gezondheidswinst door het verlagen van LDL-cholesterol met 1 mmol/L bij gezonde personen zonder hart- en of vaatziekten of diabetes. Lifetime gezondheidswinst is te interpreteren als de toename in levensverwachting vrij van hart- en vaatziekten, in vergelijking met de huidige leefstijl en/of medicamenteuze behandeling.
Figuur C Lifetime gezondheidswinst door het verlagen van de systolische bloeddruk met 10 mmHg bij gezonde personen zonder hart- en of vaatziekten of diabetes. Lifetime gezondheidswinst is te interpreteren als de toename in levensverwachting vrij van hart- en vaatziekten, in vergelijking met de huidige leefstijl en/of medicamenteuze behandeling. De schatting is alleen voor een systolische bloeddruk > 140 mmHg. Een systolische bloeddruk < 140 mmHg is al onder de streefwaarde.
Risico-communicatie en behandelbeslissingen op relatief jonge leeftijd
Het absolute 10-jaarsrisico bij relatief jongere personen is doorgaans laag, zelfs in de aanwezigheid van meerdere risicofactoren. Dit zou tot de onjuiste conclusie kunnen leiden dat deze personen een laag lifetime-risico hebben en/of dat zij vergeleken met mensen van dezelfde leeftijd en geslacht toch ‘gezond’ zijn. Alternatieve manieren van risicoberekening en communicatie kunnen worden overwogen, zoals cardiovasculaire risicoleeftijd (‘hart leeftijd’) of lifetime-risicoschattingen.
Cardiovasculaire risicoleeftijd
De risicoleeftijd van iemand met meerdere risicofactoren voor hart- en vaatziekten is de leeftijd van iemand van hetzelfde geslacht met hetzelfde risico, maar met optimale waarden van de risicofactoren. Iemand van 40 met ongunstige waarden van de risicofactoren kan dus de risicoleeftijd hebben van een 60-jarige omdat het 10-jaarsrisico gelijk is aan dat van een 60-jarige met normale risicofactoren (bijvoorbeeld niet-roker, totaal cholesterol van 4 mmol/l en systolische bloeddruk van 120 mmHg). Voor het bepalen van de risicoleeftijd kan dus de standaard-risicotabel gebruikt worden. Risicoleeftijd is een intuïtieve en makkelijk te begrijpen manier om het verhoogde risico op een hart- en vaatziekte van een jong persoon met een laag absoluut maar hoog relatief risico op hart- en vaatziekten uit te leggen. Van de risicoleeftijd is aangetoond dat deze onafhankelijk is van het gebruikte hart- en vaatziekten-eindpunt (mortaliteit of morbiditeit). Risicoleeftijd kan worden gebruikt in elke populatie.
Lifetime risico
Lifetime-risico behelst het hart- en vaatziektenrisico gedurende de verwachte levensduur van een individu, rekening houdend met risico’s op niet-cardiovasculaire (concurrerende) sterfte. Lifetime-risicoscores zijn beschikbaar voor ogenschijnlijk gezonde mensen, mensen met diabetes en patiënten met hart- en vaatziekten, zie bijlage en www.U-Prevent.com.
Er is geen beslisdrempel verbonden aan risicoleeftijd of lifetime-risico’s. Beide zijn bedoeld om de patiënt meer inzicht te geven in het risico en zo behulpzaam te zijn bij het proces van samen beslissen.
Vooral op relatief jonge leeftijd moet een afweging worden gemaakt tussen enerzijds een reductie van deze risico’s door medicamenteuze behandeling en anderzijds het zeer langdurig gebruik van preventieve medicatie.
Risico-communicatie en behandelbeslissingen bij ouderen
Een van de meest controversiële onderdelen van cardiovasculaire preventie is de vraag of ouderen zonder manifeste hart- en vaatziekte, die vooral vanwege hun leeftijd -en bijna ongeacht hun overige risicoprofiel- een hoog risico op hart- en vaatziekten hebben, in aanmerking komen voor medicamenteuze preventieve behandelingen. Het nut en de wenselijkheid van behandeling van risicofactoren bij ouderen hangt af van hun vitaliteit, levensverwachting, comorbiditeit, polyfarmacie, wensen van de patiënt en het geschatte 10-jaars hart- en vaatziekten risico met SCORE2-OP. Deze factoren samen vormen de ingrediënten voor samen beslissen en maken een behandeladvies gekoppeld aan een specifieke risicodrempel onwenselijk. De richtlijn geeft daarom geen specifieke 10-jaarsrisicodrempel aan waarboven medicamenteuze behandeling van risicofactoren moet worden overwogen.
Risico-communicatie en behandelbeslissingen bij patiënten met hart- en vaatziekte of diabetes mellitus
Met behulp van tabel 9 kunnen alle patiënten met hart- en vaatziekten en diabetes mellitus in een risicocategorie worden geplaatst. Het proces van samen beslissen over de indicatie en intensiteit van eventuele medicamenteuze behandeling kan soms baat hebben bij een meer kwantitatieve benadering van het risico. Voor het schatten van het risico op hart- en vaatziekten bij patiënten met hart- en vaatziekten en/of diabetes mellitus zijn andere risicoscores beschikbaar. Tabel 13b noemt hiervan enkele voorbeelden.
| Groep | Risicoschattings-instrument |
| Patiënten met hart- en vaatziekten | 10-jaars risico: SMART2-risicoscore Lifetime-risico: SMART-REACH |
| Personen met diabetes mellitus | 10-jaars risico en lifetime risico: DIAL2 SCORE2D |
De tools zijn te vinden in app en website www.U-prevent.com.
Triglyceriden
Hypertriglyceridemie is een significante onafhankelijke risicofactor voor hart- en vaatziekten, maar de associatie is veel minder sterk dan bij hoog LDL-C. Het risico is sterker geassocieerd met gematigde dan met zeer ernstige hypertriglyceridemie (> 10 mmol/l), die als risicofactor voor pancreatitis geldt. Er zijn echter geen gerandomiseerde onderzoeken geweest die voldoende bewijs bieden om doelwaarden te kunnen vaststellen voor triglyceriden. Meta-analyses wijzen erop dat een gerichte aanpak van triglyceriden hart- en vaatziekten kan verlagen bij patiënten met diabetes mellitus met hoge triglyceriden en lage HDL-C. Op het moment worden nuchtere triglyceriden > 1,7 mmol/l gezien als een marker voor verhoogd risico op hart- en vaatziekten, maar er is onvoldoende bewijs voor specifieke triglyceriden-verlagende behandeling om het risico op hart- en vaatziekten te verlagen.
Zeer hoge plasmatriglyceridewaarden (> 10 mmol/l) waar geen duidelijke onderliggende oorzaak voor kan worden aangewezen (bijvoorbeeld alcohol of slechte glycemische controle bij diabetes mellitus) vereisen nadere diagnostische analyse, in gespecialiseerde klinieken, naar specifieke oorzaken waaronder genetische mutaties (zoals familiaire dysbètalipoproteïnemie, LPL-deficiëntie). Voor meer informatie wordt verwezen naar de richtlijn (erfelijke) dyslipidemie in de 2e en 3e lijn.
HDL-C
Laag HDL-C is onafhankelijk geassocieerd met een hoger risico op hart- en vaatziekten. Laag HDL-C is mogelijk even ernstig als hoge concentraties LDL-C als een risicofactor voor ischemische hartziekten. De combinatie van matig verhoogde triglyceriden en lage concentraties HDL-C komt veel voor bij patiënten met type 2 diabetes mellitus, abdominale obesitas en insulineresistentie en bij personen die fysiek weinig actief zijn. Dit lipidenpatroon wordt ook gekenmerkt door de aanwezigheid van kleine, relatief zware, atherogene LDL-deeltjes. Een HDL-C-spiegel < 1,0 mmol/l bij mannen en < 1,2 mmol/l bij vrouwen kan worden gezien als een marker voor verhoogd risico. Mendeliaanse randomisatieonderzoeken hebben echter vraagtekens gezet bij de causale rol van HDL-C bij hart- en vaatziekten. Specifieke farmacologische interventies om HDL-C te verhogen leidden bij grote gerandomiseerde onderzoeken niet tot verlaging van het risico op hart- en vaatziekten. Lichaamsbeweging en andere leefstijlfactoren blijven belangrijk als methoden om de HDL-C-spiegels te laten stijgen. Ook het stoppen met roken kan het HDL-C laten stijgen. Zeer lage HDL-C-plasmaspiegels (< 0,60 mmol/l) kunnen, wanneer er geen zeer hoge TG-spiegel is, worden veroorzaakt door een onderliggende stoornis in de metabolisme van HDL-C, zoals mutaties in de apoA-, LCAT- of ABCA1-genen en rechtvaardigt verder onderzoek in gespecialiseerde klinieken. Voor meer informatie wordt naar de richtlijn (erfelijke) dyslipidemie in de tweede en derde lijn verwezen.
Lipoproteïne(a)
Lipoproteïne(a) (Lp(a)) is een low-density lipoproteïne waar een extra proteïne aan bevestigd is, het zogeheten apolipoproteïne (a). Hoge concentraties Lp(a) worden geassocieerd met een verhoogd risico op ischemische hartklachten, TIA en herseninfarct; Mendeliaanse randomisatieonderzoeken hebben de causale rol van Lp(a) bij hart- en vaatziekten aangetoond. Er is nog geen gerandomiseerd interventieonderzoek dat aantoont dat verlaging van Lp(a) leidt tot een vermindering van het risico op hart- en vaatziekten. Op dit moment is er nog geen rechtvaardigingsgrond om de algemene bevolking te screenen op Lp(a), maar dit kan worden overwogen voor patiënten met een matig verhoogd risico om de risicobeoordeling te verfijnen, bij patiënten met onverklaard prematuur of progressief vaatlijden of bij personen met familiaire voorgeschiedenis van vroegtijdige hart- en vaatziekten. Voor meer informatie wordt naar de richtlijn (erfelijke) dyslipidemie in de 2e en 3e lijn verwezen.
Apolipoproteïnen zijn structuureiwitten op lipoproteïnen. ApoB zit op VLDL- en LDL-partikels en apoA zit op HDL-partikels. Het routinematig meten van apolipoproteïnen (zoals apoA of apoB) wordt niet aanbevolen. In bijzondere situaties kan de hoogte van het apoB in samenhang met plasma lipiden gebruikt worden om een specifieke lipidendiagnose te stellen. Voor meer informatie wordt naar de richtlijn (erfelijke) dyslipidemie in de tweede en derde lijn verwezen.
Uitsluiting van secundaire oorzaken van dyslipidemie
De aanwezigheid van dyslipidemieën die secundair zijn aan andere aandoeningen moet worden uitgesloten voor begin van de behandeling, want behandeling van de onderliggende aandoeningen leidt tot verbetering van hyperlipidemie zonder dat er lipidenverlagende medicatie nodig is. Dit geldt vooral voor hypothyroïdie en nefrotisch syndroom. Secundaire dyslipidemieën kunnen ook worden veroorzaakt door roken, overmatig alcoholgebruik, diabetes mellitus, syndroom van Cushing, leveraandoeningen en geneesmiddelen (bijvoorbeeld corticosteroïden). Voor meer informatie wordt naar de richtlijn (erfelijke) dyslipidemie in de tweede en derde lijn verwezen.
Rationale
Patiënten kunnen in specifieke hoog of zeer hoog risicogroepen vallen op basis van morbiditeit of risicofactoren (tabel 9). Voor de overige patiënten is het absolute 10-jaarsrisico op hart- en vaatziekten de basis voor gesprekken en beslissingen in cardiovasculair risicomanagement (SCORE2 en SCORE2OP tabel). Patiënten met het hoogste risico op hart- en vaatziekten hebben het meeste baat bij (intensieve) preventieve maatregelen. Vooral bij relatief jonge personen kunnen lifetime-risicoschattingen worden gebruikt. Bij ouderen zonder hart- en vaatziekten geldt geen absolute risicodrempel voor behandeling. Bij patiënten met hart- en vaatziekte en/of diabetes mellitus kan ook het 10-jaars- en lifetimerisico worden geschat evenals verwachte behandeleffecten om de risicocommunicatie te verbeteren en om een weloverwogen gezamenlijke beslissing rond (het intensiveren van) de behandeling van risicofactoren te bevorderen.
Aanbevelingen
- Ga na of de patiënt in een van de patiëntgroepen valt waarvoor risicoschatting niet noodzakelijk is (tabel 9).
- Gebruik voor overige personen de SCORE2-(OP)-tabel (tabel 10) om het 10-jaars risico op hart- en vaatziekte te schatten.
- Geef uitleg over de betekenis van het geschatte risico. Bespreek altijd eerst het grote belang van leefstijlaanpassing en daarna de voor- en nadelen van mogelijke medicamenteuze behandelingen. Bepaal in een proces van samen beslissen welke interventie het beste past. Ga bij personen tot een leeftijd van 70 jaar uit van de volgende algemene aanbevelingen omtrent het aanbieden van preventieve medicatie:
- Laag risico: aanbieden van medicamenteuze behandeling doorgaans niet aangewezen.
- Matig verhoogd risico: aanbieden van medicamenteuze behandeling doorgaans niet aangewezen. Speciale aandacht is gewenst bij jonge mensen in verband met het lifetimerisico.
- Hoog risico: overweeg medicamenteuze behandeling aan te bieden.
- Zeer hoog risico: aanbieden van medicamenteuze behandeling aanbevolen.
- De beslissing om medicamenteus te behandelen zal onder andere afhangen van de mate waarin effect van leefstijlveranderingen te verwachten is, aanvullende informatie voor risicoschatting (zie tabel 12) (m.n. psychosociale factoren, coronaire-kalkscore indien beschikbaar en bloeddruk), de verwachte winst van medicamenteuze behandeling en persoonlijke voorkeuren van de patiënt.*
* NB Bij mensen die een matig verhoogd risico hebben EN een systolische bloeddruk tussen de 160 en 180 mm Hg ondanks inspanningen om de leefstijl aan te passen, kan ook overwogen worden om bloeddrukverlagende medicatie aan te bieden (zie detail Behandeling bloeddruk bij CVRM).
- Overweeg bij relatief jonge patiënten het gebruik van hartleeftijd en/of lifetime-risico om het proces van Samen Beslissen te ondersteunen.
- Hanteer geen absolute risicodrempel voor medicamenteuze-behandeladviezen bij patiënten zonder hart- en vaatziekten boven de 70 jaar. Betrek kwetsbaarheid, polyfarmacie en comorbiditeit bij het proces van Samen Beslissen.
- Overweeg bij patiënten met hart- en vaatziekten of diabetes mellitus het gebruik van aanvullende risicoschattingsinstrumenten om het proces van Samen Beslissen te ondersteunen.
De tekst van dit detail is integraal overgenomen uit het in 2017 gepubliceerde addendum (kwetsbare) ouderen bij de multidisciplinaire richtlijn CVRM. Het addendum is beschikbaar in de Richtlijnendatabase.
Uitgangsvraag
Verlagen leefstijlinterventies ook bij (kwetsbare) ouderen (> 70 jaar) het risico op het ontwikkelen van cardiovasculaire ziekten?
De uitgangsvraag omvat de volgende deelvragen:
- Verlaagt het stoppen met roken bij (kwetsbare) ouderen (> 70 jaar) het risico op hart- en vaatziekten?
- Verlaagt reductie van het gewicht het risico op hart- en vaatziekten bij (kwetsbare) ouderen (> 70 jaar)?
Inleiding
Leefstijladviezen of niet-farmacologische preventieve maatregelen vormen een belangrijke interventiestap in richtlijnen bij ouderen met of zonder hart- en vaatziekten. Het magere en bij een populatie van vooral middelbare leeftijd verkregen bewijs wordt in deze richtlijnen geëxtrapoleerd naar ouderen. Bij zowel medische professionals als niet-medici leeft de overtuiging dat het doorbreken van een lang bestaande verslaving als roken juist bij ouderen niet meer haalbaar is of dat stoppen geen gezondheidsvoordeel meer zal bieden. Voor gewichtsreductie bij ouderen betreft de zorg vooral het mogelijk bijkomende verlies van spiervolume (sarcopenie) en botdichtheid (osteoporose) met als mogelijk gevolg toenemend functieverlies, verhoogde valneiging of fracturen.
Voor de belangrijkste leefstijladviezen, namelijk stoppen met roken en gewichtsreductie door middel van dieet en/of lichaamsbeweging, hebben wij literatuur gezocht waarin verslag wordt gedaan van de effectiviteit van deze interventies bij (kwetsbare) ouderen.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvraag: wat is de effectiviteit van een interventie gericht op het stoppen met roken of het reduceren van gewicht vergeleken met geen interventie bij (kwetsbare) ouderen van zeventig jaar of ouder?
P: (kwetsbare) ouderen van zeventig jaar of ouder
I: 1) stoppen met roken; 2) gewichtsreductie
C: geen leefstijlinterventie of placebo-interventie
O: mortaliteit; incidentie van hart- en vaatziekten; kwaliteit van leven
Relevante uitkomstmaten
De werkgroep achtte hart- en vaatziekten, kwaliteit van leven en functioneren voor de besluitvorming kritieke uitkomstmaten; en bijwerkingen (onbedoelde neveneffecten) en totale mortaliteit voor de besluitvorming belangrijke uitkomstmaten.
Zoeken en selecteren (methode)
In de databases Medline (via OVID) is met relevante zoektermen gezocht naar systematische reviews, gerandomiseerde gecontroleerde trials en observationele onderzoeken. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 815 treffers op. Onderzoeken werden geselecteerd op grond van de volgende selectiecriteria:
- systematische reviews met een gedetailleerde zoekstrategie, evidence-tabellen en risk of bias-beoordeling;
- gerandomiseerde gecontroleerde trials en observationele onderzoeken met deelnemers van zeventig jaar of ouder of met gemiddeld leeftijd van zeventig jaar of ouder of een subgroepanalyse van zeventigjarigen of ouder een interventie gericht op het stoppen met roken of gewichtsreductie vergeleken met geen interventie.
Op basis van titel en abstract werden in eerste instantie dertig onderzoeken voorgeselecteerd. Na raadpleging van de volledige tekst werden vervolgens dertig onderzoeken geëxcludeerd (zie de exclusietabel onder het tabblad Verantwoording) en geen onderzoeken definitief geselecteerd.
Resultaten
Geen van de onderzoeken kon worden opgenomen in de literatuuranalyse. De belangrijkste onderzoekskarakteristieken en resultaten zijn opgenomen in de evidence-tabellen. De beoordeling van de individuele onderzoeksopzet (risk of bias) is opgenomen in de risk of bias-tabellen.
Samenvatting van de literatuur
Er zijn geen onderzoeken gevonden die in aanmerking kwamen voor inclusie.
Overwegingen
Leefstijladviezen vormen een belangrijke interventiestap in richtlijnen bij ouderen met of zonder hart- en vaatziekten. Het magere en bij een populatie van vooral middelbare leeftijd verkregen bewijs wordt in deze richtlijnen geëxtrapoleerd naar ouderen. Bij ouderen is geen bewijs voor de effectiviteit van leefstijladviezen gericht op het stoppen met roken en gewichtsreductie.
Ten aanzien van stoppen met roken blijkt uit een meta-analyse van Mons (2015) dat ook voor ouderen van zeventig jaar en ouder die gestopt zijn met roken een afname van de cardiovasculaire mortaliteit aantoonbaar is, die toeneemt met het aantal jaar dat ze gestopt zijn. Deze associatie is echter pas na twintig jaar significant, hetgeen betekent dat de meeste ouderen in deze meta-analyse ruim voor hun zeventigste gestopt zullen zijn.
In een Japans cohortonderzoek werd het risico van cardiovasculaire ziekten bij ouderen onderzocht. Bij de deelnemers van 65 tot 79 jaar werd tien jaar na het stoppen met roken een significante reductie van cardiovasculaire ziekten ten opzichte van deelnemers die zijn blijven roken vastgesteld. Ook in dit onderzoek geldt dat het stoppen met roken deels voor het zeventigste jaar heeft plaatsgevonden. In cohortonderzoeken met jongere deelnemers wordt gezondheidswinst binnen vijf jaar na het stoppen met roken gevonden. De aanwijzingen dat het bij ouderen ogenschijnlijk langer duurt voordat zij hiervan aantoonbaar voordeel ondervinden worden toegeschreven aan het healthy survivor effect. Hiermee wordt bedoeld dat degenen die tot op hoge leeftijd kunnen blijven roken zonder geassocieerde aandoeningen te krijgen, minder bevattelijk zijn voor de schadelijke effecten ervan, dan zij die door deze effecten ziek zijn geworden of dood zijn gegaan.
In diverse onderzoeken naar de effecten van gewichtsverlies bij obese ouderen worden deelnemers van vijftig jaar en ouder onderzocht. In een onderzoek van Villareal (2011) bleek bij obese ouderen van 65 jaar en ouder het fysiek functioneren te verbeteren bij het combineren van dieet met oefentherapie. Noch bij dit onderzoek, noch bij vergelijkbare onderzoeken werden cardiovasculaire eindpunten gerapporteerd.
Buiten de afwezigheid van bewijs met betrekking tot gezondheidswinst en overlevingsvoordeel van stoppen met roken en gewichtsverlies, ontbreken voor ouderen ook gegevens over relevante uitkomstmaten als behoud van functioneren en kwaliteit van leven. Prospectief onderzoek naar deze vragen bij ouderen is dringend gewenst.
In afwezigheid van bewijs en in het licht van de hiervoor vermelde overwegingen is de werkgroep van mening dat behandelaren van rokende en van obese ouderen moeten adviseren om het roken te staken en dagelijkse lichamelijk actief te zijn. Een praktische handreiking hiervoor wordt geboden in de Praktijkhandleiding Leefstijl op de website van de NHG: www.nhg.org/praktijkvoering/leefstijl.
De waarde van dieet als enkelvoudige interventie gericht op gewichtsreductie bij ouderen wordt als te omstreden gezien om te kunnen aanbevelen.
Aanbevelingen
Vitale en kwetsbare ouderen:
- Adviseer (kwetsbare) ouderen te stoppen met roken.
- Adviseer (kwetsbare) ouderen (inclusief ouderen met overgewicht of obesitas) om dagelijks te bewegen volgens de Nederlandse Norm Gezond Bewegen.
De tekst van dit detail is integraal overgenomen uit het in 2017 gepubliceerde addendum (Kwetsbare) ouderen bij de multidisciplinaire richtlijn CVRM. Het addendum is beschikbaar in de Richtlijnendatabase.
Onder organisatie van zorg wordt verstaan: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Dit detail beperkt zich tot de organisatie van zorg betreffende cardiovasculair risicomanagement bij (kwetsbare) ouderen. De rol van de primaire behandelaar (meestal de tweedelijnsspecialist), van de huisarts en zijn praktijkondersteuners, alsmede de rol van de specialist ouderengeneeskunde en de apotheker worden nader toegelicht. Reden voor een aanvulling op de multidisciplinaire richtlijn CVRM is met name gebaseerd op de vragen uit het werkveld aangaande de mogelijkheid van extrapolatie van adviezen, gebaseerd op onderzoek bij een andere doelgroep.
Op basis van een consensus-based methodiek na het houden van een invitational conference zijn door de werkgroep de volgende drie vragen geformuleerd:
- Formuleer advies ten aanzien van shared decision making: wat is de wens van de patiënt? Wat dient besproken te worden? Zijn er handvatten te geven voor het overwegen en afwegen per patiënt?
- Wanneer is verwijzing naar tweede lijn aan de orde, naar welk specialisme dient de patiënt te worden verwezen en wanneer dient terugverwijzing naar huisarts plaats te vinden?
- Hoe dient omgegaan te worden met CVRM-medicatie bij transitie van zorg en is speciale aandacht nodig voor de cognitief beperkte patiënt?
1. Advies ten aanzien van shared decision making
Samenvatting van de literatuur
Bij deze uitgangsvraag is geen systematisch literatuuronderzoek verricht omdat er verwacht werd geen onderzoeken te vinden die antwoord geven op de vraag, die specifiek is voor de Nederlandse situatie. Er worden dan ook geen conclusies vermeld. De aanbevelingen zijn uitsluitend gebaseerd op overwegingen die zijn opgesteld door de werkgroepsleden op basis van kennis uit de praktijk en waar mogelijk onderbouwd door niet systematisch literatuuronderzoek. Als er geen positief bewijs is aangaande de meerwaarde van CVRM bij ouderen zonder en met hart- en vaatziekten, wordt de rol van het shared decision proces-belangrijker.
Overwegingen
De algemeen aanvaarde richtlijnen voor de behandeling van enkelvoudige chronische ziekten zijn veelal niet van toepassing op oudere patiënten met multimorbiditeit en polyfarmacie, omdat deze patiënten niet of nauwelijks in de wetenschappelijke onderzoeken zijn geïncludeerd. Daarnaast blijken de algemeen geaccepteerde primaire uitkomsten waaraan de effectiviteit van therapie wordt afgemeten bij ouderen hun waarde te verliezen: zo is het voorkómen van mortaliteit voor veel ouderen een veel minder belangrijk behandeldoel dan behoud van kwaliteit van leven of van zelfstandig functioneren. Behandelbeslissingen zijn daarom veel meer afhankelijk van de individuele situatie van de patiënt. Shared decision making is daarom zeker bij kwetsbare ouderen gewenst.
Shared decision making is een proces waarin arts en patiënt (of zijn of haar vertegenwoordiger) gezamenlijk overleggen over te verrichten diagnostiek, beslissen over het te volgen behandelbeleid en afspraken maken over de benodigde ondersteuning. Dit proces kent drie centrale componenten:
- Uitwisseling van informatie, waarbij de arts alle noodzakelijke medische informatie verstrekt en de patiënt informatie verstrekt over zichzelf en over wat voor hem of haar belangrijk is.
- Overleg over de verschillende behandelopties, inclusief hun voordelen en nadelen, en over de voorkeuren van zowel de patiënt als de arts (mede gebaseerd op hun persoonlijke waarden).
- Bereiken van een gezamenlijke beslissing over het te volgen behandelbeleid waarmee beiden kunnen instemmen.
Shared decision making kan bemoeilijkt worden door een eventuele cognitieve achteruitgang, die regelmatig bij kwetsbare ouderen voorkomt. Actief deelnemen aan besluitvorming van een cognitief goede partner en/of een kind is dan noodzakelijk. Tevens dient uitwisseling van mogelijke adviezen door alle behandelaars te geschieden, alvorens in overleg te gaan met de patiënt/het patiëntsysteem, zodat vanuit alle gezichtspunten een juist advies geformuleerd kan worden. Conform de richtlijn Polyfarmacie wordt in de voorbereidende fase ook overleg gepleegd tussen de hoofdbehandelaar en de apotheker, liefst in samenspraak met de patiënt.
Bij het overleg tussen de patiënt (en/of diens naasten) en de behandelaar dienen de persoonlijke voorkeuren en behandeldoelen van de patiënt, bijwerkingen van medicatie, levensverwachting en medicatie compliance een belangrijke rol te spelen, want er zijn geen betrouwbare data over numbers to treat/harm beschikbaar.
Een praktisch instrument is het veelgebruikte model van gezamenlijke besluitvorming van Elwyn (2006) waarin eveneens de drie fasen, zoals hierboven beschreven, worden onderscheiden in de besluitvorming. De drie fasen zijn: choice talk (voorbereiding), waarin het uitwisselen van informatie en aanbieden van keuzemogelijkheden plaatsvindt, option talk (keuzefase) waarin het beschrijven en overwegen van alle opties met voor- en nadelen plaatsvindt en decision talk (besluitfase), waarin patiënt en dokter gezamenlijk tot besluitvorming komen, eventueel met behulp van keuzehulpen.
Wij adviseren om gebruik te maken van het stappenplan van Elwyn (2006), aangepast door Olde Rikkert.
Voorbereidende fase
- Historie: heeft de patiënt eerder al iets besproken of vastgelegd over een behandeling in het algemeen, of specifiek voor bijvoorbeeld reanimatie?
- Voorwerk voor het gesprek door de hulpverlener: zijn alle problemen voldoende in kaart gebracht? Hoe interacteren de problemen met elkaar?
- Definieer tijdens het gesprek uw gesprekspartner en eventuele toehoorders: wie neemt in dit gesprek de beslissingen (de patiënt, de vertegenwoordiger/mantelzorger, de dokter), is er een toehoorder aanwezig (bijvoorbeeld de verzorging, extra familieleden)?
- Bepaal levensvisie en beleving: kwaliteit van leven, levensovertuiging of geloof, beleving (wat doet het met u?), culturele verschillen tussen dokter en patiënt.
- Identificeer behandeldoelen: niet strikt medisch (onafhankelijkheid, wonen, zorggerelateerde doelen), mensen met een chronische ziekte: veranderend perspectief.
Keuzefase
Uitleg en uitwisselen van informatie. Hierbij kan worden overwogen om gebruik te maken van de drie goede vragen (3goedevragen.nl/). Tevens is het van belang om op een heldere manier kansen te bespreken.
Besluitfase
- Option talk: vormgegeven door 1 tot en met 5 (eventueel met keuzehulp).
- Stel een zorgplan op met behulp van stap 1 tot en met 7.
Aanbevelingen
- Overleg met actuele medebehandelaars over de te formuleren adviezen voorafgaand aan het proces van shared decision making. Dit is vooral van toepassing bij het switchen of stoppen van medicatie.
- Gebruik een stappenplan bestaande uit een voorbereidende fase, keuzefase en besluitfase, zoals hierboven beschreven.
2. Wanneer is verwijzing naar de tweede lijn aan de orde, naar welk specialisme dient de patiënt te worden verwezen en wanneer dient terugverwijzing naar de huisarts plaats te vinden?
Samenvatting van de literatuur
Bij deze uitgangsvraag is geen systematisch literatuuronderzoek verricht omdat de werkgroep verwachtte geen onderzoeken te vinden die antwoord geven op de vraag, specifiek voor de Nederlandse situatie. Er worden dan ook geen conclusies vermeld. De aanbevelingen zijn uitsluitend gebaseerd op overwegingen die zijn opgesteld door de werkgroepsleden op basis van kennis uit de praktijk en waar mogelijk onderbouwd door niet-systematisch literatuuronderzoek.
Overwegingen
Meestal worden preventieve maatregelen/behandelingen voor het cardiovasculaire risicoprofiel in de tweede lijn door orgaanspecialisten gestart, aansluitend aan een event (bijvoorbeeld myocardinfarct of CVA). Een tweede groep wordt beoordeeld door de huisarts en valt vaak in bepaalde doelgroepen (bijvoorbeeld diabeteszorg of hartfalen) die begeleid worden vanuit de huisartsenpraktijk. Bij vitale ouderen zal het bespreken van continuering van CVRM-maatregelen meestal geschieden bij de behandelaar die dit beleid initieerde.
Vaak is nu ook de specialist ouderengeneeskunde medebehandelaar bij kwetsbare ouderen, waarbij de huisarts zorg draagt voor acute problematiek en de specialist ouderengeneeskunde behandelingen of juist het achterwege laten van behandelingen in het kader van CVRM initieert.
Bij kwetsbare ouderen is regelmatig bezoek aan één of meer specialisten in een ziekenhuis een forse belasting. De werkgroep is dan ook van mening dat kwetsbare ouderen voor CVRM altijd moeten worden terugverwezen naar de huisarts en/of specialist ouderengeneeskunde, na overleg tussen patiënt, medisch specialist en huisarts.
Bij bezoek aan het ziekenhuis, klinisch of poliklinisch, dient daarom altijd de vraag op te komen of overdracht naar de huisarts gewenst is. Bij voorkeur overlegt de betrokken specialist met de huisarts/specialist ouderengeneeskunde, teneinde te voorkomen dat de zorg niet op een verantwoorde manier wordt overgedragen. Ter voorkoming van een onvolledige overdracht aan patiëntgegevens is inzage in de dossiers van de specialist en de huisarts een gewenste, maar helaas nog niet overal geregelde mogelijkheid.
Het is ook mogelijk dat verwijzing van de eerste naar de tweede lijn aan de orde is. Indien er specifieke diagnostiek noodzakelijk is die niet in de eerste lijn te regelen is, kan verwijzing met een gerichte vraag aan de orde zijn. Het is vaak de vraag naar welke specialist (een meer generalistische, zoals klinisch geriater/internist-ouderengeneeskunde, of een orgaanspecialist) de patiënt verwezen moet worden. Bij vitale ouderen, met een solitair probleem, kan gerichte verwijzing naar een orgaanspecialist aan de orde zijn, terwijl de problematiek bij een kwetsbare oudere vaak om een holistische aanpak vraagt. Landelijke transmurale afspraken (LTA’s) zijn er op meerdere gebieden en kunnen de richting van verwijzing ondersteunen.
Bij de besluitvorming hierover is het voor de kwetsbare oudere patiënt van belang dat er een goede hoofdbehandelaar wordt voorgesteld. Bij goede communicatie is het zelfs mogelijk dat de huisarts in de meeste gevallen deze rol blijft spelen, gezien de grote kans op een latere terugverwijzing naar de huisarts en dienstbegeleiding van comorbiditeiten.
Aanbevelingen
- Verwijs (kwetsbare) ouderen naar de tweede lijn.
- Verwijs (kwetsbare) ouderen bij overname van de behandeling CVRM zo spoedig mogelijk terug naar de huisarts of specialist ouderengeneeskunde.
3. Hoe dient omgegaan te worden met CVRM-medicatie bij transitie van zorg en is speciale aandacht nodig voor de cognitief beperkte patiënt?
Samenvatting van de literatuur
Bij deze uitgangsvraag is geen systematisch literatuuronderzoek verricht omdat de werkgroep verwachtte geen onderzoeken te vinden die antwoord geven op de vraag, die specifiek is voor de Nederlandse situatie. Er worden dan ook geen conclusies vermeld. De aanbevelingen zijn uitsluitend gebaseerd op overwegingen die zijn opgesteld door de werkgroepsleden op basis van kennis uit de praktijk en waar mogelijk onderbouwd door niet systematisch literatuuronderzoek.
Overwegingen
Bij overdracht van zorg dient de hoofdbehandelaar altijd de benodigde informatie aan te leveren conform de Zorgstandaard CVRM, zijnde een actuele medicatielijst (inclusief eventueel bekende zelfmedicatie, inclusief kennis over intoleranties, contra-indicaties en allergieën), een relevante medische voorgeschiedenis, een in het kader van advanced care planning gemaakte lijst met afspraken (bijvoorbeeld reanimeren, zwaarte van de behandeling/wanneer niet behandelen) en zo mogelijk een objectieve cognitiebeoordeling. Na overdracht is de dan behandelend eindverantwoordelijke arts verantwoordelijk voor de volledige, soms tijdelijke, behandeling/preventie. Tevens dient men te beoordelen in welke vorm medicatie aangeleverd dient te worden ter verbetering/realisering van de compliance van medicatie (bijvoorbeeld baxterverpakking). Tevens dient men rekening te houden met de lichamelijke en psychische beperkingen van een (kwetsbare) oudere ten aanzien van de wijze waarop medicatie wordt aangeleverd. Teneinde een zo verantwoord mogelijke overdracht te realiseren is het maken van regionale afspraken tussen de tweede lijn, huisartsen en specialisten ouderengeneeskunde zeer wenselijk.
Aanbevelingen
- Draag zorg voor een volledige overdracht bij wisseling van hoofdbehandelaarschap.
- Draag zorg voor regionale afspraken aangaande medicatieoverdracht en continuïteit van zorg.
Risicocommunicatie en behandelbeslissingen bij patiënten met hart- en vaatziekte of diabetes mellitus
Naar Samenvatting ›Met behulp van tabel 1 kunnen alle patiënten met hart- en vaatziekten en diabetes mellitus in een risicocategorie worden geplaatst. De gezamenlijke besluitvorming over de indicatie voor en intensiteit van eventuele medicamenteuze behandeling kan soms baat hebben bij een meer kwantitatieve benadering van het risico. Voor het schatten van het risico op hart- en vaatziekte bij patiënten met een hart- en vaatziekte en/of diabetes mellitus zijn andere risicoscores beschikbaar. Tabel 4 noemt hiervan enkele voorbeelden.
| Patiëntengroep | Risicoschattingsinstrument |
| Hart- en vaatziekte |
|
| Diabetes mellitus |
|
| De genoemde instrumenten zijn te vinden in de app en website U-Prevent.com. | |
Aanbevelingen
Naar Samenvatting ›- Ga na of de patiënt in een van de patiëntengroepen valt waarvoor risicoschatting niet noodzakelijk is (tabel 1).
- Gebruik voor overige personen de SCORE2-(OP)-tabel (tabel 2) om het tienjaarsrisico op hart- en vaatziekte te schatten.
- Geef uitleg over de betekenis van het geschatte risico. Bespreek altijd eerst het grote belang van leefstijl aanpassing en daarna de voor- en nadelen van mogelijke medicamenteuze behandelingen. Bepaal in een proces van samen beslissen welke interventie het beste past. Ga bij personen tot een leeftijd van 70 jaar uit van de volgende algemene aanbevelingen omtrent het aanbieden van preventieve medicatie:
- Laag risico: aanbieden van medicamenteuze behandeling doorgaans niet aangewezen.
- Matig verhoogd risico: aanbieden van medicamenteuze behandeling doorgaans niet aangewezen. Speciale aandacht is gewenst bij jonge mensen in verband met het lifetimerisico.
- Hoog risico: overweeg medicamenteuze behandeling aan te bieden.
- Zeer hoog risico: aanbieden van medicamenteuze behandeling aanbevolen.
- De beslissing om medicamenteus te behandelen zal onder andere afhangen van de mate waarin effect van leefstijlveranderingen te verwachten is, aanvullende informatie voor risicoschatting (zie tabel 5) (m.n. psychosociale factoren, coronaire kalkscore indien beschikbaar en bloeddruk), de verwachte winst van medicamenteuze behandeling en persoonlijke voorkeuren van de patiënt.
- Bij mensen die een matig verhoogd risico hebben EN een systolische bloeddruk tussen de 160 en 180 mm Hg ondanks inspanningen om de leefstijl aan te passen, kan ook overwogen worden om bloeddrukverlagende medicatie aan te bieden (zie paragraaf 2.3 Bloeddruk).
- Overweeg bij relatief jonge patiënten het gebruik van hartleeftijd en/of lifetimerisico om het proces van Samen Beslissen te ondersteunen.
- Hanteer geen absolute risicodrempel voor medicamenteuze-behandeladviezen bij patiënten zonder hart- en vaatziekten boven de 70 jaar. Betrek kwetsbaarheid, polyfarmacie en comorbiditeit bij het proces van Samen Beslissen.
- Overweeg bij patiënten met hart- en vaatziekten of diabetes mellitus het gebruik van aanvullende risicoschattingsinstrumenten om het proces van Samen Beslissen te ondersteunen.
1.3 Aanvullende risico-informatie en aandoeningen met een verhoogd cardiovasculair risico
Naar Samenvatting ›Vaak is er meer informatie over cardiovasculaire risicofactoren beschikbaar dan in de SCORE2-tabel of in het standaardrisicoprofiel wordt genoemd. De toegevoegde waarde van deze extra risico-informatie is meestal te gering om routinematig verzamelen aan te bevelen. Niettemin kán bij twijfel over het te volgen (medicamenteuze) beleid informatie over een of enkele van de in tabel 5 genoemde variabelen gebruikt worden om tot een keuze te komen. Een ongunstiger waarde dan gemiddeld of verwacht kan de balans naar ‘wel behandelen’ doen doorslaan, een waarde die gunstiger is dan gemiddeld of verwacht zou het omgekeerde effect moeten hebben. Als er meerdere bronnen van extra risico-informatie beschikbaar zijn, moeten deze tegen elkaar afgewogen worden. Het meewegen van andere risico-informatie dan de in tabel 5 genoemde wordt niet aanbevolen.
| Psychosociale factoren |
| Coronaire kalkscore (bij beschikbaarheid en acceptabele kosten) |
Bij de beoordeling of aanvullende risico-informatie nuttig is, is vooral gekeken naar het vermogen tot reclassificatie: kan de persoon in kwestie op basis van deze aanvullende informatie in een andere risicogroep geplaatst worden? Uiteindelijk zijn alleen psychosociale factoren en de coronaire kalkscore als risicomodificatoren gekozen (zie tabel 5). Andere modificatoren, zoals antropometrische variabelen, genetische bepalingen, vaatmetingen of biomarkers in bloed of urine, worden dus niet aanbevolen.
Uitgangsvraag
Welke risicofactoren, behalve de in de SCORE2-tabel opgenomen factoren, zijn van belang bij het schatten van het risico op hart- en vaatziekten en welke aandoeningen hebben een duidelijke invloed op het risico op hart- en vaatziekten?
Inleiding
De kerninformatie voor het schatten van het risico op hart- en vaatziekten wordt benoemd in detail Hoe kan het risico op hart- en vaatziekten worden geschat?. Niettemin is er soms aanvullende informatie beschikbaar of wordt het verzamelen van aanvullende informatie door sommigen gepropageerd. Dit detail bespreekt de meest bekende voorbeelden hiervan en gaat in op de waarde van deze aanvullende risico-informatie. Hierbij is hoofdzakelijk uitgegaan van het criterium van reclassificatie, dat bepalend is voor de vraag of de aanvullende risico-informatie patiënten daadwerkelijk in voldoende mate in een andere risicocategorie kan plaatsen.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is gebruik gemaakt van de Europese richtlijn Cardiovascular disease prevention in clinical practice uit 2016. Bij de herziening van deze module is gekeken naar de nieuwe versie van de Europese richtlijn uit 2021.
Overwegingen
Familiaire voorgeschiedenis
Een positieve voorgeschiedenis in de familie van overlijden door vroegtijdige hart- en vaatziekten wordt geassocieerd met een verhoogd risico op vroege hart- en vaatziekten en hart- en vaatziekten gedurende het leven. In de weinige onderzoeken die rapporteerden over de effecten van familiaire voorgeschiedenis en genetische scores op het cardiovasculaire risico, bleek familiaire voorgeschiedenis significant geassocieerd met het voorkomen van hart- en vaatziekten na correctie voor de genetische scores. Of familiaire voorgeschiedenis de incidentie van hart- en vaatziekten beter kan voorspellen dan klassieke risicofactoren van hart- en vaatziekten, is niet duidelijk. Een mogelijke verklaring is gelegen in de verschillende definities die worden gebruikt voor familiaire voorgeschiedenis en dat klassieke risicofactoren voor hart- en vaatziekten de invloed van familiaire voorgeschiedenis grotendeels verklaren. Een belaste familieanamnese is daarom vooral aanleiding om alert te zijn op de aanwezigheid voor traditionele risicofactoren.
Genetische markers
Bij sommige aandoeningen kan genetische screening en voorlichting effectief zijn, zoals bij familiaire hypercholesterolemie (FH) (zie Screening FH uit de richtlijn (Erfelijke) dyslipidemie in de tweede en derde lijn). Deze paragraaf richt zich op genetische screening op een hoog risico op hart- en vaatziekten in de algemene bevolking.
Het verband tussen genetische scores en het voorkomen van hart- en vaatziekten is prospectief onderzocht, waarbij werd gecorrigeerd voor de belangrijkste risicofactoren voor hart- en vaatziekten. De meeste onderzoeken hebben een significant verband aangetoond, met relatieve risico’s variërend van 1,02 tot 1,49 per verhoging in een score-eenheid. Uit ongeveer de helft van de onderzoeken bleek dat genetische scores van toegevoegde waarde waren bij het voorspellen van hart- en vaatziekten ten opzichte van de klassieke risicofactoren voor hart- en vaatziekten (dat wil zeggen gedefinieerd door de NRI). De grootste verbeteringen in de NRI werden gezien bij deelnemers met een gemiddeld risico en bij deelnemers met een hoog risico werd geen of slechts een kleine verbetering geobserveerd. Een onderzoek schatte dat voor elke 318 personen met een gemiddeld risico die werden gescreend een extra gebeurtenis van ischemische hartziekten zou kunnen worden voorkomen door meting van de genetische score voor ischemische hartziekten, naast de bekende risicofactoren.
Omdat er geen overeenstemming is over de vraag welke genetische markers bekeken moeten worden en hoe de genetische risicoscores moeten worden berekend, en er onzekerheden bestaan over hoe voorspellingen op risico op hart- en vaatziekten kunnen worden verbeterd, wordt het gebruik van genetische markers bij het voorspellen van hart- en vaatziekten niet aanbevolen.
Epigenetica
Epigenetica is het vakgebied dat onderzoek doet naar chemische veranderingen in het DNA die de genexpressie beïnvloeden. Methylatie van genen die verband houden met risicofactoren voor hart- en vaatziekten wordt geassocieerd met veranderingen in het niveau van een aantal risicofactoren voor hart- en vaatziekten, en een lager DNA-methylatieniveau wordt geassocieerd met een verhoogd risico op ischemische hartziekten of beroerte. Er is echter geen informatie beschikbaar over hoe het toevoegen van epigenetische markers het risico op hart- en vaatziekten beter zou kunnen voorspellen dan de klassieke risicofactoren. Epigenetische screening op hart- en vaatziekten wordt daarom niet aangeraden.
Psychosociale risicofactoren
Een lage sociaaleconomische status, gedefinieerd als laag opleidingsniveau, laag inkomen, het hebben van een baan met een lage status of het wonen in een arme woonwijk, betekent een verhoogd risico op ischemische hartziekten; het relatieve risico (RR) op mortaliteit door ischemische hartziekten is 1,3 tot 2,0. In vergelijking met de Framingham-risicoscore verbeterde door het toevoegen van dergelijke sociaaleconomische factoren de voorspelling van toekomstige hart- en vaatziekten.
Personen die geïsoleerd leven of geen contact hebben met anderen, hebben een verhoogd risico op het ontstaan van ischemische hartziekten en vroegtijdig overlijden hieraan. Gebrek aan een sociaal netwerk verhoogt ook het risico op ischemische hartziekten en verslechtert de prognose ervan.
Acute mentale stressoren kunnen triggers zijn voor een acuut coronair syndroom. Tot deze stressoren behoren blootstelling aan natuurrampen, maar ook stressoren in de privésfeer (zoals tegenslagen of andere ernstige levensgebeurtenissen) die leiden tot acute, hevige negatieve emoties (bijvoorbeeld uitbarstingen van woede of verdriet). Na het overlijden van een belangrijk persoon is de kans op een acuut myocardinfarct gedurende de eerste 24 uur ruim 20 keer zo hoog, om in de dagen daarna geleidelijk af te nemen.
Chronische stress op het werk (dat wil zeggen lange werktijden, veel overuren, grote mentale druk en werkdruk) voorspellen vroegtijdige ischemische hartziekten bij mannen (relatief risico (RR) ~1,2 tot 1,5). Langdurige stress in het gezinsleven verhoogt ook het risico op ischemische hartziekten (RR ~2,7 tot 4,0).
Klinische depressie en symptomen van depressiviteit voorspellen ischemische hartziekten (RR respectievelijk 1,6 en 1,9) en verslechteren de prognose ervan (RR respectievelijk 1,6 en 2,4). Vitale uitputting, die waarschijnlijk wijst op somatische symptomen van depressie, leverde een significante bijdrage aan ischemische hartziekten (populatie attributieve risico’s 21,1% bij vrouwen en 27,7% bij mannen). De NRI verbeterde duidelijk. Paniekaanvallen verhogen ook het risico op ischemische hartziekten (RR 4,2). Angst is een onafhankelijke risicofactor voor ischemische hartziekten (RR 1,3), voor cardiale mortaliteit na een hartinfarct (oddsratio (OR) 1,2) en voor cardiale gebeurtenissen (OR 1,7).
Meta-analyses rapporteerden een 1,5 keer zo hoog risico op hart- en vaatziekten, een 1,2 keer zo hoog risico op ischemische hartziekten en een 1,7 keer zo hoog risico op beroerte bij patiënten met schizofrenie en een 1,3 keer zo hoog risico op ischemische hartziekten, zelfs na correctie voor depressie, bij patiënten met een posttraumatisch stresssyndroom.
Vijandigheid is een persoonlijkheidskenmerk, gekenmerkt door wantrouwen en woede, en de neiging om agressieve, onaangepaste sociale relaties aan te gaan. Een meta-analyse bevestigde dat woede en vijandigheid gepaard gaan met een kleine, maar significante verhoging van het risico op hart- en vaatziekten bij zowel gezonde personen als personen met hart- en vaatziekten (RR 1,2). Iemand met een type D (‘distressed’) persoonlijkheid heeft een blijvende neiging om een breed spectrum van negatieve emoties (negatieve affectiviteit) te ervaren en tot het remmen van zelfexpressie in relatie tot anderen (sociale inhibitie). Van de type D-persoonlijkheid is aangetoond dat deze een slechte prognose heeft bij patiënten met coronaire hartziekte (RR 2,2). Psychosociale risicofactoren clusteren vaak in individuen en groepen. Zowel vrouwen als mannen met een lagere sociaaleconomische status en/of met chronische stress hebben bijvoorbeeld een grotere kans om depressief, vijandig en sociaal geïsoleerd te zijn. Het INTERHEART-onderzoek heeft aangetoond dat een cluster van psychosociale risicofactoren (dat wil zeggen sociale achterstand, stress op het werk of in het gezin en depressie) geassocieerd wordt met een verhoogd risico op acuut myocardinfarct (RR 3,5 voor vrouwen en 2,3 voor mannen). Het risico gebaseerd op demografische ontwikkelingen was 40% bij vrouwen en 25% bij mannen.
Tot de mechanismen die psychosociale factoren in verband brengen met een verhoogd risico op hart- en vaatziekten behoren een ongezonde leefstijl (vaker roken, ongezond eten en minder lichaamsbeweging (LB)) en slechte naleving van aanbevelingen voor gedragsveranderingen of hart- en vaatziekte medicatie. Daarnaast worden depressie en/of chronische stress geassocieerd met veranderingen in de autonome functie, in de hypothalamus-hypofyse-as en andere endocriene markers die de hemostatische en ontstekingsprocessen, de endotheelfunctie en de myocardfunctie beïnvloeden. Een verhoogd risico bij patiënten met depressie wordt mogelijk ook veroorzaakt door bijwerkingen van tricyclische antidepressiva.
Een analyse van psychosociale factoren bij patiënten en personen met risicofactoren voor hart- en vaatziekten moet worden overwogen als factor die het risico kan beïnvloeden bij de risicoschatting op hart- en vaatziekten, vooral bij personen met een SCORE-risico die dicht bij een grenswaarde ligt. Daarnaast kunnen psychosociale factoren mogelijke drempels voor veranderingen in leefstijl en medicatietrouw identificeren. In allerlei talen en landen zijn gestandaardiseerde methoden beschikbaar om psychosociale factoren te analyseren. Ook kan een voorlopige analyse van psychosociale factoren worden gemaakt tijdens de anamnese door de zorgverlener, zoals getoond in tabel 14.
| Lage sociaaleconomische status | Wat is uw opleidingsniveau? |
|---|---|
| Doet u fysieke arbeid? | |
| Werk- en familiestress | Heeft u weinig controle over hoe u uw werk moet doen? |
| Wordt u onderbetaald? | |
| Heeft u ernstige problemen met uw gezinsleden? | |
| Sociale isolatie | Leeft u alleen? |
| Heeft u gebrek aan een dichtbij staand vertrouwd persoon? | |
| Heeft u de laatste tijd een belangrijk familielid of goede vriend verloren? | |
| Depressie | Voelt zich u neerslachtig en hopeloos? |
| Heeft u verlies van interesse en levensplezier? | |
| Angst | Voelt u plotse angst of paniek? |
| Kunt u regelmatig niet stoppen met zorgen maken of heeft u er geen controle over? | |
| Vijandigheid | Bent u vaak kwaad over kleine dingen? |
| Bent u vaak geïrriteerd door het gedrag van andere mensen? | |
| Posttraumatische stressstoornis | Ben u blootgesteld aan een traumatische gebeurtenis? |
| Heeft u last van nachtmerries of oncontroleerbare gedachten? | |
| Andere psychiatrische aandoeningen | Heeft u last van andere psychiatrische aandoeningen? |
Niet meer dan het minimaal vereiste onderwijs en/of een ‘ja’ bij een of meer onderdelen zijn een indicatie voor een verhoogd risico op hart- en vaatziekten en kunnen worden gebruikt als factor die het risico op hart- en vaatziekten kan beïnvloeden. Het beleid ten aanzien van psychosociale risicofactoren moet worden aangepakt volgens detail Psychosociale factoren.
Bij personen met ernstige psychische aandoeningen (EPA) kunnen risicofactoren voor hart- en vaatziekten zich clusteren. Onder EPA verstaan we de groep ernstige c.q. chronische psychiatrische aandoeningen met restverschijnselen zoals schizofrenie, bipolaire stoornissen en ernstige persoonlijkheidsstoornissen vaak met verslavingsproblemen. Mensen met EPA hebben gemeenschappelijk dat zij op meerdere levensgebieden problemen hebben of beperkingen ondervinden en voor langere tijd hulp nodig hebben. Er zijn aanwijzingen dat een aantal EPA een onafhankelijke risicoverhogende factor vormt. Een recente review laat een verdubbeling van mortaliteit zien ten gevolge van hart- en vaatziekten bij mensen met een EPA vergeleken met de rest van de populatie, vooral in jongere groepen. Het verband tussen EPA en hart- en vaatziekten lijkt sterker te worden sinds 1990, hetgeen te maken kan hebben met de toename van het voorschrijven van atypische antipsychotica. Antipsychotica verschillen van elkaar wat betreft de ernst van metabole bijwerkingen. De Britse NICE-richtlijn benut zowel EPA als gebruik van antipsychotica in de risicocalculator QRISK3 op basis van Britse populatiedata. Hoewel er nog onvoldoende bewijs is om op specifieke psychiatrische aandoeningen het cardiovasculair risico te reclassificeren, is het aan te bevelen om patiënten met een EPA proactief te monitoren en QRISK3 te gebruiken voor de risico-inschatting, om tijdig te kunnen behandelen.
Het onderzoek van Jakobs (2022) naar barrières die Nederlandse huisartsen ervaren bij CVRM bij patiënten met EPA, toont dat het risicoschatten en de wijze waarop dit risico verlaagd kan worden bij deze patiënten moeilijker kan zijn, met name wanneer zij antipsychotica gebruiken. Zo kan abrupt stoppen met roken leiden tot een forse verhoging van de clozapinespiegel. Ga bij deze risicogroep op HVZ het gesprek aan en vraag of de patiënt een CVRM-inventarisatie en begeleiding ziet zitten. Doe dit eventueel in overleg met de behandelende SGGZ.
Etnische minderheden
Zie detail Etnische achtergrond.
Biomarkers
Algemeen gesteld kunnen biomarkers worden ingedeeld in inflammatoire (bijvoorbeeld hoog-sensitief(hs-)CRP, fibrinogeen), trombotische (bijvoorbeeld homocysteïne, lipoproteïnegeassocieerd fosfolipase A2), glucose- en lipidengerelateerde markers (bijvoorbeeld apolipoproteïnen) en orgaanspecifieke markers (bijvoorbeeld renale, cardiale markers). Deze biomarkers kunnen causaal gerelateerd zijn aan hart- en vaatziekten, dan wel een uiting zijn van (vroege) cardiovasculaire schade. Vanuit het oogpunt van risicostratificatie is dit evenwel niet direct relevant.
Een van de meest onderzochte en besproken biomarkers is hs-CRP. Uit meerdere grote prospectieve onderzoeken komt deze biomarker steeds weer naar voren als een risicofactor die meerdere metabole en laaggradige ontstekingsfactoren verbindt, met een RR die in de buurt komt van de klassieke risicofactoren op hart- en vaatziekten. Het levert echter waarschijnlijk slechts een beperkte toegevoegde bijdrage aan de bestaande methoden voor risicobeoordeling; dat wil zeggen de NRI is beperkt.
Uit meta-analyses en systematische reviews blijkt dat de meerderheid van de andere biomarkers de risicoclassificatie niet of beperkt kunnen verbeteren. De mate waarin ze zijn getest op hun vermogen om iets toe te voegen aan risicostratificatie varieert echter aanzienlijk, waarbij er sterke aanwijzingen zijn voor reporting bias.
Als biomarkers ondanks deze aanbevelingen toch worden gebruikt als factoren die het risico kunnen beïnvloeden, is het belangrijk te bedenken dat een ongunstig biomarkerprofiel weliswaar kan duiden op een iets hoger risico, maar ook dat een gunstig profiel op een lager risico duidt dan is berekend. De mate waarin het berekende risico wordt beïnvloed door biomarkers is onbekend, maar de invloed is kleiner dan de (aangepaste) RR’s die voor deze biomarkers in de literatuur worden genoemd. Bij het schatten van het cardiovasculaire risico bij individuen zijn na het meten van additionele biomarkers alleen kleine aanpassingen in het, bijvoorbeeld met SCORE, berekende risico gerechtvaardigd.
Meting van de preklinische vaatschade
Hoewel de meeste gevallen van hart- en vaatziekten kunnen worden verklaard door de klassieke risicofactoren, bestaat er een aanzienlijke variatie in de mate van atherosclerose. Er is dus blijvende belangstelling voor het gebruik van niet-invasieve beeldtechnieken ter verbetering van de risicobeoordeling voor hart- en vaatziekten. Bij personen bij wie het berekend risico op hart- en vaatziekten op basis van de belangrijkste, klassieke risicofactoren op de grens van de grenswaarden ligt, kunnen sommige beeldtechnieken worden overwogen als factor die het risico beïnvloedt, om zo een betere risicovoorspelling en besluitvorming mogelijk te maken.
Coronair-arterieel-calcium
Zie detail Coronaire-arteriële-calciumscore.
Echo van de halsslagader
Bevolkingsonderzoeken hebben correlaties aangetoond tussen de mate van artherosclerose in een arterieel gebied en de betrokkenheid van andere arteriën. Vroege opsporing van vaatlijden in ogenschijnlijk gezonde personen heeft zich daarom gericht op de perifere vaten, in het bijzonder op de halsslagader. Een risicobeoordeling op basis van een echo van de halsslagader is gebaseerd op een meting van de intimamediadikte (IMT) en de aanwezigheid en kenmerken van plaques.
De IMT is niet alleen een graadmeter voor atherosclerose in het beginstadium, maar ook voor hypertrofie/hyperplasie van glad spierweefsel. Het risico op hart- en vaatziekten neemt geleidelijk toe naarmate de IMT toeneemt en een waarde > 0,9 mm wordt als abnormaal beschouwd. Het risico op beroerte door IMT is niet-lineair, waarbij het gevaar sneller toeneemt bij een lagere IMT dan bij een hogere IMT. Het risico op cardiale gebeurtenissen door IMT is eveneens niet-lineair. De IMT van de halsslagader is een onafhankelijke voorspeller van hart- en vaatziekten, maar lijkt een grotere voorspellende waarde te hebben bij vrouwen dan bij mannen.
Nadelen van de IMT-meting zijn het gebrek aan standaardisatie bij de definitie en meting van IMT, de sterke variabiliteit en de lage intra-individuele reproduceerbaarheid. Een recente meta-analyse kon geen toegevoegde waarde van IMT aantonen vergeleken met de Framingham-risicoscore bij het voorspellen van toekomstige hart- en vaatziekten (de NRI was dus te gering), zelfs niet in de groep met een gemiddeld risico. Het systematisch gebruik van halsslagader-IMT-echo om de risicobeoordeling te verbeteren wordt daarom niet aangeraden.
Een plaque wordt meestal gedefinieerd als de aanwezigheid van een focale verdikking van de wand die ten minste 50% meer is dan de omringende vaatwand of als een focaal gebied met een IMT van ≥ 1,5 mm dat uitsteekt in het lumen. Plaques kunnen worden gekenmerkt door hun aantal, omvang, onregelmatigheid of echodensiteit (echolucent versus gecalcificeerd). Plaques worden geassocieerd met zowel coronaire als cerebrovasculaire gebeurtenissen en echolucente plaques vergroten de kans op ischemische cerebrovasculaire gebeurtenissen (in tegenstelling tot gecalcificeerde plaques). Meerdere onderzoeken benadrukken dat metingen waarbij ook gekeken wordt naar het aantal en de dikte van plaques en niet IMT alleen, van meerwaarde zijn bij het voorspellen van hart- en vaatziekten. Aangezien er geen formele reclassificatieanalyses zijn gedaan, wordt plaquebeoordeling in de halsslagader door middel van echografie niet aangeraden als factor die het risico kan beïnvloeden bij risicoschatting op hart- en vaatziekten.
Ecg
Zie detail Elektrocardiografie.
Enkel-armindex
Zie detail Enkel-armindex.
Echocardiografie
Echocardiografie is gevoeliger dan elektrocardiografie bij het diagnosticeren van linkerventrikelhypertrofie (LVH) en het kwantificeert heel nauwkeurig de massa van de linkerventrikel (LV) en de geometrische LVH-patronen. Hartafwijkingen die door echocardiografie kunnen worden aangetoond hebben een aanvullende voorspellende waarde. Omdat er geen overtuigend bewijs bestaat dat echocardiografie de reclassificatie van risico op hart- en vaatziekten verbetert, en vanwege de logistieke problemen die het met zich meebrengt, wordt dit beeldvormingsmiddel niet aangeraden om de risicoschatting op hart- en vaatziekten te verbeteren.
Aandoeningen met effect op het risico op hart- en vaatziekten
Diabetes mellitus
Bij patiënten met de diagnose diabetes mellitus of bij degenen die nog maar kort bekend zijn met de ziekte, is het cardiovasculair risico niet vergelijkbaar met dat van patiënten met ischemische hartziekten. Een aantal diabetespatiënten < 50 jaar heeft zelfs een laag tienjaarsrisico op hart- en vaatziekten omdat ze een normale bloeddruk en lipidenspiegels hebben, en niet roken. Het risiconiveau begint het risicoprofiel van ischemische hartziekten te benaderen na ongeveer tien jaar diabetes mellitus of bij personen met eindorgaanschade, zoals proteïnurie of een afnemende eGFR. Bij personen met diabetes mellitus met bestaande ischemische hartziekten is het vasculair risico ruim hoger dan voor patiënten met ischemische hartziekten zonder diabetes mellitus; zij hebben een aanzienlijk slechtere levensverwachting.
Diabetes mellitus type 1 gaat, vooral bij slechte glykemische controle, eveneens gepaard met een sterk verhoogd risico op hart- en vaatziekte, vermoedelijk doordat de blootstelling aan hyperglykemie vaak al van jongs af aan aanwezig is. In de context van risicoschatting is besloten geen onderscheid te maken tussen beide vormen van diabetes mellitus.
Hoewel er diabetesspecifieke methoden zijn ontwikkeld om het risico te berekenen, zijn deze minder goed gevalideerd dan bijvoorbeeld SCORE. SCORE kan echter niet worden gebruikt bij patiënten met diabetes mellitus omdat deze patiënten niet werden opgenomen in de database waar de SCORE-tabellen op zijn gebaseerd. Om die reden, en omdat deze richtlijn gebruiksvriendelijk tracht te zijn, worden de meeste patiënten met diabetes mellitus ‘automatisch’ geclassificeerd als hoog risico of zeer hoog risico, zoals aangegeven in tabel 9. Om het risico op hart- en vaatziekten te kunnen bespreken met patiënten met diabetes mellitus zouden zorgprofessionals een diabetesspecifieke risicocalculator kunnen gebruiken, zoals de ADVANCE risk engine.
In de verschillende noten bij deze richtlijn worden niet alle aspecten die van belang zijn bij het behandelen van patiënten met diabetes mellitus besproken. Onderwerpen die wel worden besproken zijn het schatten van het risico op hart- en vaatziekten bij patiënten met diabetes (in dit detail) en het behandelen van belangrijke cardiovasculaire risicofactoren (zoals bloeddruk en LDL-cholesterol) bij diabetes. De glucoseverlagende therapie bij diabetes wordt niet in deze richtlijn besproken. Daarvoor verwijzen we naar de NHG-Standaard Diabetes mellitus en de richtlijn Diabetes mellitus type 2 in de tweede lijn. Overigens zijn er verschillen tussen deze twee diabetesrichtlijnen, in het bijzonder in de positie van nieuwe middelen, zoals de SGLT2 (natriumglucose-cotransporter 2)-remmers empagliflozine en canagliflozine. Superioriteit van deze middelen ten aanzien van preventie van hart- en vaatziekten bij patiënten met een zeer verhoogd risico op hart- en vaatziekten (zoals na een doorgemaakt hartinfarct) wordt gesuggereerd door recent onderzoek, maar is onder experts nog onderwerp van discussie.
Chronische nierschade
Hypertensie, dyslipidemie en diabetes mellitus komen veel voor bij patiënten met chronische nierschade (CNS). Ontstekingsmediatoren en verkalking bevorderende stoffen veroorzaken vaatschade en kunnen verklaren waarom CNS de kans op hart- en vaatziekten vergroot, ook na correctie voor klassieke risicofactoren. Bovendien veroorzaken uremische toxines, inflammatoire mediatoren en promotors van calcificatie vasculaire schade. Een afnemende geschatte glomerulaire filtratiesnelheid (eGFR) is een belangrijk teken van een geleidelijk toenemend risico op aan hart- en vaatziekten gerelateerde mortaliteit, beginnend bij < 60 ml/min/1,73 m2 en geleidelijk oplopend tot een ongeveer drievoudig risico bij patiënten met waarden van 15 ml/min/1,73 m2. Eindstadiumnierziekte is geassocieerd met een zeer hoog risico op hart- en vaatziekten. Onafhankelijk van eGFR is verhoogde uitscheiding van albumine in de urine ook geassocieerd met het risico op hart- en vaatziektemortaliteit; het RR is ≈ 2,5 bij personen met een ernstig verhoogde albuminurie (albumine-creatinineverhouding > 30 mg/mmol). Deze bevindingen zijn vergelijkbaar bij die bij personen met diabetes mellitus en bij patiënten met hypertensie. Een onderzoek dat beoordeelt of de nauwkeurigheid van risicostratificatie voor hart- en vaatziekten verbetert bij het gebruik van informatie over CNS, naast klassieke risicofactoren voor hart- en vaatziekten, toonde aan dat het onderscheidend vermogen significant verbeterde met de toevoeging van eGFR en albuminurieniveaus. De nieuwe internationale definitie en classificatie van CNS stratificeert patiënten met CNS volgens drie globale risicogroepen, afhankelijk van eGFR en albuminuriestatus. Het gebruik van de nieuwe glomerulaire filtratiemarker cystatine C in plaats van creatinine om eGFR te schatten kan leiden tot een nog betere voorspelling van hart- en vaatziekten. De kosten van het bepalen van cystatine C zijn echter nog te hoog om haalbaar te zijn in de klinische praktijk. Op basis van het beschikbare wetenschappelijk bewijs heeft de werkgroep besloten om CNS-patiënten in te delen in drie klassen op basis van het risico op hart- en vaatziekten (tabel 9).
Patiënten die zijn behandeld voor kanker
Overlevenden van kanker vormen een groeiende populatie; de meeste van deze patiënten hebben chemotherapie en/of radiotherapie ondergaan. Chemotherapie induceert een rechtstreeks ischemisch effect op de vaten. Het kan bovendien risicofactoren, zoals hypertensie, vergroten en atherosclerose versnellen, vooral bij oudere patiënten. Deze gevolgen kunnen jaren na de behandeling optreden en zijn afhankelijk van de gebruikte chemotherapie onomkeerbaar of deels omkeerbaar.
Cardiotoxiciteit als gevolg van radiotherapie van de borstkas kan leiden tot micro- en macrovasculaire schade. Het kan atherosclerose versnellen, maar dit kan vele jaren na de eerste blootstelling optreden. Meerdere factoren beïnvloeden de latentie en ernst van cardiotoxiciteit door radiotherapie, zoals de dosis (totaal per fractie), het hartvolume dat bestraald werd, gelijktijdige toediening van andere cardiotoxische geneesmiddelen en patiëntfactoren (jongere leeftijd, klassieke risicofactoren, voorgeschiedenis hartziekten).
De eerste stap bij het identificeren van een groter risico op cardiotoxiteit bestaat uit een zorgvuldige baselineanalyse van risicofactoren voor hart- en vaatziekten. Huisartsen, cardiologen en oncologen moeten samenwerken om optimale nazorg te bieden, ook met betrekking tot (risicofactoren voor) hart- en vaatziekten. Positief, op de gezondheid gericht gedrag, waaronder gezonde voeding, stoppen met roken, regelmatig bewegen en gezond gewicht, moet sterk worden benadrukt. Vooral aerobe training wordt gezien als een veelbelovende niet-farmacologische strategie om door chemotherapie veroorzaakte cardiotoxiciteit te voorkomen en/of te behandelen.
Tekenen of symptomen van cardiale disfunctie moeten voorafgaand aan en periodiek gedurende de behandeling worden gecontroleerd, zodat zelfs asymptomatische abnormaliteiten bij patiënten die mogelijk cardiotoxische chemotherapie ondergaan vroegtijdig worden opgemerkt en de aanbevelingen uit de richtlijnen voor hartfalen moeten waar nodig worden opgevolgd. Een evaluatie van de LV-functie voorafgaande aan de behandeling is vereist.
Bij een daling van de LV-functie tijdens of na chemotherapie moet het gebruik van cardiotoxische middelen indien mogelijk worden vermeden of vertraagd tot na overleg met het oncologieteam. Om de cardiotoxiciteit door chemotherapie type I te verminderen is een groot aantal profylaxebehandelingen, waaronder bètablokkers, angiotensineconverterende enzymremmers (ACE-remmers), dexrazoxaan en statines, getest, wat is beschreven in een recente meta-analyse . Hierbij werd benadrukt dat vroegtijdige preventieve behandeling vereist is voor een maximaal effect.
Chronische inflammatoire ziektes (inclusief auto-immuunziekten)
Inflammatoire ziektes verhogen het risico op hart- en vaatziekten, zowel acuut als in de loop van de tijd. Het beste bewijs is beschikbaar voor reumatoïde artritis (RA), die het risico op hart- en vaatziekten met ongeveer 50% verhoogt boven de vastgestelde risicofactoren. Eerdere, kleinere onderzoeken gaven al aanwijzingen dat RA het risico op hart- en vaatziekten meer verhoogt dan andere risicomarkers, maar de analyse van de nationale QRESEARCH-database met 2,3 miljoen personen vormt hiervoor het best beschikbare bewijs. Dit bewijs is nu opgenomen in enkele nationale risicoscores (Board JBS, 2014) en Europese richtlijnen.
Bij andere chronische inflammatoire ziektes, zoals psoriasis, artritis psoriatica, systemische lupus erythematodes (SLE), ankyloserende spondylitis (voorheen bekend als ziekte van Bechterew) en inflammatoire darmziekten (IBD), kan het risico op hart- en vaatziekten ook verhoogd zijn. De bewijskracht is echter minder sterk, evenals de onafhankelijkheid ten opzichte van de klassieke risicofactoren. Desalniettemin lijkt het verstandig om op zijn minst te overwegen om een risicoprofiel op te stellen bij patiënten met een chronische inflammatoire ziekte, en bij twijfel over het starten van preventieve interventies rekening te houden met dergelijke aandoeningen. De cumulatieve ziektelast en recente mate van ontsteking zijn belangrijke determinanten van het risicoverhogende effect. Afgezien van een optimale anti-inflammatoire behandeling moet het risico op hart- en vaatziekten bij deze inflammatoire ziekten worden behandeld met vergelijkbare interventies als bij de algemene populatie met een hoog risico.
Voor meer informatie over reumatoïde artritis, artritis psoriatica, ankyloserende spondylitis, jicht of IBD wordt naar de desbetreffende modules verwezen.
Obstructief slaapapneu
OSA wordt gekenmerkt door terugkerend gedeeltelijke of volledige afsluiting van de bovenste luchtweg tijdens de slaap. Ongeveer 9% van de volwassen vrouwen en 24% van de volwassen mannen wordt hierdoor getroffen; het wordt geassocieerd met een RR van 1,7 op morbiditeit en mortaliteit door hart- en vaatziekten. Men vermoedt dat herhaaldelijke uitbarstingen van sympathische activiteit, verhoging van de bloeddruk en oxidatieve stress door pijn en episodische hypoxemie door verhoogde spiegels van ontstekingsmediatoren leiden tot endotheeldisfunctie en artherosclerose. Er kan worden gescreend op OSA met behulp van verschillende vragenlijsten, zoals STOP-Bang, P-SAP, Berlijn en de ASA-checklist, en slaperigheid gedurende de dag kan worden geanalyseerd met de Epworth Sleepiness Scale en oximetrie gedurende de nacht. Een definitieve diagnose vereist een slaaponderzoek en beoordeling door slaapdeskundige.
Vrouwspecifieke aandoeningen
Specifieke aandoeningen die alleen voor kunnen komen bij vrouwen en die van invloed kunnen zijn op het risico op hart- en vaatziekten kunnen worden uitgesplitst in obstetrische en niet-obstetrische aandoeningen.
Obstetrische aandoeningen
Het risico op hart- en vaatziekten later in het leven is verhoogd bij vrouwen die een zwangerschap doormaakten welke gecompliceerd werd door een hypertensieve aandoening, zoals zwangerschapshypertensie en/of pre-eclampsie. Dit geldt ook voor vrouwen wiens zwangerschap gecompliceerd werd door zwangerschapsdiabetes, en in mindere mate voor vrouwen met een voorgeschiedenis van spontane vroeggeboorte of foetale groeibeperking. Er bestaat twijfel over de relatie tussen herhaalde miskraam en hart- en vaatziekten later in het leven. Hieronder wordt verder ingegaan op deze verschillende aandoeningen.
Zwangerschapshypertensie en/of pre-eclampsie
Voor meer informatie over follow-up bij vrouwen na een hypertensieve aandoening tijdens de zwangerschap wordt verwezen naar de richtlijnmodule Follow-up na hypertensieve aandoening tijdens de zwangerschap.
Zwangerschapsdiabetes
Zwangerschapsdiabetes wordt gekenmerkt door glucose-ongevoeligheid tijdens de zwangerschap. Hierbij stijgen de bloedglucosespiegels leidend tot onder andere foetale macrosomie. Uit literatuuronderzoek blijkt dat zwangerschapsdiabetes geassocieerd is met een verhoogd risico op het ontwikkelen van type 2 diabetes mellitus binnen 10 jaar na de bevalling (RR 7,43 95%BI 4,79 tot 11,51). Echter, in deze analyse is geen rekening gehouden met confounding. De resultaten moeten daarom voorzichtig geïnterpreteerd worden. Een recente Finse follow-upstudie onder 400 vrouwen met zwangerschapsdiabetes liet zien dat in een follow-upperiode van 23 jaar de diagnose type 1 diabetes mellitus binnen 7 jaar na de bevalling vastgesteld werd, en dat een lineaire stijging van type 2 diabetes mellitus werd gezien in deze periode.
Recentere literatuur heeft daarnaast aangetoond dat voor deze groep – relatief jonge – vrouwen (onderzoek onder 5.390.591 vrouwen) het relatieve risico voor het ontwikkelen van hart- en vaatziekten op latere leeftijd bijna twee keer hoger is ten opzichte van vrouwen die geen zwangerschapsdiabetes ontwikkelen tijdens de zwangerschap (RR 1,98 95%BI 1,57 tot 2,50). Na correctie voor confounding blijft dit risico verhoogd (HR 1,59 95%BI 1,35 tot 1,85), waarbij dit verhoogde risico los staat van het wel of niet ontwikkelen van type 2 diabetes mellitus. Opmerkelijk genoeg is dit risico het hoogst in de eerste tien jaar na de bevalling (RR 2,31 95%BI 1,57 tot 3,39).
Herhaalde miskraam
Miskramen zijn de meest voorkomende zwangerschapscomplicatie bij een amenorroeduur van <16 weken. Ongeveer een derde van alle zwangerschappen eindigt in een miskraam, waarbij het risico op een miskraam per zwangerschap varieert tussen 12% en 15%. Dit risico stijgt met de leeftijd van de vrouw: ongeveer 9% bij een 22-jarige vrouw en bij 35 jaar en 45 jaar respectievelijk 23% en 60%. Een meta-analyse uit 2013 bij 514.000 vrouwen beschreef de odds op ischemische hartziekten na één miskraam op 1,40 (95%BI 1,10 tot 1,79) terwijl de odds bij twéé of meer miskramen bijna twéé keer zo groot was (OR 1,89 95%BI 1,13 tot 3,50). Deze bevindingen werden drie jaar later genuanceerd in een meta-analyse waarbij het verhoogde risico op hart- en vaatziekten op latere leeftijd na meerdere miskramen met minder zekerheid kon worden vastgesteld (RR 1,99 95%BI 0,94 tot 4,19).
Spontane vroeggeboorte
Er bestaat een verhoogd risico op hart- en vaatziekten op latere leeftijd bij vrouwen bij wie een spontane vroeggeboorte in een zwangerschap opgetreden is. Spontane vroeggeboorte wordt gedefinieerd als de geboorte van een kind voor de 37ste week van de zwangerschap. In een systematische review liet Heida (2016) zien dat vrouwen met een voorgeschiedenis van spontane vroeggeboorte een twee keer zo groot risico op hart- en vaatziekten op latere leeftijd hebben dan vrouwen zonder spontane vroeggeboorte (RR 2,06 95%BI 1,58 tot 2,68). Tevens is het risico op ischemische hartziekten (RR 1,38 95%BI 1,22 tot 1,57), CVA (RR 1,71 95%BI 1,53 tot 1,91), diabetes (RR 1,77 95%CI 1,46 tot 2,15) en hypertensie (RR 1,29 95%CI 1,24 tot 1,35) mogelijk verhoogd. De resultaten waren geadjusteerd voor socio-economische positie, maar meestal niet voor rookgedrag.
Foetale groeibeperking
Foetale groeibeperking wordt vooral veroorzaakt door utero-placentaire dysfunctie, in de regel bij hypertensieve aandoeningen in de zwangerschap zoals zwangerschapshypertensie of pre-eclampsie. Men spreekt van foetale groeibeperking als het geschatte foetale gewicht onder de 10de percentiel van de referentiewaarde voor foetaal gewicht valt gegeven de zwangerschapsduur. In een meta-analyse uit 2016 werd in 9 studies met in totaal 1.400.000 vrouwen een verhoogd risico op hart- en vaatziekten op latere leeftijd gevonden bij vrouwen wiens zwangerschap gecompliceerd werd door foetale groeibeperking (RR 1,66 95%BI 1,26 tot 2,18). Tevens werd een verhoogd risico gevonden op ischemische hartziekten (RR 1,68 95%BI 1,31 tot 2,14) en CVA (RR 1,62 95%BI 1,51 tot 1,74). Echter, de meeste studies hadden niet gecorrigeerd voor roken, wat een belangrijke confounder is in deze associatie. De resultaten moeten daarom voorzichtig geïnterpreteerd worden.
Ontslag uit het ziekenhuis en praktische toepasbaarheid
Wanneer een kraamvrouw met ontslag gaat bij wie één van bovengenoemde obstetrische aandoeningen gediagnostiseerd is, dient een adequate overdracht op papier te bestaan waarin aanbevelingen en/of adviezen aan huisarts over CVRM opgenomen dienen te worden. Aanvullende leesmateriaal zoals patiëntfolders of het wijzen op internetsites van relevante organisaties kunnen het gesprek vergemakkelijken. Het is in deze context aan te raden om lokale en/of regionale afspraken te maken met huisartsen omtrent de screening op hart- en vaatziekten op de langere termijn (zie ook de richtlijn Hypertensieve aandoeningen tijdens de zwangerschap). Een goede overdracht vanuit de tweede lijn én het goed informeren van de patiënt over mogelijke risico’s op hart- en vaatziekten op (langere) termijn, moeten bijdragen aan de praktische uitvoerbaarheid bij de huisarts. De patiënt heeft ook een eigen verantwoordelijkheid in het aankaarten van risicomanagement bij de huisarts.
Niet-obstetrische aandoeningen
Wereldwijd zijn hart- en vaatziekten de meest voorkomende doodsoorzaak in vrouwen. Het risico op het ontwikkelen van hart- en vaatziekten op latere leeftijd hangt samen met het tijdens de menopauze wegvallen van de beschermende invloed van vrouwelijke geslachtshormonen – met name oestrogeen – op het hart- en vaatstelsel. Wijzigingen van de hormonale status gaan gepaard met cardiometabole veranderingen later in het leven zoals hogere bloeddruk, toename visceraal vet, hoger LDL, meer inflammatie en afname bèta-celfunctie en daarmee meer insuline resistentie en diabetes.
Polycysteus Ovarium Syndroom (PCOS)
Polycysteus Ovarium Syndroom (PCOS) is een hormonale afwijking welke gekenmerkt wordt door endocriene dysfunctie en anovulatie. Door het uitblijven van de ovulatie treden symptomen op zoals menstruele dysfunctie, verminderde vruchtbaarheid, overgewicht en metabool syndroom. Dit laatste wordt geïllustreerd door het vaker voorkomen van insuline resistentie en diabetes mellitus type 2, dyslipidemie, hart- en vaatziekten zoals ischemische hartziekten en hypertensie. Een recente meta-analyse uit 2020 berekende voor vrouwen met PCOS in vergelijking met vrouwen zonder PCOS een hoger risico op hypertensie (RR 1,75 95%BI 1,42 tot 2,15), diabetes mellitus type 2 (RR 3,00 95%BI 2,56 tot 3,51) en hypercholesterolemie (RR 7,14 95%BI 1,58 tot 12,70). Het risico op ischemische hartziekten is potentieel ook verhoogd maar het betrouwbaarheidsinterval is vrij breed en omvat de 1,0 (RR 1,78 95%BI 0,99 tot 3,32).
Prematuur ovariële insufficiëntie/ vervroegde overgang
Prematuur ovariële insufficiëntie (POI) is de uitval van de ovariële functie voor het 40ste levensjaar en komt bij ongeveer 1:100 vrouwen voor. Het logische gevolg is uitval van de voortplantingsfunctie en afname van de hormonale activiteit van het ovarium. Een meta-analyse onder bijna 100.000 vrouwen liet zien dat het risico op hart- en vaatziekten later in het leven verhoogd is (RR 1,61 95%BI 1,22 tot 2,12), in het bijzonder ischemische hartziekten (RR 1,69 95%BI 1,29 tot 2,21) maar niet CVA (RR 1,03 95%CI 0,88 tot 1,19). Meer recente literatuur liet zien dat het cardiovasculair risicoprofiel in deze groep vrouwen daadwerkelijk afwijkend is in vergelijking met leeftijdsgenoten zonder POI: vrouwen met POI hebben een hogere systolische (124 vs. 120 mmHg; p < 0,04) en diastolische (81 vs. 78 mmHg; p < 0,01) bloeddruk. Hypertensie (45 vs. 21%; p < 0,01) alsmede het metabool syndroom (19 vs. 4%; p < 0,01) komen vaker voor.
Adviezen
Er bestaan vandaag de dag nog onvoldoende gestructureerde adviezen in Nederlandse richtlijnen betreffende de frequentie van screening teneinde hart- en vaatziekten later in het leven bij vrouwspecifieke aandoeningen te voorkomen.
Het risico op hart- en vaatziekten later in het leven is het meest uitgesproken bij vrouwen na een hypertensieve aandoening in de zwangerschap, na zwangerschapsdiabetes en bij vrouwen met Polycysteus Ovarium Syndroom. De meeste winst valt in deze groep vrouwen te behalen door adequate voorlichting, erkenning en aanpassing van lifestyle factoren aan te bevelen. Screening op risicoprofielen voor hart- en vaatziekten is eveneens van belang. De controlefrequentie is bij voorkeur de eerste jaren na diagnose jaarlijks. Afhankelijk per patiënt kan deze controle, na overleg, aangepast worden naar minder frequent, bijvoorbeeld bij een patiënte met PCOS die is afgevallen.
Aanbevelingen
- Overweeg het bepalen van psychosociale risicofactoren tijdens een consult bijvoorbeeld door middel van gestandaardiseerde vragenlijsten, om bij twijfel over het risico op hart- en vaatziekten het risico aan te. Zie detail Psychosociale factoren voor meer informatie over de risicofactoren en vragenlijsten.
- Overweeg bij personen met ernstige psychiatrische aandoeningen een risicoprofiel op te stellen.
- Overweeg een risicoprofiel op te stellen bij patiënten die worden of zijn behandeld voor kanker.
- Overweeg om een risicoprofiel op te stellen bij patiënten met een chronische inflammatoire ziekte, anders dan reumatoïde artritis.
- Overweeg bij twijfel over behandelindicatie (eerder) over te gaan tot behandeling van het risico op hart- en vaatziekten indien iemand een chronische inflammatoire ziekte heeft.
Voor meer informatie over reumatoïde artritis , artritis psoriatica , ankyloserende spondylitis , jicht of IBD wordt naar de desbetreffende modules verwezen. Voor andere inflammatoire reumatische aandoeningen wordt naar het standpunt CVRM van de NVR verwezen.
- Overweeg een risicoprofiel op te stellen bij patiënten met OSA.
- Zie af van genetische testen bij het schatten van het risico op hart- en vaatziekten.
- Bepaal geen biomarkers in het bloed of urine om het risico op hart- en vaatziekten beter te kunnen schatten.
- Verricht geen echografisch onderzoek van de halsslagader om het risico op hart- en vaatziekten beter te kunnen schatten.
- Verricht geen echocardiografisch onderzoek om het risico op hart- en vaatziekten beter te kunnen schatten.
Obstetrische aandoeningen
Zwangerschapshypertensie e/o pre-eclampsie
Aanbevelingen voor vrouwen na een hypertensieve aandoening tijdens de zwangerschap worden weergegeven in de richtlijnmodule Follow-up na hypertensieve aandoening tijdens de zwangerschap .
Zwangerschapsdiabetes
- Licht vrouwen na zwangerschapsdiabetes in over de verhoogde kans op het ontwikkelen van diabetes mellitus type 2 binnen 10 jaar na de bevalling. In deze context zijn aanpassingen in leefstijlfactoren te overwegen, zoals afvallen, sporten, gezond dieet volgen om dit risico te verlagen.
- Controleer de eerste 5 jaar jaarlijks en daarna om de drie jaar op nuchtere bloedglucosewaarde, teneinde diabetes mellitus type 2 tijdig op te sporen.
Herhaalde miskraam, vroeggeboorte, foetale groeibeperking
- Houd het risico op hart- en vaatziekten in de gaten bij de volgende groepen:
- vrouwen met herhaalde miskramen
- vrouwen die een vroeggeboorte hebben doorgemaakt
- vrouwen die zwanger waren van een kind met foetale groeibeperking
- Zorg (als gynaecoloog) voor een adequate overdracht op papier aan huisarts waarin aanbevelingen e/o adviezen over CVRM zijn opgenomen.
- Informeer de patiënt over het mogelijk verhoogde risico op (langere) termijn op hart- en vaatziekten.
Niet-obstetrische aandoeningen
Polycysteus Ovarium Syndroom (PCOS)
- Licht vrouwen met PCOS toe op de verhoogde kans op het ontwikkelen van diabetes mellitus type 2, hypercholesterolemie en hypertensie. In deze context zijn aanpassingen in leefstijlfactoren te overwegen, zoals afvallen, sporten, en gezond dieet om dit risico te verlagen.
- Screen, afhankelijk van het risicoprofiel jaarlijks of per drie jaar, op glucose teneinde diabetes mellitus type 2 tijdig op te sporen alsmede serumcholesterol teneinde signalen van dyslipidemie vroegtijdig op te sporen.
Prematuur ovariële insufficiëntie (POI)
Bespreek met vrouwen met POI de verhoogde kans op het ontwikkelen van hypertensie en het metabool syndroom. Aanpassingen in leefstijlfactoren zijn te overwegen, zoals afvallen, sporten, en aangepast dieet om dit risico te verlagen.
Uitgangsvraag
Wat is de toegevoegde waarde van de body mass index (BMI) bij het reclassificeren van het risico op hart- en vaatziekten?
Inleiding
De Europese richtlijn beschrijft dat er naast de klassieke cardiovasculaire risicofactoren opgenomen in de risicotabel, ook andere factoren zijn die mogelijk relevant zijn om het totale risico op hart- en vaatziekten te bepalen. De Sixth Joint Task Force van de Europese richtlijn beveelt aan om additionele risicofactoren toe te voegen als ze risicoclassificatie verbeteren (berekend met de Net Reclassification Index, NRI) en als het bepalen ervan haalbaar is in de dagelijkse praktijk. De BMI wordt genoemd als een van de potentiële reclassificerende risicofactoren.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvraag: leidt toevoeging van de BMI aan het predictiemodel op basis van alleen klassieke risicofactoren tot een betere risicoschatting bij patiënten zonder hart- en vaatziekten, afgemeten aan klinisch significante reclassificatie (Net Reclassification Index), voor wat betreft hun (tienjaars)mortaliteit en -morbiditeit van hart- en vaatziekten?
P: algemene populatie zonder hart- en vaatziekten
I: risicoschatting op basis van klassieke risicofactoren plus BMI
C: risicoschatting op basis van alleen klassieke risicofactoren
O: hart- en vaatziektemorbiditeit, hart- en vaatziektemortaliteit, reclassificatie uitgedrukt in Net Reclassification Index (NRI)
Relevante uitkomstmaten
De werkgroep achtte zowel hart- en vaatziektemorbiditeit/-mortaliteit als reclassificatie voor de besluitvorming kritieke uitkomstmaten. De werkgroep definieerde de genoemde uitkomstmaten niet a priori, maar hanteerde de in de onderzoeken gebruikte definities. De werkgroep definieerde een NRI van 10% voor upward of downward reclassifcatie als een klinisch (patiënt) relevant verschil.
Zoeken en selecteren (methode)
In de database Medline (via OVID), is op 10 april 2017 met relevante zoektermen gezocht naar systematische reviews en observationele onderzoeken. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 172 treffers op met zoekfilter systematische reviews/meta-analyses. Onderzoeken werden door twee onderzoekers onafhankelijk van elkaar geselecteerd op grond van de volgende selectiecriteria: systematische reviews (gedetailleerde zoekstrategie, risk of bias-beoordeling, evidence-tabel) en relevantie voor de uitgangsvraag. Conflicten werden via onderlinge discussie opgelost. Op basis van titel en abstract werden in eerste instantie twee onderzoeken voorgeselecteerd. Na raadpleging van de volledige tekst werd vervolgens één onderzoek geëxcludeerd (zie de exclusietabel onder het tabblad Verantwoording, SR/MA) en één onderzoek definitief geselecteerd. Vervolgens werd vanaf de publicatiedatum van de laatste meta-analyse (2011) gezocht naar nieuw verschenen originele onderzoeken. Deze literatuurzoekactie leverde 943 aanvullende treffers op. Op basis van titel en abstract werd er één additioneel onderzoek geïncludeerd.
Eén meta-analyse en één cohortonderzoek zijn opgenomen in de literatuuranalyse. De belangrijkste onderzoekskarakteristieken en resultaten zijn opgenomen in de evidence-tabellen. De beoordeling van de individuele onderzoeksopzet (risk of bias) is opgenomen in de risk of bias-tabellen.
Samenvatting van de literatuur
Beschrijving van de onderzoeken
Wormser (2011) gebruikte gegevens van 58 cohorten uit 17 landen om hazardratio’s te berekenen voor 1 sd hogere baselinewaarden (waaronder BMI) en berekende risicodiscriminatie en -reclassificatie. Individuele records van 221.934 deelnemers, zonder bekende geschiedenis met hart- en vaatziekten, werden gebruikt. De gemiddelde leeftijd op baseline was 58 jaar (sd 9), 56% was vrouw. Het grootste gedeelte woonde in Europa (58%).
Van Dis (2012) gebruikte gegevens van het MORGEN-project om te onderzoeken in hoeverre risicopredictie van hart- en vaatziekten verbeterde als obesitas (BMI ≥ 30 kg/m2) werd toegevoegd aan het klassieke risicofactorenmodel. De gegevens van 12.818 deelnemers in de leeftijd van 35 tot 65 jaar werd gebruikt. De gemiddelde leeftijd op baseline was 48,0 (sd 7,4) bij de mannen en 48,9 (sd 7,4) bij de vrouwen, 53% was vrouw. De uitkomst was fatale en niet-fatale hart- en vaatziekten gedurende tien jaar follow-up. De klassieke risicofactorvergelijking (verkregen met proportionele Cox-regressieanalyse) werd uitgebreid met onder andere obesitas. De NRI werd berekend om de verbetering in risicopredictie te bepalen, voor zowel 5% als 10% absolute hart- en vaatziekterisico (morbiditeit en mortaliteit) afkappunten. De analyses werden gestratificeerd voor geslacht.
Resultaten
Hart- en vaatziektemorbiditeit/-mortaliteit
In het onderzoek van Wormser (2011) werd bij deelnemers met een BMI van minimaal 20 kg/m2, de HR voor hart- en vaatziekten berekend. Wanneer gecorrigeerd werd voor baseline systolische bloeddruk, geschiedenis van diabetes mellitus, en totaal en HDL-cholesterol, was de HR voor hart- en vaatziekten met BMI 1,07 (95%-BI 1,03 tot 1,11). Geconcludeerd kan worden dat BMI de voorspelling van het risico op hart- en vaatziekten onvoldoende verbetert wanneer informatie over systolische bloeddruk, geschiedenis van diabetes mellitus en lipiden beschikbaar is.
NRI
In het onderzoek van Wormser (2011) gaf de toevoeging van BMI aan het Framingham-risicoscoremodel geen significante verbetering van het voorspellen van tienjaarsrisicocategorieën voor hart- en vaatziekten. De NRI, -0,19% (95%-BI -0,70 tot 0,32; p = 0,461), behaalde niet het klinisch relevante verschil van 10%. Met andere woorden, de toevoeging van BMI aan het Framingham-risicoscoremodel leidt niet tot een verschuiving van het geschatte risico op hart- en vaatziekten. De NRI was gebaseerd op de gegevens van 43.944 deelnemers van 20 onderzoeken (4777 cases). De C-indexverandering, een andere maat voor risicovoorspelling, was -0,0001 (95%-BI -0,0005 tot 0,0002; p = 0,430). Dit was gebaseerd op de gegevens van 144.795 deelnemers van 39 onderzoeken (8347 cases).
In het onderzoek van Van Dis (2012) bleek risicovoorspelling niet te verbeteren als BMI ≥ 30 kg/m2 werd toegevoegd aan het klassieke risicomodel, wanneer er werd gekeken naar reclassificatie bij risicocategorieën van 5% (mannen: NRI 2,2%; p = 0,3; vrouwen: NRI 1,1%; p = 0,7). Wanneer de risicocategorieën werden verdeeld in groepen van 10% verschil in absoluut risico op hart- en vaatziekten, werd er een kleine maar significante verbetering van risicopredictie gevonden door het toevoegen van BMI ≥ 30 kg/m2 aan het klassieke risicomodel voor mannen, en niet voor vrouwen (mannen: NRI 3,8%; p = 0,05; vrouwen: NRI 2,7%; p = 0,2).
Bewijskracht van de literatuur
Hart- en vaatziekten morbiditeit: de bewijskracht voor de uitkomstmaat hart- en vaatziektemorbiditeit is met drie niveaus verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias: verschil in start en looptijd van de cohorten (baseline tussen 1967 en 2006)); extrapoleerbaarheid (bias als gevolg van indirectheid: Framingham-risicoscoremodel in plaats van SCORE); en publicatiebias.
NRI Framingham-predictiemodel: de bewijskracht voor de uitkomstmaat NRI voor het Framingham-predictiemodel is met drie niveaus verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias: verschil in start en looptijd van de cohorten (baseline tussen 1967 en 2006)); extrapoleerbaarheid (bias als gevolg van indirectheid: Framingham-risicoscoremodel in plaats van SCORE); en publicatiebias.
NRI klassieke risicopredictiemodel: de bewijskracht voor de uitkomstmaat NRI voor het klassieke risicopredictie model is niet verlaagd.
Conclusie
| Framingham-predictiemodel | ||
| Zeer laag GRADE | Het is onzeker of BMI van toegevoegde waarde is aan het Framingham-risicoschattingsmodel bij het reclassificeren van personen zonder hart- en vaatziekten. | |
| Bron: Wormser 2011 | ||
| Klassiek risicopredictiemodel | |
| Hoog GRADE | Het toevoegen van BMI (≥ 30 kg/m2) aan het klassieke risicoschattingsmodel voor hart- en vaatziekten leidt niet tot reclassificatie van personen zonder hart- en vaatziekten. |
| Bron: Van Dis 2012 | |
Overwegingen
Alleen bij mannen in het onderzoek van Van Dis (2012) geeft de BMI een verbetering van NRI 3,8% bij een afkappunt van 10%. Deze verandering was statistisch significant, maar wel lager dan 10% (het afkappunt voor significantie gesuggereerd door de werkgroep). Andere onderzoekingen laten geen relevante reclassificatie zien. De kwaliteit van die laatste onderzoeken is lager dan die van Van Dis (2012).
Uitgangsvraag
Wat is de toegevoegde waarde van een coronaire kalkscore bij het reclassificeren van het risico op hart- en vaatziekten?
Inleiding
Hoewel de meeste gevallen van hart- en vaatziekten kunnen worden verklaard door de klassieke risicofactoren, is er aanzienlijke variatie in de mate van atherosclerose bij de aanwezigheid van dezelfde mate van risicofactoren. Om die reden is er toenemende belangstelling voor het gebruik van niet-invasieve beeldtechnieken om een indruk te krijgen van de mate van atherosclerose en daarmee de risicoschatting voor hart- en vaatziekten te verbeteren. Met name bij personen bij wie het berekend risico op hart- en vaatziekten op basis van de klassieke risicofactoren rond risicodrempels ligt, zou de coronaire kalkscore door middel van computertomografie (CT), een rol kunnen spelen om de risicovoorspelling te verbeteren, met name door een duidelijkere classificering van een individu in een bepaalde risicocategorie (bijvoorbeeld laag risico of hoog risico) te bewerkstelligen (reclassificatie).
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvraag (vragen):
Leidt toevoeging van de uitslag van een coronaire kalkscorebepaling aan het predictiemodel op basis van alleen klassieke risicofactoren tot een betere risicoschatting bij personen zonder hart- en vaatziekten, afgemeten aan klinisch significante reclassificatie (Net Reclassification Index), voor wat betreft hun risico op fatale of niet-fatale hart- en vaatziekten?
P: personen zonder hart- en vaatziekten;
I: risicopredictie op basis van klassieke risicofactoren plus coronaire kalkscore;
C: risicopredictie op basis van alleen klassieke risicofactoren;
O: hart- en vaatziekten morbiditeit, hart- en vaatziekten mortaliteit, reclassificatie uitgedrukt in Net Reclassification Index (NRI).
Relevante uitkomstmaten
De werkgroep achtte zowel hart- en vaatziekten morbiditeit/mortaliteit als reclassificatie voor de besluitvorming kritieke uitkomstmaten. De werkgroep definieerde de genoemde uitkomstmaten niet a priori, maar hanteerde de in de studies gebruikte definities. De werkgroep definieerde op basis van consensus een NRI van 10% voor reclassificatie als een klinisch (patiënt) relevant verschil.
Zoeken en selecteren (Methode)
Zoekactie – februari 2017
In de database Medline is met relevante zoektermen gezocht; de zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 257 treffers op met zoekfilter systematische reviews/meta-analyses (SR/MA). Studies werden door twee onderzoekers onafhankelijk van elkaar geselecteerd op grond van het volgende selectiecriterium: relevantie voor de uitgangsvraag. Conflicten werden via onderlinge discussie opgelost. Op basis van titel en abstract werden in eerste instantie 57 studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens 55 studies geëxcludeerd (zie exclusietabel in de Totstandkoming, SR/MA), en 2 studies definitief geselecteerd. Vervolgens werd vanaf de zoekdatum van de laatste systematische review (31 december 2014) gezocht naar nieuw verschenen originele onderzoeken. Op basis van titel en abstract werden daarvan in eerste instantie 13 studies geselecteerd, waarvan na raadpleging van de volledige tekst er 2 werden geïncludeerd (zie exclusietabel in de Totstandkoming).
Twee onderzoeken (SR) zijn opgenomen in de literatuuranalyse; de 2 aanvullende cohortstudies worden daarnaast globaal besproken. De belangrijkste studiekarakteristieken en resultaten van de SR zijn opgenomen in de evidence-tabel (zie Totstandkoming).
Update – maart 2022
De zoekactie is op 17-03-2022 herhaald met een paar wijzigingen (zie zoekverantwoording in de Totstandkoming). De selectiecriteria zijn hetzelfde gebleven.
Op basis van titel en abstract werden in eerste instantie 58 studies voorgeselecteerd. Na raadpleging van de volledige tekst werden vervolgens 58 studies geëxcludeerd (zie exclusietabel in de Totstandkoming) en geen studies definitief geselecteerd.
Samenvatting literatuur
Peters (2012) ondernam een systematische review naar de toegevoegde waarde voor cardiovasculaire risicostratificatie van afbeeldingstechnieken van subklinische atherosclerose, waaronder ook de coronaire kalkscore, in patiënten zonder symptomatische hart- en vaatziekten en zonder diabetes mellitus. Gelet op de uitgangsvraag worden hier alleen de relevante studies in deze SR besproken, dat wil zeggen studies waarin een overall (dat wil zeggen over het gehele spectrum van gecalculeerde risico’s met oude risicoscores op basis van alleen klassieke risicofactoren) NRI wordt gegeven. De 4 studies die een NRI berekenden betreffen 3 cohortstudies in de Verenigde Staten, Duitsland en Nederland. De uitkomstmaat in deze 3 cohorten was steeds fatale en niet-fatale coronaire hartziekten. De vierde studie is een substudie in het Duitse cohort bij personen zonder indicatie voor statinebehandeling, dat wil zeggen laag-intermediair risico. Hier waren fatale en niet-fatale hart- en vaatziekten de primaire uitkomstmaat. Paixao (2015) voegde een vierde cohortstudie toe aan bovenstaande 3 cohorten: de Dallas Heart Study (DHS). Tegelijk deden zij een SR en meta-analyse van de overall NRI’s van deze 4 cohorten. Alleen de Dallas Heart Study is meegenomen in de beoordeling, aangezien de review hetzelfde is als die van Peters (2012). Verschillende afkapwaarden voor de coronaire kalkscore werden gehanteerd. De leeftijd van de populatie was gemiddeld 44 jaar.
In aanvulling op laatstgenoemde SR rapporteerde Baber (2015) de resultaten van The BioImage Study bij 5.808 asymptomatische patiënten. Hoffmann (2016) deed hetzelfde in het Framingham Heart Study cohort bij 3.486 deelnemers. Dit brengt het totale aantal cohortstudies die voldoen aan de zoekvraag op zes, met een totale populatie van n=22.653.
Resultaten
Peters (2012)
De overall NRI in de Multi-Ethnic Study of Atherosclerosis (MESA) was 25% (95% BI; 16 tot 34%), in de Heinz-Nixdorf-Recall (HNR) studie 20% (95% BI 7 tot 33%) en in de Rotterdam-studie 14% (95% BI; 4 tot 24%). De NRI voor patiënten met een matig verhoogd risico was hoger (MESA: 55% (95%CI 41%-69%), de Rotterdam-studie had gelijke waarden als de MESA en de HNR vond een NRI van 31%).
Paixao (2015)
De overall NRI in de Dallas Heart Study bedroeg 22% (p=0,01) met gebruik van de Framingham-risicoscore en gebruik van de Framingham risico-categorieën als referentie. De gehanteerde risicodrempels voor intermediair risico waren 6% en 20%.
Baber (2015)
De overall NRI in The BioImage Study door toevoeging van de coronaire kalkscore aan de klassieke risicofactoren was 25% (95% BI; 12 tot 36%) voor het primaire eindpunt majeure cardiovaulaire events (cardiovasculaire sterfte, myocardinfarct of ischemisch CVA).
Hoffmann (2016)
De NRI in de Framingham Heart Study door toevoeging van de coronaire kalkscore aan de klassieke risicofactoren in de Framingham Risico score en 10-jaars CV risicocategorieën was 32% (95% BI; 11 tot 53%) voor het primaire gecombineerde eindpunt ‘major CHD’ (coronaire hartziekte-sterfte / myocardinfarct). Voor het eindpunt ‘major CVD’ (major CHD of ischemisch CVA) was de NRI 25% (95% BI; 8 tot 41%).
Bewijskracht van de literatuur
Voor deze prognostische studies werd uitgegaan van in beginsel hoge kwaliteit van de observationele studies bij prognostische vraagstellingen. De bewijskracht voor de uitkomstmaat NRI is met 1 niveau verlaagd in verband met beperkingen in de onderzoeksopzet van de SR van Peters (AMSTAR 8/11). De resultaten van de SR en aanvullende cohortstudies zijn voldoende consistent, homogeen, extrapoleerbaar en precies.
Conclusie
Redelijk GRADE | Het toevoegen van een coronaire kalkscore aan een risicopredictiemodel voor hart- en vaatziekten op basis van alleen klassieke risicofactoren leidt tot klinische significante reclassificatie van specifieke populaties zonder hart- en vaatziekten en zonder diabetes mellitus naar een hogere of lagere risicocategorie. Bronnen (Paixao, 2015; Peters, 2012; Baber, 2015; Hoffmann, 2016) |
Overwegingen
Coronairverkalking wordt onderzocht met behulp van computertomografie (CT). Calcificaties wijzen op (subklinische) coronaire atherosclerose in een gevorderd stadium . De mate van calcificatie, uitgedrukt in de Agatstonscore, is gecorreleerd aan de totale coronaire plaquelast. De waarde van de coronaire kalkscore kan verder worden vergroot wanneer rekening wordt gehouden met de distributie naar leeftijd, geslacht en etnische achtergrond binnen de percentielen. Voor het berekenen van het percentiel kan gebruik gemaakt worden van de Calciumscore Calculator.
Coronairverkalking, en de mate daarvan, is geen indicator voor de (in)stabiliteit van een atherosclerotische plaque maar is wel een sterke langetermijnsrisico-indicator voor het risico op hart- en vaatziekten met toegevoegde waarde bovenop risicofactoren. Een recente publicatie van een cohort met lange follow up (6,5 jaar) waarbij de SCORE2 en de impact van het toevoegen van de kalkscore onderzocht is, liet zien dat het discriminerend vermogen (C-index) van de voorspelling toenam van 0,61 naar 0,75, een klinisch relevant verschil. Ook de reclassificatie verbeterde. De betekenis van een kalkscore van 1 tot 100 of <75e percentiel is minder duidelijk.
Van de coronaire kalkscore is aangetoond dat het een zeer hoge negatieve voorspellende waarde heeft (“the power of zero”), want een Agatstonscore van 0 heeft een negatieve voorspellende waarde van 98% voor het uitsluiten van significante coronaire vernauwing en maakt cardiovasculaire events in de komende jaren zeer onwaarschijnlijk. Belangrijk om te realiseren dat met name relatief jonge mensen geen coronaire kalk hebben ondanks de aanwezigheid van risicofactoren zoals roken, hypertensie en hypercholesterolemie. Daar zou ten onrechte uit kunnen worden afgeleid dat deze risicofactoren geen schade aan coronairen zouden veroorzaken.
Een coronaire kalkscore ≥100 Agatston-eenheden of ≥75e percentiel gecorrigeerd voor leeftijd, geslacht en etniciteit wordt internationaal beschouwd als een duidelijk verhoogd risico op hart- en vaatziekten. Een kalkscore van ≥ 100 gaat gepaard met een grote toename in risico op hart- en vaatziekten en sterfte. Bij een kalkscore van ≥300, zoals in de vorige richtlijn beschreven stond, is er sprake van slechts beperkte extra risicotoename. Paixao (2015) geeft aan dat de afkapwaarde van ≥100 bij jongere patiënten zelfs aan de hoge kant is, aangezien er bij jongere personen binnen het domein van 0-100 al risicotoenames gezien worden. Daarom kan voor jongere patiënten beter worden uitgegaan van het ≥75e percentiel.
De toegevoegde waarde van de coronaire kalkscore is dus inmiddels, zij het nog beperkt, onderzocht voor de in deze richtlijn gebruikte SCORE2-risicocalculator. Tevens worden in deze nieuwe CVRM-richtlijn andere en leeftijd-specifieke afkapgrenzen voor risico gehanteerd. Het is niet bekend wat is het reclassificerende vermogen van kalkscore bij deze leeftijdsspecifieke risicodrempels.
Het reclassificerend vermogen van de coronaire kalkscore is niet onderzocht voor de risicoscores die nu worden aanbevolen in de nieuwe CVRM-richtlijn. Dit geldt ook voor de in deze richtlijn gebruikte recenter ontwikkelde SCORE2 die veel beter het CV-risico kan schatten in vergelijking met oudere risicoscores waarmee het meeste onderzoek naar het reclassificerende vermogen van kalkscore is verricht. Tevens wordt in deze nieuwe CVRM-richtlijn andere en leeftijd-specifieke afkapgrenzen voor risico gehanteerd. Het is niet bekend wat is het reclassificerende vermogen van kalkscore wanneer leeftijdsspecifieke risicodrempels worden gehanteerd. De beschikbare literatuur laat echter zien dat de kritische NRI-grens van 10% bij toevoeging van de coronaire kalkscore aan klassieke risicofactoren telkens ruimschoots gehaald wordt wanneer oude risicoscores worden gebruikt in combinatie met oude en niet leeftijd-specifieke risicodrempels.
Kosten, toepasbaarheid en beschikbaarheid
De kosten van een CT-scan om kalkscore te bepalen, variëren. De kosten zouden kunnen worden afgezet tegen het jarenlang gebruik van medicamenten (met controles) bij behandeling van risicofactoren bij patiënten die door een zeer lage kalkscore worden gereclassificeerd naar een laag cardiovasculair risico, omdat de aan de medicatie verbonden kosten (en bijwerkingen) voorkomen kunnen worden. Een formele kosteneffectiviteitsanalyse ontbreekt echter.
Vrijwel ieder ziekenhuis in Nederland biedt CT-kalkscore aan, waarbij de stralendosis gebruikelijkerwijs onder 1 mSv is (minder dan de helft van jaarlijkse achtergrondstraling in Nederland).
De laatste jaren is de toegang tot de coronaire kalkscore sterk toegenomen. In diverse regio’s in Nederland kunnen huisartsen een coronaire kalkscore al direct aanvragen, zonder tussenkomst van een aanvragend medisch specialist.
Rationale
De aanbevelingen rondom coronaire kalkscore zijn aangepast ten opzichte van de vorige CVRM-richtlijn, terwijl de studies die de NRI van coronaire kalkscores analyseerden niet nieuw zijn. Ontwikkelingen sinds 2019 zijn onder andere dat onderzoek laat zien dat patiënten met een positieve familieanamnese voor hart- en vaatziekten betere therapietrouw laten zien en meer aan leefstijlaanpassingen doen bij het kennen van een relatief hoge coronaire kalkscore. Ook is de toegang tot de coronaire kalkscore sterk toegenomen.
Ondanks de informatie die de coronaire kalkscore geeft voor het risico op hart- en vaatziekten, is het niet wenselijk dat deze bij iedereen wordt bepaald. Met behulp van de scoretabellen is het cardiovasculair risico immers over het algemeen heel goed in te schatten. Echter, het reclassificerend vermogen van de coronaire kalkscore bij mensen met een score die dicht bij een behandeldrempel ligt, kan een reden zijn voor het bepalen van een coronaire kalkscore. In de meeste gevallen is het bepalen van de coronaire kalkscore niet nodig omdat er, meestal naar aanleiding van een goed gesprek tussen patiënt en zorgverlener over het met behulp van een scoretabel geschatte risico en de voor- en nadelen van (vaak langdurige) medicatie, vaak overeenstemming wordt bereikt over het al dan niet starten van medicamenteuze behandeling om het cardiovasculair risico te verlagen. Indien het gesprek geen beslissing oplevert, kan worden overwogen een coronaire kalkscore te bepalen. Dit kan bijvoorbeeld helpen bij een jong persoon met een matig risico op basis van de risicoscoretabel, waarbij een kalkscore van 0 kan voorkomen dat een patiënt onnodig jarenlang medicatie gaat slikken.
In het algemeen zal een coronaire kalkscore van 0 geassocieerd zijn met een lager risico dan berekend op basis van SCORE2 en een score van ≥100 Agatston-eenheden (of ≥75e percentiel gecorrigeerd voor leeftijd, geslacht en etnische achtergrond) met een hoger risico.
Aanbevelingen
- Indien een coronaire kalkscore bekend is, kan deze gebruikt worden om het 10-jaarsrisico op hart- en vaatziekte, geschat met SCORE2, te reclassificeren naar een hoger of lager risico als de coronaire kalkscore daar aanleiding voor geeft.
- Overweeg om een coronaire kalkscore te bepalen bij patiënten tussen de 50 en 70 jaar als een gesprek met de patiënt over het al dan niet starten van medicamenteuze behandeling geen besluit oplevert.
- Houd bij de interpretatie van de kalkscore>0 rekening met leeftijd, geslacht en etnische achtergrond.
- Het resultaat van een coronaire kalkscore kan als volgt gebruikt worden:
- Bij een coronaire kalkscore van 0 kan gereclassificeerd worden naar een lager risico.
- Bij een coronaire kalkscore ≥ 100 (of ≥ 75ste percentiel) kan gereclassificeerd worden naar een hoger risico.
Uitgangsvraag
Wat is de toegevoegde waarde van het ecg bij het reclassificeren van het risico op hart- en vaatziekten?
Deze uitgangsvraag bevat de volgende deelvraag:
- Wat is de toegevoegde waarde van elektrocardiografische linkerventrikelhypertrofie bij het reclassificeren van het risico op hart- en vaatziekten?
Inleiding
Hoewel de meeste hart- en vaatziekten kunnen worden voorspeld met behulp van de klassieke risicofactoren, is er aanzienlijke variatie in de mate van atherosclerose. Er is dus blijvende belangstelling voor niet-invasieve diagnostiek ter verbetering van de risicoschatting op hart- en vaatziekten. Bij personen bij wie de risicoschatting op hart- en vaatziekten op basis van de klassieke risicofactoren op de grens van twee risicocategorieën ligt, zou aanvullende diagnostiek wellicht van waarde kunnen zijn voor een betere risicoschatting en besluitvorming.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvraag: leidt toevoeging van de uitslag van een ecg aan het predictiemodel op basis van alleen klassieke risicofactoren tot een betere risicoschatting bij personen zonder hart- en vaatziekten, afgemeten aan klinisch significante reclassificatie (Net Reclassification Improvement), voor wat betreft hun (tienjaars)mortaliteit en -morbiditeit van hart- en vaatziekten?
P: personen zonder hart- en vaatziekten
I: risicopredictie op basis van klassieke risicofactoren plus ecg
C: risicopredictie op basis van alleen klassieke risicofactoren
O: hart- en vaatziektemorbiditeit, hart- en vaatziektemortaliteit, reclassificatie uitgedrukt in Net Reclassification Index (NRI)
Relevante uitkomstmaten
De werkgroep achtte zowel hart- en vaatziektemorbiditeit/-mortaliteit als reclassificatie voor de besluitvorming kritieke uitkomstmaten. De werkgroep definieerde de genoemde uitkomstmaten niet a priori, maar hanteerde de in de onderzoeken gebruikte definities. De werkgroep definieerde een NRI van 10% voor upward of downward reclassifcatie als een klinisch (patiënt) relevant verschil.
Zoeken en selecteren (methode)
In de database Pubmed is in april 2017 met relevante zoektermen gezocht naar systematische reviews of meta-analyses vanaf 2005. De literatuurzoekactie leverde één systematische review van goede kwaliteit (AMSTAR 11/11), maar geen van de geïncludeerde onderzoeken in deze review had een NRI berekend. In augustus 2017 werd er een aanvullend literatuuronderzoek verricht naar RCT’s of longitudinaal onderzoek in juli 2017 vanaf begin 2011. Onderzoeken werden geselecteerd op grond van het volgende selectiecriterium: prospectief onderzoek (RCT of observationeel). Op basis van titel en abstract werden in eerste instantie negen onderzoeken voorgeselecteerd. Na raadpleging van de volledige tekst werden vervolgens vier onderzoeken geëxcludeerd (zie de exclusietabel onder het tabblad Verantwoording) en vijf onderzoeken definitief geselecteerd.
In totaal zijn vijf onderzoeken opgenomen in de literatuuranalyse. De belangrijkste onderzoekskarakteristieken en resultaten zijn opgenomen in de evidence-tabellen (zie bijlage). De beoordeling van de individuele onderzoeksopzet (risk of bias) is opgenomen in de risk of bias-tabellen (zie bijlage).
Samenvatting van de literatuur
Beschrijving van de onderzoeken
In het onderzoek van Shah (2016) werd een nieuw risicopredictiemodel voor cardiovasculaire mortaliteit ontwikkeld en gevalideerd. Er werden voor dit onderzoek twee Amerikaanse cohorten (NHANES-I en III) met 9969 burgers (inclusief diabeten) zonder hart- en vaatziekten gebruikt. De primaire uitkomstmaat was cardiovasculair overlijden, de secundaire uitkomstmaten waren major acute coronary events (MACE) en totaal overlijden. Het NHANES-III-cohort werd gebruikt om een nieuw risicoschattingsmodel (NHANES ECG risk equation) te valideren. Er werd gebruikgemaakt van de Framingham-risicoscore. De mediane follow-up was 18,8 jaar. Rookstatus, bloeddruk, aantal diabeten, totaal cholesterol en meerdere ecg-afwijkingen waren significant verschillend tussen beide cohorten.
Het onderzoek van Auer (2012) werd verricht in het Health, Aging and Body Composition (Health ABC) cohort onder 2192 volwassenen van zeventig tot 79 jaar zonder hart- en vaatziekten. Gegevens waren verzameld van 1997 tot 1998 en van 2006 tot 2007, de gemiddelde follow-upduur was acht jaar. De primaire uitkomstmaat was coronaire hartziekte, gedefinieerd als acuut myocardinfarct, coronaire mortaliteit of ziekenhuisopname voor angina pectoris of coronaire revascularisatie. Er werd gebruikgemaakt van de Framingham-risicoscore.
Jörgensen (2014) beschrijft een prospectief cohortonderzoek met deelnemers van de Copenhagen City Heart study. Personen van 65 jaar en ouder zonder hart- en vaatziekten werden benaderd voor deelname. De mediane duur van follow-up was 11,9 jaar voor cardiovasculaire morbiditeit en 9,8 jaar voor cardiovasculaire morbiditeit en mortaliteit. Er werd gebruikgemaakt van de Framingham-risicoscore of European Heart-score. Deelnemers met een follow-up van minder dan tien jaar werden geëxcludeerd. Gebruikte uitkomstmaten waren cardiovasculaire mortaliteit en gecombineerde cardiovasculaire morbiditeit en mortaliteit.
Graversen (2016) deed een onderzoek naar verbetering van de SCORE onder 8476 deelnemers uit de Copenhagen City Heart study. Deelnemers van tachtig jaar en ouder of deelnemers met hart- en vaatziekten of diabetes werden geëxcludeerd. De gebruikte uitkomstmaat was cardiovasculaire mortaliteit. De prognostische factor was major of minor ecg-afwijking. Er werd gebruikgemaakt van het Systemic Coronary Risk Evaluation (SCORE) algoritme.
In The Multi-Ethnic Study of Atherosclerosis (MESA) werd het reclassificerende vermogen van ecg-afwijkingen en de CAC-score berekend voor het risico op coronaire hartziekten. De mediane follow-upduur was tien jaar. Er werd een nieuwe risicopredictiemodel gemaakt met gebruik van klassieke risicofactoren met of zonder ecg.
Resultaten
I Gecombineerde ecg-afwijkingen als prognostische factor
a) Totale NRI
Morbiditeit als gevolg van hart- en vaatziekten
In het Health ABC-cohort was de NRI voor cardiovasculaire morbiditeit en mortaliteit 7,4% (95%-BI 3,1 tot 19,05). In het onderzoek van Jörgensen (2014) was de NRI 4,2% (95%-BI 3,5 tot 5,6%) voor de gecombineerde uitkomstmaat cardiovasculaire morbiditeit en mortaliteit. De NRI voor de uitkomstmaat coronaire morbiditeit was 2% (95%-BI niet gegeven) en 5% (95%-BI niet gegeven) voor de gecombineerde uitkomstmaat coronaire morbiditeit en mortaliteit in het onderzoek van Desai.
Mortaliteit als gevolg van hart- en vaatziekten
In het onderzoek van Shah was de NRI 11% (95%-BI 7 tot 4%). In het onderzoek van Jörgensen was de NRI 7,1% (95%-BI 6,7 tot 9%). In het onderzoek van Graversen was de NRI 1,9% (95%-BI niet gegeven, p = 0,540) in de populatie van 40 tot 70 jaar. In de totale populatie was de NRI 1,9% (95%-BI niet gegeven, p = 0,423). De NRI was 9% (95%-BI niet gegeven) voor coronaire mortaliteit in het onderzoek van Desai.
b) Intermediaire NRI
Morbiditeit als gevolg van hart- en vaatziekten
De gecorrigeerde NRI voor de intermediaire groep was 6,7% (95%-BI 1,2 tot 19,3%) in het Health ABC-cohort. Het grootste deel van de reclassificatie was naar de lagere risicogroep.
Mortaliteit als gevolg van hart- en vaatziekten
De NRI voor de intermediaire risicogroep voor major ecg-afwijkingen was 6,7% (95%-BI niet gegeven, p = 0,370). De NRI was niet gecorrigeerd voor subgroepanalyse, zoals eerder beschreven.
II Elektrocardiografische LVH als prognostische factor
Morbiditeit als gevolg van hart- en vaatziekten
In het onderzoek van Jörgensen werd een NRI van -1,1% (95%-BI -2,3 tot 0,1) gevonden voor cardiovasculaire morbiditeit en mortaliteit.
Mortaliteit als gevolg van hart- en vaatziekten
De NRI was 2,7% (95%-BI 1,0 tot 4,4) in het onderzoek van Jörgensen.
Bewijskracht van de literatuur
Voor deze prognostische onderzoeken werd uitgegaan van in beginsel hoge kwaliteit van observationeel onderzoek.
I Ecg-afwijkingen als prognostische factor
De bewijskracht voor de uitkomstmaat NRI (totaal en intermediair) is met twee niveaus verlaagd in verband met het gebruik van een andere risicoscore (overwegend Framingham in plaats van SCORE) en publicatiebias.
II Elektrocardiografische LVH als prognostische factor
De bewijskracht voor de uitkomstmaat NRI is met drie niveaus verlaagd gezien de beperkingen in onderzoeksopzet (alleen leeftijd ≥ 65 jaar), het gebruik van een andere risicoscore (overwegend Framingham in plaats van SCORE) en publicatiebias.
Conclusie
| Laag GRADE | Mogelijk leidt het toevoegen van een ecg aan een risicopredictiemodel voor hart- en vaatziekten op basis van klassieke risicofactoren niet tot klinisch significante reclassificatie van de populatie naar een hogere of lagere risicocategorie. |
| Laag GRADE | Mogelijk leidt het toevoegen van een ecg aan de intermediaire risicogroep op basis van een risicopredictiemodel voor hart- en vaatziekten met klassieke risicofactoren niet tot klinisch significante reclassificatie van de populatie naar een hogere of lagere risicocategorie. Bronnen: Auer 2012, Graversen 2016 |
| Zeer laag GRADE | We zijn te onzeker of het toevoegen van een elektrocardiografische LVH aan een risicopredictiemodel voor hart- en vaatziekten op basis van klassieke risicofactoren leidt tot klinisch significante reclassificatie van de populatie naar een hogere of lagere risicocategorie. |
| Bron: Jörgensen 2014 |
Overwegingen
Hoewel elektrocardiografische afwijkingen bij patiënten zonder hart- en vaatziekten een voorspellende waarde hebben op cardiovasculaire morbiditeit en mortaliteit, leidt het toevoegen van de ecg aan de traditionele risicoschattingen (Framingham en SCORE) niet tot een betere cardiovasculaire risicoschatting. Daarnaast zijn er ook nadelen van het verrichten van een ecg, zoals fout-positieve afwijkingen bij asymptomatische patiënten, die beperkt zijn onderzocht. In een Amerikaans retrospectief onderzoek in de huisartsenpraktijk kregen patiënten zonder hart- en vaatziekten na een ecg (in het kader van een jaarlijkse screening) 5,1 keer vaker aanvullende onderzoeken, visites en ingrepen ten opzichte van patiënten zonder ecg. Er waren iets meer cardiaalgerelateerde opnamen (0,46% versus 0,12%), coronaire revascularisaties (0,20% versus 0,04%) en overlijden (0,19% versus 0,16%) in de groep van patiënten zonder hart- en vaatziekten die een screenend ecg hadden gekregen ten opzichte van de patiënten zonder ecg. Het totale risico op hart- en vaatziekten was in beide groepen zeer laag [Bhatia 2017]. Er zijn wel veel andere indicaties voor het maken van een ecg.
Er is onvoldoende bewijs dat een elektrocardiografisch vastgestelde LVH leidt tot een betere risicoschatting ten opzichte van de traditionele risicoschattingen alleen. In een onderzoek van Tocci (2017) was elektrocardiografische LVH niet voorspellend voor een hoog risicoprofiel (≥ 5 met SCORE): bij LVH vastgesteld met Sokolow-Lyon-criteria was de OR 0,81 (95%-BI 0,18 tot 3,64) en bij LHV vastgesteld met Cornell Voltage OR 1,44 (95%-BI 0,37 tot 6,21) [Tocci 2017].
Aanbeveling
Zie af van een ecg met het doel de risicoschatting te verbeteren bij personen zonder hart- en vaatziekten.
Uitgangsvraag
Wat is de toegevoegde waarde van de enkel-armindex bij het reclassificeren van het risico op hart- en vaatziekten?
Inleiding
De enkel-armindex (EAI) is een makkelijk uit te voeren en reproduceerbare test om asymptomatische atherosclerotische aandoeningen te herkennen. Een EAI < 0,9 geeft een ≥ 50% verhoogde kans op een stenose tussen de aorta en de distale beenslagaderen. Vanwege de acceptabele sensitiviteit (79%) en specificiteit (90%) wordt een EAI < 0,9 gezien als een betrouwbare marker voor perifeer arterieel vaatlijden (PAV). Een EAI-waarde die wijst op significant PAV heeft een toegevoegde waarde voor de medische voorgeschiedenis, want 50 tot 89% van de patiënten met een EAI < 0,9 heeft geen typische claudicatioklachten, terwijl PAV aanwezig is bij 12 tot 27% van de asymptomatische personen > 55 jaar.
De EAI is omgekeerd evenredig met het risico op hart- en vaatziekten, maar er bestaat discussie over de mogelijkheid de EAI te gebruiken om patiënten te reclassificeren in verschillende risicocategorieën voor hart- en vaatziekten.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvraag: leidt toevoeging van de uitslag van een enkel-armindex aan het predictiemodel op basis van alleen klassieke risicofactoren tot een betere risicoschatting bij personen zonder hart- en vaatziekten, afgemeten aan klinisch significante reclassificatie (Net Reclassification Improvement), voor wat betreft hun (tienjaars)mortaliteit en -morbiditeit van hart- en vaatziekten?
P: personen zonder hart- en vaatziekten
I: risicopredictie op basis van klassieke risicofactoren plus enkel-armindex
C: risicopredictie op basis van alleen klassieke risicofactoren
O: hart- en vaatziekte-morbiditeit, hart- en vaatziektemortaliteit, reclassificatie uitgedrukt in Net Reclassification Index (NRI)
Relevante uitkomstmaten
De werkgroep achtte zowel hart- en vaatziektemorbiditeit/-mortaliteit als reclassificatie voor de besluitvorming kritieke uitkomstmaten. De werkgroep definieerde de genoemde uitkomstmaten niet a priori, maar hanteerde de in de onderzoeken gebruikte definities. De werkgroep definieerde een NRI van 10% voor upward of downward reclassifcatie als een klinisch (patiënt) relevant verschil.
Zoeken en selecteren (methode)
Er werd een systematisch literatuuronderzoek verricht met bovenstaande uitgangsvraag, die in eerste instantie beperkt werd tot meta-analyses en systematische reviews (zie Verantwoording). Op basis van titel en abstract werden er van de 96 reviews acht geselecteerd. Een van de acht reviews was van goede kwaliteit en bruikbaar voor beantwoording van de uitgangsvraag. De gebruikte publicatie is een onderdeel van een grotere systematische review met zes zoekvragen. Alleen onderzoeken uit de systematische review waarin een NRI was berekend zijn meegenomen in de resultaten. Er werd een aanvullend literatuuronderzoek verricht naar RCT’s en cohortonderzoeken vanaf de zoekdatum van de laatste systematische review (september 2012). Van de 459 gevonden artikelen voldeden er drie onderzoeken aan de uitgangsvraag. Daarnaast werd één onderzoek gevonden via de referenties van andere onderzoeken.
In totaal zijn er vijf onderzoeken opgenomen in de literatuuranalyse. De belangrijkste onderzoekskarakteristieken en resultaten van de systematische review en cohorten zijn opgenomen in de evidence-tabellen (zie bijlage). De beoordeling van de individuele onderzoeksopzet (risk of bias) is opgenomen in de risk of bias-tabellen (zie bijlage).
Samenvatting van de literatuur
Beschrijving van de onderzoeken
De systematische review is uitgevoerd door de United States Preventive Services Task Force (USPSTF). In deze systematische review werden veertien onderzoeken van matige tot goede kwaliteit en één meta-analyse van de ABI collaboration-cohorten van matige kwaliteit geïncludeerd [Ankle Brachial Index collaboration 2008]. Van de veertien onderzoeken in deze review werd in vier onderzoeken de uitkomstmaat NRI berekend. Twee van deze onderzoeken, de Rotterdam Study en de Atherosclerosis Risk in Communities (ARIC) study zijn later gaan deelnemen aan de ABI collaboration-cohorten en maken deel uit van de heranalyse. Een van de vier onderzoeken, de Multi-Etnic Study of Atherosclerosis (MESA), is na publicatie van de systematische review van Lin (2013) nogmaals geanalyseerd. Het laatste onderzoek is de Health, Aging and Body Composition (Health ABC) study. De ABI collaboration bestond in 2014 uit achttien cohorten. In de analyse van Fowkes werd een nieuw predictiemodel met de EAI ontwikkeld en gevalideerd in een interne en externe validatiedataset van patiënten uit de ABI collaboration cohorten (n = 44.752). Dit model werd ontwikkeld voor mannen en vrouwen afzonderlijk.
In de Rotterdam Study werden 5933 personen zonder hart- en vaatziekten geïncludeerd. De gemiddelde leeftijd was 69 jaar en 59% was vrouw. In de Health ABC study werden 2191 personen zonder hart- en vaatziekten geïncludeerd. De gemiddelde leeftijd was 74 jaar en 55% was vrouw. In de ARIC study werden 11594 personen zonder hart- en vaatziekten geïncludeerd. De gemiddelde leeftijd was 54 jaar en 56% was vrouw. In de MESA werden 1330 personen zonder hart- en vaatziekten geïncludeerd. De gemiddelde leeftijd was 64 jaar en 33% was vrouw. Een latere analyse van het MESA-cohort wordt hieronder beschreven.
In de MESA werden 5185 personen zonder hart- en vaatziekten geïncludeerd. De gemiddelde leeftijd in het cohort was 61 jaar, 53% was vrouw en het aantal hart- en vaatziekten was 6,2% na tien jaar.
In het Framingham-REGIGOR-cohort werden 5248 personen zonder hart- en vaatziekten geïncludeerd. De gemiddelde leeftijd in het cohort was 54 jaar, 54% was vrouw en het aantal hart- en vaatziekten was 3,8% na tien jaar.
In het onderzoek van Ferket (2014) werden personen zonder hart- en vaatziekten uit het National Health and Nutrition Examination Survey (NHANES) cohort (n = 3736) en een subset van de Rotterdam Study (n = 1915) geïncludeerd. De gemiddelde leeftijd in het NHANES-cohort was 53 jaar, 52% was vrouw. De mediane leeftijd in de Rotterdam Study was zeventig jaar, 45% was man.
Resultaten
I. NRI totale groep
Morbiditeit als gevolg van hart- en vaatziekten
In de Health ABC study was de NRI 3,0% (95%-BI 0,04 tot 6,5%) voor de gecombineerde uitkomstmaat coronaire morbiditeit en mortaliteit. In de ARIC study was de NRI 0,8% (95%-BI niet gegeven, p = 0,05) voor de gecombineerde uitkomstmaat cardiovasculaire morbiditeit en mortaliteit. In de ABI collaboration-cohorten was de NRI 4,3% (95%-BI 0,0 tot 7,6%) voor mannen en 9,6% (95%-BI 6,1 tot 16,4%) voor vrouwen voor de gecombineerde uitkomstmaat coronaire morbiditeit en mortaliteit. In de MESA was de NRI 3,9% (95%-BI -1,1 tot 10,9%) voor de gecombineerde uitkomstmaat cardiovasculaire morbiditeit en mortaliteit. In het Framingham-REGIGOR-cohort (n = 5248) was de NRI 2,9% (95%-BI 1,4 tot 4,5%) voor de gecombineerde uitkomstmaat cardiovasculaire morbiditeit en mortaliteit.
Mortaliteit als gevolg van hart- en vaatziekten
In de Rotterdam Study was de NRI 0,6% (95%-BI -1,8 tot 2,9%) (coronaire mortaliteit). In de Health ABC study was de NRI 7,9% (95%-BI niet gegeven) (coronaire mortaliteit). In de ABI collaboration-cohorten was de NRI 5,7% voor mannen en 15,7% voor vrouwen. Het grotere effect bij vrouwen werd mogelijk veroorzaakt door een lage voorspellende waarde van de Framingham-risicoscore in de externe validatieset. In een model waarin alle waarden van de Framingham-risicoscore en de ABI afzonderlijk werden toegevoegd was de NRI bij mannen 2,0% (95%-BI -2,3 tot 4,2%) en bij vrouwen 1,1% (95%-BI -1,9 tot 4,0%) voor coronaire mortaliteit. In het NHANES/Rotterdam Study-cohort was de NRI 0,0% (95%-BI -3,0 tot 3,0%).
II. NRI intermediaire groep
De definities voor intermediaire groep verschillen per onderzoek. NRI-berekeningen voor intermediaire risicosubgroepen zonder correctie voor vertekening zijn altijd hoger dan de gecorrigeerde NRI’s en zijn waarschijnlijk overschattingen.
Morbiditeit als gevolg van hart- en vaatziekten
In het Rotterdam Study-cohort was de gecorrigeerde NRI 3,8% (95%-BI -2,9 tot 10,5) (ernstige coronaire morbiditeit) voor de intermediaire groep (10 tot 20% tienjaarsrisico). In het Health ABC-cohort was de niet gecorrigeerde NRI 19,3% (95%-BI niet berekend) (ernstige coronaire morbiditeit) voor de intermediaire groep (10 tot 20% 7,5-jaarsrisico). In het MESA-cohort was de gecorrigeerde NRI 3,6% (95%-BI niet berekend) (ernstige coronaire morbiditeit) voor de intermediaire groep (6 tot 19% tienjaarsrisico). In de ABI collaboration-cohorten was de niet gecorrigeerde NRI 15,9% (95%-BI 6,1 tot 20,6%) voor mannen en 23,3% (95%-BI 13,8 tot 62,5%) voor vrouwen (ernstige coronaire morbiditeit) voor de intermediaire groep (10 tot 19% tienjaarsrisico). In het Framingham-REGIGOR-cohort was de niet gecorrigeerde NRI 5,1% (95%-BI 1,5 tot 10,6%) voor de gecombineerde uitkomstmaat cardiovasculaire morbiditeit en mortaliteit voor de intermediaire groep (5 tot 10% tienjaarsrisico).
Mortaliteit als gevolg van hart- en vaatziekten
In het MESA-cohort was de niet gecorrigeerde NRI 6,8% (95%-BI niet berekend) voor de intermediaire groep (6 tot 19% tienjaarsrisico). In de ABI collaboration-cohorten was de niet gecorrigeerde NRI 20,2% (95%-BI 11,6 tot 22,5%) voor mannen en 18,0% (95%-BI 13,1 tot 18,0%) voor vrouwen.
Bewijskracht van de literatuur
Voor deze prognostische onderzoeken werd uitgegaan van in beginsel hoge kwaliteit van observationeel onderzoek.
De bewijskracht voor de uitkomstmaat NRI (totale en intermediaire) is met drie niveaus verlaagd door kans op vertekening in verband met het gebruik van verschillende uitkomstmaten en verschillende referentiegroepen van de enkel-armindex, indirect bewijs door gebruik van een andere risicoscore (Framingham in plaats van SCORE) en publicatiebias.
Conclusie
| Zeer laag GRADE | We zijn onzeker of het toevoegen van een enkel-armindex aan een risicopredictiemodel voor hart- en vaatziekte op basis van traditionele risicofactoren leidt tot klinisch significante reclassificatie van de populatie naar een hogere of lagere risicocategorie. |
| Bronnen: Lin 2013, Fowkes 2014, Yehboah 2016, Velescu 2015, Ferket 2014 |
| Zeer laag GRADE | We zijn onzeker of het toevoegen van een enkel-armindex aan een intermediaire risicogroep op basis van een risicopredictiemodel voor hart- en vaatziekten met traditionele risicofactoren leidt tot klinisch significante reclassificatie van de populatie naar een hogere of lagere risicocategorie. |
| Bronnen: Lin 2013, Fowkes 2014, Velescu 2015 |
Overwegingen
De additieve waarde van de enkel-armindex (EAI) toegevoegd aan een risicopredictiemodel op basis van bovenstaande literatuur is beperkt. Daarbij is in het belangrijkste cohort (ABI collaborations) van deze literatuur de Framingham-risicoschatting gebruikt en niet de in Nederland gebruikelijke SCORE. De Framingham-risicoschatting is een slecht predictiemodel voor hart- en vaatziekten in andere populaties dan de Amerikaanse. Tevens is de EAI in verschillende cohorten op verschillende manieren gemeten en zijn er ook uiteenlopende uitkomstmaten gebruikt. In sommige cohorten zijn alleen patiënten geëxcludeerd met een voorgeschiedenis van coronaire hartziekten, maar niet met andere hart- en vaatziekten. Dit kan voor een vertekening gezorgd hebben.
De ESC-richtlijn 2016 stelt dat zowel de coronaire calciumscore, als atherosclerotische plaquedetectie door middel van scannen van de arteria carotis, als de EAI overwogen kunnen worden als een risicomodificator in de beoordeling van het cardiovasculaire risico. Deze aanbeveling komt overeen met de aanbeveling van de American College of Cardiology Foundation/AHA-richtlijn 2013.
Vanuit patiëntenperspectief is er het belang om meer zekerheid te geven over de hoogte van het cardiovasculaire risico en het al dan niet starten met behandeling. Daarvoor moet een onderzoek echter wel genoeg toegevoegde waarde hebben.
Organisatorische aspecten: de EAI is in de Nederlandse zorg goed beschikbaar, zowel in het ziekenhuis als in de eerste lijn. Dat is echter in het kader van onderzoek naar perifeer arterieel vaatlijden, waarbij er bij de uitvoering van het doppleronderzoek in de eerste lijn randvoorwaarden zijn: voldoende scholing en het onderhouden van ervaring door het regelmatig uitvoeren van deze meting (zie de NHG-Standaard Perifeer arterieel vaatlijden). Uitbreiden van de indicatie voor een EAI naar een factor in het bepalen van het cardiovasculaire risico zou een grote toename van het aantal onderzoeken betekenen, waarbij er geen onderzoek is gedaan naar de kosteneffectiviteit.
Gezien de beperkte toegevoegde waarde van de EAI aan de beschikbare risicomodellen en het niet voldoen aan de door de werkgroep gestelde waarde van NRI als klinisch relevant verschil adviseert de werkgroep om niet actief een EAI uit te voeren ter ondersteuning van het bepalen van het cardiovasculaire risico. Als toevallig al een EAI gedaan is, en het risico is in de buurt van de behandeldrempel in het kader van het cardiovasculaire risico, dan kan de EAI wel meegewogen worden in de beoordeling.
Aanbeveling
- Zie af van een enkel-armindex met het doel de risicoschatting te verbeteren bij personen zonder hart- en vaatziekten.
Uitgangsvraag
Wat is de toegevoegde waarde van etnische achtergrond bij het reclassificeren van het risico op hart- en vaatziekten?
Inleiding
In Nederland wonen veel personen van verschillende komaf. Er is veel literatuur die suggereert dat afkomst van invloed is op het cardiovasculaire risico, onafhankelijk van overige risicofactoren. Voor risicoschatting is het vooral van belang of toevoegen van afkomst aan de standaard risico-informatie een betere risicoschatting oplevert. Dit kan worden beoordeeld door reclassificatie te analyseren.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvraag:
Leidt toevoeging van afkomst aan het predictiemodel op basis van alleen klassieke risicofactoren tot een betere risicoschatting bij patiënten zonder hart- en vaatziekten, afgemeten aan klinisch significante (>10%) reclassificatie (Net Reclassification Index), voor wat betreft hun (10-jaars) mortaliteit- en morbiditeit aan hart- en vaatziekten?
P: personen zonder hart- en vaatziekten;
I: risicopredictie op basis van klassieke risicofactoren plus andere etnische achtergrond dan de Nederlandse (patiënten van Surinaamse, Turkse, Marokkaanse, Aziatische, Oost-Europese en Afrikaanse afkomst);
C: risicopredictie op basis van alleen klassieke risicofactoren;
O: hart- en vaatziekten morbiditeit, hart- en vaatziekten mortaliteit, reclassificatie uitgedrukt in Net Reclassification Index (NRI).
Relevante uitkomstmaten
De werkgroep achtte zowel hart- en vaatziekten morbiditeit/mortaliteit als reclassificatie voor de besluitvorming kritieke uitkomstmaten. De werkgroep definieerde de genoemde uitkomstmaten niet a priori, maar hanteerde de in de studies gebruikte definities. De werkgroep definieerde een NRI van 10% voor upward of downward reclassificatie als een klinisch (patiënt) relevant verschil.
Zoeken en selecteren (Methode)
Zoekactie – september 2017
In de database Medline (via OVID) is tot 25 september 2017 met relevante zoektermen gezocht naar systematische reviews en observationele studies. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 156 treffers op met zoekfilter systematische reviews/meta-analyses.
Studies werden door twee onderzoekers onafhankelijk van elkaar geselecteerd op grond van de volgende selectiecriteria: systematische reviews (gedetailleerde zoekstrategie, Risk of Bias beoordeling, evidence-tabel) en relevantie voor de uitgangsvraag. Conflicten werden via onderlinge discussie opgelost. Op basis van titel en abstract werden in eerste instantie 2 studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens geen studies geëxcludeerd en 2 studies definitief geselecteerd.
Update – maart 2022
In maart 2022 is de zoekactie herhaald, waarbij de zoekstrategie geüpdatet is naar de Nederlandse situatie (zie Zoekverantwoording). Op basis van titel en abstract werden in eerste instantie 21 studies voorgeselecteerd. Na raadpleging van de volledige tekst van 3 artikelen werden vervolgens 3 studies geëxcludeerd en geen studie definitief geselecteerd (voor meer detail, zie de exclusietabel in de Totstandkoming).
Resultaat literatuurzoekactie
Eén meta-analyse en één cohortstudie zijn opgenomen in de literatuuranalyse. De belangrijkste studiekarakteristieken en resultaten zijn opgenomen in de evidence-tabellen (zie Totstandkoming). De beoordeling van de individuele studieopzet (Risk of Bias) is opgenomen in de Risk of Bias tabellen.
Samenvatting literatuur
Beschrijving studies
Gijsberts (2015) gebruikt data van een meta-analyse op patiëntniveau, waarin 17 cohortstudies wereldwijd zijn geïncludeerd. De data van 15 cohorten met individuele records van 60.211 deelnemers, zonder bekende voorgeschiedenis van hart- en vaatziekten werden gebruikt voor de analyse. In de totale populatie was de gemiddelde leeftijd op baseline 59 jaar, 51% was man. In de totale populatie had 78% een Europese of Noord-Amerikaanse, 12% een Afrikaanse, 6% een Aziatische en 2% een Latijns-Amerikaanse achtergrond (NB in het artikel wordt gesproken over white, black, Asian en Hispanic). De gemiddelde follow-upduur was 9,1 jaar. De uitkomst cardiovasculair event werd gedefinieerd als eerste keer beroerte of myocardinfarct. De invloed van etniciteit op de associatie tussen Framingham-risicofactoren en hart- en vaatziekten werd berekend door een interactieterm voor etniciteit met elke risicofactor toe te voegen aan regressieanalyses.
Drawz (2012) onderzochten in hoeverre het toevoegen van chronische nierziekte en etnische achtergrond aan het Framingham-predictiemodel de risicostratificatie verbeterde bij patiënten met hypertensie. De primaire uitkomst was coronaire hartziekte, dit was een samengestelde maat voor fatale coronaire hartziekten, niet-fatale myocardinfarcten, coronaire revascularisatie, en angina. De data van in totaal 19.811 deelnemers, zonder bekende geschiedenis van hart- en vaatziekten werden gebruikt voor de analyse. Deze deelnemers werden gerandomiseerd naar een ontwikkelsample (N=13.207) en een validatiesample (N=6.604). In de ontwikkelsample had 61% een Europese of Noord-Amerikaanse afkomst, en 39% een Afrikaanse afkomst (het artikel spreekt over non-black and black). De gemiddelde leeftijd op baseline was in beide groepen 64 jaar. De reclassificatie van deelnemers in hogere of lagere categorieën tussen het basismodel en het model met chronische nierziekte, gestratificeerd naar etniciteit, werd geëvalueerd met de Net Reclassification Index (NRI).
Resultaten
Hart- en vaatziekten morbiditeit
In de meta-analyse van Gijsberts was de 10-jaars event rate van hart- en vaatziekten 6,7% voor mensen met Aziatische afkomst; 7,8% voor Latijns-Amerikaanse afkomst; 8,1% voor Europese of Noord-Amerikaanse afkomst en 9,2% voor mensen met een Afrikaanse afkomst.
De regressieanalyses waaraan etniciteit was toegevoegd, hadden een betere ‘model fit’ dan zonder etniciteit (likelihood ratio test p<0,001). Leeftijd en totaal-cholesterol hadden een significante interactie met etniciteit. De HR voor cardiovasculair event (eerste keer beroerte of myocardinfarct) per 10 jaar toename in leeftijd was 20% lager bij mensen met Afrikaanse afkomst (HR 1,52; 95% BI 1,44 tot 1,60) dan bij Europese of Noord-Amerikaanse afkomst (1,89; 95% BI 1,86 tot 1,93). De HR voor cardiovasculair event per 1 mmol/L toename in totaal-cholesterol was 10% hoger bij mensen met Afrikaanse afkomst (HR 1,20; 95% BI 1,13 tot 1,26) dan bij Europese en Noord-Amerikaanse afkomst (1,09; 95% BI 1,07 tot 1,12). De overige interactietermen waren niet statistisch significant.
Geconcludeerd werd dat de associatie tussen Framingham-risicofactoren met hart- en vaatziekten dezelfde richting opgaat voor verschillende etnische groepen, maar dat de grootte van de associatie voor leeftijd en totaal-cholesterol verschilt voor mensen van Afrikaanse afkomst ten opzichte van Europese en Noord-Amerikaanse afkomst. Voor de andere risicofactoren en etnische groepen was de associatie niet statistisch significant verschillend. Gijsberts heeft de Net Reclassification Index, noch andere parameters van predictie-accuratesse (bijvoorbeeld kalibratie) onderzocht.
Net Reclassification index (NRI)
De NRI voor het 5-jaarsrisico op hart- en vaatziekten werd berekend door Drawz (2012)
en geeft aan in hoeverre het model inclusief chronische nierziekte en etnische achtergrond) in staat is om deelnemers te classificeren vergeleken met het model zonder deze variabelen. Er was geen verbetering van risicoclassificatie door toevoeging van chronische nierziekte en etnische achtergrond, want geen van de berekende NRI’s was statistisch significant (Noord-Amerikaanse afkomst: mannen NRI 1,3%, P=0,54; vrouwen NRI -5,5%, P=0,11; Afrikaanse afkomst: mannen NRI -4,1%, P=0,46; vrouwen NRI 4,4%, P=0,31). Het effect van enkel toevoeging van etnische achtergrond (zonder chronisch nierziekte) werd niet weergegeven.
Bewijskracht van de literatuur
Hart- en vaatziekten morbiditeit: De bewijskracht voor de uitkomstmaat hart- en vaatziekten morbiditeit is met 3 niveaus verlaagd gezien beperkingen in de onderzoeksopzet (Risk of Bias: verschil in looptijd cohorten en verschillende definiëring etnische groepen); extrapoleerbaarheid (bias ten gevolge van indirectheid: andere definitie uitkomstmaat, Framingham risk model in plaats van SCORE; andere etnische groepen dan in PICO; vijf-jaarsrisico in plaats van tien-jaarsrisico); publicatiebias.
Conclusie
Zeer laag GRADE | Het is onzeker of toevoegen van etnische achtergrond aan een risicopredictiemodel leidt tot reclassificatie van het risico op hart- en vaatziekten bij patiënten zonder hart- en vaatziekten. Bronnen: Gijsberts 2015, Drawz 2012 |
Overwegingen
Uit de internationale literatuur komt niet duidelijk naar voren of het toevoegen van etnische achtergrond aan het risicopredictiemodel leidt tot reclassificatie van het risico op hart- en vaatziekten.
Vermeldenswaardig is de Britse QRISK2-risicoscore. Deze score vertoonde betere predictiekarakteristieken dan de voorganger QRISK1, maar verschilde van QRISK1 op meerdere punten dan alleen de toevoeging van etnische achtergrond. Bovendien waren de etnische groepen heel verschillend van de etnische groeperingen die in Nederland woonachtig zijn. Om die reden is de analyse die aantoont dat QRISK2 beter was dan QRISK1 niet meegenomen in het literatuuronderzoek.
Eerste-generatiemigranten hebben meestal een lagere mortaliteit ten gevolge van hart- en vaatziekten dan de oorspronkelijke bewoners van het gastland , maar in de loop van de tijd naderen eerste generatie migranten meestal het risico op hart- en vaatziekten van hun gastland. In vergelijking met de oorspronkelijke bewoners van het gastland varieert het mortaliteitsrisico op hart- en vaatziekten, evenals de prevalentie en het beleid ten aanzien van risicofactoren voor hart- en vaatziekten onder eerste generatie migranten afhankelijk van het land van oorsprong en het gastland. Gelet op de aanzienlijke variabiliteit in risicofactoren voor hart- en vaatziekten tussen migrantengroepen is er geen specifieke risicoscore voor hart- en vaatziekten die voldoet voor alle groepen, en het gebruik van etnisch-specifieke scores moet worden overwogen.
Eerste generatie migranten uit Turkije hebben een hoger geschat risico op hart- en vaatziekte en hogere mortaliteitscijfers voor hart- en vaatziekten dan patiënten van Nederlandse afkomst. Dit lijkt vooral te komen door een hogere incidentie van roken, diabetes mellitus, dyslipidemie, hypertensie en obesitas.
Eerste generatie migranten uit Marokko hebben een lagere incidentie van hart- en vaatziekten dan patiënten van Nederlandse afkomst. Mogelijke verklaringen zijn een lagere bloeddruk en cholesterolwaarden en een lager aantal rokers , hoewel er ook een hogere incidentie is gevonden van diabetes mellitus en obesitas. Er werden geen verschillen gevonden tussen patiënten met een Marokkaanse migratieachtergrond en patiënten van Nederlandse afkomst wat betreft het onder controle houden van hypertensie.
Eerste generatie immigranten uit Afrikaanse landen ten zuiden van de Sahara en uit het Caraïbisch gebied hebben in sommige onderzoeken een hogere incidentie van hart- en vaatziekten dan oorspronkelijke bewoners van het gastland (Groot-Brittannië en Spanje), maar niet in alle. Afrikaanse immigranten hebben een hogere incidentie van diabetes mellitus maar roken minder dan de oorspronkelijke bewoners van het gastland (Nederland en Engeland). Management van risicofactoren voor hart- en vaatziekten was in een onderzoek minder goed dan onder oorspronkelijke bewoners, maar niet in een ander onderzoek.
Met betrekking tot overige categorieën laten enkele Nederlandse cohortonderzoeken een wisselend beeld zien van verhoogde prevalenties, op relatief jongere leeftijd, van diabetes mellitus, (slecht gereguleerde) hypertensie en hart- en vaatziekten in onder andere Hindostaanse, Aziatisch-Surinaamse en Afro-Surinaamse personen. Het risico op hart- en vaatziekten bij hen is vermoedelijk tenminste gedeeltelijk onafhankelijk van de klassieke risicofactoren, maar dit is nog onvoldoende onderzocht om hier precieze uitspraken over te doen. Inmiddels is men met een onderzoek binnen de HELIUS-studie gestart naar de validiteit van SCORE2 in etnische groepen in Nederland.
Update 2023
Uiteindelijk is de belangrijkste vraag of toevoeging van etnische achtergrond aan het risicoprofiel een reden is om de risicoschatting aan te passen. In de ESC-richtlijn Cardiovascular disease prevention in clinical practice wordt het advies gegeven om de schatting van het risico op hart- en vaatziekten te vermenigvuldigen met een RR gebaseerd op resultaten uit een Engelse studie. De onderzochte etnische groepen (onder andere Pakistanen en Indiërs) laten zich echter lastig te extrapoleren naar de Nederlandse situatie. De gegevens suggereren wel dat het risico verschillend is tussen groepen. Echter, de groep Nederlanders met een Afrikaanse afkomst betreft voor een belangrijk deel mensen met een Afro-Surinaamse achtergrond die juist een hoog risico hebben. Daarom is besloten de aanbeveling uit de ESC-richtlijn niet over te nemen voor Nederland en het nieuwe onderzoek uit de HELIUS-studie af te wachten. Wel zijn er voldoende aanwijzingen dat bepaalde etnische groepen een ongunstiger risicoprofiel hebben (vooral ten aanzien van diabetes mellitus en hypertensie) en is alertheid daarop aan te bevelen.
Een zeer recent onderzoek suggereert dat SCORE2 het risico onderschat bij Nederlanders met een Surinaamse afkomst. Deze resultaten vragen om verdere validatie, liefst ook met verder onderscheid naar Afro-Surinaamse en Zuid-Aziatisch Surinaamse origine. Uit ditzelfde onderzoek kwam ook naar voren dat lagere sociaaleconomische status onafhankelijk geassocieerd is met een hoger cardiovasculair risico. Daarom zou verdiscontering van sociaaleconomische status als risicomodificator (zie ook paragraaf 1.2 Hoe wordt het cardiovasculair risico geschat en wat zijn de behandelimplicaties?) deze onderschatting mogelijk tenminste gedeeltelijk kunnen compenseren.
Aanbevelingen
- Overweeg laagdrempelig opstellen van een risicoprofiel voor hart- en vaatziekten bij bevolkingsgroepen met een migratieachtergrond.
- Zie af van het meewegen van etnische achtergrond met het doel de risicoschatting op hart- en vaatziekten te verbeteren bij personen zonder hart- en vaatziekten, vanwege het nog ontbreken van voldoende bewijs voor de Nederlandse situatie.
Uitgangsvraag
Wat is de toegevoegde waarde van urinezuur bij het reclassificeren van het risico op hart- en vaatziekten?
Inleiding
Onder de vele biochemische variabelen waarvan wordt gerapporteerd dat ze het risico op hart- en vaatziekten kunnen voorspellen bevindt zich het urinezuurgehalte. Het is evenwel onduidelijk of het urinezuurgehalte de risicoschatting daadwerkelijk verbetert.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvraag: is urinezuur een onafhankelijke voorspeller voor het risico op hart- en vaatziekten?
P: algemene populatie zonder hart- en vaatziekten
I: risicoschatting op basis van klassieke risicofactoren plus urinezuur
C: risicoschatting op basis van klassieke risicofactoren
O: hart- en vaatziektemorbiditeit, hart- en vaatziektemortaliteit, uitgedrukt in Net Reclassification Index (NRI)
Relevante uitkomstmaten
De werkgroep achtte zowel hart- en vaatziektemorbiditeit/-mortaliteit als reclassificatie voor de besluitvorming kritieke uitkomstmaten. De werkgroep definieerde de genoemde uitkomstmaten niet a priori, maar hanteerde de in de onderzoeken gebruikte definities. De werkgroep definieerde een NRI van 10% voor upward of downward reclassifcatie als een klinisch (patiënt) relevant verschil.
Zoeken en selecteren (methode)
In de database Medline (via OVID) is tot februari 2017 met relevante zoektermen gezocht naar systematische reviews of observationele onderzoeken. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 512 treffers op. Onderzoeken werden geselecteerd op grond van de volgende selectiecriteria:
- systematische reviews (gedetailleerde zoekstrategie, risk of bias-beoordeling, evidence-tabel);
- observationele onderzoeken (op basis van de bovengenoemde PICO).
De voorkeur gaat uit naar onderzoeken die als risicoschattingsmodel SCORE hebben gebruikt. Het is echter geen exclusiecriterium. Op basis van titel en abstract werden in eerste instantie drie onderzoeken voorgeselecteerd. Na raadpleging van de volledige tekst werden vervolgens twee onderzoeken geëxcludeerd (zie de exclusietabel onder het tabblad Verantwoording) en één onderzoek definitief geselecteerd.
Eén onderzoek is in de literatuuranalyse opgenomen. Dit betrof een cohortonderzoek dat de reclassificatiepotentie van urinezuur bij een schatting van het risico op hart- en vaatziekten op basis van de Framingham-risicoscore heeft geëvalueerd. De belangrijkste onderzoekskarakteristieken en resultaten zijn opgenomen in de evidence-tabellen. De beoordeling van de individuele onderzoeksopzet (risk of bias) is opgenomen in de risk of bias-tabellen.
Samenvatting van de literatuur
Beschrijving van de onderzoeken
Kavousi (2012) evalueerde of het toevoegen van nieuwe risicomarkers voor coronaire hartziekten aan de Framingham-risicoscore de schatting van het risico op hart- en vaatziekten verbeterde. Daartoe werden gegevens van de Rotterdam Study gebruikgemaakt. Deelnemers met een geschiedenis van coronaire hartziekten werden geëxcludeerd. In totaal werden 5933 deelnemers in de analyse meegenomen. De gemiddelde leeftijd was 69 jaar en 31% was man. Meerdere nieuwe markers werden aan de schatting op basis van de Framingham-risicoscore toegevoegd en geëvalueerd. Voor de uitwerking van deze uitgangsvraag werd gefocust op de toevoeging van urinezuur aan het model.
Resultaten
Coronaire hartziekten (morbiditeit en mortaliteit)
De mediaan van urinezuur in de populatie was 300 µmol/l met een 25e percentiel van 260,0 µmol/l en een 75e percentiel van 360,0 µmol/l. Het effect van urinezuur aan het schatten van het risico op coronaire hartziekten werd in de gehele populatie geëvalueerd, alsook in een groep met een intermediair risico op coronaire hartziekten. De resultaten zijn hieronder in tabel 15 weergegeven. In zowel de gehele populatie als de populatie met een intermediair risico was de NRI niet hoger dan 10%, het benoemde klinisch relevant verschil.
| NRI (95%-BI) | |
|---|---|
| Total populatie, % | 0,8 (-0,5 tot 2,1) |
| Intermediair risico, % | 2,6 (1,0 tot 4,2) |
Bewijskracht van de literatuur
NRI: de bewijskracht voor de uitkomstmaat NRI is met twee niveaus verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias; minder dan tien jaar follow-up voor het schatten van het tienjaarsrisico) en indirectheid (het gebruikte risicoschattingsmodel is de Framingham-risicoscore in plaats van het gewenste model SCORE).
Conclusie
| Laag GRADE | Het toevoegen van urinezuur aan een risicoschattingsmodel voor hart- en vaatziekten leidt mogelijk niet tot reclassificatie van personen zonder hart- en vaatziekten. |
| Bron: Kavousi 2012 |
Overwegingen
De ESC-richtlijn cardiovasculaire preventie gaat niet in op de mogelijke toegevoegde waarde van urinezuur voor cardiovasculaire risicovoorspelling. De literatuursearch leverde één onderzoek op, dat geen toegevoegde waarde van urinezuur voor cardiovasculaire risicovoorspelling suggereert. Bepaling van het urinezuurgehalte voor risicovoorspelling is daarom niet aan te raden. Evenmin is er reden om eventueel al bekende urinezuurgehaltes in de risicovoorspelling te verdisconteren.
Aanbeveling
- Gebruik urinezuur niet met het doel de risicoschatting op hart- en vaatziekten te verbeteren bij personen zonder hart- en vaatziekten.
Bij de volgende aandoeningen kan het risico op toekomstige hart- en vaatziekten extra verhoogd zijn, ook na weging van alle risicofactoren in SCORE2.
- Diabetes mellitus: zie tabel 1.
- Chronische nierschade: zie tabel 1.
- Artritis psoriatica: overweeg een risicoprofiel voor hart- en vaatziekten op te stellen bij patiënten met artritis psoriatica. Overweeg bij twijfel over de behandelindicatie (eerder) over te gaan tot behandeling van het risico op hart- en vaatziekten indien iemand artritis psoriatica heeft (zie Details).
- COPD: stel bij personen met COPD een risicoprofiel voor hart- en vaatziekten op. Overweeg bij twijfel over de behandelindicatie eerder over te gaan tot behandeling van het risico op hart- en vaatziekten bij personen met COPD (zie Details).
- Jicht: overweeg bij personen met jicht een cardiovasculair risicoprofiel op te stellen. Overweeg bij twijfel over de behandelindicatie (eerder) over te gaan tot behandeling bij personen met jicht (zie Details).
- Reumatoïde artritis: stel een cardiovasculair risicoprofiel op bij personen met reumatoïde artritis. Vermenigvuldig het resultaat uit een SCORE schatting met 1,5 bij patiënten met reumatoïde artritis (zie Details).
- Kanker: het risico op hart- en vaatziekten is verhoogd bij patiënten die in het verleden zijn behandeld voor kanker met chemotherapie en/of bestraling. Het risico is afhankelijk van de toegepaste therapie. Overweeg optimalisatie van hun risicoprofiel.
Uitgangsvraag
Wat is de rol van de ziekte artritis psoriatica bij het schatten van het risico op hart- en vaatziekten bij personen zonder hart- en vaatziekten?
Inleiding
De bewijzen voor psoriasis zijn minder duidelijk, maar een recent artikel wijst uit dat er een grofweg vergelijkbaar risico op hart- en vaatziekten bestaat voor RA en vroege ernstige psoriasis. Over het algemeen ontbreken robuuste gegevens voor onafhankelijk verhoogde risico’s op hart- en vaatziekten bij andere auto-immuunaandoeningen. Ieder geval moet daarom apart klinisch worden beoordeeld. Er zijn aanwijzingen uit post hoc-analyse van gerandomiseerde onderzoeken dat statines het risico op hart- en vaatziekten bij auto-immuunaandoeningen kunnen verminderen.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvraag: is het hebben van artritis psoriatica een onafhankelijke risicofactor voor hart- en vaatziekten?
P: algemene populatie (personen zonder hart- en vaatziekten)
I: artritis psoriatica
C: geen artritis psoriatica
O: morbiditeit en mortaliteit als gevolg van hart- en vaatziekten
Relevante uitkomstmaten
De werkgroep achtte morbiditeit en mortaliteit als gevolg van hart- en vaatziekten voor de besluitvorming kritieke uitkomstmaten.
Zoeken en selecteren (methode)
In de database Medline (via OVID) is op 15 augustus 2017 met relevante zoektermen gezocht naar systematische reviews en observationele onderzoeken. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 211 treffers op. Onderzoeken werden geselecteerd op grond van de volgende selectiecriteria:
- systematische reviews (gedetailleerde zoekstrategie, risk of bias-beoordeling, evidence-tabel);
- observationele onderzoeken (op basis van de bovengenoemde PICO).
Op basis van titel en abstract werden in eerste instantie 29 onderzoeken voorgeselecteerd. Na raadpleging van de volledige tekst werden vervolgens 26 onderzoeken geëxcludeerd (zie de exclusietabel onder het tabblad Verantwoording) en drie onderzoeken definitief geselecteerd.
Drie onderzoeken zijn opgenomen in de literatuuranalyse. De belangrijkste onderzoekskarakteristieken en resultaten zijn opgenomen in de evidence-tabellen. De beoordeling van de individuele onderzoeksopzet (risk of bias) is opgenomen in de risk of bias-tabellen.
Samenvatting van de literatuur
Beschrijving van de onderzoeken
Ogdie (2015) ondernam een onderzoek om het risico op ernstige cardiovasculaire bijwerkingen onder patiënten met artritis psoriatica te kwantificeren. Voor het uitvoeren van een cohortonderzoek werd van een populatiegebaseerde database van huisartspraktijken gebruikgemaakt. Patiënten in leeftijd van achttien tot 89 jaar met artritis psoriatica werden geïncludeerd. Tot tien controles zonder artritis psoriatica werden aan een patiënt gekoppeld. Deze controles waren ook vrij van psoriasis en RA. In totaal werden 8706 patiënten met artritis psoriatica en 81.573 controles beschreven. Een van de uitkomsten was MACE (Major Adverse Cardiovascular Events), gedefinieerd als het eerste gedocumenteerde event van myocardinfarct, beroerte of dood als gevolg van hart- en vaatziekten.
Li (2012) onderzocht onder geregistreerde verpleegkundigen de associatie tussen psoriasis en ook artritis psoriatica en het risico op niet-fatale hart- en vaatziekten. 96.008 Vrouwen die deelnamen aan de Nurses’ Health Study werden gedurende achttien jaar gevolgd. Er werden geen getallen of kenmerken van vrouwen met artritis psoriatica gerapporteerd.
Resultaten
Hart- en vaatziektemorbiditeit
Ogdie (2015) rapporteerden geen data over hart- en vaatziektemorbiditeit.
Li (2012) rapporteerde over het risico op hart- en vaatziekten bij artritis psoriatica. Het is echter niet bekend wat als hart- en vaatziekten werd gedefinieerd. In totaal kregen tien vrouwen met artritis psoriatica een hart- en vaatziekten-event, vergeleken met 688 vrouwen zonder psoriasis. Het risico op een niet-fatale hart- en vaatziekte gedurende follow-up was 247% hoger onder vrouwen met artritis psoriatica dan onder vrouwen zonder psoriasis (HR 3,47; 95%-BI 1,85 tot 6,51).
MACE
Ogdie (2015): in totaal kregen 249 (3%) patiënten met artritis psoriatica een MACE-event en onder controles kregen 2055 (3%) een event. Patiënten met artritis psoriatica werden in twee groepen gedeeld, een die antireumatische medicatie (zogenaamde DMARD) kregen en een die geen medicatie kregen. 148 Patiënten met artritis psoriatica die DMARD gebruikten, kregen een MACE-event en 101 patiënten die geen DMARD gebruikten kregen een event. Het risico om gedurende follow-up een MACE-event te krijgen was 17% verhoogd onder patiënten met artritis psoriatica en die DMARD gebruikten vergeleken met controles zonder artritis psoriatica (HR 1,17; 95%-BI 0,95 tot 1,46). Dit resultaat was voor leeftijd, geslacht, diabetes mellitus, hyperlipidemie, roken en startjaar in cohort gecorrigeerd. Het risico was 24% verhoogd onder patiënten die geen DMARD gebruikten (HR 1,24; 95%-BI 1,03 tot 1,49).
Li (2012) rapporteerde geen uitkomst over een MACE-event.
Hart- en vaatziektemortaliteit
Ogdie (2015): in totaal overleden 86 (1%) patiënten met artritis psoriatica en 902 (1%) controles aan hart- en vaatziekten. 57 Patiënten met artritis psoriatica die DMARD gebruikten en 29 patiënten die geen DMARD gebruikten overleden aan hart- en vaatziekten.
Het risico om gedurende follow-up te overlijden als gevolg van een hart- en vaatziekten-event onder patiënten met artritis psoriatica en DMARD-gebruik was vergelijkbaar met het risico onder controles zonder artritis psoriatica (HR 0,96; 95%-BI 0,64 tot 1,43). Dit resultaat was voor leeftijd, geslacht, diabetes mellitus, hyperlipidemie, roken en startjaar in cohort gecorrigeerd. Het risico was ook vergelijkbaar onder patiënten die geen DMARD gebruikten (HR 1,07; 95%-BI 0,79 tot 1,44).
Li (2012) rapporteerde geen gegevens over het risico om te overlijden aan hart- en vaatziekten onder geregistreerde verpleegkundigen.
Bewijskracht van de literatuur
Vanwege het domein etiologie van de zoekvraag start de bewijskracht op hoog.
Hart- en vaatziektemorbiditeit: de bewijskracht voor de uitkomstmaat hart- en vaatziektemorbiditeit is met drie niveaus verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias; geselecteerde populatie); publicatiebias.
MACE: de bewijskracht voor de uitkomstmaat MACE is met drie niveaus verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias; niet gevalideerde uitkomst); publicatiebias.
Hart- en vaatziektemortaliteit: de bewijskracht voor de uitkomstmaat hart- en vaatziektemortaliteit is met drie niveaus verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias; niet gevalideerde uitkomst); publicatiebias.
Conclusie
| Hart- en vaatziektemorbiditeit | |
| Zeer laag GRADE | We zijn te onzeker over de associatie tussen artritis psoriatica en risico op hart- en vaatziekten. |
| Bron: Li 2012 | |
| MACE | |
| Zeer laag GRADE | We zijn te onzeker over de associatie tussen artritis psoriatica en het risico op een MACE-event. |
| Bron: Ogdie 2015 | |
| Hart- en vaatziektemortaliteit | |
| Zeer laag GRADE | We zijn te onzeker over de associatie tussen artritis psoriatica en het risico om te overlijden aan hart- en vaatziekten. |
| Bron: Ogdie 2015 | |
Overwegingen
De gevonden literatuur is van een dergelijke kwaliteit dat het niet mogelijk is een conclusie te trekken over de associatie tussen artritis psoriatica en het risico op hart- en vaatziekten. De onderliggende ontsteking bij artritis psoriatica kan echter gelijk worden gesteld aan die bij reumatoïde artritis. Het blijkt dat reumatoïde artritis geassocieerd is met een verhoogd risico op hart- en vaatziekten, onafhankelijk van de klassieke risicofactoren (zie details paragraaf 2.3). Het risico op hart- en vaatziekten bij patiënten met reumatoïde artritis wordt daarom onderschat. Daarom is afgesproken om bij reumatoïde artritis de risicoschatting op basis van SCORE met 1,5 te vermenigvuldigen. Gezien de gelijkende onderliggende pathologie, maar tevens de zeer lage bewijskracht, wordt daarom bij patiënten met artritis psoriatica wel geadviseerd te overwegen een risicoprofiel op te stellen.
Aanbevelingen
- Overweeg een risicoprofiel voor hart- en vaatziekten op te stellen bij patiënten met artritis psoriatica.
- Overweeg bij twijfel over de behandelindicatie (eerder) over te gaan tot behandeling van het risico op hart- en vaatziekten indien iemand artritis psoriatica heeft.
Uitgangsvraag
Wat is de rol van COPD bij het schatten van het risico op hart- en vaatziekten bij personen zonder hart- en vaatziekten?
Inleiding
COPD en hart- en vaatziekten delen veel van dezelfde risicofactoren (onder meer roken), waardoor ze veelvuldig samen voorkomen. COPD is echter ook mogelijk een onafhankelijke risicofactor voor het krijgen van een hart- en vaatziekte. Deze zoekvraag onderzocht in welke mate COPD een voorspeller is voor het krijgen van hart- en vaatziekten.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvraag: is het hebben van COPD een onafhankelijke voorspeller voor het krijgen van een hart- en vaatziekte?
P: algemene populatie (personen zonder hart- en vaatziekten)
I: COPD
C: geen COPD
O: morbiditeit en mortaliteit als gevolg van hart- en vaatziekten
Relevante uitkomstmaten
De werkgroep achtte morbiditeit en mortaliteit als gevolg van hart- en vaatziekten voor de besluitvorming kritieke uitkomstmaten.
Zoeken en selecteren (methode)
In de databases Medline (via OVID), EMBASE (via Embase.com) is 8 mei 2017 met relevante zoektermen gezocht naar systematische reviews. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 138 treffers op. Onderzoeken werden door twee onderzoekers onafhankelijk van elkaar geselecteerd op grond van het volgende selectiecriterium: relevantie voor de uitgangsvraag. Conflicten werden via onderlinge discussie opgelost. Op basis van titel en abstract werden in eerste instantie vijf onderzoeken voorgeselecteerd. Na raadpleging van de volledige tekst werden vervolgens vier onderzoeken geëxcludeerd (zie de exclusietabel bij noot 11 in het document Totstandkoming) en één onderzoek definitief geselecteerd.
Eén onderzoek is opgenomen in de literatuuranalyse. De belangrijkste onderzoekskarakteristieken en resultaten zijn opgenomen in de evidence-tabellen. De beoordeling van de onderzoeksopzet (risk of bias) is opgenomen in de kwaliteit van bewijs-tabel.
Samenvatting van de literatuur
Beschrijving van de onderzoeken
Chen verrichte in 2015 een meta-analyse naar het risico op het krijgen van hart- en vaatziekten door COPD. Chen vond 27 onderzoeken die deze vraag beantwoordden. De uitkomstmaten worden weergeven in oddsratio’s. De meta-analyse onderzocht niet de uitkomstmaat mortaliteit.
Resultaten
Incidentie hart- en vaatziekte
In de evidence-tabel staat het risico op verschillende hart- en vaatziekten bij COPD. Het risico op hart- en vaatziekten bij COPD is OR 2,46; 95% BI: 2,02 tot 3,00.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat incidentie hart- en vaatziekten is met één niveau verlaagd vanwege beperkingen in de onderzoeksopzet (risk of bias). Er is niet afgewaardeerd voor tegenstrijdige resultaten (inconsistentie), ondanks de heterogeniteit van 84%. Bij nadere analyse naar de oorzaak van de heterogeniteit (Jack Knife-analyse) blijkt namelijk de effectgrootte niet significant te veranderen.
Conclusie
| Redelijk GRADE | COPD is waarschijnlijk geassocieerd met een verhoogd risico op hart- en vaatziekten, onafhankelijk van klassieke risicofactoren. |
| Bron: Chen 2015 |
Overwegingen
De aanwezigheid van COPD lijkt een onafhankelijke voorspeller te zijn voor het krijgen van een hart- en vaatziekte. Het risico op hart- en vaatziekten is bijna 2,5 keer zo hoog. Dan is het noodzakelijk om rekening te houden met de aan- of afwezigheid van COPD. Bij de aanwezigheid van COPD is het risico op hart- en vaatziekten duidelijk verhoogd, ongeacht mogelijke andere risicofactoren. Gezien het risico ligt het voor de hand om bij alle COPD-patiënten een risicoschatting voor hart- en vaatziekten te doen. Bij de meeste COPD-patiënten zijn de klassieke risicofactoren aanwezig en is de leeftijd boven de vijftig jaar. Hierdoor is het risico op hart- en vaatziekten vaak al zodanig verhoogd dat er een indicatie bestaat voor behandeling. Bij twijfel over de behandelindicatie is vanwege het verhoogde relatieve risico door COPD van circa 2,5 te overwegen om over te gaan tot behandeling.
Aanbevelingen
- Stel bij personen met COPD een risicoprofiel voor hart- en vaatziekten op.
- Overweeg bij twijfel over de behandelindicatie bij personen met COPD eerder over te gaan tot behandeling van het risico op hart- en vaatziekten.
Uitgangsvraag
Wat is de rol van jicht bij het schatten van het risico op hart- en vaatziekten bij personen zonder hart- en vaatziekten?
Inleiding
Onder de vele klinische variabelen die genoemd worden als mogelijk bijdragend aan een verbeterde voorspelling van het risico op hart- en vaatziekten bevindt zich het urinezuurgehalte in het bloed, alsmede het hebben van een voorgeschiedenis van jicht. De rol van het urinezuurgehalte wordt elders besproken (zie details Aanvullende risicofactoren).
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvraag: is het hebben van jicht een onafhankelijke voorspeller voor het risico op hart- en vaatziekten?
P: algemene populatie zonder hart- en vaatziekten
I: jicht
C: geen jicht
O: morbiditeit en mortaliteit als gevolg van hart- en vaatziekten
Relevante uitkomstmaten
De werkgroep achtte morbiditeit en mortaliteit als gevolg van hart- en vaatziekten voor de besluitvorming kritieke uitkomstmaten.
Zoeken en selecteren (methode)
In de database Medline (via OVID) is tot februari 2017 met relevante zoektermen gezocht naar systematische reviews of observationele onderzoeken. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 153 treffers op. Onderzoeken werden geselecteerd op grond van de volgende selectiecriteria:
- systematische reviews (gedetailleerde zoekstrategie, risk of bias-beoordeling, evidence-tabel);
- observationele onderzoeken (op basis van de bovengenoemde PICO).
Op basis van titel en abstract werden in eerste instantie 96 onderzoeken voorgeselecteerd. Na raadpleging van de volledige tekst werden vervolgens 92 onderzoeken geëxcludeerd (zie de exclusietabel onder het tabblad Verantwoording) en vier onderzoeken definitief geselecteerd.
Vier onderzoeken zijn opgenomen in de literatuuranalyse, waarvan één systematische review over mortaliteit als gevolg van hart- en vaatziekten, één cohortonderzoek waarmee de systematische review geüpdatet kon worden (gepubliceerd na de literatuurzoekactie) en twee cohortonderzoeken over hart- en vaatziektemorbiditeit. De belangrijkste onderzoekskarakteristieken en resultaten zijn opgenomen in de evidence-tabellen. De beoordeling van de individuele onderzoeksopzet (risk of bias) is opgenomen in de risk of bias-tabellen.
Samenvatting van de literatuur
Beschrijving van de onderzoeken
Janssens (2017) onderzocht het risico op een eerste hart- en vaatziekten-event onder huisartspatiënten met een diagnose van jicht. De onderzoek maakte gebruik van een General Practitioner Database (GP-database). Deze database bevat algemene gegevens over de patiënt, en diagnoses van de huisarts en managementinformatie van elektronische dossiers van het oosten van Nederland. Gemiddeld genomen waren de deelnemers 58 jaar en het merendeel was man. Deelnemers met jicht hadden ook vaker hypertensie, diabetes mellitus of hyperlipidemie dan deelnemers zonder jicht. In totaal werden 1859 deelnemers met jicht geïncludeerd en 6334 gematchte controles.
Clarson (2015a) onderzocht de associatie tussen jicht en incident coronaire hartziekte, hart- en vaatziekten en perifeer vaatlijden. Alleen personen ouder dan vijftig jaar kwamen in aanmerking en personen zonder een geschiedenis van hart- en vaatziekten. In totaal werden 8386 patiënten met jicht geïncludeerd met 39.766 controles. De deelnemers waren gemiddeld 66 jaar oud (sd 10,8) en 69% was man. Patiënten met jicht hadden een hogere prevalentie van alle risicofactoren voor hart- en vaatziekten, met uitzondering van diabetes mellitus, dan de controles.
Clarson (2015b) heeft een systematische review en meta-analyse uitgevoerd naar onderzoeken die de relatie tussen jicht en mortaliteit als gevolg van hart- en vaatziekten onderzochten. Medline, EMBASE, CINAHL en The Cochrane Library zijn tot november 2012 doorzocht. Patiënt-controleonderzoeken werden vanwege sampling en recall bias geëxcludeerd. In totaal voldeden zes onderzoeken aan de selectiecriteria. Van deze zes onderzoeken rapporteerden vier onderzoeken de uitkomst mortaliteit als gevolg van hart- en vaatziekten. Alleen deze onderzoeken werden verder meegenomen. Na de datum van de zoekactie werd nog een relevant cohortonderzoek gepubliceerd.
Ook dit onderzoek werd geïncludeerd en beschreven.
Kok (2012) bestudeerde de associatie tussen jicht en mortaliteit als gevolg van hart- en vaatziekten in personen zonder diabetes in de leeftijd van vijftig jaar en ouder met of zonder chronische nierziekte. De Taiwan National Health Insurance database werd voor deze onderzoeken gebruikt. Gedurende follow-up hadden totaal 164.463 personen jicht en 3.694.377 personen geen jicht. Ook in dit onderzoek was de prevalentie van risicofactoren hoger onder personen met jicht vergeleken met controles.
Resultaten
Morbiditeit als gevolg van hart- en vaatziekten
Janssens (2017) observeerde dat onder deelnemers met jicht 154 (8%) hart- en vaatziekte kregen, vergeleken met 318 (3%) zonder jicht. Het risico om hart- en vaatziekten te krijgen onder deelnemers met jicht gedurende follow-up was 44% hoger vergeleken met deelnemers zonder jicht (HR 1,44; 95%-BI 1,18 tot 1,76). Deze hazardratio was voor de volgende confounders gecorrigeerd: leeftijd, geslacht en de aanwezigheid van comorbiditeiten (hypertensie, diabetes mellitus, hypercholesterolemie).
Clarson (2015a) rapporteerde de resultaten gestratificeerd voor geslacht vanwege een statistisch significante interactie tussen jicht en geslacht. In totaal werden 11.266 vasculaire events tijdens follow-up geobserveerd. In tabel 16 worden de absolute risico per geslacht weergegeven.
| Absolute risico per 1000 persoonsjaren (95%-BI) | ||||
|---|---|---|---|---|
| Man | Vrouw | |||
| Uitkomst | Case (jicht) | Controle | Case (jicht) | Controle |
| Hart- en vaatziekten | 43,63 (41,55 tot 45,77) | 33,70 (32,86 tot 34,55) | 51,89 (48,32 tot 55,64) | 33,41 (32,15 tot 34,71) |
Het risico op een hart- en vaatziekte-event gedurende follow-up is 6% en 25% verhoogd voor mannen en vrouwen, respectievelijk. De corresponderende hazardratio’s waren 1,06 (95%-BI 1,01 tot 1,12) en 1,25 (95%-BI 1,15 tot 1,35). Deze effectschatters waren voor de volgende variabelen gecorrigeerd: geslacht, interactie tussen jicht en geslacht, leeftijd, BMI > 25 kg/m2, roken, alcoholconsumptie, Charlson Comorbidity Score, hypertensie, hyperlipidemie en chronische nierziekte, en statine- en aspirinegebruik.
Aangezien resultaten van Clarson (2015a) per geslacht zijn weergegeven, is het lastig deze resultaten met die van Janssens (2017) te combineren. De resultaten wijzen echter in dezelfde richting. Het risico op hart- en vaatziekten is verhoogd bij het hebben van jicht. Het is echter niet duidelijk hoe sterk het risico verhoogd is en in hoeverre dit verklaard kan worden door (subtiele) verschillen in overige risicofactoren.
Mortaliteit als gevolg van hart- en vaatziekten
Het individuele onderzoeksresultaat van Kok (2012) is aan de meta-analyse van Clarson (2015b) toegevoegd. Het risico om te overlijden als gevolg van hart- en vaatziekten bij het hebben van jicht was 23% hoger gedurende follow-up, vergeleken met geen jicht hebben (HR 1,23; 95%-BI 1,08 tot 1,41; (figuur 2)). Alle effectschattingen waren voor bekende risicofactoren gecorrigeerd.
Bewijskracht van de literatuur
Vanwege het domein etiologie van de zoekvraag start de bewijskracht op hoog.
Morbiditeit als gevolg van hart- en vaatziekten: de bewijskracht voor de uitkomstmaat hart- en vaatziekten is met een niveau verlaagd gezien publicatiebias.
Mortaliteit als gevolg van hart- en vaatziekten: de bewijskracht voor de uitkomstmaat mortaliteit als gevolg van hart- en vaatziekten is met twee niveaus verlaagd gezien tegenstrijdige resultaten (inconsistentie) en publicatiebias.
Conclusie
| Morbiditeit als gevolg van hart- en vaatziekten | |
| Redelijk GRADE | Het hebben van jicht is waarschijnlijk geassocieerd met een verhoogd risico op hart- en vaatziekten, onafhankelijk van klassieke cardiovasculaire risicofactoren. |
| Bronnen: Janssens 2017, Clarson 2015a | |
| Mortaliteit als gevolg van hart- en vaatziekten | |
| Laag GRADE | Het hebben van jicht is mogelijk geassocieerd met een verhoogd risico om te overlijden aan hart- en vaatziekten, onafhankelijk van klassieke risicofactoren. |
| Bron: Clarson 2015b, Kok 2012 | |
Overwegingen
Hoewel er dus aanwijzingen zijn dat het cardiovasculaire risico verhoogd is bij patiënten met jicht, blijft het onduidelijk in welke mate dit verhoogde risico verklaard wordt door (al dan niet subtiele) verschillen in het profiel van de meer bekende risicofactoren. Bovendien is er risico op bias van de bestaande literatuur. Deze richtlijn wil terughoudendheid propageren als het gaat om het laten meewegen van additionele risicofactoren/aandoeningen bij de cardiovasculaire risicoschattingen. Veel patiënten met jicht zullen om andere redenen (leeftijd, bekende risicofactoren; zie details paragraaf 2.3 Bloeddruk) in aanmerking komen voor een zorgvuldige risico-inventarisatie.
Aanbevelingen
- Overweeg bij personen met jicht een cardiovasculair risicoprofiel op te stellen.
- Overweeg bij twijfel over de behandelindicatie (eerder) over te gaan tot behandeling van het risico op hart- en vaatziekten indien iemand jicht heeft.
Uitgangsvraag
Wat is de rol van reumatoïde artritis bij het schatten van het risico op hart- en vaatziekten bij personen zonder hart- en vaatziekten?
Inleiding
Reumatoïde artritis is een chronische systemische gewrichtsontsteking die geassocieerd is met een verhoogd risico op sterfte, waarschijnlijk grotendeels als gevolg van cardiovasculaire morbiditeit. Er is inmiddels duidelijk bewijs dat ernstige ontstekingen een opstap kunnen vormen naar versneld optreden van vasculaire aandoeningen. Systemische ontstekingen lijken het risico op hart- en vaatziekten (in)direct te beïnvloeden doordat ze bestaande risicofactoren versterken. Terwijl eerdere kleine onderzoeken er al op wezen dat RA het risico op hart- en vaatziekten sterker verhoogt dan andere risicofactoren, vormt de recent geactualiseerde analyse van de nationale QRESEARCH-database onder 2,7 miljoen personen hiervoor nu het beste beschikbare bewijs. Dit bewijs is nu opgenomen in een aantal nationale risicoscores en Europese richtlijnen.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht met de volgende zoekvraag: is reumatoïde artritis een onafhankelijke risicofactor voor het krijgen van hart- en vaatziekten?
P: algemene populatie zonder hart- en vaatziekten
I: Reumatoïde artritis
C: Geen reumatoïde artritis
O: morbiditeit en mortaliteit als gevolg van hart- en vaatziekten
Relevante uitkomstmaten
De werkgroep achtte morbiditeit en mortaliteit als gevolg van hart- en vaatziekten voor de besluitvorming kritieke uitkomstmaten.
Zoeken en selecteren (methode)
In de database PubMed is op 8 mei 2017 met relevante zoektermen gezocht. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 87 treffers op met zoekfilter systematische reviews/meta-analyses, waarvan er één systematische review bruikbaar was voor beantwoording van onze uitgangsvraag. Deze review gebruikte de (gecombineerde) uitkomstmaat cardiovasculaire morbiditeit en mortaliteit. Conflicten werden via onderlinge discussie opgelost. Buiten de zoekactie (grijze literatuur) werd nog een meta-analyse met de uitkomstmaat totale mortaliteit gevonden [Dadoun 2013].
Een aanvullende literatuurzoekactie op 14 augustus 2017 (vanaf de laatste zoekdatum van de systematische review, juni 2011) leverde 268 artikelen op. Onderzoeken werden geselecteerd op grond van de volgende selectiecriteria: relevantie voor de uitgangsvraag, type onderzoek en gebruikte uitkomstmaten. Op basis van titel en abstract werden in eerste instantie elf onderzoeken voorgeselecteerd. Na raadpleging van de volledige tekst werden acht onderzoeken geëxcludeerd en drie aanvullende onderzoeken geïncludeerd (zie de exclusietabel in bijlagen). De belangrijkste onderzoekskarakteristieken en resultaten zijn opgenomen in de evidence-tabellen (zie bijlagen). De beoordeling van de individuele onderzoeksopzet is opgenomen in de risk of bias-tabellen (zie bijlagen).
Samenvatting van de literatuur
Avina-Zubieta et al. (2012) verrichtten een meta-analyse van observationele onderzoeken naar het risico op hart- en vaatziekten bij patiënten met reumatoïde artritis in vergelijking met de algemene populatie. Er werd een literatuurzoekactie verricht tot juni 2011. De auteurs definieerden hart- en vaatziekten als (fataal en niet-fatale) acute myocardinfarcten, cerebrovasculaire accidenten en congestief hartfalen. Bij vijf van de veertien onderzoeken was de follow-up niet bekend. Bij de overige onderzoeken was de gemiddelde follow-up 4,7 jaar met een range van één tot vijftien jaar. De kwaliteit van de verschillende onderzoeken werd gescoord op basis van soort onderzoeksgroep (klinisch versus niet-klinisch), cohorttype (inception (vanaf het begin van de diagnose) of non-inception), definitie van reumatoïde artritis, definitie van uitkomstmaten hart- en vaatziekten, mate van uitval en correctie voor Framingham-risicoscores. Heterogeniteit van de onderzoeken werd onderzocht met subgroepanalyses: onderzoeken werden gestratificeerd naar soort onderzoeksgroep, cohorttype, definitie van reumatoïde artritis en kwaliteitsscore. Resultaten werden gecontroleerd op robuustheid door het verrichten van een sensitiviteitsanalyse. Publicatiebias en vertekening door inclusie van kleine onderzoeken werd beoordeeld met behulp van een funnel plot en Egger’s test voor asymmetrie.
In de meta-analyse van Dadoun (2012) werden onderzoeken geïncludeerd naar de doodsoorzaken van patiënten met reumatoïde artritis [Dadoun 2012]. Er werd een literatuurzoekactie verricht tot januari 2010. In totaal konden er elf longitudinale onderzoeken worden geselecteerd met cohorten die waren gestart van 1955 tot 1995 met 51.819 patiënten. Van acht onderzoeken kon de gestandaardiseerde mortaliteitsratio (SMR) worden meegenomen in de meta-analyse. De gemiddelde SMR werd berekend met een random effectmodel, resultaten werden gecontroleerd op robuustheid door het verrichten van een sensitiviteitsanalyse.
Beschrijving van de cohortonderzoeken na juni 2011
Lindhardsen et al. (2011) verrichtten een cohortonderzoek in de gehele Deense populatie van 1997 tot 2007. Het onderzoek richtte zich op het risico op een myocardinfarct bij patiënten met reumatoïde artritis of diabetes mellitus. In totaal werden 10.477 patiënten met reumatoïde artritis vergeleken met 4,3 miljoen inwoners zonder deze ziekte. Daarnaast werd er een ‘nested’ patiënt-controleonderzoek naar de effecten van covariaten op het risico op een myocardinfarct verricht. De gemiddelde follow-up was 4,6 jaar.
In een cohortonderzoek van Ogdie (2015) met data uit een Britse eerstelijnsdatabase, The Health Improvement Network (THIN), werden 41.752 patiënten met reumatoïde artritis vergeleken met 81.573 willekeurig geselecteerde patiënten zonder reumatoïde artritis. Patiënten met reumatoïde artritis werden verdeeld in twee groepen: met en zonder DMARDS. De berekende hazardratio’s werden gecorrigeerd voor geslacht, leeftijd, hypertensie, hyperlipidemie, diabetes mellitus en tijdstip van inclusie in het cohort. De gemiddelde follow-up was vijf jaar.
Castaneda et al. (2015) analyseerden een cohort van 775 patiënten met reumatoïde artritis afkomstig van 67 poliklinieken in Spanje en vergeleken de data met 677 op leeftijd en geslacht gematchte patiënten zonder chronische reumatische gewrichtsaandoeningen. In dit onderzoek werden hart- en vaatziekten gedefinieerd als ischemische hartziekten, beroerte, perifeer arterieel vaatlijden en hartfalen. De follow-up was tien jaar.
Resultaten
Morbiditeit als gevolg van hart- en vaatziekten
De systematische review van Avina-Zubieta (2012) laat een verhoogd risico zien op de gecombineerde uitkomstmaat cardiovasculaire morbiditeit en mortaliteit (RR 1,48 (95%-BI 1,36 tot 1,62)) voor 39.901 patiënten met reumatoïde artritis ten opzichte van de algemene populatie. Aparte cardiovasculaire morbiditeitscijfers worden niet gegeven. Er was significante heterogeniteit (Q = 25,6) bij alle analyses. Deze werd deels verklaard door het cohorttype, de inception-cohorten waren de enige cohorten die geen statistisch significant verhoogd risico vonden op hart- en vaatziekten. De follow-upduur van de inception-cohorten was relatief korter dan die van de non-inception-cohorten. De gepoolde RR bleef significant verhoogd na de sensitiviteitsanalyse, een indicatie dat het resultaat robuust is. De Egger’s test voor asymmetrie van het funnel plot was niet significant.
In het onderzoek van Lindhardsen (2011) was het risico op een myocardinfarct van een patiënt met reumatoïde artritis 1,7 keer hoger ten opzichte van de algemene populatie (incidence rate ratio (IRR) 1,7 (95%-BI 1,5 tot 1,9)). In hetzelfde onderzoek werd tevens een IRR van 1,7 gevonden voor patiënten met diabetes mellitus. Dit risico was onafhankelijk van duur van medicamenteuze behandeling, comorbiditeit en sociaaleconomische status in de op leeftijd en geslacht gematchte patiënt-controleanalyse. Het risico van een patiënt met reumatoïde artritis kwam overeen met die van een tien jaar oudere patiënt zonder reumatoïde artritis.
In het onderzoek van Castaneda (2016) was het risico op hart- en vaatziekten bij patiënten met reumatoïde artritis niet significant verhoogd ten opzichte van de patiënten zonder reumatische gewrichtsaandoeningen, namelijk OR 1,58 (95%-BI 0,90 tot 2,76).
In het eerstelijnscohort van Ogdie (2015) was het risico op myocardinfarct bij patiënten met reumatoïde artritis voor beide groepen verhoogd, namelijk zonder DMARDS HR 1,33 (95%-BI 1,17 tot 1,52) en met DMARDS HR 1,96 (95%-BI 1,75 tot 2,19). Het risico op CVA was ook verhoogd, namelijk bij patiënten met reumatoïde artritis zonder DMARDS HR 1,29 (95%-BI 1,15 tot 1,45) en met DMARDS HR 1,24 (95%-BI 1,10 tot 1,39).
Mortaliteit als gevolg van hart- en vaatziekten
De systematische review van Avina-Zubieta (2012) laat een verhoogd risico op het gecombineerde eindpunt cardiovasculaire morbiditeit en mortaliteit (RR 1,48 (95%-BI 1,36 tot 1,62)) zien voor patiënten met reumatoïde artritis (zie boven).
In het eerstelijnscohort van Ogdie (2015) werd een verhoogd risico op cardiovasculaire mortaliteit gevonden bij zowel patiënten met reumatoïde artritis zonder DMARD’s HR 1,43 (95%-BI 1,28 tot 1,59) als met DMARD’s HR 1,66 (95%-BI 1,48 tot 1,86) ten opzichte van de algemene populatie.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat cardiovasculaire morbiditeit en mortaliteit is met één niveau afgewaardeerd voor indirect bewijs en relatief korte follow-up.
Conclusie
| Redelijk GRADE | Patiënten met reumatoïde artritis hebben waarschijnlijk een verhoogd risico op het krijgen van hart- en vaatziekten, onafhankelijk van de klassieke risicofactoren voor hart- en vaatziekten. |
| Bron: Avina-Zubieta 2012,Lindhardsen 2011,Castaneda 2016, Ogdie 2015 |
| Redelijk GRADE | Patiënten met reumatoïde artritis hebben waarschijnlijk een verhoogd risico om te overlijden aan hart- en vaatziekten, onafhankelijk van de klassieke risicofactoren voor hart- en vaatziekten |
| Bron: Avina-Zubieta 2012, Ogdie 2015 |
Overwegingen
Reumatoïde artritis is geassocieerd met een verhoogd risico op hart- en vaatziekten, onafhankelijk van de klassieke risicofactoren. Dit verhoogde risico lijkt onafhankelijk van de duur van de ziekte, maar is mogelijk wel afhankelijk van ziekteactiviteit. Er zijn aanwijzingen dat systemische inflammatie al aanwezig is in de jaren voordat reumatoïde artritis zich klinisch manifesteert. Het risico op hart- en vaatziekten neemt af bij adequate behandeling van de ziekte.
Bij gebruik van de SCORE voor berekening van het risico op hart- en vaatziekten zal bij patiënten met reumatoïde artritis het risico onderschat worden. Daarom is afgesproken de SCORE-risicoschatting te vermenigvuldigen met een factor 1,5. Deze factor komt overeen met het verhoogde risico dat wordt gevonden in de beschreven onderzoeken en de aanbevelingen van de European League against Rheumatism (EULAR).
Aanbevelingen
- Stel een cardiovasculair risicoprofiel op bij personen met reumatoïde artritis.
- Vermenigvuldig het resultaat uit een SCORE-schatting met 1,5 bij patiënten met reumatoïde artritis.
Ten slotte zijn er aandoeningen waarbij het cardiovasculair risico weliswaar vaak verhoogd is, maar toch (grotendeels) verklaard wordt door de gewone risicofactoren. Bij deze aandoeningen is het derhalve zaak om laagdrempelig een risicoprofiel op te stellen.
- Ankyloserende spondylitis: overweeg een cardiovasculair risicoprofiel op te stellen.
- Hiv-infectie: overweeg een cardiovasculair risicoprofiel op te stellen bij patiënten met een – al dan niet behandelde – hiv-infectie.
- Inflammatoire darmziekten (IBD): overweeg een cardiovasculair risicoprofiel op te stellen. IBD leidt niet tot reclassificatie naar een hogere risicogroep.
- Obstructief slaapapneusyndroom (OSAS): overweeg een risicoprofiel op te stellen.
- Pre-eclampsie en zwangerschapshypertensie: zie de richtlijnmodule Follow-up na hypertensieve aandoening tijdens de zwangerschap.
- Polycysteus ovarium syndroom en zwangerschapsdiabetes: beide verhogen het risico op diabetes; overweeg periodieke screening op diabetes.
- Ernstige psychiatrische aandoeningen: overweeg een risicoprofiel op te stellen.
- Vrouwen met herhaalde miskraam, die een vroeggeboorte hebben doorgemaakt en/of zwanger waren van een kind met foetale groeibeperking: houd het risico op hart- en vaatziekten in de gaten.
Uitgangsvraag
Wat is de rol van ziekte van Bechterew (ankyloserende spondylitis) bij het schatten van het risico op hart- en vaatziekten bij personen zonder hart- en vaatziekten?
Inleiding
De ziekte van Bechterew, ofwel ankyloserende spondylitis, is een gewrichtsontsteking in de wervelkolom en het bekken die tot pijn en stijfheid kan leiden. Er kunnen ook symptomen in andere organen en orgaansystemen optreden. Uit observationele onderzoeken is gebleken dat patiënten met ankyloserende spondylitis mogelijk een verhoogd risico hebben op hart- en vaatziekten en sterfte. Dit verhoogde cardiovasculaire risico wordt wellicht niet alleen veroorzaakt door atherosclerotische aandoeningen en een verhoogde prevalentie van cardiovasculaire risicofactoren, maar ook door ankyloserende spondylitis specifieke cardiovasculaire manifestaties. Het is de vraag of ankyloserende spondylitis onafhankelijk van andere bekende risicofactoren voor hart- en vaatziekten een risico verhogende factor vormt.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvraag: wat is de associatie tussen ankyloserende spondylitis en het risico op hart- en vaatziekten?
P: algemene populatie zonder hart- en vaatziekten
I: ankyloserende spondylitis (AS)
C: geen ankyloserende spondylitis
O: morbiditeit en mortaliteit als gevolg van hart- en vaatziekten
Relevante uitkomstmaten
De werkgroep achtte zowel morbiditeit als mortaliteit als gevolg van hart- en vaatziekten voor de besluitvorming kritieke uitkomstmaten. De werkgroep definieerde niet a priori de genoemde uitkomstmaten, maar hanteerde de in de onderzoeken gebruikte definities. De werkgroep definieerde een relatieve risicoverhoging van > 15% als een klinisch (patiënt) relevant verschil.
Zoeken en selecteren (methode)
In de database PubMed is op 5 juli 2017 met relevante zoektermen gezocht. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 124 treffers op met zoekfilter systematische reviews/meta-analyses en cohortonderzoeken. Onderzoeken werden geselecteerd op grond van het volgende selectiecriterium: relevantie voor de uitgangsvraag. Conflicten werden via onderlinge discussie opgelost. Op basis van titel en abstract werden in eerste instantie acht onderzoeken voorgeselecteerd. Na raadpleging van de volledige tekst werden vervolgens vier onderzoeken geëxcludeerd (zie de exclusietabel bij noot 14 in het document Totstandkoming) en vier onderzoeken definitief geselecteerd.
Vier cohortonderzoeken zijn opgenomen in de literatuuranalyse. De belangrijkste onderzoekskarakteristieken en resultaten zijn opgenomen in de evidence-tabellen. De beoordeling van de individuele onderzoeksopzet (risk of bias) is opgenomen in de risk of bias-tabellen.
Samenvatting van de literatuur
Beschrijving van de onderzoeken
Dregan et al. (2017) gebruikten data van de UK Biobank om de relatie tussen inflammatoire aandoeningen en cardiometabole ziekten en mortaliteit te onderzoeken. Ze voerden zowel een cross-sectionele analyse naar cardiometabool risico, als een prospectieve analyse naar mortaliteitsriscio uit. Cox-proportionele hazards werden gebruikt om totale en cardiovasculairgerelateerde mortaliteit te schatten. Van de totale groep met een inflammatoire ziekte (n = 19.082) hadden 1400 deelnemers (7%) ankyloserende spondylitis. De geïncludeerde groep zonder inflammatoire ziekte bestond uit 483.559 deelnemers. De follow-up tijd van de prospectieve analyse werd niet gerapporteerd.
Hung et al. (2016) gebruikten data van het landelijke cohortonderzoek Taiwan National Health Insurance Research database tussen 2000 en 2005 om te onderzoeken om CVD-events vaker voorkomen bij patiënten met ankyloserende spondylitis dan in de algemene populatie. Ze gebruikten de data van patiënten van veertig jaar en ouder met een diagnose voor ankyloserende spondylitis, en vergeleken deze met die van een gematcht cohort op leeftijd en geslacht. Er werden 537 AS-patiënten geïncludeerd en 2685 patiënten zonder ankyloserende spondylitis. De gemiddelde follow-uptijd was drie tot vier jaar (maximaal vijf jaar).
Haroon et al. (2015) gebruikten data van een cohort met data uit de gezondheidsadministratie in Canada (Ontario) tussen april 1995 en maart 2011. Alle AS-patiënt werden gematcht op basis van leeftijd en geslacht met vier personen uit hetzelfde cohort. De primaire uitkomst was vasculaire mortaliteit, gedefinieerd als een combinatie van cardiovasculaire of cerebrovasculaire sterfte. Er werden 21.473 AS-patiënten geïncludeerd en 86.606 patiënten zonder ankyloserende spondylitis. De follow-uptijd werd gerapporteerd in patiëntjaren. In de AS-groep was het aantal patiëntjaren 166.920 (= 7,8 jaar gemiddeld) en in de groep zonder ankyloserende spondylitis was het aantal patiëntjaren 1.686.461 (= 19,5 jaar gemiddeld).
Het onderzoek van Szabo (2011) gebruikte data van de Régie de l’Assurance Maladie du Québec (RAMQ) database tussen 1996 en 2006 om het risico op cardiovasculaire en cerebrovasculaire ziekten van patiënten uit Quebec met ankyloserende spondylitis te vergelijken met de algemene populatie van Quebec. Het AS-cohort bestond uit 8616 individuen en het 1% random sample van individuen zonder ankyloserende spondylitis uit 50.699 individuen. De gemiddelde follow-upduur was 10,2 jaar in het AS-cohort en 10,5 jaar in de algemene populatie. De standardized prevalence ratio werd berekend, dit is de ratio van de geobserveerde prevalentie en de verwachte prevalentie.
Resultaten
Morbiditeit als gevolg van hart- en vaatziekten
In het onderzoek van Hung (2016) was het risico om hart- en vaatziekten te krijgen voor patiënten met ankyloserende spondylitis 20% hoger vergeleken met dat van deelnemers zonder ankyloserende spondylitis (HR 1,20; 95%-BI 1,02 tot 1,42). Daarbij werd gecorrigeerd voor leeftijd, geslacht, urbanisatieniveau, geografische regio, hypertensie, hyperlipidemie en diabetes mellitus.
In het onderzoek van Szabo (2011) werden gestandaardiseerde prevalentieratio’s berekend, waarbij de prevalentie van cardiovasculaire en cerebrovasculaire ziekten onder AS-patiënten vergeleken werden met die onder de algemene bevolking. Er was een significant hoger risico op verschillende cardiovasculaire en cerebrovasculaire ziekten. De gestandaardiseerde prevalentieratio varieerde van 1,25 (95%-BI 1,15 tot 1,35) voor cerebrovasculaire ziekte, 1,34 (95%-BI 1,26 tot 1,42) voor congestief hartfalen, 1,36 (95%-BI 1,29 tot 1,44) voor andere cardiovasculaire ziekten, 1,37 (95%-BI 1,31 tot 1,44) voor ischemische hartziekte, 1,58 (95%-BI 1,31 tot 1,91) voor aortakleplijden en 1,58 (95%-BI 1,43 tot 1,74) voor niet-aortakleplijden. Dit betekent dat patiënten met ankyloserende spondylitis een 25%, 34%, 36%, 37%, 58% en 58% verhoogd risico hebben op de ontwikkeling van genoemde ziekten, vergeleken met diegenen zonder ankyloserende spondylitis van dezelfde leeftijd en geslacht.
Mortaliteit als gevolg van hart- en vaatziekten
In het onderzoek van Dregan (2017) was het risico om te overlijden als gevolg van hart- en vaatziekten voor patiënten met ankyloserende spondylitis 97% hoger gedurende follow-up vergeleken met dat van deelnemers zonder ankyloserende spondylitis (RR 1,97; 95%-BI 1,33 tot 2,90). Daarbij werd gecorrigeerd voor leeftijd, geslacht, sociaaleconomische status, etniciteit en opleidingsniveau.
In het onderzoek van Haroon (2015) werd alleen de ongecorrigeerde hazardratio (HR) voor cardiovasculaire mortaliteit gerapporteerd. Het risico om te overlijden als gevolg van hart- en vaatziekten was voor patiënten met ankyloserende spondylitis 35% hoger gedurende follow-up dan dat van deelnemers zonder ankyloserende spondylitis (HR 1,35; 95%-BI 1,07 tot 1,70). Voor vasculaire mortaliteit (combinatie van cardiovasculaire of cerebrovasculaire mortaliteit) werd de HR zowel ongecorrigeerd als gecorrigeerd gegeven. Het ongecorrigeerde risico om te overlijden als gevolg van hart- en vaatziekten was voor patiënten met ankyloserende spondylitis 43% hoger gedurende follow-up dan dat van deelnemers zonder ankyloserende spondylitis (HR 1,43; 95%-BI 1,19 tot 1,72). Het gecorrigeerde risico was 36% hoger (HR 1,36; 95%-BI 1,13 tot 1,65). Er werd gecorrigeerd voor baseline chronische nierziekten, perifeer vaatlijden, hypertensie, IBD, diabetes mellitus, dementie en kanker.
Bewijskracht van de literatuur
Morbiditeit als gevolg van hart- en vaatziekten: de bewijskracht voor de uitkomstmaat morbiditeit is met drie niveaus verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias door beperkte follow-up duur en onbekende uitval); extrapoleerbaarheid (bias als gevolg van indirectheid door verschillende definiëring van uitkomstmaat); publicatiebias.
Mortaliteit als gevolg van hart- en vaatziekten: de bewijskracht voor de uitkomstmaat mortaliteit is met drie niveaus verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias door beperkte follow-upduur en zelfgerapporteerde predictor en uitkomstmaat); extrapoleerbaarheid (bias als gevolg van indirectheid door verschillende definiëring van uitkomstmaat); publicatiebias.
Conclusie
| Morbiditeit als gevolg van hart- en vaatziekten | |
| Zeer laag GRADE | We zijn te onzeker over de associatie tussen ankyloserende spondylitis en het risico op hart- en vaatziekten. |
| Bronnen: Hung 2016, Szabo 2011 | |
| Mortaliteit als gevolg van hart- en vaatziekten | |
| Zeer laag GRADE | We zijn te onzeker over de associatie tussen ankyloserende spondylitis en het risico op overlijden aan hart- en vaatziekten. |
| Bron: Dregan 2017, Haroon 2015 | |
Overwegingen
Het is onzeker of patiënten met ankyloserende spondylitis (AS) een verhoogd risico op het ontwikkelen van hart- en vaatziekten hebben vergeleken met de algemene populatie, gezien de zeer lage bewijskracht van de verschillende observationele onderzoeken met risico op bias. De resultaten uit de onderzoeken zijn echter wel consistent. Interventieonderzoeken met bloeddrukverlaging en cholesterolverlaging naar het effect op het optreden van hart- en vaatziekten bij deze groep patiënten zijn nooit gedaan en het is zeer onwaarschijnlijk dat deze ooit gedaan zullen worden. De adviezen voor het opstellen van een vasculair risicoprofiel bij patiënten met AS wijken niet af van die bij mensen zonder AS. Voor het inschatten van het vasculaire risico kan de risicotabel worden gebruikt, waarbij het berekende risico naar alle waarschijnlijkheid een geringe onderschatting van het werkelijke risico zal zijn. Alleen is niet duidelijk hoeveel hoger het risico moet worden ingeschat.
Aanbeveling
- Gebruik bij patiënten met ankyloserende spondylitis dezelfde criteria voor het opstellen van een cardiovasculair risicoprofiel als bij patiënten zonder ankyloserende spondylitis.
Uitgangsvraag
Wat is de rol van hiv en of de antiretrovirale medicatie bij het schatten van het risico op hart- en vaatziekten bij personen zonder hart- en vaatziekten?
Inleiding
Hiv is geassocieerd met een verhoogd risico op het krijgen van een van hart- en vaatziekte (HVZ) in vergelijking met de algemene populatie. Mogelijke verklaringen zijn chronische systemische inflammatie door hiv en het gebruik van antiretrovirale medicatie.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvraag: is hiv en/of de antiretrovirale medicatie een onafhankelijke voorspeller voor het krijgen van een hart- en vaatziekte?
P: algemene populatie zonder hart- en vaatziekten
I: hiv met of zonder antiretrovirale medicatie
C: geen hiv of antiretrovirale medicatie
O: morbiditeit en mortaliteit als gevolg van hart- en vaatziekten
Relevante uitkomstmaten
De werkgroep achtte morbiditeit en mortaliteit als gevolg van hart- en vaatziekten voor de besluitvorming kritieke uitkomstmaten.
Zoeken en selecteren (methode)
In de databases PubMed (Medline (via OVID), EMBASE (via Embase.com) en de Cochrane Library (via Wiley)) is op 8 mei 2017 met relevante zoektermen gezocht naar systematische reviews. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 99 treffers op. Onderzoeken werden geselecteerd op grond van het volgende selectiecriterium: relevantie voor de uitgangsvraag. Op basis van titel en abstract werden in eerste instantie acht onderzoeken voorgeselecteerd. Na raadpleging van de volledige tekst werden zeven onderzoeken geëxcludeerd (zie de exclusietabel onder het tabblad Verantwoording) en één onderzoek definitief geselecteerd. Na de uitwerking van de zoekvraag werd gezocht op relevante artikelen na inclusiedatum van de systematische review van Islam. Dit leverde één nieuw onderzoek op. Dit onderzoek keek alleen naar het effect van antiretrovirale medicatie op de mortaliteit door een HVZ, vergeleken met geen medicatie.
Twee onderzoeken zijn opgenomen in de literatuuranalyse. De belangrijkste onderzoekskarakteristieken en resultaten zijn opgenomen in de evidence-tabellen. De beoordeling van de individuele onderzoeksopzet (risk of bias) is opgenomen in de risk of bias-tabellen.
Samenvatting van de literatuur
Beschrijving van de onderzoeken Islam (2012)
De meta-analyse van Islam onderzocht twintig onderzoeken over hiv en het risico op een hart- en vaatziekte. De uiterste inclusiedatum van de review was augustus 2010. De geïncludeerde volwassen patiënten hadden allemaal hiv. De meta-analyse heeft als relevante eindpunten:
- het risico op hart- en vaatziekten bij hiv-geïnfecteerden versus niet hiv-geïnfecteerden;
- het risico op hart- en vaatziekten bij hiv-geïnfecteerden onder behandeling met antiretrovirale medicatie versus niet hiv-geïnfecteerden;
- het risico op hart- en vaatziekten bij hiv-geïnfecteerden onder behandeling met antiretrovirale medicatie versus hiv-geïnfecteerden zonder antiretrovirale medicatie.
Het risico op sterfte door hart- en vaatziekten is niet onderzocht. Voor eindpunt A en B zijn drie onderzoeken geïncludeerd en voor eindpunt C acht onderzoeken. Enkele geïncludeerde cohortonderzoeken voor eindpunt A en B hebben een hoog risico op bias. Er was niet gecorrigeerd voor confounders, noch voor de belangrijkste confounder roken.
Resultaten
Islam (2012)
Het risico op hart- en vaatziekten is voor de drie eindpunten:
- hart- en vaatziekten bij hiv-geïnfecteerden versus niet hiv-geïnfecteerden: RR 1,61 (95%-BI 1,43 tot 1,81);
- hart- en vaatziekten bij hiv-geïnfecteerden onder behandeling met antiretrovirale medicatie versus niet hiv-geïnfecteerden: RR 2,00 (95%-BI 1,70 tot 2,37);
- hart- en vaatziekten bij hiv-geïnfecteerden onder behandeling met antiretrovirale medicatie versus hiv-geïnfecteerden zonder antiretrovirale medicatie: RR 1,52 (95%-BI 1,42 tot 1,70).
Lundgren 2015
Het risico op sterfte door een hart- en vaatziekte bij hiv-geïnfecteerden met medicatie versus hiv-geïnfecteerden zonder medicatie was HR 0,84 (95%-BI 0,39 tot 1,81). Het aantal sterfte-events mortaliteit door een HVZ was respectievelijke twaalf en veertien.
Bewijskracht van de literatuur
De bewijskracht van het onderzoek over hiv als prognostische factor voor het ontwikkelen van hart- en vaatziekten is gewaardeerd aan de hand van de GRADE-methodiek.
Islam (2012)
Eindpunt A: het risico op hart- en vaatziekten bij hiv-geïnfecteerden versus niet hiv-geïnfecteerden.
De bewijskracht voor het eindpunt is met één niveau verlaagd vanwege beperkingen in de onderzoeksopzet van de geïncludeerde onderzoeken in de meta-analyse (risk of bias). De kwaliteit van het bewijs is redelijk.
Eindpunt B: het risico op hart- en vaatziekten bij hiv-geïnfecteerden onder behandeling met antiretrovirale medicatie versus niet hiv-geïnfecteerden.
De bewijskracht voor het eindpunt is met twee niveaus verlaagd vanwege ernstige beperkingen in de onderzoeksopzet van de geïncludeerde onderzoeken in de meta-analyse (risk of bias). De kwaliteit van bewijs is redelijk.
Eindpunt C: het risico op hart- en vaatziekten bij hiv-geïnfecteerden onder behandeling met antiretrovirale medicatie versus hiv-geïnfecteerden zonder antiretrovirale medicatie.
De bewijskracht voor het eindpunt is met één niveau verlaagd vanwege imprecisie. De kwaliteit van bewijs is redelijk.
Lundgren (2015)
Eindpunt: het risico op sterfte door een hart- en vaatziekten bij een hiv-geïnfecteerde met een antiretrovirale medicatie versus een hiv-geïnfecteerde zonder antiretrovirale medicatie.
De bewijskracht is met één punt verlaagd omdat er geen correctie voor confouders is gedaan.
Beschouwing
De literatuuranalyse is voor het eindpunt risico op hart- en vaatziekten bij hiv-geïnfecteerden onder behandeling met antiretrovirale medicatie versus niet hiv-geïnfecteerden redelijk duidelijk. Er is een verhoogd risico bij een hiv-geïnfecteerde op een HVZ. Voor hiv-geïnfecteerde onder behandeling met antiretrovirale medicatie laat de literatuuranalyse een heterogeen beeld zien. De meta-analyse gebruikte vooral wat oudere onderzoeken en het destijds gebruikte behandelschema, wat inhield dat pas bij een lage CD4+ telling dan wel bij symptomen met behandelen werd begonnen. Het huidige behandelschema begint al eerder met behandeling, om te voorkomen dat er klachten en schade ontstaan, zoals atherosclerose. Het onderzoek van Lundgren gaat uit van dit schema. Door de verschillende behandelschema’s en uitkomsten van de onderzoeken is het niet mogelijk om een duidelijke conclusie te trekken over een eventueel verhoogd risico door antiretrovirale medicatie.
Conclusie
| Redelijk GRADE | Een hiv-infectie is mogelijk geassocieerd met een hoger risico op een hart- of vaatziekte in vergelijking met de algemene populatie onafhankelijk van klassieke risicofactoren. |
| Bron: Islam 2012 |
| Redelijk GRADE | Een hiv-infectie behandeld met antiretrovirale medicatie is waarschijnlijk niet geassocieerd met een verhoogd risico op een hart- of vaatziekte in vergelijking met een hiv-infectie die niet behandeld wordt met antiretrovirale medicatie, onafhankelijk van klassieke risicofactoren. |
| Bron: Islam 2012 |
Overwegingen
Al sedert vele jaren wordt er melding gemaakt van een verhoogd cardiovasculair risico bij hiv-geïnfecteerde patiënten, al dan niet met antiretrovirale behandeling. De meta-analyse die naar deze verbanden verricht is, laat wel consistent een verhoogd risico zien, maar heeft beperkingen, waaronder incomplete of onduidelijke correctie voor de klassieke cardiovasculaire risicofactoren, alsmede onvoldoende aandacht voor (publicatie)bias. Of, en zo ja, in welke mate (behandeling voor) hiv daadwerkelijk een cardiovasculair risico met zich meebrengt valt daarom niet met zekerheid te zeggen. Een cardiovasculaire risico-inventarisatie bij deze patiënten valt vanwege de bestaande aanwijzingen voor een verhoogd risico op hart- en vaatziekten te overwegen en maakt ook onderdeel uit van de meeste (inter)nationale hiv-behandelprotocollen. Op dit moment is er evenwel onvoldoende reden om bij deze populatie op basis van de uitkomsten van de risico-inventarisatie een ander beleid te voeren dan bij niet hiv-geïnfecteerden.
Aanbeveling
- Overweeg een risicoprofiel op hart- en vaatziekten op te stellen bij patiënten met een – al dan niet behandelde – hiv-infectie.
Uitgangsvraag
Wat is de rol van inflammatory bowel disease (IBD: M. Crohn (CD) en colitis ulcerosa (CU)) bij het schatten van het risico op hart- en vaatziekten bij personen zonder hart- en vaatziekten?
Inleiding
Uit observationele onderzoeken is gebleken dat patiënten met IBD mogelijk een verhoogd risico hebben op arteriële trombo-embolische events, zoals een myocardinfarct of herseninfarct, in vergelijkbare mate als het verhoogde risico bij andere inflammatoire aandoeningen, zoals reumatoïde artritis. Het is de vraag of IBD inderdaad onafhankelijk van andere bekende risicofactoren voor hart- en vaatziekten een risicoverhogende factor vormt.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvraag: hebben patiënten met IBD meer risico op het krijgen van een hart- en vaatziekte?
P: algemene populatie zonder hart- en vaatziekten
I: IBD
C: geen IBD
O: morbiditeit en mortaliteit als gevolg van hart- en vaatziekten
Relevante uitkomstmaten
De werkgroep achtte zowel morbiditeit als mortaliteit als gevolg van hart- en vaatziekten voor de besluitvorming kritieke uitkomstmaten.
Zoeken en selecteren (methode)
In de database Medline is met relevante zoektermen gezocht; de zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 327 treffers op met zoekfilter systematische reviews/meta-analyses en observationele onderzoeken. Onderzoeken werden door twee onderzoekers onafhankelijk van elkaar geselecteerd op grond van het volgende selectiecriterium: relevantie voor de uitgangsvraag. Conflicten werden via onderlinge discussie opgelost. Op basis van titel en abstract werden in eerste instantie 42 SR/MA voorgeselecteerd. Uiteindelijk zijn twee SR’s geselecteerd: een SR/MA met zoekdatum 1 maart 2013, die zowel ischemische hartziekten als CVA als eindpunten had, en een SR/MA met zoekdatum 13 mei 2015, die alleen CVA als eindpunt had. Vervolgens werd vanaf de zoekdata van de SR’s/MA gezocht naar nieuw verschenen originele onderzoeken. Voor het eindpunt CVA werden geen aanvullende observationele onderzoeken na 2015 gevonden; voor het eindpunt ischemische hartziekten werden nog vier aanvullende cohort- of patiënt-controleonderzoeken gevonden. De onderzoeken van Close, Dregan en Tsai zijn uiteindelijk niet meegenomen in de bespreking omdat deze geen nieuwe informatie gaven over de zoekvraag. De kwaliteit van de twee meta-analyses zijn respectievelijk hoog en matig en hadden een veel grotere patiëntenpopulatie.
Het cohortonderzoek van Jussilla (2014) wordt wel besproken omdat het informatie geeft over de uitkomstmaat sterfte door een hart- en vaatziekte (zie de exclusietabel onder het tabblad Verantwoording, origineel onderzoek). De belangrijkste onderzoekskarakteristieken en resultaten zijn opgenomen in de evidence-tabel. De beoordeling van de individuele onderzoeksopzet (risk of bias) is opgenomen in de kwaliteit van de onderzoeken tabellen.
Samenvatting van de literatuur
Singh et al. deden in 2014 een systematische review en meta-analyse van acht cohort- en patiënt-controlonderzoeken die incidente CVA’s (vijf onderzoeken) en ischemische hartziekten (zes onderzoeken) rapporteerden in patiënten met en zonder IBD. Gepoolde OR’s met 95%-betrouwbaarheidsintervallen zijn berekend.
Xiao deden in 2015 een vergelijkbare SR/MA als Singh, met alleen het aantal CVA’s als eindpunt. Gepoolde HR’s met 95%-betrouwbaarheidsintervallen zijn berekend.
Jussila (2014) onderzocht met een databaseonderzoek de incidentie van mortaliteit en de doodsoorzaak bij IBD in vergelijking met de verwachte sterftecijfers en doodsoorzaak in de Finse populatie.
Resultaten
Ischemische hartziekte
De meta-analyse van Singh vindt een verhoogde OR 1,18 (95%-BI 1,07 tot 1,31), voor het risico op een ischemische hartziekte bij een patiënt met IBD.
CVA
De meta-analyse’s van Singh en Xiao vinden een verhoogde OR voor het risico op een CVA bij een patiënt met IBD. In beide meta-analyses is de uitkomstmaat verhoogd, respectievelijk een OR van 1,18 (95%-BI 1,09 tot 1,27) en 1,29 (95%-BI; 1,16 tot 1,43).
Sterfte door ischemische hartziekte
Het cohortonderzoek van Jussila vindt bij de ziekte van Crohn geen verhoogd risico op sterfte door een ischemische hartziekte. Bij colitis ulcerosa is er een licht verhoogd risico op sterfte door een ischemische hartziekte, standardized mortality rate (SMR) 1,21 (95%-BI 1,10 tot 1,31).
Sterfte door CVA
Het cohortonderzoek van Jussila vindt geen verhoogd risico op sterfte door een CVA bij een IBD.
| Onderzoeken | Uitkomstmaten | |||
|---|---|---|---|---|
| Ischemische hartziekte | CVA | Sterfte door ischemische hartziekte | Sterfte door CVA | |
| SR/MA | ||||
| Singh | OR gecorrigeerd (95%-BI) 1,18 (1,07 tot 1,31) | OR gecorrigeerd (95%-BI) 1,18 (1,09 tot 1,27) | ||
| Cohort studies | ||||
| Xiao | HR (95%-BI) 1,29 (1,16 tot 1,43) | |||
| Jussila | Crohn: | Crohn: | ||
| SMR (95%-BI) 1,13 (0,90 tot 1,39) | SMR (95%-BI) 1,07 (0,72 tot 1,54) | |||
| CU: | CU: | |||
| SMR (95%-BI) 1,21 (1,10 tot 1,31) | SMR (95%-BI) 1,00 (0,84 tot 1,16) | |||
Bewijskracht van de literatuur
De bewijskracht van de onderzoeken over IBD als prognostische factor voor het ontwikkelen van hart- en vaatziekten is gewaardeerd aan de hand van de GRADE-methodiek.
Singh
De kwaliteit van bewijs is hoog; zie de tabel kwaliteit van bewijs voor details.
Xiao
De kwaliteit van bewijs is afgewaardeerd met één niveau vanwege grote heterogeniteit van de populatie. De kwaliteit van het bewijs is hiermee matig.
Jussila
Er is door de opzet risico op vertekening. Niet alle confouders zijn meegenomen en ervoor gecorrigeerd. De doodsoorzaak is afkomstig van het Finse nationale basisregistratiesysteem. De doodsoorzaak is vastgesteld met medisch of forensisch onderzoek. De laatste is nodig bij twijfel over een natuurlijke doodsoorzaak. Bij medisch onderzoek voor het vaststellen van de doodsoorzaak is er een reële mogelijkheid op overschatting door een ischemische hartziekte.
Conclusie
| Hoog GRADE | Het is zeker dat er een licht verhoogd risico is op een ischemische hartziekte door de aanwezigheid van IBD. |
| Bron: Singh 2014 |
| Redelijk GRADE | Het is aannemelijk dat er een licht verhoogd risico is op een CVA door de aanwezigheid van IBD. |
| Bronnen: Singh 2014, Xiao 2015 |
| Laag GRADE | Er is onzekerheid over het risico op sterfte door een hart- en vaatziekte door de aanwezigheid van IBD. |
| Bron: Jussila 2014 |
Overwegingen
Er is een klein significant verhoogd risico op een hart- en vaatziekte bij een IBD. Daarom lijkt het de werkgroep zinnig om bij deze groep minimaal een risico-inventarisatie op hart- en vaatziekten te doen. Het zijn wel vaak relatief jonge personen (< 50 jaar), waardoor het absolute risico op hart- en vaatziekten laag is. Door het licht verhoogde risico is reclassificatie naar een hogere risicogroep niet aan de orde. Er zijn geen aanwijzingen dat patiënten met IBD anders behandeld dienen te worden.
Aanbeveling
- Overweeg een risicoprofiel voor hart- en vaatziekten bij patiënten met IBD op te stellen. Er is geen reclassificatie naar een hogere risicogroep door de IBD.
Aanbevelingen
Naar Samenvatting ›- Overweeg het bepalen van psychosociale risicofactoren tijdens een consult of door middel van gestandaardiseerde vragenlijsten, om bij twijfel over het risico op hart- en vaatziekten het risico aan te passen.
- Indien een coronaire kalkscore bekend is, kan deze gebruikt worden om het tienjaarsrisico op hart- en vaatziekte, geschat met SCORE2, te reclassificeren naar een hoger of lager risico als de coronaire kalkscore daar aanleiding voor geeft.
- Overweeg om een coronaire kalkscore te bepalen bij patiënten tussen de 50 en 70 jaar als een gesprek met de patiënt over het al dan niet starten van medicamenteuze behandeling geen besluit oplevert.
- Houd bij de interpretatie van de kalkscore>0 rekening met leeftijd, geslacht en etnische achtergrond.
- Het resultaat van een coronaire kalkscore kan als volgt gebruikt worden:
- Bij een coronaire kalkscore van 0 kan gereclassificeerd worden naar een lager risico.
- Bij een coronaire kalkscore ≥ 100 (of ≥ 75ste percentiel) kan gereclassificeerd worden naar een hoger risico.
Richtlijnen beleid
Naar Samenvatting ›Niet-medicamenteuze behandeling
Naar Samenvatting ›2.1 Leefstijladviezen
Naar Samenvatting ›Leefstijladviezen zijn onderdeel van alle maatregelen om het risico op hart- en vaatziekten te verlagen. Aanpassing van de leefstijl verlaagt het cardiovasculair risico. Voor blijvende aanpassing is herhaling van de adviezen essentieel.
2.1.1 Gedragsverandering
Naar Samenvatting ›Leefstijl bestaat uit langdurige gedragspatronen die in stand worden gehouden door de omgeving. Dit geeft al aan dat blijvende aanpassingen lastig te bewerkstelligen zijn. Het effect van een gedragsverandering, bijvoorbeeld stoppen met roken, kan soms groot zijn.
Gedragsverandering begint bij exploratie van de achterliggende gedachten over en de motivatie voor eventuele veranderingen. Hierbij kan men gebruikmaken van cognitieve gedragsstrategieën, zoals motiverende gespreksvoering. Bepaal samen met de patiënt de individuele doelen. Deze doelen moeten haalbaar zijn en in kleine stappen kunnen worden bereikt. Het betrekken van een multidisciplinair team helpt bij het halen van de doelen. Langdurige begeleiding van gedragsverandering is effectiever dan kortdurende.
Uitgangsvraag
Wat is de meest effectieve manier om gedragsverandering ten aanzien van leefstijl tot stand te brengen en te behouden?
Inleiding
‘Leefstijl’ is meestal gebaseerd op langdurige gedragspatronen die mede in stand worden gehouden door de (sociale) omgeving. Individuele en omgevingsfactoren hinderen het vermogen een gezonde leefstijl aan te nemen en te behouden, evenals ingewikkelde of verwarrende adviezen van zorgverleners. Vriendelijke en positieve interactie maakt dat personen beter kunnen omgaan met ziekte en zich beter houden aan de aanbevolen veranderingen in leefstijl (empowerment). Het is belangrijk navraag te doen naar eerdere ervaringen, gedachten, zorgen, kennis en dagelijkse omstandigheden van elke patiënt. Individuele voorlichting vormt de basis voor motivatie en therapietrouw. De zorgverlener en de patiënt (hiertoe worden ook de partner en het gezin gerekend) moeten samen beslissen. Daarnaast kunnen zorgverleners gebruikmaken van cognitieve gedragsstrategieën om zo meer te weten te komen over de gedachten, houding en opvattingen van de patiënt en of hij/zij denkt te kunnen veranderen, evenals de invloed van de omgeving. Gedragsinterventies, zoals motiverende gespreksvoering, vergroten de motivatie en het vertrouwen van de patiënt om zijn of haar gedrag positief te veranderen.
Eerdere, niet-geslaagde pogingen beïnvloeden vaak deze motivatie en het vertrouwen in toekomstige verandering. Een belangrijke stap is ondersteunen bij het stellen van realistische doelen, in combinatie met zelf toezien op de gekozen gedragsverandering. Vooruitgang boeken met kleine, opeenvolgende stapjes is essentieel voor gedragsverandering op de lange termijn. Communicatietraining is belangrijk voor professionals in de gezondheidszorg. De principes van effectieve communicatie (tabel 18) en de tien strategische stappen om gedragsverandering te bewerkstellingen (tabel 19) kunnen helpen bij het begeleiden van gedragsverandering.
| Breng genoeg tijd door met de persoon voor het scheppen van een therapeutische band; een paar minuten meer kan al verschil maken. |
| Erken de persoonlijke visie op zijn of haar ziekte en de factoren die er aan bijdragen. |
| Bevorder het uiten van zorgen, angsten en de eigen reflectie op de motivatie en de kans op succes. |
| Spreek met de persoon op zijn of haar niveau en ondersteun elke verbetering in leefstijl. |
| Stel vragen om na te gaan of de persoon het advies heeft begrepen en of ondersteuning noodzakelijk is. |
| Bevestig dat het veranderen van levenslang gedrag moeilijk kan zijn en dat langzame veranderingen beter standhouden dan snelle veranderingen. |
| Accepteer dat de ondersteuning soms gedurende een lange periode noodzakelijk is en dat herhaalde ondersteuning nodig is om een verandering in de leefstijl te bewerkstelligen. |
| Zorg ervoor dat alle zorgverleners dezelfde informatie verstrekken. |
| Tabel overgenomen uit Martin et al. (2014) |
| 1. | Ontwikkel een therapeutische alliantie. |
| 2. | Adviseer alle individuen met een risico op of met manifeste hart- en vaatziekten. |
| 3. | Geef personen de kans om de relatie tussen hun gedrag en gezondheid te begrijpen. |
| 4. | Help individuen de belemmeringen voor gedragsverandering te beoordelen. |
| 5. | Krijg toezeggingen van individuen over het erop nahouden van hun gedragsverandering. |
| 6. | Betrek individuen bij het identificeren en selecteren van de risicofactoren om te veranderen. |
| 7. | Gebruik een combinatie van strategieën, waaronder versterking van het verandervermogen van het individu. |
| 8. | Ontwerp een plan voor aanpak voor de leefstijlaanpassingen. |
| 9. | Betrek andere gezondheidsmedewerkers waar mogelijk. |
| 10. | Volg de voortgang via controles. |
| Tabel overgenomen uit Martin et al. (2014) | |
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is gebruikgemaakt van de Europese richtlijn Cardiovascular disease prevention in clinical practice uit 2016. Er is voor beantwoording van deze uitgangsvraag geen systematisch literatuuronderzoek verricht.
Overwegingen
Het combineren van de kennis en vaardigheden van zorgverleners tot multimodale gedragsinterventies kan het preventieve werk optimaliseren. Multimodale gedragsinterventies worden vooral aangeraden voor personen met een zeer hoog risico. Per individu en in samenspraak met de patiënt kunnen een of meer zorgverleners betrokken worden: verschillende artsen (huisartsen, medisch specialisten en bedrijfsartsen), praktijkondersteuners voor de huisarts, verpleegkundigen, diëtisten, fysiotherapeuten, zorgverleners op het gebied van hartrevalidatie of leefstijlverandering en psychologen. Deze interventies omvatten het bevorderen van een gezonde leefstijl met betrekking tot voeding, lichaamsbeweging, ontspanningstraining, gewichtsbeheersing en antirookprogramma’s voor rokers die niet in staat zijn om zonder hulp te stoppen; zie de Praktijkhandleiding Leefstijl. Ze helpen bij het omgaan met de ziekte, zorgen voor betere therapietrouw en een lager risico op hart- en vaatziekten. Psychosociale risicofactoren (stress, sociale isolatie en negatieve emoties) die een hindernis kunnen vormen voor gedragsverandering moeten worden besproken tijdens gerichte individuele of groepsbegeleidingssessies. In dat geval kan het nodig zijn te verwijzen naar de praktijkondersteuner voor de geestelijke gezondheidszorg (ggz) of psycholoog.
Er zijn aanwijzingen dat hoe uitgebreider of langer de interventies, des te beter de resultaten op de lange termijn wat betreft gedragsverandering en prognose. Personen met een lage sociaaleconomische status, ouderen of vrouwen hebben mogelijk aangepaste programma’s nodig die voldoen aan hun specifieke behoeften wat betreft informatie of emotionele ondersteuning.
Voor het richting geven aan de organisatie van de zorg zouden we wat meer kunnen kijken naar de stimulansen of belemmeringen om tot gedragsverandering te komen, voor zowel de patiënten als de zorgverleners. Zorgverleners hebben een belangrijke rol in het stimuleren en begeleiden van patiënten naar ander gedrag, maar hebben daar niet (altijd) voldoende tijd, kennis en vaardigheden voor. De focus kan liggen op het vergroten van het vermogen tot zelfmanagement door patiënten en de mate waarin zorgverleners daaraan kunnen bijdragen. Ondersteuning bij zelfmanagement onder andere door het aanleren van vaardigheden en actieve participatie (bijvoorbeeld digitale ondersteuning) kan gunstige resultaten hebben. Zie hiervoor tevens detail Waar te interveniëren; zorgsetting en betrokkenen.
Hoewel interventies door de zorgverlener van belang zijn voor gedragsverandering zijn er ook beperkingen aan de effectiviteit. Inmiddels is bekend dat (overheids)maatregelen op populatieniveau met betrekking tot voedingsmiddelen, verkrijgbaarheid van tabak, verandering van leef- en werkomgeving een essentiële rol kunnen spelen (zie Interventies op populatieniveau).
Aanbevelingen
- Gebruik cognitieve gedragsstrategieën, zoals motiverende gespreksvoering en methoden om zelfmanagement te bevorderen om leefstijlverandering te ondersteunen.
- Betrek een of meer zorgverleners om gedragsveranderingen te bewerkstelligen.
- Zet multimodale interventies in voor personen met een zeer hoog cardiovasculair risico, waarin de medische behandeling geïntegreerd is met educatie over gezonde voeding, beweegadviezen, stressbeheersing en gespreksvoering over psychologische risicofactoren.
Aanbevelingen
Naar Samenvatting ›- Gebruik cognitieve gedragsstrategieën om leefstijlverandering te ondersteunen, zoals motiverende gespreksvoering en methoden om zelfmanagement te bevorderen.
- Betrek een of meer zorgverleners om gedragsveranderingen te bewerkstelligen.
- Zet multimodale interventies in voor personen met een zeer hoog cardiovasculair risico, waarin de medische behandeling geïntegreerd is met educatie over gezonde voeding, beweegadviezen, stressbeheersing en gespreksvoering over psychologische risicofactoren.
2.1.2 Psychosociale factoren
Naar Samenvatting ›Reductie van psychosociale stress, depressie en angststoornissen kan een positieve gedragsverandering stimuleren en zowel de kwaliteit van leven als de prognose verbeteren. Daarom wordt psychosociale ondersteuning aanbevolen bij personen met een hoog of zeer hoog risico op hart- en vaatziekten. Bij patiënten met depressie, angststoornissen of andere psychische aandoeningen wordt aanbevolen om te behandelen volgens de daarvoor bestaande richtlijnen (zie Details).
Uitgangsvraag
Hoe dient te worden omgegaan met psychosociale risicofactoren bij personen met een hoog/zeer hoog risico op hart- en vaatziekten of bij personen met hart- en vaatziekten?
Inleiding
Een lage sociaaleconomische status, het ontbreken van maatschappelijke steun, stress op het werk en in het gezin, vijandigheid, depressie, angst en andere psychische stoornissen dragen bij aan het risico op hart- en vaatziekten en een slechtere prognose bij hart- en vaatziekten, terwijl het ontbreken van deze factoren wordt geassocieerd met een lager risico op het ontstaan van hart- en vaatziekten en een betere prognose bij hart- en vaatziekten. Daarnaast vormen psychosociale risicofactoren een hindernis bij therapietrouw en pogingen de leefstijl te verbeteren, en bij het bevorderen van gezond gedrag onder patiënten en de bevolking.
Een lagere sociaaleconomische status, sociale isolatie, gebrek aan sociale steun en chronische stress, hebben een negatieve invloed op de leefstijl van patiënten en hun cardiovasculaire risico. Ongunstige psychosociale omstandigheden blijken gerelateerd aan een hogere incidentie van de bekende cardiovasculaire risicofactoren. Bovendien is het lastig om leefstijl gunstig te beïnvloeden wanneer een patiënt gebukt gaat onder ongunstige psychosociale omstandigheden. Het is echter nog niet helemaal duidelijk hoe er met de psychosociale risicofactoren dient te worden omgegaan bij personen met (een (zeer) hoog risico op) hart- en vaatziekten.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is gebruikgemaakt van de Europese richtlijn Cardiovascular disease prevention in clinical practice uit 2016.
Overwegingen
Zorgverleners in de klinische praktijk bekleden een unieke positie doordat ze hun patiënten rechtstreeks kunnen ondersteunen ten aanzien van psychosociale risicofactoren bij personen met een hoog risico op hart- en vaatziekten of met bestaande aandoeningen. Empathische communicatie waarbij de patiënt centraal staat, helpt bij het vormen en behouden van een vertrouwensrelatie en vormt een krachtige bron van emotionele steun en professionele begeleiding bij de omgang met psychosociale stressfactoren, depressie, angst, risicofactoren voor hart- en vaatziekten.
De principes van empathische communicatie waarbij de patiënt centraal staat, kunnen door iedere hulpverlener gehanteerd worden:
- Neem de tijd voor de patiënt, luister zorgvuldig en herhaal belangrijke sleutelwoorden.
- Moedig de patiënt aan zijn/haar emoties te uiten, bagatelliseer psychosociale lasten en zorgen niet.
- Leg belangrijke medische feiten uit aansluitend op het (taal)niveau van de patiënt, draag hoop uit en opluchting over schuldgevoelens, versterk effectieve copingstrategieën.
- Informeer bij ernstige mentale symptomen naar behandelingsvoorkeuren en bespreek samen met de patiënt toekomstige diagnostische en therapeutische stappen.
- Vat de belangrijkste punten van het consult samen om te bevestigen dat de patiënt begrepen is.
- Biedt regelmatige follow-upcontacten aan.
Gespecialiseerde psychologische interventies kunnen van aanvullend nut zijn bij gevoelens van verdriet, depressiviteit en angst, zelfs wanneer ze worden toegevoegd aan de standaardrevalidatie. Tot deze interventies behoren individuele of groepsbegeleiding over psychosociale risicofactoren, het omgaan met ziekte, programma’s voor stressmanagement, autogene training, biofeedback, ademhalingsoefeningen, yoga, mindfulness en/of spierontspanning.
Multidisciplinaire ondersteuning kan van grote en blijvende invloed zijn op depressie; dit kan bestaan uit een systematische beoordeling van de depressie, symptoommonitoring, behandelinterventies en zorgcoördinatie. Multidisciplinaire ondersteuning (collaborative care) bij depressie leidde tot een 48% lager risico op het ontstaan van eerste ischemische hartklachten acht jaar na begin van de behandeling vergeleken met gebruikelijke zorg (RR 0,52 (95%-BI 0,31, 0,86)). Online cognitieve gedragstherapie voor depressieve patiënten met een hoog risico op hart- en vaatziekten leidde tot een kleine, maar duidelijke verbetering van de depressieve symptomen en behandeltrouw, en van sommige leefstijlaspecten.
Bij patiënten met bestaande ischemische hartklachten zijn behandelingen van depressie (psychotherapie en/of medicatie) gematigd effectief bij het verminderen van hartklachten (NNT 34), maar leiden niet tot een vermindering van sterfte. Multidisciplinaire ondersteuning is vooral effectief bij symptomen van depressie en deels effectief voor de prognose van hart- en vaatziekten. Daarnaast zijn er aanwijzingen dat lichaamsbeweging effectief kan zijn bij het verbeteren van depressie bij patiënten met ischemische hartklachten.
Behalve de behandeling van stemmingssymptomen zijn er ook diverse andere benaderingen van psychosociale interventie nuttig gebleken. Twee RCT’s [Orth-Gomer 2009, Gulliksson 2011] hebben het gunstige effect van stressmanagement en sociale ondersteuningsgroepen op de prognose van klinische ischemische hartklachten aangetoond. Begeleiding door een verpleegkundige heeft een gunstig effect op angst, depressie en algemeen welzijn van patiënten met ischemische hartklachten.
Bij patiënten met hart- en vaatziekten die moeite hebben om te gaan met hun ziekte of weerstand ervaren om hun leefstijl te veranderen, kan een groepsinterventie gericht tegen hun ervaren weerstanden niet alleen leiden tot een verbetering van hun acceptatie en therapietrouw, maar ook tot een verlaging van de depressieve gevoelens, hartslag in rust en de reactiviteit van het hart- en vaatstelsel op geestelijke stress, en tot meer sociale steun en tevredenheid over het leven. Veranderingen op het werk, gericht op meer autonomie en grotere controle kunnen leiden tot verbeterde maatschappelijke steun en een vermindering van de fysiologische stressreacties. Een vermindering van de werkstress onder managers en supervisors kan een gunstig effect hebben op de gezondheid van de doelgroep, en bij hun ondergeschikten het gevoel van maatschappelijke steun verbeteren.
Aanbevelingen
- Bied personen met een hoog of zeer hoog risico op hart- en vaatziekten die psychosociale problemen hebben, naast leefstijlbegeleiding psychosociale ondersteuning aan.
- Overweeg ook psychosociale ondersteuning bij patiënten met hart- en vaatziekten die moeite hebben om te gaan met hun ziekte, of die weerstand ervaren om hun leefstijl te veranderen.
- Behandel personen met hart- en vaatziekten en een psychische aandoening (zoals depressie, psychose of angststoornis) volgens vigerende richtlijnen om zowel hun psychische als fysieke gezondheid te bevorderen.
- Overweeg behandeling van psychosociale risicofactoren die klassieke risicofactoren negatief beïnvloeden (bijvoorbeeld toename van roken bij stress).
Aanbevelingen
Naar Samenvatting ›- Bied personen met een hoog of zeer hoog risico op hart- en vaatziekten die psychosociale problemen hebben, naast leefstijlbegeleiding psychosociale ondersteuning aan.
- Overweeg ook psychosociale ondersteuning bij patiënten met hart- en vaatziekten die moeite hebben om te gaan met hun ziekte, of die weerstand ervaren om hun leefstijl te veranderen.
- Behandel personen met hart- en vaatziekten en een psychische aandoening (zoals depressie, psychose of angststoornis) volgens vigerende richtlijnen, om zowel hun psychische als fysieke gezondheid te bevorderen.
- Overweeg behandeling van psychosociale risicofactoren die klassieke risicofactoren negatief beïnvloeden (bijvoorbeeld toename van roken bij stress).
2.1.3 Sedentaire leefstijl en lichamelijke activiteit
Naar Samenvatting ›Bewegen verlaagt het risico op hart- en vaatziekten. Uit onderzoek blijkt dat de gunstige effecten toenemen naarmate de hoeveelheid beweging toeneemt. Bij volwassenen levert 75 minuten per week bewegen bij matige intensiteit al gezondheidswinst op, 150 minuten per week levert meer op en (meer dan) het dubbele is nog beter voor de gezondheid. Relatief is de grootste winst te behalen door van lichamelijk inactief (geen activiteit met matige of zware intensiteit), actief te worden met matige of zware intensiteit.
Veel zitten hangt samen met een hoger risico op sterfte aan hart- en vaatziekten en vroegtijdige sterfte. Het verband wordt zwakker naarmate personen meer bewegen en is niet aanwezig bij personen die zeer actief zijn (ruim boven de huidige beweegnorm). De wetenschappelijke onderbouwing voor de effecten van zitten is nog beduidend minder sterk dan voor bewegen (zie Details).
Uitgangsvraag
Welke vorm van lichaamsbeweging is effectief in het verminderen van het risico op hart- en vaatziekten?
Deze uitgangsvraag bevat de volgende deelvragen:
- Welke duur, frequentie en intensiteit van fysieke activiteit is effectief in het verminderen van het risico op hart- en vaatziekten?
- Is zitten een risicofactor voor hart- en vaatziekten? Zo ja, hoe kan dit risico worden verminderd?
Inleiding
Bewegen verlaagt het risico op hart- en vaatziekten. Uit onderzoek blijkt dat de gunstige effecten toenemen naarmate de hoeveelheid beweging toeneemt. De zoekvraag richt zich op wat de minimale beweegduur is en welke mate van intensiteit van bewegen nodig is om hart- en vaatziekten te voorkomen.
Onderzoeken suggereren dat veel zitten gepaard gaat met een hoger risico op hart- en vaatziekten en vroegtijdige sterfte. De zoekvraag richt zich op vanaf welke duur van zitten het risico op hart- en vaatziekten verhoogd is en hoe dit risico verminderd kan worden.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is gebruikgemaakt van de Beweegrichtlijn van de gezondheidsraad uit 2017.
Overwegingen
Bewegen
Het is overtuigend aangetoond dat bewegen het risico op hart- en vaatziekten verlaagt. Cohortonderzoek laat een verband zien tussen veel bewegen en een lager risico op hart- en vaatziekten. Dit wordt ondersteund door RCT’s die aantonen dat duurtraining en krachttraining de bloeddruk verlagen. Bovendien blijkt duurtraining ook de vetmassa en buikomvang te verminderen. Uit het cohortonderzoek komt enige indicatie naar voren van de benodigde frequentie en intensiteit van de beweging. De centrale bevinding is: hoe meer beweging, des te groter de gunstige effecten. Relatief is de meeste winst te behalen door van lichamelijk inactief, actief te worden, dat wil zeggen voldoende activiteiten uit te voeren met ten minste matige intensiteit (fietsen, tuinieren en wandelen): het onderzoek laat zien dat 75 minuten per week matig intensief bewegen het risico op een hartaanval en hartfalen al verlaagt; 150 minuten per week doet het risico verder dalen en 300 minuten of meer is nog gunstiger. Onderzoek naar beroerte laat eveneens een positief effect zien van beweging met matige en zware intensiteit op het risico op een beroerte. RCT’s bevestigen het belang van duurtraining bij matige en zware intensiteit, en van drie tot vijf keer per week krachttraining, waarbij vier keer twee minuten de spieren van handen of benen worden aangespannen. Op basis van de RCT’s is het niet mogelijk een uitspraak te doen over de benodigde hoeveelheid van de beweging. Daarvoor is de spreiding in frequentie en duur van de duurtraining en in intensiteit van de krachttraining te groot tussen de onderzoeken. Ook laten meerdere RCT’s zien dat veel bewegen een gunstig effect heeft bij diabetes mellitus of het ontstaan van diabetes mellitus. Zo blijken duurtraining en krachttraining de insulinegevoeligheid te verbeteren. Ook vermindert duurtraining het lichaamsgewicht bij volwassenen met een normaal gewicht, overgewicht en obesitas. Ten slotte laat een RCT zien dat beweging het risico op diabetes mellitus vermindert. Hoeveel beweging nodig is om het risico op diabetes mellitus te verlagen is op basis van de huidige onderzoeken niet te zeggen, omdat daarin de hoeveelheid lichamelijke activiteit onvoldoende gekwantificeerd was. RCT’s naar krachttraining vinden gunstige effecten bij twee tot drie trainingen per week bij matige tot zware intensiteit. Ook hierbij is de informatie te beperkt om de benodigde hoeveelheid te bepalen. In de enkele RCT naar het effect van bewegen op diabetes mellitus liepen de trainingsprogramma’s te zeer uiteen (30 tot 60 minuten lichte activiteit per dag tot 5 tot 10 minuten zeer zware activiteit per dag) voor kwantificering van de benodigde hoeveelheid beweging.
Conclusie
Bij volwassenen levert 75 minuten per week bewegen bij matige intensiteit al gezondheidswinst op (onder meer minder risico op hart- en vaatziekten), 150 minuten per week levert meer op en (meer dan) het dubbele is nog beter voor de gezondheid. In het cohortonderzoek nemen de gunstige effecten toe naarmate de beweging toeneemt. Relatief is de grootste winst te behalen door van lichamelijk inactief (geen activiteit met matige of zware intensiteit), actief te worden met matige of zware intensiteit. RCT’s vinden gunstige effecten van matig en zwaar intensieve duurtraining en van twee tot vijf keer per week krachttraining.
Zitten
Het is aannemelijk dat veel zitten, meer dan acht uur per dag ten opzichte van minder dan vier uur per dag, samenhangt met een hoger risico op vroegtijdig overlijden en overlijden aan hart- en vaatziekten. Cohortonderzoek laat een dergelijk verband zien bij veel zitten (meer dan acht uur per dag ten opzichte van minder dan vier uur per dag). Het verband wordt zwakker naarmate personen meer bewegen en is niet aanwezig bij personen die zeer actief zijn. Op basis van het onderzoek is het niet mogelijk te kwantificeren bij hoe lang zitten de ongunstige verbanden optreden.
De effecten van zitten op de gezondheid zijn nog beperkt onderzocht in cohortonderzoek en vrijwel niet in RCT’s. Dit geldt zowel voor onderzoek bij kinderen als volwassenen en ouderen. Hierdoor zijn harde uitspraken over deze effecten niet mogelijk. In een deel van de cohortonderzoeken wordt tv-kijken of beeldschermgebruik als indicator voor zitten gebruikt. Het is onduidelijk in hoeverre de uitkomsten verband houden met zitten in het algemeen en in hoeverre de relatie zich beperkt tot tv-kijken of beeldschermgebruik en wat daarmee samengaat, zoals bijvoorbeeld de consumptie van suikerhoudende dranken en snacks. Verder lijkt het effect van zitten afhankelijk van de mate van beweging met matige en zware intensiteit. Toekomstig onderzoek met beweegmeters kan naar verwachting meer inzicht geven in de effecten van zitten (en lichamelijke activiteit). Dit betreft niet alleen het belang van minder zitten voor de gezondheid, maar ook de vraag in hoeverre het van belang is het zitten regelmatig te onderbreken. Levert bijvoorbeeld het vervangen van zitten door staan of het regelmatig afwisselen van zitten met activiteiten met lichte intensiteit en/of staan gezondheidswinst op?
Conclusie
Veel zitten hangt samen met een hoger risico op sterfte aan hart- en vaatziekten en vroegtijdige sterfte. Het verband wordt zwakker naarmate personen meer bewegen en is niet aanwezig bij personen die zeer actief zijn (ruim boven de huidige beweegnorm). De wetenschappelijke onderbouwing voor de effecten van zitten is op het moment nog beduidend minder sterk dan voor bewegen, zowel voor volwassenen en ouderen als voor kinderen. Op grond van het onderzoek is dan ook geen kwantificering mogelijk.
Aanbevelingen
- Geef aan elke patiënt met een verhoogd risico op hart- en vaatziekten een beweegadvies conform de adviezen van de Gezondheidsraad. Bewegen is goed, meer bewegen is beter.
- Adviseer minstens 150 minuten per week aan matig intensieve inspanning, zoals wandelen en fietsen, verspreid over diverse dagen. Integreer de activiteiten in het dagelijkse leven. Langer, vaker en/of intensiever bewegen geeft extra gezondheidsvoordeel.
- Adviseer om veel zitten (meer dan 8 uur per dag) te voorkomen.
Aanbevelingen
Naar Samenvatting ›- Geef elke patiënt met een verhoogd risico op hart- en vaatziekten een beweegadvies conform de adviezen van de Gezondheidsraad. Bewegen is goed, meer bewegen is beter.
- Adviseer minstens 150 minuten per week aan matig intensieve inspanning, zoals wandelen en fietsen, verspreid over diverse dagen. Integreer de activiteiten in het dagelijkse leven. Langer, vaker en/of intensiever bewegen geeft extra gezondheidsvoordeel.
- Adviseer minstens tweemaal per week spier- en botversterkende activiteiten, voor ouderen gecombineerd met balansoefeningen.
- Adviseer om veel zitten (meer dan acht uur per dag) te voorkomen.
2.1.4. Roken
Naar Samenvatting ›Roken is een dodelijke verslaving. Het is de belangrijkste risicofactor voor hart- en vaatziekten. Ten opzichte van niet-rokers heeft een roker een 2-6 keer verhoogd risico op coronaire aandoeningen of beroerte, en een 2-4 keer verhoogd risico op hartfalen of perifeer vaatlijden. Zelfs lichte of matige rokers hebben al een verhoogd risico op hart- en vaatziekten. Het percentage rokers in Nederland neemt gestaag af, maar is nog steeds circa 23% van de volwassen populatie. Ook meeroken verhoogt het risico op hart- en vaatziekten (met tot wel 30%).
Het belang om te stoppen met roken kan, ongeacht de leeftijd, niet vaak genoeg herhaald worden. Stoppen met roken geeft een zeer effectieve verlaging van het risico op hart- en vaatziekten. Er zijn meerdere effectieve behandelingen (zie NHG-Behandelrichtlijn Stoppen met roken).
Uitgangsvraag
Welke adviezen en interventies dienen te worden gegeven ten aanzien van het stoppen met roken?
Deze uitgangsvraag bevat de volgende deelvragen:
- Is het type roken en de hoeveelheid roken van invloed op het risico op hart- en vaatziekten?
- Verhoogt meeroken het risico op hart- en vaatziekten?
- Wat is het effect van stoppen met roken op het risico van hart- en vaatziekten?
- Welke interventies gericht op stoppen met roken zijn effectief?
Inleiding
Roken is een dodelijke verslavende aandoening. Een levenslange roker heeft een risico van 50% aan het roken te overlijden en verliest gemiddeld tien levensjaren vergeleken met < 3 jaar door ernstige hypertensie en < 1 jaar door lichte hypertensie. Van roken is bekend dat het allerlei ziekten veroorzaakt en roken is verantwoordelijk voor 50% van alle vermijdbare sterfgevallen onder rokers, waarvan de helft door hart- en vaatziekten.
Hoewel het aantal rokers in Nederland afneemt, blijft het veelvoorkomend: 23,1% van de volwassen bevolking rookt (RIVM-leefstijlmonitor). In veel Europese landen is een groeiend, aan opleiding gerelateerd verschil zichtbaar in het aantal personen dat stopt met roken. In het EUROASPIRE IV-onderzoek onder patiënten met ischemische hartklachten, rookte 16% na een gemiddelde follow-uptijd van zestien maanden en bijna de helft van de deelnemers die op het moment van hun coronaire gebeurtenis rookten, was hardnekkig roker. Het onderzoek toonde ook aan dat evidence-based behandelingen om te stoppen met roken te weinig werden gebruikt.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is gebruikgemaakt van de Europese richtlijn Cardiovascular disease prevention in clinical practice uit 2016.
Overwegingen
Risico op hart- en vaatziekten
Een roker heeft een twee tot zes keer verhoogd risico op coronaire aandoeningen of een beroerte en een twee tot vier keer verhoogd risico op hartfalen of perifeer vaatlijden dan een niet-roker. Bij een op de zes personen die overlijden aan een coronaire aandoening is de oorzaak roken. Dat zijn circa 1600 personen per jaar in Nederland. Bij hartfalen is een op de negen sterfgevallen te wijten aan roken (circa 800 personen). Bij een beroerte is dat bij een op de veertien sterfgevallen (circa 600 personen).
Zelfs matig tot weinig roken geeft een vasculair risico. Roken versterkt het ontstaan van zowel atherosclerose en gesuperponeerde trombotische fenomenen. Roken beïnvloedt de werking van het endotheel, oxidatieve processen, werking van trombocyten, fibrinolyse, ontstekingen, lipide-oxidatie en vasomotorische werking. Experimentele onderzoeken hebben aangetoond dat verschillende van deze effecten geheel of deels omkeerbaar zijn, binnen een zeer korte periode. Plaqueformatie is waarschijnlijk niet volledig omkeerbaar en rokers zullen dus naar verwachting nooit het risiconiveau bereiken van personen die nooit hebben gerookt wat betreft hart- en vaatziekten. Nicotinevervanging heeft geen negatief gevolg op de uitkomst bij patiënten met hartaandoeningen.
Dosering en soort
De risico’s van roken vertonen een dosis-responsrelatie zonder ondergrens voor schadelijke gevolgen. Duur speelt eveneens een rol, en hoewel het roken van sigaretten het meest gebruikelijk is, zijn alle vormen van gerookte tabak, met inbegrip van sigaretten met een laag teergehalte (mild of light), filtersigaretten, sigaren en pijpen, schadelijk. Roken is schadelijk, in welke vorm dan ook, inclusief roken met een waterpijp. Tabaksrook is schadelijker bij inhaleren, maar rokers die beweren niet te inhaleren (bijvoorbeeld pijprokers) hebben ook een verhoogd risico op hart- en vaatziekten. Rookloze tabak wordt eveneens geassocieerd met een klein maar statistisch significant verhoogd risico op een myocardinfarct (MI) en beroerte.
Passief roken
Passief roken verhoogt het risico op ischemische hartklachten. Een rokende partner of blootstelling op de werkplek verhoogt het risico op hart- en vaatziekten naar schatting met 30%. Een omgeving met minder tabaksrook levert grote voordelen op voor de gezondheid en het rookverbod op openbare plekken in verschillende geografische locaties heeft geleid tot een significante daling van het aantal gevallen van MI (zie detail Waar te interveniëren; zorgsettings en betrokkenen).
Stoppen met roken
Er zijn veel aanwijzingen voor de voordelen van stoppen met roken. Sommige voordelen hebben direct effect; andere hebben meer tijd nodig. Het risico op hart- en vaatziekten van voormalige rokers ligt tussen dat van rokers en nooit-rokers. Stoppen met roken na een MI is mogelijk de meest effectieve van alle preventieve maatregelen: een systematisch onderzoek en meta-analyse toonden een vermindering aan in het aantal MI’s en de samengestelde eindpunten van overlijden/MI (RR respectievelijk 0,57 en 0,74) vergeleken met doorgaan met roken. Het voordeel is consistent voor geslacht, duur van follow-up, onderzoekslocatie en tijdsperiode. Significante reducties in morbiditeit vinden plaats in de eerste zes maanden. Gerandomiseerde onderzoeken tonen ook het voordeel aan van stoppen met roken, waarbij het risico op hart- en vaatziekten het risico van nooit-rokers binnen tien tot vijftien jaar benadert (maar nooit gelijk wordt aan).
Van minderen met roken is nooit aangetoond dat het de kans op stoppen met roken in de toekomst doet verminderen, maar sommigen pleiten voor nicotinegeassisteerd minder roken voor rokers die niet kunnen of willen stoppen. Alle rokers moeten worden aangemoedigd te stoppen met roken. Er is geen leeftijdsgrens voor de voordelen van stoppen met roken. Passief roken moet ook worden vermeden.
Professionele hulp kan de kansen dat personen stoppen vergroten (RR 1,66; 95%-BI 1,42 tot 1,94). Een diagnose van of (invasieve) behandeling voor hart- en vaatziekten is vaak een stimulans voor het stoppen met roken. Iemand aanmoedigen om te stoppen, een korte herhaling van de voorlichting over de verhoogde kans op hart- en vaatziekten en andere gezondheidsgevaren en het eens worden over een gericht plan met follow-up zijn evidence-based interventies.
Interventies gericht op stoppen met roken
Deze CVRM-richtlijn verwijst naar de Richtlijn Behandeling van tabaksverslaving en stoppen met roken en de NHG-behandelrichtlijn Stoppen met roken voor de ondersteuning bij het stoppen met roken. Het gebruik van de e-sigaret bij stoppen met roken is momenteel onderwerp van discussie. Er is nu geen bewijs dat deze effectief is bij het stoppen met roken. De e-sigaret geeft ook gezondheidsschade; deze is minder dan bij roken.
Aanbevelingen
- Beschouw roken in alle vormen als de belangrijkste vermijdbare risicofactor voor hart- en vaatziekten en het overlijden aan hart- en vaatziekten, en adviseer om te stoppen met alle tabaksproducten.
- Adviseer om meeroken te vermijden.
- Adviseer stoppen met roken en begeleiding op maat, en geef bij herhaling advies om te stoppen met roken. Zie voor de interventies ter ondersteuning van stoppen met roken de CBO-richtlijn Behandeling van Tabaksverslaving of de NHG-behandelrichtlijn Stoppen met roken.
Aanbevelingen
Naar Samenvatting ›- Beschouw roken als de belangrijkste risicofactor voor hart en vaatziekten en het overlijden aan hart- en vaatziekten en adviseer om te stoppen met alle tabaksproducten.
- Adviseer om meeroken te vermijden.
- Adviseer te stoppen met roken en begeleiding op maat en geef deze adviezen bij herhaling. Zie voor de interventies ter ondersteuning de NHG-Behandelrichtlijn Stoppen met roken.
2.1.5 Voeding
Naar Samenvatting ›Het voedingspatroon beïnvloedt risicofactoren voor hart- en vaatziekten zoals cholesterol, bloeddruk, lichaamsgewicht en diabetes mellitus. De belangrijkste voedingsstoffen met effect op dit risico zijn verzadigde vetzuren (deze verhogen het LDL-cholesterol ten opzichte van onverzadigde vetzuren), zout (verhoogt de bloeddruk) en vezels (verlagen het cardiovasculair risico). Groepen voedingsmiddelen die het risico op hart- en vaatziekten verlagen, zijn groente, fruit, vis en ongezouten noten. Adviezen over goede voeding zijn een standaard onderdeel van maatregelen om het risico op hart- en vaatziekten te verlagen.
De Richtlijnen goede voeding 2015 van de Gezondheidsraad, door het Voedingscentrum vertaald naar praktische adviezen in de Schijf van Vijf, geeft aanbevelingen voor een gezond voedingspatroon om het risico op hart- en vaatziekten te verminderen. Uit onderzoek blijkt dat in Nederland veel personen de aanbevelingen uit de richtlijn echter niet halen. De zorgverlener kan helpen een goed voedingspatroon te bewerkstelligen door adviezen te geven, gedragsverandering te stimuleren (zie paragraaf 2.1.1 Gedragsverandering) of te verwijzen naar een diëtist.
- Voedingsmiddelen met plantensterolen en -stanolen verlagen het LDL-cholesterol enigszins.
- Rodegistrijst lijkt geassocieerd met een verlaging van het LDL-cholesterol, maar bewijs voor de langetermijneffectiviteit ontbreekt. Daarnaast heeft rodegistrijst mogelijk wel allerlei bijwerkingen, varieert de hoeveelheid monacoline K (de werkzame stof) in supplementen met rodegistrijst en kan door het gistingsproces de giftige stof citrinine (een mycotoxine) ontstaan.
- Grootschalige onderzoeken naar de effecten van visoliesupplementen vonden geen bewijs voor een gunstig effect op het cardiovasculair risico.
Uitgangsvraag
Welke voeding verlaagt het risico op hart- en vaatziekten, in het bijzonder die voor de Nederlandse situatie?
Deze uitgangsvraag bevat de volgende deelvragen:
- Welke voedingsstoffen, voedingsmiddelen en voedingspatronen verlagen het risico op hart- en vaatziekten?
- Hoe ziet de huidige voedselconsumptie in Nederland eruit en welke adviezen zijn wenselijk?
Inleiding
Zowel de Europese richtlijn EU guidelines on CVD prevention in clinical practice uit 2016, als het Nederlandse Gezondheidsraadsadvies Richtlijnen goede voeding 2015 beschrijven de wetenschappelijke stand van zaken met betrekking tot voeding in relatie tot hart- en vaatziekten. Het Gezondheidsraadadvies beschrijft daarnaast ook de relatie van voeding tot andere welvaartsziekten. In de Europese richtlijn wordt het accent op voedingsstoffen gelegd, terwijl de Gezondheidsraad in haar advies vooral ingaat op voedingsmiddelen en voedingspatronen. Het Voedingscentrum heeft de recente adviezen van de Gezondheidsraad in combinatie met de adviezen ten aanzien van voedingsnormen (aanbevolen dagelijkse hoeveelheid voedingsstoffen) vertaald naar hoeveelheden voedingsmiddelen in de nieuwe Schijf van Vijf.
Het uitbrengen van nieuwe voedingsadviezen vraagt om actualisatie van voedingsadviezen in de standaarden en de Praktijkhandleiding Leefstijl van het Nederlands Huisartsen Genootschap en de zorgstandaard Vasculair risicomanagement van het Platform Vitale Vaten.
Uit de Voedsel Consumptiepeilingen in Nederland blijkt dat een groot aantal personen de aanbevelingen van de Richtlijnen goede voeding niet haalt.
Zoeken en selecteren
Om de eerste uitgangsvraag te kunnen beantwoorden is gebruikgemaakt van de Europese richtlijn Cardiovascular disease prevention in clinical practice uit 2016, de Voedingsnormen en Richtlijnen goede voeding van de Gezondheidsraad en de Richtlijnen Schijf van Vijf van het Voedingscentrum. Sinds het verschijnen van deze richtlijnen zijn enkele onderzoeken gepubliceerd die over controversiële voedingsproblemen op het terrein van alcohol, vetten en zout meer helderheid verschaffen. Deze onderzoeken zijn meegenomen in de overwegingen. Verder is er een aparte alinea opgenomen over functionele voedingsmiddelen in relatie tot hart- en vaatziekten. Deze komen niet aan bod in de Richtlijnen goede voeding 2015 van de Gezondheidsraad. Er is voor de uitgangsvraag van dit detail geen systematisch literatuuronderzoek verricht.
Overwegingen
1. Welke voedingsstoffen, voedingsmiddelen en voedingspatronen verlagen het risico op hart- en vaatziekten?
Indeling:
a. voedingsstoffen
- vetzuren
- mineralen
- vitaminen
- vezels
b. voedingsmiddelen
- groente en fruit
- noten
- vis
- alcoholische dranken
- frisdrank en suiker
- functionele voedingsmiddelen
c. voedingspatronen
Inleiding
Voedingsstoffen, voedingsmiddelen en voedingspatronen beïnvloeden het risico op hart- en vaatziekten, omdat zij risicofactoren, zoals cholesterol, bloeddruk, lichaamsgewicht en diabetes mellitus, beïnvloeden. Een samenvatting van de adviezen uit de Richtlijnen goede voeding (2015) van de Gezondheidsraad is opgenomen in kader 1. In kader 2 staat een verkorte beschrijving van de vertaling van deze richtlijn in het voorlichtingsmodel: de Schijf van Vijf van het Voedingscentrum. In tabel 20 staan de aanbevolen hoeveelheden en porties.
De meeste bewijzen voor het verband tussen voeding en hart- en vaatziekten zijn gebaseerd op observationele onderzoeken en een beperkt aantal gerandomiseerde klinische onderzoeken. De invloed van voeding wordt op drie niveaus bestudeerd: voedingsstoffen, voedingsmiddelen en voedingspatronen. Van die laatste is het mediterrane voedingspatroon het meest bestudeerd.
| Eet volgens een meer plantaardig en minder dierlijk voedingspatroon conform de onderstaande richtlijnen: |
|
| * Het Voedingscentrum adviseert in haar Schijf van Vijf om 250 gram groente per dag te eten om deze norm te halen. |
Schijf van VijfOm de Richtlijnen goede voeding te kunnen implementeren in de dagelijkse praktijk en in aanbevolen hoeveelheden voedingsmiddelen te kunnen formuleren heeft het Voedingscentrum de Schijf van Vijf als voorlichtingsmodel (opnieuw) uitgebracht. In de Schijf van Vijf staan productgroepen die de basis vormen van een gezond voedingspatroon en buiten de Schijf van Vijf staan voedingsmiddelen die niet bijdragen aan een gezond voedingspatroon. Het advies is om vooral de voedingsmiddelen uit de Schijf van Vijf te eten, en drie tot vijf keer per dag iets kleins en maximaal drie keer per week iets groots buiten de Schijf van Vijf te eten. Buiten de Schijf van Vijf staan bijvoorbeeld snoep, koek, snacks, frisdrank, zoet beleg. Om meer plantaardig en minder dierlijk te eten kan de volgende weekindeling een leidraad zijn: 1 dag vis, 1 dag peulvruchten, 1 dag noten, 2 dagen rund- of varkensvlees en 2 dagen kip of ander gevogelte. Vlees kan ook vervangen worden door tofu, tempé of ei. |
Hoeveelheden en portiesOp de website van het Voedingscentrum staat een tool waarmee consumenten kunnen zien hoeveel en wat ze kunnen eten (zie voedingscentrum.nl/nl/gezond-eten-met-de-schijf-van-vijf). |
De Schijf van vijf is gebaseerd op de Voedingsnormen (2001) en de Richtlijnen goede voeding (2015) van de Gezondheidsraad.
De voedingstoffen die van invloed zijn op hart- en vaatziekten zijn vetzuren (effect op lipoproteïnespiegels), mineralen (effect op de bloeddruk), vitaminen en vezels. De hoeveelheid energie in een voedingsmiddel of dagvoeding hangt af van de hoeveelheid vetten, koolhydraten, eiwitten en alcohol: 1 gram vet levert 9 kcal, 1 gram koolhydraten levert 4 kcal, 1 gram eiwit levert 4 kcal en 1 gram alcohol levert 7 kcal. Water, vitamines en mineralen leveren geen calorieën, vezels heel weinig (bron: voedingscentrum.nl, geraadpleegd maart 2018). De energiebehoefte van mannen tussen de dertig en vijftig jaar met een inactieve leefstijl ligt rond de 2.500 kilocalorieën per dag en van vrouwen rond de 2.000 kilocalorieën. Tien energie% betekent dat 10% van de energie-inname (= 250 kcal bij mannen en 200 kcal bij vrouwen) afkomstig is van een bepaalde voedingsstof. In geval van vetten 250 kcal gedeeld door 9 kcal = 28 gram vet bij mannen en 220 kcal gedeeld door 9 kcal = 22 gram vet bij vrouwen.
Onderstaande voedingsmiddelen dekken 85% van de energiebehoefte en voorzien in voldoende essentiële voedingsstoffen per doelgroep voor het Nederlandse voedingspatroon (tabel 20).
| 19 tot 50 j | 19 tot 50 j | 51 tot 69 j | 51 tot -69 j | > 70 j | > 70 j | |
|---|---|---|---|---|---|---|
| man | vrouw | man | vrouw | man | vrouw | |
| Groente (gram/dag) | 250 | 250 | 250 | 250 | 250 | 250 |
| Fruit (gram/dag) | 200 | 200 | 200 | 200 | 200 | 200 |
| Brood (sneetjes/dag) | 6 tot 8 | 4 tot 5 | 6 tot 7 | 3 tot 4 | 4 tot 6 | 3 tot 4 |
| Graanproducten (minimaal helft volkoren; opscheplepels per dag) en aardappelen (stuks per dag) | 4-5 | 4-5 | 4 | 3-4 | 4 | 3 |
| Vis (keer per week) | 1 | 1 | 1 | 1 | 1 | 1 |
| Peulvruchten (opscheplepels per week) | 2 tot 3 | 2 tot 3 | 2 tot 3 | 2 tot 3 | 2 tot 3 | 2 tot 3 |
| Vlees (gram per week) Niet meer dan 5x per week vlees, waarvan maximaal 300 gram rood vlees | < 500 | < 500 | < 500 | < 500 | < 500 | < 500 |
| Ei (aantal per week) | 2-3 | 2-3 | 2-3 | 2-3 | 2-3 | 2-3 |
| Noten (gram/dag) | 25 | 25 | 25 | 15 | 15 | 15 |
| Melk en melkproducten (porties per dag) | 2 tot 3 | 2 tot 3 | 3 | 3 tot 4 | 4 | 4 |
| Kaas (gram/dag) | 40 | 40 | 40 | 40 | 40 | 40 |
| Smeer- en bereidingsvetten (gram per dag) | 65 | 40 | 65 | 40 | 55 | 35 |
| Aanbevelingen zijn afkomstig van het Voedingscentrum | ||||||
1.a Voedingsstoffen
Vetzuren
Ter preventie van hart- en vaatziekten is het belangrijk verzadigd vet te vervangen door onverzadigd vet en complexe koolhydraten, en daarbij de hoeveelheid verzadigd vet te beperken tot maximaal 10 energie%. Deze beperking heeft mogelijk een additioneel gunstig effect op verbetering van het lipidenprofiel.
Verzadigde vetten
Het is het zeer belangrijk om aan te geven door welke type vet en koolhydraat verzadigd vet vervangen wordt. Door verzadigd vet te vervangen door geraffineerde/toegevoegde suikers neemt het risico op hart- en vaatziekten toe met 1% (figuur 3). Dit risico neemt juist af met 25%, 15% en 9% als verzadigd vet vervangen wordt door respectievelijk meervoudig onverzadigde vetzuren (HR 0,75; 95%-BI 0,67 tot 0,84), enkelvoudig onverzadigde vetzuren (HR 0,85; 95%-BI 0,74 tot 0,97) en koolhydraten uit volkoren producten (HR 0,91; 95%-BI 0,85 tot 0,98). Even grote effecten van vervanging van verzadigd vet door meervoudig en enkelvoudig onverzadigde vetzuren op de totale sterfte en van meervoudig onverzadigde vetzuren op de sterfte aan hart- en vaatziekten werden in een separate analyse aangetoond. Deze laatste bevindingen zijn gebaseerd op de Nurses’ Health Study en het Health Professionals Follow-up-onderzoek, die zich kenmerken door bepaling van de voedingssamenstelling op basis van meerdere voedselfrequentievragenlijsten (om de vier jaar) en lange follow-uptijd (24 tot dertig jaar). De totale bewijslast, ook die uit RCT’s in het kader van primaire en secundaire preventie, op een rij gezet door onafhankelijke experts van de American Heart Association, bevestigt deze resultaten.
Trans fat = Trans vet; MUFA = EOV; PUFA = MOV; Carbohydrates from refined starch: Koolhydraten van geraffineerde en toegevoegde suikers; Carbohydrates from whole grains: Complexe koolhydraten (volkoren granen). Verschil in hazardrisico’s (balken) uitgedrukt in % met 95%-betrouwbaarheidsinterval (zwarte lijn)
Onverzadigde vetzuren
Enkelvoudig onverzadigde vetzuren (EOV’s) hebben een gunstig effect op LDL-cholesterol wanneer zij verzadigde vetzuren of koolhydraten (suikers) vervangen, maar het effect op coronaire hartziekten (CHZ) is kleiner dan bij vervanging van verzadigde vetzuren door meervoudig onverzadigde vetzuren.
Meervoudig onverzadigde vetzuren (MOV’s) kunnen worden onderverdeeld in twee subgroepen: omega-6-vetzuren, voornamelijk uit plantaardige olie en margarines (linolzuur) en omega-3-vetzuren, voornamelijk uit visolie en plantaardige oliën (alfa-linoleenzuur). De omega-6-vetzuren verlagen het LDL-cholesterol en in mindere mate het HDL-cholesterol wanneer zij verzadigde vetzuren vervangen. Van de omega-3-vetzuren uit visolie zijn vooral eicosapentaeenzuur en docosahexaeenzuur (EPA/DHA) van groot belang. Vette vis bevat naast deze vetzuren ook andere gunstige voedingsstoffen, zoals vitamine D en jodium.
Visoliesupplementen wijzigen het serumcholesterolgehalte echter niet en met de momenteel beschikbare behandelingen ter verlaging van het cardiovasculair risico valt te betwijfelen of ze een gunstige invloed hebben op mortaliteit door alle oorzaken, ischemische hartziekten en beroerte. In de Alpha Omega-trial met bijna 5000 hartinfarctpatiënten die optimaal met medicatie behandeld werden, werd geen effect van margarines verrijkt met visvetzuren en alfa-linoleenzuur op hart- en vaatziekten aangetoond. Wel werd aangetoond dat degenen die gezond aten een 30% lager cardiovasculair en sterfterisico hadden ten opzichte van degenen die ongezond aten.
Transvetzuren
Van de transvetzuren, een subgroep van de onverzadigde vetzuren, is aangetoond dat ze zeer schadelijk zijn door hun ongunstige invloed op zowel het totaal cholesterol (toename) als het HDL-cholesterol (afname). Deze vetzuren worden gevormd tijdens industriële bewerking (harding) van vetten en zijn aanwezig in, bijvoorbeeld, harde margarine en bakkerijproducten. Een meta-analyse van prospectieve cohortonderzoeken heeft aangetoond dat een 2% toename in energie-inname door transvetzuren het risico op ischemische hartziekten doet toenemen met 23%.
Er wordt maximaal 1 energie% uit transvetzuren aanbevolen: hoe minder hoe beter. Door modernere hardingstechnieken wordt dit maximum in Nederland gehaald (zie beneden).
Voedingscholesterol
De invloed van cholesterol uit voeding op serumcholesterolspiegels is beperkt vergeleken met het aandeel van vetzuren in de voeding. Wanneer de richtlijnen om de inname van verzadigd vet te verlagen worden opgevolgd, leidt dit meestal tot een verlaging van de inname van cholesterol uit voeding. Sommige richtlijnen (waaronder deze) over gezonde voeding geven daarom geen specifieke richtlijnen over cholesterol uit voeding; andere noemen een beperkte inname van < 300 mg/dag.
Mineralen
Volgens een meta-analyse vermindert zelfs een bescheiden vermindering van natriuminname van 1 g/dag de systolische bloeddruk met 3,1 mmHg bij hypertensieve patiënten en 1,6 mmHg bij normotensieve patiënten. Het Dietary Approaches to Stop Hypertension (DASH) onderzoek toonde een dosis-responsrelatie aan tussen zoutreductie en verlaging van de bloeddruk. In de meeste Europese landen ligt het zoutgebruik hoog (circa 9 tot 10 g/dag). De Nederlandse Gezondheidsraad adviseert maximaal 6 gram zout per dag. De optimale hoeveelheid is mogelijk nog wel lager: circa 3 g/dag. Hoewel het verband tussen zoutgebruik en bloeddruk soms controversieel blijft, zijn er voldoende bewijzen om zoutreductie aan te bevelen als een belangrijke manier om ischemische hartziekten en beroerte te voorkomen.
Recentelijk zijn er enkele onderzoeken gepubliceerd die een J-vormige relatie hebben gevonden, dat wil zeggen een hoger risico bij een lage zoutinname. Deze onderzoeken kenmerken zich doordat het zoutgehalte in slechts een monster urine is bepaald, gevolgd door een omrekening met een formule naar 24-uursurinegehalte. Idealiter wordt het zoutgehalte in meerdere 24-uursurineverzamelingen bepaald om tot een goede schatting te komen. Dit J-vormig verband kan ook verklaard worden doordat in de laagste zoutinnamegroep personen zitten die ziek zijn, medicatie gebruiken, op doktersadvies een zoutbeperkt dieet volgen, geen eetlust hebben (bijvoorbeeld kwetsbare ouderen) en personen die onderrapporteren (bijvoorbeeld obese personen). Zij hebben op andere gronden een hoger risico.
Op basis van dergelijk onderzoek met methodologische beperkingen kan daarom niet worden gesteld dat een voeding laag in zout een hoger risico op hart- en vaatziekten met zich meebrengt.
Gemiddeld 80% van het zout in de voeding is afkomstig uit bewerkte voedingsmiddelen en slechts 20% wordt later zelf toegevoegd. Zoutreductie kan worden bereikt door andere voeding te kiezen (minder bewerkt voedsel, meer basisvoedingsmiddelen) en een andere samenstelling van voedsel (lager zoutgehalte).
Kalium en kaliumrijke voedingsmiddelen hebben een gunstig effect op de bloeddruk. Groenten en fruit zijn de belangrijkste bronnen van kalium. Er bestaat een statistisch significante omgekeerde relatie tussen kaliuminname en het risico op beroerte (RR 0,76 (95%-BI 0,66 tot 0,89)). Naast het verminderen van de zoutinname kan een verhoging van de kaliuminname bijdragen aan een verlaging van de bloeddruk. Voorzichtigheid is geboden met kaliumrijke voeding bij patiënten met hart- en nierziekten en slecht gereguleerde diabetes mellitus (vooral in combinatie met RAAS-remmers).
Vitaminen
Meerdere patiënt-controle- en prospectieve observationele onderzoeken hebben een omgekeerd verband aangetoond tussen spiegels voor vitamine A en E en het risico op hart- en vaatziekten. De resultaten van deze observationele onderzoeken zijn echter niet bevestigd door interventieonderzoeken. Onderzoek heeft geen voordeel kunnen aantonen voor B-vitaminen (B6, foliumzuur en B12) en vitamine C.
In de onderste tertiel van serumspiegels voor vitamine D liggen hart- en vaatziekten en totale mortaliteit 35% hoger (RR 1,35 (95%-BI 1,13 tot 1,61)) dan in het bovenste tertiel. Een 41% hoger risico op mortaliteit als gevolg van hart- en vaatziekten (RR 1,41 (95%-BI 1,18 tot 1,68)) en 57% hoger risico op mortaliteit door alle oorzaken (RR 1,57 (95%-BI 1,36 tot 1,81)) zijn gemeld voor het onderste versus het bovenste kwintiel van vitamine D [Schottker 2014]. Een veel kleiner effect werd gezien bij RCT’s: een vermindering van 11% in mortaliteit door alle oorzaken werd gezien bij vitamine D3-supplementen (RR 0,89 (95%-BI 0,80 tot 0,99)), maar niet voor vitamine D2-supplementen. Door de kleine aantallen was het niet mogelijk een uitspraak te doen over het eindpunt cardiovasculaire mortaliteit.
Conclusies over aanvulling van het voedingspatroon met vitamine D (soort supplement (D2 of D3), dosering en duur) ter preventie van hart- en vaatziekten kunnen dus nog niet worden gemaakt.
De Gezondheidsraad brengt wel voedingsnormen voor vitamine D uit ter bevordering van een goede botopbouw.
Vezels
Vezels zijn afkomstig van granen, groenten en fruit. Recente meta-analyses van prospectieve cohortonderzoeken tonen aan dat een verhoging van de totale dagelijkse inname van vezels met 7 g/dag is geassocieerd met een 9% lager risico op ischemische hartziekten (RR 0,91 (95%-BI 0,87 tot 0,94)) en een verhoging van de dagelijkse vezelinname naar 10 g/dag is geassocieerd met een 16% lager risico op beroerte (RR 0,84 (95%-BI 0,75 tot 0,94)) en een 6% lager risico op diabetes mellitus type 2 (RR 0,94 (95%-BI 0,91 tot 0,97)). Er is nog geen bewijs voor een vergelijkbare associatie met vezels uit groenten en fruit. Wel is bekend dat fruitvezels (pectines) het LDL-cholesterol verlagen. Hoewel nog niet helemaal duidelijk is hoe het mechanisme werkt, is wel bekend dat een hogere vezelinname de postprandiale glucoserespons na koolhydraatrijke maaltijden vermindert en het totaal cholesterol en het LDL-cholesterol verlaagt. De aanbevolen hoeveelheid vezels vastgesteld door de Gezondheidsraad is 30 tot 40 g/dag vanaf de leeftijd van veertien jaar. In de leeftijd onder de veertien jaar loopt deze hoeveelheid geleidelijk op.
De Richtlijn goede voeding van de Gezondheidsraad uit 2015 adviseert om geraffineerde graanproducten te vervangen door volkorenproducten, door dagelijks ten minste 90 gram bruin brood, volkorenbrood en andere volkorenproducten te eten.
1.b Voedingsmiddelen
In tabel 20 zijn de aanbevolen dagelijkse hoeveelheden voor onderstaande vermelde voedingsmiddelen opgenomen.
Groenten en fruit
Prospectieve cohortonderzoeken hebben aangetoond dat het eten van groenten en fruit een beschermend effect heeft op hart- en vaatziekten, maar er zijn weinig RCT’s beschikbaar. Een meta-analyse toonde een daling aan van 4% (RR 0,96 (95%-BI 0,92 tot 0,99)) op sterfte door hart- en vaatziekten voor elke extra portie fruit (gelijk aan 77 g) en groenten (gelijk aan 80 g) per dag, terwijl mortaliteit door alle oorzaken niet verder afnam met een inname van meer dan vijf porties [Wang 2014]. Een meta-analyse meldde een verlaagd risico voor beroerte van 11% (RR 0,89 (95%-BI 0,83 tot 0,97)) bij drie tot vijf porties groenten en fruit per dag en van 26% (RR 0,74 (95%-BI 0,69 tot 0,79)) voor meer dan vijf porties vergeleken met minder dan drie porties. Een meta-analyse naar ischemische hartziekten meldde een daling van 4% in het risico op ischemische hartziekten (RR 0,96 (95%-BI 0,93 tot 0,99)) voor elke extra portie groenten en fruit per dag.
Noten
Een meta-analyse van prospectieve cohortonderzoeken heeft aangetoond dat een dagelijkse consumptie van 30 gram noten het risico op hart- en vaatziekten met circa 30% (RR 0,71 (95%-BI 0,59 tot 0,85)) vermindert. Hierbij moet worden opgemerkt dat noten veel energie bevatten.
Vis
Het beschermend effect van vis op hart- en vaatziekten wordt onder andere toegeschreven aan de omega-3-vetzuren in vette vis. Gepoolde risicoschattingen uit prospectieve cohortonderzoeken tonen aan dat ten minste een keer per week vis eten leidt tot een verlaging van het risico op ischemische hartziekten met 16% (RR 0,85 (95%-BI 0,75 tot 0,95)) vergeleken met het eten van minder vis. Een recente meta-analyse heeft aangetoond dat twee tot vier keer per week vis eten het risico op een beroerte met 6% vermindert (RR 0,94 (95%-BI 0,90 tot 0,98)) vergeleken met minder dan een keer per week vis eten. De relatie tussen vis eten en het risico op hart- en vaatziekten is niet lineair. Het risico is vooral verhoogd voor personen die nauwelijks tot geen vis eten. Een kleine toename in de visconsumptie door de algemene bevolking kan dus grote gevolgen hebben voor de algehele gezondheid.
Peulvruchten
De Gezondheidsraad heeft op basis van RCT’s vastgesteld dat de consumptie van peulvruchten (soja)bonen, linzen, kikkererwten en spliterwten het LDL-cholesterol verlaagt.
Alcoholische dranken
Drie of meer alcoholische dranken per dag drinken is geassocieerd met een verhoogd risico op hart- en vaatziekten. De resultaten van epidemiologische onderzoeken geven aan dat er een lager risico op hart- en vaatziekten is bij gematigde (één tot twee eenheden per dag) alcoholconsumptie vergeleken met niet-drinkers. Deze associatie lijkt niet verklaard te kunnen worden door specifieke kenmerken van geheelonthouders, hoewel de kans op omgekeerde causaliteit niet helemaal kan worden uitgesloten.
De Gezondheidsraad adviseert om geen alcohol of in ieder geval niet meer dan één glas per dag te drinken. De Gezondheidsraad concludeert dat het aannemelijk is dat een matig gebruik (tot 15 gram per dag = 1,5 standaard glas alcoholische drank) samenhangt met een lager risico op hart- en vaatziekten, diabetes mellitus en dementie, en een hoger risico op borstkanker.
Een recent mendeliaans randomisatieonderzoek met daarin analyses van 59 epidemiologische onderzoeken heeft vraagtekens gezet bij een eventueel gunstig effect van gematigde alcoholconsumptie en het lijkt erop te wijzen dat de laagste risico’s voor hart- en vaatziekten te vinden waren bij geheelonthouders en dat elke hoeveelheid alcohol geassocieerd wordt met een verhoogde bloeddruk en BMI. In een recente analyse van data uit drie grote databanken, waaronder EPIC-CVD, werd een cumulatief hoger risico (HR 1,14; 95%-BI 1,10 tot 1,17) gevonden op herseninfarct, lager risico op hartinfarct (HR 0,94; 95%-BI 0,91 tot 0,97) en hoger risico op hartfalen (HR 1,09; 95%-BI 1,03 tot 1,15) per iedere 100 gram toename aan alcoholconsumptie per week [Wood 2018]. De totale mortaliteit was het laagst in de groep alcoholdrinkers < 100 gram per week en dit risico nam boven deze consumptie recht evenredig toe met toename in gebruik.
Frisdrank en suiker
Met suiker gezoete frisdranken vormen een belangrijke bron van calorieën in het Europese voedingspatroon. Onder kinderen en adolescenten leveren deze dranken inmiddels zelfs 10 tot 15% van de geconsumeerde calorieën. Regelmatige consumptie van frisdranken wordt geassocieerd met overgewicht, metabool syndroom en diabetes mellitus type 2. Vervanging van met suiker gezoete frisdranken door frisdranken gezoet met kunstmatige zoetstoffen leidde tot minder grote gewichtstoename bij kinderen gedurende een periode van achttien maanden. Met suiker gezoete dranken leiden ook tot gewichtstoename bij volwassenen. Regelmatige consumptie van met suiker gezoete dranken (dat wil zeggen twee porties per dag vergeleken met één portie per maand) werd geassocieerd met een 35% hoger risico op ischemische hartziekten bij vrouwen, zelfs na correctie voor een ongezonde leefstijl en voedingsfactoren, terwijl met kunstmatige zoetstoffen gezoete dranken niet waren geassocieerd met hart- en vaatziekten. De WHO-richtlijn raadt een maximale consumptie aan van 10% van de energie uit suiker (mono- en disachariden). Dit omvat ook toegevoegde suikers en suikers in fruit en vruchtensappen (WHO 2015 in ESC guideline 2017). De voorkeur gaat uit naar water, filterkoffie, groene en zwarte thee.
Functionele voedingsmiddelen
Sommige functionele voedingsmiddelen claimen het cholesterol te verlagen. Zij vallen niet onder de Wet op de Geneesmiddelen omdat zij niet claimen hart- en vaatziekten te voorkomen. Aangezien er veelvuldig gebruik van wordt gemaakt en de middelen soms ook bijwerkingen kunnen geven, worden ze in dit detail besproken.
Fytosterolen
Functionele voedingsmiddelen die fytosterolen (plantaardige sterolen en stanolen) bevatten, kunnen het LDL-cholesterol met gemiddeld 10% verlagen bij een dagelijkse consumptie van 2 g/dag. Het cholesterolverlagend effect komt bovenop het effect dat wordt verkregen met een voeding laag in verzadigd vet of bij statinegebruik. Het cholesterolgehalte kan verder worden verlaagd met hogere doses (maximaal 3 g/dag) fytosterolen. De Europese Voedselwaren Autoriteit (EFSA) heeft de claim dat een dagelijkse hoeveelheid van 1,5 tot 2,4 gram plantensterolen/stanolen een LDL-cholesteroldaling van 7 tot 10%, respectievelijk van 2,5 tot 3 gram een daling van 10 tot 12,5% goedgekeurd. Er zijn nog geen onderzoeken gedaan met klinische eindpunten, zodat de werkgroep geen aanbeveling kan geven over het gebruik van fystosterolen met als doel het verlagen van (recidief) hart- en vaatziekten.
Rode gist rijst
Supplementen met rode gist rijst bevatten het cholesterolverlagende monacoline K (10 mg) = lovastatine (circa 1%) en verlagen het LDL-cholesterol met gemiddeld 0,9 mmol/l. De RCT’s kenmerken zich door een klein aantal proefpersonen, korte duur van de interventie (meeste onderzoeken rond de twaalf tot zestien weken) en langetermijneffecten ontbreken. Tevens bevatten de meeste supplementen andere ingrediënten, zoals artisjokextract, policosanol en fytosterolen. De Europese Voedselwaren Autoriteit (EFSA) keurt de claim ‘Monacolin K uit rode gist rijst draagt bij aan het behoud van een normaal LDL-cholesterol’ goed. Het Bijwerkingencentrum Lareb waarschuwt echter voor de bijwerkingen van rode gist rijst, voor variaties in de hoeveelheid monacoline K in supplementen en de mogelijkheid dat door het gistingsproces ook de giftige stof citrinine (een mycotoxine) ontstaat. De ESC/EAS guidelines for management of dyslipidaemias (2016) concludeert dat functionele voedingsmiddelen met rode gist rijst overwogen mogen worden bij personen met verhoogde cholesterolwaarden die niet in aanmerking komen voor statines op basis van hun risicoschatting voor hart- en vaatziekten. Deze werkgroep raadt Rode gist rijst niet aan.
Visoliesupplementen
Een meta-analyse van twintig onderzoeken, grotendeels naar preventie van recidief hart- en vaatziekten en grotendeels met visoliesupplementen, kon geen voordeel aantonen van visoliesupplementen op recidief hart- en vaatziekten. Een meta-analyse van veertien RCT’s naar het effect van visoliesupplementen voor ten minste zes maanden liet een mogelijk geringe reductie zien op cardiale mortaliteit, RR 0,92 (95%-BI 0,86 tot 0,98) ten opzichte van geen gebruik. Een recente meta-analyse van tien RCT’s voor ten minste één jaar onder hoogrisicopersonen liet geen effecten van visoliesupplementen zien op fatale en niet-fatale CHD en niet-fatale hartinfarcten.
1.c Voedingspatronen
Door het hele voedingspatroon te bestuderen kan het gecombineerde effect van de afzonderlijke voedingstoffen op de preventie van hart- en vaatziekten worden aangetoond. Het mediterrane voedingspatroon omvat een groot aantal voedingstoffen en levensmiddelen die hiervoor zijn besproken: hoge consumptie van fruit, groenten, peulvruchten, volkorenproducten, vis en onverzadigde vetzuren (vooral olijfolie); matige alcoholconsumptie (in het bijzonder wijn bij maaltijd gedronken) en een beperkte consumptie van (rood) vlees, zuivel en verzadigde vetzuren. Een meta-analyse van prospectieve cohortonderzoeken heeft aangetoond dat voeding die meer overeenkomt met een mediterraan voedingspatroon wordt geassocieerd met een 10% daling van incidentie van hart- en vaatziekten of mortaliteit (gepoold RR 0,90 (95%-BI 0,87 tot 0,93)) en een vermindering van 8% bij mortaliteit door alle oorzaken (gepoold RR 0,92 (95%-BI 0,90 tot 0,94)). In de PREDIMED-RCT onder personen met een hoog risico werd gevonden dat na een mediterraan voedingspatroon met olijfolie (Extra Vierge) of met 30 gram gemengde noten gedurende een periode van vijf jaar, vergeleken met een controlevoedingspatroon, er een 28 tot 30% lager risico bestond op hart- en vaatziekten (RR voor olijfolie groep 0,70 (95%-BI 0,54 tot 0,92) respectievelijk notengroep 0,72 (95%-BI 0,54 tot 0,96)).
2. Hoe ziet de huidige voedselconsumptie in Nederland eruit en welke wijzigingen zijn wenselijk?
Het Rijksinstituut voor Volksgezondheid en Milieu (RIVM) brengt door middel van voedselconsumptiepeilingen (VCP) de voeding van Nederlanders in kaart. In de resultaten van deze peilingen wordt de consumptie van voedingsmiddelen en niet van voedingsstoffen gepresenteerd. Aanvullend wordt voedingsstatusonderzoek verricht, waarbij onder andere de zoutexcretie gemeten wordt.
Vetten
Uit de VCP over de periode 2007 tot 2010 bleek dat inname van verzadigd vet 12 tot 13 energie% bedroeg. Meer dan 85% van de bevolking at meer verzadigd vet dan de maximumgrens van 10 energie%. Door modernere hardingsmethoden en andere grondstoffen van vetten ontstaan er nog nauwelijks transvetten in vetten en oliën. De inname van transvetzuren is in Nederland dan ook gedaald naar minder dan 1 energie%. Op dit moment vormt zuivel (waarin natuurlijke transvetten zitten) de belangrijkste, maar kleine bron van transvetzuren. De meest recente VCP van 2012 tot 2014 laat zien dat twee derde (17/27 gram) van de geconsumeerde smeer- en bereidingsvetten smeerbaar of vloeibaar is, in overeenstemming met de Richtlijnen goede voeding (2015), die aanbeveelt om deze vetten zo veel mogelijk in deze vorm te gebruiken. Ongeveer een derde van de volwassenen eet één keer en 23% twee of meer keren vis per week. Ouderen eten vaker vis dan jongeren.
Groenten, fruit, noten en peulvruchten
Volwassenen eten gemiddeld 139 gram groenten en 113 gram fruit per dag. Ouderen en vrouwen eten meer groenten en/of fruit. Vijftien procent van de volwassen voldoet aan het Gezondheidsraad advies ‘Eet dagelijks ten minste 200 gram groente respectievelijk eet ten minste 200 gram fruit’. De aanbeveling van het Voedingscentrum in de Schijf van Vijf is om 250 gram groente en 200 gram fruit per dag te eten om de voedingsnormen te halen.
De nieuwe aanbevelingen om ten minste 15 gram ongezouten noten per dag wordt door 7% gehaald en wekelijks peulvruchten eten blijkt in de praktijk eens in de drie weken te zijn.
Zout
Uit voedingsstatusonderzoek blijkt dat de zoutinname 8,5 gram per dag bedraagt (mannen 9,7 gram en vrouwen 7,4 gram), terwijl de Gezondheidsraad aanbeveelt om maximaal 6 gram keukenzout per dag te eten. Uit de VCP van 2007 tot 2010 bleek dat 3% van de mannen en 19% van de vrouwen een zoutconsumptie heeft beneden dit maximum. De zoutinname is in de afgelopen decennia helaas niet gedaald.
Schijf van Vijf
Op basis van een rapportage van het Rijksinstituut voor Volksgezondheid en Milieu (RIVM) is berekend dat uitgedrukt in energie ongeveer een derde van onze voedselproducten binnen de Richtlijnen Schijf van Vijf valt.
Conclusie
Uit bovenstaande blijkt dat de meeste aanbevelingen niet gehaald worden, op die voor transvetten na.
Aanbevelingen
- Adviseer een voeding conform Richtlijnen goede voeding; Gezondheidsraad en de Richtlijnen Schijf van Vijf, met als doel het voorkomen van hart- en vaatziekten.
- Raad het gebruik van supplementen met rode gist rijst met het doel het LDL-cholesterol te verlagen niet aan.
- Raad het gebruik van visoliesupplementen met het doel het LDL-cholesterol en de kans op hart- en vaatziekten te verlagen niet aan.
Aanbevelingen
Naar Samenvatting ›- Adviseer een voedingspatroon volgens de Richtlijnen Schijf van Vijf, met het doel (recidief) hart- en vaatziekten te voorkomen.
- Raad het gebruik van supplementen met rodegistrijst met het doel het LDL-cholesterol te verlagen niet aan.
- Raad het gebruik van visoliesupplementen met het doel het LDL-cholesterol te verlagen niet aan.
2.1.6 Lichaamsgewicht
Naar Samenvatting ›Toename van lichaamsvet kan leiden tot bloeddrukverhoging, dyslipidemie, insulineresistentie, albuminurie en diabetes mellitus. Dit kan weer leiden tot hart- en vaatziekten. Voor het monitoren van het lichaamsvet zijn zowel de body mass index (BMI) als de middelomtrek geschikte methoden. In Nederland is het aantal personen met overgewicht (BMI ≥ 25) sterk gestegen, van 1 op 3 in 1990 naar 1 op 2 in 2017. Het aantal personen met obesitas (BMI ≥ 30) verdrievoudigde in die periode van 5,5% naar 14,2% in 2016.
Voor alle personen met overgewicht is het zinvol om af te vallen. Dit verlaagt het risico op hart- en vaatziekten. Hierbij is fitheid belangrijker dan het exacte gewicht. Verlaging van het gewicht kan het beste worden bereikt door voldoende te bewegen en te eten volgens de Richtlijnen goede voeding 2015. Voor meer informatie zie NHG-Standaard Obesitas en de module Voeding in de Praktijkhandleiding Leefstijl.
Aanbevelingen
Naar Samenvatting ›- Adviseer personen met een gezond gewicht (BMI 20 tot 25 kg/m2) gewichtsbehoud en gezond te eten conform de ‘Richtlijnen goede voeding 2015’ en te bewegen (zie ook Details paragrafen 2.1.3 en 2.1.5).
- Adviseer personen met overgewicht of obesitas (BMI ≥ 25 kg/m2) in het algemeen om voldoende te bewegen en op gezonde wijze af te vallen (zie Details).
Uitgangsvraag
Welk behandelbeleid kan het risico op hart- en vaatziekten bij patiënten met overgewicht of obesitas verminderen?
Inleiding
In veel landen zijn gunstige trends geobserveerd wat betreft belangrijke risicofactoren, zoals bloedcholesterol, bloeddruk en roken, wat zich vertaalt in een lagere sterfte aan hart- en vaatziekten. In alle landen is de BMI in de afgelopen decennia echter gestegen, wat heeft geleid tot een gelijktijdige toename in de prevalentie van diabetes mellitus type 2. Ook in Nederland is het aantal personen met overgewicht (BMI ≥ 25 kg/m2) sterk gestegen, van een op de drie in 1990 naar een op de twee anno 2016. Het aantal personen met obesitas (BMI ≥ 30 kg/m2) is in die periode verdrievoudigd, van 5,5% naar 14,2% in 2016. De laatste jaren vlakt de stijging af.
Het RIVM heeft berekend wat het effect is van diverse toekomstscenario’s met betrekking tot overgewicht op het aantal personen met coronaire hartziekten in de komende dertig jaar. Hierbij is uitgegaan van 1,7 miljoen Nederlanders met obesitas in 2011. Als de trend in obesitas niet verbetert, zal het aantal personen met coronaire hartziekten stijgen van ruim 600.000 in 2011 naar 930.000 in 2040 (een stijging van 55%). Als iedereen een gezond gewicht zou hebben, dan zou de stijging beperkt blijven tot 816.000 in 2040 (een stijging van 36%). Hierbij dient aangetekend te worden dat dit effect vooral een gevolg is van vergrijzing en veroudering van de bevolking en indirecte effecten van overgewicht op de bloeddruk en cholesterol niet meegenomen zijn.
De belangrijkste klinische complicaties van toegenomen lichaamsgewicht zijn verhoging van bloeddruk, dyslipidemie, insulineresistentie, systemische ontstekingen en trombofilie en albuminurie, en het optreden van diabetes mellitus en hart- en vaatziekten (HF, ischemische hartziekten, AF en beroerte).
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is gebruikgemaakt van de Europese richtlijn Cardiovascular disease prevention in clinical practice uit 2016.
Overwegingen
Welke obesitasindex heeft de beste voorspellende waarde voor cardiovasculair risico?
BMI, gewicht (in kg) gedeeld door lengte kwadraat (in m2), is eenvoudig te meten en wordt veel gebruikt om categorieën voor lichaamsgewicht te bepalen (tabel 21).
Gezond gewicht is gedefinieerd als een BMI van 18,5 tot 25 kg/m2.
| Definitie | BMI (kg/m2) |
|---|---|
| Volwassenen | |
| Ondergewicht | < 18,5 |
| Normaal | 18,5 tot 24,9 |
| Overgewicht | 25 tot 29,9 |
| Obesitas | ≥ 30 |
| Klasse 1 | 30 tot 34,9 |
| Klasse 2 | 35 tot 39,9 |
| Klasse 3 | ≥ 40 |
| BMI = body mass index | |
De BMI-meting is echter niet voor iedereen geschikt. De BMI is bedoeld voor personen met een gemiddelde spier- en vetmassa. De uitkomst van de BMI is minder geschikt voor personen die < 1,58 meter, > 1,90 meter, een grote spiermassa (atletische bouw) of een andere lichaamsbouw hebben (bijvoorbeeld Aziatische bouw), of zwanger zijn. Bij het ouder worden veranderd het lichaam. Personen verliezen spier- en botmassa, terwijl het vetweefsel minder afneemt. Het vet verplaatst zich richting de buik. Dat is minder gunstig. Met deze veranderingen houdt de BMI geen rekening (https://www.hartstichting.nl/oorzaken/overgewicht).
Behalve de hoeveelheid lichaamsvet is ook de vetverdeling belangrijk. Lichaamsvet dat is opgeslagen in het abdomen (intra-abdominaal vet) heeft een hoger risico dan subcutaan vet. Naast overgewicht is de distributie van het vet relevant. Bij mannen is dit vaker in de buikholte en bij vrouwen vaker rond de heupen. Veel buikvet geeft een hoger risico op hart- en vaatziekten. Vet rond de heupen heeft hier nauwelijks invloed op (www.hartstichting.nl/gezond-leven/bmi/buikomvang).
De optimale manier om de buikomvang te meten is halverwege tussen de onderste rib en de bovenkant van het bekken, in staande positie. Meet op de blote huid en trek het meetlint niet te strak aan (www.hartstichting.nl/gezond-leven/bmi/buikomvang).
Op basis van de grenswaarden van de WHO worden twee actieniveaus aanbevolen:
- omtrek middel ≥ 94 cm bij mannen en ≥ 80 cm bij vrouwen is de grenswaarde waarbij het gewicht niet meer mag toenemen;
- omtrek middel ≥ 102 cm bij mannen en ≥ 88 cm bij vrouwen is de grenswaarde waarbij gewichtsafname moet worden aanbevolen.
Deze grenswaarden zijn gebaseerd op personen met Kaukasische afkomst en het is duidelijk dat verschillende ijkpunten vereist zijn voor antropometrische gegevens van verschillende afkomsten. De middelomtrek is gevoeliger voor variatie, maar kan voor de follow-up van individuele patiënten handiger zijn om leefstijlverbetering te volgen, en voorspelt even goed als de BMI.
Een meta-analyse concludeerde dat BMI en de omtrek van het middel even goed zijn en over de gehele linie zijn geassocieerd met hart- en vaatziekten en diabetes mellitus type 2. De meting van BMI is dus over het algemeen voldoende in de dagelijkse praktijk. In de richtlijn wordt de nadruk gelegd op BMI omdat lengte en gewicht eenvoudig en betrouwbare metingen zijn en minder inter- en intraobservervariatie vertonen dan meting van de buikomvang. Als de buikomvang beschikbaar is kan deze vanzelfsprekend gebruikt worden. Noch BMI, noch buikomvang is geschikt om de risicoschatting te verbeteren (geen reclassificatie). Zie paragraaf 1.3.2. BMI.
Bestaat ‘metabool gezonde obesitas’?
Het fenotype van metabool gezonde obesitas (MHO), gedefinieerd als de aanwezigheid van obesitas bij het ontbreken van metabole risicofactoren, is recentelijk in de belangstelling gekomen. Sommige onderzoeken stellen dat een specifieke subgroep van personen met overgewicht resistent is voor metabole complicaties, zoals arteriële hypertensie en insulineresistentie. Personen met MHO hebben echter een hogere mortaliteit door alle oorzaken vergeleken met metabool gezonde personen met een normaal gewicht. Langetermijnresultaten uit het Whitehall-onderzoek ondersteunen het idee dat MHO een overgangsfase is naar abnormaliteiten in de glucosestofwisseling en niet een specifieke ‘staat’.
De obesitasparadox bij bestaande hartaandoening
Op populatieniveau wordt obesitas in verband gebracht met een verhoogd risico op hart- en vaatziekten. Onder degenen met bestaande ischemische hartziekten is het bewijs tegenstrijdig. Systematische reviews van patiënten met ischemische hartziekten of patiënten die percutane coronaire interventie ondergaan wijzen op een obesitasparadox waarbij obesitas bescherming lijkt te bieden. Dit geldt ook voor patiënten met HF. Deze bewijzen moeten echter niet verkeerd worden geïnterpreteerd als aanbeveling voor een hogere doel-BMI voor personen met bestaande hart- en vaatziekten, aangezien hier sprake kan zijn van omgekeerde causaliteit. De conditie van hart- en longen beïnvloedt bij de obesitasparadox mogelijk de relatie tussen overgewicht en klinische prognose. Alle niet-fitte personen, ook degenen met gezond gewicht, hebben een sterk verhoogde kans op hart- en vaatziekten. Personen met een goede conditie met obesitas of overgewicht hebben een mortaliteitsrisico dat vergelijkbaar is met personen met een goede conditie en een normaalgewicht. De resultaten van het EPIC-onderzoek wijzen bovendien uit dat de invloed van een gebrek aan lichaamsbeweging op mortaliteit groter is dan die van een hoge BMI.
Behandeldoelen en modaliteiten
Het risico op hart- en vaatziekten heeft een voortdurende positieve relatie met BMI en andere vormen van vetmeting van het lichaam. Omdat mortaliteit door alle oorzaken lijkt toe te nemen bij een BMI < 20 kg/m2, kunnen we een dergelijk lage BMI niet aanraden als behandeldoel.
Behandeling van overgewicht en obesitas bestaat uit veranderingen in voeding, beweging en gedrag, om gewicht te verlagen en fitheid te doen toenemen. Als veranderingen in leefstijl niet succesvol zijn, kan bariatrische chirurgie worden overwogen. Een recente meta-analysis heeft uitgewezen dat patiënten die bariatrische chirurgie hebben ondergaan een verlaagd risico hebben op MI, beroerte, hart- en vaatziekten en mortaliteit vergeleken met een controlegroep die geen operatie onderging. Zie ook de Richtlijn Diagnostiek en behandeling van obesitas bij volwassenen en kinderen.
Aanbevelingen
- Adviseer personen met een gezond gewicht (BMI 20 tot 25 kg/m2) gewichtsbehoud en gezond te eten conform de Richtlijnen Goede voeding 2015 (zie detail Voeding) en te bewegen (zie detail Sedentaire leefstijl en fysieke activiteit).
- Adviseer personen met overgewicht of obesitas (BMI ≥ 25 kg/m2) in het algemeen om voldoende te bewegen en op gezonde wijze af te vallen. Zie de bijlage over adviezen over afvallen hieronder.
Bijlage adviezen over afvallen
Adviezen over afvallen (zie voor details www.hartstichting.nl/gezond-leven/tips-om-af-te-vallen):
- Afvallen is een kwestie van structureel gezond en minder eten, en meer bewegen.
- Afvallen kost tijd. Geleidelijk afvallen werkt op de lange termijn het beste.
- Een eet- en beweegplan en (zelf)beloning (als het goed gaat), stimuleert om door te gaan.
- Begin met het op een rijtje zetten van het eet- en beweegpatroon op dit moment en de gewenste veranderingen.
- Streng lijnen (crashdieet) wordt ontraden.
Om af te vallen moet de gemiddelde volwassene de inname beperken tot circa:
- Mannen: 1500 tot 2000 kilocalorieën per dag
- Vrouwen: 1000 tot 1500 kilocalorieën per dag
De caloriebehoefte verschilt echter sterk met de leeftijd, activiteiten en ruststofwisseling. Het verdient aanbeveling om het gemiddeld aantal kcal dat beperkt moet worden persoonlijk te berekenen.
Bij een dieet met nog minder calorieën bestaat het risico dat:
- de spiermassa afneemt in plaats van de vetmassa;
- ondervoeding ontstaat (te weinig vitamines en mineralen);
- het dieet minder lang vol te houden is en men weer snel terugvalt (jojo-effect).
Medicamenteuze behandeling
Naar Samenvatting ›2.2 Lipiden
Naar Samenvatting ›Vooral LDL-cholesterol is een belangrijke risicofactor voor hart- en vaatziekten. Cholesterolverlagende therapie verlaagt het cardiovasculaire risico. Dit is aangetoond voor statines en in mindere mate voor andere lipidenverlagers.
In navolging van vrijwel alle bestaande (inter)nationale richtlijnen en conform de vorige CVRM-richtlijnen geeft ook deze NHG-Standaard een streefwaarde voor LDL-cholesterol. Ten eerste bieden streefwaarden in de praktijk houvast voor de patiënt en voor de behandelaren. De literatuur bevat ook aanwijzingen dat de afwezigheid van streefwaarden kan leiden tot lagere adherentie, geringere effectiviteit en, zeker bij lage uitgangswaarden, tot overbehandeling. Bovendien is titreren van de behandeling op basis van een streefwaarde niet minder effectief dan iedereen een hoge dosis voorschrijven. Ten slotte is relevant dat, ook al vertoont de relatie tussen LDL-cholesterol en het risico op hart- en vaatziekten een continu en stabiel-gradueel karakter, de hoeveelheid onderzoeksgegevens die extreem lage LDL-waarden ondersteunen beperkt is. Dit maakt het moeilijk om een heel lage streefwaarde aan te bevelen voor het LDL-cholesterol.
Cruciaal is de betekenis die aan streefwaarden moet worden gehecht. Zij geven richting aan het te kiezen beleid, maar dicteren dit niet. Indien intensivering van medicamenteuze therapie om welke reden dan ook ongewenst is, dan kan men in overleg met de patiënt genoegen nemen met een hogere waarde. Streefwaarden vormen evenmin een rechtvaardiging om elk nieuw en/of kostbaar medicijn daarvoor in te zetten. Elk medicijn dient apart op effectiviteit, veiligheid en kosteneffectiviteit geëvalueerd te worden alvorens kan worden bepaald of en, zo ja, bij welke patiënten dit medicijn kan worden ingezet om streefwaarden te halen.
De drempel om te starten met statines is afhankelijk van het uitgangsrisico (zie 1.1 Bij wie wordt het risico op hart- en vaatziekten geschat?) en van de vraag of het LDL-cholesterol zich boven de streefwaarde bevindt. Bij ouderen > 70 jaar geldt een restrictiever voorschrijfadvies.
Streefwaarden
Naar Samenvatting ›Het effect van cholesterolverlagers kan worden afgemeten aan de bereikte LDL-cholesterolspiegel, maar ook het non-HDL-cholesterol (= totaalcholesterol – HDL-cholesterol) is hiervoor een goede parameter. Bij patiënten met een doorgemaakte hart- en vaatziekte hangt de mate van cholesterolverlaging samen met het cardiovasculaire risico en wordt intensievere behandeling geadviseerd dan bij patiënten zonder doorgemaakte hart- en vaatziekte.
De overige lipidenfracties (met name triglyceriden en HDL-cholesterol) zijn geen behandeldoelen, met uitzondering van uitzonderlijk sterk verhoogde triglyceriden. Voor meer informatie, zie richtlijn Erfelijke dyslipidemie in de tweede en derde lijn.
De tekst van dit detail is integraal overgenomen uit de in 2018 gepubliceerde richtlijn (erfelijke) dyslipidemie in de tweede en derde lijn. De richtlijn is beschikbaar in de Richtlijnendatabase.
Overwegingen
Recentelijk is een consensusstatement gepubliceerd van de EAS en de European Federation of Clinical Chemistry and Laboratory Medicine waarin wordt gesteld dat het niet meer nodig is dat de patiënt nuchter is als het traditionele lipiden- en lipoproteïneprofiel wordt bepaald. In tabel 22 vindt u de waarden die als abnormaal moeten worden beschouwd, die aanbevolen worden, als er niet nuchter bloed is afgenomen.
| Lipoproteïne | Niet-nuchter (80e percentiel) |
|---|---|
| Totaal cholesterol | > 5 mmol/l |
| Triglyceriden | > 2 mmol/l |
| HDL-C | < 1,0 mmol/l |
| LDL-C | > 3 mmol/l |
| Non-HDL-C* | > 3,9 mmol/l |
| apoB | > 1,0 g/l |
| apoA1 | < 1,25 g/l |
| Lp(a) | > 50 mg/dl |
| Remnant cholesterol** | > 5 mmol/l |
| * Non-HDL-C = totaal cholesterol – HDL-C ** Remnant cholesterol = TC – (HDL-C + LDL-C). | |
Wanneer niet-nuchtere triglyceriden > 5 mmol/l is, dan wordt aanbevolen om nuchter triglyceriden te meten. In tabel 23 staat benoemd in welke omstandigheden nuchter, dan wel niet-nuchter bloed kan worden geprikt.
| Patiënten bij wie een lipoproteïneprofiel bepaald dient te worden | |
|---|---|
| Niet-nuchter | Bij de meeste patiënten, inclusief:
|
| Nuchter | Kan soms in volgende situaties nodig zijn:
|
TC, HDL-C en TG worden direct gemeten. Het LDL-C kan worden berekend met de Friedewald-formule (totaal cholesterol minus HDL-cholesterol minus (triglycerides/2,2) (in mmol/l)). Van oudsher mag de Friedewald-formule alleen worden toegepast als TG < 4,5 mmol/l. Het maakt niet uit of de patiënt nuchter is. Tegenwoordig zijn er laboratoria die de Friedewald-formule toepassen bij TG < 8 mmol/l. Afhankelijk van de lokale situatie dient LDL-C in het laboratorium direct gemeten te worden bij een TG van > 4,5 of > 8 mmol/l.
Aanbevelingen
- Bepaal het traditionele lipiden- en lipoproteïneprofiel bestaande uit TC, TG, HDL-C en LDL-C niet nuchter. De volgende waarden moeten als ‘abnormaal’ worden beschouwd, die aanbevolen worden, als er niet nuchter bloed is afgenomen: TC > 5 mmol/l; TG > 2; HDL-C < 1,0; LDL-C > 3. Voor het meten van apoB hoeft een patiënt niet nuchter te zijn. NB: bij het gebruik van het algoritme dienen de lipiden en lipoproteïnen nuchter (12 uur vasten) te worden bepaald.
- Bepaal nuchter triglyceriden wanneer de niet-nuchtere triglyceridenwaarde > 5 mmol/l is.
- Bereken LDL-C met de Friedewald-formule, behalve bij verhoogd TG (definitie hiervan is afhankelijk van lokaal laboratorium). Meet LDL-C direct bij verhoogd TG.
Uitgangsvraag
Welke streefwaarden van LDL-C dienen te worden gehanteerd bij de behandeling met lipidenverlagende medicatie bij personen tot en met 70 jaar met een (zeer) hoog risico op hart- en vaatziekten?
Inleiding
Lipiden, zoals cholesterol en triglyceriden, circuleren in het bloedplasma als lipoproteïnen, waarbij de lipiden zijn verbonden aan eiwitten (met name apolipoproteïnen). De belangrijkste drager van cholesterol in plasma, LDL-C, is atherogeen. De rol van triglyceriderijke lipoproteïnen bij atherosclerose wordt momenteel nog onderzocht. Zeer hoge concentraties van triglyceriderijke lipoproteïnen kunnen pancreatitis veroorzaken (zie voor meer informatie de richtlijn (Erfelijke) Dyslipidemie in de tweede en derde lijn).
Cholesterol is een van de belangrijkste risicofactoren voor het ontwikkelen van hart- en vaatziekten. Verlaging van cholesterol vermindert de kans op hart- en vaatziekten. De streefwaarden voor LDL-C kunnen voor verschillende groepen patiënten verschillen.
Totaal en low-density lipoproteïnecholesterol
Binnen een breed bereik van concentraties is er een krachtige en gegradeerde positieve associatie tussen totaal-cholesterol en LDL-C enerzijds en het risico op hart- en vaatziekten anderzijds. Die associatie geldt voor zowel mannen als vrouwen en zowel voor personen met- als zonder hart- en vaatziekten.
LDL-C kan rechtstreeks worden gemeten, maar in de meeste onderzoeken en in 40% van de laboratoria wordt LDL-C berekend aan de hand van de Friedewald-formule:
In mmol/l: LDL-C = totaal cholesterol − HDL-C − (0,45 × triglyceriden)
Veel laboratoria hanteren een triglyceridengrens van 4,5 mmol/l tot waar het LDL-C automatisch wordt berekend. Voor een nadere duiding hoe LDL-C kan worden gemeten verwijzen wij naar de richtlijnmodule Laboratoriumtechnische aspecten bij lipidendiagnostiek van de NVKC.
Zeer hoge plasmaconcentraties LDL-C (>95ste percentiel in geslacht/leeftijdscategorie) in combinatie met een familiaire voorgeschiedenis van vroegtijdige hart- en vaatziekten en/of verhoogd cholesterol, en/of klinische kenmerken (peesxanthomen of arcus lipoides bij een leeftijd jonger dan 40 jaar) kunnen verder genetische evaluatie naar Familiaire Hypercholesterolemie rechtvaardigen (zie module Diagnostiek van dyslipidemieën uit de richtlijn (erfelijke) dyslipidemie in de tweede en derde lijn).
Steeds meer laboratoria berekenen en rapporteren automatisch non-HDL-C (= totaal-cholesterol – HDL-C). In grote populaties komt gemiddeld een LDL-C 1,8 mmol/l overeen met non-HDL-C 2,6 mmol/l, en LDL-C 2,6 mmol/l komt gemiddeld overeen met non-HDL-C 3,4 mmol/l (zie ook de modules 2.2.3 Non-HDL-cholesterol en Laboratoriumtechnische aspecten bij lipidendiagnostiek).
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvraag: Welke streefwaarde van LDL-C dient te worden gehanteerd bij de behandeling van patiënten met een verhoogd risico op hart- en vaatziekten?
PICO1
P1: patiënten met een verhoogd risico op hart- en vaatziekten;
I1: behandeling onder streefwaarde 1 van LDL-C;
C1: behandeling onder streefwaarde 2 van LDL-C;
O1: morbiditeit en mortaliteit van hart- en vaatziekten, bijwerkingen.
Mocht er weinig of geen trials beschikbaar zijn voor PICO1, zullen er ook studies worden geïncludeerd volgens PICO2, wat indirect bewijs oplevert.
PICO2
P2: patiënten met een verhoogd risico op hart- en vaatziekten;
I2: intensieve lipidenverlagende medicatie
C2: standaard lipidenverlagende medicatie
O2: morbiditeit en mortaliteit van hart- en vaatziekten, bijwerkingen.
Relevante uitkomstmaten
De werkgroep achtte hart- en vaatziekten en bijwerkingen voor de besluitvorming als kritieke uitkomstmaten; en mortaliteit van hart- en vaatziekten voor de besluitvorming als belangrijke uitkomstmaten.
Morbiditeit en mortaliteit van hart- en vaatziekten: De werkgroep definieerde niet a priori de genoemde uitkomstmaten, maar hanteerde de in de studies gebruikte definities. Deze definities komen overigens erg vaak overeen.
Zoeken en selecteren (Methode)
Zoekactie – juni 2017
In de databases Medline (via OVID) en Embase (via Embase.com) is op 26 juni 2017 met relevante zoektermen gezocht naar systematische reviews. De zoekverantwoording is weergegeven in de Totstandkoming. De literatuurzoekactie leverde 828 treffers op. Studies werden geselecteerd op grond van de volgende selectiecriteria:
- Systematische review van RCT’s met de vergelijking tussen verschillende streefwaarden voor LDL-C met een gedetailleerde zoekstrategie en evidence-tabellen.
Op basis van titel en abstract werden in eerste instantie 29 studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens 29 studies geëxcludeerd (zie Totstandkoming) en geen studies definitief geselecteerd. Er zijn geen gerandomiseerde studies gedaan waar specifieke streefwaarden voor LDL-C met elkaar zijn vergeleken.
Echter, er is wel literatuur beschikbaar over het effect van intensieve lipiden-verlaging (zoals hoge dosis atorvastatine (40 of 80 mg) of rosuvastatine (20 of 40 mg) of combinatie van gemiddelde dosis statine en ezetimib of PCSK9-antilichaam) met minder intensieve lipidenverlagende medicatie op morbiditeit en mortaliteit van hart- en vaatziekten. Ondanks dat dit niet voldoet aan de opgestelde PICO, kunnen de resultaten van deze studies wel een deel van de vraag beantwoorden.
Drie systematische reviews konden een deel van de vraag beantwoorden:
• Chan (2011) beschreef de resultaten van een systematische review naar een intensieve behandeling met een hoge dosis statine vergeleken met een normale dosis statine.
• Nuβbaumer (2016) ondernam een systematische zoekactie naar trials die ezetimib in combinatie met statine vergeleken met alleen statine.
• Schmidt (2017) beschreef een systematische review van studies die een behandeling met PCSK9-antilichamen vergeleken met placebo bovenop reguliere behandeling (statine met of zonder ezetimib).
De resultaten van de geïncludeerde trials zijn per trial beschreven. Een additioneel criterium is dat de trials als primaire uitkomst hart- en vaatziekten benoemd moeten hebben.
Update – december 2021
De zoekactie is op 16-12-2021 herhaald met een paar wijzigingen (zie Totstandkoming). De selectiecriteria zijn hetzelfde gebleven.
Op basis van titel en abstract werden in eerste instantie 38 studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens 36 studies geëxcludeerd (zie Totstandkoming) en twee studies definitief geselecteerd. Een trial vergeleek twee streefwaarden met elkaar (TST-trial) en een trial onderzocht intensieve lipidenverlagende behandeling versus minder intensieve behandeling (ODYSSEY-OUTCOMES-trial).
Voor de uitwerking van de resultaten wordt er geen onderscheid gemaakt in het type lipidenverlagende medicatie; in de literatuursamenvatting zal alleen over lipidenverlagende medicatie worden gesproken. Zie voor toelichting de tekst bij Overwegingen.
De resultaten zijn per subgroep beschreven. Het gaat om de volgende subgroepen:
- personen zonder hart- en vaatziekten ≤70 jaar;
- patiënten met hart- en vaatziekten ≤70 jaar;
- patiënten met diabetes mellitus zonder hart- en vaatziekten;
- personen met chronische nierschade.
Europese richtlijn Cardiovascular disease prevention in clinical practice (2021)
De Europese richtlijn Cardiovascular disease prevention in clinical practice is in 2021 geüpdatet en gepubliceerd. Bij het herzien van deze module zijn, naast de update van de literatuuranalyse, ook de overwegingen van de Europese richtlijn over LDL-streefwaarde bekeken en besproken. Voor meer detail zie de overwegingen.
Samenvatting literatuur
PICO1 – subgroep patiënten met hart- en vaatziekten ≤70 jaar
Beschrijving studies
Amarenco (2020a; TST-trial) onderzocht de waarde van een streefwaarde van LDL-C van <1,8 mmol/L om het risico op hart- en vaatziekten te verlagen bij hoofdzakelijk patiënten met een herseninfarct. In totaal werden 2.148 patiënten geïncludeerd met een gemiddelde leeftijd van 67 (SD 11, bereik: 45 tot 89) jaar. 1.073 patiënten werden aan een streefwaarde van <1,8 mmol/L toegewezen en 1.075 patiënten aan een streefwaarde van 2,3 – 2,8 mmol/L. Op baseline was het gemiddelde niveau van LDL-C 3,5 mmol/L in beide groepen. De keuze voor type statine en dosering was aan de onderzoekers. Drie weken en elke zes maanden na randomisatie werd het LDL-C gemeten en afhankelijk van de uitslag werd de dosering van de statine aangepast of ezetimib toegevoegd. De follow-upduur was 5,3 jaar (mediaan). Over deze periode bereikte de interventiegroep (streefwaarde < 1,8) gemiddeld een LDL-C van 1,7 mmol/L vergeleken met 2,5 mmol/L in de controlegroep (streefwaarde 2,3 – 2,8).
NB: we gebruiken hier de resultaten van de publicatie over de Europese (Franse) studiedeelnemers. De resultaten in deze groep waren vergelijkbaar met die in de totale studiegroep, welke ook Zuid-Koreaanse deelnemers bevatte.
Resultaten
- Majeure cardiovasculaire events
De uitkomstmaat was een samengesteld eindpunt, bestaande uit niet-fataal herseninfarct of beroerte van onbekende oorzaak, niet-fataal myocardinfarct, ziekenhuisopname voor onstabiele angina, gevolgd door urgente revascularisatie van de kransslagader, TIA die dringende revascularisatie van de halsslagader vereist, of cardiovasculaire dood inclusief onverklaarde plotselinge dood. 103 (10%) deelnemers kregen een majeur cardiovasculair event bij een streefwaarde van < 1,8 mmol/L vergeleken met 139 (13%) deelnemers bij een streefwaarde van 2,3 – 2,8 mmol/L (absoluut risicoverschil 3%). Het relatieve risico op een majeur cardiovasculair event was 26% verlaagd bij een streefwaarde van < 1,8 vergeleken met 2,3 – 2,8 mmol/L (HR 0,74 95%BI: 0,57 tot 0,95, geadjusteerd en geanalyseerd met competing risk).
2. Myocardinfarct of urgente coronaire revascularisatie
In totaal kregen 18 (2%) een myocardinfarct of hadden een coronaire revascularisatie nodig bij een streefwaarde van < 1,8 mmol/l. Bij een streefwaarde van 2,3 – 2,8 mmol/L hadden 27 (3%) een myocardinfarct of een coronaire revascularisatie nodig. Het risico was daarmee potentieel 34% verlaagd bij een streefwaarde van < 1,8 mmol/L vergeleken met 2,3 – 2,8 mmol/L (HR 0,66 95%BI 0,37 tot 1,20).
3. Bijwerkingen
Er werden geen gegevens over mogelijke bijwerkingen bij een streefwaarde van < 1,8 mmol/L versus 2,3 – 2.8 mmol/L gerapporteerd.
Bewijskracht van de literatuur
Onderstaande tabel combineert de uit de literatuursamenvatting gevonden relatieve risicoreductie op hart en vaatziekten met het basisrisico van de Scoretabellen, met daarbij de NNT’s over een tijdsperiode van 10 jaar.
| GRADE HOOG | ||||
|---|---|---|---|---|
| Patiëntencategorie | Patiënten ≤ 70 jaar met eerder vastgestelde HVZ | |||
| Interventie | LDL streefwaarde < 1.8 mmol/L | |||
| Basisrisico* | ≥ 10% | 10-15% | 15-20% | ≥ 20% |
| Relatief risico | 0.74 | 0.74 | 0.74 | 0.74 |
| Relatieve risicoreductie, % | 26 | 26 | 26 | 26 |
| Absolute risicoreductie/ 10 jaar, % | ≥ 2.6 | 2.6-3.9 | 3.9-5.2 | ≥ 5.2 |
| NNT/ 10 jaar | ≤ 38 | 38-26 | 26-19 | ≤ 19 |
HVZ = hart- en vaatziekte; NNT = number needed to treat * Risico op hart- en vaatziekte, over een tijdsperiode van 10 jaar (Scoretabel) | ||||
De bewijskracht start op een hoog niveau vanwege het therapeutische domein van de zoekvraag en dat het uitgevoerde onderzoek een klinische trial betreft.
Majeure cardiovasculaire events: De bewijskracht voor de uitkomstmaat is niet verlaagd.
Myocardinfarct of urgente coronaire revascularisatie: De bewijskracht voor de uitkomstmaat is met twee niveaus verlaagd gezien imprecisie.
Bijwerkingen: De bewijskracht voor de uitkomstmaat is niet beoordeeld vanwege het ontbreken van gegevens.
Conclusies
Hoog GRADE | Een LDL-C-streefwaarde van <1,8 mmol/L vermindert bij patiënten met een herseninfarct het risico op majeure cardiovasculaire events vergeleken met een streefwaarde van 2,3 – 2,8 mmol/L Bronnen: Amarenco, 2020a |
Laag GRADE | Een LDL-C-streefwaarde van <1,8 mmol/L bij patiënten met een herseninfarct lijkt het risico op een MI of urgente revascularisatie te verminderen vergeleken met een streefwaarde van 2,3 – 2,8 mmol/L. Bronnen: Amarenco, 2020a |
- GRADE | Vanwege het ontbreken van gegevens over mogelijke bijwerkingen is het niet mogelijk een conclusie te trekken over het risico op bijwerkingen bij verschillende streefwaarden van LDL-C bij patiënten met een herseninfarct. Bronnen: - |
PICO2
Beschrijving studies – PICO2
Chan (2011) ondernam een meta-analyse naar het effect van intensieve lipidenverlaging door statines op hart- en vaatziekten bij patiënten met een verhoogd risico op hart- en vaatziekten. RCT’s met ten minste een jaar follow-up kwamen in aanmerking als het intensief verlagen van lipiden werd onderzocht en de LDL-C-streefwaarde in de buurt van 2,1 mmol/L lag. De auteurs doorzochten de databases Medline en Embase tot april 2009.
Nuβbaumer (2016) ondernam een systematische review naar de effectiviteit en veiligheid van ezetimib toegevoegd aan statine op het voorkomen van hart- en vaatziekten bij patiënten met hyperlipidemie en atherosclerose en/of diabetes mellitus. Medline, EMBASE en de Cochrane Library werden tot juli 2015 doorzocht voor relevante artikelen. In totaal kwamen negen RCT’s in aanmerking. Alle RCT’s vergeleken ezetimib (10 milligram) in combinatie met een statine met alleen een statine.
Schmidt (2017) kwantificeerde de korte- en langetermijneffecten van PCSK9-antilichamen op lipidenmarkers en de incidentie van hart- en vaatziekten. De auteurs doorzochten tot mei 2016 CENTRAL, Medline, Embase en Web of Science. Lopende studies werden tijdens de selectie geïdentificeerd, waarvan drie in maart 2017 gepubliceerd waren. Deze studies zijn aan de review toegevoegd. Alleen RCT’s met een follow-up tijd van ten minste 24 weken kwamen in aanmerking. In totaal werden 20 studies geïncludeerd en beschreven. Van deze 20 studies bleken vijf studies alleen gepubliceerd te zijn als een congresabstract en zijn daarom buiten beschouwing gelaten.
Schwartz (2018; ODYSSEY OUTCOMES-trial) onderzocht het effect van een PCSK9-antilichaam op hart- en vaatziekten bij patiënten met acute coronair syndroom. In totaal werden 18.924 patiënten geïncludeerd die 1 tot 12 maanden geleden een acuut coronair syndroom hebben gehad en voldeden aan baseline niveau van LDL-C (>1,8 mmol/L), non-HDL-C (>2,6 mmol/L) of apoB (> 80 mg/dl). Alle patiënten gebruikten statine in een hoge dosering. Patiënten werden 1:1 gerandomiseerd naar een PCSK9-antilichaam of een overeenkomende placebo. Het primaire eindpunt was een samenstelling van overlijden door coronaire hartziekte, niet-fataal myocardinfarct, fatale of niet-fatale herseninfarct of onstabiele angina waarvoor ziekenhuisopname vereist is. De mediane follow-upduur was 2,8 jaar.
Personen zonder hart- en vaatziekten ≤70 jaar
Er zijn geen trials gedaan bij personen zonder hart- en vaatziekten die een intensieve behandeling met lipidenverlagende medicatie vergeleek met een minder intensieve behandeling, met als primaire uitkomst hart- en vaatziekten. UPDATE 2021: geen trials gevonden.
Patiënten met hart- en vaatziekten ≤70 jaar
In totaal evalueerden acht trials het effect van een intensieve behandeling met lipidenverlagende medicatie met een minder intensieve behandeling bij patiënten met hart- en vaatziekten en als primaire uitkomst hart- en vaatziekten hadden. Het ging om de volgende studies: A tot Z-trial, IDEAL-trial, PROVE-IT-trial, TNT-trial, IMPROVE-IT-trial, FOURIER-trial, ODYSSEY-OUTCOMES-trial en SPIRE-1/2-trial. In tabel 1 wordt een overzicht weergegeven van baseline en bereikte LDL-C-waarden.
| Trial | Interventie (I) /controle (C) | N patiënten | Initieel LDL-C (mmol/l) | Gemiddelde LDL-C tijdens behandeling (mmol/l) |
|---|---|---|---|---|
| A-Z | I: Simvastatine 40 mg, 1m/ 80 mg | 2265 | 2,90 (mediaan) | 1,71 (mediaan) |
| C: placebo, 4m/ simvastatine 20 mg | 2232 | 2,87 (mediaan) | 2,10 (mediaan) | |
| PROVE-IT | I: Atorvastatine 80 mg | 2099 | 2,74 (mediaan) | 1,60 |
| C: Pravastatine 40 mg | 2063 | 2,74 (mediaan) | 2,46 | |
| IDEAL | I: Atorvastatine 80 mg | 4439 | 3,14 | 2,07 |
| C: Simvastatine 20 mg | 4449 | 3,14 | 2,58 | |
| TNT | I: Atorvastatine 80 mg | 4995 | 2,51 | 1,99 |
| C: Atorvastatine 10 mg | 5006 | 2,53 | 2,61 | |
| IMPROVE-IT | I: Simvastatine 40 mg + ezetimib 10 mg | 9067 | 2,4 | 1,4 |
| C: Simvastatine 40 mg + placebo | 9077 | 2,4 | 1,8 | |
| FOURIER | I: Evolocumab (background therapy: statin) | 13784 | 2,4 (mediaan) | 0,8 |
| C: Placebo (background therapy: statin) | 13780 | 2,4 (mediaan) | 2,3 | |
| ODYSSEY-OUTCOMES | I: Alirocumab (background therapy: statin) | 9462 | 2,38 | 1,7 |
| C: Placebo (background therapy: statin) | 9462 | 2,38 | 2,7 | |
| SPIRE-1 | I: Bococizumab (background therapy: statin) | 8408 | 2,4 | 1,5 |
| C: Placebo (background therapy: statin) | 8409 | 2,4 | 2,4 | |
| SPIRE-2 | I: Bococizumab (background therapy: statin) | 5312 | 3,5 | 2,3 |
| C: Placebo (background therapy: statin) | 5309 | 3,4 | 3,7 |
Resultaten
1. Hart- en vaatziekten
De resultaten van het risico op hart- en vaatziekten bij een intensieve behandeling versus een minder intensieve behandeling staan in figuur 4 weergegeven. Gepoold is het risico op een event gedurende follow-up 13% lager bij een intensieve behandeling vergeleken met een minder intensieve behandeling (HR 0,87 95%BI: 0,83 tot 0,91).
2. Mortaliteit hart- en vaatziekten
Op één trial na rapporteerden de trials gegevens over mortaliteit van hart- en vaatziekten die een meta-analyse mogelijk maakten. In figuur 5 is te zien dat het risico om te overlijden gedurende follow-up bij een intensieve behandeling gelijk is aan een minder intensieve behandeling (HR 0,97 95%BI: 0,90 tot 1,04).
3. Bijwerkingen die resulteren in het stoppen van behandeling
Alle acht trials hebben gegevens gerapporteerd over bijwerkingen die resulteerden in het stoppen met behandeling. Zowel de trialspecifieke resultaten als ook het gepoolde resultaat is in figuur 6 weergegeven. De odds ratio voor bijwerkingen resulterend in het stoppen van behandeling was 1,27 (95%BI: 1,02 tot 1,58), waarbij moet worden aangetekend dat het absolute verschil in stoppen met medicatie vanwege bijwerking tussen de intensieve en minder intensieve behandeling laag was. Tevens moet worden aangetekend dat voor deze analyse trials met intensieve statinebehandeling of toevoegen van ezetimib of PCSK9-antilichamen zijn gepoold. Bijwerkingen in de SPIRE1/2 trials hebben ertoe geleid dat bococizumab niet verder wordt ontwikkeld en niet klinisch beschikbaar komt. De gepoolde schatting van bijwerkingen die resulteerden in stoppen van de behandeling zonder het resultaat uit de SPIRE-1/2-trial was OR 1,24 95%BI 0,96 tot 1,59.
Bewijskracht van de literatuur
Hart- en vaatziekten: De bewijskracht voor de uitkomstmaat hart- en vaatziekten is met een niveau verlaagd vanwege indirectheid (vergelijking tussen intensieve en minder intensieve behandeling met lipidenverlagende medicatie in plaats van streefwaarden voor LDL-C).
Mortaliteit: De bewijskracht voor de uitkomstmaat mortaliteit is met twee niveaus verlaagd gezien imprecisie en indirectheid (vergelijking tussen intensieve en minder intensieve behandeling met lipidenverlagende medicatie in plaats van streefwaarden voor LDL-C).
Bijwerkingen die resulteren in het stoppen van behandeling: De bewijskracht voor de uitkomstmaat bijwerkingen is met twee niveaus verlaagd gezien heterogeniteit (I2 hoger dan 90% en verschil in effectschattingen (drie trials suggereren geen verschil in het risico, een trial een verlaagd risico en vier een verhoogd risico op een bijwerking)) en indirectheid (vergelijking tussen intensieve en minder intensieve behandeling met lipidenverlagende medicatie in plaats van streefwaarden voor LDL-C).
Conclusies
Hart- en vaatziekten
Redelijk GRADE | Het risico op hart- en vaatziekten bij een intensieve behandeling met lipidenverlagende medicatie is waarschijnlijk lager dan bij een minder intensieve behandeling bij patiënten met hart- en vaatziekten. Bronnen (A-Z; IDEAL; PROVE-IT; TNT; IMPROVE-IT; FOURIER; ODYSSEY-OUTCOMES; SPIRE-1/2) |
Mortaliteit
Laag GRADE | Het risico om te overlijden ten gevolge van hart- en vaatziekten bij een intensieve behandeling met lipidenverlagende medicatie is mogelijk gelijk aan het risico bij een minder intensieve behandeling bij patiënten met hart- en vaatziekten gedurende de looptijd van de trials (mediane follow-up van 10 maanden tot 6 jaar). Bronnen (A-Z; IDEAL; TNT; IMPROVE-IT; FOURIER; ODYSSEY-OUTCOMES; SPIRE-1/2) |
Bijwerkingen die resulteren in het stoppen van behandeling
Laag GRADE | Het risico op een bijwerking gedurende de looptijd van de trials (mediane follow-up van 10 maanden tot 6 jaar) is mogelijk hoger bij een intensieve behandeling met lipidenverlagende medicatie dan bij een minder intensieve behandeling bij patiënten met hart- en vaatziekten. Bronnen (A-Z; IDEAL; PROVE-IT; TNT; IMPROVE-IT; FOURIER; ODYSSEY-OUTCOMES; SPIRE-1/2) |
Patiënten met diabetes mellitus zonder hart- en vaatziekten
Verlaging van LDL-C bij patiënten met diabetes mellitus is effectief om het risico op hart- en vaatziekten te verlagen. Er zijn geen trials gedaan bij patiënten met diabetes mellitus zonder hart- en vaatziekten waarbij een intensieve behandeling met lipidenverlagende medicatie is vergeleken met een minder intensieve behandeling, met hart- en vaatziekten als primaire uitkomst. UPDATE 2021: geen trials gevonden.
Patiënten met chronische nierschade
Verlaging van LDL-C bij patiënten met chronische nierschade zonder nierfunctievervangende therapie, is waarschijnlijk effectief om het risico op hart- en vaatziekten te verlagen. Er zijn geen trials gedaan bij patiënten met chronische nierschade waarbij een intensieve behandeling met lipidenverlagende medicatie is vergeleken met een minder intensieve behandeling, met als primaire uitkomst hart- en vaatziekten. UPDATE 2021: geen trials gevonden.
Overwegingen
In epidemiologische cohortonderzoeken vertoont LDL-cholesterol een continue en stabiel-graduele relatie met het risico op cardiovasculaire ziekte, net als in meta-analyses van de data uit gerandomiseerd klinisch onderzoek naar cholesterolverlagende medicatie. In meta-analyses die een onderscheid maken naar het type medicatie wordt de relatie tussen bereikt LDL-cholesterol en het risico op hart- en vaatziekten niet beïnvloed door het type medicament.
Meta-analyses naar het effect van statines tonen aan dat er een dosis-afhankelijke relatieve vermindering in het optreden van hart- en vaatziekten bestaat bij verlaging van LDL-C. Elke vermindering van LDL-C met 1,0 mmol/L is bijvoorbeeld geassocieerd met een corresponderende 20 tot 25% reductie in mortaliteit ten gevolge van hart- en vaatziekten. De causale en graduele relatie wordt ondersteund door pathofysiologisch en genetisch onderzoek. Uitvoerig experimenteel onderzoek ondersteunt de oorzakelijke relatie tussen LDL-cholesterol en de pathogenese van atherosclerotisch vaatlijden. Mendeliaans-randomisatieonderzoek laat zien dat genetische variatie in (en dus levenslange blootstelling aan) LDL-cholesterol) zich rechtlijnig verhoudt tot de hoogte van risico op hart- en vaatziekten.
Zoals uit de systematische literatuuranalyse blijkt, ondersteunen diverse gerandomiseerde onderzoeken dat meer intensieve medicamenteuze cholesterolverlaging het risico op hart- en vaatziekten meer doet dalen dan minder intensieve behandeling. Zoals elke behandel-intensificatie gaat intensieve cholesterolverlagende therapie wel gepaard met meer bijwerkingen.
In navolging van vrijwel alle bestaande (inter)nationale richtlijnen en conform de vorige CVRM-richtlijnen wordt ook in deze richtlijn een LDL-cholesterol-streefwaarde gegeven. Ten eerste bieden streefwaarden in de praktijk houvast voor de patiënt en voor de behandelaren. Ten tweede bevat de literatuur ook aanwijzingen dat de afwezigheid van streefwaarden tot lagere adherentie en effectiviteit kan leiden. Maar ook, zeker bij lage uitgangswaarden, in overbehandeling kan resulteren. Behandeling titreren op basis van een streefwaarde is ook niet minder effectief dan iedereen een hoge dosis voorschrijven. Ondanks de relatie tussen de hoogte van het LDL-cholesterol en het risico op hart- en vaatziekten is de hoeveelheid onderzoeksgegevens die extreem lage LDL-waardes ondersteunen beperkt. Dit maakt het moeilijk om een hele lage ondergrens van de LDL-cholesterol streefwaarde aan te bevelen.
Cruciaal is de betekenis die aan streefwaarden moet worden gehecht. Deze waarden geven richting aan het te kiezen beleid, maar dicteren dit niet. Indien intensivering van medicamenteuze therapie om welke reden dan ook ongewenst is, dan kan in overleg met de patiënt met een hogere waarde genoegen genomen worden. Streefwaarden vormen evenmin een rechtvaardiging om elk nieuw en/of kostbaar medicijn daarvoor in te zetten. Elke medicijn dient apart op effectiviteit, veiligheid en kosteneffectiviteit geëvalueerd te worden alvorens kan worden bepaald of en, zo ja, bij welke patiënten dit medicijn kan worden ingezet om streefwaarden te bereiken.
In deze context is het relevant dat in de afrondingsfase van deze richtlijn de vergoedingscriteria voor PCSK9-antistoftherapie verruimd zijn naar alle patiënten met een zeer hoog cardiovasculair risico vanwege vastgestelde hart- en vaatziekten. Naar het oordeel van de werkgroep betekent dit zeker niet dat alle mensen die voor vergoeding van deze medicatie in aanmerking komen automatisch een PCSK9-remmer aangeboden zouden moeten krijgen. Vergeleken met statines zijn er met PCSK9-remmers minder gerandomiseerde trials gedaan en is er een minder uitgebreid en jarenlang bestendigd repertoire aan ondersteunende epidemiologische studies beschikbaar over de (langere-termijn-) effecten en bijwerkingen. Dit rechtvaardigt enige terughoudendheid richting grootschalig gebruik van PCSK9-remmers. Daarbij is de stap naar parenterale therapie aanzienlijk en hangt deze vanzelfsprekend af van de motivatie van de patiënt. Ook is het relevant hoe ver men met orale therapie nog van de streefwaarde verwijderd is en hoeveel winst er met PCSK9-therapie te behalen zou zijn. Gemiddeld lijkt toevoeging van PCSK9-remmers op maximaal (getolereerde) statinebehandeling het risico op ziekte of sterfte door cardiovasculaire oorzaken met 15% te reduceren.
Kortom, het valt niet exact aan te geven bij wie PCSK9-remmers moeten worden aangeboden als toevoeging aan maximale orale cholesterolverlagende therapie. Het is een kwestie van een zorgvuldige afweging van de motivatie, mate van verwijdering van de streefwaarde, de te boeken winst en de nog beperkte informatie over lange termijn effecten en bijwerkingen van deze therapie. Ten tijde van de afronding van deze richtlijn mogen PCSK9-remmers alleen in de tweede lijn worden voorgeschreven, waar ook de meeste patiënten met een extra verhoogd risico worden gezien. Patiënten in de eerste lijn kunnen, afhankelijk van bovenstaande overwegingen, voor PCSK9-remming in aanmerking komen, maar moeten daarvoor nu dus nog worden verwezen. Mocht in de toekomst de voorschrijfrestrictie worden opgeheven, dan zal deze keuze vaker in de eerste lijn moeten worden afgewogen.
Voor een exacte positiebepaling van bempedoïnezuur, een nieuwe orale cholesterolverlagende therapie, is het naar oordeel van de werkgroep nog te vroeg.
De gerandomiseerde klinische trials naar de effecten van cholesterolverlaging op het risico op hart- en vaatziekten waren doorgaans niet gericht op het bepalen van een optimale streefwaarde van de LDL-C-concentratie; in 2019 waren er geen gerandomiseerde trials waarbij twee expliciete streefwaarden werden vergeleken. De respectievelijke streefwaarden van 2,6 en 1,8 mmol/L in de CVRM-richtlijn van 2019 waren daarom vooral pragmatisch gekozen. Voor patiënten met hart- en vaatziekten bestaat recentelijk aanvullend bewijs, verkregen uit de eerste gerandomiseerde klinische trial (RCT) waarbij twee streefwaarden werden vergeleken, namelijk een LDL-C < 1.8 mmol/L versus een LDL-C tussen 2,3 en 2,8 mmol/L. Hieruit blijkt dat een LDL-C-streefwaarde van < 1,8 mmol/L gepaard gaat met een lager relatief risico op hart- en vaatziekten. Derhalve handhaaft de werkgroep de streefwaarde van < 1,8 voor patiënten tot 70 jaar met doorgemaakte hart- en vaatziekten.
Met deze streefwaarde wijkt de werkgroep af van de European Society of Cardiology richtlijn waarin in een aantal situaties voorgesteld wordt om te streven naar een LDL-C lager dan 1,4 mmol/L. Bij de update van deze module (2023) is uitgebreid gediscussieerd of in Nederland ook voor deze waarde gekozen moet worden. De keuze voor de streefwaarde van < 1,4 mmol/L in de Europese richtlijn blijkt een arbitraire keuze vanuit de argumentatie dat een lager LDL-C altijd beter is. Deze arbitraire streefwaarde had volgens de Europese richtlijn de voorkeur boven het door voorschrijvers en patiënten zelf laten bepalen hoeveel lager dan de (bewezen effectieve) streefwaarde < 1,8 mmol/L het LDL-C moet worden. Omdat het directe bewijs voor een streefwaarde van < 1,4 mmol/L ontbreekt en er evenmin aanwijzingen zijn dat de relatie tussen LDL-C en cardiovasculair risico een ‘knik’ vertoont rondom deze waarde van 1,4 mmol/L, heeft het richtlijncluster CVRM besloten geen aanbeveling voor < 1,4 mmol/L op te nemen. Het staat de zorgverlener vrij om, in overleg met de patiënt, te bepalen hoeveel lager dan 1,8 mmol/L de LDL-C-waarde idealiter zou moeten worden..
De streefwaarden < 2,6 mmol/L en < 1,8 mmol/L zijn derhalve onderdeel van een spectrum waarbinnen de individuele streefwaarde wordt bepaald op basis van het risico op hart- en vaatziekten en in overleg met de patiënt. Tijdens dit gesprek met de patiënt kan de risicotabel zoals die besproken wordt in de module ‘Schatten van het risico op hart en vaatziekten’ gebruikt worden.
In de Europese richtlijn wordt ook het advies gegeven om te streven naar < 1,4 mmol/L bij patiënten met diabetes met ernstige eindorgaanschade (zonder hart- en vaatziekten). Het richtlijncluster CVRM heeft besloten ook voor deze categorie de huidige streefwaarde van < 2,6 mmol/L aan te houden. Het belangrijkste argument om het Europese advies niet over te nemen is het ontbreken van direct bewijs. Ook hier kan, in overleg met de patiënt, besloten worden hoeveel lager dan 2,6 mmol/L gewenst is.
Patiënten met reumatoïde artritis hebben een vergelijkbaar risico op hart- en vaatziekten als patiënten met diabetes en behoren tot een van de risicogroepen bij wie een lagere LDL-c concentratie dan 2,6 mmol/L kan worden nagestreefd. Voor meer informatie over behandeling van hart- en vaatziekten bij reumatoïde artritis (RA) wordt naar de RA modules verwezen.
Voor patiënten boven de 70 jaar zijn de aanbevelingen omtrent lipidenverlagende behandeling beschreven in de module Lipidenverlagende behandeling en LDLc-streefwaarde bij (kwetsbare) ouderen >70 jaar.
Uitsluiting van secundaire oorzaken van dyslipidemie
De aanwezigheid van dyslipidemieën die secundair zijn aan andere aandoeningen moet worden uitgesloten voor het begin van de behandeling, want behandeling van de onderliggende aandoeningen leidt tot verbetering van de dyslipidemie zonder dat er lipidenverlagende medicatie nodig is. Dit geldt vooral voor hypothyroïdie en nefrotisch syndroom. Secundaire dyslipidemieën kunnen ook worden veroorzaakt door roken, overmatig alcoholgebruik, diabetes mellitus, syndroom van Cushing, leveraandoeningen en geneesmiddelen (bijvoorbeeld corticosteroïden). Voor meer informatie wordt naar de richtlijn (erfelijke) dyslipidemie in de tweede en derde lijn verwezen.
Aanbevelingen
LDL-C-streefwaarden voor patiënten ≤ 70 jaar die met lipidenverlagende medicatie worden behandeld:
- Streef naar een LDL-C < 1,8 mmol/L# bij patiënten ≤ 70 jaar met doorgemaakte hart- en vaatziekten.
- Streef naar een LDL-C < 2,6 mmol/L# bij overige patiënten ≤ 70 jaar met een verhoogd risico op hart- en vaatziekten.
De streefwaarden voor mensen > 70 jaar staan beschreven in het detail Lipidenverlagende behandeling en LDLc-streefwaarde bij (kwetsbare) ouderen >70 jaar.
# Streefwaarden dienen met enige nuance gebruikt te worden; een waarde net boven de streefwaarde kan soms geaccepteerd worden. Het is aan de zorgverlener in overleg met de patiënt te bepalen hoe vér onder de grenzen van 2,6 en 1,8 mmol/L de individuele streefwaarde wordt vastgesteld, afhankelijk van het individuele risico, het verwachte behandelvoordeel en de wens van de patiënt.
* De genoemde leeftijdsgrens is geen absolute grens. Kwetsbaarheid of vitaliteit is niet altijd gebonden aan de leeftijd van de patiënt.
Uitgangsvraag
Is de associatie tussen de hoogte van het non-HDL-cholesterol en het risico op een hart- en vaatziekte vergelijkbaar met de associatie tussen de hoogte van het LDL-cholesterol en het risico op een hart- en vaatziekte bij personen met een verschillende mate van verhoogd risico op hart- en vaatziekten?
Inleiding
Non-HDL-cholesterol (non-HDL-C) is het totaal cholesterol verminderd met het HDL-cholesterol (HDL-C). Er zijn aanwijzingen dat non-HDL-C net zoals LDL-C gebruikt kan worden als streefwaarde bij de CVRM en dat de hoogte van het non-HDL beter correspondeert met het risico op een hart- en vaatziekte dan de hoogte van het LDL-C. Het LDL-C wordt meestal berekend met de Friedewald-formule, tenzij de triglyceriden (TG) > 4,5 mmol/l zijn of wanneer sprake is van dysbètalipoproteïnemie. Oorspronkelijk was een voorwaarde voor het berekenen van het LDL-C dat bloed nuchter werd afgenomen, maar dat blijkt maar weinig invloed op de bepaling te hebben. Gebruik van non-HDL-C heeft als theoretisch voordeel dat alle atherogene lipidendeeltjes worden meegenomen (inclusief LDL-C, VLDL-C, IDL-C en Lp(a)), waardoor een betere risicoschatting kan worden gemaakt en het effect van de behandeling beter kan worden gemonitord. Met het meten van apolipoproteïne B kan vergelijkbare informatie worden verzameld over atherogene lipidendeeltjes. Tevens heeft gebruik van non-HDL-C een aantal praktische voordelen, waaronder bruikbaarheid bij hoge een TG (> 4,5 mmol/l) en het is kosteloos, in tegenstelling tot het meten van apolipoproteïne B.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is een systematische literatuuranalyse verricht naar de volgende zoekvraag: is de associatie tussen de hoogte van het non-HDL-cholesterol en het risico op een hart- en vaatziekte vergelijkbaar met de associatie tussen de hoogte van het LDL-cholesterol en het risico op een hart- en vaatziekte bij personen met een verschillende mate van verhoogd risico op hart- en vaatziekten?
P: patiënten met een verschillende mate van risico op hart- en vaatziekten
I: behandeling onder streefwaarde van non-HDL-C
C: behandeling onder streefwaarde van LDL-C
O: verschil tussen LDL-C en non-HDL-C
Relevante uitkomstmaten
De werkgroep achtte als relevante uitkomstmaat dat non-HDL-C minimaal net zo goed is als LDL-C om het risico in te schatten en het effect van cholesterolverlagende therapie te beoordelen.
Zoeken en selecteren (methode)
In de databases Medline (via OVID) en EMBASE (via Embase.com) is op 8 mei 2017 met relevante zoektermen gezocht naar meta-analyses en RCT’s. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 241 treffers op. Onderzoeken werden geselecteerd op grond van het volgende selectiecriterium: systematische review van RCT’s met de vergelijking tussen verschillende streefwaarden voor LDL-C en non-HDL-C met een gedetailleerde zoekstrategie en evidence-tabellen. Op basis van titel en abstract werden in eerste instantie 21 onderzoeken voorgeselecteerd. Na raadpleging van de volledige tekst werden vervolgens twintig onderzoeken geëxcludeerd (zie de exclusietabel onder het tabblad Verantwoording) en één onderzoek definitief geselecteerd.
Eén onderzoek is opgenomen in de literatuuranalyse. De belangrijkste onderzoekskarakteristieken en resultaten zijn opgenomen in de evidence-tabellen. De beoordeling van de individuele onderzoeksopzet (risk of bias) is opgenomen in de risk of bias-tabellen.
Samenvatting van de literatuur
Beschrijving van de onderzoeken
De meta-analyse van Boekholdt was erop gericht om bij patiënten behandeld met een statine te bepalen of het non-HDL-C een sterkere associatie heeft met hart- en vaatziekten dan het LDL-C. Hiervoor includeerde de meta-analyse acht RCT’s met een behandeling met een statine in minimaal één onderzoeksarm. Er waren een baselinemeting en vervolgmetingen van TC, LDL-C, HDL-C, non-HDL-C, TG en apolipoproteïne. Onderzoeken met een gemiddelde follow-up korter dan twee jaar werden geëxcludeerd. De auteurs van de meta-analyse gebruikten de data van de RCT’s. De primaire uitkomstmaat was de eerste belangrijke hart- en vaatziekte. Alleen patiënten behandeld met een statine zijn geïncludeerd in de meta-analyse (n = 38.153).
De geïncludeerde patiënten hadden een hart- en vaatziekte doorgemaakt, een stabiele coronaire hartziekte, angina pectoris, diabetes mellitus of hadden geen hart- en vaatziekten. De opzet van de meta-analyse beantwoordt de zoekvraag gedeeltelijk, maar wel voldoende. De geïncludeerde onderzoeken in de meta-analyse hadden als primair eindpunt de effectiviteit van een behandeling met statine.
Resultaten
Risico op hart- en vaatziekte
LDL-C: de trend voor het risico op een hart- en vaatziekte is per 1 - sd toename 1,13 (95%-BI 1,10 tot 1,17) p < 0,001; 1 - sd toename is 0,8 mmol/l van LDL-C.
Non-HDL-C: de trend voor het risico op een hart- en vaatziekte is per 1 - sd toename 1,16 (95%-BI 1,12 tot 1,19) p < 0,001; 1 - sd toename is 0,9 mmol/l van non-HDL-C.
De bootstrapanalyse voor het verschil tussen LDL-C en non-HDL-C is significant in het voordeel van non-HDL-C.
Het risico op een hart- en vaatziekte bij het wel of niet behalen van de streefwaarde met een behandeling met een statine is ook onderzocht. De gebruikte streefwaarde voor LDL-C was lager dan 2,6 mmol/l en voor non-HDL-C lager dan 3,4 mmol/l. Tabel 25 toont de associatie tussen het risico op een hart- en vaatziekte en de combinatie van de hoogte van het LDL-C en het non-HDL-C.
| LDL-C (mmol/l) | Non-HDL-C (mmol/l) | Risico op hart- en vaatziekten HR (95%-BI) |
|---|---|---|
| ≥ 2,6 | ≥ 3,4 | 1,21 (1,13 tot 1,29) |
| ≥ 2,6 | < 3,4 | 1,02 (0,92 tot 1,12) |
| < 2,6 | ≥ 3,4 | 1,32 (1,17 tot 1,50) |
| < 2,6 | < 3,4 | 1,00 (Referentie) |
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat is verlaagd met één niveau vanwege indirectheid. De geïncludeerde onderzoeken in de meta-analyse hadden niet als primair eindpunt het onderzoeken van de associatie tussen LDL-C en non-HDL-C en welke streefwaarden overeenkomen.
Conclusie
| Redelijk GRADE | De relatie tussen de hoogte van het non-HDL-C en het risico op hart- en vaatziekten is waarschijnlijk minstens even sterk (waarschijnlijk zelf sterker) als die tussen de hoogte van het LDL-C en het risico op hart- en vaatziekten. |
| Bron: Boekholdt 2012 |
Overwegingen
Routinematig gebruik van non-HDL-C heeft een aantal praktische voordelen ten opzichte het gebruik van LDL-C. Het kan ook gebruikt worden bij TG > 4,5 mmol/l, en het risico op hart- en vaatziekten kan minimaal even goed en mogelijk beter worden ingeschat met non-HDL-C dan met LDL-C, omdat alle atherogene (apoB-houdende) lipoproteïnen in de non-HDL-C-berekening worden meegenomen. De non-HDL-C-berekening is eenvoudig, kosteloos en wordt door laboratoria al vaak automatisch berekend en gerapporteerd. Non-HDL-C is even goed om residueel risico tijdens lipidenverlagende therapie te monitoren als LDL-C of apolipoproteïne B.
Vanwege dit recente inzicht zou de non-HDL-C-meting de voorkeur genieten boven LDL-C. Veel behandelaren zijn de afgelopen jaren echter gewend geraakt aan de LDL-C-metingen en streefwaarden, en in klinische trials met lipidenverlaging is LDL-C meestal prominent gerapporteerd. Er zijn aanwijzingen dat gecombineerd gebruik van non-HDL-C en LDL-C in de klinische praktijk additieve voordelen heeft voor het schatten van het (residuele) risico op hart- en vaatziekten (zie tabel 26), waarbij het laagste risico wordt gezien bij LDL-C < 2,6 mmol/l en tevens non-HDL-C < 3,4 mmol/l.
Bij individuele patiënten kunnen aanzienlijke verschillen worden gemeten in LDL-C en non-HDL-C. In grote onderzoeken bij patiënten met of zonder hart- en vaatziekte is het non-HDL-C gemiddeld 0,8 mmol/l hoger dan het LDL-C. Om aan te sluiten bij de LDL-C-streefwaarden kan daarom gekozen worden voor de volgende grenswaarden van non-HDL-C:
| LDL-C | non-HDL-C |
|---|---|
| 1,8 mmol/l | 2,6 mmol/l |
| 2,6 mmol/l | 3,4 mmol/l |
| 3,0 mmol/l | 3,8 mmol/l |
De keuze voor LDL-C of non-HDL-C als streefwaarde is volgens de werkgroep gelijkwaardig. In samenspraak met het laboratorium, de vakgroep en/of de zorggroep kan een praktische keuze worden gemaakt.
Aanbeveling
Gebruik LDL-C of non-HDL-C voor het monitoren van het effect van cholesterolverlagende behandeling, waarbij een LDL-C van 1,8 en 2,6 mmol/l correspondeert met een non-HDL-C van 2,6 en 3,4 mmol/l.
Aanbevelingen
Naar Samenvatting ›Streefwaarden LDL-cholesterol (LDL-C) bij volwassenen die met lipidenverlagende medicatie worden behandeld
- Streef naar een LDL-C <1,8 mmol/L* bij patiënten ≤70 jaar† met doorgemaakte hart- en vaatziekten.
- Streef naar een LDL-C < 2,6 mmol/L* bij overige patiënten ≤ 70 jaar† met een verhoogd risico op hart- en vaatziekten.
* Streefwaarden dienen met enige nuance gebruikt te worden; een waarde net boven de streefwaarde kan soms geaccepteerd worden. Het is aan de zorgverlener in overleg met de patiënt te bepalen hoe vér onder de grenzen van 2,6 en 1,8 mmol/L de individuele streefwaarde wordt vastgesteld, afhankelijk van het individuele risico, het verwachte behandelvoordeel en de wens van de patiënt.
† De genoemde leeftijdsgrens is geen absolute grens. Kwetsbaarheid of vitaliteit is niet altijd gebonden aan de leeftijd van de patiënt.
- Gebruik LDL-C of non-HDL-C voor het monitoren van het effect van cholesterolverlagende behandeling, waarbij een LDL-C van 1,8 en 2,6 mmol/L correspondeert met een non-HDL-C van respectievelijk 2,6 en 3,4 mmol/L.
Welke lipidenverlagende therapie?
Naar Samenvatting ›Statines zijn verreweg de best onderzochte cholesterolverlagers. Simvastatine heeft een standaarddosering van 40 mg. Andere statines, zoals rosuvastatine en pravastatine, zijn in een equipotente dosering waarschijnlijk even effectief ter verlaging van het cardiovasculair risico. Gebruik voor intensieve cholesterolverlaging een hoge dosis atorvastatine (40 of 80 mg) of rosuvastatine (20 of 40 mg), of een combinatie van een gemiddelde dosis statine met ezetimib of een PCSK9-remmer.
PCSK9-remmers vormen de nieuwste klasse cholesterolverlagers, ze verlagen het LDL-cholesterol zeer sterk, maar hun effectiviteit ten aanzien van risicoreductie en veiligheid zijn nog beperkt onderzocht. In de afrondingsfase van deze NHG-Standaard zijn de vergoedingscriteria voor PCSK9-remmers verruimd naar alle patiënten met een zeer hoog cardiovasculair risico vanwege vastgestelde hart- en vaatziekten zoals gedefinieerd in deze NHG-Standaard. Wij zijn echter van mening dat escalatie naar een PCSK9-remmer beperkt en weloverwogen moet plaatsvinden.
Uitgangsvraag
Wat is het effect van ezetimib en PCSK9-antilichamen op het krijgen van hart- en vaatziekte bij patiënten met een verhoogd risico op hart- en vaatziekte die worden behandeld met een statine?
Inleiding
Cholesterol is een belangrijke risicofactor voor het ontwikkelen van hart- en vaatziekten, en cholesterolverlagende therapie leidt tot een lager risico op hart- en vaatziekten. In de behandeling zijn statines het middel van eerste keuze. In de afgelopen jaren zijn nieuwe cholesterolverlagende therapieën beschikbaar gekomen die via andere mechanismen dan HMG-CoA-reductaseremming het cholesterol verlagen. De vraag is wat de plaats is van die nieuwere cholesterolverlagende geneesmiddelen en voor wie en wanneer die ingezet kunnen worden.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvragen: wat zijn de (on)gunstige effecten van ezetimib vergeleken met een placebo of reguliere zorg bij patiënten die reeds met een statine behandeld zijn?
P: patiënten behandeld met een statine
I: ezetimib
C: placebo of reguliere zorg
O: LDL-C-concentratie, morbiditeit en mortaliteit als gevolg van hart- en vaatziekten, bijwerkingen
Wat zijn de (on)gunstige effecten van PCSK9-antilichamen vergeleken met placebo of reguliere zorg bij patiënten reeds behandeld met een statine?
P: patiënten behandeld met een statine
I: PCSK9-antilichamen
C: placebo of reguliere zorg
O: LDL-C-concentratie, morbiditeit en mortaliteit als gevolg van hart- en vaatziekten, bijwerkingen
Relevante uitkomstmaten
De werkgroep achtte hart- en vaatziekten en bijwerkingen voor de besluitvorming kritieke uitkomstmaten; en LDL-C-concentratie en mortaliteit als gevolg van hart- en vaatziekten voor de besluitvorming belangrijke uitkomstmaten.
Hart- en vaatziekten en mortaliteit: de werkgroep definieerde niet a priori de genoemde uitkomstmaten, maar hanteerde de in de onderzoeken gebruikte definities. De werkgroep definieerde 2% absolute risicoreductie (NNT = 50) van hart- en vaatziektemorbiditeit en -mortaliteit over tien jaar als een klinisch (patiënt) relevant verschil.
Zoeken en selecteren (methode)
In de databases Medline (via OVID) en EMBASE (via Embase.com) is op 26 oktober 2017 met relevante zoektermen gezocht naar systematische reviews. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 201 treffers op. Onderzoeken werden geselecteerd op grond van het volgende selectiecriterium:
- Systematische review van RCT’s met de vergelijking tussen PCSK9-antilichamen en placebo of ezetimib en placebo met een gedetailleerde zoekstrategie en evidence-tabellen.
Op basis van titel en abstract werden in eerste instantie 37 onderzoeken voorgeselecteerd. Na raadpleging van de volledige tekst werden vervolgens 35 onderzoeken geëxcludeerd (zie de exclusietabel onder het tabblad Verantwoording) en twee onderzoeken definitief geselecteerd.
Een systematische review over ezetimib en een systematische review over PCSK9-antilichamen zijn opgenomen in de literatuuranalyse. De belangrijkste onderzoekskarakteristieken en resultaten zijn opgenomen in de evidence-tabellen. De beoordeling van de individuele onderzoeksopzet (risk of bias) is opgenomen in de risk of bias-tabellen.
Samenvatting van de literatuur
Ezetimib
Nuβbaumer (2016) ondernam een systematische review naar de effectiviteit en veiligheid van ezetimib toegevoegd aan statine voor het voorkomen van hart- en vaatziekten-events in patiënten met hyperlipidemie en atherosclerose en/of diabetes mellitus. Medline, EMBASE en de Cochrane Library werden tot juli 2015 doorzocht voor relevante artikelen. In totaal kwamen negen gerandomiseerde gecontroleerde trials in aanmerking. Alle RCT’s vergeleken ezetimib (10 mg) bovenop een statine met alleen een statine.
Resultaten
LDL-C
De auteurs hebben de resultaten over het effect op LDL-C niet gerapporteerd. Gegevens over bereikt LDL-C-niveau is uit de publicaties van de individuele trials gehaald. De wijze waarop de resultaten waren gerapporteerd, maakte een meta-analyse niet mogelijk. Daarom is ervoor gekozen om de resultaten in een tabel (tabel 27) weer te geven.
Voor het evalueren van het effect van ezetimib op LDL-C worden alleen de trials bekeken waar de dosering van de statine in de interventiearm gelijk is aan de dosering in de controlearm. Een aantal trials heeft niet de percentuele daling in LDL-C gerapporteerd. Om een indicatie te krijgen van deze daling is ervoor gekozen om deze, op basis van de gerapporteerde gemiddelde LDL-C-niveaus, te berekenen (cursief in de tabel). De daling in LDL-C bij ezetimib met statine is tussen de 9% en 20% groter dan bij alleen statine.
| Trial | Interventie (I) /controle (C) | n patiënten | Initieel LDL-C (mmol/l) | Gemiddelde LDL-C tijdens behandeling (mmol/l) | Percentage verandering ten opzichte van baseline | Verschil tussen interventie en controle* |
|---|---|---|---|---|---|---|
| Vergelijking: statine met of zonder ezetimib | ||||||
| Arimura 2012 | I: ezetimib 10 mg + atorvastatine 10 mg | 25 | – | 1,55 (sd 0,44) | – | -0,34 (SE 0,12) |
| C: atorvastatine 10 mg | 25 | – | 1,89 (sd 0,41) | – | ||
| Feldman 2004 | I1: simvastatine 10 mg + ezetimib 10 mg | 251 | 4,27 (sd 0,89) | - | -47% (SE 0,8) | -9% (SE 1,13) |
| C: simvastatine 10 mg | 253 | 4,49 (sd 1,16) | - | -38% (SE 0,8) | ||
| IMPROVE-IT | I: simvastatine 40 mg + ezetimib 10 mg | 9067 | 2,43 | 1,38 | -43% | -0,43 (SE?); -17% |
| C: simvastatine 40 mg | 9077 | 2,43 | 1,81 | -26% | ||
| Masuda 2015 | I: rosuvastatine 5 mg + ezetimib 10 mg | 21 | 3,40 (sd 0,66) | 1,48 (sd 0,52) | -55,8% (sd 18,9) | -0,46 (SE 0,17); |
| C: rosuvastatine 5 mg | 19 | 3,18 (sd 0,70) | 1,94 (sd 0,55) | -36,8% (sd 18,9) | -19% (SE 5,98) | |
| West 2011 | I1: ezetimib 10 mg + simvastatine 40 mg | 22 | 3,05 (SE 0,23) | 1,73 (SE 0,26) | -43% | -0,62 (SE 0,38); |
| C: simvastatine 40 mg | 22 | 3,05 (SE 0,26) | 2,35 (SE 0,28) | -23% | -20% | |
| Vergelijking: ezetimib + lage dosis statine versus hoge dosis statine | ||||||
| Dagli 2007 | I: pravastatine 10 mg + ezetimib 10 mg | 50 | 4,09 (sd 1,23) | 3,02 (sd 0,68) | – | -0,43 (SE 0,14) |
| C: pravastatine 40 mg | 50 | 4,28 (sd 0,77) | 3,45 (sd 0,69) | – | ||
| Gaudiani 2005 | I: simvastatine 20 mg + ezetimib | 103 | 2,43 (sd 0,74) | – | -20,8% (sd 22,3) | -20,5% (SE 3,11) |
| C: simvastatine 40 mg | 107 | 2,37 (sd 0,63) | – | - 0,3% (sd 22,8) | ||
| Meaney 2009 | I: ezetimib 10 mg + simvastatine 20/40 mg | 30 | 3,39 (sd 1,01) | 1,24 (sd 0,80) | – | 0,08 (SE 0,23) |
| C: simvastatine 40/80 mg | 30 | 3,36 (sd 0,85) | 1,16 (sd 0,96) | – | ||
| Nakamura 2012 | I: ezetimib 10 mg + statine | 29 | 3,10 | 2,38 | -23,8% (sd 15,7) | -2,9% (SE 4,51) |
| C: dubbele dosering statine | 28 | 3,13 | 2,48 | -20,9% (sd 18,3) | ||
| * Gemiddeld verschil in mmol/l, tenzij anders aangegeven | ||||||
Morbiditeit als gevolg van hart- en vaatziekten
Van de negen geïncludeerde RCT’s rapporteerden vier RCT’s gegevens over morbiditeit als gevolg van hart- en vaatziekten. De auteurs van de review hadden geen meta-analyse uitgevoerd vanwege verschillende definities van hart- en vaatziekten of vanwege het ontbreken van gegevens om risicoratio’s te kunnen berekenen.
In tabel 28 staan de resultaten van de trials die de uitkomst morbiditeit als gevolg van hart- en vaatziekten rapporteerden. De vier trials uit tabel 28 hebben allemaal statine met of zonder ezetimib vergeleken. Uiteindelijk heeft één trial voldoende power om een effect op morbiditeit als gevolg van hart- en vaatziekten te observeren, namelijk de IMPROVE-IT-trial. Het risico op hart- en vaatziekten was 6% lager bij een behandeling van ezetimib en statine vergeleken met alleen statine (HR 0,94; 95%-BI 0,89 tot 0,99). De absolute risicoreductie betrof 2% (NNT = 50) in het voordeel van ezetimib en statine na zeven jaar.
| Trial | Uitkomst | Ezetimib (+statine) n/N | Statine n/N | Effectschatter (95%-BI) |
|---|---|---|---|---|
| Arimura 2012 | Niet-fatale MI | 0/25 | 0/25 | - |
| IMPROVE-IT | Samengesteld eindpunt* | 2572/9067 (33%) | 2742/9077 (35%) | HR 0,94 (0,89 tot 0,99) |
| Masuda 2015 | MI | 0/26 | 0/25 | - |
| Coronaire revascularisatie | 1/26 (4%) | 1/25 (4%) | - | |
| West 2011 | MACE** | 4/22 (18%) | 2/22 (10%) | RR 2,22 (0,36 tot 13,62) |
| MI, myocardinfarct * Cardiovasculaire dood, MI, onstabiele AP met ziekenhuisopname tot gevolg, coronaire revascularisatie en beroerte ** Dood, MI, beroerte, TIA | ||||
Mortaliteit als gevolg van hart- en vaatziekten
Twee RCT’s rapporteerden gegevens over het risico om te overlijden als gevolg van hart- en vaatziekten, en maakte daarmee een meta-analyse mogelijk. Beide trials vergeleken statine plus ezetimib met statine zonder ezetimib. Het risico was gelijk tussen de groepen (RR 1,00; 95%-BI 0,89 tot 1,12). De forestplot wordt weergegeven in figuur 7).
Bijwerkingen
Drie RCT’s rapporteerden mogelijke bijwerkingen bij gebruik van statine of ezetimib en statine. Het risico op een bijwerking was niet verschillend tussen ezetimib bovenop statine versus een statine (RR 0,98; 95%-BI 0,89 tot 1,07) (figuur 8). Het risico op een bijwerking met als gevolg het stoppen van de behandeling was 15% lager bij gebruik van ezetimib met statine vergeleken met alleen statine (RR 0,85; 95%-BI 0,51 tot 1,43) (figuur 9).
Bewijskracht van de literatuur
LDL-C: de bewijskracht voor de uitkomstmaat LDL-C is met één niveau verlaagd vanwege imprecisie (ontbreken van een spreidingsmaat voor het berekenen van een betrouwbaarheidsinterval).
Hart- en vaatziekten: de bewijskracht voor de uitkomstmaat hart- en vaatziekten is met één niveau verlaagd vanwege imprecisie (betrouwbaarheidsinterval overschrijdt de grenzen van klinische besluitvorming).
Mortaliteit: de bewijskracht voor de uitkomstmaat hart- en vaatziektemortaliteit is niet verlaagd.
Bijwerkingen
1. Statine met of zonder ezetimib
- De bewijskracht voor de uitkomstmaat bijwerkingen is niet verlaagd.
- De bewijskracht voor de uitkomst bijwerkingen resulterend in het stoppen van behandeling is met twee niveaus verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias; geen adequate randomisatie en het ontbreken van blindering en meer dan 20% drop-out ), imprecisie (minder dan 50 events) en inconsistentie (verschil in effect).
2. Ezetimib + lage dosis statine versus hoge dosis statine
- De bewijskracht voor de uitkomstmaat bijwerkingen is met drie niveaus verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias; onduidelijkheid over randomisatieprocedure en allocation concealment) en imprecisie (minder dan 10 events).
Conclusie
| LDL-C (statine met of zonder ezetimib) | |
| Redelijk GRADE | Statine met ezetimib resulteert waarschijnlijk in een LDL-C-daling tussen 9% en 20% vergeleken met alleen statine bij patiënten met hart- en vaatziekten. Bron: Feldman 2004, IMPROVE-IT, Masuda 2015, West 2011 |
| Hart- en vaatziekten (statine met of zonder ezetimib) | |
| Redelijk GRADE | Statine met ezetimib verlaagt waarschijnlijk het risico op nieuwe hart- en vaatziekten bij patiënten met hart- en vaatziekten vergeleken met alleen statine. Bron: IMPROVE-IT |
| Mortaliteit (statine met of zonder ezetimib) | |
| Hoog GRADE | Statine met ezetimib verlaagt niet het risico om te overlijden aan hart- en vaatziekten, gedurende de looptijd van de trial, bij patiënten met hart- en vaatziekten vergeleken met alleen statine. Bron: Nußbaumer 2016 |
| Bijwerkingen | |
| Hoog GRADE | Statine met of zonder ezetimib Het risico op een bijwerking verschilt niet tussen ezetimib met statine versus alleen statine bij patiënten met hyperlipidemie en artherosclerose en/of diabetes mellitus. Bron: Nußbaumer 2016 |
| Zeer laag GRADE | Ezetimib + lage dosis statine versus hoge dosis statine Het is onzeker wat het risico op een bijwerking is van ezetimib met statine versus alleen statine bij patiënten met hyperlipidemie en artherosclerose en/of diabetes mellitus.
|
| Bijwerkingen die resulteren in het stoppen van de behandeling | |
| Zeer laag GRADE | Statine met of zonder ezetimib Het risico op een bijwerking verschilt niet tussen ezetimib met statine versus alleen statine bij patiënten met hyperlipidemie en artherosclerose en/of diabetes mellitus. Bron: Nußbaumer 2016 |
| Zeer laag GRADE | Ezetimib + lage dosis statine versus hoge dosis statine Het is onzeker wat het risico van ezetimib met statine is op een bijwerking resulterend in het stoppen van behandeling versus alleen statine bij patiënten met hyperlipidemie en artherosclerose en/of diabetes mellitus. Bron: Nußbaumer 2016 |
PCSK9-antilichamen
Beschrijving van de onderzoeken Schmidt (2017) kwantificeerde de korte- en langetermijneffecten van PCSK9-antilichamen op plasmalipiden en de incidentie van hart- en vaatziekten. De auteurs doorzochten tot mei 2016 CENTRAL, Medline, EMBASE en Web of Science. Lopende onderzoeken werden tijdens de selectie geïdentificeerd, waarvan drie in maart 2017 gepubliceerd waren. Deze onderzoeken zijn aan de review toegevoegd. Alleen gerandomiseerde, gecontroleerde trials met een follow-uptijd van ten minste 24 weken kwamen in aanmerking. In totaal werden negentien onderzoeken geïncludeerd en beschreven. Van deze negentien onderzoeken bleken er vijf alleen gepubliceerd te zijn als een congresabstract. Deze vijf onderzoeken zijn verder buiten beschouwing gelaten.
Het merendeel van de geïncludeerde onderzoeken naar het effect op plasmalipiden is verricht met alirocumab en evolocumab. Acht onderzoeken evalueerden het effect van alirocumab, vier onderzoeken dat van evolocumab en twee dat van bococizumab. Hoewel in de originele publicatie niet altijd duidelijk wordt beschreven wat de achtergrondtherapie is, wordt echter wel in de onderzoeksprotocollen beschreven dat de achtergrondtherapie altijd leefstijladviezen met statine en/of ezetimib is. De resultaten worden daarom niet per vergelijking (versus placebo of ezetimib) apart beschreven, maar gepoold. De looptijd van de trials liep uiteen van 24 weken tot 157 weken.
Resultaten
LDL-C
Alle veertien trials hebben het effect op LDL-C in percentages beschreven. De resultaten van de OSLER-1 zijn reeds meegenomen onder de trial OSLER-1/2 en wordt daarom niet apart in de analyse meegenomen. De resultaten van de LDL-C-verandering aan het einde van de trial zijn in (figuur 10) weergegeven. Aan het eind van de trial resulteerde een behandeling met een PCSK9-antilichaam in een daling van ruim 50% in LDL-C vergeleken met de controle, statine met of zonder ezetimib (gemiddeld verschil -53%; 95%-BI -53% tot -52%).
Hart- en vaatziekten
In totaal rapporteerden negen trials het risico op hart- en ziekten. Alleen de FOURIER en SPIRE-1/2-trials hadden als primair eindpunt hart- en vaatziekten en waren gepowerd om een effect van een PCSK9-antilichaam op hart- en vaatziekten te detecteren. Ondanks het gebrek aan power is er wel voor gekozen om alle gegevens mee te nemen in de meta-analyse. De resultaten zijn in (figuur 11) weergegeven. Het risico op een hart- en vaatziekte-event is 14% lager bij gebruik van een PCSK9-antilichaam vergeleken met een statine (met of zonder ezetimib) (OR 0,86; 95%-BI 0,81 tot 0,92). Een sensitiviteitsanalyse van trials die als primaire uitkomst hart- en vaatziekten hadden benoemd, leverde hetzelfde resultaat op (OR 0,87; 95%-BI 0,81 tot 0,93).
Mortaliteit als gevolg van hart- en vaatziekten
Van de veertien trials beschreven in de review van Schmidt (2017) rapporteerden twee ook de resultaten over het risico om te overlijden aan hart- en vaatziekten. Aangezien dit de grootste trials uit de review waren, is een meta-analyse uitgevoerd (figuur 12). De hazardratio om te overlijden aan hart- en vaatziekten gedurende follow-up was 1,04 bij een behandeling met een PCSK9-antilichaam vergeleken met een statine (met of zonder ezetimib) (HR 1,04; 95%-BI 0,88 tot 1,20).
Bijwerkingen
Alle trials hebben het risico op een bijwerking gerapporteerd. De resultaten zijn in (figuur 13) weergegeven. Het risico op een bijwerking was vergelijkbaar bij een behandeling met een PCSK9-antilichaam of een statine (met of zonder ezetimib) (RR 1,01; 95%-BI 1,00 tot 1,03).
Bewijskracht van de literatuur
De bewijskracht van RCT’s voor een therapeutische uitgangsvraag starten op hoog.
LDL-C: de bewijskracht voor de uitkomstmaat LDL-C is niet verlaagd. Ondanks een hoge I2 van 98% liggen de effectschattingen met betrouwbaarheidsintervallen geheel links van het klinisch relevant verschil. Om deze reden is niet voor heterogeniteit afgetrokken.
Hart- en vaatziekten: de bewijskracht voor de uitkomstmaat hart- en vaatziekten is niet verlaagd. Hoewel vier trials vanwege incomplete outcome data potentieel risk of bias hadden, is niet voor risk of bias afgetrokken aangezien de grootste trials (met het grootste gewicht in de meta-analyse) geen risk of bias hadden.
Mortaliteit: de bewijskracht voor de uitkomstmaat mortaliteit als gevolg van hart- en vaatziekten is met één niveau verlaagd vanwege imprecisie (het betrouwbaarheidsinterval overlapt de grenzen van klinische besluitvorming).
Bijwerkingen: de bewijskracht voor de uitkomstmaat hart- en vaatziekten is niet verlaagd. Ook hier is niet afgetrokken voor risk of bias in vier trials, aangezien de trials met het grootste gewicht in de meta-analyse geen risk of bias hadden.
Conclusie
| LDL-C | |
| Hoog GRADE | Gemiddelde LDL-C-daling is procentueel gemiddeld 53% groter bij een behandeling met een PCSK9-antilichaam in vergelijking met placebo bovenop een statine (met of zonder ezetimib) bij patiënten met een hoog risico op hart- en vaatziekten. Bron: Schmidt 2017 |
| Hart- en vaatziekten | |
| Hoog GRADE | Het risico op hart- en vaatziekten is 14% lager bij een behandeling met een PCSK9-antilichaam in vergelijking met placebo bovenop een statine (met of zonder ezetimib) bij patiënten met hart- en vaatziekten. Bron: Schmidt 2017 |
| Mortaliteit | |
| Redelijk GRADE | Het risico om te overlijden aan hart- en vaatziekten is waarschijnlijk gelijk bij een behandeling met PCSK9-antilichamen in vergelijking met placebo bovenop een statine (met of zonder ezetimib), gedurende de looptijd van de trials, bij patiënten met hart- en vaatziekten. Bron: Schmidt 2017 |
| Bijwerkingen | |
| Hoog GRADE | Het risico op een bijwerking bij behandeling met een PCSK9-antilichaam is vergelijkbaar met placebo bovenop behandeling met statine (met of zonder ezetimib), gedurende de looptijd van de trials, bij patiënten met een hoog risico op hart- en vaatziekten. Bron: Schmidt 2017 |
Overwegingen
Medicatie voor verlaging van LDL-C
Verlaging van het LDL-C is een effectieve strategie om het risico op hart- en vaatziekten te verlagen. Behandeling met statine is de hoeksteen van LDL-C-verlagende therapie, maar wanneer LDL-C-streefwaarden niet worden bereikt, kan additionele therapie worden overwogen. In eerste instantie cholesterolabsorptieremming met ezetimib en als dan de LDL-C-streefwaarde niet wordt bereikt, kan bij specifieke groepen patiënten ook toevoegen van PCSK9-antilichamen worden overwogen.
Bij patiënten met hart- en vaatziekten wordt geadviseerd om met intensieve lipidenverlaging te behandelen vanwege uitkomsten van klinische trials waarin intensieve lipidenverlaging is vergeleken met minder intensieve lipidenverlaging (zie detail Streefwaarden van LDL-C). Met intensieve lipidenverlaging wordt bedoeld een hoge dosis van een sterkwerkende statine: atorvastatine 40 of 80 mg, rosuvastatine 10, 20 of 40 mg, al dan niet in combinatie met ezetimib. Een andere vorm van intensieve lipidenverlagende therapie is de combinatie van een minder sterk werkende statine (simvastatine, fluvastatine of pravastatine) in combinatie met ezetimib of een lage dosis van een sterk werkende statine (atorvastatine 10 of 20 mg of rosuvastatine 5 mg) in combinatie met ezetimib. Met hoge doses statine is meer onderzoek gedaan dan met de combinatie van een statine met ezetimib. Verdere intensivering met PCSK9-antilichamen kan worden overwogen in bepaalde groepen patiënten in specifieke omstandigheden (kijk voor de vergoedingscriteria op www.zorginstituutnederland.nl).
Statines verminderen de morbiditeit en mortaliteit als gevolg van hart- en vaatziekten, en de noodzaak van kransslagaderinterventies, doordat ze LDL-C-verlagend werken. Ze zijn daarom het geneesmiddel van eerste keuze bij patiënten met een indicatie om het LDL-C te verlagen. Ook is er onder huisartsen en medisch specialisten inmiddels veel ervaring met statines.
Bij een behandeling met statines treden soms verhoogde leverwaarden of creatinekinase (CK) in plasma op; in de meeste gevallen is dit omkeerbaar. Routinecontrole van lever- of CK-waarden is niet geïndiceerd. Daarnaast klaagt 5 tot 10% van patiënten die statines gebruiken over myalgie, maar rhabdomyolyse is zeer zeldzaam. In gerandomiseerde dubbelblinde, placebogecontroleerde onderzoeken wordt geen verschil gezien in het optreden van bijwerkingen van statines in de statinebehandelde of placebobehandelde patiënten. Het risico op myopathie (ernstige spiersymptomen) kan worden geminimaliseerd door identificatie van kwetsbare patiënten en/of door vermijding van statine-interacties met specifieke geneesmiddelen (tabel 29). Omdat statines worden voorgeschreven voor langetermijngebruik, verdienen mogelijke interacties met andere geneesmiddelen extra en voortdurende aandacht, aangezien een groot aantal patiënten een farmacologische behandeling ondergaat voor concomitante aandoeningen. In de praktijk zal het beleid ten aanzien van een patiënt met myalgie maar zonder een sterke verhoging van creatininekinase gebaseerd zijn op trial-and-error, waarbij verschillende statines worden uitgeprobeerd of een zeer lage dosis gedurende meerdere dagen per week en een geleidelijke verhoging van de dosering (voor meer informatie zie Statinegerelateerde bijwerkingen uit de richtlijn (Erfelijke) dyslipidemie in de tweede en derde lijn).
| CYP3A4-remmers/substraten | Andere |
|---|---|
| Ciclosporine, tacrolimus, sirolimus | Digoxine |
| Macroliden (azitromycine, claritromycine, erytromycine) | Fibraten (gemfibrozil) |
| Triazolen (fluconazol, itraconazol, ketoconazol, posaconazol) | |
| Calciumantagonisten (diltiazem, verapamil) | |
| Hiv-proteaseremmers (atazanavir, darunavir, fosamprevanir, indinavir, lopinavir, ritonavir, saquinavir) | |
| Hepatitis C-virusproteaseremmers (boceprevir, telaprevir) | |
| Danazol | |
| Amiodaron | |
| Grapefruit en daarop lijkende vruchten | |
| Sildenafil |
Het veiligheidsprofiel van statines is over het algemeen acceptabel en eerdere bevindingen dat lipidenverlagende behandelingen kunnen bijdragen aan een verhoging van de mortaliteit niet als gevolg van hart- en vaatziekten (bijvoorbeeld kanker, zelfmoord, depressie) of psychische stoornissen zijn in een grote meta-analyse niet bevestigd.
Verhoogde spiegels van bloedglucose en geglyceerd hemoglobine (HbA1c) (dat wil zeggen verhoogd risico op diabetes mellitus type 2) treden op na behandeling met statines en zijn dosisafhankelijk, en deels geassocieerd met een heel lichte gewichtstoename. De voordelen van statinegebruik wegen echter bij het overgrote merendeel van de patiënten ruim op tegen de risico’s.
Bij het voorschrijven van statines moeten patiënten eraan herinnerd worden dat het naleven van veranderingen in leefstijl een licht risico op diabetes mellitus kan tegengaan.
Cholesterolabsorptieremming (ezetimib) wordt meestal niet gebruikt als monotherapie om het LDL-C te verlagen, tenzij een patiënt geen statines verdraagt. Cholesterolabsorptieremming wordt meestal toegevoegd aan een statine wanneer de LDL-C streefwaarde niet wordt bereikt, ondanks een maximaal getolereerde dosis van een statine.
Ook galzuurbindende harsen verlagen het totaal cholesterol en LDL-C, maar worden slecht verdragen en leiden vaak tot een verhoging van de plasmatriglycerideconcentraties. Ze worden daarom niet aanbevolen voor routinegebruik bij de preventie van hart- en vaatziekten.
Fibraten worden primair gebruikt voor verlaging van triglyceriden en verhoging van HDL-C, en visolie (n-3-vetzuren) in doses van 2 tot 4 g/dag worden gebruikt voor triglycerideverlaging. Uit klinische trials blijkt dat fibraten of visolie het hart- en vaatziekterisico niet verlagen. Fibraten hebben mogelijk wel een effect bij patiënten met diabetes mellitus met een dyslipidemie (verhoogde triglyceriden en laag HDL-C). Gezien de sterke effecten van statines op plasmalipiden en op de reductie van hart- en vaatziekten wordt het routinematig gebruik van fibraten of visolie voor preventie van hart- en vaatziekten niet aanbevolen. Ter voorkoming van pancreatitis wordt geadviseerd om de plasmatriglyceridenconcentratie te verlagen indien deze > 10 mmol/l is. Hiervoor moeten niet alleen geneesmiddelen worden gebruikt, maar ook alcoholrestrictie, behandeling van diabetes mellitus, stopzetten van oestrogeentherapie, enzovoort. Bij de zeldzame patiënten met ernstige en/of onverklaarde hypertriglyceridemie wordt verwijzing naar een centrum aanbevolen (zie richtlijn (erfelijke) dyslipidemie in de tweede en derde lijn).
Geneesmiddelcombinaties
Patiënten met hart- en vaatziekten, diabetes mellitus of personen met een verhoogd vasculair risico zullen niet altijd de LDL-C streefwaarden bereiken met de hoogst getolereerde dosis statine. Een combinatiebehandeling van statine met ezetimib en/of PCSK9-antilichaam is dan aangewezen bij zeer hoogrisicopatiënten.
De SHARP-trial voldoet strikt genomen niet aan de zoekcriteria omdat de toegevoegde waarde van ezetimib bovenop een statine niet is onderzocht. Toch is dit een relevant onderzoek omdat een lage dosis statine in combinatie met ezetimib is vergeleken met placebo in een relevante groep patiënten. In de SHARP-trial werden patiënten geïncludeerd met chronische nierschade (CNS) met of zonder dialyse, waarbij de combinatie simvastatine/ezetimib 20 mg/10 mg is vergeleken met placebo. Het overall resultaat was een 17% (HR 0,83; 95%-BI 0,74 tot 0,94) lager risico op hart- en vaatziekten. Bij de groep patiënten met CNS (mannen kreat > 150 micromol/l, vrouwen kreat > 130 micromol/l) zonder dialyse werd 22% (HR 0,78; 95%-BI 0,67 tot 0,91) lager risico en bij de dialysepatiënten 10% lager risico (HR 0,90; 95%-BI 0,75 tot 1,08) waargenomen.
Combinaties van niacine en een statine verhogen HDL-C en verlagen triglyceriden beter dan een van beide geneesmiddelen alleen, maar niacine heeft als belangrijkste bijwerking het optreden van opvliegers, wat de therapietrouw kan beïnvloeden. Het klinisch voordeel van deze combinatie is bovendien niet aangetoond.
Fibraten, in het bijzonder fenofibraat, kan nuttig zijn, niet alleen om hoge triglycerideconcentraties te verlagen en een laag HDL-C te verhogen, maar ook om LDL-C verder te verlagen in combinatie met een statine. Er is beperkt bewijs voor deze combinatie voor het verminderen van het aantal hart- en vaatziekten bij een subgroep van patiënten met diabetes mellitus type 2 met verhoogde triglyceriden en een laag HDL-cholesterol (FIELD- en ACCORD-trials). Voor fibraten is nog wel plaats in de behandeling van patiënten met specifieke erfelijke lipidenstoornissen, zoals patiënten met familiaire dysbètalipoproteïnemie (zie richtlijn (Erfelijke) dyslipidemie in de tweede en derde lijn).
Combinatietherapie met ezetimib is veilig en effectief (ongeveer 9 tot 20% LDL-C-reductie), maar het additionele risicoverlagende effect is beperkt (relatieve risicoreductie 7 tot 8%). De kosten van ezetimib zijn laag, vanwege het recente patentverlies (begin 2018) en vanwege de beschikbaarheid in combinatietabletten met statines is de belasting voor de patiënt laag.
Behandeling met PCSK9-antilichamen is de nieuwste vorm van LDL-C-verlaging, door middel van een subcutane injectie eenmaal per twee weken, waarmee een LDL-C-reductie van ongeveer 53% wordt bereikt en een relatieve risicoreductie van 15 tot 20% voor hart- en vaatziekten. De exacte kosten van PCSK9-antilichamen zijn niet bekend vanwege het prijsarrangement tussen de overheid en producenten, maar zijn naar verluid hoog. De kosten zijn voor het Zorginstituut Nederland (ZiN) aanleiding geweest om specifieke vergoedingsvoorwaarden in te stellen voor PCSK9-antilichamen door middel van een machtigingsstructuur (www.zorginstituutnederland.nl). De ervaring met PCSK9-antilichamen in de praktijk is nog gering en de veiligheid is onderzocht in trials met een beperkte mediane follow up (één tot twee jaar). Over langetermijnveiligheid is nog weinig bekend, maar in observationele onderzoeken met langere follow up (ongeveer vier jaar) worden geen ernstige bijwerkingen gerapporteerd.
Update 2024
Zeer recent zijn resultaten over langetermijnuitkomsten van het middel bempedoïnezuur als orale cholesterolverlagende therapie bekend geworden (Nissen, 2023) , naast eerder gepubliceerde RCT’s over de effectiviteit op de kortere termijn. De gerandomiseerde klinische placebo-gecontroleerde trial bij statine-intolerante patiënten van Nissen (2023) liet een reductie van 13% in het optreden van hart- en vaatziekten zien na een mediane follow-up van 40,6 maanden. Gezien het huidige traject waar een aantal modules worden herzien (en niet de gehele richtlijn), wordt de plaatsbepaling van bempedoïnezuur op basis van langetermijnuitkomsten in een volgende herzieningscyclus meegenomen.
Kijk voor de huidige vergoedingscriteria op: www.zorginstituutnederland.nl
Aanbevelingen
Patiënten met hart- en vaatziekten ≤ 70 jaar:
- Start intensieve lipidenverlaging bij voorkeur met een hoge dosis statine of anders met een combinatie van een statine met ezetimib indien het LDL-C ≥ 1,8 mmol/l.
- Intensiveer de lipidenverlagende therapie (een hogere dosis statine of sterker werkende statine en/of combinatie van statine en ezetimib) indien het LDL-C na drie maanden nog steeds ≥ 1,8 mmol/l is.
- Verder intensivering van lipidenverlagende therapie (hogere dosis statine en/of combinatie van statine en ezetimib) kan op individuele basis en in overleg met een patiënt ook worden overwogen indien, ondanks het bereiken van LDL-C < 1,8 mmol/l, een patiënt gemotiveerd is en de behandeling goed verdraagt.
- Behandeling met PCSK9-antilichamen, in combinatie met maximaal verdraagbare orale lipidenverlagende therapie, kan worden overwogen bij patiënten met een hooggeschat recidiefrisico op hart- en vaatziekten (zoals patiënten met uitgebreid of progressief vaatlijden, patiënten met diabetes mellitus met een hart- en vaatziekte en patiënten met familiaire hypercholesterolemie met een hart- en vaatziekte) die de genoemde LDL-C streefwaarden niet bereiken met optimaal/maximaal verdraagbare orale lipidenverlagende medicatie. Hiervoor gelden specifieke vergoedingscriteria.
Patiënten zonder eerdere hart- en vaatziekten ≤ 70 jaar, maar met een hoog of zeer hoog cardiovasculair risico en/of met diabetes mellitus en/of chronische nierschade:
- Start met een statine indien het risico op hart- en vaatziekten zeer hoog is en het LDL-C ≥ 2,6 mmol/l is.
- Overweeg te starten met een statine indien het risico op hart- en vaatziekten hoog is en het LDL-C ≥ 2,6 mmol/l is.
- Intensiveer de lipidenverlagende therapie (een hogere dosis statine of sterker werkende statine) indien het LDL-C na drie maanden ≥ 2,6 mmol/l is. Indien dat niet mogelijk is, overweeg dan een combinatie van statine en ezetimib.
- Intensieve(re) lipidenverlagende therapie (hoge dosis of sterker werkende statine en/of combinatie van statine en ezetimib) kan op individuele basis en in overleg met een patiënt worden overwogen indien, ondanks het bereiken van LDL-C < 2,6 mmol/l, een patiënt gemotiveerd is en de behandeling goed verdraagt.
- Behandeling met PCSK9-antilichamen, in combinatie met maximaal verdraagbare orale lipidenverlagende therapie, kan worden overwogen bij specifieke patiëntengroepen (in het bijzonder patiënten met familiaire hypercholesterolemie) die ondanks optimale orale lipidenverlagende therapie de streefwaarden voor LDL-C niet bereiken. Hiervoor gelden specifieke vergoedingscriteria.
Aanbevelingen
Naar Samenvatting ›Patiënten met hart- en vaatziekten ≤ 70 jaar:
- Start intensieve lipidenverlaging bij voorkeur met een hoge dosis statine of anders met een combinatie van een statine met ezetimib indien het LDL-C ≥ 1,8 mmol/l.
- Intensiveer de lipidenverlagende therapie (een hogere dosis statine of sterker werkende statine en/of combinatie van statine en ezetimib) indien het LDL-C na drie maanden nog steeds ≥ 1,8 mmol/l is.
- Verdere intensivering van lipidenverlagende therapie (hogere dosis statine en/of combinatie van statine en ezetimib) kan op individuele basis en in overleg met een patiënt ook worden overwogen indien, ondanks het bereiken van LDL-C < 1,8 mmol/l, de patiënt gemotiveerd is en de behandeling goed verdraagt.
- Behandeling met PCSK9-remmers, in combinatie met maximaal verdraagbare orale lipidenverlagende therapie, kan worden overwogen bij patiënten met een hooggeschat recidief risico op hart- en vaatziekten (zoals patiënten met uitgebreid of progressief vaatlijden, patiënten met diabetes mellitus met een hart- en vaatziekte en patiënten met familiaire hypercholesterolemie met een hart- en vaatziekte) die de genoemde LDL-C-streefwaarden niet bereiken met optimale/maximale verdraagbare orale lipidenverlagende medicatie. (In 2024 zijn de vergoedingscriteria voor PCSK9-remmers aanzienlijk verruimd naar alle patiënten met een zeer hoog cardiovasculair risico die de streefwaarde met orale therapie niet halen. Wij zijn echter van mening dat escalatie naar een PCSK9-remmer beperkt en weloverwogen moet plaatsvinden. )
Patiënten zonder eerdere hart- en vaatziekten ≤ 70 jaar, maar met een zeer hoog of hoog cardiovasculair risico en/of met diabetes mellitus en/of chronische nierschade:
- Start met een statine indien het risico op hart- en vaatziekten zeer hoog is en het LDL-C ≥2,6 mmol/l is.
- Overweeg te starten met een statine indien het risico op hart- en vaatziekten hoog is en het LDL-C ≥2,6 mmol/l is.
- Intensiveer de lipidenverlagende therapie (een hogere dosis statine of sterker werkende statine en/of combinatie van statine en ezetimib) indien het LDL-C na drie maanden ≥2,6 mmol/l is.
- Intensieve(re) lipidenverlagende therapie (hoge dosis of sterker werkende statine en/of combinatie van statine en ezetimib) kan op individuele basis en in overleg met een patiënt worden overwogen indien, ondanks het bereiken van LDL-C <2,6 mmol/l, een patiënt gemotiveerd is en de behandeling goed verdraagt.
- Behandeling met PCSK9-remmers, in combinatie met maximaal verdraagbare orale lipidenverlagende therapie, kan worden overwogen bij specifieke patiëntengroepen (met name patiënten met familiaire hypercholesterolemie) die ondanks optimale orale lipidenverlagende therapie de streefwaarden voor LDL-C niet bereiken. (In 2024 zijn de vergoedingscriteria voor PCSK9-remmers aanzienlijk verruimd naar alle patiënten met een zeer hoog cardiovasculair risico die de streefwaarde met orale therapie niet halen. Wij zijn echter van mening dat escalatie naar een PCSK9-remmer beperkt en weloverwogen moet plaatsvinden.)
Vitale ouderen
Starten van lipidenverlagende medicatie
- Overweeg het aanbieden van lipidenverlagende medicatie aan vitale ouderen zonder hart- en vaatziekten alleen met een voldoende hoog geschat resterende levensverwachting en een hoog geschat risico op een vasculair event. Streef naar een LDL-C < 2,6 mmol/L.
- Bijvoorbeeld: geschat met SCORE2-OP óf door de aanwezigheid van ernstige risicofactoren (zoals diabetes, een zeer hoog cholesterol (TC > 8 mmol/L) of een zeer hoge bloeddruk (≥ 180/110 mmHg)).
- Bied lipidenverlagende medicatie aan vitale ouderen met hart- en vaatziekten aan. Streef naar een LDL-C < 2,6 mmol/L. Overweeg een lagere streefwaarde als medicatie goed wordt verdragen en hart- en vaatziekte herhaald optreedt ondanks een LDL-C van <2,6 mmol/L.
- Evalueer de eventuele bijwerkingen nauwgezet. Switch naar een andere statine of verlaag de statinedosering en overweeg ezetimib toe te voegen bij het vermoeden van het ontstaan van bijwerkingen.
Stoppen met lipidenverlagende medicatie
- Stop alleen met lipidenverlagende medicatie bij onoverkomelijke bijwerkingen bij niet-kwetsbare ouderen met hart- en vaatziekten.
Kwetsbare ouderen
Starten van lipidenverlagende medicatie
- Start niet met lipidenverlagende medicatie bij kwetsbare ouderen zonder hart- en vaatziekten.
- Overweeg het geven van lipidenverlagende medicatie aan kwetsbare ouderen na een (recent) vasculair event en met een voldoende hoog geschat resterende levensverwachting.
- Overweeg te starten met een standaarddosis statine.
- Evalueer het optreden van bijwerkingen nauwgezet en waak voor myopathie, behoud van functie en kwaliteit van leven.
Stoppen met lipidenverlagende medicatie
- Stop met lipidenverlagende medicatie bij kwetsbare ouderen zonder hart- en vaatziekten.
- Overweeg te stoppen met lipidenverlagende medicatie bij kwetsbare ouderen met hart- en vaatziekten, met name bij het optreden van een mogelijke bijwerking of bij een geringe geschatte resterende levensverwachting.
Uitgangsvraag
Wat is de meerwaarde van de behandeling met lipidenverlagende middelen bij (kwetsbare) ouderen (> 70 jaar)?
Inleiding
Lipidenverlagende medicijnen zijn zowel bij patiënten met als bij patiënten zonder hart- en vaatziekten zeer effectief gebleken. Het bij een populatie van vooral middelbare leeftijd verkregen bewijs wordt breeduit, tot op richtlijnniveau geëxtrapoleerd naar ouderen. Bij ouderen is het bewijs voor de effectiviteit van lipidenverlagende medicijnen beperkt tot de jongsten en vitaalsten onder hen. Belangrijker dan morbiditeit en mortaliteit zijn voor kwetsbare ouderen de uitkomstmaten als behoud van functioneren, kwaliteit van leven, ziektevrij leven, cognitie en bijwerkingen van medicatie. Als deze uitkomstmaten niet beschikbaar zijn dan is prospectief onderzoek naar deze vragen bij kwetsbare en multimorbide ouderen dringend gewenst.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvraag:
Wat is de effectiviteit van lipidenverlagende medicijnen bij ouderen (ouder dan 70 jaar) met of zonder hart- en vaatziekten vergeleken met een placebo of geen behandeling?
P1: ouderen (ouder dan 70 jaar) met en zonder hart- en vaatziekten;
I1: lipidenverlagende therapie;
C1: placebo of geen behandeling;
O1: hart- en vaatziekte, kwaliteit van leven, functioneren, bijwerkingen, totale mortaliteit.
Welke streefwaarde van LDL-C dient te worden gehanteerd bij lipidenverlagende behandeling van ouderen met een verhoogd risico op hart- en vaatziekten?
P2: ouderen (ouder dan 70 jaar) met een verhoogd risico op hart- en vaatziekten;
I2: behandeling onder streefwaarde 1 van LDL-C;
C2: behandeling onder streefwaarde 2 van LDL-C;
O2: hart- en vaatziekte, kwaliteit van leven, functioneren, bijwerkingen, totale mortaliteit.
Relevante uitkomstmaten
De werkgroep achtte hart- en vaatziekten, kwaliteit van leven en functioneren voor de besluitvorming kritieke uitkomstmaten; en bijwerkingen en totale mortaliteit voor de besluitvorming belangrijke uitkomstmaten.
Klinische relevantie
De duiding van klinische relevantie wordt in Module Schatten van het risico op hart- en vaatziekten besproken (paragraaf van risico naar behandeladviezen).
Zoeken en selecteren (methode)
In de databases Medline (via OVID) en EMBASE (via Embase.com) is met relevante zoektermen gezocht naar systematische reviews, gerandomiseerd gecontroleerde trials en observationeel onderzoek. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 618 treffers op. Onderzoeken werden geselecteerd op grond van de volgende selectiecriteria:
- systematische reviews (gezocht in ten minste twee databases, gedetailleerde zoekstrategie beschikbaar en risk of bias-beoordeling);
- gerandomiseerde trials van patiënten ouder dan zeventig jaar, of patiënten met een gemiddelde leeftijd van zeventig jaar of ouder of een subgroepanalyse van patiënten zeventig jaar of ouder die een statine of een ander lipidenverlagend medicijn kregen vergeleken met een placebo of geen behandeling.
Op basis van titel en abstract werden in eerste instantie veertig onderzoeken voorgeselecteerd. Na raadpleging van de volledige tekst werden vervolgens 37 onderzoeken geëxcludeerd (zie de exclusietabel onder het tabblad Verantwoording) en drie onderzoeken definitief geselecteerd.
Resultaten
Er is één systematische review geïncludeerd die zich focuste op de effectiviteit van een statine bij ouderen zonder hart- en vaatziekten. In deze review waren acht gerandomiseerde gecontroleerde trials opgenomen, waarvan vijf trials voldeden aan de gestelde PICO. Naast deze review werd er één gerandomiseerde trial (beschreven in twee artikelen) gevonden waarin patiënten met hart- en vaatziekten een statine ter secundaire preventie werd gegeven. De belangrijkste onderzoekskarakteristieken en resultaten zijn opgenomen in de evidence-tabellen. De beoordeling van de individuele onderzoeksopzet (risk of bias) is opgenomen in de risk of bias-tabellen.
Zoekactie PICO2 – december 2021
De zoekactie voor de module Streefwaarden van LDL-C bij behandeling met lipidenverlagende medicatie is op 16-12-2021 herhaald met een paar wijzigingen (zie zoekverantwoording voor meer detail). Met deze zoekactie worden ook potentiële studies gevonden voor deze uitgangsvraag.
Op basis van titel en abstract werden in eerste instantie 38 studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens 37 studies geëxcludeerd (zie Totstandkoming) en een studie definitief geselecteerd. Een trial vergeleek twee streefwaarden met elkaar (TST-trial) met een subgroepanalyse van patiënten ouder dan 75 jaar.
Samenvatting van de literatuur
Beschrijving van de onderzoeken - PICO-1
Ouderen zonder hart- en vaatziekten
In de systematische review van Teng (2015) werden de effectiviteit en veiligheid van statines vergeleken met standaardzorg of placebobehandeling. De auteurs van de review beschreven echter niet wat standaardzorg in de geïncludeerde trials betrof. De literatuur werd doorzocht tot augustus 2014, en de vijf gerandomiseerde gecontroleerde trials die ook voldeden aan het leeftijdscriterium (> 70 jaar) van deze literatuursamenvatting werden hierin geïncludeerd. De onderzochte interventies bestonden uit dagelijks 40 mg pravastatine (twee onderzoeken), 10 mg atorvastatine (één onderzoek), 80 mg fluvastatine XL (één onderzoek) en 20 mg rosuvastatine (één onderzoek). Uitkomsten van de review waren hart- en vaatziekten, bijwerkingen, cognitief functioneren en mortaliteit. Aan de geïncludeerde onderzoeken deden 20.147 ouderen zonder hart- en vaatziekten mee, en de gemiddelde follow-uptijd van de onderzoeken varieerde tussen de 1 en 4,8 jaar. In een van de geïncludeerde onderzoeken namen alleen patiënten met diabetes mellitus deel en één onderzoek was niet geblindeerd.
Resultaten
I. Hart- en vaatziekten
Vier onderzoeken geïncludeerd in Teng (2015) rapporteerden het risico op een cardiovasculair event. Het gebruik van statines verlaagde het risico op een cardiovasculair event met 10% (RR 0,90; 95%-BI 0,85 tot 0,96; (figuur 14)) en NNT van 133 over gemiddeld 3,5 jaar en specifiek op een hartinfarct (totaal) met 20% (RR 0,80; 95%-BI 0,70 tot 0,90; (figuur 15)) en NNT van 25 over gemiddeld 3,5 jaar. Er werd echter geen risicoreductie van statines op beroertes gevonden (drie onderzoeken; RR 0,94; 95%-BI 0,80 tot 1,10; (figuur 16)).
Kwaliteit van leven
Teng (2015) rapporteerde geen data over kwaliteit van leven.
Functioneren, waaronder cognitie
Teng (2015) rapporteerde geen data over functioneren.
Bijwerkingen, waaronder spierklachten
Teng (2015) rapporteerde het risico op myalgie (vier onderzoeken), ontstaan van diabetes (twee onderzoeken) en ernstige bijwerkingen (vijf onderzoeken). De auteurs beschrijven niet welke bijwerkingen onder ernstige bijwerkingen vallen. De gepoolde resultaten op de uitkomsten myalgie en ernstige bijwerkingen zijn weergegeven in (figuur 17 en 18). Het risico op myalgie en op ernstige bijwerkingen was niet significant verhoogd bij gebruik van statines (myalgie RR 0,91; 95%-BI 0,69 tot 1,19; ernstige bijwerkingen RR 1,01; 95%-BI 0,97 tot 1,05). In twee door Teng (2015) geïncludeerde onderzoeken was ook het risico op het ontstaan van diabetes onderzocht; beide onderzoeken vonden geen significant effect van statines (RR 0,9; 95%-BI 0,64 tot 1,26 en RR 1,25; 95%-BI 0,91 tot 1,73).
Bewijskracht van de literatuur
Hart- en vaatziekten: de bewijskracht voor de uitkomstmaat cardiovasculair event is, gezien de beperkingen in onderzoeksopzet (risk of bias; ontbreken van blindering in de grootste trial) en aanwezige imprecisie, met drie niveaus verlaagd.
De bewijskracht voor de uitkomstmaat hartinfarct is, gezien de beperkingen in onderzoeksopzet (risk of bias; ontbreken van blindering in de grootste trial), de inconsistentie en de imprecisie met drie niveaus verlaagd.
De bewijskracht voor de uitkomstmaat beroerte is, gezien de beperkingen in onderzoeksopzet (risk of bias; ontbreken van blindering in de grootste trial) en de imprecisie met drie niveaus verlaagd.
Kwaliteit van leven en (cognitief) functioneren: de bewijskracht voor de uitkomstmaten kwaliteit van leven en (cognitief) functioneren kan niet worden gegradeerd vanwege het ontbreken van data.
Bijwerkingen: de bewijskracht voor de uitkomstmaat myalgie is, gezien beperkingen in de onderzoeksopzet (risk of bias; subgroepanalyse) en de aanwezige imprecisie, met drie niveaus verlaagd.
De bewijskracht voor de uitkomstmaat ontstaan van diabetes is, gezien de beperkingen in de onderzoeksopzet (risk of bias; subgroepanalyse), de inconsistentie en de aanwezige imprecisie, met drie niveaus verlaagd.
De bewijskracht voor de uitkomstmaat ernstige bijwerkingen is, gezien de beperkingen in de onderzoeksopzet (risk of bias; subgroepanalyse) met één niveau verlaagd.
Mortaliteit: de bewijskracht voor de uitkomstmaat all-cause mortaliteit is, gezien beperkingen in de onderzoeksopzet (risk of bias; subgroepanalyse) met één niveau verlaagd.
Ten aanzien van de generaliseerbaarheid is alleen in het PROSPER-onderzoek bij aanvang bepaald welk niveau van algemeen en cognitief functioneren de deelnemers hadden. Zij bleken in overgrote meerderheid zeer hoog te scoren op de ADL, IADL en cognitieve tests die werden uitgevoerd. De overige onderzoeken gaven hierover geen gedetailleerde gegevens. Het is zeer aannemelijk dat een selectie van de vitaalste ouderen aan de geïncludeerde onderzoeken heeft deelgenomen; er is daarmee sprake van een lage externe validiteit.
Conclusie
| Hart- en vaatziekten | |
| Zeer laag GRADE | Het gebruik van statines verlaagt het risico op een cardiovasculair event bij ouderen zonder hart- en vaatziekten vergeleken met een placebo. |
| Bron: Teng 2015 | |
| Zeer laag GRADE | Vergeleken met een placebo zorgt het gebruik van statines voor een lager risico op een hartinfarct bij ouderen zonder hart- en vaatziekten. |
| Bron: Teng 2015 |
| Zeer laag GRADE | Het gebruik van statines heeft geen effect op het risico op een beroerte vergeleken met een placebo bij ouderen zonder hart- en vaatziekten. |
| Bron: Teng 2015 |
| Kwaliteit van leven en (cognitief) functioneren | |
| - GRADE | Vanwege het ontbreken van data is het niet mogelijk een conclusie te trekken over het effect van statine ten opzichte van een placebo op kwaliteit van leven en (cognitief) functioneren bij ouderen zonder hart- en vaatziekten. |
| Bron: Teng 2015 | |
| Bijwerkingen | |
| Zeer laag GRADE | Vergeleken met een placebo geeft het gebruik van statines geen hoger risico op myalgie bij ouderen zonder hart- en vaatziekten. |
| Bron: Teng 2015 | |
| Zeer laag GRADE | Vergeleken met een placebo geeft het gebruik van statines geen hoger risico op het ontstaan van diabetes bij ouderen zonder hart- en vaatziekten. |
| Bron: Teng 2015 |
| Matig GRADE | Vergeleken met een placebo geeft het gebruik van statines geen hoger risico op het ontstaan van ernstige bijwerkingen bij ouderen zonder hart- en vaatziekten. |
| Bron: Teng 2015 |
| Mortaliteit | |
| Matig GRADE | Vergeleken met een placebo heeft het gebruik van statines geen effect op all-cause mortaliteit bij ouderen zonder hart- en vaatziekten. |
| Bron: Teng 2015 | |
Ouderen met hart- en vaatziekten
Beschrijving van de onderzoeken
Shepherd (2002) en Trompet (2010) beschrijven hetzelfde gerandomiseerde gecontroleerde onderzoek. Van alle deelnemers (n = 5804) hadden 2565 ouderen (zeventig tot 82 jaar) een vasculaire aandoening in de anamnese. Deelnemers aan het onderzoek kregen of 40 mg pravastatine per dag of een placebo, en werden gemiddeld ongeveer 3,5 jaar gevolgd. Uitkomstmaten in dit onderzoek waren cognitief functioneren met behulp van de Mini Mental State Examination bepaald en de uitkomsten gedefinieerd als het totaal van het aantal overlijden door coronaire hartziekten, niet-fatale hartinfarcten, en fatale en niet-fatale beroerten.
Resultaten
II. Hart- en vaatziekten
Shepherd (2002) rapporteerde dat dagelijks 40 mg pravastatine het risico op overlijden als het gevolg van coronaire hartziekten, een niet-fataal myocardinfarct en fatale of niet-fatale beroerte met 22% verlaagd is (HR 0,78; 95%-BI 0,66 tot 0,93 en NNT van 24 over 3,2 jaar).
Kwaliteit van leven
Shepherd (2002) en Trompet (2010) rapporteerden geen data over kwaliteit van leven.
Functioneren, waaronder cognitie
Er werd in één onderzoek verslag gedaan van het effect van statinegebruik op het cognitieve functioneren. Trompet (2010) rapporteerde dat de dagelijkse 40 mg pravastatine geen significant effect had op het cognitieve functioneren (gemeten werd: attention, gemiddeld verschil = 0,36; 95%-BI -0,02 tot 0,74; processing speed, gemiddeld verschil = –0,02; 95%-BI -0,08 tot 0,09; immediate recall, gemiddeld verschil = 0,002; 95%-BI -0,03 tot 0,04; delayed recall, gemiddeld verschil = 0,04; 95%-BI -0,01 tot 0,09).
Bijwerkingen, waaronder spierklachten
Shepherd (2002) en Trompet (2010) maakten bij de rapportage van de bijwerkingen geen onderscheid tussen ouderen zonder of met hart- en vaatziekten. Als gevolg hiervan kan er geen conclusie worden getrokken over de bijwerkingen van dagelijks 40 mg pravastatine.
Totale mortaliteit
Shepherd (2002) en Trompet (2010) maakten bij de rapportage van mortaliteit geen onderscheid tussen ouderen zonder of met hart- en vaatziekten. Als gevolg hiervan kan er geen conclusie worden getrokken over het effect van dagelijks 40 mg pravastatine op totale mortaliteit.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaten kwaliteit van leven, bijwerkingen en all-cause mortaliteit kan niet worden gegradeerd vanwege het ontbreken van data.
Hart- en vaatziekten en (cognitief) functioneren: de bewijskracht voor de uitkomstmaten functioneren, vooral het cognitieve functioneren, en hart- en vaatziekten wordt niet verlaagd.
Voor de generaliseerbaarheid is in het PROSPER-onderzoek bij aanvang bepaald welk niveau van algemeen en cognitief functioneren de deelnemers hadden. Zij bleken in overgrote meerderheid zeer hoog te scoren op de ADL, IADL en cognitieve tests die werden uitgevoerd. Er werd hierbij geen onderscheid gemaakt tussen deelnemers met en deelnemers zonder cardiovasculaire ziekten in de voorgeschiedenis. De gemiddelde uitkomsten van de (I)ADL-tests lagen echter zo dicht bij het maximum dat aannemelijk is dat beide groepen vrijwel helemaal bestonden uit volledig zelfstandig functionerende ouderen. Er is daarmee sprake van een lage externe validiteit.
Conclusie
| Hart- en vaatziekten | |
| Hoog GRADE | Vergeleken met een placebo verlaagt dagelijks 40 mg pravastatine het risico op overlijden als gevolg van coronaire hartziekten, een niet-fataal myocardinfarct en fatale of niet-fatale beroerte bij ouderen met hart- en vaatziekten. |
| Bron: Shepherd 2002 | |
| Cognitief functioneren | |
| Hoog GRADE | Vergeleken met een placebo heeft dagelijks 40 mg pravastatine geen effect op het cognitieve functioneren bij ouderen met hart- en vaatziekten. |
| Bron: Trompet 2010 | |
| Kwaliteit van leven, bijwerkingen en totale mortaliteit | |
| - GRADE | Vanwege het ontbreken van data is het niet mogelijk een conclusie te trekken over het effect van dagelijks 40 mg pravastatine vergeleken met een placebo op kwaliteit van leven, bijwerkingen en totale mortaliteit bij ouderen met hart- en vaatziekten. |
| Bronnen: Shepherd 2002,Trompet 2010 | |
Beschrijving studies – PICO2
Amarenco (2020; TST-trial) onderzocht de waarde van een streefwaarde van LDL-C van <1,8 mmol/L om het risico op hart- en vaatziekten te verlagen bij patiënten met een herseninfarct. In totaal werden 2148 patiënten geïncludeerd met een gemiddelde leeftijd van 67 (SD 11, bereik: 45 tot 89) jaar. 1073 patiënten, van wie 259 ouder dan 75 jaar, werden aan een streefwaarde van <1,8 mmol/L toegewezen en 1075 patiënten, van wie 268 ouder dan 75 jaar, aan een streefwaarde van 2,3 – 2,8 mmol/L. Op baseline was het gemiddelde niveau van LDL-C 3,5 mmol/L in beide groepen. De keuze voor type statine en dosering was aan de onderzoekers. Drie weken en elke zes maanden na randomisatie werd het LDL-C gemeten en afhankelijk van de uitslag werd de dosering van de statine aangepast of ezetimib toegevoegd. De follow-upduur was 5,3 jaar (mediaan). Over deze periode bereikte de interventiegroep (streefwaarde < 1,8) gemiddeld een LDL-C van 1,7 mmol/L vergeleken met 2,5 mmol/L in de controlegroep (streefwaarde 2,3 – 2,8).
Resultaten
De resultaten uit de subgroepanalyse bij ouderen (> 75 jaar) werden alleen beschreven.
Majeure cardiovasculaire events
De uitkomstmaat ‘majeur cardiovasculair event’ was een samengesteld eindpunt, bestaande uit niet-fataal herseninfarct of beroerte van onbekende oorzaak, niet-fataal myocardinfarct, ziekenhuisopname voor onstabiele angina, gevolgd door urgente revascularisatie van de kransslagader, TIA die dringende revascularisatie van de halsslagader vereist, of cardiovasculaire dood inclusief onverklaarde plotselinge dood. 30 (12%) deelnemers kregen een majeur cardiovasculair event bij een streefwaarde van < 1,8 mmol/L vergeleken met 38 (14%) deelnemers bij een streefwaarde van 2,3 – 2,8 mmol/L. Het relatieve risico op een majeur cardiovasculair event was 22% verlaagd bij een streefwaarde van < 1,8 vergeleken met 2,3 – 2,8 mmol/L (HR 0,78 95%BI: 0,48 tot 1,26, geadjusteerd en geanalyseerd met competing risk). Het absolute risicoverschil is -3% (95%BI -8% tot 3%).
Myocardinfarct of urgente coronaire revascularisatie of mortaliteit
Er werden geen gegevens over myocardinfarct of urgente coronaire revascularisatie of mortaliteit bij een streefwaarde van < 1,8 mmol/L versus 2,3 – 2,8 mmol/L onder ouderen (> 75 jaar) gerapporteerd.
Bijwerkingen, kwaliteit van leven, functioneren
Er werden geen gegevens over mogelijke bijwerkingen bij een streefwaarde van < 1,8 mmol/L versus 2,3 – 2,8 mmol/L onder ouderen (> 75 jaar) gerapporteerd.
Bewijskracht van de literatuur
Onderstaande tabel combineert de uit de literatuursamenvatting gevonden relatieve risicoreductie op hart en vaatziekten met het basisrisico van de Scoretabellen, met daarbij de NNT’s over een tijdsperiode van 10 jaar.
| GRADE LAAG | ||||
|---|---|---|---|---|
| Patiëntencategorie | Patiënten > 70 jaar met eerder vastgestelde HVZ | |||
| Interventie | LDL streefwaarde < 1.8 mmol/L | |||
| Basisrisico* | ≥ 10% | 10-15% | 15-20% | ≥ 20% |
| Relatief risico | 0.78 | 0.78 | 0.78 | 0.78 |
| Relatieve risicoreductie, % | 22 | 22 | 22 | 22 |
| Absolute risicoreductie/ 10 jaar, % | ≥ 2.2 | 2.2-3.3 | 3.3-4.4 | ≥ 4.4 |
| NNT/ 10 jaar | ≤ 45 | 45-30 | 30-23 | ≤ 23 |
HVZ = hart- en vaatziekte; NNT = number needed to treat * Risico op hart- en vaatziekte, over een tijdsperiode van 10 jaar (Scoretabel) | ||||
De bewijskracht start op een hoog niveau vanwege het therapeutische domein van de zoekvraag.
Majeure cardiovasculaire events: De bewijskracht voor de uitkomstmaat is met twee niveaus verlaagd gezien imprecisie (één niveau) en risk of bias (één niveau want het betreft een subgroepanalyse).
Myocardinfarct of urgente coronaire revascularisatie: De bewijskracht voor de uitkomstmaat is niet beoordeeld vanwege het ontbreken van gegevens.
Bijwerkingen: de bewijskracht voor de uitkomstmaat is niet beoordeeld vanwege het ontbreken van gegevens.
Conclusies
Laag GRADE | Een LDL-C-streefwaarde van < 1,8 mmol/L bij ouderen (> 75 jaar) met een herseninfarct lijkt mogelijk het risico op majeure cardiovasculaire events te verminderen vergeleken met een streefwaarde van 2,3 – 2,8 mmol/L. Bronnen: Amarenco 2020a |
- GRADE | Vanwege het ontbreken van gegevens over myocardinfarct of urgente coronaire revascularisatie is niet mogelijk een conclusie te trekken over het risico op bijwerkingen bij verschillende streefwaarden van LDL-C bij patiënten met een herseninfarct ouder dan 75 jaar. Bronnen: - |
- GRADE | Vanwege het ontbreken van gegevens over mogelijke bijwerkingen is niet mogelijk een conclusie te trekken over het risico op bijwerkingen bij verschillende streefwaarden van LDL-C bij patiënten met een herseninfarct ouder dan 75 jaar. Bronnen: - |
Overwegingen
Voor patiënten onder de 70 jaar zijn de aanbevelingen omtrent lipidenverlagende medicatie beschreven in de module Streefwaarden van LDL-C bij behandeling met lipidenverlagende medicatie tot en met een leeftijd van 70 jaar.
Het gebruik van statines lijkt het risico op een cardiovasculair event te verlagen bij ouderen zonder hart- en vaatziekten vergeleken met een placebo, maar de bewijskracht is laag. (Inter)Nationaal is er discussie over de LDL-streefwaarden bij ouderen mét een doorgemaakte hart- en vaatziekte, waarbij sommige (inter)nationale richtlijnen adviseren om ook voor ouderen > 70 jaar met een hart- of vaatziekte een streefwaarde van < 1,8 aan te houden. Uit de literatuur die hierboven is beschreven, lijkt een LDL-streefwaarde <1,8 mmol/L bij ouderen (>75 jaar) mogelijk het risico op majeure cardiovasculaire events te verminderen, vergeleken met een streefwaarde van 2,3-2,8 mmol/L (Amarenco, 2020a). Het betreffen echter subgroepanalyses met te weinig statistische power om precieze schattingen van het effect te kunnen doen en de bewijskracht is dan ook laag. We beschrijven hier punten die de richtlijnwerkgroep mee heeft genomen om tot de aanbevelingen te komen.
NB. Voor de definitie van vitale ouderen, verwijzen we naar de richtlijnen van de NVKG.
Veiligheid
Bij het gebruik van een lipidenverlagend medicament door zowel ouderen met als zonder hart- en vaatziekten geldt dat de omvang van het risico op bijwerkingen in de dagelijkse klinisch praktijk niet is in te schatten. Het ontbreken van relevante myopathie in de hiervoor besproken en andere studies met statines is niet te extrapoleren naar de dagelijkse praktijk: in studies zijn veelal deelnemers opgenomen die vitaler zijn en minder comorbiditeit en comedicatie hebben dan de oudere patiënten die inmiddels in groten getale met statines behandeld worden. Post-marketing surveillance geeft evenmin een betrouwbare indicatie van de incidentie van myopathie omdat deze vaak mild is en deels oude patiënten treft die al mobiliteitsstoornissen ervaren. Milde myopathie kan daarentegen wel degelijk leiden tot een relevante reductie van mobiliteit die daarmee theoretisch zelfs het nagestreefde preventieve effect teniet kan doen. Lareb meldt dat er regelmatig meldingen van ernstige spierklachten bij zowel ouderen als jongeren worden gedaan. Over de uiterste consequenties van mogelijk mobiliteitsverlies door statinegebruik, vallen en functionele achteruitgang, is niets bekend.
Tenslotte geeft het voorschrijven van een lipidenverlagend medicament aan ouderen met polyfarmacie een verhoogd risico op het ontstaan van interacties. Met name simvastatine en atorvastatine zijn door hun afhankelijkheid van het cytochroom P450 3A4 (CYP3A4) metabolisme gevoelig voor interacties met CYP3A4-remmers zoals een aantal calciumantagonisten, “azolen” en macroliden. Op theoretische gronden lijken pravastatine en rosuvastatine een gunstiger interactieprofiel te hebben dan simvastatine en atorvastatine.
Patiëntenperspectief
In de media wordt al jaren aandacht besteed aan het belang van een laag cholesterol. Daarnaast worden cholesterolmetingen gevraagd door levensverzekeraars en ook gratis op (ouderen)beurzen als gezondheidsbevorderend middel aangeboden. Al deze aandacht leidt ertoe dat ook oudere patiënten hun artsen vragen om meting van hun cholesterol en belang hechten aan het bereiken van lage waarden. Media noch verzekeraars schenken aandacht aan de onzekerheden die verbonden zijn aan de behandeling van ouderen met lipidenverlagend medicatie.
Tenslotte blijkt bij gebruikers van lipidenverlagende medicatie van middelbare leeftijd dat de lange termijn therapietrouw zeer laag is. Het is onbekend of dit samenhangt met bijwerkingen of met andere factoren. Ook is onbekend of dit voor ouderen ook geldt; dit is echter wel waarschijnlijk.
Professioneel perspectief
In de huidige richtlijnen voor cardiovasculair risicomanagement vormt hoge leeftijd een van de belangrijke risicofactoren voor cardiovasculaire ziekten. Het hieruit voorkomend advies om laagdrempelig bij ouderen met en zonder hart- en vaatziekten met lipidenverlagend medicatie toe te passen komt met name voort uit geëxtrapoleerde onderzoeksresultaten. In deze onderzoeken waren ouderen slecht vertegenwoordigd, de geïncludeerde ouderen waren zeer vitaal en kwetsbare ouderen waren vrijwel volledig uitgesloten van deelname. Bovendien zijn de voor ouderen relevante uitkomstmaten (I)ADL-functioneren en kwaliteit van leven in geen van de beschreven onderzoeken meegenomen.
Hoewel het bewijs waarop de richtlijnaanbevelingen met betrekking tot het behandelen van kwetsbare ouderen met lipidenverlagende medicatie gebaseerd zijn beperkingen kent, hebben de zorgverzekeraars het voorschrijven van lipidenverlagende medicatie aan iedereen die aan de richtlijn-karakteristieken voldoet tot norm en kwaliteitsindicator verheven. Een klein deel van de eerstelijns praktijkfinanciering kan zelfs afhankelijk zijn van het percentage patiënten dat statines krijgt voorgeschreven. Deze vorm van financiering stimuleert vanwege de hoge prevalentie van cardiovasculaire risicofactoren bij kwetsbare ouderen het voorschrijven van lipidenverlagende medicatie in de doelgroep waar de onderbouwing van de meerwaarde bij kwetsbare ouderen zonder hart- en vaatziekten afwezig is en bij kwetsbare ouderen met hart- en vaatziekten zwak is.
Indien bij ouderen met hart- en vaatziekten de keuze wordt gemaakt om een lipidenverlagend medicament voor te schrijven, moet daarbij in overweging worden genomen of de zogenaamde time-to-benefit binnen de levensverwachting van de patiënt valt. In de PROSPER-studie werd gemiddeld na ruim drie jaar statine-gebruik een significant cardiovasculair morbiditeits- en mortaliteitsvoordeel gezien met een NNT van 25. In diverse andere studies met jongere deelnemers werd een kortere time-to-benefit gevonden. Een gemiddelde 85-jarige man had in 2012 volgens het CBS een resterende levensverwachting van 5,6 jaar. De 85-jarige met hart- en vaatziekten waarbij lipidenverlagende behandeling overwogen wordt, voldoet waarschijnlijk niet aan deze levensverwachting; deze zal vooral bepaald worden door de ernst van de comorbiditeit en het actuele niveau van functioneren. Derhalve is individuele inschatting van het absoluut risico op hart- en vaatziekte bij een (kwetsbare) oudere van groot belang, evenals een individuele inschatting van het te verwachten behandeleffect van lipiden-verlaging. Bij risicocommunicatie en shared decision making met de patiënt kan het gebruik van een algoritme waarmee het 5- of 10-jaarsrisico op hart- en vaatziekten bij ouderen kan worden geschat, toegevoegde waarde hebben. Binnen deze doelgroep is het NNH (number needed to harm) onbekend.
In geen van de genoemde studies werden verschillende streefwaarden voor LDL vergeleken bij kwetsbare ouderen. Dosiswijziging of toevoeging van een lipidenverlagend medicament bij kwetsbare ouderen zal vooral gedreven zijn door de aan- of afwezigheid van bijwerkingen.
Een buiten de zoekcriteria vallend onderzoek toonde dat bij personen >75 jaar het toevoegen van ezetimib aan simvastatine het risico op hart- en vaatziekten met 20% verlaagt (HR 0,80; 95%BI 0,70 tot 0,90). Bij personen <75 jaar was er geen effect (HR 0,97; 95%BI 0,92 tot 1,03).
De veiligheid van het stoppen van lipidenverlagende medicatie is in de hierboven beschreven doelgroepen nog niet goed onderzocht.
Kosten
De kosten van behandeling met statines zijn door het verlopen van de meeste patenten inmiddels zeer laag: de goedkoopste vorm van simvastatine kost €0,025 per dag, pravastatine kost €0,035 per dag. De kosten voor ezetimib (zonder statine) zijn €0,11 per dag en in combinatie met een statine tussen €0,30 en €1,56 per dag, afhankelijk van het type en dosering statine.
Kosteneffectiviteit
Er is geen kosten-effectiviteitsonderzoek met kwetsbare ouderen beschikbaar. Los van dit feit kan ook bij een lage medicijnprijs de kosteneffectiviteit van een behandeling niet aangetoond worden als de effectiviteit niet onomstotelijk is vastgesteld.
Rationale
Cruciaal is de betekenis die aan streefwaarden moet worden gehecht. Deze waarden geven richting aan het te kiezen beleid, maar dicteren deze niet. Indien intensivering van medicamenteuze therapie om welke reden dan ook ongewenst is, dan kan in overleg met de patiënt met een hogere waarde genoegen genomen worden.
De werkgroep is van mening dat de TST-trial een streefwaarde van LDL-C < 1,8 mmol/L bij vitale patiënten boven 70 jaar met hart- en vaatziekten in enige mate ondersteunt (ook al was de subgroepanalyse van die trial die werd gepubliceerd beperkt tot 75 plussers), aangezien er geen significante heterogeniteit van het effect van een lage streefwaarde was tussen de verschillende leeftijdsgroepen. Er zijn echter ook argumenten die tegen deze lage streefwaarde pleiten. In de eerste plaats is de totale hoeveelheid literatuurgegevens over LDLc en cardiovasculair risico grotendeels gebaseerd op personen onder de 70 jaar. In de tweede plaats toont de subgroep van personen ouder dan 75 jaar in de TST-trial , indien geheel geïsoleerd van de overige leeftijdsgroepen beschouwd, geen statistisch significant resultaat. De werkgroep is zich tenslotte bewust dat deze streefwaarde in de praktijk vaak moeilijk te behalen is. Alles overwegende beveelt de werkgroep daarom voor ouderen met hart- en vaatziekten sowieso een streefwaarde van 2,6 mmol/L aan. Een lagere streefwaarde kan overwogen worden, afhankelijk van hoe de medicatie verdragen wordt en of er extra risicoverhogende omstandigheden zijn, zoals het herhaald optreden van hart- en vaatziekten.
Bij kwetsbare ouderen blijft terughoudendheid ten aanzien van lage streefwaarden sowieso gerechtvaardigd.
De inhoudelijke basis, nodig voor het samen beslissen om al dan niet met een statine te starten, kan worden geleverd door een risicoscore tabel zoals die besproken wordt in module ‘Schatten van het risico op hart- en vaatziekten.
Aanbevelingen
Vitale ouderen
Starten van lipidenverlagende medicatie
- Overweeg het aanbieden van lipidenverlagende medicatie aan vitale ouderen zonder hart- en vaatziekten alleen met een voldoende hoog geschat resterende levensverwachting en een hoog geschat risico op een vasculair event*.
- Streef naar een LDL-C < 2,6 mmol/L.
*Bijvoorbeeld: geschat met SCORE2-OP óf door de aanwezigheid van ernstige risicofactoren (zoals diabetes, een zeer hoog cholesterol (TC > 8 mmol/L) of een zeer hoge bloeddruk (≥ 180/110 mmHg)).
Starten van lipidenverlagende medicatie
- Bied lipidenverlagende medicatie aan vitale ouderen met hart- en vaatziekten aan.
- Streef naar een LDL-C < 2,6 mmol/L. Overweeg een lagere streefwaarde als medicatie goed wordt verdragen en hart- en vaatziekte herhaald optreedt ondanks een LDL-C van <2,6 mmol/L.
- Evalueer de eventuele bijwerkingen nauwgezet. Switch naar een andere statine of verlaag de statinedosering en overweeg ezetimib toe te voegen bij het vermoeden van het ontstaan van bijwerkingen.
Stoppen van lipidenverlagende medicatie
- Stop alleen met lipidenverlagende medicatie bij onoverkomelijke bijwerkingen bij vitale ouderen met hart- en vaatziekten.
Kwetsbare ouderen
Starten van lipidenverlagende medicatie
- Start niet met lipidenverlagende medicatie bij kwetsbare ouderen zonder hart- en vaatziekten.
Starten van lipidenverlagende medicatie
- Overweeg het geven van lipidenverlagende medicatie aan kwetsbare ouderen na een (recent) vasculair event en met een voldoende hoog geschat resterende levensverwachting.
- Overweeg te starten met een standaarddosis statine.
- Evalueer het optreden van bijwerkingen nauwgezet en let op myopathie, behoud van functie en kwaliteit van leven.
Stoppen van lipidenverlagende medicatie
- Stop met lipidenverlagende medicatie bij kwetsbare ouderen zonder hart- en vaatziekten.
Stoppen van lipidenverlagende medicatie
- Overweeg te stoppen met lipidenverlagende medicatie bij kwetsbare ouderen met hart- en vaatziekten, met name bij het optreden van een mogelijke bijwerking of bij een geringe geschatte resterende levensverwachting.
2.3 Bloeddruk
Naar Samenvatting ›Iedere bloeddruk boven de streefwaarde die voor de specifieke patiëntencategorie geldt, kan worden beschouwd als verhoogde bloeddruk waarvoor het aanbieden van behandeling, al dan niet medicamenteus, overwogen moet worden. Een spreekkamerbloeddruk ≥ 180 mmHg systolisch geldt als sterk verhoogd en is in principe altijd een behandelindicatie ongeacht het risico op hart- en vaatziekten. Personen met een systolische bloeddruk van 160-180 mmHg hoeven niet standaard acuut met medicatie te starten. Indien leefstijlverandering als gevolg van leefstijladviezen bij deze personen de bloeddruk niet tot < 160 mmHg verlagen, kan medicamenteuze bloeddrukverlaging overwogen worden, ook bij personen met een relatief laag berekend tienjaarsrisico volgens de SCORE2(-OP)-tabel. Een belangrijke overweging hierbij is dat hoge bloeddruk, in tegenstelling tot dyslipidemie, ook gepaard gaat met een verhoogd risico op andere aandoeningen.
De SCORE2-risicotabel blijft overigens relevant voor personen met een bloeddruk van 160-180 mmHg, om de volgende redenen:
- het berekende tienjaarsrisico op hart- en vaatziekten kan, naast de overige risico’s van orgaanschade door hypertensie, worden betrokken in de overwegingen en risicocommunicatie met de patiënt
- het berekende risico op hart- en vaatziekten is relevant voor de indicatie voor cholesterolverlagende therapie.
Deze NHG-Standaard gebruikt systolische bloeddruk voor risicostratificatie en streefwaarden.
Uitgangsvraag
Wanneer moet een verhoogde bloeddruk behandeld worden?
Inleiding
Verhoogde bloeddruk is wereldwijd een belangrijke risicofactor voor hart- en vaatziekten. In 2010 was een verhoogde bloeddruk verantwoordelijk voor 9,4 miljoen sterfgevallen en 7,0% van de disability-adjusted life-years (DALY's) wereldwijd. Vergeleken met 1990 is de invloed van hoge bloeddruk op de ziektevrije overleving verder toegenomen met ∼2,1 miljoen sterfgevallen. In de Nederlandse bevolking van 30 tot 70 jaar heeft 37% van de mannen en 26% van de vrouwen een bloeddruk ≥140 mmHg systolisch en/of gebruikt bloeddrukverlagende middelen. In de leeftijdsklasse boven de 60 jaar heeft 60 tot 70% een verhoogde bloeddruk (volksgezondheidenzorg.info).
Definitie en classificatie van bloeddruk
Internationaal worden verschillende classificaties gebruikt, zoals onder andere ‘hoog-normaal (systolische bloeddruk 130-140 mmHg) en ‘hypertensie graad 1 tot 3’. De werkgroep prefereert alleen te spreken over ‘verhoogde bloeddruk’ omdat de waardes die hier bij horen verschillen per uitgangs-CV-risico.
Indien er als gevolg van een verhoogd risico op hart- en vaatziekten een mogelijke behandelindicatie is vastgesteld en bovendien de bloeddruk boven de streefwaarde (140 mmHg bij de meeste personen) is, dan wordt aanbevolen te overwegen deze (al dan niet medicamenteus) in overleg met de patiënt te verlagen.
De systolische bloeddruk voorspelt het risico op hart- en vaatziekten beter dan de diastolische , ook bij patiënten van middelbare leeftijd. Verhoogde diastolische bloeddruk gaat vrijwel altijd samen met een verhoogde systolische bloeddruk. Geïsoleerde verhoogde systolische bloeddruk (verhoogde systolische bloeddruk bij normale diastolische bloeddruk) komt regelmatig voor, vooral bij ouderen.
Bloeddruk kan op verschillende wijzen gemeten worden. Voor de genoemde streefwaarden in verschillende modules wordt een spreekkamermeting bedoeld. Mocht de bloeddruk op een andere wijze gemeten worden, dient gebruik gemaakt te worden van Tabel 6 Geschatte bloeddrukwaarden bij verschillende meetmethoden corresponderend met spreekkamermetingen van 140 en 180 mmHg om deze andere meting te relateren aan de spreekkamermeting.
Zoeken en selecteren
In de Europese richtlijn van 2021 wordt een sterk verhoogde bloeddruk gedefinieerd als ≥ 160 mmHg. Met de update van deze module wordt bekeken of het afkappunt van 180 mmHg voor sterk verhoogde bloeddruk zoals gebruikt bij de vorige versie van deze module aangepast moet worden naar 160 mmHg.
Bij deze update is gekozen voor een aanpak met twee deelvragen:
- Wat is de associatie tussen een bloeddruk > 160 mmHg of > 180 mmHg en het risico op hart- en vaatziekten, vergeleken met een bloeddruk < 140 mmHg?
- Wat zijn de gunstige en ongunstige effecten van bloeddrukverlagende medicatie bij personen zonder hart- en vaatziekten en een bloeddruk ≥ 160 mmHg)?
Om deelvraag 1 te kunnen beantwoorden, is er een systematische literatuuranalyse verricht
P1: personen zonder hart- en vaatziekten;
I1: verhoogde bloeddruk (>160 mmHg of >180 mmHg);
C1: normale bloeddruk (<140 mmHg);
O1: hart- en vaatziekten, mortaliteit (alle oorzaken en cardiovasculair).
Voor het beantwoorden van deelvraag 2 kon gebruik gemaakt worden van een meta-analyse met individuele patiëntendata van de Blood Pressure Lowering Treatment Trialists’ Collaboration.
P2: personen zonder hart- en vaatziekten met een baseline bloeddruk hoger dan 159 mmHg;
I2: (intensieve) behandeling;
C2: minder intensieve behandeling of placebo;
O2: hart- en vaatziekten, mortaliteit (alle oorzaken en cardiovasculair), (acute) nierziekten, bijwerkingen.
Onder intensieve behandeling wordt behandeling met een lagere streefwaarde vergeleken met normale streefwaarde verstaan. In deze meta-analyse werden ook patiënten met hart- en vaatziekten en een baseline bloeddruk lager dan 160 mmHg beschreven. Aangezien deze patiënten buiten de doelpopulatie vallen en subgroepanalyses onder de doelpopulatie zijn uitgevoerd, zijn de resultaten van deze groep met een lagere baseline bloeddruk niet beschreven. In deze meta-analyse zijn ook trials geïncludeerd die verschillende types/klassen van antihypertensiva met elkaar vergeleken. Ook deze studies zijn niet meegenomen in de literatuuranalyse.
Relevante uitkomstmaten
De werkgroep achtte het risico op hart- en vaatziekten en bijwerkingen voor de besluitvorming kritieke uitkomstmaten; en mortaliteit door hart- en vaatziekten en (acute) nierziekten voor de besluitvorming belangrijke uitkomstmaten.
Morbiditeit en mortaliteit van hart- en vaatziekten: De werkgroep definieerde niet a priori de genoemde uitkomstmaten, maar hanteerde de in de studies gebruikte definities. Deze definities komen overigens erg vaak overeen.
Klinische relevantie
De duiding van klinische relevantie wordt in Module Schatten van het risico op hart- en vaatziekten besproken (paragraaf van risico naar behandeladviezen).
Zoeken en selecteren (Methode) – deelvraag 1
In de database Embase (via Embase.com) is op 31 oktober 2022 met relevante zoektermen gezocht naar observationele studies bij personen zonder hart- en vaatziekten met een verhoogde bloeddruk. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 1729 treffers op. Studies werden geselecteerd op grond van de volgende selectiecriteria: observationele studies bij personen zonder hart- en vaatziekten naar de associatie tussen een verhoogde bloeddruk en het risico op hart- en vaatziekten.
Voor het selecteren van relevante studies is gebruik gemaakt van de Artificial Intelligence (AI) functie van Rayyan. Op basis van een 5-sterren-score wordt de waarschijnlijkheid van inclusie aangegeven. Na het beoordelen van 120 referenties en gebruikmakend van de AI-functie werden tot een totaal van 175 referenties geen relevante artikelen meer geïncludeerd. Daarna is gestopt met het selecteren met de aanname dat geen andere relevante studies gevonden zouden worden.
Op basis van titel en abstract werden in eerste instantie zeven studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens zeven studies geëxcludeerd (zie exclusietabel in de Totstandkoming), en geen studie definitief geselecteerd.
Zoeken en selecteren (Methode) – deelvraag 2
Voor het beantwoorden van deelvraag 2 kon gebruik gemaakt worden van een meta-analyse met individuele patiëntendata van de Blood Pressure Lowering Treatment Trialists’ Collaboration.
Resultaten – deelvraag 2
Een onderzoek is opgenomen in de literatuuranalyse. De belangrijkste studiekarakteristieken en resultaten zijn opgenomen in de evidence-tabel (zie Totstandkoming). De beoordeling van de individuele studieopzet (risk of bias) is opgenomen in de risk-of-biastabel.
Samenvatting literatuur
Deelvraag 1
Er zijn geen studies gevonden die voldeden aan de selectiecriteria.
Deelvraag 2
Beschrijving studies
Zoals beschreven onder ‘Zoeken en selecteren’ komen niet alle trials in aanmerking. De Blood Pressure Lowering Treatment Trialists’ Collaboration verzamelde individuele patiëntgegevens van 51 studies naar bloeddrukverlagende medicatie, gepubliceerd tussen 1972 en 2013. Een meta-analyse werd uitgevoerd om de effecten van bloeddrukverlagende medicatie op het risico op majeure hart- en vaatziekten te onderzoeken per niveau van systolische bloeddruk op baseline. Er werden 48 trials geïncludeerd met een minimale follow-up van 1000 persoonsjaren per arm. De geïncludeerde trials onderzochten bloeddrukverlagende medicatie versus placebo, intensievere behandeling versus minder intensieve behandeling of verschillende klassen van bloeddrukverlagende medicatie. Voor het beantwoorden van deze deelvraag zijn alleen trials die bloeddrukverlagende medicatie versus placebo of intensieve behandeling versus minder intensieve behandeling onderzochten meegenomen. In totaal betrof dit 26 trials. Tot slot was alleen het resultaat van een subgroepanalyse van patiënten zonder hart- en vaatziekten op baseline meegenomen. De primaire uitkomst van de meta-analyse was majeure cardiovasculaire events, gedefinieerd als een samengesteld eindpunt van fatale en niet-fatale beroerte, fataal of niet-fataal myocardinfarct of ischemische hartziekte, of fataal hartfalen of opname in het ziekenhuis wegens hartfalen. In deze publicatie werden geen resultaten over bijwerkingen in de subgroepanalyses of in de overkoepelende analyses gerapporteerd. Voor meer details wordt naar de publicatie verwezen. Aangezien voor deze deelvraag 26 trials in aanmerking kwamen, is het niet mogelijk om meer samenvattende gegevens van deze trials te geven. Gemiddelde genomen was de follow-up ongeveer 4 jaar.
Resultaten
Alleen de resultaten van 26 trials bij personen zonder hart- en vaatziekten op baseline worden beschreven. De resultaten zijn gestratificeerd per baselineniveau van systolische bloeddruk. Voor deze deelvraag zijn alleen de categorieën 160-169 mmHg en ≥170 mmHg weergegeven (voor meer uitleg, zie Zoeken en selecteren). Personen met een bloeddruk hoger dan 180 mmHg zijn niet afzonderlijk bekeken, maar vallen onder de categorie ≥170 mmHg. Bij de resultaten wordt ook het absolute-risicoverschil weergegeven. Dit verschil is niet door het artikel gerapporteerd, maar zijn berekend op basis van de absolute getallen. Het absolute-risicoverschil is nodig om te bepalen of het risicoverschil ‘klinisch relevant’ is.
- Majeure cardiovasculaire events
BPLTT (2021a) heeft het effect op majeure cardiovasculaire events gerapporteerd. In onderstaande tabel worden de resultaten weergegeven. Het absolute-risicoverschil bij personen met een bloeddruk op baseline ≥170 mmHg was -1,8% (95%BI -2,9 tot -0,7). (Intensievere) behandeling met bloeddrukverlagende medicatie resulteerde in een absolute additionele risicoverlaging van 1,8% vergeleken met minder intensieve behandeling of placebo over gemiddeld genomen 4 jaar. Het absolute-risicoverschil bij personen met een baseline systolische bloeddruk van 160 tot 169 mmHg was vergelijkbaar (Risicoverschil -1,7% 95%BI -2,7 tot -0,7).
| Baseline SBD | Interventie, n/N | Controle, n/N | Relatief risico (95% CI) | Absoluut risicoverschil (95%BI) |
|---|---|---|---|---|
| 160-169 mmHg | 476/6092 (7,8%) | 564/5955 (9,5%) | 0.83 (0,73 tot 0,93) | -1,7 (-2,7 tot -0,7) |
| ≥ 170 mmHg | 589/6282 (9,4%) | 669/5977 (11,2%) | 0.84 (0,75 tot 0,93) | -1,8 (-2,9 tot -0,7) |
2. Mortaliteit (alle oorzaken en hart- en vaatziekten gerelateerd)
De resultaten op algemene mortaliteit en mortaliteit ten gevolge van hart- en vaatziekten uit de meta-analyses van BPLTT (2021a) staan in de onderstaande tabel weergegeven. De resultaten waren voor beide uitkomsten vergelijkbaar. De absolute risicoreductie voor mortaliteit bij personen met een baseline bloeddruk tussen 160 en 169 mmHg was ~0,3% voor (intensieve) behandeling met bloeddrukverlagende medicatie vergeleken met minder intensieve behandeling of placebo (RR 0,95 [95% CI, 0,83-1.09). Voor personen met een baseline bloeddruk ≥ 170 mmHg was de daling in het absolute risicoverschil 1,0% in het voordeel voor (intensieve) behandeling (RR 0,80 [95% CI, 0,68-0,95).
| Baseline SBD | Interventie, n/N | Controle, n/N | Relatief risico (95%BI) | Absoluut risicoverschil (95%BI) |
|---|---|---|---|---|
| Mortaliteit | ||||
| 160-169 mmHg | 400/6102 (6,6%) | 415/5981 (6,9%) | 0,95 (0,83 tot 1,09) | -0,4 (-1,3 tot 0,5) |
| ≥ 170 mmHg | 572/6320 (9,1%) | 603/6021 (10,0%) | 0,90 (0,81 tot 1,01) | -1,0 (-2,0 tot 0,1) |
| Mortaliteit t.g.v. hart- en vaatziekten | ||||
| 160-169 mmHg | 163/5648 (2,9%) | 178/5666 (3,1%) | 0,92 (0,75 tot 1,13) | -0,3 (-0,9 tot 0,4) |
| ≥ 170 mmHg | 242/5988 (4,0%) | 291/5765 (5,0%) | 0,80 (0,68 tot 0,95) | -1,0 (-1,8 tot -0,3) |
3. (Acute) nierziekten en bijwerkingen
BPLTT (2021a) rapporteerde geen gegevens over (acute) nierziekten of bijwerkingen [BPLTT 2021a].
Bewijskracht van de literatuur
Onderstaande tabel combineert de uit de literatuursamenvatting gevonden relatieve risicoreductie op hart en vaatziekten met het basisrisico van de Scoretabellen, met daarbij de NNT’s over een tijdsperiode van 10 jaar
| GRADE REDELIJK | ||||
|---|---|---|---|---|
| Patiëntencategorie | Patiënten zonder HVZ met bloeddruk ≥ 160 mmHg | |||
| Interventie | Intensieve behandeling bloeddruk | |||
| Basisrisico* | ≥ 10% | 10-15% | 15-20% | ≥ 20% |
| Relatief risico† | 0.83 | 0.83 | 0.83 | 0.83 |
| Relatieve risicoreductie, % | 17 | 17 | 17 | 17 |
| Absolute risicoreductie/ 10 jaar, % | ≥ 1.7 | 1.7-2.6 | 2.6-3.4 | ≥ 3.4 |
| NNT/ 10 jaar | ≤ 38 | 38-26 | 26-19 | ≤ 19 |
HVZ = hart- en vaatziekte; NNT = number needed to treat * Risico op hart- en vaatziekte, over een tijdsperiode van 10 jaar (Scoretabel) † Relatief risico, uitkomst BPLTT (2021a): niet fataal HVZ | ||||
BLPTT (2021a) rapporteerde de risk of bias conform de geüpdatete Cochrane risk of bias tool (RoB 2). Van 48 beoordeelde trials hadden 4 trials een beoordeling some concerns gekregen. De overige 44 trials werden ‘low risk of bias’ bevonden. Naar verwachting zal ook voor de gegevens uit 26 trials de risk of bias beperkt zijn geweest. Ook hadden de auteurs publicatiebias voor de uitkomstmaat majeure cardiovasculaire events bekeken door middel van een funnelplot. Deze plot liet geen publicatiebias zien.
Majeure hart- en vaatziekten: De bewijskracht voor de uitkomstmaat is met een niveau verlaagd gezien de grotere imprecisie (een grens van ‘klinische relevantie’ is overschreden door het brede betrouwbaarheidsinterval).
Mortaliteit (alle oorzaken en hart- en vaatziekten gerelateerd): De bewijskracht voor de uitkomstmaat is met een niveau verlaagd gezien de imprecisie (een grens van ‘klinische relevantie’ is overschreden door het brede betrouwbaarheidsinterval).
(Acute) nierziekten en bijwerkingen: Vanwege het ontbreken van gegevens is de bewijskracht voor deze uitkomstmaten niet beoordeeld.
Conclusies – deelvraag 2
Majeure hart- en vaatziekten
Redelijk GRADE | (Intensieve) behandeling met bloeddrukverlagende medicatie vermindert waarschijnlijk het risico op majeure cardiovasculaire events vergeleken met minder intensieve behandeling of placebo bij personen zonder hart- en vaatziekten en een baseline bloeddruk ≥ 160 mmHg.
Bron: BLPTT 2021a |
Mortaliteit (alle oorzaken en hart- en vaatziekten gerelateerd)
Redelijk GRADE | (Intensieve) behandeling met bloeddrukverlagende medicatie resulteert waarschijnlijk niet of nauwelijks in een vermindering van mortaliteit (alle oorzaken en hart- en vaatziekten gerelateerd) vergeleken met minder intensieve behandeling of placebo bij personen zonder hart- en vaatziekten en een baseline bloeddruk tussen 160 en 169 mmHg. (Intensieve) behandeling met bloeddrukverlagende medicatie vermindert waarschijnlijk het risico op mortaliteit (alle oorzaken en hart- en vaatziekten gerelateerd) vergeleken met minder intensieve behandeling of placebo bij personen zonder hart- en vaatziekten en een baseline bloeddruk ≥ 170 mmHg. Bron: BPLTT 2021a |
(acute) nierziekten & bijwerkingen
- GRADE | Vanwege het ontbreken van gegevens over (acute) nierziekten of bijwerkingen was het niet mogelijk een conclusie te trekken over het effect van behandeling bij verhoogde bloeddruk zonder eerdere hart- en vaatziekten. Bron: - |
Overwegingen (herzien in 2023)
Voor- en nadelen van de interventie
Op basis van de meta-analyse van de Blood Pressure Lowering Treatment Trialists’ Collaboration kan worden geconcludeerd dat (intensieve) behandeling met bloeddrukverlagende medicatie het risico op majeure cardiovasculaire events waarschijnlijk vermindert bij personen zonder hart- en vaatziekten en een baseline bloeddruk ≥ 160 mmHg (GRADE redelijk, absoluut risicoverschil van 1,8%). Het effect op mortaliteit is minder eenduidig, met waarschijnlijk geen of nauwelijks risicoreductie bij een bloeddruk tussen de 160 en 169 mmHg (absoluut risicoverschil 0,3%), maar wel bij een bloeddruk ≥ 170 mmHg (GRADE redelijk, absoluut risicoverschil 1%).
In een tweede publicatie publiceerde de Blood Pressure Lowering Treatment Trialists’ Collaboration de resultaten per leeftijdsgroep (<55, 55-65, 65-75, 75-85 en >85 jaar). In deze analyses bleek het niet mogelijk ook nog een aparte analyse van mensen met en zonder hart- en vaatziekte op baseline te verrichten. In de leeftijd-gestratificeerde analyses was de relatieve risicoreductie van majeure cardiovasculaire events het grootst in de jongste leeftijdsgroep en het kleinst in de oudste leeftijdsgroep. De relatie met de absolute risicoreductie was andersom: het kleinst in de jongste groep en het grootst in de oudste groep. De relatieve risicoreductie van majeure cardiovasculaire events hing niet af van de hoogte van de baselinebloeddruk (in strata van 10 mmHg startend bij <120 mmHg). Vergelijkbare resultaten werden gezien voor mortaliteit. De bevindingen van BPLTT komen overeen met de resultaten uit een meta-analyse uit 2009.
Diverse observationele onderzoeken, zoals opgesomd in de recente Europese hypertensierichtlijn ondersteunen dat hoge bloeddruk een vrijwel continu positief verband heeft met ziekte en sterfte ten gevolge van hart- en vaatziekten, ook bij waardes boven de 160 mmHg. Belangrijk is ook te realiseren dat een sterk verhoogde bloeddruk neigt te clusteren met andere risicofactoren, zoals dyslipidemie.
Rationale
Veranderingen in leefstijl worden aanbevolen voor alle patiënten met een verhoogde bloeddruk. Het besluit om te beginnen met antihypertensiva bij mensen zonder hart- en vaatziekten hing altijd af van de hoogte van de bloeddruk en van het risico op hart- en vaatziekten. Snel beginnen met medicatie werd altijd al aanbevolen bij personen met een bloeddruk ≥ 180 mmHg (ongeacht het risico op hart- en vaatziekten). Deze aanbeveling blijft gehandhaafd. In de dagelijkse praktijk worden patiënten met een bij herhaling gemeten systolische bloeddruk >160 mmHg ook vaak medicamenteus behandeld.
Personen met een systolische bloeddruk tussen de 160 en 180 mmHg hoeven niet standaard acuut met medicatie te starten. Indien leefstijlverandering als gevolg van leefstijladviezen bij deze personen de bloeddruk niet tot < 160 mmHg verlagen, dan kan medicamenteuze bloeddrukverlaging overwogen te worden, ook bij personen met een relatief laag berekend 10-jaars SCORE2-risico. Een belangrijke overweging hierbij is dat hoge bloeddruk, in tegenstelling tot dyslipidemie, ook gepaard gaat met een verhoogd risico op andere aandoeningen. Zo verhoogt hypertensie het risico op chronische nierziekte (overall relatief risico 1,57) , met een toename van het risico naarmate de bloeddruk hoger is. Tevens verdubbelt hypertensie gemiddeld het risico op de ontwikkeling van hartfalen in mannen en verdrievoudigt het risico op hartfalen bij vrouwen. Het risico op atriumfibrilleren is eveneens afhankelijk van bloeddruk, met een overall relatief risico van 1,5. Tenslotte gaat hypertensie gepaard met een verhoogd risico op retinopathie en, vooral bij hypertensie op middelbare leeftijd, op cognitieve stoornissen en dementie. Deze risico’s worden niet meegenomen in de risicotabellen voor hart- en vaatziekten en worden verlaagd door medicamenteuze therapie. Er zijn helaas geen gevalideerde risicoscores die het cumulatieve risico op alle aan hypertensie gerelateerde ernstige aandoeningen berekenen.
Gezien bovenstaande acht de werkgroep het verstandig te overwegen antihypertensieve behandeling aan te bieden indien de systolische bloeddruk, ondanks leefstijlmaatregelen, bij herhaling 160-180 mmHg blijft. De SCORE2-risicotabel blijft overigens relevant voor personen met een bloeddruk van 160-180 mmHg, om de volgende redenen:
- Het berekende 10-jaars risico op hart- en vaatziekten kan, naast de overige risico’s van hypertensieve orgaanschade, worden betrokken in de overwegingen en risicocommunicatie met de patiënt
- Het berekende risico op hart- en vaatziekten is relevant voor de indicatie voor cholesterolverlagende therapie.
Het aanbieden van bloeddrukverlagende medicatie wordt, conform paragraaf 1.2 (Risicoschatting), verder aanbevolen bij alle personen met een systolische bloeddruk > 140 mmHg bij wie het totale risico op hart- en vaatziekten zeer hoog is en moet overwogen worden bij personen met een hoog risico.
Aanbevelingen
- Geef leefstijladviezen en bied bloeddrukverlagende medicatie aan bij personen met een systolische bloeddruk ≥ 180 mmHg.
- Geef leefstijladviezen aan personen met een systolische bloeddruk tussen 160 en 180 mmHg.
- Overweeg medicamenteuze behandeling aan te bieden indien de bloeddruk na leefstijlverandering niet tot <160mmHg daalt. Hierbij kan het risico uit de SCORE2-risicotabel in de overwegingen worden betrokken.
- Stel bij alle overige personen met een verhoogde bloeddruk een risicoprofiel op en schat het risico op hart- en vaatziekten (zie paragraaf 1.2):
- Bied behandeling met bloeddrukverlagende medicatie aan bij personen met een zeer hoog risico op hart- en vaatziekten en een bloeddruk boven de streefwaarde.
- Overweeg bloeddrukverlagende medicatie aan te bieden bij personen met een hoog risico op hart- en vaatziekten en een bloeddruk boven de streefwaarde.
Aanbevelingen
Naar Samenvatting ›- Geef leefstijladviezen en bied bloeddrukverlagende medicatie aan bij personen met een systolische bloeddruk ≥ 180 mmHg.
- Geef leefstijladviezen aan personen met een systolische bloeddruk tussen 160 en 180 mmHg.
- Overweeg medicamenteuze behandeling aan te bieden indien de bloeddruk na leefstijlverandering niet tot < 160mmHg daalt. Hierbij kan het risico uit de SCORE2-risicotabel in de overwegingen worden betrokken.
- Stel bij alle overige personen met een verhoogde bloeddruk een risicoprofiel op en schat het risico op hart- en vaatziekten (zie paragraaf 1.2):
- Bied behandeling met bloeddrukverlagende medicatie aan bij personen met een zeer hoog risico op hart- en vaatziekten en een bloeddruk boven de streefwaarde.
- Overweeg bloeddrukverlagende medicatie aan te bieden bij personen met een hoog risico op hart- en vaatziekten en een bloeddruk boven de streefwaarde.
Diagnostiek
Naar Samenvatting ›Bloeddrukmeting
Naast de routine-bloeddrukmeting in de spreekkamer zijn er diverse geautomatiseerde methoden beschikbaar, zoals de BP30-meting (gedurende 30 minuten enkele metingen in een aparte ruimte), geprotocolleerde thuismeting en 24 uursmeting. Geautomatiseerde metingen zijn geschikt om een wittejasseneffect aan te tonen, maar geen ervan is gevalideerd bij atriumfibrilleren. Controleer daarom altijd de polsregulariteit.
Houd bij de interpretatie van alternatieve meetmethoden van de bloeddruk rekening met structurele verschillen met de spreekkamerbloeddruk (zie Tabel 6). In de literatuur zijn de berekeningen van risico en streefwaarden gebaseerd op de spreekkamerbloeddruk.
| Spreekkamermetingen | 140 mmHg | 180 mmHg |
| 24 uursbloeddrukmeting | 130 mmHg | 165 mmHg |
| Geprotocolleerde thuismeting | 135 mmHg | 170 mmHg |
| BP30-meting | 135 mmHg* | 170 mmHg* |
| * Indicatieve schatting: de BP30-meting is minder goed onderzocht. | ||
De werkgroep adviseert laagdrempelig geautomatiseerde meetmethoden te gebruiken om onterechte behandelindicaties te voorkomen.
Aanbevelingen
Naar Samenvatting ›- Evalueer de bloeddruk door middel van meerdere spreekkamermetingen. Gebruik bij een behandelindicatie ook een ambulante meting (zie stroomschema).
- Doe een 24-uursmeting (voorkeur) of een geprotocolleerde thuismeting om een wittejashypertensie uit te sluiten. Indien die niet haalbaar zijn, kan een BP30-meting worden overwogen.
- Voel de pols bij het meten van de bloeddruk om personen met atriumfibrilleren op te sporen.
Deze aanbevelingen zijn in de modulaire richtlijntekst geoperationaliseerd in een stroomschema (zie Details).
Uitgangsvraag
Op welke manier kan de bloeddruk het beste gemeten worden?
Deze uitgangsvraag bevat de volgende deelvraag:
- Hoe verhouden gemeten bloeddrukken zich tot elkaar wanneer gemeten wordt met verschillende bloeddrukmeetmethoden (spreekkamermetingen, 24-uursbloeddrukmetingen, geprotocolleerde thuismetingen of 30-minutenbloeddrukmetingen)?
Zoeken en selecteren
Om de deelvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvraag: welke afkapwaarde van een BP30-meting komt overeen met de huidige afkapwaarde van 24 uurs-ABPM-meting en met de afkapwaarde 140/90 mmHg bij een spreekkamermeting?
P: algemene populatie
I: 30-minutenbloeddrukmeting (BP30)
C: 24-uursbloeddrukmeting (ABPM) of spreekkamermeting (OBPM)
O: bloeddruk
Inleiding
De belangrijkste indicaties voor het meten van de bloeddruk zijn het schatten van het risico op hart- en vaatziekten en het bepalen of streefwaarden al dan niet behaald zijn. De spreekkamerbloeddrukmeting is lange tijd de meeste gebruikte meetmethode geweest. In de praktijk wordt de bloeddruk in de spreekkamer echter vaak niet goed gemeten (onvoldoende rust, geen herhaalde metingen, enzovoort). Dit kan mede een oorzaak zijn van wittejashypertensie, met mogelijk overdiagnostiek en onnodige behandeling als gevolg.
In de praktijk kunnen verschillende soorten bloeddrukmeetmethoden toegepast worden. Zo zijn er onder andere de 24-uurs ambulante bloeddrukmeting (ABPM) en de geprotocolleerde thuismeting (HBPM) (tabel 30). Ook is er recentelijk veel aandacht voor de 30-minutenbloeddrukmeting in de huisartsenpraktijk of het ziekenhuis.
| Praktijkmetingen | |
|---|---|
| Ambulante metingen | |
| OBPM | Spreekkamerbloeddrukmeting |
| AOBP | Elektronische bloeddrukmeting (niet gesuperviseerd) |
| Non-AOBP | Handmatige bloeddrukmeting |
| BP30 | Automatische bloeddrukmeting gedurende 30 minuten |
| ABPM | 24-uursbloeddrukmeting |
| HBPM | Geprotocolleerde thuismeting |
Praktijkmetingen
Een spreekkamerbloeddrukmeting (OBPM) is een bloeddrukmeting door een gezondheidszorgmedewerker. Deze kan zowel handmatig of elektronisch worden gedaan. Een elektronische bloeddrukmeting (AOBP) is een bloeddrukmeting waarbij de eerste meting wordt gedaan door een gezondheidszorgmedewerker. Daarna wordt de patiënt alleen gelaten en volgen er meerdere metingen met een interval van 1 tot 2 minuten (ofwel unattended meting).
De automatische bloeddrukmeting gedurende 30 minuten is een specifiek soort AOBP, waarbij de patiënt in een rustige ruimte zit en er met een interval van 5 minuten 30 minuten lang de bloeddruk wordt gemeten (in totaal zes metingen).
Ambulante metingen
Bij de 24-uursbloeddrukmeting (ABPM) krijgt de patiënt een automatische bloeddrukmeter mee. Er wordt 24 uur gemeten, overdag met intervallen van 20 tot 30 minuten en ’s nachts met intervallen van 30 tot 60 minuten.
Bij de geprotocolleerde thuismeting (HBPM) meet de patiënt een week lang de bloeddruk met een automatische bloeddrukmeter (telkens tweemaal), meestal ’s morgens voor het ontbijt en ’s avonds 2 uur na het eten. Er bestaan ook andere meetprotocollen voor HBPM, maar bovengenoemde variant is het meest onderzocht.
Zoeken en selecteren (methode)
In de databases Medline (via OVID) en EMBASE (via Embase.com) is op 24 juli 2017 met relevante zoektermen gezocht naar systematische reviews en observationele onderzoeken. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 110 treffers op. Onderzoeken werden geselecteerd op grond van de volgende selectiecriteria:
- systematische reviews met een gedetailleerde zoekstrategie, evidence-tabellen en risk of bias-beoordeling;
- observationele onderzoeken met een vergelijking tussen een BP30-meting en een 24-uurs-ABPM-meting of spreekkamermeting.
Op basis van titel en abstract werden in eerste instantie 22 onderzoeken voorgeselecteerd. Na raadpleging van de volledige tekst werden vervolgens 21 onderzoeken geëxcludeerd (zie de exclusietabel onder het tabblad Verantwoording) en één onderzoek definitief geselecteerd. In referentielijsten werden nog drie relevante onderzoeken gevonden.
Vier onderzoeken zijn opgenomen in de literatuuranalyse. De belangrijkste onderzoekskarakteristieken en resultaten zijn opgenomen in de evidence-tabellen. De beoordeling van de individuele onderzoeksopzet (risk of bias) is opgenomen in de risk of bias-tabellen.
Samenvatting van de literatuur
Beschrijving van de onderzoeken
Bos (2017) vergeleek een BP30-meting met een spreekkamermeting onder patiënten uit een huisartsenpraktijk. Opeenvolgende patiënten die een BP30-meting kregen, werden gedurende een periode van zes maanden geïncludeerd. Het ging hierbij om patiënten die volgens de nationale richtlijnen in aanmerking kwamen voor een zorgvuldige bloeddrukbeoordeling. De BP30-meting is een meting van de bloeddruk om de 5 minuten, gedurende 30 minuten terwijl de patiënt zit en niet gestoord wordt. De uiteindelijk geregistreerde waarde is het gemiddelde van de laatste zes metingen. Als referentie werd de laatst gemeten spreekkamerbloeddruk genomen voordat een BP30-meting plaatsvond. In totaal werden 200 patiënten geïncludeerd.
Scherpbier (2011) onderzocht de overeenstemming tussen een BP30-meting en een gestandaardiseerde spreekkamermeting. In twee huisartsenpraktijken werden opeenvolgende patiënten, waarbij een bloeddrukmeting tijdens afspraak geagendeerd was, gevraagd om aan het onderzoek deel te nemen. Patiënten met boezemfibrilleren, een gedocumenteerde hartklepaandoening, volledige axillaire lymfeklieruitsnijding aan de rechterzijde of bovenarmomtrek groter dan 35 centimeter werden geëxcludeerd. De gestandaardiseerde bloeddrukmeting werd na een rustperiode van 5 minuten in afwezigheid van de observator gemeten. Er werden drie metingen genomen. Direct aansluitend werd een BP30-meting uitgevoerd. Deze bestond uit elf metingen, waarvan tien in afwezigheid van de onderzoeker. Zowel de eerste meting van de gestandaardiseerde spreekkamermeting als die van de BP30-meting werden buiten beschouwing gelaten. Aan dit onderzoek deden 105 patiënten mee. In totaal konden de gegevens van 83 patiënten voor de analyse worden gebruikt.
Van der Wel (2011) nodigde elke patiënt van achttien jaar of ouder uit die was doorverwezen voor een 24-uurs-ABPM-meting. Patiënten bekend met boezemfibrilleren, een onregelmatige pols, zwangerschap of nachtdienstwerk werden geëxcludeerd. De BP30-meting vond voorafgaand aan de 24-uurs-ABPM-meting plaats. Alle BP30-metingen vonden plaats tussen 11 uur en 15 uur in een rustige kamer in een diagnostisch centrum. De bloeddruk werd gemeten aan de niet-dominante arm met intervallen van 5 minuten. De gemiddelde bloeddruk werd door de laatste zes metingen bepaald. De gemiddelde dag-ABPM werd berekend uit de lezingen van 9 uur tot 21 uur. In totaal werden 96 patiënten geïncludeerd.
Culleton (2006) vergeleek de BP30-meting met het daggemiddelde van de 24-uurs-ABPM-meting. Volwassen patiënten met hypertensie bij wie een ABPM aangevraagd zou worden, kwamen in aanmerking voor het onderzoek. De BP30-meting vond om de 5 minuten plaats gedurende 25 minuten. Het gemiddelde van de bloeddruk werd gebaseerd op de laatste vijf metingen. Het is onbekend hoe de 24-uurs-ABPM-meting werd verkregen. De auteurs vermeldden wel dat het daggemiddelde werd gebaseerd op de uren dat de patiënt wakker was. In totaal werden 107 patiënten geïncludeerd.
Resultaten
Bloeddruk
De resultaten van de onderzoeken van Bos (2017) en Scherpbier (2011) zijn in tabel 31 weergegeven. In beide onderzoeken was de bloeddruk gemeten volgens de BP30-meting significant lager dan de bloeddruk gemeten in de spreekkamer. Aangezien de betrouwbaarheidsintervallen niet overlappen, zijn de resultaten te heterogeen om te poolen. De resultaten wijzen echter in dezelfde richting. De systolische bloeddruk gemeten met een BP30-meting is ten minste 6 mmHg lager dan een spreekkamermeting.
Ook de resultaten uit de onderzoeken van Van der Wel (2011) en Culleton (2006) zijn weergegeven in tabel 31. In het onderzoek van Van der Wel (2011) was de BP30-meting vergelijkbaar met de ABPM-meting gedurende de dag, terwijl in het onderzoek van Culleton (2006) de bloeddruk gemeten met een BP30-meting significant lager was dan het daggemiddelde van de ABPM-meting. Vanwege tegensprekende resultaten is er geen meta-analyse uitgevoerd.
| Auteur, jaar | Systolische bloeddruk, mmHg (95%-BI) |
|---|---|
| BP30 versus OBPM | |
| Bos 2017 | -22,8 (-26,1 tot -19,8) |
| Scherpbier 2011 | -7,6 (-9,1 tot -6,1) |
| BP30 versus ABPM overdag | |
| Van der Wel 2011 | 0 (-2 tot 2) |
| Culleton 2006 | -9,7 (-12,1 tot -7,2) |
Bewijskracht van de literatuur
Bloeddruk (BP30 versus OBPM): de bewijskracht voor de uitkomstmaat bloeddruk is met één niveau verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias; heeft geen informatie over OBPM verstrekt).
Bloeddruk (BP30 versus ABPM): vanwege tegensprekende resultaten is het niet mogelijk de bewijskracht te graderen.
Conclusie
| BP30 versus OBPM | ||
| Redelijk GRADE | De systolische bloeddruk gemeten met een BP30-meting is ten minste 6 mmHg lager dan die gemeten in de spreekkamer bij patiënten met een indicatie om de bloeddruk te meten. Bronnen: Bos 2017, Scherpbier 2011 | |
| BP30 versus ABPM | |
| - GRADE | Vanwege tegensprekende resultaten is het niet mogelijk een conclusie te trekken over de vergelijkbaarheid van een BP30-meting met een 24-uurs-ABPM (daggemiddelde). Bronnen: Van der Wel 2011,Culleton 2006 |
Overwegingen
Zorgvuldig bloeddruk meten is van groot belang voor een weloverwogen behandeladvies (zie ook het protocol Bloeddruk meten). Uit de zoekvraag blijkt dat er te weinig gegevens zijn om de 30-minutenbloeddrukmeting te vergelijken met de 24-uursbloeddrukmeting. Wel lijkt het aannemelijk dat de 30-minutenbloeddrukmeting significant lagere waarden geeft dan de spreekkamermeting.
Patiëntenperspectief
Het is van belang voor de patiënt om de bloeddruk zorgvuldig te evalueren voor het bepalen van een correcte behandelindicatie en voor het behalen van streefwaarden. Er zijn verschillende voor- en nadelen verbonden aan de verschillende bloeddrukmeetmethoden. Een spreekkamermeting is weinig belastend, maar valt vaak hoger uit en is minder consistent dan een ambulante of 30-minutenmeting. Een 24-uursbloeddrukmeting is betrouwbaar, maar wordt door sommigen als belastend ervaren. Een geprotocolleerde thuismeting is minder belastend, maar vraagt wel van de patiënt dat hij een week lang volgens protocol tweemaal per dag de bloeddruk meet en geeft geen informatie over de nachtelijke bloeddruk. De BP30-meting heeft als voordeel dat ze in 30 minuten klaar is, maar voor een patiënt zou het een nadeel kunnen zijn dat hij 30 minuten alleen in een kamer zit. Ook de 30-minutenmeting geeft geen informatie over de nachtelijke bloeddruk. De bloeddruk gemeten over de nacht blijkt een sterkere voorspeller te zijn dan bloeddruk overdag. Daarom heeft een 24-uursbloeddrukmeting de voorkeur.
Beschikbaarheid van zorg
Voor de praktijk zijn een 24-uursmeting en een geprotocolleerde thuismeting relatief makkelijk uitvoerbaar. Beide vergen wel een goede instructie aan de patiënt. Bij de BP30-meting hoeft de patiënt, buiten rustig blijven zitten, niets te doen. De meting neemt echter wel veel tijd en ruimte in beslag. Dit kan in de organisatie een probleem zijn. Voor zowel de 30-minutenmeting als de thuismeting is (in elk geval in de eerste lijn) nog geen tarief vastgesteld, terwijl er naast tijd en ruimte ook goede apparatuur moet worden aangeschaft.
Praktische aspecten van de verschillende bloeddrukmeetmethoden
Spreekkamermeting
Auscultatoire of oscillometrische semiautomatische sfygmomanometers moeten worden gevalideerd en periodiek worden gecontroleerd [O’Brien 2001].
Let op: geautomatiseerde apparaten zijn niet goedgekeurd voor bloeddrukmeting bij patiënten met boezemfibrilleren. Het advies is om ook altijd de pols te voelen bij het meten van de bloeddruk om personen met boezemfibrilleren op te sporen.
In de praktijk blijkt dat spreekkamermetingen niet altijd optimaal worden uitgevoerd. De patiënt dient namelijk eerst 5 minuten in een rustige omgeving te zitten. De juiste manchet moet worden gebruikt aan de arm waarvan bekend is dat die de hoogste waarde geeft en er dienen ten minste twee metingen gedaan te worden met een tussenpoos van 1 tot 2 minuten. Er zijn aanwijzingen dat de meting zo uitvoeren met een automatische bloeddrukmeter in afwezigheid van een zorgverlener betrouwbare resultaten geeft met minder wittejasseneffect.
Ambulante metingen
De onderstaande algemene principes en opmerkingen moeten worden opgevolgd:
- De procedure moet afdoende worden uitgelegd aan de patiënt, met mondelinge en schriftelijke instructies.
- De apparaten moeten goedgekeurd zijn en regelmatig gekalibreerd worden, ten minste elke twaalf maanden.
Bloeddrukwaarden bij verschillende bloeddrukmeetmethoden
Het is bekend welke waarden van de 24-uursbloeddrukmeting en de geprotocolleerde thuismeting overeenkomen met de 140 mmHg-spreekkamermeting. Voor de hogere bloeddrukken is daar minder onderbouwing voor en is geprobeerd een schatting te maken, mede aan de hand van de Amerikaanse bloeddrukrichtlijn
en op basis van consensus van experts. Deze schattingen van de corresponderende metingen zijn weergegeven in tabel 32, waarbij ervoor gekozen is om de spreekkamermeting van 140 (streefwaarde) met 180 (absolute behandelindicatie) te vergelijken. Ten aanzien van de BP30-meting is de inhoud van deze tabel niet significant strijdig met de resultaten van de zoekstrategie. Daarom neemt de werkgroep onderstaande tabel over.
| Spreekkamermeting | 140 mmHg | 180 mmHg |
|---|---|---|
| 24-uurs-bloeddrukmeting | 130 mmHg | 165 mmHg |
| Geprotocolleerde thuismeting | 135 mmHg | 170 mmHg |
| BP30-meting | 135 mmHg | 170 mmHg |
Gebruik van ambulante metingen en de 30-minutenmeting bij het opstellen van cardiovasculair risicoprofiel
Ambulante metingen worden aanbevolen ter evaluatie van de bloeddruk, maar kunnen echter niet direct gebruikt worden als waarde bij de risicoschatting met behulp van de risicotabel (zie details Jongere personen (tot veertig jaar): cardiovasculair risico en behandelimplicaties). Uitgangspunt voor de SCORE-tabel zijn namelijk (gestandaardiseerde) spreekkamerbloeddrukmetingen. Wel kan aan de hand van een ambulante meting een schatting van de spreekkamerbloeddrukmeting gemaakt worden (tabel 32) om te gebruiken in de SCORE-tabel. Bij het bepalen van het al dan niet behaald zijn van streefwaarden met een ambulante meting geldt hetzelfde. Indien ambulante bloeddrukmetingen niet haalbaar zijn, kan een BP30-meting worden overwogen. Ook daarvoor geldt dat de corresponderende spreekkamermeting geschat moet worden.
De werkgroep adviseert de bloeddruk te bepalen aan de hand van meerdere metingen volgens onderstaand stroomschema (figuur 19). Indien de bloeddruk slechts licht verhoogd is, kan deze rustig geëvalueerd worden over een periode van weken tot maanden. Indien de bloeddruk duidelijk verhoogd is of vergezeld gaat met orgaanschade, andere risicofactoren voor hart- en vaatziekten of vastgestelde hart- en vaatziekten of chronische nierschade, zijn herhaalde bloeddrukmetingen binnen een kortere periode vereist om beslissingen te nemen over behandeling.
In dit schema is als uitgangspunt de spreekkamermeting 140 mmHg als streefwaarde gekozen. Indien in verband met bijvoorbeeld een comorbiditeit een andere streefwaarde is vastgesteld, dan kunnen de corresponderende waarden in plaats van de 140 mmHg worden aangehouden.
Aanbevelingen
- Evalueer de bloeddruk door middel van meerdere spreekkamermetingen. Gebruik bij een behandelindicatie ook een ambulante meting (zie het stroomschema).
- Doe een 24-uursmeting (voorkeur) of een geprotocolleerde thuismeting om een wittejashypertensie uit te sluiten. Indien die niet haalbaar zijn, kan het gebruik van een BP30-meting worden overwogen.
- Voel de pols bij het meten van de bloeddruk om personen met atriumfibrilleren op te sporen.
Aanvullend onderzoek
Naar Samenvatting ›Alvorens besloten wordt of behandeling aangewezen is, moet men zich afvragen of er sprake is van een vorm van secundaire hypertensie. Aanwijzingen hiervoor omvatten onder andere een jonge beginleeftijd, gebruik van specifieke medicamenten of genotsmiddelen, tekenen van schildklierdisfunctie, (bij)nierziekte of cushingsyndroom, hypokaliëmie (≤ 3,5 mmol/L), aanwijzingen voor OSAS en therapieresistente hypertensie (zie richtlijn Hypertensie in de tweede en derde lijn, module Diagnostiek secundaire hypertensie).
Bij een zeer sterk verhoogde bloeddruk (systolisch > 200 mmHg of recente sterke stijging) met klachten van hoofdpijn, misselijkheid of braken, kortademigheid of visusstoornissen kan er sprake zijn van een hypertensieve crisis. Voor de diagnostische evaluatie en therapie van een hypertensieve crisis wordt verwezen naar de richtlijn Hypertensief spoedgeval.
Ten slotte is van belang dat vóór het starten met bloeddrukverlagende medicatie bloedonderzoek plaatsvindt, niet alleen ter beoordeling van aanwijzingen voor secundaire hypertensie, maar tevens om een uitgangswaarde te krijgen voor bloedwaarden die door het gebruik van medicatie kunnen worden beïnvloed.
Laboratoriumcontroles bij RAS-remmers en/of diuretica
Het gebruik van RAS-remmers of diuretica kan leiden tot (exacerbatie van) nierfunctiestoornissen en/of elektrolytstoornissen. Controleer daarom in principe bij iedereen, vóór het starten van een RAS-remmer of diureticum en daarna jaarlijks:
- nierfunctie (eGFR)
- natrium
- kalium
De controle bij aanvang van de medicatie kan vervallen als deze bepalingen recent gedaan zijn en niet afwijkend waren.
Herhaling van de bepalingen 2 weken na starten of een driemaandelijkse controle is alleen nodig op indicatie, zie aanbevelingen.
Aanbevelingen
Naar Samenvatting ›- Controleer bij elke patiënt met een verhoogde bloeddruk of er sprake is van klinische aanwijzingen voor secundaire hypertensie (zie Details).
- Onderzoek met spoed het bestaan van acute orgaanschade bij:
- een systolische en diastolische bloeddruk > 200/120 mmHg of een recent gedocumenteerde sterke bloeddrukstijging, in combinatie met klachten van hoofdpijn, visusstoornissen, misselijkheid en/of braken;
- hypertensie in combinatie met acute neurologische symptomen of cardiopulmonale klachten.
- Bepaal nierfunctie (eGFR), natrium en kalium voor aanvang van RAS-remmer en/of diuretica.
- Bepaal nierfunctie (eGFR), natrium en kalium (opnieuw) 2 weken na aanvang van de medicatie bij:
- een afwijkende laboratoriumuitslag (eGFR < 60 mL/min/1,73 m2, kalium < 3,8 mmol/l of kalium > 4,5 mmol/l);
- een combinatie van een RAS-remmer en een diureticum.
- Herhaal de controle elke drie maanden op indicatie, bijvoorbeeld bij een ernstige nierfunctiestoornis (<30 mL/min/1,73 m2), instabiel hartfalen, kwetsbare ouderen of in het verleden nierfunctie- of elektrolytenafwijkingen bij gebruik van deze medicatie. Overweeg ook controle van eGFR, natrium en kalium in geval van (dreigende) dehydratie bij intercurrente aandoeningen (hoge koorts, fors braken of forse diarree).
Zoeken en selecteren
Om deze uitgangsvraag te kunnen beantwoorden is gebruikgemaakt van de Europese richtlijn Cardiovascular disease prevention in clinical practice uit 2016 en de richtlijn Hypertensie in de tweede en derde lijn.
Overwegingen
Diagnostiek bij het starten van bloeddrukmedicatie
Antihypertensieve medicatie als diuretica en RAS-remmers hebben effect op de nierfunctie en elektrolyten. Om het effect van bloeddrukmedicatie te kunnen beoordelen, dienen de elektrolyten en nierfunctie voor aanvang met medicatie bekend te zijn.
Laboratoriumcontroles bij RAS-remmers en/of diuretica
Het gebruik van een RAS-remmer en/of diuretica kan leiden tot (sterke) afwijkingen in nierfunctiestoornissen en/of elektrolytstoornissen. Controleer in principe iedereen bij aanvang van een RAS-remmer of diuretica en daarna jaarlijks op nierfunctie (eGFR), natrium en kalium. De controle bij aanvang van de medicatie kan vervallen als de eGFR, het natriumgehalte en kaliumgehalte het afgelopen jaar bepaald zijn en niet afwijkend waren.
Diagnostiek bij een sterk verhoogde bloeddruk
Een zeer sterk verhoogde bloeddruk of symptomatologie kan wijzen op een hypertensief spoedgeval (hypertensie met acute (verergering van) schade aan hersenen, hart, nieren, grote bloedvaten of ogen) of secundaire hypertensie. Het al of niet aanwezig zijn van acute of progressieve tekenen van orgaanschade is bepalend voor de snelheid van handelen. Ernstige hypertensie zonder symptomen of acute eindorgaanschade wordt niet beschouwd als een hypertensief spoedgeval, maar als een risicofactor voor hart- en vaatziekten.
Spoedonderzoek naar het bestaan van orgaanschade is geïndiceerd bij:
- een systolische en diastolische bloeddruk > 200/120 mmHg of een recent gedocumenteerde sterke bloeddrukstijging in combinatie met klachten van hoofdpijn, visusstoornissen, misselijkheid en/of braken;
- hypertensie in combinatie met acute neurologische symptomen of cardiopulmonale klachten.
Voor de diagnostische evaluatie en therapie van een hypertensief spoedgeval wordt naar de richtlijn Hypertensief spoedgeval verwezen.
Diagnostiek ten aanzien van secundaire hypertensie
Circa 5 tot 15% van alle patiënten heeft naar schatting een secundaire hypertensie. Vaak is hypertensie echter multifactorieel, waarbij er sprake kan zijn van zowel essentiële hypertensie als secundaire factoren. De kans neemt onder ander toe bij jongere personen en is afhankelijk van de populatie (eerste-/tweede-/derdelijns). Belangrijk is om na te gaan of er klinische aanwijzingen zijn (tabel 33). (Voor meer informatie zie de module Diagnostiek secundaire hypertensie uit de richtlijn Hypertensie in de tweede en derde lijn.)
| Anamnese |
|---|
|
| Lichamelijk onderzoek |
|
| Aanvullend onderzoek |
|
Aanbevelingen
- Controleer bij elke patiënt met een verhoogde bloeddruk of er sprake is van klinische aanwijzingen voor secundaire hypertensie (tabel 33).
- Onderzoek met spoed het bestaan van orgaanschade bij:
- een systolische en diastolische bloeddruk > 200/120 mmHg of een recent gedocumenteerde sterke bloeddrukstijging in combinatie met klachten van hoofdpijn, visusstoornissen, misselijkheid en/of braken;
- hypertensie in combinatie met acute neurologische symptomen of cardiopulmonale klachten.
- Bepaal nierfunctie (eGFR), natrium en kalium voor aanvang van RAS-remmer en/of diuretica.
- Bepaal nierfunctie (eGFR), natrium en kalium (opnieuw) twee weken na aanvang van de medicatie bij:
- een afwijkende laboratoriumuitslag (eGFR < 60 ml/min/1,73 m2, kalium < 3,8 mmol/l of kalium > 4,5 mmol/l);
- een combinatie van een RAS-remmer en een diureticum.
- Herhaal de controle elke drie maanden op indicatie, bijvoorbeeld bij ernstige nierschade (< 30 milliliter/minuten/1,73 m2), instabiel hartfalen, kwetsbare ouderen of in het verleden nierfunctie- of elektrolytenafwijkingen bij gebruik van deze medicatie. Overweeg ook controle van eGFR, natrium en kalium in geval van (dreigende) dehydratie bij intercurrente aandoeningen (bij hoge koorts, fors braken of forse diarree).
Streefwaarden bloeddruk
Naar Samenvatting ›In de discussie over streefwaarden speelt de systolische bloeddrukwaarde van 140 mmHg een centrale rol. Er is veel bewijs dat het streven naar een waarde < 140 mmHg bij de meeste patiënten veilig en effectief is. De werkgroep beveelt 140 mmHg dan ook aan als uitgangspunt voor de streefwaarde. Vervolgens kunnen er argumenten zijn om de streefwaarde verder te verlagen naar < 130 mmHg dan wel te verhogen naar < 150 mmHg.
- Verlaging van de streefwaarde naar < 130 mmHg kan worden overwogen indien de behandeling tot < 140 mmHg goed wordt verdragen, met name in aanwezigheid van extra risicoverhogende factoren zoals diabetes mellitus en chronische nierschade.
- Verhoging van de streefwaarde naar < 150 mmHg kan worden overwogen bij vergevorderde ouderdom of kwetsbaarheid bij minder vergevorderde ouderdom.
In de klinische praktijk moeten de argumenten voor en tegen aanpassing van de streefwaarde worden afgewogen. Als er zowel argumenten zijn voor verlaging als voor verhoging van de streefwaarde kan men besluiten de streefwaarde niet aan te passen. Hoe goed de actuele behandeling verdragen wordt, hoe intensief de behandeling is, de aanwezigheid van polyfarmacie en de wens van de patiënt spelen bij deze keuze een belangrijke rol.
Uitgangsvraag
Welke streefwaarden dienen te worden gehanteerd bij behandeling van verhoogde bloeddruk bij volwassenen (< 70 jaar)?
Inleiding
Sinds de publicatie van de SPRINT-trial in 2015 is er veel te doen geweest over de streefwaarden van de bloeddruk. Internationale richtlijnen hebben inmiddels de streefwaarden aangepast. De SPRINT-trial betrof patiënten > 50 jaar met een verhoogd cardiovasculair risico die geen diabetes mellitus of beroerte in de voorgeschiedenis hadden. Een eerdere trial over intensieve behandeling in patiënten met diabetes mellitus (ACCORD-trial) liet geen voordeel zien van intensieve behandeling. De uitgangsvraag van deze module is dan ook ingegeven door de discussies die zijn ontstaan over deze intensieve behandeling, waarbij intensieve behandeling wordt gedefinieerd als een behandeling met een streefwaarde van < 120 mmHg. Er wordt vanuit gegaan dat de controlestreefwaarde < 140 mmHg is.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvraag:
Wat zijn de (on)gunstige effecten van bloeddrukstreefwaarde van 120 mmHg versus 140 mmHg bij personen met een verhoogd risico op hart- en vaatziekten?
P: Personen (< 70 jaar) met een verhoogd risico op hart- en vaatziekten;
I: Behandeling onder streefwaarde van 120 mmHg systolische bloeddruk;
C: Behandeling onder streefwaarde van 140 mmHg systolische bloeddruk;
O: Morbiditeit en mortaliteit van hart- en vaatziekten, bijwerkingen.
Relevante uitkomstmaten
De werkgroep achtte het risico op hart- en vaatziekten en bijwerkingen voor de besluitvorming kritieke uitkomstmaten; en mortaliteit voor de besluitvorming belangrijke uitkomstmaten.
Morbiditeit en mortaliteit van hart- en vaatziekten: De werkgroep definieerde niet a priori de genoemde uitkomstmaten, maar hanteerde de in de studies gebruikte definities. Deze definities komen overigens erg vaak overeen.
Klinische relevantie
De duiding van klinische relevantie wordt in Module Schatten van het risico op hart- en vaatziekten besproken (paragraaf van risico naar behandeladviezen).
Zoeken en selecteren (Methode)
Voor het beantwoorden van de zoekvraag is gebruik gemaakt van een Cochrane review naar het effect van bloeddrukstreefwaarde op morbiditeit en mortaliteit bij patiënten met chronische arteriële hypertensie. De door de auteurs gebruikte zoekstrategie is op 29 maart 2022 herhaald. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 223 treffers op. Op basis van titel en abstract werden 200 artikelen geëxcludeerd. Na raadpleging van de volledige tekst werden vervolgens 21 studies geëxcludeerd (zie exclusietabel in de Totstandkoming) en twee studies definitief geselecteerd.
Arguedas (2020) ondernam een systematische review naar het effect van een lage systolische bloeddrukstreefwaarde (≤ 135 mmHg) vergeleken met een standaard of reguliere streefwaarde (≤ 140 mmHg) op mortaliteit en morbiditeit bij patiënten met chronische arteriële hypertensie. Van de 11 geïncludeerde trials kwamen drie in aanmerking voor deze uitgangsvraag. De voornaamste reden voor exclusie was onderzoek naar een streefwaarde van diastolische bloeddruk. Aangezien het resultaat van drie trials zijn meegenomen, zijn deze trials afzonderlijk beschreven in plaats van de Cochrane review. De update van de zoekstrategie leverde een additionele trial op en een update van de SPRINT-trial.
Resultaten
Vier onderzoeken zijn opgenomen in de literatuuranalyse. De belangrijkste studiekarakteristieken en resultaten zijn opgenomen in de evidence-tabellen (zie Totstandkoming). De beoordeling van de individuele studieopzet (risk of bias) is opgenomen in de risk-of-biastabellen.
Samenvatting literatuur
Beschrijving studies
Zhang (2021) onderzocht de bloeddrukstreefwaarde ter verlaging van het risico op hart- en vaatziekten bij patiënten met hypertensie. Patiënten in de leeftijd van 60 tot 80 jaar met een bloeddruk boven 140 mmHg kwamen in aanmerking. In totaal werden 4243 toegewezen naar een target tussen 110 en 130 mmHg en 4268 naar een target van 130 tot 150 mmHg. De primaire uitkomstmaat was een samenstelling van beroerte, acuut coronair syndroom (acuut myocardinfarct en ziekenhuisopname wegens onstabiele angina pectoris), acuut gedecompenseerd hartfalen, coronaire revascularisatie, atriumfibrilleren, of overlijden door cardiovasculaire oorzaken. De gemiddelde leeftijd was 66 jaar (bereik 60 tot 80 jaar) en 47% was man. De mediane follow-uptijd was 3,34 jaar. Gedurende deze periode werd in de target van 110-130 een gemiddelde bloeddruk van 126,7 mmHg en bij een target van 130-150 een gemiddelde bloeddruk van 135,9 mmHg. Deze bloeddrukken waren in de spreekkamer verkregen in aanwezigheid van een zorgverlener na 5 minuten zittende rust volgens een gedefinieerd protocol waarin gebruik werd gemaakt van oscillometrische bloeddrukmeters.
SPRINT (2021) onderzocht de hypothese dat een lagere systolische bloeddrukstreefwaarde van < 120 mmHg het risico op klinisch events verlaagt vergeleken met een streefwaarde van < 140 mmHg. Patiënten van ten minste 50 jaar met een systolische bloeddruk tussen 130 en 180 mmHg en een verhoogd risico op hart- en vaatziekten werden geïncludeerd. In totaal kregen 4678 deelnemers een intensieve behandeling met een streefwaarde van lager dan 120 mmHg en 4683 deelnemers een standaardbehandeling met een streefwaarde van 140 mmHg. De gemiddelde leeftijd was ruim 67 jaar (bereik 50 tot 84 jaar) en 36% was vrouw. Alle deelnemers werden maandelijks gezien gedurende de eerste drie maanden en daarna elke drie maanden. De medicatie van patiënten onder intensieve behandeling werd maandelijks bijgesteld om een streefwaarde van 120 mmHg te halen. Bij deelnemers onder een standaardbehandeling werd de medicatie bijgesteld om een streefwaarde van 135 tot 139 mmHg te halen. Bij een bloeddruk onder 130 mmHg tijdens een follow-up moment of onder 135 mmHg tijdens twee momenten werd de dosering verlaagd. Bloeddruk werd bepaald op basis van drie metingen na vijf minuten zittende rust zonder aanwezigheid van de arts. De mediaan follow-up was 3,33 jaar. De trial was vroegtijdig gestopt nadat de resultaten voor de primaire uitkomst op twee tijdpunten de monitoringgrens overschreden.
SPS3 (2013) ondernam een gerandomiseerd, open label trial naar het effect van bloeddrukstreefwaarde bij patiënten met een beroerte. 3020 patiënten met een beroerte werden geïncludeerd. Patiënten waren gemiddeld 63 jaar oud (bereik 41 tot 84 jaar) en ~63% was man. Bij 1501 patiënten werd gestreefd naar een bloeddruk lager dan 130 mmHg en 1519 patiënten naar een bloeddruk tussen 130 en 149 mmHg. De keuze van medicatie werd aan de betrokken arts overgelaten. Bij elk bezoek werd de bloeddruk gemeten uit een gemiddelde van drie metingen. Follow-up was gemiddeld 3,7 jaar. Aan het eind van de studie was de gemiddelde bloeddruk bij een streefwaarde van < 130 mmHg 127,0 mmHg en bij een streefwaarde tussen 130 en 149 mmHg 137,0 mmHg.
Cardio-Sis (2009) onderzocht een strenge versus een reguliere bloeddrukstreefwaarde bij patiënten met hypertensie zonder diabetes mellitus. In totaal werden 1111 patiënten geïncludeerd. 558 patiënten kregen behandeling met een streefwaarde < 130 mmHg en 553 patiënten met een streefwaarde van < 140 mmHg. De gemiddelde leeftijd was 59 jaar (bereik 55 tot 80 jaar) en 59% was vrouw. De keuze van medicatie was aan de onderzoeker. Patiënten werden elke vier maanden gevolgd voor een periode van 2 jaar, waar ook de bloeddruk werd gemeten. De bloeddruk was het gemiddelde van drie metingen bij elk bezoek. De bloeddruk werd gemeten nadat de patiënt eerst 10 minuten had gezeten. De mediane follow-up was 2,0 jaar. Aan het eind van de studie had de groep met een strenge streefwaarde een systolische bloedruk van 131,9 mmHg bereikt vergeleken met een SBP van 135,6 mmHg in de reguliere groep.
| Trial | Streefwaarde | Gebruikte bloeddrukmeter | Wijze |
|---|---|---|---|
| Zhang 2021 | I: 110 – 130 mmHg C:130 – 150 mmHg | Gevalideerde bloeddrukmonitor voor de spreekkamer. |
|
| SPRINT 2021 | I: < 120 mmHg C: < 140 mmHg | Geautomatiseerd bloeddrukmetingsysteem. |
|
| SPS3 2013 | I: < 130 mmHg C: 130 – 149 mmHg | Geautomatiseerd bloeddrukmetingsysteem. |
|
| Cardio-Sis 2009 | I: < 130 mmHg C: < 140 mmHg | Sfygmomanometers. |
|
Samenvattend hebben de trials een streefwaarde lager dan 130 mmHg vergeleken met een streefwaarde van 130 of hoger.
Resultaten
- Majeure cardiovasculair events
De vier geïncludeerde trials hebben alle naar de uitkomst majeure cardiovasculaire events gekeken. In het figuur is de meta-analyse van het risicoverschil weergegeven. Het effect is klinisch relevant, gezien de grens van 0,8% na 4 jaar follow-up. De geïncludeerde trials hadden een follow-up van ongeveer 3 jaar.
2. Mortaliteit
Alle vier geïncludeerde trials rapporteerden mortaliteit en drie rapporteerden ook mortaliteit ten gevolge van hart- en vaatziekten.
Alle oorzaken
Figuur F laat de resultaten zien van mortaliteit. Er is geen verschil in het absolute risico op mortaliteit tussen verschillende streefwaarde van bloeddruk.
Cardiovasculaire oorzaken
Figuur G laat de resultaten zien van mortaliteit ten gevolge van hart- en vaatziekten. Er is geen verschil in het absolute risico op mortaliteit tussen verschillende streefwaarden van bloeddruk.
3. Bijwerkingen
Bijwerkingen worden door alle trials gerapporteerd. Voor de uitgangsvraag zijn de gegevens over hypotensie, misselijkheid en syncope in de onderstaande tabel weergegeven. Er is geen meta-analyse uitgevoerd. Vanwege de lage aantallen bijwerkingen in een aantal trials en ook het verschil in resultaat kunnen geen conclusies getrokken worden.
| Trial | Cardio-sis | SPRINT | SPS3 | Zhang (2021) |
|---|---|---|---|---|
| Hypotensie | ||||
| Strikte target | 5 (0,9%) | 99 (2,1%) | - | 146 (3,4%) |
| Reguliere target | 2 (0,4%) | 58 (1,2%) | - | 113 (2,6%) |
| Misselijkheid | ||||
| Strikte target | 2 (0,4%) | - | 324 (22%) | 45 (1,1%) |
| Reguliere target | 4 (0,7%) | - | 304 (21%) | 49 (1,1%) |
| Syncope | ||||
| Strikte target | - | 97 (2,1%) | 11 (0,2%) | 6 (0,1%) |
| Reguliere target | - | 73 (1,6%) | 5 (0,1%) | 2 (<0,1%) |
Bewijskracht van de literatuur
Onderstaande tabel combineert de uit de literatuursamenvatting gevonden relatieve risicoreductie op hart en vaatziekten met het basisrisico van de Scoretabellen, met daarbij de NNT’s over een tijdsperiode van 10 jaar.
| GRADE HOOG | ||||
|---|---|---|---|---|
| Patiëntencategorie | Personen (< 70 jaar) met een verhoogd risico op HVZ | |||
| Interventie | Behandeling < 120 mmHg systolische bloeddruk | |||
| Basisrisico* | ≥ 10% | 10-15% | 15-20% | ≥ 20% |
| Relatief risico | 0.74 | 0.74 | 0.74 | 0.74 |
| Relatieve risicoreductie, % | 26 | 26 | 26 | 26 |
| Absolute risicoreductie/ 10 jaar, % | ≥ 2.6 | 2.6-3.9 | 3.9-5.2 | ≥ 5.2 |
| NNT/ 10 jaar | ≤ 38 | 38-26 | 26-19 | ≤ 19 |
HVZ = hart- en vaatziekte; NNT = number needed to treat * Risico op hart- en vaatziekte, over een tijdsperiode van 10 jaar (Scoretabel) | ||||
Majeure cardiovasculaire events: De bewijskracht voor de uitkomstmaat is niet verlaagd. Er is niet afgewaardeerd voor risk of bias, aangezien Cardio-Sis een laag gewicht had in het gepoolde effect en het resultaat van SPRINT overeenkomt met de rest.
Mortaliteit (alle oorzaken & hart- en vaatziekten): De bewijskracht voor de uitkomstmaat is niet verlaagd. Er is niet afgewaardeerd voor risk of bias, aangezien Cardio-Sis een laag gewicht had in het gepoolde effect en het resultaat van SPRINT overeenkomt met de rest.
Bijwerkingen: De bewijskracht voor de uitkomstmaat is niet beoordeeld.
Conclusies
Majeure cardiovasculaire events
Hoog GRADE | Een bloeddrukstreefwaarde lager dan 130 mmHg vermindert het absolute risico op majeure cardiovasculaire events vergeleken met een bloeddrukstreefwaarde van 130 mmHg of hoger bij personen met een verhoogde risico op hart- en vaatziekten. Bronnen: Zhang 2021, SPRINT 2021, SPS3 2013, Cardio-Sis 2009 |
Mortaliteit
Hoog GRADE | Een bloeddrukstreefwaarde lager dan 130 mmHg resulteert niet of nauwelijks in een vermindering van mortaliteit (alle oorzaken en hart- en vaatziekten gerelateerd) vergeleken met een bloeddrukstreefwaarde van 130 mmHg of hoger bij personen met een verhoogde risico op hart- en vaatziekten. Bronnen: Zhang 2021, SPRINT 2021, SPS3 2013, Cardio-Sis 2009 |
Bijwerkingen
- GRADE | Vanwege de lage aantallen bijwerkingen in een aantal trials en ook het verschil in resultaat kunnen geen conclusies getrokken worden over het risico op bijwerkingen bij een bloeddrukstreefwaarde lager dan 130 mmHg vergeleken met een bloeddrukstreefwaarde van 130 mmHg of hoger bij personen met een verhoogd risico op hart- en vaatziekten. Bronnen: Zhang 2021, SPRINT 2021, SPS3 2013, Cardio-Sis 2009 |
Overwegingen – van bewijs naar aanbeveling
Er zijn gerandomiseerde klinische onderzoeken die verschillende behandeldoelen hebben vergeleken. Er zijn voldoende aanwijzingen om aan te bevelen dat de systolische bloeddruk dient te worden verlaagd tot < 140 mmHg in alle niet-oudere hypertensieve patiënten.
De publicatie van de primaire resultaten van het Systolic Blood Pressure Intervention Trial (SPRINT), dat het voordeel van behandeling van systolische bloeddruk naar een doel van <120 mmHg vergeleek met behandeling naar een doel van <140 mmHg, bestreed de hierboven genoemde doelaanbevelingen voor patiënten met een hoog risico zonder diabetes mellitus. Een doel van systolische bloeddruk <120 mmHg vergeleken met <140 mmHg (gemiddelde waarden respectievelijk 121 mmHg en 136 mmHg bij het eerste jaar) leidde tot lagere incidentie van het gecombineerde eindpunt fatale en niet-fatale belangrijke hart- en vaatziekten of overlijden (ongeacht de oorzaak). Voor de groep met intensieve behandeling werd echter een significant hogere incidentie gezien van ernstige bijwerkingen, hypotensie, syncope, elektrolytafwijkingen en acute nierschade (of nierfalen), maar niet van ernstige valpartijen.
Er zijn richtlijnen die voor iedereen een streefwaarde van systolisch <130 mmHg voorstellen. Dat is met name gebaseerd op de SPRINT-trial. Deze richtlijn kiest voor een trapsgewijze streefwaarde, zoals hieronder beschreven. In SPRINT waren personen met diabetes mellitus en een beroerte in de voorgeschiedenis geëxcludeerd. Daarnaast waren er in de intensieve groep meer bijwerkingen en waren er weinig kwetsbare ouderen in de studie. Bovendien was er ook veel commentaar op de methode waarop de bloeddruk gemeten was. Dit gebeurde met een ‘unattended’ geautomatiseerde methode, waarbij de bloeddrukwaardes gemiddeld lager uitkomen dan met de normale spreekkamerbloeddruk. De vraag was met welke spreekkamerbloeddruk de streefwaarde van 120 mmHg te vergelijken was. Doordat het onderzoek een open label opzet had met een strategie die dicht in de buurt komt van reguliere zorg met frequente bezoeken, werd de antihypertensieve behandeling waarschijnlijk aangepast als er ernstige bijwerkingen optraden, teneinde het risico op complicaties tot een minimum te beperken.
Gebaseerd op de huidige data is het advies om te streven naar een systolische bloeddruk <140 mmHg. Indien de medicatie goed verdragen wordt, kan het risico nog extra verlaagd worden door te streven naar een lagere bloeddruk tot < 130 mmHg systolisch. Overweeg dit bij personen met een hoger risico op hart- en vaatziekten, door bijvoorbeeld comorbiditeit zoals diabetes mellitus of chronische nierschade (zie daarvoor de medisch specialistische richtlijn Chronische Nierschade (CNS) en NHG-standaard Chronische Nierschade (CNS)).
Duur van behandeling en follow-up
Bloeddrukverlagende behandeling moet voor onbepaalde tijd gehandhaafd worden. Bij stopzetting van de behandeling bij hypertensieve patiënten keert de bloeddruk meestal terug naar het niveau van voor de behandeling. Voor sommige patiënten, bij wie de behandeling gepaard gaat met een effectieve bloeddrukverlaging gedurende langere tijd, is het mogelijk het aantal en/of dosering van de geneesmiddelen te verlagen. Hier is vooral sprake van wanneer de bloeddrukverlaging gepaard gaat met een gezondere leefstijl en gewichtsverlies. De medicatie moet geleidelijk worden gereduceerd en de patiënt moet regelmatig worden gecontroleerd omdat de kans bestaat dat de hypertensie terugkeert.
Follow-up van patiënten wordt uitgevoerd door een team van zorgverleners. Bij een stabiele instelling (streefwaarden zijn bereikt en geen of acceptabele bijwerkingen) zijn laag-frequente controles voldoende. Bij niet goed ingestelde patiënten is een hogere frequentie nodig. Het zelf meten van de bloeddruk is effectief in het verbeteren van de bloeddrukcontrole en leidt tot minder medicatiegebruik en spreekuurbezoeken. De meerwaarde van thuismetingen geldt vooral voor diegenen met een belangrijk wittejasseneffect en voor patiënten met zogeheten gemaskeerde hypertensie. Thuismeten betrekt patiënten meer bij hun behandeling en kan met behulp van telemonitoring ook op afstand plaatsvinden. De optimale frequentie voor het thuismonitoren van de bloeddruk is niet bekend. Zowel protocollen waarbij een maal per week op gestandaardiseerde momenten de bloeddruk wordt gemeten als protocollen waarbij voorafgaand aan het spreekuurbezoek een serie gestandaardiseerde metingen wordt verricht, zijn in omloop. Voor die patiënten waarbij thuismetingen moeilijk zijn, kan een 30 minuten meting in de praktijk een alternatief zijn bij de bloeddrukcontrole als er twijfel is over wittejassenhypertensie.
Bloeddrukmeting
Een belangrijk punt is dat de hier gepropageerde bloeddrukstreefwaarde van <140 mm Hg een lege artis uitgevoerde spreekkamer¬bloeddruk betreft. Deze geeft andere referentiewaarden dan de methode zoals in de SPRINT-trial is gebruikt, waarbij de bloeddruk met een automatische meter werd gemeten in afwezigheid van een zorgverlener. De SPRINT-methode geeft ongeveer 15 mm Hg lagere systolische waarden dan de spreekkamerbloeddruk.
Aanbevelingen
Personen tot 70 jaar
- Streef naar een systolische bloeddruk < 140 mmHg.
- Streef naar een lagere systolische bloeddruk < 130 mmHg, indien de medicatie goed verdragen wordt, met name bij personen met een hoger risico op hart- en vaatziekten door bijvoorbeeld een comorbiditeit als chronische nierschade of diabetes mellitus.
Uitgangsvraag
Welke bloeddrukstreefwaarde dient te worden gehanteerd bij de behandeling van hypertensie bij (kwetsbare) ouderen (>70 jaar)?
De uitgangsvraag omvat de volgende deelvragen:
- Wat is de effectiviteit van antihypertensiva bij (kwetsbare) oudere patiënten met hypertensie?
- Wat is de effectiviteit van een intensieve behandeling met antihypertensiva bij (kwetsbare) oudere patiënten?
Inleiding
Op basis van de literatuur blijkt behandeling van hypertensie effectief te beschermen tegen hart- en vaatziekten bij 70-plussers. Er is echter discussie over de streefwaarden van bloeddruk bij ouderen. De oude richtlijn beveelt aan om bij niet-kwetsbare ouderen te streven naar een systolisch bloeddruk < 150 mmHg en indien goed verdragen, < 140 mmHg. De Europese richtlijn beveelt aan om bij ouderen te streven naar een bloeddruk van systolisch bloeddruk < 140 mmHg en indien goed verdragen, tot < 130 mmHg.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvraag:
Wat is de effectiviteit van een (intensieve) behandeling met antihypertensiva bij ouderen met en zonder hart- en vaatziekten vergeleken met een standaardbehandeling of geen behandeling?
PICO1
P1: ouderen (ouder dan 70 jaar) met en zonder hart- en vaatziekten;
I1: standaardbehandeling;
C1: placebo;
O1: kwaliteit van leven; functioneren waaronder cognitief; bijwerkingen; mortaliteit; hart- en vaatziekten; ziektevrij.
PICO2
P2: ouderen (ouder dan 70 jaar) met en zonder hart- en vaatziekten;
I2: intensieve behandeling met antihypertensiva of bloeddrukstreefwaarde A;
C2: standaardbehandeling met antihypertensiva of bloeddrukstreefwaarde B;
O2: kwaliteit van leven; functioneren waaronder cognitief; bijwerkingen; mortaliteit; hart- en vaatziekten; ziektevrij.
Relevante uitkomstmaten
De werkgroep achtte hart- en vaatziekten, kwaliteit van leven en functioneren voor de besluitvorming kritieke uitkomstmaten; en bijwerkingen en totale mortaliteit voor de besluitvorming belangrijke uitkomstmaten.
Zoeken en selecteren (Methode)
Zoekactie – april 2016
In de databases Medline (via OVID) en Embase (via Embase.com) is met relevante zoektermen gezocht naar systematische reviews en gerandomiseerd gecontroleerde trials. De zoekverantwoording is weergegeven in de Totstandkoming. De literatuurzoekactie leverde 1493 treffers op. Studies werden geselecteerd op grond van de volgende selectiecriteria:
- systematische reviews met een gedocumenteerde zoekstrategie, evidencetabellen en beoordeling van het risico op bias;
- gerandomiseerde, gecontroleerde trials waarbij of antihypertensiva vergeleken werd met placebo of een behandeling met een strikte bloeddrukcontrole werd vergeleken met standaard bloeddrukstreefwaarde bij patiënten ouder dan 70 jaar met een verhoogde bloeddruk (of een gemiddelde leeftijd van 70 jaar of een subgroepanalyse bij patiënten ouder dan 70 jaar).
Op basis van titel en abstract werden in eerste instantie 107 studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens 100 studies geëxcludeerd (zie exclusietabel in de Totstandkoming), en zeven artikelen (vijf studies) definitief geselecteerd. Een artikel werd gevonden door het doorlopen van referenties van geïncludeerde artikelen.
Resultaten
Vijf onderzoeken zijn opgenomen in de literatuuranalyse. De belangrijkste studiekarakteristieken en resultaten zijn opgenomen in de evidence-tabellen (zie Totstandkoming). De beoordeling van de individuele studieopzet (Risk of Bias) is opgenomen in de Risk of Bias tabellen.
Update – maart 2022
De zoekactie voor PICO2 is op 29-03-2022 herhaald met een paar wijzigingen (zie zoekverantwoording voor meer detail). De selectiecriteria zijn hetzelfde gebleven.
Op basis van titel en abstract werden in eerste instantie 223 studies voorgeselecteerd. Op basis van titel en abstract werden 200 artikelen geëxcludeerd. Na raadpleging van de volledige tekst werden vervolgens 21 studies geëxcludeerd (zie exclusietabel in de Totstandkoming) en twee studies definitief geselecteerd. Zhang (2021) en SPRINT (2015) zijn geïncludeerd en beschreven de vergelijking Intensieve behandeling versus standaardbehandeling.
Voor de uitwerking van de resultaten werd er geen onderscheid gemaakt in het type antihypertensiva.
Samenvatting literatuur
Beschrijving studies
1 Vergelijking: antihypertensiva versus placebo
Ouderen met of zonder hart- en vaatziekten
Beckett (2008) ondernam een gerandomiseerd, gecontroleerde trial naar de effectiviteit en veiligheid van antihypertensiva bij patiënten van 80 jaar of ouder. Patiënten met hypertensie, gedefinieerd als een aanhoudende systolische bloeddruk boven 160 mmHg, kwamen in aanmerking. Voor de start van de trial werden alle patiënten gevraagd om te stoppen met antihypertensiva en een placebo tablet te gaan slikken voor ten minste twee maanden. Na randomisatie ontvingen 1933 patiënten 1,5 milligram indapamide en 1912 patiënten een vergelijkbare placebo. Patiënten werden in het eerste jaar minstens driemaandelijks gezien en daarna elk half jaar. Tijdens elk bezoek kon perindopril (2 of 4 mg) worden toegevoegd om de bloeddrukstreefwaarde (onder 150/80 mmHg) te halen. Bloeddruk werd jaarlijks gemeten. De mediaan follow-up was 1,8 jaar (bereik: 0 tot 6,5). De trial was vroegtijdig gestopt vanwege ethische redenen (een onverwachte reductie op het risico om te overlijden bij gebruik van antihypertensiva). Data over cognitief functioneren waren beschikbaar in een publicatie van Peters (2008).
Staessen (1998) onderzocht de voordelen van antihypertensiva onder oudere patiënten met hypertensie. Patiënten kwamen in aanmerking bij een leeftijd van ten minste 60 jaar en de systolische bloeddruk tussen 160 en 219 mmHg tijdens het nemen van een placebo voor deelname aan de trial. In totaal werden 4695 patiënten gerandomiseerd met gemiddelde leeftijd van 70 jaar; 2398 ontvingen nitrendipine (10 tot 40 mg/d) en 2297 een vergelijkbare placebo. Indien nodig werd nitrendipine gecombineerd met of vervangen door enalapril (5 tot 20 milligram/dag) of hydrochlorothiazide (12,5 tot 25 mg/d) of beide. De bloeddrukstreefwaarde was 150 mmHg. Patiënten werden per drie maanden gezien. De mediane follow-up was 2,0 jaar (bereik van 1 maand tot 97 maanden). De trial was vroegtijdig gestopt vanwege reductie op het risico op een beroerte bij gebruik van antihypertensiva. Data over cognitief functioneren waren beschikbaar in een publicatie van Forette (1998).
Resultaten
- Hart- en vaatziekten
Beckett (2008) observeerde dat het risico op hart- en vaatziekten gedurende follow-up bij gebruik van antihypertensiva verlaagd was vergeleken met placebo (HR 0,66 95%BI: 0,53 tot 0,82). 138 patiënten onder actieve behandeling kregen hart- en vaatziekten vergeleken met 193 patiënten onder de controle behandeling.
Staessen (1998) rapporteerde dat 137 patiënten bij gebruik van antihypertensiva hart- en vaatziekten kregen (rate 23,3 per 1000 patiëntjaren) vergeleken met 186 patiënten die een placebo kregen (rate 33,9 per 1000 patiëntjaren). Het risico om tijdens follow-up hart- en vaatziekten te kregen was 31% lager bij gebruik van antihypertensiva (HR 0,69 95%BI: 0,55 tot 0,86).
Het gepoolde risico op hart- en vaatziekten tijdens follow-up was 33% lager in het voordeel van antihypertensiva (HR 0,67 95%BI: 0,58 tot 0,79).
2. Kwaliteit van leven
Beckett (2008) en Staessen (1998) rapporteerden geen data over kwaliteit van leven.
3. Functioneren
De HYVET-trial (Peters, 2008) observeerde een verbetering in MMSE met 0,7 punten (SD 4,0) ten opzichte van baseline bij gebruik van antihypertensiva vergeleken met een afname met 1,1 punten (SD 3,9) bij een placebo (p=0,08). Het risico op dementie was potentieel 14% verlaagd bij gebruik van antihypertensiva (HR 0,86 95%BI: 0,67 tot 1,09).
Forette (1998) rapporteerde in totaal 32 personen die gedurende de studie dementie ontwikkelden, waarvan 21 in de placebogroep en 11 in de antihypertensivagroep. Gedurende vijf jaar was de frequentie om dementie te ontwikkelen 50% lager bij gebruik van antihypertensiva vergeleken met placebo (RR 0,50 95%BI: 0,22 tot 1,08). De resultaten van het risico op dementie was gepoold. Het risico op dementie is potentieel 18% verlaagd (RR 0,82 95%BI: 0,65 tot 1,04).
De resultaten van het risico op dementie zijn gepoold. Het risico om dementie te ontwikkelen gedurende studie was potentieel 18% verlaagd bij gebruik van antihypertensiva vergeleken met placebo (RR 0,82 95%BI: 0,65 tot 1,04).
| Auteur (jaar) | Dementie (95%BI) |
|---|---|
| Peters (2008) | HR 0,86 (0,67 tot 1,09) |
| Forette (1998) | RR 0,50 (0,22 tot 1,08) |
| Gepoold | RR 0,82 (0,65 tot 1,04) |
4. Bijwerkingen
Beckett (2008) observeerde dat 358 (19%) patiënten een ernstig ongewenst voorval kregen tijdens het gebruik van antihypertensiva vergeleken met 448 (23%) patiënten tijdens het gebruik van een placebo. Het absolute verschil was 5% met een 95% BI lopend van 2% tot 8%. Het is echter onbekend om welke ernstige ongewenste voorvallen het gaat.
Staessen (1998) rapporteerde geen gegevens over mogelijke bijwerkingen of ongewenste voorvallen bij gebruik van antihypertensiva.
5. Mortaliteit
In de trial van Beckett (2008) kwamen 196 patiënten onder actieve behandeling te overlijden (rate 24 per 1000 patiëntjaren) vergeleken met 235 patiënten die een placebo kregen (rate 60 per 1000 patiëntjaren). Het risico om te overlijden gedurende follow-up was 21% lager bij gebruik van antihypertensiva vergeleken met placebo (HR 0,79 95%BI: 0,65 tot 0,95). Ook het risico om te overlijden ten gevolge van hart- en vaatziekten was verlaagd (HR 0,77 95%BI: 0,60 tot 1,01).
Staessen (1998) observeerde dat 123 patiënten (rate van 20,5 per 1000 patiëntjaren) bij gebruik van antihypertensiva tijdens follow-up kwamen te overlijden vergeleken met 137 patiënten (rate 24,0 per 1000 patiëntjaren). Het risico om te overlijden tijdens follow-up was mogelijk 14% lager bij gebruik van antihypertensiva vergeleken met placebo (HR 0,86 95%BI: 0,67 tot 1,10). Het risico om te overlijden aan hart- en vaatziekten tijdens follow-up is potentieel 27% verlaagd (HR 0,73 95%BI: 0,52 tot 1,03). In totaal overleden 59 patiënten (rate 9,8 per 1000 patiëntjaren) die antihypertensiva gebruikten en 77 patiënten (rate 13,5 per 1000 patiëntjaren) die placebo kregen.
De gepoolde hazard ratio voor mortaliteit was 0,82 (95%BI: 0,70 tot 0,95). Het risico om te overlijden tijdens follow-up is 18% lager bij gebruik van antihypertensiva. Het gepoolde effect voor mortaliteit ten gevolge van hart- en vaatziekten was 0,76 (95%BI: 0,61 tot 0,93) en daarom 24% lager in het voordeel van antihypertensiva.
| Auteur (jaar) | All-cause mortaliteit (95%BI) | Mortaliteit hart- en vaatziekten (95%BI) |
|---|---|---|
| Beckett (2008) | HR 0,79 (0,65 tot 0,95) | HR 0,77 (0,60 tot 1,01) |
| Staessen (1998) | HR 0,86 (0,67 tot 1,10) | HR 0,73 (0,52 tot 1,03) |
| Gepoold | HR 0,82 (0,70 tot 0,95) | HR 0,76 (0,61 tot 0,93) |
6. Bloeddruk
In de trial van Beckett (2008) was na twee jaar onder actieve behandeling de systolische bloeddruk gemiddeld gedaald met 29,5 mmHg (SD 15,4) ten opzichte van baseline (diastolische bloeddruk met 12,9 mmHg (SD 9,5)). Patiënten onder placebo behandeling zagen een daling in systolische bloeddruk van 14,5 mmHg (SD 18,5) (diastolische bloeddruk met 6,8 mmHg (SD 10,5)).
Staessen (1998) rapporteerde het effect op systolische en diastolische bloeddruk na de mediaan follow-up (twee jaar). Onder actieve behandeling nam de systolische bloeddruk met gemiddeld 23 mmHg af (SD 16) en de diastolische bloeddruk met 7 mmHg (SD 8) en onder placebo met respectievelijk 13 mmHg (SD 17) en 2 mmHg (SD 8). De systolische bloeddruk nam gemiddeld af met 10,1 mmHg (95%BI: 8,8 tot 11,4) in het voordeel van actieve behandeling en de diastolische bloeddruk met 4,5 mmHg (95%BI: 3,9 tot 5,1).
| Bloeddruk (mmHg) | Antihypertensiva | Placebo | Gemiddeld verschil (95%BI) |
|---|---|---|---|
| Systolische | |||
| Beckett (2008) | -29,5 (SD 15,4) | -14,5 (SD 18,5) | -15,0 (-16,1 tot -13,9) |
| Staessen (1998) | -23 (SD 16) | -13 (SD 17) | -10,1 (-11,4 tot -8,8) |
| Gepoold | -13,0 (-13,8 tot -12,2) | ||
| Diastolische | |||
| Beckett (2008) | -12,9 (SD 9,5) | -6,8 (SD 10,5) | -6.1 (-6.7 tot -5.5) |
| Staessen (1998) | -7 (SD 8) | -2 (SD 8) | -4,5 (-5,1 tot -3,9) |
| Gepoold | -5,3 (-5,7 tot -4,9) |
Gebruik van antihypertensiva resulteert na twee jaar in een afname in systolische bloeddruk van 13,0 mmHg (95%BI: 12,2 tot 13,8) en een afname in diastolische bloeddruk van 5,3 (95%BI: 4,9 tot 5,7).
Kwetsbare patiënten
Warwick (2015) heeft de studiepopulatie van de HYVET-trial gestratificeerd op basis van de Frailty Index. De Frailty Index was berekend aan het begin van de trial en op basis van aan- of afwezigheid van 60 condities. Het aantal aanwezige stoornissen werd gedeeld door 60 om de score van Frailty Index te geven. De resultaten voor de uitkomst mortaliteit en hart- en vaatziekten werd gestratificeerd per 0,1 interval van de Frailty Index Score. Het risico om te overlijden of het krijgen van hart- en vaatziekten tijdens follow-up nam af met elke toename in kwetsbaarheid. Echter, het aantal deelnemers met een hoge score en daarmee kwetsbaar is relatief klein met als gevolg brede betrouwbaarheidsintervallen. Daarnaast is de vraag of deze groep van kwetsbare patiënten een weerspiegeling is van de kwetsbare oudere patiënt uit de algemene populatie.
Bewijskracht van de literatuur
Vergelijking: antihypertensiva versus placebo
Hart- en vaatziekten: De bewijskracht voor de uitkomstmaat hart- en vaatziekten is met één niveau verlaagd gezien beperkingen in de onderzoeksopzet (Risk of Bias; 1 trial met bijna 50% lost to follow-up).
Kwaliteit van leven: Vanwege het ontbreken van gegevens is het niet mogelijk om de bewijskracht te graderen voor de uitkomstmaat kwaliteit van leven.
Functioneren: De bewijskracht voor de uitkomstmaat cognitie is met twee niveaus verlaagd gezien beperkingen in de onderzoeksopzet (Risk of Bias; bijna 50% lost to follow-up).
Bijwerkingen: De bewijskracht voor de uitkomstmaat bijwerkingen is met twee niveaus verlaagd gezien beperkingen in de onderzoeksopzet (Risk of Bias; bijna 50% lost to follow-up).
Mortaliteit: De bewijskracht voor de uitkomstmaat all-cause mortaliteit en mortaliteit ten gevolge van hart- en vaatziekten is met één niveau verlaagd gezien beperkingen in de onderzoeksopzet (Risk of Bias; 1 trial met bijna 50% lost to follow-up).
Bloeddruk: De bewijskracht voor de uitkomstmaat bloeddruk is met één niveau verlaagd gezien beperkingen in de onderzoeksopzet (Risk of Bias; 1 trial met bijna 50% lost to follow-up).
Vergelijking: antihypertensiva versus placebo
Hart- en vaatziekten
| Redelijk GRADE | Oudere patiënten die antihypertensiva gebruiken hebben waarschijnlijk een lager risico op hart- en vaatziekten vergeleken met placebo. Bronnen: Beckett 2008, Staessen,1998 |
Kwaliteit van leven
- GRADE | Vanwege het ontbreken van data is het niet mogelijk een conclusie te formuleren over het effect van een intensieve behandeling met een strikte bloeddruk op kwaliteit van leven vergeleken met een standaardbehandeling en matige bloeddrukcontrole. |
Cognitief functioneren
Laag GRADE | Risico op het optreden van dementie is mogelijk lager bij gebruik van antihypertensiva door patiënten met hypertensie van 80 jaar of ouder in vergelijking met placebo. Bronnen: Peters 2008, Forette 1998 |
Bijwerkingen
Laag GRADE | Het risico op een ernstig ongewenst voorval bij gebruik van antihypertensiva is mogelijk lager vergeleken met het gebruik van een placebo. Bron: Beckett 2008 |
Mortaliteit
| Redelijk GRADE | Het risico op overlijden binnen 6,5 jaar is waarschijnlijk lager bij gebruik van antihypertensiva vergeleken met placebo bij oudere patiënten met hypertensie. Bronnen (Beckett, 2008; Staessen, 1998) |
| Redelijk GRADE | Ten gevolge van hart- en vaatziekten Het risico op overlijden binnen 6,5 jaar ten gevolge van hart- en vaatziekten is waarschijnlijk lager bij gebruik van antihypertensiva vergeleken met placebo bij oudere patiënten met hypertensie. Bronnen: Beckett 2008, Staessen 1998 |
Bloeddruk
| Redelijk GRADE | Oudere patiënten die antihypertensiva krijgen, hebben waarschijnlijk ten minste een 12 mmHg lagere systolische bloeddruk en een 5 mmHg lagere diastolische bloeddruk vergeleken met patiënten die een placebo krijgen. Bronnen: Beckett 2008, Staessen 1998 |
2 Vergelijking: Intensieve behandeling versus standaardbehandeling
Ouderen zonder hart- en vaatziekten
Wei (2013) onderzocht of een intensieve bloeddrukbehandeling met een streefwaarde van minder dan 140 over 90 mmHg vergeleken met een behandeling en een streefwaarde van minder dan 150 over 90 mmHg cardiovasculaire uitkomsten in Chinese hypertensieve patiënten ouder dan 70 jaar kon verbeteren. Patiënten ouder dan 70 jaar kwamen in aanmerking voor deelname als de systolische bloeddruk gelijk of hoger dan 150 mmHg was en de diastolische bloeddruk gelijk of hoger dan 90 mmHg was (tweemaal gemeten op verschillende dagen) of patiënten waren al gediagnosticeerd met hypertensie en gebruikte reeds antihypertensiva. In totaal deden 724 patiënten mee waarvan 363 werden gerandomiseerd naar de intensieve behandeling en 361 naar de standaardbehandeling. Gerandomiseerde patiënten startte met één geneesmiddel (ACE-remmer: enalapril 10 milligram/ dag, β-blokker: bisoprolol 2,5 tot 5 milligram of metoprolol 50 tot 100 mg/ dag, calcium kanaal blokker: amlodipine 5 tot 10 milligram/ dag of diurecticum: indapamide 1,5 tot 2,5 mg/ dag). Om de bloeddrukstreefwaarde te halen werd stapsgewijs één, twee of drie antihypertensiva toegevoegd. Mocht de bloeddrukstreefwaarde niet worden gehaald bij vier middelen, werd het verhogen van de dosering geadviseerd. Na het starten van de studie werd bloeddruk na de vierde week, na de derde maand en na de zesde maand gemeten. Vervolgens werd elke zes maanden de bloeddruk gemeten. Patiënten waren gemiddeld voor vier jaar gevolgd.
Ouderen met of zonder hart- en vaatziekten
Ogihara (2010) bepaalde of een strikte bloeddrukcontrole (lager dan 140 mmHg) beter was dan matige bloeddrukcontrole (bloeddruk tussen 140 en 150 mmHg) in het verlagen van cardiovasculaire mortaliteit en morbiditeit bij ouderen patiënten met geïsoleerd systolische hypertensie. Patiënten van 70 tot 85 jaar met geïsoleerd systolische hypertensie (SBP >160 mmHg en DBP <90 mmHg) werden gerekruteerd. In totaal waren 1627 patiënten gerandomiseerd naar de strikte bloeddrukcontrole en 1633 naar matige bloeddrukcontrole. In beide groepen had 13% van de patiënten eerder hart- en vaatziekten gehad. Patiënten begonnen met een angiotensinereceptorblokkers eenmaal daags. Bij het niet behalen van de streefwaarde bloeddruk in een à twee maanden, kon de dosering worden verhoogd of ander typen antihypertensiva worden bijgegeven. Bloeddruk werd minimaal elke drie maanden gemeten gedurende twee jaar. Uiteindelijk waren patiënten gemiddeld voor 2,85 jaar gevolgd.
SPRINT (2015) onderzocht de hypothese dat een lagere systolische bloeddrukstreefwaarde van <120 mmHg het risico op klinisch events verlaagt vergeleken met een streefwaarde van <140 mmHg. Patiënten ten minste 50 jaar met een systolische bloeddruk tussen 130 en 180 mmHg en een verhoogd risico op hart- en vaatziekten werden geïncludeerd. In totaal kregen 1317 deelnemers een intensieve behandeling met een streefwaarde van lager dan 120 mmHg en 1319 deelnemers een standaardbehandeling met een streefwaarde van 140 mmHg. Alle deelnemers werden maandelijks gezien gedurende de eerste drie maanden en daarna elke drie maanden. De medicatie van patiënten onder intensieve behandeling werd maandelijks bijgesteld om een streefwaarde van 120 mmHg te halen. Bij deelnemers onder een standaardbehandeling werd de medicatie bijgesteld om een streefwaarde van 135 tot 139 mmHg te halen. Bij een bloeddruk onder 130 mmHg tijdens een follow-up moment of onder 135 mmHg tijdens twee momenten werd de dosering verlaagd. Bloeddruk werd bepaald op basis van drie metingen terwijl de deelnemer zat en na vijf minuten rust. De mediaan follow-up was 3,26 jaar. De trial was vroegtijdig gestopt nadat de resultaten voor de primaire uitkomst op twee tijdpunten de monitoring grens overschreven.
Gezien de gemiddelde leeftijd van de deelnemers ongeveer 67 jaar bedroeg, werd voor het uitwerken van deze vraag alleen een subgroep analyse van 75 jaar en ouder beschreven.
Zhang (2021) onderzocht de bloeddrukstreefwaarde ter verlaging van het risico op hart- en vaatziekten bij patiënten met hypertensie. Patiënten in de leeftijd van 60 tot 80 jaar met een bloeddruk boven 140 mmHg kwamen in aanmerking. In totaal werden 4243 toegewezen naar een target tussen 110 en 130 mmHg en 4268 naar een target van 130 tot 150 mmHg. De primaire uitkomstmaat was een samenstelling van beroerte, acuut coronair syndroom (acuut myocardinfarct en ziekenhuisopname wegens onstabiele angina pectoris), acuut gedecompenseerd hartfalen, coronaire revascularisatie, atriumfibrilleren, of overlijden door cardiovasculaire oorzaken. De gemiddelde leeftijd was 66 jaar en 47% was man. De mediane follow-uptijd was 3,34 jaar. Gedurende deze periode werd in de target van 110-130 een gemiddelde bloeddruk van 126,7 mmHg behaald en bij een target van 130-150 een gemiddelde bloeddruk van 135,9 mmHg.
Gezien de gemiddelde leeftijd van de deelnemers 66 jaar bedroeg, werd voor het uitwerken van deze vraag alleen een subgroepanalyse van 70 jaar tot 80 jaar beschreven. In deze leeftijdsgroep kregen 1023 (24%) patiënten een target tussen 110 en 130 mmHg toegewezen en 1032 (24%) een target van 130-150 mmHg.
Resultaten
- Hart- en vaatziekten
In de trial van Wei (2013) kregen in totaal 107 patiënten hart- en vaatziekten gedurende vier jaar, waarvan 40 (11%) patiënten onder een intensieve behandeling. Het risico op hart- en vaatziekte was 37% lager bij een bloeddrukstreefwaarde van lager dan 140 over 90 mmHg vergeleken met een streefwaarde van 150 over 90 mmHg (RR 0,63 95%BI: 0,44 tot 0,92).
Ogihara (2010) rapporteerde geen gegevens over het aantal hart- en vaatziekten.
SPRINT (2015) observeerden dat gedurende 3,26 jaar 101 (8%) deelnemers onder intensieve behandeling hart- en vaatziekten kregen vergeleken met 144 (11%) deelnemers onder standaardbehandeling. Daarmee was het risico op hart- en vaatziekten 33% verlaagd bij een bloeddrukstreefwaarde van <120 mmHg vergeleken met een streefwaarde van <140 mmHg (HR 0,67 95%BI: 0,51 tot 0,86).
Zhang (2021) rapporteerde dat 49 (4,7%) onder een bloeddrukstreefwaarde 110 mmHg tot 130 mmHg hart- en vaatziekten kregen, vergeleken met 66 (6,4%) bij een bloeddrukstreefwaarde van 130 tot 150 mmHg (HR 0,73 95%BI 0,50 tot 1,05).
Het onderstaande figuur H laat de meta-analyse van de resultaten zien. Het gepoolde effect op hart- en vaatziekten is een relatief risico van 0,67 (95%BI 0,56 tot 0,81).
2. Kwaliteit van leven
Wei (2013), Ogihara (2010) en SPRINT (2015) rapporteerden geen data over kwaliteit van leven.
3. Functioneren
Wei (2013) en Ogihara (2010) rapporteerden geen data over functioneren.
SPRINT (2015) rapporteerde gegevens over waarschijnlijke dementie in de subgroepanalyse (≥ 75 jaar). Waarschijnlijke dementie werd aan de hand een stappenplan bepaald. In dit stappenplan werd gebruik gemaakt van testen voor het bepalen van de globale cognitieve functie (Montreal Cognitive Assessment [MoCA]; range, 0-30), leren en geheugen (Logical Memory forms I and II subtests of the Wechsler Memory Scale; ranges, 0-28 and 0-14), en verwerkingssnelheid (Digit Symbol Coding Test of the Wechsler Adult Intelligence Scale; range, 0-135).
In totaal werd bij 95 deelnemers onder intensieve behandeling waarschijnlijke dementie vastgesteld (17,8 gevallen per 100 persoonsjaren). Onder de minder intensieve behandeling werd bij 116 deelnemers waarschijnlijke dementie vastgesteld. Het risico op waarschijnlijke dementie was potentieel daarmee 12% verlaagd bij een intensieve behandeling vergeleken met een minder intensieve behandeling (HR 0,88 9% BI 0,66 tot 1,16).
4. Bijwerkingen
Wei (2013) rapporteerde geen data over bijwerkingen of ongewenste voorvallen.
Ogihara (2010) rapporteerde dat de frequentie van ernstige ongewenste voorvallen hetzelfde was in beide groepen (6% bij strikte bloeddrukcontrole en 5% bij matige bloeddrukcontrole). De meeste voorvallen waren gastro-intestinale symptomen of luchtweg gerelateerd en niet per se gerelateerd aan het gebruik van antihypertensiva.
SPRINT (2015) heeft het aantal ernstige ongewenste voorvallen voor de subgroep van 75 jaar en ouder beoordeeld. In totaal hadden 640 (49%) deelnemers onder intensieve behandeling een ernstig ongewenst voorval vergeleken met 638 (48%) deelnemers onder standaardbehandeling. Het risico op een ernstig ongewenst voorval was dus niet verschillend (HR=1,00; p=0,93). Dit hoefde niet per se voorvallen te zijn gerelateerd aan de interventie. In beide groepen was een val met een nadelige gevolgen een van de meest voorkomende ongewenste voorvallen (5% versus 6%).
5. Mortaliteit
Wei (2013) observeerde dat 51 (14%) patiënten onder intensieve behandeling kwamen te overlijden vergeleken met 87 (24%) patiënten onder standaardbehandeling. Het risico om te zijn overleden aan het eind van de trial was 37% lager bij een intensieve behandeling dan bij een standaardbehandeling (RR 0,63 95%BI: 0,46 tot 0,87). 25 (7%) patiënten onder intensieve behandeling overleden ten gevolge van hart- en vaatziekten vergeleken met 50 (14%) patiënten onder standaardbehandeling. Ook het risico om te overlijden ten gevolge van hart- en vaatziekten was daarmee lager bij een intensieve behandeling vergeleken met een standaardbehandeling (RR 0,53 95%BI: 0,33 tot 0,84).
In de trial van Ogihara (2010) kwamen 24 (2%) patiënten uit de strikte bloeddrukcontrole groep te overlijden vergeleken met 30 (2%) patiënten uit de matige bloeddrukcontrole groep. Het risico om te overlijden gedurende follow-up was mogelijk 22% lager bij een strikte bloeddrukcontrole vergeleken met een matige bloeddrukcontrole (HR 0,78 95%BI: 0,46 tot 1,33). Het risico was voor leeftijd, geslacht, BMI, roken, dyslipidemie, diabetes mellitus en gebruikte antihypertensiva gecorrigeerd. Het risico om te overlijden aan hart- en vaatziekten was niet verschillend (HR 0,97 95%BI: 0,42 tot 2,25).
SPRINT (2015) rapporteerde dat 73 (6%) deelnemers ouder dan 74 jaar onder intensieve behandeling en 106 (8%) onder standaardbehandeling kwamen te overlijden gedurende follow-up. Het risico om te overlijden gedurende follow-up was daarmee 32% lager bij een intensieve behandeling (HR 0,68 95%BI: 0,50 tot 0,92). Gegevens over dood ten gevolge van hart- en vaatziekten werden niet apart gerapporteerd voor 75-jarigen en ouder.
Gezien het verschil waarmee het effect wordt geschat in een studie en de wijze waarop gecorrigeerd is voor relevante variabelen, is ervoor gekozen om de resultaten niet te poolen, maar in een tabel weer te geven.
| Auteur (jaar) | All-cause mortaliteit (95%BI) | Mortaliteit hart- en vaatziekten (95%BI) |
|---|---|---|
| Wei (2013) | RR 0,63 (0,46 tot 0,87) | RR 0,53 (0,33 tot 0,84) |
| Ogihara (2010)* | HR 0,78 (0,46 tot 1,33) | HR 0,97 (0,42 tot 2,25) |
| SPRINT (2015) | HR 0,68 (0,50 tot 0,92) | - |
*Gecorrigeerd voor leeftijd, geslacht, BMI, roken, dyslipidemie, diabetes mellitus en gebruikte antihypertensiva
6. Bloeddruk
Wei (2013) heeft het effect op bloeddruk geëvalueerd door het gemiddelde te berekenen. Patiënten onder de intensieve behandeling hadden een gemiddelde systolische bloeddruk van 135,7 mmHg (SD 9,0) en een diastolische bloeddruk van 76,2 mmHg (SD 6,1) vergeleken met respectievelijk 149,7 mmHg (SD 11,0) en 82,1 mmHg (SD 7,5) bij patiënten onder standaardbehandeling aan het eind van de trial.
Ogihara (2010) rapporteerde na drie jaar de gemiddelde bloeddruk. Na drie jaar hadden patiënten met een strikte bloeddrukcontrole een gemiddeld systolische bloeddruk van 136,6 (SD 13,3) vergeleken met 142,0 mmHg (SD 12,5) onder patiënten met een matige bloeddrukcontrole. Een strikte bloeddrukcontrole resulteerde in afname van 5,4 mmHg vergeleken met matige bloeddrukcontrole (gemiddeld verschil: -5,4 mmHg 95%BI: -6,3 tot -4,5).
SPRINT (2015) heeft alleen de gemiddelde bloeddruk voor alle deelnemers gerapporteerd en niet voor de subgroep van 75-jarigen of ouder.
| Bloeddruk (mmHg) | Strikte bloeddrukcontrole | Matige bloeddrukcontrole | Gemiddeld verschil (95%BI) |
|---|---|---|---|
| Systolische | |||
| Wei (2013) | 135,7 (SD 9,0) | 149,7 (SD 11,0) | -14,0 (-15,5 tot -12,5) |
| Ogihara (2010) | 136,6 (SD 13,3) | 142,0 (SD 12,5) | -5,4 (-6,3 tot -4,5) |
| Diastolische | |||
| Wei (2013) | 76,2 (SD 6,1) | 82,1 (SD 7,5) | -5,9 (-6,9 tot -4,9) |
| Ogihara (2010)* | - | - |
*Gezien patiënten met alleen een systolische verhoogde bloeddruk werden geïncludeerd, worden de resultaten voor diastolische bloeddruk niet gepresenteerd.
Het gepoolde gemiddelde verschil in systolische bloeddruk aan het eind van follow-up was -7,8 mmHg (95%BI: -8,6 tot -7,0). In de studie van Ogihara (2010) waren deelnemers met alleen een verhoogde systolische bloeddruk geïncludeerd en wordt het resultaat van diastolische bloeddruk niet gepoold. Verder dient ook benoemd te worden dat gezien de brede betrouwbaarheidsintervallen een deel van de deelnemers in beide trials niet de gestelde streefwaarde gehaald hebben.
Vergelijking: Intensieve behandeling versus standaardbehandeling
Vanwege het ontbreken van gegevens is het niet mogelijk om de bewijskracht te graderen voor de uitkomstmaten kwaliteit van leven.
Functioneren (waarschijnlijke dementie): De bewijskracht voor de uitkomstmaat waarschijnlijke dementie is met twee niveaus verlaagd gezien beperkingen in de onderzoeksopzet (Risk of Bias; te weinig detail over randomisatie of allocation concealment) en imprecisie (breed betrouwbaarheidsinterval).
Bijwerkingen: De bewijskracht voor de uitkomstmaat bijwerkingen is met één niveau verlaagd gezien beperkingen in de onderzoeksopzet (Risk of Bias; te weinig detail over randomisatie of allocation concealment).
Mortaliteit: De bewijskracht voor de uitkomstmaat all-cause mortaliteit is met één niveaus verlaagd gezien beperkingen in de onderzoeksopzet (Risk of Bias; te weinig detail over randomisatie of allocation concealment). De bewijskracht voor de uitkomstmaat mortaliteit ten gevolge van hart- en vaatziekten is met drie niveaus verlaagd gezien beperkingen in de onderzoeksopzet (Risk of Bias; te weinig detail over randomisatie of allocation concealment) en tegenstrijdige resultaten (inconsistentie).
Hart- en vaatziekten: De bewijskracht voor de uitkomstmaat hart- en vaatziekten is met één niveau verlaagd gezien beperkingen in de onderzoeksopzet (Risk of Bias; te weinig detail over randomisatie of allocation concealment).
Bloeddruk: De bewijskracht voor de uitkomstmaat systolische bloeddruk is met één niveaus verlaagd gezien beperkingen in de onderzoeksopzet (Risk of Bias; te weinig detail over randomisatie of allocation concealment).
Conclusies
Vergelijking: Intensieve behandeling versus standaardbehandeling
Hart- en vaatziekten
Redelijk GRADE | Het risico op hart- en vaatziekten is waarschijnlijk lager bij een intensieve behandeling met strikte bloeddrukcontrole vergeleken met een standaardbehandeling en een matige bloeddrukcontrole bij patiënten ouder dan 70 jaar. Bronnen: Wei 2013, SPRINT 2015, Zhang 2021 |
Kwaliteit van leven
- GRADE | Vanwege het ontbreken van data is het niet mogelijk een conclusie te formuleren over het effect van een intensieve behandeling met een strikte bloeddruk op kwaliteit van leven vergeleken met een standaardbehandeling en matige bloeddrukcontrole. |
Functioneren
Laag GRADE | Het risico op waarschijnlijke dementie is mogelijk verlaagd bij een intensieve behandeling met strikte bloeddrukcontrole vergeleken met een standaardbehandeling en een matige bloeddrukcontrole bij patiënten ouder dan 70 jaar. Bron: SPRINT 2015 |
Bijwerkingen
Redelijk GRADE | Het voorkomen van ernstige ongewenste voorvallen is waarschijnlijk niet verschillend tussen een intensieve behandeling met een strikte bloeddrukcontrole en een standaardbehandeling met een matige bloeddrukcontrole bij patiënten ouder dan 70 jaar met hypertensie. Bronnen: Ogihara 2010, SPRINT 2015 |
Mortaliteit
| Redelijk GRADE | Het risico op overlijden binnen drie jaar is waarschijnlijk lager bij een intensieve behandeling met een strikte bloeddrukcontrole vergeleken met een standaardbehandeling en een matige bloeddrukcontrole bij patiënten ouder dan 70 jaar met hypertensie. Bronnen: Wei 2013, Ogihara 2010, SPRINT 2015 |
| Zeer laag GRADE | Ten gevolge van hart- en vaatziekten Het is onduidelijk of het risico op overlijden binnen drie jaar ten gevolge van hart- en vaatziekten verschillend is tussen een intensieve behandeling met een strikte bloeddrukcontrole en een standaardbehandeling met een matige bloeddrukcontrole bij patiënten ouder dan 70 jaar met hypertensie. Bronnen: Wei 2013, Ogihara 2010 |
Bloeddruk
| Redelijk GRADE | Een intensieve behandeling met een strikte bloeddrukcontrole resulteert waarschijnlijk in een lagere systolische bloeddruk vergeleken met standaardbehandeling en een matige bloeddrukcontrole bij patiënten ouder dan 70 jaar. Bronnen: Wei 2013, Ogihara, 2010 |
Overwegingen
Gezien het effect van antihypertensiva op bloeddruk en cardiovasculaire morbiditeit en mortaliteit dienen zowel vitale als kwetsbare ouderen te starten met antihypertensiva; de vraag is welke bloeddrukstreefwaarde gehanteerd dient te worden. In de Europese richtlijn wordt een systolische bloeddruk < 140 mmHg geadviseerd bij ouderen > 70 jaar en tot 130 mmHg als het goed verdragen wordt. Dit met de kanttekening dat bij ouderen > 80 jaar en de kwetsbaren er minder sterk bewijs is om strikte streefwaarden te handhaven.
De meta-analyse van intensieve behandeling of strike streefwaarde uit de literatuuranalyse toont een gunstig resultaat op hart- en vaatziekten (zie Figuur H) met een redelijke GRADE. Ook is het risico op waarschijnlijke dementie mogelijk verlaagd (lage GRADE). Er is geen nieuw bewijs met betrekking tot kwetsbare ouderen.
Een trapsgewijze aanpak van verlaging van de bloeddruk lijkt dus met deze mate van bewijs te verantwoorden, waarbij afhankelijk van kwetsbaarheid, leeftijd en medische voorgeschiedenis en bijwerkingen de streefwaarden kunnen worden bepaald. Het staat de zorgverlener vrij om, in overleg met de patiënt, te bepalen hoeveel lager dan 150 mmHg de systolische bloeddruk idealiter zou moeten worden. Hierbij worden het verwachte behandelvoordeel, het optreden van bijwerkingen, kwetsbaarheid en de wensen van patiënt meegenomen in de beslissing om een lagere streefwaarde aan te houden.
Het is aangetoond dat een lage diastolische bloeddruk geassocieerd is met het risico op cardiovasculaire morbiditeit en mortaliteit bij patiënten met hart- en vaatziekten van 65 jaar en ouder. Echter, er zijn geen studies die deze resultaten hebben aangetoond bij (kwetsbare) ouderen van 70 jaar en ouder. Wel blijkt uit observationele studies bij kwetsbare ouderen dat een lage (diastolische) bloeddruk geassocieerd is met een verhoogd mortaliteitsrisico en aan verminderde functie. Verscheidene met name observationele studies hebben laten zien dat een diastolische bloeddruk onder de 60 tot 70 mmHg is geassocieerd met een hoger mortaliteitsrisico en een hoger risico op cardiale events. Er zijn aanwijzingen dat dit komt door de hoge polsdruk zelf als risicofactor en niet zozeer door bloeddruk behandeling.
In deze observationele studies is vaak sprake van confounding by indication, waardoor mogelijk een hoge mortaliteit wordt geregistreerd. In ieder geval zijn gerandomiseerde, gecontroleerde trials nodig om het effect van bloeddrukbehandeling te onderzoeken.
Duur van behandeling en follow-up
Bloeddrukverlagende behandeling moet voor onbepaalde tijd gehandhaafd worden. Bij stopzetting van de behandeling bij hypertensieve patiënten keert de bloeddruk meestal terug naar het niveau van voor de behandeling. Voor sommige patiënten, bij wie de behandeling gepaard gaat met een effectieve bloeddrukverlaging gedurende langere tijd, is het mogelijk het aantal en/of dosering van de geneesmiddelen te verlagen. Hier is vooral sprake van wanneer de bloeddrukverlaging gepaard gaat met een gezondere leefstijl en gewichtsverlies. De medicatie moet geleidelijk worden gereduceerd en de patiënt moet regelmatig worden gecontroleerd omdat de kans bestaat dat de hypertensie terugkeert.
Follow-up van patiënten wordt uitgevoerd door een team van zorgverleners. Bij een stabiele instelling (streefwaarden zijn bereikt en geen of acceptabele bijwerkingen) zijn laag frequente controles voldoende. Bij niet goed ingestelde patiënten is een hogere frequentie nodig. Het zelf meten van de bloeddruk is effectief in het verbeteren van de bloeddrukcontrole en leidt tot minder medicatiegebruik en spreekuurbezoeken. De meerwaarde van thuismetingen geldt vooral voor diegenen met een belangrijk wittejasseneffect en voor patiënten met zogeheten gemaskeerde hypertensie. Thuismeten betrekt patiënten meer bij hun behandeling en kan met behulp van telemonitoring ook op afstand plaatsvinden. Telemonitoring bij patiënten met hypertensie zorgt voor een –2,5 tot –3,5 mmHg sterkere bloeddrukdaling dan bij controlemetingen in de praktijk. De optimale frequentie voor het thuismonitoren van de bloeddruk is niet bekend. Zowel protocollen waarbij een maal per week op gestandaardiseerde momenten de bloeddruk wordt gemeten als protocollen waarbij voorafgaand aan het spreekuurbezoek een serie gestandaardiseerde metingen wordt verricht, zijn in omloop. Voor die patiënten waarbij thuismetingen moeilijk zijn, kan een 30 minuten meting in de praktijk een alternatief zijn bij de bloeddrukcontrole als er twijfel is over wittejassenhypertensie.
Definitie vitale ouderen
Ofschoon genoemde studies vitale ouderen en kwetsbare ouderen hebben geïncludeerd staat in deze module niet de definitie van wat een vitale/ kwetsbare oudere is. Hier zijn richtlijnen voor gemaakt door de NVKG, waar wij naar verwijzen (richtlijn Comprehensive Geriatric Assessment (CGA).
Samen beslissen
De inhoudelijke basis, nodig voor het samen beslissen om al dan niet met een bloeddrukverlager te starten, kan verder besproken worden op basis van een risicoscore tabel zoals die besproken wordt in module ‘Schatten van het risico op hart- en vaatziekten
Aanbevelingen
Vitale ouderen
- Streef naar de systolische bloeddruk <150 mmHg bij vitale ouderen.
- Overweeg bij het verdragen en het niet optreden van bijwerkingen van de medicatie bij vitale ouderen de systolische bloeddruk stapsgewijs nog verder te verlagen onder 140 mmHg. Monitor de bijwerkingen bij iedere controle.
- Pas de medicatie aan bij het optreden van bijwerkingen bij vitale ouderen door bijvoorbeeld het verlagen van de dosering, het switchen van medicatie of het stoppen van medicatie.
Kwetsbare ouderen
- Streef naar een systolische bloeddruk <150 mmHg bij kwetsbare ouderen onder de voorwaarde van voorzichtig titreren.
- Overweeg te stoppen met het verder intensiveren van bloeddrukverlagende behandeling en overweeg het verlagen van de dosering bij kwetsbare ouderen met een diastolische bloeddruk <70 mmHg ongeacht de hoogte van de systolische bloeddruk.
- Monitor het optreden van eventuele bijwerkingen bij kwetsbare ouderen.
De tekst van dit detail is integraal overgenomen uit het in 2017 gepubliceerde addendum (kwetsbare) ouderen bij de multidisciplinaire richtlijn CVRM. Het addendum is beschikbaar in de Richtlijnendatabase.
Inleiding
In de huidige multidisciplinaire richtlijn CVRM wordt voor alle zeventigplussers een gelijk beleid voor hypertensie geadviseerd, zonder onderscheid te maken in vitaal en kwetsbaar. Daarnaast wordt er opgemerkt dat er mogelijk overwegingen zijn om een gerichte keuze te maken voor ouderen op basis van bijwerkingenpatroon en effectiviteit.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvraag: wat is de effectiviteit van een bepaald type antihypertensiva versus een ander bij ouderen van zeventigplus met of zonder hart- en vaatziekten en met hypertensie?
P: ouderen (ouder dan zeventig jaar) met of zonder hart- en vaatziekten en met hypertensie
I: type antihypertensiva
C: type antihypertensiva
O: hart- en vaatziekten, kwaliteit van leven, functioneren, bijwerkingen, mortaliteit, bloeddruk
Relevante uitkomstmaten
De werkgroep achtte hart- en vaatziekten, kwaliteit van leven en functioneren voor de besluitvorming kritieke uitkomstmaten; en bijwerkingen, mortaliteit, bloeddruk voor de besluitvorming belangrijke uitkomstmaten.
Zoeken en selecteren (methode)
In de databases Medline (via OVID) en EMBASE (via Embase.com) is met relevante zoektermen gezocht naar systematische reviews en gerandomiseerde, gecontroleerde trials. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 369 treffers op. Onderzoeken werden geselecteerd op grond van de volgende selectiecriteria:
- systematische review met een gedetailleerde zoekstrategie, gezocht in ten minste twee databases en risico op bias-beoordeling;
- gerandomiseerde trials van patiënten met hypertensie ouder dan zeventig jaar, of patiënten met hypertensie en een gemiddelde leeftijd van zeventig jaar of ouder of een subgroepanalyse van patiënten met hypertensie van zeventig jaar of ouder waarbij verschillende typen antihypertensiva werden vergeleken.
Op basis van titel en abstract werden in eerste instantie 24 onderzoeken voorgeselecteerd. Na raadpleging van de volledige tekst werden vervolgens twintig onderzoeken geëxcludeerd (zie de exclusietabel onder het tabblad Verantwoording) en vier onderzoeken definitief geselecteerd.
Vier onderzoeken zijn opgenomen in de literatuuranalyse. In deze trials worden verschillende typen antihypertensiva met elkaar vergeleken, waardoor het niet mogelijk was om de data te poolen. De belangrijkste onderzoekskarakteristieken en resultaten zijn opgenomen in de evidence-tabellen. De beoordeling van de individuele onderzoeksopzet (risk of bias) is opgenomen in de risk of bias-tabellen.
Samenvatting van de literatuur
Beschrijving van de onderzoeken
I. Ouderen met of zonder hart- en vaatziekten
Vergelijking tussen calciumantagonist en diureticum
Saruta (2015) en Ogihara (2014) vergeleken de cardiovasculaire effecten van olmesartan gecombineerd met een calciumantagonist of een diureticum in een prospectieve, gerandomiseerde, open-label, geblindeerde eindpunttrial. Patiënten in de leeftijd van 65 tot 85 jaar met een geschiedenis van hart- en vaatziekten of met risicofactoren voor hart- en vaatziekten kwamen in aanmerking wanneer de bloeddruk meer dan 140 over 90 mmHg was onder behandeling voor hypertensie of een bloeddruk van 160 over 100 mmHg bij geen behandeling. In totaal deden 5141 patiënten mee aan de trial, van wie 2568 olmesartan met een calciumantagonist en 2573 olmesartan met een diureticum kregen. In de eerste groep waren 46 (2%) patiënten lost to follow-up en in de tweede groep 72 (3%). De redenen voor lost to follow-up waren niet bekend. De gemiddelde follow-up was 3,3 jaar.
Vergelijking tussen ACE-remmer en diureticum
Wing (2003) ondernam een prospectieve, gerandomiseerde, open-label, geblindeerde eindpunttrial ter vergelijking van de uitkomsten bij ouderen met hypertensie behandeld met ACE-remmers of met diuretica. Patiënten met hypertensie in de leeftijd van 65 tot 84 jaar onder behandeling bij een huisartsenpraktijk kwamen in aanmerking wanneer de systolische bloeddruk hoger dan 160 mmHg was of wanneer ze ten minste een diastolische bloeddruk van 90 mmHg hadden en geen hart- en vaatziekten in de laatste zes maanden hadden gehad. In totaal kregen 3044 patiënten een ACE-remmer en 3039 een diureticum. Minder dan 5% in beide groepen waren lost to follow-up. De redenen voor lost to follow-up waren niet bekend. De mediane follow-up was 4,1 jaar.
Vergelijking tussen bètablokker met diureticum en calciumantagonist
Benetos (2000) vergeleek de effectiviteit en veiligheid van een bisoprolol/hydrochlorothiazidecombinatie met die van de calciumantagonist amlodipine in de initiële behandeling van oudere patiënten met geïsoleerde systolische hypertensie. De auteurs ondernamen daartoe een dubbel geblindeerde, gerandomiseerde, multicenter-trial. Patiënten met hartfalen, beroerte of myocardinfarct in de afgelopen drie maanden kwamen niet in aanmerking, naast patiënten die aan een reeks van andere exclusiecriteria voldeden. In totaal werden 164 patiënten geïncludeerd, van wie 84 patiënten eenmaal daags in de ochtend 2,5 mg bisoprolol/6,25 mg hydrochlorothiazide kregen en tachtig patiënten eenmaal daags 5 mg amlodipine in de ochtend. De behandeling werd voor totaal twaalf weken gegeven.
Resultaten
Hart- en vaatziekten
Vergelijking tussen calciumantagonist en diureticum
In de trial van Saruta (2015) en Ogihara (2014) werden hart- en vaatziekten met een samengesteld eindpunt gemeten van zowel fatale als niet-fatale events. In totaal kregen 116 (5%) patiënten hart- en vaatziekten bij gebruik van olmesartan met een calciumantagonist vergeleken met 135 (5%) patiënten bij gebruik van olmesartan met een diureticum. De frequentie om een event te krijgen gedurende de trial was potentieel 17% verlaagd bij gebruik van olmesartan met een calciumantagonist (HR 0,83; 95%-BI 0,65 tot 1,07).
Vergelijking tussen ACE-remmer en diureticum
Ook in de trial van Wing (2003) werden hart- en vaatziekten met een composiet eindpunt van fatale en niet-fatale events gemeten. Uit de ACE-remmergroep kregen 394 (13%) patiënten hart- en vaatziekten vergeleken met 429 (14%) patiënten uit de diureticumgroep. Het risico om gedurende de trial een event te krijgen was daarmee 11% lager bij gebruik van een ACE-remmer vergeleken met een diureticum (HR 0,89; 95%-BI 0,79 tot 1,00).
Vergelijking tussen bètablokker met diureticum en calciumantagonist
Benetos (2000) rapporteerde geen gegevens over het risico op hart- en vaatziekten.
Kwaliteit van leven
Saruta (2015), Ogihara (2014) en Wing (2003) rapporteerden geen gegevens over kwaliteit van leven.
Vergelijking tussen bètablokker met diureticum en calciumantagonist
Benetos (2000) heeft kwaliteit van leven beoordeeld aan de hand van een vragenlijst met 22 vragen. De mogelijke score liep uiteen van 22 tot maximaal 88, waarbij een hogere score een indicatie is voor een betere kwaliteit van leven. Resultaten werden alleen in een figuur weergegeven (figuur 20). Beide behandelarmen gaven een verbetering in kwaliteit van leven aan. Deze toename was echter niet verschillend tussen de gebruikte medicamenten.
Functioneren
Saruta (2015), Ogihara (2014), Wing (2003) en Benetos (2000) rapporteerden geen gegevens over kwaliteit van leven.
Bijwerkingen
Vergelijking tussen calciumantagonist en diureticum
Saruta (2015) en Ogihara (2014) rapporteerden ernstige bijwerkingen gerelateerd aan de medicatie. Hierbij ging het om gastro-intestinale stoornissen, aritmie, nierfunctiestoornissen en overige bijwerkingen. Alleen bij overige bijwerkingen waren de aantallen echter groter dan vijf. Bij gebruik van olmesartan met calciumantagonist kregen 5 (0,2%) patiënten een bijwerking gerelateerd aan de gebruikte medicatie vergeleken met 16 (0,6%) bij gebruik van olmesartan en een diureticum (p = 0,02).
Vergelijking tussen ACE-remmer en diureticum
Wing (2003) rapporteerde geen gegevens over mogelijke bijwerkingen.
Vergelijking tussen bètablokker met diureticum en calciumantagonist
Benetos (2000) observeerde dat 48 (58%) patiënten een bijwerking kregen uit de bisoprolol/hydrochlorothiazidegroep en 65 (84%) uit de amlodipinegroep. Hiermee was het risico op een bijwerking 31% lager bij gebruik van bisoprolol/hydrochlorothiazide (RR 0,69; 95%-BI 0,56 tot 0,84).
Mortaliteit
Vergelijking tussen calciumantagonist en diureticum
In de trials van Saruta (2015) en Ogihara (2014) kwamen in totaal 140 patiënten te overlijden. Tijdens het gebruik van olmesartan met calciumanatagonist overleden 64 (3%) patiënten en tijdens het gebruik van olmesartan met diurecticum 76 (3%) patiënten. De frequentie om te overlijden gedurende de trial was daarmee potentieel 17% lager bij gebruik van olmesartan met calciumantagonist dan bij olmesartan met een diurecticum (HR 0,83; 95%-BI 0,59 tot 1,15).
Vergelijking tussen ACE-remmer en diureticum
Wing (2003) observeerden gedurende het onderzoek dat 195 (6%) patiënten die een ACE-remmer gebruikten kwamen te overlijden en 210 (7%) patiënten uit de diureticumgroep. Het risico om gedurende de trial te overlijden bij gebruik van een ACE-remmer was potentieel 10% verlaagd vergeleken met een diurecticum (HR 0,90; 95%-BI 0,75 tot 1,09).
Vergelijking tussen bètablokker met diureticum en calciumantagonist
Benetos (2000) rapporteerde geen gegevens over mortaliteit.
Bloeddruk
Vergelijking tussen calciumantagonist en diureticum
Saruta (2015) en Ogihara (2014) observeerden dat de gemiddelde afname in systolisch en diastolische bloeddruk ten opzichte van baseline niet verschillend was. Het ging hierbij om een systolisch bloeddrukafname van 24,4 (sd 16,4) versus 24,9 (sd 17,3) en een diastolische bloeddrukafname van 13,8 (sd 12,0) versus 13,7 (sd 12,4).
Vergelijking tussen ACE-remmer en diureticum
Wing (2003) rapporteerde na een jaar, na drie jaar en na vijf jaar de gemiddeld afname in systolische en diastolische bloeddruk ten opzichte van baseline. Op alle drie de tijdspunten verschilde de afname in bloeddruk niet tussen ACE-remmer en diurecticum. Na vijf jaar was in beide groepen de afname in bloeddruk 26 mmHg systolisch en 12 mmHg diastolisch.
Vergelijking tussen bètablokker met diureticum en calciumantagonist
Benetos (2000) heeft het effect op klinische en 24-uursbloeddruk gemeten ten opzichte van baseline. De resultaten zijn in tabel 40 weergegeven. Potentieel verlaagt bisoprolol/hydrochlorothiazide de bloeddruk meer dan amlodipine.
| Medicament | Klinische bloeddruk, mmHg | 24-uursbloeddruk, mmHg | ||
|---|---|---|---|---|
| Systolisch* | Diastolisch* | Systolisch* | Diastolisch* | |
| Bisoprolol/hydrochlorothiazide | -20,0 (13,7) | -4,5 (7,4) | -12,2 (12,3) | -8,4 (6,5) |
| Amlodipine | -19,6 (14,2) | -2,4 (8,4) | -8,1 (13,0) | -3,6 (7,4) |
| * Gemiddelden met standaarddeviaties | ||||
Bewijskracht van de literatuur
Hart- en vaatziekten: de bewijskracht voor de uitkomstmaat hart- en vaatziekten is met twee niveaus verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias; onduidelijkheid over blindering) en het geringe aantal events (imprecisie).
Kwaliteit van leven: de bewijskracht voor de uitkomstmaat kwaliteit van leven is met twee niveaus verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias; onduidelijkheid over blindering) en het geringe aantal patiënten (imprecisie).
Functioneren: vanwege het ontbreken van bewijs is het niet mogelijk om de bewijskracht voor de uitkomstmaat functioneren te graderen.
Bijwerkingen: de bewijskracht voor de uitkomstmaat bijwerkingen is met drie niveaus verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias, onduidelijkheid over blindering) en het geringe aantal patiënten (imprecisie).
Mortaliteit: de bewijskracht voor de uitkomstmaat mortaliteit is met één niveau verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias, onduidelijkheid over blindering).
Bloeddruk: de bewijskracht voor de uitkomstmaat bloeddruk is met één of twee niveaus verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias, onduidelijkheid over blindering) en in het geval van Benetos (2000) het geringe aantal patiënten.
Conclusie
| Hart- en vaatziekten | |
| Laag GRADE |
Vergelijking tussen een calciumantagonist en een diureticum Het risico op hart- en vaatziekten was niet verlaagd bij gebruik van een calciumantagonist vergeleken met een diureticum bij oudere patiënten met hypertensie. |
| Bronnen: Saruta 2015, Ogihara 2014 | |
| Laag GRADE |
Vergelijking tussen een ACE-remmer en een diureticum Het risico op hart- en vaatziekten was minimaal verlaagd bij gebruik van een ACE-remmer vergeleken met een diureticum bij oudere patiënten met hypertensie. |
| Bron: Wing 2003 |
| Kwaliteit van leven | |
| Laag GRADE |
Vergelijking tussen een bètablokker met een diureticum en een calciumantagonist Het effect op kwaliteit van leven is niet verschillend bij gebruik van een bètablokker en diureticumcombinatie vergeleken met een calciumantagonist bij oudere patiënten met hypertensie |
| Bron: Benetos 2000 | |
| Functioneren | |
| - GRADE | Vanwege het ontbreken van bewijs is het niet mogelijk een conclusie te formuleren over het effect van verschillende antihypertensiva op het functioneren bij oudere patiënten met hypertensie. |
| Bijwerkingen | |
| Zeer laag GRADE |
Vergelijking tussen een calciumantagonist en een diureticum Het risico op een ernstige aan de medicatie gerelateerde bijwerking is mogelijk verlaagd bij gebruik van een calciumantagonist vergeleken met een diureticum bij oudere patiënten met hypertensie. |
| Bronnen: Saruta 2015, Ogihara 2014 |
| Zeer laag GRADE |
Vergelijking tussen een bètablokker met een diureticum en een calciumantagonist Het risico op een bijwerking is verhoogd bij gebruik van een bètablokker tezamen met een diureticum vergeleken met een calciumantagonist bij oudere patiënten met hypertensie. |
| Bron: Benetos 2000 |
| Mortaliteit | |
| Matig GRADE |
Vergelijking tussen een calciumantagonist en een diureticum Het risico op overlijden gedurende het onderzoek was niet noemenswaardig verlaagd bij gebruik van een calciumantagonist vergeleken met een diureticum bij oudere patiënten met hypertensie. |
| Bronnen: Saruta 2015, Ogihara 2014 | |
| Matig GRADE |
Vergelijking tussen een ACE-remmer en een diureticum Het risico op overlijden gedurende het onderzoek was niet verlaagd bij gebruik van een ACE-remmer vergeleken met een diureticum bij oudere patiënten met hypertensie. |
| Bron: Wing 2003 |
| Matig GRADE |
Vergelijking tussen een calciumantagonist en een diureticum Het effect op de bloeddruk verschilt niet tussen een calciumantagonist en een diureticum bij oudere patiënten met hypertensie. |
| Bronnen: Saruta 2015, Ogihara 2014 |
| Matig GRADE |
Vergelijking tussen een ACE-remmer en een diureticum Het effect op bloeddruk verschilt niet tussen een ACE-remmer en diureticum bij oudere patiënten met hypertensie. |
| Bron: Wing 2003 |
| Laag GRADE |
Vergelijking tussen een bètablokker met een diureticum en een calciumantagonist Gebruik van een bètablokker met een diureticum lijkt de bloeddruk meer te verlagen dan een calciumantagonist bij oudere patiënten met hypertensie. |
| Bron: Benetos 2000 |
II. Ouderen met hart- en vaatziekten
Cowley (2000) onderzocht in een prospectieve, gerandomiseerde, dubbel geblindeerde trial kwaliteit van leven bij ouderen met symptomatisch hartfalen die of een angiotensinereceptorblokker (losartan) kregen of een ACE-remmer (captopril). In totaal deden patiënten uit de Verenigde Staten mee. Patiënten kregen eenmaal daags 12,5 mg losartan, getitreerd naar 50 mg eenmaal daags of driemaal daags captopril, getitreerd tot 50 mg driemaal daags. In totaal kregen 147 patiënten losartan en 153 patiënten captopril. De trial was gesponsord door de industrie en auteurs waren in dienst bij de sponsor of werden betaald voor consultaties door de sponsor. De behandeling werd voor 48 weken gegeven.
Resultaten
Hart- en vaatziekten
Cowley (2000) rapporteerde geen gegevens over het risico op hart- en vaatziekten.
Kwaliteit van leven
Kwaliteit van leven werd met twee vragenlijsten onderzocht, de hartfalen ziekte specifieke kwaliteit van leven vragenlijst (LIhFE) en een meer algemene vragenlijsten (SIP). Gegevens werden alleen in figuren gerapporteerd (figuur 21 en 22). Uit beide resultaten bleek er geen verschil in kwaliteit van leven te zijn bij gebruik van losartan of captopril.
Functioneren
Cowley (2000) rapporteerde geen gegevens over functioneren.
Bijwerkingen
Cowley (2000) rapporteerde geen gegevens over bijwerkingen.
Mortaliteit
Cowley (2000) rapporteerde geen gegevens over mortaliteit.
Bloeddruk
Cowley (2000) rapporteerde geen gegevens over bloeddruk.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat kwaliteit van leven is met twee niveaus verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias, onduidelijkheid over blindering en verschil in lost to follow-up).
Vanwege het ontbreken van bewijs is het niet mogelijk de bewijskracht te graderen voor de uitkomsten hart- en vaatziekten, functioneren, bijwerkingen, mortaliteit en bloeddruk.
Conclusie
| Laag GRADE | Er is geen verschil in het effect op kwaliteit van leven bij gebruik van een angiotensinereceptorblokker (losartan) of een ACE-remmer bij oudere patiënten met hartfalen en hypertensie. |
| Bron: Cowley 2000 |
| - GRADE | Vanwege het ontbreken van bewijs is het niet mogelijk een conclusie te formuleren over het effect van verschillende typen antihypertensiva op de uitkomsten hart- en vaatziekten, functioneren, bijwerkingen, mortaliteit en bloeddruk. |
Overwegingen
Uit bovenstaande onderzoeken komt niet naar voren dat er een voorkeursmiddel is voor ouderen boven de zeventig jaar. Er zijn echter weinig onderzoeken beschikbaar en er zijn geen gerichte onderzoeken gedaan bij kwetsbare ouderen. Gezien de afwezigheid van bewijs en het kleine aantal onderzoeken bij ouderen boven de zeventig jaar, hebben we nu geen reden om af te wijken van de huidige CVRM-richtlijn. Bloeddrukverlaging is het belangrijkste doel en het type middel zal afhangen van de comorbiditeit van de desbetreffende persoon met hypertensie.
Wel adviseert de werkgroep zo veel mogelijk eenmaal daags te doseren en het aantal middelen te beperken tot bij voorkeur twee en maximaal drie typen ter bevordering van de kwaliteit van leven en therapietrouw. Gezien de veranderde fysiologie van (kwetsbare) ouderen is het ook raadzaam om het start-low-go-slow-principe te hanteren met monitoring van bloeddruk en bijwerkingen.
Wat betreft bijwerkingen adviseren wij alfa- of bètablokkers zo veel mogelijk te vermijden, mits de comorbiditeit dit toelaat, gezien het hoge risico op orthostatische hypotensie en het daaraan verbonden valrisico. Bij het starten van een thiazidediureticum is het raadzaam om de elektrolyten te controleren.
Aanbeveling
Vitale en kwetsbare ouderen:
- Kies voor een passend antihypertensivum in relatie tot de comorbiditeit bij een (kwetsbare) oudere.
- Vermijd zo mogelijk het gebruik van alfa- of bètablokkers voor de enkelvoudige indicatie hypertensie bij (kwetsbare) ouderen wegens frequent optreden van ongewenste bijwerkingen (zoals orthostatische hypotensie).
De tekst van dit detail is integraal overgenomen uit het in 2017 gepubliceerde addendum (Kwetsbare) ouderen bij de multidisciplinaire richtlijn CVRM. Het addendum is beschikbaar in de Richtlijnendatabase.
Inleiding
Veel (kwetsbare) ouderen hebben hypertensie en worden hiervoor behandeld met antihypertensiva, met als belangrijkste oogmerk een reductie van vasculaire eindpunten en sterfte. Deze patiëntengroep is echter at risk voor het optreden van ongewenste effecten, zoals bijwerkingen van de medicatie, hypotensie, vallen of afname van het cognitieve functioneren. Het langetermijndoel van preventie van vasculaire complicaties is bij deze groep vaker onduidelijk, door bijvoorbeeld comorbiditeit of een beperkte levensverwachting. Mogelijk zijn kwetsbare ouderen juist gebaat bij een hogere bloeddruk. Wat is bekend over staken van antihypertensiva bij (kwetsbare) ouderen?
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvraag: wat is de effectiviteit van het stoppen vergeleken met het doorgaan van antihypertensiva bij (kwetsbare) ouderen?
P: ouderen (ouder dan zeventig jaar) met of zonder hart- en vaatziekten in de voorgeschiedenis die behandeld worden met antihypertensiva
I: stoppen met antihypertensiva
C: doorgaan met antihypertensiva
O: kwaliteit van leven, hart- en vaatziekten (myocardinfarct, hartfalen, herseninfarct, hersenbloeding), mortaliteit, (cognitief) functioneren, bloeddruk, ziektevrije overleving
Relevante uitkomstmaten
De werkgroep achtte kwaliteit van leven en functioneren voor de besluitvorming kritieke uitkomstmaten; en hart- en vaatziekten, totale mortaliteit en ziektevrije overleving voor de besluitvorming belangrijke uitkomstmaten.
Zoeken en selecteren (methode)
In de databases Medline (OVID) en EMBASE is met relevante zoektermen gezocht naar systematische reviews, gerandomiseerd gecontroleerde trials en observationeel onderzoek. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 431 treffers op. Onderzoeken werden geselecteerd op grond van de volgende selectiecriteria:
- systematische reviews (gezocht in ten minste twee databases, gedetailleerde zoekstrategie beschikbaar en risk of bias-beoordeling);
- gerandomiseerde trials van patiënten ouder dan zeventig jaar, of patiënten met een gemiddelde leeftijd van zeventig jaar of ouder of een subgroepanalyse van patiënten van zeventig jaar of ouder die behandeld werden met antihypertensiva en waarin een vergelijking werd gemaakt tussen stoppen met de antihypertensiva en doorgaan met antihypertensiva.
Op basis van titel en abstract werden in eerste instantie 21 onderzoeken voorgeselecteerd. Na raadpleging van de volledige tekst werden vervolgens twintig onderzoeken geëxcludeerd (zie de exclusietabel onder het tabblad Verantwoording) en één onderzoek definitief geselecteerd.
Eén onderzoek is opgenomen in de literatuuranalyse. De belangrijkste onderzoekskarakteristieken en resultaten zijn opgenomen in de evidence-tabellen. De beoordeling van de individuele onderzoeksopzet (risk of bias) is opgenomen in de risk of bias-tabellen.
Samenvatting van de literatuur
Beschrijving van de onderzoeken
Moonen (2015) onderzocht het effect van stoppen met antihypertensiva op onder andere (cognitief) functioneren (cognition compound score, Groningen Activity Restriction Scale), kwaliteit van leven (Cantril-ladder) en verandering in systolische en diastolische bloeddruk bij ouderen (> 75 jaar; n = 385) zonder serieuze cardiovasculaire aandoeningen en een systolische bloeddruk ≤ 160 m Hg, maar met milde cognitieve beperkingen (Mini-Mental State Examination-score tussen de 21 en 27). Honderdnegenennegentig participanten werden gerandomiseerd naar de interventiegroep en 186 naar de controlegroep. De interventie bestond uit het in zes weken verminderen (of helemaal stoppen) van de antihypertensiva tot de systolische bloedruk met 20 mmHg was gestegen. De arts van de participant bepaalde elke week de bloeddruk totdat een stabiel niveau van de antihypertensiva bereikt was. Bij 45 van de 199 participanten uit de interventiegroep werden de antihypertensiva niet verminderd, in de meeste gevallen in verband met een medische reden (bijvoorbeeld omdat de bloeddruk boven de veiligheidslimiet uit kwam). De controlegroep bleef gedurende de onderzoeksperiode antihypertensiva gebruiken. Zestien weken na randomisatie werd het effect van de interventie bepaald.
Resultaten
Hart- en vaatziekten
Moonen (2015) rapporteerde dat zowel in de interventie als in de controlegroep er één participant een myocardinfarct en één participant een TIA had doorgemaakt. Daarnaast was er bij één van de participanten sprake van een beroerte. Gezien dit kleine aantal patiënten met de uitkomst is het niet mogelijk om het effect van stoppen met antihypertensiva op hart- en vaatziekten te bepalen.
Kwaliteit van leven
Moonen (2015) heeft de kwaliteit van leven bepaald met behulp van de Cantril-ladder. Participanten konden tussen 1 en 10 punten scoren en hogere scores duiden op een betere kwaliteit van leven. Moonen rapporteerde dat de groepen zestien weken na randomisatie niet van elkaar verschilden in de scores voor de kwaliteit van leven (gemiddeld verschil -0,09; 95%-BI -0,34 tot 0,16).
Functioneren
Moonen (2015) heeft de scores van zes tests (Mini-Mental State Examination-score, Trail Making Test parts A and B, Interference score of the abbreviated Stroop Color-Word test, Immediate and Delayed Recall performance on the 15-word Verbal Learning Test, Visual Association Test, Letter Digit Substitution Test) gecombineerd om tot één overkoepelende maat voor cognitief functioneren te komen. De ruwe scores van elke test werden omgezet naar gestandaardiseerde z-scores ((testscoregemiddelde)/standaarddeviatie) en deze z-scores werden gemiddeld. Dagelijks functioneren werd bepaald met de Groningen Activity Restriction Scale, waarop tussen de 18 en 72 punten kan worden gescoord en waarbij hogere scores duiden op een slechter functioneren.
Moonen (2015) rapporteerde dat de groepen zestien weken na randomisatie niet van elkaar verschilden in cognitief functioneren (cognition compound score gemiddeld verschil = 0,02; 95%-BI -0,19 tot 0,23). Ook in functionele status (Groningen Activity Restriction Scale) werd er geen verschil tussen de groepen gevonden (gemiddeld verschil -0,72; 95%-BI -1,52 tot 0,09).
Mortaliteit
Moonen (2015) rapporteerde dat in beide groepen één participant tijdens het onderzoek was overleden. Het is gezien dit kleine aantal cases gerapporteerd in Moonen (2015) niet mogelijk om het effect van discontinueren van de behandeling op de mortaliteit te bepalen.
Bloeddruk
Moonen (2015) rapporteerde dat zowel de systolische als diastolische bloeddruk zestien weken na randomisatie significant hoger was bij de groep waarin de antihypertensiva werd verminderd (systolische bloeddruk gemiddeld verschil 7,36 mmHg 95%-BI 3,02 tot 11,69; diastolische bloeddruk gemiddeld verschil 2,63 mmHg 95%-BI 0,34 tot 4,93).
Ziektevrije overleving
Moonen (2015) heeft geen data over ziektevrije overleving gerapporteerd.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaten hart- en vaatziekten, mortaliteit en ziektevrije overleving kan niet worden gegradeerd gezien het kleine aantal events of vanwege het ontbreken van data.
De bewijskracht voor de uitkomstmaten kwaliteit van leven, functioneren en bloeddruk is met drie niveaus verlaagd gezien het risk of bias (patiënten en artsen waren niet geblindeerd), indirectheid (inclusie van patiënten met milde cognitieve beperking) en imprecisie (kleine aantal participanten).
Conclusie
| - GRADE | Vanwege het ontbreken van data is het niet mogelijk een conclusie te trekken over het effect van het staken of verminderen van de antihypertensiva vergeleken met het continueren van de antihypertensiva op hart- en vaatziekten, mortaliteit en ziektevrije overleving. |
| Bron: Moonen 2015 |
| Kwaliteit van leven | |
| Zeer laag GRADE | Het staken of verminderen van de antihypertensiva heeft ten opzichte van het continueren van de antihypertensiva geen effect op de kwaliteit van leven op de korte termijn. |
| Bron: Moonen 2015 | |
| Functioneren | |
| Zeer laag GRADE | Het staken of verminderen van de antihypertensiva heeft ten opzichte van het continueren van de antihypertensiva geen effect op de functioneren op de korte termijn. |
| Bron: Moonen 2015 | |
| Bloeddruk | |
| Zeer laag GRADE | Het staken of verminderen van de antihypertensiva zorgt ten opzichte van het continueren van antihypertensiva voor een verhoging van systolische en diastolische bloeddruk. |
| Bron: Moonen 2015 | |
Overwegingen
Voor kwetsbare ouderen dient een belangrijke plaats ingeruimd te worden voor veiligheidsaspecten van behandeling van hoge bloeddruk. Observationele onderzoeken maken melding van vaker optreden van onder andere orthostatische hypotensie, duizeligheid, vallen, elektrolytstoornissen en cognitieve achteruitgang als gevolg van bloeddrukverlagende behandeling. Hiermee gepaard gaand functieverlies is bij deze populatie extra belangrijk, aangezien kwaliteit van leven, functiebehoud en behoud van autonomie zwaarder wegen dan het verlies van levensjaren. De eventueel te verwachten winst van behandeling met antihypertensiva in de vorm van afname van cardiovasculaire en cerebrovasculaire eindpunten is bij kwetsbare ouderen minder duidelijk voorspelbaar, en dient hiertegen te worden afgewogen bij de individuele patiënt. Vanwege het ontbreken van bewijs krijgt de voorkeur van de patiënt meer gewicht in behandelbeslissingen. Shared decision making is hierbij belangrijk. Eventuele interacties met andere medicamenten dienen goed bewaakt te worden en moeten worden meegenomen in de beslissing om al of niet antihypertensiva te continueren.
In het DANTE-onderzoek van Moonen (2015) werd geen effect gevonden van het staken van antihypertensiva op cognitieve en functionele uitkomstmaten. De follow-upduur was echter beperkt (zestien weken) en het is niet uitgesloten dat dergelijke effecten op een langere termijn of bij een meer kwetsbare populatie wél optreden. In deze groep werd niet onderzocht of er door staken van antihypertensiva een afname is van orthostatische hypotensie of vallen. Ook kon geen uitspraak gedaan worden over een effect van staken van een specifieke klasse van antihypertensiva.
Er is meer gerandomiseerd onderzoek met een langere follow-up nodig om te bepalen of (kwetsbare) ouderen baat hebben bij minder stringente streefwaarden van de bloeddruk.
Aanbevelingen
Vitale ouderen:
- Stop het gebruik van antihypertensiva niet bij vitale ouderen, tenzij er hinderlijke bijwerkingen zijn. Voor meer advies over bijwerkingen bij ouderen verwijst de werkgroep naar het Farmaceutisch Kompas.
Kwetsbare ouderen:
- Stop laagdrempelig met antihypertensiva bij kwetsbare ouderen bij het optreden van een mogelijke bijwerking of bij een geringe geschatte resterende levensverwachting.
Aanbevelingen
Naar Samenvatting ›Bij personen ≤70 jaar
- Streef naar een systolische bloeddruk < 140 mmHg.
- Streef naar een lagere systolische bloeddruk tot < 130 mmHg, indien de medicatie goed verdragen wordt, met name bij personen met een hoger risico op hart- en vaatziekten door bijvoorbeeld een comorbiditeit als chronische nierschade of diabetes mellitus.
Vitale ouderen
- Streef naar een systolische bloeddruk < 150 mmHg bij niet-kwetsbare ouderen.
- Overweeg bij het verdragen en het niet optreden van bijwerkingen van de medicatie bij vitale ouderen de systolische bloeddruk stapsgewijs nog verder te verlagen onder 140 mmHg. Monitor de bijwerkingen bij iedere controle.
- Pas de medicatie aan bij het optreden van bijwerkingen bij vitale ouderen door bijvoorbeeld het verlagen van de dosering, het switchen van medicatie of het stoppen van medicatie.
Kwetsbare ouderen
- Streef naar een systolische bloeddruk < 150 mmHg bij kwetsbare ouderen onder de voorwaarde van voorzichtig titreren.
- Overweeg te stoppen met het verder intensiveren van bloeddrukverlagende behandeling en overweeg het verlagen van de dosering bij kwetsbare ouderen met een diastolische bloeddruk < 70 mmHg ongeacht de hoogte van de systolische bloeddruk.
- Monitor het optreden van eventuele bijwerkingen bij kwetsbare ouderen.
Medicamenteuze behandeling
Naar Samenvatting ›In principe worden voor de standaardbehandeling van hypertensie alle 4 de klassen bloeddrukverlagers aanbevolen: diuretica, calciumantagonisten, RAS-remmers (ACE-remmers/angiotensinereceptorblokkers (ARB)) en bètablokkers. (zie ook figuur 1).
- Bètablokkers zijn relatief gecontra-indiceerd bij een verhoogd risico op diabetes mellitus (bijvoorbeeld bij overgewicht of een verhoogde glucosewaarde).
- Vaak is combinatietherapie nodig om de streefwaarde te bereiken. De combinaties van bètablokker met diureticum (risico op diabetes) en ACE-remmer met ARB (risico op nierfalen) worden niet standaard aanbevolen.
- Andere dan de 4 genoemde klassen bloeddrukverlagers zijn reservemiddelen en worden alleen aanbevolen in combinatie met ≥ 1 medicijn uit de 4 hoofdklassen.
- Eenvoudige doseerregimes (middelen met een lange werkingsduur en combinatietabletten) zijn belangrijk voor therapietrouw. Met combinatiemiddelen kan eventueel worden gestart bij een sterk verhoogde aanvangsbloeddruk en/of een sterk verhoogd cardiovasculair risico.
Voor voorkeursmiddelen in specifieke situaties, zie tabel 7.
Figuur 1 Strategie voor medicamenteuze bloeddrukverlaging nadat in overleg met de patiënt is besloten antihypertensiva voor te schrijven. Deze strategie is ook geschikt voor de meeste patiënten met orgaanschade door hypertensie, diabetes mellitus, cerebrovasculaire ziekte of perifere arteriële ziekte.
| Situatie | Bloeddrukverlagend middel |
|---|---|
| Eerder myocardinfarct | Bètablokker, ACE-remmer/ARB |
| Angina pectoris | Bètablokker, calciumantagonist |
| Hartfalen | ACE-remmer/ARB, bètablokker, lis- of thiazidediureticum, kaliumsparend diureticum*/mineralocorticoïdantagonist |
| Atriumfibrilleren | Bètablokker, non-dihydropyridinecalciumkanaalblokker, ACE-remmer/ARB, kaliumsparend diureticum*/mineralocorticoïdantagonist |
| Perifeer arterieel vaatlijden | ACE-remmer |
| Diabetes mellitus | ACE-remmer/ARB |
| Zwangerschap | Methyldopa, labetalol, calciumantagonist |
| Afrikaanse herkomst (sub-Sahara) | Thiazidediureticum en calciumantagonist |
ACE = angiotensineconverterend enzym; ARB = angiotensinereceptorblokker * Amiloride, spironolacton, eplerenon | |
Uitgangsvraag
Op welke manier moet een verhoogde bloeddruk behandeld worden?
Zoeken en selecteren
Om deze uitgangsvraag met deelvragen te kunnen beantwoorden is gebruik gemaakt van de Europese richtlijn Cardiovascular Disease Prevention in Clinical Practice uit 2021 en de richtlijn Hypertensie in de 2e en 3e lijn. Voor alle ondergenoemde adviezen geldt dat er ruimte is om patiëntvoorkeuren mee te nemen in de behandelkeuze (samen beslissen).
Overwegingen
Leefstijl
Voor algemene adviezen met betrekking tot leefstijl wordt naar de details over leefstijl en naar de Praktijkhandleiding Leefstijl verwezen. Het verminderen van de hoeveelheid diëtair zout is een effectieve manier om de bloeddruk te verlagen en is groter naarmate de bloeddruk hoger is. Daarnaast versterkt een diëtaire zoutbeperking het effect van verschillende bloeddrukverlagende geneesmiddelen. Eerder onderzoek heeft laten zien dat zoutbeperking ook beschermend is voor het krijgen van hart- en vaatziekten. In Nederland is 80% van het diëtaire zout in de voeding verwerkt , wat een effectieve diëtaire zoutreductie lastig maakt. Het niet meer toevoegen van extra zout en het vermijden van voedingsmiddelen die veel zout bevatten, maakt een matige zoutreductie van 50 mmol (of 3 gram natriumchloride = 3 gram keukenzout) per dag haalbaar en brengt, gemiddeld genomen, een zoutbeperking van 6 gram per dag (= 2 gram keukenzout) binnen handbereik. Daarbij kan het gebruik van kaliumzout ondersteunend zijn. Daarnaast dragen gewichtsreductie en meer bewegen bij aan het verder verlagen van de bloeddruk.
Bloeddrukverlagende geneesmiddelen
Het grote aantal gerandomiseerde onderzoeken naar bloeddrukverlagende behandelingen, zowel die waarin actieve behandeling werd vergeleken met placebo als de onderzoeken die verschillende bloeddrukverlagende geneesmiddelen vergeleken bevestigen dat (i) het voornaamste voordeel van bloeddrukverlagende behandeling is gelegen in het verlagen van de bloeddruk op zich, en dat dit grotendeels los staat van de gebruikte geneesmiddelen; (ii) thiazide en thiazideachtige diuretica (chloortalidon en indapamide), calciumantagonisten, ACE-remmers en ARB's de bloeddruk adequaat kunnen verlagen en het risico op hart- en vaatziekten verminderen.
Thiazide(achtige) diuretica, calciumantagonisten en ACE-remmers/ARB’s worden allen aanbevolen voor het behandelen van hypertensie als monotherapie of in combinatie (met uitzondering van de combinatie ACE-remmer en ARB). Geneesmiddelen die als combinatiepreparaat gegeven kunnen worden en een lange werkingsduur hebben de voorkeur. Vereenvoudiging van de behandeling verbetert de therapietrouw en effectieve 24-uursbloeddrukcontrole is prognostisch belangrijk.
Specifieke indicaties
Bij de behandeling van ongecompliceerde hypertensie zijn bètablokkers minder effectief gebleken. Voor specifieke indicaties worden bètablokkers echter nog steeds aanbevolen. Ook voor andere bloeddrukverlagende klassen bestaat, afhankelijk van het indicatiegebied, een voorkeur die bepaald wordt door etnische afkomst, of een bijkomende aandoening (Tabel 34). Voor de behandeling van hypertensie bij patiënten met chronische nierschade (CNS) wordt verwezen naar de betreffende richtlijn (NHG-standaard en medisch-specialistische richtlijn). In het algemeen is er geen bewijs beschikbaar dat leeftijd of geslacht een andere keuze rechtvaardigen (behalve dat voorzichtigheid is geboden bij gebruik van ACE-R's en ARB's door vrouwen in de vruchtbare leeftijd vanwege mogelijk teratogene effecten).
| Situatie | Bloeddrukverlagend middel |
|---|---|
| Eerder myocardinfarct | Bètablokker, ACE-remmer/ARB |
| Angina pectoris | Bètablokker, calciumantagonist |
| Hartfalen | ACE-remmer/ARB, bètablokker, lis- of thiazidediureticum, kaliumsparend diureticum*/mineralocorticoïdantagonist |
| Atriumfibrilleren | Bètablokker, non-dihydropyridinecalciumkanaalblokker, ACE-remmer/ARB, kaliumsparend diureticum*/mineralocorticoïdantagonist |
| Perifeer arterieel vaatlijden | ACE-remmer |
| Diabetes mellitus | ACE-remmer/ARB |
| Zwangerschap | Methyldopa, labetalol, calciumantagonist |
| Afrikaanse herkomst (sub-Sahara) | Thiazidediureticum en calciumantagonist |
ACE = angiotensineconverterend enzym; ARB = angiotensinereceptorblokker * Amiloride, spironolacton, eplerenon | |
Adviezen bij RAS-remmers en/of diuretica
Voorlichting
De zorgverlener:
- adviseert als pijnstiller bij voorkeur geen NSAID’s maar paracetamol (ook als zelfzorg);
- bespreekt met de patiënt met chronische nierschade of hartfalen het belang van dosisaanpassing bij dreigende dehydratie;
- Bepaalt nierfunctie (eGFR), natrium en kalium voor aanvang van RAS-remmer en/of diuretica;
- Bepaalt nierfunctie (eGFR), natrium en kalium (opnieuw) 2 weken na aanvang van de medicatie bij:
- een afwijkende laboratoriumuitslag (eGFR <60 ml/min/1,73 m2, kalium <3,8 mmol/l of kalium > 4,5 mmol/l);
- een combinatie van een RAS-remmer en een diureticum
- instrueert de patiënt met chronische nierschade, hartfalen of diabetes mellitus die RAS-remmers, diuretica en/of NSAID’s (ondanks contra-indicatie) gebruiken, contact op te nemen met de huisartsenpraktijk in geval van hoge koorts, fors braken of forse diarree.
Overweeg om het beleid bij dreigende dehydratie met de patiënt te bespreken zodat de patiënt zelfstandig tijdelijk medicatie kan verminderen of stoppen in geval van dreigende dehydratie.
Beleid in geval van (dreigende) dehydratie/nierfunctiedaling/hyperkaliëmie/hypokaliëmie/hyponatriëmie:
(Dreigende) dehydratie:
- Overweeg bij de kwetsbare patiënt of de patiënt met multimorbiditeit (zoals hartfalen, chronische nierschade) in geval van (dreigende) dehydratie tijdelijk de RAS-remmer en/of mineralocorticoïd antagonist te halveren en het diureticum te halveren of te staken.
Nierfunctiedaling (RAS-remmer):
- eGFR >30 tot 59 milliliter/minuut/1,73 m2: enige daling van de eGFR na de start met RAS-remmers is normaal. Een daling van de eGFR met 20% van de uitgangswaarde, met 30 ml/min als ondergrens is acceptabel.
- eGFR 15 tot 29 milliliter/minuut /1,73 m2: halveer de dosis en controleer de eGFR na 2 weken.
- eGFR <15 milliliter/minuut /1,73 m2: stop de RAS-remmer en/of het diureticum en controleer de eGFR na 2 weken.
- Overweeg een internist-nefroloog te consulteren of te verwijzen bij aanhoudende lage waardes van de eGFR (<30 milliliter/minuut /1,73 m2) (zie ook de NHG-Standaard Chronische nierschade).
Nierfunctiedaling (kaliumsparend diureticum):
- eGFR 15 tot 44 milliliter/minuut /1,73 m2: halveer de dosis en controleer de eGFR na 2 weken.
- eGFR <15 milliliter/minuut 1,73 m2: stop het kaliumsparend diureticum en controleer de eGFR na 2 weken.
- Overweeg een internist-nefroloog te consulteren of te verwijzen bij aanhoudende lage waardes van de eGFR (<30 milliliter/minuut /1,73 m2) (zie ook de NHG-Standaard Chronische nierschade).
Hyperkaliëmie:
- Ga na of (andere) kaliumsparende diuretica of mineralocorticoïd antagonist (amiloride, spironolacton) worden voorgeschreven en stop die. Een serumkaliumstijging tot 5,5 mmol/l is acceptabel.
- Kalium >5,5 mmol/l: halveer de dosis en controleer het serumkalium na 2 weken.
- Kalium >6,0 mmol/l: stop de RAS-remmer/ mineralocorticoïd antagonist/kaliumsparend diureticum en controleer het serumkalium na 2 weken. Overleg met internist over de mogelijke oorzaak.
Hypokaliëmie:
- Verhoog de dosering van een eventuele RAS-remmer, en/of voeg een mineralocorticoïd antagonist of amiloride toe en eventueel kalium- en magnesiumsupplementen (hypokaliëmie gaat hand in hand met hypomagnesiëmie maar treedt eerder op).
Normo- of hypovolemische hyponatriëmie:
- Stop thiazide-(achtige) diuretica en overleg met internist of cardioloog voor beleid ten aanzien van overige diuretica, zoutinname en eventuele vochtbeperking.
Combinatiebehandeling
De meeste patiënten met hypertensie hebben meer dan één middel nodig om de bloeddruk te verlagen. Vroeg combineren in lage doses is gemiddeld effectiever dan het geven van monotherapie en geeft minder bijwerkingen. Uitzondering vormen patiënten met een uitgangsbloeddruk < 150 mmHg, of oudere en kwetsbare patiënten. De extra bloeddrukverlaging door het combineren van geneesmiddelen uit verschillende klassen is ongeveer vijf keer hoger dan verdubbeling van de dosis van een geneesmiddel en vermindert de kans op dosis-afhankelijke bijwerkingen van afzonderlijke middelen. De combinatie van twee geneesmiddelen zorgt er eveneens voor dat bij patiënten met een (sterk) verhoogd risico de bloeddruk sneller onder controle kan komen. Uit gerandomiseerde onderzoeken is gebleken dat niet alle combinaties even effectief zijn. De combinatie van een bètablokker en een diureticum is in vergelijking met een calciumkanaalblokker en ACE-remmer zowel geassocieerd met een hoger risico op hart- en vaatziekten als diabetes mellitus. Daarnaast leidt de combinatie van een ACE-remmer en ARB niet tot veel extra bloeddrukverlaging of vermindering van het risico op hart- en vaatziekten in vergelijking met alleen een ACE-remmer of ARB alleen. De combinatie van een calciumkanaalblokker met een ACE-remmer lijkt daarentegen gemiddeld effectiever in het voorkomen van hart- en vaatziekten dan een combinatie met een thiazidediureticum. Voor patiënten van sub-Sahara Afrikaanse afkomst is behandeling met een calciumkanaalblokker en ACE-remmer of thiazidediureticum effectiever dan de combinatie van een ACE-remmer en thiazidediureticum.
Bij 15 tot 20% van hypertensieve patiënten is een combinatie van drie geneesmiddelen nodig om de bloeddruk onder controle te krijgen. Hoewel studies naar cardiovasculaire eindpunten ontbreken, is de combinatie van een ACE-remmer of ARB met een thiazidediureticum en calciumkanaalblokker het best onderzocht. Deze combinatie wordt doorgaans ook als uitgang genomen voor onderzoek naar nieuwe bloeddrukverlagende geneesmiddelen en interventies.
Figuur 1 Behandelstrategie voor verlagen van de bloeddruk nadat in overleg met de patiënt is besloten antihypertensiva voor te schrijven. Het algoritme is geschikt voor de meeste patiënten met orgaanschade door hypertensie, diabetes mellitus, beroerte of perifeer arteriële ziekte.
ACE, angiotensin-converting enzyme; ARB = Angiotensine Receptor Blokker.
Resistente hypertensie
De definitie van behandelingsresistente hypertensie is het niet behalen van de systolische streefwaarde <140 mmHg met een behandelstrategie die bestaat uit toepasselijke leefstijlmaatregelen plus een diureticum en twee andere bloeddrukverlagende geneesmiddelen uit verschillende klassen bij een adequate dosis (meestal een calciumkanaalblokker en ACE-remmer of ARB). Afhankelijk van de bestudeerde populatie en de intensiteit van medische screening, ligt de gerapporteerde prevalentie van resistente hypertensie tussen 5 en 30%. Van de behandelde hypertensieve patiënten heeft ongeveer 10% resistente hypertensie. Resistente hypertensie is geassocieerd met een hoog risico op hart- en vaatziekten en chronische nierschade. Non-adherentie is een belangrijke oorzaak van resistente hypertensie. Daarnaast komt een wittejasseneffect vaak voor bij patiënten met resistente hypertensie. Voordat een patiënt echt behandelingsresistent is moet derhalve worden overwogen of er sprake kan zijn van gebrekkige therapietrouw of wittejasseneffect. Verder dient een hoge zout- of alcoholconsumptie of andere voedingsstoffen (zoals drop), evenals het gebruik van geneesmiddelen met een mogelijk bloeddrukverhogend effect, recreatieve drugs of secundaire hypertensie te worden overwogen. Voeg spironolacton 25 tot 50 milligram toe wanneer de bloeddrukstreefwaarde niet wordt gehaald na de initiële behandeling met een ACE-remmer of ARB, calciumantagonist en thiazidediureticum. Bij niet verdragen van spironolacton kan amiloride 10 tot 20 milligram als alternatief worden overwogen.
Wanneer de behandeling met geneesmiddelen niet effectief is (dat wil zeggen resistente hypertensie) of een secundaire oorzaak waarschijnlijk wordt geacht, moet verwijzing naar een specialist worden overwogen. Zie hiervoor de richtlijn Hypertensie in de tweede of derde lijn.
Duur van behandeling en follow-up
Bloeddrukverlagende behandeling moet voor onbepaalde tijd gehandhaafd worden. Bij stopzetting van de behandeling bij hypertensieve patiënten keert de bloeddruk meestal terug naar het niveau van voor de behandeling. Voor sommige patiënten, bij wie de behandeling gepaard gaat met een effectieve bloeddrukverlaging gedurende langere tijd, is het mogelijk het aantal en/of dosering van de geneesmiddelen te verlagen. Hier is vooral sprake van wanneer de bloeddrukverlaging gepaard gaat met een gezondere leefstijl en gewichtsverlies. De medicatie moet geleidelijk worden gereduceerd en de patiënt moet regelmatig worden gecontroleerd omdat de kans bestaat dat de hypertensie terugkeert.
Follow-up van patiënten wordt uitgevoerd door een team van zorgverleners. Bij een stabiele instelling (streefwaarden zijn bereikt en geen of acceptabele bijwerkingen) zijn laag -frequente controles voldoende. Bij niet goed ingestelde patiënten is een hogere frequentie nodig. Het zelf meten van de bloeddruk is effectief in het verbeteren van de bloeddrukcontrole en leidt tot minder medicatiegebruik en spreekuurbezoeken. De meerwaarde van thuismetingen geldt vooral voor diegenen met een belangrijk wittejasseneffect en voor patiënten met zogeheten gemaskeerde hypertensie. Thuismeten betrekt patiënten meer bij hun behandeling en kan met behulp van telemonitoring ook op afstand plaatsvinden. De optimale frequentie voor het thuismonitoren van de bloeddruk is niet bekend. Zowel protocollen waarbij een maal per week op gestandaardiseerde momenten de bloeddruk wordt gemeten als protocollen waarbij voorafgaand aan het spreekuurbezoek een serie gestandaardiseerde metingen wordt verricht, zijn in omloop. Voor die patiënten waarbij thuismetingen moeilijk zijn, kan een 30 minuten meting in de praktijk een alternatief zijn bij de bloeddrukcontrole als er twijfel is over wittejassenhypertensie.
Aanbevelingen
- Geef alle personen met een verhoogde bloeddruk leefstijladviezen (zie paragraaf 2.1).
- Adviezen betreft zoutinnamebeperking:
- Adviseer een zoutbeperking (natriumchloride) in het dieet van minder dan 6 gram per dag bij patiënten met hypertensie. Hierbij kan het nuttig zijn om een folder te geven aan de patiënt met informatie met instructies voor een zoutbeperkt dieet. Zie bijvoorbeeld advies op de website van het voedingscentrum.
- Ga met de patiënt na of de inzet van een diëtist of verpleegkundig specialist nodig is om zoutbeperking (natriumchloride) langdurig na te streven (conform advies uit de Praktijkhandleiding Leefstijl).
- Bloeddrukverlagende medicatie kan worden overwogen bij personen met een laag – matig risico op hart- en vaatziekten, met een verhoogde bloeddruk (> 160 mmHg), indien leefstijlmaatregelen de bloeddruk onvoldoende doen dalen.
- De meeste soorten bloeddrukverlagende middelen zijn als monotherapie ongeveer gelijkwaardig en hebben een even groot bloeddrukverlagend effect (zie voor specifieke situaties tabel 34).
- Overweeg bij de keuze bij medicamenteuze verlaging van de bloeddruk te starten met monotherapie als de systolische bloeddruk relatief laag is (< 150 mmHg) en/of bij oudere en kwetsbare patiënten. Start of vervolg bij alle overige situaties met combinatietherapie van 2 middelen (zie ook figuur I).
- Om therapietrouw te bevorderen kan het combineren van twee of drie middelen in één tablet worden overwogen.
- Instrueer de patiënt met chronische nierschade, hartfalen of diabetes mellitus die RAS-remmers, diuretica en/of NSAID’s gebruiken, contact op te nemen met de huisartsenpraktijk in geval van hoge koorts, fors braken of forse diarree.
Therapieresistentie
Naar Samenvatting ›Mogelijke oorzaken bij onvoldoende reactie op antihypertensiva zijn allereerst gebrekkige therapietrouw en vervolgens wittejasseneffect, hoge zoutinname of alcoholgebruik. Enige vorm van ambulante meting (thuis of 24-uurs) wordt bij deze patiënten sterk aanbevolen. Voeg spironolacton 25-50 mg toe wanneer de streefbloeddruk niet wordt gehaald na de initiële behandeling met een ACE-remmer/ARB, calciumantagonist en thiazidediureticum. Bij niet verdragen van spironolacton kan amiloride 10-20 mg als alternatief worden overwogen.
Uitgangsvraag
Hoe kan het beste therapietrouw bij medicamenteuze behandeling worden bevorderd, met als doel het risico op hart- en vaatziekten te verlagen?
Inleiding
Therapietrouw beïnvloedt in grote mate de effectiviteit van medicamenteuze interventies om het risico op hart- en vaatziekten te verlagen. Het is echter nog de vraag hoe therapietrouw bij de medicamenteuze behandeling van een (zeer) hoog risico op hart- en vaatziekten het beste kan worden bevorderd.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is gebruikgemaakt van de Europese richtlijn Cardiovascular disease prevention in clinical practice uit 2016.
Overwegingen
In het algemeen is therapietrouw onder personen met een verhoogd risico op hart- en vaatziekten en bij patiënten met hart- en vaatziekten slecht, wat leidt tot slechtere resultaten en hogere zorgkosten. Een maand na AMI, bijvoorbeeld, stopt 25 tot 30% van de patiënten met ten minste één geneesmiddel en in de loop van de tijd neemt dit verder af. Na één jaar meldde slechts 50% van de patiënten aanhoudend gebruik van statines, bètablokkers of bloeddrukverlagende middelen. Er zijn multifactoriële redenen voor de slechte medicatietrouw (tabel 41).
| Categorie | Voorbeeld |
|---|---|
| Zorgsysteem | Slechte arts-patiëntrelatie; weinig kennis over het geneesmiddel en/of geringe mate van implementatie van richtlijnen; geringe communicatie; geringe toegang tot de zorg; geen continuïteit van zorg |
| Aandoening | Asymptomatische chronische ziekte (zonder fysieke klachten); psychische comorbiditeit |
| Patiënt | Fysieke beperkingen (bijvoorbeeld visusproblemen of motorische beperkingen), cognitieve beperking; psychische/gedragsfactoren (voorbeeld gebrek aan motivatie, weinig zelfdoeltreffendheid; impulsiviteit); jonge leeftijd |
| Therapie | Moeilijk behandelschema; bijwerkingen. |
| Sociaaleconomisch | Laag opleidingsniveau; hoge kosten van geneesmiddelen; slechte sociale ondersteuning |
Kostengerelateerde slechte therapietrouw is een relevant probleem in veel gezondheidsstelsels. Bij Amerikaanse veteranen nam bijvoorbeeld de trouw aan lipidenverlagende medicatie af naarmate hun eigen bijdrage steeg.
Depressie verdubbelt ook onafhankelijk het risico op slechte medicatietrouw.
De redenen voor slechte therapietrouw hopen zich vaak op; ingewikkelde medicatieregimes kunnen vaak belangrijk zijn voor personen met chronische aandoeningen of meerdere risicofactoren. Dit vereist dat zorgverleners duidelijke adviezen en voortdurende zorg moeten geven.
Artsen slagen er vaak niet in belangrijke aspecten van geneesmiddelengebruik duidelijk te maken (bijvoorbeeld mogelijke bijwerkingen, hoe lang de geneesmiddelen moeten worden gebruikt of de frequentie of het tijdstip van innemen).
Er bestaat dus een behoefte om artsen te trainen, zodat ze risicofactoren voor slechte therapietrouw kunnen identificeren en therapietrouw kunnen bevorderen. Personen die hun medicatie als noodzaak ervaren blijken de beste therapietrouw te hebben, terwijl personen die inname van medicijnen associëren met negatieve dingen het minst therapietrouw zijn. (Para)medici spelen hierbij een belangrijke rol; bij het voorschrijven van een geneesmiddel besteedt een arts vaak meer tijd aan de uitleg van eventuele bijwerkingen dan aan de gunstige effecten ervan. Zo kan een negatief beeld over de therapie ontstaan,
met een verminderde therapietrouw als gevolg.
Een aantal interventies kan effectief zijn bij het verbeteren van therapietrouw bij chronische aandoeningen. Alleen de doseringseisen verlagen had een sterk effect, maar andere interventies, zoals herhaaldelijk toezicht en feedback, informatieoverdracht tijdens meerdere afspraken, gecombineerde gedragsinterventies, hadden een effect, dat varieerde van klein tot sterk. Samenwerking met apotheken of apothekergeleide zorg was beter dan standaardzorg met betrekking tot bloeddruk, totaal cholesterol en LDL-C-spiegels
In de klinische praktijk moeten artsen een schatting maken van de medicatietrouw, redenen identificeren waarom er mogelijk sprake zou kunnen zijn van slechte medicatietrouw en medicatietrouw bevorderen volgens de onderstaande principes:
- Geef duidelijk advies over de voordelen en mogelijke nadelen van de medicatie, de duur en het tijdstip van inname.
- Weeg gewoonten en voorkeuren van de patiënt mee (gedeelde besluitvorming).
- Vereenvoudig het behandelregime tot het laagst mogelijke niveau.
- Vraag patiënten (zonder te oordelen) wat zij van de medicatie vinden en bespreek eventuele redenen voor de slechte medicatietrouw (bijvoorbeeld bijwerkingen, zorgen).
- Stel herhaald toezicht in en vraag om feedback.
- Benut de expertise van gespecialiseerde verpleegkundigen, praktijkondersteuners huisartsgeneeskunde en/of apothekers.
Biedt bij voortdurende slechte therapietrouw meerdere sessies of gecombineerde gedragsinterventies aan (bijvoorbeeld in een hartrevalidatiesetting (HR) voor patiënten na myocardiale revascularisatie).
Aanbevelingen
- Geef heldere informatie over de voordelen van medicatie. Informeer realistisch over relevante bijwerkingen. Maak duidelijk waarom de voordelen opwegen tegen eventuele nadelen. Bespreek eventuele negatieve gedachten die een patiënt over medicatie heeft.
- Bevorder de therapietrouw door het laagste aantal acceptabele innamemomenten en aantal tabletten aan de patiënt voor te schrijven.
- Bevorder de therapietrouw door de patiënt feedback te geven over het bereikte behandelresultaat.
- Besteed aandacht aan therapietrouw bij de follow-up en achterhaal de oorzaken voor therapieontrouw om therapie op maat te kunnen bieden.
Aanbevelingen
Naar Samenvatting ›- Geef alle personen met een verhoogde bloeddruk leefstijladviezen (zie paragraaf 2.1).
- Adviezen betreft zoutinnamebeperking:
- Adviseer een zoutbeperking (natriumchloride) in het dieet van minder dan 6 gram per dag bij patiënten met hypertensie. Hierbij kan het nuttig zijn om een folder te geven aan de patiënt met informatie met instructies voor een zoutbeperkt dieet. Zie bijvoorbeeld advies op de website van het voedingscentrum.
- Ga met de patiënt na of de inzet van een diëtist of verpleegkundig specialist nodig is om zoutbeperking (natriumchloride) langdurig na te streven (conform advies uit de Praktijkhandleiding Leefstijl).
- Bloeddrukverlagende medicatie kan worden overwogen bij personen met een laag tot matig risico op hart- en vaatziekten, met een verhoogde bloeddruk (>160 mmHg), indien leefstijlmaatregelen de bloeddruk onvoldoende doen dalen.
- De meeste soorten bloeddrukverlagende middelen zijn als monotherapie ongeveer gelijkwaardig en hebben een even groot bloeddrukverlagend effect (zie voor specifieke situaties tabel 7).
- Overweeg bij de keuze voor medicamenteuze verlaging van de bloeddruk te starten met monotherapie als de systolische bloeddruk relatief laag is (< 150 mmHg) en/of bij oudere en kwetsbare patiënten.
- Start of vervolg bij alle overige situaties met combinatietherapie van 2 middelen (zie ook figuur 1).
- Om therapietrouw te bevorderen kan het combineren van twee of drie middelen in één tablet worden overwogen.
- Instrueer de patiënt met chronische nierschade, hartfalen of diabetes mellitus die RAS-remmers, diuretica en/of NSAID’s gebruiken, contact op te nemen met de huisartsenpraktijk in geval van hoge koorts, fors braken of forse diarree.
Uitgangsvraag
Hoe kan bij patiënten met atriumfibrilleren (AF) het cardiovasculaire risico worden verlaagd?
Inleiding
Atriumfibrilleren (AF) is een hartritmestoornis en de klassieke cardiovasculaire risicofactoren vergroten ook het risico op het ontstaan van AF. Het grootste risico bij AF is een cardiale embolie, wat kan leiden tot een herseninfarct. Het beleid is dan ook gericht op het voorkomen van trombo-embolische complicaties door het voorschrijven van antistollingen op behandeling van de cardiovasculaire risicofactoren. Voor een uitvoerige beschrijving van het beleid wordt verwezen naar de NHG-Standaard Atriumfibrilleren.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is gebruikgemaakt van de Europese richtlijn Cardiovascular disease prevention in clinical practice uit 2016.
Overwegingen
Risicoclassificatie
AF is de meest voorkomende vorm van aritmie, met een geschat cumulatief levenslang risico van 25%. AF wordt geassocieerd met een verhoogd risico op overlijden, beroerte, hartfalen (HF), trombo-embolie, cognitieve dysfunctie, hospitalisatie en verminderde kwaliteit van leven. AF wordt geassocieerd met een ongeveer twee keer verhoogd risico op AMI. Twintig procent van alle beroertes worden veroorzaakt door AF en het risico op een beroerte is ≈ 60% hoger voor vrouwen dan voor mannen. Toch kunnen patiënten met AF niet per definitie ingedeeld worden in de zeer-hoogrisicocategorie, zoals patiënten met een doorgemaakt hartinfarct of CVA, en het beleid wat betreft lipiden- of bloeddrukverlaging is dan ook anders.
Veel klassieke risicofactoren voor hart- en vaatziekten zijn ook risicofactoren voor AF, in het bijzonder leeftijd, roken, zittende leefstijl, obesitas, hypertensie en diabetes mellitus. Hypertensie en AF gaan vaak samen en leiden bij patiënten met AF tot een verdubbeling van alle complicaties en mortaliteit door hart- en vaatziekten.
Obesitas en diabetes mellitus bij patiënten met AF verhogen het risico op hart- en vaatziekten doordat ze leiden tot trombofilie. Diabetes mellitus is opgenomen in de score voor de risicobeoordeling voor beroertes, maar obesitas niet.
Interventies gericht op het verlagen van het cardiovasculaire risico
Het beleid ten aanzien van AF-patiënten is gericht op de preventie van ernstige complicaties van hart- en vaatziekten die worden geassocieerd met AF en is gebaseerd op antitrombotische therapie met vitamine-K-antagonisten of niet-vitamine-K-antagonist orale anticoagulantia. Wat betreft het onder controle houden van hartslag en hartritme bij AF-patiënten verwijzen wij naar de NHG-Standaard Atriumfibrilleren en de ESC-richtlijn Atriumfibrilleren.
Niet-medicamenteuze behandeling
Er komt steeds meer bewijs dat atriumfibrilleren eigenlijk meer een uiting is van een vergevorderd stadium van algeheel vaatlijden. Niet-medicamenteuze behandeling van de algemeen bekende risicofactoren op hart- en vaatziekten lijkt dus ook zinvol. Trials hebben een effect van lichamelijke activiteit bij AF-patiënten aangetoond op lichamelijke conditie en kwaliteit van leven, maar onderzoek naar het effect op de kans op hart- en vaatziekten ontbreekt.
Medicamenteuze behandeling
Antistolling
Aanbevelingen voor antitrombotische therapie zijn gebaseerd op risicofactoren voor beroerte, die met de CHA2DS2-VASc-score bepaald kunnen worden. Het gebruik van de HAS-BLED-score wordt aanbevolen om het risico op bloedingen bij het gebruik van antistolling met de patiënt te bespreken. Een hoge HAS-BLED-score moet echter niet worden gebruikt om af te zien van het voorschrijven van antistolling, omdat bij een hoge CHA2DS2-VASc-score de voordelen van antistolling in het algemeen opwegen tegen de nadelen. Een overblijvend hoog risico op overlijden in AF-patiënten met anticoagulantia blijft een probleem bij preventie van hart- en vaatziekten. Zie de NHG-Standaard Atriumfibrilleren en de ESC-richtlijn Atriumfibrilleren voor meer informatie over de keuze van de antistolling.
Cholesterol
Er is minder bewijs beschikbaar voor het effect van statines op belangrijke hart- en vaatziekteuitkomsten bij AF-patiënten. Deze patiënten moeten worden behandeld volgens de SCORE-aanbevelingen en niet alleen maar omdat ze AF hebben.
Bloeddruk
Bloeddrukmeting van AF-patiënten worden bij voorkeur uitgevoerd met een standaard auscultatiebloeddrukmeter, omdat de meeste automatische bloeddrukmonitoren de bloeddruk van AF-patiënten onnauwkeurig meten. Antihypertensiva, in aanvulling op antistolling, kan bijdragen aan vermindering van het risico op HVZ. Het belangrijkste doel is bloeddrukverlaging. Er zijn onvoldoende gegevens beschikbaar om specifieke geneesmiddelen aan te raden.
Idiopathisch atriumfibrilleren
Bij AF-patiënten < 65 jaar, zonder hartaandoeningen of hypertensie (Lone AF) en zonder risicofactoren die antitrombotische therapie vereisen, wordt AF niet geassocieerd met een verhoogd risico op beroerte of overlijden en wordt antistollingstherapie niet aanbevolen. Lone AF is een diagnose van uitsluiting. Het risico op een beroerte bij jonge patiënten met alleen AF neemt toe met de leeftijd of de ontwikkeling van hypertensie, wat het belang onderstreept van regelmatige herbeoordeling van risicofactoren.
Aanbevelingen
- Behandel de cardiovasculaire risicofactoren (zoals roken, lichamelijke inactiviteit, verhoogde bloeddruk en LDL-cholesterol) volgens de ESC-richtlijn Atriumfibrilleren.
- Bepaal bij atriumfibrilleren het risico op een beroerte met de CHA2DS2-VASc-score en bepaal met behulp van deze score de indicatie voor anticoagulantia.
Uitgangsvraag
Hoe kan bij patiënten met een coronaire hartziekte het cardiovasculaire risico worden verlaagd?
Inleiding
De behandeling van acute uitingen van ischemische hartklachten, de bijbehorende complicaties, en het beleid en de controle na afloop moeten plaatsvinden volgens de richtlijnen. Daarnaast hebben overlevenden behoefte aan gestructureerde steun om hun kwaliteit van leven te herstellen of in stand te houden en hun functionele capaciteiten te verbeteren.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is gebruikgemaakt van de Europese richtlijn Cardiovascular disease prevention in clinical practice uit 2016.
Overwegingen
Risicoclassificatie
Patiënten na een doorgemaakt coronair event hebben een zeer hoog risico op een nieuwe hart- en vaatziekte.
Interventies gericht op het verlagen van het cardiovasculaire risico
Niet-medicamenteuze behandeling
Een uitgebreide, professionele interventie in leefstijl gebaseerd op gedragsmodellen voor verandering wordt aangeraden, met verschillende strategieën, van de meer basale, op het gezin gebaseerde tot de meer gestructureerde en complexe modaliteiten, op basis van risicobeoordeling voor hart- en vaatziekten en concomitante aandoeningen. Een risicofactorenbeleid waarbij wordt gekeken naar effectieve beheersing van risicofactoren, advies over lichaamsbeweging, psychosociale steun, en gepast voorschrijven en trouw aan geneesmiddelen die het hart beschermen zijn essentieel om patiënten te helpen weer een zo compleet mogelijk leven te leiden. Kort gezegd, patiënten met ischemische hartklachten hebben een sterk verhoogd risico en preventieve maatregelen zijn essentieel.
Het voorschrijven van en opvolgen van aanbevelingen voor gedragsveranderingen bij directe nazorg van patiënten met ischemische hartklachten moeten een even hoge prioriteit hebben als andere preventieve maatregelen en invasieve strategieën, en rechtvaardigen de investering in het opzetten van programma’s die veranderingen in leefstijl en preventie systematisch versterken. In een groot cohort met patiënten met ischemische hartklachten in verschillende landen die deelnamen aan het gerandomiseerde onderzoek Organization to Assess Strategies in Acute Ischemic Syndromes (OASIS) 5, werd opvolgen van gedragsadvies (voeding, lichaamsbeweging en stoppen met roken) na een acute uiting van ischemische hartklachten geassocieerd met een aanzienlijk lager risico op herhaling. De voordelen bleken al vroeg (zes maanden) en elke gedragsverandering was cumulatief. Een klinische analyse, beheersing van risicofactoren en beleid ten aanzien van gedrag moeten in de acute situatie zo snel mogelijk worden opgestart. Helaas bereiken grote groepen patiënten nog altijd niet de leefstijl-, risicofactor- en behandeldoelen en de deelname aan preventieprogramma’s is nog altijd laag.
Medicamenteuze behandeling
Behandel de bloeddruk en lipiden volgens de aanbeveling voor personen met een zeer hoog risico op hart- en vaatziekten in de respectievelijke modules in deze richtlijn.
Acetylsalicylzuur 80 mg/dag is de hoeksteen van antitrombotische behandeling bij ischemische hartziekten. Voor meer informatie over antitrombotica bij ischemische hartziekten verwijzen we naar de ESC-richtlijn Management of stable coronary heart disease.
Aanbevelingen
- Beschouw patiënten met een doorgemaakte coronaire hartziekte als individuen met een zeer hoog risico op nieuwe hart- en vaatziekten.
- Start bij elke patiënt met hartrevalidatie; deze bestaat uit meerdere elementen (zoals leefstijl, bewegen).
- Geef leefstijladviezen (bijvoorbeeld over bewegen, voeding, gewicht, stoppen met roken) conform de adviezen voor personen met een zeer hoog risico op hart- en vaatziekten.
- Screening op psychosociale risicofactoren kan worden overwogen (zie detail Psychosociale factoren).
- Geef medicamenteuze therapie met bloeddruk- en LDL-cholesterolverlagers conform de adviezen voor personen met een zeer hoog risico op hart- en vaatziekten die worden beschreven in de betreffende modules van deze richtlijn.
- Geef patiënten met coronaire hartziekten antitrombotica conform de adviezen van de desbetreffende Nederlandse richtlijnen.
Uitgangsvraag
Hoe kan bij patiënten met chronisch hartfalen het risico op hart- en vaatziekten worden verlaagd?
Inleiding
In dit detail wordt alleen ingegaan op maatregelen om een nieuwe hart- en vaatziekte te voorkomen (dat wil zeggen het cardiovasculair risicomanagement) bij patiënten met chronisch hartfalen. Voor de behandeling van hartfalen (bijvoorbeeld met medicamenten en devices) wordt verwezen naar de ESC-richtlijn Hartfalen.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is gebruikgemaakt van de Europese richtlijn Cardiovascular disease prevention in clinical practice uit 2016.
Overwegingen
Risicoclassificatie
HF is een veelvoorkomende, invaliderende en dodelijke aandoening die leidt tot frequente ziekenhuisopnamen door hart- en vaatziekten. HF-patiënten hebben een zeer hoog risico voor een nieuwe hart- en vaatziekte, en verdienen extra aandacht gedurende een veelzijdige en multidisciplinaire interventie, die zo snel mogelijk moet worden opgestart tijdens en na de ziekenhuisopname, zodat ze een levenslang gestructureerd preventiepatroon kunnen ontwikkelen.
Interventies gericht op het verlagen van het cardiovasculaire risico
Preventie van hart- en vaatziekten moet ook advies omvatten over lichaamsbeweging, psychologische steun en voorlichting over aansturen van patiënt/zorgverlener. Aangezien de meeste gevallen van heropname bij exacerbaties van HF ten minste deels kunnen worden toegeschreven aan slechte zelfzorg, slechte medicatietrouw, niet opvolgen van voedingsadviezen en niet reageren op escalerende symptomen, is effectieve zelfzorg van essentieel belang bij preventie van hart- en vaatziekten.
Niet-medicamenteuze behandeling
Fitnesstraining moet worden voorgeschreven aan ambulante patiënten als fundamentele preventieve maatregel bij stabiel HF. Omdat HF-patiënten door meerdere maladaptieve veranderingen, zelfs bij optimale medische behandeling voor HF, last hebben van bewegingsintolerantie, kan fitnesstraining helpen de symptomen te verminderen en het eindresultaat beïnvloeden. Het onderzoek Heart Failure: A Controlled Trial Investigating Outcomes of Exercise Training (HF-ACTION) toonde een 7% vermindering van mortaliteit en ziekenhuisopname door alle oorzaken aan, zelfs na correctie voor vooraf vastgestelde voorspellers van mortaliteit. Een goede naleving is echter van cruciaal belang en bij de trainingsintensiteit moet een balans bestaan tussen werkzaamheid en veiligheid. De protocollen voor fitnesstraining verschillen in de meeste onderzoeken (zie ook detail Sedentaire leefstijl en lichamelijke activiteit), maar oefeningen met een gematigde tot krachtige intensiteit (50 tot 60% peak-VO2) worden veel toegepast, met een verbetering van de maximale zuurstofopname van gemiddeld 17% als resultaat. Bij sommige stabiele patiënten kan high-intensity-intervaltraining zelfs tot nog grotere verbeteringen van piek VO2 leiden. Voordat wordt begonnen aan enig trainingsprogramma, moet worden gekeken naar klinische stabiliteit, moet er een functionele evaluatie worden uitgevoerd en er is een voorstel voor een uitgebreide flowchart.
HF-patiënten komen in aanmerking voor hartrevalidatie. Er dient in samenspraak met een cardioloog geëvalueerd te worden of hartrevalidatie geïndiceerd is. Wat betreft andere leefstijladviezen (bijvoorbeeld voeding en stoppen met roken) zijn de adviezen conform de adviezen van een individu met een zeer hoog risico op hart- en vaatziekten, die worden beschreven in de respectievelijke modules van deze richtlijn.
Medicamenteuze behandeling
Hartfalen alleen is geen indicatie voor lipidenverlaging omdat uit trials is gebleken dat statines de kans op hart- en vaatziekten en sterfte niet verminderen. Indien er andere indicaties zijn voor statines bij patiënten met hartfalen (bijvoorbeeld een eerder doorgemaakt hartinfarct) worden statines wel aanbevolen. Er is ook geen reden om bij patiënten die terecht een statine gebruiken en vervolgens hartfalen ontwikkelen te stoppen met statines.
De bloeddruk wordt behandeld conform de module bloeddruk in deze richtlijn, waarbij patiënten met hartfalen worden beschouwd als individuen met een zeer hoog risico op hart- en vaatziekten. Er wordt gestreefd naar een systolische bloeddruk onder de 140 mmHg, gemeten volgens OBPM.
Voor antitrombotische therapie geldt hetzelfde als voor statines: hartfalen alleen is geen indicatie voor antitrombotica, maar als er een andere indicatie is voor antitrombotische therapie wordt aanbevolen deze voor te schrijven bij patiënten met hartfalen.
Het klinische stadium kan van invloed zijn op aanbevelingen over preventieve maatregelen, want gevorderd HF kan worden geassocieerd met een lage bloeddruk en laag lipidenprofiel, concomitante hart- en vaatziekten en andere aandoeningen (zoals AF, ventriculaire aritmie, ischemische hartklachten waarbij revascularisatie niet mogelijk is, eerdere beroerte/transiënte ischemische aanval (TIA), diabetes mellitus, anemie, ijzertekort, chronische obstructieve longaandoeningen, chronische nierschade, leverinsufficiëntie, obstructief slaapapneu, cognitieve stoornis, depressie, enzovoort) en strategieën voor de toekomst (behandeling met medische hulpmiddelen, harttransplantatie, en mechanische ondersteuning van de bloedsomloop), die gespecialiseerde interventies vereisen.
Aanbevelingen
- Beschouw patiënten met hartfalen als individuen met een zeer hoog risico op nieuwe hart- en vaatziekten.
- Geef aan elke patiënt met chronisch hartfalen beweegadvies conform de adviezen van de Gezondheidsraad.
- Geef leefstijladviezen (bijvoorbeeld met betrekking tot bewegen, voeding, gewicht, stoppen met roken) conform de adviezen voor personen met een zeer hoog risico op hart- en vaatziekten.
- Screening op psychosociale risicofactoren kan worden overwogen (zie detail Psychosociale factoren).
- Behandel de bloeddruk conform de adviezen voor personen met een zeer hoog risico op hart- en vaatziekten die worden beschreven in de module bloeddruk van deze richtlijn.
- Start niet met lipidenverlagende medicatie of antitrombotica vanwege hartfalen. Patiënten met hartfalen kunnen wel andere aandoeningen hebben met een indicatie voor deze middelen.
Uitgangsvraag
Hoe kan bij patiënten met een doorgemaakt(e) herseninfarct of -bloeding het risico op een recidief of andere hart- en vaatziekte worden verlaagd?
Inleiding
Patiënten met een doorgemaakt(e) herseninfarct of -bloeding hebben een zeer hoog risico op een recidief of andere hart- en vaatziekte. De aanbevelingen om een nieuwe hart- en vaatziekte te voorkomen bij personen met een zeer hoog risico gelden in principe ook voor herseninfarct- of -bloedingspatiënten. De behandeling kan echter verschillen afhankelijk van het type beroerte (herseninfarct of intracerebrale bloeding) en oorzaken (bijvoorbeeld cardio-embolisch, atherosclerose van de grote vaten of small vessel disease). Details over de behandeling van herseninfarct- of -bloedingspatiënten zijn te vinden in recente praktijkrichtlijnen, zoals de richtlijn Herseninfarct en hersenbloeding en de NHG-Standaard Beroerte. Deze paragraaf bespreekt enkele aspecten die specifiek zijn voor patiënten met een TIA of herseninfarct in het voorkomen van recidief hart- en vaatziekte.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden, is gebruikgemaakt van de Europese richtlijn Cardiovascular disease prevention in clinical practice uit 2016, de richtlijn Herseninfarct en hersenbloeding en de NHG-Standaard Beroerte.
Overwegingen
Risicoclassificatie
Patiënten met een doorgemaakt(e) TIA of herseninfarct hebben een zeer hoog risico op een nieuwe hart- en vaatziekte. Patiënten met een herseninfarct hebben een 45% verhoogd risico op een nieuwe hart- en vaatziekte of op overlijden. Dit risico is vergelijkbaar met dat van patiënten die een coronaire hartziekte hebben doorgemaakt [Xu 2015]. In het meest recente systematische onderzoek was het eenjaarsrisico op een recidief beroerte 11,1% (95%-BI 9,0 tot 13,3) en het vijfjaarsrisico 26,4% (95%-BI 20,1 tot 32,8). Hierbij leek het cumulatieve risico na één respectievelijk vijf jaar in de loop van de jaren af te nemen. Dit laatste zou wijzen op een afname door betere secundaire preventie in de laatste jaren. Nederlands onderzoek suggereerde echter dat tot tien jaar na een TIA of licht herseninfarct het risico constant blijft. Na een TIA is de incidentie van een herseninfarct binnen negentig dagen gemiddeld tussen de 7 en 14%. Het relatieve risico blijkt groter bij een leeftijd > 60 jaar (RR 1,5), een bloeddruk > 140/90 mmHg (RR 1,6) en de aanwezigheid van diabetes mellitus (RR 1,7); voor ieder van deze drie factoren is het 95%-BI ongeveer 1,2 tot 2,0. Deze cijfers suggereren dat het terugdringen van modificeerbare risicofactoren het recidiefrisico op een herseninfarct kan verlagen.
Interventies gericht op het verlagen van het cardiovasculaire risico
Niet-medicamenteuze behandeling
Voor beroertepatiënten zijn onvoldoende gegevens beschikbaar over de effecten van veranderingen in leefstijl.
De aanbevelingen in de richtlijn zijn gebaseerd op geëxtrapoleerde gegevens uit epidemiologisch onderzoek of hartrevalidatie. Veranderingen in leefstijl zijn niet geïntegreerd in beroerterevalidatie. Voor leefstijladviezen wordt dan ook verwezen naar de adviezen elders beschreven in deze richtlijn voor personen met een zeer hoog risico op hart- en vaatziekten.
Medicamenteuze behandeling
Er is maar één RCT verricht specifiek gericht op de effectiviteit van statines na een TIA of herseninfarct. Bij patiënten met een TIA of herseninfarct die waren opgenomen in de gerandomiseerde Heart Protection Study of het onderzoek Stroke Prevention by Aggressive Reduction in Cholesterol Levels (SPARCL) verminderde 40 mg simvastatine of 80 mg atorvastatine het langetermijnrisico op grote hart- en vaatziekten; alleen atorvastatine verminderde het risico op een beroerte.
Ondanks eerdere vermoedens van het tegenovergestelde is er geen bewijs dat statinegebruik wordt geassocieerd met een verhoogd risico op een intracerebrale bloeding.
De NNT om in vijf jaar een herseninfarct te voorkomen was 46 en voor een belangrijke cardiovasculaire gebeurtenis 29. Er zijn onvoldoende gegevens beschikbaar over de effecten van andere statines of andere cholesterolverlagende middelen bij patiënten met een TIA of beroerte, en er zijn evenmin relevante gegevens die het nut ondersteunen van het nastreven van een specifiek LDL-C-doel in deze populatie.
Bij patiënten met een herseninfarct of TIA die langer dan een week eerder had plaatsgevonden vermindert het gebruik van bloeddrukverlagende geneesmiddelen het risico op ischemische hartklachten of op een herseninfarct. Het optimale geneesmiddelenregime voor de bloeddruk is onduidelijk, omdat er slechts enkele strategieën in voldoende grote onderzoeken zijn getest. Het bewijs voor effectiviteit is het sterkst voor diuretica of diuretica in combinatie met een ACE-remmer. In de Perindopril Protection Against Recurrent Stroke Study (PROGRESS) stond de relatieve verlaging van het risico op een terugkerend herseninfarct bij de combinatie indapamide en perindopril los van de baselinebloeddruk en was de risicovermindering groter naarmate de systolische bloeddruk meer verlaagd was. Er zijn echter slechts beperkte gegevens beschikbaar en de bewijzen zijn niet afdoende. Het lijkt daarom redelijk om de keuze voor een specifiek geneesmiddel en bloeddrukdoel te baseren op de individuele kenmerken van een patiënt, zoals elders in deze richtlijn beschreven.
Antitrombotica
Bij patiënten met een TIA of herseninfarct met atherosclerose als vermoedelijke oorzaak wordt de combinatie van aspirine 30 tot 300 mg eenmaal daags en dipyridamol 200 mg tweemaal daags geassocieerd met een grotere vermindering van het risico op een grote hart- en vaatziekte dan alleen aspirine.
Clopidogrel 75 mg eenmaal daags is even effectief als de combinatie van aspirine en dipyridamol en wordt geassocieerd met minder bijwerkingen.
De richtlijn CVRM verwijst voor de exacte invulling van deze behandeling naar de richtlijn Herseninfarct en hersenbloeding en de NHG-Standaard Beroerte.
Aanbevelingen
- Adviseer de leefstijladviezen voor de patiënten met een zeer hoog risico uit de module leefstijl voor patiënten na een TIA of herseninfarct of hersenbloeding.
- Behandel patiënten na een TIA of herseninfarct met bloeddrukverlagende therapie conform de adviezen voor personen met een zeer hoog risico op hart- en vaatziekten die worden beschreven in de module bloeddruk.
- Behandel patiënten na een TIA of herseninfarct met cholesterolverlagende therapie, tenzij er een uitsluitend cardio-embolische oorzaak is of zeldzame andere oorzaken, zoals een dissectie. Hanteer bij behandeling een streefwaarde van het LDL-C conform de richtlijn Herseninfarct en hersenbloeding.
- Behandel patiënten met een herseninfarct of TIA zonder cardiale emboliebron als oorzaak (met antitrombotica) volgens de richtlijn Herseninfarct- en bloeding en de NHG-Standaard Beroerte.
Uitgangsvraag
Hoe kan bij patiënten met perifeer arterieel vaatlijden (PAV) het risico op hart- en vaatziekten worden verlaagd?
Inleiding
Patiënten met symptomatische PAV dienen te worden beschouwd als personen met een zeer hoog risico op een nieuwe hart- en vaatziekte. Wat betreft leefstijl zijn stoppen met roken en lichamelijke activiteit cruciaal. Er is voor deze specifieke groep slechts beperkt bewijs voor cardiovasculaire preventieve medicatie uit gerandomiseerde klinische trials beschikbaar. In principe is het cardiovasculair risicomanagement in deze groep gelijk aan de groep met andere hart- en vaatziekten, zoals coronair of cerebrovasculair lijden.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is gebruikgemaakt van de Europese richtlijn Cardiovascular disease prevention in clinical practice uit 2016.
Overwegingen
Risicoclassificatie
Patiënten met perifeer arterieel vaatlijden worden geclassificeerd als zeer-hoogrisicopatiënten vanwege het feit dat ze aangetoonde, symptomatische atherosclerose hebben.
Interventies gericht op het verlagen van het cardiovasculaire risico
Niet-medicamenteuze behandeling
In principe zijn de leefstijladviezen bij PAV vergelijkbaar met die voor andere personen met een zeer hoog risico op hart- en vaatziekten. De symptomen zelf kunnen conservatief of invasief worden behandeld. Bij patiënten met PAV is bewegingstherapie effectief bij het verbeteren van symptomen en het vergroten van de bewegingscapaciteit. In meta-analyses bleek dat, vergeleken met normale zorg of placebo, beweging de maximale wandeltijd significant verbeterde, met een algemene verbetering in loopvermogen. De oefeningen varieerden van krachttraining tot nordic walking en oefeningen voor de bovenste of onderste ledematen, meestal onder supervisie, ten minste twee keer per week. Bij patiënten met PAV is stoppen met roken cruciaal.
Medicamenteuze behandeling
Statines verminderen het risico op mortaliteit, hart- en vaatziekten en beroerte bij patiënten met PAV met en zonder ischemische hartklachten (WHO).
Van behandeling met ACE-remmers is aangetoond dat het bij groepen met een sterk verhoogd cardiovasculair risico een gunstig effect heeft in aanvulling op een daling van de bloeddruk. In het Heart Outcomes Prevention Evaluation (HOPE) onderzoek leidde ramipril bij patiënten met symptomatische PAV zonder bekende lage ejectiefractie of HF tot een significante 25% daling van het risico op cardiovasculaire gebeurtenissen. Het ONTARGET-onderzoek toonde aan dat telmisartan bij deze patiënten equivalent is aan ramipril.
Belangrijk is ook dat bètablokkers niet gecontra-indiceerd zijn voor patiënten met PAV. Een meta-analyse van elf gerandomiseerde, gecontroleerde onderzoeken bij patiënten met milde tot gematigde PAV toonde aan dat bètablokkers geen negatieve invloed hadden op de loopcapaciteit of de symptomen van claudicatio intermittens.
De Antithrombotic Trialists’ Collaboration-meta-analyse combineerde gegevens van 42 gerandomiseerde onderzoeken onder 9706 patiënten met claudatio intermittens en/of perifere arteriële bypass of angioplastiek. De incidentie van vasculaire sterfte, niet-fatale MI en niet-fatale beroerte bij follow-up was significant met 23% verlaagd, door antitrombotica in vergelijking met placebo. De werkzaamheid van clopidogrel vergeleken met aspirine werd onderzocht in het gerandomiseerde onderzoek Clopidogrel versus Aspirin in Patiënten at Risk for Ischemisch Events (CAPRIE), met daarin een subgroep van 6452 patiënten met PAV. Na 1,9 jaar follow-up bedroeg de jaarlijkse gecombineerde incidentie van vasculaire sterfte, niet-fatale MI en niet-fatale beroerte voor patiënten met PAV 3,7% in de clopidogrelgroep en 4,9% in de aspirinegroep, met een significante 24% daling voor clopidogrel en geen grote verschillen wat betreft veiligheid. Voor de keuze van antitrombotica wordt verwezen naar de PAV-richtlijnen (NHG-Standaard Perifeer arterieel vaatlijden; medisch specialistische richtlijn Perifeer arterieel vaatlijden).
Aanbevelingen
- Beschouw patiënten met PAV als individuen met een zeer hoog risico op nieuwe hart- en vaatziekten.
- Geef leefstijladviezen conform de adviezen voor personen met een zeer hoog risico op hart- en vaatziekten, die worden beschreven in de betreffende modules van deze richtlijn.
- Adviseer iedere patiënt met PAV lichamelijk actief te zijn, bij voorkeur in een begeleid beweegprogramma.
- Geef medicamenteuze therapie met bloeddruk- en LDL-cholesterolverlagers conform de adviezen voor personen met een zeer hoog risico op hart- en vaatziekten die worden beschreven in de betreffende modules van deze richtlijn.
- Behandel de bloeddruk bij patiënten met PAV in beginsel met een ACE-remmer.
- Overweeg ook normotensieve symptomatische PAV-patiënten te behandelen met een ACE-remmer.
- Geef patiënten met PAV antitrombotica conform de adviezen van de Nederlandse PAV-richtlijnen (NHG-Standaard Perifeer arterieel vaatlijden; medisch specialistische richtlijn Perifeer arterieel vaatlijden).
Uitgangsvraag
Wat is de effectiviteit van antitrombotische behandeling bij personen zonder hart- en vaatziekten?
Inleiding
Bij personen zonder hart- en vaatziekten, maar met een verhoogd risico op hart- en vaatziekten is de effectiviteit van een antitrombotische behandeling niet duidelijk. Bij patiënten met hart- en vaatziekte, zoals een myocardinfarct, een herseninfarct of TIA, of perifeer vaatlijden, is antitrombotische therapie effectief in het voorkomen van een recidief. Er zijn hiervoor meerdere antitrombotica beschikbaar. Deze therapieën zijn uitvoerig beschreven in desbetreffende richtlijnen voor de verschillende aandoeningen en worden hier niet verder beschreven.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is gebruikgemaakt van de Europese richtlijn Cardiovascular disease prevention in clinical practice uit 2016.
Overwegingen
Trombocytenaggregatieremmers bij personen zonder hart- en vaatziekten
Een systemische review van zes onderzoeken met 95.000 personen zonder hart- en vaatziekten onderzocht het effect op ernstige vasculaire incidenten. Er werd een absolute risicoreductie gevonden van 0,57% naar 0,51% per jaar. Het aantal ernstige gastro-intestinale en extracraniale bloedingen nam toe met 0,03% per jaar. Er was geen verschil in vasculaire mortaliteit tussen beide behandelgroepen. In een recent Japans gerandomiseerd onderzoek werden patiënten van zestig tot 85 jaar met hypertensie, dyslipidemie of diabetes mellitus behandeld met 100 mg aspirine of placebo. Het cumulatieve primaire eindpunt (overlijden door hart- en vaatziekten) na vijf jaar verschilde niet significant tussen de groepen, maar behandeling met aspirine gaf een significant hoger risico op extracraniale bloedingen die transfusie of ziekenhuisopname vereisten (p = 0,004). Bij personen met meerdere risicofactoren op hart- en vaatziekten werd clopidogrel in combinatie met aspirine versus alleen aspirine onderzocht in het Clopidogrel for High Atherothrombotic Risk and Ischemic Stabilisation, Management, and Avoidance (CHARISMA) onderzoek. Dit onderzoek toonde geen significant verschil tussen beide behandelgroepen.
Aanbeveling
- Geef geen antitrombotische therapie bij personen zonder hart- en vaatziekten met als doel het voorkomen van hart- en vaatziekten.
De tekst van dit detail is integraal overgenomen uit het in 2017 gepubliceerde addendum (Kwetsbare) ouderen bij de multidisciplinaire richtlijn CVRM. Het addendum is beschikbaar in de Richtlijnendatabase.
Inleiding
Trombocytenaggregatieremmers worden voorgeschreven ter voorkoming van stolselvorming in het arteriële vaatbed. De meest voorgeschreven trombocytenaggregatieremmers is acetylsalicylzuur, andere voorbeelden zijn carbasalaatcalcium, dipyridamol, clopidogrel, prasugrel en ticagrelor. Zij worden gebruikt als monotherapie en in combinatie. Bij personen onder de zeventig jaar zonder hart- en vaatziekten bestaat er vrijwel geen indicatie voor trombocytenaggregatieremmers. Na bijvoorbeeld een myocardinfarct of herseninfarct bestaat er vrijwel altijd een indicatie (tenzij patiënt met een herseninfarct reeds anticoagulantia gebruikt). De belangrijkste bijwerking van trombocytenaggregatieremmers is het optreden van bloedingen. Een belangrijke vraag bij ouderen is of het gunstige effect van trombocytenaggregatieremmers, namelijk het voorkomen van stolselvorming, ook opweegt tegen het ongunstige effect, namelijk het optreden van bloedingen. Met het toenemen van de leeftijd neemt niet alleen de kans op hart- en vaatziekten toe, maar stijgt ook de kans op bloedingen bij het gebruik van trombocytenaggregatieremmers.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvraag: wat is de effectiviteit van trombocytenaggregatieremmers bij ouderen (ouder dan zeventig jaar) vergeleken met een placebo?
P: oudere patiënten (ouder dan zeventig jaar) met of zonder een ischemisch CVA of myocardinfarct
I: trombocytenaggregatieremmers
C: placebo
O: kwaliteit van leven, functioneren waaronder cognitie, bijwerkingen, mortaliteit, events (hart- en vaatziekten, bloedingen), ziektevrije overleving
Relevante uitkomstmaten
De werkgroep achtte events (hart- en vaatziekten, bloedingen), kwaliteit van leven en functioneren voor de besluitvorming kritieke uitkomstmaten; en bijwerkingen, mortaliteit, en ziektevrije overleving voor de besluitvorming belangrijke uitkomstmaten.
Zoeken en selecteren (methode)
In de databases Medline (OVID) en EMBASE is met relevante zoektermen gezocht naar systematische reviews en gerandomiseerd gecontroleerde trials. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 410 treffers op. Onderzoeken werden geselecteerd op grond van de volgende selectiecriteria:
- systematische reviews (gezocht in ten minste twee databases, gedetailleerde zoekstrategie beschikbaar en risk of bias-beoordeling);
- gerandomiseerde trials van patiënten ouder dan zeventig jaar, of patiënten met een gemiddelde leeftijd van zeventig jaar of een subgroepanalyse van patiënten van zeventig jaar of ouder die een trombocytenaggregatieremmer kregen vergeleken met placebo.
Op basis van titel en abstract werden in eerste instantie veertig onderzoeken voorgeselecteerd. Na raadpleging van de volledige tekst werden vervolgens 38 onderzoeken geëxcludeerd (zie de exclusietabel onder het tabblad Verantwoording) en twee onderzoeken definitief geselecteerd.
Twee onderzoeken zijn opgenomen in de literatuuranalyse. De belangrijkste onderzoekskarakteristieken en resultaten zijn opgenomen in de evidence-tabellen. De beoordeling van de individuele onderzoeksopzet (risk of bias) is opgenomen in de risk of bias-tabellen.
Samenvatting van de literatuur
Beschrijving van de onderzoeken
I. Ouderen zonder hart- en vaatziekten
Silagy (1993) heeft een dubbelblind, gerandomiseerd, gecontroleerd onderzoek uitgevoerd naar de effectiviteit van een lage dosis acetylsalicylzuur (eenmaal daags 100 mg) bij ouderen. Personen van zeventig jaar of ouder zonder een geschiedenis van hart- en vaatziekten kwamen in aanmerking voor inclusie. Vierhonderd personen werden naar eenmaal daags 100 mg acetylsalicylzuur (n = 200) of naar een op acetylsalicylzuur gelijkende placebo (n = 200) gerandomiseerd. Acetylsalicylzuur of placebo werden voor twaalf maanden gegeven.
II. Ouderen met hart- en vaatziekten
Sivenius (1999) heeft een gerandomiseerde, placebogecontroleerde trial ondernomen om de effectiviteit van een lage dosis acetylsalicylzuur te evalueren. Naast de effectiviteit van acetylsalicylzuur werd ook de effectiviteit van dipyridamol alleen en in combinatie met acetylsalicylzuur beoordeeld. In totaal werden 6602 patiënten met recentelijk (minder dan drie maanden geleden) beroerte of TIA uit dertien landen gerekruteerd. Van de patiënten kregen 1649 tweemaal daags 25 mg acetylsalicylzuur, 1654 tweemaal daags 200 mg dipyridamol, 1650 tweemaal daags een combinatiepreparaat van acetylsalicylzuur en dipyridamol en 1649 een placebo. Patiënten werden gedurende twee jaar gevolgd. De resultaten werden gestratificeerd op leeftijd weergegeven. Voor het beantwoorden van de uitgangsvraag wordt alleen het resultaat van de subgroep van 75 jaar of ouder beschreven.
Resultaten
I. Ouderen zonder hart- en vaatziekten
Events (hart- en vaatziekten)
Het aantal hart- en vaatziekten werd niet door Silagy (2013) per behandelarm gerapporteerd vanwege het lage aantal events. Als gevolg daarvan is het niet mogelijk om een conclusie te trekken over het effect van eenmaal daags 100 mg acetylsalicylzuur op hart- en vaatziekten.
Kwaliteit van leven
Silagy (1993) rapporteerde geen data over kwaliteit van leven.
Functioneren waaronder cognitie
Silagy (1993) rapporteerde geen data over (cognitief) functioneren.
Bijwerkingen (bloedingen)
Silagy (1993) heeft bloedingen gerapporteerd als alle symptomen gerelateerd aan bloedingen. Vierendertig (17%) deelnemers die dagelijks acetylsalicylzuur slikten, kregen symptomen gerelateerd aan bloedingen vergeleken met 19 (10%) deelnemers die een placebo slikten. Het risico op een symptoom gerelateerd aan een bloeding was 79% verhoogd bij gebruik van een acetylsalicylzuur eenmaal daags voor twaalf maanden vergeleken met een placebo (RR 1,79; 95%-BI 1,06 tot 3,03). Het betrouwbaarheidsinterval is op basis van gerapporteerde gegevens berekend. Het number needed to harm (NNH) was 14. Een deelnemer met een bloeding die acetylsalicylzuur kreeg, moest opgenomen worden voor een spoedoperatie en een bloedtransfusie. Deze deelnemer bleek een diep bloedende darmzweer te hebben.
Silagy (1993) heeft ook het aantal gastro-intestinale bloedingen bekeken. Zes (3%) van de acetylsalicylzuurgebruikers kregen een gastro-intestinale bloeding vergeleken met nul placebogebruikers. Gezien het lage aantal gastro-intestinale bloedingen is het moeilijk om een effectschatting te interpreteren.
Mortaliteit
Vanwege het lage aantal events heeft Silagy (1993) het aantal doden niet per behandelarm gerapporteerd, maar een event-frequentie over de gehele trialpopulatie gerapporteerd. Als gevolg hiervan is het niet mogelijk om een conclusie te trekken over het effect van eenmaal daags 100 mg acetylsalicylzuur op mortaliteit.
Ziektevrije overleving
Silagy (1993) rapporteerde geen data over ziektevrije overleving.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaten kwaliteit van leven, functioneren, mortaliteit, hart- en vaatziekten en ziektevrije overleving kan niet worden gegradeerd vanwege het ontbreken van data.
Bijwerkingen: de bewijskracht voor de uitkomstmaat bijwerkingen (bloedingen) is met drie niveaus verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias), extrapoleerbaarheid (bias als gevolg van indirectheid; uitkomst betrof symptomen gerelateerd aan een bloeding) en het geringe aantal patiënten met een bloeding (imprecisie).
Conclusie
| - GRADE | Vanwege het ontbreken van data is het niet mogelijk een conclusie te trekken over het effect van eenmaal daags 100 mg acetylsalicylzuur vergeleken met placebo op kwaliteit van leven, functioneren, mortaliteit, hart- en vaatziekten en ziektevrije overleving. |
| Bron: Silagy 1993 |
| Bijwerkingen (bloedingen) | |
| Zeer laag GRADE | Eenmaal daags 100 mg acetylsalicylzuur vergeleken met placebo is met een verhoogd risico op symptomen gerelateerd aan bloedingen geassocieerd bij gezonde personen ouder dan zeventig jaar. |
| Bron: Silagy, 1993 | |
Resultaten
II. Ouderen met hart- en vaatziekten
Events (hart- en vaatziekten)
Sivenius (1999) heeft dit eindpunt als volgt gedefinieerd: vasculaire dood, niet-fatale beroerte, niet-fataal myocardinfarct of een andere niet-fataal vasculair event. Onder 75-jarigen of ouder kregen 132 patiënten uit 468 patiënten die acetylsalicylzuur kregen een cardiovasculaire ziekte, vergeleken met 134 patiënten van 427 uit de placebogroep. Het corresponderende relatieve risico op hart- en vaatziekten was mogelijk 10% verlaagd bij gebruik van acetylsalicylzuur vergeleken met een placebo (RR 0,90; 95%-BI 0,73 tot 1,10).
Kwaliteit van leven
Sivenius (1999) rapporteerde geen data over kwaliteit van leven.
Functioneren waaronder cognitie
Sivenius (1999) rapporteerde geen data over (cognitief) functioneren.
Bijwerkingen (bloedingen)
Sivenius (1999) heeft geen data over mogelijke bijwerkingen of specifiek bloedingen gerapporteerd.
Mortaliteit
Aangezien de data in een samengesteld eindpunt van beroerte en/of dood werden gerapporteerd, was het niet mogelijk om de data over alleen dood weer te geven.
Ziektevrije overleving
Sivenius (1999) heeft geen data over ziektevrije overleving gerapporteerd.
Bewijskracht van de literatuur
Vanwege het ontbreken van data is het niet mogelijk om de bewijskracht te graderen voor de uitkomstmaten, kwaliteit van leven, functioneren, bijwerkingen, mortaliteit of ziektevrije overleving.
Hart- en vaatziekten: de bewijskracht voor de uitkomstmaat hart- en vaatziekten is met twee niveaus verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias; randomisatie niet gestratificeerd op leeftijd).
Conclusie
| - GRADE | Vanwege het ontbreken van data is het niet mogelijk om een conclusie te formuleren over het effect van een lage dosering (tweemaal daags 25 mg) acetylsalicylzuur op kwaliteit van leven, functioneren, bijwerkingen, mortaliteit en ziektevrije overleving. |
| Bron: Sivenius 1999 |
| Hart- en vaatziekten | |
| Laag GRADE | Het gebruik van een lage dosering (tweemaal daags 25 mg) acetylsalicylzuur vergeleken met een placebo lijkt niet geassocieerd te zijn met een verlaging van het risico op hart- en vaatziekten. |
| Bron: Sivenius 1999 | |
Overwegingen
Bij jongere personen zonder hart- en vaatziekten wordt preventieve behandeling met acetylsalicylzuur niet standaard aanbevolen. In een grote meta-analyse van meer dan 100.000 personen met een gemiddelde leeftijd van 57 jaar werd er door behandeling met acetylsalicylzuur jaarlijks bij minder dan 1 op de 1000 personen een belangrijk cardiovasculair event voorkomen. Tegenover deze geringe winst stond een jaarlijks optreden van grote (hersen)bloedingen bij 1 op de 1000 personen. Voor de groep van zeventigplussers bestaat er geen subgroepanalyse. Ook is er geen gerandomiseerd onderzoek gepubliceerd naar het effect van acetylsalicylzuur bij zeventigplussers zonder hart- en vaatziekten. Bij zeventigplussers is het risico op het ontwikkelen van hart- en vaatziekten groter dan bij jongeren, wat een argument zou kunnen zijn om zeventigplussers wel preventief te behandelen met acetylsalicylzuur. Bij zeventigplussers is het risico op het krijgen van bloedingscomplicaties van behandeling met acetylsalicylzuur echter ook groter dan bij jongeren. Hoe deze balans ligt bij zeventigplussers is onbekend. Gezien het ontbreken van onderzoeksgegevens bij zeventigplussers zonder hart- en vaatziekten is het advies om hen niet preventief te behandelen met acetylsalicylzuur. Bij kwetsbare ouderen is naar verwacht het risico op bloedingscomplicaties groter dan bij vitale ouderen. Er zal nog meer terughoudendheid betracht moeten worden. Voor het gebruik van maagzuurremmers bij gebruik van acetylsalicylzuur gelden de adviezen van de vigerende richtlijnen.
Bij alle jongere patiënten met hart- en vaatziekten wordt behandeling met acetylsalicylzuur of andere trombocytenaggregatieremmers geadviseerd, gezien de duidelijk afname van recidief cardiovasculaire events. Specifiek bij zeventigplussers met hart- en vaatziekten is hier nauwelijks onderzoek naar gedaan.
Aanbeveling
Vitale en kwetsbare ouderen:
- Start niet met trombocytenaggregatieremmers bij (kwetsbare) ouderen (> 70 jaar) zonder hart- en vaatziekten.
- Start met trombocytenaggregatieremmers bij (kwetsbare) ouderen met hart- en vaatziekten. Bepaal de keuze van de trombocytenaggregatieremmer of combinatie van trombocytenaggregatieremmers op basis van indicatie.
- Geef een maagzuurremmer bij het voorschrijven van een trombocytenaggregatieremmer aan (kwetsbare) ouderen conform de NHG-Standaard Maagklachten.
De tekst van dit detail is integraal overgenomen uit het in 2017 gepubliceerde addendum (Kwetsbare) ouderen bij de multidisciplinaire richtlijn CVRM. Het addendum is beschikbaar in de Richtlijnendatabase.
Inleiding
Het beoogde doel van het voorschrijven van trombocytenaggregatieremmers is het voorkomen van stolselvorming in het arteriële vaatbed. De belangrijkste bijwerking is het optreden van bloedingen. Wanneer het beoogde voordeel niet opweegt tegen de eventuele nadelen dient overwogen te worden om de trombocytenaggregatieremmers te stoppen.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvraag: wat is de effectiviteit van stoppen met plaatsjesremmers bij ouderen (ouder dan zeventig jaar) vergeleken met continueren van plaatsjesremmer?
P: oudere patiënten (ouder dan zeventig jaar) met of zonder een CVA of MI|
I: stoppen van trombocytenaggregatieremmers
C: continueren van trombocytenaggregatieremmers
O: kwaliteit van leven, functioneren, hart- en vaatziekten, bijwerkingen, mortaliteit, ziektevrije overleving
Relevante uitkomstmaten
De werkgroep achtte kwaliteit van leven en functioneren voor de besluitvorming kritieke uitkomstmaten; en bijwerkingen, mortaliteit, events (HVZ, bloedingen) en ziektevrije overleving voor de besluitvorming belangrijke uitkomstmaten.
Zoeken en selecteren (methode)
In de databases Medline (OVID), EMBASE is met relevante zoektermen gezocht naar systematische reviews en gerandomiseerde gecontroleerde trials. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 329 treffers op. Onderzoeken werden geselecteerd op grond van de volgende selectiecriteria:
- systematische reviews (gezocht in ten minste twee databases, gedetailleerde zoekstrategie beschikbaar en risk of bias-beoordeling);
- gerandomiseerde trials van patiënten ouder dan zeventig jaar, of patiënten met een gemiddelde leeftijd van zeventig jaar of een subgroepanalyse van patiënten zeventig jaar of meer die stopte met het nemen van trombocytenaggregatieremmers, vergeleken met het continueren van trombocytenaggregatieremmers.
Op basis van titel en abstract werd in eerste instantie één onderzoek voorgeselecteerd. Na raadpleging van de volledige tekst werd dit onderzoek echter geëxcludeerd (zie de exclusietabel).
Resultaten
Geen enkel onderzoek voldeed aan de inclusiecriteria.
Samenvatting van de literatuur
Beschrijving van de onderzoeken
Er zijn geen onderzoeken gevonden.
Conclusie
Er is geen conclusie op basis van de literatuursamenvatting mogelijk aangezien er geen enkel onderzoek voldeed aan de inclusiecriteria.
Overwegingen
Er zijn geen onderzoeken gepubliceerd over het stoppen van trombocytenaggregatieremmers bij personen zonder hart- en vaatziekten of patiënten met hart- en vaatziekten, ongeacht hun leeftijdscategorie. Aangezien bij personen zonder hart- en vaatziekten er in principe geen indicatie bestaat voor behandeling met trombocytenaggregatieremmers, dient stoppen met trombocytenaggregatieremmers sterk overwogen te worden, zeker in het geval van bloedingscomplicaties. Dit advies geldt voor zowel kwetsbare als niet-kwetsbare ouderen.
De meeste patiënten met hart- en vaatziekten worden behandeld met acetylsalicylzuur of een andere trombocytenaggregatieremmer in het kader van secundaire profylaxe. Stoppen met acetylsalicylzuur dient overwogen te worden bij bloedingscomplicaties. De voor- en nadelen van (tijdelijk) stoppen dienen dan tegen elkaar afgewogen te worden. Bij gebruik van meerdere trombocytenaggregatieremmers tegelijkertijd is in het geval van bloedingscomplicaties en na twaalf maanden gecombineerd gebruik overleg met de oorspronkelijke voorschrijver wenselijk. Hierbij is de combinatie van acetylsalicylzuur-dipyridamol uitgezonderd, aangezien deze combinatie in de regel levenslang wordt voorgeschreven. Dit advies geldt voor zowel kwetsbare als niet-kwetsbare ouderen.
Aanbeveling
Vitale ouderen:
- Stop trombocytenaggregatieremmers bij vitale ouderen zonder hart- en vaatziekten.
- Overweeg tijdelijk te stoppen bij vitale ouderen met hart- en vaatziekten in geval van (spontane) bloedingscomplicaties.
Kwetsbare ouderen:
- Stop trombocytenaggregatieremmers bij kwetsbare ouderen zonder hart- en vaatziekten.
- Overweeg te stoppen bij kwetsbare ouderen met hart- en vaatziekten in geval van (spontane) bloedingscomplicaties.
3.1 Interventies op populatieniveau
Naar Samenvatting ›Maatregelen op populatieniveau kunnen de verdeling van risicofactoren voor hart- en vaatziekten in de algemene bevolking in gunstige zin verschuiven. Een kleine verlaging van bijvoorbeeld de bloeddruk in de gehele populatie leidt tot een grotere afname van de ziektelast in de algemene bevolking dan een grotere daling bij een kleinere populatie.
Maatregelen op populatieniveau die bijvoorbeeld gericht zijn op het bevorderen van een gezonde voeding, meer bewegen, niet roken, minder alcohol en meer gezonde buitenlucht, zorgen voor een gezondere leefomgeving en een gezondere leefstijl. Waarschijnlijk ook effectief zijn maatregelen die gericht zijn op prijsverhoging van ongezonde producten via belastingen, zoals een tabaksaccijns of een vet- of suikertax, of op prijsverlagingen van gezondere producten via subsidies op bijvoorbeeld groenten en fruit. Wenselijk is verder het bevorderen van kennis over de samenstelling van producten door het aangeven van de voedingswaarde en een begrijpelijk logo op de voorkant van voedingsmiddelen.
Voor meer informatie over mogelijke maatregelen, zie details.
Uitgangsvraag
Welke interventies op populatieniveau zijn effectief in het beïnvloeden van leefstijl?
Deze uitgangsvraag omvat de volgende deelvragen:
- Welke interventies op populatieniveau ten aanzien van het bevorderen van gezonde voeding zijn effectief?
- Welke interventies op populatieniveau ten aanzien van het bevorderen van lichaamsbeweging zijn effectief?
- Welke interventies op populatieniveau ten aanzien van roken en ander tabaksgebruik zijn effectief om stoppen te bevorderen of het gebruik te verminderen?
- Welke interventies op populatieniveau zijn effectief om personen te beschermen tegen alcoholmisbruik?
- Welke interventies op populatieniveau zijn effectief in het bevorderen en beschermen van een gezonde lucht?
Inleiding
De benadering op populatieniveau volgt het denkmodel van Geoffrey Rose: kleine veranderingen in het ziekterisico (of de risicofactor) in een hele populatie leiden tot een grotere afname in ziektelast dan een grote verandering beperkt tot personen met een verhoogd risico. Deze populatiebrede benadering biedt nog meer voordelen: ze pakt het risico op hart- en vaatziekten gedurende het hele leven aan en leidt tot een vermindering in gezondheidsongelijkheid.
Individueel gedrag wordt bepaald door een omgeving met hiërarchische niveaus. Hiertoe behoren individuele keuze, invloed van het gezin, culturele en etnische groepen en werk, maar ook de gezondheidszorg en het overheidsbeleid en beleid op wereldniveau (bijvoorbeeld Europees beleid en internationale handelsafspraken). Deze paragraaf heeft tot doel belanghebbenden te voorzien van onderbouwde suggesties voor de meest kansrijke interventie om het risico op hart- en vaatziekten te verminderen, die kunnen worden ingevoerd op groeps-, wijk-, regionaal, nationaal of wereldwijd niveau. Professionals in de gezondheidszorg spelen een belangrijke rol bij het aanbevelen van deze interventies op populatieniveau.
Strategieën zoals ‘nudges’ (= zachte duwtjes) en ‘de norm worden’ zijn voorgesteld als hulpmiddelen. Door de context te veranderen en zo de gezonde keuze ook de makkelijke keuze te maken, worden personen de gezonde kant op geduwd. Zowel nationale als lokale overheden moeten een maatschappelijke omgeving creëren waarin gezondere standaarden worden geboden.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is gebruikgemaakt van de Europese richtlijn Cardiovascular disease prevention in clinical practice uit 2016 en verschillende bronnen van Nederlandse maatregelen, die op dit gebied worden genomen. Er is voor beantwoording van deze uitgangsvraag geen systematisch literatuuronderzoek verricht.
De maatregelen die hier worden gepresenteerd zijn gebaseerd op recente omvangrijke reviews en individuele onderzoeken. Het is zelden haalbaar om een RCT te gebruiken om interventies op populatieniveau te evalueren (in tegenstelling tot interventies op individueel niveau). De werkgroep heeft ervoor gekozen een maatregel aan te bevelen indien het onderliggend bewijs als hoog werd ingeschat en een maatregel te overwegen als er sterke aanwijzingen waren voor effectiviteit.
Overwegingen
Maatregelen op populatieniveau ter bevordering van een gezonde leefwijze kunnen onder andere gericht zijn op het bevorderen van een gezonde voeding, meer bewegen, niet roken, minder alcohol en een gezonde lucht. Hierdoor worden een gezonde leefomgeving en gezond aanbod gecreëerd. Daarnaast hebben maatregelen om prijsverhogingen van ongezonde producten te bewerkstelligen, zoals accijnzen, belastingen (tabakswaren, alcoholische dranken of een vet-, zout- of suikertaks) of prijsverlagingen van gezondere producten via subsidies (bijvoorbeeld op groenten en fruit) een aangetoond effect op aankoopgedrag. Tevens is goed inzicht in de samenstelling van producten wenselijk, alsmede een begrijpelijk logo op de voorkant van voedingsmiddelen dat aangeeft of het gehalte van een voedingsstof hoog, gemiddeld of laag is.
Het is een gezamenlijke inspanning en verantwoordelijkheid van stakeholders om te komen tot preventieve interventies. Op internationaal en Europees niveau spelen organisaties als de World Health Federation (WHF), World Health Organisation (WHO), Europese Unie (EU) en koepels van artsen en specialisten (bijvoorbeeld de World Organization of National Colleges, Academies and Academic Associations of General Practitioners/Family Physicians (WONCA), European Society of Cardiology (ESC), Early Childhood Development Agency (ECDA), The Standing Committee of European Doctors (CPME)), organisaties van consumenten (zoals het Bureau Européen des Unions de Consommateurs (BEUC)) of hartpatiënten (bijvoorbeeld het European Heart Network) een belangrijke rol. Veel wet- en regelgeving komt heden ten dage op Europees niveau tot stand. Op nationaal en lokaal niveau spelen – afhankelijk van het thema – overheden, gezondheidsautoriteiten, gezondheidsbevorderende, consumenten- en patiëntenorganisaties, gezondheidsfondsen, de levensmiddelen- en tabaksindustrie, en aanbieders van voeding, tabakswaren, alcoholische dranken, sportfaciliteiten, enzovoort een toonaangevende rol. Ook medische beroepsorganisaties van artsen en paramedici kunnen een belangrijke rol spelen en dragen medeverantwoordelijkheid in het gezamenlijk komen tot een gezonde leefwijze en -omgeving.
De interventies op populatieniveau zullen per deelvraag (voeding, bewegen, roken, alcohol en gezonde lucht) besproken worden onderverdeeld naar:
- overheidsmaatregelen
- media en voorlichting
- etiketten en aanduidingen
- economische stimulansen
- gezonde leefomgeving (scholen, werkplekken en wijken)
Met betrekking tot bovenstaande punten spelen de beschikbaarheid (van nodige financiën, personen en middelen), de werkbaarheid en de wenselijkheid een belangrijke rol in de overwegingen.
1 Maatregelen op populatieniveau om gezonde voeding te bevorderen
Het voedingspatroon is een belangrijke determinant van een hoge bloeddruk, een hoog cholesterolgehalte, obesitas, diabetes mellitus en het ontstaan van hart- en vaatziekten. Na gunstige veranderingen in het voedingspatroon op populatieniveau wordt een snelle afname van hart- en vaatziekten waargenomen. Belanghebbenden, waaronder zorgprofessionals, delen de verantwoordelijkheid voor benaderingen op populatieniveau en kunnen helpen een gezond voedingspatroon en een gezonde leefomgeving te bevorderen.
Overheidsmaatregelen
Veel EU-landen erkennen dat verlaging van de caloriedichtheid en de hoeveelheid suiker en zout in voeding en dranken voordelen heeft voor de gezondheid, evenals het vervangen van trans- en verzadigde vetten door onverzadigde vetten. Dit heeft in sommige landen geleid tot een succesvolle vermindering van transvetten en zout. In Nederland is helaas nog geen daling in zoutinname aangetoond. De aankondiging van een suikertaks op frisdranken in Groot-Brittannië leidde reeds tot gunstige productaanpassingen nog voor de start van de taks. Verplichte bovengrenzen van voedingsstoffen in de hele EU zullen ervoor zorgen dat alle consumenten in de EU even goed beschermd zijn. Overheden kunnen landelijke samenwerking mogelijk maken tussen (lokale) overheden, niet-gouvernementele organisaties (ngo’s), de voedingsindustrie, detailhandel, catering, scholen, werkplekken en andere belanghebbenden.
Januari 2014 heeft het ministerie van VWS het Akkoord Verbetering Productsamenstelling gesloten met de Federatie Nederlandse Levensmiddelen Industrie (FNLI), het Centraal Bureau Levensmiddelenhandel (CBL), Koninklijke Horeca Nederland (KHN) en de Vereniging Nederlandse Cateringorganisaties (Veneca). Dit betreft een vorm van zelfregulering. De onafhankelijke Wetenschappelijke Adviescommissie heeft de voorstellen van de voedingsmiddelenindustrie tot nu toe beoordeeld als zwak, gering of matig ambitieus. Gezondheidsbevorderende organisaties, zoals de Consumentenbond, Hartstichting, Nierstichting, het Diabetes Fonds, en beroepsverenigingen, zoals KNMG en de Nederlandse Hypertensie Vereniging vinden dat productverbetering intensiever en in een groter tempo aangepakt moet worden om de doelstellingen van het Akkoord eind 2020 te kunnen bereiken. Een verscherping van de eerder gemaakte afspraken ten opzichte van het volledig naleven van die afspraken zou volgens het RIVM kunnen leiden tot een vermindering van de dagelijkse zoutinname met 0,7 in plaats van 0,4 gram (nu gemiddelde inname 8,7 gram; norm is 6 gram) en van de suikerinname met 5 in plaats van 2 gram (nu gemiddelde inname 119 gram), terwijl uitbreiding van de afspraken over zoutverlaging in een bredere range van voedingsmiddelen de dagelijkse zoutinname met bijna 1 gram zou kunnen laten dalen [Hoogendoorn 2016]. Als de doelen van het Akkoord eind 2020 niet behaald worden, zal strengere regelgeving vanuit de overheid hiervoor moeten zorgen. De KNMG en deze richtlijncommissie CVRM pleiten voor wetgeving. Aanvullend op nationaal beleid, zijn gelijke eisen aan voedingsmiddelenproducenten op Europees niveau nodig.
De hoeveelheid transvetten in de Nederlandse voeding is wel succesvol gedaald naar onder de 1 energie% Dit komt door modernere hardingstechnieken en andere keuze van grondstoffen. Op dit moment zijn van nature in zuivel voorkomende transvetzuren de belangrijkste bron van transvet geworden, hoewel het gehalte daarin laag is. Dit pleit voor magere zuivel. Transvetten in zuivel hebben in grote hoeveelheden eenzelfde effect als in industrieel bewerkte voedingsmiddelen
Na intensieve samenwerking door vele partijen in het kader van het convenant Overgewicht respectievelijk Gezond gewicht wordt nu sterk ingezet op de lokale JOGG-aanpak: JOngeren op Gezond Gewicht. Een derde van de Nederlandse gemeenten gebruikt de JOGG-aanpak, waarbij lokale samenwerkingsverbanden tussen private en publieke partijen zich in zetten voor een gezonder gewicht onder jongeren. Over het algemeen worden gezonder drinkgedrag en een toename van beweeggedrag geconstateerd, op eetgedrag zijn de resultaten niet eenduidig. Wat betreft overgewicht wordt over het algemeen een daling van overgewicht gerapporteerd.
Media en voorlichting
Educatieve hulpmiddelen en mediacampagnes leiden mogelijk tot een vermindering van het aantal gevallen van obesitas bij kinderen (bijvoorbeeld door ervoor te zorgen dat kinderen minder worden blootgesteld aan reclame voor ongezonde voeding). In 2013 publiceerde het European Heart Network een rapport waarin de recente ontwikkelingen op het gebied van marketing van ongezonde voeding gericht op kinderen werden samengevat. In februari 2015 is de Alliantie Stop kindermarketing ongezonde voeding in Nederland opgericht. Dit betreft een breed samenwerkingsverband van wetenschappers en maatschappelijke, consumenten- en gezondheidsorganisaties. De Alliantie pleit voor een beperking van kindermarketing tot voedingsmiddelen die passen binnen de ‘Schijf van Vijf’.
Etiketten en aanduidingen
Begeleidende campagnes voor een groter consumentenbewustzijn van gezonde voeding en voedingswaarde-etikettering kunnen effectief zijn. Consumenten begrijpen verschillende etiketteringssystemen, maar of het gebruik ervan bijdraagt aan een gezondere keuze is niet aangetoond. Het European Heart Network roept op tot de invoering van een vereenvoudigd kleurencodesysteem op de voorkant van de verpakking, dat aangeeft of de voedingswaarde hoog, gemiddeld of laag is. Dit systeem kan worden toegepast op alle levensmiddelen en kan worden uitgebreid naar bepaalde restaurants. Etikettering stimuleert bovendien de herformulering van voedingsmiddelen en biedt dus de mogelijkheid de voedselinname te verbeteren en zo de incidentie van aan voeding gerelateerde chronische aandoeningen te verminderen.
In Nederland zijn er naast het Akkoord Verbetering Productsamenstelling, het Vinkje op verpakkingen (dat op dit moment wordt uitgefaseerd) en de Schijf van Vijf. Omdat deze systemen weinig samenhang kennen – ze gebruiken verschillende productgroepen, voedingsstoffen en criteria –, pleit de Commissie Criteria Productverbetering van het RIVM voor de introductie van een integraal systeem voor productverbetering. Een integraal systeem stelt minimale eisen voor productverbetering (ten aanzien van zout, verzadigd vet, suiker, calorieën en vezel) per productgroep, waardoor deze eisen voor alle producten in die groep gelden. De producten die volgens aparte criteria de beste resultaten behalen worden gedefinieerd als koploper. In opdracht van het ministerie van VWS heeft het Voedingscentrum een app ontwikkeld, ‘Kies ik gezond?’, waarmee de consument de samenstelling van voedingsmiddelen kan inzien en producten kan vergelijken. De Hartstichting en Consumentenbond zien naast de app, ook graag een kleurcodering per 100 gram voedingsstof op de voorkant van voedingsmiddelen (multiple traffic light). Onderzoek van de Consumentenbond wijst uit dat consumenten aan dit systeem de voorkeur geven.
In Frankrijk is er vanuit de overheid een verdrag ondertekend voor het vrijwillig gebruik van een voedingslogo op de verpakking van voedingsmiddelen. Het gaat hier om een kleurscoresysteem waarbij er vijf kleuren worden gebruikt, die lopen van donkergroen (hoge voedingswaarde) tot rood (lagere voedingswaarde). Hoewel de kleurscore een reële afspiegeling zou zijn van de voedingswaarde van individuele producten en goed begrepen wordt door de consument hebben weinig supermarktketens en fabrikanten zich er vooralsnog aan gecommitteerd.
Economische stimulansen
Prijsstrategieën kunnen leiden tot een dalende verkoop van ongezonde voeding en een toenemende verkoop van groente en fruit. Modelleringsonderzoeken hebben aangetoond dat belasting op voeding de inname van calorieën en voedingstoffen, de BMI en gezondheid gunstig kan beïnvloeden. Het blijft echter onzeker of prijsstrategieën naast het beïnvloeden van aankoopgedrag ook aanzetten tot het kopen en consumeren van gezonde voeding. Een toenemend aantal landen heeft belastingen geïntroduceerd op ongezonde voeding en dranken (bijvoorbeeld de vetbelasting in Denemarken (die leidde tot een vermindering van 10 tot 15% in consumptie; inmiddels teruggeroepen) en de belasting op junkfood in Hongarije (verkoop daalde met 27%)). Tot op heden zijn in Nederland geen daadwerkelijke initiatieven genomen voor bijvoorbeeld een vet-, suiker- of zouttaks. De overheid is voor zelfregulering. In het buitenland zijn meerdere voorbeelden van geslaagde interventies, die van invloed waren op het aankoopgedrag of aanpassing van het product. In Groot-Brittannië verlaagden na invoer van de suikertaks vrijwel alle fabrikanten de hoeveelheid suiker in hun frisdranken.
Evenwichtige economische prikkels moeten worden overwogen: naast belastingen bijvoorbeeld subsidies om tegenwicht te bieden aan onevenwichtige gevolgen voor minder draagkrachtigen.
Gezonde leefomgeving
Om obesitas aan te pakken zou elke school en werkplek een beleid moeten hebben ter bevordering van een gezonde omgeving en gezonde voeding.
Gezondheidsvoorlichting zou bij voorkeur onderdeel moeten uitmaken van het onderwijsprogramma.
Vele landelijke en lokale partners, waaronder GGD’en, steunen in Nederland het project Gezonde School om gezondheid te bevorderen in het primair, het voortgezet en het middelbaar beroepsonderwijs. Een Gezonde School zet zich structureel en op een samenhangende wijze in voor de gezondheid van leerlingen en leerkrachten. Eind 2016 hebben 1065 scholen een vignet Gezonde School behaald. De themacertificaten Bewegen en Voeding worden het meeste aangevraagd. Onderdeel van het thema Voeding is een kantine die voldoet aan de Richtlijnen Gezondere Kantines van het Voedingscentrum. Diëtisten van het Voedingscentrum, de zogenaamde ‘schoolkantinebrigade’, helpen scholen het aanbod van eten en drinken en de uitstraling van de kantine te verbeteren. Ook lessen gezonde voeding zijn onderdeel van de aanpak Gezonde School. Een en ander kan leiden tot het behalen van het vignet Gezonde School, themacertificaat Voeding. Streven is om eind 2017 duizend scholen dit themacertificaat Voeding te laten behalen.
Interventies waarbij alleen het voedselaanbod op de werkplek werd aangepast of in combinatie met voorlichting over voedsel en veranderingen in de leefomgeving hebben geleid tot een verbetering in de consumptie van groenten en fruit en/of vetten. Cateraars hebben zich aangesloten bij het Akkoord Product Herformulering. In tal van bedrijven worden vitaliteitsprojecten uitgevoerd.
In de samenleving is het noodzakelijk de locatie en dichtheid van fastfoodketens te plannen, evenals goede bereikbaarheid van supermarkten, vooral in achterstandswijken. Een onlangs gepubliceerd onderzoek gericht op Nederlandse woongebieden liet een relatie zien tussen een hogere dichtheid (≥ 5) van fast-foodhorecagelegenheden in een straal van minder dan 1000 meter en het risico op hart- en vaatziekten en coronaire hartziekten bij volwassenen, respectievelijk OR 1,05 (95%-BI 1,02 tot 1,09) en OR 1,17 (95%-BI 1,09 tot 1,25) [Poelman 2018].
Aanbevelingen
Overheidsmaatregelen:
- Maak wetgeving over de samenstelling van voedingsmiddelen om het zout-, verzadigd vet- en suikergehalte van voedingsmiddelen en dranken te verminderen, en om portiegroottes (minder calorieën) te beperken.
- Blijf actief de voortgang van het Akkoord Product Herformulering monitoren.
- Introduceer een integraal systeem voor productverbetering.
- Bevorder een geïntegreerd en samenhangend beleid en activiteiten van lokale overheden, niet-gouvernementele organisaties, de voedingsindustrie, de detailhandel, catering, scholen, werkplekken en andere belanghebbenden om een gezond voedingspatroon te bevorderen en overgewicht te voorkomen; breidt het project Jongeren op Gezond Gewicht uit.
- Maak wetgeving die kindermarketing beperkt tot voedingsmiddelen uit de Schijf van Vijf.
Media en voorlichting:
- Overweeg educatieve voorlichtingscampagnes en/of tools (bijvoorbeeld apps) over de samenstelling van voedingsmiddelen te ontwikkelen om consumenten bewust te maken van de voedingswaarde van producten.
Etiketten en aanduidingen:
- Overweeg kleurcodering per voedingsstof op de voorkant van de verpakking van voedingsmiddelen.
- Overweeg een verplichte aanduiding van de voedingswaarde voor niet-voorverpakte levensmiddelen die worden verkocht in horeca, restaurants, ziekenhuizen en op het werk.
Economische stimulansen:
- Overweeg strategieën voor prijzen om ongezondere keuzen voor eten en drinken te ontmoedigen en subsidies om gezonde keuzen te bevorderen.
- Hef belastingen op voedingsmiddelen en dranken die rijk zijn aan suiker, verzadigd vet of zout, en op alcoholische dranken.
Gezonde leefomgeving:
Scholen:
- Voer een samenhangend, integraal en allesomvattend beleid op alle scholen, kleuterscholen en kinderdagverblijven om een gezond voedingspatroon te bevorderen. Breid het project Gezonde School uit.
- Vergroot de beschikbaarheid van vers drinkwater en gezond eten op scholen en in verkoopautomaten.
Werkplekken:
- Voer een samenhangend en integraal gezondheidsbeleid en stimuleer voedingseducatie bij alle bedrijven om het gezondheidsbewustzijn van werknemers te bevorderen.
- Vergroot de beschikbaarheid van vers drinkwater en gezond eten op de werkplek en in verkoopautomaten.
Wijken:
- Reguleer de locatie en dichtheid van fastfood- en alcoholverkooppunten.
2 Populatieaanpak om meer lichaamsbeweging te bevorderen
In de meeste landen haalt de meerderheid van de volwassenen en kinderen niet het minimale inspanningsniveau dat wordt aanbevolen door gezondheidsorganisaties. Het nieuwe advies Gezondheidsraad luidt om minimaal 150 minuten per week over verschillende dagen matig intensief te bewegen. Daarnaast adviseert de Raad om spier- en botversterkende oefeningen te doen, zoals traplopen, springen of tuinieren. Verder geldt zowel voor volwassenen, ouderen en kinderen; voorkom veel zitten. Voorbeelden van oefeningen biedt het Kenniscentrum Sport op de website www.allesoversport.nl.
In 2017 voldeed 48% van de Nederlandse mannen en 45% van de vrouwen niet aan de Nederlandse Norm Gezond bewegen [Gezondheidsenquête CBS 2017]. Bij preventie op populatiebasis geeft het motto ‘zeven beste investeringen’ het meest universele en uitgebreide advies om lichaamsbeweging te bevorderen.
Overheidsmaatregelen
De Rijksoverheid stimuleert personen om meer te sporten en bewegen om zo de kans op gezondheidsklachten te verminderen. Binnen het Nationaal Programma Preventie (NPP) is er aandacht om voldoende beweging te stimuleren. De sportsector kan hieraan bijdragen door een goed sport- en beweegaanbod te bieden. Naast de sportsector werkt het Rijk samen met gemeenten, bedrijven, zorgpartijen en maatschappelijke organisaties. Het NPP is gestart in februari 2014. Programma’s die het gezondheidsbeleid stimuleren zijn bijvoorbeeld de Gezonde School, Sport en Bewegen in de buurt, en Jongeren op Gezond Gewicht, zie paragraaf 1 hierboven. Er zijn ook programma’s voor specifieke doelgroepen, zoals het programma Grenzeloos Actief, dat personen met een beperking moet bevorderen om te gaan sporten door op lokaal niveau zichtbaar te maken waar personen met een beperking extra ondersteuning of coaching kunnen krijgen. Hieronder valt ook een vervoersregeling.
Het ministerie van VWS faciliteert het sluiten van preventiecoalities, met als doel het realiseren van meer door gemeenten en zorgverzekeraars gezamenlijk gedragen plannen voor effectieve preventieactiviteiten voor risicogroepen. Hiervoor wil zij samenwerking tussen gemeenten en zorgverzekeraars stimuleren en waar nodig faciliteren. De coalities zijn bedoeld om te komen tot een structurele borging van effectieve preventieactiviteiten, gefinancierd vanuit de reguliere financiële middelen van gemeenten en zorgverzekeraars. Er moet overeenstemming zijn tussen de verzekeraar en de gemeente over de te behalen doelen. Hun gezamenlijk opgestelde plannen omvatten een mix van activiteiten, die in samenhang worden uitgevoerd: in kaart brengen van gezondheidsrisico’s en bijbehorende risicogroepen, ontwikkeling en organisatie van samenhangende interventies voor de hele risicogroep (voorlichting, omgevingsinterventies, aansluiting bij andere domeinen, zoals onderwijs, sport, welzijn) en individuen daarbinnen, tijdig opsporen van individuen met een verhoogd risico. Hierover maken gemeenten en verzekeraars afspraken, vanuit ieders eigen wettelijke taken en verantwoordelijkheden.
Media en voorlichting
Gerichte media- en voorlichtingscampagnes kunnen aanzetten tot lichaamsbeweging. Recente campagnes door organisaties voor sportgeneeskunde stimuleerden huisartsen om vaker lichaamsbeweging voor te schrijven. De hoeveelheid lichaamsbeweging zou bij elk medisch contact moeten worden beoordeeld. De gecombineerde leefstijlinterventie of beweegkuur is een combinatie van ondersteuning om meer te bewegen en gezonder te eten door kleine veranderingen in gewoonten en gedrag. Onder professionele begeleiding vanuit de huisartsenpraktijk wordt dan aan een gezondere en actievere leefstijl gewerkt.
Via campagnes die door het Rijk gesteund zijn is bekendheid gegeven aan de Nederlandse Norm Gezond Bewegen, die aangeeft hoeveel je moet bewegen voor een goede gezondheid. Zo bewegen volwassenen voldoende als zij minimaal vijf dagen per week een half uur bewegen. Dit kan door te sporten, maar ook door te wandelen, fietsen of intensief huishoudelijk werk te doen.
Aanduidingen
Een eenvoudige strategie om de dagelijkse hoeveelheid beweging te vergroten is het gebruik van de trap in plaats van de lift of roltrap aan te moedigen, evenals het plaatsen van bordjes die personen naar de trappen verwijzen en het verspreiden van voorlichtingsmateriaal waarin de positieve effecten van traplopen worden benadrukt. Meer suggesties zijn te vinden op de website van organisaties als de Hartstichting en het Nederlands Instituut voor Sport en Bewegen.
Economische stimulansen
Een verhoging van brandstofprijzen kan het autogebruik terugbrengen en actief forenzen verhogen onder degenen die op loop- of fietsafstand wonen, met uitzondering van gehandicapten en zieken.
Gezonde leefomgeving
Lichamelijke opvoeding moet een verplicht onderdeel worden op peuter- en kleuteronderwijs, en op alle niveaus van het primaire en secundaire onderwijs. In het onderwijs moet een interventie met meerdere componenten gericht zijn op het stimuleren van levenslange lichaamsbeweging door getrainde docenten. Tijdens schooluren moet ten minste drie uur per week en bij voorkeur 60 minuten per dag aan sport of lichaamsbeweging worden gedaan. Regelmatig bewegen verbetert de cognitieve leervaardigheden. Dit bewegen kan worden aangevuld met actief verplaatsen naar school en het zorgen voor looproutes met toezicht van en naar school, om zo de afhankelijkheid van bussen te verkleinen.
Binnen het thema Werken aan Bewegen en Sport van de Gezonde School gaat het om stimuleren van een actieve leefstijl onder leerlingen, bijvoorbeeld door het geven van kwalitatief goede lessen lichamelijke opvoeding en extra aandacht voor inactieve leerlingen. Maar ook het aanbieden van een breed en gevarieerd aanbod van tussen- en naschoolse sport- en bewegingsactiviteiten in samenwerking met buitenschoolse beweeg- en sportaanbieders hoort bij (het stimuleren van) bewegen en sporten in en rondom de school.
Om het themacertificaat Bewegen en sport van het vignet Gezonde School te kunnen aanvragen, dienen scholen de effectiviteit van de activiteiten op het thema bewegen en sport te vergroten en integraal aan de pijlers gezondheidseducatie, fysieke en sociale omgeving, signaleren en beleid te werken.
Vanaf 2017 moeten alle Nederlandse primaironderwijsscholen per week minimaal twee uur, waar mogelijk drie uur, gymles laten geven door een bevoegde leraar. Ook wordt het buitenschoolse aanbod van sportactiviteiten versterkt. Een meerderheid van de Tweede Kamer is voorstander van een onderwijssysteem dat wettelijk voorschrijft hoeveel uur lichamelijke opvoeding een school moet geven.
Om sport en beweging te stimuleren doet de Nederlandse overheid het volgende:
- De ministeries van VWS en Onderwijs, Cultuur en Wetenschap (OCW) ondersteunen de onderwijsraden (PO, VO en MBO) bij de uitvoering van de Onderwijsagenda Sport, Bewegen en een Gezonde Leefstijl (SBGL).
- Het doel van de Onderwijsagenda SBGL is om te komen tot een kwantitatieve en kwalitatieve toename van sport, bewegen en een gezond leefstijlaanbod in en rondom de school.
- De ambitie van het Nederlands kabinet en de PO-raad is dat vanaf 2017 iedere basisschoolleerling twee uur bewegingsonderwijs door een bevoegd docent krijgt. Waar mogelijk wordt gestreefd naar drie uur.
- Een uitdagend schoolplein nodigt kinderen uit om voor- en naschools en in pauzes spelenderwijs meer te bewegen en sporten.
- Daarnaast worden buurtsportcoaches ingezet. Deze worden gefinancierd vanuit de ministeries van VWS, OCW en de gemeenten. Buurtsportcoaches leggen lokaal de verbinding tussen sport en andere sectoren, waaronder het onderwijs. Met de inzet van buurtsportcoaches wordt bereikt dat:
- meer personen kunnen sporten en bewegen in de buurt;
- sportverenigingen worden versterkt;
- verbinding wordt gelegd tussen de sportsector en sectoren als het onderwijs, welzijn, de kinderopvang en de zorg;
- sport als middel kan worden ingezet voor andere doelen, zoals het bevorderen van een gezonde leefstijl, leefbaarheid, weerbaarheid en participatie.
De werkplek kan verschillende mogelijkheden bieden om lichaamsbeweging te stimuleren. Sommige grotere bedrijven bieden een fitnesscentrum op het eigen terrein waar medewerkers gratis gebruik van kunnen maken. Interventies vanuit de werkplek kunnen ervoor zorgen dat medewerkers vaker aan lichaamsbeweging doen, maar evaluaties laten zien dat een groot aantal werknemers niet deelneemt. Supervisors en managers moeten daarom interventies vanuit de werkplek steunen door werknemers aan te moedigen meer aan lichaamsbeweging te doen.
Verbeterde toegankelijkheid van recreatie- en trainingsfaciliteiten door langere openingstijden en het benutten van openbare faciliteiten, zoals schoolpleinen, kan ertoe leiden dat alle leeftijdsgroepen meer lichaamsbeweging krijgen en de sociaaleconomische ongelijkheid van de toegankelijkheid vermindert [Exercise prescription for health 2013].
Met het programma Sport en Bewegen in de Buurt wil het ministerie van VWS ervoor zorgen dat de gezonde keuze ook een gemakkelijke keuze wordt. Wanneer personen gemakkelijker kunnen sporten en bewegen, bijvoorbeeld door aansluiting te zoeken bij werk, school of het veldje om de hoek, worden zij gestimuleerd in een actieve en gezonde leefstijl. Hiervoor zet de minister van VWS de volgende middelen in: meer dan 4000 buurtsportcoaches binnen gemeenten in Nederland, 500 Gezonde School-vignetten in het primair onderwijs en het programma Special heroes voor personen met een verstandelijke beperking. Inmiddels zijn 136 JOGG-gemeenten actief.
Verder heeft het ministerie van VWS een subsidieregeling beschikbaar gesteld voor lokale initiatieven, de Sportimpuls. Deze ondersteunt lokale sport- en beweegaanbieders bij het opstarten en uitvoeren van nieuwe activiteiten in de buurt, vooral waar achterstanden worden geconstateerd. Het is de bedoeling dat de projecten na een projectperiode van twee jaar zelfstandig kunnen worden voortgezet. Er zijn drie verschillende Sportimpuls-regelingen: één gericht op alle doelgroepen, één gericht op kinderen (‘kinderen sportief op gewicht’) en één gericht op jeugd in lage inkomensbuurten.
Aanbevelingen
Overheidsmaatregelen:
- Creëer ruimte voor lichamelijke activiteiten en sport bij het inrichten en plannen van nieuwe landschappen, gebouwen of inrichting van steden.
- Maak wetgeving dat iedere basisschoolleerling iedere week drie uur beweegonderwijs krijgt, gegeven door een bevoegd vakdocent.
Media en voorlichting:
- Overweeg doorlopende en gerichte voorlichtingscampagnes, waarbij gebruik wordt gemaakt van verschillende soorten media om lichaamsbeweging te promoten.
- Overweeg kortdurende buurtgerichte voorlichtingsprogramma’s, app’s en wearables, die gezond gedrag bevorderen, zoals wandelen.
- Overweeg het introduceren van een beweegkuur op recept, voorgeschreven door artsen.
Aanduidingen:
- Overweeg om aanduidingen te gebruiken waarbij meer bewegen wordt aangemoedigd, zoals het gebruik van de trap.
Economische stimulansen:
- Overweeg hogere belasting op brandstof (benzine) te heffen om het actieve vervoer/woon-werkverkeer te vergroten.
- Overweeg fiscale prikkels voor het aanschaffen van beweegapparaten of lidmaatschap van een sport- of fitnessclub voor individuen.
- Overweeg gecombineerde leefstijlinterventies, waaronder voeding en bewegen, op te nemen in het basispakket, onder deskundige begeleiding.
- Overweeg fiscale prikkels in te stellen voor werkgevers die leefstijlprogramma’s op de werkplek aanbieden ten aanzien van voeding, lichaamsbeweging en stoppen of voorkomen van roken.
Gezonde leefomgeving:
Scholen:
- Stel een integraal beleidsplan op voor het bevorderen van een gezonde leefstijl, waar meer bewegen onderdeel van is.
- Stimuleer het themacertificaat Bewegen en sport van het vignet Gezonde School.
- Creëer schoolpleinen die uitnodigen tot meer bewegen en ruimten met beweegapparaten voor lichaamsbeweging en sport.
- Overweeg regelmatige pauzes in het klaslokaal tijdens de les.
- Overweeg het stimuleren van actief vervoer naar school door veilige en eventueel bewaakte looproutes van en naar school.
Werkplekken:
- Overweeg leefstijlprogramma’s op de werkplek ten aanzien van voeding, lichaamsbeweging en stoppen met roken.
- Overweeg gestructureerde werkplekprogramma’s die lichaamsbeweging aanmoedigen en bied een vast tijdstip voor lichaamsbeweging tijdens werkuren.
- Overweeg om de toegang tot trappen en de aantrekkelijkheid ervan te verbeteren, eventueel in combinatie met ‘skip-stop’-liften die sommige verdiepingen overslaan.
- Overweeg het stimuleren van fitnesscentra op de werkplek.
Wijken:
- Overweeg als zorgverleners om bij elk consult naar beweeggedrag te vragen en dit aan het medisch dossier toe te voegen en zo nodig te stimuleren tot meer lichaamsbeweging.
- Verbeter de toegankelijkheid van recreatie- en sportruimten en voorzieningen (bijvoorbeeld het bouwen van parken en speelplaatsen, het verruimen van openingstijden, het gebruik van schoolfaciliteiten tijdens niet-schoolgaande dagen).
3 Populatie-aanpak om roken en tabaksgebruik te verminderen
In Nederland rookt 27% van de Nederlandse mannen en 19% van de vrouwen. [Gezondheidsenquête CBS 2017].
De Framework Convention on Tobacco Control van de WHO beveelt wetgeving tegen roken aan, zodat personen worden beschermd tegen tabaksrook en roken in openbare ruimtes wordt verboden. De WHO vindt dat er moet worden gewaarschuwd voor de gevaren van roken, de accijns op tabak moet worden verhoogd en reclameverboden moeten worden nageleefd. Kinderen en lage sociaaleconomische groepen zijn gevoelig voor tabaksinterventie op populatieniveau. Passief roken verhoogt het risico op hart- en vaatziekten, waarbij het risico voor vrouwen iets hoger is dan voor mannen. Alle vormen van (passief) roken zijn schadelijk, ook het roken van een waterpijp. Rookloze tabak (in Europa meestal in de vorm van snuif, een vochtig tabakspoeder dat onder de bovenlip wordt geplaatst) verhoogt het risico op fatale hart- en vaatzieken en het gebruik van snuif tijdens de zwangerschap verhoogt het risico op doodgeboorte. Er zijn geen bewijzen dat snuif de kans op stoppen met roken meer vergroot dan nicotinevervangende producten of medicatie. Veel rokers gebruiken e-sigaretten om te stoppen. Er zijn nog veel onbeantwoorde vragen over hun veiligheid, werkzaamheid bij stoppen met roken en impact op de volksgezondheid. De internationale wetgeving moet worden geharmoniseerd om een nieuwe tabaksepidemie gerelateerd aan e-sigaretten te voorkomen. Zie ook de RIVM-publicatie ‘E-sigaret aantrekkelijkheid voor rokers en niet-rokers.
Overheidsmaatregelen
Op 20 mei 2016 is de Tabak en rookwarenwet ingegaan, met bestaande en nieuwe regels. Een selectie:
- Roken is verboden in alle openbare ruimten en de horeca.
- Werknemers mogen op het werk alleen roken in speciaal daarvoor ingerichte ruimtes.
- Winkeliers mogen geen tabak of tabaksartikelen verkopen aan jongeren onder de achttien jaar. Dit geldt ook voor de verkoop van de e-sigaret (ook zonder nicotine) en kruidenproducten. Legitimatie is verplicht als iemand niet duidelijk ouder is dan achttien jaar.
- Elke vorm van tabaksreclame is verboden, behalve in de tabaksspeciaalzaak. Dit geldt ook voor de e-sigaret.
- Sponsoring van evenementen door de tabaksindustrie is verboden.
- Vanaf 2020 mogen rookwaren niet meer in het zicht liggen bij alle verkooppunten die een breder assortiment naast rookwaren verkopen, zoals supermarkten. Vanaf 2022 geldt dat ook voor andere verkooppunten, zoals kiosken en tankstations.
- Op nieuwe verpakkingen worden foto’s afgedrukt met een waarschuwing dat (mee)roken gezondheidsrisico’s met zich meebrengt.
- Sigaretten en shag met een smaak, zoals vanille, mogen per 20 mei 2017 niet meer verkocht worden. Vanaf 2020 geldt dit ook voor mentholsigaretten.
Media en voorlichting
Een combinatie van verschillende strategieën werkt het beste. Een verbod op reclame vermindert het tabaksgebruik en grootschalige mediacampagnes leiden ertoe dat minder tieners met roken beginnen en meer volwassenen stoppen. Media- en voorlichtingscampagnes op scholen leiden tot minder rokers en bevorderen het stoppen met roken. Redacties zouden in de media meer aandacht moeten besteden aan tabak en gezondheid. Online hulpprogramma’s of telefonische hulplijnen om te stoppen met roken leiden tot een daling in het tabaksgebruik.
De Alliantie Nederland Rookvrij is opgericht door de Hartstichting, het KWF en het Longfonds. Het is een samenwerkingsverband van publieke en private organisaties die als doel hebben om er samen voor te zorgen dat niemand meer (over)lijdt aan de gevolgen van roken. De Alliantie Nederland Rookvrij wordt gevormd door meer dan tachtig organisaties die samen een Rookvrije Generatie willen realiseren. De ambitie van de rookvrije generatie is dat alle kinderen geboren vanaf 2017 in elke fase van het opgroeien beschermd worden tegen tabaksrook en de verleidingen om te gaan roken.
Najaar 2018 wordt voor de vierde maal de campagne Stoptober gehouden onder auspiciën van de Alliantie Rookvrij. Stoptober is een campagne die rokers uitdaagt om gedurende de maand oktober niet te roken. De kracht van Stoptober is de positieve aanpak en de onderlinge samenwerking en steun. Bekende en onbekende Nederlanders helpen elkaar. In 2016 deden circa 54.000 personen hieraan mee. Ruim 80% van hen heeft het 28 dagen volgehouden om niet te roken. Ongeveer 70% van hen was na drie maanden nog steeds gestopt.
Etiketten en aanduidingen
Verpakkingen met afbeeldingen en tekst die de koper waarschuwen vergroten het bewustzijn over de gevaren van tabak. Sobere, gestandaardiseerde verpakkingen zonder merknamen verhogen de effectiviteit.
Economische stimulansen
Hogere accijnzen verminderen het tabaksgebruik en zetten aan tot stoppen, vooral onder jongeren en lagere sociaaleconomische groepen. De prijs van tabaksproducten is opgebouwd uit productiekosten, accijnzen, andere belastingen (zoals btw) en winst. Accijnzen zijn voor de overheid een bron van inkomsten, daarnaast speelt accijnsverhoging een rol in het tabaksontmoedigingsbeleid. Een stapsgewijze verhoging van de prijs van tabaksproducten wordt beschouwd als de meest effectieve beleidsmaatregel om het aantal rokers en het aantal gerookte sigaretten (bij rokers die doorgaan met roken) te verlagen.
In januari 2016 was de gemiddelde gewogen kleinhandelsprijs van een pakje van 20 sigaretten € 6,05, waarvan € 3,63 accijns en € 1,05 btw. De begrote opbrengst uit accijns op tabaksproducten bedroeg in 2016 € 2.478 miljard. De laatste accijnsverhoging was op 1 april 2018. Accijns op een pakje sigaretten werd met € 0,18 verhoogd en die op een pakje shag met € 0,36.
Gezonde leefomgeving
Een van de pijlers van de Gezonde School betreft het thema Roken en alcohol. Scholen die voldoen aan een integrale benadering van gezondheidsbevordering kunnen in aanmerking komen voor het themacertificaat Roken en alcohol van het vignet Gezonde School.
Een totaal rookverbod op werkplekken vermindert de blootstelling aan passief roken en leidt tot minder rokers en meer personen die stoppen met roken. In Nederland mogen werknemers op het werk alleen roken in speciaal daarvoor ingerichte ruimtes.
Het aantal verkooppunten van tabaksproducten in de buurt van woningen, ziekenhuizen en scholen zou moeten worden verminderd. Het is belangrijk dat zwangere vrouwen tabak vermijden en ouders geen rookwaren gebruiken in de aanwezigheid van kinderen. Zorgpersoneel, verzorgers en docenten moeten een voorbeeld geven door op het werk geen tabaksproducten te gebruiken.
Aanbevelingen
Overheidsmaatregelen:
- Verbod op tabaksverkoop, in ieder geval aan adolescenten, wordt aanbevolen. Beperk het aantal verkooppunten nog meer.
- Beperk het aantal plekken waar gerookt mag worden nog meer (bijvoorbeeld schoolpleinen, in en om sportvelden en sportfaciliteiten, in auto’s als er kinderen meerijden).
- Verbied reclame en promotie van tabaksproducten.
- Verlaag de dichtheid van verkooppunten voor tabak in woonwijken, scholen, sportclubs en ziekenhuizen.
- Maak verkoop aan de grens en belastingvrije verkoop van alle tabaksproducten uniform.
- Overweeg beperkingen op reclame, marketing en verkoop van elektronische sigaretten.
Media en voorlichting:
- Stimuleer media- en educatieve campagnes die zich uitsluitend richten op het verminderen van roken, het stoppen met roken, het verminderen van passief roken en het gebruik van rookloze tabak. Steun het initiatief ‘Stoptober’.
Etikettering en aanduidingen:
- Verplicht standaard- of neutrale verpakking van rookwaren (geen merkbeeld, logo of handelsmerk).
Economische stimulansen:
- Verhoog belastingen op en prijzen van alle tabaksproducten.
Gezonde leefomgeving:
Scholen:
- Overweeg het promoten en onderwijzen van een gezonde levensstijl, inclusief een rookvrije omgeving op alle scholen en schoolpleinen; steun de Gezonde School.
- Stimuleer de totstandkoming van de rookvrije generatie en sluit aan bij de Alliantie Nederland Rookvrij.
Werkplekken:
- Maak beleid voor gezonde keuzen op de werkplek, waaronder stoppen met/preventie van roken.
Wijken:
- Gezondheidswerkers, zorgverleners en schoolmedewerkers zouden een voorbeeld kunnen stellen door niet te roken of geen tabaksproducten op het werk te gebruiken.
- Creëer een rookvrije leefomgeving voor kinderen: in en om de woning, in de auto, in speelparken in de wijk
- Overweeg beperkingen voor roken in en om woningen aan te brengen.
4 Bescherming tegen alcoholmisbruik
In Nederland drinkt ongeveer 29% van de volwassen mannen en 51% van de vrouwen geen alcohol of maximaal één glas per dag, en 45% van de mannen en 20% van de vrouwen drinkt meer dan één glas alcohol per dag. In 2017 dronk 9,2% van de achttienplussers overmatig alcohol: 11,5% van de mannen en 7,0% van de vrouwen. Overmatig drinken betekent meer dan 21 glazen alcohol per week drinken (mannen), of meer dan veertien glazen per week (vrouwen). Overmatig drinken komt het meest voor bij jongvolwassenen onder de dertig en het minst bij dertigers.
Op populatieniveau wordt alcoholgebruik geassocieerd met meerdere gezondheidsrisico’s die duidelijk zwaarder wegen dan enig eventueel voordeel. In 2012 waren 3,3 miljoen sterfgevallen (5,9% van de totale mortaliteit wereldwijd) en 139 miljoen disability-adjusted life years (5,1% van de wereldwijde morbiditeit) toe te schrijven aan alcoholgebruik. Het grootste aantal sterfgevallen wordt veroorzaakt door hart- en vaatziekten: 33,3% van de aan alcohol toegeschreven mortaliteit. De coronaire mortaliteit ligt bij mannelijke zware drinkers 65% hoger dan bij vrouwelijke zware drinkers.
De relatie tussen alcoholgebruik en ischemische hartaandoeningen en cerebrovasculaire aandoeningen is complex. Zowel de mate van alcoholgebruik als het consumptiepatroon spelen een rol. Laag alcoholgebruik, variërend van een tot drie eenheden alcohol per dag (een eenheid staat gelijk aan ongeveer 80 ml wijn, 250 ml normaal krachtig bier of 30 tot 50 ml sterke drank) wordt in sommige delen van de populatie geassocieerd met de laagste totale mortaliteit, voornamelijk veroorzaakt door de lage coronaire mortaliteit. De Gezondheidsraad concludeert dat het aannemelijk is dat een matig gebruik (tot 15 gram per dag) samenhangt met een lager risico op hart- en vaatziekten en diabetes mellitus.
De systolische bloeddruk neemt toe wanneer het alcoholgebruik stijgt naar > 3 eenheden/dag, evenals het risico op hartaritmie, cardiomyopathie, hartstilstand en hersenbloeding. Het consumptiepatroon van alcohol heeft gevolgen voor het risico op hart- en vaatziekten; overmatig drinken wordt geassocieerd met een hoger risico op hartstilstand en beroerte.
Overheidsmaatregelen
De volgende strategieën en interventies hebben het meeste effect bij de preventie van het schadelijk gebruik van alcohol: leeftijdslimieten bij de verkoop en consumptie; strategieën tegen rijden onder invloed; verkoopmonopolie van overheid op verkoop van alcohol en vermindering van verkoopuren; verbieden van reclames voor alcoholhoudende producten; verbieden van sponsoring van evenementen door producenten van alcoholhoudende producten; verhoging van verkoopprijzen.
De overheid spant zich in om schadelijke gevolgen van alcohol tegen te gaan. In de Drank- en Horecawet staat dat het verboden is om alcohol te verkopen aan jongeren onder de achttien jaar. Gemeenten houden toezicht op de naleving van geldende leeftijdsgrenzen en de vergunningsvoorwaarden voor de verkoop van alcohol.
Het Nederlands Instituut voor Alcoholbeleid STAP is een onafhankelijke landelijke organisatie die zich er specifiek voor inzet dat effectief gebleken alcoholbeleidsmaatregelen die leiden tot een afname van alcoholgerelateerde schade worden ingevoerd en worden gehandhaafd.
De lopende actiepunten van STAP zijn:
- bijdragen dat alcohol niet te gemakkelijk verkrijgbaar is, onder meer door samenwerking met lokale Drank- en Horecawetinspecteurs, verzet tegen branchevervaging, ondersteuning van gemeenten (met name op het terrein van naleving en handhaving) en promotie van het keurmerk ‘De Alcoholvrije School’;
- bevorderen dat alcohol niet te goedkoop wordt aangeboden, vooral door het houden van een krachtig pleidooi voor invoering van een minimumprijs voor alcohol;
- oproepen om te komen tot een verbod op alcoholreclame en alcoholsponsoring. STAP pleit op landelijk en Europees niveau voor een totaalverbod op alcoholreclame en een verbod op sportsponsoring door de drankindustrie;
- versterken van de maatschappelijke bewustwording van de gezondheidsrisico’s van alcohol.
Media en voorlichting
Het wordt steeds duidelijker dat alcohol schadelijk is voor kinderen. Uit onderzoek blijkt dat ouders invloed hebben op het drinkgedrag van hun kinderen. Het is belangrijk om op tijd duidelijke afspraken te maken en in gesprek te komen over het niet drinken. Ouders vinden het niet altijd eenvoudig het gesprek hierover met hun kinderen aan te gaan. Het Trimbos-instituut heeft een website met tips voor ouders gemaakt.
De overheid wil jongeren en ouders voorlichten over alcoholgebruik en de risico’s hiervan. Bijvoorbeeld met de campagne NIX18 van het ministerie van VWS. Deze campagne laat zien dat niet drinken en roken tot je achttiende normaal is.
Etiketten en aanduidingen
Bij afwezigheid van andere maatregelen op populatieniveau, zoals accijnzen en reclamebeperkingen, is aangetoond dat het labelen van alcohol met informatie over calorieën en gezondheidswaarschuwingen over de schadelijke effecten van alcohol maar een beperkt effect heeft.
Economische stimulansen
Bier (en biermengsels) met meer dan 0,5% alcohol en andere dranken met meer dan 1,2% alcohol vallen onder het 21%-tarief. Hieronder vallen ook samengestelde alcoholhoudende dranken, zoals mixdranken en advocaat.
Gezonde leefomgeving
Maatregelen om alcoholgebruik te beperken op werkplekken, onderwijscentra en scholen zijn effectief. Dat geldt ook voor een korte interventie in de eerste lijn om alcoholmisbruik tegen te gaan.
Het Trimbos-instituut voert het programma de Gezonde School en genotmiddelen uit in opdracht van de overheid. Dit lesprogramma is gericht op voorlichting aan leerlingen in het primair en secundair onderwijs en middelbaar beroepsonderwijs, zie ook paragraaf 1 hierboven. Naast voorlichting aan leerlingen is er aandacht voor een goed schoolbeleid, de rol van de ouders en signalering van problematisch alcoholgebruik. Een van deze pijlers van de Gezonde School betreft het thema Roken en alcohol. Scholen die voldoen aan een integrale benadering van gezondheidsbevordering kunnen in aanmerking komen voor het themacertificaat Roken en alcohol van het vignet Gezonde School.
In buurten kan overmatig alcoholgebruik worden beperkt door vermindering van het aantal verkooppunten en verkooptijden, en verhoging van de minimumleeftijd waarop alcohol verkocht en geserveerd mag worden.
Slechte naleving van de leeftijdsgrenzen voor alcoholgebruik in sportkantines is nog steeds een probleem in de sport. De overheid wil alcoholmisbruik onder jongeren in de sport voorkomen. Bezoeken door NOC*NSF moeten de sportclubs bewust maken van de schadelijke gevolgen van drankgebruik onder jongeren en de mogelijke oplossingen hiervoor.
Aanbevelingen
Overheidsmaatregelen:
- Reguleer de verkrijgbaarheid van alcoholische dranken, inclusief de minimale wettelijke verkoopleeftijd, beperkingen voor de dichtheid van winkels, tijd en plaats van verkoop.
- Creëer maatregelen om alcoholgebruik te ontmoedigen, zoals verlaagde limieten voor alcoholpromillage in het bloed en zero tolerance, willekeurige ademtests en alcoholcontroles.
- Beperk en verbied reclame en promotie van alcoholische dranken.
Media en voorlichting:
- Overweeg voorlichtingscampagnes om bewustzijn te creëren over de gevaarlijke effecten van alcohol.
Etiketten en aanduidingen:
- Overweeg alcohol te voorzien van etiketten met informatie over calorische inhoud en gezondheidswaarschuwingen over de schadelijke effecten van alcohol.
Economische stimulansen:
- Verhoog de accijns op alcoholische dranken om het matigen van de alcoholinname te bevorderen.
Gezonde leefomgeving:
- Overweeg op elke school, dagopvang en sportclub voorlichting te geven om alcoholmisbruik te voorkomen.
- Maak leefstijlbeleid en biedt voorlichting aan over gezonde voeding en beperking van overmatige alcoholinname in elk bedrijf voor het stimuleren van de gezondheid van werknemers.
- Beperk het aantal verkooppunten en verkooptijden van alcohol om overmatig alcoholgebruik te voorkomen.
- Handhaaf de leeftijdsgrens voor de verkoop van alcohol in sportkantines.
5 Gezonde lucht
Luchtvervuiling draagt bij aan het risico op luchtwegaandoeningen en hart- en vaatziekten. Blootstelling aan luchtverontreiniging is verantwoordelijk voor ongeveer 3 tot 5% van de totale ziektelast in Nederland.
In de EU zijn gemotoriseerd wegverkeer, energiecentrales en industriële en huishoudelijke verwarmingsinstallaties op olie, kolen of hout belangrijke bronnen van fijnstof. Tot een derde van de Europeanen in stedelijke gebieden is blootgesteld aan waarden die de normen voor luchtkwaliteit van de EU overschrijden. Vooral jongeren en ouderen met een hoog risico op hart- en vaatziekten zijn gevoeliger voor de schadelijke effecten van luchtvervuiling op hart en vaten. Schattingen van het aantal vroegtijdige doden door luchtvervuiling in Nederland lopen uiteen van 6700 tot 12.900 per jaar. Een kwart van het fijnstof heeft een natuurlijke bron, driekwart is het resultaat van menselijk handelen.
De EU-commissie heeft een pakket beleidsmaatregelen afgekondigd dat in 2030 moet zijn ingevoerd en dat de schadelijke emissies door verkeer, energiecentrales en landbouw moet verminderen. Verdere pogingen om luchtvervuiling te verminderen moeten worden aangemoedigd en overgenomen door nationale overheden (bijvoorbeeld door passende en effectieve wetgeving). Patiëntorganisaties en gezondheidsprofessionals kunnen een belangrijke rol spelen bij het ondersteunen van beleids- en onderwijsinitiatieven en vormen een krachtige stem in de roep om actie op overheidsniveau.
De media kunnen de bevolking informeren over luchtkwaliteit (bijvoorbeeld door apps) en door smogwaarschuwingen af te geven. Er is behoefte aan informatie over het gedrag van patiënten tijdens smog. Economische prikkels zoals belastingverlaging op elektrische en hybride voertuigen kunnen bijdragen aan de verbetering van de luchtkwaliteit. Nieuwe huizen en scholen kunnen worden gebouwd in gebieden die ver weg liggen van snelwegen en vervuilende industrieën.
Overheidsmaatregelen
De EU heeft in juni 2016 de richtlijn nationale emissieplafonds (NEC-richtlijn) vastgesteld. Nederland moet hiervoor in 2018 – samen met gemeenten en provincies – een plan schrijven en dat richten op de streefwaarden voor gezonde lucht. Voor fijnstof (uitgedrukt in Particulate Matter, maat voor de grootte van de deeltjes) PM2,5 adviseert de WHO een streefwaarde van 10 μg/m3, terwijl er een EU-grenswaarde is van 25 μg/m3. De EU-grenswaarde wordt als onvoldoende beschouwd en VWS geeft aan te streven naar de WHO-advieswaarden.
In november 2016 heeft de Tweede Kamer een motie (naar aanleiding van een petitie van het Longfonds) aangenomen om in 2018 te komen tot een Nationaal Luchtplan, waarin gezondheid centraal staat en de meest vervuilde plekken worden aangepakt. Milieudefensie heeft geprobeerd de overheid te dwingen tot een actievere houding om de EU-normen tegen luchtvervuiling te halen, maar heeft de rechtszaak verloren. Het ministerie van Infrastructuur en Waterstaat verwacht voorjaar 2019 te komen met het Schone Lucht Akkoord, een aanpassing op het Nationaal Samenwerkingsplan Luchtkwaliteit.
Media en voorlichting
De overheid voert geen campagnes op dit terrein. Het Longfonds werkt aan bewustwording bij het algemene publiek om het onzichtbare probleem van luchtvervuiling meer bekendheid en urgentie te geven. Daarnaast wil het personen een handelingsperspectief geven (bijvoorbeeld de fiets in plaats van de auto te nemen, een schone auto te kiezen, de spits en drukke verkeerswegen te vermijden), in eerste instantie om zichzelf te beschermen en later ook om een bijdrage te leveren door zelf minder uit te stoten.
Aanduidingen
In Nederland brengt het RIVM smogwaarschuwingen uit en heeft de overheid een app met informatie over luchtverontreiniging. In 2013 werd het project van de Universiteit Leiden en het Longfonds ‘Meet zelf fijnstof met je iPhone’ uitgevoerd waarmee een fijnstofkaart van Nederland is gemaakt.
Economische stimulansen
Het kabinet stimuleert volledig elektrisch rijden. Vanaf 2019 komt er een (kleine) roettoeslag in de autobelastingen. Voor dieselauto’s zonder fabrieksroetfilter gaat de motorrijtuigenbelasting per 2019 met 15% omhoog.
Gezonde leefomgeving
Lokale problematiek betreft onder andere de uitstoot van houtrook, waarbij personen die in de directe omgeving wonen zeer veel last kunnen hebben van de fijnstof en andere schadelijke stoffen die vrijkomen bij de verbranding van hout. Er is nog weinig bewustwording op dit gebied, hoewel zo langzamerhand enkele gemeenten het probleem erkennen en proberen er iets aan te doen. Het Longfonds pleit (om te beginnen) voor een stookverbod bij mist en windstil weer en voor goede voorlichting over de gezondheidsrisico’s van houtstook.
Aanbevelingen
- Algemeen om de uitstoot van stikstofdioxide en fijnstof te beperken zijn landelijke maatregelen op terrein van wegverkeer, industrie, veehouderijen en houtstook in en om huis noodzakelijk.
- Ook behoud van natuur, en meer groen en minder geluidsoverlast in verstedelijkte gebieden kan meer bewegen en de algehele gezondheid bevorderen.
3.2 Interventies op individueel niveau
Naar Samenvatting ›Preventie van hart- en vaatziekten is maatwerk en gebeurt op basis van gezamenlijke besluitvorming door de patiënt en diens zorgverlener. Afspraken over de doelen en soort behandeling worden vastgelegd in een individueel zorgplan. Dit gebeurt voornamelijk in de eerste lijn, aangezien eerstelijnszorgverleners het grootste deel van de patiënten behandelen en daarmee de spil vormen van het CVRM-beleid. De praktijkondersteuner Somatiek doet de meeste van deze consulten. Het is van belang om de zorg rond cardiovasculaire preventie in de huisartsenpraktijk goed te regelen en te borgen. Meestal kan de patiënt in de eerste lijn afdoende begeleid en behandeld worden. Soms is echter verwijzing noodzakelijk. De indicaties voor verwijzing zijn beschreven in de Landelijke transmurale afspraak Cardiovasculair risicomanagement.
Bij een acute opname in het ziekenhuis voor een hart- en vaatziekte moet direct worden gestart met preventieve maatregelen ter voorkoming van een recidief hart- en vaatziekte. Naast de medicamenteuze behandelingen zijn leefstijladviezen van groot belang. Deze kunnen niet genoeg benadrukt worden. Na de opname zijn verschillende revalidatieprogramma’s voor hart- en vaatziekte beschikbaar. Het is aan te bevelen om de patiënt hiervoor te verwijzen. De programma’s richten zich naast de lichamelijke revalidatie ook op gedragsverandering. Na het revalidatieprogramma blijft aandacht voor gedragsverandering noodzakelijk om terugval te voorkomen.
Uitgangsvraag
Welke kenmerken van CVRM-aanbod zijn er en wat is bekend over de implementatie en effectiviteit, en hoe dient de zorg optimaal georganiseerd te worden?
De uitgangsvraag omvat de volgende deelvraag:
- Welke kenmerken van CVRM-aanbod (instelling, zorgverlener) zijn er en wat is bekend over de implementatie en effectiviteit?
- Hoe dient CVRM bij patiënten met (een verhoogd risico op) hart- en vaatziekten optimaal georganiseerd te worden?
Inleiding
Dit detail bestaat uit twee delen. Het eerste deel bevat de tekst van de European Society of Cardiology (ESC)-richtlijn en gaat in op de effectiviteit van het verschillende aanbod van cardiovasculair risicomanagement (CVRM).
De Nederlandse situatie is echter uniek in Europa, met de huisartsenpraktijk als poortwachter voor de tweede lijn en de organisatie van CVRM-zorg in zorggroepen en/of ketenzorgorganisaties. Het tweede deel formuleert aanbevelingen voor de invulling van de organisatie van deze zorg en de samenwerking. Deze tekst is voor een groot deel gebaseerd op de Landelijke Transmurale Afspraken (LTA) voor Cardiovasculair Risicomanagement uit 2016.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is gebruikgemaakt van de Europese richtlijn Cardiovascular disease prevention in clinical practice uit 2016 en de Landelijke Transmurale Afspraken (LTA) voor Cardiovasculair Risicomanagement uit 2016. Er is voor het beantwoorden van de uitgangsvraag geen systematisch literatuuronderzoek verricht.
Overwegingen
I. Welke kenmerken van CVRM-aanbod (instelling, zorgverlener) zijn er en hoe goed is dit aanbod geïmplementeerd?
Preventie van cardiovasculaire aandoeningen in de eerste lijn
Huisarts
De huisarts is de belangrijkste persoon bij het initiëren, coördineren en aanbieden van follow-up op de lange termijn bij de preventie van hart- en vaatziekten. In de meeste landen doen huisartsen meer dan 90% van de consulten en bieden ze de meeste vormen van publieke zorg, waaronder preventieve zorg en controle van chronische ziekten. In het geval van CVRM hebben zij een unieke rol omdat ze personen met een verhoogd risico op hart- en vaatziekten kunnen identificeren en kunnen beoordelen of zij in aanmerking komen voor interventie op basis van hun risicoprofiel.
De CVRM-ketenzorg wordt jaarlijks gemonitord, waarna er aanbevelingen worden gedaan om de spreekuurcontroles en therapietrouw verder te optimaliseren, vooral onder degenen met een zeer hoog risico op hart- en vaatziekten.
Intensieve en gestructureerde interventie in de huisartsenpraktijk draagt bij aan de preventie van terugkerende hart- en vaatziekten en vermindert het aantal ziekenhuisopnamen van patiënten met ischemische hartklachten. Een systematische benadering van risicobeoordeling wordt daarom aanbevolen, waarbij prioriteit wordt gegeven aan personen met een a priori hoger risico (zoals familiaire voorgeschiedenis van vroegtijdige hart- en vaatziekten, hypertensie, enzovoort), terwijl opportunistische screening van personen < 40 jaar zonder risicofactoren voor hart- en vaatziekten niet wordt aanbevolen (zie details bij paragraaf 1.1).
De succesvolle invoering van de CVRM-richtlijn is voor een groot deel afhankelijk van de mate waarin huisartsen risicofactoren beoordelen, interventies aanbieden en patiënten voorlichten. Het jaarrapport Transparante Ketenzorg 2017 beschrijft de programmatische ketenzorg in 2017 in Nederland op basis van de gegevens van zorggroepen voor de zorgprogramma’s diabetes mellitus type 2, COPD, astma en cardiovasculair risicomanagement (CVRM) bij patiënten met een hartvaatziekte en zonder een hartvaatziekte.
Van de patiënten met HVZ is 25% voor cardiovasculair risicomanagement onder controle in de tweede lijn. Gemiddeld 65% van de patiënten met HVZ ontvangt programmatische zorg (zorgprogramma CVRM) in de eerste lijn. De variatie tussen de zorggroepen is groot.
Het rapport vermeldt dat er in de afgelopen jaren geen substitutie van de tweede naar de eerste lijn heeft plaatsgevonden. De scores op procesindicatoren (rookstatus, eGFR, lichaamsbeweging) verbeteren licht, al blijven registratie van roken en bewegen aanzienlijk achter op die van de nierfunctie. Qua uitkomsten heeft ruim 75% van de patiënten een systolische bloeddruk op streefwaarde. De uitkomstindicator LDL-C ≤ 2,5 mmol/l wordt bij 57% van de patiënten behaald en is over vijf jaar geleidelijk verbeterd. Achttien procent van deze groep rookt nog. Dat is een mooi percentage vergeleken bij rokers in de algemene bevolking (23%). Van de patiënten met diabetes mellitus type 2 is 91% in beeld en 83% onder behandeling in de eerste lijn. Van deze patiënten haalt 64% de streefwaarde voor LDL-C < 2,5 mmol/l (60% in 2016) en rookt 14% (15% in 2016) ten opzichte 23% rokers in de algemene bevolking.
Van de patiënten zonder hart- en vaatziekten met een verhoogd risicoprofiel neemt 70% deel aan een zorgprogramma CVRM. Alle procesindicatoren scoren hoger vergeleken met 2016. Het registreren van lichaamsbeweging biedt de meeste ruimte tot verbetering. Wat betreft uitkomstindicatoren behaalt 72% de bloeddrukstreefwaarde (≤ 140 mmHg) en 30% de LDL-C-streefwaarde. Het percentage rokers is 13%. In 2016 was dit 15%.
Best practice-zorggroepen laten zien dat cardiovasculair risicomanagement nog beter kan: meer substitutie van de tweede naar de eerste lijn, betere resultaten wat betreft proces en uitkomsten en meer persoonsgerichte zorg. Om meer inzicht te krijgen in de effectiviteit van programmatische zorg heeft InEen de opdracht gegeven voor een wetenschappelijk onderzoek.
Online bronnen, mobiele apps, richtlijnen in pocketformaat en overzichtskaarten zijn beschikbaar voor de huisarts: het NHG-Preventieconsult, de NHG-Standaarden-app, het NHG-Formularium vanuit het HIS of via de NHG-Rx app.
Praktijkondersteuners huisartsenzorg
Er is bewijs dat verpleegkundigen een effectieve rol kunnen spelen bij CVRM in de eerste lijn. In een RCT van zes Europese landen werden door verpleegkundigen gecoördineerde cardiologieprogramma’s voor primaire preventie van hart- en vaatziekten vergeleken met de normale praktijk bij (door clusterrandomisatie) gematchte patiënten. In de door een verpleegkundige gecoördineerde arm behaalden meer patiënten met een verhoogd risico de doelen voor leefstijl en risicofactoren dan bij gebruikelijke zorg.
In 2009 toonde een Nederlandse RCT naar CVRM aan dat praktijkondersteuners huisartsenzorg dezelfde resultaten na één jaar follow-up behaalden als huisartsen. Een klinisch onderzoek (n = 525) in de VS toonde ook aan dat praktijkondersteuners die samenwerkten met gezondheidswerkers een significante verbetering van risicofactoren voor hart- en vaatziekten (bloeddruk, cholesterol, diabetes mellitus) kunnen bereiken in populaties van achterstandswijken ten opzichte van de gebruikelijke zorg, en dat dit kosteneffectief was.
Fysio-/oefentherapeut
De fysiotherapeut geeft individuele begeleiding en soms groepsbegeleiding en biedt speciale beweegprogramma’s voor preventie in samenwerking met huisartsen.
Diëtist
Diëtisten verlenen individuele begeleiding en in meer dan de helft van de gevallen worden patiënten verwezen voor (ernstig) overgewicht. In 2011 heeft het Netherlands institute for health research (Niped) een onderzoek gehouden onder diëtisten, waaruit bleek dat 62% aangeeft in hun praktijk of organisatie leefstijlinterventies aan te bieden. Van deze groep geeft bijna elke diëtist (98%) aan tijdens de begeleiding ook te letten op bewegen (97%), alcoholgebruik (85%) en roken (66%).
Apotheek
De apotheek kan een signalerende functie hebben bij medicatieontrouw.
Acute ziekenhuisopname
Het kan niet genoeg worden benadrukt hoe belangrijk het is met preventieve behandeling te beginnen vóór ontslag van de patiënt uit het ziekenhuis. Preventieve behandelingen na een ziekenhuisopname nemen namelijk meestal eerder af dan toe, het aandeel patiënten dat adequate behandeling ontvangt daalt in de loop van de tijd, evenals het aantal patiënten dat de streefdoelen haalt.
Zorgverleners die betrokken zijn bij de ziekenhuisopname moeten het belang van preventieve maatregelen benadrukken. Wanneer dit niet gebeurt, zou dat bij de patiënt de indruk kunnen wekken dat deze maatregelen niet van belang zijn. Een goede overdracht naar de huisarts, het hartrevalidatieteam en (indien van toepassing) de arbo- of bedrijfsarts voor het bespreken van werkhervatting en medicatieoverdracht tussen ziekenhuis en perifere apotheek is essentieel om ervoor te zorgen dat de preventieve behandelingen die tijdens het ziekenhuisverblijf zijn opgestart, worden doorgezet en ondersteund na opname, thuis en op het werk.
Gespecialiseerde preventie voor patiënten met hart- en vaatziekten in de tweede lijn
Gespecialiseerde preventieprogramma’s zijn hartrevalidatieprogramma’s of andere preventieprogramma’s voor patiënten met hart- en vaatziekten of een verhoogd risico op hart- en vaatziekten. De onderdelen en doelen van hartrevalidatie zijn gestandaardiseerd, maar de opbouw, de duur en het type van het programma verschillen enorm van land tot land, afhankelijk van nationale richtlijnen en normen, wetgeving en vergoeding.
Hartrevalidatie
Hartrevalidatie is een uitgebreid programma dat bestaat uit fitnessoefeningen, behandeling van risicofactoren, voorlichting en psychologische hulpverlening. Een overzicht van zes Cochrane reviews van hartrevalidatie (148 RCT’s met 98.093 proefpersonen) concludeerde dat hartrevalidatie voor patiënten met een laag tot matig verhoogd risico met HF, post-MI of post-revascularisatie, leidde tot een daling van het aantal ziekenhuisopnamen en een verbeterde kwaliteit van leven wat betreft gezondheid (HRQoL), vergeleken met gebruikelijke zorg, en mogelijk de mortaliteit op de langere termijn verlaagt. Een nadeel van deze reviews is dat deze ook onderzoeken includeerden uit de periode voor de moderne behandelingen, met afwijkende patiëntgroepen en heterogene hartrevalidatieprogramma’s. Er is dus meer onderzoek nodig om de optimale interventie te bepalen. Een aantal recente gecontroleerde onderzoeken heeft een overlevingsvoordeel aangetoond voor patiënten die hartrevalidatie ondergingen vergeleken met patiënten zonder hartrevalidatie. Een nog niet gepubliceerde meta-analyse met meer recent onderzoek naar hartrevalidatie zal mogelijk meer definitieve conclusies opleveren. Op dit moment lijkt het voordeel van hartrevalidatie te liggen in de rechtstreekse fysiologische gevolgen van fitnesstraining en door de resultaten van behandeling van risicofactoren, gedrag en stemming. Hartrevalidatie biedt ook een gelegenheid voor sociale hulpverlening en om patiënten te screenen op psychosociale risicofactoren.
Verwijzing naar en deelname aan hartrevalidatie verschilt enorm van land tot land: veel hartrevalidatieprogramma’s nemen geen onstabiele patiënten aan of patiënten met HF, medische hulpmiddelen of PAV, en de verwijzing en deelname van vrouwen en oudere patiënten met een verhoogd risico blijft suboptimaal. Verwijzing voor hartrevalidatie kan worden verbeterd met behulp van elektronische herinneringen of automatische verwijzingen. Deelname door patiënten kan worden verbeterd met een gestructureerde follow-up door verpleegkundigen of behandelaars, en wanneer de programma’s direct na ontslag worden opgestart.
Preventieprogramma’s geleid door verpleegkundigen
Verpleegkundigen leveren eveneens effectieve preventieprogramma’s aan patiënten met hart- en vaatziekten. Het EUROACTION-onderzoek bood een zestien weken durende aanpak aan waarbij het gezin centraal stond en die leidde tot gezondere leefstijlveranderingen wat betreft lichamelijk activiteit, voeding en een effectievere controle van risicofactoren bij patiënten en hun partners vergeleken met gebruikelijke zorg. Het onderzoek Randomised Evaluation of Secondary Prevention by Outpatient Nurse Specialists (RESPONSE) randomiseerde patiënten na ACS naar gebruikelijke zorg of door verpleegkundigen gecoördineerde preventie-interventie van poliklinische bezoeken gedurende zes maanden: na één jaar hadden patiënten in de interventiegroep de risicofactoren beter onder controle, minder heropnamen of bezoeken aan de eerste hulp gehad en een voorspelde RR voor mortaliteit (met gebruik van SCORE) die 17% lager lag dan bij de controlegroep.
Alternatieve revalidatiemodellen (thuis-/telerevalidatie)
Hartrevalidatie is voornamelijk geïmplementeerd in ziekenhuizen of wijkcentra met getraind personeel. Programma’s voor thuisrevalidatie kunnen de patiëntparticipatie vergroten doordat ze meer flexibiliteit bieden en meer mogelijkheden voor activiteiten. Een systematische review van twaalf onderzoeken (met 1978 patiënten) naar revalidatie vanuit huis of vanuit een centrum vond geen verschillen in resultaten, trouw of kosten tussen de twee programma’s op korte termijn en tot 24 maanden na inclusie. De meeste onderzoeken hadden patiënten met een laag risico op hart- en vaatziekten en voornamelijk mannen geïncludeerd. De oefeningen werden zelfstandig uitgevoerd met periodieke ondersteuning, meestal via de telefoon. Thuisrevalidatie kan dus voor sommige patiënten een alternatief bieden, al zijn er in Europa maar weinig programma’s die het aanbieden.
Van telerevalidatie, dat wil zeggen het gebruik van elektronische communicatie en informatietechnologieën om op afstand klinische zorg te bieden en te ondersteunen na een acute gebeurtenis, is aangetoond dat het effectiever is dan gebruikelijke zorg wanneer het gaat om bereiken van gedragsveranderingen, en even effectief als een hartrevalidatieprogramma. Eenvoudige telemonitoring, waaronder telefonische overdracht van ecg’s bij patiënten met hart- en vaatziekten, is veilig gebleken en acceptabel voor patiënten, en leidt tot verbeterde fysieke capaciteit. Recente onderzoeken maken ook gebruik van smartphone-applicaties voor controle en de overdracht van inhoud en steun, wat er onder jongere patiënten toe leidt dat meer personen aan de revalidatie beginnen, deze volhouden en afmaken. Telerevalidatie zou dus kunnen worden uitgebreid naar een grotere groep patiënten en zo hulp kunnen bieden bij controle en meer geïndividualiseerde gedragsondersteuning, maar grootschalige gerandomiseerde onderzoeken zijn nodig.
II. Organisatie van cardiovasculair risicomanagement
Samenwerking tussen zorgverlener en patiënt
Cardiovasculair risicomanagement is aan de orde bij uiteenlopende groepen: van personen met een licht verhoogd risico op hart- en vaatziekten tot patiënten met een manifeste hart- en vaatziekte en co- of multimorbiditeit. CVRM omvat het geheel aan risico-inventarisatie, leefstijladvisering, leefstijlbegeleiding en behandeling met medicijnen. De rol van de patiënt is hierin cruciaal: hij/zij dient, vaak levenslang, een gezondere leefstijl te bereiken en vast te houden, en medicijnen in te nemen.
De patiënt centraal stellen bij CVRM is een voorwaarde voor succes. De laatste tijd wordt hiervoor de term ‘persoonsgerichte zorg’ gebruikt. De patiënt staat centraal in het zorgproces en wordt ondersteund in het nemen van de regie (zelfmanagement) over zijn eigen gezondheid, ziekte en behandeling. Patiënt en zorgverlener gaan een gelijkwaardige samenwerkingsrelatie aan. In deze relatie komen twee contexten samen: die van de zorgverlener als kenner van de ziekte en die van de patiënt als kenner van zijn leven. Voorwaarde is dat beiden worden toegerust om deze samenwerking tot een succes te maken. Onder meer is een goede voorlichting van groot belang.
In een proces van gedeelde besluitvorming stellen zorgverlener en patiënt gezamenlijk doelen en acties op: haalbare doelen en acties waarbij duidelijk is wat het aandeel van de patiënt is en wat het aandeel van de zorgverleners is (Patiëntenfederatie Nederland, Federatie Medisch Specialisten en Nederlands Huisartsen Genootschap). De doelen en acties zijn gebaseerd op de landelijk vastgestelde richtlijnen en streefwaarden, en afgestemd op de voorkeuren, mogelijkheden en behoeften van de patiënt. De afspraken over doelen en acties worden beschreven in een individueel zorgplan (zie kader 3).
| 1 | Het individuele zorgplan bevat de afspraken over welke doelen nagestreefd worden, hoe deze bereikt gaan worden en welke taken de patiënt en de zorgverlener op zich zullen nemen. |
| 2 | Het individuele zorgplan is leesbaar en toegankelijk voor de patiënt. |
| 3 | In een individueel zorgplan worden alle onderdelen vastgelegd die van belang zijn bij de behandeling voor cardiovasculair risicomanagement en de (verbetering van de) kwaliteit van leven van een patiënt. |
| 4 | Het gaat dan om de beschrijving van de volgende elementen, die in samenspraak met de patiënt vastgelegd worden:
|
| Bron: Zorgstandaard Cardiovasculair risicomanagement voor zorgverleners | |
Samenwerking tussen zorgverleners
Door verschillende zorgverleners en in verschillende instellingen (eerste lijn, tweede lijn en werkplek (bedrijfsarts)) wordt CVRM aangeboden. Afhankelijk van de aandoening van de patiënt en de hoogte van het cardiovasculaire risico kunnen patiënten hier (achtereenvolgens) mee te maken krijgen. Een cardiovasculair risicomanagementprogramma is qua insteek multidisciplinair en transmuraal, en beschrijft de gestructureerde en geprotocolleerde CVRM-zorg in een regio. Hieronder worden de aanbevelingen per setting beschreven om goede CVRM-zorg te leveren en continuïteit van zorg te waarborgen [Boomsma 2016].
Settings waar CVRM plaatsvindt
De pre/post acute setting (eerste lijn)
De eerste lijn biedt een cardiovasculair risicomanagementprogramma aan bij:
- personen met een (zeer) hoog risico op hart- of vaatziekten zonder voorgeschiedenis van hart- en vaatziekten (leefstijladvies en/of medicatie);
- patiënten met hart- en vaatziekten die stabiel zijn na de acute fase.
De eerste lijn (huisarts, praktijkondersteuner, fysiotherapeut, diëtiste en apotheek) speelt samen met voorzieningen in wijk/gemeente/patiëntenorganisatie een grote rol in het ondersteunen bij het realiseren en vervolgens vasthouden van een gezonde leefstijl en indien van toepassing het levenslange gebruik van medicijnen (NHG-Preventie consult).
De acute setting (tweede lijn)
Start al met CVRM in de acute fase van een hart- of vaatziekte met een goede overdracht naar de eerste lijn, zodat die CVRM kan vervolgen. De tweede lijn vermeldt (onder meer) in de overdracht aan de eerste lijn aan welke doelen reeds is gewerkt en in welke mate deze behaald zijn. Verwijzing naar de bedrijfs- en arboarts is van belang bij een (dreigende) vertraagde werkhervatting na hart- en vaatziekten en het in kaart brengen van fysieke, sociale en psychische belemmeringen op de werkvloer (zie NVAB Richtlijn Ischemische hartziekten 2006).
Gespecialiseerde preventie voor hart- en vaatpatiënten
Cardiovasculair risicomanagement is onderdeel van hartrevalidatie, revalidatie na een beroerte en van gesuperviseerde looptraining bij perifeer arterieel vaatlijden.
In veel ziekenhuizen zijn er aparte spreekuren of speciale poli’s voor cardiovasculair risicomanagement als onderdeel van de medisch-specialistische behandeling. Deze zorg wordt over het algemeen geboden door verpleegkundig specialisten, physician assistants of gespecialiseerde verpleegkundigen. Van belang bij deze gespecialiseerde preventie is een goede samenwerking en afstemming binnen ziekenhuizen tussen verschillende specialismen en andere zorgverleners (huisarts, praktijkondersteuner, diëtist, fysio-/oefentherapeut, logopedist, bedrijfs-/arboarts, apotheek en eventueel praktijkondersteuners-ggz of psycholoog).
Aanbevelingen
CVRM-aanbod door de verschillende zorgverleners:
- Bied als huisarts een cardiovasculair risicomanagementprogramma aan vanuit de eerste lijn bij personen met een hoog of zeer hoog risico op hart- en vaatziekten. Betrek hierbij zo nodig andere zorgverleners uit de eerste lijn.
- Overweeg als huisarts cardiovasculair risicomanagement vanuit de eerste lijn bij sommige personen met een licht of matig hoog risico op hart- en vaatziekten.
- Start als zorgverlener betrokken bij een opname na een acute manifestatie van hart- of vaatziekte direct met cardiovasculair risicomanagement voordat de patiënt uit het ziekenhuis wordt ontslagen om het risico op ziekte en sterfte te verminderen. Zorg voor een goede overdracht naar de huisarts of het revalidatieteam en verwijs naar de arbo- of bedrijfsarts bij een (dreigende) vertraagde werkhervatting.
- Bied als zorgverlener cardiovasculair risicomanagement aan binnen een revalidatieprogramma of gespecialiseerd programma voor patiënten met hart- en vaatziekten.
Organisatie van zorg:
- Maak in gedeelde besluitvorming met de patiënt afspraken over de cardiovasculaire preventie. Overweeg samen met de patiënt of en hoe het individuele zorgplan ingezet kan worden om deze afspraken te expliciteren. Het individuele zorgplan is zo eenvoudig als mogelijk en zo uitgebreid als nodig.
- Maak regionale afspraken over waar welke zorg verleend wordt op basis van de Landelijke Transmurale Afspraken CVRM:
- verantwoordelijkheidsverdeling (wie is de hoofdbehandelaar, wie is de zorgcoördinator dan wel centrale zorgverlener, de rol van de zorgverleners) en dossiervoering (ICT);
- hoe en wanneer verwijzen, terugverwijzen of consulteren (ook overdracht over doelen, ingezette acties en evaluatie van het individuele zorgplan); overdracht bij gedeelde zorg. Bij de overgang van de tweede naar de eerste lijn dienen patiënten actief te worden opgeroepen door de eerste lijn;
- voorlichting: wie geeft welke voorlichting (uniforme boodschappen!), welke materialen, eHealth enzovoort;
- niet-medicamenteuze interventies: afstemming over het aanbod van interventies, de sociale kaart, verwijzing naar zorgverleners;
- medicamenteuze interventies: overleg met apotheker, beleid over het overzetten op andere medicijnen;
- hoe zelfmanagement te bevorderen: individueel zorgplan, consultvoorbereiding door de patiënt, wijze van consultvoering, inzage in het dossier door de patiënt;
- patiënten dienen geïnformeerd te worden over de organisatie van de zorg: hoe ziet gemiddeld het (transmurale) zorgpad eruit dat aansluit bij hun aandoening of cardiovasculair risico.
Aanbevelingen
Naar Samenvatting ›- Maak met de patiënt afspraken over de cardiovasculaire preventie, toegespitst op het individu en op basis van besluitvorming door de patiënt en de zorgverlener.
- Beschrijf de afspraken in een individueel zorgplan.
- Maak regionale afspraken over waar welke zorg verleend wordt op basis van de Landelijke Transmurale Afspraken CVRM.
- Bied een cardiovasculair risicomanagementprogramma aan vanuit de eerste lijn bij personen met een hoog of zeer hoog risico op hart- en vaatziekten.
- Bied cardiovasculair risicomanagement aan als onderdeel van de medisch specialistische behandeling indien nodig in samenwerking en afstemming met:
- andere specialismen en zorgverleners binnen de tweede lijn;
- de eerste lijn.
- Start direct met cardiovasculair risicomanagement na een acute manifestatie van hart- of vaatziekte voordat de patiënt uit het ziekenhuis wordt ontslagen om het risico op ziekte en sterfte te verminderen.
- Bied patiënten opgenomen voor een acuut myocardinfarct, PCI of CABG en patiënten met hartfalen hartrevalidatie aan (zie ook de richtlijn Hartrevalidatie).
- Bied patiënten met een beroerte revalidatie aan (richtlijn Herseninfarct en hersenbloeding).
- Bied gesuperviseerde looptraining aan patiënten met perifeer arterieel vaatlijden.
Bijlagen
Naar Samenvatting ›Bijlage 1 (Kwetsbare) ouderen
Naar Samenvatting ›In Nederland wonen 2 miljoen mensen ouder dan zeventig jaar [CBS 2016]. De komende jaren zal vooral het aandeel 70- tot 79-jarigen sterk stijgen en vanaf 2025 neemt ook de groep 80-plussers sterk toe (de dubbele vergrijzing). Een van de vijf van hen behoort tot de populatie kwetsbare ouderen. Voor zowel mannen als vrouwen stijgen de prevalentie en incidentie van hart- en vaatziekten met de leeftijd. De verwachting is dat daardoor het aantal kwetsbare oudere patiënten met hart- en vaatziekten een enorme stijging zal ondergaan. In 2008 was het aantal sterfgevallen aan hart- en vaatziekten naar leeftijd bij zowel mannen als vrouwen het grootst in de leeftijdscategorie 75 tot 94 jaar (ongeveer 17.000 vrouwen en 11.000 mannen in de leeftijdscategorie 75 tot 94) (hartstichting.nl).
Volgens de SCORE-risicotabel hebben alle ouderen boven de zeventig jaar een hoog cardiovasculair risico, en komen zij in aanmerking voor antihypertensiva, lipidenverlagende middelen en/of plaatjesremmers. Behandeling van ouderen met deze medicatie is echter slechts beperkt onderzocht. Er zijn belangrijke verschillen tussen de jongere personen die in de klinische onderzoeken zijn geïncludeerd en de ouderen uit de dagelijkse praktijk. Het is daarom niet duidelijk of het behandelen van cardiovasculaire risicofactoren op hoge leeftijd effectief is, vooral wanneer het kwetsbare ouderen betreft.
Verschillen tussen jongeren en ouderen
De kennis over CVRM is gebaseerd op klinische onderzoeken die laten zien dat CVRM een risicoreductie geeft op cardiovasculaire morbiditeit en mortaliteit. Er bestaan echter belangrijke verschillen tussen de relatief jonge personen die geïncludeerd worden in de klinische onderzoeken en de oudere personen die we in de dagelijks praktijk zien:
- Levensverwachting. De resterende levensverwachting neemt af met de leeftijd. Zo heeft de gemiddelde 70-jarige man nog 14,6 levensjaren en de gemiddelde 70-jarige vrouw nog 17,3 levensjaren te gaan. Voor de gemiddelde 80-jarige man en vrouw zijn dit 8,1 en 9,8 levensjaren (CBS). Naarmate ouderen meer comorbiditeiten hebben of kwetsbaarder zijn, liggen deze getallen een stuk lager.
- Veranderde fysiologie. Met het ouder worden veranderen de structuur en de functie van de arteriële vaatwand, wat onder andere resulteert in vaatwandstijfheid en verminderde baroreflexfunctie. Het is aannemelijk dat ouderen hun bloeddruk minder goed stabiel kunnen houden en daarnaast vatbaarder zijn voor lagere bloeddrukken door veranderde autoregulatie van vitale organen. Uit observationele onderzoeken blijkt dat er voor (kwetsbare) ouderen andere optimale waarden van cardiovasculaire risicofactoren gelden dan voor jongere populaties. Uit enkele observationele onderzoeken is zelfs gebleken dat er wat betreft hoge bloeddruk en hoog cholesterol bij kwetsbare ouderen een omgekeerde effectrelatie bestaat op het mortaliteits- en morbiditeitsrisico. Met andere woorden: hoge bloeddruk en een hoog cholesterol lijken een beschermend effect te hebben bij kwetsbare ouderen [Weverling-Rijnsburger 1997, Muller 2014].
- Multimorbiditeit. Hoe ouder mensen worden, des te groter vaak het aantal chronische ziekten waaraan ze lijden. De helft van alle 65-plussers heeft een of meer chronische ziekten. Het bestaan van multimorbiditeit kan mede invloed hebben op de levensverwachting, en zo op het nut van het cardiovasculaire risicomanagement.
- Kwetsbaarheid. Kwetsbaarheid staat tegenover vitaliteit. Kwetsbaarheid neemt toe met de leeftijd van ongeveer 10% onder de zeventig jaar tot ongeveer 50% bij ouderen boven de negentig jaar. Zie beneden voor verdere uitleg.
- Functionele beperkingen. Het hebben van meerdere chronische ziekten verhoogt de kans op functionele beperkingen en overlijden in vergelijking met mensen zonder deze aandoeningen.
- Polyfarmacie. Multimorbiditeit gaat gepaard met polyfarmacie. Bij polyfarmacie bestaat er een verhoogde kans op interactie tussen de geneesmiddelen (zie ook Geneesmiddelen bij ouderen op farmacotherapeutischkompas.nl).
- Farmacokinetiek en -dynamiek. Bij het ouder worden treden veranderingen op in lichaamssamenstelling en orgaanfunctie (nier, lever), wat kan leiden tot veranderingen in de absorptie, verdeling en eliminatie van geneesmiddelen (zie ook Geneesmiddelen bij ouderen op farmacotherapeutischkompas.nl).
- Bijwerkingen van medicatie. Bij ouderen treden meer bijwerkingen van medicatie op, waardoor de balans van voor- en nadelen van preventieve behandeling ongunstig kan uitvallen. Voor CVRM-medicatie kan gedacht worden aan orthostatische hypotensie door antihypertensiva en myopathie door statines, wat beide kan leiden tot een verhoogd valrisico en functieverlies.
- Concurrerende risico’s. Ouderen hebben een hoog absoluut risico op het krijgen van hart- en vaatziekten, maar ook op andere ziekten. Het voorkómen van hart- en vaatziekten met CVRM kan leiden tot een toename in de incidentie van andere ziekten.
- Wensen van de patiënt. De algemeen geaccepteerde primaire uitkomsten waaraan de effectiviteit van therapie wordt afgemeten verliezen bij ouderen hun waarde. Het voorkómen van mortaliteit is voor veel ouderen een veel minder belangrijk behandeldoel dan behoud van kwaliteit van leven en/of van zelfstandig functioneren. Behandelbeslissingen zijn daarom veel meer afhankelijk van de individuele situatie van de patiënt en de ervaring van de behandelend arts dan bij jongere patiënten met een enkelvoudig probleem. Shared decision making neemt een belangrijker plek in bij behandelbeslissingen.
Om te kunnen wegen of een bepaalde behandeling zinvol is bij ouderen en om behandelingen af te stemmen op de mate van vitaliteit/kwetsbaarheid van de patiënt zouden de verwachte resterende levensverwachting, de time-to-benefit van een behandeling, bijwerkingen van een behandeling en de wensen van een patiënt in kaart gebracht moeten worden.
Kwetsbaarheid
Veroudering, multimorbiditeit en polyfarmacie brengen onmiskenbaar veranderingen op functioneel, psychisch, sociaal en somatisch gebied met zich mee, die uiteindelijk kunnen leiden tot kwetsbaarheid, ook wel frailty genoemd [Clegg 2013]. Maar de groep ouderen met twee of meer ziekten en/of functionele beperkingen overlapt slechts gedeeltelijk met de groep van kwetsbare oudere patiënten (figuur 2). Met andere woorden, zeer hoge leeftijd of de aanwezigheid van comorbiditeit, zoals diabetes mellitus of nierinsufficiëntie, leidt niet per definitie tot functionele beperkingen en/of kwetsbaarheid. Daarnaast is het goed erop te wijzen dat het frailty-syndroom geen pathofysiologisch verklaringsmodel biedt voor het optreden van beperkingen, maar wel een beschrijving van die ouderen die specifieke geïntegreerde zorg nodig hebben.
Het concept kwetsbaarheid is de afgelopen jaren steeds vaker gebruikt in zowel de wetenschap als de hulpverlening. Er bestaat echter geen eenduidige definitie van dit begrip [Van Iersel 2009]. De meest gebruikte en geciteerde definitie van kwetsbaarheid is die van Fried [2001]. Volgens Fried is iemand kwetsbaar als hij of zij aan drie of meer van de volgende criteria voldoet: gewichtsverlies, energieverlies, zwakte, traagheid en inactiviteit. Deze definitie is echter door verschillende literatuuroverzichten bekritiseerd omdat deze definitie zich alleen op lichamelijke criteria richt. Volgens een Nederlandse definitie omvat kwetsbaarheid ook psychische en sociale factoren [Schuurmans 2004]. Volgens deze definitie is kwetsbaarheid een dynamische toestand die een individu treft met verliezen in een of meer domeinen van het menselijke functioneren (fysiek, psychologisch, sociaal), die veroorzaakt wordt door een scala aan factoren en die het risico op negatieve gezondheidsuitkomsten vergroot [Collard 2012] (tabel 8).
Welke criteria voor welk doel het meest geschikt zijn, blijft onderwerp van discussie, bijvoorbeeld bij triage in eerste- of tweedelijnspatiëntenzorg of op populatieniveau voor wetenschappelijk onderzoek. Bij klinische patiënten worden veelal de VMS kwetsbare ouderencriteria als eerste screening gebruikt. Op de polikliniek of in de eerste lijn kan gedacht worden aan een kort geriatrisch assessment met vragenlijsten en fysieke/cognitieve tests. In deze bijlage volgen we niet één bepaalde definitie van kwetsbaarheid. Het is echter wel belangrijk om de verschillende fysieke, psychische en sociale factoren in kaart te brengen.
| Fysieke factoren | Psychische factoren | Sociale factoren |
|---|---|---|
| Slecht lopen | Geheugenklachten | Alleen wonen |
| Slecht evenwicht kunnen bewaren | Sombere gevoelens | Gemis aan contacten |
| Lichamelijk moe zijn | Angstige gevoelens/nervositeit | Gemis aan steun |
| Slecht horen | Hulpeloosheid | Financiële problemen |
| Slecht zien | Laag opleidingsniveau | |
| Weinig tot niet wandelen | ||
| Ongewenst gewichtsverlies | ||
| Weinig handkracht hebben | ||
| [Campen, 2011, Dury, 2016] | ||
Bijlage 2 Begrippenlijst
Naar Samenvatting ›Bloeddruk: dit is bloeddruk gemeten in de spreekkamer. Als de bloeddruk gemeten moet worden met een specifieke methode, staat dit nadrukkelijk aangegeven.
BMI: body mass index (kg/m2) is het lichaamsgewicht (in kilogrammen) gedeeld door lichaamslengte (in meters) in het kwadraat.
Cardiovasculair risicoprofiel: een overzicht van factoren die een verhoogd risico geven op hart- en vaatziekten. Deze factoren worden vastgesteld door middel van anamnese, lichamelijk onderzoek en laboratoriumonderzoek.
Dyslipidemie: verhoogde of verlaagde plasmaconcentratie van lipiden (in het bijzonder LDL-cholesterol en/of HDL-cholesterol en/of triglyceriden).
Familieanamnese voor premature hart- en vaatziekten: fatale of niet-fatale hart- en vaatziekten in een eerstegraads mannelijk familielid van 55 jaar of jonger of een eerstegraads vrouwelijk familielid van 65 jaar of jonger.
Kwetsbare ouderen: zie bijlage 1 over (kwetsbare) ouderen.
Obesitas: een BMI ≥ 30 kg/m2.
Pakjaren: pakjaren betreffen het product van het aantal jaren dat iemand gerookt heeft en het (gemiddelde) aantal pakjes per dag gedurende die jaren. Het aantal pakjaren van iemand die veertig jaar lang één pakje per dag rookt en iemand die twintig jaar lang twee pakjes per dag rookt is dus hetzelfde: veertig.
Psychosociale risicofactoren: factoren binnen het psychologische of sociale domein die het risico op hart- en vaatziekten kunnen verhogen. Voorbeelden zijn: lage sociaaleconomische status, (gedefinieerd als laag opleidingsniveau, laag inkomen, het hebben van een baan met een lage status), het wonen in een achterstandswijk, geïsoleerd leven of geen contact hebben met anderen, stress op het werk of gebrek aan een sociaal netwerk.
Reclassificatie: het op basis van additionele informatie over risicofactoren in een andere risicocategorie indelen van een individu (bijvoorbeeld van hoog risico naar zeer hoog risico of van hoog risico naar laag tot matig verhoogd risico).
Risicoschatting: een schatting van het sterfterisico op hart- en vaatziekten voor de komende tien jaar. De schatting is gebaseerd op het risico uit de SCORE-tabel en op eventueel aanwezige risicoverhoogde aandoeningen/factoren.
Sedentaire leefstijl: een leefstijl met meer dan 8 uur per dag zitten.
Time-to-benefit: de tijd totdat er een significant voordeel is geobserveerd van de onderzochte therapie ten opzichte van de controlegroep bij deelnemers.
Verhoogde bloeddruk: een bloeddruk is verhoogd bij een systolische druk > 140 mmHg.
Het risico op een ernstige aan de medicatie gerelateerde bijwerking is mogelijk verlaagd bij gebruik van een calciumantagonist vergeleken met een diureticum bij oudere patiënten met hypertensie.
Referenties
- Piepoli MF, Hoes AW, Agewall S, et al. European guidelines on cardiovascular disease prevention in clinical practice: The Sixth Joint Task Force of the European Society of Cardiology and Other Societies on Cardiovascular Disease Prevention in Clinical Practice (constituted by representatives of 10 societies and by invited experts). Developed with the special contribution of the European Association for Cardiovascular Prevention & Rehabilitation (EACPR). Atherosclerosis 2016;252:207-74.
- Si S, Moss JR, Sullivan TR, et al. Effectiveness of general practice-based health checks: a systematic review and meta-analysis. Br J Gen Pract 2014;64:e47-e53.
- Jorgensen T, Jacobsen RK, Toft U, et al. Effect of screening and lifestyle counselling on incidence of ischaemic heart disease in general population: Inter99 randomised trial. BMJ 2014;348:g3617.
- Ebrahim S, Taylor F, Ward K, et al. Multiple risk factor interventions for primary prevention of coronary heart disease. Cochrane Database Syst Rev 2011;1:CD001561.
- Krogsboll LT, Jorgensen KJ, Gronhoj Larsen C, et al. General health checks in adults for reducing morbidity and mortality from disease. Cochrane Database Syst Rev 2012;10:CD009009.
- Perk J, De Backer G, Gohlke H, et al. European Guidelines on cardiovascular disease prevention in clinical practice (version 2012): the Fifth Joint Task Force of the European Society of Cardiology and Other Societies on Cardiovascular Disease Prevention in Clinical Practice (constituted by representatives of nine societies and by invited experts). Eur Heart J 2012;33:1635-701.
- National Institute for Health and Care Excellence. Lipid modification: cardiovascular risk assessment and the modification of blood lipids for the primary and secondary prevention of cardiovascular disease. London: National Institute for Health and Care Excellence, 2014.
- American Heart Association. Heart-Health Screenings Ga naar bron: American Heart Association. Heart-Health Screenings
- Scottish Intercollegiate Guidelines Network. Risk estimation and the prevention of cardiovascular disease. A national clinical guideline. Edinburgh: Scottish Intercollegiate Guidelines Network, 2007.
- Reiner Z, Catapano AL, De Backer G, et al. Guidelines for the management of dyslipidaemias: the Task Force for the management of dyslipidaemias of the European Society of Cardiology (ESC) and the European Atherosclerosis Society (EAS). Eur Heart J 2011;32:1769-818.
- Chamnan P, Simmons RK, Khaw KT, et al. Estimating the population impact of screening strategies for identifying and treating people at high risk of cardiovascular disease: modelling study. BMJ 2010;340:c1693.
- Nielsen AD, Videbech P, Gerke O, et al. Population screening for coronary artery calcification does not increase mental distress and the use of psychoactive medication. J Thorac Imaging 2012;27:202-6.
- Christensen B, Engberg M, Lauritzen T. No long-term psychological reaction to information about increased risk of coronary heart disease in general practice. Eur J Cardiovasc Prev Rehabil 2004;11:239-43.
- Lokkegaard T, Andersen JS, Jacobsen RK, et al. Psychological consequences of screening for cardiovascular risk factors in an unselected general population: results from the Inter99 randomised intervention study. Scand J Public Health 2015;43:102-10.
- Jorgensen T, Ladelund S, Borch-Johnsen K, et al. Screening for risk of cardiovascular disease is not associated with mental distress: the Inter99 study. Prev Med 2009;48:242-6.
- Visseren FLJ, Mach F, Smulders YM, Carballo D, Koskinas KC, Bäck M, et al.; ESC National Cardiac Societies; ESC Scientific Document Group. 2021 ESC Guidelines on cardiovascular disease prevention in clinical practice. Eur Heart J. 2021;42:3227-37.
- SCORE2 working group and ESC Cardiovascular risk collaboration. SCORE2 risk prediction algorithms: new models to estimate 10-year risk of cardiovascular disease in Europe. Eur Heart J. 2021;42:2439-54.
- SCORE2-OP working group and ESC Cardiovascular risk collaboration. SCORE2-OP risk prediction algorithms: estimating incident cardiovascular event risk in older persons in four geographical risk regions. Eur Heart J. 2021;42:2455-67.
- Sundstrom J, Arima H, Jackson R, Turnbull F, Rahimi K, Chalmers J, et al. Blood Pressure Lowering Treatment Trialists’ Collaboration. Effects of blood pressure reduction in mild hypertension: a systematic review and meta-analysis. Ann Intern Med 2015;162:184-91.
- Thomopoulos C, Parati G, Zanchetti A. Effects of blood pressure lowering on outcome incidence in hypertension. 1. Overview, meta-analyses, and metaregression analyses of randomized trials. J Hypertens 2014;32:2285-95.
- Thomopoulos C, Parati G, Zanchetti A. Effects of blood pressure lowering on outcome incidence in hypertension: 4. Effects of various classes of antihypertensive drugs - overview and meta-analyses. J Hypertens 2015;33:195-211.
- Kist JM, Vos RC, Mairuhu ATA, Struijs JN, van Peet PG, Vos HMM, et al. SCORE2 cardiovascular risk prediction models in an ethnic and socioeconomic diverse population in the Netherlands: an external validation study. EClinicalMedicine. 2023;57:101862.
- Cooney MT, Vartiainen E, Laatikainen T, et al. Cardiovascular risk age: concepts and practicalities. Heart 2012;98:941-6.
- Cuende JI, Cuende N, Calaveras-Lagartos J. How to calculate vascular age with the SCORE project scales: a new method of cardiovascular risk evaluation. Eur Heart J 2010;31:2351-8.
- Jaspers NEM, Blaha MJ, Matsushita K, van der Schouw YT, Wareham NJ, Khaw KT, et al. Prediction of individualized lifetime benefit from cholesterol lowering, blood pressure lowering, antithrombotic therapy, and smoking cessation in apparently healthy people. Eur Heart J. 2020;41:1190-99.
- Hageman SHJ, McKay AJ, Ueda P, Gunn LH, Jernberg T, Hagström E, et al. Estimation of recurrent atherosclerotic cardiovascular event risk in patients with established cardiovascular disease: the updated SMART2 algorithm. Eur Heart J. 2022;43:1715-27.
- Kaasenbrood L, Bhatt DL, Dorresteijn JAN, Wilson PWF, D’Agostino RB Sr, Massaro JM, et al. Estimated Life Expectancy Without Recurrent Cardiovascular Events in Patients With Vascular Disease: The SMART-REACH Model. J Am Heart Assoc. 2018;7:e009217.
- Østergaard HB, Hageman SHJ, Read SH, Taylor O, Pennells L, Kaptoge S, et al. Estimating individual lifetime risk of incident cardiovascular events in adults with Type 2 diabetes: an update and geographical calibration of the DIAbetes Lifetime perspective model (DIAL2). Eur J Prev Cardiol. 2023;30:61-69.
- Marx N, Federici M, Schütt K, Müller-Wieland D, Ajjan RA, Antunes MJ, et al; ESC Scientific Document Group. 2023 ESC Guidelines for the management of cardiovascular disease in patients with diabetes. Eur Heart J. 2023;44:4043-140.
- Sarwar N, Danesh J, Eiriksdottir G, et al. Triglycerides and the risk of coronary heart disease: 10,158 incident cases among 262,525 participants in 29 Western prospective studies. Circulation 2007;115:450-8.
- Chapman MJ, Ginsberg HN, Amarenco P, et al. Triglyceride-rich lipoproteins and high-density lipoprotein cholesterol in patients at high risk of cardiovascular disease: evidence and guidance for management. Eur Heart J 2011;32:1345-61.
- Fruchart JC, Sacks F, Hermans MP, et al. The Residual Risk Reduction Initiative: a call to action to reduce residual vascular risk in patients with dyslipidemia. Am J Cardiol 2008;102:1K-34K.
- Voight BF, Peloso GM, Orho-Melander M, et al. Plasma HDL cholesterol and risk of myocardial infarction: a mendelian randomisation study. Lancet 2012;380:572-80.
- Nordestgaard BG, Chapman MJ, Ray K, et al. Lipoprotein(a) as a cardiovascular risk factor: current status. Eur Heart J 2010;31:2844-53.
- Mons U, Müezzinler A, Gellert C. Impact of smoking and smoking cessation on cardiovascular events and mortality among older adults: meta-analysis of individual participant data from prospective cohort studies of the CHANCES consortium. BMJ 2015;350:h1551.
- Iso H, Date C, Yamamoto A, et al. Smoking cessation and mortality from cardiovascular disease among Japanese men and women: the JACC Study. Am J Epidemiol 2005;161:170-9.
- Villareal DT, Chode S, Parimi N, et al. Weight loss, exercise, or both and physical function in obese older adults. N Engl J Med 2011;364:1218-29.
- Charles C, Gafni A, Whelan T. Decision-making in the physician-patient encounter: revisiting the shared treatment decision-making model. Social Science & Medicine. 1999;49(5):651-661.
- Charles C, Gafni A, Whelan T. Decision-making in the physician-patient encounter: revisiting the shared treatment decision-making model. Cultural influences on the physician-patient encounter: the case of shared treatment decision-making. Patient Educ Couns 2006;63(3):262-7.
- Elwyn G, Frosch D, Thomson R, et al. Shared Decision Making: A Model for Clinical Practice J Gen Intern Med. 2012;27(10):1361-1367.
- Emanuel EJ, Emanuel LL. Proxy decision making for incompetent patients. An ethical and empirical analysis. JAMA 1992;267:2067-71.
- Stiggelbout AM, Van der Weijden T, De Wit M, et al. Shared decision making: really putting patients at the centre of healthcare. BMJ 2012:344:256.
- Legemaate J. Nieuwe verhoudingen in de spreekkamer: Juridische aspecten. Amsterdam: AMC, 2013.
- Wanneer samen beslissen niet meer van zelf spreekt. Den Haag: Centrum voor ethiek en gezondheid, 2014. Ga naar bron: Wanneer samen beslissen niet meer van zelf spreekt. Den Haag: Centrum voor ethiek en gezondheid, 2014.
- Bachmann JM, Willis BL, Ayers CR, et al. Association between family history and coronary heart disease death across long-term follow-up in men: the Cooper Center Longitudinal Study. Circulation 2012;125:3092-8.
- Tikkanen E, Havulinna AS, Palotie A, et al. Genetic risk prediction and a 2-stage risk screening strategy for coronary heart disease. Arterioscler Thromb Vasc Biol 2013;33:2261-6.
- Sivapalaratnam S, Boekholdt SM, Trip MD, et al. Family history of premature coronary heart disease and risk prediction in the EPIC-Norfolk prospective population study. Heart 2010;96:1985-89.
- Veronesi G, Gianfagna F, Giampaoli S, et al. Improving long-term prediction of first cardiovascular event: the contribution of family history of coronary heart disease and social status. Prev Med 2014;64:75-80.
- Yeboah J, McClelland RL, Polonsky TS, et al. Comparison of novel risk markers for improvement in cardiovascular risk assessment in intermediate-risk individuals. JAMA 2012;308:788-95.
- Hughes MF, Saarela O, Stritzke J, et al. Genetic markers enhance coronary risk prediction in men: the MORGAM prospective cohorts. PLoS One 2012;7:e40922.
- Ganna A, Magnusson PK, Pedersen NL, et al. Multilocus genetic risk scores for coronary heart disease prediction. Arterioscl Thromb Vasc Biol 2013;33:2267-72.
- Guay SP, Brisson D, Lamarche B, et al. DNA methylation variations at CETP and LPL gene promoter loci: new molecular biomarkers associated with blood lipid profile variability. Atherosclerosis 2013;228:413-20.
- Wang X, Falkner B, Zhu H, et al. A genome-wide methylation study on essential hypertension in young African American males. PLoS One 2013;8:e53938.
- Baccarelli A, Wright R, Bollati V, et al. Ischemic heart disease and stroke in relation to blood DNA methylation. Epidemiology 2010;21:819-28.
- Albert MA, Glynn RJ, Buring J, et al. Impact of traditional and novel risk factors on the relationship between socioeconomic status and incident cardiovascular events. Circulation 2006;114:2619-26.
- Alter DA, Franklin B, Ko DT, et al. Socioeconomic status, functional recovery, and long-term mortality among patients surviving acute myocardial infarction. PLoS One 2014;8:e65130.
- Woodward M, Brindle P, Tunstall-Pedoe H. Adding social deprivation and family history to cardiovascular risk assessment: the ASSIGN score from the Scottish Heart Health Extended Cohort (SHHEC). Heart 2007;93:172-6.
- Barth J, Schneider S, Von Kanel R. Lack of social support in the etiology and the prognosis of coronary heart disease: a systematic review and meta-analysis. Psychosom Med 2010;72:229-38.
- Nawrot TS, Perez L, Kunzli N, et al. Public health importance of triggers of myocardial infarction: a comparative risk assessment. Lancet 2011;377:732-40.
- Mostofsky E, Penner EA, Mittleman MA. Outbursts of anger as a trigger of acute cardiovascular events: a systematic review and meta-analysis. Eur Heart J. 2014;35: 1404–1410.
- Kivimaki M, Nyberg ST, Batty GD, et al. Job strain as a risk factor for coronary heart disease: a collaborative meta-analysis of individual participant data. Lancet 2012;380:1491-7.
- Eaker ED, Sullivan LM, Kelly-Hayes M, et al. Marital status, marital strain, and risk of coronary heart disease or total mortality: the Framingham Offspring Study. Psychosom Med 2007;69:509-13.
- Kivimaki M, Jokela M, Nyberg ST, et al. Long working hours and risk of coronary heart disease and stroke: a systematic review and meta-analysis of published and unpublished data for 603 838 individuals. Lancet 2015;386:1739-46.
- Spindler H, Pedersen SS. Posttraumatic stress disorder in the wake of heart disease: prevalence, risk factors, and future research directions. Psychosom Med 2005;67:715-23.
- Pogosova N, Saner H, Pedersen SS, et al. Psychosocial aspects in cardiac rehabilitation: from theory to practice. A position paper from the Cardiac Rehabilitation Section of the European Association of Cardiovascular Prevention and Rehabilitation of the European Society of Cardiology. Eur J Prev Cardiol 2015;22:1290-306.
- Orth-Gomer K, Wamala SP, Horsten M, et al. Marital stress worsens prognosis in women with coronary heart disease: the Stockholm Female Coronary Risk Study. JAMA 2000;284:3008-14.
- Schnohr P, Marott JL, Kristensen TS, et al. Ranking of psychosocial and traditional risk factors by importance for coronary heart disease: the Copenhagen City Heart Study. Eur Heart J 2015;36:1385-93.
- Smoller JW, Pollack MH, Wassertheil-Smoller S, et al. Panic attacks and risk of incident cardiovascular events among postmenopausal women in the Women’s Health Initiative Observational Study. Arch Gen Psychiatry 2007;64:1153-60.
- Roest AM, Martens EJ, De Jonge P, et al. Anxiety and risk of incident coronary heart disease: a meta-analysis. J Am Coll Cardiol 2010a;56:38-46.
- Roest AM, Martens EJ, Denollet J, et al. Prognostic association of anxiety post myocardial infarction with mortality and new cardiac events: a meta-analysis. Psychosom Med 2010b;72:563-9.
- Fan Z, Wu Y, Shen J, et al. Schizophrenia and the risk of cardiovascular diseases: a meta-analysis of thirteen cohort studies. J Psychiatr Res. 2013;47: 1549–1556.
- Edmondson D, Kronish IM, Shaffer JA, et al. Posttraumatic stress disorder and risk for coronary heart disease: a meta-analytic review. Am Heart J 2013;166:806-14.
- Chida Y, Steptoe A. The association of anger and hostility with future coronary heart disease: a meta-analytic review of prospective evidence. J Am Coll Cardiol 2009;53:936-46.
- Grande G, Romppel M, Barth J. Association between type D personality and prognosis in patients with cardiovascular diseases: a systematic review and meta-analysis. Ann Behav Med 2012;43:299-310.
- Chandola T, Britton A, Brunner E, et al. Work stress and coronary heart disease: what are the mechanisms? Eur Heart J. 2008;29:640–648.
- Yusuf S, Hawken S, Ounpuu S, et al. Effect of potentially modifiable risk factors associated with myocardial infarction in 52 countries (the INTERHEART study): case-control study. Lancet 2004;364:9.
- Stringhini S, Sabia S, Shipley M, et al. Association of socioeconomic position with health behaviors and mortality. JAMA 2010;303:1159-66.
- Lichtman JH, Froelicher ES, Blumenthal JA, et al. Depression as a risk factor for poor prognosis among patients with acute coronary syndrome: systematic review and recommendations: a scientific statement from the American Heart Association. Circulation 2014;129:1350-69.
- Albus C, Ladwig KH, Herrmann-Lingen C. (Psychocardiology: clinically relevant recommendations regarding selected cardiovascular diseases). Dtsch Med Wochenschr 2014;139:596-601.
- Al-Rawi S, Zolezzi M, Eltorki Y. Evaluation of cardiovascular risk in adult psychiatric outpatients in Qatar using two risk assessment tools. Qatar Med J. 2021;2021:27.
- Foguet-Boreu Q, Fernandez San Martin MI, Flores Mateo G, Zabaleta Del Olmo E, Ayerbe García-Morzon L, Perez-Piñar López M, et al. Cardiovascular risk assessment in patients with a severe mental illness: a systematic review and meta-analysis. BMC Psychiatry. 2016;16:141.
- Salvi V, Aguglia A, Barone-Adesi F, Bianchi D, Donfrancesco C, Dragogna F, et al. Cardiovascular risk in patients with severe mental illness in Italy. Eur Psychiatry. 2020;63:e96.
- Osborn DP, Hardoon S, Omar RZ, Holt RI, King M, Larsen J, et al. Cardiovascular risk prediction models for people with severe mental illness: results from the prediction and management of cardiovascular risk in people with severe mental illnesses (PRIMROSE) research program. JAMA Psychiatry. 2015;72:143-51.
- Aguglia A, Salvi V, Amerio A, Gari M, Dragogna F, Mencacci C, et al. Number of episodes and duration of illness associated with hypertension and 10-year cardiovascular risk in patients with bipolar disorder type I. Psychiatry Res. 2022;308:114344.
- Perry BI, Upthegrove R, Crawford O, Jang S, Lau E, McGill I, et al. Cardiometabolic risk prediction algorithms for young people with psychosis: a systematic review and exploratory analysis. Acta Psychiatr Scand. 2020;142:215-32.
- Cunningham R, Poppe K, Peterson D, Every-Palmer S, Soosay I, Jackson R. Prediction of cardiovascular disease risk among people with severe mental illness: A cohort study. PLoS One. 2019;14:e0221521.
- Lambert AM, Parretti HM, Pearce E, Price MJ, Riley M, Ryan R, et al. Temporal trends in associations between severe mental illness and risk of cardiovascular disease: A systematic review and meta-analysis. PLoS Med. 2022;19:e1003960.
- Rhee TG, Olfson M, Nierenberg AA, Wilkinson ST. 20-Year Trends in the Pharmacologic Treatment of Bipolar Disorder by Psychiatrists in Outpatient Care Settings. Am J Psychiatry. 2020;177:706-715.
- Pillinger T, McCutcheon RA, Vano L, Mizuno Y, Arumuham A, Hindley G, et al. Comparative effects of 18 antipsychotics on metabolic function in patients with schizophrenia, predictors of metabolic dysregulation, and association with psychopathology: a systematic review and network meta-analysis. Lancet Psychiatry. 2020;7:64-77.
- Jakobs K, Lautan L, Lucassen P, Janzing J, van Lieshout J, Biermans MCJ, et al. Cardiovascular risk management in patients with severe mental illness or taking antipsychotics: A qualitative study on barriers and facilitators among dutch general practitioners. Eur J Gen Pract. 2022;28:191-99.
- Kaptoge S, Di Angelantonio E, Pennells L, et al. C-reactive protein, fibrinogen, and cardiovascular disease prediction. N Engl J Med 2012;367:1310-20.
- Gilstrap LG, Wang TJ. Biomarkers and cardiovascular risk assessment for primary prevention: an update. Clin Chem 2012;58:72-82.
- Tzoulaki I, Siontis KC, Evangelou E, et. Bias in associations of emerging biomarkers with cardiovascular disease. JAMA Intern Med 2013;173:664-71.
- Kooter AJ, Kostense PJ, Groenewold J, et al. Integrating information from novel risk factors with calculated risks: the critical impact of risk factor prevalence. Circulation 2011;124:741-5.
- Wurtz P, Havulinna AS, Soininen P, et al. Metabolite profiling and cardiovascular event risk: a prospective study of 3 population-based cohorts. Circulation 2015;131:774–85.
- O’Leary DH, Polak JF, Kronmal RA, et al. Carotid-artery intima and media thickness as a risk factor for myocardial infarction and stroke in older adults. Cardiovascular Health Study Collaborative Research Group. N Engl J Med 1999;340:14-22.
- Chambless LE, Heiss G, Folsom AR, et al. Association of coronary heart disease incidence with carotid arterial wall thickness and major risk factors: the Atherosclerosis Risk in Communities (ARIC) Study, 1987 to 1993. Work stress and coronary heart disease: what are the mechanisms? Eur Heart J 2008;29:640-8.
- Den Ruijter HM, Peters SA, Anderson TJ, et al. Common carotid intima-media thickness measurements in cardiovascular risk prediction: a meta-analysis. JAMA 2012;308:796-803.
- Stein JH, Korcarz CE, Hurst RT, et al. Use of carotid ultrasound to identify subclinical vascular disease and evaluate cardiovascular disease risk: a consensus statement from the American Society of Echocardiography Carotid Intima-Media Thickness Task Force. Endorsed by the Society for Vascular Medicine. J Am Soc Echocardiogr 2008;21:93-111; quiz 189-90.
- Taylor HA, Penman AD, Han H, et al. Left ventricular architecture and survival in African-Americans free of coronary heart disease (from the Atherosclerosis Risk in Communities (ARIC) study). Am J Cardiol 2007;99:1413-20.
- Muiesan ML, Salvetti M, Monteduro C, et al. Left ventricular concentric geometry during treatment adversely affects cardiovascular prognosis in hypertensive patients. Hypertension 2004;43:731-8.
- Evans JM, Wang J, Morris AD. Comparison of cardiovascular risk between patients with type 2 diabetes and those who had had a myocardial infarction: cross sectional and cohort studies. BMJ 2002;324:939-42.
- Wannamethee SG, Shaper AG, Whincup PH, et al. Impact of diabetes on cardiovascular disease risk and all-cause mortality in older men: influence of age at onset, diabetes duration, and established and novel risk factors. Arch Intern Med 2011;171:404-10.
- Constantino MI, Molyneaux L, Limacher-Gisler F, et al. Long-term complications and mortality in youngonset diabetes: type 2 diabetes is more hazardous and lethal than type 1 diabetes. Cardiovascular toxicity induced by chemotherapy, targeted agents and radiotherapy: ESMO Clinical Practice Guidelines. Ann Oncology 2012;23(Suppl 7):vii155-66.
- Tonelli M, Muntner P, Lloyd A, et al. Risk of coronary events in people with chronic kidney disease compared with those with diabetes: a population-level cohort study. Lancet 2012; 380:807-14.
- Angelantonio E, Kaptoge S, Wormser D, et al. Association of cardiometabolic multimorbidity with mortality. JAMA 2015;314:52-60.
- Lind M, Svensson AM, Kosiborod M, et al. Glycemic control and excess mortality in type 1 diabetes. N Engl J Med 2014;371:1972-82.
- Woodward M, Hirakawa Y, Kengne AP, et al. ADVANCE Collaborative Group. Prediction of 10-year vascular risk in patients with diabetes: the AD-ON risk score. Diabetes Obes Metab. 2016;18(3):289-94.
- Zheng SL, Roddick AJ, Aghar-Jaffar R, et al. Association between use of sodium-glucose cotransporter 2 inhibitors, glucagon-like peptide 1 agonists, and dipeptidyl peptidase 4 inhibitors with all-cause mortality in patients with type 2 diabetes: a systematic review and meta-analysis. JAMA 2018 Apr 17;319:1580-91.
- Schiffrin EL, Lipman ML, Mann JF. Chronic kidney disease: effects on the cardiovascular system. Circulation 2007;116:85-97.
- Gansevoort RT, Correa-Rotter R, Hemmelgarn BR, et al. Chronic kidney disease and cardiovascular risk: epidemiology, mechanisms, and prevention. Lancet 2013;382:339-52.
- Matsushita K, Van der Velde M, Astor BC, et al. Association of estimated glomerular filtration rate albuminuria with all-cause cardiovascular mortality in general population cohorts: a collaborative meta-analysis. Lancet 2010;375:2073-81.
- Mahmoodi BK, Matsushita K, Woodward M, et al. for the CKD Prognosis Consortium. Associations of kidney disease measures with mortality and end-stage renal disease in individuals with and without hypertension: a meta-analysis. Lancet 2012;380:1649-61.
- Matsushita K, Coresh J, Sang Y, et al. Estimated glomerular filtration rate and albuminuria for prediction of cardiovascular outcomes: a collaborative meta-analysis of individual participant data. Lancet Diabetes Endocrinol 2015;3:514-25.
- KDIGO, Kidney Disease: Improving Global Outcomes (KDIGO) CKD Work Group. KDIGO 2012 Clinical Practice Guideline for the Evaluation and Management of Chronic Kidney Disease. Kidney Int Suppl 2013;3:1-150.
- Shlipak MG, Matsushita K, Arnlov J, et al. Cystatin C versus creatinine in determining risk based on kidney function. N Engl J Med 2013;369:932-43.
- Chen J, Long JB, Hurria A, et al. Incidence of heart failure or cardiomyopathy after adjuvant trastuzumab therapy for breast cancer. J Am Coll Cardiol 2012;60:2504-12.
- Darby S, McGale P, Peto R, et al. Mortality from cardiovascular disease more than 10 years after radiotherapy for breast cancer: nationwide cohort study of 90 000 Swedish women. BMJ 2003;326:256-7.
- Smith GL, Smith BD, Buchholz TA, et al. Cerebrovascular disease risk in older head and neck cancer patients after radiotherapy. J Clin Oncol 2008;26: 5119-25.
- Fajardo LF. Is the pathology of radiation injury different in small versus large blood vessels? Cardiovasc Radiat Med 1999;1:108-10.
- Van der Pal HJ, Van Dalen EC, Van Delden E, et al. High risk of symptomatic cardiac events in childhood cancer survivors. J Clin Oncol 2012;30:1429-37.
- Hooning MJ, Botma A, Aleman BM, et. Long-term risk of cardiovascular disease in 10-year survivors of breast cancer. J Natl Cancer Instit 2007;99:365-75.
- Yeh JM, Nohria A, Diller L. Routine echocardiography screening for asymptomatic left ventricular dysfunction in childhood cancer survivors: a model-based estimation of the clinical and economic effects. Ann Intern Med 2014;160:661-71.
- Jensen BV, Skovsgaard T, Nielsen SL. Functional monitoring of anthracycline cardiotoxicity: a prospective, blinded, long-term observational study of outcome in 120 patients. Ann Oncology 2002;13:699-709.
- Darby SC, Ewertz M, McGale P, et al. Risk of ischemic heart disease in women after radiotherapy for breast cancer. N Engl J Med 2013;368:987-98.
- Mishra SI, Scherer RW, Snyder C, et al. Exercise interventions on health-related quality of life for people with cancer during active treatment. Cochrane Database Syst Rev. 2012;8:CD008465.
- McMurray JJ, Adamopoulos S, Anker SD, et al. ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure 2012: the Task Force for the Diagnosis and Treatment of Acute and Chronic Heart Failure 2012 of the European Society of Cardiology. Developed in collaboration with the Heart Failure Association (HFA) of the ESC. Exercise interventions on health-related quality of life for people with cancer during active treatment. Cochrane Database Syst Rev 2012;8:CD008465.
- Plana JC, Galderisi M, Barac A, et al. Expert consensus for multimodality imaging evaluation of adult patients during and after cancer therapy: a report from the American Society of Echocardiography and the European Association of Cardiovascular Imaging. Eur Heart J Cardiovasc Imaging 2014;15:1063-93.
- Curigliano G, Cardinale D, Suter T, et al. Cardiovascular toxicity induced by chemotherapy, targeted agents and radiotherapy: ESMO Clinical Practice Guidelines. Ann Oncology. 2012;23(Suppl 7):vii155–vii166.
- Cardinale D, Colombo A, Lamantia G, et al. Anthracycline-induced cardiomyopathy: clinical relevance and response to pharmacologic therapy. J Am Coll Cardiol 2010;55:213-20.
- Felker GM, Thompson RE, Hare JM, et al. Underlying causes and long-term survival in patients with initially unexplained cardiomyopathy. N Engl J Med. 2000;342:1077–1084.
- Agca R, Heslinga SC, Rollefstad S, et al. EULAR recommendations for cardiovascular disease risk management in patients with rheumatoid arthritis and other forms of inflammatory joint disorders: 2015/2016update. Ann Rheum Dis 2017;76:17-28.
- Hippisley-Cox J, Coupland C, Vinogradova Y, et al. Predicting cardiovascular risk in England and Wales: prospective derivation and validation of QRISK2. BMJ 2008;336:1475-82.
- Ogdie A, Yu Y, Haynes K, Love TJ, Maliha S, Jiang Y, et al. Risk of major cardiovascular events in patients with psoriatic arthritis, psoriasis and rheumatoid arthritis: a population-based cohort study. Ann Rheum Dis. 2015;74:326-32.
- Polachek A, Touma Z, Anderson M, Eder L. Risk of Cardiovascular Morbidity in Patients With Psoriatic Arthritis: A Meta-Analysis of Observational Studies. Arthritis Care Res (Hoboken). 2017;69:67-74.
- Drosos GC, Vedder D, Houben E, Boekel L, Atzeni F, Badreh S, et al. EULAR recommendations for cardiovascular risk management in rheumatic and musculoskeletal diseases, including systemic lupus erythematosus and antiphospholipid syndrome. Ann Rheum Dis. 2022;81:768-79.
- Nasir K, Acquah I, Dey AK, Agrawal T, Hassan SZ, Glassner K, et al. Inflammatory bowel disease and atherosclerotic cardiovascular disease in U.S. adults-A population-level analysis in the national health interview survey. Am J Prev Cardiol. 2022;9:100316.
- Gonzaga C, Bertolami A, Bertolami M, et al. Obstructive sleep apnea, hypertension and cardiovascular diseases. J Hum Hypertens 2015;29:705-12.
- Johns MW. A new method for measuring daytime sleepiness: the Epworth sleepiness scale. Sleep 1991;14:540-5.
- Bellamy L, Casas JP, Hingorani AD, et al. Type 2 diabetes mellitus after gestational diabetes: a systematic review and meta-analysis. Lancet 2009;373:1773-9.
- Auvinen AM, Luiro K, Jokelainen J, Järvelä I, Knip M, Auvinen J, et al. Type 1 and type 2 diabetes after gestational diabetes: a 23 year cohort study. Diabetologia. 2020;63:2123-28.
- Kramer CK, Campbell S, Retnakaran R. Gestational diabetes and the risk of cardiovascular disease in women: a systematic review and meta-analysis. Diabetologia 2019;62:905-14.
- Nybo-Andersen AM, Wohlfahrt J, Christens P, Melbye M. Maternal age and fetal loss: population based register linkage study. BMJ 2000;320:1708-12.
- Oliver-Williams CT, Heydon EE, Smith GCS, Wood AM. Miscarriage and future maternal cardiovascular disease: a systematic review and meta-analysis. Heart 2013;99:1636-44.
- Heida KY, Bots ML, de Groot CJM, van Dunné FM, Hammoud NH. Cardiovascular risk management after reproductive and pregnancy-related disorders: A Dutch multidisciplinary evidence-based guideline. Eur j Prev Cardiol. 2016;23:1863-79.
- Tan YY, Gast GC. Gender differences in risk factors for coronary heart disease. Maturitas 2010;65:149-60.
- Wekker V, van Dammen L, Koning A, Heida KY, Painter R. Long-term cardiometabolic disease risk in women with PCOS: a systematic review and meta-analysis. Hum Reprod Update 2020;26:942-60.
- Gunning MN, Meun C, van Rijn BB, Daan NMP, Roeters van Lennep JE, Appelman Y, et al; CREW consortium. The cardiovascular risk profile of middle age women previously diagnosed with premature ovarian insufficiency: A case-control study. PLoS One. 2020;15:e0229576.
- Wormser, et al. The Emerging Risk Factors Collaboration. Separate and combined associations of body-mass index and abdominal adiposity with cardiovascular disease: collaborative analysis of 58 prospective studies. Lancet 2011;377:1085-95.
- Van Dis, et al. Do obesity and parental history of myocardial infarction improve cardiovascular risk prediction? Eur J Prevent Cardio 2012;20:793-9.
- Peters SA, Den Ruijter HM, Bots ML, et al. Improvements in risk stratification for the occurrence of cardiovascular disease by imaging subclinical atherosclerosis: a systematic review. Heart 2012;98:177-84.
- Paixao ARM, Ayers CR, el Sabbagh A, et al. Coronary artery calcium improves risk classification in younger populations. J Am Coll Cardiol 2015;11:1285-93.
- Baber U, Mehran R, Sartori S, et al. Prevalence, impact, and predictive value of detecting subclinical coronary and carotid atherosclerosis in asymptomatic adults. J Am Coll Cardiol 2015;11:1065-74.
- Hoffmann U, Massaro JM, D'Agostino RB Sr, Kathiresan S, Fox CS, O'Donnell CJ. Cardiovascular Event Prediction and Risk Reclassification by Coronary, Aortic, and Valvular Calcification in the Framingham Heart Study. J Am Heart Assoc. 2016;5:e003144.
- Tinana A, Mintz GS, Weissman NJ. Volumetric intravascular ultrasound quantification of the amount of atherosclerosis and calcium in nonstenotic arterial segments. Am J Cardiol 2002;89:757-60.
- de Ronde MWJ, Khoshiwal A, Planken RN, Boekholdt SM, Biemond M, Budoff MJ, et al. A pooled-analysis of age and sex based coronary artery calcium scores percentiles. J Cardiovasc Comput Tomogr. 2020;14:414-20.
- Burke AP, Kolodgie FD, Farb A, Weber D, Virmani R. Morphological predictors of arterial remodeling in coronary atherosclerosis. Circulation. 2002;105:297-303.
- Grandhi GR, Mirbolouk M, Dardari ZA, Al-Mallah MH, Rumberger JA, Shaw LJ, et al. Interplay of Coronary Artery Calcium and Risk Factors for Predicting CVD/CHD Mortality: The CAC Consortium. JACC Cardiovasc Imaging. 2020;13:1175-86.
- Blaha MJ, Cainzos-Achirica M, Greenland P, McEvoy JW, Blankstein R, Budoff MJ, et al. Role of Coronary Artery Calcium Score of Zero and Other Negative Risk Markers for Cardiovascular Disease: The Multi-Ethnic Study of Atherosclerosis (MESA). Circulation. 2016;133:849-58.
- Hecht HS, Superko HR. Electron beam tomography and National Cholesterol Education Program guidelines in asymptomatic women. J Am Coll Cardiol. 2001;37:1506–11.
- Temtem M, Mendonça MI, Gomes Serrão M, Santos M, Sá D, Sousa F, et al. Predictive improvement of adding coronary calcium score and a genetic risk score to a traditional risk model for cardiovascular event prediction. Eur J Prev Cardiol. 2024;31:709-15.
- Haberl R, Becker A, Leber A, et al. Correlation of coronary calcification and angiographically documented stenoses in patients with suspected coronary artery disease: results of 1,764 patients. J Am Coll Cardiol 2001;37:451-7.
- Biavati F, Saba L, Boussoussou M, Kofoed KF, Benedek T, Donnelly P, et al; DISCHARGE Trial Group. Coronary Artery Calcium Score Predicts Major Adverse Cardiovascular Events in Stable Chest Pain. Radiology. 2024;310:e231557.
- Budoff MJ, Young R, Burke G, Jeffrey Carr J, Detrano RC, Folsom AR, et al. Ten-year association of coronary artery calcium with atherosclerotic cardiovascular disease (ASCVD) events: the multi-ethnic study of atherosclerosis (MESA). Eur Heart J. 2018;39:2401-8.
- Sarwar A, Shaw LJ, Shapiro MD, Blankstein R, Hoffmann U, Cury RC, et al. Diagnostic and prognostic value of absence of coronary artery calcification. JACC Cardiovasc Imaging. 2009;2:675-88.
- Golub IS, Termeie OG, Kristo S, Schroeder LP, Lakshmanan S, Shafter AM, et al. Major Global Coronary Artery Calcium Guidelines. JACC Cardiovasc Imaging. 2023;16:98-117.
- Venkataraman P, Huynh Q, Nicholls SJ, Stanton T, Watts GF, Marwick TH; CAUGHT-CAD investigators. Impact of a coronary artery calcium-guided statin treatment protocol on cardiovascular risk at 12 months: Results from a pragmatic, randomised controlled trial. Atherosclerosis. 2021;334:57-65.
- Chou R, Arora B, Dana T, et al. Screening asymptomatic adults for coronary heart disease with resting or exercise electrocardiography: systematic review to update the 2004 U.S. Preventive Services Task Force Recommendation (Internet). Rockville (MD): Agency for Healthcare Research and Quality (US), 2011 Sep.
- Shah AJ, Vaccarino V, Janssens AC, et al. An Electrocardiogram-based risk equation for incident cardiovascular disease from the National Health and Nutrition Examination Survey. JAMA Cardiol 2016 Oct 1;1:779-86.
- Auer R, Bauer DC, Marques-Vidal P, et al. Health ABC Study. Association of major and minor ECG abnormalities with coronary heart disease events. JAMA. 2012;307(14):1497-505.
- Graversen P, Abildstrøm SZ, Jespersen L, et al. Cardiovascular risk prediction: can systematic coronary risk evaluation (SCORE) be improved by adding simple risk markers? Results from the Copenhagen City Heart Study. Eur J Prev Cardiol 2016;23:1546-56.
- Desai CS, Ning H, Soliman EZ, et al. Electrocardiographic abnormalities and coronary artery calcium for coronary heart disease prediction and reclassification: the Multi-Ethnic Study of Atherosclerosis (MESA). Am Heart J 2014;168:391-7.
- Cook NR, Paynter NP. Performance of reclassification statistics in comparing risk prediction models. Biom J 2011;53::237-58.
- Hiatt WR. Medical treatment of peripheral arterial disease and claudication. N Engl J Med 2001;24:344:1608-21.
- Ankle Brachial Index Collaboration, Fowkes FG, Murray GD, et al. Ankle brachial index combined with Framingham risk score to predict cardiovascular events and mortality: a meta-analysis. JAMA 2008;9:300:197-208.
- McDermott MM, Greenland P, Liu K, et al. The ankle brachial index is associated with leg function and physical activity: the Walking and Leg Circulation Study. Ann Intern Med 2002 Jun 18;136:873-83. Erratum in: Ann Intern Med 2003;139:306.
- Fowkes FG, Price JF, Stewart MC, et al. Aspirin for Asymptomatic Atherosclerosis Trialists. Aspirin for prevention of cardiovascular events in a general population screened for a low ankle brachial index: a randomized controlled trial. JAMA 2010;3:303:841-8.
- Lin JS, Olson CM, Johnson ES, et al. The ankle-brachial index for peripheral artery disease screening and cardiovascular disease prediction among asymptomatic adults: a systematic evidence review for the U.S. Preventive Services Task Force. Ann Intern Med 2013;3:159:333-41.
- Yeboah J, Young R, McClelland RL, et al. Utility of nontraditional risk markers in atherosclerotic cardiovascular disease risk assessment. J Am Coll Cardiol 2016;19:67:139-47.
- Velescu A, Clara A, Peñafiel J, et al. Adding low ankle brachial index to classical risk factors improves the prediction of major cardiovascular events. The REGICOR study. Atherosclerosis 2015;241:357-63.
- Ferket BS, Van Kempen BJ, Hunink MG, et al. Predictive value of updating Framingham risk scores with novel risk markers in the U.S. general population. PLoS One 2014;18:9:e88312.
- Fowkes FG, Murray GD, Butcher I, et al. Development and validation of an ankle brachial index risk model for the prediction of cardiovascular events. Eur J Prev Cardiol 2014;21:310-20.
- Gijsbers L, Dower JI, Mensink M, et al. Effects of sodium and potassium supplementation on blood pressure and arterial stiffness: a fully controlled dietary intervention study. J Hum Hypertens 2015;29;592-8.
- Drawz PE, Baraniuk S, Davis BR, et al. Cardiovascular risk assessment: addition of CKD and race to the Framingham equation. Am Heart J 2012;164:925-31.
- Patel JV, Vyas A, Cruickshank JK, et al. Impact of migration on coronary heart disease risk factors: comparison of Gujaratis in Britain and their contemporaries in villages of origin in India. Atherosclerosis 2006;185:297-306.
- Rafnsson SB, Bhopal RS, Agyemang C, et al. Sizable variations in circulatory disease mortality by region and country of birth in six European countries. Eur J Public Health 2013;23:594-605.
- Van Oeffelen AA, Vaartjes I, Stronks K, et al. Incidence of acute myocardial infarction in first and second generation minority groups: does the second generation converge towards the majority population? Int J Cardiol 2013;168:5422-9.
- Harding S, Rosato M, Teyhan A. Trends for coronary heart disease and stroke mortality among migrants in England and Wales, 1979-2003: slow declines notable for some groups. Heart 2008;94:463-70.
- Tillin T, Hughes AD, Whincup P, et al. Ethnicity and prediction of cardiovascular disease: performance of QRISK2 and Framingham scores in a U.K. tri-ethnic prospective cohort study (SABRE-Southall And Brent REvisited). Heart 2014;100:60-7.
- Glenday K, Kumar BN, Tverdal A, et al. Cardiovascular disease risk factors among five major ethnic groups in Oslo, Norway: the Oslo Immigrant Health Study. Eur J Cardiovasc Prev Rehabil 2006;13:348-55.
- Agyemang C, Ujcic-Voortman J, Uitenbroek D, et al. Prevalence and management of hypertension among Turkish, Moroccan and native Dutch ethnic groups in Amsterdam, the Netherlands: the Amsterdam Health Monitor Survey. J Hypertens 2006;24:2169-76.
- El Fakiri F, Bruijnzeels MA, Foets MM, et al. Different distribution of cardiovascular risk factors according to ethnicity: a study in a high-risk population. J Immigrant Minority Health 2008;10:559-65.
- Snijder MB, Agyemang C, Peters RJ, et al. Case finding and medical treatment of type 2 diabetes among different ethnic minority groups: the HELIUS Study. J Diabetes Res 2017:9896849.
- Bhopal RS, Bansal N, Fischbacher CM, et al. Ethnic variations in the incidence and mortality of stroke in the Scottish Health and Ethnicity Linkage Study of 4.65 million people. Eur J Prev Cardiol. 2012;19:1503–1508.
- Regidor E, de La Fuente L, Martinez D, et al. Heterogeneity in cause-specific mortality according to birthplace in immigrant men residing in Madrid, Spain. Ann Epidemiol. 2008;18:605–13.
- Bhopal RS, HumphryRW, Fischbacher CM. Changes in cardiovascular risk factors in relation to increasing ethnic inequalities in cardiovascular mortality: comparison of cross-sectional data in the Health Surveys for England 1999 and 2004. BMJ Open. 2013;3:e003485.
- Agyemang C, Kunst AE, Bhopal R, et al. Diabetes prevalence in populations of South Asian Indian and African origins: a comparison of England and the Netherlands. Epidemiology 2011;22:563-7.
- Agyemang C, Stronks K, Tromp N, et al. A cross-national comparative study of smoking prevalence and cessation between English and Dutch South Asian and African origin populations: the role of national context. Nicotine Tob Res 2010;12:557-66.
- Mathur R, Hull SA, Badrick E, et al. Cardiovascular multimorbidity: the effect of ethnicity on prevalence and risk factor management. Br J Gen Pract 2011;61: e262-70.
- Schofield P, Saka O, Ashworth M. Ethnic differences in blood pressure monitoring and control in south east London. Br J Gen Pract 2011;61:190-6.
- Agyemang C, Bindraban N, Mairuhu G, et al; SUNSET (Surinamese in The Netherlands: Study on Ethnicity and Health) Study Group. Prevalence, awareness, treatment, and control of hypertension among black Surinamese, South Asian Surinamese and white Dutch in Amsterdam, The Netherlands: the SUNSET study. J Hypertens 2005;23:1971-7.
- Agyemang C, Kieft S, Snijder MB, et al. Hypertension control in a large multi-ethnic cohort in Amsterdam, The Netherlands: the HELIUS study. Int J Cardiol 2015;183:180-9.
- Bindraban NR, Van Valkengoed IG, Mairuhu G, et al. Prevalence of diabetes mellitus and the performance of a risk score among Hindustani Surinamese, African Surinamese and ethnic Dutch: a cross-sectional population-based study. BMC Public Health 2008;8:271.
- Raza Q, Snijder MB, Seidell JC, et al. Comparison of cardiovascular risk factors and dietary intakes among Javanese Surinamese and South-Asian Surinamese in the Netherlands. The HELIUS study. BMC Res Notes. 2017;6:10(1):23.
- Li M, Hu X, Fan Y, et al. Hyperuricemia and the risk for coronary heart disease morbidity and mortality a systematic review and dose-response meta-analysis. Sci Rep 2016;6:19520.
- Kavousi M, Elias-Smale S, Rutten JH, et al. Evaluation of newer risk markers for coronary heart disease risk classification: a cohort study. Ann Intern Med 2012;156:438-44.
- Ogdie A, Yu Y, Haynes K, et al. Risk of major cardiovascular events in patients with psoriatic arthritis, psoriasis and rheumatoid arthritis: a population-based cohort study. Effect of intensive lipid-lowering therapy on cardiovascular outcome in patients with and those without inflammatory joint disease. Arthritis Rheum 2012;64:2836-46.
- Semb AG, Kvien TK, DeMicco DA, et al. Effect of intensive lipid-lowering therapy on cardiovascular outcome in patients with and those without inflammatory joint disease. Arthritis Rheum 2012;64:2836-46.
- Li J, Siegrist J. Physical activity and risk of cardiovascular disease – a meta-analysis of prospective cohort studies. Int J Environ Res Public Health 2012;9:391-407.
- Gladman DD. Toward unraveling the mystery of psoriatic arthritis. Psoriasis and risk of nonfatal cardiovascular disease in U.S. women: a cohort study. Br J Dermatol 2012;166:811-8.
- Cebron Lipovec N, Beijers RJ, Van den Borst B, et al. The prevalence of metabolic syndrome in chronic obstructive pulmonary disease: a systematic review. COPD 2016;13:399-406.
- Müllerova H, Agusti A, Erqou S, et al. Cardiovascular comorbidity in COPD: systematic literature review. Chest 2013;144:1163-78.
- Chen W, Thomas J, Sadatsafavi M, et al. Risk of cardiovascular comorbidity in patients with chronic obstructive pulmonary disease: a systematic review and meta-analysis. Lancet Respir Med 2015;3:631-9.
- Janssens HJ, Arts PG, Schalk BW, et al. Gout and rheumatoid arthritis, both to keep in mind in cardiovascular risk management: a primary care retrospective cohort study. Joint Bone Spine 2017;84:59-64.
- Clarson LE, Hider SL, Belcher J, et al. Increased risk of vascular disease associated with gout: a retrospective, matched cohort study in the UK clinical practice research datalink. Ann Rheum Dis. 2015a;74(4):642-7.
- Clarson LE, Hider SL, Belcher J, et al. Increased risk of vascular disease associated with gout: a retrospective, matched cohort study in the UK clinical practice research datalink. Increased cardiovascular mortality associated with gout: a systematic review and meta-analysis. Eur J Prev Cardiol 2015b;22:335-43.
- Kok VC, Horng JT, Lin HL, et al. Gout and subsequent increased risk of cardiovascular mortality in non-diabetics aged 50 and above: a population-based cohort study in Taiwan. BMC Cardiovasc Disord 2012;12:108.
- Sattar N, McCarey DW, Capell H, et al. Explaining how ‘high-grade’ systemic inflammation accelerates vascular risk in rheumatoid arthritis. Circulation 2003;108:2957-63.
- Hippisley-Cox J, Coupland C, Brindle P. Development and validation of QRISK3 risk prediction algorithms to estimate future risk of cardiovascular disease: prospective cohort study. BMJ 2017;357:j2099.
- Board JBS. Joint British Societies’ consensus recommendations for the prevention of cardiovascular disease (JBS3). Heart 2014;100(Suppl 2):ii1-67.
- Avina-Zubieta JA, Thomas J, Sadatsafavi M, et al. Risk of incident cardiovascular events in patients with rheumatoid arthritis: a meta-analysis of observational studies. Ann Rheum Dis 2012;71:1524-9.
- Lindhardsen J, Ahlehoff O, Gislason GH, et al. The risk of myocardial infarction in rheumatoid arthritis and diabetes mellitus: a Danish nationwide cohort study. Risk of major cardiovascular events in patients with psoriatic arthritis, psoriasis and rheumatoid arthritis: a population-based cohort study. Ann Rheum Dis 2015;74:326-32.
- Castañeda S, Martín-Martínez MA, González-Juanatey C, et al. Cardiovascular morbidity and associated risk factors in Spanish patients with chronic inflammatory rheumatic diseases attending rheumatology clinics: baseline data of the CARMA Project. Semin Arthritis Rheum 2015;44:618-26.
- Arts EE, Fransen J, Den Broeder AA, et al. The effect of disease duration and disease activity on the risk of cardiovascular disease in rheumatoid arthritis patients. Ann Rheum Dis 2015;74:998-1003.
- Demoruelle MK, Deane KD, Holers VM. When and where does inflammation begin in rheumatoid arthritis? Curr Opin Rheumatol 2014;26:64-71.
- Smolen JS, Aletaha D, McInnes IB. Rheumatoid arthritis. Lancet. 2016;388(10055):2023-2038. doi: 10.1016/S0140-6736(16)30173-8. Epub 2016 May 3. Review. Erratum in: Lancet. 2016 Oct 22;388(10055):1984.
- Dregan A, Chowienczyk P, Molokhia M. Cardiovascular and type 2 diabetes morbidity and all-cause mortality among diverse chronic inflammatory disorders. Heart 2017. pii: heartjnl-2017-311214.
- Hung YM, Chang WP, Wei JC, et al. Midlife Ankylosing Spondylitis Increases the Risk of Cardiovascular Diseases in Males 5 Years Later: A National Population-Based Study. Medicine (Baltimore). 2016;95(18):e3596.
- Haroon NN, Paterson JM, Li P, et al. Patients with ankylosing spondylitis have increased cardiovascular and cerebrovascular mortality: a population-based study. Midlife ankylosing spondylitis increases the risk of cardiovascular diseases in males 5 years later: a national population-based study. Medicine (Baltimore) 2016;95:e3596.
- Szabo SM, Levy AR, Rao SR, et al. Increased risk of cardiovascular and cerebrovascular diseases in individuals with ankylosing spondylitis: a population-based study. Arthritis Rheum 2011;63:3294-304.
- Islam FM, Wu J, Jansson J, et al. Relative risk of cardiovascular disease among people living with hiv: a systematic review and meta-analysis. HIV Med 2012;13:453-68.
- Lundgren JD, Babiker AG, Gordin F, et al. INSIGHT START Study Group. Initiation of antiretroviral therapy in early asymptomatic hiv infection. N Engl J Med 2015 Aug 27;373:795-807.
- Singh S, Singh H, Loftus EV Jr, et al. Risk of cerebrovascular accidents and ischemic heart disease in patients with inflammatory bowel disease: a systematic review and meta-analysis. Clin Gastroenterol Hepatol 2014;12:382-93.
- Xiao Z, Pei Z, Yuan M, et al. Risk of stroke in patients with inflammatory bowel disease: a systematic review and meta-analysis. J Stroke Cerebrovasc Dis 2015;24:2774-80.
- Close H, Mason JM, Wilson DW, et al. Risk of ischaemic heart disease in patients with inflammatory bowel disease: cohort study using the general practice research database. PLoS One 2015;10:e0139745.
- Dregan A, Charlton J, Chowienczyk P, et al. Chronic inflammatory disorders and risk of type 2 diabetes mellitus, coronary heart disease, and stroke: a population-based cohort study. Circulation 2014;130:837-44.
- Jussila A, Virta LJ, Pukkala E, et al. Mortality and causes of death in patients with inflammatory bowel disease: a nationwide register study in Finland. J Crohns Colitis 2014;8:1088-96.
- Tsai MS, Lin CL, Chen HP, et al. Long-term risk of acute coronary syndrome in patients with inflammatory bowel disease: a 13-year nationwide cohort study in an Asian population. Inflamm Bowel Dis 2014;20:502-7.
- Artinian NT, Fletcher GF, Mozaffarian D, et al. Interventions to promote physical activity and dietary lifestyle changes for cardiovascular risk factor reduction in adults: a scientific statement from the American Heart Association. Circulation 2010;122:406-41.
- General Medical Council. Consent: patients and doctors making decisions together. Manchester, UK: General Medical Council, 2008.
- Rubak S, Sandbaek A, Lauritzen T, et al. Motivational interviewing: a systematic review and meta-analysis. Br J Gen Pract 2005;55:305-12.
- Martin LR, DiMatteo MR, eds. The Oxford handbook of health communication, behaviour change, and treatment adherence. New York: Oxford University Press, 2014.
- U.S. Preventive Services Task Force. Guide to clinical preventive services. 2nd ed. Baltimore: Williams & Wilkins, 1996.
- Balady GJ, Williams MA, Ades PA, et al. American Heart Association Exercise CR. Core components of cardiac rehabilitation/secondary prevention programs: 2007 update: a scientific statement from the American Heart Association Exercise, Cardiac Rehabilitation, and Prevention Committee, the Council on Clinical Cardiology; the Councils on Cardiovascular Nursing, Epidemiology and Prevention, and Nutrition, Physical Activity, and Metabolism; and the American Association of Cardiovascular and Pulmonary Rehabilitation. Circulation 2007;115:2675-82.
- Piepoli MF, Corra U, Benzer W, et al. Secondary prevention through cardiac rehabilitation: from knowledge to implementation. A position paper from the Cardiac Rehabilitation Section of the European Association of Cardiovascular Prevention and Rehabilitation. Eur J Cardiovasc Prev Rehabil 2010;17:1-17.
- Auer R, Gaume J, Rodondi N, et al. Efficacy of in-hospital multidimensional interventions of secondary prevention after acute coronary syndrome: a systematic review and meta-analysis. Circulation 2008;117:3109-17.
- Janssen V, De Gucht V, Dusseldorp E, et al. Lifestyle modification programmes for patients with coronary heart disease: a systematic review and meta-analysis of randomized controlled trials. Eur J Prev Cardiol 2013;20:620-40.
- Hazelton G, Williams JW, Wakefield J, et al. Psychosocial benefits of cardiac rehabilitation among women compared with men. Zelfmanagement door mensen met chronische ziekten. Kennissynthese van onderzoek en implementatie in Nederland. Utrecht: NIVEL, 2015.
- Burell G, Granlund B. Women’s hearts need special treatment. Int J Behav Med 2002;9:228-42.
- Ladwig KH, Lederbogen F, Albus C, et al. Position paper on the importance of psychosocial factors in cardiology: update 2013. Ger Med Sci 2014;12:Doc09.
- Whalley B, Thompson DR, Taylor RS. Psychological interventions for coronary heart disease: Cochrane systematic review and meta-analysis. Int J Behav Med 2014;21:109-21.
- Huffman JC, Niazi SK, Rundell JR, et al. Essential articles on collaborative care models for the treatment of psychiatric disorders in medical settings: a publication by the academy of psychosomatic medicine research and evidence-based practice committee. Psychosomatics 2014b;55:109-22.
- Stewart JC, Perkins AJ, Callahan CM. Effect of collaborative care for depression on risk of cardiovascular events: data from the IMPACT randomized controlled trial. Psychosom Med. 2014;76:29–37.
- Glozier N, Christensen H, Naismith S, et al. Internet-delivered cognitive behavioural therapy for adults with mild to moderate depression and high cardiovascular disease risks: a randomized attention-controlled trial. PLoS One 2013;8:e59139.
- Rutledge T, Redwine LS, Linke SE, et al. A meta-analysis of mental health treatments and cardiac rehabilitation for improving clinical outcomes and depression among patients with coronary heart disease. Psychosom Med 2013;75:335-49.
- Blumenthal JA, Sherwood A, Babyak MA, et al. Exercise and pharmacological treatment of depressive symptoms in patients with coronary heart disease: results from the UPBEAT (Understanding the Prognostic Benefits of Exercise and Antidepressant Therapy) study. J Am Coll Cardiol 2012;60:1053-63.
- Lie I, Arnesen H, Sandvik L, et al. Effects of a home-based intervention program on anxiety and depression 6 months after coronary artery bypass grafting: a randomized controlled trial. J Psychosom Res 2007;62:411-8.
- Page T, Lockwood C, Conroy-Hiller T. Effectiveness of nurse-led cardiac clinics in adult patients with a diagnosis of coronary heart disease. Int J Evid Based Healthcare 2005;3:2-26.
- Bishop GD, Kaur D, Tan VL, et al. Effects of a psychosocial skills training workshop on psychophysiological and psychosocial risk in patients undergoing coronary artery bypass grafting. Am Heart J 2005;150:602-9.
- Theorell T, Emdad R, Arnetz B, et al. Employee effects of an educational program for managers at an insurance company. Psychosom Med. 2001;63:724–733.
- Gezondheidsraad (2017a). Physical activity and risk of chronic diseases. Background document to the Dutch physical activity guidelines 2017. Den Haag: Gezondheidsraad, 2017; publicatienr. 2017/08B.
- Sattelmair J, Pertman J, Ding EL, et al. Dose response between physical activity and risk of coronary heart disease: a meta-analysis. Circulation 2011;124:789-95.
- Pandey A, Garg S, Khunger M, et al. Dose-response relationship between physical activity and risk of heart failure: a meta-analysis. Circulation 2015;132:1786-94.
- Cornelissen VA, Smart NA. Exercise training for blood pressure: a systematic review and meta-analysis. J Am Heart Assoc 2013;2:e004473.
- Murtagh EM, Nichols L, Mohammed MA, et al. The effect of walking on risk factors for cardiovascular disease: an updated systematic review and meta-analysis of randomised control trials. Prev Med 2015;72:34-43.
- Inder JD, Carlson DJ, Dieberg G, et al. Isometric exercise training for blood pressure management: a systematic review and meta-analysis to optimize benefit. Hypertens Res 2016;39:88-94.
- Gao HL, Gao HX, Sun FM, et al. Effects of walking on body composition in perimenopausal and postmenopausal women: a systematic review and meta-analysis. Menopause 2016;23:928-34.
- Hespanhol Junior LC, Pillay JD, Van Mechelen W, et al. Metaanalyses of the effects of habitual running on indices of health in physically inactive adults. Sports Med 2015;45:1455-68.
- Kuhle CL, Steffen MW, Anderson PJ, et al. Effect of exercise on anthropometric measures and serum lipids in older individuals: a systematic review and meta-analysis. BMJ open 2014;4:e005283.
- Mann S, Beedie C, Balducci S, et al. Changes in insulin sensitivity in response to different modalities of exercise: a review of the evidence. Diabetes Metab Res Rev 2014;30:257-68.
- Lin X, Zhang X, Guo J, et al. Effects of exercise training on cardiorespiratory fitness and biomarkers of cardiometabolic health: a systematic review and meta-analysis of randomized controlled trials. J Am Heart Assoc 2015;4. pii: e002014.
- Weber Buchholz S, Wilbur J, Halloway S, et al. Physical activity intervention studies and their relationship to body composition in healthy women. Kasper CE, Smith BA (editors). Annual review of nursing research. Excercise in health and disease. New York: Springer Publishing Company, 2013:71-142.
- Thorogood A, Mottillo S, Shimony A, et al. Isolated aerobic exercise and weight loss: a systematic review and meta-analysis of randomized controlled trials. Am J Med 2011;124:747-55.
- US Department of Health and Human Services. Phyiscal activity guidelines advisory committee report. Washington: US Department of Health and Human Services, 2008.
- Pan XR, Li GW, Hu YH, et al. Effects of diet and exercise in preventing NIDDM in people with impaired glucose tolerance. The Da Qing IGT and Diabetes Study. Diabetes Care 1997;20:537-44.
- Cloostermans L, Wendel-Vos W, Doornbos G, et al. Independent and combined effects of physical activity and body mass index on the development of type 2 diabetes – a metaanalysis of 9 prospective cohort studies. Int J Behav Nutr Phys Act 2015;12:147.
- Aune D, Norat T, Leitzmann M, et al. Physical activity and the risk of type 2 diabetes: a systematic review and dose-response meta-analysis. Sedentary time and its association with risk for disease incidence, mortality, and hospitalization in adults: a systematic review and metaanalysis. Ann Intern Med 2015;162:123-32.
- Gezondheidsraad. (2017b) Sedentary behaviour and the risk of chronic diseases. Background document to the Dutch physical activity guidelines 2017. Den Haag: Gezondheidsraad, 2017; publicatienr. 2017/08C.
- Ekelund U, Steene-Johannessen J, Brown WJ, et al. Does physical activity attenuate, or even eliminate, the detrimental association of sitting time with mortality? A harmonized meta-analysis of data from more than 1 million men and women. Lancet 2016;388:1302-10.
- Wilmot EG, Edwardson CL, Achana FA, et al. Sedentary time in adults and the association with diabetes, cardiovascular disease and death: systematic review and metaanalysis. Diabetologia 2012;55:2895-905.
- Biswas A, Oh PI, Faulkner GE, et al. Sedentary time and its association with risk for disease incidence, mortality, and hospitalization in adults: a systematic review and metaanalysis. Annals of internal medicine. 2015;162(2):123-32.
- Zhou Y, Zhao H, Peng C. Association of sedentary behavior with the risk of breast cancer in women: update meta-analysis of observational studies. Ann Epidemiol 2015;25:687-97.
- Cong YJ, Gan Y, Sun HL, et al. Association of sedentary behaviour with colon and rectal cancer: a meta-analysis of observational studies. Br J Cancer 2014;110:817-26.
- Zhai L, Zhang Y, Zhang D. Sedentary behaviour and the risk of depression: a meta-analysis. Br J Sports Med 2015;49:705-9.
- Doll R, Peto R, Boreham J, et al. Mortality in relation to smoking: 50 years’ observations on male British doctors. BMJ 2004;328:1519.
- Kiiskinen U, Vartiainen E, Puska P, et al. Long-term cost and life-expectancy consequences of hypertension. J Hypertens 1998;16:1103-12.
- Kotseva K, Wood D, De Bacquer D, et al. EUROASPIRE IV: a European Society of Cardiology survey on the lifestyle, risk factor and therapeutic management of coronary patients from 24 European countries. Eur J Prev Cardiol 2016;23:636-48.
- Hartstichting. Infosheet Roken Ga naar bron: Hartstichting. Infosheet Roken
- Prescott E, Scharling H, Osler M, et al. Importance of light smoking and inhalation habits on risk of myocardial infarction and all cause mortality. A 22 year follow up of 12 149 men and women in the Copenhagen City Heart Study. J Epidemiol Community Health 2002;56:702-6.
- Critchley J, Capewell S. Smoking cessation for the secondary prevention of coronary heart disease. Cochrane Database Syst Rev 2004;1:CD003041.
- Woolf KJ, Zabad MN, Post JM, et al. Effect of nicotine replacement therapy on cardiovascular outcomes after acute coronary syndromes. Am J Cardiol 2012;110:968-70.
- Centers for Disease Control and Prevention. How tobacco smoke causes disease: the biology and behavioural basis for smoking-attributable disease 2010. A Report of the Surgeon General. Ga naar bron: Centers for Disease Control and Prevention. How tobacco smoke causes disease: the biology and behavioural basis for smoking-attributable disease 2010. A Report of the Surgeon General.
- He J, Vupputuri S, Allen K, et al. Passive smoking and the risk of coronary heart disease – a meta-analysis of epidemiologic studies. N Engl J Med 1999;340:920-6.
- Law MR, Morris JK, Wald NJ. Environmental tobacco smoke exposure and ischaemic heart disease: an evaluation of the evidence. BMJ 1997;315:973-80.
- Joseph AM, Norman SM, Ferry LH, et al. The safety of transdermal nicotine as an aid to smoking cessation in patients with cardiac disease. N Engl J Med 1996;335:1792-8.
- Chow CK, Jolly S, Rao-Melacini P, et al. Association of diet, exercise, and smoking modification with risk of early cardiovascular events after acute coronary syndromes. Circulation 2010;121:750-8.
- Stead LF, Bergson G, Lancaster T. Physician advice for smoking cessation. Cochrane Database Syst Rev 2008;2:CD000165.
- Heatherton TF, Kozlowski LT, Frecker RC, et al. The Fagerstrom Test for Nicotine Dependence: a revision of the Fagerstrom Tolerance Questionnaire. Br J Addict 1991;86:1119-27.
- Trimbos. Richtlijn behandeling van tabaksverslaving en stoppen met roken ondersteuning (herziening 2016).
- Gezondheidsraad. Voedingsvezel – Achtergronddocument bij Richtlijnen goede voeding 2015. Den Haag: Gezondheidsraad, 2015; publicatienr. A15/30.
- Gezondheidsraad. Voedingsnormen energie, eiwitten, vetten en verteerbare koolhydraten, 2001.
- Brink L, Postma-Smeets A, Stafleu A, Wolvers D. Richtlijnen Schijf van Vijf. Den Haag: Voedingscentrum, 2015
- Holmes MV, Dale CE, Zuccolo L, et al.; InterAct Consortium. Association between alcohol and cardiovascular disease: Mendelian randomisation analysis based on individualparticipant data. BMJ. 2014 Jul 10;349:g4164.
- Sacks FM, Lichtenstein AH, Wu JHY, et al. Dietary fats and cardiovascular disease: a presidential advisory from the American Heart Association. Circulation 2017;136:18.
- Mensink RP. Effects of saturated fatty acids on serum lipids and lipoproteins: a systematic review and regression analysis. Geneva: World Health Organization, 2016.
- Olde Engberink RHG, Van den Hoek TC, Van Noordenne ND, et al. Use of a single baseline versus multi-year 24-hour urine collections for estimation of long-term sodium intake and associated cardiovascular and renal risk. Circulation 2017 Sep 5;136:917-26.
- European Heart Network. Transforming European food and drink policies for cardiovascular health. Brussels, Belgium: European Heart Network, 2017.
- Astrup A, Dyerberg J, Elwood P, et al. The role of reducing intakes of saturated fat in the prevention of cardiovascular disease: where does the evidence stand in 2010? Am J Clin Nutr 2011;93:684-8.
- EFSA. Scientific Opinion on Dietary Reference Values for fats, including saturated fatty acids, polyunsaturated fatty acids, monounsaturated fatty acids, trans fatty acids, and cholesterol. EFSA Journal 2010;8:1461.
- Li Y et al. Saturated fats compared with unsaturated fats and sources of carbohydrates in relation to risk of coronary heart disease. A prospective cohort study. JACC 2015;66:1538-48.
- Wang X, Ouyang Y, Liu J, et al. Fruit and vegetable consumption and mortality from all causes, cardiovascular disease, and cancer: systematic review and dose-response meta-analysis of prospective cohort studies. Association of specific dietary fats with total and cause-specific mortality. JAMA Intern Med 2016;176:1134-45.
- Wen YT, Dai JH, Gao Q. Effects of omega-3 fatty acid on major cardiovascular events and mortality in patients with coronary heart disease: a meta-analysis of randomized controlled trials. Nutrition, metabolism, and cardiovascular diseases. Nutr Metab Cardiovasc Dis 2014;24:470-5.
- Rizos EC, Ntzani EE, Bika E, et al. Association between omega-3 fatty acid supplementation and risk of major cardiovascular disease events: a systematic review and meta-analysis. JAMA 2012;308:1024-33.
- Kromhout D, Giltay EJ, Geleijnse JM; Alpha Omega Trial Group. n-3 fatty acids and cardiovascular events after myocardial infarction. N Engl J Med 2010;363:2015-26.
- Sijtsma FPC, Soedamah-Muthu SS, De Goed J et al. Healthy eating and lower mortality risk in a large cohort of cardiac patients who received state-of-the art drug treatment. Am J Clin Nutr 2015 Dec;102:1527-33.
- Mozaffarian D, Katan MB, Ascherio A, et al. Trans fatty acids and cardiovascular disease. N Engl J Med 2006;354:1601-13.
- He FJ, Nowson CA, MacGregor GA. Fruit and vegetable consumption and stroke: meta-analysis of cohort studies. Lancet 2006;367:320-6.
- Sacks FM, Svetkey LP, Vollmer WM, et al. Effects on blood pressure of reduced dietary sodium the Dietary Approaches to Stop Hypertension (DASH) diet. DASH-Sodium Collaborative Research Group. N Engl J Med 2001;344:3-10.
- O’Donnell MJ, Yusuf S, Mente A et al. Urinary sodium and potassium excretion and risk of cardiovascular events. JAMA 2011;306:2229-38.
- Aburto NJ, Hanson S, Gutierrez H, et al. Effect of increased potassium intake on cardiovascular risk factors and disease: systematic review and meta-analyses. BMJ 2013;346:f1378.
- Chowdhury R, Stevens S, Gorman D, et al. Association between fish consumption, long chain omega 3 fatty acids, and risk of cerebrovascular disease: systematic review and meta-analysis. BMJ 2012;345:e6698.
- Threapleton DE, Greenwood DC, Evans CE, et al. Dietary fibre intake and risk of cardiovascular disease: systematic review and meta-analysis. BMJ 2013;347:f6879.
- Zhang Z, Xu G, Liu D, et al. Dietary fiber consumption and risk of stroke. Eur J Epidemiol. 2013;28:119–130.
- Yao B, Fang H, XuW, et al. Dietary fiber intake and risk of type 2 diabetes: a dose-response analysis of prospective studies. Eur J Epidemiol 2014;29:79-88.
- Gezondheidsraad. Richtlijn voor de vezelconsumptie, Gezondheidsraad, 2006
- Dauchet L, Amouyel P, Hercberg S, et al. Fruit and vegetable consumption and risk of coronary heart disease: a meta-analysis of cohort studies. J Nutr 2006;136:2588-93.
- Luo C, Zhang Y, Ding Y, et al. Nut consumption and risk of type 2 diabetes, cardiovascular disease, and all-cause mortality: a systematic review and meta-analysis. Am J Clin Nutr 2014;100:256-69.
- Zheng J, Huang T, Yu Y, et al. Fish consumption and CHD mortality: an updated meta-analysis of seventeen cohort studies. Public Health Nutr. 2012;15:725–737.
- Chowdhury R, Kunutsor S, Vitezova A, et al. Vitamin D and risk of cause specific death: systematic review and meta-analysis of observational cohort and randomised intervention studies. BMJ 2014;348:g1903.
- Ronksley PE, Brien SE, Turner BJ, et al. Association of alcohol consumption with selected cardiovascular disease outcomes: a systematic review and meta-analysis. BMJ. 2011;342:d671.
- De Ruyter JC, Olthof MR, Seidell JC, et al. A trial of sugar-free or sugar-sweetened beverages and body weight in children. N Engl J Med 2012;367:1397-406.
- World Health Organization. Guideline: Sugars intake for adults and children. Geneva: World Health Organization, 2015.
- Rogers PJ, Hogenkamp PS, de Graaf C et al. Does low-energy sweetener consumption affect energy intake and body weight? A systematic review, including meta-analyses, of the evidence from human and animal studies. Int J Obes. 2016;40:381-394.
- Gezondheidsraad. Richtlijn Gezonde Voeding, 2015.
- Ras RT, Geleijnse JM, Trautwein EA. LDL-cholesterol-lowering effect of plant sterols and stanols across different dose ranges: a meta-analysis of randomised controlled studies. Br J Nutr 2014;112:214-9.
- Li Y, Jiang L, Jia Z, et al. A meta-analysis of red yeast rice: an effective and relatively safe alternative approach for dyslipidemia. PLoS One. 2014;9(6):e98611.
- EFSA, 2018 website. Geraadpleegd op 14-06-2018. Ga naar bron: EFSA, 2018 website. Geraadpleegd op 14-06-2018.
- Lareb. Red yeast rice – an overview of the reported ADRs. Gepubliceerd op 11 juli 2017. Ga naar bron: Lareb. Red yeast rice – an overview of the reported ADRs. Gepubliceerd op 11 juli 2017.
- Brouwers JR, Roeters van Lennep JE, Maas AH. (‘Rode gist rijst’ als cholesterolverlager? Een waarschuwing is op zijn plaats. Ned Tijdschr Geneeskd 2016;160:D99.
- Catapano AL, Graham I, De Backer G, et al. (2016 ESC/EAS Guidelines for the Management of Dyslipidaemias). Kardiol Pol.2016;74:1234-1318.
- Maki KC, Palacios OM, Bell M, Toth PP. Use of supplemental long-chain omega-3 fatty acids and risk for cardiac death: an updated meta-analysis and review of research gaps. J Clin Lipidol 2017 Sep - Oct;11:1152-60.
- Aung et al. Associations of omega-3 fatty acid supplement use with cardiovascular disease risks. JAMA Cardiol, 2018: doi:10.1001/jamacardio.2017.5205.
- Sofi F, Abbate R, Gensini GF, et al. Accruing evidence on benefits of adherence to the Mediterranean diet on health: an updated systematic review and meta-analysis. Am J Clin Nutr 2010;92:1189-96.
- Estruch R, Ros E, Salas-Salvado J, et al. Primary prevention of cardiovascular disease with a Mediterranean diet. N Engl J Med. 2013;368:1279-1290.
- Van Rossum CTM, Buurma-Rethans EJM, Fransen HP, et al. Zoutconsumptie van kinderen en volwassenen in Nederland. Resultaten uit de Voedselconsumptiepeiling 2007 tot 2010. Bilthoven: RIVM-rapport 350050007/2012.
- Van Rossum CTM, Buurma EJM, Vennemann, FBC et al. Voedselcomsuptie in 2012 tot 2014 vergeleken met de Richtlijnen geode voeding 2015. Bilthoven: RIVM Briefrapport 2017-0095.
- Hendriksen M. et al. Zout-, jodium- en kaliuminname 2015. Voedingsstatusonderzoek bij volwassenen uit Doetinchem. RIVM Briefrapport 2016-0081.
- Hartstichting, 2016 Ga naar bron: Hartstichting, 2016
- Hartstichting, 2015 Ga naar bron: Hartstichting, 2015
- Poirier P, Alpert MA, Fleisher LA, et al. Cardiovascular evaluation and management of severely obese patients undergoing surgery: a science advisory from the American Heart Association. Circulation 2009;120:86-95.
- Emerging Risk Factors Collaboration, Wormser D, Kaptoge Set al. Separate and combined associations of body-mass index and abdominal adiposity with cardiovascular disease: collaborative analysis of 58 prospective studies. Lancet 2011;377:1085-95.
- Kramer CK, Zinman B, Retnakaran R. Are metabolically healthy overweight and obesity benign conditions? A systematic review and meta-analysis. Ann Intern Med 2013;159:758-69.
- Van der A DL, Nooyens AC, Van Duijnhoven FJ, et al. All-cause mortality risk of metabolically healthy abdominal obese individuals: the EPICMORGEN study. Obesity 2014;22:557-64.
- Bell JA, Hamer M, Sabia S, et al. The natural course of healthy obesity over 20 years. J Am Coll Cardiol 2015;65:101-2.
- Iliodromiti S, Celis-Morales CA, Lyall DM, et al. The impact of confounding on the associations of different adiposity measures with the incidence of cardiovascular disease: a cohort study of 296 535 adults of white European descent. Eur Heart J 2018 May 1;39:1514-20.
- Oreopoulos A, Padwal R, Norris CM, et al. Effect of obesity on short- and long-term mortality postcoronary revascularization: a meta-analysis. Obesity 2008;16:442-50.
- Romero-Corral A, Montori VM, Somers VK, et al. Association of bodyweight with total mortality and with cardiovascular events in coronary artery disease: a systematic review of cohort studies. Lancet 2006;368:666-78.
- Barry VW, Baruth M, Beets MW, et al. Fitness versus fatness on all-cause mortality: a meta-analysis. Prog Cardiovasc Dis 2014;56:382-90.
- Lassale C, Tzoulaki I, Moons KGM, et al. Separate and combined associations of obesity and metabolic health with coronary heart disease: a pan-European case-cohort analysis. Eur Heart J 2017;14.
- Ekelund U, Ward HA, Norat T, et al. Physical activity and all-cause mortality across levels of overall and abdominal adiposity in European men and women: the European Prospective Investigation into Cancer and Nutrition Study (EPIC). Am J Clin Nutr 2015;101:613-21.
- Berrington de Gonzalez A, Hartge P, Cerhan JR, et al. Body-mass index and mortality among 1.46 million white adults. N Engl J Med 2010;363:2211-9.
- Kwok CS, Pradhan A, Khan MA, et al. Bariatric surgery and its impact on cardiovascular disease and mortality: a systematic review and meta-analysis. Int J Cardiol 2014;173:20-8.
- Richtlijn Diagnostiek en behandeling van obesitas bij volwassenen en kinderen (CBO, 2008). Ga naar bron: Richtlijn Diagnostiek en behandeling van obesitas bij volwassenen en kinderen (CBO, 2008).
- Nordestgaard BG, Langsted A, Mora S, et al; European Atherosclerosis Society (EAS) and the European Federation of Clinical Chemistry and Laboratory Medicine (EFLM) joint consensus initiative. Fasting is not routinely required for determination of a lipid profile: clinical and laboratory implications including flagging at desirable concentration cut-points-a joint consensus statement from the European Atherosclerosis Society and European Federation of Clinical Chemistry and Laboratory Medicine. Eur Heart J 2016;37:1944-58.
- Borén J, Chapman MJ, Krauss RM, Packard CJ, Bentzon JF, Binder CJ, et al. Low-density lipoproteins cause atherosclerotic cardiovascular disease: pathophysiological, genetic, and therapeutic insights: a consensus statement from the European Atherosclerosis Society Consensus Panel. Eur Heart J. 2020;41:2313-30.
- Friedewald WT, Levy RI, Fredrickson DS. Estimation of the concentration of low-density lipoprotein cholesterol in plasma, without use of the preparative ultracentrifuge. Clin Chem 1972;18:499-502.
- Chan DK, O’Rourke F, Shen Q, et al. Meta-analysis of the cardiovascular benefits of intensive lipid lowering with statins. Acta Neurol Scand 2011;124:188-95.
- Nußbaumer B, Glechner A, Kaminski-Hartenthaler A, et al. Ezetimibe-Statin Combination Therapy. Dtsch Arztebl Int 2016;113:445-53.
- Schmidt AF, Pearce LS, Wilkins JT, et al. PCSK9 monoclonal antibodies for the primary and secondary prevention of cardiovascular disease. Cochrane Database Syst Rev 2017;4:CD011748.
- Amarenco P, Kim JS, Labreuche J, Charles H, Giroud M, Lee BC, et al; Treat Stroke to Target Investigators. Benefit of Targeting a LDL (Low-Density Lipoprotein) Cholesterol <70 mg/dL During 5 Years After Ischemic Stroke. Stroke. 2020a;51:1231-39.
- Schwartz GG, Steg PG, Szarek M, Bhatt DL, Bittner VA, Diaz R, et al.; ODYSSEY OUTCOMES Committees and Investigators. Alirocumab and Cardiovascular Outcomes after Acute Coronary Syndrome. N Engl J Med. 2018;379:2097-2107.
- Amarenco P, Kim JS, Labreuche J, Charles H, Abtan J, Béjot Y, et al; Treat Stroke to Target Investigators. A Comparison of Two LDL Cholesterol Targets after Ischemic Stroke. N Engl J Med. 2020b;382:9.
- Kearney PM, Blackwell L, Collins R, et al. Efficacy of cholesterol-lowering therapy in 18,686 people with diabetes in 14 randomised trials of statins: a meta-analysis. Lancet 2008;371:117-25.
- Baigent C, Blackwell L, Emberson J, et al. Efficacy and safety of more intensive lowering of LDL cholesterol: a meta-analysis of data from 170,000 participants in 26 randomised trials. Lancet 2010;376:1670-81.
- Ference BA, Ginsberg HN, Graham I, Ray KK, Packard CJ, Bruckert E, et al. Low-density lipoproteins cause atherosclerotic cardiovascular disease. 1. Evidence from genetic, epidemiologic, and clinical studies. A consensus statement from the European Atherosclerosis Society Consensus Panel. Eur Heart J. 2017;38:2459-72.
- Silverman MG, Ference BA, Im K, Wiviott SD, Giugliano RP, Grundy SM, et al. Association Between Lowering LDL-C and Cardiovascular Risk Reduction Among Different Therapeutic Interventions: A Systematic Review and Meta-analysis. JAMA. 2016;316:1289-97.
- Mihaylova B, Emberson J, Blackwell L, et al. The effects of lowering LDL cholesterol with statin therapy in people at low risk of vascular disease: meta-analysis of individual data from 27 randomised trials. Lancet 2012;380:581-90.
- Wei Y, Jin Z, Shen G, et al. Effects of intensive antihypertensive treatment on Chinese hypertensive patients older than 70 years. J Clin Hypertens (Greenwich) 2013;15:420-7.
- Soran H, Adam S, Durrington PN. Are recent statin recommendations to employ fixed doses and abandon targets effective for treatment of hypercholesterolaemia? Investigation based on number needed to treat. Eur J Prev Cardiol. 2017;24:76-83.
- Hong SJ, Lee YJ, Lee SJ, Hong BK, Kang WC, Lee JY, et al; LODESTAR Investigators. Treat-to-Target or High-Intensity Statin in Patients With Coronary Artery Disease: A Randomized Clinical Trial. JAMA. 2023;329:1078-87.
- Furtado RH, Giugliano RP. What Lessons Have We Learned and What Remains to be Clarified for PCSK9 Inhibitors? A Review of FOURIER and ODYSSEY Outcomes Trials. Cardiol Ther. 2020;9:59-73.
- Boekholdt SM, Arsenault BJ, Mora S, et al. Association of LDL cholesterol, non-HDL cholesterol, and apolipoprotein B levels with risk of cardiovascular events among patients treated with statins: a meta-analysis. JAMA 2012;307:1302-9.
- Arsenault BJ, Rana JS, Stroes ES, et al. Beyond low-density lipoprotein cholesterol: respective contributions of non-high-density lipoprotein cholesterol levels, triglycerides, and the total cholesterol/high-density lipoprotein cholesterol ratio to coronary heart disease risk in apparently healthy men and women. J Am Coll Cardiol 2009;55:35-41.
- Van den Berg MJ, Van der Graaf Y, De Borst GJ, et al. Low-density lipoprotein cholesterol, non-high-density lipoprotein cholesterol, triglycerides, and apolipoprotein B and cardiovascular risk in patients with manifest arterial disease. Am J Cardiol 2016;118:804-10.
- Arimura T, Miura S, Ike A, et al. Comparison of the efficacy and safety of statin and statin/ezetimibe therapy after coronary stent implantation in patients with stable angina. J Cardiol. 2012 Aug;60(2):111-8.
- Feldman T, Koren M, Insull W Jr, et al. Treatment of high-risk patients with ezetimibe plus simvastatin co-administration versus simvastatin alone to attain National Cholesterol Education Program Adult Treatment Panel III low-density lipoprotein cholesterol goals. Am J Cardiol. 2004 Jun 15;93(12):1481-6.
- Cannon CP, Blazing MA, Giugliano RP, et al; IMPROVE-IT Investigators. Ezetimibe added to statin therapy after acute coronary syndromes. N Engl J Med 2015;372:2387-97.
- Masuda J, Tanigawa T, Yamada T, et al. Effect of combination therapy of ezetimibe and rosuvastatin on regression of coronary atherosclerosis in patients with coronary artery disease. Int Heart J. 2015 May 13;56(3):278-85.
- West AM, Anderson JD, Meyer CH, et al. The effect of ezetimibe on peripheral arterial atherosclerosis depends upon statin use at baseline. Atherosclerosis 2011 Sep;218:156-62.
- Dagli N, Yavuzkir M, Karaca I. The effects of high dose pravastatin and low dose pravastatin and ezetimibe combination therapy on lipid, glucose metabolism and inflammation. Inflammation 2007 Dec;30:230-5.
- Gaudiani LM, Lewin A, Meneghini L, et al. Efficacy and safety of ezetimibe co-administered with simvastatin in thiazolidinedione-treated type 2 diabetic patients. Diabetes Obes Metab. 2005 Jan;7(1):88-97.
- Meaney A, Ceballos G, Asbun J, et al. The VYtorin on Carotid intima-media thickness and overall arterial rigidity (VYCTOR) study. J Clin Pharmacol. 2009 Jul;49(7):838-47.
- Nakamura T, Hirano M, Kitta Y, et al. A comparison of the efficacy of combined ezetimibe and statin therapy with doubling of statin dose in patients with remnant lipoproteinemia on previous statin therapy. J Cardiol. 2012 Jul;60(1):12-7.
- Colhoun HM, Betteridge DJ, Durrington PN, et al. Primary prevention of cardiovascular disease with atorvastatin in type 2 diabetes in the Collaborative Atorvastatin Diabetes Study (CARDS): multicentre randomised placebocontrolled trial. Lancet 2004;364:685-96.
- Collins R, Armitage J, Parish S, et al. MRC/BHF Heart Protection Study of cholesterol-lowering with simvastatin in 5963 people with diabetes: a randomized placebo-controlled trial. Lancet 2003;361:2005-16.
- Stroes ES, Thompson PD, Corsini A, et al. Statin-associated muscle symptoms: impact on statin therapy – European Atherosclerosis Society Consensus Panel Statement on Assessment, Aetiology and Management. Eur Heart J 2015;36:1012-22.
- Reiner Z, Galic M, Hanzevacki M, et al. (Concomitant use of statins and cytochrome P 450 inhibitors in Croatia). Lijecnicki vjesnik 2005;127:65-8.
- Emberson JR, Kearney PM, Blackwell L, et al. Lack of effect of lowering LDL cholesterol on cancer: meta-analysis of individual data from 175,000 people in 27 randomised trials of statin therapy. PLoS One. 2012;7:e29849.
- Waters DD, Ho JE, DeMicco DA, et al. Predictors of new-onset diabetes in patients treated with atorvastatin: results from 3 large randomized clinical trials. J Am Coll Cardiol 2011;57:1535-45.
- Culver AL, Ockene IS, Balasubramanian R, et al. Statin use and risk of diabetes mellitus in postmenopausal women in the Women’s Health Initiative. Arch Intern Med 2012;172:144-52.
- Sattar N, Preiss D, Murray HM, et al. Statins and risk of incident diabetes: a collaborative meta-analysis of randomised statin trials. Lancet 2010;375:735-42.
- Swerdlow DI, Preiss D, Kuchenbaecker KB, et al. HMG-coenzyme A reductase inhibition, type 2 diabetes, and bodyweight: evidence from genetic analysis and randomised trials. Lancet 2015;385:351-61.
- Sabatine MS, Giugliano RP, Keech AC, et al. Evolocumab and clinical outcomes in patients with cardiovascular disease. N Engl J Med 2017;376:1713-22.
- Boden WE, Probstfield JL, Anderson T, et al. Niacin in patients with low HDL cholesterol levels receiving intensive statin therapy. N Engl J Med 2011;365:2255-67.
- Keech AC, Mitchell P, Summanen PA, et al. Effect of fenofibrate on the need for laser treatment for diabetic retinopathy (FIELD study): a randomized controlled trial. Lancet 2007;370:1687-97.
- Ginsberg HN, Elam MB, Lovato LC, et al. Effects of combination lipid therapy in type 2 diabetes mellitus. N Engl J Med 2010;362:1563-74. Erratum in: N Engl J Med 2010 May 6;362:1748.
- Koren MJ, Sabatine MS, Giugliano RP, et al. Long-term low-density lipoprotein cholesterol-lowering efficacy, persistence, and safety of evolocumab in treatment of hypercholesterolemia: results up to 4 years from the open-label OSLER-1 extension study. Effect of combination therapy of ezetimibe and rosuvastatin on regression of coronary atherosclerosis in patients with coronary artery disease. Int Heart J 2015 May 13;56:278-85.
-
Collier DJ, Poulter NR, Dahlöf B, et al. Impact of atorvastatin among older and younger patients in the Anglo-Scandinavian Cardiac Outcomes Trial Lipid-Lowering Arm. J Hypertens 2011;29:592-9.
- ALLHAT Officers and Coordinators for the ALLHAT Collaborative Research Group. The Antihypertensive and Lipid-Lowering Treatment to Prevent Heart Attack Trial. Major outcomes in moderately hypercholesterolemic, hypertensive patients randomized to pravastatin vs usual care: the Antihypertensive and Lipid-Lowering Treatment to Prevent Heart Attack Trial (ALLHAT-LLT). JAMA 2002;288:2998-3007.
- Shepherd J, Blauw GJ, Murphy MB, et al. PROspective Study of Pravastatin in the Elderly at Risk. Pravastatin in elderly individuals at risk of vascular disease (PROSPER): a randomised controlled trial. Lancet 2002;360:1623-30.
- Teng M, Lin L, Zhao YJ, et al. Statins for primary prevention of cardiovascular disease in elderly patients: systematic review and meta-analysis. Drugs Aging 2015;32:649-61.
- Trompet S, Van Vliet P, De Craen AJ, et al. Pravastatin and cognitive function in the elderly. Results of the PROSPER study. J Neurol 2010;257:85-90.
- Stam-Slob MC, Visseren FL, Wouter Jukema J, et al. Personalized absolute benefit of statin treatment for primary or secondary prevention of vascular disease in individual elderly patients. Clin Res Cardiol 2016. (Epub ahead of print).
- Cannon CP, Blazing MA, Giugliano RP, et al. Ezetimibe added to statin therapy after acute coronary syndromes. N Engl J Med. 2015;372:2387–2397.
- Lim SS, Vos T, Flaxman AD, Danaei G, Shibuya K, Adair-Rohani H, et al. A comparative risk assessment of burden of disease and injury attributable to 67 risk factors and risk factor clusters in 21 regions, 1990-2010: a systematic analysis for the Global Burden of Disease Study 2010. Lancet. 2012;380:2224-60.
- Kannel WB, Gordon T, Schwartz MJ. Systolic versus diastolic blood pressure and risk of coronary heart disease. The Framingham study. Am J Cardiol. 1971;27:335-46.
- Stamler J, Stamler R, Neaton JD. Blood pressure, systolic and diastolic, and cardiovascular risks. US population data. Arch Intern Med 1993;153:598-615.
- Neaton JD, Blackburn H, Jacobs D, et al. Serum cholesterol level and mortality findings for men screened in the Multiple Risk Factor Intervention Trial. Multiple Risk Factor Intervention Trial Research Group. Arch Intern Med 1992;152:1490-1500.
- Benetos A, Thomas F, Bean K, et al. Prognostic value of systolic and diastolic blood pressure in treated hypertensive men. Arch Intern Med 2002;162:577-81.
- Lloyd-Jones DM, Evans JC, Larson MG, O'Donnell CJ, Levy D. Differential impact of systolic and diastolic blood pressure level on JNC-VI staging. Joint National Committee on Prevention, Detection, Evaluation, and Treatment of High Blood Pressure. Hypertension. 1999;34:381-5.
- Koek HL, Grobbee DE, Bots ML. Trends in cardiovasculaire ziekte en sterfte in Nederland, 1980 tot 2000. Ned Tijdschr Geneeskd 2004;148:27-32.
- Blood Pressure Lowering Treatment Trialists' Collaboration (BPLTT)a. Pharmacological blood pressure lowering for primary and secondary prevention of cardiovascular disease across different levels of blood pressure: an individual participant-level data meta-analysis. Lancet. 2021a;397:1625-36.
- Blood Pressure Lowering Treatment Trialists' Collaboration (BPLTT)b. Age-stratified and blood-pressure-stratified effects of blood-pressure-lowering pharmacotherapy for the prevention of cardiovascular disease and death: an individual participant-level data meta-analysis. Lancet. 2021b;398:1053-64.
- Law MR, Morris JK, Wald NJ. Use of blood pressure lowering drugs in the prevention of cardiovascular disease: meta-analysis of 147 randomised trials in the context of expectations from prospective epidemiological studies. BMJ 2009;338:b1665.
- Williams B, Mancia G, Spiering W, Agabiti Rosei E, Azizi M, Burnier M, et al.; ESC Scientific Document Group. 2018 ESC/ESH Guidelines for the management of arterial hypertension. Eur Heart J. 2018;39:3021-3104.
- Fox CS, Larson MG, Leip EP, Culleton B, Wilson PW, Levy D. Predictors of new-onset kidney disease in a community-based population. JAMA. 2004;291:844-50.
- Obermayr RP, Temml C, Knechtelsdorfer M, Gutjahr G, Kletzmayr J, Heiss S, et al. Predictors of new-onset decline in kidney function in a general middle-european population. Nephrol Dial Transplant. 2008;23:1265-73.
- Levy D, Larson MG, Vasan RS, Kannel WB, Ho KK. The progression from hypertension to congestive heart failure. JAMA. 1996;275:1557-62.
- Aune D, Mahamat-Saleh Y, Kobeissi E, Feng T, Heath AK, Janszky I. Blood pressure, hypertension and the risk of atrial fibrillation: a systematic review and meta-analysis of cohort studies. Eur J Epidemiol. 2023;38:145-78.
- Wong TY, Mitchell P. Hypertensive retinopathy. N Engl J Med. 2004;351:2310-7.
- Kennelly SP, Lawlor BA, Kenny RA. Blood pressure and dementia - a comprehensive review. Ther Adv Neurol Disord. 2009;2:241-60.
- SPS3 Study Group, Benavente OR, Coffey CS, Conwit R, Hart RG, McClure LA, Pearce LA, et al. Blood-pressure targets in patients with recent lacunar stroke: the SPS3 randomised trial. Lancet. 2013;382:507-15.
- Bos MJ, Buis S. Thirty-minute office blood pressure monitoring in primary care. Ann Fam Med 2017;15:120-3.
- Scherpbier-de Haan N, Van der Wel M, Schoenmakers G, et al. Thirty-minute compared to standardised office blood pressure measurement in general practice. Br J Gen Pract 2011;61:e590-7.
- Van der Wel MC, Buunk IE, Van Weel C, et al. A novel approach to office blood pressure measurement: 30-minute office blood pressure versus daytime ambulatory blood pressure. Ann Fam Med 2011;9:128-35.
- Culleton BF, McKay DW, Campbell NR. Performance of the automated BpTRU measurement device in the assessment of white-coat hypertension and white-coat effect. Blood Press Monit 2006;11:37-42.
- Myers MG, Godwin M, Dawes M, et al. Conventional versus automated measurement of blood pressure in the office (CAMBO) trial. Fam Pract 2012 Aug;29:376-82.
- Whelton PK, Carey RM, Aronow WS, et al 2017 ACC/AHA/AAPA/ABC/ACPM/AGS/APhA/ASH/ASPC/NMA/PCNA Guideline for the prevention, detection, evaluation, and management of high blood pressure in adults: a report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines. J Am Coll Cardiol 2017;pii:S0735-1097(17)41519-1.
- ESH/ESC Task Force for the Management of Arterial Hypertension. 2013 Practice guidelines for the management of arterial hypertension of the European Society of Hypertension (ESH) and the European Society of Cardiology (ESC): ESH/ESC Task Force for the Management of Arterial Hypertension. J Hypertens 2013;31:1925-38.
- Rimoldi SF, Scherrer U, Messerli FH. Secondary arterial hypertension: when, who, and how to screen? Eur Heart J 2014;35:1245-54.
- SPRINT Research Group. A randomized trial of intensive versus standard bloodpressure control. N Engl J Med 2015;373:2103-16.
- ACCORD Study Group; Cushman WC, Evans GW, Byington RP, Goff DC Jr, Grimm RH Jr, Cutler JA, et al. Effects of intensive blood-pressure control in type 2 diabetes mellitus. N Engl J Med. 2010;362:1575-85.
- Arguedas JA, Leiva V, Wright JM. Blood pressure targets in adults with hypertension. Cochrane Database Syst Rev. 2020;12:CD004349.
- Zhang W, Zhang S, Deng Y, Wu S, Ren J, Sun G, et al.; STEP Study Group. Trial of Intensive Blood-Pressure Control in Older Patients with Hypertension. N Engl J Med. 2021;385:1268-79.
- SPRINT group, Lewis CE, Fine LJ, Beddhu S, Cheung AK, Cushman WC, Cutler JA, et al. Final report of a trial of intensive versus standard blood-pressure control. New England Journal of Medicine. 2021;384:1921-30.
- Cardio-Sis, Verdecchia P, Staessen JA, Angeli F, de Simone G, Achilli A, et al; Cardio-Sis investigators. Usual versus tight control of systolic blood pressure in non-diabetic patients with hypertension (Cardio-Sis): an open-label randomised trial. Lancet. 2009;374:525-33.
- Verberk WJ, Kroon AA, Lenders JW, Kessels AG, van Montfrans GA, Smit AJ, et al.; Home Versus Office Measurement, Reduction of Unnecessary Treatment Study Investigators. Self-measurement of blood pressure at home reduces the need for antihypertensive drugs: a randomized, controlled trial. Hypertension. 2007;50:1019-25.
- van der Wel MC, Buunk IE, van Weel C, Thien TA, Bakx JC. A novel approach to office blood pressure measurement: 30-minute office blood pressure vs daytime ambulatory blood pressure. Ann Fam Med. 2011;9:128-35.
- Filipovský J, Seidlerová J, Kratochvíl Z, Karnosová P, Hronová M, Mayer O Jr. Automated compared to manual office blood pressure and to home blood pressure in hypertensive patients. Blood Press. 2016;25:228-34.
- Forette F, Seux ML, Staessen JA, et al. Prevention of dementia in randomised double-blind placebo-controlled Systolic Hypertension in Europe (Syst-Eur) trial. Lancet 1998;352:1347-51.
- Beckett NS, Peters R, Fletcher AE, et al. Treatment of hypertension in patients 80 years of age or older. N Engl J Med 2008;358:1887-98.
- Peters R, Beckett N, Forette F, et al. Incident dementia and blood pressure lowering in the Hypertension in the Very Elderly Trial cognitive function assessment (HYVET-COG): a double-blind, placebo-controlled trial. Lancet neurol 2008;7:683-9.
- Staessen JA, Fagard R, Thijs L, et al. Subgroup and per-protocol analysis of the randomized European Trial on Isolated Systolic Hypertension in the Elderly. Arch Intern Med. 1998;158(15):1681-91.
- Warwick J, Falaschetti E, Rockwood K, Mitnitski A, Thijs L, Beckett N, et al. No evidence that frailty modifies the positive impact of antihypertensive treatment in very elderly people: an investigation of the impact of frailty upon treatment effect in the HYpertension in the Very Elderly Trial (HYVET) study, a double-blind, placebo-controlled study of antihypertensives in people with hypertension aged 80 and over. BMC Med. 2015;13:78.
- Ogihara T, Saruta T, Rakugi H, et al. Target blood pressure for treatment of isolated systolic hypertension in the elderly: valsartan in elderly isolated systolic hypertension study. Hypertension 2010;56:196-202.
- Van Bemmel T, Gussekloo J, Westendorp RG, et al. In a population-based prospective study, no association between high blood pressure and mortality after age 85 years. J Hypertens 2006;24:287-92.
- Muller M, Jochemsen HM, Visseren FL, et al; SMART-study group. Low blood pressure and antihypertensive treatment are independently associated with physical and mental health status in patients with arterial disease: the SMART study. J Intern Med 2013;274:241-51.
- Muller M, Smulders YM, De Leeuw PW, et al. Treatment of hypertension in the oldest old: a critical role for frailty? Hypertension 2014;63:433-41.
- Sabayan B, Oleksik AM, Maier AB, et al. High blood pressure and resilience to physical and cognitive decline in the oldest old: the Leiden 85-plus Study. J Am Geriatr Soc. 2012;60(11):2014-9.
- Post Hospers G, Smulders YM, Maier AB, et al. Relation between blood pressure and mortality risk in an older population: role of chronological and biological age. High blood pressure and resilience to physical and cognitive decline in the oldest old: the Leiden 85-plus Study. J Am Geriatr Soc 2012;60:2014-9.
- McEvoy JW, Chen Y, Rawlings A, et al. Diastolic blood pressure, subclinical myocardial damage, and cardiac events: implications for blood pressure control. J Am Coll Cardiol 2016;68:1713-22.
- Messerli FH, Mancia G, Conti CR, et al. Dogma disputed: can aggressively lowering blood pressure in hypertensive patients with coronary artery disease be dangerous? Ann Intern Med 2006;144:884-93.
- Franklin SS, Gokhale SS, Chow VH, Larson MG, Levy D, Vasan RS, et al. Does low diastolic blood pressure contribute to the risk of recurrent hypertensive cardiovascular disease events? The Framingham Heart Study. Hypertension. 2015;65:299-305.
- Kalkman DN, Brouwer TF, Vehmeijer JT, Berger WR, Knops RE, de Winter RJ, et al. J Curve in Patients Randomly Assigned to Different Systolic Blood Pressure Targets: An Experimental Approach to an Observational Paradigm. Circulation. 2017;136:2220-29.
- Casteleijn FM, Golyardi B. Is telemonitoring van hypertensie de toekomst? Huisarts Wet 2022;65.
- Saruta T, Ogihara T, Saito I, et al. Comparison of olmesartan combined with a calcium channel blocker or a diuretic in elderly hypertensive patients (COLM Study): safety and tolerability. Hypertens Res. 2015;38(2):132-6.
- Ogihara T, Saruta T, Rakugi H, et al. Combinations of olmesartan and a calcium channel blocker or a diuretic in elderly hypertensive patients: a randomized, controlled trial. J Hypertens. 2014;32(10):2054-63; discussion 2063.
- Wing LMH, Reid CM, Ryan P, et al. A comparison of outcomes with angiotensin-converting-enzyme inhibitors and diuretics for hypertension in the elderly. N Engl J Med 2003;348:583-92.
- Benetos A, Consoli S, Safavian A, et al. Efficacy, safety, and effects on quality of life of bisoprolol/hydrochlorothiazide versus amlodipine in elderly patients with systolic hypertension. Am Heart J 2000;140:E11.
- Cowley AJ, Wiens BL, Segal R, et al. Randomised comparison of losartan vs. captopril on quality of life in elderly patients with symptomatic heart failure: the losartan heart failure ELITE quality of life substudy. Qual Life Res. 2000;9(4):377-84.
- Canney M, O’Connell MD, Murphy CM, et al. Single agent antihypertensive therapy and orthostatic blood pressure behaviour in older adults using beat-to-beat measurements: the Irish Longitudinal Study on Ageing. PLoS One 2016;11:e0146156.
- Moonen JE, Foster-Dingley JC, De Ruijter W, et al. Effect of Discontinuation of Antihypertensive Treatment in Elderly People on Cognitive Functioning – the DANTE Study Leiden: a randomized clinical trial. JAMA Intern Med 2015;175(10):1622-30.
- Huang L, Trieu K, Yoshimura S, Neal B, Woodward M, Campbell NRC, et al. Effect of dose and duration of reduction in dietary sodium on blood pressure levels: systematic review and meta-analysis of randomized trials. BMJ. 2020;368:m315.
- Slagman MC, Waanders F, Hemmelder MH, Woittiez AJ, Janssen WM, Lambers Heerspink HJ, et al; HOlland NEphrology STudy Group. Moderate dietary sodium restriction added to angiotensin converting enzyme inhibition compared with dual blockade in lowering proteinuria and blood pressure: randomised controlled trial. BMJ. 2011;343:d4366.
- Luft FC, Weinberger MH. Review of salt restriction and the response to antihypertensive drugs. Satellite symposium on calcium antagonists. Hypertension. 1988;11:I229-32.
- Cook NR, Appel LJ, Whelton PK. Sodium Intake and All-Cause Mortality Over 20 Years in the Trials of Hypertension Prevention. J Am Coll Cardiol. 2016 Oct 11;68(15):1609-1617.
- Neal B, Wu Y, Feng X, Zhang R, Zhang Y, Shi J, et al. Effect of Salt Substitution on Cardiovascular Events and Death. N Engl J Med. 2021;385:1067-77.
- Temme EHM, Hendriksen MAH, Milder IEJ, Toxopeus IB, Westenbrink S, Brants HAM, et al. Salt Reductions in Some Foods in The Netherlands: Monitoring of Food Composition and Salt Intake. Nutrients. 2017;9:791.
- Zanchetti A, Mancia G. Longing for clinical excellence: a critical outlook into the NICE recommendations on hypertension management – is nice always good? J Hypertens 2012;30:660-8.
- Ettehad D, Emdin CA, Kiran A, et al. Blood pressure lowering for prevention of cardiovascular disease and death: a systematic review and meta-analysis. Lancet 2016 Mar 5;387:957-67.
- Turnbull F, Neal B, Ninomiya T, et al. Effects of different regimens to lower blood pressure on major cardiovascular events in older and younger adults: meta-analysis of randomised trials. BMJ 2008;336:1121-3.
- Wald DS, Law M, Morris JK, et al. Combination therapy versus monotherapy in reducing blood pressure: meta-analysis on 11,000 participants from 42 trials. Am J Med 2009;122:290-300.
- Dahlöf B, Sever PS, Poulter NR, Wedel H, Beevers DG, Caulfield M, et al; ASCOT Investigators. Prevention of cardiovascular events with an antihypertensive regimen of amlodipine adding perindopril as required versus atenolol adding bendroflumethiazide as required, in the Anglo-Scandinavian Cardiac Outcomes Trial-Blood Pressure Lowering Arm (ASCOT-BPLA): a multicentre randomised controlled trial. Lancet. 2005;366:895-906.
- Yusuf S, Teo KK, Pogue J, et al. Telmisartan, ramipril, or both in patients at high risk for vascular events. N Engl J Med 2008;358:1547-59.
- Jamerson K, Weber MA, Bakris GL, Dahlöf B, Pitt B, Shi V, et al; ACCOMPLISH Trial Investigators. Benazepril plus amlodipine or hydrochlorothiazide for hypertension in high-risk patients. N Engl J Med. 2008;359:2417-28.
- Ojji DB, Mayosi B, Francis V, Badri M, Cornelius V, Smythe W, et al; CREOLE Study Investigators. Comparison of Dual Therapies for Lowering Blood Pressure in Black Africans. N Engl J Med. 2019;380:2429-39.
- Achelrod D, Wenzel U, Frey S. Systematic review and meta-analysis of the prevalence of resistant hypertension in treated hypertensive populations. Am J Hypertens. 2015;28:355-61.
- Daugherty SL, Powers JD, Magid DJ, et al. Incidence and prognosis of resistant hypertension in hypertensive patients. Circulation 2012;125:1635-42.
- Durand H, Hayes P, Morrissey EC, Newell J, Casey M, Murphy AW, et al. Medication adherence among patients with apparent treatment-resistant hypertension: systematic review and meta-analysis. J Hypertens. 2017;35:2346-57.
- de la Sierra A, Segura J, Banegas JR, Gorostidi M, de la Cruz JJ, Armario P, et al. Clinical features of 8295 patients with resistant hypertension classified on the basis of ambulatory blood pressure monitoring. Hypertension. 2011;57:898-902.
- Simpson SH, Eurich DT, Majumdar SR, et al. A meta-analysis of the association between adherence to drug therapy and mortality. BMJ. 2006;333:15.
- Ho PM, Bryson CL, Rumsfeld JS. Medication adherence: its importance in cardiovascular outcomes. Circulation 2009;119:3028-3035.
- Osterberg L, Blaschke T. Adherence to medication. N Engl J Med 2005;353:487-97.
- Doshi JA, Zhu J, Lee BY, et al. Impact of a prescription copayment increase on lipid-lowering medication adherence in veterans. Circulation 2009;119:390-7.
- Gehi A, Haas D, Pipkin S, et al. Depression and medication adherence in outpatients with coronary heart disease: findings from the Heart and Soul Study. Arch Intern Med 2005;165:2508-13.
- Tarn DM, Heritage J, Paterniti DA, et al. Physician communication when prescribing new medications. Arch Intern Med 2006;166:1855-62.
- Kleppe M, Lacroix J, Ham J, et al. ‘A necessary evil’: associations with taking medication and their relationship with medication adherence. Psychol Health Med 2017;22:1217-23.
- Kripalani S, Yao X, Haynes RB. Interventions to enhance medication adherence in chronic medical conditions: a systematic review. The polypill in the prevention of cardiovascular diseases: key concepts, current status, challenges, and future directions. Circulation 2010;122:2078-88.
- Santschi V, Chiolero A, Burnand B, et al. Impact of pharmacist care in the management of cardiovascular disease risk factors: a systematic review and meta-analysis of randomized trials. Arch Intern Med. 2011;171:1441-1453.
- Stewart S, Hart CL, Hole DJ, et al. Population prevalence, incidence, and predictors of atrial fibrillation in the Renfrew/Paisley study. Heart 2001;86:516-21.
- Rienstra M, Hobbelt AH, Alings M, et al. Targeted therapy of underlying conditions improves sinus rhythm maintenance in patients with persistent atrial fibrillation: results of the RACE 3 trial. Eur Heart J 2018 Aug 21;39:2987-96.
- Nyrnes A, Mathiesen EB, Njolstad I, et al. Palpitations are predictive of future atrial fibrillation. An 11-year follow-up of 22,815 men and women: the Tromso Study. Eur J Prev Cardiol 2013;20:729-36.
- Lowres N, Neubeck L, Freedman SB, et al. Lifestyle risk reduction interventions in atrial fibrillation: a systematic review. Hypertension and atrial fibrillation: diagnostic approach, prevention and treatment. Position paper of the Working Group ‘Hypertension Arrhythmias and Thrombosis’ of the European Society of Hypertension. J Hypertens 2012;30:239-52.
- Manolis AJ, Rosei EA, Coca A, et al. Hypertension and atrial fibrillation: diagnostic approach, prevention and treatment. Position paper of the Working Group Hypertension Arrhythmias and Thrombosis of the European Society of Hypertension. J Hypertens. 2012;30:239-252.
- Kirchhof P, et al. ESC Guidelines for the management of atrial fibrillation developed in collaboration with EACTS. Eur Heart J 2016;37:2893-62.
- Task Force on the management of ST-segment elevation acute myocardial infarction of the European Society of Cardiology (ESC), Steg PG, James SK, Atar D, et al. ESC Guidelines for the management of acute myocardial infarction in patients presenting with ST-segment elevation. Eur Heart J 2012 Oct;33:2569-619.
- Hamm CW, Bassand JP, Agewall S, et al; ESC Committee for Practice Guidelines. ESC Guidelines for the management of acute coronary syndromes in patients presenting without persistent ST-segment elevation: the Task Force for the management of acute coronary syndromes (ACS) in patients presenting without persistent ST-segment elevation of the European Society of Cardiology (ESC). Eur Heart J 2011 Dec;32:2999-3054.
- Task Force Members, Montalescot G, Sechtem U, Achenbach S; ESC Committee for Practice Guidelines; Document Reviewers, et al. 2013 ESC Guidelines on the management of stable coronary artery disease: the Task Force on the management of stable coronary artery disease of the European Society of Cardiology. Eur Heart J 2013 Oct;34:2949-3003.
- Roffi M, Patrono C, Collet JP, Mueller C, Valgimigli M, Andreotti F, Bax JJ, Borger MA, Brotons C, Chew DP, Gencer B, Hasenfuss G, Kjeldsen K, Lancellotti P, Landmesser U, Mehilli J, Mukherjee D, Storey RF, Windecker S; ESC Scientific Document Group . 2015 ESC Guidelines for the management of acute coronary syndromes in patients presenting without persistent ST-segment elevation: Task Force for the Management of Acute Coronary Syndromes in Patients Presenting without Persistent ST-Segment Elevation of the European Society of Cardiology (ESC). Eur Heart J. 2016 Jan 14;37(3):267-315.
- Zipes DP, Camm AJ, Borggrefe M, et al; American College of Cardiology/American Heart Association Task Force; European Society of Cardiology Committee for Practice Guidelines; European Heart Rhythm Association and the Heart Rhythm Society. ACC/AHA/ESC 2006 guidelines for management of patients with ventricular arrhythmias and the prevention of sudden cardiac death – executive summary: a report of the American College of Cardiology/American Heart Association Task Force and the European Society of Cardiology Committee for Practice Guidelines (Writing Committee to Develop Guidelines for Management of Patients with Ventricular Arrhythmias and the Prevention of Sudden Cardiac Death) Developed in collaboration with the European Heart Rhythm Association and the Heart Rhythm Society. Eur Heart J 2006 Sep;27:2099-140.
- Kolh P, Windecker S, Alfonso et al.; European Society of Cardiology Committee for Practice Guidelines; Task Force on Myocardial Revascularization of the European Society of Cardiology and the European Association for Cardio-Thoracic Surgery; European Association of Percutaneous Cardiovascular Interventions. 2014 ESC/EACTS Guidelines on myocardial revascularization: the Task Force on Myocardial Revascularization of the European Society of Cardiology (ESC) and the European Association for Cardio-Thoracic Surgery (EACTS). Developed with the special contribution of the European Association of Percutaneous Cardiovascular Interventions (EAPCI). Eur J Cardiothorac Surg 2014 Oct;46:517-92.
- European Society of Cardiology (ESC); European Heart Rhythm Association (EHRA), Brignole M, Auricchio A, Baron-Esquivias G, et al. 2013 ESC guidelines on cardiac pacing and cardiac resynchronization therapy: the task force on cardiac pacing and resynchronization therapy of the European Society of Cardiology (ESC). Developed in collaboration with the European Heart Rhythm Association (EHRA). Europace 2013 Aug;15:1070-118.
- Piepoli MF, Corra U, Adamopoulos S, et al. Secondary prevention in the clinical management of patients with cardiovascular diseases. Core components, standards and outcome measures for referral and delivery: a policy statement from the cardiac rehabilitation section of the European Association for Cardiovascular Prevention & Rehabilitation. Endorsed by the Committee for Practice Guidelines of the European Society of Cardiology. Eur J Prev Cardiol 2014;21:664-81.
- Corra U, Piepoli MF, Carre F, et al. Secondary prevention through cardiac rehabilitation: physical activity counselling and exercise training: key components of the position paper from the Cardiac Rehabilitation Section of the European Association of Cardiovascular Prevention and Rehabilitation. Eur Heart J. 2010;31:1967-1974.
- Kotseva K, Wood D, De Backer G, et al. EUROASPIRE III: a survey on the lifestyle, risk factors and use of cardioprotective drug therapies in coronary patients from 22 European countries. Eur J Cardiovasc Prev Rehabil 2009;16:121-37.
- Bjarnason-Wehrens B, McGee H, Zwisler AD, et al. Cardiac rehabilitation in Europe: results from the European Cardiac Rehabilitation Inventory Survey. Eur J Cardiovasc Prev Rehabil 2010;17:410-8.
- Kotseva K, Wood D, De Backer G, et al. Use and effects of cardiac rehabilitation in patients with coronary heart disease: results from the EUROASPIRE III survey. Eur J Prev Cardiol 2013;20:817-26.
- Ponikowski P, Voors AA, Anker SD, et al. ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: the Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC) Developed with the special contribution of the Heart Failure Association (HFA) of the ESC. 2015 ESC Guidelines for the management of acute coronary syndromes in patients presenting without persistent ST-segment elevation: Task Force for the Management of Acute Coronary Syndromes in Patients Presenting without Persistent ST-Segment Elevation of the European Society of Cardiology (ESC). Eur Heart J 2016 Jan 14;37:267-315.
- Jencks SF, Williams MV, Coleman EA. Rehospitalizations among patients in the Medicare fee-for-service program. N Engl J Med 2009;360:1418-28.
- Viswanathan M, Golin CE, Jones CD, et al. Interventions to improve adherence to self-administered medications for chronic diseases in the United States: a systematic review. Ann Intern Med. 2012;157:785-795.
- Piepoli MF, Davos C, Francis DP, et al. Exercise training meta-analysis of trials in patients with chronic heart failure (ExTraMATCH). BMJ 2004;328:189.
- O’Connor CM, Whellan DJ, Lee KL, et al. Efficacy and safety of exercise training in patients with chronic heart failure: HF-ACTION randomized controlled trial. JAMA 2009;301:1439-50.
- Piepoli MF, Guazzi M, Boriani G, et al. Exercise intolerance in chronic heart failure: mechanisms and therapies. Part I. Eur J Cardiovasc Prev Rehab. 2010a;17:637-642.
- Piepoli MF, Guazzi M, Boriani G, et al. Exercise intolerance in chronic heart failure: mechanisms and therapies. Exercise intolerance in chronic heart failure: mechanisms and therapies. Part II. Eur J Cardiovasc Prev Rehab 2010b;17:643-48.
- Conraads VM, Deaton C, Piotrowicz E, et al. Adherence of heart failure patients to exercise: barriers and possible solutions: a position statement of the Study Group on Exercise Training in Heart Failure of the Heart Failure Association of the European Society of Cardiology. Eur J Heart Fail. 2012;14:451-458.
- Mezzani A, Hamm LF, Jones AM, et al. Aerobic exercise intensity assessment and prescription in cardiac rehabilitation: a joint position statement of the European Association for Cardiovascular Prevention and Rehabilitation, the American Association of Cardiovascular and Pulmonary Rehabilitation and the Canadian Association of Cardiac Rehabilitation. Eur J Prev Cardiol 2013;20:442-467.
- Haykowsky MJ, Timmons MP, Kruger C, et al. Meta-analysis of aerobic interval training on exercise capacity and systolic function in patients with heart failure and reduced ejection fractions. Am J Cardiol 2013;111:1466-9.
- Wisloff U, Stoylen A, Loennechen JP, et al. Superior cardiovascular effect of aerobic interval training versus moderate continuous training in heart failure patients: a randomized study. Circulation 2007;115:3086-94.
- Piepoli MF, Conraads V, Corra U, et al. Exercise training in heart failure: from theory to practice. A consensus document of the Heart Failure Association and the European Association for Cardiovascular Prevention and Rehabilitation. Eur J Heart Fail 2011;13:347-57.
- Mohan KM, Wolfe CD, Rudd AG, et al. Risk and cumulative risk of stroke recurrence: a systematic review and meta-analysis. Stroke. 2011;42(5):1489-94.
- Van Wijk I, Kappelle LJ, Van Gijn J, et al. Long-term survival and vascular event risk after transient ischaemic attack or minor ischaemic stroke: A cohort study. Lancet 2005;365:2098-104.
- Johnston SC, Rothwell PM, Nguyen-Huynh MN, et al. Validation and refinement of scores to predict very early stroke risk after transient ischaemic attack. Lancet 2007;369:283-92.
- Lennon O, Galvin R, Smith K, et al. Lifestyle interventions for secondary disease prevention in stroke and transient ischaemic attack: a systematic review. Eur J Prev Cardiol 2014;21:1026-39.
- Collins R, Armitage J, Parish S, et al. Heart Protection Study Collaborative Group. Effects of cholesterol-lowering with simvastatin on stroke and other major vascular events in 20,536 people with cerebrovascular disease or other high-risk conditions. Lancet 2004;363:757-67.
- Amarenco P, Bogousslavsky J, Callahan A 3rd, et al. High-dose atorvastatin after stroke or transient ischemic attack. N Engl J Med 2006;355:549-59.
- Hackam DG, Woodward M, Newby LK, et al. Statins and intracerebral hemorrhage: collaborative systematic review and meta-analysis. Circulation 2011;124:2233-42.
- Kernan WN, Ovbiagele B, Black HR, et al. Guidelines for the prevention of stroke in patients with stroke and transient ischemic attack: a guideline for healthcare professionals from the American Heart Association/American Stroke Association. Stroke 2014;45:2160-236.
- PROGRESS Collaborative Group. Randomised trial of a perindopril-based blood-pressure-lowering regimen among 6,105 individuals with previous stroke or transient ischaemic attack. Lancet 2001;358:1033-41.
- Arima H, Chalmers J, Woodward M, et al. Lower target blood pressures are safe and effective for the prevention of recurrent stroke: the PROGRESS trial. J Hypertens 2006;24:1201-8.
- Arima H, Anderson C, Omae T, et al. Degree of blood pressure reduction and recurrent stroke: the PROGRESS trial. J Neurol Neurosurg Psychiatry 2014;85:1284-5.
- ESPRIT Study Group, Halkes PH, Van Gijn J, et al. Aspirin plus dipyridamole versus aspirin alone after cerebral ischaemia of arterial origin (ESPRIT): randomised controlled trial. Lancet 2006;367:1665-73.
- Sacco RL, Diener HC, Yusuf S, et al. Aspirin and extended-release dipyridamole versus clopidogrel for recurrent stroke. N Engl J Med 2008;359:1238-51.
- Banerjee A. A review of family history of cardiovascular disease: risk factor and research tool. Int J Clin Pract 2012;66:536-43.
- Emerging Risk Factors Collaboration, Di Angelantonio E, Sarwar N, et al. Major lipids, apolipoproteins, and risk of vascular disease. JAMA 2009;302:1993-2000.
- Wilson PW, Pencina M, Jacques P, et al. C-reactive protein and reclassification of cardiovascular risk in the Framingham Heart Study. Circ Cardiovasc Qual Outcomes 2008;1:92-97.
- Ioannidis JP. Prediction of cardiovascular disease outcomes and established cardiovascular risk factors by genome-wide association markers. Circ Cardiovasc Genet. 2009;2:7-15.
- CAPRIE Steering Committee. A randomised, blinded trial of clopidogrel versus aspirin in patients at risk of ischaemic events (CAPRIE). CAPRIE Steering Committee. Lancet 1996 Nov 16;348:1329-39.
- Baigent C, Blackwell L, Collins R, et al. Aspirin in the primary and secondary prevention of vascular disease: collaborative meta-analysis of individual participant data from randomised trials. Lancet 2009;373:1849-60.
- Ikeda Y, Shimada K, Teramoto T, et al. Low-dose aspirin for primary. JAMA 2014;312: 2510-20.
- Bhatt DL, Fox KA, Hacke W, et al. Clopidogrel and aspirin versus aspirin alone for the prevention of atherothrombotic events. N Engl J Med 2006;354:1706-17.
- Silagy CA, McNeil JJ, Donnan GA, et al. Adverse effects of low-dose aspirin in a healthy elderly population. Clin Pharmacol Ther. 1993;54(1):84-9.
- Sivenius J, Cunha L, Diener HC, Foet al. Second European Stroke Prevention Study: antiplatelet therapy is effective regardless of age. ESPS2 Working Group. Acta Neurol Scand. 1999;99(1):54-60.
- Jorgensen T, Capewell S, Prescott E, et al. Population-level changes to promote cardiovascular health. Eur J Prev Cardiol 2013;20:409-21.
- National Institute for Health and Care Excellence. Prevention of cardiovascular disease at the population level. London: National Institute for Health and Care Excellence, 2010.
- Capewell S, O’Flaherty M. Rapid mortality falls after risk-factor changes in populations. Lancet 2011;378:752-3
- EU platform on diet, physical activity and health. European Union, 2005. Ga naar bron: EU platform on diet, physical activity and health. European Union, 2005.
- Hawkes C, Smith TG, Jewell J, et al. Smart food policies for obesity prevention. Lancet 2015;385:2410-21.
- Bureau Europeén des Unions de Consommateurs. The consumer case for EU legal restrictions on the use of artificial trans-fats in food. Position paper. Brussels: European Union, 2014. Ga naar bron: Bureau Europeén des Unions de Consommateurs. The consumer case for EU legal restrictions on the use of artificial trans-fats in food. Position paper. Brussels: European Union, 2014.
- He FJ, Pombo-Rodrigues S, Macgregor GA. Salt reduction in England from 2003 to 2011: its relationship to blood pressure, stroke and ischaemic heart disease mortality. BMJ Open 2014;4:e004549.
- Hendriksen M. et al. Zout-, jodium- en kaliuminname 2015. Voedingsstatusonderzoek bij volwassenen uit Doetinchem. Association between alcohol and cardiovascular disease: Mendelian randomisation analysis based on individual participant data. BMJ 2014 Jul 10;349:g4164.
- Rijksoverheid. Akkoord verbetering productsamenstelling, 2014 Ga naar bron: Rijksoverheid. Akkoord verbetering productsamenstelling, 2014
- Hoogendoorn MP, Van den Berg M. Rijksinstituut voor Volksgezondheid en Milieu. De waarde van voedselkeuzelogo voor het voedingsbeleid. Advies van de Onafhankelijke Commissie Voedselkeuzelogo. 2016, aangepast in 2017.
- Wanders AJ, Brouwer IA, Siebelink E, et al. Effect of a high intake of conjugated linoleic acid on lipoprotein levels in healthy human subjects. PLoS ONE 2010;5:e9000.
- Collard D, Slot-Heijs J, Dellas V, Van der Poel H. Monitor jongeren op gezond gewicht 2017. Mulier instituut, 2018 Ga naar bron: Collard D, Slot-Heijs J, Dellas V, Van der Poel H. Monitor jongeren op gezond gewicht 2017. Mulier instituut, 2018
- Romon M, Lommez A, Tafflet M, et al. Downward trends in the prevalence of childhood overweight in the setting of 12-year school- and community-based programmes. Public Health Nutrition. 2009;12(10):1735-1742. doi:10.1017/S1368980008004278
- Veerman JL, Van Beeck EF, Barendregt JJ, et al. By how much would limiting TV food advertising reduce childhood obesity? Eur J Public Health 2009;19:365-9.
- Wakefield MA, Loken B, Hornik RC. Use of mass media campaigns to change health behaviour. Lancet 2010;376:1261-71.
- Grunert KG, Wills JM. A review of European research on consumer response to nutrition information on food labels. J Public Health 2007;15:385-99.
- Wilson-van den Hooven et al. Rijksinstituut voor Volksgezondheid en Milieu. Naar een integraal systeem voor productverbetering in Nederland: Advies van de Commissie Criteria Productverbetering, 2018.
- European Heart Network. Diet, physical activity and cardiovascular disease prevention in Europe. Brussels: European Heart Network, 2011.
- Consumentenbond. Consumentenonderzoek voedselkeuzelogo’s, april 2018
- Eyles H, Ni Mhurchu C, Nghiem N, et al. Food pricing strategies, population diets, and non-communicable disease: a systematic review of simulation studies. PLoS Med 2012;9:e1001353.
- Powell LM, Chriqui JF, Khan T, et al. Assessing the potential effectiveness of food and beverage taxes and subsidies for improving public health: a systematic review of prices, demand and body weight outcomes. Obesity Rev 2013;14:110-28.
- World Health Organization. Fiscal policies for diet and prevention of noncommunicable diseases: technical meeting report, 5-6 May 2015, Geneva: WHO, 2016.
- Gezonde School. geraadpleegd juni 2018. Ga naar bron: Gezonde School. geraadpleegd juni 2018.
- Geaney F, Kelly C, Greiner BA, et al. The effectiveness of workplace dietary modification interventions: a systematic review. Prev Med 2013;57:438-47.
- Lollgen H, Bockenhoff A, Knapp G. Physical activity and all-cause mortality: an updated meta-analysis with different intensity categories. Int J Sports Med 2009;30:213-24.
- American College of Sports Medicine. ACSM’s guidelines for exercise testing and prescription. 9th ed. Baltimore: Wolters Kluwer/Lippincott, 2014.
- Global Advocacy Council for Physical Activity, International Society for Physical Activity and Health. The Toronto Charter for Physical Activity: a global call for action. J Physical Activity Health 2010;7(Suppl 3):S370-85.
- Rijksoverheid. Geraadpleegd juni 2018. Ga naar bron: Rijksoverheid. Geraadpleegd juni 2018.
- Huhman ME, Potter LD, Duke JC, et al. Evaluation of a national physical activity intervention for children: VERB campaign, 2002 to 2004. Am J Prev Med 2007;32:38-43.
- EFSMA Ga naar bron: EFSMA
- Kerr J, Eves F, Carroll D. Six-month observational study of prompted stair climbing. Prev Med 2001;33:422-7.
- Hartstichting. geraadpleegd juni 2018. Ga naar bron: Hartstichting. geraadpleegd juni 2018.
- NISB. Geraadpleegd juni 2018. Ga naar bron: NISB. Geraadpleegd juni 2018.
- Mozaffarian D, Afshin A, Benowitz NL, et al. Population approaches to improve diet, physical activity, and smoking habits: a scientific statement from the American Heart Association. Circulation 2012;126:1514-63.
- Kriemler S, Zahner L, Schindler C, et al. Effect of school based physical activity programme (KISS) on fitness and adiposity in primary schoolchildren: cluster randomised controlled trial. BMJ 2010;340:c785.
- Hillman CH, Pontifex MB, Castelli DM, et al. Effects of the FITKids randomized controlled trial on executive control and brain function. Pediatrics 2014;134:e1063-71.
- Colcombe SJ, Kramer AF, Erickson KI, et al. Cardiovascular fitness, cortical plasticity, and aging. Proc Natl Acad Sci USA 2004;101:3316-21.
- Mendoza JA, Levinger DD, Johnston BD. Pilot evaluation of a walking school bus program in a low-income, urban community. BMC Public Health 2009;9:122.
- Richtlijnen voor bewegingsonderwijs van basisschool tot mbo. Geraadpleegd juni 2018. Ga naar bron: Richtlijnen voor bewegingsonderwijs van basisschool tot mbo. Geraadpleegd juni 2018.
- Leyk D, Rohde U, Hartmann ND, et al. Results of a workplace health campaign: what can be achieved? Dtsch Arztebl Int 2014;111:320-7.
- World Health Organization. Guidelines for implementation. WHO Framework Convention on Tobacco Control. Articles 5.3, 8-14. Geneva: World Health Organization, 2011.
- Iversen B, Jacobsen BK, Lochen ML. Active and passive smoking and the risk of myocardial infarction in 24,968 men and women during 11 year of follow-up: the Tromso Study. Eur J Epidemiol. 2013;28:659-667.
- Arefalk G, Hambraeus K, Lind L, et al. Discontinuation of smokeless tobacco and mortality risk after myocardial infarction. Circulation 2014;130:325-32.
- International Agency for Research on Cancer. Monographs on the evaluation of carcinogenic risks to humans. Volume 100E. Personal Habits and Indoor Combustions. Smokeless Tabacco. 2012 Ga naar bron: International Agency for Research on Cancer. Monographs on the evaluation of carcinogenic risks to humans. Volume 100E. Personal Habits and Indoor Combustions. Smokeless Tabacco. 2012
- Gallefoss F, Holmen T, Grimsrud T, et al. Snus under svangerskap er ikke ufarlig. Tidsskrift for Den norske legeforening. 2012;132:932-933.
- Rijksinstituut voor Volksgezondheid en Milieu. E-sigaret aantrekkelijkheid voor rokers en niet-rokers (2018). Ga naar bron: Rijksinstituut voor Volksgezondheid en Milieu. E-sigaret aantrekkelijkheid voor rokers en niet-rokers (2018).
- Lochen ML, Gram IT, Skattebo S, et al. Tobacco images and texts in Norwegian magazines and newspapers. Scand J Public Health 2007;35:31-8.
- Rookvrijegeneratie. Geraadpleegd juni 2018. Ga naar bron: Rookvrijegeneratie. Geraadpleegd juni 2018.
- Ketelaars T, Croes E. Effecten van accijns en prijs op het gebruik van tabaksproducten. Utrecht: Trimbos-instituut, 2015
- Leefstijlmonitor, 2017. Geraadpleegd op 2-7-2018. Ga naar bron: Leefstijlmonitor, 2017. Geraadpleegd op 2-7-2018.
- World Health Organization. Global status report on alcohol and health. Ga naar bron: World Health Organization. Global status report on alcohol and health.
- Brien SE, Ronksley PE, Turner BJ, et al. Effect of alcohol consumption on biological markers associated with risk of coronary heart disease: systematic review and meta-analysis of interventional studies. BMJ 2011;342:d636.
- Mukamal KJ, Chen CM, Rao SR, et al. Alcohol consumption and cardiovascular mortality among U.S. adults, 1987 to 2002. J Am Coll Cardiol 2010;55:1328-35.
- Klatsky AL. Alcohol and cardiovascular mortality: common sense and scientific truth. J Am Coll Cardiol 2010;55:1336-8.
- Britton A , McKee M. The relation between alcohol and cardiovascular disease in Eastern Europe: explaining the paradox. J Epidemiol Community Health. 2000;54:328-332.
- Anderson P. Global alcohol policy and the alcohol industry. Curr Opin Psychiatry 2009;22:253-7.
- Wagenaar AC, Salois MJ, Komro KA. Effects of beverage alcohol price and tax levels on drinking: a meta-analysis of 1003 estimates from 112 studies. Addiction 2009;104:179-90.
- National Institute for Health and Care Excellence. Alcohol-use disorders: preventing the development of hazardous and harmful drinking. Ga naar bron: National Institute for Health and Care Excellence. Alcohol-use disorders: preventing the development of hazardous and harmful drinking.
- Her M, Giesbrecht N, Room R, et al. Privatizing alcohol sales and alcohol consumption: evidence and implications. Addiction 1999;94:1125-39.
- Mann RE, Macdonald S, Stoduto LG, et al. The effects of introducing or lowering legal per se blood alcohol limits for driving: an international review. Accid Anal Prev 2001;33:569-83.
- Stockwell T. A review of research into the impacts of alcohol warning labels on attitudes and behaviour. British Colombia, Canada: Center for Addiction Research of BC, University of Victoria, 2006.
- Trimbos Instituut. Geraadpleegd juni 2018. Ga naar bron: Trimbos Instituut. Geraadpleegd juni 2018.
- Kaner EF, Beyer F, Dickinson HO, et al. Effectiveness of brief alcohol interventions in primary care populations. Cochrane Database Syst Rev 2007;2:CD004148.
- Newby DE, Mannucci PM, Tell GS, et al. Expert position paper on air pollution and cardiovascular disease. Eur Heart J 2015;36:83-93b.
- Rutledge-Jonker S, Berkhout JPJ, Wesseling JP et al. Monitoringsrapportage NSL 2017: Stand van zaken Nationaal Samenwerkingsprogramma Luchtkwaliteit. Bilthoven: RIVM, 2017.
- EU. Richtlijn Nationale Emissieplafonds en Pakket Luchtkwaliteit (2016). Ga naar bron: EU. Richtlijn Nationale Emissieplafonds en Pakket Luchtkwaliteit (2016).
- Tweede Kamer. Motie_van_het_lid_Van_Veldhoven_c.s._over_een_nationaal_luchtplan, 2016. Ga naar bron: Tweede Kamer. Motie_van_het_lid_Van_Veldhoven_c.s._over_een_nationaal_luchtplan, 2016.
- Milieudefensie. Geraadpleegd juni 2018. Ga naar bron: Milieudefensie. Geraadpleegd juni 2018.
- Boomsma LJ, Van de Vijver PP, Lanphen JMG, et al. Landelijk Transmurale Afspraak Cardiovasculair Risicomanagement. NHG, NVVC, NIV, NVvN, NVvV. 2016. Ga naar bron: Boomsma LJ, Van de Vijver PP, Lanphen JMG, et al. Landelijk Transmurale Afspraak Cardiovasculair Risicomanagement. NHG, NVVC, NIV, NVvN, NVvV. 2016.
- Ineen. Rapport transparante Ketenzorg 2017. Utrecht: Ineen, 2018.
- Murphy AW, Cupples ME, Smith SM, et al. Effect of tailored practice and patient care plans on secondary prevention of heart disease in general practice: cluster randomised controlled trial. BMJ 2009;339:b4220.
- Wood DA, Kotseva K, Connolly S, et al. Nurse-coordinated multidisciplinary, family-based cardiovascular disease prevention programme (EUROACTION) for patients with coronary heart disease and asymptomatic individuals at high risk of cardiovascular disease: a paired, cluster-randomised controlled trial. Lancet 2008;371:1999-2012.
- Voogdt-Pruis HR, Beusmans GH, Gorgels AP, et al. Effectiveness of nurse-delivered cardiovascular risk management in primary care: a randomised trial. Br J Gen Pract 2010;60:40-6.
- Allen JK, Dennison-Himmelfarb CR, Szanton SL, et al. Community Outreach and Cardiovascular Health (COACH) Trial: a randomized, controlled trial of nurse practitioner/community health worker cardiovascular disease risk reduction in urban community health centers. Circ Cardiovasc Qual Outcomes 2011;4:595-602.
- Koopmans B, Korevaar J, Nielen M, et al. NIVEL Overzichtsstudies: preventie kan effectiever! Deelnamebereidheid en deelnametrouw aan preventieprogramma’s in de zorg. Utrecht: NIVEL, 2012.
- Andrikopoulos G, Tzeis S, Nikas N, et al. Short-term outcome and attainment of secondary prevention goals in patients with acute coronary syndrome – results from the countrywide TARGET study. Int J Cardiol 2013;168:922-7.
- Anderson L, Taylor RS. Cardiac rehabilitation for people with heart disease: an overview of Cochrane systematic reviews. Cochrane Database Syst Rev 2014;12:CD011273.
- Clark RA, Conway A, Poulsen V, et al. Alternative models of cardiac rehabilitation: a systematic review. Eur J Prev Cardiol 2015;22:35-74.
- Karmali KN, Davies P, Taylor F, et al. Promoting patient uptake and adherence in cardiac rehabilitation. Cochrane Database Syst Rev 2014;6:CD007131.
- Gravely-Witte S, Leung YW, Nariani R, et al. Effects of cardiac rehabilitation referral strategies on referral and enrollment rates. Nat Rev Cardiol 2010;7:87-96.
- Jorstad HT, Von Birgelen C, Alings AM, et al. Effect of a nurse-coordinated prevention programme on cardiovascular risk after an acute coronary syndrome: main results of the RESPONSE randomised trial. Heart 2013;99:1421-30.
- Taylor RS, Dalal H, Jolly K, et al. Home-based versus centre-based cardiac rehabilitation. Cochrane Database Syst Rev 2010;1:CD007130.
- Neubeck L, Redfern J, Fernandez R, et al. Telehealth interventions for the secondary prevention of coronary heart disease: a systematic review. Eur J Cardiovasc Prev Rehabil 2009;16:281-9.
- Piotrowicz E, Korzeniowska-Kubacka I, Chrapowicka A, et al. Feasibility of home-based cardiac telerehabilitation: results of TeleInterMed study. Cardiol J 2014;21:539-46.
- Varnfield M, Karunanithi M, Lee CK, et al. Smartphone-based home care model improved use of cardiac rehabilitation in postmyocardial infarction patients: results from a randomised controlled trial. Heart 2014;100:1770-9.
- Van Dis I, Strijbis AM, Spreeuwenberg C. Vijf jaar cardiovasculair risicomanagement in Nederland: the state of the art. Den Haag: Hartstichting, 2014.
- Coördinatieplatform Zorgstandaarden. Factsheet. Ontwikkeling generiek individueel zorgplan. NHG, Vilans, NPCF, ZonMw. 2014. Ga naar bron: Coördinatieplatform Zorgstandaarden. Factsheet. Ontwikkeling generiek individueel zorgplan. NHG, Vilans, NPCF, ZonMw. 2014.
- Platform Vitale Vaten. Zorgstandaard cardiovasculair risicomanagement voor zorgverleners. 2013 Ga naar bron: Platform Vitale Vaten. Zorgstandaard cardiovasculair risicomanagement voor zorgverleners. 2013
- De Hart&Vaatgroep. Kwaliteitscriteria cardiovasculair risicomanagement. Den Haag: De Hart&Vaatgroep, 2013.
- Multidisciplinaire richtlijn Hartrevalidatie. Revalidatiecommissie van de Nederlandse Vereniging Voor Cardiologie/Nederlandse Hartstichting (Richtlijn Hartrevalidatie 2004), Projectgroep PAAHR (gedeeltelijke herziening 2011).
- Nederlandse Vereniging voor Neurologie, Richtlijn Beroerte, 2008. Ga naar bron: Nederlandse Vereniging voor Neurologie, Richtlijn Beroerte, 2008.
- Nederlandse Vereniging voor Heelkunde, Richtlijn Perifeer Arterieel Vaatlijden, 2016. Ga naar bron: Nederlandse Vereniging voor Heelkunde, Richtlijn Perifeer Arterieel Vaatlijden, 2016.
- KNMG. Verantwoordelijkheidsdeling bij samenwerking in de zorg. 2010. Ga naar bron: KNMG. Verantwoordelijkheidsdeling bij samenwerking in de zorg. 2010.
- Aboyans V, Ricco JB, Bartelink MEL, et al. 2017 ESC Guidelines on the Diagnosis and Treatment of Peripheral Arterial Diseases, in collaboration with the European Society for Vascular Surgery (ESVS). Rev Esp Cardiol (Engl Ed) 2018 Feb;71:111.
- Bansal N, Fischbacher CM, Bhopal RS, et al. Myocardial infarction incidence and survival by ethnic group: Scottish Health and Ethnicity Linkage retrospective cohort study. Ethnic variations in the incidence and mortality of stroke in the Scottish Health and Ethnicity Linkage Study of 4.65 million people. Eur J Prev Cardiol 2012;19:1503-8.
- Bhopal RS, Humphry RW, Fischbacher CM. Changes in cardiovascular risk factors in relation to increasing ethnic inequalities in cardiovascular mortality: comparison of cross-sectional data in the Health Surveys for England 1999 and 2004. Predicted and observed cardiovascular disease in South Asians: application of FINRISK, Framingham and SCORE models to Newcastle Heart Project data. J Public Health 2005;27:93-100.
- Bonamy AK, Parikh NI, Cnattingius S, et al. Birth characteristics and subsequent risks of maternal cardiovascular disease: effects of gestational age and fetal growth. Circulation 2011;124:2839-46.
- Boomsma LJ, Van de Vijver PP, Lanphen JMG, et al. Landelijke Transmurale Afspraak Cardiovasculair Risicomanagement. 2015. Ga naar bron: Boomsma LJ, Van de Vijver PP, Lanphen JMG, et al. Landelijke Transmurale Afspraak Cardiovasculair Risicomanagement. 2015.
- Britton A, McKee M. The relation between alcohol and cardiovascular disease in Eastern Europe: explaining the paradox. The consumer case for EU legal restrictions on the use of artificial trans-fats in food. Position paper. Brussels: European Union, 2014. Ga naar bron: Britton A, McKee M. The relation between alcohol and cardiovascular disease in Eastern Europe: explaining the paradox. The consumer case for EU legal restrictions on the use of artificial trans-fats in food. Position paper. Brussels: European Union, 2014.
- Burke AP, Kolodgie FD, Farb A, et al. Morphological predictors of arterial remodeling in coronary atherosclerosis. Prevalence, vascular distribution, and multiterritorial extent of subclinical atherosclerosis in a middle-aged cohort: the PESA (Progression of Early Subclinical Atherosclerosis) study. Circulation 2015;131:2104-13.
- Byrne D, O’Connor L, Jennings S, et al. A survey of GPs awareness and use of risk assessment tools and cardiovascular disease prevention guidelines. Irish Med J 2015;108:204-7.
- Castellano JM, Sanz G, Penalvo JL, et al. A polypill strategy to improve adherence: results from the FOCUS project. J Am Coll Cardiol 2014;64: 2071-82.
- Dallongeville J, Banegas JR, Tubach F, et al. Survey of physicians’ practices in the control of cardiovascular risk factors: the EURIKA study. Eur J Prev Cardiol 2012;19:541-50.
- De Cates AN, Farr MR, Wright N, et al. Fixed-dose combination therapy for the prevention of cardiovascular disease. Cochrane Database Syst Rev 2014;4:CD009868.
- Edwards A, Elwyn G. Shared decision-making in health care. Achieving evidence-based patient choice. Second Edition. Oxford: Oxford University Press, 2012.
- Emberson JR, Kearney PM, Blackwell L, et al. Lack of effect of lowering LDL cholesterol on cancer: meta-analysis of individual data from 175,000 people in 27 randomised trials of statin therapy. Treatment of high-risk patients with ezetimibe plus simvastatin co-administration versus simvastatin alone to attain National Cholesterol Education Program Adult Treatment Panel III low-density lipoprotein cholesterol goals. Am J Cardiol 2004 Jun 15;93:1481-6.
- Fan Z, Wu Y, Shen J, et al. Schizophrenia and the risk of cardiovascular diseases: a meta-analysis of thirteen cohort studies. Underlying causes and long-term survival in patients with initially unexplained cardiomyopathy. N Engl J Med 2000;342:1077-84.
- Gezondheidsraad. Beweegrichtlijnen 2017. Den Haag: Gezondheidsraad, 2017; publicatienr. 2017/08.
- Giannuzzi P, Temporelli PL, Marchioli R, et al. Global secondary prevention strategies to limit event recurrence after myocardial infarction: results of the GOSPEL study, a multicenter, randomized controlled trial from the Italian Cardiac Rehabilitation Network. Arch Intern Med 2008;168:2194-204.
- Giugliano RP, Pedersen TR, Park JG, et al. Clinical efficacy and safety of achieving very low LDL-cholesterol concentrations with the PCSK9 inhibitor evolocumab: a prespecified secondary analysis of the FOURIER trial. Lancet 2017;390:1962-71.
- Gulliksson M, Burell G, Vessby B, et al. Randomized controlled trial of cognitive behavioral therapy versus standard treatment to prevent recurrent cardiovascular events in patients with coronary heart disease: Secondary Prevention in Uppsala Primary Health Care project (SUPRIM). Collaborative care for depression and anxiety disorders in patients with recent cardiac events: the Management of Sadness and Anxiety in Cardiology (MOSAIC) randomized clinical trial. JAMA Intern Med 2014a;174:927-35.
- Handreiking Verantwoordelijkheidsverdeling KNMG 2010. 2010. Ga naar bron: Handreiking Verantwoordelijkheidsverdeling KNMG 2010. 2010.
- Hartstichting. Ga naar bron: Hartstichting.
- Hecht HS, Superko HR. Electron beam tomography and National Cholesterol Education Program guidelines in asymptomatic women. J Am Coll Cardiol 2001;37:1506-11.
- Hempler NF, Diderichsen F, Larsen FB, et al. Do immigrants from Turkey, Pakistan and Yugoslavia receive adequate medical treatment with beta-blockers and statins after acute myocardial infarction compared with Danishborn residents? A register-based follow-up study. Eur J Clin Pharmacol 2010;66:735-42.
- Hoffmann U, Massaro JM, D’Agostino RB, et al. Cardiovascular event prediction and risk reclassification by coronary, aortic and valvular calcification in the Framingham Heart Study. Clinical characteristics of patients with obstructive coronary lesions in the absence of coronary calcification: an evaluation by coronary CT angiography. Heart 2009;95:1056-60.
- Implementation of Spanish adaptation of the European guidelines on cardiovascular disease prevention in primary care. BMC Fam Pract 2013;14:36.
- Ioannidis JP, Tzoulaki I. Minimal and null predictive effects for the most popular blood biomarkers of cardiovascular disease. Long term mortality of mothers and fathers after pre-eclampsia: population-based cohort study. BMJ 2001;323:1213-7.
- Kociol RD, McNulty SE, Hernandez AF, et al. Markers of decongestion, dyspnea relief, and clinical outcomes among patients hospitalized with acute heart failure. Circ Heart Fail 2013;6:240-5.
- Jørgensen PG, Jensen JS, Marott JL, et al. Electrocardiographic changes improve risk prediction in asymptomatic persons age 65 years or above without cardiovascular disease. J Am Coll Cardiol 2014;2:64:898-906.
- Kotseva K, Wood D, De Backer G, et al. Management of cardiovascular risk factors in asymptomatic high-risk patients in general practice: cross-sectional survey in 12 European countries. Eur J Cardiovasc Prev Rehabil 2010;17:530-40.
- Lagro-Jansen T, Keijsers K, Olde Rikkert M. Stap voor stap samen beslissen. Med Contact 2014. Ga naar bron: Lagro-Jansen T, Keijsers K, Olde Rikkert M. Stap voor stap samen beslissen. Med Contact 2014.
- Lewington S, Clarke R, Qizilbash N, et al. Age-specific relevance of usual blood pressure to vascular mortality: a meta-analysis of individual data for one million adults in 61 prospective studies. Lancet 2002;360:1903-13.
- Liu SC, Xia L, Zhang J, et al. Gout and risk of myocardial infarction: a systematic review and meta-analysis of cohort studies. PLoS One 2015;10:e0134088.
- Longfonds. Geraadpleegd juni 2018. Ga naar bron: Longfonds. Geraadpleegd juni 2018.
- Mancia G, Facchetti R, Bombelli M, et al. Long-term risk of mortality associated with selective and combined elevation in office, home, and ambulatory blood pressure. Hypertension 2006;47:846-53.
- Matsushita K, Mahmoodi BK, Woodward M, et al. Comparison of risk prediction using the CKD-EPI equation and the MDRD study equation for estimated glomerular filtration rate. JAMA 2012;307:1941-51.
- MDR Herseninfarct/-bloeding. Werkgroep MDR Herseninfarct/-bloeding. 2017. Ga naar bron: MDR Herseninfarct/-bloeding. Werkgroep MDR Herseninfarct/-bloeding. 2017.
- Montorsi P, Ravagnani PM, Galli S, et al. Association between erectile dysfunction and coronary artery disease: matching the right target with the right test in the right patient. Eur Urol 2006;50:721-31.
- Morgan CL, Jenkins-Jones S, Currie CJ, et al. Evaluation of adverse outcome in young women with polycystic ovary syndrome versus matched, reference controls: a retrospective, observational study. Outbursts of anger as a trigger of acute cardiovascular events: a systematic review and meta-analysis. Eur Heart J 2014;35:1404-10.
- Muller I, Seyfarth M, Rudiger S, et al. Effect of a high loading dose of clopidogrel on platelet function in patients undergoing coronary stent placement. Heart (British Cardiac Society) 2001;85:92-3.
- Myers MG, Godwin M, Dawes M, et al. Measurement of blood pressure in the office: recognizing the problem and proposing the solution. Hypertension 2010;55:195-200.
- Neaton JD, Wentworth D. Serum cholesterol, blood pressure, cigarette smoking, and death from coronary heart disease. Overall findings and differences by age for 316,099 white men. Multiple Risk Factor Intervention Trial Research Group. Blood pressure measuring devices: recommendations of the European Society of Hypertension. BMJ 2001; 322:531-6.
- Neaton JD, Blackburn H, Jacobs D, et al. Serum cholesterol level and mortality findings for men screened in the Multiple Risk Factor Intervention Trial. Multiple Risk Factor Intervention Trial Research Group. Arch Intern Med. 1992;152:1490–1500.
- O’Rourke MF, Adji A. Guidelines on guidelines: focus on isolated systolic hypertension in youth. J Hypertens 2013;31:649-54.
- Orth-Gomer K, Schneiderman N, Wang HX, et al. Stress reduction prolongs life in women with coronary disease: the Stockholm Women’s Intervention Trial for Coronary Heart Disease (SWITCHD). Circ Cardiovasc Qual Outcomes 2009;2:25-32.
- Parati G, Stergiou GS, Asmar R, et al. European Society of Hypertension guidelines for blood pressure monitoring at home: a summary report of the Second International Consensus Conference on Home Blood Pressure Monitoring. J Hypertens 2008;26:1505-26.
- Pascual JM, Rodilla E, Costa JA, et al. Prognostic value of microalbuminuria during antihypertensive treatment in essential hypertension. Hypertension 2014;64:1228-34.
- Patiëntenfederatie Nederland, Federatie Medisch Specialisten. Drie goede vragen. 2018. Ga naar bron: Patiëntenfederatie Nederland, Federatie Medisch Specialisten. Drie goede vragen. 2018.
- Pencina MJ, D’Agostino RB Sr, D’Agostino RB Jr, Vasan RS. Evaluating the added predictive ability of a new marker: from area under the ROC curve to reclassification and beyond. Stat Med 2008 Jan 30;27:157-72; discussion 207-12.
- Piepoli MF, Hoes AW, Agewall S, et al. 2016 European guidelines on cardiovascular disease prevention in clinical practice. The Sixth Joint Task Force of the European Society of Cardiology and Other Societies on Cardiovascular Disease Prevention in Clinical Practice (constituted by representatives of 10 societies and by invited experts. Developed with the special contribution of the European Association for Cardiovascular Prevention & Rehabilitation). G Ital Cardiol (Rome) 2017;18:547-612.
- Ponikowski P, Voors AA, Anker SD, et al. ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: the Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC) Developed with the special contribution of the Heart Failure Association (HFA) of the ESC. New strategies for heart failure with preserved ejection fraction: the importance of targeted therapies for heart failure phenotypes. Exercise-based rehabilitation for heart failure. Cochrane Database Syst Rev 2014;4:CD003331.
- Preis SR, Hwang SJ, Coady S, et al. Trends in all-cause and cardiovascular disease mortality among women and men with and without diabetes mellitus in the Framingham Heart Study, 1950 to 2005. ESC/EAS Guidelines for the management of dyslipidaemias: the Task Force for the management of dyslipidaemias of the European Society of Cardiology (ESC) the European Atherosclerosis Society (EAS). Eur Heart J 2011;32:1769-818.
- Raad voor de Volksgezondheid & Zorg. De participerende patiënt. Den Haag: RVZ, 2013.
- Raza Q, Snijder MB, Seidell JC, et al. Comparison of cardiovascular risk factors and dietary intakes among Javanese Surinamese and South-Asian Surinamese in the Netherlands. Heterogeneity in cause-specific mortality according to birthplace in immigrant men residing in Madrid, Spain. Ann Epidemiol 2008;18:605-13.
- Reiner Z, Sonicki Z, Tedeschi-Reiner E. Physicians’ perception, knowledge and awareness of cardiovascular risk factors and adherence to prevention guidelines: the PERCRO-DOC survey. Atherosclerosis 2010;213:598-603.
- RIVM Leefstijlmonitor. Zoekterm leefstijlmonitor. Geraadpleegd 7 december 2017. Ga naar bron: RIVM Leefstijlmonitor. Zoekterm leefstijlmonitor. Geraadpleegd 7 december 2017.
- Rogers PJ, Hogenkamp PS, De Graaf C et al. Does low-energy sweetener consumption affect energy intake and body weight? A systematic review, including meta-analyses, of the evidence from human and animal studies. Association of alcohol consumption with selected cardiovascular disease outcomes: a systematic review and meta-analysis. BMJ 2011;342:d671.
- Schottker B, Jorde R, Peasey A, et al. Vitamin D and mortality: meta-analysis of individual participant data from a large consortium of cohort studies from Europe and the United States. BMJ 2014;348:g3656.
- Sehestedt T, Jeppesen J, Hansen TW, et al. Risk prediction is improved by adding markers of subclinical organ damage to SCORE. Eur Heart J 2010;31:883-91.
- Senni M, Paulus WJ, Gavazzi A, et al. New strategies for heart failure with preserved ejection fraction: the importance of targeted therapies for heart failure phenotypes. Eur Heart J 2014;35:2797-815.
- Silagy CA, McNeil JJ, Donnan GA, et al. Adverse effects of low-dose aspirin in a healthy elderly population. Second European Stroke Prevention Study: antiplatelet therapy is effective regardless of age. ESPS2 Working Group. Acta Neurol Scand 1999;99:54-60.
- Somers VK, White DP, Amin R, et al. Sleep apnea and cardiovascular disease: an American Heart Association/American College of Cardiology Foundation Scientific Statement from the American Heart Association Council for High Blood Pressure Research Professional Education Committee, Council on Clinical Cardiology, Stroke Council, and Council on Cardiovascular Nursing. In collaboration with the National Heart, Lung, and Blood Institute National Center on Sleep Disorders Research (National Institutes of Health). Circulation 2008;118:1080-111.
- Staessen JA, Fagard R, Thijs L, et al. Subgroup and per-protocol analysis of the randomized European Trial on Isolated Systolic Hypertension in the Elderly. No evidence that frailty modifies the positive impact of antihypertensive treatment in very elderly people: an investigation of the impact of frailty upon treatment effect in the HYpertension in the Very Elderly Trial (HYVET) study, a double-blind, placebo-controlled study of antihypertensives in people with hypertension aged 80 and over. BMC Med 2015;13:78.
- Stam-Slob MC, Van der Graaf Y, De Boer A, et al. Cost-effectiveness of PCSK9 inhibition in addition to standard lipid-lowering therapy in patients at high risk for vascular disease. Int J Cardiol 2018;253:148-154.
- Stewart JC, Perkins AJ, Callahan CM. Effect of collaborative care for depression on risk of cardiovascular events: data from the IMPACT randomized controlled trial. Employee effects of an educational program for managers at an insurance company. Psychosom Med 2001;63:724-33.
- Taylor RS, Sagar VA, Davies EJ, et al. Exercise-based rehabilitation for heart failure. Cochrane Database Syst Rev 2014;4:CD003331.
- Tran AT, Straand J, Diep LM, et al. Cardiovascular disease by diabetes status in five ethnic minority groups compared to ethnic Norwegians. BMC Public Health 2011;11:554.
- U.S. Preventive Services Task Force. Screening for peripheral arterial disease: recommendation statement. Am Fam Physician 2006;73:497-500.
- Udelson JE. Heart failure with preserved ejection fraction. Interventions to improve adherence to self-administered medications for chronic diseases in the United States: a systematic review. Ann Intern Med 2012;157:785-95.
- Valgimigli M, Costa F, Byrne R, et al. Dual antiplatelet therapy duration after coronary stenting in clinical practice: results of an EAPCI survey EuroIntervention 2015;11:68-74.
- Vlachopoulos C, Jackson G, Stefanadis C, et al. Erectile dysfunction in the cardiovascular patient. Eur Heart J 2013a;34:2034-46.
- Vlachopoulos CV, Terentes-Printzios DG, Ioakeimidis NK, et al. Prediction of cardiovascular events and all-cause mortality with erectile dysfunction: a systematic review and meta-analysis of cohort studies. Circ Cardiovasc Qual Outcomes 2013b;6:99-109.
- Wachtell K, Okin PM, Olsen MH, et al. Regression of electrocardiographic left ventricular hypertrophy during antihypertensive therapy and reduction in sudden cardiac death: the LIFE Study. Circulation 2007;116:700-5.
- Wald NJ, Law MR. A strategy to reduce cardiovascular disease by more than 80%. BMJ 2003;326:1419.
- Williams B, MacDonald TM, Morant S, et al.; British Hypertension Society’s PATHWAY Studies Group. Spironolactone versus placebo, bisoprolol, and doxazosin to determine the optimal treatment for drug-resistant hypertension (PATHWAY-2): a randomised, double-blind, crossover trial. Lancet 2015 Nov 21;386:2059-68.
- Woodward M, Hirakawa Y, Kengne AP, et al. ADVANCE Collaborative Group. Prediction of 10-year vascular risk in patients with diabetes: the AD-ON risk score. Metabolite profiling and cardiovascular event risk: a prospective study of 3 population-based cohorts. Circulation 2015;131:774-85.
- World Health Organisation. WHO Global Health Repository. Cardiovascular diseases, deaths per 100 000. Data by country.
- Yancy CW, Jessup M, Bozkurt B, et al. ACCF/AHA guideline for the management of heart failure: a report of the American College of Cardiology Foundation/American Heart Association Task Force on practice guidelines. Circulation 2013;128: e240-327.
- Zhang Z, Xu G, Liu D, et al. Dietary fiber consumption and risk of stroke. Fish consumption and CHD mortality: an updated meta-analysis of seventeen cohort studies. Public Health Nutr 2012;15:725-37.
- Zorgstandaard CVRM. 2013 Ga naar bron: Zorgstandaard CVRM. 2013
- Bhopal RS, Bansal N, Fischbacher CM, Brown H, Capewell S; Scottish Health and Ethnic Linkage Study. Ethnic variations in the incidence and mortality of stroke in the Scottish Health and Ethnicity Linkage Study of 4.65 million people. Eur J Prev Cardiol. 2012;19:1503-8.
- Nissen SE, Menon V, Nicholls SJ, Brennan D, Laffin L, Ridker P,et al. Bempedoic Acid for Primary Prevention of Cardiovascular Events in Statin-Intolerant Patients. JAMA. 2023;330:131-140.
- Wei L, MacDonald TM, Watson AD, Murphy MJ. Effectiveness of two statin prescribing strategies with respect to adherence and cardiovascular outcomes: observational study. Pharmacoepidemiol Drug Saf. 2007;16:385-92.
- Nußbaumer B, Glechner A, Kaminski-Hartenthaler A, et al. Ezetimibe-Statin Combination Therapy. Dtsch Arztebl Int 2016;113:445-53
- Peters MJ, Symmons DP, McCarey D, et al. EULAR evidence-based recommendations for cardiovascular risk management in patients with rheumatoid arthritis and other forms of inflammatory arthritis. Ann Rheum Dis 2010;69:325-31.
- Gijsberts CM, Groenewegen KA, Hoefer IE, et al. Race/ethnic differences in the associations of the Framingham risk factors with carotid IMT and cardiovascular events. PLoS One 2015 2;10:e0132321.
- Lim SS, Vos T, Flaxman AD, et al. A comparative risk assessment of burden of disease and injury attributable to 67 risk factors and risk factor clusters in 21 regions, 1990 tot 2010: a systematic analysis for the Global Burden of Disease Study 2010. Differential impact of systolic and diastolic blood pressure level on JNC-VI staging. Joint National Committee on Prevention, Detection, Evaluation, and Treatment of High Blood Pressure. Hypertension 1999;34:381-5.