Perifeer arterieel vaatlijden
Richtlijnen diagnostiek
Naar Volledige tekst ›Bij perifeer arterieel vaatlijden wordt onderscheid gemaakt tussen:
- acute ischemie van het (onder)been met bedreiging van de levensvatbaarheid van het been binnen enkele uren tot dagen;
- chronisch obstructief arterieel vaatlijden, onderverdeeld in claudicatio intermittens en kritieke ischemie.
Anamnese
Naar Volledige tekst ›Vraag naar:
- duur en langzame of juist snelle progressie van de klachten; links-rechtsverschil;
- klachten die wijzen op acute ischemie: rustpijn, snel progressieve gevoelsstoornissen van het been (doof gevoel), spierzwakte van been/voet, bleekheid;
- klachten die wijzen op claudicatio intermittens: pijn en vervelende sensaties (moe, stijf, krampen, temperatuurverschillen) in het been of de bilregio bij inspanning die verminderen in rust;
- klachten die wijzen op kritieke ischemie: rustpijn en/of nachtelijke pijn (vooral in voorvoet of tenen), die afneemt als patiënt opstaat of aangedane been laat hangen; afwijkingen huid of nagels aan voeten (wondjes of zweertjes);
- beperkingen bij lichamelijke activiteiten, werk of dagelijkse bezigheden; maximale loopafstand;
- gebruik van vaatvernauwende medicatie (zoals bètablokkers en ergotamine);
- risicofactoren voor hart- en vaatziekten (HVZ): leeftijd ≥ 50 jaar, doorgemaakte HVZ, diabetes mellitus, reumatoïde artritis, roken, HVZ bij ouders, broers of zusters voor het 65e levensjaar;
- voedingspatroon, alcoholgebruik, lichamelijke activiteit.
Lichamelijk onderzoek
Naar Volledige tekst ›Let bij lichamelijk onderzoek van de benen op links-rechtsverschillen. Meet de bloeddruk.
Beoordeel tekenen die wijzen op acute ischemie van het been:
- arterieel: ontbrekende pulsaties bij palpatie van a. tibialis posterior, a. dorsalis pedis en/of a. femoralis; souffle over a. femoralis; lagere huidtemperatuur van voet en onderbeen bij palpatie met handrug; bleekheid van het been;
- neurologisch: gevoelsstoornissen van het been (vaak interdigitale ruimte en voetrug tussen eerste en tweede straal); spierzwakte van been/voet (vaak zwakte/motorische uitval van intrinsieke voetspieren).
Beoordeel tekenen die wijzen op chronisch obstructief arterieel vaatlijden:
- arterieel: verzwakte pulsaties bij palpatie van a. tibialis posterior, a. dorsalis pedis en/of a. femoralis; souffle over a. femoralis; lagere huidtemperatuur van voet en onderbeen bij palpatie met handrug.
- trofische stoornissen: wondjes aan tenen, voet en enkel; verminderde beharing; nagelafwijkingen.
Aanvullend onderzoek
Naar Volledige tekst ›- Bepaal met een dopplerapparaat de enkel-armindex (EAI) bij een vermoeden van chronisch obstructief arterieel vaatlijden.
- Procedure EAI: zie volledige tekst van de standaard.
- Berekening van de EAI voor beide benen afzonderlijk:
- Volg voor laboratoriumonderzoek in het kader van cardiovasculair risicomanagement de NHG-Standaard Cardiovasculair risicomanagement.
Evaluatie
Naar Volledige tekst ›- Er is sprake van acute ischemie bij pijn in rust (Pain), afwezigheid van voetpulsaties (Pulseless), veranderingen in kleur (Pallor) en temperatuur van de voet, gevoelsstoornissen in het been (Paresthesieën) en spierzwakte van been/voet (Paralyse) (5 P’s).
- Chronisch obstructief arterieel vaatlijden is vrijwel zeker bij een eenmalige EAI < 0,8 óf bij een gemiddelde van 3 EAI-bepalingen < 0,9.
- Chronisch obstructief arterieel vaatlijden is vrijwel uitgesloten bij een eenmalige EAI > 1,1 óf bij een gemiddelde van 3 EAI-bepalingen > 1,0.
- Bij een gemiddelde EAI van 0,9 tot en met 1,0 kan diagnose chronisch obstructief arterieel vaatlijden niet met zekerheid worden gesteld. Overweeg alternatieve diagnosen zoals een wervelkanaalstenose.
- Bij diabetes mellitus kunnen, door stuggere vaatwanden, ook hoge EAI-waarden (eenmalige EAI > 1,1 óf een gemiddelde van 3 EAI-bepalingen > 1,0) wijzen op chronisch obstructief arterieel vaatlijden.
- Er is sprake van claudicatio intermittens bij pijn en vervelende sensaties (moe, stijf, krampen, temperatuurverschillen) in het been of de bilregio bij inspanning die verminderen in rust en bovengenoemde afwijkingen bij doppleronderzoek;
- Er is sprake van kritieke ischemie bij pijnklachten aan voet of been in rust en/of trofische stoornissen aan voet of been (wondjes; verminderde beharing; nagelafwijkingen) en een met een dopplerapparaat gemeten systolische enkeldruk lager dan 50 mmHg.
Richtlijnen beleid
Naar Volledige tekst ›Bij chronisch obstructief arterieel vaatlijden:
- Stoppen-met-rokeninterventie en cardiovasculair risicomanagement, inclusief het voorschrijven van een trombocytenaggregatieremmer zoals acetylsalicylzuur (zie betreffende NHG-Standaard).
- Verwijs bij claudicatio intermittens voor gesuperviseerde looptraining (fysiotherapeut) en zo nodig voor voetverzorging (pedicure met aantekening).
Controles
Naar Volledige tekst ›- Controleer de progressie van claudicatio intermittens (ook in het niet-aangedane been) de eerste drie maanden maandelijks en vervolgens driemaandelijks gedurende het eerste jaar.
- Controleer patiënten jaarlijks in het kader van cardiovasculair risicomanagement.
- Controleer in overleg met de specialist patiënten na een chirurgische of endovasculaire ingreep op restenose.
Verwijzing
Naar Volledige tekst ›- Verwijs bij vermoeden van acute ischemie met spoed voor ontstolling en eventuele directe revascularisatie.
- Verwijs bij vermoeden van chronisch obstructief arterieel vaatlijdenafhankelijk van lokale omstandigheden naar een multidisciplinair vaatteam of naar een vaatchirurg:
- als een bepaling van EAI niet in eigen beheer kan worden uitgevoerd;
- bij een gemiddelde EAI van 0,9 tot en met 1,0 en twijfel over de diagnose;
- bij diabetes mellitus en een vermoeden van chronisch obstructief arterieel vaatlijden;
- bij snelle progressie van de klachten;
- bij blijvende klachten ondanks gesuperviseerde looptraining na 6 maanden;
- bij kritieke ischemie voor aanvullend onderzoek en zo nodig invasieve behandeling.
Samenwerkingsafspraken
Naar Volledige tekst ›Maak (regionale) samenwerkingsafspraken met andere zorgverleners.
Belangrijkste wijzigingen
Naar Samenvatting ›- Richtlijnen voor het beleid bij acute ischemie van het (onder)been zijn toegevoegd; in verband daarmee wordt geleidelijk ontstaan perifeer arterieel vaatlijden nu aangeduid met de term ‘chronisch obstructief arterieel vaatlijden’
- Voor secundaire preventie van hart- en vaatziekten wordt de NHG-Standaard Cardiovasculair risicomanagement gevolgd.
- De werkwijze voor het meten van de enkel-armindex is in meer detail weergegeven.
- Bij claudicatio intermittens wordt voortaan gesuperviseerde looptherapie aanbevolen.
- Er is aandacht voor samenwerkingsafspraken tussen alle zorgverleners in de 1e en de 2e lijn.
Kernboodschappen
Naar Samenvatting ›- Maak voor het beleid bij symptomatisch perifeer arterieel vaatlijden onderscheid tussen enerzijds acute ischemie van het (onder)been en anderzijds chronisch obstructief arterieel vaatlijden.
- Chronisch obstructief arterieel vaatlijden kan verdeeld worden in 2 uitingsvormen: claudicatio intermittens en kritieke ischemie.
- Verwijs bij verdenking op acute ischemie met spoed voor ontstolling en zo nodig revascularisatie.
- Bepaal voor het bevestigen van de diagnose ‘perifeer arterieel vaatlijden’ de enkel-armindex.
- Het beleid bij chronisch obstructief arterieel vaatlijden omvat in alle gevallen cardiovasculair risicomanagement inclusief het voorschrijven van een trombocyten aggregatie remmer en stoppen met roken.
- Verwijs bij claudicatio intermittens voor gesuperviseerde looptraining.
- Verwijs bij kritieke ischemie voor aanvullend onderzoek en aanvullende behandeling.
Inleiding
Naar Samenvatting ›Scope
Naar Samenvatting ›Diagnostiek en behandeling van patiënten met klachten van gegeneraliseerde atherosclerose in de arteriën naar de onderste extremiteiten.
Buiten de scope
Naar Samenvatting ›- Secundaire preventie van hart- en vaatziekten (zie NHG-Standaard Cardiovasculair risicomanagement)
- Beleid bij asymptomatisch perifeer arterieel vaatlijden (zie Details)
Aanleiding voor de herziening van deze NHG-Standaard Perifeer arterieel vaatlijden is de herziening van nationale en internationale richtlijnen, waardoor de standaard op enkele onderdelen niet meer geheel actueel was. Deze standaard geeft richtlijnen bij het beleid bij acute ischemie en bij symptomatisch chronisch obstructief arterieel vaatlijden. Het beleid bij asymptomatisch perifeer arterieel vaatlijden valt buiten het bestek van deze standaard. Er is consistent bewijs dat slechts eenderde van de patiënten met chronisch obstructief arterieel vaatlijden symptomen heeft. Screening op asymptomatisch chronisch obstructief arterieel vaatlijden in de open populatie wordt niet geadviseerd, omdat de toegevoegde waarde daarvan onvoldoende is onderzocht. Uit een Nederlands cohortonderzoek (n = 3654) blijkt dat patiёnten met perifeer arterieel vaatlijden een verhoogd risico hebben op overige hart- en vaatziekten. Voor preventie van cardiovasculaire aandoeningen bij patiёnten met symptomatisch perifeer arterieel vaatlijden wordt verwezen naar de NHG-Standaard Cardiovasculair risicomanagement. In deze standaard is de uitvoering van de enkel-armindex bepaling gestandaardiseerd volgens de richtlijnen van het American Heart Association. Toegevoegd in deze standaard zijn richtlijnen voor het beleid bij acute ischemie van het (onder)been die in lijn zijn met de aanbevelingen van de Nederlandse Vereniging voor Heelkunde en de Nederlandse Vereniging voor Radiologie. Het beleid bij claudicatio intermittens sluit aan bij de aanbevelingen van het Koninklijk Nederlands Genootschap voor Fysiotherapie. Andere relevante NHG-Standaarden zijn de NHG-Standaard Cardiovasculair risicomanagement, de NHG-Standaard Diabetes mellitus type 2 en de NHG-Behandelrichtlijn Stoppen met roken.
Achtergronden
Naar Samenvatting ›Begrippen
Naar Samenvatting ›Perifeer arterieel vaatlijden
Naar Samenvatting ›- Gegeneraliseerde atherosclerose in de arteriën naar de onderste extremiteiten, dat wil zeggen het stroomgebied van de beide aa. iliacae communes
- Perifeer arterieel vaatlijden is een door atherotrombose veroorzaakte klinische manifestatie van hart- en vaatziekte, en als zodanig een indicatie voor secundaire preventie
- Maak onderscheid tussen:
- acute ischemie van het (onder)been
- chronisch obstructief arterieel vaatlijden (zie Details)
Er bestaan verschillende indelingen afhankelijk van de klachten en verschijnselen bij lichamelijk onderzoek bij perifeer arterieel vaatlijden (zie tabel 3). Een veel gebruikte indeling bij een enkel-armindex kleiner dan 0,9 is die van Fontaine in 4 stadia. In Angelsaksische landen en internationale wetenschappelijke publicaties past men dikwijls de indeling van Rutherford in 6 categorieën toe. In deze standaard wordt, in lijn met de richtlijn Diagnostiek en behandeling van arterieel vaatlijden van de onderste extremiteit van de Nederlandse Vereniging voor Heelkunde, een classificatie gehanteerd op basis van klinische beelden; acute ischemie en chronisch obstructief arterieel vaatlijden. Chronisch obstructief vaatlijden kent 2 uitingsvormen, claudicatio intermittens of kritieke ischemie.
| Fontaine | Rutherford | NHG-Standaard /NVvH-Richtlijn | ||||
|---|---|---|---|---|---|---|
| Stadium | Klinisch beeld | Graad | Categorie | Klinisch beeld | Klinisch beeld chronisch obstructief | Klinisch beeld acuut |
| I | asymptomatisch | 0 | 0 | asymptomatisch | asymptomatisch | |
| IIa | maximale loopafstand ≥ 100 meter | I | 1 | lichte claudicatio intermittens | ||
| IIb | maximale loopafstand < 100 meter | I | 2 | matige claudicatio intermittens | claudicatio intermittens | |
| I | 3 | ernstige claudicatio intermittens | acute ischemie | |||
| III | ischemische klachten in rust en/of trofische stoornissen | II | 4 | ischemische klachten in rust en/of trofische stoornissen | kritieke ischemie | |
| IV | ulcera of necrose of gangreen | III | 5 | kleine ulcera | ||
| III | 6 | grote ulcera | ||||
Acute ischemie
Naar Samenvatting ›- Acute perfusiestoornis van een voet of onderbeen ten gevolge van snelle progressie van een plaque of een arteriële embolie, die binnen enkele uren tot dagen een bedreiging vormt voor de levensvatbaarheid daarvan
- Kenmerkende klachten zijn pijn in rust, afwezige pulsaties, veranderde kleur en temperatuur (van de voet), doof gevoel en/of spierzwakte
Chronisch obstructief arterieel vaatlijden
Naar Samenvatting ›- Geleidelijk progressieve perfusiestoornis van een voet of onderbeen, met 2 uitingsvormen (zie Perifeer arterieel vaatlijden):
- claudicatio intermittens
- kritieke ischemie
- Roken is de belangrijkste risicofactor; andere risicofactoren zijn familiaire belasting, diabetes mellitus, hypertensie en hypercholesterolemie (zie NHG-Standaard Cardiovasculair risicomanagement).
Claudicatio intermittens
Naar Samenvatting ›Perifeer arterieel vaatlijden met pijn in de beenspieren (bil, dijbeen, kuit) die ontstaat tijdens het lopen en die na rust binnen 10 minuten volledig verdwijnt en opnieuw optreedt bij inspanning.
Kritieke ischemie
Naar Samenvatting ›Perifeer arterieel vaatlijden met vaak hevige pijn aan voet of been in rust en/of trofische stoornissen, bij een systolische enkeldruk < 50 mmHg (gemeten met een dopplerapparaat).
Epidemiologie
Naar Samenvatting ›Acute ischemie
Naar Samenvatting ›De incidentie van acute ischemie in de algemene bevolking wordt geschat op 0,14 per 1000 personen per jaar.
Chronisch obstructief arterieel vaatlijden
Naar Samenvatting ›- De prevalentie van symptomatisch chronisch obstructief arterieel vaatlijden (enkel-armindex < 0,9) in de algemene bevolking wordt geschat op 7% bij 55-jarigen en op 56% bij personen ≥ 85 jaar.
- De incidentie in de huisartsenpraktijk wordt geschat op 3 per 1000 patiënten per jaar.
- Prevalentie en incidentie van chronisch obstructief arterieel vaatlijden zijn vrijwel gelijk bij mannen en vrouwen, maar mannen ontwikkelen eerder claudicatio intermittens.
- Prevalentie en incidentie van chronisch obstructief arterieel vaatlijden zijn hoger bij rokers, bij patiënten met diabetes mellitus en bij mensen met een donkere huidskleur.
Kritieke ischemie
Naar Samenvatting ›- De prevalentie van kritieke ischemie in de algemene bevolking wordt geschat op 0,5% bij personen ≥ 60 jaar.
- De incidentie van kritieke ischemie in de huisartsenpraktijk wordt geschat op 0,5-1 per 1000 patiënten per jaar.
Etiologie en pathofysiologie
Naar Samenvatting ›- Perifeer arterieel vaatlijden is een manifestatie van gegeneraliseerde atherosclerose. Hierbij verliezen de arteriën in het been hun elasticiteit en worden stugger en dikker. Afzetting van vetten en kalk beschadigt de binnenkant van de arterie en versmalt het lumen zodat de bloeddoorstroming afneemt.
- Bij perifeer arterieel vaatlijden onderscheidt men 2 klinische manifestaties:
- acute ischemie van het (onder)been
- chronisch obstructief arterieel vaatlijden
- Chronisch obstructief vaatlijden kan verdeeld worden in 2 uitingsvormen:
- claudicatio intermittens
- kritieke ischemie (zie Begrippen).
Acute ischemie
Naar Samenvatting ›- Acute vermindering van de perfusie van een extremiteit, die binnen enkele uren tot dagen een bedreiging vormt voor de levensvatbaarheid daarvan.
- Mogelijke oorzaken:
- acute progressie van al aanwezige perifere atherosclerose
- acute embolie
- trauma (bijvoorbeeld katheterisatie)
- Acute ischemie wordt niet noodzakelijkerwijs voorafgegaan door claudicatio intermittens of kritieke ischemie.
- Patiënten presenteren zich met een combinatie van 5 kenmerkende symptomen (de 5 P’s):
- pain : pijn in rust
- pulseless : afwezigheid van voetpulsaties is een aanwijzing voor acute ischemie, afwezigheid van dopplersignalen over de voetarteriën is een extra indicatie
- pallor (bleekheid): patiënten ervaren vaak veranderingen in kleur en temperatuur van de voet
- paresthesias : veel mensen ervaren een doof gevoel
- paralysis : vaak beginnend bij de intrinsieke voetspieren
Chronisch obstructief arterieel vaatlijden
Naar Samenvatting ›- In tegenstelling tot acute ischemie ontwikkelt chronisch obstructief arterieel vaatlijden (claudicatio intermittens en kritieke ischemie) zich doorgaans geleidelijk progressief.
- Chronisch obstructief arterieel vaatlijden is een uiting van gegeneraliseerd vaatlijden en komt gecombineerd voor met atherosclerose van de coronaire en/of cerebrale arteriën (zie Details); adequate diagnostiek, behandeling en begeleiding zijn van belang om lokale progressie in de benen tegen te gaan en manifestaties van atherosclerose elders in het lichaam te voorkomen.
- Verminderde huidcirculatie en verslechterde genezing verhogen het risico op huidproblemen van de voeten en op ulcera die uiteindelijk kunnen leiden tot gangreen of zelfs amputatie.
- Patiënten hebben een verhoogd risico op coronaire hartziekten en cerebrovasculaire aandoeningen.
- Patiënten ervaren vaak minder kwaliteit van leven doordat ze minder energie hebben, frequenter pijn hebben en in hun mobiliteit beperkt zijn.
- De risicofactoren voor chronisch obstructief arterieel vaatlijden zijn gelijk aan de algemene risicofactoren voor atherosclerose (zie de NHG-Standaard Cardiovasculair risicomanagement) (zie Details).
Prevalentie
Voor het vaststellen van de prevalentie van chronisch obstructief arterieel vaatlijden wordt de enkel-armindex als indicator gebruikt. Diverse onderzoeken tonen aan dat de prevalentie van chronisch obstructief arterieel vaatlijden afhankelijk is van de methode waarop deze enkel-armindex is bepaald en de gehanteerde afkappunten (zie verder Enkel-armindex).
In een Nederlands populatieonderzoek (n = 7983) onder 55-plussers wordt de prevalentie van symptomatisch en asymptomatisch chronisch obstructief arterieel vaatlijden geschat op 19,1% (95%-BI 18,1 tot 20,0). Een groot deel daarvan is asymptomatisch. Uit ander onderzoek blijkt dat eenderde van de patiënten met chronisch obstructief arterieel vaatlijden symptomen van claudicatio intermittens heeft. In een Zweeds onderzoek werd de prevalentie van symptomatisch en asymptomatisch chronisch obstructief arterieel vaatlijden in een open populatie geschat op 18% en die van claudicatio intermittens op 7%. De prevalentie van kritieke ischemie in een open populatie ouder dan 60 jaar werd geschat op 0,4%. Andere onderzoeken laten vergelijkbare resultaten zien.
Prevalentiecijfers uit morbiditeitsregistraties door huisartsen betreffen patiënten die bij de huisarts bekend zijn wegens claudicatio intermittens. Bij vergelijking van de prevalentiecijfers in de populatie en in de huisartsenpraktijk blijkt dat slechts een minderheid bij de huisarts bekend is; circa de helft van alle personen met claudicatio intermittens bezoekt voor deze klacht de huisarts.
De verschillen in voorkomen tussen mannen en vrouwen waren in een Nederlands populatieonderzoek niet significant. De prevalentie van chronisch obstructief arterieel vaatlijden is bij jongere mannen hoger dan bij vrouwen van dezelfde leeftijd, maar op hogere leeftijd (> 75 jaar) zijn de prevalenties onder mannen en vrouwen vergelijkbaar.
De prevalentie van symptomatisch en asymptomatisch chronisch obstructief arterieel vaatlijden neemt toe met de leeftijd, van 8,1% bij 55 tot 59 jaar tot 55,8% bij 85-plussers. In een Duitse studie werd de prevalentie van asymptomatisch en symptomatisch chronisch obstructief arterieel vaatlijden bij mannen en vrouwen in de leeftijdscategorie 45 tot 49 jaar geschat op respectievelijk 3,0% en 2,7% en bij personen in de leeftijdscategorie 70 tot 75 jaar op respectievelijk 18,2% en 10,8%. De prevalentie van symptomatisch chronisch obstructief arterieel vaatlijden in een open populatie wordt bij 40-jarigen geschat op 3% en bij 60-jarigen op 6%.
Op basis van de etiologie is het aannemelijk dat chronisch obstructief arterieel vaatlijden vaker voorkomt bij patiënten met klachten van chronisch obstructief arterieel vaatlijden aan het andere been. Het is belangrijk vooral bij ouderen alert te zijn op atherosclerose aan de andere kant en ook op tekenen van coronair en cerebraal vaatlijden.
De prevalentie van chronisch obstructief arterieel vaatlijden is hoger bij patiënten die roken en patiёnten met diabetes mellitus. Van 6979 patiënten ouder dan 70 jaar die rookten of bekend waren wegens diabetes mellitus, bleek 29% met de enkel-armindex vastgesteld chronisch obstructief arterieel vaatlijden te hebben.
In onderzoek van Ness werden geen verschillen in voorkomen van chronisch obstructief arterieel vaatlijden aangetoond tussen personen met verschillende achtergronden. . Echter, de prevalentie van chronisch obstructief arterieel vaatlijden bij mensen met een Afro-Amerikaanse achtergrond (in het artikel wordt gesproken over ‘blacks’) in de San Diego-studie is meer dan 2 maal zo hoog als bij de ‘witte, niet-Hispanic’ populatie (in het artikel wordt gesproken over ‘non-hispanic whites’). Dit verschil kon niet uitsluitend verklaard worden door het vaker voorkomen van diabetes mellitus en hypertensie. Deze bevindingen werden ook bevestigd in de GENOA-studie (Genetic Epidemiology Network of Arteriopathy).
Incidentie
De incidentie van acute ischemie wordt geschat op 0,14 per 1000 personen per jaar. De incidentie van chronisch obstructief arterieel vaatlijden in de Nederlandse huisartsenpraktijk (n = 2327), gemeten met de enkel-armindex, was 9,9 per 1000 personen per jaar (95%-BI 7,3 tot 18,8); bij mannen 7,8 (95%-BI 4,9 tot 20,3), bij vrouwen 12,4 (95%-BI 7,7 tot 24,8). Voor symptomatisch chronisch obstructief arterieel vaatlijden lag de incidentie op 1,0 per 1000 per jaar (95%-BI 0,7 tot 7,5); bij mannen 0,4 (95%-BI 0,3 tot 10), bij vrouwen 1,8 (95%-BI 1,0 tot 10,3). De incidentie neemt toe met de leeftijd. In de groep 25- tot 44-jarigen was de incidentie van claudicatio intermittens 0,5 per 1000 per jaar. Dit liep op tot 12,6 per 1000 per jaar bij personen van 75 jaar en ouder. De incidentie van kritieke ischemie wordt geschat op 0,5 tot 1 per 1000 personen per jaar.
Conclusie
Mannen ontwikkelen vaker en eerder claudicatioklachten dan vrouwen, bij beiden neemt de kans toe met hogere leeftijd. Er bestaat een verhoogde kans op gecombineerd voorkomen van perifeer arterieel vaatlijden, coronair vaatlijden en cerebraal vaatlijden. Perifeer arterieel vaatlijden komt vaker voor bij rokers en bij patiënten met diabetes mellitus en er zijn aanwijzingen dat de deze aandoening vaker voorkomt bij mensen met een donkere huidskleur.
Uit 2 patiëntcontroleonderzoeken (n = 280 en n = 784) en uit 1 cohortonderzoek (n = 3659) blijken de risicofactoren voor het ontwikkelen van perifeer arterieel vaatlijden: familiaire belasting voor hart- en vaatziekten, leeftijd, roken, diabetes, hypertensie, verhoogd cholesterol, verhoogd LDL-cholesterol, fibrinogeen en verhoogde cholesterol/HDL-cholesterol-ratio. Er zijn geen arbeidsgerelateerde risicofactoren bekend.
Perifeer arterieel vaatlijden is een uiting van gegeneraliseerde atherosclerose. Volgens een review kwam de aandoening samen met coronaire hartziekten voor bij 15,2% van de patiënten, samen met cerebraal vaatlijden bij 7,1% van de patiënten, en gecombineerd met beide bij 3,3% van de patiënten. In een populatieonderzoek waarin 474 patiënten met perifeer arterieel vaatlijden werden gevonden, bleek 29% van de mannen met perifeer arterieel vaatlijden ook een coronaire hartziekte te hebben, terwijl de prevalentie in de groep zonder perifeer arterieel vaatlijden 11% was. Voor vrouwen waren deze getallen respectievelijk 21% en 9%.
Er is consistent bewijs dat roken de meest belangrijke risicofactor is voor perifeer arterieel vaatlijden en dit risico dosisafhankelijk is. In een Rotterdams cohortonderzoek onder 6450 55-plussers bleek dat 69% van het aantal gevallen van perifeer arterieel vaatlijden kon worden toegeschreven aan bekende risicofactoren voor hart- en vaatziekten, waaraan roken met 18% de grootste bijdrage leverde. In populatieonderzoek onder 1592 patiënten van 55 tot 74 jaar die 5 jaar werden vervolgd bleek bij de rokers meer perifeer arterieel vaatlijden op te treden. Het effect van roken kon ten dele worden verklaard door een aantal andere factoren. De oddsratio voor roken en perifeer arterieel vaatlijden was voor zware rokers 3,94 (95%-BI 2,04 tot 7,62) en voor matige rokers 1,87 (95%-BI 0,91 tot 3,85). Na correctie voor factoren als gebruik van antioxidanten, bloeddruk, alcoholinname, HDL-cholesterol, bloedviscositeit, plasmafibrinogeen en factoren die door de vaatwand worden geproduceerd, zoals de von Willebrand-factor, bleef de oddsratio voor roken verhoogd bij zware rokers, maar nam af tot respectievelijk 2,72 (95%-BI 1,13 tot 6,63) en 1,70 (95%-BI 0,72 tot 3,99). Uit een Cochrane-review (17 studies) blijkt dat de prevalentie van perifeer arterieel vaatlijden onder huidige rokers 2,3 maal hoger is dan onder niet-rokers. Er is sprake van een dosisresponsrelatie. Ook in ander cohortonderzoek (n = 3659) is aangetoond dat roken de belangrijkste risicofactor is voor perifeer arterieel vaatlijden. De incidentie van claudicatio intermittens is 1 jaar na het stoppen met roken vergelijkbaar met die van niet-rokers.
Diabetes mellitus is een andere belangrijke risicofactor voor perifeer arterieel vaatlijden. Ook blijkt de duur en de ernst van de diabetes de hoogte van het risico te beïnvloeden.
De meeste onderzoeken laten een associatie zien tussen hypertensie en perifeer arterieel vaatlijden. De interpretatie van deze bevindingen is lastig omdat de bloeddruk onderdeel uitmaakt van de definitie van de aandoening (enkel-armindex) en mede de mate van ischemie en de symptomen beïnvloedt. Zo was in de Limburg PAOD-studie hypertensie geassocieerd met hoger risico (RR = 2,8) op perifeer arterieel vaatlijden en in de Rotterdam studie was een EAI < 0,90 geassocieerd met zowel een hogere systolische als een hogere diastolische bloeddruk.
Een hoog totaalcholesterolgehalte en een laag HDL-cholesterolgehalte zijn onafhankelijke risicofactoren voor perifeer arterieel vaatlijden. Uit de US Physicians Health Study blijkt dat de totaal cholesterol/HDL-cholesterol-ratio de maat was die het meest correleerde met perifeer arterieel vaatlijden.
Er is inconsistent bewijs voor overige risicofactoren zoals obesitas en een verhoogde homocysteïnespiegel. Cohortonderzoeken naar een eventueel beschermend effect van geringe alcoholconsumptie laten tegenstrijdige resultaten zien.
Conclusie
Er is consistent bewijs dat de risicofactoren voor perifeer arterieel vaatlijden gelijk zijn aan die voor coronair en cerebraal vaatlijden en de typische risicofactoren voor atherosclerose: een hogere leeftijd (> 70 jaar), familiaire belasting voor hart- en vaatziekten, roken, diabetes mellitus, hypertensie en hypercholesterolemie.
Claudicatio intermittens
Naar Samenvatting ›- De meeste patiënten die de huisarts bezoeken met perifeer arterieel vaatlijden, hebben klachten van claudicatio intermittens.
- De patiënt omschrijft kenmerkende klachten in de beenspieren (bil, dijbeen, kuit) die optreden bij lopen:
- pijn (zelden hevig)
- moe en stijf gevoel
- krampen.
- Bij stilstaan verdwijnen de klachten, maar ze komen terug als de patiënt verder loopt.
- Als de patiënt sneller loopt of een heuvel op gaat, ontstaan de klachten eerder.
- De patiënt heeft geen klachten als hij zit of staat.
- Soms is er een eenzijdig koudegevoel in de voet.
Kritieke ischemie
Naar Samenvatting ›- Bij kritieke ischemie zijn er pijnklachten aan voet of been in rust en/of trofische stoornissen aan voet of been.
- De met een dopplerapparaat gemeten systolische enkeldruk is < 50 mmHg.
- Meestal is er sprake van hevige pijn, vooral in de voorvoet en aan de tenen.
- In het begin heeft de patiënt alleen ’s nachts last door het wegvallen van de zwaartekracht.
- Bij veel patiënten vermindert de pijn als ze het been buiten het bed laten afhangen of als ze even uit bed gaan.
- Gevolgen van kritieke ischemie:
- verminderde huidcirculatie (zoals koude, dove voeten)
- nagelafwijkingen
- verminderde haargroei op tenen en onderbenen
- slecht genezende huidwondjes
- soms is de voet ook wat gezwollen en erythemateus
- Bij ernstigere vormen zijn er ulcera of is er (dreigende) necrose of gangreen aan de voet.
Prognose
Naar Samenvatting ›- Het beloop van chronisch obstructief arterieel vaatlijden is doorgaans weinig progressief:
- bij ongeveer 15% van de patiënten treedt op termijn kritieke ischemie op
- 2% ondergaat een amputatie < 10 jaar na diagnose
- Factoren die de prognose negatief beïnvloeden, zijn:
- leeftijd > 70 jaar
- familiaire belasting voor hart- en vaatziekten
- roken
- ernstige klachten
- aanwezigheid van vernauwingen op meerdere niveaus
- coronaire en cerebrovasculaire aandoeningen
- diabetes mellitus
- lage enkel-armindex (zie Details).
- De levensverwachting is ca. 10 jaar korter dan die van personen zonder chronisch obstructief arterieel vaatlijden.
- De kans op andere hart- en vaatziekten is 3 × zo hoog als bij personen zonder chronisch obstructief arterieel vaatlijden (zie Details).
Bij patiënten die bekend zijn wegens claudicatio intermittens wordt de prognose mede bepaald door cardiale en cerebrale klachten. Bij patiënten met claudicatio intermittens neemt de enkel-armindex jaarlijks af met gemiddeld 0,014. Op lange termijn herstelt 25% van deze groep spontaan, blijft 30 tot 50% onveranderd en krijgt 25% meer klachten.
Het risico op kritieke ischemie in deze groep met claudicatioklachten is ongeveer 15%. Twee procent ondergaat een amputatie binnen 10 jaar na het stellen van de diagnose. In het eerste jaar na het stellen van de diagnose claudicatio intermittens is de kans op klinische verslechtering of operatie groter dan daarna.
Patiënten met kritieke ischemie hebben een grotere kans op amputatie of overlijden. De mortaliteit na 1 jaar bij deze groep wordt geschat op 20%. Bij patiënten met kritieke ischemie en diabetes mellitus is de prognose nog slechter; 26% overlijdt binnen 1 jaar vergeleken met 14% bij patiënten zonder diabetes.
De prognose na een grotere amputatie is slecht. Van de patiënten met een amputatie onder kniehoogte ondergaat 15% binnen 2 jaar een amputatie boven kniehoogte, 15% ondergaat een amputatie aan de contralaterale zijde. Binnen 5 jaar overlijdt 30% door een vasculaire oorzaak en 5 tot 10% door een niet-vasculaire oorzaak.
Uit een cohortonderzoek (n = 3659) blijkt dat een lage enkel-armindex gepaard gaat met een grotere kans op progressie van ischemie van het been en een grotere kans op cardiovasculaire morbiditeit en mortaliteit.
Bij patiënten met claudicatio is de levensverwachting ongeveer 10 jaar verkort, vooral door sterfte aan andere hart- en vaatziekten dan perifeer arterieel vaatlijden. Uit grote follow-uponderzoeken (meer dan 3000 patiënten) blijkt dat een lage enkel-armindex een goede voorspeller is van de totale mortaliteit bij patiënten met perifeer arterieel vaatlijden. Bij het stellen van de diagnose heeft ongeveer de helft van de patiënten al coronaire afwijkingen (blijkend uit klachten of afwijkingen op het ECG) en heeft eenvijfde een cerebrovasculaire ziekte (anamnestisch of aantoonbaar bij lichamelijk en aanvullend onderzoek).
Bij patiënten met diabetes mellitus blijkt een enkel-armindex ≤ 0,9 geassocieerd met een sterk verhoogd risico voor een amputatie binnen een follow-upperiode van 7 jaar. Omdat de progressie van perifeer arterieel vaatlijden niet in beide benen hetzelfde hoeft te zijn, is het noodzakelijk dat bij follow-up de klachten aan beide benen worden gevolgd.
Conclusie
Bij claudicatio intermittens is de prognose doorgaans weinig progressief. Bij ongeveer 15% van de patiënten met claudicatio intermittens treedt kritieke ischemie op. Uiteindelijk ondergaat op termijn 5% van deze patiënten een vaatoperatie en 2% een amputatie.
Patiënten met chronisch obstructief arterieel vaatlijden hebben vergeleken met gezonde personen een geringer loopuithoudingsvermogen, een lagere loopsnelheid en een lager lichamelijke fitheid. In een populatie bestaande uit mensen met en zonder chronisch obstructief arterieel vaatlijden blijkt dat lagere waarden voor de enkel-armindex geassocieerd zijn met meer functionele beperkingen en een snellere functionele achteruitgang vergeleken met personen met hogere enkel-armindexwaarden.
De kwaliteit van leven is bij mannen en vrouwen met claudicatio in gelijke mate verminderd. Dit hangt niet alleen samen met de loopafstand, maar ook met de subjectieve mate van mobiliteit en onafhankelijkheid, alsmede cardiovasculaire comorbiditeit en de aanwezigheid van rug-, heup- en knieklachten. Uit vergelijkend onderzoek onder patiënten met claudicatio intermittens en een controlegroep blijkt dat de eerstgenoemde groep zich minder energiek voelt, minder mobiel is, meer pijn heeft, sneller emotioneel reageert en slechter slaapt. De claudicatiopatiënten zijn vooral beperkt in hun huishoudelijke, sociale en vakantieactiviteiten. De beperkte mobiliteit is daarbij de verbindende onderliggende factor. Er is een geringe correlatie tussen de enkel-armindex en scores op de SF36-lijst en Walking Impairment Questionnaire (vragenlijsten voor het evalueren van respectievelijk de kwaliteit van leven en de loopfunctie).
De kwaliteit van leven, gemeten in een patiëntcontroleonderzoek (n = 214), verbeterde direct na een operatie bij patiënten met claudicatioklachten, maar niet als er al kritische ischemie was opgetreden. In een ander patiëntcontroleonderzoek onder 146 patiënten bleek dat de kwaliteit van leven toenam met de doorgankelijkheid van de vaten na operatie, maar na een follow-upperiode van een jaar niet het niveau van gezonden bereikte.
Conclusie
Patiënten met chronisch obstructief arterieel vaatlijden hebben een verminderde kwaliteit van leven die niet alleen samenhangt met een verminderde loopafstand.
Richtlijnen diagnostiek
Naar Samenvatting ›Anamnese
Naar Samenvatting ›- Besteed aandacht aan klachten die passen bij:
- acute ischemie (pijn in rust, afwezige pulsaties, veranderde kleur en temperatuur (van de voet), doof gevoel en/of spierzwakte)
- claudicatio intermittens (spierpijn in de bilregio of het been bij inspanning)
- kritieke ischemie (spierpijn aan de voet in rust)
- Besteed aandacht aan de invloed van de klachten op de kwaliteit van leven.
- Besteed aandacht aan risicofactoren voor hart- en vaatziekten.
Aard en beloop van de klachten
Naar Samenvatting ›- Vraag hoe lang de klachten bestaan.
- Vraag of er (snelle) progressie is.
- Informeer naar klachten die wijzen op acute ischemie van het been:
- pijn in rust
- gevoelsstoornissen (doof gevoel)
- spierzwakte
- bleekheid.
- Informeer naar klachten die passen bij claudicatio intermittens:
- pijn of andere vervelende sensaties (moe, stijf, krampen, temperatuurverschillen) in een spiergroep van de bilregio of het been, die optreden bij inspanning en verminderen in rust
- links-rechtsverschil
- Informeer naar klachten die wijzen op kritische ischemie van het been:
- rustpijn en/of nachtelijke pijn (vooral in de voorvoet of tenen), die afneemt als de patiënt opstaat of het aangedane been laat hangen
- afwijkingen aan de huid of nagels van de voeten, zoals wondjes of zweertjes
Kwaliteit van leven
Naar Samenvatting ›- Informeer naar beperkingen in lichamelijke activiteiten (ook seksuele), werk of alledaagse bezigheden.
- Vraag hoe groot de maximale loopafstand is (≤ 100 m?)
- Vraag naar het gebruik van vaatvernauwende medicatie zoals bètablokkers en ergotamine
Risicofactoren voor hart- en vaatziekten
Naar Samenvatting ›- Leeftijd ≥ 50 jaar
- Doorgemaakte hart- en vaatziekten, diabetes mellitus, of reumatoïde artritis
- Geslacht (mannen hoger risico dan vrouwen)
- Roken
- Familieanamnese (hart- en vaatziekten voor het 65e levensjaar bij ouders, broers of zusters)
- Voedingspatroon (afwijkend van de richtlijnen goede voeding)
- Overmatig alcoholgebruik (vrouwen meer dan 1-2 glazen/dag, mannen meer dan 2-3 glazen/dag)
- Gebrek aan lichamelijke activiteit (< 5 dagen per week 30 min/dag, bijvoorbeeld fietsen, stevig wandelen of tuinieren).
Lichamelijk onderzoek
Naar Samenvatting ›- Let bij de beoordeling op links-rechtsverschillen.
- Meet ook de bloeddruk (zie Details).
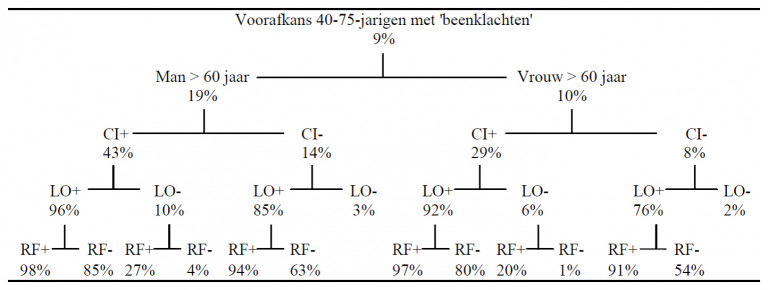
Als patiënten met beenklachten zich presenteren met typische claudicatio intermittens, is de kans dat ze perifeer arterieel vaatlijden hebben 30 tot 45%. Hebben ze geen claudicatioklachten, dan is de kans dat ze geen perifeer arterieel vaatlijden hebben 93%.
In tabel 4 worden de voorafkans en de achterafkans op perifeer arterieel vaatlijden bij ouderen afhankelijk van de aanwezigheid van claudicatioklachten en de bevindingen bij lichamelijk onderzoek weergegeven.
CI = claudicatio intermittens: CI + = aanwezig; CI − =afwezig.
LO = lichamelijk onderzoek: temperatuurverschil huid, afwijkende voetpulsaties (a. tibialis posterior, a. dorsalis pedis), souffle a. femoralis. LO+ = 1 bevinding positief; LO- = alle bevindingen negatief.
RF = risicofactoren en voorgeschiedenis: coronair lijden in voorgeschiedenis, diabetes mellitus in voorgeschiedenis, roken, hoge bloeddruk. RF+ = één risicofactor positief; RF- = alle risicofactoren ontbreken.
| Item | Sensitiviteit (%) | Specificiteit (%) | LR+ | LR- |
|---|---|---|---|---|
| Afwijkende voetpulsaties | 63-95 | 73-99 | 3,0-44,5 | 0,1-0,4 |
| Geruis over a. femoralis | 20-29 | 96 | 4,7-5,7 | 0,8 |
| Eenzijdig koud onderbeen | 10 | 98 | 5,8 | 0,9 |
| Afwijkende kleur | 24-35 | 87 | 1,6-2,8 | 0,7-0,9 |
| Verlengde capillaire refill | 25-28 | 85 | 1,6-1,9 | 0,9 |
| Trofische veranderingen | 43-50 | 71 | 1,4-1,6 | 0,8 |
| LR = ‘likelihood’-ratio van een positieve (+) of negatieve (-) testuitslag. De ‘likelihood’-ratio of aannemelijkheidscoëfficiënt is bij een positieve testuitslag (LR+ = Se/(1-Sp)) de verhouding tussen de kans op een positieve testuitslag bij personen met de ziekte en de kans op een positieve testuitslag bij personen zonder de ziekte (waarde zo hoog mogelijk). De ‘likelihood’-ratio bij een negatieve testuitslag (LR- = (1-Se)/Sp) geeft de verhouding aan tussen de kans op een negatieve testuitslag bij personen met de ziekte en de kans op een negatieve testuitslag bij personen zonder de ziekte (waarde zo dicht mogelijk bij nul). |
||||
Een systematisch literatuuronderzoek van 17 artikelen (n = 2455) naar de waarde van bevindingen bij lichamelijk onderzoek laat een vergelijkbaar beeld zien.
De bevindingen met een hoge specificiteit staan vermeld in tabel 5. De sensitiviteit ervan is echter laag, met uitzondering van de afwijkende voetpulsaties. Dit betekent dat voetpulsaties vaak ontbreken bij patiënten met perifeer arterieel vaatlijden. De positieve ‘likelihood’-ratio voor abnormale pulsaties, een souffle over de a. femoralis en een eenzijdig koud onderbeen is redelijk. Daarmee is de achterafkans bij aanwezigheid van dit kenmerk bij lichamelijk onderzoek wel duidelijk hoger dan de voorafkans.
Over de diagnostische betekenis van combinaties van klinische gegevens zijn de resultaten beschikbaar van onderzoek dat is uitgevoerd in 18 Nederlandse huisartsenpraktijken (n = 3654). Alle personen van 45 tot 80 jaar kregen een vragenlijst over klachten en risicofactoren met betrekking tot vaatlijden. Uit de groepen met een lage en een hoge risicoscore werden steekproeven getrokken, die werden uitgenodigd voor nader onderzoek, waarbij onder andere een enkel-armindex werd bepaald. Met behulp van multivariate analyses kon worden bepaald dat 10 klinische kenmerken onafhankelijk van elkaar de kans op perifeer arterieel vaatlijden verhogen: mannelijk geslacht (OR 1,5), leeftijd > 60 jaar (OR 2,2), claudicatioklachten (OR 3,5), bij palpatie aan de ene voet een lagere huidtemperatuur dan aan de andere (OR 2,5), afwijkingen in pulsaties van de voetslagaders (OR 7 tot 16, dat wil zeggen een OR van 7 bij twijfel over de pulsaties en een OR van 16 bij ontbreken van de pulsaties), souffle over de a. femoralis bij auscultatie (OR 3,5), roken (OR 2,1), verhoogde bloeddruk bij lichamelijk onderzoek (OR 1,5), coronair lijden (OR 1,7) en diabetes mellitus (OR 1,6) in de voorgeschiedenis.
Conclusie
Er is bewijs dat het lichamelijk onderzoek een belangrijke bijdrage levert aan de klinische diagnostiek. Als de beide voetarteriën goed palpabel zijn, sluit dit perifeer arterieel vaatlijden vrijwel uit (negatief voorspellende waarde van 98%); zijn beide voetarteriën niet palpabel, dan is de positief voorspellende waarde circa 40%. Voor het met voldoende zekerheid stellen van de diagnose kan men bij de meeste patiënten niet volstaan met anamnese en lichamelijk onderzoek en is bepaling van de enkel-armindex ondersteunend.
Tekenen die passen bij acute ischemie van het been
Naar Samenvatting ›Arterieel
Naar Samenvatting ›- Ontbrekende arteriële pulsaties bij palpatie van a. tibialis posterior, a. dorsalis pedis en/of a. femoralis (palpeer de a. poplitea als de a. femoralis pulseert, maar palpaties over de voetarteriën ontbreken)
- Souffle bij auscultatie van de a. femoralis met behulp van de stethoscoop (let op dat te grote druk van de stethoscoop een artificiële souffle kan opwekken)
- Lagere huidtemperatuur van voet en onderbeen bij palpatie met de handrug
- Bleekheid van het been
Neurologisch
Naar Samenvatting ›- Gevoelsstoornissen van het been (vaak de interdigitale ruimte of de voetrug tussen 1e en 2e straal)
- Spierzwakte van het been (vaak zwakte of motorische uitval van de intrinsieke voetspieren)
Tekenen die passen bij chronisch obstructief arterieel vaatlijden
Naar Samenvatting ›- Verzwakte arteriële pulsaties bij palpatie van a. tibialis posterior, a. dorsalis pedis en/of a. femoralis
- Souffle bij auscultatie van de a. femoralis
- Lagere huidtemperatuur van voeten en onderbenen bij palpatie met de handrug
- Trofische stoornissen: beoordeel de huid (vooral van de tenen, met aandacht voor wondjes), nagels, beharing van voeten en onderbenen
Aanvullend onderzoek
Naar Samenvatting ›Bij goed pulserende voetarteriën en atypische klachten is de kans op perifeer arterieel vaatlijden zeer klein en is aanvullend onderzoek niet nodig.
Acute ischemie
Naar Samenvatting ›Bij ontbrekende arteriële pulsaties van de enkelslagaders en neurologische uitval (gevoelsstoornissen en/of spierzwakte van de benen): verwijs naar een vaatchirurg voor aanvullend onderzoek naar de oorzaken en interventiemogelijkheden.
Chronisch obstructief arterieel vaatlijden
Naar Samenvatting ›- Bij slechts een kleine groep kan chronisch obstructief arterieel vaatlijden met zekerheid worden aangetoond op basis van anamnese en lichamelijk onderzoek
- Kenmerkende claudicatioklachten alleen zijn niet bewijzend.
- Bepaal de enkel-armindex in de volgende situaties:
- klachten van claudicatio intermittens
- huidtemperatuur van 1 voet duidelijk lager dan van de andere voet
- afwijkende pulsaties van de a. tibialis posterior en/of a. dorsalis pedis aan 1 voet
- souffle bij auscultatie van de a. femoralis
Enkel-armindex
Naar Samenvatting ›- Bepaal bij een vermoeden van chronisch obstructief arterieel vaatlijden met een dopplerapparaat de enkel-armindex: de hoogste systolische druk in de a. dorsalis pedis of a. tibialis posterior van een enkel, gedeeld door de hoogste systolische druk in de a. brachialis van beide armen (zie figuur 1).
- een enkel-armindex in rust > 1 wijst op een goede arteriële beencirculatie
- een enkel-armindex in rust < 0,9 ondersteunt de diagnose ‘chronisch obstructief arterieel vaatlijden’ (zie Details)
- Meet de enkel-armindex in rust, met de patiënt in rugligging (in een vaatlaboratorium kan de index ook na inspanning bepaald worden).
- Bepaal de enkel-armindex voor ieder been afzonderlijk.
- Bepaal de enkel-armindex na het stellen van de diagnose alleen opnieuw als het klinische beeld daartoe aanleiding geeft.
- Voor de praktische uitvoering zie tabel 1 (zie Details).
|
Methode |
|
|---|---|
|
Patiënt |
|
|
Materiaal |
|
|
Plaatsing van de manchet |
|
|
Meten van de systolische bloeddruk |
|
|
Volgorde |
|
|
Bepaling van de enkel-armindex |
|
- De testeigenschappen van de enkel-armindex zijn afhankelijk van de vaardigheid van degene die de test uitvoert.
- Maak in de eigen praktijk duidelijke afspraken over doppleronderzoek en zorg voor voldoende scholing, ervaring en routine van de uitvoerende (bijvoorbeeld de praktijkmedewerker) (zie Details).
- Verwijs voor de bepaling van de enkel-armindex naar een vaatchirurg indien deze in de eigen praktijk of bij een vaatfunctieafdeling in een diagnostisch centrum niet mogelijk is, maak daarbij afspraken over terugverwijzing.
Bij een vermoeden van perifeer arterieel vaatlijden op basis van klinische symptomen is de enkel-armindex ondersteunend voor het stellen van de diagnose.
Afkappunt
Een enkel-armindex kleiner dan 0,9 geldt als criterium voor chronisch obstructief arterieel vaatlijden. Waarden van 0,9 tot 1,0 moeten geïnterpreteerd worden in het kader van overige klinische risicofactoren (bijvoorbeeld roken en hogere leeftijd). Uit 4 populatie-onderzoeken blijkt dat kans op een enkel-armindex kleiner dan 0,9 voor mensen met een donkere huidskleur zonder chronisch obstructief arterieel vaatlijden groter is dan voor mensen met een blanke huidskleur.
Validiteit
In een Nederlands onderzoek (n = 117) is de waarde van de enkel-armindex bij patiënten met klachten van chronisch obstructief arterieel vaatlijden in de huisartspraktijk onderzocht door de uitkomsten te vergelijken met de resultaten van onderzoek naar vernauwingen (duplexscan) in een vaatlaboratorium. Bij het afkappunt van 0,9 werd een sensitiviteit van 82% en een specificiteit van 98% gevonden.
In een systematisch literatuuronderzoek (8 onderzoeken) werden de sensitiviteit en specificiteit van de enkel-armindex in verschillende populaties, inclusief patiënten met diabetes mellitus, geschat. De sensitiviteit en specificiteit van de enkel-armindex gemeten met de dopplermethode en een afkappunt kleiner dan of gelijk aan 0,9 varieerden van respectievelijk 69 tot 79% (met een outlier van 20%) en 83 tot 99%. De sensitiviteit was lager bij patiënten met diabetes mellitus. De area under the ROC-curve (overall maat voor de diagnostische waarde) voor de dopplermethode bedraagt 0,87 tot 0,95.
Een verband tussen een lage enkel-armindex en een snellere functionele achteruitgang is niet aangetoond. Omgekeerd leidt een verbetering van het klinisch beeld (verbetering van de loopafstand), niet direct tot een verhoging van de enkel-armindex. De enkel-armindex is echter maar een van de factoren die de functionele activiteit voorspelt (naast bijvoorbeeld spiersamenstelling, spierkracht, mitochondriale functie en gedragsmatige aspecten).
Evaluatie na revascularisatie
De enkel-armindex kan niet onafhankelijk van andere bevindingen gebruikt worden voor evaluatie na revascularisatie. Bij een daling van de enkel-armindex met een waarde van 0,10 en 0,15 voor het voorspellen van een residuale stenose > 50% bij patiënten na angioplastiek wordt de sensitiviteit geschat op respectievelijk 79% en 65% en de specificiteit op respectievelijk 92% en 100%. De diagnostische waarde van de enkel-armindex na revascularisatie is gering omdat het slechts een globale maat is voor de totale perfusie in het been en niet differentieert tussen een niet goed functionerende bypass en progressie van perifeer vaatlijden in de andere arteriën.
Hoge waarden bij diabetes mellitus
Bij calcificatie van de enkel-arteriën (media-sclerose of mönckebergsclerose) kan de systolische enkeldruk veel hoger zijn of kan de enkelarterie niet volledig comprimeerbaar zijn. Dit doet zich onder andere voor bij diabetes mellitus en ernstige nierschade. Bij patiënten met diabetes mellitus is de enkel-armindex daarom niet altijd betrouwbaar. Bij ongeveer 5% van de patiënten met chronisch obstructief arterieel vaatlijden en diabetes mellitus is de enkel-armindex normaal (groter dan 1,1), terwijl er wel sprake is van chronisch obstructief arterieel vaatlijden.
Conclusie
Er is consistent bewijs dat bij een vermoeden van chronisch obstructief arterieel vaatlijden op basis van klinische symptomen en bevindingen de enkel-armindex bepaling ondersteunend is voor het stellen van de diagnose. Het criterium voor de diagnose chronisch obstructief arterieel vaatlijden is een enkel-armindex < 0,9.
Gebrekkige standaardisatie
Uit een review over onderzoeken waarin de enkel-armindex werd bepaald blijkt dat er veel variatie bestaat in de wijze van uitvoering. De uitgangshouding van de patiënt, de breedte van de band, de plaatsing van de band op arm en been en de methode om de pulsaties aan de arm en de enkels te meten lopen uiteen. Ook is er geen uniformiteit ten aanzien van het doen van bilaterale metingen aan de armen, de keus van de arteriën aan de enkel die gebruikt worden en het doen van herhaalde metingen. Standaardisatie van de uitvoering is wenselijk.
Praktische uitvoering
Voor de uitvoering van de enkel-armindexbepaling geeft de American Heart Association de aanbevelingen die vermeld staan in tabel 1.
Uitvoerbaarheid in de huisartsenpraktijk
Bepaling van de enkel-armindex is goed uitvoerbaar in de huisartsenpraktijk, duurt gemiddeld 17 minuten en kan worden gedelegeerd aan de praktijkassistente. De bepaling wordt ook routinematig verricht in vaatfunctieafdelingen van ziekenhuizen en in een aantal diagnostische centra.
De huisarts die het dopplerapparaat voor de bepaling van de enkel-armindex in de praktijk wil gebruiken, zal ervaring moeten opbouwen en onderhouden. Het verdient aanbeveling deze taak te delegeren naar één persoon in een huisartsengroep of (groeps)praktijk, bijvoorbeeld een praktijkassistente of praktijkondersteuner. Bepaling van de enkel-armindex vergt circa 20 minuten.
Interpretatie van de metingen
De enkel-armindex reduceert de onzekerheid over de diagnose chronisch obstructief arterieel vaatlijden bij claudicatioklachten tot 10%. Bij de bepaling van de enkel-armindex moet rekening worden gehouden met de biologische en meetvariabiliteit. Uit een onderzoek in 3 Nederlandse gezondheidscentra bij 117 patiënten, waarbij de enkel-armindex − bepaald door huisartsen of praktijkassistenten − vergeleken werd met de bevindingen van het vaatlaboratorium, zijn de volgende interpretaties van de waarden van de enkel-armindex bij patiënten uit de huisartsenpraktijk afgeleid, die ook internationaal worden gehanteerd :
- chronisch obstructief arterieel vaatlijden is vrijwel zeker aanwezig (kans > 95%) bij een eenmalig gemeten enkel-armindex < 0,8 of een gemiddelde van 3 metingen < 0,9;
- chronisch obstructief arterieel vaatlijden is vrijwel uitgesloten (kans > 99%) bij een eenmalige enkel-armindex > 1,1 of een gemiddelde van 3e metingen > 1,0.
Conclusie
Voor het bepalen van de enkel-armindex adviseert de werkgroep de adviezen van de American Heart Association te volgen.
Als aanvulling op de bepaling van de enkel-armindex in rust zijn meerdere diagnostische modaliteiten voor de planning tot een interventie beschikbaar:
- looptest;
- duplexscanning;
- CT-angiografie (CTA);
- magnetische resonantieangiografie (MRA).
Looptest: de diagnostische waarde is slechts marginaal hoger (toename van de oppervlakte onder de ROC-curve met 1,6%) indien de enkel-armindex bepaald wordt na het lopen op een loopband bij de totale populatie patiënten met de diagnose chronisch obstructief arterieel vaatlijden. Tijdens het lopen treedt (ook bij gezonde proefpersonen) een lichte daling van de enkel-armindex op. Deze daling is echter meer uitgesproken bij twijfelgevallen (relatief jonge vrouwen met iliacale stenosen) met een enkel-armindex tussen 0,9 en 1,0. Daarnaast is bij patiënten met perifeer arterieel vaatlijden de hersteltijd tot de uitgangswaarde in rust langer dan die bij gezonde proefpersonen.
De enkel-armindex wordt een aantal malen bepaald nadat de patiënt op een loopband gelopen heeft. De looptest heeft twee belangrijke voordelen. Ten eerste kan arteriële insufficiëntie beter worden opgespoord door daling van de enkel-armindex tijdens het lopen (een gevolg van spierarbeid). Ten tweede kunnen de pijnvrije en de maximale loopafstand worden beoordeeld. Een daling van de index > 30% ten opzichte van de rustindex of een absolute daling van de enkeldruk > 20 mmHg heeft een hoge sensitiviteit (> 90%) voor de detectie van arteriële afwijkingen. De specificiteit varieert van 75 tot 100%. Een belangrijk nadeel van de looptest is dat de uitvoering buiten het vaatlaboratorium nauwelijks gestandaardiseerd is. Gebruik in de huisartsenpraktijk wordt daarom niet aanbevolen.
De American Heart Association adviseert bij een vermoeden van perifeer arterieel vaatlijden en een enkel-armindex > 0,9 de enkel-armindex te bepalen na het lopen op een loopband of de teen-armindex te bepalen. Een daling van de systolische enkeldruk > 30 mmHg of een daling van de enkel-armindex > 0,20 na lopen op een loopband zijn eveneens diagnostisch criterium voor chronisch obstructief arterieel vaatlijden. In Nederland hanteren de Nederlandse Vereniging voor Heelkunde en de Nederlandse Vereniging voor Radiologie een daling > 0,15 na inspanning als een extra criterium voor perifeer arterieel vaatlijden.
Beeldvormende diagnostiek
Indien, na een onvoldoende resultaat na looptraining, een invasieve therapie wordt overwogen, dient beeldvormend onderzoek te worden verricht, waarbij angiografie (multidetector CT-angiografie (CTA) en magnetische resonantieangiografie (MRA)) het referentieonderzoek is. Afhankelijk van lokale expertise en mogelijkheden kan gekozen worden voor duplexscanning of angiografie (CTA/MRA). Ook voor het maken van een behandelplan bij kritieke ischemie, in het bijzonder bij afwijkingen in het onderbeen, is CTA/MRA het referentieonderzoek.
Duplexscanning
Bij een duplex wordt een doppleronderzoek gecombineerd met echografie. Het onderzoek is geheel pijnloos en onschadelijk. Hiermee kunnen de aard en de ernst van de afwijking in het bloedvat in beeld worden gebracht. Tegelijkertijd wordt met het doppleronderzoek de invloed van de afwijking op de stroomsnelheid van het bloed in het aangedane bloedvat bepaald. Het onderzoek is tijdrovend en vereist deskundigheid. Met duplexonderzoek kan een groot deel van het vaatstelsel betrouwbaar in beeld worden gebracht. De betrouwbaarheid is voldoende om patiënten te selecteren voor een dotterbehandeling (percutane transluminale angioplastiek (PTA)). De resultaten van een meta-analyse toonden een sensitiviteit aan van 80 tot 86% en een specificiteit van > 95% voor de detectie van hemodynamisch significante stenosen en occlusies in de aorto-iliacale en femoropopliteale arteriën vergeleken met de ‘gouden standaard’-angiografie. Het is niet te verwachten dat deze resultaten kunnen worden verbeterd, aangezien angiografie en duplexscanning beide onderhevig zijn aan een zekere mate van interwaarnemervariatie. Op basis van het resultaat van de duplexscan kan veelal worden beoordeeld of een patiënt in aanmerking komt voor een PTA of een operatie. Indien PTA mogelijk lijkt, kan de patiënt direct worden gepland voor deze interventie, zonder eerst nog diagnostische angiografie te verrichten. Aanvullende angiografische opnamen kunnen zo nodig tijdens de percutane interventie worden gemaakt. Bij een dergelijke werkwijze blijkt dat een PTA in ongeveer 80 tot 90% succesvol kan worden uitgevoerd. Indien duplexscanning uitwijst dat PTA niet mogelijk is, kan worden gekozen voor operatie of conservatieve behandeling. Als voor operatie wordt gekozen, is voor het bepalen van de chirurgische reconstructie vaak nog aanvullende angiografie noodzakelijk.
Angiografie (CTA en MRA)
Angiografie is de onderzoeksmethode met de meest betrouwbare informatie over een bloedvat. In een meta-analyse werd de sensitiviteit en specificiteit van multidetector CT-angiografie (CTA) (6 studies) en van magnetische resonantieangiografie (MRA) (7 studies) voor de diagnose van symptomatisch perifeer arterieel vaatlijden onderzocht met contrastangiografie als referentietest. De sensitiviteit voor CTA bedraagt 91% (89 tot 99%) en de specificiteit 91% (83 tot 97%). De sensitiviteit voor MRA bedraagt 95% (92 tot 99,5%) en de specificiteit 97% (64 tot 99%). In Nederland hebben anno 2013 de CTA en de MRA de diagnostische intra-arteriële angiografie DSA (digitale subtractieangiografie) vervangen.
Conclusie:
Bij een vermoeden van chronisch obstructief arterieel vaatlijden en een enkel-armindex > 0,9 kan in een vaatlaboratorium de enkel-armindex na het lopen op een loopband of de teen-armindex bepaald worden. Een daling van de enkel-armindex > 0,15 na lopen op een loopband is eveneens diagnostisch criterium voor chronisch obstructief arterieel vaatlijden. Aan de hand van de resultaten van de duplexscan, CTA of MRA kan worden beoordeeld of een patiënt in aanmerking komt voor een percutane transluminale angioplastiek (PTA) of een operatie.
Laboratoriumonderzoek
Naar Samenvatting ›Voor laboratoriumonderzoek in het kader van cardiovasculair risicomanagement, zie NHG-Standaard Cardiovasculair risicomanagement.
Kritieke ischemie
Naar Samenvatting ›- Verwijs naar een vaatchirurg voor aanvullend onderzoek en het maken van een behandelplan
- In het bijzonder bij afwijkingen in het onderbeen, is multidetector CT-angiografie (CTA) en magnetische resonantieangiografie (MRA) het referentieonderzoek.
Evaluatie
Naar Samenvatting ›Acute ischemie
Naar Samenvatting ›- Schat de ernst van de ischemie in op basis van de klinische verschijnselen:
- ontbrekende arteriële pulsaties van de enkelslagaders
- spierzwakte en/of gevoelsstoornissen
- In de 2e lijn worden deze tekenen gebruikt voor het bepalen van het behandelplan (zie Details).
De gemodificeerde SVS/ISCVS (Society for Vascular Surgery/International Society for Cardiovascular Surgery)-classificatie is een nuttige indeling bij acute ischemie voor het inschatten van de ernst van de ischemie en het daaruit voortvloeiende behandelplan in de tweede lijn (tabel 7). Deze indeling wordt gebruikt in nationale en internationale richtlijnen.
| Categorie | Motorische uitval | Sensibiliteitsverlies | Doppler arterieel | Conclusie |
|---|---|---|---|---|
| I Niet vitaal bedreigd | geen | geen | aanwezig | niet acuut bedreigd |
| IIa Minimaal bedreigd | geen | geen of minimaal (tenen) | (vaak) afwezig | in principe te behouden |
| IIb Ernstig bedreigd | mild-matig | meer dan tenen, rustpijn | (meestal) afwezig | in principe te behouden |
| III Irreversibel beschadigd | uitgesproken paralyse | uitgesproken gevoelloosheid | afwezig | ernstig weefselverlies en zenuwletsel |
Chronisch obstructief arterieel vaatlijden
Naar Samenvatting ›- Stel de diagnose ‘chronisch obstructief arterieel vaatlijden’ op basis van anamnese en lichamelijk onderzoek, eventueel aangevuld met de enkel-armindex.
- De enkel-armindex ondersteunt de diagnose en is geen maat voor de ernst van de klachten; voor het evalueren van het beloop zijn de klachten leidend.
- Interpretatie van de enkel-armindex (zie tabel 2):
- < 0,8 (eenmalige bepaling) of < 0,9 (gemiddelde van 3 bepalingen): chronisch obstructief arterieel vaatlijden vrijwel zeker (kans > 95%)
- 0,9-1,0: chronisch obstructief arterieel vaatlijden niet zeker, overweeg alternatieve diagnosen of verwijs voor nadere diagnostiek bij een aanhoudend vermoeden van chronisch obstructief arterieel vaatlijden
- > 1,1 (eenmalige bepaling) of > 1,0 (gemiddelde van 3 bepalingen): chronisch obstructief arterieel vaatlijden vrijwel uitgesloten (kans < 1%)
|
Enkel-armindex < 0,8 (1×) of < 0,9 (3×) |
Enkel-armindex 0,9-1,0 |
Enkel-armindex > 1,1 (1×) of > 1,0 (3×) |
|---|---|---|
|
Chronisch obstructief arterieel vaatlijden aangetoond |
Chronisch obstructief arterieel vaatlijden mogelijk |
Chronisch obstructief arterieel vaatlijden uitgesloten |
|
|
|
|
Overwegingen bij diabetes mellitus
Naar Samenvatting ›- Bij 3-5% van de patiënten met diabetes mellitus kan de enkel-armindex door stuggere vaatwanden verhoogd zijn tot > 1,1 bij eenmalige bepaling of > 1,0 bij 3 bepalingen.
- Wees bij patiënten met diabetes mellitus alert op uitingen van chronisch obstructief arterieel vaatlijden en verwijs hen eventueel ook bij een hoge enkel-armindex voor aanvullend onderzoek.
Differentiaaldiagnose
Naar Samenvatting ›- Overweeg de volgende alternatieve diagnosen als chronisch obstructief arterieel vaatlijden onwaarschijnlijk is:
- neurologische aandoeningen (spinale stenose, ischialgie, discusprotrusie, perifere neuropathie)
- gewrichtsaandoeningen (artrose van heup of knie)
- arteriële aandoeningen (tromboangitis obliterans, entrapment van de a. poplitea, tibialisanteriorsyndroom)
- veneuze aandoeningen (veneuze insufficiëntie, nachtelijke krampen)
- restless-legssyndroom (RLS) (zie Details).
- Voor nachtelijke krampen en RLS, zie NHG-Standaard Slaapproblemen en slaapmiddelen.
Tabel 6 geeft een overzicht van de differentiële diagnosen voor perifeer arterieel vaatlijden.
| Diagnose | Verschil met PAV | Provocerende en ontlastende factoren | Overig |
|---|---|---|---|
| Neurologische aandoeningen | |||
| spinale stenose (pseudoclaudicatio, verbiestsyndroom) | pijn bij lopen, niet bij fietsen, eerder paresthesie dan pijn | pijn neemt toe bij staan en bij tillen van zware voorwerpen pijn verminderd bij zitten en voorover buigen | ernst van de klachten bij lopen zijn wisselend; goede en slechte dagen |
| ischialgie, discusprotrusie | rugpijn uitstralend naar been | klachten nemen toe bij hoesten, niezen en persen | |
| perifere neuropathie | distale pijn, sensibiliteitsstoornissen paresthesie, hyperesthesie krachtsvermindering | relatie met diabetes mellitus | |
| Gewrichtsaandoeningen | |||
| artrose | pijn in rust (zitten en staan); heupen, knieën, lage rug, stijfheid bij inactiviteit; startpijn bij lopen; pijn in heupregio bij draaien in bed. | ochtendpijn, pijn vermindert bij kortdurend lopen, pijn neemt toe bij langdurig lopen, pijn neemt na lang lopen langzamer of niet af | onvoorspelbare goede en slechte dagen |
| Arteriële aandoeningen | |||
| tromboangitis obliterans (Burger’s disease), entrapment arteria poplitea, tibialisanteriorsyndroom | vooral bij jonge mensen | ||
| Veneuze aandoeningen | |||
| chronische veneuze insufficiëntie | anamnese: varices, staand beroep, vermoeidheid, zwaar, doof, pijnlijk gevoel in (onder)been ook in rust, nachtelijke krampen in kuit, jeuk (secundair bij dermatitis), gezwollen enkels | meer nachtelijke pijnen dan ochtendpijn, klachten nemen meestal toe bij staan, klachten nemen meestal af bij lopen en bij hoog leggen van benen | onvoorspelbare goede en slechte dagen |
| nachtelijke kuitkrampen | vooral bij ouderen, vaak in combinatie met chronische veneuze insufficiëntie; meestal geen PAV | ||
| Overig | |||
| restless legs syndroom | neurovegetatieve reacties, ijzergebrek; normaal geen PAV | ||
Richtlijnen beleid
Naar Samenvatting ›Voorlichting
Naar Samenvatting ›Acute ischemie
Naar Samenvatting ›- Verwijs bij acute ischemie met spoed naar een vaatchirurg.
- Informeer de patiënt over het verdere beleid in het ziekenhuis:
- intraveneuze toediening van ongefractioneerde heparine
- zo nodig directe revascularisatie (zie Details).
- aanvullend onderzoek naar de oorzaak en eventuele interventiemogelijkheden
Bij de behandeling kan grofweg onderscheid gemaakt worden tussen minimaal invasieve interventies, welke vaak onder plaatselijke verdoving uitgevoerd kunnen worden en operatieve (chirurgische) ingrepen.
Minimale invasieve interventies: bij een patiënt met claudicatio intermittens die niet reageert op een traject met gesuperviseerde looptraining of een patiënt met kritieke ischemie kan een zogenaamde dotterbehandeling (percutane transluminale angioplastiek (PTA)) worden verricht. Soms wordt daarbij ook overgegaan op stentplaatsing als blijkt dat het vat na de PTA (nog) niet optimaal behandeld blijkt te zijn. Bij de patiënt met een acute ischemie kan soms trombolyse of trombusaspiratie worden uitgevoerd.
Een Cochrane-review (2 gerandomiseerde studies waarbij in de eerste studie de controlegroep voorlichting kreeg over roken en acetylsalicylzuur en in de tweede studie de controlegroep een oefenprogramma volgde, 98 patiënten met milde tot matige claudicatio intermittens, follow-up 2 tot 6 jaar) laat goede resultaten zien 6 maanden na een angioplastiek (een dotterprocedure al of niet met inbrengen van een stent). De enkel-armindex nam significant toe in vergelijking met de controlegroep die voorlichting kreeg (gemiddeld verschil 0,17; 95%-BI 0,11 tot 0,24). Ook de loopafstand nam toe na angioplastiek. Echter, in de tweede studie waarin de patiënten in de controlegroep looptraining kregen was er geen verschil. In deze tweede studie was na 2 jaar de doorgankelijkheid in de angioplastiekgroep ruimer dan in de controlegroep (OR 5,5; 95%-BI 1,8 tot 17), maar de loopafstand of kwaliteit van leven verschilde niet significant van de controlegroep. Na 6 jaar waren er geen verschillen meer tussen de beide onderzoeksgroepen. Uit ander onderzoek bij patiënten met perifeer arterieel vaatlijden (n = 1598) blijkt dat angioplastiek gecombineerd met looptraining in vergelijking met looptraining alleen leidt tot toename van 33 tot 61 quality-of-lifedagen. Deze winst in kwaliteit van leven is gering in vergelijking met de hoge kosten voor angioplastiek.
Operatieve ingrepen: de vaatchirurg kan onder lokale verdoving, spinale of algehele anesthesie het geoccludeerde of gestenoseerde vat schoonmaken en de plaque uit het vat verwijderen. Het vat wordt vervolgens gesloten met een patchplastiek. Deze ingreep heet een trombendarteriëctomie (TEA) en vindt bijvoorbeeld plaats in de liesslagader. Deze techniek wordt bijvoorbeeld gebruikt bij de carotis endarteriëctomie. Als de afsluiting een langer traject betreft wordt overgegaan tot het aanleggen van een bypass.
Uit een cochrane-review (8 studies; 1200 patiënten met claudicatio intermittens of kritieke ischemie; follow-up 4 jaar) blijkt dat de risico’s op amputatie of sterfte na bypassoperatie of na angioplastiek gelijk zijn. Het doorgankelijkheidspercentage (patency) was beter na bypassoperatie na 12 maanden (OR 1,6; 95%-BI 1,0 tot 2,6), maar niet na 4 jaar. Bij patiënten met kritieke ischemie is het risico op chirurgische complicaties groter na bypasschirurgie (OR 2,69; 95%-BI 1,87 tot 3,86). Het risico op een amputatie was lager na bypassoperatie in vergelijking met trombolyse (OR 0,2; 95%-BI 0,1 tot 0,6). De resultaten na bypassoperatie en looptraining zijn vergelijkbaar. Er zijn geen studies bekend waarin bypassoperatie is vergeleken met geen behandeling.
Conclusie
Afhankelijk van de lokalisatie en het karakter van de hemodynamische significante arteriële obstructie(s) kan gekozen worden voor een endovasculaire of open chirurgische behandeling door de vaatchirurg of interventieradioloog. Ten opzichte van vaatchirurgische ingrepen is het aandeel van endovasculaire behandelingen (percutane transluminale angioplastiek, al of niet met stent) bij de behandeling van claudicatio intermittens toegenomen. Indien een operatie geïndiceerd is bij claudicatio intermittens in het aorto-iliacale traject, is er geen voorkeur voor een bepaalde techniek, evenmin voor het te gebruiken (kunststof) materiaal. Voor het femoropopliteale traject heeft een autologe veneuze bypass de voorkeur. Bij een interventie voor kritieke ischemie kan een endovasculaire of chirurgische behandeling worden toegepast. Voor bypasschirurgie bij kritieke ischemie, zowel boven als onder de knie, heeft de autologe vene de voorkeur.
Chronisch obstructief arterieel vaatlijden
Naar Samenvatting ›- Leg uit dat chronisch obstructief arterieel vaatlijden een chronische, geleidelijk progressieve aandoening is.
- Geef aan dat de patiënt de aandoening zelf gunstig kan beïnvloeden met gesuperviseerde looptraining en door niet te roken; hierdoor kan reeds na enkele weken verbetering optreden, maar soms laat die langer op zich wachten.
- Bespreek de risicofactoren voor chronisch obstructief arterieel vaatlijden (roken, familiaire belasting, diabetes mellitus, hypertensie, hypercholesterolemie) en de wijze waarop deze te beïnvloeden zijn.
- Stel samen met de patiënt een individueel zorgplan op en schenk daarbij aandacht aan het belang van zelfmanagement.
- Leg uit dat regelmatige controles nodig zullen zijn om de progressie van het vaatlijden en de risicofactoren voor hart- en vaatziekten te beoordelen.
- Instrueer de patiënt om eerder dan afgesproken terug te komen bij alarmsymptomen, zoals snelle progressie van de klachten, pijn in rust of snelle verkleuring van voeten of tenen.
Thuisarts
Naar Samenvatting ›- Verwijs naar de informatie over perifeer arterieel vaatlijden op thuisarts.nl. De informatie op Thuisarts is gebaseerd op deze NHG-Standaard.
- Wijs de patiënt ook op voorlichting via de patiëntenorganisatie Harteraad en via de Hartstichting.
Niet-medicamenteuze behandeling
Naar Samenvatting ›Acute ischemie
Naar Samenvatting ›Naast spoedverwijzing naar een vaatchirurg bestaat het niet-medicamenteuze beleid uit comfort en het advies de benen eerder laag dan hoog te houden.
Chronisch obstructief arterieel vaatlijden
Naar Samenvatting ›Pas bij alle patiënten met chronisch obstructief arterieel vaatlijden de volgende interventies toe:
- stoppen met roken
- cardiovasculair risicomanagement voor patiënten met aangetoonde hart- en vaatziekte (zie NHG-Standaard Cardiovasculair risicomanagement).
Stoppen met roken
Naar Samenvatting ›- Stoppen met roken is een essentieel onderdeel van het beleid bij chronisch obstructief arterieel vaatlijden(zie Details).
- Stoppen met roken leidt niet direct tot een verbetering van de enkel-armindex of de loopafstand, maar vermindert wel de progressie van de klachten en heeft een gunstig effect op andere hart- en vaatziekten, zoals ischemische hartziekten en CVA’s.
- Bij het begeleiden van stoppen met roken gaat het om het inschatten en zo mogelijk vergroten van de motivatie om te stoppen (zie de module Roken in de praktijkhandleiding Leefstijl).
Stoppen met roken is belangrijk vanwege de gunstige invloed op andere hart- en vaatziekten en leidt tot vermindering van progressie van claudicatioklachten, minder invasieve ingrepen en betere resultaten na een operatie. In een meta-analyse van 4 onderzoeken met 184 patiënten met perifeer arterieel vaatlijden over het effect van stoppen met roken op de loopafstand konden geen conclusies worden getrokken door de heterogeniteit van de uitkomsten.
Uit een meta-analyse van prospectieve studies blijkt dat persisterende rokers een driemaal hoger risico hebben op restenose van de bypass na operatie (OR 3,09; 95%-BI 2,34 tot 4,08) Er is ook een duidelijke dosisresponsrelatie. Stoppen met roken, zelfs na de operatie, verbetert de doorgankelijkheid van de bypass tot het niveau van niet-rokers.
Conclusie
Stoppen met roken is een essentieel onderdeel van het beleid bij perifeer arterieel vaatlijden omdat stoppen met roken leidt tot vermindering van progressie van de claudicatioklachten in de benen. Stoppen met roken leidt niet direct tot een verbetering van de enkel-armindex of de loopafstand.
Cardiovasculair risicomanagement
Naar Samenvatting ›Voor de aanpak van leefstijlfactoren zie NHG-Standaard Cardiovasculair risicomanagement.
Claudicatio intermittens
Naar Samenvatting ›Behandel als aanvulling op het cardiovasculair risicomanagement de lokale klachten conservatief door middel van gesuperviseerde looptraining en voetverzorging.
Looptraining
Naar Samenvatting ›- Overleg met de patiënt over verwijzing naar een gespecialiseerde fysiotherapeut voor gesuperviseerde looptraining; deze heeft een gunstig effect op de pijnvrije én op de maximale loopafstand (zie Details).
- Leg uit dat gesuperviseerde looptraining effectiever is dan alleen een loopadvies (maximale verbetering van de loopafstand 231% versus 154%).
- Informeer de patiënt over de aard van de therapie (zie KNGF-richtlijn Symptomatisch Perifeer arterieel vaatlijden):
- het beste effect wordt bereikt bij een trainingsduur van ≥ 6 maanden
- follow-up tot 12 maanden is nuttig om terugval te voorkomen.
- de behandeling begint met ≥ 3 trainingen per week van voldoende intensiteit en duur (≥ 30 minuten)
- Zorg voor een goede taakverdeling tussen huisarts, praktijkondersteuner, fysiotherapeut en eventueel vaatchirurg.
- Bied voorlichtingsmateriaal aan en verwijs naar de informatie op thuisarts.nl, de patiëntenorganisatie Harteraad en het fysiotherapienetwerk ClaudicatioNet.
Door loopoefeningen worden frequente ischemische prikkels aan de spieren toegediend, waardoor een verbetering optreedt van de doorbloeding en de aerobe energievoorziening. Deze verbetering van de doorbloeding kan echter slechts een deel van de toename van de loopafstand verklaren.Looptraining draagt ook bij aan een verbetering van de kwaliteit van leven door verbetering van fysiek functioneren en algemene gezondheid.
In een Cochrane-review (22 studies, n = 1200 personen met stabiele klachten van PAV; follow-up 2 tot 24 maanden) blijkt looptraining tot een significante verbetering van de pijnvrije loopafstand (gemiddeld verschil 82,2 meter; 95%-BI 71,7 tot 92,7) en de maximale loopafstanden (gemiddeld verschil 113,2 meter; 95%-BI 95,0 tot 131,4) te leiden in vergelijking met de gangbare of placebobehandeling. Er is onvoldoende onderzoek om een uitspraak te doen over de effectiviteit van looptraining in vergelijking met operatieve behandeling, angioplastiek of antistollingstherapie. Uit een gerandomiseerd multicenteronderzoek (n = 252) waarin loopadvies, gesuperviseerde looptraining en gesuperviseerde looptraining met feedback door accelerometer met elkaar vergeleken werd, blijkt dat na 12 maanden de maximale loopafstand in vergelijking met de baseline verbeterd is met respectievelijk 110 meter (0 tot 300), 350 meter (152 tot 810) en 360 meter (173 tot 697). Het verschil tussen de groep die gesuperviseerde looptraining kreeg en de groep die loopadvies kreeg was 240% (95%-BI 152 tot 366%). De gemiddelde maximale loopafstand bij de loopadviesgroep en bij de groep die gesuperviseerde looptraining kreeg werd na 12 maanden in vergelijking met de maximale loopafstand aan het begin van het onderzoek geschat op respectievelijk 154% en 231%.
Ook uit 2 systematisch literatuuronderzoeken blijkt dat gesuperviseerde looptraining leidt tot een grotere toename van de pijnvrije en maximale loopafstand in vergelijking met niet-gesuperviseerde looptraining. De pijnvrije en maximale looptijden nemen vooral toe in de eerste 2 maanden van de gesuperviseerde looptraining. Uit de review van Bulmer et al. blijkt een trainingsprogramma met een duur tussen de 12 en 24 weken, een behandelfrequentie van 3 maal per week en een duur van 30 minuten per sessie, het meest effectief te zijn.
De supervisie van looptraining door een fysiotherapeut bij chronisch obstructief arterieel vaatlijden is omschreven in een richtlijn.
Conclusie
Gesuperviseerde looptraining leidt tot een toename van de pijnvrije en maximale loopafstand. Gesuperviseerde oefentherapie is effectiever dan een loopadvies bij patiënten met chronisch obstructief arterieel vaatlijden.
Voetverzorging
Naar Samenvatting ›- Leg uit dat de verminderde huidcirculatie en slechtere genezing het risico verhogen op huidproblemen en ulcera.
- Verwijs patiënten met eelt en/of drukplekken naar een pedicure voor voetverzorging of naar een podotherapeut voor corrigerend schoeisel.
- Verwijs patiënten met ulcera zo nodig naar een voetenteam.
Kritieke ischemie
Naar Samenvatting ›- Verwijs bij kritieke ischemie naar een vaatchirurg voor:
- aanvullend onderzoek
- zo nodig invasieve behandeling met als doel amputatie te voorkomen
- Looptraining is ook zinvol na een chirurgische interventie.
Medicamenteuze behandeling
Naar Samenvatting ›Acute ischemie
Naar Samenvatting ›- Geef zo nodig pijnstilling.
- Verwijs met spoed naar een vaatchirurg.
- Informeer de patiënt over de medicamenteuze behandeling in het ziekenhuis:
- intraveneuze toediening van ongefractioneerde heparine
- na interventies en bij acute trombotische gebeurtenissen anticoagulantia (cumarinederivaten)
Chronisch obstructief arterieel vaatlijden
Naar Samenvatting ›- Behandel patiënten met symptomatisch chronisch obstructief arterieel vaatlijden als andere patiënten die bekend zijn met een hart- en vaatziekte (zie NHG-Standaard Cardiovasculair risicomanagement), namelijk met antihypertensiva en LDL-cholesterolverlagers.
- De diagnose ‘chronisch obstructief arterieel vaatlijden’ is geen reden om de voorkeur te geven aan specifieke middelen.
- Het gebruik van een trombocytenaggregatieremmer (zoals acetylsalicylzuur) is geïndiceerd.
- Anticoagulantia hebben geen rol bij de conservatieve behandeling van chronische ischemie van het been.
- Medicatie ter bevordering van de arteriële doorbloeding wordt niet aanbevolen als alternatief voor gesuperviseerde looptraining en stoppen met roken (zie Details).
Pentoxifylline: in een Cochrane-review (23 onderzoeken; n = 28.160) kon geen verschil worden aangetoond tussen behandeling met pentoxifylline en placebo op de eindpunten totale loopafstand, pijnvrije loopafstand en enkel-armindex. Pentoxifylline is alleen geregistreerd voor ernstige claudicatio intermittens. Het middel kent ernstige bijwerkingen en waarschuwingen zoals hartritmestoornissen, angina pectoris en tachycardie.
Cilostazol: in een review wordt een gunstig effect van cilostazol op de loopafstand beschreven. Dit effect zou groter zijn dan dat van pentoxifylline. Uit een Cochrane-review (7 studies) blijkt dat cilostazol 100 mg 2 maal daags de maximale loopafstand verbetert met 31,3 meter (95%-BI 21,3 tot 40,9). Cilostazol is thans echter alleen geregistreerd en verkrijgbaar in de Verenigde Staten en Japan.
Ginkgo biloba: ook ginkgo biloba is onderzocht bij claudicatio intermittens. Het middel bevat vasoactieve stoffen die op de platelet-activating factor zouden ingrijpen. Een Cochrane-review, waarin 11 onderzoeken naar het effect van ginkgo biloba op de loopafstand werden geïncludeerd, toonde geen voordelen aan.
Chelatietherapie: chelatietherapie is een omstreden behandeling voor perifeer arterieel vaatlijden. Het werkingsmechanisme zou gebaseerd zijn op het binden van calciumionen in de circulatie met behulp van een edetaat(EDTA)-infuus, waarna dit als calciumedetaat wordt uitgescheiden. Mobilisatie van calcium zou selectief gericht zijn op het calcium in atherosclerotische plaques in de bloedvaten, waardoor de plaques zouden slinken.Los van de vraag of een dergelijk werkingsmechanisme plausibel is, zijn er niet onaanzienlijke bijwerkingen (nierfunctiestoornissen, acute hypocalciëmie). Er zijn 4 gerandomiseerde onderzoeken met in totaal 250 patiënten gepubliceerd die in een Cochrane-review geanalyseerd zijn. De effectiviteit van chelatietherapie voor de klinische symptomen, voor de enkel-armindex en voor angiografische bevindingen bleek niet te zijn aangetoond.
Overige middelen: in een systematisch overzicht van alle farmacologische therapieën die voor claudicatio intermittens worden genoemd, werden 52 gerandomiseerde onderzoeken met een totaal van 5088 patiënten geanalyseerd. Deze onderzoeken omvatten therapieën met vasodilatatoren (naftidrofuryl, pentoxifylline), trombocytenaggregatieremmers (ketanserine, dipyridamol, suloctidil, picotamide en indobufen) en andere medicamenten (levocarnitine, ticlopidine, ginkgo biloba). De auteurs concludeerden dat alleen pentoxifylline enige verbetering kan geven in het functioneren van patiënten met matig ernstige claudicatio intermittens. Ook van steroïden , vitamine E en anticoagulantia zijn de effecten niet bewezen.
Bij kritieke ischemie kan de pijn bestreden worden met paracetamol of met opiaten.
Conclusie
Pentoxifylline en cilostazol hebben een klein gunstig effect op de loopafstand bij patiënten met perifeer arterieel vaatlijden. De klinische effecten zijn dermate gering en de bijwerkingen dermate ernstig dat deze medicamenten niet worden aanbevolen. Bij kritieke ischemie kan de pijn bestreden worden met paracetamol of met opiaten.
Kritieke ischemie
Naar Samenvatting ›- Geef zo nodig pijnstilling.
- Verwijs naar een vaatchirurg voor aanvullend onderzoek en het maken van een behandelplan (revascularisatie kan noodzakelijk zijn om irreversibele schade te voorkomen).
Controles
Naar Samenvatting ›Claudicatio intermittens
Naar Samenvatting ›- Controleer de progressie (ook in het niet-aangedane been) maandelijks gedurende de 1e 3 maanden en vervolgens elke 3 maanden gedurende het 1e jaar.
- Instrueer de patiënt om eerder dan afgesproken terug te komen bij alarmsymptomen, zoals snelle progressie van de klachten, pijn in rust of snelle verkleuring van voeten of tenen.
- Evalueer bij iedere controle de functionele achteruitgang of verbetering op geleide van het klinische beeld (en niet de enkel-armindex).
- Besteed bij de controles aandacht aan:
- het beloop van de klachten, de ondervonden last in werk en vrije tijd, de mate van (im)mobiliteit en sociale belemmeringen
- zelfmanagement
- de mate waarin de adviezen over stoppen met roken en looptraining zijn opgevolgd en de moeilijkheden die daarbij zijn ondervonden
- cardiovasculair risicomanagement zoals vastgelegd in het individuele behandelplan
- overleg zo nodig met de fysiotherapeut in het kader van gesuperviseerde looptraining
- Wees alert op onderschatting van de ernst van de vaatobstructie bij patiënten met mobiliteitsbeperkingen door andere aandoeningen (COPD, hartfalen, artrose, reuma).
- Let bij het lichamelijk onderzoek op (dreigende) huiddefecten, in het bijzonder van de drukpunten aan de voeten (vooral bij vaatpatiënten met diabetes mellitus).
- Zet de behandeling ongewijzigd voort of stel deze bij, afhankelijk van de bevindingen.
- Als de klachten stabiel blijven en de risicofactoren voor hart- en vaatziekten adequaat zijn behandeld, vindt jaarlijkse controle plaats in het kader van cardiovasculair risicomanagement (zie NHG-Standaard Cardiovasculair risicomanagement).
Na chirurgische interventies
Naar Samenvatting ›- Overleg na een verwijzing vanwege acute of kritieke ischemie met de specialist over de verdere controles.
- Wees bij controles alert op hernieuwde klachten, vooral in het (nog) niet aangetaste been.
- Besteed aandacht aan de cardiovasculaire risicofactoren.
Revascularisatie
Naar Samenvatting ›- Na een chirurgische of endovasculaire revascularisatie is vroegtijdig opsporen van een restenose en snelle verwijzing bij klachten van belang voor het resultaat op langere termijn.
- Restenose na revascularisatie kan het best worden opgespoord door middel van duplexscanning.
Amputatie
Naar Samenvatting ›- Volg na een amputatie actief de zelfredzaamheid van de patiënt met diens prothese.
- Controleer ook het niet-geamputeerde been of voet.
Verwijzing
Naar Samenvatting ›Spoedverwijzing
Naar Samenvatting ›Verwijs bij verdenking op acute ischemie met spoed naar een vaatchirurg voor ontstolling en eventuele directe revascularisatie.
Verwijzing bij acute ischemie
Naar Samenvatting ›- Verwijs direct naar een vaatchirurg.
- Informeer de patiënt over het verdere beleid in het ziekenhuis:
- intraveneuze toediening van ongefractioneerde heparine
- zo nodig directe revascularisatie (zie Voorlichting, Acute ischemie)
- aanvullend onderzoek naar de mogelijke oorzaken en interventiemogelijkheden
- Voor opheffen van de obstructie en het revasculariseren zijn diverse percutane en chirurgische technieken voorhanden.
- De keuze tussen deze technieken wordt bepaald door ernst, oorzaak en anatomische lokalisatie van de obstructie (zie Evaluatie, Acute ischemie).
Verwijzing bij chronisch obstructief arterieel vaatlijden
Naar Samenvatting ›- Bij patiënten met chronisch obstructief arterieel vaatlijden verwijst de huisarts afhankelijk van lokale omstandigheden naar een multidisciplinair vaatteam of naar een vaatchirurg:
- als een bepaling van de enkel-armindex niet in eigen beheer kan worden uitgevoerd (diagnostiek)
- bij een gemiddelde enkel-armindex van 0,9 tot en met 1,0 en twijfel over de diagnose (diagnostiek)
- bij patiënten met diabetes mellitus en een vermoeden van chronisch obstructief arterieel vaatlijden (diagnostiek)
- met snelle progressie van de klachten (behandelopties bespreken)
- met blijvende klachten of duidelijke subjectieve invalidering ondanks gesuperviseerde looptraining na 6 maanden (behandelopties bespreken).
- Bij verwijzing bij claudicatio intermittens geeft de huisarts informatie over de stappen die in het diagnostisch traject reeds zijn gezet, over de stand van zaken betreffende de risicofactoren voor hart- en vaatziekten en over de resultaten van het stoppen met roken en de gesuperviseerde looptraining.
Verwijzing bij kritieke ischemie
Naar Samenvatting ›Verwijs naar een vaatchirurg voor aanvullend onderzoek (CTA, MRA) en een behandelplan (eventueel revascularisatie).
Samenwerkingsafspraken
Naar Samenvatting ›- Maak (regionale) samenwerkingsafspraken met de zorgverleners die naast de huisarts betrokken kunnen zijn bij de zorg voor patiënten met perifeer arterieel vaatlijden:
- praktijkondersteuner
- diëtist
- fysiotherapeut
- vaatlaborant
- vaatchirurg
- interventieradioloog
- internist
- Maak afspraken over:
- diagnostiek
- verwijzing
- indicaties voor invasieve behandeling.
- behandeling van risicofactoren
- aanpak van stoppen met roken
- gesuperviseerde looptraining
- afstemming van controles met indicaties voor terugverwijzing
Referenties
- Aboyans V, Criqui MH, Abraham P, Allison MA, Creager MA, Diehm C, et al. Measurement and interpretation of the ankle-brachial index: a scientific statement from the American Heart Association. Circulation 2012;126:2890-909.
- Hirsch AT, Haskal ZJ, Hertzer NR, Bakal CW, Creager MA, Halperin JL, et al. ACC/AHA 2005 Practice Guidelines for the management of patients with peripheral arterial disease (lower extremity, renal, mesenteric, and abdominal aortic): a collaborative report from the American Association for Vascular Surgery/Society for Vascular Surgery, Society for Cardiovascular Angiography and Interventions, Society for Vascular Medicine and Biology, Society of Interventional Radiology, and the ACC/AHA Task Force on Practice Guidelines (Writing Committee to Develop Guidelines for the Management of Patients With Peripheral Arterial Disease): endorsed by the American Association of Cardiovascular and Pulmonary Rehabilitation; National Heart, Lung, and Blood Institute; Society for Vascular Nursing; TransAtlantic Inter-Society Consensus; and Vascular Disease Foundation. Circulation 2006;113:e463-e654.
- KNGF. Richtlijn Asymptomatisch Perifeer Arterieel Vaatlijden. Nederlands Tijdschrift voor Fysiotherapie. In press.
- Lawall H, Diehm C. Deutsche Gesellschaft für Angiologie Gesellschaft für Gefäßmedizin. Leitlinien zur Diagnostik und Therapie der peripheren arteriellen Verschlusskrankheit (PAVK) (2009).
- NICE. Lower Limb Peripheral Arterial Disease: diagnosis and management (2012). Ga naar bron: NICE. Lower Limb Peripheral Arterial Disease: diagnosis and management (2012).
- Norgren L, Hiatt WR, Dormandy JA, Nehler MR, Harris KA, Fowkes FG, et al. Inter-Society Consensus for the Management of Peripheral Arterial Disease (TASC II). Eur J Vasc Endovasc Surg 2007;33 Suppl 1:S1-75.
- Tendera M, Aboyans V, Bartelink ML, Baumgartner I, Clement D, Collet JP, et al. ESC Guidelines on the diagnosis and treatment of peripheral artery diseases: Document covering atherosclerotic disease of extracranial carotid and vertebral, mesenteric, renal, upper and lower extremity arteries: the Task Force on the Diagnosis and Treatment of Peripheral Artery Diseases of the European Society of Cardiology (ESC). Eur Heart J 2011;32:2851-906.
- Vahl AC, Reekers JA. Richtlijn ‘Diagnostiek en behandeling van arterieel vaatlijden van de onderste extremiteit’ van de Nederlandse Vereniging voor Heelkunde. Ned Tijdschr Geneeskd 2005;149:1670-4.
- Dormandy J, Heeck L, Vig S. The natural history of claudication: risk to life and limb. Semin Vasc Surg 1999;12:123-37.
- Rutgers D, Meijer WT. Prevalentie van perifere arteriele vaatziekte en claudication intermittens bij personen van 55 jaar en ouder: het ERGO-onderzoek. Ned Tijdschr Geneeskd 1998;142:2851-6.
- Stoffers HE, Rinkens PE, Kester AD, Kaiser V, Knottnerus JA. The prevalence of asymptomatic and unrecognized peripheral arterial occlusive disease. Int J Epidemiol 1996a;25:282-90.
- Aboyans V, Lacroix P, Preux PM, Vergnenegre A, Ferrieres J, Laskar M. Variability of ankle-arm index in general population according to its mode of calculation. Int Angiol 2002;21:237-43.
- Allison MA, Aboyans V, Granston T, McDermott MM, Kamineni A, Ni H, et al. The relevance of different methods of calculating the ankle-brachial index: the multi-ethnic study of atherosclerosis. Am J Epidemiol 2010a;171:368-76.
- Klein S, Hage JJ. Measurement, calculation, and normal range of the ankle-arm index: a bibliometric analysis and recommendation for standardization. Ann Vasc Surg 2006;20:282-92.
- Lange SF, Trampisch HJ, Pittrow D, Darius H, Mahn M, Allenberg JR, et al. Profound influence of different methods for determination of the ankle brachial index on the prevalence estimate of peripheral arterial disease. BMC Public Health 2007;7:147.
- Sigvant B, Wiberg-Hedman K, Bergqvist D, Rolandsson O, Andersson B, Persson E, et al. A population-based study of peripheral arterial disease prevalence with special focus on critical limb ischemia and sex differences. J Vasc Surg 2007;45:1185-91.
- Hirsch AT, Criqui MH, Treat-Jacobson D, Regensteiner JG, Creager MA, Olin JW, et al. Peripheral arterial disease detection, awareness, and treatment in primary care. JAMA 2001;286:1317-24.
- Van de Lisdonk EH, Van den Bosch WJHM, Lagro-Janssen ALM. Ziekten in de huisartspraktijk. 5de druk. Maarssen: Elsevier Gezondheidszorg, 2008.
- Diehm C, Schuster A, Allenberg JR, Darius H, Haberl R, Lange S, et al. High prevalence of peripheral arterial disease and co-morbidity in 6880 primary care patients: cross-sectional study. Atherosclerosis 2004;172:95-105.
- Kroger K, Stang A, Kondratieva J, Moebus S, Beck E, Schmermund A, et al. Prevalence of peripheral arterial disease - results of the Heinz Nixdorf recall study. Eur J Epidemiol 2006;21:279-85.
- Ness J, Aronow WS. Prevalence of coronary artery disease, ischemic stroke, peripheral arterial disease, and coronary revascularization in older African-Americans, Asians, Hispanics, whites, men, and women. Am J Cardiol 1999;84:932-3, A7.
- Criqui MH, Vargas V, Denenberg JO, Ho E, Allison M, Langer RD, et al. Ethnicity and peripheral arterial disease: the San Diego Population Study. Circulation 2005;112:2703-7.
- Kullo IJ, Bailey KR, Kardia SL, Mosley TH, Jr., Boerwinkle E, Turner ST. Ethnic differences in peripheral arterial disease in the NHLBI Genetic Epidemiology Network of Arteriopathy (GENOA) study. Vasc Med 2003;8:237-42.
- Hooi JD, Kester AD, Stoffers HE, Overdijk MM, Van Ree JW, Knottnerus JA. Incidence of and risk factors for asymptomatic peripheral arterial occlusive disease: a longitudinal study. Am J Epidemiol 2001;153:666-72.
- Leng GC, Lee AJ, Fowkes FG, Whiteman M, Dunbar J, Housley E, et al. Incidence, natural history and cardiovascular events in symptomatic and asymptomatic peripheral arterial disease in the general population. Int J Epidemiol 1996b;25:1172-81.
- Ridker PM, Stampfer MJ, Rifai N. Novel risk factors for systemic atherosclerosis: a comparison of C-reactive protein, fibrinogen, homocysteine, lipoprotein(a), and standard cholesterol screening as predictors of peripheral arterial disease. JAMA 2001;285:2481-5.
- Ouriel K. Peripheral arterial disease. Lancet 2001;358:1257-64.
- Criqui MH, Denenberg JO, Langer RD, Fronek A. The epidemiology of peripheral arterial disease: importance of identifying the population at risk. Vasc Med 1997;2:221-6.
- Criqui MH. Peripheral arterial disease--epidemiological aspects. Vasc Med 2001;6:3-7.
- Fowkes FG, Housley E, Riemersma RA, Macintyre CC, Cawood EH, Prescott RJ, et al. Smoking, lipids, glucose intolerance, and blood pressure as risk factors for peripheral atherosclerosis compared with ischemic heart disease in the Edinburgh Artery Study. Am J Epidemiol 1992;135:331-40.
- Willigendael EM, Teijink JA, Bartelink ML, Kuiken BW, Boiten J, Moll FL, et al. Influence of smoking on incidence and prevalence of peripheral arterial disease. J Vasc Surg 2004;40:1158-65.
- Meijer WT, Grobbee DE, Hunink MGM, Hofman A, Hoes AW. Determinants of peripheral arterial disease in the elderly: the Rotterdam study. Arch Intern Med 2000;160:2934-8.
- Price JF, Mowbray PI, Lee AJ, Rumley A, Lowe GD, Fowkes FG. Relationship between smoking and cardiovascular risk factors in the development of peripheral arterial disease and coronary artery disease: Edinburgh Artery Study. Eur Heart J 1999;20:344-53.
- Ingolfsson IO, Sigurdsson G, Sigvaldason H, Thorgeirsson G, Sigfusson N. A marked decline in the prevalence and incidence of intermittent claudication in Icelandic men 1968-1986: a strong relationship to smoking and serum cholesterol--the Reykjavik Study. J Clin Epidemiol 1994;47:1237-43.
- Meijer WT, Hoes AW, Rutgers D, Bots ML, Hofman A, Grobbee DE. Peripheral arterial disease in the elderly: The Rotterdam Study. Arterioscler Thromb Vasc Biol 1998;18:185-92.
- Stoffers HEJH, Kester ADM, Kaiser V, Rinkens PELM, Kitslaar PJEH, Knottnerus A. The diagnostic value of the measurement of the ankle-brachial systolic pressure index in primary health care. J Clin Epidemiol 1996b;49:1401.
- Jepson RG, Fowkes FG, Donnan PT, Housley E. Alcohol intake as a risk factor for peripheral arterial disease in the general population in the Edinburgh Artery Study. Eur J Epidemiol 1995;11:9-14.
- Vliegenthart R, Geleijnse JM, Hofman A, Meijer WT, Van Rooij FJ, Grobbee DE, et al. Alcohol consumption and risk of peripheral arterial disease: the Rotterdam study. Am J Epidemiol 2002;155:332-8.
- Aquino R, Johnnides C, Makaroun M, Whittle JC, Muluk VS, Kelley ME, et al. Natural history of claudication: long-term serial follow-up study of 1244 claudicants. J Vasc Surg 2001;34:962-70.
- Murabito JM, D’Agostino RB, Silbershatz H, Wilson WF. Intermittent claudication. A risk profile from The Framingham Heart Study. Circulation 1997;96:44-9.
- Adam DJ, Beard JD, Cleveland T, Bell J, Bradbury AW, Forbes JF, et al. Bypass versus angioplasty in severe ischaemia of the leg (BASIL): multicentre, randomised controlled trial. Lancet 2005;366:1925-34.
- Fratezi AC, Albers M, De Luccia ND, Pereira CA. Outcome and quality of life of patients with severe chronic limb ischaemia: a cohort study on the influence of diabetes. Eur J Vasc Endovasc Surg 1995;10:459-65.
- Hooi JD, Stoffers HEJH. The prognosis of non-crtical limb ischaemia: a systematic review. Br J gen Pract 1999;49:49-55.
- Radack K, Deck C. Beta-adrenergic blocker therapy does not worsen intermittent claudication in subjects with peripheral arterial disease. A meta-analysis of randomized controlled trials. Arch Intern Med 1991;151:1769-76.
- Hooi JD, Stoffers HEJH, Kester AD, Van Ree JW, Knottnerus JA. Peripheral arterial occlusive disease: prognostic value of signs, symptoms, and the ankle-brachial pressure index. Med Decis Making 2002;22:99-107.
- Leng GC, Fowkes FG, Lee AJ, Dunbar J, Housley E, Ruckley CV. Use of ankle brachial pressure index to predict cardiovascular events and death: a cohort study. BMJ 1996a;313:1440-4.
- Hamalainen H, Ronnemaa T, Halonen JP, Toikka T. Factors predicting lower extremity amputations in patients with type 1 or type 2 diabetes mellitus: a population-based 7-year follow-up study. J Intern Med 1999;246:97-103.
- McDermott MM, Fried L, Simonsick E, Ling S, Guralnik JM. Asymptomatic peripheral arterial disease is independently associated with impaired lower extremity functioning: the women’s health and aging study. Circulation 2000;101:1007-12.
- McDermott MM, Ohlmiller SM, Liu K, Guralnik JM, Martin GJ, Pearce WH, et al. Gait alterations associated with walking impairment in people with peripheral arterial disease with and without intermittent claudication. J Am Geriatr Soc 2001;49:747-54.
- McDermott MM, Guralnik JM, Tian L, Liu K, Ferrucci L, Liao Y, et al. Associations of borderline and low normal ankle-brachial index values with functional decline at 5-year follow-up: the WALCS (Walking and Leg Circulation Study). J Am Coll Cardiol 2009;53:1056-62.
- Breek JC, Hamming JF, De Vries J, Aquarius AE, Van Berge Henegouwen DP. Quality of life in patients with intermittent claudication using the World Health Organisation (WHO) questionnaire. Eur J Vasc Endovasc Surg 2001;21:118-22.
- Breek JC, Hamming JF, De Vries J, Van Berge Henegouwen DP, Van Heck GL. The impact of walking impairment, cardiovascular risk factors, and comorbidity on quality of life in patients with intermittent claudication. J Vasc Surg 2002;36:94-9.
- Kitslaar PJEHM. Consensus diagnostiek en behandeling van arteriele claudicatio intermittens. Ned Tijdschr Geneeskd 1997;141:2396.
- Klevsgard R, Hallberg IR, Risberg B, Thomsen MB. Quality of life associated with varying degrees of chronic lower limb ischaemia: comparison with a healthy sample. Eur J Vasc Endovasc Surg 1999;17:319-25.
- Feinglass J, McCarthy WJ, Slavensky R, Manheim LM, Martin GJ. Effect of lower extremity blood pressure on physical functioning in patients who have intermittent claudication. The Chicago Claudication Outcomes Research Group. J Vasc Surg 1996;24:503-11.
- Klevsgard R, Hallberg IR, Risberg B, Thomsen MB. The effects of successful intervention on quality of life in patients with varying degrees of lower-limb ischaemia. Eur J Vasc Endovasc Surg 2000;19:238-45.
- Klevsgard R, Risberg BO, Thomsen MB, Hallberg IR. A 1-year follow-up quality of life study after hemodynamically successful or unsuccessful surgical revascularization of lower limb ischemia. J Vasc Surg 2001;33:114-22.
- Stoffers HE, Kester AD, Kaiser V, Rinkens PE, Knottnerus JA. Diagnostic value of signs and symptoms associated with peripheral arterial occlusive disease seen in general practice: a multivariable approach. Med Decis Making 1997;17:61-70.
- McGee SR, Boyko EJ. Physical examination and chronic lower-extremity ischemia: a critical review. Arch Intern Med 1998;158:1357-64.
- Stoffers HEJH. Noninvasive vascular tests in general practice. A literature review. In: Peripheral arterial occlusive disease. Prevalence, and diagnostic management in general practice [proefschrift]. Maastricht: Universitaire Pers Maastricht, 1995.
- Aboyans V, Criqui MH, McClelland RL, Allison MA, McDermott MM, Goff DC, Jr. et al. Intrinsic contribution of gender and ethnicity to normal ankle-brachial index values: the Multi-Ethnic Study of Atherosclerosis (MESA). J Vasc Surg 2007;45:319-27.
- Allison MA, Peralta CA, Wassel CL, Aboyans V, Arnett DK, Cushman M, et al. Genetic ancestry and lower extremity peripheral artery disease in the Multi-Ethnic Study of Atherosclerosis. Vasc Med 2010b;15:351-9.
- Carmelli D, Fabsitz RR, Swan GE, Reed T, Miller B, Wolf PA. Contribution of genetic and environmental influences to ankle-brachial blood pressure index in the NHLBI Twin Study. National Heart, Lung, and Blood Institute. Am J Epidemiol 2000;151:452-8.
- Zheng ZJ, Rosamond WD, Chambless LE, Nieto FJ, Barnes RW, Hutchinson RG, et al. Lower extremity arterial disease assessed by ankle-brachial index in a middle-aged population of African Americans and whites: the Atherosclerosis Risk in Communities (ARIC) Study. Am J Prev Med 2005;29:42-9.
- Dachun X, Jue L, Liling Z, Yawei X, Dayi H, Pagoto SL, et al. Sensitivity and specificity of the ankle--brachial index to diagnose peripheral artery disease: a structured review. Vasc Med 2010;15:361-9.
- Gardner AW, Skinner JS, Cantwell BW, Smith LK. Prediction of claudication pain from clinical measurements obtained at rest. Med Sci Sports Exerc 1992;24:163-70.
- Parr B, Noakes TD, Derman EW. Factors predicting walking intolerance in patients with peripheral arterial disease and intermittent claudication. S Afr Med J 2008;98:958-62.
- Szuba A, Oka RK, Harada R, Cooke JP. Limb hemodynamics are not predictive of functional capacity in patients with PAD. Vasc Med 2006;11:155-63.
- Amighi J, Sabeti S, Schlager O, Francesconi M, Ahmadi R, Minar E, et al. Outcome of conservative therapy of patients with severe intermittent claudication. Eur J Vasc Endovasc Surg 2004;27:254-8.
- Anderson JD, Epstein FH, Meyer CH, Hagspiel KD, Wang H, Berr SS, et al. Multifactorial determinants of functional capacity in peripheral arterial disease: uncoupling of calf muscle perfusion and metabolism. J Am Coll Cardiol 2009;54:628-35.
- Herman SD, Liu K, Tian L, Guralnik JM, Ferrucci L, Criqui MH, et al. Baseline lower extremity strength and subsequent decline in functional performance at 6-year follow-up in persons with lower extremity peripheral arterial disease. J Am Geriatr Soc 2009;57:2246-52.
- McDermott MM, Liu K, Ferrucci L, Tian L, Guralnik JM, Green D, et al. Circulating blood markers and functional impairment in peripheral arterial disease. J Am Geriatr Soc 2008;56:1504-10.
- McDermott MM, Liu K, Ferrucci L, Tian L, Guralnik JM, Liao Y, et al. Greater sedentary hours and slower walking speed outside the home predict faster declines in functioning and adverse calf muscle changes in peripheral arterial disease. J Am Coll Cardiol 2011;57:2356-64.
- Decrinis M, Doder S, Stark G, Pilger E. A prospective evaluation of sensitivity and specificity of the ankle/brachial index in the follow-up of superficial femoral artery occlusions treated by angioplasty. Clin Investig 1994;72:592-7.
- Nicolai SP, Kruidenier LM, Rouwet EV, Bartelink ML, Prins MH, Teijink JA. Ankle brachial index measurement in primary care: are we doing it right? Br J Gen Pract 2009b;59:422-7.
- Bendermacher BL. Peripheral Arterial Disease. Screening, Diagnosis and Conservative Treatment [proefschrift]. Maastricht: Maastricht University Press. 2007.
- Fowkes FG, Housley E, Macintyre CC, Prescott RJ, Ruckley CV. Variability of ankle and brachial systolic pressures in the measurement of atherosclerotic peripheral arterial disease. J Epidemiol Community Health 1988;42:128-33.
- Ouriel K, McDonnell AE, Metz CE, Zarins CK. Critical evaluation of stress testing in the diagnosis of peripheral vascular disease. Surgery 1982;91:686-93.
- Heijenbrok-Kal MH, Kock MC, Hunink MG. Lower extremity arterial disease: multidetector CT angiography meta-analysis. Radiology 2007;245:433-9.
- De Vries SO, Hunink MG, Polak JF. Summary receiver operating characteristic curves as a technique for meta-analysis of the diagnostic performance of duplex ultrasonography in peripheral arterial disease. Acad Radiol 1996;3:361-9.
- Koelemay MJ, Den Hartog D, Prins MH, Kromhout JG, Legemate DA, Jacobs MJ. Diagnosis of arterial disease of the lower extremities with duplex ultrasonography. Br J Surg 1996;83:404-9.
- De Smet AA, Visser K, Kitslaar PJ. Duplex scanning for grading aortoiliac obstructive disease and guiding treatment. Eur J Vasc Surg 1994;8:711-5.
- Elsman BH, Legemate DA, Van der Heijden FH, De Vos HJ, Mali WP, Eikelboom BC. Impact of ultrasonographic duplex scanning on therapeutic decision making in lower-limb arterial disease. Br J Surg 1995;82:630-3.
- Collins R, Burch J, Cranny G, Aguiar-Ibáñez R, Craig D, Wright K, et al. Duplex ultrasonography, magnetic resonance angiography, and computed tomography angiography for diagnosis and assessment of symptomatic, lower limb peripheral arterial disease: systematic review. BMJ 2007;334:1257.
- Rutherford RB, Baker JD, Ernst C, Johnston KW, Porter JM, Ahn S, et al. Recommended standards for reports dealing with lower extremity ischemia: revised version. J Vasc Surg 1997;26:517-38.
- Stoffers J. Peripheral arterial disease. In: Jones R, Britten N, Gulpepper L, Grass D, Grol R, Mant D et al, editors. Oxford textbook of primary medical care. Oxford: Oxford University Press, 2004: 631-7
- Bachoo P, Thorpe PA, Maxwell H, Welch K. Endovascular stents for intermittent claudication. Cochrane Database Syst Rev 2010;CD003228.
- Twine CP, Coulston J, Shandall A, McLain AD. Angioplasty versus stenting for superficial femoral artery lesions. Cochrane Database Syst Rev 2009;CD006767.
- Twine CP, McLain AD. Graft type for femoro-popliteal bypass surgery. Cochrane Database Syst Rev 2010;CD001487.
- Fowkes FG, Gillespie IN. Angioplasty (versus non surgical management) for intermittent claudication. Cochrane Database Syst Rev 2000;CD000017.
- De Vries SO, Visser K, De Vries JA, Wong JB, Donaldson MC, Hunink MG. Intermittent claudication: cost-effectiveness of revascularization versus exercise therapy. Radiology 2002;222:25-36.
- Fowkes F, Leng GC. Bypass surgery for chronic lower limb ischaemia. Cochrane Database Syst Rev 2008;CD002000.
- Fritschi C, Collins EG, O’Connell S, McBurney C, Butler J, Edwards L. The Effects of Smoking Status on Walking Ability and Health-Related Quality of Life in Patients With Peripheral Arterial Disease. J Cardiovasc Nurs 2013;28:380-6.
- Gardner AW, Killewich LA, Montgomery PS, Katzel LI. Response to exercise rehabilitation in smoking and nonsmoking patients with intermittent claudication. J Vasc Surg 2004;39:531-8.
- Smith I, Franks PJ, Greenhalgh RM, Poulter NR, Powell JT. The influence of smoking cessation and hypertriglyceridaemia on the progression of peripheral arterial disease and the onset of critical ischaemia. Eur J Vasc Endovasc Surg 1996;11:402-8.
- Girolami B, Bernardi E, Prins MH, Ten Cate JW, Hettiarachchi R, Prandoni P, et al. Treatment of intermittent claudication with physical training, smoking cessation, pentoxifylline, or nafronyl: a meta-analysis [see comments]. Arch Intern Med 1999;159:337-45.
- Willigendael EM, Teijink JA, Bartelink ML, Peters RJ, Buller HR, Prins MH. Smoking and the patency of lower extremity bypass grafts: a meta-analysis. J Vasc Surg 2005;42:67-74.
- Stewart KJ, Hiatt WR, Regensteiner JG, Hirsch AT. Exercise training for claudication. N Engl J Med 2002;347:1941-51.
- Watson L, Ellis B, Leng GC. Exercise for intermittent claudication. Cochrane Database Syst Rev 2008;CD000990.
- Guidon M, McGee H. Exercise-based interventions and health-related quality of life in intermittent claudication: a 20-year (1989-2008) review. Eur J Cardiovasc Prev Rehabil 2010;17:140-54.
- Kruidenier LM, Viechtbauer W, Nicolai SP, Buller H, Prins MH, Teijink JA. Treatment for intermittent claudication and the effects on walking distance and quality of life. Vascular 2012;20:20-35.
- Spronk S, Bosch JL, Veen HF, Den Hoed PT, Hunink MG. Intermittent claudication: functional capacity and quality of life after exercise training or percutaneous transluminal angioplasty--systematic review. Radiology 2005;235:833-42.
- Nicolai SP, Teijink JA, Prins MH. Multicenter randomized clinical trial of supervised exercise therapy with or without feedback versus walking advice for intermittent claudication. J Vasc Surg 2010;52:348-55.
- Bendermacher BL, Willigendael EM, Teijink JA, Prins MH. Supervised exercise therapy versus non-supervised exercise therapy for intermittent claudication. Cochrane Database Syst Rev 2006;CD005263.
- Gardner AW, Montgomery PS, Parker DE. Optimal exercise program length for patients with claudication. J Vasc Surg 2012;55:1346-54.
- Bulmer AC, Coombes JS. Optimising exercise training in peripheral arterial disease. Sports Med 2004;34:983-1003.
- Salhiyyah K, Senanayake E, Abdel-Hadi M, Booth A, Michaels JA. Pentoxifylline for intermittent claudication. Cochrane Database Syst Rev 2012;1:CD005262.
- CVZ. Farmacotherapeutisch Kompas 2012. College voor zorgverzekeringen. Ga naar bron: CVZ. Farmacotherapeutisch Kompas 2012. College voor zorgverzekeringen.
- Hiatt WR. Medical treatment of peripheral arterial disease and claudication. N Engl J Med 2001;344:1608-21.
- Dawson DL, Cutler BS, Hiatt WR, Hobson RW, Martin JD, Bortey EB, et al. A comparison of cilostazol and pentoxifylline for treating intermittent claudication. Am J Med 2000;109:523-30.
- Robless P, Mikhailidis DP, Stansby GP. Cilostazol for peripheral arterial disease. Cochrane Database Syst Rev 2008;CD003748.
- Nicolai SP, Kruidenier LM, Bendermacher BL, Prins MH, Teijink JA. Ginkgo biloba for intermittent claudication. Cochrane Database Syst Rev 2009a;CD006888.
- Villarruz MV, Dans A, Tan F. Chelation therapy for atherosclerotic cardiovascular disease. Cochrane Database Syst Rev 2002;CD002785.
- Moher D, Pham B, Ausejo M, Saenz A, Hood S, Barber GG. Pharmacological management of intermittent claudication: a meta-analysis of randomised trials. Drugs 2000;59:1057-70.
- Price J, Leng GC. Steroid sex hormones for lower limb atherosclerosis. Cochrane Database Syst Rev 2012;10:CD000188.
- Kleijnen J, Mackerras D. Vitamin E for intermittent claudication. Cochrane Database Syst Rev 2000;CD000987.
- Cosmi B, Conti E, Coccheri S. Anticoagulants (heparin, low molecular weight heparin and oral anticoagulants) for intermittent claudication. Cochrane Database Syst Rev 2001;CD001999.