Diabetes mellitus type 2
Richtlijnen spoed
Naar Volledige tekst ›Gebruik bij twijfel over de klinische stabiliteit van de patiënt de ABCDE-systematiek (zie NHG-ABCDE-kaart).
Zie verder Hypoglykemie en Zeer ernstige hyperglykemie.
Richtlijnen diagnostiek
Naar Volledige tekst ›Opsporing
Naar Volledige tekst ›Bepaal bloedglucose (bij voorkeur nuchter):
- bij klachten zoals dorst, polyurie, vermagering, pruritus vulvae op oudere leeftijd, recidiverende urineweginfecties en balanitis, mononeuropathie, neurogene pijnen en sensibiliteitsstoornissen.
- in het kader van spreekuurbezoek (om de 3 jaar) bij personen > 45 jaar én:
- BMI ≥ 27
- diabetes mellitus type 2 bij ouders, broers of zussen
- hypertensie (systolische bloeddruk > 140 mmHg of behandeling voor hypertensie)
- dyslipidemie (HDL-cholesterol ≤ 0,90 mmol/l, triglyceriden > 2,8 mmol/l)
- (verhoogd risico op) hart- en vaatziekten (zie NHG-Standaard Cardiovasculair risicomanagement (CVRM))
- Turkse, Marokkaanse of Surinaamse achtergrond.
- Hindostaanse achtergrond (≥ 35 jaar)
- na zwangerschapsdiabetes: de eerste 5 jaar jaarlijks, daarna om de 3 jaar.
Vaststellen van diabetes mellitus
Naar Volledige tekst ›Stel de diagnose diabetes mellitus bij:
- 2 nuchtere plasmaglucosewaarden ≥ 7,0 mmol/l op 2 verschillende dagen;
- nuchtere plasmaglucosewaarde ≥ 7,0 mmol/l of willekeurige plasmaglucosewaarde ≥ 11,1 mmol/l in combinatie met klachten passend bij hyperglykemie.
Risico-inventarisatie
Naar Volledige tekst ›- Stel een cardiovasculair risicoprofiel op (zie NHG-Standaard Cardiovasculair risicomanagement (CVRM)).
- Verricht bij chronische nierschade aanvullend onderzoek (zie NHG-Standaard Chronische nierschade).
- Verricht zo snel mogelijk (in ieder geval binnen 3 maanden na diagnose) fundusfotografie.
- Verricht voetonderzoek:
- let op: kleur, standsafwijkingen, nagelafwijkingen, drukplekken of eelt, ulcera of amputaties
- test de sensibiliteit met monofilament
- palpeer de voetarteriën en verricht dopplerechografie bij afwezigheid van pulsaties.
Richtlijnen beleid
Naar Volledige tekst ›Voorlichting en advies
Naar Volledige tekst ›Geef informatie over DM2 en over situaties waarin met spoed maatregelen nodig zijn (hypoglykemie, ernstige hyperglykemie, koorts, braken, diarree, (een verhoogd risico op) dehydratie).
Niet-medicamenteuze adviezen
Naar Volledige tekst ›- Stoppen met roken
- Voldoende bewegen
- Afvallen bij BMI > 25
- Gezonde voeding
Medicamenteuze behandeling
Naar Volledige tekst ›Algemeen
Naar Volledige tekst ›- Start bloedglucoseverlagende medicatie als niet-medicamenteuze adviezen onvoldoende zijn om een HbA1c ≤ 53 mmol/mol te bereiken.
- Er zijn 2 stappenplannen. Behandel patiënten afhankelijk van risico op hart- en vaatziekten:
- zonder zeer hoog risico (geen doorgemaakte hart- en vaatziekte, hartfalen of chronische nierschade met verhoogd cardiovasculair risico) volgens tabel s1.
- met een zeer hoog risico (zie tabel s2) volgens tabel s3, mits: niet kwetsbaar, levensverwachting > 5 jaar (bij hartfalen ook < 5 jaar)) en eGFR > 10 ml/min/1,73 m2.
- Voeg bij zeerhoogrisicopatiënten die al behandeld worden volgens het stappenplan voor patiënten zonder zeer hoog risico een SGLT2-remmer toe (bij contra-indicatie: GLP1-agonist). Pas bij gebruikers van een sulfonylureumderivaat en/of insuline met een HbA1c < 64 mmol/mol eerst de dosering aan (zie tabel s3).
- Zie ook Behandeling bij nuchter glucose ≥ 10 mmol/l op moment van diagnose.
| Stap 1 | Metformine |
| Stap 2 | Voeg gliclazide toe† |
| Stap 3 | Maak een keuze afhankelijk van de benodigde HbA1c-daling, patiëntkenmerken en patiëntvoorkeuren (zie ook tabel h6):
|
| Stap 4 | Voeg een ander middel uit stap 3 toe Bij (middel)langwerkende insuline in stap 3 (of stap 4): intensiveer insulinetherapie of voeg een GLP1-agonist toe. |
| * Patiënten zonder eerder doorgemaakte hart- en vaatziekte of hartfalen en zonder chronische nierschade met een matig tot sterk verhoogd risico † Bij patiënten met een clustering van cardiovasculaire risicofactoren of bij patiënten met obesitas kan worden overwogen om in plaats van gliclazide een middel te kiezen dat leidt tot reductie van het cardiovasculaire risico en/of het gewicht. Zie stap 2 in de hoofdtekst. | |
| Patiënten met eerder doorgemaakte hart- en vaatziekten |
|
| Patiënten met chronische nierschade met een matig tot sterk verhoogd cardiovasculair risico† |
|
| Patiënten met hartfalen‡ | Alle vormen van hartfalen, onafhankelijk van de ejectiefractie |
| Gebaseerd op de CVRM-richtlijn (2019). TIA = transiënte ischemische aanval; GFR = glomerulaire filtratiesnelheid; ACR: albumine-creatinineratio (in urine). * Behandel patiënten alleen conform tabel s3 indien niet-kwetsbaar, levensverwachting > 5 jaar en eGFR > 10 ml/min/1,73 m2. † Zie tabel 1 van de NHG-Standaard Chronische nierschade. ‡ Bij patiënten met op het moment van klachten van hartfalen een NT-proBNP 125-300 pg/ml of BNP 35-50 pg/ml is geen direct wetenschappelijk bewijs beschikbaar. Een vergelijkbaar effect is wel aannemelijk. Overweeg te behandelen volgens het zeerhoogrisico stappenplan, overleg zo nodig met de cardioloog. Overweeg te behandelen volgens het stappenplan in tabel s3, overleg zo nodig met de cardioloog. Patiënten met hartfalen hebben ook bij een levensverwachting < 5 jaar een indicatie voor een SGLT2-remmer (zie NHG-Standaard Hartfalen). | |
| Stap 1 | SGLT2-remmer. Start GLP1-agonist bij contra-indicatie voor SGLT2-remmer (bijvoorbeeld eGFR < 15 ml/min/1,73 m2, zie ook tabel h6) |
| Stap 2 | Voeg metformine toe. |
| Stap 3 | Voeg een GLP1-agonist toe† |
| Stap 4 | Voeg een van de middelen uit het stappenplan voor patiënten zonder zeer hoog risico toe (zie tabel s1) Combinatie van GLP1-agonist met DPP4-remmer is niet effectief en wordt ontraden |
| * Zie tabel s2. † Bij een zeer hoog risico alleen vanwege hartfalen is er geen aangetoond voordeel van een GLP1-agonist op harde eindpunten. | |
Streefwaarden voor bloedglucose en HbA1c
Naar Volledige tekst ›- De streefwaarden gelden voor beide stappenplannen.
- Gebruik nuchtere glucosewaarden om de dosering van voorgeschreven medicatie aan te passen.
- Streefwaarden bloedglucose: nuchter 4,5 tot 8 mmol/l; 2 uur postprandiaal < 9 mmol/l.
- Bepaal aan de hand van het HbA1c of een nieuwe stap in het stappenplan is geïndiceerd.
- Streefwaarden HbA1c:
- Patiënten < 70 jaar: ≤ 53 mmol/mol
- Patiënten > 70 jaar tot en met medicamenteuze stap 1: ≤ 53 mmol/mol
- Patiënten ≥ 70 jaar vanaf medicamenteuze stap 2: 54-58 mmol/mol (bij ziekteduur < 10 jaar) of 54-64 mmol/mol (bij ziekteduur ≥ 10 jaar)
- Bij kwetsbare ouderen en mensen met een korte levensverwachting (arbitrair < 5 jaar) zijn glucosewaarden van 6-15 mmol/l en HbA1c-waarden tot 53-69 mmol/mol acceptabel.
Praktische uitgangspunten medicamenteuze behandeling
Naar Volledige tekst ›- Verhoog de dosering elke 2-4 weken aan de hand van nuchtere glucosewaarden. Ga naar de volgende stap als dosisverhoging niet meer mogelijk is (door bijwerkingen of bereiken maximale dagdosis).
- Bij bijwerkingen of contra-indicaties voor een middel: kies andere middelen uit het stappenplan.
- Zie tabel h6 voor bijwerkingen en contra-indicaties.
- Zie tabel h10 voor doseringen van (voorbeelden van) middelen in het stappenplan; zie Bijlage Behandeling met insuline voor de praktische behandeling met insuline.
Behandeling van risicofactoren voor hart- en vaatziekten en chronische nierschade
Naar Volledige tekst ›- Voor de behandeling van risicofactoren voor hart- en vaatziekten en (beginnende) chronische nierschade bij patiënten met DM2 zie NHG-Standaard Cardiovasculair risicomanagement (CVRM), NHG-Standaard Chronische nierschade en NHG-Behandelrichtlijn Stoppen met roken.
- Behandel patiënten met DM2 zonder hypertensie maar met albuminurie én een levensverwachting ≥ 10 jaar ook met een ACE-remmer.
Controles
Naar Volledige tekst ›Driemaandelijkse controle (eventueel door praktijkondersteuner):
Naar Volledige tekst ›- Vraag naar welbevinden, hypo- of hyperglykemieën, problemen met voedings- en bewegingsadvies en/of medicatie.
- Bepaal nuchter glucose, lichaamsgewicht en bloeddruk.
- Bepaal bij patiënten die > 1 dd insuline gebruiken voorafgaand aan de controle de vierpuntsglucosedagcurve en (elke 3 of 6 maanden) het HbA1c.
- Verricht voetonderzoek bij hoog risico op een ulcus.
Jaarlijkse controles
Naar Volledige tekst ›- Evalueer de individuele streefwaarden.
- Informeer naar: welbevinden, visusproblemen, angina pectoris, claudicatio intermittens, tekenen van hartfalen, sensibiliteitsverlies, pijn of tintelingen in de benen en tekenen van autonome neuropathie, seksuele problemen, aanwijzingen voor een depressie of cognitieve problemen.
- Verricht aanvullend onderzoek: nuchter glucose, HbA1c, creatinine, eGFR, kalium, albumine-creatinineratio.
- Herhaal screening op diabetische retinopathie, afhankelijk van voorgaande classificatie (zie tabel h11).
- Overweeg dosisverlaging of stoppen van bloedglucoseverlagende middelen bij verandering in de situatie, bijvoorbeeld bij toenemende kwetsbaarheid.
Beleid bij koorts, braken of diarree
Naar Volledige tekst ›- Adviseer extra vochtinname.
- Bij koorts, braken, diarree en/of (een verhoogd risico op) dehydratie kan aanpassing van medicatie nodig zijn, zie tabel h12.
- Controleer zorgvuldig de bloedglucosewaarden en vochthuishouding.
Consultatie en verwijzing
Naar Volledige tekst ›Verwijs:
- voor voedingsadvies en voor overschakeling op insuline: naar een diëtist
- voor instellen op insuline bij afwezigheid van randvoorwaarden of onvoldoende deskundigheid in de huisartspraktijk: naar een internist
- bij onvoldoende glykemische regulatie ondanks optimale titratie intensieve insulinebehandeling: naar een internist
- bij een zwangerschap(swens): naar een internist
- bij vermoeden van MODY of LADA: naar een internist
- bij afwijkingen oogfundus: naar een oogarts (verwijs binnen 1 week in geval van vaatnieuwvormingen, preretinale fibrose, glasvochtbloeding of preretinale bloeding)
- bij (vermoeden van) mononeuropathie (met name hersenzenuwen): naar een neuroloog
- bij voetproblemen Sims 1: eventueel naar een pedicure
- bij voetproblemen Sims 2 en Sims 3: naar een podotherapeut
- bij voetulcus (plantair of diep gelegen), of bij tekenen van perifeer vaatlijden of infectie of ischemie: naar een voetenteam met spoed
- bij overige voetulcera die niet binnen 2 weken genezen: naar een voetenteam zonder spoed
- bij klachten van gebit of mond: naar een tandarts en/of mondhygiënist
- bij nierschade: conform de verwijscriteria in NHG-Standaard Chronische nierschade.
Belangrijkste wijzigingen
Naar Samenvatting ›- Het medicamenteus stappenplan voor patiënten zonder zeer hoog risico op hart- en vaatziekten is herzien. Metformine blijft stap 1. In stap 2 is gliclazide meestal een goede keuze, overweeg hier van af te wijken en een GLP1-agonist te starten bij een BMI ≥ 30 of een SGLT2-remmer te starten bij ≥ 4 risicofactoren voor hart- en vaatziekten. Vanaf stap 3 is de keuze afhankelijk van patiëntkenmerken, de benodigde HbA1c-daling en de voorkeur van de patiënt.
- Alle patiënten met hartfalen behoren nu tot de groep zeerhoogrisicopatiënten, ongeacht hun ejectiefractie.
- Bij zeerhoogrisicopatiënten die al bloedglucoseverlagende medicatie gebruiken wordt nu geadviseerd om bij HbA1c ≤ 53 mmol/mol ook een SGLT2-remmer (bij contra-indicatie: GLP1-agonist) te overwegen.
- Het beleid bij hypoglykemie is herzien: glucagon nasaal is als tweede keus toegevoegd.
- Er is een paragraaf toegevoegd over het beleid bij nuchter glucose ≥ 10 mmol/L op het moment van diagnose.
- Er is een paragraaf toegevoegd over diabetes mellitus type 2 in remissie. Hierbij heeft de patiënt zonder medicatie ≥ 3 maanden een nuchter glucose < 7 mmol/L én HbA1c < 48 mmol/mol.
Kernboodschappen
Naar Samenvatting ›- Doel van de behandeling is het voorkómen en behandelen van klachten en complicaties, zoals (toename van) hart- en vaatziekten, chronische nierschade, retino- en neuropathie.
- Geef elke patiënt regelmatig educatie en leefstijladviezen (niet roken, goede voeding, gewichtsbeheersing, voldoende bewegen).
- Voor patiënten zonder zeer hoog risico op hart- en vaatziekten is stap 1 van de behandeling metformine. In stap 2 is gliclazide meestal een goede keuze, overweeg hier van af te wijken en een GLP1-agonist te starten bij een BMI ≥ 30 of een SGLT2-remmer te starten bij ≥ 4 risicofactoren voor hart- en vaatziekten. Vanaf stap 3 is de keuze voor medicatie afhankelijk van de benodigde HbA1c-daling en van kenmerken en voorkeuren van de patiënt.
- Voor niet-kwetsbare patiënten met een zeer hoog risico op hart- en vaatziekten geldt een afwijkend medicamenteus stappenplan. SGLT2-remmers en GLP1-agonisten vormen de basis van de medicamenteuze behandeling bij deze groep.
- De streefwaarde voor HbA1c is ≤ 53 mmol/mol voor elke patiënt die behandeld wordt met leefstijladviezen en medicatie uit behandelstap 1. Vanaf behandelstap 2 is de streefwaarde afhankelijk van de leeftijd en de ziekteduur. Bij (kwetsbare) ouderen is de streefwaarde in het algemeen hoger.
- Stel de indicatie voor een antihypertensivum en een statine volgens NHG-Standaard Cardiovasculair risicomanagement (CVRM).
- De diabeteszorg wordt steeds meer geïndividualiseerd wat betreft streefwaarden en controlefrequenties.
Inleiding
Naar Samenvatting ›Scope
Naar Samenvatting ›Richtlijnen voor de diagnostiek, behandeling en begeleiding van volwassen patiënten met diabetes mellitus type 2 (in deze standaard verder te noemen ‘diabetes type 2’) binnen de huisartsenpraktijk met als doel complicaties zoals hart- en vaatziekten, chronische nierschade, retinopathie en neuropathie te voorkomen of te vertragen, en eventuele klachten te verminderen. De spoedparagraaf Hypoglykemie geldt ook voor volwassenen met diabetes mellitus type 1.
Afstemming
Naar Samenvatting ›- Deze standaard sluit voor de behandeling van cardiovasculaire risicofactoren aan bij NHG-Standaard Cardiovasculair risicomanagement (CVRM).
- De complexiteit van deze NHG-Standaard bemoeilijkt de implementatie van de aanbevelingen. Om de uitvoerbaarheid van de richtlijnen te bevorderen, verwijzen we naar het boek Protocollaire diabeteszorg 2025-2026.
- Raadpleeg voor de indicatoren voor diabeteszorg de NHG-Indicatoren Kwaliteit huisartsenzorg
Achtergronden
Naar Samenvatting ›Epidemiologie
Naar Samenvatting ›- In 2021 waren er in Nederland 1.156.900 mensen met gediagnosticeerde diabetes. De prevalentie bedroeg 70,9 per 1000 mannen en 61,1 per 1000 vrouwen.
- De prevalentie van diabetes type 2 onder mensen met een lage sociaal economische positie is circa 2,5 × hoger dan bij mensen met een hoge sociaal economische positie.
- Diabetes mellitus komt in Nederland beduidend vaker voor bij mensen met een Turkse, Marokkaanse of Surinaamse achtergrond dan bij mensen met een Nederlandse achtergrond. De prevalentie is het hoogst onder personen met een Hindostaanse achtergrond, vooral in de oudere leeftijdsgroep.
- Coronaire hartziekten als complicatie bij diabetes komen significant vaker voor bij mensen met een Turkse, Marokkaanse of Surinaamse achtergrond. Daarnaast hebben mensen met een Hindoestaanse achtergrond significant vaker diabetische nefropathie dan mensen met een Nederlandse achtergrond.
Prevalentie en incidentie van diabetes in Nederland
De prevalentie- en incidentiegegevens zijn ontleend aan het RIVM-overzicht en gebaseerd op de Registratie Peilstations Nederland van Nivel Zorgregistraties Eerste Lijn (zie VZ-info Diabetes mellitus, geraadpleegd augustus 2024).
In 2021 waren er naar schatting 1.156.900 mensen met diabetes bekend bij de huisarts. Dat waren 618.300 mannen en 538.500 vrouwen (70,9 per 1000 mannen en 61,1 per 1000 vrouwen). Vanaf 30-jarige leeftijd komt diabetes in alle leeftijdsgroepen vaker voor bij mannen dan bij vrouwen. Het aantal mannen met diabetes mellitus is toegenomen van 542.000 in 2011 naar 618.300 in 2021. Bij vrouwen was de stijging minder sterk: van 538.100 in 2011 naar 538.500 in 2021.
De incidentie van diabetes mellitus bedroeg in 2021 3,4 per 1000 mannen en 2,7 per 1000 vrouwen (in totaal 53.100 nieuwe patiënten, van wie 29.600 mannen en 23.500 vrouwen). De incidentie neemt toe met de leeftijd, maar neemt weer af op hoge leeftijd (> 75 jaar). In bijna alle leeftijdsgroepen is de incidentie hoger bij mannen dan bij vrouwen. Het aantal door de huisarts nieuw gediagnosticeerde gevallen van diabetes mellitus is in de periode 2011-2021 gedaald, voor zowel mannen als vrouwen. Bij mannen was de daling (50%) minder groot dan bij vrouwen (60%). Deze trend is gecorrigeerd voor veranderingen in de omvang en leeftijdsopbouw van de bevolking. Een review op basis van 22 miljoen diabetesdiagnoses uit 21 landen, gemeten vanaf 2010, laat zien dat de incidentie van diabetes mellitus type 2 daalt of stabiliseert in de meeste onderzochte landen. Dit beeld wordt ook ondersteund door een systematische review (SR) van onderzoeken in voornamelijk Europese populaties.
Deze SR laat zien dat de incidentie van diabetes steeg over de periode 1960-2000, en daarna stabiliseerde (30%) of daalde (36%). Meer aandacht voor preventie van diabetes wordt als mogelijke verklaring genoemd door de auteurs.
Prevalentie en sociaal-economische status
Het verband tussen het voorkomen van diabetes type 2 en sociaal-economische status (SES) (opleidingsniveau, beroep, inkomen) werd onderzocht in een SR (23 onderzoeken; populaties uit landen met hoge, gemiddelde en lage inkomens). Vergeleken met een hoge SES was een lage SES geassocieerd met een verhoogd risico op diabetes type 2, met relatieve risico’s (RR) voor respectievelijk opleiding RR 1,41 (95%-BI 1,28 tot 1,51), beroep RR 1,31 (95%-BI 1,09 tot 1,57) en inkomen RR 1,40 (95%-BI 1,04 tot 1,88). De risicoverhoging was onafhankelijk van de inkomensniveaus in de verschillende landen. In welvarende landen was deze associatie het sterkst.10 De uitkomsten van een case-cohortonderzoek in 8 Europese landen (n = 340.234; 3,99 miljoen persoonsjaren follow-up) zijn hiermee consistent. 11Personen met een laag opleidingsniveau hadden een groter risico op diabetes mellitus type 2, met hazardratio (HR) 1,77 (95%-BI 1,69 tot 1,85). De HR was nagenoeg hetzelfde na correctie voor lichamelijke activiteit, roken en voeding, maar werd kleiner na verdere correctie voor BMI (mannen HR 1,36; 95%-BI 1,23 tot 1,51; vrouwen HR 1,32; 95%-BI 1,20 tot 1,45).
Ook Nederlandse cijfers van het Nivel laten zien dat mensen met een lage SES, gemeten naar besteedbaar inkomen, vaker diabetes hebben (11,2%) dan mensen met een hogere SES (4,3%).
Prevalentie en etniciteit
Er is een duidelijk verschil in de prevalentie tussen Nederlanders met verschillende afkomst. De HELIUS-studie heeft van 2011-2015 data verzameld over het vóórkomen van diabetes type 2 onder 21.483 inwoners van Amsterdam (18-70 jaar oud), verdeeld over de 6 meest voorkomende etnische groeperingen in Amsterdam; Nederlands, Hindostaans, Afro-Surinaams, Marokkaans, Turks, Ghanees. Het onderzoek laat zien dat de prevalentie van diabetes hoger is onder mensen met een Hindostaanse achtergrond (17,7%), Afro-Surinaamse achtergrond (12,1%), Marokkaanse achtergrond (10,8%), Turkse achtergrond (10,8%) en Ghanese achtergrond (9,6%) dan onder patiënten met een Nederlandse achtergrond (2,4%). Deze verschillen waren ook aanwezig na correctie voor leeftijd. De prevalentie van diabetes mellitus type 2 onder patiënten met een migratieachtergrond is bovendien al in de leeftijdsgroepen vanaf 31-40 jaar significant hoger dan onder patiënten met Nederlandse achtergrond in dezelfde leeftijdsgroep. Het verschil in vóórkomen van diabetes mellitus type 2 op basis van leeftijd is zelfs zo groot dat de prevalentie in een gegeven leeftijdsgroep onder patiëntengroepen met een migratieachtergrond gelijk is aan de prevalentie van diabetes onder patiënten van Nederlandse afkomst die 20 jaar ouder zijn. Mannen en vrouwen uit patiëntengroepen met een migratieachtergrond hebben dus een aanzienlijk hoger risico op diabetes mellitus type 2 dan patiënten van Nederlandse afkomst (OR 3-8 voor mannen, 6-12 voor vrouwen). Na correctie voor BMI, heupomvang, alcoholinname, fysieke activiteit en opleidingsniveau is de prevalentie van diabetes in patiëntengroepen met een migratieachtergrond nog steeds een stuk hoger (OR 3-5).
Een SR met meta-analyse naar de prevalentie van diabetes mellitus type 2 onder patiëntengroepen met een migratieachtergrond in Europa toont eenzelfde beeld (20 onderzoeken, n = 430.992). Patiëntengroepen werden onderverdeeld naar geografische regio: Zuid-Azië (ZA), Sub-Sahara Afrika (SSA), Midden-Oosten en Noord-Afrika (MONA), Zuid- en Centraal-Amerika (ZCA), en het westelijke deel van de Stille Oceaan (WSO). De oddsratio (OR) voor diabetes ten opzichte van de Europese gastpopulaties was het grootst voor mensen met een ZA-achtergrond (OR 3,7; 95%-BI 2,7 tot 5,1), gevolgd door MONA (OR 2,7; 95%-BI 1,8 tot 3,9), SSA (OR 2,6; 95%-BI 1,0 tot 3,5), WSO (OR 2,3; 95%-BI 1,2 tot 4,1) en ZCA (OR 1,3; 95%-BI 1,1 tot 1.6).
Verschillen in diabetescomplicaties tussen etnische groeperingen
Een analyse van de HELIUS-studie van 2334 Amsterdamse patiënten met diabetes mellitus type 2 laat zien dat nefropathie vaker voorkomt onder patiënten met een Hindostaanse, Marokkaanse en Turkse achtergrond dan onder patiënten met een Nederlandse achtergrond, gecorrigeerd voor geslacht en leeftijd. Wanneer daarnaast ook gecorrigeerd wordt voor SES en conventionele cardiovasculaire risicofactoren (roken, alcoholconsumptie, fysieke activiteit, hypertensie, BMI, hypercholesterolemie, HbA1c, duur van diabetes) wordt er alleen nog een significant verschil gezien tussen patiënten met een Hindostaanse en patiënten met een Nederlandse achtergrond. De aldus gecorrigeerde prevalentie van nefropathie bij patiënten met een Nederlandse achtergrond verschilde niet meer van die patiënten met Afro-Surinaamse of Ghanese achtergrond. De HELIUS-studie laat ook zien dat coronaire hartziekten significant vaker voorkomen bij alle patiëntengroepen met een migratieachtergrond, ook na correctie voor leeftijd, geslacht, SES en conventionele cardiovasculaire risicofactoren. Voor perifeer arterieel vaatlijden en beroerte werden geen verschillen gezien tussen de verschillende migratieachtergronden.
Etiologie en pathofysiologie
Naar Samenvatting ›- Bij het ontstaan van diabetes type 2 spelen genetische en omgevingsfactoren een rol. De pathofysiologische ontwikkeling wordt gekenmerkt door 2 verschijnselen:
- onvoldoende insulinesecretie door bètaceldisfunctie
- insulineresistentie in lever-, spier- en vetweefsel
- Centrale adipositas en insulineresistentie worden in verband gebracht met vetstapeling in diverse organen, wat negatieve gevolgen heeft voor de functie van deze organen.
- Verder spelen hormonen (incretines), geproduceerd door de dunne darm op het moment dat het voedsel passeert, een rol.
- De belangrijkste incretines zijn ‘glucagon-like’ peptide-1 (GLP1) en ‘glucagon dependent insulinotropic’ peptide (GIP).
- De incretines bevorderen de insulinesecretie en remmen de glucagonafgifte op glucoseafhankelijke wijze.
- Bij diabetes type 2 vermindert de secretie van GLP1 en ontstaat resistentie voor GIP. Hierdoor wordt bij glucosebelasting de insulineproductie onvoldoende gestimuleerd en de glucagonafgifte onvoldoende geremd, met als gevolg hyperglykemie.
Genetische factoren
Het belang van genetische factoren blijkt vooral uit het feit dat als de ene helft van een eeneiige tweeling diabetes mellitus type 2 ontwikkelt, in 60-90% van de gevallen ook de ander de ziekte krijgt. Verder bleek uit onderzoek dat ouders, broers/zussen en kinderen van patiënten met diabetes mellitus type 2 een hoger absoluut risico hebben om vóór het 80e levensjaar diabetes te krijgen dan familieleden van mensen zonder diabetes. Voor ouders bedroeg dit risico 21 versus 9%, voor broers/zussen 38 versus 7% en voor kinderen 32 versus 15%.
Overgewicht en fysieke activiteit
Het risico op diabetes wordt mede bepaald door de aanwezigheid van overgewicht, het type vetverdeling (middelomtrek) en de mate van lichamelijke activiteit.
In 1990 had 1 op de 3 volwassen Nederlanders overgewicht (BMI ≥ 25). Sindsdien is het aantal Nederlanders met overgewicht sterk gestegen tot de helft van alle volwassenen in 2020. Deze stijging is significant bij mannen, bij vrouwen én in de totale groep. In 2020 had 14,3% van de Nederlanders ≥ 18 jaar obesitas (BMI ≥ 30), het percentage Nederlanders met obesitas is sinds 1990 meer dan verdubbeld (zie VZinfo Overgewicht, geraadpleegd augustus 2024).
De incidentie van diabetes neemt toe bij toename van de middelomtrek.
De vetverdeling blijkt een betere voorspeller van diabetes dan overgewicht vastgesteld met de BMI.
Bij vrouwen met een buikomvang > 88 cm en mannen met een buikomvang > 102 cm bleek het risico op diabetes 4 × hoger dan in de controlegroep.
Gegevens uit het Hoorn-onderzoek toonden aan dat 16,3% van de deelnemers met overgewicht en een hoge abdominale vetmassa binnen 6 jaar diabetes kreeg, versus 6,8% van de deelnemers zonder overgewicht en met een lage abdominale vetmassa.
Toename van lichamelijke activiteit blijkt bij mannen en vrouwen zonder diabetes of gestoorde glucosetolerantie te resulteren in een lager risico op het krijgen van diabetes mellitus type 2.
In het Diabetes Prevention Program werd het effect van een leefstijlinterventie op de incidentie van diabetes vergeleken met metformine en met placebo. Na 3 jaar follow-up was de incidentie van diabetes in de leefstijlarm gedaald met 58% (95%-BI 48 tot 66) ten opzichte van placebo, en in de metforminearm met 31% (95%-BI 17 tot 43). Na 7 jaar follow-up was de diabetesincidentie in de 3 onderzoeksarmen gelijk.
Na 15 jaar follow-up was reductie ten opzichte van placebo 27% in de leefstijlarm en 18% in de metforminearm.
Insulinegevoeligheid en bètacelfunctie
De verhouding tussen insulinegevoeligheid en bètacelfunctie bepaalt de glucosetolerantie. Zodra een grotere insulinebehoefte niet meer door een hogere insulineproductie kan worden opgevangen zoals bij beginnende bètaceldisfunctie, ontstaat hyperglykemie. Bij personen met gestoorde glucosetolerantie bleek een verminderde bètacelfunctie de belangrijkste voorspeller van het ontstaan van diabetes.
Glucolipotoxiciteit
Insulineresistentie leidt ook tot vetstapeling (triglyceridenopslag) in niet-vetweefsel, in het bijzonder in de lever maar bijvoorbeeld ook in hart en spieren. Dit gaat gepaard met functionele en structurele afwijkingen van de getroffen organen. De hyperglykemie en de verhoogde concentraties vrije vetzuren en triglyceriden kunnen de bestaande insulineresistentie en bètaceldisfunctie verder nadelig beïnvloeden. Dit fenomeen wordt ook wel glucolipotoxiciteit genoemd. Omgekeerd gaat normalisatie van de bloedglucosewaarde gepaard met verbetering van de bètacelfunctie, afname van de insulineresistentie en afname van de concentratie vrije vetzuren.
Metabool syndroom
De clustering van belangrijke risicofactoren voor hart- en vaatziekten, diabetes en nierziekten wordt wel gedefinieerd als het metabool syndroom. De meest gebruikte definitie volgt de NCEP-ATP-III-criteria. Van een metabool syndroom is sprake indien ≥ 3 van de volgende 5 componenten aanwezig zijn:
• middelomtrek > 102 cm (mannen) of 88 cm (vrouwen)
• triglyceriden ≥ 1,7 mmol/L
• HDL-cholesterol < 1,0 mmol/L (mannen) of < 1,3 mmol/L (vrouwen)
• bloeddruk systolisch ≥ 130 mmHg of diastolisch ≥ 85 mmHg
• nuchter bloedglucose ≥ 6,1 mmol/L.
Incretine-effect
De insulinerespons na orale inname van glucose is groter dan na intraveneuze glucosetoediening, omdat de secretie van GLP1 in de darmwand bij orale glucose belasting wél en bij intraveneuze glucosetoediening niet gestimuleerd wordt. Dit verschil in insulinerespons heet het incretine-effect. Omdat diabetespatiënten na glucose-inname onvoldoende GLP1 produceren, is bij hen het incretine-effect verminderd.
Complicaties
Naar Samenvatting ›Cardiovasculaire aandoeningen
Naar Samenvatting ›Diabetes type 2 is geassocieerd met een verhoogd risico op cardiovasculaire morbiditeit en mortaliteit. De mortaliteit als gevolg van coronaire hartziekten is hoger dan in de algemene bevolking. Vooral bij vrouwen is de relatieve toename groot.
Mortaliteit als gevolg van coronaire hartziekten
In een meta-analyse (13 onderzoeken, n = 45.108, gemiddelde follow-upduur 13,4 jaar) werd het risico op coronaire hartziekte bij diabetespatiënten zonder myocardinfarct in de voorgeschiedenis vergeleken met het risico daarop bij personen zonder diabetes maar met een reeds doorgemaakt myocardinfarct. De diabetespatiënten zonder myocardinfarct hadden een 43% lager risico (OR 0,56; 95%-BI 0,53 tot 0,60).
Conclusie: het risico bij mensen met diabetes is belangrijk verhoogd, maar minder dan dat van mensen met een myocardinfarct in de voorgeschiedenis.
SMART, een Nederlands prospectief cohortonderzoek, kwam tot vergelijkbare conclusies bij iets andere patiëntengroepen (9808 patiënten met een hoog risico op hart- en vaatziekten, van wie 1758 met diabetes mellitus type 2, gemiddelde follow-upduur 7 jaar). De incidentieratio van de samengestelde uitkomstmaat ‘niet-fataal myocardinfarct, niet-fataal CVA en vasculair overlijden’ was 5,8 per 1000 persoonsjaren bij patiënten die bij aanvang van de studie geen diabetes mellitus type 2 en geen cardiovasculaire ziekte in de voorgeschiedenis hadden, versus 15,2 per 1000 persoonsjaren bij patiënten met diabetes mellitus type 2 maar zonder cardiovasculaire ziekte, en 40,7 per 1000 persoonsjaren bij patiënten met diabetes mellitus type 2 én een cardiovasculaire ziekte. Voor de uitkomstmaat ‘vasculaire interventies’ werd een vergelijkbaar oplopende incidentieratio gezien.
In een andere meta-analyse (37 onderzoeken, n = 447.064) werd gevonden dat patiënten met diabetes mellitus type 2 een hoger risico hadden op een fatale coronaire hartziekte dan personen zonder diabetes (5,4 versus 1,6%). Het relatieve risico door diabetes was significant groter voor vrouwen dan voor mannen: respectievelijk 3,50 (95%-BI 2,70 tot 4,53) en 2,06 (95%-BI 1,81 tot 2,34). Na exclusie van 8 onderzoeken waarin alleen voor leeftijd was gecorrigeerd, verminderde dit risicoverschil, maar bleef het significant. Vrouwen met diabetes hebben een 50% hoger risico op fatale coronaire hartziekte dan mannen.
Chronische nierschade
Naar Samenvatting ›- In 2018 had 36% van de patiënten met diabetes type 2 chronische nierschade. Een verminderde nierfunctie geeft een sterk verhoogd risico op hart- en vaatziekten.
- De incidentie van nierfunctievervangende therapie (dialyse of transplantatie) onder patiënten met diabetes type 2 was in 2021 0,3 per 1000 patiënten, de prevalentie bedroeg 1,5 per 1000 patiënten.
Onder chronische nierschade wordt verstaan: een verlaagde eGFR en/of verhoogde albuminurie en/of specifieke sedimentafwijkingen die ≥ 3 maanden aanwezig zijn.
Chronische nierschade wordt gedefinieerd en gestadieerd op basis van nierfunctie (eGFR) en albuminurie. De eGFR wordt geschat met de CKD-EPI-formule. Verminderde nierfunctie is gedefinieerd als eGFR < 60 ml/min/1,73 m2; eindstadium nierfalen als eGFR < 15 ml/min/1,73 m2. De mate van albuminurie wordt bepaald aan de hand van de albumine-creatinineratio (ACR). Men onderscheidt matig verhoogde albuminurie (ACR 3-30 mg/mmol) en ernstig verhoogde albuminurie (ACR > 30 mg/mmol). Op basis van de combinatie van eGFR en albuminurie kan een stratificatie gemaakt worden voor een mild verhoogd, matig verhoogd dan wel sterk verhoogd risico op cardiovasculaire schade, progressie van nierschade en mortaliteit (zie NHG-Standaard Chronische nierschade).
Bijna 5% van de volwassen patiënten in de Nederlandse huisartsenpraktijk is bekend met chronische nierschade. Maar liefst 39% van deze patiënten heeft diabetes mellitus.
Op 1 januari 2018 was, volgens Nivel Zorgregistraties Eerste Lijn, de prevalentie van diabetes mellitus type 2 in de huisartsenpraktijk 58 per 1000 patiënten. Bij 36% van deze diabetespatiënten werd chronische nierschade vastgesteld (22% mild verhoogd risico, 8% matig verhoogd risico, 6% sterk verhoogd risico, 64% geen chronische nierschade), bij 21,7% was geen nierfunctie bekend. Het kan zijn dat de huisarts deze wel bepaald heeft maar niet op de gebruikelijke manier in het dossier heeft genoteerd, of dat de nierfunctie in de tweede lijn werd gecontroleerd. Nierschade heeft gevolgen voor het zorggebruik van patiënten met diabetes mellitus type 2. Bij een toename van de chronische nierschade neemt de prevalentie van chronische aandoeningen (met name hypertensie) toe. Ook stijgt het aantal voorgeschreven geneesmiddelen (met name antitrombotica en bètablokkers) en het aantal verwijzingen naar de tweede lijn.
Chronische nierschade en cardiovasculair risico
Chronische nierschade en hart-en vaatziekten delen een aantal risicofactoren voor progressie, zoals roken, hypertensie, hyperlipidemie en diabetes. Als de eGFR daalt tot < 60 ml/min/1,73 m2 of de albuminurie stijgt tot > 3 mg/mmol, komt er een aantal cardiovasculaire risicofactoren bij die specifiek zijn voor chronische nierschade, zoals afwijkingen in het calcium-fosfaatmetabolisme, anemie, metabole acidose, systemische inflammatie, toegenomen sympathische activiteit, activatie van specifieke hormonale systemen (zoals het renine-angiotensine-aldosteronsysteem), upregulatie van profibrotische intracellulaire mechanismen en afgifte van vasoactieve stoffen. Bovendien treedt stapeling van uremische toxines op die leidt tot toegenomen atherosclerose. Deze mechanismen maken dat patiënten met een verminderde nierfunctie een specifiek sterk verhoogd risico hebben op hart- en vaatziekten. (Overgenomen uit NHG-Standaard Chronische nierschade, 2018.)
Nierfunctievervangende therapie
De 2021 was de incidentie van nierfunctievervangende therapie (dialyse of transplantatie) onder patiënten met diabetes mellitus type 2 in Nederland 0,3 en de prevalentie 1,5 per 1000 patiënten (www.nefrovisie.nl, geraadpleegd september 2023).
Neuropathie
Naar Samenvatting ›- Ongeveer de helft van alle patiënten met diabetes krijgt te maken met perifere neuropathie. Naast perifere neuropathie kan ook autonome neuropathie ontstaan, leidend tot maag-, darm- en blaasfunctiestoornissen, seksuele stoornissen en stoornissen in de houdingsafhankelijke bloeddrukregulatie.
- Mononeuropathie van de hersenzenuwen komt ook voor bij patiënten met diabetes, zij het in veel mindere mate.
Diabetische autonome neuropathie
Diabetische autonome neuropathie is een stoornis in het autonome zenuwstelsel dat zich op diverse manieren kan manifesteren:
- cardiovasculaire autonome neuropathie (orthostatische hypotensie, gestoorde inspanningstolerantie, verhoogde hartfrequentie in rust, atypische myocardiale ischemie);
- gastro-intestinale autonome neuropathie (motiliteitstoornissen van de slokdarm, obstipatie, fecale incontinentie, diarree, gastroparese (braken bij ernstige hyperglykemische ontregeling, risico op hypoglykemie bij snelwerkende insulines);
- urogenitale autonome neuropathie (neurogene blaas, erectiele disfunctie, retrograde ejaculatie, verminderde vaginale lubricatie);
sudomotorische autonome neuropathie (anhydrosis, warmte-intolerantie, droge huid, gustatory sweating (transpireren na het nuttigen van eten)); - metabole autonome neuropathie (hypoglykemie-unawareness).
Perifere neuropathie
Diabetische perifere neuropathie is de meest voorkomende vorm van neuropathie wereldwijd. De prevalentie van perifere neuropathie onder diabetespatiënten varieert van 6-51%, afhankelijk van de onderzochte studiepopulatie. Cohortstudies met een follow-up duur tot 25 jaren laten zien dat ongeveer 50% van alle patiënten met diabetes tijdens hun leven te maken zal krijgen met perifere neuropathie. Hyperglycemie, dislipidemie en insulineresistentie dragen allen bij aan het ontstaan van perifere neuropathie. Risicofactoren voor diabetische perifere neuropathie zijn leeftijd, vrouwelijk geslacht, slechte glykemische regulering, diabetesduur, hyperlipidemie, (micro)albuminurie en een verhoogd BMI. De risicofactoren voor het ontstaan van pijnlijke diabetische neuropathie zijn niet goed bekend.
Mononeuropathie
Mononeuropathie van de hersenzenuwen komt veel minder vaak voor dan perifere neuropathie bij patiënten met diabetes mellitus type 2 en kan zich manifesteren als disfunctie van de oogspierzenuwen (vierde en zesde hersenzenuw) met oogbewegingsstoornissen en dubbelzien. Beschadiging van de n. oculomotorius (derde hersenzenuw) leidt tot ptosis, oogbewegingsstoornissen, dubbelzien en een verwijde pupil. Indien de aangezichtszenuw (zevende hersenzenuw) is aangedaan kan zich dat uiten als een afhangend gezicht/ mondhoek en onvolledige oogsluiting. Mononeuropathie kan ook optreden aan de nervus medianus (carpaaltunnelsyndroom), nervus ulnaris, nervus cutaneus femoralis lateralis (meralgia paraesthetica), nervus peroneus communis.
Diabetische voet
Naar Samenvatting ›- De jaarincidentie van voetulcera bij mensen met diabetes type 2 was in de periode 2014-2019 12,8 per 1000 patiënten; de jaarincidentie van voetamputaties was 1,8 per 1000 patiënten.
- Polyneuropathie, perifeer vaatlijden, standsafwijkingen van de voet en inadequaat schoeisel zijn, vaak in combinatie, de belangrijkste oorzaken van voetulcera.
(Preventie van) diabetische voet
Onder diabetische voet verstaat men ‘een verscheidenheid van voetafwijkingen die ontstaan door neuropathie, macroangiopathie, limited joint mobility en metabole stoornissen, die meestal in combinatie voorkomen bij patiënten met diabetes mellitus’ (MDR Diabetische voet, geraadpleegd augustus 2024).
Diabetische voetulcera ontstaan meestal door een combinatie van risicofactoren. De belangrijkste zijn neuropathie, perifeer arterieel vaatlijden (PAV), standsafwijkingen van de voeten en slecht passende schoenen.
Vaatlijden speelt naast neuropathie een steeds belangrijker rol; bij de helft van de patiënten met een voetulcus die naar een voetenteam werden verwezen, bleek er sprake van vaatlijden.
Van de voetamputaties wordt 80-90% voorafgegaan door een voetulcus. Vaak is een niet te bestrijden infectie de uiteindelijke reden voor amputatie.
Er is geen robuust bewijs dat (beperkte) educatie effectief is.
Educatie kan wel leiden tot betere kennis en gedrag met betrekking tot de zelfzorg.
Voetulcera
Blijkens gegevens van Nivel Zorgregistraties Eerste Lijn over 2010-2013 (81.793 diabetespatiënten in 355 huisartsenpraktijken) waren er in die periode 412 patiënten met een actief voetulcus. Onder patiënten bij wie ≥ 1 onderdeel van het voetonderzoek was genoteerd, was de jaarlijkse incidentie van diabetische voetulcera 0,34%.
Deze uitkomst is echter afhankelijk van de nauwkeurigheid van de registratie, die bovendien uitsluitend gegevens vermeldt uit jaarcontroles en niet over tussentijds ontstane en weer genezen voetulcera.
In het Diabetes Zorgsysteem West-Friesland was de vijfjaarsincidentie van diabetische voetulcera over de periode 2014-2019 6,4% (1,28% per jaar). Mensen met een voetulcus of amputatie in de voorgeschiedenis hebben een sterk verhoogd risico op een recidief: het risico op een (nieuw) voetulcus is 20 × en het risico op amputatie is 30 × groter dan bij mensen zonder voetulcus in de voorgeschiedenis.
Tijdige verwijzing bij het ontstaan van een voetulcus, behandeling in een multidisciplinair voetenteam en goede follow-up na genezing zijn essentiële voorwaarden voor een goede diabetische voetzorg.
Amputaties
In het Diabetes Zorgsysteem West-Friesland was de vijfjaarsincidentie van voetamputaties de periode 2014-2019 0,9%, wat neerkomt op jaarlijks 1,8 amputaties per 1000 diabetespatiënten).
Onderzoek heeft aangetoond dat het aantal amputaties 50-80% kan dalen door betere organisatie van de zorg. De grootste winst wordt behaald door tijdige verwijzing bij een voetulcus, behandeling van voetulcera in een multidisciplinair voetenteam en goede afstemming tussen eerste en tweede lijn.
Retinopathie
Naar Samenvatting ›De prevalentie van retinopathie bij patiënten met diabetes type 2 is 6,5%. Retinopathie kan al aanwezig zijn wanneer de diagnose diabetes wordt gesteld.
In Nivel Zorgregistraties Eerste Lijn werd bij 6,5% van de patiënten met diabetes mellitus type 2 in 2019 melding gemaakt van retinopathie, bij mannen vaker dan bij vrouwen (6,6 versus 5,2%).
Analyse van 12.524 patiënten uit 97 Britse huisartsenpraktijken wijst uit dat diabetische retinopathie bij 1 op de 5 diabetespatiënten in het eerste jaar na de diagnose van diabetes gediagnosticeerd wordt. Dit is hoger dan de totale prevalentie die het Nivel rapporteert, er is geen duidelijke verklaring voor het verschil in bevindingen. Leeftijd, mannelijk geslacht, hyperglykemie en hypertensie waren risicofactoren voor het vroeg ontstaan van retinopathie bij diabetes mellitus type 2.
Comorbiditeit
Naar Samenvatting ›De prevalentie van comorbiditeit bij patiënten met diabetes type 2 is hoog.
- Overgewicht en obesitas komen vaker voor bij diabetes type 2: patiënten met diabetes type 2 hebben 3,6 × vaker overgewicht en 7 × vaker obesitas dan patiënten zonder diabetes type 2.
- Depressie komt 2 × zo vaak voor onder patiënten met diabetes type 2, vergeleken met mensen zonder diabetes.
- Diabetes type 2 is geassocieerd met een verhoogde kans op cognitieve disfunctie. Het risico op de ziekte van Alzheimer is duidelijk verhoogd.
- Bij bijna de helft van de mannen met diabetes type 2 is er sprake van erectiele disfunctie. Seksuele problematiek bij vrouwelijke diabetespatiënten is naast verminderde lubricatie vooral gerelateerd aan depressie.
- Patiënten met diabetes type 2 hebben een verhoogd risico op infecties. Een slechte glykemische instelling verhoogt dit risico nog eens extra.
- De prevalentie van bepaalde typen kanker, waaronder hepatocellulair, pancreas-, colon- en mammacarcinoom, is hoger onder diabetespatiënten dan in de algemene bevolking.
- De prevalentie van diabetes type 2 is hoger onder patiënten met schizofrenie dan in de algemene bevolking.
Patiënten met diabetes mellitus type 2 hebben vaak ook andere (chronische) aandoeningen. Databaseonderzoek in Britse huisartsenpraktijken (108.588 patiënten met diabetes mellitus type 2 versus 528.667 patiënten zonder diabetes, gematcht naar leeftijd, geslacht en huisartsenpraktijk, leeftijd ≥ 16 jaar, 18 onderzochte comorbiditeiten) wijst uit dat in de diabetesgroep 76,7% ≥ 1 comorbiditeit had versus 54,2% in de gematchte groep. In beide groepen was hypertensie de meest voorkomende comorbiditeit.
In een onderzoek onder 2086 eerstelijns patiënten uit heel Nederland (gemiddelde leeftijd 65 jaar, 60% man, gemiddelde diabetesduur 6 jaar) had 62% geen comorbiditeit, 24% had 1 comorbiditeit, 9% had 2 en 5% ≥ 3 comorbiditeiten. Van de patiënten met comorbiditeit had 26% een cardiovasculaire comorbiditeit en 18% een niet-cardiovasculaire. Met het toenemen van het aantal comorbiditeiten nam de kwaliteit van leven af. Met name hartfalen, perifeer vaatlijden en reumatoïde artritis leidden tot verlies van kwaliteit van leven.
Overgewicht en obesitas
Blijkens Nivel Zorgregistraties Eerste Lijn komen overgewicht en obesitas vaker voor bij diabetes mellitus type 2: diabetespatiënten hebben 3,6 × zo vaak overgewicht en 7 × zo vaak obesitas als patiënten zonder diabetes. Zie verder detail Etiologie en pathofysiologie, paragraaf Overgewicht en fysieke activiteit.
Depressie
Depressie komt 2 keer zo vaak voor bij mensen met diabetes dan bij mensen zonder diabetes. Ieder jaar krijgt 1 op de 6 mensen met diabetes te maken met depressieve symptomen. Diabetespatiënten die reeds een depressie hebben doorgemaakt en die een andere chronische ziekte ontwikkelen hebben een groter risico op ontstaan van een depressie. Vrouwen hebben 2 keer zo veel kans op depressie dan mannen. Ernstige depressie bij type 2 diabetespatiënten is geassocieerd met een verhoogd risico op microvasculaire (HR 1,36; 95%-BI 1,05-1,75) en macrovasculaire (HR 1,24; 95%-BI 1,0-1,54) complicaties (zelfs na correctie voor eerdere complicaties van de diabetes).
Er zijn aanwijzingen dat de behandeling van depressie de glykemische controle verbetert. In Nederlands cohortonderzoek (n = 2460) was gedurende een periode van 2,5 jaar de incidentie van depressie onder diabetespatiënten 1 op 7. Vrouwelijk geslacht, lage opleiding en eerder doorgemaakte depressie waren predictoren voor een incidente depressie.
Onder patiënten die lijden aan ernstige psychiatrische aandoeningen (depressie, schizofrenie, bipolaire stoornis) is er in vergelijking met de algemene bevolking een hogere prevalentie van diabetes, slecht gereguleerde cardiovasculaire risicofactoren en cardiovasculaire mortaliteit. Een verminderde toegang tot de gezondheidszorg en door psychotrope medicatie geïnduceerde gewichtstoename dragen hieraan bij.
Cognitieve stoornissen
Diabetes is geassocieerd met cognitieve disfunctie waarbij een toename in corticale atrofie en wittestofafwijkingen wordt gevonden. In onderzoek onder 183 Nederlandse type 2 diabetespatienten bij wie diabetes door screening in een vroeg stadium was vastgesteld bleek dat zij in dit vroege stadium van diabetes reeds lichte cognitieve stoornissen hadden in vergelijking met leeftijdsgenoten zonder diabetes, met name in het kortetermijngeheugen. Een voorgeschiedenis van macrovasculaire ziekten en roken bleken de belangrijkste voorspellers voor een vertraagde informatieverwerking. Drie jaar later bleek de cognitieve achteruitgang niet te verschillen tussen mensen zonder diabetes, diabetespatiënten die volgens de NHG-Standaard werden behandeld en patiënten die intensiever werden behandeld. Lichte tekenen van een depressie hebben overigens geen invloed op het cognitief functioneren van Nederlandse type 2 diabetespatiënten.
Type 2 diabetes is ook geassocieerd met een tweemaal hoger risico op de ziekte van Alzheimer. Recidiverende ernstige hypoglykemieën verhogen het risico op dementie. Meer onderzoek is nodig voor identificatie van personen met verhoogd risico. Het is niet duidelijk of intensivering van de glykemische regulatie cognitieve achteruitgang kan voorkomen.
Seksuele disfunctie
In Nederlands onderzoek werd de prevalentie van seksueel disfunctioneren onderzocht bij mensen met type 2 diabetes tussen de 40 tot 75 jaar. Enige vorm van seksueel disfunctioneren werd gevonden bij 69% van de mannen en 70% van de vrouwen. Seksueel disfunctioneren was geassocieerd met hogere leeftijd, depressieve symptomen en diabetesgerelateerde complicaties. Depressie liet de sterkste associatie zien, zowel bij mannen als bij vrouwen.
In cross-sectioneel Nederlands onderzoek (n = 1823) was de prevalentie van erectiele disfunctie bij type 2 diabetespatiënten 41,3%. Na correctie voor het gebruik van medicatie die van invloed kan zijn op erectiele disfunctie (behalve bètablokkers zijn dat ook ACE-remmers en statines) hing erectiele disfunctie niet meer samen met een doorgemaakte cardiovasculaire gebeurtenis (OR 1,2; 95%-BI 0,9-1,5) en ook niet met een verhoogd risico op coronaire hartziekte (10-jaars UKPDS CHD risk difference 0,6%; 95%-BI -1,5-2,7) maar alleen nog met leeftijd. Vaststellen van erectiele disfunctie door middel van één vraag die door de praktijkondersteuner werd gesteld (‘Heeft u erectieproblemen?’) was even betrouwbaar als gebruik van een vragenlijst.
In Canadees crosssectioneel onderzoek (n = 3921; eerstelijnszorg) bedroeg de prevalentie van erectiele disfunctie 49,4%. Reeds doorgemaakte hart- en vaatziekten verhoogden de kans op aanwezigheid van erectiele disfunctie (OR 1,45; 95%-BI 1,16-1,81; p < 0,01). Bij vrouwen met diabetes is er verminderde lubricatie en het lijkt aannemelijk dat neuropathie en vasculaire complicaties bijdragen aan seksuele disfunctie. Psychologische factoren, met name depressie, lijken meer van belang bij de incidentie van seksuele disfunctie bij vrouwelijke diabetespatiënten. De oorzaak van eventuele seksuele problemen is multifactorieel bepaald.
Stijgende leeftijd, diabetesduur, slechte glykemische controle, hypertensie, weinig lichaamsbeweging, roken en aanwezigheid van complicaties van diabetes zijn geassocieerd met erectiele disfunctie. Optimaliseren van de glykemische regulatie, behandeling van comorbiditeit en leefstijlaanpassingen zijn van belang. Patiënten met een erectiele disfunctie kunnen worden behandeld met PDE-5-remmers (tadalafil, sildenafil of vardenafil). Voorts is diabetes bij mannelijke patiënten geassocieerd met retrograde ejaculatie en verminderde fertiliteit.
Infecties
In een Engels retrospectief onderzoek in de eerste lijn over de periode 2008-2015 werd het aantal infecties onder patiënten met diabetes mellitus type 2 (n = 102.493; 40-89 jaar) vergeleken met het aantal infecties in een controlegroep zonder diabetes (n = 203.518; gematcht naar leeftijd, geslacht en huisartsenpraktijk). Onderzocht werden 19 verschillende typen infecties. De studie laat zien dat elk van de 19 typen infecties significant vaker voorkomt bij patiënten met diabetes mellitus type 2. De grootste toename werd gezien bij pneumonie, sepsis, endocarditis, huidinfecties, bot- en gewrichtsontstekingen en schimmelinfecties (mycose). De kans op infectiegerelateerde ziekenhuisopname was significant hoger in de diabetesarm, met een incidentieratio (IRR) van 1,88 (95%-BI 1,83 tot 1,92), evenals de kans op infectiegerelateerde sterfte (IRR 1,92; 95%-BI 1,75 tot 2,10).
Dezelfde onderzoeksgroep onderzocht ook de relatie tussen de mate van glykemische controle en het risico op infecties (85.312 patiënten met diabetes uit Engelse huisartsenpraktijken, leeftijd 40-89 jaar, periode 2010-2015; 153.341 gematchte controlepatiënten). Voor onder andere huidinfecties, cellulitis, candidiasis en bot- en gewrichtsontstekingen gold dat de incidentieratio steeg met het HbA1c (hoe hoger het HbA1c hoe groter de incidentieratio). Ook voor het aantal medicatievoorschriften, ziekenhuisopnames en sterfte aan infectie resulteerde een hoger HbA1c in een hogere IRR bij patiënten met diabetes. De gesignaleerde trends bleven bestaan bij correctie voor leeftijd, geslacht, comorbiditeit en duur van de diabetes.
Kanker
In een meta-analyse van 35 cohortonderzoeken werd voor zowel vrouwen als mannen met diabetes een verhoogd risico op pancreascarcinoom gevonden (RR 1,94; 95%-BI 1,66 tot 2,27), onafhankelijk van geografie, geslacht, onderzoeksopzet, alcoholconsumptie, BMI en rookstatus. Het relatieve risico was omgekeerd evenredig aan de diabetesduur: het was het hoogst < 1 jaar na de diagnose diabetes.
Een prospectief cohortonderzoek (n = 1.053.831; 26 jaar follow-up) toonde bij vrouwen met diabetes een hoger risico op sterfte door kankers van lever (RR 1,40; 95%-BI 1,05 tot 1,86), pancreas (RR 1,31; 95%-BI 1,14 tot 1,51), endometrium (RR 1,33; 95%-BI 1,08 tot 1,65), colon (RR 1,18; 95%-BI 1,04 tot 1,33) en mammae (RR 1,16; 95%-BI 1,03 tot 1,29). Bij mannen was diabetes geassocieerd met een hoger risico op sterfte door kankers van de lever (RR 2,26; 95%-BI 1,89 tot 2,70), mondholte en farynx (RR 1,44; 95%-BI 1,07 tot 1,94), pancreas (RR 1,40; 95%-BI 1,23 tot 1,59), borst (RR 4,20; 95%-BI 2,20 tot 8,04), blaas (RR 1,22; 95%-BI 1,01 tot 1,47) en colon (RR 1,15; 95%-BI 1,03 tot 1,29), en met een lager risico op prostaatcarcinoom (RR 0,88; 95%-BI 0,79 tot 0,97).
In de ADVANCE-trial (n = 11.140, follow-up 5 jaar) werden de incidentie en mortaliteit van kanker bij patiënten met diabetes mellitus type 2 vergeleken tussen een intensief behandelde groep en een controlegroep. In de intensief behandelde groep werden 363 deelnemers gerapporteerd met kanker, versus 337 in de controlegroep (respectievelijke incidenties 1,39 en 1,28 per 100 persoonsjaren; HR 1,08; 95%-BI 0,93 tot 1,26). De incidenties van kanker en sterfte door kanker waren respectievelijk 1,25 en 0,15 per 100 persoonsjaren in de intensieve groep, versus 1,15 en 0,13 per 100 persoonsjaren in de controlegroep (HR voor kanker 1,09 (95%-BI 0,93 tot 1,27); HR voor sterfte door kanker 1,17 (95%-BI 0,75 tot 1,84)).
De auteurs concluderen dat intensieve glucoseverlagende therapie de incidentie van en sterfte door kanker bij diabetespatiënten niet vermindert.
Een meta-analyse op data van de 4 grote trials UK Prospective Diabetes Study (UKPDS), Action to Control Cardiovascular Risk in Diabetes (ACCORD), Veterans Affairs Diabetes Trial (VADT) en Action in Diabetes and Vascular Disease: Preterax and Diamicron MR Controlled Evaluation (ADVANCE) leidde tot dezelfde conclusie.
Schizofrenie en prevalentie van diabetes mellitus type 2
Bij schizofreniepatiënten is diabetes mellitus type 2 prevalenter dan in de algemene bevolking. Gedurende 7 jaar follow-up werden 679 schizofreniepatiënten vergeleken met gehospitaliseerde, voor leeftijd en geslacht vergelijkbare controlepatiënten. De prevalentie van diabetes mellitus type 2 was hoger onder schizofreniepatiënten (11,3 versus 6,3%). De aanvankelijke prevalentie van diabetes mellitus type 2 bij 100 later overleden schizofreniepatiënten was na 7 jaar significant hoger (24,0%) dan bij 579 schizofreniepatiënten die niet overleden (9,2%). De invloed van diabetes op sterfte was significant hoger bij schizofreniepatiënten dan bij controlepatiënten (RR 2,2 versus RR 1,1). In overeenstemming hiermee werd gevonden dat overleden schizofreniepatiënten significant vaker diabetes hadden dan overleden controlepatiënten (24,0 versus 10,5%). De conclusie is dat schizofreniepatiënten vaker aan diabetes lijden en dat diabetes een significante oversterfte geeft bij schizofreniepatiënten vergeleken met de controlepatiënten.
In Nederlands onderzoek werd een orale glucosetolerantietest verricht bij 200 schizofreniepatiënten (87% Nederlandse afkomst, 70% man, gemiddelde leeftijd 40,8 jaar) en werd een prevalentie van diabetes vastgesteld van 14,5% (8% was reeds bekend, 6,5% nieuw gediagnosticeerd). Diabetesprevalentie was 1,5% in voor leeftijd vergelijkbare controlegroep uit de algemene bevolking.
De prevalentie van diabetes mellitus type 2 onder 266 gehospitaliseerde schizofreniepatiënten was 9% tegen 4,9% in de algemene bevolking (OR 1,89; 95%-BI 1,14 tot 3,13; p < 0,014).
Gebruik van atypische antipsychotica door schizofreniepatiënten is geassocieerd met verhoogde incidentie van diabetes mellitus type 2, met name bij patiënten < 40 jaar.
In een systematische review werd geconcludeerd dat bij schizofrenie en schizo-affectieve stoornissen, leefstijlveranderingen en diabeteseducatie, gericht op onder andere dieetaanpassingen en bevorderen van fysieke activiteit, effectief zijn.
Richtlijnen spoed
Naar Samenvatting ›Gebruik bij twijfel over de klinische stabiliteit van de patiënt de ABCDE-systematiek.
Hypoglykemie
Naar Samenvatting ›- Stel hypoglykemie vast bij een bloedglucosewaarde < 3,9 mmol/L. Vaak gaat dit gepaard met klachten of symptomen zoals zweten, hartkloppingen, gapen, rusteloosheid, agitatie of verminderd bewustzijn. Houd er rekening mee dat mensen deze klachten veel minder hoeven te hebben als er sprake is van hypoglycemia unawareness, bijvoorbeeld bij ouderen.
- Als er geen glucose kan worden gemeten op het moment dat de klachten optreden, handel dan alsof er sprake is van een hypoglykemie: bewustzijnsverlies bij iemand met diabetes is een hypoglykemie tot het tegendeel bewezen is.
Patiënt buiten bewustzijn
Naar Samenvatting ›Bij telefonisch contact:
- laat glucagon toedienen indien aanwezig (zie voor dosering tabel h1)
- leg onmiddellijk een visite af en schakel eventueel gelijktijdig een ambulance in met directe inzet (A0/A1-urgentie)
In aanwezigheid van de patiënt:
- zorg voor een veilige houding (stabiele zijligging, ademweg vrij)
- geef intraveneus glucoseoplossing (voor dosering zie tabel h1), herhaal eenmalig indien de patiënt niet binnen 3 minuten bijkomt
- indien intraveneuze glucosetoediening moeilijkheden oplevert: geef glucagon intramusculair of subcutaan, of glucagon neuspoeder in 1 neusgat (tweede keus vanwege hoge kosten; zie voor dosering tabel h1) het effect van glucagon intramusculair/subcutaan/nasaal treedt binnen 10 minuten in
- als de patiënt niet bijkomt: bel een ambulance met directe inzet (A0/A1-urgentie)
Als de patiënt bijkomt:
- ga na wat de mogelijke oorzaak van de hypoglykemie is
- adviseer de patiënt om 2 boterhammen met zoet beleg te nemen
- bij patiënten met diabetes type 1: overleg met de behandelend specialist over het verdere beleid
- bij patiënten met diabetes type 2:
- herhaal de glucosemeting na 15, 60 en 120 minuten, en laat afwijkende waarden doorbellen aan huisarts of HAP;
- bij patiënten die SU-derivaten (zoals gliclazide) of (middel)langwerkende insuline gebruiken: overweeg deze te laten opnemen vanwege het risico op een recidief, als adequate controle thuis niet kan plaatsvinden;
- bij patiënten die geen SU-derivaten of (middel)langwerkende insuline gebruiken: deze kunnen thuisblijven indien orale inname van glucose en adequate controle van de bloedglucose mogelijk zijn.
Patiënt bij bewustzijn
Naar Samenvatting ›- Bij hypoglykemie vastgesteld middels sensortechnologie: bevestig de hypoglykemie indien mogelijk door een glucosemeting met vingerprik uit te voeren.
- Laat patiënt eten of drinken: 6 suikerklontjes/tabletten of 2 eetlepels suiker opgelost in warm water, daarna 2 boterhammen met zoet beleg.
- Laat de glucosemeting na 15 minuten, 1 uur en 2 uur herhalen en laat alle afwijkende waarden doorbellen aan huisarts of HAP.
- Ga na wat de mogelijke oorzaak van de hypoglykemie is (zie ook 'Beleid bij hypoglykemie tijdens insulinebehandeling' in de bijlage Behandeling met insuline).
Bij onvoldoende verbetering of persisterende klachten:
- leg onmiddellijk een visite af
- controleer bewustzijn en mogelijkheden tot follow-up van het bloedglucose
- overweeg bij gebruik van SU-derivaat of langwerkende insuline een opname
- ga de oorzaak van hypoglykemie na (zie ook Beleid bij hypoglykemie tijdens insulinebehandeling in de bijlage Behandeling met insuline)
Bij voldoende verbetering:
- Bij gebruik SU-derivaat: sla die een dag over. Zorg voor follow-up op dezelfde dag, eventueel via een HAP.
- Bij gebruik insuline: spuit 20% minder insuline. Verwijs naar HAP of naar spreekuur eigen huisarts de volgende dag om recidief te voorkomen (zie Beleid bij hypoglykemie tijdens insulinebehandeling).
- Zie ook de Beslisboom hypoglykemie (in de bijlagen bij deze standaard).
| Geneesmiddel | Dosering | Werkingssnelheid |
|---|---|---|
| Glucose (voorkeur) | ||
| Oplossing 10% Zak of flacon 100 ml | Volwassene en kind ≥ 25 kg: intraveneus 50 ml | < 1-2 minuten |
| Kind < 25 kg: intraveneus 2 ml/kg 10% | ||
| Herhaal indien de patiënt niet binnen 3 minuten bijkomt | ||
| Oplossing 40% Ampul 10 ml | Volwassene: intraveneus 12-20 ml (risico op flebitis) | < 1-2 minuten |
| Herhaal indien de patiënt niet binnen 3 minuten bijkomt | ||
| Glucagon | ||
| intramusculair/subcutaan Poeder 1 mg Solvens voor injectieoplossing 1 ml | Volwassene, kind ≥ 8 jaar of ≥ 25 kg: intramusculair/subcutaan 1 mg | < 10 minuten |
| Kind < 8 jaar of < 25 kg: intramusculair/subcutaan 0,5 mg | ||
| nasaal* Poeder 3 mg* | Volwassene, kind ≥ 4 jaar nasaal 3 mg in 1 neusgat, éénmalig | < 10 minuten |
| * Tweede keus ten opzichte van glucagon i.m. of s.c. in verband met aanzienlijk hogere kosten. | ||
Definitie hypoglykemie
Men spreekt van hypoglykemie bij een bloedglucosewaarde < 3,9 mmol/L. Vaak gaat dit gepaard met daarbij passende klachten of symptomen zoals zweten, hartkloppingen, gapen, rusteloosheid, agitatie of verminderd bewustzijn. Houd er rekening mee dat mensen deze klachten veel minder hoeven te hebben als er sprake is van hypoglycemia unawareness, zoals bij ouderen.
In de vorige versie van deze standaard werd gesproken van een hypoglykemie bij een bloedglucosewaarde < 3,5 mmol/L. Omdat bij klachten van een hypoglykemie er in meeste gevallen gemeten wordt met een draagbare glucosemeter met een vingerprik, en er bij dit soort meters een geaccepteerde meetvariatie van 15% geldt, is het veiliger om een hogere afkapwaarde te hanteren. Daarnaast wordt internationaal ook een grens van < 3,9 mmol/L aangehouden bij de definitie van een hypoglykemie.
Behandeling van een hypoglykemie
Vanwege de werkingssnelheid heeft bij de behandeling van een hypoglykemie intraveneuze toediening van glucoseoplossing de voorkeur. Op grond van de NIV-richtlijn wordt 5 gram glucose geadviseerd. Om 5 gram glucose toe te dienen moet 50 ml glucoseoplossing 10% worden toegediend. Om deze 50 ml vloeistof direct met een spuit in een vene te injecteren is enige vaardigheid nodig. Vaak is het handiger om te kiezen voor toediening via een infuuscanule. Omwille van een kleiner volume en minder gewicht in de visitetas is een glucoseoplossing met hogere concentratie (40%) een alternatief. Deze kan eveneens per infuuscanule worden toegediend, al is directe injectie in een vene van een dergelijk kleiner (maar evengoed nog fors) volume wat eenvoudiger dan bij glucoseoplossing 10%. Bij gebruik van hoge glucoseconcentraties (40%) is er een reëel risico op flebitis en ernstige interstitiële schade als er extravasatie optreedt.
Aflevervormen
De volgende aflevervormen zijn beschikbaar:
- glucose 10%, 100 ml flacon/zak infusievloeistof
- glucose 40%, 10 ml ampul. Om aan de vereiste 5 gram te komen moet 12 ml glucoseoplossing worden toegediend. Hiervoor zijn 2 ampullen nodig.
Intraveneuze toediening kan lastig zijn bij onrustige patiënten en bij patiënten van wie de venen lastig aan te prikken zijn. In die gevallen is glucagon intramusculair/subcutaan of nasaal een geschikt alternatief. Glucagon werkt minder snel dan glucose, is duurder en minder lang houdbaar dan glucoseoplossing. Bij langer bestaande hypoglykemie is het bovendien onvoldoende werkzaam. Ondanks de voorkeur voor glucoseoplossing kan het nuttig zijn om over beide geneesmiddelen te kunnen beschikken.
Plaatsbepaling glucagon intramusculair/subcutaan en glucagon nasaal
Zorginstituut Nederland heeft beoordeeld dat glucagon per injectie i.m./s.c. en glucagon intranasaal gelijkwaardig zijn qua effectiviteit en veiligheid. Glucagon neuspoeder kent meer gebruiksgemak; er hoeft geen injectiespuit klaargemaakt te worden en de toediening is gemakkelijk via de neus (zie GVS-advies glucagon neuspoeder (Baqsimi®) bij de behandeling van ernstige hypoglykemie van het Zorginstituut). Glucagon neuspoeder is wel aanzienlijk duurder dan glucagon voor injectie (€ 106,81 versus € 16,50 voor eenmalig gebruik; www.medicijnkosten.nl, geraadpleegd 5 oktober 2023). Het voordeel dat Zorginstituut Nederland ziet ten aanzien van het gebruiksgemak is waarschijnlijk vooral relevant bij zelfgebruik door patiënten en naasten. Ervan uitgaande dat een huisarts veel ervaring heeft en bekwaam is in het bereiden en zetten van een injectiespuit adviseert de werkgroep glucagoninjectie i.m./s.c. vanwege het verschil in kosten.
Zeer ernstige hyperglykemie
Naar Samenvatting ›Er is sprake van zeer ernstige hyperglykemie bij een bloedglucosewaarde ≥ 15 mmol/L in combinatie met ≥ 1 van de volgende verschijnselen:
- tekenen van dehydratie
- braken
- kortademigheid/hyperventilatie
- soporeus of subcomateus.
Handel bij patiënten met een zeer ernstige hyperglykemie als volgt.
- Bij braken > 4 uur in combinatie met kortademigheid/hyperventilatie: schakel een ambulance in met directe inzet (A0/A1-urgentie) (vermoeden ketoacidose).
- Bij braken > 4 uur in combinatie met tekenen van dehydratie, verwardheid of apathie:
- leg onmiddellijk een visite af.
- overleg met de internist of geriater, waarschijnlijk is een klinische opname noodzakelijk.
- Zie ook de Beslisboom hyperglykemie (in de bijlagen bij deze standaard).
Richtlijnen diagnostiek
Naar Samenvatting ›Opsporing
Naar Samenvatting ›- Bepaal de (bij voorkeur nuchtere) bloedglucosewaarde bij mensen met klachten of aandoeningen die het gevolg kunnen zijn van diabetes mellitus, zoals dorst, polyurie, vermagering, pruritus vulvae op oudere leeftijd, recidiverende urineweginfecties en balanitis, mononeuropathie, neurogene pijnen en sensibiliteitsstoornissen.
- Bepaal in het kader van een spreekuurbezoek driejaarlijks de bloedglucosewaarde bij personen > 45 jaar en ≥ 1 van de volgende patiëntkenmerken:
- BMI ≥ 27
- diabetes type 2 bij ouders, broers of zussen
- hypertensie (systolische bloeddruk > 140 mmHg of behandeling voor hypertensie)
- vetstofwisselingsstoornissen (HDL-cholesterol ≤ 0,90 mmol/L, triglyceriden > 2,8 mmol/L)
- (verhoogd risico op) hart- en vaatziekten (zie NHG-Standaard Cardiovasculair risicomanagement (CVRM))
- Turkse, Marokkaanse of Surinaamse achtergrond
- Hindostaanse achtergrond (≥ 35 jaar)
- Controleer bij vrouwen met zwangerschapsdiabetes gedurende de eerste 5 jaar jaarlijks de nuchtere glucosewaarde, daarna om de 3 jaar.
Opsporing van diabetes
In Nederland was de opbrengst van een populatiescreeningprogramma in 79 huisartsenpraktijken in 2002 tot 2004 op diabetes laag en de uitval juist in de hoogrisicogroep groot.
Populatiescreening op diabetes wordt in Nederland niet aanbevolen.
Opsporing van ongediagnosticeerde diabetes door middel van case-finding is doeltreffender dan populatiescreening. Case-finding (opportunistische screening) is een vorm van screening waarbij tijdens spreekuurbezoek mensen met een verhoogd risico op diabetes worden uitgenodigd voor een meting van de bloedglucose. In 11 Nederlandse huisartsenpraktijken was stapsgewijze opportunistische screening op basis van het risicoprofiel in het elektronisch patiëntendossier bij 45- tot 75-jarigen effectief in de hoogrisicogroep, met name bij overgewicht en obesitas, maar niet zinvol zonder aanvullende risicofactoren.
Het advies om diabetes pas op te sporen vanaf 45 jaar en niet vaker dan driejaarlijks wordt ondersteund door een recent kosteneffectiviteitsonderzoek.
De zeer hoge prevalentie bij Hindoestanen rechtvaardigt screening op diabetes in deze groep vanaf 35 jaar. 2 recente systematische reviews laten zien dat screening vooral zinvol is bij hypertensie vanwege de striktere behandelnorm bij diabetes.
Definitief bewijs ontbreekt dat vroege diagnostiek en behandeling gezondheidswinst op langere termijn opleveren.
Zwangerschapsdiabetes
De incidentie van diabetes bij vrouwen die zwangerschapsdiabetes doormaakten is het hoogst in de eerste 5 jaar na de bevalling.
De definitie van zwangerschapsdiabetes is iedere vorm van hyperglykemie die tijdens de zwangerschap ontdekt wordt.
De definitie lijkt eenvoudig maar laat ruimte aan uiteenlopende criteria. De criteria zijn bovendien in de loop der jaren gewijzigd en aangescherpt. Tot halverwege de jaren 90 van de vorige eeuw lag de focus op het vaststellen van het risico op diabetes mellitus type 2 na de zwangerschap. Later bleek dat een licht verhoogde glucosewaarde de uitkomst van de zwangerschap ongunstig beïnvloedde, waardoor het opsporen van verhoogde bloedglucosewaarden niet alleen consequenties had voor de lange termijn, maar ook voor het voorkomen van complicaties op de korte termijn, te weten perinatale morbiditeit en mortaliteit.
De incidentie van zwangerschapsdiabetes is afhankelijk van de gebruikte criteria, maar wordt wereldwijd geschat op 3 tot 5%.
Een Nederlands onderzoek vond een incidentie van 6,9%. Dit betrof een grootstedelijke populatie met relatief veel personen met een migratieachtergrond. De bekendste risicofactoren voor zwangerschapsdiabetes zijn overgewicht, belaste familieanamnese, eerder doorgemaakte zwangerschapsdiabetes, leeftijd en etniciteit.
Screening op zwangerschapsdiabetes tijdens de zwangerschap is een taak van de verloskundige. Een huisarts die een patiënte met een doorgemaakte zwangerschapsdiabetes krijgt overgedragen, zal zich moeten afvragen op welke criteria deze diagnose gesteld is.
De huisarts is verantwoordelijk voor de follow-up. Het doel van de controle van bloedglucosewaarden is tweeledig: (1) vroegtijdige diagnostiek van diabetes mellitus type 2 bij een hoogrisicogroep en (2) betere uitgangssituatie bij een eventuele volgende zwangerschap. Of screening na doorgemaakte zwangerschapsdiabetes leidt tot leefstijlverbetering, verminderd aantal complicaties in een volgende zwangerschap of minder mortaliteit en morbiditeit later in het leven, is niet bekend. Onduidelijk is ook op welke termijn en met welke frequentie de controles moeten plaatsvinden.
De NVOG-richtlijn adviseert een eerste controle 6 weken post partum te doen (nuchtere glucose) en vervolgens dit jaarlijks te blijven doen. Daarbij wordt geen duur aangegeven. Uit de beschikbare gegevens lijkt het mogelijk bij vrouwen zonder zwangerschapswens met een stabiel gewicht en normale glucosewaarden de frequentie van de controles na 5 jaar terug te brengen naar een × per 3 jaar. Bij vrouwen met normale controles die een zwangerschapswens houden blijft de huisarts jaarlijks controleren.
Dit advies is gebaseerd op consensus en 2 meta-analyses. De meta-analyse van Kim et al., waarin 28 onderzoeken waren opgenomen die waren gedaan tussen 1972 en 1999, liet zien dat ongeveer de helft van de vrouwen met een doorgemaakte zwangerschapsdiabetes binnen 5 jaar diabetes mellitus type 2 ontwikkelde. Na deze 5 jaar leek het risico op diabetes mellitus type 2 zich te stabiliseren. 129Uit een meta-analyse van Bellamy, waarin 20 onderzoeken waren opgenomen die waren uitgevoerd tussen 1991 en 2008, bleek dat de kans dat vrouwen diabetes mellitus type 2 ontwikkelden na doorgemaakte zwangerschapsdiabetes 7,3 maal groter was dan vrouwen die geen diabetes hadden tijdens hun zwangerschap.
Er zijn geen Nederlandse gegevens of controles van bloedglucosewaarden ook daadwerkelijk plaatsvinden. De internationale literatuur schetst een beeld waar ruimte is voor verbetering. Een Amerikaans onderzoek vond dat bij slechts 37% van de vrouwen met doorgemaakte zwangerschapsdiabetes nuchter bloedglucose werd bepaald.
Voorlichting aan vrouwen met doorgemaakte zwangerschapsdiabetes om hun bloedglucose te laten bepalen deed het aantal controles aanzienlijk toenemen: van 33,4% naar 52,7%.
Vaststellen van diabetes mellitus
Naar Samenvatting ›- Stel de diagnose diabetes mellitus bij 2 nuchtere plasmaglucosewaarden ≥ 7,0 mmol/L op 2 verschillende dagen.
- Ook is er sprake van diabetes mellitus bij een nuchtere plasmaglucosewaarde ≥ 7,0 mmol/L of een willekeurige plasmaglucosewaarde ≥ 11,1 mmol/L in combinatie met klachten die passen bij hyperglykemie (tabel h2).
- Bepaal de HbA1c-waarde niet voor de opsporing en diagnostiek van diabetes.
- Bij een geringe verhoging van de nuchtere waarden spreekt men van een gestoorde nuchtere glucosewaarde (tabel h2).
- Kenmerk van een gestoorde glucosetolerantie is een niet-nuchtere glucosewaarde van 7,8-11,0 mmol/L bij een normale nuchtere glucosewaarde.
- Een gestoorde nuchtere glucosewaarde en een gestoorde glucosetolerantie wijzen beide op een grotere kans op het ontwikkelen van diabetes mellitus en op een verhoogd cardiovasculair risico.
- Herhaal de nuchtere glucosebepaling met een laboratoriumtest na 3 maanden. Controleer de patiënt jaarlijks, als ook dan de diagnose diabetes mellitus niet wordt gesteld. Bepaal daarnaast het cardiovasculaire risicoprofiel (zie NHG-Standaard Cardiovasculair risicomanagement (CVRM)).
| Diagnose | Glucosewaarde* | |
|---|---|---|
| Normaal | Nuchter | < 6,1 mmol/L |
| Niet nuchter | < 7,8 mmol/L | |
| Gestoorde nuchtere glucosewaarde | Nuchter | ≥ 6,1 en < 7,0 mmol/L én |
| Niet nuchter | < 7,8 mmol/L | |
| Gestoorde glucosetolerantie | Nuchter | < 6,1 mmol/L én |
| Niet nuchter | ≥ 7,8 en < 11,1 mmol/L | |
| Diabetes mellitus | Nuchter | ≥ 7,0 mmol/L |
| Niet nuchter | ≥ 11,1 mmol/L | |
* Gestoorde nuchtere glucosewaarde en gestoorde glucosetolerantie kunnen gecombineerd voorkomen. Bron: World Health Organisation/International Diabetes Federation, 2006. | ||
- Draagbare bloedglucosemeters die werken met een vingerprik zijn gekalibreerd naar veneuze plasmaglucosewaarden. Deze meters kunnen, zelfs bij regelmatig ijken, een meetfout hebben van 10‑15%. Laat daarom bij marginaal afwijkende waarden bij de vingerprikmeting alsnog een laboratoriumbepaling verrichten.
- Besteed vooral bij een BMI < 27 extra aandacht aan het type diabetes. Er bestaan enkele varianten die kunnen lijken op diabetes type 2:
- maturity-onset diabetes of the young (MODY). Dit is een groep van autosomaal dominant overervende ziekten waarbij een monogenetisch bètaceldefect leidt tot stoornissen in de productie en/of afgifte van insuline. Denk aan MODY bij BMI < 27, leeftijd < 35 jaar en een positieve familieanamnese (MODY in ≥ 3 generaties).
- latent autoimmune diabetes in adults (LADA). LADA is het langzaam ontstaan van type 1-diabetes op oudere leeftijd (> 40 jaar). Het klassieke klinische beeld (korte ziekteduur, hyperglykemie, gewichtsverlies en ketonen in de urine) ontbreekt meestal. De behandeling met orale bloedglucoseverlagende middelen is bij deze patiënten dikwijls minder effectief dan bij patiënten met diabetes type 2. Start dan snel met insulinetherapie.
Afkappunten glucosewaarden
De in de tekst en in tabel h2 vermelde waarden komen overeen met de criteria van WHO en IDF.
HbA1c als diagnostisch criterium
Sinds 1965 zijn de criteria voor het stellen van de diagnose diabetes mellitus steeds veranderd. De nuchtere plasma-glucosewaarde en de 2-uur plasmaglucosewaarde na het drinken van een 75-grams glucoseoplossing tijdens een orale glucosetolerantietest (OGTT) waren tot 1997 de criteria voor het stellen van de diagnose. Een OGTT is echter een tijdrovende procedure. Om deze redenen wordt deze test in de dagelijkse praktijk niet gebruikt, behalve voor de diagnose van zwangerschapsdiabetes. Slechts 20 tot 50% van alle diabetespatiënten heeft tijdens een OGTT een abnormale 2-uurs plasmaglucoseconcentratie en een normale nuchtere glucosewaarde.
Deze patiënten hebben wel een hoger risico op hart- en vaatziekten dan patiënten die alleen op basis van verhoogd nuchter glucose gediagnosticeerd worden.
Meer dan de helft van de patiënten die opgenomen worden met een myocardinfarct heeft abnormale glucosewaarden tijdens een OGTT en deze groep heeft een slechtere prognose. Daarom wordt de test door de WHO aanbevolen voor de genoemde groep patiënten. Verder wordt een OGTT toegepast in wetenschappelijk onderzoek.
In 1997 werd de grenswaarde van de nuchtere plasmaglucose verlaagd naar 7,0 mmol/l.
Momenteel beveelt de American Diabetes Association (ADA) het HbA1c evenzeer aan als diagnostisch criterium voor diabetes.
De WHO heeft in 2011 in haar richtlijnen het HbA1c als diagnostisch criterium toegevoegd, maar alleen in aanvulling op glucosetests en onder strikte kwaliteitseisen.
Indien een HbA1c van 48 mmol/mol (6,5%) of hoger wordt gevonden, spreekt men ook van diabetes. In afwezigheid van klachten en/of abnormale glucosewaarden moet een tweede, bevestigende meting worden uitgevoerd. De HbA1c-bepaling is minder onderhevig aan kortdurende schommelingen dan de glucosespiegel en het HbA1c is evenals de glucoseconcentratie een goede voorspeller van het optreden van complicaties, zelfs bij bevolkingsonderzoek onder mensen zonder diabetes.
Bij mensen bij wie de HbA1c-test niet betrouwbaar is, bijvoorbeeld vanwege hemoglobinopathie of anemie, moet de diagnose op basis van glucosewaarden gesteld worden. Omdat het HbA1c de gemiddelde glucosespiegel gedurende ongeveer de voorafgaande drie maanden weerspiegelt, is het geen geschikte maat in geval van acute hyperglykemie of snel progressieve diabetes, zoals bij diabetes geïnduceerd door glucocorticoïden, diabetes mellitus type 1 bij kinderen en zwangerschapsdiabetes.
Er zijn verschillende factoren die van invloed zijn op de hoogte van het HbA1c, naast de directe invloed van de hoogte van de glucose. Zo varieert de levensduur van erythrocyten bij gezonde mensen. Er bestaat vaak verwarring over de relatie tussen HbA1c en anemie.
HbA1c wordt uitgedrukt als percentage en is dus in essentie onafhankelijk van de hoogte van het Hb. Dat geldt niet als de levensduur van erythrocyten verkort is. Die situatie doet zich voor bij hemolytische anemie, en bij correctie van een aanmaakstoornis, dus een ijzergebreksanemie die wordt behandeld met ijzer of een pernicieuze anemie die wordt behandeld met vitamine B12. In de eerste dagen zullen er dan veel jonge cellen bijkomen waardoor het HbA1c daalt.
IJzergebreksanemie op zichzelf leidt echter niet tot een toegenomen aanmaak c.q. verkorte levensduur van erythrocyten, dus heeft geen invloed op het HbA1c. Ditzelfde geldt voor de anemie bij chronische ziekte.
De mate van glycering bepaalt eveneens de hoogte van het HbA1c. Er zijn aanwijzingen dat factoren die glycering beïnvloeden, zoals de inname van acetylsalicylzuur, vitamine C en E, en roken, van invloed zijn op de hoogte van het HbA1c.
Over de mate waarin dit gebeurt en de klinische relevantie bestaat nog geen consensus. Daarnaast zijn er aanwijzingen voor het bestaan van een zogenaamde ‘glycation gap’: mensen hebben een verschillende intrinsieke neiging tot het glyceren van eiwitten.
Leeftijd en etniciteit hebben een effect op de hoogte van het HbA1c.
Bijvoorbeeld mensen met een donkere huidskleur hebben iets hogere HbA1c-waarden (0,2 tot 0,3% of 2 tot 3 mmol/mol) dan mensen met een witte huidskleur.
In de meeste onderzoeken identificeert de HbA1c-test minder mensen met diabetes dan de nuchtere plasmaglucose of de 2-uurs plasmaglucosewaarde van een OGTT. In het Nieuwe Hoorn-onderzoek werd bij 2753 willekeurig gekozen mensen in de leeftijd van 40 tot 65 jaar uit Hoorn een orale glucosetolerantietest (OGTT) uitgevoerd. Na exclusie van de mensen met bekende diabetes werd bij een afkapwaarde van HbA1c > 6,5% een sensitiviteit van 24% en een specificiteit van 99% gevonden voor de diagnose diabetes. Met andere woorden, van alle mensen die op basis van de OGTT diabetes hebben, heeft 24% een HbA1c-waarde > 6,5% (> 48 mmol/mol). Andere onderzoeken bevestigden deze bevinding. Er is een duidelijke overlap tussen de groepen die met beide methoden worden gediagnosticeerd, maar bij de keuze voor HbA1c > 6,5% (> 48 mmol/mol) als afkapwaarde wordt bij een andere groep personen de diagnose diabetes gesteld in vergelijking met de groep gediagnostiseerd door plasmaglucosewaarden.
Voordelen van de HbA-test als diagnosticum
Het voordeel van de HbA1c-bepaling is dat deze op ieder moment van de dag kan plaatsvinden, een patiënt hoeft niet nuchter te zijn. Bovendien is de intra-individuele variatie geringer dan van de glucosebepaling en is de invloed van tijdelijke factoren als stress, koorts en bijvoorbeeld alcoholinname eveneens kleiner. Ten slotte zijn de condities rondom de bepaling minder streng; de pre-analytische stabiliteit van HbA1c is relatief goed. Echter, de standaardisatie van de bepaling van het HbA1c staat een variatie toe van 7% (www.ngsp.org/news.asp). Zo kan bijvoorbeeld een waarde van 6,5% liggen tussen de 6,0 tot 7,0%.
Nadelen van de HbA-test als diagnosticum
De bepaling van HbA1c kan verstoord worden in de aanwezigheid van Hb-varianten zoals thalassemieën. Hoewel de prevalentie van hemoglobinopathieën in Nederland relatief laag is, is het in vooral de populatie van personen met een migratieachtergrond een reëel probleem. Het duurt relatief lang voordat een hyperglykemie ook daadwerkelijk leidt tot een stijging in het HbA1c, het stellen van de diagnose diabetes kan daardoor enigszins vertraging op lopen. De kosten van een HbA1c-bepaling zijn hoger dan van een plasmaglucose. Een glucosemeterstrip kost ongeveer € 0,80, de bepaling van het plasmaglucose kost ongeveer € 1,50 en een HbA1c-bepaling € 4,50.
IFG en IGT
Gestoord nuchtere glucose (impaired fasting glucose, IFG) en gestoorde glucosetolerantie (impaired glucose tolerance, IGT) kunnen als voorstadium van type 2 diabetes worden gezien. Men gebruikt ook wel de term prediabetes (al krijgt minstens de helft van deze mensen nooit diabetes). Ongeveer 30% van de bevolking van 60 jaar en ouder heeft óf een gestoord nuchtere glucose óf een gestoorde glucosetolerantie. IFG en IGT kunnen ook gecombineerd voorkomen. Naar schatting een tot twee derde van de mensen met prediabetes ontwikkelt binnen 6 jaar type 2 diabetes.
Het is in beginsel mogelijk om die kans met preventieve maatregelen, zoals leefstijlinterventies, te verlagen en het ontstaan op diabetes uit te stellen of te voorkomen. Gecombineerde leefstijlinterventies gericht op gewichtsverlies, meer lichamelijke activiteit, minder (verzadigd) vet en meer vezels, verminderden bij mensen met een gestoorde glucosetolerantie het risico op de ontwikkeling van type 2 diabetes.
IGT en IFG zijn geassocieerd met een verhoogd risico op hart- en vaatziekten. In Nederlands onderzoek werden personen gescreend op diabetes. Daarnaast werd bij personen IFG en IGT vastgesteld. Na 3 jaar follow-up bleek het aantal cardiovasculaire gebeurtenissen bij gescreende personen met IFG en IGT niet significant te verschillen van die bij de diabetespatiënten, mogelijk als gevolg van het ontberen van adequate controle respectievelijk onderbehandeling van cardiovasculaire risicofactoren bij de personen zonder diabetes.
Glucosemeting met draagbare glucosemeter met een vingerprik
Laboratoriumbepalingen zijn nauwkeuriger dan bepalingen met een draagbare glucosemeter met en vingerprik. Voor de meeste laboratoriumbepalingen geldt een maximale afwijking van 2%; bij de draagbare meters is dat 15%. Alle draagbare glucosemeters in de huisartsenpraktijk waarbij bloed wordt verkregen door middel van een vingerprik (volbloed), zijn gekalibreerd op bepaling van de glucose plasmawaarde. In Nederland zijn geen strips meer aanwezig die volbloed gekalibreerd zijn. Dit wil zeggen dat een glucosewaarde wordt weergegeven alsof deze in plasma is bepaald. Daarom gelden voor bepalingen verricht met een draagbare glucosemeter de streefwaarden van veneus plasma.
De nauwkeurigheid van een glucosemeting wordt enerzijds bepaald door de kwaliteit van de glucosemeter, anderzijds door de gebruiker. In een onderzoek bij 254 patiënten met type 2 diabetes die insuline gebruikten of orale middelen in maximale dosering bleken bij de zelfcontrole bij 24% van de patiënten fouten voor te komen. Het belangrijkste probleem was het gebruik van verlopen of verkeerde glucosestrips en problemen met de glucosemeter. Vrijwel alle patiënten bleken vragen te hebben over het gebruik van de glucosemeter.
Typen diabetes
De meeste personen die op volwassen leeftijd diabetes ontwikkelen, hebben type 2 diabetes. Het zuiver afbakenen van de diagnose diabetes mellitus type 2 is echter niet altijd eenvoudig. Er is een grote heterogeniteit in presentatie en in pathofysiologie, waarbij soms insulineresistentie en soms bètacelfalen op de voorgrond staat.
Naast de klassieke auto-immuungemedieerde type 1 diabetes bestaat er een aantal varianten van diabetes die kunnen lijken op diabetes type 2 maar die een specifieke, eigen benadering behoeven: Maturity-onset Diabetes of the Young (MODY), latent auto-immune diabetes in adults (LADA) en ketosis-prone diabetes (KPD). Enige alertheid is nodig om deze ziekten te onderscheiden van ‘klassieke’ diabetes type 2; indien de verdenking op MODY, LADA of KPD ontstaat kan, in overleg met een kaderhuisarts of internist, eventueel aanvullende diagnostiek (antistoffen, genetica) worden verricht. Naar schatting heeft van alle personen met type 2 diabetes 1-5% eigenlijk MODY en 15% eigenlijk LADA.
MODY
MODY is een groep van autosomaal dominant overervende ziekten waarbij een monogenetisch bètaceldefect in de loop van het leven aanleiding geeft tot stoornissen in de productie en/ of afgifte van insuline en daarmee tot het ontstaan van diabetes. Denk vooral aan MODY bij:
- de diagnose diabetes mellitus op jonge leeftijd (< 35 jaar)
- afwezigheid van kenmerken passend bij insulineresistentie en
- positieve familieanamnese voor diabetes
Naar schatting 1-5% van de diabetespopulatie heeft MODY. De meest frequent voorkomende vormen zijn GCK-MODY (MODY 2, gevolg van een mutatie in het glucokinasegen) en HNF1A-MODY (MODY 3, gevolg van een mutatie in het gen voor hepatocyte nuclear factor 1a). Diagnostische aanwijzingen dat er mogelijk sprake is van MODY zijn:
- diagnose diabetes op relatief jonge leeftijd (meestal, maar niet noodzakelijkerwijs, < 35 jaar)
- een familiehistorie passend bij dominante monogene overerving, dat wil zeggen diabetes in ≥ 3 generaties waarbij meerdere mensen zijn aangedaan
- afwezigheid van kenmerken van insulineresistentie, zoals obesitas
- afwezigheid van ketoacidose
- afwezigheid van autoantistoffen passend bij diabetes mellitus type 1.
De diagnose MODY kan grote therapeutische consequenties hebben. Bij GCK-MODY (MODY 2) staat de glucosesensor in de bètacel verkeerd afgesteld, zodat deze pas bij een iets hogere bloedsuikerwaarde insuline afgeeft. Hierdoor blijven de nuchtere bloedsuikerwaarden iets te hoog (> 5,4 mmol/L), maar ze worden nooit heel erg hoog (< 8,3 mmol/L).
LADA
LADA is feitelijk een langzaam ontstane diabetes mellitus type 1 op oudere leeftijd (> 40 jaar), waarbij het auto-immuunproces veel trager verloopt dan bij klassieke diabetes mellitus type 1. Hierdoor ontbreekt meestal het klassieke klinische beeld (korte ziekteduur, hyperglykemie, gewichtsverlies en ketonen in de urine). In het algemeen hebben patiënten met LADA een BMI die hoger is dan die van de doorsnee patiënt met diabetes mellitus type 1, maar beduidend lager dan die van de doorsnee patiënt met diabetes mellitus type 2. Omdat er feitelijk sprake is van een auto-immuundiabetes hebben deze patiënten ook een verhoogd risico op andere auto-immuunziekten (zoals hypothyreoïdie) en op het ontstaan van ketoacidose. De diagnose LADA kan bevestigd worden door het aantonen van diabetesspecifieke autoantistoffen (meestal anti-glutamaatdecarboxylase zoals GAD65). Orale bloedglucoseverlagende middelen zijn doorgaans minder lang effectief dan bij patiënten met diabetes mellitus type 2; daarna is insulinetoediening noodzakelijk. Bij mensen met hoge glucosewaarden en hyperglykemische klachten kan soms al ten tijde van de diagnose diabetes een behandeling met insuline nodig zijn.
| DM1 | LADA | GCK (MODY 2) | HNF4A en HNF1A (MODY 1 en 3) | DM2 | |
|---|---|---|---|---|---|
| Mediane leeftijd bij presentatie DM | 10-40 jaar | > 40 jaar | Hyperglykemie vanaf de geboorte | 10-35 jaar | > 40 jaar |
| Positieve familieanamnese | Soms (ouders 10-15% DM) | Soms (ouders 10-15% DM) | Ja | Ja | Ja |
| Erfelijkheid | Multifactorieel | Multifactorieel | Monogeen autosomaal dominant | Monogeen autosomaal dominant | Multifactorieel |
| Diabetische keto-acidose | Ja | Niet initieel, later wel mogelijk | Nee | Zelden | Zelden, vaak in combinatie met onderliggende oorzaken |
| Auto-antistoffen (GAD65, IA2, ZnT8) | + | + | – | – | – |
| Insulineresistentie | Nee* | Nee* | Nee* | Nee* | Ja |
| Initiële voorkeursbehandeling | Insuline | Initieel orale glucoseverlagende middelen, later insuline | geen | (lage dosis) SU-derivaten | Leefstijl |
DM1 = diabetes mellitus type 1; DM2 = diabetes mellitus type 2; LADA = latent auto-immune diabetes in adults ; MODY = maturity-onset diabetes of the young ; GCK = glucokinase; HNF = hepatocyte nuclear factor. GAD65 = glutamaatdecarboxylase 65; IA2 = isletantigeen 2; ZnT8 = zinktransporter 8. * Insulineresistentie is niet de primaire oorzaak van dit type diabetes. Mengvormen van diabetes kunnen voorkomen waarbij er toch enige insulineresistentie kan optreden. | |||||
Risico-inventarisatie
Naar Samenvatting ›Cardiovasculair risicoprofiel
Naar Samenvatting ›Stel het actuele cardiovasculair risicoprofiel vast (zie NHG-Standaard Cardiovasculair risicomanagement (CVRM).
Diabetische nefro- en retinopathie
Naar Samenvatting ›- Ga de aanwezigheid van diabetische nefro- en retinopathie na.
- Verricht bij chronische nierschade (≥ 3 maanden verminderde nierfunctie en/of verhoogde albuminurie en/of specifieke sedimentsafwijkingen) aanvullend onderzoek conform de NHG-Standaard Chronische nierschade.
- Verricht zo snel mogelijk, maar in ieder geval binnen 3 maanden na de diagnose, fundusfotografie (zie Consultatie en verwijzing).
Voetonderzoek
Naar Samenvatting ›- Onderzoek de voeten, met speciale aandacht voor:
- kleur
- standsafwijkingen (bijvoorbeeld hallux valgus of klauwstand van de tenen)
- nagelafwijkingen
- drukplekken, eelt of kloven
- voetulcera of amputaties
- Onderzoek de protectieve sensibiliteit met een 10 g semmes-weinsteinmonofilament op 3 plaatsen onder de voet:
- hallux
- MTP-1
- MTP-5
- er is sprake van een gestoorde protectieve sensibiliteit wanneer de patiënt het monofilament niet voelt op een van de genoemde plaatsen
- Arteriële pulsaties: palpeer de a. dorsalis pedis en de a. tibialis posterior.
- Verricht dopplerechografie bij afwezigheid van beide pulsaties (aanwezigheid van 1 van beide pulsaties wordt als normaal beschouwd).
- Aanwezigheid van mono- of bifasische dopplertonen (trifasische tonen zijn normaal) is een indicatie voor bepaling van de enkel-armindex (zie NHG-Standaard Perifeer arterieel vaatlijden).
Simsclassificatie
Een systematische review en meta-analyse van individuele patiëntgegevens laat zien dat de test met een 10 g Semmes-Weinstein monofilament de beste resultaten oplevert bij het voorspellen van het risico op een diabetisch voetulcus. De inschatting van het risico op een voetulcus en het vervolgbeleid zijn gebaseerd op de risicoclassificatie volgens Sims (tabel d2, zie ook MDR Diabetische voet, geraadpleegd augustus 2024).
| Classificatie | Risicoprofiel | Controlefrequentie |
|---|---|---|
| Sims 0 (laag risico) |
| 1 × per 12 maanden |
| Sims 1 (licht verhoogd risico) |
| 1 × per 6 maanden |
| Sims 2 (hoog risico) |
| 1 × per 3 maanden |
| Sims 3 (sterk verhoogd risico) |
| 1 × per 1-3 maanden |
Neuropathie en perifeer arterieel vaatlijden (PAV)
Bij het ontstaan van een diabetisch voetulcus spelen diabetische neuropathie en perifeer arterieel vaatlijden (PAV) een centrale rol. De neuropathie leidt tot een verminderde sensibiliteit (sensorische neuropathie) en tot standsafwijkingen van de voet (motorische neuropathie). Daarnaast kan autonome neuropathie een droge, warme voet veroorzaken door een verminderde zweetsecretie en een verhoogde arterioveneuze shunt. PAV is aanwezig bij 50% van de mensen met een diabetisch voetulcus. De aanwezigheid van PAV is een belangrijke risicofactor voor een slechte wondgenezing. Bij het ontstaan van een voetulcus vergroot PAV de kans op een amputatie zeer sterk.
Risico op ulcera
Naar Samenvatting ›Het risico op voetulcera wordt bepaald met de risicoclassificatie voor diabetische voet volgens Sims.
- Laag risico (Sims 0): normale protectieve sensibiliteiten; geen perifeer arterieel vaatlijden. Jaarlijkse controle van de voeten is voldoende.
- Licht verhoogd risico (Sims 1): verlies van protectieve sensibiliteit of perifeer arterieel vaatlijden (PAV) zonder tekenen van lokaal verhoogde druk. Zesmaandelijkse controle van de voeten door huisarts, praktijkondersteuner (POH) of diabetesverpleegkundige is aangewezen.
- Hoog risico (Sims 2): combinatie van verlies van protectieve sensibiliteit en/of PAV en/of tekenen van lokaal verhoogde druk. Verwijs naar een podotherapeut die de verdere controles verricht, met minimaal jaarlijks bericht aan de huisarts.
- Sterk verhoogd risico (Sims 3): voetulcus of amputatie in de voorgeschiedenis, inactieve Charcot-voet, eindstadium nierfalen (eGFR < 15 ml/min) of nierfunctievervangende therapie (dialyse). Verwijs naar een podotherapeut die de verdere controles verricht, met minimaal jaarlijks bericht aan de huisarts.
Richtlijnen beleid
Naar Samenvatting ›Stel samen met de patiënt het beleid vast. Naast voorlichting is het belangrijk om educatie te geven, zodat de patiënt zo goed mogelijk weet welke bijdrage hij zelf aan de behandeling kan leveren en hoeveel verantwoordelijkheid hij heeft.
Voorlichting en advies
Naar Samenvatting ›- Geef informatie over de achtergrond van de ziekte, niet-medicamenteuze adviezen, behandeling en controlebeleid, complicaties en factoren die de prognose bepalen.
- Een goede leefstijl is erg belangrijk. Besteed hier ruimschoots aandacht aan en zorg dat de voorlichting aansluit op de behoeften, mogelijkheden en gewoonten van de patiënt. Probeer ervoor te zorgen dat de patiënt zijn eigen doelen formuleert.
- Tabel h3 bevat een korte checklist van de punten die aan de orde horen te komen (zie tabel H3).
Ook groepseducatie is een optie. Maak hierbij onderscheid tussen mensen die pas kort of al langer diabetes hebben en houd ook rekening met opleidingsniveau en specifieke doelgroepen, zoals mensen met een migratieachtergrond. - Adviseer vanwege de grotere kans op tandheelkundige problematiek bij mensen met diabetes tweemaal per jaar bezoek aan de tandarts en/of mondhygiënist. Het voorkomen van parodontitis is ook van belang voor de glucoseregulatie.
- Adviseer de griepvaccinatie (zie NHG/-Praktijkhandleiding Griepvaccinatie). Griepvaccinatie leidt tot een forse vermindering van complicaties (pneumonie, exacerbatie COPD, myocardinfarct, acute glykemische ontregeling, hartfalen) en daarmee gepaard gaande ziekenhuisopnames en ook tot verlaging van mortaliteit.
- In beginsel zijn er geen beperkingen van de rijgeschiktheid en het uitoefenen van een beroep.
Educatie
In het algemeen is het effect van voorlichting beter wanneer die gecombineerd wordt met strategieën gericht op gedragsverandering. Daartoe behoren de opvattingen van de patiënt over gezondheid en ziekte, de voor- en nadelen van bepaald gedrag en de uitvoerbaarheid van verandering daarvan in beschouwing te worden genomen. Voorts moet educatie de individuele behoeften en gewoonten van de patiënt respecteren en daarop aansluiten.
Interventies gericht op betrokkenheid van de patiënt zijn effectiever dan interventies alleen gericht op kennisoverdracht. Bij patiënten met een migratieachtergrond is ook kennisoverdracht zinvol.
Aandacht voor bekrachtiging (reinforcement) van de educatie door herhaling of continue educatie is noodzakelijk om het effect te laten beklijven.
Educatie kan worden gegeven aan individuele personen of in groepsverband. Een systematische review toonde aan dat groepseducatie gericht op zelfmanagement bij mensen met type 2 diabetes het glucosegehalte, de bloeddruk, de BMI en de behoefte aan bloedglucoseverlagende middelen in gunstige zin kunnen beïnvloeden; de effecten zijn echter sterk wisselend. Weinig onderzoeken hebben de langetermijneffecten onderzocht. In Italië werden 800 type 2 diabetespatiënten die langer dan een jaar bekend waren met type 2 diabetes en geen insuline gebruikten op de polikliniek van het ziekenhuis gerandomiseerd naar groepseducatie of individuele educatie. Na 4 jaar waren de klinische, cognitieve en psychologische uitkomsten beter in de groep die groepseducatie had gekregen.
De in Groot-Brittannië uitgevoerde DESMOND-trial (het programma loopt in Nederland onder het naam PRISMA) liet na een jaar gunstige effecten zien op gewichtsdaling en stoppen met roken, maar na 3 jaar was dit gunstige effect verdwenen. De in Nederland ontwikkelde cursus voor mensen met een pas ontdekte diabetes Geen woorden maar daden (Beyond Good Intentions) is een combinatie van individuele en groepsbijeenkomsten over een periode van 14 weken. De cursus leidde op korte termijn tot verlaging van de BMI en systolische bloeddruk, ongeacht de intensiteit van de medicamenteuze behandeling. Het effect was 9 maanden later nog aantoonbaar en bleek kosteneffectief. Een interventie waarbij ‘ervaren en getrainde patiënten’ recent gediagnosticeerde Nederlandse type 2 diabetespatiënten thuis een aantal keren bezochten om hen te coachen bleek niet effectief, behalve bij de mensen die er weinig vertrouwen in hadden dat ze goed met hun ziekte zouden kunnen omgaan.
In een clustergerandomiseerde trial met een follow-up van 24 maanden onder 584 patiënten in Limburg (leeftijd 40 tot 70 jaar, = 5 jaar bekend met type 2 diabetes) werden 18 praktijkondersteuners zeer intensief getraind in motivational interviewing, terwijl 15 praktijkondersteuners ‘gewone zorg’ leverden. De praktijkondersteuners kregen tijdens de interventie ook regelmatig en intensief (totaal > 20 uur) feedback op de wijze van motivational interviewing. De resultaten op vetinname en HDL-cholesterol waren negatief, op kennis en locus of control positief. Op alle andere parameters werden geen effecten gevonden. De auteurs concluderen dat er vooralsnog onvoldoende onderbouwing is om motivational interviewing in de diabeteszorg aan te bevelen.
In een meta-analyse (34 gerandomiseerde onderzoeken, 5993 patiënten, gemiddeld 52,8 jaar, gemiddeld HbA1c 8,5% (69 mmol/mol)) werd het effect bestudeerd van door diabetesverpleegkundigen geleide zelfmanagement educatie op de glykemische controle.
De gemiddelde HbA1c-verlaging was -0,70% (-8 mmol/mol) voor de educatiegroep versus -0,21% (-2 mmol/mol) voor de controlegroep. Het effect was het sterkst bij patiënten > 65 jaar en bij een follow-upduur van 1 tot 6 maanden.
In een Cochrane-review (9 onderzoeken, n = 1359) werd de effectiviteit nagegaan van individuele patiënteducatie (face-to-face) vergeleken met routinebehandeling (6 onderzoeken) en groepseducatie (3 onderzoeken. De onderzoeken die de individuele patiënteducatie vergeleken met de routinebehandeling lieten geen significante verbetering van het HbA1c zien (weighted mean difference (WMD) -0,1% (-1 mmol/mol); 95%-BI -0,3-0,10 (-3-1 mmol/mol); p = 0,33) over een periode van 12 tot 18 maanden. Significantie werd wel gevonden in een subgroep van patiënten met een gemiddeld baseline HbA1c hoger dan 8% (WMD) -0,3% (-3 mmol/mol); 95%-BI -0,5--0,1 (-5--1 mmol/mol); p = 0,007). In de onderzoeken die individuele educatie met groepseducatie vergeleken bestond geen significant verschil in reductie van het HbA1c (0,03% (0,3 mmol/mol); 95%-BI -0,02-0,1 (-0,2-1 mmol/mol); p = 0,22). Er werden geen significante verschillen gevonden in de effecten van individuele educatie versus routinebehandeling of groepseducatie op de BMI of bloeddruk. Er waren te weinig onderzoeken om een meta-analyse uit te voeren op de effecten van individuele educatie op zelfmanagement van dieet, kennis over diabetes, psychosociale uitkomstmaten en rookgewoonten.
Tandheelkundige controle
Tussen diabetes en parodontitis bestaat een wisselwerking. Enerzijds hebben patiënten met diabetes vaker last van problemen in de mond, bijvoorbeeld parodontitis, xerostomie, schimmelinfecties, cariës, gingivitis, smaakstoornissen en mondkanker. Metabole disregulatie, zoals bijvoorbeeld chronische hyperglykemie en dyslipidemie, dragen bij aan een versterkte inflammatoire reactie in parodontium. Dit brengt vervolgens (veelal irreversibele) schade toe aan het steunweefsel van de gebitselementen, waardoor tanden los gaan staan en uiteindelijk verloren kunnen gaan. Anderzijds kan parodontitis bijdragen aan een verslechterde glucoseregulatie. Parodontitis veroorzaakt een systemische stijging van cytokines zoals interleukines-1 en -6 en tumornecrosefactor-alfa. Hierdoor wordt de insulineresistentie bevorderd en daarmee de kans op verslechtering van de glykemische regulatie. In een Cochrane-review werd gevonden dat indien de parodontitis wordt behandeld, een HbA1c-daling werd bereikt van 0,4% (4 mmol/mol) (95%-BI -0,78--0,01). In een grootschalig uitgevoerde randomized controlled trial werd dit nogmaals bevestigd, daar een daling van zelfs 0,6% (6 mmol/mol) (95%-BI 0·3–0·9; p<0·0001) werd gerealiseerd. Slechte mondgezondheid en algemene gezondheid staan ook op het gebied van kwaliteit van leven met elkaar in verband.
Recentelijk werd een vragenlijst uit de Verenigde Staten ontwikkeld voor screening op parodontitis, vertaald en gevalideerd in een Nederlandse populatie. Dit resulteerde in een snelle, non-invasieve screening tool met een nauwkeurigheid van 88% (sensitiviteit 78%; specificiteit 84%). Deze vragenlijst is vrij toegankelijk op www.perioscreening.com. De uitkomst van deze vragenlijst en uitleg over de relatie tussen diabetes en problemen in de mond kan voor de patiënt een noodzakelijke extra motivatie zijn de tandarts of mondhygiënist te bezoeken.
Influenzavaccinatie
In Nederlands onderzoek (een genest patiënt-controleonderzoek) onder 9238 personen met diabetes (44% tussen 18 en 65 jaar, 56% van 65 jaar en ouder, 81% met een influenzavaccinatie) werden 192 ‘cases’ vergeleken met 1561 ‘controles’. Vaccinatie hing samen met 56% reductie van complicaties (95%-BI 36-70%), 54% reductie van ziekenhuisopnames (95%-BI 26-71%) en 58% mortaliteitsreductie (95%-BI 13-80%). Bij mensen die voor het eerst een vaccinatie kregen was het effect iets kleiner dan bij mensen die het jaar tevoren ook gevaccineerd waren.
Diabetes, beroep en verkeer
In beginsel is er voor patiënten met diabetes geen beletsel voor het uitoefenen van een beroep of het deelnemen aan het verkeer. Dit laatste wordt ook onderschreven in adviezen van de Gezondheidsraad en in Europese richtlijnen. In Nederland is er een klein aantal beroepen (waaronder piloot) waarbij beperkingen worden opgelegd aan diabetespatiënten.
Hoewel diabetespatiënten als groep mogelijk een iets hogere kans op (verkeers-) ongevallen hebben, is er onvoldoende grond om op basis hiervan de individuele patiënt op voorhand beperkingen op te leggen. Belangrijkste overwegingen voor het opleggen van beperkingen aan diabetespatiënten zijn het risico op (ernstige) hypoglykemie of lichamelijke beperkingen door het optreden van complicaties (met name visusstoornissen zoals cataract en ernstige retinopathie). Het soort werk dat de diabetespatiënt verricht zal uiteraard een rol spelen in het beoordelen van de ongevalsrisico’s. Uit Nederlands onderzoek kwam naar voren dat de volgende factoren als ‘succesvolle diabetesgerelateerde gedragingen’ voor werk kunnen worden aangemerkt: effectieve zelfmanagement activiteiten om hypo- en hyperglykemie op het werk te voorkomen en/of erop te reageren, het informeren van relevante anderen op de werkplek en het met succes onderhandelen met de werkgever over aanpassingen aan de arbeidsomstandigheden.
Sleutelfactoren om met diabetes veilig auto te rijden zijn de bekwaamheid van bestuurders om te anticiperen en effectief te reageren op een (dreigende) hypoglykemie tijdens het autorijden en het informeren en instrueren van medepassagiers. Ter voorkoming van ongelukken in bedrijf of verkeer is het essentieel dat de diabetespatiënt zijn hypoglykemieën voelt aankomen. Bij optreden van een ernstige hypoglykemie in wakkere toestand dient de rijvaardigheid opnieuw beoordeeld te worden. Hypoglykemie-unawareness is een reden voor directe beperking van rijbevoegdheid.
Voor verlenging/afgeven van een ‘groot rijbewijs’ mag de patiënt het laatste jaar geen ernstige hypoglykemie gehad hebben, moet de patiënt blijk geven van inzicht in de risico’s van hypoglykemie en dient de patiënt bereid te zijn elke twee uur glucosecontrole te verrichten. Er dient een beoordeling door een onafhankelijke internist en een oogheelkundige rapportage plaats te vinden.
Voor meer informatie, zie de Multidisciplinaire richtlijnmodule Diabetes en arbeidmultidisciplinaire richtlijnmodule Diabetes en Arbeid van de Nederlandse Vereniging voor Arbeiden Bedrijfsgeneeskunde (NVAB) ().
Thuisarts en keuzekaart
Naar Samenvatting ›- Verwijs naar de informatie over diabetes type 2 op thuisarts.nl, die is gebaseerd op deze NHG-Standaard.
- Voor een overzicht van de medicijnen vanaf stap 2 voor patiënten zonder zeer hoog risico op hart- en vaatziekten zie ook de keuzekaart Medicijnen bij diabetes type 2.
| De patiënt heeft inzicht in het belang van |
|
| * Educatie bestaat uit het bijbrengen van kennis, inzichten en vaardigheden. |
Kwaliteit van leven
Naar Samenvatting ›- Het doel van de behandeling is een zo lang mogelijk leven met behoud van zo veel mogelijk ‘kwaliteit van leven in relatie tot de gezondheid’.
- De effectiviteit van zelfmanagement op zelfredzaamheid en kwaliteit van leven is beperkt.
- Lagere fysieke en mentale kwaliteit van leven is geassocieerd met hogere cardiovasculaire en totale mortaliteit.
- Probeer daarom niet alleen complicaties te voorkomen, maar ook de belasting van de behandeling zo veel mogelijk te beperken en rekening te houden met de wensen van de patiënt.
- Intensivering van de behandeling leidt tot iets meer tevredenheid over de verleende zorg. Dit hoeft niet te betekenen dat alle patiënten alle streefwaarden voor glucose, bloeddruk en lipiden halen.
- Over zelfzorg hebben Nederlandse diabetespatiënten onderling sterk verschillende voorkeuren. Uiteindelijk is de patiënt zelf verantwoordelijk voor het halen van zijn behandeldoelen; probeer, samen met de praktijkondersteuner, de patiënt hierbij zo goed mogelijk te ondersteunen.
In toenemende mate wordt ingezien dat het bij het behandelen van mensen met type 2 diabetes om méér gaat dan om een goede cardiometabole instelling. Zogenaamde patient reported outcomes worden beschouwd als waardevolle indicatoren voor de kwaliteit van de zorg.
In clustergerandomiseerd onderzoek in 44 huisartsenpraktijken in Groot-Brittannië werd de effectiviteit van een interventie om zelfmanagement te versterken onderzocht. Van de 5599 patiënten hadden er 2546 diabetes, 1634 COPD en 1419 prikkelbaredarmsyndroom. Praktijken werden gerandomiseerd naar wel of niet aanbieden van diverse hulpmiddelen (onder andere schriftelijke informatie, aanwezige lokale voorzieningen). Primaire uitkomstmaat was shared decision-making (Short Form Healthcare Climate Questionnaire), zelfredzaamheid (confidence to undertake the management of chronic disease) en met de gezondheid samenhangende kwaliteit van leven (EQ-5D). Na 12 maanden follow-up werden op geen van de eindpunten statistisch significante verschillen gevonden tussen patiënten in de interventiepraktijken en die in de controlepraktijken. Controlepraktijken versus interventiepraktijken: shared decision-making 69,1 versus 67,7, verschil -0,47 (95%-BI -2,55-1,61); zelfredzaamheid 71,2 versus 70,4, verschil -0,35 (95%-BI -1,42-0,71); met de gezondheid samenhangende kwaliteit van leven 0,6 versus 0,6, verschil 0,00 (95%-BI -0,020,01).
Mortaliteit en kwaliteit van leven
Het fysieke functioneren en het algemene gevoel van gezondheid, die beide met dezelfde vragenlijst zijn te meten, hangt bij Nederlandse diabetespatiënten in de eerste lijn samen met de totale mortaliteit. Enkele jaren later bleek in hetzelfde cohort, maar nu met een follow-up van 9,6 jaar, dat zowel een lagere fysieke als mentale kwaliteit van leven bij type 2 diabetespatiënten ouder dan 75 jaar samenhangt met een hogere totale en cardiovasculaire mortaliteit, zowel bij mannen als vrouwen.
Comorbiditeit en kwaliteit van leven
Onderzoek onder 2086 Nederlandse type 2 diabetespatiënten (225 Nederlandse huisartsenpraktijken) met een redelijk goede cardiometabole controle (HbA1c ≤ 58 mmol/mol, systolische bloeddruk ≤ 145 mmHg, totaal cholesterol ≤ 5,2 mmol/l; zonder het gebruik van insuline) toonde aan dat hoe meer comorbiditeit iemand heeft, des te slechter het met de gezondheid samenhangende functioneren is. Cardiovasculaire en niet-cardiovasculaire ziekten hebben ieder hun eigen invloed.
Intensieve zorg en kwaliteit van leven
Slechts een beperkt aantal grote diabetestrials heeft het effect van intensieve zorg op het functioneren van patiënten en hun kwaliteit van leven onderzocht. Intensivering van de behandeling door het aanscherpen van de doelstellingen en het voorschrijven van meer medicatie leidde onder Amerikaanse patiënten die al lang bekend waren met type 2 diabetes niet tot negatieve effecten op de kwaliteit van leven, maar wel tot een iets grotere tevredenheid over de verleende zorg. Hetzelfde werd gevonden in het ADDITION-onderzoek in 343 huisartsenpraktijken in Denemarken, Engeland en Nederland onder 3057 door screening ontdekte type 2 diabetespatiënten (40 tot 69 jaar bij screening). Van hen werd de helft behandeld volgens de nationale richtlijnen in de 3 landen en de andere helft volgens een strenger ADDITION-protocol met als streefwaarden een HbA1c < 53 mmol/ mol en een bloeddruk < 135/80 mmHg. In het ADDITION-protocol kreeg iedereen met een cholesterolgehalte > 3,5 mmol/l een statine, iedereen met een bloeddruk > 120/80 mmHg acetylsalicylzuur. Na afloop van de trial waren er geen verschillen tussen de intensief en de minder intensief behandelde groep ten aanzien van algemeen welbevinden, diabetesspecifieke kwaliteit van leven en algemeen functioneren. De intensief behandelde groep was iets meer tevreden over de verleende zorg: een DTSQ-verschil van 0,7 op een schaal van 0 tot 36. Het absolute risico op hart- en vaatziekten nam af bij de 1699 Nederlandse diabetespatiënten uit de eerste lijn bij wie de behandeling werd geïntensiveerd door middel van het Diabetes Zorg Protocol (VitalHealth) ten opzichte van de 1692 die behandeld werden volgens de NHG-Standaard. Op termijn kunnen we daarom een betere kwaliteit van leven verwachten. Op korte termijn kregen zij door de intensivering van de zorg geen slechtere kwaliteit van leven, al waren er wel aanwijzingen dat hun sociaal functioneren enigszins negatief werd beïnvloed.
Compliance
In een vragenlijstonderzoek onder 994 patiënten met type 2 diabetes (gemiddelde leeftijd 65 jaar, 54% mannen, 792 patiënten door huisarts behandeld) gaf 44,5% te kennen medicatie te willen slikken totdat alle doelstellingen voor HbA1c, bloeddruk en lipiden zijn behaald; 44,2% zei medicatie te willen gebruiken totdat bijwerkingen optreden.
In hetzelfde onderzoek bleken patiënten sterk verschillende voorkeuren te hebben voor het volgen van een dieet of meer lichamelijke activiteit. Leeftijd speelde daarbij geen rol.
Niet-medicamenteuze adviezen
Naar Samenvatting ›- Overgewicht en te weinig lichaamsbeweging spelen een belangrijke rol in het ontstaan en de progressie van diabetes type 2. Een gezonde leefstijl vormt daarom de basis van de behandeling en blijft belangrijk gedurende het hele ziektebeloop. Bij nieuwe patiënten met licht tot matig verhoogde glucosewaarden kan, zeker als er geen klachten zijn, het effect van leefstijlverbetering gedurende enkele maanden worden afgewacht, voordat gestart wordt met medicatie.
- De leefstijladviezen voor mensen met diabetes type 2 komen in grote lijnen overeen met de adviezen voor de algemene bevolking, maar dienen vooral nadrukkelijker bij deze patiëntengroep onder de aandacht te worden gebracht.
- Centrale thema’s zijn: stoppen met roken, voldoende bewegen, gezonde voeding en gewichtsverlies bij overgewicht. Overleg of de patiënt begeleiding nodig heeft om deze leefstijlaspecten aan te pakken. Spreek doelen en tijdspaden af en stem de begeleiding daarop af.
- De afgelopen jaren worden intensieve leefstijlbehandelingen toegepast, gericht op remissie van diabetes. Er is onvoldoende bewijs voor de (mate van) werkzaamheid van deze interventies om ze op grote schaal te kunnen aanbevelen. Wel zijn er aanwijzingen voor gunstige effecten op de glykemische regulering.
Stoppen met roken
Naar Samenvatting ›Roken is een van de belangrijkste risicofactoren voor hart- en vaatziekten. Wijs rokende patiënten bij herhaling op het belang van stoppen en bied daarbij ondersteuning aan. Zie voor meer informatie de NHG-Behandelrichtlijn Stoppen met roken.
Roken
Roken is de belangrijkste risicofactor voor hart- en vaatziekten. Methoden om te stoppen met roken staan beschreven in de multidisciplinaire richtlijn Behandeling van tabaksverslaving en stoppen met roken ondersteuning en de NHG-Behandelrichtlijn Stoppen met roken. De huisarts kan stoppen met roken bevorderen met de minimale interventiestrategie. Hij kan daarbij eventueel gebruikmaken van ondersteunende medicatie. Stoppen met roken vermindert het risico op hart- en vaatziekten op alle leeftijden (zie de NHG-Standaard Cardiovasculair risicomanagement). Dit effect treedt al op in de eerste 2 tot 3 jaar.
Roken is geassocieerd met een verhoogd risico op type 2 diabetes. In een systematische review werd gevonden dat dit risico hoger was voor zware rokers (≥ 20 sigaretten per dag: RR 1,61; 95%-BI 1,43-1,80) dan voor minder zware rokers (RR 1,29; 95%-BI 1,13-1,48). Roken is onafhankelijk van BMI en lichaamsbeweging een risicofactor voor type 2 diabetes. In prospectief onderzoek (41.372 personen, leeftijd 25 tot 64 jaar, zonder diabetes of hart- en vaatziekten, follow-up 21 jaar) werden 2770 personen met diabetes gediagnosticeerd. De multifactorieel gecorrigeerde hazardratio voor > 20 sigaretten per dag was 1,57 (95%-BI 1,34-1,84) voor mannen en 1,87 (95%-BI 1,36-2,59) voor vrouwen.
Voldoende bewegen
Naar Samenvatting ›- Stimuleer de patiënt minstens 5 dagen per week een half uur en bij overgewicht een uur per dag matig-intensief te bewegen en te werken aan conditieverbetering.
- Adviseer aanvullend minstens tweemaal per week spier- en botversterkende activiteiten.
- Adviseer de patiënt om veel en langdurig zitten zo veel mogelijk te vermijden.
- Lees meer over deze 3 adviezen in het rapport van de gezondheidsraad.
- Adviseer beweging die aansluit bij de mogelijkheden, patiëntvoorkeuren en dagelijkse routine van de patiënt.
- Voor de meeste patiënten met overgewicht en voor veel ouderen zijn stevig wandelen, fietsen of zwemmen het gemakkelijkst haalbaar.
- Als de gezondheid van de patiënt het toelaat, kan de patiënt kiezen voor een intensievere vorm van training (bijvoorbeeld hardlopen, intensief fietsen of roeien) onder begeleiding.
- Ook een kleine toename van lichamelijke activiteit is al gunstig. Langer, vaker en intensiever bewegen geeft extra gezondheidsvoordeel. Bewegen heeft ook zonder gewichtsverlies een gunstig effect op de bloedsuikerwaarden en op (sterfte aan) hart- en vaatziekten.
Uitgangsvraag
Is toevoeging van een beweeginterventie aan te bevelen bij patiënten met diabetes mellitus type 2 die ook een energiebeperkt dieet volgen? Zie de PICO-tabel.
| Patiënten | Patiënten met diabetes mellitus type 2 |
| Interventie | Combinatie beweeginterventie met energiebeperkt dieet |
| Vergelijking | Energiebeperkt dieet |
| Uitkomstmaten | Cruciaal:
Belangrijk:
|
Achtergrond
Bewegen heeft een positieve invloed op allerlei lichamelijke processen die tot een betere gezondheid leiden. Patiënten met diabetes mellitus type 2 die door een energiebeperkt dieet proberen af te vallen kunnen door meer te bewegen ook hun gezondheid verbeteren. De vraag is hoe effectief het is om een beweeginterventie toe te voegen aan zo’n dieet.
Methode
Er zijn systematische literatuurzoekacties uitgevoerd in PubMed en Embase in september 2019 naar RCT’s en SR’s.
Resultaten
Resultaat zoekactie
De zoekactie leverde 2 RCT’s op.
Onderzoekskarakteristieken
- In een driearmige RCT werden 40 vrouwen (50-70 jaar) met diabetes mellitus type 2 en obesitas (BMI > 30) gerandomiseerd naar een dieet- (D), beweeg- (EX) of dieet+beweeginterventie (D+EX) voor 14 weken. In de EX-groep gingen vrouwen onder begeleiding 3 tot 4 × per week 60 minuten wandelen. De D-groep kreeg het volgende dieet voorgeschreven: 40% vet, 40% koolhydraten en 20% eiwit, waarbij elk individu 2510 kJ per dag minder mocht eten dan het aantal kJ per dag waardoor ze normaliter op gewicht zouden blijven. Voor de analyse zijn alleen de D- (n = 11) en D+EX-groep (n = 11) meegenomen.
- In een vierarmige RCT werden 83 personen (56,1±7,5 jaar, BMI 35,4±4,6) met diabetes mellitus type 2 met overgewicht/obesitas gerandomiseerd naar 1 van de 2 energiebeperkende diëten (6000 kJ per dag voor vrouwen en 7000 kJ per dag voor mannen) met of zonder begeleide weerstandstraining (RT). De deelnemers kregen een dieet met normale koolhydraatinname (CON; 26% vet, 53% koolhydraten en 19% eiwit) of een dieet dat hoog was in eiwit (HP; 26% vet, 43% koolhydraten en 33% eiwit). Ze zagen eens per 2 weken een diëtist. Tijdens de RT werd er 3 × per week 45 minuten krachttraining gedaan en de weerstand (aantal kg) werd iedere week verhoogd. De interventieperiode duurde 16 weken. Voor de analyse zijn alleen de vergelijkingen CON vs. CON-RT (n = 33) en HP vs. HP-RT (n = 26) meegenomen.
Effectiviteit en bijwerkingen
De resultaten van de meta-analyse zijn samengevat in GRADE-tabellen.
Conclusies
Een beweeginterventie als toevoeging op een dieetinterventie lijkt het gewicht, de BMI en de bloeddruk niet te verminderen. Cholesterolparameters lijken niet te verbeteren.
We zijn onzeker over het effect van een beweeginterventie als toevoeging op een dieetinterventie op het HbA1c.
Voor de uitkomsten sterfte, hart- en vaatziekten, hypoglykemie, kwaliteit van leven en spiermassa is geen onderzoek gevonden.
Van bewijs naar aanbeveling
Voor- en nadelen
Er zijn in 2 kleine RCT’s geen voordelen aangetoond om beweeginterventies aan dieetmaatregelen toe te voegen bij mensen met diabetes mellitus type 2. De gewichtsvermindering lijkt ogenschijnlijk weinig, maar deze is door de korte interventieduur toch indrukwekkend. Bovendien is er bewijs dat bij personen met prediabetes een beweeginterventie gecombineerd met een dieetinterventie het risico op het ontwikkelen van diabetes mellitus type 2 verlaagt. Verder heeft bewegen een gunstige invloed op de (cardiovasculaire) conditie.
Kwaliteit van bewijs
De kwaliteit van het bewijs is laag; de onderzoeksresultaten zijn vertekend door bias en er is een onnauwkeurige schatting van het effect vanwege het lage patiëntenaantal.
Waarden en voorkeuren van patiënten
Het aanpassen van leefpatronen is lastig. Een deel van de patiënten zal ondersteuning op prijs stellen en er extra motivatie aan ontlenen.
Kosten
Het toevoegen van een beweeg- aan een dieetinterventie brengt extra kosten met zich mee. Vergoeding is soms mogelijk uit een lokaal programma.
Aanvaarbaarheid en haalbaarheid
Als de patiënt gemotiveerd is om zowel zijn dieet als beweegpatroon aan te passen en extra bewegen lukt niet zonder hulp, dan kan bewegen onder begeleiding worden overwogen.
Waarom deze aanbeveling?
Het is nog te onzeker of het toepassen van beide interventies tot een positief effect leidt. Mocht de patiënt hier zelf gemotiveerd voor zijn, dan lijkt de kans van slagen groter.
Aanbeveling
Overweeg een combinatiebehandeling van een beweeg- en dieetinterventie als de patiënt gemotiveerd is en zijn gezondheid het toelaat.
Samenvatting van bewijs
Uitgangsvraag
Is het geven van intensieve begeleiding bij het aanbrengen van leefstijlverbeteringen aan te bevelen bij patiënten met diabetes mellitus type 2? Zie de PICO-tabel.
| Patiënten | Patiënten met diabetes mellitus type 2 |
| Interventie | Intensieve begeleiding bij het aanbrengen van leefstijlverbeteringen |
| Vergelijking | Minder begeleiding of geen begeleiding |
| Uitkomstmaten | Cruciaal:
Belangrijk:
|
Achtergrond
Voldoende bewegen en een verder gezond leefpatroon dragen bij aan behoud van gezondheid. Leefstijlverandering is voor veel mensen lastig te realiseren. Intensieve begeleiding zou kunnen helpen mensen te motiveren veranderingen vol te houden. De vraag is of intensieve begeleiding bij leefstijlverandering betere resultaten geeft dan weinig begeleiding of alleen een leefstijladvies.
Methode
Er zijn systematische literatuurzoekacties uitgevoerd in PubMed en Embase in september 2019 naar RCT’s en SR’s.
Resultaten
Resultaat zoekactie
De zoekactie leverde 3 RCT’s op.
Onderzoekskarakteristieken
- In de Look AHEAD RCT kregen 5145 volwassenen (18-70 jaar; gemiddeld 100 kg) met diabetes mellitus type 2 en overgewicht/obesitas (BMI > 27) een intensieve leefstijlinterventie (ILI) of standaardzorg en educatie (DSE). De ILI was de eerste 12 maanden zeer intensief; de eerste 6 maanden kregen de patiënten wekelijks een groeps- of individuele sessie en in de volgende 6 maanden per maand 2 groepssessies en 1 individuele sessie. In jaar 2 tot en met 4 was er 2 × per maand contact en daarna 1 × per maand (mediane interventieduur: 9,6 jaar). De interventie had als doel om 7-10% gewichtsverlies te realiseren en bestond uit de volgende elementen: een voorgeschreven dieet met aanvullende strategieën (als het niet lukte om af te vallen), een beweegprogramma, terugvalpreventie, leefstijladvies op maat, probleemoplossende therapie en (zelf)monitoring.
- De DSE bestond uit 3 × per jaar (4 jaar lang) een groepssessie waarin alleen informatie werd gegeven over dieet en beweging en de groep als sociale ondersteuning diende. Na 4 jaar werd de frequentie verlaagd naar 1 × per jaar.
- In de RCT van Crasto 211kregen 189 volwassenen (45-74 jaar; gemiddeld 94 kg) met diabetes mellitus type 2 en microalbuminurie gedurende 1,5 jaar gebruikelijke zorg of een intensieve multifactoriële interventie met in totaal 8-10 individuele educatieve sessies (onderwerpen: veranderen leefstijl, algemene informatie over diabetes mellitus type 2, gezond eten, lichamelijke activiteit en lichaamsbeweging, therapietrouw en zelftitratie; alles werd bijgehouden en er werden verschillende doelstellingen geformuleerd en geëvalueerd), 3 uur voorlichting over microalbuminurie en eventueel nog insulinemanagementsessies.
In de RCT van Moncrieft kregen 111 volwassenen (18-70 jaar; gemiddeld 85 kg) met diabetes mellitus type 2 met overgewicht/obesitas (BMI ≥ 27) en depressieve symptomen (Beck Depression Inventory (BDI-2)-score tussen 11-35) gebruikelijke zorg of een leefstijlinterventie met 17 individuele en groepssessies (1,5 tot 2 uur per sessie; eerste maand wekelijks, daarna 2 maanden tweewekelijks en de laatste 9 maanden eenmaal per maand). De inhoud van de sessies ging over goede/slechte voeding, gewichtsverlies, omgaan met stress, omgaan met negatieve gedachten, sociale ondersteuning, probleemoplossing, leefstijlverandering, leren plannen en motivatiestrategieën.
Effectiviteit en bijwerkingen
De resultaten van de 3 interventies na 1-1,5 jaar zijn samengevat in GRADE-tabellen. De resultaten van de Look AHEAD RCT na 1 jaar zijn daar ook in meegenomen, omdat de interventie tot dan toe het meest intensief was en ongeveer hetzelfde moment was waarop de andere 2 interventies de uitkomstenmetingen verrichten. De resultaten van de Look AHEAD RCT zijn na 4, 8 en 9 jaar samengevat in de GRADE-tabellen. Tot jaar 4 is de interventie in de Look AHEAD RCT 210nog behoorlijk intensief (2 × per maand contact), daarna werd het teruggebracht tot een lagere intensiteit van 1 × per maand.
Conclusies
Na behandeling (1-1,5 jaar)
- Het is onduidelijk of intensieve begeleiding resulteert in meer of minder sterfte, hart- en vaatziekten of ernstige gevallen van hypoglykemie.
- Intensieve begeleiding resulteert waarschijnlijk in een vermindering van de HbA1cen systolische bloeddruk.
- Intensieve begeleiding resulteert waarschijnlijk in een vermindering van de HbA1c.
- Intensieve begeleiding lijkt de systolische bloeddruk te verminderen.
- De Look AHEAD-interventie resulteert waarschijnlijk in een toename van kwaliteit van leven en in een afname van gewicht en het triglyceridengehalte.
- De Look AHEAD-interventie resulteert waarschijnlijk in een toename van het LDL- en HDL-gehalte.
- De Crasto- en Moncriet-interventie lijken het gewicht niet te verminderen.
- De Crasto-interventie lijkt het cholesterolgehalte (totaal en LDL) te verminderen, terwijl het triglyceridengehalte lijkt toe te nemen.
Middellange termijn (4 jaar)
- De Look AHEAD-interventie resulteert waarschijnlijk in een gewichtsafname, vermindering van het triglyceridengehalte en verbetering van het HDL-gehalte.
- De Look AHEAD-interventie heeft waarschijnlijk nauwelijks effect op de HbA1c.
- De Look AHEAD-interventie lijkt nauwelijks effect te hebben op de het LDL en de systolische bloeddruk.
Lange termijn (8-9 jaar)
- De Look AHEAD-interventie heeft waarschijnlijk nauwelijks effect op gewichtsafname.
- We zijn onzeker over het effect van de Look AHEAD-interventie op sterfte en het lijkt geen effect te hebben op het verminderen van CVA en hartfalen.
Van bewijs naar aanbeveling
Voor- en nadelen
Intensieve begeleiding bij het aanbrengen van verbeteringen in de leefstijl hebben voornamelijk effect op de korte termijn (zolang men de intensieve interventie krijgt). Op 2 van de 3 cruciale uitkomsten (sterfte en hart- en vaatziekten) zijn er geen effecten of ze zijn onzeker. Op de derde cruciale uitkomst is wel effect op de korte termijn (er is geen onderzoek op de (middel)lange termijn): de kwaliteit van leven neemt toe.
Buiten de scope van de geformuleerde PICO zijn er andere korte- en langetermijneffecten van intensieve leefstijlinterventies gebleken. Uit andere rapportages over de Look Ahead-studie blijkt dat er op de lange termijn een significant effect is op afname van buikomtrek, betere glykemische regulatie, minder medicatie (antihypertensiva, statines en insulinegebruik)
en minder last van neuropathie.
Op de korte termijn (na 1 jaar) werden nog een aantal positieve effecten gevonden. Deelnemers in de intensieve leefstijlgroep hadden significant minder last van apneuklachten,
depressieve symptomen,
klachten van erectiele dysfunctie
en vrouwen hadden minder incontinentieklachten.
Bovendien bewogen de deelnemers na een jaar intensieve leefstijlbegeleiding meer en hadden zij een betere cardiorespiratoire fitheid.
In het kader van de Look Ahead-studie is er ook nog gezocht naar subgroepen van patiënten bij wie de interventie wel positieve effecten had op ernstige cardiovasculaire incidenten. 220Deze subgroep (geen cardiovasculaire voorgeschiedenis, met een goede glykemische regulatie, geen insulinegebruik, hogere SES en afwezigheid van albuminurie) werd gevonden, maar de auteurs concluderen ook dat de interventie potentieel negatieve effecten kan hebben in andere subgroepen.
Ondanks het gebrek aan een stringente bewijsvoering, die voldoet aan alle eisen zoals gesteld binnen de GRADE-systematiek, blijft een gezond leefpatroon geassocieerd met minder kans op ziekte en een langere levensduur.
Overigens kan er bij een tijdelijk (middenlang) effect van een interventie sprake zijn van een voor de patiënt positief effect, of dit nu lichamelijk of mentaal is.
Kwaliteit van bewijs
De 3 trials bevatten bias en 2 trials zijn daarnaast ook relatief klein, waardoor er op bepaalde uitkomsten onnauwkeurigheid ontstaat. De Look AHEAD-studie heeft veel deelnemers en heeft een lange follow-upduur. Zo ontstaat er een redelijk goed beeld van de effecten van de interventie. Een laatste punt over de kwaliteit van het bewijs is dat de 3 interventies onderling verschillen wat betreft inhoud en intensiteit. Daardoor ontstaat er inconsistentie in sommige resultaten. Als er te veel heterogeniteit aanwezig was, zijn resultaten voor deze uitkomst per interventie gepresenteerd.
De aanvullende korte- en langetermijnresultaten dienen met voorzichtigheid te worden geïnterpreteerd, omdat deze niet op betrouwbaarheid zijn beoordeeld. Verder zijn de resultaten van De Vries e.a. post-hoc verkregen en daarom onzeker. De effecten voor deze subgroep zouden eerst in een prospectieve RCT moeten worden onderzocht om een betrouwbare conclusie te kunnen trekken.
Waarden en voorkeuren van patiënten
Een gedeelte van de patiënten met diabetes mellitus type 2 vindt het lastig om een gezondere levensstijl aan te nemen. Motivatie voor zo’n intensieve vorm van begeleiding zal sterk per individuele patiënt verschillen.
Kosten
De kosten voor intensieve leefstijlbegeleiding (in vergelijking met gebruikelijke zorg) zijn erg hoog. De kosten en baten zijn in de Look Ahead-studie berekend. In het eerste, intensiefste jaar waren de kosten $ 2864,60(SD = 513,3) vs. $ 202,40 (SD = 76,6) en in de laatste minder intensieve 4 jaar was dit $ 1119,80 (SD = 227,7) vs. $ 102,90 (SD = 33,0) per jaar.
Daarentegen zijn de totale gezondheidszorgkosten (medicatie en zorg binnen en buiten het ziekenhuis) in de intensieve leefstijlgroep over 10 jaar gezien lager, met een verschil van $ 5280 (95%-BI $ 3385-$7175).
Waarschijnlijk is intensieve leefstijlbegeleiding zoals uitgevoerd in de Look Ahead studie niet kosteneffectief.
Aanvaarbaarheid en haalbaarheid
Intensieve leefstijlbegeleiding lijkt op de lange termijn niet te werken. Dit komt waarschijnlijk omdat de meeste interventies stoppen of minder intensief worden. Het doorzetten van zo’n intensieve vorm van begeleiding is erg duur en het is nog de vraag of een patiënt de intensiteit van de interventie vol kan houden. Daarentegen heeft een gedeelte van de patiënten wel baat bij de interventie, zeker op de korte en middellange termijn.
Waarom deze aanbeveling?
We verwachten dat intensieve begeleiding bij het aanbrengen van leefstijlverbeteringen in het begin (en dit is ook de meest intensieve fase) effect heeft, maar dat op langer termijn de positieve effecten verdwijnen. De interventie is behoorlijk intensief en op cruciale uitkomsten heeft het geen effect aangetoond. Voor bepaalde subgroepen zullen er mogelijk wel langetermijneffecten zijn.
Aanbeveling
Overweeg een langdurig programma voor intensieve begeleiding bij het aanbrengen van verbeteringen in de leefstijl bij patiënten met diabetes mellitus type 2, maar wees hierin wel terughoudend vanwege de teruglopende effecten en de hoge kosten.
Samenvatting van bewijs
Uitgangsvraag
Is een beweeginterventie aan te bevelen bij patiënten met diabetes mellitus type 2? Zie de PICO-tabel.
| Patiënten | Patiënten met diabetes mellitus type 2 |
| Interventie | Een gestructureerde en begeleide beweeginterventie (en gebruikelijke zorg) |
| Vergelijking | Geen interventie (en gebruikelijke zorg, waaronder beweegadvies) |
| Uitkomstmaten | Cruciaal:
Belangrijk:
|
Achtergrond
De Gezondheidsraad doet een aantal algemene en minimale aanbevelingen om te bewegen en op die manier gezond te blijven. Het is voor sommige personen met diabetes mellitus type 2 lastig om deze aanbevelingen op te volgen. Juist van intensiever bewegen is bekend dat het een positieve invloed heeft op allerlei lichaamsprocessen die vervolgens tot een betere gezondheid leiden, zoals een verbeterde sensitiviteit voor insuline van het lichaam. Ook draagt meer bewegen bij aan een gezond lichaamsgewicht en een kleinere kans op diabetes en vroegtijdig overlijden. Adviezen om meer te bewegen leiden vaak niet tot daadwerkelijk meer bewegen. Ondersteuning om meer te bewegen leidt daarom mogelijk tot gunstige effecten bij patiënten met diabetes mellitus type 2. Ook de generieke Zorgmodule Bewegen van de Nederlandse Diabetes Federatie (NDF) gaat hierop in, alleen is het onduidelijk of zij op systematische wijze de literatuur hebben verzameld en beoordeeld op betrouwbaarheid. Het is daarom de vraag of een patiënt met een beweeginterventie meer gezondheidswinst kan boeken dan als de patiënt alleen een advies zou krijgen om dit meer te doen.
Methode
Er zijn systematische literatuurzoekacties uitgevoerd in PubMed en Embase in november 2019 naar systematic reviews (SR’s).
Resultaten
Resultaat zoekactie
De zoekactie leverde 5 SR’s op.
Onderzoekskarakteristieken
- In een SR met meta-analyse met 30 RCT’s werd het effect van beweeginterventies (aerobe training, weerstandstraining of een combinatie) op bloeddruk vergeleken met alleen advies om meer te bewegen bij 9540 gerandomiseerde patiënten met diabetes mellitus type 2 (range gemiddelde leeftijd 51-67). De gestructureerde oefentrainingen vonden gemiddeld in 3 sessies per week plaats (range 2-5) en duurden gemiddeld 20 weken (range 6-48).
- In een SR met meta-analyse met 27 RCT’s werd het effect van een interventie gericht op aerobe training vergeleken met geen interventie bij 1372 gerandomiseerde patiënten met diabetes mellitus type 2. De trainingen duurden 4-52 weken (gemiddeld 17,8 weken, mediaan 13 weken) en er vonden 2-5 (mediaan 3) wekelijkse oefensessies plaats. De sessieduur varieerde van 15 tot 75 minuten (mediaan 50), wat neerkomt op een gemiddelde wekelijkse trainingstijd van 40 tot 300 minuten (gemiddeld 157 minuten, mediaan 150 minuten).
- In een SR met meta-analyse 233met 42 RCT’s werd het effect van begeleide beweeginterventies (aerobe training, weerstandstraining of een combinatie) op gewicht/BMI, HDL-cholesterol en LDL-cholesterol vergeleken met geen interventie bij 2808 gerandomiseerde patiënten met diabetes mellitus type 2 (gemiddeld 56,7 jaar; 51% vrouw). De beweeginterventies duurden gemiddelde 22,5 weken (range 8-108).
- In een SR met meta-analyse met 18 RCT’s werd het effect van (begeleid) lopen op HbA1c, gewicht, bloeddruk, HDL-cholesterol en LDL-cholesterol vergeleken met geen interventie bij 866 gerandomiseerde patiënten met diabetes mellitus type 2 (vaak met overgewicht; range gemiddelde leeftijd 51-70,2). De interventieperiode duurde 8-36 weken. De sessieduur varieerde van 20 tot 120 minuten en de sessies vonden 3 tot 7 × per week plaats.
- In een SR zonder meta-analyse met 30 (non-)RCT’s werd het effect van beweeginterventies (aerobe training, weerstandstraining, of een combinatie daarvan) op kwaliteit van leven onderzocht bij 2785 patiënten met diabetes mellitus type 2. De SR gaat ook in op het effect van yoga, maar dat is niet primair een vorm van bewegen en derhalve buiten beschouwing gelaten. Bij deze review werd geen meta-analyse verricht, omdat de heterogeniteit tussen de onderzoeken te groot was. De interventieperiode duurde 5-52 weken. De sessieduur varieerde van 10 tot 75 minuten en de sessies vonden 1 tot 7 × per week plaats.
Effectiviteit en bijwerkingen
De gevonden meta-analyses tonen de effecten van beweeginterventies in het algemeen, maar ook voor specifieke vormen van bewegen, zoals aerobe training, weerstandstraining, gecombineerde training en begeleid wandelen. De resultaten zijn samengevat in GRADE-tabellen.
Conclusies
Beweeginterventies in het algemeen
- Een beweeginterventie zou het BMI/gewicht kunnen verminderen bij patiënten met diabetes mellitus type 2.
- Het is onzeker, maar een beweeginterventie lijkt HbA1cte verminderen bij patiënten met diabetes mellitus type 2.
- Het is onzeker wat het effect is van een beweeginterventie op bloeddruk en cholesterol.
Aerobe training
- Aerobe training zou het BMI/gewicht kunnen verminderen en de bloeddruk kunnen verlagen bij patiënten met diabetes mellitus type 2.
- Aerobe training zou de kwaliteit van leven mogelijk verbeteren.
- Het is onzeker, maar een aerobe training lijkt HbA1cte verminderen bij patiënten met diabetes mellitus type 2.
- Aerobe training verhoogt het HDL-cholesterol wellicht niet. Aerobe training verlaagt mogelijk ook het LDL-cholesterol niet, maar deze uitkomst is onzeker.
Weerstandstraining
- Weerstandstraining zou de bloeddruk enigszins kunnen verminderen bij patiënten met diabetes mellitus type 2.
- Weerstandstraining vermindert BMI/gewicht en HbA1cwellicht niet bij patiënten met diabetes mellitus type 2.
- Weerstandstraining verhoogt het HDL-cholesterol waarschijnlijk niet. Het is onzeker wat het effect op LDL-cholesterol en de kwaliteit van leven is.
Gecombineerde training (aeroob en weerstand)
- Combinatietraining zou het BMI/gewicht enigszins kunnen verminderen bij patiënten met diabetes mellitus type 2.
- Het is onzeker, maar een combinatietraining lijkt HbA1cte verminderen voor patiënten met diabetes mellitus type 2.
- Combinatietraining vermindert de bloeddruk en verhoogt het HDL-cholesterol wellicht niet bij patiënten met diabetes mellitus type 2. Het is onzeker wat het effect op het LDL-cholesterol en de kwaliteit van leven is.
(Begeleid) wandelen
- Het is onzeker, maar (begeleid) wandelen lijkt HbA1cte verminderen voor patiënten met diabetes mellitus type 2.
- (Begeleid) wandelen vermindert het BMI en LDL-cholesterol wellicht niet.
- Het is onzeker wat het effect is van (begeleid) wandelen op de bloeddruk.
Niet gemeten uitkomsten
Voor beweeginterventies is het niet bekend of het een effect heeft op sterfte en hart- en vaatziekten.
Van bewijs naar aanbeveling
Voor- en nadelen
Voor beweeginterventies worden er op basis van de uitgevoerde zoekstrategie geen onderzoeken gevonden waarin klinisch significante nadelen optraden. Daartegenover staat wel een aantal voordelen van beweeginterventies, hoewel de interpretatie hiervan wordt bemoeilijkt doordat de kwaliteit van het bewijs vaak laag tot zeer laag is. Beweeginterventies in het algemeen lijken een positief effect te hebben op BMI/gewicht en HbA1c. Helaas ontbreken er resultaten van 2 (hart- en vaatziekten en sterfte) van de 3 cruciale uitkomstmaten voor deze interventies.
Als er naar specifieke vormen van bewegen wordt gekeken, zou aerobe training als enige beweeginterventie een positief effect hebben op de cruciale uitkomstmaat kwaliteit van leven. Ook zou aerobe training BMI/gewicht en HbA1ckunnen verlagen, net zoals een gecombineerde training. Weerstandstraining zou de bloeddruk kunnen verlagen, maar een positief effect op BMI/gewicht en HbA1cwerd niet gevonden. (Begeleid) wandelen lijkt het minste effect te hebben en heeft mogelijk alleen een positief effect op HbA1c. Verder zijn voor alle beweeginterventies de uitkomsten te onzeker of hadden de beweeginterventies geen effect.
Literatuur over effecten van bewegen in de algemene bevolking en andere patiëntengroepen
Er is veel onderzoek gedaan naar de relatie tussen al dan niet bewegen en de mate van bewegen (met daarin wisselend betrokken de intensiteit en duur per week, maar ook de invloed van tijdstip van starten in het leven en de chroniciteit (het volhouden van een gezond activiteitenpatroon)).
Veel onderzoeken zijn observationeel en hebben vaak een lange follow-upduur, terwijl er maar weinig onderzoeken met een lange follow-uptermijn zijn gerandomiseerd. In zijn algemeenheid is een toenemende vrijetijdsbesteding aan bewegen geassocieerd met het later en minder vaak optreden van ziektes en met een positieve invloed op mortaliteit.
Als grote gemene delers kunnen worden vastgesteld:
- Bewegen is altijd beter dan niet bewegen.
- Meer bewegen is in de meeste gevallen beter dan minder bewegen.
- Er zijn veel verschillende uitkomsten over de benodigde hoeveelheid inspanning op weekbasis. Centraal blijft, zeker bij de oudere mens: iets is beter dan niets, waarbij bijvoorbeeld de 10.000 stappen per dag zeker bij oudere vrouwen niet heilig blijken. Volhouden is bovendien essentieel.
Kwaliteit van bewijs
Veel van het bewijs is van lage kwaliteit. Veel onderzoeken bevatten vertekende resultaten. De onderzochte beweeginterventies zijn zo verschillend in duur, intensiteit en opzet dat ze daardoor mogelijk heterogene resultaten opleveren. In een gedeelte van de verschillende meta-analyses hebben de auteurs dit onderzocht. Hoewel voor sommige uitkomsten een langere en intensievere duur van de interventie positievere resultaten gaf, kon dit voor veel uitkomsten niet worden aangetoond. Verder is bekend dat het lastig is om in onderzoek naar beweeginterventies een (voldoende) effect aan te tonen, omdat er weinig contrast is tussen de controle- en de interventiegroep. De mensen die niet willen bewegen doen immers niet mee aan dergelijke onderzoeken. Bovendien zijn de deelnemers in de controlegroep al gemotiveerd om te bewegen.
Waarden en voorkeuren van patiënten
Veel patiënten met diabetes mellitus type 2 kampen met overgewicht en vinden het lastig zich te motiveren om meer te bewegen. Een patiënt heeft vaak wel de intentie actiever te willen zijn, maar heeft daarbij soms een steuntje in de rug nodig met behulp van een gestructureerd programma. Een beweeginterventie helpt hier mogelijk bij.
Kosten
Een beweeginterventie kan kosten met zich meebrengen. Soms is vergoeding mogelijk uit een lokaal programma.
Aanvaarbaarheid en haalbaarheid
Als een patiënt graag meer wil bewegen maar het zelf lastig vindt de motivatie op te brengen of niet goed weet wat helpt, heeft de interventie waarschijnlijk meer kans van slagen.
Waarom deze aanbeveling?
We verwachten dat voor patiënten die geholpen willen worden om meer te bewegen de mogelijke, maar onzekere voordelen opwegen tegen eventuele nadelen. Verder is bewegen in het algemeen goed en zou men ondersteund moeten worden als na verkenning met de patiënt dit goed lijkt te passen. Verder zou aerobe training de voorkeur hebben omdat er indicaties zijn dat dit de kwaliteit van leven verbetert en helpt bij het afvallen.
Aanbeveling
- We bevelen aan om de patiënt te motiveren om meer te bewegen; geef minimaal voorlichting over de voordelen van meer lichaamsbeweging.
- Als de gezondheid van de patiënt het toelaat, overweeg dan een beweeginterventie in te zetten gericht op aerobe training en bespreek de eventuele voor- en nadelen. Mocht de patiënt gemotiveerd zijn om weerstandstraining of combinatietraining te gaan doen, dan kan ook hiervoor gekozen worden.
Gewichtsverlies
Naar Samenvatting ›- Adviseer patiënten met overgewicht om af te vallen door het volgen van een energiebeperkt dieet, het aanbrengen van blijvende veranderingen in het voedingspatroon en meer te bewegen.
- Een energiebeperkt dieet conform de Richtlijnen Goede Voeding (zie ook Gezonde voeding) heeft de voorkeur. Als de patiënt toch een specifiek dieet wenst, kan hij het dieet kiezen dat het beste bij hem past.
- Op basis van de literatuur kan geen voorkeur worden uitgesproken voor een specifiek dieet om energierestrictie te bereiken. Evenmin kan worden gezegd dat een specifiek dieet gemakkelijker betere glucosespiegels, een beter vetspectrum of een grotere daling van de bloeddruk geeft dan andere diëten. Daarom is er vanuit de werkgroep geen voorkeur voor een vetbeperkt, koolhydraatbeperkt, streng koolhydraatbeperkt (ketogeen), mediterraan of paleodieet. Hetzelfde geldt voor intermitterend vasten.
- Intermitterend vasten is minder geschikt voor patiënten die een sulfonylureumderivaat of insuline gebruiken vanwege de kans op hypoglykemie en evenmin voor gebruikers van een SGLT2-remmer vanwege risico op ketoacidose.
- Bij patiënten met een BMI > 25 leidt 5 tot 10% gewichtsverlies tot lagere glucosewaarden, een betere vetstofwisseling en een lagere bloeddruk.
- Bij nieuw ontdekte diabetes kan 10 tot 20% van de patiënten met energierestrictie een adequate glucoseregulering bereiken.
- Zie voor meer informatie de Voedingsrichtlijn Diabetes.
Gewichtsdaling en diabetes mellitus type 2
Gewichtsdaling is de belangrijkste maatregel om diabetes mellitus type 2 te voorkomen. Een gewichtsdaling van 5% of meer verlaagt het risico op diabetes mellitus type 2 met meer dan 50% in een populatie met obesitas. Daarnaast levert het de patiënt gezondheidswinst op, in de zin van een verbetering van het risicoprofiel voor hart- en vaatziekten (zie de NHG-Standaard Obesitas). Er is minder onderzoek gedaan naar de effecten van gewichtsverlies bij mensen met manifeste diabetes mellitus type 2. Een systematische review (zonder meta-analyse) hiernaar liet over het algemeen (maar niet consistent) gunstige effecten zien op HbA1c, bloedglucose en lipiden.
Dieetinterventie
In de UK-Prospective Diabetes Study werden 4209 patiënten na een initiële dieetinterventie gerandomiseerd naar een intensief en een conventioneel behandelde groep en meer dan 9 jaar gevolgd.
In een inloopperiode van 3 maanden werden 5102 patiënten maandelijks intensief begeleid door een diëtist. Deelnemers kregen een matig vezelrijk dieet met een laag verzadigd vetgehalte en 50% van de calorieën kwam uit koolhydraten. Mensen met overgewicht kregen het advies af te vallen door een energiebeperkt dieet. Het lichaamsgewicht daalde gemiddeld 5 kg. Daarmee behaalde 17% een glucosegehalte < 6 mmol/L. Na 9 jaar was de nuchtere bloedglucosewaarde bij 2 derde van deze mensen gestegen tot > 6 mmol/L, zodat additionele behandeling werd gestart.
Nieuw gediagnosticeerde vrouwelijke patiënten met diabetes mellitus type 2 hebben een vergelijkbaar eetgedrag met de algemene bevolking. Vrouwelijke diabetespatiënten met hoge scores voor emotioneel eetgedrag lijken nadat de diagnose is gesteld minder goed in staat te zijn om hun eetpatroon te veranderen na dieetadviezen.
Gezonde voeding
Naar Samenvatting ›- Geef een voedingsadvies gebaseerd op de Richtlijnen Goede Voeding 2025. Dit betekent vooral: minder verzadigd vet, meer onverzadigd vet en vezelrijke koolhydraten, minder zout en zo weinig mogelijk alcohol. Gebruik van (extra) omega-3-vetzuren, vitamine E, zink, vanadium, chroom of kaneel is niet nodig. Zie voor specifiekere diabetesgerelateerde adviezen de Voedingsrichtlijn Diabetes van de Nederlandse Diabetes Federatie.
- Verwijs de patiënt voor individueel advies en begeleiding naar een diëtist. Aandachtspunten: afvallen door het samenstellen van haalbare calorierestrictie en het inpassen van gezonde voeding in de individuele situatie van de patiënt. Bij patiënten die insuline gebruiken, is er speciale aandacht nodig voor afstemming van insuline, koolhydraatinname en koolhydraatverbranding (lichamelijke activiteit).
- Overweeg begeleiding door de POH-ggz of een psycholoog om het eetgedrag in gunstige zin te beïnvloeden.
Gezonde voeding
Voor actuele inzichten in gezonde voeding, zie www.voedingscentrum.nl en www.gr.nl. Samengevat: voldoende variatie, ruim en dagelijks gebruik van groente, fruit en volkoren graanproducten, regelmatig (vette) vis eten, zo weinig mogelijk verzadigde vetzuren en enkelvoudig trans-onverzadigde vetzuren, beperkt gebruik van suikerhoudende voedingsmiddelen en dranken en dranken met een hoog gehalte aan voedingszuren, beperkte inname van keukenzout en geen of beperkt alcoholgebruik. Er is geen consensus in de literatuur over de wenselijkheid van ofwel een dieet met relatief meer koolhydraten en minder vet (High Carb, Low Fat), of juist minder koolhydraten en relatief meer vet (Low Carb, High Fat).
Voedingssupplementen
- Het gebruik van verschillende voedingssupplementen is onderwerp geweest van meerdere systematische literatuuronderzoeken. Volgens een cochranereview (n = 23 onderzoeken) kunnen omega-3-meervoudig onverzadigde vetzuren bij patiënten met diabetes mellitus type 2 triglyceriden verlagen, maar hebben ze een ongunstig effect op het LDL-cholesterol. Een systematische review van zeer matige kwaliteit (geen analyse van kwaliteit en heterogeniteit) vond te weinig kwalitatief goede data voor betrouwbare conclusies.
- In de ORIGIN-trial werden 12.536 personen met IFG, IGT of diabetes gerandomiseerd naar dagelijks 1 gram omega-3-vetzuren of placebo (follow-up 6,2 jaar). Primaire uitkomstmaat was cardiovasculaire mortaliteit. De incidentie was niet significant verlaagd onder de patiënten die omega-3-vetzuren kregen vergeleken met de controlegroep: 574 patiënten (9,1%) versus 581 patiënten (9,3%); hazardratio 0,98 (95%-BI 0,87 tot 1,10; p = 0,72). Het gebruik van omega-3-vetzuren had evenmin een significant effect op macrovasculaire gebeurtenissen, sterfte door alle oorzaken of sterfte door aritmieën. De conclusie is dat omega-3-vetzuren het optreden van cardiovasculaire gebeurtenissen niet reduceren bij personen met diabetes of gestoorde glucosetolerantie.
- Een systematische review (n = 9 onderzoeken) naar het effect van vitamine E-supplementen vond geen effecten van vitamine E in ongeselecteerde patiënten met diabetes mellitus type 2. Een cochranereview naar de effecten van zinksupplementatie bij diabetes mellitus type 2 vond slechts 1 onderzoek en geen effecten van zink. Ook voor het sporenelement vanadium bestaan theorieën dat het een rol speelt in het glucosemetabolisme, maar een systematische review naar de effectiviteit van vanadium bij diabetes mellitus type 2 vond geen betrouwbare onderzoeken. Chroom is een potentieel waardevol supplement als er sprake is van chroomdeficiëntie, maar chroomdeficiëntie is in Nederland uitermate zeldzaam. In een groot systematisch literatuuronderzoek en meta-analyse vond men vergeleken met controles een effect op het HbA1c van -0,6% (-7 mmol/mol) (95%-BI -0,9--0,2 (-10--2 mmol/mol)) en een effect op nuchtere bloedglucose van -1,1 mmol/L (95%-BI -1,6--0,6) maar geen effecten op lipiden. Omdat de helft van de onderzoeken van lage kwaliteit was, er grote heterogeniteit bestond en onvoldoende zicht op de ‘chroomstatus’ van de deelnemers, moeten deze data met terughoudendheid geïnterpreteerd worden. In Nederlands onderzoek bij patiënten met diabetes mellitus type 2 werd geen verschil gevonden tussen chroomsuppletie en placebo wat betreft verlaging van het HbA1c.
- Tot slot vond een systematische review naar kaneel een gering effect op het nuchtere bloedglucose. De kwaliteit van deze systematische review was echter dermate laag dat de resultaten niet betrouwbaar zijn.
Medicamenteuze behandeling
Naar Samenvatting ›Algemeen
Naar Samenvatting ›- Start met bloedglucoseverlagende medicatie indien het niet lukt om met niet-medicamenteuze behandeling een HbA1c van ≤ 53 mmol/mol te bereiken binnen enkele maanden.
- Behandel patiënten zonder zeer hoog risico op hart- en vaatziekten (dat wil zeggen zonder eerder doorgemaakte hart- en vaatziekte of hartfalen, en zonder chronische nierschade met een matig tot sterk verhoogd risico) volgens het stappenplan in tabel h5 (zie tabel h5).
- Behandel patiënten met een zeer hoog risico op hart- en vaatziekten (zie tabel h7) volgens het stappenplan in tabel h8 (zie tabel h8) indien:
- niet kwetsbaar
- met levensverwachting van > 5 jaar (uitzondering: bij hartfalen ook indicatie SGLT2-remmer bij levensverwachting < 5 jaar, zie NHG-Standaard Hartfalen).
eGFR > 10 ml/min/1,73 m2
- Bij nuchter glucose > 10 mmol/L op moment van diagnose geldt in eerste instantie een ander beleid (zie Behandeling bij nuchter glucose ≥ 10 mmol/L op moment van diagnose).
- De streefwaarden gelden voor beide stappenplannen (zie tabel h4, figuur 1).
Streefwaarden voor bloedglucose en HbA1c
Naar Samenvatting ›- De nuchtere glucosewaarden worden gebruikt om de dosering van de voorgeschreven medicatie aan te passen. Zie tabel h4 voor streefwaarden.
- Het HbA1c geeft informatie over de instelling van de patiënt in de voorafgaande 8-12 weken. Bepaal aan de hand van het HbA1c of de beoogde glykemische instelling is behaald en of een nieuwe stap in het stappenplan is geïndiceerd.
Streefwaarden HbA1c
Naar Samenvatting ›- Patiënten < 70 jaar: HbA1c-streefwaarde ≤ 53 mmol/mol
- Patiënten ≥ 70 jaar:
- tot en met medicamenteuze behandelstap 1: HbA1c-streefwaarde ≤ 53 mmol/mol
- vanaf medicamenteuze behandelstap 2: HbA1c-streefwaarde 54-58 mmol/mol (bij ziekteduur < 10 jaar) of 54-64 mmol/mol (bij ziekteduur ≥ 10 jaar)
Redenen om af te wijken van streefwaarden
Naar Samenvatting ›- Voor kwetsbare ouderen en patiënten met een korte levensverwachting (arbitrair: < 5 jaar) zijn glucosewaarden van 6-15 mmol/L en HbA1c-waarden van 53-69 mmol/mol acceptabel. Er is bij deze patiënten geen bewijs dat een laag HbA1c zinvol is. Het behandeldoel is vooral het voorkomen van symptomatische hypo- of hyperglykemie.
- Er kunnen ook andere redenen zijn om, in overleg met de patiënt, van bovenstaande streefwaarden af te wijken:
- chronische nierschade (lagere streefwaarde)
- comorbiditeit en/of een groot risico van eventuele hypoglykemie (hogere streefwaarde)
- haalbaarheid en patiëntvoorkeur (lagere of hogere streefwaarde).
- Zie figuur 1 voor een algoritme voor het bepalen van de HbA1c-streefwaarde.
| Glucosewaarde | Veneus plasma |
| Nuchter [mmol/L] | 4,5-8 |
| 2 uur postprandiaal [mmol/L] | < 9 |
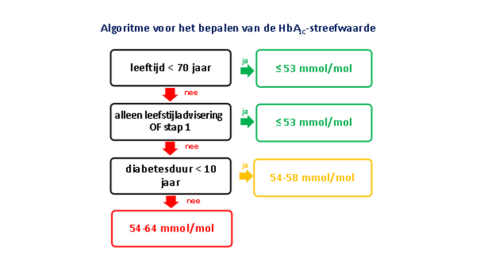
Streefwaarden HbA1c en verschillende patiëntencategorieën
Intensief behandelen van hyperglykemie leidt tot minder microvasculaire complicaties bij zowel nieuw gediagnosticeerde patiënten met diabetes mellitus type 2 als bij personen die al langer diabetes hebben. Er lijkt hierbij geen duidelijke ondergrens te bestaan voor de gewenste streefwaarde. In de UKPDS werden patiënten na diagnose behandeld met een sulfonylureumderivaat (zo nodig aangevuld met metformine en daarna insuline) of met insuline (eenmaal daags en zo nodig basaal bolusregime). Bij streven naar nuchtere glucosewaarden < 6 mmol/L (en bij insuline preprandiale waarden van 4 tot 7 mmol/L) traden 25% minder microvasculaire complicaties op na 9-11 jaar behandelingsduur.
Uit het UKPDS-postinterventieonderzoek blijkt dat patiënten die tijdens het UKPDS-onderzoek intensief behandeld zijn jaren later nog steeds een lager risico hebben op het krijgen van zowel micro- als macrovasculaire complicaties. Het positieve effect van een intensieve aanpak direct na de diagnosestelling tot 10 jaar na de diagnose, waarbij wordt gestreefd naar een HbA1c < 53 mmol/mol, blijft over een periode van (minstens) 20-25 jaar behouden.
Kwetsbare ouderen
Onder ‘kwetsbare ouderen’ wordt verstaan ouderen van hoge tot zeer hoge leeftijd die vaak chronisch ziek zijn vanwege lichamelijke, psychische, communicatieve en/of sociale beperkingen. Er is vrijwel altijd sprake van multipele pathologie. Hierdoor zijn deze patiënten tijdelijk of blijvend niet in staat tot zelfstandig functioneren. In de richtlijn Verantwoorde diabeteszorg bij kwetsbare ouderen zijn aanbevelingen opgenomen voor een eenduidige, onderbouwde zorg voor deze patiënten, die zowel thuis als in verzorgings- en verpleeghuizen kunnen wonen.
Streefwaarden HbA1c
- In het Action in diabetes and vascular disease (ADVANCE)-onderzoek werd een intensieve glucoseregulatie met een HbA1c-streefwaarde van 6,5% (48 mmol/mol) vergeleken met een minder intensieve behandeling bij patiënten met diabetes mellitus type 2 met een verhoogd cardiovasculair risico (reeds doorgemaakte hart- en vaatziekte of minimaal 1 andere risicofactor) (n = 11.140). Patiënten > 55 jaar (58±9) met een diabetesduur van 8±6 jaar en een HbA1c van 7,5±1,6% (59±6 mmol/mol) werden gemiddeld 5 jaar op deze manier behandeld. De intensief behandelde groep bereikte een gemiddelde HbA1c-waarde van 6,5% (48 mmol/mol), de controlegroep een HbA1c van 7,3% (56 mmol/mol). De intensieve behandelgroep had 24% minder microvasculaire complicaties, vooral microalbuminurie kwam minder vaak voor. Er werd geen verschil in macrovasculaire complicaties en sterfte gevonden tussen de groepen.
- In het Action to control cardiovascular risk in diabetes (ACCORD)-onderzoek (n = 10.251; gemiddelde diabetesduur 10 jaar; gemiddelde leeftijd 62,2 jaar; baseline HbA1c 8,1% (65 mmol/mol)) werd een intensieve glucoseregulatie met een HbA1c-streefwaarde van minder dan 6% (42 mmol/mol) vergeleken met een minder intensieve behandeling bij patiënten en een verhoogd cardiovasculair risico (reeds doorgemaakte hart- en vaatziekte of minimaal 2 andere risicofactoren). Het onderzoek werd na 3,5 jaar afgebroken, omdat er een hogere sterfte in de intensieve behandelgroep werd gevonden. De intensief behandelde groep bereikte een gemiddelde HbA1c-waarde van 6,4% (46 mmol/ mol), de controlegroep een HbA1c van 7,5% (56 mmol/mol). 274Retrospectieve analyse van data uit het ACCORD-onderzoek liet zien dat ernstige hypoglykemie was geassocieerd met een verhoogd sterfterisico in beide armen van het onderzoek. Echter, onder de patiënten die ≥ 1 hypoglykemische episode hadden, was het sterfterisico lager in de intensieve behandelgroep dan in de controlegroep. Ernstige hypoglykemieën leken het verschil in sterfte tussen de 2 onderzoeksarmen niet te verklaren.
- In het Veterans Affairs Diabetes Trial (VADT)-onderzoek (n = 1791) werd een intensieve glucoseregulatie vergeleken met een minder intensieve behandeling (streefwaarde HbA1c -1,5%; -18 mmol/ mol) bij voornamelijk mannen met diabetes mellitus type 2 met een gemiddelde leeftijd van 60,4 jaar en een gemiddelde diabetesduur van 11,5 jaar). 6 maanden na start van het onderzoek was het HbA1c in de intensieve groep 6,9% (52 mmol/mol) en in de controlegroep 8,4% (66 mmol/mol). Na 5,6 jaar was er geen verschil tussen de groepen wat betreft sterfte, hart- en vaatziekten en microvasculaire complicaties.
- Een groot retrospectief cohortonderzoek (n = 27.965) onderzocht de medische gegevens van bijna 48.000 Engelse patiënten met diabetes mellitus type 2 die in de eerste lijn werden behandeld met bloedglucoseverlagende medicatie. Hierbij werd gekeken naar het HbA1c en naar macrovasculaire complicaties en sterfte. Hieruit blijkt dat patiënten behandeld met een combinatie van sulfonylureumderivaten en metformine het laagste risico op sterfte hebben bij een HbA1c van 7,5% (59 mmol/mol) en in ieder geval geen verhoogd risico hebben bij een HbA1c van 6,9 tot 9,5% (52 tot 81 mmol/ mol). Bij insulinegebruik ligt het gebied met het minste sterfterisico bij een hoger HbA1c van 7,5 tot 8,0% (58 tot 64 mmol/ mol).
- Uit Nederlands observationeel onderzoek blijkt dat patiënten met gemiddelde diabetesduur 7,7 jaar in de eerste lijn een significant verhoogd sterfterisico hebben bij HbA1c > 9% (75 mmol/mol) en dat bij HbA1c-waarden < 9% (75 mmol/ mol) er weinig verschil in sterfterisico is.
Een groot Amerikaans observationeel onderzoek (n = 71.092; gemiddelde leeftijd 71 jaar) laat zien dat diabetescomplicaties en sterfte samen minder vaak voorkomen bij een HbA1c-waarde onder de 8% (64 mmol/mol). Alleen bij 80-plussers is dit pas onder de 9% (75 mmol/mol). - Er is consensus dat een HbA1c > 8,5% (69 mmol/mol) vermeden moet worden. Boven deze waarde treden er klachten op, zoals polyurie, dehydratie, vermoeidheid, verhoogd infectierisico en cognitieve achteruitgang.
Conclusie
De eerste 10 jaar na diagnose is intensieve behandeling bewezen effectief. Bij langer bestaande diabetes is dit onzeker. Naarmate de diabetesduur langer is, is door progressief bètacelfalen de diabetes moeilijker te reguleren; bij korte diabetesduur is vaak nog gemakkelijk (zonder hypoglykemie) een scherpe instelling te bereiken. Daarnaast geldt dat hoe jonger de patiënt bij het stellen van de diagnose is, hoe hoger het life-time risico op complicaties is. Hoewel goede onderzoeken bij ouderen ontbreken, lijken zij kwetsbaarder voor complicaties van een te strikte diabetesbehandeling zoals hypoglykemie, maar minder kwetsbaar voor de effecten van een hoger HbA1c.
Individueel behandelplan
De opvattingen en wensen van de individuele patiënt en zijn eigen verantwoordelijkheid zijn van belang bij de vaststelling en het bereiken van de gewenste streefwaarden en doelen voor zowel gewicht, leefgewoonten, HbA1c, bloeddruk als lipiden. Het staat vast dat Nederlandse diabetespatiënten onderling aanzienlijk verschillen in hun wensen over het nemen van verantwoordelijkheid bij de bepaling van de individuele streefwaarden. In het behandelplan worden op basis van het individuele risicoprofiel de streefwaarden vertaald in individuele zorgdoelen. Dit kan worden vastgelegd in een individueel behandelplan, zie NHG-dossier Individueel zorgplan.
Aanvullende toelichting streefwaarden
Naar Samenvatting ›- Een kortdurende hoge glucosewaarde met een snelle correctie heeft minder impact op het HbA1c dan een chronisch verhoogde bloedglucosewaarde met minder hoge pieken. Een hoge nuchtere glucosewaarde bij een goed HbA1c kan worden beschouwd als een momentane uitschieter of als beginnende ontregeling, maar sommige patiënten hebben consistent een relatief hoge nuchtere glucosewaarde, terwijl de HbA1c-waarde goed is.
- Bij patiënten die geen insuline gebruiken, bestaat er doorgaans een redelijke correlatie tussen het HbA1c en de nuchtere glucosewaarde, maar hoeft een hoge nuchtere glucosewaarde niet altijd direct tot intensivering van de behandeling te leiden.
- Bepaal het HbA1c wanneer deze waarde bij de volgende nuchtere glucosemeting opnieuw te hoog is.
- Bij een HbA1c beneden de streefwaarde is intensivering van de behandeling niet nodig en is in het vervolg het HbA1c leidend voor aanpassing van de medicatie.
- Een goede nuchtere glucosewaarde bij een hoog HbA1c duidt erop dat de patiënt mogelijk minder goed is gereguleerd dan de nuchtere waarde suggereert.
Praktische uitgangspunten medicamenteuze behandeling
Naar Samenvatting ›- Start de bloedglucoseverlagende middelen in de startdosering (zie tabel h10).
- Verhoog de dosering elke 2-4 weken aan de hand van de nuchtere glucosewaarden.
- Voor behandeladviezen bij hoge nuchtere glucosewaarden op moment van diagnose, zie Behandeling bij nuchter glucose ≥ 10 mmol/L op moment van diagnose.
- Voor beleid bij (tussentijdse) klachten als gevolg van hyperglykemie (doorgaans glucosewaarde > 15 mmol/L), zie Beleid bij hyperglykemie.
- Besteed bij elk consult, en ook voorafgaand aan de overgang naar een volgende stap, aandacht aan het belang van een gezonde leefstijl en juist gebruik van de medicatie. Bespreek ook eventuele belemmeringen om de geïndiceerde interventies voor een gezonde leefstijl toe te passen.
- Ga over naar de volgende stap als het HbA1c boven de streefwaarde ligt (zie Streefwaarden voor bloedglucose en HbA1c) en ophoging van de dosis door bijwerkingen, of door het bereiken van de maximale dagdosis, niet meer mogelijk is.
- Ga ook over naar de volgende stap indien behandeling met een van de middelen uit het stappenplan op bezwaren (bijwerkingen, contra-indicaties, interacties) stuit.
- Voor adviezen over de begeleiding van patiënten met diabetes type 2 rondom de ramadan, zie Diabetes mellitus type 2 en ramadan.
Medicamenteus stappenplan voor patiënten zonder zeer hoog risico op hart- en vaatziekten
Naar Samenvatting ›Algemeen
Naar Samenvatting ›- Zie tabel h5 voor het medicamenteus stappenplan voor patiënten zonder zeer hoog risico.
- Zie ook Aandachtspunten bij bloedglucoseverlagende middelen.
- Voor belangrijkste kenmerken van bloedglucoseverlagende middelen, zie tabel h6.
- Voor voorbeelden van middelen en doseringen, zie tabel h10.
| Stap 1 | Metformine |
| Stap 2 | Voeg gliclazide toe† |
| Stap 3 | Maak een keuze afhankelijk van de benodigde HbA1c-daling, patiëntkenmerken en patiëntvoorkeuren (zie ook tabel h6):
|
| Stap 4 | Voeg een ander middel uit stap 3 toe. Bij (middel)langwerkende insuline in stap 3 (of stap 4): intensiveer insulinetherapie of voeg een GLP1-agonist toe. |
* Patiënten zonder eerder doorgemaakte hart- en vaatziekte of hartfalen en zonder chronische nierschade met een matig tot sterk verhoogd risico op hart- en vaatziekten † Bij patiënten met een clustering van cardiovasculaire risicofactoren of bij patiënten met obesitas kan worden overwogen om in plaats van gliclazide een middel te kiezen dat leidt tot reductie van het cardiovasculaire risico en/of het gewicht. Zie stap 2 in de hoofdtekst. | |
Stap 1 Metformine
Naar Samenvatting ›Stap 2 Gliclazide toevoegen, eventueel een GLP1-agonist of SGLT2-remmer toevoegen
Naar Samenvatting ›- Voeg gliclazide toe.
- Bij patiënten bij patiënten met obesitas of met een clustering van cardiovasculaire risicofactoren kan worden overwogen hiervan af te wijken en een middel te kiezen dat leidt tot reductie van het gewicht en/of het cardiovasculaire risico.
- Overweeg om bij een BMI ≥ 30 een GLP1-agonist toe te voegen in plaats van gliclazide.
- Een GLP1-agonist geeft mogelijk gewichtsverlies, in tegenstelling tot gliclazide dat meestal gewichtstoename geeft. Semaglutide s.c. geeft gemiddeld het meeste gewichtsverlies (zie ook tabel h6).
- Staak (vanwege aanzienlijke kosten en potentiële bijwerkingen) de GLP1-agonist en stap over op gliclazide indien het gewichtsverlies na 3 maanden maximale dosering < 5% is.
- Overweeg om in plaats van gliclazide een SGLT2-remmer toe te voegen bij niet-kwetsbare patiënten zonder zeer hoog risico met ≥ 4 cardiovasculaire risicofactoren.
- SGLT2-remmers verlagen het risico op hart- en vaatziekten. Bij zeerhoogrisicopatiënten is dat effect aanzienlijk en klinisch relevant. Om deze reden zijn SGLT2-remmers de middelen van eerste keus bij patiënten met een zeer hoog risico. In de groep patiënten zonder zeer hoog risico met ≥ 4 van onderstaande cardiovasculaire risicofactoren is het effect geringer, maar niet verwaarloosbaar.
- Cardiovasculaire risicofactoren:
- roken
- therapieresistente hypertensie (spreekkamerbloeddruk ≥ 140 mmHg ondanks gebruik van 3 antihypertensiva en voldoende therapietrouw)
- LDL-cholesterol > 0,5 mmol/L boven de individuele streefwaarde ondanks medicatie
- leeftijd ≥ 60 jaar
- chronische nierschade met mild verhoogd risico (eGFR ≥ 60 ml/min/1,73 m2 met ACR 3-30 mg/mmol of eGFR 45-59 ml/min/1,73 m2 met ACR < 3 mg/mmol).
- Bespreek de mogelijke voor- en nadelen van het starten van gliclazide, GLP1-agonist of SGLT2-remmer met de patiënt en maak samen een keuze. Neem in de overweging bij de keuze het belang mee van het strikt behalen van de HbA1c-streefwaarde in relatie tot factoren zoals leeftijd, comorbiditeit, complicaties, haalbaarheid, patiëntvoorkeuren en kosten. Gebruik hiervoor de keuzekaart Medicijnen bij diabetes type 2.
- Zie Aandachtspunten bij bloedglucoseverlagende middelen: SU-derivaten (gliclazide), GLP1-agonisten, SGLT2-remmers.
Stap 3 Gliclazide, DDP4-remmer, SGLT2-remmer, GLP1-agonist of (middel)langwerkende insuline toevoegen
Naar Samenvatting ›- Weeg vanaf deze stap het belang van het strikt behalen van de HbA1c-streefwaarde af in relatie tot factoren zoals leeftijd, comorbiditeit, complicaties, haalbaarheid en patiëntvoorkeuren.\
- Maak een keuze op basis van de gewenste mate van HbA1c-daling, patiëntkenmerken, patiëntvoorkeuren en kosten (zie figuur 1, tabel h5 en tabel h6).
- Switch tussen middelen indien 3 maanden na start maximaal verdraagbare dosering van het middel er sprake is van een HbA1c-daling < 5 mmol/mol.
- Zie Aandachtspunten bij bloedglucoseverlagende middelen: SU-derivaten (gliclazide), GLP1-agonisten, SGLT2-remmers, DPP4-remmers, (Middel)langwerkende insuline.
Stap 4 Toevoeging ander middel uit stap 3 of intensivering insulinetherapie
Naar Samenvatting ›- Voeg een ander middel uit stap 3 toe (zie ook tabel h5).
- Maak een keuze op basis van de gewenste mate van HbA1c-daling (zie figuur 1 en tabel h6). Neem ook patiëntkenmerken, patiëntvoorkeuren en kosten in overweging (zie tabel h6).
- Bij gering effect 3 maanden na start maximaal verdraagbare dosering:
- switch tussen middelen bij HbA1c-daling < 5 mmol/mol
- combineer meerdere middelen bij HbA1c-daling ≥ 5 mmol/mol zonder behalen van de streefwaarde (zie tabel h5).
- Intensiveer de insulinebehandeling (2 dd. mixinsuline of basaal bolusregime) indien met (middel)langwerkende insuline de HbA1c-streefwaarde niet gehaald wordt.
- Zie Aandachtspunten bij bloedglucoseverlagende middelen: Intensiveren insulinebehandeling (facultatief).
| Middel | Effect op HbA1c | Ernstige bijwerkingen | Bijwerkingen | Effect op gewicht | Toedieningsweg/gebruiksgemak | Kosten per maand* | Contra-indicaties |
|---|---|---|---|---|---|---|---|
| Metformine | 13 mmol/mol ↓ | Zeer zelden: lactaatacidose | Gastro-intestinale bijwerkingen, hoofdpijn, vermoeidheid, smaakstoornis | ca. 1 kg ↓ | Oraal, dagelijks Dosering ophogen mogelijk | € 2 |
|
| Gliclazide | 11-22 mmol/mol ↓ | Hypoglykemie | Zelden: gastro-intestinale bijwerkingen, huiduitslag, leverfunctiestoornis, pancytopenie | ca. 2 kg ↑ | Oraal, dagelijks Dosering ophogen mogelijk | € 3 |
|
| GLP1-agonist | 11-20 mmol/mol ↓ | Verhoogd risico op cholecystitis, pancreatitis |
| 1,5-4,5 kg ↓† | Subcutaan, 1x/week of dagelijks afhankelijk van gekozen middel | € 95 |
|
| SGLT2-remmer | 7-9 mmol/mol ↓ |
|
| ca. 2 kg ↓ | Oraal, dagelijks | € 43 |
|
| DPP4-remmer | 7-9 mmol/mol ↓ |
| Zelden: gastro-intestinale bijwerkingen | ≤ 0,5 kg ↑ | Oraal, dagelijks | € 23 |
|
| Insuline | > 18 mmol/mol ↓§ | Vaak: hypoglykemie. (middel)langwerkend geeft een lager risico op hypoglykemie dan een intensief insulineschema (mixinsuline of basaal bolusregime). |
| 2-3 kg ↑ |
| € 16-25# | |
| * Kosten bij benadering op basis van middel met laagste kosten in gemiddelde dosering (voor insuline 30 E per dag), exclusief afleverkosten apotheek. † Gemiddeld gewichtsverlies verschilt per GLP1-agonist: semaglutide s.c. 4,5 kg , liraglutide s.c.2 kg, dulaglutide s.c. 1,5 kg. ‡ Indien tijdens gebruik van de SGLT2-remmer de eGFR daalt tot < 15 ml/min/1,73 m2 wordt geadviseerd om het middel te continueren en pas te staken bij de start van nierdialyse § Bij ongeveer driekwart van de patiënten lukt het om een goede glykemische regulatie te bereiken met (middel)langwerkende insuline 1 dd. # NPH-insuline € 16, insuline glargine 100 E/ml € 25; exclusief naaldjes en glucosestrips. | |||||||
- Metformine blijft de eerste stap van het medicamenteus stappenplan. Er is veel ervaring opgedaan met metformine, het is relatief veilig en de kosten zijn laag.
- In stap 2 is gliclazide in veel gevallen een goede keus. Met gliclazide is veel ervaring opgedaan, het is relatief veilig en de kosten zijn laag. Gliclazide heeft binnen de SU-derivaten de voorkeur vanwege het lagere risico op ernstige hypoglykemieën in vergelijking met de andere SU-derivaten.
Overweeg om bij BMI ≥ 30 in stap 2 een GLP1-agonist toe te voegen in plaats van gliclazide, omdat een GLP1-agonist naast verlaging van het bloedglucose ook een grote kans geeft op gewichtsreductie. De voorkeur gaat hier uit naar semaglutide s.c. omdat dit het grootste te verwachten effect heeft op het gewicht.
Overweeg om bij aanwezigheid van ≥ 4 cardiovasculaire risicofactoren in stap 2 een SGLT2-remmer toe te voegen in plaats van gliclazide met als doel verlaging van het risico op hart- en vaatziekten.. Vanwege gebruiksgemak en kosten wordt de voorkeur gegeven voor een SGLT2-remmer boven een GLP1-agonist( behalve bij een contra-indicatie voor SGLT2-remmers). - Kies in stap 3 voor toevoegen van gliclazide, een DPP4-remmer, SGLT2-remmer, GLP1-agonist of (middel)langwerkende insuline op basis van de benodigde HbA1c-daling, wensen ten aanzien van gebruiksgemak, bijwerkingen, problemen door hypoglykemieën (bijvoorbeeld beroepsmatige verkeersdeelnemers), invloed op lichaamsgewicht, zekerheid over langetermijnveiligheid en kosten. Zie tabel h6 voor informatie over deze kenmerken.
- In stap 4 hangt de keuze samen met de keuze die gemaakt is in stap 3. Kies voor toevoeging van (middel)langwerkende insuline, een DPP4-remmer, SGLT2-remmer of GLP1-agonist indien niet eerder gebruikt, of kies voor intensiveren van het insulineschema.
- Een GIP/GLP1-agonist wordt vooralsnog afgeraden omdat hier nog nauwelijks ervaring mee opgedaan is, er nog te veel onzekerheid is over de veiligheid en de kosten zeer hoog zijn.
Gewenste en ongewenste effecten
Bij de behandeling van patiënten zonder zeer hoog risico blijken de volgende gewenste en ongewenste effecten voor te komen in vergelijking met gebruikelijke zorg.
- Metformine lijkt sterfte te verminderen; insuline verhoogt mogelijk de sterfte. De overige bloedglucoseverlagende middelen hebben niet of nauwelijks effect op harde eindpunten (sterfte (alle oorzaken), niet-fataal myocardinfarct, niet-fataal CVA, eindstadium nierfalen en ziekenhuisopname door hartfalen).
- SU-derivaten, SGLT2-remmers en GIP/GLP1-agonisten hebben gemiddeld een gunstigere invloed op gezondheidsgerelateerde kwaliteit van leven.
- De verschillende middelen hebben verschillend effect op HbA1c. Gemiddeld geven GLP1-agonisten, GIP/GLP1-agonisten en insuline meer HbA1c-daling dan metformine, SU-derivaten, SGLT2-remmers en DPP4-remmers.
- De kans op lactaatacidose is bij metformine hoger dan bij andere middelen.
- De kans op ketoacidose is bij SGLT2-remmers hoger dan bij andere middelen.
- Insuline en SU-derivaten gaan gepaard met een hoger risico op hypoglykemieën. Voor SU-derivaten geldt dat dit risico waarschijnlijk beperkter is bij gliclazide.
- SGLT2-remmers en GLP1-agonisten verminderen waarschijnlijk de kans op ernstige hypoglykemie.
- GLP1-agonisten en GIP/GLP1-agonisten geven vaker ernstige gastro-intestinale bijwerkingen dan andere middelen.
- SGLT2-remmers gaan vaker dan andere middelen gepaard met genitale schimmelinfecties.
- GLP1-agonisten hebben mogelijk een gunstig effect op gewicht. GIP/GLP1-agonisten hebben een gunstig effect op gewicht. Insuline lijkt het gewicht te verhogen.
- Bij GLP1-agonisten, GIP/GLP1-agonisten, SGLT2-remmers en DPP4-remmers is er meer onzekerheid over zeldzame ernstige bijwerkingen dan bij de andere middelen.
Kwaliteit van bewijs
Bij zowel de zeer laag als laag risico patiënten is bij de meeste uitkomsten afgewaardeerd voor sponsoring.
Patiënten met een zeer laag risico
Bij patiënten met diabetes mellitus type 2 en een zeer laag risico op hart- en vaatziekten is het vertrouwen in cruciale uitkomsten als volgt:
- laag of redelijk voor metformine; er is afgewaardeerd voor een risico op vertekening van de uitkomsten door beperkingen in de onderzoeksopzet (bias) in de onderliggende RCT’s en/of onnauwkeurigheid in de effectschatting
- redelijk voor SU-derivaten; er is afgewaardeerd voor een risico op vertekening van de uitkomsten door beperkingen in de onderzoeksopzet (bias) in de onderliggende RCT’s
- redelijk voor SGLT2-remmers
- redelijk voor GLP1-agonisten; alleen bij eindstadium nierfalen werd extra afgewaardeerd voor publicatiebias, voor de eindpunten myocardinfarct en CVA waren er geen resultaten
- redelijk voor DPP4-remmers; er werd bij de meeste uitkomsten afgewaardeerd voor een risico op vertekening van de uitkomsten door beperkingen in de onderzoeksopzet (bias) in de onderliggende RCT’s
- zeer laag voor alle vormen van insulinetherapie; de brede betrouwbaarheidsintervallen resulteren in onnauwkeurigheid omdat de grenzen van klinisch relevant voor- en nadeel worden overschreden
Patiënten met een laag risico
Bij patiënten met diabetes mellitus type 2 en een laag risico op hart- en vaatziekten is het vertrouwen in cruciale uitkomsten als volgt.
- redelijk tot zeer laag voor metformine; er is afgewaardeerd voor een risico op vertekening van de uitkomsten door beperkingen in de onderzoeksopzet (bias) in de onderliggende RCT’s en voor onnauwkeurigheid in de effectschatting
- redelijk tot laag voor SU-derivaten; er is afgewaardeerd voor onnauwkeurigheid en een risico op vertekening van de uitkomsten door beperkingen in de onderzoeksopzet (bias) in de onderliggende RCT’s
- redelijk voor SGLT2-remmers; voor sterfte door alle oorzaken werd eenmaal afgewaardeerd voor onnauwkeurigheid
- redelijk tot hoog voor GLP1-agonisten; bij eindstadium nierfalen werd afgewaardeerd voor publicatiebias, bij enkele andere uitkomsten werd afgewaardeerd voor onnauwkeurigheid
- zeer laag en laag voor GIP/GLP1-agonisten; er werd afgewaardeerd voor onnauwkeurigheid
- redelijk voor DPP4-remmers; er werd afgewaardeerd voor risico op bias door beperkingen in de onderzoeksopzet van de onderliggende RCT’s
- zeer laag voor alle vormen van insulinetherapie; de brede betrouwbaarheidsintervallen resulteren in onnauwkeurigheid waardoor onduidelijk is of er sprake is van geen effect, een positief effect of een negatief effect.
Waarden en voorkeuren van patiënten
Patiënten zullen de voorkeur geven aan een middel dat eenvoudig is in gebruik, goede effecten laat zien op harde eindpunten en weinig (ernstige) bijwerkingen geeft.
Kosten
Er zijn grote prijsverschillen tussen de verschillende onderzochte bloedglucoseverlagende middelen. Maandelijkse kosten van een gemiddelde onderhoudsdosering (www.medicijnkosten.nl, geraadpleegd 30 oktober 2023):
- metformine € 2
- gliclazide € 3
- NPH-insuline € 16 (exclusief kosten voor naaldjes en apparatuur voor zelfcontrole)
- DPP4-remmer € 23
- insuline glargine 100 E/ml € 25 (exclusief kosten voor naaldjes en apparatuur voor zelfcontrole)
- SGLT2-remmer € 43
- GLP1-agonist € 95
- GIP/GLP1-agonist € 408
Aanvaardbaarheid
De aanvaardbaarheid van bloedglucoseverlagende middelen hangt, naast de bevindingen ten aanzien van de cruciale en belangrijke uitkomstmaten, ook samen met aanvullende geneesmiddelinformatie, zoals veelvoorkomende bijwerkingen en gebruiksgemak.
- Metformine en GLP1-agonisten geven vaak gastro-intestinale bijwerkingen, vooral in het begin. Door langzaam opbouwen van de dosering kan deze bijwerking vaak beperkt worden.
- Bij insuline, en in mindere mate bij GLP1-agonisten, moet de patiënt zichzelf injecties toedienen. Dit kan een bezwaar zijn. Hypoglykemieën die vooral voorkomen bij insulinetherapie, kunnen de aanvaardbaarheid beperken. Denk bijvoorbeeld aan patiënten die beroepsmatig deelnemen aan het verkeer of bij patiënten die alleen wonen.
- Het voorschrijven van GIP/GLP1-agonisten in de eerste lijn is vooralsnog niet aanvaardbaar omdat hiermee nog nauwelijks ervaring is opgedaan en de kosten zeer hoog zijn.
Haalbaarheid
Voor patiënten zonder zeer hoog risico op hart- en vaatziekten geniet 1 medicamenteus stappenplan (in plaats van 2) de voorkeur. In dit stappenplan kan wel rekening gehouden worden met specifieke patiëntkenmerken.
Overige overwegingen
Cruciale uitkomsten
De werkgroep heeft uitvoerig stilgestaan bij de vraag of er in de groep patiënten zonder zeer hoog risico op hart- en vaatziekten een subgroep zou kunnen worden aangewezen die op harde eindpunten genoeg baat zou kunnen hebben bij een SGLT2-remmer of GLP1-agonist om een van deze middelen in een vroegere fase van het stappenplan in te zetten. Deze patiënten moeten vanwege hun hogere risico vooral gezocht worden binnen de groep die in Shi 2023 is aangewezen als laagrisicogroep, dat wil zeggen patiënten zonder zeer hoog risico, maar met ≥ 4 risicofactoren op hart- en vaatziekten. De groep met een zeer laag risico (patiënten met ≤ 3 risicofactoren) komt vooralsnog sowieso niet voor deze medicatie in aanmerking.
Uit tabel d4 valt af te lezen dat de groep met > 3 risicofactoren bij gebruikelijke zorg een kans van 226 per 1000 heeft om in 5 jaar een van de events van het samengestelde eindpunt te krijgen, dat is 22,6%. Een SGLT2-remmer reduceert deze kans met 2,8% tot 19,9%, een GLP1-agonist reduceert deze kans met 2,6% tot 20,0%. Dit correspondeert met NNT's van respectievelijk 36 en 38 in 5 jaar. Dat is net boven de vooraf vastgestelde grens voor klinische relevantie (NNT 30 in 5 jaar).
Om bij een NNT van 30 te komen moet men binnen de groep met > 3 risicofactoren een subgroep selecteren die een hoger risico op hart- en vaatziekten heeft dan gemiddeld in deze groep. De werkgroep heeft verschillende opties geëxploreerd. Een daarvan was het gebruik van SCORE2-Diabetes, de recent gepubliceerde risicoscore voor het 10-jaarsrisico op hart- en vaatziekten bij patiënten met diabetes mellitus type 2 in Europa.
Volgens SCORE2-Diabetes heeft alleen een zeer beperkte groep ouderen zonder hart- en vaatziekten in de voorgeschiedenis een voldoende hoge clustering van risicofactoren om een NNT van 30 in 5 jaar te halen. Bovendien vereist SCORE2-Diabetes het invoeren van een uitgebreide set variabelen. Vanwege de geringe opbrengst en de bewerkelijkheid van het bepalen van de score is van deze optie afgezien.
De werkgroep heeft de overtuiging dat een deel van de patiënten met ≥ 4 risicofactoren wel degelijk een zodanig voordeel kan hebben van het beschermende effect op harde eindpunten van een SGLT2-remmer (bij contra-indicatie een GLP1-agonist) dat gebruik van deze middelen reeds in stap 2 van de behandeling kan worden overwogen. Deze subgroep is gevonden door de inclusiecriteria van Shi 2023 aan te scherpen. Die aanscherping is vooral bereikt door een deel van de in deze analyse gebruikte risicofactoren niet in aanmerking te laten komen, zodat men minder gemakkelijk aan een totaal van ≥ 4 komt. Dit betreft de criteria ‘hart- of vaatziekten en/of nierschade in de familie’ (in de CVRM-richtlijn geen onafhankelijke risicofactor meer), ‘HbA1c > 48 mmol/mol’ (lager dan onze streefwaarde), ‘mannelijk geslacht’ (waarmee de halve bevolking al 1 risicofactor zou hebben) en ‘etnische achtergrond Asian, African, Hispanic’ (niet goed toepasbaar op de Nederlandse bevolking). Daarnaast zijn enkele van overblijvende criteria aangescherpt door te benoemen dat het LDL-cholesterol ≥ 0,5 mmol/L boven de streefwaarde moet liggen en door ‘verhoogde bloeddruk’ (≥ 140 mmHg) te wijzigen in ‘therapieresistente hypertensie’.
Het advies van de werkgroep is om het gebruik van een SGLT2-remmer (of bij contra-indicatie een GLP1-agonist) te overwegen als stap 2 bij de bloedglucoseverlagende behandeling bij mensen met ≥ 4 van de volgende risicofactoren:
- roken
- therapieresistente hypertensie
- LDL-cholesterol > 0,5 mmol/l boven de streefwaarde ondanks medicatie
- leeftijd ≥ 60 jaar
- chronische nierschade met een mild verhoogd risico (eGFR ≥ 60 ml/min/1,73 m2 met ACR 3-30 mg/mmol of eGFR 45-59 ml/min/1,73 m2 met ACR < 3 mg/mmol).
Het gebruik van een SGLT2-remmer hoeft op deze wijze alleen te worden overwogen bij een beperkte groep met een clustering van (slecht gereguleerde) risicofactoren. De werkgroep acht het voldoende aannemelijk dat het risico op hart- en vaatziekten in deze subgroep groter zal zijn dan in de laagrisicogroep van Shi 2023, zodat ook de baten van behandeling voor deze subgroep groter zullen zijn dan de door de reviewers berekende vijfjaars NNT’s van 36 en 38.
Belangrijke uitkomsten
Naast de effecten op harde eindpunten (cruciale uitkomsten) worden ook de effecten op belangrijke uitkomsten meegewogen in het medicamenteus stappenplan. Bij 2 belangrijke uitkomstmaten is er een verschil in effect tussen de verschillende bloedglucoseverlagende middelen: gewicht en verandering in HbA1c.
- Uit tabel d5 blijkt dat de GLP1-agonist semaglutide s.c. en GIP/GLP1-agonisten een klinisch relevante gewichtsreductie geven. De werkgroep adviseert daarom om bij patiënten met BMI ≥ 30 eerder in het stappenplan een GLP1-agonist te starten, bij voorkeur semaglutide s.c. omdat dit het grootste te verwachten effect heeft op het gewicht. Een GIP/GLP1-agonist wordt vooralsnog afgeraden omdat hier nog nauwelijks ervaring mee opgedaan is en er nog te veel onzekerheid is over de veiligheid en de kosten zeer hoog zijn.
- Voor een overzicht van de maximaal te bereiken HbA1c-daling per middel, zie tabel h6. De HbA1c-daling die nodig is om de HbA1c-streefwaarde te behalen kan mede de keuze bepalen voor een bloedglucoseverlagend middel.
Uitgangsvraag
Wat is het optimale medicamenteuze stappenplan voor volwassen personen met diabetes mellitus type 2 zonder zeer hoog risico op hart- en vaatziekten.
Vanuit deze uitgangsvraag kunnen 7 PICO’s worden beschreven. Deze PICO’s zijn in 1 PICO tabel samengevat.
| Patiënten | Volwassen patiënten (≥ 18 jaar) met diabetes mellitus type 2 zonder zeer hoog risico op hart- en vaatziekte* |
| Interventie | Alle genoemde behandelingen omvatten de standaardbehandeling (monotherapie of toegevoegd aan metformine en/of een andere combinatie van glucoseverlagende medicatie):
|
| Vergelijking | Placebo + gebruikelijke zorg (ongeacht achtergrondtherapie) |
| Uitkomstmaten† | Cruciaal:
Belangrijk:
|
| * Patiënten met diabetes mellitus type 2 zonder doorgemaakte hart- en vaatziekten, zonder chronische nierschade met een matig tot sterk verhoogd cardiovasculair risico en zonder hartfalen met linkerventrikelejectiefractie < 40%. † De grens voor een klinisch relevant verschil voor effecten en ernstig bijwerkingen is 1 per 1000 per 5 jaar, dat betekent een verschil NNT van 1000 over 5 jaar. De grens voor een klinisch relevant verschil voor effecten en milde bijwerkingen is 10 per 1000 per 5 jaar, dat betekent een verschil NNT van 100 over 5 jaar. ‡ Gewicht: de volgende 2 situaties worden onderscheiden (zie MDR Diabetes mellitus type 2 in de tweede lijn): (1) bij beide behandelgroepen is sprake van gewichtstoename (klinisch relevant verschil ≥ 5% = 4-5 kg bij gemiddeld lichaamsgewicht 80-100 kg); (2) in 1 behandelgroep is sprake van gewichtstoename en bij de andere groep blijft het gewicht stabiel of neemt het af (klinisch relevant verschil ≥ 2,5% = 2-2,5 kg bij gemiddeld lichaamsgewicht 80-100 kg). § Weergegeven als SMD met standaard klinisch relevant verschil ≥ 0,2. | |
Achtergrond
Het primaire doel van de behandeling van diabetes mellitus type 2 is het voorkomen van micro- en macrovasculaire complicaties, met als resultaat een verbeterde kwaliteit van leven, en indien mogelijk, langer leven. Uit een recente netwerkmeta-analyse blijkt dat glucoseverlaging met SGLT2-remmers en GLP1-agonisten effectief is in het voorkomen van macrovasculaire complicaties bij mensen met diabetes mellitus type 2 en een zeer hoog risico op hart- en vaatziekten (volgens de NHG Standaard CVRM 2019, geraadpleegd augustus 2024). Beide middelen zijn inmiddels opgenomen in een stappenplan om deze zeerhoogrisicopatiënten te behandelen (zie tabel h10). De vraag is of deze en andere bloedglucose verlagende middelen dit effect ook kunnen hebben op patiënten met diabetes mellitus type 2 zonder zeer hoog risico op hart- en vaatziekten (hierna kortweg: diabetespatiënten zonder zeer hoog risico). Als dit het geval is, zou dit aanleiding kunnen zijn voor aanpassing van het stappenplan voor diabetespatiënten zonder zeer hoog risico.
Methode
- De review die gebruikt is voor de zeerhoogrisicogroep is inmiddels geüpdatet door Shi et al. Deze gebruiken wij voor het beantwoorden van de uitgangsvraag. Voor het beoordelen van de effecten hanteren we een vooraf bepaald klinisch relevant gebied.
- Shi 2023 beoordeelt het effect op basis van statische significantie. Onze inschattingen van de kwaliteit van bewijs (GRADE) en van het effect zullen hierdoor niet altijd hetzelfde zijn als die van de reviewers.
Shi 2023 deelt de patiënten zonder zeer hoog risico in in 2 groepen: patiënten met een zeer laag risico en patiënten met een laag risico op hart- en vaatziekten. Om deze reden zullen wij de resultaten hieronder ook in deze 2 aparte groepen presenteren. Patiënten met 0-3 risicofactoren gelden als zeerlaagrisicopatiënten, patiënten met ≥ 4 risicofactoren als laagrisicopatiënten. Bij deze indeling zijn de volgende risicofactoren meegenomen (zie ook Li 2021) :- leeftijd > 60 jaar
- man
- familiegeschiedenis van cardiovasculaire ziekte of nierschade
- onbehandeld HbA1c (≥ 48 mmol/mol)
- huidig roken
- ongecontroleerde hypertensie (> 140/90 mm Hg)
- dyslipidemieën, waaronder verhoogd totaal cholesterol (≥ 5,2 mmol/L) en verlaagd HDL-cholesterol
- Een aantal door ons vastgestelde belangrijke uitkomsten worden niet gerapporteerd in de review. Waar mogelijk kijken we naar het effect op deze uitkomsten op basis van andere niet-systematisch gezochte literatuur.
Resultaten
Onderzoekskarakteristieken
- Shi 2023. In deze netwerkmeta-analyse werden 816 RCT’s geïncludeerd met 471.038 patiënten met diabetes mellitus type 2. In de analyse werden 13 verschillende typen medicatie vergeleken een standaardbehandeling en met elkaar. De follow-upduur was gemiddeld 6 maanden (IQR 5,5-12 maanden). De populatie bestond voor 56,6% uit mannen met gemiddelde leeftijd 57,7 jaar (range 47,6-68), BMI 29,5 (IQR 29,3-29,8) en HbA1c-8,1% (IQR 8,1-8,2). De ziekteduur van de diabetes was gemiddeld 7,4 jaar (IQR 5,2-10,1) en 58,9% (IQR 40,9-74,9) had een cardiovasculaire aandoening. Voor verdere details over patiënt- en onderzoekskenmerken, resultaten, en risico op bias van de individuele onderzoeken verwijzen we naar de publicatie van Shi.
Harde eindpunten
Voor een overzicht van de relatieve en absolute effectschattingen per middel voor patiënten zonder zeer hoog risico in vergelijking met gebruikelijke zorg, zie tabellen voor de uitkomsten op harde eindpunten bij patiënten met een zeer laag risico en laag risico. In bijlage 11 van de totstandkoming wordt de effecten op de verschillende uitkomsten nogmaals weergegeven met de bijbehorende betrouwbaarheidsintervallen.
Samengestelde uitkomsten
Samengestelde uitkomsten werden niet gerapporteerd door Shi et al. Om te kunnen differentiëren tussen de verschillende middelen en om keuzes in het stappenplan te kunnen maken hebben we de harde eindpunten bij elkaar opgeteld tot een samengestelde uitkomst (zie laatste kolom tabel d3 en tabel d4).
De harde eindpunten met een GRADE waardering zeer laag hebben we hierbij niet meegeteld. Voor de samengestelde uitkomst is een klinisch relevant verschil NNT van 30 over 5 jaar behandeling gehanteerd om te beoordelen of deze klinisch relevant zijn. De samengestelde uitkomsten vergelijken het effect van de geneesmiddelengroep met gebruikelijke zorg.
Overige uitkomstmaten
Voor een overzicht zien van het effect van de verschillende bloedglucoseverlagende middelen op belangrijke uitkomstmaten zoals gevonden in Shi 2023, zie tabel d5.
Bewijs uit overige bronnen
Een aantal door ons vastgestelde belangrijke uitkomsten wordt niet gerapporteerd in de review van Shi 2023. Hieronder geven wij een overzicht van het effect op deze uitkomsten op basis van andere niet-systematisch gezochte literatuur.
HbA1c-daling
Er is een verschil in te bereiken HbA1c-daling tussen de verschillende middelen (KNMP Kennisbank, geraadpleegd 18 september 2023).
| Middel | Te bereiken HbA1c-daling |
|---|---|
| Metformine | 13 mmol/mol |
| SU-derivaten | 11-22 mmol/mol |
| DPP4-remmers | 7-9 mmol/mol |
| SGLT2-remmers | 7-9 mmol/mol |
| GLP1-agonisten | 11-20 mmol/mol |
| GIP/GLP1-agonisten | 18-22 mmol/mol |
| (Middel)langwerkende insuline | > 18 mmol/mol |
Microvasculaire complicaties
Een van de behandeldoelen voor patiënten met diabetes mellitus type 2 is het voorkómen van microvasculaire complicaties. Om te komen tot een medicamenteus stappenplan voor patiënten met diabetes type 2 zonder zeer hoog risico is het wenselijk om ook het risico op microvasculaire complicaties mee te nemen in de besluitvorming. Zoals hierboven aangegeven doet de NMA van Shi geen uitspraken over microvasculaire uitkomsten. Eerder onderzoek heeft aangetoond dat glucoseregulatie het risico op het ontwikkelen van microvasculaire complicaties verlaagt.
Omdat alle onderzochte middelen een bloedglucoseverlagend effect hebben, kan gesteld worden dat elk middel een beschermend effect heeft op het ontwikkelen van microvasculaire complicaties indien daarmee goede bloedglucoseregulatie bereikt is.
De GRADE Study Research Group heeft in een recente RCT gekeken naar de afzonderlijke effecten van insuline glargine, sulfonyluremderivaat (glimeperide), de GLP1-agonist liraglutide en de DDP4-remmer sitagliptine, alle in combinatie met metformine, op microvasculaire en macrovasculaire uitkomsten bij diabetes mellitus type 2 (n = 5047; Verenigde Staten, diabetesduur < 10 jaar bij inclusie; alleen metforminegebruik; 94% zonder zeer hoog risico en 6% met myocardinfarct of CVA ≥ 1 jaar voor inclusie).
Deze RCT liet na een gemiddelde follow-upduur van 5,0 jaar (range 0-7,6, IQR 4,1-6,0) geen klinisch relevante verschillen zien op microvasculaire uitkomsten tussen de 4 behandelgroepen.
De werkgroep stelt op basis van bovenstaande vast dat alle bloedglucoseverlagende middelen gelijkwaardig zijn als het gaat om het voorkómen van microvasculaire complicaties.
Ernstige gastro-intestinale bijwerkingen
- GLP1-agonisten: er zijn aanwijzingen dat galblaasaandoeningen, zoals cholelithiasis en acute cholecystitis, vaker voorkomen bij het gebruik van GLP1-agonisten (KNMP Kennisbank, geraadpleegd 14 september 2023). Het mechanisme is onduidelijk, maar hangt mogelijk samen met gewichtsverlies of directe effecten van GLP1- agonisten op de galblaasmotiliteit. Er zijn ook meldingen van het optreden van pancreatitis bij gebruik van GLP1-agonisten (KNMP Kennisbank, geraadpleegd 14 september 2023).
- DPP4-remmers: er zijn aanwijzingen dat de kans op pancreatitis bij patiënten met (risicofactoren voor) een cardiovasculaire aandoening verhoogd is. Daarnaast is het onzeker of DPP4-remmers de kans op pancreascarcinoom verhogen.
Ernstige hypoglykemie
- Sulfonylureumderivaten: tabel D3 laat zien dat het risico op ernstige hypoglykemie bij gebruik van SU-derivaten verhoogd is ten opzichte van andere middelen. Het is belangrijk om hierbij op te merken dat het hier gaat om het risico op ernstige hypoglykemieën bij alle verschillende typen SU-derivaten samen. Uit eerder onderzoek is bekend dat gliclazide in vergelijking met glimepiride en glibenclamide zou kunnen leiden tot minder hypoglykemieën. Van glibenclamide is bekend dat het juist een verhoogd risico geeft op (ernstige) hypoglykemieën in vergelijking met de overige SU-derivaten (zie detail Sulfonylureumderivaten). Op basis van bovenstaande is de werkgroep van mening dat gliclazide van alle SU-derivaten waarschijnlijk het veiligst is in gebruik en de voorkeur heeft vanwege het lagere risico op hypoglykemieën.
- Insuline: tabel D3 laat zien dat het risico op ernstige hypoglykemie bij gebruik van insuline verhoogd is ten opzichte van de andere middelen. De meeste patiënten met diabetes mellitus type 2 in de eerste lijn gebruiken eenmaal daags (middel)langwerkend insuline. De kans op hypoglykemie bij (middel)langwerkend insuline 1 dd is een stuk lager dan bij een intensieve insulinetherapie. Daarnaast zijn er nog een aantal belangrijke factoren die het risico op hypoglykemie verhogen: autonome neuropathie, een onregelmatig voedingspatroon, bij sport zonder aanpassing van de insulinedosering of het voedingspatroon (KNMP Kennisbank, geraadpleegd 14 september 2023).
Gangreen van Fournier
SGLT2-remmers zijn in verband gebracht met necrotiserende fasciitis van het perineum (gangreen van Fournier). Dit is een ernstige en mogelijk fatale infectie die zelden voorkomt, vooral bij mannen (KNMP Kennisbank, geraadpleegd 14 september 2023).
Conclusies
Conclusies bij toevoeging van een bloedglucoseverlagend middel aan gebruikelijke zorg in vergelijking met gebruikelijke zorg gedurende 5 jaar bij patiënten met diabetes mellitus type 2 zonder zeer hoog risico op hart- en vaatziekten:
Metformine
Patiënten met zeer laag risico
- Metformine leidt waarschijnlijk niet of nauwelijks tot een verschil in sterfte (alle oorzaken), (niet-fataal) myocardinfarct, ziekenhuisopname door hartfalen en een verschil in gewicht.
- Metformine lijkt niet of nauwelijks te resulteren in een verschil in (niet-fataal) CVA en gezondheidsgerelateerde kwaliteit van leven.
- We zijn onzeker of metformine kans op sterfte (cardiovasculair) verhoogt of verlaagt.
Patiënten met laag risico
- Metformine lijkt de kans op diabetische lactaatacidose te vergroten.
- We zijn onzeker of metformine de kans op genitale infecties gebeurtenissen, ernstige gastro-intestinale gebeurtenissen of ernstige hypoglykemie verhoogt of verlaagt.
Patiënten met zeer laag en laag risico
- Metformine lijkt niet of nauwelijks te resulteren in een verschil in gezondheidsgerelateerde kwaliteit van leven.
- Metformine leidt waarschijnlijk niet of nauwelijks tot een verschil in gewicht.
- Metformine lijkt de kans op diabetische lactaatacidose te vergroten.
- We zijn onzeker of metformine de kans op genitale infecties gebeurtenissen, ernstige gastro-intestinale gebeurtenissen en ernstige hypoglykemie verhoogt of verlaagt.
Sulfonylureumderivaten
Patiënten met zeer laag risico
Een SU-derivaat leidt waarschijnlijk niet of nauwelijks tot een verschil in sterfte (alle oorzaken en cardiovasculair), (niet-fataal) myocardinfarct, (niet-fataal) CVA, eindstadium nierfalen en ziekenhuisopname door hartfalen.
Patiënten met laag risico
- Een SU-derivaat leidt waarschijnlijk niet of nauwelijks tot een verschil in sterfte (alle oorzaken).
- Een SU-derivaat leidt waarschijnlijk niet of nauwelijks tot een verschil in sterfte (cardiovasculair), eindstadium nierfalen of ziekenhuisopname door hartfalen.
- Een SU-derivaat lijkt niet of nauwelijks te resulteren in een verschil in (niet-fataal) myocardinfarct en (niet-fataal) CVA.
Patiënten met zeer laag en laag risico
- Een SU-derivaat lijkt de kans op diabetische ketoacidose te verminderen en gezondheidsgerelateerde kwaliteit van leven enigszins te verbeteren.
- We zijn onzeker of een SU-derivaat de kans op ernstige gastro-intestinale gebeurtenissen verhoogt of verlaagt.
- Een SU-derivaat vergroot waarschijnlijk de kans op ernstige hypoglykemie.
- Een SU-derivaat vermindert waarschijnlijk de kans op een genitale infectie.
- Een SU-derivaat leidt niet of nauwelijks tot een verschil in gewicht.
- Er is niet gerapporteerd over de uitkomst amputatie.
DPP4-remmers
Patiënten met zeer laag en laag risico:
- Een DPP4-remmer leidt waarschijnlijk niet of nauwelijks tot een verschil in sterfte (alle oorzaken en cardiovasculair), (niet-fataal) myocardinfarct, (niet-fataal) CVA, ziekenhuisopname door hartfalen.
- Een DPP4-remmer leidt waarschijnlijk niet of nauwelijks tot een verschil in eindstadium nierfalen.
- Een DPP4-remmer leidt waarschijnlijk niet of nauwelijks tot vermindering of toename van diabetische ketoacidose.
- We zijn onzeker of DPP4-remmer de kans op ernstige gastro-intestinale gebeurtenissen verhoogt of verlaagt
- Een DPP4-remmer resulteert waarschijnlijk in een vergrote kans op een ernstige hypoglykemie.
- Een DPP4-remmer lijkt de kans op amputatie te verminderen.
- Een DPP4-remmer leidt waarschijnlijk tot vermindering van de kans op een genitale infectie.
- Een DPP4-remmer leidt waarschijnlijk niet of nauwelijks tot een vermindering van gewicht
- Een DPP4-remmer leidt waarschijnlijk niet of nauwelijks tot een verschil in gezondheidsgerelateerde kwaliteit van leven.
SGLT2-remmers
Patiënten met zeer laag risico
- Een SGLT2-remmer leidt niet of nauwelijks tot een verschil in sterfte (alle oorzaken en cardiovasculair), (niet-fataal) myocardinfarct, (niet-fataal) CVA, eindstadium nierfalen en ziekenhuisopname door hartfalen.
Patiënten met laag risico
- Een SGLT2-remmer leidt waarschijnlijk niet of nauwelijks tot een verschil in sterfte (alle oorzaken).
- Een SGLT2-remmer leidt waarschijnlijk niet of nauwelijks tot een vermindering van sterfte (cardiovasculair), (niet-fataal) myocardinfarct, (niet-fataal) CVA, eindstadium nierfalen en ziekenhuisopname door hartfalen.
Patiënten met zeer laag en laag risico
- Een SGLT2-remmer leidt waarschijnlijk tot een vergrote kans op diabetische ketoacidose en genitale infecties.
- Een SGLT2-remmer vermindert waarschijnlijk de kans op ernstige hypoglykemie
- Een SGLT2-remmer lijkt de kans op een amputatie te vergroten.
- Een SGLT2-remmer leidt waarschijnlijk niet of nauwelijks tot een verschil in gewicht.
- Een SGLT2-remmer lijkt gezondheidsgerelateerde kwaliteit van leven enigszins te verbeteren.
- Er is niet gerapporteerd over de uitkomst ernstige gastro-intestinale gebeurtenissen.
GLP1-agonisten
Patiënten met zeer laag risico
- Een GLP1-agonist leidt waarschijnlijk niet of nauwelijks tot een verschil in sterfte (alle oorzaken en cardiovasculair), (niet-fataal) myocardinfarct, (niet-fataal) CVA, ziekenhuisopname door hartfalen en gezondheidsgerelateerde kwaliteit van leven.
- Een GLP1-agonist leidt waarschijnlijk niet of nauwelijks tot een verschil in eindstadium nierfalen.
Patiënten met laag risico
- Een GLP1-receptoragonist leidt waarschijnlijk niet of nauwelijks tot een verschil in sterfte (alle oorzaken) en (niet-fataal) CVA.
- Een GLP1-receptoragonist leidt waarschijnlijk niet of nauwelijks tot een vermindering van sterfte (cardiovasculair), (niet-fataal) myocardinfarct, eindstadium nierfalen en ziekenhuisopname door hartfalen.
Patiënten met zeer laag en laag risico
- Een GLP1-agonist leidt waarschijnlijk niet of nauwelijks tot een verschil in diabetische ketoacidose.
- Een GLP1-agonist vergroot waarschijnlijk de kans op ernstige gastro-intestinale gebeurtenissen.
- Een GLP1-agonist lijkt de kans op ernstige hypoglykemie te verminderen.
- We zijn onzeker of een GLP1-agonist de kans op amputatie en genitale infectie verhoogt of verlaagt.
- Semaglutide s.c. resulteert waarschijnlijk in een vermindering van gewicht.
- Een GLP1-agonist leidt waarschijnlijk niet of nauwelijks tot een verschil in gezondheidsgerelateerde kwaliteit van leven.
GIP/GLP1-agonisten
Patiënten met zeer laag risico
- We zijn onzeker of GIP/GLP1-agonist de kans op sterfte (alle oorzaken en cardiovasculair) verhoogt of verlaagt.
- Een GIP/GLP1-agonist lijkt niet of nauwelijks te resulteren in een verschil in eindstadium nierfalen.
- Een GIP/GLP1-agonist leidt waarschijnlijk niet of nauwelijks tot een verschil in ziekenhuisopname door hartfalen.
Patiënten met laag risico
- Een GIP/GLP1-agonist lijkt niet of nauwelijks te resulteren in een verschil in sterfte (alle oorzaken en cardiovasculair)
- Een GIP/GLP1-agonist leidt waarschijnlijk niet of nauwelijks tot een verschil in eindstadium nierfalen, en ziekenhuisopname door hartfalen.
Patiënten met zeer laag en laag risico
- Een GIP/GLP1-agonist vergroot waarschijnlijk de kans op ernstige gastro-intestinale gebeurtenissen.
- We zijn onzeker of een GIP/GLP1-agonist de kans op ernstige hypoglykemie verhoogt of verlaagt.
- Een GIP/GLP1-agonist resulteert waarschijnlijk in een vermindering van gewicht.
- Een GIP/GLP1-agonist lijkt gezondheidsgerelateerde kwaliteit van leven enigszins te verbeteren.
- Er is niet gerapporteerd over de uitkomsten diabetische ketoacidose, amputatie en genitale infectie.
(Middel)langwerkend insuline 1 dd
Patiënten met zeer laag risico
- (Middel)langwerkend insuline 1 dd lijkt niet of nauwelijks te resulteren in een verschil in sterfte (alle oorzaken), (niet-fataal) CVA, in gezondheidsgerelateerde kwaliteit van leven en gewicht.
- (Middel)langwerkend insuline 1 dd leidt waarschijnlijk niet of nauwelijks tot een verschil in sterfte (cardiovasculair), eindstadium nierfalen en ziekenhuisopname door hartfalen.
- We zijn onzeker of (middel)langwerkend insuline 1 dd de kans op (niet-fataal) myocardinfarct verhoogt of verlaagt.
Patiënten met laag risico
- We zijn onzeker of basale insuline de kans op sterfte (alle oorzaken en cardiovasculair), (niet-fataal) myocardinfarct, (niet-fataal) CVA en ziekenhuisopname door hartfalen verhoogt of verlaagt.
- Basale insuline leidt waarschijnlijk niet of nauwelijks tot een verschil in eindstadium nierfalen.
Patiënten met zeer laag en laag risico
- We zijn onzeker of insuline 1 dd (middel)langwerkend de kans op ernstige gastro-intestinale gebeurtenissen verhoogt of verlaagt.
- Insuline 1 dd (middel)langwerkend resulteert waarschijnlijk in een vergrote kans op een ernstige hypoglykemie.
- Insuline 1 dd (middel)langwerkend lijkt niet of nauwelijks te resulteren in een verschil in gewicht en gezondheidsgerelateerde kwaliteit van leven.
- Er is niet gerapporteerd over de uitkomsten diabetische ketoacidose, amputatie en genitale infectie.
Bolusinsuline
Patiënten met zeer laag en laag risico
- We zijn onzeker of bolusinsuline de kans op sterfte (alle oorzaken en cardiovasculair), (niet-fataal) myocardinfarct, (niet-fataal) CVA, eindstadium nierfalen en ziekenhuisopname door hartfalen verhoogt of verlaagt.
- Bolusinsuline resulteert waarschijnlijk in een verhoogde kans op ernstige hypoglykemie.
- Bolusinsuline leidt niet of nauwelijks tot een verschil in gewicht.
- Bolusinsuline leidt waarschijnlijk niet of nauwelijks tot een verbetering van gezondheidsgerelateerde kwaliteit van leven.
- Er is niet gerapporteerd over de uitkomsten diabetische ketoacidose, ernstige gastro-intestinale bijwerkingen, amputatie en genitale infectie.
Insuline basaal bolusregime
Patiënten met zeer laag risico
- We zijn onzeker of insuline basaal bolusregime de kans op sterfte (alle oorzaken), (niet-fataal) myocardinfarct en (niet-fataal) CVA verhoogt of verlaagt.
- Insuline basaal bolusregime lijkt de kans op sterfte (cardiovasculair) te verhogen.
- Insuline basaal bolusregime verhoogt waarschijnlijk de kans op ernstige hypoglykemie.
- Insuline basaal bolusregime verhoogt waarschijnlijk het gewicht.
- Er is niet gerapporteerd over de uitkomsten diabetische ketoacidose, ernstige gastro-intestinale bijwerkingen, amputatie, genitale infectie en kwaliteit van leven.
Medicamenteus stappenplan voor patiënten met een zeer hoog risico op hart- en vaatziekten
Naar Samenvatting ›- Volg voor nieuwe, niet-kwetsbare patiënten met een zeer hoog risico op hart- en vaatziekten, levensverwachting > 5 jaar en eGFR > 10 ml/min/1,73 m2(zie tabel h7) het stappenplan in tabel h8.
- Patiënten met hartfalen hebben ook bij een levensverwachting < 5 jaar een indicatie voor een SGLT2-remmer (zie NHG-Standaard Hartfalen).
- Het medicamenteuze stappenplan voor patiënten zonder zeer hoog risico (zie tabel h5) is vooral gericht op de behandeling van bestaande hyperglykemie, het stappenplan voor patiënten met een zeer hoog risico heeft ook tot doel het risico op hart- en vaatziekten, progressie van chronische nierschade en/of progressie van hartfalen te verlagen.
| Patiënten met eerder doorgemaakte hart- en vaatziekten |
|
| Patiënten met chronische nierschade met een matig tot sterk verhoogd cardiovasculair risico† |
|
| Patiënten met hartfalen‡ | Alle vormen van hartfalen, onafhankelijk van de ejectiefractie |
| Gebaseerd op de CVRM-richtlijn (2019). TIA = transiënte ischemische aanval; GFR = glomerulaire filtratiesnelheid; ACR: albumine-creatinineratio (in urine). * Behandel patiënten alleen conform tabel h8 indien niet-kwetsbaar, levensverwachting > 5 jaar en eGFR > 10 ml/min/1,73 m2. † Zie tabel 1 van de NHG-Standaard Chronische nierschade. ‡ Bij patiënten met op het moment van klachten van hartfalen een NT-proBNP 125-300 pg/ml of BNP 35-50 pg/ml is geen direct wetenschappelijk bewijs beschikbaar. Een vergelijkbaar effect is wel aannemelijk. Overweeg te behandelen volgens het zeerhoogrisico stappenplan, overleg zo nodig met de cardioloog. Overweeg te behandelen volgens het stappenplan in tabel h8, overleg zo nodig met de cardioloog. Patiënten met hartfalen hebben ook bij een levensverwachting < 5 jaar een indicatie voor een SGLT2-remmer (zie NHG-Standaard Hartfalen). | |
| Stap 1 | SGLT2-remmer Start GLP1-agonist bij contra-indicatie voor SGLT2-remmer (bijvoorbeeld eGFR < 15 ml/min/1,73 m2, zie ook tabel h6) |
| Stap 2 | Voeg metformine toe |
| Stap 3 | Voeg een GLP1-agonist toe† |
| Stap 4 | Voeg een van de middelen uit het stappenplan voor patiënten zonder zeer hoog risico toe (zie tabel h5) Combinatie van GLP1-agonist met DPP4-remmer is niet effectief en wordt ontraden |
| * Zie tabel h7. † Bij een zeer hoog risico alleen vanwege hartfalen is er geen aangetoond voordeel van een GLP1-agonist op harde eindpunten. | |
Overzetten naar stappenplan voor zeerhoogrisicopatiënten
Naar Samenvatting ›- Patiënten die al langer diabetes type 2 hebben, kunnen mettertijd tot de zeerhoogrisicogroep gaan behoren, bijvoorbeeld na het doormaken van een cardiovasculair event (zie tabel h7).
- Onafhankelijk van de hoogte van het HbA1c verlagen SGLT2-remmers en GLP1-agonisten het risico op hart- en vaatziekten en/of progressie van chronische nierschade dan wel hartfalen.
- Handel als volgt bij zeerhoogrisicopatiënten (zie tabel h7) die al medicamenteus behandeld worden conform het stappenplan voor patiënten zonder zeer hoog risico:
- bij HbA1c > 53 mmol/mol: voeg een SGLT2-remmer toe aan de bestaande medicatie (zie Stap 1 SGLT2-remmer en tabel h9); bij contra-indicatie voor SGLT2-remmer, voeg een GLP1-agonist toe (zie Stap 3 GLP1-agonist toevoegen en tabel h9)
- bij HbA1c ≤ 53 mmol/mol: overweeg metformine te continueren en overige bloedglucoseverlagende middelen af te bouwen dan wel te staken (zie tabel h9), voeg vervolgens een SGLT2-remmer toe (zie Stap 1 SGLT2-remmer); bij contra-indicatie voor SGLT2-remmer, voeg een GLP1-agonist toe (zie Stap 3 GLP1-agonist toevoegen)
| Huidige medicatie | Aanpassingen (alleen nodig bij HbA1c < 64 mmol/mol)* |
|---|---|
| Medicatie met laag risico op hypoglykemie (metformine, DPP4-remmer, GLP1-agonist, SGLT2-remmer) | Geen |
| Sulfonylureum(SU-)derivaat | Stop bij gebruik van gliclazide 1 dd 30 of 80 mg, glimepiride 1 dd 2 mg of tolbutamide 1-2 dd 500 mg Halveer de dosering bij hogere doseringen |
| Insuline | Basaal insuline:
Bolus insuline: verlaag met 20% |
| SU-derivaat + insuline† | Basaal insuline:
Bolus insuline: verlaag insuline met 20% |
| * Wanneer bij deze patiënten mettertijd het HbA1c toch weer stijgt tot boven de individuele streefwaarde, pas dan de medicatie aan volgens het stappenplan voor zeerhoogrisicopatiënten (zie tabel h8). † Aangezien insuline de grootste kans geeft op een hypoglykemie heeft het de voorkeur om eerst de insuline aan te passen. | |
Stap 1 SGLT2-remmer
Naar Samenvatting ›- Voor zeerhoogrisicopatiënten (zie tabel h7) zijn gunstige effecten op harde uitkomstmaten aangetoond voor empagliflozine, dapagliflozine en canagliflozine.
- Behandeling van zeerhoogrisicopatiënten op hart- en vaatziekten met SGLT2-remmers is naar verwachting kosteneffectief.
- Zie Aandachtspunten bij bloedglucoseverlagende middelen: SGLT2-remmers.
Stap 2 Metformine toevoegen
Naar Samenvatting ›- Metformine verlaagt mogelijk de mortaliteit en het optreden van macrovasculaire en diabetesgerelateerde eindpunten. Daarnaast gaat het niet gepaard met hypoglykemieën en is het veilig gebleken op de lange termijn.
- Zie Aandachtspunten bij bloedglucoseverlagende middelen: Metformine.
Stap 3 GLP1-agonist toevoegen
Naar Samenvatting ›- Geldt ook voor patiënten met BMI < 30.
- Voor zeerhoogrisicopatiënten (zie tabel h7) zijn gunstige effecten op harde uitkomstmaten aangetoond voor liraglutide, dulaglutide en semaglutide (s.c.).
- GLP1-agonisten zijn bij deze groep waarschijnlijk kosteneffectief.
- Bij een zeer hoog risico alleen vanwege hartfalen is er geen aangetoond voordeel van een GLP1-agonist op harde eindpunten.
- Zie Aandachtspunten bij bloedglucoseverlagende middelen: GLP1-agonisten.
Stap 4 Toevoegen ander middel
Naar Samenvatting ›Voeg als de streefwaarde niet behaald wordt een van de overige middelen uit het medicamenteus stappenplan voor patiënten zonder zeer hoog risico toe (zie Streefwaarden HbA1c en Medicamenteus stappenplan voor patiënten zonder zeer hoog risico op hart- en vaatziekten).
Deze tekst is gebaseerd op de module ‘Stappenplan bij zeerhoogrisicopatiënten met diabetes mellitus type 2’ van de richtlijnendatabase (zie Medicamenteuze behandeling bij zeer hoog risico patiënten Diabetes Mellitus type 2).
Aandachtspunten bij bloedglucoseverlagende middelen
Naar Samenvatting ›Metformine
Naar Samenvatting ›- Begin met een lage dosis en verhoog de dosering geleidelijk om de kans op maag-darmklachten te verkleinen. Verlaag de dosering zo nodig (tijdelijk).
- Metformine zonder en metformine met gereguleerde afgifte (mga) zijn even effectief wat betreft HbA1c-regulatie en lijken beide even vaak gastro-intestinale bijwerkingen te hebben. Metformine zonder gereguleerde afgifte heeft de voorkeur vanwege de lagere kosten. Overweeg te switchen naar metformine mga als dit een bijdrage lijkt te kunnen leveren aan een betere therapietrouw. Houd bij omzetten dezelfde dagdosering aan.
- Staak de metformine tijdelijk bij koorts, braken, diarree en/of (een verhoogd risico op) dehydratie; vooral bij een verminderde nierfunctie (eGFR < 60 ml/min/1,73 m2) bestaat er onder deze omstandigheden een verhoogd risico op lactaatacidose.
- Voor een overzicht van contra-indicaties en (overige) bijwerkingen, zie tabel h6.
- Voor voorbeelden van middelen en doseringen, zie tabel h10.
Algemeen
Eigenschappen
Metformine remt de gluconeogenese in de lever en verbetert, mogelijk secundair aan het glucoseverlagende effect, de insulinegevoeligheid. Metformine geeft een lichte daling van het LDL-cholesterol en het totale cholesterol.
Bij een eenmaal daagse dosering heeft inname voor het slapengaan meerwaarde in verband met een gunstig effect op de nachtelijke gluconeogenese en het nuchtere glucose. Het therapeutische voordeel van inname ‘s avonds moet worden afgewogen tegen het risico van verminderde therapietrouw als de patiënt, die vaak meerdere geneesmiddelen gebruikt, deze op verschillende tijdstippen moet innemen. Daarnaast is er bij inname tijdens de maaltijd een lagere kans op gastro-intestinale bijwerkingen. De apotheek adviseert daarom de medicatie in te nemen bij de maaltijd.
Effectiviteit
In een cochranereview (12 onderzoeken over metformine versus placebo (n = 1578, leeftijd < 65 jaar) en 3 onderzoeken over metformine versus dieet (n = 914, leeftijd < 65 jaar)) werd voor metformine versus placebo een SMD gevonden van van HbA1c –0,97% (95%-BI –1,25 tot –0,69) en voor metformine versus dieet een SMD van HbA1c van –1,06% (95%-BI –1,89 tot –0,22). 283
Bijwerkingen
Gastro-intestinale klachten
Ongeveer 5% van de gebruikers verdraagt helemaal geen metformine. Ongeveer 15-20% verdraagt niet de maximale dosering.
Lactaatacidose
Wanneer rekening wordt gehouden met de voor metformine geldende contra-indicaties (nier- of leverinsufficiëntie, hypoxie bij hart- en vaatziekten, slechte voedingstoestand, fors alcoholgebruik) is er geen verhoogd risico op melkzuuracidose, die met een hoge mortaliteit gepaard gaat. In een systematische review van 176 onderzoeken (ruim 65.000 patiëntjaren) werden in de metforminegroep 0,84 gevallen van melkzuuracidose per 10.000 patiëntenjaren gevonden, versus 0,9 in de niet-metforminegroep (placebo of non-biguanide).
In Bolen 2007 werden 8 onderzoeken gevonden die een gering of geen verhoogd risico op melkzuuracidose lieten zien onder metforminegebruikers.
Deze bevinding is consistent met die in een andere review.
Kanker
- Er zijn aanwijzingen dat metformine het risico op (sterfte door) kanker verlaagt. In een systematische review en meta-analyse van 210.892 patiënten in 10 onderzoeken (2 RCT’s, 6 cohortonderzoeken, 2 patiëntcontroleonderzoeken) werden 11.117 (5,3%) gevallen van incidente kanker gevonden. Het risico op kanker onder metforminegebruikers was significant lager dan onder niet-metforminegebruikers. Het gepoolde relatieve risico (RR) was 0,66 (95%-BI 0,49 tot 0,88) voor sterfte door kanker, 0,67 (0,53 tot 0,85) voor incidentie alle kankers, 0,68 (0,53 tot 0,88) voor colorectale kanker, 0,20 (0,07 tot 0,59) voor hepatocellulaire kanker en 0,67 (0,45 tot 0,99) voor longkanker.
- Een andere meta-analyse over de relatie tussen metformine en kanker (11 onderzoeken; 4042 gevallen van kanker en 529 sterfgevallen als gevolg van kanker) liet een RR zien van 0,69 (95%-BI 0,61 tot 0,79) voor metformine vergeleken met andere bloedglucoseverlagende medicatie. De omgekeerde associatie was significant voor pancreascarcinoom en hepatocellulair carcinoom en niet-significant voor colon-, mamma- en prostaatcarcinoom.
- In Nederlands prospectief cohortonderzoek (n = 1353, mediane follow-up 9,6 jaar, gemiddelde leeftijd 68 jaar) werd een associatie gevonden tussen metforminegebruik en lagere sterfte door kanker. 289Voor patiënten die metformine gebruikten was de hazardratio voor sterfte door kanker vergeleken met patiënten die geen metformine gebruikten 0,43 (95%- BI 0,23 tot 0,80).
- Een recente systematische review (11 RCT’s met 398 kankers gedurende 51.681 persoonsjaren) kon bovengenoemde associaties niet bevestigen. Relatieve risico’s voor kanker bij personen met metforminemedicatie vergeleken met elke andere behandeling bedroegen: 1,02 (95%-BI 0,82 tot 1,26) in alle onderzoeken, 0,98 (95%-BI 0,77 tot 1,23) in een subgroepanalyse van active-comparator trials en 1,36 (95%-BI 0,74 tot 2,49) in een subgroepanalyse van placebo/usual care vergelijkende onderzoeken.
Contra-indicaties
Contra-indicaties voor metformine zijn nier- of leverinsufficiëntie, hypoxie bij hart- en vaatziekten, slechte voedingstoestand, fors alcohol-gebruik, intraveneuze toediening van röntgencontrastvloeistof.
Ook een creatinineklaring van < 10 ml/ min/1,73 m2 is een contra-indicatie voor metformine.
- Bij een klaring < 60 ml/min/1,73 m2 moet men vooral bedacht zijn op complicaties tijdens intercurrente ziekten, dan wel op comedicatie waarbij een verslechtering van de nierfunctie optreedt en melkzuuracidose mogelijk is.
- Metformine kan bij een klaring van 30-50 ml/ min/1,73 m2 worden gestart in een dosering van 500 mg 2 dd. Dit kan in individuele gevallen geleidelijk verhoogd worden in overleg met de nefroloog. Bij risico op achteruitgang van de nierfunctie de dosering niet verder verhogen.
- Bij een klaring van 10-30 ml/min/1,73 m2 kan metformine in een dosering van 500 mg 1 dd worden voorgeschreven. Het middel moet bij een verminderde nierfuntie bij braken, diarree en/of dreigende dehydratie onmiddellijk worden gestaakt.
Dit advies van de KNMP wijkt af van het advies in de Summary of Product Characteristics (SmPC) van de European Medicine Agency (EMA); de EMA hanteert een eGFR van < 30 ml/min/1,73 m2 als contra-indicatie voor metformine. De KNMP is van mening dat de kans op melkzuuracidose bij een eGFR 10-30 ml/min/1,73 m2 dermate klein is bij een dosering van 500 mg per dag dat de voordelen van gebruik van metformine opwegen tegen dit kleine risico. Ook de advisory board van de European Renal Best Practice (ERBP) adviseert bij een eGFR 15-30 ml/min/1,73 m2 metformine 500 mg per dag.
Effecten op morbiditeit en mortaliteit
Een cochranereview rapporteerde data van 5 onderzoeken over mortaliteit en morbiditeit. Er waren geen onderzoeken die metformine vergeleken met placebo. 283In de UKPDS-34 (mediane follow-up 10,7 jaar) werd metformine vergeleken met chloorpropamide, glibenclamide en insuline. 342 patiënten met overgewicht behandeld in de intensieve arm van het onderzoek met metformine werden vergeleken met 951 patiënten met overgewicht behandeld in de intensieve arm van het onderzoek met een SU-derivaat of insuline. Behandeling met metformine bleek voordeliger voor elke diabetesgerelateerde uitkomstmaat (RR 0,78; 95%-BI 0,65 tot 0,94; NNT 12; 95%-BI 7 tot 40) en voor sterfte door alle oorzaken (RR 0,73; 95%-BI 0,55 tot 0,97; NNT 19; 95%-BI 10 tot 119). Er bestond geen verschil voor diabetesgerelateerde sterfte, myocardinfarct, beroerte, perifeer vaatlijden en microvasculaire aandoeningen tussen metformine en andere bloedglucoseverlagende medicatie. De bovengenoemde 342 patiënten in de intensieve arm met metformine (dat wil zeggen snelle toevoeging van metformine aan SU-derivaat) hadden vergeleken met 411 patiënten in de controlearm een RR van 0,74 voor elke diabetesgerelateerde uitkomstmaat (95%-BI 0,60 tot 0,90; NNT 10; 95%-BI 6 tot 28), 0,61 voor diabetesgerelateerde sterfte (95%-BI 0,40 tot 0,94; NNT 19; 95%-BI 10 tot 124), 0,68 voor sterfte door alle oorzaken (95%-BI 0,49 tot 0,93; NNT 14; 95%-BI 8 tot 64) en 0,64 voor myocardinfarct (95%-BI 0,45 tot 0,92; tienjaars NNT 16; 95%-BI 9 tot 73). Bij het interpreteren van de resultaten van de UKPDS-34 moet rekening worden gehouden met methodologische beperkingen, zoals het ontbreken van blindering, de inclusie van alleen patiënten met overgewicht (> 120% van het ideale gewicht) en het lage aantal patiënten. Gepoolde data van de 4 andere onderzoeken brachten geen significante verschillen aan het licht tussen metformine en andere bloedglucoseverlagende medicatie voor sterfte door alle oorzaken en ischemische hartziekten.
In een review werden 6 onderzoeken gevonden (n = 11.385) waarin een significante risicoreductie van cardiovasculaire mortaliteit werd aangetoond (gepoolde OR 0,74; 95%-BI 0,62 tot 0,89).
In 9 onderzoeken (n = 13.046) was de gepoolde OR voor sterfte door alle oorzaken niet significant (0,81; 95%-BI 0,60 tot 1,08). Gepoolde OR voor cardiovasculaire morbiditeit van 7 onderzoeken (n = 11.986) was ook niet-significant (0,85; 95%-BI 0,69 tot 1,05).
Conclusie
Metformine verlaagt mogelijk de mortaliteit en het optreden van macrovasculaire en diabetesgerelateerde eindpunten. Daarnaast heeft het een gunstig bijwerkingenprofiel en is het veilig gebleken op de lange termijn.
Kortwerkende versus langwerkende metformine
Uitgangsvraag
- Heeft langwerkende metformine (metformine XR) de voorkeur boven ‘normale’ metformine (metformine IR) bij patiënten met diabetes mellitus type 2 en maag-darmklachten ten tijde van gebruik van metformine IR?
- Voor achtergronden, zoekstrategie, selectie van de literatuur en onderzoeksresultaten, zie Totstandkoming en methoden.
Conclusie
- Metformine XR lijkt voor wat betreft HbA1c-regulatie even effectief als metformine IR (kwaliteit van bewijs laag).
- Metformine XR lijkt even vaak gepaard te gaan met gastro-intestinale bijwerkingen als metformine IR (kwaliteit van bewijs laag).
- Metformine XR lijkt te resulteren in een stijging van triglyceriden in vergelijking tot metformine IR (kwaliteit van bewijs laag).
Van bewijs naar aanbeveling
Kwaliteit van bewijs
Er is zeer weinig onderzoek verricht naar metformine XR. De kwaliteit van het bewijs in het beschikbare onderzoek is laag tot zeer laag, de onderzoeken zijn grotendeels gefinancierd door de verschillende producenten van metformine XR en hebben een korte follow-upduur.
Balans tussen voor- en nadelen
Er lijken geen duidelijke verschillen te zijn tussen de 2 producten. Het verschil in HbA1c-daling ten gunste van metformine XR in de RCT van Schwartz is waarschijnlijk toe te schrijven aan het verschil in totale dagdosering van de metformine. Daarnaast tonen de onderzoeken vrij consistent een stijging van triglyceriden ten tijde van de behandeling met metformine XR. Het is niet duidelijk wat de pathofysiologie is achter deze stijging; ook is de klinische relevantie hiervan niet bekend, aangezien de invloed van de stijging van triglyceriden bij deze patiënten op de cardiovasculaire uitkomstmaten niet is onderzocht. Het gunstige effect ten aanzien van gastro-intestinale bijwerkingen dat toegeschreven wordt aan metformine XR, komt in deze onderzoeken niet duidelijk naar voren.
Kosten
De kosten van metformine IR en meformine XR zijn (www.medicijnkosten.nl, geraadpleegd 24 mei 2024):
- metformine IR 2 dd 500 mg IR € 0,06; metformine XR 1 dd 1000 mg € 0,12
- metformine IR 3 dd 500 mg IR € 0,09; metformine XR 1 dd 1500 mg € 0,18 (2 × 750 mg)
- metformine IR 2 dd 1000 mg IR € 0,10; metformine XR 1 dd 2000 mg € 0,24 (2 × 1000 mg)
Aanvaardbaarheid en haalbaarheid
Een voordeel van metformine XR is dat het eenmaal daags gedoseerd wordt. Metformine IR moet 2-3 dd gedoseerd worden. Veel mensen zullen de voorkeur geven aan een eenmaaldaagse dosering, wat ook de therapietrouw bevordert.
Op grond van deze overwegingen, vooral het gebrek aan onderzoek van voldoende kwaliteit, is er geen reden om metformine XR te verkiezen boven de ‘normale’ metformine. Metformine XR lijkt even vaak gepaard te gaan met gastro-intestinale bijwerkingen als metformine IR, en is duurder. Overweeg te switchen naar metformine mga als dit een bijdrage lijkt te kunnen leveren aan een betere therapietrouw.
Aanbeveling
Metformine zonder gereguleerde afgifte heeft de voorkeur. Overweeg metformine mga als dit een bijdrage lijkt te kunnen leveren aan een betere therapietrouw.
SU-derivaten (gliclazide)
Naar Samenvatting ›- Gliclazide heeft de voorkeur omdat de kans op hypoglykemie lager is bij gliclazide dan bij gebruik van andere SU-derivaten. Daarnaast is gliclazide gebruiksvriendelijk (mogelijkheid tot eenmaaldaagse dosering, dosisaanpassing bij een verslechterende nierfunctie (eGFR > 10 ml/min/1,73 m2) niet nodig).
- Gliclazide is beschikbaar in 2 verschillende formuleringen: als tablet met gereguleerde afgifte (mga) van 30 en 60 mg (langwerkend) en van 80 mg (middellangwerkend). Omdat dit 2 verschillende tabletpreparaten zijn met verschillende farmacokinetische eigenschappen, bestaat bij uitwisseling de kans op hypoglykemieën. Wissel daarom niet tussen de 2 verschillende preparaten gliclazide en combineer ze niet. Leg dit ook aan de patiënt uit.
- Staak gliclazide bij recidiverende, bij voorkeur gedocumenteerde, hypoglykemieën en ga over naar de volgende stap in het stappenplan.
- Glimepiride en tolbutamide bevelen we niet aan vanwege het verhoogde risico op hypoglykemieën in vergelijking met gliclazide. Bij patiënten die al glimepiride of tolbutamide gebruiken en een goede glykemische regulering hebben, kunnen deze middelen gecontinueerd worden. Vervang bij hypoglykemie de glimepiride en tolbutamide alsnog door gliclazide.
- Glibenclamide wordt ontraden in verband met een verhoogd risico op (ernstige) hypoglykemie.
- Wees bij patiënten die glimepiride gebruiken, vooral ouderen, alert op achteruitgang van de nierfunctie (eGFR < 50 ml/min/1,73 m2). Overweeg in dat geval vervanging door gliclazide (of pas de dosis aan).
- Voor een overzicht van contra-indicaties en (overige) bijwerkingen, zie tabel h6.
- Voor voorbeelden van middelen en doseringen, zie tabel h10.
Eigenschappen
SU-derivaten bevorderen de afgifte van insuline uit de bètacellen, waardoor de glucosewaarde daalt en de glucosetoxiciteit vermindert. SU-derivaten stimuleren insulinesecretie door ATP-sensitieve kaliumkanalen op de bètacel te inhiberen. Deze kanalen zijn echter ook in myocardweefsel en glad spierweefsel in de bloedvaten aanwezig. Inhibitie van deze kanalen kan leiden tot ongunstige cardiovasculaire effecten. Gliclazide onderscheidt zich van de andere SU-derivaten doordat het een selectieve werking heeft op de kaliumkanalen van de bètacellen in de alvleesklier, en dus niet op de kanalen in myocardweefsel en
glad spierweefsel.
SU-derivaten onderling vergeleken
Uitgangsvraag
Heeft gliclazide (al dan niet toegevoegd aan metformine) de voorkeur boven een ander SU-derivaat (tolbutamide, glimepiride, glibenclamide) bij patiënten met diabetes mellitus type 2? Zie voor de achtergronden, zoekstrategie, selectie van de literatuur en onderzoeksresultaten Totstandkoming en methoden.
Conclusies
- Gliclazide kan mogelijk tot een lagere sterfte (zowel aan alle oorzaken als aan cardiovasculaire oorzaken) leiden in vergelijking tot glibenclamide, glimepiride en tolbutamide (kwaliteit van bewijs laag).
- Het is onzeker of er verschillen zijn in optreden van acuut coronair syndroom tussen de verschillende SU-derivaten (gliclazide, glibenclamide, glimepiride of tolbutamide) (kwaliteit van bewijs zeer laag).
- Er zijn waarschijnlijk geen klinisch relevante verschillen in verandering van het HbA1c tussen gliclazide en glibenclamide of glimepiride (kwaliteit van bewijs redelijk). De vergelijking met tolbutamide is niet onderzocht.
- Gliclazide zou kunnen leiden tot minder hypoglykemieën dan glimepiride of glibenclamide (kwaliteit van bewijs laag tot redelijk). De vergelijking met tolbutamide is niet onderzocht.
- De uitkomstmaten microvasculaire morbiditeit, gewicht, kwaliteit van leven, ziekenhuisopnames en bijwerkingen (anders dan hypoglykemieën) zijn niet onderzocht.
Van bewijs naar aanbeveling
Kwaliteit van bewijs
De kwaliteit van bewijs voor het onderzoek waarin SU-derivaten onderling worden vergeleken varieert van zeer laag tot redelijk. De meeste RCT’s zijn niet opgezet om de door de werkgroep vastgestelde cruciale uitkomstmaten te onderzoeken.
Voor- en nadelen
Op basis van observationeel onderzoek lijkt er op de uitkomstmaat sterfte (aan alle oorzaken en cardiovasculair) een voordeel te zijn voor gliclazide ten opzichte van glibenclamide, glimepiride en tolbutamide. Er zijn geen redenen om te veronderstellen dat er een verschil tussen de middelen is in effectiviteit wat betreft het verlagen van het HbA1c.
Hypoglykemieën zijn slecht of niet gedefinieerd in het beschikbare onderzoek, waardoor een uitspraak hierover onbetrouwbaar is. Op basis van het beschikbare onderzoek lijkt er een voordeel te zijn voor gliclazide ten opzichte van glibenclamide en glimepiride. Het voorkomen van hypoglykemieën bij tolbutamide is niet onderzocht. Glibenclamide wordt in de NHG-Standaard uit 2006 al afgeraden in verband met de relatief grote kans op ernstige hypoglykemieën. Overigens komen ernstige hypoglykemieën zeer weinig voor in de eerstelijnspopulatie, zie Stap 2 Sulfonylureumderivaten.
De dosering van gliclazide en tolbutamide hoeft bij een eGFR ≥ 10 ml/min/1,73 m2 niet te worden aangepast. Voor glimepiride wordt geadviseerd bij een eGFR 10-50 ml/min/1,73 m2 met 50% van de standaarddosering te starten, waarna de dosis geleidelijk opgehoogd kan worden tot de standaardonderhoudsdosering.
Beschikbare middelen
Qua kosten zijn er geen relevante verschillen tussen de verschillende SU-derivaten.
Aanvaardbaarheid en haalbaarheid
Gliclazide kan in geval van het 30 of 60 mg (mga) preparaat eenmaal daags gedoseerd worden (max. 120 mg), of, in geval van het 80 mg (mga) preparaat een- tot driemaal daags (max. 240 mg) (zie onderstaand detail Verschillende formuleringen gliclazide). Tolbuta-mide wordt een- tot tweemaal daags gedoseerd (max. 2 g) en glimepiride eenmaal daags (max. 6 mg).
Op grond van deze overwegingen, vooral het mogelijke voordeel van gliclazide op (cardiovasculaire) sterfte en hypoglykemieën, bestaat er een voorkeur voor gliclazide (eerste keus) boven tolbutamide (tweede keus) en glimepiride (derde keus). Glibenclamide wordt ontraden in verband met het verhoogde risico op (ernstige) hypoglykemie.
Bij patiënten die reeds glimepiride of tolbutamide gebruiken en een goede glykemische regulering hebben wordt dit SU-derivaat gecontinueerd.
Vervang bij achteruitgang van de nierfunctie (eGFR < 50 ml/min/1,73 m2) en/ of hypoglykemie de glimepiride door gliclazide. Wees hier met name bij ouderen (vanaf circa 70 jaar) alert op.
Aanbeveling
Indien met leefstijladvisering en metformine monotherapie de glykemische instelling, vastgesteld met het HbA1c, onvoldoende is, wordt aanbevolen te starten met een SU-derivaat. Gliclazide heeft de voorkeur boven de andere SU-derivaten. Glibenclamide wordt ontraden.
Verschillende formuleringen van gliclazide
Gliclazide is beschikbaar in 2 verschillende formuleringen: als tablet met gereguleerde afgifte (mga) van 30 en 60 mg (langwerkend) en als tablet met gereguleerde afgifte (mga) van 80 mg (middellangwerkend). Dit zijn 2 verschillende tabletpreparaten met verschillende farmacokinetische eigenschappen. De werkzame stof komt via een verschillend afgifteprofiel vrij: de tabletten van 30 mg en 60 mg bevatten een hydrofiele matrixstructuur, die ervoor zorgt dat de werkzame stof langduriger wordt afgegeven dan bij de tablet van 80 mg. Daarnaast geeft de tablet van 80 mg slechts een deel van de werkzame stof af. De tablet van 80 mg bevat dan ook, om hetzelfde effect te bereiken, meer werkzame stof dan de tabletten van 30 en 60 mg.
Globaal komt de werkzaamheid van 1 tablet 80 mg (mga) overeen met 1 tablet van 30 mg (mga). De middelen zijn echter niet onderling uitwisselbaar: het is dan ook onjuist om bij patiënten die onvoldoende effect ervaren van 1 dd gliclazide, 30 mg mga om te zetten naar 1 dd gliclazide 80 mg mga. Geef in geval van dosisverhoging meerdere tabletten van 30 mg of 60 mg eenmaal per dag bij het ontbijt (max. eenmaal daags 4 tabletten van 30 mg of 2 tabletten van 60 mg). Geef de tabletten van 80 mg verspreid over de dag (max. driemaal daags 1 tablet van 80 mg). Switch bij voorkeur niet tussen de preparaten nadat de patiënt is ingesteld op een van de 2 preparaten. Er zijn waarschijnlijk geen verschillen op het gebied van effectiviteit (HbA- daling) en veiligheid (optreden van hypoglykemie). 304305 Ook de kosten van de 2 producten zijn vergelijkbaar (gliclazide 30 mg, 30 stuks € 1,26; 80 mg, 30 stuks € 1,14; www.medicijnkosten.nl, geraadpleegd 13 maart 2017).
Op grond van het gebruiksgemak van een eenmaal daagse dosering zal de formulering 30 mg/60 mg (mga) voor de meeste patiënten de voorkeur hebben. Het wordt aanbevolen om de patiënt uit te leggen dat de tabletten van 30 en 60 mg, wanneer het in eenzelfde dosering wordt voorgeschreven, veel sterker werken dan de tabletten van 80 mg en dat deze tabletten niet onderling uitwisselbaar zijn.
Conclusie
Gliclazide is beschikbaar in 2 verschillende formuleringen: als tablet met gereguleerde afgifte (mga) van 30 en 60 mg (langwerkend) en als tablet met gereguleerde afgifte (mga) van 80 mg (middellangwerkend). Dit zijn 2 verschillende tabletpreparaten met verschillende farmacokinetische eigenschappen. Wissel daarom niet tussen de preparaten en combineer ze niet. Leg dit ook aan de patiënt uit.
GLP1-agonisten
Naar Samenvatting ›- GLP1-agonisten worden subcutaan toegediend; zelfcontrole van bloedglucosewaarde is niet nodig.
- Indien de patiënt al wordt behandeld met bloedglucoseverlagende middelen met een hoog risico op hypoglykemie (SU-derivaat en/of insuline) kan dosisaanpassing nodig zijn van het SU-derivaat of insuline (zie tabel h9) alvorens een GLP1-agonist wordt toegevoegd.
- Orale GLP1-agonisten hebben niet de voorkeur omdat nog onduidelijk is of zij een beschermend effect hebben op hart- en vaatziekten, dit in tegenstelling tot de subcutane GLP1-agonisten. Daarnaast hebben orale GLP1-agonisten een onvoorspelbare biologische beschikbaarheid vanwege lage absorptie bij en interacties met voedsel en medicatie, en geven ze minder gewichtsverlies dan de subcutaan toegediende GLP1-agonisten.
- Wees terughoudend met semaglutide bij patiënten die ook insuline gebruiken en retinopathie hebben, vanwege een mogelijk risico op verslechtering daarvan.
- Gelijktijdig gebruik van een GLP1-agonist en een DPP4-remmer is niet rationeel; een DPP4-remmer heeft geen toegevoegd effect op het verlagen van het HbA1c als er ook een GLP1-agonist wordt gebruikt
- Licht de patiënt in over het verhoogde risico op galblaasaandoeningen (cholelithiasis en cholecystitis) en pancreatitis.
- Voor een overzicht van contra-indicaties en (overige) bijwerkingen, zie tabel h6.
- Voor voorbeelden van middelen en doseringen, zie tabel h10.
Deze tekst is gebaseerd op de module ‘GLP-1 receptoragonisten bij zeerhoogrisicopatiënten met diabetes mellitus type 2’ van de richtlijnendatabase (zie GLP-1 receptoragonisten bij zeerhoogrisicopatiënten met diabetes mellitus type 2)
SGLT2-remmers
Naar Samenvatting ›- Indien de patiënt al wordt behandeld met bloedglucoseverlagende middelen met een hoog risico op hypoglykemie (SU-derivaat en/of insuline) kan dosisaanpassing nodig zijn van het SU-derivaat of insuline (zie tabel h9) alvorens een SGLT2-remmer wordt toegevoegd.
- Continueer de SGLT2-remmer indien de eGFR daalt tijdens het gebruik en staak deze pas bij de start van nierdialyse. Dosisaanpassing is niet nodig. De daling van de eGFR vindt vooral plaats in de eerste maanden, terwijl de achteruitgang in nierfunctie op de lange termijn minder groot is dan bij een placebobehandeling.
- Licht de patiënt in over het mogelijk optreden en herkennen van (frequent voorkomende) genitale schimmelinfecties (vulvovaginitis, balanitis) en urineweginfecties.
- Bespreek met de patiënt risicofactoren en symptomen van euglykemische ketoacidose. Deze bijwerking komt zelden voor, maar kan een ernstig beloop hebben en is te voorkomen door het opvolgen van adviezen. Klachten die kunnen wijzen op een euglykemische ketoacidose zijn misselijkheid, braken, buikpijn, kortademigheid en een versnelde ademhaling. Een laag aanbod van koolhydraten, zoals bij vasten of een streng koolhydraatarm dieet, verhoogt het risico op een euglykemische ketoacidose. Informeer de patiënt daarom over de noodzaak om de SGLT2-remmer (tijdelijk) te staken en contact op te nemen met de huisarts bij:
- elke situatie waarin de voedselinname fors verminderd is
- koortsende ziekte
- misselijkheid en braken
- extreme dorst
- diarree
- voorafgaand aan een chirurgische ingreep (laat patiënt contact opnemen met de operateur)
- Licht de patiënt in over de noodzaak om de SGLT2-remmer te staken en contact op te nemen met de huisarts bij:
- een niet-genezende wond aan de voet
- pijn
- erytheem of zwelling in het urogenitale gebied, in combinatie met koorts en malaise (mogelijke symptomen van gangreen van Fournier)
- Jaarlijkse deelname aan de ramadan geldt niet als contra-indicatie. Wel is het advies de tabletten tijdens de vastenperiode bij de avondmaaltijd in te nemen (zie ook Diabetes mellitus type 2 en ramadan).
- Voor een overzicht van contra-indicaties en (overige) bijwerkingen, zie tabel h6.
- Voor voorbeelden van middelen en doseringen, zie tabel h10.
Deze tekst is gebaseerd op de module ‘SGLT2-remmers bij zeerhoogrisicopatiënten met diabetes mellitus type 2’ van de richtlijnendatabase (zie https://richtlijnendatabase.nl/richtlijn/medicamenteuze_behandeling_zeerhoogrisico_patienten_dm2/sglt2-remmers_bij_zeerhoogrisicopati_nten_met_diabetes_mellitus_type_2_dm2.html).
DPP4-remmers
Naar Samenvatting ›- De combinatie van een DPP4-remmer en een GLP1-agonist is niet effectief en wordt ontraden.
- Licht de patiënt in over het verhoogde risico op pancreatitis, ernstig hartfalen (saxagliptine) en ernstige nierfunctiestoornissen (sitagliptine).
- Voor een overzicht van contra-indicaties en (overige) bijwerkingen, zie tabel h6.
- Voor voorbeelden van middelen en doseringen, zie tabel h10.
(Middel)langwerkende insuline
Naar Samenvatting ›- In de aanloopfase is educatie (onder andere leefstijl, therapietrouw, leren meten van de bloedglucosewaarde, spuitinstructie) belangrijk.
- Schrijf NPH-insuline (insuline isofaan) of insuline glargine 100 E/ml voor. Weeg in de keuze mee dat glargine 100 E/ml niet gezwenkt hoeft te worden en dat nachtelijke hypoglykemieën mogelijk minder vaak optreden dan bij NPH-insuline. Daarentegen zijn de kosten van NPH-insuline lager dan insuline glargine 100 E/ml (zie ook tabel h6).
- Insuline detemir, insuline degludec en insuline glargine 300 E/ml bevelen we niet aan. Er zijn geen duidelijke voordelen ten opzichte van NPH-insuline of insuline glargine 100 E/ml, en de kosten zijn hoger.
- Voor een overzicht van contra-indicaties en (overige) bijwerkingen, zie tabel h6.
- Voor voorbeelden van middelen en doseringen, zie tabel h10.
- Voor de praktische toepassing, zie Bijlage Behandeling met insuline.
Verschillende insulineschema’s zijn mogelijk. Over het algemeen wordt geadviseerd om metformine te continueren bij start van de insulinebehandeling. Ook wordt bij voorkeur het SU-derivaat gecontinueerd bij eenmaal daagse toediening van (middel)langwerkende insuline (zie Continueren sulfonylureumderivaat bij start met eenmaal daags (middel)langwerkende insuline).
In een systematische review van 20 RCT’s (n = 1811, gemiddelde leeftijd 60 jaar, gemiddeld 9 jaar diabetes, gemiddelde follow-upduur 10 maanden) werd insuline in combinatie met orale bloedglucoseverlagende middelen vergeleken met insulinemonotherapie bij patiënten met diabetes mellitus type 2 die ‘faalden’ op alleen orale medicatie.
Van 13 RCT’s kon een meta-analyse worden uitgevoerd. De combinatie van orale medicatie overdag en 1 injectie NPH-insuline voor de nacht gaf ten opzichte van insulinemonotherapie een vergelijkbare HbA1c-daling. Bij combinatietherapie was gemiddeld 43% minder insuline nodig. De aantallen hypo’s waren vergelijkbaar. Diverse aspecten van de kwaliteit van leven verschilden niet, maar dit werd slechts onderzocht in 3 RCT’s. De combinatietherapie leidde uitsluitend tot minder gewichtstoename als metformine als enige orale middel werd gecombineerd met insuline.
In een systematische review waarin 78 onderzoeken werden geïncludeerd, werd gevonden dat continueren van de orale glucoseverlagende middelen na de start met een eenmaal daags basaal insuline resulteert in een betere glykemische controle met minder benodigde insuline, minder gewichtstoename en minder hypoglykemieën in vergelijking met het stoppen van de orale middelen.
Het voorschrijven van mixinsuline 2 dd leidt tot een betere glykemische controle dan basaal insuline 1 dd (verschil in HbA1c 0,26-0,6% (3-7 mmol/mol)), maar ook tot frequentere hypoglykemieën. Mixanalogen geven dezelfde glykemische controle, maar lagere postprandiale glucosewaarden (verschil 0,7-1,7 mmol/L) in vergelijking met humane mixinsulines.
In een systematische review (26 RCT’s, n = 2286) werd geen significant verschil gevonden tussen metformine gecombineerd met insuline en insuline alleen met betrekking tot sterfte door alle oorzaken (RR 1,30; 95%-BI 0,57 tot 2,99) of cardiovasculaire sterfte (RR 1,70; 95%-BI 0,35 tot 8,30). In een fixed effect-model traden ernstige hypoglykemieën significant vaker op met metformine en insuline dan met insuline alleen (2,83; 95%-BI 1,17 tot 6,86). In een random effects-model resulteerde metformine gecombineerd met insuline in een lager HbA1c, minder gewichtstoename en lagere dosering insuline vergeleken met alleen insuline.
In gerandomiseerd onderzoek (n = 390; follow-upduur 4,3 jaar) gaf toevoeging van metformine versus placebo aan insulinetherapie een duurzame beperking van de gewichtstoename onder insulinetherapie én een (niet door insuline bereikbare) verdere verbetering van de glucoseregulatie met een 30% lagere insulinebehoefte, zonder toename van hypoglykemieën.
Conclusie
Bij start van eenmaal daags basaal insuline worden de orale glucoseverlagende middelen bij voorkeur gecontinueerd.
Uitgangsvraag
Moet een SU-derivaat worden gecontinueerd bij patiënten met diabetes mellitus type 2 die worden behandeld met metformine en een SU-derivaat en die starten met eenmaal daags insuline?
Zie voor de achtergronden, zoekstrategie, selectie van de literatuur en onderzoeksresultaten Totstandkoming en methoden.
Conclusies
- De effectiviteit van het staken van het SU-derivaat, wanneer er wordt gestart met eenmaal daags insuline, op de uitkomstmaten sterfte, macro- en microvasculaire morbiditeit en ziekenhuisopnames is niet onderzocht.
- Er lijken geen verschillen te zijn tussen het staken dan wel continueren van het SU-derivaat bij start van eenmaal daags insuline op het gebied van HbA1c en gewicht (kwaliteit van bewijs laag).
- Het is onzeker of er verschillen bestaan tussen het staken dan wel continueren van het SU-derivaat bij start van eenmaal daags insuline ten aanzien van het optreden van hypoglykemieën en ten aanzien van kwaliteit van leven (kwaliteit van bewijs zeer laag).
Van bewijs naar aanbeveling
Kwaliteit van bewijs
De kwaliteit van het bewijs is laag tot zeer laag. Er zijn slechts 2 onderzoeken verricht met kleine patiëntaantallen. Er zijn alleen onderzoeken gevonden waarin werd gestart met insuline glargine, er waren geen onderzoeken waarin met NPH-insuline werd gestart. De streefwaarde voor het nuchtere glucose was in beide onderzoeken lager dan gangbaar is in Nederland.
Voor- en nadelen
Op basis van het beschikbare bewijs zijn er geen aanwijzingen voor een nadelig effect van het continueren van het SU-derivaat naast metformine wanneer er wordt gestart met eenmaal daags insuline. Op theoretische gronden is het waarschijnlijk dat indien het SU-derivaat gestaakt wordt, de insuline sneller opgehoogd moet worden en een hogere dosering insuline nodig is. Dit kan gepaard gaan met een gewichtsstijging. Anderzijds leidt het continueren van een SU-derivaat mogelijk tot een grotere kans op hypoglykemie.
Beschikbare middelen: behandeling
Behandeling met een SU-derivaat is goedkoop (gliclazide mga 30 mg, 30 stuks € 1,26; 60 stuks € 1,31; www.medicijnkosten.nl, geraadpleegd 6 maart 2017). Op theoretische gronden is het waarschijnlijk dat indien het SU-derivaat gestaakt wordt, een hogere dosering insuline nodig is. De kosteneffectiviteit van het al dan niet continueren van een SU-derivaat is niet onderzocht.
Aanvaardbaarheid en haalbaarheid
indien het SU-derivaat gestaakt wordt, is er waarschijnlijk een hogere dosering insuline nodig, wat mogelijk ook tot meer gewichtsstijging leidt. In geval van het continueren van het SU-derivaat zal de patiënt extra medicatie in moeten nemen, wat ten koste kan gaan van de therapietrouw.
Op basis van deze overwegingen kan overwogen worden het SU-derivaat naast metformine te continueren bij start van eenmaal daags insuline. Bij hypoglykemieën is het aan te bevelen de dosering van het SU-derivaat te verlagen en glimepiride en glibenclamide om te zetten in gliclazide. Verlaag zo nodig de insulinedosering. Staak het SU-derivaat bij onvoldoende effect van deze maatregelen.
Aanbeveling
Continueer bij voorkeur het SU-derivaat bij start van eenmaal daags (middel)langwerkende insuline; verlaag in geval van hypoglykemie allereerst de dosering van het SU-derivaat. Overweeg in dit geval ook glimepiride en glibenclamide om te zetten in gliclazide.
Uitgangsvraag
Hebben langwerkende insulineanalogen (insuline detemir, insuline glargine, insuline degludec) de voorkeur boven NPH-insuline (isofaan insuline) bij diabetes mellitus type 2?
Zie voor de achtergronden, zoekstrategie, selectie van de literatuur en onderzoeksresultaten het deel Totstandkoming en methoden.
Conclusie
Insuline detemir vs. NPH-insuline
- Het is niet onderzocht hoe insuline detemir zich tot NPH-insuline verhoudt ten aanzien van de uitkomstmaten sterfte, macrovasculaire en/of microvasculaire complicaties.
- Er lijken geen verschillen te bestaan tussen insuline detemir en NPH-insuline op het gebied van verandering van het HbA1c en gewicht (kwaliteit van bewijs laag).
- Het is onzeker hoe insuline detemir zich verhoudt tot NPH-insuline ten aanzien van (ernstige) hypoglykemieën (kwaliteit van bewijs zeer laag).
Insuline glargine vs. NPH-insuline
- Het is niet onderzocht hoe insuline glargine zich tot NPH-insuline verhoudt ten aanzien van de uitkomstmaten sterfte, macrovasculaire en/of microvasculaire complicaties.
- Er lijken geen verschillen te bestaan tussen insuline glargine en NPH-insuline op het gebied van HbA1c en gewicht (kwaliteit van bewijs laag).
- Het is onzeker hoe insuline glargine zich verhoudt tot NPH-insuline ten aanzien van (ernstige) hypoglykemieën (kwaliteit van bewijs zeer laag).
Insuline degludec vs. NPH-insuline
Het is niet onderzocht hoe insuline degludec zich tot NPH-insuline verhoudt.
Van bewijs naar aanbeveling
Kwaliteit van bewijs
De kwaliteit van bewijs is laag tot zeer laag. Het is niet mogelijk conclusies te trekken over het optreden en de ernst van hypoglykemieën door de vaak onduidelijke definities van hypoglykemieën in de onderzoeken, de lagere gehanteerde streefwaardes voor het (nuchtere) glucose dan in Nederland gangbaar zijn, en doordat geen enkel onderzoek is opgezet om het verschil in hypoglykemieën te toetsen.
Het is niet onderzocht hoe insuline degludec zich verhoudt tot NPH-insuline. Voor de vergelijking tussen insuline degludec en de andere insulineanalogen, zie onder Insuline degludec versus andere langwerkende insulineanalogen: plaatsbepaling stap 3 van de behandeling.
Balans tussen voor- en nadelen
Er lijken geen verschillen te bestaan tussen insulineanalogen (glargine 100 en detemir) en NPH-insuline ten aanzien van het effect op het HbA1c en het gewicht. Mogelijk treden er minder (nachtelijke) hypoglykemieën op bij gebruik van insulineanalogen dan bij gebruik van NPH-insuline. Overigens zijn ook bij NPH-insuline ernstige hypoglykemieën zeldzaam (incidentie 0-4,4% in het beschreven onderzoek). Er is mogelijk een verhoogd risico op borstkanker bij gebruik van insuline glargine, hoewel dit niet overtuigend is aangetoond (zie onder Insuline en borstkanker).
Beschikbare middelen
- De kosten van insulineanalogen zijn hoger dan van NPH-insuline. Bij 40 E per dag kost NPH-insuline per maand ongeveer € 21, insuline glargine 100 E/ml € 33 en insuline detemir € 41 (www.medicijnkosten.nl,geraadpleegd 8 juni 2023; laagste prijs exclusief afleverkosten en kosten voor glucosestrips en meetapparatuur).
- De kosten van insuline detemir zijn een stuk hoger dan die van glargine 100 E/ml, terwijl beide insulines gelijkwaardig zijn. Daarom gaat de voorkeur uit naar insuline glargine 100 E/ml.
Aanvaardbaarheid en haalbaarheid
NPH-insuline moet voorafgaand aan toediening minstens 10 × gezwenkt worden, wat ten koste gaat van het gebruiksgemak. Bij glargline 100 E/ml is zwenken niet nodig. Mogelijk treden er bij insuline glargine 100 E/ml minder vaak nachtelijk hypoglykemieën op.
Start een insulinebehandeling met NPH-insuline of insuline glargine 100 E/ml.
Uitgangsvraag
Leidt het gebruik van insuline glargine tot meer (sterfte aan) borstkanker dan andere insulines (met name NPH-insuline)? Voor achtergronden, zoekstrategie, selectie van de literatuur en onderzoeksresultaten zie Totstandkoming en methoden.
Conclusie
Het is onzeker of insuline glargine tot meer borstkanker leidt dan andere insulines, maar een verhoogd risico is niet uit te sluiten (kwaliteit van bewijs zeer laag).
Uitgangsvraag
Leidt het gebruik van insuline degludec tot meer sterfte (aan alle oorzaken en cardiovasculair), cardiovasculaire morbiditeit, tumoren en andere bijwerkingen dan gebruik van insuline glargine?
Conclusies
Insuline degludec lijkt het risico op sterfte aan alle oorzaken, sterfte aan cardiovasculaire oorzaken, acuut coronair syndroom, beroerte, tumoren (zowel alle tumoren als maligne tumoren) of ‘adverse events’ niet te verhogen in vergelijking tot insuline glargine op de middellange termijn (mediane follow-upduur 2 jaar).
Het is niet onderzocht hoe insuline degludec zich verhoudt tot insuline glargine wat betreft hartfalen.
Uitgangsvraag
- Heeft toevoeging van eenmaal daags insuline degludec de voorkeur boven toevoeging van eenmaal daags een andere langwerkende insulineanaloog (insuline detemir, insuline glargine (100 E/ml en 300 E/ml)) bij personen met diabetes mellitus type 2 die met orale bloedglucoseverlagende medicatie de HbA1c-streefwaarde niet bereiken?
- Vergelijking: orale bloedglucoseverlagende medicatie (bij voorkeur metformine ± SU-derivaat) + 1 dd insuline degludec versus orale bloedglucoseverlagende medicatie (bij voorkeur metformine ± SU-derivaat) + 1 dd insuline detemir of insuline glargine (100 E/ml of 300 E/ml).
- Voor achtergronden, zoekstrategie, selectie van de literatuur en onderzoeksresultaten, zie Totstandkoming en methoden.
Conclusies
- Het is niet onderzocht hoe basaal insuline degludec zich tot basaal insuline glargine verhoudt ten aanzien van de uitkomstmaten sterfte, macro- en microvasculaire morbiditeit en ziekenhuisopnames.
- Er lijken geen verschillen te bestaan tussen basaal insuline degludec en basaal insuline glargine ten aanzien van het HbA1c, gewicht en kwaliteit van leven (kwaliteit van bewijs laag).
- Het is onzeker hoe basaal insuline degludec zich verhoudt tot basaal insuline glargine ten aanzien van symptomatische, ernstige of nachtelijke hypoglykemieën en overige bijwerkingen op korte termijn (kwaliteit van bewijs zeer laag).
- Het is niet onderzocht hoe basaal insuline degludec zich verhoudt tot basaal insuline detemir.
Van bewijs naar aanbeveling
Kwaliteit van bewijs
De kwaliteit van het bewijs is laag tot zeer laag. Insuline degludec is niet in een directe vergelijking onderzocht ten opzichte van insuline detemir bij diabetes mellitus type 2.
Balans tussen voor- en nadelen
Er zijn geen redenen om aan te nemen dat er daadwerkelijke verschillen bestaan op het gebied van HbA1c en gewicht tussen insuline degludec en insuline glargine. In enkele onderzoeken traden bij gebruik van insuline degludec minder hypoglykemieën op dan bij gebruik van insuline glargine. Deze resultaten werden alleen behaald in onderzoeken waar een fors lagere streefwaarde (nuchter glucose < 5 mmol/L) werd gehanteerd dan in Nederland gangbaar is (nuchter glucose < 8 mmol/L). In deze onderzoeken traden hypoglykemieën in beide behandelgroepen frequenter op dan in onderzoek waarin hogere streefwaarden worden gehanteerd. Daarnaast is een van de onderzoeken uitgevoerd in een populatie met een hoog risico op hypoglykemie. Daardoor blijft het onduidelijk of er een verschil is ten aanzien van hypoglykemieën bij streefwaarden conform deze standaard. Eén cardiovasculair veiligheidsonderzoek (DEVOTE) toont dat insuline degludec op de korte en middellange termijn (observatieperiode: 2 jaar) ten opzichte van insuline glargine veilig lijkt ten aanzien van sterfte, macrovasculaire morbiditeit en tumoren in de onderzochte populatie met een verhoogd cardiovasculair risico (zie onder Veiligheid van insuline degludec). Insuline degludec is sinds 2014 op de markt; er is daardoor nog onvoldoende bekend over de veiligheid op de lange termijn. Insuline glargine en insuline detemir zijn sinds respectievelijk 2003 en 2005 op de markt; de langetermijnveiligheid wordt daarmee aangenomen, hoewel een verhoogd risico op borstkanker bij gebruik van insuline glargine niet kan worden uitgesloten (zie onder Insuline en borstkanker).
Beschikbare middelen
De kosten van insuline degludec zijn hoger dan van insuline glargine, insuline detemir en NPH-insuline (www.medicijnkosten.nl, geraadpleegd 2 juli 2018):
- insuline degludec 100 E/ml 3 ml € 18,60; 200 E/ml 3 ml € 37,20
- insuline glargine 100 E/ml 3 ml € 9,55
- insuline detemir 100 E/ml 3 ml € 11,40
- NPH-insuline 100 E/ml 3 ml € 5,55.
Aanvaardbaarheid en haalbaarheid
Een theoretisch voordeel van insuline degludec ten opzichte van NPH-insuline en de andere langwerkende insulineanalogen is dat er enkele uren variatie in het tijdstip van toediening kan zitten. Bij gebruik van de andere langwerkende analogen of NPH-insuline kan er echter bij diabetes mellitus type 2 ook incidenteel van het vaste tijdstip worden afgeweken. De langere werkingsduur van insuline degludec vertaalt zich bij diabetes mellitus type 2 dus niet in een praktisch voordeel.
Op grond van deze overwegingen (met name het ontbreken van duidelijke voordelen ten opzichte van de andere langwerkende insulineanalogen en NPH-insuline, de onzekerheid over de langetermijnveiligheid en de hogere kosten) wordt insuline degludec bij diabetes mellitus type 2 niet aanbevolen.
Aanbeveling
Insuline degludec wordt bij diabetes mellitus type 2 niet aanbevolen.
Uitgangsvraag
Heeft insuline glargine 300 E/ml de voorkeur boven insuline glargine 100 E/ml bij diabetes mellitus type 2, die onvoldoende gereguleerd is met orale bloedglucoseverlagende medicatie?
Voor achtergronden, zoekstrategie, selectie van de literatuur en onderzoeksresultaten zie Totstandkoming en methoden.
Conclusies
- De effectiviteit van insuline glargine 300 E/ml in vergelijking tot insuline glargine 100 E/ml op de uitkomstmaten sterfte, macro- en microvasculaire morbiditeit en ziekenhuisopnames is niet onderzocht.
- Er lijken geen verschillen te bestaan tussen insuline glargine 300 E/ml en insuline glargine 100 E/ml ten aanzien van HbA1c, gewicht, kwaliteit van leven en overige bijwerkingen op de korte termijn (kwaliteit van bewijs laag).
- Het is onzeker hoe insuline 300 E/ml zich verhoudt tot insuline glargine 100 E/ml ten aanzien van het optreden van (ernstige) hypoglykemieën (kwaliteit van bewijs zeer laag).
Van bewijs naar aanbeveling
Kwaliteit van bewijs
De kwaliteit van het bewijs is laag tot zeer laag. Het trekken van conclusies over het optreden van hypoglykemieën wordt beperkt door de vaak onduidelijke definities van hypoglykemieën in de onderzoeken, de lagere gehanteerde streefwaardes dan in Nederland gangbaar zijn, en doordat geen enkel onderzoek is opgezet om het verschil in hypoglykemieën te toetsen.
Voor- en nadelen
Er zijn geen redenen om aan te nemen dat er daadwerkelijke verschillen bestaan op het gebied van verandering van HbA1c, gewichtsverandering en hypoglykemie.
De middelen zijn niet bio-equivalent; bij gebruik van insuline glargine 300 E/ml zijn er gemiddeld 10- 18% meer eenheden nodig dan bij gebruik van insuline glargine 100 E/ml.
Insuline glargine 300 E/ml is sinds 2015 in Nederland geregistreerd, waardoor er met dit middel minder ervaring is en er minder bekend is over de effectiviteit en veiligheid dan over insuline glargine 100 E/ml, wat sinds 2003 wordt voorgeschreven.
Beschikbare middelen
De kosten per eenheid zijn vergelijkbaar; omdat in geval van insuline glargine 300 E/ml er tot gemiddeld 10-18% meer eenheden nodig kunnen zijn, is gebruik van dit middel duurder.
Aanvaardbaarheid en haalbaarheid
Bij glargine 100 E/ml moet de patiënt een groter volume spuiten; theoretisch gezien zou gebruik van glargine 300 E/ml daarom tot minder lokale reacties kunnen leiden. Zowel bij insuline glargine 100 E/ml als bij insuline glargine 300 E/ml kan maximaal 80 E per injectie worden toegediend. Bij een hoger benodigd aantal eenheden moeten bij beide concentraties meerdere injecties worden toegediend.
Op grond van bovengenoemde overwegingen (met name het ontbreken van voordelen ten opzichte van insuline glargine 100 E/ml, het hogere aantal benodigde eenheden en de hogere kosten) wordt insuline glargine 300 E/ml bij diabetes mellitus type 2 niet aanbevolen.
Aanbeveling
Insuline glargine 300 E/ml wordt bij diabetes mellitus type 2 niet aanbevolen.
Educatie verbetert de glykemische instelling
In 2 onderzoeken bleek dat door intensivering van de educatie en behandeling met orale middelen door een diabetesverpleegkundige en een diëtist na 6 maanden bij 39 respectievelijk 60% van de patiënten met een indicatie voor insuline (HbA1c > 53 mmol/mol ondanks maximale behandeling met orale bloedglucoseverlagende middelen) de glykemische instelling zodanig was verbeterd dat de indicatie voor insuline was vervallen of op zijn minst uitgesteld.
Aandachtspunten bij starten insulinetherapie
Uit Nederlands onderzoek bleek dat 67% van de huisartsen insulinetherapie initiëren. Mannelijk geslacht, leeftijd > 40 jaar, samenwerking met een praktijkondersteuner, werkzaam zijn in een gezondheidscentrum waren positief en werkzaam zijn in de stad negatief gecorreleerd met starten van insulinebehandeling. 328Barrières bij zowel patiënt als arts kunnen leiden tot uitstel van een noodzakelijke behandeling met insuline. Het gevoel ‘gefaald’ te hebben, angst voor bijwerkingen (gewichtstoename, hypoglykemieën), tijdgebrek, onvoldoende kennis en de noodzaak te moeten verwijzen naar de tweede lijn spelen hierbij een rol.
Uit een recent onderzoek bleek dat ambivalentie tegenover insulinebehandeling vooropstaat en dat starten met insuline geassocieerd was met de gedachte dat de ziekte was verergerd.
Daar staat tegenover dat behandeling met insuline bij een verbetering van de glykemische controle – naast een kleinere kans op diabetische complicaties – een positief effect heeft op tevredenheid met de behandeling, het algemeen welbevinden en de kwaliteit van leven, vooral indien ‘simpele’ insulineregimes en niet te strikte streefwaarden worden gehanteerd.
Een verbeterde HbA1c-waarde was geassocieerd met beter welbevinden. 335Het is van belang dat de patiënt goed geïnstrueerd wordt wat betreft (de uitvoering van) zelfcontrole.
Splitsen van dosering insuline
Deze aanbeveling berust op de richtlijn van de beroepsorganisatie voor diabetesverpleegkundigen en praktijkondersteuners (EADV).
Hierin staat dat het niet mogelijk is een standaarddosering waarbij insuline gesplitst moet worden te geven. Er is in de literatuur geen bewijs gevonden dat een groter volume toegediende insuline tot een vertraging van de absorptie of tot meer pijnklachten leidt.
Aanbevolen wordt om voor het bepalen van het maximaal toe te dienen volume insuline de bijsluiter van de betreffende insuline te raadplegen. Als de bijsluiter geen maximum vermeldt, lijkt het mogelijk om tot de maximaal op te draaien dosering van de insulinepen toe te dienen, tenzij:
er pijn, lekkage, huidschade of andere klachten optreden;
de patiënt weerstand heeft tegen of moeite heeft met het toedienen van een groot volume.
Afhankelijk van bovengenoemde factoren kan het bij de individuele patiënt wenselijk zijn de dosis eerder te splitsen. Het is onvoldoende onderzocht of er ten aanzien van het splitsen van de dosering verschillen bestaan tussen de verschillende soorten insulines.
Intensiveren insulinebehandeling (facultatief)
Naar Samenvatting ›- Intensivering van de insulinetherapie is geen basisaanbod en daarom facultatief. Verwijs zo nodig naar de internist.
- Voor de praktische toepassing, zie Bijlage Behandeling met insuline.
- Verwijs de patiënt ook naar de internist indien met intensieve insulinebehandeling en optimale titratie onvoldoende glykemische regulatie wordt bereikt.
Overige bloedglucoseverlagende middelen
Naar Samenvatting ›Er zijn in Nederland nog een aantal patiënten die gebruik maken van acarbose, pioglitazon of repaglinide. We bevelen het starten van deze middelen bij patiënten in de huisartspraktijk niet aan. Ter informatie wordt in het bijbehorende detail een korte beschrijving gegeven van deze middelen.
Acarbose
De toepassing van acarbose wordt beperkt door het frequent optreden van darmklachten, met name flatulentie (minder bij langzaam optitreren). Op grond van vooral de langetermijnveiligheid is er een voorkeur voor acarbose boven pioglitazon.
Pioglitazon
Pioglitazon gaat mogelijk gepaard met een verhoogd risico op fracturen en er is onduidelijkheid over het optreden van ernstige bijwerkingen, zoals blaaskanker, hartfalen en pneumonie.
Repaglinide
Repaglinide is qua werkingsmechanisme te vergelijken met de SU-derivaten. Een voordeel van repaglinide is dat het vlak voor de maaltijd wordt ingenomen en de maaltijden niet op vaste tijdstippen hoeven plaats te vinden.
| Medicament | Toedienings-weg | Werking | Bijwerkingen | Conta-indicaties |
|---|---|---|---|---|
| Pioglitazon | Oraal | Verbetert insulinegevoeligheid door activatie van de kernreceptor ‘peroxisomal proliferator activated gamma’ (PPAR-gamma) Verlaagt triglyceriden- en vetzuurplasma-waarden | Gewichtstoename (circa 1-2 kg) Oedeem Mogelijk: verhoogd fractuurrisico, blaaskanker, hartfalen, pneumonie, bovensteluchtweg-infecties Overgevoeligheidsreacties en anafylaxie, macula-oedeem, slapeloosheid | (Verhoogd risico op) hartfalen (Vermoeden van) leveraandoeningen Terughoudendheid in combinatie met insuline (vooral bij ouderen) |
| Acarbose | Oraal | Vertraagt afbraak in de darm van di-, oligo- en polysacchariden tot monosacchariden | Gastro-intestinale klachten, m.n. flatulentie en diarree (minder bij titreren) Stijging leverenzymen en leverfunctiestoornissen | Ernstige nierfunctiestoornis (eGFR < 10 ml/min/1,73 m2) Ernstige leverfunctiestoornis (Verhoogd risico op) darmobstructie Terughoudendheid bij darmziekten |
| Repaglinide | Oraal | Stimuleert afgifte van insuline door de bètacellen Werkingsduur gedurende de maaltijd | Buikpijn, diarree, gewichtstoename (circa 1-2 kg) Hypoglykemie Overgevoeligheidsreacties | Ernstige nierfunctiestoornis (eGFR < 10 ml/min/1,73 m2) Ernstige leverfunctiestoornis |
Dosering van (voorbeelden van) bloedglucoseverlagende middelen
Naar Samenvatting ›| Middel | Dosering | Gebruiksadvies | |||
|---|---|---|---|---|---|
| Start | Maximaal | Bij verminderde nierfunctie | |||
| Biguaniden | |||||
| Metformine | Tablet 500/850/1000 mg | 1 dd 500 of 850 mg | 3 dd 1000 mg |
|
|
| Tablet (mga) 500/750/1000 mg | 1 dd 500 mg | 1 dd 2000 mg | |||
| Sulfonylureumderivaten | |||||
| Gliclazide† | Tablet (mga) 80 mg (middellangwerkend) | 1 dd 80 mg | 3 dd 80 mg |
| Kort voor of tijdens maaltijd innemen |
| Tablet (mga) 30/60 mg (langwerkend) | 1 dd 30 mg | 1 dd 120 mg | Bij ontbijt | ||
| SGLT2-remmers‡ | |||||
| Dapagliflozine | Tablet 5/10 mg | 1 dd 10 mg | 1 dd 10 mg | Start geen behandeling bij eGFR < 15 ml/min/1,73 m2 | Instrueer patiënt om contact op te nemen bij elke situatie waarin de voedselinname sterk verminderd is, bij koorts, misselijkheid en braken, extreme dorst en voorafgaand aan een chirurgische ingreep |
| Empagliflozine | Tablet 10/25 mg | 1 dd 10 mg | 25 mg/dag | ||
| GLP1-agonisten | |||||
| Liraglutide | Injectievloeistof 6 mg/ml | 1 dd 0,6 mg, na minimaal 1 week 1 dd 1,2 mg | 1 dd 1,8 mg |
| Subcutaan toedienen in dij, buik of bovenarm, op een vast tijdstip van de dag, onafhankelijk van de maaltijden |
| Dulaglutide | Injectievloeistof 1,5/3/6/9 mg/ml, pen à 0,5 ml met 1 dosering | 1 × per week 1,5 mg (overweeg bij kwetsbare patiënten start met 0,75 mg), zo nodig na 4 weken dosering verhogen | 1 × per week 4,5 mg | Subcutaan toedienen in dij, buik of bovenarm, steeds op dezelfde dag van de week | |
| Semaglutide | Injectievloeistof 0,25/0,5/1 mg/dosering, pen à 0,5 ml met 4 doseringen | 1 × per week 0,25 mg, na 4 weken 1 × per week 0,5 mg | 1 × per week 1 mg | ||
| DPP4-remmers | |||||
| Sitagliptine | Tablet 25/50/100 mg | 1 dd 100 mg | 1 dd 100 mg |
| |
| Linagliptine§ | Tablet 5 mg | 1 dd 5 mg | 1 dd 5 mg | Dosisaanpassing niet nodig (bij stabiel verminderde nierfunctie) | |
| (Middel)langwerkende insuline | |||||
| NPH-insuline | Injectievloeistof 100 E/ml | 1 dd 10 E | Geen maximum (onderhoudsdosis meestal 0,3-1,0 E/kg lichaamsgewicht per dag, 1 dd) | Dosisaanpassing niet nodig (bij stabiel verminderde nierfunctie) | Tussen avondeten en bedtijd |
| Glargine 100 E/ml | |||||
| * Bij start metformine bij eGFR 30-50 ml/min/1,73 m2 kan na start met 2 dd 500 mg de dosering opgehoogd worden tot de normale maximale dosering, wees alert op dehydratie. † Gliclazide heeft 2 verschillende tabletpreparaten met verschillende farmacokinetische eigenschappen; 1 tablet 80 mg gliclazide met gereguleerde afgifte (middellangwerkend) komt ongeveer overeen met 1 tablet 30 mg gliclazide met gereguleerde afgifte (langwerkend). In verband met de farmacokinetische verschillen zijn de preparaten niet met elkaar te combineren. Wissel ook niet tussen de preparaten. ‡ Indien tijdens gebruik van de SGLT2-remmer de eGFR daalt tot < 15 ml/min/1,73 m2 wordt geadviseerd om het middel te continueren en pas te staken bij de start van nierdialyse. Canagliflozine is in deze tabel niet opgenomen omdat de kosten bij verhogen van de dosering bij onvoldoende glykemische instelling relatief hoog zijn. § De kosten van linagliptine zijn aanzienlijk hoger dan die van sitagliptine | |||||
Behandeling bij nuchter glucose ≥ 10 mmol/l op moment van diagnose
Naar Samenvatting ›- Ga na of de patiënt klachten heeft als gevolg van hyperglykemie (dorst, polydipsie, polyurie, vermagering). Indien de patiënt geen klachten heeft, kan in overleg met de patiënt eerst gestart worden met een niet-medicamenteuze behandeling (zie Niet-medicamenteuze adviezen).
- Bespreek het belang van leefstijl en geef adviezen ten aanzien van voeding en lichaamsbeweging (zie Niet-medicamenteuze adviezen).
Bloedglucoseverlagende therapie (exclusief insuline)
Naar Samenvatting ›- Overweeg bij patiënten met klachten van hyperglykemie, maar zonder zeer hoog risico op hart- en vaatziekten, direct te starten met medicatie:
- metformine bij nuchter glucose 10-15 mmol/L
- metformine en gliclazide bij nuchter glucose 15-20 mmol/L
- Overweeg bij patiënten met klachten van hyperglykemie én een zeer hoog risico op hart- en vaatziekten direct te starten met medicatie:
- start een GLP1-agonist bij nuchter glucose > 10 mmol/L
- start geen SGLT2-remmer. Bij een hoog nuchter glucose op moment van diagnose is er een verhoogde kans op LADA of diabetes type 1; bij beide is er een (relatieve) contra-indicatie voor een SGLT2-remmer vanwege het risico op ketoacidose. Zodra in een later stadium duidelijk is dat er geen sprake is van LADA of diabetes type 1 kan de GLP1-agonist gestaakt worden en de SGLT2-remmer gestart
- Zie Aandachtspunten bij bloedglucoseverlagende middelen.
Controles (exclusief insulinetherapie)
Naar Samenvatting ›- Instrueer de patiënt om binnen 3 dagen weer contact op te nemen als de hyperglykemische klachten persisteren. Instrueer de patiënt om bij benauwdheid, versnelde ademhaling of suf worden direct contact op te nemen, buiten kantoortijden zo nodig via de HAP (risico op ketoacidose).
- Controleer het nuchter glucose na enkele dagen. Verhoog de medicatie in principe elke 2-4 weken aan de hand van de nuchtere glucosewaarden. Bij aanhoudende klachten van hyperglykemie en hoge nuchtere glucosewaarden < 2 weken na de start van de medicatie kan overwogen worden om de medicatie al eerder op te hogen.
Insulinetherapie
Naar Samenvatting ›- Start direct met eenmaal daags (middel)langwerkende insuline bij nuchtere glucosewaarden ≥ 20 mmol/L, zowel met als zonder klachten van hyperglykemie
- Mogelijk betreft het een ander type diabetes (diabetes type 1 of LADA). Wees hierop vooral bedacht bij hoge (nuchtere) glucosewaarden, leeftijd < 50 jaar, BMI < 25 en/of aanwezigheid van een auto-immuunziekte (schildklierproblematiek, coeliakie, inflammatoire darmziekte, multipele sclerose, vitiligo). Let op: een BMI ≥ 25 sluit diabetes type 1 of LADA niet uit.
- In de thuissituatie moet de patiënt in staat zijn tot zelfcontrole van de glucosespiegel totdat een stabiele situatie van de glucosewaarden is ontstaan.
- Overleg zo nodig met een kaderhuisarts diabetes of een internist.
- Zie ook Bijlage Behandeling met insuline.
Diabetes mellitus type 2 en ramadan
Naar Samenvatting ›- De islam geeft mensen die door het vasten gezondheidsproblemen kunnen oplopen vrijstelling van de ramadan. Toch nemen de meeste moslims met diabetes type 2 deel aan de ramadan.
- Het is van belang om ernstige ontregeling bij deze groep te voorkomen.
- Neem daarom zelf het initiatief om het onderwerp ramadan te bespreken. Doe dit jaarlijks, tijdens de controle voorafgaand aan de ramadan.
- Ontraad patiënten met frequente hypoglykemieën en patiënten met macro- of microvasculaire complicaties deel te nemen aan de ramadan.
- Indien de patiënt ervoor kiest om toch mee te doen, pas dan de medicatie aan om de kans op hypoglykemieën zo laag mogelijk te houden.
- Voor adviezen over medicatie en zelfcontrole zie Diabetes en ramadan van de Nederlandse Diabetes Federatie.
In Nederland leven ongeveer 900.000 moslims. Ramadan is voor hen een bijzondere maand. Hoewel chronisch zieken niet verplicht zijn mee te doen aan deze vastenmaand, neemt een groot deel van de patiënten met diabetes jaarlijks deel aan het vasten. Uit het EPIDIAR-onderzoek, een retrospectief transversaal onderzoek in 13 islamitische landen onder 12.243 moslims met diabetes, bleek dat circa 43% van de mensen met diabetes mellitus type 1 en 79% van de mensen met diabetes mellitus type 2 meedoet aan de vastenmaand. Data van 1070 (8,7%) patiënten met diabetes mellitus type 1 en 11.173 (91,3%) patiënten met diabetes mellitus type 2 werden geanalyseerd. Tijdens ramadan vastten 42,8% van de diabetes mellitus type 1patiënten en 78,7% van de patiënten met diabetes mellitus type 2 tenminste 15 dagen.
Hypoglykemieën
Ernstige hypoglykemieën waarvoor ziekenhuisopname noodzakelijk was, kwamen significant vaker voor tijdens ramadan dan daarbuiten: 0,14 versus 0,03 hypoglykemieën per maand en per patiënt, p = 0,0174 (diabetes mellitus type 1) en 0,03 versus 0,004 hypoglykemieën per maand en per patiënt, p < 0,0001 (diabetes mellitus type 2). Ernstige hypoglykemieën traden vaker op bij personen die hun dosering van de orale medicatie of insuline veranderden of lichamelijk actiever waren.
Hyperglykemieën
Ook ernstige hyperglykemieën traden significant frequenter op tijdens ramadan dan daarbuiten: 0,16 versus 0,05 hyperglykemieën per maand, p = 0,1635 (patiënten met diabetes mellitus type 1) en 0,05 versus 0,01 hyperglykemieën per maand, p < 0,0001 (patiënten met diabetes mellitus type 2).
Behandeling van risicofactoren voor hart- en vaatziekten en chronische nierschade
Naar Samenvatting ›De behandeling van andere risicofactoren voor hart- en vaatziekten en (beginnende) chronische nierschade bij patiënten met diabetes type 2 sluit aan bij NHG-Standaard Cardiovasculair risicomanagement (CVRM) en NHG-Standaard Chronische nierschade.
Bloeddrukverlaging
Naar Samenvatting ›- Behandel verhoogde bloeddruk bij patiënten met diabetes type 2 conform de NHG-Standaard Cardiovasculair risicomanagement (CVRM).
- Behandel patiënten zonder hypertensie maar met albuminurie en een levensverwachting ≥ 10 jaar ook met een ACE-remmer. Streef naar een dosering die de albuminurie zoveel mogelijk onderdrukt (de effectmaat is de albumine-creatinineratio, niet de bloeddruk). Zoek bij bijwerkingen passend bij hypotensie naar de maximale dosering die de patiënt verdraagt.
Diabetespatiënten zonder hypertensie met albuminurie
ACE-remmers kunnen ook bij patiënten met diabetes mellitus type 2 en normotensie, dat wil zeggen een systolische bloeddruk ≤ 140 mmHg, de achteruitgang van de nierfunctie en de mate van eiwitverlies gunstig beïnvloeden.
Lipidenverlaging
Naar Samenvatting ›Stel de indicatie voor een statine en controle van de lipiden volgens NHG-Standaard Cardiovasculair risicomanagement (CVRM).
Chronische nierschade
Naar Samenvatting ›- De belangrijkste interventie om zowel (verdere) afname van de nierfunctie als toename van de nierschade te voorkomen is een goede bloeddrukregulatie. Zie voor behandeladviezen en streefwaarden van de bloeddruk bij chronische nierschade zie NHG-Standaard Chronische nierschade.
- Ook stoppen met roken en gewichtsreductie hebben waarschijnlijk een gunstig effect, zowel ter preventie als ter vertraging van achteruitgang van de nierfunctie.
- Daarnaast vermindert intensieve glykemische controle het risico op (toename van) albuminurie vergeleken met conventionele behandeling.
Overgewicht en obesitas en chronische nierschade
In een retrospectief cohortonderzoek zijn data van 1.194.704 adolescenten (17 jaar) geanalyseerd over toekomstig risico op eindstadium nierfalen. Incidentie van eindstadium nierfalen tussen 1980 en 2010 werd vastgelegd (30.478.675 persoonsjaren follow-up). 874 participanten (713 mannen, 161 vrouwen) ontwikkelden eindstadium nierfalen (totale incidentie 2,87 per 100.000 persoonsjaren). Vergeleken met adolescenten met normaal gewicht, hadden adolescenten met overgewicht en obesitas een verhoogd risico op toekomstig eindstadium nierfalen (incidenties respectievelijk 6,08 en 13,40 per 100.000 persoonsjaren). Na correctie voor geslacht, land van herkomst, systolische bloeddruk, was voor overgewicht de hazardratio eindstadium nierfalen 3,00 (95%-BI 2,50 tot 3,60) en voor obesitas 6,89 (95%-BI 5,52 tot 8,59).
Overgewicht (HR 5,96; 95%-BI 4,41 tot 8,06) en obesitas (HR 19,37; 95%-BI 14,13-26,55) waren onafhankelijke risicofactoren voor diabetisch eindstadium nierfalen. De auteurs concluderen dat overgewicht en obesitas geassocieerd zijn met een significant verhoogd risico op eindstadium nierfalen door alle oorzaken.
Intensieve glykemische controle en renale uitkomstmaten
Een systematische review van Ruospo et al. die onderzoek deed naar het effect van intensieve glykemische controle versus conventionele behandeling op diabetische nefropathie (14 RCT’s met 29.319 diabetes mellitus type 1 en 2 patiënten waarvan 11 RCT’s met 29.141 patiënten werden meegenomen in de meta-analyse, behandelduur gemiddeld 56.7 maanden [range 6 maanden – 10 jaar]) en beschrijft de volgende uitkomsten: intensieve glykemische controle versus conventionele behandeling heeft geen invloed op verdubbelen van het serum creatinine (4 onderzoeken; n = 26.874; RR 0,84; 95%-BI 0,64 tot1,11), ontwikkelen van eindstadium nierfalen (4 onderzoeken; n = 23.332; RR 0,62; 95%-BI 0,34 tot 1,12), sterfte door alle oorzaken (9 onderzoeken; n = 29.094; RR 0,99; 95%-BI 0,86 tot 1,13], cardiovasculaire sterfte (6 onderzoeken; n = 23.673; RR 1,19; 95%-BI 0,73 tot 1,92) of plotselinge sterfte (4 onderzoeken; n = 5913; RR 0,82; 95%-BI 0,26 tot 2,57]. Patiënten in de groep met intensieve glykemische controle hadden wel een lager risico op niet-fataal myocardinfarct (5 onderzoeken; n = 25.596; RR 0,82; 95%-BI 0,67 tot 0,99), ontstaan van micro-albuminurie (4 onderzoeken; n = 19.846; RR 0,82; 95%-BI 0,71 tot 0,93) en progressie van micro-albuminurie (5 onderzoeken; n = 13.266; RR 0,59; 95%-BI 0,38 tot 0,93). In absolute getallen betekent dit dat intensieve glykemische controle versus normale glykemische conrole in 1000 patiënten leidt tot het voorkómen van niet-fataal myocardinfarct bij 0-2 patiënten, 7 patiënten minder die micro-albuminurie ontwikkelen en het voorkómen van verslechtering van albuminurie bij 2 patiënten.
De auteurs concluderen dat patiënten met intensieve glykemische controle een vergelijkbaar risico hebben op eindstadium nierfalen, sterfte en cardiovasculaire ziekten als patiënten met conventionele glykemische controle, terwijl intensieve glykemische controle wel kan leiden tot een klein klinisch voordeel op het ontwikkelen van albuminurie, progressie van albuminurie en niet-fataal myocardinfarct.
Voetproblemen
Naar Samenvatting ›- Geef alle patiënten met diabetes algemene voorlichting over voetverzorging, voethygiëne en het belang van goed zittend schoeisel. Een belangrijke, herhaald gegeven boodschap aan alle patiënten met diabetes type 2 moet zijn om bij het ontstaan van een wond aan de voet direct contact op te nemen met de huisarts of POH. Veel patiënten zijn zich niet of onvoldoende bewust van het grote risico dat een voetulcus met zich meebrengt, waardoor uitstel van de behandeling optreedt.
- Adviseer patiënten ≥ Sims 1 om hun voeten dagelijks te (laten) inspecteren en te zorgen voor goede voetverzorging en voethygiëne. Adviseer ze om binnen en buiten goed passend schoeisel te dragen.
- Verwijs patiënten met een voetulcus direct naar een multidisciplinair voetenteam bij ≥ 1 van de volgende kenmerken:
- plantair gelokaliseerd voetulcus
- diep voetulcus
- perifeer arterieel vaatlijden (PAV)
- Verricht bij een voetulcus onderzoek naar PAV om deze aandoening uit te sluiten.
- Een niet-plantair gelokaliseerd, oppervlakkig voetulcus zonder PAV, dat met eenvoudige maatregelen en schoenaanpassing volledig drukvrij gelegd kan worden, kan in de huisartsenpraktijk behandeld worden, bij voorkeur in samenwerking met een podotherapeut. Verwijs de patiënt naar een multidisciplinair voetenteam, wanneer het voetulcus binnen twee weken niet verbetert.
- Behandel een cellulitis zonder tekenen van een systemische infectie conform de NHG-Standaard Bacteriële huidinfecties. Tijdens de behandeling moet de patiënt het lopen beperken.
- Optimaliseer de bloedglucoseregulatie. Controleer na 48 uur en verwijs de patiënt alsnog direct naar een multidisciplinair voetenteam indien de tekenen van infectie niet zijn afgenomen.
- Bij een onychomycose die tot huidlaesies leidt, is behandeling met orale antimycotica conform de NHG-Standaard Dermatomycosen aangewezen.
- Charcotvoet is een zeldzame complicatie bij patiënten met diabetes mellitus en neuropathie. De voet is gezwollen, rood, warm en enigszins pijnlijk. Meestal is de middenvoet aangedaan.
- Directe herkenning en verwijzing naar een multidisciplinair voetenteam is van belang omdat onmiddellijke immobilisatie ernstige schade aan de voet kan voorkomen.
- Zorg bij pijn door neuropathie voor pijnbestrijding (zie NHG-Standaard Pijn).
Een charcotvoet is een zeldzame complicatie bij mensen met diabetes mellitus. Directe herkenning en onmiddellijke immobilisatie kunnen ernstige schade aan de voet voorkomen. Bij de pathogenese speelt neuropathie met verlies van protectieve sensibiliteit een belangrijke rol. Een kleine verwonding kan aanleiding geven tot een cascade van ontstekingsverschijnselen en botafbraak. Door de verminderde sensibiliteit heeft de patiënt weinig klachten en blijft de voet belasten. De puntprevalentie van een actieve charcotvoet (gedurende een maand bepaald)bedroeg in Engeland 4,3/10.000 mensen met diabetes. Bij 34% van de patiënten werd de correcte diagnose binnen 2 weken gesteld. Bij de overige patiënten was er sprake van een aanzienlijke delay na de eerste presentatie aan een zorgverlener. Op de röntgenfoto zijn in het beginstadium meestal geen afwijkingen te zien. De diagnose kan worden gesteld met een MRI-scan. Onmiddellijke gipsimmobilisatie is aangewezen. Na het verdwijnen van de roodheid en zwelling kan de patiënt onder nauwgezette controle de voet gaan belasten met aangepast schoeisel. Bij te late herkenning raakt de voet in korte tijd volledig misvormd met als gevolg een duidelijk verhoogd risico op voetulcera en amputaties (MDR Diabetische voet, geraadpleegd augustus 2024).
Behandeling voetulcus
Naar Samenvatting ›- Verwijs patiënten met een voetulcus met spoed naar een multidisciplinair voetenteam indien er sprake is van ≥ 1 van de volgende kenmerken:
- plantair of diep gelegen ulcus
- tekenen van perifeer vaatlijden en/of ischemie
- tekenen van systemische infectie
- Uitsluitend een niet-plantair gelegen, oppervlakkig, neuropathisch ulcus zonder tekenen van perifeer vaatlijden, dat met eenvoudige maatregelen en schoeiselaanpassing volledig drukvrij is te leggen, is in de huisartsenpraktijk te behandelen, bij voorkeur in samenwerking met een podotherapeut.
- Bij een beperkte cellulitis zonder systemische tekenen van infectie:
- schrijf een oraal antibioticum voor (zie NHG-Standaard Bacteriële huidinfecties)
- adviseer tijdens de behandeling het lopen te beperken
- optimaliseer de bloedglucoseregulatie
- verwijs de patiënt direct naar de specialist, bij voorkeur naar een ‘voetenteam’, als de tekenen van infectie bij herbeoordeling na 48 uur niet zijn afgenomen (zie Consultatie en verwijzing)
- Indien er geen aanwijzingen zijn voor infectie:
- beoordeel het ulcus om de paar dagen
- is er binnen 2 weken met dit beleid geen genezing of genezingstendens, of verslechtert het ulcus in deze periode, verwijs de patiënt dan alsnog
Van een oppervlakkig geïnfecteerd ulcus is sprake bij een infectie van huid en subcutaan weefsel zonder systemische verschijnselen en bij ≥ 2 van de volgende symptomen: lokale zwelling of induratie, roodheid 0,5-2 cm rond het ulcus, pijn, calor, purulente afscheiding. Bij oppervlakkige infecties met beperkte cellulitis kan men doorgaans volstaan met orale antibiotica. Blind gestarte behandeling bij patiënten die niet eerder zijn behandeld met antibiotica dient gericht te zijn op bestrijding van Staphylococcus aureus (bijvoorbeeld clindamycine, flucloxacilline of amoxicilline-clavulaanzuur).
Overige behandelingen
Naar Samenvatting ›- Voor patiënten met diabetes zonder hart- en vaatziekten is er onvoldoende bewijs voor een standaardbehandeling met acetylsalicylzuur.
- Schrijf acetylsalicylzuur 1 dd 80 mg voor aan patiënten met een atherotrombotische cardiovasculaire aandoening die niet op grond van comorbiditeit (zoals atriumfibrilleren) of structurele hartafwijkingen in aanmerking komen voor orale anticoagulantia.
Bariatrische chirurgie
Naar Samenvatting ›- Een patiënt kan in aanmerking komen voor bariatrische chirurgie indien de BMI ≥ 35 is én de gangbare niet-chirurgische behandelingen niet hebben geresulteerd in blijvend gewichtsverlies of -behoud.
- Bariatrische chirurgie leidt tot aanzienlijk gewichtsverlies, verbetering van cardiovasculaire risicofactoren en vermindering van cardiovasculaire morbiditeit en mortaliteit (zie NHG-Standaard Obesitas).
- Bariatrische chirurgie leidt ook tot verbetering van de glykemische regulatie, waarbij de gewichtsafname niet de enige determinant lijkt. Na bariatrische chirurgie wordt een betere insulinerespons gezien dan na gewichtsvermindering middels dieettherapie.
- Na bariatrische chirurgie herstelt de glucosespiegel vaak tot normale waarden.
- Deze voordelen moeten worden afgewogen tegen de kans op postoperatieve complicaties en mortaliteit.
- Er zijn verschillende operatieve behandelingen, elk met specifieke voor- en nadelen. De patiënt wordt gescreend door een multidisciplinair team (internist, chirurg, anesthesist, psycholoog, diëtist, fysiotherapeut).
- De patiënt moet voldoende gezond zijn om anesthesie en chirurgie te ondergaan en moet de noodzaak van langdurige follow-up begrijpen en bereid zijn om hieraan mee te werken. Ook moet de patiënt beseffen dat hij na bariatrische chirurgie levenslang een streng dieet en voedingssupplementen moet gebruiken. Verwijdering van overtollige buikhuid kan naderhand nodig zijn.
In Zweeds prospectief cohortonderzoek (845 patiënten ondergingen bariatrische chirurgie, 845 conventionele behandeling; gemiddelde BMI 41; follow-upduur 2 jaar) werd bij geopereerde patiënten 28 kg gewichtsafname gevonden versus 0,5 kg in de controlegroep (p < 0,0001). 346Oddsratio voor de 2-jaarsincidentie van diabetes in de chirurgisch behandelde groep vergeleken met de controlegroep was 0,02 (95%-BI 0,00 tot 0,16). Ook de incidenties van hypertensie, hyperinsulinemie en hypertriglyceridemie waren lager in de chirurgisch behandelde groep.
In een meta-analyse (147 RCT’s, observationele onderzoeken en case series, mediane follow-up 36 maanden) leidde chirurgie tot het verdwijnen of verbeteren van diabetes mellitus type 2 bij 64-100% van de patiënten.
Een cochranereview (23 RCT’s en 3 prospectieve cohortonderzoeken) vergeleek chirurgische met niet-chirurgische behandeling en diverse chirurgische technieken onderling. Het merendeel van de patiënten was vrouw (30-48 jaar, BMI 39-52). De prevalentie van diabetes en hypertensie nam af.
In een systematische review (35 onderzoeken; aanzienlijke heterogeniteit in design, duur van follow-up en classificatie van diabetesstatus) werd 2 jaar na maagbandoperatie een gewichtsvermindering gevonden van 47%.
Remissieratio’s van diabetes daalden van 62% (na 6 maanden) naar 55% (na 12-24 maanden) tot 38% na 24 maanden (dalende trend is consistent met het progressieve beloop van de ziekte). In een andere meta-analyse van Buchwald (621 onderzoeken, 11.175 patiënten, BMI 47,9, in 19 onderzoeken werd gerapporteerd over gewichtsafname en remissie van diabetes) bedroeg de gewichtsafname 55,9%. In 78,1% van de diabetespatiënten trad remissie op.
In gerandomiseerd onderzoek (n = 150 diabetespatiënten, 66% vrouwen, leeftijd 49 ± 8 jaar) werden intensieve medicamenteuze behandeling, medicatie in combinatie met Rouxen-Y gastric bypass of met sleeve-resectie vergeleken.
Initiële HbA1c-waarde was 9,2±1,5% (77 ± 16 mmol/mol). Primaire eindpunt was proportie patiënten met HbA1c ≤ 6,0% (42 mmol/mol) na 12 maanden. Proporties patiënten die het eindpunt haalden waren 12% (5 van 41 patiënten) in de groep die medicamenteuze therapie kreeg, 42% (21 van 50 patiënten) in de gastricbypassgroep (p = 0,002) en 37% (18 van 49 patiënten) in the sleeve-resectiegroep (p = 0,008). De glykemische controle verbeterde in alle groepen: HbA1c was 7,5 ± 0,8% (58 ± 9 mmol/mol) in de medicamenteuze-therapiegroep, 6,4 ± 0,9% (46 ± 10 mmol/mol) in de gastric-bypassgroep (p < 0,001) en 6,6 ± 1,0% (49 ± 11 mmol/mol) in de sleeve-resectiegroep (p = 0,003). Gewichtsverlies was groter in de gastricbypass-groep en sleeve-resectiegroep (respectievelijk -29,4 ± 9,0 kg en -25,1 ± 8,5 kg) dan in de medicamenteuze-therapiegroep (-5,4 ± 8,0 kg) (p < 0,001 voor beide vergelijkingen). Er deden zich geen sterfgevallen of levensbedreigende complicaties voor in de chirurgiegroepen. Vergelijkbare resultaten werden gevonden in ander onderzoek (n = 60, leeftijd 30-60 jaar, BMI ≥ 35, diabetesduur ≥ 5 jaar) waarbij patiënten werden gerandomiseerd naar conventionele behandeling of gastic bypass of biliopancreatische omleiding. 352In de medicamenteus behandelde groep trad na 2 jaar geen remissie van diabetes op (nuchtere glucose < 5,6 mmol/L en HbA1c < 6,5% (48 mmol/mol)). Proportie van remissie was 75% in de gastricbypassgroep en 95% in de biliopancreatische-omleidinggroep (p < 0,001 voor beide vergelijkingen). Na 2 jaar was het HbA1c in de medicamenteus behandelde groep 7,69 ± 0,57% (61 ± 6 mmol/mol), in de gastricbypassgroep 6,35 ± 1,42% (46 ± 16 mmol/mol) en in de biliopancreatische-omleidinggroep 4,95 ± 0,49% (31 ± 5 mmol/mol).
Er zijn aanwijzingen dat ook bij diabetespatiënten met BMI < 35 bariatrische chirurgie een gunstig effect heeft op de glucose homeostase. Gewichtsvermindering lijkt niet de enige determinant voor verbetering van de glykemische controle na chirurgie. 353Na bariatrische chirurgie stijgen de postprandiale plasmaconcentraties van ‘glucagon-like’ peptide-1 (GLP1) en glucose-dependent insulinotropic polypeptide (GIP) 3- tot 5-voudig. De verbetering van de insulinerespons na bariatrische chirurgie werd niet in dezelfde mate gezien na gewichtsvermindering na dieettherapie.
De conclusie is dat bariatrische chirurgie de glucosecontrole verbetert bij obese diabetespatiënten. Meer onderzoek is nodig voor de effecten op lange termijn, met name het effect op harde eindpunten.
De effecten van bariatrische chirurgie op de kwaliteit van leven lijken gunstig (zie NHG-Standaard Obesitas, geraadpleegd augustus 2020).
Er zijn voorts aanwijzingen dat bariatrische chirurgie ook gunstige effecten sorteert bij patiënten met diabetes mellitus type 2 (en patiënten met IGT) met een BMI van 30-35. In een review werd gevonden dat bij deze patiënten chirurgische procedures zijn geassocieerd met grotere gewichtsafname en betere glykemische controle vergeleken met niet-chirurgische behandelingen.
Postoperatieve complicaties en mortaliteit
Operatieve complicaties van bariatrische chirurgie (voorkomend bij ongeveer 10% van de patiënten) op korte termijn zijn: trombo-embolie, bloeding, pneumonie, stenose, ulcera, infectie of hernia, peritonitis, dood. Langetermijncomplicaties zijn: galstenen en deficiënties van ijzer, calcium, vitamine D, vitamine B1, vitamine B12 en eiwit (zie NHG-Standaard Obesitas, geraadpleegd augustus 2020). De operatiemortaliteit is echter voldoende laag (< 1% voor alle procedures) om chirurgie toe te passen bij geïndiceerde personen.
Chirurgische technieken
De operatieve behandelingen kunnen in 3 groepen worden verdeeld: (1) operaties die de voedselinname beperken (restrictieve ingrepen, bijvoorbeeld aanpasbare maagband), (2) operaties die de absorptie uit de darm verminderen (malabsorptieve ingrepen, bijvoorbeeld biliopancreatische omleiding) en (3) een combinatie van beide (bijvoorbeeld gastric bypass) (zie NHG-Standaard Obesitas, geraadpleegd augustus 2020).
In prospectief gecontroleerd onderzoek (n = 2010) werd bariatrische chirurgie (maagband (n = 376), vertical banded gastroplasty (n = 1369) en gastric bypass (n = 276)) vergeleken met conventionele behandeling bij gematchte obese controles (n = 2037). Na 10 jaar was het gewicht in de controlegroep met 1,6% gestegen, terwijl het gewicht in de groep gastric bypass 25%, in de groep vertical banded gastroplasty 17% en in de maagbandgroep 13% was gedaald.
Na een gemiddelde follow-upduur van 10,9 jaar was het geschatte relatief risico op totale mortaliteit (gecorrigeerd voor leeftijd, geslacht en risicofactoren) 0,71 (95%-BI 0,54 tot 0,92) in de chirurgiegroep in vergelijking met de controlegroep. De cardiovasculaire risicofactoren verbeterden in het voordeel van de chirurgiegroep.
In een meta-analyse (136 onderzoeken, n = 22.094) verdween diabetes bij ruim driekwart van de patiënten (biliopancreatische omleiding meeste effect, maagband minste effect).
Controles
Naar Samenvatting ›- Besteed aandacht aan eventuele klachten, glucoseregulering, het actuele cardiovasculaire risicoprofiel en het vroegtijdig onderkennen van complicaties.
- Overweeg zorg op afstand voor de controles (uitzondering: de jaarcontrole inclusief voetonderzoek) indien de patiënt dit wenst. Bespreek desgewenst de voor- en nadelen van zorg op afstand.
Zorg op afstand bij tussentijdse controles van patiënten met diabetes mellitus type 2 lijkt niet effectiever of minder effectief dan gebruikelijke zorg. Voor een deel van de patiënten kan zorg op afstand naast de fysieke contacten voordelen bieden (bijvoorbeeld minder reistijd, eigen keuze van tijdstip van zorg). Zorg op afstand is alleen geschikt voor patiënten die hier mee overweg kunnen en indien zorgverleners er voor open staan om dit aan te bieden. Voor zorgverleners geldt dat zij tijd en mogelijk ook financiële middelen moeten investeren om zorg op afstand mogelijk te maken. Op dit moment kan voor zorg op afstand gebruik worden gemaakt van al bestaande toepassingen.
Voor- en nadelen
- Zorg op afstand bij de controles van patiënten met diabetes mellitus type 2 is niet duidelijk effectiever of minder effectief dan gebruikelijke zorg als wordt gekeken naar kwaliteit van leven, BMI en HbA1c. We zijn onzeker of zorg op afstand de zelfovertuiging van patiënten verhoogt of verlaagt in vergelijking met gebruikelijke zorg.
- Als wordt gekeken naar de voor- en nadelen van de specifieke interventies van zorg op afstand, blijkt dat leefstijlinterventies via videofragmenten het HbA1c mogelijk verbeteren. Daarentegen verlagen telefonische consulten mogelijk de kwaliteit van leven en verhogen digitale zelfhulpinterventies waarschijnlijk de BMI, vergeleken met gebruikelijke zorg.
Kwaliteit van bewijs
De kwaliteit van bewijs voor de effectiviteit van zorg op afstand in vergelijking met gebruikelijke zorg varieert van zeer laag tot redelijk. We hebben met name afgewaardeerd voor onnauwkeurigheid en risico op bias door het onderzoeksdesign.
Waarden en voorkeuren van patiënten
Hiervoor zijn patiënten geraadpleegd met diabetes mellitus type 2 die behandeld worden in de eerste lijn en die lid zijn van Diabetes Vereniging Nederland (DVN). In 2021 vond een ledenraadpleging plaats (n = 1243, leeftijd 73-82 jaar, 39,9% vrouw) en in 2022 is het DVN-patiëntenpanel bevraagd (n = 162, gemiddelde leeftijd 69,4 jaar, 44,2% vrouw). Voor de volledige restulaten van beide onderzoeken, zie Totstandkoming en methoden, bijlage 10.
- In het patiëntenpanel (n = 162) waren de meest genoemde voordelen van zorg op afstand snelheid van zorg, minder (reis)tijd en eigen keuze van het tijdstip van zorg. Het meest genoemde nadeel was onpersoonlijk contact met de zorgverlener (‘geen nadelen’ werd bijna even vaak genoemd).
- In de ledenraadpleging (n = 1243) antwoordde een ruime meerderheid (77,7%) dat zij 2-5 × per jaar fysieke controles met huisarts of POH wil; 17% wil ≥ 1 × per jaar contact via een videoconsult en 40,7% wil ≥ 1 × per jaar contact via een econsult.
- Van de 23 geïncludeerde RCT’s in Robson2021 keken er 5 naar het effect van zorg op afstand op de patiënttevredenheid. Het was echter niet mogelijk om deze gegevens mee te nemen in de meta-analyse omdat patiënttevredenheid op verschillende manieren gemeten werd.
Kosten
Om zorg op afstand te kunnen leveren zal mogelijk geïnvesteerd moeten worden in de ontwikkeling en implementatie van ICT toepassingen. Een kosteninschatting kan de werkgroep niet geven vanwege de grote variëteit aan digitale toepassingen.
Van de 23 geïncludeerde RCT’s in Robson 2021 keken er 6 naar zorggebruik: ziekenhuisopnames, SEH-bezoeken (voor alle oorzaken en diabetesgerelateerd) en aantal contacten met specialist, huisarts of POH. Het was echter niet mogelijk om deze gegevens mee te nemen in de meta-analyse omdat het zorggebruik op verschillende manieren gemeten werd. In 1 onderzoek werd in de interventiegroep een significant lager aantal ziekenhuisopnames gezien dan bij gebruikelijke zorg, maar dit betrof slechts een klein aantal events. De overige 5 onderzoeken zagen geen significant verschil in ziekenhuisopnames en SEH-bezoeken tussen de interventie- en controlegroep. In 1 onderzoek nam het aantal telefonische consulten met de POH significant toe in de interventiegroep.
Aanvaardbaarheid
De werkgroep is van mening dat zorg op afstand de zorg efficiënter kan maken, onder meer door verbeterde informatieoverdracht naar patiënten en tussen zorgverleners onderling. De werkgroep is echter wel bezorgd dat er bij zorg op afstand, vergeleken met fysieke zorg, minder (non-verbale) communicatie plaatsvindt en de drempel om mentale problemen te bespreken voor de patiënt hoger is. Dit kan zorguitkomsten mogelijk negatief beïnvloeden. Ook zou minder fysieke zorg de contactgroei en het vertrouwen in de behandelrelatie negatief kunnen beïnvloeden. De werkgroep is van mening dat zorgverleners de patiënt met diabetes mellitus type 2 minstens 1 × per jaar fysiek moeten zien.
Haalbaarheid
- Om zorg op afstand te kunnen aanbieden moeten beveiligde ICT-toepassingen beschikbaar zijn en geïmplementeerd worden. Daarnaast moeten zowel de patiënten als de zorgverleners digitaal vaardig zijn en kunnen omgaan met de gekozen digitale zorgtoepassing(en). Het is essentieel dat zowel de POH als de huisarts daarbij betrokken worden. Zorg op afstand is niet geschikt voor elke patiënt.
- Zorg op afstand kent verschillende modaliteiten (telefonisch consult, e-consult, videoconsult, website, app). Zorgverleners zelf zullen de diverse modaliteiten in overleg met de patiënt moeten toepassen en combineren met face-to-facecontact. Op dit moment zijn digitale omgevingen voor de controles van patiënten met diabetes mellitus type 2 onvoldoende geïntegreerd met de verschillende huisartsinformatiesystemen.
- Fysieke controles moeten ≥ 1 × per jaar plaatsvinden (vaker bij reeds bestaande voetafwijkingen). Bij de fysieke controle moet ook het voetonderzoek plaatsvinden.
Uitgangsvraag
Zijn tussentijdse controles door middel van zorg op afstand aan te bevelen bij patiënten met diabetes mellitus type 2 in de eerste lijn?
| Patiënten | Patiënten met diabetes mellitus type 2 die onder behandeling zijn in de eerste lijn |
| Interventie | Elke vorm van tussentijdse controle* door middel van zorg op afstand** |
| Vergelijking | Gebruikelijke diabeteszorg (usual care) in de eerste lijn |
| Uitkomstmaten | Cruciaal:
Belangrijk:
|
| * De controle vindt plaats tussen de fysieke jaarcontroles in en bevat minstens het uitwisselen van 1 van de volgende gegevens of het bespreken van 1 van de volgende onderwerpen/adviezen: bloeddruk, waarde van bloedglucose of HbA1c, lichaamsgewicht, medicatiegebruik/therapietrouw, doorgemaakte hypoglykemie of hyperglykemie, welbevinden, voeding, lichamelijke beweging, voedingsadvies, beweegadvies, stoppen met roken advies. ** Zorg op afstand: Zorg met zorgverlener via een videoconsult, e-consult of telefonisch consult. Eventueel levert de patiënt (zelf)metingen (lichaamsgewicht, bloeddruk, bloedglucose) digitaal aan voorafgaand aan het consult. | |
De NHG-werkgroep heeft de volgende grenzen voor klinisch relevante verschillen vastgesteld:
- sterfte (door alle oorzaken of door specifieke oorzaken): relatief risicoverschil 10% (dus RR < 0,9 of RR > 1,1)
- overige dichotome uitkomstmaten: relatief risicoverschil van 25% (dus RR < 0,75 of RR > 1,25) (dit sluit aan bij de NICE-richtlijn en is ook de door GRADE voorgestelde standaardgrens)
- HbA1c 0,5% of 5 mmol/mol (conform NICE-richtlijn en NIV-richtlijn)
- BMI (aangesloten bij NIV-richtlijn uitkomstmaat gewicht): een verschil van 5% ten opzichte van het gemiddelde BMI van de controlegroep.
- Overige continue uitkomstmaten: elk statistisch significant verschil;
- Continue uitkomstmaten gerapporteerd als standardized mean difference (SMD): 0,2 (conform de voorgestelde standaardgrens voor een klein effect) en SMD 0,5 (conform de voorgestelde standaardgrens voor een klein effect).
Methode
Voor het beantwoorden van de uitgangsvraag is er een systematische literatuurzoekactie naar SR’s en RCT’s uitgevoerd in PubMed en Embase in november 2022, met een update in mei 2023.
De werkgroep vond 1 geschikte SR, met een meta-analyse van de uitkomstmaten HbA1c en BMI. De zoekactie van de SR is geüpdatet tot aan mei 2023 en aangevuld met de uitkomstmaten kwaliteit van leven en zelfovertuiging (self-efficacy, vertrouwen van patiënten over zelfredzaamheid van en therapievaardigheden voor diabetes mellitus type 2).
Op de gevonden data voerden we een nieuwe meta-analyse uit naar het overall effect van zorg op afstand op HbA1c, BMI, kwaliteit van leven en zelfovertuiging (zie Totstandkoming en methoden). Daarnaast werden subgroepanalyses gedaan om een uitspraak te kunnen doen over de effectiviteit van videoconsult, telefonisch consult, telemonitoring, mHealth (digitale interventie via een applicatie op de smartphone), digitale zelfhulpinterventies en leefstijlinterventies via videofragmenten in vergelijking met gebruikelijke zorg (voor risk-of-biastabellen, onderzoekskarakteristieken en forest plots zie Totstandkoming en methoden).
Resultaten
Resultaat zoekactie
De zoekactie leverde 1 systematische review op. Een aanvullende search na de zoekdatum van deze SR leverde geen aanvullende RCT’s op. De update search (mei 2023) leverde geen aanvullende SR’s of RCT’s op.
Onderzoekskarakteristieken
Robson 2021: SR waarin zorg op afstand werd vergeleken met gebruikelijke zorg bij patiënten met diabetes mellitus type 2 in de eerste lijn (29 RCT’s n = 8295, leeftijd gemiddeld 58 jaar. follow-upduur gemiddeld 8,5 maand (mediaan 6; range 3-12)). We includeerden 23 onderzoeken in onze meta-analyse; van de overige 6 waren geen of incomplete data beschikbaar. De onderzoeken vonden plaats in Australië (2 ×), België, Canada, China, Duitsland, India (2 ×), Italië, Maleisië (2 ×), Noorwegen, Spanje, het Verenigd Koninkrijk (3 ×) en de Verenigde Staten (7 ×).
Effectiviteit en bijwerkingen
Voor een overzicht van effectschattingen van zorg op afstand voor patiënten met diabetes mellitus type 2 in vergelijking met gebruikelijke zorg in de eerste lijn, zie de Magic App tabel. In tabel (zorg op afstand vs gebruikelijke zorg en videoconsult vs gebruikelijke zorg) staan de verschillende uitkomsten en de GRADE beoordeling.
Conclusies
- Er is mogelijk niet of nauwelijks verschil in HbA1c tussen zorg op afstand en gebruikelijke zorg (kwaliteit van bewijs laag). Leefstijlinterventie via videofragmenten verbetert het HbA1c mogelijk in vergelijking met gebruikelijke zorg (kwaliteit van bewijs laag)
- Er is waarschijnlijk niet of nauwelijks verschil in BMI tussen zorg op afstand en gebruikelijke zorg (kwaliteit van bewijs redelijk). Digitale zelfhulpinterventie verhoogt het BMI waarschijnlijk in vergelijking met gebruikelijke zorg (kwaliteit van bewijs redelijk)
- Er is mogelijk niet of nauwelijks verschil in kwaliteit van leven tussen zorg op afstand en gebruikelijke zorg (kwaliteit van bewijs laag). Telefonisch consult verlaagt de kwaliteit van leven mogelijk in vergelijking met gebruikelijke zorg (kwaliteit van bewijs laag)
- We zijn onzeker of zorg op afstand zelfovertuiging verbetert of verslechtert in vergelijking met gebruikelijke zorg (kwaliteit van bewijs zeer laag)
Driemaandelijkse controles
Naar Samenvatting ›- De POH kan de driemaandelijkse controles zelfstandig uitvoeren. Controleer de patiënt op indicatie samen met de POH.
- Bij patiënten die zowel een goed(e) of acceptabel(e) nuchtere bloedglucosewaarde/HbA1c, lipidenspectrum als bloeddruk hebben, volstaat in principe een zesmaandelijkse controle.
- Informeer naar:
- welbevinden
- verschijnselen die wijzen op hyper- of hypoglykemie
- problemen met het voedings- en bewegingsadvies
- problemen met de medicatie
- Controleer:
- lichaamsgewicht
- bloeddruk
- voeten (bij sims 2 of 3, indien dit niet door podotherapeut wordt gedaan)
- nuchter bloedglucose
- Wanneer bepaling van de nuchtere bloedglucosewaarde lastig is in te passen in de controles van een individuele patiënt, is desgewenst de postprandiale waarde, bijvoorbeeld 2 uur na de lunch, als parameter voor de behandeling te nemen. Dit beleid moet dan wel bij de betreffende patiënt worden gecontinueerd.
- Bij patiënten die meerdere malen op een dag insuline gebruiken, is niet de nuchtere waarde maar de vierpuntsglucosedagcurve maatgevend voor eventuele aanpassing van de insulinedosering; bepaal daarnaast elke 3 of 6 maanden het HbA1c.
- Met sensortechnologie zoals flash glucose monitoring (FGM) kan subcutane glucosemonitoring plaatsvinden zonder vingerprik. FGM kan gebruikt worden bij patiënten met intensieve insulinetherapie; de resultaten kunnen besproken worden tijdens de driemaandelijkse controles.
Frequentie van diabetescontroles
Het EFFIMODI-onderzoek keek in > 100 Nederlandse huisartsenpraktijken of bij patiënten met diabetes mellitus type 2 met redelijke cardiometabole controle (HbA1c ≤ 58 mmol/mol én bloeddruk ≤ 145 mm Hg én cholesterol ≤ 5,2 mmol/L; dat is 20-25% van alle diabetespatiënten in de huisartsenpraktijk), halfjaarlijkse controle tot dezelfde cardiometabole controle leidt als driemaandelijkse controle. Deelnemers konden eerst opgeven of zij een sterke voorkeur hadden voor driemaandelijkse of zesmaandelijkse controle, of geen voorkeur hadden. Alleen de laatstgenoemde groep (33%) werd gerandomiseerd. Na 18 maanden follow-up bleek dat er geen verschillen waren in de groep patiënten zonder voorkeur die driemaandelijks werd gecontroleerd versus de groep die zesmaandelijks werd gecontroleerd. De verschillen met deelnemers die bij de start wel een sterke voorkeur hadden en daarom volgens hun voorkeur waren behandeld, waren evenmin significant.
Sensortechnologie
- Flash glucose monitoring (FGM) biedt de patiënt de mogelijkheid om zonder vingerprikken op elk moment van de dag de actuele glucosewaarde zien en hierop te reageren. Eens per 2 weken wordt een sensor geplaatst in de bovenarm. Daarna kan de patiënt de glucosewaarde aflezen door een scanner of smartphone langs de sensor te halen (flashen). De sensor meet de glucose in het onderhuidse vocht. Gemiddeld weerspiegelt dit de glucosewaarde van 5 minuten daarvoor. Bovendien slaat de sensor de glucosewaarden 8 uur lang op zodat naast de flashmomenten de tussenliggende waarden bekend zijn. In de bijbehorende app worden gemeten waarden 90 dagen opgeslagen.
- Een andere vorm van sensortechnologie is realtime continue glucosemonitoring (rt-CGM).
- Voor de vergoeding van diabteeshulpmiddelen, waaronder FGM en rt-CGM, zie Diabeteshulpmiddelen (Zvw), geraadpleegd augustus 2023.
Jaarlijkse controles
Naar Samenvatting ›- Evalueer de individuele streefwaarden.
- Informeer naar algemeen welbevinden, eventuele visusproblemen, angina pectoris, claudicatio intermittens, tekenen van hartfalen, sensibiliteitsverlies, pijn of tintelingen in de benen en eventuele tekenen van autonome neuropathie, zoals maagontledigingsproblemen of diarree.
- Vraag expliciet naar eventuele seksuele problemen (erectieproblemen, libidoverlies, verminderde lubricatie) en bespreek met de patiënt dat er soms behandelingsmogelijkheden zijn, bijvoorbeeld het weglaten van bètablokker, ACE-remmer of simvastatine.
- Ga na of er aanwijzingen zijn voor het bestaan van een depressie (zie NHG-Standaard Depressie).
- Wees alert op cognitieve problemen die mogelijk van invloed zijn op het medicatiegebruik.
- Overweeg dosisverlaging of stoppen van bloedglucoseverlagende middelen bij verandering in de situatie, bijvoorbeeld bij toenemende kwetsbaarheid of een gering geschatte resterende levensverwachting. Zie het Kennisdocument Bloedglucoseverlagende middelen bij de MDR Polyfarmacie bij ouderen (2020).
Lichamelijk onderzoek
Naar Samenvatting ›Verricht bij de jaarlijkse controle, ook als de patiënt geen klachten heeft, lichamelijk onderzoek gericht op het ontdekken van chronische complicaties. Controleer:
- lichaamsgewicht
- bloeddruk
- conditie van de voeten
- (bij insulinegebruikers) spuitplaatsen
Tandheelkundige controle
Tussen diabetes en parodontitis bestaat een wisselwerking. Enerzijds komt een verminderde mondgezondheid (xerostomie, schimmelinfecties, cariës, gingivitis en parodontitis) vaker voor bij diabetespatiënten; anderzijds leidt een verminderde mondgezondheid tot een verslechterde glucoseregulatie. De chronische hyperglykemie veroorzaakt een inflammatie van het parodontium die (veelal irreversibele) schade toebrengt aan het steunweefsel van de gebitselementen, waardoor tanden verloren kunnen gaan. De parodontitis veroorzaakt een systemische stijging van cytokines zoals de interleukines en -6 en tumornecrosefactor-alfa. Hierdoor wordt de insulineresistentie bevorderd en daarmee de kans op verslechtering van de glykemische regulatie. In een Cochrane-review werd gevonden dat indien de parodontitis wordt behandeld, een HbA1c-daling werd bereikt van 0,40% (4 mmol/mol) (95%-BI -0,78--0,01 (-9--0 mmol/mol)).
Echter, lang niet alle diabetespatiënten gaan voor controle naar de tandarts of mondhygiënist. Tijdens de diabetescontroles kan besproken worden of de patiënt de tandarts en/of mondhygiënist regelmatig bezoekt en of er klachten zijn van pijn in de mond, een droge mond, veranderde smaak, slechte adem, bloedend en/of gezwollen tandvlees of losstaande gebitselementen. Geadviseerd wordt om tweemaal per jaar de mondgezondheid te laten controleren door een tandarts en/of mondhygiënist. Ook voor patiënten met een volledige gebitsprothese is regelmatig bezoek aan de tandarts en/of mondhygiënist geïndiceerd, vanwege het verhoogd risico op schimmelinfecties.
Laboratoriumonderzoek
Naar Samenvatting ›Verricht bij de jaarlijkse controle uitvoeriger laboratoriumonderzoek.
- Bloedonderzoek:
- nuchter glucose
- HbA1c
- creatinine
- eGFR
- kalium
- Urineonderzoek: bepaal bij alle patiënten jaarlijks de albumine-creatinineratio.
- We bevelen routinematige jaarlijkse controle van de vitamine-B12-spiegel bij metforminegebruik niet aan.
Behandeling met metformine is geassocieerd met een verhoogd risico op vitamine B12-deficiëntie.
Vitamine B12-deficiëntie kan anemie veroorzaken en demyeliniserende neurologische ziekten. Symptomen van vitamine B12-deficiëntie, zoals paresthesieën, verminderde vibratiezin en verminderde proprioceptie, zijn echter moeilijk te onderscheiden van de symptomen behorend bij perifere neuropathie. Er is nog onvoldoende aangetoond dat het behandelen van metforminegerelateerde vitamine B12-deficiëntie klinische voordelen oplevert.
Zodoende bestaan er nog te veel onduidelijkheden en vragen over screening op vitamine B12-deficiëntie bij alle metforminegebruikers.
De werkgroep volgt het NHG-Standpunt Diagnostiek van vitamine-B12-deficientie als het gaat om het bepalen van vitamine B12 bij patiënten die metformine gebruiken. Indicaties voor een vitamine B12-bepaling of (indien beschikbaar) een holotranscobalaminebepaling zijn niet-microcytaire anemie en neurologische symptomen, in het bijzonder paresthesieёn en ataxie. Vanzelfsprekend dient bij patiënten die metformine gebruiken en extra risicofactoren voor een vitamine B12-deficiёntie hebben (onder andere: overmatig alcoholgebruik, een vegetarisch of veganistisch dieet, mensen met de ziekte van Crohn, na bariatrische chirurgie) eerder aan een vitamine B12-deficiёntie gedacht te worden en de werkgroep adviseert hier dan ook laagdrempelig op te testen bij deze patiëntengroepen.
Screening op diabetische retinopathie
Naar Samenvatting ›- Herhaal de screening op diabetische retinopathie na 2 jaar.
- Beoordelaars van de fundusfoto classificeren de bevindingen in:
- geen retinopathie (R0)
- milde achtergrondretinopathie (R1)
- preproliferatieve retinopathie (R2)
- proliferatieve retinopathie (R3)
- Het verdere screeningsinterval en verwijsadvies zijn afhankelijk van deze classificatie (zie tabel h11).
- Verhoog het screeningsinterval tot 3 jaar indien er tweemaal achtereen geen retinopathie zichtbaar is.
- Na verwijzing bepaalt de oogarts de controlefrequentie. De hoofdbehandelaar bewaakt of de controles daadwerkelijk plaatsvinden.
- Voor screening op diabetische retinopathie bij start van behandeling met insuline, zie Bijlage Behandeling met insuline.
- Overweeg in samenspraak met de patiënt om in geval van een korte levensverwachting niet meer te screenen op diabetische retinopathie.
- Zie tabel h11 voor gedetailleerdere informatie over het screeningsinterval op basis van de uitslag van eerdere screenings.
| Uitslag | Screeningsinterval |
|---|---|
| Eenmaal geen zichtbare retinopathie (R0) | Tweejaarlijks |
| Tweemaal achtereen geen zichtbare retinopathie (R0) | Driejaarlijks |
| Milde (achtergrond)retinopathie (R1) | Jaarlijks |
| Preproliferatieve retinopathie (R2) | Verwijzing naar oogarts |
| Proliferatieve retinopathie (R3) | |
| Maculopathie (M1) | |
| Retinopathie in beide ogen |
Het verlies van het gezichtsvermogen door diabetische retinopathie kan preventief worden beperkt door behandeling van systemische risicofactoren als hyperglykemie, hypertensie en een verhoogd cholesterol en daarnaast door tijdige detectie op basis van regelmatige screening opdat visusbedreigende diabetische retinopathie door de oogarts kan worden behandeld.
Actuele screeningprogramma’s laten een lage incidentie van visusbedreigende retinopathie zien en een trage progressie van geen retinopathie naar milde retinopathie, en van milde retinopathie naar visusbedreigende retinopathie.
In IJslands onderzoek (follow-up 10 jaar) werd de veiligheid van tweejaarlijkse screening op retinopathie bij diabetespatiënten zonder retinopathie geëvalueerd.
Van 296 patiënten ontwikkelden 172 geen retinopathie, 96 milde non-proliferatieve retinopathie, 6 klinisch significant macula-oedeem, 23 preproliferatieve retinopathie en 4 diabetespatiënten ontwikkelden proliferatieve diabetische retinopathie. Alle patiënten die macula-oedeem of proliferatieve retinopathie ontwikkelden, waren reeds gediagnosticeerd met milde non-proliferatieve retinopathie en ondergingen reeds jaarlijkse screening voordat visusbedreigende retinopathie ontstond. Bij geen enkele patiënt was er sprake van een bovenmatige uitstel van behandeling. De auteurs concluderen dat tweejaarlijkse screening op retinopathie veilig en effectief is bij diabetespatiënten zonder retinopathie.
Deze bevindingen zijn in overeenstemming met die van Nederlandse onderzoekers. In Nederlandse onderzoek, bestond er 6 jaar na het stellen van de diagnose diabetes mellitus type 2 bij 90% geen diabetische retinopathie, bij 4,0% was een trage en bij 1,4% een snelle progressie naar proliferatieve diabetische retinopathie. Bij 0,8% werd een persisterende proliferatieve diabetische retinopathie of status na lasercoagulatie gevonden. In dit onderzoek had 94% van diabetespatiënten in de loop van 6 jaar geen visusbedreigende retinopathie.
De MDR Diabetische retinopathie adviseert op retinopathie te screenen binnen 3 maanden na het stellen van de diagnose diabetes mellitus type 2. Als er geen afwijkingen zijn, volgt controle na 2 jaar. Nieuw is dat het screeningsinterval naar 3 jaar kan worden verlengd als er tweemaal achtereen geen zichtbare retinopathie is.
Snelle verbetering van de glucoseregulatie (bijvoorbeeld bij patiënten met pas ontdekte diabetes mellitus type 2 met hoge bloedglucosespiegels of overschakeling op een insulinepomp) kan tot een initiële toename van retinopathie leiden en, in geval van een ernstige retinopathie, tot glasvochtbloedingen. Verricht bij deze patiënten zo mogelijk tevoren of zo spoedig mogelijk na start van de behandeling fundusonderzoek.
Een vragenlijst werd gestuurd naar 3236 diabetespatiënten in 20 Nederlandse huisartsenpraktijken (respons 2363 patiënten). Van deze patiënten had in de 3 voorafgaande jaren 81% screening op diabetische retinopathie ondergaan. Patiënten die niet waren gescreend hadden minder diabeteseducatie gekregen, korter diabetes en gebruikten minder vaak insuline. Patiënten die werden gescreend op diabetische retinopathie bezochten vaker de huisartsenpraktijk en waren beter op de hoogte van de nadelige effecten van diabetische retinopathie op de gezichtsscherpte.
Beleid bij koorts, braken of diarree
Naar Samenvatting ›Aandoeningen die gepaard gaan met koorts, braken of diarree interfereren met het glucosemetabolisme en kunnen een hypo- of hyperglykemie veroorzaken, vooral bij patiënten die insuline gebruiken. Als gevolg van dehydratie door intercurrente aandoeningen is er ook een verhoogd risico op acute verslechtering van de nierfunctie (zeker bij gelijktijdig gebruik van diuretica, RAS-remmers, aldosteronantagonisten en/of NSAID’s), euglykemische ketoacidose (bij gebruik van SGLT2-remmers) en lactaatacidose (bij gebruik van metformine).
Aandachtspunten bij koorts, braken of diarree
Naar Samenvatting ›- Adviseer ter preventie van dehydratie extra vochtinname.
- Bij koorts, braken, diarree en/of (een verhoogd risico op) dehydratie kan aanpassing van medicatie nodig zijn, zie tabel h12.
- Controleer de bloedglucosewaarden en de vochthuishouding van een diabetespatiënt met koorts, braken of diarree zorgvuldig. Laat patiënten die insuline gebruiken een paar keer per dag het bloedglucose bepalen.
- Voor het beleid bij bloedglucosewaarden ≥ 15 mmol/L in combinatie met (een verhoogd risico op) dehydratie, braken, diarree en/of koorts, zie Beslisboom Hyperglykemie in de bijlagen bij deze standaard.
Bij koorts, braken, diarree en/of (een verhoogd risico op) dehydratie: | |
Metformine 1 | Staak tijdelijk |
SGLT2-remmers2 | |
SU-derivaten3 | Overweeg* glimepiride en tolbutamide tijdelijk te staken (gliclazide alleen staken als naast dehydratie de koolhydraatintake sterk verminderd is) |
Insuline3 | Overweeg* snelwerkende insuline tijdelijk te staken bij geen/zeer weinig intake. Staak (middel)langwerkende insuline niet, ook niet als de patiënt minder voedsel inneemt; overweeg wel doseringsaanpassing afhankelijk van gemeten glucosewaarden |
Bij kwetsbare patiënten of patiënten met comorbiditeit (zoals hartfalen, chronische nierschade) met (een verhoogd risico op) dehydratie: | |
RAS-remmers/ aldosteronantagonisten4 | Overweeg* tijdelijk te halveren |
Diuretica4 | Overweeg* tijdelijk te staken (overweeg bij hartfalen lisdiuretica te halveren) |
Overige antihypertensiva5 | Overweeg* tijdelijk te halveren of staken |
NSAID’s4 | Staken (indien mogelijk definitief) |
*In de overweging spelen mee het klinisch beeld (o.a. ernst en duur van klachten, mate van ziek zijn) en patiëntkenmerken (leeftijd, comorbiditeit, kwetsbaarheid) 1 risico op lactaatacidose
| |
Aandoeningen die gepaard gaan met koorts, braken of diarree interfereren met het glucosemetabolisme en kunnen, vooral bij patiënten die insuline gebruiken, een hypo- of hyperglykemie veroorzaken.
Bij infectieziekten is de insulinebehoefte groter. Wordt daaraan niet tegemoetgekomen, dan ontstaat hyperglykemie, glucosurie en polyurie, waardoor dehydratie dreigt. Daarnaast wordt overgegaan op vetverbranding wat resulteert in toegenomen ketonenvorming. Zorgvuldige controle en voldoende vochtinname zijn nodig om bij infectieziekten een hyperglykemisch coma te voorkomen. De hoeveelheid insuline kan zo nodig worden aangepast met behulp van de 2-4-6-regel.
Als gevolg van dehydratie bij koorts, braken of diarree is er een verhoogd risico op acute verslechtering van de nierfunctie (zeker bij gelijktijdig gebruik van diuretica, RAS-remmers en/of NSAID’s), euglykemische ketoacidose (bij gebruik van SGLT2-remmers) en lactaatacidose (bij gebruik van metformine) (KNMP Kennisbank, geraadpleegd 11 mei 2023).
Beleid bij hyperglykemie
Naar Samenvatting ›- Stel de diagnose hyperglykemie bij een bloedglucosewaarde ≥ 15 mmol/. Maak hierin onderscheid tussen patiënten met ziekteverschijnselen en zonder ziekteverschijnselen.
- Handel bij patiënten met hyperglykemie volgens de Beslisboom hyperglykemie in de bijlagen bij deze standaard.
De 2-4-6-regel
Naar Samenvatting ›- Meet elke 2 uur de bloedglucose tot een waarde < 15 mmol/L is bereikt; volg daarbij de volgende adviezen:
- bij bloedglucosewaarde > 15-20 mmol/L: geef 4 E snelwerkende insuline
- bij bloedglucosewaarde > 20 mmol/L: geef 6 E snelwerkende insuline
- Voorwaarden voor toepassing van de 2-4-6-regel zijn de mogelijkheid tot (zelf)controle van de glucosespiegel en de beschikbaarheid van snelwerkende insuline.
- Zie ook Beslisboom hyperglykemie in de bijlagen bij deze standaard.
Deze adviezen berusten op consensus en zijn ontleend aan het boek Protocollaire diabeteszorg editie 2022-2023.
Diabetes mellitus type 2 in remissie
Naar Samenvatting ›- We spreken van diabetes type 2 in remissie indien er ≥ 3 maanden sprake is van een nuchtere glucosewaarde < 7 mmol/L én HbA1c < 48 mmol/mol zonder gebruik van medicatie.
- Diabetes type 2 in remissie zal meestal optreden na gewichtsverlies door leefstijlverandering of na bariatrische chirurgie.
- Na het bereiken van diabetes type 2 in remissie kunnen alsnog complicaties van de ziekte optreden. Aangenomen wordt dat vooral het risico op microvasculaire complicaties in de eerste 5 jaar het grootst is.
- Patiënten met een zeer hoog risico gebruiken een SGLT2-remmer (bij contra-indicatie: GLP1-agonist) niet alleen voor glucoseregulatie, maar ook om het cardiovasculair risico te verlagen. Ook bij nuchtere glucosewaarden < 7 mmol/L en HbA1c < 48 mmol/mol wordt daarom aanbevolen deze middelen te continueren. Zodoende kunnen deze patiënten per definitie geen diabetes mellitus type 2 in remissie bereiken.
Vaststellen van diabetes type 2 in remissie
Naar Samenvatting ›- Het effect van het staken van bloedglucoseverlagende medicatie en bariatrische chirurgie is vaak binnen enkele maanden aanwezig en het HbA1c stabiliseert relatief snel. Na leefstijlverandering duurt het vaak langer voordat er een effect optreedt.
- Bepaal het nuchter glucose en het HbA1c:
- ≥ 3 maanden na staken van bloedglucoseverlagende medicatie, of;
- ≥ 3 maanden na bariatrische chirurgie én 3 maanden na staken van bloedglucoseverlagende medicatie, of;
- ≥ 6 maanden na start van leefstijlverandering én 3 maanden na het staken van bloedglucoseverlagende medicatie.
Controles
Naar Samenvatting ›- Patiënten met diabetes type 2 in remissie dienen gedurende 5 jaar nog jaarlijks gecontroleerd te worden binnen het Zorgprogramma diabetes type 2 (zie Jaarlijkse controles).
- Indien er na 5 jaar zonder bloedglucoseverlagende medicatie nog steeds sprake is van een nuchter glucose < 7 mmol/L én HbA1c < 48 mmol/mol is er sprake van diabetes type 2 in langdurige remissie.
- bij diabetes type 2 in langdurige remissie met microvasculaire complicaties (retinopathie, chronische nierschade, neuropathie) en/of voetproblemen ≥ Sims 1 blijft de patiënt levenslang in het Zorgprogramma diabetes type 2.
- de overige patiënten met diabetes type 2 in langdurige remissie hoeven niet meer gecontroleerd te worden binnen het Zorgprogramma diabetes type 2. Overweeg bij hen nog wel jaarlijks het nuchter glucose en HbA1c te controleren, omdat de kans op terugkeer van diabetes type 2 verhoogd blijft.
- Indien de glucosewaarden toch weer oplopen en passen bij de diagnose diabetes type 2, dienen verdere controles opnieuw plaats te vinden binnen het Zorgprogramma diabetes type 2.
Diabetes mellitus type 2 in remissie kan worden vastgesteld indien er ≥ 3 maanden sprake is van nuchtere glucosewaarde < 7 mmol/L én HbA1c < 48 mmol/mol zonder gebruik van medicatie.
Vaststellen diabetes type 2 in remissie
- Het effect van het staken van bloedglucoseverlagende medicatie en bariatrische chirurgie is vaak binnen enkele maanden aanwezig en het HbA1c stabiliseert relatief snel. Zodoende kan 3 maanden na het staken van bloedglucoseverlagende medicatie en bariatrische chirurgie een nuchtere glucosewaarde en het HbA1c bepaald worden om te zien of er sprake is van diabetes in remissie.
- Na verandering van leefstijl duurt het vaak langer voordat er een effect optreedt. Daarom wordt geadviseerd om na een leefstijlverandering ≥ 6 maanden te wachten alvorens een nuchtere glucosewaarde en het HbA1c te bepalen.
- Vervolgmetingen van nuchter glucose en HbA1c hoeven niet vaker dan 1 × per 3 maanden plaats te vinden, met een minimum van 1 × per jaar. Voor het vaststellen van diabetes mellitus type 2 in remissie moet er echter ≥ 3 maanden na het staken van bloedglucoseverlagende medicatie sprake zijn van zowel een nuchter bloedglucose < 7 mmol/L als een HbA1c < 48 mmol/mol.
- Het proces van afbouwen van bloedglucoseverlagende medicatie laten we hier buiten beschouwing.
Controles
Na het bereiken van diabetes mellitus type 2 in remissie kunnen alsnog complicaties van de ziekte optreden. Denk hierbij aan retinopathie, nefropathie, neuropathie en een aanhoudend verhoogd risico op hart- en vaatziekten.
Er is nog onvoldoende wetenschappelijk onderzoek beschikbaar om een uitspraak te doen over hoe lang na het bereiken van diabetes in remissie nog complicaties kunnen optreden. Om praktische redenen adviseert de werkgroep om de patiënt na het vaststellen van diabetes in remissie gedurende 5 jaar nog jaarlijks te blijven controleren op complicaties binnen het Zorgprogramma diabetes mellitus type 2. Tijdens deze jaarlijkse controle dienen ook het nuchter glucose en het HbA1c bepaald te worden.
Precieze getallen ontbreken, maar het is bekend dat hyperglykemie geregeld terugkeert bij patiënten met diabetes in remissie. Onder andere gewichtstoename, stress door andere ziekten en verdere achteruitgang van de bètacelfunctie kan leiden tot het terugkeren van diabetes mellitus type 2.
Consultatie en verwijzing
Naar Samenvatting ›Voedingsadvies
Naar Samenvatting ›Verwijs voor uitgebreid voedingsadvies na diagnose en voor overschakeling op insuline naar de diëtist.
Zelfcontroles
Naar Samenvatting ›Verwijs voor het aanleren van zelfcontroles of bij overzetting op insuline naar de diabetesverpleegkundige of POH.
Behandeling met insuline
Naar Samenvatting ›- Verwijs voor instellen op insuline bij afwezigheid van randvoorwaarden of bij onvoldoende deskundigheid in de huisartsenpraktijk naar de internist.
- Verwijs bij onvoldoende glykemische regulatie, ondanks intensieve insulinebehandeling met optimale titratie, naar de internist.
Zwangerschapswens
Naar Samenvatting ›Verwijs vrouwen met diabetes type 2 en zwangerschapswens of zwangerschap naar de internist.
Vermoeden van MODY of LADA
Naar Samenvatting ›Consulteer bij vermoeden van MODY of LADA de internist of verwijs de patiënt.
Diabetische retinopathie
Naar Samenvatting ›- Verwijs naar de oogarts bij (pre)proliferatieve retinopathie (R2/R3), maculopathie (M1) of retinopathie in beide ogen (ongeacht ernst).
- Verwijs binnen 1 week in geval van vaatnieuwvormingen, preretinale fibrose, glasvocht- of preretinale bloeding.
Verwijzing naar oogarts
De indicaties en termijn voor verwijzing zijn gebaseerd op de aanbevelingen in de MDR Diabetische retinopathie.
Mononeuropathie
Naar Samenvatting ›Verwijs bij (vermoeden van) mononeuropathie (van met name de hersenzenuwen) naar de neuroloog.
Voetproblemen
Naar Samenvatting ›- Sims 1: verwijs eventueel voor huid- en nagelzorg naar pedicure met aantekening diabetische voet.
- Sims 2 en 3: verwijs naar podotherapeut
- Ulcus (plantair of diep gelegen, bij tekenen van perifeer vaatlijden en/of tekenen van systemische infectie): verwijs met spoed naar voetenteam of naar een in diabetische voet gespecialiseerde internist, (vaat)chirurg, orthopeed of dermatoloog.
- Overige ulcera zonder genezingstendens binnen 2 weken: verwijs naar een multidisciplinair voetenteam.
Chronische nierschade
Naar Samenvatting ›Bij nierschade gelden de verwijscriteria van de NHG-Standaard Chronische nierschade.
Gebits- of mondklachten
Naar Samenvatting ›Verwijs bij klachten van gebit of mond naar tandarts en/of mondhygiënist.
Praktijkvoeringsaspecten
Naar Samenvatting ›- Veel huisartsenpraktijken leveren de zorg voor patiënten met diabetes type 2 binnen de kaders van een zorggroep waarin praktijkoverstijgende taken worden georganiseerd.
- Het lokaal aanpassen van de in deze standaard genoemde aanbevelingen leidt waarschijnlijk niet tot verbetering van de zorg.
- Voor indicatoren van de geleverde zorg op basis van gemeten prestaties en vergelijking van uitkomsten, zie ZorgstandaardDiabetes.nl van de Nederlandse Diabetes Federatie.
Zorggroep
De meeste huisartsen nemen deel aan een zorggroep. De diabeteszorggroep maakt het mogelijk om alle verschillende onderdelen van de diabeteszorg als integraal product of intergrale prestatie in te kopen en te declareren. De keten-dbc wordt afgesloten tussen een zorgverzekeraar en een diabeteszorggroep. Door deze nieuwe bekostigingssystematiek is een halt toegeroepen aan de versnipperde financiering van de verschillende onderdelen van de diabeteszorg.
In een zorggroep worden praktijkoverstijgende taken georganiseerd. De zorg voor de diabetespatiënt binnen de zorggroep wordt geleverd door verschillende disciplines die structureel samenwerken met de deelnemende huisartsenpraktijken. Dit gebeurt op basis van een zorgprogramma dat door de zorggroep multidisciplinair op basis van vigerende richtlijnen wordt vastgesteld, toegepast op de lokale situatie. De betrokken disciplines zijn minimaal de (kader)huisarts, de diabetes- of praktijkverpleegkundige en de POH. Afhankelijk van de regio kunnen er andere disciplines aan de zorggroep deelnemen. Consultatie- en verwijsafspraken zijn een integraal onderdeel van het zorgprogramma dat de zorggroep hanteert. Regionaal zullen daarom per zorggroep consensusafspraken besproken en uitgewerkt moeten worden.
Lokale en regionale richtlijnen
Op lokaal en regionaal niveau bestaat de neiging landelijke richtlijnen aan te passen. Zo werd de NHG-Standaard uit 1999 in de regio Apeldoorn behoorlijk aangescherpt. In een op praktijkniveau gerandomiseerd onderzoek in 11 solo- en 16 duo- of groepspraktijken werden 822 patiënten behandeld volgens het ‘lokale protocol’ en 818 volgens de NHG-Standaard. Het leidde niet tot relevante verschillen in het cardiovasculaire risico van de 2 groepen, noch tot meer of minder tevredenheid bij de patiënten. De auteurs concluderen dat het beter is energie te spenderen aan het verminderen van ‘klinische inertie’ dan aan het lokaal aanpassen van de richtlijnen.
NDF Zorgstandaard
Een zorgstandaard is een algemeen raamwerk op hoofdlijnen voor de behandeling van mensen met een bepaalde aandoening. Het beschrijft de norm (gebaseerd op richtlijnen en wetgeving) waaraan goede zorg voor een bepaalde aandoening zowel zorginhoudelijk als procesmatig bij voorkeur moet voldoen. Dit maakt het voor alle partijen in de markt inzichtelijk wat zij kunnen en mogen verwachten in het behandelingstraject. De NDF Zorgstandaard is het algemeen raamwerk op hoofdlijnen voor de behandeling van alle mensen met diabetes mellitus type 2 en biedt daarmee het fundament voor goede diabeteszorg in ons land.
Daarnaast biedt deze zorgstandaard concrete indicatoren om inzicht te verkrijgen in de geleverde zorg door het meten van prestaties en het vergelijken van uitkomsten. Het gaat dan om uitkomstindicatoren, procesindicatoren en indicatoren die de patiëntervaringen in de zorg in beeld brengen. Deze indicatoren hebben zowel een interne werking (verbeteren van de zorg en wetenschappelijke vakontwikkeling) als een externe werking (maatschappelijke verantwoording) waardoor de kwaliteit wordt geborgd. Voorts spelen de uitkomsten van zorg een belangrijke rol bij contractering van diabeteszorg (zie ook Overzicht en definitie van diabetesindicatoren huisartsenzorg).
Hierbij moet overigens de premisse worden gemaakt dat niet alles wat in de zorgstandaard vastgelegd wordt als wenselijke zorg ook mogelijk is: het blijft een omschrijving van de gewenste situatie, waarbij de haalbaarheid afhankelijk is van veel factoren.
Voorwaarden voor diabeteszorg
Naar Samenvatting ›Diabeteszorg door de huisarts dient aan de volgende voorwaarden te voldoen:
- protocollaire opzet
- sluitend afspraak- en oproepsysteem
- adequate registratie van de gegevens die zijn verzameld bij periodieke controles in het huisartsinformatiesysteem respectievelijk het ketenzorginformatiesysteem.
- Op basis van de e-Diabetes mellitus kernset kunnen berekeningen worden gemaakt die tot indicatoren leiden structurele samenwerking met POH, diabetesverpleegkundige, diëtist en internist/kaderhuisarts
- afstemming van de zorg met andere hulpverleners, zoals internist-nefroloog, podotherapeut en apotheker
- periodieke evaluatie van bovengenoemde aspecten
Uit diverse onderzoeken in de ‘gewone’ Nederlandse huisartsenpraktijk, met sterk uiteenlopende opzet en uitwerking, blijkt dat een goede diabetesregulering voor een substantieel deel van de diabetespopulatie mogelijk is.
In Nederlands prospectief cohortonderzoek werd gevonden dat in een ‘shared care’-setting een normale levensverwachting bij patiënten met diabetes mellitus type 2 vergeleken met de algemene bevolking haalbaar is. Een voorgeschiedenis van cardiovasculaire ziekten en albuminurie verhoogden echter het risico op verkorting van de levensverwachting.
In 57 Nederlandse huisartsenpraktijken (n = 3391) werd een Diabetes Care Protocol geïmplementeerd dat taakdelegatie aan de poh combineerde met computerondersteunde decision making.
Vergeleken met de controlepraktijken werd in de interventiepraktijken geen significant verschil in HbA1c-daling gevonden, maar wel in verbetering van het totaal cholesterol, LDL-cholesterol en bloeddruk.
Referenties
- ADAPPC. 6. Glycemic targets: standards of medical care in diabetes-2022. American Diabetes Association Professional Practice Committee. Diabetes Care
- NIV. Richtlijn Diabetes mellitus, hoofdstuk Behandeling ernstige hypoglykemie. 2014.
- Magliano DJ, Chen L, Islam RM, Carstensen B, Gregg EW, Pavkov ME, et al. Trends in the incidence of diagnosed diabetes: a multicountry analysis of aggregate data from 22 million diagnoses in high-income and middle-income settings. Lancet Diabetes Endocrinol 2021;9:203-11.
- Magliano DJ, Islam RM, Barr ELM, Gregg EW, Pavkov ME, Harding JL, et al. Trends in incidence of total or type 2 diabetes: systematic review. BMJ 2019;366:l5003.
- Agardh E, Allebeck P, Hallqvist J, Moradi T, Sidorchuk A. Type 2 diabetes incidence and socio-economic position: a systematic review and meta-analysis. Int J Epidemiol 2011;40:804-18.
- Sacerdote C, Ricceri F, Rolandsson O, Baldi I, Chirlaque MD, Feskens E, et al. Lower educational level is a predictor of incident type 2 diabetes in European countries: the EPIC-InterAct study. Int J Epidemiol 2012;41:1162-73.
- Horsselenberg M, Heins M, Leemrijse C, Nielen M, Korevaar J. Diabetes Mellitus in Nederland: Prevalentie naar migratieachtergrond en sociaaleconomische status. Utrecht: NIVEL, 2022.
- Snijder MB, Agyemang C, Peters RJ, Stronks K, Ujcic-Voortman JK, Van Valkengoed IG. Case finding and medical treatment of type 2 diabetes among different ethnic minority groups: the HELIUS study. J Diabetes Res 2017;2017:9896849.
- Armengol GD, Hayfron-Benjamin CF, Van den Born BH, Galenkamp H, Agyemang C. Microvascular and macrovascular complications in type 2 diabetes in a multi-ethnic population based in Amsterdam. The HELIUS study. Prim Care Diabetes 2021;15:528-34.
- Cohen D, Dekker JJ, Peen J, Gispen-de Wied CC. Prevalence of diabetes mellitus in chronic schizophrenic inpatients in relation to long-term antipsychotic treatment. Eur Neuropsychopharmacol 2006a;16:187-94.
- Köbberling J, Tillil H. Genetic and nutritional factors in the etiology and pathogenesis of diabetes mellitus. World Rev Nutr Diet 1990;63:102-15.
- Baan C, Van Kranen H. Welke factoren beïnvloeden de kans op diabetes mellitus? RIVM, 2011b.
- De Vegt F, Dekker JM, Jager A, Hienkens E, Kostense PJ, Stehouwer CD, et al. Relation of impaired fasting and postload glucose with incident type 2 diabetes in a Dutch population: The Hoorn Study. Jama 2001;285:2109-13.
- Dalton M, Cameron AJ, Zimmet PZ, Shaw JE, Jolley D, Dunstan DW, Welborn TA. Waist circumference, waist-hip ratio and body mass index and their correlation with cardiovascular disease risk factors in Australian adults. J Intern Med 2003;254:555-63.
- Folsom AR, Kushi LH, Anderson KE, Mink PJ, Olson JE, Hong CP, et al. Associations of general and abdominal obesity with multiple health outcomes in older women: the Iowa Women's Health Study. Arch Intern Med 2000;160:2117-28.
- Lean ME, Han TS, Seidell JC. Impairment of health and quality of life in people with large waist circumference. Lancet 1998;351:853-6.
- Van 't Riet E, Alssema M, Nijpels G, Dekker JM. Estimating the individual risk of diabetes: not on the grounds of overweight only. Ned Tijdschr Geneeskd 2008;152:2385-8.
- Hu G, Lindström J, Valle TT, Eriksson JG, Jousilahti P, Silventoinen K, et al. Physical activity, body mass index, and risk of type 2 diabetes in patients with normal or impaired glucose regulation. Arch Intern Med 2004;164:892-6.
- Tuomilehto J, Lindström J, Eriksson JG, Valle TT, Hämäläinen H, Ilanne-Parikka P, et al. Prevention of type 2 diabetes mellitus by changes in lifestyle among subjects with impaired glucose tolerance. N Engl J Med 2001;344:1343-50.
- Knowler WC, Barrett-Connor E, Fowler SE, Hamman RF, Lachin JM, Walker EA, Nathan DM. Reduction in the incidence of type 2 diabetes with lifestyle intervention or metformin. Diabetes Prevention Program Research Group. N Engl J Med 2002;346:393-403.
- Knowler WC, Fowler SE, Hamman RF, Christophi CA, Hoffman HJ, Brenneman AT, et al. 10-year follow-up of diabetes incidence and weight loss in the Diabetes Prevention Program Outcomes Study. Lancet 2009;374:1677-86.
- DPPRG. Long-term effects of lifestyle intervention or metformin on diabetes development and microvascular complications over 15-year follow-up: the Diabetes Prevention Program Outcomes Study. Lancet Diabetes Endocrinol 2015;3:866-75.
- Polonsky KS, Sturis J, Bell GI. Seminars in medicine of the Beth Israel Hospital, Boston. Non-insulin-dependent diabetes mellitus - a genetically programmed failure of the beta cell to compensate for insulin resistance. N Engl J Med 1996;334:777-83.
- Kahn SE. The relative contributions of insulin resistance and beta-cell dysfunction to the pathophysiology of type 2 diabetes. Diabetologia 2003;46:3-19.
- Stumvoll M, Mitrakou A, Pimenta W, Jenssen T, Yki-Järvinen H, Van Haeften T, et al. Use of the oral glucose tolerance test to assess insulin release and insulin sensitivity. Diabetes Care 2000;23:295-301.
- Nijpels G, Popp-Snijders C, Kostense PJ, Bouter LM, Heine RJ. Fasting proinsulin and 2-h post-load glucose levels predict the conversion to NIDDM in subjects with impaired glucose tolerance: the Hoorn Study. Diabetologia 1996;39:113-8.
- Reaven GM. Banting lecture 1988. Role of insulin resistance in human disease. Diabetes 1988;37:1595-607.
- Grundy SM. Obesity, metabolic syndrome, and cardiovascular disease. J Clin Endocrinol Metab 2004;89:2595-600.
- Lakka HM, Laaksonen DE, Lakka TA, Niskanen LK, Kumpusalo E, Tuomilehto J, Salonen JT. The metabolic syndrome and total and cardiovascular disease mortality in middle-aged men. JAMA 2002;288:2709-16.
- Robertson RP, Harmon J, Tran PO, Poitout V. Beta-cell glucose toxicity, lipotoxicity, and chronic oxidative stress in type 2 diabetes. Diabetes 2004;53 Suppl 1:S119-24.
- Stumvoll M, Goldstein BJ, Van Haeften TW. Type 2 diabetes: principles of pathogenesis and therapy. Lancet 2005;365:1333-46.
- Bulugahapitiya U, Siyambalapitiya S, Sithole J, Idris I. Is diabetes a coronary risk equivalent? Systematic review and meta-analysis. Diabet Med 2009;26:142-8.
- Engelen SE, Van der Graaf Y, Stam-Slob MC, Grobbee DE, Cramer MJ, Kappelle LJ, et al. Incidence of cardiovascular events and vascular interventions in patients with type 2 diabetes. Int J Cardiol 2017;248:301-7.
- Huxley R, Barzi F, Woodward M. Excess risk of fatal coronary heart disease associated with diabetes in men and women: meta-analysis of 37 prospective cohort studies. BMJ 2006;332:73-8.
- Leemrijse C, Heins M, Kager C, Korevaar J. Chronische nierschade in de huisartsenpraktijk: prevalentie en behandeling conform de NHG-standaarden. NIVEL, 2021.
- Meijer W, Heins M, Hek K, Nielen M. Diabetische nefropathie in de huisartsenpraktijk. NIVEL, 2020.
- Boulton AJ, Vinik AI, Arezzo JC, Bril V, Feldman EL, Freeman R, et al. Diabetic neuropathies: a statement by the American Diabetes Association. Diabetes Care 2005;28:956-62.
- Tesfaye S, Boulton AJ, Dyck PJ, Freeman R, Horowitz M, Kempler P, et al. Diabetic neuropathies: update on definitions, diagnostic criteria, estimation of severity, and treatments. Diabetes Care 2010;33:2285-93.
- Tesfaye S, Selvarajah D. Advances in the epidemiology, pathogenesis and management of diabetic peripheral neuropathy. Diabetes Metab Res Rev 2012;28 Suppl 1:8-14.
- Boulton AJ. The pathway to foot ulceration in diabetes. Med Clin North Am 2013;97:775-90.
- Prompers L, Huijberts M, Apelqvist J, Jude E, Piaggesi A, Bakker K, et al. High prevalence of ischaemia, infection and serious comorbidity in patients with diabetic foot disease in Europe. Baseline results from the Eurodiale study. Diabetologia 2007;50:18-25.
- Dorresteijn JA, Kriegsman DM, Assendelft WJ, Valk GD. Patient education for preventing diabetic foot ulceration. Cochrane Database Syst Rev 2014;2014:Cd001488.
- Adiewere P, Gillis RB, Imran Jiwani S, Meal A, Shaw I, Adams GG. A systematic review and meta-analysis of patient education in preventing and reducing the incidence or recurrence of adult diabetes foot ulcers (DFU). Heliyon 2018;4:e00614.
- Stoekenbroek RM, Lokin JLC, Nielen MM, Stroes ESG, Koelemay MJW. How common are foot problems among individuals with diabetes? Diabetic foot ulcers in the Dutch population. Diabetologia 2017;60:1271-75.
- Beulens JWJ, Yauw JS, Elders PJM, Feenstra T, Herings R, Slieker RC, et al. Prognostic models for predicting the risk of foot ulcer or amputation in people with type 2 diabetes: a systematic review and external validation study. Diabetologia 2021;64:1550-62.
- Van Baal JG, Aan De Stegge WB, Schaper NC. A multidisciplinary approach in diabetic foot disease is mandatory. Ned Tijdschr Geneeskd 2017;161:D1755.
- Anichini R, Zecchini F, Cerretini I, Meucci G, Fusilli D, Alviggi L, et al. Improvement of diabetic foot care after the Implementation of the International Consensus on the Diabetic Foot (ICDF): results of a 5-year prospective study. Diabetes Res Clin Pract 2007;75:153-8.
- Canavan RJ, Unwin NC, Kelly WF, Connolly VM. Diabetes- and nondiabetes-related lower extremity amputation incidence before and after the introduction of better organized diabetes foot care: continuous longitudinal monitoring using a standard method. Diabetes Care 2008;31:459-63.
- Nielen M, Poos R, Korevaar J. Comorbiditeit bij diabetes mellitus. NIVEL, 2020.
- Kostev K, Rathmann W. Diabetic retinopathy at diagnosis of type 2 diabetes in the UK: a database analysis. Diabetologia 2013;56:109-11.
- Zghebi SS, Steinke DT, Rutter MK, Ashcroft DM. Eleven-year multimorbidity burden among 637 255 people with and without type 2 diabetes: a population-based study using primary care and linked hospitalisation data. BMJ Open 2020;10:e033866.
- Wermeling PR, Gorter KJ, Van Stel HF, Rutten GE. Both cardiovascular and non-cardiovascular comorbidity are related to health status in well-controlled type 2 diabetes patients: a cross-sectional analysis. Cardiovasc Diabetol 2012a;11:121.
- Lin EH, Rutter CM, Katon W, Heckbert SR, Ciechanowski P, Oliver MM, et al. Depression and advanced complications of diabetes: a prospective cohort study. Diabetes Care 2010;33:264-9.
- Van Meeteren-Schram M, Baan C. Diabetes en depressie, een zorgelijk samenspel. RIVM, 2007.
- Nefs G, Pouwer F, Denollet J, Pop V. The course of depressive symptoms in primary care patients with type 2 diabetes: results from the Diabetes, Depression, Type D Personality Zuidoost-Brabant (DiaDDZoB) Study. Diabetologia 2012;55:608-16.
- De Hert M, Dekker JM, Wood D, Kahl KG, Holt RI, Möller HJ. Cardiovascular disease and diabetes in people with severe mental illness position statement from the European Psychiatric Association (EPA), supported by the European Association for the Study of Diabetes (EASD) and the European Society of Cardiology (ESC). Eur Psychiatry 2009;24:412-24.
- Biessels GJ, Deary IJ, Ryan CM. Cognition and diabetes: a lifespan perspective. Lancet Neurol 2008;7:184-90.
- McCrimmon RJ, Ryan CM, Frier BM. Diabetes and cognitive dysfunction. Lancet 2012;379:2291-9.
- Ruis C, Biessels GJ, Gorter KJ, Van den Donk M, Kappelle LJ, Rutten GE. Cognition in the early stage of type 2 diabetes. Diabetes Care 2009;32:1261-5.
- Koekkoek PS, Ruis C, Van den Donk M, Biessels GJ, Gorter KJ, Kappelle LJ, Rutten GE. Intensive multifactorial treatment and cognitive functioning in screen-detected type 2 diabetes--the ADDITION-Netherlands study: a cluster-randomized trial. J Neurol Sci 2012;314:71-7.
- Koekkoek PS, Rutten GE, Ruis C, Reijmer YD, Van den Berg E, Gorter KJ, et al. Mild depressive symptoms do not influence cognitive functioning in patients with type 2 diabetes. Psychoneuroendocrinology 2013;38:376-86.
- Exalto LG, Whitmer RA, Kappele LJ, Biessels GJ. An update on type 2 diabetes, vascular dementia and Alzheimer's disease. Exp Gerontol 2012;47:858-64.
- Rutte A, Van Splunter MM, Van Der Heijden AA, Welschen LM, Elders PJ, Dekker JM, et al. Prevalence and correlates of sexual dysfunction in men and women with type 2 diabetes. J Sex Marital Ther 2015;41:680-90.
- Cleveringa FG, Meulenberg MG, Gorter KJ, Van Den Donk M, Rutten GE. The association between erectile dysfunction and cardiovascular risk in men with Type 2 diabetes in primary care: it is a matter of age. J Diabetes Complications 2009;23:153-9.
- Grover SA, Lowensteyn I, Kaouache M, Marchand S, Coupal L, DeCarolis E, et al. The prevalence of erectile dysfunction in the primary care setting: importance of risk factors for diabetes and vascular disease. Arch Intern Med 2006;166:213-9.
- Giraldi A, Kristensen E. Sexual dysfunction in women with diabetes mellitus. J Sex Res 2010;47:199-211.
- Wallner LP, Sarma AV, Kim C. Sexual functioning among women with and without diabetes in the Boston Area Community Health Study. J Sex Med 2010;7:881-7.
- Rutherford D, Collier A. Sexual dysfunction in women with diabetes mellitus. Gynecol Endocrinol 2005;21:189-92.
- Phé V, Rouprêt M. Erectile dysfunction and diabetes: a review of the current evidence-based medicine and a synthesis of the main available therapies. Diabetes Metab 2012;38:1-13.
- Malavige LS, Levy JC. Erectile dysfunction in diabetes mellitus. J Sex Med 2009;6:1232-47.
- Vardi M, Nini A. Phosphodiesterase inhibitors for erectile dysfunction in patients with diabetes mellitus. Cochrane Database Syst Rev 2007;2007:Cd002187.
- Arafa M, El Tabie O. Medical treatment of retrograde ejaculation in diabetic patients: a hope for spontaneous pregnancy. J Sex Med 2008;5:194-8.
- Lotti F, Corona G, Degli Innocenti S, Filimberti E, Scognamiglio V, Vignozzi L, et al. Seminal, ultrasound and psychobiological parameters correlate with metabolic syndrome in male members of infertile couples. Andrology 2013;1:229-39.
- Carey IM, Critchley JA, DeWilde S, Harris T, Hosking FJ, Cook DG. Risk of infection in type 1 and type 2 diabetes compared with the general population: a matched cohort study. Diabetes Care 2018;41:513-21.
- Critchley JA, Carey IM, Harris T, DeWilde S, Hosking FJ, Cook DG. Glycemic control and risk of infections among people with type 1 or type 2 diabetes in a large primary care cohort study. Diabetes Care 2018;41:2127-35.
- Ben Q, Xu M, Ning X, Liu J, Hong S, Huang W, et al. Diabetes mellitus and risk of pancreatic cancer: A meta-analysis of cohort studies. Eur J Cancer 2011;47:1928-37.
- Campbell PT, Newton CC, Patel AV, Jacobs EJ, Gapstur SM. Diabetes and cause-specific mortality in a prospective cohort of one million U.S. adults. Diabetes Care 2012;35:1835-44.
- Stefansdottir G, Zoungas S, Chalmers J, Kengne AP, Knol MJ, Leufkens HG, et al. Intensive glucose control and risk of cancer in patients with type 2 diabetes. Diabetologia 2011;54:1608-14.
- Johnson JA, Bowker SL. Intensive glycaemic control and cancer risk in type 2 diabetes: a meta-analysis of major trials. Diabetologia 2011;54:25-31.
- Schoepf D, Potluri R, Uppal H, Natalwala A, Narendran P, Heun R. Type-2 diabetes mellitus in schizophrenia: increased prevalence and major risk factor of excess mortality in a naturalistic 7-year follow-up. Eur Psychiatry 2012;27:33-42.
- Cohen D, Stolk RP, Grobbee DE, Gispen-de Wied CC. Hyperglycemia and diabetes in patients with schizophrenia or schizoaffective disorders. Diabetes Care 2006b;29:786-91.
- McDonagh M, Peterson K, Carson S, Fu R, Thakurta S. Drug Class Reviews. Drug Class Review: Atypical Antipsychotic Drugs: Final Update 3 Report. Portland (OR): Oregon Health & Science University
- Copyright © 2010 by Oregon Health & Science University, Portland, Oregon 97239. All rights reserved.; 2010.
- Cimo A, Stergiopoulos E, Cheng C, Bonato S, Dewa CS. Effective lifestyle interventions to improve type II diabetes self-management for those with schizophrenia or schizoaffective disorder: a systematic review. BMC Psychiatry 2012;12:24.
- Van Den Donk M, Sandbaek A, Borch-Johnsen K, Lauritzen T, Simmons RK, Wareham NJ, et al. Screening for type 2 diabetes. Lessons from the ADDITION-Europe study. Diabet Med 2011;28:1416-24.
- Janssen PG, Gorter KJ, Stolk RP, Rutten GE. Low yield of population-based screening for Type 2 diabetes in the Netherlands: the ADDITION Netherlands study. Fam Pract 2007;24:555-61.
- Gezondheidsraad. Screening op type 2 diabetes. Gezondheidsraad, 2004.
- Klein Woolthuis EP, De Grauw WJ, Van Gerwen WH, Van Den Hoogen HJ, Van De Lisdonk EH, Metsemakers JF, Van Weel C. Yield of opportunistic targeted screening for type 2 diabetes in primary care: the diabscreen study. Ann Fam Med 2009;7:422-30.
- Kahn R, Alperin P, Eddy D, Borch-Johnsen K, Buse J, Feigelman J, et al. Age at initiation and frequency of screening to detect type 2 diabetes: a cost-effectiveness analysis. Lancet 2010;375:1365-74.
- Waugh N, Scotland G, McNamee P, Gillett M, Brennan A, Goyder E, et al. Screening for type 2 diabetes: literature review and economic modelling. Health Technol Assess 2007;11:iii-iv, ix-xi, 1-125.
- Norris SL, Kansagara D, Bougatsos C, Fu R. Screening adults for type 2 diabetes: a review of the evidence for the U.S. Preventive Services Task Force. Ann Intern Med 2008;148:855-68.
- Simmons RK, Echouffo-Tcheugui JB, Sharp SJ, Sargeant LA, Williams KM, Prevost AT, et al. Screening for type 2 diabetes and population mortality over 10 years (ADDITION-Cambridge): a cluster-randomised controlled trial. Lancet 2012;380:1741-8.
- Klein Woolthuis EP, De Grauw WJ, van Keeken SM, Akkermans RP, Van De Lisdonk EH, Metsemakers JF, Van Weel C. Vascular outcomes in patients with screen-detected or clinically diagnosed type 2 diabetes: Diabscreen study follow-up. Ann Fam Med 2013;11:20-7.
- Kim C, Newton KM, Knopp RH. Gestational diabetes and the incidence of type 2 diabetes: a systematic review. Diabetes Care 2002;25:1862-8.
- Nesto RW, Bell D, Bonow RO, Fonseca V, Grundy SM, Horton ES, et al. Thiazolidinedione use, fluid retention, and congestive heart failure: a consensus statement from the American Heart Association and American Diabetes Association. October 7, 2003. Circulation 2003;108:2941-8.
- Ben-Haroush A, Yogev Y, Hod M. Epidemiology of gestational diabetes mellitus and its association with Type 2 diabetes. Diabet Med 2004;21:103-13.
- Torloni MR, Betrán AP, Horta BL, Nakamura MU, Atallah AN, Moron AF, Valente O. Prepregnancy BMI and the risk of gestational diabetes: a systematic review of the literature with meta-analysis. Obes Rev 2009;10:194-203.
- Kim C, Liu T, Valdez R, Beckles GL. Does frank diabetes in first-degree relatives of a pregnant woman affect the likelihood of her developing gestational diabetes mellitus or nongestational diabetes? Am J Obstet Gynecol 2009;201:576.e1-6.
- Ehrlich SF, Hedderson MM, Feng J, Davenport ER, Gunderson EP, Ferrara A. Change in body mass index between pregnancies and the risk of gestational diabetes in a second pregnancy. Obstet Gynecol 2011;117:1323-30.
- Seghieri G, De Bellis A, Anichini R, Alviggi L, Franconi F, Breschi MC. Does parity increase insulin resistance during pregnancy? Diabet Med 2005;22:1574-80.
- Hunsberger M, Rosenberg KD, Donatelle RJ. Racial/ethnic disparities in gestational diabetes mellitus: findings from a population-based survey. Womens Health Issues 2010;20:323-8.
- NVOG. Richtlijn ‘Diabetes mellitus en zwangerschap’. Utrecht: NVOG, 2010.
- Bellamy L, Casas JP, Hingorani AD, Williams D. Type 2 diabetes mellitus after gestational diabetes: a systematic review and meta-analysis. Lancet 2009;373:1773-9.
- Smirnakis KV, Chasan-Taber L, Wolf M, Markenson G, Ecker JL, Thadhani R. Postpartum diabetes screening in women with a history of gestational diabetes. Obstet Gynecol 2005;106:1297-303.
- Stasenko M, Liddell J, Cheng YW, Sparks TN, Killion M, Caughey AB. Patient counseling increases postpartum follow-up in women with gestational diabetes mellitus. Am J Obstet Gynecol 2011;204:522.e1-6.
- WHO. Definition and diagnosis of diabetes mellitus and intermediate hyperglycaemia. Report of a WHO/IDF consultation. WHO, 2006.
- Van 't Riet E, Alssema M, Rijkelijkhuizen JM, Kostense PJ, Nijpels G, Dekker JM. Relationship between A1C and glucose levels in the general dutch population: the new Hoorn study. Diabetes Care 2010;33:61-6.
- Anonymus. Report of the expert committee on the diagnosis and classification of diabetes Mellitus. Diabetes Care 1997;20:1183-97.
- WHO. Use of glycated haemoglobin (HbA1c) in the diagnosis of diabetes mellitus. Abbreviated report of a WHO consultation. WHO, 2011.
- Van 't Riet E, Rijkelijkhuizen JM, Alssema M, Nijpels G, Stehouwer CD, Heine RJ, Dekker JM. HbA1c is an independent predictor of non-fatal cardiovascular disease in a caucasian population without diabetes: a 10-year follow-up of the Hoorn Study. Eur J Prev Cardiol 2012;19:23-31.
- Rahbar S, Blumenfeld O, Ranney HM. Studies of an unusual hemoglobin in patients with diabetes mellitus. Biochem Biophys Res Commun 1969;36:838-43.
- Tarim O, Küçükerdoğan A, Günay U, Eralp O, Ercan I. Effects of iron deficiency anemia on hemoglobin A1c in type 1 diabetes mellitus. Pediatr Int 1999;41:357-62.
- El-Agouza I, Abu Shahla A, Sirdah M. The effect of iron deficiency anaemia on the levels of haemoglobin subtypes: possible consequences for clinical diagnosis. Clin Lab Haematol 2002;24:285-9.
- Tack CJ, Lutterman JA. Problems in the interpretation of the percentage of glycosylated hemoglobin in patients with diabetes mellitus. Ned Tijdschr Geneeskd 1995;139:2289-92.
- Camargo JL, Stifft J, Gross JL. The effect of aspirin and vitamins C and E on HbA1c assays. Clin Chim Acta 2006;372:206-9.
- Gulliford MC, Ukoumunne OC. Determinants of glycated haemoglobin in the general population: associations with diet, alcohol and cigarette smoking. Eur J Clin Nutr 2001;55:615-23.
- Cohen RM, Holmes YR, Chenier TC, Joiner CH. Discordance between HbA1c and fructosamine: evidence for a glycosylation gap and its relation to diabetic nephropathy. Diabetes Care 2003;26:163-7.
- Pani LN, Korenda L, Meigs JB, Driver C, Chamany S, Fox CS, et al. Effect of aging on A1C levels in individuals without diabetes: evidence from the Framingham Offspring Study and the National Health and Nutrition Examination Survey 2001-2004. Diabetes Care 2008;31:1991-6.
- Cavagnolli G, Comerlato J, Comerlato C, Renz PB, Gross JL, Camargo JL. HbA(1c) measurement for the diagnosis of diabetes: is it enough? Diabet Med 2011;28:31-5.
- Kramer CK, Araneta MR, Barrett-Connor E. A1C and diabetes diagnosis: the Rancho Bernardo Study. Diabetes Care 2010;33:101-3.
- Little RR, Rohlfing CL, Tennill AL, Connolly S, Hanson S. Effects of sample storage conditions on glycated hemoglobin measurement: evaluation of five different high performance liquid chromatography methods. Diabetes Technol Ther 2007;9:36-42.
- Little RR, Roberts WL. A review of variant hemoglobins interfering with hemoglobin A1c measurement. J Diabetes Sci Technol 2009;3:446-51.
- Johnson M, Jones R, Freeman C, Woods HB, Gillett M, Goyder E, Payne N. Can diabetes prevention programmes be translated effectively into real-world settings and still deliver improved outcomes? A synthesis of evidence. Diabet Med 2013;30:3-15.
- Janssen PG, Gorter KJ, Stolk RP, Akarsubasi M, Rutten GE. Three years follow-up of screen-detected diabetic and non-diabetic subjects: who is better off? The ADDITION Netherlands study. BMC Fam Pract 2008;9:67.
- Houweling S, Kleefstra N, Van Ballegooie E, Miedema K, Rischen R, Heeg J. Diagnosis of diabetes mellitus: limited use for portable blood-glucose measuring devices. Ned Tijdschr Geneeskd 2005;149:694-7.
- Nijpels G, Serrée MJ, Dekker JM, Heine RJ. Self-monitoring by patients with type-2 diabetes mellitus one year after initiation: user errors in a quarter of cases. Ned Tijdschr Geneeskd 2003;147:1068-70.
- Maassen JA, Lemkes HH, Losekoot M. From gene to disease; 'maturity-onset diabetes of the young' (MODY), monogenetic inheritable forms of diabetes mellitus. Ned Tijdschr Geneeskd 2001;145:1352-3.
- Steele AM, Shields BM, Wensley KJ, Colclough K, Ellard S, Hattersley AT. Prevalence of vascular complications among patients with glucokinase mutations and prolonged, mild hyperglycemia. Jama 2014;311:279-86.
- Pozzilli P, Di Mario U. Autoimmune diabetes not requiring insulin at diagnosis (latent autoimmune diabetes of the adult): definition, characterization, and potential prevention. Diabetes Care 2001;24:1460-7.
- Crawford F, Cezard G, Chappell FM, Murray GD, Price JF, Sheikh A, et al. A systematic review and individual patient data meta-analysis of prognostic factors for foot ulceration in people with diabetes: the international research collaboration for the prediction of diabetic foot ulcerations (PODUS). Health Technol Assess 2015;19:1-210.
- IWGDF. IWGDF Guidelines on the prevention and management of diabetic foot disease 2019. (International Working Group on the Diabetic Foot). IWGDF, 2019.
- Uitewaal P, Bruijnzeels M, De Hoop T, Hoes A, Thomas S. Feasibility of diabetes peer education for turkish type 2 diabetes patients in dutch general practice. Patient Educ Couns 2004a;53:359-63.
- Norris SL, Engelgau MM, Narayan KM. Effectiveness of self-management training in type 2 diabetes: a systematic review of randomized controlled trials. Diabetes Care 2001;24:561-87.
- Deakin T, McShane CE, Cade JE, Williams RD. Group based training for self-management strategies in people with type 2 diabetes mellitus. Cochrane Database Syst Rev 2005:Cd003417.
- Trento M, Gamba S, Gentile L, Grassi G, Miselli V, Morone G, et al. Rethink Organization to iMprove Education and Outcomes (ROMEO): a multicenter randomized trial of lifestyle intervention by group care to manage type 2 diabetes. Diabetes Care 2010;33:745-7.
- Davies MJ, Heller S, Skinner TC, Campbell MJ, Carey ME, Cradock S, et al. Effectiveness of the diabetes education and self management for ongoing and newly diagnosed (DESMOND) programme for people with newly diagnosed type 2 diabetes: cluster randomised controlled trial. BMJ 2008;336:491-5.
- Khunti K, Gray LJ, Skinner T, Carey ME, Realf K, Dallosso H, et al. Effectiveness of a diabetes education and self management programme (DESMOND) for people with newly diagnosed type 2 diabetes mellitus: three year follow-up of a cluster randomised controlled trial in primary care. BMJ 2012;344:e2333.
- Thoolen B, De Ridder D, Bensing J, Maas C, Griffin S, Gorter K, Rutten G. Effectiveness of a self-management intervention in patients with screen-detected type 2 diabetes. Diabetes Care 2007;30:2832-7.
- Jacobs-van der Bruggen MA, Van Baal PH, Hoogenveen RT, Feenstra TL, Briggs AH, Lawson K, et al. Cost-effectiveness of lifestyle modification in diabetic patients. Diabetes Care 2009;32:1453-8.
- Van Der Wulp I, De Leeuw JR, Gorter KJ, Rutten GE. Effectiveness of peer-led self-management coaching for patients recently diagnosed with type 2 diabetes mellitus in primary care: a randomized controlled trial. Diabet Med 2012;29:e390-7.
- Heinrich E, Candel MJ, Schaper NC, de Vries NK. Effect evaluation of a motivational interviewing based counselling strategy in diabetes care. Diabetes Res Clin Pract 2010;90:270-8.
- Tshiananga JK, Kocher S, Weber C, Erny-Albrecht K, Berndt K, Neeser K. The effect of nurse-led diabetes self-management education on glycosylated hemoglobin and cardiovascular risk factors: a meta-analysis. Diabetes Educ 2012;38:108-23.
- Duke SA, Colagiuri S, Colagiuri R. Individual patient education for people with type 2 diabetes mellitus. Cochrane Database Syst Rev 2009;2009:Cd005268.
- Verhulst MJL, Loos BG, Gerdes VEA, Teeuw WJ. Evaluating all potential oral complications of diabetes mellitus. Front Endocrinol (Lausanne) 2019a;10:56.
- Borgnakke WS. IDF diabetes atlas: diabetes and oral health - a two-way relationship of clinical importance. Diabetes Res Clin Pract 2019;157:107839.
- Van Beekveld J, Timmerman M, Hart H. Mondzorg bij diabetescontrole? Huis&Wet 2013;56:179-81.
- Simpson TC, Needleman I, Wild SH, Moles DR, Mills EJ. Treatment of periodontal disease for glycaemic control in people with diabetes. Cochrane Database Syst Rev 2010:Cd004714.
- D'Aiuto F, Gkranias N, Bhowruth D, Khan T, Orlandi M, Suvan J, et al. Systemic effects of periodontitis treatment in patients with type 2 diabetes: a 12 month, single-centre, investigator-masked, randomised trial. Lancet Diabetes Endocrinol 2018;6:954-65.
- Verhulst MJ, Teeuw WJ, Gerdes VE, Loos BG. Self-reported oral health and quality of life in patients with type 2 diabetes mellitus in primary care: a multi-center cross-sectional study. Diabetes Metab Syndr Obes 2019b;12:883-99.
- Eke PI, Dye BA, Wei L, Slade GD, Thornton-Evans GO, Beck JD, et al. Self-reported measures for surveillance of periodontitis. J Dent Res 2013;92:1041-7.
- Verhulst MJL, Teeuw WJ, Bizzarro S, Muris J, Su N, Nicu EA, et al. A rapid, non-invasive tool for periodontitis screening in a medical care setting. BMC Oral Health 2019c;19:87.
- Looijmans-Van den Akker I, Verheij TJ, Buskens E, Nichol KL, Rutten GE, Hak E. Clinical effectiveness of first and repeat influenza vaccination in adult and elderly diabetic patients. Diabetes Care 2006;29:1771-6.
- Burda MH, Van Der Horst F, Van Den Akker M, Stork AD, Crebolder H, Van Attekum T, et al. Identifying experiential expertise to support people with diabetes mellitus in applying for and participating effectively in paid work: a qualitative study. J Occup Environ Med 2012a;54:92-100.
- Burda MH, Van Der Horst F, Van Den Akker M, Stork AD, Mesters I, Bours S, et al. Harvesting experiential expertise to support safe driving for people with diabetes mellitus: a qualitative study evaluated by peers in a survey. Patient 2012b;5:251-64.
- Darzi A. Quality and the NHS next stage review. Lancet 2008;371:1563-4.
- Kennedy A, Bower P, Reeves D, Blakeman T, Bowen R, Chew-Graham C, et al. Implementation of self management support for long term conditions in routine primary care settings: cluster randomised controlled trial. BMJ 2013;346:f2882.
- Kleefstra N, Landman GW, Houweling ST, Ubink-Veltmaat LJ, Logtenberg SJ, Meyboom-de Jong B, et al. Prediction of mortality in type 2 diabetes from health-related quality of life (ZODIAC-4). Diabetes Care 2008;31:932-3.
- Landman GW, Van Hateren KJ, Kleefstra N, Groenier KH, Gans RO, Bilo HJ. Health-related quality of life and mortality in a general and elderly population of patients with type 2 diabetes (ZODIAC-18). Diabetes Care 2010b;33:2378-82.
- Gandhi GY, Murad MH, Fujiyoshi A, Mullan RJ, Flynn DN, Elamin MB, et al. Patient-important outcomes in registered diabetes trials. Jama 2008;299:2543-9.
- Anderson RT, Narayan KM, Feeney P, Goff D, Jr., Ali MK, Simmons DL, et al. Effect of intensive glycemic lowering on health-related quality of life in type 2 diabetes: ACCORD trial. Diabetes Care 2011;34:807-12.
- Van Den Donk M, Griffin SJ, Stellato RK, Simmons RK, Sandbæk A, Lauritzen T, et al. Effect of early intensive multifactorial therapy compared with routine care on self-reported health status, general well-being, diabetes-specific quality of life and treatment satisfaction in screen-detected type 2 diabetes mellitus patients (ADDITION-Europe): a cluster-randomised trial. Diabetologia 2013;56:2367-77.
- Cleveringa FG, Minkman MH, Gorter KJ, Van Den Donk M, Rutten GE. Diabetes care protocol: effects on patient-important outcomes. A cluster randomized, non-inferiority trial in primary care. Diabet Med 2010;27:442-50.
- Gorter KJ, Tuytel GJ, De Leeuw RR, Bensing JM, Rutten GE. Opinions of patients with type 2 diabetes about responsibility, setting targets and willingness to take medication. A cross-sectional survey. Patient Educ Couns 2011;84:56-61.
- Gorter KJ, Tuytel GH, De Leeuw JR, Van Der Bijl JJ, Bensing JM, Rutten GE. Preferences and opinions of patients with type 2 diabetes on education and self-care: a cross-sectional survey. Diabet Med 2010;27:85-91.
- Willi C, Bodenmann P, Ghali WA, Faris PD, Cornuz J. Active smoking and the risk of type 2 diabetes: a systematic review and meta-analysis. Jama 2007;298:2654-64.
- Patja K, Jousilahti P, Hu G, Valle T, Qiao Q, Tuomilehto J. Effects of smoking, obesity and physical activity on the risk of type 2 diabetes in middle-aged Finnish men and women. J Intern Med 2005;258:356-62.
- Orth SR, Hallan SI. Smoking: a risk factor for progression of chronic kidney disease and for cardiovascular morbidity and mortality in renal patients-absence of evidence or evidence of absence? Clin J Am Soc Nephrol 2008;3:226-36.
- Giannopoulou I, Fernhall B, Carhart R, Weinstock RS, Baynard T, Figueroa A, Kanaley JA. Effects of diet and/or exercise on the adipocytokine and inflammatory cytokine levels of postmenopausal women with type 2 diabetes. Metabolism 2005;54:866-75.
- Wycherley TP, Noakes M, Clifton PM, Cleanthous X, Keogh JB, Brinkworth GD. A high-protein diet with resistance exercise training improves weight loss and body composition in overweight and obese patients with type 2 diabetes. Diabetes Care 2010;33:969-76.
- Slentz CA, Bateman LA, Willis LH, Granville EO, Piner LW, Samsa GP, et al. Effects of exercise training alone vs a combined exercise and nutritional lifestyle intervention on glucose homeostasis in prediabetic individuals: a randomised controlled trial. Diabetologia 2016;59:2088-98.
- Shaw K, Gennat H, O'Rourke P, Del Mar C. Exercise for overweight or obesity. Cochrane Database Syst Rev 2006;2006:Cd003817.
- Thomas DE, Elliott EJ, Naughton GA. Exercise for type 2 diabetes mellitus. Cochrane Database Syst Rev 2006;2006:Cd002968.
- Bray G, Gregg E, Haffner S, Pi-Sunyer XF, WagenKnecht LE, Walkup M, Wing R. Baseline characteristics of the randomised cohort from the Look AHEAD (Action for Health in Diabetes) study. Diab Vasc Dis Res 2006;3:202-15.
- Crasto W, Jarvis J, Khunti K, Skinner TC, Gray LJ, Brela J, et al. Multifactorial intervention in individuals with type 2 diabetes and microalbuminuria: the Microalbuminuria Education and Medication Optimisation (MEMO) study. Diabetes Res Clin Pract 2011;93:328-36.
- Moncrieft AE, Llabre MM, McCalla JR, Gutt M, Mendez AJ, Gellman MD, et al. Effects of a multicomponent life-style intervention on weight, glycemic control, depressive symptoms, and renal function in low-income, minority patients with type 2 diabetes: results of the community approach to lifestyle modification for diabetes randomized controlled trial. Psychosom Med 2016;78:851-60.
- Wing RR, Bolin P, Brancati FL, Bray GA, Clark JM, Coday M, et al. Cardiovascular effects of intensive lifestyle intervention in type 2 diabetes. N Engl J Med 2013;369:145-54.
- Look AHEAD Research Group. Effects of a long-term lifestyle modification programme on peripheral neuropathy in overweight or obese adults with type 2 diabetes: the Look AHEAD study. Diabetologia 2017;60:980-88.
- Foster GD, Borradaile KE, Sanders MH, Millman R, Zammit G, Newman AB, et al. A randomized study on the effect of weight loss on obstructive sleep apnea among obese patients with type 2 diabetes: the Sleep AHEAD study. Arch Intern Med 2009;169:1619-26.
- Faulconbridge LF, Wadden TA, Rubin RR, Wing RR, Walkup MP, Fabricatore AN, et al. One-year changes in symptoms of depression and weight in overweight/obese individuals with type 2 diabetes in the Look AHEAD study. Obesity (Silver Spring) 2012;20:783-93.
- Wing RR, Rosen RC, Fava JL, Bahnson J, Brancati F, Gendrano Iii IN, et al. Effects of weight loss intervention on erectile function in older men with type 2 diabetes in the Look AHEAD trial. J Sex Med 2010;7:156-65.
- Phelan S, Kanaya AM, Subak LL, Hogan PE, Espeland MA, Wing RR, et al. Weight loss prevents urinary incontinence in women with type 2 diabetes: results from the Look AHEAD trial. J Urol 2012;187:939-44.
- Jakicic JM, Jaramillo SA, Balasubramanyam A, Bancroft B, Curtis JM, Mathews A, et al. Effect of a lifestyle intervention on change in cardiorespiratory fitness in adults with type 2 diabetes: results from the Look AHEAD Study. Int J Obes (Lond) 2009;33:305-16.
- De Vries TI, Dorresteijn JAN, Van Der Graaf Y, Visseren FLJ, Westerink J. Heterogeneity of treatment effects from an intensive lifestyle weight loss intervention on cardiovascular events in patients with type 2 diabetes: data from the Look AHEAD Trial. Diabetes Care 2019;42:1988-94.
- Nyberg ST, Singh-Manoux A, Pentti J, Madsen IEH, Sabia S, Alfredsson L, et al. Association of healthy lifestyle with years lived without major chronic diseases. JAMA Intern Med 2020;180:760-68.
- Zhang Y, Pan XF, Chen J, Xia L, Cao A, Zhang Y, et al. Combined lifestyle factors and risk of incident type 2 diabetes and prognosis among individuals with type 2 diabetes: a systematic review and meta-analysis of prospective cohort studies. Diabetologia 2020;63:21-33.
- Curioni CC, Lourenço PM. Long-term weight loss after diet and exercise: a systematic review. Int J Obes (Lond) 2005;29:1168-74.
- Hetherington-Rauth M, Magalhães JP, Júdice PB, Melo X, Sardinha LB. Vascular improvements in individuals with type 2 diabetes following a 1 year randomised controlled exercise intervention, irrespective of changes in cardiorespiratory fitness. Diabetologia 2020;63:722-32.
- Rushing J, Wing R, Wadden TA, Knowler WC, Lawlor M, Evans M, et al. Cost of intervention delivery in a lifestyle weight loss trial in type 2 diabetes: results from the Look AHEAD clinical trial. Obes Sci Pract 2017;3:15-24.
- Espeland MA, Glick HA, Bertoni A, Brancati FL, Bray GA, Clark JM, et al. Impact of an intensive lifestyle intervention on use and cost of medical services among overweight and obese adults with type 2 diabetes: the action for health in diabetes. Diabetes Care 2014;37:2548-56.
- Zhang P, Atkinson KM, Bray GA, Chen H, Clark JM, Coday M, et al. Within-trial cost-effectiveness of a structured lifestyle intervention in adults with overweight/obesity and type 2 diabetes: results from the Action for Health in Diabetes (Look AHEAD) Study. Diabetes Care 2021;44:67-74.
- Weggemans RM, Backx FJG, Borghouts L, Chinapaw M, Hopman MTE, Koster A, et al. The 2017 Dutch physical activity guidelines. Int J Behav Nutr Phys Act 2018;15:58.
- 191. NDF. Bewegen voor mensen met (een hoog risico op) diabetes type 2. NDF, 2018.
- Cai H, Li G, Zhang P, Xu D, Chen L. Effect of exercise on the quality of life in type 2 diabetes mellitus: a systematic review. Qual Life Res 2017;26:515-30.
- Figueira FR, Umpierre D, Cureau FV, Zucatti AT, Dalzochio MB, Leitão CB, Schaan BD. Association between physical activity advice only or structured exercise training with blood pressure levels in patients with type 2 diabetes: a systematic review and meta-analysis. Sports Med 2014;44:1557-72.
- Gokhale M, Buse JB, Gray CL, Pate V, Marquis MA, Stürmer T. Dipeptidyl-peptidase-4 inhibitors and pancreatic cancer: a cohort study. Diabetes Obes Metab 2014;16:1247-56.
- Grace A, Chan E, Giallauria F, Graham PL, Smart NA. Clinical outcomes and glycaemic responses to different aerobic exercise training intensities in type II diabetes: a systematic review and meta-analysis. Cardiovasc Diabetol 2017;16:37.
- Hayashino Y, Jackson JL, Fukumori N, Nakamura F, Fukuhara S. Effects of supervised exercise on lipid profiles and blood pressure control in people with type 2 diabetes mellitus: a meta-analysis of randomized controlled trials. Diabetes Res Clin Pract 2012;98:349-60.
- Lobelo F, Stoutenberg M, Hutber A. The exercise is medicine global health initiative: a 2014 update. Br J Sports Med 2014;48:1627-33.
- Andersen LB, Schnohr P, Schroll M, Hein HO. All-cause mortality associated with physical activity during leisure time, work, sports, and cycling to work. Arch Intern Med 2000;160:1621-8.
- Arem H, Moore SC, Patel A, Hartge P, Berrington de Gonzalez A, Visvanathan K, et al. Leisure time physical activity and mortality: a detailed pooled analysis of the dose-response relationship. JAMA Intern Med 2015;175:959-67.
- Holtermann A, Mortensen OS, Burr H, Søgaard K, Gyntelberg F, Suadicani P. The interplay between physical activity at work and during leisure time--risk of ischemic heart disease and all-cause mortality in middle-aged Caucasian men. Scand J Work Environ Health 2009;35:466-74.
- Lee DC, Pate RR, Lavie CJ, Sui X, Church TS, Blair SN. Leisure-time running reduces all-cause and cardiovascular mortality risk. J Am Coll Cardiol 2014;64:472-81.
- Moore SC, Lee IM, Weiderpass E, Campbell PT, Sampson JN, Kitahara CM, et al. Association of leisure-time physical activity with risk of 26 types of cancer in 1.44 million adults. JAMA Intern Med 2016;176:816-25.
- Dohrn IM, Kwak L, Oja P, Sjöström M, Hagströmer M. Replacing sedentary time with physical activity: a 15-year follow-up of mortality in a national cohort. Clin Epidemiol 2018;10:179-86.
- Khaw KT, Jakes R, Bingham S, Welch A, Luben R, Day N, Wareham N. Work and leisure time physical activity assessed using a simple, pragmatic, validated questionnaire and incident cardiovascular disease and all-cause mortality in men and women: The European Prospective Investigation into Cancer in Norfolk prospective population study. Int J Epidemiol 2006;35:1034-43.
- Kujala UM, Kaprio J, Sarna S, Koskenvuo M. Relationship of leisure-time physical activity and mortality: the Finnish twin cohort. Jama 1998;279:440-4.
- Lavie CJ, Ozemek C, Carbone S, Katzmarzyk PT, Blair SN. Sedentary behavior, exercise, and cardiovascular health. Circ Res 2019;124:799-815.
- Martinez-Gomez D, Esteban-Cornejo I, Lopez-Garcia E, García-Esquinas E, Sadarangani KP, Veiga OL, Rodriguez-Artalejo F. Physical activity less than the recommended amount may prevent the onset of major biological risk factors for cardiovascular disease: a cohort study of 198 919 adults. Br J Sports Med 2020;54:238-44.
- NICE. Encouraging physical activity to prevent or treat specific conditions. NICE, 2018.
- NICE. Physical activity: encouraging activity in the community. NICE, 2019.
- WHO. Global action plan on physical activity 2018–2030: more active people for a healthier world. Geneva: WHO, 2018.
- Kim K, Choi S, Hwang SE, Son JS, Lee JK, Oh J, Park SM. Changes in exercise frequency and cardiovascular outcomes in older adults. Eur Heart J 2020;41:1490-99.
- Saint-Maurice PF, Troiano RP, Matthews CE, Kraus WE. Moderate-to-vigorous physical activity and all-cause mortality: do bouts matter? J Am Heart Assoc 2018;7.
- Saint-Maurice PF, Coughlan D, Kelly SP, Keadle SK, Cook MB, Carlson SA, et al. Association of leisure-time physical activity across the adult life course with all-cause and cause-specific mortality. JAMA Netw Open 2019;2:e190355.
- LaMonte MJ, Lewis CE, Buchner DM, Evenson KR, Rillamas-Sun E, Di C, et al. Both light intensity and moderate-to-vigorous physical activity measured by accelerometry are favorably associated with cardiometabolic risk factors in older women: The Objective Physical Activity and Cardiovascular Health (OPACH) Study. J Am Heart Assoc 2017;6.
- Lee JY, Chan CKY, Chua SS, Ng CJ, Paraidathathu T, Lee KKC, Lee SWH. Telemonitoring and team-based management of glycemic control on people with type 2 diabetes: a cluster-randomized controlled trial. J Gen Intern Med 2020;35:87-94.
- Byberg L, Melhus H, Gedeborg R, Sundström J, Ahlbom A, Zethelius B, et al. Total mortality after changes in leisure time physical activity in 50 year old men: 35 year follow-up of population based cohort. BMJ 2009;338:b688.
- Kirwan JP, Sacks J, Nieuwoudt S. The essential role of exercise in the management of type 2 diabetes. Cleve Clin J Med 2017;84:S15-s21.
- De las Souto-Gallardo M, Bacardí Gascón M, Jiménez Cruz A. Effect of weight loss on metabolic control in people with type 2 diabetes mellitus: systematic review. Nutr Hosp 2011;26:1242-9.
- Turner R, Cull C, Holman R. United Kingdom Prospective Diabetes Study 17: a 9-year update of a randomized, controlled trial on the effect of improved metabolic control on complications in non-insulin-dependent diabetes mellitus. Ann Intern Med 1996;124:136-45.
- Van De Laar FA, Van De Lisdonk EH, Lucassen PL, Stafleu A, Mulder J, Van Den Hoogen HJ, et al. Eating behaviour and adherence to diet in patients with type 2 diabetes mellitus. Diabet Med 2006;23:788-94.
- Gezondheidsraad. Richtlijnen goede voeding 2015. Den Haag: Gezondheidsraad, 2015.
- Franz MJ, Powers MA, Leontos C, Holzmeister LA, Kulkarni K, Monk A, et al. The evidence for medical nutrition therapy for type 1 and type 2 diabetes in adults. J Am Diet Assoc 2010;110:1852-89.
- Kirk JK, Graves DE, Craven TE, Lipkin EW, Austin M, Margolis KL. Restricted-carbohydrate diets in patients with type 2 diabetes: a meta-analysis. J Am Diet Assoc 2008;108:91-100.
- Kodama S, Saito K, Tanaka S, Maki M, Yachi Y, Sato M, et al. Influence of fat and carbohydrate proportions on the metabolic profile in patients with type 2 diabetes: a meta-analysis. Diabetes Care 2009;32:959-65.
- Hartweg J, Perera R, Montori V, Dinneen S, Neil HA, Farmer A. Omega-3 polyunsaturated fatty acids (PUFA) for type 2 diabetes mellitus. Cochrane Database Syst Rev 2008;2008:Cd003205.
- Thomas GN, Scragg R, Jiang CQ, Chan W, Marz W, Pilz S, et al. Hyperglycaemia and vitamin D: a systematic overview. Curr Diabetes Rev 2012;8:18-31.
- Bosch J, Gerstein HC, Dagenais GR, Díaz R, Dyal L, Jung H, et al. n-3 fatty acids and cardiovascular outcomes in patients with dysglycemia. N Engl J Med 2012;367:309-18.
- Suksomboon N, Poolsup N, Sinprasert S. Effects of vitamin E supplementation on glycaemic control in type 2 diabetes: systematic review of randomized controlled trials. J Clin Pharm Ther 2011;36:53-63.
- Beletate V, El Dib RP, Atallah AN. Zinc supplementation for the prevention of type 2 diabetes mellitus. Cochrane Database Syst Rev 2007:Cd005525.
- Smith DM, Pickering RM, Lewith GT. A systematic review of vanadium oral supplements for glycaemic control in type 2 diabetes mellitus. QJM 2008;101:351-8.
- Balk EM, Tatsioni A, Lichtenstein AH, Lau J, Pittas AG. Effect of chromium supplementation on glucose metabolism and lipids: a systematic review of randomized controlled trials. Diabetes Care 2007;30:2154-63.
- Kleefstra N, Houweling ST, Jansman FG, Groenier KH, Gans RO, Meyboom-de Jong B, et al. Chromium treatment has no effect in patients with poorly controlled, insulin-treated type 2 diabetes in an obese Western population: a randomized, double-blind, placebo-controlled trial. Diabetes Care 2006;29:521-5.
- Kleefstra N, Houweling ST, Bakker SJ, Verhoeven S, Gans RO, Meyboom-de Jong B, Bilo HJ. Chromium treatment has no effect in patients with type 2 diabetes in a Western population: a randomized, double-blind, placebo-controlled trial. Diabetes Care 2007;30:1092-6.
- Davis PA, Yokoyama W. Cinnamon intake lowers fasting blood glucose: meta-analysis. J Med Food 2011;14:884-9.
- UKPDS. Intensive blood-glucose control with sulphonylureas or insulin compared with conventional treatment and risk of complications in patients with type 2 diabetes (UKPDS 33). UK Prospective Diabetes Study (UKPDS) Group. Lancet 1998a;352:837-53.
- Holman RR, Paul SK, Bethel MA, Matthews DR, Neil HA. 10-year follow-up of intensive glucose control in type 2 diabetes. N Engl J Med 2008;359:1577-89.
- Verenso. Multidisciplinaire Richtlijn Diabetes, Verantwoorde diabeteszorg bij kwetsbare ouderen thuis en in verzorgingsof verpleeghuizen (deel 1). Utrecht: Verenso, 2011a.
- Verenso. Multidisciplinaire Richtlijn Diabetes. Verantwoorde diabeteszorg bij kwetsbare ouderen thuis en in verzorgings-of verpleeghuizen (deel 2 ). Utrecht: Verenso, 2011b.
- Patel A, MacMahon S, Chalmers J, Neal B, Billot L, Woodward M, et al. Intensive blood glucose control and vascular outcomes in patients with type 2 diabetes. N Engl J Med 2008;358:2560-72.
- Gerstein HC, Miller ME, Byington RP, Goff DC, Jr., Bigger JT, Buse JB, et al. Effects of intensive glucose lowering in type 2 diabetes. N Engl J Med 2008;358:2545-59.
- Bonds DE, Miller ME, Bergenstal RM, Buse JB, Byington RP, Cutler JA, et al. The association between symptomatic, severe hypoglycaemia and mortality in type 2 diabetes: retrospective epidemiological analysis of the ACCORD study. BMJ 2010;340:b4909.
- Duckworth W, Abraira C, Moritz T, Reda D, Emanuele N, Reaven PD, et al. Glucose control and vascular complications in veterans with type 2 diabetes. N Engl J Med 2009;360:129-39.
- Currie CJ, Peters JR, Tynan A, Evans M, Heine RJ, Bracco OL, et al. Survival as a function of HbA(1c) in people with type 2 diabetes: a retrospective cohort study. Lancet 2010;375:481-9.
- Landman GW, Van Hateren KJ, Kleefstra N, Groenier KH, Gans RO, Bilo HJ. The relationship between glycaemic control and mortality in patients with type 2 diabetes in general practice (ZODIAC-11). Br J Gen Pract 2010c;60:172-5.
- Huang ES, Liu JY, Moffet HH, John PM, Karter AJ. Glycemic control, complications, and death in older diabetic patients: the diabetes and aging study. Diabetes Care 2011;34:1329-36.
- Lipska KJ, Krumholz H, Soones T, Lee SJ. Polypharmacy in the aging Patient: a review of glycemic control in older adults with type 2 diabetes. Jama 2016;315:1034-45.
- Palmer SC, Tendal B, Mustafa RA, Vandvik PO, Li S, Hao Q, et al. Sodium-glucose cotransporter protein-2 (SGLT-2) inhibitors and glucagon-like peptide-1 (GLP-1) receptor agonists for type 2 diabetes: systematic review and network meta-analysis of randomised controlled trials. BMJ 2021;372:m4573.
- Shi Q, Nong K, Vandvik PO, Guyatt GH, Schnell O, Rydén L, et al. Benefits and harms of drug treatment for type 2 diabetes: systematic review and network meta-analysis of randomised controlled trials. BMJ 2023;381:e074068.
- Li S, Vandvik PO, Lytvyn L, Guyatt GH, Palmer SC, Rodriguez-Gutierrez R, et al. SGLT-2 inhibitors or GLP-1 receptor agonists for adults with type 2 diabetes: a clinical practice guideline. Bmj 2021;373:n1091.
- Hirst JA, Farmer AJ, Ali R, Roberts NW, Stevens RJ. Quantifying the effect of metformin treatment and dose on glycemic control. Diabetes Care 2012;35:446-54.
- Krentz AJ, Bailey CJ. Oral antidiabetic agents: current role in type 2 diabetes mellitus. Drugs 2005;65:385-411.
- Leiter LA, Shestakova MV, Satman I. Effectiveness of gliclazide MR 60 mg in the management of type 2 diabetes: analyses from the EASYDia trial. Diabetol Metab Syndr 2018;10:30.
- Hemmingsen B, Lund SS, Gluud C, Vaag A, Almdal T, Hemmingsen C, Wetterslev J. Intensive glycaemic control for patients with type 2 diabetes: systematic review with meta-analysis and trial sequential analysis of randomised clinical trials. BMJ 2011;343:d6898.
- Boussageon R, Bejan-Angoulvant T, Saadatian-Elahi M, Lafont S, Bergeonneau C, Kassaï B, et al. Effect of intensive glucose lowering treatment on all cause mortality, cardiovascular death, and microvascular events in type 2 diabetes: meta-analysis of randomised controlled trials. BMJ 2011;343:d4169.
- Nathan DM, Lachin JM, Bebu I, Burch HB, Buse JB, Cherrington AL, et al. Glycemia reduction in type 2 diabetes - microvascular and cardiovascular outcomes. N Engl J Med 2022;387:1075-88.
- SDWG. SCORE2-Diabetes: 10-year cardiovascular risk estimation in type 2 diabetes in Europe. SCORE2-Diabetes Working Group (SDWG) and the ESC cardiovascular risk collaboration. Eur Heart J 2023;44:2544-56.
- Saenz A, Fernandez-Esteban I, Mataix A, Ausejo M, Roque M, Moher D. Metformin monotherapy for type 2 diabetes mellitus. Cochrane Database Syst Rev 2005:Cd002966.
- Salpeter SR, Greyber E, Pasternak GA, Salpeter EE. Risk of fatal and nonfatal lactic acidosis with metformin use in type 2 diabetes mellitus: systematic review and meta-analysis. Arch Intern Med 2003;163:2594-602.
- Bolen S, Feldman L, Vassy J, Wilson L, Yeh HC, Marinopoulos S, et al. Systematic review: comparative effectiveness and safety of oral medications for type 2 diabetes mellitus. Ann Intern Med 2007;147:386-99.
- Salpeter SR, Greyber E, Pasternak GA, Salpeter Posthumous EE. Risk of fatal and nonfatal lactic acidosis with metformin use in type 2 diabetes mellitus. Cochrane Database Syst Rev 2010:Cd002967.
- Noto H, Goto A, Tsujimoto T, Noda M. Cancer risk in diabetic patients treated with metformin: a systematic review and meta-analysis. PLoS One 2012;7:e33411.
- Decensi A, Puntoni M, Goodwin P, Cazzaniga M, Gennari A, Bonanni B, Gandini S. Metformin and cancer risk in diabetic patients: a systematic review and meta-analysis. Cancer Prev Res (Phila) 2010;3:1451-61.
- Landman GW, Kleefstra N, Van Hateren KJ, Groenier KH, Gans RO, Bilo HJ. Metformin associated with lower cancer mortality in type 2 diabetes: ZODIAC-16. Diabetes Care 2010a;33:322-6.
- Stevens RJ, Ali R, Bankhead CR, Bethel MA, Cairns BJ, Camisasca RP, et al. Cancer outcomes and all-cause mortality in adults allocated to metformin: systematic review and collaborative meta-analysis of randomised clinical trials. Diabetologia 2012;55:2593-603.
- Wensveen B. Metformine ook bij ernstig verminderde nierfunctie. Doseeradvies per 1 januari beschikbaar in G-standaard. Pharm Weekbl 2017.
- Selvin E, Bolen S, Yeh HC, Wiley C, Wilson LM, Marinopoulos SS, et al. Cardiovascular outcomes in trials of oral diabetes medications: a systematic review. Arch Intern Med 2008;168:2070-80.
- Abdelmoneim AS, Hasenbank SE, Seubert JM, Brocks DR, Light PE, Simpson SH. Variations in tissue selectivity amongst insulin secretagogues: a systematic review. Diabetes Obes Metab 2012;14:130-8.
- Seino S, Takahashi H, Takahashi T, Shibasaki T. Treating diabetes today: a matter of selectivity of sulphonylureas. Diabetes Obes Metab 2012;14 Suppl 1:9-13.
- KNMP. Informatorium medicamentorum. Den Haag: KNMP, 2017.
- Drouin P. Diamicron mr once daily is effective and well tolerated in type 2 diabetes: a double-blind, randomized, multinational study. J Diabetes Complications 2000;14:185-91.
- Lu CH, Chang CC, Chuang LM, Wang CY, Jiang YD, Wu HP. Double-blind, randomized, multicentre study of the efficacy and safety of gliclazide-modified release in the treatment of Chinese type 2 diabetic patients. Diabetes Obes Metab 2006;8:184-91.
- Goudswaard AN, Furlong NJ, Rutten GE, Stolk RP, Valk GD. Insulin monotherapy versus combinations of insulin with oral hypoglycaemic agents in patients with type 2 diabetes mellitus. Cochrane Database Syst Rev 2004a;2004:Cd003418.
- Van Avendonk MJ, Rutten GE. Insulin therapy in type 2 diabetes: what is the evidence? Diabetes Obes Metab 2009b;11:415-32.
- Hemmingsen B, Christensen LL, Wetterslev J, Vaag A, Gluud C, Lund SS, Almdal T. Comparison of metformin and insulin versus insulin alone for type 2 diabetes: systematic review of randomised clinical trials with meta-analyses and trial sequential analyses. BMJ 2012;344:e1771.
- Kooy A, De Jager J, Lehert P, Bets D, Wulffelé MG, Donker AJ, Stehouwer CD. Long-term effects of metformin on metabolism and microvascular and macrovascular disease in patients with type 2 diabetes mellitus. Arch Intern Med 2009;169:616-25.
- Marso SP, McGuire DK, Zinman B, Poulter NR, Emerson SS, Pieber TR, et al. Efficacy and safety of degludec versus glargine in Type 2 Diabetes. N Engl J Med 2017;377:723-32.
- Goddijn PP, Meyboom-de Jong B, Feskens EJ, Van Ballegooie E, Bilo HJ. Differences between diabetes mellitus type 2 patients switched and not switched over to insulin treatment after specialist consultation. Ned Tijdschr Geneeskd 1998;142:1023-6.
- Goudswaard AN, Stolk RP, Zuithoff NP, De Valk HW, Rutten GE. Long-term effects of self-management education for patients with type 2 diabetes taking maximal oral hypoglycaemic therapy: a randomized trial in primary care. Diabet Med 2004b;21:491-6.
- Van Avendonk MJ, Gorter KJ, Van Den Donk M, Rutten GE. Insulin therapy in type 2 diabetes is no longer a secondary care activity in the Netherlands. Prim Care Diabetes 2009a;3:23-8.
- Greaves CJ, Brown P, Terry RT, Eiser C, Lings P, Stead JW. Converting to insulin in primary care: an exploration of the needs of practice nurses. J Adv Nurs 2003;42:487-96.
- Polonsky WH, Hajos TR, Dain MP, Snoek FJ. Are patients with type 2 diabetes reluctant to start insulin therapy? An examination of the scope and underpinnings of psychological insulin resistance in a large, international population. Curr Med Res Opin 2011;27:1169-74.
- De Grauw WJ, Van De Lisdonk EH, Van Gerwen WH, Van Den Hoogen HJ, Van Weel C. Insulin therapy in poorly controlled type 2 diabetic patients: does it affect quality of life? Br J Gen Pract 2001;51:527-32.
- Goudswaard AN, Stolk RP, Zuithoff P, De Valk HW, Rutten GE. Starting insulin in type 2 diabetes: continue oral hypoglycemic agents? A randomized trial in primary care. J Fam Pract 2004c;53:393-9.
- UKPDS. Quality of life in type 2 diabetic patients is affected by complications but not by intensive policies to improve blood glucose or blood pressure control (UKPDS 37). U.K. Prospective Diabetes Study Group. Diabetes Care 1999;22:1125-36.
- Van der Does FE, De Neeling JN, Snoek FJ, Grootenhuis PA, Kostense PJ, Bouter LM, Heine RJ. Randomized study of two different target levels of glycemic control within the acceptable range in type 2 diabetes. Effects on well-being at 1 year. Diabetes Care 1998;21:2085-93.
- Hajos TR, Pouwer F, De Grooth R, Holleman F, Twisk JW, Diamant M, Snoek FJ. The longitudinal association between glycaemic control and health-related quality of life following insulin therapy optimisation in type 2 diabetes patients. A prospective observational study in secondary care. Qual Life Res 2012;21:1359-65.
- Bakker-Verschoor B, Dekker M, Hensbergen J, La Croix N, Vrijhoef H, Van El W, al. e. EADV-richtlijn. De uitvoering van de zelfcontrole. EADV, 2004.
- EADV. EADV-richtlijn: ‘Het toedienen van insuline met de insulinepen’. Utrecht: EADV, 2017.
- Salti I, Bénard E, Detournay B, Bianchi-Biscay M, Le Brigand C, Voinet C, Jabbar A. A population-based study of diabetes and its characteristics during the fasting month of Ramadan in 13 countries: results of the epidemiology of diabetes and Ramadan 1422/2001 (EPIDIAR) study. Diabetes Care 2004;27:2306-11.
- HOPE. Effects of ramipril on cardiovascular and microvascular outcomes in people with diabetes mellitus: results of the HOPE study and MICRO-HOPE substudy. Heart Outcomes Prevention Evaluation Study Investigators. Lancet 2000;355:253-9.
- Vivante A, Golan E, Tzur D, Leiba A, Tirosh A, Skorecki K, Calderon-Margalit R. Body mass index in 1.2 million adolescents and risk for end-stage renal disease. Arch Intern Med 2012;172:1644-50.
- Ruospo M, Saglimbene VM, Palmer SC, De Cosmo S, Pacilli A, Lamacchia O, et al. Glucose targets for preventing diabetic kidney disease and its progression. Cochrane Database Syst Rev 2017;6:Cd010137.
- Metcalf L, Musgrove M, Bentley J, Berrington R, Bunting D, Mousley M, et al. Prevalence of active charcot disease in the East Midlands of England. Diabet Med 2018;35:1371-74.
- Admiraal WM, Celik F, Gerdes VE, Dallal RM, Hoekstra JB, Holleman F. Ethnic differences in weight loss and diabetes remission after bariatric surgery: a meta-analysis. Diabetes Care 2012;35:1951-8.
- Kahn R, Buse J, Ferrannini E, Stern M. The metabolic syndrome: time for a critical appraisal: joint statement from the American Diabetes Association and the European Association for the Study of Diabetes. Diabetes Care 2005;28:2289-304.
- Sjöström CD, Lissner L, Wedel H, Sjöström L. Reduction in incidence of diabetes, hypertension and lipid disturbances after intentional weight loss induced by bariatric surgery: the SOS Intervention Study. Obes Res 1999;7:477-84.
- Maggard MA, Shugarman LR, Suttorp M, Maglione M, Sugerman HJ, Livingston EH, et al. Meta-analysis: surgical treatment of obesity. Ann Intern Med 2005;142:547-59.
- Colquitt JL, Picot J, Loveman E, Clegg AJ. Surgery for obesity. Cochrane Database Syst Rev 2009:Cd003641.
- Dixon JB, Murphy DK, Segel JE, Finkelstein EA. Impact of laparoscopic adjustable gastric banding on type 2 diabetes. Obes Rev 2012;13:57-67.
- Buchwald H, Estok R, Fahrbach K, Banel D, Jensen MD, Pories WJ, et al. Weight and type 2 diabetes after bariatric surgery: systematic review and meta-analysis. Am J Med 2009;122:248-56.e5.
- Schauer PR, Kashyap SR, Wolski K, Brethauer SA, Kirwan JP, Pothier CE, et al. Bariatric surgery versus intensive medical therapy in obese patients with diabetes. N Engl J Med 2012;366:1567-76.
- Mingrone G, Panunzi S, De Gaetano A, Guidone C, Iaconelli A, Leccesi L, et al. Bariatric surgery versus conventional medical therapy for type 2 diabetes. N Engl J Med 2012;366:1577-85.
- Ahn SM, Pomp A, Rubino F. Metabolic surgery for type 2 diabetes. Ann N Y Acad Sci 2010;1212:E37-45.
- Laferrère B. Diabetes remission after bariatric surgery: is it just the incretins? Int J Obes (Lond) 2011;35 Suppl 3:S22-5.
- Maggard-Gibbons M, Maglione M, Livhits M, Ewing B, Maher AR, Hu J, et al. Bariatric surgery for weight loss and glycemic control in nonmorbidly obese adults with diabetes: a systematic review. Jama 2013;309:2250-61.
- Kral JG. ABC of obesity. Management: part III-surgery. BMJ 2006;333:900-3.
- Colucci RA. Bariatric surgery in patients with type 2 diabetes: a viable option. Postgrad Med 2011;123:24-33.
- Sjöström L, Narbro K, Sjöström CD, Karason K, Larsson B, Wedel H, et al. Effects of bariatric surgery on mortality in Swedish obese subjects. N Engl J Med 2007;357:741-52.
- Sjöström L, Lindroos AK, Peltonen M, Torgerson J, Bouchard C, Carlsson B, et al. Lifestyle, diabetes, and cardiovascular risk factors 10 years after bariatric surgery. N Engl J Med 2004;351:2683-93.
- Buchwald H, Avidor Y, Braunwald E, Jensen MD, Pories W, Fahrbach K, Schoelles K. Bariatric surgery: a systematic review and meta-analysis. Jama 2004;292:1724-37.
- Robson N, Hosseinzadeh H. Impact of telehealth care among adults living with type 2 diabetes in primary care: a systematic review and meta-analysis of randomised controlled trials. Int J Environ Res Public Health 2021;18.
- Basudev N, Crosby-Nwaobi R, Thomas S, Chamley M, Murrells T, Forbes A. A prospective randomized controlled study of a virtual clinic integrating primary and specialist care for patients with Type 2 diabetes mellitus. Diabet Med 2016;33:768-76.
- Weinstock RS, Teresi JA, Goland R, Izquierdo R, Palmas W, Eimicke JP, et al. Glycemic control and health disparities in older ethnically diverse underserved adults with diabetes: five-year results from the Informatics for Diabetes Education and Telemedicine (IDEATel) study. Diabetes Care 2011;34:274-9.
- Ramallo-Fariña Y, García-Bello MA, García-Pérez L, Boronat M, Wägner AM, Rodríguez-Rodríguez L, et al. Effectiveness of internet-based multicomponent interventions for patients and health care professionals to improve clinical outcomes in type 2 diabetes evaluated through the INDICA Study: multiarm cluster randomized controlled trial. JMIR Mhealth Uhealth 2020;8:e18922.
- Steventon A, Bardsley M, Doll H, Tuckey E, Newman SP. Effect of telehealth on glycaemic control: analysis of patients with type 2 diabetes in the whole systems demonstrator cluster randomised trial. BMC Health Serv Res 2014;14:334.
- Tang PC, Overhage JM, Chan AS, Brown NL, Aghighi B, Entwistle MP, et al. Online disease management of diabetes: engaging and motivating patients online with enhanced resources-diabetes (EMPOWER-D), a randomized controlled trial. J Am Med Inform Assoc 2013;20:526-34.
- Wild SH, Hanley J, Lewis SC, McKnight JA, McCloughan LB, Padfield PL, et al. Supported telemonitoring and glycemic control in people with type 2 diabetes: the telescot diabetes pragmatic multicenter randomized controlled trial. PLoS Med 2016;13:e1002098.
- Von Storch K, Graaf E, Wunderlich M, Rietz C, Polidori MC, Woopen C. Telemedicine-assisted self-management program for type 2 diabetes patients. Diabetes Technol Ther 2019;21:514-21.
- Warren R, Carlisle K, Mihala G, Scuffham PA. Effects of telemonitoring on glycaemic control and healthcare costs in type 2 diabetes: a randomised controlled trial. J Telemed Telecare 2018;24:586-95.
- Dario C, Toffanin R, Calcaterra F, Saccavini C, Stafylas P, Mancin S, Vio E. Telemonitoring of type 2 diabetes mellitus in Italy. Telemed J E Health 2017;23:143-52.
- Kleinman NJ, Shah A, Shah S, Phatak S, Viswanathan V. Improved medication adherence and frequency of blood glucose self-testing using an m-health platform versus usual care in a multisite randomized clinical trial among people with type 2 diabetes in India. Telemed J E Health 2017;23:733-40.
- Pressman AR, Kinoshita L, Kirk S, Barbosa GM, Chou C, Minkoff J. A novel telemonitoring device for improving diabetes control: protocol and results from a randomized clinical trial. Telemed J E Health 2014;20:109-14.
- Sun C, Sun L, Xi S, Zhang H, Wang H, Feng Y, et al. Mobile phone-based telemedicine practice in older Chinese patients with type 2 diabetes mellitus: randomized controlled trial. JMIR Mhealth Uhealth 2019;7:e10664.
- Guo SH, Hsing HC, Lin JL, Lee CC. Relationships between mobile eHealth literacy, diabetes self-care, and glycemic outcomes in Taiwanese patients with type 2 diabetes: cross-sectional study. JMIR Mhealth Uhealth 2021;9:e18404.
- Agarwal P, Mukerji G, Desveaux L, Ivers NM, Bhattacharyya O, Hensel JM, et al. Mobile app for improved self-management of type 2 diabetes: multicenter pragmatic randomized controlled trial. JMIR Mhealth Uhealth 2019;7:e10321.
- Egede LE, Williams JS, Voronca DC, Knapp RG, Fernandes JK. Randomized controlled trial of technology-assisted case management in low income adults with type 2 diabetes. Diabetes Technol Ther 2017;19:476-82.
- Lee PA, Greenfield G, Pappas Y. The impact of telehealth remote patient monitoring on glycemic control in type 2 diabetes: a systematic review and meta-analysis of systematic reviews of randomised controlled trials. BMC Health Serv Res 2018;18:495.
- Greenwood DA. Evaluation of a telehealth intervention combining structured self-monitoring of blood glucose and nurse care coordination among people with type 2 diabetes noninsulin-treated: University of California, Davis ProQuest Dissertations & Theses, 2014.
- Vaughan EM, Hyman DJ, Naik AD, Samson SL, Razjouyan J, Foreyt JP. A telehealth-supported, integrated care with CHWs, and medication-access (TIME) program for diabetes improves HbA1c: a randomized clinical trial. J Gen Intern Med 2021;36:455-63.
- Holmen H, Torbjørnsen A, Wahl AK, Jenum AK, Småstuen MC, Arsand E, Ribu L. A mobile health intervention for self-management and lifestyle change for persons with type 2 diabetes, part 2: one-year results from the Norwegian randomized controlled trial RENEWING HEALTH. JMIR Mhealth Uhealth 2014;2:e57.
- Fortmann AL, Gallo LC, Garcia MI, Taleb M, Euyoque JA, Clark T, et al. Dulce digital: an mhealth SMS-based intervention improves glycemic control in Hispanics with type 2 diabetes. Diabetes Care 2017;40:1349-55.
- Williams ED, Bird D, Forbes AW, Russell A, Ash S, Friedman R, et al. Randomised controlled trial of an automated, interactive telephone intervention (TLC Diabetes) to improve type 2 diabetes management: baseline findings and six-month outcomes. BMC Public Health 2012;12:602.
- Odnoletkova I, Goderis G, Nobels F, Fieuws S, Aertgeerts B, Annemans L, Ramaekers D. Optimizing diabetes control in people with type 2 diabetes through nurse-led telecoaching. Diabet Med 2016;33:777-85.
- Gupta U, Gupta Y, Jose D, Mani K, Jyotsna VP, Sharma G, Tandon N. Effectiveness of a video-based lifestyle education program compared to usual care in improving HbA1c and other metabolic parameters in individuals with type 2 diabetes: an open-label parallel arm randomized control trial (RCT). Diabetes Ther 2020;11:667-79.
- Wermeling PR, Van Den Donk M, Gorter KJ, Ardine De Wit G, Van Der Graaf Y, Rutten GE. Towards a more efficient diabetes control in primary care: six-monthly monitoring compared with three-monthly monitoring in type 2 diabetes - The EFFIMODI trial. Design of a randomised controlled patient-preference equivalence trial in primary care. BMC Fam Pract 2010;11:35.
- Wermeling P, Van den Donk M, Gorter K, Beulens J, Rutten G. Frequency of monitoring diabetes inprimary care: what do well-controlled patients prefer? Can J Diab 2012b;36:187-92.
- Houweling S, Bakker S, Hart H, Bilo H. Protocollaire diabeteszorg. Een praktische uitwerking van de NHG-Standaard Diabetes mellitus type 2, editie 2022-2023: Stichting Langerhans, 2022.
- Out M, Kooy A, Lehert P, Schalkwijk CA, Stehouwer CDA. Long-term treatment with metformin in type 2 diabetes and methylmalonic acid: Post hoc analysis of a randomized controlled 4.3year trial. J Diabetes Complications 2018;32:171-78.
- Aroda VR, Edelstein SL, Goldberg RB, Knowler WC, Marcovina SM, Orchard TJ, et al. Long-term metformin use and vitamin B12 deficiency in the diabetes prevention program outcomes study. J Clin Endocrinol Metab 2016;101:1754-61.
- Pratama S, Lauren BC, Wisnu W. The efficacy of vitamin B(12) supplementation for treating vitamin B(12) deficiency and peripheral neuropathy in metformin-treated type 2 diabetes mellitus patients: A systematic review. Diabetes Metab Syndr 2022;16:102634.
- NIV. Richtlijn diabetische retinopathie. NIV, 2017.
- Olafsdóttir E, Stefánsson E. Biennial eye screening in patients with diabetes without retinopathy: 10-year experience. Br J Ophthalmol 2007;91:1599-601.
- Zavrelova H, Hoekstra T, Alssema M, Welschen LM, Nijpels G, Moll AC, et al. Progression and regression: distinct developmental patterns of diabetic retinopathy in patients with type 2 diabetes treated in the diabetes care system west-friesland, the Netherlands. Diabetes Care 2011;34:867-72.
- Van Eijk KN, Blom JW, Gussekloo J, Polak BC, Groeneveld Y. Diabetic retinopathy screening in patients with diabetes mellitus in primary care: incentives and barriers to screening attendance. Diabetes Res Clin Pract 2012;96:10-6.
- Houweling S, Timmerman G, Hoogstraten M, Ubink-Veltmaat L, Verhoeven S, Bilo H. Recommendations concerning the initial regimen and dose adjustments of insulin therapy for type 2 diabetes mellitus. Ned Tijdschr Geneeskd 2002;146:1823-7.
- Riddle MC, Cefalu WT, Evans PH, Gerstein HC, Nauck MA, Oh WK, et al. Consensus report: definition and interpretation of remission in type 2 diabetes. Diabetes Care 2021;44:2438-44.
- Go AS, Chertow GM, Fan D, McCulloch CE, Hsu CY. Chronic kidney disease and the risks of death, cardiovascular events, and hospitalization. N Engl J Med 2004;351:1296-305.
- Van Bruggen R, Gorter KJ, Stolk RP, Verhoeven RP, Rutten GE. Implementation of locally adapted guidelines on type 2 diabetes. Fam Pract 2008;25:430-7.
- Goudswaard AN, Stolk RP, De Valk HW, Rutten GE. Improving glycaemic control in patients with type 2 diabetes mellitus without insulin therapy. Diabet Med 2003;20:540-4.
- De Grauw WJ, Van Gerwen WH, Van de Lisdonk EH, Van den Hoogen HJ, Van den Bosch WJ, Van Weel C. Outcomes of audit-enhanced monitoring of patients with type 2 diabetes. J Fam Pract 2002;51:459-64.
- Lutgers HL, Gerrits EG, Sluiter WJ, Ubink-Veltmaat LJ, Landman GW, Links TP, et al. Life expectancy in a large cohort of type 2 diabetes patients treated in primary care (ZODIAC-10). PLoS One 2009;4:e6817.
- Cleveringa FG, Gorter KJ, Van den Donk M, Rutten GE. Combined task delegation, computerized decision support, and feedback improve cardiovascular risk for type 2 diabetic patients: a cluster randomized trial in primary care. Diabetes Care 2008;31:2273-5.