Pijn
Richtlijnen diagnostiek
Naar Volledige tekst ›Anamnese
Naar Volledige tekst ›Vraag naar:
- duur, beloop, lokalisatie en uitstraling, aard en intensiteit van de pijn
- invloed op dagelijkse fysieke activiteiten, arbeid, en psychisch en sociaal functioneren
- factoren die de pijn verlichten of verergeren
- zelfzorg (dosering en duur van medicatie) en eerdere behandeling
- mogelijke oorzaken (raadpleeg relevante NHG-Standaarden bij vermoeden van een specifieke oorzaak)
- gebruik van medicatie die de klachten kan verklaren, bijvoorbeeld spierpijn door statines
- zorgen, ongerustheid, specifieke vragen en verwachtingen van de patiënt
Exploreer bij patiënten met een vermoeden van (dreigende) chronische pijn (zie hoofdtekst) welke invloed lichamelijke, psychische en sociale factoren op de pijn hebben.
Het SCEGS-model (Somatische, Cognitieve, Emotionele, Gedragsmatige en Sociale dimensie; zie hoofdtekst) biedt handvatten voor deze exploratie.
Lichamelijk onderzoek
Naar Volledige tekst ›Verricht zo nodig gericht lichamelijk onderzoek, bijvoorbeeld bij vermoeden van een specifieke onderliggende oorzaak of ter geruststelling van de patiënt.
Aanvullend onderzoek
Naar Volledige tekst ›Verricht zo nodig aanvullend onderzoek, bijvoorbeeld bij vermoeden van een specifieke onderliggende oorzaak.
Evaluatie
Naar Volledige tekst ›Maak onderscheid tussen:
- Acute nociceptieve pijn: treedt direct op bij niet-neurogene weefselbeschadiging. Er is een duidelijke relatie tussen de pijn en de oorzaak.
- Neuropathische pijn: gevolg van een beschadiging of ziekte van het perifere of centrale zenuwstelsel. Vanwege het chronische beloop voldoet neuropathische pijn meestal ook aan de definitie van chronische pijn.
- Dreigende chronische pijn: bij patiënten met acute pijn en risicofactoren voor een chronisch beloop, of pijn die langer aanhoudt dan verwacht, of waarvan een langdurig beloop wordt verwacht. Combineer het beleid bij acute nociceptieve pijn met dat bij chronische pijn. De balans daartussen is afhankelijk van de situatie en het beloop tijdens vervolgconsulten.
- Chronische pijn: aanhoudende pijn waarbij lichamelijke, psychische en sociale factoren in verschillende en wisselende mate bijdragen aan pijnbeleving, -gedrag, beperkingen en een verminderde kwaliteit van leven.
Deze indeling geldt ook voor patiënten met pijn bij kanker buiten de palliatieve/terminale fase.
Zie voor het beleid bij patiënten met pijn in de palliatieve/terminale fase Beleid bij pijn in de palliatieve en terminale fase.
Richtlijnen beleid
Naar Volledige tekst ›Beleid bij acute nociceptieve pijn
Naar Volledige tekst ›Voorlichting en advies
Naar Volledige tekst ›- Geef uitleg over (de behandeling van) de mogelijke oorzaak en over de aanpassing van activiteiten en werkzaamheden.
- Adviseer na een tijdelijke aanpassing van het activiteitenpatroon de dagelijkse, lichte werkzaamheden weer op te pakken.
Niet-medicamenteuze behandeling
Naar Volledige tekst ›Geef indien relevant gerichte, niet-medicamenteuze adviezen uit het Beleid bij chronische pijn.
Medicamenteuze behandeling
Naar Volledige tekst ›- Uitgangspunt: de patiënt krijgt de lichtst mogelijke, voldoende effectieve medicamenteuze behandeling, met de minste bijwerkingen.
- Voor een stappenplan, middelen en doseringen, zie tabel 1 (volwassenen) en tabel 2 (kinderen).
- Overweeg bij volwassenen NSAID’s en opioïden te combineren met paracetamol, zodat de patiënt kan volstaan met een lagere dosering NSAID’s en opioïden.
- Adviseer pijnmedicatie op vaste tijden en in voldoende dosering in te nemen.
- Streef naar tijdelijk gebruik van pijnmedicatie.
- Maak in overleg met de patiënt een afspraak om het effect te evalueren.
- Voor het beleid bij acute ernstige pijn, zie NHG-Behandelrichtlijn Geneesmiddelen in spoedeisende situaties, onderdeel Acute ernstige pijn.
Controles
Naar Volledige tekst ›- Als klachten langer aanhouden dan verwacht: breid de diagnostiek uit met klachtexploratie volgens SCEGS. Wees alert op dreigende chroniciteit.
- Vraag naar het effect en de bijwerkingen van pijnmedicatie en bespreek een eventuele aanpassing van de medicatie volgens het stappenplan: type, dosering, afbouw/stoppen.
- Voor indicaties, termijnen en de aanpak van controles, zie de hoofdtekst.
Consultatie en verwijzing
Naar Volledige tekst ›- Fysiotherapie: overweeg verwijzing bij pijnklachten aan het bewegingsapparaat.
- Bedrijfsarts: consulteer of verwijs bij werkgerelateerde problematiek.
- Medisch specialist (bijvoorbeeld een orthopeed of (neuro)chirurg): consulteer of verwijs zo nodig bij het vermoeden van behandelbare onderliggende somatische oorzaken van de pijn.
Beleid bij chronische pijn
Naar Volledige tekst ›Aanpak algemeen
Naar Volledige tekst ›- Erken de pijn en behandel volgens het biopsychosociale model: richt het beleid op het verminderen van de invloed van lichamelijke, psychische en sociale factoren.
- Formuleer samen met de patiënt haalbare behandeldoelen.
- Stimuleer de patiënt om zelf verantwoordelijkheid te nemen en actief deel te nemen aan de behandeling.
Voorlichting (educatie)
Naar Volledige tekst ›Leg uit:
- Lang aanhoudende pijn is in de regel geen signaal voor weefselschade en dus niet gevaarlijk.
- Een ontregeling van het centrale zenuwstelsel speelt waarschijnlijk een grote rol bij het aanhouden van de pijnklachten.
- Zowel lichamelijke, psychische als sociale factoren hebben een negatieve invloed op deze ontregeling van het zenuwstelsel.
Niet-medicamenteuze behandeling
Naar Volledige tekst ›Adviseer de patiënt naar afleiding en steun te zoeken en te zorgen voor een goede balans tussen ontspanning en inspanning (zie hoofdtekst).
Bespreek:
- verwijzing naar een psycholoog bij niet-helpende opvattingen, emoties en gedragingen rondom de pijn
- verwijzing naar een fysio- of oefentherapeut voor een beweeg- of oefenprogramma gericht op een actieve leefstijl, eventueel in combinatie met cognitief-gedragsmatige elementen
- begeleiding door maatschappelijk werk als chronische stress door psychosociale problemen een belangrijke rol speelt bij de pijn
Medicamenteuze behandeling
Naar Volledige tekst ›- Wees terughoudend met de medicamenteuze behandeling van patiënten met chronische pijn:
- het te verwachten effect is beperkt (pijnmedicatie heeft geen invloed op sensitisatie)
- vooral bij langdurig gebruik van NSAID’s en opioïden neemt het risico op ernstige bijwerkingen toe.
- Pas medicamenteuze behandeling toe als onderdeel van een beleid gebaseerd op het biopsychosociale model.
- Streef naar zo kort mogelijk gebruik van pijnmedicatie voor een specifiek behandeldoel.
- De voorkeur gaat uit naar een middel uit een zo laag mogelijke stap uit het medicamenteuze stappenplan voor acute nociceptieve pijn: bij voorkeur paracetamol.
- Schrijf geen opioïden voor bij chronische pijn zonder duidelijk persisterende nociceptieve component.
- Zie voor middelen en doseringen tabel 1.
Controles
Naar Volledige tekst ›- Focus niet op de ernst van de pijn, maar stel open vragen, zoals: ‘Hoe gaat het met je?’ en: ‘Welke beperkingen ervaar je door de pijn?’ Focus op het behalen van eventuele behandeldoelen.
- Bij gebruik van pijnmedicatie:
- Stop de medicatie na de met de patiënt afgesproken termijn.
- Overweeg alleen bij een duidelijke persisterende nociceptieve component van de pijn zo nodig de dosering te verhogen of over te stappen op een ander middel uit het stappenplan.
- Maak zo nodig afspraken met de patiënt over intermitterend gebruik.
- Voor termijnen en de aanpak van controles, zie de hoofdtekst.
Consultatie en verwijzing
Naar Volledige tekst ›Verwijs:
- kwetsbare ouderen met multimorbiditeit en onvoldoende resultaat van pijnbehandeling naar een specialist ouderengeneeskunde of klinisch geriater
- bij een hoge mate van beperkingen in het dagelijks leven door de pijn naar een revalidatiearts of pijnrevalidatieteam
- bij vermoeden van een behandelbare onderliggende oorzaak naar de betreffende medisch specialist
- bij specifieke pijn, > 6 maanden aanhoudende pijn, bewegingsangst, catastroferen, onduidelijkheid over beïnvloedende of onderhoudende factoren naar een pijnbehandelcentrum
- bij werkgerelateerde problemen naar de bedrijfsarts
Beleid bij neuropathische pijn
Naar Volledige tekst ›- Leg uit dat neuropathische pijn vaak een langdurig en/of chronisch beloop heeft.
- Voor voorlichting en niet-medicamenteus beleid, zie Beleid bij chronische pijn.
- Geef bij trigeminusneuralgie een proefbehandeling met carbamazepine; verhoog de dosering op geleide van de pijn, verlaag bij een goede respons tot het niveau van voldoende pijnstilling.
- Overweeg bij overige oorzaken een tricyclisch antidepressivum, zoals amitriptyline en bij ouderen nortriptyline.
- Voor het beleid bij onvoldoende effect, ongewenste bijwerkingen of contra-indicaties, zie hoofdtekst .
- Voor middelen en doseringen, zie tabel 14.
- Overweeg consultatie van de anesthesioloog-pijnspecialist voor een eventuele invasieve behandeling (infiltraties met lokaal anestheticum en corticosteroïd, specifieke zenuwblokkades, epidurale en spinale medicatietoediening).
- Verwijs een patiënt met hiv-neuropathie naar een hiv-poli.
Beleid bij pijn in de palliatieve en terminale fase
Naar Volledige tekst ›- Voor stappenplan, middelen en doseringen, zie tabel 1:
- Sla stap 3 van het stappenplan over.
- Bij matige tot ernstige pijn gaat de voorkeur uit naar sterkwerkende opioïden.
- Zie verder de hoofdtekst.
Beleid bij afbouwen na langdurig gebruik opioïden
Naar Volledige tekst ›- Overweeg met patiënten die > 1 maand (arbitrair) opioïden gebruiken de optie te bespreken om af te bouwen en te stoppen. Voor argumenten, zie de hoofdtekst.
- Bespreek met de patiënt een haalbaar doel: afbouwen tot een bepaalde dosering of stoppen: zie hoofdtekst.
- Stel een afbouwschema op in overleg met de patiënt:
- Verlaag de dosering elke week met 10-25%; ga uit van beschikbare doseereenheden.
- Hanteer een langzamer schema bij langduriger gebruik of bij voorkeur van de patiënt hiervoor.
- Informeer de patiënt over te verwachten ontwenningsverschijnselen en bespreek de mogelijkheden om hiermee om te gaan.
- Bespreek de behandelmogelijkheden bij eventueel optredende pijn.
- Adviseer een sociaal vangnet te organiseren bij gezin/familie/vrienden/collega’s.
Controles
Naar Volledige tekst ›- Spreek regelmatige controles af, bijvoorbeeld voorafgaand aan elke afbouwstap.
- Bij ontwenningsverschijnselen:
- Overweeg de volgende afbouwstap uit te stellen. Verhoog de dosering niet.
- Geef gericht advies, bij voorkeur niet-medicamenteus.
- Bij pijn: volg de richtlijnen voor het beleid bij (dreigende) chronische pijn.
- Na de laagste dosering kan de patiënt het gebruik helemaal stoppen. Dit is vaak de moeilijkste stap. Stel deze stap eventueel in overleg met de patiënt uit.
Samenwerking, consultatie en verwijzing
Naar Volledige tekst ›Verwijs patiënten die gemotiveerd zijn om af te bouwen naar een verslavingsarts (of consulteer):
- indien een eerste afbouwpoging in de huisartsenpraktijk is mislukt
- bij ernstige verslavingsproblematiek en/of ernstige psychiatrische comorbiditeit
- bij vragen of twijfels
| Geneesmiddel | (Trans)dermaal | Oraal | Rectaal | Opmerkingen |
| Stap 1 Paracetamol | ||||
Paracetamol (tablet, zetpil) | - | 3-4 dd 500-1000 mg (gedurende max. 1 maand) | Bij gebruik > 1 maand of bij levercirrose: zie tabel 3 in hoofdtekst. | |
| Stap 2a NSAID dermaal | ||||
Diclofenac (gel) | 2-4 dd 1-3% | - | - | Bij gelokaliseerde spier- en gewrichtspijn |
Ibuprofen (gel) | 2-4 dd 5% | - | - | |
| Stap 2b NSAID oraal / rectaal / intramusculair | ||||
Naproxen (tablet, zetpil) | - | 2 dd 250-500 mg | Wees alert op contra-indicaties (zie tabel 6 in hoofdtekst). Naproxen heeft laagste cardiovasculaire en hoogste gastro-intestinale risico; diclofenac heeft hoogste cardiovasculaire en laagste gastro-intestinale risico. Voor maagbescherming zie NHG-Behandelrichtlijn Preventie van maagcomplicaties. Dosering diclofenac intramusculair: 75 mg eenmalig diep intragluteaal | |
Ibuprofen (dragee, tablet) | - | 3-4 dd 400-600 mg | - | |
Diclofenac (tablet, zetpil, injectievloeistof) | - | 2-3 dd 25-50 mg of 2 dd 75 mg Bij hevige pijn: 2 dd 100 mg, gedurende max. 1-2 dagen | 2-3 dd 25-50 mg Bij hevige pijn: 2 dd 100 mg, gedurende max. 1-2 dagen | |
| Stap 3 Zwakwerkend opioïd | ||||
Tramadol (tablet, tablet met gereguleerde afgifte, druppels, zetpil) | - | 1-2 dd 50 mg, zo nodig elke 3-5 dagen verhogen tot max. 1-4 dd 100 mg (bij ouderen max. 1-3 dd 100 mg) Bij kwetsbare ouderen: 1-2 dd 4 druppels (=10-20 mg/dag), (langzaam) verhogen naar 1-4 dd 4-10 druppels (max. 100 mg/dag) | 1-2 dd 100 mg, zo nodig verhogen tot 1-4 dd 100 mg | Zet bij goed effect eventueel om naar tablet met gereguleerde afgifte. Schrijf zo kort mogelijk voor om het risico op afhankelijkheid en onthoudingsverschijnselen te beperken. |
| Stap 4 Sterkwerkend opioïd | ||||
Morfine (tablet met gereguleerde afgifte) | - | Start met 2 dd 10-30 mg (> 70 jaar of < 50 kg: 2 dd 10 mg) | - | Verhoog zo nodig geleidelijk de dosering. De benodigde dosering kan per individu sterk wisselen, afhankelijk van gewenning en verschillen in respons en tolerantie. Bij onvoldoende effect en blijvende indicatie: overweeg opioïdrotatie (zie hoofdtekst). Schrijf zo kort mogelijk voor om het risico op gewenning en afhankelijkheid te beperken. Voeg direct een laxans toe (zie NHG-Standaard Obstipatie). Geef bij misselijkheid kortdurend een anti-emeticum. Voor dosering kortwerkend opiaat bij doorbraakpijn, zie hoofdtekst. |
Oxycodon (tablet met gereguleerde afgifte) | - | Start met 2 dd 10 mg (evt. 2 dd 5 mg om kans op bijwerkingen te minimaliseren) | - | |
Fentanyl (pleister) bij slikklachten, aanhoudende misselijkheid, braken of darmobstructie | Start met 12 microg/uur, na 3 dagen pleister vervangen | - | - | |
Buprenorfine (pleister) bij slikklachten, aanhoudende misselijkheid, braken of darmobstructie | Bij matige pijn: start met 5 microg/uur; vervang pleister na 7 dagen (pas dosering zo nodig na 3 dagen aan). Bij ernstige pijn: start met 35 microg/uur; vervang pleister na 3 of 4 dagen . | - | - | |
| Stap 5: Sterkwerkend opioïd subcutaan of intraveneus | ||||
| Zie hoofdtekst. | ||||
|
Geneesmiddel |
Oraal of rectaal |
Opmerkingen |
|
Stap 1 Paracetamol |
||
|
Paracetamol (drank, tablet, zetpil) |
60 mg/kg/dag in 3-4 giften (max. 4 g/dag) (alleen indien leeftijd > 1 maand) |
Zie voor kortdurende hogere dosering bij ernstige pijn tabel 4 in hoofdtekst. |
|
Stap 2 NSAID |
||
|
Ibuprofen (drank, tablet, zetpil) |
20 mg/kg/dag in 3-4 giften (max. 30 mg/kg/dag, max. 1200 mg/dag), bij voorkeur max. 3 dagen (alleen indien leeftijd > 3 maanden) |
Geef geen NSAID bij waterpokken of gordelroos. |
Belangrijkste wijzigingen
Naar Samenvatting ›September 2023
- Naast morfine en fentanyl worden nu ook oxycodon en buprenorfine aanbevolen als voorkeursmiddelen binnen sterkwerkende opioïden.
- Cannabis wordt ook bij neuropathische pijn niet aanbevolen.
November 2021
- Het beleid bij acute nociceptieve pijn en bij chronische pijn (door sensitisatie) wordt in een apart onderdeel beschreven.
- Er is meer aandacht voor de beperkte indicatie voor pijnmedicatie bij chronische pijn.
- Er is meer aandacht voor de risico’s bij het gebruik van opioïden.
- Er zijn aanbevelingen over het afbouwen van opioïden na langdurig gebruik toegevoegd.
Kernboodschappen
Naar Samenvatting ›- Behandel bij acute nociceptieve pijn indien mogelijk de oorzaak en bied patiënten niet-medicamenteuze en medicamenteuze pijnbehandeling aan.
- Uitgangspunt bij de medicamenteuze behandeling van acute nociceptieve pijn is het stappenplan gebaseerd op de WHO-ladder. Hiermee krijgt de patiënt pijnmedicatie, in toenemende zwaarte passend bij het klachtenpatroon, met zo min mogelijk bijwerkingen.
- Adviseer pijnmedicatie op vaste tijden en in voldoende dosering in te nemen.
- Streef naar tijdelijk gebruik van pijnmedicatie en stop de medicatie bij goed effect zodra dit mogelijk is in overleg met de patiënt.
- Schrijf opioïden zo kort mogelijk voor, vanwege de ernstige bijwerkingen en het risico op gewenning en afhankelijkheid.
- Wees bij de behandeling van acute pijn alert op het ontstaan van chronische pijn en pas het beleid daarop aan.
- Besteed in het beleid bij chronische pijn aandacht aan zowel de lichamelijke als de psychische en sociale factoren die van invloed zijn op de pijnbeleving, pijngedrag en ervaren beperkingen. Dit geldt ook voor neuropathische pijn, gezien het meestal chronische beloop.
- Wees bij chronische pijn terughoudend met medicamenteuze behandeling. Schrijf bij de keus voor een medicamenteuze behandeling bij voorkeur kortdurend gebruik van paracetamol voor.
- Schrijf bij neuropathische pijn als eerste keus een tricyclisch antidepressivum voor (behalve bij trigeminusneuralgie, kies dan carbamazepine).
- Bied patiënten die langdurig opioïden gebruiken begeleiding bij het geleidelijk afbouwen van de dosering en stoppen van het opioïd.
Inleiding
Naar Samenvatting ›Scope
Naar Samenvatting ›- Richtlijnen voor de diagnostiek en het beleid bij volwassenen met acute en chronische pijn, en pijn bij kanker en/of in de palliatieve fase
- Richtlijnen voor het medicamenteuze beleid bij:
- acute nociceptieve pijn, neuropathische pijn, chronische pijn en pijn in de terminale fase (volwassenen)
- acute nociceptieve pijn (kinderen)
Buiten de scope
Naar Samenvatting ›- Behandeling van pijn in spoedeisende situaties (zie daarvoor NHG-Behandelrichtlijn Geneesmiddelen en zuurstof in spoedeisende situaties en NHG-Standaard Urinesteenlijden)
- Specifieke aanbevelingen bij buikpijn bij kinderen, hoofdpijn, keelpijn en klachten van het bewegingsapparaat (zie daarvoor NHG-Standaard Hoofdpijn, NHG-Standaard Buikpijn bij kinderen, NHG-Standaard Acute keelpijn, NHG-Standaard Artritis, NHG-Standaard Aspecifieke lagerugpijn, NHG-Standaard Enkelbandletsel, NHG-Standaard Epicondylitis, NHG-Standaard Hand- en polsklachten, NHG-Standaard Lumbosacraal radiculair syndroom, NHG-Standaard Niet-traumatische knieklachten, NHG-Standaard Polymyalgia rheumatica en arteriitis temporalis, NHG-Standaard Schouderklachten en NHG-Standaard Traumatische knieklachten)
Samenwerking en afstemming
Naar Samenvatting ›De standaard sluit met de diagnostiek en het beleid bij chronische pijn aan op de Zorgstandaard Chronische pijn.
Deze standaard sluit waar mogelijk aan op de Zorgstandaard Chronische Pijn. De Zorgstandaard beschrijft waaraan goede zorg moet voldoen, hoe optimale samenwerking tussen zorgprofessional en patiënt gerealiseerd kan worden en wat patiënten zelf kunnen doen in de omgang met pijn en wat er gedaan kan worden om chroniciteit te voorkomen.
De omgeving, cognities, emoties, verwachtingen en gedrag beïnvloeden het ontstaan, het verloop en de beleving van chronische pijn. Chronische pijn beïnvloedt ook het psychologisch welzijn en sociale relaties. De Zorgstandaard gaat uit van de biopsychosociale benadering van pijn, waarbij bij de diagnostiek en behandeling rekening gehouden wordt met lichamelijke, psychische en sociale factoren. De Zorgstandaard gaat over het gehele zorgcontinuüm binnen en tussen de nulde, eerste, tweede en derde lijn, vanuit het principe van de stepped care (getrapte zorg).
Achtergronden
Naar Samenvatting ›Pijn
Naar Samenvatting ›Pijn is een onplezierige sensorische en emotionele ervaring die geassocieerd is of lijkt met actuele weefselschade.
De definitie is afkomstig van de International Association for the Study of Pain (IASP). Pijn is subjectief; ieder individu leert het woord pijn te gebruiken op basis van ervaringen met weefselschade.
Acute nociceptieve pijn
Naar Samenvatting ›Acute nociceptieve pijn is pijn die direct optreedt bij niet-neurogene weefselbeschadiging. Deze pijngewaarwording zorgt in de regel voor een adequate lichamelijke reactie: men probeert te voorkomen dat men met de stimulus in aanraking komt.
Pathofysiologie
Naar Samenvatting ›- In het gehele lichaam komen pijnreceptoren voor. Pijn ontstaat doordat uit beschadigd weefsel diverse neurotransmitters en andere chemische mediatoren vrijkomen die de pijnreceptoren stimuleren (nociceptie).
- Na herhaaldelijke en meestal intense pijnstimuli kan perifere sensitisatie optreden van het nociceptieve systeem. Sensitisatie zorgt voor een drempelverlaging en versterkte gewaarwording van een pijnlijke prikkel (hyperalgesie) en pijn zonder voorafgaande pijnprikkel of door onschuldige prikkels die normaal gesproken niet pijnlijk zijn (allodynie). Deze situatie van verhoogde sensitiviteit is lokaal en verdwijnt normaliter na verloop van tijd.
Over het hele lichaam komen pijnreceptoren voor. Dit zijn vrije uiteinden van sensibele zenuwen in de perifere organen die door verschillende stimuli geprikkeld kunnen worden. Zij bestaan uit dunne, niet-gemyeliniseerde C-vezels met een lage geleidingssnelheid (< 1 m/s) en dikkere gemyeliniseerde A-deltavezels met snelle geleiding. Prikkeling van de C-vezels geeft een zeurende, doffe of brandende pijn, prikkeling van de A-deltavezels geeft een scherpe pijn. In het algemeen is weefselbeschadiging de oorzaak van de pijn. Door weefselbeschadiging komen diverse neurotransmitters en chemische mediatoren vrij die de pijnreceptoren direct of indirect prikkelen. Voorbeelden zijn acetylcholine, noradrenaline, dopamine, glycine, gamma-aminoboterzuur (GABA), glutaminezuur, substance-P, serotonine, endorfinen en enkefaline. De laatste twee zijn endogene opioïdpeptiden die pijn remmen. Histamine, serotonine en bradykinine werken stimulerend op de pijnreceptoren; prostaglandinen maken de pijnreceptoren gevoeliger voor deze stoffen.
Prikkels van de pijnreceptoren worden via sensibele zenuwbanen naar de achterhoorn van het ruggenmerg voortgeleid, daar aan de ascenderende banen in de tractus spinothalamicus overgedragen en bereiken van daaruit de cortex via het verlengde merg, de thalamus, de periventriculaire grijze massa, de hersenstam en de formatio reticularis. Vanuit de hersenen, in het bijzonder vanuit de formatio reticularis en de medulla, lopen descenderende banen terug naar de achterhoorn.
Het pijnsignaal wordt op alle niveaus gemoduleerd: in de periferie, in de opstijgende en afdalende banen en in de hersenen zelf. Deze pijnmodulatie bepaalt grotendeels waar en hoe een individu pijn ervaart.
Symptomatologie en beloop
Naar Samenvatting ›- Vaak verdwijnt de pijn door de onderliggende aandoening te behandelen. Met adequate pijnbehandeling door middel van voorlichting, advisering over fysieke activiteiten en farmacotherapie probeert men het ontstaan van chroniciteit te voorkomen.
- Pijnbeleving is subjectief. Talrijke psychische, sociale en culturele factoren bepalen hoe mensen de pijnprikkel ervaren (pijndrempel), welke betekenis zij aan de pijn toekennen (interpretatie) en hoe zij de klacht presenteren (hulpvraag).
- Bij vrouwen ligt de drempel voor pijnstimuli lager dan bij mannen. Vrouwen ervaren pijn intenser en gebruiken vaker pijnmedicatie.
De Amerikaanse neurochirurg Loeser ontwikkelde een model over pijn en pijnbeleving (figuur 1).
De eerste cirkel is de pijnprikkel: de nociceptie. Als de pijn een bepaalde drempel over gaat ontstaat de pijngewaarwording: de tweede cirkel. In de derde cirkel wordt dit gevolgd door het ‘lijden aan pijn’, de emotionele pijnbeleving. In de laatste cirkel wordt het pijngedrag zoals hulp vragen of medicatie innemen weergegeven. Hier ontstaat er communicatie tussen de pijnlijder en de omgeving. De cirkels zijn weer te geven in verschillende grootte voor elke individuele patiënt.
Uit onderzoek komt consistent naar voren dat de drempel voor pijnstimuli bij vrouwen lager is dan bij mannen en dat zij pijn intenser ervaren. Voorts bestaat er een sekseverschil in de respons op analgetica. Onderliggende oorzaken die deze sekseverschillen in pijnervaring verklaren zijn multifactorieel en complex (psychosociale, culturele en biologische (hormonale) factoren). Vrouwen blijken vaker pijnmedicatie te gebruiken. In een meta-analyse (26 cohortonderzoeken, 1 RCT) werden pijnscores en werkzaamheid van therapie bij vrouwen en mannen met reumatoïde artritis, spondylitis, artritis psoriatica en reactieve artritis vergeleken. Bij vrouwen werden hogere pijnscores gevonden (Standardized Mean Difference (SMD) in VAS-scores was 0,21; 95%-BI 0,16 tot 0,26).
(Dreigende) chronische pijn
Naar Samenvatting ›Chronische pijn is een persisterend, multifactorieel gezondheidsprobleem waarbij lichamelijke, psychische en sociale factoren (samen genoemd: biopsychosociale factoren) in verschillende mate en in wisselende onderlinge samenhang bijdragen aan:
- pijnbeleving
- pijngedrag
- ervaren beperkingen in het dagelijks functioneren
- ervaren verminderde kwaliteit van leven
Deze definitie betekent praktisch gezien dat de diagnose niet gebaseerd is op een afkappunt in tijdsduur van de pijn. Het verschil met acute pijn is dat het verband met de weefselschade en pijn als alarmsignaal minder sterk wordt (maar deze hoeft niet afwezig te zijn) en psychische en sociale factoren een grotere rol spelen. Dit geldt zowel voor acute pijn, naarmate het herstel langer duurt dan gezien de oorzaak verwacht wordt, als voor pijn door een chronische onderliggende aandoening, zoals artrose, reumatoïde artritis of een maligniteit.
Van dreigende chronische pijn is bijvoorbeeld sprake bij patiënten met:
- acute pijn met risicofactoren voor een chronisch beloop, of behorend tot een risicogroep (zie Symptomatologie en beloop, risicofactoren)
- acute pijn die langer aanhoudt dan op grond van de oorzaak te verwachten is (zonder dat de diagnose chronische pijn al te stellen is)
- acute pijn door een oorzaak waarvan een langdurig beloop verwacht wordt
De standaard sluit aan bij de definitie van chronische pijn in de Zorgstandaard Chronische pijn. Van oudsher wordt pijn als chronisch beschouwd als de pijn langer bestaat dan van het normale beloop van het herstel mag worden verwacht. Hoewel de IASP voor chronische pijn wel een afkappunt in tijdsduur hanteert, namelijk 3 maanden, is er in de Zorgstandaard expliciet voor gekozen om dit los te laten. De Zorgstandaard stelt dat een duidelijk afkappunt van een tijdsduur voor normaal herstel niet te geven is. De normale duur van het herstel hangt sterk af van de oorzaak. Bij pijn door chronische aandoeningen treedt geen herstel op.
Diagnosecode voor chronische pijn
In de ICD (International Classification of Diseases)-11 worden voor het eerst diagnosecodes geïntroduceerd voor chronische pijn, zodat de diagnose als afzonderlijk probleem vastgelegd kan worden.
Epidemiologie
Naar Samenvatting ›- De prevalentie van matige tot ernstige chronische pijn onder Nederlandse volwassenen bedraagt naar schatting ongeveer 18%.
- Chronische pijn komt in vergelijking met andere chronische aandoeningen vaak voor.
- Het betreft een frequent voorkomend probleem in de huisartsenpraktijk, maar door het ontbreken van een algemeen geaccepteerde definitie zijn er weinig betrouwbare gegevens.
- Bij patiënten met kanker komt chronische pijn vaak voor.
In een systematisch literatuuroverzicht (119 Nederlandse onderzoeken) naar de epidemiologie van chronische pijn in Nederland werd een prevalentie van matig tot ernstige pijn onder Nederlandse volwassenen gevonden van 18%. De prevalentie voor matig-ernstige tot ernstige pijn bij kanker varieerde van 27% tot 55%. Van de patiënten met gegeneraliseerde pijn of niet-kankerpijn wordt 74% behandeld; dit percentage ligt iets hoger voor kankerpatiënten. Tot 79% van de patiënten was van mening dat hun pijn inadequaat werd behandeld.
In alle onderzoeken werden nadelige effecten van chronische pijn op kwaliteit van leven, dagelijkse activiteiten en psychische gezondheid gerapporteerd.
In vergelijking met andere chronische aandoeningen komt chronische pijn heel vaak voor. Twee derde van de patiënten in ziekenhuizen ervaart pijn, en 40 tot 75% van de patiënten heeft matige tot ernstige pijn in de postoperatieve fase.
Niet goed behandelde acute pijn is een risicofactor voor chronische pijn. Ook mensen die adequaat worden behandeld kunnen desondanks een chronisch pijnprobleem ontwikkelen. Pijn is een van de meest voorkomende redenen voor een bezoek aan de Spoedeisende Hulp. Ook de prevalentie van pijn bij patiënten met kanker is hoog.
De behandeling van pijn bij kanker is bijna in de helft van de gevallen inadequaat. Uit meerdere onderzoeken is gebleken dat een aanzienlijk deel van de bevolking lijdt onder chronische pijn met een grote variëteit in etiologie. Onbehandelde chronische pijn vormt een belangrijk probleem voor het individu, maar heeft ook sterke sociaaleconomische consequenties voor het gezondheidszorgsysteem en de gemeenschap in het algemeen. Omdat chronische pijn duidelijk samenhangt met ouderdomsaandoeningen zal de vergrijzing het probleem in de nabije toekomst groter maken.
Matige tot ernstige pijn komt voor bij 64% van de patiënten met vergevorderde stadia van kanker. Schattingen van de prevalentie van neuropathische pijn in de algemene bevolking variëren van 2 à 3% tot 8%.
Pathofysiologie
Naar Samenvatting ›Er zijn in de loop der jaren verschillende verklaringsmodellen opgesteld voor het ontstaan en voortbestaan van chronische pijn. De onderbouwing van deze modellen is meestal theoretisch en slechts in beperkte mate gebaseerd op empirisch onderzoek. Centrale sensitisatie is een van de meest waarschijnlijke verklaringsmodellen voor chronische pijn.
Centrale sensitisatie
Naar Samenvatting ›- Centrale sensitisatie omvat neuronale veranderingen in het centrale zenuwstelsel, waardoor pijn niet langer gekoppeld is aan de aanwezigheid, intensiteit of duur van een specifieke perifere stimulus.
- Deze veranderingen verlopen grofweg in 2 fasen, te weten modulatie en modificatie:
- Modulatie houdt in dat veranderingen, zoals een verhoogde prikkelbaarheid, plaatsvinden in het centrale zenuwstelsel in reactie op de nociceptieve pijnsignalen (binnen enkele seconden tot uren). Deze nemen langzaam af als er geen pijnsignaal meer is.
- Modificatie ontstaat als modulatie langer duurt (enkele dagen tot weken). Er worden dan in het zenuwstelsel nieuwe neuronale verbindingen gemaakt, waardoor de structuur verandert. Indien modificatie is opgetreden, worden de behandeling en genezing van pijn lastiger.
- Klinische gevolgen:
- De relatie tussen de pijn en de initiële weefselschade wordt minder duidelijk.
- De patiënt heeft pijn zonder voorafgaande pijnprikkel of door onschuldige prikkels die normaal gesproken niet pijnlijk zijn (allodynie).
- De pijn is heviger dan te verwachten bij de stimulus (hyperalgesie) of verspreidt zich buiten het gebied van de aangedane plek (secundaire hyperalgesie).
- Centrale sensitisatie kan uit zichzelf ontstaan, of geïnitieerd of onderhouden worden vanuit perifere sensitisatie die bij acute pijn optreedt.
- Centrale sensitisatie wordt beïnvloed door inhiberende en exciterende neuronale processen, die ervoor zorgen dat pijnsignalen respectievelijk minder makkelijk of juist makkelijker worden doorgegeven. Al deze processen worden op hun beurt beïnvloed door lichamelijke, psychische en sociale factoren (stress en angst bijvoorbeeld zorgen voor minder inhibitie; geruststelling en afleiding hebben het tegenovergestelde effect).
- Naast lichamelijke spelen ook psychische en sociale factoren dus een rol bij het in stand houden van de pijnklachten. Daarom is het van belang om in het beleid bij (dreigende) chronische pijn aandacht te besteden aan al deze factoren, conform het biopsychosociale model.
Bij centrale sensitisatie worden de neuronen en circuits in de nociceptieve zenuwbanen van het centrale zenuwstelsel geïntensiveerd door toename in de membraanprikkelbaarheid en de effectiviteit van de synapsen of door verminderde inhibitie (neuronale plasticiteit). Het netto-effect is dat de voorheen ‘subtreshold’ synaptische signalen nu wel bijdragen leveren en aldus een toegenomen, versterkte actiepotentiaal genereren. Normaal draagt slechts een kleine fractie van de synaptische signalen naar de achterhoorn bij aan de actiepotentiaal. Centrale sensitisatie speelt een belangrijke rol bij de ontwikkeling van neuropathische pijn en chronische pijn.
Symptomatologie en beloop
Naar Samenvatting ›Chronische pijn kan een forse impact hebben op de kwaliteit van leven, het dagelijks functioneren en de stemming. Chronische pijn is geassocieerd met ervaren fysieke beperkingen, verminderde zelfredzaamheid, psychische klachten (zoals angst en depressie), slaapproblemen, ziekteverzuim en sociale isolatie.
In een onderzoek in vijftien Europese landen (waaronder Nederland) en Israël werd via telefonische interviews onder volwassenen (n = 46.394) de prevalentie, ernst en impact van chronische pijn onderzocht. Chronische pijn werd gedefinieerd als pijn die langer dan zes maanden aanwezig is, aanwezig is gedurende de afgelopen maand en meermalen gedurende de afgelopen week en de laatst ervaren pijn moet een intensiteit van 5 of meer hebben op de schaal van 0 (geen pijn) tot 10 (ergst voorstelbare pijn). Van de deelnemers met chronische pijn werd 70% (ook) door de huisarts gezien voor de pijnklachten, 27% door de orthopeed en 2% door een anesthesioloog-pijnspecialist.
De prevalentie van chronische pijn was in Nederland 18% (n = 3197). Van de Nederlandse respondenten met chronische pijn (n = 300) verloor 29% zijn baan, 20% moest werkgerelateerde verantwoordelijkheden wijzigen, 16% moest veranderen van baan en 19% ontwikkelde een depressie als gevolg van de chronische pijn.
Pijn interfereert met het lichamelijk functioneren. De mate waarin pijn interfereert met het lichamelijk en psychisch functioneren hangt af van aanwezige comorbiditeit en de ernst van de pijn. Interferentie van pijn met het lichamelijk functioneren neemt toe met de leeftijd en wordt vaker gezien bij vrouwen dan bij mannen. In een prospectief onderzoek (follow-up 3 jaar) werd gevonden dat zowel vrouwen van middelbare leeftijd (48 tot 55 jaar) als oudere vrouwen (72 tot 79 jaar) minder vaak pijnlijke en stijve gewrichten rapporteren als zij een hoge of gemiddelde mate van fysieke activiteiten hebben.
Risicofactoren chronisch beloop
Naar Samenvatting ›Factoren die de kans op chronische pijn verhogen en/of het herstel van chronische pijn belemmeren zijn bijvoorbeeld:
- door de patiënt ervaren hoge pijnintensiteit
- terugkerende pijnklachten
- niet oppakken, of vermijden, van lichamelijke of sociale activiteiten
- het onbehandeld laten van acute pijn en het niet in acht nemen van normale principes van herstel bij acute pijn (tijdelijk rustiger aandoen, geleidelijk activiteiten oppakken)
- comorbiditeit met pijn elders in het lichaam
- chronische stress, zoals (dreigend) verlies van werk, financiële zorgen, problemen in gezin of relatie
- psychiatrische comorbiditeit, zoals angststoornis, depressie, posttraumatische stress
- dysfunctionele cognities en catastroferen (doemdenken)
- puur somatisch verklaringsmodel van de pijn (bij de patiënt zelf)
- inadequate steun, onbegrip of juist overbezorgdheid in directe omgeving
- keuringsprocedures met eventuele negatieve financiële en juridische consequenties
Patiëntengroepen met een verhoogd risico op chronische pijn:
- (kwetsbare) ouderen
- patiënten met acute pijn en bekende psychosociale problematiek en/of somatische comorbiditeit
- patiënten na een operatieve ingreep
- patiënten met kanker in alle fasen van de ziekte en behandeling
De genoemde risicofactoren sluiten aan op en worden onderbouwd in de Zorgstandaard Chronische pijn.
Neuropathische pijn
Naar Samenvatting ›Neuropathische pijn is pijn als gevolg van een beschadiging of ziekte van het perifere of het centrale zenuwstelsel. Voorbeelden zijn pijn als gevolg van:
- diabetische (poly)neuropathie
- postherpetische neuralgie
- trigeminusneuralgie
- polyneuropathie
Epidemiologie
Naar Samenvatting ›Neuropathische pijn komt regelmatig voor, vaak in combinatie met nociceptieve pijnklachten. Er zijn geen betrouwbare prevalentiegegevens voorhanden.
Pathofysiologie
Naar Samenvatting ›- De pijn wordt veroorzaakt door een beschadiging of ziekte van het perifere dan wel centrale somatosensorische zenuwstelsel en onderscheidt zich daardoor van sensitisatie. Centrale sensitisatie kan wel bijdragen aan het in stand houden van neuropathische pijn (en andere vormen van chronische pijn).
- Volgens de definitie van neuropathische pijn moet het distributiepatroon van de pijn neuroanatomisch te verklaren zijn. Het kan echter voorkomen dat er geen duidelijke relatie is tussen de plaats van de pijn en de plaats van de schadelijke prikkel en tussen de ernst van de zenuwschade en de ernst van de pijngewaarwording.
Symptomatologie en beloop
Naar Samenvatting ›- Neuropathische pijn kan zich uiten als een abnormale pijnervaring of een overgevoeligheid voor prikkels die normaal gesproken geen pijn veroorzaken. Kenmerken zijn:
- constante schrijnende, brandende pijn die af en toe schietend of stekend is
- vaak sensorische stoornissen in het verzorgingsgebied van de aangedane perifere zenuw(wortel)
- soms allodynie (pijn zonder voorafgaande pijnprikkel of door onschuldige prikkels die normaal gesproken niet pijnlijk zijn) in het aangedane huidgebied
- autonome instabiliteit in het huidgebied dat door de aangedane zenuw wordt verzorgd
- Het beloop is meestal chronisch en reageert dikwijls niet of nauwelijks op de pijnstillers die bij nociceptieve pijn toegepast worden.
Richtlijnen diagnostiek
Naar Samenvatting ›Anamnese
Naar Samenvatting ›Vraag naar:
- duur en beloop
- lokalisatie en uitstraling
- intensiteit op schaal van 0 tot 10 (zie Pijnschalen)
- de aard van de pijn: maak bij acute pijnklachten onderscheid tussen nociceptieve en neuropathische pijn (zie Neuropathische pijn)
- invloed op dagelijkse fysieke activiteiten, psychisch en sociaal functioneren (vermijden van activiteiten)
- invloed op het werk (zie Arbeid)
- factoren die de pijn verlichten of verergeren
- zelfzorg (dosering en duur van medicatie) en andere behandeling tot nu toe
- mogelijke oorzaken (vul de anamnese gericht aan bij vermoeden van een specifieke oorzaak, raadpleeg relevante NHG-Standaarden)
- gebruik van medicatie die de klachten verklaart, bijvoorbeeld spierpijn door statines
- zorgen, ongerustheid, specifieke vragen en verwachtingen van de patiënt
Zie voor aanvullingen op de anamnese bij pijn in de terminale fase Aanvullingen op de anamnese bij pijn in de terminale fase.
Klachtexploratie middels SCEGS
Naar Samenvatting ›- Voer klachtexploratie uit bij patiënten met een vermoeden van (dreigende) chronische pijn (zie Achtergrond, (Dreigende) chronische pijn).
- Het doel hiervan is:
- een beter beeld van de patiënt en de pijn te krijgen
- prognostisch gunstige of ongunstige factoren op te sporen
- een inschatting te maken van de mate van invloed van deze factoren op de pijn
- Bij vermoeden van dreigende chronische pijn: voer klachtexploratie afhankelijk van de situatie meer of minder systematisch uit. Breid de exploratie verder uit tijdens vervolgconsulten als het beloop daartoe aanleiding geeft.
- Bij vermoeden van chronische pijn: voer systematische klachtexploratie uit, eventueel gefaseerd in vervolgconsulten. De diagnose hoeft niet in 1 consult gesteld te worden.
- SCEGS biedt handvatten voor de exploratie (zie tabel 1 voor voorbeeldvragen). Het acroniem bestaat uit 5 dimensies: de Somatische, Cognitieve, Emotionele, Gedragsmatige en Sociale dimensie. Zie voor aanvullingen over de uitvoering de NHG-Standaard Somatisch Onvoldoende verklaarbare klachten (SOLK).
| Somatische dimensie |
|---|
|
|
Cognitieve dimensie |
|
| Emotionele dimensie |
|
| Gedragsmatige dimensie |
|
| Sociale dimensie |
|
Diagnostiek depressie/angst bij aanhoudende pijn
Naar Samenvatting ›Overweeg in aanvulling op de klachtexploratie bij aanhoudende pijnklachten diagnostiek naar een (comorbide) depressie of angststoornis indien er geen duidelijke verklaring voor de aanhoudende pijn is te geven (zie de NHG-Standaarden Depressie, Angst en Somatisch Onvoldoende verklaarbare Lichamelijke Klachten).
Er bestaat een reciproke relatie tussen pijn enerzijds en symptomen van angst en depressie anderzijds. Bij 4234 personen ouder dan 50 jaar werden deze associaties bestudeerd met behulp van de Hospital Anxiety and Depression Scale. Metingen werden verricht at baseline en na 3 jaar follow-up. Met behulp van logistische regressieanalyse werd gevonden dat angst (OR 2,30; 95%-BI 1,67 tot 3,17) en depressie (OR 2,42; 95%-BI 1,24 tot 4,69) pijn voorspelden na 3 jaar follow-up. Omgekeerd was pijn at baseline een risicofactor voor het ontwikkelen van angst (OR 2,02; 95%-BI 1,60 tot 2,55) en depressie (OR 2,47; 95%-BI 1,96 tot 3,11). Na correctie voor leeftijd, geslacht en comorbiditeit werden de associaties iets zwakker maar bleven de meeste significant.
In onderzoek bij 180 patiënten met artritis (follow-up 6 maanden) werd een correlatie tussen depressie en pijn gevonden. In een narratieve review werd de relatie tussen chronische pijn en psychologische en psychiatrische factoren onderzocht. De auteurs kwamen tot de conclusie dat psychologische comorbiditeit frequent voorkomt bij chronische pijn en de prognose en het beloop van de chronische pijn significant beïnvloedt: de aanwezigheid van chronische pijn voorspelt het optreden van depressies en omgekeerd.
Patiënten met alleen chronische pijn (n = 271), met pijn en depressie (n = 98), met pijn en angst (n = 15) en met pijn en angst en depressie (n = 116) werden vergeleken. Patiënten met chronische pijn met zowel angst als depressie rapporteerden de meeste pijn (p < 0,0001) en grootste pijngerelateerde invaliditeit (p < 0,0001).
Depressieve geriatrische patiënten met chronische pijn (n = 148, retrospectief onderzoek) hebben frequenter slaapstoornissen, ervaren een grotere ziektelast en hebben vaker suïcidale ideaties dan depressieve ouderen zonder chronische pijn.
In Nederlands onderzoek (n = 1122, follow-up 4 jaar) werd nagegaan of chronische ziekten en pijn zijn geassocieerd met angst en depressie. Er werd een associatie gevonden tussen een verhoogd risico op herhaling van depressie met de toename van het aantal pijnlocaties (HR 1,10; p < 0,01) en met de ernst van de pijn (HR 1,18; p = 0,01). De auteurs concluderen dat pijn (maar niet chronische ziekten) de kans op herhaling van een depressie (maar niet van angst) verhoogt, voornamelijk door verergering van subklinische depressieve symptomen.
Heteroanamnese
Naar Samenvatting ›Voor de beoordeling van pijn is de heteroanamnese mogelijk van belang: navragen bij partner/familie van de patiënt of een andere mantelzorger kan nuttige informatie opleveren. Dit geldt in het bijzonder voor kinderen, kwetsbare ouderen en patiënten met een cognitieve of communicatieve beperking.
Verschillende onderzoeken over de heteroanamnese bij kwetsbare ouderen laten weinig overeenstemming zien tussen het oordeel van de patiënten en dat van hun verzorgers (verpleegkundigen en verzorgenden). In enkele onderzoeken blijken verpleegkundigen/verzorgenden geneigd de prevalentie en de mate van pijn te onderschatten (vooral bij patiënten met (forse) communicatieve beperkingen), terwijl zij in andere onderzoeken de prevalentie juist overschatten.
Aan de andere kant zijn mantelzorgers geneigd pijn te overschatten. Voor ouderen met cognitieve beperkingen, die in een verpleeghuis verblijven, was de interne consistentie van de pijnbeoordeling alleen goed wanneer familieleden minstens één keer per week een bezoek aan het verpleeghuis brachten. Dan correleerde de pijnbeoordeling ook goed met de pijnbeoordeling door een arts en verplegend personeel. De overeenkomst tussen pijnbeoordeling door familieleden en door verplegend personeel was groter bij ouderen met lichte cognitieve beperkingen dan bij patiënten met ernstige cognitieve beperkingen.
In het algemeen bevordert een grote mate van vertrouwdheid van de verzorgers met bewoners het vaststellen van aanwezigheid van pijn en het inschatten van de ernst ervan.
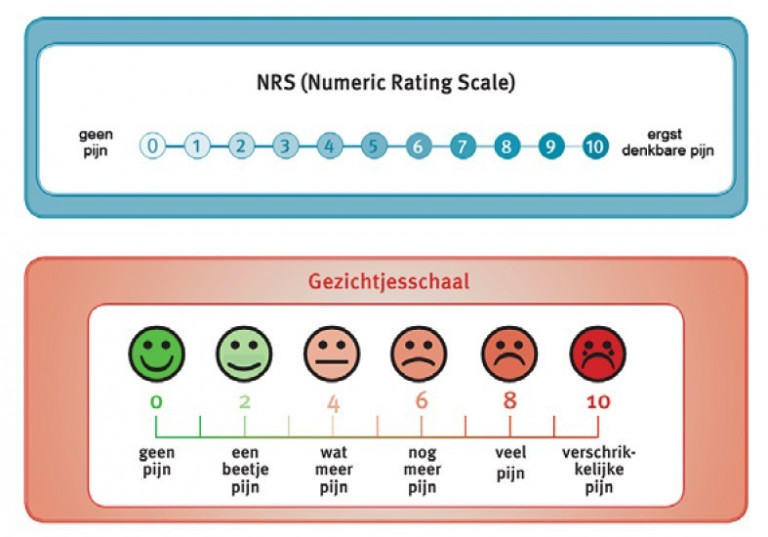
Pijnschalen
Naar Samenvatting ›- Maak een inschatting van de ernst van de pijn met behulp van de VAS-score (visueel analoge schaal) of de NRS-score (Numeric Rating Scale) (zie de NHG-TriageWijzer)
- Bij de VAS-score zet de patiënt een streepje op een balk van 100 mm (0 = geen pijn, 100 = ergst denkbare pijn).
- De NRS vraagt patiënten de mate van pijn aan te geven op een schaal van 0 tot 10 (0 = geen pijn, 10 = ergst denkbare pijn) (zie figuur 2).
- Door de pijn te scoren met de VAS of NRS kan het verloop van de pijn in de tijd gevolgd worden en voelt de patiënt zich serieus genomen. De beoordeling van de pijn blijft ook met de VAS en NRS subjectief; meetinstrumenten waarmee pijn absoluut gemeten kan worden, bestaan niet.
- De NRS kan zowel verbaal als digitaal dan wel schriftelijk gebruikt worden, maar is niet geschikt voor kinderen < 5 jaar.
- Vanaf de leeftijd van ongeveer 3 jaar kan een kind de mate van pijn aangeven door een gezichtsuitdrukking op de gezichtjesschaal aan te geven (zie figuur 2).
Pijnschalen zijn eendimensionale instrumenten voor het meten van de pijnintensiteit. Een review includeerde 54 onderzoeken (populatiegrootte varieerde van 12 tot 1387) die het gebruik van pijnschalen (Numerieke Rating Scale (NRS), Verbal Rating Scale (VRS) en Visual Analogue Scale (VAS)) bij verschillende patiëntenpopulaties (postoperatief, spoedeisende hulp, intensive care, kanker, reumatoïde artritis, ouderen, vrijwilligers, chronische pijn, gemengd) vergeleken. De NRS-11 (0 = geen pijn tot 10 = de ergste pijn die je je kunt voorstellen) leek het best bruikbaar in de meeste settings, vanwege gebruiksgemak, therapietrouw en toepasbaarheid, maar de VRS-7 en de VAS voldeden ook.
De werkgroep beveelt het gebruik van een NRS dan wel VAS aan bij langdurige pijn om het verloop van de pijn in de tijd gekwantificeerd te volgen. Het gebruik van een pijnschaal is eenvoudig en goedkoop en geeft een gezamenlijke taal bij overleg en overdracht.
Neuropathische pijn
Naar Samenvatting ›- Stel bij acute pijnklachten de volgende vragen om onderscheid te maken tussen neuropathische en nociceptieve pijn:
- Is de pijn branderig van aard?
- Gaat de pijn gepaard met tintelingen of prikkelingen?
- Bestaat er een verminderd gevoel bij aanraking?
- Wordt de pijn verergerd door wrijven?
- Deze inschatting kan worden gekwantificeerd met behulp van de DN4-screeningsvragenlijst (Douleur Neuropathique, bestaande uit 4 vragen en 10 items die met ‘ja’ of ‘nee’ beantwoord worden) (zie tabel 2). Bij ≥ 4 positieve antwoorden is (een bijdrage van) neuropathische pijn waarschijnlijk. In andere gevallen is (voornamelijk) sprake van nociceptieve pijn.
- Het onderscheid tussen neuropathische pijn en pijn door sensitisatie (bij chronische pijn) is vaak moeilijk te maken (zie ook Lichamelijk onderzoek).
De DN4 is een screeningsvragenlijst met vier vragen bestaand uit tien items, te beantwoorden met ja of nee. Bij meer dan vier positieve antwoorden is (een bijdrage van) neuropathische pijn waarschijnlijk. De sensitiviteit is 83% en de specificiteit 90% (area under the curve 0, 92). De vragenlijst is gevalideerd in het Nederlands en te downloaden op www.neuropathie.nu/download/Vragenlijsten/DN4.pdf.
|
Heeft de pijn ≥ 1 van de volgende kenmerken? |
||
|---|---|---|
|
Branderig |
□ ja |
□ nee |
|
Pijnlijk koudegevoel |
□ ja |
□ nee |
|
Elektrische schokken |
□ ja |
□ nee |
|
Gaat de pijn gepaard ≥ 1 van de volgende symptomen in hetzelfde gebied? |
||
|
Tintelingen |
□ ja |
□ nee |
|
Prikkelingen |
□ ja |
□ nee |
|
Doofheid |
□ ja |
□ nee |
|
Jeuk |
□ ja |
□ nee |
|
Is er in het pijngebied ten opzichte van een normaal aanvoelend gebied een verminderd gevoel bij: |
||
|
Aanraking |
□ ja |
□ nee |
|
Prikken (cocktailprikker) |
□ ja |
□ nee |
|
Wordt de pijn verergerd door: |
||
|
Wrijven |
□ ja |
□ nee |
|
Indien een vraag met ‘ja’ wordt beantwoord, wordt 1 punt toegekend. Bij score ≥ 4 punten is neuropathische pijn waarschijnlijk. |
||
Arbeid
Naar Samenvatting ›Informeer bij langer aanhoudende pijn naar de:
- werksituatie
- gevolgen voor het functioneren op het werk
- reactie van werkgever en collega’s
- rol en het advies van de bedrijfsarts
Chronische pijn leidt tot suboptimaal functioneren in het werk en in veel gevallen ook tot langdurig ziekteverzuim. De huisarts vraagt actief naar de werksituatie en werkgerelateerd functioneren. Hij informeert naar de mening van de bedrijfsarts of neemt zelf contact op met de bedrijfsarts. Hiermee wordt recht gedaan aan het belang van enerzijds het benutten van werk als therapeuticum en anderzijds behoud en herstel van arbeidsgeschiktheid als een voor de patiënt én maatschappij belangrijk behandeldoel. Bij elke patiënt met chronische pijn dient hij te informeren naar werk (soort werk, belasting en verhoudingen in het werk) om zich een beeld te vormen over mogelijke oorzakelijke en herstelbelemmerende factoren.
Aanvullingen op de anamnese bij pijn in de terminale fase
Naar Samenvatting ›- Exploreer de klacht systematisch door middel van SCEGS (zie Klachtexploratie middels SCEGS).
- Besteed specifiek aandacht aan:
- de fysieke, psychische, sociale en spirituele dimensie van de pijn
- onderscheid tussen achtergrond- en eventuele doorbraakpijn
- de oorzaak en beïnvloedende factoren van de (doorbraak)pijn
- verwachtingen, weerstanden en angst ten aanzien van pijnbehandeling (met name gedachten over bijwerkingen en over verslaving of versnelling van het overlijden), mede in relatie tot eerdere ervaringen hiermee
- de rol van de naasten bij de pijn, het pijngedrag en de behandeling.
De anamnese sluit aan op de uitgangspunten in de IKNL-richtlijn Pijn bij patiënten met kanker.
Lichamelijk onderzoek
Naar Samenvatting ›Verricht zo nodig gericht lichamelijk onderzoek, bijvoorbeeld:
- om een specifieke onderliggende oorzaak te vinden of uit te sluiten (raadpleeg relevante andere NHG-Standaarden), en/of
- ter geruststelling van de patiënt, en/of
- neurologisch onderzoek om, voor zover mogelijk, onderscheid te maken tussen neuropathische pijn (klachten beperken zich meestal tot ≥ 1 dermatomen) en pijn door sensitisatie (klachten zijn niet-dermatoomgebonden)
Observeer bij het uitvoeren van het onderzoek het gedrag.
Tijdens dagelijkse activiteiten, zoals sokken aandoen en opstaan uit bed, worden meer verschillende pijngedragingen geobserveerd en ook frequenter. Fysiologische veranderingen (hartslag, bloeddruk, ademhaling) zijn niet gevoelig genoeg om pijn te onderscheiden van andere vormen van ongemak/onrust. Observatie tijdens beweging bevordert het opsporen van vooral spier-, gewrichts- en skeletpijn. Gedragingen die kunnen wijzen op de aanwezigheid van pijn variëren sterk van individu tot individu en verschillen ook bij dezelfde patiënt. Alle soorten van ongebruikelijk gedrag moeten daarom worden geobserveerd en geanalyseerd, vooral bij beweging (zoals bij lopen, transfers) of bij (medische of verzorgende) ingrepen. Daarnaast moeten fysiologische veranderingen aanleiding zijn om te zoeken naar mogelijke pijn. Fysiologische signalen van de mogelijke aanwezigheid van acute pijn zijn autonome reacties, zoals bleekheid, zweten, snel ademen/veranderd ademhalingspatroon, tachycardie en hypertensie. Bij aanhoudende of chronische pijn zijn autonome signalen zeldzaam, het ontbreken van dergelijke signalen betekent dus niet dat er geen chronische pijn is.
Aanvullend onderzoek
Naar Samenvatting ›Verricht zo nodig gericht aanvullend onderzoek, bijvoorbeeld om een specifieke onderliggende oorzaak te vinden of uit te sluiten (raadpleeg relevante andere NHG-Standaarden).
Bij patiënten met chronische pijn: maak aanvullend onderzoek onderdeel van een beleid waarin ook aandacht is voor het verminderen van de invloed van lichamelijke, psychische en sociale factoren op de pijn (zie Beleid bij chronische pijn).
Evaluatie
Naar Samenvatting ›Maak onderscheid tussen:
- acute nociceptieve pijn
- neuropathische pijn
- dreigende chronische pijn
Het beleid is een combinatie van het beleid bij acute nociceptieve pijn en het beleid bij chronische pijn. De balans daartussen is afhankelijk van de situatie en het beloop tijdens vervolgconsulten. - chronische pijn
Zie Achtergronden voor begripsomschrijvingen.
Bij patiënten met pijn bij kanker buiten de palliatieve/terminale fase geldt ook bovenstaande indeling.
Zie voor het beleid bij patiënten met pijn in de palliatieve/terminale fase (door kanker of andere oorzaken) Beleid bij pijn in de palliatieve en terminale fase.
Richtlijnen beleid
Naar Samenvatting ›Beleid bij acute nociceptieve pijn
Naar Samenvatting ›Behandel een eventuele oorzaak gericht (valt buiten de scope van deze standaard), geef voorlichting en advies en bied medicamenteuze pijnbehandeling aan. Wees in het beloop alert op ontwikkeling tot chronische pijn.
Voorlichting en advies
Naar Samenvatting ›Geef voorlichting gericht op uitleg over en behandeling van de mogelijke oorzaak en op de aanpassing van activiteiten en werkzaamheden.
Adviseer na eventuele tijdelijke aanpassing van het activiteitenpatroon de dagelijkse, lichte werkzaamheden weer op te pakken.
Gebruik van vrij verkrijgbare pijnstillers van het NSAID-type
Waarschuw patiënten met (relatieve) contra-indicaties voor NSAID’s (zie Aandachtspunten veiligheid NSAID’s) die vrij verkrijgbare pijnstillers van het NSAID-type gebruiken voor de gevaren hiervan.
Uit Nederlands cross-sectioneel onderzoek blijkt dat veel mensen de vrij verkrijgbare NSAID’s (diclofenac, ibuprofen, naproxen) gebruiken. Bovendien wordt deze zelfmedicatie vaak toegepast door mensen met een verhoogde kans op ernstige complicaties. Bijna één op de drie mensen gebruikt een of meerdere NSAID’s zonder recept en bijna één op de tien gebruikers neemt meer in dan de dagelijks aanbevolen maximumdosering. Omgerekend naar de gehele Nederlandse bevolking gaat het om ongeveer 333.000 mensen.
Volgens de onderzoekers kan de huisarts een belangrijke rol spelen bij het bevorderen van veilig gebruik van de pijnstillers. Bijvoorbeeld door na een nieuwe diagnose of gewijzigde medicatie de patiënt te wijzen op zijn gewijzigde risicoprofiel, en daarmee op de gevaren van NSAID’s.
Thuisarts
Naar Samenvatting ›Verwijs naar de informatie over pijn op thuisarts.nl. De informatie op Thuisarts is gebaseerd op deze NHG-Standaard.
Bedrijfsarts
Naar Samenvatting ›- Adviseer de patiënt contact op te (laten) nemen met de bedrijfsarts als de klachten mogelijk hun oorzaak in de arbeidssituatie hebben of een gevolg voor de arbeidssituatie hebben.
- Dit advies geldt ook als mogelijke bijwerkingen van pijnstillers invloed kunnen hebben op het functioneren tijdens het werk.
- Dit geldt in het bijzonder als er sprake is van een groter veiligheidsrisico voor de betrokkene zelf of voor derden door effecten op het reactievermogen.
Houd rekening met het feit dat anno 2015 relatief veel patiënten geen bedrijfsarts hebben (zzpers, mantelzorgers) of beperkt toegang hebben tot een bedrijfsarts (beperkte contractering door werkgevers en ontbreken van wettelijke verplichting in geval er (nog) geen sprake is van verzuim). De huisarts en zijn patiënt zouden in dat geval geholpen zijn met een arbeidsgeneeskundige/bedrijfsarts in een consultatieve rol binnen de eerste lijn.
Niet-medicamenteuze behandeling
Naar Samenvatting ›Vul het beleid indien nodig aan met gerichte niet-medicamenteuze adviezen uit het beleid bij (dreigende) chronische pijn (zie Beleid bij chronische pijn, Niet-medicamenteuze behandeling).
Overweeg bij pijnklachten aan het bewegingsapparaat verwijzing naar een fysio- of oefentherapeut voor een activerende en coachende aanpak.
Medicamenteus stappenplan
Naar Samenvatting ›Bespreek de mogelijkheid om de pijn medicamenteus te behandelen. Overweging hierbij is dat het onbehandeld laten van acute pijn het risico op het ontwikkelen van chronische pijn vergroot.
Stappenplan
Naar Samenvatting ›Het stappenplan is gebaseerd op de WHO-pijnladder en heeft als uitgangspunt dat de patiënt de lichtst mogelijke, voldoende effectieve medicamenteuze behandeling krijgt, met de minste bijwerkingen.
Het in deze standaard gepresenteerde stappenplan is gebaseerd op de WHO-pijnladder. Voor een rationele farmacotherapeutische behandeling van pijn wordt wereldwijd gebruikgemaakt van deze ladder. In de oorspronkelijke WHO-pijnladder moet de medicatie volgens een gefaseerd schema worden toegediend. Stap 1 bestaat uit paracetamol (al dan niet in combinatie met een NSAID), stap 2 uit stap 1 plus een zwakwerkend opioïd (aanvankelijk codeïne; later ook tramadol) en in stap 3 wordt een sterkwerkend opioïd (bijvoorbeeld morfine, fentanyl, oxycodon, hydromorfon) aanbevolen. Stap 2 van de WHO-ladder wordt in de palliatieve fase in principe overgeslagen. Zwakwerkende opioïden hebben bij de benodigde dosering dezelfde bijwerkingen als sterkwerkende opioïden. De WHO-ladder is gepubliceerd voor farmacologische behandeling van pijn bij kanker bij volwassenen en in 2005 gemodificeerd. Er bestaat geen eenduidige consensus over de bruikbaarheid van deze ladder voor de aanpak van chronische niet-oncologische pijn.
Specifieke aandoeningen
Naar Samenvatting ›Het medicamenteuze beleid bij specifieke aandoeningen kan afwijken en valt buiten de scope van deze standaard.
Algemene uitgangspunten
Naar Samenvatting ›- Bepaal de keuze voor een pijnstiller mede op basis van overleg met de patiënt, afhankelijk van eerder gebruikte medicatie, de oorzaak en ernst van de pijn, en contra-indicaties.
- Indien de patiënt al medicatie, zoals paracetamol, heeft gebruikt: ga na of dit in adequate dosering en doseerfrequentie was. Overweeg, indien dit niet het geval is, om alsnog te starten met paracetamol.
- Spreek, afhankelijk van de oorzaak en het verwachte beloop van de pijn, met de patiënt een reële termijn af om het effect van de pijnmedicatie te evalueren.
- Bij een beloop dat past binnen de verwachting: ga bij onvoldoende effect van de pijnmedicatie in overleg met de patiënt naar de volgende stap in het medicamenteuze stappenplan.
- Bij een beloop dat trager is dan verwacht en/of als de relatie tussen de pijn en oorzaak minder duidelijk wordt (aanwijzingen voor (dreigende) chronische pijn): voer (alsnog) klachtexploratie uit (zie Klachtexploratie middels SCEGS), en pas het beleid zo nodig aan conform de richtlijnen voor het beleid bij chronische pijn. Ga dus niet zonder meer naar de volgende medicamenteuze behandelstap in het stappenplan.
- Streef naar tijdelijk gebruik van pijnmedicatie en adviseer de patiënt de medicatie te stoppen als de klachten over zijn (zie Controles).
- Behandel kinderen alleen volgens stap 1 en 2.
Stap 1: paracetamol
Naar Samenvatting ›- Leg uit dat paracetamol in adequate dosering de pijnstiller van voorkeur is, omdat de kans op ernstige bijwerkingen aanzienlijk kleiner is dan bij gebruik van andere pijnstillers. Dit geldt in het bijzonder voor ouderen, omdat zij gevoeliger zijn voor bijwerkingen van andere analgetica, zoals NSAID’s.
- Start bij voorkeur met orale behandeling, omdat rectale toediening van paracetamol een onvoorspelbaar wisselende, vertraagde absorptie geeft.
De naam paracetamol is afgeleid van de chemische stof para-acetylaminofenol. In Angelsaksische landen wordt de naam acetaminophen gebruikt.
Beschrijving onderzoeken
In twee Cochrane-reviews werd de effectiviteit van paracetamol vergeleken met die van placebo:
- Een Cochrane-review waarin paracetamol werd vergeleken met placebo of een NSAID bij patiënten met heup- of knieartrose (15 RCT’s, n = 5986, gemiddelde duur 6 weken).
- Een Cochrane-review van onderzoeken naar de effectiviteit van paracetamol bij postoperatieve pijn includeerde 51 placebogecontroleerde RCT’s (n = 5762) waarin een eenmalige dosering paracetamol gegeven werd, variërend van 325 mg tot 1500 mg.
Effectiviteit
Artrose
In vijf van de zeven placebogecontroleerde RCT’s bleek dat 4 g paracetamol per dag een kleine maar statistisch significante reductie van pijn bewerkstelligt ten opzichte van placebo. De absolute extra pijnreductie door paracetamol was 4 punten op een schaal van 1 tot 100, het number needed to treat (NNT) voor enige pijnverbetering varieerde van 4 tot 16.
Postoperatieve pijn
In de interventiegroepen trad er bij 46% van de deelnemers minimaal 50% pijnverlichting op gedurende 4 tot 6 uur, vergeleken met 20% in de placebogroepen (RR 2,4; 95%-BI 2,2 tot 2,6 en NNT 3,9; 95%-BI 3,6 tot 5,3). Hierbij was er nauwelijks verschil tussen dentale en overige chirurgie.
Bijwerkingen
Vrijwel alle RCT’s met paracetamol zijn klein, van korte duur, hanteren strikte inclusiecriteria en zijn daardoor niet geschikt om bijwerkingen te onderzoeken. Om deze reden is in het kader van het opstellen van de NICE-richtlijn Osteoarthritis een systematische literatuursearch gedaan naar cohortonderzoeken waarin het optreden van bijwerkingen door paracetamol in de algemene populatie werd onderzocht.
Er werden elf onderzoeken gevonden; in drie hiervan werden cardiovasculaire bijwerkingen gerapporteerd, in vijf onderzoeken werden gastro-intestinale bijwerkingen gerapporteerd, in vier onderzoeken werden renale bijwerkingen gerapporteerd, en in twee onderzoeken werd mortaliteit gerapporteerd. De onderzoeken laten zien dat er bij veelvuldig gebruik van paracetamol mogelijk een verhoogd risico is op cardiovasculaire, gastro-intestinale en renale bijwerkingen. De kwaliteit van het bewijs was echter zeer laag. Ondanks het feit dat de onderzoeken rapporteerden over grote cohorten, waren de patiëntenaantallen klein in veel analyses, vooral bij hogere doseringen van paracetamol. De manier waarop het paracetamolgebruik werd gedefinieerd verschilde tussen de onderzoeken (grammen; aantallen tabletten; wekelijkse, maandelijkse of levenslange blootstelling; prescriptiecijfers of zelfgerapporteerd paracetamolgebruik). In de meeste onderzoeken werd niet adequaat gecorrigeerd voor confounders, in het bijzonder niet voor ander geneesmiddelgebruik. De uitkomsten werden in de verschillende onderzoeken op verschillende manieren gedefinieerd. Daarom is het lastig om de gegevens te interpreteren en is er zeer veel onzekerheid over de effectschattingen. In het onderzoek van De Vries werden bijwerkingen vergeleken met mensen die wel in het verleden, maar nu niet meer paracetamol gebruikten. Dit impliceert confounding by indication: óf die mensen zijn destijds gestopt omdat hun aandoening over was, en zijn dus per definitie gezonder dan degenen die nu nog wel slikken óf die mensen zijn destijds gestopt vanwege bijwerkingen en dan is het logisch dat ze nu minder bijwerkingen hebben.
In een recente meta-analyse werden deze resultaten bevestigd. Hierin werd bovendien aangegeven dat er mogelijk een dosis-responsrelatie bestaat, wat op een verhoogd risico op bijwerkingen kan wijzen. Ook de kwaliteit van het bewijs van deze meta-analyse was zeer laag.
Conclusie
In het weinige onderzoek over paracetamol versus placebo komt naar voren dat paracetamol (in hoge dosering) effectief is in het verminderen van pijn op de korte termijn. Paracetamol geeft mogelijk een verhoogd risico op cardiovasculaire en gastro-intestinale bijwerkingen, maar de kwaliteit van het bewijs is zeer laag.
Overweging
Er is alleen kortetermijnonderzoek met paracetamol gevonden. Ook is er geen goed onderzoek naar mogelijke bijwerkingen van paracetamol. De werkgroep is van mening dat het beschikbare bewijs over mogelijke bijwerkingen geen reden is om het gebruik van paracetamol af te raden. Een meta-analyse die is verschenen na de sluitingsdatum van de NHG-search concludeerde dat paracetamol bij lagerugpijn en nekpijn op de korte termijn geen significante pijnverbetering geeft ten opzichte van placebo. De resultaten in deze meta-analyse over het effect van paracetamol bij artrose komen overeen met die genoemd in de Cochrane-review van Towheed (zie hierboven). Op grond van zeer ruime klinische ervaring en het brede veiligheidsprofiel, en in aansluiting op de pijnladder, is paracetamol de pijnstiller van eerste keus bij niet-ernstige tot matige pijn.
Aanbeveling
Paracetamol is bij acute en chronische pijn voor patiënten van alle leeftijden de eerste keus bij start van pijnstilling (stap 1).
Bij rectale toediening wordt paracetamol langzaam en in zeer wisselende mate geabsorbeerd. Daarbij is het de vraag of bij de algemeen gehanteerde rectale adviesdosering van 2 tot 3 dd 20 mg/kg lichaamsgewicht daadwerkelijk pijnstillende paracetamolspiegels worden bereikt. Vier uur na rectale toediening van 2 g paracetamol hadden 24 vrouwen (18 tot 60 jaar) nog steeds géén analgetische paracetamolspiegel. In een ander onderzoek kregen 10 gezonde vrijwilligers een stijgende reeks rectale doseringen paracetamol (15, 25, 35 en 45 mg/kg lichaamsgewicht). Blijvende therapeutische plasmaspiegels traden pas op vanaf een rectale dosering van 35 tot 45 mg/kg lichaamsgewicht en de hoogst gemeten spiegel was 25 mg/l, ruim onder de toxische spiegel van 120 mg/l. Dat rectale oplaaddoseringen van 40 mg/ kg lichaamsgewicht nodig kunnen zijn om therapeutische spiegels te bereiken, zowel bij volwassenen als bij kinderen, is bevestigd in andere onderzoeken (met een n van 10 tot 80), waarin het pijnstillend effect van rectale paracetamoltoediening na chirurgische ingrepen werd nagegaan.
Dosering paracetamol
Naar Samenvatting ›- Zie voor de dosering voor volwassenen tabel 3 en voor kinderen tabel 4.
- Verlaag bij noodzaak tot gebruik > 1 maand bij volwassenen de dosering.
| Oraal (tablet, oplostablet, kauwtablet) | Rectaal (zetpil) | ||
|---|---|---|---|
| Adviesdosering bij gebruik ≤ 1 maand |
|
| |
| Maximale dosering bij gebruik > 1 maand |
| ||
| Bij levercirrose, ongeacht duur van gebruik |
| ||
| # vasten of slechte voedingstoestand, chronisch gebruik > 2 eenheden alcohol per dag, gebruik van CYP2E1-enzyminducerende middelen, bestaande leveraandoeningen, kwetsbare oudere (vooral in combinatie met lichaamsgewicht < 50 kg), roken, een genetisch bepaalde lage metabolisatiesnelheid, gecombineerd gebruik van meerdere pijnstillers | |||
| Oraal (tablet, oplostablet, kauwtablet, drank 24 mg/ml) of rectaal (zetpil) | |
|---|---|
Adviesdosering* (leeftijd > 1 maand – 18 jaar) |
|
Kortdurend hogere dosering bij ernstige pijn (gedurende maximaal 2-3 dagen)* (oraal leeftijd > 6 maanden, rectaal leeftijd > 1 maand) |
|
| * Let op bij kind < 5 jaar: Sinaspril stroop bevat een te grote hoeveelheid propyleenglycol en alcohol voor kinderen < 5 jaar om veilig een adequate dosering te kunnen geven. Sanias drank en Daro stroop kunnen wel veilig gebruikt worden. | |
Bij kortdurend gebruik
De doseringen zijn gebaseerd op het advies in de KNMP Kennisbank en sluiten aan op de adviezen voor kinderen in het Kinderformularium.
Bij levercirrose
Bij levercirrose is de halfwaardetijd van paracetamol verlengd. Dit leidt bij kortdurend gebruik niet tot accumulatie en heeft geen invloed op de toxiciteit van paracetamol voor de lever. Bij kortdurend gebruik is geen dosisaanpassing nodig. Alleen bij ≥ 1 risicofactoren voor levertoxiciteit (zie risicofactoren voor toxiciteit bij gebruik > 1 maand) geldt het advies om 2 g/dag resp. 1,5 g/dag als maximum aan te houden (zie www.geneesmiddelenbijlevercirrose.nl).
Bij gebruik > 1 maand
Achtergrond
Paracetamol wordt in de lever grotendeels afgebroken tot via de urine uitscheidbare metabolieten. Hiervan wordt < 5% omgezet in het toxische radicaal N-acetyl-p-benzoquinonimine (NAPQI). Bij deze omzetting spelen de leverenzymen CYP2E1 en in mindere mate CYP3A4 een rol. Bij een hoge activiteit van deze enzymen (bijvoorbeeld als gevolg van het gebruik van enzyminducerende middelen zoals isoniazide, rifampicine, carbamazepine, fenobarbital en fenytoïne) wordt meer NAPQI gevormd. Onder normale omstandigheden wordt NAPQI in de lever door glutathion (GSH) ontgift. Wanneer de hoeveelheid NAPQI zo groot is dat het de bindingscapaciteit van GSH overtreft, leidt dit tot beschadiging van levercellen. Bij inname van een toxische dosis ontstaat leverbeschadiging al in de eerste uren na inname, terwijl de voornaamste klinische verschijnselen (zoals abdominale pijn, gevolgd door icterus, verhoging van serumtransaminasen) pas 24 tot 72 uur later optreden.
Risicofactoren voor toxiciteit
Grote (eerstelijns) onderzoeken waaruit het risico op paracetamolintoxicatie bij grote patiëntengroepen berekend kan worden, ontbreken. In verhouding met het grootschalig gebruik van paracetamol worden in de literatuur weinig ernstige reacties beschreven. De meeste literatuur over leverbeschadiging ten gevolge van chronisch gebruik van paracetamol heeft betrekking op patiënten die > 4 g per dag gebruiken en de meeste toxiciteit wordt bij gebruik rond de 12 g per dag gezien. Paracetamoltoxiciteit bij chronisch gebruik van lagere dagdoseringen wordt vooral beschreven bij gelijktijdig chronisch alcoholmisbruik, tijdens en na een periode van vasten en bij patiënten die gelijktijdig CYP2E1- inducerende medicatie gebruiken.
Risicofactoren voor het optreden van toxiciteit door paracetamol zijn:
- Vasten of een slechte voedingstoestand: vasten kan leiden tot meer CYP2E1 activiteit, waardoor meer paracetamol wordt omgezet tot NAPQI. Ook neemt bij een slechte voedingstoestand de GSH-voorraad in de lever af. Op deze manier kunnen levercellen beschadigen wanneer ondervoede patiënten therapeutische doseringen paracetamol gebruiken. In de literatuur raadt men aan om de maximaal te gebruiken dagdosering paracetamol aan te passen en maximaal 2 gram paracetamol per dag bij chronisch gebruik te adviseren.
- Chronisch gebruik > 2 eenheden alcohol per dag verlaagt de hoeveelheid beschikbaar GSH, die nodig is voor de ontgifting van de toxische NAPQI radicaal. Anderzijds zorgt chronisch gebruik van alcohol voor inductie van de CYP2E1-activiteit (tot tienvoudig), waardoor juist meer NAPQI gevormd wordt. Aan mensen die ≥ 4 alcoholeenheden per dag gebruiken moet daarom aangeraden worden niet > 2 gram paracetamol per dag in te nemen. De KNMP Kennisbank hanteert een gebruik van 2 eenheden alcohol per dag als afkappunt voor deze lagere dosering.
- Gebruik van CYP2E1-enzyminducerende middelen (zoals isoniazide, rifampicine, carbamazepine, fenytoïne, fenobarbital): gelijktijdig gebruik van paracetamol met deze middelen kan via inductie van CYP2E1-activiteit zorgen voor hepatische beschadiging bij therapeutische doseringen paracetamol. Er treedt een verhoogde en versnelde vorming van toxische metabolieten op. In de literatuur wordt daarom het advies gegeven niet > 2 gram paracetamol per dag te geven.
- Kwetsbare oudere: er is geen invloed van de leeftijd gevonden op de absorptie van paracetamol of op verandering van leverenzymen. Het conjugerend vermogen van de lever neemt bij veroudering niet veel af. Ook is er geen accumulatie gevonden bij het gebruik van paracetamol door ouderen. Alleen bij kwetsbare ouderen met een laag lichaamsgewicht (< 50 kg) of met risicofactoren voor toxiciteit is een significant verminderde klaring van paracetamol gevonden (Ephor app, monografie paracetamol, geraadpleegd 20 mei 2021).
- Roken: dit zorgt veelal voor een verhoogd GSH-verbruik. Rookgedrag heeft daarom een negatief effect op de hoeveelheid beschikbaar GSH en daarmee op de gevoeligheid voor paracetamolintoxicatie.
- Een genetisch bepaalde lage metabolisatiesnelheid: er is een grote mate van interindividuele variabiliteit in de vatbaarheid voor paracetamolgeïnduceerde levercelbeschadiging door genetische verschillen in paracetamolmetabolisme.
- Bestaande leveraandoeningen: zie ook Bij kortdurend gebruik.
- Gecombineerd gebruik van paracetamol met andere pijnmedicatie, zoals NSAID’s of opioïden.
Toxische dosering
Bij patiënten zonder verhoogd risico op levertoxiciteit treedt acute intoxicatie gemiddeld op bij inname van > 6 g in 1 keer. Hoewel zelden voorkomend is leverschade ook beschreven na chronisch gebruik van 3 tot 4 gram paracetamol per dag.
Paracetamol en het risico op gastro-intestinale complicaties
Gemiddeld genomen zorgt paracetamolgebruik slechts voor een verwaarloosbare kleine verhoging van het risico op klinisch relevante complicaties in het bovenste deel van het maag-darmkanaal. Analyse van gegevens uit de United Kingdom General Practice Research Database 1993-1998 laten bij dagdoseringen > 2 gram een verhoogd risico op gastro-intestinale complicaties zien(RR 3,7; 95%-BI 2,6-5,1), gecorrigeerd voor leeftijd, geslacht, ulcushistorie, roken en aanvullende medicatie. Er is niet gecorrigeerd voor gebruik van SSRI’s. De analyse bevat alleen gegevens van huidige gebruikers versus niet-gebruikers in de afgelopen 180 dagen. Dit geneste patiëntcontrole-onderzoek roept een aantal vragen op en kan waarschijnlijk beter als een hypothesegenererend onderzoek geïnterpreteerd worden. Er zijn meer onderzoeken die in de richting van een dosisafhankelijke gastro-intestinale toxiciteit van paracetamol wijzen. Uit een retrospectief cohortonderzoek bij mensen > 65 jaar die tussen 1994 en 1995 een voorschrift paracetamol (n = 21.207) of NSAID (n = 26.978) ontvingen, blijkt het optreden van gastro-intestinale bijwerkingen in de paracetamolgroep dosisafhankelijk te zijn: de RR's vergeleken met een hoge dosering NSAID's variëren van 0,6 (95%-BI 0,5-0,7) voor < 650 mg paracetamol per dag tot 1,0 (95%-BI 0,9-1,1) bij een dagdosering paracetamol > 3,25 gram. < 2,6 gram per dag heeft paracetamol significant minder gastro-intestinale bijwerkingen dan bij hogere doses; boven dagdoses van 3,25 gram zou het risico op ernstige complicaties in het bovenste deel van het maag-darmkanaal vergelijkbaar zijn aan dat van acetylsalicylzuur (in een dagdosering > 300 mg) en NSAID's. Onderzoeken met dagdoses van 4 gram laten vergelijkbare gastro-intestinale bijwerkingen zien als bij ibuprofen en ketoprofen. Combinatie van paracetamol met NSAID's laat een substantiële verhoging van het risico op maagcomplicaties zien. Verder wordt er een gerandomiseerd onderzoek beschreven dat paracetamol in dagdosis tot maximaal 2400 mg, ook door ouderen, gedurende 2 jaar effectief voor knieartrose gebruikt kan worden, zonder dat significante bijwerkingen optreden. Het mechanisme achter de gastro-intestinale toxiciteit van paracetamol is evenals het exacte werkingsmechanisme niet opgehelderd. Mogelijk speelt remming van de PG-synthese een rol. Samenvattend zal, naarmate de dagdosering de 3 gram verder overschrijdt, bij chronisch gebruik het risico van ernstige gastro-intestinale bijwerkingen meer gelijk zijn aan dat van de conventionele NSAID's.
Overweging
Voor risicofactoren voor levertoxiciteit geldt een cumulatief risico. Hoe meer risicofactoren aanwezig zijn, hoe lager de doseringen waarbij men toxiciteit kan verwachten bij chronisch gebruik van paracetamol.
Aanbeveling
Patiënten zonder verhoogd risico op levertoxiciteit: hanteer bij gebruik > 1 maand een maximumdosering van 3 gram per dag.
Patiënten met een risicofactor voor levertoxiciteit: in aansluiting op de literatuur geldt het advies om bij gebruik > 1 maand een maximale dosering aan te houden van 2 g per 24 uur. Bij meerdere risicofactoren tegelijk is meer voorzichtigheid aan te bevelen en geldt een maximumdosering van 1,5 mg per 24 uur.
Bij verminderde nierfunctie
Bij verminderde nierfunctie (eGFR > 10 ml/min/1,73 m2) is aanpassen van de dosis of het doseerinterval van paracetamol niet nodig. Paracetamol wordt gemetaboliseerd in de lever en uitgescheiden met de urine, voornamelijk in de vorm van het glucuronide en het sulfaatconjugaat. Bij een verminderde nierfunctie cumuleren de metabolieten in het bloed. Dit heeft geen klinische gevolgen, de metabolieten zijn inactief.
Stap 2a: dermaal NSAID
Naar Samenvatting ›- Overweeg bij volwassenen een dermaal NSAID, zoals diclofenac gel 1 tot 3% of ibuprofen gel 5% bij behandeling van gelokaliseerde acute spier- en gewrichtspijn:
- effect vergelijkbaar met dat van orale NSAID’s
- vaker (doorgaans lichte en voorbijgaande) lokale bijwerkingen dan placebo
- aanwijzingen voor minder systemische bijwerkingen dan orale NSAID’s
- Toepassing:
- wrijf de gel, afhankelijk van het preparaat, 2 tot 4 dd zacht op de pijnlijke plek in. Er zijn geen gegevens bij gebruik > 3 weken
- verwijder overtollige gel met een tissue en gooi deze weg bij het restafval
- probeer wegspoelen van gelresten via de douche- of gootsteenafvoer zo veel mogelijk te voorkomen.
Beschrijving onderzoeken
In een Cochrane-review werden dermale NSAID’s vergeleken met placebo of orale NSAID’s bij chronische spier- en gewrichtspijn (7688 patiënten, 34 gerandomiseerde dubbelblinde onderzoeken, waarvan 23 met placebo). In een andere Cochrane-review werd de werkzaamheid van dermale NSAID’s bij acute pijn onderzocht (47 onderzoeken, 3455 patiënten).
Effectiviteit
Spier- en gewrichtspijn
Dermale NSAID’s bleken significant effectiever dan placebo op vermindering van pijn als gevolg van chronische spier- en gewrichtsklachten. De gunstigste uitkomsten werden gevonden voor diclofenac bij artrose: vergeleken met placebo had dermaal diclofenac voor 50% pijnverlichting voor een periode van 8 tot 12 weken een NNT van 6,4 voor de oplossing en een NNT van 11 voor de gel. Directe vergelijking van een dermaal met een oraal NSAID liet geen verschil in werkzaamheid zien tussen de beide toepassingen.
Acute pijn
Alle dermale NSAID’s samen vergeleken met placebo hadden een NNT voor 50% pijnverlichting voor een periode van 6 tot 14 dagen van 4,5 (3,9 tot 5,3). Dermaal diclofenac, ibuprofen, ketoprofen en piroxicam waren vergelijkbaar effectief maar indomethacine was niet significant beter dan placebo. Er waren niet genoeg data om alle dermale NSAID’s betrouwbaar onderling te vergelijken.
Bijwerkingen
Dermale NSAID’s lieten een toename zien van (doorgaans lichte) lokale bijwerkingen, zoals voorbijgaande huidreacties, vergeleken met placebo. Gastro-intestinale bijwerkingen verschilden niet tussen dermale NSAID’s en placebo en traden minder frequent op dan bij gebruik van orale NSAID’s.
Conclusie
Dermale NSAID’s kunnen een goede pijnreductie geven, terwijl ze minder systemische bijwerkingen geven. Diclofenacgel is equivalent aan orale NSAID’s op vermindering van pijn als gevolg van knie- en handartrose, maar er is geen bewijs voor andere chronische pijnsyndromen.
Overwegingen
Dermale NSAID’s kunnen een goede pijnreductie geven. Na dermaal aanbrengen van NSAID’s kunnen therapeutische spiegels worden aangetoond in de gewrichtsvloeistof, spieren en fascie. Het maximaal te bereiken plasmaniveau is slechts 15% van dat van een gelijkwaardige dosering orale NSAID’s, waardoor te verwachten is dat dermale NSAID’s minder systemische bijwerkingen hebben dan orale NSAID’s.
Aanbeveling
Dermale NSAID’s worden aanbevolen bij acute spier- en gewrichtspijn en bij chronische pijn als gevolg van knie- en handartrose.
Stap 2b: oraal (of intramusculair of rectaal) NSAID
Naar Samenvatting ›- Geef een NSAID wanneer paracetamol onvoldoende effect heeft. Of voeg een NSAID toe aan paracetamol.
- Door de combinatie van paracetamol met een NSAID volstaat mogelijk een lagere dosering van het NSAID (met een kleinere kans op bijwerkingen) bij een gelijkblijvend pijnstillend effect.
- Combineer geen verschillende NSAID’s vanwege de grotere kans op bijwerkingen.
- Bespreek de bijwerkingen van NSAID’s:
- maag-darmklachten en maagcomplicaties, zoals maagbloeding of -zweer
- cardiovasculaire complicaties, zoals angina pectoris of myocardinfarct of hartfalen
- renale complicaties, zoals acute nierinsufficiëntie
- huidreacties
- Bespreek dat vanwege de mogelijke (ernstige) bijwerkingen van NSAID’s de dosering zo laag en de duur van het gebruik zo kort mogelijk dienen te zijn.
Beschrijving onderzoeken
- Een Cochrane-review (65 RCT’s, n = 11.237) waarin de effectiviteit van NSAID’s werd vergeleken met placebo en met paracetamol bij acute en chronische (langer dan 3 maanden bestaande) lagerugpijn met en zonder radiculaire klachten. Van de RCT’s was 42% van hoge kwaliteit.
- Een systematisch literatuuronderzoek (23 onderzoeken, n = 10.845) waarin de effectiviteit van NSAID’s met placebo werd vergeleken bij patiënten met knieartrose. De meeste onderzoeken duurden 2 tot 13 weken; 1 onderzoek had een follow-up van 4 jaar.
- Een Cochrane-review waarin de effectiviteit van paracetamol met NSAID’s (en met placebo) werd vergeleken bij patiënten met heup- of knieartrose (15 RCT’s, n = 5986, gemiddelde duur 6 weken).
- Een systematisch literatuuronderzoek (36 systematische reviews, RCT’s of observationele onderzoeken) waarin de effectiviteit van NSAID’s werd vergeleken met paracetamol bij patiënten met artrose en bij acute spier- en gewrichtspijn.
- Een Cochrane-review van onderzoeken naar de effectiviteit van paracetamol versus NSAID’s bij patiënten met reumatoïde artritis; er werden slechts 4 cross-overonderzoeken gevonden waarin van 4 verschillende NSAID’s de effecten op korte termijn werden onderzocht, met in totaal 121 patiënten.
- Een Cochrane-review waarin de effectiviteit van paracetamol werd vergeleken met die van ibuprofen na het verwijderen van de onderste verstandskiezen (7 RCT’s; n = 2241). De meest gebruikte doseringen in de onderzoeken waren 400 mg ibuprofen en 1000 mg paracetamol.
Effectiviteit
NSAID’s vergeleken met placebo
Lagerugpijn: NSAID’s werken beter dan placebo voor de uitkomstmaat ‘deel van de populatie dat algemene verbetering ervaart’ bij acute lagerugpijn na 1 week (7 RCT’s; n = 745; RR 1,19; 95%-BI 1,07 tot 1,33). De verandering in VAS-score is bij acute pijn −8,39 (95%-BI −12,68 tot −4,10) en bij chronische pijn −12,40 (95%-BI −15,53 tot −9,26) ten opzichte van placebo.
Knieartrose: NSAID’s toonden ten opzichte van placebo een lichte pijnreductie na 2 tot 13 weken. Het enige onderzoek uit deze meta-analyse met follow-up na 1 en 4 jaar toonde op deze langere termijn géén significant effect van NSAID’s ten opzichte van placebo.
NSAID's vergeleken met paracetamol
Lagerugpijn: het deel van de populatie dat verbetering ervaart bij acute lagerugpijn is bij NSAID’s gelijk aan dat van paracetamol (3 RCT’s; RR 1,23; 95%-BI 0, 88 tot 1,73).
Artrose: 10 RCT’s vergeleken paracetamol met een NSAID. Paracetamol bleek zonder uitzondering minder effectief dan het NSAID. De NSAID’s gaven een absolute extra pijnreductie van 6 punten op een schaal van 1 tot 100. In overeenstemming hiermee is het systematisch literatuuronderzoek van Gotzsche, waarin werd gevonden dat NSAID’s effectiever zijn dan paracetamol in vermindering van pijn bij artrose.
Acute spier- en gewrichtspijn: NSAID’s zijn even effectief als paracetamol.
Reumatoïde artritis: er kon geen verschil in effectiviteit worden aangetoond tussen paracetamol en NSAID’s, al hadden meer patiënten en behandelaars een voorkeur voor NSAID’s dan voor paracetamol. Postoperatieve pijn (verwijderen onderste verstandskiezen): in de ibuprofengroep trad er bij 76% van de patiënten minimaal 50% pijnreductie op na 6 uur, vergeleken met 48% in de paracetamolgroep (RR 1,48; 95%-BI 1,31 tot 1,61); wanneer de analyses werden beperkt tot de vergelijking ibuprofen 400 mg met paracetamol 1000 mg leidde dit tot vergelijkbare resultaten.
NSAID's onderling vergeleken
In twee systematische literatuuronderzoeken werden geen belangrijke verschillen in werkzaamheid gevonden tussen de verschillende klassieke NSAID’s en COX-2-selectieve NSAID’s.
Conclusie
NSAID’s zijn effectief in het verminderen van pijn op de korte termijn (bij patiënten met acute en chronische lagerugpijn en patiënten met knieartrose), maar op de langere termijn is dit niet aangetoond. Bij artrose en acute postoperatieve pijn, maar niet bij reumatoïde artritis, zijn NSAID’s mogelijk effectiever dan paracetamol.
Overweging
Door het gebrek aan kwalitatief goede onderzoeken is het niet goed mogelijk de effectiviteit van paracetamol en NSAID’s te vergelijken. Verschil in respons op NSAID’s tussen mannen en vrouwen is niet duidelijk. Er werd geen sekseverschil in analgetische respons op ibuprofen gevonden (tandheelkundige pijnklachten).
Aanbeveling
Geef alleen een NSAID als paracetamol onvoldoende effect heeft.
Beschrijving onderzoeken
In een Cochrane-review werden drie RCT’s geïncludeerd die een vaste combinatie van ibuprofen en paracetamol vergeleken met placebo of met alleen ibuprofen bij patiënten met acute postoperatieve pijn. Er waren gegevens over 508 deelnemers voor de vergelijking van ibuprofen 200 mg plus paracetamol 500 mg met placebo, 543 deelnemers voor de vergelijking van ibuprofen 400 mg plus paracetamol 1000 mg met placebo en 359 voor de vergelijking van ibuprofen 400 mg plus paracetamol 1000 mg met alleen ibuprofen 400 mg.
Effectiviteit
Het percentage patiënten dat ten minste 50% pijnverlichting bereikte was 7% met placebo, 52% met alleen ibuprofen, 69% met de combinatie in lage dosering en 73% met de combinatie in hoge dosering. Het NNT was 1,6 (95%-BI 1,5 tot 1,8) voor ibuprofen 200 mg plus paracetamol 500 mg vergeleken met placebo, 1,5 (95%-BI 1,4 tot 1,7) voor ibuprofen 400 mg plus paracetamol 1000 mg vergeleken met placebo en 5,4 (95%-BI 3,5 tot 12) voor ibuprofen 400 mg plus paracetamol 1000 mg vergeleken met alleen ibuprofen 400 mg. In de combinatiegroepen was het gebruik van rescuemedicatie minder snel en minder vaak nodig.
Bijwerkingen
In de groepen die ibuprofen 200 mg plus paracetamol 500 mg gebruikten traden bij 30% bijwerkingen op, in de groepen ibuprofen 400 mg plus paracetamol 1000 mg bij 29%, en in de placebogroepen bij 48%.
Conclusie
Mogelijk leidt de combinatie van paracetamol met een NSAID tot een effectievere pijnbestrijding dan paracetamol of een NSAID alleen, hoewel er weinig onderzoek beschikbaar is.
Overwegingen
Door een NSAID met paracetamol te combineren kan mogelijk bij een lagere dosering van het NSAID (en ook van paracetamol) een effectieve pijnbestrijding worden gekregen. Dit vermindert in theorie de kans op bijwerkingen.
Aanbeveling
Indien een anti-inflammatoir effect gewenst is, kan door de combinatie paracetamol met een NSAID worden volstaan met een lagere dosering van het NSAID bij gelijkblijvend pijnstillend effect.
Achtergrond
Er worden minimaal twee varianten van cyclo-oxygenase onderscheiden: COX-1 en COX-2. COX-1 is van belang voor de productie van prostaglandinen met een fysiologische functie, zoals het beschermen van de maagmucosa, het onderhouden van de renale perfusie en het stimuleren van de trombocytenfuncties door aanmaak van tromboxaan (TxA-2). Het enzym COX-1 is in relatief constante hoeveelheid aanwezig in de meeste weefsels en organen en in de bloedplaatjes. Het enzym COX-2 wordt in normale omstandigheden slechts in bepaalde weefsels en organen aangetroffen, zoals de hersenen, de nieren en de voortplantingsorganen.
COX-2 kan in snel tempo in relatief grote hoeveelheden worden gevormd in ontstekingscellen als reactie op inflammatoire stimuli. De prostaglandinen die hierbij ontstaan, spelen een rol bij pijn, koorts, ontsteking en ook bij trombocytenaggregatie; zo heeft prostacycline (PGI2) een vaatverwijdend effect en remt het de functie van de bloedplaatjes.
Remming van COX-1 wordt verantwoordelijk geacht voor de gastro-intestinale en hemostatische (bij)werkingen (verminderde tromb o cytenaggregatie), terwijl remming van COX-2 gerelateerd zou zijn aan het analgetische en anti-inflammatoire effect. Alle NSAID’s bevinden zich op een glijdende schaal voor wat betreft de verhouding waarin zij COX-1 en COX-2 remmen. Veel oudere NSAID’s remmen COX-1 sterker dan COX-2; vooral acetylsalicylzuur heeft een veel grotere affiniteit voor COX-1 dan voor COX-2.
Renale bijwerkingen NSAID's
Onder basale omstandigheden is de doorbloeding van de nier slechts in geringe mate afhankelijk van de prostaglandinesynthese. Het is nog niet helemaal opgehelderd welke rol de in de nieren aanwezige cyclo-oxygenasen hierbij spelen, maar COX-2 speelt zeker een rol bij de doorstroming van de nier en de elektrolythomeostase. Bij een verminderd circulerend volume (bijvoorbeeld bij dehydratie, diureticagebruik of hartfalen), bij levercirrose of bij een verminderde nierfunctie (bijvoorbeeld bij ouderen of bij nierziekten) kan een toename van de prostaglandinesynthese voorkomen dat in de nieren te sterke vasoconstrictie optreedt en daardoor de renale perfusie vermindert. De rol van prostaglandinen is in die omstandigheden cruciaal. NSAID’s verstoren de prostaglandinesynthese en daarmee dit beschermende compensatiemechanisme. Zij kunnen daardoor naast acute nierinsufficiëntie ook water- en zoutretentie veroorzaken, en hypertensie en hartfalen doen ontstaan of verergeren. Risicofactoren zijn onder andere hartfalen, levercirrose, nefrotisch syndroom, chronische nieraandoeningen, leeftijd, dehydratie door andere oorzaken en het gebruik van geneesmiddelen die de nierfunctie verminderen, zoals diuretica of RAS-remmers. Het advies is dan ook om geen NSAID’s voor te schrijven aan patiënten met een sterk verminderde nierfunctie (eGFR < 30 ml/min/1,73 m2). Als een NSAID toch noodzakelijk is, wordt bij een eGFR van 10 tot 30 ml/min/1,73 m2aangeraden om de nierfunctie in de gaten te houden door in ieder geval voorafgaand aan en één week na het starten van het NSAID de nierfunctie te controleren en bij voortgezet gebruik de nierfunctie regelmatig te blijven controleren. NSAID’s kunnen bij een patiënt met een slechte nierfunctie acute nierinsufficiëntie veroorzaken.
Cardiovasculaire en gastro-intestinale bijwerkingen NSAID’s
Uitgangsvraag
Leidt het gebruik van (verschillende groepen van) NSAID’s (I) tot meer cardiovasculaire en gastro-intestinale bijwerkingen (O) dan placebo (C) bij patiënten met pijn (P)?
Cruciale uitkomstmaten
Voor deze uitgangsvraag werden de volgende cruciale uitkomstmaten (O) vastgesteld:
- coronaire gebeurtenissen
- beroerte
- cardiovasculaire gebeurtenissen
- hartfalen
- sterfte
- gastro-intestinale complicaties
Methode
Cardiovasculaire en gastro-intestinale bijwerkingen vormen een belangrijke beperking voor het gebruik van NSAID’s (zowel klassieke als COX-2-selectieve). Op basis van de PHARMO-database werd vastgesteld dat er in 2000 in Nederland 2823 NSAID-gerelateerde ziekenhuisopnamen voor gastro-intestinale complicaties waren, waarbij 165 patiënten overleden. De kans op gastro-intestinale complicaties neemt toe door gebruik van een hoge dosering NSAID of van meerdere NSAID’s tegelijk, bij langer gebruik, bij een hogere leeftijd (> 70 jaar), bij een maagulcus of complicaties daarvan in de voorgeschiedenis, bij ernstige comorbiditeit (zoals hartfalen en diabetes mellitus), bij ernstige actieve reumatoïde artritis en bij het gelijktijdige gebruik van anticoagulantia, acetylsalicylzuur, corticosteroïden of SSRI’s.
De meta-analyse door de Coxib and traditional NSAID Trialists’ (CNT) Collaboration werd door de werkgroep geëvalueerd met behulp van de GRADE-methodiek (Grades of Recommendation Assessment, Development, and Evaluation). Nagegaan werd of NSAID’s en COX-2-selectieve NSAID’s vergeleken met placebo onderling verschillen met betrekking tot het optreden van cardiovasculaire en gastro-intestinale bijwerkingen. Er werden GRADE-afkappunten RR 0,75 voor considerable benefit en 1,25 voor considerable harm gebruikt.
Beschrijving onderzoeken
In de meta-analyse werden 639 trials (gemiddelde leeftijd 61 jaar, 2/3 vrouwen, 79% lichte huidskleur) naar effecten en bijwerkingen van NSAID’s geïncludeerd. In 184 hiervan werd een COX-2-selectief NSAID met placebo vergeleken, in 158 een ander NSAID (diclofenac, ibuprofen of naproxen) met placebo en in 113 een COX-2-selectief NSAID met een ander NSAID (33 diclofenac, 22 ibuprofen en 48 naproxen). COX-2-selectieve NSAID’s zijn in de meta-analyse niet onderverdeeld naar soort. De vergelijking tussen een COX-2-selectief NSAID en placebo werd direct berekend met conventionele meta-analysetechnieken, voor zover mogelijk met individuele patiëntendata; voor de vergelijking tussen de andere NSAID’s en placebo werd de directe schatting gecombineerd met een indirect verkregen schatting, door trials van een COX-2-selectief NSAID versus placebo te vergelijken met trials van een COX-2-selectief NSAID versus een ander NSAID.
Bij ongeveer 80% van de deelnemers was de indicatie voor behandeling met een NSAID reumatoïde artritis of artrose. Ongeveer 20% van de deelnemers gebruikte maagbescherming, meestal een protonpompremmer.
Kwaliteit van bewijs
De kwaliteit van bewijs voor de verschillende bijwerkingen door de verschillende NSAID’s varieerde van hoog tot laag. In veel gevallen was er sprake van onnauwkeurigheid van de resultaten. Daarnaast was er sprake van indirect bewijs voor de vergelijkingen tussen overige NSAID’s en placebo.
Bijwerkingen
Ongeveer 99% van de cruciale uitkomsten trad op in trials met een COX-2-selectief NSAID of met een hoge dosering van een ander NSAID (diclofenac 150 mg dagelijks, ibuprofen 2400 mg dagelijks, naproxen 1000 mg dagelijks).
In tabel 5 worden de resultaten over de bijwerkingen gepresenteerd voor de verschillende NSAID’s vergeleken met placebo.
| Uitkomstmaat | Geschat aantal gebeurtenissen per 1000 personen per jaar |
Relatief effect |
Aantal patiënten |
Kwaliteit van bewijs |
|
|---|---|---|---|---|---|
| Placebo* | NSAID (95%-BI) | ||||
|
COX-2-selectieve NSAID’s |
|||||
| Coronaire gebeurtenissen | 3 |
6 |
RR 1,76 |
41.328 |
⊕⊕⊕⊕ |
| Beroerte | 4 |
4 |
RR 1,09 |
40.471 |
⊕⊕⊕⊖ |
| Cardiovasculaire gebeurtenissen | 8 |
11 |
RR 1,37 |
48.037 |
⊕⊕⊕⊖ |
| Hartfalen | 3 |
6 |
RR 2,28 |
32.879 |
⊕⊕⊕⊕ |
| Sterfte door alle oorzaken | 14 |
17 |
RR 1,22 |
40.650 |
⊕⊕⊕⊖ |
| Gastro-intestinale complicaties | 2 |
3 |
RR 1,81 |
33.161 |
⊕⊕⊕⊖ |
|
Diclofenac |
|||||
| Coronaire gebeurtenissen | 3 |
6 |
RR 1,70 |
niet bekend |
⊕⊕⊖⊖ |
| Beroerte | 4 |
4 |
RR 1,18 |
niet bekend |
⊕⊕⊖⊖ |
| Cardiovasculaire gebeurtenissen | 8 |
12 |
RR 1,41 |
niet bekend |
⊕⊕⊖⊖ |
| Hartfalen | 3 |
5 |
RR 1,85 |
niet bekend |
⊕⊕⊖⊖ |
| Sterfte door alle oorzaken | 14 |
17 |
RR 1,20 |
niet bekend |
⊕⊕⊖⊖ |
| Gastro-intestinale complicaties | 2 |
4 |
RR 1,89 |
niet bekend |
⊕⊕⊖⊖ |
|
Ibuprofen |
|||||
| Coronaire gebeurtenissen | 3 |
7 |
RR 2,22 |
niet bekend |
⊕⊕⊖⊖ |
| Beroerte | 4 |
3 |
RR 0,97 |
niet bekend |
⊕⊕⊖⊖ |
| Cardiovasculaire gebeurtenissen | 8 |
12 |
RR 1,44 |
niet bekend |
⊕⊕⊖⊖ |
| Hartfalen | 3 |
6 |
RR 2,49 |
niet bekend |
⊕⊕⊖⊖ |
| Sterfte door alle oorzaken | 14 |
23 |
RR 1,61 |
niet bekend |
⊕⊕⊖⊖ |
| Gastro-intestinale complicaties | 2 |
8 |
RR 3,97 |
niet bekend |
⊕⊕⊕⊖ |
|
Naproxen |
|||||
| Coronaire gebeurtenissen | 3 |
3 |
RR 0,84 |
niet bekend |
⊕⊕⊖⊖ |
| Beroerte | 4 |
3 |
RR 0,97 |
niet bekend |
⊕⊕⊖⊖ |
| Cardiovasculaire gebeurtenissen | 8 |
8 |
RR 0,93 |
niet bekend |
⊕⊕⊖⊖ |
| Hartfalen | 3 |
5 |
RR 1,87 |
niet bekend |
⊕⊕⊖⊖ |
| Sterfte door alle oorzaken | 14 |
15 |
RR 1,03 |
niet bekend |
⊕⊕⊖⊖ |
| Gastro-intestinale complicaties | 2 |
8 |
RR 4,22 |
niet bekend |
⊕⊕⊕⊖ |
| * Geschat op basis van trials met COX-2-selectieve NSAID’s. Coronaire gebeurtenissen: niet-fataal myocardinfarct of coronaire sterfte. Cardiovasculaire gebeurtenissen: niet-fataal myocardinfarct, niet-fatale beroerte of cardiovasculaire sterfte. Gastro-intestinale complicaties: perforatie, obstructie of bloeding. |
|||||
Cardiovasculaire bijwerkingen
Er is veel zekerheid dat COX-2-selectieve NSAID’s vergeleken met placebo het risico op cardiovasculaire bijwerkingen verhogen; met name op de uitkomst myocardinfarct of sterfte aan coronaire hartziekte (RR 1,76; 95%-BI 1,31 tot 2,37; absoluut effect 3 meer per 1000 patiënten per jaar; 95%-BI 1 tot 5 meer) en hartfalen (RR 2,28; 95%-BI 1,62 tot 3,20; absoluut effect 3 meer per 1000 patiënten per jaar; 95%-BI 2 tot 6 meer) waren er klinisch relevante verschillen. Voor diclofenac en ibuprofen zijn er aanwijzingen voor vergelijkbare effecten, al is daar minder zekerheid over. De wettelijke productinformatie en bijsluiters van diclofenac zijn in de tweede helft van 2013 aangepast en vermelden een verhoogd risico op cardiovasculaire bijwerkingen en contra-indicatie bij patiënten met hartfalen, ischemische hartziekten, perifeer arterieel vaatlijden en na CVA. Naproxen lijkt het risico op cardiovasculaire bijwerkingen (met uitzondering van hartfalen) niet te verhogen, maar over deze effecten is veel onzekerheid.
In prospectief Nederlands onderzoek (n = 8423, gemiddelde leeftijd 68,5 jaar, 58% vrouwen, follow-up 12,9 jaar) werd het verband onderzocht tussen NSAID-gebruik en atriumfibrilleren; 857 personen ontwikkelden atriumfibrilleren. Huidig NSAID-gebruik vergeleken met nooit NSAID-gebruik was geassocieerd met een verhoogd risico op atriumfibrilleren: HR 1,76; 95%-BI 1,07 tot 2,88. Ook recent NSAID-gebruik (< 30 dagen na staken van NSAID’s) was geassocieerd met een verhoogd risico vergeleken met nooit NSAID-gebruik: HR 1,84; 95%-BI 1,34 tot 2,51 (gecorrigeerd voor leeftijd, geslacht en meerdere confounders).
In een Deens registratieonderzoek werd het verband onderzocht tussen NSAID-gebruik en bloedingen en cardiovasculaire gebeurtenissen bij 61.971 patiënten met een eerste myocardinfarct die antitrombotische behandeling kregen. Zowel het risico op bloedingen (HR 2,02; 95%-BI 1,81 tot 2,26) als het risico op cardiovasculaire gebeurtenissen (HR 1,40; 95%-BI 1,30 tot 1,49) was verhoogd voor NSAID-gebruik versus geen NSAID-gebruik.
Gastro-intestinale bijwerkingen
Er is veel zekerheid over het bestaan van een klinisch relevant effect op het ontstaan van gastro-intestinale complicaties door ibuprofen en naproxen vergeleken met placebo (RR ongeveer 4; absoluut effect 6 complicaties meer per 1000 patiënten per jaar). Ook het risico door COX-2-selectieve NSAID’s en diclofenac lijkt enigszins verhoogd, maar minder sterk (RR ongeveer 1,8 tot 1,9; absoluut effect 2 meer per 1000 patiënten per jaar) en hierover is minder zekerheid.
Conclusie
COX-2-selectieve NSAID’s (kwaliteit van bewijs hoog tot matig) en waarschijnlijk ook diclofenac (150 mg daags) en mogelijk ook ibuprofen (2400 mg daags) (kwaliteit van bewijs laag) kunnen leiden tot een verhoogd risico op cardiovasculaire bijwerkingen. Naproxen leidt waarschijnlijk niet tot een verhoogd risico op cardiovasculaire bijwerkingen (met uitzondering van hartfalen, zoals ook het geval is voor de overige klassieke en COX-2-selectieve NSAID’s) (kwaliteit van bewijs laag). Vooral naproxen en ibuprofen geven een verhoogd risico op gastro-intestinale bijwerkingen (kwaliteit van bewijs matig). Voor COX-2-selectieve NSAID’s (kwaliteit van bewijs matig) en diclofenac (kwaliteit van bewijs laag) kan een risicoverhoging op gastro-intestinale bijwerkingen niet worden uitgesloten, maar dit risico lijkt lager dan dat van naproxen en ibuprofen.
Overwegingen
Optreden van bijwerkingen in de tijd
Subgroepanalyses geven een aanwijzing dat het risico op gastro-intestinale bijwerkingen vooral toeneemt vlak na het starten van de behandeling. Bij risico op cardiovasculaire gebeurtenissen is dit minder duidelijk. Daarnaast was de gemiddelde duur van de trials minder dan een jaar, dus over langeretermijneffecten kan geen betrouwbare informatie worden gegeven. Bijwerkingen die optreden langer dan enkele weken nadat de patiënt gestopt was met de medicatie zijn in de meeste onderzoeken niet geregistreerd, dus ook hierover kan geen uitspraak gedaan worden.
Dosis-responsrelatie
Er leek een trend naar een lager risico bij lagere dosering celecoxib, maar de aantallen per dosering waren zo klein dat hier geen duidelijke uitspraak over kan worden gedaan. De aantallen in trials met overige COX-2-selectieve NSAID’s waren nog kleiner, zodat daarover evenmin een uitspraak kan worden gedaan. De NSAID’s waren in vrijwel alle trials hoog gedoseerd en tussen de trials was er weinig variatie. Een dosis-responsrelatie lijkt echter aannemelijk omdat het vasculaire risico waarschijnlijk gerelateerd is aan de mate van COX-2-remming, die toeneemt met toenemende dosering.
Overige overwegingen
Het cardiovasculaire risico of morbiditeit is niet altijd bekend. Omdat cardiovasculaire incidenten in de regel ernstiger zijn dan gastro-intestinale incidenten, wordt aan cardiovasculaire bijwerkingen een hoger gewicht toegekend. Omdat volgens de wettelijke productinformatie diclofenac een verhoogd risico op cardiovasculaire bijwerkingen heeft, en mogelijk ook hoog gedoseerd ibuprofen een met COX-2-selectieve NSAID’s vergelijkbaar cardiovasculair risico heeft, terwijl hoog gedoseerd naproxen geassocieerd lijkt met een lager risico, beveelt de werkgroep aan om aan patiënten met pijnklachten, die een indicatie hebben voor een NSAID, bij voorkeur naproxen voor te schrijven. Onzeker is of de bovengenoemde associaties ook gelden voor NSAID’s in lagere doseringen. Individuele patiënten kunnen wisselend gevoelig zijn voor de pijnstillende werking van verschillende NSAID’s. Daarnaast is alleen van diclofenac een injectievorm beschikbaar in de huisartsenpraktijk. Op grond van deze overwegingen zijn ook diclofenac en ibuprofen als mogelijk NSAID opgenomen.
Aanbeveling
Bij het voorschrijven van een NSAID is in geval van een verhoogd cardiovasculair risico naproxen het middel van eerste keus. Er kan ook voor diclofenac of ibuprofen worden gekozen bij een verhoogd gastro-intestinaal risico in afwezigheid van cardiovasculaire comorbiditeit. Geef NSAID’s in zo laag mogelijke dosering voor zo kort mogelijke duur. COX-2-selectieve NSAID’s worden niet aanbevolen.
In het algemeen hebben de NSAID’s een grotere impact op het oppervlaktewater dan paracetamol. Ze vormen daarmee een groter risico voor het waterleven. NSAID’s kunnen bijvoorbeeld weefselschade veroorzaken bij vissen en de voortplanting van vissen en amfibieën beïnvloeden.
Aandachtspunten veiligheid NSAID’s
Naar Samenvatting ›Houd rekening met contra-indicaties (zie tabel 6).
Bij relatieve contra-indicaties:
- Weeg extra zorgvuldig de voor- en nadelen van het gebruik van het NSAID tegen elkaar af.
- Beperk het gebruik tot 1-2 weken.
- Bij meerdere relatieve contra-indicaties: geef geen NSAID.
- Zie voor eventuele aanvullende controles Controles bij NSAID’s.
NSAID’s kunnen het effect van diuretica, RAS-remmers en bètablokkers verminderen doordat ze water- en zoutretentie veroorzaken. Bij patiënten met een verminderde nierfunctie kan het gebruik van NSAID’s leiden tot acute nierinsufficiëntie of tot water- en zoutretentie, met als gevolg het ontstaan of verergeren van hartfalen en hypertensie. Extra risicofactor hierbij is het gebruik van geneesmiddelen die de nierfunctie kunnen verminderen, zoals diuretica en RAS-remmers. NSAID’s zijn gecontra-indiceerd bij gelijktijdig gebruik van angiotensineconverterend enzym (ACE)-remmers, angiotensinereceptorblokkeerders (ARB’s) en diuretica. Een van deze geneesmiddelen dient dan gestaakt te worden. NSAID’s verhogen het bloedingsrisico, maar omdat de stollingstijd meestal niet toeneemt komt dit niet altijd tot uiting in de INR. Daarom kan de trombosedienst niet altijd ‘bijsturen’ door bijvoorbeeld de cumarinedosering aan te passen. NSAID’s moeten daarom, maar ook door hun ulcerogeen effect, zo min mogelijk worden voorgeschreven aan patiënten die cumarinederivaten gebruiken. Gelijktijdig gebruik van NSAID’s met onder andere SSRI’s en corticosteroïden vergroot het risico op gastro-intestinale complicaties, in het bijzonder bij ouderen.
Toevoeging van een NSAID aan lithium kan de lithiumspiegel doen stijgen, en toevoeging aan methotrexaat kan de methotrexaatspiegel doen stijgen (controle van onder andere bloedbeeld, nierfunctie en leverfunctie wordt geadviseerd). Voor lage dosering methotrexaat (15 tot 30 mg per week) is de klinische impact van deze interactie klein; bij dosering < 15 mg per week treedt deze interactie niet op. Tot slot kunnen NSAID’s de nefrotoxiciteit van ciclosporine versterken.
De tromboprofylactische werking van antitrombotische salicylaten (ASA, preparaten tot en met 100 mg) neemt af in combinatie met ibuprofen. Vermijd daarom deze combinatie. Ibuprofen remt de irreversibele trombocytenaggregatieremmende werking van het salicylaat. ASA remt de trombocytenaggregatie irreversibel door acetylering van COX-1. NSAID’s remmen de trombocytenaggregatie reversibel. ASA kan de actieve bindingsplaats in COX-1 niet bereiken als een ander NSAID zich in het COX-1-kanaal bevindt. De sterkste aanwijzing voor een klinisch relevante interactie van ibuprofen met ASA komt uit een post-hocanalyse van het TARGET-onderzoek bij patiënten met een hoog risico op een hartinfarct. Hierin trad ruim achtmaal zo vaak een hartinfarct op bij patiënten die naast ASA ibuprofen gebruikten als bij patiënten die daarnaast lumiracoxib gebruikten (2,14% versus 0,25%; p = 0,0310).
Van naproxen is niet bekend of het een nadelig effect heeft op het tromboprofylactisch effect van ASA. De resultaten van interactieonderzoeken zijn wisselend, het tromboprofylactisch effect van ASA gaat (deels) verloren.
In het TARGET-onderzoek werd in de subgroep van naproxengebruikers vergelijkbare incidenties gevonden als in de lumiracoxibgroep (1,58% versus 1,48%; p = 0,899).
Conclusie
Diclofenac en COX-2-selectieve NSAID’s hebben geen nadelig effect op het tromboprofylactisch effect van ASA en lijken op farmacologische gronden de voorkeur te verdienen bij patiënten die acetylsalicylzuur gebruiken en aan wie toch met dwingende noodzaak een NSAID voorgeschreven moet worden. Het is niet bekend of naproxen een nadelig effect heeft op het tromboprofylactisch effect van ASA.
De contra-indicaties in de tabel sluiten aan op de KNMP Kennisbank (geraadpleegd mei 2021). Voor de contra-indicaties bij een verminderde nierfunctie is voor een middenweg gekozen tussen het advies van de KNMP en de NHG-Standaard Chronische nierschade.
Extra voorzichtigheid voor het gebruik van klassieke NSAID’s en COX-2-selectieve NSAID’s is geboden bij kwetsbare ouderen. Geadviseerd wordt om NSAID’s zo kort mogelijk en in zo laag mogelijke dosering voor te schrijven.
Ephor
In een review uitgevoerd door het Expertisecentrum Pharmacotherapie bij Ouderen (Ephor) werden de veiligheid en werkzaamheid van NSAID’s en COX-2-selectieve NSAID’s in deze patiëntencategorie nagegaan.
Het beoordelen van de kwaliteit van de beschreven eindpunten vond plaats aan de hand van GRADE.
Gastro-intestinale bijwerkingen
COX-2-selectieve NSAID’s (celecoxib en etoricoxib) en mogelijk ook nabumeton geven een verlaagd risico op klinisch relevante gastro-intestinale bijwerkingen vergeleken met klassieke NSAID’s (bewijs veelal van lage kwaliteit). Met name piroxicam, indometacine en naproxen leiden tot een hoog risico op gastro-intestinale bijwerkingen. Combinatie van een klassiek NSAID met een maagbeschermer geeft een vergelijkbaar risico als celecoxib en nabumeton. Mogelijk wordt extra winst behaald bij gebruik van celecoxib bij patiënten > 75 jaar door toevoegen van een protonpompremmer (beperkt bewijs).
Stoppen van de behandeling als gevolg van gastro-intestinale intolerabiliteit (onder andere dyspepsie) wordt vaker gezien bij gebruik van ibuprofen en naproxen ten opzichte van diclofenac en celecoxib en vaker bij piroxicam dan nabumeton (als gevolg van misselijkheid). Het gastro-intestinale risico van meloxicam ten opzichte van andere NSAID’s is niet onderzocht bij kwetsbare ouderen.
Cardiovasculaire bijwerkingen
Er is beperkt onderzoek naar het risico op hartfalen door NSAID’s bij kwetsbare ouderen. Hierdoor is er geen onderscheid te maken tussen de verschillende NSAID’s. Observationeel onderzoek laat bij oudere patiënten een grotere kans op hartfalen zien onder NSAID-gebruik. Het risico op trombo-embolische complicaties (voornamelijk myocardinfarct en CVA) is het laagst bij gebruik van naproxen (mogelijk zelfs een beschermend effect ten opzichte van placebo).
De andere NSAID’s laten veelal geen significante verschillen zien bij onderlinge vergelijking dan wel vergelijking met placebo (mogelijk als gevolg van lage doseringen en kortdurend gebruik; gegevens hierover ontbreken veelal). Gebruik van COX-2-selectieve NSAID’s en diclofenac (3 keer daags 50 mg) laten in de algemene populatie een significant verhoogd risico zien ten opzichte van placebo.
Conclusies Ephor
De auteurs concluderen dat celecoxib het minst ongunstige gastro-intestinale risicoprofiel heeft, maar is gecontra-indiceerd bij arteriële trombo-embolische complicaties in de voorgeschiedenis (voornamelijk myocardinfarct en CVA). Naproxen is het NSAID van voorkeur wat betreft het risico op cardiovasculaire complicaties maar geeft een relatief hoog risico op gastro-intestinale bijwerkingen. Een klassiek NSAID dient bij kwetsbare ouderen in combinatie met een maagbeschermer gegeven te worden. Er zijn aanwijzingen dat de toevoeging van een protonpompremmer aan celecoxib een meerwaarde heeft bij patiënten ouder dan 75 jaar met een hoog gastro-intestinaal risicoprofiel. Gezien het ontbreken van bewijs voor effectiviteit en veiligheid en/of een hoog risico op gastro-intestinale complicaties, wordt het gebruik van etoricoxib, indometacine, meloxicam en piroxicam door Ephor ontraden bij de kwetsbare oudere patiënt.
Wat betreft de effectiviteit zijn er geen aanwijzingen dat NSAID’s bij kwetsbare ouderen onderling van elkaar verschillen. Er zijn echter geen onderzoeken uitgevoerd bij ouderen voor etoricoxib, indometacine, meloxicam en piroxicam.
Verenso
De Verenso multidisciplinaire richtlijn Pijn bepleit grote terughoudendheid in het voorschrijven van NSAID’s bij kwetsbare ouderen. Bij patiënten bij wie sprake is van artritis kunnen NSAID’s met grote voorzichtigheid kortdurend worden toegepast. COX-2-selectieve NSAID’s worden in de richtlijn niet aanbevolen bij kwetsbare ouderen, hoewel met name celecoxib een lager risico geeft op gastro-intestinale complicaties dan klassieke NSAID’s (zonder protonpompremmer). De COX-2-selectiviteit wordt tenietgedaan in combinatie met acetylsalicylzuur. Verder zijn COX-2-selectieve NSAID’s gecontra-indiceerd bij hartfalen, ischemische hartziekte en/of cerebrovasculair lijden, terwijl een substantieel deel van de kwetsbare ouderen om die reden niet in aanmerking zal komen voor een COX-2-selectieve NSAID.
Kwetsbare ouderen die klassieke NSAID’s voorgeschreven krijgen dienen als maagprotectie ook een protonpompremmer of misoprostol of hoge dosering H2-antagonist te gebruiken (hoge kwaliteit van bewijs, sterke aanbeveling). Ibuprofen dient niet te worden voorgeschreven aan kwetsbare ouderen die acetylsalicylzuur of carbasalaatcalcium gebruiken, omdat ibuprofen de trombocytenaggregatieremmende werking van acetylsalicylzuur en carbasalaatcalcium remt (middelmatige kwaliteit van bewijs, sterke aanbeveling).
Conclusie Verenso
De Verenso-richtlijn adviseert geen COX-2-selectieve NSAID's voor te schrijven aan kwetsbare ouderen. Bij patiënten met artritis kan eventueel kortdurend een klassiek NSAID worden voorgeschreven in combinatie met een protonpompremmer.
Conclusie werkgroep
De werkgroep adviseert geen COX-2-selectieve NSAID’s voor te schrijven aan kwetsbare ouderen, omdat zij juist een verhoogd risico op trombo-embolische complicaties hebben zodat COX-2-selectieve NSAID’s bij hen gecontra-indiceerd zijn. Als een NSAID toch noodzakelijk is, adviseert de werkgroep het gebruik zo kort en de dosering zo laag mogelijk te houden en een klassiek NSAID met een protonpompremmer te geven. Kies het klassieke NSAID afhankelijk van de patiëntkenmerken (zie Voorkeursmiddelen en doseringen NSAID's)
Als er een anafylactische reactie optreedt op een NSAID, gaat het meestal om een niet-allergische reactie: door de remming van cyclo-oxygenase raakt het arachidonzuurmetabolisme verstoord en dit zorgt voor degranulatie van mestcellen. Soms is er sprake van een allergische IgE-gemedieerde anafylactische reactie. Een niet-allergische reactie kan al bij eerste toediening optreden, eerdere blootstelling is niet noodzakelijk.
Beide typen anafylactische reacties zijn klinisch niet te onderscheiden op grond van de symptomen en/of de ernst. Bij het merendeel van de patiënten is er sprake van kruisovergevoeligheid voor meerdere NSAID’s, inclusief acetylsalicylzuur. Op grond van de chemische structuur van het NSAID valt niet te voorspellen of iemand die eerder anafylactisch reageerde op een bepaald NSAID ook zo zal reageren op een NSAID uit een andere chemische groep. Verwijs bij een dringende indicatie voor een NSAID of acetylsalicylzuur naar een specialist met ervaring op dit gebied. Onder gecontroleerde omstandigheden kan een klinische provocatie met een eventueel alternatief plaatsvinden. In sommige gevallen (vooral bij overgevoeligheid voor acetylsalicylzuur en NSAID’s, die zich kan uiten met neusverstopping/loopneus en bronchospasmen) kan men besluiten tot geleidelijke desensibilisatie in een klinische setting, waarna de patiënt het NSAID in chronische onderhoudstherapie soms wel goed verdraagt.
Preventie van maagcomplicaties door NSAID’s
Naar Samenvatting ›Geef patiënten met een verhoogd risico op maagcomplicaties maagbescherming met een protonpompremmer. Van een verhoogd risico is sprake bij:
- leeftijd ≥ 70 jaar
- peptisch ulcus of maagcomplicaties in de voorgeschiedenis, ongeacht de leeftijd
- ≥ 2 van de volgende factoren:
- 60-70 jaar
- ernstige invaliderende reumatoïde artritis, hartfalen of diabetes
- hooggedoseerd NSAID-gebruik (diclofenac > 100 mg per dag, ibuprofen > 1200 mg per dag, naproxen > 500 mg per dag)
- comedicatie die het risico op maagcomplicaties verhoogt (vitamine K-antagonist, DOAC, P2Y12-remmer, heparine, systemisch corticosteroïd, SSRI, venlafaxine, duloxetine, trazodon, spironolacton)
Verricht tevens H. pylori-diagnostiek bij een peptisch ulcus in de voorgeschiedenis en bij een onbekende H. pylori.-status. Zie de NHG-Behandelrichtlijn Preventie van maagcomplicaties door geneesmiddelgebruik.
|
Absolute contra-indicaties |
Relatieve contra-indicaties |
|---|---|
|
Algemeen |
|
|
overgevoeligheidsreactie op een NSAID in het verleden (kruisovergevoeligheid) |
kwetsbare ouderen
|
|
actuele infectie met waterpokken of gordelroos |
intercurrente infecties (maskering verschijnselen hiervan) |
|
levercirrose (Child Pugh A, B en C) |
leverfunctiestoornis anders dan cirrose |
|
anamnese van een longaanval na gebruik van acetylsalicylzuur of een NSAID |
psoriasis |
|
|
systemische lupus erythematodes of gemengde bindweefselziekten |
|
|
inflammatoire darmziekten (risico op exacerbatie) |
|
Zwangerschap en borstvoeding |
|
|
zwangerschap derde trimester |
zwangerschap eerste en tweede trimester |
|
|
borstvoeding |
|
Nierinsufficiëntie en risico dehydratie |
|
|
dialyse |
chronische nierschade, in het bijzonder bij eGFR < 30 ml/min/1,73 m2 of in combinatie met risicofactoren voor verdere afname van nierfunctie, zoals hartfalen of gebruik van geneesmiddelen die de nierfunctie kunnen verminderen, zoals diuretica of RAS-remmers |
|
Vochtretentie |
|
|
ernstig hartfalen |
hartfalen |
|
|
hypertensie |
|
|
gebruik van bètablokkers, diuretica en RAS-remmers (afname werking) |
|
Hart- en vaatziekten |
|
|
hart- en vaatziekten in de voorgeschiedenis (absolute contra-indicatie geldt alleen voor diclofenac en voor ibuprofen vanaf dosering 2400 mg/dag) |
(verhoogd risico op) hart- en vaatziekten
|
|
Maagcomplicaties |
|
|
huidig ulcus pepticum, huidige gastritis, gastro-intestinale bloeding (huidig of in het verleden) |
bariatrische chirurgie
|
| indicatie maagbescherming bij een verhoogd risico op maagcomplicaties, zie Preventie van maagcomplicaties door NSAID’s | |
|
Interacties |
|
|
|
gebruik van bètablokkers, diuretica en RAS-remmers (afname werking) |
|
|
lage dosering acetylsalicylzuur als trombocytenaggregatieremmer (afname werking) (alleen van toepassing bij ibuprofen) |
| vitamine K-antagonisten en DOAC’s (verhoogd bloedingsrisico) | |
|
|
lithium (lithiumspiegel kan stijgen, met toxiciteit tot gevolg)(consulteer de voorschrijvend medisch specialist, controleer lithiumspiegel (zie Controles)) |
|
|
(consulteer de voorschrijvend medisch specialist over het beleid over labcontroles) |
Voorkeursmiddelen en doseringen NSAID’s
Naar Samenvatting ›- Kies afhankelijk van specifieke patiëntkenmerken (comorbiditeit, voorgeschiedenis van cardiovasculaire of gastro-intestinale aandoeningen, respons op eerder voorgeschreven NSAID’s, indicatie voor intramusculaire toediening) voor:
- naproxen (laagste cardiovasculaire risico, hoogste gastro-intestinale risico)
- ibuprofen (niet in combinatie met laaggedoseerd acetylsalicylzuur)
- diclofenac (laagste gastro-intestinale risico, hoogste cardiovasculaire risico; als enige NSAID beschikbaar in injectievorm)
- We bevelen COX-2-selectieve NSAID’s niet aan.
- Zwangerschap/borstvoeding (zie lareb.nl):
- eerste en tweede trimester zwangerschap: naproxen, ibuprofen of diclofenac (contra-indicatie in het derde trimester)
- borstvoeding: ibuprofen (tweede keus: diclofenac).
- Zie voor doseringen NSAID’s oraal, rectaal of intramusculair tabel 7.
|
Geneesmiddel |
Oraal |
Rectaal |
Parenteraal |
|---|---|---|---|
|
Naproxen |
Tablet, 2 dd 250-500 mg |
Zetpil, 2 dd 250-500 mg |
- |
|
Ibuprofen |
Dragee, tablet, 3-4 dd 400-600 mg |
- |
- |
|
Diclofenac |
Tablet, 2-3 dd 25-50 mg of 2 dd 75 mg |
Zetpil, 2-3 dd 25-50 mg |
Injectievloeistof, 25 mg/ml; ampul, eenmalig 75 mg (= 3 ml), diep intragluteaal |
|
Overschrijd de geregistreerde maximale dagdosering niet: boven deze dosering is de kans op bijwerkingen sterk verhoogd, terwijl er geen bewijs is voor extra pijnvermindering. |
|||
NSAID’s bij kinderen
Naar Samenvatting ›- Geef kinderen bij indicatie voor een NSAID ibuprofen.
- Geef geen NSAID bij waterpokken of gordelroos.
- We bevelen de combinatie van paracetamol met een NSAID niet aan bij kinderen.
- Zie voor doseringen tabel 8.
|
Gewicht (en leeftijd) |
Oraal (drank 20 mg/ml, tablet/dragee/capsule 200 mg, 400 mg), rectaal |
|---|---|
|
Op basis van gewicht |
20 mg/kg/dag in 3-4 giften (maximaal 30 mg/kg/dag, maximaal 1200 mg/dag) |
|
Bij voorkeur gedurende maximaal 3 dagen NB Rectale toediening in verband met noodzaak magistrale bereiding en hoge kosten alleen bij uitzondering |
|
Effectiviteit
Ibuprofen
In een meta-analyse (zeventien RCT’s) werd de effectiviteit van paracetamol en ibuprofen op pijn en/of koorts bij kinderen vergeleken. Ibuprofen (4 tot 10 mg/kg) bleek even werkzaam voor de behandeling van pijn als paracetamol (7 tot 15 mg/kg). Het antipyretische effect van ibuprofen was superieur ten opzichte van paracetamol. Deze bevindingen komen overeen met die uit een latere meta-analyse (85 RCT’s) waarin de werkzaamheid van ibuprofen werd vergeleken met paracetamol bij kinderen en volwassenen. Van de achttien RCT’s waarin de werkzaamheid van ibuprofen en paracetamol bij kinderen werd vergeleken, werd in de meeste geen verschil gevonden. In zes van de achttien onderzoeken was ibuprofen effectiever. Er zijn aanwijzingen dat voor met name pijn van het houdings- en bewegingsapparaat ibuprofen effectiever is dan paracetamol.
Paracetamol en ibuprofen gecombineerd of afgewisseld. In een Cochrane-review (6 onderzoeken, 915 kinderen van 6 maanden tot 14 jaar) werd in slechts 1 van de 6 onderzoeken geconstateerd dat bij afwisseling van paracetamol en ibuprofen de met koorts geassocieerde pijnscore significant lager was. Indien paracetamol en ibuprofen gecombineerd of afwisselend worden toegediend leidt dat wel tot sterkere verlaging van de koorts maar niet tot een beter algemeen welbevinden.
Naproxen
Naproxen heeft een iets langere halfwaardetijd dan ibuprofen en moet twee-tot driemaal daags worden gegeven. Er zijn weinig onderzoeken naar het effect van naproxen. Cukiernik et al. vergeleken bij 77 kinderen met een enkeldistorsie het effect van naproxen met paracetamol. Zij vonden geen verschil in effectiviteit en bijwerkingen. Echter, de gebruikte dosering paracetamol (15 mg/kg/dosis) en naproxen (5 mg/kg/dosis, 4 doses per dag!) was laag.
Diclofenac
In een Cochrane-review over diclofenac (7 onderzoeken over werkzaamheid, 79 over veiligheid) concluderen de auteurs dat diclofenac een effectief en relatief veilig NSAID is voor acute pijn bij kinderen tot 18 jaar. De review focust echter op perioperatieve acute pijn, waardoor de resultaten niet zonder meer naar de eerste lijn te extrapoleren zijn.
COX-2-selectieve NSAID's
De effectiviteit van COX-2-selectieve NSAID’s bij kinderen is onvoldoende onderzocht.
Bijwerkingen
In een systematisch literatuuronderzoek en meta-analyse (24 RCT’s en 12 onderzoeken) wordt een vergelijkbaar veiligheidsprofiel gevonden tussen ibuprofen en paracetamol. Zowel ibuprofen als paracetamol geeft geen hogere incidentie van gastro-intestinale bloedingen, astma, nierfalen en anafylaxie dan placebo: ibuprofen versus placebo RR 1,39 (95%-BI 0,92 tot 2,10); paracetamol versus placebo RR 1,57 (95%-BI 0,74 tot 3,33). In totaal traden 2937 systemische bijwerkingen op bij 21.305 patiënten die ibuprofen gebruikten vergeleken met 1466 systemische bijwerkingen bij 11.164 patiënten op paracetamol RR 1,03 (95%-BI 0,98 tot 1,10). Deze bevindingen zijn in overeenstemming met resultaten van andere reviews.
De veiligheid van COX-2-selectieve NSAID’s bij kinderen is onvoldoende onderzocht. Over de langetermijneffecten van NSAID-gebruik bij kinderen is nog onvoldoende bekend.
Conclusie
De beschikbare informatie wijst erop dat ibuprofen even werkzaam is als paracetamol en dat er geen verschil is qua bijwerkingen.
Overwegingen
Ibuprofen heeft bij kinderen een met paracetamol vergelijkbare effectiviteit en veiligheid. Het Kinderformularium adviseert ibuprofen pas toe te passen vanaf de leeftijd van 3 maanden (NKFK, https://www.kinderformularium.nl/, geraadpleegd april 2021).
Gezien het toegenomen risico op toedieningsfouten bij dubbelmedicatie en het ontbreken van effect op algemeen welbevinden en pijnscore adviseert de werkgroep paracetamol en ibuprofen niet te combineren bij (kleine) kinderen.
Naproxen en diclofenac lijken eveneens effectief voor de behandeling van pijn bij kinderen, maar zijn minder goed onderzocht en er is minder klinische ervaring mee. Bovendien is diclofenac niet geregistreerd voor de indicatie pijn bij kinderen (behalve voor juveniele reumatoïde artritis mits in een dosering < 2 mg/kg/dag), en naproxen is pas geregistreerd voor kinderen ≥ 6 jaar.
Ook celecoxib is beschikbaar voor kinderen > 2 jaar met juveniele reumatoïde artritis, maar de effectiviteit en veiligheid van de COX-2-selectieve NSAID’s zijn nog onvoldoende onderzocht. De werkgroep beveelt deze middelen niet aan als pijnstiller bij kinderen in de eerste lijn.
Verschillende observationele onderzoeken beschrijven een verhoogd risico op secundaire huidinfecties (necrotiserende wekedeleninfecties, necrotiserende fasciitis en septische shock) bij patiënten die NSAID’s gebruiken ten tijde van een infectie met het varicellazostervirus . In deze onderzoeken kan er sprake zijn van confounding by indication. Dit betekent dat het mogelijk is dat de NSAID’s gegeven werden vanwege (pijn ten tijde van) secundaire complicaties en niet dat de NSAID’s deze complicaties mede hebben veroorzaakt. Totdat er meer duidelijkheid is over de daadwerkelijke relatie tussen NSAID-gebruik en secundaire complicaties wordt gebruik van NSAID’s echter niet geadviseerd bij waterpokken of gordelroos.
Gebruik van acetylsalicylzuur en carbasalaatcalcium kan bij kinderen met symptomen van waterpokken en influenza leiden tot het potentieel dodelijke syndroom van Reye (met ernstig braken, sufheid, ademhalingsstoornis, convulsies, coma, encefalopathie en vettige degeneratie van organen).
Aanbeveling
In aansluiting op de WHO-pijnladder is paracetamol stap 1 en ibuprofen stap 2 bij de behandeling van lichte tot matig-ernstige pijn bij kinderen. Pas ibuprofen alleen toe bij kinderen ≥ 3 maanden. De overige NSAID’s worden niet aanbevolen voor gebruik bij kinderen in de eerste lijn. Combinatie van paracetamol met een NSAID wordt niet aanbevolen bij kinderen. De werkgroep beveelt aan om geen NSAID bij waterpokken of gordelroos en geen acetylsalicylzuur voor te schrijven aan kinderen.
Controles bij NSAID’s
Naar Samenvatting ›- Bij patiënten met chronische nierschade en noodzakelijk (kortdurend) NSAID-gebruik:
- instrueer de patiënt om bij hoge koorts, braken en diarree of excessief zweten bij hitte contact op te nemen met de huisartsenpraktijk
- overweeg bij aanwijzingen voor (dreigende) dehydratie controle van de patiënt en aanvullend laboratoriumonderzoek (eGFR, kalium, natrium)
- overweeg op grond van het klinische beeld (en eventuele laboratoriumuitslagen) het NSAID in ieder geval tijdelijk te staken, maar ga ook na of dit volledig gestaakt kan worden.
- Bij patiënten met een verhoogd risico op vochtretentie (zie tabel 6): wees alert op het ontstaan van overvulling (dyspneu, toename lichaamsgewicht, oedeem).
- Bij noodzakelijke toevoeging van een NSAID aan lithium, na overleg met voorschrijver van lithium: controleer 12-uurs lithiumspiegel na stoppen, starten of dosisaanpassingen van interacterende medicatie (NSAID’s, RAS-remmers, diuretica en metronidazol) (zie de LESA Rationeel aanvragen laboratoriumdiagnostiek en het NHG-Standpunt Herhalen specialistische medicatie, bijlage Voorzorgen bij patiënten die lithium gebruiken.
Stap 3: zwakwerkend opioïd
Naar Samenvatting ›- Overweeg bij onvoldoende effect van paracetamol en NSAID toevoeging van een zwakwerkend opioïd.
- Sla bij nociceptieve pijn bij kanker deze stap over.
- Voorkeursmiddel is tramadol. Zie voor de dosering tabel 9.
- We bevelen codeïne (zowel oraal als rectaal) niet aan vanwege onvoldoende effect en het frequent optreden van bijwerkingen.
- Geef geen combinatiepreparaten van tramadol en paracetamol.
- Combineer tramadol niet met andere sterk serotonerge medicatie zoals MAO-remmers, SSRI’s of TCA’s (vooral clomipramine en imipramine), omdat dan het zeldzame maar potentieel fatale serotoninesyndroom kan optreden.
- Waarschuw voor bijwerkingen en nadelen van tramadol:
- 1 op de 5 patiënten ondervindt bijwerkingen. De meest voorkomende zijn: duizeligheid, misselijkheid, braken, hoofdpijn, droge mond, obstipatie, zweten, vermoeidheid, verwardheid en slaperigheid
- bij langer durend gebruik (arbitrair: > 1 maand): afhankelijkheid
- tramadol heeft in de therapeutische dosering een ernstig negatieve invloed op de rijvaardigheid. Bij (sub)chronisch gebruik is autorijden in ieder geval tijdens de eerste 2 weken niet toegestaan. Bij incidenteel gebruik is tramadol rijveilig vanaf 24 uur na inname van de laatste gift. Verwijs voor meer informatie naar rijveiligmetmedicijnen.nl.
- Bouw de dosering geleidelijk op, om bijwerkingen te voorkomen. Dit geldt in het bijzonder voor (kwetsbare) ouderen. Gebruik dan bijvoorbeeld druppels om op te titreren.
- Adviseer de patiënt bij de eerste aanwijzingen voor obstipatieklachten contact op te nemen voor een voorschrift voor een laxans.
- Bespreek dat het gebruik vanwege het risico op afhankelijkheid zo kort mogelijk dient te zijn.
- Om onttrekkingsverschijnselen te voorkomen na langer gebruik (arbitrair: > 1 maand): bouw de dosering geleidelijk af. Halveer de dosering bijvoorbeeld elke 2 tot 7 dagen. Bij ontwenningsverschijnselen, kwetsbare ouderen of voorkeur van de patiënt voor langzamer afbouwen: zie Beleid bij afbouwen na langdurig gebruik opioïden voor aanvullende adviezen en voorbeelden van langzamere afbouwschema’s.
| Tramadol | Oraal | Rectaal (bij misselijkheid of slikproblemen) | Bij nierfunctiestoornis (eGFR 10- 30 ml/min/1,73 m 2 | Bij levercirrose |
|---|---|---|---|---|
| Dosering volwassenen | Start met tablet, 1-2 dd 50 mg Verhoog zo nodig elke 3-5 dagen geleidelijk tot 1-4 dd 100 mg (maximaal 400 mg). | Zetpil 100 mg 1-2 dd Verhoog zo nodig geleidelijk tot 1-4 dd 100 mg, maximaal 400 mg per dag. | Verleng het doseringsinterval op geleide van het effect en de bijwerkingen.
| Child-Pugh A: start met maximaal 50 mg elke 12 uur, verhoog op geleide van effect en bijwerkingen.
Child-Pugh B en C: start met maximaal 25 mg elke 12 uur, verhoog tot maximaal 100 mg elke 12 uur. |
| Bij ouderen | Zie dosering volwassenen, verhoog tot maximaal 300 mg Bij kwetsbaarheid: Start met 1-2 dd 4 druppels$ (10-20 mg/dag). Verhoog (langzaam) tot maximaal 1-4 dd 4 tot 10 druppels (maximaal 100 mg/dag).* | - | ||
| Bij goed effect en blijvende indicatie voor tramadol | Overweeg omzetting naar preparaat met gereguleerde afgifte (MGA). Bijv. tablet MGA 2 dd 50 – 100 mg, of tablet ‘once daily’ 1 dd 200 mg. | - | - | - |
| Overschrijd de geregistreerde maximale dagdosering niet: boven deze dosering is de kans op bijwerkingen sterk verhoogd. * Bij ouderen > 75 jaar kan (onafhankelijk van nier- of leverfunctiestoornis) de eliminatiehalfwaardetijd verlengd zijn. Verleng op indicatie het doseringsinterval naar 12-24 uur. $ 1 druppel is 2,5 mg. | ||||
In de literatuur wordt in een aantal onderzoeken bij patiënten met kanker en pijn aannemelijk gemaakt dat overslaan van stap 3 (toevoegen van of overgaan op een zwakwerkend opioïd) een betere pijnstilling geeft bij patiënten met kanker.
In de klinische praktijk is het in het algemeen ook gebruikelijk om bij patiënten met heftige pijn deze stap over te slaan.
Achtergrond
Tramadol is een opioïd waarvan de actieve metaboliet een agonistisch effect heeft op de mureceptoren. Tramadol remt de heropname van noradrenaline en serotonine, waardoor het analgetisch effect versterkt wordt. Het analgetisch effect van 100 mg tramadol komt overeen met het effect van circa 15 mg morfine oraal. Tramadol valt niet onder de bepalingen van de Opiumwet.
Effectiviteit
Tramadol heeft een sterker analgetisch effect dan placebo. In dubbelblind onderzoek werden 646 patiënten met knieartrose gerandomiseerd naar behandeling met tramadol of placebo. Patiënten werden getitreerd naar hun optimale dosis (200 mg of 300 mg), wat gedurende 12 weken werd gecontinueerd. De pijnreductie in de tramadolgroep (3,0 ± 2,1 op de Pain Intensity Numerical Rating Scale) was significant groter dan in de placebogroep (p < 0, 001). Een systematisch literatuuronderzoek (11 onderzoeken, 1939 patiënten met artrose die tramadol of tramadol/paracetamol gebruikten) liet zien dat tramadol een sterkere pijnvermindering gaf dan placebo (−8,5 eenheden op een schaal 0 tot 100; 95%- BI −12,0 tot −5,0).
Vermindering van de pijn en daardoor verbetering van de slaap werd gevonden in gerandomiseerd onderzoek bij 1020 artrosepatiënten. Patiënten rapporteerden intensiteit van de pijn op een 100 mm visueel analoge schaal (VAS; 0 = geen pijn, 100 = extreme pijn). De gemiddelde pijnreductie na 12 weken was −30,4 mm en −21,5 mm voor respectievelijk tramadol en placebo (p < 0, 001). Klinisch relevante vermindering van pijngerelateerde slaapproblemen gedefinieerd als ≥ 16 mm verbetering werd vaker gevonden op tramadol dan op placebo (51% versus 42%; p = 0,022). In ander placebogecontroleerd onderzoek (follow-up 12 weken) werd eveneens een significante verbetering van de slaap gevonden door tramadol bij patiënten met artrose. Onderzoek (n = 122, cross-overdesign, follow-up 8 weken) met tramadol en tramadol retard bij chronische, matig-ernstige, niet-maligne pijn bracht een gunstiger effect op de pijn aan het licht van tramadol retard vergeleken met tramadol.
Bijwerkingen
In het systematisch literatuuronderzoek van Cepeda et al. werd gevonden dat 1 op de 5 patiënten bijwerkingen (misselijkheid, braken, duizeligheid, obstipatie, vermoeidheid, hoofdpijn) van tramadol ondervond en 1 op de 8 patiënten tramadol staakte. Het number needed to harm (NNH) was 8 (95%-BI 7 tot 12) voor ernstige bijwerkingen. Patiënten die tramadol kregen hadden een 2,27 keer zo grote kans op mineure en een 2,6 keer zo grote kans op majeure bijwerkingen vergeleken met placebo. In een onderzoek (patiënten met matig-ernstige pijn die werden behandeld met tramadol retard 100 tot 300 mg eenmaal daags) werden duizeligheid, misselijkheid, obstipatie, slaperigheid als belangrijkste bijwerkingen gerapporteerd. Onderzoek bij patiënten ≥ 65 jaar liet de volgende incidenties van het optreden van bijwerkingen zien: obstipatie (27,5%), misselijkheid (23,4%), duizeligheid (22,7%) en hoofdpijn (15,6%). In een onderzoek met tramadol retard bij patiënten met chronische, niet-maligne pijn (n = 919, follow-up 1 jaar, open label) stopte 76% van de patiënten in verband met bijwerkingen (vooral duizeligheid, misselijkheid en obstipatie). Geïndividualiseerde dosistitratie en eenmaal daagse inname tot een maximum van 300 mg beïnvloedden de verdraagbaarheid positief. De bovengenoemde bijwerkingen werden in gerandomiseerd onderzoek gevonden, waarbij 87% van de patiënten die bijwerkingen ondervonden de intensiteit van deze bijwerkingen omschreven als licht tot matig-ernstig (ongeacht de dosering).
De aanvankelijk vaak optredende misselijkheid en duizeligheid kan beperkt worden door insluipend te doseren. Tramadol veroorzaakt minder vaak obstipatie dan andere opioïden. Zelden treden psychische reacties zoals slaapstoornissen, stemmingsveranderingen of hallucinaties op. Mogelijk zijn oudere patiënten daar gevoeliger voor. Bij plotseling staken kunnen onthoudingsverschijnselen optreden.
Bij doseringen hoger dan 400 mg daags en/of in combinatie met SSRI’s is er toenemend risico op het optreden van convulsies. Bij de combinatie van tramadol met een SSRI bestaat er voorts een verhoogde kans op het serotonerg syndroom. Tramadol in therapeutische dosering beïnvloedt de rijvaardigheid negatief in ernstige mate.
Geadviseerd wordt om bij patiënten met een nierfunctiestoornis (eGFR 10 tot 30 ml/min / 1,73 m2) maximaal 100 mg tramadol per keer te geven en het doseringsinterval te verlengen naar 12 uur, dus maximaal 2 dd 100 mg tramadol te geven. Accumulatie kan tot levensbedreigende situaties leiden. Bij slechte en gemiddelde metaboliseerders van CYP2D6 kan de omzetting naar en plasmaconcentratie van actieve metaboliet verlaagd zijn. Geef in dat geval een andere pijnstiller. Bij zeer snelle metaboliseerders van CYP2D6 kan de plasmaconcentratie van de actieve metaboliet juist verhoogd zijn. Geef in dat geval 20 tot 40% van de standaarddosering.
Er is een associatie tussen tramadol en een verhoogd risico op het optreden van hypoglykemieën. Gebruikmakend van de UK Clinical Practice Research Datalink (ruim 13 miljoen patiënten uit 608 praktijken) werd een geneste patiënt-controleanalyse uitgevoerd in een cohort (n = 334.034) van met tramadol of codeïne behandelde patiënten met pijn niet ten gevolge van kanker; 1105 patiënten werden gehospitaliseerd (incidentie 0,7 per 1000 per jaar) en gematcht met 11.019 controlepatiënten.
Vergeleken met codeïne was tramadol geassocieerd met een verhoogd risico op ziekenhuisopname wegens hypoglykemie (OR 1,52; 95%-BI 1,09 tot 2,10) met name gedurende de eerste 30 dagen van de behandeling (OR 2,61; 95%-BI 1,61 tot 4,23). In hetzelfde cohort werd bovendien gedurende de eerste 30 dagen van de behandeling een verhoogd risico op ziekenhuisopname wegens hyponatriëmie gevonden: 4,6 (95%-BI 2,4 tot 8,0) (tramadol) en 1,9 (95%-BI 1,4 tot 2,5) (codëine) per 10.000 persoonsmaanden.
Conclusie
De toepassing van tramadol wordt beperkt door frequent optredende bijwerkingen. Vooral bij ouderen dient tramadol langzaam te worden getitreerd.
Overwegingen
Vanwege het optreden van onthoudingsverschijnselen bij staken van tramadol, is terughoudendheid geboden voor chronisch gebruik. Patiënten aan wie kort daarvoor tramadol is voorgeschreven en zich presenteren met voor hypoglykemie verdachte klachten moeten daarop worden onderzocht, ook al zijn zij niet bekend met riscofactoren zoals diabetes.
Wegens een gebrek aan gegevens kan geen uitspraak worden gedaan over de risico’s van tramadol voor organismen in water (fass.se, geraadpleegd april 2022).
Aanbeveling
Ter versterking van het pijnstillend effect kan men tramadol toevoegen aan de middelen uit stap 1 of 2 of deze staken en vervangen door tramadol. Met name bij (kwetsbare) ouderen is voorzichtigheid en terughoudendheid en starten met een lage dosering geboden.
Toevoegen van codeïne aan paracetamol wordt niet meer aanbevolen. De werkzaamheid van het toevoegen van codeïne is in klinische onderzoeken niet aangetoond en het gebruik van vaste combinaties bij pijnstilling wordt ontraden. In de meest gebruikte vaste combinaties is de hoeveelheid codeïne lager dan de gebruikelijke dosering van codeïne als pijnstiller, terwijl hinderlijke bijwerkingen zoals obstipatie wel optreden. Klinisch onderzoek naar de effectiviteit van de in ons land beschikbare vaste combinaties ontbreekt. Codeïne wordt omgezet in morfine en bij zeer snelle metaboliseerders voor CYP2D6 wordt aanzienlijk meer morfine gevormd dan bij personen met een normaal metabolisme, waardoor het risico op morfinegerelateerde bijwerkingen verhoogd is. Er zijn meldingen van ademhalingsdepressie (ook met fatale afloop) gedaan bij kleuters die behandeld werden met een standaarddosering codeïne en waarbij later vastgesteld werd dat zij zeer snelle metaboliseerders van CYP2D6 waren. Codeïne mag na Europese herbeoordeling niet meer gebruikt worden bij kinderen jonger dan twaalf jaar en bij adolescenten na operatieve verwijdering van keel- en/of neusamandelen vanwege slaapapneu of andere ademhalingsproblemen.
Achtergrond
Gecombineerde therapie met tramadol en paracetamol wordt regelmatig toegepast.
Effectiviteit
In gerandomiseerd onderzoek (n = 277) werd een significante pijnvermindering gevonden van de combinatie 75 mg tramadol/650 mg paracetamol vergeleken met placebo bij patiënten met acute lagerugpijn. Deze bevinding komt overeen met die in ander gerandomiseerd onderzoek.
In een onderzoek werd de combinatie tramadol (37,5 mg)/paracetamol (325 mg) vergeleken met NSAID’s (meloxicam, aceclofenac) als onderhoudstherapie na initiële gecombineerde behandeling met tramadol/paracetamol met een NSAID bij patiënten met knieartrose.
Bij patiënten die aanvankelijk gunstig reageerden op de combinatietherapie van tramadol/paracetamol met een NSAID werd geen significant verschil gevonden in effectiviteit van de daaropvolgende onderhoudsbehandeling met tramadol/paracetamol of een met een NSAID afzonderlijk.
Overwegingen
De werkzaamheid van de in Nederland beschikbare combinatiepreparaten met tramadol is niet in klinisch onderzoek vergeleken met de afzonderlijke bestanddelen. Bovendien kan de dosering bij de vaste combinatie niet worden afgestemd op de individuele behoefte van de patiënt. Daarom zijn vaste combinaties van tramadol en paracetamol niet geschikt.
Aanbeveling
Het gebruik van vaste combinaties van tramadol en paracetamol wordt afgeraden.
Het serotoninesyndroom is een medicatiegeïnduceerd klinisch syndroom dat veroorzaakt wordt door verhoogde serotonineconcentraties in het centrale en perifere zenuwstelsel. Het serotoninesyndroom is zeldzaam, maar potentieel levensbedreigend. Symptomen kunnen zijn: spiersamentrekkingen, heftig zweten, versnelde hartslag, hoge koorts, rillen, verwijde pupillen, opwinding, verwardheid, diarree, oververhitting, spierstijfheid en overactieve reflexen.
De overmaat aan serotonine kan enerzijds worden veroorzaakt door een of meer serotonerge middelen en anderzijds door verminderde klaring van deze middelen. Een ernstig serotoninesyndroom is bijna altijd het gevolg van geneesmiddeleninteracties waarbij ≥ 2 sterk serotonerg werkende middelen zijn betrokken; dit zijn onder andere tramadol, MAO-remmers, SSRI’s en TCA’s (vooral clomipramine en imipramine). Meestal verminderen de klachten spontaan na het staken van de serotonerge medicatie. De behandeling vindt plaats in de tweede lijn; deze bestaat uit staken van de medicatie en eventueel intensieve ondersteunende zorg (zie NVvP-richtlijn Acute psychiatrie).
De doseringen voor ouderen sluiten aan op de monografie over tramadol van Ephor https://www.ephorapp.nl/n/38377.
Achtergrond
Cytochroom P450- (CYP-)enzymen spelen een rol bij het metaboliseren van tramadol in de lever. Tramadol wordt met name door CYP3A4 en CYP2D6 omgezet in werkzame en niet-werkzame metabolieten. CYP2D6 is verantwoordelijk voor de omzetting naar de actieve metaboliet O-desmethyltramadol. Deze metaboliet lijkt zowel bij de pijnstilling als bij de bijwerkingen een dominante rol te spelen (KNMP Kennisbank, geraadpleegd maart 2023). Een afwijkende activiteit van CYP2D6 komt voor bij ongeveer 48% van mensen van Europese afkomst.
Genetische variaties kunnen leiden tot een afwijkende activiteit van CYP2D6 bij:
- trage en intermediaire metaboliseerders (ongeveer 44% van de Europese mensen): vertraagde omzetting van tramadol naar de actieve metaboliet, met als gevolg verminderde effectiviteit
- ultrasnelle metaboliseerders (ongeveer 3% van de Europese mensen): versnelde omzetting van tramadol naar de actieve metaboliet, waardoor meer bijwerkingen kunnen optreden
Overwegingen
Het NHG-Standpunt Farmacogenetisch onderzoek in de huisartsenpraktijk adviseert om niet standaard farmacogenetisch onderzoek te doen bij gebruik van geneesmiddelen die door CYP450-enzymen gemetaboliseerd worden.
Farmacogenetisch onderzoek vóór start tramadol
Aangezien de uitslag van het farmacogenetisch onderzoek pas na enkele dagen tot een week bekend is, is het bij acute nociceptieve pijn onwenselijk om met de start van tramadol te wachten op de uitslag van het onderzoek. We verwachten echter dat de gevolgen in geval van genvariaties van CYP2D6 te overzien zijn:
- bij trage en intermediaire metaboliseerders kan de dosering bij onvoldoende effectiviteit stapsgewijs worden verhoogd tot de maximale dagdosering (400 mg). Kies zo nodig in overleg met de patiënt voor de volgende stap in het medicamenteuze stappenplan.
- bij ultrasnelle metaboliseerders zullen naar verwachting geen ernstige bijwerkingen optreden van tramadol in de geadviseerde lage startdosering. Eventuele verdere dosisverhoging vindt plaats op geleide van effectiviteit en bijwerkingen. Het optreden van bijwerkingen zal een indicatie zijn om niet verder op te hogen of om in overleg met de patiënt de volgende stap in het medicamenteuze stappenplan te kiezen. Eventuele bijwerkingen leiden niet tot blijvende schade.
Farmacogenetisch onderzoek tijdens gebruik tramadol
Farmacogenetisch onderzoek kan theoretisch overwogen worden in specifieke gevallen, zoals uitblijven van een verwacht effect of optreden van onverwacht veel bijwerkingen. In de praktijk zal het farmacogenetisch onderzoek echter geen verschil maken voor het te volgen beleid. Bij onvoldoende effectiviteit kan de dosering tramadol stapsgewijs verhoogd worden tot de maximale dagdosering (400 mg). Bij onverwacht veel bijwerkingen zal tramadol gestaakt worden. Zo nodig zal dan in overleg met de patiënt naar de volgende stap in het medicamenteuze stappenplan worden gegaan. Dit advies is in lijn met het advies van de KNMP-Werkgroep Farmacogenetica, die adviseert om bij trage en intermediaire metaboliseerders bij onvoldoende effectiviteit de dosering te verhogen of tramadol om te zetten in alternatieve pijnmedicatie die niet door CYP2D6 gemetaboliseerd hoeft te worden, zoals morfine of oxycodon. Bij ultrasnelle metaboliseerders luidt het advies bij voorkeur een alternatief te kiezen of te starten met 40% van de normale dosering (KNMP Kennisbank, geraadpleegd maart 2023). De geadviseerde startdosering van tramadol is echter laag, waardoor bij snelle metaboliseerders in theorie geen ernstige bijwerkingen te verwachten zijn. Eventuele bijwerkingen leiden daarnaast niet tot blijvende schade.
Kosten
De kosten van het onderzoek bedragen ongeveer € 50-75 (zie NHG-Standpunt Farmacogenetisch onderzoek in de huisartsenpraktijk).
Waarom deze aanbeveling?
- We zien geen plaats voor farmacogenetisch onderzoek naar genvariaties van CYP2D6 vóór of tijdens gebruik van tramadol, omdat:
- het niet wenselijk is om te wachten op een uitslag van het onderzoek voor tramadol gestart wordt;
- er wordt gestart met een lage dosering tramadol die op geleide van effectiviteit en bijwerkingen getitreerd wordt.
- Wanneer een patiënt reeds bekend is met een genvariatie van CYP2D6 is het wel zinvol om hiermee rekening te houden in de keuze en dosering van pijnmedicatie. Schrijf alleen bij uitzondering tramadol voor en bespreek met de patiënt om, afhankelijk van de genvariatie, bij weinig effectiviteit of veel bijwerkingen laagdrempelig contact met de huisarts op te nemen.
Stap 4: sterkwerkend opioïd
Naar Samenvatting ›- Overweeg alleen een sterkwerkend opioïd als er sprake is van ernstige pijn met dusdanig veel invloed op het dagelijks functioneren dat deze situatie moet worden doorbroken en de pijn met de overige behandelingen en optimaal ingestelde medicatie uit de vorige stappen onvoldoende vermindert.
- Bespreek met de patiënt de te verwachten voor- en nadelen:
- de effectiviteit is aangetoond bij acute nociceptieve pijn en pijn bij kanker
- bijwerkingen komen vooral bij start en dosisverhoging voor: problemen in het dagelijks functioneren door sufheid, misselijkheid en braken
- bijwerkingen op langere termijn (vooral bij ouderen): vermindering van de cognitieve functies, urineretentie en verwardheid
- noodzaak tot dagelijks gebruik laxantia ter voorkoming van obstipatie
- er treedt tijdens gebruik hyperalgesie op (steeds gevoeliger worden voor pijnprikkels, met mogelijk vicieuze cirkel tot gevolg)
- er is een risico op gewenning en afhankelijkheid, waardoor steeds hogere doseringen nodig zijn en meer bijwerkingen mogelijk zijn. De kans hierop neemt toe naarmate het gebruik langer duurt
- opioïden hebben een matig tot ernstige negatieve invloed op de rijvaardigheid. Bij (sub)chronisch gebruik is autorijden in ieder geval tijdens de eerste 2 weken niet toegestaan. Bij incidenteel gebruik verschillen de adviezen per middel en werkingsduur van het preparaat. Verwijs voor meer informatie naar rijveiligmetmedicijnen.nl. Daarnaast is het gebruik van morfine onderhevig aan aanvullende wetgeving: gebruik in het verkeer is strafbaar. In de praktijk weegt het OM mee of het gebruik aantoonbaar op medische indicatie is (zie rijksoverheid.nl)
Achtergrond
Morfine, maar ook andere opioïden, nemen bij de behandeling van pijn bij kanker een belangrijke plaats in.
Uitgangsvraag
Zijn opioïden aan te bevelen bij pijn door kanker?
Uitkomstmaten
- Afname van de pijn tot niet meer dan lichte pijn binnen veertien dagen.
- Globale indruk van verandering, door de patiënt gerapporteerd (veel of zeer veel verbeterd).
- Stoppen door bijwerkingen.
- Deelnemers met minimaal één bijwerking.
Voor het beantwoorden van de uitgangsvraag is gebruikgemaakt van een overzicht van Cochrane-reviews naar gebruik van opioïden bij pijn door kanker.
Resultaten
Beschrijving onderzoeken
Er werden negen Cochrane-reviews geïncludeerd. Deze reviews includeerden in totaal 152 RCT’s met 13.254 deelnemers, hoewel het werkelijke totaal aantal unieke RCT’s en deelnemers lager zal liggen (schatting van de auteurs: ongeveer 120 unieke RCT’s). De deelnemers hadden verschillende soorten kanker, waarbij de meeste deelnemers matige of ernstige pijn hadden. De onderzochte middelen waren hydromorfon, fentanyl, methadon, oxycodon, buprenorfine, codeïne, tapentadol, morfine en tramadol. De meeste RCT’s waren head-to-head trials tussen verschillende opioïden of tussen verschillende formuleringen van hetzelfde opioïd, waarbij in de meeste gevallen de dosis werd getitreerd.
Hierbij werd een balans tussen pijnverlichting en bijwerkingen gezocht. Slechts enkele onderzoeken includeerden een placebo.
Kwaliteit van bewijs
De kwaliteit van het bewijs was zeer laag voor alle uitkomsten, voornamelijk vanwege risico op vertekening, heterogeniteit en onnauwkeurigheid, of zelfs afwezigheid van gegevens.
Effectiviteit
I. Afname van de pijn tot niet meer dan lichte pijn binnen veertien dagen
Er waren slechts twee reviews die voldoende data over meer dan tweehonderd deelnemers rapporteerden. De ene rapporteerde dat als transdermaal fentanyl werd getitreerd tot effect, 96% van de patiënten (461/479) een pijnstilling tot niet meer dan lichte pijn bereikte. De andere rapporteerde vergelijke resultaten over oraal morfine: 96% van de patiënten (362/377) bereikte een pijnstilling tot niet meer dan lichte pijn. Ook in de review over oxycodon leek het merendeel van de deelnemers binnen veertien dagen hooguit lichte pijn te ervaren (minder dan tweehonderd deelnemers; precieze aantallen niet gerapporteerd).
In de overige zes reviews was deze uitkomst niet bepaald of niet gerapporteerd in de RCT’s.
II. Globale indruk van verandering, door de patiënt gerapporteerd
In vijf reviews was dit als uitkomstmaat gebruikt, maar geen van de reviews kon deze uitkomstmaat bepalen vanwege gebrek aan gegevens.
Bijwerkingen
I. Stoppen door bijwerkingen
Het aantal patiënten dat stopte vanwege bijwerkingen varieerde, maar de percentages waren steeds lager dan 20%. Bij methadon was dit 6% (12/202), bij morfine 7% (154/2162), bij buprenorfine 12% (52/443), bij tapentadol 13% (22/168) en bij oxycodon 19% (513/2648). Voor de overige middelen was dit niet voldoende gerapporteerd in de RCT’s.
II. Deelnemers met minimaal één bijwerking
Bij tramadol was dit 11% (26/267), bij buprenorfine 57% (152/264) en bij tapentadol 77% (297/386). Voor de overige middelen was dit niet voldoende gerapporteerd in de RCT’s. Veelvoorkomende bijwerkingen waren obstipatie en misselijkheid.
Conclusie
Het is onzeker in hoeverre opioïden leiden tot een vermindering van pijn en tot het optreden van bijwerkingen bij patiënten met kanker.
Van bewijs naar aanbeveling
De hoeveelheid en kwaliteit van het bewijs zijn teleurstellend laag. Er zijn aanwijzingen dat bij een aanzienlijk deel (in het ideale geval bij ongeveer 95%) van de patiënten met matige of ernstige pijn door kanker, opioïden de pijn binnen twee weken kunnen reduceren tot geen of milde pijn. Dit is in overeenstemming met de klinische ervaring.
Een nadeel is dat veel patiënten bijwerkingen ervaren, zoals misselijkheid en obstipatie. Bij naar schatting 10 tot 20% van de patiënten zijn deze bijwerkingen dusdanig dat er een verandering van de behandeling nodig is.
Aanbeveling
Overweeg bij patiënten met kanker een sterkwerkend opioïde alleen als de pijn onvoldoende vermindert met de stappen 1, 2 en 3 van de pijnladder.
Vanwege een verhoogd risico op overmatig gebruik, gewenning en dosisescalatie, overdosering, afhankelijkheid, botbreuken, myocardinfarct en endocriene dysfunctie is terughoudendheid gewenst bij het voorschrijven van opioïden bij chronische pijn. Dit geldt in het bijzonder voor chronische, niet aan kanker gerelateerde pijn. Door de WHO-ladder zonder meer op chronische, niet aan kanker gerelateerde pijn toe te passen bestaat het risico dat het aantal patiënten dat opioïden als onderhoudsmedicatie gebruikt, stijgt. Gevaren van opioïdafhankelijkheid en overmatig gebruik moeten niet uit het oog worden verloren. Bij een equivalente dosis van 30 mg i.v. morfine per dag gedurende meer dan twee weken is er sprake van fysieke afhankelijkheid en treedt onttrekking op als de patiënt het opioïd niet meer inneemt. Dat neemt niet weg dat er ook bij niet aan kanker gerelateerde ernstige pijn kortdurend een indicatie voor opioïden kan bestaan als niet-medicamenteuze therapie en andere pijnstilling faalt.
Een andere reden om voorzichtig te zijn met het voorschrijven van opioïden bij ouderen met niet aan kanker gerelateerde pijn is een verhoogd fractuurrisico vergeleken met NSAID’s (retrospectief cohortonderzoek; n = 12.436 (opioïden), n = 4874 (NSAID’s); personen met artritis met leeftijd ≥ 65 jaar). Schrijf opioïden alleen voor aan patiënten zonder psychische aandoening en zonder gevoeligheid voor middelenafhankelijkheid (inclusief alcohol en roken). Chronische pijn verdient, zeker in dit stadium, een integrale multidimensionele aanpak in samenwerking met ketenpartners vanuit de eerste en/of tweede lijn. Bij het voorschrijven van opioïden zal men zich dit, vanwege voornoemde problemen, extra dienen te realiseren.
Aanbeveling
Schrijf opioïden alleen voor als de oorzaak van de pijn duidelijk is en de pijn met de overige behandelingen en optimaal ingestelde medicatie met niet-opioïden onvoldoende vermindert. Schrijf ze alleen voor aan patiënten zonder psychische aandoening en zonder gevoeligheid voor middelenafhankelijkheid (inclusief alcohol en roken).
Indien opioïden worden voorgeschreven bij niet-kanker gerelateerde pijn wordt aanbevolen om elke een tot twee weken te evalueren of verdere behandeling met opiaten nog wel noodzakelijk is en of de werkzaamheid opweegt tegen de bijwerkingen. Stop het opioïd bij onvoldoende pijnstilling en overweeg eventueel opioïdrotatie.
Tussen 2008 en 2017 is het gebruik van voorgeschreven opioïden in Nederland bijna verdubbeld: in 2008 kreeg ongeveer 4,1% van de totale bevolking ≥ 1 voorschriften voor een opioïd (sterk- of zwakwerkend), in 2017 7,5%. Deze toename is voornamelijk toe te schrijven aan oxycodon: in deze periode vond er een verviervoudiging van het aantal gebruikers van oxycodon plaats. Het aantal ziekenhuisopnames vanwege opioïdintoxicatie nam in deze periode toe van 2,5 naar 7,8 per 100.000 inwoners. Deze toename was geheel toe te schrijven aan opioïden op medisch voorschrift. Hoewel deze toename nog niet zo sterk is als in de Verenigde Staten, is dit reden tot zorg; dit heeft dan ook geleid tot verschillende initiatieven, zoals het oprichten van de Taakgroep Gepast gebruik van opioïden door het ministerie van Volksgezondheid, Welzijn en Sport (VWS) in 2019. Ook zijn de aanbevelingen over opioïdgebruik in de NHG-Standaard Pijn in 2018 aangescherpt. Dit lijkt zijn vruchten af te werpen: de stijging in het voorschrijven van opioïden lijkt in 2018 te stabiliseren en vanaf 2019 zelfs iets af te nemen. Desalniettemin is er ruimte voor verbetering. Het Nivel onderzocht de indicatie en voorschrijfduur van opioïden in de eerste lijn in Nederland in 2018. Dit omvatte ook de herhaalreceptuur van voorschriften waarvan de medisch specialist de initiërende behandelaar was. Per 1000 volwassenen kregen er 37 een voorschrift voor een sterkwerkend opioïd. Oxycodon werd het vaakst voorgeschreven (aan 29 per 1000 volwassenen). Bij 60,4% van de patiënten betrof het een eenmalig voorschrift, 16,8% kreeg meerdere voorschriften met ook voorschriften > 90 dagen na het eerste. Ruim 60% van de opioïden werd voorgeschreven voor klachten of aandoeningen aan het bewegingsapparaat, met name rugklachten en artrose – dit verschilt nauwelijks tussen de verschillende voorschrijfduren, terwijl de indicatie voor opioïden bij klachten aan het bewegingsapparaat zeer beperkt is en alleen voor zo kort mogelijk gebruik. Ongeveer 30% van de patiënten met een opioïdvoorschrift heeft een diagnose kanker; bij deze patiënten worden opioïden wel vaker langer voorgeschreven. Van de sterkwerkende opioïden is het eerste voorschrift in 41,6% van de gevallen van de huisarts afkomstig en in 47,6% van de gevallen van een medisch specialist.
Risicofactoren voor problematisch opioïdgebruik
Naar Samenvatting ›Wees vanwege het vermoedelijk grotere risico op het ontstaan van afhankelijkheid extra terughoudend met opioïden bij patiënten met:
- eerdere opioïdafhankelijkheid
- eerdere en huidige verslaving aan andere middelen (waaronder ook roken valt)
- psychiatrische comorbiditeit
Het bewijs voor de samenhang van genoemde factoren met het risico op verslavingsgevoeligheid is van lage tot zeer lage kwaliteit. Toch zijn deze factoren mogelijk relevant voor de huisarts om rekening mee te houden bij de beslissing om te starten met opioïden. Argumenten daarvoor:
- Er is brede consensus, ook binnen de werkgroep, dat er samenhang is tussen deze factoren en verslavingsgevoeligheid. De onderzoeken wijzen allemaal in dezelfde richting.
- Het kost nauwelijks moeite of tijd om deze factoren te betrekken in de besluitvorming.
Uitgangsvraag
Welke factoren hangen samen met een verhoogde kans op het ontwikkelen van problematisch opioïdgebruik bij patiënten met chronische pijn? Zie de PICO-tabel.
|
Patiënten |
Patiënten met chronische pijn |
|
Interventie |
Aanwezigheid van factoren |
|
Vergelijking |
Afwezigheid van factoren |
|
Uitkomstmaten |
Verslaving aan opioïden |
Achtergrond
Risico op verslaving is een probleem bij het voorschrijven van opioïden aan patiënten met chronische pijn. Uit de knelpunteninventarisatie bij de herziening van deze NHG-Standaard bleek dat huisartsen behoefte hebben aan handvatten om mogelijke verslavingsgevoeligheid van patiënten te kunnen inschatten.
Methoden
Er is een systematische literatuurzoekactie naar SR’s en observationeel onderzoek uitgevoerd in PubMed en Embase in juli 2020 met een update in mei 2021.
Resultaten
Resultaat zoekactie
De zoekactie leverde een SR op naar strategieën om patiënten te identificeren met een verhoogd risico op problematisch gebruik van voorgeschreven opioïden. Een aanvullende search na de zoekdatum van dit literatuuronderzoek (november 2018) leverde geen relevante aanvullende onderzoeken op. Ook de update in mei 2021 leverde geen aanvullende onderzoeken op.
Onderzoekskarakteristieken en -methoden
In de SR van Klimas werden 2 retrospectieve database-onderzoeken van goede kwaliteit geïncludeerd die risicofactoren voor problematisch gebruik van voorgeschreven opioïden onderzochten (onderzoeken van mindere kwaliteit werden uitgesloten). Het ene onderzoek includeerde 2,8 miljoen patiënten die voor het eerst opioïden gingen gebruiken, van wie er 2913 een ICD-9 CM (International Classification of Diseases, Ninth Revision, Clinical Modification) diagnose van opioïdverslaving of -afhankelijkheid kregen. Van de totale populatie had ongeveer 60% chronische pijn. Elke patiënt werd minimaal 2 jaar gevolgd. Het andere onderzoek includeerde 46.256 patiënten uit 2 databases, die minimaal 90 dagen opioïden gebruikten gedurende een periode van 6 maanden, waarmee impliciet werd verondersteld dat dit vanwege chronische pijn was. Patiënten werden minimaal een jaar gevolgd vanaf de start van het opioïdgebruik (in de ene database was de gemiddelde follow-upduur 818 dagen, in de andere 1212 dagen). 1465 patiënten kregen een ICD-9 CM diagnose van opioïdverslaving of -afhankelijkheid.
In de onderzoeken werd van verschillende factoren onderzocht of ze geassocieerd waren met het optreden van problematisch opioïdgebruik. Deze factoren zijn onderverdeeld in demografische factoren (zoals geslacht en leeftijd), factoren die te maken hebben met mentale gezondheid (alle psychiatrische aandoeningen) en medicatiegerelateerde factoren (zoals andere voorgeschreven medicatie, dosering van opioïden). De auteurs van de SR hebben voor deze factoren de positieve (LR+) en negatieve likelihoodratio (LR-) bepaald. De LR+ geeft aan hoe sterk de aanwezigheid van een factor de kans op verslaving vergroot; de LR- geeft aan hoe sterk de afwezigheid van een factor de kans op verslaving verkleint. Een LR+ > 2,5 of een LR- < 0,5 werd daarbij beschouwd als mogelijk klinisch relevant.
Resultaten
De volgende factoren hadden een LR+ > 2,5 (klinisch relevant verhoogd risico op problematisch gebruik):
- psychiatrische aandoeningen:
- persoonlijkheidsstoornis (LR+ 27, 95%-BI 18-41)
- pijnstoornis (LR+ 23, 95%-BI 18-29) en somatoforme stoornis (LR+ 12, 95%-BI 7,8-18) (beide uit het onderzoek waarin 60% van de deelnemers chronische pijn had)
- eerdere opioïdverslaving (LR+ range 17-22 in 2 databases)
- eerdere en huidige verslaving aan andere middelen (LR+ range 4,2-17 in 3 databases; de meest voorkomende verslavingen waren alcohol, andere (ongespecificeerde) medicatie/drugs, tabak, cocaïne en cannabis)
- psychotische stoornis (LR+ 11, 95%-BI 8,5-14)
- stemmingsstoornis (LR+ 6, 95%-BI 5,8-6,2)
- angststoornis (LR+ 5,3, 95%-BI 5-5,6)
- medicatiegebruik:
- antipsychotica (atypische antipsychotica LR+ 17, 95%-BI 15-18; overige antipsychotica LR+ 4,2, 95%-BI 2,4-7,3)
- anxiolytica (LR+ 7,3 95%-BI 6,5-8,3)
- antidepressiva (TCA’s LR+ 5,1, 95%-BI 4,8-5,3; SSRI’s 3,1, 95%-BI 2,9-3,2; overige antidepressiva LR+ 3,8, 95%-BI 3,7-4,0)
- anti-epileptica (LR+ 5, 95%-BI 4,8-5,3)
- benzodiazepines (LR+ 2,7, 95%-BI 2,6-2,8)
- gebruiksduur/dosering opioïd:
- dosering van opioïden > 120 mg morfine-equivalenten (LR+ range 3,2-3,4 in 2 databases)
- een voorschrift van ≥ 30 dagen (LR+ range 3,5-4,9 in 2 databases)
De enige factor met een LR- < 0,5 was een stemmingsstoornis. Dat betekent dat de afwezigheid daarvan mogelijk een aanwijzing is voor een verlaagd risico op problematisch opioïdgebruik.
Demografische factoren (zoals leeftijd en geslacht) waren klinisch niet relevant (LR+ < 2,5).
Kwaliteit van bewijs
De kwaliteit van bewijs is laag tot zeer laag. Veel factoren zijn slechts in 1 database-onderzoek van goede kwaliteit bepaald. Daarnaast worden er verschillende in- en exclusiecriteria gebruikt in de onderzoeken, zijn de populaties mogelijk niet goed vergelijkbaar met de Nederlandse eerstelijnspopulatie, zijn niet alle patiënten structureel onderzocht op de aanwezigheid van opioïdmisbruik of -afhankelijkheid (waardoor sprake kan zijn van misclassificatie, zoals onderrapportage) en zijn de factoren niet goed gedefinieerd.
Conclusies
Er is bewijs van zeer lage tot lage kwaliteit dat onderstaande factoren samenhangen met toekomstig problematisch opioïdgebruik:
- psychiatrische comorbiditeit, waaronder
- eerdere verslaving aan opioïden of andere middelen (zoals alcohol, tabak, cocaïne, cannabis)
- persoonlijkheidsstoornis
- pijnstoornis c.q. somatoforme stoornis
- psychotische stoornis
- stemmingsstoornis
- angststoornis
- gebruik van psychiatrische medicatie en anti-epileptica
Screeningsinstrument
Naar Samenvatting ›We bevelen het gebruik van een instrument (zoals een vragenlijst of screeningstool) om een verhoogd risico op verslaving aan voorgeschreven opioïden te voorspellen niet aan.
De verschillende instrumenten kunnen niet goed kunnen voorspellen welke patiënten met chronische pijn in de eerste lijn een verslaving aan opioïden zullen ontwikkelen en welke niet. Gebruik ervan wekt ten onrechte de indruk dat ze redelijk goed kunnen voorspellen wie een verslaving zal ontwikkelen. Daarnaast kost het tijd om een instrument af te nemen of in te vullen. Dit heeft geleid tot een sterke aanbeveling tegen het gebruik van de beschikbare instrumenten voor het voorspellen van een opioïdverslaving.
Voor- en nadelen
Geen van de instrumenten lijkt goed te kunnen voorspellen welke patiënten een verslaving aan opioïden zullen ontwikkelen, dus er is geen voordeel van het gebruik van de instrumenten. Een nadeel is de tijd die het kost om de instrumenten af te nemen of in te vullen en te interpreteren.
Kwaliteit van bewijs
De kwaliteit van bewijs van de diagnostische accuratesse was voor de meeste instrumenten laag en voor enkele instrumenten zeer laag. De bevindingen zijn niet goed te generaliseren naar de Nederlandse huisartsenpraktijk, omdat de onderzoeken zijn uitgevoerd onder patiënten die verwezen waren naar een pijnkliniek.
Waarden en voorkeuren van patiënten
Omdat het invullen van een instrument tijd kost, zonder dat dit aangetoonde aanvullende waarde heeft, denken we dat de meeste patiënten hier niet voor zullen kiezen (inschatting van de werkgroep).
Kosten
De kosten van het instrument zelf zullen niet hoog zijn, maar het afnemen/invullen, interpreteren en bespreken van het instrument kost wel (consult)tijd.
Aanvaardbaarheid
Zowel huisartsen als patiënten zullen het gebruik van een instrument waarvan de waarde niet is aangetoond, maar dat wel tijd kost om af te nemen/in te vullen, niet aanvaarden (inschatting van de werkgroep).
Haalbaarheid
Het afnemen/invullen van het instrument kost zodanig veel tijd dat dit de haalbaarheid in de weg staat.
Uitgangsvraag
Is een instrument (bijvoorbeeld een vragenlijst of screeningstool) aan te bevelen om de verhoogde kans op het ontwikkelen van problematisch opioïdgebruik te identificeren bij patiënten met chronische pijn? Zie de PICO-tabel.
|
Patiënten |
Patiënten met chronische pijn die in aanmerking willen komen voor opioïden |
|---|---|
|
Interventie |
Gebruik van instrument:
|
|
Vergelijking |
Bepaling van verslaving met gouden standaard |
|
Uitkomstmaten |
Diagnostische accuratesse voor het voorspellen van problematisch opioïdgebruik |
Achtergrond
Er bestaan diverse instrumenten, zoals screeningstools of vragenlijsten, die ontworpen zijn om een inschatting te maken van hoe gevoelig een patiënt is voor verslaving aan (voorgeschreven) opioïden. Het is onduidelijk wat de klinische bruikbaarheid van deze instrumenten is.
Methoden
Er is een systematische literatuurzoekactie naar SR’s en diagnostische accuratesse-onderzoeken uitgevoerd in PubMed en Embase in juli 2020 met een update in mei 2021.
Resultaten
Resultaat zoekactie
De zoekactie leverde een systematische review op naar de behandeling van patiënten met chronische pijn met opioïden. Een onderdeel van deze systematische review was het bepalen van de diagnostische accuratesse van instrumenten om het risico op misbruik van opioïden te voorspellen. Een aanvullende search na de zoekdatum van dit literatuuronderzoek (augustus 2019) leverde 3 aanvullende onderzoeken op. De update in mei 2021 leverde geen aanvullende onderzoeken op.
Onderzoekskarakteristieken
Chou 2020: In de SR zijn 7 observationele onderzoeken (4 prospectief, 2 retrospectief, van de laatste was dit niet duidelijk) opgenomen naar de diagnostische accuratesse van instrumenten, die worden toegepast voorafgaand aan het starten van opioïden met als doel het risico op opioïdenmisbruik te voorspellen. De populatieomvang in de verschillende onderzoeken varieerde van 48 tot 257 (totaal n = 1228) en betrof in alle gevallen patiënten met chronische pijn die waren verwezen naar een pijnkliniek en die opioïden kregen voorgeschreven. De gemiddelde leeftijd varieerde van 43 tot 55 jaar. Er waren 4 onderzoeken met een duur van 6 maanden, 1 onderzoek van 3,8 maanden, 1 van 12 maanden en 1 onderzoek rapporteerde de duur niet. Misbruik van opioïden was gebaseerd op het stoppen van opioïden door misbruik, een afwijkende urinetest duidend op misbruik of verkeerd gebruik van drugs of medicatie, of documentatie van afwijkend gedrag gedurende de follow-up.
Cheatle 2019, Nielsen 2020, Reps 2020: 3 observationele onderzoeken waarin een nieuw instrument om misbruik van opioïden te voorspellen werd ontwikkeld. Omdat voor geen van deze 3 instrumenten een validatie-onderzoek beschikbaar is, hebben we deze buiten beschouwing gelaten.
Diagnostische accuratesse
In de onderzoeken werden 7 instrumenten onderzocht:
- ORT (Opioid Risk Tool): instrument met 10 items dat de patiënt zelf invult. De score loopt van 0 tot 24, waarbij een hogere score een groter risico op opioïdmisbruik aangeeft. Bij een score van ≥ 4 is het risico matig.
- SOAPP (Screening and Opioid Assessment for Patients with Pain) versie 1: instrument met 14 items dat de patiënt zelf invult. De score loopt van 0 tot 56, waarbij een hogere score een groter risico op opioïdmisbruik aangeeft. De oorspronkelijke versie is ontworpen om patiënten te evalueren die al opioïden gebruiken, maar het instrument is ook geëvalueerd om misbruik te voorspellen voor de start met opioïden. Een score van ≥ 8 geeft een verhoogd risico aan.
- SOAPP-R (Screening and Opioid Assessment for Patients with Pain - Revised): instrument met 24 items dat de patiënt zelf invult. Het instrument is afgeleid van de SOAPP, maar aangepast om meer subtiele en sociaal aanvaardbare items om opioïdmisbruik vast te stellen, te includeren. De score loopt van 0 tot 96, waarbij een hogere score een groter risico op opioïdmisbruik aangeeft. Ook dit instrument is ontworpen om patiënten te evalueren die al opioïden gebruiken, maar het instrument is ook geëvalueerd om misbruik te voorspellen voor de start met opioïden. Een score van ≥ 18 geeft een verhoogd risico aan.
- DIRE (Diagnosis, Intractability, Risk and Efficacy): instrument met 7 items dat de arts scoort. Het was oorspronkelijk ontworpen om effectieve pijnverlichting en therapietrouw met langdurige opioïdtherapie te voorspellen. De score loopt van 7 tot 21, waarbij een score van ≤ 13 aangeeft dat de patiënt niet geschikt is voor opioïdtherapie. Het instrument is ook geëvalueerd om stoppen met opioïden door misbruik te voorspellen.
- PMQ (Pain Medication Questionnaire): instrument met 26 items dat de patiënt zelf invult. De score loopt van 0 tot 104, waarbij een hogere score een groter risico op opioïdmisbruik aangeeft. Een score van ≥ 30 geeft een verhoogd risico aan.
- BRI (Brief Risk Interview): gestandaardiseerd interview waarin scores op 12 domeinen worden bepaald. Het afnemen duurt 6-12 minuten. Patiënten worden ingedeeld in 1 van 6 categorieën, lopend van laag tot zeer hoog. De 4 hoogste categorieën samen (van medium tot en met very high) worden als hoog risico op opioïdmisbruik beschouwd.
- BRQ (Brief Risk Questionnaire): instrument met 12 items dat de patiënt zelf invult. Het instrument is afgeleid van de BRI. De score loopt van 0 tot 24, waarbij een hogere score een groter risico op opioïdmisbruik aangeeft. Een score van ≥ 3 geeft een verhoogd risico aan.
Zie tabel 10 voor de samenvatting van de resultaten. De volledige resultatentabellen zijn opgenomen in de Totstandkoming.
|
Instrument (afkappunt) |
AUROC |
Sensitiviteit |
Specificiteit |
||||
|---|---|---|---|---|---|---|---|
|
Range van Se uit onderzoeken of Se (95%-BI) |
Aantal patiënten (onderzoeken) |
Kwaliteit van bewijs |
Range van Sp uit onderzoeken of Sp (95%-BI) |
Aantal patiënten (onderzoeken) |
Kwaliteit van bewijs |
||
|
ORT (≥ 4) |
Range uit onderzoeken: 0,53 tot 0,74 |
0,20 tot 0,99 |
1025 (6) |
⨁◯◯◯ |
0,16 tot 0,88 |
977 (5) |
⨁◯◯◯ |
|
SOAPP (≥ 8) |
Niet gerapporteerd |
0,68 (0,52 tot 0,81) |
155 (1) |
⨁⨁◯◯ |
0,39 (0,29 tot 0,49) |
155 (1) |
⨁⨁◯◯ |
|
SOAPP-R (≥ 18) |
Range uit onderzoeken: 0,52 tot 0,55 |
0,25 tot 0,53 |
840 (4) |
⨁◯◯◯ |
0,62 tot 0,77 |
840 (4) |
⨁⨁◯◯ |
|
DIRE (≤ 13) |
Niet gerapporteerd |
0,17 (95%-BI niet gerapporteerd) |
48 (1) |
⨁◯◯◯ |
Niet gerapporteerd |
Niet gerapporteerd |
Niet van toepassing |
|
PMQ (≥ 30) |
0,57 |
0,34 (0,20 tot 0,51) |
263 (1) |
⨁⨁◯◯ |
0,77 (0,69 tot 0,80) |
263 (1) |
⨁⨁◯◯ |
|
BRI (high riskj) |
Range uit onderzoeken: 0,65 tot 0,93 |
0,73 tot 0,83 |
577 (3) |
⨁⨁◯◯ |
0,43 tot 0,88 |
577 (3) |
⨁◯◯◯ |
|
BRQ (≥ 3) |
0,61 |
0,80 (0,69 tot 0,88) |
257 (1) |
⨁⨁◯◯ |
0,41 (0,34 tot 0,49) |
257 (1) |
⨁⨁◯◯ |
|
a. Afgewaardeerd voor risico op vertekening: 3 onderzoeken hadden een redelijke methodologische kwaliteit, 3 een slechte. Veelvoorkomende tekortkomingen waren niet goed gedefinieerde of gestandaardiseerde methoden om misbruik vast te stellen en ontbreken van blindering. In de onderzoeken van slechte kwaliteit was daarnaast geen validatie uitgevoerd, werden alleen cases geïncludeerd of trad selectie op tijdens inclusie. Afkortingen: AUROC: Area Under the Receiver Operating Curve (opppervlakte onder de ROC-curve) Se: sensitiviteit Sp: specificiteit ORT: Opioid Risk Tool SOAPP: Screening and Opioid Assessment for Patients with Pain SOAPP-R: Screening and Opioid Assessment for Patients with Pain - Revised DIRE: Diagnosis, Intractability, Risk and Efficacy PMQ: Pain Medication Questionnaire BRI: Brief Risk Interview BRQ: Brief Risk Questionnaire |
|||||||
Conclusies
De onderzochte instrumenten hadden geen van alle een acceptabele diagnostische accuratesse om problematisch opioïdgebruik te voorspellen (kwaliteit van bewijs: laag tot zeer laag).
Praktische toepassing bij indicatie voor een sterkwerkend opioïd
Naar Samenvatting ›- Evalueer het effect en bijwerkingen elke 1-2 weken, en geef een herhaalrecept tot de volgende controle (herhaalrecepten verlopen via het spreekuur, en niet via de doktersassistente of herhaalservice van de apotheek).
- Stem van tevoren een verwachte gebruikstermijn met de patiënt af. Houd daarvoor een zo kort mogelijke periode aan. Pas de duur van het recept daar op aan.
- Bespreek uiterlijk bij het verstrijken van de afgesproken verwachte gebruikstermijn of en hoe de patiënt het gebruik kan afbouwen en stoppen (zie Afbouwen sterkwerkende opioïden na kortdurend gebruik).
- Zie voor aanbevelingen over de toepassing van opioïden bij chronische pijn Aanvullingen beleid bij gebruik van sterkwerkende opioïden bij chronische pijn.
Keuze preparaat en toedieningsvorm
Naar Samenvatting ›Geef bij voorkeur een oraal preparaat:
- Overweeg morfine of oxycodon als eerste keus vanwege de ervaring met deze middelen.
- Geef bij voorkeur een preparaat met vertraagde afgifte dat op vaste tijden (vaak 2 dd) kan worden ingenomen.
- Geef zo nodig (tijdelijk) naast het langwerkende preparaat een kortwerkend preparaat als noodmedicatie in de titratiefase of bij piekmomenten.
Overweeg bij problemen met orale toediening een pleister met fentanyl of buprenorfine:
- Met fentanyl is de meeste ervaring opgedaan, een buprenorfinepleister heeft als voordeel dat de startdosering lager kan zijn.
- Geef zo nodig (tijdelijk) naast de pleister een kortwerkend preparaat als noodmedicatie in de titratiefase of bij piekmomenten.
- Aandachtspunten bij gebruik van een pleister:
- het effect is minder goed stuurbaar door variabele afgifte (afhankelijk van de dikte van de onderhuidse vetlaag) en door de lange eliminatiehalfwaardetijd (tot 40 uur na verwijdering van de pleister door continue absorptie vanuit de huid)
- meer kans op bijwerkingen bij toename van huiddoorbloeding (transpiratie, koorts, warme douche, verwarmingsdeken, fysieke inspanning, warme dag)
- Dien morfine liever niet rectaal toe vanwege onvolledige en wisselende opname.
- Overweeg eventueel parenterale toediening van morfine (zie Stap 5: subcutane of intraveneuze toediening van sterkwerkende opioïden)
- Voor oromucosale/intranasale toediening van sterkwerkende opioïden is buiten de palliatieve/terminale fase geen indicatie.
- Voor methadon is buiten de palliatieve/terminale fase geen indicatie.
In de literatuur hebben we geen duidelijk bewijs gevonden dat bepaalde opioïden effectiever zijn of juist meer of minder bijwerkingen geven dan andere opioïden. Dit bewijs is van lage tot zeer lage kwaliteit. Als sterkwerkend opioïd wordt morfine al jarenlang veel gebruikt, maar ook met oxycodon en fentanyl is de nodige ervaring opgedaan. Het bovenstaande overziend komen we tot een zwak positieve aanbeveling voor morfine of oxycodon als eerste keuze binnen de groep van opioïden bij patiënten voor wie opioïden geïndiceerd zijn. Bij problemen met orale toediening kan een pleister worden overwogen. Vanwege het risico op overdosering bevelen we methadon als pijnmedicatie buiten de palliatieve of terminale fase niet aan.
Gewenste en ongewenste effecten
Individuele opioïden lijken onderling niet of nauwelijks van elkaar te verschillen in effectiviteit (pijnreductie, fysiek functioneren en kwaliteit van leven). Ook lijkt er niet of nauwelijks verschil in het risico op bijwerkingen (gastro-intestinale bijwerkingen, ernstige bijwerkingen en verslaving) tussen de verschillende opioïden.
Kwaliteit van bewijs
De kwaliteit van het bewijs was laag tot zeer laag. De onderzoeken zijn uitgevoerd bij patiënten met chronische pijn, terwijl de focus van onze vraag bij patiënten met acute pijn lag. Omdat het onderliggende mechanisme voor acute en chronische pijn anders is, hebben we hiervoor afgewaardeerd. Daarnaast is er afgewaardeerd voor het risico op vertekening, vaak ook voor onnauwkeurigheid en in sommige gevallen voor inconsistenties in de onderzoeksresultaten.
Waarden en voorkeuren van patiënten
In een systematische review over waarden en voorkeuren van patiënten over opioïden bij chronische niet-kankergerelateerde pijn, gaven patiënten aan dat pijnverlichting, misselijkheid en braken voor hen de belangrijkste uitkomstmaten waren. Daarbij wogen bijwerkingen als misselijkheid en braken niet op tegen pijnreductie, behalve als pijnreductie substantieel was (meer dan 2 punten op een 10-puntsschaal). Dit geldt voor opioïden in het algemeen, maar deze uitgangspunten zijn ook toe te passen bij selecteren van voorkeursmiddelen binnen de opioïden. Het risico op verslaving wordt door patiënten in de review van Goshua minder belangrijk gevonden dan de hierboven genoemde uitkomstmaten.
Kosten
De kosten van verschillende opioïden in de startdosering variëren van € 0,04 tot € 1,76 per dag. Bij sommige middelen wordt echter lager gestart en snel opgehoogd bij onvoldoende effect. Daarom is het lastig om de prijzen direct met elkaar te vergelijken. De kosten van de verschillende middelen verschillen wat ons betreft niet dermate van elkaar om op basis van de kosten een advies uit te brengen voor bepaalde voorkeursmiddelen. Hierbij speelt mee dat bij opioïden alleen kortdurend gebruik wordt aangeraden.
Aanvaardbaarheid
Opioïden zijn beschikbaar in verschillende toedieningsvormen. De meeste ervaring is opgedaan met orale middelen, in het bijzonder met morfine en oxycodon. Ook hydromorfon en tapentadol zijn in orale toedieningsvorm beschikbaar, maar deze middelen zijn minder aanvaardbaar omdat er in de eerste lijn weinig ervaring mee is opgedaan.
Fentanyl en buprenorfine zijn beschikbaar als pleister. Opioïdpleisters kennen een aantal nadelen. Vergeleken met orale middelen is het effect van een pleister minder goed stuurbaar door variabele afgifte (afhankelijk van de dikte van de onderhuidse vetlaag) en door de lange eliminatiehalfwaardetijd (tot aan 40 uur na verwijdering van de pleister door continue absorptie vanuit de huid). Ook geven pleisters meer kans op bijwerkingen bij toename van de huiddoorbloeding (door transpiratie, koorts, warme douche of verwarmingsdeken, bij fysieke inspanning of op een warme dag). Daarnaast kunnen met name bij kinderen ernstige bijwerkingen (waaronder fataal beloop) optreden bij accidenteel contact met een opioïdpleister. In het algemeen zal daarom gebruik van een orale toedieningsvorm aanvaardbaarder zijn dan een pleister, tenzij er problemen zijn bij orale toediening.
Van de pleisters is de meeste ervaring opgedaan met fentanyl. Buprenorfine kan als voordeel hebben dat het in een lagere dosering kan worden gestart.
Combinatie van tapentadol met andere sterk serotonerge middelen zoals MAO-remmers, SSRI’s en TCA’s (vooral clomipramine en imipramine) wordt afgeraden, vanwege het risico op het zeldzame, maar potentieel fatale serotoninesyndroom. Ook combinaties van fentanyl of oxycodon met MAO-remmers dienen te worden vermeden. Lichte tot matige serotonerge toxiciteit kan optreden bij onderlinge combinaties van fentanyl, oxycodon, triptanen, SSRI’s, TCA’s (vooral clomipramine en imipramine) en sint-janskruid, maar die combinaties hoeven niet te worden vermeden (KNMP Kennisbank, geraadpleegd augustus 2022).
Oxycodon is een aantal jaar geleden in het nieuws geweest, omdat er in Amerika rechtszaken werden aangespannen tegen een fabrikant van oxycodon. De aanklacht was gericht op het bagatelliseren van de verslavende gevolgen van dit middel. De betreffende fabrikant gaf bij de introductie namelijk aan dat oxycodon nauwelijks bijwerkingen zou hebben en dat bleek niet het geval. Alle opioïden geven een risico op verslaving. De afgelopen jaren is er veel aandacht geweest voor het terugdringen van opioïdgebruik en dan met name voor oxycodon, omdat het aantal voorschriften daarvan tussen 2008 en 2017 flink was toegenomen. Door alle nieuwsberichten rondom oxycodon kan het zijn dat huisartsen terughoudend zijn met het voorschrijven van oxycodon.
Bij het gebruik van methadon langer dan enkele dagen kan cumulatie optreden als gevolg van de lange en individueel wisselende halfwaardetijd. Daardoor is er specifiek bij methadon een risico op overdosering (niet bij andere opioïden). Methadon mag om deze reden alleen voorgeschreven worden door of in overleg met een arts die ervaring heeft met dit middel (zie Methadon in de palliatieve/terminale fase)
Haalbaarheid
De verschillende opioïden uit tabel 11 zijn in Nederland goed verkrijgbaar, de haalbaarheid vormt dus geen probleem.
Informatie over milieu-impact: wegens een gebrek aan gegevens kan geen uitspraak worden gedaan over de risico’s van morfine, oxycodon, hydromorfon en buprenorfine voor organismen in water. Wanneer fentanyl en tapentadol worden gebruikt zoals voorgeschreven, levert dit geen risico’s op voor het milieu (fass.se, geraadpleegd april 2022).
Uitgangsvraag
Welk opioïd is aan te bevelen bij de behandeling van volwassenen met acute nociceptieve pijn of chronische pijn met een duidelijk persisterende nociceptieve component bij wie besloten is te starten met behandeling middels opioïden? Zie de PICO-tabel.
|
Patiënten |
Volwassenen met acute nociceptieve pijn of chronische pijn met een duidelijk persisterende nociceptieve component bij wie besloten is te starten met behandeling met opioïden |
|---|---|
|
Interventie |
Opioïd |
|
Vergelijking |
Andere opioïden |
|
Uitkomstmaten |
Cruciaal
|
Voor de continue uitkomstmaten beschouwen we een verschil van 10% op de gebruikte schaal als klein, maar klinisch relevant. Dit houdt in: 1 cm op een visuele analoge schaal (VAS) van 10 cm of 10 punten op een numerieke schaal van 0-100 punten. Voor kwaliteit van leven worden verschillende schalen gebruikt, ook daar hanteren we 10% verandering in puntenscore op de betreffende schaal als klinisch relevant. Voor dichotome uitkomstmaten houden we de standaard afkapwaarden van GRADE aan: RR < 0,8 of > 1,25.
Achtergrond
Deze NHG-Standaard adviseert opioïden in stap 3 en 4 van de pijnladder bij patiënten met acute nociceptieve pijn of chronische pijn met een duidelijk persisterende nociceptieve component. Er is echter geen goede onderbouwing welk opioïd binnen de groep van opioïden de voorkeur heeft. Daarom onderzoeken we in de literatuur of we een aanbeveling kunnen doen over voorkeursmiddelen binnen de groep van opioïden.
Methoden
We hebben in PubMed en Embase een systematische literatuurzoekactie uitgevoerd naar systematische reviews (SR’s) en RCT’s. Zoekacties vonden plaats in maart 2022 (algemene zoektocht naar artikelen over de eerste lijn) en april 2022 (aanvullende zoekactie met specifieke ziektebeelden, waaronder musculoskeletale pijn en lagerugpijn). In december 2022 is een update uitgevoerd.
Resultaten
Resultaat zoekactie
De zoekactie leverde 3 SR’s op voor de verschillende uitkomstmaten. Een recente netwerkmeta-analyse over de effectiviteit en bijwerkingen van individuele opioïden bij patiënten met chronische pijn bevatte informatie over pijn, fysiek functioneren en gastro-intestinale bijwerkingen . Een SR over korte- en langetermijneffecten van opioïden bij patiënten met chronische pijn bevatte informatie over ernstige bijwerkingen (inclusief sterfte) en kwaliteit van leven. Verder bevatte een literatuurreview informatie over verslavingsgevoeligheid van oxycodon. Deze review vulden we aan met een onderzoek waarin een aantrekkelijkheidsschaal voor opioïden werd ontwikkeld en gevalideerd. Deze aantrekkelijkheidschaal is een methode om verschillen in aantrekkelijkheid voor potentieel misbruik tussen opioïden onderling te detecteren.
Bij de update werden geen nieuwe RCT’s gevonden.
Beschrijving onderzoeken
- Noori 2022: deze SR includeerde 82 RCT’s waarin 14 verschillende opioïden (in orale, transdermale of buccale vorm) met elkaar en met placebo werden vergeleken. Uitkomstmaten waren vermindering in pijn, fysiek functioneren en de bijwerkingen misselijkheid, braken en obstipatie. Alle RCT’s includeerden patiënten met niet-kankergerelateerde chronische pijn (> 3 maanden aanwezig). De oorzaak van de chronische pijn varieerde per onderzoek: artrose kwam het vaakst voor, ook patiënten met lagerugpijn en neuropathische pijn werden regelmatig geïncludeerd. Verder includeerde een aantal trials patiënten met gemengde vormen van pijn. In totaal werden 22.619 patiënten geïncludeerd met een mediane leeftijd van 57 jaar (IQR 50-62 jaar). De mediane follow-upduur was 84 dagen en de mediane duur van chronische pijn was 97 maanden.
- Chou 2020: deze review onderzocht de effectiviteit en veiligheid van opioïdgebruik (verschillende middelen) bij patiënten met chronische pijn. De auteurs van de review bekeken zowel langetermijnuitkomsten (> 1 jaar; als update van een review van dezelfde groep uit 2014) als kortetermijnuitkomsten (1-12 maanden) van zowel RCT’s als observationele onderzoeken. Bij de onderlinge vergelijking tussen opioïden werden alleen langwerkende opioïden meegenomen. Kwaliteit van leven was een uitkomstmaat in 11 RCT’s, met oxycodon als vaakst onderzochte opioïd (n = 6), gevolgd door morfine (n = 6), fentanyl (n = 4), buprenorfine (n = 2), hydromorfon (n = 1), oxymorfon (n = 1), tapentadol (n = 1) en tramadol (n = 1). Het aantal patiënten geïncludeerd in de verschillende trials varieerde van 18 tot 901. De oorzaken van de chronische pijn (lagerugpijn, artrose, chronische pancreatitis en niet-kankergerelateerde pijn) en de duur van de follow-up (4 weken tot 13 maanden) verschilden per geïncludeerde RCT. Voor ernstige bijwerkingen, waaronder sterfte, bekeken de auteurs 17 RCT’s. Onderzochte opioïden waren oxycodon (n = 11), morfine (n = 6), fentanyl (n = 4), tapentadol (n = 4), buprenorfine (n = 3), hydromorfon (n = 3), tramadol (n = 2) en oxymorfon (n = 1). Het aantal geïncludeerde patiënten varieerde van 18 tot 1117 en de mediane follow-upduur was 12 weken (range 4 weken tot 13 maanden). Lagerugpijn, artrose of een combinatie daarvan, en niet-kankergerelateerde pijn waren de meest voorkomende oorzaken van chronische pijn in deze trials. Omdat het aantal ernstige bijwerkingen erg klein was, gebruikten de auteurs naast deze 17 trials ook de resultaten van 4 retrospectieve cohortonderzoeken uit Amerika. In 3 onderzoeken bestond de onderzoekspopulatie uit Medicaid-patiënten (n = 5684, n = 38.756 en n = 50.658). In het vierde cohortonderzoek gebruikten de auteurs gegevens uit een grote Amerikaanse database voor veteranen (n = 98.068). De opioïden die werden onderzocht waren fentanyl, methadon, morfine en oxycodon.
- Remillard 2019: dit artikel bestond uit een combinatie van literatuurreview en een cross-sectionele survey over de verslavingsgevoeligheid van oxycodon in vergelijking met andere opioïden. Voor de literatuurreview gebruikten de auteurs verschillende bronnen, waaronder een aantal (kleine) trials waarin de aantrekkelijkheid van oxycodon en andere opioïden werd onderzocht (meestal in gezonde vrijwilligers) en meerdere studies die een survey hebben verricht naar aantrekkelijkheid van verschillende middelen onder opioïdgebruikers. In de cross-sectionele survey beantwoordden 86 patiënten met een diagnose van opioïdverslaving de vraag welk opioïd ze het meest gewild en het meest verslavend vonden.
- Butler 2006: de auteurs ontwikkelden eerst een aantrekkelijkheidsschaal voor opioïden en valideerden deze vervolgens met behulp van 144 personen: opioïdgebruikers, opioïdverslaafden, pijnpatiënten en medisch experts op het gebied van opioïden. Vervolgens rangschikten de auteurs op deze schaal 14 opioïden, van de meest tot de minst aantrekkelijke voor misbruik.
Effectiviteit en bijwerkingen
Voor de uitkomstmaten pijn, fysiek functioneren en gastro-intestinale bijwerkingen (misselijkheid, braken en obstipatie), zie tabel 11.
|
Uitkomstmaat → |
Pijnreductie |
Fysiek functioneren |
Misselijkheid |
Braken |
Obstipatie |
|
Middel ↓ |
Gem. verschil op schaal 0-10 (95%-BI)* |
Gem. verschil op schaal 0-100 (95%-BI)* |
OR (95%-BI)* |
OR (95%-BI) * |
OR (95%-BI) * |
|
Aantal deelnemers (RCT’s) |
Aantal deelnemers (RCT’s) |
Aantal deelnemers (RCT’s) |
Aantal deelnemers (RCT’s) |
Aantal deelnemers (RCT’s) |
|
|
Kwaliteit van bewijs (GRADE)‡ |
Kwaliteit van bewijs (GRADE)‡ |
Kwaliteit van bewijs (GRADE)‡ |
Kwaliteit van bewijs (GRADE)‡ |
Kwaliteit van bewijs (GRADE)‡ |
|
|
Conclusie§ |
Conclusie§ |
Conclusie§ |
Conclusie§ |
Conclusie§ |
|
|
Buprenorfine sublinguaal |
–0,87 (–1,11 tot –0,63) |
3,67 (–0,02 tot 7,37) |
2,03 (1,1 tot 3,75) |
5,28 (2,95 tot 9,45) |
2,58 (1,42 tot 4,69) |
|
930 (2) |
857 (2) |
971 (2) |
971 (2) |
971 (2) |
|
|
⨁⨁◯◯ |
⨁◯◯◯ |
⨁◯◯◯ |
⨁◯◯◯ |
⨁◯◯◯ |
|
|
Mogelijk beter dan placebo |
We zijn onzeker over het effect |
We zijn onzeker over het effect |
We zijn onzeker over het effect |
We zijn onzeker over het effect |
|
|
Buprenorfine transdermaal |
–0,71 (–1,01 tot –0,40) |
2,16 (–0,6 tot 4,92) |
2,89 (1,94 tot 4,3) |
3,59 (2,33 tot 5,54) |
3,55 (2,43 tot 5,19) |
|
1471 (6) |
581 (4) |
1332 (5) |
1332 (5) |
1332 (5) |
|
|
⨁◯◯◯ |
⨁◯◯◯ |
⨁◯◯◯ |
⨁◯◯◯ |
⨁◯◯◯ |
|
|
We zijn onzeker over het effect |
We zijn onzeker over het effect |
We zijn onzeker over het effect |
We zijn onzeker over het effect |
We zijn onzeker over het effect |
|
|
Fentanyl transdermaal |
–0,78 (–1,18 tot –0,40) |
1,53 (–0,6 tot 3,65) |
3,03 (1,77 tot 5,17) |
9,83 (5,9 tot 16,38) |
3,96 (2,78 tot 5,65) |
|
712 (3) |
712 (3) |
729 (3) |
729 (3) |
729 (3) |
|
|
⨁◯◯◯ |
⨁◯◯◯ |
⨁◯◯◯ |
⨁◯◯◯ |
⨁◯◯◯ |
|
|
We zijn onzeker over het effect |
We zijn onzeker over het effect |
We zijn onzeker over het effect |
We zijn onzeker over het effect |
We zijn onzeker over het effect |
|
|
Hydromorfon ER |
–0,52 (–0,88 tot –0,16) |
3,45 (1,28 tot 5,61) |
3,29 (1,77 tot 6,14) |
4,75 (2,77 tot 8,14) |
5,71 (4,15 tot 7,85) |
|
1521 (3) |
1522 (3) |
1249 (2) |
1249 (2) |
1249 (2) |
|
|
⨁◯◯◯ |
⨁◯◯◯ |
⨁◯◯◯ |
⨁◯◯◯ |
⨁⨁◯◯ |
|
|
We zijn onzeker over het effect |
We zijn onzeker over het effect |
We zijn onzeker over het effect |
We zijn onzeker over het effect |
Mogelijk schadelijker dan placebo |
|
|
Morfine ER |
–0,87 (–1,18 tot - 0,55) |
1,98 (–0,3 tot 4,26) |
3,49 (2,09 tot 5,84) |
8,77 (5,4 tot 14,25) |
5,58 (3,97 tot 7,89) |
|
880 (9) |
568 (4) |
480 (3) |
295 (1) |
565 (5) |
|
|
⨁⨁◯◯ |
⨁◯◯◯ |
⨁◯◯◯ |
⨁◯◯◯ |
⨁◯◯◯ |
|
|
Mogelijk beter dan placebo |
We zijn onzeker over het effect |
We zijn onzeker over het effect |
We zijn onzeker over het effect |
We zijn onzeker over het effect |
|
|
Oxycodon ER |
–0,67 (–0,90 tot –0,44) |
1,21 (0,01 tot 2,4) |
4,43 (3,25 tot 6,04) |
7,12 (5,42 tot 9,35) |
6,34 (5,21 tot 7,71) |
|
3579 (13) |
2659 (8) |
3715 (10) |
3091 (9) |
3424 (10) |
|
|
⨁◯◯◯ |
⨁◯◯◯ |
⨁⨁◯◯ |
⨁⨁◯◯ |
⨁⨁◯◯ |
|
|
We zijn onzeker over het effect |
We zijn onzeker over het effect |
Mogelijk schadelijker dan placebo |
Mogelijk schadelijker dan placebo |
Mogelijk schadelijker dan placebo |
|
|
Oxycodon IR |
–0,99 (–1,81 tot – 0,17) |
– |
2,26 (0,76 tot 6,68) |
4,06 (1,59 tot 10,39) |
4,82 (2,18 tot 10,64) |
|
–† |
– |
–† |
–† |
–† |
|
|
⨁◯◯◯ |
– |
⨁◯◯◯ |
⨁◯◯◯ |
⨁◯◯◯ |
|
|
We zijn onzeker over het effect |
– |
We zijn onzeker over het effect |
We zijn onzeker over het effect |
We zijn onzeker over het effect |
|
|
Tapentadol ER |
–0,81 (–1,09 tot –0,52) |
2,13 (0,67 tot 3,59) |
3,04 (2,39 tot 3,87) |
2,85 (2,11 tot 3,84) |
2,85 (2,27 tot 3,57) |
|
3085 (9) |
2177 (5) |
3048 (8) |
3139 (9) |
3119 (8) |
|
|
⨁⨁◯◯ |
⨁◯◯◯ |
⨁⨁◯◯ |
⨁◯◯◯ |
⨁⨁◯◯ |
|
|
Mogelijk beter dan placebo |
We zijn onzeker over het effect |
Mogelijk schadelijker dan placebo |
We zijn onzeker over het effect |
Mogelijk schadelijker dan placebo |
|
|
ER = extended-release (langwerkend preparaat); IR = immediate-release (kortwerkend preparaat) Alle data zijn afkomstig uit de netwerkmeta-analyse in de review van Noori. De individuele opioïden zijn onderling met elkaar en met placebo vergeleken. * Getallen zijn het gemiddelde verschil (pijnreductie en fysiek functioneren) of de OR (misselijkheid, braken en obstipatie) voor de individuele opioïden vergeleken met placebo. † Niet direct met placebo vergeleken, daarom kunnen hier geen aantallen worden gegeven. Gemiddeld verschil of OR is berekend met behulp van netwerkmeta-analyse. ‡ Kwaliteit van bewijs (GRADE-beoordeling) hebben we overgenomen uit de review van Noori. Daarnaast hebben we extra afgewaardeerd voor ‘indirect bewijs’. De onderzoeken in de review van Noori includeerden alleen patiënten met chronische pijn. Onze uitgangsvraag is met name gericht op patiënten met acute pijn. Omdat het onderliggende mechanisme anders is, verwachten we dat het effect van opioïden bij acute pijn anders kan zijn dan bij chronische pijn. § De conclusie is een combinatie van het gevonden effect en kwaliteit van het bewijs voor dat effect. Mogelijke conclusies zijn: we zijn onzeker over het effect; (mogelijk/waarschijnlijk) niet of nauwelijks verschil met placebo; (mogelijk/waarschijnlijk) beter/schadelijker dan placebo maar niet beter/schadelijker dan andere opioïden; (mogelijk/waarschijnlijk) beter/schadelijker dan een ander opioïd. |
|||||
Voor kwaliteit van leven, ernstige bijwerkingen en verslaving zijn de resultaten niet in een tabel weer te geven en volgt hieronder een beschrijving van de gevonden resultaten uit de literatuur.
Kwaliteit van leven
De review van Chou bekeek 11 RCT’s waarin kwaliteit van leven als één van de uitkomstmaten werd meegenomen. Deze trials toonden geen verschil (n = 10) of geen klinisch relevant verschil (n = 1) in kwaliteit van leven tussen de verschillende opioïden. Dit bewijs is van zeer lage kwaliteit (afwaardering vanwege het risico op bias (beperkte blindering en risico op attrition bias), ernstig indirect bewijs (patiënten met chronische pijn) en het niet goed met elkaar vergelijkbaar zijn vanwege verschillende klinische settings en gebruikte middelen). Concluderend zijn we onzeker over verschillen in (het effect op) kwaliteit van leven tussen de verschillende individuele opioïden.
Ernstige bijwerkingen (inclusief sterfte)
Chou en collega’s gebruikten in hun review 17 trials om het effect van verschillende langwerkende opioïden onderling te vergelijken. Ze keken onder andere naar verschillen in bijwerkingen, waarbij de meeste trials onderscheid maakten tussen bijwerkingen in het algemeen en ernstige bijwerkingen. Ernstige bijwerkingen kwamen echter weinig voor en de meeste trials waren niet specifiek ontworpen voor deze uitkomstmaat. Er werden dan ook geen relevante verschillen gevonden in de incidentie van ernstige bijwerkingen tussen de verschillende opioïden. De kwaliteit van het bewijs van deze RCT’s is zeer laag (afwaardering voor risico op bias (onder andere beperkte blindering, risico op attrition bias), indirect bewijs (patiënten met chronische pijn) en ernstige onnauwkeurigheid (zeer kleine aantallen events)).
Als aanvulling op deze RCT’s beschreven de auteurs van de review ook 4 retrospectieve cohortonderzoeken. Deze cohortonderzoeken toonden inconsistente resultaten. Een cohortstudie uit 2019 bij Medicaid-patiënten (n = 50.658) vond een hoger risico op overdosering (RR 1,67; 95%-BI 1,06 tot 2,63) en overlijden (RR 1,27; 95%-BI 1,05 tot 1,52) bij morfine in vergelijking tot oxycodon. Een ander cohortonderzoek bij Medicaid-patiënten uit 2015 (n = 38.756) vond een verhoogd risico op overlijden bij methadon in vergelijking tot morfine (HR 1,46; 95%-BI 1,17 tot 1,83). Een cohortonderzoek uit 2011 waarbij een grote Amerikaanse database van veteranen werd gebruikt (n = 98.068), toonde juist een verlaagd risico op overlijden voor methadon vergeleken met morfine (HR 0,56; 95%-BI 0,51 tot 0,62). Het vierde cohortonderzoek is ook uitgevoerd bij Medicaid-patiënten (n = 5684) en komt uit 2007. De auteurs van dit artikel vonden een verlaagd risico op SEH-bezoek of ziekenhuisopname als gevolg van een opioïd gerelateerd event (HR 0,45; 95%-BI 0,26 tot 0,77) en overlijden (HR 0,71; 95%-BI 0,54 tot 0,94) bij gebruik van oxycodon vergeleken met morfine. Bij patiënten met niet-kankergerelateerde pijn was fentanyl geassocieerd met een hoger risico op een SEH-bezoek (HR 1,27; 95%-BI 1,02 tot 1,59) en methadon met een hoger risico op overdosering symptomen (HR 1,57; 95%-BI 1,03 tot 2,40) in vergelijking tot morfine. Er was geen significant verschil in overlijden tussen methadon- en morfinegebruikers (HR 0,71; 95%-BI 0,46 tot 1,08). De kwaliteit van het bewijs van deze cohortonderzoeken is zeer laag vanwege afwaardering voor inconsistentie en indirect bewijs (gezien de onderzochte populaties van Amerikaanse veteranen en Medicaid-patiënten met chronische pijn).
Concluderend is het bewijs voor ernstige bijwerkingen van zeer lage kwaliteit en zijn we onzeker over het effect van verschillende individuele opioïden op ernstige bijwerkingen.
Verslaving
Het artikel van Remillard uit 2019 beschreef zowel de resultaten van een cross-sectionele survey als een literatuurreview. De cross-sectionele survey gaf de antwoorden weer van 86 patiënten met een opioïdverslaving op 3 vragen over verschillende opioïden. Uit een lijst met veel voorgeschreven orale opioïden (hydrocodon, hydromorfon, methadon, morfine, oxycodon, oxymorfon en tapentadol) koos het merendeel van de ondervraagden oxycodon als meest gewilde opioïd. Meer dan de helft van de ondervraagden vond oxycodon ook het meest verslavende middel. Aan patiënten met een voorgeschiedenis van heroïnegebruik werd ook gevraagd welk middel de toegangsweg naar heroïne was geweest. 18 van 34 patiënten die heroïne hebben gebruikt, hebben deze vraag (geldig) beantwoord en noemden ook hier oxycodon het vaakst. Uit de literatuurreview kwam een vergelijkbare boodschap naar voren. De auteurs beschreven meerdere kleine trials (n = 16-20 deelnemers) waarbij vrijwilligers zonder opioïdmisbruik/-verslaving de hoogste scores voor psychologische beloning (waaronder het opnieuw willen gebruiken) gaven aan oxycodon tijdens piek plasma levels van het gebruikte middel in vergelijking met andere opioïden. Ook beschreven de auteurs meerdere artikelen waarin surveys werden verricht bij verslaafde patiënten of recreationele gebruikers. De algemene conclusie daarvan was dat oxycodon in de vragenlijsten steeds naar voren kwam als meest gewild en meest verslavend. Dit bewijs is van zeer lage kwaliteit (er zijn bij ons geen trials of cohortonderzoeken bekend die op juiste manier corrigeren voor confounders en die deze uitkomstmaat (kunnen) onderzoeken).
Butler en collega’s hebben voor hun onderzoek een aantrekkelijkheidsschaal voor opioïden ontwikkeld en gevalideerd. Met de aantrekkelijkheidsschaal hebben ze 14 opioïden gerankt van meest aantrekkelijk voor misbruik tot minst aantrekkelijk, waarbij oxycodon (OxyContin®) het meest aantrekkelijk werd bevonden. Ook dit bewijs is van zeer lage kwaliteit.
Samenvattend is het bewijs voor verslavingsgevoeligheid van zeer lage kwaliteit en zijn wij onzeker over het effect van verschillende individuele opioïden op verslaving. We hebben geen bewijs van hoge of redelijke kwaliteit kunnen vinden dat een bepaald opioïd verslavender is dan andere opioïden.
Conclusie
- Individuele opioïden lijken onderling niet of nauwelijks van elkaar te verschillen op cruciale uitkomstmaten (pijnreductie, fysiek functioneren, gastro-intestinale bijwerkingen, kwaliteit van leven, ernstige bijwerkingen en verslaving). De kwaliteit van het bewijs is echter voor alle uitkomstmaten en opioïden laag tot zeer laag.
- Er is zeer weinig onderzoek beschikbaar waarin opioïden onderling worden vergeleken bij patiënten met acute pijn buiten het ziekenhuis. Bovenstaande conclusies zijn daarom gebaseerd op onderzoeken bij patiënten met chronische pijn.
Binnen de groep opioïden zijn er preparaten met een korte en met een lange werkingsduur. De gewone capsules en tabletten, veelal kortwerkende preparaten genoemd, hebben een korte halfwaardetijd en moeten daarom vaak 4-6 dd ingenomen worden. Bij langwerkende preparaten zorgt het ‘slow release’-principe ervoor dat het opioïd zeer geleidelijk vrijkomt (gereguleerde afgifte), met als voordeel dat het slechts 2 dd ingenomen hoeft te worden.
Over de wereld zijn er verschillende ideeën over welke preparaten de voorkeur hebben. Een recente update van de Amerikaanse CDC-richtlijn adviseert om kortwerkende preparaten voor te schrijven. De reden hiervoor is dat in een cohortstudie onder Amerikaanse veteranen een hoger risico op overdosering werd gevonden bij langwerkende preparaten. Dit bewijs is echter van zeer lage kwaliteit, waardoor wij onzeker zijn over dit effect.
Drie SR’s hebben onder andere gekeken naar RCT’s waarin kort- en langwerkende preparaten met elkaar vergeleken werden bij patiënten met chronische pijn. Noori en collega’s vonden geen significante verschillen in pijnvermindering, fysiek functioneren en gastro-intestinale bijwerkingen (misselijkheid, braken en obstipatie) tussen kortwerkende en langwerkende opioïden. Chou en collega’s beschreven twee RCT’s waarin kortwerkende en langwerkende opties van hetzelfde opioïd onderling worden vergeleken. In die trials werden geen verschillen gevonden in verbetering in pijn, functioneren, slaap, stemming en bijwerkingen. Tot slot hebben Pedersen en collega’s specifiek een SR uitgevoerd om kortwerkende en langwerkende opioïden met elkaar te vergelijken. Zij includeerden 6 RCT’s en geen van die trials toonde significante verschillen in pijnvermindering, gebruik van noodmedicatie, kwaliteit van slaap of fysiek functioneren. Bijwerkingen, verslaving, tolerantie en hyperalgesie werden niet of niet naar behoren onderzocht in die trials.
De Generieke richtlijnmodule gepast opioïdengebruik van de Nederlandse Vereniging voor Anesthesiologie adviseert om de keuze voor kortwerkende versus langwerkende preparaten te individualiseren. In de postoperatieve/acute setting hebben kortwerkende preparaten in het algemeen de voorkeur, omdat daarmee nauwkeuriger getitreerd kan worden. Bij patiënten met een verhoogd risicoprofiel voor problematisch opioïdgebruik kunnen juist langwerkende orale preparaten de voorkeur hebben. Vanwege zijn farmacokinetische profiel zal een langwerkend preparaat minder bekrachtigende effecten hebben, als men ervan uitgaat dat hoe sneller een middel piekt, des te sterker het belonende effect en dus de kans op afhankelijkheid is. Ook in de oncologische setting kunnen langwerkende preparaten de voorkeur hebben voor een onderhoudsdosering (Generieke richtlijnmodule gepast opioïdengebruik, geraadpleegd april 2022).
Concluderend is er geen overtuigend bewijs voor verschil in effectiviteit of bijwerkingen tussen kortwerkende en langwerkende opioïden. Kortwerkende opioïden geven theoretisch meer risico op verslaving door een sneller en daardoor sterker belonend effect. Het verslavingsrisico is echter niet alleen afhankelijk van de farmaceutische vorm, maar waarschijnlijk voor een groot deel ook van andere risicofactoren (zie ook het detail over risicofactoren voor problematisch opioïdgebruik). Langwerkende preparaten hebben als voordeel dat ze slechts tweemaal per dag hoeven worden ingenomen. Om deze redenen adviseren wij om bij voorkeur langwerkende opioïden voor te schrijven in de eerstelijns setting.
Dosering
Naar Samenvatting ›- Zie tabel 12 voor de startdoseringzen van morfine, oxycodon, fentanyl en buprenorfine.
- In het geval van blijvende indicatie:
- bij een goede reactie op het opioïd: verhoog bij gewenning de dosering geleidelijk om het gewenste effect te behouden.
- bij onvoldoende reactie op het opioïd: overweeg opioïdrotatie (zie Opioïdrotatie bij onvoldoende effect sterkwerkend opioïd bij acute pijn).
- Zie ook de Aanvullingen beleid bij gebruik van sterkwerkende opioïden bij chronische pijn.
| Orale middelen* | |
| Morfine | Tablet met gereguleerde afgifte, 2 dd 10-30 mg Start bij leeftijd > 70 jaar of gewicht < 50 kg: tablet retard, 2 dd 10 mg. |
| Oxycodon | Tablet met gereguleerde afgifte, 2 dd 10 mg. Eventueel 2 dd 5 mg om kans op bijwerkingen zo laag mogelijk te houden. |
| Pleisters*,† | |
| Fentanyl | Pleister, 12 microg/uur; na 3 dagen vervangen (het effect kan na 12-24 uur worden beoordeeld) |
| Buprenorfine | Bij matige pijn: 7-daagse pleister, 5 microg/uur. Het effect kan na 3 dagen worden beoordeeld. De pleister na uiterlijk 7 dagen vervangen (tijdens de titratiefase kan dosering elke 3 dagen worden aangepast). Bij ernstige pijn: 3- of 4-daagse pleister, 35 microg/uur. Het effect kan na 24 uur worden beoordeeld. De pleister na uiterlijk 72 resp. 96 uur vervangen. |
* Verhoog zo nodig geleidelijk de dosering. De benodigde dosering kan per individu sterk wisselen, afhankelijk van de gewenning en de verschillen in respons op en tolerantie voor het opioïd. Geef zo nodig naast het langwerkende preparaat tijdelijk een kortwerkend preparaat als noodmedicatie in de titratiefase of bij piekmomenten. † Pleisters zijn in Nederland alleen geregistreerd voor de behandeling van chronische pijn. Voor acute pijn is het advies dus offlabel. | |
Preventie van obstipatie bij opioïdgebruik
Naar Samenvatting ›Voorkom obstipatie door vanaf de start van het gebruik van een opioïd een laxans, zoals lactulose of macrogol, toe te voegen (tenzij er sprake is van diarree). Zie hiervoor de NHG-Standaard Obstipatie en/of pallialine.nl.
Om obstipatie te voorkomen is het belangrijk om gelijktijdig te starten met een laxans. Daarbij is het beter wat te hoog te doseren: diarree laat zich makkelijk herstellen door de laxantia 24 uur te stoppen en daarna lager te doseren. Een eenmaal vastgelopen obstipatie moet echter behandeld worden met een ‘hoog’ klysma, wat extra belastend is voor de patiënt.
Behandeling van misselijkheid en braken bij opioïdgebruik
Naar Samenvatting ›Voeg kortdurend een anti-emeticum toe indien bij het begin van de behandeling misselijkheid optreedt of indien een patiënt eerder klachten van opioïdgeïnduceerde misselijkheid en braken heeft gehad. Geef in dat geval metoclopramide of domperidon. Er is in beperkte mate onderzoek gepubliceerd, maar beide middelen zijn hiervoor geregistreerd.
- Metoclopramide
- 1 tablet, maximaal 3 dd 10 mg; behandel maximaal 5 dagen.
- Bij eGFR < 50 ml/min/1,73 m2: geef domperidon (zie voor dosering hieronder) of maximaal 3 dd 5 mg metoclopramide.
- Contra-indicaties: ziekte van Parkinson, gebruik van andere dopamineagonisten, bij gebruik van de zetpil: proctitis en rectale bloedingen.
- Bijwerkingen: slaperigheid (zeer vaak), extrapiramidale verschijnselen, zoals akathisie (bewegingsonrust of loopdwang) (vaak).
- Domperidon
- 1 tablet, maximaal 3 dd 10 mg; behandel maximaal 1 week.
- Contra-indicaties: verlengde QT-tijd, hartritme- en leverfunctiestoornissen, bekende elektrolytstoornissen (hypo- en hyperkaliëmie, hypomagnesiëmie).
- Bijwerkingen: hartritmestoornissen (zelden), extrapiramidale verschijnselen, zoals akathisie (bewegingsonrust of loopdwang) (soms).
Achtergrond
In de huisartsenpraktijk komt met enige regelmaat misselijkheid of braken bij starten van een opioïd voor. Onduidelijk is wat het effect is van behandeling met anti-emetica.
Uitgangsvraag
Wat is de effectiviteit van een anti-emeticum bij opioïdgeïnduceerde misselijkheid en braken?
Cruciale uitkomstmaten
- Afname van misselijkheid en braken
- Bijwerkingen van medicatie
Er is gebruikgemaakt van een systematische review van goede kwaliteit (AMSTAR 8/11) voor de beantwoording van deze vraag.
Er werden in deze review meerdere interventies geïncludeerd (anti-emetica, opioïdrotatie en verandering van toedieningsweg). De gebruikte uitkomstmaat in deze review was afname van misselijkheid of braken. De systematische review includeerde alle onderzoeken naar opioïdgebruik voor chronische pijn bij patiënten met kanker, waarbij misselijkheid of braken een eerste of tweede uitkomstmaat was.
Een aanvullend systematisch literatuuronderzoek leverde geen verdere bruikbare artikelen op.
Resultaten
Beschrijving onderzoeken
In de review werden in totaal 55 onderzoeken met 5741 patiënten geïncludeerd. Van deze 55 onderzoeken werden er 18 onderzoeken geïncludeerd naar de effectiviteit van anti-emetica op misselijkheid en braken bij patiënten met kanker, waarvan 7 onderzoeken een RCT betrof. Overige onderzoeken waren case-reports of series. Het aantal geïncludeerde patiënten in deze 18 onderzoeken is in de systematische review niet gegeven.
Kwaliteit van bewijs
Een grote tekortkoming van de onderzoeken was dat het vaak niet duidelijk was of de misselijkheids- en braakklachten opioïdgeïnduceerd waren. Daarnaast hadden de meeste onderzoeken grote methodologische tekortkomingen (hoog tot zeer hoog risico op vertekening in 17/18 onderzoeken, kleine aantallen en indirect bewijs). De reviewers beoordeelden de algehele kwaliteit van de bevindingen daarom als zeer zwak.
Effectiviteit
Anti-emetica
Resultaten worden selectief beschreven in het systematische onderzoek. Slechts acht van de achttien onderzoeken includeerden alleen patiënten bij wie het duidelijk was dat het om opioïdgeïnduceerde misselijkheid en braken ging. In een onderzoek naar scopolamine werd een afname van misselijkheid gezien bij 69% van de negen patiënten. In een andere onderzoek werd geen verschil gevonden tussen placebo, metoclopramide of ondansetron. Echter, het onderzoek werd voortijdig afgebroken door te langzame inclusies.
Bijwerkingen
Niet beschreven in de systematische review.
Conclusie
Anti-emetica zijn mogelijk effectief in het behandelen van opioïdgeïnduceerde misselijkheid en braken (zeer zwak bewijs).
Van bewijs naar aanbeveling
Aangezien klachten van misselijkheid of braken bij opioïdgebruik van tijdelijke aard kunnen zijn, kan bij milde klachten afgewacht worden. Bij hevige klachten kan kortdurend gebruik van een anti-emeticum overwogen worden, hoewel de effectiviteit onduidelijk is.
Aanbeveling
Geef kortdurend een anti-emeticum bij grote hinder of aanhoudende klachten van opioïdgeïnduceerde misselijkheid en braken.
Langdurige combinatie geeft een sterke toename van obstipatie en wordt daarom afgeraden. Overweeg bij aanhoudende misselijkheid of braken een andere toedieningsweg (transdermaal, rectaal of subcutaan) of opioïdrotatie.
Opioïdrotatie bij onvoldoende effect sterkwerkend opioïd bij acute pijn
Naar Samenvatting ›Overweeg opioïdrotatie bij onvoldoende effect of bijwerkingen van het opioïd.
- Als wordt gewisseld tussen morfine, oxycodon, fentanyl, buprenorfine, hydromorfon of tapentadol kan tabel 13 als uitgangspunt dienen. Ook de omrekenfunctie van de PalliArts app van IKNL kan hiervoor worden gebruikt.
- Stap bij opioïdrotatie vanwege bijwerkingen over naar 75% van de equivalente 24 uursdosering van het alternatief.
- Geef bij opioïdrotatie vanwege onvoldoende pijnstilling de equivalente dosering van het alternatief.
- Geef bij rotatie van een oraal middel naar een pleister gedurende de eerste dag na het aanbrengen van een pleister het eerder gebruikte opioïd met vertraagde afgifte in halve dosering oraal erbij ter overbrugging tot het effect van de pleister.
- Bij chronische pijn gelden mogelijk andere afwegingen (zie Aanvullingen beleid bij gebruik van sterkwerkende opioïden bij chronische pijn).
| Middel | Equivalente doseringen | |||||||
|---|---|---|---|---|---|---|---|---|
Gebaseerd op IKNL-richtlijn Pijn bij patiënten met kanker, 2019 en PalliArts app van IKNL (omrekenwaardes zijn hetzelfde, in deze tabel is een aantal extra doseringen toegevoegd t.o.v. de IKNL-richtlijn). * Als een patiënt overgaat van het ene naar het andere opioïd vanwege bijwerkingen, wordt geadviseerd 75% van de equivalente 24 uursdosering te geven. † Fentanylpleisters, buprenorfinepleisters, hydromorfon en tapentadol zijn in Nederland alleen geregistreerd voor chronische pijn en/of pijn bij kanker. Voor acute pijn is het advies dus offlabel. ‡ De 7-daagse pleister is beschikbaar in 5, 10, 15, 20 microg/uur. De pleisters voor 3 of 4 dagen zijn beschikbaar in 35, 52,5 en 70 microg/uur. § Hogere doseringen buprenorfine dan 140 microg/uur worden niet geadviseerd. ¶ De maximaal onderzochte dosis tapentadol is 500 mg/dag. Over hogere doses kunnen geen uitspraken worden gedaan. | ||||||||
| Morfine oraal (mg/24 uur) | 30 | 60 | 90 | 120 | 180 | 240 | 360 | 480 |
| Morfine s.c./i.v. (mg/24 uur) | 10 | 20 | 30 | 40 | 60 | 80 | 120 | 160 |
| Oxycodon oraal (mg/24 uur) | 20 | 40 | 60 | 80 | 120 | 160 | 240 | 320 |
| Oxycodon s.c./i.v. (mg/24 uur) | 10 | 20 | 30 | 40 | 60 | 80 | 120 | 160 |
| Fentanyl transdermaal (microg/uur)† | 12 | 25 | 37 | 50 | 75 | 100 | 150 | 200 |
| Buprenorfine transdermaal 7-daagse pleister†,‡ (microg/uur) | 10 | 25 | ||||||
| Buprenorfine transdermaal 3/4-daagse pleister†,‡ (microg/uur) | 35 | 52,5 | 105 | –§ | ||||
| Hydromorfon oraal (mg/24 uur)† | 12 | 24 | 36 | 48 | 72 | 96 | ||
| Hydromorfon s.c./i.v. (mg/24 uur)† | 2 | 4 | 6 | 8 | 12 | 16 | 24 | 32 |
| Tapentadol oraal (mg/24 uur)† | 150 | 300 | 450 | –¶ | ||||
Omdat de reactie op opioïden per patiënt sterk kan wisselen, kan het zinvol zijn van opioïdpreparaat te wisselen. Deze opioïdrotatie of opioid switching is gebaseerd op de klinische ervaring dat er intra- en interindividuele verschillen zijn in de effecten en bijwerkingen van de verschillende opioïden.
Opioïdrotatie is gebruikelijk in de klinische praktijk, vooral bij patiënten met pijn door kanker. Het bewijs hiervoor berust slechts op een aantal gevalsonderzoeken en op ongecontroleerde onderzoeken die de redenen voor de overstap (onvoldoende pijnstilling, overheersing van hinderlijke bijwerkingen of beide) niet duidelijk vermelden. Ook was in deze onderzoeken niet duidelijk of het initiële opioïd voldoende hoog gedoseerd was om maximale effectiviteit te bereiken. Als na drie tot vier verschillende opioïden de gewenste effectiviteit niet is bereikt, heeft overstappen op een ander opioïd geen zin meer.
Ook de richtlijn The 2017 Canadian Guideline for Opioids for Chronic Non-Cancer Pain (versie 4.10, gepubliceerd op 29 oktober 2018) beveelt opioïdrotatie aan als er sprake is van oncontroleerbare pijn, onacceptabele bijwerkingen of behoefte aan wisselen van toedieningsweg (https://app.magicapp.org/app#/guideline/2849). Rotatie naar een ander opioïd resulteert mogelijk in een grote pijnreductie (gemiddeld verschil −3,3 punten op de NRS-11; 95%-BI −3,5 tot −3,1; gebaseerd op 5 onderzoeken met 524 patiënten; kwaliteit van bewijs laag) en een grote toename in fysiek functioneren (gemiddeld verschil 16,7 punten op de fysieke component van de SF-36 schaal; 95%-BI 15 tot 18,4; gebaseerd op 2 onderzoeken met 206 patiënten; kwaliteit van bewijs laag). De effecten op bijwerkingen zijn onzeker (kwaliteit van bewijs zeer laag), maar de kans op succesvolle rotatie is aanzienlijk (72,5%; gebaseerd op 4 onderzoeken met 349 patiënten; kwaliteit van bewijs redelijk), terwijl er waarschijnlijk geen verschil in kans op verslaving is (gebaseerd op 2 onderzoeken met 167 patiënten; kwaliteit van bewijs redelijk).
Aanbeveling
Overweeg opioïdrotatie of veranderen van toedieningsweg bij onvoldoende pijnstillend effect.
Achtergrond
In de huisartsenpraktijk komt met enige regelmaat misselijkheid of braken bij starten van een opioïd (voor chronische pijn of in de palliatieve fase) voor. Onduidelijk is wat het effect is van opioïdrotatie of verandering van toedieningsweg.
Uitgangsvraag
Wat is de effectiviteit van opioïdrotatie of verandering van toedieningsweg op bijwerkingen van misselijkheid en braken?
Cruciale uitkomstmaten
- Afname van misselijkheid en braken
- Bijwerkingen van pijnmedicatie
Er is gebruikgemaakt van een systematische review van goede kwaliteit (AMSTAR 8/11) voor beantwoording van deze uitgangsvragen. Er werden in deze review meerdere interventies geïncludeerd (anti-emetica, opioïdrotatie en verandering van toedieningsweg). De gebruikte uitkomstmaat in deze review was afname van misselijkheid of braken. De systematische review includeerde alle onderzoeken naar opioïdgebruik voor chronische pijn bij patiënten met kanker, waarbij misselijkheid of braken een eerste of tweede uitkomstmaat was.
Het aanvullend systematisch literatuuronderzoek leverde geen bruikbare artikelen op.
Resultaten
Beschrijving onderzoeken
In de review werden in totaal 55 onderzoeken met 5741 patiënten geïncludeerd.
I. Opioïdrotatie
In totaal werden er 17 onderzoeken geïncludeerd met 3379 patiënten, waarvan 7 RCT’s, 8 niet gerandomiseerd en 2 case-reports. Van de 7 RCT’s onderzochten er 4:
- transdermale fentanyl versus placebo
- ophogen van transdermale fentanyl versus tramal voorafgaand aan ophogen transdermale fentanyl
- buprenorphine versus placebo
- starten van transdermale fentanyl in opioïd-naïeve patiënten (= patiënten die niet eerder of minder dan een bepaalde dosering aan opioïden gewend zijn) en rotatie bij patiënten met morfine.
Deze onderzoeken lieten geen verschil in prevalentie van misselijkheid/braken zien.
II. Wijziging toedieningswijze
In totaal werden 6 onderzoeken geïncludeerd (3 RCT’s, 2 non-RCT’s en 1 case-report).
Kwaliteit van bewijs
Een grote tekortkoming van de onderzoeken was dat het vaak niet duidelijk was of de klachten van misselijkheid en braken opioïdgeïnduceerd waren. Daarnaast hadden de meeste onderzoeken grote methodologische tekortkomingen (bij opioïdrotatie 16/17 en wijziging toedieningsweg opioïd 4/6). De algehele kwaliteit van de bevindingen werd daarom voor beide interventies als zwak beoordeeld door de reviewers.
Effectiviteit
I. Afname misselijkheid/braken door opioïdrotatie
Rotatie van morfine naar oxycodon
Twee van de zeven RCT’s werden opgezet om het effect van wisseling van morfine naar oxycodon op de pijn te vergelijken, waarbij bijwerkingen zoals misselijkheid/braken secundaire uitkomstmaten waren. In de eerste RCT werden twintig patiënten met kanker gerandomiseerd naar morfine en oxycodon i.v. voor 48 uur, waarna hetzelfde geneesmiddel oraal werd gegeven voor 48 uur en als laatste werd gewisseld van opioïd voor 96 uur. Oraal morfine veroorzaakte meer misselijkheid (twaalf patiënten) dan oraal/i.v. oxycodon of i.v. morfine. In de tweede (dubbelblinde, cross-over) RCT werden 45 patiënten met kanker behandeld met oxycodon of morfine, waarbij morfine significant meer braken gaf (n = 10) ten opzichte van oxycodon (n = 5), zonder verschil in misselijkheid.
Rotatie van morfine naar hydromorfon
In een prospectief ‘open-label’-onderzoek waarin honderd patiënten werden omgezet van morfine naar hydromorfon, werd significant minder misselijkheid (2,5 versus 1,5 op een schaal van 0-10) en braken (0,7 versus 0,1 episodes per dag) gezien.
II. Afname misselijkheid/braken door wijziging toedieningswijze
Van oraal of subcutaan naar rectaal morfine
De drie RCT’s vergeleken morfine rectaal versus oraal en morfine rectaal versus subcutaan, maar in geen van de onderzoeken had dit een effect op de misselijkheid.
Van oraal of intermitterend subcutaan naar continu subcutaan morfine
In een prospectief onderzoek werden 36 patiënten met morfine en bijwerkingen zoals sufheid, misselijkheid of persisterende pijn omgezet naar continue subcutane infusie van morfine als een alternatief voor intermitterende orale of subcutane morfine. Op indicatie werd metoclopramide voorgeschreven. Een patiënt was nog misselijk onder continue subcutane toediening ten opzichte van elf patiënten met intermitterend gebruik en dit verschil was significant minder.
Conclusie
Er is zwak bewijs dat misselijkheid en braken ten gevolge van morfine vermindert door te wisselen naar een ander opioïd, zoals oxycodon of hydromorfon. Er is zwak bewijs dat misselijkheid en braken ten gevolge van morfine vermindert door de toediening te veranderen van oraal of intermitterend subcutaan naar continu subcutaan.
Er is zwak bewijs dat misselijkheid en braken ten gevolge van morfine niet vermindert door de toediening te veranderen van oraal of subcutaan naar rectaal.
Van bewijs naar aanbeveling
Er is weinig onderzoek verricht naar opioïdrotatie of wijziging van toedieningsweg voor de behandeling van opioïdgeïnduceerde misselijkheid en braken. Morfine gaf niet minder misselijkheid dan oxycodon, maar wel meer braken. Als patiënten al misselijkheid en braken van oraal morfine hadden, werd er een afname gezien bij verandering van de toedieningsweg. De werkgroep concludeert dat op basis van ervaring opioïdrotatie of veranderen van toedieningsweg te overwegen valt.
Aanbeveling
Overweeg opioïdrotatie of veranderen van toedieningsweg bij aanhoudende opioïdgeïnduceerde misselijkheid en braken.
Voorbeeld van omschakeling van 2 dd 180 mg morfine slow release naar fentanylpleister van 150 microg/uur (= equivalente dosering):
- dag 1: 2 dd 180 mg morfine slow release oraal
- dag 2: start 150 microg per uur fentanylpleister en 2 dd 90 mg (50% van dagdosis van dag 1) morfine slow release
- dag 3: alleen nog fentanylpleister
Afbouwen sterkwerkende opioïden na kortdurend gebruik
Naar Samenvatting ›- Na kortdurend gebruik (arbitrair < 1 maand) geldt het uitgangspunt dat de dosering elke 2 tot 7 dagen gehalveerd kan worden.
- Zie voor afbouwen na langer durend gebruik, of bij ontwenningsverschijnselen, voorkeur van de patiënt voor langzamer afbouwen, of kwetsbare ouderen Beleid bij afbouwen na langdurig gebruik opioïden.
Om onthoudingsverschijnselen (zoals rusteloosheid, prikkelbaarheid, slapeloosheid, niezen, zwakte, angst, depressie, mydriase, anorexie, overmatige haargroei, misselijkheid en braken, diarree, koorts, hypertensie, spierkrampen, transpireren, uitdroging en gewichtsverlies) door lichamelijke afhankelijkheid te voorkomen, dient de dosering te worden afgebouwd. In het algemeen geldt dat bij het afbouwen na kortdurend gebruik (arbritrair: < 1 maand) de dosering elke 2 dagen kan worden gehalveerd. Ook schema’s waarbij de dosering wekelijks wordt gehalveerd, worden toegepast.
Aanvullingen beleid bij gebruik van sterkwerkende opioïden bij chronische pijn
Naar Samenvatting ›- Wees bij chronische pijn zeer terughoudend met opioïden, vanwege het beperkte effect dat in het algemeen te verwachten is van opioïden bij pijn door sensitisatie, en de potentieel ernstige bijwerkingen (zie Beleid bij chronische pijn).
- Aanhoudende pijn ondanks gebruik van opioïden is bij chronische pijn meestal een uiting van ineffectiviteit en niet van onderdosering. Het is dus eerder een reden om te stoppen en niet om de dosering te verhogen of opioïdrotatie toe te passen.
- Alleen bij chronische pijn met een duidelijk persisterende nociceptieve component:
- is verhoging van de dosering bij gewenning te overwegen. Houd in dat geval de dosering < 90 mg morfine-equivalent per os per dag, om overmatig gebruik van opioïden te voorkomen
- is opioïdrotatie te overwegen bij onvoldoende effect
Stap 5: subcutane of intraveneuze toediening van sterkwerkende opioïden
Naar Samenvatting ›- Start met subcutane of intraveneuze toediening van opioïden als met stap 4 onvoldoende pijnstilling wordt bereikt of als van speciale toedieningswegen een gunstiger effect wordt verwacht.
- Subcutane toediening (eenmalig, intermitterend of continu) van opioïden is ook in de thuissituatie een geschikte methode van pijnbehandeling bij kanker of in de palliatieve fase.
- Met continue subcutane infusie van opioïden worden vergelijkbare bloedspiegels bereikt als met intraveneuze toediening.
- Houd bij omzetting naar subcutane toediening een derde van de orale dagdosis morfine aan.
- Als met de genoemde methoden onvoldoende pijnstilling bereikt wordt, is epidurale of spinale toediening van opioïden mogelijk zinvol. Verwijs de patiënt hiervoor naar een anesthesioloog-pijnspecialist.
Controles
Naar Samenvatting ›Instrueer de patiënt contact op te nemen in de volgende gevallen:
- bij zeer ernstige of onhoudbare pijn: direct
- bij aanhoudende matige tot ernstige pijn (NRS > 5): binnen een week
- bij sterke toename van het disfunctioneren: na een week
- bij aanhoudende lichte pijn (NRS ≤ 5), uitbreiding van de pijn, niet verder verbeteren van pijn en/of disfunctioneren, negatieve emoties (wanhoop, somberheid): na 3 weken
- bij gebruik van pijnmedicatie: spreek afhankelijk van de oorzaak en het verwachte beloop van de pijn met de patiënt een reële termijn af om het effect van pijnmedicatie te evalueren (bij onacceptabele bijwerkingen: binnen een week, bij opioïdgebruik elke 1-2 weken)
Aanpak controles
Naar Samenvatting ›- Herhaal op indicatie (relevante delen van) de anamnese en lichamelijk onderzoek (zie Richtlijnen diagnostiek).
- Breid de anamnese naarmate klachten langer aanhouden (eventueel gefaseerd) uit met klachtexploratie volgens SCEGS.
- Heroverweeg de diagnose (oorzaak, acute versus (dreigende) chronische pijn) en pas zo nodig het beleid aan.
- Vraag naar het effect en de bijwerkingen van eventueel gebruikte pijnmedicatie (zie voor specifieke aandachtspunten per geneesmiddelgroep Medicamenteus stappenplan).
Streef naar tijdelijk gebruik van pijnmedicatie en bespreek met de patiënt dat deze de medicatie zodra dit mogelijk is (termijn afhankelijk van de oorzaak van de pijn) op proef zal stoppen (bij gebruik van opioïden kan afbouwen nodig zijn, zie de toelichting bij Stap 3: zwakwerkend opioïd en Stap 4: sterkwerkend opioïd).
Consultatie en verwijzing
Naar Samenvatting ›- Fysiotherapie: overweeg verwijzing bij pijnklachten aan het bewegingsapparaat (zie voor specifieke behandelingen en indicaties de relevante NHG-Standaarden).
- Bedrijfsarts: consulteer of verwijs bij werkgerelateerde problematiek.
- Medisch specialist (bijvoorbeeld een orthopeed of (neuro)chirurg): consulteer of verwijs zo nodig bij het vermoeden van behandelbare onderliggende somatische oorzaken van de pijn.
Beleid bij chronische pijn
Naar Samenvatting ›In dit onderdeel staat het beleid bij chronische pijn beschreven. Het beleid bij patiënten met dreigende chronische pijn is een combinatie van het beleid bij acute pijn en het beleid bij chronische pijn. De balans daartussen is afhankelijk van de situatie.
Het beleid sluit aan op de Zorgstandaard Chronische pijn, en de uitwerking daarvan berust op consensus binnen de werkgroep.
Aanpak algemeen
Naar Samenvatting ›- Bij chronische pijn staat educatie centraal. Pijneducatie is gericht op het veranderen van maladaptieve pijncognities (bijvoorbeeld de gedachte dat pijn altijd een teken is van weefselschade). Maladaptieve pijncognities kunnen leiden tot catastroferen en hebben een belangrijke negatieve invloed op de prognose van chronische pijn. Educatie, zelfinzicht en zelf aan het roer staan van de behandeling spelen een belangrijke rol bij de pijnbeleving en het voorkomen en verminderen van chroniciteit.
- Erken de pijn. Vermijd uitspraken dat de pijn ‘psychisch’ of ‘ingebeeld’ zou zijn en geef patiënten niet het advies om met de pijn te leren leven. Dit wordt geregeld als kwetsend ervaren en als het niet serieus nemen van de klachten.
- Probeer samen met de patiënt tot een probleemdefinitie van de pijn te komen en de invloed van lichamelijke, psychische en sociale factoren hierop.
- Behandel de pijn volgens het biopsychosociale model, dat wil zeggen: richt het beleid op het verminderen van de invloed van zowel lichamelijke factoren (zoals een bekende onderliggende oorzaak) als psychische en sociale factoren.
- Formuleer samen met de patiënt haalbare behandeldoelen. Bespreek dat het vaak niet mogelijk is de pijn te laten verdwijnen, maar dat verbetering van het functioneren en de kwaliteit van leven dikwijls wel mogelijk is. Besteed indien relevant aandacht aan verbetering van het functioneren op het werk als behandeldoel.
- Overweeg een behandelplan op te stellen met doelen en vaste termijnen voor controles.
- Zie voor specifieke aanbevelingen voor kwetsbare ouderen de Multidisciplinaire richtlijn Herkenning en behandeling van chronische pijn bij kwetsbare ouderen.
Achtergrond
Pijneducatie is een interventie die zich richt op cognitieve veranderingen van bijvoorbeeld maladaptieve pijncognities, zoals de gedachte dat pijn een teken is van weefselschade. Maladaptieve cognities kunnen leiden tot catastroferen en fear avoidance beliefs, fenomenen waarvan inmiddels uitvoerig bekend is dat zij bijdragen aan het ontstaan en onderhouden van chronische pijn. Pijneducatie is er met name op gericht deze maladaptieve cognities te veranderen naar adequate cognities, zodat de copingstrategieën verbeteren en de pijn afneemt.
Catastroferen komt vaker voor bij vrouwen. Sekseverschil in catastroferen draagt bij aan het sekseverschil in pijnervaring.
Beschrijving onderzoeken
Er zijn twee systematische literatuuronderzoeken uitgevoerd naar het effect van pijneducatie gebaseerd op recente neurofysiologische kennis over pijn. Clarke et al. hebben gekeken naar de effecten van pijneducatie op patiënten met chronische lagerugklachten. Louw et al. keken naar de effecten van pijneducatie op patiënten met chronische pijn ongeacht de diagnose. Daarnaast is in een ander systematisch literatuuronderzoek specifiek gekeken naar pijneducatie bij patiënten met een whiplash. In totaal zijn tien RCT’s van matige tot goede kwaliteit in het literatuuronderzoek meegenomen.
Effectiviteit
Er is bewijs dat pijneducatie een positief effect heeft op de mate van gerapporteerde beperkingen. De onderzoekers geven aan dat pijneducatie een belangrijke voorwaarde is voor het realiseren en/of onderhouden van een actieve leefstijl. Pijneducatie heeft een significant positief effect op catastroferen (met name bij patiënten met chronische lagerugpijn) en een positieve invloed op de passieve copingstrategieën. Door pijneducatie is er een verbetering van de pijnattitude. De overtuiging dat pijn schade betekent neemt af alsook de overtuiging dat men beperkt is door de pijn.
Zowel mondelinge als schriftelijke educatie, al dan niet geïntegreerd in oefenprogramma’s of gedragsmatige interventies, zijn effectief bij subacute en chronische patiënten met whiplash. In de acute fase kan een eenvoudige mondelinge instructie al voldoende zijn. In een Frans multicenter gecontroleerd onderzoek werd gevonden dat een simpele informatiefolder de kans op chronificering van acute lagerugpijn (bescheiden) doet verminderen.
Conclusie
In het algemeen concluderen de onderzoekers dat educatie zich moet richten op het weghalen van hindernissen om te leren omgaan met pijn en het bevorderen van therapietrouw. Er kunnen geen specifieke aanbevelingen gedaan worden over de beste inhoud en/of aanbiedingsvorm gezien de grote diversiteit in de onderzoeken.
Overwegingen
Educatie waarbij sterk de nadruk ligt op pathologische anatomie en biomechanica lijkt niet effectief te zijn en kan zelfs bijdragen tot een slechter begrip van de pijn en mogelijk zelfs tot een negatief effect op de pijn of het pijngedrag. Er is toenemend bewijs voor de effectiviteit van pijneducatie op catastroferen, de pijnintensiteit, kwaliteit van leven en werkhervatting.
Aanbeveling
De huisarts bespreekt met de patiënt dat verbetering van het functioneren het (belangrijkste) doel van de behandeling is. Vermindering van pijn als zodanig is niet het primaire doel, omdat dit niet altijd mogelijk is.
Voorlichting (educatie)
Naar Samenvatting ›Leg patiënten uit dat:
- lang aanhoudende pijn in de regel géén waarschuwingssignaal is voor weefselschade en dus niet gevaarlijk is. Een zoektocht naar de (somatische) oorzaak levert dus meestal niets op
- een ontregeling van het centrale zenuwstelsel waarschijnlijk een grote rol speelt bij het aanhouden van de pijn (het zenuwstelsel geeft pijnprikkels versterkt door en het zenuwstelsel geeft niet-pijnlijke prikkels als pijnlijk door)
- ook bij chronische pijn bij een bekende onderliggende oorzaak deze ontregeling van het centrale zenuwstelsel een rol speelt bij het aanhouden van de pijn
- psychologische factoren, zoals zich ongerust maken, of stress of verdriet ervaren, sociale factoren, zoals het uit de weg gaan van sociale contacten, en het vermijden van lichaamsbeweging normale verschijnselen zijn bij het hebben van pijn
- deze factoren helaas een negatieve invloed hebben op de ontregeling van het zenuwstelsel en dus op de pijn (pijnbeleving, pijngedrag, ervaren beperkingen en kwaliteit van leven)
- door de invloed van deze factoren te verkleinen bewerkstellig je daadwerkelijk veranderingen in het brein/zenuwstelsel. Hierdoor verandert de manier waarop dat met prikkels omgaat in gunstige zin
Geef patiënten bij wie een bekende onderliggende aandoening een rol speelt bij de pijn daarnaast gerichte voorlichting en advies over onderliggende aandoening.
Wijs de patiënt op het bestaan van:
- patiëntenverenigingen en -organisaties (verenigd in Samenwerkingsverband Pijnpatiënten naar één stem) en bespreek de meerwaarde die lotgenotencontact kan hebben. Informatie van deze organisaties biedt de patiënt steun in emotionele en praktische zin.
- (online) zelfhulpprogramma’s over het leren omgaan met chronische pijn, bijvoorbeeld:
- de online cursus Omgaan met pijn, en de fysieke cursus op locatie Sterk met pijn, beide via pijnpatiëntennaar1stem.nl.
- online lessen van de Retrain Pain Foundation (deze zijn in het Nederlands en vele buitenlandse talen beschikbaar), zie retrainpain.org)
Thuisarts
Naar Samenvatting ›Verwijs naar de informatie op thuisarts.nl. De informatie op Thuisarts is gebaseerd op deze NHG-Standaard.
Bedrijfsarts
Naar Samenvatting ›- Adviseer de patiënt contact op te (laten) nemen met de bedrijfsarts als de klachten mogelijk hun oorzaak in de arbeidssituatie hebben of een gevolg voor de arbeidssituatie hebben.
- Dit geldt ook als mogelijke bijwerkingen van pijnstillers invloed kunnen hebben op het functioneren tijdens het werk.
- Dit geldt in het bijzonder als er sprake is van een groter veiligheidsrisico voor de betrokkene zelf of voor derden door effecten op het reactievermogen.
Niet-medicamenteuze behandeling
Naar Samenvatting ›Bespreek, afhankelijk van de bevindingen bij klachtexploratie en de probleemdefinitie, bijvoorbeeld de volgende mogelijkheden om de invloed van factoren die het herstel belemmeren te verkleinen:
- leid de aandacht van de pijn af door bijvoorbeeld meditatie, sociale contacten en activiteiten (hobby’s, muziek, natuur)
- probeer als het kan te blijven werken of het werk geleidelijk te hervatten: overleg met werkgever en bedrijfsarts over mogelijkheden voor aangepast werk of aangepaste werktijden
- stop met zoeken naar de oorzaak van pijn, omdat dit vaak niets oplevert
- zoek steun bij partner, vrienden en/of collega’s
- zorg voor voldoende ontspanning, bijvoorbeeld door muziek luisteren, lezen, wandelen, meditatie, yoga of sporten
- maak een dagindeling: stel prioriteiten, doseer de activiteiten gedurende de dag en wissel inspannende activiteiten af met ontspannende activiteiten
- beweging:
- adviseer bij neiging tot inactiviteit/vermijden (beweeg)doelen: begin eenvoudig, en bouw stapsgewijs en tijdcontingent op (zie ook de module Bewegen in de Praktijkhandleiding Leefstijl). Bespreek dat enige mate van pijn of moeheid niet betekent dat er schade ontstaat, en vanzelf overgaat. In het algemeen geldt dat verbetering van de lichamelijke conditie gunstig is voor het herstel bij chronische pijn
- adviseer bij neiging tot volhardend beweeggedrag ondanks pijn de activiteiten te verminderen (eventueel later weer geleidelijk op te bouwen), meer te doseren en gelijkmatiger te verdelen over de dag en week
- zorg voor een goede nachtrust (zie voor adviezen bij slaapproblemen de NHG-Standaard Slaapproblemen)
Maatschappelijk werk
Naar Samenvatting ›Bespreek met patiënten bij wie chronische stress door psychosociale problemen een belangrijke rol speelt bij de pijn de mogelijkheid om begeleiding te vragen van maatschappelijk werk.
Psychologische interventies
Naar Samenvatting ›Bespreek met patiënten met chronische pijn die niet-helpende opvattingen, emoties en gedragingen rondom de pijn hebben de mogelijkheid om naar een psycholoog te verwijzen:
- Het doel van een psychologische interventie is psychologische factoren die de pijn en beperkingen in stand houden en/of versterken in kaart te brengen en weg te nemen.
- Psychologische interventies bij de behandeling van pijn betreffen cognitieve gedragstherapie (CGT) en op acceptatie gerichte interventies (ACT, acceptance and commitment therapy).
- Het uitgangspunt van CGT is dat de ervaren pijn en beperkingen niet uitsluitend het gevolg zijn van somatische pathologie, maar ook worden beïnvloed door psychologische en sociale factoren. Het doel van CGT is om niet-helpende cognities, emoties en gedrag betreffende de pijn te beïnvloeden en als gevolg hiervan ook de pijnbeleving.
- ACT, waar mindfulness deel van uitmaakt, beoogt de psychologische flexibiliteit te vergroten om negatieve ervaringen zoals pijn en sombere gedachten te kunnen opvangen.
- Zowel CGT als ACT draagt bij aan pijnvermindering. CGT en ACT worden vaak toegepast als onderdeel van een multidisciplinaire behandeling.
- Bij fibromyalgie wordt mogelijk een gunstig effect op de klachten bereikt met CGT.
- Er is geen bewijs voor de effectiviteit van alleen ontspanningstechnieken bij chronische pijn.
Psychologische interventies die kunnen worden toegepast bij patiënten met chronische pijn kunnen worden onderscheiden in cognitieve gedragstherapie (CGT) en op acceptatie gerichte interventies (ACT).
Cognitieve gedragstherapie
De meeste onderzoeken naar de effecten van psychologische interventies op pijn betreffen cognitieve gedragstherapie (CGT). Het uitgangspunt van CGT is dat pijn en de beperkingen die hieruit voortkomen niet uitsluitend een gevolg zijn van somatische pathologie. Pijn en beperkingen worden ook beïnvloed en in stand gehouden door psychologische en sociale factoren. De (intensiteit van de) pijn is dus niet uitsluitend een somatisch probleem, maar wordt ook bepaald door hoe de patiënt zich verhoudt tot zijn pijn, zijn gedachten over zijn pijn, andere psychologische stressoren en het ziektegedrag. Het doel van CGT is om niet-helpende cognities, emoties en gedrag over de pijn te beïnvloeden en als gevolg hiervan ook de pijnbeleving. CGT kan afzonderlijk worden aangeboden, maar wordt dikwijls toegepast als onderdeel van een multidisciplinaire behandeling (in samenhang met fysiotherapie, medicatie, bewegingstherapie). In een Cochrane-review (30 onderzoeken, 3438 patiënten met lagerugklachten) werd de effectiviteit op pijn onderzocht van gedragstherapie (cognitief, operant, gecombineerd). Op de korte termijn is gedragstherapie effectiever vergeleken met een wachtlijstcontrolegroep, fysiotherapie alleen of een medische behandeling (verschil −5,18 (95%-BI −9,79 tot −0,57) op een VAS van 100 punten). Op de lange termijn is er geen verschil tussen gedragstherapie en fysiotherapie (graded activity) in de mate waarin pijnreductie optreedt of depressieve symptomen verminderen. Geen specifieke vorm van gedragstherapie is effectiever dan een andere. Een Cochrane-review (15 RCT’s; n = 803; onderzoeken met laag risico op bias maar sterke heterogeniteit) liet zien dat CGT effectief was bij pijn op de borst zonder aanwijsbare oorzaak: RR voor aanwezigheid van pijn op de borst 0,68 (95%-BI 0,57 tot 0,81) na 3 maanden en RR 0,59 (95%-BI 0,45 tot 0,76) na 9 maanden.
In een systematisch literatuuronderzoek werd geen consistent effect van CGT op chronische neuropathische pijn gevonden, maar hierbij werd aangegeven dat er slechts een onderzoek van goede kwaliteit was gevonden. In een meta-analyse van 35 RCT’s (n = 4788) werd het effect van cognitieve gedragstherapie en gedragstherapie bij chronische pijn (met uitzondering van hoofdpijn) onderzocht. Beide hebben het doel om gedrag te veranderen dat een rol speelt bij het in stand houden van de pijn, de ervaren beperkingen, stress en catastroferen. CGT richt zich daarnaast op niet-helpende gedachten en gevoelens die bij chronische pijn op kunnen treden. Gedragstherapie bleek niet bewezen effectief vergeleken met een actieve controlegroep behalve een licht verbeterde stemming direct na behandeling. CGT was effectief in vergelijking met standaardzorg in het verminderen van pijn (SMD −0,21; 95%-BI −0,37 tot −0,05), ervaren beperkingen (SMD −0,26; 95%-BI −0,47 tot −0,04), het verbeteren van de stemming (SMD −0,38; 95%-BI −0,57 tot −0,18) en het verminderen van catastroferen (SMD −0,53; 95%-BI −0,76 tot −0,31). Na zes maanden waren de verschillen echter niet meer significant. De verschillen met een actieve controlegroep waren kleiner en veelal niet significant. Hoewel de effecten van CGT positief leken, waren de verbeteringen niet groot en is niet bekend welke behandeling voor welke persoon het meest geschikt is.
Op acceptatie gerichte interventies
Op acceptatie gerichte interventies (ACT) worden ook wel de derdegeneratiegedragstherapie genoemd. De eerste generatie was de gedragstherapie, daarna kwam de cognitieve gedragstherapie en vanaf halverwege de jaren negentig van de vorige eeuw is er toenemend aandacht gekomen voor op acceptatie gerichte interventies, zoals mindfulness en acceptatie en commitmenttherapie. Acceptatie verwijst in dit verband naar de bereidheid om pijn of andere stressvolle ervaringen te ervaren zonder deze te proberen te controleren. Met acceptatie wordt de psychologische flexibiliteit, nodig om negatieve ervaringen zoals pijn en sombere gedachten te kunnen opvangen, vergroot en de aandacht wordt meer verlegd naar de waarden die iemand in het leven belangrijk vindt. Hoewel pijnvermindering geen rechtstreeks doel van de behandeling is, wordt dit in de op acceptatie gerichte behandelingen wel vaker gevonden. Hypothese is dat door de behandeling de patiënt leert om minder te vechten tegen de pijn en deze meer in het moment te ervaren zonder allerlei negatieve connotaties. Hierbij is er minder fysieke inspanning en spierspanning, waardoor de vicieuze cirkel van spanning en pijn doorbroken wordt.
In een meta-analyse (22 onderzoeken, 1235 patiënten met chronische pijn, 9 van deze onderzoeken waren RCT’s) bleek ACT een klein maar significant effect te hebben op pijn (SMD 0,25; 95%-BI 0,01 tot 0,49), depressie (SMD 0,26; 95%-BI 0,05 tot 0,47) en fysiek welbevinden (SMD 0,43; 95%-BI 0,04 tot 0,82), vergeleken met de controlegroepen (meestal wachtlijst). De auteurs concluderen dat ACT een goed alternatief vormt voor CGT.
In een RCT werden patiënten met chronische, niet-maligne pijn (n = 114, follow-up 6 maanden) gerandomiseerd naar ACT of CGT (sessies gericht op gebruik in de eerste lijn gedurende acht weken). In zowel de ACT- als de CGT- groep verbeterden patiënten wat betreft pijn, depressie en angst. Er was geen significant verschil in verbetering tussen de groepen. Er werd in de ACT-groep een significant grotere patiënttevredenheid gerapporteerd.
Mindfulness wordt omschreven als een vorm van aandacht, niet oordelend, accepterend naar interne en externe ervaringen en gericht op het hier en nu. In een systematisch literatuuronderzoek (tien onderzoeken, geen meta-analyse mogelijk) werd onvoldoende bewijs gevonden voor de werkzaamheid van mindfulness bij chronische pijn.
Internetbehandeling
In een meta-analyse (11 RCT’s, n = 2953) werd gevonden dat webbased interventies (in bescheiden mate) bijdroegen aan pijnreductie. De onderzoeken rapporteerden behalve pijnvermindering verschillende andere uitkomstmaten (zoals dokterbezoek, medicatiegebruik, opvattingen over pijn en passieve copingstrategieën) waarvan de meeste significant verbeterden in de behandelgroep vergeleken met de controlegroep. In latere onderzoeken worden dezelfde resultaten gevonden.
E-health draagt bij aan het verminderen van pijn, ervaren beperkingen, angst en somberheid geassocieerd met de pijn, catastroferen en aan het verbeteren van de kwaliteit van leven. Voor lagerugpijn worden dezelfde resultaten gevonden.
Conclusie
Zowel CGT als ACT hebben positieve effecten op pijnvermindering en kwaliteit van leven. Een eventueel positief effect op chronische neuropathische pijn is minder consistent.
Aanbeveling
De werkgroep is van mening dat bij patiënten met chronische pijn en maladaptieve pijncognities CGT en ACT kunnen worden overwogen.
In een systematisch literatuuronderzoek (vijftien onderzoeken) werd geconcludeerd dat er onvoldoende bewijs is voor positieve effecten van visuele imaginatietechnieken op chronische pijn van het bewegingsapparaat. Elf onderzoeken lieten een significante verbetering zien vergeleken met relaxatie, standaardbehandeling of geen behandeling; vier onderzoeken deden dat niet. De meeste onderzoeken waren van lage methodologische kwaliteit.
In een meta-analyse (zestien RCT’s) werd gevonden dat yoga een bruikbare interventie kan zijn bij een groot aantal chronische pijnsyndromen. Het is niet duidelijk welke patiënten van welke interventie zouden kunnen profiteren. In twee systematische literatuuronderzoeken werd een mogelijk gunstig effect van yoga gevonden op (lagerug)pijn. In een meta-analyse over niet-medicamenteuze behandelingen bij lagerugpijn werd geen effectiviteit gevonden van yoga.
In een Cochrane-review (23 onderzoeken, 2031 patiënten met fibromyalgie) werd een positief effect van cognitieve gedragstherapie (CGT) gevonden op pijn, stemming en dagelijkse beperkingen gemeten direct na de behandeling en na minimaal zes maanden. Vier vormen van CGT werden bestudeerd: traditionele CGT, operante CGT (technieken voor toename van activiteit en vermindering van pijngedrag door inclusie van naasten en vermindering van pijnmedicatie), zelfmanagementprogramma’s en CGT gebaseerd op acceptatie. Op een 1 tot 10 puntenschaal voor pijn werd een vermindering van 0,5 gevonden direct na de therapie (SMD −0,29; 95%-BI −0,49 tot −0,17) en van 0,6 op lange termijn (SMD −0,40; 95%- BI −0,62 tot −0,17). De verbeteringen van stemming en dagelijkse beperkingen waren ook significant. De algehele kwaliteit van de onderzoeken was laag. De populatie bestond voor 95% uit Europese en Noord-Amerikaanse vrouwen van middelbare leeftijd. Vooral traditionele en operante CGT waren effectief. Er werd geen bewijs gevonden voor zelfmanagementprogramma’s als solitaire behandeling.
Behandeling comorbide angst en/of depressie
Naar Samenvatting ›Behandel een comorbide angststoornis of depressie (zie NHG-Standaard Angst en NHG-Standaard Depressie). Dit kan bijdragen aan reductie van chronische pijn. Omgekeerd leidt pijnvermindering tot verbetering van de depressieve symptomen.
In gerandomiseerd onderzoek (n = 205) werd onderzocht of een gecombineerde behandeling van antidepressieve medicatie en psychologische interventies zowel de depressie als de pijn vermindert bij patiënten met pijnklachten van rug, heup of knie. Uitkomstmaten waren depression (20-item Hopkins Symptom Checklist Depression Scale), pain severity and interference (Brief Pain Inventory) en global improvement in pain. Na 12 maanden had 37,4% in de interventiegroep 50% of meer verbetering van depressie versus 16,5% in de controlegroep (RR 2,3; 95%-BI 1,5 tot 3,2). Er werd een sterkere pijnreductie (≥ 30%) gevonden in de interventiegroep vergeleken met de controlegroep: 41,5% versus 17,3% (RR 2,4; 95%-BI 1,6 tot 3,2). Ook was de global improvement in pain beter in de interventiegroep: 47,2% versus 12,6% (RR 3,7; 95%-BI 2,3 tot 6,1). Meer patiënten in de interventiegroep hadden een betere primaire uitkomst (gecombineerde verbetering van depressie en pijn): 26,0% versus 7,9% (RR 3,3; 95%-BI 1,8 tot 5,4). De auteurs concluderen dat gecombineerde behandeling van antidepressieve medicatie met psychologische interventie resulteert in een substantiële verbetering van zowel depressie als pijnklachten.
In Amerikaans onderzoek werden 1801 depressieve patiënten met artritis of artrose van 60 jaar en ouder gerandomiseerd naar antidepressieve medicatie of 6 tot 8 sessies psychologische behandeling. Uitkomstmaten waren depressie, intensiteit van de pijn (schaal 0 tot 10), belemmering van dagelijkse activiteiten (schaal 0 tot 10), algehele gezondheid en kwaliteit van leven. In de interventiegroep werden na 12 maanden lagere scores gevonden voor intensiteit van de pijn (5,62 ± SD 0,16 versus 6,15 ± SD 0,16; verschil tussen groepen −0,53; 95%-BI −0,92 tot −0,14; p = 0,009), voor belemmering van dagelijkse activiteiten als gevolg van de artritis/artrose (4,40 ± SD 0,18 versus 4,99 ± SD 0,17; verschil tussen groepen −0,59; 95%-BI −1,00 tot −0,19; p = 0,004), en belemmering van dagelijkse activiteiten als gevolg van de pijn (2,92 ± SD 0,07 versus 3,17 ± SD 0,07; verschil tussen groepen −0,26; 95%-BI −0,41 tot 0,10; p = 0,002). Algehele gezondheid en kwaliteit van leven verbeterden ook in de interventiegroep.
Er zijn diverse onderzoeken uitgevoerd met antidepressiva (SSRI’s) die in verschillende patiëntengroepen in wisselende mate reductie van chronische pijn laten zien. In een meta-analyse (319 patiënten met aspecifieke thoracale pijn, 7 RCT’s, mediane follow-up 5 (3 tot 16) weken) werd een sterke associatie gevonden van antidepressieve medicatie met pijnreductie (SMD −1,26; 95%-BI −2,34 tot −0,19) en met psychologische symptomen (SMD −0,87; 95%-BI −1,67 tot −0,08), maar niet met gezondheidgerelateerde kwaliteit van leven (WMD 2,00; 95%-BI −2,54 tot 6,65).
Patiënten met een depressie in de eerste lijn kampen vaak met pijnklachten. Pijnklachten zijn geassocieerd met slechtere depressie-uitkomstmaten, terwijl vermindering van de pijn de uitkomstmaten doet verbeteren. In gerandomiseerd onderzoek (n = 573) werden patiënten behandeld met SSRI’s. Patiënten met en zonder pijn op baseline werden vergeleken. Uitkomstmaten na 6 maanden waren remissie van de depressie, partiële respons en geen respons. Vergeleken met patiënten zonder pijn bereikten patiënten met ernstige pijn minder remissie (OR 0,11; 95%-BI 0,05 tot 0,25) en partiële respons (OR 0,24; 95%-BI 0, 10 tot 0,59) versus geen respons.
De conclusie is dat behandeling van comorbide angst en depressie de pijn reduceert. Omgekeerd leidt behandeling van chronische pijn tot verbetering van depressieve symptomen.
Beweeg- en oefenprogramma’s
Naar Samenvatting ›- Bespreek de mogelijkheid van verwijzing naar een fysio- of oefentherapeut voor beweeg- of oefenprogramma gericht op een actieve leefstijl.
- Verschillende behandelingen kunnen worden toegepast om een actieve leefstijl te realiseren:
- oefentherapie, zoals oefeningen ter bevordering van de spierkracht, coördinatie en aerobe capaciteit
- bewegingstherapie, al dan niet gebaseerd op cognitief gedragsmatige principes (graded activity, graded exercise therapy, functional restoration)
Deze aanbeveling sluit aan op het beleid in de Zorgstandaard Chronische pijn en de NHG-Standaard SOLK.
In een systematisch literatuuronderzoek (35 onderzoeken, n = 2494) is het effect van verschillende vormen van oefentherapie onderzocht bij patiënten met fibromyalgie. Het SMD direct na het einde van de behandeling was voor pijnvermindering −0,31 (95%-BI −0,46 tot −0,17), vermoeidheid −0,22 (95%-BI −0,38 tot −0,05), depressie −0,32 (95%-BI −0,53 tot −0,12), gezondheidsgerelateerde kwaliteit van leven −0,40 (95%-BI −0,60 tot −0,20) en fysieke fitheid 0,65 (95%-BI 0,38 tot 0,95). Pijn was significant minder bij zowel oefentherapie op het droge als met hydrotherapie van lichte tot matige intensiteit en een frequentie van 2 tot 3 keer per week gedurende ten minste 4 weken. De positieve effecten op depressie, kwaliteit van leven en fysieke fitheid bleven gehandhaafd op lange termijn. Het blijven continueren van oefeningen na therapie was geassocieerd met positieve effecten op lange termijn (mediane follow-up 26 weken).
In een Cochrane-review werd geconcludeerd dat matig intensieve aerobe training gedurende 12 weken (20 minuten per dag, 2 tot 3 keer per week) leidt tot een verbetering van algemeen welbevinden en fysiek functioneren (en tot weinig of geen verandering in pijn). Krachttraining (2 tot 3 maal per week, 8 tot 12 herhalingen gedurende 12 weken) resulteerde in vermindering van pijn, tenderpoints en depressie, en verbetering van algemeen welbevinden, maar niet tot verbeteringen in fysiek functioneren. Er wordt gesteld dat oefenprogramma’s, op geleide van de pijn, veilig zijn. Het is niet duidelijk of oefenprogramma’s met een duur van 12 weken leiden tot een verbetering van vermoeidheid, stijfheid en slaapproblemen. Het volhouden van het oefenprogramma is een probleem bij patiënten met fibromyalgie. De onderzoeken waren van matige methodologische kwaliteit. In een andere Cochrane-review (5 onderzoeken) zijn de effecten en bijwerkingen van weerstandstraining onderzocht bij patiënten met fibromyalgie. Er zijn statistisch significante verschillen gevonden in het voordeel van de weerstandstrainingen vergeleken met geen behandeling. De Fibromyalgia Impact Questionnaire (FIQ) nam af met 16,75 punten op een 100-puntenschaal (95%-BI −23,31 tot −10,19), zelfgerapporteerde problemen met fysiek functioneren neemt −6,29 punten af op een 100-puntenschaal (95%-BI −10,45 tot −2,13), pijn neemt af met −3,3 cm op een 10 cm-schaal (95%- BI −6,35 tot −0,26), drukgevoeligheid neemt af met −1,84 van de 18 tenderpoints (95%-BI −2,6 tot −1,08) en spierkracht (beenextensie) neemt toe met 27,32 kg (95%-BI 18,28 tot 36,36). Er werd een statistisch significant verschil gevonden tussen weerstandstraining en aerobe training. Aerobe training leidde tot een grotere vermindering in pijn (0,99 cm op een 10 cm-schaal; 95%-BI 0,31 tot 1,67). Weerstandstraining heeft grotere effecten dan training gericht op verbetering van flexibiliteit. Statistisch significante verschillen zijn gevonden voor de FIQ (-6,49 FIQ-units op een 100-puntenschaal; 95%-BI −12,57 tot −0,41) en pijn (-0,88 cm op een 10 cmschaal; 95%-BI −1,57 tot −0,19), maar niet voor drukgevoeligheid (-0,46 van de 18 tender points; 95%-BI −1,56 tot 0,64) en kracht (4,77 foot pounds torque bij concentrische knie-extensie; 95%-BI −2,40 tot 11,94).
De conclusie is dat oefentherapie mogelijk een gunstig effect kan hebben bij fibromyalgie. Het bewijs is van lage kwaliteit aangezien het gebaseerd is op weinig onderzoeken en methodologisch slechte onderzoeken. Bij persisterende klachten als gevolg van fibromyalgie kan worden overwogen aerobe oefentherapie toe te passen.
Medicamenteuze behandeling
Naar Samenvatting ›- Wees terughoudend met medicamenteuze behandeling bij patiënten met chronische pijn omdat:
- het te verwachten effect beperkt is, want pijnmedicatie heeft geen invloed op sensitisatie
- vooral bij langdurig gebruik het risico op ernstige bijwerkingen door pijnstillers, vooral door NSAID’s en opioïden, toeneemt
- Pas medicamenteuze behandeling toe als onderdeel van een beleid gebaseerd op het biopsychosociale model, waarin dus aandacht is voor zowel lichamelijke als psychische en sociale factoren die van invloed zijn op de pijn. Stem de toepassing van pijnmedicatie dan ook af met eventuele andere betrokken behandelaren.
- De voorkeur gaat uit naar een middel uit een zo laag mogelijke stap uit het medicamenteuze stappenplan voor nociceptieve pijn: bij voorkeur paracetamol (zie Beleid bij acute nociceptieve pijn, Medicamenteus stappenplan).
- Er is in het beleid bij chronische pijn zonder duidelijk persisterende nociceptieve component geen plaats voor opioïden.
- Streef naar zo kort mogelijk, tijdcontingent, gebruik van pijnmedicatie, voor een specifiek behandeldoel. Indien stoppen niet mogelijk blijkt: streef naar intermitterend in plaats van continu gebruik.
- Zie voor middelen, doseringen en aanvullende aanbevelingen over de toepassing de toelichting per behandelstap in het stappenplan acute nociceptieve pijn (zie Beleid bij acute nociceptieve pijn, Medicamenteus stappenplan).
Uitgangsvraag
Zijn opioïden aan te bevelen bij chronische, niet aan kanker gerelateerde pijn?
Uitkomstmaten
- Pijn:
- VAS-score van 10 cm
- bereiken van een pijnvermindering van minimaal 1 cm op een VAS-score van 10 cm
- Fysiek functioneren:
- fysieke component van SF-36, schaal 0-100
- bereiken van een toename van minimaal 5 punten op de fysieke component van de SF-36
- Gastro-intestinale bijwerkingen
- Afhankelijkheid van opioïden
- Overdosis:
- fataal
- niet-fataal
Voor het beantwoorden van de uitgangsvraag is gebruikgemaakt van een systematische review die is uitgevoerd ter onderbouwing van de richtlijn The 2017 Canadian Guideline for Opioids for Chronic Non-Cancer Pain (versie 4.10, gepubliceerd op 29 oktober 2018) (https://app.magicapp.org/app#/guideline/2849).
Resultaten
Beschrijving onderzoeken
Er werden 49 onderzoeken geïncludeerd waarin patiënten met chronische, niet aan kanker gerelateerde pijn werden gerandomiseerd naar een opioïd of een controlegroep, waarbij de follow-up minimaal vier weken bedroeg. Alle soorten opioïden en alle soorten controles werden meegenomen.
Kwaliteit van bewijs
De kwaliteit van het bewijs was laag tot matig, voornamelijk vanwege indirect bewijs. Daarnaast was er in veel gevallen sprake van heterogeniteit, onnauwkeurigheid of risico op publicatiebias.
Effectiviteit
Pijn
VAS-score van 10 cm: behandeling met opioïden resulteerde in een afname van de VAS-score van 0,64 cm (95%-BI −0,76 tot −0,53 cm) vergeleken met controlebehandeling, gebaseerd op 27 RCT’s met 13.876 patiënten en een follow-upduur van 3 tot 6 maanden.
Bereiken van een pijnvermindering van minimaal 1 cm op een VAS-score van 10 cm: behandeling met opioïden leidde tot een toename van patiënten die een vermindering van de VAS-pijnscore met minimaal 1 cm bereikte. Per 1000 met opioïden behandelde patiënten haalden 560 patiënten dit eindpunt, vergeleken met 448 patiënten in de controlegroep (verschil 112 patiënten, 95%-BI 94 tot 130; RR 1,25; 95%-BI 1,21 tot 1,29), gebaseerd op 27 RCT’s met 13.876 patiënten en een follow-upduur van 3 tot 6 maanden.
Fysiek functioneren
Fysieke component van SF-36, schaal 0-100: behandeling met opioïden resulteerde in een gemiddelde toename van de SF-36-score van 2,16 punten (95%-BI 1,56 tot 2,76 punten) vergeleken met controlebehandeling, gebaseerd op 33 RCT’s met 12.058 patiënten en een follow-upduur van 1 tot 6 maanden.
Bereiken van een toename van minimaal 5 punten op de fysieke component van de SF-36: behandeling met opioïden leidde tot een toename van patiënten die een toename van de fysieke component van de SF-36-score met minimaal 5 punten bereikten. Per 1000 met opioïden behandelde patiënten haalden 526 patiënten dit eindpunt, vergeleken met 424 patiënten in de controlegroep (verschil 102 patiënten, 95%-BI 72 tot 127; RR 1,24, 95%-BI 1,17 tot 1,3), gebaseerd op 33 RCT’s met 12.058 patiënten en een follow-upduur van 1 tot 6 maanden.
Bijwerkingen
Gastro-intestinale bijwerkingen
Behandeling met opioïden leidde tot een toename van patiënten die een gastro-intestinale bijwerking ervaren. Per 1000 met opioïden behandelde patiënten kregen 86 patiënten een gastro-intestinale bijwerking, vergeleken met 28 patiënten in de controlegroep (verschil 58 patiënten; 95%-BI 53 tot 77; RR 3,08; 95%-BI 2,53 tot 3,75), gebaseerd op 36 RCT’s met 14.449 patiënten en een follow-upduur van 4 tot 26 weken.
Verslaving aan opioïden
Het risico op verslaving aan opioïden was 5,5% (95%-BI 3,9 tot 7,0%), gebaseerd op 9 observationele onderzoeken met 22.278 patiënten en een onbekende follow-upduur.
Overdosering
- Fataal: het risico op een fatale overdosis was 0,1% onder patiënten die < 20 mg morfine-equivalent per dag kregen, 0,14% onder patiënten die 20-49 mg morfine-equivalent per dag kregen, 0,18% onder patiënten die 50-99 mg morfine-equivalent per dag kregen en 0,23% onder patiënten die ≥ 100 mg morfine-equivalent per dag kregen, gebaseerd op 1 cohortonderzoek met 285.520 deelnemers en een mediane follow-upduur van 2,6 jaar.
- Niet-fataal: het risico op een niet-fatale overdosis was 0,2% onder 9940 patiënten in 1 cohortonderzoek met een follow-upduur van 1 maand tot 10 jaar.
Conclusie
Behandeling met opioïden resulteert mogelijk in een kleine verbetering in pijn en functie bij patiënten met chronische, niet aan kanker gerelateerde pijn. Opioïden resulteren in een klinisch relevante verhoging van de kans op (onder andere gastro-intestinale) bijwerkingen. Daarnaast kunnen opioïden tot afhankelijkheid leiden en tot een zeldzaam maar belangrijk risico op een (al dan niet fatale) overdosering.
Van bewijs naar aanbeveling
De kwaliteit van het bewijs was matig tot laag en de gevonden effecten zijn klein. Toch kunnen de verschillen in pijn en functie belangrijk genoeg zijn voor patiënten om een proefbehandeling met opioïden te starten.
Meerdere onderzoeken wijzen erop dat het belangrijk is om opioïden bij niet aan kanker gerelateerde pijn zorgvuldig voor te schrijven om zo overmatig gebruik en nadelige effecten te voorkomen. De aanbevelingen over opioïden bij chronische, niet aan kanker gerelateerde pijn sluiten aan bij The 2017 Canadian Guideline for opioids for chronic non-cancer pain.
Bij gebruik van opioïden kan tolerantie optreden: een steeds hogere dosis is nodig om hetzelfde effect te bereiken. Er is sprake van lichamelijke afhankelijkheid als bij staken of sterke dosisverlaging onthoudingsverschijnselen optreden, zoals geeuwen, zweten, subjectief gevoel van afkoeling, onrust en angst, braken en diarree, tremoren en spierkrampen. Deze effecten kunnen ook optreden als een (langdurig gebruikt) opioïd door een partiële opioïdreceptorantagonist wordt vervangen. De snelheid waarmee onthoudingsverschijnselen optreden, hangt samen met de halfwaardetijd van het gebruikte opioïd. Een geleidelijke afbouw van de dosering voorkomt ernstige onthoudingsverschijnselen. Psychische afhankelijkheid speelt bij de toepassing van opioïden voor pijnbestrijding in de terminale fase geen rol. Voorzichtigheid (aanpassing van de dosis) is geboden bij ernstige lever- of nierfunctiestoornissen, bij patiënten met een geringe respiratoire reserve en bij ouderen. Bij ouderen dient men rekening te houden met een grotere gevoeligheid voor de bijwerkingen: gebruik van een lagere (halve) startdosis wordt aanbevolen.
Deze detail is gebaseerd op de richtlijn The 2017 Canadian Guideline for Opioids for Chronic Non-Cancer Pain (versie 4.10, gepubliceerd op 29 oktober 2018) (https://app.magicapp.org/app#/guideline/2849).
Dosis-responsrelatie; effectiviteit en bijwerkingen
Meta-regressie-analyses gebaseerd op 6 RCT’s (n = 3519) vonden geen aanwijzingen voor een verschil in pijn, fysiek functioneren of gastro-intestinale bijwerkingen als de dosering opioïden beperkt werd tot een maximale dosering (kwaliteit van bewijs: redelijk). Daarentegen waren er uit observationele onderzoeken wel aanwijzingen voor een dosis-responsrelatie voor de uitkomsten fatale en niet-fatale overdosis (zie Stap 4: sterkwerkend opioïd). Deze ernstige uitkomsten zijn zeer zeldzaam bij een dosering van < 50 mg morfine-equivalent per dag, maar nemen toe als de dosering toeneemt tot 50-90 mg morfine-equivalent per dag. Hoewel nog steeds zeldzaam nemen deze uitkomsten verder toe als de dosering > 90 mg morfine-equivalent per dag is. Het risico op verslaving leek niet af te hangen van de dosering van de opioïden.
Voorlichting en advies over pijnmedicatie
Naar Samenvatting ›- Bespreek met patiënten die al pijnmedicatie gebruiken en patiënten die pijnmedicatie wensen de verwachtingen die de patiënt heeft van pijnmedicatie en stel deze zo nodig bij: het effect van pijnmedicatie bij chronische pijn door sensitisatie is niet bewezen. Er kunnen wel (ernstige) bijwerkingen optreden, vooral bij langdurig gebruik van NSAID’s en opioïden.
- Patiënten die starten met pijnmedicatie:
- bespreek de keuze van het middel en geef daarop gerichte voorlichting en uitleg
- spreek een concrete, zo kort mogelijke, behandeltermijn af die aansluit bij het behandeldoel (bijvoorbeeld 2-4 weken; in het uitzonderlijke geval dat de patiënt opioïden gebruikt: 1-2 weken)
- bespreek dat de patiënt na afloop van deze termijn zal stoppen met de pijnstiller. Overweeg eventueel intermitterend gebruik als volledig stoppen niet haalbaar blijkt
- Patiënten die al pijnmedicatie gebruiken:
- bij afwezigheid van een duidelijk persisterende oorzaak: adviseer te stoppen met het gebruik (bij opioïden geldt dat de dosering eerst afgebouwd dient te worden, zie Stap 4: sterkwerkend opioïd en Beleid bij afbouwen na langdurig gebruik opioïden)
- bij een duidelijk persisterende oorzaak: bespreek eventuele mogelijkheden om over te stappen naar een middel met minder bijwerkingen, en/of het gebruik te beperken tot intermitterend gebruik
Gebruik van vrij verkrijgbare NSAID’s
Naar Samenvatting ›Waarschuw patiënten met (relatieve) contra-indicaties voor NSAID’s die vrij verkrijgbare pijnstillers van het NSAID-type gebruiken voor de gevaren hiervan (zie Beleid bij acute nociceptieve pijn, Voorlichting en advies).
Cannabis
Naar Samenvatting ›- We bevelen in de huisartsenpraktijk het gebruik van cannabis op recept bij patiënten met chronische pijn buiten de palliatieve fase niet aan.
- We raden het gebruik van cannabisproducten via de drogist, reformzaak of coffeeshop af.
Uit onderzoek is niet aangetoond dat medicinale cannabis werkzaam is, terwijl er wel bijwerkingen en interacties kunnen optreden. Daarnaast is het gebruik van cannabis duur en zijn er diverse andere bezwaren die de aanvaardbaarheid van cannabis in de weg staan, zoals het feit dat cannabis de rijvaardigheid beïnvloedt, op de Dopinglijst staat en onder de Opiumwet valt. Dit heeft geleid tot een sterke aanbeveling tegen het gebruik van medicinale cannabis bij patiënten met chronische pijn.
Gewenste en ongewenste effecten
Mogelijk zijn er niet of nauwelijks voordelen (zoals vermindering van pijn of verbetering van fysiek functioneren) door het gebruik van cannabis. Wel leidt cannabis tot een grotere kans op niet-ernstige bijwerkingen: met name duizeligheid, maar ook misselijkheid en sufheid. Er is echter te weinig onderzoek beschikbaar om na te gaan of dit ook tot uiting komt in een grotere uitval door bijwerkingen in de interventiearmen. Over het optreden van afhankelijkheid en ernstige bijwerkingen zijn we onzeker: deze lijken niet vaak voor te komen, maar de onderzoeken zijn niet geschikt voor het bepalen van deze uitkomstmaten. Er is geen onderzoek beschikbaar over het verminderen van opioïdgebruik door cannabis bij patiënten met chronische pijn die niet door kanker is veroorzaakt.
Kwaliteit van bewijs
De kwaliteit van bewijs varieerde van laag tot zeer laag. In alle gevallen hebben we afgewaardeerd voor indirect bewijs, omdat het merendeel van de onderzochte preparaten niet vergelijkbaar is met de in Nederland op recept verkrijgbare preparaten. Ook hebben we afgewaardeerd voor inconsistentie (bij heterogene resultaten) of onnauwkeurigheid (bij kleine aantallen of overschrijden van de marge van een klinisch relevant verschil). Daarnaast zijn de meeste onderzoeken gesponsord door de industrie. Hiervoor is alleen afgewaardeerd als de resultaten op een voordelig effect voor cannabis wezen. Omdat er sensitiviteitsanalyses zijn gedaan zonder onderzoeken van lagere methodologische kwaliteit en deze analyses niet tot andere resultaten leidden, hebben we niet afgewaardeerd voor kans op vertekening (risk of bias) bij de meeste uitkomstmaten.
Waarden en voorkeuren van patiënten
Een deel van de patiënten zal niet voor de interventie kiezen omdat de effectiviteit onzeker is, terwijl er wel bijwerkingen kunnen optreden. Er zullen echter ook patiënten zijn die cannabis willen proberen, ondanks het onzekere effect en de mogelijke bijwerkingen.
Kosten
De kosten van een eventuele behandeling komen voor rekening van de patiënt. Een flesje cannabisolie van 10 ml is verkrijgbaar vanaf ongeveer € 50; de prijs loopt op bij een hogere concentratie van THC en/of CBD tot maximaal ongeveer € 200 (transvaalapotheek.nl en cannabiszorg.nl, geraadpleegd mei 2023). Het varieert hoe lang patiënten met een flesje kunnen doen; gemiddeld is dit ongeveer 1 maand.
Cannabis is ook als flos verkrijgbaar en wordt dan geleverd als hele bloemen of als granulaat. De kosten bedragen dan ongeveer € 32,50 per 5 gram (cannabiszorg.nl, geraadpleegd mei 2023).
Aanvaardbaarheid
- Er is variatie in de acceptatie van het gebruik van cannabis op recept door (de omgeving van) de patiënt. Medicinale cannabis is voor veel mensen een taboe, omdat cannabis als een drug wordt gezien.
- Er gelden diverse contra-indicaties en interacties:
- absolute contra-indicaties: psychosen, brugada-syndroom, zwangerschap, zwangerschapswens of lactatie en glaucoom (geldt alleen voor CBD)
- relatieve contra-indicaties: verslavingsgevoeligheid, verlengd QT-interval, coronairlijden, (verhoogd risico op) psychische aandoeningen (depressie, angststoornissen) en leeftijd ≤ 24 jaar
- combinatie van cannabis met andere centraal werkende of dempende stoffen zoals alcohol, benzodiazepines en opioïden versterkt het versuffende effect. Bij combinatie met pijnstillers zijn er aanwijzingen uit de praktijk dat de benodigde dosis van de pijnstiller lager kan zijn
- Cannabis beïnvloedt de rijvaardigheid en is strafbaar in het verkeer (zie rijveiligmetmedicijnen.nl en rijksoverheid.nl).
- Medicinale cannabis valt onder de Opiumwet. Het bezitten en gebruiken van medicinale cannabisolie is in veel landen verboden. Voor reizen naar het buitenland is een officiële verklaring nodig, zie voor meer informatie de website van het CAK (hetcak.nl).
- Cannabis staat op de Dopinglijst (zie dopingautoriteit.nl).
Haalbaarheid
Medicinale cannabis is in Nederland goed verkrijgbaar. Het kost enige moeite om dit aan te vragen (vanwege het invullen van formulieren).
Uitgangsvraag
Is cannabis op recept aan te bevelen aan patiënten met chronische niet-neuropathische pijn? Zie de PICO-tabel.
| Patiënten | Volwassenen met chronische pijn (van niet-neuropathische oorsprong) |
|---|---|
| Interventie | Cannabis, in Nederland op recept verkrijgbaar |
| Vergelijking | Placebo of gebruikelijke behandeling |
| Uitkomstmaten | Cruciaal
|
Voor de continue uitkomstmaten beschouwen we een verschil van 10% op de gebruikte schaal als klein, maar klinisch relevant. Dit houdt bijvoorbeeld in: 1 cm op een VAS van 10 cm of 10 punten op een numerieke schaal van 0-100 punten. Voor dichotome uitkomstmaten houden we de standaard afkapwaarden van GRADE aan: RR < 0,8 of > 1,25.
Achtergrond
Cannabis bevat verschillende werkzame stoffen, waaronder tetrahydrocannabinol (THC) en cannabidiol (CBD). THC en CBD stimuleren de cannabinoïdreceptoren die een rol spelen bij pijnmodulatie, motoriek, misselijkheid en braken. THC is daarnaast psychoactief en kan een high gevoel, duizeligheid en verwardheid veroorzaken. Er zijn aanwijzingen dat de samenstelling en verhouding van werkzame stoffen bepalend zijn voor de werkzaamheid en veiligheid.
Onder patiënten neemt de kennis over het bestaan van cannabis op recept en de mogelijkheden daarvan toe. Dit geldt onder andere voor patiënten die chronische pijn hebben en bij wie gangbare therapieën tekortschieten. Huisartsen worden in toenemende mate geconfronteerd met vragen over de mogelijkheden en effectiviteit van cannabis op recept. In dit detail onderzoeken we of cannabis aan te bevelen is bij patiënten met chronische pijn van niet-neuropathische oorsprong.
Methoden
Er is een systematische literatuurzoekactie naar SR’s en RCT’s uitgevoerd in PubMed en Embase in juni 2022, met een update in december 2022.
Omdat de gevonden systematische reviews geen onderscheid maken tussen neuropathische en niet-neuropathische pijn, hebben we de gegevens over patiënten met niet-neuropathische pijn zelf opnieuw gepoold in Review Manager 5.4.1. Daarbij maakten we gebruik van de gegevens van de afzonderlijke RCT’s zoals ze in de SR’s werden gerapporteerd. Waar mogelijk hebben we daarbij een subgroepanalyse gedaan naar THC en CBD-gehalte: preparaten met een hoog THC-gehalte (verhouding THC : CBD ≥ 2 : 1), preparaten met een hoog CBD-gehalte (verhouding CBD : THC ≥ 2 : 1) en preparaten met vergelijkbare gehaltes van beide (minder dan een factor 2 verschil). Voor dit detail is gebruikgemaakt van de resultaten bij patiënten met chronische pijn van niet-neuropathische oorsprong.
Resultaten
Resultaat zoekactie
De zoekactie leverde een Rapid Recommendations-richtlijn op over cannabis bij chronische pijn en 3 systematische reviews (SR’s) naar de effecten en bijwerkingen van chronische pijn, die in het kader van deze richtlijn werden opgesteld. Daarnaast werden nog 2 recente SR’s naar de effecten en bijwerkingen van cannabis bij (chronische) pijn gevonden. Een aanvullende search na de zoekdatum van dit literatuuronderzoek leverde geen aanvullende RCT’s op. Ook bij de update werden geen nieuwe RCT’s gevonden.
Onderzoekskarakteristieken
- Busse 2021: Rapid Recommendations-richtlijn over cannabis bij chronische pijn. In het kader van deze richtlijn zijn diverse SR’s opgesteld, waarvan we Wang 2021, Noori 2021 en Zeraatkar 2022 gebruikten.
- Wang 2021: SR naar de effecten en bijwerkingen van cannabis en cannabinoïden voor chronische pijn. De SR includeerde 32 RCT’s (n = 5174), waarvan er 29 medicinale cannabis of cannabinoïden vergeleken met placebo. 28 RCT’s gingen over chronische pijn die niet aan kanker was gerelateerd (11 over neuropathische pijn, 7 over pijn gerelateerd aan spasticiteit, 5 over nociplastische pijn, 2 over nociceptieve pijn, 1 over medicatieovergebruikshoofdpijn en 2 over gemengde chronische pijn) en 4 over pijn bij kanker; deze laatste 4 zijn buiten beschouwing gelaten. In 30 RCT’s werd de cannabis oraal ingenomen. De gemiddelde pijnscore bij aanvang was 6,1 cm op een VAS van 10 cm (IQR 5,7-6,7), de gemiddelde leeftijd van de deelnemers was 53 jaar (IQR 50-60 jaar) en 55% was vrouw (IQR 39-70%). De follow-up varieerde tussen 1 en 5,5 maanden.
- Noori 2021: SR naar het opioïdsparende effect van cannabis bij chronische pijn. De SR includeerde 5 RCT’s (n = 1540), die allemaal over pijn bij kanker gingen, en 13 observationele onderzoeken (n = 1578). Het mediane percentage vrouwen was 48% (IQR 43-58%), de mediane leeftijd 56 jaar (IQR 51-60 jaar). De follow-up van de RCT’s varieerde van 2 tot 5 weken en van de observationele onderzoeken van 4 weken tot 6,4 jaar. Alle RCT’s instrueerden de patiënten om hun opioïdgebruik constant te houden, wat erin resulteerde dat we geen uitspraak kunnen doen over het opioïdsparende effect van cannabis.
- Zeraatkar 2022: SR naar langetermijnbijwerkingen en ernstige nadelige effecten, waaronder verslaving, van cannabis bij chronische pijn. De SR includeerde 39 observationele onderzoeken (n = 12.143), waarvan 30 longitudinaal. De mediane follow-up was 24 weken (IQR 12-34 weken). In slechts 1 onderzoek werd cannabis vergeleken met standaardzorg en in 1 onderzoek met gabapentine; in de andere onderzoeken was er geen controlegroep.
- Fisher 2021: SR naar de effecten en bijwerkingen van cannabis bij pijn. De SR includeerde 36 RCT’s (n = 7217), waarvan 13 over neuropathische pijn, 6 over kanker, 4 over acute pijn na chirurgie, 10 over MS, 1 over chronische prostatitis/bekkenpijn, 1 over carpaletunnelsyndroom en 1 over rugpijn. 54% was vrouw en de gemiddelde leeftijd was 51 jaar (SD 11 jaar).
- McDonagh 2022: SR naar de effecten en bijwerkingen van op cannabis gebaseerde producten voor chronische pijn. De SR includeerde 18 placebogecontroleerde RCT’s (n = 1740) met een duur van 1-6 maanden. Daarbij waren 8 RCT’s (gemiddelde leeftijd 51 jaar) die producten onderzochten met voornamelijk THC, waarvan 6 synthetisch THC en de andere 2 plantenextracten met hoog THC-gehalte. Daarnaast waren er 7 RCT’s (gemiddelde leeftijd 53 jaar) die producten onderzochten met zowel THC als CBD (in de meeste gevallen nabiximols als oromucosale spray) en 2 RCT’s (gemiddelde leeftijd 65 jaar) die een product onderzochten met voornamelijk CBD (1 × dermale olie, 1 × orale capsule). Er was 1 RCT die cannabidivarine onderzocht; deze is buiten beschouwing gelaten. Van de in de SR geïncludeerde patiënten had 56% neuropathische pijn.
Effectiviteit en bijwerkingen
Zie tabel Cannabis vergeleken met placebo voor de samenvatting van de resultaten.
Conclusie
- Mogelijk is er niet of nauwelijks verschil in pijnreductie en fysiek functioneren tussen cannabis en placebo (kwaliteit van bewijs laag).
- We zijn onzeker over het optreden van afhankelijkheid door cannabis (kwaliteit van bewijs zeer laag).
- We zijn onzeker over een verschil in optreden van ernstige bijwerkingen tussen cannabis en placebo (kwaliteit van bewijs zeer laag).
- Waarschijnlijk verhoogt cannabis het risico op niet-ernstige bijwerkingen (uitval uit onderzoek door bijwerkingen; sufheid, duizeligheid en misselijkheid) vergeleken met placebo (kwaliteit van bewijs redelijk).
- Er is geen onderzoek beschikbaar over het verminderen van opioïdgebruik door cannabis bij patiënten met chronische pijn.
In Nederland zijn ook verschillende niet-medicinale cannabispreparaten verkrijgbaar, als zelfzorg of via de coffeeshop.
Cannabis als zelfzorg
Vrij verkrijgbare CBD (cannabidiol) of cannabisolie (CBD of wietolie) die via drogist en reformzaak verstrekt wordt, mag alleen CBD en geen THC bevatten. Deze middelen vallen niet onder de geneesmiddelenwet, maar onder de warenwet. De samenstelling en kwaliteit zijn daarom aanzienlijk minder gegarandeerd dan bij de cannabis op recept. Het aantal vergiftigingen met vrij verkrijgbare cannabisolie neemt de afgelopen jaren toe. Via cannabiszorg.nl is CBD-olie met gegarandeerde samenstelling (2%, 5% of 10%) verkrijgbaar.
Cannabis uit de coffeeshop
Cannabis kan ook gekocht worden bij de coffeeshop. De samenstelling en kwaliteit kunnen erg variëren. Verontreiniging met pesticiden, zware metalen, micro-organismen (onder andere schimmels) en haren is beschreven.
Waarom deze aanbeveling?
We raden het gebruik van cannabis uit de coffeeshop of CBD-olie van bijvoorbeeld drogist of reformzaak af omdat de samenstelling en kwaliteit niet gegarandeerd zijn.
Specifieke aandoeningen
Naar Samenvatting ›Het medicamenteuze beleid bij specifieke aandoeningen kan afwijken en valt buiten de scope van deze standaard.
Controles
Naar Samenvatting ›- Spreek met de patiënt een reële termijn af om het effect van het beleid te evalueren, bijvoorbeeld elke 2 tot 4 weken.
- Focus niet zozeer op de ernst van de pijn, maar stel open vragen zoals: ‘hoe gaat het met je?’ en ‘welke beperkingen ervaar je door de pijn?’. Focus op het behalen van eventuele doelen uit het behandelplan.
- Bij het niet of deels behalen van doelen:
- evalueer met hulp van de eerder gebleken relevante delen van de klachtexploratie
- stel gezamenlijk met de patiënt het behandelplan en -doelen bij
- overweeg afhankelijk van de situatie alsnog verwijzing naar fysio- of oefentherapeut, psycholoog of POH-ggz
- Bij het herhaaldelijk niet behalen van doelen: overweeg verwijzing naar een multidisciplinair pijnbehandelcentrum.
Aanpak controles bij gebruik pijnmedicatie
Naar Samenvatting ›- Bij aanhoudende klachten ondanks gebruik van pijnmedicatie:
- leg uit dat continueren of ophogen van de medicatie niet zinvol is en adviseer de patiënt te stoppen met de medicatie, zoals afgesproken bij de start
- overweeg alleen bij een duidelijke persisterende nociceptieve component van de pijn de dosering te verhogen of over te stappen op het middel uit de volgende stap van het medicamenteus stappenplan
- Bij goed effect:
- stop de medicatie na de met de patiënt afgesproken termijn (in het uitzonderingsgeval dat de patiënt een opioïd gebruikt, geldt het advies om de dosering af te bouwen, zie toelichting in Stap 4: sterkwerkend opioïd)
- maak zo nodig afspraken met de patiënt over intermitterend gebruik bij een tijdelijke toename van de klachten (ten aanzien van middel, dosering en frequentie en duur van het gebruik)
- Benadruk het belang van een niet-medicamenteuze behandeling bij chronische pijn.
- Zie voor specifieke aandachtspunten voor controles bij medicatiegebruik de toelichting per stap in het stappenplan medicamenteuze behandeling.
Consultatie en verwijzing
Naar Samenvatting ›Monodisciplinair werkende medisch specialisten
Naar Samenvatting ›Overweeg verwijzing naar een monodisciplinair werkend medisch specialist, zoals een neuroloog of orthopeed, bij onduidelijkheid over de diagnose of bij onvoldoende respons op de ingestelde behandeling. Voorwaarde hiervoor is dat de vraagstelling aan de medisch specialist afgebakend is en met de patiënt afgestemd is.
Fysiotherapeut/oefentherapeut
Naar Samenvatting ›Overweeg verwijzing naar een fysiotherapeut of oefentherapeut voor een beweeg- of oefenprogramma gericht op een actieve leefstijl.
Maatschappelijk werk
Naar Samenvatting ›Overweeg verwijzing bij patiënten bij wie chronische stress door maatschappelijke of psychosociale problemen een belangrijke rol speelt bij de pijn.
Psycholoog
Naar Samenvatting ›Overweeg verwijzing voor CGT of ACT bij patiënten met niet-helpende opvattingen, emoties en gedragingen rondom de pijn.
Bedrijfsarts
Naar Samenvatting ›Overweeg consultatie of verwijzing bedrijfsarts bij werkgerelateerde problematiek of voor overleg over mogelijkheden voor aanpassingen van werkzaamheden of werktijden.
In overleg met de bedrijfsarts kan de huisarts adviseren over aanpassing van de belasting in het werk en het elimineren van oorzakelijke en onderhoudende factoren in het werk. Dit alles hoort aandacht te krijgen in het behandelplan gericht op het voorkomen van chronisch worden van de pijnklachten dan wel het behandelen van al chronisch geworden klachten. Als de huisarts zichzelf onvoldoende bekwaam voelt om dit zelf te doen (of niet de tijd daarvoor heeft) zal hij actief de bedrijfsarts, als die beschikbaar is, moeten inschakelen. Afstemming van beleid tussen huisarts en bedrijfsarts is essentieel om te voorkomen dat de patiënt met verschillen in beleid wordt geconfronteerd. Met name bij de patiënt met chronische pijn is verschil van inzicht, beleid en advies tussen diverse hulpverleners onwenselijk.
Specialist ouderengeneeskunde of klinisch geriater
Naar Samenvatting ›Overweeg consultatie of verwijzing bij kwetsbare ouderen met multimorbiditeit met onvoldoende resultaat van pijnbehandeling.
Pijnbehandelcentrum
Naar Samenvatting ›Overweeg consultatie of verwijzing naar een pijnbehandelcentrum van patiënten met chronische pijn bij:
- specifieke pijn (doel: onderzoeken mogelijkheid voor pijnbehandeling door interventie)
- onvoldoende effect van behandeling binnen de eerste lijn
- complexe psychosociale problematiek
Bij voorkeur wordt behandeling uitgevoerd door een multidisciplinair pijncentrum waarbinnen gespecialiseerde artsen samenwerken met behandelaren uit andere disciplines, zoals fysio- of oefentherapeuten, psychologen en verpleegkundig specialisten. Behandeling bij het pijnbehandelcentrum kan ook monodisciplinair zijn als het verkleinen van de invloed van lichamelijke, psychische en sociale factoren op de pijn gewaarborgd wordt door transmurale samenwerking met andere disciplines binnen de eerste lijn, zoals psycholoog en/of fysiotherapeut.
Vrijwel elk ziekenhuis beschikt over een polikliniek pijnbehandeling waar de anesthesioloog-pijnspecialist de spil en coördinator van is. Daarbij is er een multidisciplinaire samenwerking in het pijnbehandelcentrum met onder andere neurologen, neurochirurgen, orthopeden, psychiaters, psychologen, fysiotherapeuten, revalidatieartsen en verpleegkundig specialisten. Verwijzing naar een pijnbehandelcentrum maakt grondige evaluatie, behandeling en begeleiding van patiënten met chronische pijn vanuit een biopsychologisch model mogelijk. Idealiter maakt een pijnbehandelcentrum deel uit van een integraal transmuraal zorgpad waarbij de behandeling van de patiënt met chronische pijn zoveel mogelijk in de eerste lijn plaatsvindt.
In het algemeen geldt dat de eerste behandeling van een pijnprobleem conservatief is met behulp van analgetica (uit stap 1 en 2) en/of enige vorm van fysiotherapie. Het gebruik van sterke opioïden dient te worden beperkt tot kortere episodes in het geval van niet-oncologische pijn. Indien onacceptabele pijnklachten persisteren is in overleg met de patiënt een verwijzing naar een pijnbehandelcentrum op zijn plaats. Vaak is een revalidatiearts lid van het multidisciplinair behandelteam op een anesthesiologisch pijncentrum. Zo nodig kan via deze weg een pijnrevalidatieprogramma worden ingezet.
Na verwijzing naar een pijnbehandelcentrum wordt doorgaans voor het eerste consult met behulp van vragenlijsten aanvullende informatie verzameld over de huidige status, voorgeschiedenis, medicatiegebruik en eventuele multifactoriële achtergronden. Een psychologische screening kan hiervan onderdeel uitmaken.
Bij een intake ziet de anesthesioloog-pijnspecialist de patiënt doorgaans als eerste. De anesthesioloog-pijnspecialist zal deze door middel van anamnese, lichamelijk onderzoek en zo nodig aanvullend onderzoek een specifieke diagnose proberen te stellen en een behandelplan opstellen.
Screening pijnmanagement in pijnbehandelcentrum
Inclusiecriteria:
- revalidanten met langdurige pijnklachten (> 6 maanden), bij wie de pijn het bewegen bemoeilijkt en leidt tot functionele beperkingen;
- leeftijd > 18 jaar en < 65 jaar;
- de medische diagnostiek is afgerond (medisch uitbehandeld);
- de pijn heeft geleid tot een verslechtering van het sociaal en/of maatschappelijk functioneren;
- de revalidant is niet gericht op verdere diagnostiek en wil zijn medische afhankelijkheid verminderen;
- de revalidant kan zich vinden in de revalidatiedoelstelling: ondanks de pijn beter leren functioneren en, indien mogelijk, werken aan herstel van het functioneren;
- de revalidant is voldoende mentaal en fysiek belastbaar om het programma aan te kunnen;
- de revalidant staat open voor een cognitief gedragsmatige aanpak van chronische pijn;
- vanwege de pijn is er aantoonbaar verlies van de conditie en van bewegingsactiviteit.
Exclusiecriteria:
- de patiënt is niet in staat instructies te begrijpen en uit te voeren;
- onvoldoende beheersing van de Nederlandse taal;
- niet in een groep kunnen functioneren vanwege onvoldoende zelftrainbaarheid tijdens groepstraining;
- bekende beperkingen in de cardiopulmonale belastbaarheid van de patiënt;
- overheersende psychopathologie (waaronder conversies en psychosen);
- ernstige psychosociale problematiek met een acuut karakter (bijvoorbeeld overlijden van een naaste, echtscheiding);
- sterke verwikkeling in een beroepskwestie rondom WIA of letselschade die een te groot beslag legt op het functioneren van de revalidant;
- pijn als gevolg van maligniteit.
Behandelmogelijkheden in een pijnbehandelcentrum kunnen bestaan uit:
- conservatieve therapie: medicatie, fysiotherapie, TENS;
- interventionele pijnbehandeling: onder meer diverse gerichte infiltraties met corticosteroïden, radiofrequente zenuwdenervaties, diverse zenuwblokkades/modulering;
- speciale technieken: onder andere neuromodulatietechnieken en epiduroscopie;
- destructie van zenuwen met neurolytische vloeistoffen (alcohol, fenol; vooral bij oncologische pijn);
- cognitieve en gedragsmatige aanpak met als hoofddoelstelling het verbeteren van de kwaliteit van leven en het wegnemen van factoren die het herstel belemmeren. Hieronder valt ook pijneducatie;
- fysiek-gedragsmatige aanpak in samenspraak met de fysiotherapeut.
Vaak zal er sprake zijn van een combinatie van behandelingen.
Pijnrevalidatieteam
Naar Samenvatting ›Overweeg verwijzing naar een revalidatiearts/pijnrevalidatieteam bij onvoldoende effect van een multidisciplinaire behandeling in de eerste lijn, en hoge mate van beperkingen in het dagelijks leven door pijn en voor het verbeteren van het functioneren met pijn en werken aan herstel.
Patiënten kunnen een poliklinisch revalidatieprogramma volgen. In enkele situaties is een klinische opname nodig om een optimaal behandelresultaat te bereiken. Leden van een pijnrevalidatieteam werken in een multidisciplinair teamverband. Het team zorgt voor afstemming tussen de verschillende behandelingen van een patiënt en bewaakt de resultaten. De revalidatiearts is eindverantwoordelijk in het pijnrevalidatieteam. In een pijnrevalidatieteam zijn in ieder geval de volgende disciplines vertegenwoordigd: revalidatiegeneeskunde, ergotherapie, fysiotherapie, psychologie, maatschappelijk werk, verpleegkunde (bij klinische opname).
Doelen van pijnrevalidatie
- Leren dagelijkse activiteiten goed en effectief uit te voeren, ondanks de pijn. Patiënten leren een evenwicht te hanteren en vanuit dat evenwicht activiteiten op te bouwen.
- Het veranderen van het denken over pijn en het voelen van pijn.
- Leren activiteiten anders te doen, leren accepteren wat wel en wat niet kan, leren activiteiten slimmer te plannen.
- Verminderen van stoornissen in lichamelijke functies bij patiënten, bijvoorbeeld door verbetering van spierkracht, bewegingsmogelijkheden en uithoudingsvermogen.
Indicaties voor pijnrevalidatie
Pijnrevalidatie is geschikt voor mensen met verschillende soorten pijnklachten waarbij een discrepantie is tussen objectiveerbare somatiek en niveau van functioneren, zoals lagerugpijnklachten, fibromyalgie, complex regionaal pijnsyndroom type 1 (CRPS 1), whiplashsyndroom, klachten van arm, nek en schouder (KANS), mensen met pijn, zich uitend elders in het houdings- of bewegingsapparaat.
Samenwerking
Naar Samenvatting ›- Stem bij verwijzing het behandelplan en -doelen af met behandelaars uit verschillende disciplines uit de eerste en tweede lijn.
- Streef naar samenwerking in een multidisciplinaire vorm in de regio. Een dergelijk team werkt in de regel onder leiding van een coördinator en omvat (para)medische en psychologische disciplines uit de eerste en tweede lijn (zoals de pijnspecialist, revalidatiearts, neuroloog, fysiotherapeut, psycholoog, verpleegkundig specialist).
- Bij patiënten met kanker of andere levensbedreigende ziekten is samenwerking met de behandelend specialist, ook in de terminale fase, belangrijk voor een optimale pijnbehandeling. De kwaliteit van leven en sterven bepaalt samen met de wens van de patiënt het beleid.
In de afgelopen decennia is de samenwerking tussen anesthesioloog-pijnspecialist en psycholoog centraler komen te staan in de behandeling van patiënten met pijn. Uit voortschrijdend wetenschappelijk inzicht komt naar voren dat multidisciplinaire samenwerking de kwaliteit van pijnbehandeling vergroot. Daarbij gaat het om samenwerking tussen medisch specialisten, huisarts, fysiotherapeut en psycholoog. Het biopsychosociale model, dat in de laatste decennia uitgangspunt is voor pijnonderzoek geeft weer dat medische, psychologische en sociale (culturele) factoren naast een afzonderlijke bijdrage aan de pijnbeleving elkaar wederzijds en in elke fase van het pijnprobleem beïnvloeden. Dit betekent dat zowel bij de diagnostiek als bij het beoordelen van de behandelingsmogelijkheden van pijn alle genoemde factoren in hun onlosmakelijke samenhang betrokken dienen te worden. De integratie van deze factoren is nodig gezien de complexiteit van de chronische pijnproblematiek.
Beleid bij neuropathische pijn
Naar Samenvatting ›Voorlichting
Naar Samenvatting ›- Leg uit dat neuropathische pijn vaak een langdurig en/of chronisch beloop heeft (zie Achtergronden).
- Sluit aan op de voorlichting bij chronische pijn (zie Beleid bij chronische pijn, Voorlichting).
Niet-medicamenteuze behandeling
Naar Samenvatting ›Sluit aan op het niet-medicamenteuze beleid bij chronische pijn (zie Beleid bij chronische pijn, Niet-medicamenteuze behandeling).
Medicamenteuze behandeling
Naar Samenvatting ›- Zet medicamenteuze behandeling in als onderdeel van een beleid waarin ook aandacht is voor het verkleinen van de invloed van lichamelijke, psychische en sociale factoren op de pijnbeleving, -gedrag en ervaren beperkingen.
- Stem de verwachtingen van het effect af met de patiënt. Bespreek met de patiënt dat hij mogelijk verscheidene geneesmiddelen moet proberen gedurende enkele weken voordat de optimale behandeling duidelijk is.
- De respons op de medicamenteuze behandeling van neuropathische pijn is vaak matig. Het effect is bovendien onvoorspelbaar en het laat, afhankelijk van het gebruikte middel, enkele weken op zich wachten. Bijwerkingen zijn zelden vermijdbaar.
- Zorgvuldige titratie van de ingezette medicatie is noodzakelijk, waarbij ook een combinatie van middelen mogelijk is.
- Overweeg als een middel enige maar onvoldoende pijnvermindering geeft een combinatie van neuropathische pijnmedicatie met een verschillend werkingsmechanisme.
Achtergrond
Als een middel voor neuropathische pijn wel enig maar niet voldoende effect heeft, zou het toevoegen van een tweede middel met een andere werking de effectiviteit mogelijk kunnen verhogen en in sommige gevallen bijwerkingen kunnen verminderen, bijvoorbeeld doordat de benodigde dosis van de gecombineerde geneesmiddelen lager zou zijn.
Beschrijving van onderzoeken
In een Cochrane-review werden 21 onderzoeken geïncludeerd die een combinatie van geneesmiddelen voor neuropathische pijn onderzochten. Hieronder waren 4 RCT’s (n = 578) die een anti-epilepticum met een opioïd combineerden, 2 RCT’s (n = 77) die een opioïd met een TCA combineerden en 1 RCT (n = 56) die gabapentine met nortriptyline combineerde.
Effectiviteit
De enige meta-analyse die mogelijk was, was die van twee RCT’s (n = 386) die gabapentine gecombineerd met een opioïd vergeleken met alleen gabapentine. De gepoolde RR voor ten minste matige pijnverlichting was 1,30 (95%-BI 1,04 tot 1,61) in het voordeel van de combinatietherapie.
Bijwerkingen
De combinatie gabapentine en opioïd leidde tot een hogere uitval vergeleken met gabapentine monotherapie (RR 2,76; 95%-BI 1,47 tot 5,21).
Conclusies en overwegingen
De conclusie van de auteurs is dat verschillende RCT’s de superioriteit van een combinatie van middelen boven monotherapie laten zien, maar dat het aantal beschikbare RCT’s voor specifieke combinaties te beperkt is en dat de bestaande RCT’s te veel beperkingen hebben (bijvoorbeeld te weinig deelnemers en te korte onderzoeksduur) om een aanbeveling te doen voor een specifieke combinatie van twee geneesmiddelen. Daarnaast hebben veel geneesmiddelen overlappende bijwerkingen op het centrale zenuwstelsel (bijvoorbeeld sedatie, cognitieve disfunctie), wat zich uit in hoge studie-uitval en in de dagelijkse praktijk de bruikbaarheid van zulke combinaties zou kunnen beperken.
Aanbeveling
Als neuropathische pijn onvoldoende reageert op monotherapie, kan een combinatie worden geprobeerd van twee geneesmiddelen met een verschillend werkingsmechanisme die bij neuropathische pijn worden toegepast.
Medicatie bij neuropathische pijn
Naar Samenvatting ›- Antidepressiva, anti-epileptica en opioïden (inclusief tramadol) zijn werkzaam bij neuropathische pijn, al zijn er grote interindividuele verschillen. De aard van de neuropathische pijn is geen leidraad voor de keuze van het middel, met uitzondering van trigeminusneuralgie, waarbij carbamazepine eerste keus is.
- De tricyclische antidepressiva (TCA’s) (vooral amitriptyline) zijn het meest onderzocht bij diverse vormen van neuropathische pijn. Ze tonen goede effectiviteit en hebben daarom de voorkeur.
- Bij ouderen heeft van de TCA’s nortriptyline in de regel de voorkeur. Het is niet nodig een oudere die goed is ingesteld op amitriptyline en geen bijwerkingen ervaart om te zetten naar nortriptyline.
- Van de anti-epileptica gaat de voorkeur uit naar gabapentine.
- Paracetamol en NSAID’s zijn in de regel niet werkzaam bij neuropathische pijn.
- Opioïden (inclusief tramadol) kunnen gewenning en afhankelijkheid geven en worden in beginsel niet geadviseerd bij neuropathische pijn. Overweeg in uitzonderingsgevallen opioïden, wanneer behandeling met de aangewezen middelen (zie tabel 14) geen of onvoldoende effect geeft en er een zeer sterke wens of noodzaak is voor een medicamenteuze aanpak van de pijn. Overleg hierover zo nodig met de anesthesioloog-pijnspecialist.
| Geneesmiddel | Startdosering | Onderhoudsdosering | Maximale dagdosering |
|---|---|---|---|
| Trigeminusneuralgie | |||
| Carbamazepine (geregistreerd bij trigeminusneuralgie) |
| 3-4 dd 200 mg
| 1200 mg |
| Overige neuropathische pijn (m.u.v. hiv-neuropathie) | |||
| Amitriptyline* (offlabel) | Start vóór de nacht met 10-25 mg, verhoog zo nodig met 25 mg elke 1-2 weken | 125 mg | |
| Nortriptyline*,† (offlabel) | Start met 10-25 mg, verhoog zo nodig met 25 mg elke 1-2 weken | 100 mg | |
| Gabapentine (geregistreerd bij perifere neuropathische pijn, zoals diabetische neuropathie en postherpetische neuralgie) | 900 mg of 1200 mg per dag, opbouwend in 3 dagen:
Verhoog zo nodig om de 2-3 dagen in stappen van 300 mg verhogen tot maximaal 3 dd 1200 mg per dag. De opbouw van een dagdosis van 1800 mg kost minimaal 1 week, een dagdosis van 2400 mg minimaal 2 weken en de maximale dagdosis van 3600 mg minimaal 3 weken | 900-3600 mg per dag in 3 giften.
| 3600 mg |
| Pregabaline (geregistreerd bij perifere en centrale neuropathische pijn) | 150 mg per dag in 2-3 giften, op geleide van individuele reactie en het kunnen verdragen, na 3-7 dagen verhogen tot 300 mg per dag. Verhoog na een extra week zo nodig tot 600 mg per dag | 150-300 mg per dag in 2-3 giften.
| 600 mg |
| Duloxetine (alleen geregistreerd bij diabetische perifere neuropathie) | 60 mg 1 dd, maximaal 120 mg/dag in gelijk verdeelde giften | 60 mg 1 dd, maximaal 120 mg/dag in gelijk verdeelde giften | 120 mg |
* Start bij ouderen en bij ervaren bijwerkingen met een lage dosering en verhoog de dosering langzaam. † Bij slapeloosheid liever niet vóór de nacht laten innemen. | |||
Beschrijving onderzoeken
In een Cochrane-review (21 RCT’s, n = 1437) werd het effect van amitriptyline op neuropathische pijn en fibromyalgie beoordeeld. De geïncludeerde onderzoeken zouden op twee niveaus van kwaliteit worden geanalyseerd. Er was echter geen onderzoek dat voldeed aan de hoge kwaliteit. Alle onderzoeken waren dus van een lagere kwaliteit (wat betreft uitkomstrapportage, trialduur, populatiegrootte), waardoor een risico op vertekening aanwezig was met een mogelijke overschatting van het effect als gevolg.
In een Cochrane-review (6 RCT’s; n = 310) werd het effect van nortriptyline op neuropathische pijn onderzocht. Drie RCT’s hadden een placebogroep. Er werd geen onderzoek van hoge kwaliteit gevonden. De onderzoeken duurden veelal kort en hadden kleine deelnemersaantallen. Gegevens konden niet gepoold worden.
In een Cochrane-review (5 onderzoeken, 168 patiënten ≥ 18 jaar met (diabetische) polyneuropathie) werd de effectiviteit van imipramine (25 tot 350 mg dagelijks) vergeleken met placebo, paroxetine, mianserine, venlafaxine en amitriptyline. Pooling van data was niet mogelijk. De kwaliteit van het bewijs was laag.
In een Cochrane-review (18 RCT’s; n = 6407) is de effectiviteit van duloxetine op diabetische perifere neuropathie, centrale pijn, fibromyalgie en pijnlijke lichamelijke symptomen van onbekende origine beoordeeld. Acht van de achttien geïncludeerde RCT’s (n = 2728) betroffen de behandeling van diabetische perifere neuropathie in de eerste en tweede lijn en werden meestal gesponsord door de farmaceutische industrie. Duloxetine werd in zes RCT’s met placebo vergeleken, in een RCT met amitriptyline en in een RCT met pregabaline gedurende maximaal twaalf weken.
In een systematisch literatuuronderzoek werd het effect van SSRI’s en SNRI’s op neuropathische pijn beschreven. Hierin werd geen meta-analyse uitgevoerd.
Effectiviteit
Tricyclische antidepressiva (TCA's)
TCA’s zijn effectief in het minimaal matig verminderen van neuropathische pijn. De review van Moore et al. toonde geen bewijs voor effectiviteit van amitriptyline bij kankergerelateerde neuropathie en hiv-neuropathie. Bij diabetische neuropathie, postherpetische neuralgie, post-CVA-pijn en fibromyalgie (8 RCT’s; n = 687) had amitriptyline een positief effect (NNT 4,6; 95%-BI 3,6 tot 6,6).
Van de drie placebogecontroleerde RCT’s naar nortriptyline vonden er twee geen verschil in pijnvermindering tussen nortriptyline en placebo, terwijl de derde een significante pijnverbetering aangaf.
In de review van Hearn et al. werd in afzonderlijke onderzoeken enige verbetering van pijn door imipramine gevonden vergeleken met placebo, maar onderzoeken werden niet gepoold.
Er is geen verschil in effectiviteit tussen de verschillende TCA’s. Wel kan de effectiviteit van de TCA’s verschillen per individu.
Selectieve serotonineheropnameremmers (SSRI’s)
SSRI’s zijn minder onderzocht dan TCA’s en lijken minder effectief. Een beschrijvende review (vijf RCT’s) concludeerde dat er meer onderzoek nodig is voor bewijs van effectiviteit.
Serotonine-norepinefrineheropnameremmers (SNRI’s)
Het effect van duloxetine (alle onderzochte doseringen) ten opzichte van placebo op de primaire uitkomstmaat ≥ 50% verbetering van de pijn binnen 12 weken was RR 1,53 (95%-BI 1,19 tot 1,96) (5 RCT’s, n = 1655) en voor een dosering van 60 mg RR 1,73 (95%-BI 1,44 tot 2,08). Voor de standaarddosering van 60 mg geldt dan een NNT van 5 (95%-BI 4 tot 7). Het gemiddelde verschil in pijn tussen duloxetine 60 mg en placebo was −0,96 (95-BI% −1,26 tot −0,65) op een 11-puntspijnschaal.
Lee et al. beschreven de resultaten van 5 RCT’s (n = 408) met venlafaxine en concludeerden dat venlafaxine effectief is in het verminderen van neuropathische pijn. De resultaten werden niet gepoold.
Bijwerkingen
TCA’s
Van de amitriptylinegebruikers had 64% minimaal een bijwerking, bij degenen die een placebo kregen 40%. De NNH was 4,1 (95%-BI 3,2 tot 5,7). De gegevens over bijwerkingen bij nortriptylinegebruik zijn zeer beperkt, maar vooral droge mond, duizeligheid en obstipatie leken vaker voor te komen bij nortriptylinegebruik dan bij gebruik van placebo.
De meestgenoemde bijwerkingen van imipramine waren droge mond, zweten, misselijkheid, duizeligheid en vermoeidheid.
SNRI's
Bijwerkingen lijken lichter te zijn dan bij TCA’s, maar misselijkheid en braken, seksuele disfunctie, droge mond, zweten en obstipatie kunnen voorkomen.
Conclusie
TCA’s en de recenter ontwikkelde SNRI’s venlafaxine (off-label) en duloxetine zijn effectief bij de behandeling van neuropathische pijn. Er is te weinig onderzoek beschikbaar om de effectiviteit van SSRI’s bij de behandeling van neuropathische pijn te beoordelen.
Overwegingen
De ervaring met TCA’s is groter dan met SSRI’s en SNRI’s. De gebruikelijke dosering TCA’s bij neuropathische pijn varieert van 25 tot 150 mg per dag. Het effect begint meestal na 1 week merkbaar te worden. Controleer het bloedbeeld in de eerste 10 behandelweken bij keelpijn en koorts (in verband met het mogelijk optreden van agranulocytose) en controleer regelmatig de bloeddruk. Bouw de dosering geleidelijk af. Bij ouderen heeft nortriptyline de voorkeur, omdat dit middel minder centrale anticholinerge effecten heeft en daardoor het cognitief functioneren minder beïnvloedt dan amitriptyline.
Aanbeveling
TCA’s zijn eerste keus bij de behandeling van neuropathische pijn. Overweeg behandeling met duloxetine (of pregabaline of gabapentine), eventueel naast een lage dosering TCA, als een TCA onvoldoende effect heeft, bij ongewenste bijwerkingen of bij een contra-indicatie voor een TCA.
Achtergrond
In Nederland zijn verschillende anti-epileptica geregistreerd voor de behandeling van neuropathische pijn: pregabaline voor diabetische neuropathie en neuropathische pijn na gordelroos, en gabapentine voor dezelfde indicaties en daarnaast voor centrale neuropathische pijn.
Uitgangsvraag
Hebben gabapentine en pregabaline (I) vergeleken met placebo (C) een betere werkzaamheid met een acceptabel bijwerkingenprofiel (O) bij patiënten met neuropathische pijn (P)?
Cruciale uitkomstmaten
Voor deze uitgangsvraag werden de volgende cruciale uitkomstmaten vastgesteld:
- afname van de pijn met ten minste 50%
- sterke of zeer sterke verbetering
- uitval vanwege gebrek aan effectiviteit (niet beschikbaar voor gabapentine)
- slaperigheid
- duizeligheid
- uitval vanwege bijwerkingen
Voor de beantwoording van deze vragen werd gebruikgemaakt van een Cochrane-review over gabapentine en een Cochrane-review over pregabaline. Er werd gekeken naar de indicaties postherpetische neuralgie en diabetische neuropathie.
Resultaten
Beschrijving onderzoeken
In de review van Moore et al. over gabapentine werden 8 placebogecontroleerde RCT’s (n = 2405) naar postherpetische neuralgie en 9 (n = 1604) naar diabetische neuropathie geïncludeerd. Deze RCT’s vergeleken gabapentine (alle doseringen, tot maximaal 3600 mg/dag) met placebo bij patiënten > 18 jaar met minimaal 3 maanden pijn met een score van ten minste 40 op een schaal van 100 mm. De verschillende doseringen zijn samen geanalyseerd.
In de review van Moore over pregabaline werden 5 RCT’s (n = 1417) naar postherpetische neuralgie en 7 RCT’s (n = 2085) naar diabetische neuropathie geïncludeerd. De RCT’s vergeleken pregabaline (alle doseringen, tot maximaal 600 mg/dag) met placebo bij patiënten > 18 jaar met minimaal 3 maanden pijn met een score van ten minste 40 op een schaal van 100 mm. In de analyses is onderscheid naar de dosering van pregabaline gemaakt. In deze noot richten wij onze aandacht op de dosering van 300 mg/dag.
Kwaliteit van bewijs
De kwaliteit van bewijs voor de verschillende uitkomstmaten varieerde van zeer laag tot hoog. In veel gevallen was er sprake van kans op vertekening (risk of bias), inconsistentie en onnauwkeurigheid van de resultaten. Er waren onvoldoende publicaties beschikbaar om publicatiebias te onderzoeken.
Effectiviteit
I. Gabapentine
In tabel 15 worden de effecten van gabapentine gepresenteerd. Gabapentine leidde bij een groter deel van de patiënten met postherpetische neuralgie (34%) en van de patiënten met diabetische neuropathie (38%) tot afname van de pijn met ten minste 50%, vergeleken met patiënten die placebo kregen (21%). Over de grootte van dit effect was veel zekerheid.
| Uitkomstmaat |
Absoluut effect per jaar |
Relatief effect |
Aantal patiënten |
Kwaliteit van bewijs |
|---|---|---|---|---|
| Postherpetische neuralgie | ||||
| Afname van de pijn met ten minste 50% |
118 meer per 1000 |
RR 1,56 |
1816 |
⊕⊕⊕⊖ |
| Sterke of zeer sterke verbetering |
93 meer per 1000 |
RR 1,32 |
2013 |
⊕⊖⊖⊖ |
| Diabetische neuropathie | ||||
| Afname van de pijn met ten minste 50% |
181 meer per 1000 |
RR 1,86 |
1277 |
⊕⊕⊕⊖ |
| Sterke of zeer sterke verbetering |
199 meer per 1000 |
RR 1,66 |
695 |
⊕⊕⊕⊖ |
| Alle neuropathische pijn samen | ||||
| Uitval vanwege gebrek aan effectiviteit* |
16 minder per 1000 |
RR 0,49 |
3693 |
⊕⊕⊖⊖ |
| Bijwerkingen | ||||
| Slaperigheid* |
94 meer per 1000 |
RR 2,88 |
4125 |
⊕⊕⊕⊕ |
| Duizeligheid* |
130 meer per 1000 |
RR 3,11 |
4576 |
⊕⊕⊕⊕ |
| Uitval vanwege bijwerkingen* |
29 meer per 1000 |
RR 1,37 |
4448 |
⊕⊕⊕⊖ |
| * Data van onderzoeken naar verschillende indicaties (o.a. postherpetische neuralgie, diabetische neuropathie, fibromyalgie, hiv-neuropathie) samengenomen | ||||
Tabel 15. Effecten van gabapentine vergeleken met placebo bij neuropathische pijn
II. Pregabaline
In tabel 16 worden de effecten van pregabaline 300 mg/dag gepresenteerd. Pregabaline 300 mg/dag leidde bij een groter deel van de patiënten met postherpetische neuralgie tot verbetering (afname van de pijn met ten minste 50%, of sterke of zeer sterke verbetering) dan placebo, maar er was veel onzekerheid over de grootte van het effect. De resultaten voor 600 mg/dag waren vergelijkbaar (niet gepresenteerd). Pregabaline 300 mg/dag leidde nauwelijks tot verbetering van de pijn vergeleken met placebo bij patiënten met diabetische neuropathie: er was zeer veel onzekerheid over de grootte van het effect. De resultaten voor 600 mg/dag waren iets gunstiger (niet gepresenteerd).
| Uitkomstmaat |
Absoluut effect per jaar |
Relatief effect |
Aantal patiënten |
Kwaliteit van bewijs |
|---|---|---|---|---|
| Postherpetische neuralgie | ||||
| Afname van de pijn met ten minste 50% |
197 meer per 1000 |
RR 2,52 |
713 |
⊕⊕⊕⊖ |
| Sterke of zeer sterke verbetering |
173 meer per 1000 |
RR 2,16 |
348 |
⊕⊕⊖⊖ |
| Uitval vanwege gebrek aan effectiviteit |
67 minder per 1000 |
RR 0,39 |
722 |
⊕⊕⊖⊖ |
| Diabetische neuropathie | ||||
| Afname van de pijn met ten minste 50% |
132 meer per 1000 |
RR 1,50 |
823 |
⊕⊖⊖⊖ |
| Sterke of zeer sterke verbetering |
179 meer per 1000 |
RR 1,59 |
359 |
⊕⊕⊖⊖ |
| Uitval vanwege gebrek aan effectiviteit |
50 minder per 1000 |
RR 0,41 |
341 |
⊕⊕⊖⊖ |
| Bijwerkingen | ||||
| Slaperigheid* |
141 meer per 1000 |
RR 3,96 |
2910 |
⊕⊕⊕⊖ |
| Duizeligheid* |
206 meer per 1000 |
RR 3,39 |
2910 |
⊕⊕⊕⊖ |
| Uitval vanwege bijwerkingen* |
72 meer per 1000 |
RR 1,92 |
2910 |
⊕⊕⊕⊖ |
| * Data van onderzoeken naar verschillende indicaties (postherpetische neuralgie, diabetische neuropathie, fibromyalgie) samengenomen | ||||
Bijwerkingen
I. Gabapentine
Slaperigheid en duizeligheid kwamen bij gebruik van gabapentine ongeveer drie keer vaker voor dan bij gebruik van placebo: slaperigheid trad op bij 14% van de gabapentine- en 5% van de placebogebruikers; voor duizeligheid waren deze percentages 20% en 6%. Over de klinische relevantie van deze effecten was zeer veel zekerheid. De uitval uit de RCT’s vanwege bijwerkingen was onder gabapentinegebruikers hoger dan onder placebogebruikers, al was dit verschil niet klinisch relevant.
II. Pregabaline
Ook bij gebruik van pregabaline kwamen slaperigheid en duizeligheid ongeveer drie keer vaker voor dan bij gebruik van placebo. Slaperigheid trad op bij ongeveer 21% van de patiënten die pregabaline gebruikten, terwijl dit bij ongeveer 6% van de placebogebruikers optrad. Deze percentages waren voor duizeligheid 34% en 9%. Over deze effecten was veel zekerheid. Daarnaast waren er in de RCT’s meer uitvallers door bijwerkingen onder de pregabaline- dan onder de placebogebruikers, maar over dit effect was onzekerheid.
Conclusie
Over het bestaan van een klinisch relevant verschil tussen gabapentine en placebo voor de behandeling van postherpetische neuralgie en diabetische neuropathie is veel zekerheid (algehele kwaliteit van bewijs matig). Over het bestaan van klinisch relevante verschillen tussen pregabaline en placebo is er veel onzekerheid voor de behandeling van postherpetische neuralgie (algehele kwaliteit van bewijs laag), en zeer veel onzekerheid voor de behandeling van diabetische neuropathie (algehele kwaliteit van bewijs zeer laag).
Van bewijs naar aanbeveling
De kwaliteit van het bewijs over de effectiviteit van anti-epileptica bij neuropathische pijn varieert van hoog tot zeer laag en er treden veel bijwerkingen op. Het is niet te voorspellen welke patiënten goed reageren op welke middelen. Daarom kunnen eerst gabapentine en bij onvoldoende effect ook pregabaline (of duloxetine) overwogen worden als een TCA niet effectief blijkt of niet voorgeschreven kan worden.
Aanbeveling
Overweeg behandeling van neuropathische pijn met gabapentine, eventueel naast een lage dosering TCA, als een TCA onvoldoende effect heeft, bij ongewenste bijwerkingen of bij een contra-indicatie voor een TCA.
Achtergrond
Sterkwerkende opioïden zijn geregistreerd voor de behandeling van acute en chronische hevige pijn en tramadol voor de behandeling van acute en chronische matige tot ernstige pijn. Wellicht zouden deze middelen ook bij neuropathische pijn kunnen helpen.
Uitgangsvraag
Hebben opioïden (inclusief tramadol) (I) vergeleken met placebo (C) een betere werkzaamheid met een acceptabel bijwerkingenprofiel (O) bij patiënten met neuropathische pijn (P)?
Cruciale uitkomstmaten
Voor deze uitgangsvraag werden de volgende cruciale uitkomstmaten vastgesteld:
- afname van de pijn (VAS-schaal)
- afname van de pijn met ten minste 50%
- uitval vanwege bijwerkingen
Voor de beantwoording van deze vraag werd gebruikgemaakt van twee Cochrane-reviews: één over sterkwerkende opioïden en één over tramadol. Daarnaast is een trial over tramadol geïncludeerd die is gepubliceerd na de laatste update van de Cochrane-review.
Resultaten
Beschrijving onderzoeken
I. Sterkwerkende opioïden
In de review werden 14 RCT’s (n = 845) geïncludeerd met een follow-upduur variërend van 1 tot 12 weken. De meeste RCT’s vergeleken morfine (6 RCT’s) of oxycodon (5 RCT’s) met placebo bij patiënten met neuropathische pijn, waaronder diabetische neuropathie, postherpetische neuralgie en fantoompijn; in de overige 3 RCT’s werden dihydrocodeïne, methadon of levorphanol vergeleken met placebo.
II. Tramadol
In de review werden 5 RCT’s (n = 373) geïncludeerd. De RCT’s vergeleken tramadol (doseringen tot maximaal 400 mg/dag) met placebo bij patiënten met neuropathische pijn (neuropathische pijn door kanker, postherpetische neuralgie, diabetische neuropathie en pijnlijke polyneuropathie). Drie onderzoeken duurden 6 weken, de overige onderzoeken duurden 4 weken.
De RCT van Norrbrink includeerde 35 patiënten met neuropathische pijn veroorzaakt door ruggenmergletsel. Dit onderzoek duurde 4 weken en ook in dit onderzoek was de maximale dosering van tramadol 400 mg/dag.
Kwaliteit van bewijs
De kwaliteit van het bewijs was laag. Er was sprake van kans op vertekening (risk of bias), heterogeniteit (alleen bij sterkwerkende opioïden) en onnauwkeurigheid van de resultaten. Er waren onvoldoende publicaties over tramadol beschikbaar om publicatiebias te onderzoeken.
Effectiviteit
I. Sterkwerkende opioïden
Opioïden leidden bij een groter deel van de patiënten tot verbetering dan placebo (afname van de pijn met ten minste 50%: RR 1,53; 95%-BI 1,14 tot 2,06; NNT 6; 95%-BI 3 tot 23), en de absolute afname van de pijn op een schaal van 100 was 12 (95%-BI 9 tot 15) punten meer in de opioïden- dan in de placebogroepen. Er was echter veel onzekerheid over de grootte van deze effecten.
II. Tramadol
De resultaten van drie van de vijf onderzoeken die in de Cochrane-review waren geïncludeerd, konden gepoold worden (n = 302). Tramadol leidde bij een groter deel van de patiënten tot verbetering (afname van de pijn met ten minste 50%) dan placebo (OR 1,70; 95%-BI 1,36 tot 2,14; NNT 3,8; 95%-BI 2,3 tot 7,4), maar er was veel onzekerheid over de grootte van het effect. De absolute afname van de pijn op een schaal van 100 was 12 (95%-BI 5 tot 19) punten meer in de tramadol- dan in de placebogroepen. De RCT van Norrbrink veranderde de resultaten niet.
Bijwerkingen
I. Sterkwerkende opioïden
De uitval vanwege bijwerkingen was groter in de opioïden- dan in de placebogroepen (OR 3,03; 95%-BI 1,81 tot 5,08; NNH 12; 95%-BI 6 tot 29). Over de grootte van dit effect was veel zekerheid. De bijwerkingen die gerapporteerd werden waren obstipatie (bij 34% van de opioïdengebruikers), slaperigheid (29%), misselijkheid (27%), duizeligheid (22%) en braken (12%). Deze bijwerkingen kwamen bij de opioïdengebruikers twee tot vier keer vaker voor dan bij de placebogebruikers.
II. Tramadol
De resultaten van twee onderzoeken konden gepoold worden (n = 195). De uitval vanwege bijwerkingen was groter in de tramadol- dan in de placebogroep (OR 5,37; 95%-BI 1,62 tot 17,75; NNH 7,5; 95%-BI 1,9 tot 52,6). De bijwerkingen die het meest optraden waren misselijkheid, duizeligheid, obstipatie, slaperigheid en droge mond. Deze bijwerkingen kwamen voor bij 20 tot 30% van de tramadolgebruikers, wat drie tot zeven keer vaker is dan bij de placebogebruikers. Er was veel onzekerheid over de grootte van deze effecten. De resultaten van Norrbrink kwamen hiermee overeen.
Conclusies
Voor de behandeling van neuropathische pijn is er veel onzekerheid over het bestaan van een klinisch relevant voordeel van opioïden (inclusief tramadol) ten opzichte van placebo (algehele kwaliteit van bewijs laag).
Van bewijs naar aanbeveling
De kwaliteit van het bewijs over de effectiviteit van opioïden (inclusief tramadol) bij neuropathische pijn is laag, en er treden veel bijwerkingen op. Daarnaast kunnen opioïden gewenning en afhankelijkheid geven, wat een nadeel kan zijn in verband met het chronische karakter van neuropathische pijn. Daarom worden deze middelen niet aanbevolen voor de behandeling van neuropathische pijn in de eerste lijn, behalve als dit in overleg met een specialist gebeurt.
Aanbeveling
Opioïden (inclusief tramadol) kunnen gewenning en afhankelijkheid geven en worden niet als eerste keus geadviseerd bij neuropathische pijn in verband met het chronische karakter van de pijn.
Achtergrond
Carbamazepine is in Nederland geregistreerd voor de behandeling van trigeminusneuralgie.
Uitgangsvraag
Dient carbamazepine (I) of placebo (C) te worden voorgeschreven ter behandeling van pijn (O) bij patiënten met trigeminusneuralgie (P)?
Voor de beantwoording van deze uitgangsvraag is gebruikgemaakt van een Cochrane-review van Wiffen.
Resultaten
Beschrijving onderzoeken
In de review van Wiffen werden 3 placebogecontroleerde, dubbelblinde (gedeeltelijk) cross-over-RCT’s met minimaal 10 deelnemers naar carbamazepine bij trigeminusneuralgie geïncludeerd (n = 152). Deze RCT’s waren gepubliceerd tussen 1966 en 1969. Twee van de RCT’s duurden kort (behandeling 5 dagen en 2 weken); slechts 1 RCT had een lange follow-up, variërend van 2 tot 42 maanden voor individuele deelnemers. In 1 van de RCT’s werden ook enkele deelnemers met een andere vorm van neuralgie geïncludeerd.
Bijwerkingen zijn bepaald in de placebogecontroleerde RCT’s naar carbamazepine voor alle indicaties, dus niet alleen trigeminusneuralgie.
Kwaliteit van bewijs
De kwaliteit van bewijs voor de onderzoeken was laag door het risico op vertekening (onvoldoende kwaliteit van randomisatie, verzegeling van toewijzing interventie en blindering) en onnauwkeurigheid van de resultaten. Daarnaast waren er inconsistenties in de resultaten van de bijwerkingen. Er waren onvoldoende onderzoeken beschikbaar om publicatiebias te onderzoeken.
Effectiviteit
De enige effectiviteitsmaat die gepoold kon worden in een meta-analyse, was ‘enige verbetering van de pijn’. Deze uitkomstmaat werd beschreven in 2 onderzoeken met in totaal 98 patiënten. De gepoolde RR voor enige verbetering van de pijn was 6,02 (95%-BI 2,82 tot 12,85), het NNT 1,7 (95%-BI 1 tot 4,7). Er was veel onzekerheid over de grootte van het effect.
Bijwerkingen
Ernstige bijwerkingen werden niet consistent gerapporteerd; ook de afwezigheid van ernstige bijwerkingen werd niet gerapporteerd. Slechts een onderzoek rapporteerde een ernstige bijwerking: een gastro-intestinale bloeding. Daarnaast werden er vier sterfgevallen gerapporteerd tijdens het gebruik van carbamazepine, die volgens de auteurs niet aan dit gebruik waren gerelateerd (tweemaal plotse dood, waarschijnlijk aan hart- en vaatziekten, eenmaal hersentumor, eenmaal progressie van een slopende ziekte). Vier onderzoeken rapporteerden patiënten die ten minste een bijwerking ondervonden, met een gepoolde RR van 2,40 (95%-BI 1,85 tot 3,12) en een NNH van 2,6 (95%-BI 1,7 tot 4,3). Specifieke bijwerkingen die veel werden gerapporteerd waren duizeligheid en slaperigheid. Er waren te weinig gegevens om deze in een meta-analyse te combineren, maar de cumulatieve incidentie van slaperigheid en duizeligheid tijdens het gebruik van carbamazepine was 40 tot 60%.
Conclusie
Voor de behandeling van trigeminusneuralgie is er veel onzekerheid over het bestaan van klinisch relevante verschillen tussen carbamazepine en placebo (algehele kwaliteit van bewijs laag).
Van bewijs naar aanbeveling
De lage kwaliteit van het bewijs maakt het opmaken van de balans lastig. Carbamazepine is echter het enige geneesmiddel dat voor de indicatie trigeminusneuralgie geregistreerd is, en bewijs van goede kwaliteit voor andere off-label geneesmiddelen is niet voorhanden.
Het is moeilijk om nog gerandomiseerd onderzoek uit te voeren, omdat veel patiënten niet het risico willen lopen dat ze gerandomiseerd worden naar placebo. Dit wijst op ten minste wat effectiviteit van dit geneesmiddel vergeleken met placebo. Ondanks de afwezigheid van robuuste evidence en omdat behandeling met carbamazepine inmiddels gemeengoed is, blijft carbamazepine aanbevolen voor de behandeling van trigeminusneuralgie.
Aanbeveling
Carbamazepine wordt aanbevolen als eerstekeusbehandeling voor trigeminusneuralgie. Als de behandeling met carbamazepine niet effectief is, niet getolereerd wordt of gecontra-indiceerd is, overweeg dan consultatie of verwijzing naar een pijnbehandelcentrum of anesthesioloog-pijnspecialist.
Orale medicatie
Naar Samenvatting ›- Geef bij trigeminusneuralgie een proefbehandeling met carbamazepine. Verhoog de dosering geleidelijk op geleide van de pijn. Verlaag bij een goede respons de onderhoudsdosering geleidelijk tot het niveau van voldoende pijnstilling.
- Geef bij neuropathische pijn anders dan door trigeminusneuralgie of hiv-neuropathie (zie Consultatie en verwijzing) als eerste keus een TCA, zoals amitriptyline of bij ouderen nortriptyline.
- TCA’s zijn gecontra-indiceerd na een recent hartinfarct, cardiale geleidingsstoornissen en bij dementie. Terughoudendheid is geboden bij (een voorgeschiedenis van of verhoogd risico op) urineretentie, lever- of nierfunctiestoornis, glaucoom, epilepsie, obstipatie, prostaathypertrofie en cardiovasculaire aandoeningen zoals hartfalen. Overweeg een ecg bij patiënten met een verhoogde gevoeligheid voor cardiovasculaire bijwerkingen voorafgaand aan de start met een TCA (zie NHG-Standaard Depressie en NHG-Standaard Angst).
- Controleer bij gebruik van TCA’s bij keelpijn en koorts in de eerste 10 behandelweken het bloedbeeld in verband met de zeldzaam voorkomende beenmergdepressie.
- Overweeg behandeling met gabapentine als een TCA onvoldoende effect heeft, bij ongewenste bijwerkingen of bij een cardiovasculaire contra-indicatie voor een TCA. Als dit ook niet effectief is of bijwerkingen geeft, overweeg dan over te stappen op een volgend middel (pregabaline of duloxetine).
- Zie tabel 14 voor doseringsadviezen.
- Alle middelen uit tabel 14 hebben een negatieve invloed op de rijvaardigheid. Bij dagelijks gebruik is autorijden in ieder geval in de eerste week niet toegestaan. Verwijs voor meer informatie naar rijveiligmetmedicijnen.nl.
Cannabis bij chronische neuropathische pijn
Naar Samenvatting ›- We bevelen in de huisartsenpraktijk het gebruik van cannabis op recept bij patiënten met chronische neuropathische pijn niet aan.
- We raden het gebruik van cannabisproducten via de drogist, reformzaak of coffeeshop af.
Uit onderzoek is niet aangetoond dat medicinale cannabis werkzaam is, terwijl er wel bijwerkingen en interacties kunnen optreden. Daarnaast is het gebruik van cannabis duur en zijn er diverse andere bezwaren die de aanvaardbaarheid van cannabis in de weg staan, zoals het feit dat cannabis de rijvaardigheid beïnvloedt, op de Dopinglijst staat en onder de Opiumwet valt. Dit heeft geleid tot een sterke aanbeveling tegen het gebruik van medicinale cannabis bij patiënten met chronische neuropathische pijn.
Gewenste en ongewenste effecten
Mogelijk zijn er niet of nauwelijks voordelen (zoals vermindering van pijn of verbetering van fysiek functioneren) door het gebruik van cannabis. Wel leidt cannabis tot een grotere kans op niet-ernstige bijwerkingen: met name duizeligheid, maar ook sufheid en misselijkheid. Dit uit zich ook in een grotere uitval door bijwerkingen uit de onderzoeken in de cannabis-armen. Over het optreden van afhankelijkheid en ernstige bijwerkingen zijn we onzeker: deze lijken niet vaak voor te komen, maar de onderzoeken zijn niet geschikt voor het bepalen van deze uitkomstmaat.
Kwaliteit van bewijs
De kwaliteit van bewijs varieerde van redelijk tot zeer laag. In alle gevallen hebben we afgewaardeerd voor indirect bewijs, omdat het merendeel van de onderzochte preparaten niet vergelijkbaar is met de in Nederland op recept verkrijgbare preparaten. Ook hebben we in sommige gevallen afgewaardeerd voor inconsistentie (bij heterogene resultaten) of onnauwkeurigheid (bij kleine aantallen of overschrijden van de marge van een klinisch relevant verschil). Daarnaast zijn de meeste onderzoeken gesponsord door de industrie. Hiervoor is alleen afgewaardeerd als de resultaten op een voordelig effect van cannabis wezen. Omdat er sensitiviteitsanalyses zijn gedaan zonder onderzoeken van lagere methodologische kwaliteit, en deze analyses niet tot andere resultaten leidden, hebben we niet afgewaardeerd voor kans op vertekening (risk of bias) bij de meeste uitkomstmaten.
Waarden en voorkeuren van patiënten
Een deel van de patiënten zal niet voor de interventie kiezen omdat de effectiviteit onzeker is, terwijl er wel bijwerkingen kunnen optreden. Er zullen echter ook patiënten zijn die cannabis willen proberen, ondanks het onzekere effect en de mogelijke bijwerkingen.
Kosten
De kosten van een eventuele behandeling komen voor rekening van de patiënt. Een flesje cannabisolie van 10 ml is verkrijgbaar vanaf ongeveer € 50; de prijs loopt op bij een hogere concentratie van THC en/of CBD tot maximaal ongeveer € 200 (transvaalapotheek.nl en cannabiszorg.nl, geraadpleegd mei 2023). Het varieert hoe lang patiënten met een flesje kunnen doen; gemiddeld is dit ongeveer 1 maand.
Cannabis is ook als flos verkrijgbaar en wordt dan geleverd als hele bloemen of als granulaat. De kosten bedragen dan ongeveer € 32,50 per 5 gram (cannabiszorg.nl, geraadpleegd mei 2023).
Aanvaardbaarheid
- Er is variatie in de acceptatie van het gebruik van cannabis op recept door (de omgeving van) de patiënt. Medicinale cannabis is voor veel mensen een taboe, omdat cannabis als een drug wordt gezien.
- Er gelden diverse contra-indicaties en interacties:
- absolute contra-indicaties: psychosen, brugada-syndroom, zwangerschap, zwangerschapswens of lactatie en glaucoom (geldt alleen voor CBD)
- relatieve contra-indicaties: verslavingsgevoeligheid, verlengd QT-interval, coronairlijden, (verhoogd risico op) psychische aandoeningen (depressie, angststoornissen) en leeftijd ≤ 24 jaar
- combinatie van cannabis met andere centraal werkende of dempende stoffen (zoals alcohol, benzodiazepines en opioïden) versterkt het versuffende effect. Bij combinatie met pijnstillers zijn er aanwijzingen uit de praktijk dat de benodigde dosis van de pijnstiller lager kan zijn
- Cannabis beïnvloedt de rijvaardigheid en is strafbaar in het verkeer (zie rijveiligmetmedicijnen.nl en rijksoverheid.nl).
- Medicinale cannabis valt onder de Opiumwet. Het bezitten en gebruiken van medicinale cannabisolie is in veel landen verboden. Voor reizen naar het buitenland is een officiële verklaring nodig, zie voor meer informatie de website van het CAK (hetcak.nl).
- Cannabis staat op de Dopinglijst (zie dopingautoriteit.nl).
Haalbaarheid
Medicinale cannabis is in Nederland goed verkrijgbaar. Het kost enige moeite om dit aan te vragen (vanwege het invullen van formulieren).
Uitgangsvraag
Is cannabis op recept aan te bevelen aan patiënten met chronische neuropathische pijn? Zie de PICO-tabel.
| Patiënten | Volwassenen met chronische neuropathische pijn |
|---|---|
| Interventie | Cannabis, in Nederland op recept verkrijgbaar |
| Vergelijking | Placebo of gebruikelijke behandeling |
| Uitkomstmaten | Cruciaal
|
Voor de continue uitkomstmaten beschouwen we een verschil van 10% op de gebruikte schaal als klein, maar klinisch relevant. Dit houdt in: 1 cm op een VAS van 10 cm of 10 punten op een numerieke schaal van 0-100 punten. Voor dichotome uitkomstmaten houden we de standaard afkapwaarden van GRADE aan: RR < 0,8 of > 1,25.
Achtergrond
Cannabis bevat verschillende werkzame stoffen, waaronder tetrahydrocannabinol (THC) en cannabidiol (CBD). THC en CBD stimuleren de cannabinoïdreceptoren die een rol spelen bij pijnmodulatie, motoriek, misselijkheid en braken. THC is daarnaast psychoactief en kan een high gevoel, duizeligheid en verwardheid veroorzaken. Er zijn aanwijzingen dat de samenstelling en verhouding van werkzame stoffen bepalend zijn voor de werkzaamheid en veiligheid.
Onder patiënten neemt kennis over het bestaan en de mogelijkheden van cannabis op recept toe. Dit geldt onder andere voor patiënten die chronische neuropathische pijn hebben en bij wie gangbare therapieën tekortschieten. Huisartsen worden in toenemende mate geconfronteerd met vragen over mogelijkheden en effectiviteit van cannabis op recept. In dit detail onderzoeken we of cannabis aan te bevelen is bij patiënten met chronische pijn van neuropathische oorsprong.
Methoden
Er is een systematische literatuurzoekactie naar SR’s en RCT’s uitgevoerd in PubMed en Embase in juni 2022, met een update in december 2022.
Omdat de gevonden systematische reviews geen onderscheid maken tussen neuropathische en niet-neuropathische pijn, hebben we de gegevens over patiënten met neuropathische pijn zelf opnieuw gepoold in Review Manager 5.4.1. Daarbij maakten we gebruik van de gegevens van de afzonderlijke RCT’s zoals ze in de SR’s werden gerapporteerd. Waar mogelijk hebben we daarbij een subgroepanalyse gedaan naar THC- en CBD-gehalte: preparaten met een hoog THC-gehalte (verhouding THC : CBD ≥ 2 : 1), preparaten met een hoog CBD-gehalte (verhouding CBD : THC ≥ 2 : 1) en preparaten met een vergelijkbaar THC- en CBD-gehalte (minder dan een factor 2 verschil). Voor dit detail is gebruikgemaakt van de resultaten bij patiënten met chronische pijn van neuropathische oorsprong. Pijn die gerelateerd is aan multipele sclerose (MS) hebben we hierbij onder neuropathische pijn geschaard, omdat er bij MS sprake is van zenuwschade en deze pijn moeilijk te onderscheiden is van pijn door spasticiteit of houdings- en loopproblemen.
Resultaten
Resultaat zoekactie
De zoekactie leverde een Rapid Recommendations-richtlijn op over cannabis bij chronische pijn en 2 systematische reviews (SR’s) naar de effecten en bijwerkingen van chronische pijn, die in het kader van deze richtlijn werden opgesteld . Daarnaast werden nog 2 recente SR’s naar de effecten en bijwerkingen van cannabis bij (chronische) pijn gevonden. Een aanvullende search na de zoekdatum van dit literatuuronderzoek leverde geen aanvullende RCT’s op. Ook bij de update werden geen nieuwe RCT’s gevonden.
Onderzoekskarakteristieken
- Busse 2021: Rapid Recommendations-richtlijn over cannabis bij chronische pijn. In het kader van deze richtlijn zijn diverse SR’s opgesteld, waarvan we Wang 2021 en Zeraatkar 2022 gebruikten.
- Wang 2021: SR naar de effecten en bijwerkingen van cannabis en cannabinoïden voor chronische pijn. De SR includeerde 32 RCT’s (n = 5174), waarvan er 29 medicinale cannabis of cannabinoïden vergeleken met placebo. 28 RCT’s gingen over chronische pijn die niet aan kanker was gerelateerd (11 over neuropathische pijn, 7 over pijn gerelateerd aan spasticiteit bij MS, 5 over nociplastische pijn, 2 over nociceptieve pijn, 1 over medicatieovergebruikshoofdpijn en 2 over gemengde chronische pijn) en 4 over pijn bij kanker; deze laatste 4 zijn buiten beschouwing gelaten. In 30 RCT’s werd de cannabis oraal ingenomen. De gemiddelde pijnscore bij aanvang was 6,1 cm op een VAS van 10 cm (IQR 5,7-6,7), de gemiddelde leeftijd van de deelnemers was 53 jaar (IQR 50-60 jaar) en 55% was vrouw (IQR 39-70%). De follow-up varieerde tussen 1 en 5,5 maanden.
- Zeraatkar 2022: SR naar langetermijnbijwerkingen en ernstige nadelige effecten, waaronder verslaving, van cannabis bij chronische pijn . De SR includeerde 39 observationele onderzoeken (n = 12.143), waarvan 30 longitudinaal. De mediane follow-up was 24 weken (IQR 12-34 weken). In slechts 1 onderzoek werd cannabis vergeleken met standaardzorg en in 1 onderzoek met gabapentine; in de andere onderzoeken was er geen controlegroep.
- Fisher 2021: SR naar de effecten en bijwerkingen van cannabis bij pijn. De SR includeerde 36 RCT’s (n = 7217), waarvan 13 over neuropathische pijn, 6 over kanker, 4 over acute pijn na chirurgie, 10 over MS, 1 over chronische prostatitis/bekkenpijn, 1 over carpaletunnelsyndroom en 1 over rugpijn. 54% was vrouw en de gemiddelde leeftijd was 51 jaar (SD 11 jaar).
- McDonagh 2022: SR naar de effecten en bijwerkingen van op cannabis gebaseerde producten voor chronische pijn. De SR includeerde 18 placebogecontroleerde RCT’s (n = 1740) met een duur van 1 tot 6 maanden. Daarbij waren 8 RCT’s (gemiddelde leeftijd 51 jaar) die producten onderzochten met voornamelijk THC, waarvan 6 synthetisch THC en de andere 2 plantenextracten met hoog THC-gehalte. Daarnaast waren er 7 RCT’s (gemiddelde leeftijd 53 jaar) die producten onderzochten met zowel THC als CBD (in de meeste gevallen nabiximols als oromucosale spray), en 2 RCT’s (gemiddelde leeftijd 65 jaar) die een product onderzochten met voornamelijk CBD (1 × dermale olie, 1 × orale capsule). Er was 1 RCT die cannabidivarine onderzocht; deze is buiten beschouwing gelaten. Van de in de SR geïncludeerde patiënten had 56% neuropathische pijn.
Effectiviteit en bijwerkingen
Zie tabel Cannabis vergeleken met placebo voor de samenvatting van de resultaten.
Conclusie
- Mogelijk is er niet of nauwelijks verschil in pijnreductie en fysiek functioneren tussen cannabis en placebo (kwaliteit van bewijs laag).
- We zijn onzeker over het optreden van afhankelijkheid door cannabis (kwaliteit van bewijs zeer laag).
- We zijn onzeker over een verschil in optreden van ernstige bijwerkingen tussen cannabis en placebo (kwaliteit van bewijs zeer laag).
- Waarschijnlijk verhoogt cannabis het risico op niet-ernstige bijwerkingen (uitval uit onderzoek door bijwerkingen; sufheid, duizeligheid en misselijkheid) vergeleken met placebo (kwaliteit van bewijs redelijk).
In Nederland zijn ook verschillende niet-medicinale cannabispreparaten verkrijgbaar, als zelfzorg of via de coffeeshop.
Cannabis als zelfzorg
Vrij verkrijgbare CBD (cannabidiol) of cannabisolie (CBD of wietolie) die via drogist en reformzaak verstrekt wordt, mag alleen CBD en geen THC bevatten. Deze middelen vallen niet onder de geneesmiddelenwet, maar onder de warenwet. De samenstelling en kwaliteit zijn daarom aanzienlijk minder gegarandeerd dan bij de cannabis op recept. Het aantal vergiftigingen met vrij verkrijgbare cannabisolie neemt de afgelopen jaren toe. Via cannabiszorg.nl is CBD-olie met gegarandeerde samenstelling (2%, 5% of 10%) verkrijgbaar.
Cannabis uit de coffeeshop
Cannabis kan ook gekocht worden bij de coffeeshop. De samenstelling en kwaliteit kunnen erg variëren. Verontreiniging met pesticiden, zware metalen, micro-organismen (onder andere schimmels) en haren is beschreven.
Waarom deze aanbeveling?
We raden het gebruik van cannabis uit de coffeeshop of CBD-olie van bijvoorbeeld drogist of reformzaak af omdat de samenstelling en kwaliteit niet gegarandeerd zijn
Dermale medicatie
Naar Samenvatting ›Capsaïcine
Naar Samenvatting ›We bevelen dermale capsaïcine niet aan in de huisartsenpraktijk.
Achtergrond
Capsaïcine is het hete bestanddeel van rode peper en wordt toegepast in de vorm van capsaïcinecrème 0,025 tot 0,075% in lanettecrème-FNA of in een pleister in hoge dosering (8%). Lokale toepassing van capsaïcine wordt gebruikt ter bestrijding van perifere neuropathische pijn. Capsaïcine is een selectieve agonist voor de transient receptor potential vanilloid 1-receptor (TRPV1). Aanvankelijk activeert capsaïcine cutane nociceptoren met TRPV1-expressie, dat leidt tot branderigheid en erytheem door het vrijkomen van vasoactieve neuropeptiden. Vervolgens worden deze cutane nociceptoren minder gevoelig voor diverse stimuli. Deze ‘desensibilisatie’ ligt vermoedelijk ten grondslag aan de pijnverlichting. De werkingsduur houdt circa twaalf weken aan.
Beschrijving onderzoeken
In een Cochrane-review (6 RCT’s, 2073 patiënten, waarvan 4 RCT’s met 1272 patiënten met postherpetische neuralgie en 2 RCT’s met 801 patiënten met hiv-neuropathie) werd de werkzaamheid en verdraagbaarheid bij chronische neuropathische pijn van capsaïcine in hoge concentratie (8%) onderzocht bij volwassenen.
Een Cochrane-review includeerde 6 RCT’s met een duur van minimaal 6 weken (n = 389, alle gepubliceerd voor 1996), waarin capsaïcine 0,075% met placebo werd vergeleken. De deelnemers hadden verschillende vormen van chronische neuropathie: postherpetische neuralgie, diabetische neuropathie, hiv-neuropathie, postmastectomiepijn, distale polyneuropathie en postoperatieve kankerpijn.
Effectiviteit
Capsaïcine 8%
Meer patiënten die capsaïcine 8% kregen dan patiënten die capsaïcine 0,04% kregen rapporteerden een pijnvermindering van minimaal 50% na 2 tot 8 weken (RR 1,44; 95%-BI 1,12 tot 1,86) en na 2 tot 12 weken (RR 1,31; 95%-BI 1,00 tot 1,71). Na 8 en 12 weken was er een significante pijnvermindering bij applicatie van capsaïcine 8% vergeleken met de controlegroep (capsaïcine 0,04%). NNT’s voor veel pijnvermindering en voor heel veel pijnvermindering waren respectievelijk 8,8 (95%-BI 5,3 tot 26) en 7,0 (95%-BI 4,6 tot 15).
Capsaïcine 0,075%
Er zijn onvoldoende gegevens om de effectiviteit van capsaïcine in lage dosering bij neuropathische pijn aan te tonen. Door de heterogeniteit in uitkomstmaten werden de onderzoeksresultaten niet gecombineerd.
Bijwerkingen
Capsaïcine 8%
Onder de groep die de 8%-pleister kreeg, werden vaker bijwerkingen gemeld, zoals erytheem, pijn, papels en oedeem, dan de groep die capsaïcine 0,04% kreeg, maar er was geen significant verschil in het optreden van ernstige bijwerkingen (4,1% versus 3,2%; RR 1,41; 95%-BI 0,82 tot 2,41) en ook was er geen verschil in uitval door bijwerkingen (RR 0,87; 95%-BI 0,37 tot 2,00).
Capsaïcine 0,075%
Vijf gepoolde RCT’s toonden dat de bijwerkingen branderig, stekend gevoel, erytheem of pruritis bij 63% van de capsaïcinegebruikers voorkwam versus 24% bij placebo (NNH 2,5; 95%-BI 2,1 tot 3,1).
Conclusie
Hoge concentratie dermaal capsaïcine bij de behandeling van postherpetische neuralgie en hiv-neuropathie leidt tot een grotere proportie patiënten met sterke pijnvermindering dan toepassing van lage concentratie capsaïcine. Over de lage concentratie capsaïcine kunnen door onvoldoende onderzoeksresultaten geen conclusies worden getrokken, maar de weinige informatie die beschikbaar is wijst erop dat het effect hiervan op pijnvermindering niet anders is dan van placebo.
Overwegingen
Lokale pijnklachten als gevolg van de behandeling met capsaïcine kunnen worden bestreden met applicatie van lidocaïne, waarbij een significante reductie in koude- en warmtesensatie en aanraking werd gevonden. De crème in lage dosering moet viermaal daags op de pijnlijke plekken worden ingewreven, waarbij contact met de slijmvliezen moet worden vermeden. De pleister in hoge dosering (8%) dient alleen in de tweede lijn toegepast te worden. Deze wordt aangebracht op de meest pijnlijke plekken en blijft 60 minuten zitten (bij hiv-neuropathie wordt de pleister aangebracht op de voeten en blijft 30 minuten zitten). De behandeling wordt elke negentig dagen herhaald, afhankelijk van de persistentie of terugkeer van de pijn. Het behandelgebied moet met een topisch anestheticum voorbehandeld worden om de pijn bij het aanbrengen van de pleister te verminderen.
Aanbeveling
Gezien de afwezige onderbouwing van de effectiviteit is de plaats van capsaïcinecrème (0,025 tot 0,075% in lanettecrème-FNA, 4 dd op de pijnlijke plekken) bij de behandeling van neuropathische pijn zeer beperkt. Capsaïcinepleisters 8% zijn werkzaam bij neuropathische pijn, in het bijzonder bij postherpetische neuralgie, maar voor deze therapie dient de patiënt verwezen te worden naar de tweede lijn.
Lidocaïne
Naar Samenvatting ›- Overweeg een lidocaïne-5%-pleister bij de behandeling van neuropathische pijn, in het bijzonder van postherpetische neuralgie.
- Gebruik daarvoor crème of zalf met lidocaïnebase (lidocaïnegel bevat in de regel lidocaïne in zoutvorm, die alleen geschikt is voor gebruik op slijmvliezen).
- Overweeg lidocaïne-prilocaïnecrème onder occlusie met een pleister als pijnverlichting bij veneuze ulcera.
Effectiviteit
Postherpetische neuralgie
Uit onderzoek bij 273 patiënten met postherpetische neuralgie die niet succesvol waren behandeld met antidepressiva of anti-epileptica bleek dat behandeling met 5%-lidocaïnepleister resulteerde in een significante reductie van gebruik van tricyclische antidepressiva en analgetica uit stap 4 van de pijnladder. De pleister werd goed verdragen; de belangrijkste bijwerking was lokale irritatie (2,6% van de gebruikers) . In placebogecontroleerd onderzoek (n = 265) werd gevonden dat 5%-lidocaïnepleister pijnreductie gaf bij postherpetische neuralgie en was geassocieerd met verbeteringen van kwaliteit van leven en slaap. In gerandomiseerd open-labelonderzoek werd bij patiënten met postherpetische neuralgie (n = 96) een betere werkzaamheid van 5%-lidocaïnepleister gevonden dan van pregabaline: meer patiënten respondeerden op 5%-lidocaïnepleister dan op pregabaline (62,2% versus 46,5%).
De 5%-lidocaïnepleister liet een grotere verbetering zien dan pregabaline wat betreft patiënttevredenheid en kwaliteit van leven.
Lidocaïneoogdruppels verlaagden significant de VAS-score van persisterende pijn in het oog als gevolg van gordelroos (baseline: 5,9 ± 2,2 cm; 15 minuten na oogdruppels: 0,9 ± 1,8 cm; p < 0,01) en in het voorhoofd (baseline: 6,3 ± 2,0 cm; 15 minuten na oogdruppels: 2,6 ± 2,7 cm; p < 0,01). Vergeleken met placebo was de pijnreductie significant (p < 0,01).
Diabetische neuropathie
In een gerandomiseerd open-labelonderzoek werd geen verschil in werkzaamheid gevonden tussen 5%-lidocainepleister en pregabaline bij patiënten met diabetische polyneuropathie (n = 204; 66,7% versus 69,1% responders).
De 5%-lidocaïnepleister liet een grotere verbetering zien dan pregabaline wat betreft patiënttevredenheid en kwaliteit van leven.
Overige toepassingen
Lidocaïneprilocaïnecrème geeft een pijnreductie bij veneuze ulcera (Cochrane-review, 6 onderzoeken, 343 patiënten).
Lidocaïne kan worden toegepast bij lokale pijn als gevolg van behandeling met capsaïcine.
Bijwerkingen
De pleister werd goed verdragen: de belangrijkste bijwerking was lokale irritatie (2,6% van de gebruikers). Lidocaïne geeft geen systemische bijwerkingen.
Conclusie
5%-lidocaïnepleister is effectief bij de behandeling van neuropathische pijn, in het bijzonder van postherpetische neuralgie. Voorts geeft lidocaïneprilocaïnecrème pijnverlichting bij veneuze ulcera. Het risico op bijwerkingen is beperkt.
Overwegingen
Lidocaïne dient niet te worden voorgeschreven aan patiënten met ernstig leverfalen bij wie excessieve bloedconcentraties theoretisch denkbaar zijn.
Aanbeveling
5%-lidocaïnepleister kan worden toegepast bij de behandeling van postherpetische neuralgie. Gebruik daarvoor alleen lidocaïnezalf of -crème die lidocaïnebase bevat en geschikt is voor gebruik op de huid. Lidocaïnegel bevat in de regel de zoutvorm en is alleen geschikt voor gebruik op slijmvliezen, omdat het zout niet door de huid wordt opgenomen.
Consultatie en verwijzing
Naar Samenvatting ›Overweeg, afhankelijk van de diagnose en/of lokalisatie, een eventuele invasieve behandeling (infiltraties met lokaal anestheticum en corticosteroïd, specifieke zenuwblokkades, epidurale en spinale medicatietoediening). Raadpleeg daarvoor de anesthesioloog-pijnspecialist.
Overweeg consultatie of verwijzing van patiënt met hiv-neuropathie naar de hiv-poli (de gebruikelijke medicamenteuze behandelingen zijn hierbij niet effectief).
Zie voor overige verwijsmogelijkheden Richtlijnen beleid chronische pijn, Consultatie en verwijzing.
Beschrijving onderzoeken
Het systematisch literatuuronderzoek naar de farmacologische behandeling van hiv-neuropathie includeerde 14 RCT’s. Hiervan gingen er 2 over amitriptyline (n = 281), 2 over gabapentine of pregabaline (n = 328), 2 over lamotrigine (n = 269), 2 over capsaïcine (8%; n = 307; 0,075%; n = 26), 2 over het roken van cannabis (n = 89), 1 over recombinant human nerve-growth factor (rhNGF, n = 270) en de overige 3 over acetyl-L-carnitine, prosapeptide en peptide T.
Effectiviteit
TCA’s en anti-epileptica zijn bij patiënten met hiv-neuropathie niet werkzaam; alleen lamotrigine zou mogelijk een positief effect kunnen hebben in de subgroep van hiv-patiënten die antiretrovirale medicatie gebruiken.
De drie middelen die mogelijk een betere werking zouden kunnen hebben dan placebo op het verminderen van de pijn door hiv-neuropathie, zijn 8%-capsaïcinepleisters (RR voor minimaal 30% pijnreductie, vergeleken met 0,04%-capsaïcinepleister 1,8; 95%-BI 1,1 tot 3,0; NNT 6,5; 95%-BI 3,9 tot 19,7), rhNGF (niet mogelijk om RR of NNT te berekenen) en gerookte cannabis (gepoolde RR 2,38; 95%-BI 1,38 tot 4,10 en NNT 3,4; 95%-BI 2,2 tot 7,5).
Overwegingen
Gerookte cannabis en rhNGF zijn niet klinisch beschikbaar en toepassing van 8%-capsaïcinepleister dient in de tweede lijn toegepast te worden.
Aanbeveling
De huisarts kan een patiënt met hiv-neuropathie verwijzen.
Beleid bij pijn in de palliatieve en terminale fase
Naar Samenvatting ›Niet-medicamenteuze behandeling
Naar Samenvatting ›- Het signaleren en monitoren van pijn is een gezamenlijke verantwoordelijkheid van zowel artsen, verpleegkundigen, naasten en mantelzorgers als van de patiënt zelf. Vraag bij elk patiëntencontact actief naar ‘comfort’, zoals de mate van pijn, naar mictie en ontlasting en naar het slaappatroon. Geef voorlichting en instrueer patiënten met pijn in de palliatieve fase proactief over pijn en de behandeling ervan.
- Laat de patiënt bij voorkeur zijn zorgdossier zelf beheren.
- Goede communicatie tussen hulpverleners en patiënten en hun naasten is essentieel in de palliatieve fase. Vroegtijdige behandeling van pijn in de palliatieve fase (die in de regel al aanvangt gedurende de curatieve fase) draagt bij aan een betere kwaliteit van leven en sterven.
- Palliatieve zorg omvat meer dan alleen de zorg voor de somatische aspecten van de ziekte. Ook het verwerkings- en aanpassingsproces, de interacties met de omgeving, de beleving van de ziekte en zingevingsvraagstukken horen hier integraal bij. Bij patiënten met een ongeneeslijke ziekte zijn deze aandachtsgebieden sterk met elkaar verweven.
- Zie voor specifieke aanbevelingen over pijn bij kanker de IKNL-richtlijn Pijn bij patiënten met kanker en voor specifieke aanbevelingen over pijn bij COPD of hartfalen de IKNL-richtlijn Pijn bij COPD of hartfalen.
Medicamenteuze behandeling
Naar Samenvatting ›- De kwaliteit van leven in relatie tot mogelijke bijwerkingen en de eigen regie en keuzemogelijkheden zijn uitgangspunt bij de behandeling.
- Bij matige tot ernstige pijn gaat de voorkeur uit naar sterkwerkende opioïden. Dit geldt zowel in geval van ziektegerichte als van symptoomgerichte palliatie (zie Stap 4: sterkwerkend opioïd en Stap 5: subcutane of intraveneuze toediening van sterkwerkende opioïden).
- Bij een onderhoudsbehandeling met orale opioïden gaat de voorkeur uit naar preparaten met vertraagde afgifte.
Het doel van de behandeling is om de pijn op een acceptabel niveau te brengen met aanvaardbare bijwerkingen. In de fase dat de ziekte nog actief wordt behandeld zijn de doelen duidelijk (ziektegerichte palliatie): niet alleen de symptomen van de ziekte maar ook de gevolgen van de behandeling moeten onder controle worden gebracht (bijvoorbeeld het bestrijden van pijn als gevolg van orale mucositis die is ontstaan na chemotherapie). In een situatie dat de ziekte niet (meer) oorzakelijk behandeld kan worden, richt de behandeling zich op verlichting van de symptomen (symptoomgerichte palliatie) met zoveel mogelijk behoud van cognitieve functies. Palliatie in de stervensfase beoogt optimale symptoomcontrole, waarbij behoud van cognitieve functies soms niet meer haalbaar of niet wenselijk is. In geval van ernstige, niet op een andere manier te behandelen (refractaire) klachten, kan palliatieve sedatie worden toegepast.
Beleid bij doorbraakpijn in de palliatieve/teminale fase
Naar Samenvatting ›- Geef bij doorbraakpijn naast de onderhoudsbehandeling met een opioïd een snelwerkend preparaat oraal, oromucosaal, intranasaal of parenteraal als noodmedicatie, bijvoorbeeld als bolus bij een continu subcutaan infuus (afhankelijk van de toepasbaarheid bij en voorkeur van de patiënt).
- Als de doorbraakpijn situatief gebonden is (bijvoorbeeld bij het verzorgen van de patiënt of bij bepaalde activiteiten van de patiënt), kan de doorbraakmedicatie 30 tot 60 minuten van tevoren worden gegeven. Geef dan bij voorkeur het kortwerkende preparaat van het opioïd dat als onderhoudsbehandeling wordt gebruikt.
- Bij doorbraakpijn op langwerkende morfine of oxycodon:
- Geef 10-15% van de 24 uursdosering in de vorm van een snelwerkend preparaat zonder gereguleerde afgifte.
- Herhaal dit zo nodig.
- Bij doorbraakpijn op een pleister:
- Geef in eerste instantie een vaste oromucosale, sublinguale of buccale dosering van hetzelfde middel: start met een lage dosering van 100 of 200 microg fentanyl, of 0,2 of 0,4 mg buprenorfine (offlabel).
- Overweeg bij onvoldoende snel effect en heftige doorbraakpijn de dosering te verhogen of de intranasale vorm te geven (alleen fentanyl; start met 50 microg).
- Verhoog de basismedicatie met 50% indien vaker dan driemaal per dag noodmedicatie nodig blijkt (behalve als dit situatief gebonden is) of als de patiënt klaagt over meer pijn, bijvoorbeeld bij meer pijn op dag 3 na het plakken van een nieuwe fentanylpleister (verklein dan niet het doseringsinterval).
- Bij voorschrijven van fentanyl neusspray of oromucosale toediening: waarschuw de patiënt (en mantelzorgers/verzorgenden) voor het risico op overdosering bij verkeerd gebruik of misbruik. Overdosering kan ernstige gevolgen hebben, zoals ademhalingsdepressie, met mogelijk een fatale afloop.
Achtergrond
Doorbraakpijn is plotseling optredende, tijdelijke, vaak hevige (toename van) pijn die optreedt bij bestaande chronische pijnklachten die onder controle zijn. Doorbraakpijn komt voor bij 50 tot 65% van de patiënten met kanker, duurt gemiddeld 30 minuten (variërend van 1 tot 240 minuten) en treedt gemiddeld viermaal per dag op. Er wordt onderscheid gemaakt tussen 3 types doorbraakpijn:
- incidente pijn: doorbraakpijn die uitsluitend of hoofdzakelijk optreedt bij bepaalde bewegingen of houdingen
- end of dose pain: doorbraakpijn die optreedt kort voor de volgende gift van het analgeticum
- spontane doorbraakpijn: doorbraakpijn die optreedt zonder aanwijsbare aanleiding.
Beschrijving onderzoeken
Een Cochrane-review onderzocht de werkzaamheid van opioïden bij doorbraakpijn bij kankerpatiënten. Er werden vijftien RCT’s (n = 1699) geïncludeerd, waarin zeven verschillende transmucosale fentanylformules werden onderzocht (vijf oraal en twee nasaal toegediend). Acht RCT’s vergeleken fentanyl met placebo, vier met een ander opioïd, een was een RCT met verschillende doseringen van dezelfde formule en twee waren gerandomiseerde titratieonderzoeken.
Effectiviteit
Orale en nasale fentanylformules waren een effectieve behandeling van doorbraakpijn. Vergeleken met placebo of orale morfine gaven deelnemers bij gebruik van fentanyl lagere pijnscores.
In één onderzoek werden transmucosale en intraveneuze toediening van fentanyl met elkaar vergeleken. Beide bleken effectief.
Conclusie
Oraal en nasaal fentanyl zijn een effectieve behandeling van doorbraakpijn.
Overwegingen
Intranasaal toegediend fentanyl is veel duurder dan de oromucosale vorm.
Aanbeveling
Geef bij doorbraakpijn bij kanker de snelwerkende vorm van het opioïd dat als onderhoudsbehandeling wordt gebruikt of oromucosaal fentanyl, ongeacht welk opioïd als onderhoudsbehandeling wordt gebruikt.
Methadon in de palliatieve/terminale fase
Naar Samenvatting ›Overweeg bij hoge uitzondering, en uitsluitend in overleg met de consulent of het consultteam palliatieve zorg of het pijnbehandelcentrum, methadon voor te schrijven. Overweeg dit alleen als verschillende soorten opioïden onvoldoende pijnstilling of onacceptabele bijwerkingen blijven geven.
Het voorschrijven van methadon vereist specifieke ervaring in verband met een relevant risico op cumulatie bij gebruik langer dan enkele dagen door grote variatie in de eliminatiehalfwaardetijd.
Achtergrond
Methadon kan in uitzonderingssituaties een alternatief vormen voor morfine en fentanyl indien die middelen niet goed werkzaam zijn of onacceptabele bijwerkingen hebben.
Beschrijving onderzoeken
In een Cochrane-review werden negen RCT’s (n = 459) geïncludeerd waarin methadon werd vergeleken met een actieve controle (morfine, dextromoramide, pethidine, diamorfine met cocaïne) bij pijn door kanker. Een andere Cochrane-review onderzocht de werking van methadon bij pijn niet door kanker. Er werden slechts twee kleine RCT’s geïncludeerd: een placebogecontroleerd cross-overonderzoek met negentien deelnemers, en een RCT waarin opioïden werden vergeleken met TCA’s. Methadon werd in dit onderzoek alleen toegepast als een deelnemer morfine niet verdroeg.
Effectiviteit en bijwerkingen
Pijn door kanker
Een meta-analyse kon niet worden uitgevoerd, omdat de onderzoeken daarvoor te veel van elkaar verschilden. Effectiviteit en bijwerkingen leken vergelijkbaar tussen methadon en morfine.
Pijn niet door kanker
Er was te weinig onderzoek voorhanden om de effectiviteit en bijwerkingen van methadon bij pijn niet door kanker te beoordelen.
Conclusie
Er is weinig goed uitgevoerd onderzoek aanwezig naar de effectiviteit en bijwerkingen van methadon, maar het weinige onderzoek dat er is wijst erop dat methadon een vergelijkbare effectiviteit en vergelijkbare bijwerkingen heeft als morfine.
Overwegingen
Een punt van zorg is gebruik van methadon langer dan enkele dagen: er kan dan cumulatie van methadon optreden als gevolg van de lange en individueel wisselende halfwaardetijd, waardoor bijwerkingen heviger kunnen optreden. De instelbaarheid is dan ook lastig. Deze bijwerking is specifiek voor methadon en niet voor andere opioïden. (In de verslavingszorg wordt routinematig gescreend op QTc-verlenging met ecg bij methadononderhoudstherapie.) Methadon moet vanwege dit risico en vanwege het gebrek aan onderzoek naar veiligheid en effectiviteit alleen worden voorgeschreven in uitzonderingssituaties en alleen door of in overleg met artsen die ervaring hebben met dit middel.
Aanbeveling
In bijzondere situaties kan overwogen worden om, in overleg met het palliatief team, methadon voor te schrijven.
Cannabis in de palliatieve/terminale fase
Naar Samenvatting ›Overweeg (een proefbehandeling met) cannabis alleen bij patiënten bij wie gangbare behandeling niet voldoende helpt of te veel bijwerkingen geeft.
Praktische toepassing
- Stem met de behandelend specialist af of cannabis gecombineerd kan worden met eventuele andere behandelingen en consulteer bij vragen eventueel de consulent of het consultteam palliatieve zorg en/of de anesthesioloog-pijnspecialist.
- Staak de behandeling bij geen of onvoldoende effect.
- Zie voor de verschillende beschikbare preparaten de Handreiking Proefbehandeling cannabis in de palliatieve fase.
De kwaliteit van het onderzoek was over het algemeen zeer laag. De onderzoeken zijn geen van alle uitgevoerd met de in Nederland verkrijgbare producten van plantaardige oorsprong (die een mengsel van werkzame stoffen bevatten), maar vaak met synthetische enkelvoudige producten. Daarnaast hadden de onderzoeken methodologische beperkingen. Uit het beschikbare onderzoek is het onzeker of er klinisch relevante verschillen zijn in pijnreductie, misselijkheid en braken of kwaliteit van leven. Bovendien leidt gebruik van cannabis mogelijk tot bijwerkingen (zie Cannabis).
Dat neemt niet weg dat (een proefbehandeling met) cannabis in de huisartsenpraktijk kan worden overwogen bij patiënten met chronische pijn in de palliatieve fase, bij wie gangbare behandelingen niet voldoende helpen of te veel bijwerkingen geven. Sommige patiënten kunnen in deze fase baat hebben van de bijwerkingen, zoals euforie en sufheid. Bij geen of onvoldoende effect kan de behandeling gestaakt worden.
De kosten van een eventuele behandeling komen meestal voor rekening van de patiënt en kunnen oplopen tot € 2000 per jaar. We raden het gebruik van cannabis via drogist, reformzaak of coffeeshop af (zie Cannabis).
Aanbeveling
Overweeg (een proefbehandeling met) cannabis alleen voor te schrijven bij patiënten in de palliatieve fase bij wie een gangbare behandeling niet voldoende helpt of te veel bijwerkingen geeft. Stem daarbij met de behandelend specialist af of cannabis gecombineerd kan worden met eventuele andere behandelingen en consulteer bij vragen eventueel het regionaal palliatief team en/of de anesthesioloog-pijnspecialist. Staak de behandeling bij geen of onvoldoende effect.
Achtergrond
Onder patiënten neemt kennis over het bestaan en de mogelijkheden van cannabis op recept toe. Dit geldt onder andere voor patiënten in de palliatieve fase bij wie gangbare therapieën tekortschieten. Huisartsen worden in toenemende mate geconfronteerd met vragen over mogelijkheden en effectiviteit van cannabis op recept.
Uitgangsvraag
Is cannabis (vergeleken met controle) aan te bevelen voor patiënten in de palliatieve fase?
Cruciale uitkomstmaten
- Pijn
- Misselijkheid en braken
- Kwaliteit van leven
- Bijwerkingen
Een systematische review naar de effectiviteit en veiligheid van cannabinoïden in de palliatieve fase diende als uitgangspunt voor de beantwoording van de uitgangsvraag.
Een search in maart 2018 leverde geen aanvullende RCT’s op.
Resultaten
Beschrijving onderzoeken
De review includeerde negen RCT’s (n = 1561) waarin cannabinoïden werden vergeleken met placebo of een actieve controle bij patiënten in de palliatieve fase. Vijf onderzoeken includeerden patiënten met kanker in de terminale fase, drie met vergevorderde hiv-infectie en één met de ziekte van Alzheimer.
Kwaliteit van bewijs
De kwaliteit van het bewijs was laag tot zeer laag. Er werd afgewaardeerd voor risico op vertekening (methodologische beperkingen van de onderzoeken), indirect bewijs (onderzoek met vormen van cannabinoïden die niet in Nederland verkrijgbaar of legaal zijn; voornamelijk synthetische enkelvoudige producten, terwijl de in Nederland verkrijgbare producten uit een mix van natuurlijke bestanddelen bestaan) en in sommige gevallen voor onnauwkeurigheid (kleine aantallen patiënten en/of brede betrouwbaarheidsintervallen).
Effectiviteit/bijwerkingen
In tabel 17 worden de resultaten gepresenteerd.
| Uitkomsten | Absolute effecten* (95%-BI) | Relatief effect (95%-BI) | Aantal deelnemers (onderzoeken) | Kwaliteit van bewijs (GRADE) | |
|---|---|---|---|---|---|
| Risico met placebo | Risico met cannabinoïden | ||||
| Pijnreductie > = 30% follow-up: range 16 dagen tot 9 weken | 227 per 1000 | 301 per 1000 (215 tot 419) | RR 1,33 (0,95 tot 1,85) | 537 (2 RCT’s)a | ⊕⊖⊖⊖ ZEER LAAGb,c,d |
| Misselijkheid en braken follow-up: range 16 dagen tot 6 weken | - | SMD 0,2 SD hoger (0,03 lager tot 0,44 hoger) | - | 307 (2 RCT’s)e | ⊕⊖⊖⊖ ZEER LAAGb,c,f |
| Gezondheidsgerelateerde kwaliteit van leven follow-up: range 16 dagen tot 6 weken | - | SMD 0 SD (0,19 lager tot 0,18 hoger) | - | 570 (4 RCT’s)g | ⊕⊕⊖⊖ LAAGb,c,h |
| Ernstige bijwerkingen follow-up: range 16 dagen tot 9 weken | 172 per 1000 | 193 per 1000 (148 tot 251) | RR 1,12 (0,86 tot 1,46) | 1031 (6 RCT’s) | ⊕⊖⊖⊖ ZEER LAAGb,c,i |
| a. Beide onderzoeken met kankerpatiënten. b. In de meeste onderzoeken zijn de randomisatieprocedure, allocation concealment, blindering, uitkomsten en selectieve rapportage onder de maat of niet beschreven. c. Alleen vormen van cannabinoïden die niet in Nederland verkrijgbaar (of legaal) zijn. Dit betreft synthetische enkelvoudige producten, terwijl in Nederland alleen producten van plantaardige oorsprong, met een mengsel van werkzame stoffen, verkrijgbaar zijn. d. Slechts weinig gebeurtenissen. Grens van klinisch relevant voordeel (RR=1,25) wordt overschreden. e. Eén onderzoek met kankerpatiënten, het andere met hiv-patiënten. f. Kleine aantallen patiënten. g. Drie onderzoeken met kankerpatiënten, één met hiv-patiënten. h. Het gehele 95%-BI ligt in de range van geen klinisch relevant verschil (SMD tussen −0,5 en +0,5). i. De grens van klinisch relevant nadeel (RR = 1,25) wordt overschreden. | |||||
Pijn
De resultaten van twee placebogecontroleerde RCT’s (n = 537), met een follow-up van zestien dagen en van negen weken, werden gepoold voor de uitkomstmaat vermindering van pijn met ten minste 30%. Door het brede betrouwbaarheidsinterval is het onzeker of er een klinisch relevant verschil is in het percentage patiënten dat een pijnreductie van 30% of meer bemerkte tussen de cannabinoïden de controlegroepen (RR 1,33; 95%-BI 0,95 tot 1,85; kwaliteit van bewijs zeer laag).
Misselijkheid en braken
De resultaten van twee placebogecontroleerde RCT’s (n = 307), met een follow-up van zestien dagen en van zes weken, werden gepoold. Het is onzeker of er een klinisch relevant verschil is tussen de groepen die cannabinoïden gebruikten en de controlegroepen (gestandaardiseerd gemiddeld verschil (SMD) −0,2; 95%-BI −0,03 tot 0,44; kwaliteit van bewijs zeer laag).
Kwaliteit van leven
De resultaten van vier placebogecontroleerde RCT’s (n = 570) met een follow-up tussen zestien dagen en zes weken werden gepoold. Er werd geen klinisch relevant verschil gevonden tussen de groepen die cannabinoïden gebruikten en de controlegroepen (gemiddeld gestandaardiseerd verschil (SMD) 0; 95%-BI −0,19 tot 0,18; kwaliteit van bewijs laag).
Bijwerkingen
Bijwerkingen kwamen veel voor. De resultaten van zes placebogecontroleerde RCT’s (n = 1031) werden gepoold voor de uitkomstmaat ‘ernstige bijwerkingen’, maar dit was niet gedefinieerd. Het is onzeker of patiënten die cannabinoïden gebruikten een grotere kans op een ernstige bijwerking hadden (20%) dan patiënten in de controlegroepen (17%) (RR 1,12; 95%-BI 0,86 tot 1,46; kwaliteit van bewijs zeer laag).
Conclusie
Het is onzeker of er een klinisch relevant verschil is in pijnreductie, misselijkheid en braken en ernstige bijwerkingen tussen cannabinoïden en placebo (kwaliteit van bewijs zeer laag). Er lijkt geen verschil te zijn in kwaliteit van leven tussen cannabinoïden en placebo (kwaliteit van bewijs laag).
Controles
Naar Samenvatting ›- Evalueer regelmatig het effect van de behandeling in overleg met de patiënt en diens naasten, zodat de (medicamenteuze) behandeling tijdig kan worden aangepast.
- Vraag naar het optreden van doorbraakpijn:
- de ernst en het beloop
- situaties waarin de doorbraakpijn optreedt
- factoren die het doorbreken van de pijn verlichten of juist verergeren
- Maak onderscheid tussen doorbraakpijn en onvoldoende behandelde achtergrondpijn.
- Overweeg het gebruik van de NRS- of VAS-score bij de controles (zie Pijnschalen).
Beleid bij afbouwen na langdurig gebruik opioïden
Naar Samenvatting ›Dit onderdeel is van toepassing op huidige langdurige gebruikers (arbitrair: > 1 maand) van sterkwerkende opioïden.
Zie Stap 4: sterkwerkend opioïd voor aanbevelingen over een verantwoorde toepassing van opioïden bij nieuwe gebruikers, over de behandelduur, herhaalrecepten, controles en afbouwen.
Indicaties
Naar Samenvatting ›Overweeg met patiënten die > 1 maand (arbitrair) opioïden gebruiken de optie te bespreken om het opioïdgebruik af te bouwen en te stoppen.
Dit kan in principe zonder directe aanleiding, bijvoorbeeld bij een verzoek om een herhaalrecept, maar bij een directe aanleiding is het zeker noodzakelijk om afbouwen ter sprake te brengen. Bijvoorbeeld:
- patiënt is genezen van de oorzaak van de acute pijn
- patiënt heeft steeds hogere doseringen nodig voor hetzelfde effect
- patiënt gebruikt hogere doseringen dan voorgeschreven
- patiënt heeft last van bijwerkingen, zoals sufheid (zich uitend in gedrag of valincidenten), obstipatie, misselijkheid, braken
Voorlichting
Naar Samenvatting ›Argumenten voor het afbouwen, ter bespreking met de patiënt:
- beperkte effectiviteit van opioïden bij chronische pijn, vanwege de grote sensitisatiecomponent
- de sensitisatiecomponent neemt ten gevolge van het opioïdgebruik zelfs toe (hyperalgesie), waardoor de patiënt nog gevoeliger wordt voor pijnprikkels. Zo ontstaat een vicieuze cirkel die doorbroken kan worden door het gebruik af te bouwen, en te stoppen
- langdurig opioïdgebruik heeft per saldo een negatieve invloed op de kwaliteit van leven
- door de dosering af te bouwen nemen de bijwerkingen af en neemt de pijn in het algemeen niet, of slechts kortdurend, toe. De pijn kan ook afnemen.
Uitgangsvraag
Wat is het effect van het (geheel of gedeeltelijk) afbouwen van opioïden na langdurig gebruik door patiënten met chronische pijn op voor de patiënt relevante uitkomsten (pijn, functioneren, kwaliteit van leven)?
Achtergrond
Langdurig opioïdgebruik door patiënten met chronische pijn heeft nadelen: de effectiviteit is beperkt, terwijl er wel bijwerkingen kunnen optreden. Afbouwen van opioïden vermindert de bijwerkingen. Patiënten kunnen echter huiverig zijn om opioïden af te bouwen vanwege angst voor toename van de pijn, en daarmee samenhangende afname van functioneren en kwaliteit van leven. Het is echter onbekend wat voor effect afbouwen met opioïden op deze uitkomsten heeft.
Resultaten
Onderzoekskarakteristieken
Voor het beantwoorden van deze vraag is gebruikgemaakt van een systematische review naar onder andere de effecten van dosisreductie of stoppen van langdurige opioïdtherapie bij patiënten met chronische pijn. Er werden 40 onderzoeken (n = 7935) geïncludeerd die het effect hiervan onderzochten op voor de patiënt relevante uitkomsten: 5 RCT’s, 6 observationele onderzoeken met controlegroep en 29 observationele onderzoeken zonder controlegroep. De interventies die onderzocht werden, waren zeer divers: verschillende interdisciplinaire pijnprogramma’s, maar ook bijvoorbeeld ondersteuning door buprenorfine of ketamine, acupunctuur of gedragsmatige interventies. Slechts 5 onderzoeken werden uitgevoerd in de eerste lijn.
Effecten
- Pijn: 36 onderzoeken (n = 7674). Acht onderzoeken waren van redelijke methodologische kwaliteit; deze rapporteerden alle 8 een verbetering van de pijn. Achtentwintig onderzoeken waren van slechte methodologische kwaliteit; hiervan rapporteerden er 21 een verbetering van de pijn, 4 geen verschil, en 3 een verergering van de pijn (kwaliteit van bewijs: zeer laag).
- Functioneren: 17 onderzoeken (n = 4809). Vijf onderzoeken waren van redelijke methodologische kwaliteit; deze rapporteerden alle 5 een verbeterd functioneren. Twaalf onderzoeken waren van slechte methodologische kwaliteit; hiervan rapporteerden er 8 een verbeterd functioneren, 2 geen verschil en 2 een verminderd functioneren (kwaliteit van bewijs: zeer laag).
- Kwaliteit van leven: 12 onderzoeken (n = 2880). Drie onderzoeken waren van redelijke methodologische kwaliteit; deze rapporteerden alle 3 een verbeterde kwaliteit van leven. Negen onderzoeken waren van slechte methodologische kwaliteit; hiervan rapporteerden er 4 een verbeterde kwaliteit van leven, 4 geen verschil en 1 een verslechterde kwaliteit van leven (kwaliteit van bewijs: zeer laag).
Overwegingen
De meeste onderzoeken lieten een gunstig effect zien op pijn, functioneren en kwaliteit van leven na het stoppen met of reduceren van opioïden na langdurig gebruik door patiënten met chronische pijn. De kwaliteit van bewijs was echter zeer laag: er waren methodologische beperkingen, met name het ontbreken van controlegroepen; daarnaast was er sprake van heterogeniteit tussen de onderzoeken wat betreft interventies en populaties, mogelijk beperkte toepasbaarheid op de huisartsenzorg en ook zijn er geen kwantitatieve resultaten gerapporteerd. De onderzoeken van redelijke kwaliteit lieten alle een verbetering zien op de onderzochte uitkomstmaten.
Conclusies
We zijn onzeker (kwaliteit van bewijs: zeer laag), maar er zijn aanwijzingen dat verminderen van of stoppen met opioïden na langdurig gebruik door patiënten met chronische pijn leidt tot afname van de pijn en verbetering van het functioneren en de kwaliteit van leven.
Aanpak afbouw van opioïden
Naar Samenvatting ›Er is consensus dat opioïdgebruik geleidelijk afgebouwd dient te worden, om het risico op ontwenningsverschijnselen te beperken.
Het is niet mogelijk op basis van wetenschappelijk bewijs een aanbeveling te geven over:
- specifieke afbouwschema’s, qua termijn tussen afbouwstappen of qua grootte van de afbouwstappen
- adjuvante medicamenteuze behandeling, bijvoorbeeld met methadon of clonidine, ter vergroting van de slagingskans van het afbouwen
- adjuvante niet-medicamenteuze behandeling, bijvoorbeeld cognitieve gedragstherapie, mindfulness, ontspanningsoefeningen, ter vergroting van de slagingskans van het afbouwen
Specifiek afbouwschema
Er is geen gerandomiseerd onderzoek naar de effecten van een bepaald afbouwschema. Op basis van het bewijs kan daarom geen aanbeveling gegeven worden over een specifiek afbouwschema.
Wel is er consensus dat afbouwen individueel moet worden aangepast. Een afbouwschema waarbij gebruik wordt gemaakt van bestaande doseringen van het gebruikte opioïd kan daarbij houvast bieden, zowel voor de huisarts als voor de patiënt.
Aanvullende medicamenteuze behandeling
Het enige onderzoek dat is gevonden over adjuvante medicamenteuze behandeling bij het afbouwen van opioïden onderzocht het effect van varenicline. Dit onderzoek was echter zo klein dat we onzeker zijn over de effecten, veiligheid en bijwerkingen van varenicline bij het afbouwen van opioïden. Bovendien is varenicline niet geregistreerd voor deze indicatie, waardoor ook de wettelijke autoriteiten geen afweging tussen effectiviteit en veiligheid bij deze indicatie uitgevoerd hebben. Voor overige medicatie is er geen onderzoek gevonden, waardoor we hierover geen aanbeveling kunnen geven.
Aanvullende niet-medicamenteuze behandeling
Er is geen onderzoek gevonden naar de effecten van een niet-medicamenteuze interventie als ondersteuning bij het afbouwen van opioïden. Daarom kunnen we hierover geen aanbeveling doen.
Voor- en nadelen
Specifiek afbouwschema
Welke afbouwsnelheid en dosisverlaging per keer de voorkeur verdienen bij het afbouwen van opioïden is niet onderzocht.
In theorie is de verwachting dat hoe geleidelijker patiënten de dosering verlagen, hoe minder zij last zullen hebben van ontwenningsverschijnselen. Een snel afbouwschema heeft in theorie als voordeel dat de patiënt sneller van het opioïd af kan zijn, maar een mogelijk nadeel is het risico dat er meer ontwenningsverschijnselen optreden, en mogelijk ook het risico dat de patiënt daardoor de dosering van opioïd weer verhoogt. Een langzamer afbouwschema heeft als mogelijk voordeel dat er minder ontwenningsverschijnselen optreden. Het nadeel is dat het afbouwen langer duurt.
Varenicline
We zijn onzeker over de voordelen (effectiviteit) van varenicline op grond van het onderzoek bij het afbouwen van opioïden. Ook over de nadelen (bijvoorbeeld over de veiligheid en bijwerkingen) biedt het onderzoek te weinig gegevens. Nadelen zijn er echter wel degelijk. Ten eerste zijn er voor patiënten met psychiatrische comorbiditeit en patiënten met hart- en vaatziekten zorgen over de veiligheid, omdat varenicline bij hen mogelijk voor een toename van de klachten zorgt. Dit is relevant, omdat psychiatrische comorbiditeit mogelijk relatief vaker voorkomt bij patiënten die afhankelijk zijn van opioïden. Ten tweede komen volgens de KNMP Kennisbank bijwerkingen, vooral misselijkheid, regelmatig voor bij vareniclinegebruik.
Een ander nadeel is dat varenicline niet geregistreerd is voor ondersteuning bij het afbouwen van opioïden en dus off-label is.
Overige interventies
Over andere medicatie en niet-medicamenteuze behandelingen is geen onderzoek gevonden.
Kwaliteit van bewijs
De kwaliteit van bewijs was zeer laag voor varenicline. Over andere interventies is geen onderzoek gevonden.
Waarden en voorkeuren van patiënten
Specifiek afbouwschema
De werkgroep verwacht dat patiënten prijs stellen op het afbouwen aan de hand van een afbouwschema. Hoewel er geen onderzoek verricht is naar een bepaald afbouwschema, kan een afbouwschema houvast geven. We verwachten dat patiënten voorkeur hebben voor een afbouwschema dat in samenspraak met hen is opgesteld en rekening houdt met hun voorkeuren.
Aanvullende medicamenteuze behandeling
We zijn onzeker zijn over de effectiviteit van varenicline bij het afbouwen van opioïden, terwijl er wel bijwerkingen kunnen optreden en er zorgen zijn over de veiligheid. Andere medicatie is niet onderzocht. Daarom denken we dat de meeste patiënten niet voor medicamenteuze ondersteuning bij het afbouwen van opioïden zullen kiezen (inschatting van de werkgroep).
Aanvullende niet-medicamenteuze behandeling
Het aanleren van ontspanningsoefeningen, mindfulness of wandelen helpen mogelijk bij het omgaan met ontwenningsverschijnselen, ook al ontbreekt wetenschappelijk bewijs voor de effectiviteit hiervan. De werkgroep schat in dat een deel van de patiënten hiervoor zal kiezen.
Kosten
De kosten van de interventies zijn niet bepaald.
De directe kosten voor het afbouwen met bestaande doseereenheden zijn naar verwachting lager dan de kosten voor het afbouwen met taperingstrips. De indirecte kosten hangen af van de effectiviteit en die is niet bekend.
Aanvaardbaarheid
Specifiek afbouwschema
Een afbouwschema is voor patiënten aanvaardbaar als het in samenspraak met hen is opgesteld en niet te star wordt toegepast. Zo moet het mogelijk zijn om bijvoorbeeld bij veel onttrekkingsverschijnselen een pauze in te lassen (de dosis te stabiliseren).
Aanvullende medicamenteuze behandeling
Aangezien er geen bewijs is voor de werking van varenicline bij het afbouwen van opioïden, er wel mogelijke nadelen zijn, en het middel niet geregistreerd is voor deze indicatie, zal varenicline voor de meeste huisartsen en patiënten niet aanvaardbaar zijn. Ditzelfde geldt voor andere medicatie.
Aanvullende niet-medicamenteuze behandeling
Interventies zoals mindfulness, ontspanningsoefeningen of cognitieve gedragstherapie zullen voor veel huisartsen en patiënten aanvaardbaar zijn.
Haalbaarheid
Specifiek afbouwschema
Het is haalbaar om een afbouwschema met bestaande doseringen van opioïden op te stellen in samenspraak met de patiënt. Afbouwschema’s met taperingstrips zijn minder haalbaar, door onder meer praktische problemen rondom de productie en vergoeding.
Aanvullende medicamenteuze en niet-medicamenteuze behandeling
Geen bijzonderheden.
Uitgangsvraag
Uitgangsvraag
Welke aanpak is aan te bevelen bij patiënten in de eerste lijn die opioïden gaan afbouwen na langdurig gebruik?
Voor deze uitgangsvraag hebben we 3 subvragen geformuleerd:
- Is een specifiek afbouwschema aan te bevelen (voor PICO, zie PICO-tabel 1)?
- Is aanvullende medicamenteuze behandeling aan te bevelen (voor PICO, zie PICO-tabel 2)?
- Is aanvullende niet-medicamenteuze behandeling aan te bevelen (voor PICO, zie PICO-tabel 3)?
|
Patiënten |
Volwassen patiënten in de eerste lijn die opioïden gaan afbouwen na langdurig gebruik |
|---|---|
|
Interventie |
Bepaald afbouwschema, met daarin aandacht voor:
|
|
Vergelijking |
|
|
Uitkomstmaten |
|
|
Patiënten |
Volwassen patiënten in de eerste lijn die opioïden gaan afbouwen na langdurig gebruik |
|---|---|
|
Interventie |
Aanvullende medicamenteuze behandeling met bijvoorbeeld methadon of clonidine |
|
Vergelijking |
Placebo |
|
Uitkomstmaten |
|
|
Patiënten |
Volwassen patiënten in de eerste lijn die opioïden gaan afbouwen na langdurig gebruik |
|---|---|
|
Interventie |
Aanvullende niet-medicamenteuze behandeling met bijvoorbeeld:
|
|
Vergelijking |
Geen aanvullende behandeling of sham-behandeling |
|
Uitkomstmaten |
|
Achtergrond
Chronisch gebruik van opioïden kent vele bezwaren, terwijl opioïden nauwelijks pijnstillende effecten hebben op de langere termijn. Er zijn verschillende aanwijzingen dat afbouwen van opioïden na langdurig gebruik niet hoeft te leiden tot toename van pijn en mogelijk zelfs leidt tot afname van pijn, toename van functie en verbeterde kwaliteit van leven. Daarom is het in bepaalde gevallen aan te bevelen om opioïden af te bouwen. Het is alleen niet goed bekend hoe dat afbouwen het beste aan te pakken is bij patiënten die langdurig opioïden gebruiken en de huisarts heeft hier weinig handvatten voor. Uit observationeel onderzoek zijn er aanwijzingen dat het opstellen van een afbouwplan de kans op succesvol afbouwen in de eerste lijn vergroot. Het is echter niet duidelijk welk afbouwschema is aan te bevelen. Daarnaast is het niet duidelijk of aanvullende medicamenteuze behandeling, bijvoorbeeld met methadon of clonidine, de slagingskans op afbouwen vergoot. Ook is niet duidelijk of aanvullende niet-medicamenteuze behandeling, bijvoorbeeld met ontspanningsoefeningen, mindfulness of cognitieve gedragstherapie, is aan te bevelen als ondersteuning bij het afbouwen.
Methoden
Er is een systematische literatuurzoekactie naar SR’s en RCT’s uitgevoerd in PubMed en Embase in september 2020 met een update in mei 2021.
Resultaten
Resultaat zoekactie
De zoekactie leverde een systematische review op naar afbouwen van opioïden bij patiënten met chronische niet-kankerpijn. Een aanvullende search na de zoekdatum van dit literatuuronderzoek (januari 2020) leverde geen aanvullende onderzoeken op. Ook de update in mei 2021 leverde geen aanvullende onderzoeken op.
Onderzoekskarakteristieken
In de SR van Mathieson zijn 10 RCT’s geïncludeerd naar diverse interventies voor het afbouwen van opioïden bij patiënten met chronische niet-kankerpijn. Geen enkele RCT onderzocht de effecten van alleen een specifiek afbouwschema vergeleken met geen afbouwschema of een ander afbouwschema of de effecten van een niet-medicamenteuze interventie als ondersteuning bij afbouwen. Er werd 1 onderzoek geïncludeerd waarin varenicline werd vergeleken met placebo. Er werden geen placebogecontroleerde onderzoeken naar andere middelen (bijvoorbeeld methadon of clonidine) geïncludeerd.
Effectiviteit en bijwerkingen
Specifiek afbouwschema
Er werd geen RCT gevonden waarin de effectiviteit van een afbouwschema (vergeleken met geen afbouwschema of een ander afbouwschema) werd onderzocht.
Aanvullende medicamenteuze behandeling
Zie de tabel voor de samenvatting van de resultaten van varenicline als ondersteuning bij het afbouwen van opioïden.
Het onderzoek biedt over de nadelen (bijvoorbeeld over de veiligheid en bijwerkingen) geen gegevens en/of is niet opgezet deze aan te tonen. Nadelen zijn er echter wel degelijk. Ten eerste zijn er voor patiënten met psychiatrische comorbiditeit en patiënten met hart- en vaatziekten zorgen over de veiligheid, omdat varenicline bij hen mogelijk voor een toename van de klachten zorgt. Ten tweede komen milde bijwerkingen, vooral misselijkheid, regelmatig voor bij vareniclinegebruik (KNMP Kennisbank, geraadpleegd mei 2021).
Er is geen vergelijkend onderzoek gevonden naar andere medicatie als ondersteuning bij het afbouwen van opioïden.
Aanvullende niet-medicamenteuze behandeling
Er werd geen RCT gevonden waarin de effectiviteit van een niet-medicamenteuze interventie als ondersteuning bij het afbouwen van opioïden werd onderzocht.
Conclusies
Specifiek afbouwschema
Geen onderzoeken gevonden.
Varenicline vergeleken met placebo
We zijn onzeker over verschillen in pijn, afbouwduur, onttrekkingsverschijnselen en bijwerkingen. De overige uitkomstmaten (aantal patiënten dat stopt met opioïden, dosering van opioïden, herstart opioïdgebruik, kwaliteit van leven en sterfte) zijn niet onderzocht.
Andere aanvullende medicamenteuze behandeling vergeleken met placebo
Geen onderzoeken gevonden.
Aanvullende niet-medicamenteuze behandeling
Geen onderzoeken gevonden.
Adviezen bij afbouwen van opioïden
Naar Samenvatting ›Op basis van consensus gelden de volgende adviezen:
- Bespreek met patiënten een haalbaar doel: tot een bepaalde dosering afbouwen of stoppen.
- Stel in overleg met de patiënt een afbouwschema op. Verlaag de dosering in principe elke week met 10-25%, en ga uit van beschikbare doseereenheden. Hanteer een geleidelijker schema naarmate het gebruik langduriger is geweest, of als de patiënt hier de voorkeur aan geeft. Zie voor voorbeeldschema’s de Handreiking afbouw opioïden.
- Informeer de patiënt over te verwachten ontwenningsverschijnselen, bijvoorbeeld:
- angst- en spanningsklachten
- rusteloosheid, zich uitend in (extreme) bewegingsdrang
- prikkelbaarheid
- spierpijn, vooral in rug en benen
- dysforie
- misselijkheid, braken, diarree
- tranende ogen, loopneus
- zweten
- slaapklachten
- Bespreek de mogelijkheden om met (de meeste) ontwenningsverschijnselen om te gaan, bijvoorbeeld het aanleren van ontspanningsoefeningen, mindfulness of wandelen, ook al ontbreekt wetenschappelijk bewijs voor de effectiviteit hiervan.
- Bespreek behandelmogelijkheden bij eventueel optredende pijn, conform het beleid bij chronische pijn (zie Beleid bij chronische pijn).
- Adviseer de patiënt een sociaal vangnet te organiseren bij gezin/familie/vrienden/collega’s door hen te informeren over het afbouwen, te verwachten ontwenningsverschijnselen en te vragen om steun als dat nodig is.
Bovenstaande adviezen zijn ook van toepassing op patiënten die langdurig tramadol hebben gebruikt en ontwenningsverschijnselen vertonen bij het afbouwen.
De adviezen bij het afbouwen van opioïden na langdurig gebruik zijn tot stand gekomen op basis van consensus van de werkgroep. Hierbij sluiten we aan bij de Handreiking afbouw opioïden. Deze handreiking is ontwikkeld in het kader van het project Gepast gebruik van opioïden. De opdrachtgever van dit project is het ministerie van VWS. De handreiking is gebaseerd op internationale richtlijnen en expert opinion en is opgesteld door medewerkers van het Radboudumc, het Nijmegen Institute for Scientist Practitioners in Addiction (NISPA), de Sint Maartenskliniek en het Instituut Verantwoord Medicijngebruik, met medewerking van de Taakgroep Gepast gebruik van opioïden. In deze taakgroep hebben vertegenwoordigers van het NHG, de wetenschappelijke verenigingen van anesthesiologen (NVA) en van verslavingsartsen (VVGN), de KNMP, de NVZA (ziekenhuisapothekers) en de Patiëntenfederatie Nederland zitting, aangevuld met experts uit bijvoorbeeld de psychiatrie. Zie voor meer informatie Opiaten - Handreiking zorgverleners voor afbouw opioïden en Instituut Verantwoord Medicijngebruik.
Controles
Naar Samenvatting ›- Spreek regelmatige controles af, bijvoorbeeld voorafgaand aan elke afbouwstap in het schema, en besteed aandacht aan de ervaren ontwenningsverschijnselen en pijn.
- Bij ontwenningsverschijnselen:
- overweeg de volgende afbouwstap uit te stellen. Verhoog de dosering niet.
- geef gericht advies ter vermindering van de ontwenningsverschijnselen, bij voorkeur niet-medicamenteus. Bij angst en spanning kan het bijvoorbeeld helpen om afleiding te zoeken of ontspanningsoefeningen te doen. Bij rusteloosheid kan het helpen om te sporten of te wandelen. Zie ook de NHG-Standaarden Angst, Slaapproblemen en slaapmiddelen en Acute diarree, en de NHG-Behandelrichtlijn Misselijkheid en braken.
- Bij pijn: volg de richtlijnen voor het Beleid bij chronische pijn.
- Na de laagste dosering kan de patiënt het gebruik helemaal stoppen. Dit is vaak de moeilijkste stap. Stel deze stap eventueel in overleg met de patiënt uit.
Samenwerking, consultatie en verwijzing
Naar Samenvatting ›Stem met eventuele betrokken andere behandelaars af wie de regie voert over het opioïdgebruik. Stem ook het afbouwen en stoppen van opioïden af.
Verwijs patiënten die gemotiveerd zijn om af te bouwen naar een verslavingsarts (of consulteer deze):
- bij wie een eerste afbouwpoging in de huisartsenpraktijk is mislukt
- met ernstige verslavingsproblematiek en/of ernstige psychiatrische comorbiditeit
- bij twijfels of vragen
Referenties
- Vereniging Samenwerkingsverband Pijnpatiënten naar één stem. Zorgstandaard Chronische Pijn (2017). Ga naar bron: Vereniging Samenwerkingsverband Pijnpatiënten naar één stem. Zorgstandaard Chronische Pijn (2017).
- Raja SN, Carr DB, Cohen M, Finnerup NB, Flor H, Gibson S, et al. The revised International Association for the Study of Pain definition of pain: concepts, challenges, and compromises. Pain 2020;161:1976-82.
- Van Kleef M, Vreeling FW. Pijn en pijnbehandeling: een basaal onderwijscurriculum. Maastricht: Universitaire Pers;, 1999.
- Paller CJ, Campbell CM, Edwards RR, Dobs AS. Sex-based differences in pain perception and treatment. Pain Med 2009;10:289-99.
- Leresche L. Defining gender disparities in pain management. Clin Orthop Relat Res 2011;469:1871-7.
- Isacson D, Bingefors K. Epidemiology of analgesic use: a gender perspective. Eur J Anaesthesiol Suppl 2002;26:5-15.
- Barnabe C, Bessette L, Flanagan C, Leclercq S, Steiman A, Kalache F, et al. Sex differences in pain scores and localization in inflammatory arthritis: a systematic review and metaanalysis. J Rheumatol 2012;39:1221-30.
- Bekkering GE, Bala MM, Reid K, Kellen E, Harker J, Riemsma R, et al. Epidemiology of chronic pain and its treatment in The Netherlands. Neth J Med 2011;69:141-53.
- Regieraad Kwaliteit van Zorg. Chronische pijn (2011). Ga naar bron: Regieraad Kwaliteit van Zorg. Chronische pijn (2011).
- Sommer M, De Rijke JM, Van Kleef M, Kessels AGH, Peters ML, Geurts JWJM, et al. The prevalence of postoperative pain in a sample of 1490 surgical inpatients. Eur J Anaesthesiol 2008;25:267-74.
- Gramke HF, De Rijke JM, Van Kleef M, Raps F, Kessels AGH, Peters ML, et al. The prevalence of postoperative pain in a cross-sectional group of patients after day-case surgery in a university hospital. Clin J Pain 2007;23:543-8.
- Berben SA, Meijs TH, van Dongen RT, van Vugt AB, Vloet LC, Mintjes-de Groot JJ, van Achterberg T. Pain prevalence and pain relief in trauma patients in the Accident & Emergency department. Injury. 2008 May;39(5):578-85. PubMed PMID: 17640644.
- Van den Beuken-Van Everdingen M, De Rijke JM, Kessels AG, Schouten HC, Van Kleef M, Patijn J. High prevalence of pain in patients with cancer in a large population-based study in The Netherlands. Pain 2007;132:312-20.
- Elliott AM, Smith BH, Penny KI, Smith WC, Chambers WA. The epidemiology of chronic pain in the community. Lancet 1999;354:1248-52.
- De Graeff A, Besse TC, Krol RJA. Pijn. Landelijke richtlijn 2.1 (2016). Ga naar bron: De Graeff A, Besse TC, Krol RJA. Pijn. Landelijke richtlijn 2.1 (2016).
- Gilron I, Watson CP, Cahill CM, Moulin DE. Neuropathic pain: a practical guide for the clinician. CMAJ 2006;175:265-75.
- Torrance N, Smith BH, Bennett MI, Lee AJ. The epidemiology of chronic pain of predominantly neuropathic origin. Results from a general population survey. J Pain 2006;7:281-9.
- Latremoliere A, Woolf CJ. Central Sensitization: a Generator of Pain Hypersensitivity by Central Neural Plasticity. J Pain 2009;10:895-926.
- Woolf CJ. Central sensitization: implications for the diagnosis and treatment of pain. Pain 2011;152:S2-S15.
- Verenso. Multidisciplinaire richtlijn Pijn. Herkenning en behandeling van pijn bij kwetsbare ouderen. Deel 1, 2 en 3 (2011). Ga naar bron: Verenso. Multidisciplinaire richtlijn Pijn. Herkenning en behandeling van pijn bij kwetsbare ouderen. Deel 1, 2 en 3 (2011).
- Scudds RJ, Ostbye T. Pain and pain-related interference with function in older Canadians: the Canadian Study of Health and Aging. Disabil Rehabil 2001;23:654-64.
- Heesch KC, Miller YD, Brown WJ. Relationship between physical activity and stiff or painful joints in mid-aged women and older women: a 3-year prospective study. Arthritis Res Ther 2007;9:R34.
-
Arola HM, Nicholls E, Mallen C, Thomas E. Self-reported pain interference and symptoms of anxiety and depression in community-dwelling older adults: can a temporal relationship be determined? Eur J Pain. 2010 Oct;14(9):966-71.
doi: 10.1016/j.ejpain.2010.02.012. Epub 2010 Apr 8. PubMed PMID: 20381389. - Schieir O, Thombs BD, Hudson M, Taillefer S, Steele R, Berkson L, et al. Symptoms of depression predict the trajectory of pain among patients with early inflammatory arthritis: a path analysis approach to assessing change. J Rheumatol 2009;36:231-9.
- Tunks ER, Crook J, Weir R. Epidemiology of chronic pain with psychological comorbidity: prevalence, risk, course, and prognosis. Can J Psychiatry 2008;53:224-34.
- Bair MJ, Wu J, Damush TM, Sutherland JM, Kroenke K. Association of depression and anxiety alone and in combination with chronic musculoskeletal pain in primary care patients. Psychosom Med 2008;70:890-7.
- Meeks TW, Dunn LB, Kim DS, Golshan S, Sewell DD, Atkinson JH, et al. Chronic pain and depression among geriatric psychiatry inpatients. Int J Geriatr Psychiatry 2008;23:637-42.
- Gerrits M, Van Oppen P, Leone S, Van Marwijk H, Van Der Horst H, Penninx B. Pain, not chronic disease, is associated with the recurrence of depressive and anxiety disorders. BMC Psychiatry 2014;14:187.
- Hall-Lord ML, Larsson G, Steen B. Chronic pain and distress among elderly in the community: comparison of patients’ experiences with enrolled nurses’ assessments. J Nurs Manag 1999;7:45-54.
- Blomqvist K, Hallberg IR. Pain in older adults living in sheltered accommodation--agreement between assessments by older adults and staff. J Clin Nurs 1999;8:159-69.
- Werner P, Cohen-Mansfield J, Watson V, Pasis S. Pain in participants of adult day care centers: assessment by different raters. J Pain Symptom Manage 1998;15:8-17.
- Blomqvist K. Older people in persistent pain: nursing and paramedical staff perceptions and pain management. J Adv Nurs 2003;41:575-84.
- Scherder E, Van Manen F. Pain in Alzheimer’s disease: nursing assistants’ and patients’ evaluations. J Adv Nurs 2005;52:151-8.
- Cohen-Mansfield J. Relatives’ assessment of pain in cognitively impaired nursing home residents. J Pain Symptom Manage 2002;24:562-71.
- Hjermstad MJ, Fayers PM, Haugen DF, Caraceni A, Hanks GW, Loge JH, et al; European Palliative Care Research Collaborative (EPCRC). Studies comparing Numerical Rating Scales, Verbal Rating Scales, and Visual Analogue Scales for assessment of pain intensity in adults: a systematic literature review. J Pain Symptom Manage 2011;41:1073-93.
- Bouhassira D, Attal N. Diagnosis and assessment of neuropathic pain: the saga of clinical tools. Pain 2011;152:S74-S83.
- Koffeman AR, Valkhoff VE, Celik S, Jong GW, Sturkenboom MC, Bindels PJ, et al. High-risk use of over-the-counter non-steroidal anti-inflammatory drugs: a population-based cross-sectional study. Br J Gen Pract 2014;64:e191-e8.
- WHO. Cancer pain relief (1986). World Health Organization. Ga naar bron: WHO. Cancer pain relief (1986). World Health Organization.
- Eisenberg E, Marinangeli F, Birkhahn J, Paladini A, Varrassi G. Time to modify the WHO analgesic ladder? Pain: Clinical Updates (International Association for The Study of Pain) 2005;13:1-4.
- Towheed TE, Maxwell L, Judd MG, Catton M, Hochberg MC, Wells G. Acetaminophen for osteoarthritis. Cochrane Database Syst Rev 2006:CD004257.
- Toms L, Mcquay HJ, Derry S, Moore RA. Single dose oral paracetamol (acetaminophen) for postoperative pain in adults. Cochrane Database Syst Rev 2008:CD004602.
- Chan AT, Manson JE, Albert CM, Chae CU, Rexrode KM, Curhan GC, et al. Nonsteroidal Antiinflammatory Drugs, Acetaminophen, and the Risk of Cardiovascular Events. Circulation 2006;113:1578-87.
- Curhan GC, Bullock AJ, Hankinson SE, Willett WC, Speizer FE, Stampfer MJ. Frequency of use of acetaminophen, nonsteroidal anti-inflammatory drugs, and aspirin in US women. Pharmacoepidemiol Drug Saf 2002;11:687-93.
- De Vries F, Setakis E, Van Staa TP. Concomitant use of ibuprofen and paracetamol and the risk of major clinical safety outcomes. Br J Clin Pharmacol. 2010;70:429-38.
- García Rodriguez LA, Hernández-Díaz S. Relative risk of upper gastrointestinal complications among users of acetaminophen and nonsteroidal anti-inflammatory drugs. Epidemiology 2001;12:570-6.
- Rahme E, Pettitt D, Lelorier J. Determinants and sequelae associated with utilization of acetaminophen versus traditional nonsteroidal antiinflammatory drugs in an elderly population. Arthritis Rheum 2002;46:3046-54.
- Rahme E, Barkun A, Nedjar H, Gaugris S, Watson D. Hospitalizations for upper and lower GI events associated with traditional NSAIDs and acetaminophen among the elderly in Quebec, Canada. Am J Gastroenterol 2008;103:872-82.
- De Abajo FJ, Gil MJ, Bryant V, Timoner J, Oliva B, Garcia-Rodriguez LA. Upper gastrointestinal bleeding associated with NSAIDs, other drugs and interactions: a nested case-control study in a new general practice database. Eur J Clin Pharmacol 2013;69:691-701.
- Curhan GC, Knight EL, Rosner B, Hankinson SE, Stampfer MJ. Lifetime nonnarcotic analgesic use and decline in renal function in women. Arch Intern Med 2004;164:1519-24.
- Kurth T, Glynn RJ, Walker AM, Rexrode KM, Buring JE, Stampfer MJ, et al. Analgesic use and change in kidney function in apparently healthy men. Am J Kidney Dis. 2003;42:234-44.
- Evans M, Fored CM, Bellocco R, Fitzmaurice G, Fryzek JP, Mclaughlin JK, et al. Acetaminophen, aspirin and progression of advanced chronic kidney disease. Nephrol Dial Transplant 2009;24:1908-18.
- Lipworth L, Friis S, Mellemkjaer L, Signorello LB, Johnsen SP, Nielsen GL, et al. A population-based cohort study of mortality among adults prescribed paracetamol in Denmark. J Clin Epidemiol 2003;56:796-801.
- Roberts E, Delgado Nunes V, Buckner S, Latchem S, Constanti M, Miller P, et al. Paracetamol: not as safe as we thought? A systematic literature review of observational studies. Ann Rheum Dis 2015.
- Machado GC, Maher CG, Ferreira PH, Pinheiro MB, Lin CW, Day RO, et al. Efficacy and safety of paracetamol for spinal pain and osteoarthritis: systematic review and meta-analysis of randomised placebo controlled trials. BMJ 2015;350:h1225.
- Hahn TW, Mogensen T, Lund C, Schouenborg L, Rasmussen M. High-dose rectal and oral acetaminophen in postoperative patients--serum and saliva concentrations. Acta Anaesthesiol Scand 2000;44:302-6.
- Stocker ME, Montgomery JE. Serum paracetamol concentrations in adult volunteers following rectal administration. Br J Anaesth 2001;87:638-40.
- Kvalsvik O, Borchgrevink PC, Hagen L, Dale O. Randomized, double-blind, placebo-controlled study of the effect of rectal paracetamol on morphine consumption after abdominal hysterectomy. Acta Anaesthesiol Scand 2003;47:451-6.
- Stocker ME, Montgomery JE. Rectal paracetamol dosages. A response to ‘Plasma paracetamol concentrations after different doses of rectal paracetamol in older children. A comparison of 1 g vs. 40 mg x kg(-1)’, Howell TK, Patel D, Anaesthesia 2003; 58: 69-72. Anaesthesia 2003;58:618.
- Van der Marel CD, Van Lingen RA, Pluim MA, Scoones G, Van Dijk M, Vaandrager JM, et al. Analgesic efficacy of rectal versus oral acetaminophen in children after major craniofacial surgery. Clin Pharmacol Ther 2001;70:82-90.
- Beck DH, Schenk MR, Hagemann K, Doepfmer UR, Kox WJ. The pharmacokinetics and analgesic efficacy of larger dose rectal acetaminophen (40 mg/kg) in adults: a double-blinded, randomized study. Anesth Analg 2000;90:431-6.
- Holmer PP, Jakobsson J, Owall A. Plasma concentrations following repeated rectal or intravenous administration of paracetamol after heart surgery. Acta Anaesthesiol Scand 2006;50:673-7.
- Howell TK, Patel D. Plasma paracetamol concentrations after different doses of rectal paracetamol in older children. A comparison of 1 g vs. 40 mg x kg(-1). Anaesthesia 2003;58:69-73.
- Altman RD, Hochberg MC, Moskowitz RW. American College of Rheumatology subcommittee on osteoarthritis guidelines. Arthritis Rheum 2000;43:1905-15.
- Bolesta S, Haber SL. Hepatotoxicity associated with chronic acetaminophen administration in patients without risk factors. Ann. Pharmacother. 2002;36:331-3.
- Bond GR, Hite LK. Population-based incidence and outcome of acetaminophen poisoning by type of ingestion. Acad Emerg Med 1999;6:1115-20.
- Dukes MNG. Meyler's side effects of drugs. Amsterdam: Elsevier, 1999.
- Kramer H, Van der Vaart H, Koëter GH. Paracetamol bij chronisch alcoholgebruik: weinig is voor de lever snel teveel. Ned Tijdschr Geneeskd 2002;146:540-1; author reply 1.
- Lane JE, Belson MG, Brown DK, Scheetz A. Chronic acetaminophen toxicity: a case report and review of the literature. J Emerg Med 2002;23:253-6.
- Mortensen ME, Cullen JL. Comment: hepatotoxicity associated with chronic acetaminophen administration in patients without risk factors. Ann Pharmacother 2002;36:1481-2; author reply 2-3.
- Van Mil AH, Janssens AR. Paracetamol bij chronisch alcoholgebruik: weinig is voor de lever snel teveel. Ned Tijdschr Geneeskd 2001;145:1873-6.
- Vitols S. Paracetamol hepatotoxicity at therapeutic doses. J Intern Med 2003;253:95-8.
- Whitcomb DC, Block GD. Association of acetaminophen hepatotoxicity with fasting and ethanol use. JAMA 1994;272:1845-50.
- Kurtovic J, Riordan SM. Paracetamol-induced hepatotoxicity at recommended dosage. J Intern Med 2003;253:240-3.
- KNMP. Informatorium Medicamentorum. Den Haag: KNMP, 2018.
- Pendleton A, Arden N, Dougados M, Doherty M, Bannwarth B, Bijlsma JW, et al. EULAR recommendations for the management of knee osteoarthritis: report of a task force of the Standing Committee for International Clinical Studies Including Therapeutic Trials (ESCISIT). Ann Rheum Dis 2000;59:936-44.DOI: 10.1136/ard.59.12.936.
- KNMP. Handboek verminderde Nierfunctie. Doseringsadviezen voor geneesmiddelen. Den Haag: Geneesmiddel Informatie Centrum van Koninklijke Nederlandse Maatschappij ter bevordering der Pharmacie, KNMP, 2012.
- Derry S, Moore RA, Rabbie R. Topical NSAIDs for chronic musculoskeletal pain in adults. Cochrane Database Syst Rev 2012a;9:CD007400.
- Massey T, Derry S, Moore RA, Mcquay HJ. Topical NSAIDs for acute pain in adults. Cochrane Database Syst Rev 2010:CD007402.
- NICE. Osteoarthritis. Care and management in adults (2014). Ga naar bron: NICE. Osteoarthritis. Care and management in adults (2014).
- Roelofs PD, Deyo RA, Koes BW, Scholten RJ, Van Tulder MW. Non-steroidal anti-inflammatory drugs for low back pain. Cochrane Database Syst Rev 2008:CD000396.
- Bjordal JM, Ljunggren AE, Klovning A, Slordal L. Non-steroidal anti-inflammatory drugs, including cyclo-oxygenase-2 inhibitors, in osteoarthritic knee pain: meta-analysis of randomised placebo controlled trials. BMJ 2004;329:1317.
- Gotzsche PC. NSAIDs. (2010). Ga naar bron: Gotzsche PC. NSAIDs. (2010).
- Wienecke T, Gotzsche PC. Paracetamol versus nonsteroidal anti-inflammatory drugs for rheumatoid arthritis. Cochrane Database Syst Rev 2004:CD003789.
- Bailey E, Worthington HV, Van Wijk A, Yates JM, Coulthard P, Afzal Z. Ibuprofen and/or paracetamol (acetaminophen) for pain relief after surgical removal of lower wisdom teeth. Cochrane Database Syst Rev 2013;12:CD004624.
- Averbuch M, Katzper M. A search for sex differences in response to analgesia. Arch Intern Med 2000;160:3424-8.
- Derry CJ, Derry S, Moore RA. Single dose oral ibuprofen plus paracetamol (acetaminophen) for acute postoperative pain. Cochrane Database Syst Rev 2013a;6:CD010210.
- Whittle BJ. COX-1 and COX-2 products in the gut: therapeutic impact of COX-2 inhibitors. GUT 2000;47:320-5.
- Vonkeman HE, Brouwers JR, Van de Laar MA. Understanding the NSAID related risk of vascular events. BMJ 2006;332:895-8.
- Golden BD, Abramson SB. Selective cyclooxygenase-2 inhibitors. Rheum Dis Clin North Am 1999;25:359-78.
- Hawkey CJ. COX-2 inhibitors. Lancet 1999;353:307-14.
- Wolfe MM, Lichtenstein DR, Singh G. Gastrointestinal toxicity of nonsteroidal antiinflammatory drugs. N Engl J Med 1999;340:1888-99.
- Silverstein FE, Faich G, Goldstein JL, Simon LS, Pincus T, Whelton A, et al. Gastrointestinal toxicity with celecoxib vs nonsteroidal anti-inflammatory drugs for osteoarthritis and rheumatoid arthritis: the CLASS study: a randomized controlled trial. Celecoxib Long-term Arthritis Safety Study. JAMA 2000;284:1247-55.
- Launay-Vacher V, Karie S, Fau JB, Izzedine H, Deray G. Treatment of pain in patients with renal insufficiency: the World Health Organization three-step ladder adapted. J Pain 2005;6:137-48.
- Panneman M, Herings RM. Kengetallen NSAID-gerelateerde gastro-intestinale morbiditeit en mortaliteit. Pharmo Institute, 2001.
- CBO, KVDG. Richtlijn NSAID-gebruik en preventie van maagschade (2003). Ga naar bron: CBO, KVDG. Richtlijn NSAID-gebruik en preventie van maagschade (2003).
- Laporte JR, Ibanez L, Vidal X, Vendrell L, Leone R. Upper gastrointestinal bleeding associated with the use of NSAIDs: newer versus older agents. Drug Saf 2004;27:411-20.
- Hernández-Díaz S, Rodriguez LA. Association between nonsteroidal anti-inflammatory drugs and upper gastrointestinal tract bleeding/perforation: an overview of epidemiologic studies published in the 1990s. Arch Intern Med 2000;160:2093-9.
- Henry D, Lim LL, Garcia Rodriguez LA, Perez GS, Carson JL, Griffin M, et al. Variability in risk of gastrointestinal complications with individual non-steroidal anti-inflammatory drugs: results of a collaborative meta-analysis. BMJ 1996;312:1563-6.
- Coxib and traditional NSAID Trialists' (CNT) Collaboration, Bhala N, Emberson J, Merhi A, Abramson S, Arber N, Baron JA, Bombardier C, Cannon C, Farkouh ME, FitzGerald GA, Goss P, Halls H, Hawk E, Hawkey C, Hennekens C, Hochberg M, Holland LE, Kearney PM, Laine L, Lanas A, Lance P, Laupacis A, Oates J, Patrono C, Schnitzer TJ, Solomon S, Tugwell P, Wilson K, Wittes J, Baigent C. Vascular and upper gastrointestinal effects of non-steroidal anti-inflammatory drugs: meta-analyses of individual participant data from randomised trials. Lancet. 2013 Aug 31;382(9894):769-79. doi: 10.1016/S0140-6736(13)60900-9. Epub 2013 May 30. PubMed PMID: 23726390; PubMed Central PMCID: PMC3778977.
- Krijthe BP, Heeringa J, Hofman A, Franco OH, Stricker BH. Non-steroidal anti-inflammatory drugs and the risk of atrial fibrillation: a population-based follow-up study. BMJ Open 2014;4:e004059.
- Schjerning Olsen AM, Gislason GH, Mcgettigan P, Fosbol E, Sorensen R, Hansen ML, et al. Association of NSAID use with risk of bleeding and cardiovascular events in patients receiving antithrombotic therapy after myocardial infarction. JAMA 2015;313:805-14.
-
Moermond CTA, Montforts MHMM, Roex EWM, Venhuis B.J. Medicijnresten en waterkwaliteit: een update. Rijksinstituut voor Volksgezondheid en Milieu
(RIVM), 2020.
Ga naar bron: Moermond CTA, Montforts MHMM, Roex EWM, Venhuis B.J. Medicijnresten en waterkwaliteit: een update. Rijksinstituut voor Volksgezondheid en Milieu
(RIVM), 2020.
- Farkouh ME, Greenberg JD, Jeger RV, Ramanathan K, Verheugt FW, Chesebro JH, et al. Cardiovascular outcomes in high risk patients with osteoarthritis treated with ibuprofen, naproxen or lumiracoxib. Ann Rheum Dis 2007;66:764-70.
- Vollaard EJ, Kramers CK, Brouwers JR. Interactie NSAID’s en acetylsalicylzuur genegeerd. Ned Tijdschr Geneeskd 2014;158:A7893.
- Oldenkamp I, Brouwers JRBJ, Van Valkenhoef G, Jansen PaF, Van Roon EN. NSAID’s Geneesmiddelbeoordeling voor de kwetsbare oude patiënt in het Farmacotherapeutisch Kompas. Herziene versie 2.1. (2014). Ga naar bron: Oldenkamp I, Brouwers JRBJ, Van Valkenhoef G, Jansen PaF, Van Roon EN. NSAID’s Geneesmiddelbeoordeling voor de kwetsbare oude patiënt in het Farmacotherapeutisch Kompas. Herziene versie 2.1. (2014).
- Hawkey CJ, Jones RH, Yeomans ND, Scheiman JM, Talley NJ, Goldstein JL, et al. Efficacy of esomeprazole for resolution of symptoms of heartburn and acid regurgitation in continuous users of non-steroidal anti-inflammatory drugs. Aliment Pharmacol Ther 2007;25:813-21.
- Rostom A, Dube C, Wells G, Tugwell P, Welch V, Jolicoeur E, et al. Prevention of NSAID-induced gastroduodenal ulcers. Cochrane Database Syst Rev 2002:CD002296.
- Gladding PA, Webster MW, Farrell HB, Zeng IS, Park R, Ruijne N. The antiplatelet effect of six non-steroidal anti-inflammatory drugs and their pharmacodynamic interaction with aspirin in healthy volunteers. Am J Cardiol 2008;101:1060-3.
- Aronson JK. The NSAID roller coaster: more about rofecoxib. Br J Clin Pharmacol 2006;62:257-9.
- Van Puijenbroek EP, Egberts AC, Meyboom RH, Leufkens HG. Different risks for NSAID-induced anaphylaxis. Ann Pharmacother 2002;36:24-9.
- Lareb. Anafylactische reacties op NSAID’s (2005). Nederlands bijwerkingen centrum Lareb.
- Berges-Gimeno MP, Simon RA, Stevenson DD. Long-term treatment with aspirin desensitization in asthmatic patients with aspirin-exacerbated respiratory disease. J Allergy Clin Immunol 2003;111:180-6.
- Lee JY, Simon RA, Stevenson DD. Selection of aspirin dosages for aspirin desensitization treatment in patients with aspirin-exacerbated respiratory disease. J Allergy Clin Immunol 2007;119:157-64.
- Stevenson DD, Simon RA. Selection of patients for aspirin desensitization treatment. J Allergy Clin Immunol 2006;118:801-4.
- Perrott DA, Piira T, Goodenough B, Champion GD. Efficacy and safety of acetaminophen vs ibuprofen for treating children’s pain or fever: a meta-analysis. Arch Pediatr Adolesc Med 2004;158:521-6.
- Pierce CA, Voss B. Efficacy and safety of ibuprofen and acetaminophen in children and adults: a meta-analysis and qualitative review. Ann Pharmacother 2010;44:489-506.
- Bárzaga Arencibia Z, Choonara I. Balancing the risks and benefits of the use of over-the-counter pain medications in children. Drug Saf 2012;35:1119-25.
- Ali S, Drendel AL, Kircher J, Beno S. Pain management of musculoskeletal injuries in children: current state and future directions. Pediatr Emerg Care 2010;26:518-24.
- Wong T, Stang AS, Ganshorn H, Hartling L, Maconochie IK, Thomsen AM, et al. Combined and alternating paracetamol and ibuprofen therapy for febrile children. Cochrane Database Syst Rev 2013;10:CD009572.
- Cukiernik VA, Lim R, Warren D, Seabrook JA, Matsui D, Rieder MJ. Naproxen versus acetaminophen for therapy of soft tissue injuries to the ankle in children. Ann Pharmacother 2007;41:1368-74.
- Standing JF, Savage I, Pritchard D, Waddington M. Diclofenac for acute pain in children. Cochrane Database Syst Rev 2009:CD005538.
- Southey ER, Soares-Weiser K, Kleijnen J. Systematic review and meta-analysis of the clinical safety and tolerability of ibuprofen compared with paracetamol in paediatric pain and fever. Curr Med Res Opin 2009;25:2207-22.
- NKFK. Kinderformularium (2015). Nederlandse Vereniging voor Farmacotherapie bij kinderen. Ga naar bron: NKFK. Kinderformularium (2015). Nederlandse Vereniging voor Farmacotherapie bij kinderen.
- Stone K, Tackley E, Weir S. BET 2: NSAIs and chickenpox. Emerg Med J 2018;35:66-68.
- Marinangeli F, Ciccozzi A, Leonardis M, Aloisio L, Mazzei A, Paladini A, et al. Use of strong opioids in advanced cancer pain: a randomized trial. J Pain Symptom Manage 2004;27:409-16.
- Maltoni M, Scarpi E, Modonesi C, Passardi A, Calpona S, Turriziani A, et al. A validation study of the WHO analgesic ladder: a two-step vs three-step strategy. Support Care Cancer 2005;13:888-94.
- Kean WF, Bouchard S, Roderich GE. Women with pain due to osteoarthritis: the efficacy and safety of a once-daily formulation of tramadol. Pain Med 2009;10:1001-11.
- Vorsanger G, Xiang J, Jordan D, Farrell J. Post hoc analysis of a randomized, double-blind, placebo-controlled efficacy and tolerability study of tramadol extended release for the treatment of osteoarthritis pain in geriatric patients. Clin Ther 2007;29 S:2520-35.
- Vorsanger GJ, Xiang J, Gana TJ, Pascual ML, Fleming RR. Extended-release tramadol (tramadol ER) in the treatment of chronic low back pain. J Opioid Manag 2008;4:87-97.
- Thorne C, Beaulieu AD, Callaghan DJ, O’mahony WF, Bartlett JM, Knight R, et al. A randomized, double-blind, crossover comparison of the efficacy and safety of oral controlled-release tramadol and placebo in patients with painful osteoarthritis. Pain Res Manag 2008;13:93-102.
- Fishman RL, Kistler CJ, Ellerbusch MT, Aparicio RT, Swami SS, Shirley ME, et al. Efficacy and safety of 12 weeks of osteoarthritic pain therapy with once-daily tramadol (Tramadol Contramid OAD). J Opioid Manag 2007;3:273-80.
- Hair PI, Curran MP, Keam SJ. Tramadol extended-release tablets. Drugs 2006;66:2017-27.
- Burch F, Fishman R, Messina N, Corser B, Radulescu F, Sarbu A, et al. A comparison of the analgesic efficacy of Tramadol Contramid OAD versus placebo in patients with pain due to osteoarthritis. J Pain Symptom.Manage. 2007;34:328-38.
- Cepeda MS, Camargo F, Zea C, Valencia L. Tramadol for osteoarthritis: a systematic review and metaanalysis. J Rheumatol 2007;34:543-55.
- Kosinski M, Janagap C, Gajria K, Schein J, Freedman J. Pain relief and pain-related sleep disturbance with extended-release tramadol in patients with osteoarthritis. Curr Med Res Opin 2007;23:1615-26.
- Florete OG, Xiang J, Vorsanger GJ. Effects of extended-release tramadol on pain-related sleep parameters in patients with osteoarthritis. Expert Opin Pharmacother 2008;9:1817-27.
- Beaulieu AD, Peloso P, Bensen W, Clark AJ, Watson CP, Gardner-Nix J, et al. A randomized, double-blind, 8-week crossover study of once-daily controlled-release tramadol versus immediate-release tramadol taken as needed for chronic noncancer pain. Clin Ther 2007;29:49-60.
- Pascual ML, Fleming RR, Gana TJ, Vorsanger GJ. Open-label study of the safety and effectiveness of long-term therapy with extended-release tramadol in the management of chronic nonmalignant pain. Curr Med Res Opin 2007;23:2531-42.
- Bijl D. Tramadol: onthouding en risico van afhankelijkheid. Geneesmiddelenbulletin 2007;41:50.
- Zorginstituut Nederland. Farmacotherapeutisch Kompas (2015). Ga naar bron: Zorginstituut Nederland. Farmacotherapeutisch Kompas (2015).
- Brouwers JRBJ, Delhaas EM. Medicamenteuze behandeling van chronische pijn bij volwassenen. Geneesmiddelenbulletin 1998;32:111-8.
- Aronson MD. Nonsteroidal anti-inflammatory drugs, traditional opioids, and tramadol: contrasting therapies for the treatment of chronic pain. Clin Ther 1997;19:420-32; discussion 367-8.
- Fournier JP, Azoulay L, Yin H, Montastruc JL, Suissa S. Tramadol use and the risk of hospitalization for hypoglycemia in patients with noncancer pain. JAMA Intern Med 2015a;175:186-93.
- Fournier JP, Yin H, Nessim SJ, Montastruc JL, Azoulay L. Tramadol for non-cancer pain and the risk of hyponatremia. Am J Med 2015b;128:418-25.
- Van Luijn JCF. Rapport. Uitstroomadvies Paracetamol-Codeïne (2012). Ga naar bron: Van Luijn JCF. Rapport. Uitstroomadvies Paracetamol-Codeïne (2012).
- CBG. News human medicines (2012). College ter beoordeling van geneesmiddelen.
- Lasko B, Levitt RJ, Rainsford KD, Bouchard S, Rozova A, Robertson S. Extended-release tramadol/paracetamol in moderate-to-severe pain: a randomized, placebo-controlled study in patients with acute low back pain. Curr Med Res Opin 2012;28:847-57.
- Hewitt DJ, Todd KH, Xiang J, Jordan DM, Rosenthal NR. Tramadol/acetaminophen or hydrocodone/acetaminophen for the treatment of ankle sprain: a randomized, placebo-controlled trial. Ann Emerg Med 2007;49:468-80.
- Park KS, Choi JJ, Kim WU, Min JK, Park SH, Cho CS. The efficacy of tramadol/acetaminophen combination tablets (Ultracet(R)) as add-on and maintenance therapy in knee osteoarthritis pain inadequately controlled by nonsteroidal anti-inflammatory drug (NSAID). Clin Rheumatol. 2012;31:317-23.
- Chow R, Kozhevnikov D, Prsic EH. Serotonin syndrome in palliative care #403. J Palliat Med 2020;23:1678-80.
- Hall J, Naranjo CA, Sproule BA, Herrmann N. Pharmacokinetic and pharmacodynamic evaluation of the inhibition of alprazolam by citalopram and fluoxetine. J Clin Psychopharmacol 2003;23:349-57.
- Swen JJ, Van der Wouden CH, Manson LE, Abdullah-Koolmees H, Blagec K, Blagus T, et al. A 12-gene pharmacogenetic panel to prevent adverse drug reactions: an open-label, multicentre, controlled, cluster-randomised crossover implementation study. Lancet 2023;401:347-56.
- Wiffen PJ, Wee B, Derry S, Bell RF, Moore RA. Opioids for cancer pain − an overview of cochrane reviews. Cochrane Database Syst Rev 2017;7:CD012592.
- Kopf A, Banzhaf A, Stein C. Perioperative management of the chronic pain patient. Best Pract Res Clin Anaesthesiol 2005;19:59-76.
- Pergolizzi J, Boger RH, Budd K, Dahan A, Erdine S, Hans G, et al. Opioids and the management of chronic severe pain in the elderly: consensus statement of an International Expert Panel with focus on the six clinically most often used World Health Organization Step III opioids (buprenorphine, fentanyl, hydromorphone, methadone, morphine, oxycodone). Pain Pract 2008;8:287-313.
- Tournebize J, Gibaja V, Muszczak A, Kahn JP. Are physicians safely prescribing opioids for chronic noncancer pain? A systematic review of current evidence. Pain Pract 2016;16:370-83.
- Miller M, Sturmer T, Azrael D, Levin R, Solomon DH. Opioid analgesics and the risk of fractures in older adults with arthritis. J Am Geriatr Soc 2011;59:430-8.
- Brady JE, Giglio R, Keyes KM, DiMaggio C, Li G. Risk markers for fatal and non-fatal prescription drug overdose: a meta-analysis. Inj Epidemiol 2017;4:24.
- Busse JW, Craigie S, Juurlink DN, Buckley DN, Wang L, Couban RJ, et al. Guideline for opioid therapy and chronic noncancer pain. CMAJ. 2017 May 8;189(18):E659-E666. doi:10.1503/cmaj.170363. PubMed PMID: 28483845; PubMed Central PMCID: PMC5422149.
- Toye F, Seers K, Tierney S, Barker KL. A qualitative evidence synthesis to explore healthcare professionals’ experience of prescribing opioids to adults with chronic non-malignant pain. BMC Fam Pract 2017;18:94.
- Chou R, Turner JA, Devine EB, Hansen RN, Sullivan SD, Blazina I, et al. The effectiveness and risks of long-term opioid therapy for chronic pain: a systematic review for a national institutes of health pathways to prevention workshop. Ann Intern Med 2015;162:276-86.
- Elzey MJ, Barden SM, Edwards ES. Patient characteristics and outcomes in unintentional, non-fatal prescription opioid overdoses: a systematic review. Pain Physician 2016;19:215-28.
- Kalkman GA, Kramers C, van Dongen RT, van den Brink W, Schellekens A. Trends in use and misuse of opioids in the Netherlands: a retrospective, multi-source database study. Lancet Public Health 2019;4:e498-e505.
- Stichting Farmaceutische Kengetallen. Aantal oxycodongebruikers vrijwel ongewijzigd in 2018 (2019). Ga naar bron: Stichting Farmaceutische Kengetallen. Aantal oxycodongebruikers vrijwel ongewijzigd in 2018 (2019).
- Stichting Farmaceutische Kengetallen. 6% minder gebruikers van sterkwerkende opioïden (2020). Ga naar bron: Stichting Farmaceutische Kengetallen. 6% minder gebruikers van sterkwerkende opioïden (2020).
- Stichting Farmaceutische Kengetallen. Opnieuw minder opioïdgebruikers (2021). Ga naar bron: Stichting Farmaceutische Kengetallen. Opnieuw minder opioïdgebruikers (2021).
- Weesie YM, Van Dijk L, Hek K. Voorschrijven van opioïden in Nederland – Toedieningsvorm, voorschrijfduur en indicatie (2020). Ga naar bron: Weesie YM, Van Dijk L, Hek K. Voorschrijven van opioïden in Nederland – Toedieningsvorm, voorschrijfduur en indicatie (2020).
- De Metz J, Lambooij A. Monitor Voorschrijven Opioïden 2018-2019 (2020). Ga naar bron: De Metz J, Lambooij A. Monitor Voorschrijven Opioïden 2018-2019 (2020).
- Klimas J, Gorfinkel L, Fairbairn N, Amato L, Ahamad K, Nolan S, et al. Strategies to Identify Patient Risks of Prescription Opioid Addiction When Initiating Opioids for Pain: A Systematic Review. JAMA Netw Open 2019;2:e193365.
- Cochran BN, Flentje A, Heck NC, Van Den Bos J, Perlman D, Torres J, et al. Factors predicting development of opioid use disorders among individuals who receive an initial opioid prescription: mathematical modeling using a database of commercially-insured individuals. Drug Alcohol Depend 2014;138:202-8.
- Edlund MJ, Martin BC, Fan MY, Devries A, Braden JB, Sullivan MD. Risks for opioid abuse and dependence among recipients of chronic opioid therapy: results from the TROUP study. Drug Alcohol Depend 2010;112:90-8.
- Chou R, Hartung D, Turner J, Blazina I, Chan B, Levander X, et al. AHRQ Comparative Effectiveness Reviews. Opioid Treatments for Chronic Pain. Rockville (MD): Agency for Healthcare Research and Quality (US); 2020.
- Cheatle MD, Compton PA, Dhingra L, Wasser TE, O'Brien CP. Development of the Revised Opioid Risk Tool to Predict Opioid Use Disorder in Patients with Chronic Nonmalignant Pain. J Pain 2019;20:842-51.
- Nielsen S, Picco L, Campbell G, Lintzeris N, Larance B, Farrell M, et al. Development of a Brief Patient-Administered Screening Tool for Prescription Opioid Dependence for Primary Care Settings. Pain Med 2020;21:e79-e88.
- Reps JM, Cepeda MS, Ryan PB. Wisdom of the CROUD: Development and validation of a patient-level prediction model for opioid use disorder using population-level claims data. PLoS One 2020;15:e0228632.
- Goshua A, Craigie S, Guyatt GH, Agarwal A, Li R, Bhullar JS, et al. Patient values and preferences regarding opioids for chronic noncancer pain: A systematic review. Pain Med 2018;19:2469-80.
- Bijl D. Ernstige bijwerkingen bij accidentele blootstelling aan fentanylpleisters (2014). Ge-Bu 2014;11:128-9. Ga naar bron: Bijl D. Ernstige bijwerkingen bij accidentele blootstelling aan fentanylpleisters (2014). Ge-Bu 2014;11:128-9.
- Van de Koppel S. Meeste klachten over sint-janskruid betreffen supplementen. Pharmaceutisch Weekblad 2020;43:14-6.
- NOS. Fabrikant zware pijnstiller OxyContin schikt voor miljarden (2019). Geraadpleegd augustus 2022. Ga naar bron: NOS. Fabrikant zware pijnstiller OxyContin schikt voor miljarden (2019). Geraadpleegd augustus 2022.
- Van Bemmel J. De opioïdenepidemie. Huisarts Wet 2019;62:24-5.
- Noori A, Sadeghirad B, Wang L, Siemieniuk RAC, Shokoohi M, Kum E, et al. Comparative benefits and harms of individual opioids for chronic non-cancer pain: a systematic review and network meta-analysis of randomised trials. Br J Anaesth 2022;129:394-406.
- Remillard D, Kaye AD, McAnally H. Oxycodone's unparalleled addictive potential: Is it time for a moratorium? Curr Pain Headache Rep 2019;23:15.
- Butler SF, Benoit C, Budman SH, Fernandez KC, McCormick C, Venuti SW, et al. Development and validation of an Opioid Attractiveness Scale: a novel measure of the attractiveness of opioid products to potential abusers. Harm Reduct J 2006;3:5.
- Chung CP, Dupont WD, Murray KT, Hall K, Stein CM, Ray WA. Comparative out-of-hospital mortality of long-acting opioids prescribed for non-cancer pain: A retrospective cohort study. Pharmacoepidemiol Drug Saf 2019;28:48-53.
- Hartung DM, Middleton L, Haxby DG, Koder M, Ketchum KL, Chou R. Rates of adverse events of long-acting opioids in a state Medicaid program. Ann Pharmacother 2007;41(6):921-8.
- Krebs EE, Becker WC, Zerzan J, Bair MJ, McCoy K, Hui S. Comparative mortality among Department of Veterans Affairs patients prescribed methadone or long-acting morphine for chronic pain. Pain 2011;152:1789-95.
- Ray WA, Chung CP, Murray KT, Cooper WO, Hall K, Stein CM. Out-of-hospital mortality among patients receiving methadone for noncancer pain. JAMA Intern Med 2015;175(3):420-7.
- Dowell D, Ragan KR, Jones CM, Baldwin GT, Chou R. CDC Clinical Practice Guideline for Prescribing Opioids for Pain - United States, 2022. MMWR Recomm Rep 2022;71:1-95.
- Miller M, Barber CW, Leatherman S, Fonda J, Hermos JA, Cho K, et al. Prescription opioid duration of action and the risk of unintentional overdose among patients receiving opioid therapy. JAMA Intern Med 2015;175:608-15.
- Pedersen L, Borchgrevink PC, Riphagen, II, Fredheim OM. Long- or short-acting opioids for chronic non-malignant pain? A qualitative systematic review. Acta Anaesthesiol Scand 2014;58:390-401.
- Laugsand EA, Kaasa S, Klepstad P Management of opioid-induced nausea and vomiting in cancer patients: systematic review and evidence-based recommendations. Palliat Med. 2011;25(5):442-53.
- Ferris FD, Kerr IG, Sone M, Marcuzzi M. Transdermal scopolamine use in the control of narcotic-induced nausea. J Pain Symptom Manage 1991;6:389-93.
- Hardy J, Daly S, McQuade B, Albertsson M, Chimontsi-Kypriou V, Stathopoulos P, et al. A double-blind, randomised, parallel group, multinational, multicentre study comparing a single dose of ondansetron 24 mg p.O. With placebo and metoclopramide 10 mg t.D.S. PO. In the treatment of opioid-induced nausea and emesis in cancer patients. Support Care Cancer 2002;10:231-6.
- Quigley C. Opioid switching to improve pain relief and drug tolerability. Cochrane Database Syst Rev 2004:CD004847.
- Kahan M, Srivastava A, Wilson L, Mailis-Gagnon A, Midmer D. Opioids for managing chronic non-malignant pain: safe and effective prescribing. Can Fam Physician 2006;52:1091-6.
- Heiskanen T, Kalso E. Controlled-release oxycodone and morphine in cancer related pain. Pain 1997;73:37-45.
- Kalso E, Vainio A. Morphine and oxycodone hydrochloride in the management of cancer pain. Clin Pharmacol Ther 1990;47:639- 46.
- Wirz S, Wartenberg HC, Nadstawek J. Less nausea, emesis, and constipation comparing hydromorphone and morphine? A prospective open-labeled investigation on cancer pain. Support Care Cancer 2008;16:999-1009.
- Babul N, Provencher L, Laberge F, Harsanyi Z, Moulin D. Comparative efficacy and safety of controlled-release morphine suppositories and tablets in cancer pain. J Clin Pharmacol 1998;38:74-81.
- De Conno F, Ripamonti C, Saita L, MacEachern T, Hanson J, Bruera E. Role of rectal route in treating cancer pain: a randomized crossover clinical trial of oral versus rectal morphine administration in opioid-naive cancer patients with pain. J Clin Oncol 1995;13:1004-8.
- Bruera E, Fainsinger R, Spachynski K, Babul N, Harsanyi Z, Darke AC. Clinical efficacy and safety of a novel controlled-release morphine suppository and subcutaneous morphine in cancer pain: a randomized evaluation. J Clin Oncol 1995;13:1520-7.
- Drexel H, Dzien A, Spiegel RW, Lang AH, Breier C, Abbrederis K, et al. Treatment of severe cancer pain by low-dose continuous subcutaneous morphine. Pain 1989;36:169-76.
- Nijs J, Van Wilgen PC, Van Oosterwijck J, Van Ittersum M, Meeus M. How to explain central sensitization to patients with ‘unexplained’ chronic musculoskeletal pain: practice guidelines. Man Ther 2011;16:413-8.
- Moseley L. Unraveling the barriers to reconceptualization of the problem in chronic pain: the actual and perceived ability of patients and health professionals to understand the neurophysiology. J Pain 2003;4:184-9.
- Edwards RR, Bingham CO, Iii, Bathon J, Haythornthwaite JA. Catastrophizing and pain in arthritis, fibromyalgia, and other rheumatic diseases. Arthritis Rheum 2006;55:325-32.
- Keefe FJ, Lefebvre JC, Egert JR, Affleck G, Sullivan MJ, Caldwell DS. The relationship of gender to pain, pain behavior, and disability in osteoarthritis patients: the role of catastrophizing. Pain 2000;87:325-34.
- Clarke CL, Ryan CG, Martin DJ. Pain neurophysiology education for the management of individuals with chronic low back pain: systematic review and meta-analysis. Man Ther 2011;16:544-9.
- Louw A, Diener I, Butler DS, Puentedura EJ. The effect of neuroscience education on pain, disability, anxiety, and stress in chronic musculoskeletal pain. Arch Phys Med Rehabil 2011;92:2041-56.
- Meeus M, Nijs J, Hamers V, Ickmans K, Oosterwijck JV. The efficacy of patient education in whiplash associated disorders: a systematic review. Pain Physician 2012;15:351-61.
- Coudeyre E, Tubach F, Rannou F, Baron G, Coriat F, Brin S, et al. Effect of a simple information booklet on pain persistence after an acute episode of low back pain: a non-randomized trial in a primary care setting. PLoS One 2007;2:e706.
- Houben RM, Ostelo RW, Vlaeyen JW, Wolters PM, Peters M, Stomp-Van Den Berg SG. Health care providers’ orientations towards common low back pain predict perceived harmfulness of physical activities and recommendations regarding return to normal activity. Eur J Pain 2005;9:173-83.
- Moseley GL. Evidence for a direct relationship between cognitive and physical change during an education intervention in people with chronic low back pain. Eur J Pain 2004;8:39-45.
- Godges JJ, Anger MA, Zimmerman G, Delitto A. Effects of education on return-to-work status for people with fear-avoidance beliefs and acute low back pain. Phys Ther 2008;88:231-9.
- Henschke N, Ostelo RW, Van Tulder MW, Vlaeyen JW, Morley S, Assendelft WJ, et al. Behavioural treatment for chronic low-back pain. Cochrane Database Syst Rev 2010:CD002014.
- Kisely SR, Campbell LA, Yelland MJ, Paydar A. Psychological interventions for symptomatic management of non-specific chest pain in patients with normal coronary anatomy. Cochrane Database Syst Rev 2012;6:CD004101.
-
Wetering EJ, Lemmens KM, Nieboer AP, Huijsman R. Cognitive and behavioral interventions for the management of chronic neuropathic pain in adults—a systematic review. Eur J Pain. 2010 Aug;14(7):670-81.
doi: 10.1016/j.ejpain.2009.11.010. Epub 2010 Jan 21. Review. PubMed PMID: 20096614.
- Williams AC, Eccleston C, Morley S. Psychological therapies for the management of chronic pain (excluding headache) in adults. Cochrane Database Syst Rev 2012;11:CD007407.
- Veehof MM, Oskam MJ, Schreurs KM, Bohlmeijer ET. Acceptance-based interventions for the treatment of chronic pain: a systematic review and meta-analysis. Pain 2011;152:533-42.
- Carpenter KM, Stoner SA, Mundt JM, Stoelb B. An online selfhelp CBT intervention for chronic lower back pain. Clin J Pain 2012;28:14-22.
- Thorsell J, Finnes A, Dahl J, Lundgren T, Gybrant M, Gordh T, et al. A comparative study of 2 manual-based self-help interventions, acceptance and commitment therapy and applied relaxation, for persons with chronic pain. Clin J Pain 2011;27:716-23.
- Wetherell JL, Afari N, Rutledge T, Sorrell JT, Stoddard JA, Petkus AJ, et al. A randomized, controlled trial of acceptance and commitment therapy and cognitive-behavioral therapy for chronic pain. Pain 2011;152:2098-107.
- Chiesa A, Serretti A. Mindfulness-based interventions for chronic pain: a systematic review of the evidence. J Altern Complement Med 2011;17:83-93.
- Macea DD, Gajos K, Daglia Calil YA, Fregni F. The efficacy of Web-based cognitive behavioral interventions for chronic pain: a systematic review and meta-analysis. J Pain 2010;11:917-29.
- Buhrman M, Nilsson-Ihrfeldt E, Jannert M, Strom L, Andersson G. Guided internet-based cognitive behavioural treatment for chronic back pain reduces pain catastrophizing: a randomized controlled trial. J Rehabil Med 2011;43:500-5.
- Ruehlman LS, Karoly P, Enders C. A randomized controlled evaluation of an online chronic pain self management program. Pain 2012;153:319-30.
- Posadzki P, Lewandowski W, Terry R, Ernst E, Stearns A. Guided imagery for non-musculoskeletal pain: a systematic review of randomized clinical trials. J Pain Symptom Manage 2012;44:95-104.
- Bussing A, Ostermann T, Ludtke R, Michalsen A. Effects of yoga interventions on pain and pain-associated disability: a meta-analysis. J Pain 2012;13:1-9.
- Posadzki P, Ernst E, Terry R, Lee MS. Is yoga effective for pain? A systematic review of randomized clinical trials. Complement Ther Med 2011a;19:281-7.
- Posadzki P, Ernst E. Yoga for low back pain: a systematic review of randomized clinical trials. Clin Rheumatol 2011b;30:1257-62.
- Chou R, Huffman LH. Nonpharmacologic therapies for acute and chronic low back pain: a review of the evidence for an American Pain Society/American College of Physicians clinical practice guideline. Ann Intern Med 2007;147:492-504.
- Bernardy K, Klose P, Busch AJ, Choy EH, Häuser W. Cognitive behavioural therapies for fibromyalgia. Cochrane Database Syst Rev 2013;2013:CD009796.
- Kroenke K, Bair MJ, Damush TM, Wu J, Hoke S, Sutherland J, et al. Optimized antidepressant therapy and pain self-management in primary care patients with depression and musculoskeletal pain: a randomized controlled trial. JAMA 2009;301:2099-110.
- Lin EH, Katon W, Von Korff M, Tang L, Williams JW, Jr., Kroenke K, et al. Effect of improving depression care on pain and functional outcomes among older adults with arthritis: a randomized controlled trial. JAMA 2003;290:2428-9.
- Tsui JI, Herman DS, Kettavong M, Anderson BJ, Stein MD. Escitalopram is associated with reductions in pain severity and pain interference in opioid dependent patients with depressive symptoms. Pain 2011;152:2640-4.
- Gaynor PJ, Gopal M, Zheng W, Martinez JM, Robinson MJ, Marangell LB. A randomized placebo-controlled trial of duloxetine in patients with major depressive disorder and associated painful physical symptoms. Curr Med Res Opin 2011;27:1849-58.
- Begré S, Traber M, Gerber M, Von KR. Change in pain severity with open label venlafaxine use in patients with a depressive symptomatology: an observational study in primary care. Eur Psychiatry 2008;23:178-86.
- Fava M, Mallinckrodt CH, Detke MJ, Watkin JG, Wohlreich MM. The effect of duloxetine on painful physical symptoms in depressed patients: do improvements in these symptoms result in higher remission rates? J Clin Psychiatry 2004;65:521-30.
- Wang W, Sun YH, Wang YY, Wang YT, Wang W, Li YQ, et al. Treatment of functional chest pain with antidepressants: a meta-analysis. Pain Physician 2012;15:E131-42.
- Deveaugh-Geiss AM, West SL, Miller WC, Sleath B, Gaynes BN, Kroenke K. The adverse effects of comorbid pain on depression outcomes in primary care patients: results from the ARTIST trial. Pain Med 2010;11:732-41.
- Häuser W, Klose P, Langhorst J, Moradi B, Steinbach M, Schiltenwolf M, et al. Efficacy of different types of aerobic exercise in fibromyalgia syndrome: a systematic review and meta-analysis of randomised controlled trials. Arthritis Res Ther 2010;12:R79.
- Busch AJ, Barber KA, Overend TJ, Peloso PM, Schachter CL. Exercise for treating fibromyalgia syndrome. Cochrane Database Syst Rev 2007:CD003786.
- Busch AJ, Webber SC, Richards RS, Bidonde J, Schachter CL, Schafer LA, et al. Resistance exercise training for fibromyalgia. Cochrane Database Syst Rev 2013;12:CD010884.
- Eccleston C, Fisher E, Thomas KH, Hearn L, Derry S, Stannard C, et al. Interventions for the reduction of prescribed opioid use in chronic non-cancer pain. Cochrane Database Syst Rev 2017;11:CD010323.
- Els C, Jackson TD, Kunyk D, Lappi VG, Sonnenberg B, Hagtvedt R, et al. Adverse events associated with mediumand long-term use of opioids for chronic non-cancer pain: an overview of cochrane reviews. Cochrane Database Syst Rev 2017;10:CD012509.
- Lawrence R, Mogford D, Colvin L. Systematic review to determine which validated measurement tools can be used to assess risk of problematic analgesic use in patients with chronic pain. Br J Anaesth 2017;119:1092-109.
- Inturrisi CE. Management of cancer pain. Pharmacology and principles of management. Cancer 1989;63:2308-20.
- McQuay H. Opioids in pain management. Lancet 1999;353:2229-32.
- Kowal M, Hazekamp A, Grotenhermen F. Review on clinical studies with cannabis and cannabinoids 2010-2014. Cannabinoids 2016;11:1-18.
- McDonagh MS, Morasco BJ, Wagner J, Ahmed AY, Fu R, Kansagara D, et al. Cannabis-based products for chronic pain : A systematic review. Ann Intern Med 2022;175:1143-53.
- Busse JW, Vankrunkelsven P, Zeng L, Heen AF, Merglen A, Campbell F, et al. Medical cannabis or cannabinoids for chronic pain: a clinical practice guideline. BMJ 2021;374:n2040.
- Wang L, Hong PJ, May C, Rehman Y, Oparin Y, Hong CJ, et al. Medical cannabis or cannabinoids for chronic non-cancer and cancer related pain: a systematic review and meta-analysis of randomised clinical trials. BMJ 2021;374:n1034.
- Noori A, Miroshnychenko A, Shergill Y, Ashoorion V, Rehman Y, Couban RJ, et al. Opioid-sparing effects of medical cannabis or cannabinoids for chronic pain: a systematic review and meta-analysis of randomised and observational studies. BMJ Open 2021;11:e047717.
- Zeraatkar D, Cooper MA, Agarwal A, Vernooij RWM, Leung G, Loniewski K, et al. Long-term and serious harms of medical cannabis and cannabinoids for chronic pain: a systematic review of non-randomised studies. BMJ Open 2022;12:e054282.
- Fisher E, Moore RA, Fogarty AE, Finn DP, Finnerup NB, Gilron I, et al. Cannabinoids, cannabis, and cannabis-based medicine for pain management: a systematic review of randomised controlled trials. Pain 2021;162:S45-s66.
- Kleijne I. Stijgend aantal vergiftigingen door olie van cannabis (2017). Geraadpleegd mei 2023. Ga naar bron: Kleijne I. Stijgend aantal vergiftigingen door olie van cannabis (2017). Geraadpleegd mei 2023.
- Venhuis BJ, van de Nobelen S. Cannabis contaminanten. Rijksinstituut voor Volksgezondheid en Milieu (RIVM), 2015. Ga naar bron: Venhuis BJ, van de Nobelen S. Cannabis contaminanten. Rijksinstituut voor Volksgezondheid en Milieu (RIVM), 2015.
- KNGF. Multidisciplinaire richtlijn aspeciefieke KANS (2012). Koninklijk Nederlands Genootschap voor Fysiotherapie. Ga naar bron: KNGF. Multidisciplinaire richtlijn aspeciefieke KANS (2012). Koninklijk Nederlands Genootschap voor Fysiotherapie.
- NVA. Artsenwijzer Pijn (2014). Nederlandse Vereniging voor Anesthesiologie. Ga naar bron: NVA. Artsenwijzer Pijn (2014). Nederlandse Vereniging voor Anesthesiologie.
- Chaparro LE, Wiffen PJ, Moore RA, Gilron I. Combination pharmacotherapy for the treatment of neuropathic pain in adults. Cochrane Database Syst Rev 2012;7:CD008943.
- Moore RA, Derry S, Aldington D, Cole P, Wiffen PJ. Amitriptyline for neuropathic pain and fibromyalgia in adults. Cochrane Database Syst Rev 2012;12:CD008242.
- Derry S, Wiffen PJ, Aldington D, Moore RA. Nortriptyline for neuropathic pain in adults. Cochrane Database Syst Rev 2015;1:CD011209.
- Hearn L, Derry S, Phillips T, Moore RA, Wiffen PJ. Imipramine for neuropathic pain in adults. Cochrane Database Syst Rev 2014;5:CD010769.
- Lunn MP, Hughes RA, Wiffen PJ. Duloxetine for treating painful neuropathy, chronic pain or fibromyalgia. Cochrane Database Syst Rev 2014;1:CD007115.
- Lee YC, Chen PP A review of SSRIs and SNRIs in neuropathic pain. Expert Opin Pharmacother 2010;11:2813-25.
- Finnerup NB, Sindrup SH, Jensen TS. The evidence for pharmacological treatment of neuropathic pain. Pain 2010;150:573-81.
- Dworkin RH, O’connor AB, Backonja M, Farrar JT, Finnerup NB, Jensen TS, et al. Pharmacologic management of neuropathic pain: evidence-based recommendations. Pain 2007;132:237-51.
- Watson CP, Gilron I, Sawynok J. A qualitative systematic review of head-to-head randomized controlled trials of oral analgesics in neuropathic pain. Pain Res Manag 2010;15:147-57.
- Moore RA, Wiffen PJ, Derry S, Toelle T, Rice AS. Gabapentin for chronic neuropathic pain and fibromyalgia in adults. Cochrane Database Syst Rev 2014;4:CD007938.
- Moore RA, Straube S, Wiffen PJ, Derry S, Mcquay HJ. Pregabalin for acute and chronic pain in adults. Cochrane Database Syst Rev 2009:CD007076.
- McNicol ED, Midbari A, Eisenberg E. Opioids for neuropathic pain. Cochrane Database Syst Rev 2013;8:CD006146.
- Hollingshead J, Duhmke RM, Cornblath DR. Tramadol for neuropathic pain. Cochrane Database Syst Rev 2006:CD003726.
- Norrbrink C, Lundeberg T. Tramadol in neuropathic pain after spinal cord injury: a randomized, double-blind, placebo-controlled trial. Clin J Pain 2009;25:177-84.
- Wiffen PJ, Derry S, Moore RA, Kalso EA. Carbamazepine for chronic neuropathic pain and fibromyalgia in adults. Cochrane Database Syst Rev 2014;4:CD005451.
- Derry S, Sven-Rice A, Cole P, Tan T, Moore RA. Topical capsaicin (high concentration) for chronic neuropathic pain in adults. Cochrane Database Syst Rev 2013b;2:CD007393.
- Derry S, Moore RA. Topical capsaicin (low concentration) for chronic neuropathic pain in adults. Cochrane Database Syst Rev 2012b;9:CD010111.
- Lam VY, Wallace M, Schulteis G. Effects of lidocaine patch on intradermal capsaicin-induced pain: a double-blind, controlled trial. J Pain 2011;12:323-30.
- Clère F, Delorme-Morin C, George B, Navez M, Rioult B, Tiberghien-Chatelain F, et al. 5% lidocaine medicated plaster in elderly patients with postherpetic neuralgia: results of a compassionate use programme in France. Drugs Aging 2011;28:693-702.
- Binder A, Bruxelle J, Rogers P, Hans G, Bosl I, Baron R. Topical 5% lidocaine (lignocaine) medicated plaster treatment for post-herpetic neuralgia: results of a double-blind, placebo-controlled, multinational efficacy and safety trial. Clin Drug Investig 2009;29:393-408.
- Baron R, Mayoral V, Leijon G, Binder A, Steigerwald I, Serpell M. 5% lidocaine medicated plaster versus pregabalin in post-herpetic neuralgia and diabetic polyneuropathy: an open-label, non-inferiority two-stage RCT study. Curr Med Res Opin 2009;25:1663-76.
- Kanai A, Okamoto T, Suzuki K, Niki Y, Okamoto H. Lidocaine eye drops attenuate pain associated with ophthalmic postherpetic neuralgia. Anesth Analg 2010;110:1457-60.
- Briggs M, Nelson EA, Martyn-St JM. Topical agents or dressings for pain in venous leg ulcers. Cochrane Database Syst Rev 2012;11:CD001177.
- Haanpää ML, Gourlay GK, Kent JL, Miaskowski C, Raja SN, Schmader KE, et al. Treatment considerations for patients with neuropathic pain and other medical comorbidities. Mayo Clin Proc 2010;85:S15-S25.
- Phillips TJ, Cherry CL, Cox S, Marshall SJ, Rice AS. Pharmacological treatment of painful HIV-associated sensory neuropathy: a systematic review and meta-analysis of randomised controlled trials. PLoS One 2010;5:e14433.
- Zeppetella G, Davies AN. Opioids for the management of breakthrough pain in cancer patients. Cochrane Database Syst Rev 2013;10:CD004311.
- Nicholson AB. Methadone for cancer pain. Cochrane Database Syst Rev 2007:CD003971.
- Haroutiunian S, Mcnicol ED, Lipman AG. Methadone for chronic non-cancer pain in adults. Cochrane Database Syst Rev 2012;11:CD008025.
- Mücke M, Weier M, Carter C, Copeland J, Degenhardt L, Cuhls H, et al. Systematic review and meta-analysis of cannabinoids in palliative medicine. J Cachexia Sarcopenia Muscle 2018.
- Frank JW, Lovejoy TI, Becker WC, Morasco BJ, Koenig CJ, Hoffecker L, et al. Patient Outcomes in Dose Reduction or Discontinuation of Long-Term Opioid Therapy: A Systematic Review. Ann Intern Med 2017;167:181-91.
- Sullivan MD, Boudreau D, Ichikawa L, Cronkite D, Albertson-Junkans L, Salgado G, et al. Primary Care Opioid Taper Plans Are Associated with Sustained Opioid Dose Reduction. J Gen Intern Med 2020;35:687-95.
- Mathieson S, Maher CG, Ferreira GE, Hamilton M, Jansen J, McLachlan AJ, et al. Deprescribing Opioids in Chronic Non-cancer Pain: Systematic Review of Randomised Trials. Drugs 2020;80:1563-76.
- Hooten WM, Warner DO. Varenicline for opioid withdrawal in patients with chronic pain: a randomized, single-blinded, placebo controlled pilot trial. Addict Behav 2015;42:69-72.