Maagklachten
Richtlijnen spoed
Naar Volledige tekst ›Spoedeisende klachten en symptomen
Naar Volledige tekst ›- Bloedbraken (hematemese) of melena
- Aanhoudend braken
- Ernstige buikpijn die verergert door beweging of vervoer, en/of koorts
- Klachten na bariatrische chirurgie in de eerste weken (tot maanden) zoals:
- acuut ontstane ernstige (buik)pijn, tachycardie of koorts
- continu braken en pijn in epigastrio
- Andere klachten na bariatrische chirurgie
Lichamelijk onderzoek bij spoedeisende klachten en symptomen
Naar Volledige tekst ›- Volg de ABCDE-methodiek
- Ga na of er aanwijzingen zijn voor peritoneale prikkeling (loslaatpijn, défense musculaire).
Beleid bij spoedeisende klachten en symptomen
Naar Volledige tekst ›- Bel bij patiënt die ABCDE-instabiel is een ambulance met A1-indicatie
- Verwijs met spoed bij: aanwijzing voor peritoneale prikkeling (vermoeden maagperforatie)
- Overleg direct met de specialist bij:
- hematemese of melena
- aanhoudend braken (vermoeden van obstructie of risico op dehydratie)
- spoedeisende klachten na recente bariatrische chirurgie (vermoeden maagperforatie)
- Andere klachten na bariatrische ingreep: overleg dezelfde dag met een bariatrisch chirurg.
Richtlijnen diagnostiek
Naar Volledige tekst ›Anamnese
Naar Volledige tekst ›- Alarmsymptomen, suggestief voor maligniteit (soms indicatie spoedverwijzing, zie Beleid bij spoedeisende klachten en symptomen):
- hematemese, melena, anemie
- aanhoudend braken
- stoornis in of pijn bij voedselpassage, aanhoudend retrosternale pijn zonder aanwijzing voor cardiale oorzaak
- ongewild gewichtsverlies
- Aard van de klachten: zuurbranden, regurgitatie en pijn boven in de buik (invloed van voedsel), opgeblazen gevoel, snelle verzadiging, misselijkheid, braken
- Ernst, duur en beloop van de klachten
- Verandering defecatiepatroon, bloed bij de ontlasting
- Factoren die maagklachten kunnen beïnvloeden:
- (zelf)medicatie (zoals NSAID’s, bisfosfonaten, kaliumchloride, antibiotica, antidepressiva, zuurremmers)
- psychosociale problematiek
- voedselintoleranties, alcohol, roken, overgewicht
- intra-abdominale drukverhoging
- Voorgeschiedenis:
- eerdere klachten en (eradicatie)behandeling
- (zelf)medicatie met antacida of zuurremmers
- eerdere gastroduodenoscopie
- H. pylori-status
- recente ijzergebreksanemie
- migratieachtergrond: mediterrane landen, Oost-Europa, Midden-Oosten, Azië, Afrika, Midden- en Zuid-Amerika (hogere H. pylori-prevalentie)
Lichamelijk onderzoek
Naar Volledige tekst ›- Inspectie huid, lippen en conjunctivae op bleekheid: aanwijzing voor anemie
- Onderzoek abdomen, inspectie, auscultatie, percussie en palpatie van de buik: uitsluiten andere pathologie
- Rectaal toucher: bij vermoeden van melena of bloed bij de ontlasting
Aanvullend onderzoek
Naar Volledige tekst ›Test op Helicobacter pylori
Naar Volledige tekst ›- Indicaties:
- patiënten afkomstig uit mediterrane landen, Oost-Europa, Midden-Oosten, Azië, Afrika, Midden- en Zuid-Amerika
- voorafgaand aan start van een PPI bij een eerste episode van maagklachten
- persisterende of recidiverende klachten bij onbekende H. pylori-status
- endoscopisch aangetoond ulcus ventriculi zonder kweek uit biopt
- controle na eradicatiebehandeling
- Fecestest heeft voorkeur
- Vóór test 4 weken geen antibioticum, 2 weken geen PPI, 1 dag geen H2-antagonist
Gastroduodenoscopie
Naar Volledige tekst ›- Absolute indicatie: alarmsymptomen voor maligniteit (zie Anamnese)
- Relatieve indicaties:
- persisterende of recidiverende maagklachten in afwezigheid van alarmsymptomen en H. pylori, bij een verhoogd risico op carcinoom (zie Risicoschatting)
- in overleg met de mdl-arts bij maagklachten en een eerstegraads familielid met maagcarcinoom
- behoefte aan meer diagnostische zekerheid
Evaluatie
Naar Volledige tekst ›- Differentiaaldiagnostische overwegingen:
- cardiale oorzaken (zie NHG-Standaard Acuut coronair syndroom en NHG-Standaard Stabiele angina pectoris)
- andere gastro-intestinale oorzaken zoals aandoeningen van galblaas, pancreas of milt
- prikkelbaredarmsyndroom (zie NHG-Standaard Prikkelbaredarmsyndroom (PDS))
- Maak onderscheid tussen:
- spoedeisende klachten of symptomen: (zie Richtlijnen spoed)
- alarmsymptomen voor maligniteit (zie Anamnese)
- maagklachten bij NSAID-gebruik
- eerste episode van maagklachten: nooit eerder of > 1 jaar geleden klachten gehad
- persisterende (> 2-3 maanden) of recidiverende (< 1 jaar na het begin van een eerdere episode) maagklachten
- beleid na positieve H. pylori-test
- beleid na gastroduodenoscopie
Richtlijnen beleid
Naar Volledige tekst ›Beleid bij maagklachten bij NSAID-gebruik
Naar Volledige tekst ›- Stop zo mogelijk of vervang het NSAID
- Adviseer het NSAID met voedsel in te nemen
- Bij ulcus in voorgeschiedenis en onbekende H. pylori-status: H. pylori-test
- Bij persisterende klachten: start een PPI in standaarddosering (zie tabel h1) en behandel verder volgens het Stroomschema Beleid bij een eerste episode van maagklachten (zie figuur h1)
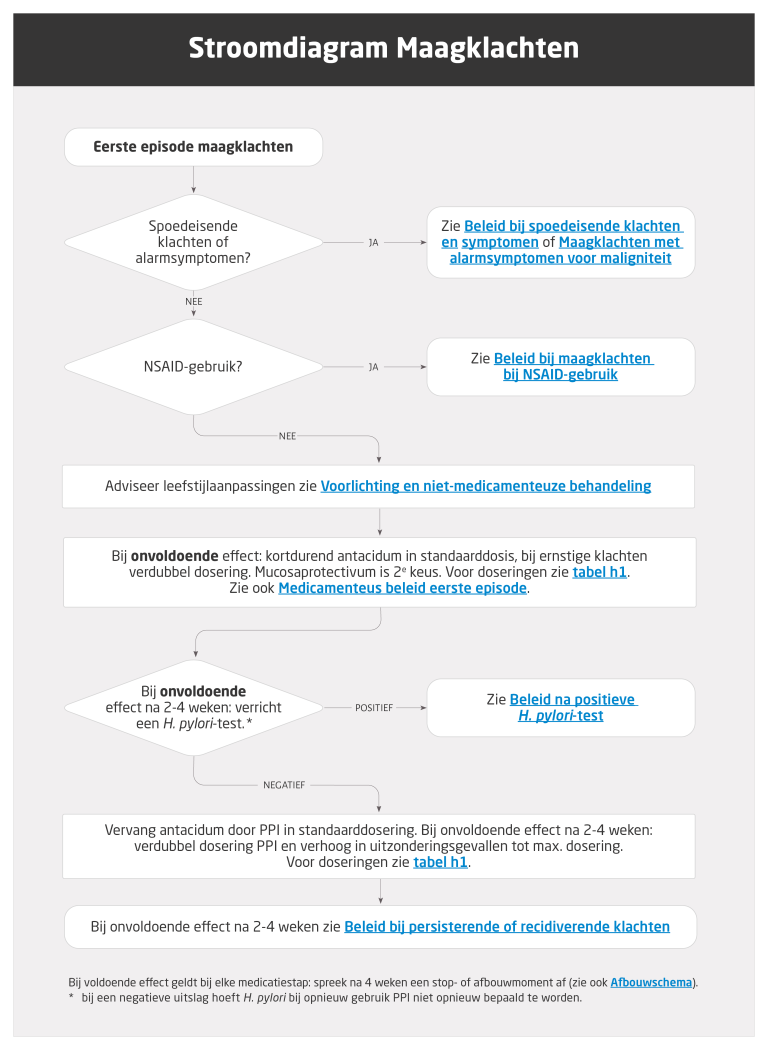
Beleid bij een eerste episode van maagklachten
Naar Volledige tekst ›Voorlichting en niet-medicamenteuze behandeling
Naar Volledige tekst ›- Bespreek mogelijke leefstijlaanpassingen zoals:
- mijd voedingsmiddelen die klachten geven
- bij nachtelijke klachten een slaaphouding met hoofdeinde omhoog
- afvallen en stoppen met roken
- Bespreek psychosociale problematiek indien van toepassing
- Bespreek de mogelijkheid van begeleiding door een diëtist
Medicamenteus beleid eerste episode
Naar Volledige tekst ›- Ga na of medicatie de maagklachten kan veroorzaken (bij NSAID gebruik: zie Maagklachten bij NSAID-gebruik).
- Adviseer geneesmiddelen volgens het Stroomschema Beleid bij een eerste episode van maagklachten (figuur h1):
- houd rekening met ervaring met (zelfzorg) medicatie
- start met antacidum (of mucosaprotectivum) in voldoende hoge dosering en doseerfrequentie (voor dosering zie tabel h1)
- bij onvoldoende effect: overweeg kortdurend een PPI en verricht eenmalig voorafgaand aan de start een H. pylori-test
- bij voldoende effect na 4 weken: stop of bouw af (zie figuur h1).
- Overweeg bij onvoldoende effect van PPI in maximale dosering om een antacidum voor de nacht toe te voegen
Beleid bij persisterende of recidiverende klachten
Naar Volledige tekst ›- Blijf alert op:
- indicaties voor een spoedverwijzing
- alarmsymptomen voor maligniteit
- redenen om de diagnose ‘maagklachten’ te heroverwegen.
- Overweeg bij onvoldoende effect van omeprazol of pantoprazol in maximale dosering deze om te zetten in esomeprazol.
- Overweeg gastroduodenoscopie.
- Bij ontbreken van indicaties voor gastroduodenoscopie: geef voorlichting om onnodige onrust weg te nemen; behandel de klachten als somatisch onvoldoende verklaard (zie NHG-Standaard Somatisch onvoldoende verklaarde lichamelijke klachten (SOLK)).
- Behandel bij klachten volgens het stroomschema (zie figuur h1):
- maak afspraken over stop- en afbouwmomenten en probeer chronisch PPI-gebruik te voorkomen
- Instrueer de patiënt contact op te nemen bij nieuwe klachten of verergering van het klachtenpatroon.
Beleid na positieve H. pylori-test
Naar Volledige tekst ›- Geef eradicatiebehandeling gevolgd door esomeprazol (voor doseringen en duur behandeling, zie tabel h3).
- Controle na eradicatiebehandeling: test op H. pylori 2 weken na het stoppen van de PPI. Behandel klachten in de tussentijd met een antacidum of mucosaprotectivum.
- Overleg met arts-microbioloog en/of mdl-arts bij een positieve H. pylori-test na de eradicatiebehandeling, of volg de regionale samenwerkingsafspraken.
Beleid na gastroduodenoscopie
Naar Volledige tekst ›- Niet-erosieve bulbitis of duodenitis, niet-erosieve gastritis, hiatushernia (hernia diaphragmatica), gastro-oesofageale prolaps of insufficiënte gastro-oesofageale overgang vormen geen verklaring voor de klachten en hebben geen consequenties voor het beleid.
- Overleg met een mdl-arts bij diagnoses als achalasie, oesofagusvarices, candida-oesofagitis, poliepen, benigne tumoren, divertikels, hypertrofische gastropathie (ziekte van Ménétrier) en corpus alienum.
Oesofagitis
Naar Volledige tekst ›- Bij refluxoesofagitis graad A/B:
- start een PPI in standaarddosering (zie tabel h1)
- verhoog bij onvoldoende effect na 2 weken naar 2 dd
- behandel gedurende 8 weken en probeer daarna de PPI te stoppen (zie Afbouwschema)
- bij persisterende klachten: geef zuurremming op geleide van de klachten, probeer uit te komen met een antacidum of mucosaprotectivum (zie Medicamenteus beleid eerste episode)
- Bij refluxoesofagitis graad C/D:
- geef levenslang een onderhoudsbehandeling met een PPI in standaarddosering (zie tabel h1)
- overleg met de mdl-arts over controlescopie na 8-12 weken en de verdere controles
- Bij barrettoesofagus of eosinofiele oesofagitis: volg het advies van de mdl-arts.
Ulcus duodeni
Naar Volledige tekst ›Geef H. pylori-eradicatiebehandeling (zie Beleid na positieve H. pylori-test).
Ulcus ventriculi
Naar Volledige tekst ›- Verricht een H. pylori-test indien nog niet verricht, en behandel zo nodig (zie Beleid na positieve H. pylori-test).
- Bij H. pylori-negatieve ulcera: behandel gedurende 4 weken met een PPI in standaarddosering (voor doseringen zie tabel h1)
- Laat altijd een controlescopie verrichten om een carcinoom uit te sluiten (8 weken na de start van een geslaagde eradicatiebehandeling).
Erosieve gastritis of bulbitis
Naar Volledige tekst ›- Verricht een H. pylori-test indien nog niet verricht, en behandel zo nodig (zie Beleid na positieve H. pylori-test).
- Bij negatieve uitslag: geef een PPI in standaarddosering gedurende 4 weken en stop daarna (voor doseringen zie tabel h1).
Geen verklarende bevindingen én refluxklachten
Naar Volledige tekst ›- Stem voorlichting en advies af op persoonlijke factoren (psychologische factoren, voedsel en leefstijl).
- Geef medicatie (zie Medicamenteus beleid eerste episode) en spreek een periodieke afbouwpoging af (zie Afbouwschema).
- Overweeg verwijzing naar een mdl-arts als ≥ 12 weken gebruik van de dubbele dosis PPI onvoldoende helpt.
Geen verklarende bevindingen én andere maagklachten dan refluxklachten
Naar Volledige tekst ›- Ga na of er sprake is van psychiatrische problematiek of psychosociale problemen.
- Overweeg als somatische en psychische of psychiatrische aandoeningen zijn uitgesloten een benadering zoals beschreven in de NHG-Standaard Somatisch onvoldoende verklaarde lichamelijke klachten (SOLK).
- Overweeg bij een gemotiveerde patiënt met langdurende maagklachten (zonder verklarende bevinding bij gastroduodenoscopie of aanwijzing voor psychiatrische aandoening) verwijzing naar een psycholoog of poh-ggz.
- Informeer de patiënt over het waarschijnlijk chronische beloop en de beperkte therapeutische opties
- Medicamenteus beleid:
- continueer medicatie bij voldoende effectiviteit (zie Medicamenteus beleid eerste episode)
- bespreek het nut van periodieke afbouwpogingen (zie Afbouwschema)
- bespreek met patiënt, als de klachten na volgen van het hierboven beschreven niet-medicamenteuze beleid blijven bestaan, en veel last geven en PPI’s onvoldoende werken, een proefbehandeling met een TCA (off-label) (zie volledige tekst)
- geef domperidon alleen bij ernstige misselijkheid en maximaal 1 week (maximaal 3 dd 10 mg)
Consultatie en verwijzing
Naar Volledige tekst ›- Verwijs voor gastroduodenoscopie of consulteer mdl-arts bij:
- alarmsymptomen voor maligniteit
- behoefte aan diagnostische zekerheid
- Verwijs naar een mdl-arts:
- direct bij spoedeisende klachten en symptomen
- bij therapieresistente refluxklachten bij > 12 weken gebruik van de dubbele dosis PPI
- bij een gastroduodenoscopisch aangetroffen carcinoom of barrettoesofagus
- Overleg met een arts-microbioloog en/of mdl-arts bij een positieve H. pylori-test na een eerste eradicatiebehandeling
- Overweeg verwijzing naar een psycholoog of poh-ggz bij een gemotiveerde patiënt met functionele maagklachten
- Overweeg verwijzing naar een diëtist
- Verwijs naar een bedrijfsarts als maagklachten (mede) zijn ontstaan of in stand worden gehouden door het werk
Stoppen of minderen van chronisch gebruik van zuurproductieremmers bij maagklachten
Naar Volledige tekst ›Vooraf
Naar Volledige tekst ›- Sluit uit dat er een indicatie voor langdurig gebruik is (zollinger-ellisonsyndroom, barretoesofagus, oesofagitis graad C/D)
- Bij onbekende H. pylori-status: verricht diagnostiek en behandel zo nodig (zie Beleid na positieve H. pylori-test)
Voorlichting
Naar Volledige tekst ›Bespreek:
- het spontane verloop van maagklachten: vaak verdwijnen ze en is medicatie niet nodig
- de voordelen van stoppen of minderen van zuurremmers en de nadelen van chronisch PPI-gebruik (zie Achtergronden)
- de mogelijkheid van reboundklachten en het nut van antacida daarbij
- de mogelijkheid van ‘zo nodig’-gebruik van zuurremmers bij recidiverende klachten
- dat antacida en H2-antagonisten daarbij sneller werken dan PPI’s
Afbouwschema
Naar Volledige tekst ›- Halveer de dosis PPI (of H2-antagonist) wekelijks tot ½ standaarddosis (zie tabel h1 en tabel h2).
- Stop na 1 week gebruik van de halve standaarddosis.
- Bij klachten tijdens afbouwen of na stoppen, adviseer:
- zo nodig gedurende 3 weken een antacidum te gebruiken
- bij recidiverende klachten ondanks adequate dosering van antacidum, ‘zo nodig’-gebruik van een H2-antagonist gedurende 1 maand
- probeer vervolgens weer uit te komen met een antacidum
Belangrijkste wijzigingen
Naar Samenvatting ›- H2-antagonisten zijn niet opgenomen in het stroomschema bij zuurremming (figuur h1) vanwege praktische bezwaren (slechtere beschikbaarheid en kosten), maar kunnen wel toegepast worden, bijvoorbeeld bij goede ervaringen van de patiënt in het verleden.
- Verricht ongeacht de te verwachten gebruiksduur een H. pylori-test voor het starten van zuurremming met een protonpompremmer (PPI).
- Overweeg bij persisterende maagklachten en onvoldoende effect van omeprazol of pantoprazol in maximale dosering deze middelen om te zetten in esomeprazol (eerste keus) of rabeprazol. Het effect van beide laatstgenoemde middelen wordt niet beïnvloed door farmacogenetische variaties.
- Start bij een indicatie voor chronisch PPI-gebruik bij voorkeur met esomeprazol (eerste keus) of rabeprazol.
- De duur van een eerste eradicatiebehandeling is verlengd naar 10 dagen.
- Controle op eradicatie van H. pylori wordt nu standaard geadviseerd na de eradicatiebehandeling.
- Indien een tweede eradicatiebehandeling van H. pylori nodig is, wordt nu geadviseerd te overleggen met een mdl-arts of arts-microbioloog (vanwege regionale verschillen in resistentiepatroon, mogelijkheid van microbiologische kweek en ervaring met diverse kuursamenstellingen), of de regionale samenwerkingsafspraken te volgen.
Kernboodschappen
Naar Samenvatting ›- Adviseer bij maagklachten in eerste instantie leefstijlaanpassingen zoals het mijden van voedingsmiddelen die klachten geven, stoppen met roken, afvallen en aanpassen van de slaaphouding bij nachtelijke klachten.
- Start bij onvoldoende effect van leefstijlaanpassingen met een antacidum of mucosaprotectivum volgens het Stroomschema Beleid bij een eerste episode van maagklachten (zie figuur h1).
- Verricht bij onvoldoende effect van deze medicatie een H. pylori-test voorafgaand aan de start van een PPI. Bespreek met de patiënt dat het gebruik in principe maximaal 4 weken is.
- Spreek bij iedere stap een controle en een stop- of afbouwmoment af.
- Begeleid patiënten die zonder indicatie chronisch een PPI gebruiken bij het afbouwen daarvan.
Deze standaard bevat geen informatie over maagbescherming. Raadpleeg daarvoor de NHG-Behandelrichtlijn Preventie van maagcomplicaties door geneesmiddelgebruik.
Inleiding
Naar Samenvatting ›Scope
Naar Samenvatting ›- Richtlijnen voor diagnostiek en behandeling van maagklachten bij volwassenen.
- Richtlijnen over het stoppen van protonpompremmers (PPI’s) bij chronisch gebruik.
Buiten de scope
Naar Samenvatting ›- Bovenbuikklachten niet veroorzaakt door maag-, slokdarm- of duodenumaandoeningen.
- Maagklachten tijdens de zwangerschap en gastro-oesofageale reflux bij pasgeborenen (zie NHG-Standaard Zwangerschap en kraamperiode).
- Richtlijnen voor maagbescherming (zie NHG-Behandelrichtlijn Preventie van maagcomplicaties door geneesmiddelgebruik).
- Maagklachten bij kinderen (zie NVK-richtlijn GORZ bij kinderen van 0-18 jaar en NVK-richtlijn Helicobacter pylori-infectie bij kinderen).
- Indicaties voor H. pylori-test bij verwanten van een patiënt met maagcarcinoom (zie Maagcarcinoom.pdf op Richtlijnendatabase.nl).
Achtergronden
Naar Samenvatting ›Begrippen
Naar Samenvatting ›Maagklachten
Naar Samenvatting ›- Niet-acute klachten van pijn boven in de buik en/of zuurbranden en/of regurgitatie, eventueel in combinatie met misselijkheid, braken, opgeblazen gevoel en snelle verzadiging, waarvan de oorsprong wordt verondersteld zich te bevinden in maag, duodenum of distale slokdarm.
- Bij het initiële beleid worden refluxklachten (zuurbranden en regurgitatie) en ulcusklachten (pijn) niet onderscheiden. Op basis van patiëntkenmerken of soort klacht is de onderliggende oorzaak (reflux of ulcusziekte) niet betrouwbaar te onderscheiden en het initiële beleid is voor beide soorten klachten hetzelfde.
- Persisterende maagklachten: maagklachten die langer dan 2-3 maanden duren.
- Recidiverende maagklachten: maagklachten die opnieuw optreden < 1 jaar na een eerdere episode.
Er bestaat geen algemeen geaccepteerde definitie van maagklachten. In 1988 definieerde de Working Party Classification het Engelse equivalent, dyspepsia, als elk symptoom dat terug te voeren was op het bovenste deel van de tractus gastro-intestinalis en > 4 weken aanwezig was. De Rome-1-consensus sloot in 1991 patiënten met zuurbranden uit van deze definitie en de Rome-3-consensus beschrijft alleen functionele maagklachten. Omdat bij de initiële presentatie van maagklachten onduidelijk is wat de oorzaak is (zie detail Verband tussen klinische en endoscopische diagnose) heeft de werkgroep besloten om maagklachten breed te definiëren en aan te sluiten bij de Working Party Classification van 1988. Ook de NICE-richtlijn Dyspepsia (2004) en de NICE-richtlijn Gastro-oesophageal reflux disease and dyspepsia in adults (laatste update 2019) volgen deze brede definitie. Hoewel maagklachten zich acuut kunnen presenteren, beschrijft deze standaard vooral het beleid bij patiënten met niet-spoedeisende klachten en spreekt daarbij van ‘niet-acute klachten’. De werkgroep sluit daarmee aan bij de periode van 4 weken uit de definities van de Working Party Classification en de NICE-richtlijn. Het beleid bij acute klachten wordt beschreven in de paragraaf Richtlijnen spoed en bij Richtlijnen Beleid onder Beleid bij maagklachten met alarmsymptomen voor maligniteit.
In veel gevallen zijn maagklachten binnen 8-12 weken verdwenen. Zo niet, dan is er aanleiding voor een evaluatie. Deze termijn is gekozen op basis van consensus binnen de werkgroep. Hiermee wordt aangesloten bij de adviezen van de Gezondheidsraad (Gezondheidsraad, 2000).
Een meta-analyse (15 onderzoeken met in totaal 11.366 patiënten, van wie 42% met de diagnose ‘organische dyspepsie’) vergeleek prospectief de diagnose van een clinicus, een computermodel en een combinatie van beide met de resultaten van gastroscopie bij volwassenen met klachten van het bovenste deel van het maag-darmkanaal die voor endoscopie verwezen werden. Het computermodel en de clinicus presteerden vergelijkbaar en daarom werden de resultaten gecombineerd. De likelihood ratio (LR) van de diagnose ‘organische dyspepsie’ was 1,6 (95%-BI 1,4 tot 1,8), van een peptisch ulcus 2,2 (95%-BI 1,9 tot 2,6) en van oesofagitis 2,5 (95%-BI 1,9 tot 3,0).
Overwegingen
Bij een LR van 2 en een pretestwaarschijnlijkheid van respectievelijk 5% (ulcus) en 20% (oesofagitis) stijgt de posttestwaarschijnlijkheid tot respectievelijk ongeveer 10% (ulcus) of bijna 40% (oesofagitis). Dergelijke LR’s zijn te laag om op basis van de klachten een betrouwbaar onderscheid te maken tussen organische en functionele ziekte.
Conclusie
Er is onvoldoende verband tussen de klinische diagnose en de gastroscopiebevinding.
Over het effect van behandeling in relatie tot het dominante symptoom (pijn versus zuurbranden en/of regurgitatie) is weinig goede informatie beschikbaar. In 6 onderzoeken is tot 2013 informatie gevonden, maar het betreft meestal subgroepanalyses, waardoor de bewijskracht beperkt is.
In een subgroepanalyse van een meta-analyse van individuele patiëntgegevens (n = 1924) naar het effect van directe gastroscopie vergeleken met H. pylori-diagnostiek en behandeling bleek geen verschil in effect (aanwezigheid van klachten na 1 jaar) tussen beide strategieën bij de patiënten (n = 929) met als dominante klacht epigastrische pijn (RR 0,96; 95%-BI 0,89 tot 1,04) versus zuurbranden (RR 0,93; 95%-BI 0,93 tot 1,02).
In een RCT (n = 349) werden eerstelijns patiënten met maagklachten verdeeld over 4 managementstrategieën: empirische behandeling gebaseerd op aanwezige symptomen (a), empirische behandeling onafhankelijk van de gepresenteerde symptomen met omeprazol (b) of cisapride (c), of directe gastroscopie (d). De patiënten werden retrospectief ingedeeld naar de dominante klacht, refluxklachten, maagklachten of niet-specifieke klachten, waarvan de eerste het meest voorkwamen (circa 50%). Na 8 weken en na 1 jaar werd tussen de 3 groepen geen significant verschil gevonden in het aantal patiënten met therapiefalen (gedefinieerd als > 8 weken geneesmiddelen voor maagklachten nodig, huisartsconsult vanwege persisterende of recidiverende klachten, aanvullend onderzoek nodig of verwijzing naar een specialist).
In een RCT (n = 699) werden eerstelijns patiënten met maagklachten gerandomiseerd tussen H. pylori-diagnostiek en -behandeling versus empirisch PPI, met als primaire uitkomstmaat de kosten per QALY. In een subgroepanalyse werd geen verschil tussen beide strategieën gevonden in kwaliteit van leven bij patiënten met maagpijn als dominante klacht (verschil 0,9; 95%-BI −1,2 tot 2,9) en evenmin bij patiënten met zuurbranden als dominante klacht (verschil 1,0; 95%-BI −1,3 tot 3,2).
In een RCT (n = 722) werden eerstelijns patiënten met maagklachten gerandomiseerd tussen 3 strategieën: ‘H. pylori-diagnostiek en-behandeling’, ‘PPI’, en ‘PPI gevolgd door H. pylori-diagnostiek en behandeling wanneer symptomen verbeterden’, met als primaire uitkomstmaten na 1 jaar symptomen, kwaliteit van leven, patiënttevredenheid en totale kosten. In een subgroepanalyse werd geen verschil in de primaire uitkomstmaten gevonden tussen patiënten met of zonder refluxsymptomen als dominante klacht.
In een RCT (n = 664) werden eerstelijns patiënten met een eerste episode van maagklachten gerandomiseerd tussen stapsgewijze behandeling met aluminiumoxide/magnesiumhydroxide 4 dd 200/400 mg (antacidum), gevolgd door ranitidine 2 dd 150 mg, gevolgd door pantoprazol 1 dd 40 mg (step-up), waarbij elke stap 4 weken duurde, of een stappenschema in omgekeerde volgorde (step-down). De primaire uitkomstmaten waren symptoombestrijding en kosteneffectiviteit na 6 maanden. In een subgroepanalyse werd geen verschil gevonden in symptoombestrijding bij de subgroep met dominante refluxklachten en bij die met dominante maagklachten (65 vs. 73%; p = 0,28) .
In een RCT (n = 294) werden eerstelijns patiënten met maagklachten en een positieve H. pylori-ureum-ademtest gerandomiseerd tussen eradicatie (PPI + antibiotica) of placebo (PPI + placebo antibiotica) gedurende 1 week, waarna het beleid werd overgelaten aan de huisarts. Na 1 jaar bleek op de primaire uitkomstmaat (geen of weinig symptomen) eradicatie effectiever dan placebo (50 vs. 36%; p = 0,02). Het percentage symptoomverbetering bij patiënten met verschillende dominante symptomen was vergelijkbaar in beide groepen (eradicatiegroep 43% bij refluxklachten en 54% bij de niet-refluxgroep; placebogroep 32% bij refluxklachten en 39% bij de niet-refluxgroep).
Conclusie
Er is consistent bewijs dat in de eerste lijn het effect van de verschillende behandelstrategieën niet verschilt bij de 2 dominante symptomen (pijn versus zuurbranden en/of regurgitatie).
In de vorige versie van deze standaard (2013) werd in de paragraaf ‘Evaluatie’ bij de diagnoses ‘eerste episode van maagklachten’ en ‘persisterende of recidiverende maagklachten’ geen onderscheid gemaakt tussen bepaalde categorieën maagklachten (zoals typische refluxklachten of typische maagklachten). Dit werd onderbouwd in detail Verband tussen klinische en endoscopische diagnose, waarin aannemelijk werd gemaakt dat er onvoldoende verband is tussen de klinische diagnose en de gastroscopiebevinding, en in detail Behandelresultaat eerste episode in relatie tot het dominante symptoom, waarin consistent bewijs werd gevonden dat het effect van de verschillende behandelstrategieën (direct gastroscopie, H. pylori-diagnostiek en -behandeling, empirisch zuurremmen) in de eerste lijn niet verschilt bij de 2 dominante symptomen (pijn versus zuurbranden en/of regurgitatie).
Pas in afwezigheid van verklarende bevindingen bij gastroscopie maakte de standaard een onderscheid tussen gastro-oesofageale refluxziekte, waarbij refluxklachten op de voorgrond staan, en functionele klachten, waarbij overige maagklachten op de voorgrond staan, met een onderling verschillend beleid.
Bij deze herziening is de vraag gesteld of er aanleiding is om het empirische beleid bij maagklachten te veranderen, omdat (in de eerste lijn) patiënten met typische refluxklachten anamnestisch goed herkenbaar zijn en een specifieker beleid bij hen mogelijk zinvol is. Daarom is gezocht naar publicaties die aannemelijk maken dat een specifiek beleid bij patiënten met een bepaalde (sub)categorie maagklachten effectiever is dan het huidige step-upbeleid, waarbij geen onderscheid wordt gemaakt in subcategorieën van maagklachten.
Methode
Een zoekstrategie naar een verschil in behandelresultaat in relatie tot het dominante symptoom met zoekdatum vanaf 2001 tot 8 augustus 2018 gaf 194 treffers in PubMed.
Resultaten
Er werd geen nieuw onderzoek gevonden. 1 publicatie concludeerde, vooral op basis van het DIAMOND-onderzoek , dat het symptoom zuurbranden (met of zonder reflux) onvoldoende specifiek en sensitief is om de middels endoscopie of pH-meting vastgestelde diagnose ‘gastro-oesofageale refluxziekte’ (GERD) te stellen.
Overwegingen
De publicatie van Estores bevestigt de conclusie uit de vorige versie van de standaard dat er onvoldoende verband is tussen de klinische diagnose en de bevindingen bij aanvullend onderzoek. De zoekstrategie vond geen onderzoek waarin bepaald beleid effectiever bleek bij patiënten met vooral zuurbranden dan bij patiënten met vooral pijn. Daarom is er geen reden om bij empirische behandeling van maagklachten onderscheid te maken tussen ‘typische’ refluxklachten en maagklachten.
Conclusie
Bij de empirische behandeling van patiënten met maagklachten is een onderscheid tussen reflux- en andere maagklachten voor het beleid niet relevant.
Consensusdefinitie
De Engelse term voor ‘gastro-oesofageale refluxziekte’ is gastro-oesophageal (of -esophageal) reflux disease (GORD of GERD). De definitie, gebaseerd op de montrealconsensus van 2005, luidt: ‘GORD is a condition which develops when the reflux of stomach contents causes troublesome symptoms and/or complications. The typical reflux syndrome is defined by the presence of troublesome heartburn and/or regurgitation.’
Overwegingen
Zuurbranden en regurgitatie worden als typische refluxklachten beschouwd. De consensusdefinitie beschrijft enerzijds een pathofysiologisch mechanisme en anderzijds een kenmerkend klachtenpatroon (syndroom). De samenhang tussen beide wordt niet duidelijk en evenmin welk onderzoek nodig is om de diagnose te stellen. Ook geeft de definitie niet aan na hoeveel tijd er sprake is van ‘klachten die langer duren’, noch of er een relatie is tussen klachtduur en mechanisme of therapie-effect. Daarom is de definitie niet geschikt voor deze standaard.
Reflux (het terugstromen van maagzuur in de slokdarm) geeft niet altijd klachten. Reflux kan worden aangetoond door een combinatie van verschillende onderzoeken, zoals gastroscopie, 24-uurs pH-meting, slokdarmmanometrie en impedantiemeting, waarbij ook andere oorzaken van klachten worden uitgesloten. In de Nederlandse praktijk wordt bij typische refluxklachten die langer duren wel van ‘refluxziekte’ gesproken zonder dat gastroscopie plaatsvindt. De veronderstelling is dat langer bestaande typische refluxklachten duiden op refluxziekte en onderscheiden kunnen worden van een functionele oorzaak. In de (inter)nationale literatuur is het gebruikelijk om bij een gastroscopie zonder afwijkingen bij typische refluxklachten (ENRD: endoscopic negative reflux disease) ook te spreken van refluxziekte. De werkgroep vindt dat het woord ‘ziekte’ passend is als de ziekte is aangetoond: er kan worden gesproken van refluxziekte als aangetoonde reflux gepaard gaat met endoscopische slokdarmafwijkingen. Daarom wordt in deze standaard gesproken over ‘refluxklachten’ (en niet over ‘refluxziekte’) bij empirische behandeling van maagklachten. Er is ook onvoldoende relatie tussen het soort klachten en de onderliggende aandoening (zie detail Verband tussen klinische en endoscopische diagnose), en daarnaast is er geen verschil in effect van verschillende empirische behandelstrategieën bij de 2 dominante symptomen, pijn versus typische refluxklachten (zie detail Behandelresultaat eerste episode in relatie tot het dominante symptoom).
Ook na een gastroscopie (bij negatieve H. pylori-status) waarbij geen verklarende afwijkingen worden gevonden en refluxklachten op de voorgrond staan, spreekt deze standaard niet van ‘refluxziekte’ maar van ‘refluxklachten’. Wel wordt in deze situatie (langer bestaande refluxklachten die hebben geleid tot een scopie) reflux als oorzaak van de klachten waarschijnlijker geacht dan wanneer reflux op de voorgrond staat bij recent ontstane maagklachten. Evenzo wordt in deze situatie een functionele klacht waarschijnlijker als andere maagklachten dan refluxklachten op de voorgrond staan. Daarom verschilt na een gastroscopie het beleid tussen deze twee categorieën patiënten (zie de paragraaf Beleid na gastroduodenoscopie in de volledige tekst). Daarmee sluit de werkgroep aan bij het beleid van mdl-artsen.
Maagcomplicaties
Naar Samenvatting ›Complicaties in maag of duodenum, zoals ulcus, bloeding, perforatie of stenose.
Maagbescherming
Naar Samenvatting ›Maatregelen om maagcomplicaties door geneesmiddelgebruik te voorkomen (zie NHG-Behandelrichtlijn Preventie van maagcomplicaties door geneesmiddelgebruik).
Geneesmiddelen bij maagklachten
Naar Samenvatting ›Hieronder verstaat deze standaard medicatie die wordt toegepast bij aan maagzuur gerelateerde aandoeningen. Daarbij onderscheidt men:
- zuurbinders (antacida)
- maagwandbeschermers (mucosaprotectiva)
- zuurproductieremmers (protonpompremmers (PPI’s) en H2-antagonisten).
Epidemiologie
Naar Samenvatting ›- De diagnose ‘maagpijn’ wordt in de huisartsenpraktijk gesteld bij 22 per 1000 patiënten per jaar; de diagnose ‘zuurbranden’ bij 7 per 1000 patiënten per jaar.
- Bij patiënten die de huisarts verwijst voor gastroduodenoscopie wegens maagklachten worden de volgende diagnoses gesteld:
- ‘geen klinisch relevante afwijking’ (60-70%)
- ‘gastro-oesofageale refluxziekte’ of ‘oesofagitis’ (20-25%)
- ‘ulcus’ (5%)
- ‘carcinoom van maag of slokdarm’ (2-3%)
- Alarmsymptomen voor maligniteit (zie Anamnese) komen voor bij ongeveer 10% van alle patiënten met maagklachten in de eerste lijn. Ongeveer 6% van de patiënten met deze alarmsymptomen heeft een carcinoom.
- De diagnose ‘maag- of slokdarmcarcinoom’ wordt in Nederland jaarlijks bij ruim 3700 nieuwe patiënten gesteld; in een normpraktijk betekent dat ongeveer 1 nieuwe patiënt per 2 jaar. De incidentie stijgt met de leeftijd.
- Bij patiënten < 50 jaar komen maag- of slokdarmcarcinomen in Nederland weinig voor: in 2023 waren dat er 126, van wie ongeveer 75% zich presenteerde met alarmsymptomen.
- De incidentie van maagcarcinoom is bij mannen ongeveer 1,5 × zo hoog als bij vrouwen; de incidentie van slokdarmcarcinoom is bij mannen bijna 3 × zo hoog als bij vrouwen.
Uit een in 1997 uitgevoerd onderzoek blijkt dat de prevalentie van maagklachten in de eerste lijn 3,4% was. Het landelijk informatienetwerk huisartsenzorg van NIVEL Zorgregistraties Eerste Lijn geeft de volgende incidenties en prevalenties aan (per 1000 patiënten): maagpijn 21,6 respectievelijk 24,5; zuurbranden 7,2 respectievelijk 8,1; ziekte van de slokdarm 5,5 respectievelijk 14,4; ulcus duodeni 0,7 respectievelijk 0,8; ander ulcus pepticum 1,4 respectievelijk 1,6; stoornis in de maagfunctie 3,6 respectievelijk 8,6 (NIVEL, november 2020). Een opvallend verschil in incidentiecijfers tussen mannen en vrouwen wordt alleen gezien bij maagpijn (zie onderstaande tabel). Een verklaring hiervoor is niet bekend.
| ICPC-code | Omschrijving | Mannen | Vrouwen |
|---|---|---|---|
| D02 | Maagpijn | 16,6 | 26,6 |
| D03 | Zuurbranden | 6,4 | 8,0 |
| D84 | Ziekte oesofagus (divertikel oesofagus, oesofagale reflux zonder oesofagitis, oesofagale reflux met oesofagitis, oesofagusstenose en barrettoesofagus) | 5,3 | 5,7 |
| D85 | Ulcus duodeni | 0,7 | 0,6 |
| D86 | Ander ulcus pepticum (waaronder ulcus ventriculi) | 1,2 | 1,6 |
| D87 | Maagfunctiestoornis (gastritis/duodenitis en dyspepsie/indigestie) | 3,1 | 4,5 |
| D90 | Hernia diafragmatica/hiatus | 1,0 | 1,5 |
Cijfers zijn aantallen per 1000 patiënten per jaar. Bron: NIVEL 2018. | |||
In een Fins onderzoek bij eerstelijns patiënten met maagklachten die endoscopie ondergingen (n = 400) was de frequentie van gastro-oesofageale refluxziekte 18%, van ulcus 15%, van galstenen 2%, van carcinoom 2%, van functionele aandoeningen 52%, van lactose-intolerantie 9% en van niet-gespecificeerde aandoeningen 4%.
In een Nederlands onderzoek (n = 565; gemiddelde leeftijd 46 jaar) ondergingen patiënten uit de huisartsenpraktijk die > 2 weken maagklachten hadden (zonder alarmsymptomen voor maligniteit en zonder maagoperatie in het verleden) een gastroscopie. Van hen had 0,7% een carcinoom, 6,7% een ulcus, 37,9% mucosaschade (oesofagitis, bulbitis of ernstige gastritis) en 0,9% andere relevante afwijkingen (onder andere slokdarmvarices, achalasie of poliepen). Het merendeel (53,8%) had geen of minimale afwijkingen (hiatushernia, gastro-oesofageale prolaps of chronische gastritis).
Een ander Nederlands onderzoek vergeleek de opbrengst van 3062 eerstelijns gastroscopieën uit 3 Nederlandse populaties (jaren 1986-1990) met die van 1286 eerstelijns gastroscopieën (jaren 2002-2004) in een niet-academisch centrum.
De prevalentie van peptisch ulcus daalde van 18 naar 5,4% (daling 12,6%; 95%-BI 14,5 tot 10,7), die van duodenitis daalde van 8,3 naar 5,4% (daling 2,9; 95%-BI 4,5 tot 1,3). De prevalentie van refluxoesofagitis steeg van 15,1 naar 22% (stijging 6,9%; 95%-BI 4,2 tot 9,6), die van barrettoesofagus steeg van 2,6 naar 4,7% (stijging 2,1%; 95%-BI 0,8 tot 4,4). De prevalentie van slokdarm- en maagkanker bleef gelijk met respectievelijk 2,0 versus 1,8% (verschil 0,2%; 95%-BI –1,1 tot 0,7).
Een ander Nederlands onderzoek beschreef de opbrengst van alle eerste gastroscopieën uit de periode 1992 tot 2012 in een niet-academisch centrum (n = 27.410), aangevraagd door huisartsen en specialisten (beide ongeveer de helft).
De opbrengst in alle jaren was gemiddeld voor hernia en/of sfincterinsufficiëntie 39% (spreiding 29 tot 46%), oesofagitis 16% (spreiding 15 tot 21%), barrettoesofagus 3,9% (spreiding 2,2 tot 4,9%), maagulcus 1,8% (spreiding 1,3 tot 5,6%), duodenumulcus 2,1% (spreiding 1,3 tot 5,6%), slokdarmkanker 1,3% (spreiding 0,2 tot 1,8%), maagkanker 1,1% (spreiding 0,6 tot 2,3%), en gastritis 5,9% (spreiding 2,4 tot 10%). Bij 27% van alle gastroscopieën werd geen enkele afwijking gevonden. In dit onderzoek bleef de incidentie van peptische ulcera over de jaren dalen: van ongeveer 150 naar ongeveer 35 per jaar.
Bij een retrospectief dossieronderzoek (n = 2054) van alle open gastroscopieën tussen 2012 en 2016 in Alkmaar werd bij 104 patiënten (5,1%) een maligniteit gevonden.
Bij 38,8% werd een klinisch niet-relevante afwijking gevonden en bij 35,2% geen afwijking. Het hoge percentage maligniteiten (5,1%) lijkt hoger dan dat in de andere bronnen en wordt door het NHG beschouwd als een toevalsbevinding.
Gegevens uit de Nederlandse eerste lijn over de incidentie van ulcus pepticum laten zien dat het aantal nieuwe gevallen van ulcus duodeni in de huisartsenpraktijk bij mannen sinds eind jaren 80 daalde van 3-4 naar < 1 per 1000 patiënten per jaar.
Bij vrouwen daalde de incidentie van 1,5 naar < 0,5 per 1000 per jaar. De leeftijdsklasse waarin de incidentie het hoogst is, is bij mannen verschoven van > 25 jaar naar > 65 jaar en bij vrouwen is de hoogste incidentie > 75 jaar. De incidentie van nieuwe gevallen van ulcus ventriculi daalde in de periode 1985-2006 bij mannen van 0,6 naar 0,2 en bij vrouwen van 0,5 naar 0,3 per 1000 patiënten per jaar.
Blijkens cijfers van de Nivel Zorgregistraties Eerste Lijn was de prevalentie van ulcus duodeni 0,9 per 1000 patiënten per jaar in 2010 en 0,8 in 2018; de prevalentie van ander ulcus pepticum was 0,8 in 2010 en 1,6 in 2018 (NIVEL, november 2020).
Conclusie
De incidentie van ulcus pepticum is gedaald. De werkgroep schat dat van door huisartsen verwezen patiënten 20-25% gastro-oesofageale refluxziekte heeft, 5% een ulcus, 60-70% functionele maagklachten en 2-3% een carcinoom van maag of slokdarm. Bij ongeveer 2/3 van alle eerstelijns gastroscopieën wordt geen klinisch relevante afwijking gevonden.
De laatste tientallen jaren neemt de incidentie van maagkanker af (zie tabel d3). In 2023 waren er 991 patiënten met de diagnose maagkanker (608 mannen en 383 vrouwen). De incidentie van slokdarmkanker is echter toegenomen. In 2023 kregen 2717 patiënten de diagnose ‘slokdarmkanker’ (1998 mannen en 719 vrouwen). Na het 50e levensjaar neemt de incidentie van zowel maag- als slokdarmkanker plotseling toe (zie tabel d4).
De trend naar minder mensen met maagkanker en meer mensen met slokdarmkanker heeft zich in 2023 voortgezet.
| Jaar | Aantal (man en vrouw) | |
|---|---|---|
| Maagkanker | Slokdarmkanker | |
| 1990 | 1899 | 813 |
| 1995 | 1674 | 1010 |
| 2000 | 1510 | 1175 |
| 2005 | 1358 | 1546 |
| 2010 | 1325 | 1958 |
| 2015 | 1126 | 2397 |
| 2020 | 1063 | 2396 |
| 2021 | 1115 | 2535 |
| 2022 | 965* | 2606* |
| 2023 | 991* | 2717* |
Bron: www.cijfersoverkanker.nl, geraadpleegd 27 februari 2024 * Voorlopige gegevens | ||
| 0-49 jaar | 50-59 jaar | 60-69 jaar | 70-79 jaar | > 80 jaar | |
|---|---|---|---|---|---|
| Maag | 60 | 101 | 224 | 335 | 271 |
| Slokdarm | 66 | 296 | 761 | 1116 | 478 |
| Bron: www.cijfersoverkanker.nl, geraadpleegd 27 februari 2024; voorlopige gegevens | |||||
Etiologie/pathofysiologie
Naar Samenvatting ›Maagzuur
Naar Samenvatting ›- Maagzuur heeft een functie als barrière tegen ziekteverwekkers, waaronder multiresistente bacteriën, Clostridium difficile en verwekkers van reizigersdiarree, en bij de opname van voedingsstoffen zoals vitamines (bijvoorbeeld B12) en mineralen (Ca, Fe, Mg).
- De secretie van maagzuur vindt plaats door de pariëtale cellen in de maag. Deze worden gestimuleerd door histamine, gastrine en acetylcholine. Histamine stimuleert de H2-receptor van de pariëtale cellen en activeert zo het enzym H+/K+-ATP-ase, dat H+-ionen naar het maaglumen pompt met als gevolg een toename van maagzuur.
Reboundeffect na staken zuurproductieremmers
Naar Samenvatting ›- Bij een deel van de patiënten komen na het stoppen van de PPI of H2-antagonist de maagklachten terug.
- Dit kan onder andere veroorzaakt worden door het reboundeffect. Bij het reboundeffect stijgt, door hyperplasie van de gastrineproducerende cellen na langdurige zuurremming, de gastrinespiegel en produceert de maag tijdelijk meer zuur.
- Het reboundeffect kan al optreden na enige maanden gebruik en treedt waarschijnlijk vaker en langduriger op bij PPI’s dan bij H2-antagonisten omdat de zuurblokkade bij PPI’s vollediger is dan bij H2-antagonisten.
Een mogelijke verklaring voor het reboundeffect en voor het verschil in ernst en duur daarvan tussen H2-antagonisten en PPI’s zijn hun verschillende werkingsmechanismen op de normale fysiologie.
Voedsel stimuleert de G-cellen in het antrum tot de productie van gastrine, dat vervolgens de enterochroomaffienachtige cellen (ECL-cellen) aanzet tot de productie van histamine. Histamine bindt aan de H2-receptor van pariëtale cellen, die daardoor zuur gaan produceren zodat de pH daalt. Een lage pH geeft negatieve feedback aan de G-cellen, zodat stimulering van de ECL-cellen stopt en uiteindelijk de zuurproductie vermindert. Een hoge pH stimuleert de G-cellen en een voortdurend hoge pH door het gebruik van zuurremmers kan zo leiden tot hyperplasie van ECL-cellen en daarmee tot een hogere histamineproductie. Na het stoppen van de zuurproductieremmer is de hogere histamineproductie nog steeds aanwezig en leidt tot hogere zuurproductie en zuurgerelateerde klachten.
H2-antagonisten binden aan de H2-receptoren op pariëtale cellen, waardoor de pH snel stijgt. Door de competitieve aard van deze binding is de zuurblokkade echter minder compleet dan bij een PPI en daardoor treedt minder ECL-celhyperplasie op. De normale fysiologie herstelt zich daarom snel na het stoppen van H2-antagonisten.
- Qvigstad 2004: PPI’s geven een completere zuurblokkade doordat ze de protonpomp remmen die de laatste stap in de zuurproductie is. De PPI-binding aan de protonpomp is sterk, zodat na het stoppen van de PPI de blokkade van de zuurproductie langzamer verdwijnt dan bij H2-antagonisten. Omdat PPI’s alleen actief werkende protonpompen blokkeren, treedt de zuurremming weliswaar later op dan bij H2-antagonisten, maar de completere zuurblokkade zorgt mogelijk wel voor meer ECL-celhyperplasie, waardoor reboundklachten langer kunnen duren. Verhoogde zuurproductie is aangetoond tot 64 uur na het stoppen van H2-antagonisten.
- Smith 1999: In deze kleine RCT (n = 35) kregen symptoomloze H. pylori-positieve patiënten 2 maanden ranitidine 300 mg per dag of placebo. Gedurende 10 dagen na stoppen was de gemiddelde dyspepsiescore in de ranitidinegroep 1,4 (spreiding 0 tot 30), versus 0 (spreiding 0 tot 6,3) in de placebogroep (p < 0,01). In de ranitidinegroep had 59% dyspeptische klachten na behandeling, in de placebogroep 14%, de gemiddelde symptoomduur was 2 dagen.
- Hunfeld 2007: Een systematische review (8 onderzoeken, waarvan 4 RCT’s, n = 138) onderzocht het voorkomen van reboundklachten na het stoppen van een PPI. Van de 8 onderzoeken werden er 6 verricht bij gezonde mensen; 5 toonden geen reboundeffect aan, 3 open-labelonderzoeken hadden wel aanwijzingen voor zo’n effect. De auteurs concluderen dat er onvoldoende bewijs is voor een klinisch relevante stijging van de zuurproductie na het stoppen van een PPI.
Na deze review verschenen nog 2 onderzoeken.
- Reimer 2009: In een RCT (n = 120) kregen jonge gezonde vrijwilligers 12 weken placebo of 8 weken esomeprazol 40 mg/dag, gevolgd door 4 weken placebo. In week 10-12 waren de scores op de Gastrointestinal Symptom Rating Scale in de PPI-groep significant hoger dan in de placebogroep. Het verschil in zuurgerelateerde klachten was in deze weken statistisch significant. Het verschil in ernst van de symptomen was echter erg klein.
- Niklasson 2010: In een andere RCT (n = 48) kregen H. pylori-negatieve gezonde personen 4 weken pantoprazol 40 mg/dag of placebo, waarna medicatie werd gestopt. De gemiddelde score op de Glasgow Dyspepsia Scale-was 1 week en 2 weken na het stoppen significant hoger in de PPI-groep dan in de placebogroep. Na > 2 weken stoppen bestond er geen verschil meer tussen beide groepen. De reboundklachten waren in deze RCT wat ernstiger, maar korter dan in de eerste RCT.
Overwegingen
Gegevens over hoe vaak het reboundeffect optreedt zijn schaars en de onderzoeken betreffen vooral gezonde proefpersonen, zodat onduidelijk is hoe vaak het reboundeffect optreedt bij patiënten. Bij H2-antagonisten treedt het reboundeffect waarschijnlijk sneller op en duurt het korter. Uit beide RCT’s met PPI’s blijkt een klinisch relevant reboundeffect, vooral in de eerste week na het stoppen. Beide onderzoeken betreffen gezonde personen die relatief kort PPI’s gebruikten; reboundklachten bij chronische gebruikers zijn daarom mogelijk ernstiger. Omdat PPI’s een completere zuurblokkade geven dan H2-antagonisten is het voorstelbaar dat het reboundeffect vaker zal optreden bij PPI’s.
In de oriënterende zoekstrategie bij de herziening van deze standaard is 1 onderzoek gevonden.
In deze retrospectieve analyse kregen H. pylori-negatieve patiënten met erosieve oesofagitis die na 4-8 weken PPI-therapie waren genezen gedurende 6 maanden een PPI of placebo. Het percentage patiënten met klachten in de eerste week na stoppen was 44% in de pantoprazolgroep versus 9% in de placebogroep (p = 0,009). De gemiddelde ernst van zuurbranden was 24 uur na stoppen 5,7 ± 11,7 in de pantoprazolgroep versus 0,74 ± 2,6 in de placebogroep (p < 0,01). In week 3 na het stoppen waren deze verschillen verdwenen. De auteurs concluderen, op basis van serumgastrinespiegels en klachten van zuurbranden enkele weken na het stoppen, dat er geen bewijs is voor reboundklachten, maar de hierboven beschreven resultaten lijken op kortere termijn het tegendeel aan te tonen. Omdat de uitval groot was, de analyse retrospectief en het onderzoek gesponsord, is de bewijskracht erg laag.
Conclusie
Er is bij gezonde personen beperkt bewijs gevonden voor een reboundeffect na stoppen met PPI’s en H2-antagonisten. Bij H2-antagonisten duurt het effect gemiddeld korter; het kan een rol spelen in de eerste 10 dagen na stoppen. Bij PPI’s treedt het effect waarschijnlijk vaker op dan bij H2-antagonisten en kan het een rol spelen in de eerste 2-4 weken na stoppen.
Dieetfactoren, genotmiddelen en psychische factoren
Naar Samenvatting ›- Roken, alcohol, koolzuurhoudende drank en voeding (bijvoorbeeld scherpe kruiden, citrusvruchten, ui, vet voedsel) zijn geassocieerd met maagklachten. Onduidelijk is of eliminatie van deze factoren effect op de klachten heeft.
- Patiënten met maagklachten hebben vaker dan patiënten zonder maagklachten last van angst, depressiviteit en stress. Dat psychische factoren een directe oorzakelijke factor zijn bij het ontstaan van maagklachten is niet aangetoond, maar ze spelen een belangrijke rol in de beleving en de presentatie van de klachten.
Een zoekstrategie leverde onderzoeken op bij patiënten met functionele klachten en patiënten met refluxklachten. Dit waren voornamelijk observationele onderzoeken en weinig goed uitgevoerde interventieonderzoeken.
- Over functionele maagklachten werd 1 systematisch overzicht gevonden, waarin uit het weinige beschikbare observationele onderzoek een mogelijke rol van het vetgehalte van voedsel op klachten werd gevonden.
- Een epidemiologisch onderzoek (n = 813) toonde een associatie tussen roken en het ontstaan van functionele maagklachten. Deze relatie bestond niet voor alcoholgebruik of een verhoogde BMI.
- Over refluxklachten werd een systematische review gevonden met een overzicht van het beschikbare observationele en interventieonderzoek (zoekdatum 1975 tot 2004).
Observationeel onderzoek
Er werd een associatie gevonden tussen het gebruik van tabak, alcohol (28 onderzoeken) of koolzuurhoudende drank (2 onderzoeken) en klachten enerzijds, en een lagere slokdarmsfincterdruk (niet voor alcohol) en een lagere pH anderzijds. Ook werd een associatie gevonden tussen het gebruik van kruiden of citrusvruchten (5 onderzoeken) en klachten. Tevens werd een verband gevonden tussen chocolade of vet voedsel (11 onderzoeken) enerzijds en fysiologische uitkomstmaten anderzijds (lagere slokdarmsfincterdruk en een lagere pH).
Er werd (38 onderzoeken van lage kwaliteit) geen associatie gevonden tussen het gebruik van koffie of overgewicht en klachten, en ook niet tussen koffie of overgewicht en fysiologische uitkomstmaten (slokdarmsfincterdruk en pH).
Interventieonderzoek
Stoppen met alcohol (1 onderzoek) heeft na 6 maanden geen effect op de klachten en op de slokdarmsfincterdruk en de pH. In 3 interventieonderzoeken naar stoppen met roken is slechts het effect gemeten van maximaal 48 uur stoppen; dit liet geen effect op de klachten zien. Het effect op de fysiologische uitkomsten (sfincterspanning, pH) was inconsistent. Interventieonderzoeken naar het vermijden van bepaalde voedingsmiddelen werden niet gevonden.
Een gewichtsvermindering van 10% (5 interventieonderzoeken) blijkt een verbetering van de oesofageale pH te geven, maar de effecten op de klachten zijn niet eensluidend.
Zowel verhogen van het hoofdeinde (2 van de 3 onderzoeken) als linker zijligging (alle 3 onderzoeken) gaf minder pH-dalingen in de slokdarm, maar verbetering van de klachten werd alleen gevonden bij verhoging van het hoofdeinde (1 onderzoek).
Aanpassen van het tijdstip van de avondmaaltijd (2 interventieonderzoeken) had geen effect op de klachten; het effect op de pH was inconsistent. Een review uit 2010 bevestigt deze bevindingen.
Daarnaast bleek dat vezelrijk voedsel (2 observationele onderzoeken) refluxklachten verminderde.
In een observationeel onderzoek (316 patiënten, 115 controlepatiënten) was de prevalentie van refluxklachten in beroepen met een verhoogde abdominale druk (operazangers, professionele bespelers van blaasinstrumenten, glasblazers) hoger dan in een controlegroep met geneeskundestudenten, leraren, advocaten en technici (ongeveer 50 vs. 35%).
Overwegingen
Het observationele onderzoek is wisselend van kwaliteit en de gevonden associaties met klachten en fysiologische uitkomstmaten zijn vaak inconsistent. Alleen voor alcohol, tabak en koolzuurhoudende drank zijn de associaties consistent. De bewijskracht van observationeel onderzoek is te laag voor een bindend advies. In interventieonderzoek bleken stoppen met alcohol en aanpassen van het tijdstip van het avondmaal geen effect te hebben. Afvallen en verhogen van het hoofdeinde zijn wel effectief voor de klachten, terwijl linker zijligging geen effect had. Het effect van verhoging van het hoofdeinde en afvallen op de pH is ook aangetoond in interventieonderzoek. Het effect enkele dagen na stoppen met roken op de klachten is onduidelijk en het latere effect is niet onderzocht. Omdat uit observationeel onderzoek bij refluxklachten en bij functionele maagklachten bleek dat roken een associatie had met de klachten en de fysiologische uitkomstmaten, is een rookstopadvies te overwegen.
In de oriënterende zoekstrategie bij de herziening van deze standaard is een review gevonden van onderzoeken naar functionele dyspepsie en dieet.
De bewijskracht van de gevonden associaties (16 onderzoeken, alle van matige kwaliteit) is te laag om een bindend advies te kunnen geven, zodat deze review de conclusie niet verandert.
Conclusie
Er is weinig bekend over de effectiviteit van niet-medicamenteuze adviezen bij reflux- en functionele klachten. Veel voedingsmiddelen kunnen invloed hebben op de klachten, daarom wordt geadviseerd aan te sluiten bij de persoonlijke voedingsintoleranties en individuele leefstijlfactoren van de patiënt. Afvallen en verhogen van het hoofdeinde kan worden geadviseerd, stoppen met roken is mogelijk zinvol.
De relatie tussen psychosociale factoren en maagklachten wordt in praktijk herkend. Ook in publicaties wordt deze relatie bevestigd, maar de literatuur hierover is onvolledig en soms tegenstrijdig.
Patiënten met functionele dyspepsie (> 3 maanden maagklachten zonder dat er gastroscopische afwijkingen gevonden zijn) ervaren meer stress, zijn vaker angstig en depressief en hebben meer psychopathologie dan patiënten met een endoscopisch bevestigd ulcus duodeni en gezonde personen.
Ook in een recente meta-analyse (23 onderzoeken, n = 59029) bleek een associatie tussen functionele dyspepsie en depressie (OR 2,28; 95%-BI 2,02 tot 3,81).
In de subgroepanalyse bleek de associatie sterker bij Europese patiënten (OR 6,19) dan bij Aziatische patiënten (OR 2,47). De auteurs wijzen er in hun conclusie op dat een causale relatie hiermee niet is vastgesteld.
De kwaliteit van leven bij patiënten met functionele dyspepsie is minder dan bij patiënten met een ulcus duodeni.
Stress lijkt een centrale rol te spelen in de ervaren gezondheid en in het hulpzoekgedrag van patiënten. In een crosssectioneel onderzoek bij 360 ongeselecteerde patiënten met maagklachten in de huisartsenpraktijk bleek stress een belangrijke determinant van de ervaren gezondheid.
Bij patiënten met een ulcus lijkt stress een cofactor te zijn bij het ontstaan van het ulcus.
Reflux
Naar Samenvatting ›- Reflux is het terugstromen van maagzuur in de slokdarm; dit kan leiden tot maagklachten of tot erosies en zweren in de slokdarm, soms met als gevolg stricturen, bloedingen of metaplasie (barrettoesofagus).
- Factoren geassocieerd met reflux zijn lage spanning van de oesofagussfincter, veranderde oesofagusperistaltiek, hiatushernia (hernia diaphragmatica), vertraagde maagontlediging, te veel eten, abdominale obesitas, roken en intra-abdominale drukverhoging.
- De relatie tussen reflux en chronische hoest of heesheid is onduidelijk; een effect van PPI’s op chronische hoest bij refluxziekte is niet aangetoond.
Verondersteld wordt dat heesheid en chronisch hoesten mogelijk veroorzaakt worden door reflux van de maaginhoud in het laryngofaryngeale gebied. Het verband tussen refluxziekte en hoestklachten is vaak gebaseerd op het resultaat van empirische behandeling met PPI’s, waarbij symptomen na 2-8 weken verdwijnen. In een cochranereview bleek dat in de onderzoeken waarin intention-to-treatgegevens beschikbaar waren (4 RCT’s, 191 volwassenen met hoestklachten zonder onderliggende longziekte) het effect van een behandeling van 2-3 maanden met PPI’s op het verdwijnen van hoestklachten niet significant te verschillen van placebo (OR 0,46; 95%-BI 0,19 tot 1,15).
Het verdwijnen van hoestklachten was de enige effectmaat die kon worden gepoold op basis van intention-to-treat; voor andere effectmaten (gemiddelde hoest, verandering in hoestscores, verandering van heesheid) kon dat niet. Ook bleek er een groot placebo- en tijdseffect op het verdwijnen van hoestklachten.
De cochranereview van Chang is sinds 2019 niet meer herzien. In mei 2018 werd bij de oriënterende search voor de revisie van deze standaard een prospectief cohortonderzoek gevonden bij 638 tweedelijns patiënten met stabiele COPD, van wie er 85 patiënten een PPI-gebruikten vanwege gastro-oesofageale refluxziekte.
Deze 85 patiënten hadden bij aanvang van het onderzoek meer en ernstiger longaanvallen en een slechtere longfunctie en inspanningstolerantie dan de overige patiënten. Ook na gemiddeld 2 jaar kwamen bij deze 85 patiënten longaanvallen vaker voor (HR 2,05; 95%-BI 1,37 tot 3,08). Dit suggereert dat PPI-gebruik wegens gastro-oesofageale refluxziekte bij stabiele COPD-patiënten longaanvallen niet voorkomt. De conclusie vormt een aanvullend argument om een PPI niet voor te schrijven ter vermindering van longaanvallen COPD. De conclusie blijft daarom onveranderd ten opzichte van de vorige versie van deze standaard.
Conclusie
De relatie tussen refluxziekte en heesheid of hoestklachten is onduidelijk en er is onvoldoende bewijs voor de effectiviteit van PPI’s op hoestklachten die aan refluxziekte gerelateerd zijn.
Ulcera
Naar Samenvatting ›- Ulcera in maag of duodenum worden meestal veroorzaakt door medicatie (NSAID) of door H. pylori (70% van de patiënten met een ulcus ventriculi en 90% van de patiënten met een ulcus duodeni).
- De meest voorkomende complicatie van een ulcus is een bloeding; perforaties en stricturen komen minder vaak voor.
Geneesmiddelen met maagbijwerkingen
Naar Samenvatting ›Veel geneesmiddelen kunnen als bijwerking maagklachten veroorzaken. Dit geldt onder andere voor antibiotica, antidepressiva, metformine, calciumantagonisten, nitraten, spironolacton, bifosfonaten, kaliumchloridetabletten, orale corticosteroïden, sommige DOAC’s en NSAID’s.
NSAID’s
Naar Samenvatting ›- Alle NSAID’s remmen in meer of mindere mate het enzym COX-1 en verlagen daardoor de productie van prostaglandinen die het maagslijmvlies beschermen, zowel de ‘klassieke’ NSAID’s (bijvoorbeeld ibuprofen, diclofenac, naproxen, acetylsalicylzuur) als de ‘COX-2-selectieve’ NSAID’s (bijvoorbeeld celecoxib, etoricoxib).
- Alle NSAID’s kunnen daarom naast maagklachten ook maagcomplicaties geven.
- NSAID’s zijn de meest voorkomende oorzaak van maagcomplicaties.
- De frequentie van maagklachten bij individuele NSAID’s varieert van 1% tot > 10%.
- Maagklachten na de start van een NSAID betekenen niet automatisch een hoger risico op maagcomplicaties.
- Bij NSAID-gebruik, zelfs bij starters, kunnen maagcomplicaties optreden zonder voorafgaande maagklachten.
Bisfosfonaten en kaliumchloride
Naar Samenvatting ›Bisfosfonaten en kaliumchloride (vooral de tabletvorm) kunnen door directe inwerking op de maag- of oesofaguswand een ulcus veroorzaken in oesofagus, maag of duodenum.
Corticosteroïden
Naar Samenvatting ›- Doordat corticosteroïden de wondgenezing vertragen, kan corticosteroïdgebruik het risico op complicaties (zoals bloeding) verhogen bij een door andere oorzaak reeds aangetaste maagwand.
- Bij patiënten met risicofactoren voor maagbeschadiging, zoals een ulcus in de voorgeschiedenis of H. pylori-aanwezigheid, verhoogt langdurig gebruik van een systemisch corticosteroïd (> 30 dagen) het risico op een maagbloeding licht.
- Dermaal of per inhalatie toegediende corticosteroïden verhogen het risico op een maagbloeding niet (zie de NHG-Behandelrichtlijn Preventie van maagcomplicaties door geneesmiddelgebruik).
Helicobacter pylori
Naar Samenvatting ›- De prevalentie van H. pylori in de algemene Nederlandse bevolking is ongeveer 20% en dalende; bij patiënten met maagklachten is de prevalentie ongeveer 30-35%.
- Bij patiënten met maagklachten uit mediterrane landen, Oost-Europa, Midden-Oosten, Azië, Afrika, Midden- en Zuid-Amerika kan de prevalentie oplopen tot 75%.
- Bij de meerderheid van de geïnfecteerden ontbreken klinische verschijnselen; bij ongeveer 20% treedt ooit een ulcus op, bij 0,1-3% een maagcarcinoom.
- De aanwezigheid van H. pylori is geassocieerd met atrofie van het maagslijmvlies (geschat risico 1% per jaar). Verondersteld wordt dat atrofische gastritis via metaplasie kan overgaan in maagcarcinoom.
- Het risico op atrofie kan worden verkleind door eradicatie van H. pylori.
- Het risico op herbesmetting na succesvolle eradicatie wordt geschat op < 1,5% per jaar.
Het meeste onderzoek naar H. pylori is gedaan bij patiënten met maagklachten; cijfers uit de algemene bevolking zijn zeer schaars. Uit 4 Nederlandse onderzoeken rond de eeuwwisseling blijkt dat de-prevalentie bij mensen met maagklachten varieerde tussen 32 en 43,7%.
In een recenter eerstelijns onderzoek was de prevalentie lager, namelijk 25,7%.
Dit suggereert een dalende trend, wat overeenkomt met mondiale gegevens. De actuele prevalentie van H. pylori in de algemene bevolking is onbekend, maar is zeer waarschijnlijk lager dan de hier gepresenteerde prevalentiecijfers bij mensen met maagklachten.
In 1998 is bij kinderen in Nederland (met serologisch onderzoek) een H. pylori-prevalentie gevonden van 1,2%, waarbij een significant verschil (p < 0,001) bestond tussen kinderen van wie beide ouders Nederlands waren (0,5%) en kinderen met ≥ 1 niet-Nederlandse ouder (2,6%).
Omdat H. pylori-besmetting vaak plaatsvindt op de kinderleeftijd in een omgeving met een hoge infectiedruk, betekent dit lage percentage waarschijnlijk dat toekomstige generaties een lagere H. pylori-prevalentie hebben. Ook in later onderzoek vond Arents een significante associatie tussen een hoger percentage H. pylori-besmettingen en een hogere leeftijd.
In onderzoek onder eerstelijnspatiënten met chronische maagklachten in de regio Amsterdam was de prevalentie van H. pylori 40% bij patiënten zonder migratieachtergrond en 76% (p < 0,05) bij patiënten afkomstig uit met name Suriname/Antillen, Marokko, Turkije en Azië.
Bij patiënten die een gastroscopie ondergingen kwam bij voornamelijk patiënten van Turkse komaf H. pylori-besmetting veel vaker voor dan bij patiënten zonder migratieachtergrond (75 vs. 33%; p < 0,0001).
Ook in Oost-Europa worden hoge prevalenties gezien (tot 84%) .
Conclusie
De prevalentie van H. pylori in de algemene bevolking van Nederland wordt geschat op 20% en is dalende. De prevalentie van H. pylori is hoger bij patiënten met een migratieachtergrond die maagklachten hebben dan bij patiënten zonder migratieachtergrond.
In een meta-analyse van 10 prospectieve patiënt-controleonderzoeken (n = 3014) bleek het jaarlijkse risico op herbesmetting met H. pylori in westerse landen 2,7%. Patiënten met een langere follow-up en een negatieve C13-ureum-ademtest hadden 1 jaar na eradicatiebehandeling een jaarlijks H. pylori-herbesmettingsrisico 1,5%. Waarschijnlijk is het aantal recidiefbesmettingen in Nederland < 1,5%. Immers, bij dit percentage zou na 15 jaar > 22% van de ge-eradiceerden opnieuw positief zijn en dat is hoger dan de geschatte prevalentie in Nederland.
Conclusie
Het herbesmettingspercentage na eradicatie van H. pylori is in Nederland laag, waarschijnlijk < 1,5% per jaar.
H. pylori-infectie is een cofactor bij het ontstaan van ulcus duodeni of ulcus ventriculi (afhankelijk van de populatie krijgt 1-10% van de geïnfecteerden een ulcus) en van maagcarcinoom (afhankelijk van de populatie krijgt ongeveer 0,1-3% van de geïnfecteerden een maagcarcinoom). Een zeer zeldzaam gevolg (< 0,01%) van H. pylori-infectie is het ontstaan van een mucosa associated lymphoid tissue (MALT-)lymfoom in de maag, dat door H. pylori-eradicatie meestal verdwijnt. De meerderheid van H. pylori-geïnfecteerden heeft echter geen klinische verschijnselen. De WHO heeft een H. pylori-infectie omschreven als een humaan carcinogeen , maar daaraan geen consequenties verbonden voor screening.
Effect van H. pylori-eradicatie op de kans op maagcarcinoom
Een meta-analyse van 24 onderzoeken van goede kwaliteit (Amstar 8/11; n = 48.064; 340.255 persoonsjaren), waarvan 22 in Aziatische populaties en 2 in andere populaties, onderzocht de relatie tussen H. pylori-eradicatie en de incidentie van maagcarcinoom bij asymptomatische H. pylori-dragers (6 RCT’s en 8 cohortonderzoeken) en bij patiënten na endoscopische resectie van early gastric cancer (2 RCT’s en 8 cohortonderzoeken). Er waren 715 deelnemers met maagcarcinoom. Na aanpassing voor incidentieverschillen bij aanvang was de incidentie van maagcarcinoom lager bij deelnemers na H. pylori-eradicatie dan bij deelnemers zonder H. pylori-eradicatie (RR 0,54; 95%-BI 0,46 tot 0,65; I2 = 0%). De aanvangsincidentie voor maagcarcinoom wisselde van 34 tot 10.256 per 100.000 persoonsjaren. In het hoogste en het middelste tertiel was het effect iets groter (RR respectievelijk 0,45 en 0,49), maar in het laagste tertiel was het effect niet significant (RR 0,80; 95%-BI 0,56 tot 1,15). Het effect verschilde niet significant tussen asymptomatische H. pylori-dragers (RR 0,62; 95%-BI 0,49 tot 0,79) en patiënten die endoscopische resectie van early gastric cancer hadden ondergaan (RR 0,46; 95%-BI 0,35 tot 0,60). Hoewel het effect van H. pylori-eradicatie is aangetoond, is de vraag nog niet beantwoord of eradicatie ook effectief is in populaties met een relatief lage maagcarcinoomincidentie in de Europese bevolking.
Verband tussen maagcarcinoom en chronisch PPI-gebruik
Verondersteld wordt dat een door H. pylori-geïnduceerde chronische gastritis kan overgaan in een atrofische gastritis die via metaplasie kan overgaan in maagcarcinoom. Chronisch PPI-gebruik is geassocieerd met het ontstaan van atrofische gastritis bij 1-positieve patiënten. Het precieze risico daarop is onbekend en laag, maar kan worden verkleind door H. pylori-eradicatie, waardoor de atrofische gastritis verdwijnt en de progressie van preneoplastische naar neoplastische lesies wordt gestopt bij bepaalde groepen patiënten. De prevalentie van atrofische gastritis bij H. pylori-positieve patiënten wordt geschat op ongeveer 1% per jaar. Bij H. pylori-negatieve patiënten bestaat deze associatie niet.
Conclusie
H. pylori is een cofactor bij het ontstaan van maagcarcinoom. Er zijn aanwijzingen dat eradicatie van H. pylori een preventief effect heeft op het ontstaan van maagcarcinoom.
De mogelijk faciliterende rol van chronisch PPI-gebruik bij H. pylori-positieve patiënten voor het ontstaan van maagcarcinoom is een extra argument om bij chronisch PPI-gebruik op H. pylori te testen.
Maag- en slokdarmcarcinoom
Naar Samenvatting ›- Ongeveer 75% van de patiënten met een maag- of slokdarmcarcinoom presenteert zich op het spreekuur met een alarmsymptoom voor maligniteit (zie Anamnese).
- Voornaamste risicofactoren zijn leeftijd (> 50 jaar) en geslacht (mannen 2-3 × vaker dan vrouwen).
Overige risicofactoren
Naar Samenvatting ›- Maag- en slokdarmcarcinoom:
- roken en alcoholgebruik (tot 4 × verhoogd risico bij > 8 glazen alcohol/dag of > 25 sigaretten/dag).
- Maagcarcinoom:
- achloorhydrie (volledig ontbreken van zuur in de maag) (2-3 × verhoogd risico)
- H. pylori (2-3 × verhoogd risico)
- eerdere maagresectie (tot 2 × verhoogd risico)
- erfelijke predispositie
- dieet met weinig groente en fruit, en veel vlees
- Plaveiselcelcarcinoom van de oesofagus:
- frequente consumptie van extreem warme dranken (tot 2 × verhoogd risico)
- achalasie (bewegingsstoornis van de slokdarm, waardoor voedsel blijft hangen in de slokdarm) (4-8 × verhoogd risico)
- radiotherapie wegens mammacarcinoom (4-8 × verhoogd risico)
- corrosief letsel (> 8 × verhoogd risico)
- plummer-vinsonsyndroom (slikklachten door een slokdarmweb, anemie en glossitis) (> 8 × verhoogd risico)
- hoofd-halsmaligniteit (> 8 × verhoogd risico)
- dieet met weinig groente en fruit, of rijk aan nitrosamine (met name gepekelde groente)
- Adenocarcinoom van de oesofagus:
- obesitas (2-4 × verhoogd risico)
- matige refluxklachten (4-8 × verhoogd risico)
- radiotherapie wegens mammacarcinoom (4-8 × verhoogd risico)
- barrettoesofagus (> 8 × verhoogd risico)
Deze standaard baseert zich bij andere risicofactoren voor maag- en slokdarmcarcinoom dan leeftijd, geslacht en de alarmsymptomen op de informatie hierover van het IKNL (IKNL, mei 2019 en IKNL, mei 2019).
Ten aanzien van het dieet beschrijft het IKNL dat is gebleken dat er een complexe relatie bestaat tussen het voedingspatroon en het optreden van maagcarcinoom. Een van de meest overtuigende bewijzen van een relatie is het epidemiologische gegeven dat nakomelingen van Japanners die emigreerden naar de Verenigde Staten binnen 2 generaties een sterk dalende incidentie hadden van maagcarcinoom en een stijgende incidentie van coloncarcinoom. Een lager risico wordt vooral toegeschreven aan een hoge inname van plantaardige producten en fruit, en een lage inname van dierlijke voedingsstoffen.
Bij slokdarmcarcinoom beschrijft het IKNL dat verscheidene patiënt-controleonderzoeken aangeven dat diëten met weinig fruit en groente geassocieerd zijn met plaveiselcelcarcinoom (tweevoudig verhoogd risico). Bij gebruik van voeding rijk aan nitrosamine (met name gepekelde groente) wordt ook een verhoogd risico gevonden.
De werkgroep vat dit praktisch samen en formuleert als risicofactor bij maagcarcinoom een dieet met weinig groente en fruit en veel vlees, en bij slokdarm (plaveiselcel)carcinoom een dieet met weinig groente en fruit, waarbij de rol van nitrosamines apart wordt beschreven.
Het plummer-vinsonsyndroom is een syndroom van grotendeel onbekende genese waarbij anemie met dysfagie, glossitis, ontbreken van maagsap en atrofie en scheurtjes van mond, tong en slokdarm optreden.
Overwegingen
Onbekend is wat de testeigenschappen zijn van de genoemde risicofactoren (alleen of in combinatie met alarmsymptomen) voor het voorspellen van de kans op een maligniteit.
Conclusie
Ondanks de genoemde overweging besluit de werkgroep deze risicofactoren wel te noemen in de standaard (naast de factor ‘hogere leeftijd’), omdat ze van belang kunnen zijn bij het besluit tot gastroscopie bij een (oudere) patiënt die geen alarmsymptomen heeft.
Familiair maagcarcinoom
Naar Samenvatting ›- Bij ongeveer 5% van de patiënten met maagcarcinoom gaat het om een familiair maagcarcinoom of om een maagcarcinoom als onderdeel van een (zeer zeldzaam) erfelijk syndroom.
- Men spreekt van ‘familiair maagcarcinoom’ als maagcarcinomen eveneens voorkomen:
- bij ≥ 2 eerste- of tweedegraads familieleden, van wie er ≥ 1 ten tijde van de diagnose < 50 jaar was, of
- bij ≥ 3 eerste- of tweedegraads familieleden, onafhankelijk van de leeftijd bij diagnose.
Bij ongeveer 5% van de patiënten met maagcarcinoom betreft het een familiair voorkomen. Familiair maagcarcinoom is gedefinieerd als maagcarcinoom vastgesteld bij ≥ 2 eerste- of tweedegraads familieleden van wie ≥ 1 persoon < 50 jaar, of vastgesteld bij ≥ 3 eerste- of tweedegraads familieleden onafhankelijk van de leeftijd bij diagnose. De Landelijke richtlijn Familiair maagcarcinoom adviseert de eerstegraads verwanten van deze maagkankerpatiënten te verwijzen naar de klinisch geneticus voor counseling en DNA-diagnostiek, en voor periodieke controles. De frequentie en inhoud van deze controles (waaronder gastroscopie) hangt af van de aanwezigheid van de CDH1-mutatie. Verder is diagnostiek en eradicatie van H. pylori relevant. Het advies is om periodieke controles uitsluitend te doen in centra met expertise op het gebied van hereditair maagcarcinoom.
N.B. De in dit detail genoemde indicaties voor H. pylori-diagnostiek en voor gastroduodenoscopie in het kader van screening op familiaire maagkanker ontbreken in de hoofdtekst van de standaard, omdat de volledige tekst maagklachten als ingang heeft; screening op familiaire maagkanker valt buiten de scope.
PPI-gebruik en maagcarcinoom
Naar Samenvatting ›- Er is een zwakke associatie tussen chronisch PPI-gebruik en maagcarcinoom. Waarschijnlijk betreft dit alleen patiënten met een H. pylori-infectie. PPI-gebruik verergert mogelijk de door H. pylori geïnduceerde maagslijmvliesatrofie (zie Helicobacter pylori).
- Toch is PPI-gebruik geen risicofactor voor maagcarcinoom en H. pylori-infectie wél, omdat:
- het beleid bij persisterende of recidiverende maagklachten primair gericht is op eradicatie van H. pylori. Chronisch PPI-gebruik zal hierdoor niet of nauwelijks voorkomen
- nooit is aangetoond dat het toevoegen van chronisch PPI-gebruik als aanvullend criterium in predictiemodellen voor een gastroduodenoscopie leidt tot het kosteneffectiever opsporen van maagcarcinomen
Zie ook Bijwerkingen bij chronisch-gebruik van PPI's en H2-antagonisten.
De kwaliteit van bewijs voor een verband tussen chronisch PPI-gebruik en maagkanker is erg laag (observationeel onderzoek, laag relatief risico, onderzoeken niet gecorrigeerd voor vertekenende factoren, zie ook detail Bijwerkingen bij chronisch gebruik van PPI’s en H2-antagonisten). Er zijn geen onderzoeksgegevens bekend over de vraag of het een zinvolle strategie is om bij chronisch PPI-gebruik gastroscopie te verrichten met als doel een mogelijk maagcarcinoom te vinden. Het IKNL-noemt chronisch PPI-gebruik niet bij de risicofactoren voor slokdarm- of maagcarcinoom (IKNL, mei 2019 en IKNL, mei 2019).
Ook is het niet zinvol om bij chronisch PPI-gebruik een gastroscopie te doen met als overweging dat dan de kans op oesofagitis graad C/D of op een barrettoesofagus erg groot is. Oesofagitis graad C/D wordt alleen gevonden indien geen behandeling met PPI’s is gegeven en het jaarlijkse risico op slokdarmcarcinoom bij barrettoesofagus is veel lager dan altijd werd aangenomen. De effectiviteit van screening van barretpatiënten op carcinoom wordt daarmee veel geringer (zie detail Barrettoesofagus) en het nut van screening van alle chronische PPI-gebruikers met als doel een barrettoesofagus op te sporen is twijfelachtig.
Bij het ontbreken van voordelen en het bestaan van nadelen van gastroscopie, zoals de belasting voor de patiënt, mogelijke bijwerkingen en kosten, is er geen goede reden om een gastroscopie te adviseren op basis van chronisch PPI-gebruik. Dit betekent dat bij chronisch PPI-gebruik dezelfde criteria voor een gastroscopie gelden als bij niet PPI-gebruik.
Conclusie
De duur van een effectieve PPI-therapie is op zichzelf geen goede indicatie voor gastroscopie om een maligniteit uit te sluiten.
Beloop van maagklachten
Naar Samenvatting ›Het beloop van maagklachten is gunstig; na 1 jaar heeft ongeveer 3/4 van de door de huisarts behandelde patiënten geen of weinig klachten meer.
In een Nederlands prospectief onderzoek bij eerstelijns patiënten (n = 583) waren bij 22% van de 518 patiënten die het onderzoek voltooiden de maagklachten toegenomen na 1 jaar beleid door de huisarts. De algemene gezondheid, gemeten met de vijfpunts COOP/Wonca-kaart, was bij 24% onveranderd of licht verslechterd en bij 9% verslechterd. In een multivariabele analyse bleek dat maagklachten (> 1 episode per jaar) en een peptisch ulcus in de voorgeschiedenis vaker geassocieerd waren met een verslechtering van maagklachten.
Conclusie
Bij ongeveer een kwart van de patiënten zijn volgens de eigen perceptie de maagklachten na 1 jaar toegenomen.
Richtlijnen spoed
Naar Samenvatting ›Gebruik bij twijfel over de klinische stabiliteit van de patiënt de ABCDE-systematiek. Wanneer de patiënt ABCDE-instabiel is: bel een ambulance met directe inzet (A0/A1-urgentie) (zie NHG-Behandelrichtlijn Geneesmiddelen en zuurstof in spoedeisende situaties).
Spoedeisende klachten en symptomen
Naar Samenvatting ›- Bloedbraken (hematemese)
- Teerkleurige ontlasting (melena)
- Aanhoudend braken
- Ernstige buikpijn die verergert door beweging of vervoer, en/of koorts (passend bij peritoneale prikkeling)
- In de eerste weken tot maanden na bariatrische chirurgie:
- acuut ontstane ernstige (buik)pijn, tachycardie of koorts
- continu braken en pijn in epigastrio
- Andere klachten na specifieke bariatrische ingrepen:
- intermitterend braken, zuurbranden of nachtelijke hoest na een maagbandje
- intermitterende buikpijn na een gastric bypass
- zuurbranden na een gastric sleeve
Lichamelijk onderzoek bij spoedeisende klachten en symptomen
Naar Samenvatting ›- Beoordeel de algemene toestand en mate van ziek zijn. Onderzoek bij een bloeding of bij veel braken de bloeddruk, hartfrequentie en zo nodig de mate van dehydratie.
- Onderzoek de buik; ga na of er aanwijzingen zijn voor peritoneale prikkeling (loslaatpijn, défense musculaire).
Beleid bij spoedeisende klachten en symptomen
Naar Samenvatting ›- Adviseer de patiënt niets meer te eten en te drinken.
- Verwijs met spoed bij aanwijzing voor peritoneale prikkeling (vermoeden maagperforatie)
- Overleg direct met de specialist bij:
- hematemese of melena
- aanhoudend braken (vermoeden van obstructie of risico op dehydratie)
- Spoedeisende klachten in de eerste weken tot maanden na bariatrische chirurgie (risico op perforatie): overleg direct en bij voorkeur met het bariatrisch centrum waar de ingreep plaatsvond.
- Andere klachten na een specifieke bariatrische ingreep: overleg dezelfde dag met een bariatrisch chirurg.
Op basis van de informatie in detail Complicaties na bariatrische chirurgie en consistent met de emergency-symptomen die Engelse huisartsen beschrijven bij patiënten die geopereerd zijn , heeft de werkgroep in overleg met de NVMDL op basis van consensus besloten dat de volgende symptomen na bariatrische chirurgie kunnen wijzen op complicaties en reden zijn voor direct verwijzen of direct contact:
- acuut ontstane ernstige pijn of tachycardie en/of koorts en/of buikpijn, in de eerste weken na de ingreep;
- continu braken en pijn in epigastrio in de eerste weken na de ingreep.
Symptomen die volgens de Engelse huisartsen geen emergency maar urgent zijn, worden toch genoemd bij het spoedbeleid. Het betreft geen spoedbeleid in de zin van direct handelen, maar er zijn wel degelijk beleidsconsequenties op dezelfde dag zodat dit de beste plaats is om deze klachten te vermelden:
- intermitterend braken en/of zuurbranden en/of nachtelijke hoest bij een maagbandje;
- intermitterend buikpijn bij een gastric bypass-operatie;
- zuurbranden bij een gastric sleeve-operatie.
Ook reden voor een verwijzing, maar niet met spoed, zijn:
- gewichtstoename;
- zwangerschap.
Er zijn verschillende types bariatrische operaties :
- maagverkleinende operatie, bijvoorbeeld een gastric sleeve of een maagband (de maagband wordt tegenwoordig in Nederland niet meer geplaatst);
- combinatie van maagverkleining en malabsorptie, bijvoorbeeld een Roux-en-Y gastric bypass of een omega-loop gastric bypass (mini gastric bypass).
De complicaties van de ingrepen verschillen per type en worden onderscheiden in vroege en late complicaties. Deze worden beschreven in de SEH-poster van de Dutch Society for Metabolic and Bariatric Surgery (www.dsmbs.nl/seh-poster, geraadpleegd 1 november 2019). In dit detail ligt de nadruk op complicaties die maagklachten geven. Trombo-embolische, respiratoire, infectieuze en nutritionele complicaties zijn niet specifiek voor bariatrische chirurgie, ze kunnen optreden na elke chirurgische ingreep met narcose (zoals trombo-embolie, longproblemen en infectie), of zijn niet acuut (nutritionele problemen). In deze standaard worden alleen de complicaties besproken die maagklachten geven of die specifiek zijn voor bariatrische chirurgie.
Gastric-sleeve
Bij een gastric-sleeve-operatie wordt de buitenbocht van de maag (ongeveer 2/3 van de maaginhoud) laparoscopisch verwijderd, waardoor een kleine buisvormige maag overblijft.
- Vroege complicaties zijn naadlekkage of fistelvorming (2%), strictuur (0,7-4%) en bloeding (1,5%).
- Late complicaties zijn gastro-oesofageale reflux (tot 25%), die vaak te controleren is met PPI’s.
Gastric bypass
Bij een gastric bypass-operatie wordt de maag doorgesneden. Uit het kleinste proximale deel wordt een kleine pouch (nieuw klein maagje) gemaakt. Het jejunum wordt ongeveer 50-150 cm na treitz doorgenomen en verbonden met de maagpouch (gastro-jejunostomie), zodat het eten doorgevoerd kan worden. Het resterende grootste deel van de maag, het duodenum en 50-150 cm jejunum, wordt ongeveer 100-150 cm na de gastro-jejunostomie verbonden met het afvoerende jejunum (jejuno-jejunostomie). Zo ontstaat een blind eindigende lis waaruit de verteringssappen uit restmaag, lever en pancreas bij de voeding kunnen komen.
- Vroege complicaties:
- naadlekkage of fistelvorming (2-3,6%); hierbij kan het beeld van een peritonitis of sepsis ontstaan, peritonitis kan bij lichamelijk onderzoek van een obees persoon moeilijk te ontdekken zijn en vaak is tachycardie het enige symptoom;
- obstructie van beide anastomosen (1-20%); obstructie ter plaatse van de gastro-jejunostomie geeft met name slikklachten, pijn in epigastrio en direct terugbraken van voeding en/of dranken; obstructie van de jejuno-jejunostomie geeft aanvankelijk mildere symptomen, vaak staan misselijkheid en buikpijn op de voorgrond, het gevaar is dat de restmaag zich vult en er een overdruk ontstaat; dan kan een perforatie optreden en deze kan leiden tot ernstige sepsis; indien de voedingslis zich vult, kan de patiënt gaan braken, dit kan leiden tot aspiratie;
- bloeding (1,7%).
- Late complicaties:
- ulcus van de anastomose (1-7%, waarvan de helft in de eerste 3 maanden); symptomen zijn pijn in epigastrio, hongergevoel, misselijkheid/braken en toename van voedselintoleratie;
- strictuur van een anastomose;
- obstructie (1-6%, waarvan 60% door interne herniatie), die vaak intermitterend aanwezig is; pijnklachten linksboven in de bovenbuik die 20-30 minuten na het eten of drinken ontstaan zijn vaak kenmerkend voor herniatie, indien de pijnklachten zeer hevig en progressief zijn, kan dit wijzen op acute beklemming van de darm en is spoedverwijzing aangewezen;
- galstenen (< 15%, voorkomend vanaf 3 maanden tot ≥ 2 jaar) door het snelle afvallen; een extra moeilijkheid is dat de galwegen na een gastric bypass-operatie niet meer toegankelijk zijn voor endoscopische retrograde cholangio- en pancreaticografie (ERCP).
Maagband
Bij een maagband wordt net onder de gastro-oesofageale overgang laparoscopisch een opblaasbare siliconenband om het bovenste deel van de maag heen geplaatst. Die band kan worden opgeblazen van buiten het lichaam door het aanprikken van een subcutaan in de buikwand geplaatst poortsysteem. Het maagdeel proximaal van de band wordt pouch genoemd.
- Vroege complicaties:
- slokdarm- of maagperforatie, meestal ontstaan tijdens de operatie en soms pas na enige dagen tot klachten leidend (0,3%);
- acute pouchdilatatie leidend tot necrose door verkeerde positionering of tot fundusherniatie door de band (0,3-2,6%); een langzaam ontstane herniatie leidt tot klachten van zuurbranden (vooral bij liggen) en nachtelijk hoesten.
- Late complicaties:
- bandruptuur, met als belangrijkste symptoom dat de band niet meer werkt;
- langzame pouchdilatatie met uiteindelijk fundusherniatie door de band (2%); klachten zijn afname van het tempo van gewichtsverlies, zuurbranden en vroeg verzadigingsgevoel;
- maagerosie (0,5-1%) tot zelfs intragastrische migratie van de band; klachten zijn gevarieerd (pijn in epigastrio, tachycardie, koorts, bloedverlies en slikmoeilijkheden), soms afwezig;
- slokdarmdilatatie (prevalentie onduidelijk).
Richtlijnen diagnostiek
Naar Samenvatting ›Anamnese
Naar Samenvatting ›- Alarmsymptomen voor maligniteit (soms indicatie voor spoedverwijzing, zie Beleid bij spoedeisende klachten en symptomen):
- hematemese
- melena
- aanhoudend braken
- stoornis in of pijn bij voedselpassage
- aanhoudende retrosternale pijn zonder aanwijzing voor cardiale oorzaak
- onbedoeld gewichtsverlies
- anemie
- Aard van de klachten:
- zuurbranden, regurgitatie en pijn boven in de buik (invloed van voedsel)
- opgeblazen gevoel, snelle verzadiging, misselijkheid, braken
- Ernst, duur en beloop van de klachten:
- incidenteel of continu
- mate van verstoring van de dagelijkse activiteiten of de nachtrust
- Defecatiepatroon:
- verandering van consistentie of frequentie
- bloed bij de ontlasting
- Factoren die maagklachten kunnen beïnvloeden:
- geneesmiddelen met maagbijwerkingen, zoals NSAID’s (ook zelfmedicatie), bisfosfonaten, kaliumchloride, corticosteroïden, antibiotica, antidepressiva, metformine, calciumantagonisten, nitraten, spironolacton en sommige DOAC’s
- (zelf)medicatie
- psychosociale problematiek, ongerustheid
- voedselintoleranties, alcohol en roken
- overgewicht
- intra-abdominale drukverhoging door bijvoorbeeld tillen, persen of bukken
- Vraag bij het overwegen van gastroduodenoscopie naar risicofactoren voor maag- of slokdarmcarcinoom, zoals:
- familiair voorkomen van maagcarcinoom
- hoofd-halsmaligniteit of radiotherapie wegens mammacarcinoom
- barrettoesofagus, corrosief letsel van de slokdarm
- achloorhydrie, achalasie, plummer-vinsonsyndroom
- roken, alcoholgebruik, obesitas, dieet (weinig groente/veel vlees, frequent extreem warm drinken)
- Voorgeschiedenis:
- eerdere klachten en behandeling, eerdere H. pylori-eradicatiebehandeling
- (zelf)medicatie
- endoscopisch of röntgenonderzoek van de maag
- H. pylori-status
- recente ijzergebreksanemie (kan duiden op gastro-intestinaal bloedverlies)
- migratieachtergrond: mediterrane landen, Oost-Europa, Midden-Oosten, Azië, Afrika, Midden- en Zuid-Amerika (hogere H. pylori-prevalentie)
De prevalentie van alarmsymptomen is hoog: 10-13% van de eerstelijns patiënten met maagklachten heeft alarmsymptomen.
In een meta-analyse van voornamelijk door de huisarts naar de tweede lijn verwezen patiënten (9 cohortonderzoeken, 16.161 ziekenhuispatiënten, gemiddelde prevalentie van een maag- of slokdarmmaligniteit 2,8%) was de gepoolde sensitiviteit van slikklachten, anemie/bloeding, misselijkheid/braken, gewichtsverlies of enig alarmsymptoom respectievelijk 25, 17, 27, 24 en 75%.
Dit laatste cijfer betekent dat 25% van de patiënten met een maagcarcinoom geen alarmsymptoom had. De gepoolde positieve voorspellende waarden (PPV) voor dezelfde symptomen waren respectievelijk 6,6, 4,6, 7,5, 7,9 en 5,9%. Dit laatste cijfer betekent dat 5,9% van de patiënten met alarmsymptomen een maligniteit had. De gepoolde negatief voorspellende waarden (NPV) waren respectievelijk 98,8, 97,9, 97,5, 94,3 en 99,4%. Dit laatste cijfer betekent dat er een kans was van ongeveer 1/175 om een maligniteit te missen bij een patiënt zonder alarmsymptomen.
In een tweede meta-analyse van eerste- en tweedelijns patiënten (15 onderzoeken, n = 57.363, gemiddelde prevalentie van een maag- of slokdarmmaligniteit 0,8%) varieerde de sensitiviteit van alarmsymptomen (bloeding, gewichtsverlies, progressieve slikklachten, persisterend braken, anemie of palpabele zwelling in epigastrio) van 0-83%.
De specificiteit varieerde van 40-98%. Als onderzoeken met een sensitiviteit van 0% werden uitgesloten, was de gepoolde sensitiviteit van de aanwezigheid van een alarmsymptoom 67% (95%-BI 54 tot 83%) en de gepoolde specificiteit 66% (95%-BI 55 tot 79%). De onzekerheid over deze waarden was groot, omdat er een hoge mate van statistische heterogeniteit tussen de resultaten bestond. De auteurs concluderen daarom dat alarmsymptomen een beperkte waarde hebben bij het diagnosticeren van maag- of slokdarmcarcinomen.
Een derde meta-analyse van eerstelijns patiënten (13 Europese en 1 Canadees onderzoek, met 22.600 deelnemers in 10 cohortonderzoeken waarin eerstelijns patiënten werden verwezen naar endoscopiefaciliteiten en 3.142.582 deelnemers in 3 retrospectieve onderzoeken die eerstelijns databases gebruikten) beschreef de sensitiviteit, specificiteit, likelihood ratio (LR) en diagnostische odds ratio (DOR) van symptomen.
Omdat de aanwezigheid van de 3 databaseonderzoeken voor veel symptomen heterogeniteit bleek te veroorzaken, zijn de resultaten van de cohort- en de databaseonderzoeken apart weergegeven (zie tabel d2).
| Parameter | Type onderzoek | Slikklachten | Gewichtsverlies | Dyspepsie | Elke pijnklacht | Anemie | Misselijkheid/braken | Reflux |
|---|---|---|---|---|---|---|---|---|
| Sensitiviteit | Cohort* | 0,32 (0,17 tot 0,52) | 0,25 (0,12 tot 0,43) | 0,42 (0,29 tot 0,56) | 0,41 (0,24 tot 0,62) | 0,12 (0,09 tot 0,19) | 0,17 (0,05 tot 0,46) | 0,23 (0,10 tot 0,46 |
| Databases† | 0,32 tot 0,46 | 0,08 tot 0,12 | 0,17 (1 database) | 0,12 tot 0,25 | 0,07 tot 0,27 | 0,13 (1 database) | 0,11 (1 database) | |
| Specificiteit | Cohort* | 0,92 (0,81 tot 0,97) | 0,96 (0,88 tot 0,98) | 0,48 (0,31 tot 0,65) | 0,75 (0,51 tot 0,89 | 0,97 (0,94 tot 0,99) | 0,84 (0,60 tot 0,94) | 0,70 (0,59 tot 0,80) |
| Databases† | 0,99 tot 0,99 | 0,99 tot 0,99 | 0,98 (0,98 tot 0,98) 1 database | 0,88 tot 0,96 | 0,90 tot 0,99 | 0,98 (0,98 tot 0,98) 1 database | 0,98 (0,98 tot 0,99) 1 database | |
| LR+ | Cohort* | 4,32 (2,46 tot 7,58) | 5,46 (3,46 tot 8,60) | 0,79 (0,55 tot 1,15) | 1,64 (1,20 tot 2,24) | 4,32 (2,64 tot 7,08 | 1,07 (0,52 tot 2,19) | 0,78 (0,47 tot 1,28) |
| Databases† | 53,2 tot 60,3 | 8,45 tot 9,81 | 7,45 (1 database) | 2,15 tot 3,04 | 2,68 – 8,33 | 6,76 (1 database) | 7,22 (1 database) | |
| DOR | Cohort* | 5,91 (3,56 tot 9,82) | 6,15 (3,35 tot 11,3) | 0,65 (0,32 tot 1,33) | 1,41 (0,64 tot 3,14) | 1,72 (0,73 tot 4,04) | 1,08 (0,46 tot 2,57) | tot |
| Databases† | 91,4 | 10,3 (9,36 tot 11,2) | 8,81 (1 database) | 2,89 (2,43 tot 3,42) | 6,32 (2,96 tot 13,1) | 7,63 (1 database) | 0,71 (0,38 tot 1,32) | |
| LR+ = positieve likelihood ratio; DOR = diagnostische odds ratio. *Waarde (95%-BI). † Spreiding over 3 databases. Bron: Astin 2015 | ||||||||
De auteurs concluderen op basis van de LR+ dat slikklachten, gewichtsverlies en anemie de meest bruikbare criteria lijken voor de selectie van patiënten die in aanmerking komen voor scopie. Daarnaast concluderen zij dat dyspepsie en reflux de zwakste associatie hebben met maag- en slokdarmkanker (DOR < 1). In de tabel valt op dat de rangorde van de verschillende symptomen bij de criteria sensitiviteit, LR+ en DOR onderling niet altijd gelijk is, dat het verschil tussen de uitkomstmaten van alle symptomen onderling relatief klein is en de spreiding van de uitkomst bij veel symptomen groot, en dat ook andere symptomen soms een bijna even hoge waarde hebben als de 3 door de auteurs genoemde symptomen.
De afwezigheid van alarmsymptomen heeft een zeer hoge voorspellende waarde voor het uitsluiten van een maagcarcinoom. Dit laatste wordt echter voor een groot deel verklaard door de relatief lage incidentie van maligniteiten van maag en slokdarm. Zo bleek in 2 retrospectieve onderzoeken in Engeland dat in de algemene bevolking de prevalentie van een maligniteit van maag of slokdarm zonder alarmsymptomen bij patiënten < 55 jaar 1 per miljoen per jaar was.
Onderzoek in Canada en de Verenigde Staten toonde soortgelijke getallen.
Overwegingen
In verschillende onderzoeken komen de symptomen die geassocieerd zijn met een maligniteit van maag of slokdarm overeen. Deze symptomen zijn consistent met de bestaande indicaties voor gastroscopie: hematemese, melena, aanhoudend braken, stoornis in of pijn bij voedselpassage, onbedoeld gewichtsverlies, anemie of tumor in de buik. Deze symptomen worden ook internationaal gehanteerd, zoals blijkt uit de Amerikaans-Canadese richtlijn.
Op basis van consensus heeft de werkgroep aanhoudende retrosternale pijn zonder aanwijzing voor cardiale oorzaak toegevoegd als alarmsymptoom.
De bevinding in de meta-analyse van Fransen dat 25% van de patiënten met een maagcarcinoom geen alarmsymptoom heeft, komt overeen met het getal van ongeveer 27% dat in een groot eerstelijns onderzoek werd gevonden.
Bij patiënten met alarmsymptomen is de kans op maligniteit 5,9% en 75% van de patiënten met een maligniteit presenteert zich met alarmsymptomen. Alarmsymptomen zijn daarom reden voor een verwijzing voor gastroscopie.
Conclusie
Alarmsymptomen voor een maligniteit zijn hematemese, melena, aanhoudend braken, stoornis in of pijn bij voedselpassage of aanhoudend retrosternale pijn zonder aanwijzing voor een cardiale oorzaak, onbedoeld gewichtsverlies, anemie of tumor in de buik.
Lichamelijk onderzoek
Naar Samenvatting ›- Wees alert op bleekheid van huid, lippen of conjunctivae (aanwijzingen voor anemie).
- Inspecteer, ausculteer, percuteer en palpeer de buik om abdominale pathologie uit te sluiten (tumoren, vergroting of verhoogde gevoeligheid van de buikorganen).
- Verricht rectaal toucher bij een vermoeden van melena of bloed bij de ontlasting.
Aanvullend onderzoek
Naar Samenvatting ›Indicaties
Naar Samenvatting ›- Maagklachten bij patiënten afkomstig uit mediterrane landen, Oost-Europa, Midden-Oosten, Azië, Afrika, Midden- en Zuid-Amerika
- Voorafgaand aan de start van een PPI bij een eerste episode van maagklachten
- Bij persisterende of recidiverende klachten, als de H. pylori-status onbekend is.
- Endoscopisch aangetoond ulcus ventriculi als tijdens de scopie geen kweek uit een biopt is gedaan (bij ulcus duodeni kan men zonder diagnostiek uitgaan van betrokkenheid van H. pylori).
- Controle na eradicatiebehandeling
N.B. Bij een negatieve testuitslag is (periodiek) herhalen van de H. pylori-test niet nodig; het risico op herbesmetting is laag.
In het verleden had H. pylori-diagnostiek pas een plaats bij persisterende of recidiverende klachten. Op dat moment echter is het PPI-gebruik vaak al een feit en huisartsen ervaren als praktisch probleem dat dat gebruik dan gedurende 2 weken gestopt moet worden voor een betrouwbare uitslag.
Chronisch gebruik van PPI’s geeft mogelijk verhoogd risico op langetermijnbijwerkingen (zie detail Bijwerkingen bij chronisch gebruik van PPI’s en H2-antagonisten) en reboundklachten zijn bij langduriger gebruik mogelijk ernstiger (zie detail Reboundeffect na het staken van zuurproductieremmers). Bij step-upbeleid is een antacidum na 6 maanden effectief bij 41% van de patiënten en hoeft niet gestart te worden met een PPI (zie detail Medicatie bij een eerste episode). Step-upbeleid beperkt het aantal patiënten dat start met een PPI en draagt bij aan het voorkomen van chronisch PPI-gebruik. Start daarom altijd eerst met een antacidum (of mucosaprotectivum) in voldoende hoge dosering en doseerfrequentie.
Voer bij patiënten bij wie dit onvoldoende effectief is een H. pylori-test uit vóór het starten van een PPI om H. pylori als mogelijke oorzaak van de klachten uit te sluiten. Op basis van symptomatologie kan geen onderscheid gemaakt worden tussen de onderliggende aandoeningen en dus ook niet tussen wie wel en wie niet baat zou kunnen hebben bij een H. pylori-bepaling en zo nodig eradicatiebehandeling. Bovendien is het van belang een H. pylori te behandelen, omdat een H. pylori-infectie een verhoogd risico op maagkanker geeft. Daarnaast is het, als de PPI eenmaal gestart is, lastiger om alsnog een H. pylori-test uit te voeren, omdat je de PPI minimaal 2 weken voor de test moet staken en er in die tussentijd reboundklachten kunnen optreden. Bij een negatieve uitslag is herhalen van de H. pylori-test bij herstarten van de PPI niet nodig; men gaat er algemeen van uit dat het risico op (her-)besmetting laag is.
Dit alles overwegende heeft de werkgroep besloten om de H. pylori-diagnostiek al in de eerste episode te laten plaatsvinden, ongeacht de inschatting van de duur van het PPI-gebruik. In de vorige standaard werd dit vooral bepleit als de huisarts inschatte dat PPI-gebruik chronisch zou kunnen worden, omdat een H. pylori-test na de start van een PPI lastiger wordt. In de praktijk ziet de werkgroep dat niet goed in te schatten is welke patiënt meer risico loopt op langduriger gebruik van PPI’s. Dit beleid is ook meer in overeenstemming met het beleid om te starten met een antacidum (of mucosaprotectivum) en met het beleid dat mdl-artsen voorstaan om bij maagklachten als eerste H. pylori-diagnostiek te doen.
Als een PPI voor een andere indicatie dan een eerste episode van maagklachten gegeven wordt, hoeft geen H. pylori-diagnostiek voorafgaand aan start aangevraagd te worden. Bij bijvoorbeeld het ontstaan van maagklachten na of in combinatie met het starten van een NSAID, is het waarschijnlijker dat de onderliggende oorzaak NSAID-gebruik (bijwerking) is dan een H. pylori-infectie. Als het gebruik van de PPI leidt tot chronisch PPI gebruik ook ná het stoppen van het NSAID, dan moet op dat moment een nieuwe afweging gemaakt worden voor wat betreft het testen op H. pylori.
In de vorige versie van deze standaard is afgestapt van het advies om na een eradicatiebehandeling standaard te controleren op H. pylori, aangezien huisartsen dat advies niet altijd volgen. In plaats daarvan werd geadviseerd om na een eradicatiebehandeling alleen te controleren bij een aangetoond ulcus pepticum (altijd) of als maagklachten niet verdwenen zijn na de eradicatiebehandeling gevolgd door 4 weken PPI.
Bij de knelpunteninventarisatie van versie 5.2 van de standaard gaven de Stichting Werkgroep Antibioticabeleid (SWAB) en de mdl-artsen aan dat de effectiviteit van de eradicatiebehandeling in de eerste lijn afgenomen lijkt te zijn. Deze afname is ook te zien in recente eradicatiecijfers (zie detail Effectiviteit van de duur van de eerste eradicatiebehandeling). Ook is het voor mdl-artsen onduidelijk of klachten bij een in de eerste lijn behandelde patiënt veroorzaakt worden door een nieuwe infectie of dat de ‘oude’ infectie onvoldoende behandeld is. Daarnaast blijkt uit de praktijk dat de in versie 5.1 aanbevolen criteria voor hertesten op H. pylori bij klachten eigenlijk leiden tot hertesten van het merendeel van de patiënten (vanwege persisteren van de klachten). Immers, ook na succesvolle eradicatie verdwijnen de klachten bij 95% van de patiënten niet. Dat komt omdat de klachten na succesvolle eradicatie vooral zullen verdwijnen wanneer een ulcus de oorzaak was, maar dat is bij slechts ongeveer 5% van de patiënten het geval (zie detail Incidentie van onderliggende aandoeningen). Bij de meest voorkomende andere oorzaken, zoals reflux of functionele maagklachten, is het effect van succesvolle eradicatie op de maagklachten meestal klein (zie Effectiviteit van eradicatiebehandeling bij ulcera, gastro-oesofageale refluxziekte en functionele maagklachten). Bij een ulcus wil je zeker weten dat de H. pylori geëradiceerd is, omdat daarmee recidieven worden voorkomen.
De werkgroep besluit dan ook om aan te sluiten bij de aanbevelingen in de tweede lijn en aan te bevelen om na elke eradicatiebehandeling standaard te hertesten op H. pylori.
Soort test bij hertesten
Door de langzame daling van de H. pylori-antistoftiter is serologisch onderzoek als controle op eradicatie pas lange tijd na een eradicatie zinvol (in de praktijk wordt 4-6 maanden geadviseerd). Er zijn echter geen gevalideerde afkapwaarden bekend over welke H. pylori-antistoftiterdaling betrouwbaar aangeeft dat H. pylori geëradiceerd is. Dit probleem bestaat niet bij de interpretatie van een uitslag van fecestests en ureum-ademtests. Deze kunnen na een H. pylori-eradicatie veel sneller gebruikt worden, zijn bovendien betrouwbaarder en zijn daarom beter bruikbaar bij controle na eradicatie.
Conclusie
Op basis van consensus is een hertest op H. pylori wenselijk na elke eradicatiebehandeling. Als hertest worden fecestests en ureum-ademtests geadviseerd. Serologisch onderzoek kan een plaats hebben als adem- of fecestests niet beschikbaar zijn of als een patiënt niet kan stoppen met een PPI.
Keuze H. pylori-test
Naar Samenvatting ›- Vraag een fecestest of een ureum-ademtest aan (de fecestest is goedkoper, de ureum-ademtest is niet overal beschikbaar).
- Serologisch onderzoek (ELISA) wordt niet geadviseerd omdat het minder betrouwbaar is, maar kan een plaats hebben als adem- of fecestests niet beschikbaar zijn of als een patiënt niet kan stoppen met een PPI.
- Sneltests op bloed (vingerprik) of feces (in het laboratorium) worden ontraden omdat ze minder betrouwbaar zijn.
- Overleg zo nodig met het laboratorium welke diagnostiek beschikbaar is.
Algemeen
H. pylori-diagnostiek kan invasief of niet-invasief plaatsvinden. Invasieve diagnostiek gebeurt door middel van gastroscopie waarbij maagwandbiopten worden genomen. Histologisch of bacteriologisch (kweek)onderzoek van biopten duurt meerdere dagen, een Rapid Urease Test, ook bekend als Campylobacter-like Organism Test (CLO-test), geeft direct uitslag. Niet-invasieve diagnostiek kan worden gedaan door een antigeenbepaling in feces, door een ureum-ademtest of door serologisch bloedonderzoek. Antigeenbepalingen in urine en speeksel zijn in het verleden onvoldoende betrouwbaar gebleken.
Voor zover bekend worden deze bepalingen in Nederland niet gebruikt.
Bij de adem- en de fecestest is de aanwezigheid van H. pylori direct bepalend voor de uitslag. Bij fecestests komt dat door H. pylori-antigenen in de ontlasting (die zeer snel verdwijnen na eradicatie van de bacterie). Bij de ureum-ademtest drinkt de patiënt ureum dat gemerkt is met niet-radioactief C13 of met radioactief C14. H. pylori produceert het enzym urease, dat het gemerkte ureum splitst in (gemerkt) koolzuurgas en ammoniak. Het gemerkte koolzuurgas kan vervolgens worden gedetecteerd in de uitademingslucht. De bepaling met C13 heeft de voorkeur boven C14, aangezien de testeigenschappen vergelijkbaar zijn, de C13-bepaling goedkoper is en C14 een radioactief isotoop is. Daarnaast is de C14-bepaling in tegenstelling tot de C13-bepaling slechts in een beperkt aantal laboratoria beschikbaar.
Bij de serologische test is niet de aanwezigheid van H. pylori bepalend, maar het aantonen van antistoffen tegen H. pylori. Deze antistoffen kunnen, nadat de bacterie is verdwenen, nog lang in een hoge titer aanwezig blijven, daarom is bloedonderzoek als controle op eradicatie pas 4-6 maanden na eradicatie betrouwbaar. Fecestests en ureum-ademtests hebben dit nadeel niet en zijn daarom beter bruikbaar ter controle na eradicatie.
| Onderzoeken | Sensitiviteit (95%-BI) | Specificiteit (95%-BI) | Positief voorspellende waarde | Negatief voorspellende waarde |
|---|---|---|---|---|
| Ureum-ademtest (C13 en C14) | ||||
| Gewogen gemiddelde in review (6 RCT’s, n = 3643) | 94,7% | 95,7% | ||
| Cross-sectioneel (23 onderzoeken, n = 3999) | 96% (95 tot 97) | 93% (91 tot 94) | ||
| Eerstelijns onderzoek in Nederland (n = 136) | 92,3% | 93,4% | 87,8% | 95,9% |
| Fecestest (monoklonaal) | ||||
| Voor eradicatie (22 RCT’s, n = 2499, H. pylori-prevalentie 62%) | 94% (93 tot 95) | 97% (96 tot 98) | LR+ 24 LR– 0,07 | |
| Na eradicatie (12 RCT’s, n = 957, H. pylori-prevalentie 20%) | 93% (89 tot 96) | 96% (94 tot 97) | LR+ 17 LR– 0,1 | |
| Serologisch onderzoek (ELISA) | ||||
| Meta-analyse | 85% | 79% | ||
| Eerstelijns onderzoek in Nederland | 93% | 90% | 96% | 83,3% |
De testeigenschappen uit tabel d5 kunnen enigszins afwijken van de praktijk om de volgende redenen.
- De testeigenschappen zijn afhankelijk van de voorafkans op H. pylori-infectie, dus de H. pylori-prevalentie. In een populatie met een lagere prevalentie zal de positief voorspellende waarde van een test dalen en de negatief voorspellende waarde stijgen. Omdat de gegevens in tabel d5 uit populaties komen waarin de frequentie van H. pylori hoger was dan op dit moment in Nederland (zie detail Prevalentie van H. pylori), zal een positieve testuitslag in de praktijk minder betrouwbaar zijn dan de tabel aangeeft;
- Testeigenschappen kunnen afwijken omdat in de praktijk tests van verschillende fabrikanten worden gebruikt of door verschillen in de uitvoeringsprocedure.
- Een test kan in verschillende populaties verschillende resultaten opleveren, onafhankelijk van de prevalentie van H. pylori. Slechts een deel van de tests is onderzocht in de Nederlandse eerstelijns populatie bij kleine patiëntenaantallen. Er zijn geen recente onderzoeken bekend.
Monoklonale versus polyklonale fecestest
De testeigenschappen van de monoklonale tests zijn in een meta-analyse uit 2006 beter dan die van de oudere polyklonale tests. De gepoolde sensitiviteit van de monoklonale en de polyklonale test, bepaalt in onderzoeken waarin beide tests zijn onderzocht, waren respectievelijk 95 versus 83% vóór eradicatie en 91 versus 76% ná eradicatie. De meta-analyse excludeerde fecessneltests omdat daarover ‘controversiële’ resultaten bekend waren. In Nederland zijn diverse monoklonale en polyklonale fecestests van verschillende leveranciers beschikbaar. De sensitiviteit en specificiteit van de test worden niet alleen beïnvloed door het monoklonale of polyklonale karakter, maar ook door de (mogelijk) uiteenlopende kwaliteit van de verschillende tests.
Ureum-ademtest
In de oriënterende literatuursearch bij de herziening van deze standaard werd een meta-analyse gevonden van 23 crosssectionele onderzoeken waarin de ureum-ademtest (14 met C13, 9 met C14) bij volwassenen met dyspeptische symptomen werd vergeleken met H. pylori-kweek (zie tabel d5). De meta-analyse was van goede kwaliteit (Amstar 8/11). De geïncludeerde onderzoeken hadden een matig risico op vertekening. Er bleek statistische heterogeniteit die niet verklaard werd in subgroepanalyses. Er werd geen significant verschil in resultaat gevonden tussen ureum-ademtests met C13 of C14. De resultaten uit deze meta-analyse komen overeen met de resultaten uit de eerdere review.
Serologisch onderzoek
Serologisch onderzoek kan plaatsvinden met een vingerprik-‘sneltest’, uit te voeren in de huisartsenpraktijk, of met een enzyme linked immunosorbent assay (ELISA), uit te voeren in het laboratorium. De resultaten van de sneltest zijn slechter dan die van ELISA . Nieuwe technieken, zoals immunoblottechniek met een current infection marker (CIM), lijken veelbelovend. Immunoblottechniek met CIM is echter een arbeidsintensieve, kostbare techniek, die niet universeel beschikbaar is op dit moment. Een eradicatiebehandeling is succesvol indien een titerdaling wordt waargenomen in een serumpaar afgenomen vlak voor aanvang (serum 1) en 4-6 maanden na aanvang van de eradicatiebehandeling (serum 2). Er zijn echter geen gevalideerde afkapwaarden bekend over de mate van H. pylori-antistoftiterdaling die betrouwbaar aangeven of H. pylori geëradiceerd is. Overleg daarom bij twijfel over de interpretatie van de uitslag met de arts-arts-microbioloog (www.saltro.nl, geraadpleegd 14 september 2023).
Vergelijking
De testeigenschappen van de monoklonale fecestest en de ureum-ademtest zijn onderling vergelijkbaar en veel beter dan de testeigenschappen van serologisch onderzoek (ELISA). Slechtere testeigenschappen en een dalende H. pylori-prevalentie in Nederland zijn de belangrijkste redenen om de serologische test niet meer te adviseren. Serologisch onderzoek kan in tegenstelling tot de fecestest en de ureum-ademtest wel uitgevoerd worden als een patiënt niet kan stoppen met een PPI. De beschikbaarheid van ureum-ademtests kan regionaal variëren. Eerstelijns laboratoria die een ureum-ademtest aanbieden, gebruiken meestal de C13-test. De fecestest is in elk laboratorium beschikbaar. Bij het aanvragen van een fecestest is het voor de huisarts meestal onbekend of het betreffende laboratorium gebruikmaakt van een monoklonale of een polyklonale fecestest. Het is aan het betreffende laboratorium om een kwalitatief goede test te verrichten. Anno 2023 zijn de kosten van de fecestest, de C13-ureum-ademtest en de serologische test respectievelijk ongeveer 27, 97 en 13 euro (diverse eerstelijns tarieven, online geraadpleegd 31 oktober2023).
Conclusie
Er is voldoende bewijskracht voor de betrouwbaarheid van de fecestest (niet voor fecessneltests) en de ureum-ademtest. De C13-ureum-ademtest heeft de voorkeur boven de C14-ureum-ademtest, omdat de C14-test radioactief is en de C13-test goedkoper en overal beschikbaar is. Fecestests zijn goedkoper dan ureum-ademtests.
Serologisch onderzoek (ELISA) is minder betrouwbaar en wordt niet geadviseerd als eerste keus. Serologisch onderzoek kan een plaats hebben als adem- of fecestests niet beschikbaar zijn of als een patiënt niet kan stoppen met een PPI. Serologische sneltests (vingerprik) zijn minder betrouwbaar dan ELISA en worden niet geadviseerd.
Uitvoering H. pylori-test
Naar Samenvatting ›- Op het moment van de feces- of ureum-ademtest mag de patiënt de volgende geneesmiddelen niet hebben gebruikt omdat zij door hun antibacteriële werking de kans op een foutnegatieve uitslag vergroten:
- gedurende 4 weken geen systemisch antibioticum (noch als eradicatiebehandeling, noch voor andere indicaties)
- gedurende 2 weken geen PPI
- gedurende 1 dag geen H2-antagonist
- Voorafgaand aan een test kan een PPI worden vervangen door een H2-antagonist, die 1 dag tevoren moet worden gestopt, of door een antacidum.
- Antacida hoeven niet gestopt te worden.
- Voor de gastroscopische test op H. pylori-urease gelden dezelfde voorwaarden; geef daarom bij een verwijzing informatie mee over recent gebruik van een antibioticum, PPI en/of H2-antagonist.
PPI’s moeten ≥ 2 weken voor een H. pylori-test worden gestopt, antibiotica en bismut ≥ 4 weken.
Deze middelen hebben een antibacteriële activiteit en verlagen het aantal H. pylori-bacteriën, wat leidt tot meer foutnegatieve testuitslagen bij de ureasetest (gastroscopie) en de feces- of ureum-ademtest. Dit is ook de reden waarom een H. pylori-controletest pas ≥ 4 weken na eradicatiebehandeling wordt geadviseerd.
H2-antagonisten hebben een minimaal effect op de sensitiviteit van de ureum-ademtest en antacida beïnvloeden die helemaal niet.
Controle na eradicatiebehandeling
Naar Samenvatting ›- Controle op eradicatie van H. pylori wordt standaard geadviseerd 2 weken na het stoppen van de PPI (zie ook Beleid na positieve H. pylori-test).
- Feces- en ureum-ademtests hebben de voorkeur omdat serologisch onderzoek minder betrouwbaar is.
- Serologisch onderzoek is alleen bruikbaar als er een eerdere antistoftiter bekend is en niet eerder dan 4-6 maanden na eradicatiebehandeling, omdat de antistoffen nog lang nadat de bacterie is verdwenen in een hoge titer aanwezig blijven (zie ook Keuze H. pylori-test). Overleg bij twijfel over de interpretatie van de uitslag met de arts-microbioloog.
Gastroduodenoscopie
Naar Samenvatting ›Zie ook Familiair maagcarcinoom.
Bij opeenvolgende patiënten die in 2002-2004 een gastroduodenoscopie in de eerste lijn ondergingen, is onderzocht hoe zij scoorden op de Hospital Anxiety and Depression Scale (HADS), op een visueel analoge schaal (VAS) voor de algemene kwaliteit van leven en op de Health-Related Quality of Life (HRQoL)-vragenlijst die onderdeel is van de EuroQol−5D .
De onderzoekers verstuurden 1769 vragenlijsten en ontvingen er 932 ingevuld terug. Daarvan werden er 280 geëxcludeerd omdat de patiënt in de voorgaande 6 maanden reeds een gastroscopie had ondergaan. Van de 652 overgebleven patiënten retourneerden er 515 de vragenlijst 1 maand na de scopie en daarvan bleken er 59 incompleet, zodat 420 lijsten werden geïncludeerd.
Bij 175 patiënten werd een organische abnormaliteit gevonden: maligniteit (2%), ulcus pepticum (12%), refluxoesofagitis (55%), andere aandoeningen zoals hiatushernia (31%).
De scores voor angst of depressie op de HADS verschilden niet significant voorafgaand aan de scopie en een maand daarna. De algemene kwaliteit van leven op de VAS veranderde evenmin. Alleen bij patiënten met organische afwijkingen trad een kleine verbetering op van 0,04 punten op de HRQoL (schaal 0-1; score 0,74 ± 0,15 vs. 0,78 ± 0,12; p < 0,01).
Overwegingen
Door de grote uitval (76%) is de kwaliteit van bewijs beperkt. De gemeten verbetering die alleen op de HRQoL wordt gezien, lijkt nauwelijks klinisch relevant. Het onderzoek doet niet expliciet een meting naar geruststelling (noch van de patiënt noch van de arts).
Conclusie
Mogelijk blijft het psychologisch welbevinden van de patiënt na een gastroscopie aangevraagd door de huisarts onveranderd.
Indien men patiënten op basis van alarmsymptomen selecteert voor gastroduodenoscopie teneinde maligniteiten op te sporen, heeft de combinatie van een hoge prevalentie van alarmsymptomen met een lage sensitiviteit en positief voorspellende waarde van alarmsymptomen voor het ontdekken van een maligniteit 2 gevolgen:
- veel patiënten ondergaan een gastroscopie waarbij weinig maligniteiten worden gevonden
- van de heel kleine groep met maligniteiten worden relatief veel (tot 25%) patiënten niet opgespoord.
Vanwege deze beperkingen heeft de werkgroep gezocht naar strategieën waarin aanvullende kenmerken zoals leeftijd en geslacht worden gebruikt om de sensitiviteit en de positief voorspellende waarde van gastroduodenoscopie voor het ontdekken van maligniteiten te verhogen.
Leeftijd
Uit de prevalentiecijfers blijkt dat slokdarm- en maagcarcinoom bijna niet voorkomen bij patiënten < 50 jaar. De Engelse en de Amerikaans-Canadese richtlijn hielden daarom tot 2017 een leeftijd van 50 of 55 jaar aan als grens waarboven gastroscopie geïndiceerd is. In 2017 is deze leeftijdsgrens in de Amerikaans-Canadese richtlijn bij patiënten met dyspepsie verhoogd naar 60 jaar, omdat de incidentie van maagcarcinoom in deze landen de afgelopen 10 jaar verder is gedaald en de kosteneffectiviteit van gastroscopieën wordt betwijfeld .
Deze richtlijn geeft aan dat het risico van een patiënt < 60 jaar met een alarmsymptoom vaak < 1% is en dat het onwaarschijnlijk is dat endoscopie bij al deze patiënten kosteneffectief is.
In Nederland hadden in 2018 in totaal 181 patiënten < 50 jaar een maag- of slokdarmcarcinoom (zie detail Epidemiologie van maag- en slokdarmkanker). Op basis van de aanname dat 25% van deze patiënten geen alarmsymptomen heeft, zullen jaarlijks 45 patiënten met een maag- of slokdarmcarcinoom geen alarmsymptomen hebben. Dit aantal is zeer laag in relatie tot het totale aantal patiënten < 50 jaar met maagklachten.
Een groot patiënt-controleonderzoek naar symptomen in het jaar voorafgaand aan de diagnose bij eerstelijns patiënten met een maag- of slokdarmcarcinoom (7471 patiënten en 32.877 controlepersonen) illustreert dat leeftijd een relevant criterium is voor de kans op maligniteit.
Van alle klachten (waaronder slikklachten, gewichtsverlies, pijn in epigastrium, maagklachten, refluxklachten, misselijkheid en braken, buikpijn, pijn in de borst en obstipatie) die in een multivariabele analyse geassocieerd bleken met gastro-oesofageale kanker (p < 0,001) was de positief voorspellende waarde (PVW) bij patiënten < 55 jaar < 1%, ook voor elke combinatie van klachten. Slikklachten hadden in deze leeftijdsgroep nog de hoogste PVW (0,8%; 95%-BI 0,4 tot 1,5%).
Bij patiënten > 55 jaar hadden slikklachten de hoogste PVW voor een gastro-oesofageale maligniteit (4,8%; 95%-BI 4,3 tot 5,9), alle andere klachten hadden een PVW < 1%. De PVW van gewichtsverlies wordt pas > 1% in combinatie met een andere klacht: maagklachten (dyspepsia, 2,1%), of misselijkheid en braken (2,8%), of refluxklachten (3,1%), of epigastrische pijn (4,2%).
Geslacht
Maag- of slokdarmkanker komt meer voor bij mannen dan bij vrouwen. In Nederland werd de diagnose in 2018 gesteld bij 2645 mannen en 1169 vrouwen.
Andere kenmerken
In een Nederlands eerstelijns diagnostisch prevalentieonderzoek (n = 861) bleek dat naast de klassieke alarmsymptomen ook de afwezigheid van nachtelijke pijn (OR 0,3) en zuurbranden overdag (OR 0,2) geassocieerd is met het aantreffen van een maligniteit. De meerwaarde van deze factoren als toevoeging aan de klassieke alarmsymptomen in een voorspellend model is tot nu toe echter niet gereproduceerd.
Onderzoek naar alternatieve strategieën
Uit computermodellen blijkt dat de toevoeging van leeftijd en geslacht als criterium voor een gastroscopie de opbrengst daarvan niet veel verbetert. De beperkte waarde van leeftijd als aanvullend criterium blijkt ook uit een groot eerstelijns onderzoek waarin alarmsymptomen het risico op maligniteit vijf- tot zesmaal deden toenemen, maar 1 jaar extra leeftijd het risico op maligniteit met slechts een factor 1,07 deed toenemen. Hierdoor kon geen definitieve leeftijdsgrens worden vastgesteld.
Overwegingen
- Het aantal patiënten met maagklachten is zeer groot. Het percentage patiënten met maag- en slokdarmcarcinomen is zeer klein en 95% van deze patiënten (3814 in 2018) is > 50 jaar. Ongeveer 25% van de patiënten met een maligniteit heeft geen alarmsymptomen.
- Onderzoek wijst uit dat toevoeging van een vaste leeftijdsgrens en geslacht aan de selectiecriteria voor patiënten met een maligniteit geen betere opbrengst geeft dan selectie op basis van alarmsymptomen.
- Bij ongeveer 2/3 van alle gastroscopieën in de eerste lijn wordt geen klinisch relevante afwijking gevonden (zie detail Incidentie van onderliggende aandoeningen). Voor mdl-artsen is dat een grote belasting, die zij graag omlaag zouden brengen; zij zijn daarom geporteerd voor een hogere leeftijdsgrens. De werkgroep overweegt dat een opbrengst van 5-6% bij met gastroscopie ontdekte carcinomen (zie detail Alarmsymptomen voor maligniteit) niet erg laag is in vergelijking tot bijvoorbeeld de opbrengst bij colonoscopieën.
- Patiënten geven aan dat voorgaande versies van deze standaard een hoge drempel opwierpen om te verwijzen voor een gastroscopie, aangezien de kernboodschap luidde dat bij een H. pylori-negatieve patiënt < 50 jaar met persisterende of recidiverende klachten en zonder alarmsymptomen een gastroscopie niet geadviseerd werd. Zij zijn geporteerd voor een lagere of geen leeftijdsgrens, onder andere vanuit de overweging dat bij een op jonge leeftijd ontdekte maligniteit de potentiële winst aan QALY’s groot is. De werkgroep vindt dit aanleiding om de betreffende passages te veranderen.
- Bij patiënten met maagklachten stijgt de kans op een slokdarm- of maagcarcinoom met het stijgen van de leeftijd en bij aanwezigheid van bepaalde kenmerken (zie detail Dieet en andere factoren dan leeftijd, geslacht en alarmsymptomen als risicofactor voor maag- en slokdarmcarcinoom). De werkgroep is van mening dat hogere leeftijd en de genoemde kenmerken van nut kunnen zijn bij het bepalen van de indicatie voor een gastroscopie bij patiënten met maagklachten zonder alarmsymptomen.
- Een leeftijdsgrens waaronder slokdarm- of maagcarcinoom niet voorkomt, is niet te geven. Incidentiecijfers van IKNL laten een knik zien vanaf de leeftijdsklasse 40-49 jaar (zie detail Epidemiologie van maag- en slokdarmkanker). Daarboven blijft de incidentie stijgen naarmate de leeftijd toeneemt. De leeftijd van 50 jaar die deze standaard noemt, is bedoeld om huisartsen een indicatie te geven dat de kans op slokdarm- of maagcarcinoom vanaf die leeftijd gaat stijgen. Daarbij is overwogen dat het absolute aantal patiënten in Nederland < 50 jaar met een maag- of slokdarmcarcinoom zonder alarmsymptomen (geschatte n = 45) erg laag is in relatie tot het totale aantal patiënten met maagklachten.
- De kenmerken genoemd in detail Dieet en andere factoren dan leeftijd, geslacht en alarmsymptomen als risicofactor voor maag- en slokdarmcarcinoom kunnen meewegen bij het besluit om een gastroscopie aan te vragen bij een oudere patiënt.
Conclusie
Een absolute indicatie bij een patiënt met maagklachten is de aanwezigheid van alarmsymptomen suggestief voor een maligniteit.
Relatieve indicaties:
- persisterende of recidiverende maagklachten zonder alarmsymptomen bij een patiënt die H. pylori-negatief is en die een verhoogd risico op een maligniteit heeft, zoals een hogere leeftijd en bij bepaalde kenmerken. Naarmate de leeftijd stijgt, neemt het risico op maag- of slokdarmkanker toe. Een ondergrens is niet te geven; vanaf ongeveer 50 jaar stijgt de incidentie. Kenmerken waarbij carcinomen iets vaker voorkomen zijn: mannelijk geslacht, roken en alcoholgebruik, dieet (weinig groente/veel vlees), achloorhydrie, H. pylori-infectie, eerdere maagresectie, erfelijke predispositie, frequent heet drinken, achalasie, radiotherapie wegens mammacarcinoom, corrosief letsel, plummer-vinsonsyndroom en hoofd-halsmaligniteiten;
- maagklachten bij een patiënt die een eerstegraads familielid heeft met familiair maagcarcinoom: overleg dan met de mdl-arts, ook over een eventueel consult door een klinisch geneticus;
- bij diagnostische onzekerheid kan goede voorlichting inclusief leefstijladviezen (zie Thuisarts en Keuzehulp Maagklachten) helpend zijn. Alternatief voor een gastroduodenoscopie is een (tele)consult met of verwijzing naar een mdl-arts.
In de oriënterende zoekstrategie werd een overzichtsartikel gevonden waarin complicaties van een diagnostische gastroscopie worden genoemd :
- cardiopulmonaire complicaties, zowel minder belangrijke (verandering in zuurstofsaturatie of hartritme) als belangrijke (aspiratiepneumonie, ademstilstand, hartinfarct, CVA, shock. Deze complicaties traden op bij 1 op de 170-10.000 gastroscopieën, afhankelijk van de ernst;
- infecties door de procedure zelf of door niet goed ontsmetten van de apparatuur, getallen werden niet genoemd;
- perforatie bij 1 op de 2200-11.000 gastroscopieën;
- bloedingen: klinisch significante bloedingen komen zelden voor, getallen werden niet genoemd.
Conclusie
Ernstige complicaties van diagnostische gastroscopieën zijn perforatie, bloeding, aspiratiepneumonie en cardiovasculaire complicaties (ademstilstand, hartinfarct, CVA, shock), met een geschatte frequentie van 1 op de 2000-10.000.
Absolute indicatie
Naar Samenvatting ›De aanwezigheid van alarmsymptomen voor maligniteit (zie Anamnese).
Relatieve indicaties
Naar Samenvatting ›- Persisterende of recidiverende maagklachten in afwezigheid van alarmsymptomen en H. pylori, bij een verhoogd risico op maag- en slokdarmcarcinoom (zie Risicoschatting).
- Maagklachten bij een patiënt die een eerstegraads familielid heeft met maagcarcinoom (overleg met de mdl-arts, ook over een eventueel consult door een klinisch geneticus).
- Behoefte aan meer diagnostische zekerheid, met als aandachtspunten:
- de Keuzehulp Maagklachten geeft de patiënt uitleg over het nut van een gastroduodenoscopie
- er zijn aanwijzingen dat een gastroduodenoscopie ‘ter geruststelling’ het psychologisch welbevinden van de patiënt niet verbetert
- overweeg bij twijfel overleg of (tele)consultatie met of verwijzing naar een mdl-arts.
Risicoschatting
Naar Samenvatting ›- Het risico op maag- en slokdarmcarcinoom is op basis van patiëntkenmerken niet betrouwbaar te schatten. Vooral (hogere) leeftijd, geslacht (man) en in mindere mate andere kenmerken bepalen het risico.
- De incidentie van maag- en slokdarmcarcinomen stijgt met de leeftijd. Vanaf ongeveer 50 jaar stijgt de incidentie scherp. Onder de 50 jaar wordt jaarlijks bij ongeveer 30 Nederlanders maag- of slokdarmcarcinoom vastgesteld zonder dat er alarmsymptomen waren.
- Bij mannen komen maag- en slokdarmcarcinomen 2-3 × vaker voor dan bij vrouwen.
- Voor andere kenmerken die het risico op maag- en slokdarmcarcinomen iets verhogen, zie Maag- en slokdarmcarcinoom.
Voorbereiding
Naar Samenvatting ›- Een voorwaarde voor gastroduodenoscopie is een negatieve H. pylori-status, tenzij de scopie op zeer korte termijn moet worden uitgevoerd. Een negatieve H. pylori-test sluit een ulcus nagenoeg uit en voorkomt zo onnodige scopieën.
- Stuur gegevens mee over recent gebruik van antibiotica (< 4 weken voor scopie), PPI’s (< 2 weken voor scopie) en H2-antagonist (< 1 dag voor scopie).
- Bespreek bij extreme angst voor gastroduodenoscopie of bij verzoek om sedatie dat sedatie mogelijk is, maar ook nadelen heeft, zoals een verhoogd risico op aspiratie, desaturatie, een langere opname (door observatie na het onderzoek), niet alleen naar huis mogen en valincidenten. Bij ouderen kunnen paradoxale reacties op sedativa (zoals rusteloosheid, agitatie en prikkelbaarheid) het onderzoek mogelijk beïnvloeden.
- Geef aan dat ernstige complicaties (perforatie, bloeding, aspiratiepneumonie, cardiovasculaire complicaties) zeldzaam zijn: naar schatting 1 op de 2000-10.000 scopieën.
- Verwijs bij een gastroduodenoscopie in eigen beheer naar de informatie op thuisarts.nl. De informatie op Thuisarts is gebaseerd op deze NHG-Standaard.
- Maak na de gastroduodenoscopie een afspraak om het vervolgbeleid te bespreken.
Evaluatie
Naar Samenvatting ›Onderscheid van maagklachten voor het te voeren beleid
Naar Samenvatting ›- Spoedeisende klachten of symptomen: (zie Richtlijnen spoed).
- Alarmsymptomen voor maligniteit: hematemese, melena, aanhoudend braken, stoornis in of pijn bij voedselpassage of aanhoudend retrosternale pijn zonder aanwijzing voor cardiale oorzaak, onbedoeld gewichtsverlies, anemie, tumor in de buik (zelden)
- Maagklachten bij NSAID-gebruik zonder alarmsymptomen voor maligniteit
- Een eerste episode van maagklachten (nooit eerder of > 1 jaar geleden klachten gehad)
- Persisterende (> 2-3 maanden) of recidiverende (< 1 jaar na het begin van een eerdere episode) maagklachten
- Beleid na positieve H. pylori-test
- Beleid na gastroduodenoscopie
Differentiaaldiagnostische overwegingen
Naar Samenvatting ›- Hartaandoening (zie NHG-Standaard Acuut coronair syndroom en NHG-Standaard Stabiele angina pectoris)
- Aandoeningen van andere organen bovenin de buik (zoals galblaas, pancreas, milt)
- Prikkelbaredarmsyndroom (zie NHG-Standaard Prikkelbaredarmsyndroom (PDS))
- Denk bij vergroting van buikorganen of zwelling eerst aan andere aandoeningen dan van de maag: bij maagklachten is een zwelling ten gevolge van maagkanker uiterst zeldzaam.
Richtlijnen beleid
Naar Samenvatting ›Voor een schematische weergave zie het Stroomschema Beleid bij een eerste episode van maagklachten (figuur h1).
Beleid bij maagklachten met alarmsymptomen voor maligniteit
Naar Samenvatting ›- Verwijs op korte termijn voor gastroduodenoscopie (maar zonder spoedindicatie) bij alarmsymptomen voor maligniteit, zoals:
- stoornis of pijn bij voedselpassage
- aanhoudend retrosternale pijn zonder aanwijzing voor cardiale oorzaak
- onbedoeld gewichtsverlies
- anemie
- tumor in de buik
- Stuur gegevens mee over recent gebruik van antibiotica (< 4 weken voor scopie), PPI (< 2 weken voor scopie) en H2-antagonist (< 1 dag voor scopie).
Beleid bij maagklachten bij NSAID-gebruik
Naar Samenvatting ›Let op: dit beleid betreft het optreden van maagklachten bij NSAID-gebruik, niet de preventie van maagbloedingen bij NSAID-gebruik (zie daarvoor NHG-Behandelrichtlijn Preventie van maagcomplicaties door geneesmiddelgebruik).
Maagklachten bij NSAID-gebruik algemeen
Naar Samenvatting ›- Oraal NSAID-gebruik is de meest waarschijnlijke oorzaak van de maagklachten.
- Stop het NSAID bij het ontbreken van een indicatie of vervang het zo mogelijk.
- Als de klachten na staken van het NSAID aanhouden, zie Beleid bij een eerste episode van maagklachten.
Beleid bij maagklachten bij noodzakelijk NSAID-gebruik
Naar Samenvatting ›- Adviseer het NSAID met voedsel in te nemen.
- Ga bij een patiënt met een ulcus in de voorgeschiedenis na of er na de eradicatiebehandeling opnieuw getest is op H. pylori. Zo nee, doe een H. pylori-test en behandel een eventueel aanwezige H. pylori (zie Beleid na positieve H. pylori-test).
- Geef voor de maagklachten een PPI in standaarddosering (zie tabel h1)
- Controleer het effect van de zuurremming na 2-4 weken en handel dan volgens het Stroomschema Beleid bij een eerste episode van maagklachten (zie figuur h1)
- Controleer, na succesvolle behandeling van de maagklachten, of er een indicatie is voor maagbescherming (zie NHG-Behandelrichtlijn Preventie van maagcomplicaties door geneesmiddelgebruik).
Kies bij patiënten die maagklachten hebben bij (noodzakelijk) NSAID-gebruik (en die geen indicatie voor maagbescherming hebben) voor een PPI in standaarddosering. H2-antagonisten blijven op basis van effectiviteit een goed alternatief, maar vanwege praktische bezwaren (slechtere beschikbaarheid en kosten) is hun plaats in de praktijk beperkter.
Voor- en nadelen
Er lijkt geen of nauwelijks verschil in klachtenvermindering tussen H2-antagonisten en PPI’s te zijn.
- Nadeel PPI’s: bij chronisch gebruik meer bijwerkingen dan H2-antagonisten.
- Nadeel H2-antagonisten: zijn regelmatig slecht leverbaar, meestal 2 × daags inname (advies CBO-richtlijn NSAID-gebruik en preventie van maagschade), PPI’s 1 × daags.
Kwaliteit van bewijs
De kwaliteit van het bewijs is laag, omdat er maar 1 RCT met 60 patiënten beschreven wordt; de kans op een onnauwkeurig resultaat is daardoor groot.
Waarden en voorkeuren van patiënten
Deze zijn onbekend.
Kosten
De kosten van een behandeling met een PPI zijn lager dan die van de H2-antagonisten.
Uitgangsvraag
Zijn H2-antagonisten (vergeleken met PPI’s) aan te bevelen voor patiënten ter vermindering van maagklachten (niet maagcomplicaties) door NSAID-gebruik? Zie de PICO-tabel.
| Patiënten | Personen met maagklachten door NSAID-gebruik |
| Interventie | H2-antagonisten |
| Vergelijking | PPI |
| Uitkomstmaten | Klachtvermindering (belang uitkomstmaat volgens de werkgroep: ‘cruciaal’ (8 uit 9)) |
Achtergrond
NSAID-gebruikers hebben een verhoogde kans op maagklachten zonder dat er een maagcomplicatie, zoals een ulcus of een gastro-intestinale bloeding, aanwezig is. Als tijdens NSAID-gebruik maagklachten optreden en het NSAID niet kan worden gestaakt, adviseert de CBO-richtlijn NSAID-gebruik en preventie van maagschade een protonpompremmer (PPI) in standaarddosering of een H2-antagonist in dubbele standaarddosering voor te schrijven. Dit betekent dat de patiënt 2 × daags een H2-antagonist zou moeten innemen of 1 × daags een PPI. In voorgaande versies van deze NHG-standaard werd vanwege de gebruiksvriendelijkheid de voorkeur gegeven aan een PPI bij de indicatie maagklachten (dus niet ter preventie van maagcomplicaties).
Methoden
In augustus 2018 is in PubMed een systematische literatuurzoekactie naar systematische reviews (SR’s) en randomized controlled trials (RCT’s) uitgevoerd.
Resultaten
Resultaat zoekactie
De zoekactie leverde geen systematische reviews waarin de effectiviteit van H2-antagonisten en PPI’s is vergeleken voor klachtenvermindering bij NSAID-gebruik. Wel werd een RCT gevonden die de therapeutische effecten van H2-antagonisten en PPI’s op ulcera bij aspirinegebruik vergelijkt.
Onderzoekskarakteristieken
De RCT includeerde 60 patiënten met een endoscopisch bewezen ulcus die een lage dosering acetylsalicylzuur gebruikten. Deze patiënten scoorden hun buiksymptomen aan begin en eind van het 8 weken durende onderzoek op de Gastro-Intestinal Symptom Rating Scale (GSRS). De GSRS is een gevalideerde lijst met 15 vragen verdeeld over 5 symptoomclusters: reflux, buikpijn, indigestie, diarree en obstipatie. De ernst van de klachten wordt weergegeven op een schaal van 1 (geen klachten) tot 7 (zeer ernstige kachten), het totale scorebereik is 15-105.
De patiënten werden willekeurig verdeeld in een groep die een PPI kreeg (lansoprazol 30 mg) en een groep die een H2-antagonist kreeg (famotidine 40 mg). Informatie over het aantal doses per dag ontbrak. Geen van de deelnemers gebruikte voor de start van het onderzoek een PPI. Patiënten in de H2-antagonistgroep die al eens famotidine hadden gebruikt, kregen ranitidine 300 mg. De dosering van alle 3 geneesmiddelen kwam overeen met de defined daily dose (DDD).
Effectiviteit
Zie tabel d6 voor de samenvatting van de resultaten.
| Uitkomsten | Absolute effecten | Aantal deelnemers (onderzoeken) | GRADE | Toelichting | |
|---|---|---|---|---|---|
| PPI | H2-antagonist | ||||
| Gemiddelde klachtvermindering voor reflux, bepaald met de GSRS (schaalbereik 0-7) na 8 weken follow-up | 0,2 (1,4 tot 1,2) | 0,2 (1,3 tot 1,1) | 60 (1 RCT) | ⨁⨁◯◯ Laag† | Het verschil in refluxvermindering tussen beide groepen is niet significant. De klachtenscores zijn bij voorbaat al laag. |
| Gemiddelde klachtvermindering voor buikpijn, bepaald met de GSRS (schaalbereik 0-7) na 8 weken follow-up | 0,3 (1,4 tot 1,1) | 0,4 (1,4 tot 1,0) | 60 (1 RCT) | ⨁⨁◯◯ Laag† | Er is een klein verschil in buikpijnvermindering ten gunste van de H2-antagonist (0,4 vs. 0,3). Dit verschil is niet significant en klinisch niet relevant. De klachtenscores zijn bij voorbaat al laag. |
| Gemiddelde klachtvermindering voor indigestie, bepaald met de GSRS (schaalbereik 0-7) na 8 weken follow-up | 0,1 (1,5 tot 1,4) | 0,3 (1,5 tot 1,2) | 60 (1 RCT) | ⨁⨁◯◯ Laag† | Er is een heel klein verschil in indigestievermindering ten gunste van de H2-antagonist (0,1 vs. 0,3). Dit verschil is niet significant en klinisch niet relevant. De klachtenscores zijn bij voorbaat al laag. |
| GSRS = Gastro-Intestinal Symptom Rating Scale. Populatie: patiënten met maagklachten door NSAID-gebruik (n = 60). Setting: ziekenhuis in Japan. Interventie: H2-antagonist. Controle: PPI. † Kleine aantallen, 1 RCT. | |||||
Conclusie
Bij gebruik van de DDD lijken er geen klinisch relevante verschillen in klachtvermindering te zijn tussen H2-antagonisten en PPI; de kwaliteit van bewijs is laag.
Het is belangrijk onderscheid te maken tussen preventie van maagcomplicaties door het gebruik van NSAID’s en de behandeling van maagklachten. Misoprostol is alleen geregistreerd voor de preventie van maagcomplicaties en niet voor maagklachten bij NSAID-gebruik (zie Farmacotherapeutisch Kompas).
De CBO-richtlijn NSAID-gebruik en preventie van maagschade acht toevoegen van misoprostol bij aanwezigheid van maagklachten niet zinvol, omdat het frequenter bijwerkingen veroorzaakt dan alleen een NSAID.
Conclusie
Geef geen misoprostol als symptomatische behandeling van maagklachten bij NSAID-gebruik.
Beleid bij een eerste episode van maagklachten
Naar Samenvatting ›Algemeen
Naar Samenvatting ›Start met het bespreken van mogelijke leefstijlaanpassingen (zie voorlichting en niet-medicamenteuze behandeling). Start, zo nodig, met een kortdurende medicamenteuze behandeling volgens het Stroomschema Beleid bij een eerste episode van maagklachten (zie figuur h1).
Behandelopties bij nieuwe episode van maagklachten
Bij een eerste episode van maagklachten zijn er, als alarmsymptomen, spoedverwijsindicaties en NSAID-gebruik zijn uitgesloten, in grote lijnen 3 beleidsopties:
- zuurremming (empirisch behandelen met een PPI)
- direct gastroscopie
- H. pylori-test, gevolgd door eradicatie bij positieve uitslag (H. pylori test-and-treat).
Direct gastroscopie vergeleken met H. pylori-test-and-treat
In een meta-analyse van individuele patiëntgegevens (5 RCT’s, n = 1924) bleek het gemiddelde verschil in symptoomscore 1 jaar na gastroscopie niet significant te verschillen van H. pylori-test-and-treat (−0,11; 95%-BI −0,28 tot 0,07), maar het relatieve risico om symptomatisch te blijven was iets hoger in de gastroscopiegroep (RR 0,95; 95%-BI 0,92 tot 0,99). De onderzoekers stellen dat er geen duidelijke verklaring voor dit verschil is en dat het verschil weinig klinische relevantie heeft. Gastroscopie bleek in elk geval niet kosteneffectief. Opvallend is dat het beste resultaat ten gunste van scopie behaald werd in 1 niet-gepubliceerde en vroegtijdig gestaakte RCT met een percentage H. pylori-positieve deelnemers (100%) dat fors afweek van de overige 4 RCT’s.
Empirisch geven van PPI’s versus H. pylori-test-and-treat
In een meta-analyse (3 RCT’s, n = 1547) bleek geen verschil in afwezigheid van klachten na 1 jaar tussen beide strategieën (RR 0,99; 95%-BI 0,95 tot 1,03). Ook was er geen verschil in kosten.
Empirisch geven van PPI’s versus direct gastroscopie
- In 4 RCT’s bleek geen verschil in effectiviteit (verschillende effectmaten, zoals symptomen, patiënttevredenheid, aanwezigheid van organische ziekte of falen van het beleid) tussen beide strategieën. In 3 van deze 4 onderzoeken bleken de kosten van scopie hoger.
- Een vijfde RCT suggereerde dat direct gastroscopie effectiever was (klachtvermindering) dan empirisch zuurremmen, maar het betrof alleen patiënten > 50 jaar.
- Een recente netwerkmeta-analyse (15 RCT’s, n = 6162) onderzocht bij volwassenen met maagklachten niet alleen het effect van de 3 bovengenoemde beleidsopties, maar ook het effect van 2 andere beleidsopties: H. pylori-diagnostiek en gastroscopie bij positieve test, en symptoombehandeling volgens richtlijnen of volgens het gebruik van de huisarts .
Het eindpunt was de kans om klachten te houden na afloop van de follow up (13 RCT’s 1 jaar, 2 RCT’s 18 maanden). Opvallend is dat in deze recente meta-analyse geen nieuw onderzoek werd gevonden. Naast de eerder genoemde 12 RCT’s bevatte meta-analyse 3 extra RCT’s.
De resultaten van de netwerkanalyse zijn, op volgorde van P-score (een maat voor de onzekerheid dat een beleidsoptie beter is dan een andere beleidsoptie, gemiddeld over alle strategieën):
- H. pylori test-and-treat (RR 0,89; 95%-BI 0,78 tot 1,02; p = 0,79)
- direct endoscopie (RR 0,90; 95%-BI 0,80 tot 1,02; p = 0,71)
- H. pylori-test en gastroscopie (RR 0,92; 95%-BI 0,79 tot 1,07; p = 0,57)
- empirisch zuurremmen (RR 0,96; 95%-BI 0,83 tot 1,09; p = 0,30)
Hieruit blijkt dat geen enkele strategie significant minder werkzaam is dan H. pylori test-and-treat.
Conclusie
Er is consistent bewijs uit vergelijkend onderzoek van de 3 behandelopties waaruit blijkt dat de 3 opties even effectief zijn.
Overwegingen
De 3 strategieën zijn gedurende 1 jaar onderzocht; er zijn geen gegevens over combinaties van deze strategieën, maar er zijn wel redenen om ze te combineren.
Een korte periode van zuurremmende medicatie laat bij veel patiënten in de eerste lijn de klachten vaak verdwijnen (zie Beloop van maagklachten).
Direct gastroscopie is niet kosteneffectief in de besproken onderzoeken. Onduidelijk is hoe de kosten van de onderzoeken verschillen van de huidige Nederlandse situatie. Omdat de kosten van PPI’s sterk zijn gedaald, is het aannemelijk dat het empirisch geven van PPI’s kosteneffectiever is geworden. Gastroscopie is daarnaast belastend voor de patiënt, kan soms leiden tot complicaties (zie Complicaties van een diagnostische gastroscopie) en er zijn capaciteitsproblemen.
H. pylori test-and-treat is bewerkelijker en waarschijnlijk minder kosteneffectief indien uitgevoerd bij alle patiënten aan het begin van een episode met maagklachten (zie detail H. pylori-diagnostiek). De zeer sterke prijsdaling van PPI’s nadat de hier aangehaalde onderzoeken zijn gedaan, heeft tot gevolg dat empirisch zuurremmen kosteneffectiever is geworden.
De resultaten van H. pylori-test-and-treat zijn onder meer afhankelijk van de testeigenschappen van de gebruikte test en van de prevalentie van H. pylori in de algemene bevolking. Bij een lage prevalentie is zelfs bij goede testeigenschappen de kans op foutnegatieve uitslagen hoog. Bij een H. pylori-prevalentie van < 10-20% heeft empirisch zuurremmen daarom de voorkeur.
Op basis van deze overwegingen heeft het de voorkeur om in de eerste lijn te beginnen met zuurremmende medicatie in plaats van direct gastroscopie of bij iedereen direct een H. pylori-test.
Voorlichting en niet-medicamenteuze behandeling
Naar Samenvatting ›- Leg uit dat maagklachten kunnen komen doordat maagzuur overlast geeft in de maag zelf (‘maagstress’) of in de slokdarm (reflux), maar ook door een zweer (zeldzaam) in de maag of het begin van de dunne darm.
- Bespreek leefstijlaanpassingen zoals:
- mijd voedingsmiddelen waarvan patiënt uit eigen ervaring weet dat ze klachten kunnen veroorzaken
- bij nachtelijke klachten een slaaphouding met hoofdeinde omhoog
- stoppen met roken, indien van toepassing
- afvallen (streef naar 5-10% gewichtsverlies), indien van toepassing
- Bespreek psychosociale problematiek, indien aanwezig.
- Bespreek de mogelijkheid van begeleiding door een diëtist voor ondersteuning bij dieetaanpassing en/of afvallen.
Zie ook Dieetfactoren, genotmiddelen en psychische factoren.
Thuisarts
Naar Samenvatting ›Verwijs naar de informatie op thuisarts.nl (inclusief de Keuzehulp Maagklachten). De informatie op Thuisarts is gebaseerd op deze NHG-Standaard.
Medicamenteus beleid algemeen
Naar Samenvatting ›- Ga na of medicatie (anders dan een NSAID) de maagklachten kan veroorzaken. Veel geneesmiddelen hebben maagklachten als bijwerking (zie Anamnese). Denk ook aan de mogelijkheid van een ulcus als bijwerking van bisfosfonaten en kaliumchloride(tabletten).
- Antacida worden niet vergoed. Zuurproductieremmers alleen indien > 6 maanden aaneengesloten voorgeschreven ter behandeling van een chronische aandoening.
- We bevelen Ziverel® (hyaluronzuur gecombineerd met chondroïtinesulfaat en poloxamer 407) en Iberogast® (alcoholhoudende vloeistof met kruidenextracten) niet aan voor de behandeling van maagklachten omdat de effectiviteit niet is vastgesteld.
Achtergrond
Iberogast® is een multikruidenpreparaat dat in Nederland geregistreerd is voor de symptomatische behandeling van dyspepsie bij volwassenen. Het is een alcoholhoudende druppelvloeistof (31%) die extracten van 9 kruiden bevat. De adviesdosering is 3 dd 20 druppels (= 1 ml), de hoeveelheid alcohol daarin komt overeen met 22,5 ml bier. De effectiviteit van Iberogast® in vergelijking met de in deze standaard geadviseerde zuurremmende medicatie bij maagklachten is niet bekend.
Methode
Een zoekstrategie in PubMed naar publicaties vanaf 2003 tot en met 30 juli 2018 over het effect van Iberogast® leverde 20 treffers op, waaronder 2 meta-analyses. De meta-analyse van Melzer is van iets betere kwaliteit (Amstar 5/11) en dient als basis bij het beantwoorden van de vraag.
Resultaten
In de meta-analyse van Melzer werden 3 RCT’s geïncludeerd waarin Iberogast® werd vergeleken met placebo en 1 RCT waarin Iberogast® werd vergeleken met cisapride. De patiënten in alle RCT’s hadden ‘functionele dyspepsie’ (niet duidelijk omschreven). Van de 3 placebogecontroleerde RCT’s was er 1 ongepubliceerd.
Effectiviteit (3 RCT’s)
De ruwe data van de 3 placebogecontroleerde RCT’s werden geanalyseerd op basis van intention-to-treat. Effect werd gedefinieerd als afname van de score van het meest dominante symptoom uit de gastro-intestinale symptoomscore (10 symptomen, gescoord op een 5-puntsschaal) van zeer ernstig/ernstig tot mild/afwezig. In totaal 138 patiënten kregen Iberogast® 3 dd 1 ml gedurende 4 weken, in de controlegroep kregen 135 patiënten placebo. Bij aanvang waren de dominante klachten zuurregurgitatie (n = 124), epigastrische pijn (n = 101), dysmotiliteitachtige symptomen (n = 30) en braken (n = 18).
Na 4 weken scoorde in de interventiegroep 7% en in de placebogroep 26% de dominante klacht als zeer ernstig/ernstig, terwijl deze scores bij aanvang niet verschilden (OR 0,22; 95%-BI 0,11 tot 0,47; p < 0,001).
Bijwerkingen (4 RCT’s)
In de 3 placebogecontroleerde RCT’s was het percentage bijwerkingen 3,6-24,6% bij Iberogast® en 1,3-25,7% bij placebo. Deze grote spreiding heeft mogelijk te maken met de mate van actieve opsporing; ernstige bijwerkingen werden niet vastgesteld, het ging vaak om maag-darmklachten (maagklachten, diarree, flatulentie), algemene klachten (duizeligheid, zweten, griepachtige klachten, druk op de borst) of luchtwegklachten (tracheïtis/bronchitis, sinusitis, hoesten en tonsillitis). Het Farmacotherapeutisch Kompas meldt als bijwerkingen zeer zelden overgevoeligheidsreacties, zoals exantheem, jeuk en dyspneu (Farmacotherapeutisch kompas).
Kwaliteit van de onderzoeken
De kwaliteit van de individuele onderzoeken werd niet systematisch besproken. Bij de deelnemers werd met gastroscopie, echo-onderzoek van de buik en laboratoriumonderzoek geen organische oorzaak vastgesteld. Dit komt niet overeen met de groep patiënten in de huisartsenpraktijk die empirisch worden behandeld. Het bewijs betreft een beperkt aantal patiënten.
Conclusie
Bij geselecteerde patiënten met functionele dyspepsie is er een erg zwakke aanwijzing dat Iberogast® effectief is, maar alleen voor de meest dominante klacht.
Van bewijs naar aanbeveling
Onduidelijk is hoe de effectmaat ‘afname van de last van het meest dominante symptoom’ zich verhoudt tot de totale klachtenlast die ook door niet-dominante klachten wordt bepaald, zodat de klinische betekenis niet kan worden geschat. Onduidelijk is of Iberogast® ook op langere termijn een gunstig effect heeft.
Er is geen bewijs gevonden voor de effectiviteit van Iberogast® bij empirische behandeling van maagklachten bij NSAID-gebruik, in een eerste episode of bij recidiverende/persisterende maagklachten. Daarom wordt het middel bij die indicaties niet geadviseerd.
Het gevonden bewijs voor het effect bij functionele dyspepsie is zo beperkt en zwak dat de werkgroep ook daar geen plaats ziet voor Iberogast®.
Bij dit advies speelt ook mee dat onduidelijk is of de samenstelling van het kruidenmengsel kan wisselen en dat de werkgroep het gebruik van alcohol ongewenst acht.
Iberogast® wordt niet vergoed. De kosten op basis van 3 dd 1 ml zijn 34 euro per maand; dit is veel meer dan omeprazol 20 mg (30 capsules = 0,58 euro; www.medicijnkosten.nl, geraadpleegd 10 april 2019).
Ziverel® is een recent in Nederland geïntroduceerd medisch hulpmiddel voor de behandeling van symptomen van gastro-esophageal reflux disease (GERD), waarin hyaluronzuur wordt gecombineerd met chondroïtinesulfaat en poloxamer 407. De patiëntbijsluiter geeft niet aan welke hoeveelheden van deze stoffen aanwezig zijn per verpakking. De effectiviteit bij empirische behandeling van maagklachten en bij refluxziekte in vergelijking tot de in deze standaard geadviseerde zuurremmende medicatie is niet bekend.
Methode
Een zoekstrategie met zoekdatum vanaf 2003 tot en met 30 juli 2018 naar het effect van Ziverel® bij patiënten met maagklachten gaf 8 treffers in PubMed en 2 in Embase. Daarbij waren slechts 2 klinische onderzoeken, waarvan er 1 niet besproken wordt omdat de kwaliteit te laag is.
Resultaten
Het tweede onderzoek betreft een RCT bij volwassen tweedelijns patiënten met non-erosive reflux disease (NERD) die endoscopisch geen slokdarmafwijkingen hadden en H. pylori-negatief waren. De geïncludeerde patiënten (n = 154) hadden een score ≥ 8 op de Reflux Disease Questionnaire (RDQ), een vragenlijst met 12 items die gescoord worden op een 5-puntsschaal. Zij werden willekeurig verdeeld over een groep die behandeld werd met een PPI plus hyaluronzuur/chondroïtinesulfaat (Esoxx One®) en een groep die behandeld werd met een PPI plus placebo.
In beide groepen was het gebruik van antacida of alginaten toegestaan.
Het primaire eindpunt was het percentage patiënten dat na 2 weken een reductie had van ≥ 3 punten op de totale symptoomscore (TSS), berekend door op de RDQ de ernst (niet de frequentie) te scoren van 4 kenmerkende symptomen (zuurbranden, retrosternale pijn, regurgitatie en zuur in de mond), zodat de TSS kon variëren tussen 0-20.
In de intention to treatanalyse haalde 52,6% in de groep die het combinatiepreparaat kreeg het primaire eindpunt, versus 32,1% in de placebogroep (p < 0,01).
Kwaliteit van het onderzoek
Na randomisatie waren er 25 uitvallers, waarvan 20 in de placebogroep. De onderzochte populatie komt niet overeen met de eerstelijns populatie en onduidelijk is of Esoxx One® precies dezelfde samenstelling heeft als Ziverel®. Het onderzoek werd gesponsord door de fabrikant van Esoxx One®.
Conclusie
Het is mogelijk dat hyaluronzuur/chondroïtinesulfaat in aanvulling op een PPI effectief is bij tweedelijns patiënten met NERD, maar onduidelijk is of Esoxx One® dezelfde samenstelling heeft als Ziverel®.
Van bewijs naar aanbeveling
Een verandering van drie punten op een schaal van 20 lijkt niet erg veel, zodat getwijfeld kan worden aan de klinische betekenis van dit verschil. De follow-up van 2 weken is kort. Het onderzoek is niet herhaald. De bewijskracht van dit onderzoek is onvoldoende om Ziverel® een plaats te geven in aanvulling op een PPI bij GERD. Als monotherapie is er geen bewijs voor effectiviteit.
Medicamenteus beleid eerste episode
Naar Samenvatting ›- Adviseer medicatie waarin de mate van zuurremming stapsgewijs wordt opgehoogd volgens het Stroomschema Beleid bij een eerste episode van maagklachten (zie figuur h1).
- Houd bij de keuze van medicatie rekening met eerdere (zelfzorg)medicatie (antacidum, mucosaprotectivum, PPI of H2-antagonist) en wat het effect daarvan op de klachten was.
- Start eerst met een antacidum (of mucosaprotectivum) in voldoende hoge dosering en doseerfrequentie.
- Bespreek met patiënt dat een PPI bij voorkeur kortdurend wordt gebruikt (in principe maximaal 4 weken), vanwege mogelijke langetermijnbijwerkingen en omdat het lastig is om na langdurig gebruik te stoppen (vanwege reboundklachten).
- Voer vóór de start van een PPI een H. pylori-test uit om H. pylori als mogelijke oorzaak van de klachten uit te sluiten. Als de PPI eenmaal gestart is, is het lastiger om alsnog een H. pylori-test uit te voeren, omdat je de PPI minimaal 2 weken voor de test moet staken en er in die tussentijd reboundklachten kunnen optreden. Bij een negatieve uitslag is een H. pylori-test eenmalig.
- H2-antagonisten zijn op basis van hogere kosten en slechtere beschikbaarheid niet meer standaard onderdeel van het medicamenteuze beleid bij een eerste episode van maagklachten, maar kunnen wel toegepast worden, bijvoorbeeld bij goede ervaringen van de patiënt in het verleden. Zie tabel h2 voor doseringen.
- Overweeg bij nachtelijke klachten ondanks PPI in maximale dosering om voor de nacht een snelwerkend middel toe te voegen voor ‘zo nodig’-gebruik, zoals een antacidum in een standaarddosering (zie tabel h1)
- Overweeg nadat bij afbouwen de laagste stap is bereikt altijd ‘zo nodig’-gebruik. Antacida hebben daarbij als voordeel boven PPI’s dat zij na inname sneller werken
| Geneesmiddel | Standaarddosering | Bijzonderheden |
| Antacidum (innemen 1 uur na elke maaltijd en voor de nacht) | ||
| Algeldraat/magnesiumhydroxide | 4 dd 1 kauwtablet (200/400 mg) of 10-15 ml suspensie (40/20 mg/ml of ‘forte’ 90/60 mg/ml)
Bij ernstige klachten: verdubbel dosering |
|
| Mucosaprotectivum (innemen ½ uur vóór elke maaltijd en voor de nacht) | ||
| Sucralfaat | 4 dd 1 g | eGFR < 30 ml/min: vermijd langdurig gebruik |
| PPI* (innemen zonder kauwen, 1 dd: vóór het ontbijt; bij 2 dd: tevens vóór de avondmaaltijd) | ||
| Omeprazol capsules (eerste keus) | 1 dd 20 mg (maximaal 2 dd 40 mg) |
|
| Esomeprazol (tweede keus) | 1 dd 20 mg (maximaal 2 dd 40 mg) | |
| Pantoprazol (tweede keus) | 1 dd 40 mg (maximaal 2 dd 80 mg) | |
| Rabeprazol | 1 dd 20 mg (standaarddosering = maximale dosering) | |
| * PPI-gebruik is off-label. | ||
Uit onderzoek naar het effect van verschillende geneesmiddelen (PPI’s, H2-antagonisten, antacida) bij empirische behandeling van maag- of refluxklachten is bekend dat al deze middelen effectief kunnen zijn. Een systematische zoekstrategie naar de vraag of step-upbeleid (begin met een antacidum, geef bij onvoldoende effect een H2-antagonist en bij onvoldoende effect daarvan een PPI) effectiever is dan step-downbeleid (step-upbeleid in omgekeerde volgorde), leverde 5 onderzoeken op.
Slechts de RCT van Van Marrewijk geeft een direct antwoord, de overige 4 onderzoeken vergeleken andere strategieën of waren niet goed generaliseerbaar.
Het onderzoek van Van Marrewijk was een niet-gesponsorde RCT (n = 664) in een Nederlandse eerstelijns populatie met maagklachten, waarin step-upbeleid (4 × daags antacida, gevolgd door 2 dd 150 mg ranitidine, gevolgd door 1 dd 40 mg pantoprazol) vergeleken werd met step-downbeleid (1 dd 40 mg pantoprazol, gevolgd door 2 dd 150 mg ranitidine, gevolgd door 4 × daags antacida). Na 6 maanden bleek het step-upbeleid even effectief als het step-downbeleid (behandelsucces respectievelijk 72 en 70%; OR 0,92; 95%-BI 0,7 tot 1,3). In de step-upgroep ontving 41% antacida, 25% ranitidine en 35% pantoprazol, in de step-downgroep ontving 47% pantoprazol, 18% ranitidine en 35% antacida. In de step-upgroep kwam dus 65% van de patiënten niet aan een PPI toe.
Overwegingen
Voor een antwoord op de vraag naar de effectiviteit van step-up- of step-downbeleid bij Nederlandse eerstelijns patiënten met maagklachten is vooral het niet-gesponsorde onderzoek van Van Marrewijk geschikt. Uit dit onderzoek van Van Marrewijk blijkt dat in de empirische behandeling van maagklachten step up- en step-downbeleid gelijkwaardig zijn, waarbij opvalt dat 2/3 van de patiënten uit de step-upgroep geen PPI nodig had. Step-upbeleid heeft ook het voordeel dat het aansluit bij het principe om te starten met het eenvoudigste middel met de minste interacties c.q. bijwerkingen. Van sterke zuurproductieremmers (PPI’s) zijn nadelen bekend die minder sterk zuurproductieremmende middelen niet of in mindere mate hebben (zie tabel d7).
| H2-antagonist | PPI | |
|---|---|---|
| Algemene overwegingen |
|
|
| Reboundeffect | Tot 10 dagen na stoppen |
|
| Absolute contra-indicaties | Cimetidine:
| – |
| Bijwerkingen |
|
|
| Bij chronisch gebruik | – |
|
| Kosten per maand* | € 25,00-42,00 | € 0,90-1,20 |
| * www.medicijnkosten.nl, geraadpleegd 9 februari 2023 | ||
Step-upbeleid beperkt het aantal PPI-starters en draagt daarmee bij aan het voorkomen van onnodig chronisch PPI-gebruik.
In de dagelijkse praktijk loopt de huisarts bij toepassen van het step-upbeleid tegen praktische bezwaren aan. In de afgelopen jaren zijn de H2-antagonisten ranitidine en nizatidine van de markt gehaald. De overgebleven H2-antagonisten zijn slecht leverbaar en hebben hoge kosten. Daarnaast is cimetidine gecontraïndiceerd bij gelijktijdig gebruik met diverse geneesmiddelen en bij een aangeboren verlengde QT-tijd. Doordat step-upbeleid in de praktijk regelmatig gedeeltelijk niet uitvoerbaar is, heeft de werkgroep gekozen om in het Stroomschema Beleid bij een eerste episode van maagklachten alleen PPI’s op te nemen (zie figuur h1). De werkgroep ziet in de praktijk dat er patiënten zijn die specifiek klachten in de nacht hebben en niet voldoende hebben aan zuurremming volgens het stroomschema.
De werkgroep adviseert te overwegen om bij onvoldoende effect van een PPI een snelwerkend middel toe te voegen voor ‘zo nodig’-gebruik in de nacht, zoals een antacidum in een standaarddosering. Dit advies is op consensus gebaseerd.
Conclusie
Start bij maagklachten met een antacidum of een mucosaprotectivum. Stap bij onvoldoende effect over op een PPI. Bij onvoldoende effect: verhoog de dosering.
Antacida
Antacida neutraliseren het maagzuur en hebben als voordeel dat zij zeer snel werken. Anno 2024 zijn in Nederland 7 preparaten beschikbaar.
- Algeldraat/magnesiumhydroxide. Als antacidum is deze combinatie eerste keus, omdat deze sneller en langer werkt (Farmacotherapeutisch kompas). De suspensie is de meest effectieve toedieningsvorm, vanwege het gebruiksgemak prefereren sommigen de tabletvorm. Algeldraat heeft een obstiperende en magnesiumhydroxide een laxerende werking; in combinatie heffen ze elkaars werking op
- Alginezuur/natriumwaterstofcarbonaat/calciumcarbonaat. Een bekende bijwerking van natriumwaterstofcarbonaat is een opgeblazen gevoel en flatulentie door CO2-ontwikkeling in de maag. Daarom is het als antacidum minder geschikt. Toediening van grote doses natrium kan bezwaarlijk zijn bij cardiovasculaire aandoeningen. Bij chronisch gebruik kunnen (door alkalisering van de urine) nierstenen worden gevormd
- Calciumcarbonaat/magnesiumcarbonaat
- Calciumcarbonaat (als kauwgom op de markt sinds 2023)
- Aluminiumhydroxide/magnesiumcarbonaat
- Magnesiumhydroxide als monopreparaat
- Algeldraat/magnesiumhydroxide met dimeticon. Deze combinatie heeft geen voordelen bij start van de behandeling en is duurder
Als wordt uitgegaan van 4 dd 1 tablet is magnesiumhydroxide als monopreparaat het goedkoopste, de overige preparaten zitten alle in dezelfde kostenrange. Algeldraat/magnesiumhydroxide is duurder als suspensie dan in tabletvorm.
Bijwerkingen
- Aluminiumzouten hebben een obstiperende werking. Zeer zeldzame bijwerkingen zijn een fosfaatdeficiëntiesyndroom door vorming van onoplosbaar aluminiumfosfaat in de darm, en encefalopathie, osteomalacie en microcytaire hypochrome anemie door stapeling van geabsorbeerd aluminium. Een fosfaatdeficiëntiesyndroom (anorexie, spierzwakte, osteomalacie, osteoporose en niersteenvorming) kan ontstaan bij chronisch gebruik of hoge doses, met name in combinatie met een fosfaatarm dieet. Encefalopathie kan ontstaan bij chronisch gebruik door dialysepatiënten.
- Carbonaten geven CO2-ontwikkeling in de maag.
- Calciumcarbonaat kan bij chronisch gebruik, met name in hoge doseringen, bij verminderde nierfunctie en/of in combinatie met veel melk leiden tot het melk-alkalisyndroom (hypercalciëmie, alkalose en een verminderde nierfunctie).
- Magnesiumverbindingen hebben een laxerende werking. Bij chronisch gebruik kan hypermagnesiëmie optreden met als gevolg hypotensie, misselijkheid, braken, ademhalingsdepressie, bradycardie en coma. Verder kunnen magnesiumverbindingen niersteenvorming induceren.
Interacties
Antacida kunnen de absorptie van diverse geneesmiddelen verminderen door verandering van de darmpassagesnelheid, door pH-verhoging van de maag of door een reactie met of adsorptie aan de antacida. Gescheiden toediening wordt aanbevolen.
De absorptie van de volgende middelen wordt verminderd (met aanbevolen gebruiksadvies):
- bisfosfonaten, rosuvastatine (≥ 2 uur vóór een antacidum)
- cefuroxim, itraconazol capsule, ketoconazol, penicillamine, tetracyclines en thyreomimetica (≥ 2 uur vóór of 4 uur na een antacidum)
- chinolonen (≥ 4 uur vóór of 4 uur na een antacidum), eventueel moet de therapie worden aangepast: het antacidum wordt tijdelijk gestaakt of bij zuurgerelateerde klachten vervangen door een secretieremmer, óf het chinolon wordt vervangen
- atazanavir, indinavir, integraseremmers, tipranavir (≥ 2 uur vóór of na een antacidum)
- tyrosinekinaseremmers (≥ 2 uur vóór of 4 uur na een antacidum)
- ledipasvir of velpatasvir (≥ 4 uur vóór een antacidum)
- ijzerzouten, gewoon preparaat (≥ 2 uur vóór of 4 uur na een antacidum)
- eltrombopag (≥ 2 uur vóór of 4 uur na een antacidum).
- ulipristal als noodanticonceptie (Ellaone®): de biologische beschikbaarheid kan afnemen
- methenamine: de werking wordt tegengegaan door alkalisering van de urine
Zwangerschap, borstvoeding
Bij normaal gebruik van antacida zijn er geen aanwijzingen voor negatieve effecten op de zwangerschap en de foetus. De absorptie van magnesium uit magnesiumhydroxide is 15-30% en uit magnesiumcarbonaat 15-20%. In theorie is het mogelijk dat een klein gedeelte van het aluminium of magnesium in de moedermelk terechtkomt. Dit heeft geen nadelige effecten op de zuigeling; magnesium is van nature aanwezig in de moedermelk. Gebruik van magnesiumzouten door de moeder verhoogt de hoeveelheid magnesium in de moedermelk slechts in geringe mate. Deze toename is waarschijnlijk niet klinisch relevant.
Chronisch gebruik van aluminiumpreparaten kan hypofosfatemie en hypercalciurie bij de zuigeling veroorzaken. Dit effect is nog nooit gemeld bij blootstelling via de borstvoeding. De hoeveelheid aluminium in de moedermelk is daarvoor waarschijnlijk veel te laag (Teratologie Informatie Service, geraadpleegd 30 oktober 2023).
De KNMP stelt dat er ruime ervaring is met antacida tijdens de zwangerschap en dat deze niet wijst op een toename van aangeboren afwijkingen. Antacida kunnen tijdens de zwangerschap en het geven van borstvoeding worden gebruikt. Hoge doses en chronisch gebruik dienen te worden vermeden (KNMP Kennisbank, geraadpleegd 30 oktober 2023).
Nier- en leverfunctiestoornissen
Vermijd chronisch gebruik van aluminiumzouten bij eGFR < 30 ml/min/1,73 m2 vanwege het risico op encefalopathie door stapeling van geabsorbeerd aluminium.
Mucosaprotectiva
Een beschikbaar mucosaprotectivum is sucralfaat 4 dd 1 g. In maag en darm vormt dit met eiwitten aan het ulcusoppervlak een complex dat het ulcus beschermt tegen de inwerking van pepsine, maagzuur en gal. Sucralfaat is geregistreerd voor ulcus duodeni, ulcus ventriculi, refluxoesofagitis en ter preventie van recidiverende ulcera. De suspensie is tevens geïndiceerd ter preventie van stressbloedingen in het proximale deel van de tractus digestivus (dosis 6 dd 1 g).
Niet geheel duidelijk is of de effectiviteit van sucralfaat bij maagklachten gelijkwaardig is aan die van algeldraat/magnesiumhydroxide. Waarschijnlijk werkt algeldraat/magnesiumhydroxide (op grond van het werkingsmechanisme) bij klachten door zuur sneller. Ten aanzien van de kosten wordt overwogen dat, als sucralfaat gelijkwaardig zou zijn aan algeldraat/magnesiumhydroxide en de dosisequivalentie wordt gesteld op 4 dd 1 kauwtablet algeldraat/magnesiumhydroxide versus 4 dd 1 sachet sucralfaat, sucralfaat bijna 2 × zo duur is. De kosten van sucralfaat zakjes met granulaat (1 g) en suspensie (1 g) verschillen niet.
Interacties
Sucralfaat vermindert de absorptie van de volgende middelen (met aanbevolen gebruiksadvies):
thyreomimetica (≥ 2 uur vóór sucralfaat innemen);
- chinolonen (≥ 4 uur vóór sucralfaat toedienen of therapie aanpassen);
- integraseremmers (≥ 2 uur vóór of 2 uur na sucralfaat innemen).
Zwangerschap, borstvoeding
Sucralfaat kan in de zwangerschap gebruikt worden en kan waarschijnlijk veilig worden gebruikt tijdens de periode van borstvoeding (Teratologie Informatie Service, geraadpleegd 30 oktober 2023).
Nier- en leverfunctiestoornissen
Vermijd chronisch gebruik van sucralfaat bij eGFR < 30 ml/min/1,73 m2 vanwege het risico op encefalopathie door stapeling van geabsorbeerd aluminium.
Overwegingen
- Algeldraat/magnesium(hydr)oxide heeft de voorkeur boven andere antacida vanwege betere effectiviteit en minder bijwerkingen. De suspensie werkt sneller, maar kauwtabletten kunnen gebruiksvriendelijker zijn.
- Sucralfaat heeft geen voordelen ten opzichte van antacida en is duurder, zodat antacida dan de voorkeur hebben.
Conclusie
Geef als een antacidum gewenst is algeldraat/magnesium(hydr)oxide en als tweede keus sucralfaat.
Tussen de verschillende H2-antagonisten bestaan nauwelijks of geen relevante verschillen in effectiviteit (Farmacotherapeutisch kompas). Medio 2021 zijn ranitidine en nizatidine in Nederland definitief uit de handel genomen en zijn alleen famotidine en cimetidine (wisselend) verkrijgbaar. Cimetidine is alleen op recept verkrijgbaar.
Cimetidine remt het CYP450-leverenzymsysteem en kan daardoor het metabolisme van andere geneesmiddelen remmen. Deze interactie treedt bij famotidine niet op. Vooral bij hogere doseringen en/of bij ouderen heeft cimetidine meer kans op interacties (Farmacotherapeutisch kompas). Ook heeft cimetidine, als enige H2-antagonist, geringe antiandrogene eigenschappen en kan daardoor (bij gebruik gedurende ≥ 1 maand) bijwerkingen geven zoals gynaecomastie.
Cimetidine is gecontra-indiceerd voor patiënten met een aangeboren lang-QT-intervalsyndroom en/of gebruik van ≥ 1 van de volgende geneesmiddelen: calciumantagonisten (dihydropyridines, diltiazem, verapamil), lipofiele bètablokkers (zoals metoprolol, bisoprolol, carvedilol en propranolol), flecaïnide, vitamine-K-antagonisten (cumarines), sildenafil, benzodiazepines, TCA’s (amitriptyline, imipramine of nortriptyline), doxepine, carbamazepine, fenytoïne en theofylline (KNMP Kennisbank, geraadpleegd 30 oktober 2023; Farmacotherapeutisch kompas, geraadpleegd 30 oktober 2023).
Famotidine en cimetidine zijn gelijkwaardig qua effectiviteit. Als dosisequivalente hoeveelheden wordt gekozen voor de defined daily doses: famotidine 40 mg, cimetidine 800 mg.
Conclusie
Binnen de H2-antagonisten is keuze uit famotidine en cimetidine. Deze middelen zijn gelijkwaardig qua effectiviteit.
Voor cimetidine gelden enkele contra-indicaties:
- een aangeboren lang-QT-intervalsyndroom en/of
- gebruik van één of meer van de volgende geneesmiddelen: calciumantagonisten (dihydropyridines, diltiazem, verapamil), lipofiele bètablokkers (zoals metoprolol, bisoprolol, carvedilol en propranolol), flecaïnide, vitamine-K-antagonisten (cumarines), sildenafil, benzodiazepines, TCA’s (amitriptyline, imipramine of nortriptyline), doxepine, carbamazepine, fenytoïne en theofylline
Tussen de verschillende PPI’s bestaan nauwelijks of geen relevante verschillen in zuurremming (Farmacotherapeutisch kompas). De geregistreerde dosering bij de behandeling van maagklachten zoals reflux-oesofagitis, ulcus duodeni en ulcus ventriculi is: esomeprazol 20-40 mg 1 dd, lansoprazol 30 mg 1 dd, omeprazol 20 mg 1 dd, pantoprazol 40 mg 1 dd en rabeprazol 20 mg 1 dd (KNMP Kennisbank, geraadpleegd 9 februari 2023).
- Bij gastro-oesofageale refluxziekte bleek in een meta-analyse de effectiviteit van pantoprazol 40 mg, lansoprazol 30 mg en rabeprazol 20 mg na 4 weken gelijk aan die van omeprazol 20 mg. Esomeprazol 40 mg bleek effectiever dan omeprazol 20 mg (20 RCT’s).
- Bij H. pylori-eradicatie bleek de effectiviteit van 2 soorten antibiotica plus pantoprazol 80 mg, lansoprazol 60 mg en rabeprazol 40 mg gelijk aan die van 2 antibiotica plus omeprazol 40 mg (19 RCT’s).
- Bij ulcus bleek de effectiviteit van lansoprazol 30 mg en rabeprazol 20 mg na 4 weken behandeling gelijk aan die van omeprazol 20 mg, terwijl pantoprazol 40 mg iets effectiever bleek (9 RCT’s; RR 1,07; 95%-BI 1,14 tot 1,23).
Overwegingen
Het grotere effect van esomeprazol 40 mg ten opzichte van omeprazol 20 mg wordt verklaard door de hogere dosering van esomeprazol en doordat esomeprazol het meest actieve bestanddeel van omeprazol is. Het kleine voordeel van pantoprazol 40 mg ten opzichte van omeprazol 20 mg werd in de meta-analyse van Klok 2003 alleen bij ulcusgenezing gevonden en is bij empirische behandeling van maagklachten in de eerste lijn nauwelijks klinisch relevant, omdat een ulcus bij slechts ongeveer 5% van de patiënten de onderliggende aandoening zal zijn.
De werkgroep besluit dat de 5 PPI’s gelijkwaardig zijn. Als dosisequivalente gelijkwaardige hoeveelheden wordt gekozen voor de geregistreerde doseringen: esomeprazol 20 mg, omeprazol 20 mg, pantoprazol 40 mg, lansoprazol 30 mg en rabeprazol 20 mg. Esomeprazol is geregistreerd voor de behandeling van maagklachten in een dosering van 20-40 mg. Aangezien esomeprazol de actieve isomeer van omeprazol bevat, is gekozen voor de laagste geregistreerde dosering.
Uit het oogpunt van dosisequivalentie van de PPI’s en vanwege voorschrijfgemak zou een zelfde dosering pantoprazol de voorkeur hebben voor zowel de preventie als de behandeling van maagklachten (zie NHG-Behandelrichtlijn Preventie van maagcomplicaties door geneesmiddelgebruik). Op basis van de geregistreerde dosering is echter gekozen voor pantoprazol 1 dd 40 mg voor de behandeling van maagklachten en pantoprazol 1 dd 20 mg voor de preventie van maagklachten. Uit de kostenvergelijking blijkt dat de omeprazol capsule de goedkoopste is, gevolgd door esomeprazol en pantoprazol (www.medicijnkosten.nl, geraadpleegd 29 oktober 2024). Bij selectie naar 3 gelijkwaardige middelen vallen lansoprazol en rabeprazol af op basis van kosten.
Conclusie
Binnen de PPI’s is bij zuurremming omeprazol (capsule) eerste keus, esomeprazol en pantoprazol zijn middelen van tweede keus.
In meerdere onderzoeken wordt beschreven dat bij een aanzienlijk deel van de patiënten met onvoldoende symptoomcontrole op dagelijks PPI het moment van inname suboptimaal is.
Het Farmacotherapeutisch Kompas adviseert een PPI 's ochtends op een lege (nuchtere) maag zonder kauwen in te nemen met een glas water (Farmacotherapeutisch kompas).
Bij het geven van de dubbele dosis PPI is 2 × daags doseren effectiever.
Conclusie
Neem een PPI ’s ochtends op een nuchtere maag in. Indien een dubbele dosering PPI nodig is, gaat de voorkeur uit naar 2 × daags doseren.
Farmacogenetisch onderzoek
Naar Samenvatting ›Het metabolisme van omeprazol en pantoprazol kan beïnvloed worden door variaties in CYP2C19-activiteit; voor esomeprazol en rabeprazol geldt dat niet. Bij start van omeprazol en pantoprazol vanwege maagklachten is farmacogenetisch onderzoek op CYP2C19-activiteit niet geïndiceerd. Pas indien een farmacogenetische variatie van CYP2C19 bekend is, zo nodig de dosering van omeprazol en pantoprazol aan of schrijf esomeprazol (eerste keus) of rabeprazol voor. Volg hierbij de adviezen in het HIS of overleg eventueel met een apotheker.
Achtergrond
Cytochroom-P450-enzymen (CYP-enzymen) spelen een rol bij het metabolizeren van protonpompremmers in de lever. PPI’s worden met name door CYP2C19 omgezet in niet-werkzame metabolieten (KNMP Kennisbank, geraadpleegd 3 april 2023). Bij esomeprazol, rabeprazol en lansoprazol speelt ook CYP3A4 een rol, maar variaties in dit cytochroom hebben waarschijnlijk geen invloed op de werkzaamheid van PPI’s.
Een genetische variatie van CYP2C19 komt voor bij ongeveer 34% van de mensen van Europese afkomst.
Genetische variaties kunnen leiden tot een afwijkende activiteit van CYP2C19:
- trage metaboliseerders (poor metabolizers, PM) en intermediaire metaboliseerders (intermediate metabolizers, IM) breken PPI's langzamer af naar niet-werkzame metabolieten, met mogelijk een hogere plasmaspiegel en meer bijwerkingen tot gevolg. Het gaat om ongeveer 28% van de mensen van Europese afkomst
- ultrasnelle metaboliseerders (ultrarapid metabolizers, UM) breken PPI's sneller af naar niet-werkzame metabolieten, met mogelijk een verlaagde plasmaspiegel en minder effectiviteit tot gevolg. Dit betreft ongeveer 5% van de mensen van Europese afkomst.
Overwegingen
Genetische variaties in CYP2C19 beïnvloeden het metabolisme van de diverse PPI’s verschillend.
Rabeprazol en esomeprazol
Rabeprazol wordt voornamelijk niet-enzymatisch omgezet en is daarom de PPI die het minst gevoelig is voor genetische variaties in CYP2C19. Bij esomeprazol is de invloed van genetische variaties op de plasmaspiegels beperkt en niet klinisch relevant. De doseringen van rabeprazol en esomeprazol hoeven daarom niet aangepast te worden aan de genetische variatie van CYP2C19. Voorafgaand aan en tijdens het gebruik van deze PPI’s is er geen indicatie voor farmacogenetisch onderzoek.
Lansoprazol, omeprazol, pantoprazol
De werkgroep Farmacogenetica van de KNMP geeft aan dat farmacogenetisch onderzoek naar varianten van CYP2C19 voorafgaand aan het gebruik van lansoprazol, omeprazol en pantoprazol mogelijk gunstig zou kunnen zijn voor de patiënt. De dosering kan in dat geval direct aangepast worden aan het genotype van de patiënt en dit zou tot een betere effectiviteit van de PPI kunnen leiden (KNMP Kennisbank, geraadpleegd 28 juni 2023).
Farmacogenetisch onderzoek bij indicaties waar op effect en bijwerkingen gedoseerd wordt
Het NHG raadt farmacogenetisch onderzoek voorafgaand aan of tijdens het gebruik van PPI’s af bij indicaties waarbij op effect (klachten) en bijwerkingen gedoseerd wordt. Bij onvoldoende effectiviteit kan immers de dosering verhoogd worden tot de maximale dosering. Dit is in lijn met het advies van de KNMP-werkgroep die bij ultrasnelle metaboliseerders afhankelijk van het gebruikte PPI een 3-5 × zo hoge dosering adviseert (KNMP Kennisbank, geraadpleegd 2 juni 2023). Bij trage metaboliseerders zijn ernstige bijwerkingen van PPI’s bij de standaarddosering niet te verwachten. Immers, bij standaarddoseringen wordt bij trage metaboliseerders in vergelijking met normale metaboliseerders ook geen hogere incidentie van bijwerkingen gevonden (KNMP Kennisbank, geraadpleegd 30 mei 2024). Omdat verdere dosisverhoging op geleide van effectiviteit en bijwerkingen gebeurt, zullen bijwerkingen vanzelf blijken en is farmacogenetisch onderzoek vooraf niet bijdragend aan het beleid. Daarnaast is voor de indicatie maagklachten geen onderzoek op harde eindpunten bekend waaruit blijkt dat bepaalde PPI’s effectiever zouden zijn. In de praktijk blijken bovendien de standaarddoses van omeprazol, lansoprazol of pantoprazol goed te werken.
Overweeg om bij onvoldoende effectiviteit van omeprazol of pantoprazol (of lansoprazol) te wisselen naar esomeprazol (of rabeprazol), PPI’s waarvan de effectiviteit niet beïnvloed wordt door variaties in CYP2C19.
Farmacogenetisch onderzoek bij indicaties voor chronisch PPI-gebruik
Bij indicaties waar niet op effect (klachten) gedoseerd wordt en PPI’s chronisch (preventief) gebruikt zullen worden, zoals ernstige oesofagitis, barrettoesofagus en zollinger-ellisonsyndroom, heeft farmacogenetische onderzoek mogelijk consequenties voor de dosering of keuze van PPI.
Er is geen specifiek beleid van mdl-artsen bij deze indicaties bekend (bij de slokdarmgerelateerde indicaties voor een PPI bepalen zij meestal het beleid). De werkgroep adviseert in deze het beleid van de mdl-arts te volgen.
Indien de huisarts zelf de PPI start, luidt het advies, gezien het levenslange gebruik en het niet kunnen doseren op geleide van klachten, om een PPI voor te schrijven waarvan het metabolisme niet beïnvloed wordt door genetische variaties van CYP2C19 (esomeprazol of rabeprazol) óf, bij een keuze voor omeprazol, pantoprazol of lansoprazol, om voor het starten van de behandeling farmacogenetisch onderzoek naar CYP2C19 uit te voeren. Op basis van kosten heeft esomeprazol de voorkeur boven rabeprazol.
- Voor meer informatie over farmacogenetisch onderzoek, zie NHG-Standpunt Farmacogenetisch onderzoek in de huisartsenpraktijk.
- Voor informatie over het gebruik van PPI’s voor de indicatie maagbescherming, zie NHG-Behandelrichtlijn Preventie van maagcomplicaties door geneesmiddelgebruik.
Farmacogenetisch onderzoek bij eradicatiebehandeling voor H. pylori
Zie detail Keuze van PPI bij een eradicatiebehandeling.
Conclusie
Er is geen plaats voor farmacogenetisch onderzoek voorafgaand aan de start of tijdens het gebruik van omeprazol en pantoprazol (en lansoprazol) voor indicaties waar gedoseerd wordt op geleide van klachten c.q. effect en bijwerkingen. Overweeg om bij onvoldoende effectiviteit van omeprazol of pantoprazol (of lansoprazol) te wisselen naar esomeprazol (of rabeprazol), middelen waarvan de effectiviteit niet beïnvloed wordt door variaties in CYP2C19.
Schrijf esomeprazol (of rabeprazol) alleen voor bij indicaties waar niet op effect (klachten) gedoseerd wordt en PPI’s chronisch (preventief) gebruikt worden, zoals ernstige oesofagitis, barrettoesofagus en zollinger-ellisonsyndroom, of vraag voorafgaand aan het starten met omeprazol, pantoprazol of lansoprazol farmacogenetisch onderzoek naar CYP2C19 aan.
Indien bij de start van het gebruik van omeprazol of pantoprazol (of lansoprazol) een genetische variatie van CYP2C19 bekend is, luidt het advies om de doseeradviezen van de KNMP-werkgroep farmacogenetica te volgen. Deze adviezen zijn te vinden in de KNMP Kennisbank (te raadplegen door abonnees/apothekers) en in het HIS op het moment van voorschrijven, mits de farmacogenetische variatie op de juiste wijze als contra-indicatie in het HIS is vastgelegd. Informatie over farmacogenetisch onderzoek en het vastleggen in het HIS is opgenomen in het NHG-Standpunt Farmacogenetisch onderzoek in de huisartsenpraktijk.
Conclusie
Pas, indien een genetische variatie van CYP2C19 bekend is, de dosering van omeprazol en pantoprazol (en lansoprazol) aan conform de adviezen in het HIS.
Beleid bij persisterende of recidiverende klachten
Naar Samenvatting ›- Blijf alert op:
- indicaties voor een spoedverwijzing (zie Richtlijnen spoed)
- alarmsymptomen (zie Anamnese)
- redenen om de diagnose ‘maagklachten’ te heroverwegen
- Bij onbekende H. pylori-status: verricht een H. pylori-test (zie Aanvullend onderzoek).
- Overweeg bij onvoldoende effect van omeprazol of pantoprazol in een maximale dosering deze om te zetten in esomeprazol (eerste keus) of rabeprazol. Het effect van laatstgenoemde middelen wordt niet beïnvloed door farmacogenetische variaties (zie Farmacogenetisch onderzoek).
- Overweeg gastroduodenoscopie bij een relatieve indicatie daarvoor (zie Gastroduodenoscopie) en bespreek dit met de patiënt
- Overweeg als er geen indicatie is voor gastroduodenoscopie, vooral bij patiënten met een zeer laag risico op een maligniteit:
- voorlichting over maagklachten die eventuele onnodige onrust bij de patiënt kan wegnemen: zie thuisarts.nl
- een benadering zoals beschreven in de NHG-Standaard Somatisch onvoldoende verklaarde lichamelijke klachten (SOLK)
- Adviseer kortdurend gebruik van middelen uit de laagst mogelijke stap van het Stroomschema Beleid bij een eerste episode van maagklachten (zie figuur h1).
- Bij medicamenteuze behandeling: maak afspraken over stop- en afbouwmomenten en probeer chronisch PPI-gebruik te voorkomen.
- Instrueer patiënt contact op te nemen bij nieuwe klachten of bij verergering van het klachtenpatroon.
N.B. Omdat het risico op herbesmetting met H. pylori laag is, wordt aangenomen dat een negatieve testuitslag betekent dat de patiënt daarna negatief zal blijven. (Periodiek) herhalen van de test is daarom niet nodig.
Beleid na positieve H. pylori-test
Naar Samenvatting ›Algemeen
Naar Samenvatting ›- H. pylori-eradicatie:
- is effectief bij 10-15% van de patiënten met functionele klachten
- heeft geen effect bij patiënten met refluxklachten
- heeft waarschijnlijk een preventief effect op het ontstaan van maagcarcinoom
- geneest ulcera en voorkomt recidieven
- Een eradicatiebehandeling bestaat uit een combinatie van 2 antibiotica en een PPI. De PPI zorgt voor een minder zure maag, waardoor antibiotica minder snel worden afgebroken en H. pylori gevoeliger is voor antibiotica.
- Bij eradicatie (in tegenstelling tot bij klachtbehandeling) is esomeprazol de PPI van eerste keus.
Voorlichting
Naar Samenvatting ›- Leg uit dat H. pylori vaak de oorzaak is van een maagzweer en soms van ‘maagstress’ of reflux, en in verband wordt gebracht met een licht verhoogde kans op maagkanker.
- Bij een maagzweer laat een behandeling met antibiotica de klachten verdwijnen en voorkomt deze dat de zweer terugkomt.
- Bij ‘maagstress’ of reflux helpt behandeling met antibiotica soms ook, maar niet altijd.
- De kans op maagkanker neemt af na behandeling.
- Leg de eradicatiebehandeling uit: starten met 2 antibiotica plus dubbele dosis PPI en aansluitend nog 4 weken een ‘kuur’ met alleen een PPI (enkele dosis) om een mogelijk aanwezige maagzweer te laten genezen en maagklachten door andere oorzaken te verlichten; daarna wordt ook de PPI gestopt (zie ook PPI-gebruik en maagcarcinoom).
- Een controletest op H. pylori volgt 2 weken na het stoppen van de PPI. Behandel eventuele klachten in de tussentijd met een antacidum, mucosaprotectivum of H2-antagonist omdat de controletest anders onbetrouwbaar is.
H. pylori-eradicatie: medicatie en controletest
Naar Samenvatting ›Let op: Op basis van regionale afspraken kan worden afgeweken van onderstaande keuze of gebruiksduur van antibiotica.
- Start met een eradicatiebehandeling gedurende 10 dagen (zie tabel h3)
- Bij een positieve H. pylori-test na de eradicatiebehandeling is een tweede kuur geïndiceerd. Overleg dan met een mdl-arts of arts-microbioloog (vanwege regionale verschillen in het resistentiepatroon, mogelijkheid microbiologische kweek en ervaring met diverse kuursamenstellingen), of volg de regionale samenwerkingsafspraken.
| Gedurende 10 dagen | Vervolgbeleid |
|---|---|
| |
| *Bij penicillineallergie: metronidazol 3 dd 500 mg | |
Ulcera
In een review (57 RCT’s) werd het effect van H. pylori-eradicatie bij ulcus duodeni en ulcus ventriculi onderzocht, met als uitkomstmaat genezing en het voorkomen van een recidief ulcus.
- Genezing ulcus duodeni: eradicatiebehandeling was effectiever dan alleen zuurremmende therapie (34 RCT’s; n = 3910; persisterend ulcus bij 12,4% in de eradicatiegroep vs. 18,7% in de zuurremmergroep; RR 0,66; 95%-BI 0,58 tot 0,76) en effectiever dan geen behandeling (2 RCT’s; n = 207; persisterend ulcus bij 24% in de eradicatiegroep vs. 58,5% in de groep zonder behandeling; RR 0,37; 95%-BI 0,26 tot 0,53).
- Genezing ulcus ventriculi: eradicatietherapie was even effectief als zuurremmende therapie (15 RCT’s; n = 1974; persisterend ulcus bij 16% in de eradicatiegroep vs. 13% in de zuurremmergroep; RR 1,23; 95%-BI 0,90 tot 1,68).
- Preventie van recidief ulcus duodeni: eradicatietherapie was effectiever dan geen therapie (27 RCT’s; n = 2509; recidief 12,9% na eradicatietherapie versus 64,4% zonder; RR 0,20; 95%-BI 0,15 tot 0,26). Eradicatietherapie bij ulcus duodeni was even effectief als onderhoudstherapie met zuurremmers (4 RCT’s; n = 319; recidiverend ulcus 11,9% in de eradicatiegroep vs.16,3% in de zuurremmergroep; RR 0,73; 95%-BI 0,42 tot 1,25).
- Preventie van recidief ulcus ventriculi: eradicatietherapie was effectiever dan geen therapie (12 RCT’s; n = 1476; recidief 16,3% in de eradicatiegroep vs. 52,4% in de groep zonder behandeling; RR 0,31; 95%-BI 0,22 tot 0,45).
Gastro-oesofageale refluxziekte
In een review werden 2 RCT’s gevonden naar de effectiviteit van H. pylori-eradicatiebehandeling bij gastro-oesofageale refluxziekte. Een RCT (n = 190) vergeleek H. pylori-eradicatiebehandeling met placebo bij patiënten met GERD. Na 1 jaar kwamen in beide groepen bij 83% de symptomen terug. De andere RCT (n = 1558) vergeleek het optreden van klachten bij patiënten met GERD. Na 2 jaar bleek er geen verschil tussen beide groepen in het optreden van zuurbranden (OR 0,90; 95%-BI 0,71 tot 1,14) of van regurgitatie (OR 0,89; 95%-BI 0,62 tot 1,29).
Functionele maagklachten
Een meta-analyse van goede kwaliteit (Amstar 8/11) onderzocht de effectiviteit van H. pylori-eradicatie bij functionele maagklachten (zoekdatum 2015, 24 Engelstalige RCT’s, n = 5555). Tijdens de laatste controle had 40% van de patiënten in de eradicatiegroep en 32% van de patiënten in de controlegroep geen of milde klachten (RR 1,23; 95%-BI 1,12 tot 1,36). Hoewel er geen erg grote heterogeniteit bleek (I2 = 42%), wees een asymmetrische funnel plot op het bestaan van publicatiebias. Symptoomverbetering door H. pylori-eradicatie bestond op de lange termijn (> 1 jaar; RR 1,24; 95%-BI 1,12 tot 1,37), maar niet op de korte termijn (RR 1,26; 95%-BI 0,83 tot 1,92).
Conclusie
- Er is consistent bewijs dat eradicatiebehandeling en zuurremmende therapie een ulcus ventriculi effectief genezen. Er is consistent bewijs dat eradicatiebehandeling effectiever is dan zuurremmende therapie bij genezing van een ulcus duodeni, maar het verschil is klein. De genezingspercentages van eradicatiebehandeling liggen bij ulcus ventriculi en ulcus duodeni rond de 85%.
- Er is sterk bewijs dat eradicatiebehandeling effectiever is dan placebo bij de preventie van een recidief ulcus (vooral ulcus duodeni). Bij een ulcus duodeni is eradicatiebehandeling even effectief als onderhoudsbehandeling met zuurremmers. Vanwege de nadelen van chronisch zuurremmergebruik heeft eradicatiebehandeling dan de voorkeur. Het gunstigere effect van eradicatiebehandeling vergeleken met een onderhoudsbehandeling met zuurremmers bij ulcera is vooral gelegen in het effectiever voorkomen van recidieven.
- Er is bewijs dat H. pylori-eradicatie bij functionele maagklachten niet op de korte, maar wel op de langere termijn (> 1 jaar) in beperkte mate effectiever is dan placebo.
- Er is bewijs dat H. pylori-eradicatie bij gastro-oesofageale refluxziekte niet effectiever is dan placebo.
Achtergrond
Bij een eradicatiebehandeling voor H. pylori wordt een PPI in hoge dosering toegevoegd omdat bij een hoge maag-pH enerzijds antibiotica minder snel worden afgebroken en anderzijds de H. pylori verhoogd gevoelig is voor de invloed van antibiotica.
Dit effect is in meerdere meta-analyses vastgesteld, waarbij met een standaarddosis PPI 2dd hogere eradicatiepercentages werden bereikt dan met een standaarddosis PPI 1 dd.
Genetische variaties in CYP2C19 kunnen het metabolisme van omeprazol, pantoprazol en lansoprasol beïnvloeden en zo zorgen voor lagere spiegels. Het metabolisme van esomeprazol en rabeprazol is minder of niet gevoelig voor variaties in CYP2C19. Een genetische variatie van CYP2C19 komt voor bij ongeveer 34% van de mensen van Europese afkomst.
In Nederland is ongeveer 5% van de bevolking een ultrasnelle metaboliseerder (UM) voor het enzym CYP2C19. Bij hen worden PPI’s snel omgezet in niet-werkzame metabolieten, waardoor de spiegel van de werkzame stof lager is en het aanvullende effect van omeprazol, lansoprazol en pantoprazol op het eradicatieresultaat van beide antibiotica geringer is. Dit is niet het geval bij trage en intermediaire metaboliseerders (PM en IM). Bij hen worden PPI’s minder snel omgezet en blijven de spiegels hoger.
In een meta-analyse (Tang 2013; 16 RCT’s; n = 3680) bleek dat eradicatiebehandelingen (zogeheten triplekuren met een PPI in de gebruikelijke dosering plus 2 antibiotica, elke PPI toegestaan) een dalend effect hadden bij normale metaboliseerders (extensive metabolizers, EM).
Het effect van H. pylori-eradicatie bleek significant te verschillen tussen EM en IM (OR 0,72; 95%-BI 0,59 tot 0,88; p = 0,001), tussen EM en PM (OR 0,50; 95%-BI 0,38 tot 0,68; p < 0,001) en tussen IM en PM (OR 0,69; 95%-BI 0,52 tot 0,90; p = 0,012). De overeenkomstige mate van H. pylori-eradicatie was bij EM 79,45%, bij IM 84,02% en bij PM 88,88%. Uitgesplitst naar de individuele PPI’s werd voor omeprazol en lansoprazol wel een significant verschil in eradicatie gevonden, maar niet voor esomeprazol en rabeprazol (zie tabel d8). In Nederland is ongeveer 65-75% van de bevolking een normale metaboliseerder voor het enzym CYP2C19.
| PPI | EM versus IM | EM versus PM | IM versus PM | ||||||
|---|---|---|---|---|---|---|---|---|---|
| n | OR (95%-BI) | p | n | OR (95%-BI) | p | n | OR (95%-BI) | p | |
| Omeprazol | 435 | 0,329 (0,195 tot 0,553) | 0,000 | 296 | 0,232 (0,105 tot 0,515) | 0,001 | 343 | 0,694 (0,299 tot 1,608) | 0,394 |
| Lansoprazol | 806 | 0,692 (0,485 tot 0,988) | 0,043 | 493 | 0,441 (0,252 tot 0,771) | 0,004 | 607 | 0,584 (0,333 tot 1,024) | 0,060 |
| Esomeprazol | 232 | 1,000 (0,410 tot 2,437) | 0,999 | 177 | 0,623 (0,200 tot 1,942) | 0,414 | 193 | 0,642 (0,209 tot 1,975) | 0,440 |
| Rabeprazol | 1055 | 0,931 (0,669 tot 1,294) | 0,396 | 623 | 0,769 (0,477 tot 1,238) | 0,279 | 842 | 0,778 (0,491 tot 1,232) | 0,284 |
| Bron: Tang 2013. | |||||||||
Overwegingen
- De werkgroep vindt het verschil van bijna 10% in eradicatiepercentage tussen PM en EM voldoende reden om het PPI-advies bij een eradicatiebehandeling aan te passen. De KNMP-werkgroep farmacogenetica adviseert om bij ultrasnelle CYP2C19-metaboliseerders (UM) de dosering van omeprazol, lansoprazol en pantoprazol bij H. pylori-eradicatiekuren respectievelijk 3, 4 en 5 × te verhogen (KNMP Kennisbank: Omeprazol, Lansoprazol, Pantoprazol, geraadpleegd mei 2020). De werkgroep van deze standaard kiest er echter niet voor om (blind) deze 3 PPI’s hoger te doseren, omdat daaraan nadelen kleven en er betere alternatieven zijn. Het nadeel van het blind hoger PPI-doseren is dat er hogere doseringen dan geregistreerd worden voorgeschreven en dat bij 25-35% van de patiënten (namelijk de PM + IM) de PPI onnodig te hoog gedoseerd wordt, met het risico op bijwerkingen.
- Het alternatief om voorafgaand aan een H. pylori-eradicatiebehandeling een farmacogenetisch profiel te bepalen en naar aanleiding van de uitslag de verschillende PPI’s te doseren volgens het KNMP-advies, vindt de werkgroep evenmin een goede optie. Nadelen zijn dat het onderzoek tijd kost, bewerkelijk is voor de huisarts, een extra belasting vormt voor de patiënt en extra kosten met zich meebrengt. Bovendien is dit nieuw beleid voor de huisarts, die relatief onbekend is met het aanvragen van farmacogenetisch laboratoriumonderzoek.
- De werkgroep heeft een voorkeur om esomeprazol te adviseren bij een eradicatiebehandeling, omdat bij esomeprazol en rabeprazol geen effect van CYP2C19-variaties op het eradicatiepercentage wordt gevonden. Esomeprazol is goedkoper dan rabeprazol en valt binnen de selectie van PPI’s voor de indicatie ‘behandeling van maagklachten’ (zie detail Keuze van PPI bij zuurremming). Daarmee worden de nadelen van het bepalen van een farmacogenetisch profiel en de nadelen van blind hoger doseren van de gangbare PPI’s bij een H. pylori-eradicatiebehandeling omzeild.
- Dit beleid sluit aan bij het beleid in de tweede lijn.
- Bij andere indicaties dan een eradicatiebehandeling blijft omeprazol de PPI van eerste keus, omdat omeprazol goedkoper is (zie detail Keuze van PPI bij zuurremming).
Conclusies
Geef bij een eradicatiebehandeling esomeprazol als PPI.
Overwegingen bij PPI-gebruik na een eradicatiebehandeling
Direct na een H. pylori-eradicatiebehandeling bestaan vaak nog maagklachten, waarvoor medicatie nodig is. Het belangrijkste argument voor de beleidskeuze om na een H. pylori-eradicatiebehandeling een vaste periode van 4 weken een PPI te geven is dat het beleid bij maagklachten bedoeld is als ‘trechter’, waarbij H. pylori-positieve patiënten en ulcuslijders eruit worden gefilterd. Adequate behandeling van een ulcus bestaat uit 4 weken een PPI.
De kans dat deze 4 weken PPI-gebruik na een H. pylori-eradicatiebehandeling leidt tot onterecht chronisch PPI-gebruik wordt klein geacht, omdat enerzijds het aantal H. pylori-eradicatiekuren in een huisartsenpraktijk niet erg groot is, en anderzijds stoppen met een PPI na een eradicatiebehandeling goed mogelijk wordt geacht door de patiënt daarover vooraf duidelijk te informeren. De kleine kans op onnodig chronisch PPI-gebruik is onvoldoende reden om de meest effectieve medicatie voor behandeling van een (mogelijk) ulcus pepticum niet te geven.
Keuze van PPI tijdens de 4 weken na een eradicatiebehandeling
In principe zou elk PPI gekozen kunnen worden. De keus voor esomeprazol wordt vooral bepaald door het pragmatische argument dat het aan de patiënt lastig uit te leggen dat er in deze ruim 5 weken 2 verschillende PPI’s worden gegeven. Daarnaast wegen de meerkosten door dubbele afleverkosten (in geval na de eerste week esomeprazol zou worden geswitcht naar het goedkopere omeprazol) niet op tegen de hogere kosten van esomeprazol.
De mate waarin H. pylori verdwijnt na een eradicatiebehandeling is afhankelijk van de resistentie van H. pylori tegen antibiotica. De keuze van antibioticum en de duur van de kuur variëren regionaal.
Resistentie tegen claritromycine en metronidazol
In 2 recente internationale richtlijnen wordt aangegeven dat de claritromycineresistentie toeneemt . Gegevens over de Nederlandse situatie zijn maar beperkt beschikbaar en van wat oudere datum.
- De Boer 2014. In een transversaal retrospectief onderzoek (biopt bij gastroscopie in 8 tweedelijns populaties, periode 1994-2012, n = 6198) lijkt de claritromycineresistentie licht toe te nemen maar < 10% te blijven, behalve in 1 onderzoek in Zaandam (20,4%). Omdat dit vaak tweedelijns (geselecteerde) populaties betrof, neemt de werkgroep aan dat de claritromycineresistentie in de eerste lijn in Nederland in die periode < 10% was. De metronidazolresistentie was 10-25% en leek in deze onderzoeken te dalen.
- Loffeld 2003a. In ander onderzoek bleek de resistentie voor claritromycine en metronidazol significant hoger bij patiënten met een migratieachtergrond uit Turkije (n = 269) of Afrika en Midden-Oosten (n = 52) dan bij patiënten zonder migratieachtergrond. Het resistentiepercentage voor claritromycine was 9,1 vs. 2,9% (p = 0,002), het resistentiepercentage voor metronidazol was 35 vs. 21% (p = 0,003).
- Debets-Ossenkopp 1999. Resistentie voor amoxicilline of tetracycline werd in een Nederlandse populatie niet gevonden.
- ISIS-AR 2020. Gegevens over resistentie van H. pylori zijn ook bekend uit het Infectieziekten Surveillance Informatie Systeem – Antibiotica Resistentie (ISIS-AR), een gezamenlijk initiatief van de Nederlandse Vereniging voor Medische Microbiologie (NVMM) en het Centrum Infectieziektebestrijding (CIb) van het RIVM. Het betreft de gegevens van 19 van de ongeveer 55 Nederlandse medische microbiologische laboratoria, die in de jaren 2010-2019 jaarlijks 381-617 isolaten onderzochten van patiënten die een gastroscopie ondergingen. De indicatie voor de resistentiebepaling is onbekend. In deze isolaten steeg de resistentie van H. pylori tegen amoxicilline van 0,9 naar 4,5%, die tegen claritromycine van 6,8 naar 39,7% en die tegen metronidazol van 14,1 naar 44,7% (ISIS-AR, geraadpleegd 2020). Het ISIS-AR-team geeft aan dat dit een overschatting zal zijn vanwege de aanzienlijke kans dat de isolaten afkomstig waren van patiënten met initieel therapiefalen, bij wie pas in tweede of derde instantie gastroscopie werd verricht. Dat de resistentie is veranderd, is echter wel waarschijnlijk omdat deze bias daarop minder invloed had.
- Malfertheiner 2007. De in-vitroresistentie van H. pylori voor metronidazol blijkt niet goed te correleren met in-vivoresultaten, zodat vooral de resistentie voor claritromycine van invloed is op het eradicatiebeleid . Uitgaand van een wenselijk eradicatiepercentage van ≥ 80% moet claritromycine niet meer gebruikt worden in triplekuren als de resistentie tegen claritromycine stijgt tot > 15-20%.
Effect van verschillende antibioticacombinaties
- Nyssen 2016. In een cochranereview (44 onderzoeken, n = 12284) werd een niet-bismutbevattende sequentiële quadrupletherapie (5 dagen amoxicilline + PPI, gevolgd door 5 dagen triplekuur) vergeleken met een triplekuur. Sequentiële therapie leek iets effectiever (82 vs. 75% in de intention-to-treatanalyse; p = 0,06; kwaliteit van bewijs redelijk), maar er bleek heterogeniteit (I²= 75%) die niet verklaard werd in subgroepanalyses, en 20 van de 44 onderzoeken toonden geen verschil. Recente onderzoeken lieten een snellere afname zien van de effectiviteit bij de sequentiële therapie (–1,72% per jaar) dan bij de triplekuur (–0,9% per jaar), zodanig dat in de meest recente onderzoeken geen verschil werd gevonden tussen een tiendaagse kuur van beide soorten.
- Leontiadis 2009. In een eerdere versie van deze standaard is een SR (5 RCT’s; n = 1128) aangehaald waaruit bleek dat bij een eradicatiebehandeling quadrupletherapie als eerste keus niet effectiever is dan tripletherapie (PPI plus claritromycine of amoxicilline plus metronidazol of tinidazol), meteradicatiepercentages van respectievelijk 79 en 80% (OR 1,00; 95%-BI 0,64 tot 1,57). Tevens bleek dat triplekuren met metronidazol en claritromycine even effectief zijn als triplekuren met amoxicilline en claritromycine: de eradicatiepercentages bedragen in beide gevallen 81% (OR 1,00; 95%-BI 0,83 tot 1,22).
Overwegingen
De Amerikaans-Canadese H. pylori-richtlijn uit 2016 stelt:
- de eerste kuur moet afhankelijk zijn van regionale antibioticaresistentie en eradicatiepercentages (statement 2).
De Europese H. pylori-richtlijn uit 2017 stelt: - PPI en claritromycine bevattende triplekuren zonder voorafgaande gevoeligheidstest zouden verlaten moeten worden bij een claritromycineresistentie > 15% (statement 3.2);
- in gebieden met een lage claritromycineresistentie wordt tripletherapie als eerstelijns empirische behandeling geadviseerd (statement 3.9);
De werkgroep heeft weinig gegevens over de resistentiegegevens in de eerste lijn in Nederland. Wat oudere onderzoeken laten zien dat de resistentie tegen claritromycine in tweedelijns populaties < 10% is, behalve in 1 onderzoek in Zaandam. Dit doet vermoeden dat de resistentie in de eerste lijn destijds veel lager lag. Recentere gegevens van het RIVM laten een duidelijke stijging zien in tweedelijnspopulaties. De werkgroep interpreteert deze gegevens, op basis van het commentaar van het ISIS-AR-team en na raadpleging van de namens de NVMM afgevaardigde arts-microbioloog, als ‘het topje van de ijsberg’ en acht deze gegevens daarom geen goede basis voor wijziging van het beleid in de eerste lijn. De werkgroep neemt aan dat de claritromycineresistentie in de eerste lijn in Nederland nog steeds < 15-20% is (uitgezonderd sommige populaties met een migratieachtergrond, bijvoorbeeld uit Turkije, Afrika of het Midden Oosten) en dat daarom een triplekuur bestaande uit amoxicilline/claritromycine/PPI nog steeds eerste keus kan blijven.
De Europese (statement 3.3) en de Amerikaans-Canadese richtlijn (statement 2) melden beide dat bij H. pylori-besmette patiënten waarschijnlijk antibioticaresistentie bestaat tegen antibiotica uit eerdere eradicatieregimes, ondanks lage regionale resistentiepercentages. Een mogelijke consequentie zou kunnen zijn om de keuze van middelen bij een H. pylori-eradicatiebehandeling te laten bepalen door anamnestisch vastgesteld eerder antibioticagebruik (vooral claritromycine). Er zijn echter geen prospectieve onderzoeken die de effectiviteit van zo’n strategie aantonen.
De werkgroep heeft overwogen om het eradicatieadvies in de standaard uit te splitsen, afhankelijk van de hoogte van het risico op claritromycineresistentie. Een hoog risico kan bestaan in bepaalde regio’s (randstad), bij mensen met een migratieachtergrond of bij patiënten met claritromycinegebruik in de voorgeschiedenis. De werkgroep heeft echter besloten te kiezen voor één eradicatieadvies en ruimte te laten aan regionale afspraken om hiervan beargumenteerd af te wijken. De overwegingen daarbij zijn dat de waarde van anamnestisch vastgesteld eerder claritromycinegebruik onduidelijk is, dat de werkgroep er niet van overtuigd is dat in het grootste deel van Nederland de claritromycineresistentie in de eerste lijn > 15% is en dat onduidelijk is waar dat wel zo is. Daarnaast zou een dergelijk gedifferentieerd advies moeilijk te implementeren zijn.
Op basis van consensus wordt bij penicillineallergie amoxicilline vervangen door metronidazol. Dit advies is voor de vorige versie van de Standaard afgestemd met de vertegenwoordiger van de NVMM.
De adviezen van de werkgroep zijn afgestemd met de vertegenwoordiger van de SWAB.
Conclusie
De eerste keus bij een eradicatiebehandeling is claritromycine 2 dd 500 mg, amoxicilline 2dd 1000 mg en een dubbele standaarddosis PPI, tenzij op basis van regionale afstemming een ander advies geldt. Bij penicillineallergie wordt amoxicilline vervangen door metronidazol.
Als alternatieve tripletherapie is ook een combinatie van een PPI met levofloxacine en amoxicilline of claritromycine mogelijk. Uit 2 meta-analyses blijkt dat de resultaten vergelijkbaar zijn met quadrupletherapie. In Nederland is geen vergelijkend onderzoek onderzoek naar het effect van levofloxacine beschikbaar. Een bekende ernstige bijwerking van levofloxacine is achillespeesruptuur (1 van 123 patiënten).
Overweging
De effectiviteit van de ‘klassieke’ tripletherapie (PPI, amoxicilline en claritromycine of PPI, amoxicilline en metronidazol) is goed. Tripletherapie met levofloxacine lijkt effectief, ook in Nederland, en wordt in de tweede lijn wel gebruikt. Er is echter in Nederland geen gerandomiseerd onderzoek in de eerste lijn gedaan waarin een betere effectiviteit dan van de ‘klassieke’ tripletherapieën wordt aangetoond. Als bijwerking van levofloxacine kan een achillespeesruptuur ontstaan.
Het is bekend dat de effectiviteit van een regime met levofloxacine aanzienlijk daalt wanneer H. pylori daartegen resistent wordt. Het NHG-beleid, afgestemd met de NVMM, is terughoudend ten opzichte van het gebruik van chinolonen om resistentieontwikkeling zoveel mogelijk te voorkomen, zodat chinolonen als ‘rescuemiddelen’ effectief blijven bij andere, meer levensbedreigende indicaties.
Conclusie
Om resistentieontwikkeling te voorkomen heeft tripletherapie met chinolonen geen plaats in de eerste lijn.
Achtergrond
- Bij de eradicatie van H. pylori wordt een eradicatiepercentage van 90% wenselijk geacht. De SWAB beveelt voor de eradicatie van H. pylori een kuur aan bestaande uit een PPI, claritromycine en amoxicilline (of metronidazol in geval van penicillineallergie) gedurende 10 tot 14 dagen (SWAB, geraadpleegd 14 september 2023).
- Het Maastricht VI/Florence consensus report van 2022 adviseert een behandelduur van 14 dagen.
- Statement 1 van de Amerikaans-Canadese H. pylori-richtlijn uit 2016 adviseert een eradicatiebehandeling van 14 dagen.
- In Nederland is bij een lage resistentie tegen claritromycine een eradicatiebehandeling van 1 week altijd gebruikelijk en effectief geweest. Bij de knelpunteninventarisatie van deze standaard gaven de SWAB en de Nederlandse Vereniging van Maag-Darm-Leverartsen (NVMDL) aan dat deze duur gezien de dalende eradicatiecijfers te kort is. De vraag is welke kuurduur in de huisartsenpraktijk aan te bevelen is.
Methoden
We hebben gebruik gemaakt van 2 SR’s, een cochranereview uit 2013 en een netwerkmeta-analyse uit 2022.
Resultaten
RCT’s: situatie 1996-2011
- Yuan 2013. Deze cochranereview includeerde RCT’s gepubliceerd tussen 1996 en 2011, afkomstig uit de gehele wereld. 17 RCT’s (n = 3271) vergeleken een zevendaagse kuur bestaande uit PPI/amoxicilline/claritromycine met een tiendaagse kuur. 34 RCT’s (n = 5801) vergeleken een zevendaagse kuur bestaande uit PPI/amoxicilline/claritromycine met een 14-daagse kuur. 2 RCT’s (n = 84) vergeleken een zevendaagse kuur bestaande uit PPI/nitromidazol/claritromycine met een tiendaagse kuur. 4 RCT’s (n = 687) vergeleken een zevendaagse kuur bestaande uit PPI/nitroimidazol/claritromycine met een 14-daagse kuur. De eradicatiepercentages zijn vermeld in tabel d9. In grote lijnen wijzen de resultaten op een eradicatiepercentage van ongeveer 75% na een kuur van 7 dagen, 80% na een kuur van 10 dagen en 83% na een kuur van 14 dagen.
| Samenstelling kuur | Kuurduur | Aantal RCT’s | Aantal eradicatie/totaal | Eradicatiepercentage |
| PPI/amoxicilline/claritromycine | 7 dagen * | 17 | 1309/1717 | 76,2% (95%-BI 74,2 tot 78,2%) |
| PPI/amoxicilline/claritromycine | 7 dagen ** | 34 | 2210/2951 | 74,9% (95%-BI 73,3 tot 76,5%) |
| PPI/amoxicilline/claritromycine | 10 dagen | 17 | 1244/1554 | 80,1% (95%-BI 78,0 tot 82,0%) |
| PPI/amoxicilline/claritromycine | 14 dagen | 34 | 2379/2850 | 83,5% (95%-BI 82,1 tot 84,8%) |
| PPI/nitromidazol/claritromycine | 7 dagen * | 2 | 60/77 | 77,9% (95%-BI 67,0 tot 86,6%) |
| PPI/nitromidazol/claritromycine | 7 dagen ** | 4 | 233/363 | 64,2% (95%-BI 59,0 tot 69,1%) |
| PPI/nitromidazol/claritromycine | 10 dagen | 2 | 56/71 | 78,9% (95%-BI 67,6 tot 87,7%) |
| PPI/nitromidazol/claritromycine | 14 dagen | 4 | 222/324 | 68,5% (95%-BI 63,2 tot 73,5%) |
| * Afkomstig uit RCT’s waarin een zevendaagse kuur werd vergeleken met een 10-daage kuur ** Afkomstig uit RCT’s waarin een zevendaagse kuur werd vergeleken met een 14-daage kuur Bron: Yuan 2013 | ||||
RCT’s: situatie 2011-2020
- Zamani 2022. Deze SR includeerde RCT’s uit de periode 2011-2020, afkomstig uit de gehele wereld. Er waren nauwelijks RCT’s die 2 kuren met dezelfde samenstelling, maar met een andere duur met elkaar vergeleken. Daarom is er een netwerkmeta-analyse uitgevoerd waarin onderzoeksarmen uit verschillende RCT’s met elkaar werden vergeleken. Daarbij konden de eradicatiepercentages worden berekend van een kuur bestaande uit PPI/amoxicilline/claritromycine gedurende 7, 10 of 14 dagen (zie tabel d10). Er waren geen onderzoeken met een kuur bestaande uit PPI/metronidazol/claritromycine.
| Kuur | Duur | Eradicatie (95%-BI ) |
|---|---|---|
| PPI/amoxicilline/claritromycine | 7 dagen | 69% (niet gerapporteerd) |
| PPI/amoxicilline/claritromycine | 10 dagen | 74,5% (70,4 tot 78%) |
| PPI/amoxicilline/claritromycine | 14 dagen | 77,3% (73,8 tot 81,4%) |
| Bron: Zamani 2022 | ||
Conclusie
In grote lijnen lijken eradicatiebehandelingen voor H. pylori met tripletherapie in de periode 2011-2020 tot 5% minder eradicatie te hebben geleid dan in de periode 1996-2011. Verder lijkt een kuur van 10 dagen te leiden tot 5% meer eradicatie dan een kuur van 7 dagen, en een kuur van 14 dagen tot nog eens 3-4% meer eradicatie.
Overwegingen
Op basis van een netwerkmeta-analyse van Zamani uit 2022 kan geen voorkeur uitgesproken worden voor behandeling van 7, 10 of 14 dagen. Bij langere kuurduur lijkt het eradicatiepercentage toe te nemen. Ook lijkt de laatste jaren het eradicatiepercentage lager te worden. Het gewenste eradicatiepercentage van 90% lijkt bij geen enkele behandeling haalbaar, behalve in combinatie met bismut. De SWAB vindt gezien de huidige eradicatiepercentages een kuur van 7 dagen te kort (ook in combinatie met een controletest). Behandelen gedurende 14 dagen, zoals aanbevolen volgens de Maastricht V/Florence-consensus van 2022, lijkt weinig extra te doen, maar zorgt er wel voor dat de patiënt meer tabletten moet slikken, het risico op bijwerkingen groter is en de kuur langer duurt, waardoor ook het risico op therapieontrouw groter is.
De werkgroep kiest ervoor de behandelduur aan te passen naar 10 dagen. Dit advies geeft een hoger eradicatiepercentage dan een behandelduur van 7 dagen en sluit aan bij de adviezen van SWAB en NVMDL.
In de vorige versie (5.1) van deze richtlijn was de aanbeveling opgenomen om na een positieve H. pylori-test na een eerste eradicatiekuur een tweede eradicatiebehandeling te geven: gedurende 14 dagen esomeprazol 2 dd 20 mg, amoxicilline 3 dd 1000 mg en metronidazol 2 dd 500 mg, met aansluitend esomeprazol gedurende 4 weken.
Op deze aanbeveling is bij de huidige beperkte herziening van deze richtlijn (versie 5.2) vanuit diverse partijen commentaar gekomen. Gezien de toegenomen resistentie van H. pylori voor deze behandeling zou de effectiviteit onvoldoende zijn. Dat de effectiviteit van de tweede eradicatiebehandeling afneemt, is in lijn met de afnemende effectiviteit van de eerste eradicatiebehandeling (zie ook detail Effectiviteit van de samenstelling van de eerste eradicatiebehandeling en detail Effectiviteit van de duur van de eerste eradicatiebehandeling). Daarbij komt dat er in de resistentieontwikkeling in Nederland regionale verschillen gezien worden waaraan de behandeling zou moeten worden aangepast. Verder komt uit het commentaar naar voren dat een kuur met bismut de voorkeur zou hebben. Bismut wordt internationaal gebruikt (en in het verleden ook in Nederland), maar is niet meer geregistreerd in Nederland. Bismut kan sinds oktober 2023 middels een generieke toestemming geïmporteerd worden (met een artsenverklaring).
De NHG-Werkwijze Keuze geneesmiddelen geeft aan dat niet geregistreerde geneesmiddelen in principe afvallen bij inventarisatie van de beschikbare middelen. In het licht van de toenemende antibioticaresistentie is het wenselijk dat bismut weer gebruikt kan worden in de H. pylori-eradicatiebehandeling. Het ontbreken van een registratie in Nederland en het voorschrijven met een artsenverklaring maken echter dat bismut op dit moment geen eerstelijns behandeling is.
De werkgroep heeft het commentaar besproken en besloten te adviseren om bij een positieve H. pylori-test na de eerste eradicatiebehandeling te overleggen met een arts-microbioloog en/of mdl-arts, of de regionale samenwerkingsafspraken te volgen in verband met relevante regionale verschillen in resistentiepatroon. Een argument om te overleggen is ook dat een tweede eradicatiebehandeling weinig voorkomt en de gemiddelde huisarts er zelden mee geconfronteerd zal worden. In de tweede lijn is meer ervaring met een tweede eradicatiebehandeling (inclusief het gebruik van bismut) en met de diagnostiek (resistentiebepaling voorafgaand aan de (tweede) kuur).
Beleid na gastroduodenoscopie
Naar Samenvatting ›- Bevindingen zoals niet-erosieve bulbitis of duodenitis, niet-erosieve gastritis, hiatushernia (hernia diaphragmatica), gastro-oesofageale prolaps of insufficiënte gastro-oesofageale overgang vormen geen verklaring voor de klachten en hebben geen consequenties voor het beleid.
- Overleg met een mdl-arts bij gastroscopische diagnoses zoals achalasie, oesofagusvarices, candida-oesofagitis, poliepen, benigne tumoren, divertikels, hypertrofische gastropathie (ziekte van Ménétrier) en corpus alienum.
Oesofagitis
Naar Samenvatting ›- Refluxoesofagitis: refluxklachten en bij gastroscopie aangetoonde slijmvliesbeschadiging aan de oesofagus.
- De ernst van de klachten correspondeert niet altijd met de ernst van de oesofagitis.
- Bij refluxoesofagitis met endoscopisch graad A of B:
- start een PPI in standaarddosering (zie tabel h1).
- geef bij onvoldoende effect na 2 weken 2 dd de standaarddosering.
- behandel gedurende 8 weken
- probeer daarna de PPI te stoppen (zie Afbouwschema).
- indien er klachten blijven bestaan: geef zuurremming op geleide van de klachten, probeer uit te komen met een antacidum of mucosaprotectivum, zie het Stroomschema Beleid bij een eerste episode van maagklachten (figuur h1).
- Bij oesofagitis met endoscopisch graad C of D:
- geef levenslang een onderhoudsbehandeling met esomeprazol (eerste keus) of rabeprazol in standaarddosering (zie Indicaties voor chronisch PPI-gebruik)
- overleg met de mdl-arts over een controlegastroduodenoscopie na 8-12 weken en over de verdere controles
- Bij barrettoesofagus of eosinofiele oesofagitis: volg het advies van de mdl-arts.
De Los Angeles Classification van oesofagitis is als volgt.
- Graad A: ≥ 1 korte laesies < 5 mm, die zich niet uitbreiden tussen de toppen van de mucosale (slijmvlies)plooien.
- Graad B: ≥ 1 benigne laesies > 5 mm, gecentreerd op de plooien, die zich niet uitbreiden tussen de toppen van de mucosale plooien.
- Graad C: ≥ 1 laesies met uitbreiding van de erosies tussen de toppen van ≥ 2 mucosale plooien, maar waarbij < 75% van de omtrek is betrokken.
- Graad D: ≥ 1 mucosale laesies met bijna circumferente uitbreiding (> 75% van de omtrek) of ontwikkeling van een zogenaamde barrettoesofagus.
In een review (zoekdatum juli 2007) bleek volgens de GRADE-systematiek dat PPI’s effectiever zijn dan H2-antagonisten, zowel bij de initiële behandeling als ook bij de onderhoudsbehandeling van oesofagitis. Zowel H2-antagonisten als PPI zijn effectiever dan placebo.
Initiële behandeling
De review vond 1 meta-analyse (zoekdatum 2004, 34 RCT’s, n = 5887) naar de behandeling van patiënten met een oesofagitis waarin PPI’s worden vergeleken met H2-antagonisten (27 RCT’s) of met H2-antagonisten plus prokinetica (de H2-antagonistgroep) (7 RCT’s). In de PPI-groep daalde het aantal patiënten met gastroscopisch vastgestelde oesofagitis na 4 weken tot 32 versus 62% in de H2-antagonistgroep (26 RCT’s; n = 4032; RR 0,50; 95%-BI 0,45 tot 0,56) en na 12 weken tot respectievelijk 23 versus 54% (3 RCT’s; n = 393; RR 0,44; 95%-BI 0,26 tot 0,63). Ook het aantal patiënten met persisterende refluxklachten was significant lager in de PPI-groep: na 4 weken 35 versus 58% (15 RCT’s; n = 2941; RR 0,57; 95%-BI 0,48 tot 0,68) en na 8 weken 32 versus 55% (3 RCT’s; n = 898; RR 0,56; 95%-BI 0,40 tot 0,77). Er bestond statistisch significante heterogeniteit tussen de onderzoeksresultaten.
Onderhoudsbehandeling
De review vond 1 systematische review en 1 later gepubliceerde RCT waarin PPI’s werden vergeleken met H2-antagonisten bij patiënten met een geheelde oesofagitis. Daarbij werden PPI’s in standaarddosis (1 dd omeprazol 20 mg, lansoprazol 30 mg, rabeprazol 20 mg of pantoprazol 40 mg) of in lage dosis (1 dd de helft van de standaarddosis) vergeleken met H2-antagonisten. Na 6-12 maanden zag men bij een standaarddosis PPI een sterkere daling van het aantal recidieven van oesofagitis (10 RCT’s; n = 1583; 22 vs. 58%; RR 0,36; 95%-BI 0,28 tot 0,46) en van het aantal recidieven van refluxklachten (5 RCT’s; n = 797, 22 vs. 44%; RR 0,48; 95%-BI 0,39 tot 0,60). Ook bij een lage dosis PPI’s was de afname van recidieven na 6-12 maanden groter dan bij H2-antagonisten, zowel van oesofagitis (6 RCT’s; n = 1156; 39 vs. 66%; RR 0,57; 95%-BI 0,47 tot 0,69) als van refluxklachten (4 RCT’s; n = 831; 31 vs. 57%; RR 0,55; 95%-BI 0,47 tot 0,65).
In de later gepubliceerde RCT bij patiënten met een geheelde oesofagitis (n = 350) bleek pantoprazol 1 dd 40 mg effectiever dan ranitidine 2 dd 150 mg (p < 0,001) ter voorkoming van recidieven. Dit gold ook voor pantoprazol 1 dd 20 mg (p < 0,001), maar niet voor pantoprazol 1 dd 10 mg. Het percentage patiënten zonder recidief na 12 maanden was bij pantoprazol respectievelijk 78, 55 en 46%, en bij ranitidine 21%.
Conclusie
Er is consistent bewijs dat PPI’s bij een endoscopisch aangetoonde oesofagitis zowel in standaarddosering als in een lagere dosis effectiever zijn dan H2-antagonisten.
Barrettoesofagus is een aandoening van de distale slokdarm waarbij strictuurvorming kan optreden en het normale plaveiselcelepitheel deels vervangen is door cilinderepitheel met soms intestinale metaplasie, wat alleen in biopten te herkennen is. Barrettoesofagus is geassocieerd met gastro-oesofageale reflux en met de ontwikkeling van adenocarcinoom.
Progressie naar slokdarmcarcinoom
Het nut van regelmatige gastroscopische controle van een patiënt met een aangetoonde barrettoesofagus in de tweede lijn (barrettsurveillance) staat ter discussie omdat er geen overtuigend wetenschappelijk bewijs is dat dit de overleving van deze patiënten verlengt. Het nemen van de juiste biopten en het betrouwbaar beoordelen daarvan is lastig. Bovendien is de geschatte incidentie van hooggradige dysplasie en vroegcarcinomen in de barrettoesofagus laag; deze werd in 2007 geschat op respectievelijk 0,9 en 0,5% per jaar.
In een recent observationeel onderzoek werden tijdens de follow-up van gemiddeld 5,2 jaar bij 11.028 Barrettpatiënten (gemiddelde leeftijd 68 jaar) 197 slokdarmcarcinomen gevonden, tegenover 2602 slokdarmcarcinomen in de algemene bevolking (5,4 miljoen Denen). De uit de barrettoesofagus voortgekomen maligniteiten vormen daarmee 7,6% van alle nieuw ontstane slokdarmcarcinomen.
Het risico op slokdarmcarcinoom van barrettpatiënten is 0,12% per jaar (95%-BI 0,09 tot 0,15), veel lager dan in 2007 werd geschat. De incidentie van adenocarcinoom bij patiënten met bij aanvang laaggradige dysplasie was 5,1 per 1000 persoonsjaren (95%-BI 3,0 tot 8,6), vergeleken met 1,0 (95%-BI 0,7 tot 1,3) bij patiënten zonder dysplasie.
Barrettsurveillance
De Richtlijn Barrett-oesofagus vermeldt over de afspraken voor barrettsurveillance met de tweede lijn dat de lengte van het aangetroffen segment barrettepitheel in de slokdarm een onafhankelijke voorspeller is voor progressie naar hooggradige dysplasie en adenocarcinoom (NVMDL, richtlijn Barrett-Oesofagus, november 2020). De richtlijn adviseert het volgende schema voor endoscopische follow-up in afwezigheid van dysplasie in een barretslokdarm:
- barrettsegmentlengte < 1 cm: geen follow-up;
- barrettsegmentlengte 1-3 cm: follow-up na 5 jaar;
- barrettsegmentlengte 3-10 cm: follow-up na 3 jaar;
- barrettsegmentlengte > 10 cm: verwijzing naar barrettexpertisecentrum.
De surveillance en behandeling van barrettpatiënten met een barrettsegmentlengte > 10 cm en van patiënten met dysplasie dient idealiter te geschieden in een centrum met specifieke barrettexpertise. De criteria waaraan een dergelijk centrum dient te voldoen en een overzicht welke centra in Nederland dit predicaat momenteel hebben, zijn in een separate aanbeveling geformuleerd (NVMDL, richtlijn Barrett-Oesofagus, november 2020.)
Conclusie
Het percentage maligniteiten bij barrettoesofagus is veel lager dan vroeger gedacht, waardoor twijfel is gerezen over het nut van barrettsurveillance. Bij bepaalde hoogrisicopatiënten is surveillance mogelijk wel zinvol. Het beleid en de controles bij patiënten met een barrettoesofagus worden bepaald door de mdl-arts in de tweede lijn.
Eosinofiele oesofagitis is een chronische ziekte die wordt gekenmerkt door de abnormale aanwezigheid van eosinofiele granulocyten in de slokdarm bij patiënten met symptomen van dysfagie of het gevoel dat vast voedsel dat blijft steken in de slokdarm (voedselimpactie). De pathofysiologie is nog niet geheel duidelijk, een allergische reactie wordt verondersteld. Het is een nieuw ziektebeeld dat in Nederland in 2005 voor het eerst werd beschreven.
De man-vrouwverhouding bij eosinofiele oesofagitis is 3: 1. De diagnose wordt meestal gesteld op de leeftijd van 20-40 jaar. Veel patiënten hebben een atopische constitutie. De prevalentie stijgt, geschat wordt dat er in 2017 in Nederland ruim 2100 patiënten waren.
De behandeling wordt ingesteld door de mdl-arts en omvat dieetmaatregelen, endoscopische dilatatie en behandeling met geneesmiddelen, waaronder PPI’s en orale en topicale glucocorticoïden.
Ulcus duodeni
Naar Samenvatting ›Geef een H. pylori-eradicatiebehandeling en controletest (zie tabel h3).
Ulcus ventriculi
Naar Samenvatting ›Verricht een H. pylori-test indien nog niet verricht (zie H. pylori-test):
- bij negatieve testuitslag: behandel gedurende 4 weken met een PPI in standaarddosering en stop daarna de PPI (zie tabel h1).
- bij positieve testuitslag: geef een H. pylori-eradicatiebehandeling (zie Beleid na positieve H. pylori-test).
- laat 8 weken na de start van een geslaagde eradicatiebehandeling altijd een controlegastroduodenoscopie verrichten om een carcinoom uit te sluiten.
Erosieve gastritis of bulbitis
Naar Samenvatting ›Verricht een H. pylori-test indien nog niet verricht (zie H. pylori-test):
- bij negatieve testuitslag: behandel gedurende 4 weken met een PPI in standaarddosering (zie tabel h1) en stop daarna de PPI-gebruik.
- bij positieve testuitslag: geef H. pylori-eradicatiebehandeling (zie Beleid na positieve H. pylori-test).
Geen verklarende bevindingen én refluxklachten
Naar Samenvatting ›- Als de dominante klacht zuurbranden en regurgitatie betreft, is reflux waarschijnlijk.
- Stem voorlichting en advies af op persoonlijke factoren (psychologische factoren, voedsel en leefstijl).
- Geef zuurremming volgens het Stroomschema Beleid bij een eerste episode van maagklachten (zie figuur h1).
- Bespreek het nut van periodieke afbouwpogingen (zie Afbouwschema).
- Bij therapieresistentie (onvoldoende resultaat bij ≥ 12 weken PPI in dubbele standaarddosis): overweeg verwijzing naar een mdl-arts voor aanvullend onderzoek.
Bewijs
In een meta-analyse (32 RCT’s, n = 9738) naar het kortetermijneffect (≤ 12 weken) van PPI’s, H2-antagonisten en prokinetica bij refluxklachten zonder endoscopische afwijkingen (ENRD) bleek het relatieve risico op remissie van zuurbranden voor PPI versus placebo 0,73 (8 RCT’s; 95%-BI 0,67 tot 0,78; NNT = 4) en voor H2-antagonisten versus placebo 0,84 (2 RCT’s; 95%-BI 0,74 tot 0,95). Het relatieve risico voor PPI versus H2-antagonisten was 0,78 (3 RCT’s; 95%-BI 0,62 tot 0,97) en voor PPI versus prokinetica 0,72 (1 RCT; 95%-BI 0,56 tot 0,92). In een andere meta-analyse naar het effect van onderhoudsbehandeling van zuurproductieremmers bij ENRD op langere termijn (12-52 weken) werd slechts 1 RCT (n = 495) gevonden. Bij omeprazol 10 mg versus placebo bleek het relatieve risico op terugval na remissie van zuurbranden 0,4 (95%-BI 0,29 tot 0,53; NNT = 3,5).
Overwegingen
Hoewel PPI’s bij ENRD effectiever zijn dan H2-antagonisten, is het advies om bij een eerste episode van maagklachten het stroomschema te volgen (antacidum gevolgd door een PPI), omdat ook minder sterke zuurremming vaak effectief is en de potentiële langetermijnbijwerkingen van PPI’s ermee worden voorkomen.
Conclusie
Er is consistent bewijs dat bij patiënten met ENRD PPI’s en H2-antagonisten effectiever zijn dan placebo en dat PPI’s effectiever zijn dan H2-antagonisten voor kortetermijnbehandeling. Er is slechts 1 RCT beschikbaar met langetermijnresultaten, waaruit blijkt dat omeprazol effectiever is dan placebo. Op grond van andere overwegingen wordt geadviseerd ook bij refluxklachten het medicamenteuze beleid bij een eerste episode te volgen (antacidum, gevolgd door een PPI).
Bewijs
Een cochranereview uit 2015 identificeert 4 RCT’s (n = 1160) waarin laparoscopische fundoplicatie werd vergeleken met PPI’s bij tweedelijns patiënten die > 6 maanden refluxklachten hadden. De patiënten konden met zuurproductieremmers behandeld worden en waren dus niet ‘therapieresistent’. Alle onderzoeken hadden een hoog biasrisico; de kwaliteit van bewijs was laag tot erg laag. Geen van de onderzoeken rapporteerde langetermijnresultaten over de algemene Health-Related Quality of Life (HRQoL) of de GORD-Specific Quality of Life (GORDQoL).
- De verschillen op de HRQoL waren niet significant: het gemiddelde verschil in standaarddeviatie tussen laparoscopische fundoplicatie en PPI was 0,14, (95%-BI -0,02 tot 0,30; n = 605) voor de periode < 1 jaar en 0,03 (95% BI -0,19 tot 0,24; n = 323) voor de periode 1-5 jaar.
- De GORDQoL was op korte termijn iets beter in de fundoplicatiegroep: het gemiddelde verschil in standaarddeviatie was 0,58 (95%-BI 0,46 tot 0,70; n = 1160) voor de periode < 1 jaar en 0,28 (95%-BI -0,27 tot 0,84; n = 994, niet significant) voor de periode 1-5 jaar.
- Ernstige bijwerkingen werden niet adequaat gerapporteerd en evenmin is duidelijk welke bijwerkingen hier volgens de onderzoekers onder vallen. De review meldt dat ernstige bijwerkingen vaker in de fundoplicatiegroep voorkwamen: bij fundoplicatie 60/331 (18,1%) en in de PPI-groep 38/306 (12,4%) (RR 1,46; 95%-BI 1,01 tot 2,11; n = 637). De review geeft op basis van andere bronnen aan dat de mortaliteit van fundoplicatie na 30 dagen geschat wordt op 0,5%.
- Dysfagie kwam op kortere termijn minder vaak voor in de fundoplicatiegroep, maar na 5 jaar verschilde dat niet meer: in het eerste jaar trad dysfagie in de fundoplicatiegroep op bij 44/331 (12,9%) en in de PPI-groep bij 11/306 (3,6%) (RR 3,58; 95%-BI 1,91 tot 6,71; n = 637). Na 1-5 jaar was dat bij respectievelijk 29/288 (10,2%) en 5/266 (1,9%) (RR 5,36; 95%- BI 2,1 tot 13,64; n = 554). Na 5 jaar was dat bij respectievelijk 25,5 en 22,8% (RR 0,9; 95%-BI 0,57 tot 1,42).
- Zuurbranden kwam minder voor in de fundoplicatiegroep: in het eerste jaar traden zuurbranden in de fundoplicatiegroep op bij 29/288 (10,0%) en in de PPI-groep bij 59/266 (22,2%) (RR 0,45; 95%-BI 0,30 tot 0,69; n = 554). Na 1-5 jaar was dat bij respectievelijk 12/288 (4,2%) en 59/266 (22,2%) (RR 0,19; 95%-BI 0,10 tot 0,34; n = 554). Na 5 jaar was dat bij de fundoplicatiegroep 46/111 (41,2%) en bij de PPI-groep 78/106 (73,6%) (RR 0,56; 95%-BI 0,44 tot 0,72; n = 217).
- Refluxklachten kwam minder voor in de fundoplicatiegroep: in het eerste jaar traden refuxklachten in de fundoplicatiegroep op bij 6/288 (2,0%) en in de PPI-groep bij 53/266 (19,9%) (RR 0,10; 95%-BI 0,05 tot 0,24; n = 554). Na 1-5 jaar was dat bij respectievelijk 6/288 (2,1%) en in de PPI-groep bij 37/266 (13,9%) (RR 0,15; 95%-BI 0,06 tot 0,35; n = 554).
Een retrospectief cohortonderzoek onderzocht 2655 volwassen Zweedse patiënten die laparoscopische refluxchirurgie vanwege GORD ondergingen (mediane follow-up 5,6 jaar).
Reflux trad op bij 17,7%, langdurige antirefluxmedicatie werd gegeven bij 83,6% en heroperatie vond plaats bij 16,4%.
Endoluminale behandeling van refluxziekte is een endoscopisch uitgevoerde antirefluxprocedure, waarbij geprobeerd wordt om de onderste slokdarmsfincter te verstevigen door middel van toepassen van radiofrequente energie, door het implanteren van volumineus materiaal of door hechttechnieken. Er zijn nog geen langetermijnresultaten bekend.
De termijn van ≥ 12 weken PPI-gebruik in maximale dosering die wordt geadviseerd alvorens te overwegen de patiënt te verwijzen, is zinvol omdat het remissiepercentage tot die tijd stijgt.
Overwegingen
Het beschikbare onderzoek betreft geen patiënten met therapieresistente vorm van refluxziekte, maar tweedelijns patiënten met refluxziekte die ook met PPI’s behandeld kunnen worden. Bij hen is een verbetering van klachten door laparoscopische fundoplicatie mogelijk, maar gezien de lage kwaliteit van bewijs en het ontbreken van verbetering op de algemene kwaliteit van leven is de vraag hoe relevant dat is.
Ook na laparoscopische fundoplicatie blijft een groep last houden van klachten (ook blijkend uit persisterend PPI-gebruik). De follow-up is kort, zodat uitspraken over langere termijn niet mogelijk zijn. Aan de ingreep zijn nadelen verbonden: behalve complicaties direct verbonden aan de chirurgische ingreep blijkt een klein percentage patiënten na operatie nieuwe klachten te kunnen ontwikkelen (dysfagie, boeren en winderigheid).
Om de diagnose therapieresistente refluxklachten te bevestigen, is verwijzing naar een mdl-arts nodig. De mdl-arts stelt de diagnose en sluit functionele klachten en aerofagie uit door (naast gastroscopie) een 24-uurs pH-meting, slokdarmmanometrie en impedantiemeting. De mdl-arts verwijst eventueel naar een chirurg.
Conclusie
Verwijs bij een vermoeden van therapieresistente refluxziekte en de vraag of operatie zinvol is, naar de mdl-arts.
Geen verklarende bevindingen én andere maagklachten dan refluxklachten
Naar Samenvatting ›Overwegingen
Naar Samenvatting ›- Als de dominante klacht een andere is dan zuurbranden of regurgitatie wordt een functionele oorzaak waarschijnlijker.
- Functionele aandoeningen worden gekarakteriseerd door:
- verwevenheid van verschillende klachten
- chronisch beloop
- therapieresistentie
- Persisteren en recidiveren van klachten en gebrek aan therapeutisch succes kunnen mede veroorzaakt worden door psychosociale of psychiatrische problemen of door onvoldoende behandeling hiervan. Met adequate behandeling zullen ook chronische functionele klachten vaker verdwijnen.
- Belangrijkste somatische en psychosociale of psychiatrische ‘rode vlaggen’ bij patiënten met chronische buikpijn:
- psychiatrische ziekte in de voorgeschiedenis
- psychiatrische ziekte in de familieanamnese
- verslaving zoals aan opioïden of alcohol (zie NHG-Standaard Problematisch alcoholgebruik)
- angst- of paniekstoornis (zie NHG-Standaard Angst)
- depressie (zie NHG-Standaard Depressie)
- andere psychopathologie
- verlies van een dierbare
- negatieve seksuele ervaringen
Niet-medicamenteus beleid bij andere klachten dan refluxklachten
Naar Samenvatting ›- Ga (opnieuw) gericht na of er sprake is van psychiatrische problematiek of psychische problemen (zie hierboven) en behandel indien mogelijk en gewenst.
- Overweeg als somatische en psychische/psychiatrische aandoeningen voldoende zijn uitgesloten een benadering zoals beschreven in de NHG-Standaard Somatisch onvoldoende verklaarde lichamelijke klachten (SOLK).
- Informeer de patiënt over het waarschijnlijk chronische beloop en de beperkte therapeutische opties.
- Overweeg verwijzing naar een psycholoog of poh-ggz bij een gemotiveerde patiënt met lang durende maagklachten die niet verklaard worden door gastroduodenoscopie of een psychiatrische stoornis. Het effect van psychologische therapie bij functionele maagklachten is niet aangetoond, maar bij sommige patiënten kan er een reden zijn om een relatie tussen psychische problematiek en klachten te veronderstellen.
De vorige versie van deze standaard beschreef een cochranereview (4 RCT’s, n = 402) waarin het effect van respectievelijk psychotherapie, cognitieve gedragstherapie, relaxatietherapie en hypnose op maagklachten bij patiënten zonder gastroscopische afwijkingen (non-ulcerdyspepsie) is onderzocht.
De gepresenteerde resultaten lieten geen meta-analyse toe. Alle afzonderlijke RCT’s suggereerden een gunstig effect na een follow-up van 1 jaar. In alle RCT’s werden statistische methoden gebruikt om baselineverschillen te corrigeren. Het effect op basis van ongecorrigeerde gegevens bleek niet significant. Er was een moeilijke werving van deelnemers en een hoge uitval. De auteurs concluderen dat er onvoldoende bewijs is dat psychologische interventies effectief zijn.
Na deze review verschenen tot 2013 nog 3 RCT’s
van zodanig lage kwaliteit dat het resultaat niet wordt beschreven. Hjelland valt af vanwege een kleine groep, tweedelijns populatie en een klein, klinisch niet-relevant effect. Cheng valt af omdat 2 vormen van therapie onderling werden vergeleken zonder placebogroep. Haag valt af vanwege 79% uitval.
De conclusie uit de vorige versie van deze standaard luidde dat er onvoldoende bewijs van goede kwaliteit is om bij geselecteerde groepen patiënten met functionele maagklachten psychologische interventies aan te bevelen.
Bewijs
In de oriënterende search bij deze revisie (over de jaren 2013-2019) werd een Amerikaans-Canadese richtlijn gevonden.
In deze richtlijn werd de vraag of psychologische therapie effectief was beantwoord door de review van Soo uit 2005 (4 RCT’s) te herzien. Er werden nog 8 onderzoeken gevonden (n = 1563). Daarom is een specifieke search nu niet gedaan.
De 12 onderzoeken toonden alle een statistisch significant effect van psychologische therapie dat meestal werd vergeleken met ‘beleid zoals gewoonlijk’. De interventies verschilden onderling en slechts 4 onderzoeken beschreven uitkomsten in de vorm van dichotome verbetering van dyspepsiesymptomen. Alle onderzoeken hadden een hoog risico op bias (geen blindering) en er bestond niet-verklaarde heterogeniteit. Daarom is de kwaliteit van bewijs zeer laag. De Amerikaans-Canadese richtlijn stelt dat aan patiënten met functionele dyspepsie die niet reageren op medicatie psychologische therapie geadviseerd kan worden.
Overwegingen
Er is onvoldoende bewijs voor het effect van psychologische interventies bij patiënten met functionele maagklachten.
Conclusie
De werkgroep herkent uit de praktijk dat bij sommige patiënten die langerdurende maagklachten hebben, bij wie gastroscopie geen verklaring vindt en bij wie ook geen omschreven psychiatrische aandoening als mogelijke oorzaak wordt gevonden (‘functionele maagklachten’) er een reden kan zijn om een relatie tussen psychische problematiek en klachten te veronderstellen. Dan kan verwijzing naar een psycholoog of POH-ggz een optie zijn. Ondanks het gebrek aan bewijs besluit de werkgroep om dit te adviseren.
In 2020 verscheen de Module Chronische buikpijn: een integrale benadering (NVVH, 2020). Deze module dient als ondersteuningsinstrument voor zorgverleners van patiënten met chronische buikpijn en biedt een structuur voor het diagnostische denkproces en de differentiaaldiagnose. De module geeft informatie over de belangrijkste somatische en psychische of psychiatrische ‘rode vlaggen’ bij patiënten met chronische buikpijn. De werkgroep acht deze psychische of psychiatrische ‘rode vlaggen’ ook relevant bij een patiënt met persisterende of recidiverende klachten wanneer met gastroscopie geen verklaring voor de klachten wordt gevonden.
Medicamenteus beleid bij andere klachten dan refluxklachten
Naar Samenvatting ›- Continueer medicatie, als deze effectief was, volgens het Stroomschema Beleid bij een eerste episode van maagklachten (zie figuur h1).
- Bespreek het nut van periodieke afbouwpogingen bij gebruik van medicatie (zie Afbouwschema).
Antidepressiva bij functionele maagklachten
Naar Samenvatting ›- Wees terughoudend met TCA’s bij functionele maagklachten, omdat het bewijs voor werkzaamheid zeer onzeker is en het werkingsmechanisme onbekend. Overweeg in overleg met de patiënt een proefbehandeling met TCA’s (off-label) alleen indien de maagklachten:
- voornamelijk functioneel geduid worden
- én blijven bestaan na het volgen van het niet-medicamenteuze beleid
- én veel last blijven geven
- én onvoldoende reageren op PPI’s
- Start met een lage dosering TCA (zie NHG-Standaard Prikkelbaredarmsyndroom (PDS), tabel 29)
- Pas zo nodig de dosering aan indien bij de patiënt een farmacogenetische variatie van CYP2D6 bekend is (volg de doseeradviezen in het HIS)
- Beoordeel na 2 weken de klachten en bijwerkingen, en verhoog zo nodig wekelijks de dosering tot de maximale dosering. Stop bij bijwerkingen die niet opwegen tegen de ervaren effectiviteit.
- Beoordeel 8 weken na start TCA nogmaals het effect:
- stop het antidepressivum bij geen of onvoldoende ervaren effect of bij bijwerkingen die niet opwegen tegen de ervaren effectiviteit
- bij ervaren effect: continueer het TCA nog maximaal 3 maanden
In vorige versies van deze standaard werd over antidepressiva bij functionele maagklachten aangegeven dat er onvoldoende onderbouwing is voor een evidencebased advies. De oriënterende zoekstrategie bij de revisie van deze standaard vond 3 meta-analyses naar het effect van psychotrope antidepressiva of anxiolytica. De meta-analyse van Hojo valt af vanwege te lage kwaliteit (Amstar 3/11). De meta-analyse van Ford (13 RCT’s, n = 1809) is van goede kwaliteit (Amstar 8/11), maar omdat deze ook antipsychotica includeert (6 RCT’s; n = 354), wordt het resultaat hier niet beschreven, evenmin als het resultaat van de subgroepanalyses naar het effect van tricyclische antidepressiva (TCA’s) en selectieve serotonineheropnameremmers (SSRI’s). Al deze onderzoeken zijn ook geïncludeerd in de meta-analyse van Lu.
Bewijs
De meta-analyse van Lu (6 RCT’s en 2 cross-overonderzoeken van gemiddeld tot hoge kwaliteit, n = 833) was van goede kwaliteit (Amstar 7/11) en vergeleek het effect van antidepressiva versus placebo bij volwassenen met functionele dyspepsie (niet beschreven is of het eerste-, tweede- of derdelijns populatie betreft). Inclusiecriteria zoals H. pylori-status, voorafgaande behandelingen, anamnestische dyspepsie en afwezigheid van depressie (slechts vastgesteld in de helft van de onderzoeken) verschilden tussen de onderzoeken. De behandelduur in de 8 onderzoeken varieerde tussen 3-12 weken. Er werd geen significant verschil in effect (wel of geen verbetering) gevonden voor de hele groep (RR 0,85; 95%-BI 0,69 tot 1,03; I2 = 55%). De heterogeniteit en ook de aanwijzing voor publicatiebias in de funnel plot verdwenen na verwijdering van 2 cross-overonderzoeken, terwijl het effect dan niet veranderde.
In een subgroepanalyse bleek echter dat TCA’s wel effectief waren (4 RCT’s, n = 309), maar SSRI’s niet (2 RCT’s). Op symptoomverbetering hadden TCA’s een voordeel boven placebo (RR 0,76; 95%-BI 0,62 tot 0,94; I2 = 0%), SSRI’s niet (RR 1,00; 95%-BI 0,86 tot 1,17; I2 = 0%).
De TCA-dagdoseringen waren amitriptyline 25 mg gedurende 8 weken, amitriptyline 25 mg gedurende 2 weken gevolgd door 50 mg gedurende 10 weken, nortriptyline 10 mg gedurende 8 weken en imipramine 25 mg gedurende 2 weken, gevolgd door 50 mg gedurende 10 weken.
Overwegingen
- Er zijn meerdere redenen om de kwaliteit van bewijs af te waarderen: niet-generaliseerbaarheid van de populatie (uit de meta-analyse van Ford, die deels dezelfde onderzoeken beschrijft als Lu, blijkt dat 5 van de 8 door Lu geïncludeerde onderzoeken tweede- en derdelijns populaties betreffen); bewijs voor effectiviteit uit subgroepanalyse met relatief kleine aantallen, waarbij soms onduidelijk is of er een depressie aanwezig was (onnauwkeurigheid); onduidelijkheid over sponsoring van individuele onderzoeken door de industrie (publicatiebias).
- De meta-analyse van Lu geeft geen informatie over de mate van effect, omdat de uitkomstmaat dichotoom is (wel of geen effect). Daardoor is een klinisch relevant oordeel over het gebruik van antidepressiva niet goed mogelijk.
- De gebruikte doses TCA zijn laag, want lager dan de defined daily dose (DDD) bij de hoofdindicatie ‘depressie’. De DDD van amitriptyline en nortriptyline is 75 mg en van imipramine 100 mg.
Conclusie
Er is geen bewijs dat SSRI’s werkzaam zijn tegen functionele maagklachten. Er is bewijs van zeer lage kwaliteit dat TCA’s effectief zijn bij patiënten met functionele maagklachten.
Van bewijs naar aanbeveling
- Na publicatie van de meta-analyse van Lu verscheen in 2018 een RCT (n = 107) naar het effect van imipramine (eerste 2 weken 25 mg, daarna 50 mg a.n.) bij H. pylori-negatieve volwassen patiënten uit Hong Kong met functionele dyspepsie die niet reageerden op behandeling met een PPI (≥ 8 weken) gevolgd door domperidon (≥ 4 weken). Na 12 weken ervoer (op een dichotome uitkomstmaat wel of niet tevreden) 63,6% in de imipraminegroep versus 36,5% in de placebogroep (p = 0,0051) voldoende symptoombestrijding. Er vielen 26 patiënten (24,3%) uit: 14 door bijwerkingen (10 in de impipraminegroep en 4 in de placebogroep), 3 door terugtrekking (placebogroep) en 9 door problemen met medicatietrouw (5 in de imipramine- en 4 in de placebogroep). Deze uitkomst is in overeenstemming met de uitkomst van de subgroepanalyse uit het onderzoek van Lu.
- TCA’s zijn niet geregistreerd voor de indicatie ‘functionele dyspepsie’, zodat dit gebruik off-label is.
- Het werkingsmechanisme bij maagklachten is onbekend. Verondersteld wordt dat TCA’s een werking kunnen hebben op het normaliseren van de maagfysiologie en bij manipulatie van pijnperceptie.
- De NICE-richtlijn adviseert geen TCA’s bij functionele dyspepsie. De gedateerde NVMDL-richtlijn Maagklachten (2004) stelt op basis van zeer beperkte evidence: ‘Het gebruik van antidepressiva bij functionele maagklachten is te overwegen indien er tevens sprake is van een stemmingsstoornis. Er dient rekening te worden gehouden met hun specifieke bijwerkingen en interacties’. De Amerikaans-Canadese richtlijn geeft aan dat TCA’s kunnen worden gebruikt bij functionele dyspepsie, maar de kwaliteit van bewijs is laag.
- De NVMDL heeft in haar commentaar op de concept-standaard aangegeven dat een behandeling met antidepressiva bij patiënten met functionele maagklachten door mdl-artsen gangbaar is. Een behandelduur van ≥ 2 en liever ≥ 3 maanden wordt dan geadviseerd. Ook wordt aangegeven dat het zeer welkom is als huisartsen deze behandeling zelf kunnen inzetten en dat verwijzing van patiënten met functionele dyspepsieklachten naar de tweede lijn vermeden moet worden.
- Effect en bijwerkingen van TCA’s zijn bij huisartsen bekend door het gebruik bij andere eerstelijns indicaties, zodat de huisarts een proefbehandeling met TCA’s bij functionele maagklachten goed kan begeleiden. Een mogelijke behandeling met TCA’s in de tweede-lijn kan hiermee soms worden voorkomen.
- Door duidelijke stopcriteria te formuleren wordt onnodig gebruik van TCA’s voorkomen.
- Hoewel het bewijs voor effectiviteit van TCA’s bij patiënten met functionele dyspepsie van zeer lage kwaliteit is, besluit de werkgroep op basis van bovenstaande overwegingen dat een proefbehandeling met TCA’s kan worden overwogen bij patiënten met persisterende maagklachten (zonder refluxklachten als dominante klacht):
- die H. pylori-negatief zijn en een normale gastroscopie hebben
- en bij wie PPI’s onvoldoende effect hebben
- en bij wie geen andere (behandelbare) psychiatrische of psychosociale problematiek bekend is
- en nadat een SOLK benadering is overwogen
- Deze behandeling dient in goed overleg met de patiënt plaats te vinden, waarbij het proefondervindelijke karakter van de behandeling, de mogelijke bijwerkingen en de stopcriteria worden besproken.
- De dosis wordt op basis van de hierboven beschreven onderzoeken beperkt tot maximaal 50 mg voor amitriptyline en (bij ouderen) maximaal 20 mg voor nortriptyline . Imipramine is sinds najaar 2023 niet meer verkrijgbaar op de Nederlandse markt. De duur van de periode om te besluiten of effect optreedt, is na overleg met de NVMDL en in aansluiting op de behandelduur in de onderzoeken gesteld op 2 maanden. Als er goed effect is, kan de behandeling 3 maanden worden volgehouden. Daarna wordt geadviseerd de medicatie te stoppen omdat het natuurlijke beloop kan fluctueren en onnodig chronisch gebruik zo wordt voorkomen. Voor het doseren van de TCA’s wordt aangesloten bij de NHG-Standaard Prikkelbaredarmsyndroom (PDS). Aangezien er geen bewijs is dat SSRI’s werkzaam zijn tegen functionele maagklachten, wordt het voorschrijven van SSRI’s afgeraden.
- Genetische varianten van CYP2D6 en CYP2C19 kunnen de plasmaconcentratie van amitriptyline en nortriptyline veranderen (voor achtergrondinformatie en plaatsbepaling van farmacogenetisch onderzoek, zie NHG-Standaard Hoofdpijn). Bij maagklachten raadt het NHG farmacogenetisch onderzoek voor start van amitriptyline en nortriptyline af, omdat de geadviseerde startdosering bij deze indicaties laag is, waardoor bij trage metaboliseerders niet meer bijwerkingen te verwachten zijn. Omdat verdere dosisverhoging geleidelijk, op geleide van effectiviteit en bijwerkingen, gebeurt, zullen bijwerkingen vanzelf blijken en is farmacogenetisch onderzoek vooraf niet bijdragend aan het beleid. Indien bij start van amitriptyline of nortriptyline een afwijkend metabolisme bekend is, is het advies om de doseeradviezen van de KNMP-werkgroep farmacogenetica te volgen. Deze adviezen zijn te vinden in de KNMP Kennisbank en in het HIS op het moment van voorschrijven, mits de farmacogenetische variatie als contra-indicatie in het HIS is vastgelegd. Voor meer informatie over farmacogenetisch onderzoek, zie NHG-Standpunt Farmacogenetisch onderzoek in de huisartspraktijk.
Prokinetica bij functionele maagklachten
Naar Samenvatting ›Domperidon heeft geen plaats als onderhoudsbehandeling. Als misselijkheid op de voorgrond staat, kan gedurende ≤ 1 week domperidon (maximaal 3 dd 10 mg) worden voorgeschreven om een moeilijke klachtenperiode te overbruggen.
- Bij nierfunctiestoornissen: verlaag de dosering naar 1-2 dd 10 mg
- Contra-indicaties: verlengde QT-tijd, hartritmestoornissen, leverfunctiestoornissen, bekende elektrolytenstoornissen (hyperkaliëmie, hypomagnesiëmie)
- Bijwerkingen: hartritmestoornissen (zelden), extrapiramidale verschijnselen (soms)
In Nederland zijn 2 prokinetica geregistreerd: metoclopramide en domperidon. Vanwege ernstige bijwerkingen geldt voor beide middelen in de officiële registratieteksten het advies kort te doseren en alleen bij strikte indicaties. Daaronder worden functionele maagklachten niet genoemd. De waarschuwing voor metoclopramide is het meest dwingend: ‘Metoclopramide maximaal 5 dagen gebruiken in verband met de kans op neurologische en andere bijwerkingen.’ Omdat metoclopramide vanwege deze beperkingen geen plaats heeft bij een chronische indicatie zoals functionele maagklachten, beperkt dit detail zich tot de gegevens over domperidon en dan alleen tot de gegevens over domperidon versus placebo.
In de vorige versie van deze standaard werd in noot 42 over medicatie bij functionele klachten aangegeven dat er beperkt bewijs is dat PPI’s, H2-antagonisten en prokinetica significant effectiever zijn dan placebo bij patiënten met endoscopisch aangetoonde non-ulcerdyspepsie. Dit gebeurde op basis van een cochranereview. Slechts 1 onderzoek was beschikbaar naar het prokineticum domperidon.
Bij de oriënterende zoekstrategie die is uitgevoerd bij de revisie van deze standaard is een cochranereview gevonden naar het effect van PPI’s
en een meta-analyse naar het effect van prokinetica.
De eindsearch vond een cochranereview over het effect van prokinetica bij functionele dyspepsie.
Bewijs
- De cochranereview van Pinto-Sanchez (23 RCT’s, n = 8759) vergeleek het effect van PPI’s ten opzichte van placebo, H2-antagonisten en prokinetica (mosapride, itopride, cisapride en DA 9701) bij patiënten met functionele dyspepsie. De auteurs concluderen dat PPI’s gedurende 2-8 weken iets effectiever zijn dan placebo (kwaliteit van bewijs matig; 16 RCT’s; n = 5968; RR 0,88; 95%-BI 0,82 tot 0,94), mogelijk iets effectiever zijn dan H2-antagonisten (kwaliteit van bewijs laag; 2 RCT’s; n = 704; RR 0,88; 95%-BI 0,74 tot 1,04 (niet significant)), en mogelijk iets effectiever zijn dan prokinetica (hoog biasrisico; 4 RCT’s; n = 892; 95%-BI 0,81 tot 1,00). Bij subgroepanalyse naar H. pylori-besmetting, land of aanwezigheid van reflux bleken geen verschillen.
- De review van Yang was van matige kwaliteit (Amstar 6/11) en vergeleek het effect van prokinetica voor behandeling van functionele dyspepsie (25 RCT’s; n = 4473) in een netwerkmeta-analyse. De review beschrijft 5 RCT’s van voor 1980 met een gebruiksduur van 2-4 weken en 1 RCT uit 1988 met een gebruiksduur van 6 weken (n = 335). Het effect werd beoordeeld op een dichotome manier (wel/niet verlichten van klachten): domperidon bleek effectiever dan placebo (OR 3,08; 95%-BI 2,28 tot 4,16).
- De cochranereview van Pittayanon bevatte 29 onderzoeken (n = 10.044) naar het effect van prokinetica (cisapride, itapride, mosapride, acotiamide, tegaserod en ABT-229). Er bleek een significant effect (RR om dyspeptische klachten te houden 0,81; 95%-BI 0,74 tot 0,89), maar de kwaliteit van bewijs was erg laag en de heterogeniteit hoog (I2 = 91%). De auteurs concluderen dat het onmogelijk is een uitspraak te doen over de effectiviteit van prokinetica vanwege de zeer lage kwaliteit van de onderzoeken.
Overwegingen
- De cochranereviews van Pinto-Sanchez en van Pittayanon betreffen geneesmiddelen die niet in Nederland verkrijgbaar zijn. De waarde van de review van Yang is beperkt omdat het oude onderzoeken, een klein aantal patiënten en een korte behandelduur betreft. Daarnaast is onduidelijk wat een OR van 3,08 betekent, omdat door de dichotome manier van effect beoordelen geen uitspraak mogelijk is over de mate van effect.
- Domperidon heeft, net als metoclopramide, ernstige bijwerkingen, waaronder ventriculaire aritmie. Daarom moet combinatie met andere medicatie die QTc-verlengend kan werken en met CYP3A4-remmende medicatie worden vermeden.
- De registratietekst van domperidon meldt als indicatie ‘verlichting van de symptomen van misselijkheid en braken’. Symptomen van functionele dyspepsie zullen meestal anders zijn. Dit in combinatie met het advies uit de registratietekst om domperidon niet > 1 week te gebruiken, betekent dat het gebruik van domperidon bij functionele dyspepsie meestal off-label zal zijn.
- Wanneer in een NHG-Standaard off-labelgebruik van een geneesmiddel geadviseerd wordt, is het gebruikelijk dat het effect daarvan op een degelijke manier is aangetoond. Voor chronisch domperidongebruik is dat niet het geval en de evidence voor kortdurend gebruik is zo beperkt dat een advies voor off-labelgebruik nauwelijks onderbouwd kan worden.
- De NVMDL heeft geen richtlijn ter zake en de NICE-richtlijn bevat geen advies. De Amerikaans-Canadese richtlijn geeft aan dat prokinetica geprobeerd kunnen worden, maar het bewijs is zeer zwak.
Conclusie
Het bewijs voor effectiviteit van domperidon bij functionele maagklachten is zeer beperkt en geldt alleen kortdurend gebruik. Off-labelgebruik gedurende langere tijd bij functionele maagklachten kan niet onderbouwd worden. Domperidon wordt daarom alleen geadviseerd voor kortdurende symptoombestrijding van misselijkheid bij functionele dyspepsie, indien geneesmiddelen uit het stroomschema niet helpen.
Consultatie en verwijzing
Naar Samenvatting ›- Verwijs direct naar een mdl-arts bij spoedeisende klachten (zie Richtlijnen spoed).
- Verwijs bij alarmsymptomen voor maligniteit (zie Anamnese) op korte termijn naar een mdl-arts voor gastroduodenoscopie in eigen beheer, of consulteer de mdl-arts bij behoefte aan diagnostische zekerheid.
- Overleg met een mdl-arts bij gastroscopische diagnoses als achalasie, oesofagusvarices, candida-oesofagitis, poliepen, benigne tumoren, divertikels, hypertrofische gastropathie (ziekte van Ménétrier) en corpus alienum.
- Verwijs in overleg met de patiënt naar een mdl-arts:
- bij therapieresistente refluxklachten (na ≥ 12 weken gebruik van de dubbele dosis PPI met onvoldoende effect) om de diagnose te bevestigen en de mogelijkheid van refluxchirurgie te bespreken
- bij een gastroscopisch aangetroffen carcinoom of barrettoesofagus
- Overweeg verwijzing naar een psycholoog of poh-ggz bij een gemotiveerde patiënt die langdurend maagklachten heeft (zonder verklaring daarvoor bij gastroduodenoscopie of door een omschreven psychiatrische aandoening) als er een relatie tussen psychische problematiek en de klachten wordt verondersteld.
- Overweeg verwijzing naar een diëtist voor patiënten met behoefte aan ondersteuning bij een dieet en/of afvallen.
- Verwijs naar een bedrijfsarts als maagklachten (mede) zijn ontstaan of in stand worden gehouden door het werk.
- Overleg met een arts-microbioloog en/of mdl-arts bij een positieve H.pylori-test na een eerste eradicatiebehandeling
Beleid bij chronisch gebruik van zuurproductieremmers
Naar Samenvatting ›Achtergronden
Naar Samenvatting ›- Chronisch gebruik van zuurproductieremmers heeft nadelen: bijwerkingen, interacties (bij comedicatie), problemen met therapietrouw (bij polyfarmacie), onnodige medicalisering, extra kosten.
- In Nederland gebruikten in 2016 > 3,1 miljoen mensen een geneesmiddel voor maagklachten; 99% van deze mensen gebruikte een PPI.
- Bij > 2,1 miljoen PPI-gebruikers ging het om chronisch gebruik (gedurende 1 jaar gemiddeld > 1 standaarddosis per dag).
- Bij veel chronische gebruikers ontbreekt een indicatie: het middel is ooit gestart ter behandeling van maagklachten, maar deze verdwijnen vaak vanzelf.
- Chronisch gebruik kan in stand worden gehouden door rebound- en placebo-effecten, en door een H. pylori-infectie als deze de oorzaak is van een behandelbare aandoening (vooral ulcus).
- De toenemende kennis over bijwerkingen is extra reden om te stoppen met een PPI als er geen goede indicatie meer is, of om de PPI te vervangen door een antacidum (heeft minder nadelen dan een PPI).
- Afbouwen blijkt succesvol bij ongeveer 70% van de chronische PPI-gebruikers zonder indicatie (30% stopt en 40% gebruikt minder PPI’s); er zijn geen patiëntkenmerken bekend die succes voorspellen.
Het aantal gebruikers in Nederland dat gedurende een kalenderjaar minstens 1 PPI-voorschrift heeft ontvangen was 1.590.000 in 2006 en 2.449.000 in 2010. Het aantal gebruikers met een voorschrift voor een H2-antagonist daalde van 257.000 in 2006 tot 174.770 in 2010. In 2010 ontving 15,5% van de 16,65 miljoen inwoners van Nederland een voorschrift voor een geneesmiddel bij maagklachten (GIPdatabank, 2012).
Het aantal chronische gebruikers, gedefinieerd als ≥ 3 voorschriften en/of ≥ 180 defined daily doses (DDD) per jaar, is bijna de helft daarvan.
Over het gebruik van antacida zijn geen betrouwbare gegevens, omdat dit zelfzorgmedicatie betreft.
In 2016 gebruikten 3,1 miljoen mensen geneesmiddelen voor maagklachten en 99% van hen gebruikte een PPI (SFK, 2020). Gegevens over handverkoop door apothekers en verkoop in drogisten zijn niet bekend. In dat jaar waren er volgens de GIP-databank 2,11 miljoen gebruikers die gemiddeld 362 DDD gebruikten (www.gipdatabank.nl, geraadpleegd 11 mei 2020). Dat zou betekenen dat er in 2016 minimaal 2,1 miljoen chronische PPI-gebruikers waren.
Voor 2018 geeft de GIP-databank aan dat het er 2.142.000 PPI-gebruikers waren, die gemiddeld 363 DDD gebruikten.
Algemeen wordt aangenomen dat het placebo-effect bij maagklachten groot is. De auteurs van een systematische review over de effecten van medicamenteuze behandeling bij functionele maagklachten bevestigen dit: zij registreerden een placeborespons van 47% bij prokinetica (19 onderzoeken, n = 3178), van 40% bij H2-antagonisten (12 onderzoeken, n = 2183) en van 25% bij PPI’s (10 onderzoeken, n = 3347). Het lagere percentage bij de PPI’s wordt mogelijk verklaard doordat de effectmaat genezing (en niet verbetering) van maagklachten was. In een RCT bij eerstelijns patiënten met een eerste episode van maagklachten (n = 484) werd gerandomiseerd naar esomeprazol 1 dd 40 mg of placebo. De respons in de placebogroep was 44% versus 68% in de PPI-groep.
Conclusie
Er is consistent bewijs voor een aanzienlijk placebo-effect bij de behandeling van maagklachten. Dit wordt geschat op ongeveer 25% bij PPI’s tot bijna 50% bij een prokineticum.
In een RCT werden 288 eerstelijns patiënten die per jaar > 180 defined daily doses PPI’s of H2-antagonisten gebruikten en bekend waren met refluxklachten of refluxziekte gedurende 4 weken overgezet op pantoprazol 1 dd 20 mg (85 uitvallers) en daarna verdeeld in een placebogroep met dagelijks placebo en als rescuemedicatie pantoprazol 20 mg (n = 141) en een controlegroep met dagelijks pantoprazol 20 mg en als rescuemedicatie placebo (n = 62). Beide groepen werden geïnstrueerd om 1 tablet per dag te gebruiken en bij inadequate symptoomcontrole de rescuemedicatie te gebruiken. De primaire uitkomstmaat was het aantal rescuetabletten per week. Secundaire uitkomstmaten waren de uiteindelijke weekdosis pantoprazol, symptoomcontrole en kwaliteit van leven. In de placebogroep stopte 19,2% van de patiënten (0-2 tabletten per week) en ging 32,6% ‘zo nodig’-gebruiken (2-6 tabletten per week). Er werd alleen gemeten in de placebogroep, omdat deze patiënten werkelijk hun PPI’s naar behoefte titreerden; de dagelijkse pantoprazolgroep werd gebruikt als controlegroep en om het onderzoek te blinderen. De symptoomcontrole en de kwaliteit van leven gerelateerd aan de gebruikte einddosis verschilde niet significant tussen beide groepen.
In dezelfde RCT bleken patiënten die hun gebruik konden verminderen op een breed scala van patiëntkenmerken niet te verschillen van patiënten die dat niet konden.
In een andere RCT werden 174 H. pylori-negatieve eerstelijns patiënten (geen gastroscopische afwijkingen) met milde refluxklachten die chronisch zuurproductieremmers gebruikten verdeeld in 2 groepen. In de ene groep werd het chronisch gebruik verminderd met steun van de huisarts (GP+), in de andere groep zonder steun van de huisarts (GP−). De gemiddelde dosis zuurproductieremmers, gemeten in equivalenten van omeprazol 1 dd 10 mg, verminderde met 71% van 2,24 tot 0,64 eenheden per dag (p < 0,05) terwijl geen of weinig antacida werden gebruikt. Afbouwen leidde tot stoppen bij 44% in GP+-groep en 35% in de GP−-groep, een niet-significant verschil. Nog eens 36% gebruikte aan het eind van de follow-upperiode < 1 eenheid per dag en 18% gebruikte 1-2 eenheden per dag. Slechts 6% verminderde het gebruik niet. Patiënten in de GP+-groep gebruikten significant minder zuurproductieremmers dan in de GP−-groep (p < 0,05). Van de deelnemers die een H2-antagonist gebruikten stopte 57%, van degenen die een PPI-gebruikten stopte 25% (p < 0,05).
Conclusie
Er is consistent bewijs dat globaal 30% van de patiënten die chronisch zuurproductieremmers gebruiken, kan stoppen en dat 40% het gebruik kan verminderen.
Aandachtspunten om onnodig chronisch gebruik te voorkomen
Naar Samenvatting ›- Onnodig chronisch gebruik van zuurproductieremmers kan worden voorkomen door een protocol waarin jaarlijks de indicatie wordt gecontroleerd aan de hand van de herhalingsreceptuur voor chronische gebruikers, en een afbouwstrategie wordt aangeboden indien de indicatie niet langer aanwezig is.
- Praktische tips:
- geef op elk nieuw PPI-recept aan of er een indicatie voor chronisch gebruik bestaat (zie Indicaties voor chronisch PPI-gebruik)
- vraag de apotheker periodiek om een uitdraai van chronische gebruikers te maken en daarop de patiënten zonder indicatie aan te geven
- vraag de apotheker om bij patiënten met een indicatie voor maagbescherming vanwege NSAID-gebruik na te gaan of het NSAID nog wordt gebruikt
- overweeg gepersonaliseerde standaard patiëntbrieven te sturen aan chronische PPI-gebruikers met de uitnodiging een afbouwpoging te ondernemen, en met informatie over de voordelen van stoppen/afbouwen en de manier waarop dat kan (apothekers kunnen een rol spelen bij de selectie van patiënten en bij het aanmaken van zulke brieven).
- overweeg de praktijkondersteuner in te schakelen bij het begeleiden van chronische PPI-gebruikers zonder indicatie die willen stoppen
Indicaties voor chronisch PPI-gebruik
Naar Samenvatting ›- Zollinger-ellisonsyndroom
- Barrettoesofagus
- Oesofagitis graad C of D
Beleid bij indicatie voor chronisch PPI-gebruik
Naar Samenvatting ›- Start bij voorkeur met esomeprazol (eerste keus) of rabeprazol.
- Indien wordt gekozen voor omeprazol, pantoprazol of lansoprazol: vraag dan voor de start farmacogenetisch onderzoek naar CYP2C19 aan.
- Voor chronisch PPI-gebruik ter preventie van maagcomplicaties door geneesmiddelgebruik, zie NHG-Behandelrichtlijn Preventie van maagcomplicaties door geneesmiddelgebruik.
- Zie ook Farmacogenetisch onderzoek.
Oorzaken van maagklachten na stoppen met een PPI
Naar Samenvatting ›- Het reboundeffect houdt in dat de oorspronkelijke klachten terugkeren na het stoppen met de zuurproductieremmer, doordat de maag dan ineens veel zuur produceert als reactie op de hoge gastrinespiegels die zijn ontstaan door een lange periode van maagzuurremming.
- Het reboundeffect is tijdelijk en kan na het staken van een PPI 2-4 weken aanhouden.
- Het reboundeffect treedt op bij ongeveer 50% van de PPI-gebruikers
- Het reboundeffect treedt na gebruik van een H2-antagonist waarschijnlijk minder vaak op en duurt korter.
- Het placebo-effect wordt geschat aanwezig te zijn bij 40% van de patiënten.
- H. pylori kan de oorzaak zijn van een aandoening die maagklachten geeft en dient daarom te worden ge-eradiceerd na het stoppen van PPI’s
Bijwerkingen bij chronisch gebruik van PPI’s en H2-antagonisten
Naar Samenvatting ›- Bijwerkingen van chronisch PPI-gebruik:
- maag-darminfecties (vooral Clostridium difficile, ook Salmonella en Campylobacter)
- kolonisatie met multiresistente bacteriën
- deficiënties van ijzer en vitamine B12
- maagcarcinoom (waarschijnlijk alleen bij H. pylori)
- fractuurrisico
- nierschade
- Al bij kortdurend PPI-gebruik is er een hoger risico op reizigersdiarree door de verminderde maagzuurbarrière.
- H2-antagonisten hebben bovengenoemde associaties niet of minder sterk.
- Enkele van de vele zeldzame bijwerkingen van PPI’s leiden tot een bijzondere waarschuwing of voorzorg:
- subacute cutane lupus erythematodes: stop de PPI
- hypomagnesiëmie: stop de PPI en suppleer magnesium
Sinds de vorige versie van deze standaard verschijnen steeds meer publicaties over bijwerkingen van PPI’s bij chronisch gebruik. Onduidelijk is of daar nieuwe bijwerkingen bij zijn en of de frequentie zo hoog is en de bijwerkingen zo ernstig blijken dat er reden is om de plaats van PPI’s te beperken. Mogelijke bijwerkingen kunnen worden onderverdeeld in:
- infecties (pneumonie, darminfecties, infecties door C. difficile, bacteriële peritonitis);
- verlaagde gehaltes van voedingsstoffen (vitamine B12, magnesium, ijzer);
- verhoogde kans op maag- en pancreascarcinoom; bij maagcarcinoom werd vroeger vooral door PPI geïnduceerde hypergastrinemie als mogelijke oorzaak verondersteld. Die zou door hyperplasie tot maagpoliepen leiden, die vervolgens tot maagcarcinoom zouden kunnen transformeren. Tegenwoordig wordt de mogelijk carcinogene rol van PPI ‘s vooral toegeschreven aan versterking van de door H. pylori geïnduceerde atrofie van het maagslijmvlies, die kan overgaan in metaplasie en daarna in een carcinoom. Hypergastrinemie wordt verondersteld een rol te spelen bij het ontstaan van pancreascarcinoom.
- andere bijwerkingen (nierschade, fractuurrisico, dementie, verhoogd cardiovasculair risico, verhoogde sterfte, maligniteiten in colon en lever).
Het reboundfenomeen wordt separaat beschreven (zie detail Reboundeffect na het staken van zuurproductieremmers).
Methode
Een brede zoekstrategie naar soort en aantal bijwerkingen van chronisch gebruik van zuurremmers of PPI's met zoekdatum vanaf 2003 tot en met 18 juli 2018 gaf 570 treffers in PubMed en 22 in PubMed/Embase. Informatie werd gevonden over de volgende bijwerkingen:
- pneumonie
- darminfecties (met name C. difficile)
- vitamine B12-deficiëntie
- hypomagnesiëmie
- maagkanker
- pancreaskanker
- leverkanker/levercarcinoom
- dikkedarmkanker
- nierschade
- fractuurrisico
- dementie
- verhoogd cardiovasculair risico (myocardinfarct en CVA)
- sterfterisico
Daarnaast werd in de eindsearch een meta-analyse gevonden over het risico van kolonisatie met multidrugresistente micro-organismen (MDRO). Na de eindsearch werd duidelijk dat er 2 goede onderzoeken waren verschenen naar het risico van ijzergebrek. De resultaten worden hierna per bijwerking apart besproken. Daarbij werd gezocht naar meta-analyses als uitgangspunt bij het beantwoorden van de vraag. Daarnaast werd onderzoek beschreven dat verscheen na de periode waarin de meta-analyse onderzoek deed. Waar gegevens beschikbaar waren over gebruik van H2-antagonisten zijn deze beschreven. De verschillende mogelijke bijwerkingen en gevonden associaties bij chronisch gebruik van PPI's en H2-antagonisten worden beschreven in de volgende details.
Overwegingen bij chronisch PPI-gebruik
- De gevonden associaties betekenen dat er een kleine kans is op een klein effect van bijwerkingen door chronisch PPI-gebruik. Deze bijwerkingen betreffen vooral maag-darminfecties (met name C. difficile-infectie), voedingsdeficiënties, maagcarcinoom, nierschade en fractuurrisico. Voor H2-antagonisten zijn deze associaties kleiner of ontbreken ze.
- Observationeel onderzoek is gevoelig voor (bekende en onbekende) vertekenende factoren (confounding) en levert daarom per definitie een zwakke kwaliteit van bewijs voor een causale relatie. In de beschreven onderzoeken kon vaak niet voor alle bekende confounders worden gecorrigeerd. De gevonden associaties in observationele onderzoeken zijn allemaal klein (OR < 3), wat de twijfel over een causale relatie versterkt. Andere criteria dan de grootte van de associatie die gebruikt worden om mogelijke causaliteit te beoordelen (de ‘hillcriteria’), zijn consistentie, specificiteit, temporaliteit, biologische gradiënt, plausibiliteit, coherentie en analogie. Bij veel van de gevonden associaties zijn veel hillcriteria niet aanwezig, leidend tot meer twijfel over de causaliteit.
- Chronisch PPI-gebruik is vanaf het eerste PPI-voorschrift aan de orde bij indicaties die altijd of langdurig aanwezig blijven en PPI-behandeling vragen, zoals preventie van maagschade, barretoesofagus, oesofagitis graad C/D en zollinger-ellisonsyndroom. In de weging die is gemaakt tussen effect en bijwerkingen van PPI-gebruik bij deze indicaties vindt de werkgroep dat de kleine kans op een klein effect de uitkomst van die weging niet verandert: PPI’s blijven geïndiceerd bij deze indicaties. PPI’s zijn bij deze indicaties zijn effectiever dan H2-antagonisten (zie NHG-Behandelrichtlijn Preventie van maagcomplicaties door geneesmiddelgebruik).
- Chronisch PPI-gebruik kan ook ontstaan bij persisterende of recidiverende klachten. Dit laatste betreft echter indicaties waarbij zuurremming in principe kortdurend (en niet chronisch of langdurend) bedoeld is. Bij kortdurend gebruik zijn langetermijneffecten niet relevant, bij chronisch PPI-gebruik neemt, mede door het toenemende aantal publicaties over deze associaties, het individueel belang toe om onnodig chronisch gebruik te voorkomen. Op populatieniveau worden de zorgen hierover groter omdat het aantal chronische PPI-gebruikers hoog is (zie detail Voorschrijfgegevens). Daarom neemt het belang van stoppogingen toe als chronisch PPI-gebruik ontstaat bij persisterende of recidiverende klachten; dit is een extra argument om het step-upbeleid te handhaven en zo te voorkomen dat PPI-gebruik chronisch wordt.
Resultaten
In de vorige versie van deze standaard werd in een meta-analyse van 8 observationele onderzoeken een zwakke associatie gevonden tussen pneumonie en gebruik van PPI’s en H2-antagonisten, met een adjusted OR van 1,27 (95%-BI 1,11 tot 1,46) respectievelijk 1,22 (95%-BI 1,09 tot 1,36).
Een belangrijke beperking was mogelijke confounding, doordat de indicatie voor het gebruik van PPI’s en H2-antagonisten vaak gastro-oesofageale refluxziekte was (met een op zichzelf al verhoogd risico op pneumonie) en het feit dat de associatie sterker was naarmate de duur van het gebruik korter was (dit strookt niet met het veronderstelde oorzakelijke mechanisme).
De zoekstrategie identificeerde 2 observationele onderzoeken na de datum van het verschijnen van deze meta-analyse.
Via de sneeuwbalmethode werd nog een meta-analyse gevonden.
- De meta-analyse van Lambert (26 onderzoeken, n = 6.351.656) was van goede kwaliteit (Amstar 8/11) en vond ook een associatie tussen PPI-gebruik en pneumonie (RR 1,49; 95%-BI 1,16 tot 1,92; I2= 99,2%). In de subgroepanalyse was PPI-gebruik < 1 maand het sterkst geassocieerd met het optreden van pneumonie (OR 2,10; 95%-BI 1,39 tot 3,16; I2= 63,3%).
- Het onderzoek van Filion was van goede kwaliteit en betrof een meta-analyse van retrospectieve cohortonderzoeken uit 8 gebieden in Canada en Engeland waarin het verschil in voorkomen van pneumonie tussen PPI- en niet-PPI-gebruikers werd onderzocht in een populatie van nieuwe gebruikers van NSAID’s > 40 jaar (n = 4.238.504). In deze populatie, die zo gekozen was om een mogelijk vertekenende invloed van de indicatie voor PPI-gebruik te minimaliseren, gebruikte 2,3% een PPI en 1,1% een H2-antagonist. Na 6 maanden gebruik bleek dat gebruik van PPI’s en H2-antagonisten niet geassocieerd was met een vergroot risico op pneumonie: de adjusted OR was respectievelijk 1,05 (95%-BI 0,89 tot 1,25; I2= 0%) en 0,95 (95%-BI 0,75 tot 1,21; I2= 0%).
- Het onderzoek van Othman was van goede kwaliteit. In een cohort van 160.000 nieuwe PPI-gebruikers in de eerste lijn was de adjusted HR 1,67 (95%-BI 1,55 tot 1,79) voor het optreden van een pneumonie, vergeleken met een gematchte controlegroep die geen PPI-gebruikte. Daarnaast werd gekeken naar de 48.451 PPI-gebruikers die ooit een pneumonie hadden gehad (self-controlled case series). De incidentieratio (pneumonie-incidentie in een observatieperiode gedeeld door de incidentie buiten die periodes) was in de periode 30 dagen na een PPI-voorschrift lager dan in de 30 dagen vóór het PPI-voorschrift, respectievelijk 1,19 (95%-BI 1,14 tot 1,25) en 1,92 (95%-BI 1,84 tot 2,00). Het bepalen van de prior event-rate ratio adjusted HR is een nieuwe methode om mogelijke confounding te onderzoeken. Daarbij wordt de HR voor pneumonie tussen PPI- en niet-PPI-gebruikers ná een PPI-voorschrift gedeeld door de HR voor pneumonie tussen PPI- en niet-PPI-gebruikers vóór een PPI-voorschrift. De prior event-rate ratio was 0,91 (95%-BI 0,83 tot 0,99). Dit betekent dat PPI-gebruikers vergeleken met niet-PPI-gebruikers een groter risico hebben op pneumonie voor het moment van een PPI-voorschrift dan daarna. De conclusie van de onderzoekers is dat de associatie tussen PPI-gebruik en pneumonie verklaard wordt door een reeds bestaand hoger risico op pneumonie bij patiënten voorafgaand aan een PPI-voorschrift.
Overwegingen
- De meta-analyses met gegevens uit observationeel onderzoek in populaties die PPI’s gebruiken vanwege maagklachten tonen een zwakke associatie tussen PPI-gebruik en pneumonie. Twijfel over een causale relatie tussen PPI-gebruik en pneumonie bestond al doordat uit subgroepanalyses van oudere meta-analyses bekend was dat de sterkste associatie tussen PPI-gebruik en pneumonie werd gevonden in de eerste periode na het starten van die PPI, waar men zou verwachten dat juist langerdurend gebruik veranderingen teweegbrengt die een verhoogd risico op pneumonie veroorzaken.
- In het onderzoek van Filion werd geen associatie gevonden tussen PPI-gebruik en pneumonie in een populatie die PPI’s gebruikte ter preventie van maagcomplicaties bij NSAID’s. Dit gegeven maakt het waarschijnlijker dat confounding by indication de oorzaak is van de associatie tussen PPI en pneumonie die werd gevonden in populaties die die PPI-gebruikten voor andere indicaties dan preventie van maagcomplicaties. Ook de bevinding in het onderzoek van Othman maakt een causaal verband tussen PPI en pneumonie onwaarschijnlijk, omdat blijkt dat patiënten die een PPI gaan gebruiken (om onopgehelderde reden) vooraf al een hoger risico op een pneumonie hebben.
Conclusie
Er is onvoldoende bewijs voor een verhoogd risico op pneumonie bij chronisch gebruik van PPI’s (of H2-antagonisten). De standaard noemt pneumonie niet als bijwerking.
Resultaten
In de vorige versie van deze standaard werd in een meta-analyse uit 2007 met alleen observationeel onderzoek een zwakke associatie tussen C. difficile-infectie en gebruik van PPI-gebruik gevonden en een zwakke associatie tussen PPI-gebruik en andere darminfecties.
Voor H2-antagonist bestond een nog zwakkere associatie.
De zoekstrategie identificeerde 3 recente meta-analyses die als uitgangspunt dienen voor het beantwoorden van de vraag of PPI-gebruik geassocieerd is met darminfecties.
- De meta-analyse van Trifan (40 patiënt-controleonderzoeken en 16 cohortonderzoeken van gemiddelde tot hoge kwaliteit, n = 356.883, 6 onderzoeken keken exclusief naar populaties buiten het ziekenhuis en 7 onderzochten gemengde eerste- en tweedelijns populaties) was van goede kwaliteit (Amstar 8/11). De onderzoekers vonden een zwakke associatie tussen PPI-gebruik en C. difficile-infecties (OR 1,99; 95%-BI 1,73 tot 2,30; I2= 85,4%). Deze associatie bleef aanwezig in de subgroepanalyse naar onderzoeksdesign (patiënt-controleonderzoek vs. cohortonderzoek; unicenter vs. multicenter; adjusted vs. unadjusted data) en leeftijd (< 65 jaar vs. > 65 jaar). Door de verschillen in onderzoeksopzet was echter onvoldoende onderzoek (multivariabele analyse) mogelijk naar vertekenende factoren, zodat de gevonden statistische heterogeniteit niet werd verklaard. Er werd geen verschil gevonden (p = 0,868) tussen in het ziekenhuis opgenomen patiënten (OR 1,95) en patiënten buiten het ziekenhuis (OR 2,10). Er waren aanwijzingen voor publicatiebias.
- De meta-analyse van Tariq (9 cohortonderzoeken van hoge kwaliteit en 7 patiënt-controleonderzoeken van matige kwaliteit, n = 7703) was van goede kwaliteit (Amstar 8/11) en vond een associatie tussen zuurproductieremmergebruik (PPI en H2-antagonist) en recidiverende C. difficile-infectie (n = 1525) (OR 1,52; 95%-BI 1,20 tot 1,94; I2= 64%). Deze associatie bleef aanwezig in subgroepanalyses naar de 9 onderzoeken die wel corrigeerden voor leeftijd en mogelijke comorbiditeit, naar aantal dagen waarbinnen het recidief optrad (< 60 dagen vs. < 90 dagen) en naar onderzoeksetting (alleen onderzoek naar gehospitaliseerde patiënten). De associatie was alleen aanwezig bij PPI- gebruikers, maar niet bij gebruikers van PPI’s en H2-antagonisten. Ook was de associatie afwezig indien het diagnosticum een PCR was (wel bij een ELISA), maar ook in deze 2 subgroepanalyses was de I2 verhoogd, zodat de heterogeniteit niet werd verklaard. Er was geen aanwijzingen voor publicatiebias.
- De meta-analyse van Hafiz (6 patiënt-controleonderzoeken, twee cohortonderzoeken en 1 nested case-control-onderzoek) was van redelijke kwaliteit (Amstar 6/11) en vond een associatie tussen PPI-gebruik en besmettelijke maagdarminfecties in de eerste lijn OR 4,84; 95%-BI 2,75 tot 9,54; I2= 85%). Een subgroepanalyse kon niet worden verricht en de heterogeniteit kon slechts gedeeltelijk worden verklaard door het type bacterie: Salmonella (OR 4,84; 95%-BI 2,75 tot 8,54; I2= 58,7%), Campylobacter (OR 5,09; 95%-BI 3,00 tot 8,64; I2= 81%) of alle bacteriën (OR 2,42; 95%-BI 0,96 tot 6,14; I2= 94,3%).
Overwegingen bij maagdarminfecties door C. difficile - De meta-analyse van Trifan beschrijft na de meta-analyse van Leonard uit 2007 nog 6 meta-analyses die alle een zwakke associatie vonden tussen PPI-gebruik en C. difficile-infectie.
- De associatie tussen PPI-gebruik en C. difficile-infectie in de meta-analyse van Tariq wordt niet gevonden in een gemengde groep die van PPI- en H2-antagonistgebruikers. Dit zou verklaard kunnen worden doordat H2-antagonistgebruikers minder risico lopen. Dit zou in overeenstemming zijn met de bevinding in de meta-analyse van Leonard waarin de associatie voor PPI-gebruik (OR 1,96; 95%-BI 1,28 tot 3,00) groter was dan voor H2-antagonistgebruik (OR 1,40; 95%-BI 0,85 tot 2,29). De meta-analyse van Trifan bevat geen gegevens over H2-antagonisten.
Overwegingen bij andere maagdarminfecties dan door C. difficile
- Alleen de meta-analyse van Hafiz keek naar andere maagdarminfecties dan door C. difficile en vond een matige associatie. Deze meta-analyse bevat geen gegevens over H2-antagonisten. De meta-analyse van Leonard vond dat de associatie tussen zuurproductieremmers en maagdarminfecties groter was voor PPI-gebruik (OR 3,33; 95%-BI 1,84 tot 6,02) dan voor H2-antagonist-gebruik (OR 2,03; 95%-BI 1,05 tot 3,92).
- Alle gevonden associaties zijn zwak en het bewijs komt alleen uit observationeel onderzoek.
Overwegingen bij alle darminfecties
Vermoed wordt dat een lage zuurgraad in de maag minder beschermt tegen ingenomen bacteriën. Echter vooral bij C. difficile is er twijfel over het oorzakelijk verband tussen PPI-gebruik en toegenomen infectiekans. De conclusie uit de vorige versie van deze standaard blijft ongewijzigd.
Conclusie
Er is zwak bewijs voor een zwak verband tussen chronisch PPI-gebruik en een verhoogde kans op besmettelijke maagdarminfecties en op C. difficile-infectie. De associatie is zwakker voor H2-antagonist-gebruik.
Resultaten
In de vorige versie van deze standaard werd kolonisatie met multidrugresistente micro-organismen (MRDO) als bijwerking niet genoemd. Er werd een meta-analyse gevonden van goede kwaliteit (Amstar 8/11).
Deze meta-analyse vond 26 observationele onderzoeken (n = 29.382, 38,9% gebruikers van zuurproductieremmers) met een mediane kwaliteit van 6 op de Newcastle-Ottawa Scale. Van de 26 onderzoeken die keken naar intestinaal dragerschap ging het in 19 onderzoeken om multidrugresistente Enterobacterales (MDR-E) en in 7 onderzoeken om vancomycineresistente enterokokken (VRE). Slechts 2 onderzoeken keken naar het optreden van (urineweg)infecties.
De primaire analyse betrof 12 onderzoeken (n = 22.305, 38,1% gebruikers van zuurproductieremmers, leeftijd meestal > 18 jaar, uit Nederland (4), België Denemarken, Duitsland, Israël, Verenigde Staten (2), Singapore en China) die risicoschattingen gaven op basis van, door gebruik van multivariabele analyse, voor confounding aangepaste resultaten. Gebruik van zuurproductieremmers was geassocieerd met MDRO-kolonisatie (OR 1,74; 95%-BI 140 tot 2,16; I2= 68%).
In de secundaire analyse van alle onderzoeken bleek gebruik van zuurproductieremmers ook geassocieerd met MDRO-kolonisatie (OR 1,70; 95%-BI 1,44 tot 1,99; I2= 54%). Sensitiviteitsanalyses toonden resultaten die consistent waren met de hier beschreven associaties; aanwijzingen voor publicatiebias werden niet gevonden. De associatie bestond met MDR-E (OR 1,60; 95%-BI 1,33 tot 1,92; I2= 54%) en met VRE (OR 1,97; 95%-BI 1,49 tot 2,60; I2= 31%). De associatie werd marginaal beïnvloed door het onderzoekstype (cohort, patiënt-controle of crosssectioneel), of de onderzoekssetting (zoals kolonisatie bij begin ziekenhuisopname (4 onderzoeken), tijdens ziekenhuisopname (11 onderzoeken) of in de eerste lijn (4 onderzoeken)). De OR voor PPI-gebruik was 1,81 (95%-BI 1,52 tot 2,16; I2= 33%, 17 onderzoeken), terwijl de OR voor H2-antagonistgebruik niet significant verhoogd was (OR 1,33; 95%-BI 0,86 tot 2,08; I2= 15%, 4 onderzoeken).
Van bewijs naar aanbeveling
- Dat zuurremming kolonisatie met MDRO’s bevordert, is aannemelijk omdat er een verminderde maagzuurbarrière bestaat bij een hogere zuurgraad en passage van meer MDRO’s de samenstelling van de intestinale flora kan beïnvloeden.
- De meta-analyses vinden een zwakke associatie tussen zuurproductieremmergebruik en kolonisatie met MDRO’s. Het gevonden bewijs is zwak omdat observationeel onderzoek ruimte laat voor mogelijk vertekenende factoren zoals geslacht, leeftijd, comorbiditeit en antibioticagebruik. De geïncludeerde onderzoeken waren heterogeen, desondanks kwamen de subgroepanalyses wel tot ongeveer dezelfde schattingen.
- De verschillen tussen PPI’s en H2-antagonisten maken aannemelijk dat het risico bij PPI’s groter is dan bij H2-antagonisten, hoewel het brede betrouwbaarheidsinterval bij de H2-antagonisten een reden is om die conclusie voorzichtig te trekken.
- De problematiek van MDRO-kolonisatie is relevant omdat daardoor het risico op extra-intestinale infecties en verspreiding van antibioticaresistentie in de populatie vergroot wordt. Gezien het grote volume aan PPI-gebruik in Nederland en de groeiende antibioticaresistentie vormt de gevonden associatie voor de werkgroep een reden deze problematiek in de hoofdtekst te noemen.
Conclusie
Er is bewijs voor een zwakke associatie tussen zuurproductieremmergebruik en kolonisatie door MDRO’s, die vooral bij chronisch PPI-gebruik consistent aanwezig is en niet bij H2-antagonisten.
Resultaten
- In de vorige versie van deze standaard was ijzerdeficiëntie niet beschreven als mogelijke bijwerking. Na de eindsearch werden 2 patiënt-controleonderzoeken gevonden.
- Het onderzoek van Tran-Duy (26.806 Engelse eerstelijns patiënten ≥ 19 jaar met een eerste diagnose ijzergebrek en evenveel op leeftijd, geslacht en behandelend huisarts gematchte controlepersonen zonder anemie) onderscheidde full users (n = 2960; PPI-gebruik ≥ 1 jaar voorafgaand aan de datum van diagnose met eventueel een periode ≤ 3 maanden zonder PPI-tussen diagnose en laatste PPI-gebruik, en met eventueel onderbrekingen ≤ 1 maand), limited users (n = 6607; ≥ 1 PPI-voorschrift in het afgelopen jaar) en non-users (n = 20.657). Full users en limited users hadden vergeleken met non-users een gecorrigeerde OR voor ijzerdeficiëntie van respectievelijk 3,60 (95%-BI 3,32 tot 3,91) en 1,51 (95%-BI 1,44 tot 1,58). Gecorrigeerd werd voor chronische ziekte, vastgesteld bloedverlies, inflammatoire darmziekte, malabsorptie en mogelijk gastro-intestinaal bloedverlies. Verder bleek er een verband tussen het risico op ijzerdeficiëntie en zowel toenemende dosis als toenemende duur van het PPI-gebruik. Niet duidelijk wordt wat de relatie is tussen ijzerdeficiëntie en anemie: de diagnose ‘ijzerdeficiëntie’ werd gesteld aan de hand van Read-codes, die ook diagnoses omvatten zonder anemie.
- Het onderzoek van Lam (77.046 patiënten > 18 jaar met een nieuwe diagnose ijzerdeficiëntie en 389.314 op leeftijd, geslacht, etniciteit, behandelcentrum en lidmaatschapsduur van de zorgverzekeraar gematchte controlepersonen zonder deze diagnose uit een Noord-Californische database van een regionale zorgleverancier) definieerde gebruik van PPI’s en H2-antagonisten als gebruik ≥ 2 jaar voorafgaand aan de datum van diagnose. Onder de patiënten en de controlepersonen waren respectievelijk 3,0% en 0,9% PPI-gebruikers, en respectievelijk 1,4% en 0,6% gebruikers van H2-antagonisten. De gecorrigeerde OR voor ijzerdeficiëntie was hoger bij PPI-gebruik (OR 2,49; 95%-BI 2,35 tot 2,64) dan bij H2-antagonisten (OR 1,58; 95%-BI 1,46 tot 1,71). Gecorrigeerd werd voor hypertensie, de enige mogelijke confounder, die de OR ≥ 10% veranderde. De associatie tussen PPI-gebruik en ijzerdeficiëntie was sterker bij hogere dagelijkse doseringen. Ook in dit onderzoek is niet duidelijk wat de relatie is tussen ijzerdeficiëntie en anemie: de diagnose ijzerdeficiëntie werd onder andere gesteld aan de hand van ICD-9-codes, waarin codes voor ijzerdeficiëntie met en zonder anemie voorkomen.
Overwegingen
- Maagzuur faciliteert de ijzeropname uit voedsel, zodat voorstelbaar is dat langdurige en sterke maagzuurremming tot ijzerdeficiëntie kan leiden. De registratieteksten van de 5 in Nederland beschikbare PPI’s noemen ijzerdeficiëntie geen van alle als mogelijke bijwerking.
- Totdat deze 2 onderzoeken verschenen, was er soms tegenstrijdig bewijs uit kleine onderzoeken die soms in niet representatieve groepen waren gedaan. De beide onderzoeken zijn van goede kwaliteit en de resultaten wijzen in dezelfde richting. De dosis-responsrelatie in beide onderzoeken, de PPI-gebruiksduurrespons in het onderzoek van Tran-Duy en de sterkere associatie met ijzergebrek van PPI’s dan van H2-antagonisten (PPI’s remmen de maagzuurproductie completer dan H2-antagonisten) in het onderzoek van Lam ondersteunen een causale relatie.
- Patiënt-controleonderzoeken vormen echter zwak bewijs omdat observationeel onderzoek ruimte laat voor vertekenende factoren. In de beide onderzoeken is daarvoor wel gecorrigeerd, maar residual confounding blijft zeer wel mogelijk.
- De klinische betekenis is ook niet geheel duidelijk, omdat beide onderzoeken niet de relatie tussen PPI-gebruik en anemie adresseren. Omdat ijzerdeficiëntie kan leiden tot anemie en gezien het grote volume aan PPI-gebruik in Nederland vormt de gevonden associatie voor de werkgroep een reden deze in de hoofdtekst te noemen.
Conclusie
Er is zwak bewijs voor een associatie tussen ijzerdeficiëntie en chronisch PPI-gebruik. De associatie tussen ijzerdeficiëntie en H2-antagonisten is kleiner en zwakker. De standaard noemt ijzerdeficiëntie als bijwerking van PPI’s.
Resultaten
In de vorige versie van deze standaard werd bij enkele subgroepen van PPI-gebruikers een zwakke associatie tussen vitamine B12-deficiëntie en chronisch PPI-gebruik beschreven, en ook dat in geen enkel onderzoek klinisch relevante gevolgen daarvan zijn beschreven.
De zoekstrategie identificeerde een patiënt-controleonderzoek
en een meta-analyse, waarin dit patiënt-controleonderzoek van Lam is meegenomen.
De meta-analyse dient als uitgangspunt voor het beantwoorden van de vraag of PPI-gebruik geassocieerd is met vitamine B12-deficiëntie.
De meta-analyse van Jung (4 patiënt-controleonderzoeken en 1 cohortonderzoek, alle van hoge kwaliteit, 4879 patiënten en 19.228 controlepersonen) was van redelijke kwaliteit (Amstar 7/11). Er bestond een associatie tussen langetermijngebruik van zuurproductieremmers en vitamine B12-deficiëntie (HR 1,83; 95%-BI 1,36 tot 2,46; I2= 37,9, publicatiebias niet ontdekt).
Overwegingen
- De associatie is zwak en het bewijs komt alleen uit observationeel onderzoek. Daarnaast is er geen bewezen oorzakelijk mechanisme tussen chronisch PPI-gebruik en vitamine B12-deficiëntie. Vermoed wordt dat er een verminderde vitamine B12-opname is door 2 oorzaken die beide het gevolg zijn van het ontbreken van zuur in de maag: het niet kunnen losmaken van vitamine B12 van eiwitten in het voedsel en bacteriële overgroei.
- Aangezien het lichaam gemiddeld voor ongeveer 4 jaar vitamine B12 in voorraad heeft, is niet te verwachten dat bij patiënten die PPI’s gebruiken, maar verder geen aanwijzing hebben voor vitaminedeficiënties, een vitamine B12-deficiëntie zal optreden < 4 jaren na de start van de PPI.
Conclusie
Er is zwak bewijs voor een zwak verband tussen chronisch PPI-gebruik en een vitamine B12-deficiëntie. Voor de aanbeveling over de controle op vitamine B12-deficiëntie, zie detail Laboratoriumcontroles bij chronisch PPI-gebruik.
Resultaten
In de vorige versie van deze standaard was hypomagnesiëmiedeficiëntie niet beschreven als mogelijke bijwerking. De zoekstrategie vond 2 meta-analyses en een prospectief onderzoek dat verscheen na deze meta-analyses. De meta-analyse van Park (Amstarscore 8/11) dient als uitgangspunt voor het beantwoorden van de vraag of PPI-gebruik geassocieerd is met hypomagnesiëmie omdat deze van betere kwaliteit is dan die van Cheungpasitporn (Amstar 4/11).
- De meta-analyse van Park (2 retrospectieve cohortonderzoeken, 6 crosssectionele onderzoeken en 1 patiënt-controleonderzoek, n = 115.455, gemiddelde kwaliteit goed) vond onder PPI-gebruikers een mediane proportie van patiënten met hypomagnesiëmie van 27,1% (spreiding 11,3 tot 55,2%) en onder niet-PPI-gebruikers 18,4% (spreiding 4,3 tot 52,7%). De gepoolde OR voor PPI-gebruik was 1,78 (95%-BI 1,08 tot 2,92; I2= 98%). Deze associatie bleef bestaan indien (waar gerapporteerd) werd gecorrigeerd voor mogelijke vertekenende factoren (OR 1,48; 95%-BI 1,10 tot 1,99; I2= 89,1%). Een subgroepanalyse verklaarde deze statistische heterogeniteit niet: er bleek geen associatie in 5 onderzoeken met alleen gehospitaliseerde patiënten, maar de statistische heterogeniteit bleef daarbij aanwezig. Een andere subgroepanalyse vond geen associatie bij 4 onderzoeken met een afkapwaarde voor hypomagnesiëmie van 1,7 mg/dl, terwijl de associatie wel bestond bij 2 onderzoeken met 1,8 mg/dl als afkapwaarde, wat impliceert dat de hypomagnesiëmie mogelijk niet zo ernstig is.
- Een prospectief vergelijkend onderzoek vergeleek de magnesiumspiegel na 1 jaar PPI-gebruik als maagbescherming bij patiënten (gemiddelde leeftijd 51 jaar) met een normale magnesiumspiegel (> 0,66 mmol/l) en zonder bekende risicofactoren voor hypomagnesiëmie die vanwege degeneratieve gewrichtsziekten een NSAID gebruikten (n = 200) met een controlegroep (n = 50). In beide groepen verschilde de magnesiumspiegel niet tussen beide meetmomenten (PPI-gebruikers 0,83 ± 0,09 vs. 0,82 ± 0,09; p = 0,367; niet-PPI-gebruikers 0,82 ± 0,09 vs. 0,82 ± 0,08; p = 0,599). Er ontwikkelden zich 6 nieuwe gevallen van hypomagnesiëmie (3,6% in de PPI- en 4,8% in de niet-PPI-groep; p = 0,724). Er is geen minimale groepsgrootte en een powerberekening gemaakt, de groepsgrootte lijkt klein en er waren 41 uitvallers.
Van bewijs naar aanbeveling
- De gevonden associatie in de meta-analyse van Park is zwak en het bewijs komt alleen uit observationeel onderzoek. Een verklarend mechanisme voor een magnesiumdeficiëntie door PPI-gebruik is niet aangetoond. De statistische heterogeniteit wordt niet verklaard in deze meta-analyse; ook gezien de brede spreiding van patiënten met hypomagnesiëmie in beide groepen veronderstelt Park dat de incidentie daarvan afhangt van de onderzoeksopzet. Er zijn dan verschillende mogelijke oorzaken voor bias te noemen, bijvoorbeeld doordat magnesiumbepalingen selectief gedaan zijn en dat dyspepsie, de reden van PPI-gebruik, mogelijk leidt tot deficiënte voedselinname. Het risico op PPI geïnduceerde hypomagnesiëmie zou door vergelijkend onderzoek moeten worden onderzocht.
- Het onderzoek van Bahtiri is zwak bewijs dat PPI-gebruik bij patiënten zonder bekende risicofactoren voor hypomagnesiëmie geen invloed heeft op de magnesiumspiegel.
- Het totale bewijs is te zwak om een betrouwbare uitspraak te doen over een mogelijk verband tussen PPI-gebruik en hypomagnesiëmie.
Conclusie
Er is geen betrouwbaar bewijs dat PPI-gebruik geassocieerd is met hypomagnesiëmie. Voor de aanbeveling over de controle op hypomagnesiëmie, zie detail Laboratoriumcontroles bij chronisch PPI-gebruik.
Resultaten
In de vorige versie van deze standaard werd maagkanker niet beschreven als mogelijke bijwerking. De zoekstrategie vond 3 meta-analyses
; na publicatie van de meest recente meta-analyse verschenen nog 2 cohortonderzoeken.
Alle meta-analyses waren van goede kwaliteit (Amstar 7/11). De meta-analyse van Islam bevat minder onderzoeken dan de andere 2 meta-analyses en valt af. De meta-analyse van Tran Duy dient als uitgangspunt voor de vraag of er een associatie is tussen PPI’s en maagkanker omdat zij van recentere datum is. Deze meta-analyse bevat echter geen gegevens over H2-antagonisten, zodat daarvoor de meta-analyse van Ahn als uitgangspunt dient.
- Het cohortonderzoek van Cheung wordt besproken omdat het aanvullende informatie bevat over het risico op maagkanker bij zowel PPI- als H2-antagonistgebruikers die voor H. pylori zijn behandeld. Het cohortonderzoek van Brusselaers wordt besproken omdat het informatie bevat over PPI-gebruik bij verschillende indicaties en over H2-antagonisten.
- De meta-analyse van Tran-Duy (2 patiënt-controleonderzoeken met in totaal 2120 patiënten en 22.991 controlepatiënten, 1 cohortonderzoek met 18.790 PPI-gebruikers) onderzocht de relatie tussen PPI-gebruik en maagcarcinoom en vond een RR van 1,43 (95%-BI 1,23 tot 1,66; I2= 0%, publicatiebias kon niet worden onderzocht door het kleine aantal onderzoeken). In een subgroepanalyse bleek dat de OR steeg bij langerdurend gebruik: 0,82 bij < 12 maanden, 3,81 bij ≥ 12 maanden en 4,02 bij > 48 maanden.
- De meta-analyse van Ahn (11 observationele onderzoeken, n = 94.558) onderzocht de relatie tussen zuurproductieremmers (H2-antagonisten en PPI’s) en maagkanker. Er was een adjusted OR van 1,42 (95%-BI 1,29 tot 1,56; I2= 48,9%). Uitgesplitst naar soort zuurproductieremmer was er voor H2-antagonisten een adjusted OR van 1,40 (95%-BI 1,24 tot 1,59; 10 onderzoeken; I2= 59,5%, niet verklaard) en voor PPI’s een OR van 1,39 (95%-BI 1,19 tot 1,64; dezelfde 3 onderzoeken als in de meta-analyse van Tran-Duy; I2= 0%). In een subgroepanalyse werd geen verschil gevonden tussen de adjusted OR voor het ontstaan van kanker na < 5 jaar of na > 5 jaar.
- Het cohortonderzoek van Cheung onderzocht het risico op maagkanker bij patiënten die voor H. pylori waren behandeld en langdurig (> 1 jaar) zuurproductieremmers gebruikten (n = 63.397, 153 patiënten met maagkanker, gemiddelde follow-up 7,6 jaren). Voor PPI-gebruik bestond een HR van 2,44 (95%-BI 1,42 tot 4,20), terwijl H2-antagonistgebruik niet was geassocieerd (HR 0,72; 95%-BI 0,48 tot 1,07). De associatie bij PPI-gebruikers werd groter naarmate het gebruik langer duurde (HR 5,04 voor ≥ 1 jaar, 6,65 voor ≥ 2 jaar en 8,34 voor ≥ 3 jaar).
- Het Zweedse cohortonderzoek van Brusselaers (n = 843.003, gemiddelde follow up 4,9 jaar) onderzocht het risico op maagkanker bij chronisch gebruik (> 180 defined daily doses (DDD) PPI of H2-antagonist gedurende de onderzoeksperiode) en vergeleek dat met het risico op maagkanker in de gehele Zweedse bevolking om een standardised incidence ratio (SIR) te berekenen. Van de PPI-gebruikers kreeg 0,28% maagkanker (SIR 3,38; 95%-BI 3,23 tot 3,53). Na uitsluiten van vroege maagkanker bleef de SIR verhoogd (SIR 1,61; 95%-BI 1,51 tot 1,71). De SIR was het hoogst voor PPI-gebruik < 1 jaar (SIR 12,82; 95%-BI 12,19 tot 13,47); significant verhoogd bij 1-3 jaar gebruik (SIR 2,19); niet-significant verhoogd bij 3-5 jaar gebruik (SIR 1,10) en zonder significant verschil bij > 5 jaren gebruik (SIR 0,61). Dit lijkt tegennatuurlijk, omdat hoe langer de PPI-invloed bestaat hoe groter het veronderstelde carcinogene effect zal zijn. De onderzoekers deden daarom een subgroepanalyse waarin patiënten met maagkanker ontstaan < 1 jaar na inclusie werden uitgesloten en vonden een stijgende SIR bij langerdurend PPI-gebruik (SIR 1,61 bij < 1 jaar gebruik en SIR 2,19 bij 1-3 jaar gebruik, geen 95%-BI beschreven). Gestratificeerd naar indicatie bleek de SIR het hoogst onder indicaties die geassocieerd zijn met maagkanker zoals H. pylori-infectie en maagulcus. De SIR was echter ook verhoogd bij indicaties die geen relatie met maagkanker hebben, zoals PPI-gebruik wegens laaggedoseerd acetylsalicylzuurgebruik (SIR 1,93; 95%-BI 1,70 tot 2,18). Gebruik van H2-antagonisten bleek niet geassocieerd met een verhoogd risico op maagkanker (SIR 0,57; 95%-BI 0,29 tot 0,99).
Van bewijs naar aanbeveling
- In beide meta-analyses en in beide aanvullende cohortonderzoeken wordt een zwakke associatie gevonden tussen PPI-gebruik en maagkanker. Het gevonden bewijs is zwak omdat observationeel onderzoek veel ruimte laat voor vertekenende factoren: hoewel voor een aantal mogelijk vertekenende factoren kon worden gecorrigeerd (zoals de indicatie voor PPI-gebruik) is dat voor andere (waaronder H. pylori-aanwezigheid, dieetfactoren, overgewicht, roken, alcoholgebruik) niet gedaan omdat gegevens hierover ontbreken.
- De gegevens over het risico van H2-antagonisten zijn tegenstrijdig; de meta-analyse van Ahn vindt wel een associatie, in tegenstelling tot de cohortonderzoeken van Cheung en Brusselaers.
- Over het verband tussen de duur van het PPI-gebruik werd in de cohortonderzoeken van Cheung en Brusselaers en in de meta-analyse van Tran-Duy gevonden dat een langere duur een hoger risico geeft. Dit zou de dosis-effectrelatie onderbouwen en daarmee een van de argumenten zijn voor een causale relatie. Er zijn echter nog te veel andere onduidelijkheden om een causale relatie aan te nemen.
Conclusie
Er is zwak bewijs voor een zwakke associatie tussen zuurproductieremmergebruik en maagkanker, die vooral bij chronisch PPI-gebruik consistent aanwezig is en niet consistent bij H2-antagonisten. Waarschijnlijk is deze associatie alleen aanwezig bij H. pylori-positieve patiënten (zie detail Relatie van H. pylori en chronisch PPI-gebruik met maagcarcinoom, waar wordt beschreven dat chronisch PPI-gebruik geassocieerd is met het ontstaan van atrofische gastritis bij H. pylori-positieve patiënten en dat een door H. pylori geïnduceerde chronische gastritis kan overgaan in maagcarcinoom).
Resultaten
De zoekstrategie vond 2 patiënt-controleonderzoeken.
- Het onderzoek van Bradley (1141 Engelse patiënten met pancreascarcinoom en 7954 gematchte controlepatiënten uit de eerste lijn, gemiddelde follow-up 10,6 jaar) vond geen verband tussen PPI-gebruik ≥ 2 jaar voor de diagnose en het risico op pancreascarcinoom (OR 1,02; 95%-BI 0,85 tot 1,22). Noch de dosis, noch de duur van het gebruik van PPI’s en H2-antagonisten was geassocieerd met een verhoogd risico. Er werden ook geen associaties met pancreascarcinoom gevonden nadat werd gecorrigeerd voor diabetes, roken, obesitas, alcoholgebruik, chronisch pancreatitis, medicatiegebruik en eerdere kankerdiagnose.
- Het onderzoek van Kearns (4113 Engelse patiënten met pancreascarcinoom en 16.072 gematchte controlepatiënten uit de eerste lijn) vond een verband tussen PPI-gebruik en pancreascarcinoom dat sterker was bij actief gebruik dat startte < 1 jaar voor de diagnose (OR 10,60; 95%-BI 9,36 tot 11,79) dan bij actief gebruik dat startte 1-2 jaar voor de diagnose (OR 3,54; 95%-BI 2,83 tot 4,43) en gebruik > 2 jaar voor de diagnose (OR 1,94; 95%-BI 1,74 tot 2,14). Deze waarden bleven ongeveer hetzelfde nadat werd gecorrigeerd voor diabetes, obesitas, alcoholgebruik en roken. De sterkere associatie met kortdurend PPI-gebruik dan met langerdurend PPI-gebruik suggereert dat de klachten van het pancreascarcinoom de oorzaak waren van het PPI-gebruik.
Overwegingen
Patiënt-controleonderzoeken zijn erg zwak bewijs en de elkaar tegensprekende resultaten in de besproken 2 patiënt-controleonderzoeken zijn onvoldoende bewijs voor het bestaan van een associatie.
Conclusie
Er is onvoldoende bewijs voor een verband tussen pancreascarcinoom en chronisch PPI-gebruik. De standaard noemt pancreascarcinoom niet als bijwerking.
Resultaten
In de vorige versie van de standaard (2013) was nierschade niet opgenomen als bijwerking. De zoekstrategie vond nu 3 meta-analyses en 2 observationele onderzoeken gepubliceerd na deze meta-analyses. De meta-analyse van Nochaiwong heeft de hoogste kwaliteit (Amstar 9/11) en dient als uitgangspunt bij het beantwoorden van de vragen.
- De meta-analyse van Nochaiwong vond 9 alleen observationele onderzoeken (vaak uit Engelse of Amerikaanse zorgverzekeringsdatabases, de gemiddelde aanvangsleeftijd was 50-66 jaar, aanvangswaarden voor nierfunctie waren onbekend, de meeste onderzoeken waren van goede kwaliteit).
- PPI-gebruik was geassocieerd (5 onderzoeken, n = 2.140.913) met een verhoogd risico op acute nierschade ten opzichte van geen PPI-gebruik (RR 1,44; 95%-BI 1,08 tot 1,91; I2= 97,6%, lage kwaliteit van bewijs). In een subgroepanalyse (1 onderzoek, n = 24.951, lage kwaliteit van bewijs) bleek het gebruik van PPI ook geassocieerd met een hoger risico ten opzichte van H2-antagonisten (RR 1,32; 95%-BI 1,17 tot 1,51).
- Het gebruik van PPI’s was, vergeleken met geen PPI-gebruik (4 onderzoeken, n = 689.953), ook geassocieerd met een verhoogd risico op chronische nierschade (RR 1,36; 95%-BI 1,07 tot 1,72; I2= 99,4%, lage kwaliteit van bewijs). In de subgroepanalyse (2 onderzoeken, n = 218.409, lage kwaliteit van bewijs) bleek het gebruik van PPI’s ook geassocieerd met een hoger risico ten opzichte van H2-antagonisten (RR 1,28; 95%-BI 1,24 tot 1,33).
Overwegingen
- Er zijn zwakke associaties gevonden tussen PPI-gebruik en verschillende vormen van nierschade. De onderzoekers geven aan dat het bewijs voor acute en chronische nierschade volgens de GRADE-systematiek laag is en voor acute interstitiële nefritis en nierfalen onvoldoende is, zodat de laatste 2 resultaten niet worden vermeld. Het mechanisme dat zou leiden tot nierschade is niet eenduidig vastgesteld.
- De ordegrootte van het effect in de meta-analyse van Nochaiwong komt overeen met de resultaten uit de meta-analyses van Yang en Islam (beide over het risico op acute nierschade) en ook met de resultaten uit de observationele onderzoeken van Hung en Klatte (beide over het risico op chronische nierziekte).
Conclusie
Er is zwak bewijs voor een zwakke associatie tussen chronisch PPI-gebruik en acute en chronische nierschade. De relatie tussen H2-antagonisten en acute en chronische nierschade is nog zwakker.
Resultaten
In de vorige versie van deze standaard werd in 2 meta-analyses uit 2011 met alleen observationeel onderzoek een zwakke associatie gevonden tussen fractuurrisico en gebruik van PPI’s.
In de meta-analyse van Yu werd dit verband niet gevonden voor H2-antagonisten (RR 1,12; 95%-BI 0,97 tot 1,30). Het ontbreken van zowel een tijdsrelatie tussen PPI-gebruik en het optreden van fracturen als een relatie tussen een stijgende dosis en optreden van meer fracturen maakt het waarschijnlijk dat vertekenende factoren de oorzaak zijn van het gevonden verband.
De zoekstrategie identificeerde 3 meta-analyses verschenen na de meta-analyse uit 2011
en 2 observationele onderzoeken verschenen na de recente meta-analyses.
De meta-analyse van Cai heeft de laagste kwaliteit (Amstar 5/11) en wordt alleen besproken voor zover het gegevens over H2-antagonistgebruik betreft (omdat de andere meta-analyses daarover geen gegevens bevatten). De meta-analyse van Islam en Zhou zijn van gelijke kwaliteit (Amstar 7/11). Omdat Zhou meer onderzoeken en meer patiënten includeerde en een subgroepanalyse beschreef, dient deze als uitgangspunt bij het beantwoorden van de vraag. Deze recente meta-analyses zijn alle gedaan omdat er nieuw prospectief observationeel onderzoek is verschenen na de meta-analyses uit 2011 (waarin 3 van de 4 cohortonderzoeken geen en 5 van de 6 patiënt-controleonderzoeken wel een associatie lieten zien).
- De meta-analyse van Zhou (18 observationele onderzoeken van redelijk tot goede kwaliteit, 244.109 fracturen en 1.006.993 controlepersonen) vond een associatie tussen PPI-gebruik en heupfracturen (RR 1,26; 95%-BI 1,16 tot 1,36; I271,9%, geen aanwijzingen voor publicatiebias). De associatie bleef bestaan indien alleen cohortonderzoek werd geanalyseerd (minder kans op bias door prospectief karakter) en het patiënt-controleonderzoek buiten beschouwing werd gelaten (RR 1,24; 95%-BI 1,06 tot 1,45; I222,7%), waarbij ook de heterogeniteit nagenoeg verdween. De associatie werd niet beïnvloed door andere mogelijk beïnvloedende factoren zoals plaats van onderzoek, geslacht of calciuminname. Evenmin werd er verschil vastgesteld tussen PPI-gebruik < 1 jaar versus > 1 jaar.
- Er was ook een associatie tussen PPI-gebruik en wervelfracturen (RR 1,58; 95%-BI 1,38 tot 1,82; I2= 2,4%, aanwijzingen voor publicatiebias) en alle fracturen (RR 1,33; 95%-BI 1,15 tot 1,54; I266,1%, geen aanwijzingen voor publicatiebias).
- De meta-analyse van Cai (18 observationele onderzoeken) vond geen associatie tussen H2-antagonistgebruik en enige fractuur, wervelfractuur of polsfractuur. Voor heupfractuur bleek een erg lage maar significante associatie (10 onderzoeken; RR 1,13; 95%-BI 1,02 tot 1,25; I2= 72,1%). Er bestond echter een hoge mate van heterogeniteit die niet verklaard werd in een subgroepanalyse: de associatie bestond alleen in cohortonderzoeken en dan niet in de Europese, maar alleen in de Amerikaanse, en niet in patiënt-controleonderzoeken.
- Het onderzoek van Harding is een retrospectief cohortonderzoek (4438 mensen > 65 jaar, gemiddelde follow-up van 6,1 jaar, 18,1% kreeg een fractuur). De adjusted HR voor het krijgen van een fractuur was bij lichte (31 tot 540 DDD tijdens follow-up) gebruikers 1,08 (95%-BI: 0,83 tot 1,40), bij gematigde (541 tot 1080 DDD) gebruikers 1,31 (95%-BI 0,86 tot 1,95) en bij zware (> 1080 DDD) gebruikers 0,95 (95%-BI 0,68 tot 1,34). Er wordt dus geen relatie gevonden tussen PPI-gebruik en fracturen.
- Het onderzoek van Paik was een prospectief cohortonderzoek (55.545 vrouwen, 547 wervelfracturen, periode 2002-2014). De adjusted RR voor een wervelfractuur was bij < 4 jaar PPI-gebruik 1,16 (95%-BI 0,90 tot 2,64), bij 4-8 jaar gebruik 1,27 (95%-BI 0,93 tot 1,73) en bij > 8 jaar gebruik 1,64 (95%-BI 1,02 tot 2,64; p = 0,01). Gebruik van H2-antagonisten was niet geassocieerd met wervelfracturen.
Overwegingen
- De meta-analyse van Zhou onderzocht alleen PPI-gebruik en niet H2-antagonist-gebruik. Deze meta-analyse laat zwakke associaties zien in dezelfde ordegrootte als de ‘oude’ meta-analyses van Ngamruengphong en Yu uit 2011. De twee observationele onderzoeken verschillen in conclusie. De bewijskracht van deze 2 onderzoeken is echter lager dan van de meta-analyses (waarin ook onderzoeken zijn opgenomen die geen associatie laten zien), zodat zij de conclusie van de meta-analyse niet veranderen.
- Nieuw is de zeer zwakke associatie tussen H2-antagonistgebruik en heupfracturen uit de meta-analyse van Cai, die niet werd gevonden in de meta-analyse van Yu uit 2011. Een mogelijke verklaring is dat de meta-analyse van Cai naast alle onderzoeken uit de meta-analyse van Yu 3 recentere observationele onderzoeken bevat. De gevonden associatie is zo zwak en de bewijskracht zo laag dat het de conclusie uit de vorige standaard niet verandert.
Conclusie
Er is zwak bewijs voor een zwakke associatie tussen chronisch PPI-gebruik en een verhoogd fractuurrisico. Dit verband is niet duidelijk voor H2-antagonisten.
Resultaten
In de vorige versie van de standaard werd dementie niet beschreven als mogelijke bijwerking. De zoekstrategie vond een meta-analyse en 5 onderzoeken verschenen na deze meta-analyse.
- De meta-analyse van Wijarnpreecha (2 prospectieve cohortonderzoeken, een patiënt-controleonderzoek en een crosssectioneel onderzoek, alle in Europa) was van goede kwaliteit (Amstar 7/11). Het risico op dementie bij PPI-gebruikers vergeleken met niet-PPI-gebruikers was niet significant verhoogd (RR 1,08; 95%-BI 0,82 tot 1,43; I299%, vanwege lage aantal onderzoeken kon publicatiebias niet worden vastgesteld). In een sensitiviteitsanalyse bleek dat de heterogeniteit verdween als alleen naar de cohortonderzoeken werd gekeken (RR 1,44; 95%-BI 1,36 tot 1,52).
- Een prospectief cohortonderzoek (70.529 Koreaanse, niet-demente personen geselecteerd uit de gezondheidsverzekeringsdatabase) vond na 6 jaar follow-up 1297 patiënten met dementie. H2-antagonistgebruik, maar niet PPI-gebruik, was geassocieerd met een hoger risico op dementie (HR 1,31; 95%-BI 1,13 tot 1,51).
- Een Koreaans onderzoek berekende de sequence ratio (SR), een methode om bijwerkingen van geneesmiddelen op te sporen. De SR wordt berekend door het aantal patiënten dat een dementiediagnose kreeg 3 jaar na de start van een PPI of H2-antagonist (de ‘causale’ groep) te delen door het aantal patiënten dat een dementiediagnose had 3 jaar vóór de start van een PPI of H2-antagonist (de ‘niet-causale’ groep). De adjusted SR voor dementie was bij PPI-gebruik (SR 1,21; 95%-BI 1,16 tot 1,27) niet hoger dan bij H2-antagonistgebruik (SR 1,91; 95%-BI 1,80 tot 2,02). De auteurs concluderen dat het risico van PPI’s mogelijk overschat wordt.
- Een prospectief cohortonderzoek (15.726 Taiwanese, niet-demente personen geselecteerd uit de gezondheidsverzekeringsdatabase die > 1 jaar werden gevolgd) vond na een gemiddelde follow-up van 9 jaar 707 patiënten met dementie. PPI-gebruik was geassocieerd met het krijgen van dementie (HR 1,22; 95%-BI 1,05 tot 1,42).
- Een Fins patiënt-controleonderzoek (70.718 nieuw gediagnosticeerde alzheimerpatiënten, 282.858 gematchte controlepatiënten) vond dat PPI-gebruik niet geassocieerd was met het risico op de ziekte van Alzheimer (adjusted OR 1,03; 95%-BI 1,00 tot 1,05). Ook was chronisch PPI-gebruik niet geassocieerd met de ziekte van Alzheimer (OR na 1-3 jaar PPI-gebruik 1,01; 95%-BI 0,97 tot 1,06; OR na ≥ 3 jaar PPI-gebruik 0,99; 95%-BI 0,94 tot 1,04). Evenmin was een hogere dosis geassocieerd met de ziekte van Alzheimer (OR bij ≥ 1,5 DDD 1,03; 95%-BI 0,92 tot 1,14).
- Een Amerikaans prospectief cohortonderzoek (3484 mensen ≥ 65 jaar zonder dementie) vond na een gemiddelde follow-up van 7,5 jaar 827 gevallen van dementie. PPI-gebruik was niet geassocieerd met dementie (p = 0,66) of de ziekte van Alzheimer (p = 0,77). Ook hogere cumulatieve doses (≤ 5 jaar dagelijks gebruik) was niet geassocieerd met het risico op dementie.
Van bewijs naar aanbeveling
- De gegevens zijn tegenstrijdig. Ook als alleen naar de gegevens uit prospectief cohortonderzoek wordt gekeken (waarvan de bewijskracht hoger is dan van patiënt-controleonderzoek en crosssectioneel onderzoek) worden tegenstrijdige resultaten gezien, immers de 2 cohortonderzoeken in de meta-analyse van Wijarnpreecha en van Tai laten wel een associatie zien, maar het cohortonderzoek van Gray niet. Indien al een associatie wordt gevonden dan is deze zeer zwak. Een oorzakelijk verband is ook niet aangetoond.
- Het bewijs is te zwak om een betrouwbare uitspraak te doen over een mogelijk verband tussen PPI-gebruik en dementie.
Conclusie
Er is geen betrouwbaar bewijs dat chronisch PPI-gebruik geassocieerd is met dementie. De standaard noemt dementie niet als bijwerking.
Resultaten
De zoekstrategie op cardiovasculair risico (myocardinfarct en CVA) identificeerde 2 meta-analyses. De meta-analyse van Batchelor had een veel betere kwaliteit (Amstar 9/11) dan die van Shiraev (Amstar 4/11) en dient als uitgangspunt bij beantwoording van de vraag.
- De meta-analyse van Batchelor (8 RCT’s en 7 observationele onderzoeken en een retrospectieve analyse van 1 RCT waarin het PPI-gebruik als onafhankelijke factor kon worden geanalyseerd, n = 447.408) vond een hoger risico op cardiovasculaire gebeurtenissen in de gepoolde data van de observationele onderzoeken (RR 1,25; 95%-BI 1,11 tot 1,42; I2= 81%) maar niet in de gepoolde data van de RCT’s (RR 0,89; 95%-BI 0,34 tot 2,33; I2= 0%).
Van bewijs naar aanbeveling - De resultaten uit de observationele onderzoeken en de RCT’s zijn niet consistent.
- De gevonden associaties voor PPI-gebruik in de observationele onderzoeken zijn echter erg zwak en er zijn veel mogelijk vertekenende factoren (er is niet gecorrigeerd voor obesitas, dieet, alcoholconsumptie, lichaamsbeweging en familiegeschiedenis van cardiovasculaire aandoeningen, en het gebruik van laaggedoseerde salicylaten als trombocytenaggregatieremming was niet bekend). Een verklarend mechanisme voor het optreden van myocardinfarct of CVA door PPI-gebruik is niet aangetoond.
- Het resultaat uit de RCT’s is van zwaarder gewicht vanwege de betere onderzoeksopzet met betere controle op vertekenende factoren.
Conclusie
Er is onvoldoende bewijs voor een associatie tussen chronisch PPI-gebruik en myocardinfarct/CVA. De standaard noemt myocardinfarct/CVA niet als bijwerking.
Resultaten
In de vorige versie van deze standaard werd sterfte niet beschreven als mogelijke bijwerking. De zoekstrategie vond 2 onderzoeken.
- De meta-analyse van Shiraev (1 prospectief vergelijkend onderzoek en 2 retrospectieve vergelijkende onderzoeken, n = 22.427) was van matige kwaliteit (Amstar 4/11) en vond een OR van 1,68 (95%-BI 1,53 tot 1,84). Er bleek klinische heterogeniteit te bestaan tussen de verschillende onderzoeken.
- Het prospectieve cohortonderzoek (US Department of Veteran Affairs) van Xie vergeleek het sterfterisico van nieuwe PPI-gebruikers (n = 275.977) met nieuwe H2-antagonistgebruikers (n = 73.335). Daarnaast werden nog 2 secundaire cohorten gevormd: PPI-gebruikers versus niet-PPI-gebruikers (n = 3.288.092) en PPI-gebruikers versus personen zonder enige medicamenteuze zuurremming (n = 2.887.030). In de analyse werd met verscheidene statistische technieken gecorrigeerd voor meerdere mogelijk verstorende prognostische factoren. Bij het begin van het onderzoek waren PPI-gebruikers gemiddeld ouder en hadden meer comorbiditeit dan H2-antagonistgebruikers. Over een gemiddelde observatieduur van 5,7 jaar was PPI-gebruik geassocieerd met een 25% verhoogd sterfterisico ten opzichte van H2-antagonistgebruik (HR 1,25; 95%-BI 1,23 tot 1,28). Vergelijkbare uitkomsten waren er in de secundaire cohorten en bij personen zonder maag-darmziekten, ook na correctie voor de mogelijk verstorende factoren. Het sterfterisico nam toe met de duur van het PPI-gebruik. Het verband met de gebruiksduur was lineair (HR bij 1-2 jaar gebruik 1,51; 95%-BI 1,47 tot 1,56).
Van bewijs naar aanbeveling
- De gevonden associaties voor PPI-gebruik en sterfte in de meta-analyse van Shiraev en het onderzoek van Xie komen in ordegrootte overeen, maar zijn zwak. Het bewijs komt alleen uit observationeel onderzoek en er zijn veel mogelijk vertekenende factoren bekend. Een verklarend mechanisme voor het optreden van hogere sterfte is onbekend.
- Na deze zoekstrategie verscheen nog een observationeel cohortonderzoek (ook US Department of Veteran Affairs) dat sterfte vergeleek onder nieuwe PPI-gebruikers (n = 157.625) en nieuwe H2-antagonistgebruikers (n = 56.842) die deze medicatie > 90 dagen gebruikten in de 180 dagen na het eerste recept (mediane leeftijd 65 jaar). Tijdens een mediane follow-up van 10 jaar overleed 37,33% van de totale populatie (37,92% van de PPI-groep en 35,69% van de H2-antagonistgroep). Het risicoverschil bij PPI dan wel H2-antagonist was 1,06 (37,92: 35,69), kleiner dan in het onderzoek dat Xie in dezelfde database deed in 2017 (risicoverschil 1,25). De bewijskracht van dit onderzoek is erg laag, omdat het observationeel was, een zeer laag risicoverschil vond en niet voor alle bekende confounders corrigeerde, en omdat er baselineverschillen bestaan.
- Om de associatie tussen PPI’s en verschillende doodsoorzaken te schatten, simuleerden de auteurs een trial op basis van de beschikbare gegevens. De resultaten suggereren dat er per 1000 PPI-gebruikers 45,52 extra doden waren (95%-BI 28,2 tot 61,40). Uitgesplitst naar oorzaak waren de extra doden overleden aan ziekte van de tractus circulatorius (17,47; 95%-BI 5,47 tot 24,28), maligniteiten (12,94; 95%-BI 1,24 tot 24,28), parasitaire infecties (4,20; 95%-BI 1,57 tot 7,02) en urogenitale ziekten (6,25; 95%-BI 3,22 tot 9,24). Uitgesplitst naar suboorzaken bleken extra doden overleden door cardiovasculaire oorzaken (15,48; 95%-BI 5,02 tot 25,19) en chronische nierziekte (4,19; 95%-BI 1,56 tot 6,58). Een interactieanalyse gericht op de vraag of de aanwezigheid van cardiovasculaire ziekte, maag- of slokdarmmaligniteit of chronische nierziekte bij aanvang van het onderzoek de associatie veranderde, toonde geen significante interacties (deze analyse kon niet worden gedaan voor clostridiuminfecties). De via deze methode gegenereerde cijfers zijn discutabel, omdat uit observationeel onderzoek geen absoluut risico berekend kan worden. De kunstmatig berekende verschillen tussen PPI en H2-antagonistgebruikers wekken de (onterechte) indruk dat de bijwerking bestaat en misschien zelfs vaak voorkomt, terwijl op basis van dit onderzoek alleen een uitspraak kan worden gedaan over de mogelijkheid dát dit effect bestaat.
Conclusie
Er is zeer zwak bewijs voor een zwakke associatie tussen PPI-gebruik en sterfte, die hoger is dan van H2-antagonisten. Omdat de kwaliteit van bewijs zo laag is en de associatie zo zwak, is er onvoldoende reden om dit als bijwerking van PPI’s te noemen.
Resultaten
In de vorige versie van deze standaard werd ontwikkeling van maligniteiten in lever niet beschreven als mogelijke bijwerking. De zoekstrategie vond 2 onderzoeken.
- Het patiënt-controleonderzoek van Shao (29.473 Taiwanese patiënten met hepatocellulair carcinoom en 294.508 controlepatiënten, alle zonder hepatitis B of C) vond een associatie tussen leverkanker en PPI-gebruik (adjusted OR 2,86; 95%-BI 2,69 tot 3,04). Verder werd een dosis-responseffect gezien: bij patiënten die 29-180, 181-240, 241-300 en > 300 DDD van een PPI kregen, was de adjusted OR ten opzichte van 0-28 DDD respectievelijk 2,74 (95%-BI 2,57 tot 2,93), 2,98 (95%-BI 2,50 tot 3,56), 3,23 (95%-BI 2,59 tot 4,02) en 3,43 (95%-BI 2,94 tot 4,00).
- Het onderzoek van Tran omvatte 1 patiënt-controleonderzoek (434 Engelse patiënten met levercarcinoom en 2103 gematchte controlepatiënten) en 1 prospectief cohortonderzoek naar zelfgerapporteerd medicatiegebruik (182 van 475.768 deelnemers ontwikkelden leverkanker). In beide onderzoeken werd een associatie gevonden tussen PPI-gebruik en een verhoogd leverkankerrisico (adjusted OR 1,80; 95%-BI 1,34 tot 2,41; adjusted HR 1,70; 95%-BI 0,82 tot 3,53).
Overwegingen
Patiënt-controleonderzoeken zijn erg zwak bewijs. De onderzoeken kunnen onvoldoende corrigeren voor mogelijk vertekenende factoren, zodat onduidelijk is of de gevonden associaties causaal zijn.
Conclusie
Er is zeer zwak bewijs voor een zwak verband tussen levercarcinoom en chronisch PPI-gebruik. De standaard noemt levercarcinoom niet als bijwerking.
Resultaten
In de vorige versie van deze standaard werd colonmaligniteit niet beschreven als mogelijke bijwerking. De zoekstrategie vond 1 meta-analyse.
- De meta-analyse van Ahn (5 patiënt-controleonderzoeken van redelijk tot goede kwaliteit, 9.514 patiënten met coloncarcinoom en 110.577 controlepatiënten) was van goede kwaliteit (Amstar 7/11) en vond geen associatie tussen PPI-gebruik en colorectale kanker (OR 1,08; 95%-BI 0,96 tot 1,20; I2= 3,5%). Uit een sensitiviteitsanalyse waarin werd gekeken naar de methodologische kwaliteit, duur van cumulatief PPI-gebruik (> 1 jaar, > 5 jaar), NSAID-gebruik en BMI bleek ook geen associatie tussen PPI-gebruik en colorectaal carcinoom.
Overwegingen
De meta-analyse bevat alleen patiënt-controleonderzoeken, zodat het bewijs zwak is. De onderzoeken kunnen onvoldoende corrigeren voor mogelijk vertekenende factoren, zodat onduidelijk is of de gevonden associaties causaal zijn. Onduidelijk is of > 5 jaar PPI-gebruik van invloed is.
Conclusie
Er is onvoldoende bewijs dat er een verband is tussen colorectaal carcinoom en chronisch PPI-gebruik. De standaard noemt colorectaal carcinoom niet als bijwerking.
Laboratoriumcontroles bij chronisch PPI-gebruik
Naar Samenvatting ›- Standaard periodieke controle van ijzer-, vitamine B12- of magnesiumdeficiëntie wordt ontraden; deze bijwerkingen zijn zeldzaam en de (kosten)effectiviteit van controles is niet onderzocht.
- Overweeg wel laboratoriumcontrole bij een bekend risico op ijzer- of vitamine B12-deficiëntie (verminderde reserve, malabsorptie) of bij klinische verschijnselen die doen denken aan ijzer- of vitamine B12-deficiëntie.
- Laboratoriumonderzoek naar een magnesiumtekort wordt alleen aangeraden bij klinische verschijnselen van hypomagnesiëmie (ernstige polyneuropathie, obstipatieklachten, spierzwakte, duizeligheid, ritmestoornissen).
Vitamine B12
In detail Bijwerkingen bij chronisch gebruik van PPI’s en H2-antagonisten wordt op basis van epidemiologisch onderzoek gesteld dat er zwak bewijs is voor een zwak verband tussen chronisch PPI-gebruik en vitamine B12-deficiëntie. De registratieteksten van alle PPI’s (behalve lansoprazol) stellen: ‘Zoals alle zuurremmende geneesmiddelen kan omeprazol de absorptie van vitamine B12 door hypo- of achloorhydrie verminderen. Dit moet worden meegewogen bij chronische behandeling van patiënten met verminderde reserves vitamine B12 of risicofactoren voor verminderde vitamine B12-absorptie.’ Er is geen bewijs gevonden dat screenen op vitamine B12-deficiëntie bij PPI-gebruikers tot gezondheidswinst leidt of kosteneffectief is.
Overwegingen
Er is veel onduidelijkheid over de diagnostiek van vitamine B12-deficiëntie (zie NHG-Standpunt Diagnostiek van vitamine-B12-deficiëntie. De registratietekst van PPI’s geeft geen aanleiding voor screening van alle PPI-gebruikers.
Conclusie
- Adviseer geen screening van chronische PPI-gebruikers op vitamine B12-deficiëntie.
- Bij patiënten die reeds bekend zijn met verminderde reserves vitamine B12 of risicofactoren voor verminderde vitamine B12-absorptie kan PPI-gebruik bijdragen aan verminderde vitamine B12-opname zodat een tussentijdse controle van de vitamine B12-spiegel zinvol kan zijn.
- Bij patiënten met verschijnselen van vitamine B12-deficiëntie moet de rol van PPI’s worden beoordeeld.
Magnesium
In detail Bijwerkingen bij chronisch gebruik van PPI’s en H2-antagonisten wordt op basis van weinig en tegenstrijdig epidemiologisch onderzoek geen betrouwbaar bewijs gevonden dat PPI-gebruik geassocieerd is met hypomagnesiëmie. De registratieteksten van alle PPI’s stellen: ‘Ernstige hypomagnesiëmie is gerapporteerd bij patiënten die gedurende ten minste 3 maanden, maar in de meeste gevallen langer dan 1 jaar, behandeld werden met een protonpompremmer zoals omeprazol. Ernstige tekenen van hypomagnesiëmie kunnen optreden, zoals vermoeidheid, tetanie, delirium, convulsies, duizeligheid en ventriculaire aritmie, echter, deze kunnen sluipend beginnen en derhalve over het hoofd gezien worden. Bij de meeste patiënten verbeterde de hypomagnesiëmie na magnesiumsuppletie en het beëindigen van de behandeling met de betreffende protonpompremmer. Bij patiënten die naar verwachting chronisch behandeld zullen worden, of patiënten die protonpompremmers gebruiken samen met digoxine of medicatie die hypomagnesiëmie veroorzaakt (bijvoorbeeld diuretica), dient overwogen te worden de magnesiumspiegels te meten voor start van de behandeling en op gezette tijden tijdens de behandeling’.
Overwegingen
Hypomagnesiëmie door chronisch PPI-gebruik lijkt erg zeldzaam. Het advies om chronische PPI-gebruikers die ook digoxine of diuretica gebruiken op gezette tijden te controleren lijkt daarom niet effectief. Er is geen bewijs gevonden dat screenen op hypomagnesiëmie bij chronisch PPI-gebruik leidt tot gezondheidswinst of kosteneffectief is.
Conclusie
- Adviseer geen standaard magnesiumbepalingen bij chronisch PPI-gebruik.
- Bepaal wel een magnesiumspiegel als er klinische verschijnselen zijn die kunnen doen denken aan hypomagnesiëmie. Dan is het beleid om de PPI te stoppen en magnesium te suppleren.
Stoppen of minderen van chronisch gebruik van zuurproductieremmers bij maagklachten
Naar Samenvatting ›Vooraf
Naar Samenvatting ›- Ga na of er een indicatie is voor chronisch gebruik.
- Controleer de H. pylori-status; als deze onbekend is, plan dan een H. pylori-test op een moment dat patiënt 2 weken geen PPI en 1 dag geen H2-antagonist heeft gebruikt.
- Eradiceer H. pylori indien aanwezig (zie Beleid na positieve H. pylori-test).
- Ga na of de patiënt vitamine K-antagonisten, fenytoïne of clozapine gebruikt:
- de concentratie vitamine K-antagonisten kan dalen door het stoppen van omeprazol, esomeprazol, pantoprazol en lansoprazol.
- de concentratie fenytoïne kan dalen door het stoppen van omeprazol en esomeprazol.
- de concentratie clozapine kan stijgen door het stoppen van omeprazol.
Indicaties voor chronisch PPI-gebruik kunnen in 3 groepen worden verdeeld:
- preventie van klachten of schade aan de slokdarm of maag door overmatige zuurproductie (zollinger-ellisonsyndroom, barretoesofagus, oesofagitis graad C/D)
- preventie van maagcomplicaties bij aanwezigheid van risicoverhogende factoren
- indicaties waarbij PPI-gebruik in principe tijdelijk bedoeld was
Bij de eerste 2 groepen is er geen discussie over de plaats van PPI’s, tenzij in de toekomst zoveel mogelijke nadelen van PPI’s bekend worden dat de afweging effect versus schade anders gemaakt moet worden dan nu gemaakt is.
In groep 3 leidt tijdelijk gebruik vaak tot chronisch gebruikt. In dit geval kan worden geprobeerd om het PPI-gebruik te stoppen.
Stoppen en afbouwen van onnodig PPI-gebruik blijkt voor veel patiënten lastig. In noot 53 van de vorige standaard werden 2 Nederlandse onderzoeken beschreven met informatie over welk deel van chronische PPI-gebruikers zonder harde indicatie voor PPI-gebruik kan stoppen met dat gebruik.
Onbekend is of er nieuw onderzoek is gedaan naar de effectiviteit van afbouwmethoden bij chronische PPI-gebruikers. Over de effectiviteit zijn meerdere vragen te onderscheiden.
- Welke stop- of afbouwmethode leidt tot het hoogste stoppercentage of het hoogste percentage vermindering van PPI-gebruik? De motivatie om te stoppen wordt bepaald door vele arts- en patiëntgebonden factoren. Dit impliceert dat het gevonden effect van stopmethodes afhankelijk kan zijn van hoeveel van die factoren zij adresseren.
- De vraag of stoppen niet mogelijk is omdat na het stoppen maagklachten aanwezig blijken die te maken hebben met de aandoening zelf, moet worden onderscheiden van de voorgaande vraag.
- Welke methode om PPI-gebruik te stoppen bij patiënten die zonder harde indicatie chronisch PPI’s gebruiken geeft de minste klachten tijdens het stopproces? Deze vraag is relevant, omdat wordt verondersteld dat bij te abrupt stoppen van PPI’s (en in mindere mate bij afbouwen van PPI’s) mogelijk reboundklachten ontstaan, wat de motivatie om (verder) af te bouwen negatief kan beïnvloeden.
Methode
Een zoekstrategie naar het effect van stop- of afbouwstrategieën bij chronisch PPI-gebruik met zoekdatum vanaf 2003 tot en met 18 juli 2018 gaf 171 treffers in PubMed en 22 in PubMed/Embase, waaronder 2 reviews , 1 meta-analyse en verder geen relevante aanvullende onderzoeken die niet al zijn opgenomen in de meta-analyse of de review.
Resultaten
- In de review van Haastrup (Amstarscore 7/11) werden klinische onderzoeken geïncludeerd naar discontinuiteits-strategieën en effecten van interventies op het discontinueren van PPI-gebruik bij volwassenen tot december 2013. Er werden 6 onderzoeken gevonden, waarvan 3 geen RCT.
Niet geheel duidelijk is waarom deze review niet de onderzoeken vond die in de meta-analyse van Boghossian werden geïdentificeerd. Een mogelijke verklaring is dat de zoektermen vooral gericht waren op stopstrategieën en ‘zo nodig’-gebruik geen zoekterm was in de review. De gebruikte stopmethodes en de behaalde stop- en dosisreductiepercentages in de 6 geïncludeerde onderzoeken waren zeer divers. - H. pylori-screening en behandeling gevolgd door informatie en een individueel actieplan begeleid door een verpleegkundige, en een antacidum bij doorbraaksymptomen. Van de 157 geïncludeerde patiënten met gastro-oesofageale refluxziekte/non ulcer dyspepsia stopte 64% na 3 en 34% na 12 maanden. Bij 30% was er dosisreductie na 3 en bij 50% na 12 maanden.
- Bij het ontstaan van symptomen na het stoppen van PPI’s endoscopie verrichten en bij normale bevindingen starten met esomeprazol 1 dd 40 mg of placebo. Van de 78 geïncludeerde patiënten die in de voorafgaande 12 maanden > 120 PPI-tabletten gebruikten en die geen endoscopie hadden ondergaan stopte 14% het PPI-gebruik definitief; 68% kreeg weer klachten en startte met esomeprazol (waarvan 81% in de eerste 4 weken). Van de 68% (n = 53) die weer met esomeprazol waren gestart had 58% (n = 31) geen afwijkingen. Deze 31 patiënten werden dubbelblind gerandomiseerd tussen esomeprazol 1 dd 40 mg en placebo gedurende 1 week. Na 7 dagen had 80% (12/15) in de esomeprazolgroep geen klachten versus 13% (2/16) in de placebogroep (p < 0,001).
- Halveren van de PPI-dosis en indien er geen symptomen zijn, PPI stoppen. Bij terugkeer van symptomen H2-antagonisten en/of prokinetica en indien dat niet helpt, weer PPI’s geven. Na 1 jaar gebruikte 58% van de 71 geïncludeerde patiënten met gastro-oesofageale refluxziekte geen PPI meer maar had 73% H2-antagonisten of prokinetica nodig.
- Een RCT waarin een informatiebrief met ook de vraag op het spreekuur te komen, werd vergeleken met geen interventie of gebruikelijke zorg (Krol 2004, niet gepubliceerd). Na 12 weken waren er respectievelijk 24 en 7% stoppers of minderaars zonder verergering van symptomen (RR 3,56; 95%-BI 1,09 tot 11,64). Na 20 weken bleef er een verschil, maar dat was niet meer significant (22 vs. 7%; RR 3,25; 95%-BI 0,98 tot 10,83).
- Een RCT waarin 97 patiënten met gastro-oesofageale refluxziekte of non ulcer dyspepsia die > 8 weken een PPI-gebruikten maar wilden stoppen en bij wie de gastroduodenoscopie normaal bleek, dubbelblind gerandomiseerd werden tussen een groep met omeprazol 1 dd 20 mg en een groep bij wie de dosis werd verminderd naar omeprazol om de dag 10 mg. Na 3 weken stopten beide groepen met omeprazol. Na 1 jaar was het aantal stoppers respectievelijk 22 en 31% (geen significant verschil).
- Een RCT waarin 171 patiënten met gastro-oesofageale refluxziekte of non ulcer dyspepsia die minimaal 2 van de 6 voorafgaande maanden een H2-antagonist of PPI-gebruikten na een H. pylori-test en -behandeling (indien positief) stopten met hun medicatie en dubbelblind gerandomiseerd werden tussen esomeprazol 1 dd 40 mg of placebo. Na 1 jaar had respectievelijk 19 en 71% weer hun oude therapie nodig. Dit betekent dat 29% in de placebogroep kon stoppen.
Bewijs
- De review van Wilsdon (Amstarscore 8/11) bevatte alleen gegevens over ouderen (mediane leeftijd > 65 jaar) en includeerde 21 onderzoeken (6 gerandomiseerde onderzoeken van lage kwaliteit en 15 niet-gerandomiseerde onderzoeken, waarvan 4 van goede, 10 van matige en 1 van slechte kwaliteit) die verschilden van de onderzoeken uit de review van Haastrup. 6 onderzoeken toonden een effect, in 11 onderzoeken was het effect onduidelijk en 4 onderzoeken toonden geen effect. Effectieve interventies waren het herhaald sturen van informatiemateriaal naar alle patiënten en betrokken artsen en apothekers, academic detailing en een door de geriater geleide interventie in een acute opname faciliteit in een ziekenhuis.
- In de meta-analyse van Boghossian werd gezocht naar RCT’s en quasi-RCT’s waarin een voorschrijfverminderende modaliteit (stoppen, step-down of reductie door intermitterend gebruik, ‘zo nodig’-gebruik of continu gebruik van een lagere dosis, of H. pylori-behandeling en stoppen van de PPI na 4 weken) werd vergeleken met continu PPI-gebruik bij volwassenen die > 28 dagen PPI’s gebruikten vanwege een bekende indicatie voor PPI-gebruik (geen harde indicatie voor PPI-gebruik). Als naast de voorschrijfverminderende modaliteit ook rescuetherapie werd gegeven (zoals het geven van antacida) werd het onderzoek geëxcludeerd, tenzij de antacida op dezelfde manier werden gegeven in de controlearm.
- De primaire uitkomstmaten waren gebrek aan symptoomcontrole (aanwezig blijven van, verslechtering of terugkeer van symptomen, of optreden van nieuwe symptomen) en PPI-gebruik. Er werden 6 onderzoeken geïncludeerd: in 5 onderzoeken ging het om ‘zo nodig’-gebruik en in 1 onderzoek om abrupt stoppen.
- De 5 onderzoeken met ‘zo nodig’-gebruik (n = 1653) konden worden geclusterd voor de effectmaat ‘gebrek aan symptoomcontrole’. Er was lage kwaliteit van bewijs dat ‘zo nodig’-gebruik het risico op gebrek aan symptoomcontrole kan vergroten (RR 1,71; 95%-BI 1,31 tot 2,21). Van de 5 onderzoeken met ‘zo nodig’-gebruik konden er 3 (n = 1152) worden geclusterd voor PPI-gebruik. In de ‘zo nodig’-groep zag men een klinisch relevante vermindering van PPI-gebruik met 3,79 pillen per week (95%-BI 2,84 tot 4,73).
- Het onderzoek naar abrupt stoppen wordt hier niet besproken, omdat het patiënten met gastro-oesofageale refluxziekte betrof die waren geclassificeerd als graad 1 tot 3 volgens de savary-millerclassificatie en niet uitgesloten kan worden dat sommige patiënten uit graad 2 en 3 uit deze classificatie overeenkomen met graad C of D uit de Los Angeles Classification die in deze standaard wordt gebruikt, een groep waarbij continu PPI-gebruik is geïndiceerd.
Conclusie
- De review van Haastrup laat zien dat verschillende strategieën om chronisch PPI-gebruik te stoppen effect hebben, variërend tussen de 14 en 64%.
- De review van Wilsdon suggereert dat sommige strategieën succesvoller zijn dan andere bij ouderen.
- De meta-analyse van Boghossian laat zien dat ‘zo nodig’-gebruik in plaats van continu gebruik tot halvering van het PPI-gebruik kan leiden, ondanks het feit dat de symptomen soms toenemen.
- De reviews van Haastrup en Wilsdon bevatten onderzoeken met zulke verschillen in design, setting, populatie en stopstrategieën dat meta-analyse niet mogelijk is.
- De meta-analyse van Boghossian vergelijkt (vooral) RCT’s waarin het effect van ‘zo nodig’-gebruik wordt vergeleken met continu gebruik van PPI’s. Het adviseren van ‘zo nodig’-gebruik is niet per se gericht op stoppen van het PPI-gebruik, zodat deze meta-analyse minder geschikt is om de onderzoeksvragen te beantwoorden. De resultaten geven mogelijk wel een indicatie over het te verwachten effect van het adviseren van ‘zo nodig’-gebruik en worden daarom toch gepresenteerd.
Van bewijs naar aanbeveling
- Er is geen onderzoek van goede kwaliteit gevonden in beide reviews en de meta-analyse dat verschillende methoden om chronisch PPI-gebruik te stoppen onderling vergelijkt bij patiënten zonder harde indicatie voor dat gebruik.
- De 2 in de standaard van 2013 beschreven Nederlandse RCT’s geven nog steeds de beste informatie over welk percentage patiënten kan stoppen met chronisch PPI-gebruik waarvoor geen ‘harde’ indicatie bestaat in de Nederlandse situatie. De gegevens uit de review van Haastrup zijn daarmee niet strijdig, zodat de werkgroep de in de hoofdtekst beschreven percentages onveranderd laat staan.
- Over de beste manier van stoppen is onvoldoende bewijs om een bepaalde methode te adviseren, zodat de aanbeveling over de methode van stoppen is gebaseerd op consensus in de werkgroep.
- Argumenten bij afbouwen in plaats van ineens stoppen zijn:
- het reboundfenomeen (zie Reboundeffect na het staken van zuurproductieremmers)
- de ervaring van de werkgroep dat reboundsymptomen bij geleidelijke reductie van de dagelijkse dosis minder heftig en minder lijken
- ook de review van Haastrup concludeert dat geleidelijk verminderen van de dosis (tapering) effectiever lijkt dan plots stoppen, maar de onderbouwing van deze conclusie is zeer zwak
- Het advies in de vorige standaard om bij afbouwen een PPI om de dag te adviseren in deze standaard wordt verlaten, omdat de werkingsduur van een PPI ongeveer 1,5 dag is en de PPI in de loop van de tweede dag uitgewerkt kan raken, waardoor mogelijk reboundklachten optreden.
- Omdat het succesvol afbouwen van PPI’s van vele factoren afhankelijk is, er zeer veel PPI-gebruik bestaat en er associaties bestaan tussen chronisch PPI-gebruik met meerdere soorten bijwerkingen, overweegt de werkgroep dat er meer aandacht zou moeten zijn voor implementatie van afbouw van onnodig chronisch PPI-gebruik, gericht op voorschrijvers, afleveraars en patiënten.
Praktische toepassingen
- Licht de patiënt voor over de reden van afbouwen en de voordelen van antacida of eventueel H2-antagonisten boven PPI’s.
- Halveer de dosis PPI elke week totdat omeprazol 1 dd 10 mg (of een dosis-equivalente hoeveelheid van de andere PPI’s) wordt gebruikt.
- Stop dat gebruik na 1 week helemaal.
- Bij klachten tijdens afbouwen of na het stoppen: adviseer zo nodig een antacidum te gebruiken en raad aan het gebruik daarvan na drie weken ook te stoppen.
- Adviseer patiënten bij wie de klachten terugkeren en bij wie ondanks een adequate dosering van antacida de klachten zo hinderlijk zijn dat sterkere zuurremming nodig is, te starten met ‘zo nodig’-gebruik van een H2-antagonist gedurende 1 maand. H2-antagonisten zijn bij chronisch gebruik minder geassocieerd met langetermijnbijwerkingen dan PPI’s.
- Adviseer ook het (‘zo nodig’-)gebruik van H2-antagonisten na 1 maand te stoppen. Probeer bij klachten uit te komen met een antacidum.
De KNMP Kennisbank beschrijft de volgende interacties van PPI’s (KNMP Kennisbank, geraadpleegd 31 maart 2020):
- omeprazol verhoogt de concentratie van vitamine K-antagonisten (cumarinederivaten) en fenytoïne, en verlaagt de concentratie van clozapine doordat omeprazol CYP2C19 remt en CYP1A2 induceert;
- esomeprazol verhoogt de concentratie van vitamine K-antagonisten (cumarinederivaten) en fenytoïne doordat esomeprazol CYP2C19 remt
- van pantoprazol en lansoprazol zijn bij gelijktijdige behandeling met vitamine K-antagonisten (cumarinederivaten) enkele gevallen van stijging van de INR gemeld;
- van rabeprazol worden geen interacties beschreven.
Voor alle PPI’s geldt dat zij het effect verlagen van cefuroxim, ketoconazol, itraconazol en ulipristal omdat door verhoging van de pH in de maag de absorptie van deze middelen afneemt. Deze interactie is niet relevant bij stoppen van een PPI, alleen bij starten van deze middelen bij PPI-gebruikers.
Voorlichting
Naar Samenvatting ›Bespreek met de patiënt:
- het spontane beloop van maagklachten; vaak verdwijnen ze, zodat geneesmiddelen niet meer nodig zijn
- de voordelen van stoppen of minderen van PPI’s
- de nadelen van chronisch PPI-gebruik (zie Achtergronden)
- de mogelijkheid van reboundklachten en het beleid daarbij (antacida bijgeven)
- de mogelijkheid van ‘zo nodig’-gebruik bij recidiverende klachten
- dat antacida en H2-antagonisten sneller werken dan PPI’s
Afbouwschema
Naar Samenvatting ›- Halveer de dosis PPI (of H2-antagonist) wekelijks tot ½ standaarddosis (zie tabel h1).
- Stop helemaal na 1 week gebruik van ½ standaarddosis.
- Bij klachten tijdens het afbouwen of na het stoppen:
- adviseer gedurende 3 weken ‘zo nodig’-gebruik van een antacidum en dit gebruik na 3 weken te stoppen
- overweeg bij hinderlijke recidiverende klachten ondanks adequate dosering van antacida gedurende 1 maand zo nodig een H2-antagonist in standaarddosering te gebruiken
- probeer vervolgens weer uit te komen met een antacidum.
Referenties
- Anonymous. Management of dyspepsia: report of a working party. Lancet 1988;1:576-9.
- Drossman DA, Dumitrascu DL. Rome III: new standard for functional gastrointestinal disorders. J Gastrointestin.Liver Dis 2006;15:237-41.
- Moayyedi P, Talley NJ, Fennerty MB, Vakil N. Can the clinical history distinguish between organic and functional dyspepsia? JAMA 2006;295:1566-76.
- Ford AC, Qume M, Moayyedi P, Arents NL, Lassen AT, Logan RF, et al. Helicobacter pylori "test and treat" or endoscopy for managing dyspepsia: an individual patient data meta-analysis. Gastroenterology 2005;128:1838-44.
- Lewin van den Broek NT, Numans ME, Buskens E, Verheij TJ, De Wit NJ, Smout AJ. A randomised controlled trial of four management strategies for dyspepsia: relationships between symptom subgroups and strategy outcome. Br J Gen Pract 2001;51:619-24.
- Delaney BC, Qume M, Moayyedi P, Logan RF, Ford AC, Elliott C, et al. Helicobacter pylori test and treat versus proton pump inhibitor in initial management of dyspepsia in primary care: multicentre randomised controlled trial (MRC-CUBE trial). BMJ 2008;336:651-4.
- Jarbol DE, Kragstrup J, Stovring H, Havelund T, Schaffalitzky de Muckadell OB. Proton pump inhibitor or testing for Helicobacter pylori as the first step for patients presenting with dyspepsia? A cluster-randomized trial. Am J Gastroenterol 2006;101:1200-8.
- Van Marrewijk CJ, Mujakovic S, Fransen GA, Numans ME, De Wit NJ, Muris JW, et al. Effect and cost-effectiveness of step-up versus step-down treatment with antacids, H2-receptor antagonists, and proton pump inhibitors in patients with new onset dyspepsia (DIAMOND study): a primary-care-based randomised controlled trial. Lancet 2009;373:215-25.
- Chiba N, Van Zanten SJ, Sinclair P, Ferguson RA, Escobedo S, Grace E. Treating Helicobacter pylori infection in primary care patients with uninvestigated dyspepsia: the Canadian adult dyspepsia empiric treatment-Helicobacter pylori positive (CADET-Hp) randomised controlled trial. BMJ 2002;324:1012-6.
- Estores DS. Symptom predictability in gastroesophageal reflux disease and role of proton pump inhibitor test. Gastroenterol Clin North Am 2014;43:27-38.
- Vakil N, Van Zanten SV, Kahrilas P, Dent J, Jones R. The Montreal definition and classification of gastroesophageal reflux disease: a global evidence-based consensus. Am J Gastroenterol 2006b;101:1900-20.
- Van Bommel MJ, Numans ME, De Wit NJ, Stalman WA. Consultations and referrals for dyspepsia in general practice--a one year database survey. Postgrad Med J 2001;77:514-8.
- Heikkinen M, Pikkarainen P, Eskelinen M, Julkunen R. GPs' ability to diagnose dyspepsia based only on physical examination and patient history. Scand.J Prim Health Care 2000;18:99-104.
- Weijnen CF, De Wit NJ, Numans ME, Kuipers EJ, Hoes AW, Verheij TJ. Helicobacter pylori testing in the primary care setting: which diagnostic test should be used? Aliment Pharmacol Ther 2001;15:1205-10.
- Van Kerkhoven LA, Van Rijswijck SJ, Van Rossum LG, Laheij RJ, Witteman EM, Tan AC, et al. Open-access upper gastrointestinal endoscopy a decade after the introduction of proton pump inhibitors and helicobacter pylori eradication: a shift in endoscopic findings. Digestion 2007;75:227-31.
- Loffeld RJ, Liberov B, Dekkers PE. The changing prevalence of upper gastrointestinal endoscopic diagnoses: a single-centre study. Neth J Med 2012;70:222-6.
- Crouwel F. De diagnostische meerwaarde van open acces gastroduodenoscopieën. Projectenboek doelmatigheidsprijs 2017. (2017). https://www.bewustzijnsproject.nl/projectenboek-doelmatigheidsprijs-2017/ geraadpleegd november 2020.
- Van de Lisdonk EH, Van den Bosch WJHM, Lagro-Janssen ALM. Ziekten in de huisartspraktijk. 5th. ed. Maarssen: Elsevier Gezondheidszorg, 2008.
- Salo M, Collin P, Kyronpalo S, Rasmussen M, Huhtala H, Kaukinen K. Age, symptoms and upper gastrointestinal malignancy in primary care endoscopy. Scand.J Gastroenterol 2008;43:122-7.
- Meineche-Schmidt V, Jorgensen T. 'Alarm symptoms' in patients with dyspepsia: a three-year prospective study from general practice. Scand.J Gastroenterol 2002;37:999-1007.
- Fransen GA, Janssen MJ, Muris JW, Laheij RJ, Jansen JB. Meta-analysis: the diagnostic value of alarm symptoms for upper gastrointestinal malignancy. Aliment Pharmacol Ther 2004;20:1045-52.
- Vakil N, Moayyedi P, Fennerty MB, Talley NJ. Limited value of alarm features in the diagnosis of upper gastrointestinal malignancy: systematic review and meta-analysis. Gastroenterology 2006a;131:390-401.
- Astin MP, Martins T, Welton N, Neal RD, Rose PW, Hamilton W. Diagnostic value of symptoms of oesophagogastric cancers in primary care: a systematic review and meta-analysis. Br J Gen Pract 2015;65:e677-91.
- Christie J, Shepherd NA, Codling BW, Valori RM. Gastric cancer below the age of 55: implications for screening patients with uncomplicated dyspepsia. Gut 1997;41:513-7.
- Gillen D, McColl KE. Does concern about missing malignancy justify endoscopy in uncomplicated dyspepsia in patients aged less than 55? Am J Gastroenterol 1999;94:2329-30.
- Talley NJ, Vakil N, Delaney B, Marshall B, Bytzer P, Engstrand L, et al. Management issues in dyspepsia: current consensus and controversies. Scand.J Gastroenterol 2004;39:913-8.
- Moayyedi PM, Lacy BE, Andrews CN, Enns RA, Howden CW, Vakil N. ACG and CAG clinical guideline: management of dyspepsia. Am J Gastroenterol 2017;112:988-1013.
- Kestens C, Van Hillegensberg R, Siersema PD. Oesafaguscarcinoom. Huisarts Wet 2014;57:34-8.
- Stapley S, Peters TJ, Neal RD, Rose PW, Walter FM, Hamilton W. The risk of oesophago-gastric cancer in symptomatic patients in primary care: a large case-control study using electronic records. Br J Cancer 2013;108:25-31.
- Qvigstad G, Waldum H. Rebound hypersecretion after inhibition of gastric acid secretion. Basic Clin Pharmacol.Toxicol. 2004;94:202-8.
- Smith AD, Gillen D, Cochran KM, El-Omar E, McColl KE. Dyspepsia on withdrawal of ranitidine in previously asymptomatic volunteers. Am J Gastroenterol 1999;94:1209-13.
- Hunfeld NG, Geus WP, Kuipers EJ. Systematic review: rebound acid hypersecretion after therapy with proton pump inhibitors. Aliment Pharmacol Ther 2007;25:39-46.
- Reimer C, Sondergaard B, Hilsted L, Bytzer P. Proton-pump inhibitor therapy induces acid-related symptoms in healthy volunteers after withdrawal of therapy. Gastroenterology 2009;137:80-7, 7.
- Niklasson A, Lindstrom L, Simren M, Lindberg G, Bjornsson E. Dyspeptic symptom development after discontinuation of a proton pump inhibitor: a double-blind placebo-controlled trial. Am J Gastroenterol 2010;105:1531-7.
- Metz DC, Pilmer BL, Han C, Perez MC. Withdrawing PPI therapy after healing esophagitis does not worsen symptoms or cause persistent hypergastrinemia: analysis of dexlansoprazole MR clinical trial data. Am J Gastroenterol 2011;106:1953-60.
- Feinle-Bisset C, Horowitz M. Dietary factors in functional dyspepsia. Neurogastroenterol.Motil. 2006;18:608-18.
- Olafsdottir LB, Gudjonsson H, Jonsdottir HH, Thjodleifsson B. Natural history of functional dyspepsia: a 10-year population-based study. Digestion 2010;81:53-61.
- Kaltenbach T, Crockett S, Gerson LB. Are lifestyle measures effective in patients with gastroesophageal reflux disease? An evidence-based approach. Arch Intern Med 2006;166:965-71.
- Stanciu C, Bennett JR. Effects of posture on gastro-oesophageal reflux. Digestion 1977;15:104-9.
- Vemulapalli R. Diet and lifestyle modifications in the management of gastroesophageal reflux disease. Nutr Clin Pract 2008;23:293-8.
- Pregun I, Bakucz T, Banai J, Molnar L, Pavlik G, Altorjay I, et al. Gastroesophageal reflux disease: work-related disease? Dig.Dis 2009;27:38-44.
- Duncanson KR, Talley NJ, Walker MM, Burrows TL. Food and functional dyspepsia: a systematic review. J Hum Nutr Diet 2018.
- Haug TT, Wilhelmsen I, Berstad A, Ursin H. Life events and stress in patients with functional dyspepsia compared with patients with duodenal ulcer and healthy controls. Scand.J Gastroenterol 1995;30:524-30.
- Wilhelmsen I, Bakke A, Tangen HT, Endresen IM, Berstad A. Psychosocial adjustment to ollness scale (PAIS-SR) in a Norwegian material of patients with functional dyspepsia, duodenal ulcer, and urinary bladder dysfunction. Clinical validation of the instrument. Scand.J Gastroenterol 1994;29:611-7.
- Talley NJ, Fung LH, Gilligan IJ, McNeil D, Piper DW. Association of anxiety, neuroticism, and depression with dyspepsia of unknown cause. A case-control study. Gastroenterology 1986;90:886-92.
- Lin S, Gao T, Sun C, Jia M, Liu C, Ma A. The association between functional dyspepsia and depression: a meta-analysis of observational studies. Eur J Gastroenterol Hepatol 2019;31:911-8.
- Wilhelmsen I. Quality of life in upper gastrointestinal disorders. Scand.J Gastroenterol Suppl 1995;211:21-5.
- Quartero AO, Post MW, Numans ME, De Melker RA, De Wit NJ. What makes the dyspeptic patient feel ill? A cross sectional survey of functional health status, Helicobacter pylori infection, and psychological distress in dyspeptic patients in general practice. Gut 1999;45:15-9.
- Levenstein S. Stress and peptic ulcer: life beyond Helicobacter. BMJ 1998;316:538-41.
- Chang AB, Lasserson TJ, Gaffney J, Connor FL, Garske LA. Gastro-oesophageal reflux treatment for prolonged non-specific cough in children and adults. Cochrane Database Syst Rev 2011:CD004823.
- Baumeler L, Papakonstantinou E, Milenkovic B, Lacoma A, Louis R, Aerts JG, et al. Therapy with proton-pump inhibitors for gastroesophageal reflux disease does not reduce the risk for severe exacerbations in COPD. Respirology 2016;21:883-90.
- Arents NL, Thijs JC, Kleibeuker JH. A rational approach to uninvestigated dyspepsia in primary care: review of the literature. Postgrad Med J 2002;78:707-16.
- Loffeld RJ, Van der Putten AB. Changes in prevalence of Helicobacter pylori infection in two groups of patients undergoing endoscopy and living in the same region in the Netherlands. Scand.J Gastroenterol 2003b;38:938-41.
- Hurenkamp GJB. Chronic dyspepsia in general practice. Tapering the use of acid suppressant drugs [proefschrift]. Amsterdam: Universiteit van Amsterdam, 2001.
- Van der Velden AW. Long term treatment of gastro-oesophageal reflux disease in primary care [dissertation]. Utrecht: Utrecht University, 2008.
- Mourad-Baars PE, Verspaget HW, Mertens BJ, Mearin ML. Low prevalence of Helicobacter pylori infection in young children in the Netherlands. Eur J Gastroenterol Hepatol 2007;19:213-6.
- Arents NL. Persoonlijke mededeling SENSE study (2011).
- Venneman K, Huybrechts I, Gunter MJ, Vandendaele L, Herrero R, Van Herck K. The epidemiology of Helicobacter pylori infection in Europe and the impact of lifestyle on its natural evolution toward stomach cancer after infection: a systematic review. Helicobacter 2018;23:e12483.
- Niv Y. H pylori recurrence after successful eradication. World J Gastroenterol 2008;14:1477-8.
- McColl KE. Clinical practice. Helicobacter pylori infection. N Engl J Med 2010;362:1597-604.
- Lee YC, Chiang TH, Chou CK, Tu YK, Liao WC, Wu MS, et al. Association between Helicobacter pylori eradication and gastric cancer incidence: a systematic review and meta-analysis. Gastroenterology 2016;150:1113-24.e5.
- Malfertheiner P, Megraud F, O'Morain CA, Gisbert JP, Kuipers EJ, Axon AT, et al. Management of Helicobacter pylori infection-the Maastricht V/Florence Consensus Report. Gut 2017;66:6-30.
- Graham DY, Genta RM. Long-term proton pump inhibitor use and gastrointestinal cancer. Curr Gastroenterol Rep. 2008;10:543-7.
- IKNL. Landelijke richtlijn Maagcarcinoom, versie 2.2. (2017). https://iknl.nl/nkr/evaluatie-met-nkr-data/richtlijnen geraadpleegd 17 mei 2019. Ga naar bron: IKNL. Landelijke richtlijn Maagcarcinoom, versie 2.2. (2017). https://iknl.nl/nkr/evaluatie-met-nkr-data/richtlijnen geraadpleegd 17 mei 2019.
- IKNL. Oesofaguscarcinoom, versie: 3.0. 2010. Ga naar bron: IKNL. Oesofaguscarcinoom, versie: 3.0. 2010.
- Quartero AO, Numans ME, Post MW, De Melker RA, De Wit NJ. One-year prognosis of primary care dyspepsia: predictive value of symptom pattern, Helicobacter pylori and GP management. Eur J Gastroenterol Hepatol 2002;14:55-60.
- Woodcock S. Primary care management of post operative bariatric patients (2014). www.rcgp.org.uk, geraadpleegd 17 juni 2019.
- Contival N, Menahem B, Gautier T, Le Roux Y, Alves A. Guiding the non-bariatric surgeon through complications of bariatric surgery. J Visc Surg 2018;155:27-40.
- Kabir S. Review article: clinic-based testing for Helicobacter pylori infection by enzyme immunoassay of faeces, urine and saliva. Aliment Pharmacol Ther 2003;17:1345-54.
- Vaira D, Vakil N. Blood, urine, stool, breath, money, and Helicobacter pylori. Gut 2001;48:287-9.
- Ferwana M, Abdulmajeed I, Alhajiahmed A, Madani W, Firwana B, Hasan R, et al. Accuracy of urea breath test in Helicobacter pylori infection: meta-analysis. World J Gastroenterol 2015;21:1305-14.
- Gisbert JP, F. DlM, Abraira V. Accuracy of monoclonal stool antigen test for the diagnosis of H. pylori infection: a systematic review and meta-analysis. Am J Gastroenterol 2006;101:1921-30.
- Van Kerkhoven LA, Van Rossum LG, Van Oijen MG, Tan AC, Laheij RJ, Jansen JB. Upper gastrointestinal endoscopy does not reassure patients with functional dyspepsia. Endoscopy 2006;38:879-85.
- Numans ME, Y. VdG, De Wit NJ, De Melker RA. How useful is selection based on alarm symptoms in requesting gastroscopy? An evaluation of diagnostic determinants for gastro-oesophageal malignancy. Scand.J Gastroenterol 2001;36:437-43.
- Ben-Menachem T, Decker GA, Early DS, Evans J, Fanelli RD, Fisher DA, et al. Adverse events of upper GI endoscopy. Gastrointest Endosc 2012;76:707-18.
- CBO KvdG. NSAID-gebruik en preventie van maagschade. Alphen a/d Rijn: Van Zuiden Communications B.V., 2003.
- Nema H, Kato M. Comparative study of therapeutic effects of PPI and H2RA on ulcers during continuous aspirin therapy. World J Gastroenterol 2010;16:5342-6.
- Ford AC, Moayyedi P, Jarbol DE, Logan RF, Delaney BC. Meta-analysis: Helicobacter pylori'test and treat' compared with empirical acid suppression for managing dyspepsia. Aliment.Pharmacol.Ther 2008;28:534-44.
- Duggan AE, Elliott CA, Miller P, Hawkey CJ, Logan RF. Clinical trial: a randomized trial of early endoscopy, Helicobacter pylori testing and empirical therapy for the management of dyspepsia in primary care. Aliment Pharmacol Ther 2009;29:55-68.
- Bytzer P, Hansen JM, Schaffalitzky de Muckadell OB. Empirical H2-blocker therapy or prompt endoscopy in management of dyspepsia. Lancet 1994;343:811-6.
- Laheij RJ, Severens JL, Van de Lisdonk EH, Verbeek AL, Jansen JB. Randomized controlled trial of omeprazole or endoscopy in patients with persistent dyspepsia: a cost-effectiveness analysis. Aliment Pharmacol Ther 1998;12:1249-56.
- Delaney BC, Wilson S, Roalfe A, Roberts L, Redman V, Wearn A, et al. Cost effectiveness of initial endoscopy for dyspepsia in patients over age 50 years: a randomised controlled trial in primary care. Lancet 2000;356:1965-9.
- Eusebi LH, Black CJ, Howden CW, Ford AC. Effectiveness of management strategies for uninvestigated dyspepsia: systematic review and network meta-analysis. BMJ 2019;367:l6483.
- Heaney A, Collins JS, Watson RG, McFarland RJ, Bamford KB, Tham TC. A prospective randomised trial of a "test and treat" policy versus endoscopy based management in young Helicobacter pylori positive patients with ulcer-like dyspepsia, referred to a hospital clinic. Gut 1999;45:186-90.
- Mahadeva S, Chia YC, Vinothini A, Mohazmi M, Goh KL. Cost-effectiveness of and satisfaction with a Helicobacter pylori "test and treat" strategy compared with prompt endoscopy in young Asians with dyspepsia. Gut 2008;57:1214-20.
- Kjeldsen HC, Bech M, Christensen B. Cost-effectiveness analysis of two management strategies for dyspepsia. Int J Technol Assess Health Care 2007;23:376-84.
- Ladabaum U, Chey WD, Scheiman JM, Fendrick AM. Reappraisal of non-invasive management strategies for uninvestigated dyspepsia: a cost-minimization analysis. Aliment Pharmacol Ther 2002;16:1491-501.
- Moayyedi P, Axon AT. The usefulness of the likelihood ratio in the diagnosis of dyspepsia and gastroesophageal reflux disease. Am J Gastroenterol 1999;94:3122-5.
- Spiegel BM, Vakil NB, Ofman JJ. Dyspepsia management in primary care: a decision analysis of competing strategies. Gastroenterology 2002;122:1270-85.
- Armstrong D, Veldhuyzen Van Zanten SJ, Barkun AN, Chiba N, Thomson AB, Smyth S, et al. Heartburn-dominant, uninvestigated dyspepsia: a comparison of 'PPI-start' and 'H2-RA-start' management strategies in primary care--the CADET-HR Study. Aliment.Pharmacol.Ther 2005;21:1189-202.
- Mason I, Millar LJ, Sheikh RR, Evans WM, Todd PL, Turbitt ML, et al. The management of acid-related dyspepsia in general practice: a comparison of an omeprazole versus an antacid-alginate/ranitidine management strategy. Compete Research Group [corrected]. Aliment Pharmacol Ther 1998;12:263-71.
- Howden CW, Henning JM, Huang B, Lukasik N, Freston JW. Management of heartburn in a large, randomized, community-based study: comparison of four therapeutic strategies. Am J Gastroenterol 2001;96:1704-10.
- Mine S, Lida T, Tabata T, Kishikawa H, Tanaka Y. Management of symptoms in step-down therapy of gastroesophageal reflux disease. J Gastroenterol Hepatol 2005;20:1365-70.
- Gundermann KJ, Godehardt E, Ulbrich M. Efficacy of a herbal preparation in patients with functional dyspepsia: a meta-analysis of double-blind, randomized, clinical trials. Adv Ther 2003;20:43-9.
- Melzer J, Rösch W, Reichling J, Brignoli R, Saller R. Meta-analysis: phytotherapy of functional dyspepsia with the herbal drug preparation STW 5 (Iberogast). Aliment Pharmacol Ther 2004;20:1279-87.
- Palmieri B, Merighi A, Corbascio D, Rottigni V, Fistetto G, Esposito A. Fixed combination of hyaluronic acid and chondroitin-sulphate oral formulation in a randomized double blind, placebo controlled study for the treatment of symptoms in patients with non-erosive gastroesophageal reflux. Eur Rev Med Pharmacol Sci 2013;17:3272-8.
- Savarino V, Pace F, Scarpignato C. Randomised clinical trial: mucosal protection combined with acid suppression in the treatment of non-erosive reflux disease - efficacy of Esoxx, a hyaluronic acid-chondroitin sulphate based bioadhesive formulation. Aliment Pharmacol Ther 2017;45:631-42.
- Klok RM, Postma MJ, Van Hout BA, Brouwers JR. Meta-analysis: comparing the efficacy of proton pump inhibitors in short-term use. Aliment Pharmacol Ther 2003;17:1237-45.
- Bate CM, Booth SN, Crowe JP, Hepworth-Jones B, Taylor MD, Richardson PD. Does 40 mg omeprazole daily offer additional benefit over 20 mg daily in patients requiring more than 4 weeks of treatment for symptomatic reflux oesophagitis? Aliment Pharmacol Ther 1993;7:501-7.
- Gunaratnam NT, Jessup TP, Inadomi J, Lascewski DP. Sub-optimal proton pump inhibitor dosing is prevalent in patients with poorly controlled gastro-oesophageal reflux disease. Aliment Pharmacol Ther 2006;23:1473-7.
- Hatlebakk JG, Katz PO, Camacho-Lobato L, Castell DO. Proton pump inhibitors: better acid suppression when taken before a meal than without a meal. Aliment Pharmacol Ther 2000;14:1267-72.
- Kuo B, Castell DO. Optimal dosing of omeprazole 40 mg daily: effects on gastric and esophageal pH and serum gastrin in healthy controls. Am J Gastroenterol 1996;91:1532-8.
- Meineche-Schmidt V. Empiric treatment with high and standard dose of omeprazole in general practice: two-week randomized placebo-controlled trial and 12-month follow-up of health-care consumption. Am J Gastroenterol 2004;99:1050-8.
- Loffeld JLF, Numans ME. Handboek refluxziekte. Utrecht: Academic Pharmaceutical Productions, 2008.
- Swen JJ, Van der Wouden CH, Manson LE, Abdullah-Koolmees H, Blagec K, Blagus T. A 12-gene pharmacogenetic panel to prevent adverse drug reactions: an open-label, multicentre, controlled, cluster-randomised crossover implementation study. Lancet 2023;401:347-56
- Ford AC, Gurusamy KS, Delaney B, Forman D, Moayyedi P. Eradication therapy for peptic ulcer disease in Helicobacter pylori-positive people. Cochrane Database Syst Rev 2016;4:CD003840.
- Leontiadis GI, Moayyedi P, Ford AC. Helicobacter pylori infection. Clin Evid (Online) 2009;2009.
- Du LJ, Chen BR, Kim JJ, Kim S, Shen JH, Dai N. Helicobacter pylori eradication therapy for functional dyspepsia: systematic review and meta-analysis. World J Gastroenterol 2016;22:3486-95.
- Tang HL, Li Y, Hu YF, Xie HG, Zhai SD. Effects of CYP2C19 loss-of-function variants on the eradication of H. pylori infection in patients treated with proton pump inhibitor-based triple therapy regimens: a meta-analysis of randomized clinical trials. PLoS One 2013;8:e62162.
- Fallone CA, Chiba N, Van Zanten SV, Fischbach L, Gisbert JP, Hunt RH, et al. The Toronto consensus for the treatment of Helicobacter pylori infection in adults. Gastroenterology 2016;151:51-69.e14.
- De Boer EM, Schneeberger PM, De Boer WA. Antibioticaresistentie van Helicobacter pylori: prevalentie in Oost-Brabant en implicaties voor de behandeling. Ned Tijdschr Geneeskd 2014;158:A7501.
- Loffeld RJ, Fijen CA. Antibiotic resistance of Helicobacter pylori: a cross-sectional study in consecutive patients, and relation to ethnicity. Clin Microbiol.Infect 2003a;9:600-4.
- Debets-Ossenkopp YJ, Herscheid AJ, Pot RG, Kuipers EJ, Kusters JG, Van den Broucke-Grauls CM. Prevalence of Helicobacter pylori resistance to metronidazole, clarithromycin, amoxycillin, tetracycline and trovafloxacin in the Netherlands. J Antimicrob.Chemother. 1999;43:511-5.
- Malfertheiner P, Megraud F, O'Morain C, Bazzoli F, El-Omar E, Graham D, et al. Current concepts in the management of Helicobacter pylori infection: the Maastricht III Consensus Report. Gut 2007;56:772-81.
- Fuccio L, Laterza L, Zagari RM, Cennamo V, Grilli D, Bazzoli F. Treatment of Helicobacter pylori infection. BMJ 2008;337:a1454.
- Nyssen OP, McNicholl AG, Megraud F, Savarino V, Oderda G, Fallone CA, et al. Sequential versus standard triple first-line therapy for Helicobacter pylori eradication. Cochrane Database Syst Rev 2016;2016:CD009034.
- Schrauwen RW, Janssen MJ, De Boer WA. Seven-day PPI-triple therapy with levofloxacin is very effective for Helicobacter pylori eradication. Neth J Med 2009;67:96-101.
- Nyssen OP, Bordin D, Tepes B, Pérez-Aisa Á, Vaira D, Caldas M, et al. European Registry on Helicobacter pylori management (Hp-EuReg): patterns and trends in first-line empirical eradication prescription and outcomes of 5 years and 21 533 patients. Gut 2021;70:40-54.
- Malfertheiner P, Megraud F, Rokkas T, Gisbert JP, Liou JM, Schulz C, et al. Management of Helicobacter pylori infection: the Maastricht VI/Florence consensus report. Gut 2022.
- Yuan Y, Ford AC, Khan KJ, Gisbert JP, Forman D, Leontiadis GI, et al. Optimum duration of regimens for Helicobacter pylori eradication. Cochrane Database Syst Rev 2013:CD008337.
- Janssen MJR. Dyspepsia et al [proefschrift]. Nijmegen: Radboud Universiteit; 2007.
- Zamani M, Alizadeh-Tabari S, Zamani V, Shokri-Shirvani J, Derakhshan MH. Worldwide and regional efficacy estimates of first-line Helicobacter pylori treatments: a systematic review and network meta-analysis. J Clin Gastroenterol 2022;56:114-24.
- Moayyedi P, Delaney B. GORD in adults. Clin Evid (Online) 2008;2008.
- Curvers WL, Festen HP, Hameeteman W, Meijer GA, Peters FT, Siersema PD, et al. Huidig beleid bij de surveillance van de barrettslokdarm in Nederland. Ned Tijdschr Geneeskd 2007;151:1879-84.
- Hvid-Jensen F, Pedersen L, Drewes AM, Sorensen HT, Funch-Jensen P. Incidence of adenocarcinoma among patients with Barrett's esophagus. N Engl J Med 2011;365:1375-83.
- Van Rijn B, Smout A, Bredenoord A. Eosinofiele oesofagitis. Ned Tijdschr Geneesk 2012;156:A4716.
- Warners MJ, De Rooij W, Van Rhijn BD, Verheij J, Bruggink AH, Smout AJPM, et al. Incidentie van eosinofiele oesofagitis in Nederland blijft stijgen: 20-jarige resultaten van een landelijke pathologiedatabase. Neurogastroenterol Motil 2018;30.
- Van Pinxteren B, Sigterman KE, Bonis P, Lau J, Numans ME. Short-term treatment with proton pump inhibitors, H2-receptor antagonists and prokinetics for gastro-oesophageal reflux disease-like symptoms and endoscopy negative reflux disease. Cochrane Database Syst Rev 2010:CD002095.
- Donnellan C, Preston C, Moayyedi P, Sharma N. Medical treatments for the maintenance therapy of reflux oesophagitis and endoscopic negative reflux disease. Cochrane Database Syst Rev 2009:CD003245.
- Garg SK, Gurusamy KS. Laparoscopic fundoplication surgery versus medical management for gastro-oesophageal reflux disease (GORD) in adults. Cochrane Database Syst Rev 2015;2015:CD003243.
- Maret-Ouda J, Wahlin K, El-Serag HB, Lagergren J. Association between laparoscopic antireflux surgery and recurrence of gastroesophageal reflux. JAMA 2017;318:939-46.
- Draaisma WA, Fegrachi S, Simmermacher RK, Broeders IA, Smout AJ, Gooszen HG. Therapieresistente gastro-oesofageale refluxziekte: endoluminale behandeling nog onvoldoende vergeleken met de gouden standaard, laparoscopische fundoplicatie volgens Nissen. Ned Tijdschr Geneeskd 2008;152:2553-8.
- Bredenoord AJ, Dent J. Proton pump inhibitor-therapy refractory gastro-oesophageal reflux disease patients, who are they? Gut 2007;56:593-4.
- Pinto-Sanchez MI, Yuan Y, Hassan A, Bercik P, Moayyedi P. Proton pump inhibitors for functional dyspepsia. Cochrane Database Syst Rev 2017;11:CD011194.
- Yang YJ, Bang CS, Baik GH, Park TY, Shin SP, Suk KT, et al. Prokinetics for the treatment of functional dyspepsia: Bayesian network meta-analysis. BMC Gastroenterol 2017;17:83.
- Pittayanon R, Yuan Y, Bollegala NP, Khanna R, Leontiadis GI, Moayyedi P. Prokinetics for functional dyspepsia. Cochrane Database Syst Rev 2018;10:CD009431.
- Hojo M, Nagahara A, Asaoka D, Shimada Y, Sasaki H, Matsumoto K, et al. A systematic review of the effectiveness of antianxiety and antidepressive agents for functional dyspepsia. Intern Med 2017;56:3127-33.
- Lu Y, Chen M, Huang Z, Tang C. Antidepressants in the treatment of functional dyspepsia: a systematic review and meta-analysis. PLoS One 2016;11:e0157798.
- Ford AC, Luthra P, Tack J, Boeckxstaens GE, Moayyedi P, Talley NJ. Efficacy of psychotropic drugs in functional dyspepsia: systematic review and meta-analysis. Gut 2017;66:411-20.
- Cheong PK, Ford AC, Cheung CKY, Ching JYL, Chan Y, Sung JJY, et al. Low-dose imipramine for refractory functional dyspepsia: a randomised, double-blind, placebo-controlled trial. Lancet Gastroenterol Hepatol 2018;3:837-44.
- Soo S, Moayyedi P, Deeks J, Delaney B, Lewis M, Forman D. Psychological interventions for non-ulcer dyspepsia. Cochrane Database Syst Rev 2005:CD002301.
- Hjelland IE, Svebak S, Berstad A, Flatabo G, Hausken T. Breathing exercises with vagal biofeedback may benefit patients with functional dyspepsia. Scand.J Gastroenterol 2007;42:1054-62.
- Cheng C, Yang FC, Jun S, Hutton JM. Flexible coping psychotherapy for functional dyspeptic patients: a randomized, controlled trial. Psychosom Med 2007;69:81-8.
- Haag S, Senf W, Tagay S, Langkafel M, Braun-Lang U, Pietsch A, et al. Is there a benefit from intensified medical and psychological interventions in patients with functional dyspepsia not responding to conventional therapy? Aliment.Pharmacol.Ther 2007;25:973-86.
- Van der Velden AW. Van der Velden persoonlijk mededeling2012.
- Talley NJ. Drug treatment of functional dyspepsia. Scand.J Gastroenterol Suppl 1991;182:47-60.
- Van der Velden AW, De Wit NJ, Quartero AO, Grobbee DE, Numans ME. Pharmacological dependency in chronic treatment of gastroesophageal reflux disease: a randomized controlled clinical trial. Digestion 2010;81:43-52.
- Eom CS, Jeon CY, Lim JW, Cho EG, Park SM, Lee KS. Use of acid-suppressive drugs and risk of pneumonia: a systematic review and meta-analysis. CMAJ 2011;183:310-9.
- Filion KB, Chateau D, Targownik LE, Gershon A, Durand M, Tamim H, et al. Proton pump inhibitors and the risk of hospitalisation for community-acquired pneumonia: replicated cohort studies with meta-analysis. Gut 2014;63:552-8.
- Othman F, Crooks CJ, Card TR. Community acquired pneumonia incidence before and after proton pump inhibitor prescription: population based study. BMJ 2016;355:i5813.
- Lambert AA, Lam JO, Paik JJ, Ugarte-Gil C, Drummond MB, Crowell TA. Risk of community-acquired pneumonia with outpatient proton-pump inhibitor therapy: a systematic review and meta-analysis. PLoS One 2015;10:e0128004.
- Leonard J, Marshall JK, Moayyedi P. Systematic review of the risk of enteric infection in patients taking acid suppression. Am J Gastroenterol 2007;102:2047-56.
- Trifan A, Stanciu C, Girleanu I, Stoica OC, Singeap AM, Maxim R, et al. Proton pump inhibitors therapy and risk of Clostridium difficile infection: systematic review and meta-analysis. World J Gastroenterol 2017;23:6500-15.
- Tariq R, Singh S, Gupta A, Pardi DS, Khanna S. Association of gastric acid suppression with recurrent Clostridium difficile infection: a systematic review and meta-analysis. JAMA Intern Med 2017;177:784-91.
- Hafiz RA, Wong C, Paynter S, David M, Peeters G. The risk of community-acquired enteric infection in proton pump inhibitor therapy: systematic review and meta-analysis. Ann Pharmacother 2018;52:613-22.
- Deshpande A, Pant C, Pasupuleti V, Rolston DD, Jain A, Deshpande N, et al. Association between proton pump inhibitor therapy and Clostridium difficile infection in a meta-analysis. Clin Gastroenterol Hepatol 2012;10:225-33.
- Tleyjeh IM, Bin Abdulhak AA, Riaz M, Alasmari FA, Garbati MA, AlGhamdi M, et al. Association between proton pump inhibitor therapy and clostridium difficile infection: a contemporary systematic review and meta-analysis. PLoS One 2012;7:e50836.
- Kwok CS, Arthur AK, Anibueze CI, Singh S, Cavallazzi R, Loke YK. Risk of Clostridium difficile infection with acid suppressing drugs and antibiotics: meta-analysis. Am J Gastroenterol 2012;107:1011-9.
- Janarthanan S, Ditah I, Adler DG, Ehrinpreis MN. Clostridium difficile-associated diarrhea and proton pump inhibitor therapy: a meta-analysis. Am J Gastroenterol 2012;107:1001-10.
- Deshpande A, Pasupuleti V, Thota P, Pant C, Rolston DD, Hernandez AV, et al. Risk factors for recurrent Clostridium difficile infection: a systematic review and meta-analysis. Infect Control Hosp Epidemiol 2015;36:452-60.
- Arriola V, Tischendorf J, Musuuza J, Barker A, Rozelle JW, Safdar N. Assessing the risk of hospital-acquired clostridium difficile infection with proton pump inhibitor use: a meta-analysis. Infect Control Hosp Epidemiol 2016;37:1408-17.
- Willems RPJ, Van Dijk K, Ket JCF, Vandenbroucke-Grauls C. Evaluation of the association between gastric acid suppression and risk of intestinal colonization with multidrug-resistant microorganisms: a systematic review and meta-analysis. JAMA Intern Med 2020;180:561-71.
- Tran-Duy A, Connell NJ, Vanmolkot FH, Souverein PC, De Wit NJ, Stehouwer CDA, et al. Use of proton pump inhibitors and risk of iron deficiency: a population-based case-control study. J Intern Med 2019;285:205-14.
- Lam JR, Schneider JL, Quesenberry CP, Corley DA. Proton pump inhibitor and histamine-2 receptor antagonist use and iron deficiency. Gastroenterology 2017;152:821-9.e1.
- Lam JR, Schneider JL, Zhao W, Corley DA. Proton pump inhibitor and histamine 2 receptor antagonist use and vitamin B12 deficiency. JAMA 2013;310:2435-42.
- Jung SB, Nagaraja V, Kapur A, Eslick GD. Association between vitamin B12 deficiency and long-term use of acid-lowering agents: a systematic review and meta-analysis. Intern Med J 2015;45:409-16.
- Park CH, Kim EH, Roh YH, Kim HY, Lee SK. The association between the use of proton pump inhibitors and the risk of hypomagnesemia: a systematic review and meta-analysis. PLoS One 2014;9:e112558.
- Cheungpasitporn W, Thongprayoon C, Kittanamongkolchai W, Srivali N, Edmonds PJ, Ungprasert P, et al. Proton pump inhibitors linked to hypomagnesemia: a systematic review and meta-analysis of observational studies. Ren Fail 2015;37:1237-41.
- Bahtiri E, Islami H, Hoxha R, Gashi A, Thaçi K, Karakulak Ç, et al. Proton pump inhibitor use for 12 months is not associated with changes in serum magnesium levels: a prospective open label comparative study. Turk J Gastroenterol 2017;28:104-9.
- Islam MM, Poly TN, Walther BA, Dubey NK, Anggraini Ningrum DN, Shabbir SA, et al. Adverse outcomes of long-term use of proton pump inhibitors: a systematic review and meta-analysis. Eur J Gastroenterol Hepatol 2018;30:1395-405.
- Ahn JS, Eom CS, Jeon CY, Park SM. Acid suppressive drugs and gastric cancer: a meta-analysis of observational studies. World J Gastroenterol 2013;19:2560-8.
- Tran-Duy A, Spaetgens B, Hoes AW, De Wit NJ, Stehouwer CD. Use of proton pump inhibitors and risks of fundic gland polyps and gastric cancer: systematic review and meta-ranalysis. Clin Gastroenterol Hepatol 2016;14:1706-19.e5.
- Brusselaers N, Wahlin K, Engstrand L, Lagergren J. Maintenance therapy with proton pump inhibitors and risk of gastric cancer: a nationwide population-based cohort study in Sweden. BMJ Open 2017;7:e017739.
- Cheung KS, Chan EW, Wong AYS, Chen L, Wong ICK, Leung WK. Long-term proton pump inhibitors and risk of gastric cancer development after treatment for Helicobacter pylori: a population-based study. Gut 2018;67:28-35.
- Bradley MC, Murray LJ, Cantwell MM, Hughes CM. Proton pump inhibitors and histamine-2-receptor antagonists and pancreatic cancer risk: a nested case-control study. Br J Cancer 2012;106:233-9.
- Kearns MD, Boursi B, Yang YX. Proton pump inhibitors on pancreatic cancer risk and survival. Cancer Epidemiol 2017;46:80-4.
- Nochaiwong S, Ruengorn C, Awiphan R, Koyratkoson K, Chaisai C, Noppakun K, et al. The association between proton pump inhibitor use and the risk of adverse kidney outcomes: a systematic review and meta-analysis. Nephrol Dial Transplant 2018;33:331-42.
- Hung SC, Liao KF, Hung HC, Lin CL, Lai SW, Lee PC, et al. Using proton pump inhibitors correlates with an increased risk of chronic kidney disease: a nationwide database-derived case-controlled study. Fam Pract 2018;35:166-71.
- Klatte DCF, Gasparini A, Xu H, De Deco P, Trevisan M, Johansson ALV, et al. Association between proton pump inhibitor use and risk of progression of chronic kidney disease. Gastroenterology 2017;153:702-10.
- Ngamruengphong S, Leontiadis GI, Radhi S, Dentino A, Nugent K. Proton pump inhibitors and risk of fracture: a systematic review and meta-analysis of observational studies. Am J Gastroenterol 2011;106:1209-18.
- Yu EW, Bauer SR, Bain PA, Bauer DC. Proton pump inhibitors and risk of fractures: a meta-analysis of 11 international studies. Am J Med 2011;124:519-26.
- Zhou B, Huang Y, Li H, Sun W, Liu J. Proton-pump inhibitors and risk of fractures: an update meta-analysis. Osteoporos Int 2016;27:339-47.
- Cai D, Feng W, Jiang Q. Acid-suppressive medications and risk of fracture: an updated meta-analysis. Int J Clin Exp Med 2015;8:8893-904.
- Harding BN, Weiss NS, Walker RL, Larson EB, Dublin S. Proton pump inhibitor use and the risk of fractures among an older adult cohort. Pharmacoepidemiol Drug Saf 2018;27:596-603.
- Paik JM, Rosen HN, Gordon CM, Curhan GC. Proton pump inhibitor use, H2-Receptor antagonist use, and risk of incident clinical vertebral fracture in women. Calcif Tissue Int 2018.
- Wijarnpreecha K, Thongprayoon C, Panjawatanan P, Ungprasert P. Proton pump inhibitors and risk of dementia. Ann Transl Med 2016;4:240.
- Hwang IC, Chang J, Park SM. A nationwide population-based cohort study of dementia risk among acid suppressant users. Am J Geriatr Psychiatry 2018.
- Tai SY, Chien CY, Wu DC, Lin KD, Ho BL, Chang YH, et al. Risk of dementia from proton pump inhibitor use in Asian population: a nationwide cohort study in Taiwan. PLoS One 2017;12:e0171006.
- Taipale H, Tolppanen AM, Tiihonen M, Tanskanen A, Tiihonen J, Hartikainen S. No association between proton pump inhibitor use and risk of Alzheimer's disease. Am J Gastroenterol 2017;112:1802-8.
- Gray SL, Walker RL, Dublin S, Yu O, Aiello Bowles EJ, Anderson ML, et al. Proton pump inhibitor use and dementia risk: prospective population-based study. J Am Geriatr Soc 2018;66:247-53.
- Park SK, Baek YH, Pratt N, Kalisch Ellett L, Shin JY. The uncertainty of the association between proton pump inhibitor use and the risk of dementia: prescription sequence symmetry analysis using a Korean healthcare database between 2002 and 2013. Drug Saf 2018;41:615-24.
- Batchelor R, Kumar R, Gilmartin-Thomas JFM, Hopper I, Kemp W, Liew D. Systematic review with meta-analysis: risk of adverse cardiovascular events with proton pump inhibitors independent of clopidogrel. Aliment Pharmacol Ther 2018;48:780-96.
- Shiraev TP, Bullen A. Proton pump inhibitors and cardiovascular events: a systematic review. Heart Lung Circ 2018;27:443-50.
- Xie Y, Bowe B, Li T, Xian H, Yan Y, Al-Aly Z. Risk of death among users of Proton Pump Inhibitors: a longitudinal observational cohort study of United States veterans. BMJ Open 2017;7:e015735.
- Xie Y, Bowe B, Yan Y, Xian H, Li T, Al-Aly Z. Estimates of all cause mortality and cause specific mortality associated with proton pump inhibitors among US veterans: cohort study. BMJ 2019;365:l1580.
- Shao YJ, Chan TS, Tsai K, Wu SY. Association between proton pump inhibitors and the risk of hepatocellular carcinoma. Aliment Pharmacol Ther 2018.
- Ahn JS, Park SM, Eom CS, Kim S, Myung SK. Use of proton pump inhibitor and risk of colorectal cancer: a meta-analysis of observational studies. Korean J Fam Med 2012;33:272-9.
- Hill AB. The environment and disease: association or causation? 1965. J R Soc Med 2015;108:32-7.
- Vaezi MF, Yang YX, Howden CW. Complications of proton pump inhibitor therapy. Gastroenterology 2017;153:35-48.
- Haastrup P, Paulsen MS, Begtrup LM, Hansen JM, Jarbol DE. Strategies for discontinuation of proton pump inhibitors: a systematic review. Fam Pract 2014;31:625-30.
- Wilsdon TD, Hendrix I, Thynne TR, Mangoni AA. Effectiveness of interventions to deprescribe inappropriate proton pump inhibitors in older adults. Drugs Aging 2017;34:265-87.
- Boghossian TA, Rashid FJ, Thompson W, Welch V, Moayyedi P, Rojas-Fernandez C, et al. Deprescribing versus continuation of chronic proton pump inhibitor use in adults. Cochrane Database Syst Rev 2017;3:CD011969.
- Murie J, Allen J, Simmonds R, De Wet C. Glad you brought it up: a patient-centred programme to reduce proton-pump inhibitor prescribing in general medical practice. Qual Prim Care 2012;20:141-8.
- Inadomi JM, Jamal R, Murata GH, Hoffman RM, Lavezo LA, Vigil JM, et al. Step-down management of gastroesophageal reflux disease. Gastroenterology 2001;121:1095-100.
- Björnsson E, Abrahamsson H, Simrén M, Mattsson N, Jensen C, Agerforz P, et al. Discontinuation of proton pump inhibitors in patients on long-term therapy: a double-blind, placebo-controlled trial. Aliment Pharmacol Ther 2006;24:945-54.
- Zwisler JE. Discontinuation of long-term antisecretory treatment in general practice [dissertation]. Odense: University of Southern Denmark; 2008.