Prikkelbaredarmsyndroom (PDS)
Begrippen
Naar Volledige tekst ›Prikkelbaredarmsyndroom (PDS)
PDS: terugkerende episodes van buikpijn die samenhangen met veranderingen en/of wisselingen in het ontlastingspatroon (in vorm en/of frequentie). Er wordt onderscheid gemaakt in:
- PDS met vooral obstipatie (PDS-C)
- PDS met vooral diarree (PDS-D)
- PDS-mengvorm (PDS-M).
Richtlijnen diagnostiek
Naar Volledige tekst ›Anamnese
Naar Volledige tekst ›Vraag naar:
- Kernsymptomen:
- terugkerende buikpijn of een ongemakkelijk of opgeblazen gevoel in de buik
- veranderingen en/of wisselingen in het ontlastingspatroon (frequentie en/of vorm)
- Overige symptomen:
- obstipatie
- diarree
- slijm bij de ontlasting
- winderigheid
- meer of minder klachten na eten
- meer of minder klachten na de ontlasting
- misselijkheid
- Overige kenmerken (waaronder alarmsymptomen) die andere aandoening dan PDS waarschijnlijker maken:
- rectaal bloedverlies (dat niet te verklaren is door bijvoorbeeld hemorroïden, fissuren, NSAID’s of antistolling; zie NHG-Standaard Rectaal bloedverlies)
- verandering in het defecatiepatroon gedurende > 2 weken naar hogere frequentie (≥ 3 × per dag), nachtelijke diarree en/of (water)dunne consistentie
- onbedoeld/onverklaard gewichtsverlies
- begin van de klachten op hogere leeftijd (≥ 50 jaar)
- eerstegraadsfamilielid met een inflammatoire darmziekte of coeliakie, of met een colorectaal, ovarium- of endometriumcarcinoom < 70 jaar
- cyclusgebonden buikpijn
- Voedingspatroon
- Frequentie en mate van lichaamsbeweging
Lichamelijk onderzoek
Naar Volledige tekst ›- Inspecteer, ausculteer en palpeer de buik.
- Verricht op indicatie een rectaal toucher en/of vaginaal toucher.
Aanvullend onderzoek
Naar Volledige tekst ›- Alleen noodzakelijk bij kenmerken (zoals alarmsymptomen, zie begrippen) die een andere aandoening dan PDS waarschijnlijker maken.
- Verricht laagdrempelig aanvullend onderzoek naar coeliakie bij patiënten met PDS-D of PDS-M en patiënten met een eerstegraadsfamilielid met coeliakie (zie NHG-Standaard Voedselovergevoeligheid).
- Verricht een calprotectinetest waarbij er op basis van niet-acute, recidiverende (3-6 maanden) klachten van diarree een verhoogd risico op inflammatoire darmziekten is.
Evaluatie
Naar Volledige tekst ›- Er is sprake van PDS bij (terugkerende) episodes van buikpijn of een ongemakkelijk gevoel in de buik die samenhangen met veranderingen of wisselingen in het ontlastingspatroon (frequentie en/of vorm).
- Let op kenmerken die een andere aandoening dan PDS waarschijnlijker maken (zoals inflammatoire darmziekten, coeliakie, maligniteit).
Richtlijnen beleid
Naar Volledige tekst ›Zie tabel 14 voor een overzicht van behandelingen.
Voorlichting en advies
Naar Volledige tekst ›Informeer patiënten in een zo vroeg mogelijk stadium over mogelijke verklaringen, prognose en bijbehorende klachten.
Zelfzorg en niet-medicamenteuze behandeling
Naar Volledige tekst ›- Geef adviezen over ongerustheid, vermijdingsgedrag, stressfactoren, voeding, probiotica en/of lichaamsbeweging.
- Adviseer de richtlijnen goede voeding van de Gezondheidsraad.
- Pas voeding aan bij één of enkele voedingsgerelateerde triggers, met behoud van een evenwichtig voedingspatroon.
- Overweeg psylliumvezels (als zelfzorg) wanneer de voedingsadviezen onvoldoende verbetering geven, of de voeding te weinig vezels bevat.
- We bevelen een glutenvrij dieet niet aan.
- Psychologische behandelingen zijn effectief voor het verminderen van darmklachten. Laat de keuze afhangen van motivatie en voorkeur van de patiënt (zie ook Consultatie en verwijzing).
Medicamenteuze behandeling
Naar Volledige tekst ›Behandeling met geneesmiddelen is bij slechts een deel van de patiënten met PDS zinvol gebleken. De effectiviteit van de meeste voorgeschreven middelen is voor de brede PDS-patiëntengroep onvoldoende vastgesteld.
- Behandeling met geneesmiddelen is bij slechts een deel van de patiënten zinvol en effectief.
- Overweeg bij PDS-C: laxantia zoals psylliumzaad en macrogol (bij bijwerkingen eventueel magnesiumhydroxide), bij onvoldoende effect: overweeg linaclotide.
- Overweeg bij PDS-D: psylliumzaad of loperamide.
- Overweeg indien pijnklachten op de voorgrond staan: paracetamol, maagsapresistente pepermuntolie.
- Overweeg antidepressiva vanwege hun invloed op de pijnperceptie en op eventuele psychische comorbiditeit.
Controles
Naar Volledige tekst ›- Nodig de patiënt expliciet uit om een nieuwe afspraak te maken als er kenmerken (alarmsymptomen, zie begrippen) optreden die een andere aandoening waarschijnlijker maken (zie Evaluatie).
- Evalueer het gebruik van medicatie, indien voorgeschreven.
Consultatie en verwijzing
Naar Volledige tekst ›Mdl-arts
- Consulteer de mdl-arts bij een afwijkende calprotectinebepaling van 50-100 microgram/gram feces; verwijs naar de mdl-arts bij > 100 microgram/gram feces.
- Consulteer of verwijs bij:
- kenmerken (waaronder alarmsymptomen) die een andere aandoening waarschijnlijker maken
- diagnostische onzekerheid (van arts en/of patiënt)
- een vastlopend behandeltraject of complexe achtergrond
Diëtist
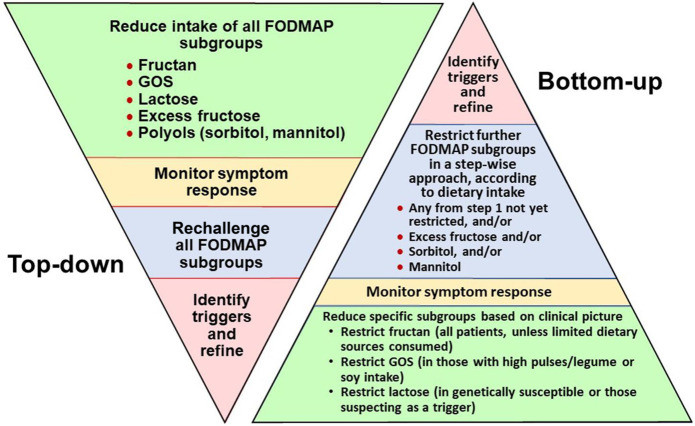
Verwijs naar de diëtist bij aanwezigheid van meerdere voedingsgerelateerde triggers, een onevenwichtig voedingspatroon en/of bij indicatie voor het laag-FODMAP-dieet.
Psychologische behandeling
- Bespreek de voordelen (mogelijk effect) en nadelen (kosten, tijdsinvestering) met de patiënt.
- Verwijs naar een gz-psycholoog, klinisch psycholoog, psychotherapeut of hypnotherapeut met kennis over en ervaring met PDS.
Bedrijfsarts
Verwijs naar de bedrijfsarts bij hinder van de PDS-klachten bij of door het werk.
Belangrijkste wijzigingen
Naar Samenvatting ›- Verricht een calprotectinetest bij patiënten waarbij er op basis van niet-acute, recidiverende (3-6 maanden) klachten van diarree een verhoogd risico op inflammatoire darmziekten is.
- Mebeverine en scopolaminebutyl worden niet langer aanbevolen.
- Overweeg bij patiënten met PDS bij wie buikpijn op de voorgrond staat een (proef)behandeling met pepermuntolie (maagsapresistente capsules).
- Overweeg linaclotide bij patiënten met PDS-C (vooral obstipatieklachten) die onvoldoende baat hebben gehad van niet-medicamenteuze behandelingen (zoals aanpassing van de voeding) en laxantia.
Kernboodschappen
Naar Samenvatting ›- Kenmerkend voor het prikkelbaredarmsyndroom (PDS) zijn terugkerende episodes van buikpijn die samenhangen met veranderingen of wisselingen in het ontlastingspatroon (frequentie en/of vorm).
- De diagnose PDS kan gesteld worden op basis van anamnese en lichamelijk onderzoek mits er geen alarmsymptomen zijn.
- Aanvullend onderzoek heeft niet tot doel PDS aan te tonen, maar andere aandoeningen minder waarschijnlijk te maken.
- Doel van het beleid is het geruststellen van de patiënt en het verminderen van de hinder die de patiënt van de klachten ondervindt.
- Alle behandelingen van PDS zijn slechts bij een deel van de patiënten effectief.
Inleiding
Naar Samenvatting ›Scope
Naar Samenvatting ›Richtlijnen voor de diagnostiek en het beleid bij volwassen patiënten met het prikkelbaredarmsyndroom (PDS) in de huisartsenpraktijk.
Afstemming
Naar Samenvatting ›Deze NHG-Standaard is gelijktijdig (gedeeltelijk) gereviseerd en afgestemd met de Multidisciplinaire richtlijn Diagnostiek en behandeling van het prikkelbaredarmsyndroom (PDS).
Achtergronden
Naar Samenvatting ›Begrippen
Naar Samenvatting ›Prikkelbaredarmsyndroom (PDS)
- Kenmerkend voor het prikkelbaredarmsyndroom (PDS) zijn terugkerende episodes van buikpijn die samenhangen met veranderingen en/of wisselingen in het ontlastingspatroon (in vorm en/of frequentie).
- Men onderscheidt 3 vormen:
- PDS met vooral obstipatie (PDS-C)
- PDS met vooral diarree (PDS-D)
- PDS-mengvorm (PDS-M).
Er bestaat geen biomarker die PDS kan aantonen. De diagnose wordt gesteld op basis van anamnese en lichamelijk onderzoek en bij afwezigheid van alarmsymptomen. Er zijn diverse criteria in omloop. Een internationale werkgroep van mdl-artsen, psychiaters en andere deskundigen heeft criteria opgesteld voor PDS en andere functionele mdl aandoeningen. Deze zogeheten Rome-criteria werden voor het eerst opgesteld in 1990 (Rome I) en gereviseerd in 1999 (Rome II), 2006 (Rome-III) en 2016 (Rome-IV). De Rome-criteria zijn oorspronkelijk opgesteld voor onderzoeksdoeleinden, maar zijn daarna steeds meer gebruikt als diagnostische criteria voor PDS in de tweede lijn (zie tabel 1).
|
Recidiverende buikpijn, gemiddeld ≥ 1 dag per week in de laatste 3 maanden en geassocieerd met ≥ 2 van de volgende:
|
|
|
EN |
|
|
Aan deze criteria is de afgelopen 3 maanden voldaan, met het begin van de symptomen ≥ 6 maanden voorafgaand aan de diagnose |
|
|
Subtypes (Bristol stool form type): |
|
|---|---|
|
PDS-C (constipatie): |
≥ 25% van de stoelgang is van het type 1 of 2 en < 25% van het type 6 of 7 |
|
PDS-D (diarree): |
≥ 25% van de stoelgang is van het type 6 of 7 en < 25% van het type 1 of 2 |
|
PDS-M (gemengd) |
≥ 25% van de stoelgang is van het type 1 of 2 en ≥ 25% van het type 6 of 7 |
|
PDS-U (ongeïdentificeerd) |
patiënten voldoen aan de criteria voor PDS, maar hebben geen van de 3 genoemde subtypes |
De Rome-IV-criteria definiëren PDS als de aanwezigheid van buikpijn, gerelateerd aan defecatie, geassocieerd met een verandering in ontlastingsfrequentie en/of ontlastingsvorm. Patiënten worden vervolgens in subgroepen ingedeeld volgens hun overheersende ontlastingspatroon om de therapie te kunnen sturen. De subgroepen zijn PDS met diarree (PDS-D), PDS met constipatie (PDS-C), PDS met gemengde stoelgang (PDS-M) of PDS niet-geclassificeerd (PDS-U).
Het hebben van buikpijnklachten in combinatie met de tijdscriteria onderscheidt PDS van andere functionele darmaandoeningen, zoals functionele constipatie, functionele diarree en functioneel opgeblazen gevoel of opgezette buik.
De Rome-IV-criteria zijn op een aantal punten specifieker dan de Rome-III-criteria waren. De term abdominal discomfort is uit de definitie gehaald, omdat dit een vage term was die niet in alle talen goed te vertalen bleek. Ten tweede werd de minimaal vereiste buikpijnfrequentie verhoogd van ≥ 3 dagen per maand naar ≥ 1 dag per week. De hogere frequentie werd gekozen omdat dit ertoe zou leiden dat minder gezonde mensen in de algemene bevolking ten onrechte de diagnose PDS zouden krijgen (met risico op ongewenste medicalisering en onnodige medicatie). Een derde verandering was dat de buikpijn niet langer verlicht hoeft te worden door defecatie, maar gerelateerd moet zijn aan de ontlasting. Daarmee wordt erkend dat sommige patiënten met PDS melden dat hun pijn verergert na de stoelgang. Dat de Rome-IV-criteria strikter zijn, is te zien aan de prevalentie van PDS in de Nederlandse bevolking: 9,7% volgens de Rome-III-criteria en 3,8% volgens de Rome-IV-criteria.
PDS is een chronische aandoening. Huisartsen hanteren de Rome-criteria in beperkte mate en gebruiken geen strikte begrenzingen ten aanzien van de duur van de klachten. Dit lijkt een van de belangrijkste verschillen tussen het diagnostische proces in de huisartsenpraktijk en dat in de Rome-criteria. Waar de Rome-IV-criteria uitgaan van de aanwezigheid van symptomen gedurende ≥ 3 van de voorafgaande 6 maanden, diagnosticeren huisartsen PDS al bij een kortere ziektegeschiedenis. In de eerste lijn kan de diagnose PDS bij jongere patiënten desondanks redelijkerwijs gesteld worden op basis van de besproken symptomen en bij afwezigheid van kenmerken die een somatische aandoening waarschijnlijker maken, vanwege de lage voorafkans op een onderliggende organische aandoening in deze groep.
In een onderzoek in de eerste lijn met 5 jaar follow-up is de positieve diagnose PDS (dus gebaseerd op symptomen) vergeleken met de diagnose per exclusionem. In de groep waarin de positieve diagnose werd gesteld, werden geen patiënten gemist met inflammatoire darmziekten, coeliakie en gastro-intestinale of gynaecologische tumoren. Ook waren de zorgkosten minder. De health-related quality of life was vergelijkbaar in beide groepen.
Epidemiologie
Naar Samenvatting ›- De incidentie van ICPC-code D93 (Prikkelbaredarmsyndroom) in de huisartsenpraktijk is 7 per 1000 patiënten per jaar.
- De incidentie ligt hoger bij vrouwen (10 per 1000) dan bij mannen (4 per 1000).
- De prevalentie in de huisartsenpraktijk is 13 per 1000 patiënten (19 voor vrouwen, 7 voor mannen).
- De diagnose wordt voornamelijk gesteld in de leeftijd 19-65 jaar.
- PDS veroorzaakt vaak langdurig klachten; een derde tot de helft van de mensen met klachten die passen bij PDS zoekt hulp.
- In Nederland wordt naar schatting 90% van de patiënten met PDS behandeld in de eerste lijn.
De epidemiologische gegevens voor Nederland zijn afkomstig van NIVEL Zorgregistraties Eerste Lijn.
Ze zijn afkomstig uit bijna 400 huisartsenpraktijken met bijna 1,5 miljoen ingeschreven patiënten. De selectie van huisartsenpraktijken is gebaseerd op de kwaliteit van hun registratie van ICPC-codes en wordt representatief geacht voor de Nederlandse bevolking.
Internationaal is er een brede variatie in prevalenties van PDS, met uitersten van 1,1% (Frankrijk en Iran) tot 35,5% (Mexico). De gepoolde wereldwijde prevalentie is 8,8%.
De prevalentie van PDS in de algemene Nederlandse bevolking bedraagt 3,8% op basis van de Rome-IV-criteria en 9,7% op basis van de ruimere Rome-III-criteria. De internationale prevalentie volgens de Rome-IV-criteria is naar schatting 4,1% (5,2% bij vrouwen en 2,9% bij mannen).
Wat oudere data uit Nederlandse morbiditeitsregistraties in de huisartsenpraktijk laten grote verschillen zien, afhankelijk van de PDS-definitie en de gebruikte Rome-criteria. De Continue Morbiditeitsregistratie geeft voor de periode 1998-2006 een incidentie bij mannen van 2-3 en bij vrouwen van 6-7 per 1000 patiënten per jaar, en een prevalentie van 4 per 1000 mannen en 10 per 1000 vrouwen.
De diagnose PDS wordt vooral gesteld op jongere leeftijd. In Nederland zijn de prevalenties 5,3% in de leeftijd 18-39 jaar, 3,7% in de leeftijd 40-64 jaar en 1,7% in de leeftijd ≥ 65 jaar. Van de mensen met klachten die passen bij PDS zoekt 33-50% hulp. Naar schatting 90% van de patiënten met PDS wordt behandeld in de eerste lijn; van de patiënten met chronische darm- en buikklachten in de eerste lijn heeft ongeveer de helft een somatisch onvoldoende verklaarde maagdarmstoornis, de meesten PDS. PDS veroorzaakt vaak langdurig klachten. Deze klachten zijn regelmatig ernstig invaliderend, hebben grote impact op de kwaliteit van leven en zorgen voor ziekteverzuim en beperkingen in het sociaal functioneren.
Etiologie
Naar Samenvatting ›- PDS is een aandoening met vaak een chronisch beloop.
- De episodes van buikpijn hangen samen met een veranderd en/of wisselend ontlastingspatroon en kunnen komen en gaan.
- Het pathofysiologische mechanisme is complex en nog niet volledig opgehelderd.
- Een aantal mogelijke pathofysiologische mechanismen zijn de volgende:
- verhoogde gevoeligheid van de darmen
- veranderingen in darmbeweeglijkheid
- verstoorde balans tussen verschillende soorten darmbacteriën (microbioomveranderingen gaan meestal gepaard met veranderde metabole functie)
- versterkte immuniteit en toegenomen permeabiliteit van de darmen
- versterkte signaaloverdracht tussen centraal en autonoom zenuwstelsel
De pathofysiologische mechanismen van PDS zijn complex en nog niet volledig opgehelderd; het gaat om een combinatie van gastro-intestinale en psychologische factoren. Ook genetische factoren, omgevingsfactoren, infecties en vroege ongunstige levensgebeurtenissen kunnen een persoon vatbaar maken voor het ontwikkelen van PDS.
Chronische stress, psychologische symptomen, bepaalde copingmechanismen en negatieve opvattingen over symptomen en ziekte kunnen de frequentie en ernst van de symptomen verhogen.
In het maag-darmstelsel zijn veranderingen in het microbioom, laaggradige slijmvliesontsteking en epitheliale disfunctie beschreven, en ook voedingsfactoren en darminfecties spelen een rol.
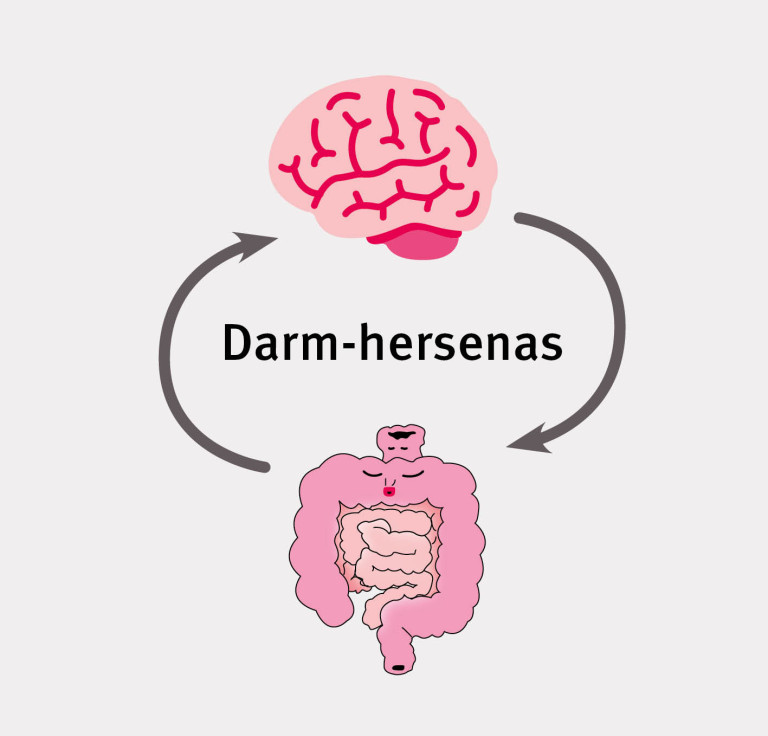
Steeds duidelijker wordt dat bij PDS, en meer in het algemeen bij functionele gastro-intestinale stoornissen, interacties tussen de darmen en de hersenen een rol spelen. In de Rome-IV-criteria is de term ‘functioneel’ dan ook geschrapt en zijn deze aandoeningen geherdefinieerd als ‘stoornissen in de darm-hersenas’.
Hungin et al. integreren 3 hoofdhypothesen tot een verklarend model dat de basis vormt voor gestructureerde uitleg aan de patiënt:
- veranderingen in perifere regulatie van de darmfunctie (inclusief sensorische en secretoire mechanismen)
- veranderde signaaloverdracht tussen hersenen en darm (inclusief viscerale overgevoeligheid)
- psychische klachten
Verschillende samenhangende pathofysiologische mechanismen zijn mogelijk verklarende factoren op basis waarvan PDS zou kunnen ontstaan. Deze worden hieronder beschreven.
Verhoogde gevoeligheid van de darmen
De hypothese van viscerale hypersensitiviteit (hyperalgesie) vindt zijn oorsprong in de waarneming dat patiënten met PDS bij luchtinsufflatie van het colon en bij ballondilatatie van het rectum meer pijn ervaren dan andere patiënten. Veel argumenten voor viscerale hyperalgesie zijn ontleend aan de overeenkomst in symptomen tussen inflammatoire en functionele darmaandoeningen, en aan dierexperimenteel onderzoek, al zijn er ook steeds meer humane data beschikbaar. Een tijdlang is er ook aandacht geweest voor de rol van serotonine (5-hydroxytriptamine-3). Een verandering in de serotoninereceptoren als gevolg van infecties, stress of andere agentia zou leiden tot blijvende verandering in het waarnemen van fysiologische prikkels in de darm. Van de patiënten met PDS heeft 20-60% een verhoogde gevoeligheid voor fysiologische (bijvoorbeeld mechanische) stimuli. Overgevoeligheid voor het uitzetten dan de darm wordt vaker gerapporteerd door patiënten met PDS-D dan door patiënten met PDS-C, en is positief gecorreleerd met de ernst van de symptomen (gecorrigeerd voor psychologische comorbiditeit en verhoogde neiging om symptomen te melden). Ongeveer 20% van de patiënten met PDS is minder gevoelig of ongevoelig voor mechanische uitzetting van de darm (vaker patiënten met PDS-C dan patiënten met PDS-D). De mate van ongevoeligheid correleerde met een opgezette buik (gemeten toename van de buikomtrek).
Veranderingen in de darmbeweeglijkheid
Onderzoek naar verstoorde darmmotiliteit gaat uit van een stoornis in de intrinsieke activiteit van het intestinale gladde spierweefsel en in de contractiliteit van dunne darm en colon. De darm kent 2 typen glad spierweefsel: circulaire spieren die over korte segmenten tonisch en over grotere gebieden langzaam fasisch contraheren (en daarmee de doorvoer van de darminhoud verzorgen), en longitudinale spieren die een geringere rol spelen (voornamelijk pompfunctie). Uit onderzoek naar de darmmotiliteit, waarbij druk en passagesnelheid worden gemeten, blijkt dat de beweeglijkheid (en doorvoer) door het colon verstoord is bij 10-20% van de patiënten met PDS-C en PDS-M en bij 25-45% van de patiënten met PDS-D.
Patiënten met een normale doorvoer kunnen na de maaltijd en na vasten nog steeds een afwijkende motiliteit hebben.
De passagetijd door de darm hangt omgekeerd evenredig samen met de consistentie van de ontlasting en (in mindere mate) met de ontlastingsfrequentie.
Bij patiënten met PDS-C wordt een verminderde motiliteit gezien, minder contracties van het colon en een vertraagde doorvoer. Bij patiënten met PDS-D wordt een toegenomen motiliteit gezien, meer contracties van het colon en een versnelde doorvoer.
Symptomen zoals pijn in het abdomen, opgeblazen gevoel en flatulentie hangen nauwelijks samen met de doorvoer door het colon. Bij patiënten met PDS-D hangen contracties van het colon met hoge amplitude samen met pijn in het abdomen.
Veranderingen in de darmmotiliteit kunnen beïnvloed worden door veranderingen in het serotoninemetabolisme. Bij patiënten met PDS-D worden hoge serotoninespiegels gezien, bij patiënten met PDS-C lage serotoninespiegels.
Verstoorde balans tussen verschillende soorten darmbacteriën
Er zijn aanwijzingen dat bacteriële, virale en parasitaire infecties van het maag-darmstelsel PDS kunnen triggeren.
Dit wordt postinfectieuze PDS genoemd en ontstaat bij ongeveer 10% van de patiënten na een infectieuze enteritis. Risicofactoren zijn geslacht (vrouw), jongere leeftijd, psychische problemen tijdens of voorafgaand aan de acute gastro-enteritis en ernst van de acute episode.
De pathogenese van postinfectieuze PDS wordt niet volledig begrepen. Veranderingen in het darmmicrobioom, het darmepitheel, de serotoninehuishouding en het immuunsysteem lijken een rol te spelen naast psychologische factoren zoals angst, depressie, somatisatie en neuroticisme tijdens of in de maanden voorafgaand aan gastro-intestinale infectie.
Een werkgroep van de Rome Foundation heeft in 2019 een beslisregel opgesteld voor de diagnostiek en behandeling van postinfectieuze PDS.
Antibioticagebruik hangt mogelijk samen met een verandering in het microbioom die mogelijk een rol zou kunnen spelen bij ófwel de ontwikkeling ófwel de verbetering van PDS-symptomen.
Veranderingen in het microbioom kunnen invloed hebben op de darmmotiliteit, de darmpermeabiliteit, de consistentie van de ontlasting en de viscerale gevoeligheid.
Er is geen sluitend bewijs voor een specifiek profiel van het microbioom bij PDS. En het is onduidelijk of veranderingen in het microbioom secundair zijn aan of verband houden met andere factoren, zoals dieet, medicijnen en veranderde fysiologie.
Meestal gaan veranderingen in het microbioom gepaard met een veranderde metabole functie (metaboloom).
Versterkte immuunfunctie en toegenomen permeabiliteit van de darmen
Een laaggradige ontsteking van het darmslijmvlies kan ontstaan door een verminderde epitheliale barrière, een veranderde stress- en immuunrespons of een disbalans in het microbioom en het metaboloom. Dit kan in verband gebracht worden met postinfectieuze PDS.
Bij histologisch onderzoek wordt vaak een toegenomen aantal mestcellen gezien.
Er is geen consensus of ook het aantal T-cellen en de cytokinespiegels in de perifere bloedsomloop abnormaal zijn.
Toegenomen permeabiliteit van de darmen wordt voornamelijk gezien bij PDS-D.
Versterkte signaaloverdracht tussen centraal en autonoom zenuwstelsel
In onderzoeksverband is bij PDS-patiënten veranderde activiteit gezien in hersengebieden die verantwoordelijk zijn voor cognitieve verwerking en emotionele en autonome reacties op viscerale en somatische stimuli. Dit hing samen met viscerale overgevoeligheid en symptoomgerelateerde angst. Het autonome zenuwstelsel verzorgt de communicatie tussen darmen en hersenen. Bij patiënten met PDS wordt frequent een verminderde activiteit van het parasympatische zenuwstelsel en een toegenomen activiteit van het sympatische zenuwstelsel gezien. Bij deze communicatie tussen darmen en hersenen spreekt men wel over de ‘darm-hersenas’.
In de NICE-richtlijn Diagnosis and management of irritable bowel syndrome in primary care wordt de vraag gesteld wat onderzoek bij patiënten met een recente diagnose PDS opbrengt aan onderliggende pathologie. Er wordt 1 systematische review beschreven van 6 diagnostische onderzoeken en 2 onderzoeken gepubliceerd na deze review. Een aanvullende zoekopdracht tot september 2009 leverde geen nieuw onderzoek op. Elk van de 8 geïncludeerde onderzoeken gebruikte verschillende inclusiecriteria.
In de 8 onderzoeken is gekeken welke tests zijn uitgevoerd en wat de opbrengst van die tests was. Een positieve testuitslag moest gerelateerd zijn aan een duidelijke diagnose die als de oorzaak van de klacht kon worden beschouwd. Voor lactose- intolerantie, coeliakie en parasieten aangetoond in feces, werd toegevoegd dat de diagnose moest worden bevestigd door een verbetering van de klachten na behandeling. In 4 onderzoeken werd gekeken naar de opbrengst van coloscopie. Van de 716 patiënten met PDS werd bij 4 (0,6%) patiënten inflammatoire darmziekte gediagnostiseerd, en bij 1 patiënt (0,1%) een colorectaal carcinoom. In 2 onderzoeken werd de opbrengst van testen op lactose- intolerantie onderzocht. Bij geen van de 1308 patiënten met PDS werd de diagnose lactoseintolerantie gesteld. In 1 onderzoek kon naar de opbrengst van onderzoek naar de schildklierfunctie worden gekeken. Bij 1209 patiënten met PDS werd TSH en T4 bepaald. Bij 3% werd een hypothyreoïdie gevonden en bij 3% een hyperthyreoïdie. In 2 onderzoeken werd gekeken naar de opbrengst van fecaal onderzoek naar parasieten. Van de 1324 geteste patiënten werd bij 19 (1,4%) een parasiet gevonden. Geen van deze parasieten waren pathogeen. In 2 onderzoeken werd gescreend op coeliakie (IgA/IgG antigliadine en EMA). Bij 66 van de 300 geteste patiënten met PDS was de test positief en 14 (4,7%) van deze patiënten hadden een door biopsie bevestigde coeliakie. In het tweede onderzoek hadden 4 van de 123 patiënten met PDS (3,3%) een door biopsie bevestigde coeliakie (in dit onderzoek was het aantal positieve serologische tests onbekend). Eén onderzoek bekeek de opbrengst van abdominale echografie. Bij 125 patiënten met PDS werden 22 afwijkingen gevonden, geen hiervan kon worden herleid tot een diagnose die de klachten kon verklaren.
In tabel 2 is het voorkomen van de verschillende aandoeningen bij patiënten met PDS vergeleken met door Cash gepresenteerde prevalenties in de algemene bevolking. Alleen coeliakie bleek duidelijk vaker voor te komen bij mensen met PDS.
|
GI-aandoeningen |
Patiënten met PDS (%) |
Algemene bevolking (%) |
|---|---|---|
|
Colitis/inflammatoire darmziekte |
0,51-0,98 |
0,3-1,2 |
|
Colorectale kanker |
0-0,51 |
4-6 |
|
Coeliakie (CBO-coeliakie) |
4,67 |
0,25-1 |
|
Gastro-intestinale infectie |
0-1,7 |
niet bekend |
|
Schildklierdisfunctie |
6 |
5-9 |
|
Lactose malabsorptie |
22-26 |
25 |
Richtlijnen diagnostiek
Naar Samenvatting ›Anamnese
Naar Samenvatting ›Klachten en verschijnselen die passen bij PDS
Naar Samenvatting ›- Kernsymptomen:
- buikpijn of een ongemakkelijk of opgeblazen gevoel in de buik
- veranderingen of wisselingen in het ontlastingspatroon (frequentie en/of vorm)
- Overige symptomen:
- obstipatie (niet alleen door frequentie, maar ook door samenstelling bepaald: ook bij meerdere keren ontlasting per dag kan er sprake zijn van obstipatie)
- diarree
- slijm bij de ontlasting
- winderigheid
- meer of minder klachten na eten
- meer of minder klachten na de ontlasting
- misselijkheid
- Overige factoren die de diagnose PDS waarschijnlijker kunnen maken:
- recente ingrijpende gebeurtenis of periode van grote spanning
- aanwezigheid van somatische en psychiatrische comorbiditeit (met name angst en depressie)
- heftige darminfectie in het verleden
- voorgeschiedenis met aanhoudende lichamelijke klachten (ALK)
- aanwezigheid van PDS in de familie
- frequent consultatiepatroon
- Inventariseer kenmerken (waaronder alarmsymptomen) die een andere aandoening dan PDS waarschijnlijker maken (zoals inflammatoire darmziekte, coeliakie, maligniteit):
- rectaal bloedverlies (bloed in de ontlasting dat niet te verklaren is door bijvoorbeeld hemorroïden, fissuren, NSAID’s of antistolling; zie NHG-Standaard Rectaal bloedverlies)
- verandering in de stoelgang gedurende > 2 weken naar hogere frequentie (≥ 3 × per dag), nachtelijke diarree en/of (water)dunne consistentie
- onbedoeld en onverklaard gewichtsverlies (> 5% in 1 maand of > 10% in 6 maanden)
- begin van de klachten op hogere leeftijd (≥ 50 jaar)
- eerstegraadsfamilielid met een inflammatoire darmziekte of coeliakie, of met een colorectaal, ovarium- of endometriumcarcinoom < 70 jaar
- cyclusgebonden buikpijn
- Schat met 2 oriënterende vragen het risico op het bestaan van een onevenwichtig voedingspatroon in:
- hebben de PDS-klachten in de beleving van de patiënt een relatie met bepaalde voedingsmiddelen?
- vermijdt de patiënt om die reden bepaalde voedingsmiddelen en zo ja, welke?
- Informeer naar de frequentie en de mate van lichaamsbeweging (lichaamsbeweging heeft invloed op de klachten van PDS).
Overig
- Besteed aandacht aan ziekte- of vermijdingsgedrag, angst voor bepaalde aandoeningen, gevolgen van de klachten voor het dagelijks leven, hobby’s, reacties uit de omgeving.
- Informeer naar relatie tussen klachten en werk: is er sprake van (frequent) verzuim vanwege de klachten? Leveren de klachten problemen op tijdens het werk? Is er sprake van werkgerelateerde stress die van invloed is op de klachten?
- Het acroniem SCEGS (somatisch, cognitief, emotioneel, gedragsmatig en sociaal) kan helpen om na te gaan of alle klachtdimensies zijn geëxploreerd.
Wanneer denken (huis)artsen in de dagelijkse praktijk aan de diagnose PDS? In een kwalitatief onderzoek heeft men geprobeerd om met 10 huisartsen met een speciale interesse voor gastro-enterologie en 2 gastro-enterologen uit 10 Europese landen die vraag te beantwoorden. Het onderzoek had tot doel om met behulp van een gevalideerde methode (de Nominal Group Technique (Rand version; NGT-R) consensus te bereiken over een diagnostisch framework voor PDS. De huisartsen en gastro-enterologen beoordeelden volgens de gevalideerde NGT-R methode 242 scenario’s op 4 domeinen: symptomen, sociale kenmerken en leefstijlkenmerken, psychologische kenmerken, en onderzoeken. Ze bereikten daarover in 46% van de stellingen consensus. Hieruit bleek dat verandering van de stoelgang, een opgeblazen gevoel en buikpijn definiërende kenmerken van PDS voor hen zijn. Aanvullende symptomen, zoals obstipatie, diarree, winderigheid of dyspepsie, kunnen de diagnose ondersteunen. De definiërende en ondersteunende PDS-symptomen kunnen per cultuur verschillen. De diagnose in de huisartsenpraktijk wordt ook bepaald door het ‘patiëntenprofiel’. Vrouwen hebben vaker PDS en er zijn familiepatronen van PDS door de generaties heen te herkennen. Enkele karakteristieken ondersteunen dit ‘PDS-profiel’: een frequent consultatiepatroon, een recent ingrijpend life event, verhoogde prevalentie van somatische en psychiatrische comorbiditeit, en een voorgeschiedenis met lichamelijk onverklaarde klachten.
Lichamelijk onderzoek
Naar Samenvatting ›- Verricht bij een eerste presentatie van buikklachten altijd lichamelijk onderzoek:
- inspecteer, ausculteer en palpeer de buik
- verricht op indicatie ook een rectaal toucher en/of vaginaal toucher, let hierbij op perianale afwijkingen (bijvoorbeeld fistels, abcessen) en op abnormale weerstand in abdomen, rectum of bekken
- Het lichamelijk onderzoek heeft tot doel een onderliggende somatische aandoening minder of meer waarschijnlijk te maken.
- Bevindingen bij het lichamelijk onderzoek maken geen deel uit van de diagnostische criteria voor PDS (zie Evaluatie).
Risicofactoren voor carcinomen
In het algemeen heeft iemand met een eerstegraadsfamilielid met een bepaalde vorm van kanker zoals colorectaal, ovarium- of endometriumcarcinoom een 2 × zo groot risico op het ontwikkelen van hetzelfde type kanker.
Rectaal bloedverlies
De gerapporteerde jaarprevalentie van rectaal bloedverlies bij volwassenen ≥ 20 jaar is 15,5-20%. De prevalentie daalt met de leeftijd. Van degenen die in het voorafgaande jaar rectaal bloedverlies hadden, bezocht 13,9% een arts.
In een observationeel onderzoek in de huisartsenpraktijk bedroeg de incidentie van rectaal bloedverlies 7 per 1000 volwassen patiënten per jaar. De incidentie steeg met de leeftijd.
In verschillende onderzoeken werden met endoscopie afwijkingen gevonden bij 14-44% van de mensen met rectaal bloedverlies. Het ging om inflammatoire afwijkingen, poliepen en colorectaal carcinoom.
Bij 2-4% van de volwassen patiënten met rectaal bloedverlies in de huisartsenpraktijk wordt een colorectaal carcinoom aangetoond.
Overige alarmsymptomen voor coloncarcinoom
In de eerste lijn stijgt de incidentie van coloncarcinoom met de leeftijd. De OR voor > 60 versus < 60 jaar is 2,8, de OR voor > 70 versus < 50 jaar is 8,2 (95%-BI 2,11 tot 31,82).
Patiënten met rectaal bloedverlies en een veranderd defecatiepatroon hebben een verhoogde kans op een coloncarcinoom (RR 1,9; 95%-BI 1,6 tot 2,2). In 1 observationeel onderzoek bij patiënten > 18 jaar met rectaal bloedverlies was de kans op coloncarcinoom niet hoger bij een veranderd defecatiepatroon. In 2 onderzoeken verhoogde bloed vermengd met de ontlasting de kans op een coloncarcinoom (OR 3,8; 95%-BI 1,4 tot 10,6). In een ander onderzoek had bloed vermengd met de ontlasting geen voorspellende waarde.
In 2 onderzoeken bij patiënten met rectaal bloedverlies verhoogde de afwezigheid van perianale afwijkingen (jeuk, ongemak, prolaps, pijn, schraalheid, zwellingen) de kans op coloncarcinoom, met in de eerste lijn een OR van 5,6 en in de tweede lijn een OR van 3,5 (95%-BI 2,9 tot 4,3; positief voorspellende waarde 12,5%).
In 2 onderzoeken blijken leeftijd, een veranderd defecatiepatroon en bloed in de ontlasting onafhankelijke voorspellers van coloncarcinoom. De aanwezigheid van de beide laatstgenoemde symptomen deed de kans op coloncarcinoom bij 70 jaar toenemen van 43 naar 86% en bij 60-jaar van 9 naar 44%.
Gewichtsverlies, loze aandrang, een eerste episode van rectaal bloedverlies of recidiverend rectaal bloedverlies zijn onvoldoende onderzocht om een uitspraak te kunnen doen over de voorspellende waarde voor coloncarcinoom.
Inflammatoire darmziekten
Bij 5% van de volwassen patiënten met rectaal bloedverlies in de huisartsenpraktijk wordt een inflammatoire darmziekte als oorzaak gevonden.
Chronische diarree (> 2 weken) verhoogt de kans op een inflammatoire darmziekte.
Een familielid met een inflammatoire darmziekte is de sterkste risicofactor voor het ontstaan van een inflammatoire darmziekte. Het levenslange risico op een inflammatoire darmziekte voor een patiënt met een eerstegraadsfamilielid met inflammatoire darmziekte is ongeveer 10%. Bij PDS is de voorspellende waarde van een positieve familieanamnese echter niet groot. Doordat PDS veel frequenter voorkomt dan inflammatoire darmziekten heeft de meerderheid van de mensen met een positieve familieanamnese voor inflammatoire darmziekte en buikklachten toch PDS [MDR Coeliakie en dermatitis herpetiformis 2022]. Tenesmi zijn een aanwijzing voor proctitis en versterken het vermoeden van inflammatoire darmziekte. Bij inspectie van de anus en rectaal toucher zijn perianale afwijkingen zoals anale verdikkingen (tags), fistels, fissura ani of een perianaal abces aanwijzingen voor de ziekte van Crohn. Deze (niet verder onderbouwde) conclusie is in tegenspraak met de bevinding uit onderzoek in de eerste lijn dat juist de afwezigheid van perianale symptomen bij rectaal bloedverlies (jeuk, ongemak, prolaps, pijn, schraalheid en zwellingen) de kans op inflammatoire darmziekte verhoogde.
Extra-intestinale verschijnselen zoals artralgie, artritis, erythema nodosum, orale aften en inflammatoire oogafwijkingen kunnen het vermoeden van inflammatoire darmziekte versterken. Een voelbare weerstand (meestal) in de rechter onderbuik verhoogt de kans op inflammatoire darmziekte.
Microscopische colitis
Microscopische colitis is een chronische ontstekingsziekte die vaak chronische waterige, niet-bloederige diarree veroorzaakt en gepaard kan gaan met buikpijn, nachtelijke diarree, aandrang, fecale incontinentie en licht gewichtsverlies. Vaak zijn er bij endoscopie geen (of weinig) afwijkingen van het darmslijmvlies zichtbaar, daarom is de diagnose afhankelijk van histologisch onderzoek van meerdere biopsiemonsters. De incidentie in de algemene bevolking is 1 per 10.000.
Microscopische colitis wordt niet geassocieerd met een verhoogde mortaliteit of (in tegenstelling tot andere inflammatoire darmziekten) ongunstige resultaten op de lange termijn zoals coloncarcinoom of de noodzaak van een operatie. Wel is er een hoge kans op recidief.
Verschillende factoren zijn in verband gebracht met een verhoogd risico op microscopische colitis:
- associaties met auto-immuunziekten zoals reumatoïde artritis, thyreoïditis en coeliakie zijn vaak gerapporteerd, maar er is geen overtuigend immunologisch bewijs voor deze associaties
- bij mensen die roken lijkt het risico op microscopische colitis 3-5 × hoger en begint de ziekte ≥ 10 jaar eerder dan bij niet-rokers
- bij (postmenopauzale) vrouwen komt microscopische colitis relatief vaak voor
- microscopische colitis wordt ook sterk geassocieerd met het gebruik van niet-steroïdale ontstekingsremmers (NSAID’s) en protonpompremmers (PPI’s). Van de patiënten met miscoscop[ische colitis had 35-55% NSAID’s of PPI’s gebruikt in het jaar voorafgaand aan de diagnose.
Conclusies
Rectaal bloedverlies verhoogt het risico op gastro-intestinale afwijkingen: het risico op colorectaal carcinoom stijgt van 0,5% naar 2-4% en dat op inflammatoire darmziekte van 0,5-1% naar 5% (zie NHG-Standaard Rectaal bloedverlies).
Symptomen die kunnen wijzen op colorectaal carcinoom bij rectaal bloedverlies:
- hogere leeftijd (arbitrair > 50 jaar)
- eerstegraadsfamilielid met colorectaal carcinoom < 70 jaar
- veranderd defecatiepatroon (bijvoorbeeld chronische diarree)
- bloed vermengd met de ontlasting
- afwezigheid van (peri)anale afwijkingen
Symptomen van PDS en inflammatoire darmziekte vertonen overlap. Chronische diarree (> 2 weken) verhoogt de kans op inflammatoire darmziekte. Andere symptomen die kunnen wijzen op inflammatoire darmziekte zijn rectaal bloedverlies, aanwezigheid van perianale afwijkingen, ongewild gewichtsverlies en een positieve familieanamnese voor inflammatoire darmziekte.
Denk bij postmenopauzale vrouwen met chronische, nachtelijke waterdunne diarree ook aan microscopische colitis.
Aanvullend onderzoek
Naar Samenvatting ›- Aanvullend onderzoek is alleen noodzakelijk bij kenmerken (waaronder alarmsymptomen) die een andere aandoening dan PDS waarschijnlijker maken.
- Aanvullend onderzoek is niet zinvol bij patiënten met PDS-C zonder kenmerken (waaronder alarmsymptomen) die een andere aandoening waarschijnlijker maken.
Coloscopie
Naar Samenvatting ›Een coloscopie heeft niet tot doel om PDS aan te tonen, maar om andere aandoeningen minder waarschijnlijk te maken.
- Op basis van anamnese, lichamelijk onderzoek en een calprotectinetest kan de huisarts een goede inschatting doen op de aan- of afwezigheid van organische aandoeningen.
- Bij afwezigheid van alarmsymptomen en een negatieve calprotectinetest acht de werkgroep een coloscopie daarom niet van toegevoegde waarde. De risico’s, de belasting en de kosten van een coloscopie wegen niet op tegen de zeer kleine kans op het missen van een andere diagnose.
- Bij patiënten die een coloscopie hebben ondergaan waarbij geen enkele afwijking wordt gevonden, hanteert het Bevolkingsonderzoek Darmkanker Nederland een termijn van 10 jaar voordat ze weer worden uitgenodigd voor deelname aan het bevolkingsonderzoek. Bij tussentijdse nieuwe klachten zal in overleg met de mdl-arts moeten worden vastgesteld of een coloscopie is aangewezen.
- Kenmerken (waaronder alarmsymptomen) die een andere (somatische) aandoening waarschijnlijker maken dan PDS als oorzaak van de klachten:
- rectaal bloedverlies
- verandering in stoelgang naar dunnere of vastere consistentie en/of andere frequentie (3 maal of vaker per dag) van ontlasting of diarree gedurende > 2 weken
- nachtelijke diarree
- onbedoeld en onverklaard gewichtsverlies
- begin van de klachten bij ≥ 50 jaar
- eerstegraadsfamilielid met inflammatoire darmziekte of coeliakie, of met een colorectaal, ovarium- of endometriumcarcinoom < 70 jaar.
Microscopische colitis
Hevige waterige diarree en een negatieve of licht verhoogde calprotectinetest kunnen duiden op microscopische colitis. Het betreft vaak vrouwen van middelbare leeftijd (> 50 jaar), die meestal ook ’s nachts klachten hebben. Wanneer klachten langdurig zijn, wordt een verwijzing naar een mdl-arts geadviseerd. Door een afwachtend beleid te voeren bij PDS-gerelateerde klachten, kan er sprake zijn van een vertraagde (niet-levensbedreigende) diagnose. De diagnose microscopische colitis wordt gesteld op basis van colonbiopten verkregen bij coloscopie.
Voor- en nadelen van de interventie
Er werden geen onderzoeken gevonden die voldeden aan de PICO en geïncludeerd konden worden in de literatuursamenvatting. Op basis van het literatuuronderzoek kunnen dus geen conclusies worden getrokken over de toegevoegde waarde van een coloscopie bij patiënten die voldoen aan de Rome-criteria, geen alarmsymptomen en een negatieve calprotectinetest hebben. Enige bevindingen uit de onderzoeken van Chey (2010), Kok (2012) en Asghar (2020) zijn belangwekkend.
- Chey 2010 laat zien dat bij PDS-patiënten (niet subtype C) zonder alarmsymptomen niet vaker een organische aandoening gevonden wordt dan in gezonde controlepersonen. Dit betreft echter een patiënt-controleonderzoek en bij deze patiënten is geen calprotectinetest uitgevoerd.
- Kok 2012 laat zien dat wanneer een patiënt aan de Rome-criteria voldoet en geen alarmsymptomen heeft, bij coloscopie zelden een organische darmaandoening wordt gevonden.
- Asghar 2020 had te weinig patiënten geïncludeerd die geen alarmsymptomen hebben om goed gebruik te kunnen maken van dit onderzoek.
Kwaliteit van het bewijs
Niet van toepassing.
Waarden en voorkeuren van patiënten
Het voordeel van een coloscopie kan zijn dat de patiënt gerustgesteld is dat aan de klachten geen organische darmziekte ten grondslag ligt. Uit onderzoek blijkt echter dat veel patiënten ook na een coloscopie niet gerustgesteld zijn (Spiegel 2005). Ook uit eigen ervaring van de werkgroep blijkt dat een deel van de patiënten met PDS-klachten en een negatieve coloscopie de arts na een tijdje opnieuw bezoekt.
Daarnaast zijn aan het uitvoeren van een coloscopie risico’s verbonden zoals perforatie of een bloeding. Bovendien is het onderzoek belastend voor de patiënt.
Het is belangrijk dat de patiënt goed geïnformeerd wordt over de diagnose PDS. Soms denkt een patiënt dat iedereen een coloscopie nodig heeft om PDS aan te tonen, terwijl een coloscopie geen PDS kan aantonen maar bedoeld is om organische aandoeningen aan te tonen dan wel uit te sluiten. De diagnose PDS kan zonder coloscopie worden vastgesteld. De huisarts weet niet altijd hoe duidelijk uit te leggen dat een coloscopie niet nodig is voor het stellen van de diagnose. Voor handvatten over voorlichting, zie Organisatie van de zorg (paragraaf Voorlichting).
Kosten (middelenbeslag)
Een coloscopie wordt in het ziekenhuis uitgevoerd en daar zijn over het algemeen (hoge) kosten aan verbonden. Kosten voor een endoscopie van het colon waren in 2020 rond de €450.
Aanvaardbaarheid, haalbaarheid en implementatie
De huisarts verwijst bij vermoeden van een organische aandoening naar een mdl-arts voor advies en analyse met eventueel coloscopie. In deze gevallen is de indicatie het aantonen of uitsluiten van een inflammatoire darmziekte of vermoeden op maligniteit. De verwachting is dat sinds het invoeren van het bevolkingsonderzoek naar darmkanker, verwijzingen vanwege een vermoeden van maligniteit in aantal zullen afnemen.
Wanneer een patiënt doorverwezen wordt voor klachten passend bij PDS, maar er bestaat diagnostische twijfel ten aanzien van de mogelijke aanwezigheid van een organische aandoening, dan heeft het de voorkeur om naar de mdl-arts te verwijzen voor intake en lichamelijk onderzoek, en niet primair voor een coloscopie. Op basis van de intake door de mdl-arts wordt het vervolgbeleid bepaald, met indien nodig eventueel een coloscopie. Soms helpt de expertise van de mdl-arts ook om de patiënt te overtuigen dat een coloscopie niet nodig is.
Uitgangsvraag
Is een coloscopie (als aanvulling op anamnese en lichamelijk onderzoek) aan te bevelen bij patiënten met PDS, die geen alarmsymptomen hebben en een negatieve calprotectinetest hebben?
Achtergrond
Bij patiënten met PDS-klachten die voldoen aan de Rome-IV-criteria zijn het ontbreken van alarmsymptomen (zie hieronder) en een negatieve calprotectinetest een sterke bevestiging van de diagnose PDS.
Alarmsymptomen of een positieve calprotectinetest zijn redenen om verder onderzoek uit te voeren om een organische aandoening of maligniteit uit te sluiten. Toch worden er nog coloscopieën gedaan bij patiënten met typische PDS-klachten zonder alarmsymptomen. Om de vraag te beantwoorden wanneer een coloscopie geïndiceerd is, kijken we naar de toegevoegde waarde van een coloscopie bij patiënten die voldoen aan de Rome-IV-criteria, met een negatieve calprotectinetest en zonder alarmsymptomen.
Search and select
A systematic review of the literature was performed to answer the following question: What is the diagnostic yield of a coloscopy in patients who fulfill the Rome-criteria and have no alarm symptoms?
|
Patients |
Patients who fulfill the Rome-criteria, have no alarm features and negative calprotectin result |
|---|---|
|
Intervention |
Anamnesis, physical examination and endoscopy |
|
Control |
Anamnesis and physical examination |
|
Outcomes |
Diagnostic yield (advanced adenoma (> 1 cm), Inflammatory Bowel Disease (IBD), microscopic colitis, malignancy) (crucial) |
Relevant outcome measures
The guideline development group considered diagnostic yield as a critical outcome measure for decision making. The working group defined the outcome measures as follows: advanced adenoma (> 1 cm), Inflammatory Bowel Disease (IBD), microscopic colitis, malignancy.
Methods (search and select)
The databases [Medline (via OVID) and Embase (via Embase.com)]. were searched with relevant search terms from 2000 until 24 november 2020. The detailed search strategy is depicted in the Annex (Totstandkoming)/ under the tab Methods. Studies were selected based on the following criteria as described in the PICO. Attachment 1 contains the PRISMA flowchart showing the number of hits, and Attachment 2 contains the reasons of exclusion.
Resultaten
There were no studies identified that included patients who fulfilled the Rome-criteria, had no alarm features and had a negative calprotectin result (< 50 µg/g), and compared two groups that had undergone a coloscopy or no coloscopy.
Summary of literature
Our literature search did not identify studies that met our selection criteria. However, below we narratively describe the results of studies that do not meet our criteria but that provide information that can be valuable for decision making.
- Chey (2010) conducted a prospective case control study including patients with suspected non-constipation-predominant IBS (Rome II) who underwent colonoscopy with rectosigmoid biopsies. Healthy persons undergoing colonoscopy for colorectal cancer screening or polyp surveillance comprised the control group. Patients reporting ‘alarm symptoms’ including unexplained weight loss (> 10 lb over 6 months), fever, significant gastrointestinal bleeding (patients with spotting of red blood on the toilet tissue after a bowel movement were eligible), or those reporting a family history of a first degree relative with colon cancer, celiac disease, or IBD were not eligible for enrollment. 466 suspected IBS patients and 451 controls were enrolled.
- Kok (2012) studied 810 patients with lower gastrointestinal complaints suggestive for organic bowel disease who were referred by their general practitioner for secondary care colonoscopy. Fulfilment of the Rome-III-criteria was ascertained by a questionnaire. General practitioners recorded the presence or absence of alarm symptoms. Alarm symptoms were defined as: rectal bleeding, change in bowel habit and weight loss, and the GPs estimate of the patients’ organic bowel disorder risk. Out of the 810 patients, organic bowel disease (colorectal cancer, advanced adenomas (> 1 cm), IBD or Diverticulitis) was diagnosed in 141 participants (17%), 431 patients (53%) were diagnosed with nonorganic bowel disease, and 238 (29%) patients did not get a diagnosis based on the colonoscopy. Overall, 222 (27%) fulfilled the Rome-III-criteria, and only 39 participants (5%) fulfilled the Rome-criteria and lacked alarm symptoms. Participants who fulfilled the Rome-III-criteria had a significantly lower risk of organic bowel disease compared with participants who did not [12% (95% CI 8–17) versus 20% (95% CI 17–23), P < 0.01]. The lowest risk for organic bowel disease was observed in patients without alarm symptoms who fulfilled the Rome-III-criteria (3%, 95% CI 0–14). Also a younger age lowered the risk of having organic bowel disease.
- Asghar (2020) determined the diagnostic yield of colonoscopy in patients with symptoms compatible with a functional bowel disorder. 646 Patients fulfilled the Rome-IV-criteria for functional bowel disorders: IBS (56%), functional diarrhea (27%) and functional constipation (17%). Almost all included patients had alarm features (98%). Alarm features were defined as: age of symptom onset ≥ 45 years, recent change in bowel habit, rectal bleeding in the absence of documented bleeding haemorrhoids or anal fissures, unintentional weight loss, nocturnal bowel symptoms, family history of colorectal cancer or inflammatory bowel disease, abnormal GI examination (i.e. palpable abdominal/rectal mass or lymphadenopathy), evidence of iron deficiency anaemia on blood testing, evidence of inflammation on blood or stool testing. The combined prevalence of organic disease was 12%, being lowest for functional constipation and IBS-constipation (~6% each), followed by IBS-mixed (~9%), and highest amongst functional diarrhea and IBS-diarrhea (~17% each). For the 11 patients without alarm features the colonoscopy was normal.
|
Colonoscopic findings |
IBS patients: number (%) |
controls: number (%) |
significance |
|---|---|---|---|
|
Polyps |
68 (14.6) |
155 (34.4) |
P < 0.0001 |
|
Mass |
0 (0) |
1 (0.2) |
P NS |
|
Mucosal erythema or ulceration |
23 (4.9) |
8 (1.8) |
P < 0.01 |
|
Diverticulosis |
41 (8.8) |
96 (21.3) |
P < 0.0001 |
|
Angiodysplasia |
1 (0.2) |
2 (0.4) |
P NS |
|
Hemorrhoids |
85 (18.2) |
74 (16.4) |
P NS |
|
Anal fistula |
0 (0) |
1 (0.2) |
P NS |
| IBS= irritable bowel syndrome, NS=not significant | |||
|
Histological findings |
IBS patients: number (%) |
Controls: number (%) |
significance |
|---|---|---|---|
|
Adenomas |
36 (7.7) |
118 (26.1) |
P < 0.0001 |
|
Hyperplastic polyps |
39 (8.4) |
52 (11.5) |
P NS |
|
Colorectal Adenocarcinoma |
0 (0.0) |
1 (0.2) |
P NS |
|
IBD |
2 (0.4) |
0 |
P NS |
|
Microscopic colitis |
7 (1.5) |
N/A |
P N/A |
|
Solitary rectal ulcer Syndrome |
1 (0.2) |
1 (0.2) |
P NS |
| IBS=irritable bowel syndrome, NS=not significant, N/A=not applicable | |||
Results
Not applicable.
Level of evidence of the literature
Not applicable.
Conclusies
Not applicable.
Fecaal immunochemische test (FIT)
Naar Samenvatting ›We raden de fecaal immunochemische test (FIT, iFOBT; ter uitsluiting van maligniteiten) bij patiënten met (vermoeden van) PDS af.
- Door de hoge negatieve voorspellende waarde van de FIT is deze test theoretisch te gebruiken om CRC uit te sluiten. Toch helpt de uitslag bij een lage voorafkans náást anamnese en lichamelijk onderzoek in de praktijk niet voldoende om CRC uit te sluiten.
- Een FIT zou kunnen leiden tot minder aanvullend onderzoek en is daarom vooral theoretisch te overwegen bij verwijzing naar de tweede lijn. In de praktijk worden personen van 55-75 jaar via het bevolkingsonderzoek darmkanker al tweejaarlijks uitgenodigd voor een FIT. Daarom is een FIT voor deze patiëntengroep meestal niet nodig.
- Bij patiënten < 50 jaar is de voorafkans op CRC en poliepen laag, en worden weinig terecht positieve FIT-uitslagen verwacht. Dus ook bij deze groep wordt een FIT niet aanbevolen.
- Resteert de groep van 50-55 jaar; deze zullen naar verwachting binnen enkele jaren in het bevolkingsonderzoek darmkanker worden opgenomen en via die weg regelmatig een FIT ondergaan.
- Tot die tijd adviseert de werkgroep om patiënten > 50 jaar met nieuw ontstane klachten bij twijfel laagdrempelig met de mdl-arts te bespreken (inclusief anamnese en voorgeschiedenis) en op basis daarvan eventueel te verwijzen voor consult en aanvullend onderzoek. Vanuit de praktijk is bekend dat een FIT bij patiënten > 50 jaar veel foutnegatieve uitslagen oplevert. Daarom beveelt de werkgroep een FIT niet aan bij patiënten > 50 jaar met PDS.
Voor- en nadelen
Voordelen
Van de patiënten met darmklachten in de eerste lijn die een FIT ondergaan, krijgt 80-90% een terecht negatieve uitslag. Deze patiënten hoeven niet doorgestuurd te worden naar de tweede lijn voor aanvullend onderzoek. Zo kunnen veel onnodige coloscopieën voorkomen worden.
Nadelen
De FIT heeft een lage positief voorspellende waarde voor colorectaal carcinoom (CRC) en andere relevante colorectale aandoeningen (significant colorectal disease; SCD), en een lage specificiteit voor CRC en SCD. Vanuit de praktijk is bekend dat een FIT bij patiënten > 50 jaar tot veel foutnegatieve uitslagen leidt (zie ook aanvullende informatie over het bevolkingsonderzoek darmkanker). De combinatie FIT plus calprotectinetest verhoogt de negatief voorspellende waarde van een enkele test niet of nauwelijks.
Kwaliteit van bewijs
De kwaliteit van het bewijs is laag tot redelijk. Er werd afgewaardeerd in verband met risico op bias door minder sterke methodologische keuzes (zoals de tijd tussen bloedafname en coloscopie) in de onderzoeken en indirectheid (populatie niet alleen eerste lijn).
Waarden en voorkeuren van patiënten
Het merendeel van de patiënten zal graag zekerheid krijgen over het al dan niet aanwezig zijn van darmkanker of een andere ernstige darmziekte. Wanneer een FIT dit kan uitsluiten én een belastende coloscopie kan voorkomen, zal dat voor deze patiënten afdoende zijn. De test biedt geruststelling terwijl hij niet belastend is.
Een klein deel van de patiënten zal vragen om extra onderzoek in de vorm van bijvoorbeeld een CT-colon of een coloscopie, omdat ze meer vertrouwen hebben in de uitslag hiervan. Met goede uitleg over zowel de FIT als CT-colon en coloscopie kan bij een deel van de patiënten worden voorkomen dat zij na een negatieve uitslag alsnog om extra onderzoek vragen.
Kosten
Het tarief voor de FIT (NZA code 070201) was in 2019 € 7,50; na indexering is dat in 2022 € 8,08.
Aanvaardbaarheid
Een fecestest is voor de meeste patiënten aanvaardbaar om PDS uit te sluiten.
Haalbaarheid
Het is voor de meeste patiënten haalbaar om wat feces in te leveren voor een test.
Bij ontstekingen en maligniteiten in de darm kan hemoglobine (bloed) in de feces gevonden worden. De fecal immunochemical test (FIT), ook wel immunologische fecaaloccultbloedtest (iFOBT) genoemd, laat zien of er al dan niet een maligniteit in de darmen zou kunnen zijn. In deze module willen we nagaan of de testeigenschappen van een FIT zodanig zijn dat die test aan te bevelen is voor het onderscheiden van maligniteiten en PDS.
Uitgangsvraag
Is de fecal immunochemical test (FIT) voor hemoglobine aan te bevelen om patiënten met een maligniteit te onderscheiden van patiënten met PDS? Zie de PICO-tabel.
|
Patients |
Patients with abdominal complaints |
|---|---|
|
Index test |
Faecal Immunochemical Test (FIT) for haemoglobin |
|
Reference test |
Colonoscopy, CT, MRI |
|
Outcomes |
|
|
Other selection criteria |
Study design: systematic reviews and cohort studies |
Clinical question
Is the fecal immunochemical test (FIT) for hemoglobin recommended to distinguish patient with malignancy from patients with IBS?
Methods (search and select)
The databases PubMed and Embase were searched with relevant search terms from 2009 until November 2020. The detailed search strategy is depicted in the Annex (Totstandkoming)/under the tab Methods. Studies were selected based on the following criteria as described in the PICO. Attachment 1 contains the PRISMA flowchart showing the number of hits, and Attachment 2 contains the reasons of exclusion.
Relevant outcome measures
The working group defined 20% as a minimal clinically (patient) important difference for all outcome measures, next to a Standardized Mean Difference (SMD) > 0,50, OR or RR < 0,75 or > 1,25 and a change of (10-)20% of the total score om a questionnaire.
|
Outcome |
Consequences for medical system |
Consequences for patient |
Weight (for decision-making) |
|---|---|---|---|
|
True positive |
A positive FIT points at a malignancy and more tests/ examination will be done (colonoscopy). |
Confirmation of complaints, maybe agitation about a serious illness and follow up tests. |
7 – crucial |
|
False positive |
A malignancy will be excluded during the test that will follow (colonoscopy). |
Unnecessary worrying about a serious illness and follow up tests (tests are not needed and not without risks). Higher costs. |
7 – crucial |
|
True negative |
A malignancy is excluded correctly. No follow up tests. |
Reassurance of patient. No referral, no follow up tests, no waiting time. Maybe some worrying if patient do not trust the result of the test. Low costs. |
7 – crucial |
|
False negative |
A malignancy is excluded while it is present. No follow up tests. Delayed diagnose. |
False reassurance of patient, wrong or no therapy, maybe less benefit because of delayed therapy. |
7 – crucial |
|
Test |
Faeces for FIT can be obtained by patient him/herself. |
Faeces for FIT is easy to obtain, not difficult for patient. |
7 – crucial |
|
Colonoscopy: is additional examination. |
Experiencing a colonoscopy is not pleasant and is risky (lesion or perforation of colon, bleeding). |
|
|
|
Resources |
Costs of FIT are low (+/- €8) compared to alternative (colonoscopy; +/- €600). Colonoscopy: visit of hospital or diagnostic centre. |
Obtaining faeces for FIT can be done at home. Colonoscopy will be done in a hospital or diagnostic centre. The patient must travel to a location. |
7 – crucial |
Results
One systematic review and six other studies (published after the search date of the systematic review (March 2016)) were included in the analysis of the literature. Important study characteristics and results are summarized in the evidence tables (Attachment 3). The assessment of the risk of bias is summarized in the risk of bias tables (Attachment 4).
Description of studies
Systematic reviews
Westwood (2017) included 9 diagnostic cohorts in the review to analyse the clinical effectiveness of FIT for triaging referrals in people with lower abdominal symptoms, particularly those who would be considered to be at low risk of having colorectal cancer (CRC). 4,883 adult patients (mean age 64 years, range: 16 – 91 years; men: mean 45%; in Spain, Scotland and the Netherlands) were included in these studies. Included FIT assays: OC-Sensor (Eiken Chemical Co. Ltd, Tokyo, Japan, supplied in the UK by MAST Group Ltd, Bootle, Merseyside) – 5 studies; HM-JACKarc (Kyowa-Medex Co. Ltd, Tokyo, Japan, supplied in the UK by Alpha Laboratories Ltd, Eastleigh, Hants) – 3 studies; FOB Gold (Sentinel Diagnostics, Milan, Italy, supplied in the UK by Sysmex UK Ltd, Milton Keynes) – 1 study; Ridascreen (R-Biopharm AG, Darmstadt, Germany, supplied in the UK by R-Biopharm Rhone Ltd, Glasgow) – no studies. All included studies were rated as having ‘high’ concerns about applicability to the specific research aim with respect to participants. This happened because all studies included some participants who had symptoms that may be considered to be associated with a higher probability of CRC and which are components of the criteria for 2- week referral (e.g. rectal bleeding). Only one study was conducted in a primary care setting, reporting that FIT was requested by GPs at the point of referral to secondary care. Reference standard: colonoscopy. Outcomes were sensitivity and specificity, the numbers of true positive (TP), false positive (FP), false negative (FN) and true negative (TN) test results for CRC (presented per cut off value; only FIT assay OC-Sensor had useable data).
Studies published after the search date of the systematic review:
- D’Souza (2021; UK) included data from 9822 patients (mean age: 64 years; 55% women) referred to secondary care with suspected CRC symptoms meeting NHS England criteria for urgent 2 weeks wait referral and triaged to investigation with colonoscopy. They were invited to perform a quantitative FIT. The sensitivity, specificity, positive and negative predictive value of FIT for CRC (cut off value 10 microgram Hb/gram faeces) were assessed.
- Nicholson (2020; UK) included faecal samples from 9,896 adult patients (mean age: 60 years; 59% women) from routine primary care practice in Oxfordshire, UK. Those samples were analysed using the MH-JACKarc FIT method. Patients were followed for up to 36 months in linked hospital records for evidence of benign and serious (colorectal cancer, high-risk adenomas and bowel inflammation) colorectal disease. The diagnostic accuracy of FIT (cut off value 10 microgram Hb/gram faeces) was reported (sensitivity, specificity, positive and negative predictive value).
- Lue (2020; Spain) recruited 404 patients (mean age: 59 years; 59% women) with gastrointestinal symptoms who completed colonic investigations and returned stool samples, on which faecal occult blood test (FOBT) (is FIT) and faecal calprotectin (FC) were performed. CRC, advanced adenoma, IBD and angiodysplasia were considered as relevant pathologies. The diagnostic accuracy of FIT (cut off value 20 microgram Hb/gram faeces) (alone or in combination with FC) was reported (sensitivity, specificity, positive and negative predictive value).
- Mowat (2019; UK) included all patients with new-onset bowel symptoms presented at GP (n = 5,372; median age: 65 years; 56% female). Practice nurses distributed a FIT kit to each patient. Patients were instructed to collect a single sample of faeces and to return the FIT device in person to the GP surgery and from there it was distributed to a lab were faecal Hb was measured using an HM-JACKarc (Kyowa Medex). Patients referred to endoscopy were investigated within 6 weeks of referral. The diagnoses of CRC, HRA and IBD were confirmed by a gastrointestinal pathologist. Outcome: referral for colonoscopy (FIT cut off value below or higher than 10 microgram Hb/gram faeces). Sensitivity and specificity, positive and negative predictive value for CRC with FIT could be calculated by hand with data in article.
- Juul (2018; Denmark) included all individuals aged ≥ 30 years with non-alarm symptoms of CRC in general practice who had performed a valid FIT (defined as a FIT result within the measuring range of the OC Sensor DIANA) (n = 3,462; mean age between 60 en 68 year; 56% female). A single FIT sample was collected from each patient containing 10 mg faeces in 2 ml buffer solution. The FITs were sent with prioritised mail for analyses. The FITs were analysed daily by trained staff with expertise in FIT analyses, using the automated analyser OC-Sensor DIANA (Eiken Chemical Company, Ltd, Japan). FIT cut off value 10 microgram Hb/gram faeces. Included individuals were followed up from the day of FIT request until 3 months after. The doctors performing the colonoscopy were not blinded to FIT results, but had no affiliation with the project. Outcome: positive predictive value. Sensitivity and specificity, and negative predictive value for CRC with FIT could be calculated by hand with data in article.
- Hogberg (2017; Sweden) included 373 consecutive patients (> 20 years; mean age 63 years; 65% women) that received a FIT or a FC test ordered by a primary care physician. The most common symptom associated with ordering a FIT and/or a FC test was abdominal pain (58%), next to change of bowel habits (46%), diarrhoea (45%) and constipation (28%). The dipstick for FIT, visually read, qualitative test Actim Faecal Blood (Oy Medix Biochemica Ab, Finland) was used for the sample collection and the analysis. The samples for FC were sent to the accredited Department of Laboratory Medicine, Umeå University Hospital, where they were analysed with the CALPROVR Calprotectin ELISA Test according to manufacturer instructions (Calpro AS, Norway). Physicians were instructed to refer patients with a positive FIT (cut off value 25-50 mcg Hb/gram faeces) or FC test (cut off value > 100 mcg/gram faeces) for bowel imaging (colonoscopy). The test results were available to the endoscopists. All colonoscopy findings were recorded in the regional electronic medical records. CRC, HRAs and IBD were diagnosed by experienced pathologists. Patients were followed for 2 years. Outcomes: sensitivity and specificity, the numbers of true positive (TP), false positive (FP), false negative (FN) and true negative (TN) test results for CRC.
- Elias (2016; the Netherlands) included 810 patients with lower abdominal complaints for at least 2 weeks, combined with rectal bleeding, change in bowel habit, abdominal pain, fever, diarrhoea, weight loss, and/or a sudden onset of abdominal complaints at > 50 years of age (median age 61 years; 55% women). Faecal samples were analysed for FIT (Clearview® iFOBT One Step Faecal Occult Blood Test Device, Alere Health) and calprotectin (ELISA; EK-CAL). Cut off value FIT: > 6 mcg Hb/gram faeces. Cut off value calprotectine: > 50 mcg/g faeces. Experienced gastroenterologists performed endoscopy in all patients. A final diagnosis was established according to routine clinical practice, including histopathology of biopsies if required, and 3 months follow-up after negative endoscopy. Outcomes: sensitivity and specificity, the numbers of true positive (TP), false positive (FP), false negative (FN) and true negative (TN) test results for significant colorectal diseases (SCD). They defined SCD as CRC, IBD, diverticulitis, or advanced adenoma (AA; > 1 cm).
Studies with the outcome measure ‘consult frequency’ were not found.
Tables 5 and 6 show the summary of results of the systematic review. Results from the eight additional RCT’s are presented in table 6 (Sensitivity and specificity FIT for CRC). Sensitivity varied between 85% and 99%, specificity varied between 49% and 93%.
Table 7 shows the results of the combination FIT + fecal calprotectin test for CRC or significant colorectal disease in four additional studies. Diagnostic accuracy measurements were in the same range as with FIT only.
|
Patient or population: patients with lower abdominal symptoms / Setting: primary and secondary care New test: FIT | Cut-off value: 10 microgram haemoglobin / gram faeces / Reference test: colonoscopy or CT/ MRI Pooled sensitivity: 0.92 (95% CI: 0.87 to 0.95) | Pooled specificity: 0.86 (95% CI: 0.78 to 0.91) |
|||||
|---|---|---|---|---|---|
|
Test result |
Number of results per 1.000 patients tested (95% CI) |
Number of participants (studies) |
Certainty of the Evidence (GRADE) |
||
|
Prevalence 0.1% |
Prevalence 1% |
Prevalence 3.6% As seen in included studies |
|||
|
As seen in Dutch primary care |
|||||
|
True positives |
1 (1 to 1) |
9 (9 to 10) |
33 (31 to 34) |
4091 (4) |
⨁⨁◯◯ LOW a,b |
|
False negatives |
0 (0 to 0) |
1 (0 to 1) |
3 (2 to 5) |
||
|
True negatives |
859 (779 to 909) |
851 (772 to 901) |
829 (752 to 877) |
||
|
False positives |
140 (90 to 220) |
139 (89 to 218) |
135 (87 to 212) |
||
|
CI: Confidence interval / a. Some methods about flow and timing uclear or at high risk of bias / b. Population primary AND secondary care New test: FIT | Cut-off value: 15 microgram haemoglobin / gram faeces / Reference test : colonoscopy or CT/ MRI Pooled sensitivity: 0.92 (95% CI: 0.87 to 0.96) | Pooled specificity: 0.87 (95% CI: 0.86 to 0.88) |
|||||
|
Test result |
Number of results per 1.000 patients tested (95% CI) |
Number of participants (studies) |
Certainty of the Evidence (GRADE) |
||
|
Prevalence 0.1% |
Prevalence 1% |
Prevalence 4.2% As seen in included studies |
|||
|
As seen in Dutch primary care |
|||||
|
True positives |
1 (1 to 1) |
9 (9 to 10) |
39 (37 to 40) |
3061 (2) |
⨁⨁⨁◯ MODERATE a |
|
False negatives |
0 (0 to 0) |
1 (0 to 1) |
3 (2 to 5) |
||
|
True negatives |
869 (859 to 879) |
861 (851 to 871) |
833 (824 to 843) |
||
|
False positives |
130 (120 to 140) |
129 (119 to 139) |
125 (115 to 134) |
||
|
CI: Confidence interval / a. Population primary AND secondary care New test : FIT | Cut-off value : 20 microgram haemoglobin / gram faeces / Reference test : colonoscopy or CT/ MRI Pooled sensitivity : 0.90 (95% CI: 0.85 to 0.93) | Pooled specificity : 0.87 (95% CI: 0.85 to 0.88) |
|||||
|
Test result |
Number of results per 1.000 patients tested (95% CI) |
Number of participants (studies) |
Certainty of the Evidence (GRADE) |
||
|
Prevalence 0.1% |
Prevalence 1% |
Prevalence 6.9% As seen in included studies |
|||
|
As seen in Dutch primary care |
|||||
|
True positives |
1 (1 to 1) |
9 (9 to 9) |
62 (59 to 64) |
3848 (3) |
⨁⨁⨁◯ MODERATE a |
|
False negatives |
0 (0 to 0) |
1 (1 to 1) |
7 (5 to 10) |
||
|
True negatives |
869 (849 to 879) |
861 (842 to 871) |
810 (791 to 819) |
||
|
False positives |
130 (120 to 150) |
129 (119 to 148) |
121 (112 to 140) |
||
|
CI: Confidence interval / a. Population primary AND secondary care *There was one Dutch study in this review which showed a prevalence of CRC of 5.4% and had a sensitivity of 91% for the cut-off values 10 and 15 microgram Hb /gram faeces, a sensitivity of 90% for cut-off value 20 microgram Hb /gram faeces. Specificity was respectively: 87%, 89% and 90%. So, near to the means of the review. |
|||||
|
Predictive Value |
Cut off value |
|
Numbers at a prevalence of 0.1% |
|
|---|---|---|---|---|
|
Negative |
10 mcg/g |
TN / (FN + TN) |
859 / (0 + 859) |
100% |
|
Positive |
10 mcg/g |
TP / (TP + FP) |
1 / (1 + 140) |
0.7% |
|
Negative |
15 mcg/g |
TN / (FN + TN) |
869 / (0 + 869) |
100% |
|
Positive |
15 mcg/g |
TP / (TP + FP) |
1 / (1 + 130) |
0.8% |
|
Negative |
20 mcg/g |
TN / (FN + TN) |
869 / (0 + 869) |
100% |
|
Positive |
20 mcg/g |
TP / (TP + FP) |
1 / (1 + 130) |
0.8% |
| Predictive Value | Cut off | Numbers at a prevalence of 1% | ||
| Negative | 10 mcg/g | TN / (FN + TN) | 851 (1 + 851) | 99.9% |
| Positive | 10 mcg/g | TP / (TP +FP) | 9 / (9 + 139) | 6.1% |
| Negative | 15 mcg/g | TN / (FN + TN) | 861 / (1 + 861) | 99.9% |
|
Positive |
15 mcg/g | TP / (TP + FP) | 9 / (9 + 129) | 6.5% |
|
Negative |
20 mcg/g | TN / (FN + TN) | 861 / (1 + 861) | 99.9% |
|
Positive |
20 mcg/g | TP / (TP + FP) | 9 / (9 +129) | 6.5% |
| Predictive Value | Cut off value | Numbers at a prevalence of studies | ||
|
Negative |
10 mcg/g | TN / (FN + TN) | 829 / (3 + 829) | 99.6% |
|
Positive |
10 mcg/g | TP / (TP + FP) | 33 / (33 + 135) | 19.6% |
|
Negative |
15 mcg/g | TN / (FN + TN) | 833 / (3 + 833) | 99.6% |
|
Positive |
15 mcg/g | TP / (TP + FP) | 39 / (39 + 125) | 23.8% |
|
Negative |
20 mcg/g | TN / (FN + TN) | 810 / (7 + 810) | 99.1% |
|
Positive |
20 mcg/g | TP / (TP + FP) | 62 / (62 + 121) | 33.9% |
The sensitivity and specificity of FIT for CRC in the additional studies ranged from resp. 85-99% and 49-91% with different cut-off values. Next to this, the PPV and NPV of FIT for CRC ranged resp. from 6-28% and 96-99,9%. The sensitivity, specificity, PPV and NPV of the combination of FIT and calprotectin is in the same range as FIT only (see Table 8 Sensitivity and specificity FIT for CRC in additional studies and Table 9 Sensitivity and specificity combination FIT + Fecal calprotectin test for CRC or SCD in additional studies in de Totstandkoming/Bijlagen).
|
Study |
Sensitivity CRC |
Specificity CRC |
PPV CRC |
NPV CRC |
|---|---|---|---|---|
|
Elias 2016* (Cut off value 6) |
88-99% |
9-53% |
19-28% |
96-99% |
|
D'Souza ‘21 (Cut off value 10) |
91% |
84% |
16% |
99,6% |
|
Nicholson ‘20 (Cut off value 10) |
91% |
91% |
10% |
99,9% |
|
Juul 2018 (Cut off value 10) |
94% |
53% |
9 or 12% |
99% |
|
Mowat 2019 (Cut off value 10) |
91% |
49% |
11% |
99% |
|
Nicholson ‘20 (Cut off value 20) |
85% |
93% |
13% |
99,8% |
|
Lue 2020 (Cut off value 20) |
88% |
84% |
18% |
99% |
|
Hogberg 2017 (Cut off value 25) |
88% |
67% |
6% |
99,6% |
| Cut off value = cut off value for FIT in microgram haemoglobin per gram faeces. *for SCD (significant colorectal diseases) instead of CRC alone. | ||||
|
Study |
Sens CRC |
Sens SCD |
Spec CRC |
Spec SCD |
PPV CRC |
PPV SCD |
NPV CRC |
NPV SCD |
|---|---|---|---|---|---|---|---|---|
|
Lue 2020 |
94% |
90% |
43% |
49% |
6% |
30% |
99% |
95% |
|
Hogberg 2017 |
88% |
89% |
61% |
63% |
5% |
11% |
99,6% |
99,1% |
|
Elias 2016 |
- |
88-100% |
- |
9-54% |
- |
19-29%
|
- |
96-100% |
| FC = faecal calprotectin. SCD = significant colorectal diseases. CRC = colorectal cancer. | ||||||||
Referral for colonoscopy
- Mowat (2019) showed that 2,521 patients were not referred for colonoscopy by GP of which 95% (2,403) had a FIT below 10 mcg/g and 5% (118) had a FIT above 10 mcg/g. 2,848 patients were referred to secondary care of which 63% (1,794) had a FIT below 10 mcg/g and 37% (1,054) had a FIT above 10 mcg/g. So, 1,172 patients had a FIT above 10 mcg/g of which 90% was referred for colonoscopy and 4,197 had a FIT below 10 mcg/g of which 43% was referred for colonoscopy.
- Juul (2018) showed that 2,628 patients were not referred for colonoscopy by GP of which 95% (2,504) had a FIT below 10 mcg/g and 5% (124) had a FIT above 10 mcg/g. 834 patients were referred to secondary care of which 50% (418) had a FIT below 10 mcg/g and 50% (416) had a FIT above 10 mcg/g. So, 540 patients had a FIT above 10 mcg/g of which 77% was referred for colonoscopy and 2,922 had a FIT below 10 mcg/g of which 14% was referred for colonoscopy.
Conclusions
Diagnostic test characteristics
The diagnostic test characteristics were assessed in a group of patients with lower abdominal complaints. FIT for haemoglobin shows if the patient has (positive test result) or has not (negative test result) a CRC.
- The negative predictive value (the percentage patients with a negative test result that really do not have a CRC) is (nearly) 100% for all cut off values (10-20 microgram haemoglobin / gram faeces) and prevalences (0.1% – 7%) (certainty of evidence is low to moderate)
- The positive predictive value (the percentage patients with a positive test result that really has a CRC) is 1-55% depending on cut off values and prevalences (certainty of evidence is low to moderate)
- FIT for patients with abdominal complaints has a sensitivity of 85-94% for the CRC (the percentage of all patients with CRC and a positive test result) (certainty of evidence is low to moderate)
- FIT for patients with abdominal complaints has a broad range of specificity, from 49% to 93% for CRC (the percentage of all patients without CRC and a negative test result) (certainty of evidence is low to moderate).
Therapeutical consequences (based on Westwood 2017)
- 0-7 of 1000 patients with abdominal complaints will not receive follow up examination and the right therapy, while it is necessary (false negative test results) (certainty of evidence is low to moderate)
- 810-869 of 1000 patients with abdominal complaints will not receive unnecessary follow up examination (colonoscopy) after a negative FIT result (certainty of evidence is low to moderate); this means 81-87% of unnecessary colonoscopy will be avoided.
- 121-140 of 1000 patients with abdominal complaints will receive unnecessary follow up examination (colonoscopy) after a positive FIT result (because they do not have an organic disease) (certainty of evidence is low to moderate).
Aanvullend onderzoek naar coeliakie
Naar Samenvatting ›- Verricht laagdrempelig aanvullend onderzoek naar coeliakie bij patiënten met:
- PDS-D of PDS-M
- een eerstegraadsfamilielid met coeliakie, onafhankelijk van het type PDS-klachten.
- Zie NHG-Standaard Voedselovergevoeligheid, kader Coeliakie.
De prevalentie van coeliakie onder patiënten met PDS is hoger dan onder de algemene bevolking. De prevalentie in de PDS populatie bedraagt 2,6% op basis van serologisch onderzoek en 3,3% op basis van histologisch onderzoek. In de algemene bevolking is dat respectievelijk 1,4 en 0,5%. De prevalentie van coeliakie is hoger bij PDS-D en PDS-M dan bij andere subtypen. PDS-patiënten met eerstegraadsfamilieleden die coeliakie hebben, hebben zelf 10% kans op coeliakie. Mensen met coeliakie hebben soms weinig of geen klachten, maar wel complicaties zoals osteoporose en anemie. Een glutenvrij dieet kan deze complicaties voorkomen, maar brengt extra kosten en sociale beperkingen met zich mee [MDR Coeliakie 2022]. Een Nederlands onderzoek naar de kosteneffectiviteit van screening op coeliakie bij patiënten met PDS liet zien dat de kosten van zo’n screening bij PDS-D en PDS-M acceptabel zijn, zowel voor bekende als voor nieuwe patiënten. Gericht screenen van patiënten met deze 2 subtypen is doelmatiger dan het screenen van alle PDS-patiënten: het is ongeveer een kwart goedkoper en levert bijna dezelfde gezondheidswinst op. Vanwege de verhoogde prevalentie van coeliakie moet bij alle patiënten die voldoen aan de criteria voor PDS-D of PDS-M aanvullend onderzoek naar coeliakie plaatsvinden.
Aanvullend onderzoek naar inflammatoire darmziekten
Naar Samenvatting ›Verricht een calprotectinetest bij patiënten waarbij er op basis van niet-acute, recidiverende (3-6 maanden) klachten van diarree (PDS-D en PDS-M) een verhoogd risico op inflammatoire darmziekten is:
- bij een positieve uitslag (> 100 microgram/gram feces): verwijs naar de mdl-arts
- bij een negatieve uitslag (< 50 microgram/gram feces) is de kans op inflammatoire darmziekten zeer gering
- bij een uitslag in het ‘grijze gebied’ (50-100 microgram/gram feces): overleg met de mdl-arts (zie Consultatie en verwijzing).
- Door de hoge negatieve voorspellende waarde van de calprotectinetest in de eerste lijn is deze goed te gebruiken om organische aandoeningen (inflammatoire darmziekten) uit te sluiten. Ook is een calprotectinetest in vergelijking met coloscopie relatief goedkoop, makkelijk uit te voeren, minder invasief en geeft minder kans op complicaties.
- Het uitvoeren van een calprotectinetest kan naar verwachting leiden tot minder verwijzingen (en coloscopieën). De calprotectinetest is vooral inzetbaar ter bevestiging van de diagnose PDS (bij negatieve uitslag) en ter voorkoming van verwijzing van de eerste naar de tweede lijn.
- Door de hogere prevalentie van organische aandoeningen in de tweede lijn en de lagere negatieve voorspellende waarde van de calprotectinetest (89% tweede lijn; 97% eerste lijn), met nog steeds geen heel hoge positief voorspellende waarde (67%), heeft de calprotectinetest minder waarde in de tweede lijn.
- Als afkapwaarde voor de calprotectinetest heeft 100 microgram per gram feces de voorkeur boven 50 microgram.
- Een uitslag van 50-100 microgram per gram feces blijft echter een grijs gebied; bij deze uitslag is het goed de patiënt met diens anamnese en voorgeschiedenis te bespreken met de mdl-arts en deze om advies te vragen. Dit betekent zeker niet dat de patiënt meteen verwezen wordt.
- Er is (te) weinig literatuur om een uitspraak te kunnen doen over het werken met afkapwaarden > 100 microgram per gram feces.
Voor- en nadelen
Voordelen
Door alleen een calprotectinetest uit te voeren bij patiënten met klachten in de buik of onderbuik kun je relatief gemakkelijk en snel organische gastro-intestinale aandoeningen (met name inflammatoire darmziekten) uitsluiten (hoge negatief voorspellende waarde, met name in de eerste lijn).
Ook kunnen door het uitvoeren van calprotectinetesten onnodige coloscopieën voorkomen worden. In een Engels onderzoek (met een iets afwijkende populatie dan die beschreven in dit detail) bleek dat na invoering van de calprotectinetest het aantal aanvragen voor calprotectinetests steeg en het percentage aanvragen voor coloscopieën daalde (van 24 naar 13%).
Bij afkapwaarden van 50 dan wel 100 microgram per gram feces is er weinig verschil in negatief voorspellende waarde. Een afkapwaarde van 100 microgram per gram feces zal iets minder foutpositieve uitslagen opleveren. De Nederlandse Vereniging van Klinische Chemie (NVKC) hanteert een afkapwaarde van 50 microgram per gram feces.
Nadelen
Er lijken grote verschillen te bestaan tussen de diverse calprotectinetests. Dit bemoeilijkt een keuze voor de optimale afkapwaarde. Ook is er weinig tot geen literatuur over afkapwaarden > 100 microgram per gram feces.
Als men alleen afgaat op de uitkomst van een calprotectinetest zal bij sommige patiënten ten onrechte een organische gastro-intestinale aandoening worden uitgesloten (gemiddeld 0-2 op de 1000 testuitslagen).
Kwaliteit van bewijs
De kwaliteit van het bewijs is redelijk tot laag. Er werd afgewaardeerd in verband met indirect bewijs (afwijkende populatie: ook tweedelijnspatiënten werden geïncludeerd in de onderzoeken) en inconsistentie/heterogeniteit (grote variatie en niet-overlappende betrouwbaarheidsintervallen).
Waarden en voorkeuren van patiënten
Het merendeel van de patiënten zal graag zekerheid krijgen over het al dan niet aanwezig zijn van een ernstige darmziekte. Wanneer een calprotectinetest inflammatoire darmziekten kan uitsluiten én een coloscopie kan voorkomen, zal dat voor deze patiënten afdoende zijn. De test biedt geruststelling en is niet belastend.
Een klein deel van de patiënten zal wellicht vragen om een coloscopie omdat ze daarin meer vertrouwen hebben. Met goede uitleg over zowel calprotectinetest als coloscopie kan bij een groot deel van de patiënten worden voorkomen dat zij na een negatieve calprotectinetest alsnog om een verwijzing naar de tweede lijn vragen.
Kosten
Het tarief voor een calprotectinetest (NZA-code 070216) was in 2019 € 50,46; na indexering is dat in 2022 € 54,36.
Aanvaardbaarheid
Het is voor de meeste patiënten aanvaardbaar om een test met feces te doen om andere aandoeningen dan PDS uit te sluiten en een coloscopie te voorkomen.
Haalbaarheid
Het is voor de meeste patiënten haalbaar om wat feces in te leveren voor een test.
Achtergrond
Calprotectine is een eiwit dat aanwezig is in neutrofiele granulocyten (witte bloedcellen). Bij ontstekingen in de darm komt dit eiwit vrij in de feces. Het aantonen van calprotectine in feces kan aangeven of er al dan niet een ontsteking in de darmen is. In dit detail gaan we na of de calprotectinetest zodanige eigenschappen heeft dat we de test kunnen aanbevelen voor het onderscheiden van inflammatoire darmziekten en PDS.
Uitgangsvraag
Is een calprotectinetest aan te bevelen voor het maken van onderscheid tussen patiënten met inflammatoire darmziekten en PDS? Zie de PICO-tabel.
| Patients | Patients with abdominal complaints |
|---|---|
| Index test | Faecal calprotectin test |
| Reference test | Colonoscopy, CT, MRI |
| Outcomes |
|
| Other selection criteria | Study design: systematic reviews and cohort studies |
Methods (search and select)
The databases PubMed and Embase were searched with relevant search terms from 2009 until November 2020. The detailed search strategy is depicted in the Annex (Totstandkoming)/under the tab Methods. Studies were selected based on the following criteria as described in the PICO. Attachment 1 contains the PRISMA flowchart showing the number of hits, and Attachment 2 contains the reasons of exclusion.
| Outcome | Consequences for medical system | Consequences for patient | Weight (for decision-making) |
|---|---|---|---|
| True positive | A positive calprotectin test points at inflammatory bowel diseases and more tests/ examination will be done (colonoscopy). | Confirmation of complaints, maybe agitation about a serious illness and follow up tests. | 7 – crucial |
| False positive | nflammatory bowel diseases will be excluded during the test that will follow (colonoscopy). | Unnecessary worrying about a serious illness and follow up tests (tests are not needed and not without risks). Higher costs. | 7 – crucial |
| True negative | inflammatory bowel diseases are excluded correctly. No follow up tests. | Reassurance of patient. No referral, no follow up tests, no waiting time. Maybe some worrying if patient do not trust the result of the test. Low costs. | 7 – crucial |
| False negative | inflammatory bowel diseases are excluded while it is present. No follow up tests. Delayed diagnose. | False reassurance of patient, wrong or no therapy, maybe less benefit because of delayed therapy. | 7 – crucial |
| Test | Faeces for calprotectin test can be obtained by patient him/herself. | Faeces for testing calprotectin is easy to obtain, not difficult for patient. | 7 – crucial |
| Colonoscopy: is additional examination. | Experiencing a colonoscopy is not pleasant and is risky (lesion or perforation of colon, bleeding). | ||
| Resources | Costs of testing calprotectin are low (+/- €50) compared to alternative (colonoscopy; +/- €600). Colonoscopy: visit of hospital or diagnostic centre. | Obtaining faeces for testing calprotecin can be done at home. Colonoscopy will be done in a hospital or diagnostic centre. The patient must travel to a location. | 7 – crucial |
Resultaten
Results (search)
One systematic review was included in the analysis of the literature. There were no new studies about this topic published after the search date of the systematic review (June 2018). Important study characteristics and results are summarized in the evidence tables (Attachment 3). The assessment of the risk of bias is summarized in the risk of bias tables (Attachment 4).
Description of study
Systematic review
An (2019) included 18 studies (from the UK (8), Italy (3), the Netherlands (2), Switzerland (2), Germany (1), Egypt (1) and Spain (1)) with 6.018 patients with lower gastrointestinal symptoms (not specified). In 16 studies only adults were included (mean age: 30-63 year), in 1 study only children (mean age: 3.5 year) and in 1 study both (mean age children: 7 year, mean age adults: 43 year). Mean percentage women in the studies was 59. Setting of the studies: seven in primary care and 11 in secondary care. (We show results for both settings separate and combined.) The index test was in all studies faecal calprotectin (measured with ELISA) with a cut off value of 50 or 100 microgram per gram. The reference/standard test was colonoscopy, CT or MRI. Three comparisons were shown: organic gastrointestinal disease vs functional gastrointestinal disorder, inflammatory bowel disease vs functional gastrointestinal disorder, and organic gastrointestinal disease or inflammatory bowel disease vs functional gastrointestinal disorder. We did use the third comparison fitting most with the research question.
For the conclusions extra analyses were executed to differentiate between primary and secondary care and between the two cut off values, using RevMan.
Studies with the outcome measures ‘referral for colonoscopy’ or ‘consult frequency’ (primary care or secondary care) were not found.
Diagnostic test characteristics and patient relevant outcomes
See tables 11 and 12 for summary of results. In table 13 a summary of additional analyses with different cut-off values is shown.
| As seen in Dutch primary care | ||||
|---|---|---|---|---|
| Test result (cut off value mostly 50 microgram/gram) | Number of results per 1.000 patients tested (95% CI) | Number of participants (studies) | Certainty of the Evidence (GRADE) | |
| Prevalence 0.1% | Prevalence 1% | |||
| True positive | 1 (1 to 1) | 8 (7 to 9) | 6018 (18) | ⨁⨁⨁◯ MODERATE a |
| False negative | 0 (0 to 0) | 2 (1 to 3) | ||
| True negative | 809 (699 to 859) | 802 (693 to 851) | ⨁⨁◯◯ LOW a,b | |
| False positive | 190 (140 to 300) | 188 (139 to 297) | ||
CI: Confidence interval / a. Population primary AND secondary care / b. A lot of variation and confidence intervals did not overlap Patients or population: patients with abdominal complaints / Setting: primary and secondary care / Reference test: colonscopy or CT/ MRI Pooled sensitivity: 0.80 (95% CI: 0.73 to 0.85) | Pooled specificity: 0.81 (95% CI: 0.70 to 0.86) | ||||
| Predictive Value | Prevalence 0.1% | Prevalence 1% | ||
|---|---|---|---|---|
| Negative | 99.8-100% | TN / (FN + TN) | 809/809 | 802/804 |
| Positive | 1-4% | TP / (TP + FP) | 1/191 | 8/196 |
| Prevalence (%)* | TP | FN | TN | FP | Positive Predicitive Value (%) | Negative Predictive Value (%) | |
|---|---|---|---|---|---|---|---|
| Primary care | 10 | 80 | 20 | 729 | 171 | 32 | 97 |
| Secondary care | 34 | 272 | 68 | 535 | 125 | 67 | 89 |
| Cut off value 50 | 26 | 41 | 95 | ||||
| Cut off value 100 | 24 | 55 | 96 | ||||
| Prim. care Cut off 50 | 10 | 23 | 97 | ||||
| Prim. care Cut off 100 | 10 | 48 | 97 | ||||
| Sec. care Cut off 50 | 35 | 67 | 89 | ||||
| Sec. care Cut off 100 | 36 | 65 | 81 | ||||
| *The prevalence in the included studies in An (2019) was much higher than the estimated prevalence in table XXX (10-34% in the included studies compared to 0,1-1% in Dutch primary care). The high prevalence in the included studies in An (2019) is probably artificial and due to the high prevalence of disease in the study population. In real life the PPV will be lower than in this table (see below tabel 12: PPV 1-4%). | |||||||
Conclusies
Conclusions are based on review An 2019.
Diagnostic test characteristics
The diagnostic test characteristics were assessed in a group of patients with abdominal complaints. Testing calprotectin shows if the patient has (positive test result) or has not (negative test result) an organic gastrointestinal disease (such as inflammatory bowel disease).
- The negative predictive value (the percentage patients with a negative test result that really do not have an organic gastrointestinal disease) is (nearly) 100% (certainty of evidence is low)
- The positive predictive value (the percentage patients with a positive test result that really has an organic gastrointestinal disease) is 1-4% (certainty of evidence is low)
- Testing calprotectin for patients with abdominal complaints has a sensitivity of 80% for organic gastrointestinal diseases (the percentage of all patients with a gastrointestinal disease and a positive test result) (certainty of evidence is moderate)
- Testing calprotectin for patients with abdominal complaints has a specificity of 81% for organic gastrointestinal diseases (the percentage of all patients without a gastrointestinal disease and a negative test result) (certainty of evidence is low).
Therapeutical consequences
- 0-2 of 1000 patients with abdominal complaints will not receive follow up examination and the right therapy, while it is necessary (false negative test result) (certainty of evidence is moderate)
- 802-809 of 1000 patients with abdominal complaints will not receive unnecessary follow up examination (colonoscopy) after a negative calprotectin test result (certainty of evidence is low); this means that in up to 80% of patients unnecessary follow up examination will be avoided.
- 188-190 of 1000 patients with abdominal complaints will receive unnecessary follow up examination (colonoscopy) after a positive calprotectin test result (because they do not have an organic disease) (certainty of evidence is low).
Rectaal bloedverlies
Naar Samenvatting ›Bij rectaal bloedverlies; zie NHG-Standaard Rectaal bloedverlies.
Fecesonderzoek
Naar Samenvatting ›Verricht fecesonderzoek naar protozoa bij patiënten met (vermoeden van) PDS met diarree die > 14 dagen bestaat maar nog niet chronisch is (zie NHG-Standaard Acute diarree).
Evaluatie
Naar Samenvatting ›- Er is sprake van PDS bij (terugkerende) episodes van buikpijn of een ongemakkelijk gevoel in de buik die samenhangen met veranderingen of wisselingen in het ontlastingspatroon (frequentie en/of vorm).
- De diagnose PDS kan gesteld worden op basis van anamnese en lichamelijk onderzoek, mits er geen alarmsymptomen zijn.
- Overweeg een andere aandoening dan PDS bij aanwezigheid van ≥ 1 van de volgende kenmerken:
- Bij rectaal bloedverlies: overweeg inflammatoire darmziekte of maligniteit (zie NHG-Standaard Rectaal bloedverlies).
- Bij verandering naar dunnere consistentie en/of frequentere ontlasting (≥ 3 × per dag) of diarree gedurende > 2 weken: overweeg inflammatoire darmziekten of coeliakie.
- Bij onbedoeld en onverklaard gewichtsverlies (> 5% in 1 maand of > 10% in 6 maanden): overweeg inflammatoire darmziekten, coeliakie of maligniteit.
- Bij begin van de klachten ≥ 50 jaar: overweeg maligniteit.
- Bij eerstegraadsfamilielid met een inflammatoire darmziekte of coeliakie, of met colorectaal, ovarium- of endometriumcarcinoom < 70 jaar: overweeg de betreffende ziekte.
- Bij cyclusgebonden buikpijn: overweeg endometriose.
- Bij perianale afwijkingen (zoals fistel, abces): overweeg inflammatoire darmziekte.
- Bij een abnormale weerstand in abdomen, rectum of bekken: overweeg inflammatoire darmziekte of maligniteit.
Richtlijnen beleid
Naar Samenvatting ›- Doel van het beleid is het geruststellen van de patiënt en het verminderen van de hinder die deze door de PDS-klachten ondervindt. Start met voorlichting en advies.
- Alle behandelingen van PDS zijn bij slechts een deel van de patiënten effectief.
- Informeer de patiënt over verschillende behandelmogelijkheden en kom tot gezamenlijke besluitvorming over de individueel meest passende keuze.
|
|
Alle patiënten met PDS |
Individuele patiënt |
Kenmerken |
|
|---|---|---|---|---|
|
Eerste consult(en) |
Anamnese en lichamelijk onderzoek |
→ |
Zo nodig aanvullend onderzoek |
|
|
→ |
Zo nodig verwijzing naar tweede lijn |
|||
|
Exploreer verwachtingen |
||||
|
Bespreek ervaren relatie tussen voedingspatroon en klachten |
→ |
Laagdrempelige verwijzing diëtist |
Bespreek de risico’s van het vermijden van essentiële voedingsmiddelen |
|
|
Bespreek impact klachten op werk |
→ |
Laagdrempelige verwijzing naar open spreekuur bedrijfsarts |
|
|
|
Geef voorlichting over mogelijke oorzaken, beloop en prognose |
|
|||
|
Neem onnodige ongerustheid weg |
Bespreken van ongerustheid reduceert de klachten |
|||
|
Bespreek ongewenstheid van vermijdingsgedrag |
Vermijdingsgedrag heeft een negatief effect op PDS |
|||
|
Ga na welke factoren stress veroorzaken en streef naar gunstige beïnvloeding en optimale rol van de omgeving |
|
|||
|
Bespreek de Richtlijnen goede voeding 2015 |
|
|||
|
Adviseer voldoende lichaamsbeweging |
|
|||
|
|
||||
|
Vervolg consult(en) |
Herhaal en bekrachtig de stappen uit eerdere consult(en) |
|
||
|
Niet-medicamenteuze interventies (optioneel) |
→ |
Psylliumvezels* |
|
|
|
→ |
Dieetadvies op maat voor bijvoorbeeld laag-FODMAP-dieet* |
|
||
|
→ |
Probiotica* |
|
||
|
Psychologische interventies (optioneel) |
→ |
Psychologische therapie* |
|
|
|
Medicamenteuze interventies (optioneel) |
→ |
Macrogol* |
Symptomatische behandeling van obstipatie bij PDS-C | |
|
→ |
Psylliumzaad* |
|
||
|
→ |
Magnesiumhydroxide |
Symptomatische behandeling van obstipatie bij PDS-C |
||
|
→ |
Linaclotide* |
|
||
|
→ |
Loperamide* |
Symptomatische behandeling van diarree bij PDS-D |
||
|
→ |
Paracetamol* |
Als buikpijnklachten op de voorgrond staan |
||
|
→ |
Pepermuntolie (maagsapresistente capsules)* |
|
||
|
→ |
Tricyclisch antidepressivum (TCA)* |
|
||
|
→ |
Selectieve serotonineheropnameremmer (SSRI)* |
|
||
|
PDS-C = prikkelbaredarmsyndroom met obstipatie; PDS-D = prikkelbaredarmsyndroom met diarree. FODMAP = fermenteerbare oligosachariden, disachariden, monosachariden en polyolen. * Voor alle genoemde behandelingen ligt het number needed to treat rond de 5. |
||||
Tabel 15 vat verschillende behandelopties voor PDS samen, met het number needed to treat (NNT) en de systematische reviews waarop deze gebaseerd zijn.
Het NNT van de in tabel 15 genoemde behandelingen ligt rond de 5.
|
Behandeling |
NNT (uitersten) |
Bron (systematische review) |
|---|---|---|
|
Cognitieve gedragstherapie |
3 (2-4) |
Black 2020, Liard 2017 |
|
Pepermuntolie |
4 (3-6) |
Alammar 2019 |
|
Psychotherapieën (algemeen) |
4 (3,5-5,5) |
Black 2020, Liard 2017 |
|
Tricyclische antidepressiva |
4 (3,5-7) |
Ford 2018a |
|
Hypnotherapie |
5 (2-10) |
Black 2020, Liard 2017 |
|
Laag-FODMAP-dieet |
5 (3-11) |
Dionne 2018 |
|
Selectieve serotonineheropnameremmers |
5 (3-16,5) |
Ford 2018a |
|
Linaclotide |
6 (5-8) |
Atluri 2014, Rao 2012 |
|
Psylliumvezels (oplosbare vezels algemeen) |
7 (4-25) |
Moayyedi 2014 (psyllium nauwelijks onderzocht) |
|
Probiotica |
7 (5-12) |
Ford 2018b |
|
Loperamide |
Niet te bepalen |
Geen onderzoeken met PDS-patiënten |
|
Magnesium(hydr)oxide |
Niet te bepalen |
Geen onderzoeken met PDS-patiënten |
|
Paracetamol |
Niet te bepalen |
Geen onderzoeken met PDS-patiënten |
|
Polyethyleenglycol |
Niet te bepalen |
Geen dichotome data voor klinische uitkomst beschikbaar (NNT 3 bij patiënten met chronische idiopathische obstipatie) |
|
FODMAP = fermenteerbare oligosachariden, disachariden, monosachariden en polyolen. Gebaseerd op: Lacy – Am J Gastroenterol – 2021, ACG Clinical Guideline: management of IBS en Ford – Am J Gastroenterology – 2018, ACG Monograph on IBS. |
||
Voorlichting en advies
Naar Samenvatting ›Informeer de patiënt in een zo vroeg mogelijk stadium over mogelijke verklaringen voor PDS, de prognose en de bijbehorende klachten.
Mogelijke verklaringen
Geef voorlichting over de mogelijke oorzaak van PDS en leg het volgende uit.
- Er is tot nu toe geen eenduidige verklaring voor de klachten van PDS gevonden.
- Er zijn verschillende theoretische verklaringen voor het ontstaan van PDS, waaronder verhoogde gevoeligheid van de darmen, veranderingen in de darmbeweeglijkheid, verstoorde balans tussen verschillende soorten darmbacteriën, veranderingen in de darmafweerfunctie en in de doorlaatbaarheid van darmcellen, veranderingen in de communicatie tussen darmen en hersenen (darm-hersenas, zie Etiologie).
- De diagnose wordt gesteld op basis van symptomen en klachten.
- Er bestaan verschillende vormen van PDS: bij PDS met diarree op de voorgrond werken de darmen te snel, bij PDS met obstipatie op de voorgrond werken de darmen te langzaam en er is een mengvorm waarbij de ene keer diarree en de andere keer obstipatie op de voorgrond staat.
- De koliekachtige pijn ontstaat doordat de darm sterk samentrekt.
- PDS geeft geen verhoogd risico op het ontstaan van ernstige darmziekten.
- De klachten lijken soms te ontstaan na een heftige darminfectie of bij een periode van grote spanning.
Beloop en prognose
- Leg uit dat het individuele beloop van de klachten niet te voorspellen valt. Sommige mensen hebben periodiek klachten van wisselende aard, bij anderen houden de klachten lang aan.
- Geef aan dat er verschillende theoretische verklaringen zijn voor het voortduren van de klachten.
- Mensen met PDS zijn gevoeliger voor pijn in de darmen en merken meer van de werking van de darmen dan mensen zonder PDS. De exacte oorzaak van deze pijngevoeligheid is niet bekend, mogelijk speelt overgevoeligheid van de zenuwen in de darmen en hersenen een rol.
- Spanningen kunnen de klachten verergeren; veel mensen zijn ongerust over hun PDS-klachten en ook dat kan de klachten in stand houden of verergeren; darmklachten kunnen een signaal zijn dat men (langdurig) in een stressvolle situatie zit.
Aanvullend onderzoek
Leg uit dat aanvullend onderzoek naar de oorzaak van PDS, bijvoorbeeld coloscopie, niet zinvol is omdat mogelijke oorzaken hiermee niet aan te tonen zijn. Coloscopie heeft geen consequenties voor het beleid en is niet zonder risico’s.
Mogelijke behandelingen van PDS
- Leg uit dat elke behandeling bij slechts een deel van de patiënten, gemiddeld bij 1 op de 5, werkt (de effectiviteit van de behandelingen is onzeker).
- Leg uit dat welke behandeling het beste bij de patiënt past, afhangt van diens eigen klachten en voorkeuren. Ook mét behandeling kunnen klachten blijven bestaan of terugkomen.
Thuisarts
Bied voorlichtingsmateriaal aan en verwijs naar de informatie op thuisarts.nl. De informatie op Thuisarts is gebaseerd op deze NHG-Standaard.
Patiëntenorganisatie
Attendeer de patiënt op de Prikkelbare Darm Syndroom Belangenorganisatie en de mogelijkheden van lotgenotencontact.
Het taalgebruik tijdens de uitleg over PDS is belangrijk. Naarmate de uitleg vager is (‘Misschien kan het PDS zijn’ versus ‘Dit is PDS’), volgt er meer onnodig onderzoek (zoals endoscopieën).
Verschillen tussen de verwachtingen van de patiënt en de aanpak van de huisarts kunnen een optimale behandeling in de weg staan. Vraag daarom wat de patiënt verwacht en bied de gelegenheid om vragen en zorgen uit te spreken.
Zelfzorg en niet-medicamenteuze behandeling
Naar Samenvatting ›- Laat de informatie over zelfzorg aansluiten op de gegevens uit de anamnese. Verstrek afhankelijk daarvan onderstaande adviezen en maak samen met de patiënt afspraken.
- Zie voor aanvullende adviezen bij PDS-C de NHG-Standaard Obstipatie.
Overbodige ongerustheid wegnemen
- Ongerustheid kan een belangrijke rol spelen bij het in stand houden van de klachten.
- Het bespreken van de ongerustheid kan klachten reduceren.
- Exploreer de ongerustheid, ga na welke vragen leven bij de patiënt en of de verstrekte informatie voldoet.
In een interventieonderzoek onder 179 patiënten met PDS in de huisartsenpraktijk bleek dat de ongerustheid over klachten zowel na 1 als na 2 jaar significant afgenomen was in de interventiearm, waarin de huisartsen onder meer expliciet aandacht besteedden aan de aard van de ongerustheid van de patiënt, vergeleken met de controlegroep die gebruikelijke zorg kreeg.
Bij 110 poliklinische patiënten met PDS bleek dat na 6 maanden de buikklachten afnamen als de arts tijdens de consulten aandacht besteedde aan de angst en de cognities die patiënten hadden met betrekking tot hun klachten. Van de patiënten rapporteerden 31% een verbetering en 12% meldde dat de klachten verdwenen waren.
Vermijdingsgedrag verminderen
Naar Samenvatting ›- Soms vermijden patiënten allerlei activiteiten en voedingsmiddelen vanwege angst dat de klachten optreden, zonder dat daar medisch gezien een noodzaak toe bestaat.
- Bespreek dat vermijdingsgedrag ongewenst is en moedig de patiënt aan de normale activiteiten zo veel mogelijk te blijven verrichten.
In een interventieonderzoek bij 179 PDS-patiënten in de huisartsenpraktijk werd gevonden dat onder meer het bespreken van ongewenst vermijdingsgedrag leidde tot een significante afname van dat gedrag na 1 en 2 jaar vergeleken met een controlegroep waarin de huisarts de zogeheten usual care gaf. Cognitieve gedragstherapie gericht op het ‘afleren’ van vermijdingsgedrag had een gunstig effect op de klachten van 25 poliklinische patiënten met PDS, die 8 sessies van 2 uur groepstherapie kregen, vergeleken met 20 patiënten die ‘op de wachtlijst stonden’. In de therapie werd onder andere aandacht besteed aan het afleren van vermijdingsgedrag. Zowel op korte termijn als na 2 jaar follow-up bleken de patiënten uit de interventiegroep significant minder klachten te hebben en minder vermijdingsgedrag te vertonen.
Factoren die spanningen veroorzaken en de rol van omgeving
Naar Samenvatting ›- Zoals bij alle ziekten, kunnen spanningen en klachten elkaar negatief beïnvloeden. Ook reacties van mensen uit de directe omgeving van de patiënt kunnen hierbij een rol spelen.
- Ga na welke factoren in verband met de klachten een rol zouden kunnen spelen. Bespreek met de patiënt of deze hierin verandering zou kunnen aanbrengen.
In een onderzoek bleken er meer psychologische afwijkingen te zijn in een groep van 72 patiënten met PDS, die medische hulp zochten, vergeleken met 2 controlegroepen. Eén controlegroep bestond uit 82 patiënten met PDS, die geen arts raadpleegden en de andere uit 84 mensen zonder PDS-klachten. Ook kwamen bij diegenen die medische hulp zochten meer andere klachten zoals misselijkheid, dyspepsie, moeheid en dysurie voor. In een ander onderzoek werden 153 patiënten met PDS uit de huisartsenpraktijk vergeleken met 10.787 mensen uit de open populatie. Ook daar bleken klachten zoals misselijkheid, maagpijn, moeheid, duizeligheid en zweten significant meer voor te komen in de PDSgroep, evenals angst, slaapstoornissen, prikkelbaarheid en apathie. In een aselecte steekproef van 48 patiënten met PDS, van wie de helft hun huisarts geconsulteerd had voor deze klachten en de andere helft niet, werd vastgesteld dat de ernst van de klachten en bezorgdheid over de klachten voor 85% de variantie tussen beide groepen verklaarde. De helft van de groep die hun arts consulteerde was bezorgd dat de klachten een ernstige oorzaak hadden tegenover 2 van de 24 personen uit de groep die geen arts geconsulteerd hadden. 10 van de 24 personen uit de eerste groep waren bang dat ze kanker zouden hebben tegenover 1 uit de tweede groep. In een psychologisch onderzoek bij 308 patiënten, die naar de polikliniek verwezen waren in verband met buikklachten werd bij 81 van hen een organische aandoening gevonden, de overigen kregen de diagnose: functionele buikklachten. Tussen deze groepen was geen verschil in scores voor depressie, angst, zelfvertrouwen, neuroticisme en probleemoplossend vermogen. In het onderzoek van Smith et al. werd bij 97 poliklinische patiënten, die verwezen waren met buikpijn en veranderde defecatie psychologisch onderzoek verricht. Bij 30 van hen werd een organische aandoening gevonden, de overigen kregen de diagnose PDS. Er werd geen verschil gevonden in scores voor angst, depressie, gebrek aan sociale steun, somatisatie en abnormaal ziektegedrag tussen deze 2 groepen. De scores waren echter in de hele groep significant hoger dan in de algemene bevolking. Verondersteld wordt dat aanwezigheid van angst, depressie of stress niet zozeer het ontstaan van het PDS bevorderen, maar een belangrijke verklaring is voor het hulpzoekgedrag. In een onderzoek met een follow-up periode van 5 jaar onder 75 poliklinische patiënten met PDS hadden degenen met bij aanvang een hogere score op de angstschaal meer hinder van hun klachten na 5 jaar. De 28 patiënten die na 5 jaar aangaven verbeterd te zijn, hadden een lage score op de angstschaal bij de baselinemeting. In een onderzoek onder 120 poliklinische patiënten met PDS bleken diegenen die hun klachten bleven toeschrijven aan een lichamelijke afwijking later vaker de huisarts te bezoeken voor hun buikklachten.
Voeding
Naar Samenvatting ›Richtlijnen Goede Voeding
Naar Samenvatting ›- Adviseer de Richtlijnen goede voeding 2015 van de Gezondheidsraad te volgen.
- Bij één of enkele duidelijke voedingsgerelateerde triggers zoals gasvormers, lactose, frisdrank, overmatig vet, pittige kruiden, cafeïne, alcohol, sorbitol, kunstmatige zoetstoffen en tarwezemelen kan de voeding hierop aangepast worden. Uitgangspunt is het behoud van een evenwichtig voedingspatroon.
- Patiënten met PDS hebben vaak een ongezond eetpatroon en een ongezonde leefstijl. Deze patiënten hebben allereerst baat bij normalisering van hun voeding. De Richtlijnen goede voeding 2015 van de Gezondheidsraad zijn gericht op de algemene bevolking. Bepaalde voedingsmiddelen uit deze richtlijnen kunnen (tijdelijk) PDS-klachten triggeren, daarom is het raadzaam deze triggers te onderzoeken en zo nodig (tijdelijk) te verminderen of te elimineren. Uit onderzoek blijkt dat mensen die ernstige PDS-symptomen ervaren, vaker en heviger reageren op voedingstriggers. Angst gerelateerd aan gastro-intestinale klachten kan de reactie op voedingstriggers versterken.
- Het NICE-IBS-dieet geeft richting aan het opsporen van voedingstriggers die PDS-klachten kunnen verergeren. Omdat voedingstriggers individueel bepaald worden, is het meestal niet nodig alle voedingstriggers te elimineren en is verminderen of elimineren van alleen de persoonlijke triggers veelal genoeg.
Voor- en nadelen
Er is geen relevante literatuur gevonden waarin het NICE-IBS-dieet wordt vergeleken met het gebruikelijke voedingspatroon bij patiënten met PDS. Er kan daarom geen conclusie worden getrokken over de uitkomstmaten bij dit dieet. Patiënten met PDS hebben vaak een ongezond eetpatroon: vezelarm en vetrijk, zeer eenzijdig of zeer onregelmatig. Uit de praktijk blijkt dat patiënten doorgaans al een stuk minder klachten ervaren door normalisering van hun voeding. Het NICE-IBS-dieet sluit in grote lijnen aan bij de Richtlijnen goede voeding 2015 van de Gezondheidsraad, met een extra beperking van voedingsmiddelen die PDS-klachten kunnen uitlokken, zoals gasvormers, cafeïne, alcohol en frisdranken. Het NICE-IBS-dieet bevat relatief weinig FODMAP’s en is minder restrictief dan bijvoorbeeld het FODMAP-dieet, maar toch kan ook dit dieet voor de patiënt lastig op te volgen zijn, niet alleen omdat veranderen van (voedings)gedrag moeilijk is, maar ook omdat het individueel bepaald is welke voedingsmiddelen de PDS-klachten triggeren, in welke hoeveelheden en op welk moment.
Omdat de klachten zo uiteenlopen blijft voedingsadvies maatwerk. Wanneer de patiënt hiervoor openstaat, kan de diëtist ondersteunend en motiverend zijn bij de verandering van voedingsgedrag en helpen om voedingstriggers te elimineren en te onderzoeken. Daarnaast zal de diëtist een adequate voedingsinname waarborgen.
Kwaliteit van bewijs
Niet van toepassing; geen onderzoeken geïncludeerd.
Waarden en voorkeuren van patiënten
Van de PDS-patiënten rapporteert 80% dat de klachten een relatie hebben met hun voedingsinname. Afhankelijk van motivatie, voorkeuren en bereidheid om het voedingsgedrag aan te passen, kan een gepaste dieetinterventie worden aangeboden. Het volgen van een dieet kan voor een deel van de PDS-patiënten tijdelijk zwaar zijn, maar veel patiënten hebben dat er wel voor over. Immers, het merendeel ervaart dat de voeding invloed heeft op de klachten. De meeste patiënten begrijpen ook het principe van eliminatie en provocatie om persoonlijke triggers op te sporen. De dieetbehandeling vergt wel enige inspanning van de patiënt zelf; de zorgverlener heeft hierbij een adviserende en ondersteunende rol. Het is belangrijk om ook de verwachtingen te bespreken; aanpassingen van het dieet zullen over het algemeen niet leiden tot klachtenvrij kunnen eten, aangezien PDS-klachten multifactorieel bepaald worden.
Kosten
De kosten van het NICE-IBS-dieet verschillen weinig van een eetpatroon volgens de Richtlijnen goede voeding 2015.
Aanvaardbaarheid
Het wordt algemeen aanvaard dat mensen hun dieet aanpassen om minder klachten te hebben. Het NICE-IBS-dieet overlapt met de Richtlijnen goede voeding 2015 en zal waarschijnlijk geaccepteerd worden door de patiënt.
Haalbaarheid
Het NICE-IBS-dieet is deels vergelijkbaar met de Richtlijnen goede voeding 2015. Het maakt deel uit van een breder concept van gezonde leefstijl en hangt samen met algemene gezondheidsvaardigheden. Mensen met lage gezondheidsvaardigheden zullen doorgaans meer moeite hebben met de therapietrouw.
Is het volgen van de richtlijnen goede voeding en/of het NICE-IBS-dieet aan te bevelen bij patiënten met PDS?
Achtergrond
Dieetaanpassing is een belangrijke initiële behandelstap bij patiënten met PDS. Er zijn verschillende soorten dieetinterventies en er is veel publieke en wetenschappelijke interesse voor de verschillende diëten. Deze toegenomen aandacht heeft ervoor gezorgd dat meer mensen zich zijn gaan verdiepen in voeding en darmklachten. Het gevaar daarbij is dat er vaak (digitale) bronnen geraadpleegd worden die niet noodzakelijkerwijs de meest accurate informatie weergeven. Veel patiënten volgen een bepaald dieet, vaak op eigen initiatief, zonder adequate (medische of diëtistische) begeleiding. Dit kan leiden tot nadelige gezondheidsuitkomsten, zoals deficiënties of ongewenste gewichtsverandering.
Het NICE-IBS-dieet maakt deel uit van het voedings- en leefstijladvies in de Britse NICE-Guideline Irritable bowel syndrome. Het dieet beschrijft onder andere regelmatig en rustig eten, met aandacht voor voldoende inname van (oplosbare) voedingsvezels en vocht bij beperkte inname van voedingsmiddelen die klachten geven zoals gasvormers, cafeïne, alcohol en frisdranken.
Clinical question
Is the NICE-IBS-diet and/ or the dietary advice on healthy balanced diet/ Dutch guideline of a healthy diet recommended for patients with IBS?
| Patients | Patients with IBS (primary and secondary care; all subgroups of IBS) |
|---|---|
| Intervention | NICE-IBS diet |
| Control | Dietary advice on healthy balanced diet/ Dutch guideline of a healthy diet |
| Outcomes |
|
| Selection criteria | Study design: systematic reviews and RCTs |
Relevant outcome measures
The guideline development group considered abdominal pain, global improvement / IBS-symptom severity score, quality of life, relief of symptoms (Likert scale; number of days without symptoms) as critical outcome measures for decision making.
The working group defined 20% as a minimal clinically (patient) important difference for all outcome measures, except the IBS-SSS. That means a Standardized Mean Difference (SMD) > 0.50, OR or RR < 0.75 or > 1.25 and a change of (10-)20% of the total score on a questionnaire. A 10% (50 points) improvement on the IBS-SSS is considered a minimal clinically (patient) important difference (based on literature). The working group defined the outcome measures as follows.
- Abdominal pain: abdominal pain can be measured on different scales, for example VAS-scale or the IBS-SSS subscale
- Global improvement / IBS symptom severity scale (IBS-SSS): global improvement or global relief is usually measured by asking patients if their symptoms were adequately controlled in the past 7 days. The IBS-SSS is in this literature summary used as a measure for global improvement.
- Quality of life: measured with a general questionnaire, such as the SF 36, or disease-specific (IBS-QOL)
- Relief of symptoms: there are many different symptoms of irritable bowel syndrome, for example bloating, nausea, stool consistency. All symptoms described in the included papers are used.
Search and select (Methods)
The databases [Medline (via OVID) and Embase (via Embase.com)]. were searched with relevant search terms from 2000 until November 2020. The detailed search strategy is depicted in the Annex (Totstandkoming)/ under the tab Methods. Studies were selected based on the following criteria as described in the PICO. Attachment 1 contains the PRISMA flowchart showing the number of hits, and Attachment 2 contains the reasons of exclusion.
Results
There were no studies identified that met the PICO.
Conclusions
Not applicable.
Psylliumvezels
Naar Samenvatting ›Overweeg het gebruik van psylliumvezels als zelfzorg (zonder hulpstoffen zoals sorbitol, inuline of aspartaam) als mogelijke aanvulling op de adviezen over goede voeding, wanneer deze adviezen onvoldoende verbetering geven, of wanneer de voeding te weinig vezels bevat:
- dosering conform verpakking
- bespreek de voordelen (klachtenverlichting, weinig bijwerkingen) en nadelen (smaak, kosten, enige gasvorming, met name in de eerste week toename van buikklachten)
- adviseer de vochtinname aan te passen op grond van de consistentie van de ontlasting (veel vocht bij obstipatie, weinig vocht bij diarreeklachten)
Het gebruik van psylliumvezels zou PDS-klachten kunnen verlichten en heeft maar beperkte bijwerkingen. Dit maakt dat psylliumvezels als dieetbehandeling kunnen worden ingezet naast de Richtlijnen goede voeding 2015, vooral als de patiënt te weinig voedingsvezels (groente, fruit, volkoren granen) eet. Verschillende psylliumproducten bevatten hulpstoffen zoals sorbitol of aspartaam, en smaakstoffen voor een verbeterde smaakervaring. Deze hulpstoffen kunnen PDS-klachten juist doen verergeren; adviseer daarom psylliumproducten zonder deze hulpstoffen.
Voor- en nadelen
De geïdentificeerde systematische review beschreef enkel de uitkomstmaat ‘algemene verbetering’. De bewijskracht voor deze uitkomstmaat was redelijk: het gebruik van psylliumvezels heeft een positief effect op de algemene verbetering, maar informatie over de dosis ontbreekt. De follow-upduur van de geïncludeerde onderzoeken is kort en dus is het lastig om uitspraken te doen over de voordelen van psylliumvezels op de lange termijn. Psylliumvezels zijn beperkt fermenteerbaar door colonbacteriën en geven daardoor weinig gasvormingsklachten. Bij obstipatie is voldoende vochtinname essentieel om coprostase te voorkomen. Bij diarree daarentegen moeten psylliumvezels met zo min mogelijk vocht ingenomen worden. Op basis van klinische ervaring lijken de bijwerkingen gering.
Kwaliteit van bewijs
De kwaliteit van het bewijs is laag.
Waarden en voorkeuren van patiënten
Van de PDS-patiënten rapporteert 80% dat de klachten een relatie hebben met hun voedingsinname. Afhankelijk van motivatie, voorkeuren en bereidheid om het voedingsgedrag aan te passen, kan een gepaste dieetinterventie worden aangeboden. Het volgen van een dieet kan voor een deel van de PDS-patiënten tijdelijk zwaar zijn, maar veel patiënten hebben dat er wel voor over. Immers, het merendeel ervaart dat de voeding invloed heeft op de klachten. De meeste patiënten begrijpen ook het principe van eliminatie en provocatie om persoonlijke triggers op te sporen. De dieetbehandeling vergt wel enige inspanning van de patiënt zelf; de zorgverlener heeft hierbij een adviserende en ondersteunende rol. Het is belangrijk om ook de verwachtingen te bespreken; aanpassingen van het dieet zullen over het algemeen niet leiden tot klachtenvrij kunnen eten, aangezien PDS-klachten multifactorieel bepaald worden.
Kosten
De kosten van psylliumvezels variëren per merk en worden niet vergoed.
Aanvaardbaarheid
Het wordt over het algemeen aanvaard dat mensen iets innemen (anders dan medicatie) om minder klachten te hebben.
Haalbaarheid
Psylliumvezels zijn afkomstig van de zaden en zaadhuiden van de plant Plantago ovata. Het feit dat dit geen farmacologisch (chemisch) supplement is, kan mensen aanspreken. Psylliumvezels zijn vrij verkrijgbaar bij drogist, supermarkt en online. Bepaalde psylliumvezelpreparaten bevatten echter toevoegingen (bijvoorbeeld sorbitol, een FODMAP) die juist bij PDS-patiënten voor een toename van klachten zorgen.
Zijn psylliumvezels (ten opzichte van het volgen van de richtlijnen gezonde voeding) aan te bevelen bij patiënten met PDS?
Achtergrond
Dieetaanpassing is een belangrijke initiële behandelstap bij patiënten met PDS. Er zijn verschillende soorten dieetinterventies en er is veel publieke en wetenschappelijke interesse voor de verschillende diëten. Deze toegenomen aandacht heeft ervoor gezorgd dat meer mensen zich zijn gaan verdiepen in voeding en darmklachten. Het gevaar daarbij is dat er vaak (digitale) bronnen geraadpleegd worden die niet noodzakelijkerwijs de meest accurate informatie weergeven. Veel patiënten volgen een bepaald dieet, vaak op eigen initiatief, zonder adequate (medische of diëtistische) begeleiding. Dit kan leiden tot nadelige gezondheidsuitkomsten, zoals deficiënties of ongewenste gewichtsverandering.
Psylliumvezels zijn oplosbare viskeuze vezels die maar beperkt fermenteerbaar zijn en die veel water kunnen opnemen. Psylliumvezels kunnen zowel bij obstipatie als bij diarreeklachten worden gebruikt om de ontlasting te verbeteren.
Bij obstipatie is het van belang om de psylliumvezels met ruim voldoende vocht in te nemen. De ontlasting wordt dan zachter en zwelt wat op, wat de stoelgang stimuleert. Bij te weinig vochtinname kan hinderlijke coprostase ontstaan.
Bij diarree moeten de psylliumvezels met zo min mogelijk vocht ingenomen worden. Dan kunnen ze in de darm het teveel aan vocht binden en zo de ontlasting juist vaster maken.
Doordat psylliumvezels beperkt fermenteerbaar zijn in het colon geven ze minder gasvormingsklachten dan andere typen vezels.
Clinical question
Is psyllium fibre (compared to a healthy balanced diet/ Dutch guideline of a healthy diet) recommended for patients with IBS?
|
Patients |
Patients with IBS (primary and secondary care; all subgroups of IBS) |
|---|---|
|
Intervention |
psyllium fiber |
|
Control |
Dietary advice on healthy balanced diet/ Dutch guideline of a healthy diet |
|
Outcomes |
|
|
Selection criteria |
Study design: systematic reviews and RCTs |
Relevant outcome measures
The guideline development group considered abdominal pain, global improvement / IBS-symptom severity score, quality of life, relief of symptoms (Likert scale; number of days without symptoms) as critical outcome measures for decision making.
The working group defined 20% as a minimal clinically (patient) important difference for all outcome measures, except the IBS-SSS. That means a Standardized Mean Difference (SMD) > 0.50, OR or RR < 0.75 or > 1.25 and a change of (10-)20% of the total score on a questionnaire. A 10% (50 points) improvement on the IBS-SSS is considered a minimal clinically (patient) important difference (based on literature). The working group defined the outcome measures as follows.
- Abdominal pain: abdominal pain can be measured on different scales, for example VAS-scale or the IBS-SSS subscale
- Global improvement / IBS symptom severity scale (IBS-SSS): global improvement or global relief is usually measured by asking patients if their symptoms were adequately controlled in the past 7 days. The IBS-SSS is in this literature summary used as a measure for global improvement.
- Quality of life: measured with a general questionnaire, such as the SF 36, or disease-specific (IBS-QOL)
- Relief of symptoms: there are many different symptoms of irritable bowel syndrome, for example bloating, nausea, stool consistency. All symptoms described in the included papers are used.
Search and select (Methods)
The databases [Medline (via OVID) and Embase (via Embase.com)]. were searched with relevant search terms from 2000 until November 2020. The detailed search strategy is depicted in the Annex (Totstandkoming)/ under the tab Methods. Studies were selected based on the following criteria as described in the PICO. Attachment 1 contains the PRISMA flowchart showing the number of hits, and Attachment 2 contains the reasons of exclusion.
Results
One systematic review (SR; Ford, 2018) and no additional RCTs were included in the analysis of the literature. Important study characteristics and results are summarized in the evidence tables (Attachment 3). The assessment of the risk of bias is summarized in the risk of bias tables (Attachment 4).
Description of studies
One systematic review was identified on psyllium fibre.
Ford (2018) aimed to assess the efficacy of psyllium fibre compared to placebo on global improvement in IBS symptoms and quality of life in a systematic review. MEDLINE, EMBASE, EMBASE classic, PsychINFO and the Cochrane central register of controlled trials were searched until July 2017. Fifteen RCTs were identified on fibre, of which seven described ispaghula husk (psyllium) in 499 patients. A meta-analysis was performed on global improvement, defined as symptoms or abdominal pain persisting with intervention compared with control. This was expressed as a relative risk (RR) with 95 % confidence intervals (CIs).
|
Included in SR |
RCT |
Participants |
Study duration |
Total intervention/controls |
Intervention versus control |
Outcome measures |
|---|---|---|---|---|---|---|
|
Ford (2018) |
Ritchie (1979) |
Author-defined IBS, tertiary care |
3 months |
12/12 |
Ispaghula husk versus placebo |
Dichotomous assessment of IBS symptoms: ‘improved‘ or ‘not improved‘ |
|
Ford (2018) |
Longstreth (1981) |
Author-defined IBS, secondary care. |
8 weeks |
37/40 |
Ispaghula versus placebo |
Global assessment of IBS symptoms on Likert scale. Much or a little better from baseline symptoms |
|
Ford (2018) |
Arthurs (1983) |
Author-defined IBS, secondary care. |
4 weeks |
40/38 |
Ispaghula husk versus placebo |
Global assessment of IBS symptoms on Likert scale. Resolved or improved from baseline symptoms |
|
Ford (2018) |
Nigam (1984) |
Author-defined IBS, secondary care. |
3 months |
21/21 |
Ispaghula husk versus placebo |
Dichotomous assessment of IBS: ‘ improved ‘ or ‘not improved‘ |
|
Ford (2018) |
Prior (1987) |
Author-defined IBS, tertiary care |
12 weeks |
40/40 |
Ispaghula husk versus placebo |
Overall improvement in well-being discussed with patient, and rated as ‘ satisfactory ‘ or ‘unsatisfactory‘ |
|
Ford (2018) |
Jalihal (1990) |
Author-defined IBS, secondary care |
4 weeks |
11/9 |
Ispaghula husk versus placebo |
Dichotomous assessment of IBS: ‘improved‘ or ‘no change‘ |
|
Ford (2018) |
Bijkerk (2009) |
Author-defined or Rome II IBS., primary care |
12 weeks |
85/93 |
20g Ispaghula husk versus placebo |
Adequate relief of IBSrelated abdominal pain or discomfort in the last week, with responders defined as those with adequate relief for 2 out of the last 4 weeks |
Results
Table Psyllium fibre shows the summary of findings for the various outcome measures. Below the table, more detailed information on the outcomes can be found. Forest plots can be found in the attachment 4.
Abdominal pain
Not reported.
Global improvement
Ford (2018) conducted a meta-analysis for the outcome measure global improvement, including 7 RCTs and 499 patients. If this was not available then improvement in abdominal pain was taken as the primary outcome. When more than one definition was provided for improvement in the primary outcome, the most stringent definition with the lowest placebo response rate was taken. The pooled risk ratio of global symptoms not improving of Ispaghula (psyllium) versus placebo was 0.83 95%CI: 0.73, 0.94, meaning that Ispaghula (psyllium) is beneficial in treating IBS symptoms. The number needed to treat (NNT) was 7 (95% 4-25).
Quality of life
Not reported.
Relief of symptoms
Not reported.
Conclusions
- Use of psyllium fibre may result in an increase in global improvement.
- The outcome abdominal pain was not reported in the included studies.
- The outcome quality of life was not reported in the included studies.
- The outcome relief of symptoms was not reported in the included studies.
Voedingsadvies van de diëtist
Naar Samenvatting ›- Verwijs patiënten met PDS laagdrempelig naar de diëtist voor voedingsadvies:
- wanneer er meerdere voedingsgerelateerde triggers bestaan
- wanneer er sprake is van een onevenwichtig voedingspatroon
- als de patiënt in aanmerking zou kunnen komen voor het laag-FODMAP-dieet
- Zie factsheet Voedingsadvies bij PDS is maatwerk voor wat de diëtist kan betekenen voor een patiënt met PDS.
- Het onderzoeken van voedingstriggers (moet) bij voorkeur plaatsvinden onder professionele begeleiding van een diëtist en moet gericht zijn op zo min mogelijk (tijdelijke) eliminaties. Indien de PDS-klachten het toelaten, is het advies om de Richtlijnen goede voeding 2015 te volgen en alleen de nodige triggers te beperken of te elimineren.
- Bij het bestaan van meerdere voedingsgerelateerde triggers en/of een onevenwichtig voedingspatroon kan een diëtist voedingsadvies geven (zie factsheet Voedingsadvies bij PDS is maatwerk). Geef als verwijsreden bij voorkeur ‘Dieetbehandeling bij PDS’, dan kan de diëtist aan de hand van het diëtistisch onderzoek maatwerkgericht een dieetbehandelplan opstellen.
- Een gepersonaliseerd laag-FODMAP-dieet wordt aanbevolen als mogelijke volgende stap in een dieetbehandeling omdat dit dieet effect kan hebben op de algemene verbetering. Het is bedoeld om uit te zoeken welke groepen voedingsmiddelen klachten geven en niet geschikt voor de lange termijn. Geadviseerd wordt bij dit dieet maatwerk toe te passen en het alleen te volgen onder begeleiding van een diëtist met kennis van dit dieet. Aangezien het klassieke laag-FODMAP-dieet veel vraagt van de patiënt en bij gebrek aan kwalitatief hoogstaand wetenschappelijk onderzoek grotendeels gebaseerd is op klinische ervaring en expertise, valt te overwegen om dit dieet in overleg met de patiënt bottom-up aan te pakken in plaats van top-down (zie figuur 1). Bij de stapsgewijze bottom-up-aanpak wordt op basis van het diëtistisch onderzoek eerst een selectie van FODMAP’s geëlimineerd en de symptoomrespons hierop afgewacht, alvorens het dieet in samenspraak met de patiënt verder te intensiveren. Bij de ‘klassieke’ top-down-aanpak worden gedurende 2-6 weken (bij voorkeur zo kort mogelijk) zoveel mogelijk FODMAP’s geëlimineerd, waarna de verschillende FODMAP’s weer langzaam stuk voor stuk worden geïntroduceerd en gemonitord.
Voor- en nadelen
De geïncludeerde onderzoeken beschreven de uitkomstmaten buikpijn, global improvement, kwaliteit van leven en verlichting van klachten. De bewijskracht was laag tot zeer laag. Het laag-FODMAP-dieet lijkt een klinisch relevant effect te hebben op de uitkomstmaat algemene verbetering. Over de uitkomstmaten buikpijn, kwaliteit van leven en verlichting van klachten kunnen geen uitspraken worden gedaan omdat het bewijs op deze uitkomstmaten zeer laag is. Meta-analyses van de uitkomstmaat algemene verbetering laten zien dat het effect van het laag-FODMAP-dieet groter is wanneer het wordt vergeleken met het normale dieet van de patiënt of met een hoog-FODMAP-dieet, dan wanneer het wordt vergeleken met een alternatief dieet – vaak een (aangepast) NICE-IBS-dieet dat relatief weinig FODMAP’s bevat.
Een belangrijke aantekening hierbij is dat de metingen in de onderzoeken plaatsvonden op het moment dat alle hoog-FODMAP-producten al enkele weken vermeden waren, maar niet na de herintroductieperiode. Hoe het laag-FODMAP-dieet scoort op de gedefinieerde uitkomstmaten na herintroductie van FODMAP’s is dus niet bekend.
Ook de langetermijneffecten van het laag-FODMAP-dieet zijn nog niet bekend. FODMAP’s vormen het substraat voor het darmmicrobioom en depletie van deze koolhydraten kan nadelige effecten hebben op de samenstelling en de activiteit van het microbioom. Bovendien zijn FODMAP’s ook een bron van korteketenvetzuren, die een positief effect hebben op het darmepitheel (bron van energie en antioxidante werking).
Belangrijk is dat het laag-FODMAP-dieet, in tegenstelling tot veel andere diëten, niet bedoeld is om langere tijd te volgen. Het laag-FODMAP-dieet is alleen bedoeld om uit te zoeken op welke FODMAP’s de patiënt reageert en op welke niet. Binnen een paar maanden is het dieet klaar en gaat de patiënt weer ‘normaal’ eten zonder de FODMAP’s die veel klachten geven.
FODMAP’s hebben een osmotisch effect en zijn substraten voor bacteriële fermentatie, en zullen dus vooral diarree, krampen en overmatige gasvorming veroorzaken. Dat geldt in het bijzonder voor mensen met de viscerale overgevoeligheid die kenmerkend is voor PDS.
Het laag-FODMAP-dieet vergt veel inspanning van de patiënt en mag alleen gevolgd worden onder begeleiding van een diëtist vanwege het risico op deficiënties bij verkeerde toepassing. In samenspraak met de diëtist vermijdt de patiënt 2-6 weken lang alle producten uit het normale dieet die veel FODMAP’s bevatten en vervangt die door producten die weinig FODMAP’s bevatten. De keuze aan voedingsmiddelen is dus beperkt. Wanneer de PDS-klachten tijdens de eliminatieperiode verminderen, worden de geëlimineerde voedingsmiddelen onder begeleiding van de diëtist stuk voor stuk opnieuw geïntroduceerd en wordt gemonitord hoe de patiënt erop reageert. Vooralsnog zijn er geen onderzoeken verricht naar deze herintroductiefase en naar de klachten die PDS-patiënten daarna ervaren.
Gezien de intensieve aard van het dieet kan, in overleg met de diëtist, eerst worden gepoogd een aantal FODMAP-rijke producten te beperken alvorens over te gaan tot een volledig laag-FODMAP-dieet. Voor deze specifieke benadering is echter geen wetenschappelijk bewijs voorhanden.
Algemene aandachtspunten bij diëten
Patiënten mijden vaak bepaalde voedingsmiddelen op eigen initiatief door een geconditioneerde, maar vaak maladaptieve respons als gevolg van door voeding uitgelokte darmklachten. Als de voeding te eenzijdig wordt, kan dit ook negatieve gevolgen hebben op de gezondheid en het microbioom. Er kan dan een neerwaartse spiraal ontstaan. Het is belangrijk om de patiënt hierop te wijzen omdat dit op termijn kan leiden tot een eetstoornis zoals Avoidant Restrictive Food Intake Disorder (ARFID).
Het gevaar van eliminatiediëten zoals het glutenvrij of het laag-FODMAP-dieet is de kans op voedingsdeficiënties, zowel in kwantitatieve als kwalitatieve zin, en op een te restrictief eetpatroon. Derhalve is het noodzakelijk om een dergelijke dieetinterventie onder begeleiding van een ter zake kundige diëtist uit te voeren.
Terughoudendheid met betrekking tot eliminatiediëten is belangrijk bij patiënten met kenmerken die wijzen op een eetstoornis (onder andere ARFID) of wanneer er aanwijzingen voor een onderliggende angst- of paniekstoornis zijn. Verwijs de patiënt in dat geval naar een psycholoog.
Kwaliteit van bewijs
Bewijskracht voor de korte termijn laag tot zeer laag, mede door kleine aantallen, gebrek aan blindering en heterogeniteit in de onderzoeken. Voor de lange termijn zijn er nog niet voldoende onderzoeken.
Waarden en voorkeuren van patiënten
Van de PDS-patiënten rapporteert 80% dat de klachten een relatie hebben met hun voedingsinname. Afhankelijk van motivatie, voorkeuren en bereidheid om het voedingsgedrag aan te passen, kan een gepaste dieetinterventie worden aangeboden. Het volgen van een dieet kan voor een deel van de PDS-patiënten tijdelijk zwaar zijn, maar veel patiënten hebben dat er wel voor over. Immers, het merendeel ervaart dat de voeding invloed heeft op de klachten. De meeste patiënten begrijpen ook het principe van eliminatie en provocatie om persoonlijke triggers op te sporen. De dieetbehandeling vergt wel enige inspanning van de patiënt zelf; de zorgverlener heeft hierbij een adviserende en ondersteunende rol. Het is belangrijk om ook de verwachtingen te bespreken; aanpassingen van het dieet zullen over het algemeen niet leiden tot klachtenvrij kunnen eten, aangezien PDS-klachten multifactorieel bepaald worden.
Kosten
- De kosten van een laag-FODMAP-dieet verschillen niet erg van een eetpatroon volgens de Richtlijnen goede voeding.
- Het tarief van een diëtist is ongeveer € 60-70 per uur. In 2022 vergoedt de basisverzekering de eerste 3 behandeluren bij een diëtist; dit gaat af van het eigen risico. De behandeling kan worden verdeeld over meerdere zorgjaren. Een aanvullende verzekering vergoedt vaak meer uren. De beperkte vergoeding van diëtetiek vanuit het basispakket kan een belemmerende factor zijn voor patiënten, zeker als het eigen risico nog niet aangesproken is.
Aanvaardbaarheid
Het wordt algemeen aanvaard dat mensen hun dieet aanpassen om minder klachten te hebben. De sociale en financiële impact van het laag-FODMAP-dieet is minder groot dan van het glutenvrije dieet, maar toch aanzienlijk. Herintroductie van FODMAPs is essentieel in verband met het voorkomen van deficiënte voeding/ gezondheidsrisico’s op de lange termijn.
Haalbaarheid
Een laag-FODMAP-dieet vergt gezien de restrictieve aard substantiële inspanningen van de patiënt. Het is een tijdelijk dieet dat bedoeld is om uit te zoeken welke groepen voedingsmiddelen klachten geven, en is niet geschikt voor de lange termijn. Het volgen van een laag-FODMAP-dieet mag alleen gebeuren onder begeleiding van een diëtist met kennis van dit dieet. De beschikbaarheid van diëtisten met specifieke kennis over het laag-FODMAP-dieet kan een belemmering zijn.
De meeste huisartsenpraktijken hebben al een korte lijn met een diëtistenpraktijk. De diëtist werkzaam in het gezondheidscentrum, de huisartsenpraktijk of de afdeling diëtetiek van het regionale ziekenhuis beschikt over een regionale sociale kaart van diëtisten en hun specialismen, zoals de subspecialisatie ‘PDS/laag-FODMAP’.
Terughoudendheid met betrekking tot een eliminatiedieet is belangrijk bij patiënten met kenmerken die wijzen op een eetstoornis (zoals ARFID) of wanneer er aanwijzingen zijn voor een onderliggende angst- of paniekstoornis. Verwijs de patiënt in dat geval naar een psycholoog of andere ter zake kundige zorgprofessional.
Is voedingsadvies van een diëtiste aan te bevelen bij patiënten met PDS?
Achtergrond
Dieetaanpassing is een belangrijke initiële behandelstap bij patiënten met PDS. Er zijn verschillende soorten dieetinterventies en er is veel publieke en wetenschappelijke interesse voor de verschillende diëten. Deze toegenomen aandacht heeft ervoor gezorgd dat meer mensen zich zijn gaan verdiepen in voeding en darmklachten. Het gevaar daarbij is dat er vaak (digitale) bronnen geraadpleegd worden die niet noodzakelijkerwijs de meest accurate informatie weergeven. Veel patiënten volgen een bepaald dieet, vaak op eigen initiatief, zonder adequate (medische of diëtistische) begeleiding. Dit kan leiden tot nadelige gezondheidsuitkomsten, zoals deficiënties of ongewenste gewichtsverandering.
FODMAP is de verzamelnaam voor een aantal koolhydraten die slecht of niet opgenomen worden in de dunne darm: fermenteerbare oligosachariden, disachariden, monosachariden en polyolen. FODMAP’s trekken door hun osmotische werking vocht aan in het darmlumen en dit kan zorgen voor dunne ontlasting. De fermentatie van deze koolhydraten in het colon leidt bovendien tot overmatige gasvorming.
Het laag-FODMAP-dieet is een eliminatiedieet dat berust op het tijdelijk (bij voorkeur zo kort mogelijk) vermijden van de FODMAP-koolhydraten. Na 2-6 weken worden de verschillende groepen koolhydraten weer langzaam een voor een getest. Na meerdere keren testen weet de patiënt welke groepen FODMAP’s klachten geven. Daarna kan de patiënt weer ‘normaal’ eten, zij het met minder of geen van de koolhydraten die tot de FODMAP’s behoren die klachten geven.
Clinical question
Is dietary advice (par ex. about a low FODMAP diet) recommended for patients with IBS?
| Patients | Patients with IBS (primary and secondary care; all subgroups of IBS) |
|---|---|
| Intervention | Low FODMAP diet |
| Control | Dietary advice on healthy balanced diet/ Dutch guideline of a healthy diet |
| Outcomes |
|
| Selection criteria | Study design: systematic reviews and RCTs |
Relevant outcome measures
The guideline development group considered abdominal pain, global improvement / IBS-symptom severity score, quality of life, relief of symptoms (Likert scale; number of days without symptoms) as critical outcome measures for decision making.
The working group defined 20% as a minimal clinically (patient) important difference for all outcome measures, except the IBS-SSS. That means a Standardized Mean Difference (SMD) > 0.50, OR or RR < 0.75 or > 1.25 and a change of (10-)20% of the total score on a questionnaire. A 10% (50 points) improvement on the IBS-SSS is considered a minimal clinically (patient) important difference (based on literature). The working group defined the outcome measures as follows.
- Abdominal pain: abdominal pain can be measured on different scales, for example VAS-scale or the IBS-SSS subscale
- Global improvement / IBS symptom severity scale (IBS-SSS): global improvement or global relief is usually measured by asking patients if their symptoms were adequately controlled in the past 7 days. The IBS-SSS is in this literature summary used as a measure for global improvement.
- Quality of life: measured with a general questionnaire, such as the SF 36, or disease-specific (IBS-QOL)
- Relief of symptoms: there are many different symptoms of irritable bowel syndrome, for example bloating, nausea, stool consistency. All symptoms described in the included papers are used.
Search and select (Methods)
The databases [Medline (via OVID) and Embase (via Embase.com)]. were searched with relevant search terms from 2000 until November 2020. The detailed search strategy is depicted in the Annex (Totstandkoming)/ under the tab Methods. Studies were selected based on the following criteria as described in the PICO. Attachment 1 contains the PRISMA flowchart showing the number of hits, and Attachment 2 contains the reasons of exclusion.
Results
One systematic review (SR; Dionne, 2018) and five RCTs (Zahedie, 2017; Eswaran, 2017; Harvie, 2017; Patcharatrakul, 2019; Pedersen, 2014) were included in the analysis of the literature. Important study characteristics and results are summarized in the evidence tables (Attachment 3). The assessment of the risk of bias is summarized in the risk of bias tables (Attachment 4).
Description of studies
One systematic review and five RCTs were identified. To enhance readability the studies are described briefly and the information per study is displayed in table 18.
- The systematic review of Dionne (2018) is described in table 18 describes the individual study characteristics. Seven RCTs were included that compared a low FODMAP diet with various control interventions in 397 participants.
- Zahedie (2017) compared a low FODMAP diet with a standard diet according to the British Dietetic Association’s guidelines in patients with IBS-D. Participants were randomly assigned to the low FODMAP diet (n = 55) or general dietary advice group (n = 55). All participants met with the specialized dietitians to educate and receive dietary plan in a 45-min one-to one appointment. The low FODMAP diet was supplied less than 0.5 gr per meal fermentable oligosaccharides, monosaccharides, disaccharides, and polyols. The general dietary advice group received recommendations such as limitation of caffeine, alcohol, spicy food, fatty food, and carbonated drinks; to eat small frequency meals; to eat slowly and in peace; and avoidance of chewing gums and sweeteners containing polyols. Participants had to follow the diet for six weeks. One-hundred-and-one participants completed the study.
- Eswaran (2016/2017) compared a low FODMAP diet with a modified diet recommended by the National Institute for Health and Care Excellence (mNICE) in patients with IBS-D. Eswaran conducted two studies using the same patient population. One study (Eswaran 2016, included in the review of Dionne) included the outcome measures adequate relief. The other study. included the outcome measure quality of life. Participants were randomly assigned to the low FODMAP diet (n = 50) or the mNICE diet (n = 42). Specially trained research dieticians gave standardized instructions about the diet interventions. The mNICE group was instructed to eat small frequent meals, avoid trigger foods, and avoid excess alcohol and caffeine. Foods containing FODMAPs were not specifically excluded as part of the mNICE instructions provided to study participants. Participants had to follow the diet for four weeks. Eighty-four participants completed the study
- Harvie (2017) compared a low FODMAP diet with no dietary advices in patients with IBS. Patients were randomly assigned to the low FODMAP diet (n = 23) or to the control group (n = 27). At three months, the comparator group crossed over to a low FODMAP diet and the initial low FODMAP group started re-challenging foods. Dietary advice was provided to individual participants in a standardized manner by an experienced registered dietitian. At the initial consultation all participants were advised to significantly reduce their intake of excess fructose, lactose, sorbitol, mannitol, Fructooligosaccharide (FOS) and Galactooligosaccharide (GOS). At follow-up (after 3 months) participants were taught to systematically try to reintroduce FODMAP molecules individually, one follow-up appointment was scheduled and then additional appointments were provided on demand. Fifty patients completed the study.
- Patcharatrakul (2019) compared a structural individual low FODMAP diet with a commonly recommended diet in patients with IBS. Patients with moderate-to-severe IBS were randomized to a low FODMAP diet (n = 33) or a brief advice on a commonly recommended diet (n = 33). Patients randomized to the low FODMAP diet received a maximum of 30 minutes of advice. High-FODMAP items that might aggravate the patient’s symptoms were identified from an individual 7-day food diary. Then, the investigator discussed with the patients to avoid high-FODMAP items and modify recipe/menu with the commonly available low-FODMAP items. The control group received brief advice on a commonly recommended diet, which included reducing certain foods that have been traditionally recognized as triggers for gas, bloating, or abdominal pain, including fruits, vegetables, nuts, beans, and garlic, and avoidance of large meals. Patients followed the diet for four weeks. Sixty-four patients completed the study.
- Pedersen (2014) compared a low FODMAP diet to a normal Danish/Western Diet in patients with IBS. Patients were randomized to a low FODMAP diet (n = 42) or a normal Danish/Western diet (n = 40). Each patient allocated to the low FODMAP diet was instructed during a one hour session by nutritionists or dietitians. Patients allocated to the normal diet were requested to follow an unchanged normal (Danish/Western) diet during the 6-wk study. Seventy-one patients completed the study.
| Included in SR | RCT | Participants | Study duration | Total intervention/controls | Intervention versus control | Outcome measures |
|---|---|---|---|---|---|---|
| Dionne (2018) | Staudacher et al. (2012) | Rome-III IBS. Recruited from secondary care. Bloating and/or diarrhea included, predominant constipation excluded. | 4 weeks | 19/22 | Low FODMAPs diet versus habitual diet | GI symptom rating scale. Patients asked ‘Were your symptoms adequately controlled over the previous week?’ |
| Dionne (2018) | Eswaran et al. (2016) | Rome-III (IBS-D) | 4 weeks | 50/42 | Low FODMAPs diet versus modified syndrome NICE diet
| Adequate relief overall IBS-D symptoms ≥ 50% of intervention weeks 3–4 FDA composite endpoint individual component |
| Dionne (2018) | McIntosh et al. (2017) | ROME III IBS (all subtypes predominantly IBS-M and -D) | 3 weeks | 20/20 | Low FODMAPs diet versus high FODMAP diet | IBS-SSS, proportion of patients defined as responders (IBS symptom reduction ≥ 50) |
| Dionne (2018) | Böhn et al. (2015) | ROME III IBS (all subtypes) | 4 weeks | 38/37 | Low FODMAPS diet versus traditional IBS diet | Reduction in IBS severity scores ≥ 50 |
| Dionne (2018) | Halmos et al. (2014) | ROME III | NA | 13/17 | Low FODMAP versus typical diet | Overall improvement in symptoms based on VAS. Secondary outcomes included improvement in pain, bloating, flatus, and satisfaction with passage of stool consistency |
| Dionne (2018) | Hustoft et al. (2017) | Rome-III IBS, diarrhea predominant or mixed | 10 days | 8/7 | All received low FODMAPs diet for 3 weeks then randomized to receive supplement of FODMAP or maltodextrin (placebo) | Continued symptom relief |
| Dionne (2018) | Staudacher et al. (2017) | ROME III IBS (IBS-C excluded) | NA | 51/53 | Low FODMAPs diet versus sham diet with similar number of foods restricted but maintaining same FODMAP intake. 2 × 2 factorial design | Adequate relief of IBS symptoms |
| Zahedi (2017) | IBS-D | 6 weeks | 55/55 | Dietary education: LFD (< 0.5 g of FODMAPs per meal) versus traditional IBS diet (British Dietetic Association) | IBS-SSS, IBS-QoL | |
| Eswaran (2017) | ROME III IBS-D | 4 weeks | 50/42 | Low FODMAPS versus modified diet recommended by the National Institute for Health and Care Excellence (mNICE) | IBS-QoL | |
| Harvie (2017) | ROME III IBS | 3 months | 23/27 | Dietary education on LFD versus no dietary education | IBS-SSS, QoL | |
| Patcharatrakul (2019) | ROME III IBS | 4 weeks | 33/33 | Low FODMAP diet (individual advice) versus dietary advice on reducing certain foods that have been traditionally recognized as triggers for gas, bloating, or abdominal pain | Responders were defined as those experiencing a ≥ 30% decrease in the average of daily worst abdominal pain/discomfort after 4 weeks, Global IBS symptom severity, gastrointestinal symptoms | |
| Pederson (2014) | ROME III IBS | 6 weeks | 42/40 | Low FODMAP diet versus normal Danish/Western diet | IBS-SSS, QoL |
Results
Table Low FODMAP diet shows the summary of findings (SoF) for the various outcome measures. Below the table, more detailed information on the outcomes can be found. Forest plots can be found in the attachment 4.
Abdominal pain
Zahedi (2017), Harvie (2017), Pederson (2014) and Patcharatrakul (2019) reported the outcome measure abdominal pain. A meta-analysis was not possible because different measurement instruments were used to measure abdominal pain and not all studies reported the absolute values. A summary of the results is presented in table 19. All studies showed a reduction in abdominal pain for the low FODMAP group compared to the control group. This difference is in some cases a clinically relevant difference.
| Study | Pain | Measurement method | Low FODMAP (Mean ± SD)
| Control (Mean ± SD) | Difference* between low FODMAP and control group |
|---|---|---|---|---|---|
| Zahedi (2017) | Pain intensity | IBS-SSS subscale (100-point scale) | 48.38 ± 29.57 at baseline to 16.13 ± 13.13 Mean difference*: -32.26 (95% CI -41.3 – -23.17) SE 4.576 | Mean ± SD 47.38 ± 33.03 to 25.88 ± 21.11 Mean difference*: -21.5 (95%CI -32.4 – -10.7) SE 5.489 | -10.76 (95% CI -24.8 – 3.2) P = 0.1361 Favors low FODMAP diet |
| Pain frequency | IBS-SSS subscale (100-point scale) | 37.38 ± 31.63 to 13.25 ± 14.21 P < 0.001 Mean difference*: -24.13 (95% CI -33.9 – -14.4) SE 4.904 | 32 ± 28.75 to 16.75 ± 17.74 P < 0.001 Mean difference*: -15.25 (95%CI -24.6 – -5.9) SE 4.731 | -8.88 (95% CI -22.23 – 4.48) P = 0.19 Favors low FODMAP diet | |
| Harvie (2017) | Pain intensity | IBS-SSS subscale (100-point scale) Absolute numbers were not reported | No effect of the low FODMAP diet was seen on severity of pain. | X | |
| Pain frequency | IBS-SSS subscale (days of pain in ten days) | Reduction in how often participants experienced pain: 3.4 ± 2.9 d in ten days | Reduction in how often participants experienced pain: 0.2 ± 1.9 d in ten days | Difference in reduction in how often participants experienced pain 3.2 days (95% CI 1.81 – 4.59) P = 0.00 Favors low FODMAP diet | |
| Patcharatrakul (2019) | Pain | 0-10 VAS | 4.8 (range 0 – 6.9) at baseline to 1.7 (range 0 –4.1) Mean difference*: -0.7 | from mean 4.4 (range 0.5–6.4) to mean 3.9 (range 0–5.2) Mean difference*: -0.5 | -0.2 Favors low FODMAP diet |
| Percentage responders | the proportion of subjects who had at least a 30% decrease in the average daily worst abdominal pain or abdominal discomfort | 18 out of 30 patients responded to the diet (60%) | 9 out of 32 responded to the diet (28%) | 35% | |
| Pederson (2014) | Pain intensity | IBS-SSS subscale (0-100) VAS Absolute numbers were not reported but read from a graph. This is an approximation | From 64 to 30 Difference*: -34 | From 68 to 56 Difference*: -12 | -22 Favors low FODMAP diet |
| Pain severity | IBS-SSS subscale (0-100) VAS Absolute numbers were not reported but read from a graph. This is an approximation. | From 58 to 36 Difference*: -22 | From 48 to 46 Difference*: -2 | -20 Favors low FODMAP diet | |
| * Not reported in the study but calculated by Kennisinstituut van de Federatie Medisch Specialisten | |||||
Global improvement
Global improvement was measured in different ways across the studies, which made it not possible to pool the results of all studies. We used the meta-analysis of Dionne as a measure for global improvement and performed a meta-analysis on the results of the RCTs that reported the IBS-SSS. We describe the results of Patcharatrakul separately since they could not be combined with any of the meta-analysis.
- Dionne (2018) included 7 RCTs in the meta-analysis (figure 1- Attachment 4). The primary outcome was global improvement in IBS symptoms. If global improvement was not reported, abdominal pain was used as the outcome of interest. If different definitions of symptom improvement were provided in the same study an improvement in IBS symptoms of > 50% would be chosen ahead of an improvement in symptoms of > 25%. This approach may lead to an underestimation of the effect of a low FODMAP diet. The relative risk of symptoms not improving in IBS compared with control was 0.69 (95%CI 0.54 – 0.88). Three studies used the IBS-SSS as an outcome measure (Zehedi, Harvie, Pedersen). We performed a meta-analysis by extracting the mean difference in IBS-SSS score between the endpoint and baseline for the low FODMAP group and the control group for all studies. If this information was not available, we calculated it ourselves by using the data from the papers. Pooled mean difference was -83.6 (-118.3, -49.0) meaning that patients in the low FODMAP group scored 83.6 points lower on the IBS-SSS compared to the control group (Figure 2, Attachment 4).
- Patcharatrakul (2019) measured global IBS symptom severity using a VAS scale (0-100). The group on the low FODMAP diet started at 61.2±21 at baseline and improved to 38.5 ± 20 at 4 weeks. The control group started at 56.3± 17.8 at baseline and improved to 53.5 ±19.2 at 4 weeks.
Quality of life
Five studies assessed quality of life (QoL) by the OBS-QoL (0= worst quality of life, 100=best quality of life). The results of four of these studies could be pooled in a meta-analysis (figure 3, Attachment 4). From each study, we extracted the mean difference in QoL score between the endpoint and baseline for the low FODMAP group and the control group. If this information was not available in the studies we calculated it ourselves by using the data from the papers. We calculated a pooled mean difference of 7.29 (-1.1, 15.7) meaning that patients in the low FODMAP group scored 7.3 points higher on the IBS-QoL compared to the control group.
Relief of symptoms
The systematic review of Dionne (2018) did not report on relief of symptoms. Patcharatrakul (2019) assessed abdominal discomfort, bloating, belching and stool urgency. In the low FODMAP group, abdominal discomfort and bloating improved statistically significant after four weeks. In the control group, none of the symptoms improved statistically significant. When comparing the improvement in the low FODMAP group with the improvement in the control group there was no clinically relevant differences between both group and no statistically significant difference.
| Study | Symptom | Measurement method | Low FODMAP baseline and after follow-up | Control group at baseline and after follow-up | Difference* |
|---|---|---|---|---|---|
| Patcharatrakul (2019) | Stool urgency | 0–10 cm VAS | 0 (0–8.1) to 0 (0–5.4) Difference*: 0 | 2.3 (0–6.6) to 0 (0–4.2) Difference*: -2.3 | 2.3 Favors control group |
| Zahedi (2017) | Stool consistency | Bristol stool form scale | 5.92 ± 0.45 to 4.3 ± 0.5 Difference: -1.62 ± 0.51 | 5.67 ± 0.61 to 4.61 ± 0.69 Difference: -1.05 ± 0.79 | -0.57 (95% CI -0.83 – -0.31) Favors low FODMAP diet |
| Zahedi (2017) | Stool frequency | number of stools per day | 3.29 ± 0.87 to -1.91 ± 0.56 Difference: -1.37 ± 0.62 | 3.3 ± 0.77 to 2.6 ± 0.96 Difference: -0.7 ± 0.88 | -0.67 (95% CI -0.97 – -0.37) Favors low FODMAP diet |
| Zahedi (2017) | Abdominal distension | IBS-SSS subscale | 60.50 ± 26.98 to 26.25 ± 18.35 Difference*: -34.25 (95% CI -43.4 – -25.1) SE 4.614 | 58.75 ± 27.09 to 36.88 ± 15.83 Difference*: -21.87 (95% CI -30.59 – -13.15) SE 4.394 | -12.38 (95% CI -24,87 – – 0.11) Favors low FODMAP diet |
| Patcharatrakul (2019) | Abdominal discomfort | 0–10 cm VAS | 5.5 (range 4.5–7.1) to 3.2 (range 1.7–5.5) Difference*: -2.3 | 5.6 (range 4.1–7.1) to 4.5 (range 2.6–6.6) Difference*: -1.1 | -1.2 Favors low FODMAP diet |
| Patcharatrakul (2019) | Bloating | 0–10 cm VAS | 5.1 (2.5–7.5) to 3.1 (1.8–5.7) Difference*: -2 | 6.2 (2.1–7.8) to 4.0 (0–6.2) Difference*: -2.2 | 0.2 Favors control group |
| Patcharatrakul (2019) | Belching | 0–10 cm VAS | 1.4 (0–5.5) to 0.7 (0–4.7) Difference*: -0.7 | 2.7 (0–5.6) to 1.0 (0–5.4) Difference*: -1.7 | 1 Favors control group |
Conclusions
- The evidence is very uncertain about the effect of a low FODMAP diet on abdominal pain.
- A low FODMAP diet may increase global improvement.
- The evidence is very uncertain about the effect of a low FODMAP diet on quality of life.
- The evidence is very uncertain about the effect of a low FODMAP diet on relief of symptoms.
Glutenvrij dieet
Naar Samenvatting ›We bevelen een glutenvrij dieet bij PDS niet aan.
Er is onvoldoende wetenschappelijk bewijs voor de effectiviteit van een glutenvrij dieet bij PDS. Derhalve dient dit niet te worden geadviseerd aan patiënten. Als er een sterk vermoeden is dat de patiënt toch op gluten reageert, is het verstandig coeliakie uit te sluiten (zie Anamnese).
Voor- en nadelen van de interventie en kwaliteit van het bewijs
De geïdentificeerde onderzoeken beschreven de uitkomstmaten buikpijn, algemene verbetering en verlichting van klachten. Kwaliteit van leven werd niet beschreven. De bewijskracht was zeer laag en daarmee kunnen ook geen uitspraken worden gedaan over de effectiviteit van een glutenvrij dieet bij patiënten met PDS. Het volgen van een glutenvrij dieet is intensief en heeft een grote sociale en financiële impact. Bovendien bevatten glutenvrije producten vaak meer vet, suiker en zout en minder vezels, vitamines en mineralen dan de reguliere producten, wat ongunstig is voor de algehele gezondheid. Gezien de aanzienlijke publieke interesse in dit type dieetbehandeling dient middels gerandomiseerde gecontroleerde onderzoeken meer bewijs te worden verzameld. Temeer omdat de mogelijke verbetering na een glutenvrij dieet niet door het elimineren van gluten per se wordt veroorzaakt, maar mogelijk door reductie van inname van fructanen (een FODMAP) of zogenaamde Amylase Trypsin Inhibitors (ATI’s). ATI’s zijn specifieke eiwitten die je in alle glutenbevattende granen vindt en ook een immunologische reactie kunnen uitlokken.
Over het algemeen is een glutenvrije voeding minder gezond (meer vet, suiker en zout en minder vezels, vitamines en mineralen dan de reguliere producten) en zijn de gezondheidsrisico’s op de langere termijn onbekend.
Kwaliteit van bewijs
De kwaliteit van bewijs is zeer laag.
Waarden en voorkeuren van patiënten
Van de PDS-patiënten rapporteert 80% dat de klachten een relatie hebben met hun voedingsinname. Afhankelijk van motivatie, voorkeuren en bereidheid om het voedingsgedrag aan te passen, kan een gepaste dieetinterventie worden aangeboden. Het volgen van een dieet kan voor een deel van de PDS-patiënten tijdelijk zwaar zijn, maar veel patiënten hebben dat er wel voor over. Immers, het merendeel ervaart dat de voeding invloed heeft op de klachten. De meeste patiënten begrijpen ook het principe van eliminatie en provocatie om persoonlijke triggers op te sporen. De dieetbehandeling vergt wel enige inspanning van de patiënt zelf; de zorgverlener heeft hierbij een adviserende en ondersteunende rol. Het is belangrijk om ook de verwachtingen te bespreken; aanpassingen van het dieet zullen over het algemeen niet leiden tot klachtenvrij kunnen eten, aangezien PDS-klachten multifactorieel bepaald worden.
Kosten
Glutenvrije producten zijn over het algemeen duurder dan reguliere producten.
Aanvaardbaarheid
Het is maatschappelijk aanvaardbaar om zelf minder gluten te gebruiken als er een verband met buikklachten wordt ervaren, maar gezien het beperkte bewijs en de gezondheidsrisico’s op de lange termijn is er medisch gezien geen reden om dit dieet te adviseren. Patiënten die de onzekerheid over de effectiviteit geen probleem vinden en die voldoende gemotiveerd zijn, staat het vrij dit dieet toch te volgen. Daarbij moet wel gewezen worden op de financiële en sociale impact. Restaurants, horeca, winkels, bakkers en feestjes bij familie en bekenden zijn vaak niet ingericht op een glutenvrij dieet.
Haalbaarheid en implementatie
Een glutenvrij dieet vergt gezien de restrictieve aard substantiële inspanningen van de patiënt. Het is belangrijk zich bewust te zijn van het risico op deficiënties bij het weglaten van gluten uit het dieet. Glutenvrije producten bevatten vaak meer vetten en suikers, en weinig vezels, ijzer, zink, magnesium en vitamine B. Bij de overgang naar een glutenvrij dieet is voedingseducatie en begeleiding van een diëtist met kennis van glutenvrije voeding raadzaam.
Is een glutenvrij dieet (vergeleken met het volgen van richtlijnen goede voeding) aan te bevelen bij patiënten met PDS?
Achtergrond
Dieetaanpassing is een belangrijke initiële behandelstap bij patiënten met PDS. Er zijn verschillende soorten dieetinterventies en er is veel publieke en wetenschappelijke interesse voor de verschillende diëten. Deze toegenomen aandacht heeft ervoor gezorgd dat meer mensen zich zijn gaan verdiepen in voeding en darmklachten. Het gevaar daarbij is dat er vaak (digitale) bronnen geraadpleegd worden die niet noodzakelijkerwijs de meest accurate informatie weergeven. Veel patiënten volgen een bepaald dieet, vaak op eigen initiatief, zonder adequate (medische of diëtistische) begeleiding. Dit kan leiden tot nadelige gezondheidsuitkomsten, zoals deficiënties of ongewenste gewichtsverandering.
FODMAP is de verzamelnaam voor een aantal koolhydraten die slecht of niet opgenomen worden in de dunne darm: fermenteerbare oligosachariden, disachariden, monosachariden en polyolen. FODMAP’s trekken door hun osmotische werking vocht aan in het darmlumen en dit kan zorgen voor dunne ontlasting. De fermentatie van deze koolhydraten in het colon leidt bovendien tot overmatige gasvorming.
Het laag-FODMAP-dieet is een eliminatiedieet dat berust op het tijdelijk (bij voorkeur zo kort mogelijk) vermijden van de FODMAP-koolhydraten. Na 2-6 weken worden de verschillende groepen koolhydraten weer langzaam een voor een getest. Na meerdere keren testen weet de patiënt welke groepen FODMAP’s klachten geven. Daarna kan de patiënt weer ‘normaal’ eten, zij het met minder of geen van de koolhydraten die tot de FODMAP’s behoren die klachten geven.
Gluten is een mengsel van eiwitten dat van nature voorkomt in bepaalde granen, zoals tarwe (waaronder spelt), rogge en gerst. Bij een glutenvrij dieet worden producten die gluten bevatten vermeden. Een gedeelte van de PDS-patiënten geeft aan te denken dat ze overgevoelig of intolerant zijn voor gluten, zonder dat ze coeliakie hebben.
Is a glutenfree diet (compared to a healthy balanced diet/ Dutch guideline of a healthy diet) recommended for patients with IBS?
Search and select
A systematic review of the literature was performed to answer the previous question:
|
Patients |
Patients with IBS (primary and secondary care; all subgroups of IBS) |
|---|---|
|
Intervention |
Gluten free diet |
|
Control |
Dietary advice on healthy balanced diet/ Dutch guideline of a healthy diet |
|
Outcomes |
|
|
Selection criteria |
Study design: systematic reviews and RCTs |
Relevant outcome measures
The guideline development group considered abdominal pain, global improvement / IBS-symptom severity score, quality of life, relief of symptoms (Likert scale; number of days without symptoms) as critical outcome measures for decision making.
The working group defined 20% as a minimal clinically (patient) important difference for all outcome measures, except the IBS-SSS. That means a Standardized Mean Difference (SMD) > 0.50, OR or RR < 0.75 or > 1.25 and a change of (10-)20% of the total score on a questionnaire. A 10% (50 points) improvement on the IBS-SSS is considered a minimal clinically (patient) important difference (based on literature). The working group defined the outcome measures as follows.
- Abdominal pain: abdominal pain can be measured on different scales, for example VAS-scale or the IBS-SSS subscale
- Global improvement / IBS symptom severity scale (IBS-SSS): global improvement or global relief is usually measured by asking patients if their symptoms were adequately controlled in the past 7 days. The IBS-SSS is in this literature summary used as a measure for global improvement.
- Quality of life: measured with a general questionnaire, such as the SF 36, or disease-specific (IBS-QOL)
- Relief of symptoms: there are many different symptoms of irritable bowel syndrome, for example bloating, nausea, stool consistency. All symptoms described in the included papers are used.
Search and select (Methods)
The databases [Medline (via OVID) and Embase (via Embase.com)]. were searched with relevant search terms from 2000 until November 2020. The detailed search strategy is depicted in the Annex (Totstandkoming)/ under the tab Methods. Studies were selected based on the following criteria as described in the PICO. Attachment 1 contains the PRISMA flowchart showing the number of hits, and Attachment 2 contains the reasons of exclusion.
Results
One systematic review (SR; Dionne, 2018) and three RCTs (Biesiekierski, 2011; Shahbazkhani, 2015; Zanwar, 2016) were included in the analysis of the literature. Important study characteristics and results are summarized in the evidence tables (Attachment 3). The assessment of the risk of bias is summarized in the risk of bias tables (Attachment 4).
Description of studies
- Dionne (2018) conducted a systematic review and meta-analysis of randomized controlled trials examining the efficacy of exclusion diets (low FODMAP and gluten-free diets) in IBS. A search of the literature was conducted in MEDLINE, EMBASE, Cochrane Central Register of Controlled Trials and Cochrane Database of Systematic Reviews until November 2017. RCTs that evaluated an FODMAP exclusion diet versus an alternative or usual diet and assessed improvement in either global IBS symptoms or abdominal pain were included. Data were synthesized as relative risk of symptoms remaining using a random effects model. A total of nine studies were eligible for inclusion. There were two RCTs describing a gluten free diet (111 participants) and seven RCTs comparing a low FODMAP diet with various control interventions (397 participants). Below the two RCT included in this review on a gluten free diet (Biesiekierski and Shahbazkhani) are described in detail:
- Biesiekierski (2011) performed a double-blind, randomized, placebo-controlled trial undertaken in patients with IBS who were symptomatically controlled on a gluten-free diet. After a two-week run-in period, participants continued the gluten free diet. After the two-week run-in period, all participants continued the gluten free diet and received in addition two bread slices and one muffin per day for six weeks. In the gluten group the bread and muffin contained gluten (total intake of 16 g / day). In the for the placebo group the bread and muffin were gluten free. With a gluten-free diet for up to six weeks. A total of 34 patients (aged 29 – 59 years, 12% men) completed the study. Nineteen patients were included in the gluten group and fifteen in the gluten free group. The primary outcome was the proportion of patients answering ‘no’ on more than half of the symptom assessments to the question. ‘Over the last week were your symptoms adequately controlled?’ was asked at the end of each study week or at withdrawal if premature. Secondary outcomes were change in overall and individual gastrointestinal symptoms as assessed by the visual analog scale (0 (none)-100 (worst)).
- Shahbazkhani (2015) studied the effect of a gluten-free diet on gastrointestinal symptoms in patients with IBS. In a double-blind RCT, 148 IBS patients fulfilling the Rome-III-criteria were enrolled. The gluten free diet was started in 102 IBS patients; 22 patients found it hard and difficult to continue with the gluten-free diet and subsequently were withdrawn from study. Eighty patients responded to the diet and achieved significant improvement. From this group 8/80 did not follow a strict gluten free diet and were unwilling to continue the diet any further, and the remaining 72 patients commenced on a gluten-free diet for up to six weeks and completed the study. From this group, 35 out of 72 were randomized in the gluten group and 37 out of 72 were in the placebo group for six weeks. The mean age in the gluten group was 44.5 ± 10 years and 43.2 ± 17 years in the placebo group. Six patients (17.1%) in the gluten group and 13 in the placebo group (35.1%) were male. In the second stage after six weeks, patients whose symptoms improved to an acceptable level were randomly divided into two groups; patients either received packages containing powdered gluten (35 cases) or patients received placebo (gluten free powder) (37 cases). Both groups still continued their gluten free diet. Outcomes were assessed using a symptom questionnaire containing the question for the primary outcomes including bloating, abdominal pain, defecation satisfaction, nausea, fatigue and overall symptoms, and scored with visual analogue scale (VAS), with 0 representing no symptoms and 10 indicating severe clinical signs and symptoms.
- Zanwar (2016) aimed to evaluate the effects of gluten on IBS symptoms. A double-blind randomized placebo-controlled rechallenge trial was performed in a tertiary care hospital with IBS patients who fulfilled the Rome-III-criteria. The participants were administered a gluten-free diet for 4 weeks and were asked to complete a symptom-based questionnaire to assess their overall symptoms, abdominal pain, bloating, wind, and tiredness on the visual analog scale (0−100) at the baseline and every week thereafter. The participants who showed improvement were randomly assigned to one of two groups to receive either a placebo (gluten-free breads) or gluten (whole cereal breads) as a rechallenge for the next 4 weeks. Sixty-five patients underwent randomization; 34 received gluten and 31 received placebo. Sixty patient completed the study.
|
Included in SR |
RCT |
Participants |
Study duration |
Total intervention/controls |
Intervention versus control |
Outcome measures |
|---|---|---|---|---|---|---|
|
Dionne (2018) |
Biesiekierski (2011) |
Rome-III IBS patients intolerant of gluten but celiac excluded |
4 weeks |
19/20 |
Diet spiked with 16g gluten versus placebo |
Patients answering ‘no’ to the question ‘Over the last week were your symptoms adequately controlled?’ |
|
Dionne (2018) |
Shahbazkhani (2015) |
Rome-III IBS patients intolerant of gluten but celiac excluded. |
6 weeks |
37/35 |
Packages containing powdered gluten versus gluten-free powder in addition to a gluten free diet |
‘Symptom control’ unclear what these symptoms were but it is implied that this includes stool satisfaction, pain, and bloating. |
|
|
Zanwar (2016) |
ROME III IBS criteria, tertiary care |
4 weeks |
34/31 |
Gluten containing bread versus gluten free bread in addition to a gluten free diet |
Abdominal pain, relief of symptoms |
Results
Table Gluten free diet shows the summary of findings (SoF) for the various outcome measures.
Abdominal pain
- Biesiekierski (2011) found that, over the entire study period, the severity score for pain was statistically significantly higher for those consuming the gluten diet compared to the gluten free diet. Absolute numbers were not reported in the paper but estimated from the included graph. After 6 weeks, the score for pain was 38 in the gluten group and 18 in the gluten free group (approximation).
- Shahbazkhani (2015) found that in the gluten-containing group, abdominal pain increased (from mean 3.1 ± 2.3 to 5.1 ± 2.2 measured on a VAS) one week after starting the gluten diet. No absolute number were reported for any of the other weeks. A graph was included in the result section of the paper but it was not possible to read the absolute values from it. However, after six weeks, no statistically significant difference between the two groups was observed.
- Zanwar (2016) found that after four weeks of gluten free diet, the median value for abdominal pain (measured on a VAS scale) was 15. After four weeks rechallenge, patients in the gluten group reported a median VAS of 30, while patients in the gluten free group reported a mean VAS of 10. Patients in the gluten group showed statistically significantly higher changes in the abdominal pain VAS scores from the fourth week of GFD to each of the 4 rechallenge weeks, compared to the patients in the placebo group (P < 0.05).
Global improvement
Dionne (2018) performed a meta-analysis with primary outcome global improvement in IBS symptoms. If global improvement was not reported, abdominal pain was used as the outcome of interest. If different definitions of symptom improvement were provided in the same study, the most stringent outcome reported was used that minimized placebo response rate (e.g., an improvement in IBS symptoms of > 50% would be chosen ahead of an improvement in symptoms of > 25%). A greater proportion of participants had an exacerbation of their IBS symptoms among those allocated to have their diet spiked with gluten, compared with those remaining on a gluten free diet. The pooled RR was 0.42; 95% CI 0.11 to 1.55; I2 = 88%.
Quality of life
None of the included studies reported the outcome measure quality of life.
Relief of symptoms (likertscale; number of days without symptoms)
- Biesiekierski (2011) found that significantly more patients in the gluten group (68 %; n = 13 / 19) reported no adequate control of symptoms on more than half of the symptom assessments compared to those using no gluten (40 % ; n = 6 / 15) (P = 0.001; generalized estimating equation). Changes in symptoms from baseline to end of week 1 as scored on the visual analog scale after 1 week ’s therapy were significantly greater in those patients who consumed the gluten diet for overall symptoms, pain, bloating, satisfaction with stool consistency, and tiredness, but not for wind or nausea. Over the entire study period, the severity scores of pain, satisfaction with stool consistency, and tiredness were significantly higher for those consuming the gluten diet. Absolute numbers were not reported in the paper but were read from the graph included in the study. After 6 weeks, the VAS score for overall symptoms was 38 in the gluten group compared to 24 in the gluten free group.
- Shahbazkhani (2015) found after six weeks of the diet, that symptoms were controlled in nine patients (25.7%) in the gluten-containing group, compared to 31 patients (83.8%) in the gluten free group, indicating that 26 out of 35 patients in the gluten group became symptomatic on a gluten containing diet (p < 0.001). In the gluten-containing group, all symptoms significantly increased one week after starting the gluten. Mean bloating VAS before starting the gluten-free diet in the gluten group was 8.4 ± 1.5, and after the six-week diet was decreased to 3.1 ± 2.3. Overall time trend analysis revealed statistically significant satisfaction with stool consistency (p = 0.01) and bloating (p = 0.05) (but no statistically significant difference between the two groups). After a one-week gluten challenge, the mean score was increased to 4 ± 2.1, which was not statistically significant compared with the gluten free group. But this symptom continued to increase to 5.1 ± 2.2 in the fifth week.
- Zanwar (2016) found that out of the initial group of 180 patients on a gluten free diet, overall symptom VAS improved for 65 patients after a gluten free diet. These 65 were subsequently randomized to a gluten free diet or gluten containing diet. After four weeks of food rechallenge, patients in the gluten-containing group exhibited worsening of symptoms, with significantly higher weekly median overall symptom VAS, compared to those in the gluten free group (P < 0,05). The mean VAS in the gluten group was 25 and in the gluten free group 10 for overall symptoms. During the entire rechallenge period, the median VAS scores for abdominal pain, bloating, and tiredness were significantly higher in the gluten group compared to the placebo. Patients in the gluten group showed significantly higher changes in the abdominal pain, bloating, and tiredness VAS scores from the fourth week of GFD to each of the four rechallenge weeks, compared to the patients in the placebo group (P < 0,05). However, VAS score for wind was not significantly different in both groups following the rechallenge (P > 0,05). Within the gluten group, the VAS scores for abdominal pain, bloating, wind, tiredness, and overall symptoms, differed significantly over the entire study period. The placebo group also showed similar changes in the VAS symptom scores over the study period; however, only the changes in abdominal pain and wind VAS scores after rechallenge remained significantly different following post hoc analysis (P < 0,05).
Conclusions
- We are uncertain about the effect of a gluten free diet on abdominal pain in IBS patients.
- We are uncertain about the effect of a gluten free diet on global improvement in IBS patient, however global improvement was much higher in the healthy nutrition group.
- The outcome measure ‘Quality of life’ was not reported in the included studies
- We are uncertain about the effect of a gluten free diet on reducing gastrointestinal symptoms in IBS patients.
Probiotica
Naar Samenvatting ›- Wees terughoudend met het adviseren van probiotica.
- Bespreek de voordelen (vermindering van klachten) en nadelen (suikers en andere toevoegingen in probioticaproducten, kosten, onduidelijkheid over langetermijnbijwerkingen).
- Leg uit dat er veel verschillende probiotica zijn, dat hun effectiviteit niet vaststaat en dat het per persoon verschilt welke probiotica een gunstig effect hebben en welke niet.
- Wanneer patiënten zelf aangeven dat ze probiotica willen uitproberen, is er geen reden om dit af te raden. Adviseer in dat geval een proefperiode van 8 weken en geef aan dat ze bij het uitblijven van effect moeten stoppen of na een ‘stopperiode’ van een aantal weken eventueel een ander soort probioticum kunnen uitproberen.
Er is geen duidelijkheid over de effecten van probiotica omdat de kwaliteit van het bewijs zeer laag is; er is wetenschappelijk geen sterk bewijs dat het werkt en de gevonden effecten zijn klein. Er zijn geen verschillen in effect te zien tussen verschillende probioticastammen, bij verschillende gebruiksduur of bij verschillend PDS-subtype. Ook is er weinig tot niets bekend over langetermijneffecten of -bijwerkingen. Toch leert de ervaring van de werkgroepleden dat probiotica op individueel niveau klachten verminderen. Daarom is een proefperiode met probiotica te overwegen bij patiënten met PDS die dit graag willen uitproberen. Geef aan dat er verschillende soorten probiotica zijn en dat het persoonsafhankelijk is welke soort het meeste effect heeft. Bespreek de voordelen (eventueel vermindering van klachten) en de nadelen (kosten, suikers en andere toevoegingen aan preparaten, onduidelijkheid over langetermijnbijwerkingen) met de patiënt. Leg uit dat er veel verschillende probiotica zijn en dat het per persoon verschilt welke probiotica werken en welke niet.
Voor- en nadelen
Er is consensus in de werkgroep dat probiotica positieve effecten lijken te hebben, waaronder vermindering van algemene symptomen en buikpijn. De verschillen met placebo zijn nét klinisch relevant, maar er was weinig tot geen verschil tussen de onderzochte soorten probiotica terwijl de samenstelling en doseringen uiteenliepen. Daarbij ging het in een groot deel van de onderzoeken om een combinatie van probiotica, wat belangrijk is omdat elk individu een ander microbioom heeft en dus waarschijnlijk baat zal hebben bij andere probiotica of combinaties daarvan. Ook is er weinig tot niets bekend over de langetermijneffecten en -bijwerkingen, en weten we dat aan probiotica soms minder gezonde hulpstoffen (zoals suikers of zoetstoffen) zijn toegevoegd die zelf PDS-klachten kunnen geven.
Kwaliteit van bewijs
De kwaliteit van het bewijs was zeer laag. Er werd afgewaardeerd in verband met risico op vertekening doordat sommige onderzoeken niet geblindeerd waren of doordat onduidelijk was of er geblindeerd was, in verband met inconsistentie door hoge heterogeniteit (verschil in effect tussen onderzoeken) en in verband met sponsoring door bedrijven.
Waarden en voorkeuren van patiënten
Een deel van de PDS-patiënten zou wel dagelijks probiotica willen innemen (en betalen) wanneer ze daardoor minder klachten hebben. Een ander deel wil dat niet, vanwege de kosten (probiotica worden niet vergoed) of omdat ze denken of ervaren hebben dat probiotica bij hen (mogelijk) niet werken. Vaak hebben PDS-patiënten wel een bepaald preparaat geprobeerd; als dit niet bleek te werken, hebben ze vaak niet nog allerlei andere geprobeerd. Vaak weten PDS-patiënten ook te weinig van probiotica, hun werking en hun kenmerken.
Kosten
De kosten van probiotica variëren per merk (€ 10-30 per maand) en worden in 2022 niet vergoed.
Aanvaardbaarheid
Het wordt algemeen aanvaardbaar geacht dat mensen iets innemen (anders dan medicatie) dat geen bijwerkingen heeft om minder klachten te hebben.
Haalbaarheid
Probiotica zijn vrij verkrijgbaar bij drogist, apotheek, supermarkt en online.
Zijn probiotica (vergeleken met placebo) aan te bevelen bij patiënten met PDS?
Achtergrond
Een van de oorzaken van PDS zou verstoring van het darmmicrobioom kunnen zijn. Verbetering van de balans in het darmmicrobioom zou de klachten eventueel kunnen verminderen. Probiotica zijn levende microbiotische voedingssupplementen die kunnen zorgen voor verbetering van de darmmicrobiota. Er zijn veel verschillende probiotica op de markt. In dit detail beschrijven we het effect van probiotica op PDS-klachten en bekijken we of er verschil zit tussen de verschillende soorten probiotica.
Clinical question
Are probiotics (compared to placebo) recommended for patients with IBS?
|
Patients |
Patients with IBS (primary and secondary care; all subgroups of IBS) |
|---|---|
|
Intervention |
Probiotics |
|
Control |
Placebo |
|
Outcomes |
|
|
Other selection criteria |
Study design: systematic reviews and RCT’s |
Methods (search)
The databases PubMed and Embase were searched with relevant search terms from 2009 until November 2020. The detailed search strategy is depicted in the Annex (Totstandkoming)/ under the tab Methods. Studies were selected based on the following criteria as described in the PICO. Attachment 1 contains the PRISMA flowchart showing the number of hits, and Attachment 2 contains the reasons of exclusion.
Relevant outcome measures
The working group defined 20% as a minimal clinically (patient) important difference for all outcome measures, next to a Standardized Mean Difference (SMD) > 0.50, OR or RR < 0.75 or > 1.25 and a change of (10-)20% of the total score om a questionnaire.
- Global improvement: usually measured by asking patients if their symptoms were adequately controlled in the past 7 days. Taken together with abdominal pain and presented with SMD.
- IBS-SSS and GI symptoms rating scale (GSRS) can be used also. 50 points (change of 10%) on the IBS-SSS is defined as a minimal clinically (patient) important difference.
- Quality of life: usually measured with a general questionnaire (SF 36) or disease-specific (IBS-QOL; clinically meaningful difference ≥ 14).
- Relief of symptoms: the review used, reported persistence of symptoms and calculated a relative ratio.
- Adverse events: present or not, a relative ratio was calculated.
Results
Results (search)
One systematic review. and 15 RCT’s. (published after the search date of the systematic review (April 2019)) were included in the analysis of the literature. Important study characteristics and results are summarized in the evidence tables (Attachment 3). The assessment of the risk of bias is summarized in the risk of bias tables (Attachment 4).
Description of studies
Systematic reviews
Niu (2020) included 35 RCT’s (n = 3,452) involving adults with IBS that compared probiotics to placebo or no therapy: 19 RCT’s used a combination of probiotics, 8 RCT’s were about Lactobacillus, 3 about Bifidobacterium, 2 about Escherichia, 1 about Bifidobacterium or Lactobacillus, 1 about Saccharomyces and 1 RCT’s about Streptococcus (duration therapy 2 to 6 months; mean age patients unknown; mean % women in study: 68%). Patients with all subtypes of IBS were included; diagnose IBS was based on Rome I, II or III-criteria, Kruis score or the Manning criteria. The setting of the studies is unknown, next to funding. The studies were carried out in the UK, Eire, Denmark, Norway, Finland, Sweden, Korea, China, India, Israel, France, Germany, Poland and USA. Outcome measures were ‘persistence of symptoms’, ‘global symptom score or abdominal pain score’ (SMD) and ‘adverse events’ (not stated which).
RCT’s published after the search date of the systematic reviews
|
RCT (published after the search date of systematic review) |
Characteristics |
Funding |
|---|---|---|
|
Gupta 2021 India |
IBS (Rome-IV) (n = 40; mean age: 35 years; 30% female; secondary care) Bacillus coagulans LBSC for 80 days versus placebo *IBS Severity Scoring System (no symptoms / mild/ moderate/ severe); patients with symptoms > Persistence of symptoms (meta-analysis) |
Probiotics Laboratory, Advanced Enzyme Technologies Limited, Thane (India) |
|
Sadrin 2020 France |
IBS (Rome-III) (n = 80; mean age: 49 years; 73% female; office-based physicians (primary care?) and secondary care) Lactobacillus acidophilus for 8 weeks versus placebo *Abdominal pain score (100 point VAS) > General symptom score or abdominal pain score (meta-analysis) |
OSEO Innovation-Bpifrance (Maisons-Alfort, France) and Laboratoire Denel-Codifra (Le Chesnay, France) |
|
Oh 2019 Korea |
IBS (Rome-III) (n = 61; mean age: 33 years; 72% female; outpatients) Lactobacilli for 4 weeks versus placebo *Subject Global Assessment of symptom relief (0-4) (responder: > 2 points of SGA each week); non-responders > Persistence of symptoms (meta-analysis) |
Ministry of Agriculture, Food and Rural Affairs (MAFRA) (316061-3) |
|
Madempudi 2019 India |
IBS (Rome-III) (n = 108; mean age: 43 years; 28% female; secondary care) Bacillus coagulans for 8 weeks versus placebo *Number of patients reporting > 50% pain reduction; number of patients not reporting > 50% pain reduction > Persistence of symptoms (meta-analysis) *Pain intensity abdominal pain (11-point numerical rating scale) > General symptom score or abdominal pain score (meta-analysis) |
R.S.M., J.J.A. and J.N. are employed by Unique Biotech Ltd. which is a manufacturer of probiotics. They wish to state that the study was conducted independently with no intervention on their part during the duration of the study. |
|
Stevenson 2019 South-Africa |
IBS (C and D) (criteria described in another article) (n = 52; mean age: 48 years; 98% female; secondary care) Lactobacillus plantarum for 8 weeks versus placebo *IBS symptoms with Francis severity score > General symptom score or abdominal pain score (meta-analysis) |
Nestle Nutrition Institute Africa (www.nnia.org) and the South African National Research Foundation [gun number 2075266]. |
|
Shi 2020 China |
Functional Bowel Disorders (clinical criteria) (n = 50; mean age: 42 years; 70% female; secondary care) Bacillus subtilis and Enterococcus faecium for 4 weeks versus placebo *Gastrointestinal Symptom Rating Scale (18 symptoms with severity scale 0-3) > General symptom score or abdominal pain score (meta-analysis) |
Wu Yingkai Foundation for Medical Research and Development, Beijing (grant numbers XD201907) |
|
Barraza 2020 Mexico |
IBS (D or mixed) (Rome-IV) (n = 55; mean age: 45 years; 67% female; outpatients) Lactobacillus plantarum or Pediococcus acidilactici for 6 weeks versus placebo *Abdominal pain: responder if > 30% reduction; non-responders > Persistence of symptoms (meta-analysis) *Abdominal pain (10-point VAS) > General symptom score or abdominal pain score (meta-analysis) |
This study received no funding. |
|
Martoni 2020 India |
IBS (Rome-IV) (n = 336; mean age: 49 years; 50% female; outpatients) Lactobacillus acidophilus and Bifidobacterium lactis for 6 weeks versus placebo *IBS symptom severity scale (5 items with 0-100) total score > General symptom score or abdominal pain score (meta-analysis) |
UAS Laboratories LLC. employees of UAS Laboratories but were not involved in the study conduct, data management or statistical analysis. |
|
Lewis 2020 Canada |
IBS (Rome-III) (n = 165; mean age: 42 years; 77% female; outpatients) Lactobacillus paracasei or and Bifidobacterium longum for 8 weeks versus placebo *IBS symptom severity scale (total score) > General symptom score or abdominal pain score (meta-analysis) |
Lallemand Health Solutions (LHS). LHS owns Lp and BI. LHS was involved in the design of the study, revising the manuscript and decision to publish the results, but was not involved in data collection and analyses, or writing the manuscript. |
|
Skrzydlo 2020 Poland |
IBS-D (Rome-III) (n = 80; mean age: 40 years; 72% female; outpatients) Lactobacillus and Bifidobacterium strains for 8 weeks versus placebo *IBS Symptom Severy Scale (5 items with 100-point VAS) [overall]. > General symptom score or abdominal pain score (meta-analysis) *IBS Adequate Relief (yes/no); number of patients without adequate relief > Persistence of symptoms (meta-analysis) |
Biocare, Copenhagen, Denmark. a company acquired by DSM Nutritional Products in 2017, but was not involved in conducting the study and data analyses. |
|
Kim 2020 Korea |
IBS-D (Rome II) (n = 63; mean age unknown; % female unknown; secondary care) Bifidobacterium longum, -bifidum, -lactis, -infantis and Lactobacillus acidophilus for 8 weeks versus placebo *IBS severity scoring system (0-100) > General symptom score or abdominal pain score (meta-analysis) |
Clinical Research Institute of the Seoul National Academisch centrum Hospital. This work was also carried out with the support of ‘‘Cooperative Research Program for Agriculture Science & Technology Development (Project No. PJ01123002)’ + 1 author from Bifodo Co. |
|
Andresen 2020 Germany |
IBS (Rome-III) (n = 443; mean age: 41 years; 70% female; primary care and referral centres) Bifidobacterium bifidum (MIMBb75) for 8 weeks versus placebo *Composite response: number of patients with response on pain and global relief; number of patients without response > Persistence of symptoms (meta-analysis) |
Synformulas. The funder of the study had no role in study design, data collection, data analysis, data interpretation, or writing of the report. The corr. author had full access to all of the data and had final responsibility |
|
Gayathri 2020 India |
IBS (Rome-III) (n = 100; mean age: 41 years; 34% female; secondary care) Saccharomyces cerevisiae (as add on) for 8 weeks versus placebo *Improvement in abdominal pain scores (8-point Likert scale (0-7)) > General symptom score or abdominal pain score (meta-analysis) |
No information.
|
|
Helo 2019 Jordan |
IBS (Rome-III) (n = 347; mean age: unknown; % female unknown; secondary care) Saccharomyces cerevisiae for 4 weeks versus placebo *Reduction of symptoms; number of patients without reduction of symptoms > Persistence of symptoms (meta-analysis) |
No information. |
|
Al-Jassim 2019 Iraq |
IBS-C (Rome-III) (n = 45; mean age unknown; % female unknown; outpatients) Brewer's yeast (= Saccharomyces cerevisiae) for 20 days versus placebo *IBS severity scale, abdominal pain (0-100) > General symptom score or abdominal pain score (meta-analysis) |
No information. |
Results (effect interventions)
See table for summary of results, based on the systematic review of Niu (2020).
The results of the RCTs also showed heterogeneity and mostly significant, but not clinically relevant, results. This did not change the results of the systematic review.
Other important results
- Subgroupanalyses did not show other results for specific probiotics or therapy duration for all outcome measures. In the forest plots of the analyses of Niu plus the RCT’s published after search date Niu (see Annex) the same is shown.
- Subgroupanalysis did neither show differences in effect for type of IBS (C or D) (forest plots see Annex).
Conclusions
- We are uncertain whether probiotics increase or decrease persistence of symptoms (certainty of the evidence: very low)
- We are uncertain whether probiotics improves or worsen adverse events (not mentioned which) (certainty of the evidence: very low)
- We are uncertain whether probiotics increases or decreases the general symptom score or abdominal pain score (certainty of the evidence: very low)
- There is no difference in effect for different strains of probiotics, different duration of therapy or different type of IBS.
Lichaamsbeweging
Naar Samenvatting ›Adviseer voldoende lichaamsbeweging volgens de Nederlandse norm voor gezond bewegen:
- wekelijks ≥ 2,5 uur matig intensief bewegen zoals wandelen en fietsen, verspreid over diverse dagen
- ≥ 2 × per week spier- en botversterkende activiteiten
In 2 onderzoeken, waarvan 1 met een vervolg met lange follow-up, wordt het effect van lichaamsbeweging op PDS-symptomen bekeken.
- Daley (2008, Verenigd Koninkrijk) includeerde 56 patiënten met PDS (73% vrouw, gemiddeld 43 jaar) en randomiseerde die over een controlegroep en een interventiegroep. In de interventiegroep kregen de patiënten in de 12 weken durende trial 2 × een persoonlijke afspraak waarin lichamelijke beweging werd gestimuleerd. In de controlegroep moesten de mensen hun leefstijl niet veranderen. Aan het begin en aan het eind van het onderzoek werden onder andere de Birmingham IBS Symptom Questionnaire en de IBS-QoL afgenomen.
- Johannesson (2011, Zweden) randomiseerde 75 patiënten met PDS (75% vrouw, gemiddeld 37 jaar) over 2 groepen: de ene groep werd door de fysiotherapeut geadviseerd om meer te bewegen, de andere groep werd geïnstrueerd om hun huidige levensstijl te continueren. Bij aanvang en na 12 weken werd de IBS-SSS afgenomen (50 punten verschil is klinisch relevant).
- Johannesson (2015, Zweden) volgde een deel van de patiënten uit het voorgaande onderzoek (n = 39; 82% vrouw, mediaan 45 jaar) nog eens ongeveer 5 jaar (uitersten 3,8-6,2 jaar). De deelnemers uit de controlegroep van 2011 waren vóór het vervolgonderzoek (2015) ook door de fysiotherapeut geïnstrueerd meer te gaan bewegen. Ook bij hen werden aan het eind van de follow-upperiode de IBS-SSS en de IBS-QoL afgenomen. Uit de resultaten (zie tabel 23) kunnen we concluderen dat op langere termijn lichaamsbeweging een positief effect heeft op PDS-symptomen en kwaliteit van leven, maar dat op korte termijn het verschil met een controlegroep niet heel groot en niet significant is.
|
Onderzoek (follow-up) |
Schaal (scorebereik) |
Verschil in eindscore controlegroep, gecorrigeerd voor aanvangsscore (95%-BI) |
|
|---|---|---|---|
|
Daley 2008 (12 weken) |
Birmingham IBS Sympt. Ques. (0-100) Lager is beter |
– 2,9 (–9,5 tot +3,7) |
|
|
IBS-QoL (0-100) Hoger is beter |
–4,4 (–12,9 tot +4,2) |
||
|
|
|
Scoreverschil controlegroep (start minus eind onderzoek) |
Scoreverschil interventiegroep (start minus eind onderzoek) |
|
Johannesson 2011 (12 weken) |
IBS-SSS (0-500) Lager is beter |
–5 (–101tot +118) |
–51 (–130 tot +49) |
|
Johannesson 2015 (gem. 5 jaar) |
IBS-SSS (0-500) Lager is beter |
n.v.t. |
–64 (onbekend) |
|
IBS-QoL (0-100) Hoger is beter |
n.v.t. |
+14 (onbekend) |
|
Psychologische behandeling
Naar Samenvatting ›- Overweeg een psychologische behandeling (denk aan gedragstherapie zoals mindfulness-based cognitieve therapie gericht op concentratie en acceptatie, relaxatietherapie of hypnotherapie).
- Laat de keuze van de behandeling afhangen van de motivatie en voorkeur van de patiënt.
- Bespreek de voordelen (mogelijk effect) en nadelen (kosten, tijdsinvestering).
- Leg uit dat psychologische behandelingen effectief zijn voor het verminderen van darmklachten.
Psychologische behandelingen en psychotherapeutisch interventies lijken zowel op korte termijn (tijdens de interventie) als op langere termijn (na het beëindigen van de interventie) te zorgen voor althans gedeeltelijke vermindering van PDS-klachten en hebben weinig tot geen bijwerkingen. Ook in afwezigheid van affectieve klachten zoals gegeneraliseerde angst of depressie kunnen psychologische behandelingen effectief zijn bij PDS-klachten. Met name de fysieke en geestelijke ontspanning lijkt effectief te zijn [Flik 2018]. Daarom hebben behandelingen met die insteek de voorkeur; denk hierbij aan derdegeneratie gedragstherapie zoals mindfulnessbased cognitieve therapie (gericht op concentratie en acceptatie), relaxatietherapie en hypnotherapie.
Voor- en nadelen
Voordelen
Er lijkt op sommige punten gezondheidswinst te behalen te zijn met psychologische behandelingen, met name PDS-klachten lijken te verminderen na een behandeling. Voor hypnotherapie zijn er 2 goed beschreven en onderzochte protocollen (deze worden ook wel scripts of draaiboeken genoemd) voor PDS, 1 uit Manchester en 1 uit Chapel Hill. Het protocol uit Manchester (IMAGINE) wordt in een aangepaste versie vaak toegepast in Nederland.
Er zijn verschillende soorten psychologische behandelingen, dus de voorkeur van de patiënt kan meegewogen worden.
Nadelen
Bij onderzoek naar psychologische behandelingen is blinderen per definitie niet mogelijk. De gevonden effecten zijn vaak klein en de kwaliteit van bewijs is laag. Er is in Nederland geen standaard-CGT voor PDS en er zijn ook geen scripts, protocollen of draaiboeken. In de onderzoeken naar CGT worden verschillende technieken en elementen gebruikt, waardoor het lastig is om deze onderling te vergelijken. Ook zijn er in Nederland geen standaard relaxatietherapieën voor PDS, maar er is wel een uitgeschreven protocol.
Kwaliteit van bewijs
De kwaliteit van het bewijs was zeer laag tot laag. Er werd afgewaardeerd in verband met risico op vertekening vanwege grote heterogeniteit (verschil in effect tussen onderzoeken), onnauwkeurigheid (brede betrouwbaarheidsintervallen, laag aantal patiënten en/of events) en kans op publicatiebias. Blindering is per definitie niet mogelijk in psychologisch onderzoek. In de GRADE-methodiek leidt een gebrek aan blindering meestal tot verdere afwaardering van het onderzoek.
Waarden en voorkeuren van patiënten
Veel patiënten met PDS zullen een psychologische behandeling willen overwegen om minder last te hebben van hun klachten of er beter mee om te gaan. Sommige PDS-patiënten vinden het lastig om een psychologische behandeling te volgen voor fysieke klachten. Toelichting dat PDS-klachten multifactorieel worden bepaald en uitleg over de darm-hersenas kan hun bezwaren misschien wegnemen. Een deel van de PDS-patiënten voelt zich niet serieus genomen als de arts een psychologische behandeling voorstelt voor lichamelijke klachten. Ook hier kan heldere uitleg over mogelijke oorzakelijke factoren van PDS en vooral over de werking van de therapie (bijvoorbeeld dat je er daadwerkelijk lichamelijke processen mee kunt beïnvloeden) helpen.
Iedere patiënt zal een eigen voorkeur hebben voor een bepaald soort psychologische behandeling. In die voorkeur moet ook de tijd, energie en motivatie van de patiënt meegewogen worden: welk psychologisch behandeltraject is haalbaar?
Kosten
De kosten van een psychologische behandeling hangen af van wie de behandeling geeft. Voor psychotherapie in de eerste lijn gelden de tarieven van de poh-ggz. Eerstelijnspsychologen met een eigen praktijk hebben vaak hogere tarieven. De (zeer variabele) tarieven van vrijgevestigde psychologen, psychotherapeuten en hypnotherapeuten zijn mede afhankelijk van de verrekening: via de generalistische basis-ggz dan wel de gespecialiseerde ggz. Na het intakegesprek zijn ongeveer 6 sessies nodig.
Niet alle psychologische behandelingen worden voor alle patiënten vergoed; dit is afhankelijk van de zorgverzekering van de patiënt. Behandelingen door klinisch psychologen in het ziekenhuis, alleen na verwijzing door de mdl-artsen, worden meestal betaald uit het ziekenhuisbudget voor psychosociale hulp.
Aanvaardbaarheid
Het wordt algemeen aanvaardbaar geacht dat mensen een psychologische behandeling ondergaan wanneer ze psychische klachten hebben, maar het volgen van een psychologische behandeling voor fysieke klachten kan soms onbegrip oproepen (zie Waarden en voorkeuren van patiënten).
Haalbaarheid
De haalbaarheid van de beschreven therapieën hangt af van de beschikbaarheid van therapeuten met de juiste expertise (de wachttijden zijn afhankelijk van de gekozen therapievorm).
Zijn psychologische behandelingen, in het bijzonder cognitieve gedragstherapie (CGT), hypnotherapie en relaxatietherapie, vergeleken met psycho-educatie of een andere niet-primair therapeutische interventie aan te bevelen bij patiënten met PDS?
Achtergrond
Psychologische behandelingen werken ook in op de darm-hersenas. Op deze theoretische grond kan verwacht worden dat psychotherapie lichamelijke klachten bij PDS zou kunnen verlichten. Cognitieve gedragstherapie, hypnotherapie en relaxatie worden genoemd als mogelijke therapieën bij PDS, gericht op klachtenvermindering, het kunnen omgaan met darmgerelateerde klachten en met de bijkomende onzekerheid, angsten of functionele beperkingen. In dit detail beschrijven we het klinische bewijs voor deze therapieën.
Clinical question
Are psychological therapies, in particular cognitive behavioral therapy (CBT), hypnotherapy and relaxation therapy (compared to psychoeducation or other relevant (not primarily therapeutic, sham) interventions) recommended for patients with IBS?
|
Patients |
Patients with IBS (primary and secondary care; all subgroups of IBS) |
|---|---|
|
Intervention |
Psychological therapies (CBT, hypnotherapy, relaxation) |
|
Control |
Psychoeducation or other relevant (not primarily therapeutic, sham) intervention |
|
Outcomes |
|
|
Other selection criteria |
Study design: systematic reviews and RCT’s |
Methods (search)
The databases PubMed and Embase were searched with relevant search terms from 2009 until November 2020. The detailed search strategy is depicted in the Annex (Totstandkoming)/under the tab Methods. Studies were selected based on the criteria as described in the PICO. Attachment 1 contains the PRISMA flowchart showing the number of hits, and Attachment 2 contains the reasons of exclusion.
Relevant outcome measures
The working group defined 20% as a minimal clinically (patient) important difference (MCID) for all outcome measures, next to a Standardized Mean Difference (SMD) > 0.50, OR or RR < 0.75 or > 1.25 and a change of 20% of the total score on a questionnaire. If there is a specific minimal clinically (patient) important difference for a questionnaire, than that MCID will be used.
- Global improvement: can be measured by asking patients if their symptoms were adequately controlled in the past 7 days (adequate relief). The IBS-SSS and GI symptoms rating scale (GSRS) can be used also (for numeric improvement on continuous scale). A 10% (50 points) change on the IBS-SSS is considered a minimal clinically (patient) important difference (based on literature).
- Abdominal pain: one review used the outcome ‘mean improvement abdominal pain’ with SMD.
- Quality of life: measured with a general questionnaire (SF 36) or disease-specific (IBS-QoL), reviews reported in SMD, narrative statements or with IBS-QoL.
- Relief of symptoms: the reviews used, reported effect / no effect and improvement / no improvement of symptoms and calculated relative ratios.
Results
Five systematic reviews. and seven RCT’s. (about four studies) (published after the search date of the systematic reviews (June 2020 and July 2017)) were included in the analysis of the literature.
|
Systematic reviews |
CBT |
Hypnotherapy |
Relaxation |
Outcome |
|---|---|---|---|---|
|
Billings 2020 |
x |
x |
x |
Mean improvement abd. pain Overall response |
|
Ford 2019 |
x |
x |
x |
No improvement IBS symptoms |
|
Li 2014 |
x |
|
|
Quality of life |
|
Lee 2014 |
|
x |
|
Quality of life |
|
Park 2014 |
|
|
x |
Quality of life |
|
RCT / studies |
CBT |
Hypnotherapy |
Relaxation |
Outcome |
|
Lackner 2019 |
x |
|
|
IBS symptoms |
|
Everitt 2019 |
x |
|
|
IBS SSS |
|
Peter 2018 |
|
x |
|
Quality of life + IBS severity |
|
Jang 2017 |
x |
|
|
GI symptoms |
Description of studies
Important study characteristics and results are summarized in the evidence tables (Attachment 3). The assessment of the risk of bias is summarized in the risk of bias tables (Attachment 4).
Systematic reviews
- Billings (2020) included 21 RCT’s about psychological therapies for adults with IBS: 9 RCT’s with respect to CBT (duration therapies 2-12 weeks; 1075 patients; mean age 38 year; women 87%), 4 RCT’s with respect to hypnotherapy (duration therapy 12 weeks; 560 patients; mean age 41 year; women 79%) and 8 RCT’s with respect to relaxation (duration therapy 4-10 weeks; 308 patients; mean age 43 year; women 67%). Patients with all subtypes of IBS were included; diagnose IBS was based on ROME I, II or III-criteria, ‘symptoms without organic disease’ or the Manning criteria. Coexisting depression or anxiety was not reported. The setting of the studies was not described by Billings. The studies were carried out in the Netherlands, Sweden, Austria, Spain, France, Germany, USA, Canada, Japan and Korea. The control-group received psychoeducation, ‘attention’, group-discussion or ‘supportive listening’. Outcome measures were ‘mean improvement in abdominal pain’ (SMD) and ‘overall response’ (as defined by each RCT: effect/no effect).
- Ford (2019) included 22 RCT’s about psychological interventions for PDS: 9 RCT’s with respect to CBT (face-to-face; duration intervention: 6-12 weeks; 610 patients; mean age unknown; 85% women), 5 RCT’s with respect to hypnotherapy (duration intervention 6-12 weeks; 278 patients; mean age unknown; 78% women) and 8 RCT’s about relaxation (NOT: stress-management or mindfulness and meditation) (duration interventions: 2-8 weeks; 360 patients; mean age unknown; 73% women). Control-groups were physician’s ‘usual management’, symptom monitoring or supportive therapy. There were also RTC’s included about self-administered / minimal contact CBT and CBT via internet. The effects of those studies will only be mentioned here, not fully described. Patients with all subtypes of IBS were included; IBS diagnose was based on clinical diagnose or Rome I, II or III-criteria. Coexisting depression or anxiety was not reported. The setting was mainly third line, only five of the 22 RCT’s were set in primary or secondary care. Studies were carried out in: the USA, Canada, the Netherlands, Sweden, Austria, England, Australia, Japan and Israel. Outcome measure was ‘no improvement in IBS symptoms’.
- Li (2014) included 18 RCT’s about CBT for 288 patients with IBS (diagnose based on ROME I, II or III-criteria; subtype IBS unknown), of which in 4 RCT’s another psychological therapy (psycho-education support, stress monitoring or -management, relaxation) as control-group was used. This comparison will be used for our PICO. Coexisting depression or anxiety was not reported, but psychological state (measured with HADS or BDI) was in some RCT’s an outcome measure. The setting of the studies is unknown (probably secondary care). The studies were carried out in the USA (2x), Australia and Sweden. CBT was individual, via internet or in a group and existed of a 1-hour-session or a few exercises in a week, during 8-10 weeks. Mean age of the patients was between 38 and 50 year and 73-81% of the patients was female. The outcome measure quality of life will be described.
- Lee (2014) included 7 RCT’s (2 from UK, 2 from the USA, 2 from Sweden, 1 from Austria) with 374 IBS patients (diagnose based on Rome I, II or III-criteria, or diagnosed by the general practitioner; subtype IBS unknown). The RCT’s compared hypnotherapy with another therapy (diet + education, psychotherapy, medication) or no therapy (only monitoring of symptoms). Patients ware between 18 and 70 year of age (mean age unknown) and 80% of the patients was female. Coexisting depression or anxiety was not reported, but psychological state (measured with HADS) was in some RCT’s an outcome measure. Setting of studies was mainly secondary care. The hypnotherapy-intervention consisted of 5-12 sessions of 30-60 minutes. During the intervention medication as usual was allowed to take. Outcome measure used: quality of life.
- Park (2014) included 8 RCT’s about relaxation therapy for IBS (5x progressive muscle-relaxation, 1x meditation, 1x self-relaxation, 1x yoga (not a psychological treatment); duration interventions: 8-12 weeks; setting unknown) compared with a control-group. Patients in control-groups was given social support, diet + education, enhanced medical care + counselling interviews, care as usual or medication (p.e. loparamine). 445 patients with IBS (diagnose based on Rome I or II, or Manning criteria, or based on specific symptoms; subtype IBS unknown) were included. Mean age of patients was between 30 and 50 year, and 50-100% was female. Coexisting depression or anxiety was not reported, but psychological state (measured with HADS, STAI or BSI) was in some RCT’s an outcome measure. Studies were carried out in Japan, USA, Germany, the Netherlands, India, Australia, UK and Spain. Outcome measure used: quality of life (described in 1 RCT with a mindfulness-based stress reduction program; measured with IBS-QoL (34 items; likert-score 1-5 (range sumscore: 34-170)).
RCT’s published after the search date of the systematic reviews:
- Lackner (2018 & 2019; USA) included 436 IBS patients (diagnose based on ROME III-criteria; 80% women, mean age 41 year; tertiary centres) who were randomly assigned to groups that received the following: standard-CBT (S-CBT, n = 146, comprising 10 weekly, 60-minute sessions that emphasized the provision of information about brain-gut interactions; self-monitoring of symptoms, their triggers, and consequences; muscle relaxation; worry control; flexible problem solving; and relapse prevention training), or 4 sessions of primarily home-based CBT requiring minimal therapist contact (MC-CBT, n = 145), in which patients received home-study materials covering the same procedures as S-CBT), or 4 sessions of IBS education (EDU, n = 145) that provided support and information about IBS and the role of life>
- Everitt (2019a-c; UK) included 558 IBS patients (diagnose based on ROME III-criteria; 76% women, mean age 43 year; primary and secondary care) who were randomised over: telephone-delivered CBT (TCBT: 6 1-hour-sessions during 9 weeks), web-based CBT (WCBT: 3 telephone calls of 30 minutes during 9 weeks) with minimal therapist support, and treatment as usual (TAU: continuation of current medications and usual GP or consultant follow-up with no psychological therapy). Follow-up data were collected 3, 6, 12 en 24 months after randomisation. Outcome measure: IBS-SSS.
- Peter (2018; Austria) included 74 IBS patients (diagnose based on ROME III-criteria; 73% women, mean age 44 year; primary and secondary care) were randomised over: 7-10 (gut directed) hypnotherapy-sessions and the other group received care as usual. Follow-up data were collected 10 months after the last hypno-session. Outcome measures: quality of life (based on 3 visual analogue scales (VAS) (3 items with score 0-100, total 0-300 (higher is better))) and IBS severity (based on sub-scale of IBS-SSS).
- Jang (2017; Korea) included 43 patients with IBS-C (based on ROME III-criteria; 100% women, mean age 22 year ; secondary care) and randomised the patients over: 8 weeks CBT (8 weekly sessions of 80 minutes) or receiving face-to-face general medical information about IBS for 50 minutes in the first week (control group). In both groups participants were assigned to a group of 4-6 people which are interviewed by the investigator about their GI symptoms. Questionnaires were filled in after 8, 16 and 24 weeks. Outcome measure: GI symptoms (GI Symptom Rating Scale (GSRS; 13 items with scale 1-7 (low better), total score 13-91).
Results (effect interventions)
See tables Cognitive behavioural therapy (CBT), Hypnotherapy and Relaxation for summary of results.
Results if only using ‘high quality’ studies (see tables 25 and 26):
- If only ‘high quality’ studies (that is: studies with a ‘high quality’ control group) will be included in the analyses to keep bias as low as possible, relaxation therapy seems to be more effective than the control intervention, while CBT is not. ‘High quality’ control groups are therapist-delivered interventions focused on IBS with direct contact with a trained therapist in a comparable number of sessions, with similar length and frequency as the treatment under study. The analysis was based on 4 studies (3 on CBT, 1 on relaxation therapy; with 3 times psycho education as control group and one study used a support group as control. (Hypnosis was not included in this analysis). Probably, this difference in effectivity is because CBT direct at IBS related thoughts and behaviour, while relaxation aims at body and mind relaxation.
- Looking at ‘high quality’ studies with respect to hypnotherapy, hypnosis may have a positive effect on improvement and adequate relief.
|
Intervention* |
Outcome |
Intervention |
Control |
SMD (95%CI) |
||||
|---|---|---|---|---|---|---|---|---|
|
|
|
Mean |
SD |
N total |
Mean |
SD |
N total |
|
|
Cognitive therapy1 |
CPRS |
0.132 |
0.44 |
120 |
0.246 |
0.4 |
46 |
-0.26 (-0.61-0.08) |
|
Cognitive therapy2 |
CPRS |
0.67 |
0.24 |
12 |
0.31 |
0.42 |
12 |
1.02 (0.16-1.88) |
|
Cognitive behavioural therapy3 IE |
BSS index |
0.54 |
0.74 |
47 |
0.25 |
0.98 |
22 |
-0.35 (-0.86-0.16) |
|
Cognitive behavioural therapy3 SM |
BSS index |
0.25 |
0.83 |
41 |
0.25 |
0.98 |
22 |
0.00 (-0.52-0.52) |
|
|
|
Positive treatment effect |
|
Positive treatment effect |
|
Odds ratio (95%CI) |
||
|
Relaxation therapy4 |
Adequate relief |
9 |
11 |
3 |
10 |
10.50 (1.36-81.05) |
||
|
* Compared with psychoeducational support (cognitive therapies and relaxation) CPRS = Composite primary symptom reduction score, high score is better |
||||||||
|
Intervention* |
Outcome |
Intervention |
Control |
OR (95%CI) |
||||
|---|---|---|---|---|---|---|---|---|
|
|
|
Positive treatment effect |
N total |
Positive treatment effect |
N total |
|
||
|
Hypnosis6 |
Improve-ment |
28 |
46 |
18 |
44 |
2.25 (0.97 – 5.22) |
||
|
Hypno-therapy7 |
Adequate relief |
31 |
91 |
6 |
35 |
2.50 (0.94 – 6.65) |
||
|
|
|
Mean |
SD |
N total |
Mean |
SD |
N total |
|
|
Hypnosis6 |
IBS-IS |
4.8 |
1.0 |
46 |
3.9 |
1.1 |
44 |
p < 0.001 |
|
Hypno-therapy7 |
IBS-SSS |
258.7 |
89.3 |
84 |
269.4 |
83.4 |
31 |
n.s. |
|
* Group hypnotherapy compared with educational supportive therapy IBS-IS = IBS Impact Scale (score: 1-7) |
||||||||
Cognitive behavioral therapy (RCT’s)
- Lackner (2019) also shows a decrease in IBS symptoms 12 months after CBT: 58-70% of the IBS patients receiving CBT state they feel an improvement in IBS symptoms, compared to 46-52% in the control-group (receiving education). Also the IBS-SSS reduces in the CBT groups (103 -120 points) compared to the score in the control-group (89-103). Jang (2017) described a same pattern: a reduction in GI symptoms after CBT, compared to the control-group (GSRS-score after 8-24 weeks: resp. 19-24 (sd 1) and 34-35 (sd 1)). And Everitt (2019) also: a decrease of 85-133 points on the IBS-SSS in the CBT-group 12 months after randomisation, compared to a 22-53 decrease in points for patients who received care as usual. After 24 months the decrease is still 97-108 points for patients with IBS who received CBT, and 61 points for patients with IBS receiving care as usual.
- Lackner (2019) shows no difference in effect between minimal contact CBT and CBT as usual (face to face), as opposed to Ford (2019) who state that self-administered / minimal contact CBT and CBT via internet may not result in improvement in IBS symptoms and seems to be less effective than face to face CBT. Everitt (2019) shows nearly no difference between CBT by telephone or via web.
Hypnotherapy (RCT)
Peter (2018) shows an increase in quality of life for patients with IBS after hypnotherapy compared to care as usual (score 179 (sd 78) versus 115 (sd 61)), next to a lower IBS severity (score 197 (sd 117) versus 304 (sd 79)).
Conclusions
Cognitive behavioral therapy
- We are uncertain whether cognitive behavioral therapy (CBT) improves or worsen the overall response (effect or no effect) [relief of symptoms]. and mean improvement in abdominal pain by patients with IBS (certainty of the evidence: very low)
- CBT may result more often in improvement in IBS symptoms [global improvement]. for patients with IBS than in a control-group, this difference is clinically relevant (certainty of the evidence: low)
- CBT may increase the quality of life for patients with IBS compared to other psychological interventions, this difference is clinically relevant (certainty of the evidence: low)
Hypnotherapy
- Hypnotherapy may have little or no effect on the overall response (effect or no effect) and mean improvement in abdominal pain by patients with IBS (certainty of the evidence: low)
- Hypnotherapy may result more often in improvement in IBS symptoms for patients with IBS than in a control-group, however this difference isn’t clinically relevant (certainty of the evidence: low)
- Hypnotherapy may not improve quality of life for patients with IBS (certainty of the evidence: low)
Relaxation
- Relaxation may have little or no effect on the overall response (effect or no effect), mean improvement in abdominal pain and quality of life by patients with IBS (certainty of the evidence: low)
- We are uncertain whether relaxation improves or worsen IBS symptoms (certainty of the evidence: very low).
Medicamenteuze behandeling
Naar Samenvatting ›Algemene uitgangspunten
Naar Samenvatting ›- Behandeling met geneesmiddelen is bij slechts een deel van de patiënten met PDS zinvol gebleken. De effectiviteit van de meeste voorgeschreven middelen is voor de brede PDS-patiëntengroep onvoldoende vastgesteld.
- Besteed aandacht aan het verwachtingspatroon van de patiënt rondom medicatie en geef aan hoe reëel de verwachtingen over de effectiviteit zijn.
- Neem de volgende overwegingen en aanbevelingen in acht bij het desondanks, in overleg met de patiënt, voorschrijven van medicatie.
Medicamenteuze behandeling bij PDS-C
Naar Samenvatting ›Laxantia
Naar Samenvatting ›- Overweeg voor de symptomatische behandeling van obstipatie:
- een volumevergrotend laxans, bijvoorbeeld psylliumzaad 1-3 sachets per dag, innemen met een ruime hoeveelheid vocht
- of een volumevergrotend én osmotisch werkzaam laxans, zoals macrogol 4000
- of een combinatiepreparaat van macrogol met elektrolyten; 1-2 sachets per dag
- Evalueer het gebruik na 2 weken en probeer het laxans te staken.
- Evalueer bij voortgezet gebruik na weer 4 weken en vervolgens op regelmatige basis.
- Geef bij langdurig gebruik de laagst werkzame dosering.
- Kies bij bijwerkingen eventueel voor magnesiumhydroxide als alternatief.
- Lactulose heeft niet de voorkeur, vanwege gasvorming (opgeblazen gevoel) in de darm als bijwerking.
Effectiviteit van volumevergrotende laxantia (bulkvormers) bij PDS algemeen
- De laxerende werking van volumevergrotende laxantia komt tot stand door het osmotische effect van slecht absorbeerbare stoffen die water in de darm aantrekken en vasthouden, waardoor de peristaltiek wordt bevorderd (zie Farmacotherapeutisch Kompas).
- In 2011 verscheen een update van een cochranereview uit 2005 waarin de werkzaamheid van volumevergrotende laxantia (bulkvormers), parasympathicolytica en antidepressiva bij patiënten met PDS is onderzocht.
In deze review werden 56 onderzoeken (2333 patiënten) geïncludeerd, waaronder 12 onderzoeken (621 patiënten) over bulkvormers. Er werd geen gunstig effect van bulkvormers ten opzichte van placebo gevonden op:
- buikpijn (4 onderzoeken; 186 patiënten; SMD 0,03; 95%-BI −0,34 tot 0,40; p = 0,87)
- global assessment (11 onderzoeken; 565 patiënten; RR 1,10; 95%-BI 0,91 tot 1,33; p = 0,32)
- symptoomscore (3 onderzoeken; 126 patiënten; SMD 0,00; 95%-BI −0,43 tot 0,43; p = 1,00).
- Subgroepanalyses die oplosbare respectievelijk onoplosbare bulkvormers vergeleken, lieten ook geen significante effecten zien.
- Obstipatie is een veelvoorkomend onderdeel van het symptomencomplex bij PDS en is als zodanig aanleiding voor het gebruik van laxantia. De werkgroep heeft gezocht naar wetenschappelijk bewijs voor de effectiviteit van laxantia bij PDS. In de NICE-richtlijn is het bewijs voor deze vraag besproken. Er werden uitsluitend onderzoeken ingesloten met een follow-up van > 4 weken die betrekking hadden op PDS met obstipatie of enkelvoudige obstipatie (zonder andere PDS-klachten). Van de 50 onderzoeken werden er uiteindelijk 12 geïncludeerd. Slechts 1 onderzoek vermeldde de deelname van patiënten met PDS (7 van de 43 deelnemers). In de overige onderzoeken werd uitsluitend gesproken over obstipatie, maar de auteurs van de review waren van mening dat het grootste deel van deze onderzoeken ook betrekking heeft op patiënten met PDS.
Effectiviteit van lactulose
- Lactulose versus placebo: er is geen onderzoek gevonden bij PDS-patiënten.
- Lactulose versus macrogol: uit onderzoek waarin de behandeling van geconstipeerde patiënten (inclusief patiënten met PDS) met macrogol werd vergeleken met lactulose worden de volgende conclusies getrokken:
- er is een redelijke hoeveelheid bewijs dat de symptomen van obstipatie verbeteren bij het gebruik van lactulose
- er is een matige hoeveelheid bewijs van goede kwaliteit dat patiënten die lactulose gebruikten significant vaker noodmaatregelen moesten nemen dan diegenen die macrogol gebruikten
- er is een matige hoeveelheid bewijs van goede kwaliteit dat er een significante verbetering van de defecatiefrequentie is bij gebruik van lactulose.
- Lactulose versus oplosbare vezel: uit onderzoek waar de behandeling van obstipatiepatiënten (inclusief enkelen met PDS) met lactulose werd vergeleken met oplosbare vezel (meestal psyllium) worden de volgende conclusies getrokken (tabel 27):
- er is een redelijke hoeveelheid bewijs van slechte kwaliteit dat beide behandelingen gelijkwaardig zijn
- 1 onderzoek van goede kwaliteit vond een gering voordeel voor oplosbare vezels bij verbetering van symptomen; dit onderzoek bevatte waarschijnlijk geen patiënten met PDS.
- 1 onderzoek van goede kwaliteit vond geen verschil tussen oplosbare vezels en lactulose op verbetering van pijn; dit onderzoek bevatte waarschijnlijk geen patiënten met PDS.
|
Vergelijking |
Samengevatte resultaten |
|---|---|
|
Lactulose versus placebo |
Geen gegevens |
|
Lactulose versus macrogol |
In het algemeen voorkeur voor macrogol (NNT = 6) |
|
Lactulose versus vezels |
Geen consistent verschil |
Bijwerkingen
De NICE-richtlijn geeft een uitgebreide bespreking van laxeermiddelen, inclusief de gerapporteerde bijwerkingen. De informatie over bijwerkingen komt uit onderzoeken naar de effecten van laxeermiddelen, lang niet altijd worden de bijwerkingen systematisch besproken. In een systematische review over bijwerkingen met behulp van gegevens uit 7 RCT’s geeft NICE enkele belangrijke beperkingen aan.
- Het patroon van bijwerkingen overlapt met symptomen van PDS: flatulentie, buikpijn en krampen, waardoor verergering van de klachten ondanks therapie feitelijk niet te scheiden is van bijwerkingen of natuurlijk beloop.
- De trials zijn niet primair gericht op het opsporen en registreren van bijwerkingen, deze gegevens worden op geheel verschillende manieren verzameld.
- De onderzoeken hebben geen van alle geanticipeerd op specifieke bijwerkingen, waardoor bijwerkingen wellicht niet voldoende zijn gesignaleerd.
Conclusies bijwerkingen laxantia
- Er is beperkt bewijs dat laxeermiddelen geassocieerd zijn met gastro-intestinale bijwerkingen (krampen, ongemak, opgezette buik, diarree, buikpijn en misselijkheid).
- Er is consistent bewijs dat lactulose het risico op buikklachten vergroot bij patiënten met obstipatie van wie waarschijnlijk een deel PDS heeft.
- Er is matig bewijs dat een lage dosis macrogol geassocieerd is met minder bijwerkingen dan een hoge dosis macrogol.
Conclusie
- De werkgroep is van mening dat obstipatie bij patiënten met PDS niet los kan worden gezien van het totale beeld en acht de uitkomsten van de NICE-richtlijn daarom niet vanzelfsprekend toepasbaar op patiënten met PDS. De werkgroep geeft de voorkeur aan laxantia als psyllium of macrogol boven lactulose.
- Macrogol kan soms buikklachten geven. Op basis van ervaring van werkgroep en patiënten kan in dat geval magnesiumhydroxide als alternatief overwogen worden (de ervaringen van patiënten met dit middel zijn vaak goed).
Linaclotide
Naar Samenvatting ›- Overweeg linaclotide bij patiënten met PDS-C die onvoldoende baat hebben gehad van niet-medicamenteuze behandeling (zoals aanpassing van de voeding) en laxantia:
- dosering 1 dd 1 capsule (290 microgram)
- innemen ≥ 30 min vóór de maaltijd (bij voorkeur voor het ontbijt)
- Informeer de patiënt over mogelijke bijwerkingen:
- ernstige diarree, met name in de eerste week (> 10% van de patiënten)
- virale gastro-enteritis, buikpijn, winderigheid, opgezette buik, duizeligheid (1-10% van de patiënten)
- Het effect op het ontlastingspatroon treedt sneller op dan het effect op de pijn en het opgeblazen gevoel.
- Mogelijke interacties:
- wees voorzichtig bij gelijktijdig gebruik met protonpompremmers, laxeermiddelen of NSAID’s, vanwege meer kans op diarree
- bij ernstige of langdurige diarree kan de resorptie en daarmee de werkzaamheid van andere geneesmiddelen zoals levothyroxine of orale anticonceptiva afnemen (zie NHG-Standaard Acute diarree).
- Geef geen linaclotide bij zwangerschap.
- incidenteel gebruik van linaclotide wordt niet aanbevolen.
- Controles:
- evalueer het effect na ≥ 4 weken alvorens linaclotide langdurig voor te schrijven; vraag de patiënt om voor de evaluatie pijn en het ontlastingspatroon bij te houden
- heroverweeg de behandeling indien na 12 weken onvoldoende verandering in ontlastingspatroon en/of pijn
- evalueer het effect (minimaal) jaarlijks
- Gezien de positieve effecten op buikpijn en klachtenvermindering bij patiënten met PDS-C kan linaclotide ingezet worden voor de behandeling van PDS-C.
- Linaclotide kan in de eerste lijn worden voorgeschreven. Goede voorlichting aan de patiënt is belangrijk, met name over de bijwerkingen in de vorm van ernstige diarree in de eerste week.<
- Gezien de relatief hoge kosten in vergelijking met andere laxeermiddelen en de mogelijke bijwerking diarree in de eerste dagen van de behandeling wordt aanbevolen eerst het gangbare niet-medicamenteuze en medicamenteuze beleid te voeren. Indien aanpassing van de voeding en de gangbare (laxeer)middelen onvoldoende effect hebben, is linaclotide een extra mogelijkheid zonder dat vooraf kan worden gesteld dat het effect naar verwachting beter zal zijn dan de eerder ingezette therapie.
Voor- en nadelen van de interventie
Linaclotide lijkt een positief effect te hebben op klachten behorende bij PDS-C. Patiënten ervaren minder buikpijn en rapporteren vaker verlichting van klachten en algehele verbetering.
Wel rapporteerde een groot deel van patiënten die linaclotide kregen ernstige diarreeklachten, voor < 5% was dit reden om met de medicatie te stoppen. De resultaten zijn gebaseerd op goed uitgevoerde, dubbelblind gerandomiseerde onderzoeken.
De oorspronkelijke PICO richtte zich op patiënten die therapieresistent zijn omdat het middel in de huidige situatie in Nederland alleen aan deze patiëntengroep wordt voorgeschreven. De beschreven onderzoeken hebben niet specifiek deze patiëntgroep geïncludeerd. Ook zijn er geen vergelijkende onderzoeken met andere beschikbare medicamenten die de klachten van pijn en/of obstipatie bij patiënten met PDS-C kunnen verlichten.
Plecanatide is een geneesmiddel uit dezelfde ATC-klasse als linaclotide (zie A06AX Other drugs for constipation). Plecanatide werkt via hetzelfde mechanisme, maar is in Nederland niet te verkrijgen en is daarom niet meegenomen in deze module.
Ook bestaat linaclotide met vertraagde afgifte. In Nederland is hiervan alleen een preparaat met een dosering van 290 microgram beschikbaar.
Omdat veel onderzoeken voornamelijk vrouwen geïncludeerd hebben, is er nog onzekerheid over de conclusies met betrekking tot mannelijke patiënten met PDS-C.
Er zijn geen vergelijkende (head-to-head) onderzoeken gedaan met gangbare goedkopere laxantia.
Black (2018) kwam in een review en netwerkmeta-analyse tot de conclusie dat alle middelen uit ATC-klasse A06AX (lubiproston, plecanatide, linaclotide, tenapanor) ongeveer hetzelfde presteren en superieur waren aan placebo. De netwerkmeta-analyse liet zien dat linaclotide het efficiëntst is op verschillende uitkomstmaten [Black 2018]. Terwijl linaclotide is onderzocht voor de specifieke doelgroep PDS-C zijn de andere middelen dat veelal niet of nauwelijks.
Kwaliteit van bewijs
De kwaliteit van bewijs is redelijk tot laag. De resultaten zijn gebaseerd op dubbelblind gerandomiseerde onderzoeken van redelijke kwaliteit. Voor de uitkomstmaten kwaliteit van leven en IBS-SSS werd afgewaardeerd voor het lage aantal deelnemers. Alle onderzoeken werden gefinancierd door bedrijven.
Waarden en voorkeuren van patiënten
Het belangrijkste doel voor de patiënt is vermindering van pijnklachten en obstipatiegerelateerde problemen, het liefst met een middel dat beide problemen behandelt en een eenvoudig doseringsschema heeft.
Het is echter onzeker of de patiënt altijd tevreden is met een middel dat in Nederland beschikbaar is in 1 vaste dosis van 290 microgram 1 dd en daardoor niet eenvoudig te titreren is.
Als bijwerking van linaclotide komt regelmatig (ernstige) diarree voor. Uit de praktijk blijkt dat de diarree met name in de eerste week optreedt en daarna snel afneemt. Wanneer het middel langere tijd wordt gebruikt, wordt deze bijwerking minder. Het is van belang dat de patiënt hier goed over wordt geïnformeerd bij de start van deze behandeling.
Kosten
Linaclotide kost in 2022 € 1,87 per capsule.
Aanvaardbaarheid
Het wordt over het algemeen aanvaardbaar geacht dat mensen iets innemen om minder klachten te hebben. Linaclotide in capsulevorm moet 1 × per dag worden ingenomen. Innemen op een lege maag (30 minuten voor het ontbijt) kan het gebruik aanvaardbaarder maken. Het middel is niet makkelijk te titreren (er is slechts 1 dosering beschikbaar).
Haalbaarheid
De werkgroep ziet geen haalbaarheidsproblemen. De plaats van linaclotide in de behandeling van PDS-C betreft patiënten bij wie de gangbare (laxerende) medicatie en aanpassing van de voeding onvoldoende resultaat geven, zowel in de eerste als in de tweede lijn.
De kosten kunnen een belemmering zijn voor sommige patiënten. Voorheen werd het middel alleen in de tweede lijn voorgeschreven, in de eerste lijn wordt het nog niet altijd standaard vergoed. Aangezien begeleiding en behandeling van PDS vooral in de eerste lijn plaatsvinden, acht de werkgroep het passend dat linaclotide ook in de eerste lijn vergoed wordt.
Om het gebruik van linaclotide te optimaliseren, is het nuttig de volgende punten te bespreken met de patiënt:
- innemen bij voorkeur 30 min voor het ontbijt
- er is een gerede kans op het optreden van diarree direct na het starten van linaclotide; de ernst van de diarree neemt na 1 week gebruik duidelijk af
- het effect op het ontlastingspatroon treedt sneller op dan het effect op de pijn en het opgeblazen gevoel
- gebruik linaclotide dagelijks, vermijd incidenteel gebruik
- neem linaclotide niet tegelijk in met middelen waarvan de opname in de darm, de bloedspiegel en de werkzaamheid worden beperkt door versnelde doorlooptijd in de darm (zoals bij antistolling, schildklierhormoon, orale anticonceptie).
Evalueer het resultaat na een korte behandeling en reserveer de onderhoudsbehandeling voor responders gezien de kosten van het middel. Dit kan door de patiënt te vragen het ontlastingspatroon en pijnpatroon bij te houden. Na 4-12 weken kan de effectiviteit met de patiënt geëvalueerd worden. Als er na 12 weken niet voldoende verandering is opgetreden in ontlastingspatroon en/of pijn, zou de behandeling moeten worden heroverwogen.
Is linaclotide (vergeleken met placebo) aan te bevelen bij therapieresistente PDS-C?
Achtergrond
De behandeling van PDS-C bestaat uit afzonderlijke behandelingen van de symptomen obstipatie en pijn. Dit heeft meestal slechts een matig effect. Linaclotide is een geneesmiddel dat wordt ingezet bij falen van de gebruikelijke, gering tot matig effectieve behandelingen van PDS-C. Er is behoefte om de effectiviteit van linaclotide bij PDS-C te evalueren en de plaats van het middel te bepalen in de behandeling van therapieresistente PDS-C, dat wil zeggen bij patiënten met langdurig bestaande klachten die niet of onvoldoende op de gebruikelijke middelen hebben gereageerd.
Clinical question
Is linaclotide (compared to placebo) recommended for patients with treatment-resistant IBS-C?
Search and select
A systematic review of the literature was performed to answer the following question:
|
Patients |
Patients with irritable bowel syndrome – constipation (IBS-C) who are therapy resistant |
|---|---|
|
Intervention |
Linaclotide |
|
Control |
Other treatment/regular treatment or placebo |
|
Outcomes |
|
Relevant outcome measures
The guideline development group considered all outcome measures as a critical outcome measure for decision making.
The working group defined the outcome measures as follows:
- Abdominal pain: measured by numeric rating scales.
- IBS symptom severity scale (IBS-SSS).
- Global improvement.
- Relief of symptoms: composite score, measured by i.e. numeric rating scale.
- Quality of life: measured with a general questionnaire, such as the SF 36, or disease-specific (IBS-QOL; clinically meaningful difference ≥ 14, Drossman 2007)
The working group defined 20% as a minimal clinically (patient) important difference for all of the outcome measures.
Search and select (Methods)
The databases [Medline (via OVID) and Embase (via Embase.com)]. were searched with relevant search terms from 2000 until 24-11-2020. The detailed search strategy is depicted under the tab Methods. The systematic literature search resulted in 226 hits. Studies were selected based on the following criteria as described in the PICO. Only systematic reviews and randomized controlled trials (RCTs) were included. Nineteen studies were initially selected based on title and abstract screening. After reading the full text, 15 studies were excluded (see PRISMA flowchart in Attachment 1; see the table with reasons for exclusion – Attachment 2), and four studies were included.
Results
One systematic review, describing three RCTs, and three other RCTs (published after the systematic review) were included in the analysis of the literature. Important study characteristics and results are summarized in the evidence tables (Attachment 3). The assessment of the risk of bias is summarized in the risk of bias tables (Attachment 4).
Summary of literature
Description of studies
- Atluri (2014) performed a systematic review on the effects of linaclotide in the treatment of IBS-C. Different databases were searched until April 2013. Only double-blind RCT’s with a ≥ 12 weeks duration were included. Patients had to be diagnosed according to the Rome II of Rome-III-criteria and had to fulfill the following criteria: having fewer than 3 spontaneous bowel movements (SBMs) per week and 1 or more of the following symptoms for at least 12 weeks in the 12 months preceding entry into the study: (1) straining during ≥ 25% of bowel movements (BMs); (2) lumpy or hard stools during ≥ 25% of BMs; or (3) sensation of incomplete evacuation during 25% of BMs. In addition, during the 2-week pretreatment baseline period, patients were required to report a mean score of ≥ 2.0 for the daily assessment of nonmenstrual abdominal pain or abdominal discomfort (i.e., at least mild on a 5-point scale ranging from 1 =none to 5 = very severe), as well as a mean of < 3 complete SBMs (CSBMs) and ≤ 6 SBMs per week. Three full articles and one conference abstract (combining the results of two RCTs) were included. The participants in these trials were predominantly female (≥ 90%) and mean age was 44 years. Cochrane risk of bias tool was used to evaluate the quality of the studies and showed a low risk of bias for each of the studies. We did not take into account the conference abstract. A short summary of the trials we take into account:
- Johnston (2010) randomized 420 patients with IBS-C (Rome II criteria). The trial had five arms with patients randomized to receive 75, 150, 300, or 600 µg of linaclotide or placebo. Study duration was 12 weeks. The endpoints studied were improvement in abdominal pain/discomfort, improvement in IBS-QOL, IBS-SSS, degree of relief from IBS symptoms. In the meta-analyses only the placebo group and 300 µg were included.
- Chey (2012) performed an RCT with 805 patients (90% female) with IBS (Rome II criteria). Patients received either daily 290 µg linaclotide or a placebo, for 26 weeks. Outcome measures were among others FDA endpoint and improvement in abdominal pain.
- Rao (2012) investigated the efficacy and safety of linaclotide compared to a placebo in 803 patients (91% female). Patients were followed for 12 weeks. Outcome measures were among others a composite score and abdominal pain (≥ 30% improvement was defined as a responder).
- Fukudo (2018a, Japan) conducted a double-blind RCT, followed by an open-label part. Participants with IBS-C (Rome-III) received either 500 µg linaclotide (n = 249) or a placebo (n = 251) for 12 weeks. Drop-out rates were equal between groups (11% in the linaclotide group and 13% in the placebo group). To be able to study the long term effects of the use of linaclotide, 160 patients of the placebo group received linaclotide after the first 12 weeks. Of the original linaclotide group, 164 patients continued with linaclotide. After 1 year follow-up, 275 patients completed the study.
- Fukudo (2018b) investigated different doses of linaclotide in a double-blind, phase II RCT. Patients with IBS-C were randomly assigned to 62,5, 125, 250, 500 µg linaclotide or a placebo for 12 weeks. A total of 559 patients was included. Drop-out rates varied between 11% in the placebo group to 22% in the study group that received 62,5 µg linaclotide. Baseline characteristics were comparable between groups, except abdominal pain. Primary outcome was responder rate of the global assessment of relief of IBS symptoms during 12 weeks. Patients with assessment of 1 or 2 for a weekly evaluation point were defined as weekly responders, and patients who were weekly responders for at least 6 of the 12 weeks were considered to be overall responders. For the meta-analyses, we only used data of the placebo group and 250 µg linaclotide group.
- Yang (2018) conducted an international, double-blind, placebo-controlled RCT, in 98 centers in China, USA, Canada, Australia and New Zealand. Adult patients were eligible if they met the Rome-III IBS criteria, subtype constipation. They received either 290 ug linaclotide, or a matching placebo capsule, for 12 weeks. A total of 839 participants were randomized. Study groups were equal at baseline, as well as drop-out rate between the groups (11,4% in placebo and 7,9% in the linaclotide group).
Results
Table shows the summary of findings for the various outcome measures. Below Table 20.2, more detailed information on the outcomes can be found. Forest plots can be found in the attachment 4.
Abdominal pain
Response to linaclotide (250-300 µg) on abdominal pain was measured in three studies. Pooled results showed a beneficial effect of linaclotide on abdominal pain, with a relative risk (RR) of 0.77 (95%CI 0.74, 0.83), meaning that less patients failed to achieve a meaningful improvement in the in the linaclotide group than in the placebo group (Figure 1 – Attachment 4). A dose of 500 µg also gave a beneficial effect of linaclotide on abdominal pain, with a RR of 0.83 (95%CI 0.77-0.91).
Global improvement
Atluri (2014) defined global relief response as a patient who responded as being ‘somewhat relieved’, ‘considerably relieved’, or ‘completely relieved’ for all 12 weeks or ‘considerably relieved’ or ‘completely relieved’ for at least six of the 12 weeks. Fukudo (2018a 2018b) used the following definition for response rate of the global relief of symptoms: patients with a score of 1 or 2 (on a 7-point scale) at each weekly evaluation point. Pooled analyses showed a smaller number of patients that failed to achieve global response in the linaclotide group (250-300 ug) compared to the placebo group (RR=0.76 (95%CI 0.69, 0.83) (Figure 2 – Attachment 4). A dose of 500 µg also gave a beneficial effect of linaclotide on global improvement, with a RR (RR=0.80, 95%CI 0.73-0.87).
IBS-SSS
The review of Atluri (2014) reported no data of the IBS-SSS. However, Johnston (2010) included this scale as one of the outcome measures. Patients treated with 300 µg linaclotide (mean endpoint IBS-SSS: 204) showed a greater reduction of the mean IBS-SSS than patients that received placebo (mean endpoint: 274, p < 0.001). Also the percentage of patients that showed a ≥ 50% reduction was higher in the linaclotide group (37%) than in de placebo group (20%, p < 0.05). Yang (2018) observed a significant change between the placebo and linaclotide group on a IBS symptom severity scale (5-point scale): mean change from baseline was -0,5 in the placebo group and -0,8 in the linaclotide group (p < 0,001). The percentage of patients with a ≥ 1-point change weekly for ≥ 6/12 weeks was 44,1% in the placebo group and 57,6% in the linaclotide group (p < 0.001).
Relief of symptoms
No studies reported a composite score on relief of symptoms.
Quality of life (IBS-QoL)
Three studies examined quality of life with the IBS-QoL. Higher scores indicate a better IBS specific quality of life.
- Johnston (2010) did not find a significant effect of linaclotide: mean score at the end of the study was 72,4 in the linaclotide group and 68,1 in the placebo group. Also the percentage of responders did not differ between groups (in both groups 37%).
- Fukudo (2018a) found a significant better overall score for the IBS-QoL for linaclotide compared with placebo after 4 weeks (p = 0.02), but after 12 weeks, the difference did not remain significant.
- Fukudo (2018b) did not find a significant improvement in QoL after 12 weeks of linaclotide compared to placebo (no data given).
Adverse events
- Atluri (2014) investigated how often diarrhea occurred as an adverse event (considered present when it was severe enough to necessitate stopping of trial drug). A higher number of patients on linaclotide experienced diarrhea necessitating trial discontinuation (RR 14.75; 95% CI 4.0–53.8) (Figure 3 – Attachment 4).
- Fukudo (2018a) reported 31,3% (8/249 patients) adverse events in the linaclotide group and 25,9% (65/251 patients) in placebo group. The incidence of diarrhea was 9,6% (24/249) in the linaclotide group and 0,4% (1/251) in de placebo.
- Fukudo (2018b) showed also a higher incidence of diarrhea in the linaclotide group (20/112 = 17,9%) than in the placebo group (3/113=2,7%). Total adverse events in linaclotide group: 46/112 (41,1%) and in placebo group (41/113=36,3%.
- Yang (2018) reported adverse events in 30% of the linaclotide group; in 9,4% of the cases it was diarrhea. In the placebo group 27% of the patients reported adverse events; 1,2% diarrhea.
Conclusions
- Linaclotide probably improves abdominal pain in patients with IBS-C (certainty of evidence: moderate).
- Linaclotide probably results in global improvement of IBS symptoms in patients with IBS-C. (certainty of evidence: moderate).
- Linaclotide has little or no difference on IBS specific quality of life (as measured with the IBS-QoL). (certainty of evidence: low).
- Linaclotide possibly results in a better IBS-symptom severity score in patients with IBS-C.
- Linaclotide causes more often adverse events, more specifically diarrhea than placebo(certainty of evidence: moderate).
Praktische toepassing
Naar Samenvatting ›- Dosering: 1 dd 1 capsule (290 microgram).
- Neem linaclotide ten minste een half uur voor een maaltijd (bij voorkeur het ontbijt) in.
- Informeer de patiënt over de mogelijke bijwerking (ernstige diarree) in met name de eerste week (> 10% van de patiënten). Andere veel voorkomende bijwerkingen zijn virale gastro-enteritis, buikpijn, winderigheid, opgezette buik en duizeligheid (1-10% van de patiënten).
- Het effect op het ontlastingspatroon treedt sneller op dan het effect op pijn en het opgeblazen gevoel.
- Wees voorzichtig bij gelijktijdig gebruik met protonpompremmers, laxeermiddelen of NSAID's vanwege meer kans op diarree.
- Bij ernstige of langdurige diarree kan tevens de resorptie en daarmee de werkzaamheid van andere geneesmiddelen afnemen (zoals levothyroxine of orale anticonceptiva). Zie hiervoor en voor mogelijke effecten op de vocht- en elektrolytenbalans de NHG-Standaard Acute diarree.
- Geef geen linaclotide bij zwangerschap.
- Incidenteel gebruik van linaclotide wordt niet aanbevolen.
- Evalueer het effect van behandeling met linaclotide na een korte behandelperiode (≥ 4 weken) alvorens het middel langdurig voor te schrijven. Vraag de patiënt om voor de evaluatie pijn en het ontlastingspatroon bij te houden. Heroverweeg de behandeling na 12 weken als niet voldoende verandering is opgetreden in ontlastingspatroon en/of pijn. Evalueer het effect (minimaal) jaarlijks.
Medicamenteus beleid bij PDS-D
Naar Samenvatting ›- Overweeg volumevergrotende laxantia, bijvoorbeeld psylliumzaad 1-3 sachets per dag.
- Overweeg als symptomatische behandeling loperamide capsules of tabletten 2 mg:
- onderhoudsdosering 2-12 mg per dag
- streef naar de laagst mogelijke effectieve dosering
Het enige antidiarreemiddel waarvan het effect bij PDS is onderzocht, is loperamide. Loperamide bindt aan opiaatreceptoren in de darmwand, vertraagt de darmmotiliteit, stimuleert de resorptie van water en ionen, en verhoogt de tonus van de inwendige anale sfincter.
In 4 placebogecontroleerde gerandomiseerde onderzoeken (1 cross-over, 3 parallel group design) bleek loperamide de defecatiefrequentie te verlagen en de consistentie van de feces te verbeteren.
In 3 van de 4 onderzoeken had loperamide ook een effect op de buikpijn van patiënten met PDS.
In deze onderzoeken werd bij de inclusie geen gebruik gemaakt van de Rome-criteria, maar de beschrijving van patiëntenpopulaties maakt waarschijnlijk dat zij voor het overgrote deel zouden hebben voldaan aan de Rome-III-criteria. De onderzoekspopulaties waren beperkt (10-34 patiënten).
In 1 onderzoek werd ook nagegaan of loperamide een gunstig effect had op de continentiebevorderende functies van het anorectum. Een dergelijk effect kon niet overtuigend aangetoond worden.
Medicamenteus beleid bij PDS met pijnklachten op de voorgrond
Naar Samenvatting ›Analgetica
Naar Samenvatting ›- Overweeg paracetamol wanneer de behoefte bestaat om pijnmedicatie te gebruiken.
- Volg de aanbevelingen voor het medicamenteuze beleid bij chronische pijn in de NHG-Standaard Pijn.
- NSAID’s en opioïden worden niet aanbevolen.
Pepermuntolie
Naar Samenvatting ›- Overweeg bij patiënten met PDS waarbij buikpijn op de voorgrond staat een (proef)behandeling met pepermuntolie in de vorm van maagsapresistente capsules.
- Pepermuntolie is vrij verkrijgbaar in verschillende toedieningsvormen.
- Adviseer maagsapresistente (MSR) capsules om de kans op irritatie van maag en slokdarm te verkleinen. De maagsapresistente coating vertraagt de afgifte tot het distale deel van de dunne darm bereikt is, de lokale werking zorgt ervoor dat het colon zich ontspant.
- Besteed aandacht aan het juiste gebruik om bijwerkingen zoveel mogelijk te voorkomen: innemen op de nuchtere maag, 30 min voor het eten met een groot glas koud water.
- Aanvangsdosis capsule MSR 182 mg 1-3 dd, zo nodig ophogen tot 2-6 capsules per dag.
- Evalueer na 8 weken het effect en eventuele bijwerkingen:
- staak de behandeling indien effect uitblijft
- overleg in geval van bijwerkingen met de patiënt of deze opwegen tegen de klachten
- Maagsapresistente pepermuntoliecapsules lijken een klein positief effect te hebben op het verminderen van buikpijn of algemene klachten, zonder dat er veel extra bijwerkingen genoemd worden. Maagsapresistente capsules verkleinen de kans op irritatie van maag (maagzuur) en slokdarm (refluxklachten), doordat de afgifte pas in het distale deel van de dunne darm plaatsvindt. De werkgroep ziet pepermuntoliecapsules dan ook als behandeloptie voor patiënten met PDS waarbij buikpijn op de voorgrond staat.
- Het belangrijkste bezwaar dat artsen kunnen hebben is dat het bewijs dat pepermuntolie werkt slechts gering is. Voor de patiënt kunnen de bijwerkingen, de kosten en de mogelijk minder dan verwachte werking bezwaren zijn. Zowel de bijwerkingen als de mindere werking kunnen te maken hebben met verkeerd gebruik (tijdstip, water).
Voor- en nadelen van de interventie
Pepermuntolie in maagsapresistente capsules lijkt een klein positief effect te hebben op algemene vermindering van klachten, zonder dat er veel extra bijwerkingen genoemd worden. Belangrijkste bijwerkingen zijn maagzuur en refluxklachten. Maagsapresistente capsules verkleinen de kans op irritatie van maag (maagzuur) en slokdarm (refluxklachten).
In een meta-analyse is pepermuntolie vergeleken met placebo, TCA’s en andere spasmolytica. Pepermuntolie leek het meest effect te hebben op algemene vermindering van klachten, maar het verschil was alleen significant ten opzichte van placebo, niet ten opzichte van de andere middelen.
Kwaliteit van bewijs
De kwaliteit van bewijs is laag, onder andere door het risico op bias. Er was weliswaar geblindeerd, maar blindering was mogelijk niet geheel succesvol omdat patiënten vanwege de smaak en geur van het supplement eenvoudig te weten konden komen welke behandeling ze kregen. Voor de uitkomstmaten IBS-SSS, kwaliteit van leven en verbetering van klachten is er veel minder bewijs (1 RCT), waardoor de conclusies minder betrouwbaar zijn. Alle onderzoeken waren van korte duur (2-12 weken), 1 onderzoek had een follow-up tot 6 maanden. De gebruikte doses lagen rond 180 mg per dag.
Waarden en voorkeuren van patiënten
Een deel van de patiënten zou wel dagelijks pepermuntolie willen innemen (en betalen) wanneer ze daardoor minder klachten hebben. Een ander deel wil dat niet in verband met de kosten (pepermuntoliecapsules worden niet vergoed) of omdat ze denken of ervaren hebben dat het bij hen (mogelijk) niet werkt.
Patiënten ervaren vaak bijwerkingen (oprispingen, pepermuntsmaak, maagzuur), maar die zijn meestal mild en verdwijnen snel als het middel gestopt wordt. De kans op bijwerkingen kan worden verkleind door de capsules op de juiste manier in te nemen: op de nuchtere maag, ongeveer 30 min voor het eten met een groot glas koud water.
In de praktijk blijken veel PDS-patiënten niet-maagsapresistente pepermuntoliecapsules te kopen. Daarom is het belangrijk de patiënt te wijzen op de juiste formulering (enteric coated of maagsapresistente capsules). De maagsapresistente coating vertraagt de afgifte tot het product het distale deel van de dunne darm bereikt en verkleint zo de kans op irritatie van maag (maagzuur) en slokdarm (refluxklachten).
Kosten
Pepermuntoliecapsules zijn makkelijk verkrijgbaar. De kosten zijn in 2022 ongeveer € 16 voor 60 capsules (gemiddelde hoeveelheid voor ongeveer 1 maand). Na ongeveer 2 maanden weet de patiënt of het middel werkt. Zo niet dan kan het eenvoudig worden gestopt. De kosten kunnen een belemmering zijn voor sommige patiënten.
Aanvaardbaarheid
Het is over het algemeen aanvaard dat men iets inneemt om minder klachten te hebben.
Haalbaarheid en implementatie
Maagsapresistente pepermuntoliecapsules zijn vrij verkrijgbaar bij drogist en apotheek, dus gemakkelijk te implementeren. Voor iedereen gelden dezelfde voorwaarden.
Is pepermuntolie aan te bevelen bij de behandeling van PDS?
Achtergrond
Pepermuntolie wordt momenteel beschouwd als een van de mogelijke behandelingen voor PDS. Pepermuntolie heeft een antispasmodisch effect op de gladde spiercellen en vermindert het schuimvolume in maag en darmen (zie Farmacotherapeutisch Kompas). Vanuit maagsapresistente capsules vindt de afgifte plaats in het distale deel van de dunne darm, waardoor het colon zich ontspant. Maagsapresistente pepermuntoliecapsules zijn in Nederland geregistreerd als kruidengeneesmiddel en zonder recept in apotheken en drogisten verkrijgbaar.
In deze module wordt de positie van pepermuntolie uitgezocht ten opzichte van placebo.
Clinical question
Is peppermint oil (compared to placebo) recommended for patients with IBS?
|
Patients |
Patients with irritable bowel syndrome (IBS) |
|---|---|
|
Intervention |
peppermint oil capsules |
|
Control |
placebo |
|
Outcomes |
|
|
Other critaria |
Study design: systematic reviews, RCT’s |
Search and select
The databases Medline (via OVID) and Embase (via Embase.com were searched with relevant search terms until 24 november 2020. The detailed search strategy is depicted under the tab Methods/ in the Annex (Totstandkoming). Studies were selected based on the following criteria as described in the PICO. Attachment 1 contains the PRISMA flowchart showing the number of hits, and Attachment 2 contains the reasons of exclusion.
Relevant outcome measures
The guideline development group considered all outcome measures as a critical outcome measures for decision making.
The working group defined 20% as a minimal clinically (patient) important difference for all outcome measures. That means a Standardized Mean Difference (SMD) > 0.50, OR or RR < 0.75 or > 1.25 and a change of (10-)20% of the total score om a questionnaire, except stated otherwise.
The working group defined the outcome measures as follows:
- IBS symptom severity scale (IBS-SSS). The working group defined 50 points (change of ≥ 10%) as a minimal clinically (patient) important difference (REF).
- Abdominal pain: measured by numeric rating scales. The working group defined 20% as a minimal clinically (patient) important difference.
- Global improvement
- Quality of life: measured with a general questionnaire, such as the SF 36, or disease-specific (IBS-QOL; clinically meaningful difference ≥ 14, Drossman 2007)
- Relief of symptoms
Results
One systematic review (describing 12 studies) and one RCT were included in the analysis of the literature. Important study characteristics and results are summarized in the evidence tables (Attachment 3). The assessment of the risk of bias is summarized in the risk of bias tables (Attachment 4).
Description of studies
- Alammar (2019) conducted a systematic review and meta-analysis to determine the effects of enteric-coated peppermint oil on abdominal pain and global symptoms in patients with irritable bowel syndrome (IBS), compared to placebo. The study was performed according to PRISMA guidelines. The databases MEDLINE (PubMed), Cochrane Central Register of Controlled Trials (Cochrane CENTRAL), ClinicalTrials.gov, EMBASE (Ovid), and Web of Science were searched from their inception to April 11 2018. Studies that met the following inclusion criteria were included: 1) randomized placebo-controlled trials comparing peppermint oil and placebo for irritable bowel syndrome with a minimum treatment duration of 2 weeks; 2) adult patients with irritable bowel syndrome as diagnosed using any of the following criteria for IBS: Manning, Rome I, II, III, IV diagnostic criteria. A total of 12 trials with 835 patients were included. The number of patients ranged from 18 to 178 per study. Most studies were parallel groups RCTs, and three studies had a cross-over design. Seven RCTs described the effect on global symptom improvement, six RCTs described abdominal pain, and eight studies described adverse effects. Follow-up durations in the studies ranged from 3 weeks to 12 weeks. There was significant variation among the included studies in the use of validated tools for the diagnosis of IBS.
- Weerts (2020) performed a RCT to compare the effects of small-intestinal-release peppermint oil and ileocolonic-release peppermint oil to placebo in patients with IBS. Patients aged 18 – 75 years, fulfilling the Rome-IV-criteria for IBS, and without alarm symptoms were eligible for the study. After the screening, eligible patients entered a 14-day pretreatment period during which they scored their daily worst abdominal pain in a digital symptom diary, using an 11-point numerical rating scale (NRS) from 0 (no pain) to 10 (worst possible pain). A total of 190 patients (mean age, 34.0 years; 77.8% female; 57.7% in primary care) who had a mean worst abdominal pain score of > 3 were randomized to receive 182 mg small-intestinal-release peppermint oil (n = 62), 182 mg ileocolonic-release peppermint oil (n = 64), or placebo (n = 64) for 8 weeks. Patients were instructed to self-administer 3 capsules per day, 30 minutes before breakfast, lunch, and dinner and to refrain from lifestyle changes through the study. During the 8-week treatment, patients had to complete daily questions on worst abdominal pain (scored on the 11-point NRS from 0 [no pain]. to 10, [worst possible pain]), and presence of adverse events. Relief of IBS symptoms (scored on a 7-point NRS from 1 [no relief]. to 7 [completely relieved]) and abdominal discomfort, abdominal bloating, abdominal cramping, belching, nausea, and urgency (all scored on an 11-point NRS from 0 [no symptoms]. to 10 [worst possible symptoms]) were assessed once weekly. In addition, at weeks 1, 2, 4, 6, and 8 and at months 3 and 6 of follow-up after the treatment period, patients were asked to complete the IBS Severity Scoring System (IBS-SSS), and Irritable Bowel Syndrome Quality of Life questionnaire. Patients, investigators, and health care providers were blinded to treatment allocation. More patients receiving peppermint oil versus placebo discontinued treatment because of adverse events: 3 in the small-intestinal–release peppermint oil group (4.8%) and 5 in the ileocolonic-release peppermint oil group (7.9%), compared with 1 in the placebo group (1.6%). The analyses were based on the intention-to-treat principle.
Table shows the summary of findings for the various outcome measures. Below Table 22.2, more detailed information on the outcomes can be found. Forest plots can be found in the Totstandkoming.
IBS-SSS (irritable bowel syndrome severity scoring system)
One study described the effects of peppermint oil on IBS severity using the IBS-SSS questionnaire. Weerts reported a corrected difference in change on the IBS-SSS total score from baseline to 8 weeks of -4,18 (95%CI -76.88 to -6.70) for small-intestinal-release peppermint oil compared to placebo. After 6 months follow-up, this difference in change was -8.86 (95%CI -42.03 to 24.31) on the IBS-SSS total score. The corrected difference in change on the IBS-SSS total score from baseline to 8 weeks for ileocolonic-release peppermint oil compared to placebo is -34.64 (95%CI -69.75 to 0.48). After 6 months follow-up, this difference in change was -0.02 (95%CI -33.27 to 33.23) on the IBS-SSS total score. These differences are not clinically relevant.
Abdominal pain
- Alammar (2019) reported a pooled effect from six RCTs for the effect of peppermint oil (n = 278) compared to placebo (n = 278) on improvement of abdominal pain. The pooled RR was 1.78 (95% CI 1.43 to 2.20), in favor of peppermint oil.
- Weerts (2020) reported that in the small-intestinal-release peppermint oil group, 29/62 patients (46.8%) had improvement of abdominal pain, compared to 22/64 patients (34.4%) in the placebo group. The RR is 1.36 (95%CI 0.88 to 2.09), in favor of the peppermint oil group.
In the ileocolonic-release peppermint oil group, 26/63 patients (41.3%) had improvement of abdominal pain, compared to compared to 22/64 patients (34.4%) in the placebo group. The RR is 1.20 (95%CI 0.77 to 1.88), in favor of the peppermint oil group.
The pooled RR of the seven RCTs was 1.63 (95%CI 1.54 to 1.96), in favor of peppermint oil (Figure 1 – Attachment 4).
Global improvement
- Alammar (2019) reported a pooled effect from seven RCTs for the effect of peppermint oil (n = 253) versus placebo (n = 254) on global improvement of IBS symptoms. The pooled RR was 2.39 (95%Ci 1.93 to 2.97), in favor of peppermint oil.
- Weerts (2020) described the effects on global relief of IBS symptoms using a 7-point NRS ranging from 1 (no relief) to 7 (completely relieved). Global relief was defined as a score of 6 or 7 in at least 4 out of 8 weeks. Weerts reported that, in the small-intestinal-release peppermint oil group, 6/62 patients (9.7%) had relief of symptoms, compared to 3/64 patients (4.7%) in the placebo group. The RR is 2.06 (95CI 0.54 to 7.89), in favor of the peppermint oil group.
In the ileocolonic-release peppermint oil group, 1/63 patients (1.6%) had relief of symptoms, compared to compared to 3/64 patients (4.7%) in the placebo group. The RR is 0.34 (95%CI 0.04 to 3.17), in favor of the placebo group.
The pooled RR of the eight RCTs was 2.35 (95%CI 1.90 to 2.91), in favor of peppermint oil (Figure 2 – Attachment 4).
Quality of life
Weerts (2020) used a questionnaire consisted of 34 items with a 5-point Likert-like scale from 1 (good) to 5 (worst quality of life). Weerts reported that all treatment groups showed improvements in quality of life over time. The corrected difference in change from baseline to 8 weeks between small-intestinal release peppermint oil and placebo was 2.56 (95%CI -0.17 to 5.29). For ileocolonic release peppermint oil, the corrected difference with placebo was 1.24 (95%CI -1.50; to 3.97). This difference is not clinically relevant.
Adequate relief /Relief of symptoms
One study described the effects of peppermint oil on relief of a variety of symptoms. Symptoms, including abdominal discomfort, abdominal bloating, abdominal cramping, belching, and urgency were scored on a 11-point NRS from 0 (no symptoms) to 10 (worst possible symptoms). No composite score was made.
Side effects
- Alammar (2019) reported a pooled results from a meta-analysis with eight RCTs on adverse events of peppermint oil (n = 344) versus placebo (n = 327). A total of 32 events occurred in patients who received peppermint oil, compared to 20 events in the placebo group. The pooled RR is 1.40 (95% CI 0.87 to 2.26), in favor of the placebo group (Figure 3). The adverse events included: heartburn, dry mouth, belching, peppermint taste, rash, dizziness, headache, and less frequent increased appetite.
- Weerts (2020) reported that in both peppermint oil groups, the total number of adverse event was higher compared to placebo. The mean (SE) number of adverse events was 4.26 (0.37) in the small-intestinal–release group, 4.54 (0.45) in the ileocolonic-release group, and 2.78 (0.34) in the placebo group. The most common adverse events included: heartburn, gastroesophageal reflux disease symptoms, belching (with and without a minty taste), and headache with small-intestinal–release peppermint oil and an altered anal sensation or sensitive urethra, headache, and abdominal cramps in ileocolonic-release peppermint oil.
Flatulence
None of the studies described the effects of peppermint oil on flatulence.
Conclusions
- Peppermint oil possibly results in little to no difference in IBS severity score in patients with IBS, compared to placebo (certainty of evidence: low). Sources: Weerts 2020
- Peppermint oil possibly results in improvement of abdominal pain in patients with IBS, compared to placebo (certainty of evidence: low). Sources: Alammar 2019; Weerts 2020
- Peppermint oil possibly result in global improvement of IBS symptoms in patients with IBS, compared to placebo (certainty of evidence: low). Sources: Alammar 2019; Weerts 2020
- Peppermint oil possibly result in little to no difference in quality of life in patients with IBS, compared to placebo (certainty of evidence: low). Sources: Weerts 2020
- Peppermint oil possibly result in little to no difference in abdominal discomfort in patients with IBS, compared to placebo (certainty of evidence: low). Sources: Weerts 2020
- Peppermint oil possibly results in a higher incidence of adverse events in patients with IBs, compared to placebo (certainty of evidence: low). Sources: Alammar 2019; Weerts 2020
Praktische toepassing
Naar Samenvatting ›- Pepermuntolie in verschillende toedieningsvormen is zonder recept (vrij) verkrijgbaar, maar adviseer de ‘enteric coated’ (maagsapresistente; MSR) capsules, om de kans op irritatie van de maag (maagzuur) en slokdarm (refluxklachten) te verkleinen. De maagsapresistente coating vertraagt de afgifte tot het product het distale deel van de dunne darm bereikt. De lokale werking zorgt ervoor dat het colon zich ontspant.
- Besteed aandacht aan het juiste gebruik van de capsules (innemen op de nuchtere maag, half uur voor het eten, met een groot glas koud water, om bijwerkingen zoveel mogelijk te voorkomen).
- De aanvangsdosis voor 182 mg MSR capsules is 1-3 dd, dit kan zo nodig worden opgehoogd tot 2-6 capsules per dag.
- Evalueer na 8 weken het effect en eventuele bijwerkingen. Staak de behandeling indien het geen effect heeft. In geval van bijwerkingen overleg met patiënt of deze opwegen tegen de klachten.
Parasympathicolytica
Naar Samenvatting ›Parasympathicolytica zoals mebeverine en scopolaminebutyl zijn niet bewezen werkzaam.
- De term ‘spasmolytica’ is verouderd en vervangen door de term ‘parasympathicolytica’. In een cochranereview zijn 29 onderzoeken (23.333 patiënten) met betrekking tot parasympathicolytica geïncludeerd.
Voor parasympathicolytica als groep (inclusief 10 farmacologische subgroepen: alverine, cimetropium/dicyclomine, mebeverine, otilonium, pepermuntolie, pinaverium, pirenzepine, propinox, scopolaminederivaten en trimebutine) werd ten opzichte van placebo een gunstig effect gevonden op:
- buikpijn: in de parasympathicolytica-arm verbeterde 58% versus 46% in de placeboarm (13 onderzoeken; 1392 patiënten; RR 1,32; 95%-BI 1,12 tot 1,55; p < 0,001; NNT = 7)
- globale beoordeling: in de parasympathicolytica-arm verbeterde 57% versus 39% in de placeboarm (22 onderzoeken; 1983 patiënten; RR 1,49; 95%-BI 1,25 tot 1,77; p < 0,0001; NNT = 5)
- symptoomscores: in de parasympathicolytica-arm verbeterde 37% versus 22% in de placeboarm (4 onderzoeken; 586 patiënten; RR 1,86; 95%-BI 1,26 tot 2,76; p < 0,01; NNT = 3); subgroepanalyses vonden significant betere resultaten voor cimetropium/dicyclomine, pepermuntolie, pinaverium en trimebutine
- er is geen bewijs voor de effectiviteit van mebeverine
- voor scopolamine verschillen de reviews ten aanzien van het bewijs; dit hangt samen met de keuze voor pooling van beschikbare onderzoeken (American College of Gastro-enterology: NNT = 4; 95%-BI 2 tot 25).
- Bijwerkingen zijn niet systematisch onderzocht. Gerapporteerd zijn droge mond, duizeligheid en wazig zien. De beschikbare onderzoeken rapporteren voor bijwerkingen van parasympathicolytica een RR van 1,62 en een NNH van 18 (95%-BI 7 tot 27).
- In een aanvullende search op 18 maart 2022 werden 2 onderzoeken gevonden die mebeverine met placebo vergeleken (in de eerste lijn). Beide onderzoeken. vonden geen effect van mebeverine op PDS-klachten.
- Door de vele subgroepen bij parasympathicolytica is pooling van onderzoeksresultaten riskant en is het lastig om tot een duidelijke aanbeveling te komen. Geen van de geïncludeerde onderzoeken scoorde methodologisch hoog en de meeste onderzochte middelen zijn in Nederland niet geregistreerd.
- Mebeverine is niet aantoonbaar effectief bij PDS en wordt daarom niet meer aanbevolen.
Antidepressiva
Naar Samenvatting ›- Antidepressiva kunnen zinvol zijn bij de behandeling van PDS vanwege hun invloed op de pijnperceptie (lichamelijke klachten) en op eventuele psychische comorbiditeit.
- Overweeg bij PDS een antidepressivum op proef offlabel voor te schrijven vanwege de veronderstelde werking als neuromodulator (zie tabel 29). Een van de hypothetische oorzaken van de ontwikkeling van PDS is een verstoorde darm-hersenas en antidepressiva beïnvloeden de neurotransmitter serotonine zowel in de hersenen als in de darmen.
- Op basis van onderzoek lijken TCA’s voor verlichting van PDS-klachten te kunnen zorgen, met name door de pijnmodulatie die de buikpijn vermindert. Het effect van SSRI’s op buikpijnklachten is onzeker.
- In de praktijk blijkt dat TCA’s vooral op de pijn inwerken en dat ook SSRI’s effect hebben bij PDS-klachten, en dan met name op algemene klachten die mede ontstaan zouden kunnen zijn door een onderliggende stemmingsstoornis. Deze stemmingsstoornis moet uiteraard (ook) behandeld worden; zie hiervoor de NHG-Standaard Depressie.
- Houd er wel rekening mee dat beide antidepressiva/neuromodulatoren voor bijwerkingen kunnen zorgen (TCA’s: onder andere obstipatie en/of tachycardie en bij SSRI’s: onder andere diarree en/of invloed op seksueel functioneren).
- Hoewel het bewijs voor effectiviteit van antidepressiva bij patiënten met PDS van lage kwaliteit is, besluit de werkgroep op basis van bovenstaande overwegingen dat een behandeling met antidepressiva kan worden overwogen bij patiënten met PDS. Het hangt van de klachten af welk middel het beste voorgeschreven kan worden:
- TCA’s werken ook anticholinerg (zorgen voor verstopping) en hebben dus de voorkeur bij PDS-D
- SSRI’s kunnen zorgen voor dunnere ontlasting en kunnen dus de voorkeur hebben bij PDS-C
- bij comorbide affectieve klachten verdient een SSRI de voorkeur
- Vanwege potentiële bijwerkingen en de kans op onnodig gebruik wordt geadviseerd deze behandeling eerst op proef te starten. Goede uitleg aan de patiënt over de lichamelijke werking is noodzakelijk. Bespreek de voordelen (vermindering klachten) en nadelen (bijwerkingen) met de patiënt. Daarnaast moet de term ‘antidepressivum’ wel besproken worden omdat de patiënt deze in de bijsluiter kan zien en dit mogelijk verwarring oplevert. Verwarring kan ook ontstaan wanneer de apotheker niet op de hoogte is van de indicatie (hoewel de dosering lager is dan wanneer het middel met depressie als indicatie wordt voorgeschreven).
Voor- en nadelen
Voordelen
Het gebruik van TCA’s of SSRI's bij PDS lijkt tot verlichting van PDS-klachten te kunnen zorgen. TCA's lijken ook voor minder buikpijn te kunnen zorgen.
Nadelen
Zowel TCA’s als SSRI’s zorgen voor bijwerkingen. De studieduur van de onderzoeken was maar 12 weken, dus langetermijnbijwerkingen zijn niet gevonden en op basis van dit bewijs kan er geen uitspraak gedaan worden over langetermijneffecten.
Er is onvoldoende bewijs dat SSRI’s effect hebben op buikpijnklachten. Er zijn geen onderzoeken gevonden die IBS-SSS, kwaliteit van leven en algemene verbetering als uitkomstmaat hadden.
Zie voor algemene informatie over bijwerkingen de NHG-Standaard Depressie.
Kwaliteit van bewijs
De kwaliteit van het bewijs in de onderzoeken met betrekking tot TCA’s was laag: er werd afgewaardeerd in verband met risico op bias door onvoldoende blindering en onvolledige data, naast kans op publicatiebias en onnauwkeurigheid door een laag aantal patiënten met bijwerkingen. De kwaliteit van het bewijs in de onderzoeken met betrekking tot SSRI’s was hoog en (zeer) laag: er werd bij (zeer) lage kwaliteit van bewijs afgewaardeerd in verband met risico op bias door onvolledige data, inconsistentie tussen de resultaten van de verschillende onderzoeken en onnauwkeurigheid (laag aantal patiënten).
Waarden en voorkeuren van patiënten
Veel patiënten willen wel medicatie slikken om klachten te voorkomen, maar het voorschrijven van antidepressiva kan hen het gevoel geven dat de arts denkt dat hun aandoening ‘tussen de oren zit’. Toch is het voorschrijven gebaseerd op andere fysiologische (onder andere anticholinerge) effecten van deze medicatie. Een duidelijke uitleg aan PDS-patiënten van de werking van de medicatie is dus belangrijk. Daar hoort in ieder geval uitleg bij over de werking van serotonine in de hersenen en de darmen, en over de invloed van deze medicatie op de serotoninehuishouding. Leg eventueel uit dat TCA’s in een lagere dosis dan gewoonlijk worden voorgeschreven en dat ze invloed hebben op processen in het lichaam. Daarnaast kan het helpen om antidepressiva ‘neuromodulatoren’ te noemen, omdat het woord ‘antidepressivum’ een negatieve connotatie kan hebben.
Kosten
Zie tabel 28.
|
Middel |
Dagdosering |
Kosten per maand (exclusief afleverkosten apotheek) |
|---|---|---|
|
TCA’s |
||
|
|
10 mg |
€ 1,80 |
|
25 mg |
€ 3,00 |
|
|
|
10 mg |
€ 0,90 |
|
12,5 mg (halve tablet van 25 mg) |
€ 0,90 |
|
|
|
25 mg |
€ 3,30 |
|
SSRI’s |
||
|
|
20 mg |
€ 1,20 |
|
|
20 mg |
€ 0,90 |
|
40 mg |
€ 0,90 |
|
|
Bron: www.medicijnkosten.nl (peildatum 28-07-2021) |
||
Aanvaardbaarheid
Het is algemeen aanvaard om medicatie in te nemen bij klachten. Toch zal het gebruik van antidepressiva bij darmklachten soms op weerstand kunnen stuiten. Het is daarom beter om naar deze medicatie te refereren met de term ‘neuromodulatoren’ en om de werking goed uit te leggen.
Haalbaarheid
Het is voor de meeste patiënten haalbaar om 1 × per dag medicatie in te nemen.
Ouderen zijn bijzonder gevoelig voor de cardiovasculaire, de anticholinerge en de hypotensieve bijwerkingen van TCA’s. Daarom wordt geadviseerd om bij deze groep te starten met een extra lage begindosis dan bij jongere volwassenen. Nortriptyline, een TCA met een relatief gunstig bijwerkingenprofiel (minder anticholinerge effecten en hypotensie), is het middel van voorkeur bij ouderen. Het effect en bijwerkingen van antidepressiva zijn bij huisartsen bekend door het gebruik bij andere eerstelijnsindicaties, zodat de huisarts een proefbehandeling met antidepressiva bij PDS goed kan begeleiden. Een mogelijke behandeling met antidepressiva in de tweede lijn kan hiermee mogelijk worden voorkomen.
- Is een tricyclisch antidepressivum (TCA) vergeleken met andere behandeling of placebo aan te bevelen bij patiënten met PDS?
- Is een selectieve serotonineheropnameremmer (SSRI) vergeleken met andere behandeling of placebo aan te bevelen bij patiënten met PDS?
Achtergrond
PDS is een complex ziektebeeld zonder eenduidige oorzaak. Naast voeding, darmmotiliteit en darmmicrobioom speelt mogelijk ook verhoogde klachtenperceptie een rol. Een verstoorde interactie tussen hersenen en darmen (darm-hersenas) ligt mogelijk ten grondslag aan het ontwikkelen van PDS. Er is bij PDS vaker dan gemiddeld sprake van een stemmingsstoornis (angststoornis of depressie). Antidepressiva kunnen zinvol zijn bij de behandeling van PDS, omdat ze invloed hebben op de pijnperceptie en eventuele psychische comorbiditeit. Omdat sommige antidepressiva ook een andere farmacologische (bijvoorbeeld anticholinerge) werking hebben, kan het gebruik wel leiden tot bijwerkingen. Daarom is het de moeite waard om uit te zoeken of antidepressiva (in dit verband te noemen: ‘neuromodulatoren’) aan te bevelen zijn bij PDS. Deze middelen hebben onder andere invloed op de neurotransmitter serotonine in zowel de hersenen als de darmen.
Clinical question
Are antidepressants (compared to another treatment or placebo) recommended for patients with IBS?
|
Patients |
Patients with IBS (primary and secondary care; all subgroups of IBS) |
|---|---|
|
Intervention |
Antidepressants (TCA, SSRI) |
|
Control |
Other treatment or placebo |
|
Outcomes |
|
|
Other selection criteria |
Study design: systematic reviews and RCT’s |
Methods (search)
The databases PubMed and Embase were searched with relevant search terms from 2009 until November 2020. The detailed search strategy is depicted in the Annex (Totstandkoming)/ under the tab Methods. Studies were selected based on the following criteria as described in the PICO. Attachment 1 contains the PRISMA flowchart showing the number of hits, and Attachment 2 contains the reasons of exclusion.
Relevant outcome measures
The working group defined 20% as a minimal clinically (patient) important difference for all outcome measures, next to a Standardized Mean Difference (SMD) > 0.50, OR or RR < 0.75 or > 1.25 and a change of (10-)20% of the total score om a questionnaire.
- Abdominal pain: present or not, a relative ratio is calculated.
- Global improvement: usually measured by asking patients if their symptoms were adequately controlled in the past 7 days. IBS-SSS and GI symptoms rating scale (GSRS) can be used also. 50 points (change of 10%) on the IBS-SSS is defined as a minimal clinically (patient) important difference.
- Quality of life: usually measured with a general questionnaire (SF 36) or disease-specific (IBS-QoL).
- Relief of symptoms: the review used no improvement of symptoms and calculated a relative ratio.
- Adverse events: present or not, a relative ratio was calculated.
Results
Three systematic reviews about prescribing antidepressants (TCA and SSRI) for IBS were selected. These reviews did include exactly the same RCTs with respect to TCAs and SSRIs. The review of Ford presented the data in the most useful way, and therefore we describe those results. There were no new RCTs about this topic published after the search date of the systematic review (July 2017). Important study characteristics and results are summarized in the evidence tables (Attachment 3). The assessment of the risk of bias is summarized in the risk of bias tables (Attachment 4).
Summary of literature
Description of studies
Ford (2019) included 11 RCTs about TCA, 6 about SSRI and 1 RCT about both antidepressants for IBS. In total, 1127 patients with IBS were included (mean age unknown; percentage women ranged from 42 to 100%; diagnose IBS was based on ROME I, II or III, sometimes in combination with clinical investigations). In most studies subtype of IBS was not stated: 1 study was about IBS-C, another study included patients with IBS-D, and in the remaining studies it was not clear, or all subtypes were included. Coexisting depression or anxiety was not reported. The studies were carried out in secondary (or tertiary) care in the USA, Canada, Australia, the Netherlands, Norway, Belgium, Germany, Iran and India. All RCTs did compare an antidepressant with placebo. Used TCA were: desipramine 150 mg (2 months, in another study 12 weeks), imipramine 25 mg (12 weeks), 50 mg (12 weeks) and 75 mg (10 weeks), trimipramine 50 mg (4 weeks, in another study 3 months), amitriptyline 10 mg (2 months) and 12,5 mg (12 weeks), nortriptyline 10 mg (2 months) or doxepin 50 mg (8 weeks) and 75 mg (6 weeks); used SSRI were: fluoxetine 20 mg (6 weeks, in another study 12 weeks), paroxetine 10-40 mg (12 weeks) and 12,5-50 mg (12 weeks), citalopram 20-40 mg (6 weeks, 8 weeks and 2 months). Outcome measures were: ‘no improvement in symptoms’, ‘abdominal pain’ and ‘adverse events’. Funding was not mentioned.
Studies with the outcome measures ‘IBS-symptom severity score’, ‘global improvement’ and ‘quality of life’ were not found.
Results (effect intervention / treatment)
See tables TCA compared to placebo in IBS and SSRI compared to placebo in IBS for summary of results.
- Ford calculated a NNT (Number Needed to Treat) for TCA of 4,5 (95% CI 3,5 – 7,0) and for SSRI of 5,0 (95% CI 3,0 – 16,5).
- Ford calculated a NNH (Number Needed to Harm) for TCA and SSRI together of 8,5 (95% CI 5,0 – 21).
Conclusions
- Use of TCA may more often result in improvement in IBS symptoms compared to placebo; this difference is clinically relevant (certainty of evidence: low)
- Use of TCA may better improve abdominal pain compared to placebo; this difference is clinically relevant (certainty of evidence: low)
- Use of TCA may increase occurrence of adverse events (sleepiness and dry mouth) compared to placebo; this difference is clinically relevant (certainty of evidence: low)
- Use of SSRI probably more often results in improvement in IBS symptoms compared to placebo; this difference is clinically relevant (certainty of evidence: moderate)
- We are uncertain whether the use of SSRI improves or worsen abdominal pain in IBS (certainty of evidence: very low)
- SSRI may have little or no difference on adverse events compared to placebo (certainty of evidence: low).
Praktische toepassing
Naar Samenvatting ›- Kies een middel op geleide van het bijwerkingenprofiel en houd rekening met contra-indicaties en onderstaande voorkeuren:
- bij pijn en/of PDS-D bij voorkeur een tricyclisch antidepressivum (TCA)
- bij comorbide affectieve klachten en/of angstklachten bij voorkeur een selectieve serotonineheropnameremmer (SSRI)
- Leg de werking uit en bespreek de voordelen (vermindering van PDS-klachten, TCA’s lijken ook voor minder buikpijn te kunnen zorgen) en de nadelen (langdurig gebruik, mogelijke bijwerkingen).
- Beoordeel na 4-6 weken het effect en hoog eventueel op bij geen of onvoldoende effect.
- Beoordeel na 12 weken nogmaals het effect:
- stop het antidepressivum bij geen of onvoldoende ervaren effect of bij bijwerkingen die niet opwegen tegen de ervaren effectiviteit
- bij ervaren effect: continueer de medicatie en bespreek na 6 maanden al dan niet stoppen
Algemene overwegingen
- Antidepressiva zijn niet geregistreerd voor de indicatie PDS, waardoor dit gebruik off-label is (zie NHG-Standpunt Offlabel voorschrijven in de huisartsenpraktijk).
- De behandeling dient in goed overleg met de patiënt te worden gestart nadat het proefondervindelijke karakter, de mogelijke bijwerkingen en de stopcriteria zijn besproken.
- Door duidelijke stopcriteria te formuleren wordt onnodig gebruik van antidepressiva voorkomen:
- stop als er na 12 weken geen effect is.
- bij goed effect kan de behandeling 6 maanden worden volgehouden
- heroverweeg of stop de medicatie na 6 maanden omdat het beloop kan fluctueren en onnodig chronisch gebruik moet worden voorkomen.
Voor TCA's
- De beschreven literatuur lijkt een groepseffect te beschrijven voor de TCA’s in effectiviteit bij patiënten met PDS waarbij pijn op de voorgrond staat.
- De startdosis wordt op basis van de hierboven beschreven onderzoeken gesteld op amitriptyline (10 mg) of imipramine (25 mg) of bij ouderen nortriptyline (10 mg).
- Verhoog de dosis zo nodig geleidelijk tot:
- amitriptyline maximaal 50 mg
- imipramine maximaal 50 mg
- (bij ouderen) nortriptyline maximaal 20 mg
- Start laag en verhoog alleen indien nodig met kleine stapjes. De beschreven doseringsverhoging is gebaseerd op ervaringen bij andere indicaties en op basis van klinische ervaring.
- Contra-indicaties voor TCA’s zijn recent hartinfarct, hartritmestoornissen, verlengde QT-tijd, ischemische hartziekte, ernstige leverfunctiestoornissen. (Kwetsbare) ouderen zijn extra gevoelig voor deze bijwerkingen, start hierom bij ouderen met een extra lage dosering.
- Bouw bij voorkeur na langdurig gebruik af.
Voor SSRI’s
- Het in dit detail beschreven effect op de verlichting van PDS-klachten is onderzocht voor fluoxetine, paroxetine en citalopram.
- De in de onderzoeken gebruikte doseringen zijn (in sommige gevallen) hoger dan de geadviseerde doseringen bij depressie of angst (zie NHG-Standaard Depressie en NHG-Standaard Angst). Gezien het proefondervindelijke karakter van de behandeling en de kans op bijwerkingen adviseert de werkgroep te starten met de laagst onderzochte dosering en niet hoger te doseren dan de aanbevolen dosering bij depressieve klachten.
- Escitalopram is niet onderzocht in de beschreven onderzoeken, maar is de actieve enantiomeer van citalopram..
- Paroxetine is wel onderzocht in de beschreven studies, maar verdient niet de voorkeur. Deze SSRI is lastiger af te bouwen dan andere SSRI’s en valt daardoor af als voorkeursmiddel,. hierbij sluiten we aan op de overwegingen in de standaard Depressie. Daarnaast verdient het de voorkeur om de huisarts ervaring op te laten doen met een beperkt aantal middelen.
- Start op basis van ervaring bij andere toepassingen met fluoxetine 10 mg, citalopram 10 mg of escitalopram 5 mg. Verhoog de dosering zo nodig tot maximaal 20 mg (escitalopram maximaal 10 mg).
- Kies bij ouderen bij voorkeur een SSRI met zo min mogelijk interacties en een milder bijwerkingenpatroon, zoals citalopram.
- Bepaal na 5-9 dagen na de start van een SSRI het natriumgehalte indien een diureticum wordt gebruikt. Herhaal deze controle bij dosisverhoging.
- Vervang bij hyponatriëmie zo mogelijk het SSRI door een TCA.
- Bepaal het natriumgehalte ook zonder gebruik van diuretica indien zich een intercurrente ziekte (diarree, braken) voordoet waarbij het risico op elektrolytstoornissen verhoogd is.
- Bouw SSRI’s af bij stoppen van gebruik, zie hiervoor het Multidisciplinair document afbouwen SSRI's en SNRI's. Fluoxetine hoeft, in tegenstelling tot de andere antidepressiva, niet te worden afgebouwd. Door de zeer lange eliminatiehalfwaardetijd daalt de plasmaconcentratie geleidelijk in de loop van weken tot maanden.
- Bij gebruik van SSRI’s bij jongvolwassenen van 18-25 jaar: zie NHG-Standaard Depressie voor informatie over suïcidaliteit en inschatting van het suïciderisico voorafgaand aan gebruik.
|
|
Startdosering |
Maximale dosering |
Interacties en contra-indicaties |
Bijwerkingen |
Bijzonderheden |
|---|---|---|---|---|---|
|
Tricyclische antidepressiva (TCA)* |
|||||
|
Amitriptyline |
1 dd 10 mg ’s avonds |
1 dd 50 mg ’s avonds |
Recent hartinfarct, hartritmestoornissen, verlengde QTc-tijd, ischemische hartziekte Ernstige leverfunctiestoornissen |
Zeer vaak (> 10%): anticholinerge bijwerkingen (droge mond, obstipatie, tachycardie, hartkloppingen, urineretentie, vooral bij ouderen verwardheid), orthostatische hypotensie, sufheid en sedatie Vaak (1-10%): cardiovasculaire afwijkingen (geleidingsstoornissen, verlengde QTc-tijd), verminderd libido, erectie- en mictiestoornissen |
PDS met pijn en/of diarree op de voorgrond. Start laag en verhoog alleen indien nodig met kleine stapjes Bouw bij voorkeur af na langdurig gebruik (6 maanden) |
|
Imipramine |
1 dd 25 mg ‘s avonds |
1 dd 50 mg ‘s avonds |
|||
|
Nortriptyline** (voorkeursmiddel voor ouderen) |
1 dd 10 mg
|
1 dd 20 mg
|
|||
|
Selectieve serotonineheropnameremmers (SSRI) |
|||||
|
Fluoxetine |
1 dd 10 mg |
1 dd 20 mg |
Niet combineren met tramadol, MAO-remmers (serotoninesyndroom) |
Misselijkheid, droge mond, hoofdpijn, slapeloosheid en slaperigheid, overmatig zweten: > 10% Diarree, braken, obstipatie, agitatie, seksuele stoornissen (erectiele disfunctie, orgasme- of ejaculatiestoornis, verminderd libido): 1-10% |
PDS met obstipatie en/of angstklachten op de voorgrond Bepaal indien een diureticum wordt gebruikt na 5-9 dagen na de start het natriumgehalte Herhaal de controle bij dosisverhoging Vervang het SSRI door een TCA bij hyponatriëmie Bij volumedepletie (braken of (toename) van diarree): bepaal het natriumgehalte (ook zonder gebruik van diuretica) Bouw bij voorkeur na langdurig gebruik af (fluoxetine kan in 1 keer gestopt worden) Zie de NHG-Standaard Depressie voor informatie over suïcidaliteit en inschatting van het suïciderisico voorafgaand aan gebruik |
|
Citalopram |
1 dd 10 mg* |
1 dd 20 mg |
|||
|
Escitalopram |
1 dd 5 mg |
1 dd 10 mg |
|||
|
* Let op: bij gebruik van citalopramdruppels lager doseren. Een dosering van 10 mg in tabletvorm is gelijk aan 8 mg van de druppelvloeistof. ** Bij slapeloosheid liever niet vóór de nacht laten innemen vanwege het stimulerende effect. |
|||||
Controles
Naar Samenvatting ›- Na afronding van de diagnostiek en het geven van uitleg en adviezen is er in principe geen medische noodzaak meer voor controles.
- Nodig de patiënt expliciet uit om wél een nieuwe afspraak te maken als er kenmerken (alarmsymptomen) optreden die een andere aandoening waarschijnlijker maken (zie Evaluatie).
- Maak, indien medicatie voorgeschreven is, controleafspraken om het gebruik daarvan te evalueren. Laat de frequentie afhangen van het gekozen middel.
- Bespreek de behoefte van de patiënt aan controleafspraken bij hardnekkige klachten met ernstige hinder, disfunctioneren en/of ongerustheid.
Consultatie en verwijzing
Naar Samenvatting ›Bespreek altijd het doel en de verwachtingen van de verwijzing met de patiënt.
Mdl-arts
Naar Samenvatting ›- Bij een afwijkende calprotectinebepaling:
- consulteer de mdl-arts bij een uitslag in het ‘grijze gebied’ (50-100 microgram/gram feces); overweeg op grond van anamnese en voorgeschiedenis een nieuwe calprotectinetest te doen en overleg of dit in eerste of tweede lijn gebeurt
- verwijs naar de mdl-arts bij een positieve uitslag (> 100 microgram/gram feces)
- Consulteer of verwijs:
- bij kenmerken (waaronder alarmsymptomen) die een andere aandoening waarschijnlijker maken (zie Evaluatie)
- indien er diagnostische onzekerheid (van arts of patiënt) bestaat
- bij een vastlopend behandeltraject of complexe achtergrond (bij voorkeur niet ter overname van de behandeling)
- Begeleiding van patiënten met PDS vindt bij voorkeur plaats buiten het ziekenhuis (bijvoorbeeld via anderhalvelijnszorg).
- Waar in deze standaard ‘mdl-arts’ wordt genoemd, kan ook ‘internist met specialisatie in de gastro-enterologie’ worden gelezen.
Diëtist
Naar Samenvatting ›- Verwijs laagdrempelig voor voedingsadvies:
- bij meerdere voedingsgerelateerde triggers
- bij een onevenwichtig voedingspatroon
- wanneer de patiënt in aanmerking zou kunnen komen voor het laag-FODMAP-dieet (zie factsheet Voedingsadvies bij PDS is maatwerk).
- Vermeld als verwijsreden bij voorkeur ‘Dieetbehandeling bij PDS’, zodat de diëtist een dieetbehandelplan-op-maat kan opstellen.
Verwijs naar een diëtist wanneer er sprake is van een onevenwichtig voedingspatroon, wanneer de patiënt ondersteuning wenst bij het systematisch onderzoeken van voedingstriggers en/of het veranderen van voedingsgedrag of bij behoefte aan het laag-FODMAP-dieet. Daarnaast zal de diëtist een adequate voedingsinname waarborgen. Zie het factsheet Voedingsadvies bij PDS is maatwerk voor wat de diëtist kan betekenen voor een patiënt met PDS.
Hoe vind ik een diëtist gespecialiseerd in PDS?
De meeste huisartsenpraktijken hebben al een korte lijn met een diëtistenpraktijk. De diëtist in het gezondheidscentrum, de huisartsenpraktijk of de afdeling diëtetiek van het regionale ziekenhuis beschikt over een regionale sociale kaart van diëtisten en de bijbehorende specialismen.
Praktische uitwerking met betrekking tot PICO van Voeding
Deze praktische uitwerking is grotendeels gebaseerd op klinische ervaring en expertise. Besteed ruim voldoende tijd aan educatie, geruststellen van de patiënt en aangeven van realistische verwachtingen ten aanzien van voedingsverandering.
- Bij PDS is er sprake van een verandering in de autonome (onbewuste) communicatie tussen hersenen en darmen. Hierdoor verandert onder andere darmbeweeglijkheid en kan obstipatie of diarree ontstaan. Ook neemt de pijngevoeligheid in de darm toe en kunnen er klachten ontstaan als misselijkheid, buikpijn en een opgeblazen gevoel. Stress, depressie of angst kunnen deze klachten verergeren.
- Voeding kan PDS-klachten veroorzaken of juist verminderen. Diverse voedingsmiddelen kunnen (tijdelijk) triggers zijn voor PDS-klachten. Welke voedingsmiddelen dat zijn, verschilt per persoon. Het streven naar een situatie waarbij voedingsinname geen enkele klacht uitlokt is onrealistisch aangezien PDS-klachten multifactorieel bepaald zijn (stress, stemming, hormonen, beweging, slaap, voeding, hypersensitiviteit darmwand, leefstijl). Daarnaast kunnen PDS-klachten fluctueren, net als aan voeding gerelateerde klachten. Van belang is daarom te blijven streven naar een zo gezond en volwaardig mogelijke voeding met voldoende voedingsvezels.
- Vezels spelen een belangrijke rol bij het verbeteren van het stoelgangvolume en de stoelgangfrequentie. Daarnaast komen bij het fermentatieproces van fermenteerbare vezels korteketenvetzuren vrij zoals boterzuur, die een belangrijke voedingsbron vormen voor ons darmslijmvlies. De anti-inflammatoire effecten van vezels, en de effecten op de serotonineaanmaak in de darm, de darmbarrièrefunctie en het immuunsysteem, komen het ziektebeeld PDS ten gunste.
- De kunst is om een balans te bereiken tussen een zo volwaardig en gevarieerd mogelijk eetpatroon met zo min mogelijk klachten enerzijds, en (tijdelijke) vermindering of eliminatie van alleen die voedingsmiddelen die daadwerkelijk PDS-klachten triggeren anderzijds. Het uiteindelijke doel is dat de patiënt met deze chronische aandoening zelfredzaam wordt.
Gezonde voeding
- Adviseer als uitgangspunt de Richtlijnen goede voeding 2015 van de Gezondheidsraad.
- Onderzoek hierbij zo nodig eerst anamnestisch en vervolgens middels eliminatie-provocatie of er duidelijke voedingsgerelateerde triggers zijn voor PDS-klachten (gasvormers, lactose, frisdrank, overmatig vet, pittige kruiden, cafeïne, alcohol, sorbitol, kunstmatige zoetstoffen, (overmatig) tarwezemelen). Verminder of elimineer zo nodig alleen (tijdelijk) het gebruik van deze voedingsmiddelen.
- Gebruik regelmatige maaltijden, in ieder geval 3 hoofdmaaltijden en eventueel iets tussendoor, eet zittend en rustig, kauw voldoende lang, sla geen maaltijden over.
- Probeer, wanneer er sprake is van een lage voedingsvezelinname, de vezelinname in stappen van ca. 5 g op te hogen tot aan de tolerantiegrens van de PDS-klachten of tot aan de richtlijnen van de Gezondheidsraad (30-40 g per dag). Patiënten met PDS kunnen gevoeliger reageren op voedingsvezelinname. Het is onvoldoende duidelijk of de richtlijnen van de Gezondheidsraad voor vezelinname kunnen worden gehaald.
- Adviseer voldoende te drinken.
- Waarborg een adequate, volwaardige voeding.
- Geef daarnaast advies over een gezonde leefstijl, ontspanning en een juiste toilethouding.
Leefstijladviezen
- Adviseer voldoende bewegen volgens de Beweegrichtlijnen 2017 van de Gezondheidsraad voor volwassenen en ouderen:
- ≥ 150 minuten per week matige of intensieve inspanning (wandelen, fietsen, tuinieren, zwemmen, voetballen, hardlopen), verspreid over diverse dagen
- daarbij ≥ 2 × per week spier- en botversterkende activiteiten, eventueel in combinatie met balansoefeningen
- voorkom veel stilzitten
- Vermijd stress en ontspan voldoende. Er zijn diverse manieren om stress te reguleren: ontspanningsoefeningen, mindfulness, yoga of meditatie, creatieve bezigheden, maar ook bewegen. Bewegen kan helpen om de gedachten te verzetten en het lichaam te ontspannen.
- Zorg voor voldoende nachtrust.
- Neem een goede houding aan op het toilet. Ga iets voorover gebogen zitten met een krukje onder de voeten, zodat de knieën iets omhoog komen. De darm kan zich op die manier het beste legen. Ga direct naar het toilet zodra u aandrang voelt. Probeer elke dag op hetzelfde tijdstip naar het toilet te gaan.
- Drink geen alcohol of in ieder geval niet > 1 glas per dag (zie Alcohol - Achtergronddocument bij Richtlijnen goede voeding 2015).
- Niet roken of stop met roken.
Psylliumvezel
Overweeg het gebruik van psylliumvezels wanneer bovenstaande adviezen onvoldoende verbetering geven of wanneer de voeding te weinig vezels bevat.
- Dosering 1-3 sachets per dag (1 sachet bevat 3,25-3,66 g vezel); psylliumzaad of psyllium husk (vliesjes van psylliumzaad) zijn ook verkrijgbaar in de reformwinkel.
- Adviseer psylliumvezels zonder hulpstoffen (sorbitol, inuline, aspartaam).
- Adviseer om psylliumvezels met veel vocht in te nemen wanneer de patiënt last heeft van obstipatie, en met weinig vocht wanneer de patiënt diarreeklachten heeft.
- Adviseer de vezels te mengen met water, vruchtensap of melk en direct op te drinken. Mengen kan ook met yoghurt, vla of havermout vanwege de smaak en de beperkte wateroplosbaarheid.
Laag-FODMAP-dieet
- Overweeg het dieet maatwerkgericht in te zetten volgens een bottom-up-aanpak alvorens over te gaan tot het ‘klassieke’ laag-FODMAP-dieet. Breng hiervoor de patiënt goed in kaart:
- hoeveel en welke FODMAP’s gebruikt de patiënt?
- welke FODMAP’s zou de patiënt weg willen laten? (voedselvoorkeuren)
- is er sprake van lactose-intolerantie? (houd rekening met etniciteit)
- ernst van de voedingsgerelateerde klachten (invloed op kwaliteit van leven)
- is er sprake van angst voor voedingsgerelateerde klachten?
- sociale anamnese, motivatie, leefstijl
- haalbaarheid en sociale inpasbaarheid (kookvaardigheden)
- Maak op basis hiervan samen met de patiënt een keuze om eerst een select aantal FODMAP’s te beperken of te elimineren, en de symptoomrespons af te wachten alvorens het dieet verder te intensiveren (bottom-up).
- Overweeg, aangezien er vooralsnog onvoldoende onderzoek gedaan is naar de herintroductie van FODMAP’s, ook in deze fase van het dieet maatwerk:
- welk voedselvoorkeuren heeft de patiënt
- welk voedingsmiddel is voor de patiënt van belang om (als eerste) te herintroduceren?
- overweeg afhankelijk van de ernst van de klachten en eventuele angst voor de voedingsgerelateerde klachten om FODMAP’s sneller te herintroduceren
- vraag de patiënt (ja/nee-antwoord) of deze meteen de volledige testdosering wil in plaats van te beginnen met een kleine dosis en deze in 3 dagen langzaam te verhogen.
Glutenvrij dieet
Een glutenvrij dieet wordt niet aanbevolen. Wanneer de patiënt zelf een expliciete hulpvraag heeft om glutensensitiviteit als trigger te onderzoeken, volg dan het volgende stappenplan:
- probeer graanproducten met minder fructanen (bijvoorbeeld speltbrood)
- richt het eliminatiebeleid op symptoomreductie door gluten (tijdelijk) te verminderen op geleide van de klachten (bottom up-aanpak)
- herintroduceer gluten wanneer het PDS in remissie is
Psychologische therapie
Naar Samenvatting ›- Bespreek de voordelen (mogelijk effect) en nadelen (kosten, tijdsinvestering) met de patiënt.
- Verwijs naar een voor de betreffende therapie gekwalificeerde gz-psycholoog, klinisch psycholoog, psychotherapeut of hypnotherapeut met kennis over en ervaring met PDS.
- Zie verder Psychologische behandeling.
Bedrijfsarts
Naar Samenvatting ›Adviseer contact op te nemen met de bedrijfsarts wanneer de patiënt bij of door het werk hinder van de PDS-klachten ondervindt (bijvoorbeeld frequent verzuim, verergering van klachten door stress vanuit het werk, omgaan met klachten tijdens het werk)
Organisatie van de zorg
Naar Samenvatting ›Uitgangspunt in de organisatie van de zorg is dat PDS-patiënten zoveel mogelijk in de eerste lijn (huisarts, diëtist, psycholoog) worden begeleid.
Uitgangspunt is dat de PDS zoveel mogelijk in de eerste lijn wordt begeleid. Verwijzing is alleen noodzakelijk bij twijfel over de diagnose, vastlopend behandeltraject in de eerste lijn of bij complexe achtergrond), maar dan bij voorkeur consultatief, en niet ter overname van de behandeling en liefst buiten het ziekenhuis, bijvoorbeeld via anderhalvelijnszorg.
Voorbeeld organisatie van zorg: de Stadspoli in Maastricht
Anderhalvelijnszorg is een intensieve samenwerking van huisartsen en medisch specialisten in speciale centra, buiten de muren van het ziekenhuis. Zoals bijvoorbeeld in de Stadspoli van Maastricht. Hier zien medisch specialisten van het Maastricht UMC+ de patiënt en geven een behandeladvies aan de huisarts, die de regie houdt. Anderhalvelijnszorg is gericht op het voorkómen van onnodige verwijzingen vanuit de eerstelijns huisartsenzorg naar de tweede lijns specialistische ziekenhuiszorg.
Concreet houdt dit in dat een mdl-arts spreekuur doet op een zorglocatie buiten het ziekenhuis, te weten de Stadspoli. Huisartsen verwijzen de patiënt naar de Stadspoli waarbij de wachttijd doorgaans vrij kort is (ongeveer 2 weken) en de zorgvraag meestal met een eenmalig consult beantwoord kan worden. Er wordt gebruik gemaakt van dezelfde elektronische patientendossier als in het MUMC+ dus dat maakt de eventuele overgang naar de tweede lijn ook makkelijker.
De patiënt hoeft het eigen risico niet aan te spreken, behoudens de kosten voor medicatie of aanvullend onderzoek. Inhoudelijk betreft het hier vooral patiënten met functionele buikklachten zoals PDS. Voor de huisartsen zijn er ook duidelijke kaders geschetst voor verwijzing: patiënten met alarmsymptomen (rectaal bloedverlies, gewichtsverlies) of levertestafwijkingen, dienen meteen naar de tweede lijn verwezen te worden.
Het initiatief voor de Stadspoli werd genomen door de minister van VWS die in 2013 9 regio's benoemde tot ‘Proeftuinen Betere zorg met minder kosten'. Eén daarvan was voorzien in de regio Maastricht-Heuvelland: Blauwe Zorg. De kaders voor de Stadspoli werden ontworpen in samenwerking tussen zorgverzekeraar VGZ, de zorggroep Zorg in Ontwikkeling (ZIO), een koepelorganisatie voor de regionale eerstelijnszorg, Maastricht UMC+ en patiëntenorganisatie Burgerkracht Limburg. De kosten van het consult op de Stadspoli worden gedeclareerd bij de zorgverzekeraar als eerstelijns ‘meekijkconsult’ door ZIO. De vakgroep MDL van Maastricht UMC+ krijgt een vergoeding voor haar inzet op de Stadspoli.
Hoewel er nog nader onderzoek verricht dient te worden om aan te tonen dat een dergelijke manier van zorgorganisatie bij PDS-patiënten daadwerkelijk tot betere behandeluitkomsten en/of minder zorgkosten leidt, zijn alle betrokken partijen positief over de Stadspoli en wordt deze samenwerking, mede dankzij de eerdere financiële afspraken, verder voortgezet.
Voor- en nadelen van de interventie
De hierboven beschreven zorgmodellen zijn onderzocht in andere zorgstelsels dan het Nederlandse. De zorg voor PDS-patiënten in Nederland vindt primair plaats in de eerste lijn. In de Nederlandse situatie is het daarom van groot belang dat er duidelijke afspraken worden gemaakt tussen de huisarts en andere betrokken zorgverleners over de behandeling van PDS in de zorgketen. Die afspraken kunnen worden vastgelegd in een zorgpad of in een regionale transmurale afspraak. Binnen de eerstelijnszorg kan dat gaan om samenwerkingsafspraken tussen de huisarts en diëtist, eerstelijnspsycholoog of hypnotherapeut over PDS-behandeling. Ook de bedrijfsarts kan betrokken worden als de klachten invloed hebben op werk, er sprake is van (frequent) verzuim, stress van werk waardoor klachten verergeren of als er sprake is van klachten waar lastig mee kan worden omgegaan tijdens het werk.
De specialistische zorg aan PDS-patiënten kan binnen dat zorgpad op verschillende manieren worden aangeboden; bijvoorbeeld door de individuele mdl-arts, of multidisciplinair via een ‘zorgteam functionele buikklachten’ in het ziekenhuis, vaak gecoördineerd door een mdl-verpleegkundige.
Er zijn diverse ziekenhuizen in Nederland die multidisciplinaire PDS-zorg aanbieden en waar patiënten besproken worden in het multidisciplinair overleg gericht op functionele MDL-aandoeningen. Deze ziekenhuizen werken samen in een landelijk netwerk, waar patiënten met moeilijk te behandelen klachten door zowel huisarts als mdl-arts naar toe verwezen kunnen worden voor verdere uitleg, bespreking en uitvoering van behandeling en begeleiding.
In het kader van gedeelde PDS-zorg zijn er op veel plaatsen regionale initiatieven ontstaan waarbij samenwerking tussen huisarts en mdl-arts op een andere wijze wordt ingericht. Dat gaat vaak in de vorm van zogenaamde anderhalvelijnszorg. Hierbij wordt zorg die door een medisch specialist wordt verleend verplaatst van het ziekenhuis naar huisartsenpraktijk of gezondheidscentrum. Er zijn diverse manieren waarop deze zorg kan worden ingericht:
- de medisch specialist verricht een eenmalig consult in de eerste lijn en stelt daarna een advies op voor de huisarts, die de patiënt (met PDS) verder opvolgt
- teleconsultatie, waarbij huisartsen laagdrempelig een mdl-arts kunnen consulteren over een PDS-patiënt. Op basis van patiëntengegevens die worden uitgewisseld kan de mdl-arts een advies formuleren
- meekijkconsult of gezamenlijk consult, waarbij de mdl-arts en huisarts(en) samen het consult doen, eventueel via een videoverbinding.
Hoewel een aantal van deze initiatieven goed is gedocumenteerd, is er (nog) geen wetenschappelijk onderzoek verricht naar de effectiviteit ervan in de Nederlandse situatie. Een evaluatie van anderhalvelijnszorg in verschillende ‘proeftuinen’ door Maastricht UMC+ laat zien dat patiënten en zorgverleners tevreden zijn over deze aanpak, dat de verbetering in ervaren gezondheid gelijk is aan die in reguliere zorg en dat er geen nadelige gevolgen zijn.
Bij alle vormen van gedeelde zorg is het belangrijk dat de huisarts samen met de patiënt het verdere beleid bespreekt op grond van contact met de mdl-arts.
Landelijke ontwikkelingen zoals gepaste en doelmatige zorg en taakherschikking krijgen aandacht en verdienen ruimere toepassing binnen de PDS-zorg. Diverse initiatieven en projecten zijn gestart in regionaal of lokaal verband. Het is van belang dat deze projecten wetenschappelijk worden geëvalueerd op (kosten)effectiviteit, kwaliteit van zorg en duurzaamheid.
Wat betreft taakherschikking wordt de PDS-zorg in de tweede lijn in toenemende mate mede verleend door mdl-verpleegkundigen en verpleegkundig specialisten wat betreft intakes, behandeling, begeleiding en als contactpersoon en coördinator van multidisciplinair overleg. Dat gebeurt onder supervisie van een mdl-arts. Een dergelijke constructie kan in de toekomst ook in de eerste of anderhalve lijn worden georganiseerd.
Bepaalde behandelingen kunnen worden begeleid door andere (para)medici, waar het gaat om complexere diëten of psychologische behandelingen zoals cognitieve gedragstherapie of hypnotherapie. Zie hiervoor Voeding, Psychologische behandelingen en de verwijscriteria onder Consultatie en verwijzing.
Waarden en voorkeuren van patiënten
Zoals in elk arts-patiëntcontact is het ook bij PDS van groot belang om goede voorlichting en advies te geven die aansluit bij wensen en voorkeuren van patiënten. In Nederlands onderzoek noemen PDS-patiënten de volgende onderwerpen als belangrijk: open communicatie met hun behandelaar(s), breed toegankelijke informatie en – indien nodig – toegang tot een multidisciplinair behandelteam en PDS-expertisecentra. Bovendien onderstrepen patiënten het belang van wetenschappelijk onderzoek over PDS.
Uit ervaringen van PDS-patiënten (via de patiëntenorganisatie PDSB) blijkt dat patiënten regelmatig uit ongerustheid of onbegrip om een verwijzing naar de tweede lijn vragen. Patiënten zijn dan bang dat ze een andere aandoening hebben of zijn in de veronderstelling dat de huisarts niet voldoende kennis en ervaring heeft om de diagnose PDS te kunnen stellen. Gedeelde zorg, waarbij de huisarts met een mdl-arts overlegt over de patiënt, zorgt ervoor dat de patiënt zich meer serieus voelt genomen. Voor de patiënten is goede uitleg waarom een verwijzing niet nodig is belangrijk. Uit wetenschappelijk onderzoek komt naar voren dat PDS-patiënten behoefte hebben aan meer informatie over PDS, met name wat betreft oorzaken, ziektebeloop, diagnostiek, behandelmogelijkheden, voeding, psychische factoren en manieren om beter met de aandoening te leren omgaan. Gegevens over voorlichting aan PDS-patiënten zijn verder uitgewerkt in submodule 2.
Kosten
Zorg in het ziekenhuis is momenteel duurder dan eerstelijnszorg. Gedeelde zorg tussen eerste en tweede lijn kan bijdragen aan lagere kosten omdat er minder patiënten naar het ziekenhuis worden verwezen en anderhalvelijnszorg een goedkoper alternatief is. Uit de evaluatie door het Maastricht UMC+ blijkt dat de gemiddelde zorgkosten van patiënten verwezen naar de anderhalvelijnszorg significant lager liggen dan zorgkosten van patiënten die rechtstreeks verwezen zijn naar het ziekenhuis. Of dit ook betekent dat anderhalvelijnszorg ook daadwerkelijk kostenbesparend is op de langere termijn en of dit meer specifiek ook geldt voor PDS-zorg, is onbekend. Er is in 2022 nog geen structurele financiering voor anderhalvelijns PDS-zorg.
Aanvaardbaarheid en haalbaarheid
Diagnostiek, begeleiding en behandeling van PDS-patiënten vindt grotendeels al in de eerste lijn plaats. Als dat niet het gewenste effect heeft, kan de PDS-patiënt voor advies verwezen worden naar de tweede lijn. De bovengenoemde initiatieven voor anderhalvelijns zorg vormen daar mogelijk een goed alternatief voor, vanuit het perspectief van doelmatigheid en passende zorg. Meer wetenschappelijk onderzoek is nodig om vast te stellen of anderhalvelijnszorg werkelijk tot substitutie van zorg leidt.
Uit de evaluatie van het Maastricht UMC+ over anderhalvelijnszorg blijkt dat zowel huisartsen als specialisten aangeven dat er nog verbetering kan plaatsvinden op het gebied van communicatie, samenwerking en kennis delen tussen huisartsen en specialisten. Het was bijvoorbeeld niet voor alle huisartsen duidelijk welke patiënten terecht kunnen bij de anderhalvelijnscentra en beide partijen hadden gehoopt meer te leren van elkaars expertise.
Uitgangsvragen
- Hoe ziet gedeelde zorg eruit bij patiënten met het PDS?
- Welke voorlichting kan worden gegeven aan patiënten?
Achtergrond
De diagnostiek van PDS is gestoeld op de anamnese, met lichamelijk onderzoek en eventueel beperkt aanvullend onderzoek. Diagnostiek en behandeling vinden in principe plaats in de eerste lijn. Alleen bij specifieke indicaties (twijfel over de diagnose of onvoldoende effect van behandeling) wordt een patiënt ter consultatie verwezen naar de tweede lijn (en daarna met advies in principe weer terugverwezen). PDS-zorg moet kwalitatief goede en doelmatige zorg zijn. Huisartsen, mdl-artsen en internisten met ervaring in de gastro-enterologie zijn bevoegd en bekwaam om PDS te behandelen en hun kennis is complementair bij PDS. Daarom wordt steeds meer toegewerkt naar ‘gedeelde zorg’ tussen huisarts en mdl-arts en naar samenwerking met niet-medische disciplines zoals diëtist en psycholoog (zie submodule 1).
PDS is een symptoomgebaseerde diagnose zonder zichtbare anatomische afwijkingen en met meerdere pathofysiologische verklaringen. Patiënt en arts kunnen verschillende verwachtingen of ideeën hebben over de ziekte en de onderliggende verklaringen. In de klinische praktijk kan dit een belemmering zijn die de diagnosestelling, communicatie en begeleiding bemoeilijkt. Ook blijkt er vaak miscommunicatie te zijn tussen wat de patiënt denkt dat de oorzaak van de klachten is en hoe de arts dat ziet (zie submodule 2).
Om deze redenen is het van groot belang dat PDS-zorg wordt geboden in een zorgcontinuüm, waarin de betrokken zorgprofessionals dezelfde uitgangsprincipes ten aanzien van de aandoening en het beleid hebben, er goede onderlinge communicatie bestaat en er duidelijke samenwerkingsafspraken zijn gemaakt over ieders bijdrage in het zorgtraject. Dit shared care-principe kan op verschillende manieren worden ingevuld. Daarom hebben we in de wetenschappelijke literatuur gekeken naar bewijs van effectiviteit van de verschillende samenwerkingsvormen in de PDS-zorg.
Zoeken en selecteren
Voor de subvraag over gedeelde zorg is een systematische search verricht. Er werd gezocht naar modellen voor gedeelde zorg bij PDS (shared care, integrated delivery of health care, health care coalitions, extramural, multidisciplinary or interdisciplinary care or model). Van de 228 gevonden artikelen zijn 9 artikelen geïncludeerd die modellen voor gedeelde zorg beschreven.
Voor de subvraag over patiëntenvoorlichting is geen systematisch literatuuronderzoek verricht. De aanbevelingen zijn gebaseerd op de beschreven overwegingen. Deze overwegingen zijn opgesteld door de werkgroepleden op basis van kennis uit de praktijk en waar mogelijk onderbouwd door niet-systematisch literatuuronderzoek.
Gedeelde zorg
In het Nederlandse zorgstelsel presenteert de patiënt zich in eerste instantie bij de huisarts. De huisarts is primair degene die de diagnosestelling, behandeling en begeleiding van de patiënt uitvoert. Alleen op indicatie (diagnostische twijfel, vastlopend behandeltraject, complexe achtergrond) volgt verwijzing voor kortdurende specialistische consultatie (dus in principe geen overname van behandeling). Laagdrempelig contact van huisarts met de tweede lijn is nodig wanneer er twijfel is over de diagnose of bij ernstige PDS-klachten wanneer eerstelijnsbehandelingen niet het gewenste effect hebben.
De hieronder beschreven zorgmodellen over gedeelde zorg bij PDS zijn onderzocht in zorgstelsels die duidelijk verschillen van de Nederlandse situatie, waarbij de huisarts, anders dan in Nederland, geen poortwachtersfunctie heeft.
In de literatuur worden 3 verschillende zorgmodellen voor functionele maag-darmaandoeningen (FGID) en PDS beschreven, waarbij altijd een mdl-arts is betrokken:
- zorg door mdl-arts
- niet-geïntegreerde multidisciplinaire zorg: mdl-arts plus ≥ 1 disciplines
- geïntegreerde multidisciplinaire zorg: mdl-arts plus ≥ 1 disciplines
In figuur 2 worden de modellen als opeenvolgend weergegeven.
In het traditionele monodisciplinaire zorgmodel wordt de patiënt door de huisarts verwezen naar de mdl-arts, en deze is de enige die PDS-zorg verleent. Basnayake (2020) noemt in zijn review dat onderzoek liet zien dat een minderheid van de patiënten verbetering rapporteerde en dat een meerderheid van de patiënten in het onderzoek (die alleen zorg van een mdl-arts kregen) het gevoel had dat hun klachten hetzelfde waren of dat er verslechtering was.
In het multidisciplinaire zorgmodel verlenen naast de mdl-arts ook andere individuele zorgverleners een deel van de PDS-zorg. Bijvoorbeeld psychologische therapie door een psycholoog of onafhankelijke diagnostiek en management door een verpleegkundige. De effecten van deze gecombineerde zorg lijken iets beter dan in het monodisciplinaire model: een deel van de patiënten geeft aan dat hun klachten verminderd zijn en er zijn minder medische procedures nodig wanneer naast de gebruikelijke zorg een andere vorm van zorg gegeven wordt, zoals cognitieve gedragstherapie of hypnotherapie (de review beschrijft geen getallen). Er zijn echter niet minder bezoeken aan de mdl-arts, waarschijnlijk omdat dit 2 losse trajecten zijn.
Het geïntegreerde zorgmodel beschrijft een zorg die meer op samenwerking tussen mdl-arts en andere professionals gebaseerd is. Bijvoorbeeld dat patiënten worden getrieerd, gescreend en gezien door een verpleegkundige of diëtist voor- of nadat ze naar de mdl-arts gaan. Vaak wordt er educatie gegeven tijdens deze consulten. Het effect hiervan is soms verbetering van de klachten, soms ook niet, maar vaak zijn er daarna wel minder ziekenhuisbezoeken en minder verwijzingen. Wanneer een mdl-arts en psycholoog samen een consult met de patiënt hebben, is er een positiever effect dan wanneer de patiënt in een traject met alleen de mdl-arts of alleen de psycholoog zou samenzitten. Dit komt waarschijnlijk doordat de eventuele psychologische comorbiditeit ook aandacht krijgt en behandeld wordt. Wanneer patiënten tijdens hetzelfde ziekenhuisbezoek meerdere disciplines (diëtist, psychiater, biofeedback-therapeut, hypnotherapeut) kunnen spreken en therapie ontvangen, en in een multidisciplinair overleg worden besproken, zijn de uitkomsten (symptomen, kwaliteit van leven) beter dan bij gebruikelijke zorg van alleen de mdl-arts.
Volgens 2 onderzoeken is in theorie een tertiair zorgteam bestaand uit mdl-arts plus een verpleegkundig specialist, diëtist, psycholoog, psychotherapeut, fysiotherapeut en huisarts het meest ideaal. Het is (nog) niet exact beschreven hoe dit praktisch te realiseren is en de waarde van het model is (nog) niet wetenschappelijk onderzocht.
Er zijn nog geen multidisciplinaire zorgmodellen of modellen van gedeelde zorg beschreven vanuit de eerste lijn. Het ligt voor de hand dat in de Nederlandse situatie deze zorgmodellen voor PDS ook vanuit de eerste lijn opgezet gaan worden.
Voorlichting aan patiënten
Voor veel patiënten met PDS is het feit dat er geen duidelijke aantoonbare medische oorzaak voor hun klachten is en er soms geen eenduidige behandeling bestaat, lastig te begrijpen en soms moeilijk te accepteren. Uit focusgroepen blijkt dat patiënten behoefte hebben aan duidelijke en open communicatie, adequate voorlichting en breed beschikbare informatie over PDS. Dat vraagt een goede vertrouwensrelatie met hun behandelaar en gezamenlijke besluitvorming. Vooral erkenning en herkenning zijn voor veel PDS-patiënten heel belangrijk. Bij PDS is het belangrijk om als professional de juiste insteek te kiezen: benader PDS als een diagnose die op basis van bepaalde criteria kan worden gesteld en niet als een ‘uitsluitingsdiagnose’ (zie Bijlage: korte uitleg voor de patiënt over PDS). Uit wetenschappelijk onderzoek blijkt dat de positieve benadering even effectief is, even acceptabel voor de patiënt en tot aanzienlijk lagere kosten leidt.
Vanuit patiënten is er behoefte aan duidelijke uitleg over de betekenis van factoren die in de verklaring van een ‘multidimensionale’ ziekte als PDS een rol kunnen spelen: verstoord microbioom, verhoogde darmgevoeligheid, verstoorde peristaltiek, verstoorde werking van de darm-hersenas, copingmechanismen, voedselintolerantie enzovoort. Goede uitleg en aansluiting op de beleving van de patiënt zorgt ervoor dat patiënten niet naar huis gaan met het idee dat het ‘tussen de oren zit’ of geen idee hebben wat ze ermee moeten. De arts moet in ieder geval voldoende tijd nemen om uitleg te geven en de patiënt handvatten te geven om zelf aan de slag te gaan, zodat de patiënt ervaart zelf de regie te hebben over de eigen gezondheid. Over de verschillende mogelijke behandelingen is uitleg nodig. Patiënten kunnen verwezen worden naar thuisarts.nl, de Keuzehulp PDS en de PDSB-website. Patiënten kunnen baat hebben bij lotgenotencontact met andere PDS-patiënten via de PDSB.
Voorlichting en advies
Informeer de patiënt in een zo vroeg mogelijk stadium over mogelijke verklaringen voor PDS, de prognose en de bijbehorende klachten.
Mogelijke verklaringen
Geef voorlichting over de mogelijke oorzaak van PDS en leg het volgende uit.
- Er is tot nu toe geen eenduidige verklaring voor de klachten van PDS gevonden.
- Er zijn verschillende theoretische verklaringen voor het ontstaan van PDS, waaronder verhoogde gevoeligheid van de darmen, veranderingen in de darmbeweeglijkheid, verstoorde balans tussen verschillende soorten darmbacteriën, veranderingen in de darmafweerfunctie en in de doorlaatbaarheid van darmcellen, veranderingen in de communicatie tussen darmen en hersenen (darm-hersenas, zie Etiologie).
- De diagnose wordt gesteld op basis van symptomen en klachten.
- Er bestaan verschillende vormen van PDS: bij PDS met diarree op de voorgrond werken de darmen te snel, bij PDS met obstipatie op de voorgrond werken de darmen te langzaam en er is een mengvorm waarbij de ene keer diarree en de andere keer obstipatie op de voorgrond staat.
- De koliekachtige pijn ontstaat doordat de darm sterk kan samentrekken.
- Er is geen verhoogd risico op het ontstaan van ernstige darmziekten.
- De klachten lijken soms te ontstaan na een heftige darminfectie of bij een periode van grote spanning.
Beloop en prognose
- Leg uit dat het individuele beloop van de klachten niet te voorspellen valt. Sommige mensen hebben periodiek klachten van wisselende aard, bij anderen houden de klachten lang aan.
- Geef aan dat er verschillende theoretische verklaringen zijn voor het voortduren van de klachten.
- Mensen met PDS zijn gevoeliger voor pijn in de darmen en merken meer van de werking van de darmen dan mensen zonder PDS. De exacte oorzaak van deze pijngevoeligheid is niet bekend, mogelijk speelt overgevoeligheid van de zenuwen in de darmen en hersenen een rol.
- Spanningen kunnen de klachten verergeren; veel mensen zijn ongerust over hun PDS-klachten en ook dat kan de klachten in stand houden of verergeren; darmklachten kunnen een signaal zijn dat men (langdurig) in een stressvolle situatie zit.
Aanvullend onderzoek
Leg uit dat aanvullend onderzoek naar de oorzaak van PDS, bijvoorbeeld coloscopie, niet zinvol is omdat mogelijke oorzaken hiermee niet aan te tonen zijn. Coloscopie heeft geen consequenties voor het beleid en is niet zonder risico’s.
Mogelijke behandelingen van PDS
- uit dat elke behandeling bij slechts een deel van de patiënten werkt (de effectiviteit van de behandelingen is onzeker).
- uit dat welke behandeling het beste bij de patiënt past, afhangt van diens eigen klachten en voorkeuren. Ook mét behandeling kunnen klachten blijven bestaan of terugkomen.
Thuisarts
Bied voorlichtingsmateriaal aan en verwijs naar de informatie op thuisarts.nl. De informatie op Thuisarts is gebaseerd op deze NHG-Standaard.
Patiëntenorganisatie
Attendeer de patiënt op de Prikkelbare Darm Syndroom Belangenorganisatie en de mogelijkheden van lotgenotencontact.
Bijlage: korte uitleg voor de patiënt over PDS
(Het helpt om ter plekke een tekening te maken, zoals op de bijgevoegde afbeeldingen, of aan de hand van het plaatje het verhaal te vertellen)
- ‘PDS noemen we een functionele stoornis. Dat wil zeggen, als je de darmen onderzoekt, je laat er een camera doorheen gaan, dan zal je in die darmen geen afwijking vinden: geen ontstekingen, geen rare plekken, die darmen op zich zijn in orde. Maar als je mensen met het PDS vergelijkt met anderen, dan vallen er een aantal dingen op, is uit onderzoek gebleken.
- De motiliteit, de beweeglijkheid van de darmen is verstoord, dat wil zeggen: bij sommige mensen werken de darmen te snel: die krijgen diarree. Bij anderen werken ze te langzaam: die krijgen obstipatie en dan heb je mensen die hebben een mengvorm: de ene keer diarree en de andere keer obstipatie en er zijn ook mensen, bij wie die darm ineens zomaar samentrekt: dan krijg je zo’n koliekachtige pijn.
- Het tweede is, dat mensen met het PDS in de darmen pijngevoeliger zijn dan anderen. Ze zijn niet pijngevoeliger in het geheel: dus als ik u knijp en ook iemand anders, zegt u niet eerder ‘auw’, maar specifiek in de darmen zijn mensen met PDS wel pijngevoeliger. Hoe dat komt, weten we niet precies, maar het lijkt erop dat bij mensen met PDS, er een verhoogde gevoeligheid van de zenuwuiteinden in de darmen is ontstaan; signalen die normaal niet doordringen tot het bewustzijn maar wel bij patiënten met PDS. Soms komt dat omdat iemand eerder een ontsteking heeft gehad, maar dat hoeft niet altijd het geval te zijn. Die zenuwen zenden prikkels naar de hersenen via opgaande banen en ook in de hersenen kan een overgevoeligheid ontstaan zijn, waardoor er bij u eerder pijn geregistreerd wordt, dan bij anderen, zonder PDS.
- De derde factor is voeding. Veel PDS-patiënten merken dat bepaalde voeding de klachten kan opwekken of erger kan maken. De darmen kunnen sterk reageren op bepaalde voeding. Het is echter heel verschillend per persoon en ook per situatie welke voeding wel en geen klachten geeft. Er bestaan dan ook geen voedingsmiddelen die voor alle PDS-patiënten worden aanbevolen of afgeraden. Met behulp van een diëtist en/of een voedseldagboek, kun je uitzoeken welke voedingsmiddelen bij jou persoonlijk de klachten erger maken. Hierbij is de hoeveelheid van belang: een klein beetje gaat vaak wel goed, wordt nog wel verdragen.
- De vierde factor is: spanningen, ook weleens stress genoemd. Meestal maken spanningen de klachten erger. Dat is bij iedere ziekte zo: als je rugpijn hebt, of diabetes of longziekte, meestal maken spanningen de klachten erger. Dat wil niet zeggen dat de spanningen de klachten veroorzaken, maar dat ze er wel een invloed op hebben. De meeste mensen herkennen dat wel. De gedachten die je over je aandoening hebt, kunnen tot deze spanning leiden. Als je denkt: ‘dit gaat nooit meer over’, kunt u zich voorstellen dan je meer spanning krijgt dan als je denkt: ’ik moet uitzoeken wat ik hieraan kan doen’.
- 'Kunt u zich er zoiets bij voorstellen? Heeft u daar vragen over?’ (Aansluiten bij wat de patiënten naar voren brengen.)
Referenties
- Thompson WG, Longstreth GF, Drossman DA, Heaton KW, Irvine EJ, Muller-Lissner SA. Functional bowel disorders and functional abdominal pain. GUT 1999;45 Suppl 2:II43-II47.
- Longstreth GF, Thompson WG, Chey WD, Houghton LA, Mearin F, Spiller RC. Functional bowel disorders. Gastroenterology 2006;130:1480-91.
- Drossman DA, Hasler WL. Rome IV-functional Gi disorders: disorders of gut-brain interaction. Gastroenterology 2016;150:1257–61.
- Mearin F, Lacy BE, Chang L. Bowel disorders. Gastroenterology 2016;150:1393–407.
- Begtrup LM, Engsbro AL, Kjeldsen J, Larsen PV, Schaffalitzky de Muckadell O, Bytzer P, Jarbøl DE. A positive diagnostic strategy is noninferior to a strategy of exclusion for patients with irritable bowel syndrome. Clin Gastroenterol Hepatol. 2013 Aug;11(8):956-62.e1.
- Engsbro AL, Begtrup LM, Haastrup P, Storsveen MM, Bytzer P, Kjeldsen J, Schaffalitzky De Muckadell O, Jarbøl DE. A positive diagnostic strategy is safe and saves endoscopies in patients with irritable bowel syndrome: A five-year follow-up of a randomized controlled trial. Neurogastroenterol Motil. 2021 Mar;33(3):e14004.
- Nielen MMJ, Hek K, Schermer TRJ. Jaarcijfers aandoeningen: incidenties en prevalenties. Uit: Nivel Zorgregistraties Eerste Lijn [internet]. 2020 [Laatst gewijzigd op 31-08-2020; geraadpleegd op 03-12-2021]. Ga naar bron: Nielen MMJ, Hek K, Schermer TRJ. Jaarcijfers aandoeningen: incidenties en prevalenties. Uit: Nivel Zorgregistraties Eerste Lijn [internet]. 2020 [Laatst gewijzigd op 31-08-2020; geraadpleegd op 03-12-2021].
- Sperber AD, Dumitrascu D, Fukudo S, et al. The global prevalence of IBS in adults remains elusive due to the heterogeneity of studies: a Rome Foundation working team literature review. Gut 2017;66:1075–82.
- Sperber A et al. Worldwide prevalence and burden of functional gastrointestinal disorders, results of Rome foundation global study; Gastroenterology 2021; 160: 99-114.
- Van de Lisdonk EH, Van den Bosch WJHM, Lagro-Janssen ALM, Schers HJ. redactie. Ziekten in de huisartspraktijk. Maarssen: Elsevier Gezondheidszorg, 2008.
- Guthrie E, Thompson D. Abdominal pain and functional gastrointestinal disorders. BMJ 2002;325:701-3.
- Chitkara DK, van Tilburg MAL, Blois-Martin N, et al. Early life risk factors that contribute to irritable bowel syndrome in adults: a systematic review. Am J Gastroenterol 2008;103:765–74.
- Saito YA, Talley NJ. Genetics of irritable bowel syndrome. Am J Gastroenterol 2008;103:2100–4.
- Spiller R, Garsed K. Postinfectious irritable bowel syndrome. Gastroenterology 2009;136:1979–88.
- Meaney MJ, Szyf M. Environmental programming of stress responses through DNA methylation: life at the interface between a dynamic environment and a fixe genome. Dialogues Clin Neurosci 2005;7:103–23.
- Van Oudenhove L, Levy RL, Crowell MD, et al. Biopsychosocial aspects of functional gastrointestinal disorders: how central and environmental processes contribute to the development and expression of functional gastrointestinal disorders. Gastroenterology 2016;150:1355–67.
- Windgassen S, Moss-Morris R, Chilcot J, et al. The journey between brain and gut: a systematic review of psychological mechanisms of treatment effect in irritable bowel syndrome. Br J Health Psychol 2017;22:701–36.
- Hungin APS, Becher A, Cayley B, Heidelbaugh JJ, Muris JWM, Rubin G, Seifert B, Russel A, De Wit NJ. Irritable bowel syndrome: an integrated explanatory model for clinical practice. Neurogastroenterology and Motility 2015;27(6):750-763
- Ludidi S, Conchillo JM, Keszthelyi D, Van Avesaat M, Kruimel JW, Jonkers DM, Masclee AA. Rectal hypersensitivity as hallmark for irritable bowel syndrome: defining the optimal cutoff. Neurogastroenterol Motil 2012;24:729-33.
- Sanger GJ, Chang L, Bountra C, et al. Challenges and prospects for pharmacotherapy in functional gastrointestinal disorders. Therap Adv Gastroenterol 2010;3:291–305.
- Simrén M, Törnblom H, Palsson OS, et al. Visceral hypersensitivity is associated with Gi symptom severity in functional Gi disorders: consistent findings from five different patient cohorts. Gut 2018;67:255–62.
- Agrawal A, Houghton LA, Lea R, et al. Bloating and distention in irritable bowel syndrome: the role of visceral sensation. Gastroenterology 2008;134:1882–9.
- Camilleri M, McKinzie S, Busciglio I, et al. Prospective study of motor, sensory, psychologic, and autonomic functions in patients with irritable bowel syndrome. Clin Gastroenterol Hepatol 2008;6:772–81.
- Törnblom H, Van Oudenhove L, Sadik R, et al. Colonic Transit Time and IBS Symptoms: What’s the Link? Am J Gastroenterol 2012;107:754–60.
- Ravi K, Bharucha AE, Camilleri M, et al. Phenotypic variation of colonic motor functions in chronic constipation. Gastroenterology 2010;138:89–97.
- Spiller R, Aziz Q, Creed F, et al. Guidelines on the irritable bowel syndrome: mechanisms and practical management. Gut 2007;56:1770–98.
- Atkinson W, Lockhart S, Whorwell PJ, et al. Altered 5-hydroxytryptamine signaling in patients with Constipation- and diarrhea-predominant irritable bowel syndrome. Gastroenterology 2006;130:34–43.
- Thijssen AY, Mujagic Z, Jonkers DM, Ludidi S, Keszthelyi D, Hesselink MA, Clemens CH, Conchillo JM, Kruimel JW, Masclee AA. Alterations in serotonin metabolism in the irritable bowel syndrome. Aliment Pharmacol Ther. 2016 Jan;43(2):272-82.
- Klem F, Wadhwa A, Prokop LJ, et al. Prevalence, risk factors, and outcomes of irritable bowel syndrome after infectious enteritis: a systematic review and meta-analysis. Gastroenterology 2017;152:1042–54.
- Barbara G, Grover M, Bercik P, Corsetti M, Ghoshal UC, Ohman L, Rajilić-Stojanović M. Rome Foundation Working Team Report on Post-Infection Irritable Bowel Syndrome. Gastroenterology. 2019 Jan;156(1):46-58.e7
- Villarreal AA, Aberger FJ, Benrud R. Use of broad-spectrum antibiotics and the development of irritable bowel syndrome. WMJ 2012;111:17–20.
- Pimentel M, Lembo A, Chey WD, et al. Rifaximin therapy for patients with irritable bowel syndrome without constipation. N Engl J Med Overseas Ed 2011;364:22–32.
- Bhattarai Y, Muniz Pedrogo DA, Kashyap PC. Irritable bowel syndrome: a gut microbiota-related disorder? Am J Physiol Gastrointest Liver Physiol 2017;312:G52–62.
- Grover M, Kanazawa M, Palsson OS, et al. Small intestinal bacterial overgrowth in irritable bowel syndrome: association with colon motility, bowel symptoms, and psychological distress. Neurogastroenterology & Motility 2008;20:998–1008.
- Hugerth LW, Andreasson A, Talley NJ, et al. No distinct microbiome signature of irritable bowel syndrome found in a Swedish random population. Gut 2020;69:1076–84.
- Tap J, Derrien M, Törnblom H, et al. Identification of an intestinal microbiota signature associated with severity of irritable bowel syndrome. Gastroenterology 2017;152:111–23.
- Jeffery IB, Das A, O'Herlihy E, Coughlan S, Cisek K, Moore M, Bradley F, Carty T, Pradhan M, Dwibedi C, Shanahan F, O'Toole PW. Differences in Fecal Microbiomes and Metabolomes of People With vs Without Irritable Bowel Syndrome and Bile Acid Malabsorption. Gastroenterology. 2020 Mar;158(4):1016-1028.e8.
- Martin-Viñas JJ, Quigley EMM. Immune response in irritable bowel syndrome: a systematic review of systemic and mucosal inflammatory mediators. J Dig Dis 2016;17:572–81.
- Burns G, Carroll G, Mathe A, et al. Evidence for local and systemic immune activation in functional dyspepsia and the irritable bowel syndrome: a systematic review. Am J Gastroenterol 2019;114:429–36.
- Robles A, Perez Ingles D, Myneedu K, et al. Mast cells are increased in the small intestinal mucosa of patients with irritable bowel syndrome: a systematic review and meta‐analysis. Neurogastroenterology & Motility 2019;31:e13718.
- Mujagic Z, Ludidi S, Keszthelyi D, Hesselink MA, Kruimel JW, Lenaerts K, Hanssen NM, Conchillo JM, Jonkers DM, Masclee AA. Small intestinal permeability is increased in diarrhoea predominant IBS, while alterations in gastroduodenal permeability in all IBS subtypes are largely attributable to confounders. Aliment Pharmacol Ther. 2014 Aug;40(3):288-97.
- Black CJ, Yiannakou Y, Houghton LA. Anxiety‐related factors associated with symptom severity in irritable bowel syndrome. Neurogastroenterology and motility : the official journal of the European Gastrointestinal Motility Society 2020:e13872.
- Mayer EA, Labus J, Aziz Q, et al. Role of brain imaging in disorders of brain–gut interaction: a Rome working team report. Gut 2019;68:1701–15.
- Salvioli B, Pellegatta G, Malacarne M, et al. Autonomic nervous system dysregulation in irritable bowel syndrome. Neurogastroenterology & Motility 2015;27:423–30.
- Cash BD, Schoenfeld P, Chey WD. The utility of diagnostic tests in irritable bowel syndrome patients: a systematic review. Am J Gastroenterol 2002;97:2812-9.
- Sanders DS, Patel D, Stephenson TJ, Ward AM, McCloskey EV, Hadjivassiliou M, et al. A primary care cross-sectional study of undiagnosed adult coeliac disease. Eur J Gastroenterol Hepatol 2003;15:407-13.
- Pimentel M, Chow EJ, Lin HC. Normalization of lactulose breath testing correlates with symptom improvement in irritable bowel syndrome. a double-blind, randomized, placebo-controlled study. Am J Gastroenterol 2003;98:412-9.
- Hamm LR, Sorrells SC, Harding JP, Northcutt AR, Heath AT, Kapke GF, et al. Additional investigations fail to alter the diagnosis of irritable bowel syndrome in subjects fulfilling the Rome criteria. Am J Gastroenterol 1999;94:1279-82.
- Tolliver BA, Herrera JL, DiPalma JA. Evaluation of patients who meet clinical criteria for irritable bowel syndrome. Am J Gastroenterol 1994;89:176-8.
- MacIntosh DG, Thompson WG, Patel DG, Barr R, Guindi M. Is rectal biopsy necessary in irritable bowel syndrome? Am J Gastroenterol 1992;87:1407-9.
- Francis CY, Duffy JN, Whorwell PJ, Martin DF. Does routine abdominal ultrasound enhance diagnostic accuracy in irritable bowel syndrome? Am J Gastroenterol 1996;91:1348-50.
- Sanders DS, Carter MJ, Hurlstone DP, Pearce A, Ward AM, McAlindon ME, et al. Association of adult coeliac disease with irritable bowel syndrome: a case-control study in patients fulfilling ROME II criteria referred to secondary care. Lancet 2001;358:1504-8.
- Cash BD, Chey WD. Diagnosis of irritable bowel syndrome. Gastroenterol Clin North Am 2005;34:205-20, vi.
- Bijkerk CJ. Prikkelbaredarmsyndroom in de huisartsenpraktijk. Huisarts Wet 2009;52:17-20.
- Rubin G, De Wit N, Meineche-Schmidt V, Seifert B, Hall N, Hungin P. The diagnosis of IBS in primary care: consensus development using nominal group technique. Fam Pract 2006;23:687-92.
- Vereniging Klinische Genetica Nederland, Stichting Opsporing erfelijke tumoren. Erfelijke tumoren. Richtlijnen voor diagnostiek en preventie (2017). Ga naar bron: Vereniging Klinische Genetica Nederland, Stichting Opsporing erfelijke tumoren. Erfelijke tumoren. Richtlijnen voor diagnostiek en preventie (2017).
- Fijten GH, Blijham GH, Knottnerus JA. Occurrence and clinical significance of overt blood loss per rectum in the general population and in medical practice. Br J Gen Pract 1994;44:320-5.
- Crosland A, Jones R. Rectal bleeding: prevalence and consultation behaviour. BMJ 1995;311:486-8.
- Talley NJ, Jones M. Self-reported rectal bleeding in a United States community: prevalence, risk factors, and health care seeking. Am J Gastroenterol 1998b;93:2179-83.
- Talley NJ, Boyce P, Jones M. Identification of distinct upper and lower gastrointestinal symptom groupings in an urban population. GUT 1998a;42:690-5.
- Ellis BG, Thompson MR. Factors identifying higher risk rectal bleeding in general practice. Br J Gen Pract 2005;55:949-55.
- Helfand M, Marton KI, Zimmer-Gembeck MJ, Sox HC Jr. History of visible rectal bleeding in a primary care population. Initial assessment and 10-year follow-up. JAMA 1997;277:44-8.
- Metcalf JV, Smith J, Jones R, Record CO. Incidence and causes of rectal bleeding in general practice as detected by colonoscopy. Br J Gen Pract 1996;46:161-4.
- Hamilton W, Sharp D. Diagnosis of colorectal cancer in primary care: the evidence base for guidelines. Fam Pract 2004;21:99-106.
- Fijten GH, Starmans R, Muris JW, Schouten HJ, Blijham GH, Knottnerus JA. Predictive value of signs and symptoms for colorectal cancer in patients with rectal bleeding in general practice. Fam Pract 1995;12:279-86.
- Ferraris R, Senore C, Fracchia M, Sciallero S, Bonelli L, Atkin WS, et al. Predictive value of rectal bleeding for distal colonic neoplastic lesions in a screened population. Eur J Cancer 2004;40:245-52.
- Lawrenson R, Logie J, Marks C. Risk of colorectal cancer in general practice patients presenting with rectal bleeding, change in bowel habit or anaemia. Eur J Cancer Care (Engl) 2006;15:267-71.
- Norrelund N, Norrelund H. Colorectal cancer and polyps in patients aged 40 years and over who consult a GP with rectal bleeding. Fam Pract 1996;13:160-5.
- Robertson R, Campbell C, Weller DP, Elton R, Mant D, Primrose J, et al. Predicting colorectal cancer risk in patients with rectal bleeding. Br J Gen Pract 2006;56:763-7.
- Thompson MR, Perera R, Senapati A, Dodds S. Predictive value of common symptom combinations in diagnosing colorectal cancer. Br J Surg 2007;94:1260-5.
- Fijten GH, Muris JW, Starmans R, Knottnerus JA, Blijham GH, Krebber TF. The incidence and outcome of rectal bleeding in general practice. Fam Pract 1993;10:283-7.
- Sanchez A, Munoz C, Bujanda L, Iriondo C, Gil-Molet A, Cosme A, et al. The value of colonoscopy to assess rectal bleeding in patients referred from Primary Care Units. Rev Esp Enferm Dig 2005;97:870-6.
- Sands BE. From symptom to diagnosis: clinical distinctions among various forms of intestinal inflammation. Gastroenterology 2004;126:1518-32.
- Verhaegh BP, Jonkers DM, Driessen A, Zeegers MP, Keszthelyi D, Masclee AA, Pierik MJ. Incidence of microscopic colitis in the Netherlands. A nationwide population-based study from 2000 to 2012. Dig Liver Dis. 2015 Jan;47(1):30-6.
- Verhaegh BP, van Dijk MA, Goudkade D, Pierik MJ, Masclee AA. Chronische diarree door microscopische colitis: alertheid loont [Chronic diarrhoea due to microscopic colitis: awareness pays]. Ned Tijdschr Geneeskd. 2016;160:A9584.
- Masclee GM, Coloma PM, Kuipers EJ, Sturkenboom MC. Increased risk of microscopic colitis with use of proton pump inhibitors and non-steroidal anti-inflammatory drugs. Am J Gastroenterol. 2015 May;110(5):749-59.
- Miehlke S, Verhaegh B, Tontini GE, Madisch A, Langner C, Münch A. Microscopic colitis: pathophysiology and clinical management. Lancet Gastroenterol Hepatol. 2019 Apr;4(4):305-314.
- Chey WD, Nojkov B, Rubenstein JH, et al. The yield of colonoscopy in patients with non-constipated irritable bowel syndrome: results from a prospective, controlled us trial. Am J Gastroenterol 2010;105:859–65.
- Kok L, Elias SG, Witteman BJ, Goedhard JG, Romberg-Camps MJ, Muris JW, Moons KG, de Wit NJ. Application of the Rome-III-criteria is not likely to reduce the number of unnecessary referrals for colonoscopy in primary care. Eur J Gastroenterol Hepatol. 2013 May;25(5):568-74. doi: 10.1097/MEG.0b013e32835d4ddd. PMID: 23325277.
- Asghar Z, Thoufeeq M, Kurien M, Ball AJ, Rej A, David Tai FW, Afify S, Aziz I. Diagnostic Yield of Colonoscopy in Patients With Symptoms Compatible With Rome-IV Functional Bowel Disorders. Clin Gastroenterol Hepatol. 2020 Aug 31:S1542-3565(20)31221-0. doi: 10.1016/j.cgh.2020.08.062. Epub ahead of print. PMID: 32882424.
- Grobbee EJ, Wisse PH, Schreuders EH, van Roon A, van Dam L, Zauber AG, Lansdorp-Vogelaar I, Bramer W, Berhane S, Deeks JJ, Steyerberg EW, van Leerdam ME, Spaander MC, Kuipers EJ. Guaiac-based faecal occult blood tests versus faecal immunochemical tests for colorectal cancer screening in average-risk individuals. Cochrane Database Syst Rev. 2022 Jun 6;6(6):CD009276.
- Westwood M, Lang S, Armstrong N, van Turenhout S, Cubiella J, Stirk L, Ramos IC, Luyendijk M, Zaim R, Kleijnen J, Fraser CG. Faecal immunochemical tests (FIT) can help to rule out colorectal cancer in patients presenting in primary care with lower abdominal symptoms: a systematic review conducted to inform new NICE DG30 diagnostic guidance. BMC Med. 2017 Oct 24;15(1):189. doi: 10.1186/s12916-017-0944-z. PMID: 29061126; PMCID: PMC5654140.
- D'Souza N, Georgiou Delisle T, Chen M, Benton S, Abulafi M; NICE FIT Steering Group. Faecal immunochemical test is superior to symptoms in predicting pathology in patients with suspected colorectal cancer symptoms referred on a 2WW pathway: a diagnostic accuracy study. Gut. 2021 Jun;70(6):1130-1138. doi: 10.1136/gutjnl-2020-321956. Epub 2020 Oct 21. PMID: 33087488; PMCID: PMC8108285.
- Nicholson BD, James T, Paddon M, Justice S, Oke JL, East JE, Shine B. Faecal immunochemical testing for adults with symptoms of colorectal cancer attending English primary care: a retrospective cohort study of 14 487 consecutive test requests. Aliment Pharmacol Ther. 2020 Sep;52(6):1031-1041. doi: 10.1111/apt.15969. Epub 2020 Jul 17. PMID: 32677733.
- Lué A, Hijos G, Sostres C, Perales A, Navarro M, Barra MV, Mascialino B, Andalucia C, Puente JJ, Lanas Á, Gomollon F. The combination of quantitative faecal occult blood test and faecal calprotectin is a cost-effective strategy to avoid colonoscopies in symptomatic patients without relevant pathology. Therap Adv Gastroenterol. 2020 May 18;13:1756284820920786. doi: 10.1177/1756284820920786. PMID: 32523623; PMCID: PMC7235671.
- Mowat C, Digby J, Strachan JA, McCann R, Hall C, Heather D, Carey F, Fraser CG, Steele RJC. Impact of introducing a faecal immunochemical test (FIT) for haemoglobin into primary care on the outcome of patients with new bowel symptoms: a prospective cohort study. BMJ Open Gastroenterol. 2019 May 4;6(1):e000293. doi: 10.1136/bmjgast-2019-000293. PMID: 31275586; PMCID: PMC6577357.
- Juul JS, Hornung N, Andersen B, Laurberg S, Olesen F, Vedsted P. The value of using the faecal immunochemical test in general practice on patients presenting with non-alarm symptoms of colorectal cancer. Br J Cancer. 2018 Aug;119(4):471-479. doi: 10.1038/s41416-018-0178-7. Epub 2018 Aug 1. PMID: 30065255; PMCID: PMC6133998.
- Högberg C, Karling P, Rutegård J, Lilja M. Diagnosing colorectal cancer and inflammatory bowel disease in primary care: The usefulness of tests for faecal haemoglobin, faecal calprotectin, anaemia and iron deficiency. A prospective study. Scand J Gastroenterol. 2017 Jan;52(1):69-75. doi: 10.1080/00365521.2016.1228120. Epub 2016 Sep 14. PMID: 27623716.
- Elias SG, Kok L, de Wit NJ, Witteman BJ, Goedhard JG, Romberg-Camps MJ, Muris JW, Moons KG. Is there an added value of faecal calprotectin and haemoglobin in the diagnostic work-up for primary care patients suspected of significant colorectal disease? A cross-sectional diagnostic study. BMC Med. 2016 Sep 26;14(1):141. doi: 10.1186/s12916-016-0684-5. PMID: 27666114; PMCID: PMC5036273.
- Irvine AJ, Chey WD, Ford AC. Screening for celiac disease in irritable bowel syndrome: An updated systematic review and meta-analysis. Am J Gastroenterol 2017;112:65–76.
- Mohseninejad L, Feenstra T, van der Horst HE, Woutersen-Koch H, Buskens E. Targeted screening for Coeliac Disease among irritable bowel syndrome patients: analysis of cost-effectiveness and value of information. Eur J Health Econ. 2013 Dec;14(6):947-57.
- Turvill J, Turnock D. Audit of the impact of the York faecal calprotectin care pathway on colonoscopy activity. Frontline Gastroenterol. 2019 Oct 24;11(4):285-289. doi: 10.1136/flgastro-2019-101315. PMID: 32587672; PMCID: PMC7307046.
- NVKC. Zinnige Diagnostiek; overwegingen bij het aanvragen van calprotectine in feces. 2015.
- Pathirana WGW, Chubb SP, Gillett MJ, Vasikaran SD. Faecal Calprotectin. Clin Biochem Rev. 2018 Aug;39(3):77-90. PMID: 30828114; PMCID: PMC6370282.
- An YK, Prince D, Gardiner F, Neeman T, Linedale EC, Andrews JM, Connor S, Begun J. Faecal calprotectin testing for identifying patients with organic gastrointestinal disease: systematic review and meta-analysis. Med J Aust. 2019 Nov;211(10):461-467. doi: 10.5694/mja2.50384. Epub 2019 Nov 3. PMID: 31680263.
- Ford AC, Moayyedi P, Chey WD, Harris LA, Lacy BE, Saito YA, Quigley EMM; ACG Task Force on Management of Irritable Bowel Syndrome. American College of Gastroenterology Monograph on Management of Irritable Bowel Syndrome. Am J Gastroenterol. 2018 Jun;113(Suppl 2):1-18. doi: 10.1038/s41395-018-0084-x. PMID: 29950604.
- Linedale EC, Mikocka-Walus A, Gibson PR, Andrews JM. The potential of integrated nurse-led models to improve care for people with functional gastrointestinal disorders: a systematic Review. Gastroenterol Nurs 2020;43:53-64.
- Van der Horst HE, Schellevis EG, Van Eijk JT, Deville W. Health education for patients with irritable bowel syndrome in general practice. Jaarverslag EMGO Instituut 1997.
- Van Dulmen AM, Fennis JFM, Bleijenberg G. Betere prognose van functionele buikklachten door aandacht voor psychische factoren. Ned Tijdschr Geneeskd 1998;142:641.
- Van Dulmen AM, Fennis JF, Mokkink HG, Bleijenberg G. The relationship between complaint-related cognitions in referred patients with irritable bowel syndrome and subsequent health care seeking behaviour in primary care. Fam Pract 1996;13:12-7.
- Drossman DA, McKee DC, Sandler RS, Mitchell CM, Cramer EM, Lowman BC, et al. Psychosocial factors in the irritable bowel syndrome. A multivariate study of patients and nonpatients with irritable bowel syndrome. Gastroenterology 1988;95:701-8.
- Donker GA, Foets M, Spreeuwenberg P. Patients with irritable bowel syndrome: health status and use of health care services. Br J Gen Pract 1999;49:787-92.
- Kettell J, Jones R, Lydeard S. Reasons for consultation in irritable bowel syndrome: symptoms and patient characteristics. Br J gen Pract 1992;42:459-61.
- Bleijenberg G, Fennis JF. Anamnestic and psychological features in diagnosis and prognosis of functional abdominal complaints: a prospective study. GUT 1989;30:1076-81.
- Smith RC, Greenbaum DS, Vancouver JB, Henry RC, Reinhart MA, Greenbaum RB, et al. Psychosocial factors are associated with health care seeking rather than diagnosis in irritable bowel syndrome. Gastroenterology 1990;98:293-301.
- Fowlie S, Eastwood MA, Ford MJ. Irritable bowel syndrome: the influence of psychological factors on the symptom complex. J Psychosom Res 1992;36:169-73.
- Rijnaarts I, Witteman BJM, Zoetendal EG, Govers C, de Wit NJW, de Roos NM. Subtypes and Severity of Irritable Bowel Syndrome Are Not Related to Patients' Self-Reported Dietary Triggers: Results From an Online Survey in Dutch Adults. J Acad Nutr Diet. 2021 Sep;121(9):1750-1762.e8. doi: 10.1016/j.jand.2021.01.007. Epub 2021 Mar 2. PMID: 33674208.
- Singh P, Tuck C, Gibson PR, Chey WD. The Role of Food in the Treatment of Bowel Disorders: Focus on Irritable Bowel Syndrome and Functional Constipation. Am J Gastroenterol. 2022 Jun 1;117(6):947-957.
- Geisslitz S, Shewry P, Brouns F, America AHP, Caio GPI, Daly M, D'Amico S, De Giorgio R, Gilissen L, Grausgruber H, Huang X, Jonkers D, Keszthelyi D, Larré C, Masci S, Mills C, Møller MS, Sorrells ME, Svensson B, Zevallos VF, Weegels PL. Wheat ATIs: Characteristics and Role in Human Disease. Front Nutr. 2021 May 28;8:667370. doi: 10.3389/fnut.2021.667370. PMID: 34124122; PMCID: PMC8192694.
- Hamer HM, Jonkers D, Venema K, Vanhoutvin S, Troost FJ, Brummer RJ. Review article: the role of butyrate on colonic function. Aliment Pharmacol Ther. 2008 Jan 15;27(2):104-19. doi: 10.1111/j.1365-2036.2007.03562.x. Epub 2007 Oct 25. PMID: 17973645.
- Leeming ER, Johnson AJ, Spector TD, Le Roy CI. Effect of Diet on the Gut Microbiota: Rethinking Intervention Duration. Nutrients. 2019;11(12):2862. Published 2019 Nov 22. doi:10.3390/nu11122862
- Böhn L, Störsrud S, Törnblom H, Bengtsson U, Simrén M. Self-reported food-related gastrointestinal symptoms in IBS are common and associated with more severe symptoms and reduced quality of life. Am J Gastroenterol. 2013 May;108(5):634-41. doi: 10.1038/ajg.2013.105. PMID: 23644955.
- So D, Gibson PR, Muir JG, Yao CK. Dietary fibres and IBS: translating functional characteristics to clinical value in the era of personalised medicine. Gut. 2021 Dec;70(12):2383-2394. doi: 10.1136/gutjnl-2021-324891. Epub 2021 Aug 20. PMID: 34417199.
- Dionne J, Ford AC, Yuan Y, Chey WD, Lacy BE, Saito YA, Quigley EMM, Moayyedi P. A Systematic Review and Meta-Analysis Evaluating the Efficacy of a Gluten-Free Diet and a Low FODMAPs Diet in Treating Symptoms of Irritable Bowel Syndrome. Am J Gastroenterol. 2018 Sep;113(9):1290-1300. doi: 10.1038/s41395-018-0195-4. Epub 2018 Jul 26. PMID: 30046155.
- Biesiekierski JR, Newnham ED, Irving PM, Barrett JS, Haines M, Doecke JD, Shepherd SJ, Muir JG, Gibson PR. Gluten causes gastrointestinal symptoms in subjects without celiac disease: a double-blind randomized placebo-controlled trial. Am J Gastroenterol. 2011 Mar;106(3):508-14; quiz 515. doi: 10.1038/ajg.2010.487. Epub 2011 Jan 11. PMID: 21224837.
- Shahbazkhani B, Sadeghi A, Malekzadeh R, Khatavi F, Etemadi M, Kalantri E, Rostami-Nejad M, Rostami K. Non-Celiac Gluten Sensitivity Has Narrowed the Spectrum of Irritable Bowel Syndrome: A Double-Blind Randomized Placebo-Controlled Trial. Nutrients. 2015 Jun 5;7(6):4542-54. doi: 10.3390/nu7064542. PMID: 26056920; PMCID: PMC4488801.
- Zanwar VG, Pawar SV, Gambhire PA, Jain SS, Surude RG, Shah VB, Contractor QQ, Rathi PM. Symptomatic improvement with gluten restriction in irritable bowel syndrome: a prospective, randomized, double blinded placebo controlled trial. Intest Res. 2016 Oct;14(4):343-350. doi: 10.5217/ir.2016.14.4.343. Epub 2016 Oct 17. PMID: 27799885; PMCID: PMC5083263.
- Staudacher HM, Lomer MCE, Anderson JL, Barret JS, Muir JG, Irving PM, et al. Fermentable carbohydrate restriction reduces luminal bifdobacteria and gastrointestinal symptoms in patients with irritable bowel syndrome. J Nutr. 2012;142:1510–8. PMID: 22739368
- Eswaran SL, Chey WD, Han-Markey T, Ball S, Jackson K. A Randomized Controlled Trial Comparing the Low FODMAP Diet vs. Modified NICE Guidelines in US Adults with IBS-D. Am J Gastroenterol 2016; 111(12): 1824-1832. PMID: 27725652
- McIntosh K, Reed DE, Schneider T, Dang F, Keshteli AH, De Palma G, et al. FODMAPs alter symptoms and the metabolome of patients with IBS: a randomized controlled trial. Gut. 2017;66:1241–51. PMID: 26976734
- Böhn L, Storsrud S, Liljebo T, Collin L, Lindfors P, Tornblom H, et al. Diet low in FODMAPs reduces symptoms of Irritable Bowel Syndrome as well as traditional dietary advice: a randomized controlled trial. Gastroenterology. 2015;149:1399–407. PMID: 26255043
- Halmos EP, Power VA, Shepherd SJ, Gibson PR, Muir JG. A diet low in FODMAPs reduces symptoms of irritable bowel syndrome. Gastroenterology. 2014;146:67–75. PMID: 24076059
- Hustof, TN, Hausken, T, Ystad, SO, Valeur, J, Brokstad, K, Hatlebakk, JG, et al. Effects of varying dietary content of fermentable short-chain carbohydrates on symptoms, fecal microenvironment, and cytokine profiles in patients with irritable bowel syndrome. Neurogastroenterol Motil 2017; 29: e12969. PMID: 27747984
- Staudacher HM, et al. A Diet Low in FODMAPs Reduces Symptoms in Patients With Irritable Bowel Syndrome and A Probiotic Restores Bifidobacterium Species: A Randomized Controlled Trial. Gastroenterology 2017; 153: 936-947. PMID: 28625832
- Zahedi MJ, Behrouz V, Azimi M. Low fermentable oligo-di-mono-saccharides and polyols diet versus general dietary advice in patients with diarrhea-predominant irritable bowel syndrome: A randomized controlled trial. J Gastroenterol Hepatol. 2018 Jun;33(6):1192-1199. doi: 10.1111/jgh.14051. Epub 2018 Feb 21. PMID: 29159993.
- Eswaran S, Chey WD, Jackson K, Pillai S, Chey SW, Han-Markey T. A Diet Low in Fermentable Oligo-, Di-, and Monosaccharides and Polyols Improves Quality of Life and Reduces Activity Impairment in Patients With Irritable Bowel Syndrome and Diarrhea. Clin Gastroenterol Hepatol. 2017 Dec;15(12):1890-1899.e3. doi: 10.1016/j.cgh.2017.06.044. Epub 2017 Jun 28. PMID: 28668539.
- Harvie RM, Chisholm AW, Bisanz JE, Burton JP, Herbison P, Schultz K, Schultz M. Long-term irritable bowel syndrome symptom control with reintroduction of selected FODMAPs. World J Gastroenterol. 2017 Jul 7;23(25):4632-4643. doi: 10.3748/wjg.v23.i25.4632. PMID: 28740352; PMCID: PMC5504379.
- Patcharatrakul T, Juntrapirat A, Lakananurak N, Gonlachanvit S. Effect of Structural Individual Low-FODMAP Dietary Advice vs. Brief Advice on a Commonly Recommended Diet on IBS Symptoms and Intestinal Gas Production. Nutrients. 2019 Nov 21;11(12):2856. doi: 10.3390/nu11122856. PMID: 31766497; PMCID: PMC6950148.
- Pedersen N, Andersen NN, Végh Z, Jensen L, Ankersen DV, Felding M, Simonsen MH, Burisch J, Munkholm P. Ehealth: low FODMAP diet vs Lactobacillus rhamnosus GG in irritable bowel syndrome. World J Gastroenterol. 2014 Nov 21;20(43):16215-26. doi: 10.3748/wjg.v20.i43.16215. PMID: 25473176; PMCID: PMC4239510.
- Drossman D, Morris CB, Hu Y, Toner BB, Diamant N, Whitehead WE, Dalton CB, Leserman J, Patrick DL, Bangdiwala SI. Characterization of health related quality of life (HRQOL) for patients with functional bowel disorder (FBD) and its response to treatment. Am J Gastroenterol. 2007 Jul;102(7):1442-53. doi: 10.1111/j.1572-0241.2007.01283.x. Epub 2007 May 17. PMID: 17509027.
- Niu HL, Xiao JY. The efficacy and safety of probiotics in patients with irritable bowel syndrome: Evidence based on 35 randomized controlled trials. Int J Surg. 2020 Mar;75:116-127. doi: 10.1016/j.ijsu.2020.01.142. Epub 2020 Jan 31. PMID: 32014597.
- Gupta AK, Maity C. Efficacy and safety of Bacillus coagulans LBSC in irritable bowel syndrome: A prospective, interventional, randomized, double-blind, placebo-controlled clinical study [CONSORT Compliant]. Medicine (Baltimore). 2021 Jan 22;100(3):e23641. doi: 10.1097/MD.0000000000023641. PMID: 33545934; PMCID: PMC7837859.
- Skrzydło-Radomańska B, Prozorow-Król B, Cichoż-Lach H, Majsiak E, Bierła JB, Kosikowski W, Szczerbiński M, Gantzel J, Cukrowska B. The Effectiveness of Synbiotic Preparation Containing Lactobacillus and Bifidobacterium Probiotic Strains and Short Chain Fructooligosaccharides in Patients with Diarrhea Predominant Irritable Bowel Syndrome-A Randomized Double-Blind, Placebo-Controlled Study. Nutrients. 2020 Jul 5;12(7):1999. doi: 10.3390/nu12071999. PMID: 32635661; PMCID: PMC7400954.
- Shi J, Gao F, Zhang J. Effect of Combined Live Probiotics Alleviating the Gastrointestinal Symptoms of Functional Bowel Disorders. Gastroenterol Res Pract. 2020 Sep 17;2020:4181748. doi: 10.1155/2020/4181748. PMID: 33014039; PMCID: PMC7519468.
- Sadrin S, Sennoune S, Gout B, Marque S, Moreau J, Zinoune K, Grillasca JP, Pons O, Maixent JM. A 2-strain mixture of Lactobacillus acidophilus in the treatment of irritable bowel syndrome: A placebo-controlled randomized clinical trial. Dig Liver Dis. 2020 May;52(5):534-540. doi: 10.1016/j.dld.2019.12.009. Epub 2020 Jan 15. PMID: 31952938.
- Martoni CJ, Srivastava S, Leyer GJ. Lactobacillus acidophilus DDS-1 and Bifidobacterium lactis UABla-12 Improve Abdominal Pain Severity and Symptomology in Irritable Bowel Syndrome: Randomized Controlled Trial. Nutrients. 2020 Jan 30;12(2):363. doi: 10.3390/nu12020363. PMID: 32019158; PMCID: PMC7071206.
- Lewis ED, Antony JM, Crowley DC, Piano A, Bhardwaj R, Tompkins TA, Evans M. Efficacy of Lactobacillus paracasei HA-196 and Bifidobacterium longum R0175 in Alleviating Symptoms of Irritable Bowel Syndrome (IBS): A Randomized, Placebo-Controlled Study. Nutrients. 2020 Apr 21;12(4):1159. doi: 10.3390/nu12041159. PMID: 32326347; PMCID: PMC7230591.
- Kim J, Cho K, Kim JS, Jung HC, Kim B, Park MS, Ji GE, Cho JY, Hong KS. Probiotic treatment induced change of inflammation related metabolites in IBS-D patients/double-blind, randomized, placebo-controlled trial. Food Sci Biotechnol. 2019 Dec 23;29(6):837-844. doi: 10.1007/s10068-019-00717-2. PMID: 32523793; PMCID: PMC7256134.
- Gayathri R, Aruna T, Malar S, Shilpa B, Dhanasekar KR. Efficacy of Saccharomyces cerevisiae CNCM I-3856 as an add-on therapy for irritable bowel syndrome. Int J Colorectal Dis. 2020 Jan;35(1):139-145. doi: 10.1007/s00384-019-03462-4. Epub 2019 Dec 5. PMID: 31807856.
- Barraza-Ortiz DA, Pérez-López N, Medina-López VM, Minero-Alfaro JI, Zamarripa-Dorsey F, Fernández-Martínez NDC, Llorente-Ramón A, Ramos-Aguilar GA. Combination of a Probiotic and an Antispasmodic Increases Quality of Life and Reduces Symptoms in Patients with Irritable Bowel Syndrome: A Pilot Study. Dig Dis. 2021;39(3):294-300. doi: 10.1159/000510950. Epub 2020 Aug 18. PMID: 32810850.
- Andresen V, Gschossmann J, Layer P. Heat-inactivated Bifidobacterium bifidum MIMBb75 (SYN-HI-001) in the treatment of irritable bowel syndrome: a multicentre, randomised, double-blind, placebo-controlled clinical trial. Lancet Gastroenterol Hepatol. 2020 Jul;5(7):658-666. doi: 10.1016/S2468-1253(20)30056-X. Epub 2020 Apr 8. PMID: 32277872.
- Stevenson C, et al. Probiotic effect and dietary correlations on faecal microbiota profiles in irritable bowel syndrome. South African J Clin Nutr 2019:1-6.
- Oh JH, Jang YS, Kang D, Chang DK, Min YW. Efficacy and Safety of New Lactobacilli Probiotics for Unconstipated Irritable Bowel Syndrome: A Randomized, Double-Blind, Placebo-Controlled Trial. Nutrients. 2019 Nov 27;11(12):2887. doi: 10.3390/nu11122887. PMID: 31783597; PMCID: PMC6950464.
- Madempudi RS, Ahire JJ, Neelamraju J, Tripathi A, Nanal S. Randomized clinical trial: the effect of probiotic Bacillus coagulans Unique IS2 vs. placebo on the symptoms management of irritable bowel syndrome in adults. Sci Rep. 2019 Aug 21;9(1):12210. doi: 10.1038/s41598-019-48554-x. PMID: 31434935; PMCID: PMC6704184.
- Helo AA. Treatment of Irritable Bowel Syndrome with Saccharomyces Cerevisiae. J Gastroenterol Hepatol Res 2019;8(4):2919-2922.
- AL-Jassim, Zainab G. "Using brewer’s yeast and ginger in the management of constipation-predominant irritable bowel syndrome: a randomized double-blind placebocontrolled trial." Asian J Pharm Clin Res 12.3 (2019): 372-376.
- Daley AJ, Grimmett C, Roberts L, Wilson S, Fatek M, Roalfe A, Singh S. The effects of exercise upon symptoms and quality of life in patients diagnosed with irritable bowel syndrome: a randomised controlled trial. Int J Sports Med 2008;29:778-82.
- Johannesson E, Simrén M, Strid H, Bajor A, Sadik R. Physical activity improves symptoms in irritable bowel syndrome: a randomized controlled trial. Am J Gastroenterol 2011;106:915-22.
- Johannesson E, Ringstrom G, Abrahamsson H, Sadik R. Intervention to increase physical activity in irritable bowel syndrome shows long-term positive effects. World J Gastroenterol 2015;21:600-8.
- Flik et al. Effectiveness of psychological treatments for irritable bowel syndrome when compared to high-quality placebo control conditions: a systematic review, in: Hypnotherapy in the management of Irritable Bowel Syndrome, Utrecht, the Netherlands, 2018.
- Flik CE, Laan W, Zuithoff NPA, Van Rood YR, Smout AJPM, Weusten BLAM, et al. Efficacy of individual and group hypnotherapy in irritable bowel syndrome (IMAGINE): a multicentre randomised controlled trial. Lancet Gastroenterol Hepatol 2019;4:20-31.
- Palsson OS, Van Tilburg M. Hypnosis and guided imagery treatment for gastrointestinal disorders: experience with scripted protocols developed at the University of North Carolina. Am J Clin Hypn;58:5-21.
- Van der Veek PP, Van Rood YR, Masclee AA. Clinical trial: short- and long-term benefit of relaxation training for irritable bowel syndrome. Aliment Pharmacol Ther 2007;26:943-52.
- Billings W, Mathur K, Craven HJ, Xu H, Shin A. Potential benefit with complementary and alternative medicine in irritable bowel syndrome: a systematic review and meta-analysis. Clin Gastroenterol Hepatol 2021;19:1538-53.e14.
- Ford AC, Lacy BE, Harris LA, Quigley EMM, Moayyedi P. Effect of antidepressants and psychological therapies in irritable bowel syndrome: an updated systematic review and meta-analysis. Am J Gastroenterol 2019;114:21-39.
- Lee HH, Choi YY, Choi MG. The Efficacy of hypnotherapy in the treatment of irritable bowel syndrome: a systematic review and meta-analysis. J Neurogastroenterol Motil 2014;20:152-62.
- Li L, Xiong L, Zhang S, Yu Q, Chen M. Cognitive-behavioral therapy for irritable bowel syndrome: a meta-analysis. J Psychosom Res 2014;77:1-12.
- Park et al. Relaxation therapy for irritable bowel syndrome: a Systematic Review. Asian Nursing Research 2014;8:182-92.
- Lackner JM, Jaccard J, Radziwon CD, Firth RS, Gudleski GD, Hamilton F, et al. Durability and decay of treatment benefit of cognitive behavioral therapy for irritable bowel syndrome: 12-month follow-up. Am J Gastroenterol 2019;114:330-38.
- Everitt HA, Landau S, O'Reilly G, Sibelli A, Hughes S, Windgassen S, et al. ACTIB trial group. Assessing telephone-delivered cognitive-behavioural therapy (CBT) and web-delivered CBT versus treatment as usual in irritable bowel syndrome (ACTIB): a multicentre randomised trial. Gut 2019;68:1613-23.
- Everitt H, Landau S, Little P, Bishop FL, O'Reilly G, Sibelli A, et al. Therapist telephone-delivered CBT and web-based CBT compared with treatment as usual in refractory irritable bowel syndrome: the ACTIB three-arm RCT. Health Technol Assess 2019;23:1-154.
- Everitt HA, Landau S, O'Reilly G, Sibelli A, Hughes S, Windgassen S, et al. Cognitive behavioural therapy for irritable bowel syndrome: 24-month follow-up of participants in the ACTIB randomised trial. Lancet Gastroenterol Hepatol 2019;4:863-72.
- Peter J, Tran US, Michalski M, Moser G. The structure of resilience in irritable bowel syndrome and its improvement through hypnotherapy: cross-sectional and prospective longitudinal data. PLoS One 2018;13:e0202538.
- Jang A, Hwang SK, Padhye NS, Meininger JC. Effects of cognitive behavior therapy on heart rate variability in young females with constipation-predominant irritable bowel syndrome: a parallel-group Trial. J Neurogastroenterol Motil 2017;23:435-45.
- Ford AC, Lacy BE, Harris LA, Quigley EMM, Moayyedi P. Effect of antidepressants and psychological therapies in irritable bowel syndrome: an updated systematic review and meta-analysis. Am J Gastroenterol 2019114:21-39.
- Moser G, Trägner S, Gajowniczek EE, Mikulits A, Michalski M, Kazemi-Shirazi L, et al. Long-term success of GUT-directed group hypnosis for patients with refractory irritable bowel syndrome: a randomized controlled trial. Am J Gastroenterol 2013;108:602-9.
- Blanchard EB, Lackner JM, Sanders K, Krasner S, Keefer L, Payne A, et al. A controlled evaluation of group cognitive therapy in the treatment of irritable bowel syndrome. Behav Res Ther 2007;45:633-48.
- Payne A, Blanchard EB. A controlled comparison of cognitive therapy and self-help support groups in the treatment of irritable bowel syndrome. J Consult Clin Psychol 1995;63:779-86.
- Craske MG, Wolitzky-Taylor KB, Labus J, Wu S, Frese M, Mayer EA, et al. A cognitive-behavioral treatment for irritable bowel syndrome using interoceptive exposure to visceral sensations. Behav Res Ther 2011;49:413-21.
- Shinozaki M, Kanazawa M, Kano M, Endo Y, Nakaya N, Hongo M, et al. Effect of autogenic training on general improvement in patients with irritable bowel syndrome: a randomized controlled trial. Appl Psychophysiol Biofeedback 2010;35:189-98.
- Ruepert L, Quartero AO, De Wit NJ, Van der Heijden GJ, Rubin G, Muris JW. Bulking agents, antispasmodics and antidepressants for the treatment of irritable bowel syndrome. Cochrane Database Syst Rev 2011;CD003460.
- Ruepert L, Quartero AO, De Wit NJ, Van der Heijden GJ, Rubin G, Muris JW. Bulking agents, antispasmodics and antidepressants for the treatment of irritable bowel syndrome. Cochrane Database Syst Rev 2011:CD003460.
- Brenner DM, Fogel R, Dorn SD, Krause R, Eng P, Kirshoff R, et al. Efficacy, safety, and tolerability of plecanatide in patients with irritable bowel syndrome with constipation: results of two phase 3 randomized clinical trials. Am J Gastroenterol 2018;113:735-45
- Shah ED, Kim HM, Schoenfeld P. Efficacy and tolerability of guanylate cyclase-c agonists for irritable bowel syndrome with constipation and chronic idiopathic constipation: a systematic review and meta-analysis. Am J Gastroenterol 2018;113:329-38.
- Chey WD, Lembo AJ, Lavins BJ, Shiff SJ, Kurtz CB, Currie MG, et al. Linaclotide for irritable bowel syndrome with constipation: a 26-week, randomized, double-blind, placebo-controlled trial to evaluate efficacy and safety. Am J Gastroenterol 2012;107:1702-12.
- Rey E, Mearin F, Alcedo J, Ciriza C, Delgado-Aros S, et al. Optimizing the use of linaclotide in patients with constipation-predominant irritable bowel syndrome: an expert consensus report. Adv Ther 2017;34:587-98.
- Atluri DK, Chandar AK, Bharucha AE, Falck-Ytter Y. Effect of linaclotide in irritable bowel syndrome with constipation (IBS-C): a systematic review and meta-analysis. Neurogastroenterol Motil 2014;26:499-509.
- Johnston JM, Kurtz CB, Macdougall JE, Lavins BJ, Currie MG, Fitch DA, et al. Linaclotide improves abdominal pain and bowel habits in a phase IIb study of patients with irritable bowel syndrome with constipation. Gastroenterology 2010;139:1877-86.
- Rao S, Lembo AJ, Shiff SJ, Lavins BJ, Currie MG, Jia XD, et al. A 12-week, randomized, controlled trial with a 4-week randomized withdrawal period to evaluate the efficacy and safety of linaclotide in irritable bowel syndrome with constipation. Am J Gastroenterol 2012;107:1714-24.
- Fukudo S, Miwa H, Nakajima A, Haruma K, Kosako M, Nakagawa A, et al. A randomized controlled and long-term linaclotide study of irritable bowel syndrome with constipation patients in Japan. Neurogastroenterol Motil 2018;30:e13444.
- Fukudo S, Nakajima A, Fujiyama Y, Kosako M, Nakagawa A, Akiho H, et al. Determining an optimal dose of linaclotide for use in Japanese patients with irritable bowel syndrome with constipation: a phase II randomized, double-blind, placebo-controlled study. Neurogastroenterol Motil 2018;30:e13275.
- Yang Y, Fang J, Guo X, Dai N, Shen X, Yang Y, et al. Linaclotide in irritable bowel syndrome with constipation: a phase 3 randomized trial in China and other regions. J Gastroenterol Hepatol 2018;33:980-9.
- Cann PA, Read NW, Holdsworth CD, Barends D. Role of loperamide and placebo in management of irritable bowel syndrome (IBS). Dig Dis Sci 1984;29:239-47.
- Thimister PW, Hopman WP, Van Roermund RF, Willems HL, Rosenbusch G, Woestenborghs R, et al. Inhibition of pancreaticobiliary secretion by loperamide in humans. Hepatology 1997;26:256-61.
- Sun WM, Read NW, Verlinden M. Effects of loperamide oxide on gastrointestinal transit time and anorectal function in patients with chronic diarrhoea and faecal incontinence. Scand J Gastroenterol 1997;32:34-8.
- Lavo B, Stenstam M, Nielsen AL. Loperamide in treatment of irritable bowel syndrome--a double-blind placebo controlled study. Scand J Gastroenterol Suppl 1987;130:77-80.
- Efskind PS, Bernklev T, Vatn MH. A double-blind placebo-controlled trial with loperamide in irritable bowel syndrome. Scand J Gastroenterol 1996;31:463-8.
- Hovdenak N. Loperamide treatment of the irritable bowel syndrome. Scand J Gastroenterol Suppl 1987;130:81-4.
- Black CJ, Yuan Y, Selinger CP, Camilleri M, Quigley EMM, Moayyedi P, et al. Efficacy of soluble fibre, antispasmodic drugs, and gut-brain neuromodulators in irritable bowel syndrome: a systematic review and network meta-analysis. Lancet Gastroenterol Hepatol 2020;5:117-31.
- Alammar N, Wang L, Saberi B, Nanavati J, Holtmann G, Shinohara RT, et al. The impact of peppermint oil on the irritable bowel syndrome: a meta-analysis of the pooled clinical data. BMC Complement Altern Med 2019;19:21.
- Alam MS, Roy PK, Miah AR, Mollick SH, Khan MR, Mahmud MC, et al. Efficacy of peppermint oil in diarrhea predominant IBS - a double blind randomized placebo - controlled study. Mymensingh medical journal : MMJ. 2013;22(1):27–30. PMID: 23416804
- Cash BD, Epstein MS, Shah SM. A novel delivery system of peppermint oil is an effective therapy for irritable bowel syndrome symptoms. Dig Dis Sci. 2016;61(2):560–71. PMID: 26319955
- Capanni M, Surrenti E, Biagini MR, Milani S, Surrenh C, Galli A. Efficacy of peppermint oil in the treatment of irritable bowel syndrome: a randomized, controlled trial. Gazz med ital arch sci med [Internet]. 2005; 164(2):119–26.
- Cappello G, Spezzaferro M, Grossi L, Manzoli L, Marzio L. Peppermint oil (Mintoil((R))) in the treatment of irritable bowel syndrome: a prospective double blind placebo-controlled randomized trial. Dig Liver Dis. 2007;39(6):530–6. PMID: 17420159
- Carling L, Svedberg LE, Hulten S. Short term treatment of the irritable bowel syndrome: a placebo-controlled trial of peppermint oil against hyoscyamine. Opuscula Medica. 1989;34(3):55–7.
- Dew MJ, Evans BK, Rhodes J. Peppermint Oil for the Irritable Bowel Syndrome - a Multicenter Trial. Br J Clin Pract. 1984;38(11–1):394. PMID: 6397219
- Lech Y, Olesen KM, Hey H, Rask-Pedersen E, Vilien M, Ostergaard O. Treatment of irritable bowel syndrome with peppermint oil. A double-blind investigation with a placebo. Ugeskr Laeger. 1988;150(40):2388–9.
- Liu JH, Chen GH, Yeh HZ, Huang CK, Poon SK. Enteric-coated peppermint-oil capsules in the treatment of irritable bowel syndrome: a prospective, randomized trial. J Gastroenterol. 1997;32(6):765–8. PMID: 9430014
- Merat S, Khalili S, Mostajabi P, Ghorbani A, Ansari R, Malekzadeh R. The effect of enteric-coated, delayed-release peppermint oil on irritable bowel syndrome. Dig Dis Sci. 2010;55(5):1385–90. PMID: 19507027
- Rees WD, Evans BK, Rhodes J. Treating irritable bowel syndrome with peppermint oil. Br Med J. 1979;2(6194):835–6. PMID: 389344
- Schneider MMEOM. Efficacy of Colpermin in the treatment of patients with irritable bowel syndrome. Gastroenterology. 1990;98.
- Weiss WKC. Treatment of irritable bowel syndromewith peppermint oil capsules: results of a double blind study. Therapiewoche Osterreich. 1988;3:3–8.
- Weerts ZZRM, Masclee AAM, Witteman BJM, Clemens CHM, Winkens B, Brouwers JRBJ, et al. Efficacy and safety of peppermint oil in a randomized, double-Blind trial of patients with irritable bowel syndrome. Gastroenterology 2020;158:123-36.
- Hazel Everitt, Rona Moss-Morris, Alice Sibelli, Laura Tapp, Nicholas Coleman, Lucy Yardley, Peter Smith and Paul Little. Management of irritable bowel syndrome in primary care: the results of an exploratory randomised controlled trial of mebeverine, methylcellulose, placebo and a self-management website. BMC Gastroenterology 2013, 13:68.
- Chakraborty, D.S.; Hazra, A.; Sil, A.; Pain, S. Will controlled release mebeverine be able to surpass placebo in treatment of diarrhoea predominant irritable bowel syndrome? J. Fam. Med. Prim. Care 2019, 8, 3173–3178.
- Oh SJ, Takakura W, Rezaie A. Shortcomings of trials assessing antidepressants in the management of irritable bowel syndrome: a critical review. J Clin Med 2020;9:2933.
- VWS. Kamerbrief Proeftuinen en pilots 'betere zorg met minder kosten'. Kenmerk:110702-102148-CZ. Den Haag: Ministerie van VWS; 2013.
- Masclee GMC, Snijkers JTW, Boersma M, Masclee AAM, Keszthelyi D. Patient preferences of healthcare delivery in irritable bowel syndrome: a focus group study. BMC Gastroenterol 2021;21:438.
- Flik CE, Van Rood YR, De Wit NJ. Systematic review: knowledge and educational needs of patients with irritable bowel syndrome. Eur J Gastroenterol Hepatol 2015;27:367-71.
- Van den Bogaart E, Quanjel T, Kroese M, et al. Monitoring en evaluatie van substitutie van zorg in drie Limburgse proeftuinen – Evaluatierapport, 2019.
- Hungin AP, Whorwell PJ, Tack J, Mearin F. The prevalence, patterns and impact of irritable bowel syndrome: an international survey of 40,000 subjects. Aliment Pharmacol Ther 2003;17:643-50.
- Berry SK, Chey WD. Integrated care for irritable bowel syndrome: the future is now. Gastroenterol Clin North Am 2021;50:713-20.
- Basnayake C, Kamm MA, Salzberg MR, Wilson-O'Brien A, Stanley A, Thompson AJ. Delivery of care for functional gastrointestinal disorders: a systematic review. J Gastroenterol Hepatol 2020;35:204-10.
- Mutsekwa RN, Larkins V, Canavan R, Ball L, Angus RL. A dietitian-first gastroenterology clinic results in improved symptoms and quality of life in patients referred to a tertiary gastroenterology service. Clin Nutr ESPEN 2019;33:188-194.
- Novak KL, Halasz J, Andrews C, Johnston C, Schoombee W, Tanyingoh D, et al. Nurse-Led, shared medical appointments for common gastrointestinal conditions-improving outcomes through collaboration with primary care in the medical home: a prospective observational study. J Can Assoc Gastroenterol 2020;3:59-66.
- Williams M, Barclay Y, Harper L, Marchant C, Seamark L, Hickson M. Feasibility, acceptability and cost efficiency of using webinars to deliver first-line patient education for people with irritable bowel syndrome as part of a dietetic-led gastroenterology service in primary care. J Hum Nutr Diet 2020;33:758-66.
- Gerson CD, Gerson MJ. A collaborative health care model for the treatment of irritable bowel syndrome. Clin Gastroenterol Hepatol 2003;1:446-52.
- Basnayake C, Kamm MA, Stanley A, Wilson-O'Brien A, Burrell K, Lees-Trinca I, et al. Standard gastroenterologist versus multidisciplinary treatment for functional gastrointestinal disorders (MANTRA): an open-label, single-centre, randomised controlled trial. Lancet Gastroenterol Hepatol 2020;5:890-9.
- Chey WD, Keefer L, Whelan K, Gibson PR. Behavioral and diet therapies in integrated care for patients with irritable bowel syndrome. Gastroenterology 2021;160:47-62.