Rectaal bloedverlies
Richtlijnen diagnostiek
Naar Volledige tekst ›Anamnese
Naar Volledige tekst ›- Duur en hoeveelheid rectaal bloedverlies; al dan niet vermengd met ontlasting.
- Veranderd defecatiepatroon.
- (Peri)anale klachten: pijn, jeuk, zwelling, lekkage ontlasting en/of slijm.
- Loze aandrang.
- Koorts, buikpijn, malaise, gewichtsverlies.
- Eerdere episode met bloedverlies, hemorroïden, inflammatoire darmziekten, recente coloscopie.
- Deelname bevolkingsonderzoek darmkanker.
- Familieanamnese inflammatoire darmziekten en colorectaal carcinoom.
- Zelfzorgmiddelen, bloedverdunners, NSAID’s, SSRI’s.
- Seksueel gedrag (risico soa bij vermoeden proctitis, etiologie fissura ani).
- Traumata.
Lichamelijk onderzoek
Naar Volledige tekst ›- Bij aanzienlijk bloedverlies: meet pols en bloeddruk.
- Onderzoek van abdomen; inspectie perianale regio met goede belichting; rectaal toucher.
- Bij algemene klachten: uitgebreider lichamelijk onderzoek.
- Facultatief: proctoscopie.
Aanvullend onderzoek
Naar Volledige tekst ›- Bij recidiverend bloedverlies, onduidelijke anamnese of vermoeden van ijzergebreksanemie: Hb, MCV, ferritine.
- Bij vermoeden inflammatoire darmziekte: CRP, Hb, leukocyten, trombocyten, albumine.
- Indicatie coloscopie bij rectaal bloedverlies én:
- vermoeden van colorectaal carcinoom (bij aanwezigheid van ≥ 1 risicofactoren (zie stroomschema), recidiverend bloedverlies of andere klachten die het vermoeden op pathologie versterken, zoals loze aandrang);
- ijzergebreksanemie.
Evaluatie
Naar Volledige tekst ›- Hemorroïden: zwelling die gepaard gaat met bloedverlies en eventueel pijn. Een geprolabeerd hemorroïd is meestal reponibel.
- Getromboseerde perianale randvene: in korte tijd ontstane, pijnlijke, homogeen donkerblauw tot paarse trombusmassa.
- Fissura ani: pijnlijke laesie van de huid van de anus. Kenmerken chronische fissuur: > 4 weken aanwezig; geïndureerde wondranden; zichtbare bleke spiervezels van interne sfincter; aanwezigheid van poliep of skintag.
- Neoplasmata: de diagnose colorectaal carcinoom wordt gesteld in de tweede lijn. Bij poliepen krijgt de patiënt een surveillanceadvies.
- Vermoeden inflammatoire darmziekte: (bloederige) diarree, buikpijn en algemene klachten (bijvoorbeeld malaise). Verhoogd CRP, leukocyten, trombocyten en verlaagd Hb en albumine ondersteunen de diagnose; normale waarden sluiten de diagnose niet uit.
- Proctitis: loze aandrang en een dof, onaangenaam gevoel. Bij proctoscopie: gelig beslag, rood en makkelijk bloedend slijmvlies.
- Andere oorzaken, zoals ischemische colitis, diverticulose/diverticulitis, angiodysplasieën of iatrogene oorzaken.
Richtlijnen beleid
Naar Volledige tekst ›Hemorroïden
Naar Volledige tekst ›- Adviseer vezelrijke voeding, voldoende drinken, toegeven aan defecatiereflex en zo nodig laxeren.
- Desgewenst lokale therapie: indifferent (bijvoorbeeld vaselinecetomacrogolcrème, zinksulfaatvaselinecrème 5 mg/g of zinkoxidezetpillen 100 mg/g) of anestheticum (bijvoorbeeld lidocaïnevaselinecrème 30 mg/g, lidocaïnezinksulfaatcrème 30/5 mg/g) 2 dd en na elke ontlasting (maximaal 4 weken).
Getromboseerde perianale randvene
Naar Volledige tekst ›- Voorlichting en lokale medicamenteuze behandeling als bij hemorroïden.
- Bij veel pijnklachten: incisie (door huisarts) of verwijzen voor excisie.
Fissura ani
Naar Volledige tekst ›- Voorlichting als bij hemorroïden; lokaal anestheticum aanbrengen vóór de ontlasting.
- Bij onvoldoende verlichting van de pijn, onvoldoende genezing na 4 weken of chronische fissuur: diltiazemvaselinecrème of -gel rectaal 20 mg/g 2 dd, maximaal 12 weken.
Controles en verwijzing
Naar Volledige tekst ›Controle
Naar Volledige tekst ›- Bij recidiverend rectaal bloedverlies na genezing van de vermoedelijke oorzaak (hemorroïden, fissura ani): coloscopie ter uitsluiting van neoplasmata.
Verwijzing
Naar Volledige tekst ›- Bij persisterende of ernstige klachten van hemorroïden: verwijs naar (proctologisch deskundige) collega-huisarts, chirurg of MDL-arts die rubberbandligaturen plaatst.
- Bij persisterende klachten van fissura ani: verwijs naar (proctologisch deskundige) chirurg of dermatoloog.
- Overleg of verwijs patiënten naar een MDL-arts of internist bij:
- proctitis die onvoldoende verbetert met de ingestelde behandeling;
- vermoeden van inflammatoire darmziekte.
Belangrijkste wijzigingen
Naar Samenvatting ›- Gewichtsverlies en buikpijn zijn toegevoegd aan de risicofactoren voor colorectaal carcinoom.
- Voor sigmoïdoscopie is geen plaats meer in het diagnostisch traject voor het vaststellen of uitsluiten van een colorectaal carcinoom.
- De behandeling van fissura ani met diltiazemvaselinecrème is opgenomen in de standaard en de indicatie is uitgebreid.
- De standaard bespreekt ook de situatie bij patiënten met rectaal bloedverlies die hebben deelgenomen aan het bevolkingsonderzoek darmkanker.
- Er is een Bijlage Erfelijke darmkanker opgenomen ter identificatie van patiënten zonder rectaal bloedverlies maar met een hoog risico op familiair of erfelijk colorectaal carcinoom.
Kernboodschappen
Naar Samenvatting ›- Rectaal bloedverlies berust meestal op onschuldige aandoeningen zoals hemorroïden of fissura ani.
- Behandeling van fissura ani en hemorroïden door de huisarts bestaat met name uit voorlichting, behandeling van aanwezige comorbiditeit en zo nodig lokale medicamenteuze behandeling.
- Rectaal bloedverlies kan een aanwijzing zijn voor een ernstige aandoening, zoals een colorectaal carcinoom of een inflammatoire darmziekte.
- In combinatie met rectaal bloedverlies zijn risicofactoren voor colorectaal carcinoom: hogere leeftijd (arbitrair > 50 jaar), eerstegraads familielid met colorectaal carcinoom < 70 jaar, veranderd defecatiepatroon, bloed vermengd met de ontlasting, buikpijn, onbedoeld of onverklaard gewichtsverlies; afwezigheid van (peri)anale afwijkingen.
Inleiding
Naar Samenvatting ›Scope
Naar Samenvatting ›Diagnostiek en behandeling van volwassen mannen en vrouwen met zichtbaar rectaal bloedverlies.
Deze standaard behandelt:
- afwijkingen van anus, rectum en colon die rectaal bloedverlies veroorzaken
- diagnostiek en behandeling van onschuldige oorzaken
- diagnostiek van ernstige oorzaken
De standaard geeft de huisarts houvast voor het maken van een keuze tussen afwachtend beleid of een meer belastend aanvullend onderzoek bij patiënten met rectaal bloedverlies.
Rectaal bloedverlies is een regelmatig voorkomend verschijnsel in de algemene bevolking en bij patiënten in de huisartsenpraktijk.
- Rectaal bloedverlies wordt meestal veroorzaakt door lokale afwijkingen in het distale deel van de tractus digestivus. Het merendeel van deze afwijkingen, zoals hemorroïden en fissura ani, is onschuldig.
- Rectaal bloedverlies kan ook een aanwijzing zijn voor het bestaan van een ernstige aandoening, zoals een colorectaal carcinoom of een inflammatoire darmziekte.
- Een hevige bloeding vanuit het proximale deel van de tractus digestivus (maag of dunne darm) kan ook rectaal bloedverlies veroorzaken. De passage van het bloed verloopt dan zo snel dat er geen melena (geoxideerd bloed; zwart gekleurd en kenmerkende geur) gevormd wordt. Er is dan vaak ook hemodynamische instabiliteit.
Bloedverlies na deelname bevolkingsonderzoek
Naar Samenvatting ›In de komende jaren zullen onder de patiënten die zich op het spreekuur melden met rectaal bloedverlies, steeds meer patiënten zijn die niet lang geleden een immunologische fecaaloccultbloedtest (iFOBT) of coloscopie hebben ondergaan vanwege het bevolkingsonderzoek darmkanker. In de dagelijkse praktijk kan dit leiden tot diagnostische dilemma’s voor de huisarts.
De standaard bespreekt de situatie bij patiënten die na deelname aan het bevolkingsonderzoek rectaal bloedverlies hebben. Voor de inhoudelijke procedure van het bevolkingsonderzoek verwijst de standaard naar het voorlichtings- en scholingsmateriaal van NHG en RIVM.
Informatie voor zorgverleners:
Informatie voor patiënten:
Geen rectaal bloedverlies, wel risico colorectaal carcinoom
Naar Samenvatting ›Omdat colorectaal carcinoom een belangrijk onderdeel is van de standaard, bevat de standaard een bijlage Erfelijke darmkanker met verwijscriteria voor patiënten zonder rectaal bloedverlies maar met een hoog risico op een familiair of erfelijk colorectaal carcinoom. Dit is het enige onderdeel van deze standaard dat gaat over patiënten zonder bloedverlies.
Achtergronden
Naar Samenvatting ›Epidemiologie
Naar Samenvatting ›Incidentie en prevalentie
Naar Samenvatting ›Jaarlijks maakt ongeveer 1/5 van de algemene volwassen bevolking een episode van rectaal bloedverlies door. In de huisartsenpraktijk melden zich hiermee jaarlijks ongeveer 5 per 1000 patiënten. De verdeling over de geslachten is nagenoeg gelijk.
In een systematisch literatuuronderzoek naar de incidentie van rectaal bloedverlies in de algemene bevolking werden 9 onderzoeken geïncludeerd. In 2 onderzoeken (n = 10.364) maakte 2% van de ondervraagde (volwassen) personen melding van rectaal bloedverlies in de voorgaande 2 weken. In 4 andere onderzoeken (n = 10.088) meldde 7-16% bloedverlies in de afgelopen 6 maanden en in nog weer een ander onderzoek, onder personen van 20-90 jaar (n = 1620) rapporteerde 20% bloedverlies in het afgelopen jaar. Deze resultaten komen overeen met die van recent onderzoek. In 1995 werd een jaarincidentie gevonden van 19% bij 1200 volwassenen; de gemelde incidentie van rectaal bloedverlies daalde met het stijgen van de leeftijd, van 27% (20-29 jaar), via 14% (50-59 jaar) tot 9% (> 70 jaar).
In de Verenigde Staten werd naar 2133 volwassenen van 20-64 jaar een vragenlijst gestuurd, van wie 77% antwoordde. De prevalentie van rectaal bloedverlies was 15,5% (95%-BI 13,6 tot 17,4). Ook in dit onderzoek daalde de prevalentie van rectaal bloedverlies met het stijgen van de leeftijd, van 18,9% (20-40 jaar) tot 11,3% (> 40 jaar). Van de deelnemers met rectaal bloedverlies bezocht 13,9% een arts in het voorafgaande jaar.
De incidentie van rectaal bloedverlies (ICPC-code D16) bedroeg in 2014 5,4 per 1000 patiënten per jaar. Waarschijnlijk wordt een belangrijk deel van de patiënten die zich met rectaal bloedverlies bij de huisarts presenteren geclassificeerd in een meer specifieke categorie, hoofdzakelijk hemorroïden (K96) en fissura ani (D95).
Fijten kwam op basis van de data uit 4 registratieprojecten (die deels ook worden gebruikt in de Tweede Nationale Studie) tot een incidentie van 4-8 per 1000 patiënten per jaar. In een observationeel onderzoek vond Fijten een incidentie in de huisartsenpraktijk van 7 per 1000 patiënten per jaar; de incidentie in de verschillende participerende praktijken liep overigens uiteen van 0 tot 18.
Oorzaken rectaal bloedverlies
Naar Samenvatting ›Mogelijke oorzaken van rectaal bloedverlies:
- hemorroïden (16-35%)
- fissura ani (5-9%)
- colorectaal carcinoom (7%)
- poliepen (2-12%)
- inflammatoire darmziekte (5%)
- diverticulose (1%)
De incidentie van hemorroïden in de huisartsenpraktijk is 9 per 1000 patiënten per jaar. De incidentie is iets hoger bij vrouwen dan bij mannen, respectievelijk 10,6 versus 7,2. In een Nederlands onderzoek bij 269 patiënten met rectaal bloedverlies in de huisartsenpraktijk bleek 16% hemorroïden te hebben. In een additioneel onderzoek (n = 44) waarbij speciale maatregelen waren getroffen om patiënten te includeren en uitval te minimaliseren was dit percentage hoger, namelijk 30%. Bij een Engels onderzoek in 17 huisartsenpraktijken (n = 99) werd bij 28% van de patiënten het rectaal bloedverlies veroorzaakt door hemorroïden. In een prospectief onderzoek waarin alle patiënten met rectaal bloedverlies (n = 126) vanuit de eerste lijn werden verwezen naar de tweede lijn voor aanvullend onderzoek, was bij 35% sprake van hemorroïden.
De incidentie in de huisartsenpraktijk is 2,5 per 1000 patiënten per jaar. De incidentie is het hoogst bij vrouwen van 25-44 jaar, namelijk 4,3 per 1000.
In een onderzoek van Fijten et al., verricht in de huisartsenpraktijk (n = 269), had 7% (en 9% in het additionele onderzoek) van de patiënten rectaal bloedverlies veroorzaakt door fissura ani. Bij een Spaans onderzoek was bij 4% van de patiënten met rectaal bloedverlies sprake van fissura ani.
In meerdere onderzoeken is het vóórkomen van poliepen bij patiënten met rectaal bloedverlies bestudeerd (zie tabel 3). Hoewel met selectiebias rekening moet worden gehouden, kan worden geconcludeerd dat 2-12% van de patiënten die zich met rectaal bloedverlies bij de huisarts melden poliepen heeft. Blijkens een systematische review heeft ongeveer 7% van de patiënten met rectaal bloedverlies een colorectaal carcinoom, zie Patiëntkenmerken en colorectaal carcinoom.
| Bron | Populatie | Risico poliep (%) | Opmerkingen |
|---|---|---|---|
| Ellis 2005 | 319 patiënten ≥ 35 jaar | 12 | Risico op poliep > 1 cm of villeuze poliep bij sigmoïdoscopie 7,8% |
| Fijten 1995 | 269 patiënten 18-75 jaar | 2 | |
| Metcalf 1996 | 99 patiënten > 40 jaar | 25 | Selectiebias door patiënt die werd geattendeerd op onderzoek, en door huisarts in voordeel van klinisch relevant rectaal bloedverlies |
| Norrelund 1996 | 364 patiënten ≥ 40 jaar | 10 |
Er is een lichte stijging van de incidentie van colorectaal carcinoom. In 2000 en 2013 bedroeg de incidentie (ESR) respectievelijk 50 en 56 per 100.000 personen per jaar.
In 2013 werden 13.136 nieuwe patiënten met colorectaal carcinoom gediagnosticeerd, 7396 mannen en 5740 vrouwen. De toename van de incidentie is grotendeels toe te schrijven aan de vergrijzing.
In 2013 overleden 4940 patiënten aan de gevolgen van colorectaal carcinoom (zie http://statline.cbs.nl/statweb, geraadpleegd 18 maart 2015). De absolute aantallen per leeftijdscategorie staan in tabel 4. Vanaf de leeftijd van 50 jaar nemen de aantallen aanzienlijk toe. Tabel 5 beschrijft het gemiddelde cumulatieve risico op CRC voor de Nederlandse algemene bevolking.
| Carcinoom | Leeftijd | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 25-29 | 30-34 | 35-39 | 40-44 | 45-49 | 50-54 | 55-59 | 60-64 | 65-69 | 70-74 | 75-79 | 80-84 | |
| Colon | 13 | 14 | 41 | 121 | 200 | 394 | 624 | 985 | 1491 | 1436 | 1582 | 1201 |
| Rectum | 4 | 8 | 28 | 57 | 149 | 242 | 387 | 536 | 687 | 593 | 537 | 409 |
| Rectosigmoid | 0 | 0 | 2 | 2 | 6 | 18 | 24 | 27 | 35 | 30 | 32 | 29 |
| Bron: IKNL 2015, Nederlandse Kankerregistratie 2016. | ||||||||||||
| Tijd | Leeftijd | ||||
|---|---|---|---|---|---|
| 40 jaar | 50 jaar | 60 jaar | 70 jaar | ||
| Gemiddeld (♀ en ♂) | 10 jaar | 0,2% | 0,7% | 1,6% | 2,6% |
| Levenslang | 6,0% | 5,9% | 5,5% | 4,5% | |
| Bron: IKNL 2015. | |||||
In een prospectief onderzoek in Zuid-Limburg over de jaren 1991-1995 werden de incidenties van de ziekte van Crohn en colitis ulcerosa bepaald op respectievelijk 6,9 en 10,0 per 100.000 inwoners per jaar. In de huisartsenpraktijk is het aantal nieuwe patiënten met colitis ulcerosa 0,3 per 1000 patiënten per jaar.
Er zijn maar enkele onderzoeken die gekeken hebben naar het risico op inflammatoire darmziekten bij patiënten met rectaal bloedverlies. De cijfers variëren van 0-11% (zie tabel 6).
| Auteur jaar | Aantal personen | Populatie | Risico | Opmerkingen |
|---|---|---|---|---|
| Ellis 2005 | 319 | patiënten ( ≥ 35 jr) met rectaal bloedverlies, 3 huisartsenpraktijken | 1,9% | |
| Metcalf 1996 | 99 | patiënten (> 40 jr) met rectaal bloedverlies, huisartsenpraktijk | 11% | Selectiebias in voordeel van klinisch relevant rectaal bloedverlies, door patiënt die werd geattendeerd op onderzoek en door huisarts |
| Fijten 1993 | onderzoek (A) n = 269 onderzoek (B) n = 44 | patiënten (18-75 jr) met rectaal bloedverlies, huisartsenpraktijk | (A): proctitis 4,5%, colitis 5% (B): proctitis 0%, colitis 7% | Selectiebias in voordeel van klinisch relevant rectaal bloedverlies |
| Sanchez 2005 | 126 | patiënten (19-80 jr) met rectaal bloedverlies, huisartsenpraktijk verwezen naar tweede lijn | 4,7 | Selectiebias in voordeel van klinisch relevant rectaal bloedverlies |
De incidentie van diverticulose/diverticulitis in de huisartsenpraktijk is gemiddeld 0,7 per 1000 patiënten per jaar. De incidentie is het hoogst bij vrouwen > 75 jaar, namelijk 3,9 per 1000 patiënten. Bij mannen in dezelfde leeftijdscategorie is de incidentie 2,4 per 1000 patiënten. Zie ook de NHG-Standaard Diverticulitis.
Overige oorzaken rectaal bloedverlies
Naar Samenvatting ›Bij een aanzienlijk deel van de patiënten wordt geen oorzaak gevonden (30-40%).
De reden dat er bij ongeveer 40% van de patiënten die met rectaal bloedverlies bij de huisarts komen geen oorzaak gevonden wordt, is dat niet bij alle patiënten uitputtend onderzoek verricht wordt. In een onderzoek is bijvoorbeeld na een jaar gekeken of er een ernstige diagnose gesteld was. Was dit niet het geval, dan werd niet verder gezocht naar de oorzaak van het rectaal bloedverlies en nam men aan dat de oorzaak benigne was. Ook in huisartsregistraties wordt soms alleen rectaal bloedverlies vermeld zonder dat er een diagnose aan gekoppeld is.
Anatomie en fysiologie
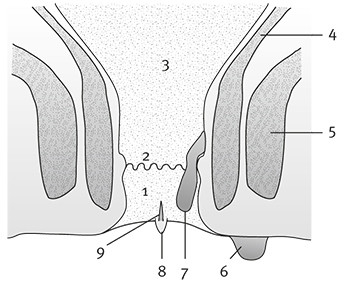
Naar Samenvatting ›Anale kanaal
Naar Samenvatting ›Het anale kanaal heeft een totale lengte van 3-4 cm en wordt distaal afgesloten door de anus, die bedekt is met verhoornend plaveiselepitheel (huid). Net proximaal van de anus (proximaal van de linea anocutanea) gaat de huid over in niet-verhoornend plaveiselepitheel dat geïnnerveerd is met somatische zenuwvezels, waardoor dit gebied zeer gevoelig is. Proximaal wordt deze intermediaire zone begrensd door de linea dentata; proximaal van de linea dentata wordt het anale kanaal bekleed door cilinderepitheel, dat niet wordt geïnnerveerd door somatische zenuwvezels.
De anus is normaal gesloten als gevolg van de contractie van de interne en externe sfincter. De interne sfincter is een spierlaag rondom het anale kanaal. De externe sfincter ligt rondom de interne sfincter en de anus, en is opgebouwd uit willekeurig spierweefsel. Deze sfincter kan extra sluitkracht leveren als dat nodig is om de continentie te handhaven.
Rectum
Naar Samenvatting ›Het rectum bevindt zich proximaal van het anale kanaal. Het anale kanaal is bekleed met slijmvlies dat niet wordt geïnnerveerd door somatische zenuwvezels.
Net boven de linea dentata, in het distale deel van het rectum, bevinden zich sponsachtige arterioveneuze zwellichamen. Deze vaatkussentjes zijn, samen met de interne en externe sfincter, belangrijk voor het lucht- en vochtdicht afsluiten van de anus. Bandligaturen voor hemorroïden worden dan ook ruim proximaal van de linea dentata aangelegd (zie ook figuur 1).
Colon
Naar Samenvatting ›Het colon wordt gekenmerkt door haustraties. Deze ontstaan door contracties van de taenia coli: een longitudinale spierlaag die in 3 bundels verloopt tot aan het rectum.
De hoofdfunctie van het colon is waterresorptie en slijmsecretie.
Etiologie en pathofysiologie
Naar Samenvatting ›Hemorroïden
Naar Samenvatting ›Hemorroïdaal weefsel is fysiologisch weefsel dat zich in het distale deel van het rectum bevindt als ondersteuning voor de continentie (corpus cavernosum recti). Het bestaat uit arterioveneuze verbindingen die functioneren als zwellichamen.
Normaliter glijdt het hemorroïdaale weefsel bij de ontlasting gedeeltelijk een stukje met de feces mee naar beneden, waarna het door spiervezels en elastisch bindweefsel weer teruggebracht wordt naar de oorspronkelijke plek.
Hemorroïden zijn pathologisch. Zij ontstaan als hemorroïdaal weefsel beschadigd raakt en bloedverlies optreedt. Door schade aan het steunweefsel kan hemorroïdaal weefsel ook (gedeeltelijk) gaan prolaberen, waardoor bloedverlies kan optreden
Er is een verband tussen het ontstaan van hemorroïden en verkeerd defecatiegedrag (obstipatie, uitstel van aandrang, persen), al dan niet in combinatie met onvoldoende inname van vezelrijke voeding en vocht.
Geprolabeerde zwellichamen hebben een verminderde veneuze return, waardoor de plexus dilateert en veneuze stasis ontstaat. Door afknelling en stuwing in het anale kanaal kunnen pijn en bloeding ontstaan. Zwangerschap, veel persen bij obstipatie en veel hoesten verhogen de kans op veneuze stuwing. Waarschijnlijk is er een verband tussen het ontstaan van hemorroïden en verkeerd defecatiegedrag (obstipatie, uitstel van aandrang, persen), al dan niet in combinatie met verkeerde eetgewoonten (vezelarm en volumearm). In diverse onderzoeken werd bij patiënten met symptomatische hemorroïden een hogere anaalsfincterspanning in rust gevonden, die normaliseert na hemorroidectomie.
Bloedverlies door hemorroïden ontstaat door beschadiging van de mucosa of door ontsteking. Over de prognose wordt in de literatuur weinig geschreven.
Klachten die passen bij inwendige hemorroïden zijn bloeding, prolaps, pijn, trombose, verlies van mucus en jeuk. Deze klachten kunnen zich ook afzonderlijk presenteren.
Hemorroïden worden ingedeeld naar hun locatie ten opzichte van de linea dentata en naar de gradatie van prolaps. Inwendige hemorroïden bevinden zich proximaal van de linea dentata en zijn bedekt met mucosa; naar de ernst van de prolaps worden ze ingedeeld volgens de Goligher-classificatie:
- graad I: normaal, niet-prolaberend hemorroïdaal weefsel;
- graad II: prolaps bij defecatie, spontaan terugtrekken van de hemorroïden;
- graad III: prolaps spontaan of bij ontlasting, manuele reductie nodig;
- graad IV: permanente prolaps, niet reduceerbaar.
Klachten
Naar Samenvatting ›- De meest gepresenteerde klacht is helderrood bloedverlies op de ontlasting, aan het toiletpapier of in de toiletpot na de ontlasting, of een prolapsgevoel.
- Jeukklachten kunnen optreden als gevolg van soiling door slijm of ontlasting, of door een andere oorzaak zoals eczeem of mycose.
- Pijn treedt op bij getromboseerde hemorroïden.
Gradering hemorroïden
Naar Samenvatting ›Hemorroïden worden ingedeeld naar de mate van prolabering naast het bloedverlies:
- graad I: alleen bij proctoscopie zichtbaar, geen prolaps
- graad II: prolaps bij persen met spontane repositie
- graad III: spontane prolaps met de mogelijkheid digitaal te reponeren
- graad IV: prolaps zonder de mogelijkheid digitaal te reponeren
Getromboseerde perianale randvene
Naar Samenvatting ›Een acuut ontstane pijnlijke zwelling van een perianale randvene wordt ook wel een ‘extern hemorroïd’ genoemd. Maar in etiologie verschilt de getromboseerde perianale randvene van de hemorroïden: bij hemorroïden is de veneuze plexus proximaal van de linea dentata gezwollen als gevolg van verzwakking van het steun- en bindweefsel, bij de randvene is trombusvorming de oorzaak van de zwelling.
Klachten van getromboseerde perianale randvenen die tijdens de zwangerschap en de bevalling zijn ontstaan, verdwijnen meestal spontaan na enkele weken.
Fissura ani
Naar Samenvatting ›Een fissura ani is een pijnlijke, radiaire laesie van de huid van het distale deel van het anale kanaal. Naast pijn is er tijdens en vlak na de defecatie vaak (meestal gering) helderrood bloedverlies op de feces of op het toiletpapier.
De fissuur bevindt zich meestal aan de posterieure commissuur (in rugligging op zes uur), omdat de doorbloeding daar minder is dan in de overige anale kwadranten.
Een acute fissuur ontstaat waarschijnlijk door een verwonding van het anale kanaal, mogelijk door obstipatie en passage van harde feces. Er ontstaat dan vaak een vicieuze cirkel: fissuur − pijn bij defecatie − angst voor pijn en daarom uitstellen van defecatie – obstipatie – fissuur. Een voorafgaande periode van diarree of anaal seksueel contact worden eveneens als oorzakelijke factoren genoemd.
Zelden worden fissuren gezien in het kader van aandoeningen als ziekte van Crohn en colitis ulcerosa.
Als een acute fissuur niet geneest, kan na enkele weken een chronische fissuur ontstaan. De definitie van ‘chronische fissuur’ is niet eenduidig. Er wordt gesproken van een chronische fissuur bij een klachtenduur langer dan 4-6 weken of bij aanwezigheid van de volgende klinische kenmerken: geïndureerde wondranden; zichtbare bleke spiervezels van de interne sfincter; hypertrofische anale poliep (gezwollen papil ter hoogte van de linea dentata) proximaal van de fissuur; skintag (uitwendig oedemateus huidflapje, ook wel mariske genoemd) distaal van de fissuur.
Aangenomen wordt dat de pijn van een acute fissuur (radiaire laesie van het distale deel van het anale kanaal) reflectoir een verhoogde sfincterspanning veroorzaakt, waarna een vicieuze cirkel ontstaat: verhoogde sfincterspanning − obstipatie − harde feces − fissuur − pijn − verhoogde sfincterspanning. De verhoogde tonus van de interne sfincter met een daaruit voortvloeiende verminderde doorbloeding en genezingstendens lijken ook een rol te spelen bij het persisteren van de fissuur. Er is een directe relatie aangetoond tussen de tonus van de interne sfincter en de doorbloeding van de posterieure commissuur: hoe hoger de sfincterspanning, des te minder is de doorbloeding van de commissuur. Bekend is dat patiënten met chronische fissuren in rust een hoge tonus van de interne sfincter hebben, met inadequate kortdurende relaxaties. Deze hypertonie en het onvermogen tot relaxatie van de interne sfincter veroorzaken compressie van de eindarteriën die door de interne sfincter lopen, en daarmee ischemie van de anodermis. De soms hevige pijn wordt waarschijnlijk gedeeltelijk verklaard door ischemie. Het is niet opgehelderd waarom sommige acute fissuren genezen en andere chronisch worden.
Bij patiënten met colitis ulcerosa en de ziekte van Crohn vindt men (vaak meerdere) fissuren die breed en buiten de mediaanlijn gelegen zijn. Bij de ziekte van Crohn staan de ulceraties en ontstekingsverschijnselen van de fissuren meer op de voorgrond. Ook komen fissuren voor bij andere aandoeningen, zoals tuberculose en leukemie.
Neoplasmata en poliepen
Naar Samenvatting ›Neoplasmata (adenomen, colorectaal carcinoom, anuscarcinoom) zijn weinig frequente oorzaken van rectaal bloedverlies.
Een colorectaal carcinoom ontwikkelt zich vanuit normale mucosa via adenomateuze poliep en adenoom tot een invasief groeiend carcinoom. Het doorlopen van deze stadia kan 10-20 jaar duren.
De meest voorkomende darmpoliep is de tubulaire adenomateuze poliep; het risico op maligne ontaarding is bij dit type minder groot dan bij de villeuze adenomateuze poliep.
Grotere poliepen in het rectum en sigmoïd zijn goed gevasculariseerd en bloeden vaak als gevolg van passerende feces. Het bloedverlies ontstaat dan met name tijdens defecatie.
De hoger gelegen poliepen bloeden minder vaak. Er is zelden hevig bloedverlies.
Er zijn drie soorten darmpoliepen, namelijk juveniele, hyperplastische en adenomateuze. De adenomateuze poliep wordt verder onderverdeeld in tubulair, villeus en tubulovilleus, en wordt als premaligne beschouwd. Van de adenomateuze poliepen is 40-70% gelokaliseerd in het rectum of het sigmoïd. Er lijkt een tendens te bestaan dat ze vaker voorkomen in het colon ascendens. Een derde van de patiënten heeft meerdere poliepen. Van de adenocarcinomen is 60% gelokaliseerd in het rectumsigmoïd.
Circa 70% van de coloncarcinomen ontwikkelt zich via de klassieke adenoom-carcinoomsequentie: normaal epitheel – poliep – adenoom – carcinoom. De verschillende stadia, die histologisch zijn te onderscheiden, gaan gepaard met een toenemende hoeveelheid mutaties in proto-oncogenen en tumorsuppressorgenen. Er zijn aanwijzingen dat er ook andere ontwikkelingsstadia zijn, waaronder de serrated pathway, maar hierover is minder bekend.
In een onderzoek in Florida onder 9550 patiënten met colorectaal carcinoom liet zien dat de tumor ten tijde van de diagnose bij 42% proximaal gelokaliseerd was, in colon ascendens en colon transversum. De onderzoekers keken vooral naar demografische factoren en comorbiditeit: vrouwelijk geslacht, hogere leeftijd en comorbiditeit (hartfalen, ulcus pepticum, diabetes mellitus) waren geassocieerd met een proximale lokalisatie.
Zuid-Koreaans onderzoek liet zien dat diabetes mellitus geassocieerd was met een distale lokalisatie en galstenen met een proximale lokalisatie. Het betrof 523 patiënten met een colorectaal carcinoom (waarvan 77% distaal), die allen vóór de operatie een vragenlijst hadden ingevuld. De symptomen buikpijn, gewichtsverlies en palpabele massa in de buik kwamen frequenter voor bij een proximale lokalisatie. Ook werd vaker een lager Hb gezien. De symptomen rectaal bloedverlies en vervormde ontlasting werden meer gezien bij een distale lokalisatie.
Adenoom
Naar Samenvatting ›Een adenoom is een premaligne laesie. De ontwikkeling tot carcinoom hangt af van verschillende factoren, zoals grootte van de laesie, mate van dysplasie en morfologie.
Het risico op maligne ontaarding van adenomen wordt per 10 jaar geschat op < 1 cm: 1-3% en > 1 cm: 10-20%. Het ontstaan van colorectaal carcinoom is geassocieerd met diverse omgevingsfactoren, waaronder overmatig alcoholgebruik, adipositas en consumptie van rood of bewerkt vlees.
De ontwikkeling van colorectaal carcinoom is geassocieerd met een aantal omgevingsfactoren. De in hier beschreven onderzoeken zijn uitgevoerd in de algemene bevolking en niet specifiek bij patiënten met klachten.
In EPIC, een Europees multicentrisch prospectief cohortonderzoek, is de relatie onderzocht tussen dieet, diverse leefstijlen en omgevingsfactoren en de incidentie van kanker. Tussen 1992 en 2000 zijn 400.000 personen (afhankelijk van omgevingsfactor) geïncludeerd, die ongeveer 6 jaar werden gevolgd. Alcoholconsumptie verhoogde het risico op colorectaal carcinoom, waarbij het risico toenam bij een inname van > 3 eenheden per dag. Bij mannen waren gewicht en BMI gerelateerd aan het ontstaan van coloncarcinoom: het relatieve risico voor een gewicht ≥ 90 kg versus < 71 kg was 1,43 (95%-BI 1,02 tot 2,02), het relatieve risico voor BMI ≥ 29,4 versus < 23,6 was 1,55 (95%-BI 1,12 tot 2,15).
De gezondheidsraad concludeert dat het aannemelijk is dat er een verband is tussen de consumptie van rood vlees en bewerkt vlees en een hoger risico op colorectaal carcinoom: het relatief risico is 1,10-1,21 bij 100 g rood vlees per dag en 1,16-1,19 bij 50 g bewerkt vlees per dag.
Conclusie
Het ontstaan van colorectaal carcinoom is geassocieerd met diverse omgevingsfactoren, waaronder overmatig alcoholgebruik, adipositas en consumptie van rood en bewerkt vlees.
Er zijn verschillende soorten onderzoeken gedaan naar de diagnostische waarde van rectaal bloedverlies en additionele symptomen voor het risico op CRC. Hier worden de review’s besproken van Olde Bekkink et al. en Del Giudice et al., en het predictieonderzoek van Hippisley-Cox et al.
In de huisartsenpraktijk is een CRC de oorzaak van het rectaal bloedverlies bij ongeveer 7% van alle volwassen patiënten met deze klacht. Uit het enige Nederlandse onderzoek kwam een percentage van 3% naar voren. Het is voor de huisarts belangrijk te weten of er combinaties zijn van symptomen en anamnestische gegevens die bij de individuele patiënt een gefundeerde risico-inschatting van ernstige pathologie mogelijk maken.
Een review van 8 onderzoeken (n = 2323) naar de diagnostische waarde van additionele symptomen bij rectaal bloedverlies in de eerste lijn vond dat de toegevoegde waarde van deze symptomen voor de diagnose ‘CRC’ gering is. Leeftijd > 60 jaar, gewichtsverlies, veranderd defecatiepatroon en bloed vermengd met de ontlasting waren de kenmerken die het risico op een CRC bij presentatie met rectaal bloedverlies het meest deden toenemen. Daarnaast was het bestaan van een anemie geassocieerd met een groter risico op CRC.
Een recentere review van 27 eerstelijns onderzoeken (n = 2.862.306) en 5 meta-analyses kwam tot grotendeels dezelfde conclusies. Tabel 7 toont de relatieve invloed van de onderzochte patiëntkenmerken op het ontstaan van CRC.
| Kenmerk | Sensitiviteit (95%-BI)* | Specificiteit (95%-BI)* | LR (95%-BI)* | PVW (spreiding)† |
|---|---|---|---|---|
| Patiëntkenmerken | ||||
| Leeftijd > 50 jaar | 5,9 (4 tot 11)‡ | |||
| Mannelijk geslacht | 0,58 (0,48 tot 0,67) | 0,52 (0,48 tot 0,56) | 1,21 (1,00 tot 1,46) | – |
| Familieanamnese colorectaal carcinoom | 0,15 (0,06 tot 0,28) | 0,85 (0,82 tot 0,87) | 1,05 (0,16 tot 6,88) | – |
| Symptomen | ||||
| Donkerrood bloedverlies | 0,22 (0,13 tot 0,34) | 0,84 (0,69 tot 0,93) | 1,37 (0,59 tot 3,30) | 9,7 (7,4 tot 17) |
| Gewichtsverlies | 0,17 (0,06 tot 0,37) | 0,91 (0,83 tot 0,96) | 1,89 (1,03 tot 3,07) | 13 (4,7 tot 23) |
| Buikpijn | 0,25 (0,04 tot 0,62) | 0,73 (0,52 tot 0,89) | 0,94 (0,19 tot 1,59) | 5,1 (1,7 tot 23) |
| Veranderd defecatiepatroon | 0,62 (0,18 tot 0,94) | 0,68 (0,53 tot 0,80) | 1,92 (0,54 tot 3,57) | 10,5 (9,2 tot 27) |
| Bloed vermengd met ontlasting | 0,40 (0,04 tot 0,93) | 0,81 (0,23 tot 0,98) | 1,91 (0,75 tot 5,51) | 11,0 (3,0 tot 21) |
| Afwezigheid van perianale symptomen | – | – | – | 10,8 (6,9 tot 18) |
| Diagnostische test | ||||
| Anemie | 0,17 (0,05 tot 0,35) | 0,95 (0,93 tot 0,96) | 3,67 (1,30 tot 10,35) | 11,0 (7,7 tot 41)§ |
| LR = likelihoodratio (LR > 1 beduidt groter risico; LR < 1 beduidt kleiner risico); PVW = positief voorspellende waarde. * Bron: Olde Bekkink 2010 † Bron: Del Giudice 2014. | ||||
In een prospectief cohortonderzoek is de voorspellende waarde onderzocht van diverse symptomen en risicofactoren voor het risico op diverse soorten maligniteiten, waaronder CRC. Geïncludeerd werden in totaal 3.587.653 gezonde patiënten van 30-84 jaar die tussen 2000 en 2012 geregistreerd stonden in 776 huisartsenpraktijken. De onderzoekers ontwikkelden een algoritme op basis van 224 praktijken en valideerden dit in 452 praktijken. De gemiddelde leeftijd bedroeg 50 jaar. Er werden risico’s berekend voor mamma-, long-, colorectaal, maag-, slokdarm-, pancreas-, ovarium-, niercel- en cervixcarcinoom, voor maligniteit van de uterus, voor hematologische maligniteit, en voor ‘overige maligniteiten’). Bij aanvang werd een aantal risicofactoren bepaald, waaronder leeftijd, BMI, roken, alcoholgebruik, eerdere diagnose carcinoom, anemie en belaste familieanamnese. ‘Afwezigheid van perianale symptomen’ en ‘bloed vermengd met ontlasting’ zijn niet meegenomen in de analyse. De primaire uitkomstmaat was de diagnose ‘kanker’ 2 jaar na start van het onderzoek.
De onderzoekers gingen uit van de volgende predictoren: (1) nieuwe klacht van rectaal bloedverlies, verminderde eetlust of gewichtsverlies; in de voorgaande 12 maanden (2) anemie, (3) opgezette buik, (4) obstipatie, (5) diarree, (6) verandering van defecatiepatroon of (7) vermoeidheid; (8) leeftijd; (9) BMI; (10) alcoholgebruik (0, < 1, 1-2 of ≥ 3 glazen per dag); (11) roken;(12) postcode; (13) gastro-intestinaal carcinoom in de familieanamnese; (14) eerdere diagnose maligniteit (niet colorectaal); (15) inflammatoire darmziekte (ziekte van Crohn, colitis ulcerosa, coeliakie); (16) darmpoliep in de voorgeschiedenis; (17) diabetes mellitus. Na een eerste analyse werd er een definitieve set predictoren vastgesteld:
- alcoholgebruik;
- belaste familieanamnese voor gastro-intestinaal carcinoom;
- anemie in de voorgaande 12 maanden;
- actuele klachten van rectaal bloedverlies, buikpijn, verminderde eetlust en verandering van defecatiepatroon (alleen bij mannen).
Rectaal bloedverlies kwam voor bij 2% van de onderzoekspopulatie, dit percentage was voor mannen en vrouwen gelijk. Gedurende de follow-up van 2 jaar werd de diagnose ‘CRC’ gesteld bij 4798 deelnemers in de onderzoeksgroep en 2603 in de validatiegroep.
| Kenmerk | 30 jaar | 40 jaar | 50 jaar | 60 jaar | 70 jaar | 80 jaar | ||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ♂ | ♀ | ♂ | ♀ | ♂ | ♀ | ♂ | ♀ | ♂ | ♀ | ♂ | ♀ | |
| Rectaal bloedverlies (als enige symptoom) | 0,03 | 0,03 | 0,24 | 0,24 | 1,06 | 0,79 | 2,84 | 1,67 | 5,09 | 2,76 | 6,61 | 3,94 |
| In combinatie met rectaal bloedverlies: | ||||||||||||
| - alcoholgebruik ≥ 3 per dag | 0,05 | 0,05 | 0,38 | 0,37 | 1,64 | 1,24 | 4,34 | 2,62 | 7,7 | 4,3 | 9,92 | 6,09 |
| - belaste familieanamnese CRC | 0,05 | 0,04 | 0,37 | 0,35 | 1,58 | 1,17 | 4,2 | 2,48 | 7,44 | 4,08 | 9,6 | 5,79 |
| - anemie in de voorgaande 12 maanden | 0,13 | 0,13 | 0,98 | 1,02 | 4,16 | 3,32 | 10,5 | 6,83 | 17,59 | 10,86 | 21,87 | 14,87 |
| - buikpijn | 0,14 | 0,13 | 1,1 | 1,04 | 4,64 | 3,41 | 11,6 | 7,01 | 19,26 | 11,15 | 23,82 | 15,26 |
| - verminderde eetlust | 0,05 | 0,05 | 0,42 | 0,39 | 1,8 | 1,29 | 4,71 | 2,73 | 8,23 | 4,46 | 10,51 | 6,29 |
| - veranderd defecatiepatroon in de voorgaande 12 maanden | 0,11 | 0,6 | 0,89 | 0,5 | 3,76 | 1,67 | 9,63 | 3,52 | 16,35 | 5,74 | 20,49 | 8,07 |
| - gewichtsverlies | 0,09 | 0,08 | 0,73 | 0,65 | 3,12 | 2,16 | 7,95 | 4,5 | 13,42 | 7,27 | 16,78 | 10,1 |
| Bron: Hippisley-Cox 2012. | ||||||||||||
Leeftijd: Een duidelijke leeftijdsgrens waarbij het risico op CRC significant toeneemt, is er niet, maar de werkgroep is van mening dat het risico op CRC in de gehele bevolking vanaf ongeveer 50 jaar duidelijk stijgt (zie Epidemiologie van colorectaal carcinoom). De verschillende reviews laten de scherpste stijging van het risico op CRC bij de combinatie van rectaal bloedverlies en leeftijd > 60 jaar. De ondergrens voor het bevolkingsonderzoek darmkanker is gesteld op 55 jaar. Omdat de absolute aantallen vanaf ongeveer 50 jaar duidelijk stijgen, stelt de werkgroep als risicofactor een leeftijd > 50 jaar. Dit is een arbitraire grens, geen strikte leeftijdsgrens.
Buikpijn: De positief voorspellende waarde van buikpijn bedroeg in een review 5,1, met een spreiding van 1,7 tot 23. In de andere review was het symptoom ‘buikpijn’ van mindere waarde (LR 0,94; 95%-BI 0,19 tot 1,59). In het predictiemodel komt buikpijn naar voren als een risicofactor voor CRC (zie tabel 8).
Gewichtsverlies: Het is algemeen bekend dat maligniteiten in een gevorderd stadium gewichtsverlies veroorzaken. De mate van het gewichtsverlies wordt in onderzoeken echter meestal niet gekwantificeerd. Er zijn geen criteria voor abnormaal gewichtsverlies. De werkgroep gaat bij volwassenen uit van onverklaard of onbedoeld gewichtsverlies van meer dan 5% van het oorspronkelijk gewicht ontstaan in een tijdsbestek van 1 maand, of van 10% in een periode van 6 maanden.
Afwezigheid van perianale afwijkingen: De aanwezigheid van perianale afwijkingen (anders dan eczeem of jeuk) lijkt het risico op de aanwezigheid van CRC te verminderen.
Anemie: Over de diagnostische waarde van een hemoglobinebepaling bij het vermoeden van een CRC zonder klinische tekenen van anemie is een beperkt aantal artikelen verschenen. In een onderzoek onder 9143 patiënten met CRC (totale populatie 2.800.000) bleek dat de combinatie van anemie en rectaal bloedverlies een hogere positief voorspellende waarde had voor CRC dan anemie alleen (PVW 2,7; 95%-BI 2,3 tot 3,2), en dan rectaal bloedverlies alleen (PVW 1,5; 95%-BI 1,3 tot 1,7).
In een Engels patiënt-controleonderzoek onder 349 eerstelijns patiënten met CRC en 1744 controlepersonen bleek rectaal bloedverlies met anemie een hogere positief voorspellende waarde te hebben (3,2%) dan rectaal bloedverlies alleen (2,4%). Omdat de auteurs de ondergrens voor verwijzing bepaalden op een risico van ≥ 2% was rectaal bloedverlies alleen ook voldoende voor een verwijzing.
In de review uit 2010 leek anemie sterk bij te dragen aan het risico op CRC (zie tabel 7). De likelihoodratio van 3,67 is echter gebaseerd op twee onderzoeken, waarvan er één een beschrijvend onderzoek was (422 patiënten met rectaal bloedverlies, van wie 4% met een CRC) dat niet tot doel had de diagnostische waarde van een Hb-bepaling te berekenen. Ook in het andere onderzoek (269 patiënten, van wie 3% met een CRC) was het doel van de Hb-bepaling niet duidelijk. In het predictieonderzoek is anemie niet onderzocht in combinatie met rectaal bloedverlies.
Alcoholgebruik: Uit epidemiologisch onderzoek komt naar voren dat alcoholgebruik geassocieerd is met het ontstaan van CRC (zie ook Omgevingsfactoren en colorectaal carcinoom in de algemene bevolking). Uit het predictieonderzoek blijkt dat ook op individueel niveau de alcoholinname is geassocieerd met het risico op CRC. Omdat dit uit de twee reviews echter niet naar voren komt, is alcoholinname niet toegevoegd aan de set risicofactoren.
Overig: Een eerste episode van of een verandering in rectaal bloedverlies kan mogelijk een aanwijzing zijn voor pathologie, maar daar is momenteel nog onvoldoende wetenschappelijke onderbouwing voor. In één onderzoek is aangetoond dat een verandering van rectaal bloedverlies gepaard gaat met een toegenomen risico op een CRC. De werkgroep is van mening dat bij recidiverend rectaal bloedverlies waarbij aanvankelijk een benigne oorzaak gevonden wordt, de huisarts alert moet zijn op een mogelijke andere oorzaak.
Combinatie van patiëntkenmerken: In één onderzoek is aangetoond dat combinaties van patiëntkenmerken en symptomen het risico op CRC doen toenemen. Zo zou bij een 70-jarige het risico (predicted probability) op CRC bij een veranderd defecatiepatroon verdubbelen van 0,43 naar 0,86 als daarnaast ook sprake is van bloed vermengd met de ontlasting. Bij een 60-jarige zou het risico zelfs verviervoudigen (van 0,09 naar 0,44).
In het Engelse patiënt-controleonderzoek onder 349 eerstelijns patiënten werd voor rectaal bloedverlies een positief voorspellende waarde gevonden van 2,4%. Dit nam toe in combinatie met andere symptomen: met gewichtsverlies tot 4,7%, met buikpijn tot 3,1%, met abdominal tenderness tot 4,5% en met afwijkend rectaal toucher tot 8,5%.
Uit het predictieonderzoek komt eveneens naar voren dat combinaties van risicofactoren het risico op CRC doen toenemen.
Conclusie
Rectaal bloedverlies geeft een verhoogd risico op CRC. Dit risico neemt toe in combinatie met een hogere leeftijd, een veranderd defecatiepatroon, bloed vermengd met de ontlasting, buikpijn of gewichtsverlies. Bij meerdere risicofactoren is er de toename van het risico groter. Ook anemie is risicoverhogend, al is niet duidelijk bij welke groep patiënten een Hb-bepaling geïndiceerd is. Om overdiagnostiek te voorkomen heeft de werkgroep ervoor gekozen het hemoglobine alleen te bepalen als er een indicatie is of wanneer er geen verklaring voor het rectaal bloedverlies gevonden kan worden. Alcoholgebruik is een aandachtspunt tijdens het consult, maar is niet bepalend voor het beleid.
Colorectaal carcinoom
Naar Samenvatting ›Van alle colorectale carcinomen is ongeveer 5% erfelijk. Voorbeelden zijn het Lynch-syndroom en familiaire adenomateuze polyposis (FAP).
Familiaire clustering van colorectale carcinomen zonder bekende erfelijke vorm komt voor bij 15-20% van de patiënten.
Kader Risicofactoren voor colorectaal carcinoom bij een patiënt met rectaal bloedverlies
Naar Samenvatting ›Bij een patiënt met de klacht rectaal bloedverlies verhogen de volgende kenmerken onafhankelijk van elkaar het risico:
- hogere leeftijd (arbitrair > 50 jaar)
- eerstegraads familielid met colorectaal carcinoom < 70 jaar
- veranderd defecatiepatroon
- bloed vermengd met ontlasting
- buikpijn
- onbedoeld en/of onverklaard gewichtsverlies
- afwezigheid van zichtbare (peri)anale afwijkingen
Anuscarcinoom
De meeste anuscarcinomen zijn plaveiselcelcarcinomen. Carcinomen uitgaande van het bovenste gedeelte van het anale kanaal zijn meestal een gemengd plaveiselcelcarcinoom en adenocarcinoom (adenosquameus carcinoom).
Er is een verhoogd risico op anuscarcinoom bij:
- hiv-positiviteit
- HPV-besmetting
- mannen die seks hebben met mannen (MSM)
- immunosuppressie
- voorgeschiedenis met vulva- of cervixcarcinoom
De volgende groepen hebben een verhoogd risico op anuscarcinoom: hiv-positieve mannen die seks hebben met mannen (MSM), hiv-negatieve MSM, hiv-positieve vrouwen, transplantatiepatiënten, vrouwen met een vulva- of cervixcarcinoom in de voorgeschiedenis.
Bij een onderzoek in de Verenigde Staten werden 119 mannen en 187 vrouwen geïnterviewd bij wie een anuscarcinoom was vastgesteld tussen 1986 en 1998, en werkten 1700 controlepatiënten met een andere genitale maligniteit mee aan een interview en een bloedonderzoek. Roken, anale seks, HPV-infectie en aantal seksuele partners lijken van invloed te zijn op de stijgende incidentie van anuscarcinoom. Van de deelnemers met anuscarcinoom was 88% positief voor humaan papillomavirus (HPV), waarvan 73% met HPV-16 en 6,9% met HPV-18, ongeacht geslacht. Van de MSM met een anuscarcinoom was 97,7% HPV-positief. Mannen of vrouwen met ≥ 15 seksuele partners hadden een verhoogd risico op anuscarcinoom (mannen OR 5,3; 95%-BI 2,4 tot 12,0; vrouwen OR 11,0; 95%-BI 5,5 tot 22,1). Rokers hadden onafhankelijk van geslacht, leeftijd en andere risicofactoren een verhoogd risico op het ontwikkelen van een anuscarcinoom.
Uit een onderzoek waarin 208 patiënten met anuscarcinoom en 208 controlepatiënten werden geïnterviewd, bleken condylomen, syfilis, ernstige hemorroïden, fysieke inactiviteit, meerdere seksuele partners en roken het risico op anuscarcinoom bij vrouwen te verhogen; bij mannen was naast de genoemde factoren ook anale seks risicoverhogend.
Inflammatoire darmziekten
Naar Samenvatting ›Rectaal bloedverlies kan worden veroorzaakt door een inflammatoire darmziekte, bijvoorbeeld ziekte van Crohn, colitis ulcerosa en proctitis.
Bij patiënten met inflammatoire darmziekten is het risico op colorectaal carcinoom verhoogd.
Veel aangehaalde meta-analyses hebben gerapporteerd dat zowel prevalentie van als cumulatief risico op CRC sterk verhoogd is bij patiënten met colitis ulcerosa en ziekte van Crohn van het colon. Uit recenter populatieonderzoek kwam naar voren dat het risico voor deze patiënten minder sterk verhoogd is, of zelfs dat de incidentie van CRC in deze populatie vergelijkbaar is met die in de algemene bevolking. Een recente meta-analyse, waarin ook populatieonderzoeken zijn opgenomen, levert voor de populatie patiënten met colitis ulcerosa en ziekte van Crohn een gestandaardiseerde incidentieverhouding op van 1,7. Het risico op CRC is het hoogst bij patiënten met uitgebreide ziekte, patiënten met een chronisch actieve ziekte, patiënten met primair scleroserende cholangitis en patiënten met een positieve familieanamnese voor CRC.
Ziekte van Crohn
Naar Samenvatting ›De ziekte van Crohn leidt niet altijd tot rectaal bloedverlies, omdat deze ziekte zich vooral manifesteert in het terminale ileum en het colon ascendens. Als het ziekteproces gelokaliseerd is in het colon descendens of het rectum, is er vaak wel rectaal bloedverlies. Alle lagen van de wand van het maag-darmkanaal zijn bij het ontstekingsproces betrokken.
Colitis ulcerosa
Naar Samenvatting ›Colitis ulcerosa is een chronische ontsteking van de mucosa van het colon en/of rectum. Colitis ulcerosa leidt tot nogal bloederige diarree, met buikpijn en loze aandrang.
Proctitis
Naar Samenvatting ›Proctitis is een ontsteking die beperkt blijft tot het rectum. Een proctitis kan rectaal bloedverlies met loze aandrang en een dof onaangenaam gevoel veroorzaken, bij meestal normale ontlasting.
Proctitis kan een uiting zijn van:
- colitis ulcerosa
- ziekte van Crohn
- een soa zoals gonorroe, syfilis of Chlamydia-infectie (zie de NHG-Standaard Het soa-consult)
- een infectie met het herpessimplex- of cytomegalovirus bij immuungecompromitteerde patiënten
Niet altijd wordt de oorzaak gevonden, men spreekt dan van idiopathische proctitis.
Ischemische colitis
Naar Samenvatting ›Ischemische colitis is een bijzondere vorm van colitis die veroorzaakt wordt door een passagère ischemie waardoor de mucosa van de darm, die gevoelig is voor ischemie, loslaat.
Ischemische colitis komt vooral voor bij ouderen, meestal na een periode van hypotensie. De ernst van de klachten (bloederige diarree, krampende buikpijn) hangt af van de duur van de ischemie; na kortdurende ischemie kan de darmwand geheel genezen. Ongeveer de helft van de patiënten geneest spontaan. Complicaties zijn gangreen en perforatie, stricturen of chronische colitis.
Diverticulose en diverticulitis
Naar Samenvatting ›Diverticulose en diverticulitis kunnen rectaal bloedverlies veroorzaken, soms in grote hoeveelheden.
Een divertikel is een uitstulping van de mucosa, submucosa en serosa door de spierwand aan de mesenteriale zijde van de darm, meestal het sigmoïd. Een divertikelbloeding ontstaat door een ruptuur van een arteriole in het divertikel. Deze arteriële bloedingen veroorzaken in het algemeen geen pijn en zijn vaak zelflimiterend (zie ook de NHG-Standaard Diverticulitis).
Infectieuze aandoeningen
Naar Samenvatting ›Rectaal bloedverlies kan het gevolg zijn van een infectieuze aandoening van het colon. Dit kan een teken zijn van een ernstig beloop van de ziekte.
Zie voor infectieuze enterocolitis, de NHG-Standaard Acute diarree.
Specifieke infecties die rectaal bloedverlies kunnen geven zijn:
- tuberculose
- overgroei van Clostridium difficile na antibioticagebruik
Angiodysplasieën
Naar Samenvatting ›Angiodysplasieën zijn vasculaire malformaties die zich bevinden in de (sub-) mucosa, vooral in het caecum en colon ascendens. Bloedingen komen vooral voor bij ouderen; bij 90% van de patiënten stoppen ze spontaan.
De exacte etiologie is vooralsnog onbekend. Een theoretische verklaring is dat angiodysplasieën ontstaan door obstructie van submucosale venen op het punt waar deze door de spierlagen van het colon gaan. Door herhaalde episoden van obstructie ontstaan dilataties in de arterioveneuze vaten, met als gevolg een intermitterende bloeding.
Iatrogene oorzaken en traumata
Naar Samenvatting ›Bestralingsproctitis
Naar Samenvatting ›Tijdens of direct na radiotherapie in het kleine bekken (meestal van de prostaat) kan een bestralingsproctitis ontstaan, met bloederige diarree, loze aandrang en buikpijn.
Een latere complicatie van bestraling is chronische proctitis. Het gaat dan niet om werkelijke proctitis, maar om door bestraling geïnduceerde, gemakkelijk bloedende teleangiëctasieën.
Geneesmiddelengebruik
Naar Samenvatting ›Een andere iatrogene oorzaak van rectaal bloedverlies is geneesmiddelengebruik. Rectaal bloedverlies kan ontstaan door:
- orale anticoagulantia: cumarines, DOAC’s
- trombocytenaggregatieremmers: acetylsalicylzuur, clopidogrel
- NSAID’s: oraal, rectaal, per injectie en in aanzienlijk mindere mate door regelmatig dermaal gebruik van grote hoeveelheden NSAID-gel
Bij combinatie van NSAID’s met de volgende middelen neemt het risico op bloedverlies verder toe:
- andere trombocytenaggregatieremmers
- orale anticoagulantia
- corticosteroïden
- SSRI’s
- spironolacton
Bij bloedingen door cumarines kan sprake zijn van een onderliggende aandoening zoals een carcinoom of diverticulitis.
Cumarinederivaten, DOAC’s en trombocytenaggregatieremmers kunnen een al dan niet occulte bloeding in de tractus digestivus veroorzaken. De frequentie van ernstige bloedingen door cumarinederivaten is 0,1-3% per behandelingsjaar; vaak bij patiënten met een onderliggende aandoening zoals carcinoom, diverticulitis of een ulcus zonder klachten. NSAID’s kunnen niet alleen een bloeding in de tractus digestivus veroorzaken, maar na rectale toediening ook een proctitis. Het bloedingsrisico neemt toe bij combinatie van NSAID’s met corticosteroïden, anticoagulantia, acetylsalicylzuur, SSRI’s of spironolacton, en bij combinatie van cumarines met acetylsalicylzuur.
Het relatief risico van een maag-darmbloeding door SSRI-gebruik is 3, wat vergelijkbaar is met het risico van laaggedoseerd ibuprofen, maar neemt toe tot 12 bij SSRI-gebruik in combinatie met NSAID’s.
Oestrogenen, penicillinen, clindamycine, goudverbindingen en isotretinoïne kunnen in zeldzame gevallen een colitis veroorzaken en daardoor leiden tot bloedverlies.
Traumata
Naar Samenvatting ›Traumata die rectaal bloedverlies veroorzaken, kunnen onder andere ontstaan door seksueel gedrag of seksueel misbruik, maar ook thermometerlaesies komen voor.
Richtlijnen diagnostiek
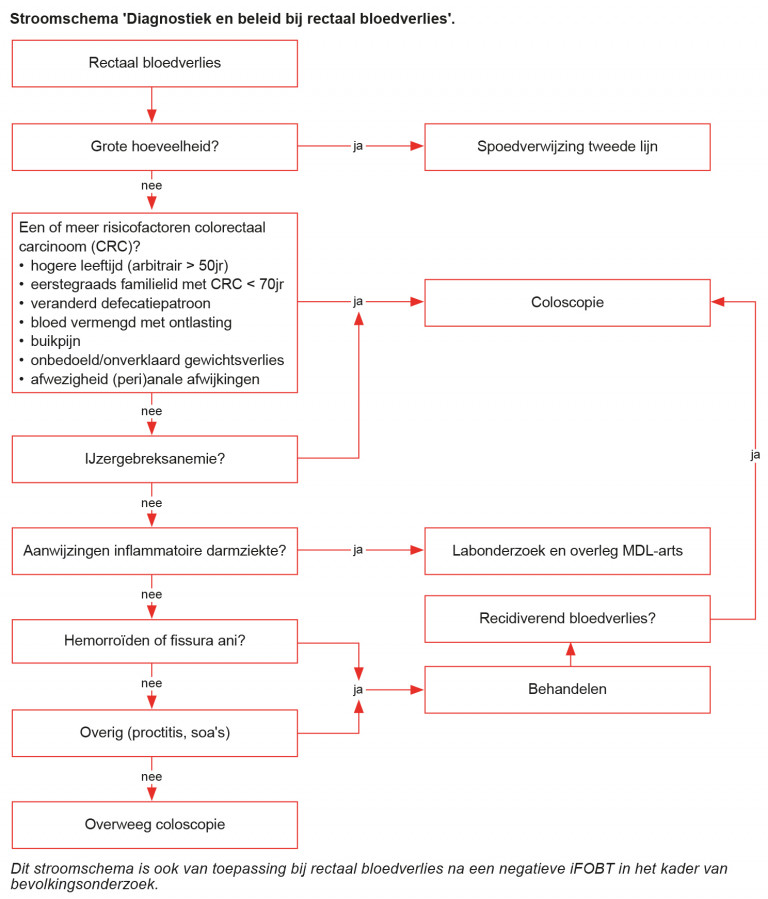
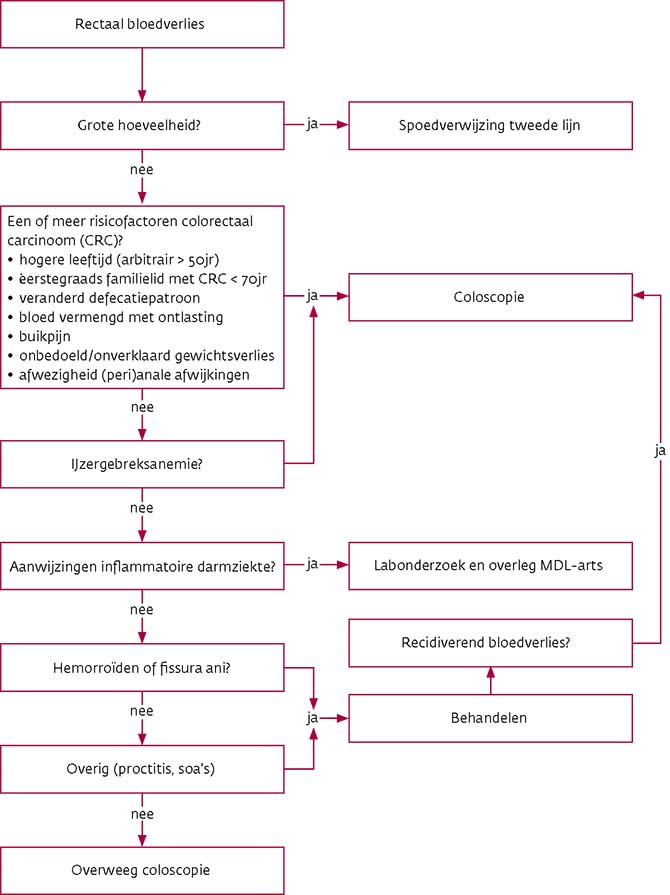
Naar Samenvatting ›Spoed
Naar Samenvatting ›- Stel bij een aanzienlijke hoeveelheid rectaal bloedverlies in eerste instantie de klinische stabiliteit van de patiënt vast volgens de ABCDE-systematiek.
- Verwijs de patiënt bij hemodynamische instabiliteit (hypotensie en tachycardie) direct per ambulance naar een internist of MDL-arts.
- Afhankelijk van de klinische toestand van de patiënt (en daarmee de noodzaak snel te handelen) en de differentiaaldiagnostische overwegingen zijn de verdere anamnese en lichamelijk onderzoek meer of minder uitgebreid.
- Wees erop bedacht dat een hemodynamisch stabiele patiënt bij een aanzienlijke bloeding alsnog snel kan verslechteren. Een divertikelbloeding of een bloeding uit het proximale deel van de tractus digestivus kan aanzienlijk rectaal bloedverlies veroorzaken. Voorbeelden van minder frequente oorzaken zijn enterocolitis, angiodysplasieën, thermometerlaesies, bloeding na poliepectomie, stollingsstoornis, teleangiëctasieën en aorto-enterale fistels.
Anamnese
Naar Samenvatting ›Ga na of vraag naar:
- duur en hoeveelheid van het bloedverlies
- aard van het bloedverlies (bloed vermengd met ontlasting verhoogt het risico op colorectaal carcinoom)
- defecatiepatroon (bij verandering van defecatiepatroon is het risico op colorectaal carcinoom verhoogd)
- (peri)anale klachten: pijn, jeuk, zwelling, lekkage van ontlasting of slijm
- loze aandrang (aanwijzing voor proctitis of neoplasma) (zie Details)
- algemene klachten: koorts, buikpijn, malaise, onbedoeld of onverklaard gewichtsverlies (> 5% in 1 maand of 10% in 6 maanden)
- voorgeschiedenis: eerdere episode met bloedverlies, hemorroïden, inflammatoire darmziekten, recente coloscopie
- > 55 jaar: deelname aan het bevolkingsonderzoek darmkanker
- voorkomen van inflammatoire darmziekten en colorectaal carcinoom (zie Details en zie Familiair voorkomen van colorectaal carcinoom) in de familie familieleden met maligniteiten van endometrium, maag, dunne darm, ovarium, galgangen, ureter, nierbekken of talgklieren op relatief jonge leeftijd (Lynch-syndroom)
- medicatiegebruik: zelfzorgmiddelen, cumarines, DOAC’s, trombocytenaggregatieremmers zoals acetylsalicylzuur, clopidogrel en NSAID’s (oraal, rectaal, injecties en in veel mindere mate dermaal), SSRI’s, spironolacton, corticosteroïden (zie Medicatie en rectaal bloedverlies)
- seksueel gedrag (anale seks, soarisico bij een vermoeden van proctitis, etiologie van fissura ani)
- traumata
Het is niet in huisartsgeneeskundig onderzoek aangetoond dat aanwezigheid van loze aandrang het risico op colorectaal carcinoom doet toenemen. Vanuit anatomisch-fysiologisch perspectief is het echter aannemelijk dat loze aandrang een symptoom kan zijn van een rectumtumor. De werkgroep is daarom van mening dat deze factor meegenomen moet worden in de evaluatie van rectaal bloedverlies.
Het hebben van een familielid met een inflammatoire darmziekte is de sterkste risicofactor voor het ontstaan van een inflammatoire darmziekte. Het lifetime risk op een inflammatoire darmziekte voor iemand met een eerstegraads familielid met inflammatoire darmziekte is ongeveer 10%. In families is er meestal sprake van óf colitis ulcerosa óf de ziekte van Crohn. De oorzaak van inflammatoire darmziekte is vooralsnog onbekend. De etiologie lijkt multifactorieel en onder andere bepaald te worden door genetische predispositie, omgevingsfactoren en veranderingen in het immuunsysteem.
Lichamelijk onderzoek
Naar Samenvatting ›- Meet bij een aanzienlijke bloeding pols en bloeddruk (zie Spoed).
- Onderzoek het abdomen:
- let vooral op het bestaan van palpabele weerstanden
- inspecteer de perianale regio met goede belichting; spreid de billen
- inspecteer de huid en let op eczeem, mycose, krabeffecten
- laat patiënt even persen: hierdoor wordt een eventueel (2e graads) hemorroïd of rectumprolaps beter zichtbaar
- Verricht rectaal toucher om een palpabele afwijking op te sporen, tenzij er veel pijnklachten zijn ten gevolge van een fissura ani (zie Proctoscopie):
- breng zo nodig vooraf een lokaal anestheticum aan, zoals lidocaïnevaselinecrème 3%
- Bepaal het gewicht bij gewichtsverlies.
- Verricht uitgebreider lichamelijk onderzoek bij algemene klachten (zie Anamnese).
Bij inspectie kunnen een bloedende fissura ani en een bloedend prolaberend hemorroïd gemakkelijk worden gediagnosticeerd. Inspectie op ooghoogte van de arts met goede belichting is essentieel.
De patiënt ligt in zijligging met opgetrokken knieën en kan zelf meehelpen bij het spreiden van de billen. De arts spreidt de perianale huid maximaal om een eventuele verborgen bloedende fissuur aan het licht te brengen en om de huid te inspecteren. Hemorroïden graad 2 prolaberen tijdens persen en laten zich zo ook makkelijk inspecteren.
Rectumtumoren bevinden zich vaak in het distale rectum; zij zijn bij het rectaal toucher palpabel als een harde massa of harde rand in het zachte en soepele rectum. De diagnostische waarde van het rectaal toucher is echter beperkt. Slechts 24-40% van de rectumtumoren wordt bij een rectaal toucher gevoeld. Ook hemorroïden graad 1 en graad 2 worden bij een rectaal toucher niet gevoeld. Proctoscopie is van weinig waarde bij de opsporing van rectumtumoren, omdat de proctoscoop te kort is en bovendien een eventuele induratie ‘wegduwt’. Wel kan bij proctoscopie een bloedend hemorroïd worden gezien of een proctitis met bloedverlies. De werkgroep vond geen onderzoek naar de diagnostische waarde van het verrichten van lichamelijk onderzoek bij patiënten met rectaal bloedverlies.
Conclusie
Uit (gedateerd) onderzoek is naar voren gekomen dat bij rectaal toucher minder dan de helft van de rectumtumoren wordt gevoeld. Als een (rectum)tumor palpabel is, zal dit consequenties hebben voor het beleid (directe verwijzing). Hoewel de waarde van rectaal toucher beperkt is, is de werkgroep van mening dat lichamelijk onderzoek inclusief rectaal toucher wel verricht moet worden. Aanbevolen wordt het rectaal toucher achterwege te laten als de patiënt veel pijn heeft ten gevolge van een fissura ani.
Proctoscopie (facultatief)
Naar Samenvatting ›De huisarts kan door middel van proctoscopie met meer zekerheid de oorzaak van het anale bloedverlies vaststellen of uitsluiten (hemorroïden, proctitis, poliep). Bij het vermoeden van een soa kan nadere diagnostiek ingezet worden (zie NHG-Standaard Het soa-consult).
Proctoscopie kan snel en eenvoudig tijdens het spreekuur worden verricht, zonder voorbereiding van de patiënt, en zonder verdoving:
Voer voorafgaand aan proctoscopie een goede inspectie van de anus en een rectaal toucher uit.
Voer geen proctoscopie in aanwezigheid van een fissuur; dit is erg pijnlijk.
Zie voor de procedure het Handboek verrichtingen in de huisartsenpraktijk.
Aanvullend onderzoek
Naar Samenvatting ›Laboratoriumonderzoek
Naar Samenvatting ›Ijzergebreksanemie
Naar Samenvatting ›Bepaal bij het vermoeden van ijzergebreksanemie (moeheid, duizeligheid, malaise, bleekheid), recidiverend bloedverlies of onduidelijke anamnese het hemoglobine, MCV en ferritine.
Inflammatoire darmziekte
Naar Samenvatting ›Bepaal bij het vermoeden van een inflammatoire darmziekte (bloederige diarree en algemene klachten zoals buikpijn, koorts, malaise of gewichtsverlies, ook bij jonge patiënten) CRP, Hb, leukocyten, trombocyten en albumine.
De ziekte van Crohn is geassocieerd met een verhoogde concentratie C-reactief proteïne (CRP), maar bij colitis ulcerosa is de CRP-spiegel vaak normaal of slechts licht verhoogd. Er is geen goede verklaring voor dit verschil. Mogelijk is bij colitis ulcerosa alleen de mucosa betrokken, waardoor de acute-fase-eiwitten in het bloed niet altijd stijgen, terwijl de ontsteking bij de ziekte van Crohn transmuraal is. Een normale CRP-spiegel sluit de aanwezigheid van een inflammatoire darmziekte dus niet uit.
Bij beide kan het leukocytenaantal verhoogd zijn. Het leukocytenaantal kan echter ook worden beïnvloed door bepaalde geneesmiddelen zoals corticosteroïden (verhoogd), of azathioprine (verlaagd). Ook het trombocytenaantal kan verhoogd zijn, maar dit is geen specifieke marker. Het albumine en het hemoglobine zullen tijdens ontsteking dalen. Bij patiënten met een milde tot matig actieve inflammatoire darmziekte zijn het CRP en de BSE vaak niet of slechts licht verhoogd. Bovendien sluiten normale laboratoriumwaarden voor Hb, BSE of CRP een inflammatoire darmziekte niet uit.
Recent zijn enkele onderzoeken verschenen naar fecale eiwitten als markers voor inflammatoire darmziekte. Fecaal calprotectine is geassocieerd met histologische en endoscopische activiteit van de ziekte van Crohn en colitis ulcerosa. De bepaling van fecaal calprotectine wordt in Nederland aangeboden door diverse huisartsenlaboratoria. In 2012 is de waarde onderzocht van deze bepaling bij 423 eerstelijns patiënten (gemiddelde leeftijd 60 jaar) die gedurende 2 weken klachten van de onderbuik hadden in combinatie met één van de volgende kenmerken: rectaal bloedverlies; veranderd defecatiepatroon; buikpijn; koorts; diarree; gewichtsverlies; plotseling begin van de klachten bij ouderen; palpabele abdominale of rectale massa. Primaire uitkomstmaten waren colorectaal carcinoom, adenomen, inflammatoire darmziekte en diverticulitis. Er waren 141 patiënten met de klacht rectaal bloedverlies; 19 patiënten kregen de diagnose ‘colitis ulcerosa’, ‘proctitis’, ‘ziekte van Crohn’ of ‘andere colitis’. De sensitiviteit van de enzyme-linked immunosorbent assay (ELISA) voor inflammatoire darmziekte bedroeg 0,84 (95%-BI 0,62 tot 0,94), die van de point-of-caretest 0,79 (95%-BI 0,57 tot 0,91); de specificiteit van beide was lager maar werd niet vermeld. Voor de patiënt met alleen rectaal bloedverlies heeft het bepalen van fecaal calprotectine in de eerste lijn vooralsnog geen toegevoegde waarde, ook al wordt deze bepaling door diverse huisartsenlaboratoria aangeboden.
Conclusie
Bij vermoeden van een inflammatoire darmziekte kunnen de volgende parameters worden onderzocht: CRP, hemoglobine, leukocyten, trombocyten en albumine. Normale laboratoriumuitslagen sluiten een inflammatoire darmziekte niet uit.
Colorectaal carcinoom
Naar Samenvatting ›We bevelen geen fecaaloccultbloedtest of ander aanvullend laboratoriumonderzoek bij patiënten met rectaal bloedverlies (waaronder bepaling van tumormarkers).
In 1995 is in de huisartsenpraktijk de waarde onderzocht van enkele laboratoriumparameters (Hb, BSE en leukocytenaantal) voor de diagnose ‘CRC’. Bij 225 van de 269 patiënten werd laboratoriumonderzoek verricht; de voorafkans op een colorectaal carcinoom was 2,2% (5/225). Bij een BSE < 30 mm/uur was het risico op colorectaal carcinoom 1%, een BSE > 30 mm/uur had een positief voorspellende waarde van 17% (OR 14, p < 0,01). Bij een leukocytenaantal < 10 × 109/l was het risico op colorectaal carcinoom 0,5%, een leukocytenaantal > 10 × 109/l had een positief voorspellende waarde van 12% (OR 26,3, p < 0,01).
Ook in andere artikelen is een relatie beschreven tussen leukocytenaantal, CRP en BSE en het risico op een gastro-intestinale maligniteit. De prognose zou slechter zijn bij verhoogde waarden. In geen van deze artikelen werden echter de specificiteit en sensitiviteit van de afzonderlijke tests voor CRC beschreven.
De Europese richtlijn Tumour markers in colorectal cancer raadt het bepalen van tumormarkers voor diagnostiek of screening expliciet af, in verband met hun lage specificiteit en sensitiviteit. Tumormarkers zijn geschikt voor de evaluatie van een behandeling en van de eventuele aanwezigheid van metastasen.
Ook het bepalen van leverenzymen om (lever)-metastasen van een colorectaal carcinoom aan te tonen, is niet geschikt voor diagnostiek of screening.
Conclusie
Er zijn aanwijzingen dat bij rectaal bloedverlies het hemoglobine, het leukocytenaantal en de bezinking een voorspellende waarde hebben voor het diagnosticeren van CRC. De werkgroep is echter van mening dat er te weinig onderzoek gedaan is om een eenduidige conclusie te kunnen trekken. Zij raadt daarom op dit moment het verrichten van laboratoriumonderzoek zonder dat er klinische tekenen zijn van ontsteking af. Ook is er geen plaats voor het routinematig aanvragen van tumormarkers.
In het kader van het bevolkingsonderzoek darmkanker wordt de immunologische fecaaloccultbloedtest (iFOBT) gebruikt. De iFOBT, die ook wordt aangeboden door huisartsenlaboratoria, spoort onzichtbare sporen bloed in de ontlasting op, op basis van antistoffen tegen humaan hemoglobine. De iFOBT is specifiek gericht op humaan bloed, er zijn dus geen voorafgaande dieetmaatregelen noodzakelijk. Er zijn verschillende soorten iFOB-tests, waaronder de OC-sensor, gebruikt in de voorbereidende fase van het bevolkingsonderzoek, en de thans gebruikte FOB Gold. Bij een afkapwaarde van 88 ng/ml is bij eenmalig screenen de sensitiviteit 65% voor CRC en 27% voor voortgeschreden adenomen (zie NHG-Standpunt Bevolkingsonderzoek darmkanker). Inmiddels is de afkapwaarde in het bevolkingsonderzoek opgehoogd naar 275 ng/ml.
In een Zweeds retrospectief onderzoek is de waarde van iFOBT onderzocht bij 495 eerstelijns patiënten met CRC of hooggradige dysplasie en klachten zoals anemie of buikklachten, met of zonder rectaal bloedverlies. Bij 60 van de 116 patiënten met colorectaal carcinoom en rectaal bloedverlies was een iFOBT uitgevoerd en de uitslag was in alle gevallen positief. Bij de overige 56 patiënten was geen iFOBT verricht. De auteurs concluderen dat een iFOBT bij patiënten met rectaal bloedverlies overbodig is. De sensitiviteit van de iFOBT bedroeg 88%; bij exclusie van patiënten met rectaal bloedverlies was de sensitiviteit 83%. Bij patiënten met andere klachten dan rectaal bloedverlies vertraagt de iFOBT het stellen van de diagnose.
Conclusie
Bij patiënten met rectaal bloedverlies heeft de iFOBT geen toegevoegde waarde en is zij niet geschikt als diagnostisch instrument.
Coloscopie
Naar Samenvatting ›Voor het vaststellen of uitsluiten van een colorectaal carcinoom is coloscopie het onderzoek van 1e keus.
Voor sigmoïdoscopie is geen plaats meer in het diagnostisch traject.
Hoewel coloscopie een relatief veilige onderzoeksmethode is, hebben sigmoïdoscopie, X-colon en CT-colografie een geringer risico op complicaties. Coloscopie is belastend voor de patiënt en kan niet in elke regio in eigen beheer worden aangevraagd of uitgevoerd. Een X-colon is obsoleet geworden. Momenteel heeft sigmoïdoscopie nauwelijks plaats bij patiënten met klachten. Als bij sigmoïdoscopie poliepen of een CRC worden gevonden, is een coloscopie alsnog geïndiceerd; bij een CRC kan dat ook gecombineerd worden met een eventuele operatie. Als er een andere verklaring wordt gevonden, bijvoorbeeld proctitis of divertikels, kan in eerste instantie behandeling respectievelijk afwachtend beleid worden ingesteld. Als echter bij sigmoïdoscopie géén afwijkingen worden gevonden of indien er poliepen worden gezien, is een coloscopie alsnog geïndiceerd, zeker bij aanhoudend bloedverlies. CT-colografie is minder belastend, vergt een minder intensieve voorbereiding en geeft minder risico op complicaties omdat een ‘roesje’ niet nodig is. Bij CT-colografie kan echter geen weefsel worden verkregen voor histologisch onderzoek.
Door de ontwikkeling van CT-colografie zijn het X-colon en dubbelcontrastbariumonderzoek obsoleet geworden.
CT-colografie: In een overzichtsartikel wordt de plaats beschreven van de CT-colografie (virtuele coloscopie). Bij een CT-colografie wordt uit CT-beelden van het met bariumpap gecoate en met lucht gevulde colon een reconstructie van het lumen gemaakt. In een meta-analyse was de sensitiviteit 96% (95%-BI 94 tot 98), vergelijkbaar met coloscopie (95%; 95%-BI 90 tot 97). Ook in een Brits onderzoek bleek de detectie van CRC bij symptomatische patiënten (n = 1580) met beide technieken vergelijkbaar (10,7 versus 11,4%). De CT-colografie is echter voor poliepen < 10 mm of vlakke poliepen minder accuraat dan coloscopie. CT-colografie kent een beperkte indicatie. Het is een niet-invasief onderzoek en er kunnen dus geen biopten genomen worden. CT-colografie is geïndiceerd als coloscopie niet uitgevoerd kan worden en de uitslag wel consequenties heeft.
Bij CT-colografie worden regelmatig afwijkingen buiten het colon vastgesteld. Deze zijn meestal onschuldig en behoeven geen vervolgonderzoek. In een onderzoek was bij ongeveer 10% van de patiënten na de CT-colografie (n = 475) nadere diagnostiek nodig in verband met een buiten het colon gelegen afwijking zoals een maligniteit (n = 9) of een aneurysma abdominalis (n = 9). Bij 17 patiënten werd een diagnose gesteld die een van de symptomen kon verklaren.
Coloscopie: Voor het diagnosticeren van CRC is coloscopie de gouden standaard. Het voordeel van een coloscopie is dat het gehele colon in beeld kan worden gebracht en dat er weefsel voor pathologisch onderzoek kan worden afgenomen. In een systematische review werd gemiddeld 2% (95%-BI 0,3 tot 7,3) van de grote (> 10 mm) adenomateuze poliepen gemist. De referentie was een tweede coloscopie, verricht op dezelfde dag als de eerste (tandemcoloscopie). Logischerwijs nam het percentage gemiste adenomateuze poliepen toe naarmate deze kleiner waren. Van de poliepen van 5-10 mm werd 13% (95%-BI 8,0 tot 18,0) gemist, van de poliepen < 5 mm 26% (95%-BI 27 tot 35).
Het risico op perforatie bedraagt bij coloscopie minder dan 0,001%; bij coloscopie met poliepectomie bedraagt het risico op perforatie ≤ 0,05%; het risico op bloeding ≤ 0,01% .
X-colon versus CT-colografie versus coloscopie: In een Engels prospectief, geblindeerd cohortonderzoek is de sensitiviteit van X-colon, CT-colografie en coloscopie vergeleken. Inclusiecriteria waren rectaal bloedverlies, positieve FOBT, onbegrepen ijzergebreksanemie en positieve familieanamnese voor CRC. De patiënten (n = 614) ondergingen alle onderzoeken binnen twee weken. Uitkomstmaten waren poliepen en carcinomen. Als referentie werd de som van alle gegevens verkregen met de drie methoden gebruikt. Voor laesies van 6-9 mm was de sensitiviteit van X-colon 35%, die van CT-colografie 51% en die van coloscopie 99%. Voor laesies groter of gelijk dan 10 mm bedroeg de sensitiviteit voor X-colon 48%, CT-colografie 59% en coloscopie 98%. De specificiteit was respectievelijk 90, 96 en 99,6%.
Conclusie
Voor het diagnosticeren van colorectaal carcinoom heeft coloscopie de hoogste specificiteit en sensitiviteit.
Toelichting bij coloscopie
Naar Samenvatting ›Van de patiënten met rectaal bloedverlies heeft ongeveer 7% een colorectaal carcinoom. Aanwezigheid van een van de risicofactoren (zie kader Risicofactoren) verhoogt dit risico tot 10-11% (met een ruime spreiding) (zie Patientenkenmerken en colrectaal carcinoom).
Vanwege deze geringe stijging van het risico is het niet goed mogelijk om strikte richtlijnen te formuleren wanneer aanvullend onderzoek zou moeten plaatsvinden.
Gecombineerd voorkomen van meerdere risicofactoren verhoogt de kans op aanwezigheid van een colorectaal carcinoom (zie Details).
Ook klachten zoals loze aandrang en recidiverend rectaal bloedverlies kunnen het vermoeden van pathologie versterken (zie Patientenkenmerken en colrectaal carcinoom en zie Overige patiëntkenmerken en colorectaal carcinoom).
Met coloscopie zijn in diverse onderzoeken afwijkingen gevonden bij 14-44% van de patiënten met rectaal bloedverlies. Het ging daarbij om inflammatoire afwijkingen, poliepen en colorectaal carcinoom (zie Patiëntkenmerken en colorectaal carcinoom).
In een Engels onderzoek in de eerste lijn werden de genoemde afwijkingen gevonden bij 14% van de patiënten met alleen rectaal bloedverlies, bij 20% van de patiënten met rectaal bloedverlies en een veranderd defecatiepatroon (LR 1,7; 95%-BI 1,3 tot 2,3), en bij 32% van de patiënten met rectaal bloedverlies en afwezigheid van perianale afwijkingen (LR 2,7; 95%-BI 1,9 tot 3,9).
In een Amerikaans onderzoek, verricht in 1981-1983 onder patiënten in de wachtkamer, meldden 297 mensen rectaal bloedverlies. Er werden 96 patiënten geëxcludeerd (45 patiënten kregen ander aanvullend onderzoek dan beschreven was in het onderzoeksprotocol en 51 patiënten waren niet verschenen bij het onderzoek). De overgebleven 201 patiënten kregen een sigmoïdoscopie en een coloninloopfoto. Van deze patiënten hadden er 48 (24%) afwijkingen, namelijk inflammatoire afwijkingen (9), poliepen (26) of een coloncarcinoom (13). Alleen leeftijd > 40 jaar en bloed door de ontlasting waren positief geassocieerd met ernstige pathologie.
In een ander onderzoek in de Engelse huisartsenpraktijk werd coloscopie uitgevoerd bij 99 patiënten > 40 jaar met rectaal bloedverlies. Bij 44% werd serieuze pathologie aangetroffen, waaronder CRC, poliepen en inflammatoire aandoeningen. Bloed door de ontlasting, een veranderd defecatiepatroon en buikpijn waren vaker genoemd door patiënten bij wie ernstige pathologie voorkwam, maar de symptomatologie was ten tijde van de presentatie bij de huisarts anders dan tijdens de coloscopie. Ook was er mogelijk sprake van selectiebias. Dit maakt de waarde van dit onderzoek minder.
Conclusie
Een veranderd defecatiepatroon, bloed vermengd met ontlasting, een hogere leeftijd en afwezigheid van perianale afwijkingen zijn van toegevoegde waarde voor het detecteren van een ernstige afwijking, zoals poliepen, colorectaal carcinoom of een inflammatoire afwijking.
Indicaties
Naar Samenvatting ›Coloscopie is geïndiceerd bij een patiënt met rectaal bloedverlies:
Erfelijk colorectaal carcinoom
Ongeveer 5% van alle gevallen van colorectaal carcinoom (CRC), inclusief het Lynch-syndroom of hereditair non-poliepose-colorectaal carcinoom (HNPCC, een inmiddels verlaten term) en erfelijke coloncarcinomen met adenomateuze polyposis zoals familiaire adenomateuze polyposis (FAP), attenuated FAP (AFAP) en MUTYH-geassocieerde polyposis (MAP), is erfelijk bepaald.
Bij het Lynch-syndroom leidt een DNA-mutatie tot een snelle ontwikkeling van adenoom naar carcinoom, meestal in enkele jaren tijd. De maligniteiten ontstaan vaak rechtszijdig en het risico op een tweede primair colorectaal carcinoom is groot. Bij mensen met aanleg voor het Lynch-syndroom is de kans op het ontstaan van colorectaal carcinoom 25-70% en de kans op endometriumcarcinoom 15-55%. Ook het risico op maligniteiten van onder andere maag, dunne darm, ovarium, galgangen, ureter, nierbekken en talgklieren is verhoogd (1-15%, afhankelijk van tumortype). De gemiddelde leeftijd waarop het carcinoom wordt gediagnosticeerd is ongeveer 45 jaar. Het risico op CRC is mogelijk hoger bij mannen dan bij vrouwen; het risico op CRC en endometriumcarcinoom is hoger in families met relatief veel aangedane verwanten.
Bij minder dan 1% van alle patiënten met CRC is er sprake van familiaire adenomateuze polyposis (FAP). FAP leidt, indien onbehandeld, bij bijna 100% van de patiënten tot CRC op een leeftijd tussen 35 en 45 jaar. AFAP en MAP zijn zeldzame ziektebeelden die fenotypisch op FAP lijken.
Familiair CRC
Bij 15-20% van de patiënten met CRC komt familiaire clustering van de aandoening voor zonder bekende erfelijke factor. Er is wel een verhoogd familiair risico. Een individu zonder klachten heeft een verhoogd risico op CRC als er bij eerstegraads familieleden een colorectaal carcinoom is vastgesteld op een leeftijd < 70 jaar. Indien het carcinoom op jongere leeftijd is vastgesteld of bij meerdere familieleden, neemt het risico verder toe.
Men spreekt van ‘familiair CRC’ wanneer het risico op CRC voor een eerstegraads familielid (kinderen, ouders, broers en zusters) minstens driemaal hoger is dan het bevolkingsrisico; dat geldt voor circa 10% van alle patiënten met CRC (zie tabel 9).
| Aantal familieleden met diagnose CRC en leeftijd bij diagnose | Relatief risico |
|---|---|
| 1 eerstegraads familielid 50-70 jaar | 2 |
| 1 eerstegraads familielid < 50 jaar | 3 |
| 1 eerstegraads familielid 50-70 jaar en ≥ 1 tweedegraads familielid < 70 jaar | 3 |
| ≥ 2 eerstegraads familieleden 50-70 jaar | 4 |
| ≥ 2 eerstegraads familieleden, van wie 1 < 50 jaar | 6 |
Gedeelde besluitvorming
Naar Samenvatting ›Weeg bij de gezamenlijke besluitvorming over het al dan niet aanvragen van coloscopie naast de risicofactoren mee:
- de levensverwachting van de patiënt
- diens behoefte aan diagnostische zekerheid
Geef de patiënt informatie over het onderzoek: patiënteninformatie over coloscopie is te vinden op thuisarts.nl.
CT-colon
Naar Samenvatting ›We bevelen een CT-colon aan als alternatief voor (oudere) patiënten wanneer er geen of zo min mogelijk interventie, maar wel nader onderzoek gewenst is.
Bij een CT-colon kunnen ook afwijkingen van andere organen worden gevonden. Meestal gaat het om benigne afwijkingen.
Een CT-colon leidt bij ongeveer 10% van de patiënten tot aanvullende diagnostiek.
Door de ontwikkeling van CT-colografie zijn het X-colon en dubbelcontrastbariumonderzoek obsoleet geworden.
CT-colografie: In een overzichtsartikel wordt de plaats beschreven van de CT-colografie (virtuele coloscopie). Bij een CT-colografie wordt uit CT-beelden van het met bariumpap gecoate en met lucht gevulde colon een reconstructie van het lumen gemaakt. In een meta-analyse was de sensitiviteit 96% (95%-BI 94 tot 98), vergelijkbaar met coloscopie (95%; 95%-BI 90 tot 97). Ook in een Brits onderzoek bleek de detectie van CRC bij symptomatische patiënten (n = 1580) met beide technieken vergelijkbaar (10,7 versus 11,4%). De CT-colografie is echter voor poliepen < 10 mm of vlakke poliepen minder accuraat dan coloscopie. CT-colografie kent een beperkte indicatie. Het is een niet-invasief onderzoek en er kunnen dus geen biopten genomen worden. CT-colografie is geïndiceerd als coloscopie niet uitgevoerd kan worden en de uitslag wel consequenties heeft.
Bij CT-colografie worden regelmatig afwijkingen buiten het colon vastgesteld. Deze zijn meestal onschuldig en behoeven geen vervolgonderzoek. In een onderzoek was bij ongeveer 10% van de patiënten na de CT-colografie (n = 475) nadere diagnostiek nodig in verband met een buiten het colon gelegen afwijking zoals een maligniteit (n = 9) of een aneurysma abdominalis (n = 9). Bij 17 patiënten werd een diagnose gesteld die een van de symptomen kon verklaren.
Coloscopie: Voor het diagnosticeren van CRC is coloscopie de gouden standaard. Het voordeel van een coloscopie is dat het gehele colon in beeld kan worden gebracht en dat er weefsel voor pathologisch onderzoek kan worden afgenomen. In een systematische review werd gemiddeld 2% (95%-BI 0,3 tot 7,3) van de grote (> 10 mm) adenomateuze poliepen gemist. De referentie was een tweede coloscopie, verricht op dezelfde dag als de eerste (tandemcoloscopie). Logischerwijs nam het percentage gemiste adenomateuze poliepen toe naarmate deze kleiner waren. Van de poliepen van 5-10 mm werd 13% (95%-BI 8,0 tot 18,0) gemist, van de poliepen < 5 mm 26% (95%-BI 27 tot 35).
Het risico op perforatie bedraagt bij coloscopie minder dan 0,001%; bij coloscopie met poliepectomie bedraagt het risico op perforatie ≤ 0,05%; het risico op bloeding ≤ 0,01%.
X-colon versus CT-colografie versus coloscopie: In een Engels prospectief, geblindeerd cohortonderzoek is de sensitiviteit van X-colon, CT-colografie en coloscopie vergeleken. Inclusiecriteria waren rectaal bloedverlies, positieve FOBT, onbegrepen ijzergebreksanemie en positieve familieanamnese voor CRC. De patiënten (n = 614) ondergingen alle onderzoeken binnen twee weken. Uitkomstmaten waren poliepen en carcinomen. Als referentie werd de som van alle gegevens verkregen met de drie methoden gebruikt. Voor laesies van 6-9 mm was de sensitiviteit van X-colon 35%, die van CT-colografie 51% en die van coloscopie 99%. Voor laesies groter of gelijk dan 10 mm bedroeg de sensitiviteit voor X-colon 48%, CT-colografie 59% en coloscopie 98%. De specificiteit was respectievelijk 90, 96 en 99,6%.
Conclusie
Voor het diagnosticeren van colorectaal carcinoom heeft coloscopie de hoogste specificiteit en sensitiviteit.
Overwegingen
Hoewel coloscopie een relatief veilige onderzoeksmethode is, hebben sigmoïdoscopie, X-colon en CT-colografie een geringer risico op complicaties. Coloscopie is belastend voor de patiënt en kan niet in elke regio in eigen beheer worden aangevraagd of uitgevoerd. Een X-colon is obsoleet geworden. Momenteel heeft sigmoïdoscopie nauwelijks plaats bij patiënten met klachten. Als bij sigmoïdoscopie poliepen of een CRC worden gevonden, is een coloscopie alsnog geïndiceerd; bij een CRC kan dat ook gecombineerd worden met een eventuele operatie. Als er een andere verklaring wordt gevonden, bijvoorbeeld proctitis of divertikels, kan in eerste instantie behandeling respectievelijk afwachtend beleid worden ingesteld. Als echter bij sigmoïdoscopie géén afwijkingen worden gevonden of indien er poliepen worden gezien, is een coloscopie alsnog geïndiceerd, zeker bij aanhoudend bloedverlies. CT-colografie is minder belastend, vergt een minder intensieve voorbereiding en geeft minder risico op complicaties omdat een ‘roesje’ niet nodig is. Bij CT-colografie kan echter geen weefsel worden verkregen voor histologisch onderzoek.
Aanbeveling
De werkgroep is van mening dat coloscopie het onderzoek van eerste keus is.
Aanvullend onderzoek na recente deelname bevolkingsonderzoek
Naar Samenvatting ›Als het rectaal bloedverlies optreedt na een negatieve uitslag van de iFOBT in het kader van het bevolkingsonderzoek darmkanker, geldt het normale beleid van deze standaard.
Het is meestal niet zinvol om een coloscopie binnen 10 jaar te herhalen.
Als het rectale bloedverlies optreedt na een positieve iFOBT en een coloscopie zonder afwijkingen bij het bevolkingsonderzoek darmkanker, is herhaalde coloscopie alleen geïndiceerd in de volgende gevallen:
- als er andere risicofactoren (anders dan leeftijd) of andere klinische aanwijzingen zijn voor colorectaal carcinoom
- als surveillance geïndiceerd is bij gevonden poliepen
- bij persisterende klachten
- bij een andere aandoening waarvoor coloscopie geïndiceerd is (bijvoorbeeld een inflammatoire darmziekte)
In 2014 is het bevolkingsonderzoek darmkanker van start gegaan. Dit betekent dat zich in de komende jaren op het spreekuur steeds vaker patiënten met rectaal bloedverlies zullen melden die recent een iFOBT of coloscopie hebben ondergaan.
Gezien het grote percentage foutnegatieve uitslagen bij iFOBT is het beleid voor degenen met een negatieve iFOBT in het verleden hetzelfde als voor de doorsnee-populatie. Bij een positieve iFOBT, waarbij nog geen coloscopie is verricht, wordt aangeraden de patiënt alsnog voor coloscopie te verwijzen.
Bij het bevolkingsonderzoek darmkanker krijgen deelnemers na een negatieve coloscopie pas na 10 jaar weer een oproep voor een iFOBT. Zijn er adenomen gevonden, dan hangt het vervolg af van de grootte en de histologie van de adenomen (zie NHG-Standpunt Bevolkingsonderzoek darmkanker). Het risico op een CRC na een negatieve coloscopie is zeer klein, het risico op een significante adenomateuze poliep is beduidend kleiner dan in de algemene bevolking.
In een systematische review werd gemiddeld 2% (95%-BI 0,3 tot 7,3) van de grote (> 10 mm) adenomateuze poliepen gemist. De referentie was een tweede coloscopie, verricht op dezelfde dag als de eerste (tandemcoloscopie). Logischerwijs nam het percentage gemiste adenomateuze poliepen toe naarmate deze kleiner waren. Van de poliepen van 5-10 mm werd 13% (95%-BI 8,0 tot 18,0) gemist, van de poliepen < 5 mm 26% (95%-BI 27 tot 35).
In een ander Amerikaans onderzoek werd gekeken naar patiënten die na een negatieve screeningscoloscopie (n = 147.375) binnen 10 jaar nogmaals een coloscopie ondergingen om uiteenlopende redenen (n = 17.525). In laatstgenoemde groep werd bij 3,7% (95%-BI 3,5 tot 4,0) een adenomateuze poliep > 9 mm gevonden en bij 0,4% (95%-BI 0,3 tot 0,5) een tumor, die bij iets meer dan de helft verdacht voor maligniteit was. De reden voor hernieuwd onderzoek was bij 23% rectaal bloedverlies of anemie. Binnen deze subgroep was in 3,5-6,7% sprake van poliepen > 9 mm, het meest in het eerste jaar na de aanvangscoloscopie. Er is in dit onderzoek niet gekeken naar andere oorzaken van rectaal bloedverlies. Het percentage nieuwvormingen bij patiënten met klachten die een coloscopie hebben ondergaan binnen 10 jaar na een negatieve screeningscoloscopie is ongeveer de helft minder vergeleken met het voorkomen van poliepen of CRC bij patiënten met rectaal bloedverlies (respectievelijk 3,7% en 0,2-0,4% versus 2-12% en 2-4%).
Conclusie
De eerste 10 jaar na een coloscopie bij een nieuwe klacht van rectaal bloedverlies is afwachtend beleid gerechtvaardigd, mits er geen andere klinische tekenen of risicofactoren (behalve leeftijd) aanwezig zijn voor een maligniteit of voor een andere aandoening waarvoor coloscopie geïndiceerd is.
Zie figuur 2 voor een schematische weergave van de diagnostiek en het beleid bij rectaal bloedverlies.
Dit stroomschema is ook van toepassing bij rectaal bloedverlies na een negatieve iFOBT in het kader van bevolkingsonderzoek.
Figuur 2 Stroomschema voor diagnostiek en beleid bij rectaal bloedverlies
Evaluatie
Naar Samenvatting ›Maak onderscheid tussen de verschillende oorzaken van rectaal bloedverlies.
Hemorroïden
Naar Samenvatting ›Bij een hemorroïd is er vaak sprake van zwelling met bloedverlies. Door lekkage van slijm of ontlasting kan jeuk of irritatie optreden.
Bij het rectaal toucher zijn hemorroïden graad 1 en graad 2 niet voelbaar. Hemorroïden graad 3 en graad 4 kunnen pijnklachten geven. Met een proctoscoop is te zien welk hemorroïdaal weefsel fysiologisch is en welk weefsel pathologisch. Hemorroïden zijn rood tot blauwachtig (livide), gezwollen en bloeden gemakkelijk.
Klachten van een hemorroïd ontstaan vaak minder acuut; een geprolabeerd hemorroïd kan meestal worden gereponeerd.
Getromboseerde perianale randvene
Naar Samenvatting ›Bij een getromboseerde perianale randvene ontstaat in korte tijd een pijnlijke homogeen donkerblauw tot paarse trombusmassa, die onder een gespannen huid op de rand van de anus doorschemert.
Fissura ani
Naar Samenvatting ›Fissurae ani zijn herkenbaar als al dan niet bloedende laesies van de huid van de anus. Pijnklachten staan veelal op de voorgrond.
Een fissuur wordt chronisch genoemd bij:
- > 4-6 weken klachten of
- klinische kenmerken zoals:
- geïndureerde wondranden
- zichtbare bleke spiervezels van de interne sfincter
- anale poliep proximaal van de fissuur (een gezwollen papil ter hoogte van de linea dentata)
- een skintag distaal van de fissuur
Let op: bij aanhoudende klachten of verandering van het klachtenpatroon van hemorroïden en fissurae ani kan er een andere oorzaak voor het rectaal bloedverlies zijn.
Neoplasmata
Naar Samenvatting ›De diagnose ‘colorectaal carcinoom’ of ‘anuscarcinoom’ wordt gesteld op basis van de uitslag van coloscopie en pathologisch-anatomisch onderzoek.
Als bij de coloscopie (met een goede voorbereiding) geen afwijkingen worden gevonden, is een colorectaal carcinoom met voldoende zekerheid uitgesloten. Als er poliepen zijn gevonden, zal de MDL-arts advies geven over de surveillance.
Inflammatoire darmziekte
Naar Samenvatting ›De klinische kenmerken van inflammatoire darmziekten zijn divers en kunnen variëren van (bloederige) diarree tot (chronische) pijn in de onderbuik, meestal met verandering van het defecatiepatroon (zie Details). Ook kunnen er algemene klachten zijn zoals malaise, gewichtsverlies, onverklaarde anemie of koorts.
De volgende laboratoriumwaarden ondersteunen de diagnose inflammatoire darmziekte en geven een indicatie van de ernst van de ontsteking:
- verhoogde ontstekingsparameters: bezinking, CRP, leukocyten
- verhoogde trombocyten
- verlaagd hemoglobine en albumine
De klinische verschijningsvormen waarmee een inflammatoire darmziekte zich kan presenteren zijn diarree met of zonder bloedverlies, chronische pijn in de onderbuik, subacute pijn in de rechter onderbuik (lijkend op appendicitis) meestal met defecatieveranderingen (toegenomen frequentie, brijiger consistentie, bloed of pusbijmenging), gewichtsverlies, malaise of onverklaarde anemie. Slechts één onderzoek beschrijft in de huisartsenpraktijk de diagnostische waarde van combinaties van symptomen en patiëntkarakteristieken specifiek voor proctocolitis. Van de 319 patiënten met rectaal bloedverlies hadden er slechts 6 een proctocolitis; van deze 6 hadden er 5 tevens een veranderd ontlastingspatroon. Dit symptoom had voor proctitis een likelihoodratio van 1,9 (95%-BI 1,3 tot 2,8). Geen van de zes patiënten met proctocolitis had perianale symptomen. De likelihoodratio van het ontbreken van perianale symptomen in combinatie met rectaal bloedverlies was 4,6 (95%-BI 3,6 tot 5,7).
Een veranderd defecatiepatroon en afwezigheid van perianale symptomen lijken voorspellend voor een inflammatoire aandoening bij patiënten met rectaal bloedverlies. Echter, de getallen in dit onderzoek waren te klein om er harde conclusies aan te verbinden.
Laboratoriumuitslagen
Naar Samenvatting ›Houd er rekening mee dat normale laboratoriumuitslagen een inflammatoire darmziekte niet uitsluiten.
De ziekte van Crohn is geassocieerd met een verhoogde concentratie C-reactief proteïne (CRP), maar bij colitis ulcerosa is de CRP-spiegel vaak normaal of slechts licht verhoogd. Er is geen goede verklaring voor dit verschil. Mogelijk is bij colitis ulcerosa alleen de mucosa betrokken, waardoor de acute-fase-eiwitten in het bloed niet altijd stijgen, terwijl de ontsteking bij de ziekte van Crohn transmuraal is. Een normale CRP-spiegel sluit de aanwezigheid van een inflammatoire darmziekte dus niet uit.
Bij beide kan het leukocytenaantal verhoogd zijn. Het leukocytenaantal kan echter ook worden beïnvloed door bepaalde geneesmiddelen zoals corticosteroïden (verhoogd), of azathioprine (verlaagd). Ook het trombocytenaantal kan verhoogd zijn, maar dit is geen specifieke marker. Het albumine en het hemoglobine zullen tijdens ontsteking dalen. Bij patiënten met een milde tot matig actieve inflammatoire darmziekte zijn het CRP en de BSE vaak niet of slechts licht verhoogd. Bovendien sluiten normale laboratoriumwaarden voor Hb, BSE of CRP een inflammatoire darmziekte niet uit.
Recent zijn enkele onderzoeken verschenen naar fecale eiwitten als markers voor inflammatoire darmziekte. Fecaal calprotectine is geassocieerd met histologische en endoscopische activiteit van de ziekte van Crohn en colitis ulcerosa. De bepaling van fecaal calprotectine wordt in Nederland aangeboden door diverse huisartsenlaboratoria. In 2012 is de waarde onderzocht van deze bepaling bij 423 eerstelijns patiënten (gemiddelde leeftijd 60 jaar) die gedurende 2 weken klachten van de onderbuik hadden in combinatie met één van de volgende kenmerken: rectaal bloedverlies; veranderd defecatiepatroon; buikpijn; koorts; diarree; gewichtsverlies; plotseling begin van de klachten bij ouderen; palpabele abdominale of rectale massa. Primaire uitkomstmaten waren colorectaal carcinoom, adenomen, inflammatoire darmziekte en diverticulitis. Er waren 141 patiënten met de klacht rectaal bloedverlies; 19 patiënten kregen de diagnose ‘colitis ulcerosa’, ‘proctitis’, ‘ziekte van Crohn’ of ‘andere colitis’. De sensitiviteit van de enzyme-linked immunosorbent assay (ELISA) voor inflammatoire darmziekte bedroeg 0,84 (95%-BI 0,62 tot 0,94), die van de point-of-caretest 0,79 (95%-BI 0,57 tot 0,91); de specificiteit van beide was lager maar werd niet vermeld. Voor de patiënt met alleen rectaal bloedverlies heeft het bepalen van fecaal calprotectine in de eerste lijn vooralsnog geen toegevoegde waarde, ook al wordt deze bepaling door diverse huisartsenlaboratoria aangeboden.
Conclusie
Bij vermoeden van een inflammatoire darmziekte kunnen de volgende parameters worden onderzocht: CRP, hemoglobine, leukocyten, trombocyten en albumine. Normale laboratoriumuitslagen sluiten een inflammatoire darmziekte niet uit.
Familiair risico
Naar Samenvatting ›Een eerstegraads familielid met een inflammatoire darmziekte is een risicofactor voor het ontstaan van een inflammatoire darmziekte bij de patiënt.
Het hebben van een familielid met een inflammatoire darmziekte is de sterkste risicofactor voor het ontstaan van een inflammatoire darmziekte. Het lifetime risk op een inflammatoire darmziekte voor iemand met een eerstegraads familielid met inflammatoire darmziekte is ongeveer 10%. In families is er meestal sprake van óf colitis ulcerosa óf de ziekte van Crohn. De oorzaak van inflammatoire darmziekte is vooralsnog onbekend. De etiologie lijkt multifactorieel en onder andere bepaald te worden door genetische predispositie, omgevingsfactoren en veranderingen in het immuunsysteem.
Proctitis
Naar Samenvatting ›Bij proctoscopie is het slijmvlies niet mooi roze maar juist rood, bloedt het gemakkelijk en heeft het gelig beslag.
Als de klachten ondanks behandeling blijven bestaan of als de patiënt koorts of buikpijn krijgt, overweeg dan de aanwezigheid van een soa (zie de NHG-Standaard Het soa-consult) of een colitis.
Andere oorzaken
Naar Samenvatting ›Overweeg andere oorzaken van rectaal bloedverlies, zoals:
- ischemische colitis
- diverticulose of diverticulitis
- angiodysplasieën
- iatrogene oorzaken
- bestralingsproctitis
- geneesmiddelen
- cave onderliggend lijden bij gebruik cumarines, of traumata.
Richtlijnen beleid
Naar Samenvatting ›Hemorroïden
Naar Samenvatting ›Voorlichting en advies
Naar Samenvatting ›Leg uit dat:
- bij de meeste patiënten kan men volstaan met niet-medicamenteuze behandeling.
- eventuele aanwezige obstipatie wordt behandeld (zie de NHG-Standaard Obstipatie).
Adviseer:
- vezelrijke voeding
- voldoende drinken
- toegeven aan de defecatiereflex.
Er is onvoldoende bewijs dat lichaamsbeweging, beperkte tijd doorbrengen op het toilet of verbeteren van lokale hygiëne leidt tot vermindering van klachten van hemorroïden.
Medicamenteuze behandeling
Naar Samenvatting ›Bloedverlies ten gevolge van hemorroïden: is op zichzelf geen indicatie voor medicamenteuze therapie.
Overweeg medicatie voor bij pijn of jeuk (meestal hemorroïden graad 3 of 4), maak een keuze tussen:
- kortdurend lokale indifferente middelen (2 dd en na elke ontlasting):
- vaselinecetomacrogolcrème
- zinksulfaatvaselinecrème 5 mg/g
- zinkoxidezetpillen 100 mg/g
- lokale anesthetica (2 dd en na elke ontlasting, maximaal 4 weken):
- lidocaïnevaselinecrème 30 mg/g
- lidocaïnezinksulfaatcrème 30/5 mg/g
Jeukklachten kunnen optreden als gevolg van soiling door slijm/ontlasting, of een andere oorzaak hebben zoals eczeem of mycose. Pijn treedt vooral op bij getromboseerde hemorroïden.
- Indifferente middelen: Er is geen gecontroleerd onderzoek gedaan naar het effect van indifferente preparaten bij hemorroïden. Vaselinecetomacrogolcrème lijkt geschikt voor anaal gebruik bij hemorroïden. Hierbij wordt een barrière aangebracht zonder gevaar voor maceratie van de huid door een afsluitende laag, zoals bij gebruik van pure vaseline.
- Zinkoxidezetpillen worden toegepast bij de behandeling van aambeien. Bij het inbrengen van de zetpil worden hemorroïden in het anale kanaal omhooggeduwd, wat een prettig effect kan geven. De zetpil heeft een zodanige samenstelling dat het smeltpunt relatief laag is, waardoor de pil reeds bij het inbrengen oppervlakkig smelt en een klein deel als beschermende zalf achterblijft in het anale kanaal. Daarnaast heeft zinkoxide een zwak adstringerende werking, waardoor lichte ontstekingsverschijnselen verdwijnen.
- Lokale anesthetica: Er werd geen gecontroleerd onderzoek naar het gebruik van lidocaïne bij hemorroïden gevonden. Lokaal toegediend werkt lidocaïne snel; afhankelijk van de plaats van toediening en de hoeveelheid is de werking langer en dieper. Het middel wordt kortdurend gebruikt bij oppervlakkige laceraties van de huid vanwege de jeuk- en pijnstillende werking.
- Bloedende hemorroïden zijn een contra-indicatie voor lidocaïnevaselinecrème omdat het gebruik van niet-steriele crèmes op wonden moet worden vermeden. Aangezien de perianale regio niet steriel is, zal het risico op infectie door een niet-steriele crème echter verwaarloosbaar zijn. Het risico van opname van lidocaïne zal vergelijkbaar zijn als bij het gebruik van fissura ani. Lidocaïnevaselinecrème mag bij fissura ani, maar ook bij bijvoorbeeld schaafwonden en oppervlakkige schaafwonden voorgeschreven worden. Daarom kan lidocaïnevaselinecrème naar de mening van de werkgroep gebruikt worden bij hemorroïden die niet excessief bloeden.
- Overig: Er zijn geen RCT’s uitgevoerd naar het effect van nitraatzalf als conservatieve behandeling van hemorroïden. Lokale applicatie van isosorbidedinitraatcrème (1%) zou mogelijk de pijn bij hemorroïden verminderen door vermindering van de anusspanning, maar het effect is statistisch niet significant. Diverse andere preparaten tegen hemorroïden, met combinaties van hierboven genoemde bestanddelen, zijn zonder recept verkrijgbaar. Suppositoria en zalven hebben beide hetzelfde effect op lokale klachten van pijn en jeuk.
Conclusie
Er is geen bewijs voor het effect van lokale therapie, zoals anesthetica of corticosteroïden, op de genezing. Patiënten ervaren vaak wel enige verlichting van met name corticosteroïden en lokale anesthetica, maar bij langdurig gebruik is er risico op het ontstaan van een lokale allergische reactie en sensibilisatie.
Getromboseerde perianale randvene
Naar Samenvatting ›Behandel bij voorkeur conservatief (geef voorlichting en lokale medicatie)
Bespreek bij veel pijnklachten de mogelijkheid van een incisie.
Praktische uitvoering incisie
- geef lokale verdoving
- breng een incisie aan in de gespannen huid
- verwijder na de incisie het stolsel, eventueel met een scherp lepeltje
- laat de wond open
- stelp een eventuele bloeding met een gaasje
Er zijn diverse behandelstrategieën voor een getromboseerde perianale randvene (‘extern hemorroïd’), zoals incisie en exprimatie van de trombus of en-blocresectie inclusief de trombus.
Er is geen goed uitgevoerd onderzoek waarin de effectiviteit van incisie vergeleken is met excisie of conservatieve behandeling. Excisie geeft de eerste dagen na de interventie mogelijk minder pijnklachten en minder nabloedingen, maar de onderzoeken zijn van zeer lage kwaliteit [NVvH 2015]. Bij een incisie blijft de randvene hogerop openstaan. Daardoor kan een bloeding kan optreden of kan de randvene zich vullen zodat er een recidief ontstaat. Bij een excisie wordt de randvene gedicht. Het risico op recidief en bloeding is waarschijnlijk hoger als de klachten van een getromboseerde randvene < 72 uur aanwezig zijn. Bij een klachtenduur > 72 uur is er obliteratie hogerop en neemt het risico af. Het risico op complicaties door een incisie in de huisartsenpraktijk is onbekend. Ook is onduidelijk in hoeverre incisie dan wel excisie kringspierletsel kan geven.
Conclusie
Een getromboseerde perianale randvene wordt bij voorkeur in eerste instantie conservatief behandeld. Omdat incisie relatief eenvoudig is en weinig complicaties lijkt te veroorzaken, adviseert de werkgroep incisie als de patiënt ernstige pijnklachten heeft.
De huisarts kan ook kiezen voor excisie en de patiënt verwijzen. Andere indicaties voor verwijzing zijn twijfel of de zwelling een perianale randvene of hemorroïd betreft, en nabloeding of recidief na incisie. Voor uitgebreide beschrijving van incisie, zie het Handboek verrichtingen in de huisartsenpraktijk.
Fissura ani
Naar Samenvatting ›Voorlichting en niet-medicamenteuze behandeling
Naar Samenvatting ›Leg uit dat:
- bij de meeste patiënten kan men volstaan met niet-medicamenteuze behandeling.
- dat eventuele aanwezige obstipatie en zo nodig diarree wordt behandeld (zie NHG-Standaard Obstipatie en NHG-Standaard Acute diarree).
- uitstel van defecatie kan leiden tot een verhoogde sfinctertonus en tot obstipatie, en daarmee tot het in stand houden van aanwezige fissuren.
- bij de meeste patiënten kan men volstaan met niet-medicamenteuze behandeling.
Behandel obstipatie (zie de NHG-Standaard Obstipatie). Leg uit
Adviseer:
- vezelrijke voeding
- voldoende drinken
- toegeven aan de defecatiereflex.
Er zijn vrijwel geen onderzoeken bekend naar het effect van leefstijladviezen bij fissura ani. Wel is er een relatie tussen het bestaan van gastro-intestinale klachten en het optreden van fissuren; zowel bij diarree als bij obstipatie is het risico verhoogd. Aangenomen wordt dat het telkens uitstellen van de defecatie bij het optreden van defecatiedrang kan leiden tot een verhoogde sfinctertonus en tot obstipatie, en tot het in stand houden van aanwezige fissuren.
Naar de relatie tussen perianale hygiëne en het ontstaan van fissura ani is weinig onderzoek verricht. Wel is er een relatie tussen chronische pruritus ani of perianaal eczeem en het optreden van hemorroïden en fissuren. Langdurig gebruik van natte toiletdoekjes, zalven en sprays kan een dermatitis veroorzaken (zie de FTR Pruritus ani). In één onderzoek bleek preventieve behandeling met vezelrijke voeding effectiever dan placebo (OR 0,1; 95%-BI 0,03 tot 0,34).
Er is geen wetenschappelijke onderbouwing voor het mijden van koffie, koolzuur, alcohol of kruiden als preventieve maatregel. Een zitbad is niet effectiever dan placebo (OR 0,91; 95%-BI 0,12 tot 4,12).
Conclusie
Bij fissura ani is regulatie van de defecatie belangrijk, waarbij zowel obstipatie als diarree moeten worden vermeden.
Medicamenteuze therapie
Naar Samenvatting ›Bloedverlies ten gevolge van een fissura ani is geen indicatie voor medicamenteuze behandeling.
Lokale anesthetica en diltiazemvaselinecrème rectaal kunnen bij acute fissuren enige verlichting van de pijnklachten geven (zie tabel 1).
Schrijf voor rectaal gebruik als lokaal anestheticum voor:
- lidocaïnevaselinecrème 30 mg/g
- lidocaïnezinksulfaatcrème
Vermeld op het recept dat het gaat om rectaal gebruik, zodat de apotheek een canule, vingercondoom of handschoen kan meeleveren.
Leg uit dat:
- de crème tot ín het anale kanaal dun aangebracht dient te worden
- aanbrengen vóór de defecatie is het meest zinvol
Instrueer de patiënt om bij gebruik langer dan 4 weken op het spreekuur te komen; de huisarts kan dan beoordelen of de diagnose herzien, of het beleid gewijzigd moet worden.
| Middel | Dosering |
|---|---|
| Lidocaïnevaselinecrème rectaal 30 mg/g | 2 dd en zo mogelijk voor elke ontlasting |
| Lidocaïne/zinksulfaatcrème rectaal 30/5 mg/g | 2 dd en zo mogelijk voor elke ontlasting |
| Diltiazemvaselinecrème of diltiazemgel rectaal 20 mg/g | 2 dd |
Chronische fissuren
Naar Samenvatting ›Geef als na 4 weken onvoldoende genezing is bereikt, of bij een chronische fissuur diltiazemvaselinecrème of diltiazemgel rectaal 20 mg/g, 2 dd.
Leg uit dat:
- diltiazemcrème of -gel aangebracht moet worden op de fissuur en de huid rondom de anus
- totdat de fissuur visueel is genezen, of tot de patiënt klachtenvrij is met een maximum van 12 weken
Wanneer een fissura ani persisteert ondanks lokale medicamenteuze therapie, is verwijzing geïndiceerd (zie paragraaf Verwijzing).
Lokale anesthetica
In een Cochrane-review is onder andere lidocaïne met placebo vergeleken. Lidocaïne had geen significant effect op de genezing (OR 0,55; 95%-BI 0,13 tot 2,31) ].? Een lokaal anestheticum heeft waarschijnlijk wel een pijnstillend effect. Bij applicatie op de slijmvliezen wordt het snel geresorbeerd waardoor de werking snel intreedt en 30-45 minuten aanhoudt.
In de praktijk moet aan de patiënt worden uitgelegd dat de crème of zalf dun moet worden aangebracht tot ín het anale kanaal. Aanbrengen vóór de defecatie is het meest zinvol.
Nitraathoudende zalven
Uitgangsvraag
Zijn nitraathoudende zalven aan te bevelen voor de behandeling van patiënten met fissura ani?
Achtergrond
De neurotransmitter stikstofmonoxide (NO), die betrokken is bij de relaxatie van de interne anale sfincter, kan worden vrijgemaakt uit organische nitraten zoals nitroglycerine (glyceryltrinitraat) en isosorbidedinitraat. Anale applicatie van nitraathoudende zalven blijkt de anale rustdruk te verlagen en de anodermale doorbloeding te verhogen. Isosorbidedinitraat heeft een kortere werkingsduur dan nitroglycerine, zodat het frequent moet worden aangebracht. In Nederland is alleen 1%-isosorbidedinitraatvaselinecrème beschikbaar.
Resultaten
Effectiviteit
In een Nederlandse dubbelblinde RCT met 37 tweedelijns patiënten had behandeling met isosorbidedinitraatvaselinecrème gedurende 1-10 weken een statistisch significant groter effect op de genezing dan placebo (85 versus 35%). In een onderzoek dat isosorbidedinitraatvaselinecrème vergeleek met sfincterotomie, was de genezing in de isosorbidedinitraatgroep na 5 weken 67% en in de sfincterotomiegroep 96% (p < 0,001), Na 10 weken was de genezing niet significant verschillend (respectievelijk 89 en 100%). Een meta-analyse van de resultaten van onderzoeken die glyceryltrinitraat met placebo vergeleken toonde een bescheiden effect van glyceryltrinitraat op de genezing (non-healing OR 0,33; 95%-BI 0,18 tot 0,62). Een andere review komt tot een gelijkluidende conclusie.
Kwaliteit van bewijs
Een beperking van de meta-analyse was dat de geïncludeerde onderzoeken verschillend van opzet waren.
Bijwerkingen
In de meta-analyse bleek het risico van hoofdpijn bij glyceryltrinitraat 30%.
Conclusie
Nitraathoudende zalf of crème heeft waarschijnlijk een bescheiden positief effect op de genezing van chronische fissurae ani.
Van bewijs naar aanbeveling
Zie ‘van bewijs naar aanbeveling’ bij calciumantagonisten.
Aanbeveling
Isosorbidedinitraatcreme 1% FNA wordt niet aanbevolen voor de behandeling van fissura ani.
Calciumantagonisten
Uitgangsvraag
Is lokale behandeling met een calciumantagonist, ten opzichte van lokale behandeling met nitraten, aan te bevelen voor de behandeling van patiënten met fissura ani?
Achtergrond
Calciumantagonisten verlagen de sfincterspanning. Een meta-analyse concludeerde dat het effect vergelijkbaar is met dat van nitraten. Sinds 2010 is diltiazemcrème beschikbaar in Nederland.
Resultaten
Onderzoeken
In een onderzoek (n = 90) bij patiënten met een chronische anale fissuur (> 6 weken) zijn 3 groepen vergeleken (lokaal diltiazem 2% 2 dd, lokaal glyceryltrinitraat 0,2% 2 dd, controlegroep met alleen vezelrijk dieet). In een tweede onderzoek (n = 80) bij patiënten met een chronische fissuur (> 8-12 weken) werd diltiazemcrème 2% 2 dd vergeleken met glyceryltrinitraat 0,2% 2 dd. In een derde onderzoek (n = 102) kregen patiënten met een chronische fissuur (> 6 weken) diltiazemcrème 2% 2 dd of glyceryltrinitraat 0,2% 2 dd.
Kwaliteit van bewijs
De bewijskracht is matig. Alle onderzoeken zijn kortdurende, kleine onderzoeken, uitgevoerd in de tweede lijn. Slechts één onderzoek is dubbelblind uitgevoerd. Ondanks de kleine aantallen wijzen de uitkomsten in dezelfde richting; ze zijn derhalve niet inconsistent.
Effectiviteit
Van de controlegroep met alleen vezelrijk dieet was 33% klachtenvrij na 6 weken, in de nitraatgroep 73% en in de diltiazemgroep 80% (significante verschillen). In de diltiazemgroep nam de pijnscore af van 7,8 ± 1,0 naar 2 ± 0,7. In de controlegroep was dit 7,0 ± 0,8 naar 5 ± 0,8.
Na 8 weken was er in de diltiazemgroep 78% klachtenvrij versus 82,5% in de glyceryltrinitraatgroep (p = 0,775). In de diltiazemgroep hadden 9 deelnemers hoofdpijnklachten, in de glyceryltrinitraatgroep 27 (significant verschil). Het effect op de pijnscore is niet gerapporteerd.
In de diltiazemgroep was 72,5% compleet klachtenvrij, in de glyceryltrinitraatgroep 54,9% (p = 0,06). De gemiddelde behandelingsduur (tot genezing was bereikt) was in de diltiazemgroep 7,58 ± 2,01 weken, in de glyceryltrinitraatgroep 4,58 ± 1,84 weken (p = 0,001). Tijdens de behandeling waren er geen significante verschillen in pijnscores. Bij aanvang bedroeg de gemiddelde pijnscore 8 op een tienpunts visuele analoge schaal (VAS), in de diltiazemgroep daalde de score na 2 weken tot 7 en na 4 weken tot 3.
Conclusie
Lokale behandeling met calciumantagonisten is voor pijn en genezing van chronische fissurae ani even effectief als lokale behandeling met nitraten.
Van bewijs naar aanbeveling
In Nederland was tot 2010 alleen de isosorbidedinitraatvaselinecrème 1% beschikbaar. Isosorbidedinitraat heeft een kortere werkingsduur dan nitroglycerine, zodat het frequent moet worden toegepast. Lokale calciumantagonisten (diltiazemcrème) hebben twee voordelen boven isosorbidedinitraat: ze hoeven maar tweemaal per dag te worden aangebracht (in plaats van vijfmaal) en geven minder hoofdpijnklachten. Men veronderstelt dat calciumantagonisten bij lokale behandeling van chronische fissuren in de eerste lijn even effectief zijn als in de tweede lijn. De plaats van diltiazem bij acute fissuren is niet onderzocht, maar het is aannemelijk dat diltiazem ook gebruikt kan worden voor acute fissuren. De kosten van lokale anesthica en diltiazemvaselinecreme zijn vergelijkbaar. Diltiazemgel is duurder dan de crème (medicijnkosten.nl, geraadpleegd 11 september 2015).
Aanbeveling
Voor de behandeling van chronische fissuren wordt behandeling met diltiazemhydrochloridevaselinecrème 2% FNA 2 dd aanbevolen.
Proctitis
Naar Samenvatting ›We bevelen aan om een proctitis alleen te behandelen als er proctologisch onderzoek is verricht en als er anamnestisch geen vermoeden bestaat van een colitis (afwezigheid van buikpijn en koorts) of een soa.
Zie de NHG-Standaard Het soa-consult voor het beleid bij het vermoeden van een soa.
Medicamenteuze therapie
Naar Samenvatting ›- Start met rectale toediening van mesalazine (zetpil of klysma).
- Evalueer de behandeling om de 2 weken.
- Bij onvoldoende effect is behandeling met een corticosteroïdklysma geïndiceerd.
- De duur van de behandeling tijdens de remissiefase wordt bepaald in overleg met de MDL-arts.
| Groep | Acute fase (2-6 weken) | Remissiefase |
|---|---|---|
| Mesalazine | zetpil 500 mg 3 dd; of | zetpil 250 mg 3 dd of |
| zetpil 1 g 1-2 dd; of | klysma 2 g 1 dd voor de nacht | |
| klysma 1-2 g 1-2 dd | ||
| Budesonide | tablet voor klysma 2,3 mg, 1 dd voor de nacht | |
| Beclometason | klysma 100 g, 0,03 mg/g, 1 dd voor de nacht | |
| Bron: Commissie Farmaceutische Hulp 2016. | ||
Er is weinig literatuur over de behandeling van (alleen) proctitis. Literatuur over de medicamenteuze behandeling van colitis ulcerosa en ziekte van Crohn wordt in deze standaard niet besproken.
In een systematische review van behandelingen van (ulceratieve) proctitis zijn in Medline 21 onderzoeken gevonden, waarvan 3 van goede kwaliteit. Uit de gepoolde resultaten van 2 onderzoeken bleek dat mesalazine (1,5 g/dag) effectiever was dan placebo: na 4 weken trad klinische verbetering op bij 44,3% van de deelnemers (95%-BI 29,4 tot 59,1); na 6 weken bij 57,9% (95%-BI 36,1 tot 79,7).
De auteurs van een Amerikaans literatuuronderzoek komen op basis van diverse kleine onderzoeken van matige kwaliteit tot de conclusie dat corticosteroïden en 5-aminosalicylzuur (mesalazine) bij lokale applicatie werkzaam zijn bij (ulceratieve) proctitis.
Een beclomethasonklysma wordt in regel alleen vergoed als de patiënt niet uitkomt met budesonide.
Aanbeveling
De werkgroep adviseert om bij milde acute ontstekingsverschijnselen te starten met een geneesmiddel dat mesalazine afgeeft. Bij onvoldoende effect van mesalazine of bij ernstige ontstekingsverschijnselen is een corticosteroïd geïndiceerd. Tijdens remissie kan men volstaan met een mesalazinepreparaat.
Controles en verwijzing
Naar Samenvatting ›Controle
Naar Samenvatting ›Persisterende klachten
Als recidiverend rectaal bloedverlies persisteert nadat hemorroïden, fissura ani of andere vermoedelijke oorzaken zijn genezen, vraag dan alsnog een coloscopie aan.
Hemorroïden
Naar Samenvatting ›- Verwijs patiënten met hemorroïden bij persisterende klachten (graad 1 of 2) of ernstige klachten (graad 3 of 4) voor verdere behandeling naar een (proctologisch deskundig) collega-huisarts, chirurg of MDL-arts die rubberbandligaturen plaatst.
- Bespreek met de patiënt de mogelijke voordelen van een ingreep. Van de patiënten met hemorroïden graad 2 is ongeveer de helft 2 jaar na een rubberbandligatie klachtenvrij, versus 20% van degenen bij wie een afwachtend beleid is gevoerd.
- Bespreek ook de nadelen en mogelijke complicaties zoals pijn of bloedingen.
- Betrek de patiënt bij de besluitvorming.
Getromboseerde perianale randvene
Naar Samenvatting ›- Verwijs patiënten met een getromboseerde perianale randvene naar een (proctologisch deskundige) chirurg bij aanhoudend bloedverlies na incisie, of verwijs de patiënt direct voor excisie.
Fissura ani
Naar Samenvatting ›- Verwijs patiënten met een fissura ani die ondanks behandeling persisteert naar een (proctologisch deskundige) dermatoloog of chirurg voor een injectie met botulinetoxine.
- Chirurgische interventie zal plaatsvinden bij onvoldoende effect van de medicamenteuze behandelingen.
Hemorroïden: De behandeling van hemorroïden is afhankelijk van hun gradering. Er zijn niet-operatieve en operatieve behandelopties. Niet-operatieve behandelopties zijn vezelrijk dieet, rubberbandligatie, sclerotherapie en lasertherapie.
Bij rubberbandligatie worden in een aantal sessies elastiekjes geschoten om de basis van het hemorroïdale weefsel, waardoor dit weefsel infarceert. Er ontstaat een wondje dat verlittekent en zo de omliggende anale mucosa fixeert waardoor er minder risico is op prolaps. Twee jaar na een rubberbandligatie is 48% van de patiënten (met hemorroïden graad 2) klachtenvrij, versus 20% bij afwachtend beleid. Bij lasertherapie worden de uiteinden van de aftakkingen gedicht door middel van pulserende laserstoten (5 per gevonden arterie) via een proctoscoop. Bij sclerotherapie wordt het hemorroïdale weefsel gefixeerd met scleroserende agentia. Eventuele nadelige effecten zijn niet of niet goed beschreven. Nadelige effecten van rubberbandligatie kunnen zijn: pijn, bloedingen en anale stenose. Mogelijk geeft sclerotherapie minder bijwerkingen dan rubberbandligatie.
De Richtlijn Proctologie doet de volgende aanbevelingen voor de behandeling van hemorroïden in de tweede lijn.
- Dieetadviezen en eventueel laxantia voor patiënten met obstipatie en/of harde ontlasting.
- Behandeling van hemorroïden graad 1, 2 of 3 met rubberbandligatie.
- Bij aanhoudend rectaal bloedverlies na maximaal 4 sessies wordt een operatie overwogen (hemorroïdectomie of hemorroïdopexie).
- Als het rectaal bloedverlies aanhoudt na 2 behandelsessies met rubberbandligatie wordt aanbevolen andere pathologie uit te sluiten.
- Laserbehandeling wordt niet aan- of afgeraden.
- Bij circulaire hemorroïden graad 3 en 4 kan gekozen worden voor operatie. Men kiest voor stapled hemorroïdectomie als de chirurg voldoende ervaring heeft met deze techniek, omdat deze minder pijnklachten geeft kort na de operatie. Als alternatief kan een conventionele hemorroïdectomie worden overwogen.
Fissura ani: Chiorurgische ingrepen ter behandeling van chronische fissurae ani zijn interne sfincterotomie en anale dilatatie. Beide behandelingen verlagen de anale rustdruk en in vergelijkend onderzoek zijn voor vergelijkbare genezingspercentages gevonden van 70-95%. Deze ingrepen hebben als nadeel het risico van incontinentie (bijvoorbeeld voor flatus). In de literatuur worden, afhankelijk van de gebruikte techniek en de meetmethode, incontinentiepercentages genoemd van 12-50% na anusdilatatie en tot 35% na laterale sfincterotomie. Omdat anale dilatatie een hoger risico op incontinentie geeft en waarschijnlijk minder effectief is, wordt deze techniek ontraden.
Injectie van botulinetoxine in de interne sfincter zorgt voor tijdelijke verlamming van het spierweefsel zodat de sfincterspanning afneemt. Botuline is een exotoxine, afkomstig van de bacterie Clostridium botulinum, dat het vrijkomen van acetylcholine uit de presynaptische axonuiteinden voorkomt en daardoor de neuromusculaire transmissie in het spierweefsel stillegt. In een vergelijkend onderzoek was het genezingspercentage 90% na laterale sfincterotomie en 45% na botulinetoxine-injecties. De kans op incontinentie was gelijk in beide groepen, maar in de botulinetoxinegroep traden vaker recidieven op.
De Richtlijn Proctologie doet de aanbeveling botulinetoxine te overwegen als alternatief binnen de behandeling van chronische fissuren of als step-up indien lokale behandeling faalt, alvorens over te gaan tot chirurgische interventie.
Proctitis, inflammatoire darmziekte, risicofactoren colorectaal carcinoom
Naar Samenvatting ›Overleg met of verwijs de patiënt naar een MDL-arts of een internist in de volgende gevallen:
- indien een proctitis onvoldoende verbetert met de ingestelde behandeling
- bij het vermoeden van een inflammatoire darmziekte of proctitis: overleg over het verdere diagnostische traject
- als er risicofactoren aanwezig zijn voor colorectaal carcinoom, maar de patiënt geen coloscopie wil of kan ondergaan en toch meer zekerheid wil hebben over de diagnose
Geen rectaal bloedverlies, vermoeden erfelijk colorectaal carcinoom
Naar Samenvatting ›Voor verwijscriteria bij het vermoeden van familiair of erfelijk colorectaal carcinoom (Lynch-syndroom, FAP) voor patiënten zonder rectaal bloedverlies: zie de bijlage Erfelijke darmkanker.
Referenties
- Fijten GH, Blijham GH, Knottnerus JA. Occurrence and clinical significance of overt blood loss per rectum in the general population and in medical practice. Br J Gen Pract 1994;44:320-5.
- Crosland A, Jones R. Rectal bleeding: prevalence and consultation behaviour. BMJ 1995;311:486-8.
- Talley NJ, Jones M. Self-reported rectal bleeding in a United States community: prevalence, risk factors, and health care seeking. Am J Gastroenterol 1998;93:2179-83.
- NIVEL. Zorgregistraties eerste lijn: Incidenties en prevalenties [internet]. Utrecht: Nederlands Instituut voor Onderzoek van de Gezondheidszorg, 2016. http://www.nivel.nl/nl/NZR/incidenties-en-prevalenties, geraadpleegd 27 juni 2016. Ga naar bron: NIVEL. Zorgregistraties eerste lijn: Incidenties en prevalenties [internet]. Utrecht: Nederlands Instituut voor Onderzoek van de Gezondheidszorg, 2016. http://www.nivel.nl/nl/NZR/incidenties-en-prevalenties, geraadpleegd 27 juni 2016.
- Fijten GH, Muris JW, Starmans R, Knottnerus JA, Blijham GH, Krebber TF. The incidence and outcome of rectal bleeding in general practice. Fam Pract 1993;10:283-7.
- Metcalf JV, Smith J, Jones R, Record CO. Incidence and causes of rectal bleeding in general practice as detected by colonoscopy. Br J Gen Pract 1996;46:161-4.
- Sanchez A, Munoz C, Bujanda L, Iriondo C, Gil-Molet A, Cosme A, et al. The value of colonoscopy to assess rectal bleeding in patiënts referred from Primary Care Units. Rev Esp Enferm Dig 2005;97:870-6.
-
Van der Linden MW, Westert GP, De Bakker DH, Schellevis FG. Tweede Nationale Studie naar ziekten en verrichtingen in de huisartspraktijk: klachten en aandoeningen in de bevolking en in de huisartspraktijk. Utrecht/Bilthoven: NIVEL/RIVM, 2004.
- Olde Bekkink M, McCowan C, Falk GA, Teljeur C, Van de Laar FA, Fahey T. Diagnostic accuracy systematic review of rectal bleeding in combination with other symptoms, signs and tests in relation to colorectal cancer. Br J Cancer 2010;102:48-58.
- Nederlandse Kankerregistratie. www.cijfersoverkanker.nl, geraadpleegd 18 maart 2015.
- IKNL. Landelijke richtlijn Erfelijke darmkanker, versie 2.0. Utrecht: Integraal Kankercentrum Nederland, 2015.
-
Russel MG, Stockbrugger RW. Epidemiologische ontwikkelingen en inzichten met betrekking tot chronische inflammatoire darmziekten. Ned Tijdschr Geneeskd 2001;145:1448-52.
- Fijten GH, Starmans R, Muris JW, Schouten HJ, Blijham GH, Knottnerus JA. Predictive value of signs and symptoms for colorectal cancer in patiënts with rectal bleeding in general practice. Fam Pract 1995;12:279-86.
- Nisar PJ, Scholefield JH. Managing haemorrhoids. BMJ 2003;327:847-51.
- Janssen LW. Consensus Hemorroiden. Ned Tijdschr Geneeskd 1994;138:2106-9.
- Wigersma L. Adviezen bij aambeien en pruritis ani: waarheden en mythen. Huisarts Wet 1997;40:204-9.
- Hulme-Moir M, Bartolo DC. Hemorrhoids. Gastroenterol Clin North Am 2001;30:183-97.
- Acheson AG, Scholefield JH. Management of haemorrhoids. BMJ 2008;336:380-3.
- NVvH. Richtlijn Proctologie (2015). Utrecht: Nederlandse Vereniging voor Heelkunde. Ga naar bron: NVvH. Richtlijn Proctologie (2015). Utrecht: Nederlandse Vereniging voor Heelkunde.
- Witte ME, Klaase JM. Gunstige resultaten van lokale injectie met botuline A toxine bij patiënten met chronische anale fissuren die niet reageren op behandeling met isosorbidedinitraat. Ned Tijdschr Geneeskd 2006;150:1513-7.
- Van der Meer J, Stehouwer CDA. Interne geneeskunde. Houten: Bohn Stafleu van Loghum, 2005.
- Punt CJA, Marijnen CAM, Nagtegaal ID, Van de Velde CJH, redactie. Handboek Colorectaal carcinoom. Utrecht: de Tijdstroom, 2013.
- Gonzalez EC, Roetzheim RG, Ferrante JM, Campbell R. Predictors of proximal vs. distal colorectal cancers. Dis Colon Rectum 2001;44:251-8.
- Oh SW, Kim YH, Choi YS, Chang DK, Son HJ, Rhee PL, et al. The comparison of the risk factors and clinical manifestations of proximal and distal colorectal cancer. Dis Colon Rectum 2008;51:56-61.
- Ferrari P, Jenab M, Norat T, Moskal A, Slimani N, Olsen A, et al. Lifetime and baseline alcohol intake and risk of colon and rectal cancers in the European prospective investigation into cancer and nutrition (EPIC). Int J Cancer 2007;121:2065-72.
- Pischon T, Lahmann PH, Boeing H, Friedenreich C, Norat T, Tjonneland A, et al. Body size and risk of colon and rectal cancer in the European Prospective Investigation Into Cancer and Nutrition (EPIC). J Natl Cancer Inst 2006;98:920-31.
- Gezondheidsraad. Richtlijnen goede voeding 2015. Den Haag: Gezondheidsraad, 2015. Publicatienr. 2015/24. Ga naar bron: Gezondheidsraad. Richtlijnen goede voeding 2015. Den Haag: Gezondheidsraad, 2015. Publicatienr. 2015/24.
- Del Giudice ME, Vella ET, Hey A, Simunovic M, Harris W, Levitt C. Systematic review of clinical features of suspected colorectal cancer in primary care. Can Fam Physician 2014;60:e405-15.
- Hippisley-Cox J, Coupland C. Identifying patients with suspected colorectal cancer in primary care: Derivation and validation of an algorithm. Br J Gen Pract 2012;62:e29-37.
- Jellema P, Van der Windt DA, Bruinvels DJ, Mallen CD, Van Weyenberg SJ, Mulder CJ, et al. Value of symptoms and additional diagnostic tests for colorectal cancer in primary care: Systematic review and meta-analysis. BMJ 2010;340:c1269.
- Lawrenson R, Logie J, Marks C. Risk of colorectal cancer in general practice patiënts presenting with rectal bleeding, change in bowel habit or anaemia. Eur J Cancer Care (Engl) 2006;15:267-71.
- Hamilton W, Round A, Sharp D, Peters TJ. Clinical features of colorectal cancer before diagnosis: a population-based case-control study. Br J Cancer 2005;93:399-405.
- Hamilton W, Lancashire R, Sharp D, Peters TJ, Cheng K, Marshall T. The risk of colorectal cancer with symptoms at different ages and between the sexes: A case-control study. BMC Med 2009;7:17.
- Heintze C, Matysiak-Klose D, Krohn T, Wolf U, Brand A, Meisner C, et al. Diagnostic work-up of rectal bleeding in general practice. Br J Gen Pract 2005;55:14-9.
- Nørrelund N, Nørrelund H. Colorectal cancer and polyps in patiënts aged 40 years and over who consult a GP with rectal bleeding. Fam Pract 1996;13:160-5.
- IKNL. Landelijke richtlijn Anuscarcinoom. Utrecht: Integraal Kankercentrum Nederland, 2012a. Ga naar bron: IKNL. Landelijke richtlijn Anuscarcinoom. Utrecht: Integraal Kankercentrum Nederland, 2012a.
- Daling JR, Madeleine MM, Johnson LG, Schwartz SM, Shera KA, Wurscher MA, et al. Human papillomavirus, smoking, and sexual practices in the etiology of anal cancer. Cancer 2004;101:270-80.
- Tseng HF, Morgenstern H, Mack TM, Peters RK. Risk factors for anal cancer: results of a population-based case-control study. Cancer Causes Control 2003;14:837-46.
- Lutgens MW, Van Oijen MG, Van der Heijden GJ, Vleggaar FP, Siersema PD, Oldenburg B. Declining risk of colorectal cancer in inflammatory bowel disease: An updated meta-analysis of population-based cohort studies. Inflamm Bowel Dis 2013;19:789-99.
- ICC. Handleiding behandeling IBD – 2014-2015: Moderniseren van de richtlijn IBD 2009. Haarlem: Haarlem: Initiative on Crohn and Colitis/Nederlandse Vereniging voor Maag-Darm-Leverartsen, 2015. Ga naar bron: ICC. Handleiding behandeling IBD – 2014-2015: Moderniseren van de richtlijn IBD 2009. Haarlem: Haarlem: Initiative on Crohn and Colitis/Nederlandse Vereniging voor Maag-Darm-Leverartsen, 2015.
- Commissie Farmaceutische Hulp. Farmacotherapeutisch Kompas 2016. Diemen: Zorginstituut Nederland, 2016. Ga naar bron: Commissie Farmaceutische Hulp. Farmacotherapeutisch Kompas 2016. Diemen: Zorginstituut Nederland, 2016.
- KNMP. Informatorium Medicamentorum. Den Haag: Koninklijke Nederlandse Maatschappij ter bevordering der Pharmacie, 2016.
- Aronson JK. Meyler’s side effects of drugs: the international encyclopedia of adverse drug reactions and interactions. Amsterdam: Elsevier, 2006.
- Hamilton W, Sharp D. Diagnosis of colorectal cancer in primary care: the evidence base for guidelines. Fam Pract 2004;21:99-106.
- Bindewald H. Indikationen und Treffsicherheit der Rektoskopie. MMW Munch Med Wochenschr 1976;118:1271-2.
- Weiss W, Hanak H, Huber A. Effizienz der rektal-digitalen Untersuchung zur Fruherkennung des Dickdarmkarzinoms. Wien Klin Wochenschr 1977;89:654-60.
- Goudswaard AN, In ‘t Veld CJ, Kramer WLM. Handboek verrichtingen in de huisartsenpraktijk. Houten: Prelum Uitgevers, 2014.
- Vermeire S, Van Assche G, Rutgeerts P. Laboratory markers in IBD: useful, magic, or unnecessary toys? Gut 2006;55:426-31.
- CBO. Richtlijn Diagnostiek en behandeling van inflammatoire darmziekten bij volwassenen. Utrecht: Kwaliteitsinstituut voor de gezondheidszorg CBO, 2008. Ga naar bron: CBO. Richtlijn Diagnostiek en behandeling van inflammatoire darmziekten bij volwassenen. Utrecht: Kwaliteitsinstituut voor de gezondheidszorg CBO, 2008.
- Cummings JR, Keshav S, Travis SP. Medical management of Crohn’s disease. BMJ 2008;336:1062-6.
- Kok L, Elias SG, Witteman BJ, Goedhard JG, Muris JW, Moons KG, et al. Diagnostic accuracy of point-of-care fecal calprotectin and immunochemical occult blood tests for diagnosis of organic bowel disease in primary care: The cost-effectiveness of a decision rule for abdominal complaints in primary care (cedar) study. Clin Chem 2012;58:989-98.
- Erlinger TP, Platz EA, Rifai N, Helzlsouer KJ. C-reactive protein and the risk of incident colorectal cancer. JAMA 2004;291:585-90.
- Lee YJ, Lee HR, Nam CM, Hwang UK, Jee SH. White blood cell count and the risk of colon cancer. Yonsei Med J 2006;47:646-56.
- Duffy MJ, Van Dalen A., Haglund C, Hansson L, Holinski-Feder E, Klapdor R, et al. Tumour markers in colorectal cancer: European Group on Tumour Markers (EGTM) guidelines for clinical use. Eur J Cancer 2007;43:1348-60.
- NHG-Standpunt Bevolkingsonderzoek darmkanker. Huisarts & Wetenschap. https://www.henw.org/artikelen/nhg-standpunt-bevolkingsonderzoek-darmkanker
- Högberg C, Karling P, Rutegård J, Lilja M, Ljung T. Immunochemical faecal occult blood tests in primary care and the risk of delay in the diagnosis of colorectal cancer. Scand J Prim Health Care 2013;31:209-14.
- IKNL. Landelijke richtlijn Colorectaalcarcinoom. Utrecht: Integraal Kankercentrum Nederland, 2014. Ga naar bron: IKNL. Landelijke richtlijn Colorectaalcarcinoom. Utrecht: Integraal Kankercentrum Nederland, 2014.
- Pickhardt PJ, Hassan C, Halligan S, Marmo R. Colorectal cancer: Ct colonography and colonoscopy for detection--systematic review and meta-analysis. Radiology 2011;259:393-405.
- Atkin W, Dadswell E, Wooldrage K, Kralj-Hans I, Von Wagner C, Edwards R, et al. Computed tomographic colonography versus colonoscopy for investigation of patiënts with symptoms suggestive of colorectal cancer (siggar): A multicentre randomised trial. Lancet 2013;381:1194-202.
- NVMDL. Nederlandse richtlijn Coloscopie surveillance (2013). Haarlem: Nederlandse Vereniging voor Maag-Darm-Leverartsen. Ga naar bron: NVMDL. Nederlandse richtlijn Coloscopie surveillance (2013). Haarlem: Nederlandse Vereniging voor Maag-Darm-Leverartsen.
- Stoker J, Dekker E. CT-colonografie in de dagelijkse praktijk. Ned Tijdschr Geneeskd 2013;157:A6477.
- Van Rijn JC, Reitsma JB, Stoker J, Bossuyt PM, Van Deventer SJ, Dekker E. Polyp miss rate determined by tandem colonoscopy: a systematic review. Am J Gastroenterol 2006;101:343-50.
- Rockey DC, Paulson E, Niedzwiecki D, Davis W, Bosworth HB, Sanders L, et al. Analysis of air contrast barium enema, computed tomographic colonography, and colonoscopy: prospective comparison. Lancet 2005;365:305-11.
- Ellis BG, Thompson MR. Factors identifying higher risk rectal bleeding in general practice. Br J Gen Pract 2005;55:949-55.
- Helfand M, Marton KI, Zimmer-Gembeck MJ, Sox HC, Jr. History of visible rectal bleeding in a primary care population. Initial assessment and 10-year follow-up. JAMA 1997;277:44-8.
- Lieberman DA, et al. Low rate of large polyps (>9mm) within 10 years after an adequate baseline colonoscopy with no polyps. Gastroenteroloy 2014;147:343-350.
- Alonso-Coello P, Castillejo MM. Office evaluation and treatment of hemorrhoids. J Fam Pract 2003;52:366-74.
- Hodes B. Hemorrhoidal products. Handbook of nonprescription drugs. Washington: American Pharmaceutical Association, 1982. p. 641-55.
- Anonymus. Local preparations for ano-rectal symptoms. Drug Ther Bull 1969;7:41-3.
- Joosten AAM. Dermatica op recept. Den Haag: Koninklijke Nederlandse Maatschappij ter bevordering der Pharmacie, 2011.
- Briel JW, Zimmerman DD, Schouten WR. Treatment of acute strangulated internal hemorrhoids by topical application of isosorbide dinitrate ointment. Int J Colorectal Dis 2000;15:253-4.
- Gorfine SR. Treatment of benign anal disease with topical nitroglycerin. Dis Colon Rectum 1995;38:453-6.
- Van den Berg M, Stroeken HJ, Hoofwijk AG. Gunstige resultaten van conservatieve behandeling met isosorbidedinitraat van 25 patiënten met graad-4-hemorroiden: een pilotstudie. Ned Tijdschr Geneeskd 2003;147:971-3.
- Smith RB, Moodie J. Comparative efficacy and tolerability of two ointment and suppository preparations (‘Uniroid’ and ‘Proctosedyl’) in the treatment of second degree haemorrhoids in general practice. Curr Med Res Opin 1988;11:34-40.
- Pigot F, Siproudhis L, Allaert FA. Risk factors associated with hemorrhoidal symptoms in specialized consultation. Gastroenterol Clin Biol 2005;29:1270-4.
- Jensen SL. Treatment of first episodes of acute anal fissure: prospective randomised study of lignocaine ointment versus hydrocortisone ointment or warm sitz baths plus bran. Br Med J (Clin Res Ed) 1986;292:1167-9.
- Nelson R. Non surgical therapy for anal fissure. Cochrane Database Syst Rev 2012;CD003431.
- Stassen LPS, Schouten WR. Behandeling van chronisch fissura ani met nitraatzalf. Ned Tijdschr Geneeskd 1999;143:13.
- Cook TA, Brading AF, Mortensen NJ. The pharmacology of the internal anal sphincter and new treatments of ano-rectal disorders. Aliment Pharmacol Ther 2001;15:887-98.
- Madoff RD, Fleshman JW. AGA technical review on the diagnosis and care of patiënts with anal fissure. Gastroenterology 2003;124:235-45.
- Werre AJ, Palamba HW, Bilgen EJ, Eggink WF. Isosorbide dinitrate in the treatment of anal fissure: a randomised, prospective, double blind, placebo-controlled trial. Eur J Surg 2001;167:+382-5.
- Parellada C. Randomized, prospective trial comparing 0.2 percent isosorbide dinitrate ointment with sphincterotomy in treatment of chronic anal fissure: a two-year follow-up. Dis Colon Rectum 2004;47:437-43.
- Jonas M, Scholefield J. Anal fissure (chronic). Clin Evid 2004;581-90.
- Shrivastava UK, Jain BK, Kumar P, Saifee Y. A comparison of the effects of diltiazem and glyceryl trinitrate ointment in the treatment of chronic anal fissure: a randomized clinical trial. Surg Today 2007;37:482-5.
- Jawaid M, Masood Z, Salim M. Topical diltiazem hydrochloride and glyceryl trinitrate in the treatment of chronic anal fissure. J Coll Physicians Surg Pak 2009;19:614-7.
- Sanei B, Mahmoodieh M, Masoudpour H. Comparison of topical glyceryl trinitrate with diltiazem ointment for the treatment of chronic anal fissure: a randomized clinical trial. Acta Chir Belg 2009;109:727-30.
- Cohen RD, Woseth DM, Thisted RA, Hanauer SB. A meta-analysis and overview of the literature on treatment options for left-sided ulcerative colitis and ulcerative proctitis. Am J Gastroenterol 2000;95:1263-76.
- Regueiro M, Loftus EV, Jr., Steinhart AH, Cohen RD. Medical management of left-sided ulcerative colitis and ulcerative proctitis: critical evaluation of therapeutic trials. Inflamm Bowel Dis 2006;12:979-94.
- Nelson R. Operative procedures for fissure in ano. Cochrane Database Syst Rev 2005;CD002199.
- Arroyo A, Perez F, Serrano P, Candela F, Lacueva J, Calpena R. Surgical versus chemical (botulinum toxin) sphincterotomy for chronic anal fissure: long-term results of a prospective randomized clinical and manometric study. Am J Surg 2005;189:429-34.