Beroerte
Richtlijnen diagnostiek
Naar Volledige tekst ›Eerste (telefonische) contact
Naar Volledige tekst ›Beoordeel de klinische toestand van de patiënt volgens de ABCDE-systematiek.
ABCDE instabiel
- Bel, indien de patiënt ABCDE-instabiel is, bijvoorbeeld bij verlaagd bewustzijn of epileptisch insult, direct een ambulance met A1-indicatie.
- Overweeg vervolgens een spoedvisite af te leggen.
- Indien er alleen neurologische uitvalsverschijnselen zijn, volg het beleid bij ABCDE stabiel.
ABCDE stabiel
Naar Volledige tekst ›- Maak (telefonisch) een inschatting van de waarschijnlijkheid van een TIA, herseninfarct of hersenbloeding. Overweeg hierbij de FAST-test te gebruiken.
- Zie verder Anamnese en Richtlijnen Beleid acute fase
FAST-test (Face-Arm-Speech-Time-test)
- Deze test wordt bij voorkeur afgenomen door iemand in de directe omgeving van de patiënt:
1. Gezicht: vraag de patiënt de tanden te laten zien. Let op scheefstand mond en afhangende mondhoek.
2. Arm: vraag de patiënt beide armen tegelijk horizontaal naar voren te strekken en de handpalmen naar boven te draaien. Let op of een arm wegzakt of rondzwalkt.
3. Spraak: vraag naar veranderingen in het spreken (onduidelijk spreken, niet meer uit de woorden kunnen komen).
4. Tijd: vraag hoe laat de klachten zijn begonnen. - Interpretatie: bij geen goede uitvoering van ≥ 1 van de eerste 3 opdrachten is er verdenking op een beroerte. Houd er rekening mee dat de FAST-test negatief kan zijn, vooral bij een beroerte in het vertebrobasilaire stroomgebied.
Anamnese
Naar Volledige tekst ›Vraag bij vermoeden van een beroerte naar:
- aard van de uitvalsverschijnselen (zoals paresen, spraak-/taalstoornis)
- tijdstip van ontstaan van de uitvalsverschijnselen
- acuut of geleidelijk begin
- beloop
- eerdere episoden met gelijksoortige verschijnselen
- gebruik van orale anticoagulantia; tijdstip van laatste inname; recente bloedingen of operaties
- risicofactoren voor beroerte: hoge bloeddruk, hart- en vaatziekten waaronder atriumfibrilleren, diabetes mellitus, overgewicht, overmatig alcoholgebruik, roken, migraine, drugsgebruik, hormoontherapie tijdens de overgang of als anticonceptie
Lichamelijk onderzoek
Naar Volledige tekst ›- Onderzoek de aanwezigheid, aard en ernst van de uitvalsverschijnselen (ook indien anamnestisch geen uitvalsverschijnselen meer).
- Meet de bloeddruk en ausculteer het hart (ritme en frequentie).
Evaluatie
Naar Volledige tekst ›- Stel de werkdiagnose herseninfarct of intracerebrale bloeding bij patiënten met focale uitvalsverschijnselen die nog aanwezig zijn bij presentatie. Kenmerkend is dat de verschijnselen acuut, gelijktijdig en zonder voortekenen zijn begonnen.
- Stel de werkdiagnose TIA bij patiënten met passagère focale uitvalsverschijnselen die bij presentatie volledig verdwenen zijn. Kenmerkend is dat de uitvalsverschijnselen acuut, gelijktijdig en zonder voortekenen zijn begonnen, en te verklaren zijn vanuit een stoornis in 1 cerebraal stroomgebied.
- Voor de belangrijkste differentiaaldiagnostische overwegingen bij neurologische uitvalsverschijnselen, zie tabel 4.
Richtlijnen beleid acute fase
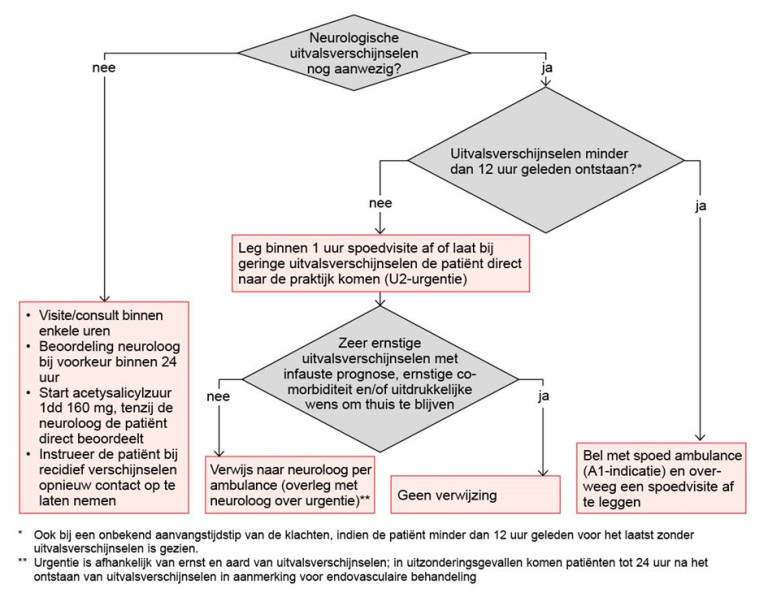
Naar Volledige tekst ›De aanwezigheid van uitvalsverschijnselen en de mogelijkheid tot acute behandeling bepalen de verwijs-urgentie (zie stroomschema).
Beoordeel tot welke categorie de patiënt behoort op basis van aanwezigheid en duur van de uitvalsverschijnselen en eventuele behandelbeperking:
Uitvalsverschijnselen aanwezig, < 12 uur geleden ontstaan (U1, spoed)
Naar Volledige tekst ›- Bel met spoed een ambulance (A1-indicatie) en verwijs patiënt naar de neuroloog.
- Overweeg, na het inschakelen van de ambulance, een spoedvisite af te leggen (U1-urgentie).
- Verwijs de patiënt ook met spoed indien onduidelijk is wanneer de uitvalsverschijnselen zijn begonnen (bijvoorbeeld wake-up stroke), maar de patiënt < 12 uur geleden voor het laatst zonder uitvalsverschijnselen is gezien.
- Verzamel, indien mogelijk, informatie over de contra-indicaties voor intraveneuze trombolyse (zie tabel 5).
Uitvalsverschijnselen aanwezig, ≥ 12 uur geleden ontstaan (U2, < 1 uur)
Naar Volledige tekst ›- Leg een spoedvisite af (U2-urgentie, < 1 uur) of laat de patiënt met geringe uitvalsverschijnselen direct naar de praktijk komen.
- Overleg vervolgens, wanneer een beroerte aannemelijk is, met de neuroloog over de urgentie waarmee patiënt verwezen moet worden (A1- of A2-indicatie, onder andere afhankelijk van duur en ernst van de uitvalsverschijnselen).
Uitvalsverschijnselen aanwezig: infauste prognose of wens thuis te blijven (U2, < 1 uur)
Naar Volledige tekst ›- Leg een spoedvisite af (U2-urgentie, < 1 uur)
- Houd bij de besluitvorming over opname rekening met de wens van de patiënt en diens familie. Of de patiënt thuis kan blijven, hangt af van de mogelijkheden van de omgeving (partner, mantelzorg, thuiszorg). Zie Aandachtspunten indien de patiënt thuis blijft.
Uitvalsverschijnselen volledig verdwenen (U3, binnen enkele uren)
Naar Volledige tekst ›- Laat de patiënt naar de praktijk komen of leg een visite af (U3, binnen enkele uren).
- Instrueer de patiënt om direct opnieuw contact met de huisarts op te nemen indien de verschijnselen in de tussentijd recidiveren.
- Bij de werkdiagnose TIA:
- overleg met de neuroloog over de gewenste termijn van beoordeling door de neuroloog (bij voorkeur binnen 24 uur)
- start acetylsalicylzuur 1 dd 160 mg, tenzij de neuroloog de patiënt direct beoordeelt.
Richtlijnen beleid na ontslag
Naar Volledige tekst ›Overdracht van tweede lijn naar huisarts
Naar Volledige tekst ›- De aard en intensiteit van de nazorg direct na ontslag hangt af van de toestand van de patiënt (aard en ernst van de restverschijnselen, complicaties) en van diens prognose.
- Het verdient aanbeveling om contact op te nemen met de patiënt binnen enkele dagen na het ontslag; leg een visite af of nodig de patiënt uit op het spreekuur.
Aandachtspunten
Naar Volledige tekst ›Besteed, afhankelijk van de fase waarin de patiënt verkeert, eventuele behandeling en controle elders en aard en ernst van de uitvalsverschijnselen, aandacht aan de volgende aspecten en betrek daarbij, indien mogelijk, de partner/mantelzorger:
- Bespreek de beperkingen, ervaren steun en behandeling, zoals deelname aan een revalidatieprogramma, depressieve of angstklachten, relationele en seksuele problemen, vermoeidheidsklachten, het maatschappelijk functioneren en de re-integratie in het arbeidsproces.
- Beoordeel de (ernst van beperkingen in de) communicatie en waarneming (zoals neglect, hemianopsie, afasie en/of dysartrie), aanwezigheid van cognitieve stoornissen.
- Verricht diagnostiek bij tekenen van een cognitieve stoornis (zie NHG-Standaard Dementie).
- Beoordeel de belastbaarheid van de mantelzorg.
Voorlichting
Naar Volledige tekst ›Bespreek:
- aard en oorzaak van de aandoening
- behandeling (revalidatietraject, secundaire preventie)
- prognose
- geef informatie over het omgaan met de ziekte en de beperkingen
- adviseer direct contact op te nemen met de huisarts bij opnieuw optreden van uitvalsverschijnselen
Secundaire preventie
- Na een TIA of herseninfarct is er sprake van een zeer hoog risico op hart- en vaatziekten.
- Wees alert op aanwijzingen voor (paroxismaal) atriumfibrilleren.
- Benadruk het belang van de leefstijladviezen en het juiste gebruik van de voorgeschreven medicatie (zie Medicamenteuze onderhoudsbehandeling).
- Ga met de patiënt na op welke leefstijlfactor(en) de grootste winst te behalen is en wat de meest haalbare aanpak is. Adviseer:
- niet te roken en/of mee te roken;
- voldoende te bewegen: ≥ 150 minuten per week matig intensieve inspanning zoals wandelen en fietsen, verspreid over diverse dagen; < 8 uur per dag zitten;
- te streven naar een optimaal gewicht: BMI 20-25 kg/m2;
- gezond te eten volgens de Schijf van Vijf van het Voedingscentrum;
- stress te voorkomen.
- Ontraad patiënten met een doorgemaakt(e) TIA of herseninfarct:
- oestrogeenbevattende anticonceptiva (zie NHG-Standaard Anticonceptie);
- hormoontherapie vanwege overgangsklachten (zie NHG-Standaard De overgang).
Medicamenteuze onderhoudsbehandeling
Naar Volledige tekst ›De neuroloog start de secundaire preventie. Continueer deze medicatie in principe levenslang.
Na een TIA of herseninfarct
- Trombocytenaggregatieremmers:
- acetylsalicylzuur 1 dd 80 mg in combinatie met dipyridamol 2 dd 200 mg (eerste 2 weken 1 dd 200 mg)
óf - clopidogrel 1 dd 75 mg
- acetylsalicylzuur 1 dd 80 mg in combinatie met dipyridamol 2 dd 200 mg (eerste 2 weken 1 dd 200 mg)
- Patiënten met een TIA of minor stroke kunnen gedurende 3 weken behandeld worden met de combinatie clopidogrel en acetylsalicylzuur, mits dit binnen 24 uur door de neuroloog wordt gestart. De duale behandeling wordt gevolgd door clopidogrel monotherapie of door dipyridamol in combinatie met acetylsalicylzuur.
- Bij een TIA of herseninfarct als gevolg van atriumfibrilleren of andere cardiale emboliebron: geef vitamine K-antagonisten of DOAC’s in plaats van een trombocytenaggregatieremmer, zie NHG-Standaard Atriumfibrilleren.
- Cholesterolverlagende medicatie: zie NHG-Standaard CVRM.
- Antihypertensiva: zie NHG-Standaard CVRM.
Na een intracerebrale bloeding
- Antihypertensiva: ook bij systolische bloeddruk ≤ 140 mmHg, mits een lagere bloeddruk wordt verdragen (volg stappenplan, zie NHG-Standaard CVRM).
- Trombocytenaggregatieremmers kunnen waarschijnlijk veilig gebruikt worden bij patiënten met een intracerebrale bloeding die optrad tijdens het gebruik van antitrombotische medicatie (trombocytenaggregatieremmers of orale anticoagulantia).
Controles
Naar Volledige tekst ›- Maak afspraken met patiënt en diens partner/mantelzorger over de frequentie van de controles; dit hangt mede af van de beperkingen van de patiënt.
- Wees ook na een minor stroke of TIA alert op beperkingen.
- Indien de patiënt stabiel is en alle benodigde zorg is ingeschakeld, ligt de nadruk bij controles op cardiovasculair risicomanagement.
- Soms blijft een diagnose TIA onzeker. Besteed dan bij vervolgconsulten aandacht aan eventuele recidiverende verschijnselen en blijf alert op een alternatieve oorzaak voor de klachten.
Consultatie en verwijzing
Naar Volledige tekst ›- Bij recidief uitvalsverschijnselen en complicaties (zoals epileptische insulten): neuroloog
- Bij beperkingen van somatisch of maatschappelijk functioneren: revalidatiearts of specialist ouderengeneeskunde
- Bij contracturen of spasticiteit: revalidatiearts
- Bij (te verwachten) problemen met de re-integratie in het arbeidsproces: bedrijfsarts
- Bij onduidelijkheid over bestaan en aard van cognitieve stoornissen en/of emotionele gedragsstoornissen: neuropsycholoog (in overleg met neuroloog en/of revalidatiearts)
- Bij cognitieve stoornissen, indien cognitieve revalidatie wordt overwogen: ergotherapeut, revalidatiearts of specialist ouderengeneeskunde
- Bij een kwetsbare oudere met complexe problematiek: specialist ouderengeneeskunde
- Bij taal-, spraak- en/of slikproblemen: logopedist
- Bij mobiliteitsproblemen: oefen- of fysiotherapeut
- Bij ernstige vermoeidheid, beperkingen bij werkhervatting, ADL en huishoudelijke verrichtingen en/of noodzaak tot aanpassingen en hulpmiddelen in de thuissituatie: ergotherapeut
Belangrijkste wijzigingen
Naar Samenvatting ›- Er is meer aandacht voor de (differentiaal)diagnose bij uitvalsverschijnselen in het vertebrobasilaire stroomgebied.
- Het beleid in de acute fase bij vermoeden van een beroerte is gewijzigd:
- bel met spoed een ambulance (A1-indicatie) bij patiënten met uitvalsverschijnselen, die < 12 uur geleden zijn ontstaan;
- leg een visite af (U2-urgentie) bij patiënten met uitvalsverschijnselen die ≥ 12 uur bestaan en verwijs vervolgens bij vermoeden van een beroerte direct naar de neuroloog;
- beoordeel patiënten bij wie de uitvalsverschijnselen volledig verdwenen zijn, binnen een paar uur (U3-urgentie). Verwijs vervolgens patiënten bij wie u de werkdiagnose TIA stelt naar de neuroloog, bij voorkeur binnen 24 uur.
- Duale therapie na een TIA of minor stroke is toegevoegd: patiënten kunnen gedurende 3 weken behandeld worden met de combinatie clopidogrel en acetylsalicylzuur, mits dit binnen 24 uur door de neuroloog wordt gestart.
- Er is meer aandacht voor vermoeidheid en cognitieve problemen na een TIA of minor stroke.
Kernboodschappen
Naar Samenvatting ›- Plotseling optredende verschijnselen van focale uitval in de hersenen als gevolg van ischemie (TIA of herseninfarct) of van een spontane intracerebrale bloeding, worden in de standaard aangeduid met de overkoepelende term ‘beroerte’.
- Het beleid bij het vermoeden van een beroerte is afhankelijk van de aanwezigheid van uitvalsverschijnselen bij presentatie en de mogelijkheid tot acute behandeling.
- Stel de werkdiagnose TIA bij patiënten bij wie geen uitvalsverschijnselen meer aanwezig zijn bij presentatie aan de huisarts.
- Start acetylsalicylzuur 1dd 160 mg bij de werkdiagnose TIA, tenzij de patiënt direct door de neuroloog wordt onderzocht.
- Een patiënt met een doorgemaakte TIA of herseninfarct wordt beschouwd als een patiënt met een zeer hoog risico op hart- en vaatziekten. Inventariseer en optimaliseer de risicofactoren voor hart- en vaatziekten.
- Een beroerte kan tot (ernstige) restverschijnselen op lichamelijk en psychisch gebied leiden. Controleer de patiënt, afhankelijk van de aard en ernst van de verschijnselen, regelmatig en wees alert op lichamelijke en neuropsychologische restverschijnselen.
Inleiding
Naar Samenvatting ›Scope
Naar Samenvatting ›- Diagnostiek en beleid bij patiënten met neurologische uitvalsverschijnselen die plotseling ontstaan zijn als gevolg van cerebrale ischemie (transient ischaemic attack (TIA) of herseninfarct) of van een spontane intracerebrale bloeding.
- De rol van de huisarts na het ontslag uit het ziekenhuis of revalidatie instelling:
- het signaleren en begeleiden van patiënten met restverschijnselen
- secundaire preventie
Buiten de scope
Naar Samenvatting ›- Andere oorzaken van neurologische uitvalsverschijnselen, zoals een subduraal hematoom of subarachnoïdale bloeding.
- Het beleid bij een herseninfarct dat is vastgesteld middels beeldvorming en niet gepaard is gegaan met klinisch herkenbare uitvalsverschijnselen (stil herseninfarct).
Afstemming
Naar Samenvatting ›De aanbevelingen sluiten zoveel mogelijk aan bij de volgende richtlijnen:
Achtergronden
Naar Samenvatting ›Begrippen
Naar Samenvatting ›Beroerte
Overkoepelende term voor plotseling optredende verschijnselen van focale uitval in de hersenen als gevolg van ischemie (TIA en herseninfarct) of een spontane intracerebrale bloeding.
Transient ischaemic attack (TIA)
Voorbijgaande episode met neurologische verschijnselen als gevolg van focale ischemie van de hersenen, het ruggenmerg of de retina zonder dat er bij beeldvorming aanwijzingen zijn voor verse infarcering.
Herseninfarct
Plotseling optredende verschijnselen van focale uitval in de hersenen als gevolg van infarcering.
Minor stroke
Klein herseninfarct met geringe uitvalsverschijnselen die niet volledig herstellen.
Intracerebrale bloeding
Plotseling optredende verschijnselen van focale uitval in de hersenen als gevolg van een spontane parenchymateuze bloeding.
De huidige definitie van een TIA (volgens de American Heart Association) luidt: een voorbijgaande episode met neurologische uitval als gevolg van focale ischemie van de hersenen, het ruggenmerg of de retina zonder acute infarcering. Als er sprake is van infarcering bij beeldvormend onderzoek (CT/MRI) is er, onafhankelijk van de duur van de symptomen, sprake van een herseninfarct.
De internationaal langdurig gehanteerde tijdsgrens van 24 uur is inmiddels verlaten, aangezien bij 3 op de 4 patiënten de uitvalsverschijnselen binnen 1 uur volledig zijn verdwenen. Daarnaast worden met diffusiegewogen MRI (DWI) verse ischemische afwijkingen gevonden bij circa 1 op de 3 patiënten met een TIA volgens bovenstaande definitie.
Wat betreft oorzaken, diagnostiek en secundaire preventie bestaat er geen verschil tussen een TIA of herseninfarct. Daarnaast is het bij uitvalsverschijnselen onwenselijk om af te wachten of deze voorbijgaand zijn. De werkdiagnose TIA wordt gehanteerd bij patiënten bij wie geen uitvalsverschijnselen meer aanwezig zijn bij presentatie aan de huisarts. De neuroloog stelt de definitieve diagnose TIA indien er geen aanwijzingen zijn voor andere intracraniële pathologie en er bij beeldvormend onderzoek geen aanwijzingen zijn voor verse infarcering.
De term ‘beroerte’ is de vertaling van de Engelse term stroke, een verzamelnaam voor spontane intracerebrale bloedingen, subarachnoïdale bloedingen en infarcten van de hersenen, ruggenmerg of retina.
In deze standaard hanteren we ‘beroerte’ als overkoepelende term voor herseninfarct, spontane intracerebrale bloeding en TIA. Subarachnoïdale bloedingen vallen buiten het bestek van deze standaard.
Epidemiologie
Naar Samenvatting ›- De incidentie van TIA (ICPC-code K89) in de huisartsenpraktijk bedroeg in 2020 3,1 per 1000 personen per jaar.
- De incidentie van herseninfarct en intracerebrale bloeding (ICPC K90) in de algemene bevolking bedroeg in 2020 2,0 per 1000 personen per jaar en neemt sterk toe met de leeftijd.
- De incidentie is ongeveer gelijk voor vrouwen en mannen. Vrouwen zijn gemiddeld ouder dan mannen op het moment van hun eerste beroerte; de klinische presentatie is niet wezenlijk verschillend.
- Een herseninfarct of hersenbloeding was bij 9288 patiënten in 2019 de primaire doodsoorzaak. De gemiddelde leeftijd van overlijden was 83 jaar voor vrouwen en 79 jaar voor mannen.
- Bij ongeveer 80% van de patiënten met een beroerte is er sprake van een herseninfarct, bij 20% is er sprake van een intracerebrale bloeding.
Mortaliteit
- De kans om binnen 30 dagen na de eerste opname te overlijden was in 2019 na een herseninfarct 11,4% en na een hersenbloeding 35,5%. Na 1 jaar was de kans respectievelijk 21,8 en 42,4%, en na 5 jaar 45,6 en 60,6%.
- De eerste dagen na een herseninfarct of intracerebrale bloeding is de sterfte meestal het gevolg van de hersenschade of cardiale problematiek. Hierna komen andere oorzaken op de voorgrond te staan, zoals complicaties als gevolg van immobiliteit of andere hart- en vaatziekten.
Incidentie en prevalentie
Om tot het Nederlandse incidentie- en prevalentiecijfer te komen heeft het NIVEL het aantal personen geteld dat ooit een vermelding van TIA of CVA had in het huisartsendossier. Doordat deze cijfers gebaseerd zijn op klinische diagnoses is er zeer waarschijnlijk sprake van onderregistratie.
In 2019 werden 23.016 mannen en 19.578 vrouwen opgenomen in het ziekenhuis met de diagnose beroerte; de gemiddelde leeftijd bij opname was 70 jaar voor mannen en 73 jaar voor vrouwen.
In 2019 overleden in totaal 4001 mannen en 5287 vrouwen aan een beroerte, hun gemiddelde leeftijd was 79 jaar voor mannen en 83 jaar voor vrouwen. De kans om binnen 30 dagen na een beroerte te overlijden was 11,8%, de kans om binnen 1 jaar te overlijden is 20,2% en de kans om binnen 5 jaar te overlijden 37,9%. De overlijdenskans is na een hersenbloeding veel hoger dan na een herseninfarct: in 2019 was de kans om binnen 30 dagen na de eerste opname voor een hersenbloeding te overlijden 35,5%, bij herseninfarct was dit 11,4%.
Tussen 1980 en 2019 is het voor de bevolkingsopbouw gecorrigeerde sterftecijfer voor beroerte bij mannen gedaald met 69% (van 148 naar 46 per 100.000 patiënten) en bij vrouwen met 65% (van 172 naar 61 per 100.000 patiënten).
Deze verbetering in de prognose kan verklaard worden door het beschikbaar komen van stroke-units en door verbeteringen in de secundaire preventie (Beroerte | Cijfers & Context | Trends | Volksgezondheidenzorg.info).
In de periode 2011-2017 is de jaarprevalentie (het aantal mensen met beroerte dat bekend was bij de huisarts) gestegen met ongeveer 15% voor zowel mannen als vrouwen. Sinds 2017 is het cijfer gestabiliseerd. De trend is gecorrigeerd voor veranderingen in de omvang en leeftijdsopbouw van de bevolking. De aanvankelijke stijging is mogelijk te verklaren door betere diagnostiek en door de stijgende prevalentie van risicofactoren zoals hypertensie en diabetes mellitus type 2.
(Beroerte | Cijfers & Context | Trends | Volksgezondheidenzorg.info)
Etniciteit
In Nederland hebben verschillende etnische groepen na correctie voor leeftijd, burgerlijke staat, urbanisatiegraad en sociaaleconomische status een hoger risico om te overlijden aan hart- en vaatziekten, vooral als gevolg van een herseninfarct of -bloeding. Mannen van Turkse afkomst hebben een hoger relatief risico om te overlijden aan een beroerte dan blanke mannen van Nederlandse afkomst (RR 1,44; 95%-BI 1,14 tot 1,82). Ditzelfde geldt voor mannen van Surinaamse afkomst (RR 1,90; 95%-BI 1,66 tot 2,17). Vrouwen van Surinaamse afkomst hebben een hoger relatief risico om te overlijden aan een beroerte dan blanke vrouwen van Nederlandse afkomst (RR 1,37; 95%-BI 1,20 tot 1,56). Ten aanzien van de vrouwen van Turkse afkomst en mannen én vrouwen van Marokkaanse en Antilliaanse afkomst zijn er geen significante verschillen met de blanke bevolking van Nederlandse afkomst.
Populaties van Afrikaanse afkomst (afkomstig uit landen ten zuiden van de Sahara) woonachtig in West-Europa, lopen verhoudingsgewijs een hoger risico op beroerte in vergelijking tot de blanke West-Europese populatie.
Over andere, minder grote etnische groeperingen in Nederland, zoals Aziaten, zijn geen recente cijfers beschikbaar.
Ook personen van West- of Zuid-Afrikaanse afkomst hebben in vergelijking tot blanke personen een verhoogd risico op een beroerte. Zo bedraagt het relatieve risico op een intracerebrale bloeding bij personen van West- of Zuid-Afrikaanse afkomst beneden de leeftijd van 75 jaar in vergelijking tot blanke personen 2,3 (95%-BI 1,5 tot 3,6).
Conclusie
Vrouwen en mannen van Surinaamse afkomst en mannen van Turkse afkomst hebben in vergelijking tot blanke personen een verhoogd risico op het krijgen van een beroerte. Personen van West- of Zuid-Afrikaanse afkomst hebben een grotere kans op het doormaken van een intracerebrale bloeding in vergelijking tot personen van kaukasische afkomst.
Seksespecifieke verschillen
De leeftijdsspecifieke incidentie voor beroerte in Nederland is hoger bij mannen dan bij vrouwen. In verband met de hogere levensverwachting van vrouwen en de stijging van de incidentie met de leeftijd ligt de absolute incidentie van beroertes hoger bij vrouwen dan bij mannen.
De gemiddelde leeftijd waarop mannen een eerste beroerte doormaken, bedroeg in de Framingham Heart Study, een cohortonderzoek, 71,1 jaar voor mannen versus 75,1 jaar voor vrouwen.
Er zijn aanwijzingen dat bij vrouwen een herseninfarct vaker een cardio-embolische oorzaak heeft, terwijl bij mannen atherosclerotisch vaatlijden een belangrijke rol inneemt. Seksespecifieke risicofactoren voor het krijgen van een beroerte zijn zwangerschap, kraamperiode en postmenopauzale hormoontherapie.
Wat betreft klinische presentatie lijken er geen belangrijke seksespecifieke verschillen te zijn. Een prospectief onderzoek (n = 461) beschrijft dat vrouwen vaker dan mannen niet-traditionele symptomen hebben bij presentatie, zoals pijn en bewustzijnsdaling. Het grootste verschil werd gezien op de uitkomst ‘verandering van de mentale toestand’ (23,2% bij vrouwen versus 15,2% bij mannen; p = 0,03).
In een retrospectief statusonderzoek (n = 1107) werd echter geen verschil aangetoond in symptomen bij presentatie.
Er is geen verschil in ernst van de uitvalsverschijnselen bij presentatie.
Uit de gegevens van het PRACTISE-onderzoek (n = 5515) blijkt dat vrouwen in Nederland minder vaak behandeld worden met intraveneuze trombolyse dan mannen. Dit is het gevolg van latere presentatie in het ziekenhuis. Zevenentwintig procent van de vrouwen die deelnamen aan de studie was binnen 4 uur in het ziekenhuis tegenover 33% van de mannen. Eenmaal op tijd in het ziekenhuis hebben mannen en vrouwen evenveel kans om behandeld te worden.
Mogelijk ligt het feit dat oudere vrouwen vaker alleen wonen ten grondslag aan de latere presentatie. Dit speelt ook een rol bij het gegeven dat vrouwen procentueel minder vaak naar huis worden ontslagen dan mannen.
Vrouwen hebben een grotere kans op een post-strokedepressie.
Conclusie
De aangetoonde sekseverschillen zijn met name gerelateerd aan de hogere leeftijdsverwachting van vrouwen en de gemiddeld hogere leeftijd bij presentatie.
(Risicofactoren voor) hart- en vaatziekten bij patiënten met een beroerte
Uit de Oxford Vascular Study blijkt dat (risicofactoren voor) hart- en vaataandoeningen bij patiënten met een eerste beroerte veelvuldig voorkomen. In de periode 2002 tot 2004 werden onder andere de volgende factoren geregistreerd: hypertensie (systolische bloeddruk ≥ 150 mmHg) bij 45,7% en een serumcholesterolspiegel > 6,0 mmol/l bij 29,5% van de patiënten. Roken, atriumfibrilleren en diabetes mellitus waren aanwezig bij respectievelijk 18,1, 16,8 en 9,5% van de patiënten.
Kosten
De zorgkosten voor beroerte werden in 2007 geschat op 700 miljoen euro voor mannen en 937 miljoen euro voor vrouwen. In totaal bedroegen de kosten voor zorg voor mensen met een beroerte 2,2% van de totale kosten voor gezondheidszorg in Nederland, waarbij het grootste gedeelte naar verpleging en verzorging gaat.
In een systematisch literatuuronderzoek met 21 observationele (veelal retrospectieve) onderzoeken verricht in de Verenigde Staten, Australië, Verenigd Koninkrijk, China, Zweden en Canada (n = 6934) werd gevonden dat 2-52% van alle patiënten bij wie een beroerte in het ziekenhuis werd vastgesteld, de beroerte door het ambulancepersoneel niet als zodanig was herkend, ondanks gebruik van screeningsinstrumenten zoals FAST, LAPSS, MASS, CPSS en ROSIER.
De meest voorkomende symptomen bij degenen bij wie de beroerte niet herkend was, waren spraakproblemen (13-28%), misselijkheid/braken (8-38%), duizeligheid (23-27%), ‘veranderingen van de mentale status’ (verwardheid, delier, gestoorde oriëntatie en geheugen; 8-25%) en visusklachten (visusdaling, diplopie of wazig zien; 13-29%). Al deze klachten zijn zelden het enige symptoom van een beroerte. De auteurs van het literatuuronderzoek concluderen dat het ambulancepersoneel vooral spraakproblemen en symptomen van een beroerte in het achterste (vertebrobasilaire) stroomgebied niet altijd herkent als een mogelijke beroerte.
Ongeveer 20% van de herseninfarcten vindt plaats in het achterste stroomgebied. Ongeveer 10% van de infarcten in het cerebellum presenteert zich met alleen draaiduizeligheid. Op de Spoedeisende Hulp is de kans dat een patiënt met acute draaiduizeligheid zonder andere uitvalsverschijnselen symptomen een herseninfarct heeft naar schatting 0,7-5%. In de huisartsenpraktijk zal dit percentage nog lager zijn.
In een narratief literatuuronderzoek naar factoren die bijdragen aan het missen van een beroerte in het achterste stroomgebied, wordt beschreven dat de kans dat een beroerte in het achterste (vertebrobasilaire) stroomgebied bij presentatie op de Spoedeisende Hulp wordt gemist bijna 3 × zo groot is als voor een beroerte in het stroomgebied van de carotiden. De voornaamste klachten bij de gemiste beroertes waren misselijkheid, braken en duizeligheid. Vooral als de klachten mild, voorbijgaand of aspecifiek waren, werd de beroerte gemist. Andere factoren waarbij beroertes vaker gemist werden, zijn leeftijd ≤ 35 jaar, dissectie als oorzaak en vrouwelijk geslacht.
Van de patiënten die direct, zonder beoordeling door een huisarts, ingestuurd worden met vermoeden van een beroerte, blijkt een aanzienlijk deel uiteindelijk geen beroerte te hebben. Dit bleek uit een cross-sectioneel onderzoek in Nederlandse huisartsenposten (n = 1269) naar de accuraatheid van het Nederlands Triage Systeem (NTS) bij patiënten met verschijnselen die bij een TIA, herseninfarct of hersenbloeding kunnen passen. Bij 45% van de met behulp van het NTS getrieerde patiënten werd uiteindelijk een andere diagnose gesteld, zoals migraine, epilepsie of perifeer vestibulair syndroom. De overige diagnoses waren TIA/minor stroke (34,2%), herseninfarct of intracerebrale bloeding (15,8%) en andere ernstige neurologische aandoening, zoals intracraniële bloeding of meningitis (4,8%).
In een Nederlands cross-sectioneel onderzoek (MIND-TIA) kreeg circa 40% van de patiënten die met vermoeden van een TIA naar de TIA-service werden verwezen uiteindelijk een andere diagnose: migraine (30%), stressgerelateerde (of somatoforme) klachten (20%) en syncope (11,3%). In een Zwitsers cohortonderzoek werd bij 15% van de patiënten met vermoeden van een TIA uiteindelijk een andere diagnose gesteld: bij ongeveer 44% epilepsie en bij 24% migraine. Overige diagnoses waren onder andere transient global amnesia (3,6%), hypertensieve encefalopathie (3,6%) en een psychogene oorzaak (3,6%).
In buitenlands onderzoek is gerapporteerd dat vooral niet-specialisten de diagnose ‘TIA’ te lichtvaardig stellen. Portugees onderzoek op basis van enkele tientallen patiënten meldde dat de diagnose vooral ten onrechte gesteld werd bij patiënten die voorbijgaande bewustzijns- of evenwichtsstoornissen aangaven. Ook onder – in cerebrovasculaire aandoeningen gespecialiseerde – neurologen bestaat geen volledige overeenstemming over het stellen van de diagnose ‘TIA’. Nederlands onderzoek toont een matige overeenstemming (kappa 0,65-0,77) tussen neurologen indien zij onafhankelijk van elkaar bij dezelfde patiënt de anamnese afnamen en lichamelijk onderzoek uitvoerden.
Afgaand op de diagnoses gesteld door het expertpanel in het MIND-TIA-cohort (n = 206) waren de behandelend neurologen bij twijfel geneigd te kiezen voor levenslange plaatjesremming. Dertig (van totaal 80) patiënten van wie het panel vond dat er geen sprake was van een TIA waren wel als zodanig behandeld, 10 op basis van de diagnose ‘TIA’ en 20 op basis van de diagnose ‘mogelijk TIA’. Slechts eenmaal stelde het expertpanel de diagnose ‘TIA’ terwijl de behandelend neuroloog had geconcludeerd dat het geen TIA was.
Etiologie en pathofysiologie
Naar Samenvatting ›TIA en herseninfarct
Naar Samenvatting ›TIA’s en herseninfarcten zijn het gevolg van focale ischemie in de hersenen. De meest voorkomende oorzaken hiervan zijn een embolie afkomstig uit het hart of de aanvoerende cerebrale arteriën en atherosclerose van de cerebrale vaten.
Risicofactoren zijn onder andere:
- atherosclerose van de carotiden of intracerebrale arteriën, onder andere als gevolg van:
- hypertensie
- roken
- hypercholesterolemie
- overmatig alcoholgebruik
- diabetes mellitus
- overgewicht
- hormoontherapie tijdens de overgang of als anticonceptie (zie NHG-Standaard De overgang en NHG-Standaard Anticonceptie).
- atriumfibrilleren
- hartklepafwijkingen, recent myocardinfarct
- migraine met aura. Waarschijnlijk is migraine zonder aura ook een risicofactor, maar de risico’s zijn lager en minder eenduidig aangetoond (zie NHG-Standaard Hoofdpijn).
Minder vaak voorkomende oorzaken van TIA of herseninfarct zijn:
- Arteriële dissectie, cerebrale vasculitis, verhoogde stollingsneiging, patent foramen ovale en veneuze sinustrombose. Deze oorzaken komen relatief frequent voor bij mensen met een TIA of herseninfarct onder de leeftijd van 50 jaar.
- Bloeddrukdaling: met name bij de aanwezigheid van een ernstige carotisstenose, kan dit leiden tot infarcering in de grensgebieden tussen 2 stroomgebieden (waterscheidingsinfarct).
- Vaatspasmen, bijvoorbeeld in het kader van een subarachnoïdale bloeding of het reversibele cerebrale vasoconstrictiesyndroom.
Uitvalsverschijnselen
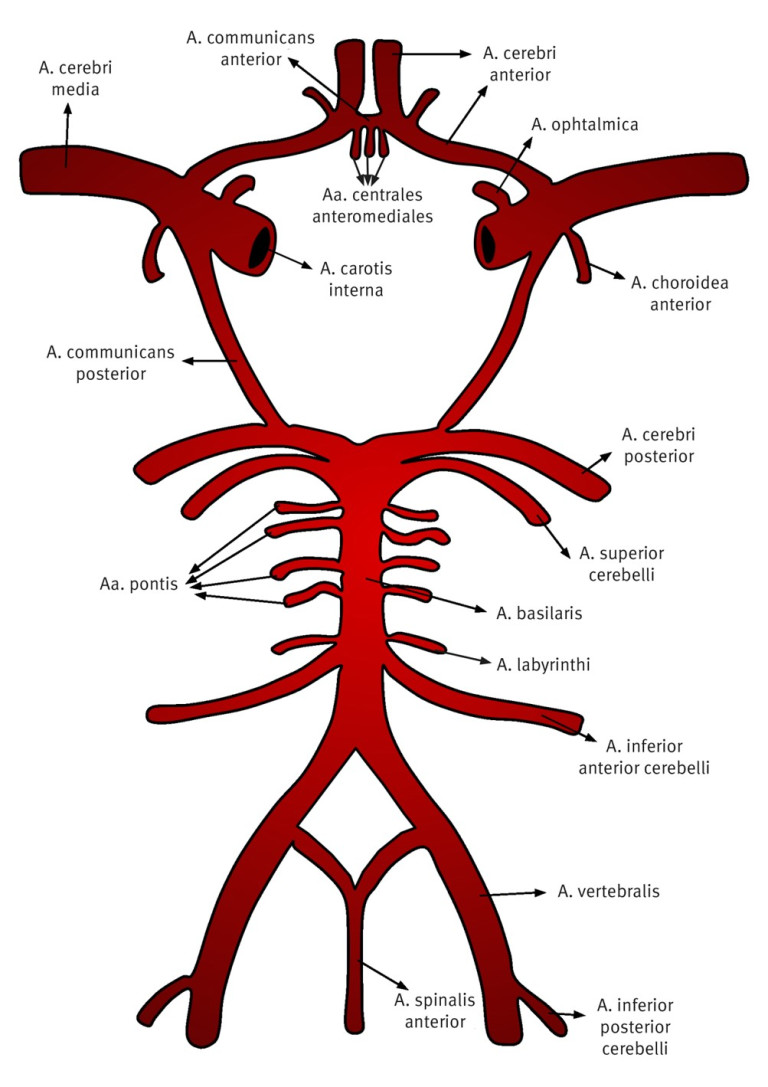
De bloedvoorziening van de hersenen bestaat uit het stroomgebied van de linker en rechter arteria carotis interna en het vertebrobasilaire stroomgebied (figuur 1). In tabel 1 is per stroomgebied aangegeven welke uitvalsverschijnselen kunnen optreden bij verstoring van de doorbloeding. Ischemie in het stroomgebied van de carotiden komt naar schatting 4 × zo vaak voor als ischemie in het vertebrobasilaire stroomgebied.
|
Stroomgebied a. carotis interna (links of rechts) |
Vertebrobasilair stroomgebied |
|---|---|
|
Contralaterale hemiparese |
Parese in een of beide lichaamshelften |
|
Contralaterale sensibiliteitsstoornis |
Sensibiliteitsstoornis in een of beide lichaamshelften |
|
Homonieme hemianopsie |
Homonieme hemianopsie |
|
Dysartrie |
Combinaties van:
|
|
Neglect |
|
|
Afasie |
|
|
Amaurosis fugax |
Risicofactoren voor stolselvorming
Alleen de belangrijkste factoren die de kans op de vorming van stolsels doen toenemen zijn in de standaard vermeld. Andere, zeldzamere, risicofactoren zijn ernstige anemie, polycytemie, trombocytemie, maligniteiten en (congestieve) cardiomyopathie.
Atriumfibrilleren en risico op trombo-embolie
Uit prospectief onderzoek naar risicofactoren voor beroerte bleek dat, gecorrigeerd voor leeftijd, bij patiënten met atriumfibrilleren de kans op het krijgen van een herseninfarct 4,8 × zo groot is als bij patiënten zonder atriumfibrilleren. Atriumfibrilleren is hiermee verantwoordelijk voor 15-25% van de herseninfarcten. Het risico op een ischemisch CVA bij atriumfibrilleren kan ingeschat worden met behulp van de CHA2DS2-VASc-score (zie NHG-Standaard Atriumfibrilleren). Het optreden van een herseninfarct of TIA bij een patiënt met atriumfibrilleren betekent niet automatisch dat een embolie de oorzaak is. In twee onderzoeken bij patiënten met een herseninfarct en atriumfibrilleren werd met behulp van echografie vastgesteld dat waarschijnlijk in 70% van de gevallen sprake was van een cardiale embolie. Tijdens een eerste aanval van atriumfibrilleren is het risico op trombo-embolie gedurende de eerste 48 uur waarschijnlijk niet verhoogd. Op pathofysiologische gronden valt namelijk aan te nemen dat tijdens kort bestaand atriumfibrilleren geen thrombusvorming plaatsvindt.
Migraine, risicofactor voor een herseninfarct
Patiënten met migraine met aura hebben een circa 2 × verhoogd risico op een herseninfarct. Ook het risico op een hersenbloeding, myocardinfarct en mogelijk ook atriumfibrilleren en veneuze trombo-embolie is verhoogd. De risico’s zijn het hoogst voor vrouwen. Migraine met aura lijkt een onafhankelijke risicofactor te zijn. Mede gezien de leeftijd van de patiënten met migraine zijn de absolute risico’s op een herseninfarct laag. Zo bedroeg de cumulatieve incidentie van een herseninfarct na 19 jaar follow-up in een prospectief cohortonderzoek (n = 51.032) 45 per 1000 migrainepatiënten vs. 25 per 1000 in de algemene bevolking. Waarschijnlijk is migraine zonder aura ook een risicofactor, de risico’s zijn echter lager en minder eenduidig aangetoond.
Het is onduidelijk of het verhoogde risico het gevolg is van het pathofysiologische mechanisme dat ten grondslag ligt aan migraine met aura of dat zowel het herseninfarct als migraine met aura een uiting zijn van dezelfde predispositie voor vasculair disfunctioneren. Waarschijnlijk is de oorzaak multifactorieel; hypothesen zijn een genetische predispositie, systemische vasculopathie, hypercoagulabiliteit, een relatie met NSAID-gebruik en de aanwezigheid van een patent foramen ovale. Waarschijnlijk ligt atherosclerose niet ten grondslag aan het verhoogde risico op hart- en vaatziekten bij migrainepatiënten (zie NHG-Standaard Hoofdpijn).
Oorzaken van vaatspasmen
Vaatwandbeschadiging, hypertensie en verstoring van de natrium-, kalium-, calcium- en magnesiumhuishouding zouden aan vaatspasmen ten grondslag kunnen liggen.
Het reversibele cerebrale vasoconstrictiesyndroom wordt gekenmerkt door segmentele vasoconstrictie van cerebrale arteriën. De incidentie is onbekend; dit is het gevolg van het ontbreken van een eenduidige definitie en het gegeven dat de diagnose steeds vaker gesteld wordt sinds de komst van de MR-angiografie. Kenmerkend is de peracute, hevige hoofdpijn (thunderclap headache).
De vasoconstrictie kan ook leiden tot een TIA of herseninfarct. De vasoconstrictie kan spontaan optreden, maar kan ook worden uitgelokt door drugs, vasoactieve middelen, serotonerge medicatie, hypercalciëmie en zwangerschap of puerperium.
Acuut gehoorverlies
Ischemie in het stroomgebied van de a. cerebelli anterior inferior (AICA) wordt gekarakteriseerd door acuut ipsilateraal gehoorverlies in combinatie met draaiduizeligheid. Ook kunnen het syndroom van Horner, extremiteitsataxie, nystagmus en hypesthesie optreden.
Circa 4% van de cerebellaire infarcten vindt plaats in het stroomgebied van de AICA; de overige in het stroomgebied van de a. cerebelli posterior inferior (PICA).
Bij de combinatie van acuut gehoorverlies en draaiduizeligheid moet differentiaaldiagnostisch gedacht worden aan het syndroom van Ramsay-Hunt (herpes zoster oticus) en de ziekte van Ménière.
Intracerebrale bloeding
Naar Samenvatting ›Intracerebrale bloedingen ontstaan als een verzwakte vaatwand ruptureert. Dit kan tot acute focale uitvalsverschijnselen leiden. Deze zijn afhankelijk van de grootte en lokalisatie van de bloeding. Door groei van het hematoom en oedeemvorming kunnen de verschijnselen gedurende de eerste dagen toenemen. Bewustzijnsdaling kan optreden door een verhoogde intracraniële druk ten gevolge van oedeemvorming en ruimte-innemende werking van de bloeding.
Risicofactoren zijn onder andere:
- hypertensie: vooral in de kleine penetrerende arteriën (bijvoorbeeld in de basale ganglia) ontstaan hierdoor vaatwandveranderingen die gevoelig zijn voor rupturering.
- amyloïdangiopathie: bij 20-30% van de patiënten de onderliggende oorzaak. De hierdoor ontstane vaatwandveranderingen kunnen leiden tot bloedingen in de hersenen, die meestal lobair of subcorticaal zijn gelokaliseerd.
- stollingsstoornissen
- anticoagulantia, zoals acenocoumarol, fenprocoumon, directwerkende orale anticoagulantia (DOAC’s) en laag moleculair heparine (LMWH)
- mannelijk geslacht
- overmatig alcoholgebruik, gebruik van amfetamine en/of cocaïne
- roken
- diabetes mellitus
Minder vaak voorkomende oorzaken van intracerebrale bloeding zijn vaatafwijkingen (waaronder arterioveneuze malformatie), tumoren, veneuze sinustrombose en eclampsie.
Bloedingen zijn meestal gelokaliseerd in de basale ganglia of elders in de hemisferen; andere lokalisaties zijn, in afnemende frequentie: thalamus, cerebellum en pons.
In een systematische review van 11 cohort- en 14 patiëntcontroleonderzoeken werden de volgende risicofactoren en bijbehorende risico’s voor intracerebrale bloedingen gevonden: leeftijdstoename met 10 jaar RR 1,97 (95%-BI 1,79 tot 2,16), alcohol > 56 g/dag (komt overeen met > 4 eenheden per dag) OR 3,36 (95%-BI 2,21 tot 5,12), hypertensie OR 3,68 (95%-BI 2,52 tot 5,38), mannelijk geslacht RR 3,73 (95%-BI 3,28 tot 4,25), roken RR 1,31 (95%-BI 1,09 tot 1,58) en diabetes mellitus RR 1,30 (95%-BI 1,02 tot 1,67). Ook cocaïne- en/of amfetaminegebruik leidt tot een 2-3 × verhoogd risico op een intracerebrale bloeding.
Beloop en prognose
Naar Samenvatting ›Frequent optredende complicaties
- Inadequate inname van voedsel en vocht met als mogelijk gevolg spiermassaverlies
- Verslikpneumonieën als gevolg van slikstoornissen
- Schouderpijn door afhangen van arm door een parese of overstrekken van de hand en pols
- Oedeem van de hand als gevolg van een verkeerde houding bij zitten en/of liggen, negeren lichaamsdeel en onvoldoende ondersteuning tijdens verzorging
- Decubitus
- Valincidenten
- Delier
Ontslagbestemming
Bijna de helft van de patiënten die een herseninfarct of intracerebrale bloeding heeft doorgemaakt kan direct terugkeren naar huis. Ongeveer 30% gaat (tijdelijk) naar een verpleeghuis (inclusief geriatrische revalidatie) en ongeveer 10% naar een revalidatiecentrum. De overige 10% gaat naar een verzorgingshuis.
Prognose
- De gevolgen van een beroerte zijn in Nederland de belangrijkste oorzaak van invaliditeit. Van alle overlevenden van een herseninfarct functioneert bijna de helft na 6 maanden zelfstandig. Na een intracerebrale bloeding functioneert slechts een derde van de patiënten uiteindelijk weer zelfstandig.
- De grootste vooruitgang vindt plaats in de eerste weken na de beroerte. Herstel kan tot circa een jaar na een beroerte nog plaatsvinden.
- Patiënten hebben na een TIA of herseninfarct een kans van circa 15% per jaar op een ernstige vasculaire aandoening indien geen secundaire preventie gestart wordt.
- Uiteindelijk overlijdt circa 20% van de patiënten die ooit een beroerte heeft doorgemaakt aan een andere hart- en vaatziekte.
Ontslagbestemming
In 2020 waren er 41.048 klinische opnamen voor beroerte (exclusief subarachnoïdale bloeding). Van deze patiënten wordt 41% vanuit het ziekenhuis naar huis ontslagen, gaat 33,0% naar een verpleeghuis (inclusief geriatrische revalidatie), gaat 8,4% naar een revalidatiecentrum en overlijdt 10% in het ziekenhuis. De overige patiënten zijn overgeplaatst naar een andere ziekenhuisafdeling of ontslagen naar een verzorgingshuis.
Prognose
Het herstel na het optreden van een herseninfarct of intracerebrale bloeding is onder andere afhankelijk van de lokalisatie en grootte van het infarct of de bloeding. Verschillende mechanismen spelen een rol in het herstel, waaronder restitutie (herstel van de functionaliteit van het beschadigde weefsel), substitutie (reorganisatie van de structuren die intact gebleven zijn) en compensatie. De grootste vooruitgang vindt plaats in de eerste weken. Herstel kan echter de eerste maanden tot jaren na een beroerte nog plaatsvinden.
Van alle overlevenden van een herseninfarct is slechts 45% na 6 maanden functioneel onafhankelijk. Na een hersenbloeding is de prognose nog slechter; in een systematische review wordt geschat dat tussen de 12 en 39% van de patiënten uiteindelijk functioneel onafhankelijk is na een bloeding. Na een beroerte bedraagt de kans op een ernstige vasculaire aandoening (myocardinfarct, recidief herseninfarct of overlijden door een vasculaire oorzaak) zonder behandeling 9 tot 15% per jaar. Na een TIA bedraagt de kans op een herseninfarct 5,2% gedurende de eerste 7 dagen, blijkt uit een systematische review, waarin zowel patiënten die reeds met secundaire preventie waren gestart als patiënten die nog niet werden behandeld werden geïncludeerd. Na 90 dagen worden percentages tot 17,3% beschreven.
In een Australisch population-based onderzoek (n = 22.157) werden patiënten die met een TIA waren opgenomen gedurende 9 jaar vervolgd. Na 1 jaar bleek 91,5% nog in leven te zijn, in vergelijking tot 95% van de op basis van de leeftijd verwachte overleving. Na 9 jaar was de geobserveerde overleving 20% lager dan de op basis van leeftijd verwachte overleving. Leeftijd > 65 jaar, hartfalen, atriumfibrilleren en een eerdere opname voor beroerte waren factoren die geassocieerd waren met een afname van de overlevingskans.
Mortaliteit
De kans om te overlijden is na een intracerebrale bloeding veel hoger dan na een herseninfarct: de kans om na een herseninfarct binnen 30 dagen na de eerste opname te overlijden was in 2019 11,4% en na een hersenbloeding 35,5%.
Het voor de bevolkingsopbouw gecorrigeerde sterftecijfer voor beroerte daalde tussen 1980 en 2019 voor mannen met 69% (van 148 naar 46 per 100.000) en voor vrouwen met 65% (van 172 naar 61 per 100.000).
De daling van de mortaliteit kan waarschijnlijk worden toegeschreven aan toegenomen zorggebruik, verbeterde secundaire preventie, nieuwe behandelingsmogelijkheden (intraveneuze trombolyse) en de beschikbaarheid van richtlijnen en stroke units.
Restverschijnselen
Naar Samenvatting ›- Parese in ten minste 1 van de ledematen. Na een half jaar heeft ongeveer de helft van de patiënten nog motorische uitval.
- Spraak-/taalstoornissen:
- Afasie: bij circa 75% begint het herstel van de afasie in de eerste 2 weken. Bij ongeveer 20% is na een half jaar geen enkele vooruitgang opgetreden. Circa 40% herstelt (vrijwel) volledig binnen een jaar.
- Dysartrie: bij 15% van de patiënten herstelt dysartrie niet volledig.
- Slikstoornissen
- Visusstoornissen (bijvoorbeeld hemianopsie)
- Verlies van controle over de blaas en defecatieproblemen
- Vermoeidheid en vermindering van het uithoudingsvermogen
- Epilepsie
Spraak-, taal- en slikstoornissen
Bij 92% van de rechtshandigen en 69% van de linkshandigen zijn de belangrijkste taalgebieden in de linkerhersenhelft gelokaliseerd. Afasie treedt dan ook voornamelijk op bij rechtszijdige paresen. Gegevens over het voorkomen en beloop van afasie en dysartrie zijn ontleend aan onderzoeken van Wade et al., Dickey et al. en El Hachioui et al. en een overzichtsartikel van Ferro et al.. Over het voorkomen van slikstoornissen bij patiënten meldt de literatuur een percentage van 40 tot 80%. In ongeveer 50% van de gevallen verbetert dit spontaan gedurende de eerste twee weken.
Blaasfunctiestoornissen en defecatieproblemen
Afhankelijk van de uitgebreidheid en lokalisatie van het herseninfarct of intracerebrale bloeding komen blaasfunctiestoornissen bij 37 tot 79% van de patiënten voor. Blaascontrole keert meestal binnen twee weken terug. Circa 30% van de patiënten heeft in het acute stadium fecale incontinentie. Eén jaar na de beroerte is dit bij 11% van alle patiënten niet volledig hersteld. Als gevolg van inactiviteit kunnen patiënten ook klachten krijgen van obstipatie en urineretentie.
Neuropsychologische functiestoornissen na herseninfarct of intracerebrale bloeding
Naar Samenvatting ›Na een herseninfarct of intracerebrale bloeding kunnen op verschillende domeinen problemen ontstaan. Voorbeelden zijn:
- Vermindering van de cognitieve vermogens. Dit kan onder andere tot stoornissen in aandacht, geheugen of oriëntatie leiden. Circa 10% van de patiënten ontwikkelt (vasculaire) dementie.
- Stoornissen in de waarneming:
- neglect komt in de acute fase veelvuldig voor; de patiënt neemt de lichaamshelft contralateraal aan de aangedane hersenhelft onvolledig waar
- anosognosie kan optreden bij laesies in de pariëtale cortex van de niet-dominante hemisfeer; de patiënt meent hierbij bijvoorbeeld de getroffen lichaamshelft normaal te kunnen gebruiken
- vermindering van de visueel-ruimtelijke waarneming gaat vaak gepaard met apraxie
- Verandering in emoties of gedrag. Het kan gaan om initiatiefverlies, emotionele labiliteit, impulsiviteit, ontremming, egocentriciteit, aandacht vragend gedrag, agressiviteit, angst of prikkelbaarheid en veranderingen in de seksualiteit. Een derde van alle patiënten ontwikkelt vroeg of laat een depressie.
- Vermoeidheid.
De neuropsychologische functiestoornissen komen soms pas weken tot maanden na de beroerte duidelijk tot uiting. Meer nog dan de ‘zichtbare’ gevolgen hebben ze een negatieve invloed op de motivatie om te revalideren, het herstel, de persoonlijke verzorging, het weer oppakken van de dagelijkse handelingen, de tijdsbesteding en de eventuele arbeidsre-integratie. Cognitieve, emotionele en gedragsmatige veranderingen kunnen daarnaast een negatieve invloed hebben op de relaties met naasten.
Vermoeidheid
De prevalentie van vermoeidheid na het doormaken van een herseninfarct of -bloeding loopt in de verschillende onderzoeken uiteen van 39 tot 72% van de patiënten. Het uiteenlopen van deze percentages is het gevolg van de volgende factoren: verschillen in onderzochte populatie, ernst van de uitval, verstreken tijd, of patiënten met een depressie ook werden geïncludeerd en de gehanteerde definitie van vermoeidheid. De helft van de patiënten meldt na een jaar nog moe te zijn, dit is vaak onafhankelijk van het bestaan van emotionele en cognitieve problematiek.
Behandeling met antidepressiva is niet effectief. Cognitieve therapie gedurende twaalf weken leidt bij 24% van de patiënten tot vermindering van de vermoeidheid. Indien dit wordt gecombineerd met een bewegingsprogramma, rapporteert 58% van de patiënten een verbetering.
Cognitieve stoornissen
Circa 10% van de patiënten ontwikkelt na een eerste herseninfarct of intracerebrale bloeding dementie. Hoewel het in de lijn der verwachting ligt dat dit vooral vasculair van oorzaak is, is de bijdrage van degeneratieve veranderingen onbekend. Cognitieve stoornissen, zoals verminderd concentratievermogen, geheugenverlies en een verminderd ziekte-inzicht, komen bij een hoger percentage van de patiënten voor. Percentages van 35 (stoornissen op minstens vier domeinen) tot 55 (stoornis op minstens één domein) worden beschreven, drie maanden na het optreden van een herseninfarct of -bloeding. In de subacute fase (twee weken na de beroerte) worden percentages tot 91,5 (stoornis op minstens één domein) beschreven. De aanwezigheid van cognitieve stoornissen leidt tot een grotere kans op verminderde functionaliteit en een geïnstitutionaliseerde woonsituatie. Bij aanwijzingen voor cognitieve stoornissen wordt in de regel gedurende het revalidatieproces een neuropsychologisch onderzoek verricht, waarbij met verschillende testen alle relevante domeinen van het cognitief functioneren worden getest. Een neuropsychologisch onderzoek kan worden aangevraagd indien sprake is van een onduidelijk beeld of om onderscheid te maken tussen een depressie en cognitieve problematiek. Cognitieve revalidatie door de neuropsycholoog, onder andere gericht op het aanleren van compensatiestrategieën, is mogelijk zinvol bij de aanwezigheid van cognitieve stoornissen.
Depressiviteit
Uit een meta-analyse over 51 observationele onderzoeken blijkt dat circa 33% (95%-BI 29 tot 36%) van de personen die een herseninfarct of intracerebrale bloeding hebben doorgemaakt een depressie ontwikkelt. In deze onderzoeken werden verschillende criteria toegepast om de diagnose depressie te stellen. Een depressie kan in alle fasen na een beroerte optreden.
Het beloop van een depressie varieert. Sommige patiënten herstellen vlot zonder behandeling, maar tot 45% van de patiënten met een depressie lijdt hier langer dan één jaar aan. Het ontstaansmechanisme is waarschijnlijk multifactorieel, waarbij zowel somatische factoren, zoals lokalisatie van het infarct of de bloeding en verandering in de neurotransmitters, als psychologische en sociale factoren een rol spelen.
Er zijn aanwijzingen dat de aanwezigheid van een depressie het revalidatieproces kan belemmeren. Afname van de depressieve symptomen leidt tot een verbetering van het functioneel herstel. De effectiviteit van antidepressiva bij een post-strokedepressie werd in een systematische review (16 RCT’s, n = 1655) onderzocht. In 7 trials werden de patiënten met een SSRI behandeld, in 2 trials met een TCA en in de overige trials met andere middelen, zoals trazodon. Er werd een significant effect gezien op de uitkomstmaat complete remissie van de depressie. Patiënten die behandeld werden met een antidepressivum hadden in vergelijking tot de patiënten die met placebo werden behandeld een lagere kans om aan het einde van de behandelperiode (variërend van 4 tot 26 weken) nog te voldoen aan de criteria voor de diagnose depressie of dysthymie (OR 0,47; 95%-BI 0,2 tot 0,98). Dit gunstige effect ging gepaard met een significante toename van bijwerkingen, zoals sufheid en gastro-intestinale bijwerkingen. Er was geen invloed op de functionaliteit. Een subgroepanalyse naar de effectiviteit van de verschillende soorten antidepressiva werd niet verricht. Van verschillende vormen van psychotherapie (bijvoorbeeld cognitieve gedragstherapie of motiverende gespreksvoering) werd geen effect aangetoond. De onderzoeken die in deze review werden geïncludeerd vertonen heterogeniteit wat betreft de toegepaste diagnostische criteria, de uitkomstmaten en de analyse, wat ten koste gaat van de bewijskracht. Gezien het frequente optreden van een depressie is het advies om bij de controles expliciet na te vragen of er symptomen zijn die passen bij een depressie. De Checklijst voor het opsporen van cognitieve en emotionele klachten na een beroerte (CLCE-24) kan hierbij behulpzaam zijn.
Conclusie
Circa 33% van de patiënten die een herseninfarct of intracerebrale bloeding hebben doorgemaakt ontwikkelt een depressie. Het spontane beloop varieert. Mede omdat er aanwijzingen zijn dat een depressie een vertragende invloed heeft op het revalidatieproces, dient de behandelaar alert te zijn op de aanwezigheid van depressieve symptomen. Voor de behandeling van een depressie is het advies de NHG-Standaard Depressie te volgen.
Neuropsychologische functiestoornissen na TIA
Naar Samenvatting ›Per definitie zijn de uitvalsverschijnselen bij een TIA voorbijgaand. Er lijkt echter een associatie tussen het doormaken van een TIA of minor stroke en het voorkomen van neuropsychologische restverschijnselen, zoals depressie, angst, cognitieve stoornissen en vermoeidheid.
Na een herseninfarct of intracerebrale bloeding komen neuropsychologische functiestoornissen, zoals cognitieve stoornissen, depressie en vermoeidheid frequent voor.
De uitvalsverschijnselen bij een TIA zijn per definitie voorbijgaand. Er zijn echter aanwijzingen dat neuropsychologische functiestoornissen ook na een TIA voorkomen. In dit detail beschrijven wij het voorkomen van neuropsychologische functiestoornissen na een TIA aan de hand van 1 systematische review en 2 na de zoekdatum van deze review gepubliceerde observationele onderzoeken.
Moran 2014
In een systematisch literatuuronderzoek werd de prevalentie van cognitieve stoornissen, depressie, vermoeidheid, angst en posttraumatische stressstoornis onderzocht bij patiënten die een TIA of minor stroke hadden doorgemaakt. De reviewers includeerden 31 onderzoeken (n = 4109), waarvan 22 in de tweede lijn. De kwaliteit van de geïncludeerde onderzoeken was zeer laag. De voornaamste beperking was veelal het ontbreken van een controlegroep, gematcht naar leeftijd en geslacht. Ook is onduidelijk wat de prevalentie van de klachten was voorafgaand aan de TIA of minor stroke. Hierdoor kon niet worden vastgesteld of die prevalentie bij patiënten die een TIA of minor stroke hadden doorgemaakt hoger was dan in de algemene bevolking. Andere beperkingen waren de heterogeniteit in opzet, inclusiecriteria en meetinstrumenten. Tenslotte werd voor de verschillende uitkomstmaten beperkt onderzoek gevonden.
Cognitieve stoornissen
In 15 onderzoeken werd de prevalentie van cognitieve stoornissen bepaald met behulp van de MMSE, MoCA of neuropsychologisch onderzoek. De gepoolde prevalenties waren respectievelijk 17, 54 en 39%; cognitieve stoornissen kwamen vaker voor na een minor stroke dan na een TIA. De gehanteerde afkapwaarden voor de MMSE varieerden en waren over het algemeen hoger dan wordt aanbevolen in de NHG-Standaard Dementie (MMSE < 24 is indicatief voor dementie). De gehanteerde afkapwaarde voor de MoCA was < 26. Twee onderzoeken vonden geen verschil in prevalentie van cognitieve stoornissen op respectievelijk 26 en 52 weken na het event en 1 en 4 weken na het event.
Depressie
In 10 onderzoeken werd de prevalentie van depressie onderzocht. Deze was 6-42%. De prevalentie was 4 weken na het event het hoogst en daalde tussen 6 weken en 3 maanden na de TIA. In de verschillende onderzoeken werden verschillende meetinstrumenten gebruikt. Er was geen verschil in prevalentie na TIA en minor stroke.
Vermoeidheid
In 3 onderzoeken werd de prevalentie van vermoeidheid 6-12 maanden na een TIA of minor stroke onderzocht. Er werden verschillende vragenlijsten gehanteerd. De gerapporteerde prevalentie was 23-40%. In 1 onderzoek was er 6 en 12 maanden na het event geen verschil in prevalentie. Geen van de onderzoeken had een controlegroep.
Angst
In 1 onderzoek bedroeg de prevalentie van angstklachten 14 dagen na een TIA 52% en na een minor stroke 65% (in de controlegroep 23%). In 1 onderzoek werd de prevalentie 1 jaar na het minor stroke onderzocht. Deze bedroeg 24%. Beide onderzoeken gebruikten de Hospital Anxiety and Depression Scale (HADS-A) om angst te meten, maar gebruikten verschillende afkapwaarden (resp. > 4 en > 8).
Posttraumatische stressstoornis (PTSS)
In 1 onderzoek (n = 49) werd 12 maanden na een minor stroke een prevalentie van 31% gevonden. De diagnose werd gesteld met de Impact of Events Scale. De auteurs van de review concluderen dat er bewijs is dat patiënten die een TIA of minor stroke hebben doorgemaakt restverschijnselen kunnen houden. Ze vermelden echter dat de resultaten voorzichtig geïnterpreteerd moeten worden, gezien de zeer lage kwaliteit van bewijs.
Turner 2016
In een retrospectief cohortonderzoek op basis van huisartsendossiers werden patiënten die een eerste TIA hadden doorgemaakt in de periode 2009-2013 (n = 9419) gematcht met een controlegroep (n = 46.511) op basis van leeftijd, geslacht en huisartsenpraktijk.
Er werd gecorrigeerd voor verschillende variabelen, zoals leeftijd, BMI, roken, comorbiditeit én aanwezigheid van vermoeidheid, psychische en cognitieve beperkingen voorafgaand aan het doormaken van de TIA. Een beperking van dit onderzoek was dat niet bij alle patiënten beeldvormend onderzoek werd verricht, dus de deelnemers hadden mogelijk wel een infarct doorgemaakt. Daarnaast werden symptomen geregistreerd en niet alleen klinische diagnoses. Zo werden dus niet alleen angststoornissen geregistreerd, maar ook angstgevoelens.
Vermoeidheid
Tijdens de follow-upperiode van mediaan 17,2 maanden voor TIA-patiënten en 19,1 maanden voor controlepatiënten rapporteerde in de TIA-arm 9,8% vermoeidheid, versus 5,9% in de controlearm. De kans dat een patiënt in de TIA-arm de huisarts consulteerde in verband met vermoeidheid was 43% groter dan in de controlegroep (HR 1,43; 95%-BI 1,33 tot 1,54).
Psychische beperking
Een psychische beperking, gedefinieerd als angst, depressie of PTSS, dan wel eerste voorschrift voor een antidepressivum of anxiolyticum, werd geregistreerd bij 3159 TIA-patiënten (34,2%) en bij 11.126 controlepatiënten (24,1%). Bij 11.040 patiënten was de consultreden depressie, bij 2691 angst, bij 546 angst en depressie en bij 8 PTSS.
De kans dat een patiënt in de TIA-arm de huisarts consulteerde in verband met een psychische beperking was 26% groter dan in de controlearm (HR 1,26; 95%-BI 1,20 tot 1,31).
Cognitieve beperking
Een cognitieve beperking, gedefinieerd als problemen met geheugen, aandacht, ruimtelijk inzicht, perceptie, apraxie en executief functioneren, maar géén dementie, werd geregistreerd bij 3,9% van de TIA-patiënten en 2,3% van de controlepatiënten (mediane follow-up 18,8 maanden in de TIA-arm en 20 maanden in de controlearm). De kans dat een patiënt in de TIA-arm de huisarts consulteerde in verband met een cognitieve beperking was 45% groter dan in de controlearm (HR 1,45; 95%-BI 1,28 tot 1,65). De auteurs concluderen dat het doormaken van een TIA geassocieerd is met een significant verhoogd risico op consultatie van de huisarts in verband met vermoeidheid, psychologische of cognitieve beperkingen.
Van Rooij 2014
In dit prospectieve onderzoek kregen 107 patiënten van 45-65 jaar bij wie een TIA was gediagnosticeerd in een academisch ziekenhuis binnen 3 maanden na de TIA een neuropsychologisch onderzoek. Een TIA werd gedefinieerd als een focale neurologische stoornis van vasculaire origine met een plotseling begin en volledig verdwijnen van de focale symptomen binnen 24 uur. Patiënten werden vergeleken met controlepatiënten uit hun eigen omgeving. Er waren geen verschillen qua geslacht, opleidingsniveau of score op angst- en depressieschaal. De patiënten waren gemiddeld ouder dan de controlegroep (56,6 vs. 52,9 jaar).
Patiënten die een TIA hadden doorgemaakt scoorden slechter op alle cognitieve domeinen, met uitzondering van het episodisch geheugen. Het werkgeheugen, de aandacht en de informatieverwerkingssnelheid waren gestoord bij respectievelijk 25, 22 en 16%. Dit was vaker dan in de controlearm: de odds ratio’s (gecorrigeerd voor leeftijd en geslacht) varieerden van 3,5 (95%-BI 0,7 tot 16,7) voor executieve functies tot 22,5 (95%-BI 2,9 tot 174,3) voor werkgeheugen. In de TIA-arm had 38,3% een stoornis op ≥ 1 cognitief domein (OR 5,9; 95%-BI 2,4 tot 14,5).
Conclusie
Er lijkt een associatie tussen het doormaken van een TIA of minor stroke en het voorkomen van neuropsychologische functiestoornissen zoals depressie, angst, cognitieve stoornissen en vermoeidheid.
Behandelingsmogelijkheden
Naar Samenvatting ›Het beloop na een beroerte kan bij geselecteerde patiënten gunstig beïnvloed worden door de volgende behandelingen:
- opname op een stroke unit
- intraveneuze trombolyse
- endovasculaire behandeling
- secundaire preventie
- revalidatie
Opname op een stroke unit
Naar Samenvatting ›Opname op een stroke unit leidt tot een reductie van de sterfte onder patiënten met een herseninfarct of intracerebrale bloeding en tot minder invaliditeit. Dit is het gevolg van:
- aandacht voor preventie van en eerder ingrijpen bij complicaties (bijvoorbeeld verslikpneumonie, longembolie, spiermassaverlies, decubitus en/of urosepsis)
- snelle start van revalidatie, vooral vroege mobilisatie
- diagnostiek naar eventuele onderliggende aandoeningen, zoals atriumfibrilleren en carotisstenosering
- start van secundaire preventie (zie Medicamenteuze onderhoudsbehandeling)
Stroke units in ziekenhuizen moeten onderscheiden worden van stroke units in verpleeghuizen of revalidatiecentra die vooral gericht zijn op de revalidatie van patiënten met een herseninfarct of intracerebrale bloeding, na het acute stadium. In een update van een Cochrane-review over 26 gerandomiseerde onderzoeken met in totaal 5592 patiënten werd de uitkomst van opname op een stroke unit in een ziekenhuis vergeleken met die van opname op een gewone ziekenhuisafdeling. Het belangrijkste resultaat van deze meta-analyse is dat opname op een stroke unit één jaar nadien resulteert in een relatieve risicoreductie van de kans op overlijden of het hebben van een handicap met afhankelijkheid met 18% (HR 0,82; 95%-BI 0,73 tot 0,92; p = 0,001). Opname op een stroke unit lijkt ook bij patiënten met slechts geringe uitvalsverschijnselen ten tijde van de randomisatie tot minder afhankelijkheid te leiden, zonder invloed op de mortaliteit. Daarnaast lijken de voordelen van behandeling op een stroke unit onafhankelijk te zijn van de leeftijd van de patiënt. De duur van de opname lijkt niet toegenomen in vergelijking tot opname op een gewone ziekenhuisafdeling.
Deze gunstige resultaten worden bevestigd door een observationele studie en systematische reviews over eerder uitgevoerde observationele studies. De interpretatie van de reviews wordt bemoeilijkt doordat zowel het begrip stroke unit als de behandeling die wordt gegeven in de controlegroepen in de afzonderlijke trials dikwijls niet scherp is omschreven. Gemeenschappelijk kenmerk in de onderzoeken is de aanwezigheid van een multidisciplinair team dat zich speciaal heeft toegelegd op de behandeling van patiënten met een beroerte. Doorgaans bestaat een dergelijk team uit een neuroloog, speciaal getrainde verpleegkundigen, een revalidatiearts, een fysiotherapeut, een ergotherapeut, een logopedist en een maatschappelijk werker. Ook de inbreng van een diëtist of neuropsycholoog en de mogelijkheid van vlotte consultatie van een internist of cardioloog kunnen van belang zijn.
Algemeen wordt aangenomen dat de gunstige resultaten van stroke units in het acute stadium toegeschreven moeten worden aan de snellere en betere diagnostiek, behandeling door een neuroloog, meer toepassing van intraveneuze trombolyse, preventie van en sneller ingrijpen bij complicaties, de technisch betere verpleging (preventie en behandeling van bijvoorbeeld verslikken, decubitus, incontinentie) en een intensievere revalidatie.
Conclusie
Opname op een stroke unit in een ziekenhuis leidt tot reductie van de sterfte onder patiënten met een herseninfarct of intracerebrale bloeding en tot minder invaliditeit nadien.
Intraveneuze trombolyse
Naar Samenvatting ›- Het doel van intraveneuze trombolyse is het herstellen van de bloedtoevoer naar het ischemische gebied door de lokale trombose of afsluitende trombo-embolie op te lossen met het trombolyticum recombinant alteplase (rt-PA).
- De effectiviteit neemt duidelijk af met het verstrijken van de tijd. Ook komt slechts een beperkt aantal patiënten in aanmerking voor de behandeling bij een klachtenduur van > 4,5 uur of een onbekend tijdstip van ontstaan van de uitvalsverschijnselen.
- Er is bij volwassenen geen leeftijdscriterium voor intraveneuze trombolyse.
Voordat kan worden overgegaan tot behandeling met trombolyse moet ook de ziekenhuisorganisatie aan bepaalde criteria voldoen. Zo dienen er nauwkeurige protocollen voor trombolyse te zijn en moet er 24 uur per dag een team bereikbaar zijn. Naar schatting wordt in Nederland 0,4 tot 23% van de patiënten met een acuut herseninfarct met intraveneuze trombolyse behandeld. Het percentage patiënten dat onder de meest gunstige omstandigheden te behalen valt, ligt tussen de 18 en 24%. Deze percentages werden berekend bij een maximale tijdsduur van het ontstaan van de uitvalsverschijnselen tot start van de trombolyse van respectievelijk 3 en 4 uur. Dat dit percentage in de praktijk niet behaald wordt, is met name het gevolg van patient’s delay. Een snelle diagnostiek en verwijzing door de huisarts, snel ambulancevervoer, een correcte toepassing van de contra-indicaties voor intraveneuze trombolyse en een snelle geprotocolleerde diagnostiek en behandeling in het ziekenhuis zijn andere factoren die van belang zijn.
Patiënten worden in het ziekenhuis steeds sneller behandeld, de mediane deur-tot-naaldtijd bedroeg in 2005 73 minuten.
De leeftijd van de patiënt (ouder of jonger dan 80 jaar) lijkt geen invloed te hebben op het effect van alteplase. Er is geen overtuigend bewijs dat leeftijd de tijd verkort waarbinnen behandeling met alteplase voordeel heeft. Ook lijkt de kans op het ontstaan van fatale intracerebrale bloedingen niet afhankelijk te zijn van de leeftijd.
Endovasculaire behandeling
Naar Samenvatting ›- Bij endovasculaire (intra-arteriële) behandeling wordt de trombus verwijderd. Deze behandeling leidt bij patiënten met een herseninfarct als gevolg van een proximale occlusie in het stroomgebied van de carotiden tot een betere functionele uitkomst.
- Met het verstrijken van de tijd neemt de effectiviteit af en komen minder patiënten in aanmerking voor de behandeling.
- Diagnostiek vindt, afhankelijk van regionale afspraken, meestal plaats in het dichtstbijzijnde ziekenhuis. Mocht een patiënt in aanmerking komen voor endovasculaire behandeling wordt hij vervolgens verwezen naar een interventiecentrum.
Secundaire preventie
Naar Samenvatting ›- Na een TIA of herseninfarct is de kans op het doormaken van een herseninfarct verhoogd. Deze kans is gedurende de eerste dagen het grootst.
- Een snelle start van medicamenteuze secundaire preventie leidt tot verlaging van het risico op een recidief.
Na een TIA of klein herseninfarct is de kans op een herseninfarct gedurende de eerste dagen het hoogst: ongeveer 3% in de eerste twee dagen, 5 tot 10% in de eerste week en 12 tot 18% gedurende het eerste jaar.
Uit het prospectieve EXPRESS-onderzoek blijkt dat snelle start van secundaire preventie (plaatjesaggregatieremmers of anticoagulantia, statine, antihypertensiva) na een TIA of minor stroke (gemiddelde tijd tot start behandeling: een dag) in vergelijking tot latere start van de behandeling (gemiddelde tijd tot start behandeling: twintig dagen) leidt tot een significante afname van de kans op een herseninfarct binnen negentig dagen: 2,1 versus 10,3% (HR 0,20; p = 0,0001; NNT 12). De kans op een intracerebrale bloeding was niet toegenomen bij een vroege start van de secundaire preventie. Het is in dit onderzoek niet duidelijk aan welk medicijn welk deel van het effect is toe te schrijven.
In 2011 is het medicamenteuze behandelbeleid van huisartsen bij patiënten na een TIA of herseninfarct in Nederland geëvalueerd aan de hand van NIVEL Zorgregistraties Eerste lijn. Patiënten die een TIA of herseninfarct hebben doorgemaakt werden vrijwel altijd behandeld met een trombocytenaggregatieremmer (respectievelijk 86 en 79%) of een vitamine K-antagonist (respectievelijk 12 en 16%). Slechts een minderheid van de patiënten kreeg een combinatie van acetylsalicylzuur en dipyridamol (respectievelijk 21 en 19%) of clopidogrel monotherapie (respectievelijk 3 en 5%). Van de patiënten die een TIA hadden doorgemaakt gebruikte 60% lipidenverlagende therapie, van de patiënten die een herseninfarct hadden doorgemaakt 68%. Respectievelijk 66 en 72% gebruikte antihypertensiva.
Vrijwel alle ziekenhuizen in Nederland beschikken over een TIA-service (-poli). Het bezoek aan de neuroloog, het aanvullende diagnostische onderzoek – doorgaans bestaand uit bloedonderzoek, een ecg, een duplex/CTA van de carotiden (bij uitvalsverschijnselen in het stroomgebied van de carotiden) en CT-scan van het cerebrum – en het opstellen van een behandelplan bij patiënten die verwezen zijn in verband met (een verdenking van) een TIA, vindt op één dag plaats. Het doel hiervan is, naast het eventueel bevestigen van de diagnose, het zo snel mogelijk vaststellen of de patiënt risicofactoren heeft voor een (recidief) infarct, die door behandeling gunstig beïnvloed kunnen worden. Snelle diagnostiek naar de doorgankelijkheid van de carotiden is daarnaast van belang, zodat een eventuele carotisendarteriëctomie zo snel mogelijk kan plaatsvinden.
Carotisdesobstructie
Naar Samenvatting ›- Circa 20% van de herseninfarcten en 15% van de TIA’s zijn het gevolg van een stenose van de a. carotis interna.
- Bij een TIA of minor stroke in het carotisstroomgebied wordt tijdens de opname op de stroke unit of via de TIA-service zo snel mogelijk diagnostiek uitgevoerd naar het bestaan van een ipsilaterale stenose van de a. carotis interna.
- Van de patiënten die in de voorafgaande 6 maanden een herseninfarct, TIA of retinale ischemie doormaakten, heeft een geselecteerde groep met een ipsilaterale stenose van 50-99% een indicatie voor carotisdesobstructie.
- Bij recidiverende TIA’s (> 2 in 1 week) bestaat een indicatie voor spoedinterventie (< 72 uur).
Diagnostiek
De diagnostiek is erop gericht om die patiënten te identificeren die mogelijk baat hebben van carotisdesobstructie en wordt verricht bij patiënten die een TIA of minor stroke in het stroomgebied van de a. carotis hebben doorgemaakt. Duplexultrasonografie (DUS) kan gebruikt worden als eerste screening, zo nodig gevolgd door CT- of MR-angiografie.
Indicaties voor carotisendarteriëctomie
De effectiviteit van carotisdesobstructie door middel van carotisendarteriëctomie (CEA) bij een symptomatische carotisstenose is afhankelijk van verschillende factoren, waaronder de leeftijd en het geslacht van de patiënt, de aard van de uitvalsverschijnselen en de ernst van de stenose.
De aanbevelingen voor wat betreft de indicaties voor carotisdesobstructie zijn afkomstig uit de Richtlijn Herseninfarct en hersenbloeding van de Nederlandse Vereniging voor Neurologie.
De indicaties zijn gebaseerd op onderzoeken uit de jaren 80 en 90. Destijds werden patiënten niet altijd behandeld met plaatjesremmers, zelden met statines en vaak onvoldoende met bloeddrukverlagende middelen. Het effect van een carotisdesobstructie kan tegenwoordig door de betere medicamenteuze secundaire preventie minder groot zijn dan in de tijd dat de trials werden uitgevoerd.
Bij de beslissing om al dan niet te behandelen wordt gebruikgemaakt van de CAR-score (sealedenvelope.com). Dit algoritme is gebaseerd op trialdata en aangepast aan de huidige inzichten over secundaire preventie. Overwegingen bij de behandelbeslissing:
- kans op peroperatieve complicaties
- het effect bij vrouwen is kleiner dan bij mannen
- carotisdesobstructie is effectiever bij oudere patiënten (NNT 5 bij 75 jaar, 16 bij 65-74 jaar en 18 bij < 65 jaar)
- carotisdesobstructie is effectiever bij hemisferale ischemie dan bij retinale ischemie
- bij een stenose < 50% is het risico op een ipsilateraal herseninfarct zo laag dat carotisdesobstructie niet in aanmerking komt
- na carotisdesobstructie hebben patiënten nog steeds een risico op een ipsilateraal herseninfarct van 1-2% per jaar
Techniek
Carotisdesobstructie vindt plaats door middel van een CEA. Bij een endovasculaire behandeling is het risico op een herseninfarct of hersenbloeding binnen 30 dagen significant hoger dan bij een CEA.
Ischemie in het vertebrobasilaire stroomgebied
Ischemie in het vertebrobasilaire stroomgebied heeft geen behandelconsequenties en is daarom geen indicatie voor diagnostiek naar een eventuele stenosering. Beeldvormend onderzoek van het vertebrobasilaire stroomgebied kan wel geïndiceerd zijn bij onduidelijkheid over de oorzaak van het infarct of bij vermoeden van een dissectie.
Beleid bij asymptomatische stenose
Een asymptomatische carotisstenose (als toevalsbevinding of contralateraal van het herseninfarct) vormt meestal geen indicatie voor een carotisendarteriëctomie. Een CEA kan alleen worden overwogen bij mannen < 75 jaar met een asymptomatische stenose van > 70% en een operatierisico < 3% op een invaliderend herseninfarct, hersenbloeding of overlijden.
Beleid bij occlusie van de a. carotis interna
Bij circa 15% van de patiënten met een infarct in het stroomgebied van de a. carotis interna wordt een occlusie van een van de aa. carotis internae aangetoond. Het jaarlijks risico op een recidief infarct bedraagt circa 5,5%. Het jaarlijks risico op een ipsilateraal infarct bedraagt circa 2,1%. Bij patiënten met een occlusie van de a. carotis interna is geen meerwaarde aangetoond van bypasschirurgie.
Revalidatie na herseninfarct of intracerebrale bloeding
Naar Samenvatting ›- Revalidatie zorgt voor een verbeterd functieherstel en bestaat over het algemeen uit oefentherapie, ergotherapie en logopedie.
- Bij cognitieve stoornissen kan cognitieve revalidatie worden overwogen met als doel patiënten te leren omgaan met (blijvende) cognitieve gevolgen in het dagelijks leven.
- De beslissing waar de revalidatie het best kan plaatsvinden, wordt (in samenspraak met de patiënt) genomen tijdens opname op de stroke unit en hangt onder andere af van de ernst van de beperkingen en de leerbaarheid, motivatie en leeftijd van de patiënt. Daarnaast is de belastbaarheid van een eventuele mantelzorger van invloed op de beslissing.
- In de acute fase (de eerste paar dagen) is de revalidatie met name gericht op snelle mobilisatie.
- In de revalidatiefase (de fase waarin nog herstel te verwachten is, over het algemeen de eerste 6 maanden) is de revalidatie gericht op verbetering van de functionaliteit en het bevorderen van de re-integratie thuis en in de maatschappij.
- In de chronische fase (na de revalidatiefase) ligt de nadruk op het omgaan met blijvende beperkingen.
Effectiviteit
Het functieherstel wordt verbeterd door revalidatie. In het revalidatieproces zijn verschillende organisaties betrokken, zoals ziekenhuis, verpleeghuis, revalidatiecentrum, thuiszorgorganisatie en huisarts. In de acute fase resulteert multidisciplinaire zorg op een stroke unit, waaronder een snelle mobilisatie, één jaar nadien in een relatieve risicoreductie van de kans op overlijden of het hebben van een handicap met afhankelijkheid met 18% (HR 0,82; 95%-BI 0,73 tot 0,92; p = 0,001). Uit enkele overzichtsartikelen komt naar voren dat start van een revalidatieprogramma binnen enkele dagen het functionele herstel op korte en middellange termijn (tot circa een half jaar) ten goede komt. Op basis van een gepoolde analyse over twee gerandomiseerde onderzoeken (n = 103) zijn er aanwijzingen dat patiënten bij wie snel werd gestart met mobilisatie (mediane tijdsduur van ontstaan van de uitvalsverschijnselen tot start van de mobilisatie: 21 uur) in vergelijking tot patiënten bij wie langer werd gewacht (mediane tijdsduur tot start van mobilisatie: 31 uur) een grotere kans hebben op functionele onafhankelijkheid na drie maanden: OR (gecorrigeerd voor onder andere leeftijd en premorbide functioneren) 3,11; 95%-BI 1,03 tot 9,33.
Twee meta-analyses (20 RCT’s, n = 2686 respectievelijk 14 RCT’s, n = 725) tonen dat meer tijd besteed aan oefentherapie (fysio- en ergotherapie) resulteert in een grotere ADL-zelfstandigheid en beter loopvermogen. Op basis van deze resultaten wordt nagestreefd dat patiënten met een barthelindex < 19 tijdens opname dagelijks in de gelegenheid worden gesteld om minimaal twee keer per dag minimaal twintig tot dertig minuten per behandelsessie te oefenen onder begeleiding van een fysio- en/of ergotherapeut.
Revalidatie na ontslag uit het ziekenhuis
De revalidatie na ontslag uit het ziekenhuis kan op verschillende manieren vormgegeven worden: vanuit de thuissituatie met enkel- of meervoudige eerstelijnstherapie, vanuit de thuissituatie met poliklinische revalidatiebehandeling op een revalidatieafdeling van het ziekenhuis of een revalidatiecentrum, vanuit de thuissituatie met geriatrische dagbehandeling/revalidatie, klinische revalidatie in een revalidatiecentrum of klinische revalidatie in een verpleeghuis op een speciale revalidatieafdeling. Bij de beslissing waar de revalidatie plaats zal vinden, spelen de volgende factoren een rol: de ernst van de beperkingen, de prognose, de leerbaarheid of het leervermogen, de motivatie, de leeftijd, de wens van de patiënt en zijn naaste(n), hun psychische en sociale draagkracht en de beschikbaarheid van noodzakelijke (mantel)zorg en voorzieningen. Patiënten die in een revalidatiecentrum worden opgenomen zijn gemiddeld ongeveer twintig jaar jonger dan degenen die in een verpleeghuis worden opgenomen. Het multidisciplinaire team op de stroke unit schakelt zo nodig thuiszorg en therapie thuis in of verzorgt de overdracht naar het revalidatiecentrum of verpleeghuis.
Conclusie
Patiënten met een herseninfarct of intracerebrale bloeding moeten, binnen hun mogelijkheden, snel gemobiliseerd worden. In de acute fase is zorg op een gespecialiseerde stroke unit de beste optie. Na ontslag uit het ziekenhuis vindt verdere revalidatie plaats. De beslissing waar de revalidatie het beste kan plaatsvinden hangt van verschillende factoren af en wordt tijdens opname op de stroke unit in een multidisciplinair overleg genomen.
Oefen- en ergotherapie
Naar Samenvatting ›- Oefentherapie is gericht op het herstel van functionaliteit, basisvaardigheden en mobiliteit.
- Ergotherapie is gericht op het herstel van de dagelijkse activiteiten, zoals ADL, huishouden, werk(hervatting) en vrije tijdbesteding. De ergotherapeut kan ook een rol spelen bij het leren omgaan met vermoeidheid en cognitieve problemen.
Oefentherapie is gericht op het herstel van functies, basisvaardigheden en mobiliteit. In het kader van het mobiliteitsherstel wordt aandacht geschonken aan het handhaven of veranderen van de houding, lopen, verplaatsen met een rolstoel, traplopen en gebruik van vervoermiddelen. Verschillende methoden zijn effectief gebleken, waaronder constraint induced movement therapy (CIMT).
Deze therapie, waarbij de niet-aangedane arm geïmmobiliseerd wordt, leidt tot verbetering van de motorische functie van de aangedane arm. Cardiorespiratoire training en krachttraining zijn effectief om de conditie en mobiliteit te verbeteren na een herseninfarct of -bloeding. De loopsnelheid en -afstand verbeteren met training op een loopband.
Ergotherapie is gericht op het herstel van ADL- en huishoudelijke verrichtingen. Tijdens een huisbezoek inventariseert de ergotherapeut de noodzaak tot aanpassingen in de thuissituatie. Een meta-analyse (9 RCT’s, n = 1258) toont dat ergotherapie gericht op ADL-verrichtingen tot een lager risico op een slechte uitkomst (mortaliteit, functionele verslechtering of afhankelijkheid; OR 0,67; 95%-BI 0,51 tot 0,87) leidt. Er werd een number needed tot treat (NNT) van 11 berekend om bij één persoon een slechte uitkomst te voorkomen. Daarnaast heeft de therapie een gunstig effect op de mobiliteit buitenshuis.
Uit overzichtsartikelen blijkt dat meer tijd besteed aan fysio- en ergotherapie resulteert in een grotere ADL-zelfstandigheid. De training dient progressief te zijn en vooral toegespitst op het leren van vaardigheden die van belang zijn voor het dagelijks leven van de patiënt.
Ook in de thuissituatie is het van belang dat de patiënt activiteiten ontplooit en mobiel blijft. Uit een Nederlands cohortonderzoek blijkt dat 21% van de patiënten die een eerste beroerte hebben doorgemaakt drie jaar nadien een significant slechtere mobiliteit heeft dan één jaar na de beroerte. Inactiviteit thuis bleek hiervoor een onafhankelijke determinant, evenals cognitieve problematiek, depressie en een gevoel van vermoeidheid.
Conclusie
Oefen- en ergotherapie dragen bij aan een grotere ADL-zelfstandigheid en betere mobiliteit.
Logopedie
Naar Samenvatting ›Logopedie speelt een belangrijke rol in het verbeteren van spraak, taal en de slikfunctie.
Logopedie is gericht op het verbeteren van de communicatie door het aanleren en uitbouwen van resterende verbale en non-verbale communicatiemogelijkheden. Daarnaast kan de logopedist aandacht schenken aan de omgang met de spraak-/taalstoornis door middel van psychosociale begeleiding van de patiënt en zijn omgeving. Uit overzichtsartikelen blijkt dat toepassing van intensieve afasietherapie door logopedisten, zowel in de eerste maanden als in de periode van zes tot twaalf maanden na de beroerte, zorgt voor een verbetering van de communicatieve mogelijkheden, indien dit vergeleken wordt met geen interventie. Indien intensieve spraaktherapie vergeleken wordt met frequente alledaagse gesprekken met bezoekers, is er geen verschil op de uitkomst functionele communicatie. De optimale duur en vorm van de therapie is niet bekend. Over de effectiviteit van logopedische behandeling van dysartrie is weinig bekend. Op basis van niet-gecontroleerd onderzoek zijn er aanwijzingen dat patiënten met dysartrie baat kunnen hebben bij logopedie. In een gerandomiseerd onderzoek werd echter geen verschil aangetoond in effectiviteit van intensieve spraaktherapie in de vroege fase van een beroerte in vergelijking tot frequente alledaagse gesprekken met bezoekers bij patiënten met dysartrie.
De logopedist kan de patiënt eveneens leren veilig te slikken en te eten. Direct na het optreden van een herseninfarct of intracerebrale bloeding wordt het bestaan van dysfagie onderzocht. Behandeling van slikstoornissen is belangrijk ter voorkoming van aspiratie en ondervoeding. Hiervoor zijn diverse methodes in omloop. Een positief effect op de slikfunctie en het voorkomen van pneumonie is beschreven van geprotocolleerde behandeling, bestaand uit dagelijkse slikoefeningen en dieetmodificatie onder begeleiding van een logopedist of getrainde strokeverpleegkundige.
Conclusie
Logopedie speelt een belangrijke rol in de behandeling van dysfagie en waarschijnlijk ook van afasie als gevolg van een herseninfarct of intracerebrale bloeding.
Richtlijnen diagnostiek
Naar Samenvatting ›Eerste (telefonische) contact
Naar Samenvatting ›Maak (telefonisch of bij het eerste fysieke contact) een klinische inschatting op basis van de ABCDE-systematiek. Maak vervolgens een inschatting van de waarschijnlijkheid van een TIA, herseninfarct of intracerebrale bloeding.
ABCDE instabiel
- Bel, indien de patiënt ABCDE-instabiel is, bijvoorbeeld bij verlaagd bewustzijn of epileptisch insult, direct een ambulance met A1-indicatie. Indien er alleen neurologische uitvalsverschijnselen zijn, volg het beleid bij ABCDE stabiel.
- Overweeg vervolgens een spoedvisite af te leggen.
- Zie voor het beleid bij een epileptisch insult NHG-Behandelrichtlijn Geneesmiddelen en zuurstof in spoedeisende situaties.
ABCDE stabiel
- Maak (telefonisch) een inschatting van de waarschijnlijkheid van een TIA, herseninfarct of hersenbloeding. Overweeg hierbij de FAST-test te gebruiken.
- Zie verder Anamnese en Richtlijnen Beleid acute fase.
FAST-test (Face-Arm-Speech-Time-test)
Naar Samenvatting ›- Overweeg de FAST-test te gebruiken als hulpmiddel voor het telefonisch inschatten van de waarschijnlijkheid van een beroerte (door huisarts of doktersassistente). Deze test wordt bij voorkeur afgenomen door iemand in de directe omgeving van de patiënt:
1. Gezicht: vraag de patiënt de tanden te laten zien. Let op scheefstand van de mond of een afhangende mondhoek.
2. Arm: vraag de patiënt om beide armen tegelijk horizontaal naar voren te strekken en de handpalmen naar boven te draaien. Let op of een arm wegzakt of rondzwalkt.
3. Spraak: vraag naar veranderingen in het spreken (onduidelijk spreken of niet meer uit de woorden kunnen komen).
4. Tijd: vraag hoe laat de klachten zijn begonnen. - Interpretatie: bij geen goede uitvoering van ≥ 1 van de eerste 3 opdrachten is er verdenking op een beroerte. Houd er rekening mee dat de FAST-test negatief kan zijn, vooral bij een beroerte in het vertebrobasilaire stroomgebied.
De FAST-test is eenvoudig hulpmiddel voor paramedici om een beroerte snel te kunnen herkennen. Met een sensitiviteit van 85% (bij afname door paramedici) is de kans op een foutnegatieve uitslag echter nog steeds 15%. Vooral beroertes in het vertebrobasilaire stroomgebied worden gemist. Vergeleken met de CPSS had de FAST-test in dit literatuuronderzoek een iets hogere sensitiviteit, maar een lagere specificiteit. De FAST test is beter onderzocht dan de KPSS, BE-FAST en Pre-HAST, die in slechts 1 geïncludeerd onderzoek voorkwamen.
Of de FAST-test ook bij telefonische triage door doktersassistenten een betrouwbaar oordeel oplevert, is niet onderzocht. Daarom kunnen we geen onderbouwde uitspraak doen over de waarde van deze test tijdens telefonische triage, bijvoorbeeld op de huisartsenpost. De FAST-test lijkt echter wel een goed hulpmiddel om de symptomen van een beroerte meer bekendheid te geven onder de bevolking. De werkgroep verwacht dat leken met behulp van de FAST-test een goede eerste indruk kunnen krijgen over de aard van de symptomen.
Op basis van deze review lijkt de FAST-test nog steeds het meest geschikt voor een telefonische inschatting van de waarschijnlijkheid van een beroerte door een triagist, doktersassistente of meldkamer ambulance. Dit is aanleiding voor de zwak positieve aanbeveling om de FAST-test te gebruiken als hulpmiddel (voor huisarts of doktersassistente) bij het telefonisch inschatten van de waarschijnlijkheid van een beroerte. Houd rekening met de kans op een foutnegatieve uitslag. Dit lijkt vooral van toepassing voor beroerte in het vertebrobasilaire stroomgebied.
Uitgangsvraag
Is de Face-Arm-Speech-Time-test (FAST-test), vergeleken met de Cincinnati Prehospital Stroke Scale (CPSS), Pre-HAST (Prehospital Ambulance Stroke Test), Balance Eyes FAST (BE-FAST) en Kurashiki Prehospital Stroke Scale (KPSS), aan te bevelen als hulpmiddel om in de eerste lijn telefonisch de kans op een beroerte in te schatten?
Achtergrond
De FAST-test is een screeningstest die gebruikt kan worden om telefonisch een inschatting te maken van de waarschijnlijkheid van de diagnose beroerte. De FAST-test wordt daarnaast al jaren gebruikt in publiekscampagnes om meer bekendheid te geven aan de symptomen van een beroerte. Bovendien zijn de vragen uit de FAST-test onderdeel van de triagewijzer. Er zijn echter meer screeningstests voor de herkenning van een beroerte. De vraag is hoe deze zich verhouden tot de FAST-test.
De CPSS is vrijwel hetzelfde als de FAST-test, alleen de vraag naar de duur van de klachten ontbreekt. Deze vraag is onder andere belangrijk om de urgentie te kunnen inschatten, bijvoorbeeld om te beoordelen of de patiënt mogelijk in aanmerking komt voor acute behandeling. De BE-FAST is de FAST-test, aangevuld met 2 extra items: coördinatie en diplopie. De Pre-HAST is ontworpen voor ambulancepersoneel, heeft 8 vragen en is te ingewikkeld voor een snelle telefonische beoordeling. De KPSS bestaat uit 4 vragen (bewustzijnsniveau, verwardheid, kracht in arm en been, en spraak) en is ontworpen om een beroerte te herkennen en tegelijk de ernst in te schatten.
Buiten beschouwing laten we hier screeningstests waarbij het bloedglucose gemeten wordt, zoals de LAPSS, OPSS, ROSIER, MASS, Med-PACS en FASTER, aangezien deze meting bij een telefonische beoordeling niet mogelijk is.
Methoden
In april 2021 is in PubMed een literatuursearch uitgevoerd naar systematische literatuuronderzoeken, RCT’s en observationeel onderzoek met een update in februari 2022.
Resultaten
Resultaat zoekactie
De literatuursearch leverde een systematisch literatuuronderzoek op. Er werden geen na de zoekdatum van de review gepubliceerde onderzoeken met betrekking tot dit onderwerp meer gevonden. Bij de update in februari 2022 werd een observationeel onderzoek gevonden dat in lijn is met onderstaande resultaten en daarom de aanbeveling niet zal veranderen.
Onderzoekskarakteristieken
Meyran et al. includeerden 24 observationale onderzoeken (n = 10.446) waarin 10 screeningstests werden geëvalueerd, bij 5 waarvan de glucosewaarde niet gemeten wordt (FAST-test, KPSS, CPSS, Pre-HAST en BE-FAST). Geïncludeerd werden tests die buiten het ziekenhuis waren uitgevoerd door paramedici, verpleegkundigen of eerstehulpverleners, bij volwassenen met mogelijk een TIA, herseninfarct of hersenbloeding. Onderzoek naar telefonische triage werd niet gevonden.
De uitslag van de screeningstest werd vergeleken met de diagnose die uiteindelijk in het ziekenhuis werd gesteld. Uitkomstmaten waren onder andere verschil in tijd tot behandeling, aanvankelijke herkenning van de beroerte ؘ– onderscheiden in klinische doelmatigheid (deel patiënten dat de juiste behandeling krijgt) en diagnostische accuratesse (deel patiënten dat de juiste diagnose krijgt) – en goede neurologische uitkomst.
De positief en negatief voorspellende waarde van BE-FAST en de FAST-test werden niet beschreven in het systematische onderzoek van Meyran et al. Hiervoor hebben we teruggegrepen op het oorspronkelijke onderzoek van Pickham.
Uitkomsten
- Tijd tot behandeling:
- KPSS: in 1 retrospectief observationeel onderzoek (n = 430) arriveerde 62,9% van de patiënten bij wie de KPSS werd toegepast < 3 uur na het ontstaan van de symptomen in het ziekenhuis, en 52,3% van de patiënten bij wie de KPSS niet werd toegepast (RR 1,2; 95%-BI 1,01 tot 1,43; kwaliteit van bewijs zeer laag). De gemiddelde tijd tot opname bedroeg 2,1 uur, versus 2,7 uur zonder toepassing van de KPSS. (p = 0,024; kwaliteit van bewijs zeer laag).
- Voor de FAST-test, CPSS, Pre-HAST en BE-FAST werd geen onderzoek gevonden.
- Herkenning van beroerte (deel patiënten dat de juiste behandeling krijgt):
- FAST-test: in 1 onderzoek (n = 356) werd bij gebruik van FAST-test een groter deel van de patiënten binnen 3 uur na ontstaan van de symptomen behandeld dan wanneer de FAST-test niet werd gebruikt (48,2 vs. 14,6%; RR 3.3; 95%-BI 2,29 tot 4,75; kwaliteit van bewijs zeer laag)
- KPSS: in 1 onderzoek (n = 430) was het percentage patiënten dat de diagnose beroerte kreeg of behandeld werd met trombolyse even groot in de groep bij wie de KPSS werd toegepast als in de controlegroep (kwaliteit van bewijs laag).
- Herkenning van beroerte (deel patiënten dat de juiste diagnose krijgt)
- FAST-test: deze uitkomstmaat werd onderzocht in 4 prospectieve observationele onderzoeken (n = 1585). De sensitiviteit was 0,85 (95%-BI 0,69 tot 0,94) en de specificiteit 0,38 (95%-BI 0,16 tot 0,66) (kwaliteit van bewijs zeer laag).
- CPSS: deze uitkomstmaat werd onderzocht in 6 prospectieve en 6 retrospectieve observationele onderzoeken (n = 4842). De sensitiviteit was 0,81 (95%-BI 0,70 tot 0,89) en de specificiteit 0,55 (95%-BI 0,39 tot 0,69) (kwaliteit van bewijs zeer laag).
- Pre-HAST: in 1 onderzoek (n = 69) was de sensitiviteit 1,00 (95%-BI 0,87 tot 1,00) en de specificiteit 0,40 (95%-BI 0,25 tot 0,56).
- BE-FAST: in 1 onderzoek (n = 359) was de sensitiviteit 0,91 (95%-BI 0,86 tot 0,95) en de specificiteit 0,26 (95%-BI 0,20 tot 0,33).
- KPSS: geen onderzoek gevonden.
- BE-FAST vs. FAST-test: in een directe vergelijking (n = 359) was de positief voorspellende waarde van BE-FAST 0,49 en van de FAST-test 0,53. De negatief voorspellende waarde van BE-FAST was 0,93 en van de FAST-test 0,86.
- Goede neurologische uitkomst: geen onderzoek gevonden.
Anamnese
Naar Samenvatting ›Vraag bij vermoeden van een beroerte naar:
- aanwezigheid uitvalsverschijnselen
- tijdstip van ontstaan van de uitvalsverschijnselen. Indien dit onbekend is: wanneer de patiënt voor het laatst zeker geen uitvalsverschijnselen had
- acuut of geleidelijk begin, opbouw van de uitvalsverschijnselen, eventuele voortekenen
- aard van de uitvalsverschijnselen: verlamming ledematen, scheefstand gezicht, spraakstoornissen, dubbelzien, draaiduizeligheid, coördinatiestoornissen, hoofdpijn, misselijkheid, braken of anderszins
- bewustzijn patiënt
- beloop
- eerdere episoden met gelijksoortige verschijnselen
- bijkomende factoren: gebruik van anticoagulantia en, in het geval van een DOAC, het tijdstip van de laatste inname; recente bloedingen of operaties
Vraag naar risicofactoren voor beroerte:
- hoge bloeddruk, hart- en vaatziekten, diabetes mellitus, overgewicht en/of overmatig alcoholgebruik
- belaste familieanamnese voor premature hart- en vaatziekten
- atriumfibrilleren
- roken
- migraine
- drugsgebruik, zoals ecstasy en cocaïne
- gebruik van hormonale medicatie (waaronder anticonceptie)
Lichamelijk onderzoek
Naar Samenvatting ›Verricht ook bij patiënten die anamnestisch geen uitvalsverschijnselen meer hebben, lichamelijk onderzoek om eventuele resterende neurologische uitval, waarvan de patiënt zich niet bewust is, vast te stellen. Patiënten merken bepaalde uitvalsverschijnselen, zoals hemianopsie, vaak niet op.
Onderzoek:
- het bewustzijn
- het gezichtsveld
- de spraak/taal
- de pupilreacties
- de kracht van de gelaatsmusculatuur en de stand van de ogen
- de kracht van de bovenste en onderste extremiteiten
- de coördinatie en sensibiliteit
- het looppatroon
- het hart- en vaatstelsel: meet de bloeddruk, ausculteer het hart (ritme en frequentie)
Overweeg de Head Impulse Test (HIT) toe te passen bij draaiduizeligheid die constant aanwezig is, zonder andere uitvalsverschijnselen, om een perifere oorzaak van de duizeligheid meer waarschijnlijk te maken (zie NHG-Standaard Duizeligheid).
Hemianopsie
Ongeveer zestig procent van de patiënten met gezichtsvelduitval blijkt zich hiervan niet bewust te zijn.
Centrale versus perifere n. facialis-uitval
Bij onderzoek van de kracht van de gelaatsmuculatuur wordt zo mogelijk onderscheid gemaakt tussen een centrale en perifere n. facialis-uitval. Wanneer het bovenste deel van de aangezichtsspieren evenveel is aangedaan als het onderste, is er sprake van een perifere uitval. Door de dubbele innervatie van de bovenste aangezichtsspieren is de oogsluiting bij eenzijdige centrale laesies altijd intact. Differentiatie tussen een centrale en perifere facialisuitval is in de lichtere gevallen klinisch niet altijd mogelijk.
Aanvullend onderzoek
Naar Samenvatting ›Meet de bloedglucosewaarde om een hypo- of hyperglykemie als oorzaak van de uitvalsverschijnselen uit te sluiten.
Hypo- en hyperglykemie kunnen de oorzaak zijn van passagère uitvalsverschijnselen
Uit een subgroepanalyse in het literatuuronderzoek van Meyran et al. bleek dat screeningstests waarbij ook een bloedglucosemeting gedaan wordt (LAPSS, OPSS, ROSIER, MASS en Med-PACS) een vergelijkbare sensitiviteit hebben als de FAST-test. Een aantal van deze tests scoorde op specificiteit beter dan de FAST-test (specificiteit 0,18-0,86 versus 0,38 voor de FAST-test). De screeningstests werden verricht bij patiënten met vermoeden van een beroerte. Er zijn in dit literatuuronderzoek geen subgroepanalyses gedaan bij patiënten met en zonder diabetes mellitus type 2.
De werkgroep acht het zinvol om, bij het eerste telefonische contact indien de patiënt over een bloedglucosemeter beschikt of anders tijdens het eerste persoonlijke contact (consult of visite), eveneens de bloedglucosewaarde te (laten) meten om een hypo- of hyperglykemie als oorzaak van de klachten uit te sluiten.
Predictiemodel
Naar Samenvatting ›We bevelen het predictiemodel Explicit Diagnostic Criteria for TIA (EDCT) niet aan.
De (gemodificeerde) EDCT zouden een nuttige beslisondersteuner kunnen zijn voor huisartsen, vooral bij het uitsluiten van een TIA. Dit zou kunnen resulteren in minder verwijzingen naar de TIA-service. Op dit moment is er echter onvoldoende wetenschappelijke onderbouwing om algemeen gebruik van de EDCT aan te bevelen. Om de daadwerkelijke bruikbaarheid van de (gemodificeerde) EDCT in de Nederlandse huisartsenpraktijk te bepalen, is validatie- en implementatieonderzoek nodig.
Als de resultaten van de validatie van de EDCT in het eerstelijns MIND-TIA cohort direct zouden worden vertaald naar de praktijk, zouden de EDCT van elke 100 patiënten met vermoeden van een TIA er 24 aanwijzen als geen TIA, die niet verwezen hoeven te worden naar de neuroloog. Bij de gemodificeerde EDCT zou het om 29 patiënten gaan en met beide versies zou 1 TIA gemist worden. We zijn echter onzeker over deze aantallen.
Op dit moment is het wetenschappelijke bewijs voor de EDCT beperkt en de gemodificeerde EDCT zouden gevalideerd moeten worden in een onafhankelijk cohort. Idealiter zouden de EDCT getoetst moeten worden in een setting waarin een huisarts de criteria toepast in plaats van een getrainde onderzoeker.
Ook zonder ze letterlijk te volgen, kunnen de EDCT een nuttige ondersteuning vormen voor huisartsen bij een lastige diagnose en gebrek aan andere diagnostische middelen. De criteria kunnen helpen concreet te maken welke symptomen in de anamnese wel en niet kenmerkend zijn voor een TIA, en handvatten geven voor het bespreken van de patiënt met een neuroloog.
Uitgangsvraag
Zijn de Explicit Diagnostic Criteria for TIA (EDCT) aan te bevelen als predictiemodel voor de huisarts bij een verdenking op een TIA?
Achtergrond
De EDCT (tabel 2) vormen een predictiemodel voor de diagnose ‘TIA’. Het is een klinische tool, ontwikkeld door 2 neurologen op basis van klinische ervaring in plaats van statistische methoden. Aan de hand van type, duur en ontstaanswijze van de klinische verschijnselen onderscheiden de EDCT een TIA van beelden die een TIA kunnen nabootsen, zoals migraine, epilepsie of (pre)syncope. Een klachtenepisode wordt geduid als TIA wanneer de klinische verschijnselen aan alle criteria voldoen: een plots begin, een begin in volle intensiteit zonder een geleidelijke opbouw van symptomen, de aanwezigheid van neurologische uitvalsverschijnselen en de afwezigheid van zogeheten positieve symptomen.
In een eerste onderzoek hebben de ontwikkelaars van de EDCT onderzocht hoe dit predictiemodel presteert in een cohort van patiënten met een TIA (n = 120) en 2 cohorten van patiënten met migraine met aura, maar zonder TIA (n = 1390 en n = 152). De resultaten waren veelbelovend: van de TIA-patiënten werd 99% terecht geclassificeerd; van de migrainepatiënten werd 4-5% geclassificeerd als TIA. Het is echter onduidelijk hoe de EDCT presteren in een ongeselecteerde populatie van patiënten met vermoeden van een TIA.
Methoden
In juni 2021 is in PubMed een literatuursearch uitgevoerd naar systematische literatuuronderzoeken en observationeel onderzoek. In februari 2022 is een update uitgevoerd.
Resultaten
Resultaat zoekactie
De literatuursearch leverde, naast het oorspronkelijke onderzoek, 2 observationele cross-sectionele onderzoeken op waarin de EDCT werden gevalideerd naar diagnostische accuratesse. De update in februari 2022 leverde geen nieuwe onderzoeken op.
Beschrijving onderzoeken
- Dolmans et al. (2019): Deze onderzoeksgroep valideerde de EDCT in het Nederlandse eerstelijnscohort MIND-TIA (Markers in the Diagnosis of TIA) van patiënten bij wie hun huisarts een TIA vermoedde en die binnen 72 uur konden worden geïncludeerd (n = 206). Alle patiënten werden verwezen voor aanvullend onderzoek op een TIA-service. Een onderzoeksverpleegkundige legde de symptomen vast door middel van een gestandaardiseerde vragenlijst. Deze bevatte alle onderdelen van de EDCT. Volgens de uiteindelijke diagnose, gesteld door een expertpanel van 3 vasculair neurologen, had 61% van de patiënten een TIA of minor stroke. De onderzoekers maakten een geringe aanpassing in de C-criteria, die de interpretatie en toepassing moet verhelderen en tegelijkertijd aansluit bij de symptomatologie van een TIA (gemodificeerde EDCT; zie tabel 2).
- Göbel et al (2021): In dit onderzoek werd de EDCT gevalideerd in een spoedeisendehulpsetting in Duitsland, onder 128 patiënten die werden verdacht van een TIA. De oorspronkelijke EDCT werd in een interview afgenomen door een lid van het onderzoeksteam, en vergeleken met de uiteindelijke diagnose van de neuroloog. 61% van de patiënten had een TIA volgens deze diagnose.
De onderzoekers voegden een extra criterium toe om de specificiteit te verhogen, namelijk ‘de symptomen worden niet beter verklaard door een andere medische of mentale aandoening’ (criterium F; zie tabel 2).
|
A |
Plots begin van volledig reversibele neurologische symptomen (hemiparese, hemihypesthesie, dyfasie, neglect, amaurosis fugax, hemianopsie, hemiataxie) |
|---|---|
|
B |
Duur < 24 uur |
|
C |
Ten minste 2 van de volgende criteria:
|
|
C* |
Ten minste 2 van de volgende criteria:
geen hoofdpijn tijdens de neurologische symptomen of < 1 uur erna |
|
D |
Geen geїsoleerd optreden van de volgende symptomen (deze mogen wel optreden samen met meer kenmerkende symptomen): shaking spells, dubbelzien, duizeligheid, vertigo, syncope, verminderd bewustzijn, verwardheid, met hyperventilatie geassocieerde paresthesieën, onverklaard vallen, amnesie. |
|
E |
Bij beeldvormend onderzoek geen tekenen van acute infarcering (in bijpassend hersengebied) |
|
F# |
De symptomen worden niet beter verklaard door een andere medische of mentale aandoening |
|
* Gemodificeerde criteria uit het onderzoek van Dolmans et al..
|
|
Onderzoeksresultaten
Tabel 3 geeft de diagnostische testkarakteristieken van de EDCT weer zoals gevonden in de beide onderzoeken, zowel voor de oorspronkelijke versie als voor beide aangepaste versies van de EDCT. Door de aanpassingen werd de specificiteit, en daarmee het aantal terecht-negatieve testuitslagen, verhoogd, terwijl het aantal foutpositieve testuitslagen werd verlaagd. De aanpassingen hadden geen invloed op de sensitiviteit en dus het aantal terechtpositieve en foutnegatieve testuitslagen.
|
Auteur |
Versie EDCT |
N |
Sensitiviteit (95%-BI) |
Specificiteit (95%-BI) |
AOC |
Uitslagen per 1000 geteste patiënten (95%-BI) |
|||
|---|---|---|---|---|---|---|---|---|---|
|
TP |
FN |
TN |
FP |
||||||
|
Dolmans |
Origineel |
206 |
0,98 (0,94 tot 1,00) |
0,61 (0,50 tot 0,72) |
0,80 (0,73 tot 0,87) |
600 (576 tot 609) |
10 (1 tot 34) |
239 (194 tot 280) |
151 (110 tot 196) |
|
Dolmans |
Gemodificeerd* |
|
|
0,74 (0,63 tot 0,83) |
0,86 (0,80 tot 0,92) |
|
|
288 (245 tot 324) |
102 (66 tot 145) |
|
Göbel |
Origineel |
128 |
0,96 (0,89 tot 0,99 |
0,88 (0,76 tot 0,95) |
niet gerapporteerd |
586 (543 tot 604) |
24 (6 tot 67) |
343 (296 tot 371) |
47 (19 tot 94) |
|
Göbel |
Origineel met extra criterium* |
|
|
0,98 (0,90 tot 1,00) |
|
|
|
382 (349 tot 389) |
8 (1 tot 41) |
|
* Alleen die uitkomsten zijn vermeld die door de aanpassingen werden beïnvloed. AOC = Area Under the Curve; TP = terecht positief; FN = foutnegatief; TN = terecht negatief FP = foutpositief. |
|||||||||
Conclusie
De EDCT lijken een goede diagnostische accuratesse te hebben met in de onderzoeken slechts 1-2% foutnegatieve testuitslagen, waardoor in theorie het aantal verwijzingen met ongeveer 30% kan worden teruggebracht. Het model is echter slechts in twee kleine onderzoeken gevalideerd, waardoor deze schattingen onzeker zijn. In beide onderzoeken zijn verbeteringen aangebracht in het model, die nog niet in onafhankelijk onderzoek zijn gevalideerd. Het model lijkt dus nog niet uitgekristalliseerd.
Evaluatie
Naar Samenvatting ›Acute focale neurologische uitvalsverschijnselen kunnen zowel bij een TIA, herseninfarct of een hersenbloeding optreden en zijn afhankelijk van de lokalisatie van de ischemie of bloeding (zie tabel 1).
Stel de werkdiagnose herseninfarct of intracerebrale bloeding bij patiënten met focale uitvalsverschijnselen die nog aanwezig zijn bij presentatie. Kenmerkend is dat de verschijnselen acuut, gelijktijdig en zonder voortekenen zijn begonnen. Zie: Kenmerken die een beroerte waarschijnlijker maken en Kenmerken die een beroerte minder waarschijnlijk maken.
Stel de werkdiagnose TIA bij patiënten met passagère focale uitvalsverschijnselen die bij presentatie volledig verdwenen zijn. Typisch is dat de uitvalsverschijnselen acuut, gelijktijdig en zonder voortekenen zijn begonnen en te verklaren zijn vanuit een stoornis in één cerebraal stroomgebied. Zie: Kenmerken die een beroerte waarschijnlijker maken en Kenmerken die een beroerte minder waarschijnlijk maken.
De neuroloog stelt de diagnose TIA indien er geen aanwijzingen zijn voor andere intracraniële pathologie en er bij beeldvorming geen aanwijzingen zijn voor verse infarcering (zie Begrippen).
Kenmerken die een beroerte waarschijnlijker maken
- De uitvalsverschijnselen zijn acuut en zonder voortekenen begonnen. In enkele gevallen nemen de uitvalsverschijnselen in de loop van minuten tot uren in ernst toe (stuttering stroke of intracerebrale bloeding).
- Alle verschijnselen zijn tegelijk ontstaan.
- De uitvalsverschijnselen zijn te verklaren vanuit een stoornis in het stroomgebied van een van de carotiden of het vertebrobasilaire stroomgebied, zie tabel 1.
- Vooral bij een infarct in het vertebrobasilaire stroomgebied en bij een intracerebrale bloeding kunnen bewustzijnsdaling, progressieve uitvalsverschijnselen, hoofdpijn, misselijkheid en braken optreden.
- Visusdaling in 1 oog waarbij het lijkt of er een donker gordijn naar beneden zakt (amaurosis fugax).
- Patiëntgebonden kenmerken:
- leeftijd > 65 jaar
- de aanwezigheid van een of meer risicofactoren voor hart- en vaatziekten
- beroerte in de voorgeschiedenis
- atriumfibrilleren
- gebruik van antistolling
Kenmerken die een beroerte minder waarschijnlijk maken
- Uitvalsverschijnselen die gepaard gaan met of voorafgegaan zijn door trekkingen.
- Licht gevoel in het hoofd en/of wazig zien, gevolgd door passagère bewustzijnsverlies.
- Licht of zweverig gevoel in het hoofd.
- Positieve symptomen zoals fotopsie (lichtflikkeringen), kleuren zien en paresthesiёen.
- Een ‘mars’ van symptomen verspreid over verschillende delen van het lichaam.
- Geïsoleerd voorkomen van draaiduizeligheid (zonder andere uitvalsverschijnselen).
- Geïsoleerd voorkomen van verwardheid of amnesie.
- Lichtflitsen zien (flikkerscotomen), wazig zien en/of beweging van het beeld.
- Passagère uitvalsverschijnselen gevolgd door hoofdpijn.
Differentiaaldiagnose
Voor een overzicht van de belangrijkste differentiaaldiagnostische overwegingen bij neurologische uitvalsverschijnselen, zie tabel 4. Bij twijfel over de interpretatie van verschijnselen: overleg met de neuroloog.
Acute draaiduizeligheid
- Het maken van een onderscheid tussen een centrale en perifere oorzaak is vaak lastig.
- Bij geïsoleerde acute aanhoudende draaiduizeligheid zonder aanwijzingen voor bijkomende (nieuwe) neurologische verschijnselen is de kans op een beroerte klein (< 5%).
- Houd bij de interpretatie rekening met patiëntgebonden kenmerken (zie Kenmerken die een beroerte waarschijnlijker maken).
- Extremiteitsataxie (verstoring van evenwicht en bewegingscoördinatie, zich uitend in afwijkende top-neusproef, knie-hakproef en diadochokinese) past bij een centrale oorzaak. Een afwijkend (breedbasisch) looppatroon kan zowel bij centrale als vestibulaire oorzaken voorkomen en is dus niet onderscheidend.
Acuut dubbelzien
Naar Samenvatting ›- Acuut binoculair dubbelzien kan verschillende oorzaken hebben, zoals een herseninfarct, een aneurysma of trombose van de sinus cavernosus of zenuwcompressie.
- Verwijs patiënten met acuut binoculair dubbelzien én bijkomende neurologische verschijnselen naar de neuroloog (zie Richtlijnen beleid acute fase). Verwijs de overige patiënten met dubbelzien naar de oogarts (zie NHG-Standaard Visusklachten).
Dubbelzien wordt onderscheiden in monoculair of binoculair dubbelzien.
Binoculair dubbelzien komt het meest voor en ontstaat doordat de oogspieren van beide ogen niet goed samenwerken. Vasculaire afwijkingen, compressie van de zenuw (nn. III, IV of VI) of myogene oorzaken kunnen hieraan ten grondslag liggen. Ischemie kan leiden tot oogspierparesen en is alarmerend wanneer zij in combinatie met andere neurologische symptomen voorkomt, of wanneer alle oogspieren zijn aangedaan. Een acute totale oftalmoplegie (nn. III, IV en VI) kan worden veroorzaakt door een aneurysma of trombose van de sinus cavernosus. Compressie van de zenuw (nn. III, IV of VI) kan optreden bij schedeltrauma (orbitafractuur), een aneurysma, tumoren of metastasen, of een verhoogde intracraniële druk. Myogene oorzaken zijn bijvoorbeeld myasthenia gravis of ziekte van Graves.
Monoculaire dubbelbeelden komen weinig voor en zijn vrijwel altijd het gevolg van lokale oogafwijkingen, zoals subluxatie van de lens.
Niet-acute monoculaire diplopie komt voor bij een gestoorde traanfilm, cataract en sterk astigmatisme. Psychogene oorzaken komen ook voor. Ook intoxicaties (insecticiden, botulisme, alcohol) en geneesmiddelen, zoals anti-epileptica, kunnen dubbelzien veroorzaken.
Niet-acute binoculaire diplopie met een intermitterend karakter wordt veelal veroorzaakt door een lang bestaand en decompenserend latent strabisme.
Zie ook NHG-Standaard Visusklachten.
|
|
Hoofdkenmerk(en) |
Duur uitvalsverschijnselen |
Ontwikkeling uitvalsverschijnselen |
Begeleidende symptomen |
Onderscheidend(e) kenmerk(en) van beroerte |
|---|---|---|---|---|---|
|
(Partiële) epileptische aanval |
Trekkingen, (postictale) bewustzijnsdaling en/of hemiparese |
Aanval: enkele seconden (partieel) tot > 30 minuten (status epilepticus) Postictale parese: enkele minuten tot enkele dagen |
Snelle uitbreiding van distaal naar proximaal |
Soms voorafgegaan door een aura |
Trekkingen en bewustzijnsdaling gevolgd door verwardheid |
|
Migraine-aura |
Reversibel(e) focale neurologisch(e) sympto(o)m(en) (bv flikker-scotoom, visuele prikkelingsverschijnselen, paresthesieën, hypesthesie, parese en/of spraakstoornis), meestal binnen 1 uur gevolgd door bonkende unilaterale hoofdpijn |
Maximaal 60 minuten |
Ontstaat geleidelijk, bereikt een maximum in 5-20 minuten |
Hoofdpijnfase gepaard gaande met misselijkheid, braken, foto- en fonofobie. Aura hoeft niet gevolgd te worden door hoofdpijn (migraine sans migraine) |
Uitvalsverschijnselen ontwikkelen zich geleidelijk en worden meestal gevolgd door bonkende unilaterale hoofdpijn. De visuele verschijnselen zijn dynamisch met veelal kleuren, bij een amaurosis fugax statisch en donker. |
|
Arteriitis temporalis |
Variabel: gedeeltelijk of totaal verlies van gezichtsveld, snel ontstane visusdaling, dubbelzien enkel- of dubbelzijdig, voorbijgaand of permanent Pijnlijke, verdikte arteria temporalis, afwezige pulsaties. |
Visusdaling varieert van voorbijgaand na enkele minuten tot blijvende blindheid |
Acuut |
Hoofdpijn, malaise, sterk verhoogd BSE/CRP |
Aanwezigheid van hoofdpijn en malaise bij visusdaling of gezichtsvelduitval |
|
Perifeer vestibulair syndroom |
Draaiduizeligheid |
BPPD: < 2 minuten, vooral gerelateerd aan houdingsverandering Neuritis vestibularis: enkele dagen tot weken Ziekte van Ménière: uren tot enkele dagen, aanvalsgewijs |
BPPD: latentietijd 0-40 seconden (meestal 7-8 seconden) Neuritis vestibularis: acuut Ziekte van Ménière: 20 minuten tot enkele uren |
Nystagmus (afname bij fixatie), vegetatieve verschijnselen, gehoorklachten (ziekte van Ménière) |
Afwezigheid van diplopie en dysartrie en nystagmus die afneemt bij fixatie; draaiduizeligheid is over het algemeen heviger dan bij een centrale oorzaak |
|
Perifere uitval n. facialis |
Volledige of gedeeltelijke, eenzijdige verlamming van de aangezichtsmusculatuur |
Herstel begint binnen enkele weken tot 6 maanden |
Ontstaat binnen 1-2 dagen, verergering kan de eerste dagen hierna nog optreden |
Smaakverlies, verminderde speekselsecretie, overgevoeligheid voor geluid |
Uitval van de bovenste gelaatshelft Afwezigheid van diplopie, ataxie en parese |
|
Ruimte-innemend proces |
Geleidelijk toenemende uitvalsverschijnselen |
Persisterend |
Ontstaat geleidelijk in de loop van dagen tot weken een bloeding in een tumor kan leiden tot acute uitval |
Afhankelijk van de lokalisatie: hoofdpijn, insulten, visusklachten, parese, gevoelsstoornissen |
Geleidelijk ontstaan van de uitvalsverschijnselen |
|
Perifere (compressie)neuropathie |
Parese en/of gevoelsstoornis, meestal uitgelokt door een bepaalde houding of beweging uitvalsverschijnselen in het verzorgingsgebied van 1 zenuw |
Meestal voorbijgaand, duur van enkele minuten tot uren, soms persisterend |
Variabel, meestal geleidelijk |
Pijn, paresthesieën |
Uitval in het verzorgingsgebied van 1 perifere zenuw |
|
Overige oorzaken van neurologische uitvalsverschijnselen Spoedeisend
Minder spoedeisend
|
|||||
Monoculaire (voorbijgaande) visusstoornissen kunnen behalve door amaurosis fugax en arteriitis temporalis ook veroorzaakt worden door glaucoom, maligne hypertensie, migraine, ablatio retinae, neuritis optica en tumoren.
Transient global amnesia (TGA) is een syndroom met als klinisch kenmerk een acuut ontstaan van algeheel geheugenverlies, zowel anterograad als retrograad, gedurende maximaal 24 uur. De patiënt is helder en in staat te communiceren. Tevens is hij in staat tot het uitvoeren van complexe handelingen. Na de episode is er een amnesie voor het gebeuren. In de literatuur wordt de jaarlijkse incidentie van TGA geschat op 3 per 100.000. De meeste patiënten zijn ouder dan 50 jaar en het syndroom komt iets vaker voor bij vrouwen dan bij mannen. De recidiefkans bedraagt 3 tot 4%. De differentiaaldiagnose bestaat uit epilepsie, amnesie na een hoofdtrauma en ischemie in het posterior stroomgebied. De pathofysiologie van transient global amnesia is onbekend.
Met behulp van MRI zijn er aanwijzingen gevonden voor een focaal verminderde functie van de hippocampus gedurende de periode met amnesie.
Verwijzing naar de neuroloog en aanvullend onderzoek zijn niet geïndiceerd bij een typische, eenmalige episode. Aangezien er geen duidelijke aanwijzingen zijn voor een ischemische genese, is medicamenteuze therapie in het kader van cardiovasculaire preventie niet geïndiceerd.
Een drop attack wordt omschreven als een val als gevolg van voorbijgaande atonie, meestal optredend tijdens lopen, die niet gepaard gaat met bewustzijnsverlies of andere symptomen. Er zijn geen restverschijnselen. Drop attacks treden vooral op bij vrouwen ouder dan 40 jaar. Een drop attack kan uiteenlopende oorzaken hebben en de differentiaaldiagnose is uitgebreid. Uit een onderzoek waarin patiënten met drie of meer drop attacks in de voorgaande zes maanden een uitgebreid onderzoek ondergingen, werd voor 90% van de patiënten één of meerdere waarschijnlijke oorzaken voor de val gevonden: cardiovasculair (53%), neurologisch (29%, waaronder vertebrobasilaire insufficiëntie, ziekte van Parkinson en cerebrovasculaire stoornis), medicatie (11%) en houdings- en/of balansstoornissen (18%). In 10% werd geen oorzaak gevonden voor de val. Dit laatste percentage ligt waarschijnlijk hoger in de populatie die minder frequent een drop attack heeft gehad. Ook binnenoordisfunctie, bijvoorbeeld in het kader van de ziekte van Ménière, wordt als oorzaak beschreven.
Richtlijnen beleid acute fase
Naar Samenvatting ›De aanwezigheid van uitvalsverschijnselen en de mogelijkheid tot acute behandeling bepalen de verwijs-urgentie (zie stroomschema). Indien de patiënt ABCDE-instabiel is: zie Eerste (telefonische) contact.
Beoordeel tot welke categorie de patiënt behoort op basis van aanwezigheid en duur van de uitvalsverschijnselen en eventuele behandelbeperking:
- uitvalsverschijnselen aanwezig, < 12 uur geleden ontstaan (U1, spoed)
- uitvalsverschijnselen aanwezig, ≥ 12 uur geleden ontstaan (U2, < 1 uur)
- uitvalsverschijnselen aanwezig: infauste prognose of wens thuis te blijven (U2, < 1 uur)
- uitvalsverschijnselen volledig verdwenen (U3, binnen enkele uren)
Uitvalsverschijnselen aanwezig, < 12 uur geleden ontstaan (U1, spoed)
Naar Samenvatting ›- Bel met spoed een ambulance (A1-indicatie) en verwijs de patiënt naar de neuroloog
- Overweeg, na het inschakelen van de ambulance, een spoedvisite af te leggen
- Start geen trombocytenaggregatieremmer of antihypertensivum.
- Verwijs de patiënt ook met spoed indien het onduidelijk is wanneer de uitvalsverschijnselen zijn begonnen (bijvoorbeeld wake-up stroke), maar de patiënt < 12 uur geleden voor het laatst zonder uitvalsverschijnselen is gezien.
- Verzamel, indien mogelijk, informatie over de contra-indicaties voor intraveneuze trombolyse (zie tabel 5). Zorg dat dit niet tot vertraging in het verwijsproces leidt.
|
Contra-indicatie |
Geen contra-indicatie |
|---|---|
|
Herseninfarct < 6 weken geleden |
Hogere leeftijd |
|
Intracraniële bloeding < 3 maanden geleden |
Geringe uitvalsverschijnselen |
|
Bloeding in maag-darmkanaal of urinewegen < 2 weken geleden |
Gebruik van een trombocytenaggregatieremmer |
|
Grote chirurgische ingreep < 2 weken geleden |
Menstruatie |
|
Gebruik van vitamine K-antagonist en INR > 1,7 |
Recent acuut myocardinfarct |
|
Gebruik DOAC* |
|
| * Tenzij laatste inname > 24 uur geleden; dabigatran kan eventueel gecoupeerd worden. | |
Toelichting
- Binnen 12 uur na het ontstaan van de verschijnselen komt een aanzienlijk deel van patiënten met een beroerte in aanmerking voor een acute behandeling (herseninfarct: intraveneuze trombolyse en/of endovasculaire behandeling; intracerebrale bloeding: couperen antistolling), zodat dit spoedverwijzing rechtvaardigt. De termijn van 12 uur voor verwijzing met A1-urgentie is vastgesteld in een landelijke afspraak met betrokken partijen (Nederlandse Vereniging voor Neurologie (NVN), Ambulancezorg NL).
- Het aantal patiënten dat intraveneuze trombolyse en/of endovasculaire behandeling kan ondergaan, neemt af met het verstrijken van de tijd. Ook neemt de effectiviteit van de behandelingen af, naarmate de uitvalsverschijnselen langer bestaan.
De urgentie waarmee de huisarts de patiënt naar de neuroloog verwijst bij vermoeden van een beroerte is afhankelijk van de aanwezigheid van uitvalsverschijnselen en de mogelijkheid tot behandeling in de acute fase.
Mogelijkheden tot behandeling in de acute fase
Hier wordt een overzicht gegeven van de behandelingsmogelijkheden in de acute fase. Voor de referenties verwijzen we naar de details waarin deze behandelingen uitvoerig worden besproken.
Intracerebrale bloeding
Couperen antistolling
Gebruik van orale anticoagulantia is een risicofactor voor intracerebrale bloedingen. Indien bij beeldvormend onderzoek sprake is van een intracerebrale bloeding, kunnen vitamine K-antagonisten eventueel gecoupeerd worden met vitamine K of protrombinecomplex. Dabigatran kan gecoupeerd worden met idarucizumab. Rivaroxaban, apixaban en edoxaban kunnen gecoupeerd worden met protrombinecomplex.
Operatie
Incidenteel worden patiënten met een spontane intracerebrale bloeding geopereerd (evacuatie hematoom). Indicaties hiervoor kunnen zijn:
- supratentorieel hematoom: progressieve neurologische achteruitgang met een oppervlakkig gelegen hematoom.
- infratentorieel hematoom: progressieve neurologische achteruitgang of bij initiële slechte neurologische toestand.
Herseninfarct
Intraveneuze trombolyse tot 4,5 uur na het ontstaan van de uitvalsverschijnselen
Intraveneuze trombolyse met alteplase tot 4,5 uur na het ontstaan van de uitvalsverschijnselen bij een herseninfarct is effectief en veilig.
Naar schatting wordt in Nederland circa 20% van de patiënten met een acuut herseninfarct behandeld met intraveneuze trombolyse. Onder de meest gunstige omstandigheden kan 18-24% van de patiënten behandeld worden. Deze percentages werden berekend bij een tijdsduur van respectievelijk 3 en 4 uur tussen ontstaan van de uitvalsverschijnselen en start van de trombolyse.
Intraveneuze trombolyse 4,5-9 uur na het ontstaan van de uitvalsverschijnselen
Tussen 4,5 en 9 uur na het begin van de uitvalsverschijnselen en bij een onbekend aanvangstijdstip van de uitvalsverschijnselen is intraveneuze trombolyse eveneens effectief, maar komt een aanzienlijk lager percentage patiënten hiervoor in aanmerking, aangezien er strengere selectiecriteria worden gehanteerd die gebaseerd zijn op beeldvormend onderzoek.
Het exacte percentage patiënten dat in aanmerking komt voor deze behandeling is niet bekend. We vonden 1 prospectief observationeel onderzoek dat werd uitgevoerd in 1 centrum in Griekenland. Hierin bleek dat van alle patiënten die zich presenteerden met een acuut herseninfarct in een periode van 9 maanden (n = 317), bij ongeveer 10% de klachten 4,5-9 uur tevoren ontstaan waren. Van deze patiënten voldeed bij beeldvormend onderzoek ongeveer een kwart aan de criteria voor intraveneuze trombolyse (EXTEND; n = 7; 2,2% van de totale populatie), maar slechts 4 van hen (1,3% van de totale populatie) kregen de behandeling. De overige 3 voldeden niet aan de klinische criteria (te lage NIHSS-score, te hoge INR of voorbehandeld met een DOAC). Van de patiënten die zich 4,5-9 uur na het begin van de klachten presenteerden kreeg 12,9% intraveneuze trombolyse.
Intraveneuze trombolyse bij onbekend tijdstip van ontstaan van de uitvalsverschijnselen
Naar schatting 20-25% van de herseninfarcten ontstaat tijdens de slaap. Het exacte percentage patiënten dat in aanmerking komt voor intraveneuze trombolyse bij een wake-up stroke is niet bekend. In de praktijk wordt 12 uur na last seen well als bovengrens gehanteerd voor intraveneuze trombolyse.
In de WAKE UP trial werden 1362 patiënten met een onbekend aanvangstijdstip van de klachten gescreend; 859 patiënten werden geëxcludeerd en 503 werden gerandomiseerd. Vervolgens werden 79 patiënten alsnog geëxcludeerd, voornamelijk op grond van bevindingen bij beeldvormend onderzoek; 424 patiënten (31,1%) kwamen in aanmerking voor trombolyse. Deze percentages zijn echter niet naar de algemene bevolking te vertalen, want daarvan komt – door de strikte inclusiecriteria – een naar verwachting veel lager percentage in aanmerking voor behandeling.
Endovasculaire behandeling tot 6 uur na het begin van de uitvalsverschijnselen
Endovasculaire behandeling kan worden toegepast bij geselecteerde patiënten met een herseninfarct bij wie de uitvalsverschijnselen ≤ 6 uur bestaan en een occlusie van de distale a. carotis interna of de proximale a. cerebri media (M1 of M2) is opgetreden. Naar schatting < 10% van de patiënten met een herseninfarct komt echter in aanmerking voor deze behandeling
Endovasculaire behandeling 6-24 uur na het begin van de uitvalsverschijnselen
Endovasculaire behandeling kan ook worden toegepast bij patiënten met een herseninfarct met ernstige uitvalsverschijnselen (score ≥ 10 uit 42 op de National Institutes of Health Stroke Scale (NIHSS)), die sinds 6-24 uur bestaan én die voldoen aan strikte radiologische criteria (occlusie van de distale a. carotis interna of de proximale a. cerebri media (M1 of M2), infarctkern < 25 ml en penumbra ≥ 80% van de grootte van de infarctkern).
Het exacte percentage patiënten dat in aanmerking komt voor deze behandeling is niet bekend. In een observationeel onderzoek in 1 centrum bleek dat ongeveer 3% van de patiënten die zich presenteerden met een acuut herseninfarct voldeed aan de inclusiecriteria van DAWN of DEFUSE 3 (zie detail Endovasculaire behandeling).
Operatie
Chirurgische decompressie wordt incidenteel overwogen bij patiënten met klinische en radiologische tekenen van een ruimte-innemend herseninfarct, binnen 48 uur na ontstaan van het infarct.
Medicamenteuze secundaire preventie
Een snelle start van medicamenteuze secundaire preventie na een herseninfarct leidt tot verlaging van het risico op een recidief.
Carotisdesobstructie
Carotisdesobstructie dient zo spoedig mogelijk na het ontstaan van de symptomen te gebeuren, maar niet binnen de eerste 24 uur.
TIA
Medicamenteuze secundaire preventie
Een snelle start van medicamenteuze secundaire preventie na een TIA leidt tot verlaging van het risico op een recidief TIA of op een herseninfarct.
Duale therapie
Bij patiënten met een minor stroke of TIA met hoge recidiefkans verlaagt duale behandeling met clopidogrel en acetylsalicylzuur binnen 24 uur na de uitvalsverschijnselen het risico op een recidief of een herseninfarct.
Carotisdesobstructie
Carotisdesobstructie dient zo spoedig mogelijk na het ontstaan van de symptomen te gebeuren, maar niet binnen de eerste 24 uur.
Bij recidiverende TIA’s (> 2 in 1 week) is er een indicatie voor relatieve spoedinterventie (< 72 uur).
Overwegingen bij het bepalen van de verwijsurgentie
Bij de vertaling van de mogelijkheden tot acute behandeling naar indicaties voor spoedverwijzing moet rekening worden gehouden met de volgende factoren:
- de kans dat er daadwerkelijk sprake is van een herseninfarct of intracerebrale bloeding
- de kans dat acute behandeling mogelijk is
- de impact van een spoedverwijzing op de patiënt, de ambulancezorg én Spoedeisende Hulp
Kans dat er daadwerkelijk sprake is van een herseninfarct of intracerebrale bloeding
Een aanzienlijk deel van de patiënten die direct, zonder beoordeling door een huisarts, ingestuurd worden met verdenking op een beroerte, heeft uiteindelijk geen beroerte. In een cross-sectioneel onderzoek op de Nederlandse huisartsenposten (n = 1269) werd de accuraatheid van het NTS bij patiënten met verschijnselen die bij een TIA, herseninfarct of intracerebrale bloeding kunnen passen, onderzocht. Bij 45% van de met behulp van het NTS getrieerde patiënten met vermoeden van TIA, herseninfarct of intracerebrale bloeding werd uiteindelijk een andere diagnose gesteld, zoals migraine, epilepsie of perifeer vestibulair syndroom; 34,2% kreeg de diagnose TIA/minor stroke, 15,8% herseninfarct of intracerebrale bloeding en 4,8% andere ernstige neurologische aandoening, zoals een intracraniële bloeding of meningitis.
Kans dat een acute behandeling mogelijk is
Zoals hierboven beschreven staat, ontbreken exacte percentages. Bekend is dat een aanzienlijk deel van de patiënten met een herseninfarct tot 4,5 respectievelijk 6 uur na ontstaan van de klachten in aanmerking komt voor respectievelijk intraveneuze trombolyse en/of endovasculaire behandeling. Omdat de effectiviteit van deze behandelingen afneemt naarmate de tijd verstrijkt en de vereiste diagnostiek en eventuele doorverwijzing naar een expertisecentrum (voor endovasculaire behandeling) de nodige tijd kosten, adviseerde de NHG-Standaard Beroerte al in 2018 om deze patiënten met U1-urgentie te verwijzen.
Indien de klachten langer bestaan, óf als onbekend is hoe lang de klachten bestaan, komen sommige patiënten ook in aanmerking voor intraveneuze trombolyse (< 9 uur na ontstaan van de uitvalsverschijnselen) en/of endovasculaire behandeling (< 24 uur na ontstaan van de uitvalsverschijnselen). Omdat de selectiecriteria bij deze termijnen echter veel strenger zijn, komt een aanzienlijk lager deel voor deze behandelingen in aanmerking. Ook neemt de effectiviteit van de behandeling af naarmate de verschijnselen langer bestaan.
De ontwikkelingen op het gebied van endovasculaire behandeling en intraveneuze trombolyse gaan snel. De termijnen waarbinnen deze behandelingen toegepast kunnen worden zijn aan verandering onderhevig en worden steeds verder verruimd.
Impact van een spoedverwijzing op de patiënt, de ambulancezorg én Spoedeisende Hulp
Op de patiënt maakt een verwijzing per ambulance met A1-indicatie vaak veel indruk. Daarnaast legt een verwijzing met A1-indicatie meer druk op de ambulancezorg en Spoedeisende Hulp dan een verwijzing met A2- indicatie. Tenslotte heeft een ambulancerit met A1-indicatie impact op de verkeersveiligheid.
Samenwerking
De werkgroep hecht groot belang aan eenduidige, in de praktijk goed toepasbare richtlijnen voor verwijscriteria en verwijsurgenties. Discrepanties met het beleid van neurologen en ambulancepersoneel/meldkamer zijn onwenselijk. Daarom zijn in samenspraak met Ambulancezorg NL en de Nederlandse Vereniging voor Neurologie (NVN) richtlijnen opgesteld waarbij bovengenoemde factoren in overweging zijn genomen.
Uitvalsverschijnselen aanwezig
Er is consensus dat tot een termijn van 12 uur na het begin van de uitvalsverschijnselen zodanig veel patiënten met een herseninfarct in aanmerking komen voor intraveneuze trombolyse en/of endovasculaire behandeling (en couperen van orale anticoagulantia) dat dit verwijzing met U1-urgentie rechtvaardigt. Dit geldt ook voor patiënten met een onbekend aanvangstijdstip van de klachten, maar die < 12 uur geleden voor het laatst zonder uitvalsverschijnselen zijn gezien. Patiënten worden (afhankelijk van regionale afspraken) naar een lokaal of regionaal ziekenhuis verwezen voor diagnostiek. Patiënten die in aanmerking komen voor endovasculaire behandeling worden vervolgens naar een expertisecentrum verwezen.
Na de termijn van 12 uur achten wij het zinvol dat de huisarts eerst de patiënt beoordeelt (U2-urgentie) om de uitvalsverschijnselen te objectiveren en een inschatting te maken of sprake is van een beroerte of van een andere aandoening zoals migraine, drukneuropathie of perifeer vestibulair syndroom. Indien een beroerte waarschijnlijk is, wordt de patiënt per ambulance naar het ziekenhuis vervoerd. Overleg met de neuroloog over de urgentie waarmee de patiënt verwezen moet worden. Of patiënt met A1- of A2-urgentie verwezen moet worden, is afhankelijk van de kans dat de patiënt endovasculair behandeld kan worden. Slechts een klein deel van de patiënten met ernstige uitvalsverschijnselen in het stroomgebied van de carotiden komt hiervoor in aanmerking. Eerste beoordeling door de huisarts en overleg over de verwijsurgentie voorkomen onevenredig grote druk op de ambulancezorg en Spoedeisende Hulp.
Met de verlenging van de termijn voor spoedverwijzing van 4,5-6 naar 12 uur is behandeling met orale anticoagulantia komen te vervallen als aparte indicatie voor verwijzing met U1-urgentie. Indien een patiënt die orale anticoagulantia gebruikt voor het eerst contact opneemt als de uitvalsverschijnselen al > 12 uur bestaan, is het zinvol eerst de patiënt zelf te beoordelen (U2-urgentie) alvorens deze naar het ziekenhuis te verwijzen.
Uitvalsverschijnselen volledig verdwenen
Patiënten bij wie de uitvalsverschijnselen inmiddels volledig zijn verdwenen, komen niet in aanmerking voor bovenstaande behandelingen. Daarmee is de urgentie tot beoordeling door de neuroloog lager. In geval van een recidief kan de patiënt echter alsnog in aanmerking komen voor deze behandelingen, het is dan ook van belang om patiënten te instrueren om bij recidiefklachten direct contact op te nemen met de huisarts.
Indien bij beoordeling van deze patiënten (binnen een paar uur, U3-urgentie) de werkdiagnose TIA wordt gesteld, moet met de neuroloog worden overlegd over de gewenste termijn van beoordeling. Het is wenselijk om zo snel mogelijk te starten met secundaire preventie en diagnostiek naar een mogelijke carotisstenose te verrichten. Bovendien kunnen patiënten met een hoogrisico TIA in aanmerking komen voor duale behandeling, mits deze binnen 24 uur gestart kan worden. Op basis van deze overwegingen wordt aanbevolen patiënten met een TIA bij voorkeur binnen 24 uur naar de neuroloog te verwijzen.
Conclusie
- Uitvalsverschijnselen die nog aanwezig zijn, maar < 12 uur geleden zijn ontstaan, zijn een indicatie voor spoedverwijzing (U1-urgentie).
- Als de uitvalsverschijnselen ≥ 12 uur bestaan, leg dan een visite af of laat de patiënt bij geringe uitvalsverschijnselen direct naar de praktijk komen (U2-urgentie). Overleg, indien op basis van anamnese en lichamelijk onderzoek een beroerte aannemelijk is, met de neuroloog over de urgentie waarmee patiënt verwezen moet worden (A1- of A2-indicatie, onder andere afhankelijk van duur en ernst van de uitvalsverschijnselen).
- Leg bij patiënten bij wie de uitvalsverschijnselen nog aanwezig zijn, maar die een infauste prognose hebben of de wens om thuis te blijven, direct een visite af (U2-urgentie).
- Beoordeel patiënten bij wie de uitvalsverschijnselen volledig verdwenen zijn binnen een paar uur (U3-urgentie). Verwijs vervolgens patiënten bij wie de werkdiagnose TIA gesteld wordt bij voorkeur binnen 24 uur naar de neuroloog.
Een internationale definitie van ‘klein herseninfarct’ oftewel minor stroke ontbreekt. Over het algemeen spreekt men hiervan bij geringe uitvalsverschijnselen die niet volledig herstellen. In onderzoeksverband wordt vaak een score ≤ 3 op de National Institutes of Health Stroke Scale (NIHSS) toegepast om de ernst van de uitvalsverschijnselen bij een minor stroke te definiëren.
Het advies is om alle patiënten die bij presentatie nog uitvalsverschijnselen vertonen, onafhankelijk van de ernst hiervan, direct naar het ziekenhuis te verwijzen. In de praktijk blijkt namelijk dat patiënten die aanvankelijk slechts geringe uitvalsverschijnselen vertonen in de loop van uren tot dagen een toename van uitval kunnen krijgen. Zo toonde een prospectief observationeel onderzoek (n = 2165) dat 17% van de patiënten die niet in aanmerking kwamen voor behandeling met intraveneuze trombolyse omdat zij slechts geringe uitvalsverschijnselen hadden (gemiddelde NIHSS bij opname 3), tijdens opname waren overleden of niet functioneel onafhankelijk waren bij ontslag uit het ziekenhuis (gemodificeerde rankinscore (mRS) > 2). Dit percentage komt redelijk overeen met de bevindingen uit een prospectief onderzoek waarin 510 patiënten met een minor stroke (NIHSS < 4) of met een TIA werden geïncludeerd. Exclusiecriteria waren onder andere behandeling met intraveneuze trombolyse en mRS = 2. Vijftien procent van de patiënten bleek na negentig dagen functioneel verslechterd, gedefinieerd als een mRS = 2. Het grootste deel van deze patiënten (74%) had geen recidief (gedefinieerd als uitvalsverschijnselen die minstens 24 uur aanhielden) doorgemaakt. Het doormaken van een recidief (ruim 7% van alle patiënten) was wel geassocieerd met een slechtere uitkomst: 53% was na negentig dagen functioneel afhankelijk.
Naast de kans op functionele verslechtering bij een minor stroke blijkt ook dat opname op een stroke unit bij patiënten met slechts geringe uitvalsverschijnselen ten tijde van randomisatie tot minder afhankelijkheid leidt. Ten slotte blijkt uit een prospectief cohortonderzoek (onderdeel van de Oxford Vascular Study, n = 87) dat er een reëel risico is op het optreden van een herseninfarct na een minor stroke (NIHSS = 3). Gedurende de eerste zeven dagen na het ontstaan van de uitvalsverschijnselen bedraagt deze kans 11,5%, gedurende de eerste maand 15% en gedurende de eerste drie maanden 18,5%. Snelle start van secundaire preventie is daarom wenselijk.
Patiënten met slechts geringe uitvalsverschijnselen komen ook in aanmerking voor behandeling met intraveneuze trombolyse indien sprake is van interferentie met de functionaliteit, wat bijvoorbeeld het geval is bij een geïsoleerde afasie of hemianopsie.
Conclusie
Alle patiënten met uitvalsverschijnselen bij presentatie worden, onafhankelijk van de ernst hiervan, met U1- of U2-indicatie (afhankelijk van de eventuele mogelijkheid tot acute behandeling) naar het ziekenhuis verwezen.
In een gerandomiseerd open-labelonderzoek (n = 642) werd de effectiviteit en veiligheid van toediening van 300 mg acetylsalicylzuur binnen 90 minuten na start van intraveneuze trombolyse onderzocht. In dit onderzoek bleek dat vroege toediening van acetylsalicylzuur na intraveneuze trombolyse gepaard gaat met een toename van de kans op symptomatische intracerebrale bloedingen in vergelijking tot een start 24 uur na behandeling met intraveneuze trombolyse (4,3% versus 1,6%; absoluut risicoverschil 2,8%; 95%-BI 0,2 tot 5,4%).
Er was geen significant verschil in de kans op een gunstige uitkomst na drie maanden.
Conclusie
Indien een patiënt met intraveneuze trombolyse wordt behandeld, wordt voorafgaand hieraan en gedurende de eerste 24 uur na de behandeling, geen acetylsalicylzuur gestart.
Circa 80% van de patiënten met een beroerte heeft in de acute fase een verhoogde bloeddruk (> 140 mmHg systolisch). Deze daalt gedurende de eerste 24 uur na het ontstaan van de uitvalsverschijnselen met gemiddeld 28%. De hoge bloeddruk in de acute fase kan het gevolg zijn van stress als gevolg van het infarct, een volle blaas, misselijkheid, een fysiologische respons op hypoxie, een verhoogde intracraniële druk en/of pre-existente hypertensie.
Herseninfarct
In theorie kan het medicamenteus verlagen van de bloeddruk in de acute fase van een herseninfarct leiden tot vermindering van hersenoedeem, verdere vasculaire schade en het verlagen van de kans op hemorragische transformatie van het infarct en op een vroeg recidief. Anderzijds is het autoregulatiemechanisme ten tijde van een acuut infarct verstoord, waardoor de cerebrale perfusie afhankelijk is van de systemische bloeddruk. Indien deze actief verlaagd wordt, bestaat er een kans op een verminderde perfusie van de penumbra en groei van het infarct.
In theorie leidt actieve verlaging van de bloeddruk bij een hersenbloeding tot een vermindering van de uitbreiding van het hematoom, minder perihematomaal oedeem en een verlaging van de kans op hernieuwd bloeden.
In een dubbelblind gerandomiseerd onderzoek (n = 2029) werden patiënten met een herseninfarct of -bloeding binnen dertig uur na het ontstaan van de uitvalsverschijnselen geïncludeerd indien zij een systolische bloeddruk > 140 mmHg hadden. Hierbij werden patiënten die de eerste zeven dagen met candesartan zijn behandeld (85% herseninfact, 14% -bloeding), vergeleken met patiënten die de eerste zeven dagen met placebo zijn behandeld (86% herseninfarct, 13% -bloeding). Na zes maanden was er geen verschil op het samengestelde eindpunt vasculaire sterfte, myocardinfarct of beroerte. Een subgroepanalyse toonde geen verschil tussen de uitkomst bij een herseninfarct of -bloeding. De auteurs verrichtten ook een meta-analyse (11 RCT’s). Hieruit blijkt dat behandeling met antihypertensiva in de acute fase van een herseninfarct of -bloeding niet van invloed is op de mortaliteit of invaliditeit (mRS 3-6) na 6 maanden. Uit het EXPRESS-onderzoek blijkt dat snelle start van secundaire preventie, waaronder behandeling met antihypertensiva, na een TIA of minor stroke leidt tot een significante afname van de kans op het optreden van een herseninfarct binnen negentig dagen.
Hersenbloeding
Een gerandomiseerde pilotstudie (Interact) toonde dat snelle (< 6 uur na het ontstaan van de symptomen), intensieve bloeddrukverlaging (streefwaarde systolische bloeddruk: 140 mmHg) bij een hersenbloeding tot een significante vermindering van de uitbreiding van het hematoom leidt (verschil: 2,80 ml; 95%-BI 1,04 tot 4,56) in vergelijking tot minder agressieve behandeling (streefwaarde systolische bloeddruk: 180 mmHg). Er werd niet gekeken of dit ook invloed had op de functionele uitkomst.
Dit werd wel onderzocht in de Interact 2 trial. Hierbij werden patiënten met een hersenbloeding (n = 2794) binnen zes uur na het begin van de klachten behandeld met intensieve bloeddrukverlaging (intraveneuze en orale medicatie, op geleide van lokale behandelprotocollen; streefwaarde systolische bloeddruk > 140 mmHg, binnen één uur te bereiken en gedurende zeven dagen te handhaven) of bloeddrukverlagende behandeling, naar inzicht van de behandelaar (streefwaarde systolische bloeddruk 180 mmHg). De gemiddelde systolische bloeddruk bij randomisatie was 179 mmHg. Na één uur was de systolische bloeddruk in de behandelgroep tot gemiddeld 150 mmHg gedaald, 33,4% van de patiënten bereikte de streefwaarde (< 140 mmHg); in de controlegroep bedroeg de bloeddruk na één uur gemiddeld 164 mmHg. Er werd geen verschil gevonden op de primaire uitkomstmaat (mortaliteit of ernstige beperking (mRS 3-6; OR 0,87; 95%-BI 0,77 tot 1,00)). Een ordinale analyse toonde een net significant verschil ten gunste van intensieve bloeddrukbehandeling op de scores van de mRS (OR voor ernstige beperking 0,87; 95%-BI 0,77 tot 1,00). Er was geen verschil in mortaliteit en optreden van ernstige bijwerkingen.
In de ATACH 2 trial werden patiënten met een hersenbloeding (n = 1000) gerandomiseerd tussen intensieve bloeddrukverlaging (streefwaarde systolische bloeddruk 110-139 mmHg) of standaardbehandeling (streefwaarde systolische bloeddruk 140-179 mmHg). Beide groepen werden met intraveneus nicardipine behandeld, toegediend binnen 4,5 uur na het begin van de symptomen. De gemiddelde systolische bloeddruk bij randomisatie was 201 mmHg. In de behandelgroep was de minimale systolische bloeddruk (2 uur na randomisatie) gemiddeld 129 mmHg en in de controlegroep gemiddeld 141 mmHg.
Er was geen verschil op de primaire uitkomstmaat (mortaliteit of ernstige beperking (mRS 4-6) na 3 maanden) (RR 1,04; 95%-BI 0,85 tot 1,27). Ook was er geen verschil in ernstige bijwerkingen, gerelateerd aan de behandeling, in de eerste 3 dagen na randomisatie (1,6 versus 1,2%; RR 1,37; 95%-BI 0,47 tot 3,95). Bijwerkingen ten aanzien van de nieren (niet gedefinieerd) in de eerste 7 dagen traden in de behandelgroep bij 9% van de patiënten op en in de controlegroep bij 4%; p = 0,002).
Op grond van deze onderzoeken is het niet mogelijk om een uitspraak te doen over de optimale streefwaarde van de systolische bloeddruk in de acute fase van een hersenbloeding. Voor intensieve bloeddrukdaling in de acute fase van een hersenbloeding is op dit moment de meerwaarde onvoldoende aangetoond. Vooral op theoretische gronden is er consensus om antihypertensiva te starten indien de systolische bloeddruk bij herhaalde metingen > 180 mmHg bedraagt.
Of antihypertensiva veilig gecontinueerd kunnen worden in de acute fase na een beroerte werd onderzocht door 763 patiënten, die reeds voor het ontstaan van de uitvalsverschijnselen antihypertensiva gebruikten, binnen 48 uur na het ontstaan van de symptomen te randomiseren. Van hen continueerden 397 de antihypertensiva, 384 patiënten staakten gedurende 14 dagen de behandeling met antihypertensiva. Er was geen verschil op de primaire uitkomstmaat mortaliteit of afhankelijkheid na 2 weken.
Conclusie
In de acute fase van een TIA of klein herseninfarct is het advies de secundaire preventie zo snel mogelijk te starten, waaronder behandeling met antihypertensiva. Dit gebeurt over het algemeen klinisch. In het geval van een groot herseninfarct of grote -bloeding is het advies om in het acute stadium geen antihypertensiva te starten, tenzij de bloeddruk bij herhaalde metingen > 220/120 mmHg (herseninfarct) of > 180/105 mmHg (hersenbloeding) bedraagt. Deze aanbevelingen zijn vooral op theoretische overwegingen gebaseerd. Indien patiënten al antihypertensiva gebruiken, kunnen deze gecontinueerd worden.
Het doel van intraveneuze trombolyse bij het acute herseninfarct is het bewerkstelligen van een herstelde bloedtoevoer naar het ischemische gebied door het oplossen van de lokale trombose of afsluitende trombo-embolie met het trombolyticum alteplase (recombinant weefselplasminogeenactivator, rt-PA). Zo snel mogelijke behandeling is aangewezen om zo veel mogelijk levensvatbare neuronen te behouden.
In een gepoolde analyse (7 RCT’s, n = 3670) werd gekeken naar de effectiviteit van behandeling met intraveneuze trombolyse met alteplase in verschillende tijdsintervallen na het ontstaan van de uitvalsverschijnselen. Deze analyse toont dat intraveneuze trombolyse met alteplase tot 4,5 uur na het ontstaan van de uitvalsverschijnselen effectief en veilig is. De kans op een gunstige uitkomst (functionele onafhankelijkheid, gedefinieerd als een gemodificeerde rankinscore (mRS) 0 of 1 na 90 dagen) neemt duidelijk af naarmate de tijd verstrijkt. De berekende oddsratio’s voor een gunstige uitkomst zijn 2,55 (95%-BI 1,44 tot 4,52) voor behandeling binnen de termijn < 1,5 uur, 1,64 (95%-BI 1,12 tot 2,40) voor de termijn 1,5 tot 3 uur en 1,34 (95%-BI 1,06 tot 1,68) voor de termijn 3 tot 4,5 uur ten gunste van de patiënten behandeld met intraveneus alteplase in vergelijking tot placebo. Voor het tijdsinterval 4,5 tot 6 uur is er geen significant verschil tussen beide behandelgroepen (indien er geen selectie wordt verricht aan de hand van geavanceerde beeldvormende diagnostiek). De bijbehorende numbers needed to treat (NNT) staan samengevat in (tabel 6). Grote parenchymale bloedingen werden gezien bij 5,2% van alle patiënten die behandeld werden met intraveneus alteplase en bij 1,0% van alle controlepatiënten (OR 5,37; 95%-BI 3,22 tot 8,95; p < 0,0001; number needed to harm (NNH) 24). Er was geen duidelijke relatie met de tijd tot behandeling. De mortaliteit was verhoogd indien de behandeling met alteplase later dan 4,5 uur na het begin van de symptomen gestart werd (OR 1,49; 95%-BI 1,00 tot 2,21).
|
Tijdsduur tot start van intraveneuze trombolyse |
Number needed to treat* |
|---|---|
|
< 1,5 uur |
5 |
|
1,5 tot 3 uur |
9 |
|
3 tot 4,5 uur |
15 |
|
* Number needed to treat voor een goede uitkomst na 90 dagen (gemodificeerde rankinscore 0 of 1) voor behandeling met intraveneuze trombolyse in verhouding tot het tijdsinterval van ontstaan van de uitvalsverschijnselen tot start van de behandeling. |
|
In de hierna gepubliceerde Third International Stroke Trial (IST-3) (gerandomiseerde, open-label studie, n = 3035) werden de veiligheid en effectiviteit onderzocht van intraveneuze trombolyse met alteplase 0,9 mg/kg, indien dit binnen 6 uur na het ontstaan van de uitvalsverschijnselen werd toegediend (zonder selectie op basis van geavanceerde beeldvormende diagnostiek). Alleen patiënten bij wie twijfel bestond over de indicatie tot trombolyse, op grond van de in het algemeen gehanteerde exclusiecriteria, werden geïncludeerd. Dit betekent dat 33% van de in totaal 3035 patiënten gerandomiseerd werd tussen 4,5 en 6 uur na het begin van de uitvalsverschijnselen. Daarnaast was 53% van de patiënten ouder dan 80 jaar. Tussen de twee behandelgroepen was er geen significant verschil op de primaire uitkomstmaat levend en onafhankelijkheid (Oxford Handicap score (OHS) 0 tot 2, deze score is vergelijkbaar met de gemodificeerde rankinscore) na 6 maanden. Alleen bij een secundaire, ordinale analyse bleek dat er een significante verschuiving was van de OHS-scores ten gunste van de groep die behandeld werd met trombolyse.
Behandeling met intraveneuze trombolyse ging gepaard met een toename van het aantal symptomatische intracraniële bloedingen binnen 7 dagen (7% in de behandel- versus 1% in de controlegroep; OR 6,94; 95%-BI 4,07 tot 11,8; NNH 16,7). Ook was de mortaliteit gedurende de eerste 7 dagen in de behandelgroep verhoogd ten opzichte van de controlegroep (11% versus 7%; OR 1,60; 95%-BI 1,22 tot 2,08; NNH 25). De mortaliteit tussen 7 dagen en 6 maanden lag in de controlegroep echter hoger, zodat er na 6 maanden evenveel patiënten overleden waren in de behandel- en controlegroep (27%). De effectiviteit van behandeling was gedurende de eerste 3 uur na het ontstaan van de uitval het grootst en was bij patiënten van 80 jaar of ouder minstens zo groot als bij jongere patiënten. Een meta-analyse (12 RCT’s, n = 7012), waarin bovengenoemde IST-3 trial werd geïncludeerd, toont dat intraveneuze trombolyse met alteplase, indien toegediend binnen 6 uur na het begin van de uitvalsverschijnselen, de kans om na 6 maanden te leven en onafhankelijk (mRS 0 tot 2) te zijn vergroot (46,3% in de behandel- versus 42,1% in de controlegroep; OR 1,17; 95%-BI 1,06 tot 1,29; p = 0,001; NNT 23,8). Bij uitsplitsing naar tijdsvenster van behandeling was dit verschil alleen significant voor de groep patiënten die behandeld werd binnen 3 uur na het begin van de klachten (OR 1,53; 95%-BI 1,26 tot 1,86). Patiënten die met trombolyse werden behandeld hadden een grotere kans op een symptomatische intracraniële bloeding (7,7% versus 1,8% in de controlegroep; OR 3,72; 95%-BI 2,98 tot 4,64; NNH 16,9). De kans hierop was niet gerelateerd aan het tijdsvenster van behandeling.
De totale mortaliteit was niet verschillend tussen de behandel- en controlegroep. Echter bij uitsplitsing naar tijdsvenster van behandeling bleek in de subgroep patiënten die met trombolyse werd behandeld tussen 3 en 6 uur na het ontstaan van de uitval de mortaliteit (net significant) verhoogd ten opzichte van de controlegroep (17,8% versus 16,0%; OR 1,16; 95%-BI 1,00 tot 1,35; NNH 55,6). In deze meta-analyse werd, in tegenstelling tot in de hierboven beschreven gepoolde analyse van Lees et al., het tijdsvenster 3 tot 4,5 uur na het ontstaan van de uitvalsverschijnselen niet onderzocht. Op basis van deze meta-analyse valt dan ook geen uitspraak te doen over de effectiviteit en veiligheid van intraveneuze trombolyse tot 4,5 uur na het ontstaan van de uitvalsverschijnselen. In de gepoolde analyse van Lees et al. zijn de effectiviteit en veiligheid van intraveneuze trombolyse tot 4,5 uur na het ontstaan van de uitvalsverschijnselen echter afdoende aangetoond.
Op basis van enkele secundaire analyses bestaat er geen overtuigend bewijs dat er, afgezien van de tijd tot start van de behandeling, patiëntkenmerken zijn die invloed hebben op het effect van de behandeling met intraveneuze trombolyse.
Conclusie
De voordelen van behandeling met intraveneuze trombolyse met alteplase bij een herseninfarct wegen op tegen de risico’s, indien dit gestart wordt binnen 4,5 uur na het begin van de symptomen bij geselecteerde patiënten. Met het verstrijken van de tijd neemt de effectiviteit van intraveneuze trombolyse aanzienlijk af. Daarom is een zo snel mogelijke behandeling van essentieel belang.
Samenvatting van bewijs
Uitgangsvraag
Is intraveneuze trombolyse (vergeleken met standaardzorg) aan te bevelen bij patiënten met een herseninfarct, geselecteerd op basis van beeldvormende diagnostiek, bij wie de uitvalsverschijnselen 4,5-9 uur bestaan, of met een onbekend aanvangstijdstip van de verschijnselen? Zie de PICO-tabel.
|
Patiënten |
Patiënten met een herseninfarct, geselecteerd op basis van beeldvormende diagnostiek
|
|---|---|
|
Interventie |
Intraveneuze trombolyse |
|
Vergelijking |
Standaardzorg |
|
Uitkomstmaten (gemeten na 3 maanden) |
Cruciaal
|
Achtergrond
Het doel van intraveneuze trombolyse bij een acuut herseninfarct is het bewerkstelligen van een herstelde bloedtoevoer naar het ischemische gebied door het oplossen van de lokale trombose of afsluitende trombo-embolie met een trombolyticum (een recombinant weefselplasminogeenactivator (rt-PA) zoals alteplase). Zo snel mogelijke behandeling is aangewezen om zo veel mogelijk levensvatbare neuronen te behouden. Intraveneuze trombolyse met alteplase < 4,5 uur na het ontstaan van de uitvalsverschijnselen is effectief en veilig. De kans op een gunstige uitkomst (functionele onafhankelijkheid, gedefinieerd als een gemodificeerde rankinscore (mRS) 0 of 1 na 90 dagen) neemt echter af naarmate de tijd verstrijkt.
Behandeling met alteplase binnen 4,5 uur na het optreden van de verschijnselen van een herseninfarct is dan ook standaardbeleid in Nederland. Soms is het echter niet mogelijk om patiënten op deze korte termijn te behandelen. Ook is het niet altijd mogelijk om het aanvangstijdstip van de verschijnselen aan te wijzen, bijvoorbeeld als het herseninfarct ontstaat tijdens de slaap (wake-up stroke). Dit laatste is naar schatting het geval in 20-25% van de herseninfarcten.
De uitgangsvraag is daarom of intraveneuze trombolyse is aan te bevelen bij patiënten met een herseninfarct in het interval 4,5-9 uur na het ontstaan van de verschijnselen, en bij patiënten met een onbekend aanvangstijdstip, die op basis van beeldvormende diagnostiek geselecteerd worden.
Methoden
Voor het beantwoorden van deze vraag is gebruikgemaakt van de module Trombolyse met alteplase bij acuut herseninfarct) van de richtlijn Herseninfarct en hersenbloeding van de Nederlandse Vereniging voor Neurologie.
De NHG-werkgroep heeft de resultaten en de conclusies uit deze richtlijn besproken en heeft een aanbeveling geformuleerd.
Resultaten
Onderzoekskarakteristieken
Behandeling 4,5-9 uur na het ontstaan van de verschijnselen
Dit onderdeel van de NVN-module is gebaseerd op een systematische review met een meta-analyse. Inclusiecriteria waren RCT’s bij patiënten die > 4,5 uur na het begin van de symptomen (bekend aanvangstijdstip) óf bij het ontwaken (onbekend aanvangstijdstip) waren geselecteerd met geavanceerd beeldvormend onderzoek en vervolgens behandeld met alteplase of placebo. Het beeldvormend onderzoek bestond uit perfusie-CT of perfusie-diffusie-MRI. In de meta-analyse werden 3 RCT’s geïncludeerd: EXTEND (n = 225; vroegtijdig afgebroken wegens onverwacht positieve resultaten van de interventie), ECASS4-EXTEND (n = 116; vroegtijdig afgebroken wegens trage inclusie) en EPITHET (n = 101; behandeld 3-6 uur na het aanvangstijdstip; in de meta-analyse werden alleen de 69 patiënten geïncludeerd die 4,5-6 uur na het aanvangstijdstip behandeld waren). In totaal 414 patiënten werden in de meta-analyse geïncludeerd; de resultaten werden gestratificeerd voor 3 subgroepen: (1) patiënten behandeld 4,5-6 uur na het bekende aanvangstijdstip, (2) patiënten behandeld 6-9 uur na het bekende aanvangstijdstip, (3) patiënten die wakker waren geworden met symptomen (onbekend aanvangstijdstip). De NVN-werkgroep heeft de resultaten van subgroepen (1) en (2) gepoold voor dit onderdeel van de module.
In een prospectief observationeel onderzoek dat werd uitgevoerd in 1 centrum in Griekenland bleek dat van alle patiënten die zich presenteerden met een acute ischemische beroerte in een periode van 9 maanden (n = 317), ongeveer 10% zich presenteerde 4,5-9 uur na het ontstaan van de klachten. Bij beeldvormend onderzoek voldeed ongeveer een kwart van deze patiënten aan de selectiecriteria van EXTEND (n = 7; 2,2% van de totale populatie), maar slechts 4 van hen (1,3% van de totale populatie) werden behandeld met trombolyse. De overige 3 voldeden niet aan de klinische criteria (te lage NIHSS-score, te hoge INR of voorbehandeld met een DOAC).
Behandeling na een onbekend aanvangstijdstip van de verschijnselen
Dit onderdeel van de NVN-module is gebaseerd op een systematische review met meta-analyse van individuele patiëntendata. De reviewers includeerden RCT’s die trombolyse met alteplase vergeleken met placebo of standaardzorg bij patiënten na een herseninfarct met onbekend aanvangstijdstip. De patiënten waren voor trombolyse geselecteerd met perfusie-CT, perfusie-diffusie-MRI of de op MRI-gebaseerde ‘weefselklok’ (DWI/FLAIR mismatch). Alleen RCT’s met ≥ 20 patiënten werden geïncludeerd.
In deze meta-analyse werden 4 RCT’s geïncludeerd: EXTEND (n = 225; vroegtijdig afgebroken wegens onverwacht positieve resultaten van de interventie), ECASS4-EXTEND (n = 116; vroegtijdig afgebroken wegens trage inclusie), WAKE-UP (n= 503; vroegtijdig afgebroken voor volledige inclusie wegens gebrek aan fondsen) en THAWS (n = 131; vroegtijdig afgebroken wegens onverwacht positieve resultaten van de interventie). In totaal werden 843 individuele patiënten in deze meta-analyse geïncludeerd. Van EXTEND (n = 146) en ECASS-4-EXTEND (n = 63) werden alleen gegevens gebruikt van patiënten van wie het aanvangstijdstip onbekend was. De mediane duur van last seen well tot start behandeling was in de alteplasegroep 10,6 uur (interkwartielafstand (IQR) 8,6-12,4 uur) en in de controlegroep 10,5 uur (IQR 8,4-12,3 uur).
Er zijn geen betrouwbare gegevens bekend over het percentage patiënten dat voor deze behandeling in aanmerking komt, maar de verwachting is dat dit slechts een zeer klein percentage is.
Effectiviteit en bijwerkingen
Zie tabellen Intraveneuze trombolyse 4,5-9 uur na het ontstaan van de verschijnselen en Intraveneuze trombolyse na een onbekend aanvangstijdstip van de verschijnselen voor de samenvatting van de resultaten.
Conclusies
Behandeling 4,5-9 uur na het ontstaan van de verschijnselen
- Intraveneuze trombolyse leidt waarschijnlijk tot een grotere kans op functionele onafhankelijkheid en (vrijwel) volledig herstel dan standaardzorg (kwaliteit van bewijs redelijk).
- Intraveneuze trombolyse leidt mogelijk tot een grotere kans op sterfte dan standaardzorg (kwaliteit van bewijs laag).
- We zijn onzeker over het effect van intraveneuze trombolyse op de kans op een symptomatische intracraniële bloeding (kwaliteit van bewijs zeer laag).
Behandeling na een onbekend aanvangstijdstip van de verschijnselen
- Intraveneuze trombolyse leidt waarschijnlijk tot een grotere kans op functionele onafhankelijkheid en (vrijwel) volledig herstel dan standaardzorg (kwaliteit van bewijs redelijk).
- Intraveneuze trombolyse leidt mogelijk tot een grotere kans op sterfte en op een symptomatische intracraniële bloeding dan standaardzorg (kwaliteit van bewijs laag).
Van bewijs naar aanbeveling
Voor- en nadelen
Intraveneuze trombolyse leidt bij geselecteerde patiënten met een herseninfarct met onbekend aanvangstijdstip of met uitvalsverschijnselen die 4,5-9 uur geleden begonnen zijn tot een grotere kans op functionele onafhankelijkheid en vrijwel volledig herstel. Daar staat tegenover dat het risico op sterfte en op het ontstaan van een symptomatische intracraniële bloeding mogelijk toeneemt. Deze nadelen treden op bij een kleiner, maar niet te verwaarlozen percentage van de patiënten.
Kwaliteit van bewijs
De kwaliteit van bewijs varieert voor de meeste uitkomstmaten van redelijk tot laag. Er is afgewaardeerd met 1 of 2 niveaus voor onnauwkeurigheid vanwege de brede betrouwbaarheidsintervallen en (zeer) kleine aantallen gebeurtenissen. Daarnaast is er in 1 onderzoek afgewaardeerd voor indirect bewijs: resultaten voor de uitkomstmaat ‘symptomatische intracraniële bloeding’ waren niet alleen gerapporteerd voor patiënten met verschijnselen die 4,5-9 uur bestonden, maar voor alle geïncludeerde patiënten inclusief die met onbekend aanvangstijdstip.
Waarden en voorkeuren van patiënten
De werkgroep schat in dat de meeste patiënten, gezien de impact van afhankelijkheid door een herseninfarct, zullen kiezen voor intraveneuze behandeling.
Kosten
De kosten van trombolyse zijn niet bepaald.
Aanvaardbaarheid
Intraveneuze trombolyse is aanvaardbaar, zowel voor patiënten als voor behandelaars (neurologen).
Haalbaarheid
Intraveneuze trombolyse is een algemeen geaccepteerde behandeling waar inmiddels veel ervaring mee is opgedaan en in alle ziekenhuizen met een Spoedeisende Hulp kan worden verricht. Om de patiënten te selecteren die baat kunnen hebben bij deze behandeling, moet een CT of MRI perfusie worden verricht. Op basis hiervan wordt het volume van de (veronderstelde) infarctkern en penumbra gemeten. Deze beeldvormende technieken zijn in alle ziekenhuizen beschikbaar.
Slechts een klein percentage van de patiënten komt op grond van de criteria in aanmerking voor intraveneuze trombolyse na 4,5 uur na het ontstaan van de verschijnselen.
Waarom deze aanbeveling?
Intraveneuze trombolyse leidt bij geselecteerde patiënten met een herseninfarct 4,5-9 uur na het ontstaan van de verschijnselen, of met onbekend aanvangstijdstip, tot een grotere kans op functionele onafhankelijkheid en vrijwel volledig herstel. Dit gunstige effect weegt op tegen de mogelijke toename van de kans op sterfte en symptomatische intracraniële bloeding. Er is inmiddels veel ervaring met intraveneuze trombolyse en gezien de impact van uitvalsverschijnselen zullen veel patiënten deze behandeling willen ondergaan. Op grond hiervan komen wij tot een sterke aanbeveling voor verwijzing voor intraveneuze trombolyse binnen 4,5-9 uur na het begin van de uitvalsverschijnselen of na een onbekend aanvangstijdstip van de uitvalsverschijnselen bij (op basis van beeldvormend onderzoek geselecteerde) patiënten.
In de praktijk is de leidraad bij patiënten met een onbekend aanvangstijdstip van de uitvalsverschijnselen dat, indien zij < 12 uur geleden voor het laatst zonder uitvalsverschijnselen zijn gezien (last seen well), beoordeeld wordt of zij in aanmerking komen voor trombolyse. Voor de behandeling gelden strenge selectiecriteria, waardoor slechts een klein percentage van de patiënten voor trombolyse in aanmerking zal komen.
Samenvatting van bewijs
Uitgangsvraag
Is endovasculaire behandeling (vergeleken met standaardzorg) aan te bevelen bij patiënten met een herseninfarct < 6 uur na het ontstaan van de verschijnselen, en 6-24 uur na het ontstaan van de verschijnselen? Zie de PICO-tabel.
|
Patiënten |
Patiënten met een herseninfarct
|
|---|---|
|
Interventie |
Endovasculaire behandeling |
|
Vergelijking |
Standaardzorg |
|
Uitkomstmaten |
Cruciaal
|
Achtergrond
Endovasculaire behandeling kan worden toegepast bij een herseninfarct als gevolg van een occlusie van een van de proximale intracraniële arteriën. Dit is een minimaal invasieve behandeling die met behulp van angiografie wordt uitgevoerd. Hierbij wordt in de meeste gevallen een katheter via de lies ingebracht in de a. femoralis tot de plaats van de trombus. Er zijn vervolgens verschillende technieken beschikbaar om de trombus te verwijderen.
Met vroegere technieken leidde endovasculaire behandeling weliswaar tot een hoger percentage rekanalisatie, maar dit had geen effect op de functionele uitkomst.
Het laatste decennium zijn de behandelingstechnieken veranderd. In 2015 werden er 5 RCT’s gepubliceerd waarin de effectiviteit en veiligheid van de nieuwe behandelingstechnieken met een zelfontplooiende stent werd onderzocht. Deze trials verschillen niet alleen qua behandelingstechniek van de eerder gepubliceerde trials, ze hanteren ook strengere inclusiecriteria. Zo werd voorafgaand aan de randomisatie een eventuele occlusie van een proximale intracraniële arterie bevestigd middels beeldvormend onderzoek (CTA of MRA). Dit werd in de oudere trials niet altijd gedaan.
Meer recent is gebleken dat bij het hanteren van nog strengere inclusiecriteria, waaronder de grootte van de penumbra ten opzichte van het infarct, endovasculaire behandeling geschikt kan zijn bij patiënten met een ernstig herseninfarct in het interval 6-24 uur na het ontstaan van de uitvalsverschijnselen.
Methoden
Voor het beantwoorden van deze vraag is gebruikgemaakt van hoofdstuk 3 van de Australian and New Zealand Clinical Guidelines for Stroke Management en van de module Endovasculaire trombectomie (EVT) bij herseninfarct van de richtlijn Herseninfarct en hersenbloeding van de Nederlandse Vereniging voor Neurologie.
Uitgangspunt voor dit detail zijn de bewijstabellen uit de Australische richtlijn, aangevuld met informatie uit de NVN-richtlijn. De NHG-werkgroep heeft de bewijstabellen en de conclusies uit beide richtlijnen besproken en heeft een aanbeveling geformuleerd.
Resultaten
Onderzoekskarakteristieken
Behandeling < 6 uur na het ontstaan van de verschijnselen
In 5 RCT’s werd endovasculaire behandeling volgens de nieuwe behandelingstechniek onderzocht bij volwassenen met een infarct als gevolg van een met CTA bewezen occlusie van de distale a. carotis interna, de proximale a. cerebri anterior of de a. cerebri media. Patiënten en behandelaars werden niet geblindeerd, de effectbeoordelaars wel.
In alle RCT’s werd endovasculaire behandeling (al dan niet in aanvulling op intraveneuze trombolyse) vergeleken met standaardbehandeling (al dan niet in aanvulling op intraveneuze trombolyse). In 1 RCT (EXTEND) kregen alle patiënten vooraf intraveneuze trombolyse. De endovasculaire behandeling werd gestart < 6 uur (3 RCT’s), < 8 uur (1 RCT) of < 12 uur (1 RCT) na het ontstaan van de uitvalsverschijnselen. In 3 RCT’s werden alleen patiënten geïncludeerd bij wie op een perfusiescan aanwijzingen waren gevonden voor mogelijk te redden hersenweefsel. Eén trial (MR CLEAN) werd in Nederland uitgevoerd.
In een meta-analyse van individuele patiëntendata (n = 1287) werden de gegevens van bovenstaande 5 RCT’s gepoold. Deze meta-analyse is gebruikt als uitgangspunt voor de bewijstabel.
In de interventiegroep waren voorafgaand aan de endovasculaire behandeling minder patiënten met intraveneuze trombolyse behandeld dan in de controlegroep (83 vs. 87%; p = 0,04). De behandelgroepen waren vergelijkbaar wat betreft de overige patiëntkarakteristieken, zoals ernst van uitval, lokalisatie van de occlusie en tijd tot start van intraveneuze trombolyse. Ook was er geen verschil wat betreft de uitgebreidheid van ischemische veranderingen op de CT-scan.
Na deze meta-analyse verschenen nog 1 grote RCT met vergelijkbare resultaten en 2 RCT’s die voortijdig gestopt waren en daarom kleine deelnemeraantallen hadden, maar ook met vergelijkbare resultaten. Omdat deze RCT’s de resultaten en de aanbevelingen niet zouden veranderen, zijn ze verder buiten beschouwing gelaten.
Behandeling 6-24 uur na het ontstaan van de verschijnselen
De bewijstabel is gebaseerd op 2 RCT’s naar endovasculaire behandeling bij patiënten tussen 6-16 uur (DEFUSE 3) of 6-24 uur (DAWN) na het ontstaan van de symptomen. DAWN includeerde 206 patiënten op basis van een mismatch tussen de ernst van de neurologische uitval en de infarctgrootte op perfusie-CT of MRI. Bij ernstige neurologische uitval en een relatief klein infarctvolume werd in deze trial verondersteld dat er sprake was van een grote penumbra. DEFUSE 3 maakte gebruik van een mismatch tussen de grootte van het infarct en dat van de penumbra op perfusie-CT, waarbij het totale ischemische gebied tenminste 1,8 × zo groot moest zijn als het infarct.
Beide RCT’s beperkten zich tot patiënten met een herseninfarct door een occlusie van de distale a. carotis interna of het M1-segment van de a. cerebri media, die vóór het herseninfarct geen beperkingen hadden (gemodificeerde rankinscore (mRS) 0 of 1) en bij inclusie een score op de National Institutes of Health Stroke Scale (NIHSS)hadden van ≥ 10 (DAWN) of ≥ 6 (DEFUSE 3). De patiënten hadden dus ernstige uitval bij een kleine infarctkern. Patiënten werden gerandomiseerd tussen wel of geen endovasculaire behandeling. De behandeling werd uitgevoerd met een stent retriever (DAWN) of elk gecertificeerd instrument (DEFUSE 3). Beide RCT’s zijn voortijdig beëindigd toen was aangetoond dat endovasculaire behandeling ook bij een termijn > 6 uur tot een grotere kans op een goed herstel leidde.
In 1 centrum dat deelnam aan DAWN bleek uit observationeel onderzoek dat ongeveer 3% van alle patiënten die zich presenteerden met een acuut herseninfarct voldeed aan de inclusiecriteria van DAWN of DEFUSE 3. Van de patiënten die zich presenteerden binnen 6-24 uur was dit ongeveer 9%.
Effectiviteit en bijwerkingen
Behandeling < 6 uur na het ontstaan van de verschijnselen
Zie tabel Endovasculaire behandeling < 6 uur na het ontstaan van de verschijnselen voor de samenvatting van de resultaten.
Behandeling 6-24 uur na het ontstaan van de verschijnselen
Zie tabel Endovasculaire behandeling 6-24 uur na het ontstaan van de verschijnselen voor de samenvatting van de resultaten. Het betreft geselecteerde patiënten met ernstige neurologische uitval bij een kleine infarctkern.
Conclusies
Behandeling < 6 uur na het ontstaan van de verschijnselen
- Endovasculaire behandeling leidt waarschijnlijk tot een grotere kans op functionele verbetering en functionele onafhankelijkheid dan standaardzorg (kwaliteit van bewijs redelijk).
- Er is mogelijk niet of nauwelijks verschil in het risico op sterfte en op een symptomatische intracraniële bloeding (kwaliteit van bewijs laag).
Behandeling 6-24 uur na het ontstaan van de verschijnselen (geselecteerde patiënten met ernstige neurologische uitval en een kleine infarctkern)
- Endovasculaire behandeling leidt waarschijnlijk tot een grotere kans op functionele onafhankelijkheid dan standaardzorg (kwaliteit van bewijs redelijk).
- Endovasculaire behandeling leidt mogelijk tot een kleinere kans op sterfte dan standaardzorg (kwaliteit van bewijs laag).
- Endovasculaire behandeling leidt mogelijk tot een hoger risico op een symptomatische intracraniële bloeding dan standaardzorg (kwaliteit van bewijs laag).
Van bewijs naar aanbeveling
Voor- en nadelen
Endovasculaire behandeling leidt bij geselecteerde patiënten met een herseninfarct als gevolg van een proximale occlusie in het stroomgebied van de carotiden tot een grotere kans op functionele onafhankelijkheid. Het risico op sterfte lijkt niet toe te nemen en neemt mogelijk af, terwijl het risico op het ontstaan van een symptomatische intracraniële bloeding niet of nauwelijks toeneemt.
Het bovenstaande geldt wanneer de behandeling wordt gestart < 6 uur na het ontstaan van de verschijnselen. Hoewel de effectiviteit afneemt met het verstrijken van de tijd, blijft het voordeel van de behandeling bestaan wanneer deze binnen 6-24 uur na het ontstaan van de verschijnselen gestart wordt, mits de patiënt voldoet aan strenge voorwaarden. De NVN heeft de volgende criteria geformuleerd:
- de behandeling kan worden gestart < 24 uur na begin van de verschijnselen
- NIHSS ≥ 10 vóór de behandeling
- infarctkern < 25 ml, bepaald met behulp van perfusie-CT of MRI
- grootte van de penumbra ≥ 80% van die van de infarctkern
Kwaliteit van bewijs
De kwaliteit van bewijs varieert van redelijk tot laag. Er is afgewaardeerd voor kans op vertekening en publicatiebias (commerciële sponsoring). Daarnaast is er voor de uitkomstmaten sterfte en intracraniële bloeding afgewaardeerd voor onnauwkeurigheid vanwege de brede betrouwbaarheidsintervallen en kleine aantallen gebeurtenissen.
Waarden en voorkeuren van patiënten
De werkgroep is van mening dat voor de meeste patiënten met een herseninfarct de grotere kans op functionele onafhankelijkheid zwaar weegt.
Kosten
De kosten van endovasculaire behandeling zijn hoog. De kosteneffectiviteit is niet onderzocht.
Aanvaardbaarheid
Endovasculaire behandeling is aanvaardbaar, zowel voor patiënten als voor behandelaars (neurologen, interventieradiologen).
Haalbaarheid
De endovasculaire behandeling van een herseninfarct is een complexe procedure, die uitgevoerd wordt door een daarvoor geschoolde interventieradioloog. Om voldoende expertise en 24-uurszorg te kunnen waarborgen is deze zorg in Nederland anno 2021 geconcentreerd in 19 ziekenhuizen (zie Intervention centers: MR CLEAN, geraadpleegd oktober 2021). Om vast te stellen of een patiënt voldoet aan de behandelcriteria, zal hij of zij beoordeeld moeten worden in een ziekenhuis waar met spoed perfusie-CT of MRI kan worden verricht. In de praktijk zullen patiënten in het dichtstbijzijnde ziekenhuis worden gediagnostiseerd en bij aanwezigheid van een proximale intracraniële arteriële occlusie worden doorgestuurd naar een interventiecentrum (afhankelijk van regionale afspraken).
Waarom deze aanbeveling?
Voor de meeste patiënten wegen de voordelen van een endovasculaire behandeling (grotere kans op functionele verbetering en onafhankelijkheid, en mogelijk kleinere kans op sterfte) zwaarder dan de nadelen (mogelijk grotere kans op een symptomatische intracraniële bloeding, met name bij behandeling 6-24 uur na het ontstaan van de uitvalsverschijnselen). Dit heeft geleid tot een sterke aanbeveling voor verwijzing voor endovasculaire behandeling.
Zowel het aantal patiënten dat in aanmerking komt voor de behandeling als de effectiviteit ervan nemen echter af met het verstrijken van de tijd. De selectiecriteria bij een klachtenduur van 6-24 uur zijn strenger dan de criteria bij een klachtenduur < 6 uur, waardoor een (veel) lager percentage patiënten voor de behandeling in aanmerking komt.
Intraveneuze trombolyse
De contra-indicaties zijn ontleend aan de Richtlijn Herseninfarct en hersenbloeding van de Nederlandse Vereniging voor Neurologie. Verzamel, indien mogelijk, informatie over de contra-indicaties voor intraveneuze trombolyse en endovasculaire behandeling.
Veel van de contra-indicaties zijn ter beoordeling aan de neuroloog en voor de huisartsgeneeskundige beoordeling niet relevant.
Contra-indicaties
- Intracraniële bloeding (inclusief hemorragische transformatie van een infarct) bij beeldvormend onderzoek
- Matig of ernstig schedelhersenletsel in voorgaande 2 maanden
- Herseninfarct in de voorgaande 6 weken (in verband met de kans op hemorragische transformatie)
- Intracraniële bloeding in voorgaande 3 maanden
- Bloeding in maag-darmkanaal of urinewegen in voorgaande twee weken
- Grote chirurgische ingreep in voorgaande twee weken
- Bloeddruk systolisch ≥ 185 mmHg of diastolisch ≥ 110 mmHg (eventueel in de tweede lijn medicamenteus te verlagen)
- Actieve bloeding of traumatisch letsel (bijvoorbeeld fractuur)
- Gebruik van een vitamine K-antagonist en INR > 1,7
- Gebruik van een direct werkend oraal anticoagulantium (DOAC), tenzij laatste inname > 24 uur geleden én eGFR ≥ 60 ml/min/1,73 m2. Bij twijfel over het gebruik van een DOAC kan een therapeutische spiegel worden uitgesloten door bepaling van bepaalde stollingsparameters. Alleen bij dabigatran kan 10 minuten na couperen met intraveneus idarucizumab trombolyse worden toegepast
- Gebruik van een laagmoleculairgewicht heparine (LMWH) in therapeutische dosering, tenzij > 4 uur geleden een subcutane gift en normale anti-factor-Xa-spiegel.
- Trombocytengetal < 90 × 109/L
- Serumglucose < 2,7 mmol/L als mogelijke oorzaak van de verschijnselen, of serumglucose > 22,0 mmol/L
Relatieve contra-indicatie: epileptisch insult
Bij circa 5,7-7,7% van de patiënten met een herseninfarct gaat het ontstaan van uitvalsverschijnselen gepaard met een insult. Ook een epileptisch insult, dus zonder herseninfarct, kan echter leiden tot een voorbijgaande postictale parese (toddparese). In de praktijk kan het lastig zijn om uitvalsverschijnselen als gevolg van een herseninfarct te onderscheiden van een postictale parese. Een angio- of perfusie-CT of -MRI kan hierbij behulpzaam zijn.
Geen contra-indicaties
- Gebruik van een trombocytenaggregatieremmer
- Menstruatie
- Gebruik van LMWH in profylactische dosering
- Dissectie van de extracraniële a. carotis of a. vertebralis
- Vroege ischemische veranderingen op CT zonder contrastmiddel, die niet suggereren dat het infarct ouder is dan 4,5 uur
- Ongeruptureerd intracranieel aneurysma of arterioveneuze of caverneuze malformatie.
- Recent acuut myocardinfarct (de neuroloog overlegt zo nodig met de cardioloog)
Endovasculaire behandeling
De informatie hierna is ontleend aan de Richtlijn Herseninfarct en hersenbloeding van de Nederlandse Vereniging voor Neurologie.
Contra-indicaties
- Intracraniële bloeding (inclusief hemorragische transformatie van een infarct) bij beeldvormend onderzoek
- Herseninfarct als gevolg van occlusie van de a. basilaris in het vertebrobasilaire stroomgebied
- De uitvalsverschijnselen zijn > 24 uur geleden ontstaan
Relatieve contra-indicatie
Infarct in het aangedane stroomgebied in de voorgaande 6 weken.
Uitvalsverschijnselen aanwezig, ≥ 12 uur geleden ontstaan (U2, < 1 uur)
Naar Samenvatting ›- Leg een spoedvisite af of laat de patiënt met geringe uitvalsverschijnselen direct naar de praktijk komen (U2-urgentie, binnen 1 uur).
- Overleg, indien op basis van anamnese en lichamelijk onderzoek een beroerte aannemelijk is, met de neuroloog over de urgentie waarmee patiënt verwezen moet worden (A1- of A2-indicatie, oa. afhankelijk van de duur en ernst van de uitvalsverschijnselen).
- Start geen trombocytenaggregatieremmer of antihypertensivum.
Toelichting
- Tussen 12 en 24 uur na het ontstaan van de verschijnselen komen patiënten slechts bij uitzondering voor endovasculaire behandeling in aanmerking.
- Een aanzienlijk deel van de patiënten die direct, zonder beoordeling door een huisarts, ingestuurd worden wegens vermoeden van een beroerte blijkt uiteindelijk geen beroerte te hebben.
- Na de termijn van 12 uur is het daarom zinvol om eerst de uitvalsverschijnselen te objectiveren en te beoordelen of een beroerte waarschijnlijk is, alvorens de patiënt te verwijzen.
Uitvalsverschijnselen aanwezig: infauste prognose of wens thuis te blijven (U2, < 1 uur)
Naar Samenvatting ›Patiënten met:
- ernstige comorbiditeit
- terminale patiënten
- ernstige uitvalsverschijnselen met een infauste prognose
- uitdrukkelijke wens om thuis te blijven
Beleid
- Leg een spoedvisite af (U2-urgentie, binnen 1 uur).
- Opname op een stroke unit is effectief, onafhankelijk van de leeftijd van de patiënt of de ernst van de uitvalsverschijnselen. Daarnaast hebben patiënten met ernstige uitvalsverschijnselen complexe zorg nodig, zeker in de acute fase. Verwijzing naar de neuroloog heeft dan ook bij het merendeel van de patiënten de voorkeur.
- In uitzonderlijke gevallen, bij zodanig massale uitvalsverschijnselen dat de prognose op korte termijn infaust lijkt, kan worden overwogen de patiënt niet te verwijzen.
- Een zeer slechte uitgangssituatie door omvangrijke comorbiditeit kan aanleiding zijn om af te zien van een opname.
- Zie voor een hulpmiddel bij de besluitvorming over doorbehandelen na een ernstige beroerte: behandelbeleidbijberoerte.nl.
- Houd bij de besluitvorming over opname rekening met de wens van de patiënt en diens familie. Of de patiënt thuis kan blijven, hangt af van de mogelijkheden van de omgeving (partner, mantelzorg, thuiszorg). Zie Aandachtspunten indien de patiënt thuis blijft.
Aandachtspunten indien de patiënt thuis blijft
Patiënten die op verzoek thuis blijven
- Start in de acute fase, in overleg met de neuroloog, secundaire preventie en revalidatie, tenzij de prognose infaust lijkt.
- Laat een logopedist de slikfunctie onderzoeken vóórdat de patiënt iets eet of drinkt. Indien dit praktisch niet haalbaar is, kan een indruk van de slikfunctie worden gekregen door de patiënt in zittende houding enkele slokjes water te laten drinken.
- Bij aanwijzingen voor slikstoornissen (hoesten, stemveranderingen, water uit de mond laten lopen) mag de patiënt uitsluitend eten en drinken in de (door een logopedist geadviseerde) veilige consistenties, tot de slikfunctie (grotendeels) hersteld is, in verband met de kans op aspiratie en aspiratiepneumonie.
- Plaats bij onvoldoende intake door slikstoornissen (en de wens tot doorbehandelen) een neussonde of laat deze plaatsen, bijvoorbeeld door een gespecialiseerde wijkverpleegkundige. Consulteer de diëtist voor begeleiding bij sondevoeding.
- Overleg zo nodig met de apotheker over hoe de medicatie toe te dienen bij plaatsing van een neussonde.
- Coördineer zorg en revalidatie conform de regionale afspraken. Overleg regelmatig met de betrokken eerstelijnshulpverleners (thuiszorg, fysiotherapeut, ergotherapeut, logopedist, diëtist).
Patiënten met een infauste prognose
Zie voor zorgaspecten in de palliatieve fase (zoals decubituspreventie) de richtlijnen van het Integraal Kankercentrum Nederland op pallialine.nl.
Uitvalsverschijnselen volledig verdwenen (U3, binnen enkele uren)
Naar Samenvatting ›- Laat de patiënt naar de praktijk komen of leg een visite af, in ieder geval binnen enkele uren (U3-urgentie).
- Instrueer de patiënt om direct opnieuw contact met de huisarts op te nemen indien de verschijnselen in de tussentijd recidiveren.
- Overleg direct met de neuroloog, indien u na onderzoek de werkdiagnose TIA stelt, over de gewenste termijn van beoordeling door de neuroloog (bij voorkeur binnen 24 uur).
- Bij patiënten met een recidief TIA die reeds onderzocht zijn: overleg met de neuroloog over de noodzaak tot herbeoordeling.
- Start acetylsalicylzuur, tenzij de neuroloog de patiënt direct beoordeelt (zie tabel 7 en Trombocytenaggregatieremmers in de acute fase bij TIA)
Trombocytenaggregatieremmers in de acute fase bij TIA
- Start acetylsalicylzuur, tenzij de neuroloog de patiënt direct beoordeelt. Continueer dit tot de neuroloog de patiënt beoordeelt (zie tabel 7).
- De neuroloog kan adviseren i.p.v. acetylsalicylzuur te starten met clopidogrel eenmalig 300 mg gevolgd door 1 dd 75 mg. Acetylsalicylzuur heeft echter de voorkeur op grond van:
- de effectiviteit van clopidogrel in de acute fase van een TIA of herseninfarct is (in tegenstelling tot acetylsalicylzuur) niet onderzocht.
- de plaatsbepaling van farmacogenetisch onderzoek voorafgaand aan start van clopidogrel is onderwerp van onderzoek (er zijn aanwijzingen dat bij een deel van de patiënten clopidogrel niet of minder werkzaam is).
- Start geen orale anticoagulantia bij verdenking atriumfibrilleren of andere cardiale emboliebron als oorzaak van de TIA, omdat eerst een intracerebrale bloeding als oorzaak van de uitvalsverschijnselen moet worden uitgesloten.
- Continueer trombocytenaggregatieremmers of orale anticoagulantia in ongewijzigde dosering indien de patiënt deze reeds gebruikt.
|
Geneesmiddel |
Dosering en contra-indicaties |
Werkingssnelheid en duur |
|---|---|---|
|
Acetylsalicylzuur, wateroplosbare (dispergeerbare) tablet 80 mg |
1 dd 160 mg (in water opgelost) Contra-indicaties: actief peptisch ulcus, actieve maag-darmbloeding, overgevoeligheid voor salicylaten |
Snelheid: na 30-60 minuten Duur: 7-10 dagen |
Het effect van toediening van acetylsalicylzuur in de acute fase van een herseninfarct werd onderzocht in twee trials: de IST en de CAST. In elk van deze onderzoeken werden circa 20.000 patiënten geïncludeerd die bij randomisatie voor acetylsalicylzuur binnen 48 uur na het begin van de uitvalsverschijnselen 300 mg (IST) of 160 mg (CAST) per dag kregen. In het CAST-onderzoek werd deze dosering gedurende vier weken of tot ontslag gegeven, in het IST-onderzoek gedurende veertien dagen of tot ontslag. Het CAST-onderzoek was geblindeerd en placebogecontroleerd, de IST had een multifactoriële niet-geblindeerde opzet waarbij een deel van de patiënten ook heparine kreeg.
Uit een meta-analyse over deze twee onderzoeken blijkt dat gebruik van acetylsalicylzuur in de acute fase van het herseninfarct na een follow-up van veertien dagen (IST) of een maand (CAST) resulteert in een geringe, maar significante daling van 1,2% van het aantal overleden of afhankelijke patiënten (dit is 12 per 1000 behandelde patiënten, NNT 83). Het effect berust vooral op een vermindering van het aantal recidief infarcten dat slechts in beperkte mate teniet wordt gedaan door enkele extra optredende hemorragische infarcten. Een tweetal andere meta-analyses, waarin de gegevens vrijwel volledig op deze twee onderzoeken berusten, komen tot overeenkomstige conclusies. In zowel de IST als de CAST ondergingen de meeste patiënten vóór randomisatie een CT-scan ter uitsluiting van een hersenbloeding. Indien een CT-scan voornamelijk om organisatorische redenen niet bijtijds gerealiseerd kon worden, kon de patiënt toch worden geïncludeerd als het klinisch beeld een herseninfarct deed vermoeden. Twee procent van deze patiënten bleek uiteindelijk een hersenbloeding te hebben. Bij deze patiënten waren er geen aanwijzingen voor een slechtere uitkomst. Onderzoek naar het effect van zeer snelle toediening van acetylsalicylzuur na het ontstaan van uitvalsverschijnselen werd niet verricht. Er bestaat geen onderzoek naar de optimale dosering acetylsalicylzuur in de acute fase. De dosering van 160 tot 300 mg die in de praktijk wordt toegepast komt overeen met de dosering in de hiervoor besproken trials. De dosering van 160 mg die in deze richtlijn geadviseerd wordt, komt overeen met de laagste dosering die gebruikt werd in de hiervoor besproken trials. De optimale duur waarop deze dosering gecontinueerd dient te worden in de acute fase, voordat deze naar 80 mg per dag verlaagd wordt, is niet onderzocht. In de onderzoeken bedroeg de duur van behandeling twee (IST) en vier weken (CAST). Met een eenmalige oplaaddosering van 160 mg is de plaatjesaggregatieremming echter al maximaal. In de praktijk worden er in de tweede lijn verschillende richtlijnen gehanteerd. De behandeling met de hogere dosis (160 tot 300 mg) wordt ofwel eenmalig toegediend, ofwel gecontinueerd tot ontslag naar huis of gedurende de eerste veertien dagen.
Conclusie
Het advies is zo snel mogelijk behandeling met acetylsalicylzuur te starten bij een herseninfarct, nadat een hersenbloeding middels beeldvormend onderzoek is uitgesloten, tenzij er behandeling met intraveneuze trombolyse plaatsvindt. Bij patiënten met een TIA of met spontaan sterk verbeterende uitvalsverschijnselen bij wie niet binnen een paar uur een CT-scan kan worden verricht, kan de huisarts ‘blind’ starten met acetylsalicylzuur van 160 mg eenmaal daags. Deze dosering wordt gecontinueerd tot het consult met de neuroloog. De neuroloog stelt het vervolgbeleid vast.
Samenvatting van bewijs
Uitgangsvraag
Is clopidogrel in oplaaddosering (vergeleken met acetylsalicylzuur 1 dd 160 mg) aan te bevelen bij patiënten met een TIA die niet direct door een neuroloog kunnen worden gezien? Zie de PICO- tabel.
|
Patiënten |
Patiënten met een TIA die niet direct door een neuroloog kunnen worden beoordeeld |
|---|---|
|
Interventie |
Clopidogrel in oplaaddosering |
|
Vergelijking |
Acetylsalicylzuur 1 dd 160 mg (of 320 mg) |
|
Uitkomstmaten (follow-upduur 3 maanden) |
Cruciaal
|
Achtergrond
De Module Plaatjesaggregatieremmers na TIA of herseninfarct van de NVN-richtlijn Herseninfarct en hersenbloeding beveelt aan om patiënten na een TIA of herseninfarct te behandelen met trombocytenaggregatieremmers. In principe wordt deze behandeling door de neuroloog zo snel mogelijk opgestart (bij behandeling met intraveneuze trombolyse pas na 24 uur). Bij een patiënt met een TIA die niet dezelfde dag door een neuroloog kan worden beoordeeld kan de huisarts ‘blind’ starten met een oplaaddosering. In de acute fase van een TIA of herseninfarct is acetylsalicylzuur een effectieve behandeling. Of clopidogrel een geschikt alternatief is, is niet bekend.
Methoden
Er is een systematische literatuurzoekactie naar systematische reviews en RCT’s uitgevoerd in PubMed in april 2021, met een update in februari 2022.
Resultaten
Resultaat zoekactie
De zoekactie leverde geen geschikte systematische review of RCT op. De update in februari 2022 leverde geen RCT’s op.
Onderzoekskarakteristieken
Er is geen onderzoek gevonden dat antwoord gaf op de uitgangsvraag.
Effectiviteit en bijwerkingen
Er is geen onderzoek gevonden dat antwoord gaf op de uitgangsvraag.
Conclusies
Er is geen onderzoek gevonden dat antwoord gaf op de uitgangsvraag.
Van bewijs naar aanbeveling
Voor- en nadelen
Er is geen direct vergelijkend onderzoek beschikbaar tussen acetylsalicylzuur en clopidogrel in de acute fase van een TIA. De effectiviteit van acetylsalicylzuur is onderzocht in de acute fase van een TIA en herseninfarct, die van clopidogrel niet.
Na de acute fase is clopidogrel een geschikt alternatief voor de behandeling met acetylsalicylzuur in combinatie met dipyridamol; theoretisch is het waarschijnlijk dat een oplaaddosering clopidogrel ook in de acute fase direct werkzaam is.
Kwaliteit van bewijs
Niet van toepassing.
Waarden en voorkeuren van patiënten
Geen bijzonderheden.
Kosten
De kosten van een oplaaddosering acetylsalicylzuur (eenmalig 160 mg) bedragen € 0,06 (1 tablet van 80 mg kost € 0,03). De kosten van een oplaaddosis clopidogrel (eenmalig 300 mg) bedragen € 0,20 (1 tablet van 75 mg kost € 0,05) (Medicijnkosten.nl, geraadpleegd 6 december 2021).
Aanvaardbaarheid
Zowel behandeling met acetylsalicylzuur als met clopidogrel is aanvaardbaar voor patiënten en huisartsen. De NVN-richtlijn Herseninfarct en hersenbloeding beveelt farmacogenetisch onderzoek voorafgaand aan de behandeling met clopidogrel momenteel niet aan. De plaatsbepaling van farmacogenetisch onderzoek is echter onderwerp van onderzoek. Mogelijk is clopidogrel bij een deel van de patiënten niet of minder effectief (zie detail Farmacogenetisch onderzoek bij clopidogrel).
Haalbaarheid
Zowel acetylsalicylzuur als clopidogrel zijn goed verkrijgbaar in Nederland. De huisarts heeft met het voorschrijven van beide middelen veel ervaring. De huisarts heeft standaard de beschikking over acetylsalicylzuur in de spoedkoffer.
Waarom deze aanbeveling?
De effectiviteit van acetylsalicylzuur in de acute fase van een TIA is onderzocht. Daarnaast beschikt de huisarts over dit middel in de spoedkoffer. Op grond hiervan is acetylsalicylzuur eerste keus in de acute fase van een TIA.
Hoewel clopidogrel in de acute fase niet is onderzocht, is het waarschijnlijk dat ook dit middel direct werkzaam is als met een oplaaddosering wordt gestart (300 mg). Mogelijk is clopidogrel echter bij een deel van de patiënten niet of minder effectief (zie detail Farmacogenetisch onderzoek bij clopidogrel).
In de praktijk is het gangbaar dat neurologen clopidogrel adviseren bij patiënten met een TIA in de acute fase.
Op grond van bovenstaande argumenten heeft acetylsalicylzuur 1 dd 160 mg in de acute fase van een TIA in de huisartsenpraktijk echter de voorkeur.
ABCD²-score
Naar Samenvatting ›We bevelen toepassing van de ABCD2-score door huisartsen niet aan.
Achtergrond
De ABCD2-score (tabel 8) is een predictiemodel waarmee het risico op een herseninfarct gedurende de eerste dagen na het optreden van een TIA ingeschat kan worden. Dit predictiemodel werd gevalideerd in vier onafhankelijke cohorten (n = 2893), waaronder één eerstelijnscohort. In tabel 9 staan de risico’s voor het optreden van een herseninfarct aan de hand van de ABCD2-score samengevat. Bij de termijnbepaling waarop een patiënt met een TIA door de neuroloog beoordeeld moet worden, kan dit risico worden meegewogen. Er zijn neurologen die ervoor pleiten om patiënten met een hoge risicoscore kortdurend ter observatie op te nemen op een stroke unit.
|
Klinisch kenmerk |
Punten |
|---|---|
|
A Leeftijd |
> 60 jaar: 1 |
|
B Bloeddruk |
Systolisch > 140 mmHg of diastolisch > 90 mmHg: 1 |
|
C Symptomen (clinical features) |
Spraakstoornis zonder unilaterale zwakte: 1; unilaterale zwakte: 2 |
|
D Duur |
10-59 minuten: 1; ≥ 1 uur: 2 |
|
D Diabetes mellitus |
Diabetes mellitus: 1 |
|
ABCD2-score |
Risico op een herseninfarct binnen 2 dagen |
Risico op een herseninfarct binnen 7 dagen |
|---|---|---|
|
0-3 (laag) |
1% |
1,2% |
|
4-5 (gemiddeld) |
4,1% |
5,9% |
|
6-7 (hoog) |
8,1% |
11,7% |
Resultaten
I. Bron
Systematische review en gepoolde analyse over 18 validatie(cohort)onderzoeken (n = 9436), zowel retrospectief als prospectief. Het betreft 4 onderzoeken in eerstelijnspopulaties, de overige onderzoeken zijn uitgevoerd in de tweede lijn. Voor elk cohort werd het risico op een herseninfarct en de bijbehorende sensitiviteit en specificiteit berekend voor de afkapwaarden van de intervallen die werden gerapporteerd. De prognostische waarde van de ABCD2-score voor de kans op beroerte zeven dagen na een TIA werd beschreven aan de hand van de gepoolde oppervlakte onder de ROC-curve (AUC).
Kwaliteit
Er is sprake van significante heterogeniteit tussen de onderzoeken, vooral als gevolg van verschillen in methodologie.
Effect
De ABCD2-score voorspelt de kans op het optreden van een herseninfarct binnen zeven dagen matig tot redelijk: de gepoolde AUC voor de risicoschatting binnen zeven dagen bedraagt voor de ABCD2-score 0,72 (95%-BI 0,63 tot 0,80).
II. Bron
Systematische review en meta-analyse over zestien validatieonderzoeken (n = 8482). Twee retrospectieve onderzoeken die in de eerstelijnspopulatie werden verricht, werden geïncludeerd, de overige onderzoeken werden verricht binnen de tweede lijn. Het op basis van de ABCD2-score voorspelde aantal patiënten met een herseninfarct (op basis van de derivatiestudie) werd vergeleken met het in de validatieonderzoeken geobserveerde aantal patiënten met een herseninfarct na zeven en na negentig dagen. De gepoolde resultaten werden gestratificeerd naar risicogroep: laag (0 tot 3 punten), gemiddeld (4 tot 5 punten) en hoog (6 tot 7 punten) en uitgedrukt in relatieve risico’s (RR > 1: overschatting van het risico op een herseninfarct; RR < 1: onderschatting van het risico op een herseninfarct).
Kwaliteit
Er is sprake van significante heterogeniteit tussen de onderzoeken, vooral als gevolg van methodologische verschillen.
Effect
Bij alle drie de risicogroepen voorspelt de ABCD2-score de kans op het optreden van een herseninfarct binnen zeven dagen redelijk goed: lage score RR 0,86 (95%-BI 0,47 tot 1,58), gemiddelde score RR 0,99 (95%-BI 0,67 tot 1,47), hoge score RR 0,84 (95%-BI 0,6 tot 1,19). Na negentig dagen was sprake van een trend naar overschatting van het risico op een herseninfarct bij toepassing van de ABCD2-score: lage score RR 1,31 (95%-BI 0,77 tot 2,23); gemiddelde score 1,64 (95%-BI 0,98 tot 2,77); hoge score 1,40 (95%-BI 0,81 tot 2,40).
III. Bron
Een meta-analyse en meta-regressieanalyse om de accuraatheid van de voorspelling van het risico op beroerte twee, zeven en negentig dagen na een TIA, middels de ABCD2 -score, te beoordelen (33 onderzoeken, n = 16.070).
Kwaliteit
Ook abstracts voor conferenties werden geïncludeerd. Er werd geen onderzoek geïncludeerd waarin de waarde van de ABCD2-score bij beoordeling door huisartsen werd beoordeeld. Er was sprake van heterogeniteit (I2 > 50) bij het poolen voor de bepaling van de positieve likelihood ratio, dit bleek bij de meta-regressieanalyse grotendeels verklaard te worden door het specialisme van de arts die de diagnose TIA stelde (53,1%) en de methode van diagnostiek van beroerte (mondeling of door statusonderzoek) (45,7%).
Effect
Bij een onderverdeling van de ABCD2-score in laag risico (score 0 tot 3) en hoog risico (score 4 tot 7) bedraagt de sensitiviteit van de ABCD2-score voor het voorspellen van het risico op een herseninfarct binnen zeven dagen na het optreden van een TIA 0,89 (95%-BI 0,87 tot 0,91), de specificiteit 0,34 (95%-BI 0,33 tot 0,35), de positief voorspellende waarde 0,08 (95%-BI 0,07 tot 0,09), de negatief voorspellende waarde 0,98 (95%-BI 0,98 tot 0,98), de positieve likelihood ratio 1,43 (95%-BI 1,33 tot 1,54), de negatieve likelihood ratio 0,40 (95%-BI 0,33 tot 0,50) en de AUC 0,70 (95%-BI 0,62 tot 0,78). De resultaten na twee en negentig dagen waren vergelijkbaar. De positieve likelihood ratio was hoger indien de neuroloog de diagnose TIA stelde (1,51; 95%-BI 1,37 tot 1,66) dan wanneer de eerstehulparts dat deed (1,25; 95%-BI 1,19 tot 1,31).
Conclusie
De bewijskracht voor een goede voorspellende waarde van de ABCD2-score voor het optreden van een herseninfarct na een TIA bij beoordeling door neurologen is redelijk. Toepassing van de score in een eerstelijnspopulatie door de huisarts is beperkt onderzocht.
Van bewijs naar aanbeveling
Toepassing van de ABCD2-score door neurologen is voldoende gevalideerd. Uitgebreid onderzoek naar toepassing van de score in een eerstelijnspopulatie door huisartsen (bij voorkeur in de Nederlandse setting) is noodzakelijk voordat routinematige toepassing geadviseerd kan worden. Daarnaast is het nog onvoldoende duidelijk of routinematige toepassing van de score de prognose van de patiënt verbetert en of het opnemen van de patiënt ter observatie in het ziekenhuis bij een hoge score de uiteindelijke prognose van de patiënt daadwerkelijk verbetert. Ook bestaat er nog geen landelijk opnamebeleid dat gebaseerd is op de ABCD2-score.
Richtlijnen beleid na ontslag
Naar Samenvatting ›Overdracht van tweede lijn naar huisarts
Naar Samenvatting ›- Op de stroke unit ligt het accent, na diagnostiek en behandeling, op het voorkomen van complicaties zoals trombose en aspiratiepneumonie. Snelle mobilisatie en start van secundaire preventie is van groot belang.
- In een multidisciplinair overleg wordt besproken of er een indicatie bestaat voor verdere revalidatie na ontslag uit het ziekenhuis (zie Behandelingsmogelijkheden).
- De coördinatie van het revalidatietraject vindt over het algemeen plaats vanuit de tweede lijn, tenzij dit regionaal anders is afgesproken (zie Ketenzorg).
- De neuroloog zorgt bij ontslag van de stroke unit direct (uiterlijk binnen 24 uur) voor een ontslagbrief en bij voorkeur ook voor telefonische overdracht aan de huisarts.
- De aard en intensiteit van de nazorg hangt, direct na ontslag uit het ziekenhuis, af van de toestand van de patiënt (aard en ernst van de uitvalsverschijnselen, complicaties) en van diens prognose.
- Het verdient aanbeveling om contact op te nemen met de patiënt binnen enkele dagen na het ontslag uit een ziekenhuis of revalidatie-instelling; leg een visite af of nodig de patiënt uit op het spreekuur.
Aandachtspunten
Naar Samenvatting ›Besteed tijdens de controles, afhankelijk van de fase waarin de patiënt verkeert, de behandeling die de patiënt elders krijgt en de aard en ernst van eventuele uitvalsverschijnselen, aandacht aan de onderstaande aspecten. Betrek daarbij ook, indien mogelijk, de partner/mantelzorger. Ook na een TIA of minor stroke is aandacht voor onderstaande aspecten van belang.
De genoemde punten voor de inventarisatie van de zorgbehoefte zijn gebaseerd op de verschillende domeinen van het SAMPC-model (of SFMPC-model) ((S)omatisch, (A) ctiviteiten in het dagelijks leven, (M)aatschappelijk functioneren, (M)antelzorg, (P)sychisch functioneren, (C)ommunicatie/waarneming). Indien alle punten van dit model worden geïnventariseerd wordt er een goed overzicht verkregen van de problemen en mogelijkheden op de verschillende terreinen. Op basis hiervan kan zo nodig een zorgplan worden opgesteld.
Behandeling
Naar Samenvatting ›- Inventariseer het door de neuroloog, revalidatiearts of specialist ouderengeneeskunde ingezette beleid.
- Zet de secundaire preventie voort:
- inventariseer leefstijl en medicatie (therapietrouw, problemen met gebruik, mogelijke bijwerkingen)
- wees alert op aanwijzingen voor (paroxismaal) atriumfibrilleren (zie NHG-Standaard Atriumfibrilleren).
Beperkingen
- Inventariseer en vervolg de functionele beperkingen (zie Barthelindex).
- Beoordeel beperkingen in de communicatie en waarneming, vooral bij hemianopsie, afasie en/of dysartrie. Verwijs de patiënt zo nodig naar een logopedist, en/of specialist ouderengeneeskunde of revalidatiearts.
- Beoordeel of sprake is van (dreigende) contracturen of spasticiteit. Verwijs de patiënt zo nodig naar de revalidatiearts.
Barthelindex
Naar Samenvatting ›Overweeg de barthelindex te gebruiken voor het vervolgen van de beperkingen in het dagelijks functioneren (zie tabel 10). Het advies is om de index na 1 week, 3 maanden en 6 maanden af te nemen, tenzij dit in het kader van het revalidatieproces al elders gebeurt.
De barthelindex geeft aan in hoeverre de patiënt zelfredzaam is wat betreft de algemene dagelijkse levensverrichtingen (ADL). De betrouwbaarheid en validiteit van de barthelindex zijn goed.
In vergelijking tot andere meetinstrumenten, zoals de gemodificeerde rankinscore (mRS) en de Functional Independence Measure (FIM), geniet de barthelindex de voorkeur op basis van de praktische toepasbaarheid (de index is snel en eenvoudig af te nemen) en betrouwbaarheid. De voornaamste beperking is het zogeheten plafondeffect. Aangezien het instrument alleen eenvoudige activiteiten meet, garandeert een maximale score niet dat patiënten, hoewel ze ADL-zelfstandig zijn, volledig zonder beperkingen zijn bij complexere activiteiten. Daarnaast zijn het bestaan van afasie, cognitieve stoornissen, visusstoornissen en pijn niet in de scorelijst betrokken.
|
Item |
Waarde |
Score |
|---|---|---|
|
Ontlasting |
Incontinent |
0 |
|
|
Soms incontinent |
1 |
|
|
Continent |
2 |
|
Urine |
Incontinent/katheter |
0 |
|
|
Soms incontinent |
1 |
|
|
Continent |
2 |
|
Persoonlijke hygiëne |
Hulpbehoevend |
0 |
|
|
Zelfstandig in staat tot verzorging gelaat, haren, tanden, scheren |
1 |
|
Toiletbezoek |
Hulpbehoevend |
0 |
|
|
Weinig hulp nodig |
1 |
|
|
Zelfstandig |
2 |
|
Baden |
Hulpbehoevend |
0 |
|
|
Zelfstandig |
1 |
|
Eten |
Hulpbehoevend |
0 |
|
|
Hulp, bijvoorbeeld bij smeren of snijden |
1 |
|
|
Zelfstandig |
2 |
|
Van bed naar stoel |
Niet toe in staat |
0 |
|
|
Veel hulp nodig, kan zitten |
1 |
|
|
Weinig hulp (verbaal/lichamelijk)* |
2 |
|
|
Zelfstandig |
3 |
|
Lopen |
Niet toe in staat |
0 |
|
|
Zelfstandig in rolstoel bewegen |
1 |
|
|
Lopen met hulp (verbaal/lichamelijk) |
2 |
|
|
Zelfstandig |
3 |
|
Aankleden |
Hulpbehoevend |
0 |
|
|
Gedeeltelijk mogelijk |
1 |
|
|
Zelfstandig (inclusief knopen, rits, veters) |
2 |
|
Traplopen |
Niet toe in staat |
0 |
|
|
Met hulp (verbaal/lichamelijk)* |
1 |
|
|
Zelfstandig |
2 |
|
* De hulp kan zowel bestaan uit verbale aanmoediging als uit fysieke ondersteuning. Maximale score na optelling per item: 20 punten. Interpretatie: |
||
Neuropsychologisch
Naar Samenvatting ›- Beoordeel of er aanwijzingen zijn voor een depressie of angststoornis. Soms komen psychische klachten pas weken tot maanden na de beroerte tot uiting. Ook na een TIA of minor stroke worden deze klachten beschreven.
- Overweeg een antidepressivum bij een angststoornis en/of depressie met ernstig sociaal disfunctioneren en/of grote lijdensdruk (zie NHG-Standaard Depressie en NHG-Standaard Angst)
- Informeer naar het bestaan van vermoeidheid. Overweeg verwijzing naar een ergotherapeut of revalidatiearts bij ernstige vermoeidheid.
- Wees alert op cognitieve stoornissen, vooral bij ouderen. Let op:
- emotionaliteit en/of onverschilligheid
- ontplooiing van initiatieven
- vermogen tot het opslaan van nieuwe informatie en het uitvoeren van verschillende taken tegelijkertijd
- besef van tijd, plaats, ruimte of persoon
- Verricht diagnostiek volgens de NHG-Standaard Dementie bij tekenen van een cognitieve stoornis.
- Verwijs bij aanhoudende onduidelijkheid over het bestaan en de aard van cognitieve stoornissen naar een neuropsycholoog (in overleg met neuroloog en/of revalidatiearts).
- Overweeg cognitieve revalidatie (ergotherapeut, ziekenhuis, revalidatie-instelling of geriatrische revalidatiezorg) na een herseninfarct of hersenbloeding bij patiënten met cognitieve stoornissen, om hen te leren omgaan met (blijvende) cognitieve gevolgen in het dagelijks leven. Overleg met neuroloog, specialist ouderengeneeskunde of revalidatiearts.
MoCA
Naar Samenvatting ›We bevelen de Montreal Cognitive Assessment (MoCA) niet aan voor de diagnostiek van cognitieve stoornissen na een beroerte.
- Op de stroke unit wordt in principe bij iedere patiënt in de acute fase een MoCA en zo mogelijk ook een kort neuropsychologisch onderzoek (NPO) gedaan.
- Ook na de acute fase is het van belang om alert te blijven op het bestaan van cognitieve stoornissen, zeker als een patiënt hier nog niet op is onderzocht en bij oudere patiënten. Dit geldt ook voor patiënten die een minor stroke of TIA hebben doorgemaakt.
- Op grond van het beschreven onderzoek, met aanzienlijke methodologische beperkingen, lijken er geen grote verschillen te zijn in de diagnostische accuratesse van de MMSE en de MoCA, hoewel de kwaliteit van bewijs zeer laag is.
- In de NHG-Standaard Dementie wordt een combinatie van de MMSE en de kloktekentest aanbevolen. De kloktekentest onderzoekt enkele uitvoerende taken die niet in de MMSE worden onderzocht. Naar verwachting is de sensitiviteit van de combinatie MMSE en kloktekentest hoger dan die van de MMSE alleen.
- Er is geen bewijs dat de MoCA in een eerstelijnspopulatie met een beroerte beter is dan de MMSE (en kloktekentest). Andere nadelen van de MoCA:
- de huisarts heeft geen ervaring met het afnemen
- vooral geschikt voor patiënten met een hoger opleidingsniveau
- ontbreken van consensus over de afkapwaarde (ook de NVN-richtlijn Herseninfarct en hersenbloeding noemt geen afkapwaarde voor de MoCA)
- Op grond van deze argumenten adviseert de werkgroep om bij tekenen van cognitieve stoornissen na een herseninfarct of hersenbloeding onderzoek hiernaar te verrichten volgens de NHG-Standaard Dementie. Als screeningsinstrument in de chronische fase zijn een MMSE in combinatie met een kloktekentest naar verwachting voldoende betrouwbaar in de eerste lijn. We bevelen de MoCA niet aan voor de diagnostiek van cognitieve stoornissen na een beroerte.
- Verwijs bij aanhoudende onduidelijkheid over het bestaan en de aard van cognitieve stoornissen, naar een neuropsycholoog.
- Bij cognitieve stoornissen na een herseninfarct of hersenbloeding kan cognitieve revalidatie (ziekenhuis, ergotherapeut, revalidatie-instelling of geriatrische revalidatiezorg) worden overwogen met als doel patiënten te leren omgaan met (blijvende) cognitieve gevolgen in het dagelijks leven. Overleg in dit geval met de neuroloog en/of revalidatiearts.
Uitgangsvraag
Is de Montreal Cognitive Assessment (MoCA) vergeleken met MMSE aan te bevelen voor het screenen op cognitieve stoornissen na een beroerte in de eerste lijn?
Achtergrond
Circa 10% van de patiënten ontwikkelt dementie na een eerste herseninfarct of hersenbloeding. Cognitieve stoornissen, zoals verminderd concentratievermogen, geheugenverlies en verminderd ziekte-inzicht, komen voor bij een tamelijk groot deel van de patiënten. Drie maanden na het optreden van een herseninfarct of -bloeding worden percentages beschreven van 35% (stoornissen op ≥ 4 domeinen) tot 55% (stoornis op ≥ 1 domein). In de subacute fase (2 weken na de beroerte) worden voor een stoornis op ≥ 1 domein percentages tot 91,5% beschreven.
Ook na minor stroke en TIA worden cognitieve stoornissen beschreven.
Cognitieve stoornissen zijn van invloed op het functioneel herstel, de kwaliteit van leven en de sociale participatie na een herseninfarct of hersenbloeding. Signalering en diagnostiek zijn gewenst om de juiste revalidatiebegeleiding te kunnen bieden. De NVN-richtlijn Herseninfarct en hersenbloeding adviseert cognitieve revalidatie te overwegen om patiënten met cognitieve stoornissen te leren omgaan met (blijvende) cognitieve gevolgen in het dagelijks leven. Gerichte informatie en psycho-educatie dienen altijd aangeboden te worden. Trainingen gericht op het herstel van cognitieve functies (digitale cognitieve training, niet-invasieve hersenstimulatie, medicatie) worden niet aangeraden omdat deze geen langetermijneffecten hebben en er geen generalisatie van de behandeleffecten naar het dagelijks leven optreedt.
De NHG-Standaard Dementie beveelt de Mini-Mental State Evaluation (MMSE) in combinatie met de kloktekentest aan als screeningstest bij aanwijzingen voor cognitieve stoornissen. De NVN-richtlijn Herseninfarct en hersenbloeding beveelt de Montreal Cognitive Assessment (MoCA) aan als screeningstest in de acute en subacute fase na een herseninfarct of hersenbloeding. De MMSE zou bij deze patiëntenpopulatie onvoldoende sensitief zijn voor cognitieve stoornissen en de criteriumvaliditeit (sensitiviteit ≥ 80%, specificiteit ≥ 60%) wordt onvoldoende geacht. De uitgangsvraag is of de MoCA ook ná de acute fase de voorkeur heeft bij patiënten die weer thuis zijn na een herseninfarct of -bloeding.
Methoden
In april 2021 is in PubMed een literatuursearch uitgevoerd naar systematische literatuuronderzoeken, RCT’s en observationeel onderzoek, met in februari 2022 een update.
Resultaten
Resultaat zoekactie
De literatuursearch leverde 2 systematische literatuuronderzoeken op. Op grond van verschil in inclusiecriteria en methodologie werd besloten beide onderzoeken te beschrijven.
Er werden geen na de zoekdatum van de review van Shi gepubliceerde onderzoeken gevonden.
Bij de update in februari 2022 werd een systematische review en een observationeel onderzoek gevonden, die in lijn zijn met onderstaande resultaten en daarom de aanbeveling niet zullen veranderen.
Onderzoekskarakteristieken
- Shi 2018: includeerde 12 onderzoeken (n = 2130) waarin de MoCA werd onderzocht; de referentietest was een neuropsychologisch onderzoek. Alle onderzoeken werden in het ziekenhuis afgenomen. In 7 onderzoeken werden patiënten met een TIA, herseninfarct of hersenbloeding geïncludeerd, in 5 onderzoeken patiënten met een herseninfarct of hersenbloeding. In 7 onderzoeken werd de MoCA met een andere screeningstest vergeleken, in 6 daarvan met de MMSE. In 3 onderzoeken werden de testeigenschappen van de MoCA en de MMSE bij afname 3-6 maanden na de beroerte onderzocht. De testeigenschappen van deze 2 tests werd bij verschillende afkapwaarden onderzocht. Van de 12 onderzoeken hadden er 7 een lage kans op vertekening.
- Lees 2014: Systematische review en meta-analyse van 32 onderzoeken (n = 3562) waarin cognitieve screeningstests, waaronder de MMSE en MoCA, werden onderzocht bij patiënten die een herseninfarct of hersenbloeding hadden doorgemaakt. De referentie was een diagnose dementie of cognitieve problemen op verschillende domeinen, vastgesteld met een erkend classificatiesysteem of neuropsychologisch onderzoek. Geïncludeerd werden patiënten in verschillende stadia na het event: hyperacuut (< 7 dagen); acuut (8-14 dagen); postacuut (15 dagen tot 3 maanden); middellang (3-12 maanden) en lang (> 1 jaar). De resultaten werden gepoold. De kwaliteit van bewijs was echter zeer laag op grond van kans op vertekening en heterogeniteit (inclusiecriterium, fase na beroerte, referentietest). De testeigenschappen van de beide tests werden bij verschillende afkapwaarden onderzocht: de MMSE bij < 22 en < 26 (de NHG-Standaard Dementie hanteert een afkapwaarde < 24 als indicatie voor dementie) en de MoCA bij < 25 en < 27 (de NHG-Standaard Dementie acht een score ≥ 26 op de MoCA indicatief voor een normaal geheugen).
Uitkomsten
- Shi 2018: In 2 onderzoeken waren de testeigenschappen van de MMSE en de MoCA 3-6 maanden na het event vergelijkbaar. In 1 onderzoek had de MMSE een slechtere sensitiviteit dan de MoCA. Samengenomen had de MMSE een hogere specificiteit en de MoCA een hogere sensitiviteit. In beide tests is de maximale score 30. Voor de MMSE werden de afkapwaarden < 25, < 26 en < 27 onderzocht en voor de MoCA < 22, < 23 en < 24. Hoe lager de afkapwaarde, hoe lager de sensitiviteit en hoe hoger de specificiteit (zie tabel 11).
|
MMSE |
MoCA |
||||
|---|---|---|---|---|---|
|
Afkapwaarde |
Sensitiviteit* |
Specificiteit * |
Afkapwaarde |
Sensitiviteit* |
Specificiteit* |
|
< 25 |
0,73 |
0,82 |
< 21 |
0,86 |
0,67 |
|
< 26 |
0,83 |
0,70 |
< 22 |
0,87 |
0,69 |
|
< 27 |
0,89 |
0,65 |
< 23 |
0,93 |
0,63 |
|
*Betrouwbaarheidsintervallen niet gerapporteerd. Bron: Shi et al. 2018. Geïncludeerde onderzoeken: Dong et al. [2], Dong et al. [16], Cumming et al. [36] |
|||||
Lees 2014
- De MMSE werd in 12 onderzoeken (n = 1639) onderzocht met een afkapwaarde < 25. Bij 30% was een cognitieve stoornis vastgesteld met het referentieonderzoek. De sensitiviteit was 0,71 (95%-BI 0,60 tot 0,80), de specificiteit 0,85 (95%-BI 0,80 tot 0,89), positieve likelihood ratio (LR+) 4,73 (95%-BI 3,63 tot 6,17) en negatieve likelihood ratio (LR-) 0,34 (95%-BI 0,25 tot 0,47). De MoCA werd in 4 onderzoeken (n = 326) onderzocht met een afkapwaarde < 26. Bij 40% werd een cognitieve stoornis vastgesteld met het referentieonderzoek. De sensitiviteit was 0,95 (95%-BI 0,89 tot 0,98), specificiteit 0,45 (95%-BI 0,34 tot 0,57), LR + 1,73 (95%-BI 1,43 tot 2,1) en LR- 0,1 (95%-BI 0,04 tot 0,23). Zie tabel 12 voor de testeigenschappen per afkapwaarde.
|
Test (afkapwaarde) |
Onderzoeken (n) |
Cognitieve beperking, n (%) |
Sensitiviteit (95%-BI) |
Specificiteit (95%-BI) |
LR+ (95%-BI) |
LR– (95%-BI) |
|---|---|---|---|---|---|---|
|
MMSE (< 25) |
12 (1639) |
483 (30%) |
0,71 (0,60 tot 0,80) |
0,85 (0,80 tot 0,89) |
4,73 (3,63 tot 6,17) |
0,34 (0,25 tot 0,47) |
|
MMSE (< 27) |
5 (445) |
195 (44%) |
0,88 (0,82 tot 0,92) |
0,62 (0,50 tot 0,73) |
2,33 (1,72 tot 3,17) |
0,19 (0,13 tot 0,29) |
|
MoCA (< 22) |
6 (726) |
289 (39%) |
0,84 (0,76 tot 0,89) |
0,78 (0,69 tot 0,84) |
3,75 (2,77 tot 5,08) |
0,20 (0,15 tot 0,29) |
|
MoCA (< 26) |
4 (326) |
131 (40%) |
0,95 (0,89 tot 0,98) |
0,45 (0,34 tot 0,57) |
1,73 (1,43 tot 2,10) |
0,10 (0,04 tot 0,23) |
|
LR+ = positieve likelihood ratio; LR– = negatieve likelihood ratio. Bron: Lees et al. 2014. |
||||||
Maatschappelijk functioneren
Naar Samenvatting ›- Beoordeel het maatschappelijk functioneren aan de hand van de volgende aspecten:
- sociale situatie
- woonomstandigheden en -voorzieningen
- dagbesteding
- huishouding
Arbeidsre-integratie
- Bespreek met de patiënt en naasten in een zo vroeg mogelijk stadium de mogelijke gevolgen van de beroerte die de terugkeer naar werk kunnen beïnvloeden.
- Informeer naar de re-integratie in het arbeidsproces. Ga na of de bedrijfsarts het proces van arbeidsre-integratie begeleidt. Overleg zo nodig met de revalidatie- en/of bedrijfsarts (of medisch adviseur van de particuliere verzekeraar bij zelfstandige ondernemers).
- In Nederland is circa 40% van degenen die voor het optreden van niet-aangeboren hersenletsel (waaronder traumatisch hersenletsel en beroerte) werkzaam waren, 2 jaar na het letsel weer aan het werk.
- Internationaal keert 40-73% van de patiënten die voor het 45e levensjaar een beroerte hebben doorgemaakt naar verloop van tijd weer terug op de arbeidsmarkt. Die terugkeer leidt over het algemeen tot een hogere kwaliteit van leven.
- Factoren die positief geassocieerd zijn met re-integratie zijn onder andere normale spierkracht, zelfstandig kunnen lopen, het ontbreken van cognitieve stoornissen, het verrichten van kantoorwerkzaamheden, hoog opleidingsniveau, steun van omgeving en leidinggevende, en goede medewerking aan de revalidatie. Negatief geassocieerd met werkhervatting zijn onder andere depressie, cognitieve stoornissen, gebrek aan begeleiding, het ontbreken van steun en ernstige uitvalsverschijnselen.
- Bij de inschatting of iemand weer aan het werk kan, wordt gekeken naar cognitieve functies, fysieke beperkingen, mentale beperkingen, fysieke belastbaarheid, mentale belastbaarheid, sociaal functioneren en emotioneel functioneren. Dit wordt beoordeeld in samenhang met de benodigde capaciteiten voor het werk.
- Bespreek met patiënt en naasten in een zo vroeg mogelijk stadium de mogelijke gevolgen van niet-aangeboren hersenletsel die het proces van terugkeer naar werk kunnen beïnvloeden, waarbij de timing van de informatieverstrekking afhankelijk is van de klinische toestand van de patiënt en het ingezette revalidatietraject.
- Arbeidsgerichte interventies zijn mogelijk. Adviseer de patiënt om, wanneer er problemen met werkhervatting worden verwacht, vóór het hervatten van het werk de op dat moment ervaren of vastgestelde beperkingen met zowel de leidinggevende als de bedrijfsarts te bespreken. De bedrijfsarts kan verwijzen naar een ergotherapeut of revalidatie-instelling.
- Ook voor zelfstandig ondernemers en zzp’ers bestaan er arbeidsgerichte interventies. Deze kunnen in gang worden gezet via de medisch adviseur van de verzekeraar. Zelfstandig ondernemers zonder arbeidsongeschiktheidsverzekering kan men het beste (terug)verwijzen naar de revalidatiearts of naar hersenz.nl.
Conclusie
- Bespreek met de patiënt en diens naasten in een zo vroeg mogelijk stadium de huidige (ervaren) beperkingen die het proces van maximale terugkeer naar werk kunnen beïnvloeden. Laat de timing van deze informatieverstrekking afhangen van de klinische toestand van de patiënt en het ingezette revalidatietraject.
- Zowel de revalidatiearts als de bedrijfsarts hebben een belangrijke rol bij de re-integratie. Ga, als de patiënt door de klachten (nog) niet kan werken, na of de bedrijfsarts het proces van arbeidsre-integratie begeleidt en stem de voortgang, in overleg met de patiënt, indien mogelijk af met de bedrijfsarts.
Mantelzorg
Naar Samenvatting ›Beoordeel de belastbaarheid van de mantelzorg en evalueer dit regelmatig. De zorg voor een patiënt met een beroerte vraagt veel van mantelzorgers; daarnaast kunnen de eventuele verandering van karakter en een andere rol in de relatie belastend zijn voor de mantelzorger en andere naasten (zie Toolkit Mantelzorg in de huisartsenpraktijk van de LHV).
Naasten van patiënten met een herseninfarct of intracerebrale bloeding ervaren een hoge zorglast. Deze zorglast wordt aangegeven in termen van zware verantwoordelijkheid, onduidelijkheid over de zorgbehoeften van de patiënt, constante bezorgdheid, verminderde sociale contacten en het gevoel er alleen voor te staan.
Vooral de neuropsychologische functiestoornissen die het gevolg zijn van de beroerte blijken voor de partners belastend te zijn. Doorgaans hebben partners minder mogelijkheden voor ontspanningsactiviteiten. Ook treden er veranderingen in rolpatronen op die spanningen met zich mee kunnen brengen. Vaak ontstaat er minder wederkerigheid in de relatie.
Uit een prospectief onderzoek (n = 100) blijkt dat 30 tot 33% van de mantelzorgers een depressie ontwikkelt gedurende een achttien maanden durende follow-up. De ernst van de uitval en leeftijd van de patiënt zijn met het ontstaan hiervan geassocieerd. Daarnaast spelen de gezondheidstoestand, copingstijl van de mantelzorger en de ervaren sociale steun een rol in het ontstaan van een depressie bij de mantelzorger.
Voorlichting
Naar Samenvatting ›Ook na ontslag uit het ziekenhuis hebben de patiënt en diens familie behoefte aan aanvullende informatie, afgestemd op het stadium waarin de patiënt zich bevindt. Een doorgemaakte beroerte is een belangrijke gebeurtenis voor patiënt en naasten, betrek ook de naasten bij de voorlichting.
Bespreek:
- aard en oorzaak van de aandoening
- behandeling (revalidatietraject, secundaire preventie)
- prognose
- chronische fase:
- Emoties en eventuele cognitieve stoornissen kunnen de opname van informatie bemoeilijken.
- Geef informatie over het omgaan met de ziekte en de beperkingen (waaronder neuropsychologische functiestoornissen) én de eventuele zorgmogelijkheden.
- adviseer direct contact op te nemen met de huisarts bij opnieuw optreden van uitvalsverschijnselen
Secundaire preventie
- Een patiënt met een doorgemaakt(e) TIA of herseninfarct wordt beschouwd als een patiënt met een zeer hoog risico op hart- en vaatziekten (zie NHG-Standaard Cardiovasculair risicomanagement)
- Benadruk het belang van de leefstijladviezen en het juiste gebruik van de voorgeschreven medicatie (zie Medicamenteuze onderhoudsbehandeling).
- Ontraad patiënten met een doorgemaakt(e) TIA of herseninfarct:
- oestrogeenbevattende anticonceptiva (zie NHG-Standaard Anticonceptie)
- hormoontherapie vanwege overgangsklachten (zie NHG-Standaard De overgang)
Leefstijladviezen
Naar Samenvatting ›Ga met de patiënt na op welke leefstijlfactor(en) de grootste winst te behalen is en wat de meest haalbare aanpak is. Adviseer:
- niet te roken en meeroken te vermijden;
- voldoende te bewegen: ten minste 150 minuten per week matig intensieve inspanning, zoals wandelen en fietsen, verspreid over diverse dagen; niet meer dan 8 uur per dag te zitten;
- te streven naar een optimaal gewicht: BMI 20-25 kg/m2;
- gezond te eten volgens de Schijf van Vijf van het Voedingscentrum;
- stress te voorkomen.
Voor gerichte leefstijladviezen, zie NHG-Standaard Cardiovasculair risicomanagement.
Het effect van leefstijlmodificatie op de recidiefkans van een beroerte is niet onderzocht. Wel is aangetoond dat roken, overmatig alcoholgebruik, overgewicht en weinig lichaamsbeweging geassocieerd zijn met het risico op een (recidief) herseninfarct.
Stoppen met roken
Roken is een onafhankelijke risicofactor voor het optreden van een herseninfarct. Het risico neemt toe met het aantal pakjaren. In een prospectieve studie bleek het relatieve risico op mortaliteit bij patiënten die een beroerte hebben doorgemaakt na een gemiddelde follow-up van 7,5 jaar 2,27 (95%-BI 1,12 tot 4,47) voor rokers in vergelijking met niet-rokers.
Op alle leeftijden leidt stoppen met roken tot een afname van de kans op hart- en vaatziekten (HVZ). De voordelen van stoppen lijken groter in jongere leeftijdsgroepen. In de oudere leeftijdsgroepen is het relatieve risico van roken weliswaar kleiner dan in de jongere groepen, maar is de absolute kans op HVZ beduidend groter, zodat het ook voor ouderen zin heeft om te stoppen. Uit een cohortonderzoek blijkt dat het risico op HVZ vijf jaar na het stoppen op hetzelfde niveau ligt als bij personen die nooit gerookt hebben.
In een prospectieve studie (n = 1139) rookte 32,3% ten tijde van het doormaken van een beroerte. Van de 151 rokers die na een jaar nog leefden waren er 62 (41,4%) gestopt, de meesten in de eerste drie maanden na de beroerte.
Lichaamsbeweging
Lichamelijke inactiviteit is een risicofactor voor het optreden van een beroerte. Regelmatige lichamelijk activiteit leidt niet alleen rechtstreeks tot een verlaagd risico op HVZ, maar ook indirect via het effect op bloeddruk en gewicht, vasodilatatie, glucosetolerantie en het lipidenspectrum. Uit een meta-analyse van achttien cohortstudies en vijf patiëntcontroleonderzoeken bleek dat zeer actieve mensen 27% minder kans hebben op een beroerte ten opzichte van inactieve personen (RR 0,73; 95%-BI 0,67 tot 0,79). Gemiddeld actieve individuen hadden een 20% lager risico op een beroerte in vergelijking met inactieve personen (RR 0,80; 95%-BI 0,74 tot 0,86). Het ligt in de lijn der verwachting dat, in overeenstemming met de gunstige effecten in de secundaire preventie bij coronair vaatlijden, regelmatige lichaamsbeweging aangepast aan de mogelijkheden van de patiënt en eventueel onder begeleiding van een fysiotherapeut of in de vorm van een beweegprogramma, een gunstig effect heeft op de recidiefkans van een herseninfarct.
Het advies is om voldoende te bewegen, conform de NHG-Standaard Cardiovasculair risicomanagement:
- ≥ 150 minuten per week matig intensieve inspanning zoals wandelen en fietsen, verspreid over diverse dagen
- voorkom > 8 uur per dag zitten
- verricht daarnaast ≥ 2 × per week spier- en botversterkende activiteiten zoals traplopen, springen of tuinieren
- voor ouderen: combineer spier- en botversterkende activiteiten met balansoefeningen
Overmatig alcoholgebruik
Overmatige alcoholconsumptie is een onafhankelijke risicofactor voor beroerte. Een meta-analyse (zeventien cohortonderzoeken en negen patiëntcontroleonderzoeken) toont dat de kans op een hersenbloeding toeneemt met het gemiddeld aantal glazen alcohol dat per dag wordt gedronken. Wat betreft het risico op een herseninfarct is sprake van een J-vormige curve, waarbij het laagste risico op een herseninfarct gevonden wordt bij een alcoholconsumptie van één eenheid per dag. Vanaf een consumptie van drie eenheden per dag nemen het risico op een herseninfarct en de mortaliteit toe, zowel bij vrouwen als bij mannen. Mogelijk speelt de bloeddrukverhogende werking van alcohol hierbij een grote rol. In een prospectief onderzoek was 72,1% van de patiënten die voorafgaand aan een eerste beroerte overmatig alcohol dronken (vrouwen > 14 eenheden/week; mannen > 21 eenheden/week), drie maanden na de beroerte gestopt met het excessieve alcoholgebruik.
Het advies is om volgens de Richtlijnen goede voeding (2015) van de Gezondheidsraad geen alcohol of ten hoogste 1 eenheid alcohol per dag te nuttigen (zie NHG-Standaard Cardiovasculair risicomanagement).
Gewichtsreductie
Een meta-analyse van 25 prospectieve onderzoeken toont dat overgewicht (BMI 25-29,9) en obesitas (BMI ≥ 30) onafhankelijke risicofactoren zijn voor het optreden van een herseninfarct (overgewicht RR 1,22; 95%-BI 1,05 tot 1,41; obesitas RR 1,64; 95%-BI 1,36 tot 1,99). Er was geen significante relatie tussen overgewicht en obesitas en het optreden van een hersenbloeding. In een prospectief onderzoek voldeed 56,3% ten tijde van de eerste beroerte aan de criteria voor obesitas (MHR bij mannen > 0,98; bij vrouwen > 0,88). Na 1 jaar voldeed nog 36,1% van de patiënten aan deze criteria. Adviseer personen met een gezond gewicht (BMI 20-25) gewichtsbehoud en gezond te eten conform de Richtlijnen goede voeding 2015 en te bewegen. Adviseer personen met overgewicht of obesitas (BMI ≥ 25) in het algemeen om voldoende te bewegen en op gezonde wijze af te vallen (zie NHG-Standaard Obesitas en NHG-Standaard Cardiovasculair risicomanagement).
Conclusie
Roken, overmatig alcoholgebruik, overgewicht en lichamelijke inactiviteit zijn geassocieerd met het risico op een (recidief) herseninfarct. Hoewel onderzoek naar de effectiviteit van de afzonderlijke leefstijlinterventies in de secundaire preventie ontbreekt, ligt het in de lijn der verwachting dat naleving van bovenstaande adviezen tot een lagere recidiefkans leidt.
Rijgeschiktheid
Naar Samenvatting ›- Indien er geen cognitieve of lichamelijke functiestoornissen zijn die met de rijgeschiktheid interfereren, is autorijden toegestaan (patiënt moet wel een ‘Gezondheidsverklaring’ invullen):
- in personenauto’s en motorrijwielen (groep 1) vanaf 2 weken na de beroerte
- in vrachtwagens en autobussen (groep 2) vanaf 4 weken na de beroerte
- Indien er wel functiestoornissen zijn, bedraagt de termijn van de rijongeschiktheid in ieder geval 3 maanden, waarna de patiënt een ‘Gezondheidsverklaring’ moet invullen en evt. een rijtest moet afleggen bij het CBR.
- Als er met de rijgeschiktheid interfererende functiestoornissen zijn, kan men niet geschikt worden verklaard voor groep 2.
Rijbewijzen van groep 1
Personen met een TIA, herseninfarct of hersenbloeding (die niet het gevolg is van een misvorming van de hersenvaten), mogen gedurende twee weken na het ontstaan van de uitvalsverschijnselen niet autorijden (groep 1: personenauto’s en motorrijwielen, rijbewijzen A, B, BE). Na 2 weken wordt door de neuroloog beoordeeld of er een met de rijgeschiktheid interfererende lichamelijke of geestelijke functiestoornis bestaat: indien er geen met de rijgeschiktheid interfererende cognitieve of lichamelijke functiestoornissen zijn, mag men 2 weken na een TIA, herseninfarct of hersenbloeding 2 weken weer autorijden. Aanbevolen wordt een Gezondheidsverklaring in te vullen. Er is geen meldingsplicht aan het Centraal Bureau Rijvaardigheidsbewijzen (CBR).
Bestaat er na twee weken een vermoeden van een met de geschiktheid interfererende lichamelijke of geestelijke functiestoornis, dan blijft de patiënt ongeschikt tot drie maanden na het ontstaan van de uitvalsverschijnselen. Na die termijn is een Gezondheidsverklaring vereist, zo nodig gevolgd door er een rijtest (zie Regeling eisen geschiktheid 2000, geraadpleegd augustus 2021, en Regels voor het rijden na een beroerte, geraadpleegd maart 2022).
Rijbewijzen van groep 2
Gedurende 4 weken na een TIA, herseninfarct of hersenbloeding (die niet het gevolg is van een misvorming van de hersenvaten) is men ongeschikt voor rijbewijzen van groep 2 (vrachtwagens en autobussen, rijbewijzen C, CE, D, DE).
Na 4 weken wordt door de neuroloog beoordeeld of er met de rijgeschiktheid infererende lichamelijke of geestelijke functiestoornis bestaat:
- Bestaat er na vier weken na het begin van de uitvalsverschijnselen geen met de geschiktheid interfererende lichamelijke of geestelijke functiestoornis, dan kunnen zij op basis van een van de door de keurend arts ingevulde beroertevragenlijst geschikt worden verklaard voor rijbewijzen van groep 2 zonder termijnbeperking.
- Bestaat er na vier weken een vermoeden op met de geschiktheid interfererende lichamelijke of geestelijke functiestoornis dan zijn zij ongeschikt tot drie maanden na het ontstaan van de uitvalsverschijnselen.
Daarna is een specialistisch rapport, opgesteld door een neuroloog of een revalidatiearts, vereist. Zij kunnen geschikt worden verklaard als uit het specialistisch rapport blijkt dat er geen met de geschiktheid interfererende lichamelijke of geestelijke functiestoornis is.
Zijn er wel met de rijgeschiktheid interfererende functiestoornissen, dan kan men niet geschikt worden verklaard voor groep 2 (zie Regeling eisen geschiktheid 2000, geraadpleegd augustus 2021, en Regels voor het rijden na een beroerte, geraadpleegd maart 2022).
Seksualiteit
Naar Samenvatting ›- Een herseninfarct of intracerebrale bloeding is geen reden om af te zien van seksuele activiteit.
- Vertel de patiënt en diens partner dat erectiele disfunctie en/of een verminderd seksueel verlangen over het algemeen van voorbijgaande aard zijn en informeer hen over de eventuele behandelingsmogelijkheden, zie NHG-Standaard Seksuele klachten.
Na een herseninfarct of intracerebrale bloeding rapporteert 17 tot 57% van de patiënten een verminderd seksueel verlangen. Daarnaast kan sprake zijn van erectiele disfunctie, die meestal binnen 7 weken na de beroerte herstelt, of een vermindering van de vaginale lubricatie en het orgasmevermogen. In zeldzame gevallen wordt hyperseksualiteit gezien. De oorzaak van de seksuele stoornis is meestal multifactorieel waarbij lichamelijke factoren een rol spelen, zoals comorbiditeit (hypertensie, diabetes mellitus, perifeer arterieel vaatlijden), medicatie, verminderde functionaliteit en lokalisatie van het infarct of de bloeding. Daarnaast spelen vaak psychische factoren een rol, zoals angst voor een recidief, veranderd rolpatroon, verlies van zelfvertrouwen en het eventuele bestaan van een ‘post-stroke’-depressie.
Een herseninfarct is geen reden om af te zien van seksuele activiteit. Ook na een hersenbloeding is er meestal geen beperking. Voor de behandeling van erectiele disfunctie wordt verwezen naar de NHG-Standaard Erectiele disfunctie. Het is aan te bevelen dat de huisarts actief vraagt naar seksuele problemen en voorlichting geeft.
De brochure Intimiteit en seksualiteit na een beroerte van de Hart&Vaatgroep geeft adequate patiëntinformatie Brochure Seksualiteit en Beroerte.pdf (harteraad.nl).
Thuisarts
Naar Samenvatting ›Verwijs naar de informatie op thuisarts.nl. De informatie op Thuisarts is gebaseerd op deze NHG-Standaard. Of verwijs de patiënt voor informatie naar de patiëntenvereniging hersenletsel.nl of naar breinlijn.nl.
Medicamenteuze onderhoudsbehandeling
Naar Samenvatting ›De neuroloog start tijdens opname de secundaire preventie. Continueer deze medicatie in principe levenslang.
Na TIA of herseninfarct
Naar Samenvatting ›Trombocytenaggregatieremmers
Naar Samenvatting ›- Voor de onderhoudsbehandeling zijn er 2 gelijkwaardige behandelopties:
- dipyridamol met gereguleerde afgifte 2dd 200 mg in combinatie met acetylsalicylzuur 1dd 80 mg óf
- clopidogrel 1dd 75 mg
- Kies in geval van bijwerkingen voor het alternatief.
- De neuroloog bepaalt of farmacogenetisch onderzoek nodig is voorafgaand aan de start van clopidogrel.
- Indien er geen bijwerkingen zijn en geen problemen met de therapietrouw is er geen reden om de combinatie dipyridamol en acetylsalicylzuur om te zetten naar clopidogrel monotherapie.
- Overleg bij omzetten van de combinatiebehandeling naar clopidogrel monotherapie met de neuroloog over de noodzaak tot farmacogenetisch onderzoek.
- Bij patiënten met een minor stroke of TIA met een hoge recidiefkans kan de neuroloog besluiten tot duale behandeling met clopidogrel en acetylsalicylzuur gedurende ≤ 21 dagen, mits deze < 24 uur na de uitvalsverschijnselen gestart kan worden. De duale behandeling wordt gevolgd door clopidogrel monotherapie of door dipyridamol in combinatie met acetylsalicylzuur.
Achtergrond
In de PROFESS-studie (n = 20.332, non-inferiority design) kon geen verschil in effectiviteit worden aangetoond van de combinatiebehandeling van tweemaal daags 25 mg acetylsalicylzuur en 200 mg dipyridamol ten opzichte van clopidogrel 75 mg/dag, bij een gemiddelde follow-up van 2,5 jaar (het risico op een recidief beroerte bij genoemde behandelingen bedroeg respectievelijk 9,0 en 8,8%). De mediane tijd van TIA of herseninfarct tot start van de behandeling bedroeg 15 dagen. Patiënten die behandeld werden met de combinatie acetylsalicylzuur en dipyridamol rapporteerden meer bijwerkingen (vooral hoofdpijn, duizeligheid, misselijkheid en braken), die leidden tot staken van de therapie dan de patiënten die met clopidogrel behandeld werden (16,4 versus 10,6%). Ernstige bloedingen kwamen voor bij 4,1% van de patiënten die met de combinatie behandeld werden en bij 3,6% van de patiënten die met clopidogrel behandeld werden (HR 1,15; 95%-BI 1,00 tot 1,32). Eerder was in de CAPRIE-studie, voor patiënten die bekend waren met atherosclerotisch vaatlijden, een klein maar statistisch significant effect ten gunste van clopidogrel ten opzichte van acetylsalicylzuur aangetoond (relatieve risicoreductie op samengesteld eindpunt ‘beroerte, hartinfarct of vasculaire sterfte’ 8,7%; 95%-BI 0,3 tot 16,5%), overeenkomend met een absolute risicoreductie van 1,3% in 2 jaar. Voor de subgroep patiënten met een herseninfarct was het effect ongeveer even groot, maar niet statistisch significant.
In een netwerkanalyse waarin geprobeerd werd resultaten van deze trials aan elkaar te relateren en consistent te maken, kon niet worden aangetoond dat clopidogrel effectiever is dan acetylsalicylzuur alleen. In deze analyse werd als uitkomst echter ‘stroke’ gebruikt, en niet de klinisch relevantere gecombineerde uitkomst ‘niet-fatale beroerte, hartinfarct of vasculaire sterfte’. Daardoor blijft de paradox onopgehelderd dat na een TIA of herseninfarct: 1) acetylsalicylzuur plus dipyridamol effectiever is dan acetylsalicylzuur alleen, 2) acetylsalicylzuur plus dipyridamol equivalent lijkt aan clopidogrel, terwijl 3) clopidogrel niet duidelijk effectiever lijkt dan acetylsalicylzuur.
Resultaten
Behandeling met acetylsalicylzuur in combinatie met clopidogrel werd vergeleken met behandeling met monotherapie met clopidogrel in het MATCH-onderzoek en met monotherapie met acetylsalicylzuur in het CHARISMA- en SPS 3-onderzoek. Beide onderzoeken toonden geen toegevoegde waarde van combinatiebehandeling, terwijl de combinatiebehandeling wel gepaard ging met een toename van bloedingen. Er werd geen onderzoek verricht naar de effectiviteit van clopidogrel versus placebo en de combinatiebehandeling clopidogrel en dipyridamol in de secundaire preventie na TIA of herseninfarct.
Clopidogrel heeft hetzelfde werkingsmechanisme als ticlopidine, maar gaat minder vaak gepaard met ernstige bijwerkingen, zoals neutropenie en trombocytopenie.
Conclusie
Clopidogrel lijkt even effectief als de combinatiebehandeling acetylsalicylzuur en dipyridamol in de secundaire preventie na een TIA of herseninfarct. De meerwaarde van de combinatiebehandeling acetylsalicylzuur en dipyridamol boven monotherapie met acetylsalicylzuur is overtuigender aangetoond dan de eventuele meerwaarde van clopidogrel boven acetylsalicylzuur.
Van bewijs naar aanbeveling
Clopidogrel wordt in toenemende mate binnen de tweede lijn gebruikt als alternatief voor de combinatiebehandeling acetylsalicylzuur en dipyridamol. Voordelen van clopidogrel zijn het gebruiksgemak (één tablet in plaats van drie tabletten per dag) en het minder frequent optreden van bijwerkingen. Daarnaast is de behandeling met clopidogrel goedkoper dan de combinatiebehandeling. Een nadeel is dat de meerwaarde van de combinatiebehandeling acetylsalicylzuur en dipyridamol boven monotherapie met acetylsalicylzuur overtuigender is aangetoond dan de eventuele meerwaarde van clopidogrel boven acetylsalicylzuur. Mogelijk is bij een deel van de patiënten clopidogrel niet of minder effectief, zie detail Farmacogenetisch onderzoek bij clopidogrel. Op grond van bovenstaande overwegingen is monotherapie met clopidogrel een gelijkwaardig alternatief voor de behandeling met acetylsalicylzuur in combinatie met dipyridamol na een TIA of herseninfarct.
Aanbeveling
Monotherapie met dagelijks clopidogrel is een gelijkwaardig alternatief voor de combinatiebehandeling met acetylsalicylzuur en dipyridamol bij patiënten die een TIA of herseninfarct (zonder cardiale emboliebron) hebben doorgemaakt.
De baten van gebruik van acetylsalicylzuur door patiënten met een TIA of een herseninfarct zijn in vele trials aangetoond. In een meta-analyse is berekend dat dit middel zowel de kans op het doormaken van een niet-dodelijk herseninfarct als een niet-dodelijk myocardinfarct met circa 25% vermindert. De relatieve reductie van de kans op sterfte is geringer en bedraagt circa 10%. De absolute reductie van de kans op cardiovasculaire morbiditeit of mortaliteit bedraagt in de trials ruim 1% per jaar. Er is geen duidelijke dosis-effectrelatie. Ook in een ander overzichtsartikel wordt geconcludeerd dat alle doseringen van 50 tot 1500 mg daags even effectief zijn en wordt het niet uitgesloten dat de ondergrens verder verlaagd kan worden. Het enige onderzoek waarin werd gewerkt met een dosering van minder dan 50 mg per dag, is de Dutch TIA Trial. Hieruit blijkt dat 30 mg een even goed resultaat geeft als een dosering van 283 mg en met minder gastro-intestinale bijwerkingen gepaard gaat. Op theoretische gronden is zelfs wel gesuggereerd dat 30 mg effectiever is dan hogere doseringen, omdat de remming van de plaatjesaggregatie door vermindering van de productie van tromboxaan A2 in de bloedplaatjes bij deze lage dosering al volledig is, terwijl de productie van het aggregatieremmende prostaglandine in de endotheelcellen nog nauwelijks is verlaagd.
Omdat de hoeveelheid bewijs voor de effectiviteit van een dosering van meer dan 50 mg acetylsalicylzuur per dag veel groter is dan die voor de effectiviteit van lagere doseringen en gebruik van 80 mg per dag ook voor andere indicaties wordt toegepast, wordt het gebruik van 80 mg acetylsalicylzuur per dag geadviseerd.
Conclusie
Na een TIA of herseninfarct leidt behandeling met dagelijks acetylsalicylzuur 80 mg tot een absolute reductie van de kans op cardiovasculaire morbiditeit of mortaliteit van ruim 1% per jaar.
Achtergrond
In het verleden werd alleen acetylsalicylzuur als trombocytenaggregatieremmer voorgeschreven aan patiënten die een TIA of herseninfarct (zonder cardiale emboliebron) hebben doorgemaakt. Het is de vraag of de combinatie met dipyridamol effectiever is in de secundaire preventie.
Bron
De effectiviteit en veiligheid van de combinatiebehandeling van tweemaal daags 200 mg dipyridamol en 30 tot 325 mg acetylsalicylzuur in vergelijking tot behandeling met alleen 30 tot 325 mg acetylsalicylzuur bij patiënten die een TIA of herseninfarct hebben doorgemaakt, werd onderzocht in de European/Australian Stroke Prevention in Reversible Ischaemia Trial (ESPRIT), een gerandomiseerd open-labelonderzoek (n = 2763, gemiddelde follow-up 3,5 jaar). De primaire uitkomstmaat bestond uit het samengestelde eindpunt vasculaire sterfte, niet-fataal herseninfarct, niet-fataal myocardinfarct of een ernstige bloeding. Secundaire uitkomstmaten waren onder andere mortaliteit, recidief herseninfarct en bloedingen. Daarnaast zijn na het verschijnen van de resultaten van de ESPRIT-trial verschillende meta-analyses verricht: een netwerkanalyse (24 RCT’s, n = 42.688), een meta-analyse met gebruik van individuele patiëntgegevens (5 RCT’s, n = 7612, gemiddelde follow-up 2,6 jaar), een meta-analyse (6 RCT’s, n = 7648) en een heranalyse (2 RCT’s, n = 5700).
Kwaliteit
De deelnemers in de ESPRIT-trial waren niet geblindeerd. De beoordelaars van de uitkomsten waren dit wel. Daarnaast werden alleen patiënten met een minor stroke geïncludeerd (mRS = 3). De dosering acetylsalicylzuur was variabel (30 tot 325 mg/ dag). De meta-analyse met gebruik van individuele patiëntinformatie is van de hoogste kwaliteit, hierbij wordt gebruikgemaakt van gepoolde data. In de netwerkanalyse wordt geprobeerd resultaten van de trials aan elkaar te relateren, wat ten koste gaat van de bewijskracht.
Resultaten
De resultaten zijn samengevat in tabel 13.
Toelichting
In de ESPRIT-trial bedroeg de absolute risicoreductie bij behandeling met de combinatie acetylsalicylzuur en dipyridamol in vergelijking tot alleen acetylsalicylzuur voor het samengestelde eindpunt (vasculaire sterfte, niet-fataal herseninfarct, niet-fataal myocardinfarct of een ernstige bloeding) 0,96% per jaar (95%-BI 0,1 tot 1,8%; NNT 104).
In de analyse waarbij gebruik werd gemaakt van individuele patiëntgegevens (IPD) werd een absoluut risicoverschil berekend van 1,0% per jaar voor het samengestelde eindpunt vasculaire mortaliteit, acuut myocardinfarct en herseninfarct (HR 0,82; 95%-BI 0,72 tot 0,92; NNT 100) ten gunste van de combinatiebehandeling in vergelijking tot behandeling met alleen acetylsalicylzuur.
Een heranalyse van de patiëntgegevens van de ESPRIT- en ESPS-2-trials toont dat de effectiviteit van de combinatiebehandeling onafhankelijk is van de ernst van het voorgaande herseninfarct (HR 0,79; 95%-BI 0,69 tot 0,91). Hierbij dient te worden aangetekend dat slechts 7,5% van de patiënten een invaliderend herseninfarct (rankinscore 4-5) heeft doorgemaakt, en dat deze patiënten allen afkomstig zijn uit de ESPS-2-trial.
In de ESPRIT-trial waren hoofdpijn en gastro-intestinale bijwerkingen de voornaamste redenen om de therapie te staken.
In de verschillende onderzoeken werd geen verschil in het optreden van bloedingen gevonden.
|
Studie |
Opzet |
ASA + Dp |
ASA |
Herseninfarct |
Vasculaire sterfte |
Herseninfarct/AMI/vasculaire sterfte |
Staken therapie agv bijwerkingen |
Bewijskracht |
|||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
|
|
n |
n |
ASA + Dp (n) |
ASA(n) |
HR (95%-BI) |
ASA + Dp (n) |
ASA (n) |
HR (95%-BI) |
ASA + Dp (n) |
ASA (n) |
HR (95%- BI) |
ASA +Dp (%) |
ASA |
|
|
Esprit; 2006 |
RCT |
1363 |
1376 |
96 |
116 |
0,84 (0,64-1,10) |
44 |
60 |
0,75 (0,51-1,10) |
173 |
216 |
0.80 (0,66-0,98) |
34 |
17 |
matig |
|
Verro; 2008 |
Metaanalyse |
3823 |
3826 |
294 |
381 |
0,77 (0,67-0,89) |
|
|
|
542 |
640 |
0,85 (0,76-0,94) |
|
|
matig |
|
Halkes; 2008 |
IPD |
3800 |
3812 |
341 |
429 |
0,78 (0,68-0,90) |
175 |
187 |
0,96 (0,78-1,18) |
475 |
579 |
0,82 (0,72 -0,92) |
|
|
matig |
|
Thijs; 2008 |
Netwerk-meta-analyse |
|
|
|
|
|
|
|
|
|
|
0,78 (0,70-0,87) |
|
|
laag |
|
ASA: acetylsalicylzuur;Dp: dipyridamol; AMI: acuut myocardinfarct; n: aantal patiënten per subgroep; RCT: randomised controlled trial; IPD: individual patient data meta-analyse. |
|||||||||||||||
Conclusie
Er zijn aanwijzingen dat de combinatiebehandeling met dipyridamol met gereguleerde afgifte (tweemaal daags 200 mg) en acetylsalicylzuur in vergelijking tot monotherapie met acetylsalicylzuur na een herseninfarct (onafhankelijk van de ernst) of TIA een geringe toegevoegde waarde heeft in de preventie van een herseninfarct en andere vasculaire complicaties (matige bewijskracht).
Overweging
Het additionele effect van dipyridamol ligt in dezelfde orde van grootte als het effect van acetylsalicylzuur, vergeleken met placebo. Op basis hiervan, in combinatie met de ernst van het te voorkomen event (cardiovasculaire morbiditeit en mortaliteit), achten wij het bescheiden effect van dipyridamol klinisch relevant. Behandeling met dipyridamol gaat niet gepaard met een verhoogd risico op bloedingen. Hoofdpijn, duizeligheid en gastro-intestinale bijwerkingen treden vaker op ten tijde van een behandeling met dipyridamol. Een literatuuronderzoek naar de kosteneffectiviteit van toevoeging van dipyridamol aan de behandeling in de secundaire preventie na een TIA of herseninfarct concludeert dat combinatiebehandeling gedurende vijf jaar kosteneffectief is.
Bij keuze voor de combinatiebehandeling is het advies de dipyridamol op te bouwen (week 1 en 2 dipyridamol 200 mg eenmaal daags, hierna 2dd 200 mg. De bijwerking hoofdpijn lijkt hiermee deels te voorkomen. Dit advies is gebaseerd op expert opinion. Omdat de geadviseerde dosering acetylsalicylzuur 80 mg per dag bedraagt, ontraden we het gebruik van het combinatiemiddel dipyridamol/acetylsalicylzuur 200/25 mg. De effectiviteit van een lagere dosering acetylsalicylzuur is niet onderzocht.
Aanbeveling
Behandeling met dipyridamol met gereguleerde afgifte (2dd 200 mg) en acetylsalicylzuur wordt aanbevolen bij patiënten die een herseninfarct (onafhankelijk van de ernst) of TIA (zonder cardiale emboliebron) hebben doorgemaakt. Clopidogrel is een gelijkwaardig alternatief.
P2Y12-remmers (ticagrelor, prasugrel en clopidogrel) worden door verschillende enzymen uit het enzymsysteem cytochroom P450 (CYP450) omgezet in werkzame metabolieten (KNMP Kennisbank, geraadpleegd januari 2022). Er bestaan genetische verschillen die voor een tragere of snellere activiteit van de CYP-enzymen kunnen zorgen. Clopidogrel is een prodrug en en de werkzaamheid ervan is afhankelijk van omzetting door voornamelijk CYP2C19 en CYP3A4.
De NVN-richtlijn Herseninfarct en hersenbloeding raadt anno 2022 standaard farmacogenetisch onderzoek naar de activiteit van CYP2C19 bij het starten van behandeling met clopidogrel niet aan, vanwege het gebrek aan wetenschappelijk bewijs van een voordeel voor de patiënt. Dit is. echter onderwerp van onderzoek naar de plaatsbepaling van farmacogenetisch onderzoek bij clopidogrel, waarbij het streven is om samen met de NVN een aanbeveling op te stellen.
Momenteel besluit de primaire voorschrijver, in dit geval de neuroloog, of voorafgaand aan de start van clopidogrel farmacogenetisch onderzoek op CYP2C19 wordt aangevraagd. De neuroloog bepaalt ook het beleid bij verminderde activiteit van CYP2C19.
Zie voor meer informatie ook het NHG-Standpunt Farmacogenetisch onderzoek in de huisartspraktijk.
Samenvatting van bewijs
Uitgangsvraag
Is duale behandeling gedurende 3 weken met acetylsalicylzuur en clopidogrel (vergeleken met acetylsalicylzuur monotherapie) aan te bevelen bij patiënten met een minor stroke of een hoogrisico TIA (ABCD2 score ≥ 4, start binnen 24 uur)? Zie de PICO-tabel.
|
Patiënten |
Patiënten met een minor stroke of een hoogrisico TIA (ABCD2 score ≥ 4, start binnen 24 uur) |
|---|---|
|
Interventie |
Acetylsalicylzuur en clopidogrel |
|
Vergelijking |
Acetylsalicylzuur monotherapie |
|
Uitkomstmaten (follow-upduur 3 maanden) |
Cruciaal
|
Achtergrond
Behandeling met een trombocytenaggregatieremmer (acetylsalicylzuur of clopidogrel) is effectief als secundaire preventie na een doorgemaakte beroerte of TIA. Acetylsalicylzuur en clopidogrel hebben een synergistische werking bij het remmen van de trombocytenaggregatie. Daarom is het plausibel dat duale therapie een effectievere secundaire preventie teweegbrengt dan monotherapie. Duale therapie gaat echter mogelijk gepaard met een verhoogd risico op bloedingen.
Methoden
Voor het beantwoorden van deze vraag hebben wij gebruikgemaakt van de rapid recommendations-richtlijn over duale trombocytenaggregatieremming na een licht herseninfarct of hoogrisico TIA. Deze richtlijn is gebaseerd op een systematische review. De NHG-werkgroep heeft de bewijstabellen en de conclusies uit de richtlijn en de review besproken, en heeft een aanbeveling geformuleerd. In februari 2022 werd een aanvullende search uitgevoerd na de zoekdatum van de systematische review (juli 2018).
Resultaten
Resultaat zoekactie
De aanvullende search in februari 2022 leverde geen aanvullende RCTs op van na de zoekdatum van de systematische review (juli 2018).
Onderzoekskarakteristieken
In de systematische review werden 3 RCT’s geïncludeerd waarin duale therapie (acetylsalicylzuur en clopidogrel) werd vergeleken met acetylsalicylzuur monotherapie: FASTER, CHANCE en POINT. De onderzochte populatie bestond uit patiënten met een licht herseninfarct (in alle RCT’s gedefinieerd als een score ≤ 3 op de National Institutes of Health Stroke Scale (NIHSS)) of een hoogrisico TIA (in CHANCE en POINT gedefinieerd als een ABCD2-score ≥ 4; in FASTER gedefinieerd volgens de WHO-definitie).
- Kennedy 2017: RCT (FASTER) uitgevoerd in Noord-Amerika. Patiënten (n = 396) werden gerandomiseerd naar duale therapie met acetylsalicylzuur (81 mg/dag, eventueel met een oplaaddosis van 162 mg) en clopidogrel (oplaaddosis van 300 mg, daarna 75 mg/dag) (n = 201) of acetylsalicylzuur monotherapie (81 mg per dag , eventueel met een oplaaddosis van 162 mg) (n = 195). De patiënten waren gemiddeld 68 jaar oud en 47% was vrouw. De behandeling werd gestart binnen 24 uur na het optreden van de symptomen (mediaan 8,2-9,1 uur) en duurde 90 dagen.
- Wang 2013 : RCT (CHANCE) uitgevoerd in China. Patiënten (n = 5170) werden gerandomiseerd naar duale therapie met acetylsalicylzuur (op dag 1 een oplaaddosis van 75-300 mg, te bepalen door de behandelend arts, op dag 2-21 75 mg/dag, vanaf dag 22 geen acetylsalicylzuur meer) en clopidogrel (oplaaddosis van 300 mg, daarna 75 mg/dag) (n = 2584) of acetylsalicylzuur monotherapie (op dag 1 een oplaaddosis van 75-300 mg, te bepalen door de behandelend arts, daarna 75 mg/dag) (n = 2586). De patiënten waren mediaan 62-63 jaar oud en 34% was vrouw. De behandeling werd gestart binnen 24 uur na het optreden van de symptomen (mediaan 13 uur) en duurde 90 dagen.
- Johnston 2018: RCT (POINT) uitgevoerd in Noord-Amerika, Australië, Nieuw-Zeeland en verschillende Europese landen. Patiënten (n = 4881) werden gerandomiseerd naar duale therapie met acetylsalicylzuur (50-325 mg/dag vanaf dag 2; de aanbevolen dosering was 162 mg op dag 2-6 en daarna 81 mg/dag) en clopidogrel (oplaaddosis van 600 mg, daarna 75 mg/dag) (n = 2432) of acetylsalicylzuur monotherapie (50-325 mg/dag vanaf dag 2; de aanbevolen dosering was 162 mg op dag 2-6 en daarna 81 mg/dag) (n = 2449). De patiënten waren mediaan 65 jaar oud en 45% was vrouw. De behandeling werd gestart binnen 12 uur na het optreden van de symptomen (mediaan 7 uur) en duurde 90 dagen.
Zie tabel Duale behandeling met acetylsalicylzuur en clopidogrel vergeleken met acetylsalicylzuur monotherapie voor de samenvatting van de resultaten.
De auteurs van de review hebben daarnaast de timing van het stoppen met clopidogrel geanalyseerd. Het grootste voordeel van duale therapie (voorkomen van recidief infarct) wordt behaald in de eerste 10 dagen van de behandeling(OR 0,64; 95%-BI 0,55 tot 0,76), terwijl er tussen dag 22 en dag 90 niet of nauwelijks voordeel meer is (OR 1,47; 95%-BI 0,84 tot 2,56). Het toegenomen risico op bloedingen blijft echter bestaan tot dag 90. Dit impliceert dat de duale behandeling niet langer dan 21 dagen (mogelijk zelfs maar 10 dagen) zou moeten duren.
Conclusies
- Duale behandeling verlaagt het risico op een recidief herseninfarct vergeleken met monotherapie (kwaliteit van bewijs hoog); deze risicoverlaging treedt op in de eerste 21 dagen van de behandeling.
- Duale behandeling leidt waarschijnlijk tot een kleine, maar mogelijk belangrijke toename van het risico op een ernstige bloeding vergeleken met monotherapie (kwaliteit van bewijs redelijk).
- Er is waarschijnlijk niet of nauwelijks verschil in het risico op recidief TIA, sterfte, functionele afhankelijkheid en lage kwaliteit van leven (kwaliteit van bewijs redelijk).
Van bewijs naar aanbeveling
Voor- en nadelen
Duale therapie, gestart binnen 24 uur na het optreden van de verschijnselen en toegepast gedurende 3 weken, verlaagt het risico op een recidief herseninfarct bij patiënten met een licht herseninfarct of hoogrisico TIA, vergeleken met monotherapie. Daar staat tegenover dat duale therapie het risico op een ernstige bloeding waarschijnlijk verhoogt. Het absolute aantal bloedingen dat optreedt is echter klein. Er lijkt niet of nauwelijks verschil te zijn in het risico op sterfte, recidief TIA, functionele onafhankelijkheid en lage kwaliteit van leven.
Kwaliteit van bewijs
De kwaliteit van bewijs was redelijk tot hoog. De RCT’s waren goed uitgevoerd in populaties die vergelijkbaar zijn met de Nederlandse populatie. Voor sommige uitkomstmaten is afgewaardeerd voor onnauwkeurigheid vanwege brede betrouwbaarheidsintervallen.
Waarden en voorkeuren van patiënten
Duale therapie gedurende 3 weken voorkomt meer herseninfarcten dan dat er extra ernstige bloedingen optreden. Daarom verwacht de werkgroep dat de meeste patiënten zullen kiezen voor duale therapie gedurende een periode van 3 weken.
Kosten
Een economische analyse, gebaseerd op CHANCE, vond dat duale therapie bij patiënten met acute TIA of licht herseninfarct kosteneffectief was in vergelijking tot monotherapie. De additionele kosten waren $ 5200 per gewonnen QALY (referentiejaar 2011). Voor Nederland is geen economische analyse beschikbaar. Omdat de kosten voor clopidogrel niet hoog zijn (€ 0,08 per dag (Medicijnkosten.nl, geraadpleegd oktober 2021)) en de duur van de duale behandeling maar 3 weken is, neemt de werkgroep aan dat duale therapie ook in Nederland kosteneffectief zal zijn.
Aanvaardbaarheid
Duale therapie is aanvaardbaar voor zowel patiënten als huisartsen.
Bij patiënten ≥ 70 jaar geldt combinatiebehandeling van acetylsalicylzuur en clopidogrel als indicatie voor behandeling met een protonpompremmer (pantoprazol). Clopidogrel monotherapie is geen indicatie voor behandeling met een maagbeschermer; de combinatiebehandeling acetylsalicylzuur en dipyridamol is dat alleen bij bepaalde patiënten (zie NHG-Behandelrichtlijn Preventie van maagcomplicaties door geneesmiddelgebruik).
Haalbaarheid
Zowel acetylsalicylzuur als clopidogrel zijn goed verkrijgbaar in Nederland. De behandeling moet binnen 24 uur door de neuroloog gestart worden, hetgeen impliceert dat deze patiënten op korte termijn doorverwezen moeten worden.
Waarom deze aanbeveling?
Voor de meeste patiënten wegen de voordelen van duale behandeling (kleinere kans op een herseninfarct) zwaarder dan de nadelen (grotere kans op een ernstige bloeding; het absolute aantal bloedingen dat optreedt is echter klein). Dit heeft geleid tot een zwakke aanbeveling voor duale behandeling met acetylsalicylzuur en clopidogrel, gestart < 24 uur na ontstaan van de uitvalsverschijnselen bij patiënten met een minor stroke of hoogrisico TIA (ABCD2-score ≥ 4) voor een periode van ≤ 21 dagen.
Orale anticoagulantia
Naar Samenvatting ›- Vitamine K-antagonisten of DOAC’s zijn geïndiceerd na een TIA of herseninfarct als gevolg van atriumfibrilleren of een andere cardiale emboliebron, in plaats van (een) trombocytenaggregatieremmer(s). Voor keuze en dosering, zie NHG-Standaard Atriumfibrilleren.
- Orale anticoagulantia worden, afhankelijk van de grootte van het infarct, direct of tot maximaal 14 dagen na het herseninfarct gestart. Bij een groot infarct verhoogt eerder starten waarschijnlijk het risico op hemorragische transformatie van het herseninfarct. In deze eerste periode gebruikt de patiënt tijdelijk een trombocytenaggregatieremmer.
Bij circa 15 tot 25% van de patiënten die een TIA of herseninfarct hebben doorgemaakt is dit het gevolg van een cardiale emboliebron, voornamelijk atriumfibrilleren. Vitamine K-antagonisten zijn effectiever dan acetylsalicylzuur bij patiënten met atriumfibrilleren die een TIA of herseninfarct hebben doorgemaakt in het voorkomen van een herseninfarct. In de European Atrial Fibrillation Trial (EAFT) bleek behandeling met vitamine K-antagonisten het herhalingsrisico met naar schatting 65% te reduceren ten opzichte van behandeling met placebo. De absolute risicoreductie (ARR) bedraagt 8%. Uit een Cochrane-review (2 RCT’s, n = 1.371) blijkt dat behandeling met vitamine K-antagonisten versus behandeling met trombocytenaggregatieremmers bij patiënten met atriumfibrilleren die reeds een TIA of herseninfarct hebben doorgemaakt, leidt tot een significante reductie van de kans op het samengestelde eindpunt vasculaire sterfte, myocardinfarct, herseninfarct en systemische embolie (Peto OR 0,67; 95%-BI 0,50 tot 0,91) en de kans op een recidief herseninfarct (Peto OR 0,49; 95%-BI 0,33 tot 0,72). Dit gunstige effect werd deels tenietgedaan door een toename van ernstige, extracraniële bloedingscomplicaties (Peto OR 5,16; 95%-BI 2,08 tot 12,83). Er was geen significant verschil in het optreden van intracraniële bloedingen. Volgens de huidige inzichten ligt de streefwaarde van de internationaal gestandaardiseerde protrombinetijdratio (International Normalized Ratio (INR)) tussen de 2,0 en 3,0.
De vraag of vitamine K-antagonisten ook beter dan trombocytenaggregatieremmers tegen vasculaire complicaties beschermen bij patiënten die een TIA of herseninfarct hebben doorgemaakt zonder cardiale emboliebron, is onderwerp van een recente meta-analyse (8 RCT’s, n = 5762). Behandeling met vitamine K-antagonisten bleek bij geen enkele antistollingsintensiteit effectiever dan behandeling met acetylsalicylzuur in het voorkomen van ischemische complicaties. Er was echter sprake van een significante toename van ernstige bloedingscomplicaties in de patiëntengroep die met vitamine K-antagonisten werd behandeld (INR 2,0-3,0: RR 1,93; 95%-BI 1,27 tot 2,94, INR 3,0-4,5: RR 9,02; 95%-BI 3,91 tot 20,8).
Conclusie
Bij patiënten die een TIA of herseninfarct hebben doorgemaakt en bij wie sprake is van een cardiale emboliebron, zoals (paroxismaal) atriumfibrilleren, biedt behandeling met vitamine K-antagonisten betere bescherming tegen vasculaire complicaties dan behandeling met acetylsalicylzuur.
Achtergrond
Sinds 2012 is er een alternatief voor vitamine K-antagonisten beschikbaar: de zogeheten directwerkende orale anticoagulantia (DOAC’s, voorheen NOAC’s). Dabigatran (directe trombineremmer), edoxaban, rivaroxaban en apixaban (directe factor Xa-remmers) zijn in Europa geregistreerd voor de indicatie ‘preventie van beroerte en systemische embolie bij niet-valvulair atriumfibrilleren’. Het is de vraag hoe deze middelen zich verhouden tot de vitamine K-antagonisten bij patiënten met niet-valvulair atriumfibrilleren bij patiënten die eerder een TIA of herseninfarct doormaakten.
Deze tekst is gebaseerd op de NHG-Standaard Atriumfibrilleren.
Uitgangsvraag
Zijn DOAC’s vergeleken met vitamine K-antagonisten aan te bevelen bij patiënten van 65 jaar en ouder met niet-valvulair atriumfibrilleren die eerder een TIA of herseninfarct doormaakten?
Resultaten
De search leidde tot twee Cochrane-reviews over directe trombineremmers (dabigatran) en factor Xa-remmers (apixaban, edoxaban, rivaroxaban) en een netwerkmeta-analyse waarin onderzoeken naar orale antitrombotica ter preventie van herseninfarct bij patiënten met atriumfibrilleren van 65 jaar en ouder zijn geïncludeerd. We gebruiken hier de resultaten van de netwerkmeta-analyse (n = 897.748), omdat daarin de bevindingen uit 25 RCT’s en de resultaten van 24 cohortonderzoeken zijn betrokken. De meeste daarvan vergeleken warfarine met een DOAC. Daarbij is vooral gekeken naar bewijs voor non-inferioriteit van de DOAC’s, waarbij een conservatieve non-inferioriteitsmarge van 10% wordt gehanteerd. Omdat in deze netwerkmeta-analyse geen subgroepanalyses werden gedaan naar de subgroep patiënten die een TIA of herseninfarct doormaakten, worden ook de resultaten van vooraf gedefinieerde subgroepanalyses van 3 gerandomiseerde non-inferiority trials beschreven. In deze subgroepanalyses werd de effectiviteit en veiligheid van de DOAC’s ten opzichte van warfarine bij patiënten met een voorgeschiedenis van een TIA of herseninfarct onderzocht.
Kwaliteit van bewijs
De RCT’s waren van goede kwaliteit, maar kwaliteit van bewijs uit de RCT’s voor de verschillende uitkomstmaten is overwegend matig, soms laag. Er is afgewaardeerd omdat de onderzoeksgroepen niet geheel representatief zijn voor de patiëntenpopulatie met een indicatie voor antistolling in de huisartsenpraktijk; ze hadden gemiddeld minder comorbiditeit. Dit laatste is verdisconteerd door een terughoudender beleid te formuleren voor deze specifieke subgroepen. Daarnaast is soms afgewaardeerd voor onnauwkeurigheid (bijvoorbeeld door lage aantallen complicaties en daardoor brede betrouwbaarheidsintervallen). Er is niet afgewaardeerd vanwege het feit dat de meeste onderzoeken DOAC’s vergelijken met warfarine (en niet met de in Nederland verkrijgbare vitamine K-antagonisten acenocoumarol of marcoumar), omdat de mate van ontstolling bij vitamine K-antagonisten steeds gecontroleerd is met bepaling van de INR. Evenmin is afgewaardeerd voor het feit dat het meeste onderzoek verricht is in landen zonder trombosedienst, omdat er onvoldoende aanwijzingen zijn dat de time in therapeutic range (TTR) in Nederland hoger is dan in andere landen of dat een hogere TTR bij gebruik van vitamine K-antagonisten de gelijkwaardige effectiviteit van DOAC’s doet verdwijnen.
Effectiviteit
Uit de RCT’s blijkt dat DOAC’s niet inferieur zijn aan warfarine wat betreft het voorkómen van beroerte (hersenbloeding en herseninfarct) en systemische embolieën, evenals het voorkómen van sterfte aan alle oorzaken. Alleen voor rivaroxaban, apixaban en edoxaban kan inferioriteit niet geheel worden uitgesloten voor de uitkomstmaat herseninfarct. De cohortonderzoeken bevestigen deze resultaten in grote lijnen. Subgroepanalyses naar leeftijd laten geen grote verschillen in effectiviteit zien tussen de leeftijdsgroepen 65 tot 75 en 75 tot 85 jaar.
In de subgroepanalyses van drie gerandomiseerde non-inferiority trials bleken de effecten van de DOAC’s bij patiënten met een voorgeschiedenis van een TIA of herseninfarct consistent met de resultaten van de gehele onderzoekspopulatie. In deze onderzoeken werden echter geen patiënten geïncludeerd tijdens de eerste veertien dagen na een herseninfarct of de eerste zeven tot veertien dagen na een TIA. De meerderheid van de patiënten werd zelfs pas meer dan een jaar na de TIA of het herseninfarct geïncludeerd. Hierdoor is er geen uitspraak te doen over de veiligheid van de behandeling met DOAC’s gedurende de eerste weken na een TIA of herseninfarct. Verder is het opvallend dat het jaarlijks percentage recidief herseninfarcten in de patiëntengroep die met warfarine werd behandeld laag is (2,8 tot 3,0% per jaar) ten opzichte van eerdere onderzoeken, zoals het EAFT-onderzoek (4,0% per jaar).
Veiligheid
Wat betreft het optreden van ernstige bloedingen zijn dabigatran, apixaban en edoxaban in de RCT’s niet inferieur aan warfarine; voor rivaroxaban kan dit niet worden uitgesloten. Intracraniële bloedingen komen in de RCT’s minder voor bij alle DOAC’s dan bij warfarine. De gegevens over het optreden van gastro-intestinale bloedingen en myocardinfarcten zijn minder duidelijk: de brede betrouwbaarheidsintervallen door lage aantallen leiden tot uiteenlopende resultaten tussen DOAC’s onderling. De gegevens uit de cohortonderzoeken over het optreden van bijwerkingen, voor zover beschikbaar, zijn hiermee overwegend in overeenstemming. Wel laten subgroepanalyses naar leeftijd verschillen zien: bij de oudste ouderen (75 tot 85 jaar) leiden DOAC’s in vergelijking met warfarine mogelijk vaker tot ernstige bloedingen, met name gastro-intestinale bloedingen. Intracraniële bloedingen deden zich overigens ook bij de oudste ouderen minder vaak voor bij gebruik van dabigatran, apixaban en edoxaban dan bij warfarine.
Conclusie
Het is vrij zeker dat DOAC’s even effectief zijn als vitamine K-antagonisten in het voorkomen van trombo-embolische gebeurtenissen en sterfte bij patiënten met atriumfibrilleren. Voor patiënten tot 75 jaar zonder veel comorbiditeit zijn er geen aanwijzingen voor het optreden van extra bijwerkingen bij gebruik van DOAC’s, terwijl de middelen leiden tot minder intracraniële bloedingen. Dit geldt waarschijnlijk ook voor patiënten die eerder een herseninfarct doormaakten. Uit cohortonderzoek blijkt dat voor patiënten van 75 jaar en ouder bij gebruik van dabigatran en rivaroxaban enige zorg gerechtvaardigd blijft over het vaker optreden van gastro-intestinale bloedingen.
Van bewijs naar aanbeveling
Voor de indicatie niet-valvulair atriumfibrilleren is de gelijkwaardige effectiviteit van DOAC’s ten opzichte van vitamine K-antagonisten voldoende aangetoond. Er zijn geen aanwijzingen dat gebruik van DOAC’s gepaard gaat met meer bloedingen dan gebruik van vitamine K-antagonisten, hoewel dit niet geheel kan worden uitgesloten. Dit is het gevolg van de lage aantallen complicaties (en daardoor bredere betrouwbaarheidsintervallen) voor wat betreft een deel van de DOAC’s en sommige bloedingscategorieën. Ten slotte zijn er duidelijke aanwijzingen dat DOAC-gebruik gepaard gaat met minder intracraniële bloedingen. Enige zorg blijft gerechtvaardigd over eventuele extra gastro-intestinale bloedingen bij 75-plussers.
Praktisch voordeel van DOAC-gebruik is de vaste dosering: titreren door periodieke bloedafname en bepaling van de INR door de trombosedienst zijn niet nodig. Dit komt de patiëntvriendelijkheid en het gebruiksgemak ten goede, wat kan bijdragen aan een betere therapietrouw. Anderzijds kunnen INR-controles bij vitamine K-antagonisten bijdragen aan een betere therapietrouw. Daarnaast wordt onder- en overdosering door interacties met andere medicatie, veranderende farmacokinetiek (bijvoorbeeld door het stijgen van de leeftijd, of door optredende comorbiditeit (bijvoorbeeld infecties)) eerder gesignaleerd. De voorschrijvend arts kan de therapietrouw bij DOAC-gebruik minder goed monitoren. Hierbij is het ook van belang dat DOAC’s vaker dan vitamine K-antagonisten aanleiding geven tot gastro-intestinale bijwerkingen (misselijkheid en/ of diarree), waardoor patiënten soms stoppen met de medicatie. Uit de RCT’s bleek dat patiënten die DOAC’s gebruikten vaker stopten vanwege bijwerkingen dan degenen die warfarine gebruikten.
Vergeleken met vitamine K-antagonisten lijken DOAC’s minder frequent interacties aan te gaan met andere geneesmiddelen. Een kanttekening hierbij is dat DOAC’s nog relatief kort op de markt zijn waardoor wellicht nog niet alle interacties in kaart zijn gebracht.
Een nadeel van DOAC’s is de hogere prijs in vergelijking met vitamine K-antagonisten, waarbij de exacte prijs onbekend is vanwege geheime prijsafspraken.
Dit verschil wordt slechts gedeeltelijk tenietgedaan door de (sterk uiteenlopende) kosten van de trombosedienst bij gebruik van vitamine K-antagonisten. Het is onduidelijk of er verschillen in effectiviteit en veiligheid tussen de verschillende DOAC’s zijn; op dit moment is er geen reden om een van de DOAC’s wel of niet aan te bevelen, zie de NHG-Standaard Atriumfibrilleren.
Op basis van de beschikbare gegevens over effectiviteit, veiligheid en gebruiksgemak zijn DOAC’s een gelijkwaardig alternatief voor vitamine K-antagonisten voor de meeste patiënten met de indicatie niet-valvulair atriumfibrilleren, en waarschijnlijk ook voor de subgroep patiënten die een TIA of herseninfarct hebben doorgemaakt. Voor de contra-indicaties van de DOAC’s en richtlijnen voor het maken van een keuze tussen behandeling met vitamine K-antagonisten of de DOAC’s: zie NHG-Standaard Atriumfibrilleren.
Aanbeveling
DOAC’s (voorheen NOAC’s) zijn een gelijkwaardig alternatief voor vitamine K-antagonisten voor patiënten met niet-valvulair atriumfibrilleren die een TIA of herseninfarct hebben doorgemaakt. Voor de contra-indicaties van de DOAC’s en richtlijnen voor het maken van een keuze tussen behandeling met vitamine K-antagonisten of de DOAC’s, zie NHG-Standaard Atriumfibrilleren.
Cholesterolverlagende medicatie
Naar Samenvatting ›Zie voor streefwaarden, voorkeursmiddelen en stopcriteria NHG-Standaard Cardiovasculair risicomanagement).
In het Stroke Prevention by Aggressive Reduction in Cholesterol Levels (SPARCL-)onderzoek werd de effectiviteit en veiligheid onderzocht van behandeling met 80 mg atorvastatine per dag in vergelijking tot placebo bij patiënten die 1 tot 6 maanden voorafgaand aan de randomisatie een niet-invaliderende beroerte (rankinscore = 3) hadden doorgemaakt. Het betreft een gerandomiseerd, dubbelblind onderzoek (n = 4731, gemiddelde follow-up 4,9 jaar). Patiënten werden geïncludeerd indien zij een LDL-cholesterolwaarde tussen 2,6 en 4,9 mmol/l hadden en niet bekend waren met coronair vaatlijden. Patiënten met een cardiale emboliebron werden geëxcludeerd. In de atorvastatinegroep daalde het LDL-cholesterol met 45% (tot 1,6 mmol/l), in de placebogroep met 4% (tot 3,3 mmol/l). De primaire uitkomstmaat, fatale en niet-fatale beroerte, werd significant minder frequent bereikt in de atorvastatinegroep in vergelijking tot de placebogroep (11,2 versus 13,1%; p = 0,03). De absolute risicoreductie bedraagt 2,2% per 5 jaar, number needed to treat (NNT) 46 gedurende 5 jaar. Daarnaast was sprake van een significante reductie van belangrijke cardiovasculaire gebeurtenissen (beroerte, myocardinfarct of overlijden als gevolg van een cardiale oorzaak) (14,1 versus 17,2%; p = 0,002; NNT 29 gedurende 5 jaar). Er was geen verschil in de totale mortaliteit. Er traden significant vaker intracerebrale bloedingen op in de atorvastatinegroep in vergelijking tot de placebogroep (2,3 versus 1,4%; HR 1,66; 95%-BI 1,08 tot 2,55; NNH 111). De behandeling met de hoge dosering atorvastatine werd goed verdragen.
De optimale LDL-concentratie om een beroerte te voorkomen is niet bekend. In dit onderzoek werd 80 mg atorvastatine voorgeschreven, het is onbekend of een lagere dosis afdoende is.
In een secundaire analyse van de Heart Protection Study werd het effect van behandeling met simvastatine 40 mg/dag onderzocht in de subgroep patiënten die een beroerte hadden doorgemaakt en een totaal cholesterolwaarde > 3,5 mmol/l hadden (n = 3280, gemiddeld interval tussen event en inclusie 4,3 jaar). In deze studie bleek geen sprake van een reductie van het aantal beroertes ten tijde van behandeling met simvastatine. Wel was er sprake van een significante reductie van de kans op een vasculaire gebeurtenis: 24,7% in de statine- versus 29,8% in de placebogroep; p = 0,001.
Een drietal meta-analyses, die voornamelijk op bovenstaande 2 onderzoeken zijn gebaseerd, tonen een geringe reductie van de kans op een beroerte bij patiënten die een beroerte hebben doorgemaakt (OR 0,88; 95%-BI 0,77 tot 1,00), gepoold relatief risico 0,88 (95%-BI 0,78 tot 0,99); RR 0,84 (95%-BI 0,71 tot 0,99). Daarnaast was sprake van een overtuigendere reductie van de kans op een vasculaire gebeurtenis (beroerte, myocardinfarct en vasculaire mortaliteit) OR 0,74 (95%-BI 0,67 tot 0,82), gepoold relatief risico 0,83 (95%-BI 0,76 tot 0,90) en HR 0,80 (95%-BI 0,69 tot 0,92).
In de NHG-Standaard Cardiovasculair risicomanagement (2012) staat het advies te starten met simvastatine 40 mg/dag en een LDL-waarde van ≤ 2,5 mmol/l na te streven.
De Europese richtlijn voor cardiovasculair risicomanagement uit 2016 houdt echter bij zeer hoogrisicopatiënten met atherosclerotische cardiovasculaire aandoeningen (gedocumenteerd acuut myocardinfarct, coronair vaatlijden, aneurysma van de aorta, herseninfarct of TIA, perifeer arterieel vaatlijden óf significante stenosering/plaquevorming van de carotiden) een bovengrens voor het LDL-cholesterol van 1,8 mmol/l aan. Bij de herziening van de NHG-Standaard Cardiovasculair risicomanagement zal ter sprake komen of deze aanbeveling wordt overgenomen.
Conclusie
Behandeling met een statine bij patiënten die een TIA of herseninfarct hebben doorgemaakt leidt tot een reductie van de kans op een herseninfarct en andere cardiovasculaire gebeurtenissen. Voor het beleid (keuze statine, LDL-streefwaarde) wordt verwezen naar de NHG-Standaard Cardiovasculair risicomanagement.
Antihypertensiva
Naar Samenvatting ›- Zie voor streefwaarden en voorkeursmiddelen NHG-Standaard Cardiovasculair risicomanagement.
- Wees vooral bij ouderen alert op bijwerkingen en op interacties met eventuele comedicatie.
- Verlaag de bloeddruk langzaam naar de streefwaarde bij een onbehandelde hooggradige (≥ 70%) carotisstenose of -occlusie; controleer de bloeddruk regelmatig, bijvoorbeeld elke 2 weken.
Behandeling met de ACE-remmer perindopril, eventueel in combinatie met het diureticum indapamide, reduceert het risico op een recidief beroerte na TIA, herseninfarct of hersenbloeding in de eerste 4 jaar met gemiddeld 28% (95%-BI 17 tot 38%) en het risico op het samengestelde eindpunt myocardinfarct, beroerte of vasculaire mortaliteit met 26% (95%-BI 16 tot 34%). Uit het PROGRESS-onderzoek (n = 6105, gemiddelde follow-up 3,9 jaar) bleek dat het effect onafhankelijk was van de diagnose bij randomisatie en van de aanwezigheid van belangrijke risicofactoren. Een gunstig effect werd alleen gezien in de subgroep die met de combinatie perindopril en indapamide werd behandeld. De gemiddelde bloeddrukdaling in deze groep was ook groter dan in de groep die met monotherapie werd behandeld (12/5 mmHg versus 5/3 mmHg). Het gunstige effect was in dezelfde orde van grootte bij patiënten met een niet-verhoogde bloeddruk. Hierbij dient te worden aangetekend dat verhoogde bloeddruk werd gedefinieerd als een systolische bloeddruk (SBD) ≥ 160 mmHg of een diastolische bloeddruk (DBD) ≥ 90 mmHg. Meer dan een derde van de patiënten had echter bij randomisatie een SBD < 140 mmHg en een DBD < 90 mmHg, terwijl slechts een kwart van de patiënten een SBD ≥ 160 mmHg had en een vijfde een DBD ≥ 95 mmHg. Er waren geen aanwijzingen voor een toename van complicaties bij lagere bloeddrukwaarden.
Op basis van deze resultaten kan worden geconcludeerd dat niet de absolute hoogte van de bloeddruk, maar vooral de mate van bloeddrukverlaging van belang is, waarbij de grootste absolute risicoreductie behaald wordt bij patiënten met de hoogste recidiefkans.
Een groot gerandomiseerd onderzoek (n = 20.332; gemiddelde follow-up 2,5 jaar) toonde geen effect van het toevoegen van telmisartan, een angiotensine-II-antagonist, aan de gebruikelijke bloeddrukbehandeling na een herseninfarct op de eindpunten recidief infarct, belangrijke cardiovasculaire gebeurtenissen of het ontstaan van diabetes mellitus type 2. In een post-hocanalyse van dit onderzoek werd de relatie onderzocht tussen de gemiddelde systolische spreekkamerbloeddruk tijdens de follow-up van 2,5 jaar en het risico op een recidief beroerte. De secundaire uitkomstmaat was een combinatie van beroerte, myocardinfarct en mortaliteit door vasculaire oorzaak. Zowel de primaire als de secundaire uitkomstmaat werd het meest frequent behaald in de groep patiënten met een systolische bloeddruk (SBD) ≥ 150 mmHg, gevolgd door de groep met een SBD 140 tot 150 mmHg, < 120 mmHg, 120 tot 130 mmHg en 130 tot 140 mmHg. In de subgroep patiënten ouder dan 75 jaar werd de secundaire uitkomstmaat het meest frequent behaald in de groep patiënten met een SBD < 120 mmHg. Deze resultaten komen niet overeen met de resultaten van het PROGRESS-onderzoek. Aangezien het secundaire analyses betreft, kunnen de resultaten slechts als hypothesevormend beschouwd worden en moeten de bevindingen eerst bevestigd worden in gerandomiseerd onderzoek alvorens de streefwaarden voor bloeddrukbehandeling aan te passen.
Een meta-analyse (10 RCT’s, n = 37.737), waarin onder andere bovenstaande onderzoeken zijn geïncludeerd, toont dat behandeling met antihypertensiva in de secundaire preventie na een beroerte tot een significante reductie leidt op de eindpunten recidief beroerte (OR 0,71; 95%-BI 0,59 tot 0,86) en cardiovasculaire gebeurtenissen (mortaliteit als gevolg van vasculaire oorzaak, recidief beroerte, myocardinfarct) (OR 0,69; 95%-BI 0,57 tot 0,85). Er was geen effect op de totale mortaliteit. Inmiddels is van diuretica, ACE-remmers en angiotensine-II-antagonisten aangetoond dat ze effectief en veilig zijn bij patiënten die recent een beroerte hebben doorgemaakt. Voor calciumantagonisten en bètablokkers bestaan onvoldoende gegevens met betrekking tot de secundaire preventie na een beroerte.
Conclusie
Het is zinvol om alle patiënten na een beroerte te behandelen met een antihypertensivum, indien dit goed verdragen wordt. Het advies is om het stappenplan, zoals beschreven in de NHG-Standaard Cardiovasculair risicomanagement, te volgen.
Beleid na een herseninfarct als gevolg van arteriële dissectie
Naar Samenvatting ›Patiënten met een herseninfarct als gevolg van arteriële dissectie worden gedurende 3-6 maanden met orale anticoagulantia of een trombocytenaggregatieremmer behandeld.
Een dissectie van de cervicale arteriën is in 1 tot 2,5% van de gevallen de oorzaak van een herseninfarct. Dit treedt vooral op bij jongvolwassenen. Als gevolg van de scheur in de vaatwand ontstaan stolsels die een emboliebron vormen. Daarnaast kan zwelling van de vaatwand leiden tot verkleining van de diameter van het lumen van het bloedvat en op deze manier aanleiding geven tot hemodynamische veranderingen.
Er bestaat geen gerandomiseerd onderzoek naar de effectiviteit van behandeling ter preventie van (recidief) ischemie. In de praktijk worden patiënten met een dissectie over het algemeen met trombocytenaggregatieremmers of acetylsalicylzuur behandeld gedurende 2 tot 6 maanden, om (recidief) ischemie te voorkomen. In een Cochrane-review over 36 niet-gerandomiseerde onderzoeken (n = 1285) en een meer recente meta-analyse over 40 niet-gerandomiseerde onderzoeken (n = 1636) werd geen meerwaarde aangetoond van één van deze therapieën ten opzichte van elkaar. Er zijn geen onderzoeken verricht naar de effectiviteit van antihypertensiva en cholesterolverlagende medicatie bij patiënten die een herseninfarct als gevolg van een dissectie van de a. carotis hebben doorgemaakt. Gezien de pathofysiologie van een dissectie bestaat er geen indicatie om deze patiënten routinematig met antihypertensiva en cholesterolverlagende medicatie te behandelen.
Na een intracerebrale bloeding
Naar Samenvatting ›Trombocytenaggregatieremmers
Naar Samenvatting ›Trombocytenaggregatieremmers kunnen waarschijnlijk veilig gebruikt worden bij patiënten met een intracerebrale bloeding die optrad tijdens het gebruik van antitrombotische medicatie (trombocytenaggregatieremmers of orale anticoagulantia).
- Waarschijnlijk leiden trombocytenaggregatieremmers niet tot een hogere kans op een recidief intracerebrale bloeding.
- Overleg zo nodig met de neuroloog over de termijn waarop de trombocytenaggregatieremmer herstart kan worden.
Er lijkt geen duidelijk toegenomen kans op schade te zijn na het herstarten van trombocytenaggregatieremmers na de acute fase van een intracerebrale bloeding (tijdens het gebruik van antitrombotische medicatie). Herstarten lijkt ook geen duidelijke voordelen te hebben, behalve mogelijk een kleinere kans op een herseninfarct. Deze onzekerheid is mogelijk het gevolg van een gebrek aan power door de relatief kleine patiëntenaantallen en de korte follow-upduur. Uit andere trials bleken trombocytenaggregatieremmers wel tot betere uitkomsten te leiden bij patiënten met ischemische hart- en vaatziekten in de voorgeschiedenis.
De beslissing om een trombocytenaggregatieremmer wel of niet te herstarten moet daarom zorgvuldig besproken worden met de patiënt en eventueel diens familie, rekening houdend met individuele patiëntenfactoren om in te schatten of de voordelen opwegen tegen de nadelen. Voor een patiënt met een hoger risico op ischemische hart- en vaatziekten (zoals bij instabiele angina pectoris) zal de afweging wellicht anders zijn dan voor een patiënt met een hoger bloedingsrisico. Deze afweging zal bij de patiënt met een intracerebrale bloeding primair worden gemaakt door de neuroloog, eventueel in samenspraak met de cardioloog, tijdens de ziekenhuisopname. De huisarts krijgt een rol als de patiënt op een later moment een indicatie voor een trombocytenaggregatieremmer krijgt. Overleg in dat geval zo nodig met de neuroloog en/of cardioloog.
Voor- en nadelen
Het herstarten van een trombocytenaggregatieremmer (in het gebruikte onderzoek mediaan 76 dagen na het ontstaan van de uitvalsverschijnselen) leek niet of nauwelijks effect te hebben op het voorkómen van ischemische hart- en vaatziekten (mogelijk wel op het voorkómen van herseninfarcten), maar ook niet op het optreden van intracerebrale bloedingen, (andere) ernstige bloedingen en sterfte na drie jaar follow-up. Mogelijk geven trombocytenaggregatieremmers op de langere termijn meer bescherming tegen ischemische events, maar dat is op basis van het huidige onderzoek niet vast te stellen.
Kwaliteit van bewijs
Het bewijs is gebaseerd op 1 onderzoek uitgevoerd in het Verenigd Koninkrijk en is laag vanwege het risico op bias (met name doordat de deelnemers en behandelend artsen niet geblindeerd waren) en onnauwkeurigheid (door de kleine aantallen gebeurtenissen).
Waarden en voorkeuren van patiënten
De voor- en nadelen leken na 3 jaar vergelijkbaar, ongeacht het al dan niet herstarten van trombocytenaggregatieremmers, al is de kans op een herseninfarct mogelijk iets kleiner bij herstarten. Hoewel niet is onderzocht hoe de balans op de langere termijn is, is het aannemelijk dat trombocytenaggregatieremmers op de langere termijn bescherming geven tegen ischemische events, terwijl deze wat betreft bloedingen niet veel kwaad kunnen. Als dit wordt uitgelegd aan patiënten na een intracerebrale bloeding, zullen de meesten kiezen voor het starten met trombocytenaggregatieremmers, al zal dat mede afhangen van hun persoonlijke omstandigheden en risico-inschatting.
Kosten
De kosten van trombocytenaggregatieremmers zijn laag.
Aanvaardbaarheid
Zowel starten met als vermijden van trombocytenaggregatieremmers is aanvaardbaar voor (huis)artsen en patiënten.
Haalbaarheid
Geen bijzonderheden.
Uitgangsvraag
Is (her)start van trombocytenaggregatieremmers aan te bevelen bij patiënten met een intracerebrale bloeding ten tijde van gebruik van trombocytenaggregatieremmers of orale anticoagulantia? Zie de PICO-tabel.
|
Patiënten |
Patiënten met een intracerebrale bloeding ten tijde van gebruik van trombocytenaggregatieremmers of orale anticoagulantia |
|---|---|
|
Interventie |
Trombocytenaggregatieremmers |
|
Vergelijking |
Geen trombocytenaggregatieremmers of placebo |
|
Uitkomstmaten (follow-upduur 3 maanden) |
Cruciaal
|
Achtergrond
Ongeveer 1 op de 3 volwassenen met een spontane intracerebrale bloeding gebruikt trombocytenaggregatieremmers of anticoagulantia vanwege eerdere hart- en vaatziekten of risicofactoren daarvoor. Na een intracerebrale bloeding worden deze middelen direct gestopt vanwege het risico op groei van het hematoom. Of het aan te bevelen is deze middelen na de intracerebrale bloeding weer op te starten is onduidelijk. In theorie verhogen ze het risico op een recidief intracerebrale bloeding, maar verlagen ze het risico op een trombotisch event.
Methoden
Er is een systematische literatuurzoekactie naar systematische reviews en RCT’s uitgevoerd in PubMed in oktober 2021, met een update in februari 2022.
Resultaten
Resultaat zoekactie
De zoekvraag leverde 1 systematische review op naar het herstarten van trombocytenaggregatieremmers bij patiënten met een intracerebrale bloeding. In deze review werd 1 RCT geïncludeerd: de RESTART-trial. Een aanvullende search na de zoekdatum van de systematische review (juli 2021) leverde een recentere publicatie van de RESTART-trial met een langere follow-upduur op. De update in februari 2022 leverde geen nieuwe RCT’s op.
Onderzoekskarakteristieken
RESTART: RCT uitgevoerd in 122 ziekenhuizen in het Verenigd Koninkrijk naar het herstarten van trombocytenaggregatieremmers bij patiënten met een intracerebrale bloeding ten tijde van het gebruik van antistolling (trombocytenaggregatieremmers en/of orale anticoagulantia). Er werden 537 patiënten geïncludeerd met een intracerebrale bloeding, bij wie de patiënt (of naaste) en de behandelend arts twijfelden of er wel of niet gestart zou moeten worden met trombocytenaggregatieremmers. Ongeveer 25% van de patiënten had atriumfibrilleren en 88% had voorafgaand aan de hersenbloeding een ischemisch event (17% had beide). De patiënten werden gerandomiseerd naar het starten met (n = 268) of vermijden van (n = 269) trombocytenaggregatieremmers (oraal acetylsalicylzuur, dipyridamol, clopidogrel of een combinatie, dosering te bepalen door behandelend arts), mediaan 76 dagen na het optreden van de uitvalsverschijnselen. De gemiddelde leeftijd van de patiënten was 76 jaar en ongeveer een derde was vrouw. De patiënten en hun behandelende artsen waren niet geblindeerd. De onderzoeksmedewerkers en het team dat de uitkomsten beoordeelde waren wel geblindeerd. De patiënten werden in eerste instantie gevolgd gedurende mediaan 2 jaar. Daarna werd de trial met 1 jaar verlengd, tot mediaan 3 jaar follow-up.
Effectiviteit en bijwerkingen
Zie tabel Starten versus niet starten met trombocytenaggregatieremmers voor de samenvatting van de resultaten.
Conclusies
- Mogelijk leidt starten met trombocytenaggregatieremmers tot een kleinere kans op een herseninfarct (kwaliteit van bewijs laag).
- Mogelijk is er niet of nauwelijks verschil in risico op ischemische hart- en vaatziekten, intracerebrale bloeding, ernstige bloeding en sterfte (kwaliteit van bewijs laag).
- Overige bijwerkingen en kwaliteit van leven zijn niet onderzocht.
Anticoagulantia
Naar Samenvatting ›De beslissing om orale anticoagulantia te hervatten of deze te vervangen door trombocytenaggregatieremmers wordt door de neuroloog en cardioloog genomen. Hierbij moeten de risico’s op een trombo-embolie en recidief intracerebrale bloeding tegen elkaar afgewogen worden. Overleg, indien er op een later moment een indicatie voor orale anticoagulantia ontstaat, met de neuroloog.
Antihypertensiva
Naar Samenvatting ›- Ook bij een systolische bloeddruk ≤140 mmHg is bloeddrukverlagende behandeling geïndiceerd, mits een lagere bloeddruk wordt verdragen (zie Antihypertensiva).
- Zie voor de keuze van antihypertensiva NHG-Standaard Cardiovasculair risicomanagement.
Cholesterolverlagende medicatie
Naar Samenvatting ›Een intracerebrale bloeding is geen indicatie voor behandeling met een statine.
Behandeling van patiënten die een TIA of herseninfarct hebben doorgemaakt met statines leidt tot een significante reductie van het risico op een recidief herseninfarct en andere vasculaire ziekten. In de Stroke Prevention by Aggressive Reduction in Cholesterol Levels (SPARCL)-studie bleek uit post-hocanalyses dat er sprake was van een toegenomen risico op een hersenbloeding bij behandeling met atorvastatine in het kader van secundaire preventie na een beroerte (2,3% in de atorvastatine- versus 1,4% in de placebogroep, HR 1,66; 95%-BI 1,0 tot 2,55).
Uit een secundaire analyse blijkt dat de patiënten die een intracerebrale bloeding hadden doorgemaakt (2% van de patiënten, n = 93) voorafgaand aan de inclusie het hoogste risico hierop hebben (HR 5,65; 95%-BI 2,82 tot 11,30). Daarnaast was er bij deze patiënten ook sprake van een toename van de kans op een recidief beroerte of ander cardiovasculaire gebeurtenis ten tijde van de behandeling met atorvastatine (HR 2,82; 95%-BI 0,89 tot 9,01). Er kon geen relatie worden aangetoond tussen de waarde van het totale cholesterol of LDL-cholesterol en de kans op een intracerebrale bloeding.
In de subgroepanalyse van de Heart Protection Study over patiënten die een beroerte hadden doorgemaakt (n = 3280, gemiddeld interval tussen event en inclusie 4,3 jaar) bleek sprake van een niet-significante toename van het aantal patiënten dat een hersenbloeding doormaakte in de statinegroep.
De bevinding dat behandeling met een statine na een beroerte in het kader van secundaire preventie tot een verhoogde kans op een intracerebrale bloeding leidt, wordt in 3 meta-analyses bevestigd: HR 1,73; 95%-BI 1,19 tot 2,50 en HR 1,72; 95%-BI 1,20 tot 2,46. Uit berekeningen volgens een Markov-model bleek het risico op een hersenbloeding vooral verhoogd bij patiënten die eerder een lobaire bloeding hadden doorgemaakt. Bij deze patiënten leidde het toepassen van behandeling met een statine tot een stijging van het jaarlijkse risico op een intracerebrale bloeding van 14 naar 22% en een 2,2 jaar kortere levensduur. Bij een bloedingslokalisatie dieper in de hersenen (basale ganglia of thalamus) lijken de risico’s van behandeling met een statine minder groot.
Onderzoek primair gericht op de effectiviteit en veiligheid van statines bij patiënten die een intracerebrale bloeding hebben doorgemaakt ontbreekt. De bewijskracht van bovenstaande onderzoeken is verminderd door het kleine aantal patiënten met een intracerebrale bloeding ten tijde van de inclusie. Daarnaast zijn de bevindingen gebaseerd op secundaire analyses en is de in het SPARCL-onderzoek onderzochte dosering atorvastatine 80 mg hoog. Het is onbekend of bij een lagere dosering ook sprake is van een toegenomen risico op intracerebrale bloedingen. Statines verminderen de trombocytenaggregatie en stimuleren de fibrinolyse, hetgeen de mogelijke toename van de kans op intracerebrale bloedingen kan verklaren.
In 2 meta-analyses (31 RCT’s, n = 182.803 en 23 RCT’s, 19 observationele onderzoeken, n = 248.391) werd geen relatie gevonden tussen het gebruik van een statine in het kader van primaire of secundaire preventie van (cardio)vasculaire aandoeningen en het optreden van een intracerebrale bloeding.
Conclusie
Er zijn aanwijzingen dat behandeling met een statine bij patiënten die een beroerte (vooral een intracerebrale bloeding) hebben doorgemaakt, gepaard gaat met een verhoogd risico op een intracerebrale bloeding. Bij patiënten die een herseninfarct of TIA hebben doorgemaakt, wegen de voordelen van behandeling met een statine op tegen de verhoogde kans op een hersenbloeding. Na een spontane intracerebrale bloeding, met name indien deze lobair gelokaliseerd is, is het onduidelijk of het positieve effect opweegt tegen de mogelijk toegenomen kans op een intracerebrale bloeding.
Controles
Naar Samenvatting ›- Maak afspraken met de patiënt en diens partner en/of mantelzorger over de frequentie en de wijze waarop periodieke controles plaatsvinden.
- Zie voor aandachtspunten bij controles Aandachtspunten na ontslag; wees ook na een minor stroke of TIA alert op beperkingen.
- Wanneer de patiënt stabiel is en alle benodigde zorg is ingeschakeld, komt de nadruk bij de controles te liggen op het cardiovasculair risicomanagement:
- in het eerste jaar minstens halfjaarlijkse controle
- de controlefrequentie kan na een jaar verlaagd worden als de streefwaarden behaald zijn (zie NHG-Standaard Cardiovasculair risicomanagement)
Soms blijft een diagnose TIA onzeker, ook na aanvullend onderzoek. Besteed in dat geval bij vervolgconsulten aandacht aan het bestaan van recidiverende verschijnselen en blijf alert op een alternatieve oorzaak voor de klachten, bijvoorbeeld migraine (zie tabel 4). Overleg zo nodig met de neuroloog (ook over de noodzaak tot het continueren van de secundaire preventie).
Consultatie en verwijzing
Naar Samenvatting ›- bij recidief uitvalsverschijnselen en complicaties (zoals epileptische insulten): neuroloog
- bij beperkingen op het gebied van somatisch of maatschappelijk functioneren: specialist ouderengeneeskunde of revalidatiearts
- bij (dreigende) contracturen of spasticiteit: revalidatiearts
- bij (te verwachten) problemen met de re-integratie in het arbeidsproces: bedrijfsarts (of medisch adviseur van de particuliere verzekeraar bij zelfstandige ondernemers) en eventueel ergotherapeut of revalidatiearts
- bij onduidelijkheid over het bestaan en de aard van cognitieve stoornissen en/of
- emotionele gedragsstoornissen: neuropsycholoog (in overleg met neuroloog en/of revalidatiearts)
- bij cognitieve stoornissen, indien cognitieve revalidatie wordt overwogen: ergotherapeut, revalidatiearts of specialist ouderengeneeskunde
- bij een kwetsbare oudere met complexe problematiek, bijvoorbeeld voor advies over het beleid bij gedragsproblematiek of over een indicatie tot somatische of psychogeriatrische opname: specialist ouderengeneeskunde
- bij taal-, spraak- en/of slikproblemen: logopedist
- bij ernstige vermoeidheid en problemen in het uitvoeren van dagelijkse activiteiten en/of werkhervatting: ergotherapeut
- bij mobiliteitsproblemen: oefen- of fysiotherapeut
- bij beperkingen in ADL en huishoudelijke verrichtingen en/of noodzaak tot aanpassingen en hulpmiddelen in de thuissituatie: ergotherapeut
- bij problemen op het gebied van dagbesteding: sociaal wijkteam/WMO-consulent
CVA ketenzorg
Naar Samenvatting ›- Veel patiënten blijven na een beroerte afhankelijk van verschillende hulpverleners. Om optimale coördinatie van deze multidisciplinaire zorg te waarborgen, ligt in Nederland de zorg voor deze patiënten gedurende alle stadia van het ziekteproces vaak in handen van een regionale zorgketen (stroke service).
- In deze keten werken verpleegkundigen, neurologen, fysio-/oefentherapeuten, ergotherapeuten, logopedisten, diëtisten, psychologen, geriaters, specialisten ouderengeneeskunde, revalidatieartsen en apothekers samen. Deelname van de huisarts kan meerwaarde hebben.
- Eenduidige afspraken over het behandeltraject, de samenwerking en de overdracht zijn belangrijke voorwaarden. Binnen de zorgketen moet duidelijk zijn wie verantwoordelijk is voor welk deel van de zorg en voor welke gegevensaanlevering.
- Voor de patiënt moet duidelijk zijn wie het aanspreekpunt is bij problemen. Aandachtspunten zijn:
- de benoeming van een zorgcoördinator
- het opstellen van een zorgplan
- Omdat de zorg voor de patiënt na ontslag uit ziekenhuis of revalidatie-instelling over het algemeen onder de regie van de huisarts valt, kan het maken van afspraken met de huisarts meerwaarde hebben.
Er zijn aanwijzingen dat implementatie van een zorgketen leidt tot kwaliteitswinst van de zorg voor de patiënt met een beroerte. Dit geldt voor een reductie van de gemiddelde opnameduur in een ziekenhuis, een verbetering van de gezondheidsuitkomsten en de kwaliteit van leven. Er zijn geen recente cijfers beschikbaar over de effectiviteit van de ketenzorg in Nederland. In de verschillende landen wordt multidisciplinaire zorg voor patiënten met een beroerte op wisselende wijze vormgegeven. De onderzoeksgegevens zijn daarom niet extrapoleerbaar naar de Nederlandse situatie.
Om de ketenzorg te kunnen sturen en verbeteren, is het belangrijk om gezamenlijke doelstellingen te formuleren en die ook te registreren. In Nederland waren er op 1 januari 2012 67 stroke services die deelnamen aan de stichting Kennisnetwerk CVA Nederland. Doel van dit netwerk is waarborging en verdere verbetering van de zorg voor patiënten die een beroerte hebben doorgemaakt, onder meer door het opstellen van prestatie-indicatoren.
Conclusie
In Nederland wordt de zorg voor patiënten met een beroerte in toenemende mate in zorgketens vormgegeven.
De ketenzorg is gericht op een goede samenwerking tussen alle disciplines die betrokken zijn bij de zorg voor een patiënt met een beroerte, in alle fases van het ziekteproces.
Referenties
- Easton JD, Saver JL, Albers GW, Alberts MJ, Chaturvedi S, Feldmann E, et al. Definition and evaluation of transient ischemic attack: a scientific statement for healthcare professionals from the American Heart Association/American Stroke Association Stroke Council; Council on Cardiovascular Surgery and Anesthesia; Council on Cardiovascular Radiology and Intervention; Council on Cardiovascular Nursing; and the Interdisciplinary Council on Peripheral Vascular Disease. The American Academy of Neurology affirms the value of this statement as an educational tool for neurologists. Stroke 2009;40:2276-93.
- Mendelson SJ, Prabhakaran S. Diagnosis and Management of Transient Ischemic Attack and Acute Ischemic Stroke: A Review. Jama 2021;325:1088-98.
- Sacco RL, Kasner SE, Broderick JP, Caplan LR, Connors JJ, Culebras A, et al. An updated definition of stroke for the 21st century: a statement for healthcare professionals from the American Heart Association/American Stroke Association. Stroke 2013;44:2064-89.
- Hartstichting. Hart- en vaatziekten in Nederland 2020: cijfers over risicofactoren, hartinterventies, ziekte en sterfte. (2020). Geraadpleegd mei 2022. Ga naar bron: Hartstichting. Hart- en vaatziekten in Nederland 2020: cijfers over risicofactoren, hartinterventies, ziekte en sterfte. (2020). Geraadpleegd mei 2022.
- Nielen MM, Hek K, Schermer TR. Jaarcijfers aandoeningen: incidenties en prevalenties. (2021). Geraadpleegd mei 2022. Ga naar bron: Nielen MM, Hek K, Schermer TR. Jaarcijfers aandoeningen: incidenties en prevalenties. (2021). Geraadpleegd mei 2022.
- Vaartjes I, O'Flaherty M, Capewell S, Kappelle J, Bots M. Remarkable decline in ischemic stroke mortality is not matched by changes in incidence. Stroke 2013;44:591-7.
- Bos V, Kunst AE, Keij-Deerenberg IM, Garssen J, Mackenbach JP. Ethnic inequalities in age- and cause-specific mortality in The Netherlands. Int J Epidemiol 2004;33:1112-9.
- Agyemang C, Addo J, Bhopal R, De Graft Aikins A, Stronks K. Cardiovascular disease, diabetes and established risk factors among populations of sub-Saharan African descent in Europe: a literature review. Global Health 2009;5:7.
- Alter M. Black-white differences in stroke frequency: challenges for research. Neuroepidemiology 1994;13:301-7.
- Broderick JP, Brott T, Tomsick T, Huster G, Miller R. The risk of subarachnoid and intracerebral hemorrhages in blacks as compared with whites. N Engl J Med 1992;326:733-6.
- Reeves MJ, Bushnell CD, Howard G, Gargano JW, Duncan PW, Lynch G, et al. Sex differences in stroke: epidemiology, clinical presentation, medical care, and outcomes. Lancet Neurol 2008;7:915-26.
- RIVM. 30-dagen sterfte na acuut myocardinfarct of beroerte (2011).
- Petrea RE, Beiser AS, Seshadri S, Kelly-Hayes M, Kase CS, Wolf PA. Gender differences in stroke incidence and poststroke disability in the Framingham heart study. Stroke 2009;40:1032-7.
- Lisabeth LD, Brown DL, Hughes R, Majersik JJ, Morgenstern LB. Acute stroke symptoms: comparing women and men. Stroke 2009;40:2031-6.
- Stuart-Shor EM, Wellenius GA, DelloIacono DM, Mittleman MA. Gender differences in presenting and prodromal stroke symptoms. Stroke 2009;40:1121-6.
- Persky RW, Turtzo LC, McCullough LD. Stroke in women: disparities and outcomes. Curr Cardiol Rep 2010;12:6-13.
- Dirks M, Niessen LW, Van Wijngaarden JDH, Koudstaal PJ, Franke CL, Van Oostenbrugge RJ, et al. Promoting thrombolysis in acute ischemic stroke. Stroke 2011;42:1325-30.
- Rothwell PM, Coull AJ, Giles MF, Howard SC, Silver LE, Bull LM, et al. Change in stroke incidence, mortality, case-fatality, severity, and risk factors in Oxfordshire, UK from 1981 to 2004 (Oxford Vascular Study). Lancet 2004a;363:1925-33.
- Franke CL, Poos MJJC, Van Wieren S. Hoeveel zorg gebruiken patiënten met beroerte en wat zijn de kosten? Nationaal Kompas Volksgezondheid. (2011b).
- Jones SP, Bray JE, Gibson JM, McClelland G, Miller C, Price CI, et al. Characteristics of patients who had a stroke not initially identified during emergency prehospital assessment: a systematic review. Emerg Med J 2021;38:387-93.
- Tsang BKT, Chen ASK, Paine M. Acute evaluation of the acute vestibular syndrome: differentiating posterior circulation stroke from acute peripheral vestibulopathies. Intern Med J 2017;47:1352-60.
- Venhovens J, Meulstee J, Verhagen WI. Acute vestibular syndrome: a critical review and diagnostic algorithm concerning the clinical differentiation of peripheral versus central aetiologies in the emergency department. J Neurol 2016;263:2151-7.
- Kerber KA, Brown DL, Lisabeth LD, Smith MA, Morgenstern LB. Stroke among patients with dizziness, vertigo, and imbalance in the emergency department: a population-based study. Stroke 2006;37:2484-7.
- Kim JS, Lee H. Vertigo due to posterior circulation stroke. Semin Neurol 2013;33:179-84.
- Hoyer C, Szabo K. Pitfalls in the Diagnosis of Posterior Circulation Stroke in the Emergency Setting. Front Neurol 2021;12:682827.
- Erkelens DC, Rutten FH, Wouters LT, Dolmans LS, de Groot E, Damoiseaux RA, et al. Accuracy of telephone triage in patients suspected of transient ischaemic attack or stroke: a cross-sectional study. BMC Fam Pract 2020;21:256.
- Dolmans LS, Rutten F, Bartelink MEL, van Dijk EJ, Nederkoorn PJ, Kappelle J, et al. Serum biomarkers in patients suspected of transient ischaemic attack in primary care: a diagnostic accuracy study. BMJ Open 2019a;9:e031774.
- Amort M, Fluri F, Schafer J, Weisskopf F, Katan M, Burow A, et al. Transient ischemic attack versus transient ischemic attack mimics: frequency, clinical characteristics and outcome. Cerebrovasc Dis 2011;32:57-64.
- Ferro JM, Falcao I, Rodrigues G, Canhao P, Melo TP, Oliveira V, et al. Diagnosis of transient ischemic attack by the nonneurologist. A validation study. Stroke 1996;27:2225-9.
- Kraaijeveld CL, Van Gijn J, Schouten HJ, Staal A. Interobserver agreement for the diagnosis of transient ischemic attacks. Stroke 1984;15:723-5.
- Koudstaal PJ, Van Gijn J, Staal A, Duivenvoorden HJ, Gerritsma JG, Kraaijeveld CL. Diagnosis of transient ischemic attacks: improvement of interobserver agreement by a check-list in ordinary language. Stroke 1986;17:723-8.
- Dolmans LS, Rutten FH. Praktische aanbevelingen voor de diagnostiek van een TIA. Huisart Wet 2020;63.
- Scheinberg P. Transient ischemic attacks: an update. J Neurol Sci 1991;101:133-40.
- Howard G, Evans GW, Thomas JL, Ryu JE, Kahl FR, Crouse JR. Reevaluation of transient ischemic attacks as a risk factor for early mortality. Stroke 1991;22:582-5.
- Autret A, Pourcelot L, Saudeau D, Marchal C, Bertrand P, De Boisvilliers S. Stroke risk in patients with carotid stenosis. Lancet 1987;1:888-90.
- Behar S, Tanne D, Abinader E, Agmon J, Barzilai J, Friedman Y, et al. Cerebrovascular accident complicating acute myocardial infarction: incidence, clinical significance and short- and longterm mortality rates. The SPRINT Study Group. Am J Med 1991;91:45-50.
- Wolf PA, Abbott RD, Kannel WB. Atrial fibrillation as an independent risk factor for stroke: the Framingham Study. Stroke 1991;22:983-8.
- Marini C, De Santis F, Sacco S, Russo T, Olivieri L, Totaro R, et al. Contribution of atrial fibrillation to incidence and outcome of ischemic stroke: results from a population-based study. Stroke 2005;36:1115-9.
- Miller VT, Rothrock JF, Pearce LA, Feinberg WM, Hart RG, Anderson DC. Ischemic stroke in patients with atrial fibrillation: effect of aspirin according to stroke mechanism. Stroke Prevention in Atrial Fibrillation Investigators. Neurology 1993;43:32-6.
- Bogousslavsky J, Van Melle G, Regli F, Kappenberger L. Pathogenesis of anterior circulation stroke in patients with nonvalvular atrial fibrillation: the Lausanne Stroke Registry. Neurology 1990;40:1046-50.
- Adelborg K, Szépligeti SK, Holland-Bill L, Ehrenstein V, Horváth-Puhó E, Henderson VW, et al. Migraine and risk of cardiovascular diseases: Danish population based matched cohort study. Bmj 2018;360:k96.
- Mahmoud AN, Mentias A, Elgendy AY, Qazi A, Barakat AF, Saad M, et al. Migraine and the risk of cardiovascular and cerebrovascular events: a meta-analysis of 16 cohort studies including 1 152 407 subjects. BMJ Open 2018;8:e020498.
- Pulsinelli W. Pathophysiology of acute ischaemic stroke. Lancet 1992;339:533-6.
- Wise RJ, Bernardi S, Frackowiak RS, Legg NJ, Jones T. Serial observations on the pathophysiology of acute stroke. The transition from ischaemia to infarction as reflected in regional oxygen extraction. Brain 1983;106 (Pt 1):197-222.
- Buikema H, Van Gilst WH. Fysiologische rol van endotheel. Hart bulletin 1992;23:215-20.
- Anonymus. Treatment for stroke? Lancet 1991;337:1129-31.
- Treadwell SD, Thanvi B, Robinson TG. Stroke in pregnancy and the puerperium. Postgrad Med J 2008;84:238-45.
- Rouvroije VJH, Raupp SFA, Sluzewski M. Plotselinge ernstige hoofdpijn niet altijd onschuldig. ‘Thunderclap headache’ door reversibele cerebrale vasoconstrictie. Ned Tijdschr Geneeskd 2011;155:A3184.
- Ariesen MJ, Claus SP, Rinkel GJE, Algra A. Risk factors for intracerebral hemorrhage in the general population: a systematic review. Stroke 2003;34:2060-5.
- Pozzi M, Roccatagliata D, Sterzi R. Drug abuse and intracranial hemorrhage. Neurol Sci 2008;29 Suppl 2:S269-S270.
- Franke CL, Blokstra A. Beroerte: hoe zijn preventie en zorg georganiseerd? Nationaal Kompas Volksgezondheid. (2011a).
- Langhorne P, Bernhardt J, Kwakkel G. Stroke rehabilitation. Lancet 2011;377:1693-702.
- Kwakkel G, Kollen B, Twisk J. Impact of time on improvement of outcome after stroke. Stroke 2006b;37:2348-53.
- Kwakkel G, Kollen BJ. Predicting activities after stroke: what is clinically relevant? Int J Stroke 2013;8:25-32.
- Van Straten A, Reitsma JB, Limburg M, Van den Bos GA, De Haan RJ. Impact of stroke type on survival and functional health. Cerebrovasc Dis 2001;12:27-33.
- Van Asch CJ, Luitse MJ, Rinkel GJ, Van der Tweel I, Algra A, Klijn CJ. Incidence, case fatality, and functional outcome of intracerebral haemorrhage over time, according to age, sex, and ethnic origin: a systematic review and meta-analysis. Lancet Neurol 2010;9:167-76.
- Warlow C. Secondary prevention of stroke. Lancet 1992;339:724-7.
- Appelros P, Nydevik I, Viitanen M. Poor outcome after first-ever stroke: predictors for death, dependency, and recurrent stroke within the first year. Stroke 2003;34:122-6.
- Eriksson SE, Olsson JE. Survival and recurrent strokes in patients with different subtypes of stroke: a fourteen-year follow-up study. Cerebrovasc Dis 2001;12:171-80.
- Giles MF, Rothwell PM. Risk of stroke early after transient ischaemic attack: a systematic review and meta-analysis. Lancet Neurol 2007;6:1063-72.
- Kleindorfer D, Panagos P, Pancioli A, Khoury J, Kissela B, Woo D, et al. Incidence and short-term prognosis of transient ischemic attack in a population-based study. Stroke 2005;36:720-3.
- Coull AJ, Lovett JK, Rothwell PM. Population based study of early risk of stroke after transient ischaemic attack or minor stroke: implications for public education and organisation of services. BMJ 2004;328:326.
- Gattellari M, Goumas C, Garden F, Worthington JM. Relative survival after transient ischaemic attack: results from the Program of Research Informing Stroke Management (PRISM) study. Stroke 2012;43:79-85.
- Van Cranenburgh B. Neurowetenschappen, een overzicht. Maarssen: Elsevier/De Tijdstroom, 1998.
- Wade DT, Hewer RL, David RM, Enderby PM. Aphasia after stroke: natural history and associated deficits. J Neurol Neurosurg Psychiatry 1986;49:11-6.
- Dickey L, Kagan A, Lindsay MP, Fang J, Rowland A, Black S. Incidence and profile of inpatient stroke-induced aphasia in Ontario, Canada. Arch Phys Med Rehabil 2010;91:196-202.
- El Hachioui H, Lingsma HF, Van de Sandt-Koenderman MW, Dippel DW, Koudstaal PJ, Visch-Brink EG. Long-term prognosis of aphasia after stroke. J Neurol Neurosurg Psychiatry 2013;84:310-5.
- Vermeer SE, Koudstaal PJ, Oudkerk M, Hofman A, Breteler MMB. Prevalence and risk factors of silent brain infarcts in the population-based Rotterdam Scan Study. Stroke 2002;33:21-5.
- Flamand-Roze C, Cauquil-Michon C, Denier C. Tools and early management of language and swallowing disorders in acute stroke patients. Curr Neurol Neurosci Rep 2012;12:34-41.
- Dumoulin C, Korner-Bitensky N, Tannenbaum C. Urinary incontinence after stroke: does rehabilitation make a difference? A systematic review of the effectiveness of behavioral therapy. Top Stroke Rehabil 2005;12:66-76.
- Harari D, Coshall C, Rudd AG, Wolfe CDA. New-onset fecal incontinence after stroke: prevalence, natural history, risk factors, and impact. Stroke 2003;34:144-50.
- Carlsson GE, Moller A, Blomstrand C. Consequences of mild stroke in persons < 75 years -- a 1-year follow-up. Cerebrovasc Dis 2003;16:383-8.
- Glader EL, Stegmayr B, Asplund K. Poststroke fatigue: a 2-year follow-up study of stroke patients in Sweden. Stroke 2002;33:1327-33.
- Van der Werf SP, Van den Broek HL, Anten HW, Bleijenberg G. Experience of severe fatigue long after stroke and its relation to depressive symptoms and disease characteristics. Eur Neurol 2001;45:28-33.
- McGeough E, Pollock A, Smith LN, Dennis M, Sharpe M, Lewis S, et al. Interventions for post-stroke fatigue. Cochrane Database Syst Rev 2009;CD007030.
- Zedlitz AMEE, Rietveld TCM, Geurts AC, Fasotti L. Cognitive and graded activity training can alleviate persistent fatigue after stroke: a randomized, controlled trial. Stroke 2012;43:1046-51.
- Pendlebury ST, Rothwell PM. Prevalence, incidence, and factors associated with pre-stroke and post-stroke dementia: a systematic review and meta-analysis. Lancet Neurol 2009;8:1006-18.
- Tatemichi TK, Desmond DW, Stern Y, Paik M, Sano M, Bagiella E. Cognitive impairment after stroke: frequency, patterns, and relationship to functional abilities. J Neurol Neurosurg Psychiatry 1994;57:202-7.
- Madureira S, Guerreiro M, Ferro JM. Dementia and cognitive impairment three months after stroke. Eur J Neurol 2001;8:621-7.
- Jaillard A, Naegele B, Trabucco-Miguel S, LeBas JF, Hommel M. Hidden dysfunctioning in subacute stroke. Stroke 2009;40:2473-9.
- Gottesman RF, Hillis AE. Predictors and assessment of cognitive dysfunction resulting from ischaemic stroke. Lancet Neurol 2010;9:895-905.
- Cicerone KD, Dahlberg C, Malec JF, Langenbahn DM, Felicetti T, Kneipp S, et al. Evidence-based cognitive rehabilitation: updated review of the literature from 1998 through 2002. Arch Phys Med Rehabil 2005;86:1681-92.
- Lincoln NB, Majid MJ, Weyman N. Cognitive rehabilitation for attention deficits following stroke. Cochrane Database Syst Rev 2000;CD002842.
- Nair RD, Lincoln NB. Cognitive rehabilitation for memory deficits following stroke. Cochrane Database Syst Rev 2007;CD002293.
- Herrmann N, Black SE, Lawrence J, Szekely C, Szalai JP. The Sunnybrook Stroke Study: a prospective study of depressive symptoms and functional outcome. Stroke 1998;29:618-24.
- Bhogal SK, Teasell R, Foley N, Speechley M. Lesion location and poststroke depression: systematic review of the methodological limitations in the literature. Stroke 2004;35:794-802.
- Paolucci S, Antonucci G, Pratesi L, Traballesi M, Grasso MG, Lubich S. Poststroke depression and its role in rehabilitation of inpatients. Arch Phys Med Rehabil 1999;80:985-90.
- Schmid AA, Kroenke K, Hendrie HC, Bakas T, Sutherland JM, Williams LS. Poststroke depression and treatment effects on functional outcomes. Neurology 2011;76:1000-5.
- Chemerinski E, Robinson RG, Kosier JT. Improved recovery in activities of daily living associated with remission of poststroke depression. Stroke 2001;32:113-7.
- Saxena SK, Ng TP, Koh G, Yong D, Fong NP. Is improvement in impaired cognition and depressive symptoms in post-stroke patients associated with recovery in activities of daily living? Acta Neurol Scand 2007;115:339-46.
- Hackett ML, Anderson CS, House A, Xia J. Interventions for treating depression after stroke. Cochrane Database Syst Rev 2008;CD003437.
- Van Heugten C, Rasquin S, Winkens I, Beusmans G, Verhey F. Checklist for cognitive and emotional consequences following stroke (CLCE-24): development, usability and quality of the self-report version. Clin Neurol Neurosurg 2007;109:257-62.
- Moran GM, Fletcher B, Feltham MG, Calvert M, Sackley C, Marshall T. Fatigue, psychological and cognitive impairment following transient ischaemic attack and minor stroke: a systematic review. Eur J Neurol 2014;21:1258-67.
- Turner GM, Calvert M, Feltham MG, Ryan R, Marshall T. Ongoing impairments following transient ischaemic attack: retrospective cohort study. Eur J Neurol 2016;23:1642-50.
- Van Rooij FG, Schaapsmeerders P, Maaijwee NA, Van Duijnhoven DA, De Leeuw FE, Kessels RP, et al. Persistent cognitive impairment after transient ischemic attack. Stroke 2014;45:2270-4.
- Stroke Unit Trialists’ Collaboration. Organised inpatient (stroke unit) care for stroke. Cochrane Database Syst Rev 2007;CD000197.
- Saposnik G, Kapral MK, Coutts SB, Fang J, Demchuk AM, Hill MD. Do all age groups benefit from organized inpatient stroke care? Stroke 2009;40:3321-7.
- Xian Y, Holloway RG, Chan PS, Noyes K, Shah MN, Ting HH, et al. Association between stroke center hospitalization for acute ischemic stroke and mortality. JAMA 2011;305:373-80.
- Seenan P, Long M, Langhorne P. Stroke units in their natural habitat: systematic review of observational studies. Stroke 2007;38:1886-92.
- O’Rourke K, Walsh C. Impact of stroke units on mortality: a Bayesian analysis. Eur J Neurol 2010;17:247-51.
- Langhorne P, Dennis MS. Stroke units: the next 10 years. Lancet 2004;363:834-5.
- Stam J, Koudstaal PJ, Franke CL, Kappelle LJ, Boiten J. Trombolyse voor het herseninfarct: het einde van het begin. Ned Tijdschr Geneeskd 2000;144:1028-32.
- Kappelle LJ, Frijns CJ. Behandeling van patiënten met een TIA of een herseninfarct. Ned Tijdschr Geneeskd 2002;146:1678-81.
- Limburg M, Beusmans GHMI, Courlander J, Edelbroek M, Franke-Barendse B, van Gorp E, et al. CVA-zorg in kaart gebracht. Med Contact 2010;65:404-6.
- Boode B, Welzen V, Franke C, van Oostenbrugge R. Estimating the number of stroke patients eligible for thrombolytic treatment if delay could be avoided. Cerebrovasc Dis 2007;23:294-8.
- NVN. Herseninfarct en hersenbloeding (2021). Ga naar bron: NVN. Herseninfarct en hersenbloeding (2021).
- Hankey GJ. Long-term outcome after ischaemic stroke/transient ischaemic attack. Cerebrovasc Dis 2003;16 Suppl 1:14-9.
- Rothwell PM, Giles MF, Chandratheva A, Marquardt L, Geraghty O, Redgrave JNE et al. Effect of urgent treatment of transient ischaemic attack and minor stroke on early recurrent stroke (EXPRESS study): a prospective population-based sequential comparison. Lancet 2007;370:1432-42.
- Verburg AFE, Stirbu-Wagner I, Wiersma T, Korevaar J. Secundaire preventie na een beroerte. Huisart Wet 2013;12.
- Klijn CJ, Kappelle LJ, Tulleken CA, Van Gijn J. Symptomatic carotid artery occlusion. A reappraisal of hemodynamic factors. Stroke 1997;28:2084-93.
- Fluri F, Engelter S, Lyrer P. Extracranial-intracranial arterial bypass surgery for occlusive carotid artery disease. Cochrane Database Syst Rev 2010;CD005953.
- Powers WJ, Clarke WR, Grubb RLJ, Videen TO, Adams HPJ, Derdeyn CP. Extracranial-intracranial bypass surgery for stroke prevention in hemodynamic cerebral ischemia: the Carotid Occlusion Surgery Study randomized trial. JAMA 2011;306:1983-92.
- Langhorne P, Wagenaar R, Partridge C. Physiotherapy after stroke: more is better? Physiother Res Int 1996;1:75-88.
- Kwakkel G, Wagenaar RC, Koelman TW, Lankhorst GJ, Koetsier JC. Effects of intensity of rehabilitation after stroke. A research synthesis. Stroke 1997;28:1550-6.
- Craig LE, Bernhardt J, Langhorne P, Wu O. Early mobilization after stroke: an example of an individual patient data meta-analysis of a complex intervention. Stroke 2010;41:2632-6.
- Kwakkel G. Impact of intensity of practice after stroke: issues for consideration. Disabil Rehabil 2006a;28:823-30.
- Kwakkel G, Van Peppen R, Wagenaar RC, Wood Dauphinee S, Richards C, Ashburn A, et al. Effects of augmented exercise therapy time after stroke: a meta-analysis. Stroke 2004;35:2529-39.
- Veerbeek JM, Koolstra M, Ket JCF, Van Wegen EEH, Kwakkel G. Effects of augmented exercise therapy on outcome of gait and gait-related activities in the first 6 months after stroke: a meta-analysis. Stroke 2011;42:3311-5.
- Langhorne P, Coupar F, Pollock A. Motor recovery after stroke: a systematic review. Lancet Neurol 2009;8:741-54.
- Legg LA, Drummond AE, Langhorne P. Occupational therapy for patients with problems in activities of daily living after stroke. Cochrane Database Syst Rev 2006;CD003585.
- Legg L, Drummond A, Leonardi-Bee J, Gladman JRF, Corr S, Donkervoort M, et al. Occupational therapy for patients with problems in personal activities of daily living after stroke: systematic review of randomised trials. BMJ 2007;335:922.
- Walker MF, Leonardi-Bee J, Bath P, Langhorne P, Dewey M, Corr S, et al. Individual patient data meta-analysis of randomized controlled trials of community occupational therapy for stroke patients. Stroke 2004;35:2226-32.
- Van de Port IGL, Kwakkel G, Van Wijk I, Lindeman E. Susceptibility to deterioration of mobility long-term after stroke: a prospective cohort study. Stroke 2006;37:167-71.
- Brady MC, Kelly H, Godwin J, Enderby P. Speech and language therapy for aphasia following stroke. Cochrane Database Syst Rev 2012;5:CD000425.
- Robey RR. A meta-analysis of clinical outcomes in the treatment of aphasia. J Speech Lang Hear Res 1998;41:172-87.
- Mackenzie C, Lowit A. Behavioural intervention effects in dysarthria following stroke: communication effectiveness, intelligibility and dysarthria impact. Int J Lang Commun Disord 2007;42:131-53.
- Bowen A, Hesketh A, Patchick E, Young A, Davies L, Vail A, et al. Effectiveness of enhanced communication therapy in the first four months after stroke for aphasia and dysarthria: a randomised controlled trial. BMJ 2012;345:e4407.
- Carnaby G, Hankey GJ, Pizzi J. Behavioural intervention for dysphagia in acute stroke: a randomised controlled trial. Lancet Neurol 2006;5:31-7.
- Meyran D, Cassan P, Avau B, Singletary E, Zideman DA. Stroke Recognition for First Aid Providers: A Systematic Review and Meta-Analysis. Cureus 2020;12:e11386.
- Exalto LG, van Doorn S, Erkelens DCA, Smit K, Rutten FH, Kappelle LJ, et al. Call Characteristics of Patients Suspected of Transient Ischemic Attack (TIA) or Stroke During Out-of-Hours Service: A Comparison Between Men and Women. Front Neurol 2021;12:669090.
- Pickham D, Valdez A, Demeestere J, Lemmens R, Diaz L, Hopper S, et al. Prognostic Value of BE-FAST vs. FAST to Identify Stroke in a Prehospital Setting. Prehosp Emerg Care 2019;23:195-200.
- Celesia GG, Brigell MG, Vaphiades MS. Hemianopic anosognosia. Neurology 1997;49:88-97.
- Oosterhuis HJGH. Klinische Neurologie. Houten/Zaventem: Bohn Stafleu Van Loghum, 2000.
- Lebedeva ER, Gurary NM, Gilev DV, Christensen AF, Olesen J. Explicit diagnostic criteria for transient ischemic attacks to differentiate it from migraine with aura. Cephalalgia 2018;38:1463-70.
- Dolmans LS, Lebedeva ER, Veluponnar D, van Dijk EJ, Nederkoorn PJ, Hoes AW, et al. Diagnostic Accuracy of the Explicit Diagnostic Criteria for Transient Ischemic Attack: A Validation Study. Stroke 2019b;50:2080-5.
- Göbel CH, Karstedt SC, Münte TF, Göbel H, Wolfrum S, Lebedeva ER, et al. Explicit Diagnostic Criteria for Transient Ischemic Attacks Used in the Emergency Department Are Highly Sensitive and Specific. Cerebrovasc Dis 2021;50:62-7.
- Sandercock P. Recent developments in the diagnosis and management of patients with transient ischaemic attacks and minor ischaemic strokes. Q J Med 1991;78:101-12.
- Alblas CL, Beneder PR, Bulens C. Voorbijgaand geheugenverlies (‘transient global amnesia’): aanwijzigingen voor een syndroom van cerebrale veneuze stase. Ned Tijdschr Geneeskd 2006;150:1685-8.
- Erkelens CD, Snoek JW. What doctors should not forget about transient global amnesia. Eur J Gen Pract 2010;16:182-5.
- Bartsch T, Deuschl G. Transient global amnesia: functional anatomy and clinical implications. Lancet Neurol 2010;9:205-14.
- Thijs RD, Bloem BR, Van Dijk JG. Falls, faints, fits and funny turns. J Neurol 2009;256:155-67.
- Parry SW, Kenny RA. Drop attacks in older adults: systematic assessment has a high diagnostic yield. J Am Geriatr Soc 2005;53:74-8.
- Brantberg K, Ishiyama A, Baloh RW. Drop attacks secondary to superior canal dehiscence syndrome. Neurology 2005;64:2126-8.
- Psychogios K, Magoufis G, Safouris A, Kargiotis O, Katsanos AH, Spiliopoulos S, et al. Eligibility for intravenous thrombolysis in acute ischemic stroke patients presenting in the 4.5-9 h window. Neuroradiology 2020;62:733-9.
- Thomalla G, Simonsen CZ, Boutitie F, Andersen G, Berthezene Y, Cheng B, et al. MRI-Guided Thrombolysis for Stroke with Unknown Time of Onset. N Engl J Med 2018;379:611-22.
- Jadhav AP, Desai SM, Kenmuir CL, Rocha M, Starr MT, Molyneaux BJ, et al. Eligibility for Endovascular Trial Enrollment in the 6- to 24-Hour Time Window: Analysis of a Single Comprehensive Stroke Center. Stroke 2018;49:1015-7.
- Barber PA, Zhang J, Demchuk AM, Hill MD, Buchan AM. Why are stroke patients excluded from TPA therapy? An analysis of patient eligibility. Neurology 2001;56:1015-20.
- Coutts SB, Modi J, Patel SK, Aram H, Demchuk AM, Goyal M, et al. What causes disability after transient ichemic attack and minor stroke? Results from the CT And MRI in the triage of TIA and minor cerebrovascular events to identify high risk patients (CATCH) study. Stroke 2012;43:3018-22.
- Zinkstok SM, Roos YB. Early administration of aspirin in patients treated with alteplase for acute ischaemic stroke: a randomised controlled trial. Lancet 2012;380:731-7.
- Oliveira-Filho J, Silva SCS, Trabuco CC, Pedreira BB, Sousa EU, Bacellar A. Detrimental effect of blood pressure reduction in the first 24 hours of acute stroke onset. Neurology 2003;61:1047-51.
- Sandset EC, Bath PMW, Boysen G, Jatuzis D, Korv J, Luders S, et al. The angiotensin-receptor blocker candesartan for treatment of acute stroke (SCAST): a randomised, placebo-controlled, double-blind trial. Lancet 2011;377:741-50.
- Anderson CS, Huang Y, Arima H, Heeley E, Skulina C, Parsons MW, et al. Effects of early intensive blood pressure-lowering treatment on the growth of hematoma and perihematomal edema in acute intracerebral hemorrhage: the Intensive Blood Pressure Reduction in Acute Cerebral Haemorrhage Trial (INTERACT). Stroke 2010;41:307-12.
- Anderson CS, Heeley E, Huang Y, Wang J, Stapf C, Delcourt C, et al. Rapid blood-pressure lowering in patients with acute intracerebral hemorrhage. N Engl J Med 2013;368:2355-65.
- Qureshi AI, Palesch YY, Barsan WG, Hanley DF, Hsu CY, Martin RL, et al. Intensive blood-pressure lowering in patients with acute cerebral hemorrhage. N Engl J Med 2016;375:1033-43.
- Robinson TG, Potter JF, Ford GA, Bulpitt CJ, Chernova J, Jagger C, et al. Effects of antihypertensive treatment after acute stroke in the Continue or Stop Post-Stroke Antihypertensives Collaborative Study (COSSACS): a prospective, randomised, open, blinded-endpoint trial. Lancet Neurol 2010;9:767-75.
- Lees KR, Bluhmki E, von Kummer R, Brott TG, Toni D, Grotta JC, et al. Time to treatment with intravenous alteplase and outcome in stroke: an updated pooled analysis of ECASS, ATLANTIS, NINDS, and EPITHET trials. Lancet 2010;375:1695-703.
- Sandercock P, Wardlaw JM, Lindley RI, Dennis M, Cohen G, Murray G, et al. The benefits and harms of intravenous thrombolysis with recombinant tissue plasminogen activator within 6 h of acute ischaemic stroke (the third international stroke trial [IST-3]): a randomised controlled trial. Lancet 2012;379:2352-63.
- Wardlaw JM, Murray V, Berge E, Del Zoppo G, Sandercock P, Lindley RL, et al. Recombinant tissue plasminogen activator for acute ischaemic stroke: an updated systematic review and meta-analysis. Lancet 2012;379:2364-72.
- Meseguer E, Mazighi M, Labreuche J, Arnaiz C, Cabrejo L, Slaoui T, et al. Outcomes of intravenous recombinant tissue plasminogen activator therapy according to gender: a clinical registry study and systematic review. Stroke 2009;40:2104-10.
- Bluhmki E, Chamorro A, Davalos A, Machnig T, Sauce C, Wahlgren N, et al. Stroke treatment with alteplase given 3.0-4.5 h after onset of acute ischaemic stroke (ECASS III): additional outcomes and subgroup analysis of a randomised controlled trial. Lancet Neurol 2009;8:1095-102.
- Hacke W, Donnan G, Fieschi C, Kaste M, Von Kummer R, Broderick JP, et al. Association of outcome with early stroke treatment: pooled analysis of ATLANTIS, ECASS, and NINDS rt-PA stroke trials. Lancet 2004;363:768-74.
- Wahlgren N, Ahmed N, Eriksson N, Aichner F, Bluhmki E, Davalos A, et al. Multivariable analysis of outcome predictors and adjustment of main outcome results to baseline data profile in randomized controlled trials: Safe Implementation of Thrombolysis in Stroke-MOnitoring STudy (SITS-MOST). Stroke 2008;39:3316-22.
- Campbell BCV, Ma H, Ringleb PA, Parsons MW, Churilov L, Bendszus M, et al. Extending thrombolysis to 4.5-9 h and wake-up stroke using perfusion imaging: a systematic review and meta-analysis of individual patient data. Lancet 2019.
- Ma H, Campbell BCV, Parsons MW, Churilov L, Levi CR, Hsu C, et al. Thrombolysis Guided by Perfusion Imaging up to 9 Hours after Onset of Stroke. N Engl J Med 2019;380:1795-803.
- Ringleb P, Bendszus M, Bluhmki E, Donnan G, Eschenfelder C, Fatar M, et al. Extending the time window for intravenous thrombolysis in acute ischemic stroke using magnetic resonance imaging-based patient selection. Int J Stroke 2019;14:483-90.
- Davis SM, Donnan GA, Parsons MW, Levi C, Butcher KS, Peeters A, et al. Effects of alteplase beyond 3 h after stroke in the Echoplanar Imaging Thrombolytic Evaluation Trial (EPITHET): a placebo-controlled randomised trial. Lancet Neurol 2008;7:299-309.
- Thomalla G, Boutitie F, Ma H, Koga M, Ringleb P, Schwamm LH, et al. Intravenous alteplase for stroke with unknown time of onset guided by advanced imaging: systematic review and meta-analysis of individual patient data. Lancet 2020;396:1574-84.
- Broderick JP, Palesch YY, Demchuk AM, Yeatts SD, Khatri P, Hill MD, et al. Endovascular therapy after intravenous t-PA versus t-PA alone for stroke. N Engl J Med 2013;368:893-903.
- Ciccone A, Valvassori L, Nichelatti M, Sgoifo A, Ponzio M, Sterzi R, et al. Endovascular treatment for acute ischemic stroke. N Engl J Med 2013;368:904-13.
- Kidwell CS, Jahan R, Gornbein J, Alger JR, Nenov V, Ajani Z, et al. A trial of imaging selection and endovascular treatment for ischemic stroke. N Engl J Med 2013;368:914-23.
- Berkhemer OA, Fransen PS, Beumer D, van den Berg LA, Lingsma HF, Yoo AJ, et al. A randomized trial of intraarterial treatment for acute ischemic stroke. N Engl J Med 2015;372:11-20.
- Goyal M, Menon BK, van Zwam WH, Dippel DW, Mitchell PJ, Demchuk AM, et al. Endovascular thrombectomy after large-vessel ischaemic stroke: a meta-analysis of individual patient data from five randomised trials. Lancet 2016;387:1723-31.
- Jovin TG, Chamorro A, Cobo E, de Miquel MA, Molina CA, Rovira A, et al. Thrombectomy within 8 hours after symptom onset in ischemic stroke. N Engl J Med 2015;372:2296-306.
- Saver JL, Goyal M, van der Lugt A, Menon BK, Majoie CB, Dippel DW, et al. Time to Treatment With Endovascular Thrombectomy and Outcomes From Ischemic Stroke: A Meta-analysis. Jama 2016;316:1279-88.
- Stroke Foundation. Clinical Guidelines for Stroke Management (2021). Ga naar bron: Stroke Foundation. Clinical Guidelines for Stroke Management (2021).
- Campbell BC, Mitchell PJ, Kleinig TJ, Dewey HM, Churilov L, Yassi N, et al. Endovascular therapy for ischemic stroke with perfusion-imaging selection. N Engl J Med 2015;372:1009-18.
- Goyal M, Demchuk AM, Menon BK, Eesa M, Rempel JL, Thornton J, et al. Randomized assessment of rapid endovascular treatment of ischemic stroke. N Engl J Med 2015;372:1019-30.
- Saver JL, Goyal M, Bonafe A, Diener HC, Levy EI, Pereira VM, et al. Stent-retriever thrombectomy after intravenous t-PA vs. t-PA alone in stroke. N Engl J Med 2015;372:2285-95.
- Bracard S, Ducrocq X, Mas JL, Soudant M, Oppenheim C, Moulin T, et al. Mechanical thrombectomy after intravenous alteplase versus alteplase alone after stroke (THRACE): a randomised controlled trial. Lancet Neurol 2016;15:1138-47.
- Mocco J, Zaidat OO, von Kummer R, Yoo AJ, Gupta R, Lopes D, et al. Aspiration Thrombectomy After Intravenous Alteplase Versus Intravenous Alteplase Alone. Stroke 2016;47:2331-8.
- Muir KW, Ford GA, Messow CM, Ford I, Murray A, Clifton A, et al. Endovascular therapy for acute ischaemic stroke: the Pragmatic Ischaemic Stroke Thrombectomy Evaluation (PISTE) randomised, controlled trial. J Neurol Neurosurg Psychiatry 2017;88:38-44.
- Albers GW, Marks MP, Kemp S, Christensen S, Tsai JP, Ortega-Gutierrez S, et al. Thrombectomy for Stroke at 6 to 16 Hours with Selection by Perfusion Imaging. N Engl J Med 2018;378:708-18.
- Nogueira RG, Jadhav AP, Haussen DC, Bonafe A, Budzik RF, Bhuva P, et al. Thrombectomy 6 to 24 Hours after Stroke with a Mismatch between Deficit and Infarct. New England Journal of Medicine 2018;378:11-21.
- De Keyser J, Gdovinova Z, Uyttenboogaart M, Vroomen PC, Luijckx GJ. Intravenous alteplase for stroke: beyond the guidelines and in particular clinical situations. Stroke 2007;38:2612-8.
- Sylaja PN, Dzialowski I, Krol A, Roy J, Federico P, Demchuk AM. Role of CT angiography in thrombolysis decision-making for patients with presumed seizure at stroke onset. Stroke 2006;37:915-7.
- Anonymus. The International Stroke Trial (IST): a randomised trial of aspirin, subcutaneous heparin, both, or neither among 19435 patients with acute ischaemic stroke. International Stroke Trial Collaborative Group. Lancet 1997b;349:1569-81.
- Anonymus. CAST: randomised placebo-controlled trial of early aspirin use in 20,000 patients with acute ischaemic stroke. CAST (Chinese Acute Stroke Trial) Collaborative Group. Lancet 1997a;349:1641-9.
- Chen ZM, Sandercock P, Pan HC, Counsell C, Collins R, Liu LS, et al. Indications for early aspirin use in acute ischemic stroke: a combined analysis of 40 000 randomized patients from the chinese acute stroke trial and the international stroke trial. On behalf of the CAST and IST collaborative groups. Stroke 2000;31:1240-9.
- Anonymus. Collaborative meta-analysis of randomised trials of antiplatelet therapy for prevention of death, myocardial infarction, and stroke in high risk patients. BMJ 2002;324:71-86.
- Sandercock PAG, Counsell C, Gubitz GJ, Tseng MC. Antiplatelet therapy for acute ischaemic stroke. Cochrane Database Syst Rev 2008;CD000029.
- Patrignani P, Filabozzi P, Patrono C. Selective cumulative inhibition of platelet thromboxane production by low-dose aspirin in healthy subjects. J Clin Invest 1982;69:1366-72.
- Galvin R, Geraghty C, Motterlini N, Dimitrov BD, Fahey T. Prognostic value of the ABCD(2) clinical prediction rule: a systematic review and meta-analysis. Fam Pract 2011;28:366-76.
- Johnston SC, Rothwell PM, Nguyen-Huynh MN, Giles MF, Elkins JS, Bernstein AL, et al. Validation and refinement of scores to predict very early stroke risk after transient ischaemic attack. Lancet 2007;369:283-92.
- Dippel DWJ. TIA: wel reden voor spoedopname. Ned Tijdschr Geneeskd 2011;155:A3133.
- Giles MF, Rothwell PM. Systematic review and pooled analysis of published and unpublished validations of the ABCD and ABCD2 transient ischemic attack risk scores. Stroke 2010;41:667-73.
- Sanders LM, Srikanth VK, Blacker DJ, Jolley DJ, Cooper KA, Phan TG. Performance of the ABCD2 score for stroke risk post TIA: meta-analysis and probability modelling. Neurology 2012;971-80.
- Wind AW, Van der Werf GTh. Huisartsgeneeskunde voor ouderen (1): regie over complexe zorg vereist zorgplan. Huisarts Wet 2007;126-7.
- De Haan R, Limburg M, Schuling J, Broeshart J, Jonkers L, Van Zuylen P. Klinimetrische evaluatie van de Barthel Index. Ned Tijdschr Geneeskd 1993;137:917-21.
- Huybrechts KF, Caro JJ. The Barthel Index and modified Rankin Scale as prognostic tools for long-term outcomes after stroke: a qualitative review of the literature. Curr Med Res Opin 2007;23:1627-36.
- Shi D, Chen X, Li Z. Diagnostic test accuracy of the Montreal Cognitive Assessment in the detection of post-stroke cognitive impairment under different stages and cutoffs: a systematic review and meta-analysis. Neurol Sci 2018;39:705-16.
- Lees R, Selvarajah J, Fenton C, Pendlebury ST, Langhorne P, Stott DJ, et al. Test accuracy of cognitive screening tests for diagnosis of dementia and multidomain cognitive impairment in stroke. Stroke 2014;45:3008-18.
- Chen X, Han Y, Zhou J, Ma M, Liu X. Diagnostic accuracy of cognitive screening tools under different neuropsychological definitions for poststroke cognitive impairment. Brain Behav 2020;10:e01671.
- Khaw J, Subramaniam P, Abd Aziz NA, Ali Raymond A, Wan Zaidi WA, Ghazali SE. Current Update on the Clinical Utility of MMSE and MoCA for Stroke Patients in Asia: A Systematic Review. Int J Environ Res Public Health 2021;18.
- Kappelle LJ, Adams HPJ, Heffner ML, Torner JC, Gomez F, Biller J. Prognosis of young adults with ischemic stroke. A long-term follow-up study assessing recurrent vascular events and functional outcome in the Iowa Registry of Stroke in Young Adults. Stroke 1994;25:1360-5.
- Musolino R, La Spina P, Granata A, Gallitto G, Leggiadro N, Carerj S, et al. Ischaemic stroke in young people: a prospective and longterm follow-up study. Cerebrovasc Dis 2003;15:121-8.
- Neau JP, Ingrand P, Mouille-Brachet C, Rosier MP, Couderq C, Alvarez A, et al. Functional recovery and social outcome after cerebral infarction in young adults. Cerebrovasc Dis 1998;8:296-302.
- Vestling M, Tufvesson B, Iwarsson S. Indicators for return to work after stroke and the importance of work for subjective well-being and life satisfaction. J Rehabil Med 2003;35:127-31.
- Treger I, Shames J, Giaquinto S, Ring H. Return to work in stroke patients. Disabil Rehabil 2007;29:1397-403.
- Saeki S, Ogata H, Okubo T, Takahashi K, Hoshuyama T. Return to work after stroke. A follow-up study. Stroke 1995;26:399-401.
- Coronel Instituut voor Arbeid en Gezondheid. Niet-Aangeboren Hersenletsel (NAH) en Arbeidsparticipatie. Multidisciplinaire Richtlijn voor Beoordelen, Behandelen en Begeleiden (2012). Ga naar bron: Coronel Instituut voor Arbeid en Gezondheid. Niet-Aangeboren Hersenletsel (NAH) en Arbeidsparticipatie. Multidisciplinaire Richtlijn voor Beoordelen, Behandelen en Begeleiden (2012).
- VRA. NAH en arbeidsparticipatie (2021). Ga naar bron: VRA. NAH en arbeidsparticipatie (2021).
- Visser-Meily A, Van Heugten C. Zorg voor de mantelzorg (2004).
- Schure LM. Partners van CVA-patiënten: een onderzoek naar de gevolgen van een cerebrovasculair accident voor de partner van de patiënt [proefschrift]. Groningen: Rijksuniversiteit Groningen, 1995.
- Berg A, Palomaki H, Lonnqvist J, Lehtihalmes M, Kaste M. Depression among caregivers of stroke survivors. Stroke 2005;36:639-43.
- Paul SL, Thrift AG, Donnan GA. Smoking as a crucial independent determinant of stroke. Tob Induc Dis 2004;2:67-80.
- Shinton R, Beevers G. Meta-analysis of relation between cigarette smoking and stroke. BMJ 1989;298:789-94.
- Wolf PA, D’Agostino RB, Kannel WB, Bonita R, Belanger AJ. Cigarette smoking as a risk factor for stroke. The Framingham Study. JAMA 1988;259:1025-9.
- Myint PK, Welch AA, Bingham SA, Luben RN, Wareham NJ, Day NE, et al. Smoking predicts long-term mortality in stroke: the European Prospective Investigation into Cancer (EPIC)-Norfolk prospective population study. Prev Med 2006;42:128-31.
- Redfern J, McKevitt C, Dundas R, Rudd AG, Wolfe CD. Behavioral risk factor prevalence and lifestyle change after stroke: a prospective study. Stroke 2000;31:1877-81.
- Wendel-Vos GCW, Schuit AJ, Feskens EJM, Boshuizen HC, Verschuren WMM, Saris WHM, et al. Physical activity and stroke. A meta-analysis of observational data. Int J Epidemiol 2004;33:787-98.
- Lee CD, Folsom AR, Blair SN. Physical activity and stroke risk: a meta-analysis. Stroke 2003;34:2475-81.
- Gordon NF, Gulanick M, Costa F, Fletcher G, Franklin BA, Roth EJ, et al. Physical activity and exercise recommendations for stroke survivors: an American Heart Association scientific statement from the Council on Clinical Cardiology, Subcommittee on Exercise, Cardiac Rehabilitation, and Prevention; the Council on Cardiovascular Nursing; the Council on Nutrition, Physical Activity, and Metabolism; and the Stroke Council. Stroke 2004;35:1230-40.
- Patra J, Taylor B, Irving H, Roerecke M, Baliunas D, Mohapatra S, et al. Alcohol consumption and the risk of morbidity and mortality for different stroke types--a systematic review and meta-analysis. BMC Public Health 2010;10:258.
- Strazzullo P, D’Elia L, Cairella G, Garbagnati F, Cappuccio FP, Scalfi L. Excess body weight and incidence of stroke: meta-analysis of prospective studies with 2 million participants. Stroke 2010;41:e418-e426.
- Calabro RS, Gervasi G, Bramanti P. Male sexual disorders following stroke: an overview. Int J Neurosci 2011;121:598-604.
- Korpelainen JT, Nieminen P, Myllyla VV. Sexual functioning among stroke patients and their spouses. Stroke 1999;30:715-9.
- Sacco RL, Diener HC, Yusuf S, Cotton D, Ounpuu S, Lawton WA, et al. Aspirin and extended-release dipyridamole versus clopidogrel for recurrent stroke. N Engl J Med 2008;359:1238-51.
- Anonymus. A randomised, blinded, trial of clopidogrel versus aspirin in patients at risk of ischaemic events (CAPRIE). CAPRIE Steering Committee. Lancet 1996;348:1329-39.
- Kent DM, Thaler DE. Stroke prevention-insights from incoherence. N Engl J Med 2008;359:1287-9.
- Diener HC, Bogousslavsky J, Brass LM, Cimminiello C, Csiba L, Kaste M, et al. Aspirin and clopidogrel compared with clopidogrel alone after recent ischaemic stroke or transient ischaemic attack in high-risk patients (MATCH): randomised, double-blind, placebo-controlled trial. Lancet 2004;364:331-7.
- Bhatt DL, Fox KAA, Hacke W, Berger PB, Black HR, Boden WE, et al. Clopidogrel and aspirin versus aspirin alone for the prevention of atherothrombotic events. N Engl J Med 2006;354:1706-17.
- Benavente OR, Hart RG, McClure LA, Szychowski JM, Coffey CS, Pearce LA et al. Effects of clopidogrel added to aspirin in patients with recent lacunar stroke. N Engl J Med 2012;367:817-25.
- Sudlow CL, Mason G, Maurice JB, Wedderburn CJ, Hankey GJ. Thienopyridine derivatives versus aspirin for preventing stroke and other serious vascular events in high vascular risk patients. Cochrane Database Syst Rev 2009;CD001246.
- Zuurbier SM, Vermeer SE, Hilkens PHE, Algra A, Roos YBWE. Secundaire preventie met clopidogrel na TIA of herseninfarct. Ned Tijdschr Geneeskd 2013;157:A5836.
- Antithrombotic Trialists Collaboration. Collaborative meta-analysis of randomised trials of antiplatelet therapy for prevention of death, myocardial infarction, and stroke in high risk patients. Bmj 2002;324:71-86.
- Johnson ES, Lanes SF, Wentworth CE, Satterfield MH, Abebe BL, Dicker LW. A metaregression analysis of the dose-response effect of aspirin on stroke. Arch Intern Med 1999;159:1248-53.
- Dutch TIA Trial Study Group. A comparison of two doses of aspirin (30 mg vs. 283 mg a day) in patients after a transient ischemic attack or minor ischemic stroke. N Engl J Med 1991;325:1262.
- Kalmann R, Nieuwenhuis HK, De Groot P, Van Gijn J. Effects of low dosis of aspirin, 10 mg and 30 mg daily, on bleeding time, tomboxane production and 6-keto-PGF1[alpha]-excretion in healthy subjects. Tromb Res 1987;45:355-61.
- Algra A, Koudstaal PJ, Van Gijn J. Secundaire preventie na cerebrale ischemie: monotherapie met acetylsalicylzuur nog steeds de eerste keus? Ned Tijdschr Geneeskd 1998;142:277.
- Halkes PHA, Van Gijn J, Kappelle LJ, Koudstaal PJ, Algra A. Aspirin plus dipyridamole versus aspirin alone after cerebral ischaemia of arterial origin (ESPRIT): randomised controlled trial. Lancet 2006;367:1665-73.
- Thijs V, Lemmens R, Fieuws S. Network meta-analysis: simultaneous meta-analysis of common antiplatelet regimens after transient ischaemic attack or stroke. Eur Heart J 2008;29:1086-92.
- Halkes PH, Gray LJ, Bath PM, Diener HC, Guiraud-Chaumeil B, Yatsu FM, et al. Dipyridamole plus aspirin versus aspirin alone in secondary prevention after TIA or stroke: a meta-analysis by risk. J Neurol Neurosurg Psychiatry 2008;79:1218-23.
- Verro P, Gorelick PB, Nguyen D. Aspirin plus dipyridamole versus aspirin for prevention of vascular events after stroke or TIA: a meta-analysis. Stroke 2008;39:1358-63.
- Dippel DW, Maasland L, Halkes P, Kappelle LJ, Koudstaal PJ, Algra A. Prevention with low-dose aspirin plus dipyridamole in patients with disabling stroke. Stroke 2010;41:2684-6.
- Diener HC, Cunha L, Forbes C, Sivenius J, Smets P, Lowenthal A. European Stroke Prevention Study. 2. Dipyridamole and acetylsalicylic acid in the secondary prevention of stroke. J Neurol Sci 1996;143:1-13.
- Heeg B, Damen J, Van Hout B. Oral antiplatelet therapy in secondary prevention of cardiovascular events: an assessment from the payer’s perspective. Pharmacoeconomics 2007;25:1063-82.
- Prasad K, Siemieniuk R, Hao Q, Guyatt G, O'Donnell M, Lytvyn L, et al. Dual antiplatelet therapy with aspirin and clopidogrel for acute high risk transient ischaemic attack and minor ischaemic stroke: a clinical practice guideline. 2018;363:k5130.
- Hao Q, Tampi M, O'Donnell M, Foroutan F, Siemieniuk RA, Guyatt G. Clopidogrel plus aspirin versus aspirin alone for acute minor ischaemic stroke or high risk transient ischaemic attack: systematic review and meta-analysis. BMJ 2018;363:k5108.
- Kennedy J, Hill MD, Ryckborst KJ, Eliasziw M, Demchuk AM, Buchan AM. Fast assessment of stroke and transient ischaemic attack to prevent early recurrence (FASTER): a randomised controlled pilot trial. Lancet Neurol 2007;6:961-9.
- Wang Y, Wang Y, Zhao X, Liu L, Wang D, Wang C, et al. Clopidogrel with aspirin in acute minor stroke or transient ischemic attack. N Engl J Med 2013;369:11-9.
- Johnston SC, Easton JD, Farrant M, Barsan W, Conwit RA, Elm JJ, et al. Clopidogrel and Aspirin in Acute Ischemic Stroke and High-Risk TIA. N Engl J Med 2018;379:215-25.
- Pan Y, Wang A, Liu G, Zhao X, Meng X, Zhao K, et al. Cost-effectiveness of clopidogrel-aspirin versus aspirin alone for acute transient ischemic attack and minor stroke. J Am Heart Assoc 2014;3:e000912.
- Anonymus. Secondary prevention in non-rheumatic atrial fibrillation after transient ischaemic attack or minor stroke. EAFT (European Atrial Fibrillation Trial) Study Group. Lancet 1993;342:1255-62.
- Saxena R, Koudstaal P. Anticoagulants versus antiplatelet therapy for preventing stroke in patients with nonrheumatic atrial fibrillation and a history of stroke or transient ischemic attack. Cochrane Database Syst Rev 2004;CD000187.
- Anonymus. Optimal oral anticoagulant therapy in patients with nonrheumatic atrial fibrillation and recent cerebral ischemia. The European Atrial Fibrillation Trial Study Group. N Engl J Med 1995a;333:5-10.
- De Schryver EL, Algra A, Kappelle LJ, Van Gijn J, Koudstaal PJ. Vitamin K antagonists versus antiplatelet therapy after transient ischaemic attack or minor ischaemic stroke of presumed arterial origin. Cochrane Database Syst Rev 2012;9:CD001342.
- Salazar CA, del Aguila D, Cordova EG. Direct thrombin inhibitors versus vitamin k antagonists for preventing cerebral or systemic embolism in people with non-valvular atrial fibrillation. Cochrane Database Syst Rev 2014:CD009893.
- Bruins Slot KM, Berge E. Factor xa inhibitors versus vitamin k antagonists for preventing cerebral or systemic embolism in patients with atrial fibrillation. Cochrane Database Syst Rev 2013:CD008980.
- Lin L, Lim WS, Zhou HJ, Khoo AL, Tan KT, Chew AP, et al. Clinical and safety outcomes of oral antithrombotics for stroke prevention in atrial fibrillation: a systematic review and network meta-analysis. J Am Med Dir Assoc 2015;16:1103.e1-19.
- Diener HC, Connolly SJ, Ezekowitz MD, Wallentin L, Reilly PA, Yang S, et al. Dabigatran compared with warfarin in patients with atrial fibrillation and previous transient ischaemic attack or stroke: a subgroup analysis of the RE-LY trial. Lancet Neurol 2010;9:1157-63.
- Hankey GJ, Patel MR, Stevens SR, Becker RC, Breithardt G, Carolei A, et al. Rivaroxaban compared with warfarin in patients with atrial fibrillation and previous stroke or transient ischaemic attack: a subgroup analysis of ROCKET AF. Lancet Neurol 2012;11:315-22.
- Easton JD, Lopes RD, Bahit MC, Wojdyla DM, Granger CB, Wallentin L, et al. Apixaban compared with warfarin in patients with atrial fibrillation and previous stroke or transient ischaemic attack: a subgroup analysis of the ARISTOTLE trial. Lancet Neurol 2012;11:503-11.
- Wallentin L, Yusuf S, Ezekowitz MD, Alings M, Flather M, Franzosi MG, et al. Efficacy and safety of dabigatran compared with warfarin at different levels of international normalised ratio control for stroke prevention in atrial fibrillation: an analysis of the RE-LY trial. Lancet 2010;376:975-83
- Adam SS, McDuffie JR, Ortel TL, Williams JW, Jr. Comparative effectiveness of warfarin and new oral anticoagulants for the management of atrial fibrillation and venous thromboembolism: a systematic review. Ann Intern Med 2012;157:796-807.
- Amarenco P, Bogousslavsky J, Callahan A, Goldstein LB, Hennerici M, Rudolph AE, et al. High-dose atorvastatin after stroke or transient ischemic attack. N Engl J Med 2006;355:549-59.
- Collins R, Armitage J, Parish S, Sleight P, Peto R. Effects of cholesterol-lowering with simvastatin on stroke and other major vascular events in 20536 people with cerebrovascular disease or other high-risk conditions. Lancet 2004;363:757-67.
- Manktelow BN, Potter JF. Interventions in the management of serum lipids for preventing stroke recurrence. Cochrane Database Syst Rev 2009;CD002091.
- Vergouwen MDI, De Haan RJ, Vermeulen M, Roos YBWE. Statin treatment and the occurrence of hemorrhagic stroke in patients with a history of cerebrovascular disease. Stroke 2008;39:497-502.
- Amarenco P, Labreuche J. Lipid management in the prevention of stroke: review and updated meta-analysis of statins for stroke prevention. Lancet Neurol 2009;8:453-63.
- Piepoli MF, Hoes AW, Agewall S, Albus C, Brotons C, Catapano AL, et al. 2016 european guidelines on cardiovascular disease prevention in clinical practice: the sixth joint task force of the european society of cardiology and other societies on cardiovascular disease prevention in clinical practice (constituted by representatives of 10 societies and by invited experts) developed with the special contribution of the european association for cardiovascular prevention & rehabilitation (eacpr). Eur Heart J 2016;37:2315-81.
- PROGRESS Collaborative Group. Randomised trial of a perindopril-based blood-pressure-lowering regimen among 6105 individuals with previous stroke or transient ischaemic attack. Lancet 2001;358:1033-41.
- Yusuf S, Diener HC, Sacco RL, Cotton D, Ounpuu S, Lawton WA, et al. Telmisartan to prevent recurrent stroke and cardiovascular events. N Engl J Med 2008;359:1225-37.
- Ovbiagele B, Diener HC, Yusuf S, Martin RH, Cotton D, Vinisko R, et al. Level of systolic blood pressure within the normal range and risk of recurrent stroke. JAMA 2011;306:2137-44.
- Lakhan SE, Sapko MT. Blood pressure lowering treatment for preventing stroke recurrence: a systematic review and meta-analysis. Int Arch Med 2009;2:30.
- Debette S, Leys D. Cervical-artery dissections: predisposing factors, diagnosis, and outcome. Lancet Neurol 2009;8:668-78.
- Lyrer P, Engelter S. Antithrombotic drugs for carotid artery dissection. Cochrane Database Syst Rev 2010;CD000255.
- Kennedy F, Lanfranconi S, Hicks C, Reid J, Gompertz P, Price C, et al. Antiplatelets vs anticoagulation for dissection: CADISS nonrandomized arm and meta-analysis. Neurology 2012;79:686-9.
- Béjot Y, Cordonnier C, Durier J, Aboa-Eboulé C, Rouaud O, Giroud M. Intracerebral haemorrhage profiles are changing: results from the Dijon population-based study. Brain 2013;136:658-64.
- Cheng B, Li J, Peng L, Wang Y, Sun L, He S, et al. Efficacy and safety of restarting antiplatelet therapy for patients with spontaneous intracranial haemorrhage: A systematic review and meta-analysis. J Clin Pharm Ther 2021;46:957-65.
- RESTART Collaboration. Effects of antiplatelet therapy after stroke due to intracerebral haemorrhage (RESTART): a randomised, open-label trial. Lancet 2019;393:2613-23.
- Al-Shahi Salman R, Dennis MS, Sandercock PAG, Sudlow CLM, Wardlaw JM, Whiteley WN, et al. Effects of Antiplatelet Therapy After Stroke Caused by Intracerebral Hemorrhage: Extended Follow-up of the RESTART Randomized Clinical Trial. JAMA Neurol 2021;78:1179-86.
- Goldstein LB, Amarenco P, Szarek M, Callahan A, Hennerici M, Sillesen H, et al. Hemorrhagic stroke in the stroke prevention by aggressive reduction in cholesterol levels study. Neurology 2008;70:2364-70.
- Westover MB, Bianchi MT, Eckman MH, Greenberg SM. Statin use following intracerebral hemorrhage: a decision analysis. Arch Neurol 2011;68:573-9.
- Visseren FL, Lansberg PJ, Erkelens DW, Kastelein JJ. Statinen: mogelijk meer dan alleen verandering van de lipideconcentratie. Ned Tijdschr Geneeskd 2000;144:316-21.
- McKinney JS, Kostis WJ. Statin therapy and the risk of intracerebral hemorrhage: a meta-analysis of 31 randomized controlled trials. Stroke 2012;43:2149-56.
- Hackam DG, Woodward M, Newby LK, Bhatt DL, Shao M, Smith EE, et al. Statins and intracerebral hemorrhage: collaborative systematic review and meta-analysis. Circulation 2011;124:2233-42.
- Huijsman R. Stroke service biedt betere zorg voor CVA-patiënten. Med Contact 2001;48:1765-8.
- Minkman MMN, Schouten LMT, Huijsman R, Van Splunteren PT. Integrated care for patients with a stroke in the Netherlands: results and experiences from a national Breakthrough Collaborative Improvement project. Int J Integr Care 2005;5:e14.
- Mitchell GK, Brown RM, Erikssen L, Tieman JJ. Multidisciplinary care planning in the primary care management of completed stroke: a systematic review. BMC Fam Pract 2008;9:44.
- Kennisnetwerk CVA NL. Deelname stroke services aan Kennisnetwerk CVA NL (2013). Ga naar bron: Kennisnetwerk CVA NL. Deelname stroke services aan Kennisnetwerk CVA NL (2013).