Schildklieraandoeningen
Richtlijnen diagnostiek
Naar Volledige tekst ›Anamnese
Naar Volledige tekst ›Een schildklierfunctiestoornis is lastig te herkennen. Klachten en symptomen zijn meestal aspecifiek:
- klachten passend bij hypothyreoïdie zijn gewichtstoename, kouwelijkheid, obstipatie, myxoedeem in het gezicht, traagheid, vermoeidheid
- klachten passend bij hyperthyreoïdie zijn gewichtsverlies ondanks normale eetlust, diarree, nervositeit, oftalmopathie, hartkloppingen, tremor.
Lichamelijk onderzoek
Naar Volledige tekst ›- Palpatie van de schildklier en cervicale lymfklieren.
- Bij een vermoeden van hyperthyreoïdie: pols en auscultatie hart.
Aanvullend onderzoek
Naar Volledige tekst ›- Bepaal TSH en indien afwijkend fT4. Volg voor de interpretatie de (leeftijdsspecifieke) referentie-intervallen van het laboratorium.
- Bij een vermoeden van subacute thyreoïditis: bepaal CRP en leukocyten.
- Controle subklinische hyperthyroïdie (3 maanden na de diagnose): bepaal TSH-R-antistoffen.
Evaluatie
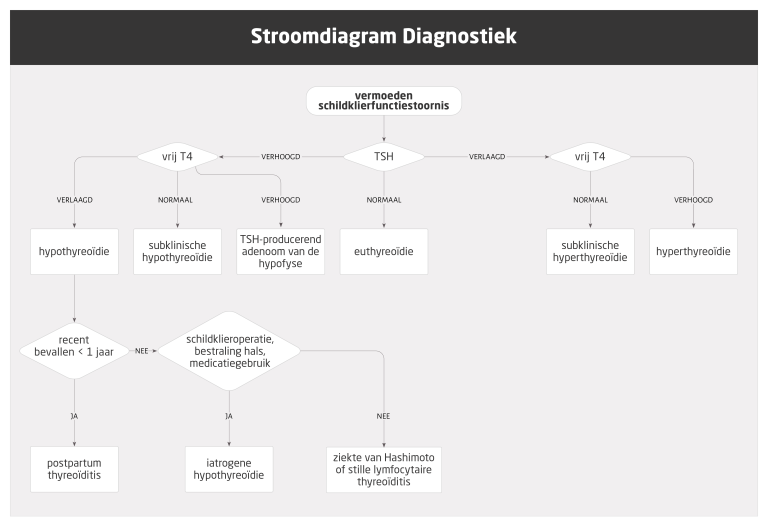
Naar Volledige tekst ›- Voor de interpretatie van laboratoriumonderzoek, zie figuur h1 Stroomdiagram diagnostiek bij vermoeden van schildklierfunctiestoornis.
- Maak bij palpabele afwijkingen onderscheid tussen een solitaire nodus, een diffuus struma en een multinodulair struma met of zonder dominante nodus.
Richtlijnen beleid bij hypothyreoïdie
Naar Volledige tekst ›Voorlichting
Naar Volledige tekst ›- Leg uit dat de schildklier te langzaam werkt. Behandeling bestaat uit suppletie met schildklierhormoon.
- Adviseer patiënten om direct contact op te nemen na een positieve zwangerschapstest.
- Adviseer patiënten geen zwangerschap na te streven totdat ze goed zijn ingesteld.
Medicamenteuze behandeling
Naar Volledige tekst ›- De medicamenteuze behandeling bestaat uit substitutie met levothyroxine.
- Voor dosering en aandachtspunten bij levothyroxine, zie tabel h1.
Controles
Naar Volledige tekst ›- Bepaal elke 6 weken het TSH en fT4, tot de patiënt (zo goed als) klachtenvrij is.
- In het eerste jaar nadat de patiënt klachtenvrij is: controleer TSH en fT4 elke 3 maanden.
- Na het eerste klachtenvrije jaar: controleer jaarlijks, of eerder bij klachten.
Consultatie en verwijzing
Naar Volledige tekst ›Verwijs naar de internist(-endocrinoloog) bij:
- vermoeden van een centrale oorzaak
- ernstige cardiale problemen
- ernstige, persisterende klachten ondanks adequate behandeling met levothyroxine > 6 maanden
Richtlijnen beleid bij subklinische hypothyreoïdie
Naar Volledige tekst ›Voorlichting
Naar Volledige tekst ›Leg uit dat de schildklier goed werkt, maar dat het TSH afwijkend is.
Medicamenteuze behandeling
Naar Volledige tekst ›We bevelen een (proef)behandeling met levothyroxine niet aan.
Controles
Naar Volledige tekst ›Herhaal laboratoriumonderzoek alleen bij klachten die wijzen op hypothyreoïdie.
Richtlijnen beleid bij hyperthyreoïdie
Naar Volledige tekst ›Voorlichting
Naar Volledige tekst ›Leg uit dat de schildklier te snel werkt. Behandeling vindt plaats door de internist(-endocrinoloog).
Consultatie en verwijzing
Naar Volledige tekst ›- Verwijs patiënten met hyperthyreoïdie naar een internist(-endocrinoloog).
- Spoedverwijsindicaties:
- vermoeden van een thyreotoxische crisis
- diagnose voor het eerst gesteld tijdens zwangerschap
Richtlijnen beleid bij subklinische hyperthyreoïdie
Naar Volledige tekst ›Voorlichting
Naar Volledige tekst ›- Leg uit dat schildklier goed werkt, maar dat het TSH afwijkend is.
- Behandeling is niet nodig, controles zijn geïndiceerd in verband met verhoogd risico op atriumfibrilleren en op fracturen. Daarom volgen er extra controles.
Controles
Naar Volledige tekst ›- Herhaal pols en auscultatie hart (atriumfibrilleren)
- Na 3 maanden: TSH, fT4 en (eenmalig) TSH-R-antistoffen.
- Indien na 3 maanden de TSH-concentratie verlaagd blijft: overweeg DXA-VFA-meting naar osteoporose (zie NHG-Standaard Fractuurpreventie).
Consultatie en verwijzing
Naar Volledige tekst ›Verwijs naar internist(-endocrinoloog) bij:
- persisterend (> 3 maanden) TSH onder referentie-interval én aanwezigheid atriumfibrilleren of osteoporose
- persisterend (> 3 maanden) TSH onder referentie-interval en positieve TSH-R-antistoffen
- TSH < 0,1 mU/L
Richtlijnen beleid bij zwelling of palpabele afwijkingen in de schildklier
Naar Volledige tekst ›- Voor beleid, zie tabel h2.
- Wanneer een struma klachten veroorzaakt, is behandeling geïndiceerd. Bepaal het TSH en volg het beleid zoals beschreven bij de betreffende schildklierfunctiestoornis.
Schildklieraandoeningen tijdens zwangerschap, zwangerschapswens en postpartumperiode
Naar Volledige tekst ›Verwijs zwangere patiënten met de ziekte van Graves in de voorgeschiedenis naar de internist(-endocrinoloog) en de gynaecoloog.
Hypothyreoïdie
Naar Volledige tekst ›- Overleg met de internist(-endocrinoloog) over behandeling indien (subklinische) hypothyreoïdie ontstaat tijdens de zwangerschap.
- Voorafgaand aan de zwangerschap in huisartsenpraktijk behandeld voor hypothyreoïdie én goed ingesteld op medicatie: verhoog de dosis levothyroxine met circa 25-30% (2 keer per week een dubbele dosering) zodra zwangerschap is aangetoond.
Belangrijkste wijzigingen
Naar Samenvatting ›- De leeftijdsgrens is vervallen bij het vertraagde opbouwschema van levothyroxine voor de behandeling van hypothyreoïdie.
- Bij patiënten met subklinische hypothyreoïdie bevelen we (proef)behandeling met levothyroxine niet meer aan.
- Herhaal bij patiënten met subklinische hypothyreoïdie de bepaling van TSH en vrije T4 (fT4) alleen bij klachten die wijzen op hypothyreoïdie.
- Bij patiënten met subklinische hyperthyreoïdie is de controle uitgebreid en zijn de verwijscriteria uitgebreider omschreven.
- De voor de huisarts facultatieve behandeling bij hyperthyreoïdie is vervallen.
Kernboodschappen
Naar Samenvatting ›- Ga uit van de referentie-intervallen voor TSH en vrije T4 (fT4) zoals het laboratorium die aangeeft.
- Behandel een subklinische hypothyreoïdie niet met een (proef)behandeling levothyroxine en herhaal TSH en fT4 alleen bij klachten die wijzen op hypothyreoïdie.
- Overleg met de internist(-endocrinoloog) bij patiënten met een subklinische hypothyreoïdie en een zwangerschap of zwangerschapswens; voor hen geldt mogelijk een behandelindicatie.
Inleiding
Naar Samenvatting ›Scope
Naar Samenvatting ›- Diagnostiek en behandeling van hypothyreoïdie en subklinische hypothyreoïdie bij volwassenen.
- Diagnostiek van hyperthyreoïdie bij volwassenen.
- Diagnostiek en behandeling bij veranderingen in van de omvang van de schildklier, zoals struma of een nodus bij volwassenen.
- Diagnostiek en behandeling van vrouwen met (subklinische) hypothyreoïdie en een zwangerschap, zwangerschapswens en/of postpartum.
Samenwerking en afstemming
Naar Samenvatting ›Deze NHG-Standaard sluit aan bij:
- Richtlijn Schildklierfunctiestoornissen van de Nederlandse Internisten Vereniging (NIV)
- Richtlijn Schildklierfunctiestoornis voor, tijdens en na de zwangerschap van de Nederlandse Vereniging voor Obstetrie en Gynaecologie (NVOG)
Achtergronden
Naar Samenvatting ›Begrippen
Naar Samenvatting ›TSH
Naar Samenvatting ›Thyreoïdstimulerend hormoon (TSH). Bepaling van het TSH is de belangrijkste screeningstest voor de schildklierfunctie.
Vrije T4 (fT4 )
Naar Samenvatting ›Het deel van het totale thyroxine (T4) in het bloed dat niet aan dragereiwitten is gebonden.
T3
Naar Samenvatting ›Tri-jodothyronine (T3), het biologisch actieve schildklierhormoon dat voornamelijk in de weefsels aanwezig is.
Euthyreoïdie
Naar Samenvatting ›Normale schildklierfunctie, met TSH en fT4 beide binnen het referentie-interval (meetbaar in het bloed).
Hypothyreoïdie
Naar Samenvatting ›Verminderde schildklierfunctie, met als kenmerk een verhoogd TSH en een verlaagd fT4.
Hyperthyreoïdie
Naar Samenvatting ›Overproductie van schildklierhormonen door de schildklier zelf, veroorzaakt door aandoeningen zoals de ziekte van Graves of toxisch multinodulair struma. Bij hyperthyreoïdie met een primaire oorzaak in de schildklier is sprake van een verhoogde schildklierfunctie, met als kenmerk een verlaagd TSH en een verhoogd fT4. Bij hyperthyreoïdie met centrale oorzaak (niet primair in de schildklier) is het TSH niet verlaagd.
Subklinische schildklierfunctiestoornis
Naar Samenvatting ›Bevinding bij laboratoriumonderzoek waarbij het TSH te hoog (subklinische hypothyreoïdie) of te laag (subklinische hyperthyreoïdie) is en het fT4 een waarde binnen het referentie-interval heeft. Het TSH normaliseert meestal spontaan, deze kans wordt kleiner naarmate de TSH-waarden hoger zijn. De gemeten concentraties zijn afhankelijk van de methode (en daarmee laboratoriumafhankelijk) en niet te vangen in één absolute afkapwaarde.
De in de NHG-Standaard gebruikte definitie van subklinische schildklierfunctiestoornissen is in de internationale literatuur de meest gebruikelijke. Het is een diagnose gebaseerd op laboratoriumuitslagen. De term ‘subklinisch’ geeft aan dat het vrije T4 zich in het normale referentiegebied bevindt met een afwijkende TSH. De relatie met eventuele klachten is niet altijd duidelijk. Subklinische schildklierfunctiestoornissen aan de hand van de laboratoriumuitslagen komen vaker voor dan de klinische vormen.
Thyreotoxicose
Naar Samenvatting ›Een te hoge concentratie fT4 in het bloed. TSH is verlaagd. Er zijn meerdere oorzaken van thyreotoxicose, waaronder de ziekte van Graves, een toxisch adenoom. Hyperthyreoïdie en thyreotoxicose zijn termen die vaak door elkaar worden gebruikt, maar verschillen van betekenis. Thyreotoxicose is een overmaat aan schildklierhormonen in het bloed, ongeacht de bron, en kan ook worden veroorzaakt door exogene factoren zoals medicatie of door aandoeningen zoals subacute thyreoïditis, waarbij de schildklierhormoonproductie niet verhoogd is, maar dit "weglekt", niet zelden gevolgd door een episode van hypothyreoïdie. In de dagelijkse praktijk zal in de huisartsgeneeskunde vaak voor beide vormen de term "hyperthyreoïdie" worden gebruikt.
Thyreotoxische crisis
Naar Samenvatting ›Een ernstige zeldzame thyreotoxicose (ook wel thyreotoxische storm genoemd). Dit kan door een hyperthyreoïdie komen, waarbij de schildklier te veel hormoon aanmaakt, maar ook door een thyreoïditis waardoor vanwege schade aan de schildkliercellen schildklierhormoon weglekt uit de cel (en er dus geen verhoogde aanmaak is). Symptomen zijn: koorts > 39° C, diarree, braken, dyspnoe, ernstige palpitaties, oedeem, icterus, verwardheid, convulsies, hartfrequentie > 140/min (meestal boezemfibrilleren), decompensatio cordis, icterus, delier, hyperkinesie, hyperreflexie. Mogelijke uitlokkende factoren zijn: infectie, operatie, bevalling, beroerte, diabetische ketoacidose, longembolie, myocardinfarct.
Hypothyreotische crisis
Naar Samenvatting ›Een langer bestaande onbehandelde hypothyreoïdie kan door een uitlokkende factor (bijvoorbeeld infectie, beroerte, hartinfarct of gastro-intestinale bloeding) leiden tot een hypothyreotische crisis, voorheen: myxoedeem coma (zeldzaam, levensbedreigend). Symptomen zijn onder andere een veranderde mentale status, respiratoire insufficiëntie, hypothermie, hartfalen, bradycardie en hypotensie.
Ernstige, langdurig onbehandelde hypothyreoïdie kan bij een oudere patiënt leiden tot een hypothyreotische crisis. Dit werd voorheen myxoedeem coma genoemd. Een verwarrende naamgeving aangezien er geen myxoedeem noch coma hoeft te bestaan bij deze aandoening. Daarom is besloten de naam aan te passen naar hypothyreotische crisis. Het is een levensbedreigende aandoening. Symptomen zijn verminderd bewustzijn en vaak hypothermie en verder oedeem, hypoventilatie, hyponatriëmie, hypoglykemie, bradycardie en hypotensie.
Anti-TPO
Naar Samenvatting ›Auto-antistoffen gericht tegen thyreoïdperoxidase (TPO), een enzym dat betrokken is bij de productie van schildklierhormoon.
TSH-R-antistoffen
Naar Samenvatting ›Auto-antistoffen gericht tegen de TSH-receptor, ook wel TSH-receptorstimulerende immunoglobulines genoemd (TSH-R-antistoffen of TSI). Deze stimulerende auto-antistoffen binden aan de TSH-receptor en stimuleren zo de aanmaak van schildklierhormoon. Indien er sprake is van een (subklinische) hyperthyreoïdie dan is de aanwezigheid van stimulerende TSH-R-antistoffen bewijzend voor de ziekte van Graves.
Thyreoïdperoxidase (TPO) is een enzym dat is betrokken bij de productie van schildklierhormoon. Bij de medicamenteuze behandeling van hyperthyreoïdie maakt men gebruik van remming van TPO.
Bij aanwezigheid van TPO-antistoffen (anti-TPO) is er een verhoogde kans op het ontwikkelen van hypothyreoïdie. De hoogte van de concentratie van anti-TPO is geen maat voor de ernst van de ziekte. Het is onduidelijk waarom sommige patiënten bij wie anti-TPO kunnen worden aangetoond, hypothyreoïdie krijgen en anderen niet.
Vrouwen met anti-TPO hebben een risico van 2 tot 3% per jaar om (subklinische) hypothyreoïdie te ontwikkelen. Hebben zij tevens een subklinische hypothyreoïdie met een TSH > 6 U/L, dan is het risico op de ontwikkeling van hypothyreoïdie 4 tot 5% per jaar. Bij mannen is de kans om hypothyreoïdie te ontwikkelen kleiner, maar de aanwezigheid van anti-TPO verhoogt het risico bij mannen meer dan bij vrouwen, respectievelijke HR 25,0 (95%-BI 10,0 tot 63,0) en 8,0 (95%-BI 5,0 tot 25,0). De oddsratio bij een combinatie van een verhoogd TSH en positieve anti-TPO is voor mannen 173 (95%-BI 81 tot 370) en voor vrouwen 38 (95%-BI 22 tot 65).
Een overzichtsartikel van McDermott geeft aan dat anti-TPO aanwezig kunnen zijn bij meerdere oorzaken van een hypothyreoïdie (ziekte van Hashimoto, post-partumthyreoïditis, stille of lymfocytaire thyreoïditis en subacute thyreoïditis).
Bij aanwezigheid van anti-TPO zal een subklinische hypothyreoïdie bij 58,8% na 10 jaar klinisch manifest worden, tegen 23,2% bij negatieve antistoffen.
De oddsratio’s voor het ontwikkelen van klinisch manifeste hypothyreoïdie zijn: (a) alleen verhoogd serum TSH: vrouwen 8 (95%-BI 3 tot 20), mannen 44 (95%-BI 19 tot 104), (b) alleen positieve anti-TPO: vrouwen 8 (95%-BI 5 tot 15). De aanwezigheid van anti-TPO zou kunnen worden meegewogen bij de uitleg over de prognose, maar de aanwezigheid van anti-TPO heeft echter geen invloed op het beleid. De werkgroep ziet daardoor geen indicatie voor de bepaling ervan. In de module ‘Miskraam, vroegtijdige bevalling en TPOAb’ (anti-TPO, schildklierautoantistoffen) van de NVOG uit 2021 wordt aangegeven dat er onvoldoende bewijs is om screening van alle vrouwen op anti-TPO in het eerste trimester van de zwangerschap aan te bevelen.
Auto-antistoffen gericht tegen de TSH-receptor, ook wel TSH-receptorstimulerende immunoglobulines genoemd (TSH-R-antistoffen of TSI), zijn stimulerende auto-antistoffen binden aan de TSH-receptor en stimuleren zo de aanmaak van schildklierhormoon. Indien er sprake is van een (subklinische) hyperthyreoïdie dan is de aanwezigheid van stimulerende TSH-R-antistoffen bewijzend voor de ziekte van Graves. Laboratoria in Nederland gebruiken verschillende assays met verschillende afkapwaarden.
Oftalmopathie
Naar Samenvatting ›Een auto-immuunfenomeen dat kan optreden bij de Ziekte van Graves. Door een auto-immuunreactie treden verdikking van de oogspieren, toename van retrobulbair vetweefsel en fibrosering op, waardoor er uitpuiling van de ogen ontstaat. Dit resulteert in exoftalmus (proptosis), ooglidoedeem, pijn, tranenvloed, dubbelzien en soms visusstoornissen met kans op blindheid. Bij de ziekte van Graves heeft 5% van de patiënten een ernstige, klinisch manifeste oftalmopathie en 45% (milde) orbitopathie.
Oftalmopathie is waarschijnlijk het gevolg van een auto-immuunontsteking van de retrobulbaire weefsels. Patiënten met een oftalmopathie worden verwezen naar een internist met ervaring op het gebied van Graves’ oftalmopahtie, omdat hun behandeling vaak moeizaam verloopt. Voor meer informatie, zie NIV-richtlijn Schildklierfunctiestoornissen, module Graves’ ophthalmopathie.
Schildkliernodus
Naar Samenvatting ›Knobbel in de schildklier. De aard varieert van benigne tot schildkliercarcinoom. Een dominante nodus: een vergrote nodus (> 1 cm) in een multinodulair struma.
De kans op een maligniteit bij een dominante nodus in een multinodulair struma is even groot als bij een solitaire nodus. Aanwijzingen bij anamnese en lichamelijk onderzoek voor een schildkliercarcinoom zijn een nieuwe nodus met een (snelle) duidelijke groei, positieve familieanamnese voor schildkliercarcinoom, bestraling van het halsgebied in de voorgeschiedenis, leeftijd < 20 jaar of > 60 jaar in het bijzonder mannen, onverklaarde heesheid en verandering van de stem geassocieerd met een struma, cervicale lymfadenopathie, stridor, nodus > 4 cm, solitaire nodus, vast-hard aspect en fixatie. Bij echografie zijn de volgende aspecten van belang: hypo-echogeniciteit, (micro)calcificaties, irregulaire grens, de afwezigheid van een halo en een vaste zwelling komen vaker voor bij een maligne dan bij een benigne schildkliernodus. Echografie met geleide cytologische punctie (Fine Needle Aspiration Cytology (FNAC) geldt in recente specialistische richtlijnen als een accurate test voor het vaststellen of uitsluiten van een maligniteit bij een schildkliernodus. Hoewel FNAC een hoge mate van zekerheid kan geven over de aard van een nodus, sluit de uitslag ‘benigne’ een schildkliercarcinoom niet met zekerheid uit, likelihood ratio 0,1 (95%-BI 0 tot 0,3). Voor het aantonen dan wel uitsluiten van een schildkliercarcinoom is een multidisciplinaire benadering noodzakelijk met beoordeling van alle bovengenoemde aspecten.
Struma
Naar Samenvatting ›Vergroting van de schildklier. Kan diffuus of nodulair zijn, en een enkele of meerdere noduli bevatten. De aanwezigheid van een struma leidt niet altijd tot een schildklierfunctiestoornis.
Epidemiologie
Naar Samenvatting ›- Hypothyreoïdie (ICPC-code T86) in de huisartsenpraktijk:
- Incidentie: 1 per 1000 patiënten per jaar (1,6 per 1000 vrouwen, 0,6 per 1000 mannen)
- Prevalentie: 29,4 per 1000 patiënten (47,5 voor vrouwen, 11 voor mannen)
- Hyperthyreoïdie (ICPC-code T85) in de huisartsenpraktijk:
- Incidentie: 1,5 per 1000 patiënten per jaar (2,4 per 1000 vrouwen, 0,6 per 1000 mannen)
- Prevalentie: 4,1 per 1000 patiënten (6,6 voor vrouwen, 1,5 voor mannen)
- De incidentie van beide aandoeningen neemt toe met de leeftijd.
- Schildkliernodus en struma komen vooral bij vrouwen voor. De incidentie voor deze aandoeningen samen bedraagt 0,3 per 1000 patiënten per jaar. De incidentie neemt toe met de leeftijd.
De in de hoofdtekst genoemde gegevens zijn afkomstig van Nivel Zorgregistraties Eerste Lijn 2021.
Het NHG ontvangt van het Nivel een uitgebreide set aan gegevens. Deze zijn berekend uit de gegevens van bijna 400 huisartsenpraktijken met ruim 1,7 miljoen ingeschreven patiënten. De selectie van huisartsenpraktijken is gebaseerd op de kwaliteit van hun registratie van ICPC-codes en wordt representatief geacht voor de Nederlandse bevolking. De gegevens in de hoofdtekst over de incidentie van maligniteiten van de schildklier zijn gebaseerd op de registratie van de Vereniging van Integrale Kankercentra (NKR-cijfers, geraadpleegd 11 april 2003). In 2022 werd bij 894 patiënten in Nederland een maligniteit van de schildklier gediagnosticeerd.
In de literatuur bestaat geen eenstemmigheid over de vraag of patiënten met de ziekte van Graves een hoger risico hebben op een schildkliercarcinoom. Stocker en Burch includeerden 23 onderzoeken in hun review.
Alle onderzoeken waren retrospectief en vaak zonder controlegroep. De gevonden frequenties van schildkliercarcinoom varieerden van 0 tot bijna 10%. De auteurs concluderen dat het risico verhoogd is en schildkliercarcinoom vooral voorkomt bij patiënten met een palpabele nodus of met een koude nodus op de schildklierscintigrafie. Pazaitou concludeert in een review met 46 onderzoeken (reviews, originele onderzoeken en case reports) dat het verband tussen de ziekte van Graves en de verhoogde kans op schildkliercarcinoom niet bewezen is.
In 2022 werd bij 894 patiënten in de algemene bevolking een maligniteit van de schildklier gediagnosticeerd (602 vrouwen en 292 mannen).
Fysiologie
Naar Samenvatting ›De schildklier heeft een centrale plaats in het metabolisme. De schildklierfunctie wordt gereguleerd vanuit de hypothalamus en de hypofyse. Thyreotropine-‘releasing’ hormoon (TRH) uit de hypothalamus stimuleert de afgifte van thyreoïdstimulerend hormoon (TSH, thyreotroponine) in de hypofysevoorkwab. TSH zet de schildklier aan tot productie van de schildklierhormonen thyroxine (T4) en tri-jodothyronine (T3). De schildklier produceert ongeveer 10-20 keer zoveel T4 als T3. T4 is een overwegend inactief prohormoon dat in nieren, lever, hersenen, spieren en hypofyse wordt omgezet in het biologisch actieve hormoon T3. Omgekeerd remmen de schildklierhormonen de productie van TRH en TSH, waardoor een evenwicht ontstaat (negatieve feedback regulatie). Er kunnen allerlei processen van invloed zijn op deze regelkring; dag-nachtritme, acute ontsteking, chronische ziekte en/of voedingstoestand. Bij schildklierfunctiestoornissen is dit evenwicht verstoord.
Pathofysiologie
Naar Samenvatting ›Een tekort aan schildklierhormonen resulteert in een verlaagd metabolisme, een overmaat resulteert in een verhoogd metabolisme. Er kan sprake zijn van een primaire oorzaak (in de schildklier zelf) of een centrale oorzaak (in de hersenen). Het laatste is zeldzaam. Primaire hypothyreoïdie gaat gepaard met een verhoging van TSH en primaire hyperthyreoïdie met verlaging van TSH. Een TSH binnen het referentie-interval sluit een schildklierfunctiestoornis nagenoeg uit.
Bij 95% van de patiënten met een schildklierfunctiestoornis is er sprake van een primaire stoornis van de schildklier. De terugkoppeling is wel intact. Een primaire schildklierfunctiestoornis is vaak een auto-immuunziekte. Deze patiënten hebben een verhoogd risico op andere auto-immuunziekten, bijvoorbeeld diabetes mellitus type 1, reumatoïde artritis of pernicieuze anemie.
Als de oorzaak buiten de schildklier ligt, wordt dit een centrale stoornis genoemd. Secundair als de oorzaak ligt in de hypofyse, tertiair als de oorzaak in de hypothalamus ligt. Een secundaire hypothyreoïdie heeft meestal een iatrogene oorzaak. Bijvoorbeeld immuuntherapie-geassocieerd, bestraling van de hypofyse of een operatie.
Geassocieerde auto-immuunziekten
Bij schildklierfunctiestoornissen gaat het vaak om auto-immuunziekten. Auto-immuunziekten zoals ziekte van Graves (primaire hyperthyreoïdie), ziekte van Hashimoto (primaire hypothyreoïdie), diabetes mellitus type 1, reumatoïde artritis, ziekte van Addison, vitiligo, systemische lupus erythematodes (SLE), coeliakie, pernicieuze anemie en het syndroom van Sjögren komen regelmatig gecombineerd voor. Er is geen onderzoek beschikbaar over de incidentie in de eerste lijn van gezamenlijk voorkomen van de auto-immuunziekten, waardoor het niet mogelijk is om een exact verhoogd risico aan te geven. Het is niet bewezen effectief om na vaststellen van een schildklierziekte te screenen op de geassocieerde auto-immuunziekten. Indien er bij een adequate behandeling van een schildklierfunctiestoornis klachten blijven bestaan, is er mogelijk sprake van een tweede auto-immuunziekte.
Iatrogene oorzaken van schildklierfunctiestoornissen
Invloed geneesmiddelen op de schildklierfunctie. Van een groot aantal geneesmiddelen is bekend dat ze het metabolisme van de schildklier via verschillende mechanismen kunnen beïnvloeden, maar bij slechts enkele geneesmiddelen is dit van klinische betekenis. Zo kan de productie van schildklierhormonen beïnvloed worden, de hypothalamus-hypofyse-schildklier-as kan verstoord raken, er kunnen effecten zijn op de activatie, perifere omzetting en eliminatie van schildklierhormonen, toxische effecten op de schildklier en auto-immuunreacties. Er zijn geen geneesmiddelen bekend die bij een patiënt met een afwijkende schildklierfunctie kunnen zorgen voor een ‘normaal’ laboratoriumbeeld.
Jodium
Jodium wordt door het lichaam gebruikt bij de aanmaak van schildklierhormonen. De mens krijgt jodium binnen via de voeding (onder andere brood en keukenzout). Een overmaat aan jodium zorgt voor remming van de aanmaak en afgifte van schildklierhormoon. Jodium zit onder andere ook in röntgencontrastmiddelen. Andere bronnen zijn oogdruppels met povidonjodium, multivitaminen, visoliecapsules jodiumtinctuur en povidonjodium als oplossing, in gazen en wondpoeder. Ook in zeewiersupplementen (kelp) komt jodium voor.
In veel gevallen gaat het om zelfmedicatie. Bij chronische overschrijding van 10 tot 20 maal de dagelijkse behoefte (volgens het WHO-advies 150 tot 250 μg/dag) lijkt het risico op het ontstaan van schildklierfunctiestoornissen verhoogd te zijn.
Lagere doseringen leiden dankzij aanpassingsmechanismen van de schildklier meestal niet tot schildklierfunctiestoornissen. Schieten deze aanpassingsmechanismen tekort, dan kan een hypo- of hyperthyreoïdie ontstaan. Het effect van jodium is meestal binnen 12 weken na staken van het geneesmiddel verdwenen.
De reden dat wordt aangeraden bij een kernongeval jodiumtabletten in te nemen is omdat dan door de jodiumtabletten de schildklier verzadigd raakt met stabiel jodium. Daardoor neemt de schildklier minder radioactief jodium op, waardoor de kans om kanker te ontwikkelen afneemt.
Hypothyreoïdie na radioactief jodium
Na behandeling van hyperthyreoïdie met radioactief jodium neemt de prevalentie van hypothyreoïdie met de jaren toe. Follow-uponderzoeken laten uiteenlopende getallen zien. De kans op hypothyreoïdie na behandeling met radioactief jodium is na een jaar 30 tot 60%. Na het eerste jaar is er een toename met ongeveer 3% per jaar, tot 50 à 80% na 10 jaar. Patiënten met de ziekte van Graves hebben een grotere kans om hypothyreoïdie te ontwikkelen na een behandeling met radioactief jodium dan patiënten met een multinodulair struma. Bij de ziekte van Graves is dit bijna 100%. Ter vergelijking: na chirurgische behandeling (hemithyreoïdectomie) van hyperthyreoïdie ontwikkelt in de loop van de eerste 2 jaar na de operatie een deel van de patiënten ook hypothyreoïdie. Dit risico is met ongeveer 40% uiteindelijk kleiner dan na behandeling met radioactief jodium. Het hangt echter ook van de dosering af.
Amiodaron
Amiodaron is een jodiumhoudend antiaritmicum en wordt gebruikt bij diverse hartritmestoornissen. Het kan effect hebben op de schildklierfunctie, maar ook alleen op de TSH-waarde. Het kan resulteren in afwijkende TSH-waarden zonder dat er sprake is van een stoornis in de schildklierfunctie. Interpretatie van schildklierwaarden bij een patiënt die amiodaron gebruikt is complex.
Een stijging van het TSH kan ontstaan na starten van amiodaron en is vaak tijdelijk van aard. Ook kan er een omzettingsstoornis van T4/fT4 naar T3 ontstaan. Door deze omzettingsstoornis kan bij een amiodaron-geïnduceerde hypothyreoïdie een relatief hoog fT4 gemeten worden.
Uit een prospectieve studie is gebleken dat 89% van de met amiodaron behandelde patiënten euthyreotisch blijft na een gemiddelde follow-up van 16 maanden.
De grote hoeveelheden jodium in amiodaron (74 mg jodium per tablet van 200 mg) kan tot thyreotoxicose (hyperthyreoïdie) leiden, maar door remming van de synthese en afgifte van schildklierhormoon ook tot hypothyreoïdie. In een Nederlands onderzoek met een follow-up van 54 maanden werd gezien dat respectievelijk 12.1% en 6.9% een hyper- of hypothyreoïdie ontwikkelden. Na 18 maanden werden er al geen nieuwe gevallen meer van hypothyreoïdie geconstateerd.
Amiodaron wordt opgeslagen in vetweefsel en daardoor kunnen schildklierfunctiestoornissen ook nog maanden na het staken van amiodaron ontstaan. Als er hypothyreoïdie ontstaat, kan dit worden behandeld met levothyroxine. De behandeling van een door amiodaron geïnduceerde thyreotoxicose is daarentegen niet eenvoudig en vergt eerst uitgebreide diagnostiek.
Het optreden van een thyreotoxicose gebeurt plotseling en is niet afhankelijk van de duur van de behandeling met amiodaron. Er worden twee typen amiodarongeïnduceerde thyreotoxicose onderscheiden. Type I ontstaat door een overmaat aan jodium en type II door destructie van de follikelepitheelcellen. Type II komt verreweg het meeste voor. Om beide ziektes te onderscheiden is uitgebreide diagnostiek nodig, zoals laboratoriumonderzoek, echografie of schildklierscintigrafie.Het beleid bij type I is het staken van de amiodaron en behandeling starten met thiamazol en kaliumperchloraat. Bij type II kan de amiodaron worden gecontinueerd en wordt deze behandeld met prednison.
Door de uitgebreide diagnostiek, het moeilijk onderscheid tussen beide types amiodarongeïnduceerde thyreotoxicose en de ingewikkelde behandeling is verwijzing naar de internist-endocrinoloog geïndiceerd.
Lithium
Lithium wordt voorgeschreven bij een bipolaire stoornis en remt de secretie van T3 en T4. Het negatieve feedbackmechanisme van de schildklierhormonen valt weg en de TSH-concentratie stijgt. Dit kan leiden tot een struma. Na 1 tot 5 jaar lithiumgebruik komt bij 4% van de patiënten hypothyreoïdie voor na meer dan 10 jaar is dit gestegen tot 21%. Lithium kan sporadisch ook tot hyperthyreoïdie leiden.
Voedingssupplementen
‘Kelp’ is een soort zeewier met een hoog jodiumgehalte. Een overmaat aan jodium kan zorgen voor remming van de aanmaak en afgifte van schildklierhormoon. Het effect van te veel supplementen slikken kan daardoor resulteren in hypothyreoïdie.
Biotine (vitamine B8) is een voedingssupplement dat vrij verkrijgbaar is. Van nature komt deze vitamine voor in zuivel, orgaanvlees en peulvruchten en speelt het een rol bij vorming van vetzuren. Gebruik van biotine kan leiden tot analytische interferenties en daarmee tot afwijkingen in TSH en vrij T4 concentraties, zonder dat er sprake is van een schildklierstoornis. De TSH-concentratie kan foutief verlaagd zijn en de vrije T4- en vrij T3-concentraties kunnen foutief verhoogd zijn.
Orale oestrogenen
Oestrogenen verhogen de aanmaak van transporteiwitten (thyreoxinebindend globuline; TBG), dit leidt tot meer T4-binding. Hierdoor kan er een daling ontstaan in de vrije T4-concentratie in het bloed. Bij vrouwen met een normaal werkende schildklier werkt het compensatiemechanisme voldoende, maar bij vrouwen met hypothyreoïdie is de schildklier minder goed in het compenseren, waardoor het vrije T4 kan dalen en er mogelijk een hogere dosering van levothyreoxine nodig is.
Heparine
Heparine kan schildklierhormoon van transporteiwitten verdringen. De klinische relevantie is echter verwaarloosbaar. Heparine zou de laboratoriumresultaten van de schildklierhormonen kunnen beïnvloeden. De TSH-waarde wordt echter nauwelijks beïnvloed.
Corticosteroïden
Corticosteroïden kunnen door remming van de TRH-afgifte in de hypothalamus verlaagde TSH-concentratie veroorzaken. Controle van de schildklierwaarden is niet nodig omdat dit bij langdurig gebruik niet leidt tot hypothyreoïdie.
Dopamineagonisten
Ook dopamineagonisten, somatostatine en daarvan afgeleide geneesmiddelen verlagen de TSH-concentraties via een direct effect op de hypofyse. Bij deze geneesmiddelen lijkt er geen risico te bestaan op het ontwikkelen van hypothyreoïdie.
Metformine
In verschillende onderzoeken is gezien dat metformine TSH-afgifte kan onderdrukken. Het exacte mechanisme waarmee dit plaatsvindt is nog niet opgehelderd. Zo werd bij patiënten met diabetes mellitus type 2 en behandelde hypothyreoïdie een verlaging van de TSH-concentratie gezien bij gebruik van metformine. Bij patiënten met diabetes mellitus type 2 met een normale schildklierfunctie werd dit effect van metformine niet gezien. Omdat er bij patiënten zonder schildklierstoornis geen effect lijkt te zijn, is het niet nodig om schildklierwaarden tijdens het gebruik van metformine te controleren of het gebruik van metformine te vermijden.
Immuuntherapie
Voor meerdere soorten kanker wordt immuuntherapie ingezet. De bijwerkingen (ongewenste immuunrespons tegen het eigen lichaam) van deze middelen kunnen leiden tot schildklierfunctiestoornissen, zowel hypo- als hyperthyreoïdie.
Radiotherapie
Bij radiotherapie van het hoofd-halsgebied ligt de schildklier soms in het bestralingsveld, waardoor de patiënt het risico loopt hypothyreoïdie te ontwikkelen. In follow-uponderzoeken zijn prevalenties van hypothyreoïdie gevonden van 20 tot 50% na 5 jaar, met een verdere toename van 30 tot 70% na 10 jaar. Ook is na radiotherapie van het hoofd-halsgebied het risico op de ontwikkeling van de ziekte van Graves verhoogd.
Hypothyreoïdie
Naar Samenvatting ›Hypothyreoïdie berust vrijwel altijd op onvoldoende vorming en afgifte van schildklierhormoon (primaire hypothyreoïdie). Hypothyreoïdie ontstaat vaak geleidelijk. Op de voorgrond staan moeheid, kouwelijkheid, traagheid, obstipatie, droge huid, droog haar, soms haaruitval en gewichtstoename. Gegeneraliseerd myxoedeem ontstaat meestal pas bij ernstige hypothyreoïdie. Het wordt veroorzaakt door ophoping van waterbindende glycosamineoglycanen in de huid en parenchymateuze organen. Het is in tegenstelling tot echt oedeem niet wegdrukbaar. Oorzaken zijn de ziekte van Hashimoto, stille of pijnloze lymfocytaire thyreoïditis en iatrogeen.
Ziekte van Hashimoto
Naar Samenvatting ›De ziekte van Hashimoto (auto-immuun thyreoïditis van Hashimoto) is een chronische auto-immuunziekte van de schildklier en de belangrijkste oorzaak van primaire hypothyreoïdie. Antistoffen tegen thyreoïdperoxidase (anti-TPO) zijn vaak aantoonbaar, maar niet bewijzend voor de aandoening. De ziekte van Hashimoto komt hoofdzakelijk voor bij vrouwen en is in 90-95% de oorzaak van hypothyreoïdie. De ziekte leidt op korte of lange termijn tot totaal functieverlies van de schildklier. Levenslange substitutietherapie is nodig.
Stille of pijnloze lymfocytaire thyreoïditis
Naar Samenvatting ›Een auto-immuunziekte waarbij destructie van schildklierweefsel plaatsvindt, gevolgd door regeneratie. Bij deze vorm van thyreoïditis kan hypothyreoïdie optreden, maar kan ook in de cel opgeslagen schildklierhormoon weglekken door destructie (thyreotoxicose). Kenmerkend is het spontane herstel. Het geneest in 1-4 maanden en het verloopt meestal asymptomatisch. Substitutietherapie is zelden nodig.
Hoewel een stille of pijnloze lymfocytaire thyreoïditis zelden voorkomt, wordt deze volledigheidshalve wel vermeld. Het onderscheid met de ziekte van Hashimoto is soms moeilijk te maken. Bij een lymfocytaire thyreoïditis zijn in vergelijking met de ziekte van Hashimoto de klachten milder en het TSH en vrije T4 vertonen een kleinere afwijking. De huisarts kan een lymfocytaire thyreoïditis vermoeden als er bijvoorbeeld een zeer lage dosering levothyroxine volstaat. Indien er een vermoeden is van een onderliggende lymfocytaire thyreoïditis, kan de huisarts de behandeling met levothyroxine na een half jaar stoppen. De huisarts spreekt met de patiënt zes weken na staken van de medicamenten een controle af en laat tevoren het TSH en vrije T4 bepalen. De controle wordt vervolgens elke zes weken herhaald totdat de schildklierwaarden twee keer normaal zijn. Bij een lymfocytaire thyreoïditis zullen de schildklierwaarden normaal blijven.
Iatrogene oorzaken van hypothyreoïdie
Naar Samenvatting ›Iatrogene oorzaken van een primaire hypothyreoïdie kunnen zijn: (hemi)thyreoïdectomie, bestraling van de hals, behandeling met radioactief jodium, jodiumhoudende contrastmiddelen, medicatie (amiodaron, lithium) en immuuntherapie.
- Wanneer na thyreoïdectomie of na behandeling met radioactief jodium hypothyreoïdie ontstaat, is levenslange substitutietherapie nodig.
- Amiodaron heeft een lange halfwaardetijd, waardoor stapeling kan optreden tot wel 6-9 maanden na het staken en het effect op de schildklier aanhoudt.
- De effecten van lithium en jodiumbevattende medicatie zijn meestal 12 weken na het staken van het middel verdwenen.
- Dit geldt ook voor jodiumbevattende zelfzorgmiddelen (bijvoorbeeld zeewier, kelp, visoliecapsules, multivitamines met jodium) met hypothyreoïdie als mogelijke bijwerking.
Hyperthyreoïdie
Naar Samenvatting ›Eén van de belangrijkste klinische klachten is vermagering bij een goede eetlust. Andere klachten zijn gejaagdheid, hartkloppingen (tachycardie), warmte-intolerantie, tremor (vooral bij gespreide vingers waarneembaar), angst of agitatie, en soms diarree. Oorzaken zijn onder andere de ziekte van Graves, hyperthyreotisch (multi)nodulair struma, toxisch adenoom.
Ziekte van Graves
Naar Samenvatting ›- Een auto-immuunziekte van de schildklier, veelal gekenmerkt door de aanwezigheid van TSH-R-antistoffen, die net zoals TSH aan de TSH-receptoren op de schildklier binden en de schildklier stimuleren tot productie van T4.
- 70 tot 80% van de patiënten met hyperthyreoïdie heeft de ziekte van Graves.
- De aandoening ontwikkelt zich binnen 1 tot enkele maanden en komt vooral voor bij vrouwen in de leeftijdsgroep van 20-40 jaar.
- Circa 60% van de patiënten heeft een diffuus struma.
- Van de patiënten met de ziekte van Graves heeft 5% een ernstige, klinisch manifeste oftalmopathie en 45% (milde) oogklachten. Bij oftalmopathie wordt de inhoud van de orbita (oogspieren en orbitaal vet) aangetast. Vanuit de retrobulbaire weefsels ontstaan ooglidoedeem, pijnklachten, tranenvloed, dubbelzien, proptosis, soms visusstoornissen met kans op blindheid. De oogleden kunnen gezwollen zijn. Naast lidretractie van de oogleden is er een protrusio bulbi, ook wel proptosis of exoftalmus genoemd. De oogklachten treden meestal tegelijk op met de schildklierklachten, maar soms gaan ze eraan vooraf of ontstaan ze later. Roken (bij de ziekte van Graves) vergroot het risico op het ontstaan en verergeren van oftalmopathie zeer sterk.
- Ook de huid kan aangetast zijn, zoals bij pretibiaal gelokaliseerd myxoedeem (niet te verwarren met gegeneraliseerd myxoedeem bij hypothyreoïdie).
- Bij sommige patiënten gaat de ziekte binnen één tot anderhalf jaar spontaan blijvend in remissie.
In een onderzoek onder 543 vrouwen met de ziekte van Graves bleek het relatieve risico op de ziekte van Graves onder rooksters 1,93 (95%-BI 1,54-2,43) en onder ex-rooksters 1,27 (95%-BI 1,03-1,56). Kimball vond in een retrospectief onderzoek onder 221 patiënten met de ziekte van Graves een verwaarloosbaar effect van roken op de remissiekans na een jaar thyreostaticagebruik. Onder mannen was het verschil wel significant. Het relatieve risico op een recidief na staken van de medicatie was 11,1 (95%-BI 1,25-98,5). Een overzichtsartikel van Stan beschrijft een verhoogd risico op oftalmopathie door roken; OR 5,2 (95%-BI 2,4-11,5). Ondanks het gebrek aan bewijs dat stoppen met roken de kans op remissie van de ziekte van Graves en genezing van oftalmopathie vergroot, is het zeer aan te bevelen om te stoppen met roken vanwege de lichamelijke schade door roken.
Hyperthyreotisch (multi)nodulair struma
Naar Samenvatting ›Diffuse knobbelvormige zwelling van de schildklier, gekenmerkt door de ontwikkeling van haarden die schildklierhormonen produceren, onafhankelijk van sturing door TSH. Het duurt enkele jaren voordat een nodulair struma tot volledige ontwikkeling is gekomen. De schildklier wordt langzaam groter, terwijl gelijktijdig de autonomie van de klier toeneemt. (Multi)nodulair struma is na de ziekte van Graves de meest voorkomende oorzaak van hyperthyreoïdie (10-15%); bij ouderen is het de meest voorkomende oorzaak. Vaak is er een familiaire aanleg.
Toxisch adenoom
Naar Samenvatting ›Autonoom functionerende benigne tumor in de vorm van een solitaire schildkliernodus. De term ‘autonoom’ betekent dat de activiteit niet onderdrukt wordt door remming vanuit het feedbackmechanisme. Deze aandoening komt zelden voor.
(Sub)acute thyreoïditis van De Quervain
Naar Samenvatting ›(Virale) ontsteking van de schildklier, gekenmerkt door hevige pijn in de schildklierregio, koorts, koude rillingen, malaise, tijdelijke thyreotoxicose (overmaat aan schildklierhormoon) gedurende enkele weken tot maanden, verhoging van de bezinking en leukocytose. De aandoening geneest spontaan. Aan het herstel gaat soms een periode van hypothyreoïdie vooraf.
Iatrogene oorzaken van hyperthyreoïdie
Naar Samenvatting ›Mogelijke iatrogene oorzaken van hyperthyreoïdie zijn jodiumbevattende contrastmiddelen en het gebruik van jodiumbevattende medicatie zoals amiodaron. Dit effect is meestal 12 weken na het staken van het middel verdwenen. Bij gebruik van amiodaron kan dit door de lange halfwaardetijd tot 6-9 maanden duren.
Thyreotoxicose
Naar Samenvatting ›Een te hoge hoeveelheid schildklierhormoon in het bloed. Er zijn meerdere oorzaken van thyreotoxicose: hyperthyreoïdie, thyreoïditis of een toxisch adenoom. Een thyreotoxische storm of crisis is een levensbedreigende aandoening. Mogelijke luxerende factoren voor thyreotoxische storm bij hyperthyreoïdie zijn: infectie, operaties, bevalling, beroerte, diabetische ketoacidose, longembolie, myocardinfarct.
Subklinische schildklierafwijkingen
Naar Samenvatting ›Subklinische hypothyreoïdie
Naar Samenvatting ›Bij subklinische hypothyreoïdie is de TSH-waarde verhoogd, maar valt het fT4 binnen de referentie-intervallen. De kans op het ontwikkelen van een klinische hypothyreoïdie neemt toe bij een hoger TSH. Bij veel patiënten herstelt het TSH spontaan tot normale waarde, deze kans is kleiner naarmate de TSH-waarden hoger zijn.
Er zijn meerdere meta-analyses verschenen over het risico op coronaire events, sterfte en sterfte aan coronaire events bij patiënten met een subklinische hypothyreoïdie. De meta-analyses gebruikten grotendeels dezelfde onderzoeken. Alle meta-analyses includeerden cohortonderzoeken, alleen Razvi includeerde ook cross-sectionele onderzoeken. De meta-analyses onderzochten onderstaande eindpunten, tenzij anders vermeld.
Totale mortaliteit
Volzke (3 onderzoeken; n = 8858; onbekend aantal events) vond een verhoogd risico op sterfte bij een subklinische hypothyreoïdie, HR 1,25 (95%-BI 1,03-1,53). Ochs, Haentjes en Rodondi vonden geen significant verhoogd risico. Razvi deed geen onderzoek naar dit eindpunt.
Sterfte aan coronaire events
Rodondi (10 onderzoeken; n = 54.301; 2168 events) vond een verhoogd risico op sterfte ten gevolge van een coronair event bij patiënten tussen 65 en 79 jaar, HR 1,32 (95%-BI 1,08-1,62). Het absoluut risico in de controlegroep is 0,39% per jaar versus 0,51% per jaar in de groep met subklinische hypothyreoïdie. Razvi (8 onderzoeken; n = 14.719; onbekend aantal events) vindt een verhoogd risico op sterfte aan een coronaire events bij patiënten jonger dan 65 jaar, HR 1,37 (95%-BI 1,04-1,79). Rodondi onderzocht als enige de relatie tussen de hoogte van het TSH en sterfte aan een coronair event: een TSH > 7 mU/L geeft een significant verhoogd risico op sterfte aan een coronair event in vergelijking tot een TSH ≤ 7 mU/L, HR 1,53 (95%-BI 1,13-2,07). Het absoluut risico in de controlegroep is 0,39% per jaar versus 0,60% per jaar in de groep met subklinische hypothyreoïdie. Ochs vond geen significant verhoogd risico. Volzke deed geen onderzoek naar dit eindpunt.
Risico op coronaire events
Rodondi (7 onderzoeken; n = 25.977; > 18 jaar; 4470 events) vond een verhoogd risico op een coronair event bij een TSH > 10 mU/L, HR 1,86 (95%-BI 1,22-2,82), Het absoluut risico in de controlegroep was 1,72% per jaar versus 3,25% per jaar in de groep met subklinische hypothyreoïdie. Razvi (3 onderzoeken; n = 4899; onbekend aantal events) en Ochs (10 onderzoeken; n = 14.021; 2134 events; follow-up 2 tot 20 jaar; onbekend gemiddelde follow-up) vonden bij patiënten jonger dan 65 jaar een verhoogd risico op coronaire events respectievelijk HR 1,68 (95%-BI 1,27-2,23) en HR 1,51 (95%-BI 1,02–2,43). Deze laatste bevinding wordt niet ondersteund door het onderzoek van Rodondi. Haentjes en Volke deden geen onderzoek naar dit eindpunt. Concluderend is er geen overtuigend bewijs dat subklinische hypothyreoïdie leidt tot een verhoogd risico op coronaire events of (coronaire) sterfte: de resultaten zijn inconsistent en de klinische relevantie van de verhoogde risico’s is twijfelachtig.
Heupfracturen
Lee onderzocht in een prospectief onderzoek (3678 patiënten ouder dan 65 jaar; follow-up 13 jaar) het risico op heupfracturen bij subklinische hypothyreoïdie. Van de 543 patiënten (m/v: 184/369) met een subklinische hypothyreoïdie kregen 54 een heupfractuur (m/v: 18/36) versus 256 heupfracturen in de controlegroep met 2852 patiënten. Voor mannen was het risico significant verhoogd, HR 1,86 (95%-BI 1,09-3,16); vrouwen hadden een niet-significant verlaagd risico, HR 0,87 (95%-BI 0,61-1,24). Het gevonden hogere risico op heupfracturen bij mannen ouder dan 65 jaar moet nog worden bevestigd in vervolgonderzoek voordat een oordeel mogelijk is.
Hartfalen
Over het risico op hartfalen bij een subklinische hypothyreoïdie verschenen 2 onderzoeken. In het eerste onderzoek van Rodondi werden 2730 patiënten uit de algemene populatie tussen de 70 en 79 jaar 4 jaar lang gevolgd. Er hadden 338 patiënten een subklinische hypothyreoïdie, 178 patiënten ontwikkelden hartfalen, waarvan 27 behoorden tot de groep met subklinische hypothyreoïdie. Het risico op hartfalen was significant verhoogd in de subklinische hypothyreoïdiegroep, HR 1,61 (95%-BI 1,02-2,52). Het absoluut risico in de controlegroep is 1,65% per jaar versus 2,67% per jaar in de groep met subklinische hypothyreoïdie. De subgroepanalyse toonde een significant verhoogd risico aan bij een TSH tussen de 7 en 9,9 mU/L, HR 2,58 (95%-BI 1,19-5,60). Het absoluut risico in de controlegroep is 1,65% per jaar versus 4,26% per jaar in de groep met subklinische hypothyreoïdie met een TSH > 7mU/L. Bij TSH >10 mU/L is het risico ook significant verhoogd, HR 3,26 (95%-BI 1,37-7,77). Het absoluut risico in de controlegroep is 1,65% per jaar versus 5,38% per jaar in de groep met subklinische hypothyreoïdie met een TSH > 10 mU/L. In het tweede onderzoek van Rodondi werden 3044 patiënten ouder dan 65 jaar zonder hartfalen 12 jaar lang gevolgd. Onder de 474 patiënten met een subklinische hypothyreoïdie waren er 105 nieuwe gevallen van hartfalen. Alleen in de groep met een TSH hoger 10 mU/L was het risico op hartfalen significant verhoogd, HR 1,88 (95%-BI 1,05-33,34), Het absoluut risico in de controlegroep is 2,05% per jaar versus 3,85% per jaar in de groep met subklinische hypothyreoïdie. Rodondi concludeerde in beide onderzoeken dat er een significant verhoogd risico bestaat op hartfalen bij een subklinische hypothyreoïdie bij patiënten ouder dan 65 jaar. Concluderend zijn er aanwijzingen voor een verhoogd risico op hartfalen bij patiënten ouder dan 65 jaar, maar gezien het geringe aantal events en de kleine aantallen patiënten, is een definitieve conclusie nog niet mogelijk.
Subklinische hypothyreoïdie komt veel voor. De relatie met klachten en de kans op complicaties zijn echter onduidelijk. Over het natuurlijke beloop van subklinische hypothyreoïdie zijn enkele onderzoeken verschenen. Meyerovitch onderzocht in een retrospectief observationeel onderzoek het natuurlijke beloop van euthyreoïdie en subklinische hypo/hyperthyreoïdie bij 422.242 Israëlische patiënten zonder voorgeschiedenis van schildklieraandoeningen bij wie de huisarts op niet nader omschreven indicatie het TSH had bepaald. Na de eerste TSH-bepaling werd 3,6% van de patiënten behandeld voor een schildklieraandoening en niet meer meegenomen in de resultaten van het onderzoek. Van de overgebleven patiënten werd bij 346.549 over een periode van 5 jaar opnieuw het TSH bepaald (zie tabel d1). Bij de tweede meting was bij 93% van de patiënten met een verhoogd TSH het vrije T4 normaal. Bij groep 1 (TSH > 10 mU/L) en groep 2 (TSH 5,5 tot 10 mU/L) normaliseerde het TSH bij respectievelijk 27,7 en 62,1% van de patiënten. Meyerovitch concludeert dat hoe hoger het TSH bij de eerste bepaling, hoe groter de kans dat het verhoogde TSH persisteert. Een subanalyse van de groep met een TSH van 5,5 tot 10 mU/L liet zien dat bij een TSH < 6,1 mU/L de kans op stijging van het TSH kleiner dan 1% is.
| Uitgangswaarde | TSH bij 2e meting | |||
| Groepen (totaal = 346.549) | > 10 mU/L | 5,5-10 mU/L | 0,35-5,5 mU/L | < 0,35 mU/L |
| 1 TSH > 10 mU/L (n = 669) | 35,4% | 36,5% | 27,7% | 0,4% |
| 2 TSH 5,5-10 mU/L (n = 7533) | 2,9% | 34,6% | 62,1% | 0,3% |
| 3 TSH 0,35-5,5 mU/L (n = 334.572) | 0,1% | 1,4% | 98,0% | 0,6% |
| 4 TSH < 0,35 mU/L (n = 3775) | 0,6% | 1,2% | 51,5% | 46,7% |
| Bron: Meyerovitch 2007. | ||||
Huber onderzocht prospectief bij 82 vrouwen (gemiddelde leeftijd 50,7 jaar ± 1,4 jaar; 2e lijn; follow-up 9,2 jaar) het natuurlijke beloop van een subklinische hypothyreoïdie. De onderliggende oorzaken waren (de behandeling van) de ziekte van Graves (n = 42; 32 behandeld met radioiodine en 10 chirurgisch), thyreoïditis van Hashimoto (n = 29) en struma (n = 11; die allemaal chirurgie hadden ondergaan). Tweeënveertig (51%) patiënten waren positief voor anti-TPO, 23 (28%) patiënten ontwikkelden een klinische hypothyreoïdie, 65 (68%) patiënten bleven subklinisch, en 3 (4%) patiënten werden euthyreotisch. Huber concludeert dat de hoogte van het TSH en aanwezigheid van anti-TPO onafhankelijke risicofactoren zijn voor het ontwikkelen van een klinische hypothyreoïdie en dat een TSH vanaf 12 mU/L een klinisch relevante kans geeft om een klinische hypothyreoïdie te ontwikkelen: per jaar is de kans voor vrouwen 11,4% (± 3,0%), deze kans is cumulatief. Leeftijd als risicofactor voor ontwikkeling van een hypothyreoïdie is niet onderzocht.
Diez verrichtte een prospectief cohortonderzoek (n = 107; gemiddelde follow-up 31 maanden) bij tweedelijnspatiënten ouder dan 55 jaar met subklinische hypothyreoïdie. Een TSH tussen de 10 tot 15 mU/L gaf een kans van 19,7% per jaar op het ontwikkelen van een klinische hypothyreoïdie. De aanwezigheid van klinische symptomen gaf een kans van 17,2% per jaar en een laag-normaal vrije T4 (9,7 tot 12,8 pmol/L) gaf een kans van 18,0% per jaar op het ontwikkelen van een klinische hypothyreoïdie.
Concluderend neemt de kans op het ontwikkelen van een klinische hypothyreoïdie toe bij een hoger TSH.
Subklinische hyperthyreoïdie
Naar Samenvatting ›Bij een subklinische hyperthyreoïdie is er sprake van een biochemische diagnose met een TSH-waarde onder het referentie-interval met een fT4 binnen het referentie-interval. Hoe lager het TSH is, hoe groter de kans is op het ontwikkelen van een klinische hyperthyreoïdie. De kans dat het TSH normaliseert is groter dan de kans op een klinische hyperthyreoïdie. De kans op ontwikkeling tot een klinische hyperthyreoïdie lijkt in het eerste jaar het grootst, daarna neemt de kans af. Patiënten met subklinische hyperthyreoïdie hebben een 2-3 keer verhoogd risico op atriumfibrilleren. Daarnaast is het risico op fracturen verhoogd. De associatie met complicaties is sterker in de groep met subklinische hyperthyreoïdie met een TSH < 0,1 mU/L.
Bij een subklinische hyperthyreoïdie is er sprake van een biochemische diagnose met een TSH-waarde onder de referentie-interval met een normaal vrij T4 en normaal (vrij) T3. Indien het (vrij) T3 verhoogd is met een normaal vrij T4 wordt gesproken van een T3-thyreotoxicose, wat een vroeg begin kan zijn van een manifeste hyperthyreoïdie. De oorzaak van subklinische hyperthyreoïdie kan endogeen zijn, bijvoorbeeld bij de ziekte van Graves, toxisch multinodulair struma, een toxisch adenoom of thyreoïditis. Ook kan de oorzaak exogeen zijn bij suppletie met schildklierhormoon, maar in deze NHG-Standaard bedoelen wij met subklinische hyperthyreoïdie de endogene soort. Subklinische hyperthyreoïdie wordt onderverdeeld als type 1 of ‘mild’ bij een TSH tussen 0,1 en 0,4 mU/L en type 2 of ‘severe’ bij een TSH < 0,1 mU/L. De prevalentie en incidentie van endogene subklinische hyperthyreoïdie wordt wisselend beschreven in de beschikbare literatuur. Bij internationaal onderzoek wisselt de prevalentie tussen 0,6% en 16% afhankelijk van onder andere de diagnostische criteria, leeftijd, geslacht, TSH-assay en inname van jodium. Gemiddeld wordt 1-2% beschreven, maar percentages nemen toe met hogere leeftijd. De relatie met klachten is onduidelijk.
Beloop
Meyerovitch onderzocht het natuurlijke beloop van euthyreoïdie en subklinische hyperthyreoïdie in de eerste lijn met retrospectief observationeel onderzoek.
Er was sprake van een subklinische hyperthyreoïdie (TSH < 0,35 mU/L) bij 1,2% van de gehele populatie. Bij 51,5% herstelde het TSH binnen 5 jaar, bij 46,7 % bleef het TSH < 0,35 mU/L.
Vadiveloo onderzocht in een retrospectief observationeel onderzoek in Schotland het natuurlijke beloop van subklinische hyperthyreoïdie in de eerste lijn (n = 2024; follow-up = 51 maanden).
Tabel d2 toont het beloop van subklinische hyperthyreoïdie. Er was geen relatie tussen leeftijd en de kans op ontwikkeling van een klinische hyperthyreoïdie. Wel bleek uit een subanalyse dat de kans op ontwikkeling van een klinische hyperthyreoïdie het hoogst in het eerste jaar na ontdekking van de subklinische waarden. Bij een TSH van 0,1 tot 0,4 is de kans 4,7% en bij een TSH van < 0,1 mU/L is de kans 10,2% in het eerste jaar.
| Baseline categorie | ||||
|---|---|---|---|---|
| Totaal | TSH 0,1-0,4 mU/L | TSH < 0,1 mU/L | Ongeclassificeerd | |
| Na 2 jaar (n = 1044) | ||||
| TSH 0,1-0,4 mU/L | 62,7% | 71,8% | 29,5% | 54,5% |
| TSH < 0,1 mU/L | 19,1% | 10,7% | 51,3% | 20,5% |
| Normaal | 17,2% | 16,7% | 17,1% | 25,0% |
| Hyperthyreoïdie | 0,6% | 0,5% | 1,0% | 0% |
| Overleden | 6,7% | 7,4% | 5,2% | 2,3% |
| Behandeld | 6,3% | 2,5% | 16,5% | 17,0% |
| Na 5 jaar (n = 693) | ||||
| TSH 0,1-0,4 mU/L | 49,5% | 55,0% | 29,0% | 40,9% |
| TSH < 0,1 mU/L | 18,0% | 12,5% | 40,2% | 18,2% |
| Normaal | 31,5% | 31,6% | 29,9% | 36,4% |
| Hyperthyreoïdie | 0,7% | 0,7% | 0% | 4,5% |
| Overleden | 6,8% | 6,2% | 8,4% | 9,1% |
| Behandeld | 18,9% | 11,3% | 36,7% | 38,9% |
| Na 7 jaar (n = 495) | ||||
| TSH 0,1-0,4 mU/L | 45,7% | 50,2% | 25,0% | 47,1% |
| TSH < 0,1 mU/L | 17,3% | 12,2% | 37,5% | 29,4% |
| Normaal | 35,6% | 37,6% | 29,7% | 23,5% |
| Hyperthyreoïdie | 0,5% | 0,0% | 3,1% | 0,0% |
| Overleden | 6,4% | 5,8% | 7,8% | 11,8% |
| Behandeling | 24,0% | 17,1% | 44,3% | 29,2% |
| Bron: Vadiveloo 2011b | ||||
Díez onderzocht retrospectief 75 patiënten in de tweede lijn met subklinische hyperthyreoïdie gedurende 56 maanden.
De auteurs concludeerden dat er een omgekeerde relatie is tussen de hoogte van het TSH, de aanwezigheid van klinische symptomen en het risico op het ontwikkelen van een klinische hyperthyreoïdie. Van deze patiënten ontwikkelde 45% een klinische hyperthyreoïdie bij een subklinische hyperthyreoïdie, 20% herstelde.
Rosario verrichtte een prospectief onderzoek onder 102 vrouwen ouder dan 60 jaar in de tweede lijn met een gemiddelde follow-up van 41 maanden en concludeert een statistisch significante kans op het ontwikkelen van een hyperthyreoïdie bij een TSH < 0,20 mU/L in vergelijking met TSH > 0,20 mU/L (p < 0,05).
Poola verrichtte retrospectief onderzoek bij 116 patiënten met subklinische hyperthyreoïdie in de tweede lijn. Gemiddelde follow-upduur was 38 maanden, waarbij 7% ontwikkelde een klinische hyperthyreoïdie en 53,5% herstelde. In de analyse werden ook 25 patiënten meegenomen met een stille thyreoïditis, daarbij normaliseert het TSH altijd. Het onderzoek geeft daardoor een onderschatting van de ontwikkeling tot een klinische hyperthyreoïdie.
Schouten onderzocht retrospectief 96 patiënten met subklinische hyperthyreoïdie gedurende 60 maanden.
De auteur maakte onderscheid per onderliggende diagnose. Bij de ziekte van Graves is de kans op een klinische hyperthyreoïdie na 5 jaar 9%. Bij een nodus is de kans op een klinische hyperthyreoïdie 61%.
Conclusie
Concluderend is het risico dat een subklinische hyperthyreoïdie zich ontwikkelt tot een klinische hyperthyreoïdie 0,5% tot 45%; de kans op herstel varieert van 20% tot 53%.
Belangrijke beperkingen van veel onderzoeken zijn de tweedelijnssetting, kleine aantallen en een retrospectieve opzet. Meyerovitch en Vadiveloo geven een beter beeld van de eerste lijn. Met inachtneming van de beperkingen van de onderzoeken lijken de volgende conclusies gerechtvaardigd: hoe lager het TSH is, hoe groter de kans is op het ontwikkelen van een hyperthyreoïdie. De kans dat het TSH normaliseert is groter dan de kans op een klinische hyperthyreoïdie. De kans op ontwikkeling tot een klinische hyperthyreoïdie lijkt in het eerste jaar het grootst, daarna neemt de kans af.
Veel patiënten met subklinische hyperthyreoïdie hebben geen klachten. Maar er zijn ook patiënten met klachten zoals tachycardie, tremoren, warmte-intolerantie of gewichtsverlies. Bij subklinische hyperthyreoïdie spelen patiëntgerelateerde factoren zoals leeftijd en onderliggende cardiale ziekten een rol bij de kans op complicaties. Potentiële complicaties zijn atriumfibrilleren, fractuurrisico, cardiovasculaire ziekten en sterfte. Daarnaast lopen patiënten het risico dat een subklinische hyperthyreoïdie zich tot een manifeste (klinische) hyperthyreoïdie kan ontwikkelen (zie het detail Beloop).
Totale mortaliteit
Verschillende longitudinale onderzoeken hebben de correlatie tussen subklinische hyperthyreoïdie en mortaliteit onderzocht. Deze onderzoeken worden beschouwd in de Europese en Amerikaanse internationale richtlijnen over subklinische hyperthyreoïdie. De associatie met complicaties is sterker in de groep met subklinische hyperthyreoïdie met een TSH < 0,1 mU/L. Een meta-analyse van Collet et al. van 52.674 patiënten, verzameld uit 10 cohorten, concludeerde dat subklinische hyperthyreoïdie een 24% verhoogd risico op algemene sterfte met zich meebrengt (hazard ratio [HR], 1,24; 95%-BI: 1,06 tot 1,46).
Coronair event
Collet vond een verhoogd risico op een coronair event in vergelijking met euthyreoïdie. De op leeftijd en geslacht aangepaste hazard ratio voor coronaire events bij patiënten met subklinische hyperthyreoïdie (SHyper) 1,21 (95%-BI: 0,99 tot 1,46). Het risico verschilde niet bij een TSH boven of onder 0,1 mU/L.
Sterfte aan coronair event
Twee meta-analyses onderzochten de sterfte door coronaire events, een op basis van 17 cohorten en een op basis van 52.674 deelnemers. Beide analyses concludeerden dat subklinische hyperthyreoïdie een verhoogd risico op cardiovasculaire sterfte met zich meebrengt, met hazardratio’s van respectievelijk 1,52 (95%-BI: 1,08 tot 2,13) en 1,29 (95%-BI: 1,02 tot 1,62). Dit risico is groter bij een lager TSH.
Atriumfibrilleren
Patiënten met subklinische hyperthyreoïdie hebben een 2 tot 3 keer verhoogd risico op atriumfibrilleren. Het risico is hoger bij een sterker onderdrukt TSH (HR 1,6 [95%-BI:1,0 tot 2,5] en 1,85 [95%-BI: 1,14 tot 3,00]). In de Europese en Amerikaanse internationale richtlijnen over subklinische hyperthyreoïdie zijn de verschillende onderzoeken over atriumfibrilleren samengevat. Naast de cohortonderzoeken zijn er kleine niet-gerandomiseerde onderzoeken die een mogelijk positief effect laten zien van behandeling.
Dementie
Er zijn tegenstrijdige bevindingen over het risico op dementie bij ouderen met subklinische hyperthyreoïdie. Meer grootschalig en langdurig onderzoek is nodig om dit verband te verduidelijken.
Fracturen
Subklinische hyperthyreoïdie verhoogt het risico op fracturen. In een meta-analyse van 13 prospectieve cohortonderzoeken was subklinische hyperthyreoïdie, vergeleken met euthyreoïdie, geassocieerd met een verhoogd risico op heupfracturen (hazard ratio [HR] 1,52, 95%-betrouwbaarheidsinterval [BI] 1,19 tot 1,93), alle fracturen (HR 1,42, 95%-BI 1,16 tot 1,74) en wervelfracturen (HR 1,74, 95%-BI 1,01 tot 2,99). In deze analyse waren lagere TSH-waarden (< 0,10 mU/L) geassocieerd met hogere fractuurpercentages. In een prospectieve cohortstudie nam het risico op heupfracturen toe met 1,07 (95%-BI 1,04 tot 1,10) voor elke 6 maanden waarin de TSH lager was dan 0,3 mU/L.
In een Zweeds subcohortonderzoek van de Osteoporotic Fractures in Men (MrOS) (gemiddelde leeftijd 75 jaar) hadden de 25 deelnemers met subklinische hyperthyreoïdie (zonder levothyroxinebehandeling) een verhoogd risico op wervelfracturen in vergelijking met euthyreotische individuen (31,8 versus 9,2%, aangepaste HR 3,12, 95%-BI 1,37 tot 7,12).
In een cohortonderzoek van 10.946 individuen die 3556 fracturen meemaakten met een mediane follow-up van 21 jaar, hadden degenen met subklinische hyperthyreoïdie (TSH < 0,56 mIU/L) een hazard ratio voor fracturen van 1,34 (95%-BI 1,09 tot 1,65).
Osteoporose
Segna et al. vonden in 284 patiënten, gecombineerd uit 6 prospectieve cohorten dat het jaarlijkse verlies van botdichtheid in het femurhalsgebied 0,59% groter was bij degenen met een TSH < 0,1 mU/L in vergelijking met individuen met een TSH binnen het referentie-interval. Daarnaast zijn er kleine ongerandomiseerde onderzoeken waarbij postmenopauzale vrouwen met subklinische hyperthyreoïdie, die werden behandeld met methimazol, een hogere botdichtheid in het distale deel van de onderarm hadden in vergelijking met onbehandelde vrouwen. Ook postmenopauzale vrouwen met subklinische hyperthyreoïdie die behandeld werden met radioactief jodium en 2 jaar werden gevolgd, verloren geen botmassa in de wervelkolom of de heup, terwijl onbehandelde vrouwen botmassa verloren op beide locaties (respectievelijk 4,5 en 2,0 procent, p < 0,02).
Hartfalen
In een meta-analyse van Gencer et al. met 648 deelnemers met subklinische hyperthyreoïdie met een mediane follow-up van 10,4 jaar, was er een verhoogd risico op hartfalen in de groep met een TSH < 0,1 mU/L (HR = 1,94; 95%-betrouwbaarheidsinterval: 1,01 tot 3,72).
Struma
Naar Samenvatting ›Vergroting van de schildklier. Een vergrote schildklier kan diffuus of nodulair vergroot zijn. Een nodulaire vergroting kan bestaan uit een enkele nodus of verschillende noduli (multinodulair struma). Een euthyreotisch struma kan jarenlang onveranderd aanwezig zijn. Het kan ook geleidelijk in grootte toenemen. Een struma kan zich ontwikkelen tot hyperthyreotisch multinodulair struma door de ontwikkeling van autonoom functionerende noduli (zie Hyperthyreotisch (multi)nodulair struma). Een vergrote nodus (> 1 cm) in een multinodulair struma wordt een dominante nodus genoemd. Minder dan 5% van alle noduli (dominant/solitair) die gevonden worden in de huisartsenpraktijk zijn maligne.
Factoren die de kans op een schildklierfunctiestoornis vergroten
Naar Samenvatting ›- Familieanamnese voor schildklierziekten
- Comorbiditeit: andere auto-immuunziekten
- Medicatie die de schildklier kan beïnvloeden (jodiumbevattende contrastmiddelen, lithium, amiodaron). Voedingssupplementen kunnen ook jodium bevatten
- Voorgeschiedenis met:
- recente partus (< 1 jaar geleden)
- postpartumthyreoïditis in de voorgeschiedenis
- behandeling van hyperthyreoïdie met radioactief jodium of (hemi)thyreoïdectomie
- radiotherapie van het hoofd-halsgebied
- syndroom van Down
Patiënten met het syndroom van Down hebben een grotere kans op functiestoornissen van de schildklier. In een Zweeds onderzoek bij 85 patiënten met het syndroom van Down kregen tijdens 15 jaar follow-up 28 patiënten hypothyreoïdie op een leeftijd tussen 1 en 25 jaar. Twee patiënten kregen hyperthyreoïdie. In een Italiaans onderzoek onder 344 patiënten met het syndroom van Down had 35,2% een subklinische hypothyreoïdie. In hetzelfde onderzoek zijn 201 patiënten met het syndroom van Down langer dan 2 jaar gevolgd. Van hen hadden er 14 een subklinische hypothyreoïdie en positieve antistoffen, 3 van hen kregen hypothyreoïdie en 2 hyperthyreoïdie; 13 patiënten waren euthyreotisch met positieve antistoffen, 2 van hen kregen hypothyreoïdie en 1 hyperthyreoïdie. Bij de patiënten zonder antistoffen kwamen tijdens de follow-upperiode geen functiestoornissen voor. Een Spaans onderzoek (n = 1832, waarvan 12 met hyperthyreoïdie) toonde een grotere prevalentie van hyperthyreoïdie aan bij het syndroom van Down (43 per 10.000 patiënten) dan bij de algemene bevolking (2,4 per 10.000 patiënten).
Hypothyreoïdie tijdens zwangerschap
Naar Samenvatting ›- Tijdens de zwangerschap neemt de behoefte aan schildklierhormoon toe. Gezonde zwangere patiënten produceren daarom meer schildklierhormoon, maar zwangere patiënten met hypothyreoïdie lukt dat niet. Om te zorgen dat de patiënt euthyreotisch blijft, moet de dosis levothyroxine verhoogd worden wanneer een patiënt met hypothyreoïdie zwanger raakt.
- Euthyreoïdie is noodzakelijk voor een goede ontwikkeling van het embryo. Het ongeboren kind is in de eerste fase van de zwangerschap nog geheel afhankelijk van de moeder voor schildklierhormonen. Na 10-12 weken is de schildklier ver genoeg ontwikkeld om jodium op te nemen en enkele weken later begint de eigen schildklierhormoonproductie. Onderbehandelde hypothyreoïdie tijdens de zwangerschap verhoogt het risico op zwangerschapscomplicaties, zoals een miskraam, zwangerschapshypertensie, pre-eclampsie, placentaloslating, anemie en bloedverlies post partum en verhoogt het risico op een verminderde cognitieve ontwikkeling van de foetus.
- Na de zwangerschap moet de patiënt direct weer overgaan op de dosering zoals die was voorafgaand aan de zwangerschap, anders is er het risico op overdosering.
Een inadequate behandeling van hypothyreoïdie tijdens de zwangerschap verhoogt het risico op zwangerschapscomplicaties zoals intra-uteriene vruchtdood, vroeggeboorte en verminderde cognitieve ontwikkeling bij de foetus.
Uit onderzoek van Abalovich
blijkt dat bij inadequate behandeling van hypothyreoïdie tijdens de zwangerschap het percentage abortussen 60% is bij patiënten met manifeste hypothyreoïdie en 71,4% bij patiënten met subklinische hypothyreoïdie. Daarnaast is er een verhoogd risico op vroeggeboorte en congenitale afwijkingen. Bij adequate behandeling met levothyroxine tijdens de zwangerschap kan echter 100% van de patiënten met manifeste hypothyreoïdie en 90,5% van de patiënten met subklinische hypothyreoïdie de zwangerschap voldragen zonder complicaties. Volgens Haddow
kan onbehandelde hypothyreoïdie bij zwangere vrouwen de neuropsychologische ontwikkeling van hun kinderen nadelig beïnvloeden. Kinderen van moeders met hypothyreoïdie scoorden gemiddeld 7 punten lager op de Wechsler Intelligence Scale for Children (WISC-III) dan kinderen van moeders zonder hypothyreoïdie. Bovendien had 19% van deze kinderen een IQ van 85 of lager, vergeleken met 5% van de kinderen van moeders zonder hypothyreoïdie. Dit effect was vooral duidelijk bij moeders die tijdens de zwangerschap niet behandeld werden. De studie benadrukt het belang van screening en behandeling van hypothyreoïdie tijdens de zwangerschap om de cognitieve ontwikkeling van het kind te beschermen.
Er zijn aanwijzingen dat subklinische hypothyreoïdie tijdens de zwangerschap het risico op zwangerschapscomplicaties verhoogt, hoewel het bewijs hiervoor beperkt is. Van den Boogaard et al. (2011) voerden een systematische review uit van 43 studies, waaronder gerandomiseerde gecontroleerde onderzoeken (RCT’s), patiëntcontrole- en cohortstudies, om de relatie tussen (sub)klinische hypothyreoïdie en zwangerschapscomplicaties te onderzoeken.
Van deze studies richtten er vijf zich specifiek op subklinische hypothyreoïdie tijdens de zwangerschap. Eén van deze onderzoeken hanteerde een afwijkende definitie, namelijk een normaal TSH-niveau met een verlaagd vrij T4. In alle onderzoeken werd de schildklierfunctie tijdens de zwangerschap gescreend. De resultaten zijn samengevat in tabel d3.
| Complicatie | Oddsratio (95%-BI) | Aantal onderzoeken |
|---|---|---|
| Pre-eclampsie | 1,7 (1,1 tot 2,6) | 2 onderzoeken, n = 838 |
| Perinatale morbiditeit | 2,7 (1,6 tot 4,7) | 3 onderzoeken, n = 1010 |
| NICU-opname | 1,8 (1,2 tot 1,8) | 1 onderzoek, n = niet vermeld |
| Verlaagde intelligentie- en motoriekscore | 16 (4,7 tot 52) | 1 onderzoek, n = 18 |
Hoewel deze resultaten wijzen op een verhoogd risico op complicaties, blijft het bewijs zwak vanwege het beperkte aantal onderzoeken en de kleine populatie van zwangere vrouwen die aan deze onderzoeken deelnamen.
Hyperthyreoïdie tijdens zwangerschap
Naar Samenvatting ›- Verhoogt het risico op zwangerschapscomplicaties, zoals intra-uteriene groeivertraging en vroeggeboorte.
- Geeft een verhoogd risico op een thyreotoxische storm bij de patiënt (moeder), vooral rond de partus en het kraambed.
- Bij de ziekte van Graves veroorzaken TSH-R-antistoffen hyperthyreoïdie, deze antistoffen blijven soms langdurig aanwezig ook na een succesvolle behandeling. De antistoffen passeren de placenta en kunnen een neonatale hyperthyreoïdie veroorzaken. Het risico op zwangerschapscomplicaties is verhoogd, ook in afwezigheid van klachten en/of hyperthyreoïdie.
- Tijdens het eerste trimester van de zwangerschap kan een voorbijgaande onderdrukking van TSH optreden. Humaan choriongonadotrofine (HCG) heeft een TSH-achtige werking en stimuleert de schildklier, met mogelijk hyperthyreoïdie tot gevolg.
Postpartumthyreoïditis
Naar Samenvatting ›- Is een spontaan genezende ontsteking van de schildklier die optreedt < 1 jaar na de bevalling.
- Uit zich op 1 van de volgende manieren:
- voorbijgaande hyperthyreoïdie, gevolgd door voorbijgaande hypothyreoïdie
- alleen hyperthyreoïdie
- alleen hypothyreoïdie
- Herstelt vrijwel altijd spontaan binnen een half jaar.
- Bij 25-50% van de patiënten ontstaat in de jaren daarna alsnog een hypothyreoïdie.
Pop et al. onderzochten in Nederland het voorkomen van post-partumthyreoïditis door herhaalde screening van de schildklierfunctie bij 293 vrouwen. Bij 21 (7%) vonden zij een tijdelijke hypo- of hyperthyreoïdie. Nog eens 5 vrouwen hadden een tijdelijke subklinische functiestoornis. In buitenlandse onderzoeken zijn vergelijkbare incidentiecijfers gevonden. Othman bestudeerde in een follow-uponderzoek 43 vrouwen die een post-partumthyreoïditis doormaakten. In de follow-upperiode van 3,5 jaar ontwikkelden 10 (23%) vrouwen een hypothyreoïdie. Premawardhana vond na ruim 7 jaar bij 22 van 48 patiënten (46%) een hypothyreoïdie. Dit betrof vooral vrouwen die post partum alleen een hypothyreotische fase doormaakten.
Richtlijnen diagnostiek
Naar Samenvatting ›Anamnese
Naar Samenvatting ›Algemeen
Naar Samenvatting ›De patiënt heeft meestal aspecifieke klachten en symptomen. Daardoor is een schildklierfunctiestoornis lastig te herkennen en de anamnese lastig.
Vraag bij een vermoeden van een schildklierfunctiestoornis naar:
- gewichtstoename
- kouwelijkheid
- obstipatie
- myxoedeem in het gezicht
- traagheid
- vermoeidheid
- gewichtsverlies ondanks normale eetlust
- diarree
- nervositeit,
- hartkloppingen
- tremor
- oftalmopathie
Ook zijn er factoren die de kans op een schildklierfunctiestoornis vergroten (zie Factoren die de kans op een schildklierfunctiestoornis vergroten)
Vraag bij een struma naar:
- sinds wanneer de zwelling bestaat, verandering in grootte
- klachten zoals heesheid en globusgevoel
- familieanamnese en voorgeschiedenis schildklieraandoeningen
Vrijwel alle patiënten met een klinische schildklierfunctiestoornis hebben klachten en symptomen die kunnen passen bij een te traag dan wel te snel werkende schildklier. Een uitgesproken beeld met klassieke symptomen is in de praktijk zeldzaam.
De klachten bij schildklierfunctiestoornissen hebben weinig voorspellende waarde. Dit geldt zowel voor afzonderlijke klachten als voor combinaties van klachten. Oftalmopathie is de uitzondering hierop: deze klacht komt vaak voor bij de ziekte van Graves.
Als denkraam kan men gebruikmaken van de ‘zes H’s’: habitus, huid, hoofd, hals, hart en handen, zoals vermeld in tabel d4. Het is gebaseerd op een overzicht van klachten en verschijnselen bij hyperthyreoïdie zoals beschreven door Wiersinga en Krenning.
| Hypothyreoïdie | Hyperthyreoïdie | |
|---|---|---|
| Habitus | Traagheid, gewichtstoename, vermoeidheid | Nervositeit, gewichtsverlies ondanks toegenomen eetlust, vermoeidheid en hyperkinesie |
| Huid | Droog, koud en bleek, myxoedeem in het gezicht, pasteuze huid | Warm, vochtig, overmatig transpireren, pretibiaal myxoedeem |
| Hoofd | Opgeblazen gezicht, opgezette oogleden, haaruitval | Exoftalmie, pijn in of achter de ogen, lichtschuwheid of verminderde visus |
| Hals | Struma, stemverandering | Struma |
| Hart | Bradycardie | Tachycardie, atriumfibrilleren |
| Handen | Tremor |
Patiënten met een schildklieraandoening ervaren uiteenlopende klachten die mogelijk het gevolg zijn van de ziekte.
De patiëntenvereniging SchildklierNL geeft aan dat, naast de al genoemde symptomen, de volgende klachten bij een hypothyreoïdie kunnen voorkomen:
- hoge en lage bloeddruk;
- psychische klachten zoals nervositeit, depressiviteit, apathie, angst en paniek;
- slaapapneu;
- traagheid in denken en handelen, geheugenverlies (concentratiestoornissen), langzame spraak;
- gewrichtspijn, spierzwakte, spierpijn en -stijfheid, vooral in armen, benen en heupen;
- carpaletunnelsyndroom, knipmesvinger, tintelingen in de handen;
- hartklachten;
- breekbare, brosse nagels;
- kortademigheid (oppervlakkige ademhaling), benauwdheid;
- doofheid;
- libidoverlies;
- oogklachten (exoftalmie bij circa 3% van de patiënten met Hashimoto).
Mogelijke klachten bij een hyperthyreoïdie volgens de SON:
- kortademigheid bij inspanning;
- bewegingsonrust;
- spierzwakte (krachtsverlies in de spieren);
- geheugenzwakte;
- instabiliteit, geïrriteerdheid, angst, andere psychisch klachten;
- retractie (terugtrekking) van het bovenooglid.
Een schildklierfunctiestoornis is lastig te herkennen, vooral bij ouderen. Echter ook voor het herkennen van de ziekte van Graves bij jongeren geldt dat ze moeilijk te herkennen zijn doordat ze kunnen lijken op mentale of burn-out-achtige klachten.
Canaris et al. bestudeerden in een patiëntcontroleonderzoek de waarde van klachten en bevindingen voor het stellen van de diagnose hypothyreoïdie.
Zij includeerden via laboratoria patiënten met een eerste diagnose hypothyreoïdie. De patiënten en een controlegroep kregen vervolgens een vragenlijst waarin gevraagd werd naar (verandering van) symptomen. Rauwe stem, droge huid of spierkramp was geassocieerd met de hypothyreoïdie. Bij 20% van de patiënten met hypothyreoïdie kwam echter geen van deze 3 symptomen voor. Aanwezigheid van alle 3 symptomen kwam weinig voor en niet significant vaker dan bij euthyreotische patiënten. Wanneer patiënten veranderingen in de ervaren klachten aangaven, leidde dit bij 13 symptomen tot significante verschillen. De meest voorkomende klacht was ‘meer moe’; dit kwam voor bij 54% van de patiënten en bij 26% van de controles. Pas bij aanwezigheid van ≥ 7 veranderde symptomen was er een significant verschil in voorkomen van hypothyreoïdie; dit kwam voor bij 35% van de patiënten.
Zulewski voerde een vergelijkbaar onderzoek uit bij patiënten die een polikliniek endocrinologie in Basel bezochten.
De onderzoekers maakten een scorelijst met 12 items. Aanwezigheid van ≥ 5 symptomen maakte de diagnose hypothyreoïdie zeer waarschijnlijk, aanwezigheid van 0-2 symptomen zeer onwaarschijnlijk. Ongeveer 40% van de patiënten en de controles zat in het intermediaire gebied.
Indra onderzocht 130 patiënten zonder schildklieraandoeningen in de voorgeschiedenis van de poli interne geneeskunde in een derdelijns ziekenhuis in India.
De patiënten waren geselecteerd op basis van een vragenlijst over klachten passend bij een hypothyreoïdie. Bij 1 positief antwoord volgde lichamelijk onderzoek gericht op de volgende punten; droge huid, langzaam bewegen, bradycardie, pretibiaal oedeem, oedeem in het gezicht en vertraagde enkelreflex. Daarna werd de schildklierfunctie bepaald. Bij 23 patiënten werd een hypothyreoïdie vastgesteld op basis van het laboratoriumonderzoek. Gezichtsoedeem had in deze populatie een sensitiviteit van 91,3% en een specificiteit van 20,6%; bradycardie een specificiteit van 88,8% en een sensitiviteit van 43,5%. De combinatie van een vertraagde enkelreflex, bradycardie en dunne huid gaf een specificiteit van 84% en een sensitiviteit van 60%.
Dupuits onderzocht de mogelijkheid om hyperthyreoïdie te voorspellen op klinische gronden om op die manier het aantal testaanvragen te beperken.
De onderzoekers gingen hiervoor klachten en symptomen na bij 668 patiënten bij wie huisartsen het TSH hadden laten bepalen. Van hen hadden er 37 (5,5%) hyperthyreoïdie. Zeven klachten en symptomen waren voorspellend voor hyperthyreoïdie. Door de indicatie voor een testaanvraag te beperken tot patiënten met een voorafkans op hyperthyreoïdie van ten minste 5% op grond van de vragenlijst, nam het aantal bepalingen met ruim 50% af. De diagnose hyperthyreoïdie zou bij dit beleid bij 4 patiënten (0,6%) worden gemist.
Een groot aantal klachten en symptomen is geassocieerd met hypo- of hyperthyreoïdie. Deze zijn afzonderlijk en in combinatie onvoldoende sensitief en specifiek om de diagnose met voldoende zekerheid te stellen of uit te sluiten. Bij klachten die mogelijk het gevolg zijn van een functiestoornis van de schildklier laat de huisarts daarom het TSH bepalen (zie Aanvullend onderzoek). De diagnose kan alleen worden gesteld op basis van TSH en vrije T4.
Lichamelijk onderzoek
Naar Samenvatting ›Palpatie van de schildklier
Naar Samenvatting ›Palpeer de schildklier en cervicale lymfeklieren als:
- er een (vermoeden van) een schildklieraandoening is
- de patiënt een zwelling in de hals ziet, een knobbel in de hals voelt, pijnklachten in de schildklierregio heeft
- de huisarts een zwelling in de hals ziet.
Bij een vermoeden van hyperthyreoïdie: onderzoek het hartritme (pols, auscultatie hart).
Tijdens het slikken beweegt de schildklier omhoog (het orgaan zit vast aan de trachea), waardoor onderscheid kan worden gemaakt tussen de schildklier en ander weefsel. Meestal is de schildklier niet palpabel; indien deze wel palpabel is, voelt een normale schildklier week aan. Let bij palpatie op structuur, grootte en vorm van de schildklier en ga na, bij een nodus, of deze los ligt van de onderlaag en huid. Palpeer daarnaast de lymfeklieren. Indien de schildklier niet zichtbaar is of vergroot bij palpatie, dan is de kans op aanwezigheid van een struma verlaagd, LR− = 0,4. Ook als een schildklier palpabel is, maar alleen zichtbaar bij strekken van de nek, is er geen vergrote kans op een struma. Als de zwelling zichtbaar is bij een normale houding van de nek, is de kans op een struma verhoogd (LR+ = 26,3).
De Jongh beschrijft twee manieren van palpatie van de schildklier. Bij beide onderzoeken staat de onderzoeker achter de zittende patiënt en laat de patiënt slikken, bij voorkeur met een slokje water.
De symmetrische methode: de onderzoeker palpeert met twee handen met enkele vingers onder het thyreoïd en boven het manubrium, daarbij maken ze kleine draaiende bewegingen.
De asymmetrische methode: hierbij worden enkele vingers voorzichtig tegen de trachea aan gedrukt en maakt kleine ronddraaiende bewegingen. De andere hand pakt aan de andere zijde de m. sternocleidomastoïdeus en drukt voorzichtig de trachea en larynx naar de palperende hand.
Het volgende wordt als basiskennis verondersteld. Let bij palpatie van de schildklier op:
- neem plaats achter de patiënt.
- leg de handen losjes op de schildklier en vraag de patiënt te slikken.
- let op structuur, grootte en vorm van de schildklier.
- stel vast of er sprake is van een diffuse zwelling van de schildklier, van een solitaire nodus of van verscheidene noduli met of zonder dominante nodus.
- ga bij een nodus na of deze los ligt van de onderlaag en huid.
Aanvullend onderzoek
Naar Samenvatting ›Laboratoriumonderzoek
Naar Samenvatting ›Leeftijdsspecifieke referentie-intervallen
Naar Samenvatting ›Volg de (leeftijdsspecifieke) referentie-intervallen van het laboratorium waar het serum/plasma van de patiënt onderzocht is. De breedte van het referentie-interval kan verschillen per laboratorium.
Ga uit van de referentie-intervallen voor TSH en vrije T4 zoals het laboratorium die aangeeft. TSH-waarden kunnen met de leeftijd variëren. In meerdere Nederlandse laboratoria zijn leeftijdsspecifieke referentie waarden vastgesteld voor TSH en fT4. In een Nederlandse studie binnen 13 laboratoria zag men dat bij volwassenen TSH bovengrenzen toenamen vanaf de leeftijd van 60 jaar bij mannen en vanaf de leeftijd van 50 jaar bij vrouwen. De fT4 bovengrens nam toe vanaf 70 jaar.
- Hollowell bepaalde in een Amerikaans bevolkingsonderzoek onder andere het TSH bij 13.344 personen zonder schildklierziekte of risicofactor hiervoor. In deze groep had 95% een TSH van 0,45-4,12 mU/L, waarmee per definitie de referentie-intervallen voor deze groep en voor de gebruikte test waren gevonden. De gemiddelde TSH was 1,39 mU/L, dus laag-normaal; ongeveer driekwart van de onderzochte personen had een TSH van 0,5-2,0 mU/L.
- Kratzsch deed een vergelijkbaar onderzoek bij donoren.
Exclusiecriteria waren de aanwezigheid van een schildklierziekte of een risicofactor hiervoor, alsmede afwijkingen van de schildklier bij echoscopie. De onderzoekers vonden als referentie-intervallen voor TSH 0,40 tot 3,77 mU/L (respectievelijk 2,5e en 97,5e percentiel), met als mediane concentratie 1,35 mU/L. Er waren geen significante verschillen tussen vrouwen en mannen. Hamilton komt in een populatieonderzoek onder patiënten zonder schildklierziekte (n = 1861) tot een vergelijkbare conclusie.
TSH
Naar Samenvatting ›- Bepaal het TSH bij:
- vermoeden van een schildklierfunctiestoornis
- vaststellen van nieuwe diagnose hartfalen, atriumfibrilleren en houdings-/bewegingstremor
- Zie NHG-Standaard Hartfalen, NHG-Standaard Atriumfibrilleren en NHG-Behandelrichtlijn Essentiële tremor.
fT4
Naar Samenvatting ›Laat bij een afwijkend TSH het fT4 bepalen (als het laboratorium dit niet al gedaan heeft). Bij twijfel over de diagnose kan na enkele weken een TSH-waardebepaling herhaald worden om vast te stellen of er sprake is van een persisterende afwijking
Overig laboratoriumonderzoek
Naar Samenvatting ›- Bepaal op indicatie (zie ook Evaluatie en Stroomdiagram diagnostiek):
- CRP en aantal leukocyten: bij een (vermoeden van) subacute thyreoïditis
- TSH-R-antistoffen: 3 maanden na de diagnose (bij controle van) subklinische hyperthyreoïdie
- Bepaal geen fT3. In de huisartsenpraktijk heeft een (f)T3 bepaling geen toegevoegde waarde.
Vanuit de praktijk kwamen vragen over anti-TPO en T3 en of de bepalingen hiervan zinvol zijn in de huisartsenpraktijk. Anti-TPO heeft geen klinische consequenties en kan derhalve achterwege gelaten worden. Zie ook Detail Anti-TPO en TSH-R-antistoffen.
In de huisartsenpraktijk heeft een (f)T3-bepaling geen toegevoegde waarde. Het draagt niet bij aan het beter in kaart brengen van de schildklierstatus bij de diagnostiek naar schildklieraandoeningen of tijdens de behandeling met levothyroxine. Een zeldzame diagnose is een fT3-thyreotoxicose waarbij er een normaal fT4, een verhoogd (f)T3 en een onderdrukt TSH (zoals bij subklinische hyperthyreoïdie) is. Aangezien er in dit geval, zoals bij manifeste hyperthyreoïdie, vrijwel altijd een TSH < 0,1 mU/L zal zijn, is dit een verwijsindicatie voor de tweede lijn en zal daar zo nodig verder onderzoek plaatsvinden. De andere plaats is voor mensen met specifieke combinatietherapie met T3, welke ook in de tweede lijn zal plaatsvinden.
Voor meer informatie zie ook NIV richtlijn Schildklierfunctiestoornissen, module Biochemische bepalingen bij schildklierfunctiestoornissen. Daarin staat onder andere de volgende aanbeveling:
‘Eerste test om schildklierdysfunctie uit te sluiten is het meten van de serum TSH-concentratie. Bij afwijkende TSH-concentratie of klinisch sterk vermoeden op zeldzame schildklierfunctiestoornis of hypofysedisfunctie; FT4-concentratie bepaling. Het bepalen van de FT3-concentratie is alleen in specifieke gevallen aangewezen. Bij een onmeetbaar laag TSH met FT4-concentraties binnen het referentie interval is een FT3 bepaling relevant om te onderzoeken of er sprake is van T3-toxicose. De (F)T3-concentratie is ook van toegevoegde waarde wanneer aan een van de schildklierhormoonresistentiesyndromen wordt gedacht. Voor (F)T3 is een referentie methode beschikbaar, maar geen gedefinieerd of geharmoniseerd referentie interval. Het is dan ook belangrijk dat ieder laboratorium zich ervan vergewist het juiste interval te gebruiken.’
‘Een TSH-concentratie binnen het referentie-interval sluit primaire schildklierdysfunctie vrijwel uit (negatief voorspellende waarde 99,7%).’
Rege onderzocht enkele testeigenschappen van een TSH-bepaling bij 357 gerandomiseerde patiënten met een onduidelijke herkomst.
De diagnose werd gesteld op het klinische beeld en de bepaling van het TSH met een andere methode, het fT4 en bij enkele patiënten het vrije T3 en antistoffen. Bij het gebruik van een TSH-bepaling van de derde generatie vonden zij een sensitiviteit en specificiteit van 92 en 100% voor euthyreoïdie, van 100 en 93% voor hypothyreoïdie (TSH > 3,5 mU/L) en van 100 en 99% voor hyperthyreoïdie (TSH < 0,15 mU/L). Een normale TSH is dus praktisch bewijzend voor euthyreoïdie. Bij een afwijkende TSH volgt de bepaling van het vrije T4.
DHerbomez onderzocht enkele testeigenschappen van 9 verschillende assays voor de bepaling van het vrije T4.
Zij gebruikten sera van onder andere 156 euthyreotische bloeddonors, 27 patiënten met de ziekte van Graves en 34 patiënten met een onbehandelde hypothyreoïdie. De diagnose hyper- of hypothyreoïdie was gesteld op grond van het klinisch beeld, TSH-bepaling en antistoffen en echografie. Door de afkapwaarden zo te kiezen dat de sensitiviteit voor het aantonen van hypothyreoïdie 100% was, vonden de onderzoekers voor de verschillende assays een specificiteit van 91,2 tot 100%. Voor hyperthyreoïdie varieerde de specificiteit van 97,9 tot 100%.
Interpretatie laboratoriumonderzoek
Reviews beschrijven de interpretatie van het laboratoriumonderzoek.
Valkuilen bij de interpretatie zijn uitzonderlijke zaken zoals onbekende of intermitterende inname van levothyroxine of non-thyroidal illness. In zeldzame gevallen kan er sprake zijn van een secundaire schildklierfunctiestoornis waarbij de TSH-concentratie zich in het normale gebied bevindt.
In het algemeen geldt voor de huisarts wanneer laboratoriumuitslagen niet passen bij het klinisch beeld; denk ook aan een mogelijke meetfout (bijvoorbeeld door tegelijkertijd supplementgebruik) en overleg met de klinisch chemicus van het laboratorium waar het aanvullend onderzoek is gedaan.
Echografie
Naar Samenvatting ›- Verricht echografie van de schildklier bij palpabele afwijkingen van de schildklier zonder functiestoornissen. Verricht echografie wanneer er twijfel bestaat of de palpabele afwijking inderdaad in de schildklier gelokaliseerd is, of bij een klinische verdachte anamnese (bijvoorbeeld snelle groei van de palpabele afwijking).
- Verricht geen echografie bij hyperthyreoïdie.
- Verricht geen echografie met punctie in de eerste lijn.
De toegevoegde waarde van echografie bij de diagnostiek van schildklierfunctiestoornissen is voor de huisarts gering. Afwijkende waarden van TSH en vrije T4 en op indicatie bepaling van antilichamen, bezinking en leukocyten zijn al vaak voldoende voor het vaststellen van de diagnose.
Schildklierscintigrafie
Naar Samenvatting ›Verricht geen schildklierscintigrafie in de eerste lijn.
Schildklierscintigrafie, die met radioactieve jodiumisotopen of pertechnetaat kan worden uitgevoerd, kan inzicht geven in de activiteitsverdeling in de schildklier, waarmee actieve (‘warme’) en niet-actieve (‘koude’) gebieden worden onderscheiden. De werkgroep oordeelt dat het vervaardigen van een schildklierscintigrafie geen plaats heeft in de eerste lijn. De ziekte van Graves is aangetoond bij de aanwezigheid van TSH-R-antistoffen. Post-partumthyreoïditis en subacute thyreoïditis kunnen op basis van anamnese en laboratoriumonderzoek worden vastgesteld. Voor de overige oorzaken van een hyperthyreoïdie, met een mogelijke indicatie voor schildklierscintigrafie, is verwijzing naar de internist geïndiceerd, dan wel vanwege een mogelijke maligniteit dan wel vanwege de behandeling met radioactief jodium of met een operatie. Het wel of niet vervaardigen van een scan heeft dus geen consequenties voor het verdere beleid van de huisarts.
Evaluatie
Naar Samenvatting ›- De schildklierfunctiestoornis wordt vastgesteld op grond van de uitkomsten van het laboratoriumonderzoek.
- Let bij meerdere bepalingen van het TSH op de trend (ook als de waarden binnen de referentie-intervallen liggen). Zie het Stroomdiagram diagnostiek (figuur h1) voor de interpretatie van de mogelijke uitkomsten.
- Bij palpabele afwijkingen: maak onderscheid tussen een solitaire nodus, een diffuus vergrote schildklier (struma) en een multinodulair struma met of zonder dominante nodus.
- Denk bij laboratoriumuitslagen die niet passen bij het klinisch beeld ook aan een mogelijke meetfout (bijvoorbeeld door tegelijkertijd supplementgebruik) en overleg met de klinisch chemicus van het laboratorium.
Hypothyreoïdie
Naar Samenvatting ›Voor het stellen van de diagnose ‘hypothyreoïdie’ volstaat bepaling van TSH en fT4.
Differentiatie naar oorzaak
- De ziekte van Hashimoto: > 90% van de patiënten.
- Stille of pijnloze lymfocytaire thyreoïditis: zeldzaam en moeilijk te onderscheiden van de ziekte van Hashimoto (mildere klachten en kleinere afwijking TSH/fT4).
- Postpartumthyreoïditis: treedt op < 1 jaar na de bevalling.
- Iatrogeen: zie Iatrogene oorzaken van hypothyreoïdie.
Hyperthyreoïdie
Naar Samenvatting ›Voor het stellen van de diagnose ‘hyperthyreoïdie’ volstaat bepaling van TSH en fT4.
Richtlijnen beleid bij hypothyreoïdie
Naar Samenvatting ›Voorlichting
Naar Samenvatting ›- Leg uit dat de schildklier te langzaam werkt. De behandeling bestaat uit suppletie met schildklierhormoon.
- Verwijs naar de informatie over schildklieraandoeningen op thuisarts.nl. De informatie op Thuisarts is gebaseerd op deze NHG-Standaard.
- Attendeer de patiënt op SchildklierNL
- Adviseer vrouwen met (subklinische) hypothyreoïdie om contact op te nemen direct na een positieve zwangerschapstest (zie verder Schildklierfunctiestoornissen voor, tijdens en na de zwangerschap).
- Adviseer patiënten geen zwangerschap na te streven totdat ze goed zijn ingesteld.
Medicamenteuze behandeling
Naar Samenvatting ›Levothyroxine
Naar Samenvatting ›- De medicamenteuze behandeling bestaat uit substitutie met levothyroxine.
- Bij de ziekte van Hashimoto is levenslange substitutie met levothyroxine nodig.
- Bij hypothyreoïdie door een medicamenteuze oorzaak:
- overleg met de voorschrijvend arts of stoppen of omzetten van deze medicatie mogelijk is
- controleer na de aanpassing de schildklierwaarden elke 6 weken tot deze 2 opeenvolgende keren weer binnen het referentie-interval zijn
- stel behandeling met levothyroxine in als de medicatie niet kan worden aangepast of de schildklierwaarden niet normaliseren
- Bij de overige iatrogene oorzaken is levenslange substitutietherapie nodig.
- Bij stille of pijnloze lymfocytaire thyreoïditis of een subacute thyreoïditis De Quervain is medicamenteuze behandeling (meestal) niet geïndiceerd.
Algemeen
Naar Samenvatting ›- Doel van de substitutie met levothyroxine is dat de patiënt klachtenvrij is, dan wel zo min mogelijk klachten ervaart, en dat het TSH genormaliseerd is.
- De dosering moet worden aangepast onder bepaling van het TSH en het fT4.
- Motiveer de patiënt tot therapietrouw. Maak het belang van de medicatie duidelijk en geef heldere uitleg over het juiste gebruik. Informeer de patiënt dat het effect pas na enkele weken merkbaar is en dat de instelfase maanden kan duren.
- Benadruk bij aanvang van de behandeling dat sommige patiënten restklachten blijven houden, ook als ze goed zijn ingesteld. Overbehandeling kan nadelige effecten hebben; vergelijkbaar met die van (subklinische) hyperthyreoïdie.
- Naarmate de patiënt ouder wordt kan de behoefte aan levothyroxine afnemen tot 75% van de aanvangsdosering.
Er verschenen 2 onderzoeken over de streefwaarde van het TSH bij de behandeling van hypothyreoïdie, 1 onderzoek over het risico op cardiovasculaire aandoeningen en fracturen bij een behandeling met levothyroxine in relatie met de hoogte van het TSH en 1 onderzoek over de relatie tussen de hoogte van TSH en het optreden van atriumfibrilleren. Walsh bestudeerde in een blind, gerandomiseerd cross-overonderzoek met 56 hypothyreoïdiepatiënten het effect van 3 doseringen: laag (normale dosis), midden (25 µg meer dan de lage dosis) en hoog (50 µg meer dan de lage dosis). Elke dosering werd 8 weken gebruikt, waarna direct een andere dosering volgde. De volgorde was gerandomiseerd en blind voor de patiënt. Vijftig patiënten maakten het onderzoek af. De gemiddelde TSH-concentratie was 2,8, 1,0 en 0,3 voor respectievelijk de lage, midden en hoge dosering. De eindpunten waren kwaliteit-van-levenscores. Hiervan was alleen sociaal disfunctioneren significant verschillend, waarbij deze verbeterde naarmate de dosering afnam. Een beperking is de korte behandeltijd, in de praktijk is vaak al 6 weken nodig om een steady state van het TSH te bereiken. Boeving onderzocht in een prospectieve cross-overtrial met 42 nieuwe hypothyreoïdiepatiënten de TSH-streefwaarde. De behandeling bestond uit levothyroxine gedurende 12 maanden. In groep A was de TSH-streefwaarde laag-normaal (0,4 tot 2,0), in groep B hoog-normaal (2,0 tot 4,0). Het enige significante verschil was een betere Resting Energy Expenditure (indirect calorimetriemeting door blazen in canule tijdens rustademhaling) in groep A. De kleine patiëntengroep is een beperking. Flynn onderzocht in een retrospectief observationeel cohortonderzoek (n = 17.684; mediane follow-up 4,5 jaar) het risico op cardiovasculaire aandoeningen en fracturen bij een behandeling met levothyroxine. Patiënten met een gemiddelde TSH tussen de 0,4 en 4,0 mU/L waren de controlegroep. Patiënten met een gemiddelde TSH > 4,0 mU/L hebben een verhoogd risico op cardiovasculaire ziekten, ritmestoornissen en fracturen, respectievelijk gecorrigeerde HR 1,95 (95%-BI 1,73-2,21), 1,80 (95%-BI 1,33-2,44), 1,83 (95%-BI 1,41-2,37). Voor patiënten met een TSH < 0,04 mU/L is er een significant verhoogd risico van respectievelijk, gecorrigeerde HR 1,37 (95%-BI 1,17-1,60), 1,60 (95%-BI 1,10-2,33), 2,02 (95%-BI 1,55-2,62). Patiënten met een gemiddelde TSH tussen 0,04 en 0,4 mU/L hebben geen verhoogde kans op deze aandoeningen. Kanttekening bij dit onderzoek is de retrospectieve opzet. Heeringa onderzocht in een prospectief cohortonderzoek (n = 1426; leeftijd > 55 jaar; mediane follow-up 8 jaar) de relatie tussen de hoogte van het TSH en de kans op atriumfibrilleren bij een natuurlijk beloop. Bij aanvang van het onderzoek werd het TSH bepaald en een ECG uitgevoerd. Er waren in totaal 105 nieuwe gevallen van atriumfibrilleren. De kans op atriumfibrilleren was bijna 2 keer zo hoog bij een TSH < 1,04; HR 1,94 (95%-BI 1,13-3,34). Daarnaast nam de kans op atriumfibrilleren toe bij een lager wordende TSH (trend significant, p = 0,02). Bij een TSH tussen 1 en 2 is er geen verhoogde kans op atriumfibrilleren vergeleken met hogere TSH-waarden. Een beperking is dat de onderzochte populatie niet bestond uit hypothyreoïdiepatiënten behandeld met levothyroxine. Veelal voelen patiënten zich het beste bij een TSH in het laag-normale gebied en een vrije T4 in het hoog-normale gebied. Een verklaring hiervoor is dat er extra T4 nodig is voor de omzetting in T3, dat anders door de schildklier geproduceerd wordt. Verder bevinden het TSH van de meeste gezonde mensen zich in het laag-normale gebied.
Starten met levothyroxine
Naar Samenvatting ›Start met levothyroxine volgens de doseringen in tabel h1.
De maximale startdosering is gebaseerd op consensus.
In de eerdere versies van de standaard was het advies om bij mensen met een leeftijd > 60 jaar geleidelijk te beginnen met de dosering levothyroxine bij aanvang van de therapie vanwege de mogelijk cardiale risico’s als direct met een volledige substitutiedosis werd gestart. Bij een opbouwschema met een geleidelijke dosering is de kans hierop gering. Door een lage startdosering en geleidelijke verhoging ervan duurt het echter maanden voordat een patiënt voldoende gesubstitueerd is. Dit beleid werd gevoerd onder het motto: ‘better safe than sorry’. Bewijs voor deze aanpak ontbreekt echter. Een voordeel van een direct starten met volledige substitutiedosis is het gebruiksgemak voor de patiënt en de huisarts.
De KNMP adviseert een startdosis van 25-100 µg per dag, bij ouderen en cardiovasculaire comorbiditeit een startdosis van 12,5-25 µg per dag. De NIV-richtlijn Schildklierfunctiestoornissen benoemt geen startdoseringen. In de Europese richtlijn zijn 2 aanbevelingen opgenomen:
‘For patients without cardiac disease, a weight-related dose of L-thyroxine should be used, approximating to 1.5 μg/kg/day (e.g. 75 or 100 μg/day for a woman, 100 or 125 μg for a man). For patients with cardiac disease and in the elderly, a small dose of L-thyroxine should be started, 25 or 50 μg daily. The dose of L -thyroxine should be increased by 25 μg/day every 14–21 days until a full replacement dose is reached.’
In de Amerikaanse richtlijn wordt aangegeven dat de volgende factoren meegenomen moeten worden in de keuze voor de startdosering: het gewicht van de patiënt, de oorzaak van de hypothyreoïdie, de TSH-waarde, leeftijd en de algehele klinische context, waaronder de aanwezigheid van cardiale ziekten en zwangerschap.
Met het vorderen van de leeftijd kan de behoefte aan levothyroxine afnemen tot 75% van de aanvangsdosering. Dit is fysiologisch bij veroudering; het schildkliermetabolisme verandert met de leeftijd. Een gezonde schildklier produceert minder, maar ook een hoger TSH kan als normaal worden beschouwd.
Opbouwschema
Naar Samenvatting ›- Verhoog de dosering in stappen van 12,5 tot 25 µg als er nog klachten zijn of als het TSH verhoogd blijft.
- Overweeg een langzamer opbouwschema bij patiënten met cardiale comorbiditeit. Bespreek het voordeel (mogelijk een kleinere kans op cardiale klachten) en het nadeel (het duurt langer voor de juiste dosering bereikt is).
Er is geen literatuur gevonden over het verschil in effect tussen een vertraagd en regulier opbouwschema van levothyroxine bij patiënten met hypothyreoïdie en cardiale comorbiditeit. Er zijn daarnaast ook geen observationele onderzoeken of case reports bekend over ernstige events bij een regulier opbouwschema. Omdat er wel cardiale effecten bekend zijn van levothyroxine, is het gebruikelijk om bij cardiale comorbiditeit een vertraagd opbouwschema te gebruiken. Dit heeft geleid tot een zwakke aanbeveling voor een vertraagd opbouwschema bij patiënten met cardiale comorbiditeit. In de praktijk zal hier pragmatisch mee omgegaan worden: het vertraagde opbouwschema kan eventueel iets versneld worden bij relatief gezonde ouderen die cardiaal stabiel zijn.
Gewenste en ongewenste effecten
Er is (nog steeds) geen onderzoek gevonden naar de effecten van en vertraagd versus regulier opbouwschema van levothyroxine bij patiënten met hypothyreoïdie en cardiale comorbiditeit.
Het voordeel van een vertraagd opbouwschema (geleidelijke dosering) is de mogelijk kleinere kans op cardiale klachten. Een nadeel van een vertraagd opbouwschema is dat het langer duurt voordat de patiënt op een optimale dosering zit en daardoor langer schildkliergerelateerde klachten heeft.
Kwaliteit van bewijs
Niet van toepassing.
Waarden en voorkeuren van patiënten
De meeste patiënten zullen het belangrijk vinden om bij nieuwe medicatie rekening te houden met eventueel effect op hun cardiale comorbiditeit, zeker wanneer er mogelijke cardiale effecten bekend zijn. Tegelijkertijd zullen sommige patiënten een té traag opbouwschema ook vervelend kunnen vinden, omdat er waarschijnlijk vaker bloed geprikt zal moeten worden en het langer duurt voor de effectieve dosis bereikt is (de effecten merkbaar zijn). De waarden en voorkeuren van patiënten kunnen dus verschillen (inschatting werkgroep).
Kosten
De kosten voor de medicatie in beide schema’s zullen ongeveer gelijk zijn. Bij het vertraagde opbouwschema kunnen er extra kosten zijn voor (laboratorium)controles.
Aanvaardbaarheid
Het is algemeen aanvaard om het zekere voor het onzekere te nemen (‘better safe than sorry’) en wat meer terughoudend te zijn bij het starten van nieuwe medicatie en aanwezigheid van comorbiditeit. Ook al kost het meer tijd en meer (laboratorium)controles.
Haalbaarheid
Het is haalbaar om bij patiënten met hypothyreoïdie en cardiale comorbiditeit met een vertraagd opbouwschema te werken, omdat dit al de gangbare praktijk is en de meeste artsen hier bekend mee zijn.
Uitgangsvraag
Is een behandeling van hypothyreoïdie met levothyroxine met een vertraagd opbouwschema (ten opzichte van het reguliere opbouwschema) aan te bevelen bij patiënten met hypothyreoïdie en cardiale comorbiditeit? Zie de PICO-tabel.
| Patiënten | Patiënten met hypothyreoïdie en cardiale comorbiditeit |
| Interventie | Behandeling met levothyroxine – vertraagd opbouwschema |
| Vergelijking | Behandeling met levothyroxine – regulier opbouwschema |
| Uitkomstmaten | Cruciaal:
Belangrijk:
|
Klinisch relevant verschil voor uitkomstmaten
De werkgroep heeft bepaald dat 20% het minimale klinisch relevante verschil is voor alle uitkomstmaten, net als een SMD (Standardized Mean Difference) > 0,50, een oddsratio (OR) of relatief risico (RR) < 0,8 of > 1,25 en een verandering van 20% op de totale score van een vragenlijst.
Specifiek per uitkomstmaat:
- Klachtenreductie aan de hand van ThyPRO (schaal 0-100): een verschil van 6,3 – 14,3 punten is klinisch relevant.
- Cardiovasculaire events: een verschil van 10-20 personen op 1000 is een klinisch relevant verschil.
- Sterfte: een verschil van 10-20 personen op 1000 is een klinisch relevant verschil.
Achtergrond
Substitutietherapie bij hypothyreoïdie bestaat uit behandeling met levothyroxine. In de NHG-Standaard Schildklieraandoeningen van 2013 werd aanbevolen om bij aanvang van de behandeling een onderscheid te maken tussen 2 groepen. Bij patiënten < 60 jaar zonder cardiale comorbiditeit werd aanbevolen om te starten met een volledige substitutiedosis. Bij patiënten > 60 jaar óf cardiale comorbiditeit werd aanbevolen de dosering stapsgewijs te verhogen. Dit omdat bij gebruik van levothyroxine (substitutietherapie) cardiale klachten bekend zijn (KNMP Kennisbank, 6 april 2023). Deze cardiale klachten zijn geen bijwerkingen, maar toe te schrijven aan de werking van levothyroxine. Bij een opbouwschema met een geleidelijke dosering zou de kans op mogelijke cardiale risico’s geringer zijn, onder het motto: ‘Better safe than sorry’. Door de lage startdosering en de geleidelijke verhoging ervan duurt het echter maanden voordat een patiënt voldoende gesubstitueerd is. Dit was tot op heden gebruikelijk beleid. Bewijs voor deze aanpak ontbreekt echter.
Resultaten
Resultaat zoekactie
De zoekactie leverde geen SR’s en RCT’s op naar een vertraagd versus regulier opbouwschema van levothyroxine bij patiënten met hypothyreoïdie en cardiale comorbiditeit. De update in januari 2024 leverde ook geen onderzoeken over deze uitgangsvraag op.
Onderzoekskarakteristieken
Niet van toepassing.
Effectiviteit en bijwerkingen
Bij overdosering, een te hoge aanvangsdosering of een te snelle stijging van de dosering kunnen onder andere optreden: tachycardie, hartkloppingen, ontstaan of verergeren van angina pectoris, bloeddrukstijging, hartfalen, hartritmestoornissen, myocardinfarct, nervositeit, rusteloosheid, slapeloosheid, vermoeidheid, opvliegers, diarree, braken, gewichtsverlies, menstruatiestoornissen (KNMP Kennisbank, 6 april 2023).
Conclusie
- Er werden geen onderzoeken gevonden naar een vertraagd versus regulier opbouwschema van levothyroxine bij patiënten met hypothyreoïdie en cardiale comorbiditeit. Wetenschappelijk bewijs over een voorkeur voor 1 van 2 opbouwschema’s ontbreekt.
- Een te hoge aanvangsdosering van levothyroxine of te snelle stijging van de dosering kan leiden tot cardiale klachten, het uitlokken van een myocardinfarct en andere klachten van hyperthyreoïdie (zoals vermoeidheid, diarree en gewichtsverlies) (KNMP Kennisbank, 6 april 2023).
Evaluatie
Naar Samenvatting ›Evalueer de behandeling 6 weken na de start. Laat voor deze evaluatie vooraf het TSH en het fT4 bepalen. Besteed bij patiënten met cardiale comorbiditeit (in de voorgeschiedenis) extra aandacht aan cardiale klachten.
Instructies aan de patiënt
Naar Samenvatting ›Instrueer de patiënt:
- om de tabletten dagelijks op hetzelfde tijdstip en bij voorkeur op een lege maag in te nemen (in ieder geval 30 minuten tussen inname tabletten en ontbijt).
- om contact op te nemen bij klachten zoals nervositeit, hoofdpijn, zweten, pijn op de borst, palpitaties, tachycardie, diarree, gewichtsverlies en psychische veranderingen. Dit kan duiden op overdosering of een te snelle dosisverhoging.
- dat bepaalde zelfzorgmiddelen de werking van schildklier en levothyroxine kunnen beïnvloeden (bijvoorbeeld zeewier, kelp, visoliecapsules, multivitamines met jodium).
- dat starten (en ook staken) van levothyroxine altijd aan de trombosedienst moet worden doorgegeven. Levothyroxine heeft invloed op de werking van vitamine-K-antagonisten en daarmee de dosering. Er is geen interactie met DOAC’s.
Het is belangrijk dat de patiënt het middel op een vast tijdstip en op een lege maag inneemt. Voedsel in de maag kan absorptie van levothyroxine vertragen. Bolk vergeleek in een cross-overtrial (n = 105) de TSH-concentratie bij een ochtend- en avondinname van levothyroxine. De avondinname liet een significante daling van de TSH-concentratie zien, de ochtendinname niet. Er was geen verschil in kwaliteit van leven en andere uitkomsten. Een kanttekening bij dit onderzoek zijn de grote verschillen tussen de baseline TSH-concentratie van de ochtend- en avondgroep. De avondgroep had een hogere TSH bij aanvang van het onderzoek. Een mogelijk verklaring voor de betere waarden bij avondinname is dat levothyroxine beter kan worden opgenomen bij lagere darmmotiliteit (in de avond), want dan blijft het langer in het maag-darmkanaal. Instrueer de patiënt om de tabletten eenmaal daags in te nemen steeds op hetzelfde tijdstip, op een lege maag en erna nuchter te blijven. Adviseer patiënt bij inname in de ochtend om 30 minuten tot 1 uur nuchter te blijven. Bij inname in de avond: van tevoren minimaal 4 uur nuchter en nuchter blijven na inname.
Overdosering
Bij overdosering kunnen tachycardie, palpitaties, hypertensie, (toename van) angina pectoris, tremor, nervositeit, slapeloosheid, hoofdpijn, toegenomen eetlust, gewichtsverlies, zweten, braken, diarree en koorts optreden (KNMP Kennisbank, 12 september 2023). Bij een juiste dosering treden in het algemeen geen bijwerkingen op. Zelden worden overgevoeligheidsreacties zoals huiduitslag en jeuk gezien. Alleen chronisch gebruik van te veel levothyroxine, blijkend uit te lage of onmeetbaar lage TSH-concentratie, leidt tot verlies van botmassa. Bij gebruik van de doseringen die in de standaard worden aanbevolen is daarvan geen sprake.
Interacties
Er zijn verschillende interacties mogelijk. De opname van levothyroxine in het lichaam kan worden verminderd door complexvorming met andere geneesmiddelen. Er ontstaan niet-resorbeerbare complexen met onder andere ijzer-, aluminium en magnesiumverbindingen, fosfaatbinders en galzuurbindende harsen.
Dit zijn tijdsgebonden interacties: Levothyroxine mag niet worden ingenomen binnen 2 uur voor de inname van geneesmiddelen die de absorptie van levothyroxine verminderen. Dit geldt voor: antacida, calciumzouten, sucralfaat, ijzerpreparaten en magnesiumzouten.
Levothyroxine mag niet worden ingenomen binnen 4 uur voor of na inname van colestyramine of colesevelam (galzuurbindende harsen), vanwege vermoedelijke absorptie van levothyroxine door deze middelen.
Orale oestrogenen beïnvloeden (verhogen) tijdelijk de concentratie van thyroxinebindend globuline en kunnen daardoor een verlaging van de vrije-T4 concentratie geven.
Ook bestaan er vormen van interactie door beïnvloeding van enzymen (door enzyminductoren) die een rol spelen bij de eliminatie. De afbraaksnelheid kan versnellen of juist vertragen.
Fenytoïne (anti-epilepticum), fenobarbital (anti-epilepticum) en carbamazepine (anti-epilepticum) en rifampicine (antibioticum/tuberculosemiddel) veroorzaken mogelijk leverenzyminductie, waardoor de afbraak van levothyroxine beïnvloed (verhoogd) wordt.
Het effect van leverenzyminductie is dubieus, zeker in mensen. Anti-epileptica veroorzaken met name verdringing van de bindende eiwitten, maar hebben veelal geen relevant effect op fT4 en TSH.
Bij patiënten met hypothyreoïdie worden vitamine K-afhankelijke stollingsfactoren minder sterk afgebroken. Vitamine K-antagonisten zijn minder effectief en er is een hogere dosering nodig. Als de hypothyreoïdie wordt gecorrigeerd heeft dit ook invloed op de afbraak van stollingsfactoren, waarbij de dosering van vitamine K-antagonisten moet worden aangepast. Daarom moet zowel het starten als het staken van schildkliermiddelen aan de trombosedienst worden doorgegeven.
Controles
Naar Samenvatting ›- Bepaal elke 6 weken het TSH en het fT4, gevolgd door een controle tot de patiënt (zo goed als) klachtenvrij is, en het TSH genormaliseerd is.
- Houd er rekening mee dat de serumwaarden sneller verbeteren dan de klachten. Een TSH buiten het referentie-interval geeft een verhoogd risico op complicaties zoals atriumfibrilleren.
- Adviseer de patiënt om op een vast tijdstip en bij hetzelfde laboratorium bloed af te laten nemen (bij voorkeur vóór inname van de medicatie).
- Vermijd het wisselen van levothyroxine preparaten (zie NHG-Leidraad verantwoord wisselen medicijnen). Indien wisseling in verband met beschikbaarheid noodzakelijk is en er klachten ontstaan, dan is het advies om het TSH 6 weken na wisselen te laten controleren.
- In het eerste jaar nadat de patiënt klachtenvrij is en het TSH binnen het referentie-interval is:
- controleer het TSH en het fT4 elke 3 maanden
- Na het eerste jaar klachtenvrij en genormaliseerd TSH:
- controleer jaarlijks bij stabiele waarden
- controleer eerder bij klachten
| Patiënt | Startdosering | Doseringsverhoging per 6 weken |
|---|---|---|
| Zonder cardiale comorbiditeit | 1,6 µg /kg tot maximale startdosis van 150 µg* | 12,5-25 µg afhankelijk van ernst van de klachten en TSH-waarde tot het doel bereikt is† |
| Met cardiale comorbiditeit (in de voorgeschiedenis) | 1 dd 25 µg | 12,5 µg afhankelijk van ernst van de klachten en TSH-waarde tot het doel bereikt is† |
| Zwangere patiënten stabiel ingesteld op levothyroxine | Verhoog de dosis levothyroxine met circa 25-30% zodra een zwangerschap is aangetoond. Pas vervolgens aan op geleide van TSH. De uiteindelijke dosis levothyroxine is 25-50% hoger dan de dosis voorafgaand aan de zwangerschap | |
| Bij oudere patiënt kan de behoefte aan levothyroxine afnemen tot 75% van de aanvangsdosering | ||
Aandachtspunten:
| ||
* Gemiddelde substitutiedosis levothyroxine is 1,6 µg per kg lichaamsgewicht per dag, maar de individuele variatie is groot. † De doorsnee dosering levothyroxine is 100-125 µg 1 dd, maar sommige patiënten hebben meer nodig, tot wel 300 µg. | ||
Levothyroxine staat op de rode lijst van NHG-Leidraad Verantwoord wisselen medicijnen. Deze rode lijst bevat medicijnen waarbij je niet van merk mag wisselen.
Persisterende klachten
Naar Samenvatting ›- Ondanks optimale behandeling kunnen patiënten toch klachten houden, in het bijzonder vermindering van neurocognitieve functies en algemeen welbevinden.
- Denk bij persisterende klachten aan de mogelijkheid van bijkomende ziekten, in het bijzonder auto-immuunaandoeningen (zie Pathofysiologie).
- Overweeg ook een preventieve afspraak met een bedrijfsarts bij langer bestaande klachten om te inventariseren wat qua werkaanpassing mogelijk of nodig zou kunnen zijn.
Er is een aantal onderzoeken gedaan naar de kwaliteit van leven van patiënten met hypothyreoïdie en naar hun functioneren en welbevinden tijdens de behandeling. Wekking et al. onderzochten met behulp van gevalideerde scorelijsten het neurocognitief functioneren (met items zoals aandacht en geheugen) en het welbevinden van behandelde patiënten met hypothyreoïdie (n = 141; leeftijd 48,8 ± 9,8 jaar). Zij concluderen dat ondanks behandeling mogelijk geen volledig herstel wordt bereikt. Saravanan vergeleek het welbevinden van 397 behandelde patiënten met hypothyreoïdie met een normale TSH met dat van 551 gematchte controles. Zij stelden vast dat het welbevinden significant was verminderd.
Consultatie en verwijzing
Naar Samenvatting ›Verwijs patiënten met hypothyreoïdie naar de internist(-endocrinoloog) bij:
- vermoeden van een centrale oorzaak (zoals laag of normaal TSH in combinatie met laag fT4 (dit wijst op een zeldzame, centrale oorzaak. Het kan ook voorkomen dat patiënten wel een normaal TSH hebben maar daarbij een laag fT4).
- ernstige cardiale problemen (hartfalen in NYHA-klasse III-IV en angina pectoris met klachten bij geringe inspanning; zie NHG-Standaard Hartfalen en NHG-Standaard Stabiele angina pectoris).
- ernstige persisterende klachten ondanks adequate behandeling met levothyroxine van > 6 maanden met TSH binnen het referentie-interval.
Bij patiënten met cardiale klachten of ischemische hartafwijkingen is er een verhoogd risico op hartkloppingen, angina pectoris of hartfalen en vaak verdragen zij de volledige substitutiedosis niet. Bij hypothyreoïdie met extreem lage vrije T4 is er al bij een lage aanvangsdosis een geringe kans op een infarct.
In de NIV richtlijn Schildklierfunctiestoornissen staat dat een combinatiebehandeling is te overwegen bij patiënten met ernstige persisterende klachten ondanks adequate monobehandeling van minimaal 6 maanden met laag-normale TSH-concentraties. Na de instellingsperiode duurt de combinatiebehandeling minimaal 6 maanden op dezelfde dosis. Gezien de complexe (biochemische) monitoring van combinatiebehandeling dient de behandeling door een internist-endocrinoloog in de tweede lijn plaats te vinden.
Richtlijnen beleid bij subklinische hypothyreoïdie
Naar Samenvatting ›Voorlichting
Naar Samenvatting ›- Leg uit dat bij het bloedonderzoek een afwijkende waarde is gevonden, maar dat de schildklier een normale hoeveelheid schildklierhormoon produceert.
- Een subklinische hypothyreoïdie is zelden de verklaring voor lichamelijke klachten.
- Het TSH normaliseert meestal spontaan.
- Voor zwangere patiënten, zie Schildklieraandoeningen tijdens zwangerschap, zwangerschapswens en postpartumperiode).
Medicamenteuze behandeling
Naar Samenvatting ›Geen proefbehandeling
Naar Samenvatting ›We bevelen (proef)behandeling met levothyroxine niet aan bij patiënten met subklinische hypothyreoïdie (ongeacht leeftijd en aanwezigheid van comorbiditeit).
De literatuur laat zien dat er geen verschil in uitkomsten is bij al dan geen behandeling van subklinische hypothyreoïdie met levothyroxine, ongeacht de leeftijd en aanwezigheid comorbiditeit van de patiënt.
Het is wel belangrijk dat de huisarts aan de patiënt uitlegt dat subklinische hypothyreoïdie vooral een laboratoriumuitslag is en dat de relatie met klachten niet duidelijk is. Het is dus niet nodig om medicatie te geven bij de laboratoriumuitslagen waarbij geen klachten bestaan. Ook wanneer er wél klachten zijn, is het onwaarschijnlijk dat medicatie zal helpen om de klachten te laten afnemen. Daarnaast kan medicatie wel bijwerkingen geven en zijn er kosten aan verbonden.
Dit heeft geleid tot een sterke aanbeveling tegen de behandeling van subklinische hypothyreoïdie.
Gewenste en ongewenste effecten
Er lijken niet of nauwelijks verschillen in de uitkomstmaten te zijn tussen wel of geen behandeling met levothyroxine bij subklinische hypothyreoïdie, ongeacht de leeftijd en aanwezigheid van comorbiditeit bij de patiënten.
Kwaliteit van bewijs
De kwaliteit van het bewijs varieerde van zeer laag tot hoog. Er werd afgewaardeerd voor risico op bias (in een aantal studies was er geen blindering), inconsistentie (hoge heterogeniteit en de richting van het effect was bij sommige uitkomstmaten niet eenduidig), onnauwkeurigheid (de grens van klinische relevantie kwam soms in het 95%-betrouwbaarheidsinterval voor en het betrouwbaarheidsinterval was soms zeer breed) en publicatiebias (betrokkenheid van de industrie).
Waarden en voorkeuren van patiënten
Het zal voor de meeste patiënten belangrijk zijn om niet onnodig medicatie in te nemen, zeker als het niet zeker is dat de medicatie hun klachten kan verminderen, of omdat medicatie voor bijwerkingen kan zorgen. Aan de andere kant zouden sommige patiënten wel uit willen proberen of medicatie hen zal helpen (dit naar inschatting van de werkgroep).
Kosten
De gemiddelde prijs per dag van het generieke middel (levothyroxine) is € 0,06 (Zorginstituut Nederland. Farmacotherapeutischkompas.nl).
Aanvaardbaarheid
Het is aanvaardbaar om bij een subklinische aandoening geen medicatie voor te schrijven of in te nemen. Het is wel belangrijk dat de huisarts de patiënt duidelijk uitleg geeft over de reden ervan: de relatie tussen de laboratoriumuitslag en de klachten is niet duidelijk, en het is onwaarschijnlijk dat medicatie helpt om eventuele klachten te laten afnemen.
Haalbaarheid
Het is haalbaar om geen medicatie voor te schrijven bij subklinische hypothyreoïdie.
Uitgangsvraag
a Is behandeling van volwassen patiënten met subklinische hypothyreoïdie (verhoogd TSH met normaal vrij T4) met klachten die zouden kunnen passen bij schildklierafwijkingen (onder andere vermoeidheid, toename van BMI, depressieve klachten) met levothyroxine aan te bevelen?
b Is behandeling van kwetsbare ouderen met subklinische hypothyreoïdie met levothyroxine aan te bevelen?
| Patiënten |
|
| Interventie | Behandeling met levothyroxine |
| Vergelijking | Geen behandeling (of placebo) |
| Uitkomstmaten | Cruciaal:
Belangrijk:
|
Klinisch relevant verschil voor uitkomstmaten
Specifiek per uitkomstmaat:
- klachtenreductie aan de hand van ThyPRO (schaal 0-100): een verschil van 6,3-14,3 punten (afhankelijk van de subschaal) is klinisch relevant.
- cardiovasculaire events: een verschil van 15 personen op 1000 is een klinisch relevant verschil
- sterfte: een verschil van 15 personen op 1000 is een klinisch relevant verschil
Voor de overige uitkomstmaten heeft de werkgroep bepaald dat 20% het minimale klinisch relevante verschil is voor alle uitkomstmaten, net als een oddsratio (OR) of relatief risico (RR) < 0,8 of > 1,25, een verandering van 20% op de totale score van een vragenlijst en een standardized mean difference (SMD) > 0,50.
Achtergrond
Bij subklinische hypothyreoïdie is er sprake van een bevinding bij laboratoriumonderzoek waarbij de TSH-concentratie te hoog is en het vrije T4 een waarde heeft binnen het referentie-interval. Deze definitie is in de internationale literatuur de meest gebruikelijke. De term ‘subklinisch’ geeft aan dat de relatie met klachten niet altijd duidelijk is. Bij ouderen komt subklinische hypothyreoïdie veel vaker voor dan in jongere populaties. Of dit de gezondheid en levensverwachting van oudere personen (arbitrair ≥ 65 jaar) en in het bijzonder kwetsbare ouderen beïnvloedt, was tot nu toe niet duidelijk vanwege tegenstrijdig bewijs over mogelijke verbanden tussen subklinische hypothyreoïdie en bijvoorbeeld cognitief en lichamelijk functioneren, welbevinden en overlijden.
Met het antwoord op deze uitgangsvraag willen we de huisarts en de patiënt handvatten bieden bij het overwegen subklinische hypothyreoïdie wel of niet te behandelen.
Methode
Er is een systematische literatuurzoekactie naar systematische reviews (SR’s) en RCT’s uitgevoerd in Pubmed en Embase in februari 2023, met een update in januari 2024.
Resultaten
Resultaat zoekactie
De zoekactie leverde 2 SR’s op naar de behandeling van subklinische hypothyreoïdie: 1 met betrekking tot alle volwassen en 1 over patiënten van 60 jaar en ouder. Daarnaast wordt een RCT over patiënten van 80 jaar en ouder apart beschreven om een beeld te krijgen of deze leeftijdsgroep (waarin waarschijnlijk de kwetsbare ouderen zitten) anders behandeld zou moeten worden. Deze RCT was ook geïncludeerd in de SR van Zhao. Een aanvullende search na de zoekdatum van de SR’s leverde 1 aanvullende RCT op. De update in januari 2024 leverde geen nieuwe onderzoeken voor deze uitgangsvraag op.
Onderzoekskarakteristieken
- Feller 2018 includeerde 21 RCT’s met in totaal 2.192 volwassenen met subklinische hypothyreoïdie (definitie in onderzoeken: de grenswaarde van TSH varieerde van 3,5 tot 5,5 mIU/L en vrije thyroxine was normaal). Deze patiënten kregen 3-18 maanden een schildklierhormoonbehandeling ((levo)thyroxine) of placebo (of geen behandeling). Het aantal personen in de onderzoeken varieerde van 20 tot 737 deelnemers; de gemiddelde leeftijd van 32 tot 74 jaar; het percentage vrouwen van 46 tot 100% en de baseline gemiddelde TSH-waarde van 4,4 tot 12,8 mIU/L. In 11 van de 21 RCT’s werden patiënten met comorbiditeit geëxcludeerd, in 3 RCT’s werd comorbiditeit gerapporteerd en in 7 RCT’s is het percentage patiënten met comorbiditeit onbekend (zie tabel X Comorbiditeit en de tabel met onderzoekskarakteristieken Feller (in tabel Totstandkoming en methoden).
- Zhao 2022 includeerde 13 RCT’s met in totaal ongeveer 5000 volwassenen (60 jaar of ouder) met subklinische hypothyreoïdie (definitie in onderzoeken: de grenswaarde van thyreotropine (zet aan tot TSH) varieerde van 4,2 tot 5,5 mIU/L en vrij T4 was normaal). Deze patiënten kregen 6-60 maanden een schildklierhormoonbehandeling of placebo (of geen behandeling). Het aantal personen in de onderzoeken varieerde van 50 tot 1977 deelnemers; de gemiddelde leeftijd van 65 tot 85 jaar; het percentage vrouwen van 32 tot 80% en de baseline gemiddelde thyreotropinewaarde worden niet genoemd in de review. In 9 van de 13 RCT’s werden patiënten met comorbiditeit geïncludeerd en in de overige 4 RCT’s is het percentage patiënten met comorbiditeit onbekend (zie tabel X Comborbiditeit en de tabel met onderzoekskarakteristieken Zhao (in tabel Totstandkoming en methoden)).
- Mooijaart 2019 (Nederland, Zwitserland, Ierland, Verenigd Koninkrijk) includeerde 251 patiënten (80 jaar of ouder; gemiddelde leeftijd 85 jaar; 47% vrouw; comorbiditeit zie tabel X Comorbiditeit) met subklinische hypothyreoïdie (definitie in onderzoek: thyreotropine verhoogd = tussen 4,6 en 19,9 mIU/L en vrij T4 binnen referentie interval van het laboratorium). Deze patiënten werden gerandomiseerd over 2 groepen: 1) interventiegroep (12 maanden levothyroxine) en 2) controlegroep (12 maanden placebo). Voor de start van de medicatie en na 12 en 24 maanden werden onder andere schildkliergerelateerde klachten en kwaliteit van leven bepaald aan de hand van respectievelijk de ThyPRO (score range 0-100; hogere score = meer klachten) en EuroQoL-5D (score range 0 – 1,0; hogere score = hogere kwaliteit van leven) en EuroQoL-VAS (score range 0-100; hogere score = betere gezondheid). Daarnaast werd ook de BMI bepaald.
- Mowafy 2022 (Egypte) includeerde 90 patiënten (18-65 jaar; gemiddelde leeftijd onbekend; 87% vrouw; 22% heeft diabetes mellitus en 9% hypertensie) met subklinische hypothyreoïdie (TSH > 10 mlU/L). Deze patiënten werden gerandomiseerd over 2 groepen: 1) interventiegroep (3 maanden levothyroxine) en 2) controlegroep (geen behandeling). Voor de start van de medicatie en na 3 maanden werd onder andere de kwaliteit van leven bepaald aan de hand van de ‘Short-Form 36 Questionnaire’ (score range 0-100; hogere score = betere gezondheidstoestand).
Er werden geen onderzoeken specifiek over kwetsbare ouderen met subklinische hypothyreoïdie gevonden.
| Comorbiditeit | ≥ 18 jaar | ≥ 60 jaar | ≥ 80 jaar |
|---|---|---|---|
| Cardiovasculaire ziekten | 0-14% | 8-50% | 24% |
| Atriumfibrilleren | 0-12% | 7-19% | 19% |
| Hypertensie | 0-50% | 43-85% | 50% |
| Diabetes mellitus | 0-16% | 11-54% | 12% |
Effectiviteit en bijwerkingen
Zie de tabellen Levothyroxine vergeleken met placebo of geen behandeling (18-plussers, 60-plussers en 80-plussers) voor de samenvatting van de resultaten.
Bijwerkingen levothyroxine:
- Bij een optimale dosering (bij controles ligt de TSH en vrij T4 tussen de referentie-intervallen) treden geen bijwerkingen op. Te hoge doses of snel opvoeren van de dosering kan leiden tot symptomen van hyperthyreoïdie, zoals: tachycardie, hartkloppingen, ontstaan of verergeren van angina pectoris, bloeddrukstijging, hartfalen, hartritmestoornissen, myocardinfarct, nervositeit, rusteloosheid, slapeloosheid, vermoeidheid, tremor.
- Botverlies kan ontstaan bij langdurig gebruik van hoge doses die leiden tot onderdrukking van TSH.
- Zelden kunnen overgevoeligheidsreacties in de vorm van huiduitslag, jeuk en/of angio-oedeem optreden. Deze worden vermoedelijk veroorzaakt door de hulpstoffen; wisseling van preparaat kan dan helpen (KNMP Kennisbank, 6 april 2023).
Conclusies
Alle leeftijden
- Er is geen verschil in schildkliergerelateerde klachten en BMI bij wel of geen behandeling met levothyroxine (kwaliteit van bewijs is hoog).
- Er is waarschijnlijk niet of nauwelijks verschil in depressieve klachten, vermoeidheid, kwaliteit van leven en bijwerkingen bij wel of geen behandeling met levothyroxine (kwaliteit van bewijs is redelijk).
- Er is mogelijk geen verschil in cardiovasculaire events en sterfte bij wel of geen behandeling met levothyroxine (kwaliteit van bewijs is laag).
Alleen 60-plussers
- Er is geen verschil in schildkliergerelateerde klachten, vermoeidheid en kwaliteit van leven bij wel of geen behandeling met levothyroxine (kwaliteit van bewijs is hoog).
- Er komt mogelijk minder sterfte voor bij behandeling met levothyroxine dan bij placebo of geen behandeling (kwaliteit van bewijs is laag).
Er is waarschijnlijk niet of nauwelijks verschil in bijwerkingen en depressieve klachten bij wel of geen behandeling met levothyroxine (kwaliteit van bewijs is redelijk). - Er is mogelijk geen verschil in BMI en cognitieve functie, bij wel of geen behandeling met levothyroxine (kwaliteit van bewijs is laag).
We zijn onzeker over het effect van levothyroxine op cardiovasculaire events (kwaliteit van bewijs is zeer laag).
Alleen 80-plussers
- Er is geen verschil in schildkliergerelateerde klachten, vermoeidheid, kwaliteit van leven en BMI bij wel of geen behandeling met levothyroxine (kwaliteit van bewijs is hoog).
- Er is waarschijnlijk geen verschil in ernstige bijwerkingen bij wel of geen behandeling met levothyroxine (kwaliteit van bewijs is redelijk).
Er is mogelijk iets meer sterfte en er zijn iets minder cardiovasculaire events bij behandeling met levothyroxine ten opzichte van placebo (kwaliteit van bewijs is laag). - Er werden geen onderzoeken met de uitkomstmaat cognitieve achteruitgang gevonden.
Er werden geen onderzoeken specifiek over kwetsbare ouderen met subklinische hypothyreoïdie gevonden.
Controles
Naar Samenvatting ›- Ga na of er een andere verklaring is voor de klachten.
- Volg de (leeftijdsspecifieke) referentie-intervallen van het laboratorium. De kans op het ontwikkelen van een klinische hypothyreoïdie neemt toe bij een hoger TSH.
- TSH-waarden normaliseren vaak spontaan.
- Herhaal de controle alleen bij klachten die wijzen op hypothyreoïdie.
Richtlijnen beleid bij hyperthyreoïdie
Naar Samenvatting ›Voorlichting
Naar Samenvatting ›- Leg uit dat de schildklier te snel werkt. Behandeling vindt plaats door de internist(-endocrinoloog).
- Verwijs naar de informatie over schildklieraandoeningen op Thuisarts, die is gebaseerd op deze NHG-Standaard.
- Attendeer de patiënt op SchildklierNL.
Consultatie en verwijzing
Naar Samenvatting ›Verwijs patiënten met hyperthyreoïdie naar een internist(-endocrinoloog).
Spoedverwijzing
Verwijs met spoed bij:
- vermoeden van een thyreotoxische crisis
- diagnose voor het eerst gesteld tijdens zwangerschap
Richtlijnen beleid bij subklinische hyperthyreoïdie
Naar Samenvatting ›Voorlichting
Naar Samenvatting ›- Leg uit dat bij het bloedonderzoek een afwijkende waarde is gevonden, maar dat de schildklier een normale hoeveelheid schildklierhormoon produceert.
- Patiënten met subklinische hyperthyreoïdie hebben een hoger risico op atriumfibrilleren en op fracturen. Daarom volgen er extra controles.
Controles
Naar Samenvatting ›- Doe lichamelijk onderzoek naar atriumfibrilleren en indien aanwezig: behandel het atriumfibrilleren volgens NHG-Standaard Atriumfibrilleren.
Bepaal na 3 maanden: TSH, het fT4 en TSH-R-antistoffen. - Indien na 3 maanden de TSH-concentratie verlaagd blijft: overweeg aanvullend onderzoek (DXA-VFA-meting) naar osteoporose (zie NHG-Standaard Fractuurpreventie).
- Indien de patiënt niet verwezen is: controleer TSH en fT4 het eerste jaar elke 3 maanden, daarna jaarlijks of eerder bij klachten passend bij hyperthyreoïdie.
Als bij laboratoriumdiagnostiek een subklinische hyperthyreoïdie gevonden wordt, is er een grotere kans op manifestatie van hyperthyreoïdie binnen het eerste jaar. Zie voor achtergronden ook het detail Beloop subklinische hyperthyreoïdie.
Bij positieve TSH-R-antistoffen is het waarschijnlijk de ziekte van Graves in wording. Hierdoor kan de patiënt tijdig goed worden voorgelicht. Ongeacht de uitkomst van het ander onderzoek wordt de bepaling van het TSH en vrije T4 elke 3 maanden herhaald, bij klachten eerder, een jaar lang. Indien er nog steeds een subklinische hyperthyreoïdie aanwezig is, voldoet een jaarlijkse controle met laboratoriumonderzoek.
Consultatie en verwijzing
Naar Samenvatting ›Verwijs naar internist(-endocrinoloog) voor mogelijke behandeling bij persisterend (na 3 maanden):
- TSH onder het referentiewaarde-interval en aanwezigheid atriumfibrilleren of osteoporose
- TSH onder het referentiewaarde-interval en positieve TSH-R-antistoffen
- TSH < 0,1 mU/L (zie detail Beloop subklinische hyperthyreoïdie)
Richtlijnen beleid bij zwelling of palpabele afwijkingen in de schildklier
Naar Samenvatting ›- Wanneer struma klachten veroorzaakt, is behandeling geïndiceerd.
- Volg als er ook schildklierfunctiestoornissen aanwezig zijn het beleid zoals beschreven bij de betreffende schildklierfunctiestoornis.
- Wanneer struma geen klachten veroorzaakt, instrueer patiënt om terug te komen bij klachten.
Voorlichting
Naar Samenvatting ›Een euthyreotisch multinodulair struma kan jarenlang onveranderd aanwezig zijn, het kan ook geleidelijk in grootte toenemen en door ontwikkeling van autonoom functionerende noduli een hyperthyreotisch multinodulair struma worden.
Controles
Naar Samenvatting ›- Controleer de patiënt met een (multinodulair) struma wanneer er klachten ontstaan of wanneer de zwelling toeneemt.
- Bespreek de klachten en palpeer de schildklier.
- Bepaal bij schildklierfunctieklachten of eerdere afwijkende waarden opnieuw het TSH.
- Voor informatie wanneer een echografie wel of niet is geïndiceerd, zie Echografie.
Consultatie en verwijzing
Naar Samenvatting ›- Verwijs patiënten met een solitaire nodus of multinodulair struma met een dominante nodus naar de internist(-endocrinoloog) voor nadere diagnostiek naar een eventuele maligniteit.
- Bij mechanische (globusgevoel) of cosmetische klachten verwijs naar de chirurg.
| Palpabele afwijking | Beleid |
|---|---|
| Solitaire nodus | Verwijzing naar internist(-endocrinoloog) |
| Diffuus struma | Behandeling bij klachten (zie betreffende functiestoornis of bij mechanische/cosmetische klachten verwijs naar de chirurg) |
| Multinodulair struma zonder dominante nodus | Behandeling bij klachten (zie betreffende functiestoornis of bij mechanische/cosmetische klachten verwijs naar de chirurg) |
| Multinodulair struma met dominante nodus | Verwijzing naar de internist(-endocrinoloog) |
Schildklieraandoeningen tijdens zwangerschap, zwangerschapswens en postpartumperiode
Naar Samenvatting ›Richtlijnen diagnostiek
Naar Samenvatting ›- Bepaal, bij vrouwen die bekend zijn met schildklierfunctiestoornissen, aan het begin van de zwangerschap TSH. Geef aan dat patiënte zwanger is. Laat bij een afwijkend TSH het fT4 bepalen (als het laboratorium dit niet al gedaan heeft).
- Volg het referentie-interval van het laboratorium.
- Bepaal geen TSH-R-antistoffen.
- Bepaal geen TPO-antistoffen.
- Als < 1 jaar na de bevalling hypo- of hyperthyreoïdie optreedt is de meest waarschijnlijke oorzaak postpartumthyreoïditis.
Volgens de richtlijnen van de American Thyroid Association wordt pragmatisch de TSH minus 0,5 mIU/L aangehouden voor zwangere patiënten. Ook is er door Nederlandse onderzoekers gekeken naar trimester specifieke referentie-intervallen in de zwangerschap.
Richtlijnen beleid
Naar Samenvatting ›Hypothyreoïdie
Naar Samenvatting ›- Wanneer hypothyreoïdie ontstaat tijdens de zwangerschap:
- overleg met de internist(-endocrinoloog) over de behandeling
- Wanneer patiënten met hypothyreoïdie vóór hun zwangerschap ook in de huisartsenpraktijk behandeld worden én goed zijn ingesteld:
- verhoog de dosis levothyroxine met circa 25-30% (dit kan ook door 2 keer per week een dubbele dosering te nemen) zodra een zwangerschap is aangetoond.
- controleer bij een zwangerschap iedere 4 weken het TSH tot de eerste helft van de zwangerschap, daarna iedere 6 weken.. Vaker controleren is niet zinvol. Het duurt 6 weken voor een steady state is bereikt met levothyroxine (6x halfwaardetijd). Na 4 weken is de snelle variant.
- Doseer vooral op geleide van het TSH, maar probeer een verhoogd fT4 te vermijden.
- Verwijs de patiënt naar de internist(-endocrinoloog) en de gynaecoloog indien het niet lukt om de patiënt goed in te stellen. Dat wil zeggen: als de patiënt na enkele dosiswijzigingen niet binnen het streefgebied komt.
- Bij patiënten met hypothyreoïdie in de postpartumperiode:
- verlaag direct na de bevalling de dosering levothyroxine naar de dosering van vóór de zwangerschap.
- controleer vervolgens na 6 weken het TSH en het fT4.
- levothyroxine kan veilig gebruikt worden tijdens lactatie.
Een behandeling met levothyroxine tijdens de zwangerschap is veilig en geeft geen bijwerkingen. Er zijn geen schadelijke effecten gezien bij moeder en kind. Het middel is gebruikt door veel zwangere patiënten. Levothyroxine passeert de placenta in geringe mate. Dat is nodig voor de ontwikkeling van de foetus. Schildklierfuncties moeten gedurende de zwangerschap vaker worden gecontroleerd en de dosering moet zo nodig worden aangepast (meestal verhoogd) (KNMP Kennisbank, geraadpleegd 28 september 2023) Alexander et al. beschrijven een onderzoek onder 20 zwangere patiënten met hypothyreoïdie. Bij 17 van hen moest de dosering levothyroxine in de eerste weken van de zwangerschap worden verhoogd. De gemiddelde dosisverhoging was uiteindelijk 48%. De onderzoekers geven als praktisch advies: zodra een zwangerschap is vastgesteld verhoogt de vrouw de dosering levothyroxine door 2 dagen per week een dagdosis extra in te nemen. Verdere aanpassing van de dosering gebeurt op basis van laboratoriumuitslagen. Direct na de bevalling konden alle patiënten weer de dosering levothyroxine gebruiken zoals zij dat deden voor de zwangerschap. Wiersinga noemt bij zwangere patiënten een gemiddelde verhoging van de dagdosis van 50 µg, met direct na de bevalling een verlaging naar de dosering van vóór de zwangerschap.
Levothyroxine kan worden gebruikt tijdens de zwangerschap en het geven van borstvoeding. Ervaring met levothyroxine tijdens het geven van borstvoeding is beperkt. Het gaat in kleine hoeveelheden over in de moedermelk. Het is niet waarschijnlijk dat dit effect heeft op de schildklier van een gezonde zuigeling (KNMP Kennisbank, geraadpleegd 28 september 2023).
Subklinische hypothyreoïdie
Naar Samenvatting ›- Bij vrouwen die voorafgaand aan de zwangerschap al bekend zijn met subklinische hypothyreoïdie:
- bepaal bij aanvang van de zwangerschap opnieuw het TSH en het fT4 als uitgangswaarde voor het verdere beleid
- als de concentraties binnen het referentie-interval vallen, volstaat eenmalige controle na 3 maanden
- indien het TSH buiten het referentie-interval valt: overleg met de internist(-endocrinoloog) over eventuele behandeling van de schildklier en overleg met de verloskundige over verwijzing naar de gynaecoloog
- Bij vrouwen die niet bekend zijn met subklinische hypothyreoïdie voorafgaand aan de zwangerschap en bij wie subklinische hypothyreoïdie tijdens de zwangerschap wordt ontdekt:
- overleg met de internist(-endocrinoloog) over de behandeling van de schildklier en overleg met de verloskundige over verwijzing naar de gynaecoloog
De behandeling met levothyroxine tijdens de zwangerschap is veilig en geeft geen bijwerkingen. Er zijn geen schadelijke effecten gezien bij moeder en kind. Het middel is gebruikt door veel zwangere vrouwen (KNMP Kennisbank, geraadpleegd 28 september 2023). De aanbeveling uit de NHG-Standaard sluit aan bij de NIV-richtlijn Schildklierfunctiestoornissen, module Subklinische hypothyreoïdie zwangerschap bij schildklierfunctiestoornissen.
Hyperthyreoïdie
Naar Samenvatting ›Verwijs patiënten met de ziekte van Graves in de voorgeschiedenis en een zwangerschap of zwangerschapswens naar de internist(-endocrinoloog) en de gynaecoloog.
Zowel de internist-endocrinoloog als de gynaecoloog zijn betrokken, de internist-endocrinoloog bepaalt het beleid over de behandeling van de schildklierfunctiestoornissen en de gynaecoloog over het beleid rondom bevalling, indicaties voor echo’s enzovoort.
Subklinische hyperthyreoïdie
Naar Samenvatting ›Verwijs patiënten met subklinische hyperthyreoïdie en een zwangerschap of zwangerschapswens naar de internist (-endocrinoloog) en de gynaecoloog.
Postpartumthyreoïditis
Naar Samenvatting ›- Controleer het TSH elke 6 weken.
- Staak de controle als de waarden 2 keer achter elkaar binnen het referentie-interval vallen.
- Suppletie is doorgaans niet nodig.
- Leg uit dat het risico op een permanente hypothyreoïdie verhoogd is en instrueer de patiënt contact op te nemen bij klachten.
- Bij langer dan 6 maanden persisterende hypo- of hyperthyreoïdie is er sprake van een andere onderliggende oorzaak dan postpartumthyreoïditis.
Referenties
- Cooper DS, Biondi B. Subclinical thyroid disease. Lancet 2012;379:1142-54.
- Surks MI, Ortiz E, Daniels GH, Sawin CT, Col NF, Cobin RH, et al. Subclinical thyroid disease: scientific review and guidelines for diagnosis and management. Jama 2004;291:228-38.
- Mathew V, Misgar RA, Ghosh S, Mukhopadhyay P, Roychowdhury P, Pandit K, et al. Myxedema coma: a new look into an old crisis. J Thyroid Res 2011;2011:493462.
- Longo DL, Kasper DL, Jameson JL, Fauci AS, Hauser SL, Loscalzo J. J. Harrison’s principles of internal medicine. 18 ed. New York: McGraw-Hill Medical Publishing Division, 2012.
- Drexhage HA. Immunologische aspecten van schildklierziekten. Schildklierziekten. Houten/Diemen: Bohn Stafleu Van Loghum 1998.
- Downs H, Meyer AA, Flake D, Solbrig R. Clinical inquiries: how useful are autoantibodies in diagnosing thyroid disorders? J Fam Pract 2008;57:615-6.
- McDermott MT. In the clinic. hypothyroidism. Ann Intern Med 2009;151:Itc61.
- Pearce EN, Farwell AP, Braverman LE. Thyroiditis. N Engl J Med 2003;348:2646-55.
- Van der Pump MP, Tunbridge WM, French JM, Appleton D, Bates D, Clark F, et al. The incidence of thyroid disorders in the community: a twenty-year follow-up of the whickham survey. Clin Endocrinol (Oxf) 1995;43:55-68.
- Huber G, Staub JJ, Meier C, Mitrache C, Guglielmetti M, Huber P, et al. Prospective study of the spontaneous course of subclinical hypothyroidism: prognostic value of thyrotropin, thyroid reserve, and thyroid antibodies. J Clin Endocrinol Metab 2002;87:3221-6.
- Soeters MR, Van Zeijl CJ, Boelen A, Kloos R, Saeed P, Vriesendorp TM, et al. Optimal management of Graves orbitopathy: a multidisciplinary approach. Neth J Med 2011;69:302-8.
- Bahn RS, Castro MR. Approach to the patient with nontoxic multinodular goiter. J Clin Endocrinol Metab 2011;96:1202-12.
- Peccin S, De Castsro JA, Furlanetto TW, Furtado AP, Brasil BA, Czepielewski MA. Ultrasonography: is it useful in the diagnosis of cancer in thyroid nodules? J Endocrinol Invest 2002;25:39-43.
- Consorti F, Anello A, Benvenuti C, Boncompagni A, Giovannone G, Moles N, et al. Clinical value of calcifications in thyroid carcinoma and multinodular goiter. Anticancer Res 2003;23:3089-92.
- Alexopoulou O, Beguin C, Buysschaert M, Squifflet JP, De Burbure C, De Nayer P, et al. Predictive factors of thyroid carcinoma in non-toxic multinodular goitre. Acta Clin Belg 2004;59:84-9.
- Cooper DS, Doherty GM, Haugen BR, Kloos RT, Lee SL, Mandel SJ, et al. Revised American Thyroid Association management guidelines for patients with thyroid nodules and differentiated thyroid cancer. Thyroid 2009;19:1167-214.
- Heins M, Bes J, Weesie Y, Davids R, Winckers M, Korteweg L, et al. Zorg door de huisarts. Nivel zorgregistraties eerste lijn: jaarcijfers 2021 en trendcijfers 2017-2021. 2022.
- Stocker DJ, Burch HB. Thyroid cancer yield in patients with Graves' disease. Minerva Endocrinol 2003;28:205-12.
- Pazaitou-Panayiotou K, Michalakis K, Paschke R. Thyroid cancer in patients with hyperthyroidism. Horm Metab Res 2012;44:255-62.
- Boelaert K, Newby PR, Simmonds MJ, Holder RL, Carr-Smith JD, Heward JM, et al. Prevalence and relative risk of other autoimmune diseases in subjects with autoimmune thyroid disease. Am J Med 2010;123:183.e1-9.
- Surks MI, Sievert R. Drugs and thyroid function. N Engl J Med 1995;333:1688-94.
- De Klerk S, Lansbergen G, Veneman TF, Borgsteede SD. Invloed van geneesmiddelen op schildklierwaarden. Schildklier en geneesmiddelen deel 1. Gebu 2021;55:95-9.
- De Smet PA, Stricker BH, Wilderink F, Wiersinga WM. Hyperthyreoidie tijdens gebruik van Kelp tabletten. Ned Tijdschr Geneeskd 1990;134:1058-9.
- Van der Heide D. Jodium en schildklierhormoon. Houten/Diegem: Bohn Stafleu Van Loghum, 1998.
- Kung AW, Yau CC, Cheng AC. The action of methimazole and L-thyroxine in radioiodine therapy: a prospective study on the incidence of hypothyroidism. Thyroid 1995;5:7-12.
- Nygaard B, Hegedüs L, Gervil M, Hjalgrim H, Hansen BM, Søe-Jensen P, et al. Influence of compensated radioiodine therapy on thyroid volume and incidence of hypothyroidism in Graves' disease. J Intern Med 1995;238:491-7.
- Tavintharan S, Sundram FX, Chew LS. Radioiodine (I-131) therapy and the incidence of hypothyroidism. Ann Acad Med Singap 1997;26:128-31.
- McDermott MT. Hyperthyroidism. Ann Intern Med 2012;157:Itc1-16.
- Gómez JM, Gómez N, Amat M, Biondo S, Rafecas A, Jaurrieta E, et al. Hypothyroidism after iodine-131 or surgical therapy for Graves' disease hyperthyroidism. Ann Endocrinol (Paris) 2000;61:184-91.
- Nademanee K, Singh BN, Callahan B, Hendrickson JA, Hershman JM. Amiodarone, thyroid hormone indexes, and altered thyroid function: long-term serial effects in patients with cardiac arrhythmias. Am J Cardiol 1986;58:981-6.
- Trip MD, Wiersinga W, Plomp TA. Incidence, predictability, and pathogenesis of amiodarone-induced thyreotoxicosis and hypothyroidism. Am J Med 1991;91:507-11.
- Bogazzi F, Bartalena L, Martino E. Approach to the patient with amiodarone-induced thyreotoxicosis. J Clin Endocrinol Metab 2010;95:2529-35.
- Perrild H, Hegedüs L, Baastrup PC, Kayser L, Kastberg S. Thyroid function and ultrasonically determined thyroid size in patients receiving long-term lithium treatment. Am J Psychiatry 1990;147:1518-21.
- Aronson JK. Meyler's side effects of drugs: the international encyclopedia of adverse drug reactions and interactions. 15 ed. Amsterdam: Elsevier, 2006.
- Burch HB. Drug effects on the thyroid. New England Journal of Medicine 2019;381:749-61.
- Haugen BR. Drugs that suppress TSH or cause central hypothyroidism. Best Pract Res Clin Endocrinol Metab 2009;23:793-800.
- Inaba H, Ariyasu H, Okuhira H, Yamamoto Y, Akamatsu H, Katsuda M, et al. Endocrine dysfunctions during treatment of immune-checkpoint inhibitors. Trends in Immunotherapy 2018;2.
- Kumpulainen EJ, Hirvikoski PP, Virtaniemi JA, Johansson RT, Simonen PM, Terävä MT, et al. Hypothyroidism after radiotherapy for laryngeal cancer. Radiother Oncol 2000;57:97-101.
- Mercado G, Adelstein DJ, Saxton JP, Secic M, Larto MA, Lavertu P. Hypothyroidism: a frequent event after radiotherapy and after radiotherapy with chemotherapy for patients with head and neck carcinoma. Cancer 2001;92:2892-7.
- Srikantia N, Rishi KS, Janaki MG, Bilimagga RS, Ponni A, Rajeev AG, et al. How common is hypothyroidism after external radiotherapy to neck in head and neck cancer patients? Indian J Med Paediatr Oncol 2011;32:143-8.
- Tell R, Lundell G, Nilsson B, Sjödin H, Lewin F, Lewensohn R. Long-term incidence of hypothyroidism after radiotherapy in patients with head-and-neck cancer. Int J Radiat Oncol Biol Phys 2004;60:395-400.
- Holm IA, Manson JE, Michels KB, Alexander EK, Willett WC, Utiger RD. Smoking and other lifestyle factors and the risk of Graves' hyperthyroidism. Arch Intern Med 2005;165:1606-11.
- Kimball LE, Kulinskaya E, Brown B, Johnston C, Farid NR. Does smoking increase relapse rates in Graves' disease? J Endocrinol Invest 2002;25:152-7.
- Stan MN, Bahn RS. Risk factors for development or deterioration of Graves' ophthalmopathy. Thyroid 2010;20:777-83.
- Díez JJ, Iglesias P. Spontaneous subclinical hypothyroidism in patients older than 55 years: an analysis of natural course and risk factors for the development of overt thyroid failure. J Clin Endocrinol Metab 2004;89:4890-7.
- Meyerovitch J, Rotman-Pikielny P, Sherf M, Battat E, Levy Y, Surks MI. Serum thyrotropin measurements in the community: five-year follow-up in a large network of primary care physicians. Arch Intern Med 2007;167:1533-8.
- Haentjens P, Van Meerhaeghe A, Poppe K, Velkeniers B. Subclinical thyroid dysfunction and mortality: an estimate of relative and absolute excess all-cause mortality based on time-to-event data from cohort studies. Eur J Endocrinol 2008;159:329-41.
- Ochs N, Auer R, Bauer DC, Nanchen D, Gussekloo J, Cornuz J, et al. Meta-analysis: subclinical thyroid dysfunction and the risk for coronary heart disease and mortality. Ann Intern Med 2008;148:832-45.
- Razvi S, Shakoor A, Van der Pump M, Weaver JU, Pearce SH. The influence of age on the relationship between subclinical hypothyroidism and ischemic heart disease: a metaanalysis. J Clin Endocrinol Metab 2008;93:2998-3007.
- Rodondi N, Den Elzen WP, Bauer DC, Cappola AR, Razvi S, Walsh JP, et al. Subclinical hypothyroidism and the risk of coronary heart disease and mortality. Jama 2010;304:1365-74.
- Völzke H, Schwahn C, Wallaschofski H, Dörr M. Review: The association of thyroid dysfunction with all-cause and circulatory mortality: is there a causal relationship? J Clin Endocrinol Metab 2007;92:2421-9.
- Lee JS, Buzková P, Fink HA, Vu J, Carbone L, Chen Z, et al. Subclinical thyroid dysfunction and incident hip fracture in older adults. Arch Intern Med 2010;170:1876-83.
- Rodondi N, Newman AB, Vittinghoff E, De Rekeneire N, Satterfield S, Harris TB, et al. Subclinical hypothyroidism and the risk of heart failure, other cardiovascular events, and death. Arch Intern Med 2005;165:2460-6.
- Rodondi N, Bauer DC, Cappola AR, Cornuz J, Robbins J, Fried LP, et al. Subclinical thyroid dysfunction, cardiac function, and the risk of heart failure. The cardiovascular health study. J Am Coll Cardiol 2008;52:1152-9.
- Ross DS, Burch HB, Cooper DS, Greenlee MC, Laurberg P, Maia AL, et al. 2016 American Thyroid Association Guidelines for diagnosis and management of hyperthyroidism and other causes of thyreotoxicosis. Thyroid 2016;26:1343-421.
- Biondi B, Bartalena L, Cooper DS, Hegedüs L, Laurberg P, Kahaly GJ. The 2015 European thyroid association guidelines on diagnosis and treatment of endogenous subclinical hyperthyroidism. Eur Thyroid J 2015;4:149-63.
- McCahon D, Haque MS, Parle J, Hobbs FR, Roberts LM. Subclinical thyroid dysfunction symptoms in older adults: cross-sectional study in UK primary care. Br J Gen Pract 2020;70:e208-e14.
- Vadiveloo T, Donnan PT, Cochrane L, Leese GP. The Thyroid Epidemiology, Audit, and Research Study (TEARS): the natural history of endogenous subclinical hyperthyroidism. J Clin Endocrinol Metab 2011b;96:E1-8.
- Díez JJ, Iglesias P. An analysis of the natural course of subclinical hyperthyroidism. Am J Med Sci 2009;337:225-32.
- Rosario PW. Natural history of subclinical hyperthyroidism in elderly patients with TSH between 0.1 and 0.4 mIU/L: a prospective study. Clin Endocrinol (Oxf) 2010;72:685-8.
- Poola R, Mathiason MA, Caplan RH. A retrospective study of the natural history of endogenous subclinical hyperthyroidism. WMJ 2011;110:277-80.
- Schouten BJ, Brownlie BE, Frampton CM, Turner JG. Subclinical thyreotoxicosis in an outpatient population – predictors of outcome. Clin Endocrinol (Oxf) 2011;74:257-61.
- Ursem SR, Boelen A, Bruinstroop E, Elders PJM, Gussekloo J, Poortvliet RKE, et al. A systematic review of subclinical hyperthyroidism guidelines: a remarkable range of recommendations. Eur Thyroid J 2024;13.
- Collet TH, Gussekloo J, Bauer DC, Den Elzen WP, Cappola AR, Balmer P, et al. Subclinical hyperthyroidism and the risk of coronary heart disease and mortality. Arch Intern Med 2012;172:799-809.
- Yang LB, Jiang DQ, Qi WB, Zhang T, Feng YL, Gao L, et al. Subclinical hyperthyroidism and the risk of cardiovascular events and all-cause mortality: an updated meta-analysis of cohort studies. Eur J Endocrinol 2012;167:75-84.
- Biondi B, Cooper DS. Subclinical Hyperthyroidism. N Engl J Med 2018;378:2411-9.
- Blum MR, Bauer DC, Collet TH, Fink HA, Cappola AR, da Costa BR, et al. Subclinical thyroid dysfunction and fracture risk: a meta-analysis. Jama 2015;313:2055-65.
- Abrahamsen B, Jørgensen HL, Laulund AS, Nybo M, Brix TH, Hegedüs L. Low serum thyrotropin level and duration of suppression as a predictor of major osteoporotic fractures-the OPENTHYRO register cohort. J Bone Miner Res 2014;29:2040-50.
- Svensson J, Ohlsson C, Karlsson MK, Lorentzon M, Lewerin C, Mellström D. Subclinical hyperthyroidism is associated with increased risk of vertebral fractures in older men. Osteoporos Int 2021;32:2257-65.
- Segna D, Bauer DC, Feller M, Schneider C, Fink HA, Aubert CE, et al. Association between subclinical thyroid dysfunction and change in bone mineral density in prospective cohorts. J Intern Med 2018;283:56-72.
- Mudde AH, Houben AJ, Nieuwenhuijzen Kruseman AC. Bone metabolism during anti-thyroid drug treatment of endogenous subclinical hyperthyroidism. Clin Endocrinol (Oxf) 1994;41:421-4.
- Faber J, Jensen IW, Petersen L, Nygaard B, Hegedüs L, Siersbaek-Nielsen K. Normalization of serum thyrotrophin by means of radioiodine treatment in subclinical hyperthyroidism: effect on bone loss in postmenopausal women. Clin Endocrinol (Oxf) 1998;48:285-90.
- Gencer B, Collet TH, Virgini V, Bauer DC, Gussekloo J, Cappola AR, et al. Subclinical thyroid dysfunction and the risk of heart failure events: an individual participant data analysis from 6 prospective cohorts. Circulation 2012;126:1040-9.
- Karlsson B, Gustafsson J, Hedov G, Ivarsson SA, Annerén G. Thyroid dysfunction in Down's syndrome: relation to age and thyroid autoimmunity. Arch Dis Child 1998;79:242-5.
- Rubello D, Pozzan GB, Casara D, Girelli ME, Boccato S, Rigon F, et al. Natural course of subclinical hypothyroidism in Down's syndrome: prospective study results and therapeutic considerations. J Endocrinol Invest 1995;18:35-40.
- Goday-Arno A, Cerda-Esteva M, Flores-Le-Roux JA, Chillaron-Jordan JJ, Corretger JM, Cano-Pérez JF. Hyperthyroidism in a population with Down syndrome (DS). Clin Endocrinol (Oxf) 2009;71:110-4.
- Abalovich M, Gutierrez S, Alcaraz G, Maccallini G, Garcia A, Levalle O. Overt and subclinical hypothyroidism complicating pregnancy. Thyroid 2002;12:63-8.
- Haddow JE, Palomaki GE, Allan WC, Williams JR, Knight GJ, Gagnon J, et al. Maternal thyroid deficiency during pregnancy and subsequent neuropsychological development of the child. N Engl J Med 1999;341:549-55.
- Van den Boogaard E, Vissenberg R, Land JA, Van Wely M, Van der Post JA, Goddijn M, et al. Significance of (sub)clinical thyroid dysfunction and thyroid autoimmunity before conception and in early pregnancy: a systematic review. Hum Reprod Update 2011;17:605-19.
- Pop VJ, De Rooy HA, Vader HL, Van der Heide D, Essed GG, De Geus CA. Voorkomen van postpartale schildklierfunctiestoornissen in Nederland. Ned Tijdschr Geneeskd 1992;136:917-21.
- Lucas A, Pizarro E, Granada ML, Salinas I, Foz M, Sanmarti A. Postpartum thyroiditis: epidemiology and clinical evolution in a nonselected population. Thyroid 2000;10:71-7.
- Shahbazian HB, Sarvghadi F, Azizi F. Prevalence and characteristics of postpartum thyroid dysfunction in Tehran. Eur J Endocrinol 2001;145:397-401.
- Othman S, Phillips DI, Parkes AB, Richards CJ, Harris B, Fung H, et al. A long-term follow-up of postpartum thyroiditis. Clin Endocrinol (Oxf) 1990;32:559-64.
- Premawardhana LD, Parkes AB, Ammari F, John R, Darke C, Adams H, et al. Postpartum thyroiditis and long-term thyroid status: prognostic influence of thyroid peroxidase antibodies and ultrasound echogenicity. J Clin Endocrinol Metab 2000;85:71-5.
- Wiersinga WM, E.P. K. Hyperthyroidie. Houten/Diegem: Bohn Stafleu Van Loghum, 1998.
- Canaris GJ, Steiner JF, Ridgway EC. Do traditional symptoms of hypothyroidism correlate with biochemical disease? J Gen Intern Med 1997;12:544-50.
- Zulewski H, Müller B, Exer P, Miserez AR, Staub J. Estimation of tissue hypothyroidism by a new clinical score: evaluation of patients with various grades of hypothyroidism and controls. J Clin Endocrinol Metab 1997;82:771-6.
- Indra R, Patil SS, Joshi R, Pai M, Kalantri SP. Accuracy of physical examination in the diagnosis of hypothyroidism: a cross-sectional, double-blind study. J Postgrad Med 2004;50:7-11; discussion
- Dupuits FM, Pop P, Hasman A, Schouten HJ. A rational request behavior: the development of prediction instruments regarding thyroid function tests in primary care. Methods Inf Med 1999;38:31-6.
- De Jongh TOH, Buis J, Daelmans HEM, Dekker MJHJ, De Jong E, Kramer WLM, et al. Fysische diagnostiek. Uitvoering en betekenis van het lichamelijk onderzoek: Bohn Stafleu van Loghum, 2010.
- Dirks NF, Den Elzen WPJ, Hillebrand JJ, Jansen HI, Boekel ET, Brinkman J, et al. Should we depend on reference intervals from manufacturer package inserts? Comparing TSH and FT4 reference intervals from four manufacturers with results from modern indirect methods and the direct method. Clin Chem Lab Med 2024;62:1352-61.
- Jansen HI, Dirks NF, Hillebrand JJ, Ten Boekel E, Brinkman JW, Buijs MM, et al. Age-specific reference intervals for thyroid-stimulating hormones and free thyroxine to optimize diagnosis of thyroid disease. Thyroid 2024.
- Hollowell JG, Staehling NW, Flanders WD, Hannon WH, Gunter EW, Spencer CA, et al. Serum TSH, T(4), and thyroid antibodies in the United States population (1988 to 1994): National Health and Nutrition Examination Survey (NHANES III). J Clin Endocrinol Metab 2002;87:489-99.
- Kratzsch J, Fiedler GM, Leichtle A, Brügel M, Buchbinder S, Otto L, et al. New reference intervals for thyrotropin and thyroid hormones based on National Academy of Clinical Biochemistry criteria and regular ultrasonography of the thyroid. Clin Chem 2005;51:1480-6.
- Hamilton TE, Davis S, Onstad L, Kopecky KJ. Thyrotropin levels in a population with no clinical, autoantibody, or ultrasonographic evidence of thyroid disease: implications for the diagnosis of subclinical hypothyroidism. J Clin Endocrinol Metab 2008;93:1224-30.
- Rege V, Mojiminiyi O, Wilcox H, Barron J. Comparison of Kodak Amerlite FT4 and TSH-30 with T4 and TSH as first-line thyroid function tests. Clin Biochem 1996;29:1-4.
- Wiersinga WM. Geneesmiddelen bij schildklieraandoeningen. Ned Tijdschr Geneeskd 1986;130:2163-6.
- Wiersinga WM. De interpretatie van de bepaling avn thyreoïdstimulerend hormoon (TSH) proefschrift. Ned Tijdschr Geneeskd 2003;147:1156-8.
- DHerbomez M, Forzy G, Gasser F, Massart C, Beaudonnet A, Sapin R. Clinical evaluation of nine free thyroxine assays: persistent problems in particular populations. Clin Chem Lab Med 2003;41:942-7.
- Franklyn JA, Boelaert K. Thyreotoxicosis. Lancet 2012;379:1155-66.
- Roberts CG, Ladenson PW. Hypothyroidism. Lancet 2004;363:793-803.
- Walsh JP, Ward LC, Burke V, Bhagat CI, Shiels L, Henley D, et al. Small changes in thyroxine dosage do not produce measurable changes in hypothyroid symptoms, well-being, or quality of life: results of a double-blind, randomized clinical trial. J Clin Endocrinol Metab 2006;91:2624-30.
- Boeving A, Paz-Filho G, Radominski RB, Graf H, Amaral de Carvalho G. Low-normal or high-normal thyrotropin target levels during treatment of hypothyroidism: a prospective, comparative study. Thyroid 2011;21:355-60.
- Flynn RW, Bonellie SR, Jung RT, MacDonald TM, Morris AD, Leese GP. Serum thyroid-stimulating hormone concentration and morbidity from cardiovascular disease and fractures in patients on long-term thyroxine therapy. J Clin Endocrinol Metab 2010;95:186-93.
- Heeringa J, Hoogendoorn EH, Van der Deure WM, Hofman A, Peeters RP, Hop WC, et al. High-normal thyroid function and risk of atrial fibrillation: the Rotterdam study. Arch Intern Med 2008;168:2219-24.
-
Wiersinga WM. Adult Hypothyroidism. In: Feingold KR, Anawalt B, Blackman MR, Boyce A, Chrousos G, Corpas E, et al., editors. Endotext. South Dartmouth (MA): MDText.com, Inc.
Copyright © 2000-2023, MDText.com, Inc.; 2000. - Pearce SH, Brabant G, Duntas LH, Monzani F, Peeters RP, Razvi S, et al. 2013 ETA Guideline: management of subclinical hypothyroidism. Eur Thyroid J 2013;2:215-28.
- Jonklaas J, Bianco AC, Bauer AJ, Burman KD, Cappola AR, Celi FS, et al. Guidelines for the treatment of hypothyroidism: prepared by the american thyroid association task force on thyroid hormone replacement. Thyroid 2014;24:1670-751.
- Nordqvist SF, Boesen VB, Rasmussen Å K, Feldt-Rasmussen U, Hegedüs L, Bonnema SJ, et al. Determining minimal important change for the thyroid-related quality of life questionnaire ThyPRO. Endocr Connect 2021;10:316-24.
- Slee P, HThJ., Wiltink EHH. Levothyroxine hoeft niet half uur voor ontbijt. Pharmaceutisch Weekblad 2005;140:1288-9.
- Skelin M, Lucijanić T, Amidžić Klarić D, Rešić A, Bakula M, Liberati-Čizmek AM, et al. Factors affecting gastrointestinal absorption of levothyroxine: a review. Clin Ther 2017;39:378-403.
- Bolk N, Visser TJ, Nijman J, Jongste IJ, Tijssen JG, Berghout A. Effects of evening versus morning levothyroxine intake: a randomized double-blind crossover trial. Arch Intern Med 2010;170:1996-2003.
- Cooper DS. Thyroid hormone, osteoporosis, and estrogen. Jama 1994;271:1283-4.
- Schneider DL, Barrett-Connor EL, Morton DJ. Thyroid hormone use and bone mineral density in elderly women. Effects of estrogen. Jama 1994;271:1245-9.
- Wekking EM, Appelhof BC, Fliers E, Schene AH, Huyser J, Tijssen JG, et al. Cognitive functioning and well-being in euthyroid patients on thyroxine replacement therapy for primary hypothyroidism. Eur J Endocrinol 2005;153:747-53.
- Saravanan P, Chau WF, Roberts N, Vedhara K, Greenwood R, Dayan CM. Psychological well-being in patients on 'adequate' doses of l-thyroxine: results of a large, controlled community-based questionnaire study. Clin Endocrinol (Oxf) 2002;57:577-85.
- Hennemann G. Hypothyreoïdie bij volwassenen. Houten/Diegem: Bohn Stafleu Van Loghum, 1998.
- Hall R, Besser M. Fundamentals of clinical endocrinology. Edinburgh: Churchill Livingstone, 1989.
- Canaris GJ, Manowitz NR, Mayor G, Ridgway EC. The Colorado thyroid disease prevalence study. Arch Intern Med 2000;160:526-34.
- Feller M, Snel M, Moutzouri E, Bauer DC, De Montmollin M, Aujesky D, et al. Association of thyroid hormone therapy with quality of life and thyroid-related symptoms in patients with subclinical hypothyroidism: a systematic review and meta-analysis. Jama 2018;320:1349-59.
- Zhao C, Wang Y, Xiao L, Li L. Effect of levothyroxine on older patients with subclinical hypothyroidism: a systematic review and meta-analysis. Front Endocrinol (Lausanne) 2022;13:913749.
- Mooijaart SP, Du Puy RS, Stott DJ, Kearney PM, Rodondi N, Westendorp RGJ, et al. Association between levothyroxine treatment and thyroid-related symptoms among adults aged 80 years and older with subclinical hypothyroidism. Jama 2019;322:1977-86.
- Mowafy M, Rushdy EA, Rakha M, Elshekheiby E, Soliman S. The impact of early levothyroxine replacement in subclinical hypothyroidism on glycemic control parameters and quality of life in adult patients. Open Access Macedonian Journal of Medical Sciences 2022;10:2098-103.
- Joosen AM, Van der Linden IJ, De Jong-Aarts N, Hermus MA, Ermens AA, De Groot MJ. TSH and fT4 during pregnancy: an observational study and a review of the literature. Clin Chem Lab Med 2016;54:1239-46.
- Briggs G. Drugs in pregnancy and lactation, for pda: a reference guide to fetal and neonatal risk: Lippincott Williams & Wilkins, 2005.
- Alexander EK, Marqusee E, Lawrence J, Jarolim P, Fischer GA, Larsen PR. Timing and magnitude of increases in levothyroxine requirements during pregnancy in women with hypothyroidism. N Engl J Med 2004;351:241-9.
- Wiersinga WM, Corssmit EP, Boer K, Prummel MF. Tijdige herkenning en behandeling van zwangeren met hypothyreoïdie: het belang voor het kind. Ned Tijdschr Geneeskd 2001;145:713-6.
- Van Buren HCS, Colijn CG, Eimermann VM, De Gier JJ, Neutkens SWG. Commentaren medicatiebewaking 2012/2013. Houten: Health Base, 2012.