Delier
Begrippen
Naar Volledige tekst ›Een delier kenmerkt zich door:
- een aandachts- en bewustzijnsstoornis;
- acuut begin (in uren tot dagen) en over de dag fluctuerende ernst van de symptomen;
- verandering in cognitie of waarnemingsstoornis (hallucinaties); soms ook (paranoïde) wanen.
De stoornis wordt veroorzaakt door een of meer lichamelijke ziekten, geneesmiddelenintoxicaties of onttrekking van medicatie of alcohol.
Richtlijnen diagnostiek
Naar Volledige tekst ›- Benader de patiënt rustig en empathisch; stel uzelf voor en leg uit wat u komt doen; spreek in korte, duidelijke zinnen; bestrijd angst door (open) te vragen naar de reden van de angst.
- Vraag de patiënt naar actuele lichamelijke klachten met korte, gesloten vragen.
- Verzamel aanvullende gegevens (zoals symptoomfluctuaties over de dag) via naasten.
Anamnese en heteroanamnese
Naar Volledige tekst ›Vraag voor het stellen van de diagnose delier naar:
- aard van de verschijnselen: zie kenmerken delier onder Begrippen;
- begin en beloop, fluctuatie van symptomen over de dag (aanwezigheid en ernst).
Vraag voor het opsporen van onderliggende oorzaken naar:
- verschijnselen van een infectie (koorts, hoesten, dyspneu, mictieklachten);
- reeds aanwezige neurologische, cardiale, respiratoire, metabole, endocriene aandoeningen;
- insufficiënte voeding en vochtinname;
- medicatie en zelfzorgmiddelen: type en dosering, recente wijzigingen (start, dosisverandering, staken medicatie), therapietrouw; beoordeel de medicatie desgewenst in overleg met apotheker;
- alcohol-, nicotine- of cannabisonttrekking;
- pijn, urineretentie, obstipatie, recent trauma, medische ingreep, anesthesie, immobiliteit;
- visus- en gehoorbeperking;
- slaaptekort.
Lichamelijk onderzoek
Naar Volledige tekst ›Verricht uitgebreid lichamelijk onderzoek, gericht op opsporing van onderliggende oorzaken:
- algemene indruk, tekenen van hypoxie, hydratietoestand;
- lichaamstemperatuur, bloeddruk, polsfrequentie, auscultatie hart en longen;
- buikonderzoek (wees alert op een overvulde blaas; katheteriseer eventueel);
- neurologische uitvalsverschijnselen;
- aanwijzingen voor uitwendig letsel, fractuur en factoren die pijn luxeren.
Aanvullend onderzoek
Naar Volledige tekst ›Onderzoek direct ‘aan het bed’: glucosespiegel, nitriettest, zuurstofsaturatie (bij dyspneu).
Breid dit, bij onvoldoende verklaring voor het delier, uit met:
- BSE of CRP, Hb, Ht, leukocyten, TSH;
- creatinine (eGFR-schatting), natrium, kalium, calcium (bij bedlegerige patiënten en botmetastasen);
- ALAT, γ-GT (versterking vermoeden overmatig alcoholgebruik);
- dipslide of urinesediment;
- op indicatie: gericht aanvullend onderzoek.
De uitgebreidheid van het onderzoek hangt in belangrijke mate af van het premorbide functioneren en de levensverwachting van de patiënt.
Evaluatie
Naar Volledige tekst ›Stel de diagnose delier bij aanwezigheid van de drie kenmerken genoemd onder Begrippen. Aanwijzingen dat de stoornis wordt veroorzaakt door een of meer lichamelijke ziekten, geneesmiddelenintoxicaties of onttrekking van medicatie of alcohol, ondersteunen de diagnose.
Differentieeldiagnostiek: vooral depressie, psychose en probleemgedrag bij dementie.
Richtlijnen beleid
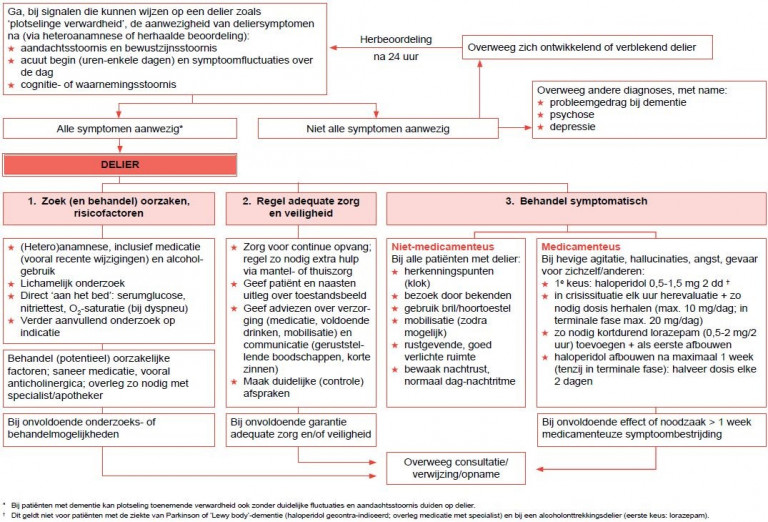
Naar Volledige tekst ›Zie ook stroomschema.
Behandeling van de oorzaken
Naar Volledige tekst ›- Beperk medicatie tot het noodzakelijke minimum en vermijd combinaties uit dezelfde medicijngroep.
- Voor behandeling van somatische oorzaken zie de betreffende NHG-Standaarden.
Regel adequate zorg en veiligheid
Naar Volledige tekst ›- Stel één van de betrokken hulpverleners aan als coördinator en aanspreekpunt.
- Noteer de gemaakte afspraken in een toegankelijk zorgdossier.
- Consulteer zo nodig een deskundige op het gebied van ouderenzorg of palliatieve zorg.
- Ondersteun de adviezen met schriftelijk materiaal (zie Thuisarts).
Medicamenteuze behandeling van deliersymptomen
Naar Volledige tekst ›- Overweeg symptoombehandeling alleen bij hevige motorische onrust, angst en/of hallucinaties.
- 1e keus haloperidol (maximaal 1 week) in laagste effectieve dosering; alleen bij blijvende onrust in combinatie met lorazepam (zie stroomschema).
- Bij de ziekte van Parkinson, ‘Lewy body’-dementie: geen haldol; overleg met specialist;
- Bij alcoholonttrekkingsdelier: lorazepam 1 tot 2 mg/2 uur oraal of parenteraal, op korte termijn aangevuld met vitamine B1-suppletie.
- Zie bij ernstige agitatie ook: hoofdstuk Ernstige agitatie uit de NHG-Behandelrichtlijn Geneesmiddelen en zuurstof in spoedeisende situaties.
Specifieke aandachtspunten bij een delier in de palliatieve fase
Naar Volledige tekst ›- Bij delier na verhoging morfinedosering: dosering verlagen of opioïdrotatie (fentanyl < > morfine).
- Bij middelen-/alcoholonttrekkingsdelier: herstart onttrokken middel zoals benzodiazepine, nicotinepleister.
- Zo nodig dosering haloperidol ophogen tot maximaal 20 mg/24 uur, zonder beperking gebruiksduur; eventueel in combinatie met lorazepam 1 tot 2 mg, zo nodig elke 6 uur; bij slikproblemen sublinguaal of parenteraal.
- Consulteer zo nodig een consulent palliatieve zorg en overweeg verzorging in een hospice.
Controle en verwijzing
Naar Volledige tekst ›Controles
Naar Volledige tekst ›- Controleer eerste dagen dagelijks op: beloop symptomen delier; beloop van onderliggende ziekte; complicaties (ondervoeding, dehydratie, vallen, urineretentie, decubitus, contracturen).
- Evalueer belasting mantelzorgers en (noodzaak van) aanvullende zorg.
- Pas de behandeling aan of verricht alsnog nadere diagnostiek indien het delier niet opklaart.
- Maak duidelijke afspraken met verzorgers (volgende bezoek, contact opnemen bij verslechtering toestand) en zorg voor een goede overdracht naar de huisartsenpost.
Consultatie en verwijzing
Naar Volledige tekst ›- Bij onvoldoende onderzoeks-, behandel- en verzorgingsmogelijkheden of veiligheid.
- Bij onvoldoende behandeleffect of noodzaak medicamenteuze behandeling > 1 week.
- Bij patiënten met de ziekte van Parkinson of ‘Lewy body’-dementie.
Overdracht na ontslag uit het ziekenhuis bij persisterende symptomen van delier
Naar Volledige tekst ›Overleg ter voorbereiding op ontslag met behandelend specialist (afbouwschema deliermedicatie, niet-medicamenteuze maatregelen, informatieverstrekking) en stem af met patiënt, mantelzorger en thuiszorg.
Nazorg en recidiefpreventie
Naar Volledige tekst ›- Bied patiënt en mantelzorgers aan het doorgemaakte delier te bespreken, met aandacht voor oorzaak, symptomen en emoties die het oproept; adviseer direct contact op te nemen bij vergelijkbare symptomen.
- Richt de zorg op beperking van risicofactoren en wees alert op een recidief bij een volgende ziekte-episode. Vermeld een doorgemaakt delier duidelijk in het dossier en bij ziekenhuisopnames.
Klik om te vergroten
Belangrijkste wijzigingen
Naar Samenvatting ›- Deze herziening behandelt, naast het delier bij ouderen, ook het delier in de palliatieve fase.
- Er is meer aandacht voor preventie van een delier. Dit betreft zowel de vroege herkenning van (prodromale) symptomen als maatregelen om een recidief te voorkomen.
- De standaard bespreekt aandachtspunten voor overdracht bij ontslag uit het ziekenhuis van patiënten met persisterende symptomen van een delier.
Kernboodschappen
Naar Samenvatting ›- Een delier is een ernstig, spoedeisend beeld dat wordt uitgelokt door 1 of meer somatische stoornissen; onderzoek naar en behandeling van de oorzaken staan centraal in de aanpak.
- Een delier kan voor patiënt en naasten/verzorgers een beangstigende ervaring zijn en leiden tot een (crisis)situatie waarin de omgeving op korte termijn om een oplossing vraagt, in het bijzonder bij ernstig zieke of zeer onrustige patiënten.
- Denk aan delier bij een bewustzijnsverandering met een aandachtsstoornis, incoherent denken of desoriëntatie, als dit beeld in korte tijd (uren tot dagen) is ontstaan en de ernst van de symptomen over het etmaal fluctueert.
- Patiënten met een cognitieve stoornis/dementie hebben een (sterk) verhoogde kans op een delier. Ook zonder aandachtsstoornis en duidelijke fluctuaties kan plotseling toenemende verwardheid bij hen duiden op een delier.
- Een goede heteroanamnese van verzorger(s) is essentieel voor herkenning van een delier, omdat de anamnese vanwege de wisselende toestand van de patiënt niet betrouwbaar is.
- De behandeling en preventie richten zich op beïnvloedbare factoren die een delier kunnen uitlokken, zoals medicatie, (sterke) ondervoeding, dehydratie, slaapdeprivatie, immobiliteit, visus- en gehoorbeperking.
- Indien medicamenteuze bestrijding van angst, achterdocht, hallucinaties of hevige motorische onrust is geïndiceerd, is haloperidol het middel van eerste keus, behalve bij patiënten met de ziekte van Parkinson of ‘Lewy body’-dementie.
- Belangrijke voorwaarden voor (thuis)behandeling van een patiënt met een delier zijn:
- een veilige omgeving, met continue aanwezigheid van verzorgers
- één van de betrokken hulpverleners (bij voorkeur wijkverpleegkundige of huisarts) is coördinator en aanspreekpunt
- Als voorbereiding op ontslag uit het ziekenhuis van een patiënt met nog aanwezige symptomen van een delier is transmuraal overleg tussen behandelend specialist en huisarts vereist, evenals afstemming met patiënt, mantelzorger en eventueel de thuiszorgorganisatie.
Inleiding
Naar Samenvatting ›Scope
Naar Samenvatting ›- Richtlijnen voor signalering van een delier en het diagnostisch en therapeutisch beleid bij een delier bij kwetsbare ouderen en bij patiënten in de palliatieve fase
- Preventie van een recidief delier bij ouderen en aandachtspunten voor het organiseren van adequate zorg, waarin veiligheid voor de patiënt en diens omgeving is gegarandeerd
Achtergronden
Naar Samenvatting ›Begrippen
Naar Samenvatting ›Delier
Naar Samenvatting ›- Een delier is een neuropsychiatrisch toestandsbeeld, dat zich kenmerkt door (zie Details):
- aandachtsstoornis (verminderd vermogen de aandacht ergens op te richten, vast te houden of te wisselen)
- bewustzijnsstoornis (gedaald bewustzijn of gedaald besef van de omgeving)
- acuut opgetreden verandering (in uren tot dagen)
- fluctuerende symptomatologie: de verschijnselen manifesteren zich in de avond en nacht doorgaans nadrukkelijker dan overdag
- een verandering in cognitie (zoals een geheugenstoornis, oriëntatiestoornis, taalstoornis) of het ontwikkelen van een waarnemingsstoornis (hallucinaties), die niet beter is te verklaren door pre-existente of zich ontwikkelende dementie
- mogelijke aanwezigheid van (paranoïde) wanen
- Een aanvullend diagnostisch criterium is dat, op grond van de anamnese, het lichamelijk onderzoek of de laboratoriumgegevens, het vermoeden bestaat dat 1 of meer lichamelijke ziekten, geneesmiddelenintoxicaties of onttrekking (dan wel wijziging) van medicatie of alcohol de stoornis veroorzaakt.
- Indien een kwetsbare oudere een beeld ontwikkelt met bovenstaande kenmerken is de kans dat het om een delier gaat groot, ook als er niet (direct) een afdoende verklaring wordt gevonden. Tevens kan een delier moeilijk te onderscheiden zijn van andere ziektebeelden, zoals dementie en depressie, en daar ook mee samengaan.
- Bij patiënten met een cognitieve stoornis/dementie kan plotseling toenemende verwardheid (ook zonder duidelijke fluctuaties en aandachtsstoornis) duiden op een delier.
- Er zijn verschillende psychomotorische verschijningsvormen van delier (zie Details): de onrustige/hyperactieve vorm, de apathische/hypoactieve vorm en de gemengde vorm. Dit onderscheid is vooral relevant voor het herkennen van een delier. Er is geen overtuigend bewijs dat het consequenties heeft voor de behandeling.
- Een delier wordt soms niet herkend, vooral de hypoactieve, apathische vorm (‘stil delier’), ook omdat de symptomen van een delier over de dag fluctueren (zie Details).
De deliercriteria zijn overgenomen uit de Diagnostic and Statistical Manuel of Mental Disorders fifth edition (DSM-V).
Het meeste onderzoek naar presentatie en verschijningsvormen van delier is gedaan onder geïnstitutionaliseerde patiënten. Er zijn geen gegevens over het voorkomen van de verschillende verschijningsvormen van delier in de eerste lijn. De Rooij et al. verrichtten een systematische review naar het voorkomen van de verschillende subtypes van delier in verschillende patiëntenpopulaties (> 65 jaar). Zij vonden 10 onderzoeken in diverse ziekenhuispopulaties met allemaal een eigen deliersubtypedefinitie en -indeling, waarbij een onderverdeling op grond van psychomotore kenmerken het meest bruikbaar en reproduceerbaar lijkt te zijn. Op grond hiervan vonden zij de volgende verdeling: hyperactief delier 15 tot 30% (op psychogeriatrische afdelingen 50 tot 80%), hypoactief delier 19 tot 73% en delier van het gemengde type 42 tot 52%. Er is werd geen duidelijke relatie gevonden tussen deliersubtype en etiologie.
Herhaaldelijke beoordeling van 100 opeenvolgende volwassenen met een delier in de palliatieve fase liet zien dat het subtype bij 62% van de patiënten constant bleef gedurende de delierepisode.
Een onderzoek onder 784 arts-assistenten in 34 ziekenhuizen in het Verenigd Koninkrijk, die gemiddeld 30 maanden waren afgestudeerd, liet zien dat deze artsen de ernst en behandelbaarheid van delier goed inschatten, maar toonde ook een grote spreiding in kennis over de prevalentie, prognose, diagnostische criteria en aanbevolen startdosering van haloperidol. Van de deelnemers was 16% van mening dat ze voldoende delierscholing hadden gehad, 21% vond dat ze de diagnostische criteria goed kenden en 30% voelde zich vertrouwd met de behandeling. De eigen rapportage over de kennis van de diagnostische criteria van delier was opvallend slechter dan die over andere veel voorkomende acute aandoeningen (95% voor pneumonie, 90% voor het acuut coronair syndroom en 77% voor pancreatitis). De arts-assistenten met specifieke geriatrische ervaring (n = 399, 51%) voelden zich meer vertrouwd met de diagnostische criteria van delier (28% versus 14%, p < 0,001), rapporteerden een betere delier-scholing (24% versus 9%, p < 0,001) en waren vaker op de hoogte van de aanbevolen startdosering haloperidol (42% versus 31%, p < 0,001) dan degenen die deze ervaring niet hadden. De vragen die betrekking hadden op de diagnostische kennis van delier werden door hen echter niet beter beantwoord.
In een retrospectief onderzoek van de dossiers van 525 patiënten die door de huisarts of een ziekenhuisspecialist waren verwezen voor psychiatrische consultatie bleken 100 patiënten een delier te hebben. Slechts 36 patiënten waren verwezen met de diagnose delier/verwardheid; de overige patiënten waren verwezen in verband met depressie (33%), middelenafhankelijkheid (22%), algemeen psychiatrische evaluatie (18%), suïcidaliteit (14%), psychose (8%), angst (5%), agitatie (5%), beoordeling van toerekeningsvatbaarheid (5%), gedragsproblemen (3%) en somatisatie (2%). Een verwijsdiagnose anders dan delier was waarschijnlijker bij jongere patiënten.
Onrustige/hyperactieve vorm
Naar Samenvatting ›- Deze vorm kenmerkt zich door:
- motorische onrust en agitatie (aan de dekens plukken, doelloos bewegen of ronddwalen, uit bed willen klimmen)
- verminderde controle (niet stil kunnen zitten/liggen als de situatie dat vergt)
- rusteloosheid (klachten over mentale rusteloosheid of agitatie)
- roepen, schelden en afweren van verzorgers
- vaak hyperalertheid
- Meestal zoeken de verzorgers bij een hyperactief delier snel hulp, omdat de verzorging als moeilijk wordt ervaren.
Apathische/hypoactieve vorm (‘stil delier’)
Naar Samenvatting ›- Deze vorm kenmerkt zich door:
- bewegingsarmoede (afname van spontane bewegingen, trager op gang komen en uitvoeren van activiteiten)
- verminderde interactie met de omgeving
- minder en langzamer spreken
- verminderd bewustzijn van de omgeving (passief, onverschillig reagerend
- apathisch of zich terugtrekkend gedrag
- verminderde aandacht
- Een apathisch-delirante patiënt wordt doorgaans als een gemakkelijke patiënt ervaren, waardoor het beeld vaak laat of niet als delier wordt herkend en nogal eens wordt verward met depressie of dementie.
Gemengde vorm
Naar Samenvatting ›- Deze vorm kenmerkt zich door: afwisselend hyper- en hypoactief zijn
- Deze vorm komt bij ouderen veel voor.
Epidemiologie en prognose
Naar Samenvatting ›- De prevalentie van delier onder ouderen > 65 jaar in de algemene bevolking varieert van 1,8-2,3%. In onderzoek naar delier onder bewoners in Nederlandse verzorgingshuizen werd een incidentie van 14,6 per 100 persoonsjaren en een prevalentie van 8,2% gevonden.
- Over het voorkomen van delier in de huisartsenpraktijk zijn slechts beperkt cijfers beschikbaar (zie Details).
- Hoewel delier als een reversibel beeld wordt beschouwd, blijkt uit onderzoek dat ouderen die een delier doormaakten tijdens een ziekenhuisopname een ongunstige prognose hebben met betrekking tot volledig herstel, levensverwachting, opnames in zorginstellingen en cognitieve achteruitgang (zie Details).
- Van patiënten ≥ 50 jaar die tijdens ziekenhuisopname een delier doormaakten had 45% bij ontslag nog symptomen; 3 maanden na ontslag was dat nog 26% (zie Details).
- Het risico op langdurig persisterende symptomen is hoger bij patiënten met comorbiditeit (zoals dementie), een ernstig delier en een hypoactief delier (zie Details).
Huisartsregistratie
Het delier heeft geen specifiekere ICPC-code dan P71 ‘andere organische psychosen’, wat de registratie bemoeilijkt. In TransHis, een Nederlands huisartsregistratiesysteem met een bestand van ongeveer 16.000 patiënten, is delier wel als een aparte diagnose vastgelegd. Over de periode 01-01-2009 t/m 31-12-2012 registreerden de huisartsen voor de verschillende subcodes als volgt (tussen haakjes bij elke subcode de niet-leeftijdgespecificeerde aantallen en de prevalentie per 1000 patiënten): F04 organisch amnestisch syndroom, niet geïnduceerd door alcohol of andere psychoactieve middelen (n = 17; 0,27/1000); F05 delier, niet geïnduceerd door alcohol of andere psychoactieve middelen (n = 2; 0,03/1000); F05.0 delier, niet gesuperponeerd op bestaande dementie (n = 9; 0,14/1000); F05.1 delier gesuperponeerd op bestaande dementie (n = 3; 0,05/1000); F05.8 ander delier (n = 5; 0,08/1000) en F05.9 delier, niet nader gespecificeerd (n = 17; 0,33/1000). Het totale prevalentiecijfer is ongeveer 0.9 per 1000 patiënten.
Leeftijdsspecifieke gegevens zijn bekend over de periode 1995 t/m 2008. Over die periode was de incidentie voor 65- tot 74-jarigen 0,9/1000 per jaar en onder ouderen vanaf 75 jaar 4,9/1000 per jaar. De prevalentie was in deze leeftijdscategorieën respectievelijk 1,7/1000 en 7,6/1000.
Als kanttekening kan worden gesteld dat deze cijfers mogelijk de werkelijke incidentie en prevalentie onderschatten. Het is namelijk de vraag of het delier binnen TransHis altijd als aparte code is geregistreerd of dat het gekoppeld is aan de aandoening die het delier veroorzaakt (waarbij het delier dus niet is terug te vinden in bovenstaande cijfers)
Onderzoek
De Lange et al. verrichtten een review naar de prevalentie van delier onder ouderen vanaf 65 jaar in de algemene bevolking en in zorginstellingen. In de 8 onderzoeken in de algemene bevolking liep de prevalentie uiteen van 0,5 tot 34%. De prevalentie nam toe met de leeftijd, de observatieduur en als er ook dementerende patiënten waren geïncludeerd. Prevalentiecijfers uit onderzoeken onder ouderen vanaf 65 jaar (inclusief dementerende ouderen) die geen extra zorg ontvingen, variëren van 1,75 tot 2,3%.
In een dwarsdoorsnedeonderzoek in de Verenigde Staten onder 30 zelfstandig wonende ouderen (> 65 jaar) die een dagopvang bezochten, hadden 2 ouderen (6,7%) een delier volgens een korte, gevalideerde versie van de Confusion Assessment Method (CAM-ICU). De meerderheid van deze (selecte) groep ouderen had een of meer chronische aandoeningen, zoals artrose (83%), hypertensie (77%), diabetes mellitus (60%), hart- en vaatziekten (40%), CVA (40%), recidiverende urineweginfecties (27%) en de ziekte van Alzheimer (13%).
Boorsma-Meerman et al. deden onderzoek naar het voorkomen van delier onder bewoners in 23 verzorgingshuizen (n = 1365) en 6 verpleeghuizen (n = 828). Delier was in dit onderzoek gedefinieerd als een positieve score op de Nursing Home Confusion Assessment Method (NH-CAM). In dit onderzoek was de incidentie van delier in verzorgingshuizen 14,6 per 100 persoonsjaren en in verpleeghuizen 20,7 per 100 persoonsjaren. De prevalentie van delier was in de verzorgingshuizen 8,2% en in verpleeghuizen 8,9%.
Witlox et al. verrichtten een meta-analyse van observationele onderzoeken, gepubliceerd in de periode 1981 tot 2010, naar de associatie tussen delier bij opgenomen ouderen (gemiddelde of mediane leeftijd = 65 jaar) en de langetermijnprognose met betrekking tot mortaliteit, opname in een zorginstelling of dementie. Zij includeerden 51 onderzoeken met een minimale follow-up van 3 maanden. In de primaire analyse includeerden zij alleen de onderzoeken met een hoge methodologische kwaliteit, waarin statistisch was gecorrigeerd voor een aantal belangrijke beïnvloedende factoren: leeftijd, geslacht, comorbiditeit, ziekte-ernst en dementie bij aanvang van het onderzoek. Op grond van 7 onderzoeken (n = 2957) met een gemiddelde follow-up van 22,7 maanden blijkt dat delier het risico op overlijden verhoogt: van de patiënten die een delier hadden gehad overleed 38% tegenover 27,5% van de patiënten zonder doorgemaakt delier (HR 1,95; 95%-BI 1,51 tot 2,52). Uit 7 onderzoeken (n = 2579, gemiddelde follow-upduur van 14,6 maanden) bleek dat een delier ook een risicofactor is voor opname in een zorginstelling: van de patiënten die een delier hadden gehad werd 33,4% opgenomen in een zorginstelling tegenover 10,7% van degenen zonder delier (OR 2,41; 95%-BI 1,77 tot 3,29). Tot slot bleek uit 2 onderzoeken (n = 241, gemiddelde follow-upduur van 4,1 jaar) dat een doorgemaakt delier gepaard gaat met een verhoogde kans op de ontwikkeling van dementie: van de patiënten die een delier hadden gehad was bij follow-up 62,5% dement tegenover 8,1% van de patiënten zonder delier (OR 12,52; 95%-BI 1,86 tot 84,21). Ook De Lange et al. vonden in hun literatuuroverzicht van onderzoek in de eerste lijn dat ouderen na het doormaken van een delier een verhoogd risico hadden op het ontwikkelen van dementie en een kortere overlevingsduur. Fong et al. deden een cohortonderzoek: binnen een groep ouderen met de ziekte van Alzheimer vergeleken zij de cognitieve achteruitgang van degenen die een delier doormaakten (n = 72) met degenen zonder delier (n = 336). Na correctie voor leeftijd, geslacht, opleidingsniveau, comorbiditeit, familiegeschiedenis voor dementie en dementie ernst-score, bleek er een significant snellere cognitieve achteruituitgang op te treden na het doormaken van een delier.
Kat et al. onderzochten de mortaliteit, geassocieerd met delier, onder ouderen (n = 603, gemiddelde leeftijd 80 jaar) na heupchirurgie met een follow-up van 2 jaar. De mortaliteit onder de ouderen die een delier hadden ontwikkeld (29/74 = 39%) was duidelijk hoger dan de mortaliteit in de totale groep (90/603 = 15%). De verhoogde mortaliteit lijkt echter vooral samen te hangen met (de ernst van) onderliggende aandoeningen: van de patiënten die een delier hadden (n = 74), waren bij opname 27 ouderen ernstig ziek, van wie 14 patiënten gedurende de follow-up overleden; van de 47 niet-ernstig zieke ouderen overleden er 15 (RR 1,63; 95%-BI 0,93 tot 2,38).
Conclusie
Delier bij ouderen lijkt geassocieerd te zijn met een verhoogd risico op overlijden, opname in een zorginstelling en dementie. Verder zijn er aanwijzingen voor een snellere cognitieve achteruitgang na een delier bij patiënten bij de ziekte van Alzheimer.
Cole et al. verrichtten een systematische review om de prognose van een delier in het ziekenhuis te achterhalen. Zij includeerden 18 onderzoeken met in totaal 1322 patiënten van 50 jaar en ouder met een delier.
Het percentage patiënten met nog persisterende symptomen van een delier bij ontslag, en na 1, 3 en 6 maanden na ontslag was respectievelijk 45% (95%-BI 27 tot 64%), 33% (95%-BI 18 tot 47%), 26% (95%-BI 8 tot 43%) en 21% (95%-BI 1 tot 41%). Op de uitkomsten mortaliteit, verpleeghuisopname, functie en cognitie scoorden patiënten met een bij ontslag nog persisterend delier consistent slechter dan patiënten die tijdens ziekenhuisopname waren hersteld van hun delier.
Het delier kan een chronisch beloop hebben als de onderliggende aandoening ernstig en irreversibel is (zoals terminaal hartfalen of COPD) of de cognitieve restfunctie gering is.
In een observationeel cohortonderzoek onder 432 in een ziekenhuis opgenomen patiënten ouder dan 65 jaar werden de presentatie, het beloop en de duur van delier onderzocht. Alle patiënten werden dagelijks gescreend op verwardheid aan de hand van de DSM-III-R-criteria. Ongeveer 15% van de patiënten maakte een delier door; bij 69% van hen waren de symptomen slechts een dag aanwezig. Bij de groep patiënten met een meerdere dagen durend delier bestond meer comorbiditeit.
In een prospectief onderzoek werden 193 patiënten van 65 jaar en ouder (van wie 136 met dementie), die in het ziekenhuis werden opgenomen met een delier of dit tijdens de eerste week na opname ontwikkelden, 12 maanden gevolgd vanaf ontslag uit het ziekenhuis. Patiënten met dementie hadden op alle meetmomenten een gemiddeld hoger aantal symptomen van een delier dan patiënten zonder dementie (bij diagnose 4,5 versus 3,4; na 12 maanden 3,5 versus 2,2). Na 6 maanden was delier nog aanwezig bij 38,5% van de ouderen met dementie en bij 9% van de ouderen zonder dementie; na 12 maanden was dit het geval bij 49% respectievelijk 15%. Het meest persisterend waren: gestoorde aandacht, desoriëntatie en geheugenstoornis. Bij de 12-maandsmeting was 31% van de patiënten overleden.
Dasgupta et al. verrichtten een systematische review om te achterhalen welke factoren samenhangen met langer durende symptomen van delier. Op grond van 21 onderzoeken in verschillende medische settings met een follow-up tot 6 maanden na aanvang van het delier vonden zij dat symptomen van delier bij ontslag uit het ziekenhuis nog vaak aanwezig zijn en dat, uit een veelheid van mogelijke factoren, een langere duur van symptomen samenhangt met: reeds bestaande dementie (gebaseerd op 6 onderzoeken: OR 1,8 tot 8,4), een toenemend aantal comorbide aandoeningen, ernstiger symptomen van een delier (gebaseerd op 3 onderzoeken: OR 5,0 tot 6,7), een hypoactief delier (gebaseerd op 5 onderzoeken: OR 1,5 tot 11,3) en hypoxie bij patiënten met kanker (gebaseerd op 3 onderzoeken: OR of HR voor het opklaren van delier 0,2 tot 0,4).
Etiologie en pathofysiologie
Naar Samenvatting ›- Een delier is een uiting van een acute, diffuse cerebrale ontregeling met complexe pathofysiologie.
- De leidende hypothese is dat een disbalans in het cholinerge-dopaminerge systeem een centrale rol speelt, met een (relatief) tekort aan acetylcholine (zie Details).
- Met het ouder worden treden geleidelijk veranderingen in het lichaam op, waarbij de lichamelijke en geestelijke reservecapaciteit en draagkracht afnemen en de vatbaarheid voor een delier toeneemt. Alle ernstige somatische stressoren kunnen bij daarvoor gevoelige personen een delier uitlokken.
- Vaak ontstaat een delier in aanwezigheid van verschillende predisponerende en uitlokkende factoren. Bij een opeenstapeling van factoren en het tekortschieten van compensatiemechanismen, kan een relatief geringe prikkel al aanleiding zijn voor het ontstaan van een delier.
- Binnen de geriatrie wordt het delier gerekend tot de ‘geriatrische syndromen’, die multifactorieel bepaald zijn en waarbij de aanpak bestaat uit zoeken naar en behandelen van etiologisch gerelateerde aandoeningen en inventarisatie en zo mogelijk verminderen van de risicofactoren (zie Details).
In het bijzonder functionele veranderingen in de cholinerge neurotransmissie, die gerelateerd zijn aan leeftijd en cognitieve achteruitgang, lijken verantwoordelijk voor de verhoogde kwetsbaarheid van ouderen om een delier te ontwikkelen. Ook pro-inflammatoire cytokines (die een rol spelen bij infecties en traumata), cortisol (geassocieerd met acute stress) en directe neuronale beschadiging (bijvoorbeeld als gevolg van hypoxie, hypoglykemie, metabole stoornissen) lijken een rol te kunnen spelen bij het ontstaan van een delier.
De huidige pathofysiologische kennis biedt vooralsnog geen aanknopingspunten voor diagnostiek en behandeling.
De term ‘geriatrisch syndroom’ wordt (in de literatuur) gebruikt voor diverse veelvoorkomende symptomatologie bij ouderen, zoals delier, instabiliteit/vallen, incontinentie, verminderde cognitie en kwetsbaarheid. In tegenstelling tot het klassieke syndroomconcept (een specifieke combinatie van symptomen met één pathogenetisch verklaringsmodel) gaat het bij deze syndromen vaak om één bepaald symptoom of symptoomcomplex met hoge prevalentie op hogere leeftijd, veroorzaakt door verschillende aandoeningen en risicofactoren (multifactorieel verklaringsmodel). De aanpak bestaat dan ook uit zoeken naar en behandeling van etiologisch gerelateerde aandoeningen en inventarisatie en zo mogelijk vermindering van de risicofactoren.
Niet-beïnvloedbare risicofactoren
Naar Samenvatting ›Predisponerende, niet-beïnvloedbare factoren, die bijdragen aan een verhoogde kwetsbaarheid voor het ontstaan van een delier, zijn (zie ook Potentieel beïnvloedbare risicofactoren):
- dementie of andere cognitieve stoornis
- hoge leeftijd
- eerder doorgemaakt delier
- ernstige (multi)morbiditeit
Potentieel beïnvloedbare risicofactoren
Naar Samenvatting ›Diverse potentieel beïnvloedbare factoren kunnen bijdragen aan het uitlokken van een delier, zoals (zie Details):
- infectie, zoals een urineweginfectie en pneumonie
- metabole ontregeling, zoals:
- hyponatriëmie (bijvoorbeeld bij diuretica, SSRI’s, venlafaxine, NSAID’s, carbamazepine)
- hyper- of hypoglykemie
- hypercalciëmie
- ondervoeding
- dehydratie
- alcoholmisbruik
- alcohol-, nicotine- of cannabisonttrekking
- medicatie (zie kader Geneesmiddelen met verhoogd risico op delier), medicatiewijziging of -onttrekking, polyfarmacie (in het bijzonder bij cumulatie van anticholinerge effecten)
- cerebrale pathologie:
- CVA
- intracraniële bloeding
- hersentumor/metastase
- meningitis (carcinomatosa)
- pijn
- urineretentie of obstipatie
- acuut trauma, met name een fractuur, operatie
- immobiliteit, mobiliteitsbeperkende maatregelen, katheter
- verminderde oriëntatie door gehoor- en/of visusbeperking
- slaaptekort
- omgevingsverandering (bijvoorbeeld ziekenhuis- of dagopname)
Vrijwel alle lichamelijk en psychisch belastende factoren kunnen een delier uitlokken, zoals infecties, neurologische, cardiale, respiratoire, metabole en endocriene ziekten, iatrogene schade, acute traumata, operaties, anesthetica, polyfarmacie, medicatie- en alcoholonttrekking, vrijheidsbeperkende maatregelen en de introductie van een blaaskatheter.
In een Fins beschrijvend onderzoek onder 87 opeenvolgende patiënten = 70 jaar (gemiddelde leeftijd 84 jaar) die met een delier werden opgenomen op een interne afdeling werd nagegaan welke predisponerende en potentieel uitlokkende factoren aanwezig waren. De meestvoorkomende factoren waren: infecties (69% had een of meerdere infecties, vooral urineweginfecties en luchtweginfecties); metabole stoornissen (44% had een endocriene stoornis, 14% ernstige ondervoeding en 13% ernstige anemie); bijwerkingen van medicatie (42%; 17% gebruikte tramadol of codeïne); cardiovasculaire aandoeningen (40%; 13% had een CVA of TIA, 8% een aritmie, 8% een acuut myocardinfarct en 7% hartfalen). Er kwamen, bij de uitgebreide diagnostiek die in dit onderzoek werd verricht, vaker zeldzame aandoeningen (zoals een buikabces, ziekte van Addison, hypercalciëmie) aan het licht dan de onderzoekers hadden verwacht. De onderzoekers vermoeden dat dergelijke aandoeningen vaak over het hoofd worden gezien, als te snel wordt gedacht dat bij het vinden van bijvoorbeeld een urineweginfectie dit de enige oorzaak van een delier is. De patiënten in dit onderzoek hadden gemiddeld 5 predisponerende factoren en 3 potentieel uitlokkende factoren, dus gemiddeld 8 risicofactoren per persoon. Deze accumulatie en synergie van risicofactoren draagt waarschijnlijk in hoge mate bij aan de kwetsbaarheid voor delier; de direct uitlokkende factor kan dan een relatief klein probleem zijn.
In een cohortonderzoek onder bewoners van 23 Nederlandse verzorgingshuizen (n = 1365) vond Boorsma-Meerman met multivariate analyse dementie (OR 1,8; 95%-BI 1,31 tot 2,55) en valincidenten (OR 1,7; 95%-BI 1,20 tot 2,48) als risicofactoren voor het ontwikkelen van een delier. Op vergelijkbare wijze werden in 6 Nederlandse verpleeghuizen (n = 828) de volgende risicofactoren gevonden: mobiliteitsbeperking (OR 2,3; 95%-BI 1,27 tot 4,28), dementie (OR 3,3; 95%-BI 2,03 tot 5,24) en de ziekte van Parkinson (OR 2,3; 95%-BI 0,96 tot 5,63).
In een onderzoek onder 504 vrouwen van 85 jaar en ouder, van wie 53% zelfstandig wonend in een stedelijk gebied in Zweden en een plattelandsgemeenschap in Finland, werd onderzocht welke factoren samenhingen met het optreden van een delier (met als primaire doel na te gaan of een urineweginfectie geassocieerd was met het optreden van een delier). De deelneemsters werden uitgebreid geïnterviewd en onderzocht, waarbij werd nagegaan of er sprake was (geweest) van een delier (in de afgelopen maand). Na multivariate logistische regressieanalyse bleken de volgende factoren onafhankelijk geassocieerd met een delier: de ziekte van Alzheimer (OR 5,8; 95%-BI 3,5 tot 9,5), multi-infarct dementie (OR 5,4; 95%-BI 3,0 tot 9,8), depressie (OR 3,1; 95%-BI 2,0 tot 5,0), hartfalen (OR 2,3; 95%-BI 1,4 tot 3,7) en een urineweginfectie (OR 1,9; 95%-BI 1,1 tot 3,3). Van de 87 (17%) vrouwen in dit onderzoek met een urineweginfectie hadden 39 (45%) vrouwen een delier of een delier gehad in de voorafgaande maand; van de 137 (27%) vrouwen met een delier hadden 39 (28,5%) een urineweginfectie.
De Lange et al. concluderen in hun literatuurreview dat er overeenstemming is dat het risico op een delier in belangrijke mate toeneemt met leeftijd en cognitieve achteruitgang. In de enkele onderzoeken naar de meestvoorkomende oorzaken van delier in de eerste lijn lijken infecties (urineweginfecties en pneumonieën) op de eerste plaats te komen.
In de NICE-richtlijn Delirium is de literatuur over risicofactoren samengevat. Het betrof 32 prospectieve cohortonderzoeken, 3 dwarsdoorsnedeonderzoeken en 3 retrospectieve onderzoeken, die allemaal alleen betrekking hebben op ziekenhuispopulaties, onder patiënten met een gemiddelde leeftijd van 52 tot 87 jaar. NICE maakt hierbij onderscheid tussen beïnvloedbare factoren (zoals medicatie) en niet-beïnvloedbare factoren (zoals geslacht) en tussen patiëntkenmerken (zoals leeftijd en geslacht) en omgevingsfactoren (zoals aard van de afdeling en lichtcondities) of procedures (zoals type operatie, katheter). Samenvattend identificeert NICE de volgende (vooral niet-beïnvloedbare) risicofactoren voor delier:
- leeftijd met een grensleeftijd van 65 jaar, waarbij aangenomen mag worden dat boven deze leeftijd het risico geleidelijk toeneemt;
- cognitieve stoornis, in het bijzonder dementie;
- recente heupfractuur;
- ernstige ziekte, gedefinieerd als een klinische toestand die aan verslechtering onderhevig is dan wel op korte termijn kan verslechteren.
Conclusie
Het risico op een delier neemt in belangrijke mate toe met leeftijd en cognitieve achteruitgang. Veelvoorkomende oorzaken en/of precipiterende factoren van delier zijn infecties (urineweginfecties, pneumonieën) en valincidenten/fracturen.
Risicofactoren in de palliatieve fase
Naar Samenvatting ›In de palliatieve fase leiden de volgende factoren vaak tot een delier:
- gebruik van morfinepreparaten (verhoogd risico op cumulatie van morfinemetabolieten bij verminderde nierfunctie in combinatie met uitdroging)
- plotseling staken van medicatie, met name langdurig gebruikte benzodiazepinen en antidepressiva (met name de middelen met een korte halfwaardetijd, zie NHG-Standaard Depressie), alcohol of nicotine
- metabole stoornissen, zoals hypercalciëmie als gevolg van botmetastasen (vooral problematisch in combinatie met dehydratie)
- hersentumor of -metastasen
- meningitis carcinomatosa
- dehydratie
- anemie
- hypoxie
Geneesmiddelen met verhoogd risico op delier
Naar Samenvatting ›Deze lijst is niet limitatief; er zijn alleen geneesmiddelen vermeld waarvan we het gebruik in NHG-Standaarden aanbevelen. Bij oudere en kwetsbare patiënten kunnen in principe alle middelen een delier induceren. Alertheid is vooral geboden bij een medicatie- of doseringswijziging.
Psychofarmaca
- benzodiazepinen, met name bij gebruik > 1 maand en middelen met lange halfwaardetijd: chloordiazepoxide, nitrazepam, diazepam
- antidepressiva: tricyclische (anticholinerge werking sterkst bij amitriptyline, minst bij nortriptyline) en SSRI’s
- antipsychotica (met name bij gebruik > 1 maand)
Analgetica
- opiaten, met name langwerkende (zoals morfinetabletten met gereguleerde afgifte en fentanylpleisters); ook tramadol en codeïne
- NSAID’s (o.a. risico op verslechteren van de nierfunctie)
Overige groepen
- urogenitale parasympathicolytica (anticholinergica): oxybutynine, tolterodine
- klassieke antihistaminica (met name bij gebruik > 1 week): dimetindeen, hydroxyzine, promethazine, clemastine, cinnarizine, cyclizine, alimemazine
- corticosteroïden, met name hoge doses: prednison (vanaf circa 40 mg/dag), dexamethason (vanaf circa 10 mg/dag)
- metoclopramide, vooral bij gebruik > 5 dagen en doseringen > 3 dd 10 mg
De lijst met geneesmiddelen met een verhoogd risico op het ontwikkelen van een delier (zoals middelen met een anticholinerge werking) of op een toename van risicofactoren die tot een delier kunnen leiden (zoals hyponatriëmie of verslechtering van de nierfunctie), bevat alleen geneesmiddelen die in NHG-richtlijnen worden vermeld en is daarmee niet limitatief. De lijst is gebaseerd op de STOP-criteria (zie de MDR Polyfarmacie).
Corticosteroïden zijn in de lijst opgenomen, ondanks het feit dat deze in de STOP-criteria niet worden vermeld als delier-inducerende middelen. In de (huisarts)praktijk en bij Lareb zijn diverse casuïstische mededelingen van een ‘steroïdpsychose’ gedaan (waarbij de causale relatie niet altijd vaststaat) en ook Meyler’s Side Effects of Drugs vermeldt verschillende psychologische en psychiatrische effecten van (hoge doseringen) corticosteroïden, zoals slaaptekort en psychose.
In een systematische review van 14 prospectieve onderzoeken naar de associatie tussen diverse medicamenten en het risico op het ontwikkelen van een delier bij patiënten opgenomen in een ziekenhuis of verpleeghuis bleek het risico op delier verhoogd bij: opioïden (OR 2,5; 95%-BI 1,2 tot 5,2); benzodiazepinen (OR 3,0; 95%-BI 1,3 tot 6,8), met name benzodiazepinen met een lange halfwaardetijd (OR 5,4; 95%-BI 1,0 tot 29,2) en hogere doses benzodiazepinen; dihydroperidinederivaten (zoals amlodipine en nifedipine) (OR 2,4; 95%-BI 1,0 tot 5,8).
Aanbeveling
Bij patiënten met een verhoogd risico op het ontwikkelen van een delier moeten (langwerkende) benzodiazepinen worden vermeden (niet starten, afbouwen of stoppen). Bij deze patiënten vergt het voorschrijven van verschillende medicamenten, zoals opioïden, de nodige voorzichtigheid.
Richtlijnen diagnostiek
Naar Samenvatting ›Een delier duidt altijd op onderliggende somatische aandoeningen en risicofactoren, en is multifactorieel bepaald. Daarom zijn een uitgebreide (hetero)anamnese en lichamelijk onderzoek nodig om zowel de diagnose delier te stellen als om onderliggende pathologie en risicofactoren op te sporen.
Signalering
Naar Samenvatting ›- Vooral bij kwetsbare ouderen en patiënten in de palliatieve fase is het van belang om extra alert te zijn op verschijnselen die wijzen op het ontwikkelen van een delier (zie Details).
- Hierbij is informatie van de partner of verzorger van grote waarde.
- Belangrijke signalen zijn dat een patiënt zich plotseling ‘niet zichzelf voelt’ of dat naasten aangeven dat de patiënt plotseling verward of in korte tijd veranderd is. Hierbij kan het gaan om diverse verschijnselen zoals:
- het niet kunnen volgen van een gesprek als het onderwerp verandert, vaak herhalen van antwoorden of moeten herhalen van vragen, summier oogcontact, staren (aanwijzingen voor een aandachtsprobleem)
- niet helder kunnen denken, vreemde associaties en bizarre uitlatingen, van de hak op de tak springen en onsamenhangend spreken
- veranderd slaap-waakritme, met slaperigheid overdag en nachtelijke onrust, levendige dromen, nachtmerries en verwardheid bij het wakker worden
- angstig, rusteloos, emotioneel labiel of snel geïrriteerd zijn
- desoriëntatie en waarnemingsstoornissen
- Alertheid is ook geboden als de verzorger vertelt dat de patiënt urenlang stilletjes in bed ligt, lijkt te slapen en niemand lijkt te herkennen, maar vervolgens weer heel helder is, zelfs relatief onbekenden herkent, en er niets aan de hand lijkt te zijn.
Vroegherkenning is altijd van belang om de verdere ontwikkeling tot een delier te kunnen voorkomen, maar in de palliatieve fase is er (vanwege het frequente voorkomen) reden om actief te zoeken naar prodromale verschijnselen van een delier.
Anamnese en heteroanamnese
Naar Samenvatting ›- Bij de meeste delirante patiënten met verminderd bewustzijn is het niet mogelijk een betrouwbare anamnese af te nemen over de voorgeschiedenis en de premorbide situatie.
- Om de diagnose te stellen en om onderscheid te kunnen maken tussen delier en dementie, is het essentieel om aanvullende gegevens te verzamelen via naasten en/of verzorgers die de patiënt goed kennen.
- De actuele lichamelijke klachten kan de patiënt vaak wel zelf duidelijk maken.
- Het is van belang de patiënt rustig te benaderen en korte, liefst gesloten vragen te stellen.
- Omdat op ‘goede momenten’ het beeld gemist kan worden, kan herhaald beoordelen nodig zijn om de diagnose te stellen of uit te sluiten.
Vragen om diagnose delier te stellen
Naar Samenvatting ›- Heeft de patiënt moeite om de aandacht te richten en deze bij een gesprek of handeling te houden of moeite zich te concentreren (snel afgeleid)?
- Hoe kan het bewustzijnsniveau van de patiënt worden omschreven?
- alert (normaal)
- hyperalert (schrikachtig, prikkelbaar, geagiteerd)
- hypoalert (traag reagerend, in zichzelf gekeerd, wegdromend of slaperig)
- Is de verandering acuut ontstaan?
- Fluctueren de verschijnselen gedurende de dag?
- wisselend aan- en afwezig
- wisselend in ernst
- Is het denken van de patiënt ongeorganiseerd of incoherent, bijvoorbeeld door onsamenhangende of irrelevante conversatie, een onduidelijke of onlogische gedachtegang of onvoorspelbare verandering van onderwerp?
- Zijn er aanwijzingen voor een geheugenstoornis?
- Herinnert de patiënt zich recente gebeurtenissen?
- Is de patiënt gedesoriënteerd?
- Denkt de patiënt ergens anders te zijn?
- Beseft de patiënt welk dagdeel het is?
- Zijn er aanwijzingen voor hallucinaties?
- Ziet of hoort de patiënt dingen die er niet zijn?
- Zijn er aanwijzingen voor wanen?
- Hierbij is de gedachtegang meestal logisch en te volgen, maar is de inhoud bizar, niet berustend op de werkelijkheid.
- Is de patiënt achterdochtig?
- Is er sprake van motorische onrust (‘plukkerig’, rusteloos) of (afgewisseld met) apathie?
Gebruik observatieschalen
Naar Samenvatting ›Er zijn op basis van de DSM-IV-deliercriteria diverse observatieschalen ontwikkeld die gevalideerd zijn in ziekenhuispopulaties en daar behulpzaam kunnen zijn bij het stellen van de diagnose delier en het monitoren van de ernst. Geen van deze instrumenten is echter getest onder patiënten in de huisartsenpraktijk, waardoor de betrouwbaarheid en de toegevoegde waarde van het gebruik in de huisartsenpraktijk niet duidelijk zijn (zie Details).
Er zijn op basis van de DSM-IV-criteria diverse observatieschalen ontwikkeld die behulpzaam kunnen zijn bij het stellen van de diagnose delier en bij het monitoren van de ernst. In een review beschreven Adamis et al. van 24 momenteel beschikbare delierschalen de psychometrische kwaliteiten, het gebruiksdoel (screening of meting van de ernst van de symptomen), de inhoud en de beoordelings- en scoringsprocedures. Ook de oorspronkelijke validatieonderzoeken van deze schalen worden in de review besproken. Hoewel geen enkele schaal gevalideerd is voor gebruik in de huisartsenpraktijk worden hier 2 veelgebruikte delierschalen besproken: het diagnostisch algoritme van de Confusion Assessment Method (CAM; internationaal, ook in onderzoek naar delier veelgebruikt en (in de tweede lijn) robuust en bruikbaar gebleken ) en de Delier Observatie Screening (DOS) schaal, een in Nederland ontwikkelde, toegankelijke en inmiddels (in de tweede lijn, verpleeg- en verzorgingshuizen) gangbare schaal.
Confusion Assessment Method (CAM)
Als hulpmiddel bij het stellen van de diagnose delier kan het diagnostisch algoritme van de CAM (gebaseerd op de DSM-IV) worden gebruikt, ook door getrainde hulpverleners zonder psychiatrische specialisatie. Het omvat de volgende criteria:
- aandachtsstoornis en veranderd bewustzijn;
- acuut ontstaan en fluctuerende symptomatologie;
- ongeorganiseerd, incoherent denken;
- aanwijzingen dat de stoornis veroorzaakt is door een of meer lichamelijke ziekten, geneesmiddelenintoxicaties of onttrekking van medicatie of alcohol.
In het oorspronkelijke, prospectieve valideringsonderzoek in 2 ziekenhuizen onder 56 patiënten van 65 tot 98 jaar die een geriatrische polikliniek bezochten of opgenomen waren, bleek dit algoritme een bruikbaar instrument om de diagnose delier te stellen. Vergeleken met de diagnose, gesteld door een psychiater op basis van de DSM-IIIR-criteria was de sensitiviteit 94 tot 100% en de specificiteit 90 tot 95%; de kappa was 0,81. In latere reviews liep de sensitiviteit uiteen van 46 tot 68% en de specificiteit van 92 tot 97% of bleken de variaties zelfs nog groter (sensitiviteit 13 tot 89%, specificiteit 92 tot 100%), afhankelijk van ervaring, training en de aard van de beschikbare informatie (alleen observatie of ook beknopt cognitief testen).
Beoordeling met behulp van het diagnostisch algoritme de CAM duurt ongeveer 5 minuten, maar vereist wel training. Steis et al. deden onderzoek naar de overeenkomst ten aanzien van het opsporen van een delier tussen de Confusion Assessment Method (CAM), afgenomen door getrainde interviewers, en een voor mantelzorgers ontwikkelde versie van de CAM, afgenomen door familie/naasten (FAM-CAM). Het onderzoek vond plaats onder 52 ouderen (vanaf 65 jaar) die al bekend waren met cognitieve achteruitgang en hun mantelzorgers, die werden geïnstrueerd in de afname van de FAM-CAM. In deze onderzoekspopulatie was de prevalentie van delier 13%, gebaseerd op de uitkomsten van de CAM. De overeenkomst tussen beide screeningsmethoden bleek zeer goed (kappa 0,85; 95%-BI 0,65 tot 1,00), wat aangeeft dat mantelzorgers accurate informatie kunnen verschaffen en daarmee hulpverleners (in een vroeg stadium) alert kunnen maken op de verschijnselen van een delier. Dit is onder meer van belang om in de thuissituatie het (fluctuerende) beloop over de dag te kunnen volgen.
Delier Observatie Screening (DOS) schaal
De DOS-schaal, eveneens gebaseerd op de DSM-IV-criteria, werd ontwikkeld als screeningsinstrument voor verpleegkundigen, waarbij de uitslag een indicatie geeft voor aanwezigheid en de ernst van een delier; de items worden gescoord op basis van observaties. De oorspronkelijke schaal met 25 items is later ingekort tot een versie met 13 items (zie detail Interpretatie DOS-score bij Aandachtspunten voor overdracht naar de huisarts). Om de diagnose delier te kunnen stellen is aanvullend informatie nodig over het begin van de symptomen (acuut) en het beloop over de dag (fluctuerend).
Verschillende scoremomenten per etmaal zijn van waarde vanwege het fluctuerende beloop en om de ernst van de verschijnselen te kunnen vervolgen tijdens behandeling van een delier. De DOS kan binnen 5 minuten worden gescoord, met scores variërend van 0 (‘normaal gedrag’) tot 13; 3 punten of meer is een indicatie voor aanwezigheid van een delier. In een systematische review naar de diagnostische waarde van verschillende instrumenten (vergeleken met de DSM-diagnose delier door geriater, psychiater of neuroloog) was de gepoolde sensitiviteit voor de DOS-schaal 92% en de gepoolde specificiteit 82%.
Ook Scheffer et al. toonden, in een onderzoek onder patiënten van 65 jaar en ouder met een heupfractuur of opgenomen op een interne afdeling, aan dat de DOS een voor verpleegkundigen geschikt, gemakkelijk bruikbaar en betrouwbaar instrument is om op een tijdsefficiënte manier (het beloop van) de ernst van een delier te beoordelen, in ieder geval in een groep ouderen met een verhoogd risico op delier.
Conclusie
Er zijn diverse delierobservatieschalen ontwikkeld en gevalideerd in de tweede lijn. Omdat geen enkele schaal gevalideerd is voor gebruik in de huisartsenpraktijk, kan de werkgroep echter geen goed onderbouwd advies geven over het gebruik en de plaatsbepaling van deze schalen in de huisartsenpraktijk.
Vragen om mogelijke oorzaken op te sporen
Naar Samenvatting ›- verschijnselen van een infectie (koorts, hoesten, dyspneu, mictieklachten)
- al aanwezige neurologische, cardiale, respiratoire, metabole, endocriene aandoeningen
- insufficiënte voeding en vochtinname
- medicatie (zie kader Geneesmiddelen met verhoogd risico op delier) en zelfzorgmiddelen:
- type en dosering
- recente wijzigingen (starten, dosisverandering, staken medicatie)
- therapietrouw
- desgewenst te beoordelen met ondersteuning van de apotheker
- alcohol-, nicotine- of cannabisonttrekking
- pijn, urineretentie, obstipatie, recent trauma, medische ingreep, anesthesie, immobiliteit
- visus- en gehoorbeperking; slaaptekort
Lichamelijk onderzoek
Naar Samenvatting ›- Voer een uitgebreid lichamelijk onderzoek uit om de onderliggende oorzaak of oorzaken op te sporen. Meet en beoordeel:
- algemene indruk, tekenen van hypoxie, hydratietoestand
- lichaamstemperatuur
- bloeddruk en polsfrequentie
- auscultatie hart en longen
- buikonderzoek, in het bijzonder letten op een overvulde blaas (eventueel katheteriseren)
- neurologische uitvalsverschijnselen (gelaatsmusculatuur, extremiteiten)
- aanwijzingen voor uitwendig letsel, fractuur en factoren die pijn luxeren
- Breid het lichamelijk onderzoek gericht uit als de anamnese of de bevindingen bij het lichamelijk onderzoek daartoe aanleiding geven.
- Bij zeer onrustige patiënten kan het uitvoeren van onderzoek moeilijk zijn. Soms is hulp van een derde (bijvoorbeeld een vertrouwd familielid) nodig om de patiënt af te leiden. Is het lichamelijk onderzoek desondanks niet uitvoerbaar, dan kan het geïndiceerd zijn medicatie toe te dienen (zie Medicamenteuze behandeling van deliersymptomen).
Aanvullend onderzoek
Naar Samenvatting ›Hoe uitgebreid en urgent het aanvullend onderzoek moet zijn, wordt mede bepaald door:
- de mate van ziek zijn en onrust van de patiënt
- de mogelijkheid om anamnese en lichamelijk onderzoek goed en volledig uit te voeren en de bevindingen hierbij
- de voorgeschiedenis en premorbide toestand van de patiënt
- het tijdstip van de dag of nacht waarop de patiënt wordt gezien
- de diagnostische mogelijkheden
Onderzoek direct ‘aan het bed’
Naar Samenvatting ›- glucosespiegel
- nitriettest
- Bij oudere vrouwen komt een asymptomatische bacteriurie vaak voor. Beschouw daarom een positieve nitriettest bij een oudere vrouw zonder klinische verschijnselen van een urineweginfectie niet zonder meer als afdoende verklaring voor een delier.
- zuurstofsaturatie (bij tekenen van dyspneu)
Uitgebreider onderzoek
Naar Samenvatting ›Breid het onderzoek uit, indien het onderzoek ‘aan het bed’ onvoldoende verklaring biedt voor het delier:
- BSE of CRP (zie Details)
- Hb, Ht
- leukocyten
- TSH
- creatinine (voor eGFR-schatting)
- natrium, kalium
- calcium, vooral bij:
- bedlegerige patiënten
- (vermoeden van) botmetastasen (zie Details)
- ALAT (en eventueel g-GT, ter versterking van een vermoeden op overmatig alcoholgebruik)
- dipslide of urinesediment (zie Details)
Bij een delier is het van belang behandelbare etiologische factoren, zoals infecties, snel op te sporen. De bezinking (BSE) reageert traag op fysiologische veranderingen; bij het begin van een ziekteproces duurt het enige dagen voordat de eiwitconcentratie voldoende hoog is om een verhoogde bezinking te krijgen. Dit in tegenstelling tot het CRP, dat binnen 6 tot 8 uur kan verdubbelen (en halveren). De keuze voor BSE of CRP hangt af van hoe lang de verschijnselen al bestaan en van de snelheid waarmee het laboratoriumonderzoek kan worden verricht zie de LESA Rationeel aanvragen van laboratoriumdiagnostiek 2012.
Hypercalciëmie kan (mede)oorzaak zijn van een delier. Bij bedlegerige patiënten en bij patiënten met (het vermoeden van) botmetastasen is calciumbepaling relevant. Bij ouderen is plotselinge immobilisatie een belangrijke oorzaak van hypercalciëmie.
Het onderzoek van de urine bestaat uit de nitriettest, bij een negatieve uitslag gevolgd door een semi-kwantitatieve kweek met behulp van een dipslide of eventueel een microscopisch onderzoek van het sediment naar de aanwezigheid van bacteriën, zie de NHG-Standaard Urineweginfecties.
Gericht uitgebreid onderzoek
Naar Samenvatting ›- Breid het aanvullend onderzoek gericht uit indien de anamnese of de bevindingen bij het lichamelijk onderzoek daar aanleiding toe geven (zie Details).
- Aanhouden van het delier, ondanks adequate behandeling van de onderliggende aandoening(en), vergroot de noodzaak van verder aanvullend onderzoek; hoe uitgebreid dit moet zijn, zal in belangrijke mate afhangen van factoren als het premorbide functioneren en de levensverwachting van de patiënt.
- De ervaring leert dat er niet altijd een afdoende verklaring is te vinden voor het ontstaan van het delier.
Indien de anamnese of de bevindingen bij lichamelijk onderzoek daar aanleiding toe geven, wordt het aanvullend onderzoek gericht uitgebreid, bijvoorbeeld met ECG, X-thorax, vitaminestatus (vitamine B1, vitamine B12, foliumzuur), albumine, geneesmiddelspiegels (digoxine, anti-epileptica, lithium), waarbij bedacht moet worden dat bij ouderen ook therapeutische doses en normale bloedspiegels kunnen bijdragen aan de ontwikkeling van een delier.
Evaluatie
Naar Samenvatting ›- Stel de diagnose delier op basis van de aanwezigheid van:
- een aandachts- en bewustzijnsstoornis
- acuut begin (in uren tot dagen) en over de dag fluctuerende ernst van de symptomen
- verandering in cognitie of waarnemingsstoornis (hallucinaties)
- Daarnaast kunnen zich (paranoïde) wanen voordoen.
- Als op grond van anamnese, lichamelijk onderzoek of laboratoriumgegevens het vermoeden bestaat dat de stoornis een organische oorzaak heeft, ondersteunt dit de diagnose delier nog verder. (Zie Begrippen voor een uitgebreidere beschrijving.)
Differentiaaldiagnostiek
Naar Samenvatting ›Houd differentiaaldiagnostisch vooral rekening met een psychose, een acute gedragsstoornis bij dementie of een depressie (zie Details). Vooral het onderscheid met de 2 laatstgenoemde beelden kan lastig zijn door de veelvormige en overlappende symptomatologie (tabel 1). Bovendien kunnen de beelden ook samengaan.
|
|
Delier |
Dementie |
Depressie |
|---|---|---|---|
|
Begin |
Acuut (in uren tot dagen) |
Sluipend (in maanden tot jaren) |
Geleidelijk (meestal in enkele weken) |
|
Beloop |
Symptomen fluctueren over het etmaal (doorgaans meer uitgesproken in avond en nacht) |
Stabiel over het etmaal |
Dagschommelingen: doorgaans zijn de klachten ’s morgens erger dan ‘s avonds |
|
Bewustzijn |
(Afwisselend) gedaald of hyperalert |
Ongestoord |
Ongestoord |
|
Aandacht |
Gestoord |
In beginstadium ongestoord |
Kan gestoord zijn door interesseverlies |
|
Oriëntatie |
Fluctuerend |
Gestoord (afhankelijk van ernst dementie) |
Ongestoord |
|
Spraak |
Incoherent |
Afasie (afhankelijk van de ernst) |
Ongestoord of langzaam |
|
Denken |
Ongeorganiseerd |
Verarmd |
Ongestoord |
|
Geheugen |
Kortetermijngeheugen gestoord |
Korte- en langetermijngeheugen gestoord |
Intact, maar soms gestoord t.g.v. gestoorde aandacht en concentratie |
|
Hallucinaties en wanen |
Doorgaans aanwezig (vluchtig en inhoudelijk niet-complex)(zie Details) |
Doorgaans afwezig behalve in latere stadia)(zie Details) |
Doorgaans afwezig (behalve bij psychotische depressie) |
In een prospectief onderzoek onder 67 in een algemeen ziekenhuis opgenomen patiënten van 60 jaar en ouder voor wie in verband met het vermoeden van depressie een psychiatrisch consult werd aangevraagd, bleek bij 28 patiënten (41,8%) sprake te zijn van een delier (met depressieve symptomen). Het onderscheid is van belang omdat de diagnose delier doorgaans een snelle en uitgebreide diagnostiek vergt naar oorzakelijke factoren en omdat het therapeutisch beleid bij delier sterk verschilt van dat bij depressie.
Visuele hallucinaties kunnen bij slechtziende ouderen ook optreden als geïsoleerd psychopathologisch verschijnsel in het kader van het syndroom van Charles Bonnet. Dit syndroom wordt gekenmerkt door aanwezigheid van visuele hallucinaties, waarbij de patiënt weet dat deze niet echt zijn (tenzij er sprake is van gelijktijdige dementie), afwezigheid van hallucinaties van andere zintuigen en afwezigheid van wanen. De hallucinaties doen zich hierbij niet voor in het kader van dementie, delier, epilepsie, migraine, een rouwproces, gebruik van hallucinogene drugs, extreme vermoeidheid of sensorische deprivatie, en ook niet uitsluitend in de overgangsfase tussen slapen en waken. Een verminderd gezichtsvermogen door perifere dan wel centrale oorzaken en een hoge leeftijd zijn de belangrijkste risicofactoren.
In onderzoek onder honderd opeenvolgende patiënten met een delier in de palliatieve fase (gemiddelde leeftijd zeventig jaar) bleken de psychotische verschijnselen bij delier te verschillen van de verschijnselen bij een schizofrene psychose: bij een delier zijn hallucinaties vaker visueel dan auditief en wanen betreffen doorgaans thema’s die betrekking hebben op de directe omgeving en omstandigheden.
In het verdere beloop van een alzheimerdementie kunnen hallucinaties en wanen voorkomen. Een ‘Lewy body’-dementie wordt juist gekenmerkt door het in een relatief vroeg stadium periodiek optreden van (visuele) hallucinaties en bewustzijnsdaling, waardoor het beeld moeilijk te onderscheiden is van een delier, en door het optreden van parkinsonisme.
In een onderzoek onder ambulante patiënten bij wie kort tevoren de diagnose alzheimerdementie (n = 109) of ‘Lewy body’-dementie (n = 61) was gesteld werd de behandelaars gevraagd naar de symptomen waarmee patiënten zich hadden gepresenteerd. Van de patiënten met ‘Lewy body’-dementie had bij presentatie in 44% visuele hallucinaties, van de patiënten met alzheimerdementie slechts 3%.
Richtlijnen beleid
Naar Samenvatting ›Het beleid bij een delier steunt op een aantal pijlers (zie schema Samenvatting diagnostiek en beleid bij delier):
- behandeling van de oorzakelijke factoren
- creëren en waarborgen van een veilige omgeving, waarin de patiënt behandeld en verzorgd kan worden
- zo nodig medicamenteuze behandeling van symptomen
Organisatie van zorg bij thuisbehandeling
Naar Samenvatting ›- Beoordeel en bespreek of thuisbehandeling mogelijk is. Voorwaarden zijn:
- de onderliggende somatische aandoeningen zijn thuis adequaat te behandelen
- er kan continue zorg en veiligheid geboden worden
- de mantelzorgers stemmen in met behandeling thuis en willen hieraan een bijdrage leveren
- Maak in overleg met de mantelzorgers een inschatting van de belasting die dit voor hen betekent en schakel zo nodig aanvullende zorg in.
- Schakel zo nodig een kaderhuisarts ouderenzorg, specialist ouderengeneeskunde, ouderenpsychiater of een sociaalpsychiatrische verpleegkundige vanuit de ambulante ouderenzorg van de ggz in.
- Stel 1 van de betrokken hulpverleners (bij voorkeur wijkverpleegkundige of huisarts) aan als coördinator en aanspreekpunt. Deze ziet toe op de samenhang in het zorgaanbod en de aansluiting op de behoefte van de patiënt en bevordert overleg tussen de betrokken hulpverleners.
- Beperk het aantal prikkels tot het noodzakelijke minimum.
- Noteer in een zorgdossier, dat voor alle zorgverleners toegankelijk is, het zorgproces en de verdere onderlinge afspraken en vragen en zorg voor een goede overdracht naar de huisartsenpost.
- Overweeg bij een terminaal zieke patiënt een consulent palliatieve zorg te consulteren. Als de zorg voor de naasten te zwaar dreigt te worden, kan de inzet van een opgeleide vrijwilliger van de regionale afdeling van de Vrijwillige Palliatieve Terminale Zorg (VPTZ) een welkome aanvulling betekenen op het reguliere zorgnetwerk.
Voorlichting en advies
Naar Samenvatting ›- Betrek de naasten bij het zorgproces en geef uitleg aan patiënt en alle mantelzorgers over de aard van het toestandsbeeld en het tijdelijke karakter daarvan.
- Vertel de naasten dat het moeilijk kan zijn om een gesprek te voeren of om contact te krijgen met de patiënt als gevolg van een aanwezige denkstoornis, wanen (vreemde ideeën, achterdocht) of hallucinaties (zien en/of horen van dingen die er niet zijn) en dat de patiënt vaak anders (agressief of juist teruggetrokken) reageert dan normaal, niet aanspreekbaar is op zijn denken en handelen en niet in staat is om afspraken te maken.
- Wijs de naasten er op dat het belangrijk is de patiënt regelmatig te bezoeken, omdat de patiënt de familie vaak ervaart als ‘reddingslijn’ naar de realiteit.
- Bespreek de noodzaak om de oorzaken op te sporen en leg uit dat als de oorzaken behandeld kunnen worden, het acuut verslechterde cognitieve functioneren weer kan verbeteren.
Communicatie
Naar Samenvatting ›Let bij de communicatie met de patiënt op de volgende punten:
- stel uzelf bij elk contact voor
- leg uit waar de patiënt is, wat er aan de hand is en wat u komt doen
- spreek in korte, duidelijke zinnen en leg in eenvoudige bewoording uit wat u doet
- wees u bewust van uw eigen (non-)verbale houding en gedrag: blijf kalm en gecontroleerd en niet afwijzend of overheersend
- zorg voor een luisterende en empathische houding met aandacht voor klachten, zorgen en frustraties
- bestrijd angst door open vragen te stellen over de reden van de angst
- geef de familie of verzorgers adviezen over de communicatie met en de verzorging van de patiënt, zie kader Aandachtspunten communicatie en verzorging bij een delier
Thuisarts
Naar Samenvatting ›Verwijs naar de informatie over delier op thuisarts.nl, die is gebaseerd op deze NHG-Standaard.
Aandachtspunten communicatie en verzorging bij een delier
Naar Samenvatting ›Vertrouwdheid creëren
- Bied oriëntatie- en herkenningspunten (klok, kalender, foto’s).
- Benoem regelmatig persoon, plaats, dag en tijdstip.
- Spreek rustig en in korte zinnen en stel korte, gesloten, enkelvoudige vragen.
- Laat, indien van toepassing, de patiënt bril en hoortoestel gebruiken.
- Zorg voor een continue verlichting van de kamer (’s nachts gedempt licht).
Rust creëren
- Beperk bezoek (aantal personen en duur van het bezoek).
- Beperk het aantal prikkels tot het noodzakelijk minimum.
- Verstoor de slaap zo min mogelijk en activeer overdag (stimulering normaal dag-nachtritme).
Omgang met hallucinaties, wanen en angst
- Laat de patiënt zo min mogelijk alleen, zeker bij angst of paniek; stimuleer de continue aanwezigheid van vertrouwde, rustgevende personen.
- Toon begrip voor de angst die door hallucinaties en wanen kan worden opgewekt; ga niet mee in waanideeën, maak duidelijk dat uw waarneming anders is, zonder de patiënt tegen te spreken (vermijd discussie), maar blijf empathisch.
- Fluister niet met derden in aanwezigheid van de patiënt.
Verzorging
- Zorg voor voldoende vochtinname, adequate voeding en goede medicatie-inname.
- Pas in principe géén vrijheidsbeperkende maatregelen/fixatie toe (zie Details).
De standaard sluit met deze adviezen aan bij de wijdverbreid geadviseerde psychosociale maatregelen bij de behandeling van een delier, die vooral gericht zijn op het ondersteunen van de oriëntatie in tijd, plaats en persoon. Zie ook de NICE-richtlijn Delirium en de Multidisciplinaire Richtlijn Delier volwassenen.
Het gebruik van fysieke vrijheidsbeperkende maatregelen is een risicofactor voor het ontstaan van een delier en kan de toestand bij een bestaand delier verergeren.
Behandeling van de oorzaken
Naar Samenvatting ›- Beperk medicatie, zo nodig in overleg met de voorschrijvend specialist, tot het noodzakelijke minimum (dosis verlagen, staken dan wel afbouwen, vervangen door een minder delierinducerend alternatief).
- Vermijd combinaties van diverse middelen uit dezelfde medicijngroep.
- Zie voor de behandeling van andere somatische oorzaken de betreffende NHG-Standaarden.
Medicamenteuze behandeling van deliersymptomen
Naar Samenvatting ›- Start, vanwege potentiële bijwerkingen, niet routinematig met medicamenteuze behandeling van een delier.
- Beperk behandeling met een medicament zoals haloperidol tot de laagst effectieve dosis in tijd en duur, zo mogelijk tot maximaal een week.
- Overweeg medicamenteuze behandeling van de symptomen van een delier indien sprake is van 1 van de volgende indicaties (zie Details):
- angst en/of hallucinaties, achterdocht, (paranoïde) wanen
- hevige motorische onrust, mede om te voorkomen dat de patiënt zichzelf of anderen letsel toebrengt (zie Details)
- nachtelijke onrust en/of verstoord dag-nachtritme
- om essentieel onderzoek of behandeling mogelijk te maken
- Zie bij ernstige agitatie ook: hoofdstuk Ernstige agitatie uit de NHG-Behandelrichtlijn Geneesmiddelen en zuurstof in spoedeisende situaties.
De wetenschappelijke onderbouwing voor de medicamenteuze behandeling van het delier is beperkt. Bovendien wordt de klinische relevantie beperkt omdat onderzoeken veelal geen patiënten met dementie includeren, terwijl dit in de klinische praktijk de grootste groep patiënten met een delier is en antipsychotica in deze kwetsbare groep meer bijwerkingen hebben. Dit leidt er toe dat ook in Nederland practice basedaanbevelingen de behandeling van het delier bepalen (zie MDR Delier, publicatie verwacht begin 2014).
Vanwege de beperkt aangetoonde effectiviteit en de potentiële bijwerkingen (zie onder) adviseert de NICE-richtlijn Delirium om niet routinematig te starten met medicamenteuze behandeling van delier en indien een medicament (zoals haloperidol) wordt voorgeschreven deze behandeling te beperken tot de laagst effectieve dosis in tijd en duur (zo mogelijk maximaal een week). Het advies luidt pas te starten met medicatie bij ernstige symptomen, zoals agitatie en psychotische verschijnselen of als de veiligheid van de patiënt in het geding is. De werkgroep sluit aan bij dit advies.
Effectiviteit
Typische (= klassieke) antipsychotica
Haloperidol is een snel en sterk werkend typisch antipsychoticum dat een antipsychotisch effect heeft bij een lage dosering, omdat het een grote affiniteit voor dopaminereceptoren heeft. Het heeft een lage anticholinerge activiteit en minimale hypotensieve effecten; de bijwerkingen zijn voornamelijk extrapiramidaal.
In 2009 verscheen een Cochrane-review over de effectiviteit en incidentie van bijwerkingen van haloperidol in vergelijking met atypische antipsychotica (risperidon en olanzapine) en/of placebo. De meta-analyse, uitgevoerd op de resultaten van 2 gerandomiseerde en geblindeerde onderzoeken, toonde in alle interventiegroepen een significant sterkere verbetering van de delierscore dan in de placebogroep, maar geen significant verschil in effect op delierscores tussen haloperidol enerzijds en olanzapine of risperidon anderzijds (OR 0,63; 95%-BI 0,29 tot 1,38; p = 0,25). De eindconclusie van de Cochrane-review is dat er bij lage dosering haloperidol (< 3 mg/dag) geen significant verschil is in effect op delierscores en (extrapiramidale) bijwerkingen tussen haloperidol en de atypische antipsychotica olanzapine en risperidon. Bij een hogere dosering haloperidol (> 4,5 mg/dag) traden extrapiramidale bijwerkingen echter wel vaker op dan bij olanzapine.
Kalisvaart et al. onderzocht in een gerandomiseerd, placebogecontroleerd onderzoek onder 430 patiënten > 70 jaar, die een heupoperatie ondergingen, het profylactische effect van haloperidol 1,5 mg/dag (preoperatief gestart en gecontinueerd tot 3 dagen postoperatief). De incidentie van postoperatief delier nam met deze haloperidoldosering niet af (haloperidolgroep 15,1% versus 16,5% in de placebogroep; RR 0,91, 95%-BI 0,6 tot 1,3). In de haloperidolgroep was de delierscore wel significant lager, de duur van het delier significant korter (gemiddeld 5,4 versus 11,8 dagen; p < 0,001) evenals de opnameduur (gemiddeld 17,1 ± 11,1 versus 22,6 ± 16,7 dagen; p < 0,001). Bijwerkingen van haloperidol deden zich in dit onderzoek niet voor.
Atypische antipsychotica
Een review uit 2009 over het effect van atypische antipsychotica bij delier laat zien dat verreweg het meeste onderzoek methodologisch zwak is; slechts 1 onderzoek uit 2004 (ook opgenomen in de Cochrane-review van Lonergan 2009) was dubbelblind uitgevoerd en geen enkel onderzoek was placebogecontroleerd. Sinds het verschijnen van deze review verscheen nog een aantal onderzoeken. In een gerandomiseerd onderzoek onder 32 patiënten van 36 tot 82 jaar (mediane leeftijd 70 jaar) met een delier die waren verwezen naar een Zuid-Koreaans universiteitsziekenhuis werd de effectiviteit van olanzapine en risperidon vergeleken, waarbij de beoordelaars van de delierscore geblindeerd waren. Dit onderzoek liet geen significant verschil zien tussen beide behandelgroepen wat betreft verbetering van de delierscore en het percentage patiënten met een gunstig effect. Wél was de respons op risperidon significant slechter in de groep vanaf 70 jaar, vergeleken met de groep jonger dan 70 jaar. Een dergelijk leeftijdseffect werd niet gevonden in de groep die met olanzapine werd behandeld. Een nadeel van olanzapine bij delier is echter dat het ook anticholinerg en sederend werkt, vooral bij hogere doseringen. Een dubbelblind, gerandomiseerd, placebogecontroleerd onderzoek naar de effectiviteit van quetiapine onder 42 in het ziekenhuis opgenomen patiënten (gemiddelde leeftijd 84 jaar) liet zien dat delierscores in de quetiapinegroep significant sneller verbeterden dan in de controlegroep.
Op basis van literatuuronderzoek van het Expertisecentrum Pharmacotherapie bij Ouderen (Ephor) naar de therapeutische waarde (effectiviteit, veiligheid, ervaring en gebruiksgemak) van diverse antipsychotica bij een delier bij kwetsbare ouderen geeft Ephor de voorkeur aan haloperidol of risperidon. Ephor concludeert dat andere antipsychotica, zoals clozapine, olanzapine en quetiapine, sterk negatieve overwegingen hebben ten opzichte van het referentiegeneesmiddel haloperidol; deze middelen worden daarom niet geadviseerd voor toepassing bij kwetsbare oudere patiënten.
Bijwerkingen (niet-extrapiramidaal)
Risico op CVA
Retrospectief cohortonderzoek laat zien dat antipsychotica bij langdurig gebruik (3 tot 4 maanden) het risico op een CVA significant verhogen; bij atypische antipsychotica is dit effect sterker (relatief risico in vergelijking met geen behandeling 2,32; 95%-BI 1,73 tot 3,11) dan bij het typische antipsychoticum haloperidol (relatief risico in vergelijking met geen behandeling 1,28; 95%-BI 1,18 tot 1,40). Bij een behandelduur van ten minste 30 dagen werd geen verschil in risico op CVA gevonden tussen risperidon en olanzapine. Het risico op een CVA bij de veel beperktere behandelduur van delier met antipsychotica (maximaal 1 week) is niet bekend.
Verlengde QTc-tijd bij intraveneuze toediening haloperidol
Intraveneus haloperidol kan de gecorrigeerde QT-tijd (QTc-tijd) verlengen met het risico op torsades de pointes, een ernstige ventriculaire aritmie. Dit risico is vooral relevant bij patiënten met een reeds verlengde QTc-tijd en/of gebruik van andere medicatie die de QTc-tijd verlengt (onder andere antiaritmica, sommige antibiotica, tamoxifen, furosemide).
Aanbeveling: gezien de potentiële bijwerkingen is de werkgroep van mening dat, zeker bij toch al kwetsbare patiënten, zorgvuldig moet worden afgewogen of het gebruik van antipsychotica bij een delier strikt noodzakelijk is. Als dat het geval is, geniet vooralsnog een lage dosis haloperidol de voorkeur (mits niet gecontra-indiceerd zoals bij patiënten met de ziekte van Parkinson), omdat hiermee wijdverbreid de meeste ervaring is opgedaan. Vanwege het risico op ernstige bijwerkingen is voorzichtigheid geboden bij intraveneuze toediening van haloperidol in de thuissituatie.
De Rooij et al. verrichtten een systematische review (op basis van 10 onderzoeken, met in totaal 1065 patiënten met een delier) naar de klinische relevantie van subtypering van delier, onder meer gelet op de therapeutische consequenties. Zij concludeerden dat een psychomotorisch hypoactief delier (bij kankerpatiënten) even intensief en stressvol kan zijn als andere, onrustige vormen, maar dat de verschijnselen van een hypoactief delier mogelijk minder responsief zijn voor antipsychotica. Psychostimulantia zijn wel geopperd voor de behandeling van een hypoactief delier, maar de effectiviteit is niet bewezen.
Haloperidol
Naar Samenvatting ›- Indien symptomatische behandeling van een delier bij ouderen noodzakelijk is, geef dan bij voorkeur haloperidol 0,5-1,5 mg 2 dd oraal, gedurende maximaal 1 week.
- Deze voorkeur geldt niet voor patiënten met de ziekte van Parkinson of ‘Lewy body’-dementie en evenmin bij een delier als gevolg van alcohol- of benzodiazepineonttrekking (zie Andere belangrijke punten).
- Start laag en bouw zo nodig geleidelijk op. De ervaring leert dat het effect van haloperidol individueel sterk kan verschillen; leeftijd, gewicht, geslacht en ernst van de symptomen zijn niet duidelijk richtinggevend voor het bepalen van de optimale (start)dosering.
- Bouw haloperidol na maximaal 1 week af; bij langer gebruik neemt het risico op ernstige bijwerkingen (parkinsonisme, tardieve dyskinesie, CVA) toe (zie Details en Medicamenteuze behandeling van deliersymptomen). Hanteer als vuistregel om met de afbouw te starten zodra de patiënt 2 maal achtereen een goede nachtrust had. Bouw af door elke 2 dagen de dosering te halveren; stop 2 dagen nadat een dosis van 1 mg/dag is bereikt.
In aansluiting op een vragenlijstonderzoek onder 52 Amerikaanse deskundigen (ouderenpsychiaters, geriaters en huisartsen) over het optimale gebruik van antipsychotica bij ouderen werd consensus bereikt om bij delirante patiënten met een goede respons op het voorgeschreven antipsychoticum het middel na 1 week af te bouwen. Ook de NICE-richtlijn Delirium adviseert om het gebruik van antipsychotica te beperken tot maximaal 1 week. De standaard sluit zich aan bij deze adviezen.
Toedieningsvormen
Naar Samenvatting ›- Naast tabletten van 1 en 5 mg is voor orale toediening ook druppelvloeistof beschikbaar (2 mg/ml; 1 druppel = 0,1 mg), waarmee het zo nodig buccaal kan worden toegediend.
- Ook subcutane, intramusculaire of intraveneuze toediening is mogelijk (ampul injectievloeistof à 1 ml bevat 5 mg haloperidol/ml), maar terughoudendheid is hierbij geboden:
- intramusculaire toediening is pijnlijk en alleen te overwegen bij ernstige motorische onrust
- intraveneuze toediening kan (in hogere doseringen) leiden tot verlenging van de QTc-tijd (zie Medicamenteuze behandeling van deliersymptomen)
Crisissituatie of blijvende onrust
Naar Samenvatting ›- Overweeg in crisissituaties kortdurend een hogere dosis (tot maximaal 10 mg/24 uur) (zie ook NHG-Behandelrichtlijn Geneesmiddelen en zuurstof in spoedeisende situaties):
- evalueer (telefonisch) na de startdosering elk uur of de motorische onrust en/of angst al voldoende onder controle zijn
- herhaal zo nodig de startdosering of kies voor intramusculaire toediening (2,5 mg)
- Overweeg, als de patiënt ondanks (de maximale dosering) haloperidol erg onrustig blijft, kortdurend en op geleide van de symptomen een benzodiazepine toe te voegen:
- bij voorkeur lorazepam 0,5-2 mg/2 uur oraal of parenteraal
- indien acute parenterale toediening noodzakelijk is: midazolam intramusculair, zie ook NHG-Behandelrichtlijn Geneesmiddelen en zuurstof in spoedeisende situaties)
- bouw de benzodiazepine ook weer als eerste af, als de patiënt tot rust is gekomen (zie Symptomatische behandeling in de palliatieve fase)
Andere belangrijke punten
Naar Samenvatting ›- Indien na toediening van haloperidol de agitatie en onrust toenemen, is mogelijk sprake van een paradoxale reactie; dit is reden voor verwijzing.
- Consulteer een specialist of verwijs de patiënt indien de maximale dosering haloperidol (eventueel gecombineerd met een benzodiazepine) onvoldoende effect sorteert of als symptoombestrijding > 1 week noodzakelijk is. Voor langdurige symptoombestrijding lijkt risperidon een veiliger middel.
- We adviseren bij delier geen andere middelen dan haloperidol (of eventueel risperidon) voor te schrijven; de effectiviteit van andere antipsychotica en cholinesteraseremmers is niet goed onderbouwd en de ervaring met deze middelen in de eerste lijn is beperkt (zie Details en Medicamenteuze behandeling van deliersymptomen).
- Overleg over medicamenteuze behandeling van delier bij patiënten met; ‘Lewy body’-dementie (zie Details) en; de ziekte van Parkinson (zie Details) met een (behandelend) specialist; beide aandoeningen zijn een contra-indicatie voor haloperidol, wegens een hoog risico op extrapiramidale bijwerkingen of toename van motorische parkinsonverschijnselen (zie ook NHG-Standaard Dementie en NHG-Standaard Ziekte van Parkinson).
- Geef ouderen met een delier ten gevolge van alcohol- of benzodiazepineonttrekking waarbij zich hevige angst of onrust voordoet, lorazepam (0,5-2 mg/2 uur oraal of parenteraal, op geleide van de symptomen). Voeg, indien de symptomen persisteren, haloperidol toe. Bij een alcohol(onttrekkings)delier moet daarnaast op korte termijn worden gestart met vitamine-B1 -suppletie (zie ook NHG-Standaard Problematisch Alcoholgebruik).
Van diverse geneesmiddelen is de werkzaamheid bij delier onderzocht. Middelen met een sterke antihistaminerge werking zijn ongewenst vanwege het sederende effect. Reductie van de agitatie wordt veroorzaakt door het antipsychotische effect, niet door sedering.
Benzodiazepine-monotherapie
In een Cochrane-review uit 2009 werd het beschikbare bewijs over de effectiviteit en bijwerkingen van benzodiazepinen bij een delier geëvalueerd. De reviewers beschrijven 1 gerandomiseerd, geblindeerd onderzoek uit 2007, waarin het effect van lorazepam werd vergeleken met dexmedetomidine (een selectieve alpha-2-adrenerge receptorantagonist) bij een niet-alcoholisch delier bij mechanisch beademde patiënten op de intensive care. Dexmedetomidine was in dit onderzoek geassocieerd met meer delier- en comavrije dagen dan lorazepam (gemiddeld 7 versus 3 dagen, p = 0,01). Een ander onderzoek liet zien dat lorazepam minder effectief was dan haloperidol en chloorpromazine; dit onderzoek werd overigens voortijdig afgebroken vanwege een niet acceptabele toename van bijwerkingen in de met lorazepam behandelde groep.
Cholinesteraseremmers
In een andere Cochrane-review uit 2009 werd het beschikbare bewijs over de effectiviteit en veiligheid van cholinesteraseremmers bij de behandeling van een delier geëvalueerd. Er was slechts één gerandomiseerd, geblindeerd onderzoek beschikbaar, waarin donepezil in vergelijking met placebo de duur van het delier niet bleek te bekorten. Na deze review publiceerden Van Eijk et al. de uitkomst van hun RCT onder op de intensive care opgenomen patiënten, waarin symptomen van delier langer aanhielden in de met rivastigmine behandelde groep (mediane duur vijf dagen) dan in de placebogroep (mediane duur drie dagen). Vanwege een toename van sterfte in de rivastigminegroep werd het onderzoek voortijdig gestaakt.
Conclusie
Benzodiazepinen lijken minder effectief dan antipsychotica bij een delier en leiden tot meer bijwerkingen.
Aanbeveling
Voor gebruik van benzodiazepinen als monotherapie is alleen plaats bij een delier als gevolg van alcohol- of benzodiazepineonttrekking. Bij een niet-alcoholisch delier worden ze (als monotherapie) niet aanbevolen. Cholinesteraseremmers hebben geen plaats bij de behandeling van delier in de eerste lijn; het vergt veel expertise en de effectiviteit is niet bewezen.
Bij de behandeling van een delier bij een patiënt met ‘Lewy body’-dementie zijn typische antipsychotica (zoals haloperidol) en ook het atypische antipsychoticum risperidon gecontra-indiceerd, vanwege een sterke dopaminerge bindingscapaciteit en een hoog risico op extrapiramidale bijwerkingen of toename van motorische parkinsonverschijnselen. Alleen bij het atypische antipsychoticum clozapine is het risico op extrapiramidale bijwerkingen gering. Bij het gebruik van clozapine is leukocytencontrole geïndiceerd vanwege het risico op agranulocytose: wekelijks in de eerste achttien weken van het gebruik, bij langer gebruik maandelijks en tevens bij koorts. Bij contra-indicaties voor clozapine komt quetiapine nog in aanmerking, hoewel hier minder bewijs voor is. Het lijkt een veilig alternatief. Ook olanzapine is hiervoor onderzocht, maar is eveneens minder onderbouwd en heeft bovendien een negatief effect op de motoriek. Omdat de meeste huisartsen met het voorschrijven van deze middelen geen ervaring hebben, is bij patiënten met ‘Lewy body’-dementie en een delier overleg met de behandelend specialist gewenst.
Evenals bij patiënten met ‘Lewy body’-dementie zijn typische antipsychotica (zoals haloperidol) en ook het atypische antipsychoticum risperidon bij patiënten met de ziekte van Parkinson gecontra-indiceerd, vanwege een sterke dopaminerge bindingscapaciteit en hoog risico op extrapiramidale bijwerkingen of toename van motorische parkinsonverschijnselen.
De NHG-Standaard Ziekte van Parkinson adviseert in aansluiting bij de Multidisciplinaire Richtlijn Parkinson bij een psychose/delier bij patiënten met de ziekte van Parkinson met de behandelend neuroloog of geriater te overleggen over eventuele aanpassing van de parkinsonmedicatie. Indien aanpassing niet mogelijk is of geen effect heeft, is behandeling met clozapine een mogelijkheid, omdat hierbij het risico op extrapiramidale bijwerkingen gering is. Vanwege het risico bij clozapine op granulocytopenie of agranulocytose, is gedurende deze behandeling intensieve leukocytencontrole noodzakelijk. Geadviseerd wordt dit middel (en eventuele alternatieven; zie Symptomatische behandeling in de palliatieve fase) uitsluitend in overleg met de behandelend specialist voor te schrijven, zie ook de NHG-Standaard Ziekte van Parkinson.
Behandeling in de palliatieve fase
Naar Samenvatting ›Het beleid bij een delier in de palliatieve fase komt in grote lijnen overeen met die van het delier in andere levensfasen, maar kent ook enkele specifieke aandachtspunten (zie Details):
- Wees extra alert op prodromale delierverschijnselen en neem bij vroege herkenning maatregelen om te voorkomen dat een delier en een crisissituatie ontstaan.
- Bestrijd angst, achterdocht, hallucinaties of motorische onrust om de patiënt de mogelijkheid te bieden zijn gedachten weer op orde te krijgen en waardig afscheid te nemen.
- In de palliatieve fase is doorgaans al veel zorg ingezet. Wees bij een delier echter alert dat het zorgsysteem kan (dreigen te) decompenseren.
- Overweeg consultatie van een consulent palliatieve zorg, omdat een delier in de terminale fase moeilijk behandelbaar kan zijn.
De aanbevelingen in deze standaard voor de aanpak van het delier in de palliatieve fase zijn grotendeels overgenomen uit de consensus-based Richtlijn Delier van het Integraal Kankercentrum Nederland.
Symptomatische behandeling in de palliatieve fase
Naar Samenvatting ›Aanbevelingen voor symptomatische behandeling van een delier in de palliatieve fase komen in grote lijnen overeen met bovenstaande aanbevelingen. Let daarbij op de volgende specifieke aandachtspunten (zie Details).
- Overweeg bij gebruik van morfinepreparaten, vooral als het delier zich aandient na een recente verhoging van de morfinedosering, de dosering van het opioïd te verlagen of ‘opioïdwisseling’ (bijvoorbeeld fentanyl in plaats van morfine of vice versa; zie NHG-Standaard Pijn). Consulteer hiervoor zo nodig een kaderhuisarts of consulent palliatieve zorg.
- Behandel een delier waarbij plotselinge onttrekking van middelen een rol lijkt te spelen, zoals na langdurig gebruik van nicotine of benzodiazepinen, in principe door het gestaakte middel (of nicotinepleisters) weer te starten.
- Geef ter bestrijding van angst, hallucinaties of motorische onrust haloperidol (zie Haloperidol), met een maximale dosering van 20 mg/24 uur en zonder beperking in de duur.
- Bouw, bij opklaren van het delier, haloperidol af zoals beschreven onder Haloperidol.
- Overweeg kortdurend een benzodiazepine toe te voegen als een patiënt, ondanks toedienen van haloperidol, erg onrustig blijft (zie Details). Bij patiënten die niet kunnen slikken: lorazepam sublinguaal 1-2 mg, zo nodig elke 6 uur (kan ook i.m., s.c. of i.v. worden toegediend). Bouw dit weer als eerste af, als de patiënt tot rust is gekomen (zie Details).
- Consulteer een kaderhuisarts/consulent palliatieve zorg bij onvoldoende effect of indien haloperidol gecontra-indiceerd is (zie Andere belangrijke punten); overweeg, in nauwe samenspraak met naasten, palliatieve sedatie als ondanks maximale behandeling symptomen van delier persisteren.
- Er is onvoldoende bewijs om bij een hypoactief delier methylfenidaat aan te bevelen (zie Details).
Als een oudere of terminaal zieke patiënt ondanks toedienen van haloperidol erg onrustig blijft, kan het toevoegen van een benzodiazepine zinvol zijn. Benzodiazepinen moeten echter nooit zonder haloperidol worden voorgeschreven, omdat deze middelen het bewustzijn verder verlagen. Dit is onwenselijk omdat het de patiënt de kans ontneemt om greep te krijgen op zijn situatie en een toename van angst en onrust tot gevolg kan hebben. Indien een patiënt tot rust is gekomen, is het raadzaam eerst het benzodiazepine en daarna de haloperidol af te bouwen.
De voorkeur bij ouderen gaat uit naar lorazepam of midazolam, omdat deze middelen een korte halfwaardetijd hebben en geen actieve metabolieten. Hoewel beide middelen parenteraal kunnen worden toegediend, zijn in de NHG-Checklist Spoedgeneesmiddelen in de visitetas midazolam-ampullen wel opgenomen, maar lorazepam alleen in tabletvorm. In situaties waarin een indicatie bestaat voor acute toediening van een benzodiazepine, maar orale toediening van lorazepam niet mogelijk is, wordt derhalve aanbevolen om midazolam intramusculair te geven (zie ook de Behandelrichtlijn Geneesmiddelen en zuurstof in spoedeisende situaties).
In een Cochrane-review uit 2012 werd het beschikbare bewijs over de effectiviteit van medicatie voor de symptomatische behandeling van een delier in de palliatieve fase geëvalueerd, waarbij gezocht werd naar prospectief onderzoek al dan niet gerandomiseerd en/of geblindeerd. Er werd slechts 1 (dubbelblind, niet-placebogecontroleerd) onderzoek gevonden, uitgevoerd in 1996 onder 30 in het ziekenhuis opgenomen terminaal zieke aidspatiënten met een delier (gemiddelde leeftijd 39,2 jaar, spreiding 23 tot 56 jaar), waarin de effectiviteit en bijwerkingen van haloperidol, chloorpromazine en lorazepam werden vergeleken. De score op de Delirium Rating Scale verbeterde bij zowel haloperidol als chloorpromazine alleen gedurende de eerste 24 uur na het starten van de medicatie. De cognitieve status verbeterde in de chloorpromazinegroep gedurende de eerste 24 uur, maar verslechterde weer vanaf de 2e behandeldag. Bij patiënten in de lorazepamgroep verslechterde de cognitie en vanwege excessieve sedatie werd deze behandelarm voortijdig gestaakt. In geen van de behandelgroepen deden zich ernstige extrapiramidale bijwerkingen voor.
De auteurs van de Cochrane-review concluderen dat er onvoldoende bewijs is om conclusies te trekken over de rol van medicamenteuze behandeling van een delier bij terminaal zieke volwassenen en adviseert vooralsnog de huidige richtlijnen, met haloperidol als middel van eerste keus, te volgen.
Methylfenidaat bij hypoactief delier (in de palliatieve fase)
In een klein onderzoek onder 14 patiënten (41 tot 80 jaar) met vergevorderde kanker en een hypoactief delier, resulteerde behandeling met methylfenidaat (2 dd 10 mg oraal, indien nodig verder opgehoogd in stappen van 5 mg tot maximaal 50 mg/dag) in een significante verbetering van de cognitieve functie (de mediane MMSE-score nam toe van 21 voor de start van de behandeling naar 28 bij bereiken van een stabiele, effectieve dosis). Deze cognitieve verbetering hield bij de meeste patiënten stand tot enkele dagen voor het overlijden. In de IKNL-richtlijn Delier wordt gebruik van methylfenidaat bij een hypoactief/stil delier in de palliatieve fase echter niet aanbevolen. Het bewijs is zeer beperkt en bovendien is het niet voldoende duidelijk of er bij de beschreven patiënten wel sprake was van een delier.
Conclusie
er is vrijwel geen bewijs voor de effectiviteit van medicamenteuze behandeling van een delier in de palliatieve fase en de middelenkeuze.
Aanbevelingen
ook bij de behandeling van een delier in de palliatieve fase is haloperidol middel van eerste keus. Er is onvoldoende bewijs is om bij een hypoactief delier methylfenidaat aan te bevelen. De aanbevelingen in de standaard zijn grotendeels overgenomen uit de consensus-based richtlijn Delier van het Integraal Kankercentrum Nederland.
Controles
Naar Samenvatting ›- Verricht bij een patiënt met een delier in de eerste dagen dagelijkse controles:
- controleer de deliersymptomen; in verband met de fluctuaties in de symptomatologie zijn de observaties van verzorgers/familie hierbij van groot belang
- vervolg het beloop van de onderliggende ziekte
- wees alert op mogelijke complicaties zoals ondervoeding, dehydratie, immobiliteit, vallen, urineretentie, incontinentie, decubitus en contracturen
- wees alert op mogelijke oorzaken van pijn en op pijnbeleving
- evalueer de (noodzaak van) aanvullende zorg en belasting van de mantelzorgers
- Spreek af wanneer het volgende bezoek plaatsvindt.
- Geef instructies om contact op te nemen als de toestand verslechtert of als niet meer aan de voorwaarden voor een adequate thuisbehandeling is te voldoen.
- Pas de medicamenteuze behandeling aan of verricht nadere diagnostiek naar nog niet onderkende oorzaken indien het delier niet opklaart.
- Zorg voor een goede overdracht naar de huisartsenpost voor de continuïteit van zorg in avond-, nacht- en weekenddiensten.
Consultatie en verwijzing
Naar Samenvatting ›- Gezien het vaak complexe, multifactoriële en urgente karakter van het toestandsbeeld, kan het raadzaam zijn te overleggen met een specialist over de diagnose, de behandeling en/of de verzorging. Denk hierbij, afhankelijk van de situatie, aan een specialist ouderengeneeskunde, klinisch geriater, internist met aandachtsgebied ouderengeneeskunde, ouderenpsychiater of de specialist bij wie de patiënt al onder behandeling is.
- Overleg in de palliatieve fase met een consulent palliatieve zorg en overweeg verzorging in een hospice.
- Indicaties voor consultatie en/of verwijzing bij (vermoeden van) een delier zijn:
- onvoldoende onderzoeks-, behandel- en verzorgingsmogelijkheden of veiligheid in de thuissituatie
- onvoldoende effect van de ingestelde behandeling
- noodzaak om medicamenteuze symptoombestrijding > 1 week te continueren
- patiënten met de ziekte van Parkinson (zie Details) of ‘Lewy body’-dementie (zie Andere belangrijke punten)
- Verwijs naar een (niet-psychiatrisch) ziekenhuis indien verwijzing of opname geïndiceerd is (zie Details).
Neuropsychiatrische verschijnselen bij patiënten met de ziekte van Parkinson kunnen berusten op: delier ten gevolge van antiparkinsonmedicatie, geassocieerde comorbiditeit zoals dementie en depressie, een psychiatrische stoornis die niet gerelateerd is aan de ziekte van Parkinson of medicatie en een delier op basis van een bijkomende somatische aandoening. Alle antiparkinsonmiddelen (anticholinergica, amantadine, levodopa, dopaminereceptoragonisten, monoamineoxidaseremmers) kunnen een delier (mede) veroorzaken. Het gebruik van andere antiparkinsonmiddelen naast levodopa veroorzaakt een groter risico op hallucinaties dan het gebruik van levodopa alleen; zie ook de NHG-Standaard Ziekte van Parkinson.
Aanbeveling
Omdat het delier bij de ziekte van Parkinson een complex beeld is, is de werkgroep van mening dat dit (spoed)overleg vergt met de behandelend specialist.
Het is van belang een delier te herkennen als een ernstig psychiatrisch syndroom ten gevolge van een lichamelijke aandoening. Een belangrijke valkuil is dat de gedragsstoornis die bij het delier hoort als een primair psychiatrische aandoening wordt beschouwd, waarna lichamelijk onderzoek achterwege blijft en de patiënt wordt verwezen naar een psychiatrische instelling, die veelal onvoldoende is toegerust voor goede somatische diagnostiek en behandeling.
Een delirante patiënt heeft een aangepaste veilige omgeving nodig, met zowel goede somatische zorg als aandacht voor de behandeling van het delier. Een geriatrische afdeling algemeen ziekenhuis (GAAZ) voldoet aan deze criteria, waarbij onderlinge afspraken binnen het ziekenhuis uiteindelijk bepalend zijn waar een patiënt het beste opgenomen kan worden (zie ook MDR Delier, publicatie verwacht begin 2014).
Nazorg
Naar Samenvatting ›Het doormaken van een delier is een stressvolle gebeurtenis, voor zowel de patiënt als de naasten. Daarom is nazorg van belang. Deze bestaat uit de volgende elementen.
- Bied, na het verdwijnen van de delirante symptomen en het opklaren van de lichamelijke toestand, aan de gebeurtenissen tijdens de delierperiode te bespreken met de patiënt en mantelzorger(s) met aandacht voor de oorzaak van het delier, de herinneringen die de patiënt aan deze periode heeft en de emoties die dit oproept (zie Details). Door aandacht aan de symptomen van delier te schenken is het voor de mantelzorger mogelijk om een volgende keer deze symptomen (vroeg) te herkennen.
- Adviseer om bij opnieuw optreden van vergelijkbare symptomen direct contact met de huisarts op te nemen.
- Verricht bij eventuele restverschijnselen in overleg met de patiënt gericht aanvullend onderzoek (zoals MMSE; zie NHG-Standaard Dementie).
- Vermeld een doorgemaakt delier duidelijk in het dossier van de patiënt en bij een eventuele nieuwe ziekenhuisopname.
De herinneringen aan een delier zijn sterk verschillend; sommige patiënten kunnen zich de episode niet herinneren, terwijl anderen er levendige en angstige herinneringen aan hebben. Het kan nodig zijn de patiënt bij de verwerking hiervan te begeleiden. Er zijn ook aanwijzingen dat een delier (tijdens ziekenhuisopname) geassocieerd is met een verhoogd risico op depressie en angst. In een literatuurstudie werden acht onderzoeken geïncludeerd, waarvan vier onderzoeken een statistisch significante associatie vonden tussen een delier en depressieve symptomen tot twee jaar na de delierepisode; één studie vond een dergelijke associatie tussen delier en angstsymptomen.
In hun review van de literatuur over ervaringen van patiënten, hun naasten en verzorgers concluderen O’Malley et al. dat een delier vooral distress oplevert als er sprake was van wanen en hallucinaties, dat niet alle patiënten hun ervaring willen bespreken en dat er geen evidence is dat debriefing op lange termijn psychologische problemen voorkomt en evenmin dat het schaadt als mensen het liever laten rusten.
In een dwarsdoorsnedeonderzoek onder 200 mantelzorgers van patiënten met kanker en een levensverwachting minder dan 6 maanden werd nagegaan of en hoe vaak de mantelzorger de patiënt verward/delirant mee had gemaakt en of dit geassocieerd was met psychische problemen en ervaren belasting van de mantelzorger. Mantelzorgers van patiënten met een delier hadden significant vaker last van gegeneraliseerde angst dan mantelzorgers van niet-delirante patiënten (OR 12,1; p < 0,01).
Conclusie
Het doormaken van delier is voor de patiënt en diens verzorgers een stressvolle gebeurtenis.
Aanbeveling
De werkgroep adviseert dat nabespreking en hulp bij verwerking wordt aangeboden en plaatsvindt op geleide van de behoefte van de patiënt en zijn mantelzorger(s).
Overdracht en zorg na ontslag bij persisterend delier
Naar Samenvatting ›- Als een patiënt een delier in het ziekenhuis heeft doorgemaakt is deze vaak niet volledig hersteld bij ontslag (zie Details). Het streven is een voorgeschreven antipsychoticum zo snel mogelijk, op geleide van de symptomen af te bouwen (zie Medicamenteuze behandeling van deliersymptomen).
- Als voorbereiding op het ontslag van een patiënt met nog aanwezige symptomen is transmuraal overleg tussen behandelend specialist en huisarts vereist om adequate zorg in een veilige omgeving te waarborgen (zie kader Aandachtspunten voor overdracht naar de huisarts) evenals afstemming met patiënt, mantelzorger, professionals van de afdeling waar de patiënt heeft gelegen, en eventueel de thuiszorgorganisatie.
Cole et al. verrichtten een systematische review om de prognose van een delier in het ziekenhuis te achterhalen. Zij includeerden 18 onderzoeken met in totaal 1322 patiënten van 50 jaar en ouder met een delier.
Het percentage patiënten met nog persisterende symptomen van een delier bij ontslag, en na 1, 3 en 6 maanden na ontslag was respectievelijk 45% (95%-BI 27 tot 64%), 33% (95%-BI 18 tot 47%), 26% (95%-BI 8 tot 43%) en 21% (95%-BI 1 tot 41%). Op de uitkomsten mortaliteit, verpleeghuisopname, functie en cognitie scoorden patiënten met een bij ontslag nog persisterend delier consistent slechter dan patiënten die tijdens ziekenhuisopname waren hersteld van hun delier.
Aandachtspunten voor overdracht naar de huisarts
Naar Samenvatting ›Voor de overdracht naar de huisarts bij ontslag van een patiënt met persisterende symptomen van delier vanuit een ziekenhuis/instelling naar (verzorgings)huis, zijn de volgende punten van belang.
- Gebruikelijke overdrachtgegevens en daarnaast:
- waarden van het ADL-functioneren om het niveau van noodzakelijke steun te bepalen
- de aanwezige symptomen van delier, met eventueel de DOS-score (zie Details)
- de mate van cognitief functioneren (bijvoorbeeld MMSE) bij ontslag
- Informatie over de verstrekte informatie aan patiënt en mantelzorger over het delier
- Afbouwschema van deliermedicatie (indien van toepassing)
- Contactgegevens van de behandelaar van het delier, met wie de huisarts contact zoekt als het delier niet verbleekt of de medicatieafbouw niet lukt
- Gegevens van degenen die thuis ADL-ondersteuning gaan bieden (thuiszorg/mantelzorg)
- Afspraak wie informatie verstrekt over de prognose van het delier qua herstel en recidief
- Advies over niet-medicamenteuze maatregelen
Deze aandachtspunten zijn ontleend aan de multidisciplinaire richtlijn Delier en vergen regionale afstemming en invulling.
Hoewel de Delier Observatie Screening (DOS) schaal niet voor gebruik in de huisartsenpraktijk is gevalideerd en daarom in deze standaard niet wordt aanbevolen (zie Gebruik observatieschalen), wordt de DOS wel in toenemende mate in de tweede lijn gebruikt. Dit kan betekenen dat in de communicatie over een patiënt de DOS-score wordt genoemd. Om de huisarts in staat te stellen een dergelijke score te kunnen interpreteren heeft de werkgroep besloten, de DOS, de manier waarop deze wordt gescoord en de interpretatie van de score hier weer te geven. (Zie tabel 2).
| De patiënt | nooit | soms-altijd | weet niet | |
|---|---|---|---|---|
| 1 | zakt weg tijdens gesprek of bezigheden | 0 | 1 | - |
| 2 | is snel afgeleid door prikkels uit de omgeving | 0 | 1 | - |
| 3 | heeft aandacht voor gesprek of handeling | 1 | 0 | - |
| 4 | maakt vraag of antwoord niet af | 0 | 1 | - |
| 5 | geeft antwoorden die niet passen bij de vraag | 0 | 1 | - |
| 6 | reageert traag op opdrachten | 0 | 1 | - |
| 7 | denkt ergens anders te zijn | 0 | 1 | - |
| 8 | beseft wel welk dagdeel het is | 1 | 0 | - |
| 9 | herinnert zich recente gebeurtenis | 1 | 0 | - |
| 10 | is plukkerig, rommelig, rusteloos | 0 | 1 | - |
| 11 | trekt aan infuus, sonde, katheter etc. | 0 | 1 | - |
| 12 | is snel of plotseling geëmotioneerd | 0 | 1 | - |
| 13 | ziet/hoort dingen die er niet zijn | 0 | 1 | - |
| Elk item wordt gescoord met 0 of 1 punt of geen score (‘weet niet’). DOS-scores variëren dus van 0 (‘normaal gedrag’) tot 13. Interpretatie: 3 punten of meer is een indicatie voor aanwezigheid van een delier. De DOS is niet bedoeld om de diagnose delier te stellen, maar de uitslag geeft wel een indicatie voor aanwezigheid en de ernst van een delier. Om de diagnose delier te kunnen stellen is aanvullend informatie nodig over het begin van de symptomen (acuut) en het beloop over de dag (fluctuerend). | ||||
Preventie
Naar Samenvatting ›Alertheid op recidief-delier
Naar Samenvatting ›Wees bij patiënten die eerder een delier doormaakten alert op het ontwikkelen van een recidief-delier bij een volgende stress- of ziekte-episode.
Risicofactoren recidief-delier
Naar Samenvatting ›Richt de zorg op het zo veel mogelijk beperken van risicofactoren voor een recidief-delier (zie ook uitlokkende factoren in Etiologie en pathofysiologie). In aansluiting op de individuele situatie en risicofactoren en zo mogelijk in samenwerking met mantelzorger(s), bestaat deze zorg uit een combinatie van de volgende elementen (zie Details):
- optimaliseren oriëntatie en vertrouwdheid:
- verzorging bij voorkeur door bekende personen
- (nieuwe) verzorgers geven heldere uitleg over hun rol
- duidelijke oriëntatiepunten bieden (klok, kalender) en goede verlichting
- optimaliseren visus en gehoor (nagaan of bril op sterkte is en gehoorapparaat functioneert en of ze worden gebruikt; oorsmeer verwijderen)
- stimuleren cognitieve activiteiten
- optimaliseren behandeling:
- medicatie beperken, vooral middelen met een sterk anticholinerge werking (zie kader Geneesmiddelen met verhoogd risico op delier)
- op indicatie: elektrolytcontrole
- optimaliseren individueel noodzakelijke behandeling, zoals pijnbehandeling, zuurstoftoediening
- voorkomen (iatrogene) infecties (bijvoorbeeld katheters vermijden)
- optimaliseren lichamelijke conditie:
- stimuleren adequate vochtinname
- obstipatie tegengaan
- stimuleren adequate voeding (onder andere nagaan of gebit goed past) en goede mondhygiëne
- stimuleren voldoende slaap en regelmatig slaappatroon
- stimuleren mobilisatie/bewegen (lopen, actief oefenschema)
De geactualiseerde NICE-richtlijn uit 2010 heeft de beschikbare evidence geëvalueerd van preventieve maatregelen (los of als pakket) gericht op het voorkomen van delier onder hoogrisicopatiënten in het ziekenhuis en in zorginstellingen voor langdurig verblijf. Dit leverde alleen betrouwbare onderzoeksgegevens op over in het ziekenhuis opgenomen patiënten, vooral van twee onderzoeken van redelijk respectievelijk hoge kwaliteit, die elk een pakket aan preventieve maatregelen onderzochten. Aanbevelingen voor preventieve maatregelen voor hoog-risicopatiënten opgenomen in zorginstellingen voor langdurig verblijf of thuiswonend zijn daarom noodgedwongen gebaseerd op dit indirecte bewijs.
Referenties
- American Psychiatric Association. Diagnostic and Statistical Manual of Mental Disorders: DSM-5. Washington DC: American Psychiatric Association, 2013.
- De Rooij SE, Schuurmans MJ, Van der Mast RC, Levi M. Clinical subtypes of delirium and their relevance for daily clinical practice: a systematic review. Int J Geriatr Psychiatry 2005;20:609-15.
- Meagher DJ, Leonard M, Donnelly S, Conroy M, Adamis D, Trzepacz PT. A longitudinal study of motor subtypes in delirium: frequency and stability during episodes. J Psychosom Res 2012;72:236-41.
- Davis D, MacLullich A. Understanding barriers to delirium care: a multicentre survey of knowledge and attitudes amongst UK junior doctors. Age Ageing 2009;38:559-63.
- Swigart SE, Kishi Y, Thurber S, Kathol RG, Meller WH. Misdiagnosed delirium in patient referrals to a university-based hospital psychiatry department. Psychosomatics 2008;49:104-8.
- Okkes IM, Oskam SK, Van Boven K, Lamberts H. EFP. Episodes of care in Family Practice. Epidemiological data based on the routine use of the International Classification of Primary Care (ICPC) in the Transition Project of the Academic Medical Center/University of Amsterdam (1985-2003). In: Okkes IM, Oskam SK, Lamberts H, editors. ICPC in the Amsterdam Transition Project. Oxford: Oxford University Press, 2005.
- De Lange E, Verhaak PF, Van der Meer K. Prevalence, presentation and prognosis of delirium in older people in the population, at home and in long term care: a review. Int J Geriatr Psychiatry 2012;28:127-34.
- Bull MJ. Delirium in older adults attending adult day care and family caregiver distress. Int J Older People Nurs 2011;6:85-92.
- Boorsma M, Joling KJ, Frijters DH, Ribbe ME, Nijpels G, Van Hout HP. The prevalence, incidence and risk factors for delirium in Dutch nursing homes and residential care homes. Int J Geriatr Psychiatry 2012;27:709-15.
- Witlox J, Eurelings LS, De Jonghe JF, Kalisvaart KJ, Eikelenboom P, Van Gool WA. Delirium in elderly patients and the risk of postdischarge mortality, institutionalization, and dementia: a meta-analysis. JAMA 2010;304:443-51.
- Fong TG, Jones RN, Shi P, Marcantonio ER, Yap L, Rudolph JL et al. Delirium accelerates cognitive decline in Alzheimer disease. Neurology 2009;72:1570-5.
- Kat MG, De Jonghe JF, Vreeswijk R, Van der Ploeg T, Van Gool WA, Eikelenboom P, et al. Mortality associated with delirium after hip-surgery: a 2-year follow-up study. Age Ageing 2011;40:312-8.
- Cole MG, Ciampi A, Belzile E, Zhong L. Persistent delirium in older hospital patients: a systematic review of frequency and prognosis. Age Ageing 2009;38:19-26.
- Rudberg MA, Pompei P, Foreman MD, Ross RE, Cassel CK. The natural history of delirium in older hospitalized patients: a syndrome of heterogeneity. Age Ageing 1997;26:169-74.
- McCusker J, Cole M, Dendukuri N, Han L, Belzile E. The course of delirium in older medical inpatients: a prospective study. J Gen Intern Med 2003;18:696-704.
- Dasgupta M, Hillier LM. Factors associated with prolonged delirium: a systematic review. Int Psychogeriatr 2010;22:373-94.
- Van der Mast RC. Pathophysiology of delirium. J Geriatr Psychiatry Neurol 1998;11:138-45.
- Maldonado JR. Pathoetiological model of delirium: a comprehensive understanding of the neurobiology of delirium and an evidence-based approach to prevention and treatment. Crit Care Clin 2008;24:789-856, ix.
- Maclullich AM, Ferguson KJ, Miller T, De Rooij SE, Cunningham C. Unravelling the pathophysiology of delirium: a focus on the role of aberrant stress responses. J Psychosom Res 2008;65:229-38.
- Olde Rikkert MG, Rigaud AS, Van Hoeyweghen RJ, De Graaf J. Geriatric syndromes: medical misnomer or progress in geriatrics? Neth J Med 2003;61:83-7.
- Inouye SK, Studenski S, Tinetti ME, Kuchel GA. Geriatric syndromes: clinical, research, and policy implications of a core geriatric concept. J Am Geriatr Soc 2007;55:780-91.
- Lipowski ZJ. Delirium in the elderly patient. N Engl J Med 1989;320:578-82.
- Olde Rikkert MGM, Van de Lisdonk EH. ABC voor analyse van acute verwardheid bij ouderen. Huisarts Wet 2001;44:291-6.
- Laurila JV, Laakkonen ML, Tilvis RS, Pitkala KH. Predisposing and precipitating factors for delirium in a frail geriatric population. J Psychosom Res 2008;65:249-54.
- Eriksson I, Gustafson Y, Fagerstrom L, Olofsson B. Urinary tract infection in very old women is associated with delirium. Int Psychogeriatr 2011;23:496-502.
- NICE. Delirium: diagnosis, prevention and management (2010). Ga naar bron: NICE. Delirium: diagnosis, prevention and management (2010).
- Gallagher P, O’Mahony D. STOPP (Screening Tool of Older Persons’ potentially inappropriate Prescriptions): application to acutely ill elderly patients and comparison with Beers’ criteria. Age Ageing 2008;37:673-9.
- Aronson JK. Meyler’s side effects of drugs: The international encyclopedia of adverse drug reactions and interactions. Amsterdam: Elsevier, 2006.
- Clegg A, Young JB. Which medications to avoid in people at risk of delirium: a systematic review. Age Ageing 2011;40:23-9.
- Wanrooij B, Koelewijn M. De aanpak van het delier in de palliatieve fase. Huisarts Wet 2005;48:362-7.
- Bannink M, De Graeff A, Monster H. IKNL. Delier landelijke richtlijn, versie 3.0 (2010). Pallialine. Ga naar bron: Bannink M, De Graeff A, Monster H. IKNL. Delier landelijke richtlijn, versie 3.0 (2010). Pallialine.
- Adamis D, Sharma N, Whelan PJ, Macdonald AJ. Delirium scales: A review of current evidence. Aging Ment Health 2010;14:543-55.
- Wong CL, Holroyd-Leduc J, Simel DL, Straus SE. Does this patient have delirium?: value of bedside instruments. JAMA 2010;304:779-86.
- Inouye SK, Van Dyck CH, Alessi CA, Balkin S, Siegal AP, Horwitz RI. Clarifying confusion: the confusion assessment method. A new method for detection of delirium. Ann Intern Med 1990;113:941-8.
- Timmers J, Kalisvaart K, Schuurmans M, De Jonghe J. Een overzicht van beoordelingsschalen voor delier. Tijdschr Gerontol Geriatr 2004;35:5-14.
- Steis MR, Evans L, Hirschman KB, Hanlon A, Fick DM, Flanagan N et al. Screening for delirium using family caregivers: convergent validity of the Family Confusion Assessment Method and interviewer-rated Confusion Assessment Method. J Am Geriatr Soc 2012;60:2121-6.
- Schuurmans MJ, Deschamps PI, Markham SW, Shortridge-Baggett LM, Duursma SA. The measurement of delirium: review of scales. Res Theory Nurs Pract 2003;17:207-24.
- Scheffer AC, Van Munster BC, Schuurmans MJ, De Rooij SE. Assessing severity of delirium by the Delirium Observation Screening Scale. Int J Geriatr Psychiatry 2011;26:284-91.
- Raymakers JA. Hypercalciëmie bij bejaarden. Tijdschr Gerontol Geriatr 1990;21:11-6.
- Carter GL, Dawson AH, Lopert R. Drug-induced delirium. Incidence, management and prevention. Drug Saf 1996;15:291-301.
- Farrell KR, Ganzini L. Misdiagnosing delirium as depression in medically ill elderly patients. Arch Intern Med 1995;155:2459-64.
- Teunisse RJ. Complexe visuele hallucinaties bij slechtziende ouderen: syndroom van Charles Bonnet. Ned Tijdschr Geneeskd 2002;146:49-52.
- Meagher DJ, Moran M, Raju B, Gibbons D, Donnelly S, Saunders J, et al. Phenomenology of delirium. Assessment of 100 adult cases using standardised measures. Br J Psychiatry 2007;190:135-41.
- Drevets WC, Rubin EH. Psychotic symptoms and the longitudinal course of senile dementia of the Alzheimer type. Biol Psychiatry 1989;25:39-48.
- Auning E, Rongve A, Fladby T, Booij J, Hortobagyi T, Siepel FJ, et al. Early and presenting symptoms of dementia with lewy bodies. Dement Geriatr Cogn Disord 2011;32:202-8.
- McCusker J, Cole M, Abrahamowicz M, Han L, Podoba JE, Ramman-Haddad L. Environmental risk factors for delirium in hospitalized older people. J Am Geriatr Soc 2001;49:1327-34.
- Inouye SK, Charpentier PA. Precipitating factors for delirium in hospitalized elderly persons. Predictive model and interrelationship with baseline vulnerability. JAMA 1996;275:852-7.
- Brungardt GS. Patient restraints: new guidelines for a less restrictive approach. Geriatrics 1994;49:43-50.
- Lonergan E, Luxenberg J, Areosa SA. Benzodiazepines for delirium. Cochrane Database Syst Rev 2009;CD006379.
- Kalisvaart KJ, De Jonghe JF, Bogaards MJ, Vreeswijk R, Egberts TC, Burger BJ, et al. Haloperidol prophylaxis for elderly hip-surgery patients at risk for delirium: a randomized placebo-controlled study. J Am Geriatr Soc 2005;53:1658-66.
- Peritogiannis V, Stefanou E, Lixouriotis C, Gkogkos C, Rizos DV. Atypical antipsychotics in the treatment of delirium. Psychiatry Clin Neurosci 2009;63:623-31.
- Kim SW, Yoo JA, Lee SY, Kim SY, Bae KY, Yang SJ, et al. Risperidone versus olanzapine for the treatment of delirium. Hum Psychopharmacol 2010;25:298-302.
- Tahir TA, Eeles E, Karapareddy V, Muthuvelu P, Chapple S, Phillips B et al. A randomized controlled trial of quetiapine versus placebo in the treatment of delirium. J Psychosom Res 2010;69:485-90.
- Expertisecentrum Pharmacotherapie bij Ouderen. Antipsychotica (2012). Ga naar bron: Expertisecentrum Pharmacotherapie bij Ouderen. Antipsychotica (2012).
- Beach SR, Celano CM, Noseworthy PA, Januzzi JL, Huffman JC. QTc prolongation, torsades de pointes, and psychotropic medications. Psychosomatics 2013;54:1-13.
- Alexopoulos GS, Streim J, Carpenter D, Docherty JP. Using antipsychotic agents in older patients. J Clin Psychiatry 2004;65 Suppl 2:5-99.
- Overshott R, Karim S, Burns A. Cholinesterase inhibitors for delirium. Cochrane Database Syst Rev 2008;CD005317.
- Van Eijk MM, Roes KC, Honing ML, Kuiper MA, Karakus A, Van der Jagt M, et al. Effect of rivastigmine as an adjunct to usual care with haloperidol on duration of delirium and mortality in critically ill patients: a multicentre, double-blind, placebo-controlled randomised trial. Lancet 2010;376:1829-37.
- Huisman-Baron M, Van der Veen L, Jansen PA, Van Roon EN, Brouwers JR, Van Marum RJ. Criteria for drug selection in frail elderly persons. Drugs Aging 2011;28:391-402.
- Candy B, Jackson KC, Jones L, Leurent B, Tookman A, King M. Drug therapy for delirium in terminally ill adult patients. Cochrane Database Syst Rev 2012;11:CD004770.
- Gagnon B, Low G, Schreier G. Methylphenidate hydrochloride improves cognitive function in patients with advanced cancer and hypoactive delirium: a prospective clinical study. J Psychiatry Neurosci 2005;30:100-7.
- Gray SL, Lai KV, Larson EB. Drug-induced cognition disorders in the elderly: incidence, prevention and management. Drug Saf 1999;21:101-22.
- Young BK, Camicioli R, Ganzini L. Neuropsychiatric adverse effects of antiparkinsonian drugs. Characteristics, evaluation and treatment. Drugs Aging 1997;10:367-83.
- Van Waarde JA, Van der Mast RC. Een delirium? Opname in het algemene ziekenhuis, niet in het psychiatrische. Ned Tijdschr Geneeskd 2000;144:913-5.
- Davydow DS. Symptoms of depression and anxiety after delirium. Psychosomatics 2009;50:309-16.
- O’Malley G, Leonard M, Meagher D, O’Keeffe ST. The delirium experience: a review. J Psychosom Res 2008;65:223-8.
- Buss MK, Vanderwerker LC, Inouye SK, Zhang B, Block SD, Prigerson HG. Associations between caregiver-perceived delirium in patients with cancer and generalized anxiety in their caregivers. J Palliat Med 2007;10:1083-92.
- Inouye SK, Bogardus ST, Jr., Charpentier PA, Leo-Summers L, Acampora D, Holford TR, et al. A multicomponent intervention to prevent delirium in hospitalized older patients. N Engl J Med 1999;340:669-76.
- Marcantonio ER, Flacker JM, Wright RJ, Resnick NM. Reducing delirium after hip fracture: a randomized trial. J Am Geriatr Soc 2001;49:516-22.
- O’Mahony R, Murthy L, Akunne A, Young J. Synopsis of the National Institute for Health and Clinical Excellence guideline for prevention of delirium. Ann Intern Med 2011;154:746-51.