Astma bij kinderen
Richtlijnen diagnostiek
Naar Volledige tekst ›Overweeg astma bij kinderen met recidiverende klachten van een piepende uitademing, hoesten, kortademigheid of benauwdheid.
Anamnese
Naar Volledige tekst ›Vraag naar:
- piepende uitademing, hoesten, kortademigheid of benauwdheid
- ernst, duur, frequentie en het patroon van de klachten
- aanwijzingen voor allergische of niet-allergische prikkels
- roken door de ouders, de omgeving of het kind zelf
- invloed op het dagelijks functioneren
Inventariseer:
- voorgeschiedenis en comorbiditeit: perinatale gegevens, frequentie van luchtweginfecties of klachtenperiodes, atopie, allergie, afbuigen van de groeicurve
- familieanamnese: astma, atopie bij eerstegraads familieleden
Lichamelijk onderzoek
Naar Volledige tekst ›- Let op gebruik van hulpademhalingsspieren, neusvleugelen, intrekkingen sub- of intercostaal.
- Bij tekenen van dyspneu: tel adem- en hartfrequentie en overweeg saturatiemeting.
- Ausculteer de longen: let op verlengd expirium en expiratoir piepen.
Aanvullend onderzoek
Naar Volledige tekst ›- Bij kinderen < 6 jaar: bloedonderzoek op inhalatieallergenen alleen bij twijfel over het in te stellen beleid.
- Bij kinderen ≥ 6 jaar:
- bloedonderzoek op inhalatieallergenen heeft in de diagnostische fase geen toegevoegde waarde.
- overweeg een bloedonderzoek op inhalatieallergenen in de beleidsfase met als doel nog niet eerder onderkende allergieën te vinden.
- overweeg spirometrie bij twijfel over de diagnose ‘astma’.
Evaluatie
Naar Volledige tekst ›- Bij kinderen < 6 jaar:
- wees terughoudend met het stellen van de diagnose ‘astma’.
- stel de symptoomdiagnose ‘episodisch expiratoir piepen’ bij ≥ 2 episodes met expiratoir piepen.
- Bij kinderen ≥ 6 jaar:
- stel de diagnose ‘astma’ alleen bij hoge waarschijnlijkheid. Astma is waarschijnlijker bij: piepende uitademing, hoesten, kortademigheid of benauwdheid, piepend verlengd expirium over meerdere longvelden, verbetering na SABA en atopische aanleg (zie verder tabel 4 in de volledige tekst).
- indien spirometrie verricht: aangetoonde reversibiliteit (≥ 12%) toont astma aan, normale spirometrie sluit astma niet uit.
Richtlijnen beleid
Naar Volledige tekst ›- Doel van de behandeling is goede astmacontrole: zo min mogelijk klachten, geen beperkingen in activiteiten, normale deelname aan het maatschappelijke leven en zo min mogelijk bijwerkingen van medicatie, afgestemd op de persoonlijke behandeldoelen.
- Gebruik hiervoor de kenmerken: klachten overdag, beperkingen in activiteiten, klachten tijdens slapen en gebruik van SABA (zie tabel 6 in de volledige tekst).
Voorlichting en niet-medicamenteuze behandeling
Naar Volledige tekst ›- Geef voorlichting over de aandoening, doel en werking van de medicatie en het zorgproces.
- Adviseer prikkels die klachten uitlokken te vermijden.
- Raad roken af door ouders, door het kind zelf en door anderen in de omgeving van het kind.
- Bespreek het belang van regelmatige lichaamsbeweging.
- Bespreek hoe kind en ouders met de aandoening omgaan.
Medicamenteuze behandeling
Naar Volledige tekst ›- Geef inhalatiemedicatie bij klachten en als onderhoudsbehandeling (zie tabel 9 in de volledige tekst).
- Kies afhankelijk van leeftijd, inhalatiekracht, oog-handcoördinatie en voorkeuren van het kind of de ouders een dosisaerosol of een poederinhalator.
- Zorg voor goede inhalatie-instructie.
- Ga bij onvoldoende astmacontrole (≥ 6 jaar) of bij onvoldoende verbetering van de klachten (< 6 jaar) naar een volgende stap.
- Geef instructies voor het beleid bij toename van klachten.
Stappenplan episodisch expiratoir piepen bij kinderen < 1 jaar
Naar Volledige tekst ›- Stap 1: geef tijdens het consult SABA (voor doseringen zie tabel 1). Bij goed effect: geef SABA zo nodig bij klachten. Evalueer het effect na 1-2 weken.
- Stap 2: verwijs bij persisterende klachten.
Stappenplan episodisch expiratoir piepen bij kinderen 1-6 jaar
Naar Volledige tekst ›- Stap 1: geef tijdens het consult een SABA (voor doseringen zie tabel 1). Bij goed effect: geef SABA zo nodig bij klachten. Evalueer het effect na 1-2 weken.
- Stap 2: voeg gedurende 6 weken een ICS toe in de startdosering (voor doseringen zie tabel 2). Bij voldoende verbetering: continueer de ICS in de startdosering nog 6 weken. Bouw hierna, indien er geen klachten meer zijn, de ICS af.
- Stap 3: verwijs of consulteer bij onvoldoende verbetering na 6 weken.
Stappenplan astma bij kinderen ≥ 6 jaar
Naar Volledige tekst ›- Stap 1: geef bij weinig frequente klachten (< 2 × per week overdag) een SABA zo nodig (voor doseringen zie tabel 1).
- Gebruik bij inspanningsklachten een SABA uiterlijk 10-15 minuten voor de inspanning.
- Stap 2: voeg een ICS toe in de startdosering gedurende 3 maanden (voor doseringen zie tabel 2). Streef daarna naar afbouwen van de dosering naar een zo laag mogelijke effectieve dosering waarbij goede astmacontrole wordt bereikt.
- Stap 3: verwijs of consulteer bij onvoldoende verbetering na 3 maanden.
Controles
Naar Volledige tekst ›- Maak bij elke controle onderscheid tussen goede en onvoldoende astmacontrole. Overweeg spirometrie bij twijfel hierover.
- Frequentie van de controles:
- bij goede astmacontrole:
- stap-1-medicatie: na 3-6 maanden, verdere controle niet noodzakelijk bij gelijkblijvend klachtenpatroon en < 2 × per week SABA
- stap-2-medicatie: eerste jaar elke 3-6 maanden, daarna minimaal jaarlijks.
- bij onvoldoende astmacontrole: elke 2-4 weken; verwijs of consulteer na 6 weken (kinderen 1-6 jaar) tot 3 maanden (kinderen ≥ 6 jaar).
- bij goede astmacontrole:
- Vraag naar luchtwegklachten, aanpassingen of beperkingen, SABA-gebruik, bijwerkingen.
- Ga de TIP-aandachtspunten na: therapietrouw, inhalatietechniek en prikkelvermijding.
- Bij goede astmacontrole > 1 jaar: overweeg ICS af te bouwen in stappen van 25-50% per 3 maanden.
Acute ernstige dyspneu (longaanval astma)
Naar Volledige tekst ›Zie hoofdtekst of NHG-Behandelrichtlijn Geneesmiddelen en zuurstof in spoedeisende situaties.
Consultatie en verwijzing
Naar Volledige tekst ›Verwijs naar of consulteer een kinder(long)arts of kaderhuisarts astma bij:
- twijfel aan de diagnose ‘astma’
- kinderen < 1 jaar: onvoldoende verbetering door SABA
- kinderen van 1-6 jaar: onvoldoende verbetering door ICS gedurende 6 weken
- kinderen ≥ 6 jaar: niet bereiken van goede astmacontrole met ICS gedurende 3 maanden
- ≥ 1 ziekenhuisopnames of ≥ 2 prednisonkuren in de voorafgaande 12 maanden wegens astma
|
Geneesmiddel |
Leeftijd |
Dosering (microgram) |
Maximale dosering per dag (microgram) |
|---|---|---|---|
|
Kortwerkende bèta-2-sympathicomimetica (short acting bèta-2-agonists, SABA) |
|||
|
Salbutamol (werkingsduur 4-6 uur) |
|||
|
aerosol |
< 1 jaar |
1-4 dd 100-200 |
800 |
|
aerosol |
≥1 jaar |
1-4 dd 100-400 |
1600 |
|
poeder* |
1-4 dd 100-200 |
1600 |
|
|
Terbutaline |
|||
|
poeder* |
1-4 dd 500 |
4000 |
|
|
Kortwerkende parasympaticolytica (short-acting muscarin antagonists, SAMA) |
|||
|
Ipratropium (zelden geïndiceerd, uitsluitend als SABA niet verdragen wordt) |
|||
|
aerosol |
> 1 maand |
1-4 dd 20-40 |
320 |
|
poeder* |
|
1-4 dd 40-80 |
640 |
|
* Aanbevolen vanaf 7 jaar, zie Keuze toedieningsvorm. |
|||
|
|
Startdosering (microgram) |
Lagere dosering (microgram) |
|---|---|---|
|
Beclometason |
||
|
dosisaerosol |
2 dd 200 |
1-2 dd 50-100 |
|
extrafijn dosisaerosol |
2 dd 100 |
1-2 dd 50 |
|
poeder* |
2 dd 200 |
1 dd 200 |
|
Budesonide |
||
|
dosisaerosol |
2 dd 200 |
1 dd 200 |
|
poeder* |
2 dd 200 |
1-2 dd 100 |
|
Fluticasonproprionaat |
||
|
dosisaerosol |
2 dd 125 |
1-2 dd 50-125 |
|
poeder* |
2 dd 100 |
1 dd 100 |
|
Ciclesonide† |
||
|
dosisaerosol |
1 dd 160 |
1 dd 80 |
|
* Aanbevolen vanaf 7 jaar, zie Keuze toedieningsvorm. |
||
Belangrijkste wijzigingen
Naar Samenvatting ›- Bij kinderen < 6 jaar met episodisch expiratoir piepen wordt bloedonderzoek op inhalatieallergenen alleen aanbevolen als er twijfel is over het in te stellen beleid.
- Bij kinderen ≥ 6 jaar heeft in de diagnostische fase een bloedonderzoek op inhalatieallergenen geen toegevoegde waarde. In de beleidsfase kan dit bloedonderzoek worden overwogen om niet eerder onderkende allergieën te vinden.
- De driedeling goede, gedeeltelijke en slechte astmacontrole is vervangen door de tweedeling goede en onvoldoende astmacontrole.
- De adviezen voor gebruik van kortwerkende bèta-2-sympathicomimetica (short acting beta-2-agonists, SABA) bij kinderen die frequent sporten, zijn verduidelijkt.
- Er zijn adviezen toegevoegd voor het afbouwen van inhalatiecorticosteroïden (ICS).
- Het beleid bij een longaanval is geactualiseerd (instructies voor gebruik van SABA thuis na een longaanval, de dosering van prednison en de duur daarvan).
Kernboodschappen
Naar Samenvatting ›- De standaard onderscheidt verschillende leeftijdsgroepen (< 6 jaar en ≥ 6 jaar), omdat diagnostiek en beleid bij deze groepen verschillen.
- Stel bij kinderen < 6 jaar de symptoomdiagnose ‘episodisch expiratoir piepen’ bij ≥ 2 episodes met expiratoir piepen.
- Stel de diagnose ‘astma’ alleen bij grote waarschijnlijkheid. Wees terughoudend met het stellen van de diagnose ‘astma’ bij kinderen < 6 jaar.
- Overweeg bij kinderen ≥ 6 jaar een diagnostische spirometrie tijdens klachten als er twijfel is over de diagnose ‘astma’.
- Het doel van de behandeling is het bereiken van goede astmacontrole: zo min mogelijk klachten, geen beperkingen in activiteiten, normale deelname aan het maatschappelijke leven, afgestemd op persoonlijke behandeldoelen en zo min mogelijk bijwerkingen van medicatie.
- Goede inhalatie-instructie en controle van de inhalatietechniek zijn belangrijk voor een goede astmacontrole.
- Na het starten van inhalatiemedicatie is evaluatie van het effect van de behandeling noodzakelijk. Evalueer tijdens de controleafspraak met name bij kinderen < 6 jaar ook de diagnose.
- Controleer alle kinderen met astma voor wie onderhoudsmedicatie nodig is regelmatig en minimaal jaarlijks.
Inleiding
Naar Samenvatting ›Scope
Naar Samenvatting ›Richtlijnen voor de diagnostiek, behandeling en monitoring van (een vermoeden van) astma bij kinderen van 0 tot 16 à 18 jaar
De NHG-Standaard Astma bij kinderen geeft richtlijnen voor de diagnostiek, behandeling en monitoring van astma bij kinderen van 0 tot 16 à 18 jaar.
De overgang van kind naar volwassenheid (de puberteit) is een transitiefase. Daarom wordt een leeftijdsrange van 16 tot 18 jaar gehanteerd.
Voor ouders en zorgverleners is het nogal eens een uitdaging om jongeren in de adolescentie goede ondersteuning te bieden bij het verwerven van zelfredzaamheid en -management.
Hoewel maatwerk gewenst is, zullen jongeren met astma die onder behandeling van een kinder(long)arts staan in de regel vanaf de leeftijd van 18 jaar behandeld worden door een longarts. Een goed moment is meestal de overgang van de middelbare school naar andere vormen van onderwijs. Deze overgang is ook van toepassing op deze NHG-Standaard. Voor jongeren en jongvolwassenen met astma onder behandeling van de huisarts geldt ook dat vanaf de leeftijd van 16 tot 18 jaar de richtlijnen van de NHG-Standaard Astma bij volwassenen worden aanbevolen.
Buiten de scope
Naar Samenvatting ›- Diagnostiek en behandeling van overige longziekten.
- Diagnostiek en behandeling van astma bij volwassenen (zie NHG-Standaard Astma bij volwassenen).
- Diagnostiek en behandeling van COVID-19 (zie NHG-Standaard COVID-19).
Samenwerking en afstemming
Naar Samenvatting ›Deze standaard is afgestemd op:
- de Zorgstandaard Astma bij kinderen en jongeren (Long Alliantie Nederland)
- de richtlijn Astma bij kinderen (Nederlandse Vereniging voor Kindergeneeskunde)
- de richtlijn Astma (Jeugdgezondheidszorg)
Achtergronden
Naar Samenvatting ›Begrippen
Naar Samenvatting ›Astma
Aanvalsgewijs optredende, reversibele bronchusobstructie op basis van een verhoogde gevoeligheid van de luchtwegen voor allergische (IgE-gemedieerde, bijvoorbeeld huisstofmijt, pollen, huisdieren) en/of niet-allergische prikkels (bijvoorbeeld koude of vochtige lucht, rook, stof, inspanning, emoties).
Astmacontrole
Mate van controle over de astmaklachten van de afgelopen weken en geschat risico op ernstige of blijvende klachten (bijvoorbeeld risico op een longaanval).
Goede astmacontrole betekent: zo min mogelijk klachten, geen beperkingen in activiteiten, normale deelname aan het maatschappelijke leven, afgestemd op persoonlijke behandeldoelen en zo min mogelijk bijwerkingen van medicatie.
Astmaklachten uitgelokt door inspanning
Inspanning is een veelvoorkomende prikkel voor het uitlokken van klachten van piepen, hoesten en kortademigheid bij patiënten met astma. Frequent optreden van inspanningsgebonden klachten duidt vaak op onvoldoende astmacontrole.
Atopie
Aangeboren aanleg voor astma, eczeem en allergie.
Bronchiale hyperreactiviteit
De eigenschap van de luchtwegen om met een versterkte bronchusobstructie te reageren op allergische of niet-allergische prikkels waarop mensen zonder astma niet of nauwelijks reageren.
Episodisch expiratoir piepen
Aanvalsgewijze piepende uitademing (≥ 2 episodes in de voorgeschiedenis), al dan niet met hoesten, meestal tijdens een bovensteluchtweginfectie. Dit is een symptoomdiagnose die alleen gesteld wordt bij kinderen < 6 jaar.
Longaanval (exacerbatie)
Snelle verergering van kortademigheid, hoesten of piepen, meestal als gevolg van een virale luchtweginfectie of een andere prikkel (zie Etiologie en pathofysiologie) of door verkeerd of onvoldoende medicatiegebruik (inhalatiecorticosteroïden). Meestal is aanvullende behandeling nodig.
Persoonlijke behandeldoelen
Behandeldoelen die bijvoorbeeld gericht zijn op activiteiten die het kind wil kunnen uitvoeren maar waarbij de astmaklachten belemmerend zijn (zoals slapen, eten, actief spelen, sport of schoolactiviteiten). Het kan ook gaan om het voorkomen van angst voor kortademigheid of een longaanval, of bijvoorbeeld om het niet hoeven gebruiken van een SABA.
Epidemiologie
Naar Samenvatting ›- Ongeveer 20% van de 2- en 3-jarigen heeft wel eens een expiratoir piepende ademhaling.
- De percentages kinderen met frequente klachten (≥ 4 episodes van piepen en/of benauwdheid binnen 1 jaar) zijn lager: ongeveer 5% bij kinderen < 6 jaar en 3-4% bij kinderen van 6-17 jaar.
- Bij kinderen < 6 jaar is astma moeilijk te onderscheiden van andere luchtwegklachten, zodat prevalentieschattingen voor die leeftijdsgroep onzeker zijn.
- Van de kinderen van 6-17 jaar heeft naar schatting ongeveer 12% astmaklachten (piepen, kortademigheid, hoesten), meestal incidenteel.
- Tot de leeftijd van 13 jaar komt astma vaker voor bij jongens, daarna meer bij meisjes.
Incidentie en prevalentie
De hier genoemde gegevens zijn afkomstig van NIVEL Zorgregistraties eerste lijn 2019. Deze registraties zijn gebaseerd op ICPC codes in de deelnemende huisartsenpraktijken (ongeveer 400 huisartsenpraktijken met 1,5 miljoen ingeschreven patiënten) en komen waarschijnlijk niet geheel overeen met de daadwerkelijke incidentie en prevalentie van astma, omdat bij een deel van de (jongere) kinderen een piepende ademhaling of episodisch piepen, als astma (ICPC R96) is geregistreerd in het HIS.
De incidentiecijfers van astma in de huisartsenpraktijk dalen met de leeftijd en gaan van 34,0 bij 0-1 jaar naar 13,9 bij 2-4 jaar en 8,4 bij 5-11 jaar in 2019 (per 1000 patiëntjaren). Op volwassen leeftijd (18-64) is dit 4,1 per 1000 patiëntjaren. De jaarprevalentie van astma bij kinderen stijgt met de leeftijd, bij 2-4 jaar ligt dit rond de 80 (jongens) en 55 (meisjes) per 1000 patiëntjaren, bij 12-18 jaar rond de 150 (jongens) en 110 (meisjes) per 1000 patiëntjaren.
Bij astma bij kinderen is bekend dat er overregistratie speelt (zie Evaluatie). Uit een ander onderzoek, het PIAMA-onderzoek, zijn ook Nederlandse prevalentiecijfers bekend.
Het PIAMA-onderzoek was een geboortecohort waarin ongeveer 3.500 kinderen vanaf hun geboorte in 1996-1997 zijn gevolgd tot de leeftijd van 23-24 jaar. Het onderzoek betrof de ontwikkeling van astma, allergie, overgewicht, cardiometabole risicofactoren, mentale gezondheid, een breed scala aan leefstijl- en omgevingsfactoren die daarop van invloed kunnen zijn, en de gevolgen voor de kwaliteit van leven. De gegevens zijn verzameld met behulp van vragenlijsten, klinisch onderzoek en metingen in de woningen van deelnemers.
|
leeftijd |
jongen |
meisje |
|---|---|---|
|
3 |
12,6 |
7,3 |
|
4 |
10,3 |
6,8 |
|
5 |
10,6 |
5,8 |
|
6 |
10,2 |
5,9 |
|
7 |
8,2 |
5,1 |
|
8 |
8,4 |
6,1 |
|
11 |
6,4 |
5,0 |
|
14 |
7,6 |
7,3 |
|
17 |
6,4 |
7,3 |
|
20 |
6,2 |
7,7 |
|
|
Inc (man) |
JaarP (man) |
Inc (vrouw) |
JaarP (vrouw) |
|---|---|---|---|---|
|
0-1 jaar |
11,7 |
18,5 |
6,6 |
11,6 |
|
2-4 jaar |
5,7 |
60,3 |
3,9 |
41,7 |
|
5-11 jaar |
3,8 |
117,3 |
2,8 |
78,6 |
|
12-18 jaar |
1,6 |
148,5 |
3 |
106,8 |
|
19-24 jaar |
1,4 |
134,9 |
3,4 |
121,2 |
Mortaliteit
In 2019 zijn in totaal 183 patiënten aan astma overleden, waarvan 6 kinderen in de leeftijd van 0 tot 19 jaar (zie VZinfo/Astma). In totaal overleden er in 2019 1046 kinderen in de leeftijd van 0 tot 19 jaar (astma dus 0,6% vd totale kindersterfte) (zie VZinfo/Sterfte).
Genderverschillen
Op jonge leeftijd hebben jongens meer astma-achtige klachten dan meisjes. Een mogelijke verklaring is dat jongens nauwere luchtwegen hebben dan meisjes in verhouding tot hun longvolume, waardoor er bij jongens sneller klachten ontstaan. Na de puberteit komt astma meer voor bij meisjes.
Etiologie en pathofysiologie
Naar Samenvatting ›- Zowel patiëntgebonden factoren als omgevingsfactoren hebben invloed op het ontwikkelen van astma.
- Patiëntgebonden factoren:
- Astma of allergie bij een of beide ouders en andere atopische aandoeningen bij het kind (constitutioneel eczeem of allergische rinitis).
- Astma komt vaker voor bij te vroeg geboren kinderen, kinderen met obesitas of kinderen met een lage sociaal-economische status.
- Het is onzeker of borstvoeding de kans op astma vermindert.
- Omgevingsfactoren:
- Allergische prikkels, zoals huisstofmijt, huisdieren, pollen en schimmels.
- Niet-allergische prikkels, zoals roken door het kind zelf, tweede- of derdehands tabaksrook (stoffen die tijdens het roken in de omgeving neerdalen en daar achterblijven na het roken, maar op een later moment weer in de lucht terechtkomen en dan ingeademd worden, zoals na buiten roken), luchtweginfecties, blootstelling aan vluchtige organische stoffen, kou en mist, luchtvervuiling en fijnstof, lichamelijke inspanning of emoties.
- De precieze bijdrage van virale luchtweginfecties op jonge leeftijd aan het risico op astma is niet duidelijk.
De precieze oorzaak van hyperreactieve luchtwegen en astma is onduidelijk. Epidemiologisch onderzoek heeft een aantal factoren in verband gebracht met een hoger risico op episodisch expiratoir piepen en astma. Deze risicofactoren zijn onder te verdelen in patiëntgebonden factoren en omgevingsfactoren.
Patiëntgebonden factoren
Genetische factoren
Astma of allergie bij (1 of beide) ouders is een belangrijke risicofactor voor het ontwikkelen van astma. Kinderen waarvan 1 ouder astma of allergie heeft hebben een 2 × zo grote kans om astma te ontwikkelen als kinderen zonder ouders met allergie of astma.
Als beide ouders allergisch zijn (en dat is het geval bij 10% van de kinderen) heeft 25-30% van hun kinderen klachten die aan astma doen denken en heeft 7-9% deze klachten frequent. Als 1 of beide ouders astma hebben, heeft 20-30% van hun kinderen klachten die aan astma doen denken en heeft 7-10% deze klachten frequent. Ter vergelijking: als geen van beide ouders astma heeft, heeft 10-20% van de kinderen klachten die aan astma doen denken en heeft 2-5% frequent deze klachten.
Atopie
Eczeem en sensibilisering voor een inhalatieallergeen zijn beide onafhankelijke voorspellers voor het ontwikkelen van astma. Eczeem komt ongeveer 1,5 tot 2 × zo vaak voor bij kinderen met astma. Bij kinderen van 8 jaar met astmaklachten is de prevalentie van verhoogd specifiek IgE 62-72%, bij kinderen zonder astmaklachten 22%. Een verhoogd specifiek IgE duidt erop dat het immuunsysteem geneigd is om allergisch te reageren (sensibilisering). Niet iedereen met een verhoogd specifiek IgE heeft ook daadwerkelijk allergische klachten.
De prevalentie van neusklachten (klachten allergische rinitis: niezen, een loopneus of een verstopte neus, zonder verkoudheid, in combinatie met tranende, jeukende ogen) bij kinderen zonder astma is 2-3% op jonge leeftijd tot 8% op 11-jarige leeftijd, bij kinderen met astmaklachten 9% op 3 jarige leeftijd tot 32% op 11-jarige leeftijd.
Geboorte en borst- of kunstvoeding
Vroeggeboorte (zwangerschapsduur < 37 weken) vergroot het risico op episodisch piepen (pooled odds ratio [pOR] 1,34; 95%-BI 1,25 tot 1,43) en astma op de basisschoolleeftijd (pOR 1,40; 95%-BI 1,18 tot 1,67) enigszins, onafhankelijk van het geboortegewicht.
Het is onzeker of borstvoeding de kans op astma verkleint. Bij de herziening van de JGZ richtlijn Astma in 2020 werd enig bewijs gevonden dat borstvoeding het risico op astma bij kinderen in de leeftijd van 5 tot 18 jaar vermindert (JGZ richtlijn Astma). Het grootste beschermende effect wordt gevonden in landen met een laag gemiddeld inkomen. De kwaliteit van het gevonden bewijs was echter zeer laag.
Vanwege de vele gezondheidsvoordelen wordt borstvoeding aangeraden, maar niet vanwege de bescherming tegen astma (JGZ richtlijn Astma).
In een Cochrane-review werd geen verschil gevonden tussen jonge zuigelingen die exclusief borstvoeding kregen vergeleken met zuigelingen die (gehydrolyseerde) zuigelingenvoeding kregen op de kans op astma.
Overgewicht
Snelle gewichtstoename in de eerste levensjaren geeft een licht verhoogd risico op het optreden van episodisch piepen (odds ratio (OR) 1,79; 95%-BI 1,45 tot 2,21) en astma op de basisschoolleeftijd (OR 1,69; 95%-BI 1,19 tot 2,38). Kinderen met overgewicht (relatief risico (RR) 1,17; 95%-BI 1,10 tot 1,25, gecorrigeerd voor confounders) en kinderen met obesitas (RR 1,26; 95%-BI 1,18 tot 1,34) hebben een groter risico op astma dan kinderen met een normaal gewicht. Op grond hiervan is te veronderstellen dat astma in 10% van de gevallen kunnen worden voorkomen bij afwezigheid van overgewicht en obesitas.
Sociaal economische status en psychische stress
Het risico op astma bij jonge kinderen in families met een lager inkomen en een lagere opleiding is licht verhoogd (gecorrigeerde hazard ratio (HR) 1,19; 95%-BI 1,09 tot 1,31). Er zijn aanwijzingen dat psychische stress verergering van het astma kan geven.
Omgevingsfactoren
Omgevingsfactoren zijn onder te verdelen in allergische en niet-allergische prikkels. Onder invloed van deze prikkels geven de geactiveerde ontstekingscellen (in het bijzonder mestcellen, eosinofiele leukocyten en T-lymfocyten) mediatoren (onder andere histamine) af, die kunnen leiden tot astmaklachten.
Allergische prikkels
Allergenen kunnen bij mensen die daar gevoelig voor zijn een IgE-gemedieerde reactie veroorzaken. De meest voorkomende allergenen zijn huisstofmijt, kat, hond, schimmels, berk en kruiden (bijvoet, smalle weegbree).
Niet-allergische prikkels
Er bestaan vele soorten niet-allergische prikkels. De prikkels die erom bekend staan dat ze astmaklachten veroorzaken en/of verergeren, zijn:
- Tabaksrook (zie Niet roken).
- Luchtweginfecties. Vooral rinovirussen, maar ook (para)influenza-, adeno- en coronavirussen zijn veelvoorkomende oorzaken van verergering van astmaklachten. De rol die het doormaken van virale luchtweginfecties op jonge leeftijd speelt bij de kans op astma is niet duidelijk. In sommige onderzoeken wordt een verhoogd risico op astma gevonden bij kinderen met frequente luchtweginfecties. Bij andere onderzoeken is de relatie minder duidelijk.
- Weersomstandigheden. Mist en kou kunnen astmaklachten uitlokken.
- Luchtvervuiling en fijnstof (inclusief kachels en vuurwerk). Tijdens of vlak na een smogepisode kan er sprake zijn van een verhoogde gevoeligheid voor luchtwegklachten, bijvoorbeeld bij aanhoudend erg warm zomerweer wanneer er veel ozon in de lucht is. Ook in de winter kan smog (fijnstof) klachten veroorzaken. Bij kinderen met astma die in de buurt van Schiphol wonen, nemen de klachten en het gebruik van medicatie toe op dagen waarop er door de windrichting een verhoogde blootstelling aan ultrafijn stof is. Kinderen die in een omgeving wonen met veel verkeer, of daar naar school of een kinderopvang gaan, hebben een groter risico om luchtwegklachten te ontwikkelen.
- Vocht en schimmel. Vochtige woonomstandigheden, schimmel en de geur van schimmel in de woning verhogen het risico op het ontwikkelen van astma en andere luchtwegklachten.
- Vluchtige organische stoffen (VOS): ‘prikkelende luchtjes’. VOS zijn organische stoffen die bij kamertemperatuur makkelijk verdampen. Deze worden vaak toegevoegd aan bijvoorbeeld luchtverfrissers, schoonmaakmiddelen en meubelwassen en zijn een bestanddeel van huishoudproducten zoals verf, boenwas, nagellak en andere geurende cosmetica, lijm en kunststof vloerbedekking. De concentratie van deze stoffen in de lucht lijkt samen te hangen met het risico op episodisch piepen en astma.
- Inspanning en emoties. Inspanning kan astmaklachten uitlokken. Bij jonge kinderen kan bijvoorbeeld lachen of huilen astmaklachten uitlokken. Ook woede, verdriet, angst of spanning kunnen astmaklachten verergeren.
- Geneesmiddelen. Sommige geneesmiddelen, zoals acetylsalicylzuur en andere NSAID’s kunnen ernstige longaanvallen veroorzaken.
Fenotypes
Er zijn verschillende klinische patronen (fenotypes) van episodisch piepen en astma bij kinderen beschreven. De beschrijving van deze fenotypes verschilt tussen publicaties, en er is nog geen consensus. Bij kinderen in de eerste lijn heeft het onderscheiden van verschillende fenotypes op dit moment geen meerwaarde.
Beloop en prognose
Naar Samenvatting ›- Astmaklachten op de kinderleeftijd hoeven niet te leiden tot astma in het latere leven.
- Ruim 1/3 van alle kinderen maakt ≥ 1 periodes met expiratoir piepen door vóór de leeftijd van 3 jaar, vaak tijdens of aansluitend op virale bovensteluchtweginfecties. Meer dan de helft van deze kinderen heeft op de leeftijd van 6 jaar geen klachten meer.
- Bij ongeveer 20% van de kinderen bij wie de diagnose ‘astma’ op 7-jarige leeftijd is gesteld, verdwijnen de klachten rond de puberteit. Ongeveer 80% houdt in het verdere leven astma, van hen heeft de helft periodiek klachten.
- Bij kinderen > 12 jaar met astma kunnen ook andere factoren het beloop beïnvloeden, bijvoorbeeld een verhoogd risico op therapieontrouw, mogelijk startend rookgedrag en school- en beroepskeuzes.
Het beloop van astma is variabel.
Bijna 1 op de 3 peuters heeft klachten van piepen, benauwdheid of kortademigheid, maar bij de meeste kinderen (60%) zijn deze klachten binnen 1-2 jaar over.
Ongeveer 3 van de 4 kinderen met astma-achtige klachten op de basisschoolleeftijd hebben op volwassen leeftijd geen klachten meer.
Van de kinderen bij wie op 7 of 8-jarige leeftijd de diagnose ‘astma’ werd gesteld (op basis van uitgebreide anamnese; aanvullend laboratoriumonderzoek en longfunctieonderzoek), was 21% (43/205) in remissie op de leeftijd van 19 jaar (geen astmamedicatie meer en geen klachten van piepen in de afgelopen 3 jaar), had 41% (84/205) persisterend astma (klachten van piepen of medicatiegebruik) en was er bij 38% (78/205) periodiek sprake van medicatiegebruik of klachten van piepen. Van de 118 jongens waren er 31 in remissie, van de 87 meisjes 12.
De kans op persisteren van astma of terugkeer van astma op latere leeftijd is groter bij ernstig astma op de vroege kinderleeftijd, begin van astma na het tweede levensjaar, verminderde longfunctie en verhoogde bronchiale hyperreactiviteit op die leeftijd, en bovendien bij roken en vrouwelijk geslacht en mogelijk atopie bij het kind zelf of eerstegraadsfamilieleden.
Conclusie
Onderzoeksresultaten wijzen erop dat een groot deel van de jonge kinderen met klachten van astma ‘er overheen groeien’. Bij een grotere waarschijnlijkheid van astma is het risico op persisterende of terugkerende klachten op volwassen leeftijd groter.
Richtlijnen diagnostiek
Naar Samenvatting ›- Overweeg astma bij kinderen met ≥ 1 van de volgende recidiverende klachten:
- piepende uitademing
- hoesten
- kortademigheid
- benauwdheid
- Op jonge leeftijd staan vooral piepende uitademing en hoesten op de voorgrond. Op oudere leeftijd komt het klassieke aanvalsgewijze patroon van piepende uitademing en kortademigheid vaker voor.
Spoed
Naar Samenvatting ›Bij een kind dat ernstig kortademig is: stel de klinische stabiliteit van het kind vast volgens de ABCDE-systematiek (zie NHG-Behandelrichtlijn Geneesmiddelen en zuurstof in spoedeisende situaties).
Anamnese
Naar Samenvatting ›Vraag naar:
- luchtwegklachten: piepende uitademing, hoesten overdag of tijdens het slapen, kortademigheid of benauwdheid
- ernst, duur, frequentie en het patroon van de luchtwegklachten: incidenteel, aanvalsgewijs, regelmatig of dagelijks; klachtenvrije periodes; seizoensinvloed
- aanwijzingen voor allergische prikkels:
- klachten passend bij allergische rinitis, zoals niezen, jeuk in neus of ogen, een loopneus of verstopte neus
- optreden of verergeren van klachten: in een stoffige omgeving (huisstofmijt), in voorjaar of zomer (pollen van bomen, grassen of kruiden) of bij contact met dieren (katten, honden, knaagdieren, paarden)
- aanwijzingen voor niet-allergische prikkels:
- persisterende klachten tijdens of aansluitend aan virale luchtweginfecties
- optreden of verergeren van klachten bij emoties, koude of vochtige lucht, mist, tabaksrook, fijnstof of luchtverontreiniging, vluchtige stoffen (zoals baklucht, verflucht en parfumlucht)
- tijdens of na lichamelijke inspanning
- roken:
- door ouders, verzorgers of anderen in de omgeving van het kind
- door het kind zelf
- invloed van de klachten op het dagelijks functioneren: thuis, op school, tijdens het slapen, op sportactiviteiten, andere hobby’s en buiten spelen
- familieanamnese: astma of atopische aandoeningen bij eerstegraads familieleden
- psychosociale omstandigheden, zoals gezins- en woonsituatie, schoolverzuim, pesten
Inventariseer:
- comorbiditeit en andere atopische aandoeningen (constitutioneel eczeem; allergische rinitis)
- frequentie van luchtweginfecties
- eerder verricht allergie- of longfunctieonderzoek
- in het verleden gebruikte medicatie voor de luchtwegen en het effect daarvan
- eerdere ziekenhuisopnames voor longproblematiek (bijvoorbeeld bronchiolitis of pneumonie)
- afbuigen van de groeicurve en/of achterblijven in psychomotorische ontwikkeling
- perinatale gegevens, zoals prematuriteit, laag geboortegewicht, postnatale zuurstoftoediening en/of kunstmatige beademing
Lichamelijk onderzoek
Naar Samenvatting ›- Bepaal de mate van ziek zijn.
- Maak een inschatting van de ademarbeid: gebruik van hulpademhalingsspieren, neusvleugelen, intrekkingen sub- of intercostaal.
- Bij tekenen van dyspneu: tel de adem- en de hartfrequentie (zie Spoed).
- Overweeg bij tekenen van dyspneu een saturatiemeting, indien deze beschikbaar is en de praktijk het toelaat. Een saturatiemeting bij jonge kinderen is soms lastiger door bijvoorbeeld beweging. De saturatie bij kinderen daalt pas laat, omdat zij grote ademarbeid kunnen leveren. Verlaagde saturatie bij kinderen is een zeer ernstig teken (zie Spoed).
- Ausculteer de longen, let op een verlengd expirium en expiratoir piepen.
- Onderzoek keel en oren bij klachten die wijzen op een bovensteluchtweginfectie.
- Onderzoek de huid bij anamnestische aanwijzingen voor constitutioneel eczeem.
Normaalwaarden ademfrequentie en hartfrequentie bij kinderen
Normaalwaarden voor de ademfrequentie en hartfrequentie bij kinderen zijn leeftijdsafhankelijk. Waarden die afwijken van de normaalwaarde zijn niet altijd alarmerend en moeten op grond van de verdere klinische bevindingen geïnterpreteerd worden.
|
Leeftijd |
Ademfrequentie |
Hartfrequentie |
|---|---|---|
|
< 1 |
30-40 |
110-160 |
|
1-2 |
25-35 |
100-150 |
|
2-5 |
25-30 |
95-140 |
|
5-12 |
20-25 |
80-120 |
|
> 12 |
15-20 |
60-100 |
In de GINA wordt bij kinderen ≤ 5 jaar een ademfrequentie > 40 per minuut en bij kinderen vanaf 6 jaar, adolescenten en volwassenen een ademfrequentie van > 30 per minuut gebruikt als grenswaarde voor een ernstige longaanval.
In deze versie van de standaard worden, in navolging van de NHG-Behandelrichtlijn Geneesmiddelen en zuurstof in spoedeisende situaties, alleen de normaalwaarden voor de adem- of hartfrequentie benoemd. De beoordeling of een waarde afwijkt is sterk afhankelijk van de context. Bij de bepaling van de mate van dyspneu moet men zich realiseren dat het om een continuüm gaat en dat het vooral gaat om de ademarbeid.
Auscultatie van de longen
Ademgeruis wordt omschreven aan de hand van het karakter (vesiculair, verscherpt of bronchiaal ademgeruis), de intensiteit (normaal of verzwakt) en de tijdsverhouding tussen het inspirium en het expirium. Bij een verlengd expirium is het hoorbare deel van het expirium even lang als het inspirium of zelfs langer.
Bijgeluiden zijn abnormale longgeluiden. Rhonchi zijn piepende of brommende bijgeluiden die ontstaan bij obstructie van de luchtwegen. Piepende rhonchi wijzen vooral op bronchospasmen, brommende rhonchi op verdikte bronchuswanden of taai slijm in de grotere luchtwegen. De intensiteit van het geluid is een slechte voorspeller voor de ernst van de obstructie, sterker nog bij zeer ernstige obstructie kan het piepen juist weer onhoorbaar worden, omdat de luchtstroom te gering is. Het effect van een luchtwegverwijder is vooral te verwachten op de piepende rhonchi.
Longgeluiden hebben over het algemeen een beperkte diagnostische waarde en een lage interobserverbetrouwbaarheid. Daarnaast sluiten normale bevindingen bij lichamelijk onderzoek astma zeker niet uit.
Saturatiemeting bij kinderen
De percutane zuurstofsaturatiemeter of ‘pulsimeter’ meet de zuurstofverzadiging in het perifere bloed (SpO2). Daarnaast meet het instrument de polsfrequentie.
De saturatiemeter zendt rood en infrarood licht door weefsel (bijvoorbeeld vinger, bij kleinere kinderen de teen of oorlel) en meet aan de tegenovergestelde zijde de hoeveelheid doorgelaten licht. De verhouding tussen het passerende rood/infrarood licht is gerelateerd aan de verhouding Hb/O2Hb in het arteriële bloed. Deze verhouding bepaalt het saturatiepercentage.
Een saturatiemeting bij kinderen vergt extra inspanning. Bij kinderen > 6 jaar kan vaak gebruik worden gemaakt van de saturatiemeter voor volwassenen. Deze is in de meeste huisartsenpraktijken voorhanden. Bij jongere kinderen lukt het soms om op een andere plaats, bijvoorbeeld de teen of de oorlel een meting met een volwassenenmeter te verrichten. Indien beschikbaar kan met een speciale saturatiemeter voor kinderen een meting worden verricht. Speciale aanschaf van apparatuur vindt de werkgroep niet noodzakelijk.
De saturatiemeting wordt minder betrouwbaar door bijvoorbeeld beweging, druk, koude of vochtige handen, kunstnagels, nagellak en vuil. Snel wisselende saturatiepercentages zijn fysiologisch onmogelijk. Het gaat dan om een meetfout.
Bij kinderen is de saturatie normaal > 95%. De saturatie daalt bij kinderen pas laat, omdat zij langdurig een grote ademarbeid kunnen verrichten. Kinderen raken in een later stadium plots uitgeput en een saturatie van ≤ 95% bij kinderen is dus een ernstig teken.
Het gebruik van hulpademhalingsspieren, verhoging van de ademhalingsfrequentie en van de hartfrequentie zijn eerder aanwezige belangrijke alarmsymptomen om de ernst van de benauwdheid bij kinderen in te schatten.
Aanvullend onderzoek
Naar Samenvatting ›Bloedonderzoek op inhalatieallergenen
Naar Samenvatting ›Bij kinderen < 6 jaar
Naar Samenvatting ›- Een positief bloedonderzoek op inhalatieallergenen maakt de diagnose ‘astma’ waarschijnlijker (deze diagnose wordt meestal pas gesteld als het kind ≥ 6 jaar is, zie Evaluatie). Een negatief bloedonderzoek sluit astma echter niet uit.
- We bevelen een bloedonderzoek op inhalatieallergenen bij kinderen met episodisch expiratoir piepen alleen aan als er twijfel is over het in te stellen beleid: het wel of niet voorschrijven van inhalatiecorticosteroïden (ICS).
Bij kinderen < 6 jaar met aangetoond specifiek IgE is het risico op het daadwerkelijk ontwikkelen van astma verhoogd. Het is belangrijk deze factor mee te wegen in het geheel van andere aanwijzingen uit de anamnese en het lichamelijk onderzoek (zie tabel 4) om de waarschijnlijkheid van de diagnose ‘astma’ te vergroten. Als er daarna twijfel is over het in te stellen beleid, bijvoorbeeld afwachten of starten van medicatie, kan volgens de werkgroep een screeningsonderzoek op inhalatieallergenen behulpzaam zijn in het diagnostisch proces. Het is denkbaar dat bij een negatief onderzoek eerder gekozen wordt voor afwachten en bij een positief onderzoek eerder voor medicamenteuze behandeling.
Voor- en nadelen
De aanwezigheid van specifiek IgE kan de diagnose ‘astma’ bij kinderen < 6 jaar waarschijnlijker maken. Hierdoor ontvangen waarschijnlijk meer kinderen een juiste indicatie en een juiste behandeling. Nadeel is dat de interpretatie van de uitslagen soms lastig is (zie Achtergrond).
Kwaliteit van bewijs
De kwaliteit van het bewijs was laag. Oorzaak is dat er vertekening van resultaten kan zijn omdat het design tussen de onderzoeken verschilde (1 prospectief en 2 retrospectieve onderzoeken). Verder waren de groepen waar de relatie tussen IgE en astma zijn onderzocht onderling verschillend wat betreft leeftijd, aanwezigheid mogelijke klachten van/risicofactoren op astma en leeftijd bij het stellen van de diagnose. Door deze verschillen is het niet met zekerheid conclusies te trekken over de gehele groep (kinderen < 6 jaar met episodisch (expiratoir) piepen). Wel wijzen alle onderzoeken eenduidig richting een toegevoegde waarde (OR > 1) van de bepaling van specifiek IgE voor het stellen van de diagnose ‘astma’ op latere leeftijd.
Hoewel de auteurs van de review sponsoring van de farmaceutische industrie ontvingen, hebben we hiervoor niet afgewaardeerd bij de kwaliteit van het bewijs. Reden hiervoor is dat de auteurs verklaarden geen verdere belangen te hebben. Bovendien verklaarden de auteurs van de 3 geïncludeerde onderzoeken geen belangen te hebben en waren deze onderzoeken niet gesponsord door de farmaceutische industrie.
Waarden en voorkeuren van patiënten
Bloedafname bij een kind kan soms via een vingerprik, soms via venapunctie. Sommige kinderen kunnen angstig zijn en de prik zal even pijn doen. Eventueel kan de prikplaats van tevoren met spray of zalf worden verdoofd. Er zijn geen belangrijke complicaties.
Kosten
De kosten van het screeningsonderzoek zijn € 16,86. Indien de inhalatieallergenen daarna verder uitgesplitst worden, bedragen de kosten 11 × € 12,59. De totale kosten komen dan neer op € 155,35 (zie saltro.nl/products/inhalatie-allergenen).
Aanvaardbaarheid
Huisartsen hebben ervaring met het aanvragen van een inhalatieallergenenscreening bij kinderen. De interpretatie van de uitslagen kan echter lastig zijn (zie achtergrond).
Haalbaarheid
De haalbaarheid wordt ingeschat als goed.
Uitgangsvraag
Wat is de toegevoegde waarde van onderzoek op inhalatieallergenen bij kinderen < 6 jaar met episodisch (expiratoir) piepen op de diagnose ‘astma’?
|
Patiënten |
Kinderen < 6 jaar met episodisch (expiratoir) piepen |
|---|---|
|
Interventie |
Onderzoek op inhalatieallergenen (bloed) |
|
Vergelijking |
Astmadiagnose op oudere leeftijd (> 6 jaar) |
|
Uitkomstmaten |
Risico (OR/RR/ARR) op astma |
Achtergrond
Bij allergieonderzoek wordt in Nederland vaak een screeningsonderzoek op inhalatieallergenen verricht. Hierbij wordt meestal de aanwezigheid van specifiek immunoglobuline E (IgE) in serum of bloed simultaan bepaald voor een vast mengsel van meerdere inhalatieallergenen. Er zijn 2 uitslagen mogelijk: positief of negatief.
Indien de screeningstest positief is, wordt het onderzoek verder uitgesplitst naar de specifieke allergenen (wisselend per laboratorium, over het algemeen: huisstofmijt, gras-, boom- en kruidpollen, honden- en kattenepitheel, en schimmels). Hierbij wordt een afkapwaarde van 0,35 kU/L gebruikt (zie verder de LESA Rationeel aanvragen van laboratoriumdiagnostiek, onderdeel Overgevoeligheid).
Bij de interpretatie van de resultaten van de test zijn de volgende punten belangrijk om mee te nemen.
- De screeningstest kan foutpositief of foutnegatief zijn (beide ongeveer 7-8% in de volwassen algemene bevolking)
- Hoe jonger het kind, hoe vaker de test (nog) negatief is. Hierdoor kan het zinvol zijn de test na enkele jaren te herhalen.
- Alleen bij anamnestische klachten is er daadwerkelijk sprake van een klinisch relevante allergie. Een positieve test wijst namelijk alleen op sensibilisering voor het allergeen.
- De relatie tussen de concentratie van een specifieke IgE (sIgE) en het risico op het hebben van een klinische allergie verschilt per allergeen.
- Er kunnen kruisreacties optreden, bijvoorbeeld berkenpollen-appel, huisstofmijt-garnaal. Dit betekent dat er dan ook allergische klachten ontstaan bij mensen met een berkenpollenallergie, tijdens of na het eten van appel. Het immuunsysteem kan geen onderscheid maken, omdat deze allergenen erg op elkaar lijken.
Meting van het totaal IgE geeft geen aanvullende informatie. Een normaal totaal IgE sluit een verhoging van het allergeenspecifiek IgE niet uit.
Bij kinderen < 6 jaar wordt de waarschijnlijkheid op de diagnose ‘astma’ hoger of lager op basis van kenmerken uit de anamnese en bij het lichamelijk onderzoek. Spirometrie is op deze leeftijd vaak nog niet uitvoerbaar. De uitslag van het allergieonderzoek zou mogelijk bij kunnen bijdragen aan de waarschijnlijkheid. Hierbij is dus de vraag of het risico op astma hoger is bij jonge kinderen met klachten van episodisch piepen
Methoden
Er is een systematische literatuurzoekactie naar systematische reviews (SR’s) en gerandomiseerde gecontroleerde trials (RCT’s) uitgevoerd in PubMed en Embase in oktober 2020.
Resultaten
Resultaat zoekactie
De zoekactie leverde 1 systematische review met meta-analyse (MA) op over de voorspellende waarde van de aanwezigheid van allergeenspecifiek IgE bij kinderen (< 6 jaar) voor astma op latere leeftijd (≥ 6 jaar). De literatuur in deze review liep tot 30 juni 2017, het NHG heeft de search aangevuld met 1 onderzoek.
Onderzoekskarakteristieken
In de systematische review onderzochten de auteurs welke risicofactoren bij kinderen rond de 3 jaar (tot maximaal 6 jaar) voorspellers zijn van astma op de leeftijd van 6-11 jaar. Zij vonden 17 prospectieve of retrospectieve cohort- en case-controlonderzoeken. De auteurs includeerden 2 onderzoeken naar de voorspellende waarde van de aanwezigheid van allergeenspecifiek IgE. De belangrijkste kenmerken van de onderzoeken worden hieronder beschreven.
In een prospectief onderzoek werd bij 438 kinderen met een hoog risico op astma (57% jongens) op 3-jarige leeftijd het totale en specifieke IgE tegen kat, hond of huisstofmijt (positief bij > 0,35 kU/L) bepaald. Op 6-jarige leeftijd werd de diagnose ‘astma’ (prevalentie 42,7%) bepaald aan de hand van aanwezigheid van persisterende astmaklachten en/of gebruik van astmamedicatie in het laatste jaar, in combinatie met bewezen reversibiliteit.
In een retrospectief onderzoek werden gegevens verzameld van 200 kinderen < 2 jaar met een piepende ademhaling (gemiddeld 13 ± 4 maanden; 64% jongens), bij wie onder andere een specifiek IgE bepaald was. Op 6-jarige leeftijd werd de diagnose ‘astma’ (prevalentie 47,5%) bepaald aan de hand van de International Study on Asthma and Allergy in Children (ISAAC) vragenlijst.
De onderzoeken uit de review zijn aangevuld met 1 onderzoek. In dit onderzoek werden retrospectief, op basis van het medisch dossier, 116 kinderen geïdentificeerd (62,9% jongens) die op de leeftijd van 1-3 jaar het ziekenhuis bezochten met een piepende ademhaling. Data over de aanwezigheid van specifiek IgE (kat, hond, huisstofmijt, pollen) op die leeftijd werd eveneens uit het medisch dossier gehaald. Op de gemiddelde leeftijd van 7,8 jaar (± 1,3 jaar; minimaal 6 jaar follow up) werd de diagnose ‘astma’ bepaald (prevalentie 64,7%) aan de hand van ICS-gebruik óf klachten van piepen óf piepen tijdens of na inspanning, alle in de laatste 12 maanden.
Analyse
De resultaten van de 3 onderzoeken zijn geanalyseerd met behulp van een meta-analyse, de forestplot is opgenomen als bijlage in Totstandkoming en methoden. De resultaten zijn samengevat in tabel Bloedonderzoek op inhalatieallergenen bij kinderen < 6 jaar.
Conclusie
Een screening op inhalatieallergenen in het bloed zou het risico op astma kunnen voorspellen (lage kwaliteit van bewijs).
Bij kinderen ≥ 6 jaar
Naar Samenvatting ›- In de diagnostische fase heeft bloedonderzoek op inhalatieallergenen bij kinderen ≥ 6 jaar geen toegevoegde waarde. Overweeg bij twijfel over de diagnose vanaf deze leeftijd een spirometrie (zie Spirometrie).
- Overweeg in de beleidsfase bloedonderzoek op inhalatieallergenen om nog niet eerder onderkende allergieën te vinden. Overweeg dit:
- indien het anamnestisch onduidelijk is of er een allergische oorzaak kan zijn;
- bij kinderen die ondanks behandeling met ICS onvoldoende astmacontrole bereiken of houden.
Aandachtspunten
Naar Samenvatting ›- Bij bloedonderzoek op inhalatieallergenen verricht het laboratorium over het algemeen eerst een screeningstest. Deze screeningstest heeft twee mogelijke uitkomsten: positief of negatief.
- Bij een positieve screeningstest bepaalt het laboratorium vaak automatisch het allergeenspecifieke IgE van de meest voorkomende inhalatieallergenen (huisstofmijt, gras-, boom- en kruidpollen, honden- en kattenepitheel, schimmels).
- Houd er rekening mee dat de uitslag van de test foutnegatief of foutpositief kan zijn.
- Een eventuele positieve test zónder anamnestische aanwijzingen voor een allergie wijst op sensibilisering, maar niet op een klinisch relevante allergie.
Screeningstest op voedselallergenen
Naar Samenvatting ›- We bevelen een screeningstest naar voedselallergenen niet aan.
- Bij kinderen met voedselallergie komt astma vaker voor dan bij kinderen zonder voedselallergie. Het is niet waarschijnlijk dat astma het gevolg is van de voedselallergie. Waarschijnlijk zijn beide uitingen van onderliggende atopie.
- Zie NHG-Standaard Voedselovergevoeligheid en coeliakie.
Spirometrie
Naar Samenvatting ›- Overweeg bij twijfel over de diagnose ‘astma’ een diagnostische spirometrie tijdens klachten.
- Bij een grote waarschijnlijkheid van de diagnose ‘astma’ heeft diagnostische spirometrie weinig toegevoegde waarde. Bij een lage waarschijnlijkheid van de diagnose ‘astma’ is diagnostische spirometrie niet zinvol.
Aandachtspunten
- Bij kinderen vanaf ongeveer 6 jaar kan geprobeerd worden om een spirometrie uit te voeren.
- Verricht de spirometrie bij voorkeur tijdens klachten.
- Verricht spirometrie met reversibiliteitstest; reversibiliteit (≥ 12%) toont astma aan.
- Een normale of licht afwijkende uitslag van de spirometrie sluit astma niet uit. Eenmalige herhaling van de spirometrie tijdens klachten is dan zinvol.
- Overweeg bij blijvende verdenking op astma een diagnostische verwijzing (zie Consultatie en verwijzing)
Randvoorwaarden
- Kies, afhankelijk van de (regionale) mogelijkheden, voor spirometrie in de eigen praktijk, in een diagnostisch centrum, in een longfunctielaboratorium of bij de kinder(long)arts via een diagnostische verwijzing.
- Voor het verrichten van een kwalitatief goede spirometrie bij kinderen en het beoordelen van de uitslag zijn oefening, aanvullende scholing en een ervaren praktijkondersteuner vereist.
- Het gebruik en onderhoud van spirometers en de uitvoering van spirometrie vereisen deskundigheid (zie het NHG-boek Astma en COPD in de huisartsenpraktijk) en een aantal kwaliteitsvoorzorgen (zie CAHAG Spirometrie).
Referentiewaarden spirometrie
- Interpreteer spirometrische parameters zoals FEV1, FVC en FEV1/FVC op basis van referentiewaarden (Z-score). Beoordeel de aanwezigheid van reversibiliteit.
- Overweeg zo nodig (tele)consultatie over de interpretatie van de uitslagen met een kaderhuisarts of kinder(long)arts.
Een gouden standaard voor de diagnose ‘astma’ ontbreekt. Een zinvol aanvullend onderzoek bij de diagnostiek naar astma is spirometrie. Bij kinderen vanaf ongeveer 6 jaar kan geprobeerd worden om dit onderzoek uit te voeren. Bij jongere kinderen lukt spirometrie vaak nog niet. Ook bij kinderen vanaf 6 jaar zijn oefening, aanvullende scholing en ervaring van de uitvoerder nodig om het kind een goede spirometrie te laten blazen. Er zijn regionaal verschillen waar deze expertise voorhanden is. Een normale spirometrie sluit astma niet uit. Veel kinderen met ongecontroleerd astma hebben een normale longfunctie tussen de longaanvallen door.
Om bovenstaande redenen is de werkgroep van mening dat een spirometrie alleen nodig is bij twijfel over de diagnose ‘astma’ (diagnostische fase) of bij twijfel over de astmacontrole (beleidsfase).
Randvoorwaarden
Bij de uitvoering van spirometrie moet worden voldaan aan de eisen van de American Thoracic Society (ATS) en de European Respiratory Society (ERS).
In veel huisartsenpraktijken bestaat de mogelijkheid om spirometrie bij volwassenen te verrichten. Richtlijnen en randvoorwaarden hiervoor zijn te vinden op de website van de CAHAG. Voor certificering van spirometrie in de eerste lijn is de CASPIR-cursus of gelijkwaardig vereist. Uitvoerders (bijvoorbeeld de praktijkondersteuner) en beoordelaars (bijvoorbeeld de huisarts) van een spirometrie bij kinderen hebben een aanvullende scholing en competenties nodig. Hiervoor is via de CAHAG de aanvullende KASPIR-cursus vereist.
Als alternatief is het in eerstelijns diagnostische centra vaak mogelijk een spirometrie uit te laten voeren volgens de SAN-praktijkrichtlijn longfunctieonderzoek. Deze richtlijn is bruikbaar voor kinderen vanaf 16 jaar. Voor jongere kinderen volgt nog een separaat addendum.
Een derde mogelijkheid is om op aanvraag van de huisarts een spirometrie in een longfunctielaboratorium verbonden aan een ziekenhuis te laten verrichten. Indien geen van deze mogelijkheden voorhanden is, kan een diagnostische verwijzing naar de tweede lijn plaatsvinden.
Referentiewaarden
In 2014 is in overleg met andere betrokken Nederlandse beroepsorganisaties besloten de meestal gebruikte voorspelde waarden voor kinderen en voor volwassenen te vervangen door actuelere voorspelde waarden. In 2012 heeft de Task Force Global Lung Function Initiative van de European Respiratory Society een nieuw referentiewaardensysteem voorgesteld dat is gestratificeerd voor geslacht, leeftijd, lengte en herkomst, gebaseerd op > 97.000 metingen bij gezonde niet-rokers van 3-95 jaar in 5 etnische groepen.
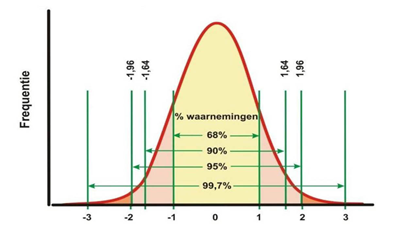
In dit referentiesysteem wordt geadviseerd om een z-score te gebruiken. De z-score is een getal dat aangeeft hoeveel standaarddeviaties een meetresultaat van de voorspelde waarde verschilt. Een z-score < -1,64 definieert de onderste 5% (5e percentiel) van een normaal verdeelde parameter, zoals de FEV1 of FEV1/FVC-ratio in een bepaalde populatie. Bij patiënten met klachten passend bij astma wordt een z-score < –1,64 beschouwd als afwijkend.
Diagnostische criteria voor spirometrie bij kinderen
Bij de beoordeling van een spirometrie worden naast de longfunctiecurve en meetgegevens ook de klinische aspecten mee gewogen. Beoordeling bestaat uit de volgende onderdelen.
Beoordeling kwaliteit
- Herhaalbaarheid: de hoogste en de op een na hoogste meting van FVC en FEV1 mogen niet meer dan 150 ml van elkaar verschillen, zowel voor bronchodilatatie als na bronchodilatatie.
- De flow-volumecurve moet een snelle stijging, een scherpe piek en een gladde curve laten zien die geleidelijk daalt tot de x-as.
- De volume-tijdcurve moet een uitademing van ≥ 6 seconden laten zien, of van 5 seconden mits er de laatste seconde al een plateaufase bereikt was.
Interpretatie spirometrie
Beoordeel bij voldoende kwaliteit het onderzoek volgens de ROER-systematiek.
- Restrictie: als de FVC na bronchusdilatatie < 80% van voorspeld is, kan er sprake zijn van restrictie.
- Obstructie: bij een FEV1/FVC-ratio na bronchusdilatatie met z-score < –1,64 is er sprake van obstructie.
- Ernst: een FEV1 na bronchusdilatatie in % van voorspeld geeft de ernst van de obstructie aan.
- Reversibiliteit: bij een percentage van ≥ 12% is er bij kinderen sprake van reversibiliteit.
Eenmalig salbutamol als diagnosticum
Naar Samenvatting ›Overweeg bij kinderen met klachten van piepende ademhaling tijdens het spreekuurcontact een eenmalige behandeling met 2-4 inhalaties salbutamol. Duidelijke afname van de klachten na 15 minuten wijst op reversibiliteit (en dus hogere waarschijnlijkheid op de symptoomdiagnose ‘episodisch expiratoir piepen’ of op de diagnose ‘astma’) en kan richting geven aan het verdere beleid.
Overig aanvullend onderzoek
Naar Samenvatting ›- Een thoraxfoto is niet zinvol bij de diagnostiek van astma. Wel is een thoraxfoto te overwegen om een andere diagnose, zoals een pneumonie of pneumothorax, aan te tonen of uit te sluiten (zie LESA radiologische diagnostiek).
- Gebruik in de diagnostische fase geen enkelvoudige (hand-)FEV1-meters, want daarmee kan geen flowvolumecurve worden geproduceerd.
- Bepaling van de fractie stikstofmonoxide in uitgeademde lucht (FeNO-meting) heeft in de eerste lijn geen plaats in de diagnostiek van astma.
- Provocatietests, zoals een metacholine-, histamine- of inspanningsprovocatietest, hebben in de eerste lijn geen plaats in de diagnostiek van astma bij kinderen.
Voor de FeNO-meting, het bepalen van de fractie stikstofmonoxide (NO) in uitgeademde lucht, verwijst de werkgroep naar de Richtlijn astma bij kinderen, waarin de volgende aanbeveling is opgenomen: FeNO heeft bij kinderen met astma vooralsnog geen duidelijke toegevoegde waarde in aanvulling op of in plaats van de standaard diagnostiek (gestructureerde anamnese, spirometrie en provocatietests). Titreren van de behandeling (afbouwen van inhalatiecorticosteroïden) op geleide van FeNO-metingen leidt niet tot een betere uitkomst en wordt niet aangeraden.
Evaluatie
Naar Samenvatting ›Overweeg de diagnose ‘astma’ bij een karakteristiek patroon van terugkerende klachten van piepen, hoesten, kortademigheid of benauwdheid.
- Stel de diagnose ‘astma’ alleen bij grote waarschijnlijkheid:
- Wees terughoudend met het stellen van de diagnose ‘astma’ bij kinderen < 6 jaar.
- Stel bij kinderen < 6 jaar de symptoomdiagnose ‘episodisch expiratoir piepen’ bij ≥ 2 episodes met expiratoir piepen.
- Diagnostische aandachtspunten:
- Aangetoond specifiek IgE tegen inhalatieallergenen bij kinderen < 6 jaar maakt de diagnose ‘astma’ meer waarschijnlijk, maar is op zichzelf onvoldoende voor de diagnose.
- Een normale spirometrie sluit astma niet uit.
- Inspanningsgebonden klachten zonder verdere aanwijzingen voor astma of atopie zijn niet altijd het gevolg van astma, maar kunnen ook komen door een slechte conditie, bewegingsarmoede of overgewicht/obesitas. Inspanningsgebonden astma is geen aparte diagnose.
|
Aanwijzingen die de diagnose ‘astma’ waarschijnlijker maken |
|
|---|---|
|
Aanwijzingen die de diagnose ‘astma’ minder waarschijnlijk maken |
|
|
* Bronnen: Richtlijn astma bij kinderen, British guideline on the management of asthma |
|
Overregistratie en overdiagnostiek van astma bij kinderen vormen een probleem in de Nederlandse huisartsenpraktijk. Pouwelse et al. hebben in 7 Brabantse huisartsenpraktijken onderzocht wat de betrouwbaarheid is van de geregistreerde diagnose ‘astma’ (R96) bij kinderen van 6-16 jaar.
Bij 9% van de onderzochte kinderen was een astmacode in het HIS geregistreerd. Slechts bij 92 (42%) van de 218 kinderen met een compleet medisch dossier waren aanwijzingen voor astma in het dossier te vinden. Bij 28 (13%) kinderen was de diagnose ‘astma’ onwaarschijnlijk en bij 98 (45%) kinderen kon geen uitspraak gedaan worden over de validiteit van de diagnose ‘astma’.
De conclusie was dat de diagnose ‘astma’ niet bevestigd kon worden bij een meerderheid van de kinderen met code R96. Bij jonge kinderen of kinderen bij wie op jongere leeftijd R96 was vastgelegd bleek het vaker onmogelijk de diagnose te verifiëren. De onderzoekers concluderen dat de diagnostiek van astma bij kinderen en de registratie hiervan in de huisartsenpraktijk meer aandacht verdienen.
In een vergelijkbaar onderzoek hebben Looijmans et al. met een retrospectieve analyse alle kinderen van 6-18 jaar in een viertal academische huisartsenpraktijken in Utrecht geïdentificeerd, die de diagnose ‘astma’ hadden of werden behandeld met astmamedicatie.
Daarna werden de kinderen verdeeld over 4 groepen. Kinderen met afwijkende spirometrie werden ingedeeld in de groep ‘bevestigd astma’. Kinderen met een suggestieve voorgeschiedenis, medicatiegebruik en die lichamelijk onderzocht waren, werden ingedeeld in de groep ‘waarschijnlijk astma’. Kinderen zonder exacerbaties en met weinig tot geen medicatiegebruik werden ingedeeld in de groep ‘onwaarschijnlijk astma’ en kinderen bij wie door een specialist de diagnose werd ontkracht kwamen in de groep ‘geen astma’. Bij 652 kinderen was de diagnose ‘astma’ gesteld, bij slechts 23,2% was deze diagnose bevestigd door spirometrie en 53,5% viel uiteindelijk in de groepen ‘onwaarschijnlijk astma’ of ‘geen astma’.
Astma blijkt vaak als werkhypothese te worden gebruikt, vooral bij jonge kinderen. Als deze diagnose later onterecht of onwaarschijnlijk blijkt, is het van belang dit alsnog aan te passen, zodat deze kinderen niet onnodig medicatie gebruiken of onnodig een contra-indicatie in hun dossier hebben.
Differentiaaldiagnose
Naar Samenvatting ›- Er zijn veel andere oorzaken voor piepen, hoesten en/of benauwdheid, zoals pneumonie, bronchitis, rinitis, obesitas of een andere luchtweginfectie (zie voor bronchiolitis en pseudokroep NHG-standaard Acuut hoesten)
- Overweeg bij jonge kinderen, die langdurig hoesten of piepen ook de mogelijkheid van (tracheo)bronchomalacie, aangeboren afwijkingen van hart of grote vaten, of een corpus alienum in de onderste luchtwegen
- De diagnostiek naar cystische fibrose (CF) is sinds 2011 in het hielprikonderzoek bij pasgeborenen opgenomen. Hierdoor zal een bestaande diagnose ‘CF’ over het algemeen al bekend zijn.
- Bij kinderen (meestal >12 jaar) met benauwdheidsklachten die niet goed reageren op luchtwegverwijding en die gepaard gaan met druk op de borst, tremoren en paresthesieën, kan sprake zijn van een disfunctionele ademhaling.
Alternatieve diagnoses bij piepende ademhaling
Bij kinderen < 6 jaar is het lastig om de diagnose ‘astma’ te stellen. Met name in deze jonge leeftijdsgroep is het belangrijk om andere diagnoses te overwegen en eventueel uit te sluiten. Klinische aanwijzingen voor een alternatieve diagnose bij kinderen die piepen zijn:
|
Voorgeschiedenis/familieanamnese |
Mogelijke diagnose |
|---|---|
|
Klachten aanwezig direct vanaf de geboorte of perinataal longprobleem |
Cystische fibrose; chronische longziekte van de neonaat; primaire ciliaire dyskinesie; aanlegstoornis (bijvoorbeeld vaatring, tracheamalacie, bronchomalacie) |
|
Familieanamnese van bijzondere longziekte |
Cystische fibrose; neuromusculaire aandoening |
|
Ernstige bovenste luchtweginfecties |
Afweerstoornis; primaire ciliaire dyskinesie |
|
Klachten en symptomen |
Mogelijke diagnose |
|
Persisterende productieve hoest |
Cystische fibrose; bronchiëctasie; bronchitis; recidiverende aspiratie; afweerstoornis; primaire ciliaire dyskinesie; aanlegstoornis; corpus alienum |
|
Excessief spugen |
Gastro-oesofageale refluxziekte (al dan niet met aspiratie) |
|
Dysfagie |
Slikstoornis (al dan niet met aspiratie) |
|
Benauwd en licht in het hoofd en perifere tintelingen |
Paniekstoornis/disfunctionele ademhaling (hyperventilatie) |
|
Inspiratoire stridor |
Trachea- of larynxprobleem |
|
Abnormaal stemgeluid (evt bij huilen) |
Larynxprobleem |
|
Focale afwijkingen (auscultatie) |
Aanlegstoornis; postinfectieus; bronchiëctasie; tuberculose |
|
Clubbing/horlogeglasnagels |
Cystische fibrose; bronchiëctasie |
|
Failure to thrive |
Cystische fibrose; afweerstoornis; gastro-oesofageale refluxziekte; congenitale hartziekte |
|
Benauwd, geen afwijkingen bij auscultatie |
Diabetische ketoacidose bij (nieuwe) diabetes mellitus type 1 |
Disfunctionele ademhaling
De werkgroep verwijst hiervoor naar de Richtlijn astma bij kinderen, waarin de volgende aanbevelingen voor de kinderarts zijn opgenomen.
- Overweeg in de differentiaaldiagnose van astma de diagnose ‘disfunctionele ademhaling’ bij kinderen en adolescenten met aanvallen van benauwdheid die vergezeld gaan van specifieke klachten (kortademigheid, druk op de borst, duizeligheid, tremoren en paresthesieën) en die niet goed reageren op luchtwegverwijding.
- Stel de diagnose ‘disfunctionele ademhaling’ op de anamnese en de afwezigheid van positieve tests die een andere diagnose suggereren. Een hyperventilatieprovocatietest met capnogram wordt niet aanbevolen. Het gebruik van een (voor volwassenen gevalideerde) vragenlijst kan behulpzaam zijn.
- Bij (vermoeden van) disfunctionele ademhaling kan behandeling door een ervaren (kinder)oefentherapeut of (kinder)fysiotherapeut overwogen worden. Afhankelijk van de lokale situatie kan ook (proef)behandeling door een logopedist of ontspanningsoefeningen door middel van yoga in individuele gevallen worden uitgeprobeerd.
- Bij (een vermoeden van) gelijktijdige of voorafgaande bronchusobstructie is luchtwegverwijding aangewezen.
Richtlijnen beleid
Naar Samenvatting ›Behandeldoel
Naar Samenvatting ›Goede astmacontrole: zo min mogelijk klachten, geen beperkingen in activiteiten, normale deelname aan het maatschappelijke leven, afgestemd op de persoonlijke behandeldoelen en zo min mogelijk bijwerkingen van medicatie (zie Achtergronden).
Astmacontrole
Naar Samenvatting ›- Bepaal de mate van astmacontrole bij ieder vervolgconsult na het stellen van de diagnose.
- Beoordeel hiervoor de kenmerken uit tabel 6 over de 4 voorafgaande weken.
- Daarnaast kan ter bepaling van de astmacontrole bij kinderen gebruik worden gemaakt van gevalideerde vragenlijsten (zie CAHAG screeningsinstrumenten):
- Childhood Asthma Control Test (C-ACT; 4-11 jaar)
- Asthma Control Test (ACT; ≥ 12 jaar)
- Asthma Control Questionnaire (ACQ6; ≥ 12 jaar)
- De vragenlijsten kunnen ook als hulpmiddel gebruikt worden om over de klachten in gesprek te gaan
- Betrek bij het gesprek hierover de klachten en beperkingen bij dagelijkse activiteiten, zoals school, sport, spelen enzovoort.
Astmacontrole: 2 of 3 niveaus?
In de GINA-richtlijn wordt de mate van astmacontrole ingedeeld in 3 niveaus: ‘controlled’, ‘partly controlled’ en ‘uncontrolled’. In de Nederlandse situatie was er aanvankelijk consensus over de termen ‘goede’, ‘gedeeltelijke’ en ‘slechte’ astmacontrole. Deze indeling is dus overgenomen in de Zorgstandaard Astma Kinderen & Jongeren. In de huisartsenpraktijk gaf deze driedeling echter verwarring, omdat het beleid bij gedeeltelijke en slechte astmacontrole niet verschilde. Bij de herziening van de NHG-Standaard Astma bij volwassenen (2020) is daarom gekozen om deze driedeling te vervangen door een tweedeling in ‘goede’ en ‘onvoldoende’ controle. De werkgroep is van mening dat deze tweedeling ook bij kinderen met astma beter toepasbaar is en sluit daarmee aan bij de NHG-Standaard Astma bij volwassenen. De mate van controle wordt beoordeeld aan de hand van tabel 6 en als hulpmiddel kan een vragenlijst (ACQ6 of (C-)ACT) worden gebruikt (zie Astmacontrole 2).
Perceptie van astmacontrole
Er bestaat een discrepantie in de perceptie van astmacontrole tussen de arts en de patiënt. Daarnaast hebben zowel arts als patiënt de neiging om de mate van astmacontrole te overschatten. Onvoldoende astmacontrole komt vaak voor. Bij een onderzoek in de eerste lijn onder 2429 kinderen van 4-17 jaar met astma rapporteerde 46% onvoldoende astmacontrole.
Risicofactoren ernstige of blijvende klachten
Naar Samenvatting ›Betrek naast de klachten van de afgelopen 4 weken ook de risicofactoren voor ernstige of blijvende klachten, zoals eerdere longaanval(len), ziekenhuisopname, comorbiditeit en/of aanhoudende blootstelling aan prikkels, bij het bepalen van de mate van astmacontrole.
|
|
Goede controle |
Onvoldoende controle* |
|---|---|---|
|
Klachten overdag |
≤ 2 × per week |
≥ 3 × per week |
|
Beperking activiteiten |
Geen |
Ja |
|
Klachten tijdens slapen |
Geen |
Ja |
|
Gebruik SABA† |
≤ 2 × per week |
≥ 3 × per week |
|
Spirometrie |
Normaal |
Afwijkend‡ |
|
* Elke longaanval in de afgelopen 4 weken wordt gezien als onvoldoende controle Gebaseerd op Global strategy for asthma management and prevention. |
||
Astmacontrole bestaat uit de mate van controle over de astmaklachten van de afgelopen weken en een inschatting van het risico op ernstige of blijvende klachten.
Bij het bepalen van de mate van astmacontrole kan een vragenlijst worden gebruikt, deze evalueren de klachten van de afgelopen 4 weken (ACT) of 1 week (ACQ6). Evaluatie van de klachten van de afgelopen week of weken kan echter suboptimaal zijn, omdat:
- (te) frequent gebruik van luchtwegverwijders de klachten onder controle kan brengen, maar gepaard gaat met een groter risico op onder meer longaanvallen
- klachten veroorzaakt kunnen worden door comorbiditeit zoals angst of verminderde fysieke conditie
Risicofactoren voor toekomstige gezondheidsschade:
- longaanvallen (risico wordt vergroot door eerdere longaanval(len), suboptimaal medicatiegebruik, allergische comorbiditeit, armoede)
- persisterend verminderde longfunctie (risico wordt vergroot door blootstelling aan sigarettenrook of andere schadelijke stoffen, chronische hypersecretie van slijm, longaanval bij patiënten die geen ICS gebruiken)
- bijwerkingen van inhalatiemedicatie (risico op systemische schade wordt groter door hogere dosering; risico op lokale bijwerkingen wordt groter door slechte inhalatietechniek)
De werkgroep vindt met name het aantal longaanvallen in het afgelopen jaar waarvoor een orale corticosteroïdkuur of ziekenhuisopname noodzakelijk was een belangrijke factor om mee te wegen voor het toekomstige risico op een (ernstige) longaanval.
Voorlichting en niet-medicamenteuze behandeling
Naar Samenvatting ›Bespreek de volgende onderwerpen. Ga hierbij na wat de ouders en het kind al weten en welke voorlichting gewenst is.
Aard van de aandoening
Naar Samenvatting ›Leg uit bij episodisch expiratoir piepen
- Episodisch expiratoir piepen komt veel voor bij jonge kinderen, vaak bij een luchtweginfectie.
- Veel van deze kinderen hebben of krijgen geen astma.
- De kans op astma is groter als het kind ook last heeft van bijvoorbeeld eczeem of allergie.
Leg uit bij astma
- Astma is een ontstekingsziekte, waarbij periodes met en zonder klachten elkaar afwisselen.
- Astma is over het algemeen goed behandelbaar.
- De klachten kunnen worden uitgelokt door:
- allergische prikkels (vooral door huisstofmijt en huisdieren);
- niet-allergische prikkels (virale infecties, rook, fijnstof, inspanning, stress).
Prikkelbeperkende maatregelen
Naar Samenvatting ›Vermijd bij astma zoveel mogelijk prikkels die klachten uitlokken.
Niet-allergische prikkels
Naar Samenvatting ›- Bespreek, indien de anamnese aanwijzingen bevat voor niet-allergische prikkels, of en hoe deze vermeden kunnen worden (behalve klachten bij inspanning; zie Bewegen).
- Zie voor specifieke adviezen over weersomstandigheden en luchtverontreiniging, vocht en schimmel en irriterende stoffen het detail.
Om niet allergische prikkels te vermijden zijn de volgende maatregelen te overwegen. Deze zijn gebaseerd op richtlijnen van het RIVM (2018)en van NICE, waarbij zoveel mogelijk gebruik is gemaakt van de beschikbare evidence. Daarnaast is gebruik gemaakt van de expertise van het Longfonds.
Tabaksrook
Zorg voor een rookvrije omgeving (zie Niet roken).
Weersomstandigheden en luchtverontreiniging
- Let op luchtkwaliteit en smogwaarschuwingen afgegeven door het RIVM, dat verschillende klassen luchtkwaliteit onderscheidt.
- Overweeg bij verminderde luchtkwaliteit lichamelijke beweging te verminderen.
- Overweeg om deuren en ramen te sluiten bij verminderde luchtkwaliteit (en lokaal bijvoorbeeld ook bij barbecues of houtstook in de omgeving).
- Ga bij smog (door ozon, fijnstof en NO2) niet sporten in de middag of vroege avond.
- Kies bij fietsen, lopen of joggen een route die niet langs drukke wegen of kruispunten gaat en vermijd drukke momenten (ochtend- en avondspits).
Vocht en schimmel
- Schimmels gedijen goed in een vochtige omgeving. Vocht in de woning dat gegenereerd wordt door de aanwezigheid van personen, het gebruik van water, koken, douchen enzovoort gaat door ventileren naar buiten.
- Ventileer de woning 24/7 door klepramen en roosters open te laten (ook bij mist en regenachtig weer).
- Gebruik, indien aanwezig, het mechanische ventilatiesysteem (stand 2).
- Verwarm de woning goed en gelijkmatig (overdag 18-20 °C, overdag niet hoger dan 22 °C en 's nachts niet lager dan 18 °C). Voorkom grote temperatuurschommelingen.
- Lucht de woning regelmatig door ramen tegen elkaar open te zetten (niet bij regen of mist), doe dit als het kind niet in de kamer is.
- Ventileer extra goed bij koken en douchen (afzuigkap aan bij koken en daarna half uur aan laten staan of, indien aanwezig, mechanisch ventilatiesysteem tot een half uur na het douchen of koken op de hoogste stand aan laten staan).
- Deksel op de pan bij koken.
- Droog de was buiten of gebruik een wasdroger.
- Houd de deur van keuken en badkamer dicht bij koken en douchen:
- ventileer goed tijdens het douchen en douche zo kort mogelijk
- maak na het douchen wanden en vloer droog met een wisser
- verhelp lekkage en vochtproblemen zo snel mogelijk
- Pak vocht en schimmelplekken in huis aan. Neem hiervoor zo nodig contact op met de verhuurder of woningbouwvereniging.
Vluchtige organische stoffen en ‘prikkelende luchtjes’
- Ventileer de woning 24/7 door klepramen/roosters open te laten (ook bij mist en regenachtig weer).
- Zet bij koken de afzuigkap aan en laat deze daarna nog een half uur aan staan.
- Vermijd irriterende stoffen binnenshuis, bijvoorbeeld door houtgestookte apparaten of een open haard, (geur)kaarsen en wierook, planten en bloemen, schoonmaakmiddelen, spuitbussen en andere geurverspreiders.
Onderhoud mechanische ventilatiesystemen regelmatig.
Allergische prikkels
Naar Samenvatting ›- Vermijd zoveel mogelijk allergische prikkels die klachten uitlokken.
- Bespreek bij onvoldoende astmacontrole bij kinderen ≥ 6 jaar de mogelijkheid van een bloedonderzoek op inhalatieallergenen (zie Aanvullend onderzoek). Overweeg het bloedonderzoek na enkele jaren te herhalen als de uitslag op jonge leeftijd negatief was.
Huisdieren
- Bij een allergie voor huisdieren lijkt afstand doen van het dier de meest effectieve maatregel. Dit lijkt beter te werken dan optimale medicamenteuze behandeling. Het dier op proef korte tijd uit huis doen is niet zinvol, omdat het enige maanden kan duren voordat de allergenen verdwenen zijn.
- Indien de patiënt of een van de andere gezinsleden geen afstand van het huisdier kan doen:
- bespreek het nut van:
- een glad vloeroppervlak
- aangepast schoonmaken (regelmatig vochtig afnemen en stofzuigen in afwezigheid van de patiënt)
- adviseer contact met het huisdier (aaien/knuffelen) te vermijden en het dier niet in de slaapkamer te laten
- adviseer direct na het contact de handen te wassen indien er toch contact is geweest
- bespreek het nut van:
- Adviseer geen nieuw huisdier aan te schaffen.
- Zie verder NHG-Standaard Astma bij volwassenen.
Pollenallergie
- Adviseer bij hooikoorts buiten een bril of zonnebril te dragen, wasgoed niet buiten te drogen, het gezicht met een washand af te nemen na buiten te zijn geweest en frequent voor het slapen gaan de haren te wassen met water om achtergebleven pollen te verwijderen.
- Raad aan de hooikoortsverwachting te volgen. Dan kan het kind (en/of de ouders) besluiten preventief (extra) medicatie te nemen.
- Zie verder NHG-Standaard Allergische en-niet-allergische rinitis.
Huisstofmijt
- Huisstofsanering heeft een beperkt effect: overweeg maatregelen ter reductie van de blootstelling aan huisstofmijt alleen bij blijvend onvoldoende astmacontrole indien een relatie met huisstofallergie erg waarschijnlijk is. Zie verder NHG-Standaard Astma bij volwassenen, Verminderen blootstelling huisstofmijt.
- Maatregelen om blootstelling aan huisstofmijt te verminderen:
- vochtbestrijding door regelmatig ventileren van de woning; dit is ook goed om schimmelvorming te voorkomen
- glad slaapkamervloeroppervlak (gemakkelijk te reinigen)
- aangepast schoonmaken (regelmatig vochtig afnemen en stofzuigen in afwezigheid van de patiënt)
- Aanvullende maatregelen bij blijvend onvoldoende astmacontrole:
- Maak in overleg met het kind/ouders een inschatting van de haalbaarheid van de volgende maatregelen en het te verwachten resultaat.
- Was beddengoed minstens 1 × per 2 weken op 60 °C.
- Allergeenwerende hoezen voor matras, kussen en dekbed zijn alleen zinvol als onderdeel van een totaalpakket ‘vermindering huisstofmijtexpositie’. Adviseer dit alleen indien alle hiervoor genoemde maatregelen ook haalbaar zijn.
- In sommige gevallen kan een astmaverpleegkundige of praktijkondersteuner aan de hand van een huisbezoek problemen signaleren en voorlichting en adviezen geven op het gebied van prikkelreductie.
- Voor informatie over aanvullende maatregelen bij huisstofmijtallergie, zie de website van het Longfonds.
Thuisarts
Naar Samenvatting ›Verwijs naar de informatie op thuisarts.nl. De informatie op Thuisarts is gebaseerd op deze NHG-Standaard.
Niet roken
Naar Samenvatting ›Streef naar een rookvrije omgeving voor het kind:
- raad roken door het kind zelf af
- raad roken door de ouders/verzorgers, of door anderen in de omgeving van het kind af
- raad ook blootstelling aan derdehandsrook af (zie Achtergronden).
Toelichting
- Roken door de ouders verhoogt voor het kind het risico op onvoldoende astmacontrole, longaanvallen of ziekenhuisopname vanwege astma of een luchtweginfectie.
- Roken verergert het beloop van astma en zorgt voor een afname van de werkzaamheid van ICS.
- Zie voor gedetailleerde informatie de NHG-Behandelrichtlijn Stoppen met roken.
- Blootstelling aan rook tijdens de zwangerschap en passief roken op de kinderleeftijd geven een verhoogd risico op astma en op lage luchtweginfecties bij kinderen.
- In een meta-analyse van het effect van roken door ouders of andere huisgenoten en het risico op piepen en astma bleek dat blootstelling pre- of postnataal aan tweedehands rook (passief roken of meeroken) geassocieerd was met een minstens 20% grotere kans op piepen en astma. Tweedehands rook gaf een 30-70% grotere kans op piepen (grootste effect van postnataal roken door de moeder op piepen bij kinderen ≤ 2 jaar; OR 1,70; 95%-BI 1,24 tot 2,35; 4 onderzoeken) en een 21-85% grotere kans op astma (grootste effect van prenataal roken door de moeder op astma bij kinderen ≤ 2 jaar; OR 1,85; 95%-BI 1,35 tot 2,53; 5 onderzoeken).
- Bij kinderen met astma en blootstelling aan tweedehands rook is het risico op ziekenhuisopnamen verhoogd (in een systematische review van 25 observationele onderzoeken met ruim 430.000 kinderen, gemiddelde leeftijd 7,9 jaar, OR 1,85; 95%-BI 1,20 tot 2,86) en onvoldoende astmacontrole. Vermindering van tweedehands rook verbetert de astmacontrole en vermindert het risico op ziekenhuisopnamen (18% minder bij kinderen < 19 jaar).
- Bij kinderen en adolescenten die zelf roken is er een verhoogd risico op slechte astmacontrole en ziekenhuisopname. Daarnaast leidt roken tot verminderde effectiviteit van inhalatie- en orale corticosteroïden en tot versnelde afname van de longfunctie (zie Inhalatiecorticosteroïden). Stoppen met roken geeft een verbetering van de longfunctie.
- Als tabaksrook neerdaalt in de omgeving en daar reageert met andere stoffen ontstaan nieuwe, schadelijker stoffen. Consequent buiten roken door de ouders voorkomt niet dat kinderen blootgesteld worden aan bestanddelen van tabaksrook. Het neerdalen van stoffen die tijdens het roken vrijkomen en na het roken achterblijven op haren, kleding, huid, muren en meubels (‘derdehands rook’) draagt mogelijk ook bij aan een verhoogde risico op luchtwegklachten (zie de brochure Kinderen en roken van Trimbos). Hoe groot de gezondheidsschade door derdehands rook is, is nog niet bekend. Onderzoekers schatten dat 5-60% van de schade die nu toegeschreven wordt aan meeroken veroorzaakt wordt door derdehands rook.
Conclusie
Er is bewijs dat roken en meeroken het risico op het ontstaan van astma vergroten en de klachten van astma verergeren.
Overwegingen
Uit onderzoeken blijkt dat roken en meeroken de klachten van astma verergeren. In internationale richtlijnen op het gebied van astma wordt roken ontraden. De werkgroep sluit met deze aanbeveling aan bij de internationale richtlijnen.
Griepvaccinatie
Naar Samenvatting ›- Het NHG volgt het advies inzake griepvaccinatie van de Gezondheidsraad (2021).
- De Gezondheidsraad adviseert een jaarlijkse griepvaccinatie voor kinderen met astma die een onderhoudsbehandeling met ICS krijgen (zie NHG-Praktijkhandleiding Griepvaccinatie 2021)
- Bespreek met kinderen met astma en hun ouders die twijfelen over het nut van vaccineren dat:
- de ernst van het astma belangrijk is om mee te nemen in de overweging
- het bewijs voor effectiviteit van de griepvaccinatie gering is
Ademhalingsoefeningen
Naar Samenvatting ›Overweeg ademhalingsoefeningen uitsluitend bij kinderen met astma bij wie een slechte ademtechniek de klachten beïnvloedt. Dit zijn bijvoorbeeld klachten van benauwdheid die niet reageren op luchtwegverwijding.
Toelichting
Verwijs dan naar een (kinder)fysiotherapeut of (kinder)oefentherapeut met expertise op het gebied van ademhalingsoefeningen of ademregulatietherapie.
Uit de onderzoeken, van zeer lage kwaliteit, blijkt geen duidelijk effect van ademhalingsoefeningen op de astmacontrole en/of op de astmagerelateerde kwaliteit van leven. De werkgroep vindt op basis hiervan dat er voor de grote groep kinderen met astma in de eerste lijn geen indicatie is voor ademhalingsoefeningen. Alleen bij kinderen met astma bij wie de huisarts vermoedt dat een slechte ademtechniek van invloed is op de klachten kunnen ademhalingsoefeningen overwogen worden.
Voor- en nadelen
De voor- en nadelen zijn moeilijk in te schatten, er zijn zeer voorzichtige aanwijzingen dat ademhalingsoefeningen longaanvallen zouden kunnen voorkomen. De interventie vraagt een tijdsinvestering van de patiënt en de ouders. Er zijn geen schadelijke lichamelijke gevolgen van de interventie bekend. Ademhalingsoefeningen zouden mogelijk verwarring kunnen geven bij het kind en de ouders over het ontstaan van astma, namelijk dat verkeerd ademhalen astma zou veroorzaken. Uitleg over het ontstaan van astma voorafgaand aan de interventie zou dit kunnen voorkomen.
Kwaliteit van bewijs
De kwaliteit van het bewijs was zeer laag. Oorzaak is dat er vertekening van resultaten kan zijn omdat er bij 1 onderzoek een simpele randomisatie is uitgevoerd bij een kleine onderzoeksgroep (waardoor er een scheve verdeling van kenmerken van de onderzoeksgroepen kan ontstaan) en er bij het andere een verschil was tussen de groepen in longfunctie op de baseline. Verder waren het aantal events klein (soms maar 2-3 in een onderzoeksgroep), waardoor de uitkomsten onnauwkeurig zijn (breed betrouwbaarheidsinterval).
Waarden en voorkeuren van patiënten
We denken dat het kind en de ouders voorkeur geven aan een behandeling waarbij het te verwachten effect opweegt tegen de tijdsinvestering die hiervoor moet worden gedaan.
Kosten
De kosten per behandeling zijn € 37-45 per behandeling van een half uur (zie https://defysiotherapeut.com). In 2021 wordt kinderfysiotherapie of kinderoefentherapie voor kinderen < 18 jaar vanuit de basisverzekering vergoed voor maximaal 18 behandelingen per jaar.
Aanvaardbaarheid
De interventie is aanvaardbaar.
Haalbaarheid
(Kinder)fysiotherapeuten en (kinder)oefentherapeuten, bij voorkeur met ervaring met ademhalingsoefeningen, zijn in heel Nederland beschikbaar. Er zijn in Nederland ongeveer 1800 geregistreerde kinderfysiotherapeuten (zie https://dekinderfysiotherapeut.com) en 300 geregistreerde kinderoefentherapeuten (zie https://kinderoefentherapie.nl). Een kinderfysiotherapeut of kinderoefentherapeut heeft meer ervaring en scholing op het gebied van de omgang met de omgeving (bijvoorbeeld de ouders) van kinderen. Met name bij jonge kinderen heeft dit toegevoegde waarde. Bij oudere kinderen kan ook een fysio- of oefentherapeut met ervaring op het gebied van astma en affiniteit met kinderen deze doelgroep behandelen. De haalbaarheid wordt ingeschat als goed.
Uitgangsvraag
Zijn ademhalingsoefeningen aan te bevelen bij kinderen en adolescenten van 6-18 jaar met astma in de eerste lijn?
| Patiënten | Kinderen met astma 6-11 jaar Kinderen en adolescenten met astma van 12-18 jaar |
|---|---|
| Interventie | Ademhalingsoefeningen begeleid door een therapeut |
| Vergelijking | Gebruikelijke zorg |
| Uitkomstmaten | Astmacontrole
|
Achtergrond
In de vorige versie van deze NHG-Standaard werd beschreven dat bij kinderen met astma tot nu toe onvoldoende bewijs was voor het inzetten van ademhalingsoefeningen als niet-medicamenteuze behandeling in de eerste lijn, maar dat ademhalingsoefeningen in bepaalde situaties mogelijk zinvol zouden kunnen zijn. De NHG-Standaard omschreef echter niet duidelijk welke situaties dit betrof.
Uit onderzoek van matige kwaliteit bij volwassenen met astma, bij wie een slechte ademhalingstechniek de klachten beïnvloedt, blijkt dat ademhalingsoefeningen mogelijk de klachten van disfunctionele ademhaling (hyperventilatie), de longfunctie en de kwaliteit van leven kunnen verbeteren.
In internationale richtlijnen wordt geadviseerd om bij volwassenen ademhalingsoefeningen te overwegen als toevoeging op de conventionele behandeling indien een slechte ademhalingstechniek de klachten beïnvloedt.
De vraag is of ademhalingsoefeningen ook bij kinderen met astma van toegevoegde waarde kunnen zijn.
Methoden
Er is een systematische literatuurzoekactie naar SR’s en RCT’s uitgevoerd in PubMed en Embase in oktober 2020.
Resultaten
Resultaat zoekactie
De zoekactie leverde een systematische review met meta-analyse van goede kwaliteit op naar fysiotherapeutische interventies bij kinderen en adolescenten met astma.
Bij 2 van de 18 RCT’s in deze review bestond de interventie uit ademhalingsoefeningen.
Bij de overige 16 onderzoeken bestond de interventie uit bewegen (bijvoorbeeld zwemmen, hardlopen, fietsen). Alleen de 2 onderzoeken over ademhalingsoefeningen hebben wij meegenomen.
De search van Zhang et al. liep tot november 2018 en is door het NHG aangevuld tot oktober 2020. Er werd geen nieuw relevant onderzoek gevonden. De eindsearch op 27 oktober 2021 leverde 1 relevante RCT op,
de resultaten uit deze RCT veranderen de wetenschappelijke conclusies niet.
Onderzoekskarakteristieken
In de RCT van Lima et al. werden 50 kinderen (gemiddeld 9,7 jaar; range 8-12 jaar) met onvoldoende astmacontrole (geen ACT-score beschreven), zonder voorafgaande astmabehandeling, gerandomiseerd in 2 groepen.
De ademhalingsoefeningengroep kreeg gedurende 7 weken 2 × per week 25 minuten ademhalingsoefeningen waarin de oefening 10 × werd herhaald, aangevuld met 25 minuten krachttraining van de ademhalingsspieren (inspiratory muscle training, IMT), eenmalig 1 uur astma-educatie en een maandelijks medisch controlebezoek gedurende 3 maanden. De controlegroep kreeg alleen astma-educatie en medische controlebezoeken. De uitkomsten werden verzameld bij de medische controlebezoeken en werden vergeleken met het eerste bezoek (dag 0) en het laatste bezoek (dag 90).
In de RCT van Bignall et al. werden 33 Afro-amerikaanse kinderen (gemiddeld 15,5 jaar; range 12-17 jaar; 66% vrouw) met astma met onvoldoende astmacontrole (ACT-score ≤ 20) gerandomiseerd naar een ademhalingsoefeninginterventie met 2 sessies van elk 30 minuten, plus een instructiescript en -cd om thuis te oefenen en astma-educatie, versus 2 sessies astma-educatie in de controlegroep.
Tussen de 2 sessies zaten gemiddeld 33 dagen.
Analyse
De resultaten van de 2 onderzoeken zijn gepoold, de forestplot is opgenomen als als bijlage in Totstandkoming en methoden. De resultaten staan samengevat in tabel Ademhalingsoefeningen begeleid door een professional voor kinderen en adolescenten met astma versus gebruikelijke zorg.
Conclusies
- We zijn onzeker over het effect van ademhalingsoefeningen op het risico op longaanvallen. Mogelijk kunnen ademhalingsoefeningen het risico op longaanvallen verminderen.
- We zijn onzeker over het effect van ademhalingsoefeningen op astmagerelateerde kwaliteit van leven en risico op ziekenhuisopname en behandeling op de SEH.
- We zijn onzeker, maar mogelijk hebben ademhalingsoefeningen een effect op astmacontrole.
Bewegen
Naar Samenvatting ›- Adviseer bij kinderen met astma minimaal de Beweegrichtlijnen 2017 aan te houden.
- Inspanningsgebonden klachten kunnen optreden door een verminderde conditie (afgenomen inspanningscapaciteit), maar ook door angst voor inspanningsgebonden astmaklachten.
- Bespreek de mogelijkheid van een verwijzing naar een (kinder)oefen- of (kinder)fysiotherapeut, bij voorkeur met expertise op het gebied van astma. Doe dit met name bij:
- kinderen die onvoldoende bewegen of bij wie de motoriek achterblijft, of bij twijfel over een verminderde conditie
- kinderen met inspanningsgebonden (astma)klachten
- kinderen of ouders met vragen over bewegen en/of sporten
- Raad intensief bewegen of sporten tijdens een longaanval af.
Achtergrond
Bij kinderen met astma verbetert regelmatige lichaamsbeweging volgens de beweegnorm de cardiovasculaire conditie en de kwaliteit van leven.
Daarnaast wijzen eerdere publicaties op verbetering van de cardiovasculaire conditie bij kinderen met astma door oefentherapie. Het effect op astmacontrole, longfunctie en de astmagerelateerde kwaliteit van leven is niet eenduidig.
Uitgangsvraag
Wat is het effect van oefentraining bij kinderen met astma op de astmacontrole, longfunctie en astmagerelateerde kwaliteit van leven?
Methoden
Niet-systematische zoekactie in PubMed.
Resultaten
In 2018 werd een systematische review en meta-analyse verricht naar het effect van oefentherapie op longfunctie en kwaliteit van leven bij kinderen met respiratoire aandoeningen.
Er werden 17 onderzoeken (RCT’s) geïncludeerd uit 13 verschillende landen, gepubliceerd tussen 1998 en 2015, van kinderen met astma onder behandeling in de eerste of tweede lijn, leeftijd 8-14 jaar, onderzoekspopulatie 8-105 (gemiddeld 34). Ernst van het astma, medicatiegebruik of conditie voorafgaand aan de interventie werden niet gerapporteerd.
Alle interventies bestonden uit gesuperviseerde, meestal individuele oefentherapie. De interventies verschilden van aard (bijvoorbeeld hardlopen, fietsen, zwemmen, combinaties van aerobics met krachttraining), duur (meerderheid 6-16 weken), frequentie (meerderheid 2-3 × per week) en duur van de sessie (gemiddeld 50-60 minuten). De controlegroep kreeg meestal gebruikelijke zorg volgens de geldende richtlijnen. Bij 5 onderzoeken was geen informatie over de controlegroep vermeld.
Bij 11 van de 17 onderzoeken bij kinderen met astma was de kwaliteitsscore ≥ 6 (Pedro-schaal 0-9, niet te blinderen voor de interventie). Voor de meta-analyse werden de meest voorkomende uitkomsten gebruikt: de cardiovasculaire conditie (maximale zuurstofopname (piek-VO2), 4 onderzoeken), de longfunctie (FEV1 % van voorspeld, 10 onderzoeken) en de astmagerelateerde kwaliteit van leven (PAQLQ, 6 onderzoeken). Meta-analyse van deze 3 uitkomsten toonde dat oefentherapie bij kinderen met astma de cardiovasculaire conditie (standardized mean difference (SMD) 1,97; 95%-BI 0,61 tot 3,32) en de astmagerelateerde kwaliteit van leven (SMD 1,33; 95%-BI 0,65 tot 2,01) verbeterde, maar geen effect had op de longfunctie (SMD 0,06; 95%-BI –0,52 tot 0,65).
Overwegingen
Bewegen volgens de beweegnorm verbetert ook bij kinderen met astma de kwaliteit van leven. Deze norm kan ook gehanteerd worden bij kinderen met astma. Onderzoek naar oefentherapie laat geen duidelijk aanvullend of nadelig effect zien op astmagerelateerde uitkomsten.
Conclusie
De werkgroep onderschrijft de Beweegrichtlijnen van de Gezondheidsraad. Deze norm kan ook gehanteerd worden voor kinderen met astma.
Gewichtsreductie
Naar Samenvatting ›Adviseer gezonde voeding en beweging (zie Bewegen; zie ook de Richtlijnen goede voeding 2015 en de Beweegrichtlijnen 2017 van de Gezondheidsraad).
Toelichting
- Kinderen met astma en overgewicht ervaren meer klachten, onder meer door vergrote druk van de buik.
- Bij kinderen met astma en overgewicht is vaak een hogere dosering ICS nodig.
- Leg uit dat gewichtsreductie (op gezonde wijze) zinvol is.
- Overweeg de mogelijkheid van een verwijzing naar de (kinder)diëtist bij kinderen met sociale of gezinsfactoren of bij lage gezondheidsvaardigheden die het aanleren van nieuw gedrag of gewoontes bemoeilijken.
Gecombineerde leefstijlinterventie
Naar Samenvatting ›Overweeg een gecombineerde leefstijlinterventie (GLI) bij kinderen met overgewicht of obesitas (zie NHG-Standaard Obesitas). Bespreek de voor- en nadelen.
Bij kinderen met obesitas en astma is het onzeker of een GLI de astmacontrole of de kwaliteit van leven zou kunnen verbeteren. Er is wel bekend dat minimaal stabilisatie van het gewicht bij kinderen met obesitas (zonder astma) al een algehele aanzienlijke gezondheidswinst oplevert (zie NHG-Standaard Obesitas). Er zijn geen belangrijke lichamelijke nadelen van de interventie bij kinderen met astma beschreven. Ondanks de zeer lage kwaliteit en de onzekerheid van het bewijs vindt de werkgroep de algehele gezondheidswinst, die een GLI voor kinderen met obesitas kan opleveren een belangrijke overweging om mee te nemen in de aanbeveling.
Voor- en nadelen
Er worden bij de onderzoeken geen duidelijke voordelen of negatieve effecten nadelen gevonden van een GLI op astmagerelateerde uitkomsten. Er wordt een verschil van ongeveer 2 punten op de ACT gezien in het voordeel van de interventie, maar het minimaal klinisch relevante verschil bij de ACT is 3 punten. Bekend is dat gewichtsstabilisatie bij kinderen zonder astma al een algehele belangrijke gezondheidswinst oplevert (zie NHG-Standaard Obesitas). Nadelen van een GLI zijn de motivatie en de tijdsinspanning die het vergt van het kind en de ouders.
Kwaliteit van bewijs
De kwaliteit van het bewijs was zeer laag. Oorzaak is dat er vertekening van resultaten kan zijn omdat de groepen erg klein waren en er in 1 onderzoek
veel uitval van deelnemers was. Daarnaast was het bij beide onderzoeken niet mogelijk om de deelnemers te blinderen. Bij het onderzoek van Willeboordse et al. werden ook kinderen meegenomen met een verhoogd risico op het ontwikkelen van astma (dus geen diagnose ‘astma’) en obesitas.
Het onderzoek van Willeboordse et al. werd gesponsord door het Longfonds en door de farmaceutische industrie. Hier is niet voor afgewaardeerd bij de kwaliteit van het bewijs, omdat de sponsoren geen directe betrokkenheid hadden bij onderzoeksopzet, interventie, dataverzameling en analyse, noch bij de publicatie.
Waarden en voorkeuren van patiënten
We denken dat het voor het kind en de ouders belangrijk is dat het een niet-medicamenteuze behandeling is, met blijvende algehele gezondheidswinst. Het vergt inspanning van het kind en het gezin om een GLI vol te houden.
Kosten
Een GLI bestaat uit een intake (NZA-tarief 2021: € 61,58), een behandelfase van 1 jaar (NZA-tarief 2021: 4 × € 115,19 = 460,76) en een onderhoudsfase van 1 jaar (4 × € 78,35 = 313,40). De totale kosten zijn € 835,74. In 2021 wordt een GLI vanuit de basisverzekering vergoed voor volwassenen en kinderen van 16 en 17 jaar na verwijzing door de huisarts. Regionaal kan er vergoeding beschikbaar zijn vanuit het sociaal domein (in 2021 lopen er 2 programma’s).
Aanvaardbaarheid
De aanvaardbaarheid wordt ingeschat als redelijk. In sommige regio’s is ervaring met het aanbevelen van een GLI bij volwassenen met obesitas. Het kan voor de huisarts moeilijk zijn om gewichtsreductie aan te kaarten bij het kind en de ouders. Voor kinderen met obesitas loopt tot maart 2021 het implementatietraject Kind naar gezonder gewicht.
Haalbaarheid
De interventie is alleen haalbaar als het kind en zijn omgeving gemotiveerd zijn om blijvende aanpassingen in hun dagelijks leven te implementeren. Het is van belang om vóór het starten de motivatie en belemmerende factoren voor het kind en de ouders in kaart te brengen.
Uitgangsvraag
Is een gecombineerde leefstijlinterventie (GLI) gericht op gewichtsreductie aan te bevelen bij kinderen en adolescenten van 6-18 jaar met astma en obesitas?
| Patiënten | Kinderen van 6-11 jaar met astma en obesitas Kinderen en adolescenten van 12-18 jaar met astma en obesitas |
|---|---|
| Interventie | Gecombineerde beweeg- en dieetinterventie (GLI) gericht op gewichtsreductie |
| Vergelijking | Gebruikelijke astmazorg |
| Uitkomstmaten | Astmacontrole
|
Achtergrond
Uit een recente meta-analyse van 18 onderzoeken onder ruim 73.000 kinderen blijkt dat overgewicht of obesitas op de kinderleeftijd geassocieerd is met astma bij kinderen (OR 1,30; 95%-BI 1,23 tot 1,39) maar ook met een piepende ademhaling zonder astmadiagnose (OR 1,90; 95%-BI 1,38 tot 2,63).
De vraag is of gewichtsreductie bij kinderen met obesitas en astma de astmacontrole verbetert en longaanvallen voorkomt. Bij kinderen met obesitas (zonder astma) levert minimale stabilisatie van het gewicht al een algehele aanzienlijke gezondheidswinst op (zie voor meer gedetailleerde informatie NHG-Standaard Obesitas).
Er zijn verschillende onderzoeken gedaan naar een geïsoleerde dieet- of beweeginterventie bij kinderen met obesitas en astma. Deze onderzoeken waren vaak van korte duur en de gebruikte uitkomsten werden door de werkgroep als niet-cruciaal beoordeeld (bijvoorbeeld alleen de longfunctie en geen patiëntrelevante uitkomsten). De werkgroep heeft besloten deze onderzoeken buiten beschouwing te laten omdat gecombineerde interventies bij kinderen met obesitas zonder astma effectiever lijken (zie NHG-Standaard Obesitas). In dit detail worden daarom alleen onderzoeken naar GLI behandeld.
Een observationeel onderzoek van lage kwaliteit naar een GLI bij 26 kinderen met obesitas en astma liet na 1 jaar een afname zien van astmagerelateerde klachten (hoesten en piepen) (DaSilva, 2012}. In een onderzoek naar een GLI bij volwassenen met astma leidde gewichtsverlies van 5-10% tot een klinisch relevante toename van de astmacontrole (ACQ −0,5; SD 0,7) en verbeterde de astmacontrole bij 58% van de patiënten.
Methoden
Er is een systematische literatuurzoekactie naar SR’s en RCT’s uitgevoerd in PubMed en Embase in oktober 2020.
Resultaten
Resultaat zoekactie
De zoekactie leverde 1 systematische review van goede kwaliteit op. De geïncludeerde onderzoeken waren meestal van matige kwaliteit. Bij 2 onderzoeken bestond de interventie uit een GLI. Alleen het onderzoek van Willeboordse et al. rapporteerde de cruciale uitkomsten. De search liep tot november 2018 en is door het NHG aangevuld met 1 onderzoek.
Onderzoekskarakteristieken
In de RCT van Willeboordse et al. werden 87 kinderen (gemiddeld 12,2 jaar; range 6-16 jaar) met astma of verhoogd risico op het ontwikkelen van astma (minstens 1 eerstegraads familielid met astma) én overgewicht (BMI-SDS of ≥ 1,1 en < 2,3) of obesitas (BMI-SDS of ≥ 2,3) gerandomiseerd in 2 groepen (multifactoriële gewichtsinterventiegroep en controlegroep).
Zowel kinderen met astma onder behandeling in de eerste lijn als in de tweede lijn konden deelnemen, 43% van de kinderen gebruikte een ICS.
De interventiegroep volgde 18 sessies door een diëtist en een psycholoog gericht op leefstijl (75-90 minuten, dieetadvies en cognitieve gedragstherapie), 10 sessies voor de ouders (60 minuten, gericht op leefstijl), 8 individuele sessies en sportsessies (60 minuten, 2 × per week gedurende de eerste 6 maanden, daarna voor 12 maanden 3 × per maand en 1 × bij week bij sportclub in de buurt). De controlegroep ontving de gebruikelijke astmazorg volgens de geldende NHG-Standaard en de NVK-richtlijn. De totale duur van het onderzoek was 18 maanden, met elke 6 maanden een controle.
In een pilot-RCT van Fedele et al. werden 24 kinderen (gemiddeld 8,7 jaar, range 6-12 jaar) met astma onder behandeling bij de kinderarts en een BMI ≥ p85 gerandomiseerd in 2 groepen.
De interventiegroep volgde samen met de ouders 12-groepssessies (90 minuten, 3 × per maand) en 4 individuele sessies (90 minuten, 1 × per maand) gericht op implementeren van gezondere dieet- en beweegpatronen in het dagelijks leven aan de hand van wekelijks opgestelde persoonlijke doelstellingen. De controlegroep ontving samen met de ouders de gebruikelijke astmazorg met daarbij hetzelfde aantal sessies als de interventiegroep, waarin als placebo actieve spellen gespeeld werden, zonder verdere specifieke uitleg. De resultaten werden gemeten direct na de interventieperiode (4 maanden) en na 6 maanden follow-up en vergeleken met baseline.
Analyse
De resultaten van de 2 onderzoeken zijn niet gepoold, vanwege verschillen tussen de interventies en een verschillende interventie- en follow-upperiode. De ongepoolde forestplots zijn opgenomen als bijlage in Totstandkoming en methoden. De resultaten zijn samengevat in tabel Gecombineerde leefstijlinterventie bij kinderen en adolescenten met astma en obesitas vergeleken met de gebruikelijke astmazorg.
Conclusie
- We zijn onzeker over het effect van een GLI op de astmacontrole. Er wordt geen klinisch relevant verschil gevonden op de astmacontrole.
- We zijn onzeker over het effect van een GLI op de astmagerelateerde kwaliteit van leven.
Omgang van het kind (en/of de ouders) met de aandoening
Naar Samenvatting ›Bespreek of het kind (en of de ouders):
- angstig is voor kortademigheid en of dit problemen geeft in het dagelijks leven
- moeite heeft met of schaamte heeft voor het gebruik van inhalatiemedicatie in gezelschap
- andere klachten heeft, zoals vermoeidheid, en of die problemen geven in het dagelijks leven
Werk- en beroepskeuze
Naar Samenvatting ›- Voor jongeren met astma en hun ouders is het vaak onbekend welk soort werk astma kan verergeren. Het is bij de school- en beroepskeuze van belang hier rekening mee te houden.
- Risicovol zijn werkomstandigheden waarin blootstelling optreedt aan allergische en/of niet-allergische prikkels (poeders, prikkelende stoffen in de lucht) of die intensieve fysieke inspanning vereisen.
- Bespreek zo nodig de opties voor werk- en beroepskeuze en geef aan wanneer werkomstandigheden ongunstig zijn of adviseer de werk- en beroepskeuze te bespreken met de JGZ.
- Zie verder NHG-Standaard Astma bij volwassenen, onderdeel Werk.
Risicovolle beroepen voor mensen met astma kunnen bijvoorbeeld zijn: bakker, hout- of metaalbewerker, lasser, schilder, texielverwerker, productie/opslagmedewerker, schoonmaker, werk in verzorging, thuiszorg en verpleging, werk met dieren, tandheelkundig of laboratoriummedewerker en kapper.
Zelfmanagement en individueel zorgplan
Naar Samenvatting ›- Afhankelijk van de ernst van het astma en de mate waarin het kind zijn astma onder controle heeft, kan de behandeling worden vastgelegd in een Individueel Zorgplan (IZP). Dit is vooral belangrijk bij kinderen met onvoldoende astmacontrole en ernstiger astma.
- Zie voor meer gedetailleerde informatie Uitgebreidere controles.
Ondersteunende informatie
Naar Samenvatting ›- Op www.begrijpjelichaam.nl is eenvoudige uitleg en beeldmateriaal over astma te vinden.
- De site inhalatorgebruik.nl bevat instructiefilmpjes met inhalatie-instructies.
- Patiëntenvereniging het Longfonds. Voor ouders van kinderen met astma is hier aparte informatie (ook in het Turks en Arabisch) beschikbaar.
- Voor kinderen met astma is er de website astmakids.nl en voor jongeren van 12-17 jaar de app Astmaatje. Deze app kan ook gebruikt worden ter ondersteuning van de controles of bij het maken van een IZP.
- Informeer het kind en de ouders over de mogelijkheden van lotgenotencontact, bijvoorbeeld via een betrouwbaar forum (www.longforum.nl) of via de digitale zorggids van de Patiëntenfederatie.
Thuisarts
Naar Samenvatting ›Verwijs naar de informatie op thuisarts.nl. De informatie op Thuisarts is gebaseerd op deze NHG-Standaard.
Medicamenteuze behandeling
Naar Samenvatting ›Uitgangspunten
Naar Samenvatting ›- Maak bij de behandeling van episodisch expiratoir piepen en astma gebruik van inhalatiemedicatie.
- Het beleid is afhankelijk van de leeftijd: zie het stappenplan < 1 jaar, 1-6 jaar en ≥ 6 jaar.
- Controleer in de instelfase elke 2-4 weken en maak daarbij onderscheid tussen goede en onvoldoende astmacontrole.
- Ga bij onvoldoende astmacontrole de TIP-aandachtspunten na: therapietrouw, inhalatietechniek en prikkelvermijding (zie ook Algemeen en NHG-Standaard Allergische en niet-allergische rinitis).
- Ga, indien dit geen verbetering van de astmacontrole geeft, in samenspraak met het kind en de ouders naar een volgende stap.
- Geef instructies voor het beleid bij tijdelijke toename van klachten (zie Zelfbehandeling).
Bij de behandeling van astma wordt gebruikgemaakt van verschillende groepen inhalatiemedicatie. De effectiviteit van deze groepen geneesmiddelen is niet opnieuw nagegaan; hiervoor wordt verwezen naar de internationale richtlijn(en).
Inhalatiemedicatie bij kinderen
Naar Samenvatting ›Kortwerkende bèta-2- sympathicomimetica ( (short acting beta-2-agonists, SABA)
Naar Samenvatting ›- SABA zijn eerste keus bij de behandeling van:
- kinderen < 6 jaar met episodisch expiratoir piepen
- kinderen ≥ 6 jaar met astma die slechts incidenteel medicatie nodig hebben
- Schrijf bij kinderen ≥ 1 jaar met frequentere klachten SABA zo nodig voor bij klachten, naast onderhoudsbehandeling met ICS.
- Het beoogde effect van SABA is het verminderen van bronchusobstructie en daardoor verminderen van klachten.
- Tussen de verschillende geneesmiddelen binnen de groep SABA is geen verschil in effectiviteit, veiligheid en bijwerkingen.
- Bij gebruik van een SABA kunnen bijwerkingen optreden, zoals tremor van handen, hoofdpijn, tachycardie en palpitaties.
Achtergrond
Bij de behandeling van astma wordt vaak gebruik gemaakt van SABA. Deze kortwerkende luchtwegverwijders geven relaxatie van de spiercellen in de longen en daardoor bronchusverwijding. Ten tijde van de totstandkoming van deze standaard zijn er in Nederland verschillende SABA geregistreerd: salbutamol en terbutaline.
Effectiviteit
De effectiviteit van deze geneesmiddelen is niet opnieuw nagegaan; hiervoor wordt verwezen naar de internationale richtlijn(en). De plaatsbepaling voor SABA sluit aan op deze internationale richtlijnen.
Veiligheid/bijwerkingen
Vaak (1-10%) voorkomende bijwerkingen zijn onder andere tachycardie, hoofdpijn, rusteloosheid, tremor van de handen of palpitaties. Zelden (0,01- 0,1%) treden hoesten, paradoxale bronchospasmen of hyperactief gedrag op (KNMP Kennisbank, geraadpleegd april 2021; NKFK, geraadpleegd april 2021).
Bij kinderen < 1 jaar beveelt de werkgroep een lagere maximale dosering SABA aan dan in het Kinderformularium. Het advies is om deze kinderen, als deze lagere maximale dosering onvoldoende effect heeft, te controleren om de diagnose te heroverwegen en een behandelplan op te stellen.
Kortwerkende parasympathicolytica (short-acting muscarin antagonists, SAMA)
Naar Samenvatting ›Overweeg alleen een SAMA indien een SABA niet wordt verdragen.
Achtergrond
SAMA zijn kortwerkende luchtwegverwijders, die na inhalatie bronchospasmolytisch werken. Ten tijde van de totstandkoming van deze standaard is in Nederland alleen ipratropium als SAMA geregistreerd.
Effectiviteit
Er is geen onderzoek gevonden naar het effect van ipratropium als ‘zo nodig’-behandeling bij kinderen met astma. Wel is er een Cochrane-review beschikbaar waarin onderhoudsbehandeling van astma bij kinderen met ipratropium is vergeleken met placebo of andere behandeling. In deze review zijn 3 RCT’s geïncludeerd met in totaal 122 kinderen, bij wie ipratropium werd vergeleken met placebo. Op geen enkele uitkomst (FEV1, klachten, gebruik aanvullende noodmedicatie, ziekenhuisopname) bleek er een verschil te zijn tussen ipratropium en placebo. In de GINA wordt ipratropium alleen bij volwassenen met astma als alternatieve mogelijkheid voor SABA geadviseerd, met als nadeel dat het langer duurt voordat de werking optreedt.
Veiligheid/bijwerkingen
Vaak voorkomende bijwerkingen (1-10%) zijn droge mond, heesheid, hoest, irritatie aan de keel, misselijkheid, duizeligheid en hoofdpijn. Soms voorkomende bijwerkingen (< 1%) zijn onder andere tachycardie, paradoxale bronchospasmen, droge keel en maagdarmklachten.
Conclusie
Volgens de werkgroep kan alleen een SAMA worden overwogen als een SABA niet wordt verdragen.
Inhalatiecorticosteroïden (ICS)
Naar Samenvatting ›Onderhoudsbehandeling met ICS
- Wordt niet aanbevolen bij kinderen < 1 jaar met episodisch expiratoir piepen
- Is te overwegen bij kinderen van 1-6 jaar met persisterende klachten van episodisch expiratoir piepen ondanks behandeling met SABA
- Wordt geadviseerd bij kinderen ≥ 6 jaar met >2 × per week klachten. Bij frequent sportende kinderen ≥ 6 jaar wordt ongepland SABA-gebruik >2 × per week gehanteerd (zie Beleid bij frequent sportende kinderen).
- Het beoogde effect is vermindering van ontstekingsverschijnselen in de luchtwegen en daardoor voorkomen van klachten.
Keuze ICS
- Er is geen voorkeur voor het voorschrijven van extrafijn of normaal ICS.
- Er is geen onderling verschil in effectiviteit, veiligheid en bijwerkingen tussen de verschillende ICS.
Dosering ICS
- De startdosering is voor alle leeftijden gelijk. Streef bij goede astmacontrole naar stapsgewijs afbouwen.
- Verhogen van de dosering ICS boven de startdosering wordt niet geadviseerd. Consulteer of verwijs bij onvoldoende astmacontrole.
- Bijwerkingen van ICS
- We bevelen aan dat bij het voorschrijven van ICS volgens de gebruikte dosering in de eerste lijn op voorhand geen rekening hoeft te worden gehouden met bijwerkingen.
Toelichting
- Vraag op individueel niveau bij controles naar bijwerkingen van medicatie, mede omdat dit ook van invloed is op de therapietrouw en daarmee ook de astmacontrole.
- ICS kunnen lokale bijwerkingen geven, zoals orale candidiasis.
- Goede inhalatietechniek, inhalatie-instructie en controle hiervan kunnen het risico op lokale bijwerkingen verminderen.
- ICS kunnen de lengtegroei van kinderen met astma beperkt verminderen. Het verschil op de eindlengte is meestal niet klinisch relevant. Verricht een meting van lengte en gewicht bij twijfel of ongerustheid bij de ouders of het kind over de lengtegroei, en vergelijk deze met de groeicurve van het kind.
ICS en roken
Roken bij patiënten met astma is geassocieerd met een lagere therapeutische respons op ICS.
Achtergrond
Bij de behandeling van astma wordt vaak gebruik gemaakt van ICS vanwege de ontstekingsremmende werking.
Effectiviteit
De effectiviteit van deze groep geneesmiddelen is niet opnieuw nagegaan; hiervoor wordt verwezen naar de internationale richtlijn(en).
Onderlinge vergelijking ICS
De verschillende soorten inhalatiecorticosteroïden zijn vergelijkbaar in effectiviteit en veiligheid ten opzichte van elkaar voor de doseringen zoals die in de productinformatie wordt aangegeven. Dat geldt ook voor verschillende vormen van een inhalatiecorticosteroïd (bijvoorbeeld extra fijn).
Specifiek over beclometason extra fijn en ciclesonide is hieronder nog extra onderzoek toegevoegd ter verduidelijking. Beide middelen hebben deeltjes met een diameter van 1,9 micrometer en worden beschouwd als extra fijne deeltjes ICS, maar worden apart besproken vanwege een andere depositie werkingsmechanisme.
Beclometason dipropionaat extra fijn
Achtergrond
Als een lagere dosering extrafijn ICS even effectief is als hogere dosering normaal fijn ICS, zou dat een reden kunnen zijn om de variant met extrafijn aan te bevelen. Het is niet zeker of de systemische opname bij de meeste patiënten daadwerkelijk verschilt. Kleine deeltjes kunnen over het algemeen dieper de long in dringen dan grote deeltjes en de alveoli bereiken. In de alveoli vindt met name de systemische absorptie plaats. Hoewel de totale hoeveelheid (metered dose) beclometason extrafijn dus minder is dan beclometason normaal, kan er toch een vergelijkbare expositie plaatsvinden.
Uitgangsvraag
In 2013 is door de Nederlandse Vereniging voor Kindergeneeskunde NVK een evidence review uitgewerkt met als uitgangsvraag ‘zijn inhalatiesteroïden met extrafijne deeltjes effectiever (en veiliger) dan inhalatiesteroïden met normale deeltjes bij kinderen met astma?’.
Resultaten
Hierbij werden 2 onderzoeken gevonden, uitgevoerd bij kinderen van ≥ 6 jaar. Bij kinderen < 6 jaar zijn geen onderzoeken gevonden. Van Aalderen et al. randomiseerden 280 kinderen van5-12 jaar, met minimaal 3 maanden astma en onvoldoende astmacontrole (waarvoor start of verhoging ICS geïndiceerd) over beclometason extra fijn (200 microgram per dag) versus fluticason (200 microgram per dag), met een follow up van 18 weken. Er werden geen verschillende in longaanvallen, klachtenvrije dagen en astmagerelateerde kwaliteit van leven gevonden. Robroeks et al. randomiseerden 66 kinderen (6-12 jaar, matig astma behandeld met ICS, follow up 3 maanden) over beclometason extra fijn (200 microgram per dag) versus fluticason (200 microgram per dag). Er waren geen longaanvallen tijdens het onderzoek en geen verschil in klachtenvrije dagen. De kwaliteit van de onderzoeken was laag tot zeer laag (afgewaardeerd vanwege beperkingen in de onderzoeksopzet, indirectheid, brede betrouwbaarheidsintervallen en sponsoring door de farmaceut).
Overwegingen en conclusie
Er zijn geen aanwijzingen uit gerandomiseerd klinisch onderzoek dat beclometason met extrafijne deeltjes effectiever is dan ICS met normale deeltjes bij kinderen met astma ≥ 6 jaar. Er zijn geen onderzoeken bekend bij kinderen < 6 jaar. Beclometason met extrafijne deeltjes is qua effectiviteit niet beter of slechter dan de andere ICS bij kinderen met astma en is geregistreerd voor kinderen ≥ 5 jaar. Ondanks de lagere dosering hoeven de bijwerkingen niet minder te zijn: vanwege een betere longdepositie is er waarschijnlijk ook meer systemische opname.
Ciclesonide
Achtergrond
Ciclesonide is een ICS wat wordt geïnhaleerd als pro-drug en in de longen wordt gemetaboliseerd tot de werkzame stof (des-ciclesonide), het bestaat uit fijne deeltjes en wordt eenmaal daags gedoseerd vanwege een grote bindingsaffiniteit aan de receptor, waardoor het langer werkzaam is. Deze eigenschappen zouden mogelijk voordelen kunnen bieden, bijvoorbeeld om met een eenmaal daagse dosering de therapietrouw te verbeteren bij adolescenten.
Resultaten
In 2013 is een SR uitgevoerd naar de effectiviteit en bijwerkingen van ciclesonide vergeleken met budesonide en flucticason bij kinderen met chronisch astma. Er zijn 6 RCT’s geïncludeerd (3256 kinderen, 4-17 jaar) met een follow-up van 12 weken. Bij 3 onderzoeken werd de diagnose ‘astma’ vastgesteld aan de hand van de classificatie van GINA (2003) of de American Thoracic Society (1987), in andere 3 onderzoeken werd er onvoldoende of geen informatie over het stellen van de diagnose beschreven. In alle onderzoeken werden als primaire uitkomst astmaklachten gerapporteerd, 5 onderzoeken rapporteerden ook de uitkomst longaanval (vastgesteld op basis van wisselende kenmerken) en 5 onderzoeken beschreven bijwerkingen. Vier onderzoeken zijn gesponsord door de farmaceut van ciclesonide. De kwaliteit van het bewijs was zeer laag tot matig.
- Ciclesonide vergeleken met budesonide (ratio dosering 1 : 2, 2 onderzoeken): geen verschil op astmaklachten en bijwerkingen (meta-analyse niet mogelijk vanwege onvoldoende data). Bij meta-analyse geen verschil in longaanvallen (RR 2,20; 95%-BI 0,75 tot 6,43)
- Ciclesonide vergeleken met fluticason (ratio dosering 1 : 1, 3 onderzoeken): geen verschil op astmaklachten en bijwerkingen (meta-analyse niet mogelijk vanwege onvoldoende data). Bij meta-analyse geen verschil in longaanvallen (RR 1,37; 95%-BI 0,58 tot 3,21)
- Ciclesonide vergeleken met fluticason (ratio dosering 1 : 2, 1 onderzoek): geen verschil op astmaklachten en bijwerkingen. Er waren meer kinderen met een longaanval in de ciclesonidegroep (RR 3,57; 95%-BI 1,35 tot 9,47)
Overwegingen en conclusie
Bij onderzoeken van zeer lage tot matige kwaliteit werden geen voor- of nadelen gevonden voor ciclesonide op astmaklachten, longaanvallen of bijwerkingen ten opzichte van andere ICS. Ciclesonide is qua effectiviteit niet beter of slechter dan de andere ICS bij kinderen met astma en is geregistreerd voor kinderen vanaf 12 jaar.
Dosering ICS
De werkgroep adviseert om ICS bij kinderen van 1 tot 18 jaar voor te schrijven volgens een voor alle leeftijden overeenkomstige startdosering (zie tabel 11) en geen leeftijdsafhankelijke dosering of opbouwdosering te hanteren. De opname van de inhalatiemedicatie is bij jongere kinderen vaak matig, waardoor jongere kinderen al een relatief hoge dosering nodig hebben. Daarnaast wordt bij alle kinderen met astma, na 3 maanden behandeling in de startdosering, gestreefd naar een zo laag mogelijke effectieve dosis waarbij goede astmacontrole wordt bereikt. De werkgroep verwacht het beste resultaat bij de meeste kinderen door te starten op een wat hoger niveau (zoals de geadviseerde startdosering) en daarna af te bouwen als het kan. Indien met behandeling in stap 2 onvoldoende resultaat wordt bereikt, adviseert de werkgroep consultatie of verwijzing.
Bijwerkingen ICS
ICS worden vaak langdurig gebruikt bij kinderen met astma. Daarom is de vraag naar mogelijke bijwerkingen op (langere) termijn van belang voor het kind en de ouders. Mogelijke bijwerkingen of angst voor bijwerkingen zijn een reden voor ouders en kinderen om een ICS niet te nemen, minder te nemen of onregelmatig te nemen en zijn een belangrijke reden voor therapieontrouw.
Uitgangsvraag
In hoeverre moet bij het voorschrijven van inhalatiecorticosteroïden aan kinderen met astma rekening gehouden worden met bijwerkingen?
| Patiënten | Kinderen met (werkdiagnose) astma |
|---|---|
| Interventie | Behandeling met ICS |
| Vergelijking | Geen behandeling met ICS, andere dosering, andere duur behandeling |
| Uitkomstmaten | Groeivertraging, onderdrukte bijnieras, invloed op gedrag, candidiasis, heesheid, moeheid, (diabetes mellitus) (algemeen side effects), gewicht (met aandacht voor leeftijdsverschillen) |
Methode
Door de NVK is bij de herziening van richtlijn Astma bij kinderen in de tweede lijn in 2020 een systematische literatuurzoekactie naar SR’s en RCT’s in PubMed en Embase uitgevoerd. Aangezien de herzieningstrajecten van de NVK en van de NHG-Standaard gelijk opliepen, is door de werkgroep besloten geen nieuwe zoekactie te verrichten, maar op basis van de gevonden en gegradeerde onderzoeken een eigen afweging te maken voor de eerste lijn.
Samenvatting onderzoeken
Na de literatuurselectie bleken 7 SR’s het meest geschikt voor uitwerking van de uitgangsvraag.
- Adams et al. includeerden 86 onderzoeken met 16.160 patiënten, waarvan 8 bij kinderen > 2 jaar, (ernst van astma variërend van mild tot ernstig, duur van de meeste geïncludeerde onderzoeken 12 weken) naar de effectiviteit en veiligheid van fluticason (dagdosis 100-800 microgram) vergeleken met placebo. De resultaten van kinderen zijn separaat geanalyseerd voor een aantal relevante uitkomsten op het gebied van bijwerkingen.
- De SR van Chauhan et al. includeerde in totaal 6 RCT’s, waarvan 2 bij jonge kinderen (n = 498) en 2 bij schoolgaande kinderen (n = 259), bij wie dagelijks beclomethason werd vergeleken met beclomethason zo nodig (duur behandeling 12-52 weken).
- Kramer et al. (SR met 6 RCT’s, 3256 kinderen met matig tot ernstig astma, leeftijd 4-17 jaar, follow up 12 weken) onderzochten de effectiviteit en bijwerkingen van ciclesonide in vergelijking met fluticason (verhouding 1 : 1 en 1 : 2).
- De SR van Manning et al. (in totaal 21 onderzoeken, waarvan 3 bij kinderen, 1664 kinderen, mediane leeftijd 9-14 jaar, follow up 12 weken) onderzocht de effectiviteit en bijwerkingen van ciclesonide (200 microgram) ten opzichte van andere ICS (fluticason 200 microgram en budesonide 400 microgram).
- Pruteanu et al. (SR met 10 RCT’s, in totaal 3394 kinderen (leeftijd 1-17 jaar) met mild tot matig astma, follow up 3-12 maanden) onderzochten of er een dosis-responsrelatie bestaat tussen ICS en verschillende groeiparameters.
- Zhang et al. (SR met 25 RCT’s, in totaal 8471 kinderen (leeftijd tot 18 jaar) met mild tot matig astma, duur interventie 3 maanden tot 6 jaar, 1 onderzoek follow up tot volwassen leeftijd) keken naar de impact van dagelijks gebruik van ICS in vergelijking met placebo op de lengtegroei.
- Axelsson et al. (6 RCT’s, 1199 kinderen van 4-12 jaar met mild tot matig astma, duur 6-20 maanden) vergeleken verschillende ICS en toedieningswijzen met elkaar op de lengtegroei.
De kwaliteit van het bewijs was in het algemeen zeer laag, alleen voor de onderzoeken met betrekking tot lengtegroei en lichaamsgewicht was de kwaliteit redelijk. De kwaliteit was met name laag door problemen met randomisatie, blindering en intention-to-treat-principe, en door imprecisie vanwege een beperkt aantal patiënten of events in bepaalde analyses.
Samenvatting resultaten
Voor de uitkomstmaten invloed op gedrag, moeheid en diabetes zijn geen resultaten gevonden.
- Lengtegroei: ICS kunnen de lengtegroei van kinderen met astma beperkt verminderen (gemiddeld verschil in eindlengte –1,2 cm; 95%-BI –1,9 tot –0,5 cm). De vertraging treedt vooral op in het eerste jaar dat ICS gebruikt worden. Er is geen klinisch relevant verschil gevonden tussen de verschillende soorten ICS. Wel lijkt er een dosis-responsrelatie te zijn.
- Onderdrukking van de bijnieras: er lijkt geen aanwijzing voor onderdrukking van de bijnieras.
- Orale candidiasis: er lijkt geen klinisch relevant effect te zijn van gebruik van ICS op het optreden van orale candidiasis bij kinderen met astma.
- Heesheid: er lijkt geen associatie tussen gebruik van ICS en het optreden van heesheid bij kinderen met astma.
- Veranderingen in lichaamsgewicht: gebruik van ICS is waarschijnlijk niet geassocieerd met een verandering in lichaamsgewicht bij kinderen met astma.
- Overige bijwerkingen: er is geen bewijs gevonden voor een klinisch relevante associatie tussen gebruik van ICS en overige bijwerkingen.
Voor een uitgebreide beschrijving van de zoekstrategie, resultaten en GRADE-tabel, zie Richtlijn astma bij kinderen.
Overwegingen voor de eerste lijn
In de gebruikte SR’s is gekeken naar gemiddelden. De kwaliteit van het bewijs is redelijk voor onderzoeken over lengtegroei en voor de overige uitkomsten zeer laag. Dat hierin geen tot weinig effecten zijn gevonden neemt niet weg dat er voor individuele patiënten relevante bijwerkingen kunnen zijn.
Volgens de KNMP Kennisbank komt bijvoorbeeld orale candidiasis voor bij > 10% van de gebruikers van ICS en heesheid bij 1-10% van de gebruikers. Groeivertraging wordt zelden gemeld, maar beperkte groeivertraging is mogelijk ook lastig te signaleren in de praktijk. Mogelijk zijn (zorgen over) bijwerkingen nadelig voor de therapietrouw en daarmee ook voor de astmacontrole.
Lokale bijwerkingen zijn waarschijnlijk te voorkomen met behulp van praktische adviezen: voor orale candidiasis en cariës helpt mondspoelen, voor heesheid kan het helpen om over te stappen naar een dosisaerosol met voorzetkamer. De werkgroep wil het belang van goede inhalatie-instructie en regelmatige controle van de inhalatietechniek nogmaals benadrukken, mede om het risico op deze lokale bijwerkingen te verminderen.
De in onderzoek gevonden verminderde lengtegroei valt ruim binnen de 95%-range die gebruikt wordt voor het berekenen van de eindlengte (target height; TH) van kinderen op basis van de lengte van hun ouder(s) (95%-range voor jongens TH– 11 cm, TH+ 11 cm; voor meisjes TH– 10 cm, TH+ 10 cm; zie JGZ-richtlijn lengtegroei 2019). De werkgroep beschouwt de te verwachten kleine verandering van ICS-gebruik op de volwassen eindlengte mede daarom als niet klinisch relevant. In de eerste lijn worden vaak lage doseringen ICS gebruikt bij kinderen. Kinderen met onvoldoende astmacontrole worden over het algemeen verwezen. In de onderzoeken werd een dosis-responsrelatie gevonden. Ondanks de lage doseringen ICS die in de eerste lijn gebruikt worden, vindt de werkgroep het belangrijk dat bij ongerustheid bij de ouders of het kind (bijvoorbeeld bij een al verwachte kleine lengte op basis van de lengte van de ouders) of twijfel een meting van lengte/gewicht wordt verricht en dat deze wordt vergeleken met de groeicurve van het kind.
ICS bij rokers
Roken en astma zijn geassocieerd met een lagere therapeutische respons op inhalatiecorticosteroïden, zowel na kortdurend gebruik van 12 weken als na langdurig gebruik. Het verschil in therapeutische respons tussen rokers en niet-rokers wordt kleiner bij gebruik van de maximale dagdosering inhalatiecorticosteroïd. Het mechanisme van deze ‘corticosteroïdresistentie’ is onbekend. Stoppen met roken zou de gevoeligheid van astmapatiënten voor corticosteroïden ten minste gedeeltelijk herstellen.
ICS geen meerwaarde boven SABA zo nodig bij klachten ≤ 2 × per week overdag
Naar Samenvatting ›We bevelen een uitbreiding van huidige stap-1-medicatie (SABA zo nodig) met een (gelijktijdig zo nodig) ICS bij kinderen met astma met klachten ≤ 2 × per week overdag niet aan.
Achtergrond
Bèta-2-sympathicomimetica (SABA) verlichten snel de dyspneuklachten, maar er is een risico op overmatig gebruik en een toegenomen risico op longaanvallen (door onderbehandeling met ICS, omdat patiënt de klachten verlicht met SABA).
In de internationale richtlijnen
wordt, om dit risico te verminderen, geadviseerd om bij adolescenten vanaf 12 jaar te starten met een combinatie van een ICS/formoterol. Belangrijke overwegingen om een combinatie te adviseren in plaats van ICS monotherapie zijn het risico op onvoldoende (verminderde therapietrouw) en onjuist gebruik van ICS. Bij kinderen van 6-11 jaar met astma zonder risicofactoren op een ernstige longaanval en < 2 × per maand klachten bestaat de eerste behandelstap alleen uit een SABA. Bij kinderen met klachten > 2 x per maand wordt een combinatie met een ICS geadviseerd.
In de NHG-Standaard Astma bij volwassenen zijn bij de laatste herziening 2 gelijkwaardige opties opgenomen als aanbeveling voor stap 1:
- SABA zo nodig; eventueel stap 1 overslaan en laagdrempelig starten met ICS
- of starten met een combinatie van ICS + formoterol in een lage dosis zo nodig (maximaal 2 × per week)
Uitgangsvraag
Is voor stap-1 behandeling van kinderen met astma ≥ 6 jaar een behandeling met onderhoud ICS + salbutamol zo nodig aan te bevelen?
| Patiënten | Kinderen met nieuw gestelde diagnose ‘astma’ |
|---|---|
| Interventie | Salbutamol zo nodig + onderhoud inhalatiecorticosteroïden |
| Vergelijking | Salbutamol zo nodig |
| Uitkomstmaten | Astmacontrole (ACT), SEH-bezoek/longaanvallen, (aantal) prednisonkuren, ziekenhuisopname, kwaliteit van leven klachten (astmascore), schoolverzuim, IC opname, mortaliteit |
Methode
Bij de herziening van de Richtlijn astma bij kinderen
is in 2020 een systematische literatuurzoekactie naar SR’s en RCT’s in PubMed en Embase uitgevoerd. Aangezien de herzieningstrajecten van de NVK en van de NHG-Standaard gelijk opliepen, is door de werkgroep besloten geen nieuwe zoekactie te verrichten, maar op basis van de gevonden en gegradeerde onderzoeken een eigen afweging te maken voor de eerste lijn.
Samenvatting onderzoeken
Na de literatuurselectie bleken 6 artikelen geschikt voor uitwerking van de uitgangsvraag, alle 6 artikelen beschreven resultaten van hetzelfde onderzoek, de START-trial.
In dit internationale dubbelblinde placebogecontroleerde multicentrische onderzoek (499 ziekenhuizen in 32 landen) werd onderzocht of ICS effectief zijn als vroege behandeling bij kinderen met mild persisterend astma. In totaal werden 1974 kinderen van 5-10 jaar en 1221 kinderen van 11-17 jaar geïncludeerd. In de interventiearm kregen patiënten budesonide onderhoud 1 dd 200 microgram (< 11 jaar) of 400 microgram (≥ 12 jaar) en in de controlegroep kregen patiënten een placebo. Aanvullende kortwerkende medicatie kon daarbij genomen worden. Uitkomsten waarnaar gekeken werd, zijn onder andere longaanvallen, spoedbehandelingen en gebruik van systemische corticosteroïden.
De algehele kwaliteit van het bewijs was laag, er werd afgewaardeerd vanwege:
- indirect bewijs
- er is alleen gekeken naar budesonide in een dosering van 1 dd 200 microgram per inhalatie met de Turbuhaler®
- de resultaten zijn alleen separaat beschreven voor kinderen van 5-10 jaar. Voor kinderen van 11-17 jaar konden geen gegevens over de vooraf vastgestelde uitkomsten worden afgeleid
- kinderen hadden gemiddeld al 9 maanden astma (30% < 3 maanden, ongeveer 40% 12-24 maanden)
- er is mogelijk vertekening van de resultaten omdat het onderzoek was gefinancierd door de producent van budesonide en de co-auteurs van het onderzoek werkzaam waren bij deze producent.
Resultaten
Voor de uitkomstmaten astmacontrole, mortaliteit en kwaliteit van leven zijn geen resultaten beschikbaar.
- Er lijkt geen verschil in SEH-bezoek: 18/1000 in de budesonidegroep versus 29/974 in de alleen-SABA-groep (absolute risicoreductie (ARR) 12 kinderen minder per 1000 behandelde kinderen; 95%-BI –20 tot 2).
- Er lijkt minder ongepland ziekenhuisbezoek vanwege een ernstige longaanval: 52/1000 in de budesonidegroep versus 82/974 in de alleen-SABA-groep (ARR 32 minder per 1000 kinderen; 95%-BI –47 tot –12; NNT 31).
- Er lijkt mogelijk minder gebruik van systemische corticosteroïden: 11/1000 in de budesonidegroep versus 24/974 in de alleen-SABA-groep (ARR 14 minder per 1000 kinderen; 95%-BI –2 tot –19; NNT 73).
- Er lijken mogelijk minder ziekenhuisopnames 34/1000 in de budesonidegroep versus 53/974 in de alleen-SABA-groep (ARR 20 minder per 1000 kinderen; 95%-BI –32 tot –2; NNT 49).
Voor een uitgebreide beschrijving van de zoekstrategie, resultaten en GRADE Evidence tabel, zie de Richtlijn astma bij kinderen.
Conclusie
De NVK-werkgroep constateert dat er geen reden is om stap-1 nu uit te breiden met ICS. Dit is overeenkomstig met de adviezen uit de laatste richtlijnen van BTS/SIGN en NICE.
Overwegingen voor de eerste lijn
- De kinderen in de onderzoeken hadden gemiddeld al een jaar astma. In de eerste lijn wordt vaak de initiële behandeling (stap-1-medicatie) gestart bij kinderen met een nieuwe diagnose ‘astma’; deze groep kinderen lijkt matig overeen te komen met de onderzochte kinderen. De toepasbaarheid op de Nederlandse eerste lijn is beperkt, omdat het ICS dat in de onderzoeken gebruikt werd (budesonide 1 dd 200 microgram) in Nederland geen gebruikelijke dosering is. De kwaliteit van het bewijs is laag.
- GINA adviseert altijd ICS zo nodig of continu toe te voegen bij de behandeling van adolescenten en volwassenen. Voor kinderen van 6-11 jaar wordt als alternatieve optie gegeven een ICS te gebruiken op het moment dat er een SABA nodig is (dus 2 verschillende losse inhalatoren op het moment van klachten). Voor kinderen ≥ 12 jaar adviseert GINA als stap 1 ICS + formoterol zo nodig. Deze aanbeveling is gebaseerd op onderzoek van O'Byrne et al., dat geen uitkomsten beschreef voor adolescenten apart.
De werkgroep vindt dat er op dit moment onvoldoende bewijs is om stap-1-medicatie (‘zo nodig’) uit te breiden met gelijktijdig ‘zo nodig’ ICS, vanwege de lage kwaliteit van de onderzoeken, de onvoldoende bewezen effectiviteit, de slechte toepasbaarheid van de onderzoeken en de GINA-adviezen op de Nederlandse eerste lijn en het risico op overbehandeling bij kinderen met milde klachten.
Langwerkende luchtwegverwijders
Naar Samenvatting ›We bevelen langwerkende luchtwegverwijders als monotherapie niet aan bij kinderen met astma.
Langwerkende bèta-2-sympathicomimetica (long-acting beta-2-agonists, LABA) als monotherapie
In een review over de veiligheid van formoterol of salmeterol als monotherapie bij kinderen met astma werden 21 onderzoeken, met 7474 kinderen van 4 tot 17 jaar geïncludeerd. Mortaliteit kon niet worden onderzocht vanwege een te laag aantal events. Er werd een groter risico op ernstige bijwerkingen gevonden bij kinderen met formoterol monotherapie (OR 2,48; 95%-BI 1,27 tot 4,83; 5 onderzoeken met 1335 kinderen, van goede kwaliteit) en mogelijk ook bij salmeterol monotherapie (OR 1,30; 95%-BI 0,82 tot 2,05; 5 onderzoeken met 1333 kinderen, van redelijke kwaliteit).
Overwegingen en conclusie
Uit onderzoek komt naar voren dat LABA monotherapie een groter risico geeft op ernstige bijwerkingen. Ook internationale richtlijnen
raden gebruik van LABA als monotherapie af. De werkgroep sluit zich hierbij aan.
Langwerkende parasympathicolytica (long-acting muscarin antagonists, LAMA)
In de GINA wordt het langwerkende parasympathicolyticum tiotropium optioneel opgenomen in stap 4 van het stappenplan indien de astmacontrole onvoldoende is met een lage dosis ICS + LABA.
Er is onvoldoende bewijs om tiotropium te adviseren boven een combinatie ICS + LABA.
Overwegingen en conclusie
Kinderen met astma zijn, indien stap 4 nodig is, onder behandeling in de tweede lijn of moeten daarnaar verwezen worden. De werkgroep beveelt daarom in de eerste lijn tiotropium niet aan bij kinderen met astma.
Combinatie LABA en ICS
Naar Samenvatting ›Bij kinderen met astma is niet aangetoond dat een combinatie van een ICS en een langwerkend bèta-2-sympathicomimeticum (LABA) in stap 1 of stap 2 toegevoegde waarde heeft boven het gebruik van een ICS alleen.
Uitgangsvraag
Is de toevoeging van een LABA aan ICS-onderhoudsbehandeling bij kinderen met astma effectief en veilig?
Achtergrond
Er bestaat al lange tijd onduidelijkheid over de veiligheid van LABA (mogelijk hoger risico op astmagerelateerde ziekenhuisopname) en het gebruik op de juiste indicatie bij patiënten met astma.
Methoden
De review van Chauhan et al. was bekend bij de werkgroepleden. De werkgroep heeft vanaf de zoekdatum van deze review met dezelfde zoektermen in PubMed en de Cochrane-database gezocht naar aanvullende publicaties tot juni 2021.
Resultaten
In een Cochrane-review naar de toevoeging van LABA aan ICS bij de behandeling van astma bij kinderen van 2-18 jaar werden 33 RCT’s geïncludeerd met in totaal 6381 kinderen (gemiddeld 10-11 jaar, ongeveer 60% jongens).
Van deze kinderen had 90% onvoldoende astmacontrole met alleen een ICS.
De toevoeging van LABA aan dezelfde dosering ICS leidde niet tot een reductie in het aantal longaanvallen waarvoor orale steroïden nodig waren (RR 0,95; 95%-BI 0,70 tot 1,28, 12 onderzoeken, 1669 kinderen). Ook werd geen verschil gevonden in ziekenhuisopnames (RR 1,74; BI 0,90 tot 3,36, 7 onderzoeken, 1292 kinderen), bijwerkingen (RR 1,17; 95%-BI 0,75 tot 1,85, 17 onderzoeken, 4021 kinderen) en astmagerelateerde kwaliteit van leven (gemiddelde verandering (MD) –0,02; 95%-BI 0,14 tot 0,10, 4 onderzoeken, 668 kinderen).
De combinatie LABA plus ICS in vergelijking met een dubbele dosering ICS verschilde niet in het risico op longaanvallen (RR 1,69; 95%-BI 0,85 tot 3,32 3 onderzoeken, 581 kinderen), het risico op ziekenhuisopname (RR 1,90; 95%-BI 0,65 tot 5,54, 4 onderzoeken, 1008 kinderen) en bijwerkingen (RR 1,01; 95%-BI 0,92 tot 1,10, 7 onderzoeken, 1254 kinderen). De kwaliteit van het bewijs was redelijk (meestal afgewaardeerd vanwege onnauwkeurigheid door brede betrouwbaarheidsintervallen).
In een prospectief onderzoek naar de veiligheid van salmeterol toegevoegd aan fluticason onderhoudsbehandeling werden 6208 kinderen van 4-11 jaar met een onderhoudsbehandeling voor astma én ≥ 1 longaanval in het afgelopen jaar gerandomiseerd.
In de fluticason-salmeterolgroep werden 27 kinderen opgenomen in het ziekenhuis met een longaanval, versus 21 kinderen in de fluticasongroep (HR 1,28; 95%-BI 0,73 tot 2,27). In de fluticason-salmeterolgroep kregen 265 kinderen (8,5%) een ernstige longaanval, versus 309 (10%) in de fluticasongroep (HR 0,86; 95%-BI 0,73 tot 1,01).
In 2 Cochrane-reviews
is gekeken naar het risico op mortaliteit en ernstige bijwerkingen bij patiënten met astma (van welke ernst dan ook) die een combinatie van een LABA (respectievelijk salmeterol en formoterol) in combinatie met een ICS vergeleken met ICS monotherapie (gemiddelde behandelduur 6 maanden).
Cates et al. includeerden 8 onderzoeken met 8453 kinderen, Janjua et al. includeerden 10 onderzoeken met in totaal 4035 kinderen. In beide reviews was er geen mortaliteit bij kinderen. In Cates et al. kregen 29 kinderen in de salmeterol-ICS-groep een ernstige longaanval, versus 23 kinderen in de ICS-groep (gepoolde Peto odds ratio 1,25; 95%-BI 0,72 tot 2,16; kwaliteit van bewijs redelijk). In Janjua et al. kregen 9 kinderen in de formoterol-ICS-groep een ernstige longaanval, versus 5 kinderen in de ICS groep (gepoolde Peto odds ratio 1,18; 95%-BI 0,40 tot 3,51; zeer lage kwaliteit van bewijs).
Overwegingen en conclusie
Er is onvoldoende bewijs dat een combinatie van LABA met ICS voordelen heeft boven ICS monotherapie bij kinderen met astma in stap 1 en stap 2. Bij onderzoeken naar de veiligheid werden bij kinderen zeer weinig events beschreven, waardoor het moeilijk blijft om hier een conclusie uit te trekken.
In internationale richtlijnen wordt bij kinderen met astma vanaf stap 3 optioneel een combinatie van LABA en ICS aanbevolen.
De werkgroep volgt deze aanbeveling. In Nederland zullen deze kinderen (met onvoldoende astmacontrole in stap 2) onder behandeling zijn bij de kinder(long)arts.
Keuze toedieningsvorm
Naar Samenvatting ›- Doe ervaring op met een beperkt aantal inhalatoren (dosisaerosolen en bijvoorbeeld 2 verschillende poederinhalatoren). Zorg voor een demonstratiemodel van deze inhalatoren in de praktijk, om mede aan de hand daarvan een keuze te maken voor een inhalatortype.
- Kies een toedieningsvorm afhankelijk van de leeftijd (zie tabel 8), de inhalatiekracht en de oog-handcoördinatie en de voorkeuren van de patiënt (bijvoorbeeld gebruiksgemak en vertrouwen in het gebruik van de inhalator).
- Houd ook rekening met het volgende.
- De uniformiteit (beschikbaarheid van inhalatiemiddelen uit andere therapeutische groepen met dezelfde toedieningsvorm) van dosisaerosolen is groter dan die van veel poederinhalatoren.
- Een poederinhalator vereist meer oog-handcoördinatie en inhalatiekracht dan een aerosol met voorzetkamer. Bij kinderen <10 jaar zijn deze regelmatig nog onvoldoende aanwezig.
- Een (niet-ademgestuurde) dosisaerosol moet met een passende voorzetkamer gebruikt worden. Voorwaarden ten aanzien van de voorzetkamer zijn ten eerste dat het masker/mondstuk goed moet passen, ten tweede dat de voorzetkamer periodiek, bijvoorbeeld jaarlijks, vervangen wordt om de kwaliteit te waarborgen.
- Bij kinderen ≥ 12 jaar is er regelmatig vermindering van de therapietrouw bij een dosisaerosol met voorzetkamer.
- Dosisaerosolen bevatten broeikasgassen, die schadelijk zijn voor het milieu.
|
Leeftijd |
Toedieningsvorm |
|---|---|
|
0-1 jaar |
Dosisaerosol met voorzetkamer met babymasker |
|
1-4 jaar |
Dosisaerosol met voorzetkamer met kindermasker |
|
4-7 jaar |
Dosisaerosol met voorzetkamer met mondstuk |
|
7-12 jaar |
|
|
> 12 jaar |
|
|
*Mits voldoende inhalatiekracht en oog-handcoördinatie |
|
Achtergrond
Ongeveer 70% van de patiënten met astma voert essentiële handelingen rondom het inhalatorgebruik verkeerd uit.
Het kiezen van een passende toedieningsvorm is hierdoor van extra belang. Aangezien er geen aanwijzingen zijn voor het bestaan van klinisch relevante verschillen in effectiviteit, veiligheid, bijwerkingen, doseerfrequentie en toepasbaarheid tussen de beschikbare middelen per geneesmiddelgroep voor astma bij kinderen, kan de keuze van het middel bepaald worden op basis van leeftijd, toedieningsvorm en persoonlijke voorkeur.
Daarbij maakt de huisarts in samenspraak met de ouders en het kind een passende keuze.
Leeftijd, inhalatiekracht en oog-handcoördinatie
Voor dosisaerosolen met een voorzetkamer is minder inhalatiekracht en oog-handcoördinatie noodzakelijk dan voor poederinhalatoren. Bij kinderen < 10 jaar zijn de inhalatiekracht en oog-handcoördinatie volgens de werkgroep vaak nog onvoldoende voor het gebruik van een poederinhalator, maar dit verschilt per kind en kan getest worden door het uitproberen van verschillende inhalatoren. Bij kinderen ≥ 12 jaar is de therapietrouw bij een dosisaerosol met voorzetkamer regelmatig minder goed.
De benodigde inhalatiekracht en techniek variëren tussen de verschillende poederinhalatoren. Bij sommige inhalatoren verlaat het poeder eerder de inhalator dan bij andere, evenals het benodigde type inademing (krachtig, al of niet initieel, of meer gelijkmatig). Bij sommige inhalatoren merkt de patiënt niet dat hij poeder inhaleert. Dit is voor sommige patiënten een bezwaar, voor anderen een voordeel.
Uniformiteit
Om een juiste inhalatietechniek te bevorderen is het van belang om bij patiënten die meerdere inhalatiemiddelen gebruiken gebruiksfouten als gevolg van verschillende toedieningsvormen te voorkomen. Dit geldt zowel bij gelijktijdig gebruik van verschillende middelen als bij het gebruik van andere middelen, bij het doorlopen van het stappenplan.
Aandachtspunten dosiaerosol versus poederinhalator
Voorzetkamer
Dosisaerosolen moeten met voorzetkamer worden gebruikt. Met het gebruik van een voorzetkamer wordt de longdepositie en dus de effectiviteit vergroot. Voor sommige kinderen kan dit bezwaarlijk zijn, voor anderen niet. Voorzetkamers zijn tegenwoordig in een relatief klein formaat beschikbaar dat gemakkelijk in een tas past, maar ze passen niet in een broekzak. Niet elke dosisaerosol kan met elke voorzetkamer gecombineerd worden. De voorzetkamers verschillen in vorm, maar ook in de mate waarin ze de longdepositie kunnen vergroten. Dit kan van invloed zijn op de effectiviteit en de veiligheid van de dosisaerosol. Instructie over het schoonmaken van een voorzetkamer is beschikbaar op www.inhalatorgebruik.nl.
Dosisteller of indicator
Vrijwel alle poederinhalatoren hebben een indicator om aan te geven of de inhalator leeg is. Bij dosisaerosolen is dat niet altijd het geval. De afwezigheid geldt als beperkend. Een dosisteller geeft aan hoeveel inhalaties er nog over zijn. Er zijn losse universele dosistellers beschikbaar die op vrijwel elke dosisaerosol (met voorzetkamer) passen. De ervaringen hiermee in de werkgroep lopen uiteen.
Duurzaamheid
Dosisaerosolen gebruik hydrofluorkoolwaterstoffen (HFK’s), als hulpstof. Dit zijn zeer sterke broeikasgassen, waardoor de uitstoot van broeikasgas per dosis (2 inhalaties) van een dosisaerosol gemiddeld 29-77 × hoger is dan die van een poederinhalator (de diskus).
Het duurt 14 jaar voordat HFK’s in de atmosfeer zijn afgebroken.
In de levenscyclusanalyse van Jeswani et al. werden ook andere milieuvervuilende aspecten van de dosisaerosol en de poederinhalator vergeleken, waaronder productie, transport en afval. Nadelen van dit onderzoek waren dat de voorzetkamer niet werd meegenomen in de vergelijking en dat de beoordeling van andere typen poederinhalatoren dan de diskus ontbrak. Ongeveer 60% van de patiënten vervangt de voorzetkamer ieder jaar en bij de productie wordt veel plastic gebruikt (zie www.gipdatabank.nl).
Aandachtspunt poederinhalator: unidose versus multidose
Voor veel kinderen is een poederinhalator met een ‘unidose’-doseersysteem (met losse capsules) onhandig, omdat de inname gepaard gaat met meerdere handelingen (en daardoor meer kans op fouten) en de capsules los van de inhalator moeten worden bewaard. Dit bezwaar geldt meer bij ‘zo-nodig’-gebruik dan bij onderhoudsbehandeling, dus inname op reguliere tijdstippen.
Instructie van de inhalatietechniek
Naar Samenvatting ›- Zorg bij het voorschrijven van een inhalator dat de patiënt instructie krijgt over het gebruik. Spreek binnen de praktijk en/of in samenwerking met apotheek af wie de inhalatie-instructie geeft. Zorg er ook voor dat alle zorgverleners op de hoogte zijn van de inhalatie-instructie en dat iedereen dezelfde uitleg geeft.
- Vertel welke zorgverlener inhalatie-instructie geeft: huisarts, praktijkondersteuner of apotheker.
- Vraag de patiënt en de ouders tijdens vervolgconsulten of zij deze instructie hebben gekregen (zie Samenwerkingsafspraken).
- Adviseer de patiënt en de ouders inhalatorgebruik.nl te raadplegen voor herhaling van de instructie en voor instructiefilmpjes.
- Vraag de patiënt bij iedere controle de inhalatoren (met eventuele voorzetkamer) mee te nemen en vraag de patiënt om de inhalatietechniek te demonstreren, zodat eventuele fouten gecorrigeerd kunnen worden.
- Adviseer na gebruik de mond te spoelen. Dit zou lokale bijwerkingen kunnen verminderen (zie Inhalatiecorticosteroïden (ICS)).
Instructie van de inhalatietechniek bestaat uit uitleg van het gebruik en de handelingen, demonstratie van het gebruik, het laten voordoen van het gebruik door het kind of de ouders, en reflectie op het gebruik. Hendriks et al. vonden dat na een gestandaardiseerde inhalatie-instructie aan 182 ouders van 0-3-jarigen het merendeel (89%) van de kinderen in staat was om de inhalator goed te gebruiken.
Kamps et al. onderzochten bij 66 kinderen met astma die voor het eerst verwezen waren naar de polikliniek voor kinderlongziekten hoe hun inhalatietechniek was.
Van deze groep had 91% inhalatie-instructie gehad voordat zij naar de polikliniek verwezen werden. Van de kinderen die een poederinhalator gebruikten inhaleerde 29% goed en van de kinderen die een dosisaerosol met voorzetkamer gebruikten inhaleerde 67% goed. Kinderen die een inhalatie-instructie hadden gehad met herhaalde check-ups deden het beter (79 en 93%). In een ander onderzoek laten Kamps et al. zien dat door herhaalde instructie de inhalatietechniek positief kan worden beïnvloed.
Conclusie
Uit onderzoek blijkt dat een herhaalde instructie van de inhalatietechniek nodig is om een inhalator goed te (blijven) gebruiken.
Stappenplan
Naar Samenvatting ›- Het stappenplan is afhankelijk van de leeftijd van het kind, zie tabel 9.
- Heroverweeg de diagnose ‘astma’ indien bij goed gebruik van de medicatie de klachten persisteren.
|
Leeftijd |
Stap 1 |
Stap 2 |
Stap 3 |
|---|---|---|---|
|
< 1 jaar |
Alleen SABA zo nodig* bij klachten |
Verwijzing |
|
|
1-6 jaar |
Alleen SABA zo nodig* bij klachten |
ICS + SABA zo nodig* bij klachten |
Verwijzing of consultatie |
|
≥ 6 jaar |
Alleen SABA zo nodig* bij klachten |
ICS + SABA zo nodig* bij klachten |
Verwijzing of consultatie |
|
* Gebruik > 2 × per week wijst op onvoldoende astmacontrole. Bij frequent sportende kinderen wijst ongepland gebruik > 2 × per week op onvoldoende astmacontrole, zie Beleid bij frequent sportende kinderen. |
|||
Stappenplan episodisch expiratoir piepen bij kinderen < 1 jaar
Naar Samenvatting ›Stap 1: SABA
Naar Samenvatting ›- Geef tijdens het consult een SABA (voor doseringen zie tabel 10).
- Schrijf als dit de klachten vermindert een SABA zo nodig voor (voor doseringen zie tabel 10)
- Evalueer het effect na 1-2 weken en stop de SABA indien de klachten over zijn.
- Instrueer de ouders om contact op te nemen als de klachten op een later moment terugkomen, zodat in overleg het beleid kan worden bepaald.
Stappenplan episodisch expiratoir piepen bij kinderen 1-6 jaar
Naar Samenvatting ›Stap 1: SABA
Naar Samenvatting ›- Geef tijdens het consult een SABA (voor doseringen zie tabel 10).
- Schrijf bij verbetering van de klachten zo nodig een SABA voor op geleide van de klachten (voor doseringen zie tabel 10).
- Evalueer het effect na 1-2 weken en stop de SABA indien de klachten over zijn. Instrueer de ouders om contact op te nemen als de klachten terugkomen. Gebeurt dit binnen 4 weken, ga dan naar stap 2; start in andere situaties opnieuw met stap 1.
- Indien de SABA verbetering geeft maar de klachten persisteren en > 2 × per week gebruik van SABA nodig is: continueer de behandeling nog 1-2 weken of ga naar stap 2.
- Overweeg eveneens stap 2 indien de klachten na het staken van een SABA binnen 4 weken recidiveren.
- Verricht bij persisterende klachten bloedonderzoek op inhalatieallergenen als er twijfel is over het wel of niet voorschrijven van ICS. Een positieve uitslag kan een reden zijn om wel ICS te starten, een negatieve uitslag niet (zie Bloedonderzoek op inhalatieallergenen).
Stap 2: Onderhoudsbehandeling met ICS
Naar Samenvatting ›- Heroverweeg de diagnose.
- Voeg gedurende 6 weken een ICS toe in de startdosering (voor doseringen zie tabel 11).
- Adviseer de ouders bij klachten zo nodig een SABA te geven.
- Continueer bij voldoende verbetering de ICS in de startdosering nog 6 weken (in totaal 3 maanden ICS in de startdosering).
- Bouw hierna, indien er geen klachten meer zijn, de ICS af in stappen van 25-50% per 3 maanden (zie Afbouwen ICS).
Stap 3: Verwijzing
Naar Samenvatting ›Verwijs bij onvoldoende verbetering na 6 weken naar een kinder(long)arts.
Stappenplan astma bij kinderen ≥ 6 jaar
Naar Samenvatting ›Stap 1: SABA
Naar Samenvatting ›- Schrijf bij weinig frequente klachten (< 2 × per week overdag) een SABA voor (voor doseringen zie tabel 10).
- Evalueer het effect na 2-4 weken.
- Indien de SABA verbetering geeft, maar de klachten persisteren en gebruik van SABA >2 × per week nodig is, ga naar stap 2.
- Wees alert op overmatig gebruik van SABA (> 2 × per week); dit geeft risico op ernstige longaanvallen en ziekenhuisopname.
Inspanningsgebonden klachten
- Adviseer bij inspanningsgebonden klachten een SABA uiterlijk 10-15 minuten voor de inspanning.
- Evalueer het effect en overweeg een stoppoging na 3-6 maanden.
- Maak bij frequent sportende kinderen onderscheid tussen ‘gepland’ en ‘ongepland’ gebruik van SABA. Ga bij ongepland gebruik in samenspraak met het kind en de ouders na in hoeverre een volgende stap geïndiceerd is (zie verder Beleid bij frequent sportende kinderen).
Stap 2: Onderhoudsbehandeling met ICS
Naar Samenvatting ›- Voeg een ICS in de startdosering toe (voor doseringen zie tabel 11).
- Adviseer bij klachten gebruik van SABA zo nodig.
- Continueer de ICS in de startdosering gedurende 3 maanden.
- Streef bij goede astmacontrole naar afbouwen van de dosering in stappen van 25-50% per 3 maanden, tot een zo laag mogelijke effectieve dosis waarbij goede astmacontrole wordt bereikt (zie Afbouwen ICS).
- Continueer de ICS in een zo laag mogelijke effectieve dosis bij goede astmacontrole in totaal minimaal 1 jaar (voor overwegingen en adviezen over (verder) afbouwen, zie Afbouwen ICS).
Stap 3: Consultatie of verwijzing naar kinder(long)arts
Naar Samenvatting ›Consulteer of verwijs naar een kinder(long)arts indien in bovenstaande stappen binnen 3 maanden geen goede astmacontrole is bereikt.
|
Geneesmiddel |
Leeftijd |
Dosering (microgram) |
Maximale dosering per dag (microgram) |
|---|---|---|---|
|
Kortwerkende bèta-2-sympathicomimetica (short acting bèta-2-agonists, SABA) |
|||
|
Salbutamol (werkingsduur 4-6 uur) |
|||
|
aerosol |
< 1 jaar |
1-4 dd 100-200 |
800 |
|
aerosol |
≥1 jaar |
1-4 dd 100-400 |
1600 |
|
poeder* |
1-4 dd 100-200 |
1600 |
|
|
Terbutaline |
|||
|
poeder* |
1-4 dd 500 |
4000 |
|
|
Kortwerkende parasympaticolytica (short-acting muscarin antagonists, SAMA) |
|||
|
Ipratropium (zelden geïndiceerd, uitsluitend als SABA niet verdragen wordt) |
|||
|
aerosol |
> 1 maand |
1-4 dd 20-40 |
320 |
|
poeder* |
|
1-4 dd 40-80 |
640 |
|
* Aanbevolen vanaf 7 jaar, zie Keuze toedieningsvorm. |
|||
|
|
Startdosering (microgram) |
Lagere dosering (microgram) |
|---|---|---|
|
Beclometason |
||
|
dosisaerosol |
2 dd 200 |
1-2 dd 50-100 |
|
extrafijn dosisaerosol |
2 dd 100 |
1-2 dd 50 |
|
poeder* |
2 dd 200 |
1 dd 200 |
|
Budesonide |
||
|
dosisaerosol |
2 dd 200 |
1 dd 200 |
|
poeder* |
2 dd 200 |
1-2 dd 100 |
|
Fluticasonproprionaat |
||
|
dosisaerosol |
2 dd 125 |
1-2 dd 50-125 |
|
poeder* |
2 dd 100 |
1 dd 100 |
|
Ciclesonide† |
||
|
dosisaerosol |
1 dd 160 |
1 dd 80 |
|
* Aanbevolen vanaf 7 jaar, zie Keuze toedieningsvorm. |
||
Beleid bij frequent sportende kinderen
Naar Samenvatting ›Ga bij frequent sportende kinderen (arbitrair > 2 × per week) het volgende na.
- Bij welke intensiteit van de inspanning treden er klachten op? Intensieve inspanning is bijvoorbeeld een sportwedstrijd of sporttraining. Fietsen naar school of buitenspelen beschouwen we niet als intensieve inspanning.
- Treden de klachten uitsluitend op tijdens intensieve inspanning of zijn er ook op andere momenten klachten?
- Is er sprake van ‘gepland’ gebruik van SABA (voorafgaand aan de inspanning om klachten te voorkomen) of van ‘ongepland’ gebruik (vanwege klachten tijdens of na de intensieve inspanning)?
- Indien de klachten uitsluitend optreden bij intensieve inspanning en het SABA-gebruik hiervoor gepland wordt, is ook bij > 2 × week SABA-gebruik (maximum arbitrair 5 × per week) nog sprake van goede astmacontrole. Er hoeft dan geen volgende stap in het stappenplan te worden genomen.
Geneesmiddelen bij allergische rinitis
Naar Samenvatting ›Geneesmiddelen bij allergische rinitis
Naar Samenvatting ›Behandel allergische rinitis volgens de NHG-Standaard Allergische en niet-allergische rinitis.
Leukotrieenreceptorantagonisten (LTRA)
Naar Samenvatting ›We bevelen LTRA niet aan bij de behandeling van kinderen met astma in de eerste lijn.
De werkgroep verwijst hiervoor naar de Richtlijn astma bij kinderen.
Bij kinderen > 6 jaar is bekend dat leukotrieenreceptorantagonisten (LTRA) minder effectief zijn dan ICS. Er zijn geen aanwijzingen dat LTRA effectiever en veiliger zijn dan ICS bij kinderen < 6 jaar met recidiverend piepen.
LTRA hebben een aantal vrij zeldzame, heel specifieke bijwerkingen zoals het syndroom van Churg-Strauss (vasculitis van de kleine bloedvaten) en psychische klachten (hallucinaties, desoriëntatie obsessieve gedachten, suïcidale gedachten).
Bij een aanhoudend slechte inhalatietechniek kan een LTRA in de tweede lijn overwogen worden als alternatief voor ICS.
Controles
Naar Samenvatting ›Doel
Naar Samenvatting ›- Evaluatie van de eerder gestelde diagnose ‘episodisch expiratoir piepen’ of ‘astma’
- Bepalen van de mate van astmacontrole.
- Herhaalde instructie inhalatietechniek (zie Instructie van de inhalatietechniek)
- Evaluatie en zo nodig aanpassen van het (niet-)medicamenteuze beleid
- Voorkomen van onder- en overbehandeling
Algemeen
Naar Samenvatting ›- Vraag bij iedere controle naar:
- luchtwegklachten
- aanpassingen of beperkingen op school, tijdens sport, hobby’s of buiten spelen
- frequentie SABA gebruik (> 2 × per week kan wijzen op onvoldoende astmacontrole)
- eventuele bijwerkingen van medicatie
- Controleer hoe de inhalatiemedicatie gebruikt wordt en geef waar mogelijk adviezen voor verbetering.
- Besteed bij alle kinderen met astma aandacht aan de therapietrouw. Besteed hier extra aandacht aan bij adolescenten vanwege leeftijdsgerelateerde belemmeringen.
Therapietrouw is gedefinieerd door de World Health Organization (WHO) als ‘de mate waarin de patiënt zijn behandeling uitvoert in overeenstemming met de afspraken die hij heeft gemaakt met zijn behandelaar’.
Zowel bij kinderen als adolescenten met astma bleek de therapietrouw laag (30-70%). Het gevonden percentage hangt vooral af van de gebruikte onderzoeksmethode: lager bij onderzoek met electronic monitoring devices versus eerstelijns databases versus vragenlijsten en telefonische interviews).
De belangrijkste consequentie van verminderde therapietrouw zijn onvoldoende astmacontrole, waardoor toename van klachten en longaanvallen en een verminderde kwaliteit van leven. Bij een therapietrouw > 75-80% werd vermindering van het aantal longaanvallen gevonden ten opzichte van therapietrouw < 75%.
Bij adolescenten met astma bleek de therapietrouw lager dan bij jongere kinderen en oudere patiënten met astma.
Mogelijke oorzaken hiervoor zijn: leeftijdsspecifieke belemmeringen, zoals afstand nemen van ouderlijk toezicht op de medicatie-inname, het vergeten van medicatie, de overtuiging dat medicatie niet werkzaam is, ontkenning dat ze astma hebben, moeilijkheden bij het gebruiken van de inhalatieapparaten, angst voor bijwerkingen, zich ongemakkelijk voelen bij het innemen van medicatie bij vrienden en luiheid.
Astmacontrole
Naar Samenvatting ›- Maak bij elk controleconsult onderscheid tussen goede en onvoldoende astmacontrole (zie Astmacontrole). Gebruik hiervoor tabel 6 en/of een vragenlijst.
- Overweeg het gebruik van een vragenlijst, in aanvulling op een gerichte anamnese, bij kinderen ≥ 6 jaar met astma om de mate astmacontrole te bepalen.
- Ga het aantal longaanvallen waarvoor een orale corticosteroïdkuur of ziekenhuisopname noodzakelijk was in het afgelopen jaar na. Dit geeft een indicatie voor het toekomstige risico op een (ernstige) longaanval (zie ook Risicofactoren ernstige of blijvende klachten).
Uitgangsvraag
Is gebruik van een vragenlijst om de mate van astmacontrole te bepalen bij kinderen met astma aan te bevelen?
Achtergrond
Vragenlijsten zijn mogelijk een hulpmiddel om de mate van astmacontrole te kwantificeren en zo nodig in de tijd te vervolgen. Drie verschillende vragenlijsten, de ACT, C-ACT en ACQ, zijn gevalideerd voor gebruik in de eerste lijn. Alle 3 de vragenlijsten inventariseren klachten overdag, klachten ’s nachts, beperking in activiteiten en gebruik van SABA. Bij de ACT scoort de door de patiënt ervaren ziektelast gescoord. Bij de ACQ-7 is de longfunctie 1 van de items, bij de ACQ-6 niet.
Methoden
Niet-systematische zoekactie in PubMed. De search is beperkt tot de 3 gevalideerde vragenlijsten (ACT, C-ACT en ACQ)
Resultaten
De zoekactie leverde 2 niet-systematische reviews op en 2 cross-sectionele niet-gerandomiseerde onderzoeken.
|
Vragenlijst |
Leeftijd |
Aantal items |
Score |
Bevraagde periode |
MID* |
Test-eigenschappen |
|---|---|---|---|---|---|---|
|
Astma Control Test (ACT) |
Kinderen ≥ 12 jaar Volwassenen |
5 |
≤ 19 onvoldoende astmacontrole (range 5-25) |
4 weken |
3 (volw) 2 (kind) |
Sens 69-71% Spec 71-76% |
|
Childhood Astma Control Test (C-ACT) |
Kinderen 4-11 jaar |
7 (4 kind, 3 ouder) |
≤ 19 onvoldoende astmacontrole (range 5-27) |
4 weken |
2 |
Sens 48-68% Spec 69-74% |
|
Astma Control Questionnaire (ACQ) |
Kinderen ≥ 6 jaar (6-10 jaar afname door getrainde interviewer) Volwassenen |
7 (ACQ7 = inclusief FEV1) of 6 (ACQ6 = exclusief FEV1) |
< 0,75 = goede astmacontrole (range |
1 week |
0,5 |
NPV** (score < 0.75) = 85% PPV*** (score ≥ 1,50) = 88% |
|
* MID = mean important difference |
||||||
Conclusie
Drie vragenlijsten (ACT, c-ACT en ACQ) zijn gevalideerd voor gebruik in de eerste lijn. De sensitiviteit en specificiteit zijn bij alle 3 ongeveer 70%.
Overwegingen
Voordelen van het gebruik van een vragenlijst is dat systematisch klachten en beperkingen kunnen worden gemeten en dat ze snel een overzicht kunnen geven van de huidige astmacontrole van de patiënt. Ze zijn makkelijk toepasbaar in de praktijk, eventueel kunnen ze in de wachtkamer of thuis voorafgaand aan het consult worden ingevuld. Hierdoor zou de anamnese meer toegespitst kunnen worden op specifieke punten. Een belangrijke beperking is dat de astmacontrole kan worden overschat doordat de patiënt en/of de ouders de klachten minder goed herkennen, daarnaast is het soms lastig om de klachten vanuit de bevraagde periode terug te halen voor de patiënt. Met een sensitiviteit van rond de 70% sluiten de vragenlijsten onvoldoende astmacontrole niet genoeg uit en blijft de anamnese van belang om de mate van astmacontrole te bepalen.
Uitgebreidere controles
Naar Samenvatting ›- Afhankelijk van de astmacontrole, de inschatting van de huisarts en voorkeuren van de ouders en het kind, kan de verdere controle meer of minder uitgebreid plaatsvinden.
- Uitgebreidere controles zijn vooral van belang bij kinderen met onvoldoende astmacontrole en ernstiger astma.
- Voor aandachtspunten bij (niet-)medicamenteuze behandeling.
- Het vastleggen van de behandeling in een Individueel Zorgplan (IZP) is vooral belangrijk bij kinderen met onvoldoende astmacontrole en ernstiger astma.
Uitgebreidere controles zijn vooral van belang bij kinderen met onvoldoende astmacontrole en ernstiger astma. Besteed bij deze uitgebreidere controles extra aandacht aan onderstaande aandachtspunten en aan zelfmanagement en individueel zorgplan.
Aandachtspunten (niet-)medicamenteuze behandeling
Stel de volgende TIP-aandachtspunten zo nodig bij.
- Therapietrouw. Besteed bij alle kinderen met astma aandacht aan de therapietrouw. Besteed hier bij adolescenten, vanwege leeftijdsgerelateerde belemmeringen of barrières extra aandacht aan (zie Algemeen).
- Inhalatietechniek. Controleer het gebruik van de inhalatiemedicatie. Vraag om de inhalatoren en de eventuele voorzetkamer bij elke controle mee te nemen. Laat het kind of de ouders het inhaleren voordoen tijdens het consult en demonstreer de inhalatietechniek opnieuw als er stappen niet goed gaan. Maak hiervoor eventueel ook gebruik van de filmpjes op www.inhalatorgebruik.nl. Adviseer het filmpje thuis regelmatig terug te kijken.
- Prikkelvermijding. Adviseer het kind allergische en niet-allergische prikkels die klachten uitlokken of verergeren zoveel mogelijk te vermijden.
Bespreek indien hier aanleiding voor is:
- de psychische of sociale gevolgen van astma (bijvoorbeeld angst voor dyspneu, vermijden van inspanning of sociale activiteiten, schoolverzuim, school- en beroepskeuze)
- hoeveel het kind beweegt (of sport) en het nut van bewegen (zie Bewegen)
- overweeg een meting van lengte en gewicht en bepaal de BMI. Bespreek bij obesitas (BMI is leeftijdsafhankelijk, zie NHG-Standaard Obesitas) de mogelijkheden om te komen tot gewichtsreductie, bijvoorbeeld met behulp van een GLI (zie Gewicht)
Zelfmanagement en individueel zorgplan
- Stimuleer het kind en de ouders om mee te denken en te beslissen over de behandeldoelen en de behandeling. Voor extra toelichting, zie 3goedevragen.nl/kinderen.
- Afhankelijk van de mate van de ernst van het astma en de mate waarin het kind zijn astma onder controle heeft, wordt de behandeling vastgelegd in een Individueel Zorgplan (IZP; zie NHG-Dossier). Dit is vooral belangrijk bij kinderen met onvoldoende astmacontrole en ernstiger astma.
- Leg indien een IZP wordt opgesteld bijvoorbeeld vast:
- namen, rol en bereikbaarheid van de betrokken zorgverleners (ook buiten kantooruren)
- persoonlijke behandeldoelen
- actueel medicatieoverzicht
- de besproken niet-medicamenteuze adviezen (bijvoorbeeld vermijden prikkels, stoppen met roken door de ouders)
- longaanval-actieplan: wat te doen bij toename van de klachten (zie Actieplan Astma bij kinderen)
- afspraken over de frequentie van controles
Frequentie van de controles
Naar Samenvatting ›Goede astmacontrole
Bij stap-1-medicatie
- Controleer kinderen met ‘zo nodig’-gebruik van een SABA in de eerste 3-6 maanden eenmalig. Bij gelijkblijvend klachtenpatroon en ≤ 2 × per week gebruik van SABA is controle niet noodzakelijk.
- Controleer bij een toename van de voorschriftfrequentie van SABA (en bij ≥ 3 voorschriften per jaar).
- Instrueer de patiënt en de ouders om zelf een controleafspraak te maken bij toename van klachten. Bespreek ook dat controle noodzakelijk is als SABA-gebruik > 4 weken > 2 × per week nodig is.
Bij stap-2-medicatie
- Controleer in jaar 1 na de start van de onderhoudsbehandeling frequenter, bijvoorbeeld elke 3-6 maanden.
- Controleer bij een onderhoudsbehandeling met ICS minimaal jaarlijks.
Onvoldoende astmacontrole
- Controleer elke 2-4 weken totdat goede astmacontrole bereikt is.
- Stel de medicatie bij aan de hand van het stappenplan.
- Overweeg een andere diagnose bij onvoldoende verbetering na adequate astmabehandeling.
- Verwijs bij onvoldoende verbetering van de astmacontrole na 6 weken (kinderen 1-6 jaar) tot 3 maanden (kinderen ≥ 6 jaar), andere klachten of comorbiditeit (voor specifieke en leeftijdsgebonden verwijscriteria, zie Consultatie en verwijzing).
De frequentie van de controles is voornamelijk afhankelijk van de mate van astmacontrole van de patiënt, eerdere reactie op medicatie en mate van zelfbehandeling. Volgens de GINA2020 is de ideale controlefrequentie elke 1-3 maanden na start of verhoging van de medicatie en elke 3-12 maanden in de periode daarna.
Bij aanpassing van de onderhoudsbehandeling treedt vaak na een aantal dagen tot een week verbetering op en na ongeveer 3-4 maanden wordt bij ICS het volledige effect van de aanpassing zichtbaar. Daarna is geen verdere verbetering van de aanpassing te verwachten.
De werkgroep heeft frequenties van de controles geformuleerd op basis van de GINA en adviseert het volgende te overwegen:
- de mate van astmacontrole
- de periode vanaf de aanvang van de onderhoudsbehandeling (stap-2-medicatie)
- de eerdere reactie op medicatiewijzingen
- de wens van de patiënt om de medicatie zelf bij te kunnen stellen
Spirometrie in de controlefase
Naar Samenvatting ›- Bij kinderen met goede astmacontrole heeft routinematige spirometrie geen plaats in de eerste lijn.
- Overweeg spirometrie bij twijfel of de astmacontrole voldoende is.
Spirometrie in de controlefase (dus niet als diagnostiek) is volgens de werkgroep in de eerste lijn vooral zinvol als er twijfel bestaat over de mate van astmacontrole. De uitslag van de spirometrie kan helpen bij de overweging om een volgende stap te nemen in het stappenplan.
De spirometrie bestaat uit een meting onder gebruik van eigen medicatie van de patiënt. De patiënt hoeft de eigen medicatie niet te staken. Vraag (de ouders van) het kind diens eigen medicatie gewoon te gebruiken. Gestandaardiseerde bronchusverwijding is alleen zinvol bij discrepantie tussen klachten en spirometrie of twijfel over de (wijze van) gebruik van inhalatiemedicatie.
Afbouwen ICS
Naar Samenvatting ›- Overweeg bij goede astmacontrole gedurende minimaal 1 jaar om de onderhoudsmedicatie ICS af te bouwen en eventueel geheel te stoppen.
- Wees echter terughoudend met afbouwen bij ziekenhuisopnames, longaanvallen en/of orale corticosteroïdkuren in de afgelopen 3 jaar. Houd bij een IC-opname vanwege astma een periode van 5 jaar aan.
- Bouw af in stappen van 25-50% per 3 maanden. Gebruik bij lage doseringen ICS een eenmaaldaags toedieningsschema. Stop als er geen lagere doseereenheid meer is.
- Evalueer de klachten na 3 maanden.
- Hervat bij verslechtering de oorspronkelijke dosering.
- Streef naar een stabiele situatie. Vermijd herhaaldelijk stoppen en starten van ICS. Na enkele jaren kan een nieuwe poging om af te bouwen overwogen worden.
De werkgroep heeft de tijdsperiode waarin sprake geweest moet zijn van een goede astmacontrole voordat overwogen kan worden om de onderhoudsmedicatie ICS bij kinderen met astma af te bouwen, verlengd naar 1 jaar. Dit is besloten op basis van onderstaande overwegingen:
- kinderen met goede astmacontrole worden jaarlijks gecontroleerd
- na 1 jaar zijn alle seizoenen doorgemaakt en is duidelijk of er bij het kind variaties in de klachten optreden tussen verschillende seizoenen
- het belang om een zo stabiel mogelijk beleid te voeren
Zelfbehandeling
Naar Samenvatting ›- Maak desgewenst afspraken met ouders en kinderen, die adequaat met de aandoening en medicatie omgaan, over het zo nodig gebruik van een SABA tot de maximale dosering bij toename van klachten.
- Spreek af dat ze contact opnemen als verhoging van de SABA geen of onvoldoende effect heeft binnen 24-48 uur.
- Bespreek dat SABA-gebruik > 2 × per week langer dan 4 weken wijst op onvoldoende astmacontrole. Spreek af dat de patiënt of de ouders contact opnemen als dit zo is.
Tijdelijke verhoging van de dosering ICS als zelfbehandeling
We bevelen een tijdelijke verhoging van de dosering ICS als zelfbehandeling bij toename van klachten niet aan.
Uitgangsvraag
Voorkomt tijdelijke verhoging van de onderhoudsdosering ICS door de ouders of door het kind zelf bij toename van klachten bij kinderen met astma een longaanval?
Achtergrond
Een verviervoudiging van de onderhoudsdosering ICS bij volwassenen met astma met een tijdelijke verergering van klachten verkleint het risico op een ernstigere longaanval, waarvoor orale corticosteroïden nodig zouden zijn. Bij kinderen is deze relatie minder duidelijk en werd in een RCT geen voordeel van verhoging van ICS gevonden.
Methoden
Niet-systematische zoekactie naar SR’s in PubMed.
Resultaten
Resultaat zoekactie
Er werd 1 recent gepubliceerde SR van goede kwaliteit gevonden naar de effectiviteit van een tijdelijke verhoging (bijvoorbeeld verviervoudiging) van de onderhoudsdosering ICS bij kinderen en volwassenen met astma bij tekenen van onvoldoende astmacontrole als zelfbehandeling op het voorkomen van een longaanval.
Beschrijving onderzoek
In de SR werden 5 RCT’s geïncludeerd, waarvan 1 onderzoek bij kinderen. In dit onderzoek werden 254 kinderen van 5-11 jaar (gemiddeld 8 jaar) geïncludeerd met mild tot matig astma die afgelopen jaar 1 longaanval hadden, waarvoor behandeling met corticosteroïden nodig was.
Alle kinderen werden 48 maanden behandeld met een lage dosis ICS (fluticason 2 dd 88 microgram) en werden gerandomiseerd in een groep met continue lage dosering en een groep die bij beginnende tekenen van verminderde astmacontrole gedurende 7 dagen de dosering ICS vervijfvoudigde (fluticason 2 dd 440 microgram).
De kwaliteit van dit onderzoek werd beoordeeld als zeer laag, daarnaast werd er een ruim tweemaal zo hoge dosering ICS gebruikt ten opzichte van de maximale geadviseerde dosering bij kinderen. Voor de uitkomst ‘longaanvallen behandeld met corticosteroïden’ was het RR 1,3 (95%-BI 0,8 tot 2,1).
Conclusie
In dit onderzoek van zeer lage kwaliteit bleek dat verhoging van de onderhoudsdosering ICS geen voordelen of nadelen gaf vergeleken met een normale dosering ICS, wat betreft het voorkomen van longaanvallen.
Overwegingen
Er is onvoldoende bewijs om een verhoging van de onderhoudsdosering ICS te adviseren als zelfbehandeling bij tekenen van onvoldoende astmacontrole.
Blended care
Naar Samenvatting ›Overweeg bij de controles van kinderen met astma de mogelijkheid van het gebruik van blended care te bespreken met de patiënt en de ouders.
Blended care bij de controles van kinderen met astma is niet duidelijk effectiever of minder effectief dan gebruikelijke zorg. Voor een deel van de kinderen en hun ouders kan gebruik van e-health toepassingen naast de face-to-face contacten voordelen bieden (bijvoorbeeld minder reistijd, makkelijk te combineren met school en werk) en zou het de patiënttevredenheid kunnen verhogen. Op dit moment kan er gebruik worden gemaakt van al bestaande e-health toepassingen.
Voor- en nadelen
Voor de meeste vooraf vastgestelde uitkomstmaten (SEH-bezoek, ziekenhuisopname, astmagerelateerde kwaliteit van leven, therapietrouw) is er geen duidelijk verschil te zien tussen de interventie- en de controlegroepen in de onderzoeken waarin blended care vergeleken wordt met gebruikelijke zorg. De astmacontrole zou enigszins kunnen verbeteren en het aantal longaanvallen zou mogelijk kunnen verminderen. Op de door ons geformuleerde uitkomstmaten werden geen duidelijke nadelige effecten van blended care gevonden in vergelijking met gebruikelijke zorg.
Kwaliteit van bewijs
De kwaliteit van het bewijs was laag tot zeer laag. Er werd afgewaardeerd vanwege weinig events, afwezigheid van blindering en brede betrouwbaarheidsintervallen. Bij de afwaardering is rekening gehouden met indirectheid van het bewijs. Er zijn geen onderzoeken gevonden bij kinderen in de eerste lijn. Daarnaast is er weinig onderzoek gedaan bij kinderen met een goede astmacontrole. De onderzochte groepen bestonden vaak (voor een groot deel) uit kinderen met onvoldoende astmacontrole. In de eerste lijn worden kinderen met > 3 maanden onvoldoende astmacontrole over het algemeen verwezen.
Waarden en voorkeuren van patiënten
Sommige kinderen en hun ouders zullen de voorkeur geven aan het persoonlijke contact met de huisarts (of de praktijkondersteuner). Voor anderen is het gemakkelijker om minder naar het spreekuur te hoeven komen, meer zelfregie te hebben en kan het eventueel tijdwinst opleveren om een deel van de zorg digitaal te krijgen. Thuis moeten de kinderen en/of de ouders enkele handelingen verrichten. De vooraf ingevulde informatie zou verdieping van het spreekuurcontact kunnen geven. Hoewel patiënttevredenheid geen vooraf vastgestelde uitkomstmaat was bij deze uitgangsvraag, beschreven Morton et al. in de discussie dat er positieve feedback van de ouders en de adolescenten kwam op de blended care. Uit de eHealth-monitor 2019 van Nictiz en het NIVEL blijkt dat ongeveer 40% van de zorggebruikers (van alle leeftijden) enthousiast is over en/of gebruik wil maken van een digitale zorgtoepassing.
Kosten
Uit een kosteneffectiviteitsanalyse van Van den Wijngaart et al. bleek dat de directe kosten van een VAC significant lager waren dan die van gebruikelijke zorg (mediaan € 726,52 versus € 875,86). Ook de maatschappelijke kosten waren lager.
Aanvaardbaarheid
Aangezien er in de maatschappij steeds meer gebruik wordt gemaakt van digitale toepassingen, verwachten we dat een blended care voor de patiënt en de zorgverlener een aanvaardbare mogelijkheid is.
Haalbaarheid
Op dit moment is er geen bestaande blended care voor de controles bij kinderen met astma in de eerste lijn. Er kan gebruik worden gemaakt van reeds bestaande e-healthtoepassingen zoals beeldbellen, een website of app, die door de zorgverlener(s) zelf in overleg met de patiënt/ouders, worden gecombineerd met face-to-face contact.
Uitgangsvraag
Is blended care aan te bevelen van kinderen en adolescenten van 0-17 jaar met astma?
| Patiënten | Kinderen < 12 jaar en ouders Kinderen en adolescenten van 12-18 jaar (zelf) |
|---|---|
| Interventie | Blended care (combinatie face-to-face en online hulpverlening) |
| Vergelijking | Gebruikelijke zorg (face-to-face of telefonisch contact) |
| Uitkomstmaten | Astmacontrole
|
Achtergrond
In de gezondheidszorg wordt steeds meer gebruik gemaakt van websites, mobiele applicaties en online toepassingen om ‘zorg op afstand’ te kunnen leveren.
Een blended behandeling omvat een geïntegreerd zorgaanbod van zowel online als face-to-face-interventies. De interventies kunnen onderling variëren. Er bestaat tot op heden geen duidelijke definitie van ‘blended’. Door Wentzel et al. is een voorstel gedaan aan welke voorwaarden blended care zou moeten voldoen:
- De online en offline componenten van de interventie zijn geïntegreerd.
- Zowel het face-to-facecontact als de technologische component dragen substantieel bij aan de interventie.
- Er is zorgvuldig afgewogen welke online componenten deel uitmaken van de interventie en in welke mate deze bijdragen aan de interventie.
- De interventie moet dynamisch en flexibel zijn.
- Er moet door de zorgverlener nagedacht worden over afstemming met de patiënt (als eindgebruiker).
In de tweede lijn in Nederland bestaat bij ongeveer 15 ziekenhuizen de mogelijkheid om via een online tool (luchtbrug.nl) een deel van de poliklinische astmacontroles online te doen. Daarnaast is de app Astmaatje ontwikkeld, die losstaand of in combinatie met de luchtbrug gebruikt kan worden.
Methoden
Er is een systematische literatuurzoekactie naar SR’s en RCT’s uitgevoerd in PubMed en Embase in oktober 2020. Waarbij we onderzoek geselecteerd hebben op basis van de voorgestelde definitie en voorwaarden van blended care uit het artikel van Wentzel et al..
Resultaten
Resultaat zoekactie
De zoekactie leverde 5 RCT’s op naar blended care bij kinderen en adolescenten.
Onderzoekskarakteristieken
In de RCT van Jacobson et al. werden Amerikaanse jongeren van 8-17 jaar met astma onder behandeling in de tweede lijn geïncludeerd die minimaal eenmaal door hun astma in het ziekenhuis waren opgenomen of tweemaal naar de eerste hulp waren geweest. Deze 59 jongeren (50,8% vrouw; 49,2% 8-10 jaar; 50,8% 11-15 jaar) werden gerandomiseerd naar een elektronisch astmabewakingssysteem (AMS) of alleen een dagboek (plus gebruikelijke zorg) gedurende 32 maanden.
AMS is een instrument dat astmaklachten monitort door middel van vragen, reminders geeft met betrekking tot medicatie en adviezen bij verslechtering. Een hulpverlener gaf telefonische of face-to-facehulp. Van de 29 jongeren in de AMS-groep maakten er 5 tijdens het onderzoek geen gebruik van het instrument.
In de RCT van Lv et al. werden Chinese kinderen met mild (90%) en matig (10%) astma met 7-11 longaanvallen in het afgelopen jaar geïncludeerd.
De 152 kinderen (50% vrouw; gemiddeld 7,9 jaar (SD 0,8); range 6-11,9 jaar) werden gerandomiseerd naar een mobiele applicatie geïntegreerd met gebruikelijke zorg of naar gebruikelijke zorg gedurende 1 jaar. De interventie bestond uit reminders, het monitoren van de ernst van astma, adviezen bij verslechtering, direct contact via de app met hulpverleners en face-to-facecontact.
In de RCT van Morton et al. werden jongeren (6-16 jaar) geïncludeerd bij wie het astma niet goed onder controle was.
De 89 kinderen (44% vrouw; gemiddeld 10,3 jaar (SD 1,67)) werden gerandomiseerd naar een reminder- en monitoringapparaat dat op de inhaler werd geplaatst of naar een groep waar het apparaat was uitgeschakeld. Het apparaat werd elke 3 maanden uitgelezen door een hulpverlener en de resultaten werden geëvalueerd met de jongere en de ouder(s) om eventuele therapietrouwproblemen op te lossen. De follow-up was een jaar.
In de RCT van Rikkers-Mutsaerts et al. werden adolescenten (12-18 jaar) geïncludeerd bij wie astma niet goed onder controle was.
De 90 adolescenten (50% vrouw; gemiddeld 13,6 jaar; range 12-17) werden gerandomiseerd naar een internetzelfmanagementsysteem (IBSM) of naar gebruikelijke zorg. De interventie betrof educatie (ook face-to-face), monitoren van de ernst van astma, adviezen voor aanpassingen medicatie (via een algoritme), detecteren van verslechtering en face-to-face-evaluatie. De follow-up was 1 jaar.
In de RCT van Van den Wijngaart et al. werden jongeren (6-16 jaar) met astma geïncludeerd die onder behandeling waren in de tweede lijn.
Deze 220 jongeren (40,5% vrouw; gemiddeld 11,3 jaar (SD 2,8); 30% ongecontroleerd astma) werden gerandomiseerd naar een virtuele astmakliniek (VAC) of naar gebruikelijke zorg gedurende 16 maanden. Binnen de VAC had de patiënt contact met lotgenoten en het behandelteam; onderdelen van de interventie waren het behandelplan, educatie, monitoring van de ernst van het astma, adviezen voor aanpassingen van de medicatie (bij langdurige verslechtering) en daarnaast structurele face-to-faceafspraken.
Analyse
Van de onderzoeksresultaten is een meta-analyse gemaakt, de forestplots zijn opgenomen als als bijlage in Totstandkoming en methoden. De resultaten zijn samengevat in tabel Blended care voor kinderen en adolescenten van 0-18 jaar met astma.
Conclusie
- Blended care zou longaanvallen kunnen verminderen en astmacontrole enigszins kunnen verbeteren.
- Blended care lijkt geen effect te hebben op SEH-bezoek en kwaliteit van leven. (in vergelijking met gebruikelijke zorg)
- We zijn onzeker over het effect van blended care op ziekenhuisopnames.
- We zijn onzeker over het effect van blended care op therapietrouw. Daarbij dient opgemerkt te worden dat in een subgroep waar onderzoek gedaan is naar ‘een reminder en monitoring apparaat die op de inhaler werd geplaatst’ een groot effect was.
Acute ernstige dyspneu (longaanval astma)
Naar Samenvatting ›Onderstaande tekst is ontleend aan de NHG-Behandelrichtlijn Geneesmiddelen en zuurstof in spoedeisende situaties, onderdeel Achtergronden.
ABCDE instabiel (cyanose, bewustzijnsdaling, uitputting)
Naar Samenvatting ›Handel als volgt (zie voor doseringen en toedieningsvorm, zie tabel 13).
- Bel een ambulance met directe inzet (A0/A1-urgentie).
- Geef zuurstof indien beschikbaar (zie NHG-Behandelrichtlijn Geneesmiddelen en zuurstof in spoedeisende situaties).
- Bij vermoeden longaanval astma: combineer zuurstof met salbutamol en ipratropium per vernevelaar. Indien er geen vernevelaar beschikbaar is: geef salbutamol per dosisaerosol met voorzetkamer.
- Breng zo mogelijk een infuusnaald in, spuit door met ten minste 2 ml NaCl 0,9%.
ABCDE stabiel
Naar Samenvatting ›Richtlijnen diagnostiek bij kinderen met acute ernstige kortademigheid (longaanval astma)
Naar Samenvatting ›- Stel de diagnose ernstige dyspneu (ernstige longaanval astma) bij kinderen als naast expiratoir piepen en een verlengd expirium ≥ 1 van de volgende symptomen aanwezig zijn:
- intrekkingen inter- of subcostaal, neusvleugelen
- gebruik van hulpademhalingsspieren
- verminderd of afwezig ademgeruis bij zeer ernstige dyspneu
- tachypneu (bij zeer ernstige dyspneu neemt ademfrequentie weer af!)
- tachycardie
- zuurstofsaturatie < 95% indien beschikbaar bij kinderen < 12 jaar met een kindersaturatiemeter. De saturatie daalt bij kinderen vaak pas laat omdat zij grote ademarbeid kunnen leveren; een lage saturatie bij kinderen is een zeer ernstig teken
- Als alle genoemde criteria afwezig zijn, is er een minder ernstige longaanval (zie verder onder Richtlijnen beleid).
- Ga de oorzaak van de acute dyspneu na: incorrect of onvoldoende gebruik medicatie, infectie, allergie of andere oorzaak
- Overweeg een eventuele andere oorzaak voor de kortademigheid dan astma.
Richtlijnen beleid bij kinderen met acute ernstige kortademigheid (longaanval astma)
Naar Samenvatting ›Handel als volgt (zie voor doseringen en toedieningsvorm, zie tabel 13)
- Stap 1: geef 1 × 4-8 inhalaties salbutamol per voorzetkamer. Herhaal bij persisterende klachten de 4-8 inhalaties na een kwartier. Verwijs als er geen of onvoldoende verbetering is.
- Stap 2:
- Indien 1 × 4-8 inhalaties salbutamol tijdens het consult voldoende verbetering geven, dan kan het kind naar huis met alleen salbutamol
- Schrijf een orale prednisonkuur voor indien herhaling van de inhalaties tijdens het consult noodzakelijk is.
- Geef instructies voor het gebruik van salbutamol: 4 inhalaties elke 3-4 uur tot de controle de volgende dag.
- Geef de instructie om contact op te nemen als de klachten aanhouden of terugkomen
- Controleer bij voorkeur de volgende dag.
- Geef instructies voor het gebruik van salbutamol de komende dagen: bouw bij duidelijke afname van de klachten per dag af, bijvoorbeeld op dag 2: 2 inhalaties elke 4 uur, op dag 3: 2 inhalaties elke 6 uur, op dag 4: 1 inhalatie elke 6 uur en daarna zo nodig op geleide van de klachten.
- Bij ernstige kortademigheid en vermoeden van astma bij een ABCDE-stabiel kind, gaat de voorkeur uit naar een dosisaerosol met een voorzetkamer. Deze toedieningsvorm is even effectief als verneveling.
Verwijzing
Naar Samenvatting ›Verwijs bij:
- onvoldoende verbetering
- onvoldoende zorgmogelijkheden in de eerstvolgende 12-24 uur
- een ziekenhuisopname wegens astma of een zeer ernstig verlopen longaanval in de voorafgaande 12 maanden
- een longaanval die de volgende dag ondanks adequaat ingestelde medicatie onvoldoende verbetert
|
Geneesmiddel |
Dosering |
Werkingssnelheid/-duur |
|
Salbutamol |
Volwassene: 100 microg (= 1 puf) per keer in voorzetkamer, 5 maal inademen, herhaal 4-10 keer |
Binnen 5 minuten |
|
Kind:
|
||
|
inhalatievloeistof: |
Volwassene en kind ≥ 5 jaar: |
|
|
Kind < 5 jaar: |
||
|
Ipratropiumbromide |
Volwassene: |
Binnen 15 minuten |
|
inhalatievloeistof |
Volwassene en kind ≥ 5 jaar: |
|
|
Kind < 5 jaar: |
||
|
Prednisolon |
Volwassene: |
Na enige uren |
|
Kind:
|
||
|
Dexamethason |
Volwassene: |
Na enige uren |
|
* Geef 6 tot 8 liter zuurstof/minuut om de (minimaal 4 ml) vloeistof in de vernevelkamer te vernevelen (vul eventueel aan met fysiologisch zout). De vernevelkamer kan worden aangesloten op een vernevelmasker. |
||
Consultatie en verwijzing
Naar Samenvatting ›Verwijs naar of consulteer een kinder(long)arts of kaderhuisarts astma (afhankelijk van de regionale mogelijkheden) bij:
- twijfel aan de diagnose, zoals bij een kind met onbegrepen klachten van (episodisch) piepen en/of benauwdheid, met veel invloed op het dagelijks leven.
- kinderen < 1 jaar met onvoldoende verbetering door behandeling met een SABA (behandeling met ICS van kinderen < 1 jaar is niet aangewezen in de eerste lijn)
- kinderen van 1-6 jaar met de symptoomdiagnose ‘episodisch expiratoir piepen’ die onvoldoende verbeteren na behandeling met een SABA en/of ICS in de startdosering gedurende 6 weken
- kinderen ≥ 6 jaar die geen goede astmacontrole bereiken met gedurende 3 maanden een startdosering ICS en adequate zorg met aandacht voor de TIP-aandachtspunten: therapietrouw, inhalatietechniek en prikkelvermijding.
Overige verwijsredenen
Naar Samenvatting ›- (Alsnog) indien in de voorafgaande 12 maanden ≥1 ziekenhuisopnames of ≥2 prednisonkuren nodig waren wegens astma.
- Indien intensieve begeleiding gewenst is vanwege complicerende psychosociale factoren die adequate behandeling structureel bemoeilijken.
- Complicerende comorbiditeit.
Samenwerking
Naar Samenvatting ›De aanbevelingen in deze NHG-Standaard (2022) sluiten aan bij de Zorgstandaard Astma bij kinderen en jongeren (2012) en de richtlijn Astma bij kinderen (2021).
Voorlichting
Naar Samenvatting ›- De huisarts en de kinder(long)arts stemmen hun mondelinge en schriftelijke voorlichting op elkaar af.
- De huisarts en kinder(long)arts gebruiken een uniform, schriftelijk longaanval-actieplan.
Hoofdbehandelaarschap
Naar Samenvatting ›- Er is 1 hoofdbehandelaar (huisarts, kaderhuisarts, kinder(long)arts).
- In het algemeen geldt (tenzij regionaal andere afspraken zijn gemaakt):
- in de eerste lijn als het kan, in de tweede lijn als het nodig is.
- tijdens de instelfase van recent door de huisarts vastgesteld astma bij kinderen is de huisarts hoofdbehandelaar
- bij kinderen met goede astmacontrole met stap-1- en -2-medicatie is de huisarts meestal hoofdbehandelaar
- bij kinderen met aanhoudend onvoldoende astmacontrole is de kinder(long)arts hoofdbehandelaar
- bij kinderen bij wie astmacontrole bereikt wordt met een hogere dosis dan stap-2-medicatie is de kinder(long)arts hoofdbehandelaar
- Jongeren met astma die onder controle van de kinder(long)arts zijn, krijgen bij de transitie naar volwassenheid een andere hoofdbehandelaar. De kinder(long)arts, de huisarts en de longarts maken onderling afspraken over adequate zorg in deze transitiefase.
Verwijzing of consultatie
Naar Samenvatting ›Werkwijze bij consultatie van of verwijzing naar de kinder(long)arts
Naar Samenvatting ›- Formuleer een adequate vraagstelling en geef daarbij duidelijk aan of het:
- een diagnostisch of een behandelingsprobleem betreft
- om een eenmalige consultatie gaat, dan wel om kortdurende of langdurige begeleiding
- Verstrek in de verwijsbrief relevante gegevens over diagnostische problemen, voorgeschiedenis, ziektebeloop, luxerende factoren, mate van astmacontrole, medicatie, comorbiditeit en competentie verzorgers/kind, bij voorkeur digitaal volgens de NHG-Richtlijn Informatie-uitwisseling tussen Huisarts en Specialist (HASP).
- De kinder(long)arts rapporteert schriftelijk aan de huisarts:
- na het vaststellen van de diagnose of een behandelplan
- minimaal jaarlijks bij blijvend hoofdbehandelaarschap
- tussentijds bij nieuwe gezichtspunten die van belang zijn voor de huisarts
- bij terugverwijzing
Terugverwijzing
Naar Samenvatting ›Kinder(long)arts
- De kinder(long)arts verwijst de patiënt over het algemeen terug:
- indien de vraag van de huisarts beantwoord is
- indien de diagnostiek in de tweede lijn afgerond is
- bij goede astmacontrole met behandeling in stap 2 gedurende 3-6 maanden, waarbij de huisarts de controles over kan nemen
- De kinder(long)arts stelt daarbij een duidelijk behandelplan op.
- De kinder(long)arts verstrekt relevante gegevens met betrekking tot ziektebeloop, medicatie, mate van astmacontrole en toegepaste behandeling
Bij ontslag uit ziekenhuis of SEH
- Bij ontslag na ziekenhuisopname of behandeling op de SEH wordt de huisarts ingelicht en wordt aangegeven wie verantwoordelijk is voor de vervolgbehandeling en controle.
- Indien een patiënt met een longaanval direct via de SEH in de tweede lijn terechtgekomen is, is het beleid over het algemeen:
- na aansluitende ziekenhuisopname: instelfase in de tweede lijn; bij goede astmacontrole in stap 2 gedurende 3-6 maanden terugverwijzing naar de huisarts
- zonder aansluitende ziekenhuisopname: terugverwijzing naar de huisarts voor instelfase ICS en goede astmacontrole in stap 2.
Samenwerking bij longaanvallen
Naar Samenvatting ›- De patiënt en diens omgeving moeten weten wat te doen bij een longaanval, bij voorkeur met een schriftelijk astma-actieplan (eventueel als onderdeel van een individueel zorgplan, zie Zelfmanagement en individueel zorgplan) dat onder andere informatie bevat over bereikbaarheid van de hoofdbehandelaar binnen en buiten kantooruren.
- De hoofdbehandelaar draagt zorg voor continuïteit van zorg, ook buiten kantooruren.
- De huisarts beoordeelt kinderen die onder controle van de kinder(long)arts zijn maar zich desondanks melden met astmagerelateerde klachten, volgens de NHG-Standaard. De huisarts overlegt daarbij laagdrempelig met de behandelend of dienstdoend kinder(long)arts over het beleid.
- De kinder(long)arts beoordeelt kinderen die onder controle van de huisarts zijn maar zich desondanks via de SEH bij de kinder(long)arts melden, en verwijst bij stabiele situatie terug naar de huisarts.
- In bovenstaande gevallen informeren huisarts en kinder(long)arts elkaar bij een belangrijke verandering van de medicatie (zoals structureel verhogen van de onderhoudsmedicatie, prednisolonkuur), bij voorkeur digitaal en indien dit niet mogelijk is door een uitdraai van het consult mee te geven.
Referenties
- Nielen MMJ, Hek K, Schermer TRJ. Jaarcijfers aandoeningen: incidenties en prevalenties. (2020). Ga naar bron: Nielen MMJ, Hek K, Schermer TRJ. Jaarcijfers aandoeningen: incidenties en prevalenties. (2020).
- Wijga AH, Kerkhof M, Gehring U, de Jongste JC, Postma DS, Aalberse RC, et al. Cohort profile: the prevention and incidence of asthma and mite allergy (PIAMA) birth cohort. Int J Epidemiol 2014;43:527-35.
- Dharmage SC, Perret JL, Custovic A. Epidemiology of Asthma in Children and Adults. Front Pediatr 2019;7:246.
- Rodríguez-Martínez CE, Sossa-Briceño MP, Castro-Rodriguez JA. Factors predicting persistence of early wheezing through childhood and adolescence: a systematic review of the literature. J Asthma Allergy 2017;10:83-98.
- Pinart M, Benet M, Annesi-Maesano I, von Berg A, Berdel D, Carlsen KC, et al. Comorbidity of eczema, rhinitis, and asthma in IgE-sensitised and non-IgE-sensitised children in MeDALL: a population-based cohort study. Lancet Respir Med 2014;2:131-40.
- Wijga AH, Van Buul LW, Blokstra A, Wolse A, P.H.. Astma bij kinderen tot 12 jaar: Resultaten van het PIAMA-onderzoek (2011). Ga naar bron: Wijga AH, Van Buul LW, Blokstra A, Wolse A, P.H.. Astma bij kinderen tot 12 jaar: Resultaten van het PIAMA-onderzoek (2011).
- Sonnenschein-van der Voort AM, Arends LR, de Jongste JC, Annesi-Maesano I, Arshad SH, Barros H, et al. Preterm birth, infant weight gain, and childhood asthma risk: a meta-analysis of 147,000 European children. J Allergy Clin Immunol 2014;133:1317-29.
- Osborn DA, Sinn JK, Jones LJ. Infant formulas containing hydrolysed protein for prevention of allergic disease. Cochrane-Database Syst Rev 2018;10:Cd003664.
- Lang JE, Bunnell HT, Hossain MJ, Wysocki T, Lima JJ, Finkel TH, et al. Being Overweight or Obese and the Development of Asthma. Pediatrics 2018;142.
- Gong T, Lundholm C, Rejnö G, Mood C, Långström N, Almqvist C. Parental socioeconomic status, childhood asthma and medication use-a population-based study. PLoS One 2014;9:e106579.
- Sandberg S, Paton JY, Ahola S, McCann DC, McGuinness D, Hillary CR, et al. The role of acute and chronic stress in asthma attacks in children. Lancet 2000;356:982-7.
- Rantala AK, Jaakkola MS, Mäkikyrö EM, Hugg TT, Jaakkola JJ. Early Respiratory Infections and the Development of Asthma in the First 27 Years of Life. Am J Epidemiol 2015;182:615-23.
- Scheltema NM, Nibbelke EE, Pouw J, Blanken MO, Rovers MM, Naaktgeboren CA, et al. Respiratory syncytial virus prevention and asthma in healthy preterm infants: a randomised controlled trial. Lancet Respir Med 2018;6:257-64.
- RIVM. GGD-richtlijn medische milieukunde: luchtkwaliteit en gezondheid. (2018). Ga naar bron: RIVM. GGD-richtlijn medische milieukunde: luchtkwaliteit en gezondheid. (2018).
- RIVM. GGD-richtlijn medische milieukunde: Schimmel- en vochtproblemen in woningen. (2012). Ga naar bron: RIVM. GGD-richtlijn medische milieukunde: Schimmel- en vochtproblemen in woningen. (2012).
- GINA. Global strategy for asthma management and prevention. Global Initiative for asthma (2020). Ga naar bron: GINA. Global strategy for asthma management and prevention. Global Initiative for asthma (2020).
- NVK. Astma bij kinderen (2021). Ga naar bron: NVK. Astma bij kinderen (2021).
- Litonjua AA, Weiss ST. Natural history of asthma (2021). Ga naar bron: Litonjua AA, Weiss ST. Natural history of asthma (2021).
- Guilbert T, Krawiec M. Natural history of asthma. Pediatr Clin North Am 2003;50:523-38.
- Andersson M, Hedman L, Bjerg A, Forsberg B, Lundbäck B, Rönmark E. Remission and persistence of asthma followed from 7 to 19 years of age. Pediatrics 2013;132:e435-42.
- Hovland V, Riiser A, Mowinckel P, Carlsen KH, Lødrup Carlsen KC. The significance of early recurrent wheeze for asthma outcomes in late childhood. Eur Respir J 2013;41:838-45.
- Jenkins MA, Hopper JL, Bowes G, Carlin JB, Flander LB, Giles GG. Factors in childhood as predictors of asthma in adult life. Bmj 1994;309:90-3.
- Strachan DP, Butland BK, Anderson HR. Incidence and prognosis of asthma and wheezing illness from early childhood to age 33 in a national British cohort. Bmj 1996;312:1195-9.
- Jansveld CA, Bakker W, Braat MC. Rapport van de commissie Nomenclatuur Longgeluiden Ned Tijdschr Geneeskd 1991;135:2380-3.
- Bakker W, Dijkman JH. Rhonchi en crepitaties: nomenclatuur en interpretatie. Ned Tijdschr Geneeskd 1990;134:477-80.
- Muris JWM. Auscultatie van de longen in de huisartsenpraktijk. Een literatuuroverzicht.. Huisarts Wet 1990;33:258-62.
- Beijaert R. Percutane zuurstofsaturatiemeting. Huisarts Wet 2019;62.
- Vidal C, Gude F, Boquete O, Fernández-Merino MC, Meijide LM, Rey J, et al. Evaluation of the phadiatop test in the diagnosis of allergic sensitization in a general adult population. J Investig Allergol Clin Immunol 2005;15:124-30.
- Bao Y, Chen Z, Liu E, Xiang L, Zhao D, Hong J. Risk Factors in Preschool Children for Predicting Asthma During the Preschool Age and the Early School Age: a Systematic Review and Meta-Analysis. Curr Allergy Asthma Rep 2017;17:85.
- Boersma NA, Meijneke RWH, Kelder JC, van der Ent CK, Balemans WAF. Sensitization predicts asthma development among wheezing toddlers in secondary healthcare. Pediatr Pulmonol 2017;52:729-36.
- van der Mark LB, van Wonderen KE, Mohrs J, van Aalderen WM, ter Riet G, Bindels PJ. Predicting asthma in preschool children at high risk presenting in primary care: development of a clinical asthma prediction score. Prim Care Respir J 2014;23:52-9.
- Vial Dupuy A, Amat F, Pereira B, Labbe A, Just J. A simple tool to identify infants at high risk of mild to severe childhood asthma: the persistent asthma predictive score. J Asthma 2011;48:1015-21.
- Graham BL, Steenbruggen I, Miller MR, Barjaktarevic IZ, Cooper BG, Hall GL, et al. Standardization of Spirometry 2019 Update. An Official American Thoracic Society and European Respiratory Society Technical Statement. Am J Respir Crit Care Med 2019;200:e70-e88.
- SAN. Spirometrie – SAN Praktijkrichtlijn. 2019.
- Zapletal A, Paul T, Samánek M. Die Bedeutung heutiger Methoden der Lungenfunktionsdiagnostik zur Feststellung einer Obstruktion der Atemwege bei Kindern und Jugendlichen. Z Erkr Atmungsorgane 1977;149:343-71.
- Quanjer PH, Tammeling GJ, Cotes JE, Pedersen OF, Peslin R, Yernault JC. Lung volumes and forced ventilatory flows. Report Working Party Standardization of Lung Function Tests, European Community for Steel and Coal. Official Statement of the European Respiratory Society. Eur Respir J Suppl 1993;16:5-40.
- Quanjer PH, Hall GL, Stanojevic S, Cole TJ, Stocks J. Age- and height-based prediction bias in spirometry reference equations. Eur Respir J 2012;40:190-7.
- Quanjer P, Stam H, Mertens FW, de Jongste JC, Chavannes NH, Hoogsteden HC. Eigentijdse interpretatie van longfunctiegegevens. Ned Tijdschr Geneeskd 2014;158:A7031.
- Pouwelse M, Van der Meer V, Van den Boomgaard M, Hugen C, Merkus P, Van den Bemt L. Astma bij kinderen: hoe zeker is de diagnose? Huisarts Wet 2015.
- Looijmans-van den Akker I, van Luijn K, Verheij T. Overdiagnosis of asthma in children in primary care: a retrospective analysis. Br J Gen Pract 2016;66:e152-7.
- Alzahrani YA, Becker EA. Asthma Control Assessment Tools. Respir Care 2016;61:106-16.
- Liu AH, Gilsenan AW, Stanford RH, Lincourt W, Ziemiecki R, Ortega H. Status of asthma control in pediatric primary care: results from the pediatric Asthma Control Characteristics and Prevalence Survey Study (ACCESS). J Pediatr 2010;157:276-81.e3.
- NICE. Air pollution: outdoor air quality and health. NICE guideline [NG70] (2017). Ga naar bron: NICE. Air pollution: outdoor air quality and health. NICE guideline [NG70] (2017).
- NICE. Indoor air quality at home. NICE guideline [NG149] (2020). Ga naar bron: NICE. Indoor air quality at home. NICE guideline [NG149] (2020).
- BTS. BTS/SIGN Guideline for the management of asthma 2019 (2019). Ga naar bron: BTS. BTS/SIGN Guideline for the management of asthma 2019 (2019).
- Burke H, Leonardi-Bee J, Hashim A, Pine-Abata H, Chen Y, Cook DG, et al. Prenatal and passive smoke exposure and incidence of asthma and wheeze: systematic review and meta-analysis. Pediatrics 2012;129:735-44.
- Wang Z, May SM, Charoenlap S, Pyle R, Ott NL, Mohammed K, et al. Effects of secondhand smoke exposure on asthma morbidity and health care utilization in children: a systematic review and meta-analysis. Ann Allergy Asthma Immunol 2015;115:396-401.e2.
- Acuff L, Fristoe K, Hamblen J, Smith M, Chen J. Third-Hand Smoke: Old Smoke, New Concerns. J Community Health 2016;41:680-7.
- Santino TA, Chaves GS, Freitas DA, Fregonezi GA, Mendonça KM. Breathing exercises for adults with asthma. Cochrane-Database Syst Rev 2020;3:Cd001277.
- NICE. Asthma: diagnosis, monitoring and chronic asthma management. NICE guideline [NG80] (2021). Ga naar bron: NICE. Asthma: diagnosis, monitoring and chronic asthma management. NICE guideline [NG80] (2021).
- Zhang W, Wang Q, Liu L, Yang W, Liu H. Effects of physical therapy on lung function in children with asthma: a systematic review and meta-analysis. Pediatr Res 2021;89:1343-51.
- Lima EV, Lima WL, Nobre A, dos Santos AM, Brito LM, Costa Mdo R. Inspiratory muscle training and respiratory exercises in children with asthma. J Bras Pneumol 2008;34:552-8.
- Bignall WJ, Luberto CM, Cornette AF, Haj-Hamed M, Cotton S. Breathing retraining for African-American adolescents with asthma: a pilot study of a school-based randomized controlled trial. J Asthma 2015;52:889-96.
- Vagedes J, Helmert E, Kuderer S, Vagedes K, Wildhaber J, Andrasik F. The Buteyko breathing technique in children with asthma: a randomized controlled pilot study. Complement Ther Med 2021;56:102582.
- Pieles GE, Horn R, Williams CA, Stuart AG. Paediatric exercise training in prevention and treatment. Arch Dis Child 2014;99:380-5.
- Beggs S, Foong YC, Le HC, Noor D, Wood-Baker R, Walters JA. Swimming training for asthma in children and adolescents aged 18 years and under. Cochrane-Database Syst Rev 2013:Cd009607.
- Crosbie A. The effect of physical training in children with asthma on pulmonary function, aerobic capacity and health-related quality of life: a systematic review of randomized control trials. Pediatr Exerc Sci 2012;24:472-89.
- Wanrooij VH, Willeboordse M, Dompeling E, van de Kant KD. Exercise training in children with asthma: a systematic review. Br J Sports Med 2014;48:1024-31.
- Welsh L, Kemp JG, Roberts RG. Effects of physical conditioning on children and adolescents with asthma. Sports Med 2005;35:127-41.
- Joschtel B, Gomersall SR, Tweedy S, Petsky H, Chang AB, Trost SG. Effects of exercise training on physical and psychosocial health in children with chronic respiratory disease: a systematic review and meta-analysis. BMJ Open Sport Exerc Med 2018;4:e000409.
- Schatz M, Kosinski M, Yarlas AS, Hanlon J, Watson ME, Jhingran P. The minimally important difference of the Asthma Control Test. J Allergy Clin Immunol 2009;124:719-23.e1.
- Fedele DA, Janicke DM, McQuaid EL, Abu-Hasan M, Baker D, Zou B, et al. A Behavioral Family Intervention for Children with Overweight and Asthma. Clin Pract Pediatr Psychol 2018;6:259-69.
- Deng X, Ma J, Yuan Y, Zhang Z, Niu W. Association between overweight or obesity and the risk for childhood asthma and wheeze: An updated meta-analysis on 18 articles and 73 252 children. Pediatr Obes 2019;14:e12532.
- Scott HA, Gibson PG, Garg ML, Pretto JJ, Morgan PJ, Callister R, et al. Dietary restriction and exercise improve airway inflammation and clinical outcomes in overweight and obese asthma: a randomized trial. Clin Exp Allergy 2013;43:36-49.
- Okoniewski W, Lu KD, Forno E. Weight Loss for Children and Adults with Obesity and Asthma. A Systematic Review of Randomized Controlled Trials. Ann Am Thorac Soc 2019;16:613-25.
- Abd El-Kader MS, Al-Jiffri O, Ashmawy EM. Impact of weight loss on markers of systemic inflammation in obese Saudi children with asthma. Afr Health Sci 2013;13:682-8.
- Willeboordse M, van de Kant KDG, Tan FE, Mulkens S, Schellings J, Crijns Y, et al. A Multifactorial Weight Reduction Programme for Children with Overweight and Asthma: A Randomized Controlled Trial. PLoS One 2016;11:e0157158.
- McDonald NJ, Bara AI. Anticholinergic therapy for chronic asthma in children over two years of age. Cochrane-Database Syst Rev 2003;2003:Cd003535.
- Robroeks CM, van de Kant KD, van Vliet D, Kester AD, Hendriks HJ, Damoiseaux JG, et al. Comparison of the anti-inflammatory effects of extra-fine hydrofluoroalkane-beclomethasone vs fluticasone dry powder inhaler on exhaled inflammatory markers in childhood asthma. Ann Allergy Asthma Immunol 2008;100:601-7.
- van Aalderen WM, Price D, De Baets FM, Price J. Beclometasone dipropionate extrafine aerosol versus fluticasone propionate in children with asthma. Respir Med 2007;101:1585-93.
- Kramer S, Rottier BL, Scholten RJ, Boluyt N. Ciclesonide versus other inhaled corticosteroids for chronic asthma in children. Cochrane-Database Syst Rev 2013:Cd010352.
- Adams NP, Bestall JC, Lasserson TJ, Jones P, Cates CJ. Fluticasone versus placebo for chronic asthma in adults and children. Cochrane-Database Syst Rev 2008:Cd003135.
- Chauhan BF, Chartrand C, Ducharme FM. Intermittent versus daily inhaled corticosteroids for persistent asthma in children and adults. Cochrane-Database Syst Rev 2013:Cd009611.
- Manning P, Gibson PG, Lasserson TJ. Ciclesonide versus other inhaled steroids for chronic asthma in children and adults. Cochrane-Database Syst Rev 2008:Cd007031.
- Pruteanu AI, Chauhan BF, Zhang L, Prietsch SO, Ducharme FM. Inhaled corticosteroids in children with persistent asthma: dose-response effects on growth. Cochrane-Database Syst Rev 2014:Cd009878.
- Zhang L, Prietsch SO, Ducharme FM. Inhaled corticosteroids in children with persistent asthma: effects on growth. Cochrane-Database Syst Rev 2014;2014:Cd009471.
- Axelsson I, Naumburg E, Prietsch SO, Zhang L. Inhaled corticosteroids in children with persistent asthma: effects of different drugs and delivery devices on growth. Cochrane-Database Syst Rev 2019;6:Cd010126.
- Chalmers GW, Macleod KJ, Little SA, Thomson LJ, McSharry CP, Thomson NC. Influence of cigarette smoking on inhaled corticosteroid treatment in mild asthma. Thorax 2002;57:226-30.
- Tomlinson JE, McMahon AD, Chaudhuri R, Thompson JM, Wood SF, Thomson NC. Efficacy of low and high dose inhaled corticosteroid in smokers versus non-smokers with mild asthma. Thorax 2005;60:282-7.
- Dijkstra A, Vonk JM, Jongepier H, Koppelman GH, Schouten JP, ten Hacken NH, et al. Lung function decline in asthma: association with inhaled corticosteroids, smoking and sex. Thorax 2006;61:105-10.
- Livingston E, Thomson NC, Chalmers GW. Impact of smoking on asthma therapy: a critical review of clinical evidence. Drugs 2005;65:1521-36.
- Thomson NC, Chaudhuri R, Livingston E. Asthma and cigarette smoking. Eur Respir J 2004;24:822-33.
- Busse WW, Pedersen S, Pauwels RA, Tan WC, Chen YZ, Lamm CJ, et al. The Inhaled Steroid Treatment As Regular Therapy in Early Asthma (START) study 5-year follow-up: effectiveness of early intervention with budesonide in mild persistent asthma. J Allergy Clin Immunol 2008;121:1167-74.
- Chen YZ, Busse WW, Pedersen S, Tan W, Lamm CJ, O'Byrne PM. Early intervention of recent onset mild persistent asthma in children aged under 11 yrs: the Steroid Treatment As Regular Therapy in early asthma (START) trial. Pediatr Allergy Immunol 2006;17 Suppl 17:7-13.
- O'Byrne PM, Pedersen S, Busse WW, Tan WC, Chen YZ, Ohlsson SV, et al. Effects of early intervention with inhaled budesonide on lung function in newly diagnosed asthma. Chest 2006;129:1478-85.
- Pauwels RA, Pedersen S, Busse WW, Tan WC, Chen YZ, Ohlsson SV, et al. Early intervention with budesonide in mild persistent asthma: a randomised, double-blind trial. Lancet 2003;361:1071-6.
- Tan WC, Lamm CJ, Chen YZ, O'Byrne PM, Pedersen S, Busse WW, et al. Effectiveness of early budesonide intervention in Caucasian versus Asian patients with asthma: 3-year results of the START study. Respirology 2006;11:767-75.
- Weiss K, Buxton M, Andersson FL, Lamm CJ, Liljas B, Sullivan SD. Cost-effectiveness of early intervention with once-daily budesonide in children with mild persistent asthma: results from the START study. Pediatr Allergy Immunol 2006;17 Suppl 17:21-7.
- O'Byrne PM, FitzGerald JM, Bateman ED, Barnes PJ, Zhong N, Keen C, et al. Inhaled Combined Budesonide-Formoterol as Needed in Mild Asthma. N Engl J Med 2018;378:1865-76.
- Cates CJ, Oleszczuk M, Stovold E, Wieland LS. Safety of regular formoterol or salmeterol in children with asthma: an overview of Cochrane-reviews. Cochrane-Database Syst Rev 2012;10:Cd010005.
- NICE. Asthma: medicines safety priorities (2015). Ga naar bron: NICE. Asthma: medicines safety priorities (2015).
- Sobieraj DM, Weeda ER, Nguyen E, Coleman CI, White CM, Lazarus SC, et al. Association of Inhaled Corticosteroids and Long-Acting β-Agonists as Controller and Quick Relief Therapy With Exacerbations and Symptom Control in Persistent Asthma: A Systematic Review and Meta-analysis. Jama 2018;319:1485-96.
- Chauhan BF, Chartrand C, Ni Chroinin M, Milan SJ, Ducharme FM. Addition of long-acting beta2-agonists to inhaled corticosteroids for chronic asthma in children. Cochrane-Database Syst Rev 2015:Cd007949.
- Stempel DA, Szefler SJ, Pedersen S, Zeiger RS, Yeakey AM, Lee LA, et al. Safety of Adding Salmeterol to Fluticasone Propionate in Children with Asthma. N Engl J Med 2016;375:840-9.
- Cates CJ, Schmidt S, Ferrer M, Sayer B, Waterson S. Inhaled steroids with and without regular salmeterol for asthma: serious adverse events. Cochrane-Database Syst Rev 2018;12:Cd006922.
- Janjua S, Schmidt S, Ferrer M, Cates CJ. Inhaled steroids with and without regular formoterol for asthma: serious adverse events. Cochrane-Database Syst Rev 2019;9:Cd006924.
- LAN. Goed gebruik inhalatiemedicatie Astma en COPD (2018). Ga naar bron: LAN. Goed gebruik inhalatiemedicatie Astma en COPD (2018).
- Jeswani HK, Azapagic A. Life cycle environmental impacts of inhalers (2019). Ga naar bron: Jeswani HK, Azapagic A. Life cycle environmental impacts of inhalers (2019).
- Hendriks HJ, Overberg PC, Brackel HJ, Vermuë NA. Handling of a spacer (Babyhaler) for inhalation therapy in 0- to 3-year-old children. J Asthma 1998;35:297-304.
- Kamps AW, Brand PL, Roorda RJ. Determinants of correct inhalation technique in children attending a hospital-based asthma clinic. Acta Paediatr 2002;91:159-63.
- Kamps AW, van Ewijk B, Roorda RJ, Brand PL. Poor inhalation technique, even after inhalation instructions, in children with asthma. Pediatr Pulmonol 2000;29:39-42.
- WHO. Adherence to Long-Term Therapies – Evidence for Action (2013). Ga naar bron: WHO. Adherence to Long-Term Therapies – Evidence for Action (2013).
- Kaplan A, Price D. Treatment Adherence in Adolescents with Asthma. J Asthma Allergy 2020;13:39-49.
- Williams LK, Peterson EL, Wells K, Ahmedani BK, Kumar R, Burchard EG, et al. Quantifying the proportion of severe asthma exacerbations attributable to inhaled corticosteroid nonadherence. J Allergy Clin Immunol 2011;128:1185-91.e2.
- Buston KM, Wood SF. Non-compliance amongst adolescents with asthma: listening to what they tell us about self-management. Fam Pract 2000;17:134-8.
- Voorend-van Bergen S, Vaessen-Verberne AA, de Jongste JC, Pijnenburg MW. Asthma control questionnaires in the management of asthma in children: A review. Pediatr Pulmonol 2015;50:202-8.
- Liu AH, Zeiger R, Sorkness C, Mahr T, Ostrom N, Burgess S, et al. Development and cross-sectional validation of the Childhood Asthma Control Test. J Allergy Clin Immunol 2007;119:817-25.
- Somashekar AR, Ramakrishnan KG. Evaluation of Asthma Control in Children Using Childhood- Asthma Control Test (C-ACT) and Asthma Therapy Assessment Questionnaire (ATAQ). Indian Pediatr 2017;54:746-8.
- Jackson DJ, Bacharier LB, Mauger DT, Boehmer S, Beigelman A, Chmiel JF, et al. Quintupling Inhaled Glucocorticoids to Prevent Childhood Asthma Exacerbations. N Engl J Med 2018;378:891-901.
- Morton RW, Elphick HE, Rigby AS, Daw WJ, King DA, Smith LJ, et al. STAAR: a randomised controlled trial of electronic adherence monitoring with reminder alarms and feedback to improve clinical outcomes for children with asthma. Thorax 2017;72:347-54.
- van den Wijngaart LS, Kievit W, Roukema J, Boehmer ALM, Brouwer ML, Hugen CAC, et al. Online asthma management for children is cost-effective. Eur Respir J 2017a;50.
- Wentzel J, van der Vaart R, Bohlmeijer ET, van Gemert-Pijnen JE. Mixing Online and Face-to-Face Therapy: How to Benefit From Blended Care in Mental Health Care. JMIR Ment Health 2016;3:e9.
- Jacobson JS, Lieblein A, Fierman AH, Fishkin ER, Hutchinson VE, Rodriguez L, et al. Randomized trial of an electronic asthma monitoring system among New York City children. Am J Manag Care 2009;15:809-14.
- Lv S, Ye X, Wang Z, Xia W, Qi Y, Wang W, et al. A randomized controlled trial of a mobile application-assisted nurse-led model used to improve treatment outcomes in children with asthma. J Adv Nurs 2019;75:3058-67.
- Rikkers-Mutsaerts ER, Winters AE, Bakker MJ, van Stel HF, van der Meer V, de Jongste JC, et al. Internet-based self-management compared with usual care in adolescents with asthma: a randomized controlled trial. Pediatr Pulmonol 2012;47:1170-9.
- van den Wijngaart LS, Roukema J, Boehmer ALM, Brouwer ML, Hugen CAC, Niers LEM, et al. A virtual asthma clinic for children: fewer routine outpatient visits, same asthma control. Eur Respir J 2017b;50.