Astma bij volwassenen
Richtlijnen diagnostiek
Naar Volledige tekst ›Denk aan astma bij dyspneu, een piepende ademhaling, > 3 weken hoesten of minder specifieke klachten, zoals snelle vermoeidheid, kortademigheid bij inspanning of conditievermindering.
Anamnese
Naar Volledige tekst ›Vraag naar:
- kortademigheid, al dan niet in combinatie met piepen; frequentie, duur; nachtelijke klachten en hoesten
- aanwijzingen voor allergische en niet-allergische prikkels
- roken en rookgeschiedenis
- voorgeschiedenis (allergie, medicatiegebruik en effect), familieanamnese (astma, atopie), werkgerelateerde klachten
- invloed van klachten op het dagelijks functioneren
- preventieve maatregelen en effect
Lichamelijk onderzoek
Naar Volledige tekst ›- Let op dyspneu, ademhalingsfrequentie, gebruik van hulpademhalingsspieren en stand thorax.
- Ausculteer hart en longen; let op verlengd expirium en/of expiratoir piepen en de hartfrequentie.
- Overweeg bij dyspneu saturatiemeting.
Aanvullend onderzoek
Naar Volledige tekst ›Bij aanwijzingen voor astma:
- spirometrie: FEV1, FVC en flowvolumecurve voor en na gestandaardiseerde bronchusverwijding
- overweeg bij blijvende diagnostische twijfel een histamine- of metacholineprovocatietest
- screeningstest op inhalatieallergenen bij anamnestische twijfel over allergische oorzaken
Evaluatie
Naar Volledige tekst ›- Stel de diagnose astma bij aanvalsgewijze dyspneu, expiratoir piepen of hoesten én:
- aangetoonde reversibiliteit (FEV1-toename: ≥ 12% én ≥ 200 ml) óf
- variabiliteit (FEV1-verschil ≥ 12% én ≥ 200 ml tussen 2 metingen na ≥ 4 weken) óf
- een positieve histamine- of metacholineprovocatietest
- Stel de diagnose astma naast COPD (ACO) bij patiënten > 40 jaar met tabaksrook- of andere expositie en herhaaldelijk vastgestelde reversibiliteit in combinatie met een persisterende obstructie.
Richtlijnen beleid
Naar Volledige tekst ›- Het doel van de behandeling is een goede astmacontrole: het minimaliseren van klachten, het risico op longaanvallen, beperking in functioneren, persisterende luchtwegobstructie, mortaliteit en bijwerkingen van medicatie; aangepast aan de persoonlijke behandeldoelen.
- Maak bij ieder vervolgconsult onderscheid tussen goede en onvoldoende astmacontrole.
- Gebruik hiervoor een vragenlijst ACQ6 (afwijkend bij score ≥ 0,75) of ACT (afwijkend bij score < 20).
Niet-medicamenteuze adviezen
Naar Volledige tekst ›- Bespreek aard, oorzaak en prognose.
- Adviseer prikkels die klachten uitlokken te vermijden.
- Geef rokers een ‘stoppen met roken’-advies, adviseer een gestructureerde aanpak en bied intensieve begeleiding.
- Raad meeroken en het gebruik van e-sigaretten af.
- Adviseer dagelijks ten minste een half uur matig intensieve beweging en (indien relevant) gewichtsreductie.
- Bespreek de gevolgen voor werk en functioneren.
Medicamenteuze behandeling
Naar Volledige tekst ›- Maak gebruik van inhalatiemedicatie voor onderhoudsbehandeling en gebruik bij klachten.
- Kies in overleg met de patiënt een toedieningsvorm waar de patiënt goed mee om kan gaan (zie ook de Tabel inhalatoren astma).
- Controleer in de instelfase elke 2-6 weken en maak onderscheid tussen goede en onvoldoende astmacontrole.
- Ga bij onvoldoende astmacontrole de ‘TIP’-aandachtspunten na: Therapietrouw, Inhalatietechniek en Prikkelvermijding.
- Ga bij onvoldoende astmacontrole naar een volgende stap.
- Geef instructies voor het beleid bij een tijdelijke toename van klachten.
| Stap 1 (optioneel) SABA Of ICS-formoterol zo nodig | Stap 2 ICS | Stap 3 Lage dosis ICS/LABA | Stap 4 Intermediaire tot hogere dosis ICS/LABA | Stap 5 Verwijzing | |
|---|---|---|---|---|---|
| (Onderhouds) behandeling | Alleen SABA zo nodig of lage dosis ICS-formoterol of meteen stap 2 | Lage dosis ICS of lage dosis ICS-formoterol zo nodig bij klachten | Lage dosis ICS + LABA of intermediaire dosis ICS (zonder LABA) | Intermediaire tot (tijdelijk) hogere dosis ICS + LABA Overweeg stap 5 | Verwijzing longarts |
| Bij klachten | - Bij gebruik ICS-formoterol: extra inhalatie lage dosering ICS-formoterol (maximaal 8 inh/dag) of aanvullend SABA - Anders: SABA | ||||
Stap 1: SABA of ICS-formoterol zo nodig
Naar Volledige tekst ›- Bij incidentele klachten (≤ 2/week overdag): SABA (kortwerkend bèta-2-mimeticum) zo nodig of combinatiepreparaat met lage dosering formoterol en ICS (inhalatiecorticosteroïden) (zie tabel 4).
- Overweeg stap 1 over te slaan en ICS in een lage dosering te geven.
Stap 2: Onderhoudsbehandeling met ICS of ICS-formoterol zo nodig
Naar Volledige tekst ›- Geef ICS in een lage dosis; continueer 3 maanden(zie tabel 5).
- Bouw zo mogelijk af naar een lagere dosis, maar staak ICS bij een duidelijke astmadiagnose niet.
Stap 3: Onderhoudsbehandeling met een LABA en lage dosis ICS
Naar Volledige tekst ›- Geef een LABA (langwerkend bèta-2-mimeticum) met lage dosis ICS als met stap 2 geen goede astmacontrole is bereikt (zie tabel 6).
- Een alternatief is een intermediaire dosis ICS zonder LABA.
- Overweeg bij onvoldoende astmacontrole toevoeging van montelukast 1 dd 10 mg.
Stap 4: Onderhoudsbehandeling met een LABA en een intermediaire tot hogere dosering ICS
Naar Volledige tekst ›- Geef een LABA met een intermediaire tot (tijdelijk) hogere dosis ICS indien met stap 3 geen goede astmacontrole is bereikt (zie tabel 4, 5 en 6).
- Een alternatief is een hogere dosis ICS zonder LABA.
- Overweeg bij blijvende onvoldoende astmacontrole tiotropium en/of montelukast 1 dd 10 mg toe te voegen of verwijs naar een longarts (stap 5).
Stap 5: Consultatie longarts
Naar Volledige tekst ›Consulteer of verwijs naar de longarts indien binnen 3-6 maanden geen goede astmacontrole is bereikt.
Monitoring
Naar Volledige tekst ›- Maak bij ieder monitoringsconsult onderscheid tussen goede en onvoldoende astmacontrole met een vragenlijst (ACQ6 of ACT).
- Monitor bij onvoldoende astmacontrole elke 6-12 weken totdat persoonlijke behandeldoelen zijn bereikt.
- Monitor bij goede astmacontrole jaarlijks, verricht bij rokers of stap 3- of stap 4-medicatie spirometrie.
- Ga bij ieder monitoringsconsult de hoeveelheid SABA-gebruik na.
- Wees bij patiënten > 40 jaar alert op ontwikkeling van COPD naast astma.
- Overweeg bij patiënten die na initiële diagnostiek en behandeling blijvend onvoldoende reageren op behandeling met ICS de mogelijkheid van niet-allergisch astma, zoals bij patiënten met obesitas (BMI > 30) of als de astmaklachten op de volwassen leeftijd zijn ontstaan. Overweeg deze patiënten te verwijzen naar een longarts.
Consultatie of verwijzing
Naar Volledige tekst ›Verwijzing naar of consultatie van een longarts of consultatie van een kaderhuisarts is aangewezen bij:
- twijfel aan de diagnose astma
- het vermoeden van astma én COPD
- < 40 jaar: naar longarts ter uitsluiting van alfa 1-antitrypsinedeficiëntie
- > 40 jaar: consulteer een kader- of longarts; verwijs bij blijvende twijfel
- discrepantie tussen klachten en spirometrie
- persisterend vermoeden onderliggende pathologie
- blijvende onvoldoende astmacontrole na 3-6 maanden of het niet bereiken van de persoonlijke behandeldoelen ondanks stap 4-medicatie
- vermoeden van astma veroorzaakt of verergering door werk; verwijs ook naar een bedrijfsarts
- patiënten met complexe comorbiditeit
- persisterend overmatig SABA-gebruik ondanks adequate onderhoudsbehandeling en voorlichting
Longaanval astma bij volwassenen
Naar Volledige tekst ›Bij ABCDE instabiel of een ernstige longaanval: zie NHG-Behandelrichtlijn Geneesmiddelen en zuurstof in spoedeisende situaties.
Beleid minder ernstige longaanval
Naar Volledige tekst ›Belangrijkste wijzigingen
Naar Samenvatting ›- De diagnostische criteria zijn aangescherpt: spirometrisch aangetoonde reversibiliteit of variabiliteit (FEV1-verschil van 12% en 200 ml tussen 2 metingen) is obligaat voor de diagnose. Bij blijvende diagnostische twijfel is bepaling van de histamine- of metacholinedrempel geïndiceerd.
- De 3-deling goede, gedeeltelijke en slechte astmacontrole is vervangen in de 2-deling goede en onvoldoende astmacontrole en wordt gemaakt op grond van een vragenlijst (ACQ6 of ACT).
- Het indicatiegebied voor gebruik van een kortwerkend bèta-2-mimeticum (SABA) is beperkter geworden.
- Het beleid bij overmatig SABA-gebruik is toegevoegd.
- Bij het medicamenteuze stappenplan kan vanaf nu stap 1 worden overgeslagen.
- De mogelijkheid om bij stap 2 formoterol-ICS voor gebruik zo nodig te geven is aan het stappenplan toegevoegd.
- De informatie over medicatiegebruik bij zwangerschap en borstvoeding is aangevuld.
- Inhalatiemedicatie wordt weergegeven in een lage, intermediaire en hoge dosering.
- Het beleid bij een longaanval is geactualiseerd.
Kernboodschappen
Naar Samenvatting ›- Stel de diagnose astma op basis van anamnese, lichamelijk onderzoek en spirometrie.
- De belangrijkste niet-medicamenteuze maatregel is niet roken en een rookvrije omgeving.
- Start niet met (onderhouds)medicatie voordat de diagnose astma voldoende zeker is gesteld.
- Inhalatiecorticosteroïden (ICS), al dan niet in combinatie met langwerkende bèta-2-mimetica (LABA), vormen de basis van de medicamenteuze behandeling.
- Bij een goede astmacontrole is SABA-gebruik vrijwel niet nodig; (overmatig) SABA-gebruik > 2/week is een teken van onvoldoende astmacontrole.
- Verwijsredenen zijn onder meer: discrepantie tussen klachten en longfunctie-afwijkingen, blijvende onvoldoende astmacontrole na 3-6 maanden of het niet bereiken van de persoonlijke behandeldoelen ondanks stap 4-medicatie, al dan niet in combinatie met aanwijzingen voor niet-allergisch astma (onvoldoende reactie op ICS, obesitas (BMI > 30) of als de astmaklachten op de volwassen leeftijd zijn ontstaan.
Inleiding
Naar Samenvatting ›Scope
Naar Samenvatting ›De NHG-Standaard Astma bij volwassenen geeft richtlijnen voor de diagnostiek, behandeling en monitoring van astma bij patiënten ≥ 16-18 jaar.
Leeftijdsgrens van deze standaard
De NHG-Standaard Astma bij volwassenen geeft richtlijnen voor de diagnostiek, behandeling en monitoring van astma bij volwassenen. Richtlijnen voor de diagnostiek en behandeling van astma bij kinderen worden beschreven in de NHG-Standaard Astma bij kinderen en richtlijnen voor de diagnostiek en behandeling van allergische rinitis in de NHG-Standaard Allergische en niet-allergische rinitis. Richtlijnen voor de diagnostiek en behandeling van COPD worden beschreven in de NHG-Standaard COPD.
Deze standaard sluit aan op de Zorgstandaard Astma bij volwassenen, bij delen van de multidisciplinaire richtlijn Astma (beide geïnitieerd door de Longalliantie Nederland) en bij de richtlijn Ernstig astma van de Nederlandse Vereniging van Artsen voor Longziekten en Tuberculose.
Zorg voor jongeren met astma
De overgang van kind naar volwassenheid (de puberteit) is een transitiefase. De NHG-Standaard Astma bij kinderen hanteert om deze reden een leeftijdsrange van 16 tot 18 jaar. Voor zorgverleners is het nogal eens een uitdaging om jongeren in deze fase goede ondersteuning te bieden bij het verwerven van zelfredzaamheid en -management.
Hoewel maatwerk gewenst is, zullen jongeren met astma die onder behandeling van een kinder(long)arts staan in de regel vanaf de leeftijd van 18 jaar behandeld worden door een longarts. Een goed moment is meestal de overgang van de middelbare school naar andere vormen van onderwijs. Deze overgang is ook van toepassing op deze standaard. Voor jongeren en jongvolwassenen met astma onder behandeling van de huisarts geldt ook dat vanaf de leeftijd van 16 tot 18 jaar de richtlijnen van de NHG-Standaard Astma bij volwassenen gevolgd kunnen worden.
Buiten de scope
Naar Samenvatting ›- De diagnostiek en behandeling van COPD. Zie de NHG-Standaard COPD.
- De diagnostiek en behandeling van astma bij kinderen tot 16-18 jaar. Zie daarvoor de NHG-Standaard Astma bij kinderen.
- Diagnostiek en behandeling van overige longziekten.
Samenwerking en afstemming
Naar Samenvatting ›- Bij diagnostische problemen of bij moeilijk in te stellen astma wordt samenwerking met en/of verwijzing naar een longarts aanbevolen (zie Transmurale Afspraak).
- De standaard sluit aan op:
- de Zorgstandaard Astma bij volwassenen
- de multidisciplinaire richtlijn Astma van de Longalliantie Nederland
- de richtlijn Ernstig astma van de Nederlandse Vereniging van Artsen voor Longziekten en Tuberculose
- De richtlijn Astma en COPD van de Nederlandse Vereniging voor Arbeids- en Bedrijfsgeneeskunde
Achtergronden
Naar Samenvatting ›Astma
Naar Samenvatting ›Aanvalsgewijs optredende, reversibele bronchusobstructie op basis van een verhoogde gevoeligheid van de luchtwegen voor allergische (IgE-gemedieerde) en/of niet-allergische prikkels.
Astmacontrole
Naar Samenvatting ›Mate van controle over de astmaklachten. Goede astmacontrole betekent: geen klachten overdag en
’s nachts, geen beperkingen, normale spirometrie (indien geïndiceerd), al dan niet met medicatie in een zo laag mogelijke dosering en toedieningsfrequentie en met zo weinig mogelijk bijwerkingen. Gebruik voor het onderscheid tussen goede en onvoldoende controle een vragenlijst (ACQ6 of ACT).
Atopie
Naar Samenvatting ›Aangeboren aanleg voor astma, eczeem en allergie, gekenmerkt door verhoogde activiteit van IgE immunoglobuline.
Bronchiale hyperreactiviteit
Naar Samenvatting ›De eigenschap van de luchtwegen om met een versterkte bronchusobstructie te reageren op de niet-allergische prikkels waarop mensen zonder astma niet of nauwelijks reageren.
Disfunctioneel ademen
Naar Samenvatting ›Gelijktijdig astma en COPD (Astma-COPD-overlap of ACO)
Naar Samenvatting ›Longaanval (exacerbatie) astma
Naar Samenvatting ›Toenemende verergering van dyspneuklachten, hoesten of piepen, die gepaard gaan met een verminderde longfunctie, meestal als gevolg van een virale luchtweginfectie of een andere prikkel (zie Etiologie en pathofysiologie) of door verkeerd of onvoldoende medicatiegebruik (ICS-gebruik). Meestal is aanvullende behandeling aangewezen. De term longaanval heeft de voorkeur boven de oude benaming exacerbatie, omdat deze in de communicatie met patiënten beter wordt begrepen.
Persoonlijke behandeldoelen
Naar Samenvatting ›Behandeldoelen die zich richten op de bezigheden die een patiënt wil kunnen uitvoeren maar waarbij de astmaklachten belemmerend zijn. Voorbeelden zijn: de hond uitlaten, een fietstocht maken, sporten, familiebezoek.
Epidemiologie
Naar Samenvatting ›- Astma begint meestal op de jonge kinderleeftijd, maar kan ook na het 50e jaar voor het eerst optreden.
- De incidentie van astma in de huisartsenpraktijk is bij volwassenen ongeveer 6 per 1000 patiënten per jaar en daalt licht met de leeftijd.
- De prevalentie in de huisartsenpraktijk is 107 per 1000 patiënten en neemt af van 130 per 1000 bij jongvolwassenen (19-24 jaar) tot 94-97 per 1000 patiënten van ≥ 25 jaar.
- Astma vermindert de levensverwachting nauwelijks.
De incidentiecijfers van astma dalen met de leeftijd en gaan van 39,5 bij 0-1 jaar naar 14,1 bij 2-4 jaar en 6,0 bij 5-11 jaar in 2017. Op volwassen leeftijd (18-64) is dit 4,1. De jaarprevalentie van astma bij volwassenen ligt rond de 100 per 1000 patiëntjaren in de huisartsenpraktijk (dalend van 19-24 jaar: 130 naar > 85: 86). Bij jongens zijn de incidentie en prevalentie wat hoger dan bij meisjes, op volwassen leeftijd zijn de incidentie en prevalentie bij vrouwen iets hoger dan bij mannen.
Mortaliteit
Het RIVM rapporteert in 2017 in totaal 160 sterfgevallen door astma. In 2017 overleden in totaal 160 personen aan astma: 46 mannen en 114 vrouwen (0,5 per 100.000 mannen en 1,3 per 100.000 vrouwen). Mensen sterven als gevolg van astma vooral op hogere leeftijd. Zie volksgezondheidenzorg.info van het RIVM.
Genderverschillen
Astma ontstaat meestal op de peuter- of de basisschoolleeftijd. Op jonge leeftijd ontwikkelen jongens bijna tweemaal zo vaak astma als meisjes. Rond de puberteit komt astma echter vaker voor bij meisjes dan bij jongens. Bovendien blijken vrouwen frequenter een ernstiger vorm van astma dan mannen te hebben.
Opleidingsniveau en inkomensgroep
Het CBS rapporteerde in 2016 dat bij mensen met alleen basisonderwijs als hoogst behaalde opleiding astma bijna 2 keer zo vaak voorkomt als bij mensen die wetenschappelijk onderwijs behaalden.
Ruim 8% van de mensen met een gestandaardiseerd besteedbaar huishoudinkomen in de laagste inkomensgroep rapporteerde astma tegenover ruim 4% in de hoogste inkomensgroep. Zie Bevolkingstrends: astma en COPD in beeld van het CBS.
Etiologie en pathofysiologie
Naar Samenvatting ›- Astma is een longaandoening die wordt gekenmerkt door aanvalsgewijs optredende, reversibele bronchusobstructie op basis van een verhoogde gevoeligheid van de luchtwegen voor allergische (meestal IgE-gemedieerde) en niet-allergische prikkels met als pathologisch substraat een chronische ontstekingsreactie.
- Genetische factoren hebben invloed op het ontwikkelen van astma.
- Bij het ontwikkelen van astma zijn sensibilisatie voor allergische prikkels door inhalatie of aanwezigheid in de voeding van belang, zoals:
- huisstofmijt
- huisdieren
- schimmels
- pollen
- melk, soja, pinda’s of noten
- beroepsmatig contact met allergenen
- Daarnaast kunnen klachten ontstaan door blootstelling aan niet-allergische prikkels, zoals:
- virale infecties
- (tabaks)rook, inclusief meeroken, damp van e-sigaretten en rook van een waterpijp
- fijnstof, inclusief blootstelling aan houtkachels en vuurwerk
- werkgerelateerde stoffen (zoals schoonmaakmiddelen)
- lichamelijke inspanning
- stress
- kou en mist
- geneesmiddelen, zoals acetylsalicylzuur, NSAID’s, (niet-selectieve) orale bètablokkers
Risicofactoren die het ontstaan en verergeren van astma beïnvloeden zijn in te delen in patiëntgebonden factoren en omgevingsfactoren. Patiëntgebonden factoren zijn bijvoorbeeld erfelijke aanleg voor atopie of bronchiale hyperreactiviteit of obesitas. Omgevingsfactoren zijn onder te verdelen in allergische en niet-allergische prikkels.
Allergische prikkels
Allergenen activeren onder meer de degranulatie van mestcellen, waarbij onder andere histamine vrijkomt. Daarnaast spelen ontstekingscellen een essentiële rol. Bij allergenen maakt men onderscheid tussen:
- allergenen binnenshuis (huisstofmijt, huisdieren, schimmels)
- allergenen buitenshuis (pollen, schimmels)
- beroepsgebonden allergenen (bijvoorbeeld meelstof bij bakkers), zie Werkgerelateerd astma en Werk.
Niet-allergische prikkels
Niet allergische prikkels die het ontstaan of verergeren van astma beïnvloeden zijn:
- virusinfecties
Vooral rinovirussen, maar ook (para)influenza-, adeno- en coronavirussen zijn veelvoorkomende oorzaken van verergering van astmaklachten. - roken
Roken is geassocieerd met een versnelde achteruitgang van de longfunctie bij patiënten met astma, verhoogt de ernst van astma, verlaagt het effect van medicatie en verlaagt de kans op astmacontrole. Het effect van passief roken bij volwassenen met astma is onvoldoende onderzocht, maar bij kinderen is het geassocieerd met een verhoogd risico op respiratoire aandoeningen, waaronder astma. - fijnstof
Er zijn aanwijzingen dat blootstelling aan fijnstof de klachten van astma verergeren. - mist en kou
- lichamelijke inspanning
Lichamelijke inspanning kan astmaklachten verergeren. - geneesmiddelen, zoals acetylsalicylzuur en andere NSAID’s
Deze middelen kunnen ernstige astma-longaanvallen veroorzaken.
Bij volwassenen is allergie voor een voedingsmiddel als uitlokkende prikkel ongebruikelijk. Alleen in het zeldzame geval dat hier aanleiding toe is, dient een voedselallergie met een veilig uitgevoerde provocatie-eliminatietest te worden vastgesteld.
Verschillende vormen van astma
Naar Samenvatting ›Astma is een heterogeen ziektebeeld en kan zich uiten als allergisch en niet-allergisch astma. Beide vormen kunnen werkgerelateerd zijn en in combinatie met COPD voorkomen.
Omdat astma in de klinische praktijk een heterogeen ziektebeeld is, werd met behulp van zogenaamde clusteranalyses nagegaan of er verschillende groepen patiënten zijn te onderscheiden met overeenkomstige kenmerken; de zogenaamde fenotypes. Uit dergelijk onderzoek werden verschillende sets van fenotypes geïdentificeerd.
In een systematisch literatuuronderzoek werden 12 artikelen geïncludeerd waarin een verschil tussen early-onset (diagnose < 12 jaar) en late-onset (diagnose > 12 jaar) werd geïdentificeerd. Volwassenen met early-onset astma waren vaker atopisch en hadden meer longaanvallen. Kenmerken van late-onset: vaker vrouw, rokers, geen atopie en minder reversibiliteit. Gezien het cross-sectionele karakter en de methodologische beperkingen van de onderzoeken moet dit met terughoudendheid worden geïnterpreteerd.
Het severe asthma research program (SARP) gebruikte klinische kenmerken en beschrijft mild, matig en ernstige early-onset atopisch astma, late-onset ernstig astma bij voornamelijk oudere vrouwen met obesitas en een late-onset zeer ernstige groep met minder atopie en minder reversibiliteit.
Een andere onderzoeksgroep betrok het type inflammatie (al dan niet eosinofiel) en identificeerde een early-onset atopisch astma, obees non-eosinofiel astma, early-onset symptoomdominant astma en late-onset ontstekingsdominant (eosinofiel) astma.
Deze laatstgenoemde indeling heeft internationaal veel navolging gekregen. Andere auteurs beschrijven andere indelingen.
Door een aantal auteurs wordt het zogenaamde eosinofiele astma gedefinieerd; een vorm met eosinofilie in weefsel en sputum, verdikking van de basale membraan en meestal een goede respons op corticosteroïden.
Indeling GINA-richtlijn
De GINA-richtlijn stelt dat de relatie tussen pathologie en klinische kenmerken zwak is en noemt als de meest bruikbare fenotypes:
- allergisch astma
Begint gewoonlijk in de kindertijd en is geassocieerd met een familiair voorkomen en/of allergische aandoeningen, zoals eczeem, rinitis, voedselallergie. In sputum is vaak een eosinofiele inflammatie aantoonbaar. Deze patiënten reageren gewoonlijk goed op behandeling met ICS. - niet-allergisch astma
Volwassenen zonder allergieën. Deze patiënten reageren minder goed op behandeling met ICS. - late-onset astma
Astma die zich manifesteert op volwassen leeftijd, vooral bij vrouwen. Deze patiënten zijn meestal niet-allergisch en reageren matig of niet goed op behandeling met ICS. - astma met gefixeerde luchtwegbelemmering (irreversibiliteit, lijkend op COPD)
Sommige patiënten met lang bestaand astma ontwikkelen een luchtwegobstructie die vermoedelijk wordt veroorzaakt door ‘remodeling’. - astma bij obesitas
Sommige patiënten met obesitas hebben uitgesproken respiratoire klachten zonder eosinofiele inflammatie.
Beleid in de 2e lijn
In de 2e lijn wordt inmiddels regelmatig onderscheid gemaakt tussen verschillende fenotypes. Dit heeft, vooral voor patiënten bij wie de diagnose en behandeling lastig zijn, belangrijke consequenties. Bij de behandeling van deze complexe patiënten wordt gestreefd naar persoonsgerichte zorg, waarbij individuele behandeling wordt gebaseerd op behandelbare eigenschappen: treatable traits, zoals de mate van obstructie en eosinofiele inflammatie. Titratie van onder meer ICS en luchtwegverwijders gebeurt op grond van deze eigenschappen. Aanvullende tweedelijnsbehandeling kan onder meer bestaan uit onderhoudsbehandeling met antibiotica of biologicals; bepaling van de steroïdgevoeligheidsbehandeling van comorbiditeit (bronchiëctasieën, slaap-apneusyndroom, refluxziekte), extrapulmonaire zaken (KNO-problematiek, gewicht, cardiovasculaire of psychische problemen) en andere factoren, zoals roken, compliance en polyfarmacie(zie Behandelingsmogelijkheden in de 2e lijn).
Overwegingen
Een indeling in verschillende fenotypes door de huisarts is alleen zinvol wanneer deze behandelconsequenties heeft. Op dit moment is het diagnostisch onderscheid tussen de verschillende subtypes nog onvoldoende uitgekristalliseerd om in de huisartsenpraktijk te gebruiken. Patiënten die bij het doorlopen van het stappenplan onvoldoende astmacontrole houden (met name niet goed op ICS reageren) heeft nadere diagnostiek en fenotypering door een longarts of consultatie van een kaderarts mogelijk meerwaarde.
Conclusie
De meeste patiënten in de 1e lijn hebben allergisch astma. Fenotypering van astma heeft geen meerwaarde in de 1e lijn.
Allergisch astma
Naar Samenvatting ›- Allergisch astma is de meest voorkomende uitingsvorm.
- Allergisch astma begint meestal in de kindertijd en is geassocieerd met een familiair voorkomen en/of atopie: een allergische aanleg door IgE-gemedieerde allergie voor inhalatie- en/of voedselallergenen, zich uitend als constitutioneel eczeem, allergische rinitis of voedselallergie.
- Patiënten reageren gewoonlijk goed op behandeling met inhalatiecorticosteroïden (ICS).
- Adequate behandeling van allergische rinitis is van belang voor het bereiken van goede astmacontrole (zie de NHG-Standaard Allergische rinitis).
Niet-allergisch astma
Naar Samenvatting ›Andere uitingsvormen van astma zijn bijvoorbeeld astma met obesitas en astma dat op de volwassen leeftijd ontstaat (late-onset asthma). Deze laatste vorm is regelmatig niet-allergisch en treedt vaker op na een doorgemaakte luchtweginfectie.
Werkgerelateerde astma
Naar Samenvatting ›Astma kan ontstaan of verergeren door het werken met allergische of niet-allergische prikkels. In sommige gevallen is blijvende expositie de oorzaak van onvoldoende astmacontrole.
Zowel allergisch als niet-allergisch astma kan werkgerelateerd zijn en in combinatie met COPD voorkomen (zie Werk).
Een overzicht van beroepsallergenen en van werknemers die hiermee in aanraking kunnen komen staat in de NVALT-richtlijn werkgerelateerd Astma en de NVAB Richtlijn astma en COPD. Bij de NVAB is meer terug te vinden via de themapagina astma & COPD.
Gelijktijdig astma en COPD
Naar Samenvatting ›- Bij patiënten > 40 jaar is het onderscheid tussen astma en COPD niet altijd goed mogelijk (zie tabel 1) en een patiënt kan tegelijkertijd beide aandoeningen hebben: astma- en COPD-overlap (ACO).
- Rokende patiënten die vanaf hun 40e jaar klachten ontwikkelen kunnen zowel COPD als astma hebben.
| Astma | COPD | |
|---|---|---|
| Belangrijkste risicofactor | Atopie | Roken |
| Luchtwegobstructie | Wisselend, in de regel reversibel | Per definitie deels irreversibel |
| Pathofysiologie | Chronische ontsteking in alle luchtwegen, meestal gevoelig voor corticosteroïden | Chronische ontsteking, met name in de kleine luchtwegen, relatief ongevoelig voor corticosteroïden |
| Uitlokkende factor | Allergische en niet-allergische prikkels | - |
| Leeftijd | Alle leeftijden | Meestal > 40 jaar |
| Beloop | Meestal gunstig met variërende klachten | Overwegend chronisch, geleidelijk progressief |
| Levensverwachting | (Vrijwel) normaal bij optimale behandeling | Verminderd, ook bij optimale behandeling |
| Longfunctie (spirometrie) | Meestal normaal (of met reversibele obstructie) | Blijvend verminderd (irreversibele obstructie) |
Een patiënt kan tegelijkertijd astma en COPD hebben: Astma- en COPD-overlap, afgekort als ACO. De term ACO vervangt de in het verleden gebruikte term ‘astma COPD overlapsyndroom (ACOS)’, omdat het niet om 1 aandoening gaat, maar een beschrijving is van 2 gelijktijdig aanwezige maar in pathofysiologische zin verschillende aandoeningen. Bij astmapatiënten kunnen op middelbare leeftijd, door roken of door een langer bestaande ontsteking die onvoldoende behandeld is, structurele veranderingen ontstaan, waardoor de luchtwegvernauwing naast een reversibele ook een irreversibele component krijgt. Bij ernstig astma is ook met een maximale behandeling, een irreversibele verandering van de luchtwegen niet altijd te voorkomen. Daarnaast kunnen bij oudere patiënten met een voorgeschiedenis van astma irreversibele veranderingen van de luchtwegen zijn ontstaan, omdat inhalatiecorticosteroïden (ICS) voor 1970 nog niet beschikbaar waren.
Verklaringen voor het bestaan van de combinatie astma en COPD zijn gelegen in gemeenschappelijke risicofactoren voor beide aandoeningen (bijvoorbeeld bronchiale hyperreactiviteit en roken), vermindering van longfunctie en incomplete longgroei bij kinderen. Ook (frequente) infecties hebben hier invloed op. Omdat patiënten met ACO veelal geëxcludeerd worden in wetenschappelijk onderzoek, is het optimale behandelbeleid bij deze patiënten niet bekend.
Richtlijnen diagnostiek
Naar Samenvatting ›- Doe onderzoek naar de diagnose astma bij een patiënt die − voor het eerst of na een lange periode zonder medicatie of controles − komt met dyspneuklachten, een piepende ademhaling of > 3 weken bestaande hoestklachten.
- Overweeg astma ook bij minder specifieke klachten, zoals snelle vermoeidheid, kortademigheid bij inspanning of conditievermindering.
- Stel de diagnose astma op grond van een kenmerkende anamnese in combinatie met spirometrische bevindingen.
- Om de diagnose astma te kunnen stellen zijn vaak meerdere consulten nodig.
Anamnese
Naar Samenvatting ›Vraag naar:
- kortademigheid, al dan niet in combinatie met piepen; frequentie, duur (incidenteel, aanvalsgewijs, regelmatig, dagelijks)
- nachtelijke klachten
- hoesten
- aanwijzingen voor allergische prikkels
- Zijn er dyspneuklachten na blootstelling aan een allergeen, zoals:
- aanwijzingen voor een allergische rinitis; is de patiënt vaak ‘verkouden’?
- verergeren de klachten in een stoffige omgeving (huisstofmijt)?
- klachten in voorjaar of zomer (pollen van bomen, grassen, onkruiden)
- klachten bij contact met dieren (katten, honden, knaagdieren, paarden) of
- klachten tijdens werk of hobby’s (tuinder, graanverwerking, werk met dieren) (zie Werkgerelateerde klachten)
- aanwijzingen voor niet-allergische prikkels:
- persisterende klachten na virale luchtweginfecties
- verergering van klachten bij blootstelling aan koude lucht, mist, (tabaks)rook (zie Roken), fijnstof, baklucht, verflucht, parfumluchtjes (zie Werkgerelateerde klachten)
- na lichamelijke inspanning
- aanwijzingen voor een verband met geneesmiddelen zoals acetylsalicylzuur, NSAID’s, (niet-selectieve) orale bètablokkers, parasympathicomimetica en conserveermiddelen in inhalatiemedicatie
- roken:
- huidig of voormalig rookgedrag
- beginleeftijd en aantal jaren dat men gerookt heeft en het gemiddelde aantal sigaretten per dag uitgedrukt in aantal pakjaren (20 sigaretten per dag gedurende een jaar)
- roken door anderen (gezinsleden, huisgenoten, vrienden, collega’s)
- invloed op het dagelijks functioneren , thuis of elders (ziekteverzuim)
- preventieve maatregelen die de patiënt heeft getroffen en het effect daarvan
Voorgeschiedenis
Naar Samenvatting ›Informeer naar:
- de leeftijd waarop de klachten zijn begonnen
- aanwezigheid frequente luchtweginfecties of periodes met hoesten, piepen of door de patiënt gemelde bronchitis
- in het verleden gebruikte medicatie voor de luchtwegen en het effect daarvan
- andere atopische aandoeningen: constitutioneel eczeem of allergische rinitis
- eerder verricht allergologisch onderzoek of longfunctieonderzoek
- astma of andere atopische aandoeningen bij eerstegraadsfamilieleden
Ga bij patiënten die reeds lange tijd luchtwegmedicatie gebruiken na of en hoe de diagnose is gesteld; overweeg bij onvoldoende duidelijkheid over de diagnose hernieuwde diagnostiek.
Bij werkgerelateerde klachten
Naar Samenvatting ›- of de patiënt blootgesteld is aan fijnstof of andere schadelijke stoffen
- of de klachten tijdens werk of bij hobby’s verergeren
- of de klachten invloed hebben op het werk of andersom
- welke aanpassingen de werkgever heeft gedaan
- of de patiënt contact heeft met de bedrijfsarts en zo ja, hoe dat verloopt
Lichamelijk onderzoek
Naar Samenvatting ›- Bij een 1e consult:
- bepaal de mate van dyspneu: let op ademhalingsfrequentie, gebruik van hulpademhalingsspieren en stand van de thorax
- ausculteer de longen: let op de aanwezigheid van een verlengd expirium en/of expiratoir piepen
- bepaal de hartfrequentie
- overweeg bij aanwezige dyspneu saturatiebepaling
- Het lichamelijk onderzoek bij diagnostische vervolgconsulten is afhankelijk van de klachten.
Een tonvormige thorax, hypersonore percussie beiderzijds en laagstaande (< Th11) en weinig beweeglijke longgrenzen (< 2 vingers) zijn aanwijzingen voor hyperinflatie zoals die voorkomt bij ernstig astma of emfyseem. Deze zijn echter weinig betrouwbaar vast te stellen. Percussie maakt geen deel uit van het standaard lichamelijk onderzoek; het heeft bij de diagnostiek van astma in sommige gevallen meerwaarde bij het onderscheid met COPD of differentiaaldiagnostische overwegingen (pneumothorax).
Auscultatie
Een verlengd expirium is een expirium dat minstens even lang is als het inspirium bij een normale, niet-geforceerde ademhaling. Rhonchi zijn bijgeruisen met een continu karakter. Ze worden onderscheiden in hoog- (fluitende, piepende) en laagfrequente (brommende) rhonchi. Bij een (piepend) verlengd expirium (eventueel tijdens geforceerde uitademing) is in het algemeen wel differentiatie mogelijk tussen astma en COPD enerzijds en andere luchtwegklachten anderzijds, maar niet tussen astma en COPD. Bij hartfalen zijn soms ook rhonchi aanwezig door vocht dat van extern de bronchi dicht drukt. Normale bevindingen bij lichamelijk onderzoek sluiten astma geenszins uit.
Normaalwaarden ademfrequentie en hartfrequentie
Normaalwaarden van de adem- en hartfrequentie bij volwassenen zijn 15 tot 20 respectievelijk 60 tot 100/min. In de GINA-richtlijn hanteert men als grenswaarden voor een ernstige longaanval een ademhalingsfrequentie > 30 en een hartfrequentie > 120/min. In deze versie van de standaard worden, in navolging van de NHG-Behandelrichtlijn Geneesmiddelen en zuurstof in spoedeisende situaties, geen grenswaarden voor de adem- of hartfrequentie genoemd, omdat deze sterk afhankelijk zijn van de context, het bij de bepaling van de mate van dyspneu om een continuüm gaat en omdat het vooral gaat om de ademarbeid.
Saturatiemeting
Met de zuurstofsaturatiemeter (pulsoximeter) kan aan de vinger transcutaan de zuurstofverzadiging in het bloed worden gemeten.
Over een afkappunt voor hypoxie bestaat echter nog geen consensus. In een onderzoek bij patiënten met een longaanval COPD was het optimale afkappunt voor hypoxie (arteriële PaO2 ≤ 60 mmHg) een perifere zuurstofsaturatie (SpO2) van 92% (100% sensitiviteit, 86% specificiteit).
Perifere saturatiemeting is minder betrouwbaar of soms onmogelijk bij een SpO2 < 80%, vooral bij een donker gepigmenteerde huid, slechte doorbloeding door hypotensie of een koude omgeving, hartfalen of aritmie en ten slotte bij nagellak, kunstnagels en vuil.
Saturatiemeting toont geen astma aan en is evenmin geschikt om het uit te sluiten en heeft daarom strikt genomen geen plaats bij de diagnostiek van astma. Saturatiebepaling is daarentegen informatief om de ernst van aanwezige dyspneuklachten te objectiveren. Consumentensaturatiemeters zijn lang niet altijd betrouwbaar.
Allergieonderzoek
Naar Samenvatting ›- Verricht bij patiënten met (aanwijzingen voor) astma een screeningstest op inhalatieallergenen in het bloed als aanwijzingen voor allergische oorzaken anamnestisch onduidelijk zijn.
- Een positieve test zonder anamnestische aanwijzingen voor een allergie wijst op sensibilisering, maar van een klinisch relevante allergie is dan geen sprake.
- Het doel van een screeningstest is nog niet eerder onderkende allergieën te vinden.
- Houd er rekening mee dat de screeningstest zowel vals-negatief als vals-positief kan zijn.
- Bij een positieve screeningstest bepaalt het laboratorium vaak automatisch het allergeenspecifieke IgE van de meest voorkomende inhalatieallergenen (huisstofmijt, gras-, boom- en kruidpollen, honden- en kattenepitheel, en schimmels).
- Overweeg bij aanwijzingen voor een andere allergie, bijvoorbeeld cavia, konijn, paard of vogels, het dienovereenkomstige allergeenspecifieke IgE gericht na te bepalen.
- Verricht een screeningstest bij patiënten met onvoldoende astmacontrole ondanks medicatie. Een screeningstest is daarmee altijd geïndiceerd vóór verwijzing naar een longarts.
- Adviseer prikkelbeperkende maatregelen bij een positieve test die overeenstemt met anamnestische aanwijzingen voor de bijpassende allergie (zie Niet-medicamenteus beleid).
- Onderzoek naar sensibilisatie van voedselallergenen heeft geen toegevoegde waarde (zie NHG-Standaard Voedselovergevoeligheid).
- Overweeg herhaling van ouder allergieonderzoek na meerdere jaren omdat allergieën in de loop van de tijd kunnen ontstaan of verdwijnen.
Screenend allergieonderzoek dient vooral om niet eerder ontdekte, of niet-onderkende allergieën op te sporen, zoals allergie voor huisdieren of huisstof. Omdat een allergietest fout-positief of fout-negatief kan zijn (beide ongeveer 10%) is de anamnese leidend voor de behandeling, al geeft ook de anamnese niet altijd uitsluitsel. Een allergieonderzoek is daarom niet bij alle patiënten geïndiceerd. Bij een duidelijke anamnestische allergie heeft allergieonderzoek geen toegevoegde waarde. In sommige gevallen is een (geobjectiveerd) allergieonderzoek van waarde om niet-medicamenteuze prikkelbeperkende (de zogenoemde ‘TIP’) maatregelen te adviseren. Omgekeerd kan een allergieonderzoek er soms toe bijdragen patiënten te motiveren om te stoppen met allergiemedicatie waarvan de indicatie niet voldoende duidelijk is.
Bij patiënten met blijvend onvoldoende astmacontrole is aanbevolen, vóór verwijzing naar een longarts, de allergie goed in kaart te brengen. Hierbij is ook een allergieonderzoek geïndiceerd. Adviseer prikkelbeperkende maatregelen bij een positieve test die overeenstemt met de anamnestische aanwijzingen (zie Niet-medicamenteus beleid).
Omdat allergieën in de loop van de tijd kunnen ontstaan of verdwijnen, valt herhaling van (ouder) allergieonderzoek na meerdere jaren te overwegen.
Neem bij de beslissing of een allergietest moet worden aangevraagd ook de kosten in overweging. De test is kostbaar en valt onder het eigen risico (zie LESA Laboratoriumdiagnostiek). Het tarief voor een inhalatiescreening is € 17 (in 2020), maar de kosten (vaak voor eigen risico van de patiënt) kunnen gemakkelijk verachtvoudigen bij een positieve screeningstest, omdat wordt doorgetest per allergeen (€ 12-13 per allergeen, bij 11 allergenen in totaal € 155). Bij volwassenen is de rol van voedingsstoffen (voedselallergie) als uitlokkende prikkel ongebruikelijk. Een voedselallergie dient in dubbelblinde provocatie te worden vastgesteld (zie NHG-Standaard Voedselovergevoeligheid).
Spirometrie
Naar Samenvatting ›- Verricht bij vermoeden van astma spirometrie; bij voorkeur ten tijde van klachten (zie tabel 2).
- Het doel van spirometrie is aanwijzingen voor restrictie na te gaan, obstructie aan te tonen, de ernst van de obstructie te bepalen en de mate van reversibiliteit.
- Spirometrie is ook geïndiceerd in de monitoringsfase om onopgemerkte obstructie te signaleren en na te gaan of deze reversibel is (zie Monitoring).
- Bepaal de FEV1/FVC-ratio om een luchtwegobstructie vast te stellen.
- Bepaal de FEV1 voor en na gestandaardiseerde bronchusverwijding om vast te stellen of de longfunctieafwijkingen reversibel zijn.
- Normale of licht afwijkende spirometrie sluit astma niet uit. Herhaal het diagnostisch spirometrisch onderzoek bij de volgende indicaties:
- Bij een blijvend vermoeden van astma: kort na het werk, ’s ochtends vroeg of na inspanning.
- Bij licht verlaagde waarden van de FEV1/FVC-ratio na bronchusverwijding of bij diagnostische twijfel tussen astma en COPD. Indien mogelijk ten tijde van klachten, anders na 4 tot 12 weken.
- Bij herdiagnostiek vanwege twijfel aan een in het verleden vastgestelde diagnose: staak ICS ten minste 6 weken voorafgaand aan de spirometrie. Als staken leidt tot toename van klachten: verricht spirometrie op korte termijn (< 2-3 dagen).
Een gouden standaard voor de diagnose astma ontbreekt. Een zinvol onderzoek bij de diagnostiek van astma is spirometrie. Met spirometrie kunnen differentieeldiagnostische aanwijzingen voor restrictie worden nagegaan, kan obstructie worden aangetoond en de ernst ervan worden bepaald. Bij de obstructie is het mogelijk de aanwezigheid en de mate van reversibiliteit te meten.
De diagnose astma wordt gesteld op basis van anamnese en spirometrisch aangetoonde reversibiliteit (FEV1-toename ten opzichte van de waarde vóór bronchusverwijding met ≥ 12% én ≥ 200 ml variabiliteit; FEV1-verschil ≥ 12% én ≥ 200 ml tussen 2 metingen na ≥ 4 weken, ‘beste versus slechtste’) (zie Diagnostische criteria astma).
In veel huisartsenpraktijken bestaat de mogelijkheid spirometrie te verrichten; ook zijn er eerstelijns diagnostische centra die deze mogelijkheid bieden. Aan het verrichten van spirometrie in eigen beheer zijn randvoorwaarden verbonden.
Randvoorwaarden spirometrie
Naar Samenvatting ›- Kies voor spirometrie in de eigen praktijk of in een diagnostisch centrum of longfunctielaboratorium.
- Overweeg zo nodig (tele)consultatie over de interpretatie van de uitslagen van de kaderhuisarts of longarts, of een diagnostische verwijzing naar een longarts, met het verzoek om terugverwijzing.
- Het gebruik en onderhoud van spirometers en de uitvoering van het spirometrisch onderzoek vereisen deskundigheid en een aantal kwaliteitsvoorzorgen (zie Protocollaire Astma/COPD-Zorg van het NHG).
- Gebruik in de diagnostische fase geen enkelvoudige (hand-)FEV1-meters waarmee geen flowvolumecurve kan worden geproduceerd.
Richtlijnen en randvoorwaarden voor spirometrisch onderzoek in de huisartsenpraktijk zijn te vinden op de website van de CAHAG. In eerstelijns diagnostische centra wordt spirometrie uitgevoerd volgens de SAN praktijkrichtlijn longfunctieonderzoek. Bij de uitvoering van spirometrie moet worden voldaan aan de eisen van de American Thoracic Society (ATS) en de European Respiratory Society (ERS). De door de patiënt geblazen waarde wordt vergeleken met referentiewaarden (= voorspelde waarden), die ontleend zijn aan gezonde, niet-rokende populaties. Voor certificering van spirometrie in de 1e lijn is de CASPIR-cursus of gelijkwaardig vereist.
In een validatieonderzoek van spirometers in de huisartsenpraktijk was de gemiddelde afwijking van de FEV1 ten opzichte van de gestandaardiseerde waarde uit een computergestuurde ijkspuit 25 ml (95%-BI 12 tot 39 ml) en van de FVC 27 ml (95%-BI 10 tot 45 ml). Gemiddeld genomen is er een lichte overschatting van de FEV1 en FVC. De auteurs geven aan dat praktijken meer aandacht zouden moeten besteden aan kalibratie van de apparatuur (volgens gebruiksaanwijzing).
Referentiewaarden spirometrie
Naar Samenvatting ›- Interpreteer spirometrische parameters zoals FEV1, FVC en FEV1/FVC-ratio op basis van referentiewaarden (voorspelde waarden).
- Zie voor het beleid bij aanwijzingen voor restrictie de NHG-Standaard COPD.
| Gebruik eigen luchtwegmedicatie | Procedure | Interpretatie |
|---|---|---|
|
Gebruik voor de test geen kort (4 uur) of langwerkende (24 uur) luchtwegverwijder Bij herdiagnostiek:
|
|
Reversibiliteit/variabiliteit FEV1-toename ten opzichte van de waarde vóór bronchusverwijding met ≥ 12% én ≥ 200 ml of toe- of afname bij herhaalde meting na ten minste 4 weken (variabiliteit) wijst op astma (ook bij een normale FEV1/FVC-ratio), maar sluit COPD niet uit. Geen persisterende obstructie Normale FEV1/FVC-ratio (≥ 5e percentiel) na bronchusverwijding sluit COPD uit maar astma niet. Persisterende obstructie Afwijkende FEV1/FVC-ratio (< 5e percentiel) kan wijzen op nog onvoldoende behandeld astma maar ook een aanwijzing zijn voor COPD. |
In 2014 is in overleg met andere betrokken Nederlandse beroepsorganisaties besloten de voorspelde waarden van de European Community for Steel and Coal (ECSC 1983) te vervangen door actuelere voorspelde waarden van het Global Lung Function Initiative (GLI 2012), zoals ook de European Respiratory Society adviseert.
Referentiewaarden 2012
In 2012 heeft de Task Force Global Lung Function Initiative van de European Respiratory Society nieuwe voor geslacht, leeftijd, lengte en herkomst gestratificeerde voorspelde waarden opgesteld op basis van gepoolde onderzoeksgegevens van 72 centra in 33 landen (ruim 74.000 gezonde niet-rokers, van wie 55,3% vrouwen, leeftijd 3 tot 95 jaar). De European Respiratory Society (ERS) en de American Thoracic Society (ATS) en diverse andere organisaties ondersteunen de toepassing van de GLI 2012 voorspelde waarden.
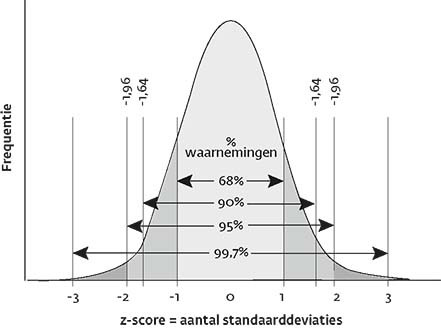
Z-score
De GLI-groep 2012 adviseert bij patiënten met klachten passend bij astma of COPD een z-score < −1,64 te gebruiken om normaal van afwijkend te onderscheiden. Een z-score < −1,64 definieert de onderste 5% (5e percentiel) van een normaal verdeelde parameter, zoals de FEV1 of FEV1/FVC-ratio in een bepaalde populatie. Zie ook figuur 1.
Histamine- of metacholineprovocatietest
Naar Samenvatting ›- Overweeg bij blijvende onzekerheid over de diagnose astma (klachten zonder aangetoonde reversibele of variabele luchtwegobstructie) een histamine- of metacholineprovocatietest. Afhankelijk van regionale afspraken in eigen beheer bij een eerstelijns diagnostische centrum of via een diagnostische consultatie van de longarts.
- Een normale histamine- of metacholineprovocatietest sluit astma vrijwel uit.
Cockcroft et al. onderzochten in een steekproef van 500 studenten (20 tot 29 jaar, blank, Canada) de sensitiviteit en specificiteit van de histamineprovocatietest voor astma en allergische rinitis. Van deze 500 patiënten waren er 52 bekend met astma, van wie er 17 op dat moment astmaklachten hadden. Bij 48% van de personen bekend met astma was de histamineprovocatietest positief, en dat was bij alle 17 patiënten met astmaklachten het geval. Bij 4,5% van de studenten zonder astma of allergische rinitis in de voorgeschiedenis was de histamineprovocatietest positief. De sensitiviteit was 100%, de specificiteit was 93%. Zie ook Diagnostische criteria astma.
X-thorax
Naar Samenvatting ›Een X-thorax is alleen geïndiceerd (op juiste indicatie) als oorzaken voor de benauwdheidsklachten anders dan astma worden overwogen, zoals bij aanwijzingen voor bronchuscarcinoom.
Bepaling van eosinofielen in het bloed
Naar Samenvatting ›We bevelen bepaling van eosinofielen in het bloed niet aan.
In een aantal publicaties is de meerwaarde van eosinofielenbepaling (bepaling van het aantal eosinofiele granulocyten in het bloed, uitgedrukt in miljard per liter) in de huisartsenpraktijk bij de diagnostiek van astma nagegaan. Met eosinofielenbepaling zou op theoretische gronden een onderscheid gemaakt kunnen worden tussen steroïdegevoelig en niet-steroïdegevoelig en daarmee de indicatie voor inhalatiecorticosteroïden, de ernst van het astma en het risico op longaanvallen. Er zijn echter mensen met allergisch astma bij wie deze waarde in het bloed niet aantoonbaar hoger is. In de literatuur is nagegaan of de eosinofielenbepaling in het bloed bruikbaar is in de huisartsenpraktijk.
Sputum
De ontstekingsreactie die wordt gezien bij astmapatiënten heeft zowel kenmerken van een acute IgE-mestcelgedreven-type-1-reactie als van een chronische T-helpercel-type-2-gemedieerde inflammatoire respons, waarbij vooral eosinofiele granulocyten zijn betrokken. Het percentage eosinofielen in actief opgewekt (geïnduceerd door inhaleren van een zoutoplossing) sputum wordt gezien als een maat voor de ontstekingsactiviteit. Definities van eosinofiel astma houden als afkapwaarde een percentage eosinofielen in het sputum tussen de 1 en 3% aan. In verschillende onderzoeken werd een verhoogd aantal eosinofielen in sputum gevonden bij patiënten met ernstig astma. Het normaliseren van deze verhoogde waarden zou opnamen en longaanvallen kunnen voorkomen.
Bloed
Testeigenschappen eosinofielen in perifeer bloed voor eosinofielen sputumwaarden
In een Nederlands cohort van 110 patiënten met matig tot ernstig astma werden eosinofielen in sputum vergeleken met eosinofielen in perifeer bloed. Het sputum werd geproduceerd na inhalatie van hypertoon zout en salbutamol. De resultaten van het onderzoek werden vervolgens in een replicatiecohort (n = 37) herhaald. De sensitiviteit van eosinofielen in het bloed ten opzichte van sputum was 86% bij een afkapwaarde van 0,22 x 109/l, de specificiteit was 79%. Bij een hogere afkapwaarde (0,7 x 109) daalde de sensitiviteit naar 78% en steeg de specificiteit naar 91% .
Relatie concentratie eosinofiele granulocyten in het bloed en ernst van astma
In een retrospectief databaseonderzoek werden 1144 patiënten bij wie in het jaar na de astmadiagnose ten minste een keer eosinofielen in het bloed waren bepaald, op grond van medicatiegebruik ingedeeld in licht (40%) of matig tot ernstig (60%). Eosinofielwaarden die bepaald werden tijdens systemisch corticosteroïdgebruik, werden geëxcludeerd.
Onder patiënten met matig tot ernstig astma had 24% verhoogde eosinofielen (> 400/ul) tegenover 19% in de groep met licht astma (p = 0,053). Logistische regressie toonde een grotere kans op een verhoogd aantal eosinofielen in de groep patiënten met matig tot ernstig astma (OR 1,38; 95%-BI 1,02 tot 1,86).
Voorspellen eosinofielwaarden in het bloed astma longaanvallen?
In een retrospectief database onderzoek in de 1e lijn werden de patiëntengegevens van 130.547 astmapatiënten in het Vereniging Koninkrijk nagegaan 1 jaar vóór en 1 jaar na de laatste eosinofielenbepaling. Bij een verhoogde hoeveelheid eosinofielen (> 400/ul) was het risico op ≥ 2 longaanvallen (incidentie 7%) groter (OR 1,48; 95%-BI 1,39 tot 1,58).
Conclusie
Er lijkt enig verband tussen de hoeveelheid eosinofielen in het bloed en sputum en de ernst van astma en het risico op longaanvallen.
Overwegingen
Eosinofielenbepaling heeft momenteel in de 2e lijn een plaats bij indicatiestelling voor derdelijns behandeling van ernstig astma (zie Behandelmogelijkheden in de 2e en 3e lijn bij ernstig astma). Eosinofielenbepaling in de huisartsenpraktijk is eenvoudig uitvoerbaar en kan mogelijk nuttig blijken bij het onderscheid steroïdegevoelig en niet-steroïdegevoelig astma en daarmee de indicatie voor ICS. Er is echter beperkt onderzoek naar de meerwaarde van eosinofielenmeting in de huisartsenpraktijk en een prospectieve studie naar diagnostische of gezondheidswinst is nog niet gedaan. Op dit moment heeft het bepalen van de hoeveelheid eosinofielen nog geen meerwaarde voor diagnose of behandeling in de huisartsenpraktijk.
Fractitional expiratory stikstofoxide (FeNO)-meting
Naar Samenvatting ›We bevelen bepaling van het stikstofoxide in de uitgeademde lucht (FeNO) om de mate van astmacontrole te monitoren en de behandeling van astma op te baseren niet aan.
Voor- en nadelen
Behandeling gebaseerd op de FeNO vermindert waarschijnlijk het risico op een longaanval, maar het is niet zeker of de klachten en symptomen verminderen. Bijwerkingen werden niet gerapporteerd, maar zijn niet te verwachten. De interpretatie kan lastig zijn: er zijn veel beïnvloedende factoren, zoals roken (verlaagt FeNO) en een bovensteluchtweginfectie (verhoogt FeNO).
Kwaliteit van bewijs
De kwaliteit van bewijs varieerde van zeer laag tot redelijk (zie GRADE-tabel in de Totstandkoming).
Waarden en voorkeuren van patiënten
De meeste patiënten zullen de onzekerheid over de voordelen op klachten en symptomen van de FeNO-meting veel belangrijker achten dan de mogelijke nadelen, zoals de belasting van een extra onderzoek. De meting zelf is vrijwel niet belastend.
Kosten
De aanschaf van een FeNO-meter gaat gepaard met eenmalige kosten. De kosten van een FeNO-meting liggen rond de € 8-12 per meting, afhankelijk van intensiteit van gebruik (bij frequent gebruik zijn de kosten relatief lager).
Aanvaardbaarheid en haalbaarheid
Huisartsen zijn niet bekend met het gebruik en interpretatie van de FeNO-meting. Implementatie zou gepaard gaan met scholing en instructie. De aanvaardbaarheid wordt redelijk geschat.
Beleid in de 2e lijn
De FeNO-bepaling heeft een plaats in de fenotypering van astma in de 2e lijn als voorspeller van eosinofiele inflammatie en respons op ICS. Een lage FeNO wordt echter onvoldoende geacht om het starten van ICS achterwege te laten. Dit geldt ook voor patiënten die nooit eerder ICS gebruikt hebben. In de 2e lijn wordt de FeNO-meting niet gebruikt voor monitoring van astma (zie Behandelmogelijkheden in de 2e en 3e lijn bij ernstig astma).
Achtergrond
Het gehalte stikstofoxide in de uitgeademde lucht (FeNO) is een niet-invasieve ontstekingsmarker die van waarde zou zijn om de astmacontrole te monitoren en waarop behandeling kan worden gebaseerd. De hoogte van het FeNO wordt door een aantal factoren beïnvloed, zoals allergische rinitis, eczeem en roken. Dit detail beschrijft de waarde van de FeNO-bepaling als beleidsbepalende interventie voor de huisarts.
Uitgangsvraag
Is de FeNO-meting aan te bevelen om het beleid mede te baseren bij astmapatiënten in de huisartsenpraktijk?
Uitkomstmaten
- Longaanvallen (cruciaal)
- Klachten/symptomen (cruciaal)
- ICS-gebruik (cruciaal)
- Astmagerelateerde kwaliteit van leven (cruciaal)
- Longfunctie (FEV1) (belangrijk)
Om deze vraag te beantwoorden werd in een literatuuronderzoek een cochranereview van goede kwaliteit geïncludeerd waarin de waarde van de FeNO-meting voor het beleid bij astma werd vergeleken met strategieën zonder FeNO-meting.
Resultaten
Beschrijving onderzoek
De cochranereview includeerde 7 RCT’s met in totaal 1700 patiënten. Patiënten waren gemiddeld tussen de 28 en 54 jaar oud, de diagnose astma werd op uiteenlopende wijze gesteld, alle patiënten gebruikten medicatie. In de interventiegroepen werd het beleid (meestal het medicamenteus beleid) gebaseerd op een FeNO-meting, waarbij de afkapwaarden tussen de onderzoeken verschilden. In de controlegroep werd het beleid gebaseerd op klachten en symptomen, lichamelijk onderzoek, spirometrie en medicatiegebruik (1 onderzoek); de Asthma Control Test (2 onderzoeken); of richtlijnen (4 onderzoeken). Uitkomsten waren longaanvallen (aantal per jaar, blijkend uit orale corticosteroïdkuren of ziekenhuisopname), longfunctie, astmacontrole en astmagerelateerde kwaliteit van leven en ICS-gebruik aan het eind van het onderzoek. De onderzoeksperiode liep van 4 tot 12 maanden. De definities van een longaanval verschilden.
Kwaliteit van bewijs
Voor de uitkomsten ≥ 1 longaanval tijdens onderzoeksperiode, aantal longaanvallen per jaar en corticosteroïdgebruik aan het eind van de onderzoeksperiode waardeerden de reviewers met 1 niveau af vanwege risico op vertekening (gebrek aan blindering, selectiebias).
Voor de uitkomst corticosteroïdgebruik aan het eind van de onderzoeksperiode werd ook 1 niveau afgewaardeerd vanwege heterogeniteit (doseringen liepen sterk uiteen, I2 = 82%) en vanwege imprecisie (eveneens 1 niveau).
Een aantal maar niet alle geïncludeerde onderzoeken vonden (deels) plaats in de 1e lijn. De werkgroep waardeerde het bewijs hier niet verder voor af (indirect bewijs), behalve bij longaanvallen waarvoor ziekenhuisopname nodig was; het enige onderzoek waarin dit voorkwam was uitsluitend uitgevoerd bij zwangere vrouwen.
Zie voor een verdere toelichting van redenen om af te waarderen het GRADE-evidence profiel.
Effectiviteit (zie evidence-profiel in de Totstandkoming)
Longaanvallen
- ≥ 1 longaanvallen tijdens onderzoeksperiode 5 RCT’s; n = 1005; OR 0,60 (95%-BI 0,43 tot 0,84); redelijke kwaliteit
- aantal longaanvallen per jaar: 5 RCT’s, n = 842; RR 0,59 (95%-BI 0,45 tot 0,77); redelijke kwaliteit
- longaanvallen: orale corticosteroïden; 3 RCT’s; n = 495; OR 0,86 (95%-BI 0,50 tot 1,48); lage kwaliteit
- longaanvallen waarvoor ziekenhuisopname: 3 RCT’s; n = 488; OR 0,14 (95%-BI 0,01 tot 2,67); lage kwaliteit
Klachten/symptomen
Astmacontrole (Asthma Control Test): 4 RCT’s; n = 707; MD -0,08 (95%-BI -0,18 tot 0,01); redelijke kwaliteit (minimal important clinical difference (MCID) = 3 punten).
Medicatiegebruik
Corticosteroïdgebruik aan het eind van het onderzoek: 4 RCT’s; n = 582; MD -147,15 (95%-BI -380,85 tot 86,56); zeer lage kwaliteit
Astmagerelateerde kwaliteit van leven
AQLQ: 2 RCT’s; n = niet vermeld; MD 0,00 (95%-BI -0,10 tot 0,10), redelijke kwaliteit
Longfunctie
- Longfunctie (FEV1): 4 RCT’s; n = 802; MD 0,11 (95%-BI -1,15 tot 1,37); redelijke kwaliteit.
- FeNO aan het eind van het onderzoek: 5 RCT’s; n = 668; SMD -0,00 (95%-BI -0,16 tot 0,15) (niet GRADE-profiel).
Bijwerkingen
Er werden geen bijwerkingen gerapporteerd.
Conclusies
- Behandeling van astma gebaseerd op de FeNO-meting vermindert waarschijnlijk het risico op een longaanval ten opzichte van behandeling op basis van klachten en symptomen (redelijke kwaliteit van bewijs).
- Het is zeer onzeker of door behandeling van astma gebaseerd op de FeNO het ICS-gebruik afneemt (zeer lage kwaliteit van bewijs).
- Het is waarschijnlijk dat behandeling van astma gebaseerd op de FeNO geen effect heeft op klachten en symptomen en astmagerelateerde kwaliteit van leven en longfunctie (redelijke kwaliteit van bewijs).
Evaluatie
Naar Samenvatting ›- Stel de diagnose astma bij patiënten met aanvalsgewijze dyspneu, expiratoir piepen of hoesten.
- Voor de diagnose is ook een van de volgende bevindingen vereist:
- spirometrisch aangetoonde reversibiliteit (FEV1-toename ten opzichte van de waarde vóór bronchusverwijding met ≥ 12% én ≥ 200 ml) tijdens klachten óf
- spirometrisch aangetoonde variabiliteit ( FEV1-verschil ≥ 12% én ≥ 200 ml tussen 2 metingen na ≥ 4 weken, ‘beste versus slechtste’) óf
- bronchiale hyperreactiviteit op basis van een positieve histamine- of metacholineprovocatietest
- Een normale longfunctie sluit astma niet uit. Overweeg bij blijvende onzekerheid een histamine- of metacholineprovocatietest (zie Aanvullend onderzoek).
- Astma is onwaarschijnlijk als ten tijde van dyspneuklachten bij spirometrie geen obstructie en reversibiliteit aanwezig zijn.
- Stel de diagnose astma naast COPD (ACO (zie Begrippen) bij patiënten > 40 jaar
- met een anamnestisch vermoeden van astma én
- tabaksrookexpositie of andere expositie én
- herhaaldelijk vastgestelde reversibiliteit in combinatie met een persisterende obstructie in de zin van afwijkende FEV1/FVC-ratio na gestandaardiseerde bronchusverwijding.
In vorige versies van deze NHG-Standaard kon de diagnose onder meer op uitsluitend anamnestische gronden worden gesteld bij patiënten die periodiek klachten hebben van dyspneu en expiratoir piepen al dan niet met hoesten. Reversibiliteit na bronchusverwijding bij spirometrie diende ter ondersteuning van de diagnose. Dit 'ondersteunen' gaf aanleiding tot onduidelijkheid over de meerwaarde in de diagnostische fase en er was zorg over mogelijke overdiagnose bij gebruik van uitsluitend anamnestische criteria (zie Epidemiologie).
Diagnostisch algoritme met spirometrie en histamine/metacholineprovocatietest
In een onderzoek onder 499 patiënten bij wie de diagnose astma door een arts was gesteld (patient reported) werd gevonden dat deze diagnose in > 90% van de gevallen met behulp van spirometrie met reversibiliteitsmeting en eventueel een histamine/metacholinetest kon worden bevestigd of uitgesloten. Bij 46 (9%) bleek een uitgebreider assessment nodig.
In een Nederlands onderzoek onder 659 verwezen patiënten bij wie de huisarts in 97% astma vermoedde, werden in een astma-adviespolikliniek anamnese afgenomen en lichamelijk onderzoek en een histamineprovocatietest verricht. Bij 52% (n = 340) werd de diagnose astma uitgesloten en bij 42% (n = 275) werd de diagnose astma bevestigd.
GINA 2019
Volgens de GINA-richtlijn wordt de diagnose astma gesteld op grond van (1) een typische anamnese en (2) excessieve variabiliteit in longfunctie geobjectiveerd met 1 van de volgende tests:
- spirometrie met reversibiliteitsmeting
- peak-flow-variabliteit gedurende 2 weken
- verbeterde Fev1 na 4 weken behandeling inhalatie- of orale corticosteroïden
- variabiliteit in Fev1 tussen 2 spirometrieën
- inspanningstest
- metacholine/histaminetest
Conclusie
Bij een groot deel van de patiënten bij wie door een arts de diagnose astma is gesteld, blijkt deze diagnose aan de hand van spirometrie en histamineprovocatietest niet te kunnen worden bevestigd. Dit ondersteunt het betrekken van spirometrie en bij twijfel een histamineprovocatietest in de diagnostiek .
Overwegingen
In deze versie van de NHG-Standaard Astma heeft de werkgroep besloten tot aanscherping van de diagnostische criteria om onder- en overdiagnose en daarmee gepaard gaande onder- of overbehandeling te voorkomen. De diagnose wordt daarom conform internationale richtlijnen gesteld op grond van een kenmerkende anamnese in combinatie met spirometrische variabiliteit, dat wil zeggen reversibiliteit na een bèta-2-mimeticum of bij een FEV1-verschil van 12% en 200 ml tussen 2 metingen. Met deze aanpak is de diagnose astma in de 1e lijn bij een groot deel van de patiënten te stellen of uit te sluiten. Bij deze overwegingen is de nieuwe mogelijkheid om stap 1 over te slaan en als stap 2 formoterol-ICS zo nodig te geven meegewogen. Aanscherping is nodig om onnodig laagdrempelig gebruik van (kostbare) geneesmiddelen met mogelijke bijwerkingen te voorkomen. Van belang is te benadrukken dat een typische anamnese een obligaat diagnostisch criterium blijft. De diagnose is echter niet meer op anamnestische gronden alléén te stellen. Evenals in de vorige versie van deze NHG-Standaard is een metacholine- of histamineprovocatietest aangewezen bij blijvende diagnostische onduidelijkheid (kenmerkende anamnese met normale spirometrieën). Bij een normale histamine- of metacholineprovocatietest is de diagnose astma onwaarschijnlijk. Deze test is tegenwoordig ook in sommige eerstelijns laboratoria beschikbaar.
Differentiaaldiagnose
Naar Samenvatting ›- Er zijn veel andere oorzaken van dyspneuklachten, zoals:
- pneumonie
- longembolieën
- hartfalen
- angststoornis
- disfunctionele ademhaling
- obesitas
- neuromusculaire aandoeningen
- Inspanningsgebonden dyspneu kan veroorzaakt worden door onvoldoende astmacontrole, maar ook door een slechte conditie, bewegingsarmoede, hartfalen of overgewicht/obesitas.
- Inspanningsgebonden dyspneu bij (top)sporters zonder voorgeschiedenis van of aanwijzingen voor astma of atopie is meestal niet het gevolg van astma (zie Overmatig SABA-gebruik).
- Als geen duidelijke astmadiagnose kan worden gesteld (bijvoorbeeld bij dyspneuklachten door recidiverende respiratoire infecties): codeer prikkelbare luchtwegen (R29.02).
Richtlijnen beleid
Naar Samenvatting ›Behandeldoel
Naar Samenvatting ›- Het doel van de behandeling is:
- goede astmacontrole: het minimaliseren van klachten, het risico op longaanvallen, beperking in functioneren, persisterende luchtwegobstructie, mortaliteit en bijwerkingen van medicatie
- het bereiken van goede astmacontrole, afgestemd op de persoonlijke behandeldoelen (zie Begrippen) van de patiënt
- De door de patiënt ervaren klachten en de manier waarop de patiënt hiermee omgaat staan bij de behandeling centraal.
- Goede astmacontrole is niet altijd haalbaar. Maak bij blijvend onvoldoende astmacontrole afspraken over haalbare (persoonlijke) behandeldoelen.
Astmacontrole
Naar Samenvatting ›- Bepaal als de diagnose astma is gesteld bij ieder vervolgconsult de mate van astmacontrole.
- Gebruik hiervoor een vragenlijst zoals ACQ6 (Asthma Control Questionnaire, 6 items; range 0-6, afwijkend bij score ≥ 0,75) of ACT (Asthma Control Test, 5 items; range 5-25; afwijkend bij score < 20); zie ook screeningsinstrumenten CAHAG.
Astmacontrole: 2 of 3 niveaus
In de GINA-richtlijn wordt de mate van astmacontrole ingedeeld in drie niveaus: ‘controlled’, ‘partly controlled’ en ‘uncontrolled’. In de Nederlandse situatie was er aanvankelijk consensus over de termen goede, gedeeltelijke en slechte astmacontrole. Deze indeling is dus overgenomen in de Zorgstandaard astma voor volwassenen. In de huisartsenpraktijk gaf deze driedeling echter verwarring, omdat het beleid tussen gedeeltelijke en slechte astmacontrole niet verschilde. De werkgroep is daarom van mening dat de driedeling in goede, gedeeltelijk en slechte controle moet worden vervangen door de tweedeling goede en onvoldoende controle. De mate van controle wordt beoordeeld aan de hand van een vragenlijst (ACQ6 of ACT). Deze maken vaak al deel uit van de ketenzorg.
Perceptie van astmacontrole
Er blijkt een relevante discrepantie tussen perceptie van de astmacontrole versus de controle gemeten met de ACQ. In een onderzoek in 11 landen (waaronder Nederland) met 3415 patiënten, van wie 77 geïncludeerd door de huisarts, bleek 55% de astmacontrole als redelijk goed te scoren, terwijl de ACQ (> 1,5) wees op onvoldoende astmacontrole. Dit kan ten dele het gevolg zijn van adaptatie: de patiënt is geleidelijk gewend geraakt aan luchtwegklachten en beschouwt deze niet als afwijkend (nachtelijk hoesten, kortademigheid bij inspanning, beperkte actieradius).
Longaanval of exacerbatie
De term longaanval heeft bij veel betrokkenen bij de zorg rondom astma en COPD de voorkeur gekregen in plaats van de oude benaming exacerbatie. In de Zorgstandaard COPD van de Longalliantie Nederland (LAN) wordt de term longaanval gehanteerd, evenals in andere richtlijnen. De werkgroep geeft hier ook de voorkeur aan, omdat longaanval in de communicatie met patiënten beter begrepen wordt. Bovendien kan deze term voor zowel astma als COPD gebruikt worden.
Bereiken goede astmacontrole
Bateman et al. onderzochten in een door de farmaceutische industrie gesponsord onderzoek de mogelijkheid om bij astmapatiënten goede astmacontrole te bereiken met fluticason of een combinatie van fluticason en salmeterol. Het streven was hierbij volledig dan wel goed gecontroleerd astma te behalen (‘totally controlled’ versus ‘well-controlled’ astma). Volledige controle na een jaar werd bereikt bij 28% van de gebruikers van fluticason en bij 41% van de gebruikers van fluticason in combinatie met salmeterol. Het percentage patiënten met ‘well-controlled’ astma na een jaar was 59% respectievelijk 71%. In een Nederlands onderzoek onder 434 astmapatiënten uit 6 huisartsenpraktijken werd de mate van astmacontrole bepaald met behulp van de ACQ, waarbij een totale score > 3 (in plaats van de gemiddelde score die doorgaans wordt gebruikt) als suboptimale astmacontrole werd beschouwd. Hierbij werd bij 53% (95%-BI 48 tot 59) suboptimale astmacontrole vastgesteld.
Conclusie
Er is enig bewijs dat goede astmacontrole bij een aanzienlijk deel van de patiënten bereikt wordt, maar niet bij alle patiënten.
Overdiagnose
In een Canadees onderzoek bleek bij 203 (33,1%; 95%-BI 29,4% tot 36,8%) van 631 patiënten bij wie < 5 jaar de diagnose astma was gesteld deze diagnose niet te kunnen worden bevestigd na onderzoek met spirometrie, dagelijkse peakflowmeting, klachtmonitoring en een bronchiale provocatietest. Na 12 maanden follow-up was dat nog steeds zo bij 181 patiënten (29,5%; 95%-BI 25,9% tot 33,1%). Bij 44% van de patiënten die geen astma bleken te hebben was geen spirometrie verricht bij het vaststellen van de diagnose in de 1e lijn. Deze bevindingen bevestigen de resultaten van eerder onderzoek.
Behandeling van gelijktijdig astma en COPD
Naar Samenvatting ›Hanteer de aandoening die het meest op de voorgrond staat als leidend voor de behandeling. Behandel patiënten die duidelijke kenmerken van beide aandoeningen hebben medicamenteus volgens de NHG-Standaard Astma bij volwassenen; zie voor het niet-medicamenteuze beleid ook de NHG-Standaard COPD.
Voorlichting en niet-medicamenteuze adviezen
Naar Samenvatting ›Bespreek de volgende onderwerpen. Ga hierbij na wat een patiënt al weet en welke voorlichting hij wenst.
Aard van de aandoening
Naar Samenvatting ›- Astma is in het algemeen een goed behandelbare aandoening.
- Astma is een ontstekingsziekte met een variabel beloop.
- Vaak blijft de aandoening levenslang aanwezig.
- De levensverwachting is bij optimale behandeling met een goede astmacontrole normaal; deze is echter korter bij roken of COPD.
- De klachten kunnen worden uitgelokt door:
- Allergische prikkels (vooral door huisstofmijt en huisdieren) en
- niet-allergische prikkels (zoals virale infecties, rook, fijnstof, inspanning of stress)
Prikkelreductie
Naar Samenvatting ›- Bespreek bij onvoldoende astmacontrole de mogelijkheid van een screeningsallergietest en de betekenis van niet eerder ontdekte allergieën (zie Aanvullend onderzoek). Bij de behandeling van allergieën is de anamnese leidend (een positieve test zonder anamnestische aanwijzingen wijst alleen op sensibilisatie).
- Vermijd bij (allergisch) astma zoveel mogelijk prikkels die klachten uitlokken (zie NHG-Standaard Allergische rinitis).
- Bespreek bij aanwijzingen voor niet-allergische prikkels hoe deze vermeden kunnen worden (behalve klachten bij inspanning; zie Bewegen).
Huisdieren
Naar Samenvatting ›Bespreek dat bij een allergie voor huisdieren het wegdoen van het huisdier de klachten kan verminderen.
In Japan is het effect van het wegdoen van huisdieren onderzocht. Het onderzoek werd uitgevoerd bij 20 volwassen patiënten (24 tot 52 jaar) met een aangetoonde allergie. Zij kregen het advies om hun harige huisdieren weg te doen. De 10 patiënten die het advies opvolgden werden vergeleken met de 10 die hun huisdier behielden. Na ten minste 1 jaar follow-up scoorde de groep zonder huisdier aanzienlijk beter op de metacholineprovocatietest en gebruikte zij minder ICS, maar de FEV1 en de peak-flow-variabiliteit waren niet verbeterd. Het dier uit huis doen werkte beter dan optimale farmacotherapie en thuishouden van het huisdier: de noodzakelijke dosis ICS kon verlaagd worden bij alle 10 patiënten die hun dier uit huis plaatsten.
In een cochranereview over maatregelen om bij aanwezigheid van huisdieren de verspreiding van allergenen door de woning te beperken waren onvoldoende gegevens om een conclusie te kunnen trekken.
Het verminderen van blootstelling aan met name kattenallergeen lijkt klinisch relevant.
Het vermijden van blootstelling aan kattenallergeen is in de praktijk niet haalbaar. Zo bleek uit een onderzoek van Wood dat 20 tot 24 weken na het verwijderen van de kat in slechts 8 van de 15 huizen de concentratie van kattenallergeen gelijk was aan die van controlehuizen zonder kat.
Conclusie
Het wegdoen van een huisdier bij een aangetoonde allergie kan leiden tot minder astmaklachten.
Verminderen blootstelling huisstofmijt
Naar Samenvatting ›- Huisstofsanering heeft een beperkt effect; overweeg maatregelen ter reductie van de blootstelling aan huisstofmijt alleen bij blijvende onvoldoende astmacontrole waarbij een relatie met huisstofallergie erg waarschijnlijk is.
- Maatregelen om blootstelling aan huisstofmijt te verminderen:
- vochtbestrijding in huis door regelmatig ventileren van de woning; dit is ook goed om schimmelvorming te voorkomen
- glad slaapkamervloeroppervlak (gemakkelijk te reinigen)
- aangepast schoonmaken (regelmatig vochtig afnemen en stofzuigen in afwezigheid van de patiënt)
Aanvullende maatregelen bij blijvende onvoldoende astmacontrole waarbij een relatie met huisstofallergie waarschijnlijk is
- Maak in overleg met de patiënt een inschatting van de haalbaarheid van de volgende maatregelen en het te verwachten resultaat.
- Allergeenwerende hoezen voor matras, kussen en dekbed hebben een zeer beperkte toepassing en alleen als onderdeel van een totaalpakket ‘vermindering huisstofmijtexpositie’.
- Was beddengoed (wanneer geen allergeenwerende hoezen worden gebruikt) minstens 1 maal per 2 weken op 60 °C.
- In sommige gevallen kan een astmaverpleegkundige of praktijkondersteuner aan de hand van een huisbezoek problemen signaleren en voorlichting en adviezen geven op het gebied van prikkelreductie.
- Zie de website van het Longfonds voor informatie over aanvullende maatregelen bij huisstofmijtallergie (Saneren: weg met huisstofmijt).
- Zie ook Thuisarts: ‘Ik wil iets doen tegen huisstofmijt’.
De werkgroep verwijst hiervoor naar de LAN-richtlijn Astma, waaruit de volgende tekst is overgenomen: ‘Er is bewijs van lage kwaliteit dat combinaties van chemische middelen en fysieke interventies (zoals niet-doorlatende matrashoezen en wassen op 60 graden) niet leiden tot minder astmaklachten of een hogere FEV1.’
De werkgroep bemerkt in de praktijk echter dat allergeenreducerende maatregelen bij individuele patiënten zinvol kunnen zijn.
Bij patiënten met astma worden multipele allergeenreducerende maatregelen in het algemeen niet aanbevolen ter vermindering van de astmaklachten en verbetering van de FEV1. Voor patiënten bij wie het astma moeilijk onder controle te krijgen is, zijn de in de hoofdtekst vermelde aanvullende allergeenreducerende maatregelen mogelijk zinvol.
Niet-roken
Naar Samenvatting ›- Roken leidt tot een versnelde afname van de longfunctie en een verkorting van de levensduur.
- Stoppen met roken voorkomt de versnelde achteruitgang van de longfunctie.
- Roken verergert het beloop van astma en zorgt voor een afname van de werkzaamheid van ICS.
Stoppen met roken
- Geef rokers een krachtig ‘stoppen met roken’-advies en adviseer een gestructureerde aanpak, gevolgd door intensieve begeleiding door bijvoorbeeld een deskundige praktijkondersteuner.
- Raad ook meeroken en het gebruik van e-sigaretten krachtig af.
- Betrek een eventuele rokende partner.
- Een gedragsmatige aanpak, ondersteund door medicamenteuze behandeling, verdubbelt de kans op langdurig stoppen. Zie de NHG-Behandelrichtlijn Stoppen met roken en het Partnership Stoppen met roken.
- Vaak zijn meerdere stoppogingen nodig.
- Bespreek bij patiënten die niet gemotiveerd zijn of bij wie het stoppen niet lukt, de motivatie om te stoppen en eventuele barrières op een later tijdstip opnieuw.
Het roken van sigaretten heeft meerdere schadelijke effecten bij mensen met astma. Roken is geassocieerd met een verhoogd risico op slechte astmacontrole, ziekenhuisopnamen en, in sommige onderzoeken, overlijden door astma. Het verhoogt de snelheid van achteruitgang van de longfunctie en kan leiden tot COPD en het vermindert de effectiviteit van inhalatie- en orale corticosteroïden. Daarnaast zijn er andere bekende gevolgen, zoals een verhoogd risico op longkanker, COPD en hart- en vaatziekten. Blootstelling tijdens de zwangerschap geeft een verhoogd risico op astma en lageluchtweginfecties bij kinderen. Bij mensen met astma (kinderen en volwassenen) verhoogt passief roken het risico op ziekenhuisopname en onvoldoende astmacontrole. Stoppen met roken verbetert de longfunctie. Vermindering van passieve blootstelling aan rook verbetert de astmacontrole en vermindert het risico op ziekenhuisopnamen.
Een longitudinaal onderzoek onder 286 adolescenten leert dat mensen met astma en met ernstiger astmaklachten een hogere nicotine-afhankelijkheid hadden en vaker een niet-succesvolle poging om te stoppen met roken hadden, in vergelijking met mensen zonder astma of met minder ernstige symptomen.
Nicotine-afhankelijkheid ontwikkelt zich sneller bij adolescenten met astma. Preventie van roken en aanbieden van stoppen-met-rokenprogramma’s worden aanbevolen.
Zie voor gedetailleerdere informatie de NHG-Behandelrichtlijn Stoppen met roken, alsmede het addendum en het Partnership Stoppen met roken.
Bewegen
Naar Samenvatting ›- Adviseer de patiënt dagelijks ten minste een half uur matig intensieve beweging, zoals wandelen, fietsen, zwemmen of een andere sport (zie Beweegrichtlijnen 2017).
- Bespreek als de patiënt onvoldoende beweegt, bijvoorbeeld door aanhoudende (angst voor) dyspneu en/of als ADL-activiteiten minder goed uitgevoerd kunnen worden, de mogelijkheid van een verwijzing naar een gespecialiseerde oefen- of fysiotherapeut, bij voorkeur met expertise op het gebied van astma (fysiotherapeutische behandeling van astma wordt vanuit de basisverzekering niet vergoed).
- Adviseer bij inspanningsgebonden klachten bij sport een adequate warming-up.
- Zie de module ‘bewegen’ van de Praktijkhandleiding Leefstijl.
In een cochranereview (19 onderzoeken, n = 695) nam de conditie van hart en longen gemeten met de maximale zuurstofopname en de maximale expiratoire ventilatie toe. Patiënten van ≥ 8 jaar met alle mate van controle werden geïncludeerd. Onderzoeken werden geïncludeerd als de interventie ten minste 2 minuten volledige lichaamsinspanning 2 maal per week gedurende minimaal 4 weken omvatte. De controlegroep kreeg geen interventie. Uitkomsten waren astmacontrole, kwaliteit van leven, inspanningstolerantie en longfunctie. De resultaten konden niet gepoold worden vanwege de heterogeniteit van de onderzoeken. Fysieke training gaf ook geen verbetering van de longfunctie. Er is een mogelijk effect op de kwaliteit van leven. De kwaliteit van bewijs was voor alle uitkomsten laag tot zeer laag. Fysieke inspanning gaf wel een toename van de maximale hartslag en de zuurstofopnamecapaciteit en werd door de meeste patiënten goed verdragen. De werkgroep onderschrijft de beweegnorm van het Nederlands Instituut voor Sport en Bewegen: iedereen zou ten minste 5 dagen in de week 30 minuten matig intensief moeten bewegen. Deze norm kan ook gehanteerd worden voor mensen met astma.
Gewicht
Naar Samenvatting ›- Leg uit dat overgewicht en daarmee gepaard gaande aandoeningen de behandeling van astma compliceren.
- Adviseer gezonde voeding en beweging; zie de module ‘voeding’ van de Praktijkhandleiding Leefstijl.
- Adviseer gewichtsreductie bij overgewicht en obesitas; overweeg verwijzing naar een diëtist en/of een fysiotherapeut.
In een RCT met 46 patiënten met een gemiddelde BMI van 33,7 werd het effect van een dieet gericht op gewichtsverlies en/of beweging nagegaan. Patiënten werden gerandomiseerd tussen 10 weken dieetinterventie, oefening of combinatie van beide. Het gemiddelde gewichtsverlies was respectievelijk 8,5, 1,8 en 8,3 kg. De astmacontrole (ACQ) verbeterde in de groep met de dieetinterventie (−0,6; sd 0,5; p ≤ 0,001) en combinatie-interventie (−0,5; sd 0,7; p = 0,04). Gewichtsverlies van 5 tot 10% was gerelateerd aan een klinisch relevante toename van de astmacontrole bij 58% van de patiënten. De kwaliteit van dit onderzoek was laag. Gewichtsverlies van 5 tot 10% geeft in het algemeen al een aanzienlijke gezondheidswinst (NHG-Standaard Obesitas).
Conclusie
Bij mensen met astma en overgewicht is afvallen, eventueel onder begeleiding van een diëtist, van belang.
Werk
Naar Samenvatting ›- Leg uit dat tijdig onderkennen van werkgerelateerd astma (astma dat door het werk is ontstaan en astma dat door het werk verergert) van belang is. Bespreek het risico op verergering, en de eventuele gevolgen bij re-integratie en revalidatie.
- Bespreek aspecten die belangrijk zijn voor het functioneren/participeren.
- Geef informatie over de belasting en invloed van het werk op de klachten of aandoening.
- Adviseer de patiënt bij werkgerelateerde problemen contact op te nemen met de bedrijfsarts; neem zo nodig in overleg en met toestemming van de patiënt zelf contact op.
- Wijs de patiënt op praktische tools die ontwikkeld zijn om werknemers te ondersteunen bij het bespreken van een aandoening met hun werkgever en collega’s. Verwijs hiervoor bijvoorbeeld naar
- het dossier ‘Chronisch ziek en werk’ van Patiëntenfederatie Nederland
- het centrum chronisch ziek en werk (CCZW)
- de themapagina astma & COPD van de NVAB en
- de werkwijzer astma van het Longfonds
- Op Thuisarts staat informatie over ziekzijn en contact met de bedrijfsarts (‘Ik ben ziek: hoe zit het met contact met de bedrijfsarts’).
Werkgerelateerd astma kan worden onderverdeeld in astma dat door het werk is ontstaan (beroepsastma) en reeds bestaand astma dat verergert door werk. Bij ruim 15% van de patiënten bij wie astma op volwassen leeftijd is begonnen is beroepsmatige blootstelling aan allergische en niet-allergische stoffen de oorzaak van het ontstaan. Daarnaast is het ziekteverzuim en de kans op arbeidsongeschiktheid verhoogd bij patiënten met astma ten opzichte van de algemene populatie.
Conclusie
Bij mensen met astma bij wie de klachten mogelijk werkgerelateerd zijn, dient in samenspraak met de bedrijfsarts de mogelijkheid van werkaanpassing te worden onderzocht.
Belemmeringen in het functioneren
Naar Samenvatting ›Bespreek belemmeringen in het functioneren door angst voor kortademigheid of weerstand voor het gebruik van inhalatiemedicatie in gezelschap.
Ademhalingstechniek
Naar Samenvatting ›Overweeg astmapatiënten bij wie een slechte ademhalingstechniek de klachten beïnvloedt te verwijzen naar een fysiotherapeut met ervaring met ademhalingsoefeningen (zie ook Begrippen disfunctioneel ademen).
Bij sommige astmapatiënten zijn de klachten gerelateerd aan een slechte ademtechniek. Kenmerkend is dat de bronchusobstructie subjectief ernstiger wordt beleefd dan op objectieve gronden aantoonbaar is. Disfunctioneel ademen is gerelateerd aan angst en paniekklachten. In het verleden werd hier vaak de term hyperventilatie voor gebruikt, maar deze term is verlaten. In de literatuur worden verschillende disfunctionele adempatronen beschreven.
Er is echter geen consensus over objectieve criteria. Dit laatste relativeert de bruikbaarheid van vragenlijsten zoals de Nijmeegse vragenlijst. In de 2e lijn wordt gebruikgemaakt van vragenlijsten, een ‘vocal cord function’-test, fietsergometrie of een hyperventilatieprovocatietest. Soms wordt de diagnose disfunctioneel ademen per exclusionem gesteld.
Ondersteunende informatie
Naar Samenvatting ›- Bied voorlichtingsmateriaal aan en verwijs naar de informatie over astma op www.thuisarts.nl. De informatie op Thuisarts is gebaseerd op deze NHG-Standaard.
- Wijs voor inhalatie-instructie op de instructiefilmpjes op inhalatorgebruik.nl.
- Het is raadzaam te wijzen op de patiëntenvereniging van het Longfonds, onder meer voor de patiëntenversie van de Zorgstandaard astma bij volwassenen met daarin praktische informatie en voor de Longpunten (ontmoetingsplekken voor longpatiënten).
Zelfmanagement
Naar Samenvatting ›- Stimuleer de patiënt zelfstandig keuzes te maken bij dagelijkse bezigheden die mogelijk beïnvloed worden door astma.
- Bevorder dat de patiënt zelf meedenkt en -beslist over de behandeling van de aandoening.
- Leg afspraken vast, bij voorkeur in een individueel zorgplan (zie ook NHG-dossier individueel zorgplan).
De werkgroep verwijst naar de multidisciplinaire LAN-richtlijn Astma voor een beschrijving van de onderzoeken waarop onderstaande conclusies zijn gebaseerd.
Conclusies MDR Astma:
- Er is bewijs van lage kwaliteit dat educatie van patiënten met astma in vergelijking met usual care leidt tot minder astmaklachten.
- Er is bewijs van redelijke kwaliteit dat een combinatie van maatregelen gericht op zelfmanagement leidt tot minder longaanvallen, gemeten met bezoek aan de spoedeisende hulp.
- Er is bewijs van lage kwaliteit dat zelfmanagementmaatregelen in vergelijking met usual care bij volwassenen met astma leiden tot een betere longfunctie, gemeten met de FEV1.
- Er is bewijs van lage kwaliteit dat zelfmanagementmaatregelen in vergelijking met usual care bij volwassenen met astma geen effect hebben op het gebruik van noodmedicatie.
- Er is bewijs van lage kwaliteit dat zelfmanagementmaatregelen in vergelijking met usual care bij volwassenen met astma geen effect hebben op de kwaliteit van leven.
Overwegingen
In de MDR Astma staat de volgende zwak-positieve aanbeveling geformuleerd: ‘Maatregelen op het gebied van het bevorderen van zelfmanagement zijn met name zinvol als de controle suboptimaal is, waarbij het belangrijk is dat patiënten zich medeverantwoordelijk voelen voor hun behandeling. Individuele zorgplannen kunnen de astmacontrole mogelijk verbeteren en lijken met name zinvol bij patiënten met frequente longaanvallen, patiënten met onvoldoende astmacontrole, en patiënten met een lage participatie. Hierbij lijkt een combinatie van schriftelijk materiaal en andere vormen van bevordering van zelfmanagement aangewezen.’
Bij de herziening van deze NHG-Standaard is verduidelijkt welke niet-medicamenteuze adviezen bij iedere patiënt en welke zaken in het kader van zelfmanagement kunnen worden besproken.
Individueel zorgplan (IZP)
Naar Samenvatting ›- Afspraken over persoonsgerichte zorg zijn vooral – maar niet uitsluitend – zinvol bij patiënten met blijvend onvoldoende astmacontrole. Let hierbij op de gezondheidsvaardigheden van de patiënt.
- In het IZP worden bijvoorbeeld vastgelegd:
- persoonlijke behandeldoelen
- afspraken over de frequentie van controles
- leefstijlverandering
- anticiperen op bekende uitlokkende factoren
- medicatiegebruik en voorkomen overmatig gebruik
- afspraken over aanpassing van de medicatie door de patiënt zelf
- beleid bij een longaanval
Bij adequaat zelfmanagement is het mogelijk om patiënten zelf de dosering luchtwegverwijder en/of inhalatiecorticosteroïd te laten aanpassen bij een longaanval of door te anticiperen op niet-vermijdbare voor de patiënt bekende prikkels. - in welke situaties contact op te nemen met de praktijk en in welke situaties met de huisartsenpost
- afspraken met andere zorgverleners
- Ga in overleg met de patiënt na of gebruik van e-health meerwaarde heeft (zie E-health in de monitoringsfase).
Bespreek met de patiënt zijn persoonlijke behandeldoelen en leg deze bij voorkeur vast in een individueel zorgplan. Dit is vooral zinvol bij patiënten met onvoldoende astmacontrole. De werkgroep verwijst hiervoor naar de Zorgstandaard Astma bij volwassenen. De mate waarin alle aspecten van het IZP worden vastgelegd, is mede afhankelijk van de mate van ernst van het astma ofwel de mate waarin de patiënt zijn astma onder controle heeft. Voor goed gebruik van een IZP is een goede instructie onontbeerlijk. Het NHG heeft ook een (eenvoudiger) generiek IZP. Zie hiervoor het dossier individueel zorgplan NHG met het IZP-format.
Stappenplan medicamenteuze behandeling astma
Naar Samenvatting ›Uitgangspunten medicatiestappen
Naar Samenvatting ›- Maak bij de behandeling van astma gebruik van inhalatiemedicatie, als onderhoudsbehandeling en voor ‘zo nodig’-gebruik bij klachten. Zie tabel 3.
- Controleer in de instelfase elke 2-6 weken en maak daarbij onderscheid tussen goede en onvoldoende astmacontrole (ACQ6 of ACT).
- Ga bij onvoldoende astmacontrole de TIP-aandachtspunten na: Therapietrouw, Inhalatietechniek en Prikkelvermijding (zie ook NHG-Standaard Allergische en niet-allergische rinitis).
- Ga bij onvoldoende astmacontrole in samenspraak met de patiënt naar een volgende stap.
- Geef instructies voor het beleid bij tijdelijke toename van klachten (zie Gebruik van medicatie zo nodig bij dyspneuklachten).
Bij de behandeling van astma wordt gebruikgemaakt van verschillende groepen inhalatiemedicatie. De effectiviteit van deze geneesmiddelen is niet opnieuw nagegaan; hiervoor wordt verwezen naar de internationale richtlijn(en). Zie voor de effectiviteit en de plaatsbepaling van de leukotriëenantagonist montelukast stap 3 onder Gebruik van medicatie ‘zo nodig’ bij dyspneuklachten.
Keuze toedieningsvorm inhalatiemedicatie
Naar Samenvatting ›- De middelen binnen de meeste geneesmiddelgroepen zijn over het algemeen gelijkwaardig voor wat betreft effectiviteit, veiligheid, bijwerkingen, gebruiksgemak (doseerfrequentie) en toepasbaarheid (zie de toelichting bij de afzonderlijke medicatiestappen).
- Doe ervaring op met een beperkt aantal inhalatoren (aerosolen en bijvoorbeeld 2 verschillende poederinhalatoren). Zorg voor een demonstratiemodel van deze inhalatoren in de praktijk, om mede aan de hand daarvan een keuze te maken voor een inhalatortype.
- Kies in overleg met de patiënt een toedieningsvorm waar de patiënt goed mee kan omgaan.
- Houd rekening met de volgende zaken:
- Een aerosol moet met voorzetkamer gebruikt worden.
- De uniformiteit (mate waarin inhalatiemiddelen uit andere therapeutische groepen met dezelfde toedieningsvorm beschikbaar zijn) van een aerosol is meestal groter dan van de meeste poederinhalatoren.
- Voor gebruik van een aerosol met voorzetkamer is minder inhalatiekracht nodig dan bij een poederinhalator. Bij de gemiddelde astmapatiënt zal de inhalatiekracht voldoende zijn, aangezien astma vooral een uitademingsprobleem is.
- Een algemeen bezwaar tegen aerosolen is dat ze een sterk milieubelastend broeikasgas bevatten.
- Gebruiksgemak (vooral bepaald door de patiënt zelf).
- Kosten.
- Zie voor een overzicht van de belangrijkste kenmerken van inhalatoren bij astma de Tabel inhalatoren astma.
Achtergrond
Aangezien er op enkele uitzonderingen na geen aanwijzingen zijn voor het bestaan van klinisch relevante verschillen in effectiviteit, veiligheid, bijwerkingen, gebruiksgemak (doseerfrequentie) en toepasbaarheid tussen de beschikbare middelen per geneesmiddelgroep voor astma, kan de keuze van het middel bepaald worden op basis van de toedieningsvorm. Daarbij maakt de huisarts in samenspraak met de patiënt een passende keuze.
Uitzonderingen op de gelijkwaardigheid zijn:
- Formoterol werkt sneller dan salmeterol. Dit is van belang indien gekozen wordt voor klachtbehandeling met formoterol-ICS zo nodig.
- Voor behandeling van astma met toevoeging van een LAMA is alleen tiotropium geregistreerd. Tiotropium is de enige LAMA waarvan de effectiviteit bij astma is nagegaan (zie stap 3 onder Gebruik van medicatie ‘zo nodig’ bij dyspneuklachten).
- Formoterol-ICS gebruik voor zo nodig zijn alleen formoterol-budesonide en formoterol-beclometason geregistreerd.
Gebruiksgemak hangt sterk samen met de voorkeur en eigenschappen van de patiënt.
- Voor veel patiënten is een ‘unidose’-doseersysteem (met losse capsules) onhandig, omdat de inname gepaard gaat met meerdere handelingen en de capsules los van de inhalator moeten worden bewaard. Dit bezwaar geldt meer bij on-demand gebruik dan bij onderhoudsbehandeling, dus inname op reguliere tijdstippen.
- Een dosisteller voorkomt het gebruik nadat de multidose leeg is. De afwezigheid geldt als beperkend. Vrijwel alle poederinhalatoren hebben zo’n indicator. Bij aerosolen is dat niet altijd het geval.
- De benodigde ademkracht en techniek variëren tussen de verschillende poederinhalatoren. Bij sommige inhalatoren verlaat het poeder eerder de inhalator dan bij andere, evenals het benodigde type inademing (krachtig, al of niet initieel, of meer gelijkmatig). Bij sommige inhalatoren ‘merkt’ de patiënt niet dat hij poeder inhaleert. Dit is voor sommige patiënten een bezwaar, voor anderen niet.
Aerosol of poederinhalator (de keuze tussen een poederinhalator of een aerosol met voorzetkamer)
- Voor dosisaerosolen is minder ademkracht en coördinatie noodzakelijk dan voor poederinhalatoren.
- Bij poederinhalatoren bestaat het coördinatieprobleem van een aerosol bij indrukken en inademen niet.
- Dosisaerosolen moeten met voorzetkamer worden gebruikt en dit kan voor sommige patiënten bezwaarlijk zijn, maar voor anderen niet. Voorzetkamers zijn tegenwoordig in een relatief klein formaat beschikbaar dat gemakkelijk in een tas past, maar niet in een broekzak.
- Bij sommige poederinhalatoren verlaat het poeder eerder de inhalator dan bij andere, evenals het benodigde type inademing (krachtig, al of niet initieel, of meer gelijkmatig). Bij sommige inhalatoren ‘merkt’ de patiënt niet dat hij poeder inhaleert, bij andere wel.
- Aerosolen maken gebruik van ‘HFK’ drijfgas. Het drijfgas HFK tast de ozonlaag niet aan, maar het is een zeer sterk broeikasgas. De milieubelasting van 1 inhalatie van een aerosol is 25 keer groter dan van een poederinhalator door de drijfgassen. De gevolgen van productie, transport en afval (verwerking plastic, doordrukstrips) zijn niet meegewogen.
Uniformiteit
- Om een juiste inhalatietechniek te bevorderen is het van belang om bij patiënten die meerdere inhalatiemiddelen gebruiken gebruiksfouten als gevolg van verschillende toedieningsvormen te voorkomen.
- Dit geldt zowel bij gelijktijdig gebruik van verschillende middelen als bij het gebruik van andere middelen of combinatiepreparaten, bij het doorlopen van het stappenplan.
Kosten
Bij gelijkwaardige middelen kunnen ook de kosten meegewogen worden bij de keuze (conform het NHG-Standpunt NHG-werkwijze Keuze geneesmiddelen).
Instructie van de inhalatietechniek
Naar Samenvatting ›- Geef bij het voorschrijven van een inhalator instructie voor het gebruik. Adviseer de patiënt eventueel www.inhalatorgebruik.nl te raadplegen voor herhaling van de instructie en filmpjes.
- Laat de patiënt weten welke zorgverlener instructie zal geven: de huisarts, praktijkondersteuner of apotheker. Vraag tijdens consulten na bij de patiënt of deze instructie heeft ontvangen (zie Praktijkvoeringsaspecten en de LTA).
- Vraag de patiënt bij iedere controle de geneesmiddelen en inhalatoren mee te nemen om de inhalatietechniek te kunnen controleren om eventuele fouten te corrigeren.
- Adviseer na gebruik de mond te spoelen.
| Stap 1 (optioneel) SABA Of ICS-formoterol zo nodig |
Stap 2 ICS |
Stap 3 Lage dosis ICS/LABA |
Stap 4 Intermediaire tot hogere dosis ICS/LABA |
Stap 5 |
|
|---|---|---|---|---|---|
| (Onderhouds) behandeling |
Alleen SABA zo nodig* of lage dosis ICS-formoterol of meteen stap 2 |
Lage dosis ICS of lage dosis ICS-formoterol zo nodig bij klachten* |
Lage dosis ICS + LABA of intermediaire dosis ICS (zonder LABA) |
Intermediaire tot (tijdelijk) hogere dosis ICS + LABA of hogere dosis ICS (zonder LABA) |
Overweeg stap 5 Verwijzing longarts |
| Bij klachten* |
|
||||
| * Gebruik > 2/week wijst op onvoldoende astmacontrole. Alleen formoterol-budesonide en formoterol-beclometason zijn voor ‘zo nodig’-gebruik naast onderhoudsbehandeling geregistreerd. | |||||
Gebruik van medicatie zo nodig bij dyspneuklachten
Naar Samenvatting ›- Adviseer een SABA bij incidentele klachten (< 2/week overdag). Continueer een SABA voor zo nodig vanaf stap 2 (zie tabel 4).
- Een gelijkwaardig alternatief is zo nodig (extra) inhalaties van een combinatiepreparaat met formoterol-budenoside of formoterol-beclomethason. Formoterol werkt snel en heeft een grote therapeutische breedte. Het gebruik zo nodig is alleen in genoemde combinaties onderzocht.
- Adviseer een SABA voor zo nodig bij klachten bij onderhoudsbehandeling met een ICS in combinatie met een andere LABA dan formoterol.
- Adviseer bij inspanningsklachten een SABA (ongeveer 2 uur bescherming) of bij gebruik van een combinatiepreparaat met ICS en formoterol dit preparaat te gebruiken, 10 tot 15 minuten voor de inspanning.
- Bij verwachte inspanningsklachten: adviseer gebruik van bovenstaande ‘zo nodig’-medicatie 10 tot 15 minuten voor de inspanning.
- Gebruik van ‘zo nodig’-medicatie > 2x/week, ook als dit gebeurt ter preventie van inspanningsklachten bij frequente sporters, wijst op onvoldoende astmacontrole. Ga in dat geval in samenspraak met de patiënt naar een volgende stap.
Bij onderhoudsbehandeling met een combinatiepreparaat kan worden overwogen om bij toegenomen dyspneuklachten een snelwerkend langwerkende LABA te geven in plaats van een SABA. Het gaat daarbij in de 1e lijn voornamelijk om een combinatie met formoterol. Deze benadering kent enkele voordelen; er wordt maar 1 soort middel en toedieningsvorm voorgeschreven en daarnaast wordt bij toegenomen klachten ook de ICS-dosering verhoogd. Potentiële nadelen zijn overdosering van een of van beide componenten, en hogere kosten ten opzichte van een SABA. In de literatuur is de onderbouwing voor deze behandelwijze nagegaan. De meeste van de gerefereerde onderzoeken zijn gefinancierd door de farmaceutische industrie.
Budesonide/formoterol
In een cochranereview (4 onderzoeken, n = 9130) werden de effectiviteit en veiligheid van budesonide/formoterol ‘onderhoud plus zo nodig’ (single-inhaler) versus combinatie-inhalers met een hogere (vaste) dosis ICS dan in de single-inhaler plus SABA zo nodig onderzocht bij kinderen en volwassenen met astma. In deze review werden adolescenten en volwassenen met astma met onderhoudsmedicatie met een klinisch belangrijke longaanval in het voorafgaande jaar geïncludeerd. Er werd geen verschil gevonden op de uitkomstmaten fatale en ernstige bijwerkingen, klachten en gebruik van noodmedicatie. Er was wel een verschil ten gunste van budesonide/formoterol ‘onderhoud plus zo nodig’ wat betreft longaanvallen waarvoor orale steroïden nodig waren (OR 0,75; 95%-BI 0,65 tot 0,87; NNT 42; klinisch niet relevant), longaanvallen waarvoor een ziekenhuisbezoek nodig was (OR 0,72; 95%-BI 0,57 tot 0,90; NNT 66; klinisch niet relevant), FEV1 (gemiddeld verschil 19 ml; 95%-BI 3 tot 36; klinisch niet relevant) en kwaliteit van leven (gemiddeld verschil 0,06 punten op AQLQ; 95%-BI 0,02 tot 0,10; klinisch niet relevant). In een recente meta-analyse (16 RCT’s, n = 22.524) werden minder longaanvallen gevonden bij gebruik van budesonide-formoterol zo nodig vergeleken met eenzelfde dosering budesonide onderhoudsbehandeling en een SABA zo nodig (RR, 0,64; 95%-BI 0,53 tot 0,78) en in mindere mate vergelijking met een hogere dosering budesonide onderhoudsbehandeling en SABA zo nodig RR 0,59 (95%-BI 0,49 tot 0,71). De reviewers waardeerden de kwaliteit van het bewijs als laag tot redelijk.
Beclometason/formoterol
Papi et al. voerden een gerandomiseerd dubbelblind onderzoek uit bij patiënten met astma, waarbij zij beclometason/formoterol (‘100/6’, 2 dd 1) ‘onderhoud plus zo nodig’ (single-inhaler, interventie) vergeleken met beclometason/formoterol vaste onderhoudsdosis plus salbutamol ‘zo nodig’ (controle).
Dit dubbelblinde multicenter Europese onderzoek werd uitgevoerd bij 1714 patiënten, waarbij primair werd gekeken naar de tijd tot een ernstige longaanval. Secundaire uitkomsten waren onder meer longfunctie, klachten en astmacontrole. De beide groepen waren vergelijkbaar bij de start van het onderzoek. In de interventiegroep kreeg 12% gedurende de follow-up van 48 weken een longaanval; in de controlegroep was dit 18% (ARR 6%, NNT 16, p = 0,0005). De tijd tot de eerste longaanval was langer bij beclometason/formoterol ‘onderhoud plus zo nodig’ dan bij beclometason/formoterol onderhoud plus salbutamol ‘zo nodig’ (verschil 65 dagen, 209 versus 134 dagen, p = 0,0003). Parameters op het gebied van longfunctie, klachten en astmacontrole waren niet statistisch significant verschillend. Ook het aantal lichte longaanvallen was niet statistisch significant verschillend. Wel waren er meer bijwerkingen (stemklachten, candida, tachycardie en tremor) en meer onverwachte complicaties in de beclometason/formoterol ‘onderhoud plus zo nodig’ groep. Opgemerkt moet worden dat niet gekeken is naar veiligheid van de interventie op de lange termijn.
Patel et al. voerden een gerandomiseerd onderzoek uit in 4 eerstelijnscentra en een ziekenhuis in Nieuw-Zeeland, waarin zij beclometason/formoterol (‘200/6’, 2 dd 2) ‘onderhoud plus zo nodig’ (single-inhaler, interventie) vergeleken met beclometason/formoterol vaste onderhoudsdosis plus salbutamol (100 microg) ‘zo nodig’ (controle).
In dit onderzoek werden 303 patiënten geïncludeerd. De primaire uitkomstmaat was het aantal episodes waarin een hogere dosis bèta-2-agonisten gebruikt werden (> 8 maal ‘zo nodig’-medicatie in 24 uur in interventiegroep en > 16 maal in controlegroep); secundair werd gekeken naar medicatiegebruik, ernstige longaanvallen en bijwerkingen. Op de primaire uitkomstmaat werd geen statistisch significant verschil gevonden. Wel was het relatieve risico op een ernstige longaanval in de interventiegroep lager dan in de controlegroep (RR 0,56; 95%-BI 0,38 tot 0,84; ARR 14%; NNT 7; klinisch relevant).
Fluticason/formoterol
Er zijn geen kwalitatief goede onderzoeken beschikbaar waarin de effectiviteit en veiligheid van fluticason/formoterol ‘onderhoud plus zo nodig’ versus een vaste onderhoudsdosis plus SABA zo nodig is geëvalueerd.
Het Farmacotherapeutisch Kompas vermeldt voor budesonide en beclomethason/formoterol ter verlichting van acute bronchoconstrictie in combinatie met een onderhoudsbehandeling ‘zo nodig’ 1 inhalatie extra te nemen; indien de klachten aanhouden nog een 2e inhalatie. De geregistreerde extra dosering verschilt per toedieningsvorm. De totale dosering (onderhoudsdosering plus ‘zo nodig’) is maximaal 6 inhalaties per keer en 8 inhalaties per dag.
Conclusies
- Een combinatiepreparaat budesonide/formoterol of beclometason/formoterol ‘onderhoud plus zo nodig’ is iets effectiever voor het voorkomen van longaanvallen en verbetering van de kwaliteit van leven in vergelijking met een vaste onderhoudsdosis van dit combinatiepreparaat plus een ander ‘zo nodig’-middel (SABA).
- Voor het combinatiepreparaat fluticason/formoterol zijn geen gegevens beschikbaar over ‘onderhoud plus zo nodig’-gebruik.
- Er is geen onderzoek gevonden over de werkzaamheid van combinatiepreparaten met salmeterol ‘onderhoud plus zo nodig’.
Overwegingen
Internationaal is de trend formoterol-ICS laagdrempelig in te zetten, ook al vanaf stap 1 (zie stap 1 onder Gebruik van medicatie ‘zo nodig’ bij dyspneuklachten). Redenen hiervoor zijn de klachtenverlichting van formoterol, de combinatie met ICS zodat een preventief effect wordt bewerkstelligd, het risico op overmatig gebruik van een SABA en een eenduidiger patiënteninstructie en een groter gemak voor de patiënt; de patiënt hoeft immers maar 1 toedieningsvorm te gebruiken voor zowel onderhoud als bij klachten. Het bewijs voor meerwaarde op de uitkomsten longfunctie, klachten en astmacontrole is echter beperkt en combinatiepreparaten zijn duurder dan een SABA. De werkgroep weegt mee dat formoterol-ICS voor ‘zo nodig’-gebruik reeds langere tijd geadviseerd wordt voor gebruik bij onderhoudsbehandeling + zo nodig. Patiënten met goede astmacontrole die een SABA voor zo nodig gebruiken (< 1/week) of ICS-salmeterol onderhoudsbehandeling gebruiken hoeven niet te worden omgezet.
Stap 1: SABA of ICS-formoterol zo nodig
Naar Samenvatting ›- Alleen bij patiënten met zeer weinig frequente klachten (< 2x/week overdag) volstaat een SABA voor zo nodig, bijvoorbeeld incidenteel in reactie op een allergeen. Sla in andere gevallen stap 1 over.
- Bij gebruik van een SABA kunnen bijwerkingen optreden, zoals tremor van handen, hoofdpijn, tachycardie en palpitaties.
- Bij gebruik van een SABA is er risico op overmatig gebruik met risico op ernstige astma-longaanvallen, ziekenhuisopname en sterfte.
- Een gelijkwaardig alternatief is stap 1 over te slaan en laagdrempelig met ICS te starten of met formoterol-budesonide of formoterol-beclometason in een lage dosis zo nodig (maximaal 2x/week). ICS-formoterol zo nodig is vooral geschikt voor patiënten met mogelijk beperkte therapietrouw of een beperkt ziekte-inzicht.
De mogelijkheid formoterol-ICS zo nodig aan te bieden is een goed en gelijkwaardig alternatief voor de benadering met laagdrempelig ICS-onderhoudsbehandeling en SABA zo nodig.
Voor- en nadelen
SABA als 1e stap ten opzichte van formoterol-ICS zo nodig en ICS-onderhoudsbehandeling
- Voordeel: een SABA heeft in dit kader diagnostische betekenis, omdat het bij bestaan van astma onmiddellijk leidt tot klachtenvermindering.
- Voordeel: vaak is in de 1e lijn de diagnose astma nog niet zeker in het begin en zou direct starten met ICS of formoterol-ICS zo nodig voor een groep patiënten tot overbehandeling kunnen leiden.
- Nadeel: overmatig gebruik van een SABA gaat gepaard met risico’s (zie Preventie van overmatig gebruik van kortwerkende bèta-2-agonisten). Het is niet altijd duidelijk hoe vaak een patiënt SABA gebruikt. Enerzijds kan het gebruik fors vaker zijn dan bij de huisarts bekend is of uit het HIS imponeert (gebruik van 2 dosisaerosolen van 200 doses in 3 maanden kan corresponderen met > 30 SABA innames per week). Anderzijds kan indien uit voorschrijf- en herhaalgegevens blijkt dat een patiënt mogelijk te veel SABA gebruikt, alsnog ICS toegevoegd worden.
- Nadeel: door te starten met een SABA ‘went’ de patiënt aan het gebruik ervan en wordt ook bij blijvende klachten/gebruik van > 2/week de ICS mogelijk te laat toegevoegd.
Formoterol-ICS zo nodig als 1e stap ten opzichte van ICS-onderhoudsbehandeling en SABA zo nodig
- Voordeel: er lijkt een lagere longaanval-rate te zijn bij gebruik van formoterol/ICS zo nodig.
- Voordeel: GINA redeneert dat een SABA als 1e stap de patiënt laat ervaren dat deze medicatie snelle klachtenverlichting geeft. De vaak noodzakelijke stap naar ICS als onderhoudsbehandeling zonder dit snelle merkbare effect is daardoor lastig voor de patiënt, ook omdat dit gepaard gaat met het advies terughoudend met het gebruik van een SABA te zijn. Mede om redenen van een eenduidiger patiëntenvoorlichting beveelt de GINA-richtlijn een combinatie van ICS-formoterol als 1e stap aan. Het is daarbij wel de vraag in hoeverre deze redenering terecht is als voldoende tijd genomen wordt voor een juiste instructie.
- Nadeel: het is onduidelijk wat de farmacotherapeutische bijdrage is van incidenteel gebruik van ICS.
- Nadeel: de kosten bij incidenteel gebruik van formoterol-ICS zo nodig zijn hoger dan van een SABA zo nodig.
ICS-onderhoudsbehandeling als 1e stap ten opzichte van formoterol-ICS en SABA zo nodig
- Voordeel: ICS-onderhoudsbehandeling lijkt hetzelfde effect te hebben als formoterol/ICS indien nodig.
- Nadeel: ICS heeft minder directe diagnostische betekenis, omdat het bij bestaan van astma gebruik van ICS niet onmiddellijk leidt tot klachtenvermindering.
- Nadeel: grotere expositie aan corticosteroïden.
- Nadeel: risico op minder therapietrouw.
Kwaliteit van bewijs
De kwaliteit van het bewijs was laag. Er werd afgewaardeerd voor indirectheid, omdat het in alle 4 RCT’s patiënten betrof die een indicatie hadden voor ten minste stap 2-behandeling (in plaats van stap 1); namelijk onvoldoende astmacontrole met alleen SABA zo nodig (> 2/week). Daarnaast werd afgewaardeerd voor sponsoring door de farmaceutische industrie. De kwaliteit van bewijs voor wat betreft bijwerkingen bij formoterol/ICS zo nodig versus ICS-onderhoudsbehandeling was zeer laag. Dit in verband met het extra afwaarderen voor heterogeniteit van de resultaten van de verschillende onderzoeken.
Waarden en voorkeuren van patiënten
De werkgroep schat in dat de meeste patiënten liever geen inhalatiecorticosteroïden gebruiken bij geringe/infrequente astmaklachten. Goede astmacontrole, waarbij het gebruik van medicatie voor zo nodig niet of zelden nodig is, heeft de voorkeur. Als dit het best met onderhoudsbehandeling kan worden bereikt, heeft dat de voorkeur. Bij zeer incidentele klachten schat de werkgroep in dat de meeste patiënten gebruik zo nodig met direct een merkbaar effect prettiger vinden dan dagelijks gebruik zonder direct merkbaar effect.
Waarden en voorkeuren huisartsen
In de 1e lijn bestaat vermoedelijk weerstand tegen het laagdrempelig gebruik van ICS bij geringe/infrequente astmaklachten. In Nederland zijn er, als gevolg van de scheiding tussen 1e- en 2elijnszorg, meer mensen met betrekkelijk geringe astmaklachten dan wel een (nog) onzekere astmadiagnose in de 1e dan in de 2e lijn; mogelijk is dit in het buitenland anders.
Kosten
Combinatiepreparaten (formoterol/ICS) zijn flink duurder dan een SABA en duurder dan ICS-onderhoudsbehandeling.
Aanvaardbaarheid en haalbaarheid van de interventie
ICS-onderhoudsbehandeling: mogelijk een minder goede compliance door het ontbreken van een direct merkbaar effect. Hierdoor wordt het gemakkelijk vergeten en wordt teruggegrepen op een SABA. Ook weestand tegen corticosteroïden kan leiden tot minder goede compliance. ICS-formoterol zo nodig is een gemakkelijk implementeerbare stap. Immers de kans op overmatig SABA-gebruik is afwezig. Bij frequenter gebruik met enige instructie gaat men als het ware vanzelf over naar stap 3. Een nadeel is dat onderhoudsbehandeling met laaggedoseerd ICS overgeslagen zou kunnen worden.
Achtergrond
Bèta-2-mimetica verlichten snel de dyspneuklachten, maar hebben het risico op overmatig gebruik, toegenomen risico op longaanvallen en verhoogde mortaliteit (zie ook Preventie van overmatig gebruik van kortwerkende bèta-2-agonisten).
In de GINA-richtlijn Asthma 2019 wordt om dit risico te verminderen geadviseerd om meteen te starten met een combinatiepreparaat ICS en formoterol (LABA) on demand.
Uitgangsvraag
Moet bij patiënten met astma als stap 1-medicatie formoterol (LABA)/ICS zo nodig worden aanbevolen in plaats van SABA zo nodig dan wel laagdrempelig ICS-onderhoudsbehandeling?
Methoden
Er is een systematische literatuurzoekactie naar SR’s en RCT’s uitgevoerd in PubMed (januari 2013 tot november 2019).
Resultaten
Resultaat zoekactie
De zoekactie leverde 4 RCT’s naar het verschil in effectiviteit tussen budesonide(ICS)-formoterol(LABA) zo nodig versus budesonide(ICS)-onderhoudsbehandeling (met terbutaline (SABA) of albuterol (= salbutamol) (SABA) zo nodig) of versus monotherapie terbutaline (SABA) of albuterol (SABA) zo nodig. Een meta-analyse werd niet gevonden.
Beschrijving onderzoeken
Bateman (2018) includeerde 4176 patiënten (> 12 jaar, gemiddeld 41 jaar, 62% vrouw) met ‘lichte’ astma in de 52 weken durende, dubbelblinde, gerandomiseerde, multicenter trial. Deze patiënten, die in aanmerking kwamen voor ICS-onderhoudsbehandeling, werden (na een ‘run-in’-periode van 2-4 weken waarin ze alleen terbutaline (0,5 mg) indien nodig mochten gebruiken) gerandomiseerd over 2 onderzoeksarmen: 1 – 2 x daags placebo plus budesonide (200 µg; ICS)-formoterol (6 µg; LABA) zo nodig; 2 – budesonide(ICS)-onderhoudsbehandeling (2 x daags 200 µg) (plus terbutaline (0,5 mg; SABA) zo nodig). Uitkomstmaten waren aantal ernstige longaanvallen (per jaar), symptomen aan de hand van de Asthma Control Questionnaire-5 (ACQ-5; met schaal 0 (geen beperking) - 6 (maximaal beperkt)) en bijwerkingen.
Beasley (2019) voerde ook een 52 weken durende, gerandomiseerde, gecontroleerde trial uit met patiënten met ‘lichte’ astma (n = 668, gemiddeld 36 jaar, 55% vrouw) (ongeblindeerd). Patiënten die in de 3 maanden voorafgaand aan het onderzoek ≥ 2 keer een SABA hadden gebruikt, of een longaanval hadden in 12 maanden voorafgaand, werden geïncludeerd. Deze patiënten werden gerandomiseerd over 3 onderzoeksarmen: 1 – albuterol (100 µg; SABA) indien nodig; 2 – budesonide(ICS)-onderhoudsbehandeling (2 x daags 200 µg) (plus albuterol (0,5 mg; SABA) zo nodig); 3 – budesonide (200 µg; ICS)-formoterol (6 µg; LABA) indien nodig. Primaire uitkomstmaat was de jaarlijkse longaanval-rate, het aantal ernstige longaanvallen per jaar, ook werd het cumulatief ICS-gebruik gemeten, de ACQ-5 ingevuld en werden bijwerkingen bijgehouden.
Ook Hardy (2019) voerde een 52 weken durende, gerandomiseerde gecontroleerde, multicenter trial uit (ongeblindeerd). Participanten waren astmapatiënten tussen de 18 en 75 jaar oud, die in de 12 weken voor inclusie SABA gebruikten met of zonder ICS-onderhoudsbehandeling. Deze patiënten (n = 885, gemiddeld 43 jaar, 55% vrouw) werden gerandomiseerd over 2 onderzoeksarmen: 1 – budesonide (200 µg; ICS)-formoterol (6 µg; LABA) zo nodig; 2 – budesonide(ICS)-onderhoudsbehandeling (2 dd 200 µg) (plus terbutaline (250 µg; SABA) zo nodig). Er waren 6 contactmomenten: bij de randomisatie en bij 4, 16, 28, 40 en 52 weken. Primaire uitkomstmaat was het aantal longaanvallen per jaar, ook werd de ACQ-5 ingevuld en werden bijwerkingen bijgehouden.
O’Byrne (2018) randomiseerde 3.849 patiënten (> 12 jaar, gemiddeld 40 jaar, 61% vrouw) in 3 groepen. Alle patiënten hadden ten minste 6 maanden astma, en onvoldoende astmacontrole met een SABA (zo nodig of laaggedoseerd ICS en een SABA). De diagnose astma werd bevestigd op grond van anamnese en spirometriegegevens. De onderzoeksarmen waren: 1 – 2 x per dag placebo plus terbutaline (0,5 mg; SABA) zo nodig; 2 – 2 x per dag placebo plus budesonide (200 µg; ICS)-formoterol (6 µg; LABA) zo nodig; 3 – budesonide(ICS)-onderhoudsbehandeling (2 dd 200 µg) (plus terbutaline (0,5 mg; SABA) zo nodig). De follow-up was 52 weken. Uitkomsten waren het percentage weken met goede astmacontrole en ernstige longaanvallen. Ook werd de ACQ-5 ingevuld en werden bijwerkingen bijgehouden.
De resultaten van deze onderzoeken zijn door het NHG gepoold, zie de forest plots in de Totstandkoming.
Samenvatting van het bewijs
- Er lijken minder ernstige en matige-ernstige longaanvallen voor te komen bij gebruik van formoterol/ICS (budesonide) zo nodig ten opzichte van SABA zo nodig.
- Er lijkt geen of nauwelijks verschil in het voorkomen van (ernstige) longaanvallen bij gebruik van formoterol/ICS (budesonide) zo nodig ten opzichte van ICS-onderhoudsbehandeling.
- Er lijkt geen klinisch relevant verschil te zijn voor wat betreft astmacontrole (beoordeeld op basis van de ACQ-5) bij gebruik van formoterol/ICS (budesonide) zo nodig ten opzichte van SABA zo nodig of ICS-onderhoudsbehandeling.
- Er lijkt geen of nauwelijks verschil in het voorkomen van bijwerkingen bij gebruik van formoterol/ICS zo nodig, SABA zo nodig en ICS (budesonide)-onderhoudsbehandeling.
Alle kwaliteit van bewijs is laag (zie bijlage 3 van de Totstandkoming).
Preventie van overmatig gebruik van kortwerkende bèta-2-agonisten
Naar Samenvatting ›- Ga bij ieder monitoringsconsult de hoeveelheid SABA-gebruik na.
- Bij aanwijzingen voor overmatig SABA-gebruik (> 2x/week):
- Benadruk het belang om een SABA alleen bij daadwerkelijke klachten te gebruiken (of voorafgaand aan inspanning).
- Leg uit dat veelvuldig SABA-gebruik een teken is van onvoldoende gecontroleerd astma, dit kan leiden tot verminderde werking (receptortolerantie) en een risico vormt voor een longaanval.
- Vraag na welke drempels er zijn voor dagelijks gebruik van ICS. Probeer eventuele misconcepties zoveel mogelijk te corrigeren.
- Stel bij overmatig SABA-gebruik de medicatie bij volgens het stappenplan.
- Bij (risico op) overmatig gebruik is afleveren van dosisaerosolen met 200 inhalaties erg royaal. Overweeg de voorgeschreven hoeveelheden te verkleinen als de gekozen toedieningsvorm dit toelaat.
- In sommige gevallen is verwijzing naar een psycholoog nodig als de patiënt erg nerveus wordt van (angst voor) benauwdheid en snel naar een SABA grijpt.
- Evalueer bij aanwijzingen voor overmatig SABA-gebruik iedere 6 weken tot 3 maanden.
- Geef bij (top)sportgerelateerde klachten geen SABA ‘op proef’ voordat de diagnose astma is gesteld.
- Geef geen SABA (herhaal)recept aan sporters die met een SABA hun sportprestaties wensen te verbeteren.
Epidemiologie van overmatig gebruik van bèta-2-agonisten in Nederland
In een cross-sectionele retrospectieve analyse in een apothekersdatabase met gegevens van 500.000 Nederlanders werden de (astma)inhalatiemedicatievoorschriften nagegaan (SABA, LABA, ICS, ICS/LABA). In deze database staan geen diagnoses. Alleen patiënten tussen de 17 en 48 jaar werden geïncludeerd; in deze leeftijdsgroep is de diagnose astma onder gebruikers van inhalatiemedicatie dominant en > 48 jaar neemt het percentage patiënten met COPD snel toe. In totaal werden de gegevens van 8504 patiënten die inhalatiemedicatie gebruikten geanalyseerd. Van deze patiënten gebruikten 21% > 100 DDD SABA per jaar (corresponderend met ≥ 2/week). Van hen gebruikte 21% > 400 DD (> 7/week) en 31% 100-199 DDD (2-4/week) geen onderhoudsmedicatie (ICS). In deze groep gebruikte 6% van de patiënten orale corticosteroïden; van hen gebruikte 17% geen ICS.
Uit recente nog ongepubliceerde vervolgdata van dezelfde database in 2018 bleek dat 6226 van de 12.372 patiënten die inhalatiemedicatie gebruikten ten minste een SABA-prescriptie hadden. Van deze SABA-gebruikers kreeg 47% eveneens een ICS (+/-LABA) voorgeschreven. Het gemiddelde aantal SABA-voorschriften was 2,55 (SD 2,65). Bij 1264 van de 12.372 (10,2%) patiënten was er in 2018 overmatig SABA-gebruik (gedefinieerd als > 104 DDD/jaar, ≥ 2/week). Van deze groep was bij 594 patiënten geen ICS (+/- LABA) voorgeschreven.
In totaal kreeg 43% van de patiënten die een SABA gebruikten ICS voorgeschreven en deze groep was daarmee te beschouwen als ICS-therapietrouw (gedefinieerd als voldoende voorschriften voor > 75% van de dagen).
Een beperking van het onderzoek is dat het gebaseerd is op medicatievoorschriften; de exacte diagnose en het daadwerkelijk gebruik is niet bekend.
Conclusie
In deze grote Nederlandse populatie zijn sterke aanwijzingen voor overmatig SABA-gebruik (> 10%).
Wanneer is er sprake van overmatig SABA-gebruik?
Bij ≥ 2 keer per week gebruik van een SABA is er minder goede astmacontrole en wordt aangeraden de medicatie volgens het stappenplan bij te stellen. Dit geldt ook als patiënten frequent (> 3 /week) sporten en daarbij een SABA nodig hebben of gebruiken. Gebruik van > 3 volledige aerosolen (3 x 200 dosis salbutamol of equivalent) per 12 maanden (> 12 per week) geeft een 2-3 keer verhoogd risico op een longaanval, het risico neemt met 8-14% per aerosol toe.
Overmatig SABA-gebruik is bovendien geassocieerd met frequentere klachten, verhoogd gebruik van gezondheidszorg, minder mentaal en fysiek functioneren en overlijden (bij gebruik van ≥ 1 aerosol van 200 dosis per maand: > 46 doses per week).
Wat zijn de nadelige gevolgen van overmatig SABA-gebruik?
Kortwerkende bèta-2-agonisten geven snel verlichting en zijn levensreddend bij acuut ernstig astma maar regelmatig langdurig gebruik van SABA leidt tot receptortolerantie (neerwaartse regulatie) voor hun bronchodilaterende effecten en vertonen in labarotoriumsituaties een inflammatoir effect.
Bijwerkingen van een SABA zijn onder meer palpitaties en tachycardie. Bij overmatig gebruik neemt het risico hierop toe.
Bij ongeveer de helft van de mensen met astma is de mate van astmacontrole minder goed dan deze potentieel zou kunnen zijn, zie ook Gelijktijdig astma en COPD.
Frequent gebruik van een SABA is dan ook een teken van onvoldoende astmacontrole.
Overmatig gebruik van SABA en (daaruitvolgend) onvoldoende gebruik van ICS wordt in verband gebracht met astmasterfte.
Oorzaken van overmatig gebruik van een SABA
Patiënten ervaren astma nogal eens als een recidiverende acute aandoening, in plaats van een chronische aandoening. Ze gebruiken hierdoor kortwerkende bèta-2-agonisten (SABA) om de klachten te verlichten in plaats van een behandeling gericht op de onderliggende inflammatoire oorzaken van astma. De vrijwel onmiddellijke verbetering van de klachten na gebruik van een SABA, die bij gebruik van ICS niet instantaan optreedt, ligt hieraan ten grondslag.
De drempel om een SABA te gebruiken verschilt tussen patiënten. Er is geen eensluidende instructie bij welke (ernst van) klachten een patiënt medicatie zou moeten gebruiken of dat deze dit nog kan uitstellen. Mogelijk gebruiken sommige patiënten de medicatie erg laagdrempelig, bijvoorbeeld bij de vrees om kortademig te worden.
Sommige patiënten ervaren angstklachten als ‘benauwdheidsklachten’ en gebruiken om deze reden een SABA. Het is denkbaar dat indien de klachten niet verdwijnen de patiënt de medicatie vaker neemt.
Bij een deel van de patiënten is na initiële behandeling geen vervolgdiagnostiek gedaan en is overmatig gebruik het gevolg van het herhaaldelijk aanvragen van SABA-herhaalreceptuur.
Niet alle LABA/ICS-combinatiepreparaten geven een direct merkbaar effect; zeker niet als er reeds goede astmacontrole is. Een SABA wordt dan alsnog, wellicht direct na het combipreparaat gebruikt.
Patiënten hebben het ICS-gebruik onvoldoende in hun dagelijkse bestaan ingebed, beheersen de inhalatietechniek onvoldoende of het ontbreekt aan motivatie om deze dagelijks te gebruiken.
Soms speelt de vrees voor gebruik van corticosteroïden.
Er is een toenemende trend van (top)sporters die met gebruik van SABA hun sportprestaties proberen te verbeteren. Deze groep sporters heeft er belang bij dat de diagnose astma gesteld wordt, waardoor een SABA op medische indicatie gebruikt kan worden. De werkgroep acht deze ontwikkeling onwenselijk (‘legale doping’) en adviseert heel terughoudend te zijn en de diagnose astma altijd op juist gronden te stellen. Gebruik van een SABA ‘op proef’ wordt bij deze groep dringend afgeraden.
Bij patiënten die een SABA overmatig gebruiken, spelen vermoedelijk een of meer van bovengenoemde factoren.
Stap 2: Onderhoudsbehandeling met ICS of ICS-formoterol zo nodig
Naar Samenvatting ›- Geef ICS in een lage dosis (zie tabel 5).
- Continueer de ICS gedurende 3 maanden
- Bouw zo mogelijk af naar een lagere dosis (zie Controle). Staak ICS bij een duidelijke astmadiagnose niet, tenzij er uitsluitend seizoensgebonden klachten zijn.
- ICS kunnen lokale bijwerkingen geven, zoals heesheid en orale candidiasis.
- Lokale bijwerkingen kunnen soms verminderen door na het nemen van de medicatie de mond te spoelen (zie Beleid bij heesheid door ICS-gebruik).
- Bij hogere doses ICS neemt het risico op systemische bijwerkingen toe, zoals hematomen of bijnierschorsinsufficiëntie.
- Een alternatief is om formoterol-budesonide of formoterol-beclometason in een lage dosis zo nodig voor te schrijven (zie Gebruik van medicatie zo nodig bij dyspneuklachten).
ICS zijn anti-inflammatoire middelen die worden ingezet voor klachtenvermindering, verbetering van de longfunctie en vermindering van longaanvallen.
Werkzaamheid ICS ten opzichte van placebo
In een cochranereview (43 onderzoeken, n = 2801) was budesonide werkzamer dan placebo wat betreft FEV1 (gewogen gemiddeld verschil 3,7%; 95%-BI 0,1 tot 7,2%), klachten en uitval vanwege longaanvallen (RR 0,17; 0,09 tot 0,33). Doses van 500 tot 800 microg/dag leken een enigszins beter effect te hebben dan lagere doses.
In een cochranereview (60 onderzoeken, n = 6542) waren doses van ≤ 400 microg/dag beclometason (57 onderzoeken) werkzamer dan placebo wat betreft FEV1 (gewogen gemiddeld verschil 12,4% van voorspeld; 8,2 tot 16,6), gebruik van SABA en uitval vanwege longaanvallen (RR 0,25; 0,12 tot 0,51).
Om een optimaal resultaat te behalen was een behandelingsperiode nodig van > 4 weken. Ook beclometason extrafijn (3 onderzoeken) was werkzamer dan placebo (FEV1, klachten, gebruik van SABA). Na 6 weken behandeling werden duidelijke effecten bereikt.
Verschil in effectiviteit onderling
In een cochranereview (9 onderzoeken; n = 1265; 3 tot 12 weken) werd geen verschil gevonden in werkzaamheid (FEV1, klachten, kwaliteit van leven, uitval) of bijwerkingen tussen beclometason extrafijn en fluticason in gelijke doses.
In een cochranereview (71 onderzoeken; n = 14.602) was fluticason in een dosisratio van 1:2 iets werkzamer dan budesonide of beclometason wat betreft FEV1 (0,04 l; 95%-BI 0,00 tot 0,07; klinisch niet relevant), en was fluticason geassocieerd met minder klachten en lager gebruik van noodmedicatie. Bij gebruik van fluticason was het risico op keelklachten hoger.
In de cochranereview van Manning et al. werden de effectiviteit en veiligheid van ciclesonide vergeleken met fluticason, beclometason en budesonide in equivalente dagdoseringen. Patiënten in de onderzoeken waren zowel kinderen als volwassenen met astma. Alleen onderzoeken met een minimale duur van 4 weken werden geïncludeerd en patiënten mochten medicatie blijven gebruiken in een stabiele dosering. Als primaire uitkomstmaat werd gekeken naar longaanvallen (waarbij orale steroïden nodig waren) en de longfunctie (FEV1 en PEF). Secundaire uitkomstmaten betroffen zorggebruik (bijvoorbeeld doktersbezoek), morbiditeit (bijvoorbeeld absentie), compliance, astmaklachten, gebruik noodmedicatie en bijwerkingen. In totaal werden 21 onderzoeken geïncludeerd met 1664 kinderen en 5367 adolescenten/volwassenen. Er is bewijs van redelijke kwaliteit dat er geen verschillen zijn in effectiviteit tussen ciclesonide en andere ICS.
Step-up versus step-down
In een cochranereview (26 onderzoeken) werd geen verschil in effect (longfunctie, klachten, gebruik SABA of astma-instelling) gevonden tussen een ‘step-down’-benadering versus een constante lage/matige onderhoudsdosis ICS. Starten met een matige dosis ICS lijkt iets werkzamer dan starten met een lagere dosis (gewogen gemiddeld verschil PEF 11,1 l/min; 95%-BI 1,3 tot 20,9; nachtelijke klachten). Starten met een intermediaire dosis is equivalent aan starten met een hogere dosis en omlaagtitreren.
Bijwerkingen
ICS kunnen lokale bijwerkingen geven, zoals heesheid en orale candidiasis. Lokale bijwerkingen kunnen soms verminderen door na het nemen van de medicatie de mond te spoelen (zie Beleid bij heesheid door ICS-gebruik).
Bij hogere doses ICS neemt het risico op systemische bijwerkingen toe, zoals hematomen of bijnierschorsinsufficiëntie.
Conclusie
Beclometason, budesonide, fluticason en ciclesonide zijn werkzame middelen bij astma. Er is geen bewijs voor een onderling verschil in effectiviteit.
Geen voorkeur voor een bepaald ICS vanwege verhoogd risico op pneumonie
Naar Samenvatting ›Bij astma is er geen voorkeur voor een bepaald ICS vanuit het oogpunt van een verhoogd risico op pneumonie.
Uitgangsvraag
Is de kans op pneumonie verhoogd voor patiënten met astma bij gebruik van inhalatiecorticosteroïden (ICS)?
Achtergrond
Het gebruik van ICS (met name fluticason) is geassocieerd met een verhoogd risico op pneumonie bij mensen met COPD. Geldt dit ook voor mensen met astma? Een oorzaak zou zijn gelegen in het gegeven dat fluticason lipofiel is en zich beter aan de cel hecht en waardoor stapeling zou kunnen ontstaan.
Methoden
Er is een systematische literatuurzoekactie naar SR’s en RCT’s uitgevoerd in PubMed en Embase.
Resultaten
Resultaat zoekactie
De zoekactie leverde 1 systematisch literatuuronderzoek van zeer goede kwaliteit op naar de relatie tussen het gebruik van ICS en pneumonie bij patiënten met astma. Een aanvullende search na de zoekdatum van dit literatuuronderzoek leverde geen aanvullende RCT’s op.
Beschrijving onderzoeken
Bansal includeerde 10 RCT’s over ICS-gebruik bij astma waarin pneumonie als bijwerking werd meegenomen (setting: 1e lijn; duur: 4 weken tot 3 jaar, mediaan: 12 weken) met in totaal 19.098 patiënten. De meeste patiënten hadden ‘mild to moderate’ persisterende astma en waren ≥ 12 jaar. Er is geen informatie gerapporteerd over ICS-gebruik voor studie-aanvang. In elke RCT was een placebo-arm (waarbij de patiënten in 2 onderzoeken naast placebo montelukast kregen) en elke RCT was dubbelblind. Daarnaast includeerde Bansal 4 observationele studies (setting: 1e en 2e lijn; duur: half jaar tot 12 jaar) met in totaal 44.016 patiënten.
ICS in studies: fluticason, budesonide en mometason in verschillende doseringen (doseringen in RCT's relatief laag).
Een onderlinge vergelijking van verschillende soorten ICS is in de review niet gedaan; analyse van de data levert geen aanwijzingen voor een mogelijk verschil.
Conclusie
Op basis van RCT's en observationele studies is het onzeker of pneumonie minder vaak of vaker voorkomt bij patiënten met astma bij ICS-gebruik (kwaliteit van bewijs: zeer laag).
Geen voorkeur voor extrafijn ICS ten opzichte van ‘normaal’ fijn ICS bij astma
Naar Samenvatting ›Bij astma is er geen voorkeur voor het voorschijven van extrafijn of normaal fijn ICS.
Er is onvoldoende bewijs voor een verschil (misschien een klein positief effect) in effectiviteit bij gebruik van extrafijn ICS ten opzichte van normaal fijn ICS. Extrafijn ICS kan in een lagere dosering ICS voorgeschreven worden, maar niet duidelijk is of dit het risico op (lokale en systemische) bijwerkingen kleiner maakt. De kosten verschillen bij ICS-monotherapie maar niet bij combinatie met een LABA. Om deze redenen is besloten tot een neutrale aanbeveling.
Voor- en nadelen
Er lijkt niet of nauwelijks verschil tussen gebruik van extrafijn ICS ten opzichte van normaal fijn ICS te zijn voor wat betreft alle uitkomstmaten, maar het effect is vaak onzeker (kwaliteit van bewijs: laag tot zeer laag). Dit betekent dat het onduidelijk is welke medicatievorm de voorkeur heeft.
Het is een algemeen principe dat bij gelijke effectiviteit een lagere dosering de voorkeur heeft boven een hogere dosering ICS om de kans op bijwerkingen op lange termijn te verkleinen. Daarentegen is niet duidelijk of het risico op bijwerkingen als gevolg van de kleinere deeltjes groter is bij extrafijn door een grotere systemische opname dan wel lokale depositie.
De geïncludeerde onderzoeken waren te klein of hadden gebrek aan power om een eventueel verschil in bijwerkingen aan te tonen.
Kwaliteit van bewijs
De kwaliteit van het bewijs was zeer laag. Er werd afgewaardeerd voor de lage aantallen patiënten in de onderzoeken, dat het op zichzelf staande studies zijn (meestal geen meta-analyse mogelijk) en sponsoring door de farmacie.
Waarden en voorkeuren van patiënten
We zijn van mening dat de meeste patiënten geen voorkeur hebben voor extrafijn of normaal fijn ICS, tenzij het duidelijk is dat de ene ‘vorm’ veel beter werkt dan de andere of minder bijwerkingen heeft (inschatting van de werkgroep).
Kosten
Het verschil in kosten is in de regel niet groot, wel zijn er verschillen in gebruiksgemak en uniformiteit.
Aanvaardbaarheid en haalbaarheid van de interventie
De interventie is aanvaardbaar, al zijn er verschillen in kosten en uniformiteit bij de verschillende toedieningsvormen.
Achtergrond
Beclometason (fomoterol) 2 dd 100 extrafijn is volgens het Farmacotherapeutisch Kompas bijvoorbeeld overeenkomstig met 2 dd 250 normaal fijn. Als een lagere dosering extrafijn ICS even effectief is als hogere dosering normaal fijn ICS, zou dat een reden kunnen zijn om de variant met extrafijn aan te bevelen. De gedachte is dat bij een lagere dosis er een kleiner risico is op systemische opname en bijwerkingen. Het is niet zeker of de systemische opname bij de meeste patiënten daadwerkelijk verschilt. Kleine deeltjes kunnen over het algemeen dieper de long in dringen dan grote deeltjes en de alveoli bereiken. In de alveoli vindt met name de systemische absorptie plaats. Hoewel de totale hoeveelheid (metered dose) beclometason extrafijn dus minder is dan beclometason normaal, kan er toch een vergelijkbare expositie plaatsvinden.
Uitgangsvraag
Is een lagere dosering extrafijn ICS even effectief als hogere dosering ‘normaal’ fijn ICS bij volwassen patiënten met astma?
Methoden
Er is een systematische literatuurzoekactie naar SR’s en RCT’s uitgevoerd in PubMed in mei 2019.
Resultaten
Resultaat zoekactie
De zoekactie leverde 3 onderzoeken op naar het verschil in effectiviteit tussen de extrafijne (HFA) variant van beclometason dipropionaat (BDP) ten opzichte van de normaal fijne (CFC) variant. Juniper verwees naar een artikel van Fireman waarin meer resultaten van hetzelfde onderzoek werden gepubliceerd. Twee recente artikelen over dit onderwerp: een meta-analyse van observationele/real-life studies en een retrospectief NL database-onderzoek, werden geëxcludeerd in verband met de onderzoeksopzet (observationeel) en de onjuiste medicatievergelijkingen (normaal fijne variant van het ene ICS ten opzichte van extrafijne variant van het andere ICS) (indirectheid).
Beschrijving onderzoeken
Boulet (Canada) includeerde 141 patiënten met matig-ernstige astmaklachten die 1000-2000 microgram normaal fijn BDP per dag voorgeschreven kregen. Na een twee weken durende ‘run-in’-periode, waarin alle patiënten 1500 microgram normaal fijn BDP kregen, kregen 70 patiënten gedurende 26 weken 800 microgram extrafijn BDP voorgeschreven en 71 patiënten 1500 microgram normaal fijn BDP. Tijdens deze weken werden onder andere astmaklachten, longaanvallen en bijwerkingen (jeuk, orale candidiasis) bijgehouden. Gebruik van andere astmamedicatie was tijdens het onderzoek toegestaan (sponsoring door farmacie).
Juniper en Fireman (Verenigde Staten, België, Nederland, Verenigd Koninkrijk) vergeleken onder andere astmagerelateerde kwaliteit van leven (aan de hand van AQLQ), astmaklachten, bèta-2-agonistgebruik, longaanvallen en bijwerkingen tussen 354 patiënten met stabiele astma die 200-800 microgram extrafijn BDP per dag voorgeschreven kregen en 119 patiënten die 400-1600 microgram normaal fijn BDP per dag voorgeschreven kregen, na een ‘run-in’-periode van 2 weken waarin de patiënten hun ‘eigen’ medicatiedoseringen gebruikten. In de 12 maanden van het onderzoek waren er 8 meetmomenten. Longaanvallen van astma mochten behandeld worden met de meest gebruikelijke behandeling (sponsoring door farmacie).
Magnussen (Duitsland) onderzocht het verschil tussen 400 microgram extrafijn BDP (72 patiënten) en 1000 microgram normaal fijn BDP per dag (78 patiënten) onder in totaal 150 patiënten met stabiele astmaklachten. Tijdens een ‘run-in’-periode van 4 weken kregen alle patiënten 1000 microgram normaal fijn BDP voorgeschreven. Symptoomscores, longaanvallen en bijwerkingen werden gedurende 4+10 weken bijgehouden (sponsoring onderzoek door farmacie).
Huchon (België, Frankrijk, Hongarije, Polen, Roemenië en Rusland) includeerde 645 patiënten met matig-ernstige astma (volgens GINA 2005) die minimaal 2 maanden lang CFC BDP (750-1000 µg) (of een equivalent ervan) hebben gebruikt, met eventueel een LABA (formoterol 24 g of salmeterol 100 g per dag), én dagelijks een SABA. Na een ‘run-in’-periode van 2 weken waarin de patiënten hun eigen astmamedicatie gebruikten, werden de patiënten gerandomiseerd over 1 van de 3 groepen: 1 - Extrafijn HFA combi van BDP (200 µg) + Formoterol (12 µg) in 1 pMDI inhaler (n = 212), 2 - CFC BDP (500 µg) pMDI + formoterol (12 µg) DPI in 2 losse inhalers (n = 220), 3 - CFC BDP (500 µg) pMDI (n = 213). Alleen de 1e 2 groepen worden hier beschreven. Gedurende 24 weken werden onder andere astmaklachten, longaanvallen en bijwerkingen geregistreerd. Longaanvallen van astma mochten behandeld worden met de meest gebruikelijke behandeling (sponsoring door farmacie.)
Samenvatting van het bewijs
Zie de GRADE-tabel behorend bij het detail Normaal fijn versus extrafijn ICS in de Totstandkoming
- Astmaklachten: het is onzeker of er verschil in astmaklachten is bij gebruik van extrafijn ICS ten opzichte van normaal fijn ICS door patiënten met astma (kwaliteit van bewijs: laag tot zeer laag).
- Bèta-2-agonist-gebruik: het is onzeker of er verschil is in bèta-2-agonist-gebruik bij gebruik van extrafijn ICS ten opzichte van normaal fijn ICS door patiënten met astma (kwaliteit van bewijs: zeer laag).
- Longaanvallen: het is onzeker of er een (klinisch relevant) verschil is in het voorkomen van longaanvallen bij gebruik van extrafijn ICS ten opzichte van normaal fijn ICS door patiënten met astma (kwaliteit van bewijs: laag tot zeer laag).
- Astmagerelateerde kwaliteit van leven: er lijkt een iets grotere, maar niet klinisch relevante, verandering in astmagerelateerde kwaliteit van leven te zijn bij gebruik van extra fijn ICS ten opzichte van normaal fijn ICS door patiënten met astma (kwaliteit van bewijs: laag).
- Bijwerkingen: het is onzeker/er lijkt geen klinisch relevant verschil te zijn in het voorkomen van bijwerkingen bij gebruik van extra fijn ICS ten opzichte van normaal fijn ICS door patiënten met astma (kwaliteit van bewijs: (zeer) laag).
Inhalatiecorticosteroïden bij rokers
Naar Samenvatting ›- Roken bij patiënten met astma is geassocieerd met een lagere therapeutische respons op ICS.
- Stoppen met roken kan de gevoeligheid van astmapatiënten voor ICS ten minste gedeeltelijk herstellen; adviseer rokers ook om deze reden te stoppen met roken.
Roken bij patiënten met astma is geassocieerd met een lagere therapeutische respons op ICS, zowel na kortdurend gebruik van 12 weken als na langdurig gebruik. Het verschil in therapeutische respons tussen rokers en niet-rokers wordt kleiner bij gebruik van de maximale dagdosering ICS. Het mechanisme van deze ‘corticosteroïdresistentie’ is onbekend. Stoppen met roken zou de gevoeligheid van astmapatiënten voor ICS ten minste gedeeltelijk herstellen.
Beleid bij heesheid door ICS-gebruik
Naar Samenvatting ›- Stap bij heesheid als bijwerking van ICS niet meteen over op een ander ICS.
- Instrueer de ICS voor het eten te inhaleren en de mond na inhalatie te spoelen.
- Overweeg een aerosol in plaats van een poederinhalator of wissel van toedieningsvorm.
- Overweeg pas als bovenstaande maatregelen niet succesvol zijn, te wisselen van soort ICS.
Voordelen versus nadelen
Ten aanzien van het wisselen van type ICS of device zijn wat betreft effectiviteit geen nadelen, mogelijk wel ten aanzien van het risico op non-compliance.
Kwaliteit van bewijs
Of er een verschil is in risico op heesheid bij verschillende ICS is onzeker (kwaliteit van bewijs: zeer laag).
Waarden en voorkeuren patiënten
Voor patiënten met hardnekkige klachten van heesheid is het belangrijk dat er een oplossing wordt gezocht. Aanvaardbaarheid en haalbaarheid Overstappen naar een ander middel is haalbaar: er zijn voldoende alternatieven beschikbaar met een vergelijkbare effectiviteit. De aanvaardbaarheid van het overstappen voor de patiënt hangt mogelijk af van het gebruiksgemak van het device. Er is niet gekeken naar de verschillen in heesheid bij verschillende type inhalatoren
Achtergrond
De incidentie van heesheid als bijwerking van inhalatiecorticosteroïden bij astma loopt in de literatuur uiteen van 5 tot 58%. We gaan na of een wijziging van het type inhalatiecorticosteroïd aanbevolen kan worden om de bijwerking heesheid te verminderen.
Uitgangsvraag
Is er bij patiënten met astma die een inhalatiecorticosteroïd (ICS) gebruiken en last hebben van heesheid een ander ICS aan te bevelen?
Cruciale uitkomstmaat
Heesheid
Resultaten
Literatuursearch
Er werden geen onderzoeken gevonden waarbij patiënten met heesheid een ander ICS kregen voorgeschreven. Om de vraag te kunnen beantwoorden werd een cochranereview gebruikt waarin fluticasongebruik werd vergeleken met beclometason en budesonide bij volwassen en kinderen > 2 jaar met astma, een cochranereview uit 2006 waarin fluticason met beclometason extrafijn werd vergeleken en een trial die fluticason met ciclesonide vergeleek. Alle onderzoeken hadden een andere primaire onderzoeksvraag; heesheid was steeds een secundaire uitkomstmaat. In de cochranereview werden 71 RCT´s geïncludeerd met in totaal 14.602 patiënten. Er werden zowel poederinhalatoren als dosisaerosolen gebruikt, maar slechts in 29 onderzoeken werd in beide armen hetzelfde type inhalator gebruikt, in 7 onderzoeken was de toedieningsvorm niet duidelijk. Eerder onderzoek tussen beclometason en budesonide vond geen verschil in heesheid als bijwerking, waardoor deze werden samengenomen. Er werden dosisverhoudingen van 1:1 gebruikt (fluticason: beclometason/budesonide) en 1:2 (fluticason: beclometason) onderzocht. In 2 onderzoeken werden patiënten geïncludeerd met een onderhoudsdosering van orale corticosteroïden, in driekwart van de onderzoeken gebruikten patiënten voor aanvang van het onderzoek reeds inhalatiecorticosteroïden. Het is niet duidelijk of er al heesheid bestond bij aanvang van de onderzoeken en hoe heesheid is gemeten.
Fluticason versus beclometason en/of budesonide (1:2)
In 10 RCT’s (n = 2321) werd de dosisverhouding fluticason:beclometason of budesonide 1:2 onderzocht, zoals in huidige richtlijnen aanbevolen. De doseringen liepen uiteen van 200 mcg tot 1000 mcg fluticason per dag en 336 mcg tot 2000 mcg beclometason/budesonide per dag. De duur van de onderzoeken varieerde van 4 weken tot 12 maanden.
Fluticason versus beclometason en/of budesonide (1:1)
In 5 RCT’s (n = 1016) werd de dosisverhouding fluticason:beclometason/budesonide 1:1 onderzocht. De doseringen tussen de onderzoeken liepen uiteen van 400 tot 2000 mcg per dag. De duur van de onderzoeken liep uiteen van 4 weken tot 12 maanden.
Fluticason versus ciclesonide
In een open label RCT (n = 528) werd fluticason 2 dd 330 mcg vergeleken met ciclesonide 2 dd 320 mcg onder patiënten ≥ 6 maanden bekend met matig-ernstig tot ernstig astma.
Fluticason versus fluticason extrafijn
In een cochranereview uit 2006 werd heesheid tussen fluticason en fluticason extrafijn vergeleken.
Kwaliteit van bewijs
Cochranereview fluticason versus beclometason en/of budesonide: de kwaliteit van het bewijs was zeer laag. Er werd afgewaardeerd met 1 niveau wegens gebrek aan blindering, tekortkomingen aan randomisatie en uitval. Ook werd 1 niveau afgewaardeerd vanwege heterogeniteit in onderzoeksduur, onderzoekpopulatie en in dosering. Ten slotte is afgewaardeerd vanwege imprecisie (breed BI). Bijna alle onderzoeken vonden plaats in de 2e lijn (poliklinisch). Er was een onderzoek dat alleen kinderen includeerde. Hiervoor is niet afgewaardeerd.
Trial: Fluticason versus ciclesonide:dit was een niet-geblindeerd onderzoek in 100 centra in West-Europa (waaronder Nederland), Zuid-Afrika en Canada. Heesheid was geen primaire uitkomst maar een bijwerking. De gerapporteerde p-waarde betreft het voorkomen van candidiasis en heesheid samen.
Cochrane-review fluticason versus fluticason extra fijn: de kwaliteit van het bewijs was zeer laag. Er werd afgewaardeerd met 1 niveau wegens gebrek aan blindering, geblindeerde toewijzing en tekortkomingen in randomisatie, onnauwkeurigheid (breed BI) en indirectheid (geen eerstelijnspopulatie).
Heesheid bij fluticason versus beclometason en/of budesonide: 1:2: Er bleek een iets kleiner maar niet significant verschillend risico op heesheid bij gebruik van fluticason dan beclometason/budesonide bij de onderzochte patiënten (gepoold OR 0,89; 95%-BI 0,47 tot 1,67).
1:1: In dezelfde dosering (1:1) veroorzaakt fluticason niet significant vaker heesheid dan beclometason/budesonide (Peto OR 1,47; 95%-BI 0,71 tot 3,04).
Het BI was in beide vergelijkingen zowel verenigbaar met een voordeel van fluticason als beclometason en/of budesonide als met geen verschil.
Heesheid bij fluticason versus ciclesonide: Er werd meer heesheid gevonden bij fluticasongebruik (9,2% (n = 25) versus 3,1% (n = 8); geen 95%-BI vermeld, p = 0,0023).
Fluticason versus fluticason extrafijn
In een cochranereview waarin fluticason met extrafijn werd vergeleken hadden in 2 RCT’s in totaal 32 van de 246 tegenover 21 van de 250 patiënten last van heesheid (RR 1,53; 95%-BI 0,92 tot 2,54).
Conclusie
Er is zeer veel onzekerheid over het bestaan van een verschil in risico op heesheid tussen fluticason en beclometason en/of budesonide of extrafijn (bewijs van kwaliteit: zeer laag). Er is mogelijk een verschil tussen fluticason en ciclesonide, in het voordeel van ciclesonide.
Stap 3: Onderhoudsbehandeling met een LABA en lage dosis ICS
Naar Samenvatting ›- Voeg een LABA aan een lage dosis ICS toe ( zie tabel 6).
- Bij gebruik van een LABA(-ICS) kunnen bijwerkingen optreden, zoals tremor van handen, hoofdpijn, tachycardie en palpitaties.
- Combineer een LABA bij astmabehandeling altijd met een ICS. Gebruik van een LABA zonder ICS geeft een verhoogd risico op ernstige astma-longaanvallen, ziekenhuisopname en sterfte; in combinatie met een ICS is dit risico niet verhoogd.
- Een alternatief is een intermediaire dosis ICS zonder LABA.
- Wees terughoudend met gelijktijdig een los ICS en los LABA, vanwege de hogere kosten en het risico op een minder goede therapietrouw (ICS wordt vergeten of weggelaten vanwege een door de patiënt vermeende mindere effectiviteit doordat geen snelle klachtverlichting plaatsvindt).
In een cochranereview (70 onderzoeken; n = 21.148, van wie 16.623 volwassenen) werd het effect van LABA onderzocht bij patiënten met als onderhoudsmedicatie ICS. Toevoeging van LABA versus placebo aan ICS verminderde het absolute risico op een longaanval, waarbij orale steroïden nodig waren met 4% (15% versus 11%; RR 0,77; 95%-BI 0,68 tot 0,87; veelal onderzoeken bij volwassenen; NNT 25; klinisch niet relevant). Er was geen statistisch significant verschil tussen de combinatie van LABA plus ICS versus ICS alleen wat betreft ernstige bijwerkingen (RR 1,06; 95%-BI 0,87 tot 1,30). Toevoeging van LABA was geassocieerd met een grotere verbetering van de FEV1 (0,11 l; 95%-BI 0,09 tot 0,13) en een grotere verbetering van het percentage symptoomvrije dagen (11,9%; 95%-BI 8,3 tot 15,5) dan bij gebruik van ICS alleen. Toevoeging van LABA aan ICS was geassocieerd met een vermindering van het gebruik van noodmedicatie (−0,58 inhalaties/dag; 95%-BI −0,80 tot −0,35).
Conclusie
Bij volwassenen met astma die ICS als onderhoudstherapie gebruiken en klachten hebben, is toevoeging van LABA werkzaam wat betreft verbetering van de longfunctie, vermindering van klachten en vermindering van het gebruik van noodmedicatie.
Overwegingen
Formoterol werkt sneller (na 1-2 minuten) dan salmeterol (na 10-20 minuten) en kan zo nodig worden gebruikt bij dyspneuklachten (zie Gebruik van medicatie zo nodig bij dyspneuklachten). Een combinatiepreparaat met ICS-formoterol kan om deze reden de voorkeur hebben boven combinatie van ICS met salmeterol met een SABA voor gebruik zo nodig.
LAMA (tiotropium) als alternatief voor een LABA
Naar Samenvatting ›- Overweeg tiotropium als alternatief bij bijwerkingen van een LABA (palpitaties of tremoren).
- Tiotropium is geen alternatief voor ICS.
- Een veelvoorkomende bijwerking is een droge mond.
Toevoegen leukotrieënreceptorantagonist (LTRA)
Naar Samenvatting ›- Overweeg bij onvoldoende astmacontrole toevoeging van montelukast 1 dd 10 mg.
- Geef montelukast niet als alternatief voor ICS, alleen als toevoeging.
- Evalueer na 2 maanden of er verbetering is opgetreden en staak montelukast indien het geen verbetering van de astmacontrole geeft of er bijwerkingen zijn.
- Bijwerkingen van montelukast zijn bovensteluchtweginfecties, hoofdpijn, buikpijn, koorts, huiduitslag, misselijkheid, braken, diarree en een verhoogd ALAT/ASAT.
Voor- en nadelen van de interventies
Voor de meeste patiënten met mild tot matig astma wegen de voordelen (lager risico op longaanvallen) op tegen de nadelen (bijwerkingen).
Kwaliteit van bewijs
De kwaliteit van het bewijs voor de verschillende uitkomsten naar LTRA bij ernstig of niet goed gecontroleerd astma varieert van laag tot hoog.
Waarden en voorkeuren
We schatten in dat patiënten de uitkomsten op eenzelfde manier tegen elkaar zullen afwegen behoudens de longfunctie. Deze laatste is wel gerelateerd aan klachten en de prognose.
Aanvaardbaarheid/haalbaarheid van de interventie
We schatten in dat de haalbaarheid van de interventie voor zowel arts als patiënt groot is. Voor de patiënt betekent het wel een extra pilinname, terwijl de inhalatiemedicatie dient te worden gecontinueerd. Voor sommige patiënten is dit misschien bezwaarlijker dan een verhoging van ICS. Bij het voorschrijven van montelukast is het belangrijk de respons te evalueren. Als er na 2 maanden geen verbetering van de klachten is opgetreden, is het raadzaam montelukast te staken.
Achtergrond
Er is discussie over de waarde van LTRA in de 1e lijn. Om deze reden werd de evidence voor de plaats van montelukast bij deze herziening opnieuw nagegaan.
Uitgangsvraag
Is montelukast aan te bevelen bij patiënten met astma?
Vergelijkingen
- Montelukast en ICS versus gelijke dosis ICS
- Montelukast en ICS versus hogere dosis ICS
Op grond van de relevante vergelijkingen en patiëntrelevante uitkomsten beschrijven we de cochranereview van Chauhan 2017.
Cruciale uitkomstmaten
- Longaanvallen (cruciaal)
- De mate van astmacontrole (cruciaal)
- Astmagerelateerde kwaliteit van leven (cruciaal)
- Longfunctie (belangrijk)
- Bijwerkingen (inclusief minder ernstige) (belangrijk)
- Ernstige bijwerkingen (overlijden, levensbedreigend, ziekenhuisopname noodzakelijk, persisterende beperking) (cruciaal)
Resultaten
Beschrijving onderzoeken
De cochranereview includeerde 37 onderzoeken met in totaal 6128 volwassenen en adolescenten (> 15 jaar) met mild tot matig ernstig astma. Montelukast 10 mg/dag (n = 24), zafirlukast (40-160 mg/dag, n = 11) en pranlukast (450 mg/dag, n = 2). De controlegroep kreeg ICS in uiteenlopende doseringen (budesonide 200 µg tot 1600 µg/dag, beclometason 400 µg tot 4000 µg/dag, fluticason 100-800 µg/dag). De follow-upduur varieerde van 4 weken tot 5 jaar. De primaire uitkomst in de meta-analyse was longaanvallen waarvoor orale corticosteroïden nodig waren. Secundaire uitkomsten waren longaanvallen waarvoor ziekenhuisopname of SEH-bezoek nodig was, longfunctiewaarden, astmacontrole (asthma symptom score), bèta-2-gebruik, nachtelijke klachten, kwaliteit van leven en bijwerkingen.
Kwaliteit van het bewijs (GRADE-waardering van de reviewers)
LTRA en ICS versus gelijke dosis ICS
- Longaanvallen:voor de uitkomst longaanvallen waarvoor orale corticosteroïden werden voorgeschreven, werd afgewaardeerd vanwege tekortkomingen in opzet en uitvoering van het onderzoek (redelijke kwaliteit)
- Astmagerelateerde kwaliteit van leven: niet met GRADE gewaardeerd
- De mate van astmacontrole (asthma symptom score) was van hoge kwaliteit
- Longfunctie was van hoge kwaliteit
- Bijwerkingen: lage kwaliteit; afgewaardeerd vanwege onnauwkeurigheid
- LTRA en ICS versus hogere dosis ICS
- Longaanvallen: voor de uitkomst longaanvallen waarvoor orale corticosteroïden werden voorgeschreven, werd afgewaardeerd vanwege onnauwkeurigheid (redelijke kwaliteit)
- Astmagerelateerde kwaliteit van leven: niet met GRADE gewaardeerd
- De mate van astmacontrole (asthma symptom score): afgewaardeerd vanwege onnauwkeurigheid (redelijke kwaliteit)
- Longfunctie: afgewaardeerd vanwege imprecisie en heterogeniteit (lage kwaliteit)
Effectiviteit
LTRA en ICS versus gelijke dosis ICS
- Longaanvallen: het aantal longaanvallen waarvoor orale corticosteroïdbehandeling geïndiceerd was, was verminderd bij LTRA (GRADE-waardering van de reviewers: redelijke kwaliteit: 4 RCT’s, 815 patiënten, RR 0,50 (95%-BI 0,29 tot 0,86)
- Astmagerelateerde kwaliteit van leven: de cochranereview maakt melding van 1 RCT (n = 325) waarin geen verschil werd gevonden (MD 0,08; 95%-BI -0,06 tot 0,22)
- De mate van astmacontrole. De astmasymptoomscore was lager in de LTRA-groep (SMD -0,15; 95%-BI -0,26 tot -0,05): 3 RCT’s, 1386 patiënten; hoge kwaliteit
- Longfunctie: de PEF was 8,36 L/min (95%-BI 3,64 tot 13,07) hoger in de LTRA-groep, 4 RCT’s, 1489 patiënten. De reviewers waardeerden dit als hoge kwaliteit, de werkgroep waardeert af vanwege imprecisie (breed BI). De FEV1 was 0,11 l hoger (95%-BI 0,03 tot 0,19); 3 RCT’s, 760 patiënten. Dit is meer dan het minimaal klinisch relevante verschil van 100 ml. De reviewers waardeerden dit als hoge kwaliteit, de werkgroep waardeert af vanwege imprecisie (het BI omvat lagere waarden)
- Bijwerkingen (inclusief minder ernstige): de kans op bijwerkingen was iets groter bij LTRA-gebruik (RR 1,06; 95%-BI 0,92 tot 1,22); 3 RCT’s, 1024 patiënten, redelijke kwaliteit
- Mortaliteit: RR 0,35 (95%-BI 0,01 tot 8,49); 2 RCT’s 761 patiënten, 1 sterfgeval; lage kwaliteit
LTRA en ICS versus hogere dosis ICS
- Longaanvallen het aantal longaanvallen waarvoor orale corticosteroïdbehandeling geïndiceerd was verminderde bij LTRA (GRADE-waardering van de reviewers redelijk): RR 0,90 (95%-BI 0,58 tot 1,39); 4 RCT’s, 1179 patiënten. Het betrouwbaarheidsinterval is zowel verenigbaar met een voordeel voor de interventie als voor de controle of geen verschil
- Astmagerelateerde kwaliteit van leven: de cochranereview maakt melding van 1 RCT (n = 75) waarin geen verschil werd gevonden (MD 0,25; 95%-BI -0,14 tot 0,64)
- De mate van astmacontrole: de astmasymptoomscore verschilde vrijwel niet tussen de groepen (SMD-0,2 lager; 95%-BI -0,13 tot 0,08); 3 RCT’s, 1539 patiënten, redelijke kwaliteit
- Longfunctie: de Peak Flow (PEFR) was 10,38 L/min (95%-BI 1,32 tot 22,08) hoger in de LTRA-groep, 5 RCT’s, 925 patiënten, lage kwaliteit. De FEV1 was 0,06l hoger (95%-BI 0,01 tot 0,13); 4 RCT’s, 958 patiënten, lage kwaliteit. Dit is minder dan het minimaal klinisch relevante verschil
- Bijwerkingen (inclusief minder ernstige): de kans op bijwerkingen was iets lager bij LTRA-gebruik RR 0,96 (0,89 tot tot 1,03); 3 RCT’s, 1024 patiënten, De reviewers waardeerden dit als redelijke kwaliteit, de werkgroep waardeert af vanwege imprecisie (lage incidentie)
- Mortaliteit: er waren geen sterfgevallen (3 RCT’s, 834 patiënten, lage kwaliteit)
Conclusies
- Longaanvallen: toevoegen van LTRA aan ICS geeft een vermindering van het risico op longaanvallen (hoge kwaliteit). Verhoging van de ICS-dosis geeft echter een vergelijkbaar effect (redelijke kwaliteit)
- Astmagerelateerde kwaliteit van leven: er was vrijwel geen verschil bij zowel gelijke als hogere dosis ICS
- Mate van astmacontrole: er was vrijwel geen verschil bij zowel gelijke als hogere dosis ICS (redelijk-hoge kwaliteit)
- Longfunctie: LTRA verbeterde de FEV1 iets ten opzichte van gelijke dosis ICS (redelijke kwaliteit), bij hogere dosis ICS was er geen verschil (lage kwaliteit)
- Bijwerkingen (inclusief minder ernstige): LTRA-gebruik gaf geen relevant risico op bijwerkingen (lage kwaliteit)
- Het Farmacotherapeutisch Kompas en de Kennisbank KNMP vermelden het zeer vaak voorkomen van bovensteluchtweginfecties (> 10%). In de SMPC-registratietekst wordt echter vermeld dat deze bijwerking, in klinische studies gemeld als ‘zeer vaak’ bij patiënten die montelukast kregen, ook zeer vaak werden gemeld bij patiënten die placebo kregen. De SMPC-tekst vermeldt ook dat hoofdpijn en buikpijn vaak (≥ 1/100 tot < 1/10) werden gemeld in klinische studies bij met montelukast behandelde astmapatiënten en met een grotere incidentie dan bij met placebo behandelde patiënten.
- Mortaliteit: het is onzeker of er een verschil is in sterfterisico (lage kwaliteit)
Stap 4: Onderhoudsbehandeling met een LABA en een intermediaire tot hogere dosering ICS
Naar Samenvatting ›- Geef een LABA met een intermediaire tot (tijdelijk) hogere dosis ICS indien met stap 3 geen goede astmacontrole is bereikt ( zie tabel 6).
- Een alternatief is een hogere dosis ICS zonder LABA.
- Overweeg bij blijvend onvoldoende astmacontrole tiotropium en/of montelukast 1dd 10 mg toe te voegen of verwijs naar een longarts.
Toevoegen LAMA (tiotropium)
Naar Samenvatting ›- Overweeg toevoeging van tiotropium bij onvoldoende astmacontrole ondanks stap 4-medicatie. De effectiviteit van tiotropium is beperkt.
- Ga na 2 maanden na of er bijwerkingen zijn. Een veelvoorkomende bijwerking is een droge mond.
- Evalueer na 1 jaar de effectiviteit. Staak tiotropium als het geen verbetering van de astmacontrole geeft.
- Geef tiotropium niet als alternatief voor ICS.
De te verwachten verbetering bij triotropiumgebruik is beperkt. Tiotropium zou een alternatief kunnen zijn bij patiënten die LABA’s niet goed verdragen.
Voor- en nadelen van de interventies
Het toevoegen van tiotropium aan ICS geeft mogelijk een iets lager aantal longaanvallen en verbetert de FEV1. De kwaliteit van leven en de astmacontrole verbeteren niet.
Kwaliteit van het bewijs
De kwaliteit van het bewijs voor de verschillende uitkomsten naar tiotropium bij ernstig of niet goed gecontroleerd astma varieert van laag tot hoog.
Waarden en voorkeuren
We schatten in dat patiënten de uitkomsten op eenzelfde manier tegen elkaar zullen afwegen behoudens de longfunctie. Deze laatste wordt door sommige patiënten wel gerelateerd aan klachten en de prognose.
Aanvaardbaarheid/haalbaarheid van de interventie
- Het toevoegen van tiotropium is een betrekkelijk eenvoudige behandelingsoptie bij patiënten die gewend zijn aan inhalatiemedicatie. Het vergt wel een extra handeling en inhalatie.
- Gebruik van een extra inhalator gaat gepaard met enig ongemak.
Achtergrond
Parasympathicolytica
Parasympathicolytica remmen de werking van acetylcholine door competitieve blokkade van de muscarinereceptoren, waardoor het bronchiale gladde spierweefsel relaxeert. Er zijn kortwerkende (SAMA) en langwerkende parasympaticolytica (LAMA). Alleen het langwerkende tiotropium is geregistreerd voor behandeling van astma. Zie de details bij Stap 2 Onderhoudsbehandeling met ICS of ICS-formoterol zo nodig en Stap 3 Onderhoudsbehandeling met een LABA en lage dosis ICS voor onderbouwing van de indicatiestelling. Een veelvoorkomende bijwerking is een droge mond.
LAMA
Het parasympaticolyticum tiotropium (LAMA) is als enige middel binnen deze groep sinds 2014 geregistreerd voor de behandeling van astma. De vraag of tiotropium toegevoegd aan ICS en eventueel een LABA aanbevolen kan worden bij patiënten met astma die niet onder controle is met stap 2- of 3-medicatie is door deze registratie actueel geworden. We beschrijven hier de evidence voor tiotropium als behandelmogelijkheid naast ICS en eventueel een LABA bij patiënten met ernstig astma of matige astmacontrole. Tiotropium is beschikbaar als poederinhalatie of verneveling (mist inhalator). Er is ook een combinatiepreparaat tiotropium met LABA (olodaterol) beschikbaar. De andere in Nederland verkrijgbare LAMA’s glycopyrronium, aclidinium en umeclidinium zijn niet voor astma geregistreerd.
Uitgangsvraag
Is tiotropium als add-on te adviseren bij patiënten met astma?
Vergelijkingen
- Tiotropium + ICS versus gelijke dosis ICS
- Tiotropium + ICS versus hogere dosis ICS
- Tiotropium + ICS versus LABA + ICS
- Tiotropium + LABA + ICS versus LABA + ICS
Cruciale uitkomstmaten voor alle vergelijkingen
- Longaanvallen
- Astmagerelateerde kwaliteit van leven
- De mate van astmacontrole
- Longfunctie
- Ernstige bijwerkingen (overlijden, levensbedreigend, ziekenhuisopname noodzakelijk, persisterende beperking)
In de literatuur is gezocht naar placebogecontroleerde RCT’s waarin tiotropium met gebruikelijke zorg, dat wil zeggen ICS of LABA of ICS + LABA is vergeleken.
Resultaten
Beschrijving onderzoeken
Er werden 7 systematische literatuuronderzoeken met een meta-analyse gevonden naar de vraag of tiotropium als add-on effectief is bij astma, waaronder 3 cochranereviews. De andere reviews vonden overeenkomstige resultaten, maakten geen onderscheid tussen ICS-dosering (gelijk en hoger) of ICS met LABA in de controlegroep of deden geen meta-analyse. Bij het beschrijven van de resultaten voor de eerste 3 vergelijkingen zijn de GRADE-profielen zoals beschreven in de cochranereviews als uitgangspunt genomen. Voor de 4e vergelijking is een GRADE-profiel opgesteld (zie de GRADE-tabel behorend bij het detail Tiotropium in de Totstandkoming).
- Tiotropium + ICS versus gelijke dosis ICS
In een cochranereview werden 5 RCT’s met in totaal 2563 volwassenen geïncludeerd. De follow-up was 12 tot 52 weken. Patiënten waren gemiddeld tussen de 41 en de 48 jaar en hadden een lange voorgeschiedenis van astma. De interventie bestond uit 2,5 of 5 microg tiotropium of placebo. Patiënten bleven gedurende het onderzoek ICS gebruiken in een vaste dosering. Uitkomstmaten waren longaanvallen waarvoor corticosteroïden of ziekenhuisopname nodig waren, kwaliteit van leven (AQLQ-score), ernstige bijwerkingen, longfunctie en astmacontrole (ACQ).
Kwaliteit van bewijs: de reviewers waardeerden de kwaliteit van bewijs hoog voor de uitkomstmaten longaanvallen waarvoor corticosteroïden of ziekenhuisopnamen nodig waren, longfunctie en kwaliteit van leven. Voor de overige uitkomsten (ernstige bijwerkingen en astmacontrole) was de waardering laag tot redelijk; er werd afgewaardeerd voor indirectheid (1 niveau) en heterogeniteit (1 niveau).
- Tiotropium + ICS versus hogere dosis ICS
Een cochranereview die tiotropium + ICS vergeleek met een hogere ICS-dosis includeerde 1 RCT met 221 patiënten met matig tot ernstig astma. Tiotropium + ICS werd vergeleken met verdubbeling van de ICS-dosis (beclometason) in een cross-over design. De follow-up was 14 weken. Uitkomsten: het aantal longaanvallen waarvoor corticosteroïden werden voorgeschreven, SEH-bezoek of ziekenhuisopname nodig was, kwaliteit van leven (AQLQ-score), longfunctie (FEV1) en astmacontrole (ACQ).
Kwaliteit van bewijs: de reviewers waardeerden de kwaliteit van bewijs voor alle uitkomsten als laag vanwege indirectheid (1 niveau) (1 middel van beide geneesmiddelklassen, korte follow-up) en imprecisie (brede betrouwbaarheidsintervallen) (1 niveau). Alleen voor longfunctie werd de kwaliteit redelijk bevonden.
- Tiotropium + ICS versus LABA + ICS
Een cochranereview poolde resultaten van 4 RCT’s met in totaal 2000 patiënten. De inclusiecriteria verschilden tussen de RCT’s, maar alle geïncludeerde patiënten hadden een FEV1 > 40%, reversibiliteit, en gebruikten dagelijks inhalatiemedicatie. De gemiddelde leeftijd lag tussen de 37 en de 45 jaar. In deze RCT’s werd tiotropium (2,5 of 5 microg) vergeleken met salmeterol (50 microg 2 dd) als add-on. Patiënten bleven hun ICS gedurende het onderzoek gebruiken in een vaste dosering. De follow-up was 22-23 weken. Uitkomsten waren het aantal longaanvallen waarvoor corticosteroïden nodig waren, SEH-bezoek of ziekenhuisopname nodig was, kwaliteit van leven (AQLQ-score), longfunctie (FEV1) en astmacontrole (ACQ).
Kwaliteit van bewijs: voor de meeste uitkomsten werd afgewaardeerd vanwege heterogeniteit (1 niveau) en imprecisie (brede of zeer brede betrouwbaarheidsintervallen en lage incidentie: 1 of 2 niveaus). De kwaliteit liep uiteen van zeer laag tot hoog.
- Tiotropium + ICS + LABA versus ICS + LABA
In een SR werd nagegaan of tiotropium als add-on meerwaarde heeft (triple therapy). In 3 RCT’s (n = 1041) werd tiotropium, LABA en ICS vergeleken met LABA en een hogere dosis ICS bij patiënten met ernstig astma. Uitkomsten waren longaanvallen, longfunctie (FEV1), kwaliteit van leven (AQLA) en astmacontrole (ACQ-7).
Kwaliteit van bewijs: de kwaliteit van bewijs was hoog voor de uitkomsten kwaliteit van leven en longfunctie. Voor de uitkomst longaanvallen werd afgewaardeerd vanwege imprecisie (1 niveau). Voor astmacontrole werd afgewaardeerd vanwege heterogeniteit (1 niveau).
Effectiviteit
- Tiotropium + ICS versus gelijke dosis ICS
- Longaanvallen: het aantal longaanvallen waarvoor corticosteroïdbehandeling was geïndiceerd verminderde bij tiotropiumgebruik (GRADE-waardering van de reviewers: 4 RCT’s, n = 2277, hoge kwaliteit van bewijs: OR 0,65; 95%-BI 0,46 tot 0,93). De bovengrens van het betrouwbaarheidsinterval overschrijdt echter de grens van klinische relevantie (10%); wij hebben om deze reden de kwaliteit met 1 niveau verlaagd (redelijk). Het aantal ziekenhuisopnamen vanwege een longaanval verminderde niet significant (5 RCT’s, n = 2562, redelijke kwaliteit: OR 0,42; 95%-BI 0,12 tot 1,47; het absolute aantal opnamen (n = 9) was echter te laag om hier conclusies aan te verbinden.
- Kwaliteit van leven: de score op de AQLQ-vragenlijst was hoger in de tiotropiumgroep (3 RCT’s, n = 1713, hoge kwaliteit: gemiddeld verschil (MD) 0,05; 95%-BI -0,03 tot 0,12). Dit verschil is kleiner dan de MCID (minimal clinical important difference) van -0,5.
- Longfunctie: de FEV1 verbeterde in de tiotropiumgroep ten opzichte van de ICS-groep (5 RCT’s, n = 2459, hoge kwaliteit: toename van 0,14 l; 95%-BI 0,10 tot 0,17).
- Astmacontrole: de ACQ-score verbeterde in de tiotropiumgroep (3 RCT’s, n = 1916, redelijke kwaliteit: MD -0,08, 95%-BI -0,19 tot 0,03). Dit verschil is kleiner dan de MCID (minimal clinical important difference) van -0,5.
- Het aantal ernstige bijwerkingen was niet significant lager bij tiotropiumgebruik (5 RCT’s; n = 2562; lage kwaliteit: OR 0,60; 95%-BI 0,23 tot 1,57).
- Tiotropium + ICS versus hogere dosis ICS
- Longaanvallen: het aantal longaanvallen behandeld met orale corticosteroïden was niet aantoonbaar lager in de tiotropiumgroep (1 RCT, n = 221, lage kwaliteit: OR 0,57; 95%-BI 0,22 tot 1,43). Dit gold ook voor het aantal SEH-bezoeken vanwege een longaanval (OR 0,49; 95%-BI 0,09 tot 2,8). Het aantal ziekenhuisopnamen verschilde niet (OR 1,0; 95%-BI 0,06 tot 16,2).
- De kwaliteit van leven verschilde niet tussen de groepen (1 RCT, n = 221, lage kwaliteit: MD 0,10; 95%-BI –0,07 tot 0,27).
- Longfunctie: de FEV1 verbeterde meer in de tiotropium- dan in de ICS-groep (1 RCT, n = 221, redelijke kwaliteit: MD 0,10, 95%-BI 0,03 tot 0,17), het verschil nam af na salbutamolinhalatie (MD 0,04; 95%-BI 0,01 tot 0,07).
- Astmacontrole: de ACQ-score verbeterde in de tiotropiumgroep meer dan in de ICS-groep (1 RCT, n = 221, lage kwaliteit: MD – 0,18; 95%-BI –0,34 tot –0,02). Dit verschil is kleiner dan de MCID (minimal clinical important difference) van -0,5.
- Het aantal ernstige bijwerkingen verschilde niet tussen de groepen (1 RCT, n = 221, lage kwaliteit: OR 1,0; 95%-BI 0,20 tot 5,09).
- Tiotropium + ICS versus LABA + ICS
- Longaanvallen: het aantal longaanvallen behandeld met orale corticosteroïden verschilde niet tussen de groepen (3 RCT’s, n = 1755, lage kwaliteit: OR 1,05; 95%-BI 0,50 tot 2,18). Het aantal ziekenhuisopnamen was niet aantoonbaar lager in de tiotropiumgroep (4 RCT’s, n = 2022, zeer lage kwaliteit: OR 0,72; 95%-BI 0,18 tot 2,92). Afgaand op de breedte van het BI, was het aantal opnamen vermoedelijk zeer klein (n = niet vermeld).
- Kwaliteit van leven: de tiotropiumgroep scoorde iets lager op de AQLQ (4 RCT’s, n = 1745, hoge kwaliteit: MD -0,12; 95%-BI -0,18 tot -0,05). Dit verschil is kleiner dan de MCID (minimal clinical important difference) van -0,5.
- Longfunctie: de FEV1 was hoger in de tiotropiumgroep, maar het verschil was klein (4 RCT’s, n = 1745, redelijke kwaliteit: MD 0,05; 95%-BI 0,01 tot 0,09) Dit verschil is precies gelijk aan de MCID (minimal clinical important difference) van 0,05.
- Astmacontrole: de ACQ7-score verbeterde iets in de salmeterolgroep (3 RCT’s, n = 1483, hoge kwaliteit: MD 0,06; 95%-BI 0,00 tot 0,13). Dit verschil is kleiner dan de MCID (minimal clinical important difference) van -0,5.
- Bijwerkingen: het aantal ernstige bijwerkingen was lager in de tiotropiumgroep (4 RCT’s; n = 2012, lage kwaliteit: OR 0,84; 95%-BI 0,41 tot 1,73).
- Tiotropium, LABA en ICS versus LABA en ICS (zie GRADE-tabel in de Totstandkoming)
- Longaanvallen: het risico op een longaanval was kleiner bij tiotropiumgebruik (3 RCT’s, n = 1169, lage kwaliteit: RR 0,70; 95%-BI 0,53 tot 0,94). De bovengrens van het betrouwbaarheidsinterval overschrijdt echter de grens van klinische relevantie (10%).
- Kwaliteit van leven: de astmagerelateerde kwaliteit van leven was hoger in de tiotropiumgroep (3 RCT’s, n = 1169, redelijke kwaliteit: MD 0,12 punt; 95%-BI 0,05 tot 0,18,). Dit verschil is kleiner dan de MCID (minimal clinical important difference) van 0,5.
- Longfunctie: de FEV1 verbeterde iets bij tiotropiumgebruik (3 RCT’s, n = 1119, redelijke kwaliteit: MD 0,08; 95%-BI 0,04 tot 0,11). Dit verschil ligt net boven de MCID (minimal clinical important difference) van 0,05.
- Astmacontrole: de ACQ7-score verbeterde iets bij tiotropiumgebruik (2 RCT’s, n = 912, lage kwaliteit: MD -0,20; 95%-BI -0,25 tot -0,09). Dit verschil is kleiner dan de MCID (minimal clinical important difference) van 0,5.
- Het aantal ernstige bijwerkingen: het risico op een ernstige bijwerking was lager bij tiotropiumgebruik (3 RCT’s, n = 1119, zeer lage kwaliteit: RR 0,71; 95%-BI 0,32 tot 1,55).
Bijwerkingen
De cochranereviews vonden minder ernstige bijwerkingen wanneer tiotropium aan ICS en/of LABA werd toegevoegd. De verschillen waren niet significant en de kwaliteit van dit bewijs was laag. Het Farmacotherapeutisch Kompas noemt als mogelijke bijwerking: vaak (1–10%): droge mond. Soms (0,1-1%): (supraventriculaire) tachycardie, hartkloppingen, atriumfibrilleren. Paradoxale bronchoconstrictie, orale of faryngeale candidiasis, hoest, faryngitis, dysfagie, smaakstoornissen, stemstoornissen. Duizeligheid, hoofdpijn, slapeloosheid. Obstipatie. Bemoeilijkte mictie, urineretentie. Huiduitslag, jeuk. Bij hogere leeftijd kan de incidentie van anticholinerge effecten (zoals droge mond en obstipatie) toenemen.
Conclusies
- Longaanvallen: toevoeging van tiotropium aan ICS geeft mogelijk een iets lager aantal longaanvallen dan ICS alleen in hogere of een gelijke dosis (laag respectievelijk redelijke kwaliteit). Het is niet zeker of het aantal ziekenhuisopnamen vanwege een longaanval vermindert.
- Kwaliteit van leven: toevoeging van tiotropium aan ICS bij gelijke of hogere dosis, in plaats van of in combinatie met LABA (salmeterol) gaf geen klinisch relevante verbetering van astmagerelateerde kwaliteit van leven (laag tot hoge kwaliteit).
- Longfunctie: toevoeging van tiotropium aan ICS bij gelijke of hogere dosis, in plaats van of in combinatie met LABA (salmeterol) verbetert de FEV1 (redelijk tot hoge kwaliteit).
- Astmacontrole: toevoeging van tiotropium aan ICS bij gelijke of hogere dosis, in plaats van of in combinatie met LABA (salmeterol) geeft mogelijk wel wat verbetering van de astmacontrole (ACQ), maar dit is niet klinisch relevant (laag tot hoge kwaliteit).
- Ernstige bijwerkingen: het is zeer onzeker of toevoeging van tiotropium aan ICS bij gelijke of hogere dosis, in plaats van of in combinatie met LABA (salmeterol) het risico op ernstige bijwerkingen verlaagt (zeer laag tot lage kwaliteit).
Stap 5: Consultatie longarts
Naar Samenvatting ›Consulteer of verwijs naar de longarts indien in bovenstaande stappen binnen 3 tot 6 maanden geen goede astmacontrole is bereikt.
| Luchtwegverwijder | Dosering in microgram | Maximale dosering per dag |
|---|---|---|
| Kortwerkende luchtwegverwijders (short acting beta-2-agonists; SABA) | ||
| Salbutamol | ||
| Aerosol Poeder (let op: dosering afhankelijk van de toedieningsvorm) |
1-4 dd 100-400 1-4 dd 100-400 |
800 800-1600 |
| Terbutaline | ||
| Poeder | 1-4 dd 250-500 | 4 dd 1000 |
| Langwerkende bèta-2-agonist-luchtwegverwijders (long acting beta-2-agonists; LABA) | ||
| Formoterol | ||
| Aerosol Poeder |
2 dd 12 1-2 dd 6-12 |
2 dd 24 (Kortdurend: 2 dd 36 maximaal) |
| Salmeterol | ||
| Aerosol Poeder |
2 dd 50 (2 maal 25) 2 dd 50 |
2 dd 100 |
| Langwerkende muscarine antagonist luchtwegverwijders (long acting muscarin antagonists; LAMA) | ||
| Tiotropium | ||
| Vloeistof (mist inhalator) Poeder (offlabel) |
1 dd 5 1 dd 18/10* |
Idem |
| * De dosering die het mondstuk verlaat is bij beide toedieningsvormen 10 microgram. Bron: KNMP Kennisbank |
||
| Inhalatiesteroïde | Lage (start)dosering | Intermediaire dosering | Hogere dosering (meestal tijdelijk) |
|---|---|---|---|
| Beclometason | |||
| Aerosol Poeder Aerosol extrafijn |
2 dd 200 2 dd 200 2 dd 100 |
2 dd 400 2 dd 400 2 dd 200 |
2 dd 500 2 dd 800 2 dd 400 |
| Budesonide | |||
| Aerosol Poeder |
2 dd 200 2 dd 200 |
2 dd 400 2 dd 400 |
2 dd 800 2 dd 800 |
| Fluticasonpropionaat | |||
| Aerosol Poeder |
2 dd 125 2 dd 100 |
2 dd 250 2 dd 250 |
2 dd 500 2 dd 500 |
| Ciclesonide | |||
| Aerosol | 1 dd 80 | 1 dd 160 |
2 dd 320 (= maximum) |
| Combinatiepreparaat | Lage (start)dosering | Intermediaire dosering | Hogere dosering (meestal tijdelijk) |
|---|---|---|---|
| Beclometason/formoterol | |||
| Aerosol/poeder (extrafijn) | 2 dd 100/6 | 2 dd 2 x 100/6 (of 2 dd 200/6) |
2 dd 2 x 200/6 |
| Budesonide/formoterol | |||
|
Aerosol (offlabel) Poeder |
2 dd 200/6 2 dd 160/4,5 |
2 dd 2 à 200/6 2 dd 320/9 |
2 dd 4 à 200/6 2 dd 2 x 320/9 |
| Fluticason/salmeterol | |||
| Aerosol Poeder |
2 dd 2 x 50/25 2 dd 100/50 |
2 dd 2 x 125/25 2 dd 250/50 |
2 dd 2 x 250/25 2 dd 500/50 |
| Fluticason/vilanterol* | |||
| Inhalatiepoeder | 1 dd 92/22 | 1 dd 184/22 | |
| Budesonide/salmeterol* | |||
| Inhalatiepoeder | 2 dd 120/20 | 2 dd 240/20 | |
| Fluticason/formoterol | |||
| Aerosol | 2 dd 2 x 50/5 | 2 dd 2 x 125/5 | 2 dd 2 x 250/10 |
| * Van deze middelen zijn 2 doseringssterktes geregistreerd. | |||
Overige geneesmiddelen bij astma
Naar Samenvatting ›Kortwerkende (SAMA) parasympathicolytica
Naar Samenvatting ›Adviseer geen SAMA bij de behandeling van volwassen patiënten met astma voor gebruik zo nodig of als onderhoudsbehandeling.
Er zijn geen systematische literatuuronderzoeken gevonden over kortwerkende anticholinergica voor ‘zo nodig’-gebruik door volwassenen met astma.
In een cochranereview (13 onderzoeken, n = 205) over het gebruik van (kortwerkende) anticholinergica als onderhoudsbehandeling door volwassen patiënten met astma werden anticholinergica met placebo vergeleken.
In deze review werd naast ipratropium ook onderzoek met ander anticholinergica, zoals oxitropiumbromide, geïncludeerd. De kwaliteit van de geïncludeerde onderzoeken was beperkt en de onderzoeken waren gedateerd. Deze onderzoeken bestudeerden een veelheid aan uitkomstmaten, waarbij de overlap tussen de onderzoeken gering was, zodat de mogelijkheid tot meta-analyse van de data beperkt was tot 3 onderzoeken met 70 patiënten. Op de uitkomstmaten symptoomscore, patiëntenvoorkeuren, uitval en bijwerkingen werd geen verschil aangetoond tussen ipratropium en placebo. Bij de uitkomstmaat PEF was er wel een verschil tussen ipratropium en placebo; het gemiddelde verschil was 14,4 l/min (95%-BI 7,7 tot 21,1); dit is klinisch niet relevant. De uitkomstmaat FEV1 is in dit onderzoek niet onderzocht.
Conclusie
Ipratropium heeft geen plaats in de standaardbehandeling van volwassen patiënten met astma.
Geneesmiddelen bij allergische rinitis
Naar Samenvatting ›- Behandeling van allergische klachten is veelal van belang voor het bereiken van goede astmacontrole.
- Zie ook Prikkelreductie.
- Behandel allergische rinitis volgens de NHG-Standaard Allergische rinitis met bijvoorbeeld orale en nasale antihistaminica en een corticosteroïdneusspray.
Uit verschillende onderzoeken blijkt dat 15 tot 40% van de patiënten met allergische rinitis astma heeft.
Omgekeerd heeft een groot deel van de patiënten met astma ook allergische rinitis.
Men denkt dat er bij prikkeling van de bovenste luchtwegen ook een reactie in de onderste luchtwegen kan ontstaan. Onderzoek heeft aangetoond dat een allergische prikkel van het neusslijmvlies bij mensen met allergische rinitis maar zonder astma leidt tot migratie van eosinofiele cellen vanuit het neusslijmvlies tot in de circulatie, rekrutering in het beenmerg van nieuwe eosinofiele cellen, wat uiteindelijk resulteert in een episode van astma in de lage luchtwegen.
In 2001 stelde een panel van experts dat optimale behandeling van rinitis bij astmapatiënten de astma kan verminderen.
Een in 2003 uitgevoerde meta-analyse (12 onderzoeken, n = 425) naar het effect van intranasale corticosteroïden op de astmaklachten toonde echter geen statistisch significant effect aan wat betreft verbetering van astmaklachten, longfunctie en hyperreactiviteit.
Conclusie
Hoewel nog niet duidelijk is of behandeling van allergische rinitis astmaklachten vermindert, lijkt een optimale behandeling van allergische rinitis bij astmapatiënten zinvol.
Griepvaccinatie
Naar Samenvatting ›- We bevelen jaarlijkse griepvaccinatie (zie de NHG/SNPG-Praktijkhandleiding Griepvaccinatie) aan voor patiënten met astma met een onderhoudsbehandeling met inhalatiecorticosteroïden.
- Bespreek met patiënten die twijfelen over het nut van vaccineren dat het bewijs voor effectiviteit van de griepvaccinatie bij astma gering is.
Algehele kwaliteit van bewijs
De algehele kwaliteit van het bewijs is zeer laag voor alle uitkomsten.
Balans voor en nadelen
Het aanbieden van een griepvaccinatie aan astmapatiënten is al vele jaren standaardbeleid. Vaccinatie kan mogelijk het aantal griepgevallen verminderen, maar het is onzeker of het risico op longaanvallen, SEH-bezoek, ziekenhuisopname en luchtwegziektes erdoor vermindert. De werkgroep weegt af dat de nadelen van niet-vaccineren mogelijk groter zijn dan van vaccineren.
Aanvaardbaarheid/haalbaarheid
De interventie is haalbaar; deze wordt al vele jaren aangeboden. Tot op heden heeft het NHG het advies van de Gezondheidsraad gevolgd. Omdat tot op heden geen reactie is gekomen op het verzoek van het NHG dit advies opnieuw te bezien heeft de werkgroep besloten de afweging opnieuw te maken. Als gevolg van de wetenschappelijke discussie die ook in de media wordt gevoerd is de aanvaardbaarheid de afgelopen jaren verminderd.
Kosten
De kosten van griepvaccinatie bedragen iets meer dan € 17 per vaccin plus de kosten voor de toediening door de huisarts (bron: medicijnkosten.nl, juni 2020). Er is niet gezocht naar kosten-effectiviteitsonderzoek waarin de medische kosten en verlies aan arbeidsproductiviteit als gevolg van griepgerelateerde klachten en complicaties bij astmapatiënten zijn onderzocht.
Verdere overwegingen
Het NHG volgt het advies van de gezondheidsraad om geen verwarring te creëren en vanuit het algemeen belang dat voorzichtig moet worden omgesprongen met twijfels over het nut van vaccineren. Er is geen nieuwe evidence beschikbaar sinds het laatste rapport van de raad; een wijziging van het huidige advies op basis van evidence is daarom niet waarschijnlijk. Een beperking van de vraagstelling is bovendien dat deze tot astmapatiënten is beperkt; het is de vraag of het effect voor iedere chronische aandoeningen separaat zou moeten worden onderzocht.
Achtergrond
Het advies om astmapatiënten zich jaarlijks te laten vaccineren tegen seizoensgriep is in 2007 geformuleerd door de Gezondheidsraad.
De analyses concentreerden zich vrijwel alleen op kinderen met astma (tot 18 jaar). In de herziening van het advies in 2011 oordeelde de raad: ‘gezien de beperkingen van het onderzoek was het niet duidelijk welke conclusies daaraan verbonden kunnen worden.’ De raad oordeelde dat een gunstig effect van vaccinatie niet verworpen kan worden. Verder oordeelde de raad dat: ‘nader onderzoek naar de effectiviteit van griepvaccinatie bij kinderen met astma werd aanbevolen’.
In de herziening van 2014 wordt niet over de astma-indicaties bij kinderen of volwassenen gerept.
Op basis van een cochranereview waarin geconcludeerd werd dat er geen verschil was tussen longaanvallen, FEV1 en gebruik van bronchodilatatoren, werd in de MDR de volgende aanbeveling opgenomen: ‘Bij volwassen en kinderen met astma is influenzavaccinatie mogelijk niet meer geïndiceerd voor alle patiënten.’
Aldus ontstond er een discrepantie tussen het advies van de Gezondheidsraad en de aanbeveling uit de MDR. Dit heeft geleid tot een discussie binnen de werkgroep en met de AC, waarvan de uitkomst was: ‘Het Nederlands Huisartsen Genootschap is van mening dat patiënten en huisartsen gebaat zijn bij een eenduidig beleid. Om die reden adviseert het Nederlands Huisartsen Genootschap voorlopig de adviezen van de Gezondheidsraad op te volgen.’ Naar aanleiding hiervan heeft het NHG de Gezondheidsraad gevraagd het advies over griepvaccinatie voor astmapatiënten opnieuw te bezien. Voor zover bekend heeft dit tot op heden nog niet tot een nieuwe publicatie geleid. Uit de knelpuntenanalyse kwam opnieuw de vraag om het advies over seizoensgriepvaccinatie voor astmapatiënten te actualiseren naar voren.
Uitgangsvraag
Is seizoensgriepvaccinatie aan te bevelen aan volwassenen met astma?
Cruciale uitkomsten
- Griepinfecties
- Lageluchtweginfecties
- Astma-longaanvallen
- Mortaliteit
Resultaten
Beschrijving onderzoeken
Een literatuuronderzoek leverde een systematische review op van Vasileiou waarin 35 artikelen werden geïncludeerd met in totaal 142.519 patiënten voor een kwalitatieve synthese, en 4 voor een meta-analyse.
Het betrof 26 trials, waarvan 6 niet-gerandomiseerd en daarnaast 9 observationele onderzoeken.
Uitkomsten waren griep, astma-longaanval, ziekenhuisopname, SEH-bezoek, luchtwegziekte, medicatiegebruik, school of werkverzuim en veiligheid.
Kwaliteit van bewijs
Uit de analyse met behulp van GRADE (in de supplementary files) werd de kwaliteit van bewijs voor alle uitkomsten inclusief de veiligheidsuitkomsten zeer laag gewaardeerd. Er werd afgewaardeerd vanwege tekortkomingen in onderzoeksopzet en uitvoering, inconsistentie, imprecisie, indirectheid en het risico op publicatiebias.
Effectiviteit:
- Het aantal griepinfecties was lager onder gevaccineerden (gepoolde OR uit 2 observationele onderzoeken (n = 1825) 0,55 (95%-BI 0,44 tot 0,69); gepoolde RR uit 2 RCT’s (n = 61) 0,19 (95%-BI 0,06 tot 0,67); totaal: 7 onderzoeken (kwaliteit van bewijs zeer laag).
- Het aantal luchtwegziekten verminderde eveneens onder gevaccineerden (gepoolde RR uit 2 RCT’s 0,28 (95%-BI 0,10 tot 0,80) (kwaliteit van bewijs zeer laag).
- Voor alle overige uitkomsten, astma-longaanvallen, inclusief de veiligheidsuitkomsten (bijwerkingen) kon geen gepoold effect berekend worden vanwege te grote heterogeniteit. Mortaliteit werd niet gerapporteerd.
In de hoofdtekst van het artikel wordt een aantal uitkomsten narratief beschreven. Hierin wordt beschreven dat vaccinatie 59 tot 78% van de astma-longaanvallen kan voorkomen die tot SEH-bezoek of ziekenhuisopname leiden (zeer lage kwaliteit van bewijs).
Conclusie
Het is zeer onzeker of seizoensgriepvaccinatie het aantal griepgevallen en luchtwegziekten bij astmapatiënten vermindert (zeer lage kwaliteit van bewijs). Voor de overige uitkomsten zijn geen conclusies te rapporteren (effecten niet te berekenen en zeer lage kwaliteit van bewijs).
Gebruik van bètablokkers bij astma
Naar Samenvatting ›- Astma al dan niet in combinatie met COPD is geen contra-indicatie voor het gebruik van bèta-1-selectieve bètablokkers.
- Heroverweeg bij onvoldoende astmacontrole ondanks optimale behandeling de (cardiovasculaire) indicatie van een (niet-)selectieve bètablokker.
In een cochranereview (19 onderzoeken eenmalige dosis, 10 onderzoeken langduriger behandeling) werd na een eenmalige dosis van een bèta-1-selectieve bètablokker een FEV1-afname van 7,5% gevonden (95%-BI 5,6 tot 9,3), terwijl ondanks de bètablokker na een bèta-2-agonist een toename van de FEV1 (4,6%; 95%-BI 2,5 tot 6,8) behouden bleef in vergelijking met placebo. Langduriger behandeling (3 tot 28 dagen) resulteerde niet in een verandering van FEV1, klachten of gebruik van inhalatiemiddelen, terwijl na een bèta-2-agonist een toename van de FEV1 behouden bleef (8,7%; 95%-BI 2,0 tot 15,5).
Conclusie
Bij licht of matig ernstig astma veroorzaken bèta-1-selectieve bètablokkers op korte termijn geen respiratoire bijwerkingen.
Protonpompremmers
Naar Samenvatting ›We bevelen geen protonpompremmers aan bij de behandeling van astma; astma is daarentegen geen contra-indicatie voor de gastro-intestinale indicatie van een protonpompremmer.
De werkgroep verwijst hiervoor naar de LAN-richtlijn Astma, waaruit onderstaande tekst is overgenomen.
‘Chan et al. beschreven de resultaten van een systematische review met meta-analyse over de effectiviteit van protonpompremmers (PPI) bij de behandeling van astma bij volwassen patiënten. Gastro-oesofageale reflux was niet in alle geïncludeerde onderzoeken een inclusiecriterium.
In deze review werden onderzoeken opgenomen uitgevoerd bij volwassen patiënten met astma waarin ten minste 4 weken behandeling met PPI werd vergeleken met placebo. De primaire uitkomstmaat in dit onderzoek was het gemiddelde verschil in de ochtend PEF tussen patiënten behandeld met PPI en placebo. Secundair werd ook gekeken naar andere longfunctiematen, astmacontrole en kwaliteit van leven. In totaal werden 11 onderzoeken geïncludeerd met in totaal 2524 patiënten. De behandeling bestond uit omeprazol, lasoprazol, pantoprazol, esomeprazol of rabeprazol, met een dosering van 2 tot 80 mg per dag, gedurende 4 tot 26 weken. Er werd een gepoold gemiddeld verschil tussen PPI en placebo gevonden in ochtend PEF van 8,68 l/min (95%-BI 2,35 tot 15,02). Een subanalyse van patiënten met en zonder diagnose gastro-oesofageale reflux liet vergelijkbare resultaten zien. In de review van Chan werd in 3 geïncludeerde onderzoeken gekeken naar astmaklachten. Er werden statistisch niet-significante verschillen gevonden ten aanzien van astmasymptoomscore (gestandaardiseerd gemiddeld verschil 0,11; 95%-BI −0,42 tot 0,26) en kwaliteit van leven (AQLQ(S); gepoold gemiddeld verschil 0,197; 95%-BI −0,078 tot 0,472).’
Conclusie
Er is bewijs van hoge kwaliteit dat PPI’s de ochtend-PEF iets verbetert in vergelijking met placebo bij volwassenen met astma, maar dit resultaat is klinisch niet relevant. Er is bewijs van redelijke kwaliteit dat PPI’s niet van invloed zijn op astmacontrole in vergelijking met placebo bij volwassenen met astma. Er is bewijs van lage kwaliteit dat PPI’s niet van invloed zijn op de kwaliteit van leven in vergelijking met placebo bij volwassenen met astma.
Subcutane of sublinguale immunotherapie
Naar Samenvatting ›We bevelen geen subcutane of sublinguale immunotherapie aan bij de behandeling van astma in de 1e lijn.
In een cochranereview (88 onderzoeken, 42 over huisstofmijtallergeen, 27 over pollenallergeen, 10 over huisdierallergeen) werd bij subcutane immunotherapie een verbetering in astmasymptoomscores gezien (gestandaardiseerd gemiddeld verschil −0,6; 95%-BI −0,8 tot −0,4) in vergelijking met bij placebo (NNT 3; 95%-BI 3 tot 5). Immunotherapie was geassocieerd met minder bronchiale hyperreactiviteit dan placebo (vooral allergeenspecifiek). Er werd geen consistent effect op de longfunctie gevonden. Bijwerkingen kwamen voor bij 1/16 (lokaal) en 1/9 (systemisch) van de deelnemers. In een meta-analyse (25 onderzoeken; n = 1706; waarvan 8 over huisstofmijtallergeen, 14 over pollenallergeen en 3 met andere allergenen; follow-up 3 maanden tot 3 jaar) werd bij sublinguale immunotherapie minder vaak een verslechtering van het astma (samengestelde uitkomstmaat, bestaand uit astmaklachten, gebruik ‘zo nodig’-medicatie, longfunctie) gezien dan bij placebo (23% (116/497) versus 51% (195/379)). Er werd een niet-significant verschil gezien in astmaklachten als afzonderlijke uitkomstmaat (gestandaardiseerd gemiddeld verschil –0,38; 95%-BI –0,79 tot 0,03). Er werden geen ernstige bijwerkingen gevonden, terwijl lichte bijwerkingen zoals jeuk of roodheid in de mond wat vaker voorkwamen (immunotherapie 14% (116/830) versus placebo 9% (60/671)). In de meta-analyse is sublinguale immunotherapie alleen met placebo vergeleken en niet met de gangbare medicamenteuze behandeling. Door de samengestelde uitkomstmaat van de meta-analyse is de klinische relevantie van het effect moeilijk in te schatten.
Conclusie
Er is enig bewijs voor de werkzaamheid van subcutane en sublinguale immunotherapie bij allergisch astma. Het gebruik van subcutane immunotherapie wordt beperkt door de – weliswaar kleine – kans op ernstige anafylactische reacties en het ongemak van regelmatig terugkerende injecties. De werkgroep is daarom terughoudend in het gebruik van subcutane immunotherapie in de 1e lijn. Voor de plaatsbepaling van sublinguale immunotherapie in de 1e lijn is verder onderzoek nodig, zoals vergelijking met de gebruikelijke behandeling, bepaling van de optimale onderhoudsdosis en van de werkzaamheid op lange termijn, en vaststelling van de meest geschikte patiëntengroep.
Medicamenteuze behandelmogelijkheden in de 2e lijn
Naar Samenvatting ›In de 2e lijn bestaan voor bepaalde patiënten met persisterend onvoldoende astmacontrole onder meer de volgende medicamenteuze behandelmogelijkheden:
- Subcutane en sublinguale immunotherapie bij patiënten met (voornamelijk) een mono-allergie
- Behandeling met monoklonale antilichamen (biologicals); toediening van omalizumab, een monoklonaal antilichaam tegen IgE, mepolizumab, reslizumab en benralizumab (monoklonale antilichamen tegen IL-5/IL5R) en dupilumab (anti IL4/IL-13)
- Behandeling met systemische corticosteroïden
- Onderhoudsbehandeling met een macrolide of antimycoticum
Zwangerschap en borstvoeding
Naar Samenvatting ›Zwangerschap
Naar Samenvatting ›- Goede astmacontrole met medicamenteuze behandeling tijdens de zwangerschap is veiliger en geeft minder complicaties dan het accepteren van astmaklachten en longaanvallen door het staken van medicatie uit zorg over bijwerkingen voor het kind.
- Salbutamol, terbutaline, salmeterol, formoterol, fluticason, beclometason en budesonide kunnen in de gebruikelijke dosering zonder problemen worden gebruikt; dit geldt ook voor combinatiepreparaten van deze middelen.
- De ervaring met het gebruik van andere geneesmiddelen (waaronder montelukast en tiotropium) tijdens de zwangerschap is beperkt. Zet deze middelen bij voorkeur om naar een geneesmiddel waarvan meer bekend is over de risico’s.
- Bij een ernstige longaanval weegt het voorkomen van hypoxemie zwaarder dan de eventuele risico’s van systemische corticosteroïden voor de foetus en de zwangere (zwangerschapshypertensie, vroeggeboorte, groeivertraging en laag geboortegewicht). Behandel een longaanval tijdens de zwangerschap op dezelfde manier als buiten de zwangerschap.
- Roken tijdens de zwangerschap heeft negatieve gevolgen voor de longgroei en vergroot het risico op COPD op jongere leeftijd.
Voor meer informatie over astma en zwangerschap, zie de multidisciplinaire richtlijn Astma en Zwangerschap. De belangrijkste aanbevelingen voor de huisarts uit deze richtlijn zijn opgenomen in de bijlage Samenvatting van de belangrijkste aanbevelingen.
Borstvoeding
Naar Samenvatting ›- Salbutamol, terbutaline, beclometason, budesonide, fluticason en ciclesonide kunnen zonder problemen bij borstvoeding gebruikt worden.
- Voor formoterol en salmeterol geldt dat alleen bij gebruik van een zeer hogere dosis door de moeder dit rusteloosheid en tachycardie bij de zuigeling kan veroorzaken.
- Over het gebruik van montelukast en tiotropium tijdens borstvoeding is onvoldoende bekend; het is waarschijnlijk veilig. Overweeg montelukast of tiotropium (tijdelijk) te staken.
Monitoring
Naar Samenvatting ›- Bij iedere controle staat de anamnese centraal. Eventuele spirometriegegevens dienen ter ondersteuning.
- Maak bij ieder monitoringsconsult onderscheid tussen goede en onvoldoende astmacontrole (zie Astmacontrole). Gebruik hiervoor een vragenlijst (ACQ6, 6 items; range 0-6, afwijkend bij score ≥ 0,75 of ACT, 5 items; range 5-25; afwijkend bij score < 20); zie ook screeningsinstrumenten CAHAG.
- Wees bij patiënten > 40 jaar alert op de ontwikkeling van COPD naast astma.
- Overweeg bij patiënten die na initiële diagnostiek en behandeling blijvend onvoldoende reageren op behandeling met ICS de mogelijkheid van niet-allergisch astma, zoals bij patiënten met obesitas (BMI > 30) of als de astmaklachten op de volwassen leeftijd zijn ontstaan. Overweeg deze patiënten te verwijzen naar een longarts.
Frequentie van monitoring astma
Naar Samenvatting ›Bij onvoldoende astmacontrole
- Monitor patiënten met onvoldoende astmacontrole elke 6-12 weken totdat persoonlijke behandeldoelen zijn bereikt en de medicatie optimaal is gedoseerd.
- Verwijs bij blijvend onvoldoende astmacontrole na 3-6 maanden of het niet bereiken van de persoonlijke behandeldoelen ondanks stap 4-medicatie naar een longarts.
Bij goede astmacontrole
- Monitor patiënten met een goede astmacontrole met stap 1-medicatie jaarlijks, tenzij anders afgesproken.
- Monitoring kan desgewenst telefonisch of per e-mail (zie Spirometrie in de monitoringsfase).
- Er is een groep patiënten die gemakkelijk SABA gebruikt of blijft gebruiken zonder strikt genomen een indicatie te hebben voor stap 2-medicatie (zie Stap 1: SABA of ICS-formoterol zo nodig). Betrek bij het vaststellen van de optimale monitoringsfrequentie de (SABA-)herhaalreceptuur en maak indien mogelijk gebruik van gegevens van de apotheek om na te gaan hoe vaak de patiënt een SABA gebruikt.
- Monitor patiënten met een goede astmacontrole met stap 2-medicatie of stap 3-medicatie jaarlijks inclusief spirometrie (stap 2 alleen de eerste 3 jaar spirometrie, de beste FEV1 geldt als uitgangswaarde).
- Monitor alle patiënten die roken met astma jaarlijks inclusief spirometrie; ook bij goede astmacontrole en stap 1-medicatie.
| Frequentie | Gebruik luchtwegmedicatie | Gestandaardiseerde bronchusverwijding | Interpretatie |
|---|---|---|---|
|
6-12 weken Jaarlijks Gedurende de eerste 3 jaar jaarlijks |
Eigen luchtwegmedicatie voorafgaand aan monitoringsconsult continueren | Alleen bij: discrepantie tussen klachten en spirometrie of twijfel aan diagnose twijfel over (wijze van) gebruik eigen medicatie |
Fysiologische daling: Persisterende obstructie of meer dan fysiologische daling FEV1 |
Achtergrond
De multidisciplinaire richtlijn astma stelt dat monitoring bij onderhoudsinhalatiemedicatie minimaal jaarlijks nodig is. Deze frequentie is op grond van consensus vastgesteld. De vraag is of monitoring met goede astmacontrole minder frequent zou kunnen, of alleen bij toename van klachten.
Uitgangsvraag
Verbetert regelmatige monitoring bij patiënten met goede astmacontrole de uitkomsten voor de patiënt op langere termijn?
Methode
Een search in maart 2018 leverde geen hits op. Hieronder wordt weergegeven wat 3 (inter)nationale richtlijnen hierover schrijven.
Resultaten
Citaten over monitoring astma bij volwassenen:
- National Asthma Control Initiative. A program of the National Institutes of Health. Artikel GIP Priority Message: Schedule Follow-up Visits: Patiënts who have asthma should be scheduled for planned follow-up visits at periodic intervals in order to assess their asthma control and modify treatment if needed.
- National Institute for health and Care Excellence. Asthma: diagnosis, monitoring and chronic asthma management: The focus of asthma management in recent years has been on supporting people with asthma and their healthcare professional to devise a personalised treatment plan that is effective and relatively easy to implement. Monitor asthma control at every (annual) review.
- Global INitiative for Asthma. Global strategy for asthma management and prevention: A component of effective asthma self-management education is regular review by a health care provider. Follow-up consultations should take place at regular intervals.
Samenvatting
Frequentie van monitoring astma bij volwassenen wordt niet genoemd in (internationale) richtlijnen of niet met onderzoek onderbouwd. De frequentie van monitoring astma bij volwassenen berust (internationaal) op consensus.
Overige overweging
Een betrouwbare uitspraak over een versnelde daling van de FEV1 kan slechts worden gedaan indien verschillende metingen (minimaal 3) over een langere periode (minimaal 2 jaar) worden verricht. Bij blijvend goede astma controle is spirometrie nadien niet van toegevoegde waarde.
Astmacontrole
Naar Samenvatting ›Vraag naar:
- astmaklachten
- nachtrust
- ervaren beperkingen
- frequentie van het gebruik van SABA of extra formoterol-ICS
- het aantal longaanvallen waarvoor een orale corticosteroïdkuur of ziekenhuisopname noodzakelijk was
Vragenlijsten over astmacontrole in de monitoringfase
Naar Samenvatting ›Maak gebruik van een korte vragenlijst, zoals de ACQ6 of ACT.
Een voordeel van gebruik van een vragenlijst is dat systematisch klachten en beperkingen kunnen worden gemeten. Door de behandeling af te stemmen op de ervaren beperkingen en klachten en niet uitsluitend op de longfunctie, kan de tevredenheid van de patiënt over de behandeling toenemen. Gevalideerde vragenlijsten voor het meten van de astma-instelling zijn de Asthma Control Test (ACT; 5 vragen met antwoorden op een 5-puntsschaal; score ≤ 19 = slechte controle) (www.asthmacontrol.com) en de Asthma Control Questionnaire (ACQ-7; 7 items; score 0 tot 6; score < 0,75 = goede astmacontrole; > 1,50 = slechte astmacontrole, tussen 0,75 en 1,50 = gedeeltelijke astmacontrole; of ACQ-6; 6 items (zonder FEV1); < 0,75 = goede astmacontrole en > 1,50 = slechte astmacontrole). Jia et al. onderzochten in een systematische review de Asthma Control Test en de Asthma Control Questionnaire om de mate van astmacontrole te bepalen. In dit onderzoek werden 3 onderzoeken geïncludeerd die zowel de ACT als de ACQ bestudeerden, 12 over de ACT en 6 over de ACQ. In totaal werden ongeveer 23.500 patiënten geïncludeerd in de analyse. De gepoolde uitkomsten die werden gevonden voor diagnostische accuratesse van de verschillende meetinstrumenten staan vermeld in onderstaande tabel.
| Mate van astmacontrole | Vragenlijst | Sensitiviteit (95%-BI) | Specificiteit (95%-BI) |
|---|---|---|---|
| Goede astmacontrole | ACT ACQ-7 ACQ-6 |
0,77 (0,68-0,84) 0,95 (0,90-0,99) 0,91 (0,85-0,96) |
0,84 (0,74-0,91) 0,50 (0,36-0,63) 0,62 (0,54-0,69) |
| Gedeeltelijke astmacontrole | ACT ACQ-7 ACQ-6 |
0,75 (0,63-0,83) 0,74 (0,61-0,83) 0,65 (0,52-0,76) |
0,82 (0,76-0,87) 0,81 (0,72-0,88) 0,90 (0,86-0,92) |
| Slechte astma | ACT | 0,49 (0,42-0,56) | 0,92 (0,86-0,96) |
In de 3 genoemde vragenlijsten worden klachten overdag, klachten ’s nachts, beperking in activiteiten en gebruik van SABA geïnventariseerd. Bij de ACT is daarnaast de door de patiënt ervaren ziektelast van belang en bij de ACQ-7 wordt de longfunctie in kaart gebracht.
De auteurs concluderen dat de ACT en de ACQ-6 en ACQ-7 gebruikt kunnen worden om onderscheid te maken tussen goede en onvoldoende astmacontrole. Hierbij geven zij aan dat er een lichte voorkeur bestaat voor de ACT boven de ACQ, vanwege de betere diagnostische accuratesse en omdat er voor de ACQ nog validatieonderzoeken nodig zijn. Beide vragenlijsten zijn volgens de auteurs niet geschikt om onvoldoende astmacontrole aan te tonen. Het minimaal klinisch relevante verschil van de ACQ is 0,5 en van de ACT 3 punten.
Overweging
De ACT en de ACQ-6 zijn in de praktijk makkelijker toepasbaar en dragen bij aan gestandaardiseerde monitoring. Gebruik van vragenlijsten moet niet in de plaats komen van een gerichte anamnese. In deze versie van de NHG-Standaard Astma is de driedeling goede, gedeeltelijke en slechte astmacontrole vervangen door de tweedeling goede en onvoldoende astmacontrole op grond van een vragenlijst (ACQ-6 of ACT).
Monitoring niet-medicamenteuze adviezen
Naar Samenvatting ›Bespreek de TIP-aandachtspunten:
- Therapietrouw
- adequate Inhalatietechniek
- het vermijden van Prikkels die klachten uitlokken of verergeren
en daarnaast:
- de rookstatus
- gewichtsreductie bij overgewicht
- beperkingen in het functioneren
- psychische of sociale gevolgen van astma (bijvoorbeeld angst voor dyspneu, vermijden van inspanning of sociale activiteiten waarbij wordt gerookt of een kat of huisstof aanwezig is)
Monitoring medicamenteuze behandeling
Naar Samenvatting ›- Stel de medicatie bij onvoldoende astmacontrole bij aan de hand van het stappenplan.
- Bespreek eventuele bijwerkingen van medicatie, zoals heesheid of hematomen bij ICS.
- Overweeg bij goede astmacontrole gedurende 3 maanden de onderhoudsmedicatie te minderen tot de laagste effectieve dosis ICS, al dan niet in combinatie met een LABA. Hervat bij verslechtering na de medicatiewijziging het oorspronkelijke middel of pas de dosis aan. Streef naar een stabiele situatie.
- Controleer het gebruik van de inhalatiemedicatie.
- Check of de patiënt nog steeds de voorgeschreven inhalator gebruikt, of dat deze is omgezet naar een andere inhalator.
- Behandel een eventueel aanwezige allergische rinitis.
Spirometrie in de monitoringsfase
Naar Samenvatting ›- Spirometrie tijdens de monitoringsfase heeft tot doel onopgemerkte obstructie te signaleren en versneld longfunctieverlies vroegtijdig te signaleren.
- Ga bij (reversibele) obstructie de niet-medicamenteuze adviezen na en overweeg de medicatie aan te passen volgens het stappenplan.
- Zie tabel 7 voor frequentie, uitvoering en interpretatie van spirometrie in de monitoringsfase.
Spirometrie in de monitoringfase (dus niet als diagnostiek) bestaat uit een meting onder gebruik van eigen medicatie van de patiënt. De patiënt hoeft de eigen medicatie voor controlespirometrie niet te staken. Gestandaardiseerde bronchusverwijding is alleen zinvol bij discrepantie tussen klachten en spirometrie of bij twijfel aan de diagnose of twijfel over de (wijze van) gebruik van inhalatiemedicatie. Spirometrie tijdens de monitoringsfase heeft tot doel onopgemerkte obstructie te signaleren en na te gaan of deze reversibel is.
Er is geen bewijs gevonden voor het nut van het meegeven van een handspirometer om de longfunctie thuis of elders te registreren, bijvoorbeeld als er onduidelijkheid bestaat over het effect van de behandeling of over het belang van beroepsgebonden of andere uitlokkende factoren. De fysiologische achteruitgang van de FEV1 vanaf de leeftijd van 30 jaar is 25 tot 35 ml per jaar. Bij patiënten met COPD die blijven roken is de jaarlijkse afname van de FEV1 groter, gemiddeld 62 ml. Bij patiënten die definitief stoppen met roken normaliseert de afname naar 31 ml; dit valt binnen de fysiologische grenzen van longfunctieverlies. Lageluchtweginfecties veroorzaken een geringe extra afname van de FEV1 (7 ml). Een betrouwbare uitspraak over een versnelde daling van de FEV1 kan slechts worden gedaan indien verschillende metingen (minimaal 3) over een langere periode (minimaal 2 jaar) worden verricht.
E-health in de monitoringsfase
Naar Samenvatting ›- Er zijn veel vormen van e-health; astmacontrole op afstand (via e-mail, website of telefoon) of telemonitoring via sms, apps, websites of tijdens een telefoongesprek.
- Ga in overleg met de patiënt na of gebruik van e-health meerwaarde heeft.
- E-health vervangt het monitoringsconsult niet, maar kan een hulpmiddel zijn ter ondersteuning van zelfmanagement.
E-health voor volwassenen met astma is niet duidelijk slechter of juist effectiever dan gebruikelijke zorg. E-health is daardoor geen vervanging van een controleconsult maar kan bijdragen aan het ontwikkelen van zelfmanagementvaardigheden. Voor bepaalde groepen patiënten kan e-health een voordeel bieden.
Voor- en nadelen
Er is geen duidelijk verschil te zien tussen de interventie- en de controlegroepen in de onderzoeken waarin gebruik van e-health vergeleken wordt met gebruikelijke zorg voor de meeste uitkomstmaten (longaanvallen, astmacontrole, bijwerkingen, kwaliteit van leven, ongeplande gezondheidszorgbezoeken) (kwaliteit van bewijs: laag tot gemiddeld). De longfunctie lijkt wel (iets) te verbeteren bij astmacontrole op afstand en telemonitoring (kwaliteit van bewijs: redelijk). Sommige patiënten zullen de voorkeur geven aan het persoonlijke contact met de praktijkondersteuner of huisarts, voor anderen is een voordeel dat ze niet op het spreekuur hoeven komen.
Kwaliteit van bewijs
De kwaliteit van het bewijs was laag tot redelijk. Er werd afgewaardeerd in verband met kleine RCT’s en weinig events, afwezigheid van blindering en brede betrouwbaarheidsintervallen of heterogeniteit.
Waarden en voorkeuren van patiënten
Patiënten waarderen de genoemde uitkomsten min of meer gelijkelijk. Sommige patiënten hebben liever contact tijdens het spreekuur, anderen geven de voorkeur aan de mogelijkheid van controles en contact op afstand.
Kosten
De kosten van e-health komen meestal voor rekening de zorggroep. De programma’s zelf kosten de patiënt niets. De patiënt moet thuis handelingen verrichten, maar hoeft niet op het spreekuur te komen.
Achtergrond
Steeds vaker wordt er gebruik gemaakt van websites, apps, beeldbellen of andere technologie om ‘op afstand’ zorg te verlenen. Zou dit ook te gebruiken zijn voor astma? Voordelen zijn gemak en tijdswinst voor patiënt en huisarts en potentieel lagere kosten. De vraag is of de kwaliteit van de zorg niet slechter is dan de gebruikelijke zorg waarbij de patiënt op consult komt.
Uitgangsvraag
Is e-health niet inferieur aan gebruikelijke zorg bij volwassenen met astma?
Uitkomsten
- longaanvallen
- astmacontrole
- ongepland spreekuurbezoek
- astmagerelateerde kwaliteit van leven
Methode
Twee systematische reviews naar het effect van e-health; in dit geval astmacontroles op afstand met gebruikmaking van technologie (bijvoorbeeld telefoon en internet) en home telemonitoring (het elektronisch delen van informatie tussen patiënt en gezondheidszorg medewerker) dienden als uitgangspunt bij de beantwoording van de uitgangsvraag.
Resultaten
Beschrijving onderzoeken
Astmacontrole op afstand: Voor de review over e-health en astma werden 6 RCT’s geïncludeerd (n = 2100) waarin astmacontroles op afstand (via e-mail, een website of telefoon) met gebruikelijke face-to-face/live contactcontroles werden vergeleken. De astmacontroles waren dus of ‘op afstand’ (interventiegroep) of live (controlegroep). Patiënten werden tussen de 6 en 12 maanden gevolgd.
Telemonitoring: De review over home telemonitoring bevat 12 RCT’s (n = 1.549) waarin volwassenen met astma tussen de 3 tot 12 maanden gevolgd werden. Er werd in de verschillende RCT’s gebruik gemaakt van verschillende technologieën: de mensen in de interventiegroep konden hun klachten vastleggen en delen via sms, apps, websites of delen tijdens een telefoongesprek. Dit was soms in plaats van livecontact, en soms als extra naast de gebruikelijke zorg. Mensen in de controlegroepen kregen zorg zoals gebruikelijk.
Samenvatting van het bewijs (zie GRADE-tabel behorend bij het detail E-health in de Totstandkoming)
Astmacontrole op afstand:
- Astmacontrole op afstand lijkt longaanvallen en ongeplande gezondheidszorgbezoeken niet te verminderen (kwaliteit van bewijs: laag); ook lijkt de astmacontrole op afstand de astmacontrole en astmagerelateerde kwaliteit van leven niet te verbeteren (kwaliteit van bewijs: laag/redelijk).
- Astmacontrole op afstand verbetert waarschijnlijk de longfunctie (kwaliteit van bewijs: redelijk).
Telemonitoring:
- Telemonitoring lijkt longaanvallen waarbij orale corticosteroïden nodig zijn niet te verminderen en astmacontrole of kwaliteit van leven te verbeteren (kwaliteit van bewijs: laag).
- Telemonitoring vermindert waarschijnlijk longaanvallen waarbij ziekenhuisopname nodig is en verbetert waarschijnlijk de longfunctie (kwaliteit van bewijs: redelijk).
- Het effect van telemonitoring op ongeplande bezoeken aan de gezondheidszorg is onzeker (kwaliteit van bewijs: zeer laag).
Redenen voor consultatie of verwijzing
Naar Samenvatting ›Verwijzing naar of consultatie van een longarts of consultatie van een kaderhuisarts is aangewezen bij:
- twijfel aan de diagnose astma
- het vermoeden van astma én COPD (ACO)
- < 40 jaar: naar longarts ter uitsluiting van alfa 1-antitrypsinedeficiëntie
- > 40 jaar: benader afhankelijk van de lokale mogelijkheden in de zorggroep consultatief een kaderarts of vraag een meedenkconsult bij de longarts aan. Verwijs bij blijvende twijfel naar een longarts
- discrepantie tussen klachten en spirometrie
- persisterend vermoeden onderliggende pathologie (zie Differentiaaldiagnose)
- blijvend onvoldoende astmacontrole na 3-6 maanden of het niet bereiken van de persoonlijke behandeldoelen ondanks stap 4-medicatie:
- tenzij de onvoldoende astmacontrole alleen gebaseerd is op 1 longaanval in de afgelopen 12 maanden
- al dan niet in combinatie met aanwijzingen voor niet-allergisch astma (onvoldoende reactie op ICS, obesitas (BMI > 30) of als de astmaklachten op volwassen leeftijd zijn ontstaan)
- het vermoeden van door het werk veroorzaakt astma waarbij het werk of de loopbaanplanning in gevaar komt en bij al bestaand astma dat door het werk verergert ondanks stap 2-medicatie. In beide gevallen is ook verwijzing naar een bedrijfsarts geïndiceerd
- patiënten met complexe comorbiditeit
- persisterend overmatig SABA-gebruik. ondanks adequate onderhoudsbehandeling en voorlichting
Overweeg (top)sporters met inspanningsgebonden klachten zonder verdere voorgeschiedenis van astma of allergie die een SABA wensen te gebruiken te verwijzen naar een sportarts of longarts.
Longaanval astma bij volwassenen
Naar Samenvatting ›ABCDE instabiel
Naar Samenvatting ›Hierbij is sprake van cyanose, bewustzijnsdaling en/of uitputting. Zie ook de paragraaf Acuut respiratoir falen en zuurstofbehandeling.
Handel als volgt:
- Bel een ambulance met directe inzet (A0/A1-urgentie).
- Geef zuurstof indien beschikbaar (zie NHG-Behandelrichtlijn Geneesmiddelen en zuurstof in spoedeisende situaties).
- Geef salbutamol en ipratropium (met zuurstof en vernevelmasker) per vernevelaar of indien geen vernevelaar beschikbaar is, per dosisaerosol met voorzetkamer (zie tabel 8).
- Breng een infuusnaald in, spuit door met ten minste 2 ml NaCl 0,9%.
- Overweeg, indien er voldoende tijd is, in afwachting van de ambulance dexamethason intraveneus/intramusculair. Dit heeft een lagere prioriteit dan het inbrengen van de infuusnaald.
Combinatie van salbutamol en ipratropium
Dien salbutamol en ipratropium, indien een vernevelaar gebruikt wordt, eventueel gelijktijdig toe.
ABCDE stabiel
Naar Samenvatting ›Richtlijnen diagnostiek
- Stel de diagnose longaanval astma bij progressieve dyspneu, soms met hoesten of slijm opgeven.
- Maak onderscheid tussen een ernstige en een minder-ernstige longaanval astma.
- Ga de oorzaak van de longaanval na: medicatie niet gebruikt, infectie (zie NHG-Standaard Acuut hoesten), allergie of een andere oorzaak.
Ernstige longaanval astma bij volwassenen
Naar Samenvatting ›Er is een ernstige longaanval bij ≥ 1 van de volgende criteria:
- (een toename van de) dyspneu in rust, moeite met uitspreken van een hele zin, niet plat kunnen liggen
- hoge ademarbeid, dit uit zich in een hoge ademfrequentie of gebruik van hulpademhalingsspieren
- versnelde hartslag > 100/minuut
- Saturatie: O2 < 94%
Als al deze criteria afwezig zijn of bij een vlotte verbetering na salbutamolinhalatie, is er sprake van een minder-ernstige longaanval.
Beleid ernstige longaanval astma
Naar Samenvatting ›(Zie voor doseringen en toedieningsvorm (zie tabel 8))
- Geef salbutamol via een voorzetkamer.
- Geef bij onvoldoende verbetering ipratropium via een voorzetkamer.
- Als salbutamol en ipratropium per vernevelaar worden toegediend, kan dit eventueel gelijktijdig
- Geef bij verbetering een orale kuur prednisolon, gedurende 5 dagen (afhankelijk van controle te verlengen tot maximaal 14 dagen).
- Verhoog de dosering luchtwegverwijders gedurende de komende 24 uur en/of pas de toedieningsvorm aan. Let op de juiste de inhalatietechniek. Overweeg gebruik van een dosisaerosol met een voorzetkamer in plaats van poederinhalatie.
Orale steroïden: systemische corticosteroïden zijn effectief bij de behandeling van astma-longaanvallen . Orale steroïden hebben hierbij de voorkeur boven intraveneus toegediende steroïden, vanwege het niet-invasieve karakter en de lagere kosten. Intramusculaire toediening kan een alternatief zijn. Een 7-daagse kuur is net zo effectief als een 14-daagse kuur. Afbouwen van de dosering gedurende de kuur wordt niet geadviseerd. Hooggedoseerde ICS (2,4 mg budesonide per dag in 4 doseringen) kunnen even effectief zijn als 40 mg orale prednisolon. Verder onderzoek hiernaar is echter nodig.
Dosisaerosol versus vernevelaar: in een cochranereview (25 onderzoeken; 614 volwassenen met acuut astma) werd geen verschil gezien in het aantal ziekenhuisopnamen van patiënten die met een dosisaerosol met voorzetkamer werden behandeld en patiënten die een vernevelaar gebruikten.
Vroeg (binnen een uur na binnenkomst op SEH) starten met orale corticosteroïden versus placebo: in een andere cochranereview (12 onderzoeken, n = 863) resulteerde het vroeg starten met orale corticosteroïden bij een ernstige longaanval op een SEH-afdeling versus placebo in een vermindering van het aantal ziekenhuisopnames (OR 0,40; 95%-BI 0,21 tot 0,78; NNT 8).
ICS plus orale corticosteroïden versus orale corticosteroïden: in een 3e cochranereview (3 onderzoeken; n = 909) zag men geen toegevoegde waarde van ICS plus systemische corticosteroïden versus systemische corticosteroïden alleen.
Hogere dosis ICS versus orale corticosteroïden: in 9 onderzoeken (n = 1296) werd monotherapie met een hogere dosis ICS vergeleken met monotherapie met systemische corticosteroïden na ontslag van de SEH. Er werd geen significant verschil gevonden wat betreft opnieuw optredende verslechtering en evenmin wat betreft secundaire uitkomstmaten (gebruik SABA, symptomen of bijwerkingen). De power van de gepoolde gegevens was onvoldoende om een betrouwbare uitspraak te doen of een van beide opties inferieur was. Bovendien waren patiënten met een ernstige longaanval astma uitgesloten.
Conclusie
Toediening van inhalatiemedicatie via een dosisaerosol is gelijkwaardig aan toediening via een vernevelaar. Vroeg starten met systemische steroïden vermindert het aantal ziekenhuisopnames bij een astma longaanval.
Verwijzing ernstige longaanval astma
Naar Samenvatting ›Verwijs een patiënt met een ernstige longaanval astma als er:
- geen verbetering optreedt
- thuis onvoldoende zorgmogelijkheden zijn
- ernstige interfererende comorbiditeit is
- bij eerdere longaanvallen steeds een ziekenhuisopname noodzakelijk was
Als niet wordt verwezen: de ernst van het klinisch beeld en het effect van de ingestelde behandeling bij eerdere longaanvallen bepalen mede de behandeling en controlefrequentie na een longaanval.
Beleid minder ernstige longaanval
Naar Samenvatting ›Hiervan is sprake als de criteria voor een ernstige longaanval afwezig zijn.
- Adviseer een SABA of verhoog de dosis, zo nodig tot de maximale dagdosis (zie tabel 8).
- Een SABA kan ook (tijdelijk) naast een LABA/ICS worden gebruikt.
- Overweeg het starten of verhogen van ICS (of ICS/LABA) tot de maximale dosering (zie tabel 5 en tabel 6) gedurende 5 tot maximaal 14 dagen.
- Overweeg afhankelijk van eerdere ervaringen een orale kuur prednisolon, gedurende 5 dagen (afhankelijk van controle te verlengen tot maximaal 14 dagen).
- Maak een controle-afspraak voor follow-up.
Controle en follow-up na een ernstige of minder ernstige longaanval
Naar Samenvatting ›- Evalueer klachten en ervaren beperkingen.
- Onderzoek zo nodig de longen.
- Overweeg indien de klachten niet verbeteren alsnog een prednisonkuur te starten of deze te verlengen tot maximaal 14 dagen.
- Besteed aandacht aan therapietrouw, inhalatietechniek en uitlokkende factoren (TIP).
- Stel eventueel het medicamenteus beleid bij volgens het stappenplan.
|
Geneesmiddel |
Dosering |
Werkingssnelheid/-duur |
|
Salbutamol |
Volwassene: 100 microg (= 1 puf) per keer in voorzetkamer, 5 maal inademen, herhaal 4-10 keer |
Binnen 5 minuten |
|
Kind:
|
||
|
inhalatievloeistof: |
Volwassene en kind ≥ 5 jaar: |
|
|
Kind < 5 jaar: |
||
|
Ipratropiumbromide |
Volwassene: |
Binnen 15 minuten |
|
inhalatievloeistof |
Volwassene en kind ≥ 5 jaar: |
|
|
Kind < 5 jaar: |
||
|
Prednisolon |
Volwassene: |
Na enige uren |
|
Kind:
|
||
|
Dexamethason |
Volwassene: |
Na enige uren |
|
* Geef 6 tot 8 liter zuurstof/minuut om de (minimaal 4 ml) vloeistof in de vernevelkamer te vernevelen (vul eventueel aan met fysiologisch zout). De vernevelkamer kan worden aangesloten op een vernevelmasker. |
||
Praktijkvoeringsaspecten astma
Naar Samenvatting ›Zorggroep
In een deel van de huisartsenpraktijken wordt de zorg voor patiënten met astma geleverd binnen een zorggroep. In een zorggroep worden praktijkoverstijgende taken georganiseerd.
Zorg voor astmapatiënten door de huisarts dient aan de volgende voorwaarden te voldoen:
- protocollaire opzet
- sluitend afspraak- en oproepsysteem
- adequate registratie in het Huisarts Informatie Systeem (HIS) respectievelijk Ketenzorg Informatie Systeem (KIS) van de gegevens die worden verzameld bij periodieke controles. Op basis van deze kernset van gegevens kunnen berekeningen worden gemaakt die tot indicatoren leiden
- implementatie van een (transmuraal) formularium astma en ondersteunend FTO
- structurele samenwerking en afstemming van de zorg met praktijkondersteuner of longverpleegkundige, fysiotherapeut, apotheker, verloskundige, diëtist, longarts (onder andere meedenkconsult), kaderhuisarts en indien relevant met de bedrijfsarts
- verzamelen van gegevens op basis van kwaliteitsinformatie (zoals de minimale dataset astma) bij volwassenen
- periodieke evaluatie van bovengenoemde aspecten
(Overige) aandachtspunten voor bespreking in de regio
Naar Samenvatting ›Regionaal zijn er verschillen in aanpak mogelijk, afhankelijk van beschikbare expertise en de lokale situatie.
Aandachtspunten voor het maken van afspraken in de regio zijn:
- afspraken over consultatie van een kaderhuisarts en van de longarts, verwijzing en terugverwijzing
- hoofdbehandelaarschap, invulling van gedeelde zorg
- inhoud van de gestructureerde verwijsbrief
- inhoud van terugrapportage met concrete adviezen over de behandelmogelijkheden door de huisarts indien de klachten toenemen alvorens te herverwijzen
- het registreren en delen van gegevens (bijvoorbeeld via KIS of teleconsultatie) en wijze van informatie-uitwisseling over:
- monitoring
- tussentijdse wijzigingen
- longaanvallen
- comorbiditeit
- individueel zorgplan
- afspraken met:
- apotheker(s) in de regio over het uniformeren en regelmatig herhalen van de inhalatie-instructie en monitoring van het medicatiegebruik inclusief signalering (overmatig) SABA-gebruik en afstemming in een (transmuraal) formularium
- medebehandelaars zoals verloskundigen, diëtisten en fysiotherapeuten
- zorgverzekeraars over gedeelde zorg en keten-DBC
- thuiszorg en eventueel gespecialiseerde longverpleegkundigen vanuit de thuiszorg, die huisbezoeken af kunnen leggen (indien lokaal mogelijk)
- management van longaanvallen en regeling van spoedzorg in geval van acute ernstige kortademigheid
- op elkaar afgestemd voorlichtingsmateriaal in 1e en 2e lijn
- scholing, nascholing en casuïstiekbesprekingen
- transparantie van indicatoren
Landelijke Transmurale Afspraak Astma bij volwassenen
Naar Samenvatting ›Betrokken zorgprofessionals naast de huisarts en longarts
Naar Samenvatting ›1e lijn
- Kaderhuisarts astma (en COPD)
De kaderhuisarts adviseert over het astmaprotocol bij regionale zorggroepen en is te consulteren bij vragen (bijvoorbeeld discrepantie klachten en spirometrie ). De kaderhuisarts onderneemt initiatieven om de behandeling van astma- en COPD-patiënten in de regio te verbeteren, bijvoorbeeld door implementatie van deze NHG-Standaard, de Zorgstandaard Astma, volgens de NHG-boeken Astma en COPD-zorg in de huisartspraktijk, consultatie op afstand via een diagnostisch centrum, horizontale consultatie binnen de 1e lijn en teleconsultatiefeedback door een kader- of longarts over een in de praktijk gemaakte spirometrie. - POH (praktijkondersteuner huisartsenzorg)
Patiënten met goede astmacontrole kunnen periodiek worden gezien door de POH, met adequate rapportage in het HIS. De POH verricht spirometrie, geeft voorlichting over astma, inhalatie-instructie, therapietrouw (zie Niet-medicamenteuze en medicamenteuze behandeling), leefstijladviezen en zelfzorgitems. Verder biedt de POH zo nodig hulp bij het aanvragen van voorzieningen en signaleert en begeleidt bij cognitieve, sociale en psychische problemen. Voor de ondersteuning van zelfmanagement kan de POH gebruikmaken van het individueel zorgplan. De POH heeft regulier overleg met de huisarts over het beleid en kan hierover bij acute problemen op elk moment contact opnemen. De POH kan overleggen met de in astma en COPD gespecialiseerde longverpleegkundige of physician assistent in de 2e lijn.
2e lijn
- Longarts-astma
Het is wenselijk dat binnen de afdeling longziekten minimaal 1 in astma gespecialiseerde longarts als vast aanspreekpunt voor de 1e lijn bereikbaar is. Deze longarts neemt actief deel aan regionale transmurale overleggen, biedt meedenkconsulten aan en stimuleert up-to-date astmazorg volgens de vigerende richtlijnen in zowel de 1e als 2e lijn. Deze longarts organiseert bijscholing en opleiding naar behoefte van en in samenwerking met de 1e lijn en op grond van regionale afspraken. - Astmaverpleegkundige 2e lijn
De gespecialiseerd longverpleegkundige, physician assistent (PA) of verpleegkundig specialist (SV) voor astma in de 2e lijn is een belangrijk aanspreekpunt voor gedeelde patiëntenzorg, onderhoudt contacten met de POH’s, is aanwezig bij regionale transmurale overleggen en draagt bij aan scholing in samenwerking met de 1e lijn en op grond van regionale afspraken.
Spirometrie en ander aanvullend onderzoek
Naar Samenvatting ›- De huisarts heeft de keuze zelf spirometrie te verrichten en te interpreteren of hierbij samen te werken met een eerstelijns diagnostisch centrum of het ziekenhuis.
- Het diagnostisch centrum of ziekenhuis zorgt voor de uitvoering van de longfunctiemetingen of ander aanvullend onderzoek (onder andere histamine/metacholinedrempel, bodybox) en laat deze samen met klinische gegevens interpreteren door een kaderhuisarts of longarts. Een consult bij de longarts is hiervoor niet altijd noodzakelijk.
Hoofdbehandelaarschap
Naar Samenvatting ›- De longarts krijgt steeds meer een consulterende rol in de zorgketen, terwijl de huisarts de regie voert.
- De longarts wordt (meer dan voorheen) direct toegankelijk voor de huisarts voor consultatie van medisch-specialistische kennis. Om deze toegankelijkheid mogelijk te maken kan gebruik gemaakt worden van bijvoorbeeld tele-, e-mail- of telefonische consultatie, meekijkconsulten en patiëntenbesprekingen.
- Maak afspraken over hoofdbehandelaarschap of gedeelde zorg en over wie aanspreekpunt is voor de patiënt en communiceer dit met de patiënt.
- In het algemeen geldt (tenzij regionaal andere afspraken gemaakt zijn):
- de huisarts is hoofdbehandelaar bij patiënten met goede astmacontrole met stap 1-4-medicatie
- de longarts is hoofdbehandelaar bij patiënten met aanhoudend onvoldoende astmacontrole, waarbij in de 1e lijn potentieel onderhoudende factoren (TIP) eerst uitvoerig zijn behandeld
- de longarts is hoofdbehandelaar bij patiënten met een hogere medicatiedosis dan stap 4
- Jongeren met astma die onder controle van de kinder(long)arts zijn, krijgen bij de transitie naar volwassenheid een andere hoofdbehandelaar. De kinder(long)arts, de huisarts en de longarts maken onderling afspraken over adequate zorg in deze transitiefase.
Werkwijze bij consultatie of verwijzing naar een longarts
Naar Samenvatting ›- Formuleer bij consultatie van of verwijzing naar een longarts een adequate vraagstelling waarbij duidelijk is aangegeven
- of het een diagnostisch of een behandelingsprobleem betreft
- of de vraag ook met behulp van teleconsultatie behandeld kan worden
- Stuur uitslagen van spirometrie en een allergietest mee, tenzij er redenen waren om deze niet te verrichten. Verstuur de uitslagen en de verwijzing bij voorkeur digitaal volgens de richtlijn Informatie-uitwisseling tussen Huisarts en Specialist (HASP).
- Leg aan de patiënt het doel en de reden van verwijzing uit, desgewenst ook schriftelijk, bijvoorbeeld in het behandelplan.
De longarts rapporteert schriftelijk aan de huisarts:
- na het vaststellen van de diagnose of een (definitief) behandelplan
- minimaal jaarlijks bij blijvend hoofdbehandelaarschap
- tussentijds bij nieuwe gezichtspunten die van belang zijn voor de huisarts
- bij terugverwijzing (zie Werkwijze bij terugverwijzen naar de huisarts)
Werkwijze bij terugverwijzen naar de huisarts
Naar Samenvatting ›- Verwijs de patiënt terug indien:
- de vraag van de huisarts of patiënt beantwoord is
- de diagnostiek in de 2e lijn afgerond is,of
- het beleid door de huisarts kan worden voortgezet
- bij goede astmacontrole gedurende 3 maanden met stap 4-medicatie, tenzij de patiënt een voorgeschiedenis van veel dan wel levensbedreigende longaanvallen heeft of uitgebreide comorbiditeit
- Verstrek relevante gegevens over het verwachte ziektebeloop, medicatie, mate van astmacontrole en toegepaste behandeling, bij voorkeur digitaal volgens de richtlijn Informatie-uitwisseling tussen Huisarts en Specialist (HASP).
- Geef concrete adviezen over de behandelmogelijkheden door de huisarts indien de klachten toenemen.
- Leg aan de patiënt het doel en de reden van terugverwijzing uit, desgewenst ook schriftelijk, bijvoorbeeld in het individueel behandelplan.
- Licht bij ontslag na ziekenhuisopname of behandeling op de SEH de huisarts in. Hierbij wordt aangegeven wie verantwoordelijk is voor de vervolgbehandeling en monitoring.
Samenwerking bij longaanvallen
Naar Samenvatting ›- De patiënt en diens omgeving moeten weten wat te doen bij een longaanval, bij voorkeur met een geschreven longaanval-actieplan (eventueel als onderdeel van een individueel zorgplan) met onder andere informatie over bereikbaarheid van de hoofdbehandelaar binnen en buiten kantooruren (zie nederland-davos.nl).
- De hoofdbehandelaar draagt zorg voor continue zorg, ook buiten kantooruren.
- Patiënten die onder behandeling van de longarts zijn, maar zich melden bij de huisarts met astmagerelateerde klachten beoordeelt de huisarts volgens de NHG-Standaard. Indien nodig overlegt de huisarts met de behandelend (of zo nodig dienstdoend) longarts.
- Patiënten die onder behandeling van de huisarts zijn, maar zich desondanks (via de SEH) melden bij de longarts, beoordeelt de longarts. Bij een stabiele situatie verwijst hij terug naar de huisarts.
Referenties
-
LAN. Zorgstandaard Astma Volwassenen (2012). Long Alliantie Nederland. http://www.longalliantie.nl/files/4113/7335/4473/Zorgstandaard_Astma_Volwassenen.pdf
-
LAN. Multidisciplinaire richtlijn astma; actuele knelpunten (2013). Long Alliantie Nederland. http://www.longalliantie.nl/files/2313/9506/6963/Multidisciplinaire_richtlijn_astma_STATUS_GEAUTORISEERD_28012014_def.pdf
-
NVALT. Richtlijn diagnostiek en behandeling van ernstig astma. Nederlandse vereniging van artsen voor longziekten en tuberculose (2013).
Ga naar bron: NVALT. Richtlijn diagnostiek en behandeling van ernstig astma. Nederlandse vereniging van artsen voor longziekten en tuberculose (2013).
-
NIVEL. LINH-zorgregistratie huisartsen. Incidentie- en prevalentiecijfers in de huisartsenpraktijk (2018). www.nivel.nl/nl/nivel-zorgregistraties-eerste-lijn/incidenties-en-prevalenties
-
Schaubel D, Johansen H, Dutta M, Desmeules M, Becker A, Mao Y. Neonatal characteristics as risk factors for preschool asthma. J Asthma 1996;33:255-64.
-
Gissler M, Jarvelin MR, Louhiala P, Hemminki E. Boys have more health problems in childhood than girls: follow-up of the 1987 Finnish birth cohort. Acta Paediatr 1999;88:310-4.
-
Berhane K, McConnell R, Gilliland F, Islam T, Gauderman WJ, Avol E, et al. Sex-specific effects of asthma on pulmonary function in children. Am J Respir Crit Care Med 2000;162:1723-30.
-
Strachan DP, Butland BK, Anderson HR. Incidence and prognosis of asthma and wheezing illness from early childhood to age 33 in a national British cohort. BMJ 1996;312:1195-9.
- Abrahamson M, Kutin JJ, Raven J, Lanigan A, Czarny D, Walters EH. Risk factors for asthma among young adults in Melbourne, Australia. Respirology 1996;1:291-7.
-
Wenzel S. Pathology of difficult asthma. Paediatr Respir Rev 2003;4:306-11.
-
GINA. Global strategy for asthma management and prevention. Global Initiative for asthma (2019). https://ginasthma.org/wp-content/uploads/2019/06/GINA-2019-main-report-June-2019-wms.pdf
-
Nguyen VN, Chavannes N, Le Lan TT, Price D. The Asthma Control Test (ACT) as an alternative tool to Global Initiative for Asthma (GINA) guideline criteria for assessing asthma control in Vietnamese outpatiënts. Prim Care Respir J 2012:21;85-9.
-
Chung KF, Wenzel SE, Brozek JL, Bush A, Castro M, Sterk PJ, et al. International ERS/ATS guidelines on defintion, evaluation and treatment of severre asthma. Eur Respir J 2014;43:343-73.
-
Tan DJ, Walters EH, Perret JL, Lodge CJ, Lowe AJ, Matheson MC, et al. Age-of-asthma onset as a determinant of different asthma phenotypes in adults: a systematic review and meta-analysis of the literature. Expert Rev Respir Med 2015;9:109-23.
-
Moore WC, Meyers DA, Wenzel SE, Teague WG, Li H, D’Agostini R Jr, et al. Identification of asthma phenotypes using cluster analysis in the severe asthma research programm. Am J Respir Crit Care Med 2010;181:315-23.
-
Schleich, F, Bruselle G, Louis R, Vandenplas O, Michils A, Pilette C, et al. Heterogeneity of phenotypes in severe asthmatics. The Belgian Severe Asthma Registry (BSAR). Respir Med 2014;108:1723-32.
-
Loza MJ, Djukanovic R, Chung KF, Horowitz D, Ma K, Branigan P, et al. Validated and longitudinally stable asthma phenotypes based on cluser analysis of the ADEPT study. Respir Res 2016;17:165.
-
Zaihra T, Walsh CJ, Achmed S, Fugère C, Hamid QA, Olivenstein R, et al. Phenotyping of difficult asthma using longitudinal physiological and biomarker measurements reveals significant differences in stability between clusters. BMC Pulm Med 2016;16:74.
-
Wang L, Liang R, Zhou T, Zheng J, Liang BM, Zhang HP, et al. Identification and validation of asthma phenotypes in Chinese population using cluster analysis. Ann Allergy Asthma Immunol 2017;119:324-32.
-
Walford HH, Doherty TA. Diagnosis and management of eosinophilic asthma: a US perspective. J Asthma Allergy 2014;7:53-65.
-
Agustí A, Bafadhel M, Beasley R, Bel EH, Faner R, Gibson PG, Louis R, et al. Precision medicine in airway diseases: moving to clinical practice. Eur Respir J 2017;50:1701655.
-
Pavord ID, Beasly R, Agustí A, Anderson GP, Bel E, Bruselle G. After asthma: redefining airway diseases. Lancet 2018;391:350-400.
-
Gibson PG, Simpson JL. The overlap syndrome of asthma and COPD: what are its features and how important is it? Thorax 2009;64:728-35.
-
Bakker W, Dijkman JH. Rhonchi en crepitaties: nomenclatuur en interpretatie. Ned Tijdschr Geneeskd 1990;134:477-80.
-
Jansveld CA, Bakker W, Braat MC. Rapport van de commissie Nomenclatuur Longgeluiden. Ned Tijdschr Geneeskd 1991;135:2380-3.
-
Van den Bosch W, Schermer TRJ, Chavannes NH. Utility of pulse-oximetry in general practice. Huisarts Wet 2005;48:467-9.
-
Kelly AM, McAlpine R, Kyle E. How accurate are pulse oximeters in patiënts with acute exacerbations of chronic obstructive airways disease? Respir Med 2001;95:336-40.
-
Chavannes N. Pulse oximetry and respiratory disease in primary care. Primary care respiratory journal 2003;12:2-3.
-
Anonymous. Clinical use of pulse oximetry. European federation of allergy and airways diseases patiënts associations (2010). http://www.theipcrg.org
-
SAN Praktijkrichtlijn longfunctieonderzoek (2015).
Ga naar bron: SAN Praktijkrichtlijn longfunctieonderzoek (2015).
-
Miller MR, Hankinson J, Brusasco V, Burgos F, Casaburi R, Coates A, et al. Standardisation of spirometry. Eur Respir J 2005;26:319-38.
-
Quanjer PH, Stanojevic S, Cole TJ, Baur X, Hall GL, Culver B, et al. Multi-ethnic reference values for spirometry for the 3-95 year age range: the global lung function 2012 equations. Report of the Global Lung Function Initiative (GLI), ERS Task Force to establish improved Lung Function Reference Values. Eur Respir 2012;40:1324-43.
-
Schermer TR, Verweij EH, Cretier R, Pellegrino A, Crockett AJ, Poels PJ. Accuracy and precision of desktop spirometers in general practices. Respiration 2012;83:344-52.
-
Cockcroft DW, Murdock KY, Berscheid BA, Gore BP. Sensitivity and specificity of histamine PC20 determination in a random selection of young college students. J Allergy Clin Immunol 1992;89:23-30.
-
Woodruff PG, Boushey HA, Dolganov GM, Barker CS, Yang YH, Donnelly S, et al. Genome-wide profiling identifies epithelial cell genes associated with asthma and with treatment response to corticosteroids. Proc Natl Acad Sci USA 2007;104:15858-65.
-
Wagener AH, De Nijs SB, Lutter R, Sousa AR, Weersink EJ, Bel EH, Sterk PJ. External validation of blood eosiniphils, FE(NO) and serum periostin as surrogates for sputum eosinophils in asthma. Thorax 2015;70:115-20.
-
Casciano J, Krishnan JA, Small MB, Buck PO, Gopalan G, Li C, et al. Value of peripheral blood eosinophil marker to predict severity of asthma. BMC Pul Med 2016;16:109.
-
Price D, Wilson AM, Chisholm A, Rigazio A, Burden A, Thomas M, et al. Predicting frequent asthma exacerbations using blood eosinophil count and other patient data routinely available in clinical practice. J Asthma Allergy 2016;9:1-12.
-
Braunstahl GJ. De toegevoegde waarde van FeNO bij de diagnose astma. Ned Tijdschr Allergie & Astma 2016;16:11-4.
-
Luks VP, Vandemheen KL, Aaro SD. Confirmation of asthma in an era of overdiagnosis. Eur Repir J 2010;36:255-60.
-
Gillis RME, Van Litsenburg W, Van Balkom RH, Muris JW, Smeenk FW. The contribution of an asthma diagnostic consultation service in obtaining an accurate asthma diagnosis for primary care patients: results of a real-life study. NPJ Primary Care Respiratory 2017;27:35.
-
Partridge MR, Van der Molen T, Myrseth SE, Busse WW. Attitudes and actions of asthma patiënts on regular maintenance therapy: the INSPIRE study. BMC Pulm Med 2006;6:13.
-
LAN. Zorgstandaard COPD (2016). Long Alliantie Nederland.
http://www.longalliantie.nl/files/9014/5578/9160/LAN_Zorgstandaard_COPD-2016-2.pdf -
Bateman ED, Boushey HA, Bousquet J, Busse WW, Clark TJ, Pauwels RA, et al. Can guideline-defined asthma control be achieved? The Gaining Optimal Asthma ControL study. Am J Respir Crit Care Med 2004;170:836-44.
-
Van den Nieuwenhof L, Schermer T, Heins M, Grootens J, Eysink P, Bottema B, et al. Tracing uncontrolled asthma in family practice using a mailed asthma control questionnaire. Ann Fam Med 2008;6 Suppl 1:S16-S22.
- Aaron SD, Vandemheen KL, FitzGerald JM, Ainslie M, Gupta S, Lemière C, et al. Reevaluation of diagnosis in adults with psysician-diagnosed astma. JAMA 2017;317:269-79.
- Aaron SD, Vandemheen KL, Boulet LP, McIvor RA, Fitzgerald JM, Hernandez P, et al. Overdiagnosis of asthma in obese and nonobese adults. CMAJ 2008;179:1121–31.
-
Shirai T, Matsui T, Suzuki K, Chida K. Effect of pet removal on pet allergic asthma. Chest 2005;127:1565-71.
-
Kilburn S, Lasserson TJ, McKean M. Pet allergen control measures for allergic asthma in children and adults. Cochrane Database Syst Rev 2003;CD002989.
-
Wood RA, Chapman MD, Adkinson NF, Jr., Eggleston PA. The effect of cat removal on allergen content in household-dust samples. J Allergy Clin Immunol 1989;83:730-4.
- Van De Ven MO, Van Zundert RM, Engels RC. Effects of asthma on nicotine dependence development and smoking cessation attempts in adolescence. J Asthma 2013;50:250-9.
-
Carson KV, Chandratilleke MG, Picot J, Brinn MP, Esterman AJ, Smith BJ. Physical training for asthma. Cochrane Database Syst Rev 2013:CD001116.
-
Scott HA, Gibson PG, Garg ML, Pretto JJ, Morgan PJ, Callister R, et al. Dietary restriction and exercise improve airway inflammation and clinical outcomes in overweight and obese asthma: a randomized trial. Clin Exp Allergy 2013;43:36-49.
-
Toren K, Blanc PD. Asthma caused by occupational exposures is common - a systematic analysis of estimates of the population-attributable fraction. BMC Pulm Med 2009;9:7.
-
Ghosh RE, Cullinan P, Fishwick D, Hoyle J, Warburton CJ, Strachan DP, et al. Asthma and occupation in the 1958 birth cohort. Thorax 2013;68:365-71.
-
Heijmans M, Zwijnenberg N, Baan D, Spreeuwenberg P, Devillé W. Monitor zorg- en leefsituatie van mensen met astma of COPD: trends en ontwikkelingen over de periode 2001-201. Nationaal panel chronische zieken en gehandicapten. Utrecht: NIVEL, 2013.
-
Baur X, Sigsgaard T, Aasen TB ,Burge PS, Heederik D, Henneberger P, et al. on behalf of the ERS Task Force on the Management of Work-related Asthma. Guidelines for the management of work-related asthma. Eur Respir J 2012;39:529-545.
-
NVALT. Richtlijn werkgerelateerd astma. Een vertaling van de ERS Guidelines for the management of workrelated asthma. Nederlandse Vereniging van Artsen voor Longziekten en Tuberculose (2016). https://www.nvalt.nl/kwaliteit/richtlijnen/copd-astma-allergie
-
Boulding R, Stacey R, Niven R, Fowler SJ. Dysfunctional breathing: a review of the literature and proposal for classification. Eur Resp 2016;25:287-294.
-
Grammatopoulou EP, Skordilis EK, Georgoudis G, Haniotou A, Evangelodimou A, Fildissis G, et al. Hyperventilation in asthma: a validation study of the Nijmegen questionnaire – NQ. J Asthma 2014; 51:839-46.
-
LAN. Rapport Goed gebruik Inhalatiemiddelen (2014). Long Alliantie Nederland. http://www.longalliantie.nl/files/8614/1647/9380/Rapport_Goed_Gebruik_Inhalatiemedicatie_2014.pdf
-
Kew KM, Karner C, Mindus SM, Ferrara G. Combination formoterol and budesonide as maintenance and reliever therapy versus combination inhaler maintenance for chronic asthma in adults and children. Cochrane Database Syst Rev 2013;12:CD009019.
-
Sobieraj DM, Weeda ER , Nguyen E, Coleman CI , White CM, Lazarus SC, Blake KV, et al. Association of inhaled corticosteroids and long-acting β-agonists as controller and quick relief therapy with exacerbations and symptom control in persistent Asthma: a systematic review and meta-analysis. JAMA 2018;319:1485-96.
-
Papi A, Corradi M, Pigeon-Francisco C, Baronio R, Siergiejko Z, Petruzzelli S, et al. Beclometasone-formoterol as maintenance and reliever treatment in patiënts with asthma: a double-blind, randomised controlled trial. Lancet Respir Med 2013;1:23-31.
-
Patel M, Pilcher J, Pritchard A, Perrin K, Travers J, Shaw D, et al. Efficacy and safety of maintenance and reliever combination budesonide-formoterol inhaler in patiënts with asthma at risk of severe exacerbations: a randomised controlled trial. Lancet Respir Med 2013;1:32-42.
-
Bateman ED, Reddel HK, O’Byrne PM, Barnes PJ, Zhong N, Keen C, et al. As-needed budesonide-formoterol versus maintenance budesonide in mild asthma. N Engl J Med 2018;37:1877-87.
-
Beasley R, Holliday M, Reddel HK, Braithwaite I, Ebmeier S, Hancox RJ, et al for the Novel START Study Team. Controlled trial of budesonide-formoterol as needed for mild asthma. N Eng J Med 2019;380:2020-30.
-
Hardy J, Baggott C, Fingleton J, Reddel HK, Hancox RJ, Harwood M, et al on behalf of the PRACTICAL study team. Budesonide-formoterol reliever therapy versus maintenance budesonide plus terbutaline reliever therapy in adults with mild to moderate asthma (PRACTICAL): a 52-week, open-label, multicentre, superiority, randomised controlled trial. Lancet 2019;394:919-28.
-
O’Byrne PM, Fitzgerald JM, Bateman ED, Barnes PJ, Zhong N, Keen c, et al. Inhaled combined budesonide-formoterol as needed in mild asthma. N Engl J Med 2018;378:1865-76.
-
Van Boven. The pharmacists' potential to provide targets for interventions to optimize pharmacotherapy in patients with asthma. Int J Clin Pharm 2013;35:1075–82.
-
Stanford RH, Shah MB, D’Souza AO, Dhamane AD, Schatz M. Short-acting β-agonist use and its ability to predict future asthma-related outcomes. Ann Allergy Asthma Immunol 2012;109:403-7.
-
Gerald JK, Carr TF, Wei CY, Holbrook JT, Gerald LB. Albuterol overuse: a marker of psychological distress? J Allergy Clin Immunol Pract 2015;3:957-62.
-
Thomson NC. Reliever inhaler overuse, asthma symptoms, and depression. J Allergy Clin Immunol Pract 2015;3:963-4.
-
Hancox RJ. Concluding remarks: can we explain the association of beta-agonists with asthma mortality? A hypothesis. Clin Rev Allergy Immunol 2006;31:279-88.
-
Taylor DR, Hannah D. Management of beta-agonist overuse: why and how? J Allergy Clin Immunol 2008;122:836-8.
-
Reddel HK, Sawyer SM, Everett PW, Flood PV, Peters MJ. Asthma control in Australia: a cross-sectional web-based survey in a nationally representative population. Med J Aust 2015;202:492-7.
-
Patel M, Pilcher J, Reddel HK, Qi V, Mackey B, Tranquilino T, et al. Predictors of severe exacerbations, poor asthma control, and β-agonist overuse for patients with asthma. J Allergy Clin Immunol Pract 2014;2:751-8.
-
RCP. Why asthma still kills. Royal college of physicians (2015).
Ga naar bron: RCP. Why asthma still kills. Royal college of physicians (2015).
-
Cole S, Seale C, Griffiths C. The blue one takes a battering, why do young adults with astma overuse bronchodilator inhalers. A qualitative study. BMJ Open 2013;3:e002247.
-
Diette GB, Wu AW, Skinner EA, Markson L, Clark RD, McDonald RC, et al. Treatment patterns among adult patients with asthma factors associated with overuse of inhaled beta-agonists and underuse of inhaled corticosteroids. Ach Intern Med 1999;159:2697-704.
-
Adams N, Bestall J, Jones PW. Budesonide for chronic asthma in children and adults. Cochrane Database Syst Rev 2001;CD003274.
-
Adams NP, Bestall JC, Lasserson TJ, Jones PW. Inhaled fluticasone versus placebo for chronic asthma in adults and children. Cochrane Database Syst Rev 2005;CD003135.
-
Lasserson TJ, Cates CK, Jones AB, Steele EH, White J. Fluticasone versus HFA-beclometasone dipropionate for chronic asthma in adults and children. Cochrane Database Syst Rev 2006;CD005309.
-
Adams N, Lasserson TJ, Cates CJ, Jones PW. Fluticasone versus beclometasone or budesonide for chronic asthma in adults and children. Cochrane Database Syst Rev 2007;CD002310.
-
Manning P, Gibson PG, Lasserson TJ. Ciclesonide versus other inhaled steroids for chronic asthma in children and adults. Cochrane Database Syst Rev 2008;CD007031.
-
Powell H, Gibson PG. High dose versus low dose inhaled corticosteroid as initial starting dose for asthma in adults and children. Cochrane Database Syst Rev 2004;CD004109.
-
Bansal V, Mangi MA, Johnson MM, Festic E. Inhaled corticosteroids and incident pneumonia in patients with asthma: systematic review and meta-analysis. Acta Medica Academica 2015;44:135-58.
-
Bousquet J, Poli G, Acerbi D, Monno R, Ramael S, Nollevaux F. Systemic exposure and implications for lung deposition with an extra-fine hydrofluoroalkane beclometasone dipropionate/formoterol fixed combination. Clin Pharmacokinet 2009;48:347-58.
-
Boulet LP, Cartier A, Ernst P, Larivée P, Laviolette M. Safety and efficacy of HFA-134a beclomethasone dipropionate extra-fine aerosol over six months. Can Respir J 2004;11:123-30.
-
Juniper EF, Price DB, Stampone PA, Creemers JPHM, Mol SJM, Fireman P. Clinically important improvements in asthma-specific quality of life, but no difference in conventional clinical indexes in patiënts changed from conventional e dipriopionate to approximately half the dose of extrafine beclomethasone dipropionaat. Chest 2002;121:1824-32.
-
Huchon G, Magnussen H, Chuchalin A, Dymek L, Bonnet Gonod F, Bousquet J. Long function and asthma control with beclomethasone and formoterol in a single inhaler. Resp Med 2009;103:41-9.
-
Magnussen H. Equivalent asthma control after dose reduction with HFA-134a beclomethasone solution aerosol. Comparative Inhaled Steroid Investigation Group (CISIG). Resp Med 2000;94:549-55.
-
Fireman P, Prenner BM, Vincken W, Demedts M, Mol SJ, Cohen RM. Long-term safety and efficacy of a CFC-free e dipropionate extrafine aerosol. Ann Allergy Asthma Immunol 2001;86:557-65.
-
Sonnappa S, McQueen B, Postma DS, Martin RJ, Roche N, Grigg J, Guilbert T, et al. Extrafine versus fine inhaled corticosteroids in relation to asthma control: a systematic review and meta-analysis of observational real-life studies. J Allergy Clin Immunol Pract. 2018;6:907-15.
-
Van der Molen T, Postma DS, Martin RJ, Herings RMC, Overbeek JA, Thomas V, Miglio C, et al. Effectiveness of initiating extrafine-particle versus fine-particle inhaled corticosteroids as asthma therapy in the Netherlands. BMC Pulm Med 2016;16:80.
-
Chalmers GW, Macleod KJ, Little SA, Thomson LJ, McSharry CP, Thomson NC. Influence of cigarette smoking on inhaled corticosteroid treatment in mild asthma. Thorax 2002;57:226-30.
-
Thomson NC, Spears M. The influence of smoking on the treatment response in patiënts with asthma. Curr Opin Allergy Clin Immunol 2005;5:57-63.
-
Tomlinson JE, McMahon AD, Chaudhuri R, Thompson JM, Wood SF, Thomson NC. Efficacy of low and high dose inhaled corticosteroid in smokers versus non-smokers with mild asthma. Thorax 2005;60:282-7.
-
Dijkstra A, Vonk JM, Jongepier H, Koppelman GH, Schouten JP, Ten Hacken NH, et al. Lung function decline in asthma: association with inhaled corticosteroids, smoking and sex. Thorax 2006;61:105-10.
-
Livingston E, Thomson NC, Chalmers GW. Impact of smoking on asthma therapy: a critical review of clinical evidence. Drugs 2005;65:1521-36.
-
Thomson NC, Chaudhuri R, Livingston E. Asthma and cigarette smoking. Eur Respir 2004;24:822-33.
-
Galván CA, Guarderas JC. Practical considerations for dysphonia caused by inhaled corticosteroids. Mayo Clin Proc 2012;87:901.
-
Ducharme FM, Ni CM, Greenstone I, Lasserson TJ. Addition of long-acting beta2-agonists to inhaled corticosteroids versus same dose inhaled corticosteroids for chronic asthma in adults and children. Cochrane Database Syst Rev 2010;CD005535.
-
Tian JW, Chen JW, Chen R, Chen X. Tiotropium versus placebo for inadequately controlled asthma: a meta-analysis. Respir Care 2014;59:654-66.
-
Lee LA, Yang S, Kerwin E, Trivedi R, Edwards LD, Pascoe S. The effect of fluticasone ruroate/umeclidinium in adult patients with asthma: a randomized, dose-ranging study. Respir Med 2015;109:54-62.
-
Befekadu E, Onofrei C, Colice GL. Tiotropium in asthma: a systematic review. J Asthma Allergy 2014;7:11-21.
-
Anderson DE, Kew KM, Boyter AC. Long-acting muscarinic antagonists (LAMA) added to inhaled corticosteroids (ICS) versus the same dose of ICS alone for adults with asthma. Cochrane Database Syst Rev 2015:CD011397
-
Evans DJ, Kew KM, Anderson DE, Boyter AC. Long-acting muscarinic antagonists (LAMA) added to inhaled corticosteroids (ICS) versus higher dose ICS for adults with asthma. Cochrane Database Syst Rev 2015:CD011437.
-
Kew KM, Evans DJ, Allison DE, Boyter AC. Long-acting muscarinic antagonists (LAMA) added to inhaled corticosteroids (ICS) versus addition of long-acting beta2-agonists (LABA) for adults with asthma. Cochrane Database Syst Rev 2015:CD011438.
-
Rodrigo GJ, Castro-Rodríguez JA. Tiotropium for the treatment of adolescents with moderate to severe symptomatic asthma: a systematic review with meta-analysis. Ann Allergy Asthma Immunol 2015;115:211-6.
-
Westby M, Benson M, Gibson P. Anticholinergic agents for chronic asthma in adults. Cochrane Database Syst Rev 2004;CD003269.
-
Leynaert B, Neukirch F, Demoly P, Bousquet J. Epidemiologic evidence for asthma and rhinitis comorbidity. J Allergy Clin Immunol 2000;106:S201-S205.
-
Greisner WA, III, Settipane RJ, Settipane GA. Co-existence of asthma and allergic rhinitis: a 23-year follow-up study of college students. Allergy Asthma Proc 1998;19:185-8.
-
Guerra S, Sherrill DL, Martinez FD, Barbee RA. Rhinitis as an independent risk factor for adult-onset asthma. J Allergy Clin Immunol 2002;109:419-25.
-
Yawn BP, Yunginger JW, Wollan PC, Reed CE, Silverstein MD, Harris AG. Allergic rhinitis in Rochester, Minnesota residents with asthma: frequency and impact on health care charges. J Allergy Clin Immunol 1999;103:54-9.
-
Braunstahl GJ, Overbeek SE, Fokkens WJ, Kleinjan A, McEuen AR, Walls AF, et al. Segmental bronchoprovocation in allergic rhinitis patiënts affects mast cell and basophil numbers in nasal and bronchial mucosa. Am J Respir Crit Care Med 2001a;164:858-65.
-
Braunstahl GJ, Overbeek SE, Kleinjan A, Prins JB, Hoogsteden HC, Fokkens WJ. Nasal allergen provocation induces adhesion molecule expression and tissue eosinophilia in upper and lower airways. J Allergy Clin Immunol 2001b;107:469-76.
-
Bousquet J, Van Cauwenberge P, Khaltaev N. Allergic rhinitis and its impact on asthma. J Allergy Clin Immunol 2001;108:S147-S334.
-
Taramarcaz P, Gibson PG. Intranasal corticosteroids for asthma control in people with coexisting asthma and rhinitis. Cochrane Database Syst Rev 2003;CD003570.
-
Gezondheidsraad. Griepvaccinatie: herziening van de indicatiestelling (2007). https://www.gezondheidsraad.nl/documenten/adviezen/2007/03/08/griepvaccinatie-herziening-van-de-indicatiestelling
-
Gezondheidsraad. Vaccinatie tegen seizoensgriep (2011). https://www.gezondheidsraad.nl/documenten/adviezen/2011/09/28/vaccinatie-tegen-seizoensgriep
-
Vasileiou E, Sheick A, Butler C, El Ferkh K, Von Wissmann B, McMenamin J, et al. Effectiveness of influenza vaccines in asthma: a systematic review and meta-analysis. Clin Infect Dis 2017;65:1388-95.
-
Salpeter S, Ormiston T, Salpeter E. Cardioselective beta-blockers for reversible airway disease. Cochrane Database Syst Rev 2002;CD002992.
-
Chan WW, Chiou E, Obstein KL, Tignor AS, Whitlock TL. The Efficacy of Proton Pump Inhibitors for the Treatment of Asthma in Adults. A Meta-analysis. Archives of Internal Medicine 2011;171:620-9.
- Abramson MJ, Puy RM, Weiner JM. Injection allergen immunotherapy for asthma. Cochrane Database Syst Rev 2010a;CD001186.
-
Calamita Z, Saconato H, Pela AB, Atallah AN. Efficacy of sublingual immunotherapy in asthma: systematic review of randomized-clinical trials using the Cochrane Collaboration method. Allergy 2006;61:1162-72.
-
NACI. A program of the National Institutes of Health. GIP Priority Message: schedule follow-up visits. National Asthma Control Initiative (2013).
Ga naar bron: NACI. A program of the National Institutes of Health. GIP Priority Message: schedule follow-up visits. National Asthma Control Initiative (2013).
-
NICE. Asthma: diagnosis, monitoring and chronic asthma management. Nice National Institute for health and Care Excellence (2017).
Ga naar bron: NICE. Asthma: diagnosis, monitoring and chronic asthma management. Nice National Institute for health and Care Excellence (2017).
-
Jacobs JE, Van de Lisdonk EH, Smeele I, Van Weel C, Grol RP. Management of patiënts with asthma and COPD: monitoring quality of life and the relationship to subsequent GP interventions. Fam Pract 2001;18:574-80.
-
Jia CE, Zhang HP, Lv Y, Liang R, Jiang YQ, Powell H, et al. The Asthma Control Test and Asthma Control Questionnaire for assessing asthma control: Systematic review and meta-analysis. J Allergy Clin Immunol 2013;131:695-703.
-
Anthonisen NR, Connett JE, Kiley JP, Altose MD, Bailey WC, Buist AS, et al. Effects of smoking intervention and the use of an inhaled anticholinergic bronchodilator on the rate of decline of FEV1. The Lung Health Study. JAMA 1994;272:1497-505.
-
Kanner RE, Anthonisen NR, Connett JE. Lower respiratory illnesses promote FEV(1) decline in current smokers but not ex-smokers with mild chronic obstructive pulmonary disease: results from the lung health study. Am J Respir Crit Care Med 2001;164:358-64.
-
Quanjer PH, Tammeling GJ, Cotes JE, Pedersen OF, Peslin R, Yernault JC. Lung volumes and forced ventilatory flows. Report Working Party Standardization of Lung Function Tests, European Community for Steel and Coal. Official Statement of the European Respiratory Society. Eur Respir J Suppl 1993;16:5-40.
-
Scanlon PD, Connett JE, Waller LA, Altose MD, Bailey WC, Buist AS, et al. Smoking cessation and lung function in mild-to-moderate chronic obstructive pulmonary disease. The Lung Health Study. Am J Respir Crit Care Med 2000;161:381-90.
-
Kew KM, Cates CJ. Home telemonitoring and remote feedback between clinical visits for asthma. Cochrane Database Syst Rev 2016a:CD011714.
-
Kew KM, Cates CJ. Remote versus face-to-face check-ups for asthma. Cochrane Database Syst Rev 2016b:CD011715.
-
Cates CJ, Crilly JA, Rowe BH. Holding chambers (spacers) versus nebulisers for beta-agonist treatment of acute asthma. Cochrane Database Syst Rev 2006;CD000052.
- Rowe BH, Spooner C, Ducharme FM, Bretzlaff JA, Bota GW. Early emergency department treatment of acute asthma with systemic corticosteroids. Cochrane Database Syst Rev 2001;CD002178.
- Edmonds ML, Milan SJ, Brenner BE, Camargo CA, Jr., Rowe BH. Inhaled steroids for acute asthma following emergency department discharge. Cochrane Database Syst Rev 2012;12:CD002316.
-
Chauhan BF, Yeyaraman MM, Singh Mann A, Lys J, Abou-Setta AM, Zarychanski R, Ducharme FM. Addition of anti-leukotriene agents to inhaled corticosteroids for adults and adolescents with persistent asthma. Cochrane Database Syst Rev 2017:CD010347.
-
Levy ML, Garnett F, Kuku A, Pertsovskaya I, McKnight E, Haughney J. A review of asthma care in 50 general practices in Bedfordshire united kingdom. NPJ Prim Care Respir Med 2018;28:29.