COPD
Richtlijnen diagnostiek
Naar Volledige tekst ›Anamnese
Naar Volledige tekst ›- Overweeg COPD bij rokers of ex-rokers > 40 jaar met klachten van hoesten, slijm opgeven of geleidelijk progressieve dyspneu.
- Vraag naar:
- werkgerelateerde klachten
- vrijetijdsbesteding
- invloed van de klachten op functioneren
- allergieën
- cardiovasculaire voorgeschiedenis
- medicatiegebruik
Lichamelijk onderzoek
Naar Volledige tekst ›- Let op dyspneu, ademhalingsfrequentie, cyanose, gebruik hulpademhalingsspieren, stand van de thorax, oedeem van de benen.
- Ausculteer hart en longen; let op een verlengd expirium, expiratoir piepen en crepiteren, hartritme en souffles. Ausculteer bij vervolgconsulten alleen bij dyspneuklachten.
- Bepaal bij ernstige dyspneu de saturatie, de bloeddruk en de ademhalings- en hartfrequentie.
- Meet gewicht en lengte, bereken de BMI; ga na of er ongewenst gewichtsverlies is.
Aanvullend onderzoek
Naar Volledige tekst ›- Bepaal FVC, FEV1 en de flowvolumecurve voor en na gestandaardiseerde bronchusverwijding.
- Bij twijfel tussen hartfalen en COPD: overweeg ecg en bepaling van BNP of NT-proBNP.
- Bij discrepantie tussen klachten en spirometrische bevindingen: X-thorax.
- Bij een mogelijke restrictieve afwijking, zie Aanwijzingen voor een mogelijke restrictieve afwijking bij spirometrie.
Evaluatie
Naar Volledige tekst ›- Stel de diagnose COPD bij patiënten:
- > 40 jaar én
- klachten van dyspneu en/of hoesten, al of niet met slijm opgeven én
- een relevante rookhistorie of andere relevante expositie én
- een afwijkende FEV1/FVC-ratio na gestandaardiseerde bronchusverwijding bij 2 verschillende metingen met een interval > 4-6 weken.
- Breng direct na de diagnose de ziektelast in kaart aan de hand van de 4 subdomeinen (zie tabel), maak onderscheid tussen lichte en verhoogde ziektelast.
| Subdomein | Afwijkend indien |
|---|---|
| Klachten, hinder en beperkingen | MRC ≥ 3 of CCQ ≥ 2* |
| Longaanvallen | ≥ 2 longaanvallen per jaar behandeld met orale corticosteroïden of ≥ 1 ziekenhuisopname wegens COPD |
| Voedingstoestand | Ongewenst gewichtsverlies > 5%/maand of > 10%/6 maanden of verminderde voedingstoestand (BMI < 21 kg/m2) zonder andere verklaring |
| Longfunctie† | FEV1 na bronchusverwijding < 50% van voorspeld of < 1,5 l absoluut Of progressief longfunctieverlies (bijvoorbeeld ↓ FEV1 > 150 ml per jaar) gedurende ≥ 3 jaar (≥ 3 metingen) |
| Ziektelast | |
| Lichte ziektelast | Geen van de subdomeinen afwijkend |
| Verhoogde ziektelast | ≥ 1 subdomein afwijkend |
Richtlijnen beleid
Naar Volledige tekst ›Behandeldoelen: verbeteren van de prognose door begeleiding bij stoppen met roken en verminderen ziektelast.
Voorlichting en niet-medicamenteuze adviezen
Naar Volledige tekst ›- Geef rokers een stoppen-met-rokenadvies, adviseer een gestructureerde aanpak en bied intensieve begeleiding, raad meeroken af.
- Adviseer de patiënt voldoende te bewegen: ≥ 150 min per week matig intensieve inspanning, overweeg verwijzing naar een fysiotherapeut.
- Overweeg bij overgewicht verwijzing naar een diëtist en bij ongewild gewichtsverlies tevens naar een longarts.
- Bespreek psychische gevolgen voor werk en functioneren.
- Stimuleer de patiënt zelfstandig keuzes te maken bij dagelijkse bezigheden en bevorder actieve participatie tijdens de behandeling.
- Overweeg samen met de patiënt persoonlijke behandeldoelen te formuleren en hoe deze te verwezenlijken. Leg desgewenst vast in een individueel zorgplan.
Medicamenteuze behandeling
Naar Volledige tekst ›- Bespreek het volgende met de patiënt:
- luchtwegverwijders bieden symptomatische behandeling bij klachten, beperkingen en longaanvallen
- bij ≥ 2 longaanvallen per jaar kan onderhoudsbehandeling met inhalatiecorticosteroïden het risico op een longaanval verkleinen
- inhalatiemedicatie heeft geen effect op de geleidelijke afname van de longfunctie (FEV1) op lange termijn
- Kies in overleg met de patiënt een toedieningsvorm (zie ook de Tabel inhalatoren COPD) en geef een duidelijke inhalatie-instructie.
- Controleer in de instelfase elke 6 weken; ga bij onvoldoende verbetering ondanks goede therapietrouw en inhalatietechniek naar een volgende stap.
- Gebruik bij combinatietherapie in eerste instantie losse monopreparaten; overweeg bij blijvende indicatie een combinatiepreparaat.
| Stap 1 | Stap 2 | Stap 3 | |
|---|---|---|---|
| Infrequente dyspneuklachten, geen longaanvallen | Regelmatige dyspneuklachten, hinder of beperkingen | Persisterende dyspneuklachten, hinder of beperkingen | |
| Dyspneuklachten, hinder of beperkingen | SABA of SAMA, zo nodig | LAMA of LABA, onderhoud | LAMA + LABA, onderhoud |
| Longaanvallen, ≥ 2 per jaar | Niet van toepassing | Voeg ICS toe* Start of continueer luchtwegverwijder | Voeg ICS toe Bij voorkeur 1 luchtwegverwijder (overweeg de andere te staken) Overweeg verwijzing |
| SAMA = kortwerkende muscarineantagonist (parasympathicolyticum); SABA = kortwerkende bèta-2-agonist; LAMA = langwerkende muscarineantagonist (parasympathicolyticum); LABA = langwerkende bèta-2-agonist; ICS = inhalatiecorticosteroïd. * Als de patiënt verder weinig klachten heeft, volstaat een LAMA. | |||
Gebruik van ICS bij stap 2 of 3
Naar Volledige tekst ›- Geef ICS bij ≥ 2 longaanvallen per jaar (behandeld met ≥ 2 kuren prednis(ol)on of een antibioticum) of 1 ziekenhuisopname in verband met COPD.
- Wees terughoudend met tripletherapie (LAMA + LABA + ICS).
- Staak het ICS ineens als het aantal longaanvallen in 1 jaar niet duidelijk afneemt of als er gedurende een langere periode (2 jaar) geen longaanvallen meer zijn.
| Middel | Dosering in microgram* | Maximum per dag |
|---|---|---|
| Kortwerkende luchtwegverwijders | ||
| SABA | ||
|
1-4 dd 100-400 | 800-1600 , afhankelijk van toedieningsvorm |
|
1-4 dd 100-200 | |
|
1-4 dd 250-500 | 4000 |
| SAMA | ||
|
1-4 dd 40 | 240 |
|
1-4 dd 40 | |
| Langwerkende luchtwegverwijders | ||
| LABA | ||
|
1-2 dd 12 | 24-48 |
|
1-2 dd 12 | |
|
2 dd 50 | 100 |
|
2 dd 50 | |
|
1 dd 5 | 5 |
|
1 dd 150-300 | 300 |
| LAMA | ||
|
1 dd 18/10 , afhankelijk van toedieningsvorm | 18/10 |
|
1 dd 5 | 5 |
|
2 dd 322 | 644 |
|
1 dd 55 | 55 |
|
1 dd 44 | 44 |
| * Gebaseerd op monopreparaten. De doseringen van duo- of triplepreparaten kunnen afwijken. | ||
| Middel* | Dosering† |
|---|---|
| Beclometason aerosol | 2 dd 500 |
| Beclometason aerosol extra fijn | 2 dd 200 |
| Beclometason poeder | 2 dd 400 |
| Budesonide aerosol/poeder | 2 dd 400 |
| Fluticasonpropionaat aerosol/poeder | 2 dd 500 |
| * Beclometason en budesonide als monopreparaat zijn niet geregistreerd voor de behandeling van COPD en worden dus offlabel gebruikt. Fluticasonproprionaat monopreparaat is geregistreerd voor COPD. † Gebaseerd op monopreparaten. De exacte doseringen van duo- of triplepreparaten kunnen afwijken. |
|
Monitoring
Naar Volledige tekst ›- Evalueer de 4 subdomeinen, het rookgedrag, gebruik van medicatie en het effect van de niet-medicamenteuze behandeling en stel zo nodig bij.
- Stem de frequentie van de controleconsulten af op de behoeften en wensen van de patiënt als deze een stabiele situatie heeft bereikt; houd als vuistregel aan: bij lichte ziektelast jaarlijks; bij verhoogde ziektelast ten minste 2 × per jaar.
- Gebruik eventueel van een monitoringsinstrument.
- Verricht zo nodig spirometrie; instrueer de patiënt de eigen medicatie zoals gebruikelijk te nemen (zie tabel 8 in de volledige tekst).
Consultatie en verwijzing
Naar Volledige tekst ›Consulteer of verwijs naar de longarts of kaderhuisarts bij:
- twijfel aan de diagnose
- COPD ≤ 50 jaar
- snel progressief beloop
- FEV1 < 50% van de voorspelde waarde of < 1,5 l ondanks optimale behandeling
- blijvende klachten, hinder en beperkingen (CCQ ≥ 2, MRC ≥ 3) ondanks optimale behandeling
- ≥ 2 longaanvallen per jaar ondanks behandeling met LAMA + LABA of combinatie met een ICS
- verminderde voedingstoestand of ongewenst gewichtsverlies ten gevolge van COPD
- complexe comorbiditeit of ernstige problemen op meerdere subdomeinen (vraag aan de longarts of patiënt in aanmerking komt voor longrevalidatie)
- werkgerelateerde problemen of belemmeringen (ook naar de bedrijfsarts)
- psychosociale problemen of problemen met het omgaan met de ziekte (ook naar poh-ggz)
Beleid bij longaanval COPD
Naar Volledige tekst ›Voor het beleid bij longaanvallen, zie de hoofdtekst en de NHG-Behandelrichtlijn Geneesmiddelen en zuurstof in spoedeisende situaties.
Belangrijkste wijzigingen
Naar Samenvatting ›- De ernst van de ziektelast wordt uitgedrukt in 2 niveaus: lichte en verhoogde ziektelast.
- Het beleid bij aanwijzingen voor restrictie is geconcretiseerd.
- Het beleid bij COPD richt zich op 4 subdomeinen van de ziektelast bij COPD: klachten en beperkingen, longaanvallen, voedingstoestand en mate van luchtwegobstructie.
- De aanpak van spirometrie bij aanwijzingen voor restrictie bij spirometrie is verduidelijkt.
- Een exacerbatie wordt voortaan ‘longaanval’ genoemd.
- Bij onvoldoende effect van 1 langwerkende luchtwegverwijder is de mogelijkheid toegevoegd een tweede luchtwegverwijder uit de andere groep te overwegen.
- Een aanpak voor het staken van ICS is toegevoegd.
Kernboodschappen
Naar Samenvatting ›- COPD komt vrijwel uitsluitend voor bij (ex-)rokers > 40 jaar.
- De ernst van de luchtwegobstructie correleert slechts beperkt met de klachten die patiënten ervaren. De fysiologische stoornis, uitgedrukt als de mate van luchtwegobstructie en de klachten, beperkingen en kwaliteit van leven vormen samen de ziektelast. Voor de huisartsenpraktijk betekent dit het in kaart brengen, behandelen en monitoren van klachten en beperkingen, longaanvallen, voedingstoestand en mate van luchtwegobstructie.
- Formuleer persoonlijke behandeldoelen in samenspraak met de patiënt.
- Stoppen met roken is verreweg de belangrijkste interventie naast andere leefstijlveranderingen, zoals meer bewegen.
- Dyspneuklachten kunnen worden behandeld met kort- en langwerkende luchtwegverwijders. Deze middelen hebben geen effect op het beloop van de longfunctie (FEV1).
- Overweeg behandeling met een inhalatiecorticosteroïd (ICS) alleen bij patiënten met frequente longaanvallen (≥ 2 per jaar), ondanks behandeling met een of meer langwerkende luchtwegverwijders.
Inleiding
Naar Samenvatting ›Scope
Naar Samenvatting ›Diagnostiek, behandeling en monitoring van chronic obstructive pulmonary disease (COPD).
Buiten de scope
Naar Samenvatting ›- Diagnostiek en behandeling van astma bij volwassenen (zie NHG-Standaard Astma bij volwassenen)
- Andere longziekten
- COVID-19 (zie NHG-Dossier Coronavirus (COVID-19) achtergronden, adviezen over diagnostiek, behandeling, infectiepreventie en organisatie van de zorg, richtlijnen, leidraden en standpunten en hulpmiddelen voor de praktijk zijn te vinden in het webdossier.
Samenwerking en afstemming
Naar Samenvatting ›- De aanbevelingen voor samenwerkingsafspraken zijn opgesteld in overleg met de Nederlandse Vereniging van Artsen voor Longziekten en Tuberculose (NVALT).
- De inhalatie-instructie kan ook worden gegeven door de apotheek.
- Deze standaard sluit aan op de Zorgstandaard COPD van Long Alliantie Nederland.
- De behandeling van COPD-patiënten in de laatste levensfase is afgestemd met de palliatieve richtlijnen, zie Pallialine).
Deze standaard sluit aan op de Zorgstandaard COPD. Voor de ontwikkeling van deze standaard is gebruikgemaakt van internationale richtlijnen en documenten op het gebied van COPD, met name van de GOLD strategie 2019, als ook van multidisciplinaire Nederlandse richtlijnen. Bij deze herziening waren vertegenwoordigers van de Nederlandse Vereniging van Artsen voor Longziekten en Tuberculose (NVALT) en het Longfonds (patiëntenvereniging) als werkgroeplid betrokken.
De huisarts kan de meeste patiënten met COPD zelf behandelen en monitoren. Een deel van de zorg, zoals voorlichting, hulp bij stoppen met roken, spirometrie, inhalatie-instructie en monitoring, kan worden gedelegeerd aan een praktijkondersteuner (zie Protocollaire Astma/COPD zorg). De inhalatie-instructie kan ook worden uitgevoerd door de apotheek. Sommige huisartsenpraktijken leveren COPD-zorg als ketenzorgprogramma binnen een zorggroep met andere zorgverleners, zoals longarts, fysiotherapeut en diëtist. Deze standaard bevat aanbevelingen voor transmurale afspraken, die samen met de NVALT zijn opgesteld.
Richtlijnen voor de diagnostiek of behandeling van astma bij volwassenen staan beschreven in de NHG-Standaard Astma bij volwassenen. Diagnostiek en behandeling van andere oorzaken van dyspneu, zoals pneumonie, hartfalen, longembolie of angststoornis, vallen buiten het bestek van deze standaard. Zie hiervoor NHG-Standaard Acuut hoesten, NHG-Standaard Hartfalen, NHG-Standaard Diepveneuze trombose en longembolie en NHG-Standaard Angst.
Achtergronden
Naar Samenvatting ›Begrippen
Naar Samenvatting ›COPD
Naar Samenvatting ›- COPD wordt gedefinieerd als ‘aanhoudende luchtwegklachten en luchtwegobstructie door afwijkingen aan luchtwegen en/of alveoli’.
- COPD wordt meestal veroorzaakt door aanzienlijke blootstelling aan schadelijke deeltjes of gassen.
In deze standaard wordt de definitie gebruikt die is opgesteld door het Global Initiative for Chronic Obstructive Lung Disease (GOLD). De GOLD-richtlijn, formeel een strategie, is onder auspiciën van de Wereldgezondheidsorganisatie (WHO) opgesteld door een brede, internationale groep deskundigen en beschrijft de diagnose, behandeling en preventie van COPD. GOLD definieert COPD als een ‘te voorkomen en te behandelen aandoening die gekarakteriseerd wordt door aanhoudende luchtwegklachten en luchtwegobstructie die het gevolg is van afwijkingen in de luchtwegen en/of alveoli die meestal het gevolg zijn van blootstelling aan schadelijke deeltjes of gassen’.
De meest voorkomende luchtwegklachten bij COPD zijn dyspneu, hoesten en overmatige sputumproductie. Gedurende het verloop van de aandoening kunnen longaanvallen plaatsvinden, periodes van acute verslechtering van de luchtwegklachten. De meeste COPD-patiënten hebben bijkomende chronische aandoeningen die de morbiditeit en mortaliteit van COPD verhogen.
Classificatie van luchtwegobstructie
De afkapwaarde voor luchtwegobstructie is in deze standaard sinds de voorgaande versie gebaseerd op een percentiel (FEV1/FVC-ratio < p5). De GOLD-classificatie voor de ernst van de COPD gaat uit van de FEV1 (zie tabel 1). Het zou statistisch juister zijn om ook voor deze afkapwaarde de bovengrens van de FEV1 voorspeld te hanteren. Zorgverleners in Nederland zijn echter gewend aan het gebruik van de GOLD-indeling op basis van de FEV1 van voorspeld. Vooral bij ouderen ligt het 5e percentiel van de FEV1 vaak in de range van FEV1 70-80% van voorspeld. De bovengrens van FEV1 80% van voorspeld, wordt in deze standaard daarom gehandhaafd, evenals de afkapwaarden die door GOLD gehanteerd worden voor de ernst van de obstructie (80%, 50% en 30%).
| Luchtwegobstructie | FEV1/FVC-ratio | FEV1 % van voorspelde waarde* |
|---|---|---|
| GOLD 1 Licht | < p5 (z-score < −1,64) | ≥ 80% |
| GOLD 2 Matig ernstig | 50-80% | |
| GOLD 3 Ernstig | 30-50% | |
| GOLD4 Zeer ernstig | < 30% | |
| * De grenswaarden van FEV1 zijn waarden na luchtwegverwijding. | ||
Ziektelast
Naar Samenvatting ›- De ernst van de luchtwegobstructie correleert slechts in beperkte mate met de klachten die patiënten ervaren.
- De fysiologische stoornis, uitgedrukt in de mate van luchtwegobstructie, en de klachten, beperkingen en kwaliteit van leven vormen samen de hoofddomeinen van de ziektelast.
- Voor de huisartsenpraktijk betekent dit het in kaart brengen van 4 subdomeinen:
- klachten en beperkingen, gemeten met de CCQ, en dyspneu, gemeten met de MRC (zie Monitoringsinstrumenten)
- frequentie van longaanvallen
- voedingstoestand, bepaald aan de hand van gewicht en body-mass index (BMI)
- mate van luchtwegobstructie, gemeten als forced expiratory volume in 1 second (FEV1)
- De (totale) ziektelast is verhoogd als ≥ 1 van de 4 subdomeinen afwijkt, volgens de criteria in tabel 5.
- De behandeling van COPD bestaat uit het steeds opnieuw in kaart brengen, behandelen en monitoren van deze 4 subdomeinen.
De ernst van de luchtwegobstructie correleert slechts zwak met de mate van klachten die patiënten ervaren en geeft onvoldoende inzicht in de prognose en de kwaliteit van leven. Naast dyspneuklachten zijn beperkingen in het dagelijks functioneren en problemen in de kwaliteit van leven bepalend bij COPD. De fysiologische stoornis, klachten, beperkingen in het dagelijks functioneren, problemen met de kwaliteit van leven vormen samen de 4 hoofddomeinen van de integrale gezondheidstoestand, ook wel ziektelast genoemd.
De 4 hoofddomeinen van de ziektelast zijn onder te verdelen in verschillende concrete subdomeinen. Het in kaart brengen van deze subdomeinen geeft niet alleen inzicht in de ernst van de ziektelast, maar helpt ook om samen met de patiënt persoonlijke behandeldoelen op te stellen. Voor de huisartsenpraktijk is dit geoperationaliseerd door het in kaart brengen van basale parameters zoals klachten en beperkingen gemeten met de Clinical COPD Questionnaire (CCQ), dyspneu gemeten met de Medical Research Council-score, voedingstoestand via de BMI, frequentie van longaanvallen en mate van luchtwegobstructie door middel van de FEV1. Het evalueren en monitoren van al deze 4 subdomeinen is van groot belang in de COPD-zorg door de huisarts.
Adaptatie
Net als bij andere chronische aandoeningen ervaart de patiënt met COPD dat zijn normale leven definitief verandert. De patiënt past zich aan deze nieuwe situatie aan. Klachten, beperkingen en kwaliteit van leven worden mede bepaald door de mate waarin de patiënt erin slaagt zich aan de stoornis aan te passen. Of deze aanpassing slaagt, hangt onder meer af van inhalatietechniek, therapietrouw, omgaan met longaanvallen, gezonde leefstijl (stoppen met roken, regelmatige lichamelijke inspanning, voeding), energiebesparende technieken (temporiseren, energie verdelen), ademregulatie, omgaan met stress, adequate ziektecognities, communicatie met de omgeving over de ziekte en aanpassingen in het werk. Bij de behandeling van COPD speelt het ondersteunen van deze aanpassingen een centrale rol. In het algemeen geldt: hoe beter de patiënt met zijn ziekte omgaat des te lager is de ziektelast. Het is de taak van de huisarts en andere zorgverleners de patiënt hierbij zo goed mogelijk te ondersteunen.
Ernst van de ziektelast: van 3 naar 2 niveaus
De Zorgstandaard COPD maakt onderscheid tussen lichte, matige en ernstige ziektelast. In de huisartsenpraktijk bleek het onderscheid tussen ‘matig’ en ‘ernstig’ vaak niet duidelijk. Omdat de overgang van matige naar ernstige ziektelast een glijdende schaal is en ‘ernstige ziektelast’ in feite een verwijscriterium is, is de relevantie van deze term voor de huisartsenpraktijk dermate beperkt dat de aanduiding ‘ernstige ziektelast’ kan vervallen. Bij de revisie heeft de werkgroep besloten om de ziektelast in te delen in 2 niveaus: ‘licht’ en ‘verhoogd’. De (totale) ziektelast is verhoogd als een van de 4 subdomeinen afwijkend is. Het belang van deze tweedeling is gelegen in de borging van de zorg voor COPD-patiënten met een verhoogde ziektelast, zij hebben in de regel meer zorg nodig dan patiënten met een lichte ziektelast.
‘Verhoogde ziektelast’ correspondeert met het oude ‘matige ziektelast’. Het eerder gehanteerde ‘ernstige ziektelast’ is vervangen door verwijscriteria. Problemen in de samenwerking met de tweede lijn als gevolg van deze wijziging vallen niet te verwachten, omdat de indeling van ziektelast voor de huisartsenpraktijk gebaseerd is op het in kaart brengen van basale parameters die ook in de tweede lijn bekend zijn. In deze standaard resulteert dit in de volgende indeling.
Lichte ziektelast
Patiënten met een FEV1 > 50% van voorspeld, zonder ernstige klachten of beperkingen door dyspneu (MRC < 3; CCQ < 2,0), zonder verminderde voedingstoestand, zonder frequente longaanvallen en bij wie de ziektelast in geringe mate beïnvloed wordt door comorbiditeit.
Verhoogde ziektelast
Patiënten met ofwel een FEV1 < 50% van voorspeld, ernstiger klachten of beperkingen door dyspneu (MRC ≥ 3; CCQ ≥ 2,0), verminderde voedingstoestand, frequente longaanvallen en/of bij wie de ziektelast beïnvloed wordt door comorbiditeit.
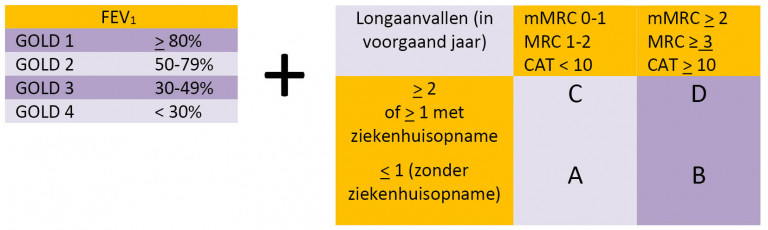
GOLD ABCD-indeling ziektelast
In de tweede lijn wordt veelal gewerkt met de GOLD-classificatie. In 2017 publiceerde de GOLD een gereviseerde classificatie van COPD: een ‘gecombineerde’ classificatie. Deze gecombineerde classificatie wordt in de huidige GOLD-strategie nog steeds gebruikt en vormt een verfijning van de ABCD-indeling uit 2011. Hoewel de indeling uit 2011 door de incorporatie van onder andere ziektelast al een grote verbetering vormden ten opzichte van de eerder gebruikte indeling op basis van alleen spirometrie, bleek deze de mortaliteit en andere gezondheidsuitkomsten niet beter te voorspellen. In de ‘gecombineerde’ assessment uit 2017 staan daarom de spirometrische indeling en de ABCD-indeling los van elkaar, de stadia bestaan nu uit zowel een cijfer (spirometrie) als een letter (ABCD, gebaseerd op klachten en longaanvallen in het afgelopen jaar). Ook de nieuwe GOLD-classificatie lijkt mortaliteit echter niet beter te kunnen voorspellen dan de vorige indeling.
Voor de huisarts is de GOLD-classificatie vooral van betekenis voor de communicatie vanuit en met de tweede lijn. In deze NHG-Standaard wordt de ernst van COPD ingedeeld op grond van de ziektelast. Hierbij wordt lichte en verhoogde ziektelast onderscheiden op grond van criteria in tabel 5, dit geeft een inzichtelijker assessment dan een letteraanduiding. Het gebruik van de GOLD-classificatie heeft op dit moment binnen de huisartsenzorg dan ook geen duidelijke meerwaarde.
Persoonlijke behandeldoelen
Naar Samenvatting ›Individueel gewenst resultaat van de behandeling van de COPD. Het gaat daarbij om specifieke bezigheden die een patiënt wil kunnen doen, maar waarin de COPD-klachten hem belemmeren. Voorbeelden zijn: de hond uitlaten, een fietstocht maken, sporten, familiebezoek enzovoort.
Restrictieve longaandoeningen
Naar Samenvatting ›- Hieronder vallen onder andere (idiopathische) longfibrose, ‘stoflongen’, (osteoporotische) wervelinzakkingen ernstige kyfoscoliose.
- Een afwijkende forced vital capacity (FVC) in combinatie met een normale FEV1/FVC kan een aanwijzing zijn voor een restrictieve stoornis, maar is in de eerste lijn meestal het gevolg van een technisch onvoldoende uitgevoerde test.
Hyperinflatie
Naar Samenvatting ›- Toename van de functionele residuale capaciteit bij (meestal) een gelijktijdige toename van de totale longcapaciteit.
- Hyperinflatie is waarschijnlijk een van de oorzaken van het gevoel van dyspneu bij patiënten met COPD.
Hyperinflatie (‘tonvormige thorax’) kan ontstaan door toename van de functionele reservecapaciteit bij een gelijktijdige toename van de totale longcapaciteit. Vermindering van de bronchusobstructie na luchtwegverwijding leidt bij een deel van de patiënten tot vermindering van de dyspneu door een afname van de hyperinflatie en een toename van de vitale capaciteit. Statische hyperinflatie is het verschijnsel waarbij een COPD-patiënt onvoldoende tijd heeft om voldoende uit te ademen als gevolg van een luchtwegobstructie in de kleine luchtwegen, irreversibele afbraak van longweefsel en ‘slappe’ longen. Dit fenomeen is een van de belangrijkste oorzaken van kortademigheidsklachten bij COPD. Hierbij zijn in vergelijking met gezonde personen het residuale volume (RV) en de functionele residuele capaciteit (FRC) verhoogd en de inspiratoire capaciteit (IC, ‘ademruimte’) verlaagd. Bij inspanning neemt het probleem van de hyperinflatie (dynamische hyperinflatie of air trapping) verder toe omdat de ademhalingsfrequentie omhoog moet, er minder tijd is om goed uit te ademen en het RV verder toeneemt. Door de toename van het RV en de FRC neemt de IC verder af. De patiënt wordt dus benauwd(er) en zal de inspanning beëindigen. Ook bij minder ernstig COPD is er sprake van hyperinflatie, zij het bij een beperkter aantal patiënten.
Longaanval (exacerbatie) COPD
Naar Samenvatting ›Een verslechtering van de conditie van de patiënt binnen 1 of enkele dagen, gekenmerkt door een toename van dyspneu en/of hoesten die groter is dan de normale dagvariabiliteit.
Keuze voor de term ‘longaanval’ of ‘exacerbatie’
Veel betrokkenen bij de zorg rondom astma en COPD geven de voorkeur aan de term ‘longaanval’ boven de oude benaming ‘exacerbatie’ en richtlijnen zoals de Zorgstandaard COPD doen dat ook. De werkgroep geeft eveneens de voorkeur aan de term ‘longaanval’, omdat deze in de communicatie met patiënten beter begrepen wordt dan ‘exacerbatie’.
Definitie van longaanval
Er is geen wereldwijd breed geaccepteerde definitie van ‘acute longaanval van COPD’. De internationale richtlijnen hanteren een combinatie van klinische symptomen (toename van dyspneu, sputumvolume en purulentie en/of hoesten). GOLD definieert een longaanval als een ‘acute verslechtering van luchtwegklachten die aanvullende behandeling noodzakelijk maken’. Ook wordt wel beschreven dat patiënten met een acute longaanval van COPD aspecifieke klachten kunnen hebben, zoals malaise, slapeloosheid, vermoeidheid, depressie, verwardheid, verminderde inspanningstolerantie en koorts.
Gelijktijdig astma en COPD (astma-COPD overlap of ACO)
Naar Samenvatting ›Aanvalsgewijze bronchusobstructie (astma) die niet-volledig reversibel is. Dit komt regelmatig voor bij astmapatiënten die roken of hebben gerookt, en bij oudere astmapatiënten die in het verleden suboptimaal zijn behandeld.
Epidemiologie
Naar Samenvatting ›- In Nederland is de incidentie van COPD in de huisartsenpraktijk 2,1 per 1000 patiënten per jaar voor mannen en 2,3 per 1000 per jaar voor vrouwen.
- De prevalentie is 35,6 per 1000 patiënten per jaar voor zowel mannen als vrouwen. Boven de 65 jaar komt COPD vaker voor bij mannen.
- In Nederland is bij in totaal 613.000 mensen de diagnose ‘COPD’ gesteld, het werkelijke aantal ligt waarschijnlijk hoger in verband met onderdiagnostiek.
- COPD kwam in het verleden vaker voor bij mannen, maar komt steeds meer bij vrouwen voor, doordat meer vrouwen zijn gaan roken. Vrouwen hebben vaak ernstiger COPD (meer longaanvallen en ernstiger dyspneu) en deze ontstaat ook vaker op relatief jongere leeftijd.
- COPD komt beduidend vaker voor bij mensen met een lagere opleiding, ook na correctie voor een hogere prevalentie van roken.
- Bij naar schatting 10-15% van de rokers wordt de diagnose ‘COPD’ gesteld; bij zware rokers loopt dit op tot bijna 50%.
- COPD gaat gepaard met een hoge mortaliteit en staat in de top 10 van gerapporteerde doodsoorzaken in Nederland.
- De economische impact van COPD is groot door directe zorgkosten en door indirecte kosten van werkverzuim en arbeidsongeschiktheid.
De prevalentie van COPD is in de afgelopen decennia onder vrouwen fors gestegen omdat vrouwen sinds 1950 steeds meer zijn gaan roken. Tussen 2000 en 2010 is het aantal vrouwen met COPD zelfs verdubbeld. Bij mannen is de prevalentie juist gestabiliseerd [huisartsenregistratie RNH-Limburg]. In 2018 was de jaarprevalentie van de ICPC-codes R91 (chronische bronchitis/bronchiëctasieën) en R95 (emfyseem/COPD) 35,6 per 1000 patiënten voor zowel mannen als vrouwen, de prevalentie van alleen R95 was voor mannen 29,5 en voor vrouwen 28,1 (zie Volksgezondheid.info en NIVEL Zorgregistraties). In 2018 overleden in Nederland 6879 mensen aan COPD en daarmee is COPD de 6e doodsoorzaak (zie CBS doodsoorzakenstitistiek).
Deze cijfers vormen waarschijnlijk een onderschatting van het daadwerkelijke aantal COPD-patiënten omdat de aandoening vooral bij vrouwen, maar ook bij relatief jonge patiënten met matige klachten vaak (nog) niet wordt herkend. De belangrijkste oorzaak van deze onderdiagnostiek is dat COPD geleidelijk ontstaat. Ook de diagnostiek zelf speelt een rol: huisartsen zouden mogelijk onvoldoende spirometrie inzetten en als ze dat wel doen, zou die niet altijd van voldoende kwaliteit zijn.
COPD wordt veel vaker vastgesteld bij mensen uit de lagere sociaal-economische klassen. Dit betekent dat 46% van de patiënten met COPD verminderd gezondheidsvaardig is. Gegevens uit huisartsenpraktijken wijzen niet op verschillen in het vóórkomen van COPD bij Nederlanders met of zonder migratieachtergrond; ook dit kan te maken hebben met onderdiagnostiek. Een mogelijk hogere prevalentie van COPD bij Turkse mannen van 40-65 jaar verdween na correctie voor opleidingsniveau. In een Noors onderzoek was een laag opleidingsniveau in vergelijking met een universitair opleidingsniveau een risicofactor voor COPD na correctie voor beroepsexpositie en roken (OR 5,2; 95%-BI 2,0 tot 13,4). Een review ondersteunt deze conclusie.
Incidentie van longaanvallen
De frequentie van longaanvallen bij patiënten die in de huisartsenpraktijk onder behandeling zijn, ligt lager dan bij patiënten die geïncludeerd zijn in gesponsorde onderzoeken. Bij patiënten met een lichte luchtwegobstructie heeft 34% ≥ 1 longaanval per jaar en 12% ≥ 2 longaanvallen per jaar. Internationaal is het jaarlijks aantal ziekenhuisopnames vanwege een longaanval 10-25%, in Nederland 10%.
Pathofysiologie
Naar Samenvatting ›COPD wordt gekenmerkt door aanhoudende luchtwegklachten en luchtwegobstructie. Dit is het gevolg van een meestal door roken veroorzaakt chronisch inflammatoir proces in de centrale en perifere luchtwegen, het longparenchym en de pulmonale bloedvaten.
COPD is een heterogene aandoening. Op basis van de pathofysiologische en klinische presentatie kunnen er 3 domeinen worden onderscheiden: obstructie van de kleine luchtwegen, emfyseem en chronische bronchitis. Deze gaan overigens gepaard met dezelfde longfunctieafwijkingen.
De luchtwegobstructie bij COPD is geassocieerd met een abnormale inflammatoire reactie van de longen op schadelijke partikels en gassen. Al in een vroeg stadium van de aandoening veroorzaakt de persisterende ontsteking schade aan de kleine luchtwegen (obstructieve bronchiolitis) en het parenchym (emfyseem). Dit leidt vervolgens tot progressieve bronchusobstructie, hyperinflatie (zie Hyperinflatie), hypersecretie van mucus en uiteindelijk tot gaswisselingsstoornissen, emfyseem, pulmonale hypertensie en cor pulmonale. Bij sommige patiënten persisteren de chronische ontsteking en de hyperreactiviteit ondanks stoppen met roken.
De veranderingen in de centrale luchtwegen bestaan vooral uit een exsudaat van macrofagen en T-lymfocyten, toename van slijmbeker- en kliercellen, disfunctie en afname van trilhaarepitheel, toename van gladde spiercellen en bindweefsel, degeneratie van kraakbeen en hypersecretie van mucus. Deze veranderingen treden ook op in de perifere luchtwegen, maar daar is de luchtwegobstructie het belangrijkst. Door de herhaalde beschadiging van de luchtwegwand neemt de collageenformatie toe en treedt littekenvorming op. Bij de veranderingen in het parenchym gaat het vooral om dilatatie en destructie van alveoli (centrilobulair emfyseem). De veranderingen in de pulmonale vaten betreffen vooral endotheeldisfunctie met verdikking van de intima en toename van glad spierweefsel.
De luchtwegobstructie is per definitie niet volledig reversibel, maar een verbetering na gebruik van luchtwegverwijders is verenigbaar met de diagnose ‘COPD’.
Bij ongeveer 10% van de patiënten met COPD ontstaan metabole en systemische veranderingen – een gestoorde eiwitbalans en afname van de vetvrije massa – die leiden tot een verminderde voedingstoestand.
Veel patiënten met COPD hebben andere aandoeningen die gerelateerd zijn aan de risicofactoren voor COPD (roken, gevorderde leeftijd, weinig bewegen). Gaswisselingsstoornissen, hyperinflatie en de verhoogde aanwezigheid van ontstekingsmediatoren door COPD vergroten het risico op hartfalen, ischemisch vaatlijden, skeletspierverlies, osteoporose, normocytaire anemie en diabetes mellitus.
Risicofactoren
Naar Samenvatting ›Roken
Naar Samenvatting ›Roken is verreweg de belangrijkste risicofactor voor het ontstaan van COPD.
De meeste patiënten met COPD hebben lange tijd gerookt. Het verschil in gevoeligheid voor de gevolgen van roken is voor een deel genetisch bepaald. Er is een duidelijke relatie tussen de totale tabaksconsumptie en de ernst van de longfunctievermindering, maar GOLD rapporteert een lifetime risico op COPD van < 50% bij zware rokers.
Mensen die hun hele leven roken, sterven gemiddeld 10 jaar eerder dan mensen die nooit gerookt hebben. Ongeveer 25% van de oversterfte bij rokers is te wijten aan longcarcinoom en COPD. In een groep langdurige rokers (> 10 jaar) bij wie nog geen obstructie met spirometrie was vastgesteld, werd op een CT-scan vaak (het begin van) emfyseem gezien.
In een Amerikaans cohort had de helft van de (ex-)rokers klachten zonder dat zij voldeden aan de spirometrische criteria voor COPD.
In de algemene bevolking van de Verenigde Staten is de geschatte prevalentie van COPD (FEV1/FVC < 0,7) bij rokers 14%, zowel bij mannen als bij vrouwen. De prevalentie van niet eerder vastgesteld COPD (FEV1/FVC < 0,7) bij mannelijke rokers ≥ 40 jaar varieerde van 12% in een Grieks onderzoek tot 30% in een Nederlands onderzoek. Bij patiënten met COPD die blijven roken is de jaarlijkse afname van de FEV1 gemiddeld 62 ml, versus 31 ml bij patiënten die definitief stoppen. Laatstgenoemde waarde valt binnen de fysiologische grenzen van longfunctieverlies. In een cohort rokers werd gevonden dat bij patiënten met COPD in GOLD-stadium 1 iedere longaanval leidde tot 23 ml extra FEV1-verlies per jaar (95%-BI 2 tot 44 ml; p = 0,03), en ernstige longaanvallen zelfs tot 87 ml (95%-BI 23 tot 151 ml; p = 0,008). Bij patiënten in GOLD-stadia 2 en 3 was het extra FEV1-verlies door longaanvallen minder groot.
Bij een groep mannelijke rokers van 40-65 jaar (n = 399) was roken vóór de leeftijd van 16 jaar een onafhankelijke voorspeller van matig ernstig COPD 5 jaar later. Recent onderzoek wijst uit dat de duur van het roken het risico op COPD beter voorspelt dan de cumulatieve hoeveelheid sigaretten uitgedrukt in pakjaren.
Passief roken
De relatie tussen passief roken en een verminderde longfunctie is minder duidelijk. Passief roken leidt wel tot meer luchtwegklachten. Een systematisch literatuuronderzoek leverde sterke aanwijzingen op voor een relatie tussen passieve blootstelling aan rook op de werkplek en in de thuissituatie enerzijds, en chronische luchtwegklachten en in mindere mate – en dan vooral bij een hoge blootstelling – een verminderde longfunctie anderzijds.
Fijnstof
Naar Samenvatting ›Verhoogde blootstelling aan fijnstof is geassocieerd met een afname van de FEV1 en een toename van de prevalentie en mortaliteit van COPD.
Achtergrond
Fijnstof is één van de stoffen die zorgt voor luchtverontreiniging. Fijnstof wordt gedefinieerd als alle deeltjes in de lucht < 10 microm, afgekort PM10. Deeltjes < 2,5 microm worden aangeduid als ultrafijnstof (PM2,5). In de literatuur wordt als kortetermijneffect van verhoogde blootstelling aan fijnstof bij ouderen een toename van het aantal longaanvallen bij COPD en een verhoogde mortaliteit beschreven.
Er is in dit detail niet gekeken naar de rol van NOx en O3.
Uitgangsvraag
Geeft verhoogde blootstelling aan fijnstof een verhoogd risico op het ontwikkelen van COPD?
Zoekstrategie
In de huidige richtlijnen, zoals het WHO-rapport van 2018, wordt de relatie tussen fijnstof en het ontwikkelen van COPD niet beschreven. Het volgende overzicht is op basis van een PubMed-search en 3 later verschenen artikelen.
Resultaten
PM2,5
In een Brits onderzoek werd de associatie onderzocht tussen de spirometriegegevens uit een biobank van 303.887 mensen van 40-69 jaar in stedelijke gebieden in Engeland, Wales en Schotland, en de blootstelling van de patiënten aan PM2,5. Een toename van 5 microg/m3 bleek geassocieerd met een FEV1-afname van −83,13 ml (95%-BI −92,50 tot −73,75 ml) evenals de FVC (−62,62 ml; 95%-BI −73,91 tot −51,32 ml). De COPD-prevalentie steeg bij hogere concentraties PM2,5 (OR 1,52 per 5 microg/m3; 95%-BI 1,42 tot 1,62).
In een cohortonderzoek in de VS onder 5780 deelnemers van 45-84 jaar afkomstig uit 6 grote steden werd een associatie gevonden tussen PM2,5 en emfyseem, gemeten met een CT-scan. Bij follow-up gedurende 10 jaar werd geen progressie van het emfyseem gevonden bij voortdurende PM2,5-expositie (die in alle gebieden afnam).
De relatie tussen PM2,5 en COPD werd eveneens nagegaan in 625 steden van 24 landen of regio’s (merendeels Oost-Azië, Europa en de VS). De toename in totale mortaliteit voor een toename van 10 microg/m3 was 0,68% (95%-BI 0,59 tot 0,77%) en voor respiratoire aandoeningen 0,74% (95%-BI 0,53 tot 0,95%).
PM10
Het onderzoek van Schikowski (2014) was onderdeel van de European Study of Cohorts for Air Pollution Effects (ESCAPE). In dit onderzoek zijn 4 cohortonderzoeken geïncludeerd waarin bij 3692 deelnemers werd gekeken naar blootstelling aan PM10. Deelnemers waren in de periode 1985-2010 at random geselecteerd uit de algemene bevolking. De gemiddelde PM10-waarden lagen tussen de 16 en 27 microg/m3. Op baseline en gedurende de follow-up werden longfunctietests gedaan om te bepalen welke deelnemers COPD ontwikkelden. Bij een toename van 10 microg/m3 PM10 was de OR 1,04 (95%-BI 0,71 tot 1,53).
In 2015 analyseerde Atkinson een cohort van 812.063 Engelse patiënten zonder COPD die in 2002 werden geselecteerd uit de algemene bevolking en die in de periode 2003-2007 werden gevolgd. Bij 16.034 patiënten (1,92%) werd de diagnose COPD in deze periode gesteld door een huisarts of in het ziekenhuis. Gegevens werden verzameld uit een landelijke database. De blootstelling aan PM10 per individu werd berekend met behulp van een wiskundige simulatie van de verspreiding van PM10. De correlatie (R2) tussen de berekende en de werkelijke blootstelling aan PM10 was 0,29 en 0,46). De gemiddelde concentratie PM10 was 19,3 microg/m3 (SD 2,3). Bij een toename van 3 microg/m3 PM10 was de hazard ratio voor stijging van de incidentie van COPD 0,97 (95%-BI 0,79 tot 1,18).
Situatie in Nederland
In Nederland mag het jaargemiddelde van geïnhaleerd PM10 niet > 40 microg/m3 bedragen, voor PM2,5 is dit 25 microg/m3. De luchtkwaliteit in Nederland verbetert, tussen 2004 en 2016 werd een jaarlijkse afname van 0,9 microg/m3 PM10 gezien. De gemiddelde PM10-waarden waren in 2015 in Amsterdam 19,9 microg/m3 en in Friesland 14,6 microg/m3. De verschillen tussen blootstelling aan PM10 binnen Nederland zijn klein.
Met name langs een aantal wegen in drukke stadscentra is de expositie aan PM2,5 boven de norm. De WHO adviseert te streven naar een PM2,5-expositie < 10 microg/m3. Dit is ongeveer 5 microg/m3 minder dan de huidige gemiddelde waarde in Nederland.
Conclusie
Er is een associatie tussen de blootstelling aan met name PM2,5 en FEV1-afname, COPD-prevalentie en respiratoire mortaliteit. Ook bij PM10-expositie stijgt de incidentie van COPD. De exacte rol van fijnstof en ultrafijnstof bij het ontstaan van COPD is niet volledig duidelijk. Omdat duidelijk is dat een hogere blootstelling aan fijnstof bij al bestaande COPD een verhoogde mortaliteit en morbiditeit veroorzaakt, is een causaal verband bij het ontstaan van COPD op grond van deze dosiseffectrelatie en op pathofysiologische gronden aannemelijk.
Alfa-1-antitrypsinedeficiëntie
Naar Samenvatting ›- In zeldzame gevallen is een aangeboren deficiëntie van het enzym alfa-1-antitrypsine de oorzaak van COPD.
- De aandoening erft autosomaal recessief over (beide ouders moeten drager zijn en de patiënt kan de eerste of enige in de familie zijn).
In zeldzame gevallen is COPD het gevolg van een aangeboren deficiëntie van het enzym alfa-1-antitrypsine. Deze deficiëntie is een autosomaal recessieve aandoening en kan zich dus voor het eerst openbaren zonder dat andere familieleden de ziekte hebben. Ook heterozygote dragers hebben mogelijk een licht verhoogd risico op het ontwikkelen van COPD. Alfa-1-antitrypsine gaat normaal gesproken het verlies van elasticiteit in de longen tegen. De klachten beginnen in de leeftijd 35-45 jaar. Alfa-1-antitrypsine kan in het serum worden bepaald.
De behandeling van de longklachten bij alfa-1-antitrypsinedeficiëntie bestaat onder meer uit inhalatiemedicatie (bronchusverwijders, onstekingsremmers) en uit leefstijladviezen, zoals niet roken, houdingsdrainage en sporten. Bij longaanvallen start de longarts of de huisarts laagdrempelig een behandeling met prednison en/of antibiotica. Een eventuele oorzakelijke behandeling is suppletie met alfa-1-antitrypsine. Met deze behandeling is geen genezing mogelijk, maar het blijkt bij een deel van de patiënten onder andere het proces van de longbeschadiging te vertragen.
Zie ook de NHG-brochure Alpha-1-antitrypsinedeficiëntie.
Overige risicofactoren
Naar Samenvatting ›- Chronische blootstelling van de longen aan kleine deeltjes, zoals:
- blootstelling aan stof, steengruis, gassen en dampen, smog, mist, nevel of rook in de leef- en werkomgeving, bijvoorbeeld in stallen, mijnen of huishoudens waar op hout gekookt wordt
- blootstelling aan tabaksrook in utero of op de kinderleeftijd
- gebruik van waterpijp of inhaleren van (hard)drugs
- Laag geboortegewicht en vroeggeboorte zijn eveneens risicofactoren.
Er is een verband aangetoond tussen beroepsmatige blootstelling aan onder meer cadmium (batterij-industrie), steenkoolstof, steengruis en agrarische stof (bijvoorbeeld graanstof) en de ontwikkeling van COPD. In een onderzoek onder (ex-)werknemers van 30-75 jaar (n = 10.000) werd het COPD bij ruim 19% van het totaal aantal COPD-patiënten in de Amerikaanse beroepsbevolking toegeschreven aan het werk. Voor patiënten met COPD die nooit gerookt hadden, lag dat op ruim 30%. In een review van 19 onderzoeken in de Amerikaanse algemene bevolking werd gemeld dat beroepsmatige blootstelling voor ongeveer 15% bijdroeg aan de ontwikkeling van COPD in de totale Amerikaanse bevolking. Er zijn onvoldoende gegevens om een dergelijke schatting te kunnen doen in de Nederlandse bevolking.
Blootstelling aan rook van houtvuur of steenkool is geassocieerd met een groter risico op COPD. Andere oorzaken van COPD op jonge leeftijd zijn het roken van harddrugs zoals cocaïne en heroïne, en het gebruik van een waterpijp.
Er zijn aanwijzingen dat een laag geboortegewicht en frequente luchtweginfecties op jonge leeftijd eveneens risicofactoren voor COPD zijn.
Oorzaak van longaanvallen
Naar Samenvatting ›- Longaanvallen kunnen worden uitgelokt door virale en bacteriële luchtweginfecties (50-70%) en omgevingsfactoren zoals fijnstof (10%). Bij circa 30% van de longaanvallen blijft de oorzaak echter onbekend.
- Allergische prikkels spelen bij longaanvallen van COPD meestal geen rol van betekenis, tenzij de patiënt ook astma heeft.
Haemophilus influenzae (11%), Streptococcus pneumoniae (10%), Moraxella catarrhalis (10%) en Haemophilus parainfluenzae (10%) worden bij longaanvallen het meest gekweekt. Bij 20-30% van de patiënten met klinisch stabiel COPD is de sputumkweek positief voor bacteriën. Het blijft echter controversieel of bacteriële kolonisatie een longaanval veroorzaakt of dat het een marker is voor de ernst van de ziekte.
Rinovirussen worden gedetecteerd bij ruim 20% van de longaanvallen door COPD. Afhankelijk van de diagnostische methode varieert het percentage longaanvallen waarbij een virus wordt aangetroffen van 20% bij kweken of serologie tot 40% bij PCR. De grote spreiding wordt mede veroorzaakt door seizoensinvloeden en door de sensitiviteit van de samplingmethode.
Bij 14% van de longaanvallen werd een verband gevonden met Mycoplasma pneumoniae.
Epidemiologische onderzoeken laten zien dat er frequent longaanvallen van COPD optreden wanneer de luchtvervuiling is toegenomen. Rookdeeltjes (SO2, O3, NOx) worden geassocieerd met een toename van luchtwegklachten, ziekenhuisopnamen en mortaliteit vanwege COPD. Ongeveer 9% van de ziekenhuisopnamen in verband met COPD lijkt gerelateerd aan luchtvervuiling, vooral ’s zomers.
In een onderzoek bij ruim 1000 patiënten met een acute longaanval van ernstig COPD bleek hartfalen in 26% van de gevallen de symptomen te verklaren, terwijl de etiologie in ongeveer 30% van de gevallen onbekend bleef.
Concluderend wordt 50-70% van de longaanvallen veroorzaakt door een virale of bacteriële infectie, 10% door omgevingsfactoren en 30% door onbekende factoren.
Beloop en prognose van COPD
Naar Samenvatting ›- De ernst van de luchtwegobstructie op het moment dat de aandoening wordt vastgesteld en het rookgedrag bepalen in belangrijke mate het beloop en de prognose van COPD.
- Vaak is de kwaliteit van leven voor wat betreft functionele beperkingen, psychisch welbevinden en sociaal functioneren bij patiënten met COPD verminderd.
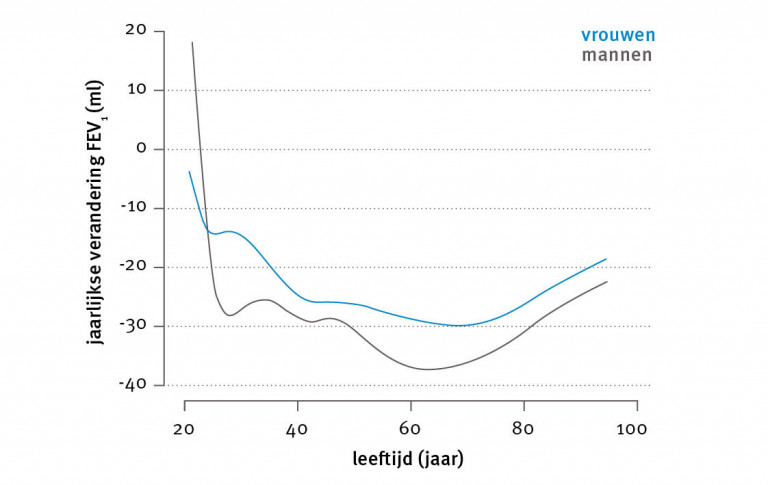
Normale achteruitgang van de longfunctie
De mate waarin de FEV1 daalt vormt een van de indicatoren voor het bereiken van de behandeldoelen. Uit cross-sectioneel onderzoek blijkt dat bij vrouwen de FEV1 vanaf 30 jaar daalt met 15 ml per jaar, wat toeneemt tot 30 ml/jaar omstreeks het 70e en daarna geleidelijk weer afneemt tot 20 ml per jaar. Bij mannen is de afname 25 ml per jaar vanaf 30 jaar, 40 ml per jaar omstreeks het 65e en 25 ml per jaar op latere leeftijd (zie figuur 2). Het daadwerkelijke longitudinale beloop bij een individu kan echter afwijken van dat wat gevonden wordt bij cross-sectioneel onderzoek.
De fysiologische achteruitgang van de FEV1 is 25-35 ml per jaar vanaf de leeftijd van 30 jaar. Bij patiënten met COPD die blijven roken is de jaarlijkse afname van de FEV1 gemiddeld 62 ml, versus 31 ml bij degenen die definitief stoppen. Dit laatste valt binnen de fysiologische grenzen van longfunctieverlies. Lagereluchtweginfecties veroorzaken een geringe extra afname van de FEV1 (7 ml).
Achteruitgang van de longfunctie bij COPD
Het beloop en de prognose van COPD worden in eerste instantie vooral bepaald door het rookgedrag, de ernst van de luchtwegobstructie op het moment dat de aandoening wordt vastgesteld en de gevolgen daarvan voor de gezondheidstoestand. De fysiologische achteruitgang van de FEV1 > 30 jaar is ≤ 35 ml per jaar, bij rokers met COPD > 60 ml per jaar. Bij ex-rokers neemt de FEV1-daling in het algemeen weer af tot fysiologische waarden. Er zijn echter aanwijzingen dat bij sommige ex-rokers met COPD de ontsteking voortduurt en de FEV1-daling progressief is. Longaanvallen zijn verantwoordelijk voor een extra FEV1-daling van 10-30 ml per jaar, afhankelijk van de ernst van de COPD. Mogelijk spelen ook frequente lagereluchtweginfecties een negatieve rol. Naarmate de aandoening verder is voortgeschreden doen zich meer systemische effecten voor, zoals gewichtsverlies. Samen met inspanningsintolerantie en comorbiditeit, zoals hartfalen, bepalen deze systemische effecten in dat stadium de verdere prognose wat betreft kwaliteit van leven en levensverwachting. Bij COPD met een lichte of matig ernstige luchtwegobstructie (FEV1 > 50% van voorspeld) is de mate van progressie moeilijk te voorspellen. COPD is een aandoening met verschillende uitingsvormen, zoals die met frequente longaanvallen. Andere uitingsvormen worden gekenmerkt door klachten van dyspneu en inspanningsbeperking of door chronisch hoesten en slijm opgeven.
Prognostische factoren
Negatieve prognostische factoren voor de kwaliteit van leven en de levensverwachting zijn hogere leeftijd, slechtere longfunctie, comorbiditeit (hartfalen, longcarcinoom) en een verminderde voedingstoestand (laag lichaamsgewicht, ongewenst gewichtsverlies of geringe vetvrije massa). Verschillende ziektegerelateerde factoren (treatable traits) zijn min of meer onafhankelijk geassocieerd met een slechtere gezondheidsstatus: moeheid, sombere stemming, frequente longaanvallen, roken, slechte voedingstoestand, verminderde fysieke conditie of acitviteit, weinig zelfmanagement.
Daarnaast leidt dyspneu tot een neerwaartse spiraal waarbij afname van het inspanningsvermogen leidt tot vermijden van inspanning, wat leidt tot toename van het disfunctioneren en zo verder. Bij ernstiger vormen van COPD wordt dit versterkt door metabole en systemische veranderingen (verstoorde eiwitbalans, verhoogde ademarbeid en afname van de vetvrije massa). Depressie en angstklachten vergroten het risico op een ziekenhuisopname bij een longaanval.
Kwaliteit van leven
In vergelijking met de algemene bevolking is de kwaliteit van leven (functionele beperkingen, psychisch welbevinden, sociaal functioneren) van patiënten met COPD verminderd. Comorbiditeit heeft hierbij een grote invloed. Bij patiënten met matig ernstig COPD heeft de mate van beperkingen door dyspneu een sterker verband met de kwaliteit van leven dan de FEV1. Vaak spelen ook psychische factoren een rol, zoals angst voor kortademigheid of juist voor het overschrijden van de beperkte fysieke mogelijkheden. Er is een relatie tussen COPD en angst- of stemmingsklachten.
Onderscheid en gelijktijdig bestaan van astma en COPD
Naar Samenvatting ›- Bij patiënten met astma kunnen op middelbare leeftijd, door roken of door een langer bestaande ontsteking die onvoldoende behandeld is, structurele veranderingen ontstaan waardoor de luchtwegvernauwing naast een reversibele ook een irreversibele component krijgt (ACO of astma met persisterende obstructie).
- Bij ernstig astma is irreversibele verandering van de luchtwegen niet altijd te voorkomen, ook met maximale behandeling.
|
|
Astma |
COPD |
|---|---|---|
|
Belangrijkste risicofactor |
Atopie |
Roken |
|
Luchtwegobstructie |
Wisselend, in de regel reversibel |
Per definitie deels irreversibel |
|
Pathofysiologie |
Chronische ontsteking in alle luchtwegen, meestal gevoelig voor corticosteroïden |
Chronische ontsteking met name in de kleine luchtwegen, relatief ongevoelig voor corticosteroïden |
|
Uitlokkende factor |
Allergische en niet-allergische prikkels |
– |
|
Leeftijd |
Alle leeftijden |
Meestal > 40 jaar |
|
Beloop |
Meestal gunstig met variërende klachten |
Overwegend chronisch, geleidelijk progressief |
|
Levensverwachting |
(Vrijwel) normaal bij optimale behandeling |
Verminderd, ook bij optimale behandeling |
|
Longfunctie (spirometrie) |
Meestal normaal of met reversibele obstructie |
Blijvend verminderd (irreversibele obstructie) |
Richtlijnen diagnostiek
Naar Samenvatting ›- Overweeg COPD bij rokers of ex-rokers > 40 jaar met klachten van hoesten, al dan niet met slijm opgeven of geleidelijk progressieve dyspneu.
- Bij mensen < 40 jaar komt COPD voornamelijk voor als gevolg van alfa-1-antitrypsinedeficiëntie, (hard)drugsverslaving of al dan niet beroepsmatige blootstelling aan stof, rook, gassen of dampen.
Anamnese
Naar Samenvatting ›Vraag naar:
- kortademigheid, al of niet in combinatie met piepen, frequentie, duur (incidenteel, regelmatig, dagelijks), ’s nachts)
- hoesten: productieve (ochtend)hoest, chronisch hoesten; problemen met ophoesten van slijm, hemoptoë
- roken: huidig en voormalig rookgedrag, op welke leeftijd begonnen, aantal jaren gerookt en gemiddeld aantal sigaretten per dag, meeroken
- arbeidsomstandigheden en vrijetijdsbesteding waarin blootstelling aan stof, gassen, dampen of rook optreedt (open haardvuur, schilder, chauffeur, kapper, bakker, omgeving met veel fijnstof van bijvoorbeeld steen, metaal, graan)
- invloed van de klachten op het functioneren: sociale contacten, hobby’s, sport, werk, verzuim en arbeidsongeschiktheid, moeheid
- voorkomen van COPD en alfa1-antitrypsinedeficiëntie in de familie
- ongewenst gewichtsverlies of verlies van spierkracht, verminderd vermogen tot lichamelijke inspanning
- drugsgebruik, vooral bij inhalatie, gebruik van een waterpijp
- angst voor kortademigheid, depressieve klachten, sociale situatie.
Voorgeschiedenis en comorbiditeit
Naar Samenvatting ›- Vraag naar comorbiditeit zoals diabetes mellitus (ook als gevolg van prednis(ol)ongebruik), aandoeningen van het bewegingsapparaat en hart- en vaatziekten (in verband met eventuele inspanningstraining).
- Vraag bij twijfel tussen COPD en hartfalen naar cardiovasculaire risicofactoren, voorgeschiedenis en klachten (zie NHG-Standaard Hartfalen).
- Vraag bij twijfel tussen COPD en astma naar allergieën (zie NHG-Standaard Astma bij volwassenen).
Lichamelijk onderzoek
Naar Samenvatting ›- Inspecteer de patiënt en let op de mate van dyspneu, de ademhalingsfrequentie, cyanose, het gebruik van hulpademhalingsspieren en de eventuele aanwezigheid van een inspiratiestand van de thorax.
- Ausculteer bij een eerste consult hart en longen en let daarbij op:
- verlengd expirium, expiratoir piepen en crepiteren.
- hartritme en souffles (zie Differentiaaldiagnose en comorbiditeit)
- Ausculteren bij vervolgconsulten hoeft alleen bij dyspneuklachten.
- Bepaal bij ernstige dyspneu de saturatie, de bloeddruk en de ademhalings- en hartfrequentie.
- Meet gewicht en lengte, bereken de BMI en ga als vroegere gegevens beschikbaar zijn na of er ongewenst gewichtsverlies is (> 5% in 1 maand of > 10% in 6 maanden).
- Inspecteer de benen op oedemen door mogelijk hartfalen (zie Differentiaaldiagnose en comorbiditeit).
De sensitiviteit en specificiteit van het lichamelijk onderzoek bij matig ernstig COPD zijn gering en de reproduceerbaarheid van de bevindingen is wisselend. Bij oudere patiënten met COPD is het van belang na te gaan of hartfalen mede een oorzaak is. Eenduidige omschrijving van de longgeluiden draagt ertoe bij dat de bevindingen bij auscultatie van de longen vergelijkbaar zijn. Een verlengd exspirium is minstens even lang als het inspirium bij een normale, niet-geforceerde ademhaling. Rhonchi zijn longgeluiden met een muzikaal karakter. Ze worden onderscheiden in hoogfrequente (fluitende, piepende) en laagfrequente (brommende) rhonchi. Crepitaties zijn niet-muzikale explosieve, knappende geluiden die vooral bij de inspiratie optreden. De likelihood ratio van rhonchi voor de diagnose ‘COPD’ was 2,9, na correctie voor anamnestisch verkregen informatie zoals COPD in de voorgeschiedenis. Bij een (piepend) verlengd exspirium (eventueel tijdens geforceerde uitademing) is in het algemeen differentiatie mogelijk tussen een obstructieve longaandoening enerzijds en andere luchtwegklachten anderzijds, maar niet tussen COPD en astma.
Normale bevindingen bij het lichamelijk onderzoek sluiten astma of COPD niet uit. Een tonvormige thorax, hypersonore percussie beiderzijds, laagstaande (lager dan Th11) en weinig beweeglijke longgrenzen (< 2 vingers) zijn aanwijzingen voor hyperinflatie, zoals die voorkomt bij COPD of ernstig astma. Deze symptomen zijn echter weinig betrouwbaar vast te stellen.
Een verminderde voedingstoestand (te laag lichaamsgewicht, ongewenst gewichtsverlies of te geringe vetvrije massa) komt voor bij 7% van de patiënten met licht COPD, bij 10% met matig ernstig COPD en bij 13% met ernstig COPD.
Aanvullend onderzoek
Naar Samenvatting ›- Verricht diagnostische spirometrie bij patiënten met aanwijzingen voor COPD.
- Overweeg een ecg en bepaling van BNP of NT-proBNP bij twijfel tussen hartfalen en COPD of bij vermoeden van beide (zie NHG-Standaard Hartfalen).
Spirometrie
Naar Samenvatting ›Verricht spirometrie bij vermoeden van COPD om na te gaan of er obstructie is en zo ja, om de ernst en de reversibiliteit hiervan te bepalen (zie tabel 3 en tabel 4):
- bepaal FVC, FEV1 en flowvolumecurve
- bereken de FEV1/FVC-ratio voor het vaststellen van luchtwegobstructie
- bepaal de FEV1 vóór en na gestandaardiseerde bronchusverwijding om reversibiliteit vast te stellen
Referentiewaarden en interpretatie van spirometrie
Naar Samenvatting ›- Interpreteer spirometrische parameters, zoals FEV1, FVC en FEV1/FVC-ratio, met behulp van referentiewaarden.
- Bij aanwijzingen voor een mogelijke restrictieve afwijking (Z-score FVC < –1,64) zie Aanwijzingen voor een mogelijke restrictieve afwijking bij spirometrie.
- Herhaal de spirometrie na 6 weken bij (licht) afwijkende uitslag. De beste waarde geldt als uitgangswaarde omdat de patiënt na 6 weken meestal hersteld is van een mogelijke eerste longaanval.
- Meetresultaten dicht bij de afkapwaarde zijn lastig te duiden vanwege de natuurlijke variabiliteit. Een groot verschil tussen de metingen kan wijzen op reversibiliteit.
- Bij twijfel tussen astma en COPD: herhaal de spirometrie bij voorkeur ten tijde van klachten (zie tabel 2 en NHG-Standaard Astma bij volwassenen).
In 2014 is in overleg met andere betrokken Nederlandse beroepsorganisaties en conform het advies van de European Respiratory Society (ERS) besloten de referentiewaarden voor de voorspelde FEV1 (1993) te vervangen door actuelere waarden die het Global Lung Initiative (GLI) voorstelde. Daarnaast is besloten voor het onderscheid tussen wel of geen luchtwegobstructie bij personen met een mogelijke longaandoening een statistisch correct en klinisch gevalideerd afkappunt te kiezen, namelijk een waarde kleiner dan het vijfde percentiel (p5) van de referentiepopulatie. Dit afkappunt wordt ook wel lower limit of normal 5% (LLN5%) genoemd.
De gefixeerde FEV1/FVC-ratio (< 0,7) had als belangrijke nadelen overdiagnostiek van obstructie bij personen > 50 jaar en onderdiagnostiek onder die leeftijd. De GLI-waarden als maat voor obstructie hebben deze nadelen niet.
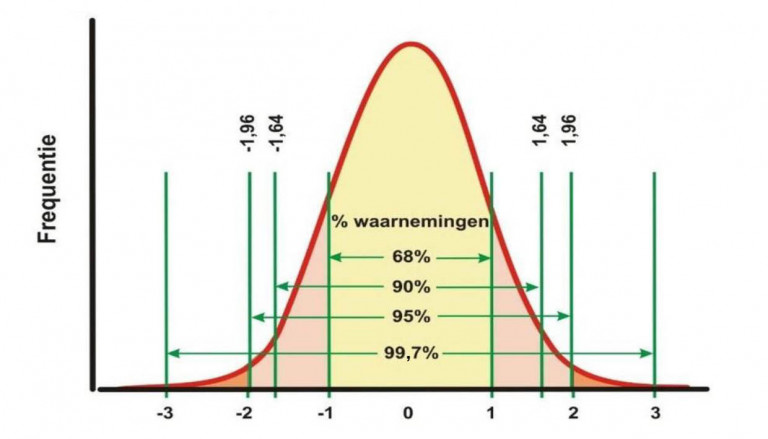
Z-score
De GLI adviseert bij patiënten met klachten passend bij astma of COPD een z-score < −1,64 te gebruiken om normaal van afwijkend te onderscheiden. De z-score beschrijft het aantal standaarddeviaties in een normaal verdeelde parameter zoals de FEV1 of de FEV1/FVC-ratio in een populatie. Een z-score < −1,64 definieert p5, de onderste 5% (zie figuur 3).
Licht verlaagde waarden bij spirometrie
Een gemeten waarde dicht bij de ondergrens van normaal hoeft niet afwijkend te zijn. Bij twijfel aan de diagnose bij licht verlaagde postbronchodilatatoire waarden van de FEV1/FVC-ratio wordt het spirometrische onderzoek herhaald. Als indicatie voor ‘licht verlaagd’ kan een z-score tussen −1,96 en −1,64 worden aangehouden; dit komt overeen met waarden tussen p2,5 en p5.
Randvoorwaarden voor spirometrie
Naar Samenvatting ›- Kies afhankelijk van de plaatselijke mogelijkheden en de deskundigheid voor spirometrie in de eigen praktijk of op aanvraag in een diagnostisch centrum of longfunctielaboratorium.
- Overweeg (tele)consultatie van de kaderhuisarts of longarts, of diagnostische verwijzing naar de longarts met het verzoek om terugverwijzing na de diagnostische fase.
- De spirometers en de uitvoering van het spirometrisch onderzoek vereisen een aantal kwaliteitsvoorzorgen (zie de NHG-uitgave Protocollaire Astma/COPD zorg).
- Gebruik in de diagnostische fase geen enkelvoudige FEV1-meters waarmee geen flowvolumecurve kan worden geproduceerd.
Organisatie
De keuze om spirometrie in de eigen praktijk uit te voeren of dit op aanvraag te laten doen in een diagnostisch centrum of longfunctielaboratorium hangt af van de plaatselijke mogelijkheden en van de deskundigheid die de huisartsenpraktijk in huis heeft. De huisarts kan kiezen voor (tele)consultatie van de kaderhuisarts of longarts, of voor een diagnostische verwijzing naar de longarts met het verzoek om terugverwijzing na de diagnostische fase. Enkelvoudige FEV1-meters worden niet aanbevolen voor diagnostische spirometrie omdat hiermee geen flowvolumecurve kan worden geproduceerd .
Uitvoering
Er zijn veel spirometers op de markt. De American Thoracic Society (ATS) en de European Respiratory Society (ERS) hebben eisen gesteld waaraan de apparaten en de uitvoering (reproduceerbaarheid) van het onderzoek moeten voldoen. De door de patiënt geblazen waarde wordt vergeleken met referentiewaarden (voorspelde waarden) ontleend aan gezonde, niet-rokende populaties. Richtlijnen en randvoorwaarden voor spirometrisch onderzoek in de huisartsenpraktijk zijn te vinden op de website van de CAHAG. In eerstelijns diagnostische centra wordt spirometrie uitgevoerd volgens de SAN-Praktijkrichtlijn longfunctieonderzoek.
In een validatieonderzoek van spirometers in de huisartsenpraktijk was de gemiddelde afwijking van de FEV1 ten opzichte van de gestandaardiseerde waarde uit een computergestuurde ijkspuit 25 ml (95%-BI 12 tot 39 ml) en die van de FVC 27 ml (95%-BI 10 tot 45 ml). Gemiddeld werden de FEV1 en de FVC licht overschat. De auteurs geven aan dat praktijken meer aandacht zouden moeten besteden aan het kalibreren van de apparatuur volgens de gebruiksaanwijzing. Voor certificering van spirometrie in de eerste lijn is de CASPIR-cursus of gelijkwaardig certificaat vereist.
Salbutamol of ipratropium bij gestandaardiseerde bronchusverwijding
Parasympathicolytica hebben geen voordeel boven kortwerkende bèta-2-sympathicomimetica (SABA). De voorkeur voor ipratropium boven salbutamol voor gestandaardiseerde bronchusverwijding bij personen > 60 jaar die vroeger gold, is vervallen.
|
Frequentie |
Luchtwegmedicatie |
Procedure |
Interpretatie |
|---|---|---|---|
|
2 ×, tenzij eerste keer normaal |
Vóór de test:
|
|
|
|
* Voor spirometrie in de monitoringfase, zie tabel 10. |
|||
|
|
Z-score |
|---|---|
|
Restrictie |
FVC < –1,64 |
|
Obstructie |
FEV1/FVC < –1,64 |
Aanwijzingen voor een mogelijke restrictieve afwijking bij spirometrie
Naar Samenvatting ›- Een Z-score van de FVC < –1,64 bij spirometrie is een aanwijzing voor een mogelijke restrictieve afwijking.
- Een verlaagde FVC is veelal het gevolg van een technisch onvoldoende spirometrie, maar kan ook het gevolg zijn van obstructie met hyperinflatie of van een andere onderliggende aandoening.
- Wees vooral bij duidelijke aanwijzingen voor restrictie zonder obstructie bedacht op een daadwerkelijke restrictieve aandoening.
Aanpak
Naar Samenvatting ›- Ga na of er een technische onvolkomenheid kan zijn. Dit is onder meer te herkennen aan het ontbreken van een lange uitademing (≥ 6 sec) of aan het ontbreken van een duidelijk plateau in het volumetijddiagram.
- Ga na of er eerder aanwijzingen voor restrictie waren en wat er destijds geconcludeerd is (eerdere verwijzingen?).
- Ga daarnaast na of er anamnestisch aanwijzingen zijn voor restrictie (zie Begrippen).
- Schrijf een luchtwegverwijder voor en herhaal de spirometrie op korte termijn met speciale aandacht voor de technische uitvoering. Let daarbij met name op een volledige uitademing. Overweeg de spirometrie in een diagnostisch centrum te laten uitvoeren.
- Bij vermoeden van een onderliggende aandoening: baseer het beleid hierop. Verwijs bij herhaalde aanwijzing voor restrictie zonder verklaring naar een longarts of consulteer bij twijfel een kaderarts.
Restrictieve longaandoeningen zoals (idiopathische) longfibrose, ‘stoflongen’ of ernstige kyfoscoliose gaan gepaard met een afname van het longvolume. Een normale FVC sluit een restrictieve aandoening vrijwel uit. Voor het aantonen van een restrictieve longaandoening is spirometrie geen geschikte methode. Een verminderde FVC in combinatie met een normale FEV1/FVC-ratio kan een aanwijzing zijn voor een restrictieve stoornis, maar is in de eerste lijn meestal het gevolg van een technisch onvoldoende uitgevoerde spirometrie. Om na te gaan of er werkelijk sprake is van een restrictieve aandoening is het raadzaam na te gaan of deze eerder in kaart is gebracht, de anamnese gericht uit te diepen en de spirometrie na 1 of enkele weken te herhalen.
Bij herhaalde aanwijzingen voor een restrictieve aandoening is verwijzing naar de longarts aangewezen. In de meeste gevallen heeft de verwijzing niet primair tot doel een restrictieve aandoening vast te stellen, maar gaat het erom een technisch goed uitgevoerde spirometrie te verkrijgen.
Beeldvormend onderzoek
Naar Samenvatting ›- Een X-thorax is niet nodig bij de diagnostiek van COPD, wel bij sommige aandoeningen in de differentiaaldiagnose (onder andere longkanker).
- Maak wel een X-thorax bij een discrepantie tussen de klachten of beperkingen en de spirometrische afwijkingen (chronisch hoesten of dyspneu bij betrekkelijk geringe spirometrische afwijkingen).
Evaluatie
Naar Samenvatting ›Criteria voor de diagnose ‘COPD’
Naar Samenvatting ›- > 40 jaar
- Klachten van dyspneu en/of hoesten, al of niet met slijm opgeven
- Relevante rookhistorie (arbitrair > 10 jaar roken) of andere relevante expositie
- Afwijkende FEV1/FVC-ratio na gestandaardiseerde bronchusverwijding, vastgesteld bij 2 verschillende metingen met een interval > 4-6 weken
- COPD is vrijwel uitgesloten bij een normale FEV1/FVC-ratio na gestandaardiseerde bronchusverwijding (≥ p5, oftewel Z-score ≥ -1,64)
- COPD bij patiënten < 50 jaar is zeldzaam en reden voor verwijzing
- COPD door andere oorzaken dan roken (alfa-1-antitrypsinedeficiëntie, drugsgebruik, chronische blootstelling aan fijnstof of aan andere stoffen) is zeldzaam. Bij vermoeden hiervan is verwijzing naar de longarts aangewezen voor nadere diagnostiek, en indien relevant naar de bedrijfsarts.
Differentiaaldiagnose en comorbiditeit
Naar Samenvatting ›Gelijktijdig bestaan van astma en COPD (ACO)
Naar Samenvatting ›- Bij patiënten > 40 jaar is het onderscheid tussen astma en COPD niet altijd goed mogelijk (zie tabel 2) en kan er astma-COPD-overlap zijn (zie Begrippen).
- Reversibiliteit van de FVC kan het gevolg zijn van vermindering van hyperinflatie na het gebruik van luchtwegverwijders.
- ACO is aannemelijk bij de volgende kenmerken:
- > 40 jaar
- anamnestisch vermoeden van astma (aard van het klachtenpatroon, astma in de voorgeschiedenis, atopische aandoening bij de patiënt zelf of eerstegraadsfamilieleden) én
- anamnestisch vermoeden van COPD (relevante rookgeschiedenis of andere risicofactor voor COPD) én
- vastgestelde reversibiliteit (FEV1-toename ≥ 12% en ≥ 200 ml) in combinatie met een afwijkende FEV1/FVC-ratio na gestandaardiseerde bronchusverwijding
- Afwezigheid van reversibiliteit sluit de diagnose ‘astma’ naast COPD niet uit; dit kan voorkomen bij astma dat voor het eerst op volwassen leeftijd optreedt, vaak gepaard gaand met chronische niet-allergische rino(sinus)itis
- Tracht zo mogelijk aan te geven welke aandoening op de voorgrond staat: COPD met astmakenmerken (allergie, reversibiliteit) dan wel astma met COPD-kenmerken (persisterende obstructie).
Overige aandoeningen
Naar Samenvatting ›- Hartfalen: 20% van de patiënten met COPD heeft ook hartfalen, zie NHG-Standaard Hartfalen
- Longcarcinoom: hemoptoë, veranderd hoestpatroon, borstkaspijn, gewichtsvermindering
- Restrictieve longaandoeningen (zie Begrippen)
- Obesitasgerelateerde aandoeningen, zoals het obesitashypoventilatiesyndroom of obstructief slaapapneu (OSA)
- Interstitiële longaandoeningen (longfibrose), bijvoorbeeld door extrinsieke allergische alveolitis (allergenen van duiven en parkieten), vasculitis, medicatie (nitrofurantoïne) of radiotherapie (zie Aanwijzingen voor een mogelijke restrictieve afwijking bij spirometrie)
- Bronchiëctasieën: bij chronisch hoesten en opgeven van veel sputum en betrekkelijk geringe spirometrische afwijkingen
- Andere oorzaken van dyspneu, zoals een longembolie (zie NHG-Standaard Diepveneuze trombose en longembolie), pneumothorax of disfunctioneel ademhalen
Ziektelast
Naar Samenvatting ›- Breng zodra de diagnose ‘COPD’ is gesteld de ziektelast in kaart aan de hand van de 4 subdomeinen (zie tabel 5).
- Maak daarbij onderscheid tussen lichte en verhoogde ziektelast.
|
Subdomein |
Afwijkend indien |
|---|---|
|
Klachten, hinder en beperkingen |
MRC ≥ 3 of CCQ ≥ 2* |
|
Longaanvallen |
≥ 2 longaanvallen per jaar behandeld met orale corticosteroïden of ≥ 1 ziekenhuisopname wegens COPD |
|
Voedingstoestand |
Ongewenst gewichtsverlies > 5%/maand of > 10%/6 maanden of verminderde voedingstoestand (BMI < 21 kg/m2) zonder andere verklaring |
|
Longfunctie† |
FEV1 na bronchusverwijding < 50% van voorspeld of < 1,5 l absoluut Of progressief longfunctieverlies (bijvoorbeeld ↓ FEV1 > 150 ml per jaar) gedurende ≥ 3 jaar (≥ 3 metingen) |
|
Ziektelast |
|
|
Lichte ziektelast |
Geen van de subdomeinen afwijkend |
|
Verhoogde ziektelast |
≥ 1 subdomein afwijkend |
|
MRC =Medical Research Council dyspneuschaal (schaalbereik 1-5); CCQ = Clinical COPD Questionnaire (schaalbereik 0-6) * Zie CAHAG Screeningsinstrumenten. † Gebruik voor het bepalen van de ziektelast de laatste spirometrie-uitslag |
|
Richtlijnen beleid
Naar Samenvatting ›Doel en aanpak van de behandeling
Richt het beleid op het verbeteren van de prognose en het verminderen van de ziektelast.
- Bied begeleiding bij stoppen met roken
- Probeer de ziektelast te verminderen op de 4 subdomeinen:
- verminder klachten en beperkingen en verbeter fysieke capaciteit (conditie) en activiteit
- voorkom longaanvallen
- voorkom onder- of overgewicht
- stabiliseer de achteruitgang van de longfunctie
- Bepaal de ziektelast voor de 4 subdomeinen en maak onderscheid tussen lichte en verhoogde ziektelast (zie tabel 5). De ziektelast is verhoogd als ≥ 1 subdomein afwijkend is.
- Patiënten met een verhoogde ziektelast hebben in de regel meer zorg nodig dan patiënten met een lichte ziektelast (zie Doel en frequentie van controleconsulten).
- Geef ondersteuning bij het zich aanpassen aan de ziekte en bij het opstellen en nastreven van persoonlijke behandeldoelen.
Hanteer bij patiënten met astma-COPD-overlap (ACO) de aandoening die het meest op de voorgrond staat als leidend voor de behandeling. Behandel patiënten die duidelijke kenmerken van beide aandoeningen hebben medicamenteus volgens de indicatie astma bij volwassenen (zie NHG-Standaard Astma bij volwassenen); en voor het niet-medicamenteus beleid deze NHG-Standaard COPD.
Voorlichting en niet-medicamenteuze adviezen
Naar Samenvatting ›Aanpassen aan de ziekte (adaptatie)
Naar Samenvatting ›- Leg uit dat COPD een chronische aandoening is.
- Bespreek met de patiënt dat COPD een aandoening is met invloed op meerdere gebieden. COPD kan leiden tot:
- kortademigheidsklachten door de luchtwegobstructie (ontstekingsreacties van de luchtwegen en schade aan longblaasjes)
- conditieverlies en moeheid
- gewichtsverlies
- longaanvallen
- COPD heeft daardoor invloed op de kwaliteit van leven. Leg uit dat het zinvol is om het leven hierop hieraan aan te passen.
- Leg uit dat de patiënt invloed heeft op een groot aantal factoren die de ziektelast kunnen verminderen.
- Leg uit dat leefstijlveranderingen zoals stoppen met roken en meer bewegen de basis zijn van het beleid.
- Leg uit dat de huisarts en andere zorgverleners hierbij ondersteuning kunnen bieden.
- Leg uit dat de klachten kunnen worden behandeld met kort- en langwerkende luchtwegverwijders, maar dat deze middelen geen effect hebben op de achteruitgang van de longfunctie.
Begeleiding bij stoppen met roken
Naar Samenvatting ›- Leg uit dat roken verreweg de belangrijkste oorzaak is. Roken veroorzaakt onherstelbare schade aan de longen, waardoor op de leeftijd > 40 jaar kortademigheid kan ontstaan.
- Leg uit dat stoppen met roken de versnelde achteruitgang van de longfunctie vertraagt.
- Geef een krachtig stoppen-met-rokenadvies, gevolgd door intensieve begeleiding (zie NHG-Behandelrichtlijn Stoppen met roken en keuzetabel Stoppen met roken op thuisarts.nl).
- Raad roken door huisgenoten sterk af.
- Adviseer geen ruimtes te bezoeken waarin gerookt wordt.
Voor gedetailleerdere informatie wordt verwezen naar de NHG-Behandelrichtlijn Stoppen met roken, de de module Roken in de Praktijkhandleiding Leefstijl en het Partnership Stoppen met Roken.
Bewegen
Naar Samenvatting ›- Leg uit dat bewegen bijdraagt aan het verbeteren of stabiel houden van het fysiek functioneren.
- Adviseer de patiënt voldoende te bewegen: ≥ 150 min per week matig intensieve inspanning, zoals wandelen en fietsen, verspreid over diverse dagen (langer geeft extra gezondheidsvoordeel).
- Adviseer om voorafgaand aan de inspanning eventueel een kortwerkende luchtwegverwijder te gebruiken (zie Medicamenteuze behandeling).
Fysiotherapie
Naar Samenvatting ›- Overweeg bij patiënten met een verhoogde ziektelast (met name bij CCQ ≥ 2) verwijzing naar een fysiotherapeut met voldoende kennis en ervaring in de behandeling van patiënten met COPD. Bij deze patiënten kan de fysieke activiteit en/of capaciteit verminderd zijn door bijvoorbeeld (angst voor) kortademigheid of slijmvorming. Een blijvend verhoogde ziektelast is een indicatie voor verwijzing naar de longarts (zie Consultatie en verwijzing).
- Overweeg verwijzing naar een fysiotherapeut om dezelfde reden eveneens bij patiënten met een lichte ziektelast die fysieke beperkingen ervaren (met name bij CCQ 1-2).
- Geef bij verwijzing naar een fysiotherapeut de volgende informatie mee:
- FEV1
- MRC- en CCQ-scores
- aantal doorgemaakte longaanvallen en/of ziekenhuisopnames in de afgelopen 12 maanden
- De fysiotherapeut bepaalt aan de hand van een screening van fysieke activiteit en capaciteit of fysiotherapie geïndiceerd is.
- Bij patiënten met een verlaagde fysieke capaciteit en een indicatie voor inspanningstraining overlegt de fysiotherapeut met de huisarts over een eventuele maximale-inspanningstest om te bepalen welke intensiteit en wijze van inspanning veilig is. Voor deze test is een verwijzing nodig. De test wordt bij voorkeur afgenomen onder supervisie van een longarts.
- Zie KNGF-richtlijn COPD 2020.
Zorginstituut Nederland presenteerde in 2018 het Pakketadvies gesuperviseerde oefentherapie bij COPD aan de minister van VWS. Het Zorginstituut oordeelde positief over de effectiviteit van fysiotherapie op kwaliteit van leven en fysiek functioneren. In 12 van de 17 aangehaalde onderzoeken werden op deze beide gebieden significante positieve verschillen aangetoond tussen interventie- en controlegroepen, die groter waren dan het minimale klinisch relevante verschil. In 3 onderzoeken was er wel een significant verschil in fysieke capaciteit, maar niet in kwaliteit van leven. In 9 onderzoeken waren zowel de verschillen in fysieke uitkomsten als die in kwaliteit van leven significant en slechts 1 van de 17 onderzoeken vond geen enkel significant of klinisch relevant verschil in fysiek functioneren of kwaliteit van leven. In 3 van de 17 onderzoeken was het verschil in fysiek functioneren wel significant, maar kleiner dan het minimale klinisch relevante verschil, zonder significant verschil in kwaliteit van leven. In 1 van deze 3 onderzoeken werd wel een duidelijk verschil in het percentage ziekenhuisopnames wegens COPD gevonden. In een ander onderzoek werd in een van de interventiegroepen een verschil gevonden in fysiek functioneren, maar dit was kleiner dan het minimale klinisch relevante verschil en werd niet getoetst op significantie. In geen van de 17 onderzoeken werden relevante bijwerkingen of complicaties van de interventies gerapporteerd. Het Zorginstituut was onzeker over de kosteneffectiviteit, maar het achtte vergoeding noodzakelijk en uitvoerbaar.
Het Zorginstituut adviseerde oefentherapie onder supervisie van een fysio- of oefentherapeut voor mensen met COPD-stadium ≥ GOLD 2 in de basisverzekering op te nemen vanaf de eerste behandeling tot een maximaal aantal behandelsessies in de eerste 12 maanden: 5 sessies voor groep A (lage ziektelast), 27 sessies voor groep B (verhoogde ziektelast, relatief stabiel met weinig tot geen longaanvallen) en 70 sessies voor groep C en D (1 longaanval met ziekenhuisopname of 2 longaanvallen zonder ziekenhuisopname, zie ook tabel 1). De minister voor Medische Zorg heeft hierop besloten om oefentherapie bij COPD voor groep C en D met ingang van 1 januari 2019 te vergoeden tot maximaal 70 sessies in het eerste behandeljaar; daarna is het aantal sessies afhankelijk van de ernst van de COPD. In 2020 adviseerde het Zorginstituut andermaal de vergoeding uit te breiden naar groep B (zie Pakketadvies gesuperviseerde oefentherapie bij COPD).
Overwegingen
Parallel aan de ontwikkeling van deze NHG-Standaard werd de KNGF-richtlijn COPD ontwikkeld. De aanbevelingen in deze NHG-Standaard zijn afgestemd met vertegenwoordigers van de KNGF-richtlijnwerkgroep.
Op basis van deze afstemming en op basis van de gevonden effectiviteit is bij een verhoogde ziektelast (met name bij een CCQ-score ≥ 2) verwijzing te overwegen naar een fysiotherapeut met voldoende kennis en ervaring in de behandeling van patiënten met COPD. Bij deze patiënten kan er namelijk sprake zijn van een verminderde fysieke activiteit en/of capaciteit, bijvoorbeeld door (angst voor) kortademigheid of slijmvorming. De fysiotherapeut brengt de fysieke activiteit en capacitieit (conditie) in kaart en probeert beide te verbeteren.
Bij een persisterende verhoogde ziektelast (met name op basis van de CCQ) is ook verwijzing naar een longarts aangewezen.
Ook bij patiënten met een lichte ziektelast kan fysiotherapie overwogen worden wanneer zij fysieke beperkingen ervaren (met name bij een CCQ-score van 1-2).
Patiënten met een lichte ziektelast en weinig klachten hoeven niet te worden verwezen.
Indien de fysiotherapeut meer informatie wil verkrijgen over de maximale inspanning die een patiënt veilig kan leveren, om een adequaat traininsgprogramma te kunnen opstellen, kan deze de huisarts verzoeken om een maximale inspanningstest te laten verrichten. Voor deze Cardiopulmonary Exercise Test (CEPT) is een verwijzing nodig; zij wordt bij voorkeur afgenomen onder supervisie van een longarts.
Mucusklaring
In een systematisch overzicht van 7 onderzoeken (126 patiënten) werd geconcludeerd dat verschillende fysiotherapeutische technieken enig effect op de mucusklaring lijken te hebben, maar niet op de longfunctie. Gezien de kleine aantallen, de lage kwaliteit en de tegenstrijdige resultaten van de onderzoeken is echter geen duidelijke uitspraak mogelijk over het effect. Fysiotherapeutische behandeling die zich richt op de mucusklaring wordt om deze reden niet voor iedere patiënt aanbevolen, maar kan onderdeel uitmaken van de behandeling als deze klachten op de voorgrond staan.
Zelfmanagement
Naar Samenvatting ›- Bespreek met de patiënt hoe deze zelfstandig keuzes kan maken bij dagelijkse bezigheden die mogelijk beïnvloed worden door COPD en stimuleer actief te participeren in de behandeling van de aandoening.
- Overweeg samen met de patiënt diens persoonlijke behandeldoelen te formuleren en bespreek de mogelijkheden om deze te verwezenlijken. Leg deze behandeldoelen eventueel vast in een individueel zorgplan.
- Bespreek met de patiënt de gewenste frequentie van monitoring en de taak van de praktijkondersteuner (zie Zorgstandaard COPD).
In een Canadees onderzoek verbeterde de kwaliteit van leven bij patiënten met COPD met behulp van een speciaal programma, Living Well with COPD. Daarbij werd een reductie in ziekenhuisopnames gezien van 40%. In Nederland werd met hetzelfde zelfmanagementprogramma voor patiënten in de huisartsenpraktijk geen verbetering gevonden van kwaliteit van leven of self-efficacy. Een reden voor deze discrepantie kan zijn dat de patiënten in Nederland minder ernstig COPD hadden, waardoor er minder ruimte voor verbetering was. Ook andere onderzoeken laten zien dat ondersteuning van zelfmanagement geen effect heeft op mortaliteit of heropnames van patiënten met COPD. Er werden wel positieve effecten gevonden bij een subgroep van COPD-patiënten die relatief jong waren, niet alleen leefden en een ernstiger mate van luchtwegobstructie en cardiale comorbiditeit hadden. Zelfmanagementeducatie geeft mogelijk een daling van ziekenhuisopnames, maar door de grote verschillen tussen de onderzoeken is pooling van de resultaten niet mogelijk. Zelfmanagement lijkt effectief wanneer het is geïntegreerd in de dagelijkse zorgpraktijk en is toegespitst op een subgroep van vooral die patiënten die een ernstiger ziektelast hebben of die behandeld worden in de tweede lijn.
Een bekend hulpmiddel bij zelfmanagement is het individueel zorgplan. Daarnaast zijn er verschillende andere instrumenten beschikbaar om zelfmanagement in de praktijk te implementeren, waaronder ook steeds meer digitale tools (zie E-health).
Conclusie
Er is geen overtuigend wetenschappelijk bewijs voor de effectiviteit van gestructureerde zelfmanagementprogramma’s op mortaliteit, kwaliteit van leven of aantal opnames bij COPD-patiënten in het algemeen. Wel lijkt zelfmanagementeducatie een gunstig effect te hebben op het aantal ziekenhuisopnames.
Aanbevelingen
- Stimuleer de patiënt zelfstandig keuzes te maken bij dagelijkse bezigheden die mogelijk beïnvloed worden door COPD en bevorder dat de patiënt actief participeert in de behandeling van de aandoening.
- Besteed aandacht aan zelfmanagementeducatie.
- Een belangrijk hulpmiddel bij zelfmanagement is het individueel zorgplan (zie Individueel zorgplan).
- Daarnaast zijn er instrumenten beschikbaar om zelfmanagement in de praktijk te implementeren, waaronder verschillende digitale tools (zie Individueel zorgplan).
Individueel zorgplan
Naar Samenvatting ›- Bespreek met de patiënt de wenselijkheid een individueel zorgplan (IZP) te maken:
- In een IZP kan onder meer worden vastgelegd:
- persoonlijke behandeldoelen
- afspraken over de frequentie van controles
- leefstijlverandering
- medicatie
- afspraken met andere zorgverleners
- beleid bij longaanvallen. Leg het beleid bij longaanvallen vast in een longaanval-actieplan (zie Zelfmanagement bij longaanvallen).
In een cochranereview is de effectiviteit van een individueel zorgplan geëvaluieerd bij patiënten met COPD. In de review had het zorgplan de vorm van een geschreven actieplan. Er werden 5 onderzoeken geïncludeerd met in totaal 574 patiënten met matig tot ernstig COPD. De follow-up was 6-12 maanden. Er was geen bewijs dat actieplannen het gebruik van gezondheidszorg verminderden, wanneer werd gekeken naar bezoeken aan de spoedeisende hulp of ziekenhuisopnamen. Het gebruik van actieplannen was geassocieerd met het vaker starten van behandeling voor acute longaanvallen. Kennis over zelfmanagementstrategieën was verbeterd in de interventiegroepen, evenals de intentie om de juiste behandeling te starten. Ook herkenden patiënten een ernstige longaanval beter.
In een gerandomiseerd gecontroleerd onderzoek had een individueel zorgplan geen effect op het aantal longaanvallen, maar leek het de duur en de intensiteit wel te verminderen.
Conclusie
Een individueel zorgplan kan bijdragen aan de kennis over zelfmanagementstrategieen en herkenning van een ernstige longaanval.
Aanbevelingen
Maak samen met de patiënt een individueel zorgplan met daarin aandacht voor persoonlijke behandeldoelen, afspraken over controlefrequentie, leefstijl, medicatie, afspraken met andere zorgverleners en beleid bij longaanvallen (een longaanval-actieplan). Hierbij kan gebruik gemaakt worden van het Longaanval actieplan COPD van het Longfonds. Het NHG heeft ook een (eenvoudiger) generiek IZP-format (zie NHG-dossier Individueel zorgplan).
Zelfmanagement bij longaanvallen
Naar Samenvatting ›- Bespreek de wenselijkheid en mogelijkheden tot zelfmanagement bij longaanvallen; betrek hierbij de ziektelast in de diverse subdomeinen en de aanwezigheid van mantelzorg (zie Betrekken van gezinsleden)
- Bespreek het belang van vroege herkenning van een longaanval. Longaanvallen, ook minder ernstige, kunnen schade veroorzaken.
- Leg uit dat veel patiënten het lastig vinden een longaanval tijdig te herkennen of tijdig te melden. Maak daarom samen met de patiënt een longaanval-actieplan.
- Leg uit dat een longaanval-actieplan in combinatie met begeleiding door bijvoorbeeld de praktijkondersteuner de kwaliteit van leven kan verbeteren en het risico op ziekenhuisopnames verlaagt, en dat e-health hierbij eveneens waardevol kan zijn.
- In een longaanval-actieplan staat:
- welke klachten bij deze patiënt wijzen op een beginnende longaanval
- bij welke klachten en op welk moment de patiënt contact moet opnemen en met wie
- op welk moment, op welke wijze en hoe lang de patiënt de dosering van luchtwegverwijders zelf kan verhogen (indien de patiënt dit adequaat kan toepassen)
- op welk moment een patiënt zelf kan starten met prednisolon (indien de patiënt dit adequaat kan toepassen)
- wanneer de patiënt contact moet opnemen als de zelf ingestelde behandeling niet aanslaat
- Leg het longaanval-actieplan bij voorkeur schriftelijk vast (bijvoorbeeld met behulp van het actieplan van het Longfonds of van de CAHAG).
Betrekken van gezinsleden
Naar Samenvatting ›Betrek, met toestemming van de patiënt, gezinsleden, mantelzorger(s) en/of verzorgenden bij de behandeling en bij het individueel zorgplan en longaanval-actieplan. Dit is met name van belang bij een verhoogde ziektelast.
Het betrekken van gezinsleden (met name partners) in de behandeling van COPD-patiënten is zeer belangrijk. Ze kunnen verschillende rollen vervullen, als vanzelf of door daar gericht voor te kiezen.
- Mantelzorger: gezinsleden kunnen veel zorgtaken uitvoeren, met name in de sfeer van persoonlijke verzorging.
- Therapieondersteuner: patiënten hebben soms moeite zich met onderdelen van de therapie te verenigen en zich eraan te houden. Een gezinslid kan daarbij behulpzaam zijn.
- Informatieverstrekker dan wel informatievrager: via een gezinslid kan informatie over het verloop van de ziekte genuanceerder in beeld gebracht worden. Een gezinslid is ook in staat vragen te stellen die de patiënt zelf vergeet te stellen.
- Zorgcoördinator: soms is een gezinslid beter in staat de zorg van de verschillende zorgverleners op elkaar af te stemmen dan een buitenstaander.
- Medeslachtoffer: de ziekte confronteert gezinsleden met de veranderingen in de capaciteit van de patiënt en daarmee ook in diens rol binnen het gezin of de relatie. Ook een veranderd levensperspectief kan een harde confrontatie opleveren. Soms gaat een en ander gepaard met rouwverschijnselen bij gezinsleden (vooral de partner).
De huisarts kan gezinsleden actief betrekken in een of meer rollen. Welke rollen dat zijn, hangt af van de mogelijkheden (gezondheidsvaardigheden) van het gezinslid en die van de patiënt, en soms van het verloop van de ziekte. Bij veel COPD-patiënten openbaart de ziekte zich (soms onverwachts) pas in het tweede deel van het leven. Dat kan het adaptief vermogen van patiënten, maar ook van hun gezinsleden, verkleinen.
E-health
Naar Samenvatting ›- Er zijn veel vormen van e-health:
- COPD-controles op afstand via e-mail, een website of per telefoon
- telemonitoring via sms, een app, een website of een telefoongesprek
- E-health vervangt het monitoringsconsult niet, maar kan bijdragen aan het ontwikkelen van zelfmanagementvaardigheden.
- E-health kan mogelijk helpen om longaanvallen te voorkomen.
- Bespreek bij patiënten met frequente longaanvallen of e-health meerwaarde kan hebben.
E-health lijkt bij patiënten met COPD een substantieel deel van de longaanvallen te kunnen voorkomen, maar is niet op alle punten duidelijk slechter of beter dan gebruikelijke zorg. E-health is daardoor geen vervanging van een controleconsult, maar kan een belangrijk hulpmiddel zijn bij zelfmanagement. Voor bepaalde groepen patiënten kan e-health een voordeel hebben.
Voor- en nadelen
E-health (dagelijks doorgeven van gegevens) lijkt voor patiënten met COPD een voordeel te hebben voor wat betreft longaanvallen, ziekenhuisopnames en kwaliteit van leven. Deze vorm van e-health geeft geen verbetering van dyspneuklachten of algehele fysieke conditie. De meerwaarde lijkt zich te concentreren op vroegsignalering van longaanvallen.
De reviews laten geen verschil zien tussen het gebruik van e-health (wekelijkse telefoontjes van zorgverlener) en gebruikelijke zorg met betrekking tot fysieke capaciteit en dyspneu.
De onderzochte interventies hebben als nadeel dat zij de patiënt en/of de zorgverlener (extra) tijd kunnen kosten door de benodigde handelingen. Verder zullen sommige patiënten de voorkeur geven aan face-to-facecontact met de praktijkondersteuner of huisarts, terwijl anderen het een voordeel vinden dat ze niet naar het spreekuur hoeven. Door dit laatste aspect kan de zorgverlener juist tijd besparen en efficiënter werken. Bepaalde patiënten kunnen opzien tegen het gebruik van smartphone of internetprogramma’s, terwijl anderen daar juist enthousiast over zijn.
Kwaliteit van bewijs
De kwaliteit van het bewijs in de reviews was laag tot redelijk. Er werd afgewaardeerd in verband met lage aantallen in de onderzoeken, afwezigheid van blindering en bias in de rapportage.
Waarden en voorkeuren van patiënten
Patiëntenvertegenwoordigers in de werkgroep geven aan dat e-health een extra hulpmiddel is waarvan gebruik kan worden gemaakt bij COPD. Dit geldt echter alleen voor patiënten die beschikken over voldoende gezondheidsvaardigheden en in staat zijn om met internet om te gaan.
Kosten
De kosten van e-health komen meestal voor rekening van de zorggroep of zorgverzekeraar. De programma’s zelf kosten de patiënt niets. De patiënt moet thuis wel regelmatig handelingen verrichten, maar hoeft niet op het spreekuur te komen.
Achtergrond
Steeds vaker wordt er gebruik gemaakt van websites, apps, beeldbellen of andere technologie om zorg-op-afstand te verlenen. Zou dit ook te gebruiken zijn voor COPD?
Uitgangsvraag
Is e-health aan te bevelen bij COPD? Is e-health niet slechter dan gebruikelijke zorg bij COPD?
Methoden
In mei 2018 is een systematische literatuurzoekactie naar systematische literatuuronderzoeken uitgevoerd in PubMed.
Resultaten
Resultaat zoekactie
De zoekactie leverde 4 systematische literatuuronderzoeken naar de effectiviteit van e-health bij COPD op.
Beschrijving onderzoeken
De volgende 4 systematische literatuuronderzoeken zijn gebruikt. De interventies in de geïncludeerde RCT’s verschilden evenals de onderzochte uitkomstmaten in de reviews.
- Alwashmi includeerde 3 RCT’s (n = 209) waarin e-health – in dit geval het dagelijks invoeren van klachten en soms gegevens van een draagbare spirometer of saturatiemeter op een smartphone met (eventueel) feedback van een zorgteam – werd vergeleken met gebruikelijke zorg voor wat betreft het voorkomen van longaanvallen. De duur van de onderzoeken was 4-9 maanden.
- Cruz includeerde 9 RCT’s (n = 587) die de effectiviteit van home-telemonitoring ten opzichte van gebruikelijke zorg onderzochten met betrekking tot kwaliteit van leven en ziekenhuisopnames. Home-telemonitoring bestond in deze onderzoeken uit het dagelijks via internet doorgeven van persoonlijke data (gewicht, temperatuur, hartslag, bloeddruk, spirometer-parameters, zuurstof-saturatie, klachten, activiteiten, enzovoort), waarop feedback gegeven werd wanneer de data buiten een bepaald normbereik lagen. Patiënten werden 2-12 maanden gevolgd.
- Lundell includeerde 9 RCT’s (n = 1034) waarin het effect van tele-healthcare op dyspneu en kwaliteit van leven bij COPD werd onderzocht. Wekelijks bellen om patiënten aan te moedigen te sporten of informatie en feedback te geven werd vergeleken met gebruikelijke zorg. De follow-upduur varieerde van 8 weken tot 18 maanden.
- McCabe includeerde 3 RCT’s (n = 472) waarin de e-healthinterventie via computer of mobiel voornamelijk gericht was op het stimuleren van gezond gedrag (meer bewegen met behulp van een stappenteller, stoppen met roken). Deelnemers kregen feedback op hun beweeg- en rookgedrag. De interventies duurden 6 maanden en werden vergeleken met gebruikelijke zorg. De beschreven uitkomstmaat was ziektegerelateerde kwaliteit van leven.
Samenvatting
- Zie Totstandkoming en methoden, tabel 2a.
- E-health (in de zin van het dagelijks doorgeven van gegevens over bijvoorbeeld longfunctie en andere symptomen) lijkt de kwaliteit van leven van patiënten met COPD te verhogen (kwaliteit van bewijs laag tot redelijk).
- E-health (in de zin van het dagelijks doorgeven van gegevens) lijkt de kans op longaanvallen en ziekenhuisopnames te verminderen (kwaliteit van bewijs laag respectievelijk redelijk).
- E-health (in de zin van wekelijkse telefoontjes van de zorgverlener) heeft waarschijnlijk geen effect op uithoudingsvermogen en dyspneu bij patiënten met COPD (kwaliteit van bewijs redelijk).
Werk
Naar Samenvatting ›- Adviseer de patiënt bij werkgerelateerde problemen of belemmeringen contact op te nemen met de bedrijfsarts
- Overweeg met de bedrijfsarts te overleggen over de afstemming van het beleid; een belangrijk contactmoment is als arbeidsreïntegratie dreigt te mislukken.
- Overweeg ook de longarts bij dit overleg te betrekken; vroegtijdige interventie is noodzakelijk om structurele problemen met de arbeidsparticipatie te voorkomen.
COPD kan ontstaan of verergeren door beroepsmatige blootstelling. Tijdige onderkenning en een hierop toegesneden interventie kan de prognose verbeteren en arbeidsongeschiktheid voorkomen. De bedrijfsarts kan de belasting en de pulmonale belastbaarheid bepalen, en zo nodig interventies doorvoeren op het gebied van aanpassing van werk en/of werktijden of vermindering van de inhalatoire belasting.
Van de mensen met COPD ontvangt een groter deel een arbeidsongeschiktheidsuitkering dan de gemiddelde algemene beroepsbevolking. Vooral in de leeftijd 45-64 jaar ontvangen mensen met COPD vaker een arbeidsongeschiktheidsuitkering dan leeftijdgenoten in de algemene bevolking.
Van de werkende mensen met COPD heeft ruim 20% recent problemen ondervonden bij het uitvoeren of behouden van werk; van de mensen met astma is dat 17%. Ruim 75% van de mensen met COPD en ruim 70% van de mensen met astma die betaald werk verrichten, heeft te maken met vermoeidheid bij het werk als gevolg van de longaandoening. In beide populaties kampt 30-50% tijdens het werk met stress of spanning en concentratieproblemen.
Voedingstoestand
Naar Samenvatting ›- Voeding en bewegen zijn onlosmakelijk met elkaar verbonden. Bespreek het belang van een gezonde leefstijl en gezond gewicht. Leg uit dat fors overgewicht de klachten kan verergeren.
- COPD kan leiden tot gewichtsverlies als gevolg van metabole en systemische veranderingen. Onbedoeld gewichtsverlies bij COPD is ernstig; het wijst op een ernstige fysiologische stoornis.
- Overweeg patiënten met COPD bij verminderde voedingstoestand (BMI < 21 kg/m2)of ongewenst gewichtsverlies (> 5% in 1 maand of > 10% in 6 maanden) te verwijzen naar de longarts voor verdere analyse en een behandeladvies. Overweeg tegelijkertijd alvast verwijzing naar een diëtist.
- Overweeg patiënten met overgewicht te verwijzen naar een diëtist (onder andere bij gewichtstoename na stoppen met roken).
Gewicht
In een Deens bevolkingsonderzoek bleek bij patiënten met COPD en een BMI < 25 kg/m2 de laagste sterfte op te treden bij degenen bij wie het lichaamsgewicht was toegenomen, terwijl bij patiënten met een BMI > 25 kg/m2 de laagste sterfte plaatsvond bij degenen met een stabiel gewicht.
Obesitas heeft een nadelige invloed op de mortaliteit bij patiënten met licht tot matig ernstig COPD, maar kan een beschermend effect hebben bij patiënten met vergevorderd COPD, bij wie verlies van vetvrije massa de kans vergroot dat ze op korte termijn overlijden.
Vaststellen van de voedingstoestand
De voedingstoestand kan worden vastgesteld door bepaling van BMI, gewichtsverloop en lichaamssamenstelling, uitgedrukt in de vetvrijemassa-index (VVMI). De VVMI kan worden bepaald aan de hand van huidplooidikte, bio-elektrische impedantieanalyse (BIA) of dual-energy X-ray absorptiometry (DEXA). BIA is eenvoudig, patiëntvriendelijk en snel, en gevalideerd bij stabiele COPD-patiënten met matige, ernstige of zeer ernstige luchtwegobstructie (FEV1 < 80% voorspeld). Een DEXA-scan is betrouwbaar maar kostbaar en geeft stralingsbelasting.
De beschikbaarheid van diagnostische methoden ter bepaling van de VVMI verschilt per regio. In de huisartsenpraktijk volstaat in de regel bepaling van de BMI en het gewichtsverloop.
Voedingsinterventie
In een cochranereview van 14 onderzoeken bij patiënten met stabiel COPD (n = 487) werd geconcludeerd dat een geïsoleerde voedingsinterventie geen effect had op het lichaamsgewicht, de longfunctie (FEV1), de kracht van de ademhalingsspieren of de conditie. Het is echter aannemelijk dat bij patiënten met ernstig COPD en een verminderde voedingstoestand een voedingsinterventie in combinatie met inspanningstraining resulteert in verbetering van de spierkracht en toename van vetvrije massa, inspanningstolerantie en kwaliteit van leven. Het is niet duidelijk of dit ook geldt voor patiënten met matig ernstig COPD.
Zie voor meer informatie over de diëtetiek bij COPD de Artsenwijzer Diëtetiek longziekten van de NVD.
Psychosociale gevolgen en psychiatrische problematiek
Naar Samenvatting ›- Breng tijdens het monitoringsconsult de psychische gevolgen in kaart.
- Bespreek bijvoorbeeld:
- angst voor dyspneu en longaanvallen
- gevoelens van schaamte
- sociaal isolement
- seksuele problemen (zie NHG-Standaard Seksuele klachten)
- angst en depressieve klachten (zie NHG-Standaard Angst en NHG-Standaard Depressie)
- Het domein ‘mentale status’ van de CCQ kan hierbij signalerend zijn
- Indien anamnestisch de kortademigheid gerelateerd is aan angst, paniek of depressieve klachten kan verwezen worden naar de poh-ggz
- Verwijs bij ernstiger klachten of psychiatrische problematiek naar de ggz.
Angst en depressie
Angst en depressie komen veel voor bij ouderen met COPD en beïnvloeden de kwaliteit van leven negatief. In de eerste lijn is de effectiviteit van een door een verpleegkundige geleide minimale psychologische interventie vergeleken met gebruikelijke zorg.
In dit onderzoek werden COPD-patiënten > 60 jaar met een lichte of matige depressie geïncludeerd. De interventie was gebaseerd op cognitieve gedragstherapie en zelfmanagement. Patiënten in de interventiegroep hadden na 9 maanden minder symptomen van depressie (p = 0,04) en angst (p = 0,003), en een betere kwaliteit van leven.
Er zijn beperkte aanwijzingen dat cognitieve gedragstherapie bij COPD-patiënten leidt tot een afname van angst en depressie en een toename van het welbevinden.
Psychosociale interventies
Bij COPD zijn de volgende psychosociale interventies relevant: training in copingvaardigheden, relaxatieoefeningen, cognitieve gedragstherapie en stressmanagement. Er zijn beperkte aanwijzingen dat psychosociale interventies bij COPD-patiënten in alle GOLD-stadia een positief effect hebben op het welbevinden en het psychosociale functioneren, maar de betreffende onderzoeken laten geen duidelijke conclusies toe. Zo zijn er aanwijzingen dat relaxatietraining op korte termijn kan leiden tot minder angst en spanning en tot een beter emotioneel evenwicht. Langetermijneffecten zijn niet bekend.
Preventie van comorbiditeit
Naar Samenvatting ›Cardiovasculair risicomanagement
Naar Samenvatting ›- Bij patiënten met COPD, meestal (ex)rokers, komen vaker hart- en vaatziekten en diabetes mellitus voor dan bij patiënten zonder COPD.
- Maak voor alle COPD-patiënten een cardiovasculaire risicoschatting, voer behandeling en controles uit volgens de NHG-Standaard Cardiovasculair risicomanagement.
Gebruik van bètablokkers
Naar Samenvatting ›Bèta-1-selectieve bètablokkers kunnen bij juiste indicatie in de gebruikelijke dosering veilig gegeven worden bij patiënten met COPD, ook bij (zeer) ernstige obstructie.
In een Schots retrospectief cohortonderzoek is het gebruik van bètablokkers door patiënten met COPD geëvalueerd door een bestand met patiëntgegevens te koppelen aan een bestand met sterftecijfers, ziekenhuisopnames en medicatiegebruik. De onderzoekers berekenden de risico’s met en zonder bètablokkers, gerelateerd aan de ernst en de behandeling van COPD. Van bijna 6000 patiënten > 50 jaar (gemiddeld 69 jaar) met licht tot ernstig COPD was gemiddeld 4,35 jaar aan follow-updata beschikbaar. Van deze patiënten hadden er 819 langdurig bètablokkers gebruikt, bij 720 van hen was dit een relatief cardioselectieve bètablokker. De sterfte bedroeg 34%. Na correctie voor verschillen tussen gebruikers en niet-gebruikers bleek het gebruik van bètablokkers geassocieerd met een sterftereductie van 22%. Dit voordeel was aantoonbaar in alle subgroepen met verschillende inhalatiebehandelingen en ernst, en gold vooral de sterfte door myocardinfarct (n = 288), maar ook de sterfte door COPD (n = 625). In de subgroepanalyses bleek het gebruik van bètablokkers ook geassocieerd met minder gebruik van orale steroïdkuren (26-37% lager met bètablokkers dan zonder bètablokkers) en met minder ziekenhuisopnames door pulmonale oorzaak (40% lager). Het gebruik van bètablokkers in combinatie met alle verschillende vormen van inhalatietherapie had niet geleid tot meer achteruitgang van de longfunctie.
In een Brits cohortonderzoek is nagegaan of het voorschrijven van bètablokkers aan patiënten met COPD die een myocardinfarct hadden gehad, geassocieerd was met overleving. De 1063 patiënten met COPD die gedurende de ziekenhuisopname vanwege het myocardinfarct startten met een bètablokker hadden een overlevingsvoordeel (HR 0,50; 95%-BI 0,36 tot 0,69). Patiënten die al vóór het myocardinfarct een bètablokker gebruikten, hadden eveneens een overlevingsvoordeel (HR: 0,59; 95%-BI 0,44 tot 0,79)
Conclusie
Er is bewijs van lage kwaliteit voor een verband tussen het gebruik van (vooral bèta-1-selectieve) bètablokkers en minder sterfte en longaanvallen bij patiënten met COPD in alle stadia. Dit geldt in combinatie met alle vormen van inhalatietherapie. Er is geen nadelig effect op de longfunctie. Dit effect komt bovenop de werking van bètablokkers ter vermindering van het cardiovasculaire risico.
Influenza- en pneumokokkenvaccinatie
Naar Samenvatting ›- Adviseer jaarlijkse influenzavaccinatie om het risico op longaanvallen door influenza te verkleinen.
- Adviseer pneumokokkenvaccinatie volgens het rijksvaccinatieprogramma.
- De indicatie voor pneumokokkenvaccinatie bij COPD patienten onder de 60 jaar vanwege een verhoogd risico wordt in de tweede lijn gesteld
Influenzavaccinatie
In een cochranereview van 11 RCT’s (n = 6750) concludeerde men op grond van 2 RCT’s (n = 180) dat influenzavaccinatie bij patiënten met COPD het aantal longaanvallen verminderde (gewogen gemiddeld verschil –0,37; 95%-BI –0,64 tot –0,11) en het aantal ziekenhuisopnames vermindert (OR 0,33; 95%-BI 0,09 tot 1,24). De kwaliteit van bewijs werd echter als laag gewaardeerd vanwege de kleine aantallen en brede betrouwbaarheidsintervallen. Ook waren de betreffende RCT’s gedateerd (1961 en 2004) en daarom niet extrapoleerbaar naar de huidige vaccins.
Conclusie
Er is beperkt bewijs dat influenzavaccinatie het aantal longaanvallen bij COPD vermindert.
Pneumokokkenvaccinatie
Een cochranereview met 12 RCT’s met een follow-upduur van 0,5-3 jaar evalueerde de effectiviteit van pneumokokkenvaccinatie bij COPD-patiënten (n = 2171). Pneumokokkenvaccinatie was weliswaar geassocieerd met minder pneumonieën (6 RCT’s; n = 1372; OR 0,59; 95%-BI 0,41 tot 0,85; NNT = 19, redelijke kwaliteit), maar niet met een significante afname van het risico op pneumokokkenpneumonieën (OR 0,26%; 95%-BI 0,05 tot 1,31, lage kwaliteit) en overlijden (3 RCT’s; n = 1053; OR 1,07; 95%-BI 0,69 tot 1,66; redelijke kwaliteit). Het risico op een longaanval was kleiner bij gevaccineerden (4 RCT’s; n = 446; OR 0,60; 95%-BI 0,39 tot 0,93; redelijke kwaliteit). De kans op een ziekenhuisopname verschilde minder duidelijk (3 RCT’s; n-= 391; OR 0,74; 95%-BI 0,32 tot 1,74; redelijke kwaliteit).
Conclusie
Pneumokokkenvaccinatie verkleint het risico op een longaanval bij COPD.
Overwegingen
- Veel patiënten met COPD komen vanwege hun leeftijd of andere comorbiditeit al in aanmerking voor influenzavaccinatie. Ondanks het beperkte bewijs wordt daarom aanbevolen alle patiënten met COPD jaarlijks voor influenza te vaccineren.
- Voor volwassenen ≥ 60 jaar wordt pneumokokkenvaccinatie geadviseerd.
Fractuurpreventie
Naar Samenvatting ›- Bij patiënten die ≥ 3 maanden orale corticosteroïden gebruiken, gemiddeld ≥ 15 mg per dag: geef ongeacht de leeftijd bisfosfonaat, vitamine-D-suppletie en eventueel calciumsuppletie, afhankelijk van de calciuminname (zie NHG-Standaard Fractuurpreventie)
- Bij patiënten die ≥ 3 maanden orale corticosteroïden gebruiken, gemiddeld ≥ 7,5 mg per dag: geef mannen > 70 jaar en postmenopauzale vrouwen bisfosfonaat en vitamine-D-suppletie, al dan niet aangevuld met calcium (zie NHG-Standaard Fractuurpreventie).
- Bij patiënten die geen orale corticosteroïden gebruiken maar alleen ICS, is er geen indicatie voor fractuurpreventie.
De Lung Health Study (n = 412; gemiddelde leeftijd 57 jaar; follow-up 3 jaar) liet bij gebruikers van ICS (triamcinolon, 600 microg) een significante achteruitgang zien van de botdichtheid van de femurhals bij mannen, maar niet bij vrouwen (1,8%; p < 0,001).
Uit een patiëntcontroleonderzoek (n = 1708; gemiddelde leeftijd 63 jaar) bleek dat COPD-patiënten die een hoge dosering ICS gebruiken (> 700 microg/dag) een verhoogd risico hebben op fracturen (OR 1,8; 95%-BI 1,1 tot 2,6) in vergelijking met COPD-patiënten die nooit ICS hadden gebruikt.
In een onderzoek bij oudere patiënten met astma of COPD (n = 982; gemiddelde leeftijd 81 jaar; follow-up 9,4 jaar) werd een dosisgerelateerde verhoging van het fractuurrisico gevonden (RR 2,5 bij gemiddelde dosis ICS > 601 microg; 95%-BI 1,6 tot 3,9), ook na correctie voor confounders.
In een ander patiëntcontroleonderzoek (n = 9624 fracturen; gemiddelde leeftijd 81 jaar) werd daarentegen geen verhoogd risico op een fractuur gevonden, met uitzondering van een kleine subgroep (< 1% van de populatie) met ca. 2000 microg/dag en 8 jaar follow-up.
Een cochranereview uit 2002 (3 onderzoeken; astma/COPD) en een meta-analyse uit 2004 (14 longitudinale onderzoeken; astma/COPD) lieten geen verhoogde afname van de botdichtheid of verhoogd fractuurrisico zien als gevolg van ICS-gebruik.
Conclusie
Er is geen consistent bewijs voor het verband tussen ICS-gebruik en fractuurrisico.
Overwegingen
In de recente internationale COPD-richtlijn wordt geen specifieke diagnostiek of behandeling aanbevolen bij langdurig gebruik van ICS. De richtlijn benadrukt wel het verband tussen een slechte gezondheid en een lage BMI, zoals bij veel COPD-patiënten wordt gezien, en het belang van adequate behandeling met inhalatiecorticosteroïden als daar een indicatie voor is, ook bij patiënten met osteoporose. Systemische corticosteroïden kunnen beter zoveel mogelijk vermeden worden.
Maagbescherming
Naar Samenvatting ›- Ga bij langdurig of frequent gebruik van orale corticosteroïden na of er een indicatie is voor maagbescherming (zie NHG-Standaard Maagklachten en NHG-Behandelrichtlijn Preventie van maagcomplicaties).
- ICS vergroten het risico op een maagbloeding niet.
Ondersteunende informatie
Naar Samenvatting ›Thuisarts
- Verwijs naar de informatie op thuisarts.nl. De informatie op Thuisarts is gebaseerd op deze NHG-Standaard.
- Zie op Thuisarts ook Begeleiding van de bedrijfsarts.
Overige informatiebronnen
- Voor informatie over het gebruik van inhalatoren, neusmedicatie en vernevelaars , zie inhalatorgebruik.nl.
- Overweeg daarnaast te verwijzen naar het Longfonds voor praktische informatie, zoals de patiëntenversie van de Zorgstandaard COPD, de Werkwijzer COPD en de Longpunten (ontmoetingsplekken voor longpatiënten).
- Voor patiënten met beperkte gezondheidsvaardigheden heeft het NHG in samenwerking met Pharos en het Longfonds het patiëntenboek Ik heb COPD, wat kan ik doen? ontwikkeld.
Medicamenteuze behandeling COPD
Naar Samenvatting ›Plaats van medicamenteuze behandeling van COPD
Naar Samenvatting ›- Medicamenteuze behandeling van COPD is symptomatisch en als zodanig een aanvulling op de niet-medicamenteuze behandeling.
- Bespreek de verwachtingen van de patiënt en stel deze zo nodig bij:
- inhalatiemedicatie heeft geen effect op de geleidelijke afname van de longfunctie (FEV1)
- inhalatiemedicatie dient ter vermindering van klachten, beperkingen en longaanvallen, de medicatie kan achterwege blijven bij weinig klachten of beperkingen
- bij ≥ 2 longaanvallen per jaar kan een onderhoudsbehandeling met inhalatiecorticosteroïden het risico op een longaanval verkleinen
- Extra aandacht verdienen (medicamenteuze) preventie en behandeling van comorbiditeit.
Toedieningsvormen van inhalatiemedicatie
Naar Samenvatting ›- De middelen binnen de toegepaste geneesmiddelgroepen zijn over het algemeen gelijkwaardig voor wat betreft effectiviteit, veiligheid, bijwerkingen, gebruiksgemak (doseerfrequentie) en toepasbaarheid (zie de toelichting bij de afzonderlijke medicatiestappen).
- Kies in overleg met de patiënt een toedieningsvorm waar deze goed mee kan omgaan.
- Houd bij de keuze tussen aerosol of poederinhalator rekening met de volgende zaken:
- een aerosol moet met voorzetkamer gebruikt worden
- de uniformiteit (de beschikbaarheid van andere middelen met dezelfde toedieningsvorm) is meestal groter bij aerosolen dan bij poederinhalatoren
- een aerosol met voorzetkamer vereist minder inhalatiekracht dan een poederinhalator; de gemiddelde COPD-patiënt zal echter voldoende inhalatiekracht hebben aangezien COPD vooral een uitademingsprobleem is
- een algemeen bezwaar tegen aerosolen is dat ze een sterk milieubelastend broeikasgas bevatten
- Zie voor een overzicht van de belangrijkste kenmerken van inhalatoren bij COPD de Tabel inhalatoren COPD.
Inhalatie-instructie
Naar Samenvatting ›- Geef een duidelijke inhalatie-instructie: demonstreer het juiste gebruik en laat de patiënt oefenen
- Adviseer na inhalatie de mond te spoelen om het risico op bijwerkingen te verminderen
- De inhalatie-instructie is ook een taak van poh en apotheek: maak afspraken om de instructies op elkaar af te stemmen (zie Praktijkvoering)
- Leg uit waar elk geneesmiddel toe dient. Houd rekening met de mogelijkheid dat sommige toedieningsvormen gewisseld kunnen worden door de apotheker.
- Tracht bij de uitleg aan te sluiten aan de gezondheidsvaardigheden van de patiënt.
- Verwijs ter ondersteuning van de mondelinge uitleg naar de instructiefilmpjes op inhalatorgebruik.nl.
Stappenplan inhalatiemedicatie
Naar Samenvatting ›Uitgangspunten
Naar Samenvatting ›- Controleer in de instelfase elke 6 weken.
- Controleer bij onvoldoende verbetering de tevredenheid met de toedieningsvorm, de therapietrouw en de inhalatietechniek.
- Ga bij onvoldoende verbetering ondanks goede therapietrouw en inhalatietechniek in samenspraak met de patiënt naar een volgende stap (zie tabel 6).
- Geef bij elke stap instructies over het beleid bij tijdelijke toename van klachten.
- Luchtwegverwijders verminderen dyspneu, en daarmee hinder en beperkingen.
- Bij ≥ 2 longaanvallen per jaar is er een indicatie voor ICS, maar als de patiënt verder weinig klachten heeft, volstaat een langwerkend parasympathicolyticum (LAMA).
- Bijwerkingen van kort- of langwerkende parasympathicolytica (SAMA of LAMA) zijn een droge mond, urineretentie, tachycardie en accommodatiestoornissen. Dit zijn anticholinerge effecten.
- Bijwerkingen van kort- of langwerkende bèta-2-agonisten (SABA of LABA) zijn tremor van handen en vingers, hoofdpijn, nachtelijke spierkrampen en stijging van de hartfrequentie.
Combinatiepreparaten
Naar Samenvatting ›- Gebruik bij de diverse vormen van combinatietherapie in eerste instantie bij voorkeur losse monopreparaten en evalueer het effect en mogelijke bijwerkingen.
- Overweeg bij een blijvende indicatie voor combinatietherapie een combinatiepreparaat vanwege gebruiksgemak en ter bevordering van de therapietrouw.
- Bij monitoring van combinatiepreparaten is het raadzaam regelmatig te evalueren wat elke afzonderlijke component aan de behandeling bijdraagt.
| Stap 1 | Stap 2 | Stap 3 | |
|---|---|---|---|
| Infrequente dyspneuklachten, geen longaanvallen | Regelmatige dyspneuklachten, hinder of beperkingen | Persisterende dyspneuklachten, hinder of beperkingen | |
| Dyspneuklachten, hinder of beperkingen | SABA of SAMA, zo nodig | LAMA of LABA, onderhoud | LAMA + LABA, onderhoud |
| Longaanvallen, ≥ 2 per jaar | Niet van toepassing | Voeg ICS toe* Start of continueer luchtwegverwijder |
Voeg ICS toe Bij voorkeur 1 luchtwegverwijder (overweeg de andere te staken) Overweeg verwijzing |
| SAMA = kortwerkende muscarineantagonist (parasympathicolyticum); SABA = kortwerkende bèta-2-agonist. LAMA = langwerkende muscarineantagonist (parasympathicolyticum); LABA = langwerkende bèta-2-agonist. ICS = inhalatiecorticosteroïd. * Als de patiënt verder weinig klachten heeft, volstaat een LAMA. |
|||
Er zijn 3 groepen langwerkende inhalatiemedicatie voor COPD geregistreerd: langwerkende muscarineantagonisten (LAMA), langwerkende bèta-2-agonisten (LABA) en inhalatiecorticosteroïden (ICS). Deze kunnen enkelvoudig (monotherapie) of in combinatie (duo- of tripletherapie) voorgeschreven worden. In Stap 1-3 en Gebruik van inhalatiecorticosteroïden (ICS) is de wetenschappelijke onderbouwing nagegaan. Het stappenplan is hier in belangrijke mate op gebaseerd.
| a | Monotherapie: LAMA of LABA (vergelijkingen: LAMA versus placebo, LABA versus placebo en LAMA versus LABA) |
| b | Duotherapie: LAMA met LABA zonder ICS (vergelijkingen: LAMA + LABA versus mono (LAMA (+ ICS) of LABA (+ ICS))) |
| c | Duotherapie: LAMA of LABA met ICS (vergelijking LAMA + ICS versus LAMA en vergelijking LABA + ICS versus LABA) |
| d | Tripletherapie: LAMA met LABA met ICS (vergelijkingen: LAMA + LABA + ICS versus LAMA, LABA, LAMA + ICS, LABA + ICS en LAMA + LABA). |
Dit resulteert in de volgende vergelijkingen:
a Monotherapie (zie Stap 2 Onderhoudsbehandeling: monotherapie met LAMA of LABA):
- LAMA versus placebo
- LABA versus placebo
- LAMA versus LABA
b Duotherapie (zie Stap 3 Onderhoudsbehandeling: duotherapie LAMA + LABA)
- LAMA + LABA versus LAMA
- LAMA + LABA versus LABA
- LAMA + LABA versus LAMA + ICS
- LAMA + LABA versus LABA + ICS
c Duotherapie (zie Indicatie voor ICS bij stap 2 of 3)
- LAMA + ICS versus LAMA
- LABA + ICS versus LABA
d Tripletherapie (zie Tripletherapie)
- LAMA + LABA + ICS versus LAMA
- LAMA + LABA + ICS versus LABA
- LAMA + LABA + ICS versus LAMA + ICS
- LAMA + LABA + ICS versus LABA + ICS
- LAMA + LABA + ICS versus LAMA + LABA
Samenvatting van de aanbevelingen in Stap 1-3 en Gebruik van inhalatiecorticosteroïden (ICS)
- Bij de keuze tussen LAMA of LABA heeft LAMA in geringe mate de voorkeur.
- Weeg echter ook de bijwerkingen mee:
- overweeg een LABA bij (een voorgeschiedenis van) urineretentie, glaucoom of refluxziekte
- overweeg een LAMA bij palpitaties of tremoren
- Switch bij bijwerkingen die specifiek zijn voor LAMA of juist LABA.
- Switch niet van LAMA monotherapie naar LABA monotherapie en vice versa indien na 1,5-3 maanden onvoldoende effect is bereikt.
- Overweeg duotherapie LAMA + LABA bij persisterende klachten ondanks monotherapie met LAMA of LABA.
- Geef een ICS naast een langwerkende luchtwegverwijder bij ≥ 2 longaanvallen per jaar.
- Overweeg 1 luchtwegverwijder te staken bij patiënten met een indicatie voor ICS die 2 luchtwegverwijders gebruiken (stap 3).
- Overweeg uitsluitend tripletherapie (LAMA + LABA + ICS) indien de ziektelast persisterend hoog is:
- én de patiënt ≥ 2 longaanvallen per jaar heeft
- én duotherapie van LAMA + ICS of LABA + ICS onvoldoende vermindering van de ziektelast geeft
- Gebruik bij de diverse vormen van combinatietherapie in eerste instantie losse monopreparaten en evalueer het effect en mogelijke bijwerkingen. Overweeg bij tevredenheid en een blijvende indicatie voor combinatietherapie een combinatiepreparaat ter bevordering van de therapietrouw.
|
Nr. |
Medicatie |
RCT’s |
Ziektelast, SGRQ-score |
Long-aanvallen (matig-ernstig /OR) |
Long-aanvallen (ernstig/ OR) |
Dyspneu, TDI-score |
Sterfte, OR |
Bijwerkingen, OR |
|---|---|---|---|---|---|---|---|---|
|
a |
Monotherapie |
|
||||||
|
a1 |
LAMA (tio) versus placebo |
22 |
–2,89 (–3,35 tot –2,44) REDELIJK |
0,78 (0,70 tot 0,87) LAAG |
0,85 (0,72 tot 1,00) LAAG |
– |
0,98 (0,86 tot 1,11) LAAG |
1,03 (0,97 –1,10) LAAG |
|
|
LAMA (acl) versus placebo |
10 |
–2,34 (–3,18 tot –1,51) LAAG |
0,88 (0,74 tot 1,04) REDELIJK |
0,64 (0,46 tot 0,88) LAAG |
0,84 (0,50 tot 1,18) LAAG |
0,92 (0,43 tot 1,94) ZEER LAAG |
0,89 (0,70 tot 1,14) LAAG |
|
|
LAMA (ume) versus placebo |
4 |
–4,79 (–8,84 tot –0,75) ZEER LAAG |
0,61 (0,46 tot 0,80) LAAG |
0,86 (0,25 tot 2,92) ZEER LAAG |
0,76 (0,43 tot 1,09) LAAG |
1,68 (0,52 tot 5,48) LAAG |
1,33 (0,89 –2,00) LAAG |
|
a2 |
LABA (f/s) versus placebo |
20 |
–2,32 (–3,09 tot –1,55) LAAG |
0,73 (0,61 tot 0,87) LAAG |
0,73 (0,56 tot 0,95) LAAG |
– |
0,90 (0,75 tot 1,08) REDELIJK |
0,97 (0,83 tot 1,14) LAAG |
|
|
LABA (ind) versus placebo |
14 |
–3,60 (–4,36 tot –2,83) REDELIJK |
0,81 (0,70 tot 0,94) REDELIJK |
– |
OR 1,96 (1,73 tot 2,22) REDELIJK |
0,42 (0,16 tot 1,08) LAAG |
1,00 (0,82 tot 1,23) REDELIJK |
|
|
LABA (olo) versus placebo |
13 |
–
|
–
|
–
|
– |
1,31 (0,90 tot 1,89) LAAG |
1,03 (0,91 tot 1,15) REDELIJK |
|
a3 |
LAMA versus LABA |
14 |
–0,39 (–1,03 – + 0,25) LAAG |
0,86 (0,79 tot 0,93) LAAG |
0,76 (0,53 tot 1,10) LAAG |
–0,12 (–0,24 tot 0,01) LAAG |
0,96 (0,75 tot 1,24) LAAG |
0,94 (0,87 tot 1,02) LAAG |
|
b |
Duotherapie LAMA met LABA |
|||||||
|
b1 |
LAMA + LABA versus LAMA |
25 |
–1,31 (–1,93 tot –0,70) LAAG |
0,96 (0,75 tot 1,23) LAAG |
0,90 (0,59 tot 1,36) LAAG |
0,32 (0,17 tot 0,46) LAAG |
1,01 (0,75 tot 1,36) REDELIJK |
1,01 (0,92 tot 1,12) REDELIJK |
|
b2 |
LAMA + LABA versus LABA |
11 |
–1,09 (–1,99 tot –0,22) LAAG |
0,77 (0,62 tot 0,97) ZEER LAAG |
0,78 (0,55 tot 1,12) LAAG |
0,40 (0,23 tot 0,57) LAAG |
1,19 (0,68 tot 2,09) ZEER LAAG |
1,06 (0,91 tot 1,22) LAAG |
|
b3 |
LAMA + LABA versus LAMA + ICS |
0 |
– |
– |
– |
– |
– |
– |
|
b4 |
LAMA + LABA Versus LABA + ICS |
9 |
–1,18 (–2,20 tot –0,16) REDELIJK |
0,86 (0,74 tot 1,00) REDELIJK |
0,76 (0,46 tot 1,27) LAAG |
0,13 (–0,24 tot 0,51) REDELIJK |
1,01 (0,61 tot 1,68) LAAG |
0,89 (0,75 tot 1,07) REDELIJK |
|
c |
Duotherapie met ICS |
|||||||
|
c1 |
LAMA + ICS versus LAMA |
0 |
–
|
– |
– |
– |
– |
– |
|
c2 |
LABA + ICS versus LABA |
19 |
–1,32 (–1,94 tot –0,70) REDELIJK |
0,83 (0,77 tot 0,89) REDELIJK |
1,00 (0,88 tot 1,14) LAAG |
0,21 (–0,09 tot 0,50) REDELIJK |
0,94 (0,79 tot 1,11) LAAG |
1,03 (0,94 tot 1,13) REDELIJK |
|
d |
Tripletherapie |
|||||||
|
d1 |
LAMA + LABA + ICS versus LAMA |
8 |
–2,78 (–3,87 tot –1,70) REDELIJK |
0,71* (0,60 tot 0,85) LAAG |
0,58* (0,47 tot 0,72) REDELIJK |
– |
0,71* (0,45 tot 1,10) LAAG |
0,98* (0,92 –1,04) REDELIJK |
|
d2 |
LAMA + LABA + ICS versus LABA |
1 |
–7,40 (–9,16 tot –5,64) ZEER LAAG |
– |
– |
– |
– |
– |
|
d3 |
LAMA + LABA + ICS LAMA + ICS |
0 |
–
|
– |
– |
– |
– |
– |
|
d4 |
LAMA + LABA + ICS versus LABA + ICS |
11 |
–1,81 (–2,28 tot –1,35) REDELIJK |
0,77* (0,66 tot 0,91) LAAG |
0,87* (0,75 tot 1,00) LAAG |
– |
0,88* (0,69 tot 1,13) ZEER LAAG |
1,02* (0,99 tot 1,04) LAAG |
|
d5 |
LAMA + LABA + ICS versus LAMA + LABA |
4 |
–1,59 (–2,24 tot –0,95) REDELIJK |
0,71* (0,60 tot 0,84) LAAG |
– |
– |
– |
0,85 (0,69 tot 1,06) LAAG |
|
Cijfers zijn verschilscore of odds ratio (OR) met 95%-BI; gearceerd zijn verschillen die significant én klinisch relevant zijn. LAMA = langwerkende muscarineantagonist; LABA = langwerkende bèta-2-agonist; ICS = inhalatiecorticosteroïd; SGRQ = St. George Respiratory Questionnaire (hogere score → grotere ziektelast); TDI = Transition Dyspnea Index (positieve score → verbetering; negatieve score → verslechtering); acl = aclidinium; tio = tiotropium; ume = umeclidinium; f/s = formoterol/salmeterol; ind = indacaterol; olo = olodaterol. * Relatief risico (RR) in plaats van odds ratio (OR). |
||||||||
Stap 1 Kortdurende luchtwegverwijding zo nodig
Naar Samenvatting ›- Bij infrequente dyspneuklachten en weinig hinder of beperkingen bij patiënten die nog geen longaanval hebben gehad volstaat in eerste instantie zo nodig gebruik van een kortwerkende luchtwegverwijder (zie tabel 8): een SAMA (ipratropium) of SABA.
- We bevelen onderhoudsbehandeling met 4 × daags een SAMA of SABA niet aan; ga bij indicatie voor onderhoudsbehandeling naar stap 2.
Bèta-2-sympathicomimetica stimuleren selectief de bèta-2-receptoren van het sympathische zenuwstelsel in de luchtwegen, waardoor het bronchiale gladde spierweefsel ontspant en dyspneuklachten verminderen. Kortwerkende bèta-2-sympathicomimetica (SABA) werken 4-6 uur; er kunnen bijwerkingen optreden zoals tremor van handen en vingers, hoofdpijn, perifere vaatverwijding en stijging van de hartfrequentie. Op basis van een cochranereview kan geconcludeerd worden dat SABA een beter effect hebben dan placebo op de klachten (dyspneu, moeheid) en de longfunctie.
Ook kortwerkende muscarineantagonisten (SAMA) zoals ipratropium, zijn werkzamer dan placebo wat betreft de longfunctie. Deze parasympathicolytica remmen de werking van acetylcholine door competitieve blokkade van de muscarinereceptoren, waardoor het bronchiale gladde spierweefsel ontspant. Veelvoorkomende bijwerkingen zijn een droge mond, irritatie van mond en keelholte, hoest en hoofdpijn. De resultaten van onderzoeken naar het effect van SAMA op dyspneu zijn enigszins tegenstrijdig. De combinatie SABA + SAMA heeft een beter effect op de longfunctie dan monotherapie met de afzonderlijke componenten, maar niet op de klachten.
Ipratropium, alleen of in combinatie met een SABA, lijkt een beperkt voordeel te hebben boven een SABA alleen wanneer gekeken wordt naar longfunctie, symptomen en inspanningstolerantie. De auteurs concluderen echter dat per patiënt het best geprobeerd kan worden welke strategie met kortwerkende middelen het beste resultaat geeft.
Conclusie
Zowel kortwerkende bèta-2-sympathicomimetica (SABA) als kortwerkende parasympathicolytica (SAMA) hebben bij COPD een gunstig effect op de longfunctie, maar het langetermijneffect op de longfuctie wordt niet beschreven. SABA hebben ook een gunstig effect op ervaren dyspneu, voor SAMA is dit onduidelijk. Combinatietherapie met beide middelen heeft geen toegevoegd effect op de ervaren klachten, wel op de longfunctie.
Stap 2 Onderhoudsbehandeling met een langwerkende luchtwegverwijder
Naar Samenvatting ›- Bij regelmatige of aanhoudende dyspneuklachten, hinder of beperkingen, onvoldoende effect bij zo nodig gebruik van een kortwerkende luchtwegverwijder of longaanval(len): start een langwerkende luchtwegverwijder (zie tabel 8): een LAMA of LABA.
- Sla zo nodig stap 1 over.
- Bij keuze tussen LAMA of LABA monotherapie bevelen we de medicatie aan die de COPD-patiënt het best verdraagt:
- een LAMA beschermt mogelijk iets beter tegen (minder ernstige) longaanvallen en heeft daarom in geringe mate de voorkeur
- overweeg echter een LABA bij (een voorgeschiedenis van) urineretentie, glaucoom of refluxziekte
- Kies bij bijwerkingen die specifiek zijn voor LABA of LAMA de andere soort luchtwegverwijder (overweeg bijvoorbeeld een LAMA bij palpitaties door LABA, overweeg een LABA bij droge mond door LAMA).
- Combineer geen SAMA met LAMA, geen SABA met LABA.
- Switchen tussen LAMA of LABA monotherapie wegens onvoldoende effect geeft meestal weinig verbetering, tenzij er bijwerkingen zijn: ga bij onvoldoende verbetering op monotherapie meteen naar stap 3.
In dit detail is de wetenschappelijke onderbouwing nagegaan van langwerkende monotherapie met LAMA of LABA. Dit heeft geresulteerd in de volgende vergelijkingen (zie ook tabel 7):
- LAMA versus placebo
- LABA versus placebo
- LAMA versus LABA
Uitgangsvraag a1 Is een LAMA bij COPD effectiever dan placebo?
PICO a1 LAMA versus placebo
Patiënten
COPD-patiënten in de eerste lijn
Interventie
LAMA
Vergelijking
Placebo
Uitkomstmaten
Ziektelast (domein: klachten, hinder, beperkingen)
Cruciaal
Lichte longaanvallen (met voorschrijven van antibiotica of orale steroïden)
Dyspneu
Ernstige longaanvallen (met ziekenhuisopname)
Mortaliteit
(Ernstige) bijwerkingen
Methode
In december 2018 werd een search uitgevoerd naar de meerwaarde van LAMA ten opzichte van placebo bij patiënten met COPD.
Resultaten
Resultaat zoekactie
De search leverde 9 systematische reviews met meta-analyse op met betrekking tot de vergelijking tussen LAMA en placebo. Na het lezen van de volledige tekst werden 6 reviews geëxcludeerd vanwege het ontbreken van de juiste uitkomstmaten (Halpin 2016; Ismaila 2015; Kew 2014; Oba 2015; Tricco 2015) en te lage kwaliteit (Zou 2016). Voor dit detail werden 3 systematische literatuuronderzoeken met een meta-analyse van hoge kwaliteit gebruikt met betrekking tot tiotropium, aclidinium en umeclidinium.
Na publicatie van deze reviews zijn er 2 publicaties verschenen met de juiste uitkomstmaten: een had betrekking op tiotropium ten opzichte van placebo, de ander op aclidinium ten opzichte van placebo.
Beschrijving van de onderzoeken
- Karner 2014 includeerde 19 placebogecontroleerde, dubbelblinde RCT’s (n = 23.309). De deelnemers hadden matig tot matig ernstig COPD (gemiddelde FEV 1 < 50% bij inclusie). De onderzoeksduur was 3 maanden tot 4 jaar. De gemiddelde leeftijd was 60-68 jaar en gemiddeld 75% was man. In elke RCT gebruikten de deelnemers eenmaal daags tiotropium of placebo. In de meeste onderzoeken was het gebruik van andere medicatie, waaronder SABA, toegestaan. Gerapporteerd werden: acute longaanvallen, matig (met voorschrijven van antibiotica of orale steroïden) of ernstig (met ziekenhuisopname), mortaliteit en ernstige bijwerkingen. Na 6 maanden werd de ziektelast(verandering) gemeten met de St. George Respiratory Questionnaire (SGRQ; hogere score correspondeert met grotere ziektelast).
- Ferguson 2017 analyseerde de resultaten van 4 RCT’s (n = 6782) waarin olodaterol, tiotropium en placebo in verschillende combinaties werden vergeleken. De meeste deelnemers waren mannen. Na 12 weken werd de ziektelast(verandering) gemeten met de SGRQ en dyspneu met de Transition Dyspnea Index (TDI; positieve score correspondeert met verbetering; negatieve score met verslechtering).
- Ni 2014 includeerde 10 RCT’s (n = 9547) waarin aclidiniumbromide en placebo werden vergeleken bij matige of ernstige COPD (FEV 1 46-58%). De onderzoeksduur was 4-52 weken, de gemiddelde leeftijd was 62-66 jaar, de meeste deelnemers waren mannen. Gebruik van ICS was toegestaan. Gerapporteerd werden acute longaanvallen, matig (met voorschrijven van antibiotica of orale steroïden) of ernstig (met ziekenhuisopname), mortaliteit en (ernstige) bijwerkingen. Na 6 maanden werd de ziektelast(verandering) gemeten met de SGRQ en dyspneu met de TDI.
- Lee 2015 includeerde 263 Koreaanse patiënten met matig tot ernstige COPD in zijn dubbelblinde RCT en randomiseerde ze over 2 groepen (aclidinium of placebo). Uitkomstmaten waren longaanvallen, SGRQ, TDI en (ernstige) bijwerkingen.
- Ni 2017 includeerde 4 gerandomiseerde, dubbelblinde, placebogecontroleerde parallelle-groeponderzoeken (n = 3798) waarin umeclidiniumbromide en placebo (beide eenmaal daags) werden vergeleken bij patiënten met matig tot ernstige COPD (gemiddelde FEV 1 45-55% bij inclusie). De onderzoeksduur was 12-52 weken, de gemiddelde leeftijd was 60-65 jaar en de meeste deelnemers waren mannen. Het gebruik van ICS was toegestaan. Gerapporteerd werden acute longaanvallen, matig (met voorschrijven van antibiotica of orale steroïden) of ernstig (met ziekenhuisopname), mortaliteit en (ernstige) bijwerkingen. Na 6 maanden werd de ziektelast(verandering) gemeten met de SGRQ en dyspneu met de TDI.
Conclusies
Zie Totstandkoming en methoden, tabel 3a.
- De ziektelast lijkt lager te zijn bij gebruik van tiotropium en aclidinium ten opzichte van placebo, maar het verschil is niet klinisch relevant (kwaliteit van bewijs laag, respectievelijk redelijk).
- Het is onzeker of er verschil in ziektelast is bij gebruik van umeclidinium ten opzichte van placebo (kwaliteit van bewijs zeer laag).
- Er lijken minder longaanvallen voor te komen bij gebruik van tiotropium en umeclidinium ten opzichte van placebo (kwaliteit van bewijs laag).
- Er is waarschijnlijk geen verschil in longaanvallen bij gebruik van aclidinium ten opzichte van placebo (kwaliteit van bewijs redelijk).
- Er lijkt minder dyspneu voor te komen bij gebruik van aclidinium en umeclidinium ten opzichte van placebo, maar het verschil is niet klinisch relevant (kwaliteit van bewijs laag).
- Het aantal ziekenhuisopnames door ernstige longaanvallen lijkt lager bij gebruik van tiotropium en aclidinium ten opzichte van placebo (kwaliteit van bewijs laag).
- Het is onzeker of het aantal ziekenhuisopnames verschilt bij gebruik van umeclidinium ten opzichte van placebo (kwaliteit van bewijs zeer laag).
- Er lijkt geen verschil in sterfte te zijn bij gebruik van tiotropium of umeclidinium ten opzichte van placebo (kwaliteit van bewijs laag).
- Het is onzeker of er verschil in sterfte is bij gebruik van aclidinium ten opzichte van placebo (kwaliteit van bewijs zeer laag).
- Er lijkt geen verschil in ernstige bijwerkingen te zijn bij gebruik van LAMA (tiotropium, aclidinium en umeclidinium) ten opzichte van placebo (kwaliteit van bewijs laag).
Ferguson 2017 laat een toename in SGRQ-score zien van 0-1 punten bij placebo en 2,5-3,5 punten bij tiotropium. De verandering in de TDI-score is 0-0,2 punten bij placebo en 1,0-1,2 punten bij tiotropium.
Lee 2015 toont significante en klinisch relevante verbeteringen op de SGRQ bij aclidinium (–7 punten) ten opzichte van placebo (–4 punten), een geringer percentage longaanvallen bij aclidinium (5,4%) dan bij placebo (15,6%) en een verbetering op de TDI van + 2 punten bij aclidinium en + 1,5 punten bij placebo. Er werd tussen aclidinium en placebo geen verschil in (ernstige) bijwerkingen gevonden.
Uitgangsvraag a2 Is een LABA bij COPD effectiever dan placebo?
|
Patiënten |
COPD-patiënten in de eerste lijn |
|---|---|
|
Interventie |
LABA |
|
Vergelijking |
Placebo |
|
Uitkomstmaten |
Ziektelast (domein: klachten, hinder, beperkingen) |
|
Cruciaal |
Lichte longaanvallen (met voorschrijven van antibiotica of orale steroïden) Ernstige longaanvallen (met ziekenhuisopname) Dyspneu Mortaliteit (Ernstige) bijwerkingen |
Methode
In december 2018 werd een search uitgevoerd naar de meerwaarde van LABA ten opzichte van placebo bij patiënten met COPD.
Resultaten
Resultaat zoekactie
De search leverde 9 systematische literatuuronderzoeken (SR’s) met meta-analyse op met betrekking tot de vergelijking tussen LABA en placebo. Na het lezen van de volledige teksten werden 6 reviews geëxcludeerd vanwege het ontbreken van de juiste uitkomstmaten (Kew 2014; Tricco 2015; Xia 2015), geen kwantitatieve SR (Metaxas 2018), het bestaan van een recentere SR (Chung 2013) en lage kwaliteit (Karbasi-Afshar 2016). Voor dit detail zijn de SR’s met meta-analyse van hoge kwaliteit gebruikt met betrekking tot indacaterol, formoterol en salmeterol en olodaterol.
Na publicatie van de genoemde reviews is er 1 publicatie verschenen met de juiste uitkomstmaten, waarin formoterolfumaraat vergeleken werd met placebo.
Beschrijving onderzoeken
Kew 2013 includeerde 26 onderzoeken (n = 14.939) waarin formoterol of salmeterol bij patiënten met COPD vergeleken werd met placebo. De onderzoeksduur was 3 maanden (9 onderzoeken), 6 maanden (10 onderzoeken ), 1 jaar (6 onderzoeken) en 3 jaar (1 onderzoek). De gemiddelde leeftijd was 64 jaar en ruim 70% was man. In een aantal onderzoeken was het gebruik van ICS toegestaan. Gerapporteerd werden lichte (met voorschrijven van antibiotica of orale steroïden) en ernstige longaanvallen (met ziekenhuisopname), mortaliteit en ernstige bijwerkingen. Na 6 maanden werd de ziektelastverandering gemeten met de SGRQ (een hogere score correspondeert met een grotere ziektelast).
Hanania 2018 onderzocht in een dubbelblinde, placebogecontroleerde RCT (n = 1071) formoterolfumaraat bij patiënten met COPD. De gemiddelde leeftijd was 63 jaar en 49% van de deelnemers was man. Gerapporteerd werden mortaliteit, ernstige longaanvallen (met ziekenhuisopname) en TDI-score (een positieve score correspondeert met verbetering, een negatieve met verslechtering).
Geake 2015 includeerde 10 onderzoeken (n = 8562) waarin indacaterol vegeleken werd met placebo bij patiënten met COPD. De onderzoeksduur varieerde van 12 weken (5 onderzoeken) tot 1 jaar (2 onderzoeken). De gemiddelde leeftijd was 64 jaar en deelnemers waren voor het grootste deel mannen. In alle onderzoeken was ICS-gebruik toegestaan. Gerapporteerd werden acute longaanvallen, mortaliteit en ernstige bijwerkingen. Na 6 maanden werd de ziektelast(verandering) gemeten met de SGRQ; ook werd ‘klinisch significante verbetering’ in dyspneu aangegeven.
Lee 2017 includeerde 16 onderzoeken (n = 11.195) waarin olodaterol werd vergeleken met placebo bij patiënten met COPD. De onderzoeksduur was 4-6 weken (11 onderzoeken), 48 weken (4 onderzoeken) en 1 jaar (1 onderzoek). De gemiddelde leeftijd was 60-65 jaar, en 53-95% van de deelnemers was man. In een aantal onderzoeken was ICS-gebruik toegestaan. Gerapporteerd werden mortaliteit en ernstige bijwerkingen.
Conclusies
Zie Totstandkoming en methoden, tabel 3b.
- Er lijkt een lagere ziektelast te zijn bij gebruik van formoterol, salmeterol of indacaterol ten opzichte van placebo, maar het verschil is niet klinisch relevant (kwaliteit van bewijs laag en redelijk).
- Er lijken minder lichte longaanvallen voor te komen bij gebruik van formoterol, salmeterol of indacaterol ten opzichte van placebo (kwaliteit van bewijs laag en redelijk). Het risico op een ernstige longaanval was lager bij gebruik van een LAMA (OR 0,76), maar het betrouwbaarheidsinterval was breed (0,53-1,10) en overlapte de 1 (kwaliteit van bewijs laag).
- Er komt waarschijnlijk minder dyspneu voor bij gebruik van indacaterol ten opzichte van placebo (kwaliteit van bewijs redelijk).
- Er lijken minder ziekenhuisopnames door ernstige longaanvallen voor te komen bij gebruik van formoterol of salmeterol ten opzichte van placebo (kwaliteit van bewijs laag).
- Er lijkt geen verschil in sterfte te zijn bij gebruik van LABA (formoterol, salmeterol, indacaterol of olodaterol) ten opzichte van placebo (kwaliteit van bewijs laag en redelijk).
- Er lijkt geen verschil in ernstige bijwerkingen te zijn bij gebruik van LABA (formoterol, salmeterol, indacaterol of olodaterol) ten opzichte van placebo (kwaliteit van bewijs laag en redelijk).
Hanania 2018 vond soortgelijke uitkomsten voor sterfte (1 in de placebogroep en 0 in de formoterolgroep) en ernstige bijwerkingen (HR 0,772; 95%-BI 0,533 tot 1,118), dus geen verschil bij LABA ten opzichte van placebo. Voor wat betreft dyspneu werd in de formoterolgroep op de TDI een kleine, maar klinisch niet relevante verbetering gevonden (0,7 punten versus 0 punten in de placebogroep).
Uitgangsvraag a3 Is een LAMA bij COPD effectiever dan een LABA?
|
Patiënten |
COPD-patiënten in de eerste lijn |
|---|---|
|
Interventie |
LAMA |
|
Vergelijking |
LABA |
|
Uitkomstmaten |
Ziektelast (domein: klachten, hinder, beperkingen) |
|
Cruciaal |
Lichte longaanvallen (met voorschrijven van antibiotica of orale steroïden) Ernstige longaanvallen (met ziekenhuisopname) Dyspneu Mortaliteit (Ernstige) bijwerkingen |
Methode
In december 2018 werd een search uitgevoerd naar de meerwaarde van LAMA ten opzichte van LABA bij patiënten met COPD.
Resultaten
Resultaat zoekactie
De search leverde een systematisch literatuuronderzoek met meta-analyse van goede kwaliteit op met betrekking tot de vergelijking tussen LAMA en LABA. Na publicatie van deze review zijn er geen nieuwere RCT’s met betrekking tot deze vergelijking verschenen.
Beschrijving onderzoeken
Oba 2018 includeerde 18 onderzoeken (n = 27.507) waarin LAMA werd vergeleken met LABA bij patiënten met COPD (FEV 1 < 80%). In de meeste onderzoeken was ICS-gebruik toegestaan. De onderzoeksduur varieerde van 12 weken tot 1 jaar (6 maanden in 10 van de 18 onderzoeken). De gemiddelde leeftijd was ca. 63,5 jaar en 53-78% van de deelnemers was man. In de meeste onderzoeken werd tiotropium vergeleken met salmeterol of indacaterol of formoterol; daarnaast werden ook formoterol en aclidinium of glycopyrronium vergeleken. Gerapporteerd werden acute longaanvallen (matig en ernstig), mortaliteit en (ernstige) bijwerkingen. Na 6 maanden werd de ziektelast(verandering) gemeten met de SGRQ en dyspneu met de TDI.
Conclusies
Zie Totstandkoming en methoden, tabel 3c.
- Er lijkt tussen LAMA of LABA geen verschil te zijn in ziektelast (kwaliteit van bewijs laag).
- Zowel een LABA als een LAMA lijkt ten opzichte van placebo minder longaanvallen en minder ziekenhuisopames te geven (kwaliteit van bewijs laag).
- Bij LAMA lijken minder lichte longaanvallen op te treden dan bij LABA (kwaliteit van bewijs laag).
- Er lijkt tussen LAMA of LABA geen verschil te zijn in het optreden van ernstige longaanvallen (kwaliteit van bewijs laag).
- Er lijkt tussen LAMA of LABA geen verschil te zijn in dyspneu (kwaliteit van bewijs laag).
- Er lijkt tussen LAMA of LABA geen verschil te zijn in sterfte (kwaliteit van bewijs laag).
- Er lijkt tussen LAMA of LABA geen verschil te zijn in (ernstige) bijwerkingen (kwaliteit van bewijs laag).
Van bewijs naar aanbeveling
Voor- en nadelen
Voor onderhoudsbehandeling van COPD zijn langwerkende luchtwegverwijders praktischer dan kortwerkende luchtwegverwijders, onder andere door de lagere toedieningsfrequentie (zie Overzicht van inhalatiemedicatie bij COPD). Tussen LAMA en LABA worden geen grote verschillen gevonden en geen van beide heeft grote voor- of nadelen. Waarschijnlijk treden bij gebruik van een een LAMA minder lichte longaanvallen op dan bij een LABA.
Voor wat betreft de overige uitkomstmaten ziektelast, ernstige longaanvallen, sterfte en (ernstige) bijwerkingen zijn geen verschillen gevonden. Wel weten we dat de bijwerkingenprofielen van LAMA en LABA verschillen. Bijwerkingen die beschreven worden bij een LAMA zijn droge mond, nasofaryngitis, hoest, misselijkheid en hoofdpijn. Bekende bijwerkingen van een LABA zijn palpitaties en tremoren.
Er zijn geen contra-indicaties voor een LABA, maar bij het starten van een LAMA is voorzichtigheid geboden bij nauwekamerhoekglaucoom (in verband met risico op verergering), pre-existente mictieklachten (in verband met risico op urineretentie) en refluxziekte (in verband met afname van de druk op de onderste slokdarmsfincter).
Kwaliteit van bewijs
De kwaliteit van het bewijs was laag. Er werd voornamelijk afgewaardeerd voor afwezigheid van blindering, heterogeniteit en sponsoring door de industrie (er waren geen onafhankelijke onderzoeken).
Waarden en voorkeuren van patiënten
De patiënt zal de voorkeur aan het geneesmiddel geven dat het minste bijwerkingen geeft.
Kosten
De kosten van inhalatiemedicatie zijn afhankelijk van het gekozen geneesmiddel en de toedieningsvorm. Een LAMA is over het algemeen duurder dan een LABA.
Haalbaarheid en aanvaardbaarheid
Behandeling met een luchtwegverwijder is voor arts en patiënt een aanvaardbare interventie, mits een geschikt middel wordt voorgeschreven, in de juiste toedieningsvorm en met een goede inhalatie-instructie.
Rationale
Er zijn nauwelijks verschillen tussen LAMA en LABA voor wat betreft de beschreven uitkomstmaten. Waarschijnlijk geeft een LAMA minder lichte longaanvallen dan een LABA. Voor wat betreft de overige uitkomstmaten (ziektelast, ernstige longaanvallen, dyspneu, sterfte, (ernstige) bijwerkingen) werden geen verschillen gevonden. Bij keuze tussen een LAMA of LABA als monotherapie beveelt de werkgroep aan de medicatie te gebruiken die de patiënt het best verdraagt.
Stap 3 Onderhoudsbehandeling met duotherapie LABA + LAMA
Naar Samenvatting ›- Overweeg samen met de patiënt duotherapie met LAMA + LABA als dyspneuklachten, hinder of beperkingen persisteren ondanks monotherapie.
- Verwijs bij weinig verbetering naar een longarts.
In dit detail is de wetenschappelijke onderbouwing nagegaan ten aanzien van de effectiviteit van duo-behandeling van een LABA en LAMA ten opzichte van een mono-behandeling of mono-behandeling plus ICS. Dit heeft geresulteerd in de volgende vergelijkingen (zie ook tabel 7).
- LAMA + LABA versus LAMA
- LAMA + LABA versus LABA
- LAMA + LABA versus LAMA + ICS
- LAMA + LABA versus LABA + ICS
Uitgangsvraag b1 Is een combinatie van een LABA met een LAMA effectiever dan LAMA monotherapie?
|
Patiënten |
COPD-patiënten in de eerste lijn |
|---|---|
|
Interventie |
LAMA + LABA |
|
Vergelijking |
LAMA |
|
Uitkomstmaten |
Ziektelast (klachten, hinder en beperkingen) |
|
Cruciaal |
Longaanvallen (matig-ernstig) Longaanvallen (ernstig) Dyspneu Mortaliteit (Ernstige) bijwerkingen |
Methode
In december 2018 werd een search uitgevoerd naar de meerwaarde van een combinatiepreparaat LAMA + LABA boven LAMA-monopreparaat voor patiënten met COPD in de eerste lijn.
Resultaten
Resultaat zoekactie
De search met betrekking tot de vergelijking tussen LAMA + LABA ten opzichte van LAMA leverde 1 systematische review met meta-analyse van goede kwaliteit op. Na publicatie van deze review zijn er geen nieuwere RCT’s met betrekking tot deze vergelijking verschenen. Voor publicatie van de standaard werd de search in januari 2021 geüpdatet en werden 4 nieuwe reviewartikelen met betrekking tot deze vergelijking gevonden. De resultaten van deze reviews zijn alle in lijn met de beschreven onderzoeken en ondersteunen de aanbeveling in dit detail.
Beschrijving onderzoeken
Oba 2018 includeerde 27 onderzoeken (n = 23.416) met betrekking tot LAMA + LABA versus monotherapie LAMA bij patiënten met COPD (FEV 1 < 80%). In de meeste onderzoeken was ICS-gebruik toegestaan. De onderzoeksduur varieerde van 12 weken tot 1 jaar (12 weken in 10 onderzoeken; 6 maanden in 10 onderzoeken). De gemiddelde leeftijd was ca. 63 jaar en 50-78% van de deelnemers was man. De meest voorkomende vergelijking was die tussen indacaterol of formoterol met tiotropium of glycopyrronium en tiotropium of glycopyrronium alleen. Daarnaast werden ook vilanterol met umeclidinium ten opzichte van tiotropium alleen, en olodaterol met tiotropium ten opzichte van tiotropium alleen vergeleken. Gerapporteerd werden acute longaanvallen (matig en ernstig), mortaliteit en (ernstige) bijwerkingen. Na 6 maanden werd de ziektelast(verandering) gemeten met de St. George Respiratory Questionnaire (SGRQ; een hogere score correspondeert met een grotere ziektelast), en de dyspneu met de Transition Dyspnea Index (TDI; een positieve score correspondeert met verbetering; een negatieve score met verslechtering).
Conclusies
Zie Totstandkoming en methoden, tabel 4a.
- Er lijkt een iets lagere ziektelast te zijn bij gebruik van LAMA + LABA ten opzichte van LAMA, maar het verschil is niet klinisch relevant (kwaliteit van bewijs laag).
- Er lijkt geen verschil te zijn in het optreden van lichte longaanvallen bij gebruik van LAMA + LABA ten opzichte van LAMA (kwaliteit van bewijs laag).
- Er lijkt geen verschil te zijn in het optreden van ernstige longaanvallen bij gebruik van LAMA + LABA ten opzichte van LAMA (kwaliteit van bewijs laag).
- Er lijkt minder dyspneu voor te komen bij gebruik van LAMA + LABA ten opzichte van LAMA, maar het verschil is niet klinisch relevant (kwaliteit van bewijs laag).
- Er is waarschijnlijk geen verschil in sterfte bij gebruik van LAMA + LABA ten opzichte van LAMA (kwaliteit van bewijs redelijk).
- Er is waarschijnlijk geen verschil in (ernstige) bijwerkingen bij gebruik van LAMA + LABA ten opzichte van LAMA (kwaliteit van bewijs redelijk).
Uitgangsvraag b2 Is een combinatie van een LABA met een LAMA effectiever dan LABA monotherapie?
|
Patiënten |
COPD-patiënten in de eerste lijn |
|---|---|
|
Interventie |
LAMA + LABA |
|
Vergelijking |
LABA |
|
Uitkomstmaten |
Ziektelast (klachten, hinder en beperkingen) |
|
Cruciaal |
Longaanvallen (matig-ernstig) Longaanvallen (ernstig) Dyspneu Mortaliteit (Ernstige) bijwerkingen |
Methode
In december 2018 werd een search uitgevoerd naar de meerwaarde van een combinatiepreparaat LAMA + LABA boven een LABA monopreparaat voor patiënten met COPD in de eerste lijn.
Resultaten
Resultaat zoekactie
De search met betrekking tot de vergelijking tussen LAMA + LABA ten opzichte van LABA leverde 1 systematisch literatuuronderzoek met meta-analyse van goede kwaliteit op. Na publicatie van deze review zijn geen nieuwere RCT’s met betrekking tot deze vergelijking verschenen. Voor publicatie van de standaard werd de search in januari 2021 geüpdatet en werden 3 nieuwe reviewartikelen gevonden. De resultaten van deze reviews zijn in lijn met de beschreven onderzoeken en ondersteunen de aanbeveling in dit detail.
Beschrijving onderzoeken
Oba 2018 includeerde 13 onderzoeken (n = 9379) waarin LAMA + LABA werden vergeleken met LABA monotherapie bij patiënten met COPD (FEV 1 < 80%). In de meeste onderzoeken was ICS-gebruik toegestaan. De onderzoeksduur varieerde van 12 weken tot 1 jaar (12 weken in 5 onderzoeken, 6 maanden in 5 onderzoeken). De gemiddelde leeftijd was ca. 64 jaar en 53-96% was man. De meest voorkomende vergelijking was die tussen formoterol met aclidinium of glycopyrronium en formoterol alleen. Daarnaast werden ook indacaterol met glycopyrroium ten opzichte van indacaterol, en olodaterol met tiotropium ten opzichte van olodaterol monotherapie vergeleken. Gerapporteerd werden acute longaanvallen (matig en ernstig), mortaliteit en (ernstige) bijwerkingen. Na 6 maanden werd de ziektelast(verandering) gemeten met de SGRQ en de dyspneu met de TDI.
Samenvatting van het bewijs
Zie Totstandkoming en methoden, tabel 4b.
- Er lijkt een iets lagere ziektelast te zijn bij gebruik van LAMA + LABA ten opzichte van LABA, maar het verschil is niet klinisch relevant (kwaliteit van bewijs laag).
- Het is onzeker of er minder lichte longaanvallen optreden bij gebruik van LAMA + LABA ten opzichte van LABA (kwaliteit van bewijs zeer laag).
- Er lijkt geen verschil te zijn in het optreden van ernstige longaanvallen bij gebruik van LAMA + LABA ten opzichte van LABA (kwaliteit van bewijs laag).
- Dyspneu lijkt minder voor te komen bij gebruik van LAMA + LABA ten opzichte van LABA, maar het verschil is niet klinisch relevant (kwaliteit van bewijs laag).
- Het is onzeker of er verschil in sterfte is bij gebruik van LAMA + LABA ten opzichte van LABA (kwaliteit van bewijs zeer laag).
- Er lijkt geen verschil te zijn in (ernstige) bijwerkingen bij gebruik van LAMA + LABA ten opzichte van LABA (kwaliteit van bewijs laag).
Uitgangsvraag b3 Is de combinatie LABA + LAMA effectiever dan de combinatie LAMA + ICS?
|
Patiënten |
COPD-patiënten in de eerste lijn |
||
|---|---|---|---|
|
Interventie |
LAMA + LABA |
||
|
Vergelijking |
LAMA + ICS |
||
|
Uitkomstmaten |
Ziektelast (klachten, hinder en beperkingen) |
||
|
Cruciaal |
Longaanvallen (matig-ernstig) Longaanvallen (ernstig) Dyspneu Mortaliteit (Ernstige) bijwerkingen |
||
Methode
In januari 2021 werd een search uitgevoerd naar de meerwaarde van duotherapie LAMA + LABA boven duotherapie LAMA + ICS voor patiënten met COPD in de eerste lijn.
Resultaten
Resultaat zoekactie
De search leverde geen artikelen op.
Samenvatting van het bewijs
Het is niet bekend of ziektelast, longaanvallen, mortaliteit en (ernstige) bijwerkingen afnemen dan wel toenemen bij gebruik van LAMA + LABA ten opzichte van LAMA + ICS.
Uitgangsvraag b4 Is de combinatie LABA + LAMA effectiever dan de combinatie LABA + ICS?
|
Patiënten |
COPD-patiënten in de eerste lijn |
||
|---|---|---|---|
|
Interventie |
LAMA + LABA |
||
|
Vergelijking |
LABA + ICS |
||
|
Uitkomstmaten |
Ziektelast (klachten, hinder en beperkingen) |
||
|
Cruciaal |
Longaanvallen (matig-ernstig) Longaanvallen (ernstig) Dyspneu Mortaliteit (Ernstige) bijwerkingen |
||
Methode
In januari 2021 werd een search uitgevoerd naar de meerwaarde van een combinatiepreparaat LAMA + LABA boven een combinatie van een LABA + ICS voor patiënten met COPD in de eerste lijn.
Resultaten
Resultaat zoekactie
De search leverde 1 systematisch literatuuronderzoek met meta-analyse van goede kwaliteit op met betrekking tot de vergelijking tussen LAMA + LABA ten opzichte van LABA + ICS.
Beschrijving onderzoeken
Oba 2018 includeerde 9 onderzoeken (n = 8796) waarin LAMA + LABA werden vergeleken met LABA + ICS bij patiënten met COPD (FEV 1 < 80%). De onderzoeksduur was 12-26 weken (1 jaar in 1 onderzoek). De gemiddelde leeftijd was ca. 64 jaar en 64-91% was man.
De meest voorkomende vergelijkingen waren die tussen indacaterol met glycopyrrolaat versus fluticasonpropionaat met salmeterol en die tussen umeclidinium met vilanterol versus fluticasonpropionaat met salmeterol. Daarnaast werden ook tiotropium met indacaterol en aclidinium met formoterol vergeleken met fluticasonpropionaat met salmeterol. Gerapporteerd werden acute longaanvallen (matig en ernstig), mortaliteit en (ernstige) bijwerkingen. Na 6 maanden werd de ziektelast(verandering) gemeten met de SGRQ en dyspneu met de TDI.
Samenvatting van het bewijs
Zie Totstandkoming en methoden, tabel 4c.
- Er is waarschijnlijk een iets lagere ziektelast bij gebruik van LAMA + LABA ten opzichte van LABA + ICS, maar het verschil is niet klinisch relevant (kwaliteit van bewijs redelijk).
- Er zijn waarschijnlijk iets minder lichte longaanvallen bij gebruik van LAMA + LABA ten opzichte van LABA + ICS, maar het verschil is niet klinisch relevant (kwaliteit van bewijs redelijk).
- Er lijkt geen verschil te zijn in het optreden van ernstige longaanvallen bij gebruik van LAMA + LABA ten opzichte van LABA + ICS (kwaliteit van bewijs laag).
- Er is waarschijnlijk geen verschil in dyspneu bij gebruik van LAMA + LABA ten opzichte van LABA + ICS (kwaliteit van bewijs redelijk).
- Er lijkt geen verschil te zijn in sterfte bij gebruik van LAMA + LABA ten opzichte van LABA + ICS (kwaliteit van bewijs laag).
- Er is waarschijnlijk geen verschil in (ernstige) bijwerkingen bij gebruik van LAMA + LABA ten opzichte van LABA + ICS (kwaliteit van bewijs redelijk).
Van bewijs naar aanbeveling
Voor- en nadelen
Duotherapie met LAMA + LABA geeft mogelijk iets minder longaanvallen en dyspneu dan LABA monotherapie of LABA + ICS. Of dit mogelijke voordeel ook geldt ten opzichte van LAMA monotherapie of LAMA + ICS (niet onderzocht) is minder duidelijk. Hoewel het bewijs hiervoor beperkt is, weegt de werkgroep dat bij klachten en beperkingen ondanks monotherapie toevoeging van een luchtwegverwijder uit een andere groep overwogen moet worden. Indien hiervoor wordt gekozen, moet het effect geëvalueerd worden. Bij ≥ 2 longaanvallen per jaar heeft duotherapie met een ICS de voorkeur (zie Indicatie voor ICS bij stap 2 of 3).
Om de effectiviteit, de patiënttevredenheid en eventuele bijwerkingen te evalueren wordt aangeraden om in een eerste periode van duotherapie de beide middelen als losse monopreparaten voor te schrijven. Bij tevredenheid en een blijvende indicatie voor duotherapie kan in een later stadium een combinatiepreparaat overwogen worden ter bevordering van de therapietrouw.
Kwaliteit van bewijs
De kwaliteit van het bewijs was redelijk tot (zeer) laag. Er werd afgewaardeerd voor afwezigheid van blindering, risico op bias door incomplete data, heterogeniteit en sponsoring door de industrie (er waren geen onafhankelijke onderzoeken).
Waarden en voorkeuren van patiënten
De patiëntenvertegenwoordigers in de werkgroep hebben in algemene zin geen voorkeur voor LAMA of LABA of een combinatie van beide. Het kan voor patiënten de moeite waard zijn om uit te proberen wat het meest effectief blijkt.
Kosten
De kosten van inhalatiemedicatie zijn afhankelijk van de gekozen geneesmiddelen en de toedieningsvorm. In het algemeen zijn combinatiepreparaten (iets) duurder dan monotherapie. Bij een duidelijke, blijvende indicatie voor duotherapie is een combinatiepreparaat echter in veel gevallen goedkoper dan 2 losse monopreparaten.
Haalbaarheid en aanvaardbaarheid
Indien de ziektelast persisterend verhoogd is onder monotherapie kan een aanvullend geneesmiddel worden overwogen. Bij het monitoren van duotherapie moet herhaaldelijk worden geëvalueerd wat elk van de geneesmiddelen bijdraagt aan de behandeling.
Rationale
Combinatie van een LAMA en een LABA geeft mogelijk enig voordeel ten opzichte van monotherapie (minder lichte longaanvallen dan bij LABA monotherapie).
Gebruik van inhalatiecorticosteroïden (ICS) in stap 2 of 3
Naar Samenvatting ›Indicatie
Naar Samenvatting ›- Overweeg behandeling met inhalatiecorticosteroïden (ICS) gedurende 1 jaar bij patiënten met frequente longaanvallen ondanks onderhoudsbehandeling met (een) langwerkende luchtwegverwijder(s) (≥ 2 prednis(ol)on of antibioticakuren of 1 ziekenhuisopname per jaar in verband met COPD) (zie tabel 9).
- Bij ≥ 2 longaanvallen maar verder weinig klachten volstaat een LAMA.
- Continueer de luchtwegverwijders; indien 2 luchtwegverwijders worden gebruikt (stap 3): zie Tripletherapie.
- Evalueer het effect na 1 jaar en continueer ICS bij afname van het aantal longaanvallen.
- Staak de ICS als het aantal longaanvallen na 1 jaar niet duidelijk is afgenomen of als er gedurende een langere periode (2 jaar) geen longaanvallen meer zijn (zie Stoppen met ICS).
- Lokale bijwerkingen, zoals heesheid en orale candidiasis, kunnen verminderd worden door de ICS vóór het eten te inhaleren en erna de mond te spoelen (zie NHG-Standaard Astma bij volwassenen).
In dit detail is de wetenschappelijke onderbouwing (opnieuw) nagegaan ten aanzien van de toevoeging van een ICS aan de behandeling met een LABA of LAMA. Dit heeft geresulteerd in de volgende vergelijkingen (zie ook tabel 7):
c1 LAMA + ICS versus LAMA
c2 LABA + ICS versus LABA
Uitgangsvraag c1 Is de combinatie LAMA + ICS effectiever dan LAMA monotherapie?
| Patiënten | COPD-patiënten in de eerste lijn |
|---|---|
| Interventie | LAMA + ICS |
| Vergelijking | LAMA |
| Uitkomstmaten | Ziektelast (klachten, hinder en beperkingen) |
| Cruciaal |
Longaanvallen (matig-ernstig) Longaanvallen (ernstig) Dyspneu Mortaliteit (Ernstige) bijwerkingen |
Methode
In december 2018 werd een search uitgevoerd naar de meerwaarde van de combinatie LAMA + ICS boven LAMA monotherapie voor patiënten met COPD in de eerste lijn.
Resultaten
Resultaat zoekactie
De search leverde geen artikelen op.
Samenvatting van het bewijs
Het is niet bekend of ziektelast, longaanvallen, mortaliteit en (ernstige) bijwerkingen afnemen of toenemen bij gebruik van LAMA en ICS ten opzichte van LAMA monotherapie.
Uitgangsvraag c2 Is de combinatie LABA + ICS effectiever dan LABA monotherapie?
| Patiënten | COPD-patiënten in de eerste lijn |
|---|---|
| Interventie | LABA + ICS |
| Vergelijking | LABA |
| Uitkomstmaten | Ziektelast (klachten, hinder en beperkingen) |
| Cruciaal |
Longaanvallen (matig-ernstig) Longaanvallen (ernstig) Dyspneu Mortaliteit (Ernstige) bijwerkingen |
Methode
In december 2018 werd een search uitgevoerd naar de meerwaarde van een combinatiepreparaat LABA + ICS boven een LABA monopreparaat voor patiënten met COPD in de eerste lijn.
Resultaten
Resultaat zoekactie
De search leverde een systematisch literatuuronderzoek met meta-analyse van goede kwaliteit op met betrekking tot de vergelijking tussen LABA + ICS ten opzichte van LABA.
Na publicatie van deze review zijn er geen nieuwere RCT’s met betrekking tot deze vergelijking verschenen.
Beschrijving onderzoeken
Oba 2018 includeerde 19 onderzoeken (n = 19.204) waarin LABA + ICS vergeleken werden met LABA bij patiënten met COPD. De onderzoeksduur varieerde van 12 weken tot 3 jaar (1 onderzoek 12 weken; 7 onderzoeken 24-26 weken; 3 onderzoeken 44-48 weken; 6 onderzoeken 1 jaar; 2 onderzoeken 3 jaar). De gemiddelde leeftijd was ca. 64 jaar en 54-89% was man. De 2 meest voorkomende vergelijkingen waren fluticasonpropionaat met salmeterol ten opzichte van salmeterol monotherapie en budesonide met formoterol ten opzichte van formoterol monotherapie. Gerapporteerd werden acute longaanvallen (matig en ernstig), mortaliteit en (ernstige) bijwerkingen. Na 6 maanden werd de ziektelast(verandering) gemeten met de St. George Respiratory Questionnaire (SGRQ; een hogere score correspondeert met een grotere ziektelast), en de dyspneu met de Transition Dyspnea Index (TDI; een positieve score correspondeert met verbetering; een negatieve score met verslechtering).
Samenvatting van het bewijs
Zie Totstandkoming en methoden, tabel 5b.
- Er is waarschijnlijk een lagere ziektelast bij duotherapie met LABA + ICS ten opzichte van LABA monotherapie, maar het verschil is niet klinisch relevant (kwaliteit van bewijs redelijk).
- Er komen waarschijnlijk minder lichte longaanvallen voor bij duotherapie met LABA + ICS ten opzichte van LABA monotherapie (kwaliteit van bewijs redelijk).
- Er lijkt geen verschil te zijn in het aantal ernstige longaanvallen bij duotherapie met LABA + ICS ten opzichte van LABA monotherapie (kwaliteit van bewijs laag).
- Er is waarschijnlijk geen verschil in dyspneu tussen duotherapie met LABA + ICS ten opzichte van LABA monotherapie (kwaliteit van bewijs redelijk).
- Er lijkt geen verschil te zijn in sterfte bij duotherapie met LABA + ICS ten opzichte van LABA monotherapie (kwaliteit van bewijs laag).
- Er is waarschijnlijk geen verschil in (ernstige) bijwerkingen bij duotherapie met LABA + ICS ten opzichte van LABA monotherapie (kwaliteit van bewijs redelijk).
Van bewijs naar aanbeveling
Voor- en nadelen
Er lijken iets minder lichte longaanvallen op te treden bij toevoeging van ICS aan een LABA, maar er is geen verschil op andere uitkomstmaten. Het toevoegen van een ICS aan de behandeling betekent dat er een tweede geneesmiddel gebruikt moet worden, met een risico op bijwerkingen. We vonden geen bewijs voor de combinatie ICS met een LAMA.
Kwaliteit van bewijs
De kwaliteit van het bewijs was laag. Er werd afgewaardeerd voor risico op bias door incomplete data, sponsoring door de industrie (er waren geen onafhankelijke onderzoeken) en het lage aantal events in de onderzoeken.
Waarden en voorkeuren van patiënten
In veel gevallen valt bij de keuze voor toevoeging van een geneesmiddel een combinatiepreparaat te overwegen in plaats van 2 losse preparaten. Een combinatiepreparaat is gemakkelijker in het gebruik en voorkomt fouten bij de toediening. Men moet echter rekening houden met een voor de patiënt geschikt inhalatiedevice, in sommige gevallen is een zelfde device als de patiënt gewend is te verkiezen boven een gewijzigde toedieningswijze met een combinatiepreparaat.
Kosten
De kosten van inhalatiemedicatie zijn afhankelijk van de gekozen geneesmiddelen en de toedieningsvorm. In het algemeen zijn combinatiepreparaten (iets) duurder dan monotherapie. Bij een duidelijke, voortdurende indicatie voor duotherapie kan een combinatiepreparaat echter goedkoper zijn dan 2 losse monopreparaten.
Haalbaarheid en aanvaardbaarheid
Indien de ziektelast persisterend verhoogd is onder monotherapie kan een aanvullend geneesmiddel worden overwogen. Bij het monitoren van duotherapie moet herhaaldelijk worden geëvalueerd wat elk middel bijdraagt aan de behandeling.
Rationale
Bij duotherapie met LABA + ICS lijken er iets minder lichte longaanvallen op te treden dan bij LABA monotherapie. Bij ≥ 2 longaanvallen per jaar kan toevoeging van een ICS geïndiceerd zijn, omdat hiermee het aantal longaanvallen lijkt te verminderen. Indien gekozen wordt voor duotherapie moeten het effect en de mogelijke bijwerkingen geëvalueerd worden. In het kader van deze evaluatie wordt aangeraden om bij duotherapie in eerste instantie losse monopreparaten te gebruiken. Bij tevredenheid en een blijvende indicatie voor duotherapie kan in een later stadium een combinatiepreparaat overwogen worden ter bevordering van de therapietrouw.
Tripletherapie
Naar Samenvatting ›- Wees terughoudend met tripletherapie (LAMA + LABA + ICS); overweeg tripletherapie alleen indien de indicatie voor 2 luchtwegverwijders en voor ICS gedurende langere tijd persisteert.
- Overweeg 1 luchtwegverwijder te staken bij een indicatie voor ICS wanneer de patiënt al 2 luchtwegverwijders gebruikt (stap 3).
- Voeg bij het overgaan op tripletherapie in eerste instantie een monopreparaat toe en evalueer daarvan het effect en de mogelijke bijwerkingen. Overweeg bij tevredenheid en een blijvende indicatie een combinatiepreparaat vanwege gebruiksgemak en ter bevordering van de therapietrouw.
- Blijf het effect van tripletherapie monitoren.
- Verwijs bij weinig verbetering naar een longarts.
In dit detail is de wetenschappelijke onderbouwing nagegaan ten aanzien van tripletherapie. Dit heeft geleid tot de volgende vergelijkingen (zie ook tabel 7):
d1 LAMA + LABA + ICS versus LAMA
d2 LAMA + LABA + ICS versus LABA
d3 LAMA + LABA + ICS versus LAMA + ICS
d4 LAMA + LABA + ICS versus LABA + ICS
d5 LAMA + LABA + ICS versus LABA + LAMA
Uitgangsvraag d1 Is tripletherapie effectiever dan LAMA monotherapie?
| Patiënten | COPD-patiënten in de eerste lijn |
|---|---|
| Interventie | Tripletherapie |
| Vergelijking | LAMA |
| Uitkomstmaten | Ziektelast (klachten, hinder en beperkingen) |
| Cruciaal | Longaanvallen (matig-ernstig) Longaanvallen (ernstig) Dyspneu (niet gevonden) Mortaliteit (Ernstige) bijwerkingen |
Methode
In december 2018 werd een search uitgevoerd naar de meerwaarde van tripletherapie (LAMA + LABA + ICS) ten opzichte van LAMA monotherapie voor patiënten met COPD in de eerste lijn.
Resultaten
Resultaat zoekactie
De search leverde 1 systematisch literatuuronderzoek met meta-analyse van goede kwaliteit op met betrekking tot de vergelijking tussen tripletherapie ten opzichte van LAMA. Na publicatie van deze review zijn er geen nieuwere RCT’s met betrekking tot deze vergelijking verschenen.
Beschrijving onderzoeken
Zheng 2018 includeerde 10 onderzoeken (n = 5140) waarin tripletherapie werd vergeleken met LAMA monotherapie bij patiënten met COPD (FEV1 < 80%). De onderzoeksduur varieerde van 12 weken tot 1 jaar (gemiddeld 24 weken). De gemiddelde leeftijd was 67 jaar en 43-97% was man. De meest voorkomende vergelijking was die tussen fluticason + salmeterol + tiotropium en tiotropium alleen. Daarnaast werden ook budesonide + formoterol + tiotropium en beclomethasondipropionaat + formoterol(fumaraat) + tiopropium of glycopyrronium ten opzichte van tiotropium monotherapie vergeleken. Gerapporteerd werden acute longaanvallen (matig en ernstig), mortaliteit en (ernstige) bijwerkingen. De ziektelast(verandering) werd gemeten met de St. George Respiratory Questionnaire (SGRQ; een hogere score correspondeert met een grotere ziektelast).
Samenvatting van het bewijs
Zie Totstandkoming en methoden, tabel 6a.
- Er is waarschijnlijk een lagere ziektelast bij tripletherapie ten opzichte van LAMA monotherapie, maar het verschil is niet klinisch relevant (kwaliteit van bewijs redelijk).
- Er lijken minder lichte longaanvallen op te treden bij tripletherapie ten opzichte van LAMA monotherapie (kwaliteit van bewijs laag).
- Er treden waarschijnlijk minder ernstige longaanvallen op bij gebruik van tripletherapie ten opzichte van LAMA monotherapie (kwaliteit van bewijs redelijk).
- Er lijkt geen verschil te zijn in sterfte bij tripletherapie ten opzichte van LAMA monotherapie (kwaliteit van bewijs laag).
- Er is waarschijnlijk geen verschil in (ernstige) bijwerkingen bij tripletherapie of LAMA monotherapie (kwaliteit van bewijs redelijk).
Uitgangsvraag d2 Is tripletherapie effectiever dan LABA monotherapie?
| Patiënten | COPD-patiënten in de eerste lijn |
|---|---|
| Interventie | Tripletherapie |
| Vergelijking | LABA |
| Uitkomstmaten | Ziektelast (klachten, hinder en beperkingen) |
| Cruciaal | Longaanvallen (matig-ernstig) (niet gevonden) Longaanvallen (ernstig) (niet gevonden) Dyspneu (niet gevonden) Mortaliteit (niet gevonden) (Ernstige) bijwerkingen (niet gevonden) FEV1 |
Methode
In december 2018 werd een search uitgevoerd naar de meerwaarde van tripletherapie (LAMA + LABA + ICS) ten opzichte van een LABA monopreparaat voor patiënten met COPD in de eerste lijn.
Resultaten
Resultaat zoekactie
De search leverde 1 RCT op met betrekking tot de vergelijking tussen tripletherapie ten opzichte van LABA monotherapie. Na publicatie van deze RCT zijn er geen nieuwere RCT’s met betrekking tot deze vergelijking verschenen.
Beschrijving onderzoeken
Hoshino 2013 includeerde 60 patiënten met COPD (FEV1 < 70%) en vergeleek verschillende medicatieregimes: tripletherapie, tiotropium, salmeterol en salmeterol + fluticasonpropionaat. De onderzoeksduur was 16 weken. De gemiddelde leeftijd was 70 jaar, 87% was man. In de vergelijking tussen LABA (salmeterol) versus tripletherapie waren 29 patiënten gerandomiseerd. De uitkomstmaten waren ‘luchtwegdimensies’ (gemeten met CT-scan), verandering in longfunctie en ziektelast aan de hand van SGRQ.
Samenvatting van het bewijs
Zie Totstandkoming en methoden, tabel 6b.
- Het is onzeker of er een lagere ziektelast is bij tripletherapie ten opzichte van LABA monotherapie, en of het verschil klinisch relevant is (kwaliteit van bewijs zeer laag).
- Het is onzeker of er een verbetering van de longfunctie is bij tripletherapie ten opzichte van LABA monotherapie (kwaliteit van bewijs zeer laag).
Uitgangsvraag d3 Is tripletherapie effectiever dan LAMA + ICS?
| Patiënten | COPD-patiënten in de eerste lijn |
|---|---|
| Interventie | Tripletherapie |
| Vergelijking | LAMA + ICS |
| Uitkomstmaten | Ziektelast (klachten, hinder en beperkingen) |
| Cruciaal | Longaanvallen (matig-ernstig) Longaanvallen (ernstig)/ziekenhuisopname Dyspneu Mortaliteit (Ernstige) bijwerkingen |
Methode
In december 2018 werd een search uitgevoerd naar de meerwaarde van tripletherapie (LAMA + LABA + ICS) ten opzichte van een LAMA + ICS combinatiepreparaat voor patiënten met COPD in de eerste lijn.
Resultaten
Resultaat zoekactie
De search leverde geen artikelen op.
Uitgangsvraag d4 Is tripletherapie effectiever dan LABA + ICS?
| Patiënten | COPD-patiënten in de eerste lijn |
|---|---|
| Interventie | Tripletherapie |
| Vergelijking | LABA + ICS |
| Uitkomstmaten | Ziektelast (klachten, hinder en beperkingen) |
| Cruciaal | Longaanvallen (matig-ernstig) Longaanvallen (ernstig) Dyspneu (niet gevonden) Mortaliteit (Ernstige) bijwerkingen |
Methode
In december 2018 werd een search uitgevoerd naar de meerwaarde van tripletherapie (LAMA + LABA + ICS) ten opzichte van duotherapie met LABA + ICS bij patiënten met COPD in de eerste lijn.
Resultaten
Resultaat zoekactie
De search leverde 2 systematische literatuuronderzoeken met meta-analyse op waarin tripletherapie werd vergeleken met LABA + ICS. De kwaliteit van Zhengs review was hoger en was het uitgangspunt voor dit detail. Calzetta gebruikte overigens vergelijkbare criteria en rapporteerde vergelijkbare resultaten. Na publicatie van de review van Zheng zijn er geen nieuwere RCT’s met betrekking tot deze vergelijking verschenen.
Beschrijving onderzoeken
Zheng 2018 includeerde 11 onderzoeken (n = 11.676) waarin tripletherapie werd vergeleken met duotherapie met LABA + ICS bij patiënten met COPD (FEV1 < 80%). De onderzoeksduur varieerde van 12 weken (8 onderzoeken) tot 1 jaar (3 onderzoeken). De gemiddelde leeftijd was 65 jaar en 59-87% was man. De meest voorkomende vergelijking was die tussen fluticason of formoterolfumaraat + salmeterol of vilanterol + umeclidinium of tiotropium ten opzichte van fluticason of formoterolfumaraat + salmeterol of vilanterol. Daarnaast werd in een enkel onderzoek ook glycopyrronium gebruikt in plaats van tiotropium, budesonide + formoterol of beclometasondipropionaat + glycopyrronium. Gerapporteerd werden acute longaanvallen (matig en ernstig), mortaliteit en (ernstige) bijwerkingen. De ziektelast(verandering) werd gemeten met de SGRQ.
Samenvatting van het bewijs
Zie Totstandkoming en methoden, tabel 6d
- Er is waarschijnlijk een lagere ziektelast bij tripletherapie ten opzichte van LABA + ICS duotherapie, maar het verschil is niet klinisch relevant (kwaliteit van bewijs redelijk).
- Er lijken minder lichte longaanvallen op te treden bij tripletherapie dan bij LABA + ICS duotherapie (kwaliteit van bewijs laag).
- Er lijken iets minder ernstige longaanvallen op te treden bij tripletherapie dan bij LABA + ICS duotherapie (kwaliteit van bewijs laag).
- Het is onzeker of er verschil in sterfte is bij tripletherapie ten opzichte van LABA + ICS duotherapie (kwaliteit van bewijs zeer laag).
- Er lijkt geen verschil te zijn in (ernstige) bijwerkingen bij tripletherapie ten opzichte van LABA + ICS duotherapie (kwaliteit van bewijs laag).
Uitgangsvraag d5 Is tripletherapie effectiever dan LAMA + LABA?
| Patiënten | COPD-patiënten in de eerste lijn |
|---|---|
| Interventie | Tripletherapie |
| Vergelijking | LAMA + LABA |
| Uitkomstmaten | Ziektelast (klachten, hinder en beperkingen) |
| Cruciaal | Longaanvallen (matig-ernstig) Dyspneu (niet gevonden) Bijwerkingen (alle) (Ernstige) bijwerkingen |
Methode
In april 2019 werd een search uitgevoerd naar de meerwaarde van tripletherapie (LAMA + LABA + ICS) ten opzichte van duotherapie met LAMA + LABA bij patiënten met COPD in de eerste lijn.
Resultaten
Resultaat zoekactie
De search leverde 1 systematisch literatuuronderzoek met meta-analyse op met betrekking tot de vergelijking tussen tripletherapie ten opzichte van LAMA + LABA. Na publicatie van deze review zijn geen nieuwere RCT’s met betrekking tot deze vergelijking verschenen.
Beschrijving onderzoeken
Zayed 2019 includeerde 4 onderzoeken (n = 9310) waarin tripletherapie werd vergeleken met LAMA + LABA bij patiënten met COPD (FEV1 < 80%). De onderzoeksduur varieerde van 24 weken (1 onderzoek) tot 1 jaar (3 onderzoeken). De gemiddelde leeftijd was 65 jaar en 57-72% was man. De medicatievergelijkingen waren:
- fluticasonpropionaat + salmeterol + tiotropium versus salmeterol + tiotropium
- budesonide + formoterolfumaraat + glycopyrrolaat versus formoterolfumaraat + glycopyrrolaat
- fluticasonfuroaat + vilanterol + umeclidinium versus vilanterol + umeclidinium
- beclomethasondipropionaat + formoterolfumaraat + glycopyrronium versus indacaterol + glycopyrronium
Gerapporteerd werden acute longaanvallen (matig ernstig) en (ernstige) bijwerkingen. De ziektelast(verandering) werd gemeten met de SGRQ.
Samenvatting van het bewijs
Zie Totstandkoming en methoden, tabel 6e.
- Er is waarschijnlijk een lagere ziektelast bij tripletherapie ten opzichte van LAMA + LABA duotherapie, maar het verschil is niet klinisch relevant (kwaliteit van bewijs redelijk).
- Er lijken minder matig ernstige longaanvallen op te treden bij tripletherapie ten opzichte van LAMA + LABA duotherapie (kwaliteit van bewijs laag).
- Er lijkt geen verschil te zijn in bijwerkingen (alle dan wel ernstige) bij tripletherapie ten opzichte van LAMA + LABA duotherapie (kwaliteit van bewijs laag).
Van bewijs naar aanbeveling
Voor- en nadelen
Tripletherapie (LAMA + LABA + ICS) lijkt bij patiënten met ≥ 2 longaanvallen per jaar voordelen te hebben ten opzichte van monotherapie (LAMA, LABA) of duotherapie (LABA + ICS, LAMA + LABA). Het voordeel betreft met name longaanvallen. Op ziektelast en op belangrijke uitkomstmaten (mortaliteit en (ernstige) bijwerkingen) is er meestal geen verschil met mono- of duotherapie.
Kwaliteit van bewijs
De kwaliteit van het bewijs was laag. Er werd afgewaardeerd voor afwezigheid van blindering, heterogeniteit en sponsoring door de industrie (er waren geen onafhankelijk onderzoeken).
Waarden en voorkeuren van patiënten
In veel gevallen valt bij de keuze voor toevoeging van een geneesmiddel te overwegen om een combinatiepreparaat te starten in plaats van 2 of 3 losse preparaten. Een combinatiepreparaat is gemakkelijker in het gebruik en voorkomt fouten bij de toediening. Men moet echter rekening houden met een voor de patiënt geschikt inhalatiedevice, in sommige gevallen is een zelfde device als de patiënt gewend is te verkiezen boven een gewijzigde toedieningswijze met een combinatiepreparaat.
Kosten
De kosten van inhalatiemedicatie zijn afhankelijk van het gekozen geneesmiddelen en de toedieningsvorm. In het algemeen zijn combinatiepreparaten (iets) duurder dan monotherapie. Bij een duidelijke, voortdurende indicatie voor tripletherapie kan een combinatiepreparaat echter goedkoper zijn dan 3 losse monopreparaten.
Haalbaarheid en aanvaardbaarheid
Indien de ziektelast persisterend verhoogd is onder monotherapie of duotherapie kan een aanvullend geneesmiddel worden overwogen. Bij het monitoren van combinatietherapie moet herhaaldelijk worden geëvalueerd wat elk middel bijdraagt aan de behandeling.
Rationale
Op alle cruciale uitkomstmaten (ziektelast, matige en ernstige longaanvallen) is tripletherapie iets effectiever dan LAMA monotherapie en dan duotherapieën met LABA + ICS en LAMA + LABA (kwaliteit laag tot redelijk). Het verschil in ziektelast is niet klinisch relevant. Daarom is terughoudendheid met tripletherapie aangewezen. Bij patiënten die een indicatie voor ICS hebben en 2 luchtwegverwijders gebruiken is het te overwegen 1 luchtwegverwijder te staken. Tripletherapie is alleen aangewezen indien zowel de indicatie voor 2 luchtwegverwijders als de indicatie voor ICS persisteert.
Stoppen met ICS
Naar Samenvatting ›- Staak ICS ineens. Overleg met de patiënt wat een goed moment is om te stoppen. Afbouwen is niet nodig, maar kan overwogen worden indien de patiënt er de voorkeur aan geeft.
- Leg uit dat hoestklachten als gevolg van toegenomen hyperreactiviteit tijdelijk kunnen toenemen.
- Controleer na 1-2 maanden of het stoppen gelukt is.
- Ga, indien stoppen niet gelukt is, na wat de patiënt heeft weerhouden.
- Controleer zo nodig enkele malen (telefonisch). Informeer naar klachten en/of het stoppen blijvend is geslaagd.
Er lijkt wetenschappelijk en klinisch gezien geen afbouwperiode van ICS nodig te zijn. Er is geen informatie over het succespercentage van langdurig zonder ICS blijven na afbouwen dan wel direct staken van ICS.
Voor- en nadelen
Het lijkt goed mogelijk ICS direct te staken zonder afbouwperiode, zonder dat longaanvallen of vermindering van longfunctie vaker voorkomen. Omdat patiënten de medicatie soms al lange tijd gebruiken, is goede voorlichting belangrijk: patiënten zouden bezorgd kunnen zijn dat zij na stoppen met ICS vaker longaanvallen zullen krijgen. Geleidelijk afbouwen heeft geen grote nadelen. Op grond van pathofysiologie en uit ervaring binnen de werkgroep kunnen hoestklachten tijdelijk toenemen als gevolg van toegenomen hyperreactiviteit.
Over enig verschil in het succespercentage van stoppen is geen informatie gevonden.
Kwaliteit van bewijs
Narratief beschreven, zeer heterogeen; niet volgens GRADE te beoordelen. De kwaliteit is om deze reden zeer laag.
Waarden en voorkeuren van patiënten
Patiëntenvertegenwoordigers in de werkgroep geven aan voorkeur te hebben voor het ineens staken van ICS; tegelijkertijd kan men huiverig zijn voor toename van de klachten op korte of langere termijn. Van groot belang daarbij is goede voorlichting over de te verwachten gevolgen.
Kosten
Er zijn geen extra kosten verbonden aan het afbouwen of direct staken van ICS. Staken van ICS betekent vermindering van de kosten voor inhalatiemedicatie.
Achtergrond
Veel COPD-patiënten gebruiken ICS zonder duidelijke indicatie. Het is daarom bij veel van deze patiënten aan te bevelen de ICS te staken om het risico op bijwerkingen te verminderen en onnodige kosten te voorkomen. In de praktijk blijkt dit voor veel patiënten moeilijk te zijn, vanwege de zorg dat de klachten toenemen en vanwege het veranderen van een gewoonte.
Uitgangsvraag
Hoe kun je patiënten het beste laten stoppen met ICS: afbouwen of direct staken?
| Patiënten | Patiënten met COPD |
|---|---|
| Interventie | Afbouwen ICS |
| Vergelijking | Direct staken ICS? |
| Uitkomstmaten | Succespercentage stoppen, recidief klachten |
Methode
De search met bovenstaande PICO-onderdelen leverde geen reviews, meta-analyses of RCT’s op die deze vraag zou kunnen beantwoorden. Wel leverde de search 4 artikelen op.
Resultaten
Beschrijving onderzoeken
Direct vergelijkende onderzoeken met betrekking tot afbouwen of direct staken zijn niet gedaan.
Geleidelijk afbouwen
Ariel 2017 beschrijft een afbouwprocedure voor ICS op grond van 5 onderzoeken. Deze afbouwprocedure bestaat uit het optimaliseren van COPD-management, het evalueren van het voor- en nadelenprofiel met betrekking tot doorgaan met ICS (met name of er astma-COPD-overlap is). Indien er geen ICS-indicatie is, wordt de dosis ICS elke 6-12 weken verlaagd, met daarna elke 3 maanden een follow-upbezoek gedurende het eerste jaar. Dit beleid is gebaseerd op 4 onderzoeken:
- Magnussen 2014, waaruit bleek dat geleidelijk afbouwen van ICS niet leidde tot meer longaanvallen, maar wel tot een wat slechtere longfunctie
- Calzetta 2017, waaruit bleek dat stoppen met ICS niet zorgde voor meer longaanvallen, maar wel voor een verhoogd risico op een ernstige longaanval
- Miravitlles 2016, die beschrijft dat ICS vooral effectief is bij patiënten met astma-COPD-overlap
- Kaplan 2015, die stelt dat alleen bepaalde COPD-fenotypes baat hebben bij ICS; de afbouwprocedure die Kaplan beschrijft, is door Ariel overgenomen
Direct staken
Miravitlles 2017b concludeerde dat ICS direct gestaakt kan worden, zonder afbouwperiode. Dit is gebaseerd op 5 onderzoeken.
- INSTEAD: een gerandomiseerde ‘switch’-trial met betrekking tot indacaterol versus salmeterol/fluticason bij COPD waaruit bleek dat patiënten niet meer of minder longaanvallen hadden na het stoppen met ICS
- FLAME: een gerandomiseerde trial met betrekking tot indacaterol/glycopyrroium versus salmeterol/fluticason bij COPD waaruit bleek dat de patiënten niet meer of minder longaanvallen hadden na het stoppen met ICS
- OPTIMO: een trial waarin er geen verschil was in aantal longaanvallen en longfunctie tussen de groep patiënten die meteen stopte met ICS en die ICS bleef doorgebruiken
- CRYSTAL: een gerandomiseerde trial waarin een directe switch naar indacaterol/glycopyrronium werd onderzocht en waaruit bleek dat deze combinatie beter was dan LABA + ICS met betrekking tot longfunctie en dyspneu
- DACCORD: een observationeel onderzoek waaruit bleek dat voor de meeste patiënten met COPD een longaanval een zeldzaam event is
Ook Ferreira 2016 concludeerde in een systematische review dat verschillende onderzoeken geen informatie geven over de verschillen tussen afbouwen dan wel direct stoppen met ICS en dat in de meeste onderzoeken ICS direct gestaakt werd zonder evidente problemen. Alleen in het WISDOM-onderzoek werd ICS afgebouwd. Ferreira concludeerde op basis van de geïncludeerde onderzoeken dat er geen noodzaak tot afbouwen is en dat er ook geen bewezen voordelen zijn ten opzichte van direct staken.
Controles
Driemaandelijkse follow-upafspraken gedurende een jaar worden aanbevolen door alle auteurs.
Samenvatting van het bewijs
- Er zijn geen onderzoeken die het afbouwen van ICS vergelijken met het direct staken van ICS
- Er lijkt geen noodzaak te zijn voor het afbouwen van ICS
- Follow-up wordt aanbevolen.
|
Middel |
Dosering in microgram* |
Maximum per dag |
|---|---|---|
|
Kortwerkende luchtwegverwijders |
||
|
SABA |
||
|
1-4 dd 100-400 |
800-1600, afhankelijk van toedieningsvorm |
|
1-4 dd 100-200 |
|
|
1-4 dd 250-500 |
4000 |
|
SAMA |
||
|
1-4 dd 40 |
240 |
|
1-4 dd 40 |
|
|
Langwerkende luchtwegverwijders |
||
|
LABA |
||
|
1-2 dd 12 |
24-48 |
|
1-2 dd 12 |
|
|
2 dd 50 |
100 |
|
2 dd 50 |
|
|
1 dd 5 |
5 |
|
1 dd 150-300 |
300 |
|
LAMA |
||
|
1 dd 18/10, afhankelijk van toedieningsvorm |
18/10 |
|
1 dd 5 |
5 |
|
2 dd 322 |
644 |
|
1 dd 55 |
55 |
|
1 dd 44 |
44 |
|
* Bron: KNMP Kennisbank. Gebaseerd op monopreparaten. De doseringen van duo- of triplepreparaten kunnen afwijken. |
||
|
Middel* |
Dosering † |
|---|---|
|
Beclometason aerosol |
2 dd 500 |
|
Beclometason aerosol extra fijn |
2 dd 200 |
|
Beclometason poeder |
2 dd 400 |
|
Budesonide aerosol/poeder |
2 dd 400 |
|
Fluticasonpropionaat aerosol/poeder |
2 dd 500 |
|
* Beclometason, en budesonide zijn als monopreparaat niet geregistreerd voor de behandeling van COPD en worden dus offlabel gebruikt. Fluticasonproprionaat monopreparaat is geregistreerd voor COPD. † Gebaseerd op monopreparaten. De exacte doseringen van duo- of triplepreparaten kunnen afwijken. |
|
Overige medicatie
Naar Samenvatting ›Orale corticosteroïden
Naar Samenvatting ›Onderhoudsbehandeling met orale steroïden heeft geen plaats in de eerste lijn.
Een cochranereview van 24 onderzoeken bij COPD-patiënten in overwegend GOLD-stadia 2 en 3 (n = 1029; 80% man) liet na 2 weken behandeling met een lage dosis orale corticosteroïden (10 tot 15 mg/dag) een significante toename zien van de FEV1 (gewogen gemiddeld verschil 53 ml; 95%-BI 22 tot 84), maar geen significant verschil in het risico op een longaanval gedurende 2 jaar behandeling. De gevonden verschillen in kwaliteit van leven (gemeten met de CRQ) waren significant, maar klinisch niet relevant. Een significante toename van de functionele status (gestandaardiseerd gemiddeld verschil 0,44; 95%-BI 0,14 tot 0,74) werd gevonden in de groep die werd behandeld met orale corticosteroïden (3 onderzoeken). Er was een toename van bijwerkingen zoals verhoogde bloedglucoseconcentratie, hypertensie en bijniersuppressie.
Conclusie
Orale corticosteroïden hebben een geringe toegevoegde waarde bij de behandeling van mannen met stabiel COPD, maar de voordelen wegen niet op tegen de nadelen.
Antibiotica ter preventie van longaanvallen
Naar Samenvatting ›Onderhoudsbehandeling met antibiotica heeft geen plaats in de eerste lijn.
Een onderhoudsbehandeling met azitromycine (250 mg/dag gedurende 1 jaar) is vergeleken met placebo bij patiënten met matig tot ernstig COPD. Hierbij werd de al bestaande medicatie doorgebruikt. Primair werd gekeken naar de tijd tot het optreden van een eerste longaanval; daarnaast werd onder meer de kwaliteit van leven nagegaan. De hazard ratio voor het krijgen van een acute longaanval was 0,73 (95%-BI 0,63 tot 0,84). De longaanvalfrequentie was 1,48 per patiëntjaar in de azitromycinegroep en 1,83 in de placebogroep (verschil 0,35 per patiëntjaar; NNT 2,9; klinisch relevant). De kwaliteit van leven was hoger in de azitromycinegroep dan in de placebogroep, maar dit verschil was niet klinisch relevant. De auteurs concluderen dat azitromycine mogelijk een plaats heeft in de behandeling van COPD bij een geselecteerde populatie (die in de tweede lijn onder behandeling is), maar dat strenge patiëntselectie nodig is vanwege het risico op ernstige bijwerkingen.
Conclusie
Onderhoudsbehandeling met antibiotica is mogelijk effectief bij een streng geselecteerde populatie.
Acetylcysteïne
Naar Samenvatting ›Acetylcysteïne heeft geen plaats bij de behandeling van COPD in de eerste lijn.
In een cochranereview van 30 onderzoeken (n = 7436) werd de effectiviteit van mucolytica versus placebo nagegaan bij patiënten met chronische bronchitis of COPD. Primair werd hierbij gekeken naar longaanvallen en ziektedagen. Secundair werden ook longfunctie, kwaliteit van leven en bijwerkingen nagegaan. Bij een deel van de geïncludeerde onderzoeken is de randomisatieprocedure niet volledig adequaat uitgevoerd en ook is er mogelijk sprake van selectiebias, waardoor de kwaliteit van het bewijs beperkt is. De meta-analyse laat een verschil in longaanvallen zien in het voordeel van de patiënten die mucolytica gebruikten (OR 1,84; 95%-BI 1,63 tot 2,07). Recenter uitgevoerde trials laten echter een kleiner voordeel zien dan onderzoeken die eerder zijn gedaan, waardoor dit effect met de nodige voorzichtigheid moet worden beoordeeld. Het aantal ziektedagen per maand was lager bij patiënten die mucolytica gebruikten (gemiddeld verschil −0,48; 95%-BI −0,65 tot −0,30). Er was geen klinisch relevant verschil in longfunctie, kwaliteit van leven, bijwerkingen en mortaliteit.
Conclusie
Het is onzeker of acetylcysteïne een voordeel heeft boven placebo voor patiënten met COPD.
Medicamenteuze behandelingsmogelijkheden in de tweede lijn
Naar Samenvatting ›- We bevelen de volgende middelen niet aan in de huisartsenpraktijk vanwege de onbekendheid van de effectiviteit en bijwerkingen op de lange termijn:
- fosfodiësterase-4-remmers (roflumilast)
- azitromycine
- theofylline
- Verwijs patiënten die vanwege een persisterend verhoogde ziektelast mogelijk toch in aanmerking komen voor deze middelen naar een longarts.
- Ook voor zuurstofbehandeling thuis stelt de longarts de indicatie (zoals permanent verlaagde saturatie of desaturatie bij inspanning).
Er is een cochranereview uitgevoerd over de effectiviteit van de fosfodiësterase-4-remmers (PDE-remmers) roflumilast en cilomilast versus placebo bij de behandeling van (veelal ernstig) COPD. Van de 29 geïncludeerde onderzoeken gingen er 15 (n = 12.654) over roflumilast 250-500 microg en 14 over cilomilast (n = 6457). De kwaliteit van de geïncludeerde onderzoeken was beperkt (onder andere aanwijzingen voor selectiebias, problemen met randomisatie en blindering). Omdat cilomilast niet geregistreerd is voor COPD en in Nederland niet beschikbaar is, zijn alleen de gegevens over roflumilast meegenomen. Behandeling met roflumilast was geassocieerd met een statistisch significante, maar klinisch niet relevante verbetering van de FEV1 (gemiddeld verschil 54 ml; 95%-BI 44 tot 64 ml). Er werd geen statistisch significant verschil in kwaliteit van leven gevonden ten gunste van roflumilast. Behandeling met roflumilast 500 mg was geassocieerd met een lagere kans op een of meer longaanvallen (OR 0,77; 95%-BI 0,69 tot 0,87; NNT 16 (klinisch relevant)). In de behandelgroepen hadden de patiënten meer (lichte) bijwerkingen dan in de placebogroep, vooral gastro-intestinale bijwerkingen en hoofdpijn. Behandeling met roflumilast was geassocieerd met gewichtverlies, slapeloosheid en depressieve klachten gedurende de behandeling.
Conclusie
Van behandeling met roflumilast is geen meerwaarde aangetoond ten opzichte van gangbare behandelingen in de huisartsenpraktijk. Er is geen onderzoek gevonden waarin PDE-remmers vergeleken werden met gangbare middelen.
Monitoring
Naar Samenvatting ›Doel en frequentie monitoring
Naar Samenvatting ›- Het doel van monitoring is het verminderen van de ziektelast door:
- de 4 subdomeinen te evalueren
- rookgedrag te staken of te verminderen
- therapietrouw en gebruik van medicatie te evalueren evenals therapietrouw en
- het effect van de niet-medicamenteuze behandeling te evalueren (zie tabel 5).
- Evalueer per subdomein en stel de behandeling zo nodig bij.
- Stem de frequentie van de monitoringsconsulten af op de behoeften en wensen van de patiënt als deze een stabiele situatie heeft bereikt; houd als vuistregel aan: bij lichte ziektelast jaarlijks; bij verhoogde ziektelast ten minste 2 × per jaar.
Voor- en nadelen
Er is geen onderzoek gedaan naar frequentere of minder frequente controles, bijvoorbeeld alleen bij (toename van) klachten van COPD. Er kunnen dus geen voor- en nadelen uit eventueel onderzoek worden genoemd. De werkgroep is van mening dat jaarlijkse controle gewenst is bij patiënten met COPD die (blijven) roken. Bij het vaststellen van de controlefrequentie moet het risico op onderbehandeling, mogelijk als gevolg van adaptatie aan geleidelijke achteruitgang, worden afgewogen tegen de belasting van de controles.
Kwaliteit van bewijs
Niet van toepassing.
Waarden en voorkeuren van patiënten
De wqerkgroep is van mening dat de meeste patiënten het prettig vinden om de frequentie van monitoring vast te stellen in overleg met huisarts en praktijkondersteuner (inschatting van de werkgroep).
Achtergrond
Bij patiënten met verhoogde ziektelast is regelmatige monitoring aangewezen om de ziektelast en het effect van de behandeling te evalueren. Patiënten die een stabiele lichte ziektelast hebben (en niet meer roken) zijn daar niet altijd toe gemotiveerd. De vraag is wat de meerwaarde van een jaarlijkse controle bij de lichte ziektelast is. In de literatuur is nagegaan of monitoring bij lichte ziektelast minder frequent zou kunnen, of alleen bij toename van klachten.
Uitgangsvraag
Verbetert regelmatige monitoring bij patiënten met lichte ziektelast de uitkomsten voor de patiënt op langere termijn?
| Patiënten | Patiënten met COPD met lichte ziektelast |
|---|---|
| Interventie | Regelmatige monitoring (meestal ≥ 1 keer per jaar) |
| Vergelijking | Alleen contact bij (toename) klachten |
| Uitkomstmaten | Longaanvallen, klachten/symptomen COPD, ziektelast |
Methode
Een search in maart 2018 met bovenstaande PICO-onderdelen leverde geen hits op. Hieronder wordt weergegeven wat (inter)nationale richtlijnen schrijven.
Resultaten
Citaten uit (inter)nationale richtlijnen met betrekking tot monitoring van COPD:
NICE 2019
- Er zijn geen gegevens beschikbaar om aanbevelingen op te baseren over hoe vaak patiënten moeten worden gecontroleerd. Dit zal variëren afhankelijk van de individuele omstandigheden en de ernst van de ziekte. Sommige patiënten met COPD verslechteren sneller dan andere en het is belangrijk om deze patiënten te identificeren omdat zij mogelijk baat hebben bij specialistische zorg.
- In principe moeten patiënten met COPD minstens één keer per jaar worden gezien voor controle, of vaker op indicatie. Wanneer patiënten met zeer ernstige COPD worden gecontroleerd in de eerste lijn, moeten zij ten minste tweemaal per jaar worden gezien.
NVALT 2010
Er is geen literatuur ter onderbouwing van een nuttige controlefrequentie of frequentie van herhaling van spirometrie bij patiënten met COPD. De NVALT-werkgroep is van mening dat – direct na een initiële diagnose COPD – de controlefrequentie aangepast moet worden aan het beloop van de ervaren klachten en aan de doelen die gesteld zijn. De werkgroep is van mening dat tijdens een stabiele fase van lichte COPD de controle minimaal 1 × per jaar moet plaatsvinden. Deze controles dienen eens in de 3 jaar aangevuld te worden met spirometrie.
Global Initiative For Chronic Obstructive Lung Disease (GOLD)
De werkgroep onderstreept het belang van geregelde monitoring, maar geeft geen aanbevelingen voor een frequentie.
Samenvatting
De frequentie van monitoring bij COPD wordt niet met onderzoek onderbouwd of niet genoemd in (inter)nationale richtlijnen. De controlefrequentie bij COPD berust (inter)nationaal op consensus.
Monitoringsinstrumenten
Naar Samenvatting ›- Tijdens een monitoringsconsult komen veel onderwerpen aan bod. Een monitoringsinstrument kan helpen het gesprek te structureren en zelfmanagement te bevorderen.
- Hiertoe kan gebruik worden gemaakt van eenvoudige monitoringsinstrumenten zoals de MRC en de CCQ; of van een uitgebreider monitoringsinstrument zoals de Ziektelastmeter COPD (zie CAHAG screeningsinstrumenten).
Algemeen
De meeste monitoringsinstrumenten bestaan uit een vragenlijst die de patiënt invult, al of niet aangevuld met spirometrie of andere gegevens. Er zijn vragenlijsten ontwikkeld om de ernst van de ziekte in te schatten, de invloed van de ziekte op symptomen en beperkingen te meten en het effect van de behandeling te evalueren. Verschillende vragenlijsten worden regelmatig gebruikt als ziektemonitor of zijn er onderdeel van (voor het downloaden van de vragenlijsten zie CAHAG).
Een voordeel van het gebruik van monitoringsinstrumenten is het integrale overzicht van verschillende aspecten van de ziekte. Naast lichamelijke aspecten worden ook psychische, sociale en emotionele aspecten systematisch in kaart gebracht. Artsen onderschatten vaak de mate van beperkingen en het niveau van de klachten van hun patiënten. Een praktisch voordeel is dat de patiënt een of meer vragenlijsten voorafgaand aan het consult kan invullen. Door de behandeling af te stemmen op de ervaren beperkingen en klachten, en niet uitsluitend op de longfunctie, is het aannemelijk dat de tevredenheid van patiënt en dokter over de behandeling toeneemt. Patiënten die tevreden zijn over de behandeling zijn eerder geneigd adviezen op te volgen en medische hulp te zoeken bij verergering van de klachten. Een mogelijk nadeel van het gebruik van een monitoringsinstrument is dat de zorg als onpersoonlijk zou kunnen worden ervaren, indien deze niet gepaard gaat met een aanvullend gesprek. Bovendien kunnen niet alle patiënten vragenlijsten even goed invullen als gevolg van een taalbarrière, laaggeletterdheid of lage gezondheidsvaardigheden. Een monitoringsinstrument is een hulpmiddel en levert daardoor niet altijd de kennis en inzichten van een gedegen afgenomen systematische anamnese met interesse voor de beleving van de patiënt op verschillende terreinen waarop kan worden doorgevraagd.
In de literatuur werden geen directe onderlinge vergelijkingen van monitoringsinstrumenten gevonden. In een overzichtsartikel worden 21 monitoringsvragenlijsten besproken aan de hand van 12 kwaliteitsvereisten door een expertgroep. Alle vragenlijsten voldeden voor wat betreft het in kaart brengen van de lichamelijke beleving. De meeste kunnen door de patiënt zelf en betrekkelijk snel (< 10 minuten) worden ingevuld. Het merendeel brengt het beloop in tijd in kaart en de scores kunnen meestal gemakkelijk worden berekend. Daarentegen vraagt het merendeel van de vragenlijsten niet naar de emotionele beleving en een deel brengt evenmin de psychologische beleving of sociale aspecten in kaart.
Veelgebruikte vragenlijsten
- MRC: de Medical Research Council-score (MRC-scorebereik 0-5) is een veelgebruikte methode om de mate van functionele beperkingen door dyspneu in 5 gradaties te scoren. De MRC-score correspondeert goed met andere kwaliteit-van-leven-instrumenten bij patiënten met verschillende ernststadia van COPD.
- mMRC: dit is een aangepaste versie van de MRC. Het verschil is dat de eerste vraag (‘Ik heb geen last van kortademigheid’) vervalt en de score van de andere vragen met 1 punt is verlaagd (mMRC-scorebereik 0-4).
- CCQ: met de Clinical COPD Questionnaire (CCQ) wordt in 10 vragen de ziektegerelateerde gezondheidstoestand beoordeeld op 3 domeinen: symptomen, functionele en mentale status. De CCQ is gevalideerd voor gebruik op groeps- en individueel niveau.
- RIQ-MON10: de Respiratory Illness Questionnaire-Monitoring bevat 10 vragen over 4 domeinen: fysieke en mentale klachten, fysieke en sociale beperkingen. Het instrument meet vooral de door de patiënt ervaren last van de aandoening. De lijst is ontworpen voor volwassen eerstelijnspatiënten met respiratoire aandoeningen. De RIQ-MON10 is gevalideerd op basis van 2 follow-uponderzoeken.
- CAT: de COPD Assessment Test is een veelgebruikte (online) vragenlijst naar de ziektegerelateerde kwaliteit van leven die bestaat uit 8 vragen met een score van 0 tot 5 (scorebereik 0-40).
- SGRQ: de St. George’s Respiratory Questionnaire is een (online) vragenlijst met 53 vragen in 2 secties met verschillende vraagcategorieën. Iedere vraag heeft een gewogen score, resulterend in een totale score van 0-100 (hoger is slechter). Een daling van de score met 4 punten is geassocieerd met een enigszins effectieve behandeling, een daling van 8 punten met een redelijk effectieve behandeling en daling van 12 punten met een zeer effectieve behandeling.
- TDI: de Transition Dyspnea Index meet veranderingen in dyspneu met 24 vragen op 3 domeinen. De score loopt van –9 tot +9 (lager is ernstiger). Het klinisch minimaal relevante verschil (MICD) is ≥ 1.
Ziektelastmeter COPD (ABC-tool)
Achtergrond
De Ziektelastmeter COPD is ontwikkeld aan de Universiteit van Maastricht onder auspiciën van de Long Alliantie Nederland als monitoringsinstrument van de gezondheidstoestand van patiënten met COPD. De ziektelastmeter bestaat uit een aantal parameters zoals longfunctie, longaanvallen, BMI, comorbiditeit, rookstatus en lichamelijke activiteit, en bevat een vragenlijst die grotendeels is gebaseerd op de CCQ. De ziektelastmeter omvat 11 domeinen, waaronder symptomen, functionele status, mentale status, vermoeidheid en emoties. Daarmee wordt de integrale gezondheidstoestand in beeld gebracht, wat de voorlichting aan de patiënt en het gesprek met de zorgverlener vergemakkelijkt. De verschillende aspecten van de ziekte worden geobjectiveerd door ze te visualiseren als gekleurde ballonnen. Via een behandelalgoritme(mede gebaseerd op deze NHG-Standaard en op de NVALT-richtlijn leidt dit tot behandeladviezen die de patiënt en de zorgverlener kunnen bespreken Zij kunnen dan gezamenlijk besluiten over een behandelplan dat is opgesteld in termen die de patiënt zelf formuleert.
Uitgangsvraag
Is het gebruik van de ziektelastmeter COPD (I) in vergelijking met gebruikelijke zorg (C) aan te bevelen bij patiënten met COPD (P)?
Uitkomstmaten (geselecteerd door de werkgroep)
- Ziektegerelateerde kwaliteit van leven (cruciaal)
- Patiënttevredenheid over zorg (cruciaal)
- Longaanvallen (cruciaal)
- Longfunctie (belangrijk)
Om deze vraag te beantwoorden werd een clustergerandomiseerde trial gebruikt waarin de ziektelastmeter werd vergeleken met gebruikelijke zorg.
Resultaten
Beschrijving onderzoek
De clustergerandomiseerde trial includeerde 357 COPD-patiënten (≥ 40 jaar, FEV1/FVC < 0,7) in 39 huisartsenpraktijken en 17 ziekenhuizen. De follow-upduur was 18 maanden. Deelnemers in de interventiegroep (n = 146) hadden in deze periode ten minste 4 controleconsulten bij huisarts, praktijkondersteuner, verpleegkundig specialist of longarts. Bij ieder consult werd de Ziektelastmeter COPD gebruikt. De controlegroep (n = 148) kreeg gebruikelijke zorg, zonder ziektelastmeter. De primaire uitkomst was verbetering van de ziektegerelateerde kwaliteit van leven, gedefinieerd als het aantal patiënten met na 18 maanden een verbetering van 4 punten op de SGRQ (scorebereik 0-100, hoger is slechter). Een stijging met 4 punten is geassocieerd met een minimaal klinisch relevante verbetering. Secundaire uitkomsten waren de absolute score op de SGRQ, de score op de 8-item CAT (scorebereik 0-40, hoger is slechter) en de tevredenheid over de zorg gemeten met de Patient Assessment of Chronic Illness Care (PACIC; scorebereik 0-5; hoger is beter).
Kwaliteit van bewijs
De kwaliteit van het bewijs was laag tot redelijk. Er werd afgewaardeerd vanwege risico op vertekening en onnauwkeurigheid van de resultaten.
Effectiviteit
Voor het GRADE-evidenceprofiel, zie Totstandkoming en methoden.
Ziektegerelateerde kwaliteit van leven
- En verbetering van de SGRQ-score met ≥ 4 punten na 18 maanden trad op bij 49 patiënten (33,6%) in de interventiegroep versus 33 patiënten (22,3%) in de controlegroep (OR 1,85; 95%-BI 1,08 tot 3,16).
- Geen verbetering of verslechtering na 18 maanden trad op bij 37% in de interventiegroep versus 38,5% in de controlegroep (OR en 95%-BI niet gerapporteerd).
- Een verslechtering van de SGRQ-score na 18 maanden trad op bij 29,4% in de interventiegroep versus 39,2% in de controlegroep (OR 0,64; 95%-BI 0,39 tot 1,04).
- De gemiddelde SGRQ-score daalde in 18 maanden van 39,7 naar 38,4 in de interventiegroep; in de controlegroep steeg de SGRQ-score van 36,2 naar 37,8 (p = 0,008).
- Na 18 maanden was er geen verschil tussen de groepen op de CAT (−0,26 punten; 95%-BI −1,52 tot 0,99; geschat minimaal klinisch relevant verschil > −2,0 tot −3,0 punten).
Patiënttevredenheid
Na 18 maanden was de PACIC-score in de interventiegroep gemiddeld 0,32 punten hoger dan in de controlegroep (95%-BI 0,14 tot 0,50).
Longaanvallen en longfunctie
Niet gerapporteerd.
Conclusie
- Gebruik van de Ziektelastmeter COPD kan resulteren in een beperkte tot niet klinisch relevante toename van ziektegerelateerde kwaliteit van leven (kwaliteit van bewijs laag tot redelijk).
- Bij gebruik van de Ziektelastmeter COPD zijn patiënten waarschijnlijk iets tevredener over de kwaliteit van de zorg (kwaliteit van bewijs redelijk).
- Het is onzeker wat de effecten zijn op longaanvallen en longfunctie.
Van bewijs naar aanbeveling
Voor- en nadelen
- Het gebruik van de Ziektelastmeter COPD heeft mogelijk enkele voordelen voor de ziektespecifieke kwaliteit van leven en de door de patiënt ervaren kwaliteit van zorg. Het is onduidelijk wat de effecten zijn op het optreden van longaanvallen en longfunctie.
- De ziektelastmeter kan de patiënt meer inzicht in en vat op de ziekte geven en de huisarts (en praktijkondersteuner) helpen een behandelplan op te stellen.
- Nadelen, zoals een mogelijk verkeerd behandeladvies door een verkeerde classificatie, zijn niet gemeten in het onderzoek.
Kwaliteit van bewijs
De effecten van de ziektelastmeter op een klinisch relevante verbetering van de gezondheidsstatus en kwaliteit van leven van COPD-patiënten zijn onzeker (kwaliteit van bewijs laag).
Waarden en voorkeuren van patiënten
De werkgroep schat in dat patiënten over het algemeen de mogelijke voordelen (beperkte winst in kwaliteit van leven) vinden opwegen tegen mogelijke nadelen (deze worden ingeschat als beperkt, maar zijn onzeker, want veelal niet gemeten).
Kosten
Er zijn geen gegevens bekend over de kosten van het gebruik van de Ziektelastmeter COPD. Wij hebben hiernaar geen systematisch literatuuronderzoek uitgevoerd. De werkgroep schat dat de kosten beperkt blijven tot de (extra) tijd die er tijdens het consult aan besteed moet worden, de implementatie en het eventueel inbouwen in het HIS of aanschafkosten. Er zijn software-omgevingen waarin de Ziektelastmeter COPD al aanwezig is.
Aanvaardbaarheid
Gebruik van de Ziektelastmeter COPD werd in een kwalitatief onderzoek door de samenstellers van de ziektelastmeter positief gewaardeerd door zowel artsen als patiënten. Of dit effect op lange termijn (meerdere jaren) blijvend is, is niet onderzocht. Mogelijk kunnen sommige patiënten het herhaaldelijk invullen onplezierig vinden. In het kwalitatieve onderzoek was dit na een follow-up van 18 maanden nog niet het geval. De werkgroep beschouwt de Ziektelastmeter COPD als een aanvaardbare interventie voor het merendeel van de patiënten en artsen.
Haalbaarheid
De Ziektelastmeter COPD maakt verschillende aspecten van de ziekte inzichtelijk voor de patiënt en maakt daardoor individueel aangepaste zorg beter mogelijk. Problemen zullen voornamelijk bestaan uit implementatieproblemen (in het HIS/KIS) en een eventuele extra belasting voor huisarts, praktijkondersteuner en patiënt. Omdat gezondheidsvaardigheden tussen patiënten verschillen, wordt geadviseerd regelmatig na te gaan of de patiënt goed in staat is de vragenlijsten in te vullen.
De Ziektelastmeter COPD kan voordelen bieden bij de transmurale overdracht, als zij ook in de tweede lijn wordt gebruikt.
Gelijkheid
Niet alle patiënten kunnen vragenlijsten even goed invullen door bijvoorbeeld een taalbarrière, laaggeletterdheid en lage gezondheidsvaardigheden.
Overige opmerkingen
Een mogelijk probleem op langere termijn is dat bij herziening van deze NHG-Standaard de aanbevelingen in het behandelalgoritme van de ziektelastmeter gaan afwijken van die in de standaard. Het is niet zeker of bij dergelijke wijzigingen de gevonden effecten nog steeds zouden bestaan, ook niet als de behandelalgoritmes in de ziektelastmeter navenant worden aangepast.
Afweging voor- en nadelen
De werkgroep denkt dat de mogelijke voordelen van het gebruik van de Ziektelastmeter COPD voor het merendeel van de patiënten opwegen tegen de nadelen. De voordelen zijn echter beperkt en het effect op 2 relevante uitkomstmaten is onzeker vanwege gebrek aan gegevens. De ziektelastmeter kan wel meerwaarde hebben om de communicatie met een patiënt beter te structureren. Er is in dat opzicht meer evidence voor de Ziektelastmeter COPD dan voor de gangbare monitoringsinstrumenten.
Rationale
- Op grond van de huidige evidence valt geen eenduidig advies te formuleren over het gebruik van de Ziektelastmeter COPD met als doel de ziektegerelateerde kwaliteit van leven, patiënttevredenheid over zorg, aantal longaanvallen of longfunctie te verbeteren.
- Gebruik van een monitoringsinstrument zoals de ziektelastmeter heeft echter geen grote nadelen. Het instrument kan naar behoefte worden ingezet om de patiënt meer inzicht in en vat op zijn ziekte te geven en het kan huisarts en praktijkondersteuner helpen een behandelplan op te stellen en de communicatie indien nodig beter te structureren.
Aanbeveling (neutrale aanbeveling)
Tijdens een controleconsult komen veel onderwerpen aan bod. Een monitoringsinstrument kan dan helpen om het gesprek te structureren en zelfmanagement te bevorderen. De Ziektelastmeter COPD kan gebruikt worden als monitoringsinstrument bij controleconsulten.
Nijmegen Clinical Screening Instrument (NCSI)
Methode
In een observationeel onderzoek in 5 huisartsenpraktijken werden praktijkondersteuners getraind in het Nijmegen Clinical Screening Instrument (NCSI), een internetvragenlijst die ook in de tweede lijn wordt gebruikt. Van de 180 uitgenodigde patiënten vulden er 134 (74%) de vragenlijst in, waarna de praktijkondersteuner de ziektetoestand met hen besprak aan de hand van een visuele weergave (patiëntenprofielkaart) op 21 items in 8 subdomeinen. Op voorhand schatten de praktijkondersteuners dat 81,3% van de patiënten een lichte ziektelast had, 17,6% een matige en 1,1% een ernstige.
Resultaten
Het percentage patiënten met ernstige problemen varieerde per subdomein van de NCSI, van 21% (tevredenheid met relatie en sociale contacten) tot 65% (algemene kwaliteit van leven). Meer dan de helft ervoer ernstige problemen in ≥ 3 van de 8 subdomeinen.
In focusgroepen van praktijkondersteuners en patiënten werd de methode positief geëvalueerd, met name doordat de invloed van de ziekte op verschillende terreinen visueel inzichtelijk werd.
Conclusie
Dit onderzoek bevestigt de indruk dat praktijkondersteuners de ziektelast onderschatten, vermoedelijk doordat zij uitgaan van de vroegere GOLD-classificatie, waarin de FEV1 gold als belangrijkste criterium voor de ziektelast.
Of de NSCI-methode geschikt is voor gebruik in de huisartsenpraktijk kan op grond van dit onderzoek niet worden aangegeven, vanwege de beperkte omvang en het ontbreken van een vergelijking op klinische uitkomstmaten met een controlegroep die gebruikelijke zorg kreeg zonder NCSI.
Spirometrie
Naar Samenvatting ›- Verricht zo nodig spirometrie (zie tabel 10).
- Instrueer de patiënt op de dag van de spirometrie de eigen medicatie op de gebruikelijke manier te nemen.
| Frequentie | Gestandaardiseerde bronchusverwijding | Interpretatie |
|---|---|---|
|
Lichte ziektelast:†
Verhoogde ziektelast:†
|
Alleen geïndiceerd bij:
|
Daling van de FEV1 met gemiddeld ≤ 35 ml per jaar gedurende ≥ 3 jaar (≥ 3 metingen) is fysiologisch Bij niet-fysiologische daling: ga oorzaak na en pas beleid aan |
| * Voor spirometrie in de diagnostische fase, zie tabel 3. † Voor ziektelast zie tabel 5. Bij afwezigheid van jaarlijkse spirometrie kan uitgegaan worden van de laatst gemeten waarden. |
||
Consultatie en verwijzing
Naar Samenvatting ›Verwijs naar of consulteer een longarts, of consulteer een kaderhuisarts, bij:
- twijfel aan de diagnose, bijvoorbeeld bij discrepantie tussen de ernst van de klachten en objectieve bevindingen (lichamelijk onderzoek en spirometrie)
- blijvende twijfel tussen COPD en hartfalen
- COPD ≤ 50 jaar;
- snel progressief beloop:
- toename dyspneu, afname inspanningsvermogen, daling van FEV1 met gemiddeld > 150 ml per jaar gedurende ≥ 3 jaar (≥ 3 metingen) ondanks maximale behandeling
- FEV1 > 50% van de voorspelde waarde en saturatie in rust < 90%
- FEV1 < 50% van de voorspelde waarde of < 1,5 l ondanks optimale behandeling
- blijvend verhoogde ziektelast:
- blijvende klachten, hinder en beperkingen (CCQ ≥ 2, MRC ≥ 3) ondanks optimale behandeling
- verminderde voedingstoestand of ongewenst gewichtsverlies COPD (zie Voedingstoestand)
- ≥ 2 longaanvallen per jaar waarvoor behandeld is met orale corticosteroïden, ondanks duo- of tripletherapie
- complexe comorbiditeitof ernstige problemen op meerdere subdomeinen (vraag de longarts of de patiënt in aanmerking komt voor longrevalidatie)
- werkgerelateerde problemen of belemmeringen (betrek hierbij de bedrijfsarts)
- psychosociale problemen of problemen met het omgaan met de ziekte (ook naar poh ggz/GGZ).
Beleid bij longaanval COPD
Naar Samenvatting ›ABCDE instabiel
Naar Samenvatting ›Handel als de patiënt ABCDE instabiel is (cyanose, bewustzijnsdaling, uitputting) als volgt:
- Bel een ambulance met directe inzet (A0/A1-urgentie).
- Geef zuurstof indien beschikbaar (zie NHG-Behandelrichtlijn Geneesmiddelen en zuurstof in spoedeisende situaties).
- Plaats de patiënt in zittende of voorovergebogen houding, probeer rust te creëren en patiënt gerust te stellen
- vernevel (met zuurstof en vernevelmasker) salbutamol 2,5-5,0 mg en ipratropiumbromide 0,5 mg, indien beschikbaar (zie NHG-Behandelrichtlijn Geneesmiddelen en zuurstof in spoedeisende situaties, Medicamenteuze behandeling van longaanval astma/COPD bij volwassenen en kinderen)
- indien geen vernevelapparatuur beschikbaar: per dosisaerosol met voorzetkamer salbutamol 100 microg (4-10 puffs) en ipratropium 20 microg (2-4 puffs), per keer 5 × inademen
- Breng een infuusnaald in, spuit door met ten minste 2 ml NaCl 0,9%.
- Overweeg, indien er voldoende tijd is, prednisolon 40 mg oraal of dexamethason 8-10 mg intraveneus/intramusculair (5 mg/ml, 2 ampullen van 1 ml). Dit heeft een lagere prioriteit dan het inbrengen van de infuusnaald.
- Wees alert op bijkomend hartfalen (zie NHG Standaard Hartfalen en NHG-Behandelrichtlijn Geneesmiddelen en zuurstof in spoedeisende situaties)
Onderzoek
In een cochranereview met 4 onderzoeken (n = 129) werd geconcludeerd dat parasympathicolytica eenzelfde verbetering van de FEV1 gaven als bèta-2-sympathicomimetica bij een longaanval COPD. In dezelfde review bleek een combinatie van beide middelen op korte termijn geen duidelijk voordeel te hebben (gewogen gemiddeld verschil na 90 minuten 0,02 l; 95%-BI –0,08 tot 0,12 l), en ook niet op lange termijn (gewogen gemiddeld verschil na 24 uur –0,05 l; 95%-BI –0,14 tot 0,05 l). Er bestaat onduidelijkheid over de optimale dosering en het gewenste interval tussen de toedieningen in relatie tot werkzaamheid en bijwerkingen. Een dosering van 800-1000 microg salbutamol (4-5 puffs van 200 microg) of een equivalente dosis van een ander bèta-2-sympathicomimeticum, toegediend via een dosisaerosol met inhalatiekamer (of een ruim 10 × zo hoge dosering via een vernevelaar), lijkt effectief en veilig bij een longaanval van COPD.
Er zijn nog onvoldoende publicaties over de effectiviteit van langwerkende bèta-2-sympathicomimetica (LABA) bij een acute longaanval van COPD om een uitspraak te doen over hun plaats bij de behandeling van een longaanval.
Conclusie
Bij een longaanval zijn kortwerkende parasympathicolytica (SAMA) en bèta-2-sympathicomimetica (SABA) even effectief.
Overwegingen
Bij een acute longaanval is ter directe bestrijding van (ernstige) acute dyspneuklachten afhankelijk van de ernst en de beschikbare toedieningswijze een parasympathicolyticum (SAMA), een bèta-2-sympathicomimeticum (SABA) of een combinatie van beide geïndiceerd. Als er geschikte vernevelapparatuur beschikbaar is, heeft een combinatiepreparaat om praktische redenen de voorkeur boven separaat toedienen van de middelen. Het doel is om bij zeer ernstige longaanvallen of instabiliteit een mogelijk additioneel effect te bereiken, ondanks gebrek aan evidence. Het (geringe) risico op bijwerkingen weegt op tegen de mogelijke meerwaarde. Een SABA werkt sneller dan een SAMA, na 90 minuten is er geen verschil (zie boven).
Aanbeveling
Dien (een) kortwerkende luchtwegverwijder(s) toe bij een longaanval ter bestrijding van dyspneu.
ABCDE stabiel
Naar Samenvatting ›Richtlijnen diagnostiek
Naar Samenvatting ›- Stel de diagnose ‘longaanval COPD’ bij een acute verslechtering met toename van dyspneu en hoesten, al of niet met slijm opgeven, die groter is dan de normale dag-tot-dagvariabiliteit (differentiaaldiagnose: cardiale oorzaak, pneumonie, longembolie).
- Maak onderscheid tussen een ernstige en een minder ernstige longaanval.
- Ga de oorzaak van de longaanval na (medicatie niet gebruikt, infectie, allergie of andere oorzaak).
Ernstige longaanval COPD
Naar Samenvatting ›- Er is een ernstige longaanval bij ≥ 1 van de volgende criteria:
- (toename van) dyspneu in rust, moeite met uitspreken van een hele zin, niet plat kunnen liggen
- hoge ademarbeid (hoge ademfrequentie of gebruik van hulpademhalingsspieren)
- versnelde hartslag (> 100/min)
- zuurstofsaturatie < 92%, tenzij patiënt bekend is met lagere saturatiewaarden
- Als al deze criteria afwezig zijn of bij een snelle verbetering na inhalatiemedicatie, is er een minder ernstige longaanval.
Richtlijnen beleid bij ernstige longaanval
Naar Samenvatting ›Beslis bij een ernstige longaanval of behandeling thuis mogelijk is dan wel in de tweede lijn noodzakelijk is (A2-indicatie).
Initiële behandeling tijdens consult of visite
Naar Samenvatting ›- Geef:
- salbutamol en bij onvoldoende verbetering ipratropium per dosisaerosol met voorzetkamer, of salbutamol en ipratropiumbromide
- met vernevelapparatuur (zie NHG-Behandelrichtlijn Geneesmiddelen en zuurstof in spoedeisende situaties, tabel 11).
Beleid bij verbetering
Naar Samenvatting ›- Geef een orale kuur prednisolon gedurende 5 dagen; afhankelijk van verbetering bij controle verlengen tot maximaal 14 dagen.
- Verhoog de dosering luchtwegverwijders gedurende de eerste 24 uur (bijvoorbeeld dubbele dosis) en/of pas de toedieningsvorm aan (let op de juiste inhalatietechniek).
- Overweeg gebruik van een dosisaerosol met voorzetkamer in plaats van poederinhalatie.
- Geef antibiotica (voor de keuze, zie NHG-Standaard Acuut hoesten):
- bij infectieverschijnselen (> 38 °C, algemeen ziek zijn, veranderd hoestpatroon, veranderd sputum)
- aan kwetsbare patiënten, bijvoorbeeld met een reeds bekende ernstige bronchusobstructie
- bij een voorgeschiedenis van ernstige longaanvallen waarbij steeds antibiotica nodig waren.
- Controleer bij voorkeur de volgende dag (zie verder Controle en follow-up).
Achtergrond
Een stootkuur prednis(ol)on bij een longaanval COPD is een effectieve behandeling die kan zorgen voor sneller herstel en minder recidieven. Gebruik van prednis(ol)on bij COPD kan ook leiden tot bijwerkingen zoals hypertensie, diabetes mellitus, bijniersuppressie en osteoporose. De kans op bijwerkingen neemt toe als de frequentie van kuren en cumulatieve dosis van het gebruik toenemen.
Tot nu toe is de aanbeveling om bij een longaanval COPD 40 mg prednis(ol)on voor te schrijven gedurende 5 dagen en die op geleide van de kliniek eventueel te verlengen tot in totaal 7-14 dagen, of als alternatief 30 mg prednis(ol)on gedurende 7 dagen. Mogelijk is verlenging zelden nodig en kan vaak volstaan worden met een korte stootkuur van 5 dagen.
Uitgangsvraag
Is een korte prednis(ol)onkuur van 5-7 dagen even effectief als een langere kuur van 10-14 dagen bij een longaanval COPD in de eerste lijn?
Cruciale en belangrijke uitkomstmaten
- Behandelfalen (noodzaak van ziekenhuisopname of extra behandeling, respiratoire insufficiëntie)
- Recidief longaanval na afloop van de behandeling
- Longfunctie
- Dyspneu
- Mortaliteit
- Bijwerkingen; hypertensie, hyperglycemie, bijnierschorsinsufficiëntie, oedeem
Methode
Als uitgangspunt is een cochranereview genomen. Aanvullend is in oktober 2018 een systematische literatuursearch uitgevoerd naar RCT’s en SR’s verschenen na de sluitingsdatum van de zoekactie in deze review.
Resultaten
Resultaten zoekactie
In de cochranereview werden 8 onderzoeken (n = 582) geïncludeerd. Van 3 onderzoeken waren geen gegevens beschikbaar, daarom zijn slechts 5 onderzoeken gebruikt voor kwantitatieve analyse. De aanvullende zoekactie leverde geen aanvullende literatuur op.
Beschrijving onderzoeken
Walters 2018 includeerde 5 RCT’s (n = 519), uitgevoerd bij COPD-patiënten in tweede- en derdelijnscentra en gepubliceerd tussen 1997 en 2013. De gemiddelde leeftijd was 65-73 jaar. In 3 onderzoeken was inclusie gebaseerd op een definitie van COPD of een afkapwaarde van FEV1, in 2 onderzoeken was inclusie gebaseerd op een definitie van een longaanval op basis van symptomen.
In deze 5 onderzoeken werd een korte stootkuur (3-7 dagen) vergeleken met een lange stootkuur (10-14 dagen). In de meeste onderzoeken kregen patiënten (deels) orale behandeling met prednis(ol)on, waarbij de korte kuur gevolgd werd door een placebo. Wel werd soms standaard antibiotica gegeven.
De meeste auteurs rapporteerden als uitkomstmaat de longfunctie, het optreden van een recidief longaanval en een symptoomscore voor onder andere dyspneu.
Kwaliteit van bewijs
De kwaliteit van bewijs varieerde van zeer laag tot redelijk. Voor verschillende uitkomsten werd afgewaardeerd vanwege onnauwkeurigheid, onvoldoende blindering, hoge uitval en heterogeniteit.
Conclusie
De optimale duur van de behandeling van een longaanval COPD met een stootkuur prednis(ol)on is onzeker (kwaliteit van bewijs laag).
Van bewijs naar aanbeveling
De kwaliteit van bewijs is laag tot redelijk, onderzoeken in de eerste lijn ontbreken. Er zijn echter aanwijzingen dat een korte kuur van ongeveer 5 dagen niet minder effectief is dan een langere kuur. Een zo kort mogelijke kuur heeft de voorkeur om het risico op bijwerkingen te minimaliseren. Uitsluipen had geen meerwaarde in onderzoek bij patiënten met astma. Dergelijke onderzoeken zijn, voor zover bekend, niet uitgevoerd bij patiënten met COPD. De werkgroep is daarom van mening dat de huisarts een zo kort mogelijke kuur moet nastreven, die eventueel op geleide van het klinisch beeld verlengd kan worden.
Keuze tussen prednisolon versus prednison
Er zijn 2 redenen om de voorkeur te geven aan prednisolon boven prednison:
- prednison is farmacologisch inactief en pas werkzaam na omzetting in prednisolon
- bij hoge doseringen is prednisolon patiëntvriendelijker omdat voor de inname van de benodigde hoeveelheid prednison een grotere hoeveelheid tabletten nodig is
Dosering
In de cochranereview zijn verschillende behandelduren met elkaar vergeleken, maar geen verschillende doseringen. In de praktijk wordt zowel de dosering prednisolon 30 mg als de dosering prednisolon 40 mg gebruikt. Er is geen evidence beschikbaar die de keuze voor één van deze doseringen ondersteunt. Om die reden is ervoor gekozen om in aansluiting bij de NVALT-richtlijn Diagnostiek en behandeling COPD-longaanval in het ziekenhuis en conform het GOLD-advies een dosering van 40 mg te adviseren.
Aanbevelingen
- Geef bij een ernstige longaanval oraal prednisolon 40 mg 1 dd gedurende 5 dagen.
- Overweeg verlenging van de kuur bij onvoldoende effect tot in totaal 10 (maximaal 14) dagen.
In een cochranereview met 16 onderzoeken (n = 2068, in de analyse is onderscheid gemaakt tussen eerstelijns-, tweedelijns- en IC-populaties) werd de effectiviteit van antibiotica versus placebo onderzocht bij patiënten met een longaanval COPD. Bij patiënten in de eerste lijn (lichte tot matige longaanvallen) bleek gebruik van antibiotica het risico op behandelfalen binnen een maand te reduceren ten opzichte van placebo, maar wanneer werd gekeken naar de momenteel beschikbare medicatie werd dit effect niet gevonden. Bij ziekenhuispatiënten met een ernstige longaanval bleken antibiotica wel effectief met betrekking tot vermindering van behandelfalen. Bij ziekenhuispatiënten werd geen verschil in mortaliteit gezien, bij IC-patiënten was dit verschil er wel. Bij patiënten die met antibiotica werden behandeld kwamen meer bijwerkingen voor, met name diarree.
Bij 152 eerstelijnspatiënten met licht tot matig COPD uit de placeboarm van een RCT waarin amoxicilline/clavulaanzuur vergeleken werd met placebo, bleek CRP (naast purulent sputum) de enige factor geassocieerd met een ongunstige uitkomst (CRP 40 mg/l; OR 13,4; 95%-BI 4,6 tot 38,8). Bij aanwezigheid van beide items was de waarschijnlijkheid van falen zonder antibioticum 63%.
Overwegingen
Omdat matig tot ernstig zieke patiënten het meeste baat hebben bij antibiotica, wordt aanbevolen de behandeling van een longaanval met antibiotica te reserveren voor patiënten met ernstig COPD of met klinische infectieverschijnselen (temperatuur > 38 °C of algemeen ziekzijn). Omdat onderzoek naar de behandeling van een longaanval van COPD met klinische infectieverschijnselen ontbreekt, worden de richtlijnen van de Stichting Werkgroep Antibiotica Beleid (SWAB) voor behandeling van een in de bevolking opgelopen pneumonie gehanteerd.
Er is geen overtuigend bewijs dat Haemophilus influenzae en Moraxella catarrhalis bij COPD vaak de oorzaak van een pneumonie zijn, de behandeling hoeft daarom niet specifiek op deze verwekkers gericht te zijn. In Nederland was anno 2013 de resistentie van Streptococcus pneumoniae en H. influenzae voor amoxicilline of doxycycline laag (< 15% bij patiënten die opgenomen zijn in verband met een pneumonie), maar tegen ciprofloxacine, claritromycine en cotrimoxazol bestond hoge resistentie.
De keuze van antibioticum is empirisch en wordt mede bepaald door de vraag of ambulante behandeling mogelijk is.
Bij de inschatting of ambulante behandeling mogelijk is, zijn de volgende risicofactoren voor een ernstig beloop van belang:
- leeftijd ≥ 65 jaar
- ademhalingsfrequentie ≥ 30/min
- systolische bloeddruk < 90 mmHg
- desoriëntatie in tijd, plaats of persoon
- nierfunctiestoornis en/of risico op een Legionella-infectie.
Er is veel variatie in voorschrijfbeleid bij een longaanval van COPD. Gemiddeld krijgt 73% van de patiënten bij een ernstige longaanval prednisolon in combinatie met een antibioticumkuur. Bij 55% is sprake van een gelijktijdige start, 10% krijgt eerst een antibioticum en dan prednison, 8% krijgt eerst prednison en vervolgens een antibioticum.
Onnodig voorschrijven van antibiotica bij een longaanval van COPD komt frequent voor. De chronische inflammatie bij COPD leidt slechts tot een zeer beperkte verhoging van het CRP (< 20 mg/l) die in het algemeen alleen bepaald kan worden met high sensitivity-CRP. Bij gebrek aan gegevens lijkt een CRP-bepaling tijdens een COPD-longaanval zinvol bij patiënten met lichte of matige obstructie bij wie de huisarts twijfelt over de noodzaak van een antibioticum, en dan vooral om onnodig voorschrijven van een antibioticum te voorkomen. Geadviseerd wordt hierbij de afkapwaarden van de NHG-Standaard Acuut hoesten te hanteren.
Er is onvoldoende onderzoek naar de optimale duur van de antibioticakuur. Een duur van 7-10 dagen is gebruikelijk.
Aanbeveling
De werkgroep is van mening dat voor de keuze van een antibioticum het best aangesloten kan worden bij de NHG-Standaard Acuut hoesten.
Verwijzing
Naar Samenvatting ›Verwijs (A2) een patiënt met een ernstige longaanval:
- als na de inhalaties geen verbetering optreedt;
- bij onvoldoende zorgmogelijkheden thuis;
- bij ernstige interfererende comorbiditeit;
- bij risicofactoren voor een ernstig beloop:
- leeftijd ≥ 65 jaar
- fors verhoogde ademhalingsfrequentie
- beloop bij eerdere ziekenhuisopname.
Richtlijnen beleid minder ernstige longaanval
Naar Samenvatting ›Bij een minder ernstige longaanval is er duidelijk toegenomen dyspneu maar ontbreken criteria voor een ernstige longaanval.
Behandeling
Naar Samenvatting ›- Verhoog de dosering luchtwegverwijders gedurende de eerste 24 uur (bijvoorbeeld dubbele dosis) en/of pas de toedieningsvorm aan (let op de juiste inhalatietechniek).
- Bepaal bij het eerste consult of na herbeoordeling of behandeling met prednis(ol)on nodig is (orale kuur gedurende 5 dagen, afhankelijk van verbetering te verlengen tot maximaal 14 dagen). Dit is afhankelijk van de mate van dyspneu
- Maak een controleafspraak.
Controle en follow-up na een longaanval
Naar Samenvatting ›- Evalueer klachten en ervaren beperkingen.
- Onderzoek zo nodig de longen.
- Let op therapietrouw en inhalatietechniek; stel eventueel het beleid bij.
- Maak in een vervolgafspraak een (kort) longaanval-actieplan (zie Zelfmanagement bij longaanvallen). Doel is longaanvallen te voorkomen of in een zo vroeg mogelijke fase te onderbreken.
- Overweeg ICS bij frequente ernstige longaanvallen (≥ 2 per jaar).
- Besteed aandacht aan uitlokkende factoren en aan comorbiditeit
- Bespreek het belang van bewegen en overweeg verwijzing naar een fysiotherapeut (zie Bewegen).
- Geef geen onderhoudsbehandeling met antibiotica ter preventie van een longaanval (zie Orale corticosteroïden).
|
Geneesmiddel |
Dosering |
Werkingssnelheid/-duur |
|
Salbutamol |
Volwassene: 100 microg (= 1 puf) per keer in voorzetkamer, 5 maal inademen, herhaal 4-10 keer |
Binnen 5 minuten |
|
Kind:
|
||
|
inhalatievloeistof: |
Volwassene en kind ≥ 5 jaar: |
|
|
Kind < 5 jaar: |
||
|
Ipratropiumbromide |
Volwassene: |
Binnen 15 minuten |
|
inhalatievloeistof |
Volwassene en kind ≥ 5 jaar: |
|
|
Kind < 5 jaar: |
||
|
Prednisolon |
Volwassene: |
Na enige uren |
|
Kind:
|
||
|
Dexamethason |
Volwassene: |
Na enige uren |
|
* Geef 6 tot 8 liter zuurstof/minuut om de (minimaal 4 ml) vloeistof in de vernevelkamer te vernevelen (vul eventueel aan met fysiologisch zout). De vernevelkamer kan worden aangesloten op een vernevelmasker. |
||
Organisatie van de zorg
Naar Samenvatting ›Zorggroep
Naar Samenvatting ›- De zorg voor patiënten met COPD wordt in een aantal huisartsenpraktijken geleverd als ketenzorgprogramma met betrokkenheid van andere zorgverleners, zoals fysiotherapeut, diëtist, apotheek en (consultatie van) de longarts.
- Een deel van de zorg, zoals voorlichting, hulp bij stoppen met roken, spirometrie, inhalatie-instructie en monitoring, kan worden gedelegeerd aan een praktijkondersteuner.
Actieve opsporing
Naar Samenvatting ›- Overweeg (case-finding) diagnostiek naar COPD bij (ex)rokers, vooral bij klachten en/of recidiverende luchtweginfecties (> 1 per jaar).
- Gebruik desgewenst de COPD-risicotest bij patiënten met lage gezondheidsvaardigheden.
Om de (verwachte) toename van patiënten met ernstig COPD te verminderen lijkt het voor de hand te liggen de aandoening in een vroeg stadium op te sporen in de huisartsenpraktijk, bijvoorbeeld bij patiënten met risicofactoren voor COPD die met een willekeurige klacht bij de huisarts komen (case-finding).
Het aantal bekende patiënten met COPD in de Nederlandse huisartsenpraktijk is lager dan de in onderzoek gevonden prevalentie. In de Tweede Nationale Studie was de prevalentie van COPD in de huisartsenpraktijk 2%. Er zijn naar schatting 2 × zo veel patiënten met een verminderde longfunctie dan dat er gediagnosticeerde COPD-patiënten zijn. In de literatuur wordt een aantal factoren genoemd die de discrepantie tussen de werkelijke en de gemeten prevalentie zouden kunnen verklaren: er worden in de praktijk te weinig spirometrieën uitgevoerd, de diagnoses ‘COPD’ en ‘astma’ worden te vaak verwisseld en ten slotte blijken patiënten met COPD de dokter niet gemakkelijk te bezoeken, omdat zij zich vaak schuldig voelen vanwege een ziekte die door eigen toedoen is veroorzaakt.
Er zijn in 2012 in de Nederlandse huisartsenpraktijk 2 onderzoeken gedaan naar de opbrengst en haalbaarheid van actieve opsporing van COPD. Onder de noemer ‘Preventieconsult COPD’ werden personen van 40-70 jaar aangeschreven die niet bekend waren met astma of COPD. In het eerste onderzoek werd de effectiviteit van dit vroege-opsporingsprogramma onderzocht met de Respiratory Health Screening Questionnaire (RHSQ). Deze internationaal gevalideerde vragenlijst is verstuurd naar ruim 10.000 patiënten van 16 huisartsenpraktijken in Nederland. Personen met een verhoogd risico op basis van de RHSQ werden vervolgens opgeroepen voor spirometrie. In een geclusterde onderzoeksopzet werden 2 strategieën vergeleken. In de ene strategie verzocht de praktijk patiënten de RHSQ in te vullen en daarna zelf contact op te nemen met de praktijk voor het uitrekenen van de risicoscore, een consult bij de huisarts en zo nodig spirometrie (bij hoog risico op COPD). In de andere strategie nam de praktijk het initiatief om de patiënt op te roepen voor de genoemde activiteiten. De strategie waarbij het initiatief bij de praktijk lag, bleek effectiever. In een standaardhuisartsenpraktijk (2350 patiënten) werden met deze strategie gemiddeld 9 nieuwe patiënten met COPD opgespoord (20% meer dan het gemiddelde van 47 al bekende patiënten met COPD), versus 3 nieuwe patiënten wanneer het initiatief bij de patiënt lag. In praktijkpopulaties met een gemiddeld lage sociaal-economische status (SES) werden meer patiënten met een hoog risico voor COPD gevonden (16%) dan in populaties met een wat hogere SES (9%). De meeste nieuw gedetecteerde patiënten met COPD in dit onderzoek waren actieve rokers. Bij ongeveer 30% van de patiënten die zich meldden met een hoog risico voor COPD op basis van de RHSQ werd ook feitelijk COPD door de huisarts vastgesteld.
In het tweede onderzoek werden de implementatiemogelijkheden van het Preventieconsult COPD in termen van werklast en kosten voor de praktijk onderzocht in 10 huisartsenpraktijken, waarvan 5 in een omgeving met een lage SES en 5 in een omgeving met een matig hoge SES. Het onderzoek duurde 3 maanden, waarbij per maand 1 leeftijdscohort werd opgeroepen. De respons in praktijken met een lage SES was beter dan in praktijken met een matig hoge SES (41% versus 31%). De extra werkbelasting was gemiddeld 18,5 uur per standaardpraktijk per 3 maanden (9,5 uur voor de assistent, 6 uur voor de praktijkondersteuner, 3 uur voor de huisarts). De gemiddelde kosten van deze extra werkzaamheden bedroegen 760 euro, de vergoeding voor de consulten en spirometrieën was 300 euro. Per praktijk bleef aldus een bedrag van 460 euro over aan (ongedekte) onkosten. De onkosten in een praktijk met lage SES (520 euro) waren gemiddeld hoger dan die in een praktijk met matig hoge SES (398 euro).
In een onderzoek werd bij 584 gezonde rokers (> 20 pakjaren) gekeken naar vroege symptomen en naar het succes van een stoppen-met-rokeninterventie. Na 2 jaar bezocht 93% de follow-upcontrole. Hierbij bleek dat 23% gestopt was met roken. Er waren 4 voorspellers voor succesvol stoppen met roken: positieve attitude, farmacotherapie, hogere leeftijd en hogere BMI. Factoren als hoesten, obstructie, geslacht, aantal pakjaren en nicotineafhankelijkheid bleken niet van invloed.
Overwegingen
Het is aan te bevelen om het Preventieconsult COPD in eerste instantie te richten op rokers, omdat er dan direct aanknopingspunten zijn voor de behandeling.
Op verzoek van de werkgroep in 2015 zijn bovenstaande data opnieuw bekeken, waarbij met name is gekeken of het zinvol is om subgroepen te onderscheiden op basis van rookgedrag en hoestklachten. Het percentage hoogrisicopatiënten bleek te verdubbelen van 12 naar 24% wanneer alleen de huidige rokers in het onderzoek betrokken werden. Werd hierna ook nog geselecteerd op patiënten met hoestklachten, dan steeg dit percentage verder van 24 naar 41%. Dit bevestigt eerder onderzoek, waaruit bleek dat roken en hoesten het meest discriminerend zijn bij vroege opsporing van COPD.
Conclusie
Er is bewijs dat actieve opsporing van COPD met een online vragenlijst bij patiënten > 40 jaar vanuit de huisartsenpraktijk (juist ook in praktijkpopulaties met een lage SES) werkzamer is dan opsporing waarbij het initiatief bij de patiënt ligt. Omdat echter de effectiviteit van de vervolgstappen (stoppen-met-rokeninterventie en preventie van ernstiger vormen van COPD) nog niet zijn onderzocht, is er onvoldoende onderbouwing voor een aanbeveling om alle patiënten van 40-70 jaar actief te benaderen met de COPD-risicotest.
| Criterium | Score | |
|---|---|---|
| Leeftijd | 40-49 jaar | 0 |
| 50-59 jaar | 4 | |
| 60-69 jaar | 8 | |
| Rookhistorie | 0-14 pakjaren* | 0 |
| 15-24 pakjaren* | 2 | |
|
25-49 pakjaren* |
3 | |
| ≥ 50 pakjaren* | 7 | |
| BMI | < 25, 4 kg/m2 | 5 |
| 25,4-29,7 kg/m2 | 1 | |
| Invloed van het weer op hoesten | Ja | 3 |
| Nee | 0 | |
| Slijm ophoesten bij afwezigheid van verkoudheid | Ja | 3 |
| Nee | 0 | |
| Gewoonlijk slijm ophoesten bij het opstaan | Ja | 0 |
| Nee | 3 | |
| Last van piepende ademhaling | Af en toe of vaker | 4 |
| Nee | 0 | |
| Last van allergieën nu of in het verleden | Ja | 0 |
| Nee | 3 | |
| * Uitgaande van 1 pakje (20 sigaretten) per dag. | ||
COPD-risicotest
De COPD-risicotest staat weergegeven in tabel 12. Bij een score > 20 is er sprake van een verhoogd risico op COPD en is verdere diagnostiek aangewezen. De test kan uitgevoerd worden door de praktijkassistente of praktijkondersteuner (zie NHG-Praktijkwijzer Preventieconsult COPD).
Herevaluatie van de diagnose ‘COPD’
Naar Samenvatting ›- Heroverweeg de diagnose ‘licht COPD’ op basis van een FEV1/FVC-ratio < 0,7. Dit criterium is vervallen.
- Bij niet-afwijkende spirometrie volgens de referentiewaarden van GLI 2012 (zie Referentiewaarden en interpretatie van spirometrie) vervalt de diagnose ‘COPD’ en bij afwezigheid van klachten, beperkingen en longaanvallen kan de monitoring gestaakt worden.
De nieuwe criteria voor de ernst van COPD in GLI 2012 hebben gezorgd voor een verschuiving in de ernstverdeling ten opzichte van GOLD 2014. Dit kan geïllustreerd worden aan de hand van een screeningsonderzoek naar longfunctieafwijkingen in de algemene bevolking (NHANES III). In tabel 13 staan de gegevens van personen > 30 jaar (n = 11.865) bij wie de ernst van luchtwegobstructie is bepaald volgens de critieria van GOLD 2014 en GLI 2012. Hieruit blijkt dat de stadia GOLD1 en GOLD2 om heroverweging vragen als GLI 2012 aangeeft dat er géén obstructie is; graderingen 3 en 4 behoeven geen heroverweging.
| GOLD 2014 | GLI 2012 | |||||
|---|---|---|---|---|---|---|
| Normaal | Licht | Matig | Ernstig | Zeer ernstig | ||
| 0 | Normaal | 9511 | 59 | 23 | 0 | 0 |
| 1 | Licht | 651 | 493 | 0 | 0 | 0 |
| 2 | Matig | 252 | 0 | 653 | 0 | 0 |
| 3 | Ernstig | 8 | 0 | 0 | 180 | 0 |
| 4 | Zeer ernstig | 1 | 0 | 0 | 0 | 34 |
Praktijkoverstijgende taken
Naar Samenvatting ›Zorg voor COPD-patiënten in de eerste lijn moet aan de volgende voorwaarden voldoen. Regionaal zijn er verschillen in aanpak mogelijk, afhankelijk van beschikbare expertise en de lokale situatie.
- Protocollaire opzet
- Aandacht voor een individueel zorgplan
- Sluitend afspraak- en oproepsysteem
- Adequate registratie van gegevens die worden verzameld bij periodieke controles in een huisarts- of ketenzorginformatiesysteem. Op basis van deze kernset van gegevens kunnen berekeningen worden gemaakt die tot indicatoren leiden.
- Structurele en aantoonbare samenwerking en afstemming van de zorg met praktijkondersteuner, longverpleegkundige, fysiotherapeut, apotheker, diëtist, longarts, kaderhuisarts en indien relevant bedrijfsarts
- Verzamelen van gegevens op basis van kwaliteitsinformatie (zoals de minimale dataset COPD) bij volwassenen
- Periodieke evaluatie van bovengenoemde aspecten
Aandachtspunten voor bespreking in de regio
Naar Samenvatting ›- Monitoring volgens de Zorgstandaard COPD
- Afspraken over consultatie van kaderhuisarts en longarts, verwijzing en terugverwijzing
- Hoofdbehandelaarschap, invulling van gedeelde zorg
- Inhoud van de gestructureerde verwijsbrief met duidelijke vraagstelling
- Longaanvalmanagement en regeling van spoedzorg in geval van acute ernstige kortademigheid
- Inhoud van terugrapportage met concrete adviezen over de behandelmogelijkheden door de huisarts indien de klachten toenemen
- Het delen van gegevens (bijvoorbeeld via keteninformatiesysteem) en wijze van informatie-uitwisseling bij:
- monitoring (beschrijving ziektelast volgens subdomeinen)
- tussentijdse wijzigingen
- longaanvallen
- individueel zorgplan
- Afspraken met andere betrokkenen:
- apothekers, over het uniformeren en regelmatig herhalen van de inhalatie-instructie, monitoring van het medicatiegebruik en eventueel een regionaal formularium
- medebehandelaars, zoals diëtisten en fysiotherapeuten
- zorgverzekeraars, over gedeelde zorg en keten-dbc
- thuiszorg en eventueel gespecialiseerde longverpleegkundigen vanuit de thuiszorg, die huisbezoeken kunnen afleggen
- Afstemming van voorlichtingsmateriaal in eerste en tweede lijn en schriftelijk actieplan
- Scholing en nascholing
- Transparantie van indicatoren
Samenwerking
Naar Samenvatting ›Zorgverleners
Naar Samenvatting ›Kaderhuisarts COPD (en astma)
Naar Samenvatting ›- De kaderhuisarts adviseert over het protocol COPD bij regionale zorggroepen en is te consulteren bij vragen (bijvoorbeeld discrepantie klachten en spirometrie).
- De kaderhuisarts onderneemt initiatieven om de behandeling van astma- en COPD-patiënten in de regio te verbeteren bijvoorbeeld volgens de NHG-boeken Protocollaire Zorg, door gestructureerd transmuraal overleg te stimuleren en door consultatie al dan niet op afstand mogelijk te maken via een diagnostisch centrum of via teleconsultatiefeedback door een longarts over een in de praktijk gemaakte spirometrie.
Praktijkondersteuner (poh)
Naar Samenvatting ›- Patiënten met COPD kunnen periodiek worden gezien door de poh, met adequate rapportage in het huisartsinformatiesysteem.
- De poh verricht spirometrie, brengt de 4 subdomeinen van de ziektelast in kaart, geeft voorlichting en niet-medicamenteuze adviezen, begeleidt stoppen met roken en geeft inhalatie-instructie.
- De poh biedt zo nodig hulp bij het aanvragen van voorzieningen, signaleert cognitieve, sociale en psychische problemen en en begeleidt deze.
- De poh maakt samen met de patiënt het longaanval-actieplan, ondersteunt zelfmanagement en kan daarbij ook gebruik maken van het individueel zorgplan.
- De poh heeft regulier overleg met de huisarts over het beleid en kan bij acute problemen op elk moment met de huisarts contact opnemen.
- De poh kan overleggen met de gespecialiseerd astma/COPD-longverpleegkundige.
- Ook bij verregaande taakdelegatie blijft de huisarts verantwoordelijk voor het medisch beleid.
Longarts COPD
Naar Samenvatting ›- Het is wenselijk dat elk ziekenhuis binnen de afdeling longziekten een vast aanspreekpunt heeft voor de eerste lijn , bijvoorbeeld een in COPD-gespecialiseerde longarts.
- Deze longarts neemt actief deel aan regionale transmurale overleggen en stimuleert up-to-date COPD-zorg volgens de vigerende richtlijnen in zowel de eerste als tweede lijn.
- Deze longarts organiseert bijscholing en opleiding naar behoefte van de eerste lijn.
Longverpleegkundige, physician assistant of verpleegkundig specialist voor COPD in de tweede lijn
Naar Samenvatting ›- De longverpleegkundige is een aanspreekpunt voor patiënten bij gedeelde patiëntenzorg
- De longverpleegkundige onderhoudt contacten met de poh (het is raadzaam binnen de huisartsenpraktijk een poh als vast aanspreekpunt aan te wijzen)
- De longverpleegkundige is aanwezig bij regionale transmurale overleggen en draagt bij aan scholing.
Apotheker
Naar Samenvatting ›- De apotheker is verantwoordelijk voor medicatiebewaking en begeleidt de patiënt bij het juist en veilig gebruik van zijn medicatie.
- De apotheker kan inhalatie-instructie geven en periodiek nagaan of de patiënt de inhalatie-medicatie juist gebruikt.
- De apotheker stemt met andere zorgverleners af welke zorgverlener de inhalatie-instructie uitvoert en op welk moment, rapporteert hierover in het apotheekinformatiesysteem en koppelt dit terug naar andere betrokken zorgverleners.
- De apotheker signaleert farmacotherapeutische problemen, begeleidt de patiënt daarbij en kijkt samen met de patiënt naar de best passende oplossing.
Samenwerkingsafspraken
Naar Samenvatting ›Spirometrie en ander aanvullend onderzoek
Naar Samenvatting ›- De huisarts heeft de keuze zelf spirometrie te verrichten en te interpreteren, of hierbij samen te werken met een ziekenhuis of eerstelijns diagnostisch centrum.
- Het diagnostisch centrum of ziekenhuis zorgt voor de uitvoering van de longfunctiemetingen of ander aanvullend onderzoek (CO-diffusiemeting, bodybox) en laat deze samen met klinische gegevens interpreteren door een kaderhuisarts of longarts. Een consult bij de longarts is hiervoor niet altijd noodzakelijk.
Hoofdbehandelaarschap
Naar Samenvatting ›- De longarts krijgt steeds meer een consulterende rol in de zorgketen waarbij de huisarts de regie voert.
- De longarts wordt (meer dan voorheen) direct toegankelijk voor de huisarts voor consultatie van medisch specialistische kennis.
- Om deze toegankelijkheid mogelijk te maken kan gebruik gemaakt worden van bijvoorbeeld: tele-, e-mail- of telefonische consultatie, meekijkconsulten en patiëntenbesprekingen.
- Maak afspraken over hoofdbehandelaarschap of gedeelde zorg en over wie aanspreekpunt is voor de patiënt en communiceer dit met de patiënt.
- In het algemeen geldt (tenzij regionaal andere afspraken gemaakt zijn):
- de huisarts is hoofdbehandelaar bij patiënten met lichte ziektelast
- de longarts is hoofdbehandelaar bij patiënten met aanhoudend verhoogde ziektelast.
Werkwijze van de huisarts bij consultatie of verwijzing naar een longarts
Naar Samenvatting ›- De huisarts gaat na of de vraag ook via teleconsultatie behandeld kan worden.
- De huisarts formuleert bij (tele)consultatie van of verwijzing naar een longarts een adequate vraagstelling, waarin duidelijk is aangegeven of het een diagnostisch of een behandelingsprobleem betreft
- De huisarts stuurt uitslagen van spirometrie en eventueel ander aanvullend onderzoek bij voorkeur digitaal mee (zie Richtlijn Informatie-uitwisseling tussen Huisarts en Specialist)
- De huisarts legt aan de patiënt het doel en de reden van verwijzing uit, desgewenst ook schriftelijk, bijvoorbeeld in het behandelplan.
Werkwijze van de longarts bij consultatie of verwijzing
Naar Samenvatting ›De longarts rapporteert schriftelijk aan de huisarts:
- na het vaststellen van diagnose of (definitief) behandelplan
- minimaal jaarlijks bij blijvend hoofdbehandelaarschap
- tussentijds bij nieuwe gezichtspunten die van belang zijn voor de huisarts
- bij terugverwijzing
Werkwijze van de longarts bij terugverwijzing naar de huisarts
Naar Samenvatting ›- De longarts verwijst de patiënt terug indien:
- de vraag van huisarts of patiënt beantwoord is
- de diagnostiek in de tweede lijn afgerond is
- het beleid door de huisarts kan worden voortgezet
- de zorg van de longarts niet verder bijdraagt aan het verminderen van de ziektelast
- De longarts verstrekt relevante gegevens met betrekking tot het verwachte ziektebeloop, medicatie, ziektelast en toegepaste behandeling.
- De longarts geeft zo mogelijk concrete adviezen over de behandelmogelijkheden door de huisarts indien de klachten toenemen.
- De longarts legt aan de patiënt het doel en de reden van terugverwijzing uit, desgewenst ook schriftelijk, bijvoorbeeld in het individueel behandelplan.
- De longarts licht de huisarts in bij ontslag na ziekenhuisopname of behandeling op de SEH, en geeft hierbij aan wie verantwoordelijk is voor de vervolgbehandeling en monitoring.
Samenwerking bij longaanvallen
Naar Samenvatting ›- De hoofdbehandelaar draagt zorg voor continue zorg, ook buiten kantooruren.
- De patiënt en diens omgeving moeten weten wat te doen bij een longaanval, bij voorkeur door een geschreven longaanval-actieplan (eventueel als onderdeel van een individueel zorgplan), dat informatie bevat over de bereikbaarheid van de hoofdbehandelaar binnen en buiten kantooruren.
- De huisarts beoordeelt patiënten die zich melden met COPD-gerelateerde klachten terwijl zij onder behandeling zijn van een longarts volgens deze standaard en overlegt indien nodig met de behandelend longarts, of indien deze niet bereikbaar is met de dienstdoend longarts.
- De longarts beoordeelt patiënten die zich (via de SEH) melden terwijl zij onder behandeling zijn bij de huisarts en verwijst deze bij stabiele situatie terug naar de huisarts.
Beleid in eindstadium COPD
Naar Samenvatting ›- Het beloop van COPD in een vergevorderd stadium is moeilijk te voorspellen. Daarom is advance care planning wenselijk: bespreek samen met de patiënt welke zorg deze zou willen in verschillende mogelijke scenario’s, waaronder beademing.
- De behandeling van COPD-patiënten in de laatste levensfase vergt vaak intensieve begeleiding en soms een aangepaste behandeling (voor adviezen, zie Pallialine). Goede samenwerking tussen de verschillende betrokken behandelaars is daarbij essentieel.
- Het Landelijk transmuraal zorgpad COPD longaanval met ziekenhuisopname geeft concrete handvatten voor advance care planning en goede onderlinge afstemming.
- Maak afspraken wie de hoofdbehandelaar is. Als de patiënt thuis verblijft, is dit meestal de huisarts.
- Via het Longfonds kan de gratis patiëntenversie van de Richtlijn palliatieve zorg bij COPD besteld worden om mee te geven aan de patiënt en diens naasten.
Taken van de hoofdbehandelaar
- Breng tijdig, in goed onderling overleg en op een rustig en voor de patiënt geschikt moment ter sprake wat medisch nog wel en niet meer zinvol is. Indien de patiënt dit wenst, zijn gezinsleden, mantelzorgers en andere naasten aanwezig bij dit gesprek
- Ga na welke onderwerpen de patiënt en diens naasten bezighouden (bijvoorbeeld angst om te stikken)
- Besteed aandacht aan de draagkracht van de mantelzorger(s).
- Bespreek de wensen en verwachtingen van de patiënt ten aanzien van de zorg en behandeling.
- Bespreek de wensen van de patiënt ten aanzien van beademing, reanimatie en het levenseinde.
- Leg besluiten hieromtrent vast in het dossier en zorg dat dit dossier in acute situaties beschikbaar is.
- Deel, indien de patiënt dit wenst, de uitkomsten van het gesprek voor zover nodig en mogelijk schriftelijk met mantelzorgers en medebehandelaars.
Terminale fase
Het is lastig aan te geven wanneer bij een patiënt sprake is van een eindstadium van COPD. Bij ernstig COPD gaat de ziektespecifieke behandeling hand in hand met ondersteunende behandeling gericht op kwaliteit van leven. Men spreekt van de terminale fase wanneer het overlijden op zeer korte termijn (1-2 weken) valt te verwachten.
In de terminale fase kan overwogen worden te stoppen met ziektespecifieke behandelingen of af te zien van behandelingen die het moment van overlijden zouden kunnen uitstellen. Gezien het onvoorspelbare verloop van COPD is echter niet goed te definiëren wanneer een patiënt de terminale fase ingaat. Het eindstadium van COPD kan een langdurig beloop hebben.
Advance Care Planning
De zorg voor patiënten in het eindstadium van COPD vergt vaak intensieve begeleiding. Het verdient aanbeveling om met de patiënt en (voor zover mogelijk en gewenst) diens naaste omgeving tijdig aandacht te besteden aan:
- ernstige kortademigheid
- angst om te stikken
- sputumretentie
- zuurstoftherapie
- schaamte
- schuldgevoel (rokersverleden)
- depressieve gevoelens
- slapeloosheid en vragen over reanimeren
- beademing en behandeling op de IC
Samen met de patiënt kan besproken worden welke zorg gewenst is in verschillende mogelijke scenario’s. Goede samenwerking tussen de verschillende betrokken behandelaars is hierbij essentieel. Het landelijke transmurale Zorgpad COPD longaanval met ziekenhuisopname van Longalliantie Nederland geeft concrete handvatten voor advance care planning en goede onderlinge afstemming. Voor een goed verloop van de communicatie en de samenwerking moet er een multidisciplinair en up-to-date dossier zijn dat te allen tijde ook ter beschikking staat van de (familie van de) patiënt.
Voor adviezen ten aanzien van de behandeling van COPD in de laatste levensfase, zie Pallialine COPD.
Referenties
- LAN. Zorgstandaard COPD. Amersfoort: Long Alliantie Nederland, 2016. www.longalliantie.nl/zorgstandaard-copd, geraadpleegd december 2020. Ga naar bron: LAN. Zorgstandaard COPD. Amersfoort: Long Alliantie Nederland, 2016. www.longalliantie.nl/zorgstandaard-copd, geraadpleegd december 2020.
- GOLD. Global strategy for the diagnosis, management and prevention of chronic obstructive pulmonary disease: 2019 report. Fontana (WI): Global Initiative for Chronic Obstructive Lung Disease (GOLD), 2019. https://goldcopd.org, geraadpleegd december 2020. Ga naar bron: GOLD. Global strategy for the diagnosis, management and prevention of chronic obstructive pulmonary disease: 2019 report. Fontana (WI): Global Initiative for Chronic Obstructive Lung Disease (GOLD), 2019. https://goldcopd.org, geraadpleegd december 2020.
- CBO. Multidisciplinaire richtlijn diagnostiek en behandeling van COPD. Utrecht: Kwaliteitsinstituut voor de Gezondheidszorg CBO, 2010. www.longalliantie.nl, geraadpleegd december 2020. Ga naar bron: CBO. Multidisciplinaire richtlijn diagnostiek en behandeling van COPD. Utrecht: Kwaliteitsinstituut voor de Gezondheidszorg CBO, 2010. www.longalliantie.nl, geraadpleegd december 2020.
- LAN. Richtlijn palliatieve zorg voor mensen met COPD. Amersfoort: Long Alliantie Nederland, 2011. https://www.nvalt.nl/kwaliteit/richtlijnen/copd-astma-allergie, geraadpleegd december 2020.
- Gedebjerg A, Szépligeti SK, Wackerhausen LH, Horváth-Puhó E, Dahl R,Hansen JG, et al. Prediction of mortality in patients with chronic obstructive pulmonary disease with the new Global Initiative for Chronic Obstructive Lung Disease 2017 classification: a cohort study. Lancet Respir Med 2018;6:204-12.
- Park J, Lee CH, Lee YJ, Park JS, Cho YJ, Lee JH et al. Longitudinal changes in lung hyperinflation in COPD. Int J Chron Obstruct Pulmon Dis 2017;12:501-8.
- Gagnon P, Guenette JA, Langer D, Laviolette L, Mainguy V, Maltias F, et al. Pathogenesis of hyperinflation in chronic obstructive pulmonary disease. Int J Chron Obstruct Pulmon Dis 2014;9:187-201.
- Pellegrino R, Brusasco V. Lung hyperinflation and flow limitation in chronic airway obstruction. Eur Respir J 1997;10:543-9.
- Calverley PM, Koulouris NG. Flow limitation and dynamic hyperinflation: key concepts in modern respiratory physiology. Eur Respir J 2005;25:186-99.
- Rossi A, Aisanov Z, Avdeev S, Di Maria G, Donner CF, Izquerdo JL et al. Mechanisms, assessment and therapeutic implications of lung hyperinflation in COPD. Respir Med 2015:109:785-802.
- Schermer TR, Saris CG, Van den Bosch WJ, Chavannes NH, Van Schayck CP, Dekhuijzen PN, et al. Exacerbations and associated healthcare cost in patients with COPD in general practice. Monaldi Arch Chest Dis 2006;65:133-40.
- Fabbri LM, Hurd SS. Global Strategy for the diagnosis, management and prevention of COPD: 2003 update. Eur Respir J 2003;22:1-2.
- CBO. Richtlijn medicamenteuze therapie van COPD. Utrecht: Kwaliteitsinstituut voor de Gezondheidszorg CBO, 2007. www.oncoline.nl, geraadpleegd december 2020. Ga naar bron: CBO. Richtlijn medicamenteuze therapie van COPD. Utrecht: Kwaliteitsinstituut voor de Gezondheidszorg CBO, 2007. www.oncoline.nl, geraadpleegd december 2020.
- Tabak C, Smit HA. De morbiditeit van astma en COPD in Nederland; leemtes in kennis opgevuld door aanvullende analyses en actualisering van beschikbare gegevensbronnen. Bilthoven: RIVM, 2002.
- Mullenders P, Van Vlaardingen F, Versloot A, Van der Vliet C. Pakketscan COPD. Gevraagde, aangeboden en verzekerde zorg vergeleken. Diemen: College voor zorgverzekeringen, 2013. www.zorginstituutnederland.nl, geraadpleegd december 2020. Ga naar bron: Mullenders P, Van Vlaardingen F, Versloot A, Van der Vliet C. Pakketscan COPD. Gevraagde, aangeboden en verzekerde zorg vergeleken. Diemen: College voor zorgverzekeringen, 2013. www.zorginstituutnederland.nl, geraadpleegd december 2020.
- Heins MJ, Spreeuwenberg P, Heijmans M. Leven met een longziekte in Nederland: cijfers en trens over de zorg- en leefsituatie van mensen met een longziekte 2018. Utrecht: Nivel, 2019. www.nivel.nl, geraadpleegd december 2020 Ga naar bron: Heins MJ, Spreeuwenberg P, Heijmans M. Leven met een longziekte in Nederland: cijfers en trens over de zorg- en leefsituatie van mensen met een longziekte 2018. Utrecht: Nivel, 2019. www.nivel.nl, geraadpleegd december 2020
- Zantinge EM, Deville WLJM, Heijmans MJWM. Allochtonen met astma, COPD of hooikoorts in Nederland: wat is er bekend? Utrecht: NIVEL, 2006.
- Bakke PS, Hanoa R, Gulsvik A. Educational level and obstructive lung disease given smoking habits and occupational airborne exposure: a Norwegian community study. Am J Epidemiol 1995;141:1080-8.
- Prescott E, Vestbo J. Socioeconomic status and chronic obstructive pulmonary disease. Thorax 1999;54:737-41.
- Kruis AL, Ställberg B, Jones RC, Tsiligianni IG, Lisspers K, Van der Molen T et al. Primary care COPD patients compared with large pharmaceutically-sponsored COPD studies: an UNLOCK validation study. Plos One 2014;9:e90145.
- Halpin DM, Miravitlles M, Metzdorf N, Celli B. Impact and prevention of severe exacerbations of COPD: a review of the evidence. Int J Chron Obstruct Pulmon Dis 2017;12: 2891-2908.
- Postma DS, Bush A, Van den Berge M. Risk factors and early origins of chronic obstructive pulmonary disease. Lancet 2014.
- Hogg JC, McDonough JE, Suzuki M. Small airway obstruction in COPD: new insights based on micro-CT imaging and MRI imaging. Chest 2013;143:1436-43.
- Heijdra YF, Pinto-Plata V, Frants R, Rassulo J, Kenney L, Celli BR. Muscle strength and exercise kinetics in COPD patients with a normal fat-free mass index are comparable to control subjects. Chest 2003;124:75-82.
- Pauwels RA, Buist AS, Calverley PM, Jenkins CR, Hurd SS. Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease. NHLBI/WHO Global Initiative for Chronic Obstructive Lung Disease (GOLD) Workshop summary. Am J Respir Crit Care Med 2001;163:1256-76.
- GOLD. Global strategy for the diagnosis, management and prevention of chronic obstructive pulmonary disease: 2020 report. Fontana (WI): Global Initiative for Chronic Obstructive Lung Disease, 2020. https://goldcopd.org, geraadpleegd december 2020. Ga naar bron: GOLD. Global strategy for the diagnosis, management and prevention of chronic obstructive pulmonary disease: 2020 report. Fontana (WI): Global Initiative for Chronic Obstructive Lung Disease, 2020. https://goldcopd.org, geraadpleegd december 2020.
- Doll R, Peto R, Boreham J, Sutherland I. Mortality in relation to smoking: 50 years’ observations on male British doctors. BMJ 2004;328:1519.
- Han MK, Tayob N, Murray S, Woodruff PG, Curtis JL, Kim V, Criner G, et al. Association between emphysema and chronic obstructive pulmonary outcomes in the COPDGene and spiromics coherts: a post hoc analysis of two clinical trials. Am J Respir Crit Cure Med 2018;15:265-7.
- Woodruff PG, Barr RG, Bleecker E, Christenson SA, Couper D, Curis JL, et al. Clinical significance of symptoms in smokers with preservied pulmonary function. N Engl J Med 2016;374:1811-21.
- Mannino DM, Gagnon RC, Petty TL, Lydick E. Obstructive lung disease and low lung function in adults in the United States: data from the National Health and Nutrition Examination Survey, 1988-1994. Arch Intern Med 2000;160:1683-9.
- Tzanakis N, Anagnostopoulou U, Filaditaki V, Christaki P, Siafakas N. Prevalence of COPD in Greece. Chest 2004;125:892-900.
- Geijer RM, Sachs AP, Hoes AW, Salome PL, Lammers JW, Verheij TJ. Prevalence of undetected persistent airflow obstruction in male smokers 40-65 years old. Fam Pract 2005;22:485-9.
- Anthonisen NR, Connett JE, Kiley JP, Altose MD, Bailey WC, Buist AS, et al. Effects of smoking intervention and the use of an inhaled anticholinergic bronchodilator on the rate of decline of FEV1. The Lung Health Study. JAMA 1994;272:1497-505.
- Kanner RE, Anthonisen NR, Connett JE. Lower respiratory illnesses promote FEV(1) decline in current smokers but not ex-smokers with mild chronic obstructive pulmonary disease: results from the lung health study. Am J Respir Crit Care Med 2001;164:358-64.
- Dransfield MT, Kunisaki KM, Strand MJ, Anzueto A, Bhat SP, Bowler RP et al. COPD-Gene Investigators. Acute exacerbations and lung function loss in smokers with and without chronic obstructive pulmonary disease. Am J Respir Crit Care Med 2017;195:324-30.
- Geijer RM, Sachs AP, Verheij TJ, Salome PL, Lammers JW, Hoes AW. Incidence and determinants of moderate COPD (GOLD II) in male smokers aged 40-65 years: 5-year follow up. Br J Gen Pract 2006;56:656-61.
- Bhatt SP, Kim YI, Harrington KF, Hokanson JE, Lutz SM, Cho MH, et al. Smoking duration alone provides stronger risk estimates of chronic obstructive pulmonary disease than pack-years. Thorax 2018;73:414-421.
- Jaakkola MS, Jaakkola JJ. Effects of environmental tobacco smoke on the respiratory health of adults. Scand J Work Environ Health 2002;28 Suppl 2:52-70.
- Oberg M, Jaakkola MS, Woodward A, Peruga A, Pruss-Ustun A. Worldwide burden of disease from exposure to second-hand smoke: a retrospective analysis of data from 192 countries. Lancet 2011;377:139-46.
- Putcha N, Barr EG, Han MK, Woodruff PG, Bleecker ER, Kanner RE, et al. Understanding the impact of second hand smoke exposure on clinical outcomes in participants with COPD in the spiromics cohort. Thorax 2016;71:411-20.
- Simoni M, Baldacci S, Maio S, Cerrai S, Sarno G, Viegi G. Adverse effects of outdoor pollution in the eldery. J Thorac Dis 2015;7:34-45.
- Gezondheidsraad. Gezondheidswinst door schonere lucht. Den Haag: Gezondheidsraad, 2018. www.gezondheidsraad.nl, geraadpleegd december 2020. Ga naar bron: Gezondheidsraad. Gezondheidswinst door schonere lucht. Den Haag: Gezondheidsraad, 2018. www.gezondheidsraad.nl, geraadpleegd december 2020.
- WHO. Review of evidence on health aspects of air pollution – REVIHAAP project: final technical report. Geneva: World Health Organization, 2018.
- Doiron D, De Hoogh K, Probst-Hensch N, Fortier I, Cai Y, De Matteis S, et al. Air pollution, long function and COPD: results from the population-based UK biobank studt. Eur Respir J 2019;54:1802140.
- Liu C, Chen R, Sera F, Vicedo-Cabrera AM, Guo Y, Tong S, et al. Ambient particulate air pollution and daily mortality in 652 cities. N Engl J Med 2019;381:705-15.
- Wang M, Pistenmaa Aaron C, Madrigano J, Hoffman EA, Angeline E, Yang J, et al. Association between long-term exposure to ambient air pollution and change in quantitively assessed emphysema and long function. JAMA 2019;322:546-56.
- Schikowski T, Adam M, Marcon A, Cai Y, Vierkotter A, Carsin AE, et.al. Association of ambient air pollution with the prevalence and incidence of COPD. Eur Respir J 2014;44:614-26.
- Atkinson RW, Carey IM, Kent AJ, Van Staa TP, Anderson HR, Cook DG. Long-term exposure to outdoor air pollution and the incidence of chronic obstructive pulmonary disease in a national English cohort. Occup Environ Med 2015;72:42-8.
- RIVM. Dossier Fijnstof (2018). Bilthoven: Rijksinstituut voor Volksgezondheid en Milieu, 2018. https://www.rivm.nl/dossier-fijn-stof, geraadpleegd december 2020. Ga naar bron: RIVM. Dossier Fijnstof (2018). Bilthoven: Rijksinstituut voor Volksgezondheid en Milieu, 2018. https://www.rivm.nl/dossier-fijn-stof, geraadpleegd december 2020.
- Hersh CP, Dahl M, Ly NP, Berkey CS, Nordestgaard BG, Silverman EK. Chronic obstructive pulmonary disease in alpha1-antitrypsin PI MZ heterozygotes: a meta-analysis. Thorax 2004;59:843-9.
- McElvaney NG, Burdon J, Holmes M, Glanville A, Wark PAB, Thompson PJ et al. RAPID Extension Trial Group. Long-term efficacy and safety of α1 proteinase inhibitor treatment for emphysema caused by severe α1 antitrypsin deficiency: an open-label extension trial (RAPID-OLE). Lancet Respir Med 2017;5:51-60.
- Hnizdo E, Sullivan PA, Bang KM, Wagner G. Association between chronic obstructive pulmonary disease and employment by industry and occupation in the US population: a study of data from the Third National Health and Nutrition Examination Survey. Am J Epidemiol 2002;156:738-46.
- Balmes J, Becklake M, Blanc P, Henneberger P, Kreiss K, Mapp C, et al. American Thoracic Society Statement: Occupational contribution to the burden of airway disease. Am J Respir Crit Care Med 2003;167:787-97.
- Orozco-Levi M, Garcia-Aymerich J, Villar J, Ramírez-Sarmiento A, Antó JM , Gea J. Wood smoke exposure and risk of chronic obstructive pulmonary disease. Eur Respir J 2006;27:542-6.
- Salvi SS, Barnes PJ. Chronic obstructive pulmonary disease in non-smokers. Lancet 2009;374:733-43.
- Martinez FD. Natural history. In: Barnes PJ, Drazen JM, Rennard S, editors. Asthma and COPD. Londen: Elsevier Science, 2002.
- Fagon JY, Chastre J, Trouillet JL, Domart Y, Dombret MC, Bornet M, et al. Characterization of distal bronchial microflora during acute exacerbation of chronic bronchitis. Use of the protected specimen brush technique in 54 mechanically ventilated patients. Am Rev Respir Dis 1990;142:1004-8.
- Monso E, Ruiz J, Rosell A, Manterola J, Fiz J, Morera J, et al. Bacterial infection in chronic obstructive pulmonary disease. A study of stable and exacerbated outpatiënts using the protected specimen brush. Am J Respir Crit Care Med 1995;152:1316-20.
- Sachs AP, Koeter GH, Groenier KH, Van der Waaij D, Schiphuis J, Meyboom-de Jong B. Changes in symptoms, peak expiratory flow, and sputum flora during treatment with antibiotics of exacerbations in patients with chronic obstructive pulmonary disease in general practice. Thorax 1995;50:758-63.
- Sethi S. Infectious etiology of acute exacerbations of chronic bronchitis. Chest 2000;117:380S-5S.
- Jansen HM, Sachs AP, Van Alphen L. Predisposing conditions to bacterial infections in chronic obstructive pulmonary disease. Am J Respir Crit Care Med 1995;151:2073-80.
- Seemungal TA, Harper-Owen R, Bhowmik A, Jeffries DJ, Wedzicha JA. Detection of rhinovirus in induced sputum at exacerbation of chronic obstructive pulmonary disease. Eur Respir J 2000;16:677-83.
- Seemungal T, Harper-Owen R, Bhowmik A, Moric I, Sanderson G, Message S, et al. Respiratory viruses, symptoms, and inflammatory markers in acute exacerbations and stable chronic obstructive pulmonary disease. Am J Respir Crit Care Med 2001;164:1618-23.
- Beckham JD, Cadena A, Lin J, Piedra PA, Glezen WP, Greenberg SB, et al. Respiratory viral infections in patients with chronic, obstructive pulmonary disease. J Infect 2005;50:322-30.
- White AJ, Gompertz S, Stockley RA. Chronic obstructive pulmonary disease. 6: The aetiology of exacerbations of chronic obstructive pulmonary disease. Thorax 2003;58:73-80.
- Lieberman D, Lieberman D, Ben-Yaakov M, Lazarovich Z, Hoffman S, Ohana B, et al. Infectious etiologies in acute exacerbation of COPD. Diagn Microbiol Infect Dis 2001;40:95-102.
- WHO Regional Office for Europe. Acute effects on health of smog episodes. World Health Organization, 1992.
- Anderson HR, Spix C, Medina S, Schouten JP, Castellsague J, Rossi G, et al. Air pollution and daily admissions for chronic obstructive pulmonary disease in 6 European cities: results from the APHEA project. Eur Respir J 1997;10:1064-71.
- Connors AF, Jr., Dawson NV, Thomas C, Harrell FE, Jr., Desbiens N, Fulkerson WJ, et al. Outcomes following acute exacerbation of severe chronic obstructive lung disease. The SUPPORT investigators (Study to Understand Prognoses and Preferences for Outcomes and Risks of Treatments). Am J Respir Crit Care Med 1996;154:959-67.
- Quanjer PH, Stanojevic S, Cole TJ, Baur X, Hall GL, Culver B, et al. Multi-ethnic reference values for spirometry for the 3-95 year age range: the global lung function 2012 equations. Eur Respir J 2012;40:1324-43.
- Quanjer PH, Tammeling GJ, Cotes JE, Pedersen OF, Peslin R, Yernault JC. Lung volumes and forced ventilatory flows. Report Working Party Standardization of Lung Function Tests, European Community for Steel and Coal. Official Statement of the European Respiratory Society. Eur Respir J Suppl 1993;16:5-40.
- Scanlon PD, Connett JE, Waller LA, Altose MD, Bailey WC, Buist AS, et al. Smoking cessation and lung function in mild-to-moderate chronic obstructive pulmonary disease. The Lung Health Study. Am J Respir Crit Care Med 2000;161:381-90.
- Van Manen JG. Quality of life and comorbidity in COPD patients in general practice (dissertation) Amsterdam: Universiteit van Amsterdam, 2001.
- Landbo C, Prescott E, Lange P, Vestbo J, Almdal TP. Prognostic value of nutritional status in chronic obstructive pulmonary disease. Am J Respir Crit Care Med 1999;160:1856-61.
- Prescott E, Almdal T, Mikkelsen KL, Tofteng CL, Vestbo J, Lange P. Prognostic value of weight change in chronic obstructive pulmonary disease: results from the Copenhagen City Heart Study. Eur Respir J 2002;20:539-44.
- Van ‘t Hul AJ, Koolen EH, Antons JC, De Man M, Djamin RS, In ’t Veen JJCM, et al. Treatable traits qualifying for nonpharmacological interventions in COPD patients upon first referral to a pulmonologist: the COPD straitosphere. ERJ Open Res 2020;6:00438-2020.
- Pooler A, Beech R. Examining the relationship between anxiety and depression and exacerbations of COPD which result in hospital admission: a systematic review. Int J Chron Obstruct Pulmon Dis 2014;9:315-30.
- Wijnhoven HA, Kriegsman DM, Hesselink AE, De Haan M, Schellevis FG. The influence of co-morbidity on health-related quality of life in asthma and COPD patients. Respir Med 2003;97:468-75.
- Miravitlles M, Ribera A. Understanding the impact of symptoms on the burden of COPD. Respir Res 2017a;18:67.
- Smith MC, Wrobel JP. Epidemiology and clinical impact of major comorbidities in patients with COPD. Int J Chron Obstruct Pulmon Dis 2014;9:871-88.
- Bestall JC, Paul EA, Garrod R, Garnham R, Jones PW, Wedzicha JA. Usefulness of the Medical Research Council (MRC) dyspnoea scale as a measure of disability in patients with chronic obstructive pulmonary disease. Thorax 1999;54:581-6.
- Blakemore A, Dickens C, Guthrie E, Bower P, Kontopantelis E, Afzal C, Coventry PA. Depression and anxiety predict health-related quality of life in chronic obstructive pulmonary disease: systematic review and meta-analysis. Int J Chron Obstruct Pulmon Dis 2014;9:501-12.
- Van Manen JG, Bindels PJ, Dekker FW, IJzermans CJ, Van der Zee JS, Schade E. Risk of depression in patients with chronic obstructive pulmonary disease and its determinants. Thorax 2002;57:412-6.
- Badgett RG, Tanaka DJ, Hunt DK, Jelley MJ, Feinberg LE, Steiner JF, et al. Can moderate chronic obstructive pulmonary disease be diagnosed by historical and physical findings alone? Am J Med 1993;94:188-96.
- Muris JWM. Auscultatie van de longen in de huisartspraktijk: een literatuuroverzicht. Huisarts Wet 1990;33:258-62.
- Rutten FH, Cramer MJ, Grobbee DE, Sachs AP, Kirkels JH, Lammers JW, et al. Unrecognized heart failure in elderly patients with stable chronic obstructive pulmonary disease. Eur Heart J 2005;26:1887-94.
- Bakker W, Dijkman JH. Rhonchi en crepitaties: nomenclatuur en interpretatie. Ned Tijdschr Geneeskd 1990;134:477-80.
- Jansveld CA, Bakker W, Braat MC. Rapport van de commissie Nomenclatuur Longgeluiden. Ned Tijdschr Geneeskd 1991;135:2380-3.
- Holleman DR, Jr., Simel DL, Goldberg JS. Diagnosis of obstructive airways disease from the clinical examination. J Gen Intern Med 1993;8:63-8.
- Miller MR, Hankinson J, Brusasco V, Burgos F, Casaburi R, Coates A, et al. Standardisation of spirometry. Eur Respir J 2005;26:319-38.
- SAN. Praktijkrichtlijn longfunctieonderzoek. Eindhoven: SAN Centra voor medische diagnostiek, 2012. www.de-san.nl/Praktijkrichtlijnen, geraadpleegd december 2020. Ga naar bron: SAN. Praktijkrichtlijn longfunctieonderzoek. Eindhoven: SAN Centra voor medische diagnostiek, 2012. www.de-san.nl/Praktijkrichtlijnen, geraadpleegd december 2020.
- Schermer TR, Verweij EH, Cretier R, Pellegrino A, Crockett AJ, Poels PJ. Accuracy and precision of desktop spirometers in general practices. Respiration 2012;83:344-52.
- Singh SJ, Jones PW, Evans R, Morgan MDL. Minimum clinically important improvement for the incremental shuttle walking test. Thorax 2008;63:775-7.
- KNGF. Richtlijn COPD. Amersfoort: Koninklijk Nederlands Genootschap voor Fysiotherapie, 2020. www.kngf2.nl, geraadpleegd december 2020. Ga naar bron: KNGF. Richtlijn COPD. Amersfoort: Koninklijk Nederlands Genootschap voor Fysiotherapie, 2020. www.kngf2.nl, geraadpleegd december 2020.
- Jones A, Rowe BH. Bronchopulmonary hygiene physical therapy in bronchiectasis and chronic obstructive pulmonary disease: a systematic review. Heart Lung 2000;29:125-35.
- Bourbeau J, Julien M, Maltais F, Rouleau M, Beaupre A, Begin R, et al. Reduction of hospital utilization in patients with chronic obstructive pulmonary disease: a disease-specific self-management intervention. Arch Intern Med 2003;163:585-91.
- Bischoff EW, Akkermans R, Bourbeau J, Van Weel C, Vercoulen JH, Schermer TR. Comprehensive self management and routine monitoring in chronic obstructive pulmonary disease patients in general practice: randomised controlled trial. BMJ 2012;345:e7642.
- Bischoff EW, Hamd DH, Sedeno M, Benedetti A, Schermer TRJ, Bernard S, et al. Effects of written action plan adherence on COPD exacerbation recovery. Thorax 2011;66:26-31.
- Bucknall CE, Miller G, Lloyd SM, Cleland J, McCluskey S, Cotton M, et al. Glasgow supported self-management trial (GSuST) for patients with moderate to severe COPD: randomised controlled trial. BMJ 2012;344:e1060.
- Zwerink M, Brusse-Keizer M, Van der Valk PD, Zielhuis GA, Monninkhof EM, Van der Palen J, et al. Self management for patients with chronic obstructive pulmonary disease. Cochrane Database Syst Rev 2014:CD002990.
- Walters JA, Smith S, Poole P, Granger RH, Wood-Baker R. Injectable vaccines for preventing pneumococcal infection in patients with chronic obstructive pulmonary disease. Cochrane Database Syst Rev 2010:CD001390.
- Trappenburg JCA, Monninkhof EM, Bourbeau J, Troosters T, Schrijvers AJP, Verheij TJM, et al. Effect of an action plan with ongoing support by a case manager on exacerbation-related outcome in patients with COPD: a multicentre randomised controlled trial. Thorax 2011;66:977-84.
- Broerse JE, Breukers WJ, Elberse JE, Branje D. Patiëntenparticipatie bij de ontwikkeling van een individueel zorgplan voor mensen met COPD. Amsterdam: Athena Instituut/Vrije Universiteit, 2012. www.longfonds.nl/individueel-zorgplan, geraadpleegd december 2020. Ga naar bron: Broerse JE, Breukers WJ, Elberse JE, Branje D. Patiëntenparticipatie bij de ontwikkeling van een individueel zorgplan voor mensen met COPD. Amsterdam: Athena Instituut/Vrije Universiteit, 2012. www.longfonds.nl/individueel-zorgplan, geraadpleegd december 2020.
- Alwashmi M, Hawboldt J, Davis E, Marra C, Gamble JM, Abu Ashour W. The effect of smartphone interventions on patients with chronic obstructive pulmonary disease exacerbations: a systematic review and meta-analysis. JMIR Mhealth Uhealth 2016;4:e105.
- Cruz J, Brooks D, Marques A. Home telemonitoring effectiveness in COPD: a systematic review. Int J Clin Pract 2014;68:369-378.
- Lundell S, Holmner A, Rehn B, Nyberg A, Wadell K. Tele-Healthcare in COPD: a systematic review and meta-analysis on physical outcomes and dyspnea. Resp Med 2015;109:11-26.
- McCabe C, McCann M, Brady AM. Computer and mobile technology interventions for self-management in chronic obstructive pulmonary disease. Cochrane Database Syst Rev 2017:CD011425.
- NVAB. Richtlijn astma en COPD voor het handelen van de bedrijfsarts bij behoud van en terugkeer naar werk. Nederlandse Vereniging voor Arbeids- en Bedrijfsgeneeskunde (2019) https://nvab-online.nl, geraadpleegd december 2020.
- Maurits E, Heymans M, Stirbu-Wagner I, Rijken M. Werken met een chronische longaandoening (rapport). Utrecht: Nivel, 2012.
- Franssen FM, O’Donnell DE, Goossens GH, Blaak EE, Schols AM. Obesity and the lung: 5. Obesity and COPD. Thorax 2008;63:1110-7.
- Stratton RJ, Green CJ, Elia M. Disease-related malnutrition: an evidence-based approach to treatment. Wallingford: CABI Publishing, 2003.
- Steiner MC, Barton RL, Singh SJ, Morgan MD. Bedside methods versus dual energy X-ray absorptiometry for body composition measurement in COPD. Eur Respir J 2002;19:626-31.
- Ferreira IM, Brooks D, Lacasse Y, Goldstein RS, White J. Nutritional supplementation for stable chronic obstructive pulmonary disease. Cochrane Database Syst Rev 2005:CD000998.
- Lamers F, Jonkers CC, Bosma H, Chavannes NH, Knottnerus JA, Van Eijk JT. Improving quality of life in depressed COPD patients: effectiveness of a minimal psychological intervention. COPD 2010;7:315-22.
- Kunik ME, Braun U, Stanley MA, Wristers K, Molinari V, Stoebner D, et al. One session cognitive behavioural therapy for elderly patients with chronic obstructive pulmonary disease. Psychol Med 2001;31:717-23.
- Lacasse Y, Goldstein R, Lasserson TJ, Martin S. Pulmonary rehabilitation for chronic obstructive pulmonary disease. Cochrane Database Syst Rev 2006:CD003793.
- Short PM, Lipworth SI, Elder DH, Schembri S, Lipworth BJ. Effect of beta blockers in treatment of chronic obstructive pulmonary disease: a retrospective cohort study. BMJ 2011;342:d2549.
- Quint JK, Herrett E, Bhaskaran K, Timmis A, Hemingway H, Wedzicha JA, et al. Effect of beta blockers on mortality after myocardial infarction in adults with COPD: population based cohort study of UK electronic healthcare records. BMJ 2013;347:f6650.
- Kopsaftis Z, Wood-Baker R, Poole P. Influenza vaccine for chronic obstructive pulmonary disease (COPD). Cochrane Database Syst Rev 2018:CD002733.
- Walters JAE, Tang JNQ, Poole P, Wood-Baker R. Pneumococcal vaccines for preventing pneumonia in chronic obstructive pulmonary disease. Cochrane Database Syst Rev 2017:CD001390.
- Scanlon PD, Connett JE, Wise RA, Tashkin DP, Madhok T, Skeans M, et al. Loss of bone density with inhaled triamcinolone in Lung Health Study II. Am J Respir Crit Care Med 2004;170:1302-9.
- Lee TA, Weiss KB. Fracture risk associated with inhaled corticosteroid use in chronic obstructive pulmonary disease. Am J Respir Crit Care Med 2004;169:855-9.
- Hubbard R, Tattersfield A, Smith C, West J, Smeeth L, Fletcher A. Use of inhaled corticosteroids and the risk of fracture. Chest 2006;130:1082-8.
- Suissa S, Baltzan M, Kremer R, Ernst P. Inhaled and nasal corticosteroid use and the risk of fracture. Am J Respir Crit Care Med 2004;169:83-8.
- Jones A, Fay JK, Burr M, Stone M, Hood K, Roberts G. Inhaled corticosteroid effects on bone metabolism in asthma and mild chronic obstructive pulmonary disease. Cochrane Database Syst Rev 2002:CD003537.
- Halpern MT, Schmier JK, Van Kerkhove MD, Watkins M, Kalberg CJ. Impact of long-term inhaled corticosteroid therapy on bone mineral density: results of a meta-analysis. Ann Allergy Asthma Immunol 2004;92:201-7.
- Sestini P, Renzoni E, Robinson S, Poole P, Ram FS. Short-acting beta 2 agonists for stable chronic obstructive pulmonary disease. Cochrane Database Syst Rev 2002:CD001495.
- Liesker JJ, Wijkstra PJ, Ten Hacken NH, Koeter GH, Postma DS, Kerstjens HA. A systematic review of the effects of bronchodilators on exercise capacity in patients with COPD. Chest 2002;121:597-608.
- Dahl R, Greefhorst LA, Nowak D, Nonikov V, Byrne AM, Thomson MH, et al. Inhaled formoterol dry powder versus ipratropium bromide in chronic obstructive pulmonary disease. Am J Respir Crit Care Med 2001;164:778-84.
- Mahler DA, Donohue JF, Barbee RA, Goldman MD, Gross NJ, Wisniewski ME, et al. Efficacy of salmeterol xinafoate in the treatment of COPD. Chest 1999;115:957-65.
- Rennard SI, Anderson W, ZuWallack R, Broughton J, Bailey W, Friedman M, et al. Use of a long-acting inhaled beta2-adrenergic agonist, salmeterol xinafoate, in patients with chronic obstructive pulmonary disease. Am J Respir Crit Care Med 2001;163:1087-92.
- COMBIVENT Inhalation Aerosol Study Group. In chronic obstructive pulmonary disease, a combination of ipratropium and albuterol is more effective than either agent alone. An 85-day multicenter trial. Chest 1994;105:1411-9.
- Appleton S, Jones T, Poole P, Pilotto L, Adams R, Lasserson TJ, et al. Ipratropium bromide versus short acting beta-2 agonists for stable chronic obstructive pulmonary disease. Cochrane Database Syst Rev 2006:CD001387.
- Karner C, Chong J, Poole P. Tiotropium versus placebo for chronic obstructive pulmonary disease. Cochrane Database Syst Rev 2014:CD009285.
- Kew KM, Seniukovich A. Inhaled steroids and risk of pneumonia for chronic obstructive pulmonary disease. Cochrane Database Syst Rev 2014:CD010115.
- Ni H, Soe Z, Moe S. Aclidinium bromide for stable chronic obstructive pulmonary disease. Cochrane Database Syst Rev 2014:CD010509.
- Ismaila AS, Huisman EL, Punekar YS, Karabis A. Comparative efficacy of long-acting muscarinic antagonist monotherapies in COPD: a systematic review and network meta-analysis. Int J Chron Obstruct Pulmon Dis 2015;10:2495-517.
- Oba Y, Lone NA. Comparative efficacy of long-acting muscarinic antagonists in preventing COPD exacerbations: a network meta-analysis and meta-regression. Ther Adv Respir Dis 2015;9:3-15.
- Tricco AC, Strifler L, Veroniki AA, Yazdi F, Khan PA, Scott A, et al. Comparative safety and effectiveness of long-acting inhaled agents for treating chronic obstructive pulmonary disease: a systematic review and network meta-analysis. BMJ Open 2015;5:e009183.
- Halpin DM, Vogelmeier C, Pieper MP, Metzdorf N, Richard F, Anzueto A. Effect of tiotropium on COPD exacerbations: a systematic review. Respir Med 2016 May;114:1-8.
- Zou Y, Xiao J. Yang DH, Li J, Chen Q. Efficacy and safety of an aclidinium bromide treatment for 12 weeks or longer in patients with moderate-to-severe COPD: a meta-Analysis. COPD 2016;13:499-508.
- Ni H, Htet A, Moe S. Umeclidinium bromide versus placebo for people with chronic obstructive pulmonary disease (COPD). Cochrane Database Syst Rev 2017:CD011897.
- Ferguson GT, Karpel J, Bennett N, Clerisme-Beaty E, Grönke L, Voß F, et al. Effect of tiotropium and olodaterol on symptoms and patient-reported outcomes in patients with COPD: results from four randomised, double-blind studies. NPJ Prim Care Respir Med 2017;27:7.
- Lee SH, Lee J, Yoo KH, Uh ST, Park MJ, Lee SY, et al. Efficacy and safety of aclidinium bromide in patients with COPD: a phase 3 randomized clinical trial in a Korean population. Respirology 2015;20:1222-8.
- Chung VC, Ma PH, Hui DS, Tam WW, Tang JL. Indacaterol for chronic obstructive pulmonary disease: systematic review and meta-analysis. PLoS One 2013;8:e70784.
- Kew KM, Mavergames C, Walters JA. Long-acting beta2-agonists for chronic obstructive pulmonary disease. Cochrane Database Syst Rev 2013:CD010177.
- Geake JB, Dabscheck EJ, Wood-Baker R, Cates CJ. Indacaterol, a once-daily beta2-agonist, versus twice-daily beta₂-agonists or placebo for chronic obstructive pulmonary disease. Cochrane Database Syst Rev 2015:CD010139.
- Xia N, Wang H, Nie X. Inhaled long-acting beta2-agonists do not increase fatal cardiovascular adverse events in COPD: a meta-analysis. PLoS One 2015;10:e0137904.
- Karbasi-Afshar R, Aslani J, Ghanei M. Efficacy and safety of conventional long acting β2- agonists: systematic review and meta-analysis. Caspian J Intern Med 2016;7:64-70.
- Lee HW, Kim HJ, Lee CH. The impact of olodaterol on the risk of mortality and serious adverse events: a systematic review and meta-analysis. Br J Clin Pharmacol 2017;83:1166-75.
- Metaxas E, Balis E. The safety of indacaterol for the treatment of COPD. Expert Opin Drug Saf 2018;6:637-42.
- Hanania NA, Sethi S, Koltun A, Ward JK, Spanton J, Ng D. Long-term safety and efficacy of formoterol fumarate inhalation solution in patients with moderate-to-severe COPD. Int J Chron Obstruct Pulmon Dis 2018;14:117-127.
- Oba Y, Keeney E, Ghatehorde N, Dias S. Dual combination therapy versus long-acting bronchodilators alone for chronic obstructive pulmonary disease (COPD): a systematic review and meta-analysis. Cochrane Database Syst Rev 2018:CD012620.
- Axson EL, Lewis A, Potts J, Pang M, Dickinson S, Vioix H, et al. Inhaled therapies for chronic obstructive pulmonary disease: a systematic review and meta-analysis. BMJ Open 2020;10:e036455.
- Chen CY, Chen WC, Huang CH, Hsiang YP, Shue CC, Chen YC, et al. LABA/LAMA fixed-dose combinations versus LAMA monotherapy in the prevention of COPD exacerbations: a systematic review and meta-analysis. Ther Adv Respir Dis 2020;14:1-10.
- Lee HW, Park J, Jo J, Jang EJ, Lee CH. Comparisons of exacerbations and mortality among regular inhaled therapies for patients with stable chronic obstructive pulmonary disease: systematic review and Bayesian network meta-analysis. PLoS Med 2019;16:e1002958.
- Mammen MJ, Pai V, Aaron SD, Nici L, Alhazzani W, Alexander PE. Dual LABA/LAMA Therapy versus LABA or LAMA monotherapy for chronic obstructive pulmonary disease a systematic review and meta-analysis in support of the american thoracic society clinical practice guideline. Ann Am Thorac Soc 2020;17:1133-43
- Zheng Y, Zhu J, Liu Y, Lai W, Lin C, Qiu K, et al. Triple therapy in the management of chronic obstructive pulmonary disease: systematic review and meta-analysis. BMJ 2018;363:k4388.
- Hoshino M, Ohtawa J. Effects of tiotropium and salmeterol/fluticasone propionate on airway wall thickness in chronic obstructive pulmonary disease. Respiration 2013;86:280-7.
- Calzetta L, Cazzola M, Matera MG, Rogliani P. Adding a LAMA to ICS/LABA therapy: a Meta-analysis of Triple Combination Therapy in COPD. Chest 2019;155:758-70.
- Zayed Y, Barbarawi M, Kheiri B, Haykal T, Chahine A, Rashdan L, et al. Triple versus dual inhaler therapy in moderate-to-severe COPD: a systematic review and meta-analysis of randomized controlled trials. Clin Respir J 2019;13:413-28.
- Ariel A, Altraja A, Belevskiy A, Boros PW, Danila E, Fležar M, et al. Inhaled therapies in patients with moderate COPD in clinical practice: current thinking. Int J Chron Obstruct Pulmon Dis 2018;13:45-56.
- Ferreira AJ, Reis A, Marçal N, Pinto P, Bárbara C. COPD: a stepwise or a hit hard approach? Rev Port Pneumol 2016;22:214-21.
- Miravitlles M, Cosío BG, Arnedillo A, et al. A proposal for the withdrawal of inhaled corticosteroids in the clinical practice of chronic obstructive pulmonary disease. Respir Res 2017b;18:198.
- Magnussen H, Disse B, Rodriguez-Roisin R, Kirsten A, Watz H,Tetzlaff K, et al. Withdrawal of inhaled glucocorticoids andexacerbations of COPD. N Engl J Med 2014;371:1285-94.
- Calzetta L, Matera MG, Braido F, Contoli M, Corsico A, Di Marco F, et al. Withdrawal of inhaled corticosteroids in COPD: a meta-analysis. Pulm Pharmacol Ther 2017;45:148-58.
- Miravitlles M, D’Urzo A, Singh D, Koblizek V. Pharmacological strategies to reduce exacerbation risk in COPD: a narrative review. Respir Res 2016;17:112.
- Kaplan AG. Applying the wisdom of stepping down inhaled corticosteroids in patients with COPD: a proposed algorithm for clinical practice. Int J Chron Obstruct Pulmon Dis 2015;10:2535-48.
- Rossi A, Van der Molen T, Del Olmo R, Papi A, Wehbe L, Quinn M, et al. INSTEAD: a randomised switch trial of indacaterol versus salmeterol/fluticasone in moderate COPD. Eur Respir J 2014a;44:1548-56. PMID: 25359348
- Wedzicha JA, Banerji D, Chapman KR, Vestbo J, Roche N, Ayers RT, et al. Indacaterol-glycopyrronium versus salmeterol-fluticasone for COPD. N Engl J Med 2016;374:2222-34.
- Rossi A, Guerriero M, Corrado A. Withdrawal of inhaled corticosteroids can be safe in COPD patients at low risk of exacerbation: a real-life study on the appropriateness of treatment in moderate COPD patients (OPTIMO). Respir Res 2014b;15:77.
- Vogelmeier CF, Gaga M, Aalamian-Mattheis M, Gruelich T, Marin JM, Castellani W, et al. Efficacy and safety of direct switch to indacaterol/glycopyrronium in patients with moderate COPD: the CRYSTAL open-label randomised trial. Respir Res 2017;18:140. PMID: 28720132
- Kardos P, Vogelmeier C, Worth H, Buhl R, Lossi NS, Mailänder C, et al. A two-year evaluation of the 'real life' impact of COPD on patients in Germany: the DACCORD observational study. Respir Med 2017;124:57-64. PMID: 28284322
- Walters JA, Walters EH, Wood-Baker R. Oral corticosteroids for stable chronic obstructive pulmonary disease. Cochrane Database Syst Rev 2005:CD005374.
- Albert RK, Connett J, Bailey WC, Casaburi R, Cooper JA, Jr., Criner GJ, et al. Azithromycin for prevention of exacerbations of COPD. N Engl J Med 2011;365:689-98.
- Poole P, Black PN, Cates CJ. Mucolytic agents for chronic bronchitis or chronic obstructive pulmonary disease. Cochrane Database Syst Rev 2012:CD001287.
- Chong J, Poole P, Leung B, Black PN. Phosphodiesterase 4 inhibitors for chronic obstructive pulmonary disease. Cochrane Database Syst Rev 2011:CD002309.
- Van der Molen T, Kocks JW. Do health-status measures play a role in improving treatment in chronic obstructive pulmonary disease? Expert Opin Pharmacother 2006;7:57-61.
- Sprangers MA, Aaronson NK. The role of health care providers and significant others in evaluating the quality of life of patients with chronic disease: a review. J Clin Epidemiol 1992;45:743-60.
- Jacobs JE, Van de Lisdonk EH, Smeele I, Van Weel C, Grol RP. Management of patients with asthma and COPD: monitoring quality of life and the relationship to subsequent GP interventions. Fam Pract 2001;18:574-80.
- Haddad S, Potvin L, Roberge D, Pineault R, Remondin M. Patiënt perception of quality following a visit to a doctor in a primary care unit. Fam Pract 2000;17:21-9.
- Slok AH, In ᾽t Veen JC, Chavannes NH, Van der Molen T, Rutten-van Mölken MP, Kerstjens HA, et al. Development of the Assessment of Burden of COPD tool: an integrated tool to measure the burden of COPD. NPJ Prim Care Respir Med 2014;24:14021.
- Geijer RM, Sachs AP, Verheij T, Kerstjens HA, Kuyvenhoven MM, Hoes AW. Quality of life in smokers: focus on functional limitations rather than on lung function? Br J Gen Pract 2007;57:477-82.
- NICE. Chronic obstructive pulmonary disease in over 16s diagnosis and management. London: National Institute for Health and Care Excellence, 2019. https://www.nice.org.uk/guidance/NG115, geraadpleegd december 2020. Ga naar bron: NICE. Chronic obstructive pulmonary disease in over 16s diagnosis and management. London: National Institute for Health and Care Excellence, 2019. https://www.nice.org.uk/guidance/NG115, geraadpleegd december 2020.
- Kocks JW, Tuinenga MG, Uil SM, Van den Berg JW, Stahl E, Van der Molen T. Health status measurement in COPD: the minimal clinically important difference of the clinical COPD questionnaire. Respir Res 2006;7:62.
- Van der Molen T, Willemse BW, Schokker S, Ten Hacken NH, Postma DS, Juniper EF. Development, validity and responsiveness of the Clinical COPD Questionnaire. Health Qual Life Outcomes 2003;1:13.
- Jacobs JE, Maille AR, Akkermans RP, Van Weel C, Grol RP. Assessing the quality of life of adults with chronic respiratory diseases in routine primary care: construction and first validation of the 10-Item Respiratory Illness Questionnaire-monitoring 10 (RIQ-MON10). Qual Life Res 2004;13:1117-27.
- Jones PW, Harding G, Berry P, Wiklund I, Chen WH, Kline Leidy N. Development and first validation of the COPD assessment test. Eur Respir J 2009;34:648-54.
- Jones PW, Brusselle G, Dal Negro RW, Ferrer M, Kardos P, Levy ML. Properties of the COPD assessment test in a cross-sectional european study. Eur Respir J 2011;38:29-35.
- Dodd JW, Hogg L, Nolan J, Jefford H, Grant A, Lord VM. The COPD assessment test (CAT): response to pulmonary NHG-Standaard COPD - pagina 110 rehabilitation. a multicentre, prospective study. Thorax 2011;66:425-9.
- Mahler DA, Weinberg DH, Wells CK, Feinstein AR. The measurement of dyspnea. Contents, interobserver agreement, and physiologic correlates of two new clinical indexes. Chest 1984;85:751-8.
- Slok AH, Bemelmans TC, Kotz D, Van der Molen T, Kerstjens HA, In ’t Veen JC, et al. The assessment of burden of COPD (ABC) scale: a reliable and valid questionnaire. COPD 2016b;13:431-8.
- Van Schayck CP. Ziektelastmeter COPD. Functioneel ontwerp en specificaties. Universiteit Maastricht en Long Alliantie Nederland 2016:1-43.
- Kon SS, Canavan JL, Jones SE, Nolan CM, Clark AL, Dickson MJ, et al. Minimum clinically important difference for the COPD assessment test: a positive analysis. Lancet Respir Med 2014;2:195-203.
- Smid DE, Franssen FM, Houben-Wilke S, Vanfleteren LE, Janssen DJ, Wouters EF, et al. Responsiveness and MCID estimates for CAT, CCQ and HADS in patients with COPD undergoing pulmonary rehabilitation: a prospective analysis. J Am Med Dir Assoc 2017;18:53-8.
- Slok AHM, Twellaar M, Jutbo L, Kotz D, Chavannes NH, Holverda S, et al. To use or not to use: a qualitative study to evaluate experiences of healthcare providers and patients with the assessment of burden of COPD (ABC) tool. NPJ Primary Care Respiratory Medicine 2016a;26:16074.
- Bischoff EW, Vercoulen J, Elbers L, Behr RA, Schermer TR. De NCSImethode: maatwerk voor COPD-zorg. Huisarts Wet 2016;59:242-7.
- McCrory DC, Brown CD. Anti-cholinergic bronchodilators versus beta2-sympathomimetic agents for acute exacerbations of chronic obstructive pulmonary disease. Cochrane Database Syst Rev 2002:CD003900.
- Walters JAE, Tan DJ, White CJ, Gibson PG, Wood‐Baker R, Walters EH. Systemic corticosteroids for acute exacerbations of chronic obstructive pulmonary disease. Cochrane Database Syst Rev 2014:CD001288.
- De Vries F, Bracke M, Leufkens HGM, Lammers JWJ, Cooper C, Van Staa TP. Fracture risk with intermittent high-dose oral glucocorticoid therapy. Arthritis Rheum 2007;56:208.
- Walters JAE, Tan DJ, White CJ, Wood‐Baker R. Different durations of corticosteroid therapy for exacerbations of chronic obstructive pulmonary disease. Cochrane Database Syst Rev 2018:CD006897.
- Chen G, Xie C. The efficacy and treatment length of oral corticosteroids in patients with acute exacerbations of chronic obstructive pulmonary disease. Eur Respir J 2005;26:1966.
- Leuppi JD, Schuetz P, Bingisser R, Bodmer M, Briel M, Drescher T, et al. Short-term versus conventional glucocorticoid therapy in acute exacerbations of chronic obstructive pulmonary disease: the REDUCE randomized clinical trial. JAMA 2013;309:2223-31.
- Sayiner A, Aytemur ZA, Cirit M, Unsal I. Systemic glucocorticoids in severe exacerbations of COPD. Chest 2001;119:726‐30.
- Sirichana W, Sittipunt C, Kawkitinarong K, Wongtim S. Comparison between 5 days and 10 days of prednisolone in treatment of acute exacerbation of chronic obstructive pulmonary disease. Respirology 2008;13:A120.
- Wood-Baker RWJ, Pearce M, Ryan G: a double-blind, randomised, placebo-controlled trial of corticosteroids for acute exacerbations of chronic obstructive pulmonary disease. Aust NZ J Med 1997;28:21.
- Hurst JR, Wedzicha JA. Chronic obstructive pulmonary disease: the clinical management of an acute exacerbation. Postgrad Med J 2004;80:497-505.
- Vollenweider DJ, Jarrett H, Steurer-Stey CA, Garcia-Aymerich J, Puhan MA. Antibiotics for exacerbations of chronic obstructive pulmonary disease. Cochrane Database Syst Rev 2012:CD010257.
- Miravitlles M, Soler-Cataluña JJ, Calle M, Soriano JB. Treatment of COPD by clinical phenotypes: putting old evidence into clinical practice. Eur Respir J 2013;41:1252-6.
- Wiersinga WJ, Bonten MJ, Boersma WG, Jonkers RE, Aleva RM, Kullberg BJ, et al. SWAB/NVALT (Dutch Working Party on Antibiotic Policy and Dutch Association of Chest Physicians) guidelines on the management of community-acquired pneumonia in adults. Neth J Med 2012;70:90-101.
- RIVM. NETHMAP/MARAN 2013: Consumption of antimicrobial agents and antimictrobial resistance among medically important bacteria in The Netherlands. Bilthoven: Rijksinstituut voor Volksgezondheid en Milieu, 2013. www.rivm.nl, geraadpleegd december 2020. Ga naar bron: RIVM. NETHMAP/MARAN 2013: Consumption of antimicrobial agents and antimictrobial resistance among medically important bacteria in The Netherlands. Bilthoven: Rijksinstituut voor Volksgezondheid en Milieu, 2013. www.rivm.nl, geraadpleegd december 2020.
- Kruis AL, Smidt N, Assendelft WJ, Gussekloo J, Boland MR, Rutten-van Mölken M, et al. Integrated disease management interventions for patients with chronic obstructive pulmonary disease. Cochrane Database Syst Rev 2013:CD009437.
- Stoller JK. Clinical practice. Acute exacerbations of chronic obstructive pulmonary disease. N Engl J Med 2002;346:988-94.
- Van Schayck CP, Loozen JM, Wagena E, Akkermans RP, Wesseling GJ. Detecting patients at a high risk of developing chronic obstructive pulmonary disease in general practice: cross sectional case finding study. BMJ 2002;324:1370-3.
- Van den Berg MJ, Kolthof ED, De Bakker DH, Van der Zee J. Tweede nationale studie naar ziekten en verrichtingen in de huisartsenpraktijk: De werkbelasting van huisartsen. Utrecht: Nivel, 2004. https://www.nivel.nl/nl/publicatie/tweede-nationale-studie-naar-ziekten-en-verrichtingen-de-huisartspraktijk-de Ga naar bron: Van den Berg MJ, Kolthof ED, De Bakker DH, Van der Zee J. Tweede nationale studie naar ziekten en verrichtingen in de huisartsenpraktijk: De werkbelasting van huisartsen. Utrecht: Nivel, 2004. https://www.nivel.nl/nl/publicatie/tweede-nationale-studie-naar-ziekten-en-verrichtingen-de-huisartspraktijk-de
- Price D, Freeman D, Cleland J, Kaplan A, Cerasoli F. Earlier diagnosis and earlier treatment of COPD in primary care. Prim Care Respir J 2011;20:15-22.
- Soriano JB, Zielinski J, Price D. Screening for and early detection of chronic obstructive pulmonary disease. Lancet 2009;374:721-32.
- Van Schayck CP, Van der Heijden FM, Van den Boom G, Tirimanna PR, Van Herwaarden CL. Underdiagnosis of asthma: is the doctor or the patiënt to blame? The DIMCA project. Thorax 2000;55:562-5.
- Jones RC, Dickson-Spillmann M, Mather MJ, Marks D, Shackell BS. Accuracy of diagnostic registers and management of chronic obstructive pulmonary disease: the Devon primary care audit. Respir Res 2008;9:62.
- Miravitlles M, De la Roza C, Morera J, Montemayor T, Gobartt E, Martin A, et al. Chronic respiratory symptoms, spirometry and knowledge of COPD among general population. Respir Med 2006;100:1973-80.
- Halding AG, Heggdal K, Wahl A. Experiences of self-blame and stigmatisation for self-infliction among individuals living with COPD. Scand J Caring Sci 2011;25:100-7.
- Dirven JA, Tange HJ, Muris JW, Van Haaren KM, Vink G, Van Schayck OC. Early detection of COPD in general practice: patiënt or practice managed? A randomised controlled trial of two strategies in different socioeconomic environments. Prim Care Respir J 2013a;22:331-7.
- Dirven JA, Tange HJ, Muris JW, Van Haaren KM, Vink G, Van Schayck OC. Early detection of COPD in general practice: implementation, workload and socioeconomic status. A mixed methods observational study. Prim Care Respir J 2013b;22:338-43.
- Toljamo T, Kaukonen M, Nieminen P, Kinnula VL. Early detection of COPD combined with individualized counselling for smoking cessation: a two-year prospective study. Scand J Prim Health Care 2010;28:41-6.