Hartfalen
Classificatie
Naar Volledige tekst ›De diagnostische classificatie volgens internationale richtlijnen is gebaseerd op de linkerventrikelejectiefractie (LVEF), veelal bepaald met echocardiografie:
- HFpEF: hartfalen met behouden (preserved) LVEF (≥ 50%)
- HFmrEF: hartfalen met matige (midrange) LVEF (40-49%)
- HFrEF: hartfalen met verminderde (reduced) LVEF (< 40%)
Richtlijnen diagnostiek
Naar Volledige tekst ›Denk aan hartfalen bij:
- aspecifieke klachten, zoals kortademigheid, verminderd inspanningsvermogen, moeheid
- risicofactoren voor hartfalen, zoals hogere leeftijd of doorgemaakt myocardinfarct
Anamnese
Naar Volledige tekst ›- Klachten: verminderd inspanningsvermogen, kortademigheid, vermoeidheid, orthopneu, aanvalsgewijze nachtelijke dyspneu, perifeer oedeem, nycturie.
- Uitlokkende factoren: angineuze klachten; palpitaties of syncope; gebruik van toxische stoffen (alcohol, cocaïne, cytostatica); gebruik van geneesmiddelen die kunnen leiden tot natrium- en vochtretentie (NSAID’s, corticosteroïden); schildklierfunctiestoornissen; anemie.
- Voorgeschiedenis: cardiale problemen.
- Risicofactoren voor hart- en vaatziekten: roken, hypertensie, diabetes mellitus type 2, overmatig alcoholgebruik, hypercholesterolemie, obesitas en chronische nierschade.
Lichamelijk onderzoek
Naar Volledige tekst ›- Pols, bloeddruk en ademfrequentie
- Ausculatie hart: let op hartgeruisen wijzend op klepafwijkingen
- Palpatie ictus cordis: passend bij hartfalen indien buiten de midclaviculairlijn in rugligging of heffend/verbreed in linker zijligging
- Tekenen van overvulling:
- verhoogde centraalveneuze druk (uitgezette halsvenen)
- longen: crepitaties, demping, verminderd ademgeruis basaal; soms rhonchi, piepen
- buik: vergrote lever, ascites
- perifeer oedeem (enkels en sacrum)
- Voedingstoestand en gewicht
Aanvullend onderzoek
Naar Volledige tekst ›Laboratoriumonderzoek en ecg
Naar Volledige tekst ›- Bepaal BNP of NT-proBNP, met als afkapwaarden:
- BNP 35 pg/ml (komt overeen met 10 pmol/l)
- NT-proBNP 125 pg/ml (komt overeen met 15 pmol/l)
- Ecg, desgewenst met interpretatie door een cardioloog
- Overweeg uitbreiding van het laboratoriumonderzoek:
- Hb, TSH en glucose ter uitsluiting van andere oorzaken en comorbiditeit
- natrium, kalium, eGFR en creatinine bij sterk vermoeden van hartfalen en mogelijk starten van medicatie
Echocardiografie
Naar Volledige tekst ›Verwijs bij verhoogd (NT-pro)BNP en/of afwijkend ecg naar de cardioloog voor echocardiografie (soms is eerstelijns echocardiografie voorhanden).
Aanvullend onderzoek indien geen verwijzing naar de tweede lijn
Naar Volledige tekst ›- Bij verhoogd (NT-pro)BNP en/of afwijkend ecg: eerstelijns echocardiografie indien mogelijk
- Overweeg onderzoek om andere oorzaken en eventuele comorbiditeit uit te sluiten:
- Hb, glucose, TSH
- X-thorax (pneumonie, maligniteit)
- spirometrie (astma, COPD)
Evaluatie
Naar Volledige tekst ›Diagnose ‘hartfalen’ na echocardiografie
Naar Volledige tekst ›De cardioloog stelt de diagnose hartfalen op basis van de klachten, met aanvullende criteria om het type te bepalen
| HFpEF | HFmrEF | HFrEF | |
|---|---|---|---|
| (NT-pro)BNP | Verhoogd | Verhoogd | Verhoogd* |
| Echocardiogram |
|
|
LVEF < 40% |
| * Een verhoogd BNP behoort niet tot de criteria voor HFrEF. | |||
Inschatting hartfalen zonder echocardiografie
Naar Volledige tekst ›Als echocardiografie geen optie is, maak dan een inschatting van het type hartfalen op basis van risicofactoren.
- HFpEF komt vaker voor bij hoge leeftijd, vrouwelijk geslacht, obesitas, hypertensie, COPD, atriumfibrilleren, diabetes mellitus type 2 en voorgeschiedenis zónder myocardinfarct
- HFrEF komt vaker voor bij voorgeschiedenis mét myocardinfarct
Richtlijnen beleid
Naar Volledige tekst ›Voorlichting
Naar Volledige tekst ›Voorlichting over de aandoening
Naar Volledige tekst ›- Leg uit dat de klachten het gevolg zijn van een verminderde pompfunctie van het hart.
- Bespreek wat de oorzaak van het hartfalen is en of deze oorzaak te behandelen is.
- Leg uit dat hartfalen vaak onvoorspelbaar verloopt met exacerbaties.
- Start tijdig gesprekken over advance care planning (ACP) bij patiënten met hartfalen NYHA klasse III-IV (zie tabel 1); verwijs zo nodig naar de informatie op Thuisarts.nl.
Voorlichting over medicatie
Naar Volledige tekst ›- De klachten nemen door medicijnen meestal af, evenals de kans op exacerbaties en vroegtijdig overlijden.
- De medicijnen zijn vaak levenslang nodig.
- Klachten van duizeligheid komen bij aanvang vaak voor en worden vaak vanzelf minder.
- Ontraad gebruik van NSAID’s.
- Adviseer tijdig contact op te nemen bij hoge koorts, fors braken of forse diarree, omdat mogelijk dosisaanpassing nodig is.
Voorlichting over zelfzorg en flexibel diureticumbeleid
Naar Volledige tekst ›- Adviseer de patiënt zich regelmatig te wegen, bijvoorbeeld 2 × per week.
- Instrueer de patiënt tijdig contact op te nemen en tijdelijk extra diuretica in te nemen bij tekenen van extra vocht vasthouden:
- toename van kortademigheid of dikke onderbenen
- gewichtstoename ≥ 2 kg binnen 3 dagen
- Flexibel diureticumbeleid: verdubbel de dosering diureticum gedurende 2-7 dagen bij tekenen van vocht vasthouden.
Overige voorlichting
Naar Volledige tekst ›- Adviseer jaarlijkse griepvaccinatie.
- Seksuele activiteit is in het algemeen goed mogelijk. In NYHA-klasse III of IV is het risico op decompensatie licht verhoogd; adviseer eventueel profylactisch nitroglycerine (sublinguaal).
- Autorijden (rijbewijs A, B, BE of T; zie tabel 1 voor de NYHA-classificatie):
- NYHA klasse I en II: toegestaan
- NYHA klasse III: rapport van een medisch specialist noodzakelijk
- NYHA klasse IV: niet toegestaan.
Niet-medicamenteuze behandeling
Naar Volledige tekst ›Vocht- en zoutbeperking
Naar Volledige tekst ›- Adviseer geen zout toe te voegen bij de maaltijdbereiding, en inname van producten met veel zout te beperken.
- Ontraad het gebruik van zoutvervangende producten die kalium bevatten.
- Adviseer patiënten in NYHA-klasse III en IV de vochtinname te beperken tot 1,5-2 l per dag.
- Verwijs zo nodig naar een diëtist.
Beweging
Naar Volledige tekst ›- Ga na hoeveel de patiënt beweegt en wat eventuele belemmeringen zijn.
- Adviseer regelmatig bewegen indien de patiënt stabiel is; houd rekening met de mogelijkheden en wensen van de patiënt.
- Overweeg verwijzing naar:
- multidisciplinaire hartrevalidatie (via de cardioloog);
- een gespecialiseerde fysio- of oefentherapeut.
Leefstijl
Naar Volledige tekst ›- Bij cachexie: ga na of de patiënt voldoende calorieën binnenkrijgt; verwijs zo nodig naar een diëtist.
- Bij ernstige obesitas (BMI > 35 kg/m2): adviseer af te vallen en verwijs zo nodig naar een diëtist.
- Voor overige leefstijladviezen (roken, voeding, alcohol, psychosociale factoren), zie NHG-Standaard Cardiovasculair risicomanagement, NHG-Behandelrichtlijn Stoppen met roken, NHG-Zorgmodule Leefstijl Voeding en NHG-Zorgmodule Leefstijl Alcohol
Medicamenteuze behandeling
Naar Volledige tekst ›- De cardioloog start in principe de medicatie.
- Bij een sterk vermoeden van hartfalen kan de huisarts de medicatie bij verwijzing alvast starten, of de medicatie zelf instellen indien de patiënt niet naar de cardioloog kan of wil.
- De huisarts behandelt HFpEF doorgaans zelf.
Medicamenteuze behandeling van HFpEF
Naar Volledige tekst ›- Streef naar symptoomverlichting en verbetering van de kwaliteit van leven.
- Behandel cardiovasculaire en niet-cardiovasculaire morbiditeit conform de betreffende richtlijnen.
- Behandel hypertensie volgens de NHG-Standaard Cardiovasculair risicomanagement, maar vermijd calciumantagonisten met een niet-dihydropiridinestructuur (diltiazem en verapamil).
- Geef bij tekenen van overvulling een lisdiureticum; verlaag de dosis als de patiënt voldoende ontwaterd is tot de laagste effectieve dosering of staak tijdelijk.
Medicamenteuze behandeling van HFrEF en HFmrEF
Naar Volledige tekst ›Stappenplan hartfalenmedicatie
Naar Volledige tekst ›- Bepaal eerst eGFR plus creatinine, natrium en kalium (of controleer of deze recent bepaald zijn).
- Start een RAS-remmer (een ACE-remmer of indien deze niet wordt verdragen een ARB) en bij tekenen van overvulling ook een lisdiureticum.
- Voeg bij patiënten die met RAS-remmer en diureticum klinisch stabiel zijn een bètablokker toe.
- Verhoog de dosering van RAS-remmer en bètablokker (bijvoorbeeld per 2 weken) tot de maximale dosis die wordt verdragen, met inachtneming van de maximale dosering. Verhoog de bètablokker niet bij tekenen van exacerbatie, hypotensie of bradycardie.
- Verlaag de dosering van het lisdiureticum als de patiënt voldoende ontwaterd is en continueer de laagst effectieve dosering.
- Overweeg toevoeging van een aldosteronantagonist bij aanhoudende klachten ondanks adequate instelling.
Controles na aanvang of aanpassing medicatie
Naar Volledige tekst ›- Vraag naar klachten (inspanningsvermogen) en mogelijke bijwerkingen van de medicatie.
- Meet bloeddruk, pols en gewicht.
- Bij asymptomatische lage bloeddruk en sinusbradycardie is aanpassing van de medicatie meestal niet nodig.
- Bepaal 1-2 weken na start of aanpassing van diureticum, RAS-remmer of aldosteronantagonist eGFR plus creatinine, natrium en kalium.
Controles
Naar Volledige tekst ›De instelfase op medicatie vindt veelal plaats in de tweede lijn. De huisarts kan, afhankelijk van regionale afspraken, de controles doen bij:
- patiënten voor wie behandeling in de tweede lijn niet wenselijk is
- patiënten met HFpEF
- patiënten met HFrEF die stabiel zijn
Controles in de stabiele fase
Naar Volledige tekst ›- Controleer patiënten die de maximaal verdragen dosering van de medicatie hebben bereikt na 3 en na 6 maanden, en daarna jaarlijks zo lang het hartfalen stabiel is.
- Controleer op indicatie vaker, bijvoorbeeld bij variatie in klachten, bij ernstige nierfunctiestoornis (eGFR < 30 ml/min/1,73 m2), bij kwetsbare ouderen en bij patiënten met in het verleden nierfunctie- of elektrolytenafwijkingen door deze medicatie.
- Vraag naar klachten, onder andere inspanningsvermogen.
- Informeer naar therapietrouw en mogelijke bijwerkingen van de medicatie.
- Meet bloeddruk, pols en gewicht.
- Bepaal eGFR plus creatinine, natrium en kalium.
- Wees alert op (langzame) verergering van het hartfalen. Pas zo nodig de medicatie aan volgens het Stappenplan hartfalenmedicatie of overleg met de cardioloog.
Consultatie en verwijzing
Naar Volledige tekst ›- Redenen voor consultatie of (terug)verwijzing naar de cardioloog:
- vermoeden van hartfalen met afwijkend ecg en/of verhoogd (NT-pro)BNP (overweeg kwetsbare patiënten bij wie diagnostiek en behandeling in de tweede lijn niet wenselijk zijn niet te verwijzen)
- geleidelijke progressie van het hartfalen ondanks adequate instelling op medicatie.
- exacerbatie hartfalen: bij ernstige of aanhoudende klachten ondanks behandeling.
- dehydratie: bij ernstige of aanhoudende klachten ondanks behandeling.
- Redenen voor overleg met de cardioloog:
- achteruitgang van de nierfunctie of elektrolytstoornissen
- persisterende hypertensie ondanks adequate instelling op hartfalenmedicatie
- onvoldoende controle van symptomen van angina pectoris met hartfalenmedicatie
- patiënt is mogelijk gebaat bij multidisciplinaire hartrevalidatie
Palliatieve zorg bij hartfalen
Naar Volledige tekst ›- De levensverwachting is moeilijk in te schatten, gezien het vaak grillige beloop van hartfalen.
- Start tijdig gesprekken over ACP bij patiënten in NYHA-klasse III of IV en beperkte levensverwachting.
Acuut hartfalen
Naar Volledige tekst ›- Kenmerk van acuut hartfalen is een snel begin of snelle toename van klachten.
- Behandel ernstig acuut hartfalen (asthma cardiale) als ABCDE instabiel (zie NHG-Behandelrichtlijn Geneesmiddelen en zuurstof in spoedeisende situaties).
Klinische tekenen
Naar Volledige tekst ›- (Half)zittende houding, angstige blik, reutelende/versnelde ademhaling, bleek/grauwe kleur, transpireren, klamme koude huid
- Verhoogde ademfrequentie, vergrote ademarbeid, verlaagde saturatie
- Pols meestal snel en zwak
- Bloeddruk in ernstige situaties soms verlaagd
- Auscultatie hart: hartgeruis, aritmie of extra toon
- Auscultatie longen: tweezijdig crepiteren, veelal ook rhonchi, soms piepen (bij acute exacerbatie van chronisch hartfalen mogelijk ook demping en nauwelijks of geen ademgeruis basaal, passend bij pleuravocht)
- Oedeem, gestuwde halsvenen (verhoogde centraalveneuze druk).
Beleid
Naar Volledige tekst ›Bij telefonisch contact
Naar Volledige tekst ›- Adviseer de patiënt rechtop te zitten, met afhangende benen.
- Adviseer alvast nitroglycerinespray 0,4 mg of isosorbidedinitraat 5 mg sublinguaal (indien beschikbaar), ongeacht of er pijn op de borst is.
- Adviseer geen nitroglycerine of isosorbidedinitraat als de patiënt bekend is met een lage bloeddruk.
- Laat een ambulance met A1-indicatie bellen en maak een visite.
In aanwezigheid van de patiënt
Naar Volledige tekst ›- Bel een ambulance met A1-indicatie.
- Geef zuurstof indien beschikbaar, 10-15 l/min via een non-rebreathing masker.
- Plaats de patiënt in zittende houding.
- Bij systolische bloeddruk > 90 mmHg: geef elke 5 minuten nitroglycerine 0,4 mg sublinguaal, 1-2 sprays tot de klachten voldoende verbeteren of de systolische bloeddruk daalt < 90 mmHg.
- Contra-indicatie voor nitroglycerine: recent gebruik van een fosfodiësterase-5-remmer (avanafil, sildenafil, tadalafil, vardenafil).
- Breng een infuusnaald in en spuit door met NaCl 0,9% 2 ml .
- Geef bij dyspneu met aanwijzingen voor vochtretentie furosemide 40 mg intraveneus in 2-3 minuten of bumetanide 1 mg intraveneus (maximaal 4 mg). Doseer hoger bij eGFR < 30 ml/min/1,73m2.
- Wees terughoudend met morfine (contra-indicatie: ernstig COPD); overweeg uitsluitend bij persisterend hevige onrust, dyspneu, angst of pijn op de borst morfine 2,5-5 mg intraveneus langzaam in 4-5 minuten; herhaal zo nodig na 10-20 minuten.
Belangrijkste wijzigingen
Naar Samenvatting ›- In lijn met internationale richtlijnen wordt niet langer gesproken van ‘systolisch’ of ‘diastolisch’ hartfalen maar van hartfalen met een al dan niet verminderde ejectiefractie (HFpEF, HFmrEF of HFrEF).
- De behandeling van HFrEF en HFmrEF wordt in principe opgestart door de cardioloog.
- Thiazidediuretica en digoxine worden niet langer aanbevolen voor de behandeling van hartfalen in de eerste lijn.
Kernboodschappen
Naar Samenvatting ›- Bepaal bij vermoeden van niet-acuut hartfalen laagdrempelig het BNP of NT-proBNP en maak een ecg.
- Verwijs patiënten met een verhoogd (NT-pro)BNP of een afwijkend ecg naar de cardioloog voor echocardiografie en verdere diagnostiek, en voor (het opstarten van) eventuele behandeling.
- Overweeg medicamenteuze behandeling van patiënten met HFmrEF en HFrEF ook zonder dat de cardioloog de diagnose ‘hartfalen’ heeft bevestigd, indien verwijzing naar de tweede lijn niet wenselijk is. Volg daarbij het Stappenplan hartfalenmedicatie.
Inleiding
Naar Samenvatting ›Scope
Naar Samenvatting ›Diagnostiek en behandeling van hartfalen bij volwassenen:
- chronisch hartfalen (geleidelijk ontstaan)
- acuut hartfalen (ontstaan of verergerd in enkele uren), zie Acuut hartfalen
- exacerbatie van chronisch hartfalen (ontstaan of verergerd in enkele dagen), zie Beleid bij exacerbaties)
Samenwerking en afstemming
Naar Samenvatting ›- Leden van de werkgroep waren huisartsen, een cardioloog en een afvaardiging van de Harteraad.
- De aanbevelingen sluiten zoveel mogelijk aan bij de volgende richtlijnen:
Buiten de scope
Naar Samenvatting ›Systolische of diastolische linkerventrikeldisfunctie zonder klachten passend bij hartfalen (kan een voorstadium van hartfalen zijn).
Achtergronden
Naar Samenvatting ›Begrippen
Naar Samenvatting ›Hartfalen
Naar Samenvatting ›- Hartfalen is een klinisch syndroom dat ontstaat door structurele of functionele afwijkingen van het hart waarbij de pompfunctie is verminderd of alleen met verhoogde intracardiale druk kan worden gehandhaafd.
- Klachten zijn onder andere kortademigheid, verminderde inspanningstolerantie en vocht vasthouden.
HFpEF, HFmrEF, HFrEF
Naar Samenvatting ›- De diagnostische classificatie volgens internationale richtlijnen is gebaseerd op de linkerventrikelejectiefractie (LVEF), veelal bepaald met echocardiografie.
- HFpEF: hartfalen met behouden (preserved) LVEF (≥ 50%)
- HFmrEF: hartfalen met matige (midrange) LVEF (40-49%)
- HFrEF: hartfalen met verminderde (reduced) LVEF (< 40%)
- Het medicamenteuze beleid wordt bepaald op basis van het type hartfalen en is voor HFrEF en HFmrEF hetzelfde.
NYHA-classificatie
Naar Samenvatting ›- De classificatie van hartfalen volgens de New York Heart Association (NYHA) is een functionele classificatie op basis van de ernst van de klachten bij inspanning (zie tabel 1).
- Deze classificatie is een momentopname en kan variëren in de tijd.
- Aan de hand van de NYHA-klasse wordt onder andere bepaald of een patiënt geschikt is om auto te rijden.
| Klasse I | Geen beperking van het inspanningsvermogen; normale lichamelijke activiteit veroorzaakt geen overmatige vermoeidheid, palpitaties of kortademigheid |
|---|---|
| Klasse II | Enige beperking van het inspanningsvermogen; in rust geen klachten maar normale lichamelijke inspanning veroorzaakt overmatige vermoeidheid, palpitaties of kortademigheid |
| Klasse III | Ernstige beperking van het inspanningsvermogen; in rust geen of weinig klachten, maar lichte lichamelijke inspanning veroorzaakt overmatige vermoeidheid, palpitaties of kortademigheid |
| Klasse IV | Geen enkele lichamelijke inspanning mogelijk zonder klachten; ook klachten in rust |
Epidemiologie
Naar Samenvatting ›Prevalentie
Naar Samenvatting ›- In 2018 waren er in de Nederlandse huisartsenpraktijk circa 242.300 patiënten bekend met de diagnose ‘hartfalen’ (ICPC-code K77).
- Huisartsen registreerden in 2018 circa 38.000 nieuwe hartfalenpatiënten, iets meer vrouwen dan mannen; de meeste mannen waren 75-84 jaar, de meeste vrouwen > 85 jaar.
- In 2019 was de prevalentie van geregistreerd hartfalen in de Nederlandse bevolking ≥ 65 jaar 6,1%, ongeveer even veel vrouwen als mannen; de prevalentie stijgt met de leeftijd en was ≥ 85 jaar bijna 21%.
- Personen > 55 jaar hebben circa 30% kans om gedurende het leven hartfalen te krijgen.
- Hartfalen was in 2018 de primaire doodsoorzaak bij circa 4300 vrouwen en circa 3200 mannen; de gemiddelde leeftijd van overlijden was 88 jaar voor vrouwen en 83 jaar voor mannen.
Prevalentie van hartfalen
Om tot het Nederlandse prevalentiecijfer te komen heeft het NIVEL het aantal personen geteld dat ooit een vermelding van hartfalen had in het huisartsendossier. Doordat deze cijfers gebaseerd zijn op klinische diagnoses is er zeer waarschijnlijk sprake van onderregistratie. Er werd geen onderscheid gemaakt tussen HFrEF en HFpEF. Gegevens over sterfte komen van het CBS.
In het prospectieve Rotterdam-onderzoek is de prevalentie van hartfalen geregistreerd bij 7734 deelnemers > 55 jaar zonder hartfalen vanaf de start van het onderzoek (1989-1993) tot 1 januari 2000. Het risico om hartfalen te ontwikkelen gedurende de rest van het leven bleek 32% voor mannen en 29% voor vrouwen. Er werd geen onderscheid gemaakt tussen HFrEF en HFpEF.
Prevalentie van HFrEF en HFpEF
Een systematisch literatuuronderzoek includeerde 9 onderzoeken (n = 12.894) naar de prevalentie van ventriculaire disfunctie of hartfalen bij mensen ≥ 60 jaar in de algemene bevolking (of waaruit deze prevalentie kon worden berekend), bij wie de diagnose was gesteld met echocardiografie. De mediane prevalentie van hartfalen was 11,8% (95%-BI 4,7 tot 13,3); 4 onderzoeken rapporteerden de prevalentie van HFrEF (mediaan 3,3%; 95%-BI 2,4 tot 5,8%), 3 die van HFpEF (mediaan 4,9%; 95%-BI 3,8 tot 7,4%). Verschillen in prevalentie kwamen waarschijnlijk door verschillen in populatiekenmerken (leeftijd, geslacht, comorbiditeit) en onderzoeksopzet (diagnosestelling, interpretatie van de echografie.
PREVEND, een Nederlands cohortonderzoek met 8592 deelnemers, onderzocht de incidentie van HFrEF en HFpEF. Deelnemers werden geworven in 1997/1998 en gevolgd tot 2010; zij waren bij inclusie gemiddeld 49 jaar (SD 12). Gedurende de follow-up werden ziekenhuisgegevens van deelnemers opgevraagd en beoordeelde een expertpanel of er sprake was van HFrEF of HFpEF volgens de criteria van de European Society of Cardiology (linkerventrikelejectiefractie (LVEF) < 40% voor HFrEF en > 50% voor HFpEF). Bij 586 patiënten (6,8%) waren tekenen van mogelijk nieuw hartfalen gevonden, bij 374 van hen (4,4%) bevestigde het expertpanel de diagnose. Van deze 374 hadden er 241 (64%) HFrEF en 125 (33%) HFpEF; 8 patiënten (2,1%) met LVEF 41-49% werden geëxcludeerd. Mannen hadden vaker HFrEF, vrouwen vaker HFpEF. Roken en myocardinfarct in de voorgeschiedenis waren geassocieerd met HFrEF, atriumfibrilleren met HFpEF.
In ADHERE, een Amerikaans retrospectief onderzoek op basis van > 100.000 ziekenhuisdossiers, bleek dat patiënten met HFpEF (LVEF > 40%) vaker ouder waren, vrouw waren en hypertensie hadden dan patiënten met HFrEF (LVEF < 40%).
De hartfalenpopulatie die bij de huisarts onder controle is, verschilt van die bij de cardioloog. In Nederlands onderzoek was de leeftijd van patiënten in de eerste lijn gemiddeld 79 jaar, 58% was vrouw. In de tweede lijn was dit respectievelijk 64 jaar en 22%. De meeste onderzoeken naar medicatie zijn uitgevoerd in de tweede lijn en dus bij een relatief jonge, mannelijke populatie met vaker HFrEF.
Onderrapportage
Naar Samenvatting ›- Er is sprake van onderrapportage van hartfalen, met name bij patiënten met COPD en diabetes mellitus type 2.
- Het aandeel van HFpEF binnen de totale incidentie van hartfalen stijgt met de leeftijd.
- Onderrapportage van HFpEF komt vaak voor in de groep (kwetsbare) ouderen met verminderd inspanningsvermogen, vermoeidheid en/of dyspneu.
- Geassocieerd met HFpEF zijn onder andere: hoge leeftijd, vrouwelijk geslacht, obesitas, hypertensie, COPD, atriumfibrilleren, diabetes mellitus type 2, en een voorgeschiedenis zónder myocardinfarct.
De diagnose ‘hartfalen’ wordt in de praktijk vaak gemist. Dit bleek onder andere in een cross-sectioneel onderzoek uit 2005 naar de aanwezigheid van hartfalen bij 405 patiënten > 65 jaar die bij de huisarts bekend waren met COPD zónder diagnose ‘hartfalen’. Bij 83 patiënten (20,5%; 95%-BI 16,7 tot 24,8) werd hartfalen vastgesteld (circa 50% systolisch en 50% diastolisch bij afkappunt LVEF 45%). Bij een aanzienlijk deel van de patiënten hield de diagnose ‘COPD’ geen stand.
In een recenter cross-sectioneel onderzoek bij 581 patiënten > 60 jaar met diabetes mellitus type 2 bleken er 161 (28%) niet-ontdekt hartfalen te hebben (5% HFrEF en 23% HFpEF bij afkappunt LVEF 45%).
Onderrapportage van HFpEF komt vaak voor bij (kwetsbare) ouderen met verminderd inspanningsvermogen, vermoeidheid of kortademigheid. In een onderzoek naar de prevalentie van hartfalen bij 585 patiënten ≥ 65 jaar die bij de huisarts kwamen met klachten van kortademigheid bij inspanning zonder bekend te zijn met hartfalen kregen 92 patiënten (16%) een nieuwe diagnose ‘hartfalen’. Bij afkappunt LVEF 45% had 19% (11 mannen en 6 vrouwen) HFrEF en 76% (30 mannen en 40 vrouwen) HFpEF.
In een soortgelijk onderzoek onder kwetsbare ouderen ≥ 65 jaar met verminderde inspanningstolerantie en dyspneu (n = 371) kreeg 34% een nieuwe diagnose ‘hartfalen’. Bij afkappunt LVEF 45% had 28% (24 mannen en 12 vrouwen) HFrEF en 70% (40 mannen en 49 vrouwen) HFpEF.
Kenmerken geassocieerd met HFpEF
De volgende kenmerken en comorbiditeit zijn meer geassocieerd met HFpEF dan met HFrEF:
- hoge leeftijd
- vrouwelijk geslacht
- obesitas
- hypertensie
- atriumfibrilleren
- diabetes mellitus type 2
- COPD
Etiologie, pathofysiologie en symptomatologie
Naar Samenvatting ›Etiologie
Naar Samenvatting ›Meest voorkomende oorzaken
Naar Samenvatting ›- Ischemische hartziekte
- Hypertensie
- Obesitas
- Diabetes mellitus
- Toxische stoffen (alcohol, cocaïne, cytostatica)
- Schildklierfunctiestoornissen
- Hartklepafwijkingen (aortaklepstenose, mitralisklepinsufficiëntie)
- Ritme- en geleidingsstoornissen (bradycardie, tachycardie, atriumfibrilleren); bij atriumfibrilleren is er vaak een vullingsprobleem met behouden LVEF (HFpEF)
Minder frequente oorzaken
Naar Samenvatting ›- Primaire hartspieraandoeningen (waaronder erfelijke, zoals in het kader van Duchenne)
- Andere beschadigingen van de hartspier (bijvoorbeeld myocarditis)
- Overige:
- middelen die kunnen leiden tot zout- en vochtretentie (NSAID’s inclusief COX-2-remmers, corticosteroïden)
- anemie
- ernstige infecties
Tabel 2 toont de etiologische factoren bij hartfalen.
In NHANES-I, een groot prospectief epidemiologisch onderzoek, zijn 13.643 mensen circa 20 jaar gevolgd en population-attributable risks berekend voor de verschillende risicofactoren. Van hoog naar laag waren de risicofactoren:
- coronaire hartziekten
- roken
- hypertensie
- lichamelijke inactiviteit
- mannelijk geslacht
- laag opleidingsniveau
- overgewicht
- diabetes mellitus
- kleplijden.
Deze resultaten komen grotendeels overeen met eerdere analyses van de Framingham Study.
Het CARDIA-onderzoek startte in 1985 met de inclusie van 5115 deelnemers, evenredig verdeeld over leeftijd (18-30 jaar) en etniciteit (Afro-Amerikaans of Europees-Amerikaans; mensen met andere etniciteiten werden geëxcludeerd). Van de 27 deelnemers die gedurende de follow-up van 20 jaar hartfalen ontwikkelden, waren er 26 Afro-Amerikaans.
| Etiologische factor | Vorm | Voorbeelden en bijzonderheden |
|---|---|---|
| Ischemische hartziekte | Veel verschijningsvormen | |
| Hypertensie | Veelal essentieel | Belangrijkste (bijdragende) factor |
| Metabool | Endocrien | Diabetes mellitus, hypo- of hyperthyreoïdie, ziekte van Cushing, bijnierinsufficiëntie, groeihormoonsurplus, feochromocytoom |
| Genetisch | Diverse vormen | Hypertrofische, gedilateerde, restrictieve, aritmogene rechterventrikel, andere cardiomyopathieën |
| Aritmie | Brady- en tachyaritmieën, atriumfibrilleren | |
| Toxine | Middelenmisbruik | Alcohol, cocaïne, amfetamine, anabole steroïden |
| Zware metalen | Koper, ijzer, lood, kobalt | |
| Geneesmiddelen |
Middelen die kunnen leiden tot natrium- en vochtretentie (NSAID’s inclusief COX-2-remmers, corticosteroïden), Immuunmodulerende medicatie (interferonen, monoklonale antistoffen zoals trastuzumab en cetuximab) |
|
| Bestraling | ||
| Immunologisch | Infectiegerelateerd | Bacteriën, spirocheten, fungi, protozoa, parasieten, rickettsiae, virussen (waaronder hiv) |
| Tumorgerelateerd | Immuuncheckpointremmers (myocarditis) | |
| Niet-infectiegerelateerd | Auto-immuunziekten | |
| Infiltratief | Maligniteit | Directe uitbreiding, metastase |
| Niet-maligne infiltraat | Onder andere amyloïdose, sarcoïdose, hemochromatose | |
| Voeding | Thiaminedeficiëntie, obesitas, cachexie | |
| Hartklepgebreken | Verworven | Vooral aortastenose en mitralisklepinsufficiëntie |
| Congenitaal | Atrium- en ventrikelseptumdefecten | |
| Pericardiaal | Pericarditis, pericardeffusie | |
| Verhoogde output | Anemie, sepsis | |
| Overvulling | Nierfalen, iatrogeen | |
| NSAID = non-steroidal anti-inflammatory drug; COX = cyclo-oxygenase, HIV = humaan immunodeficiëntievirus. Bron: ESC-richtlijn. |
||
Pathofysiologie
Naar Samenvatting ›- Het hart kan worden beschouwd als een zuigpomp. Bij hartfalen is deze niet in staat voldoende bloed rond te pompen om aan de behoefte van de weefsels te voorzien.
- Bij HFrEF en HFmrEF is de contractiekracht van de linker ventrikel onvoldoende, waardoor de ejectiefractie is verlaagd (systolische disfunctie).
- Bij HFpEF is de ejectiefractie niet afgenomen, maar is de vulling van de linker ventrikel vertraagd en verminderd door toegenomen stijfheid van het myocard; met als gevolg onvoldoende slagvolume bij inspanning of hoge hartfrequentie (diastolische disfunctie).
- Hartfalen is een chronische, progressieve ziekte. Patiënten kunnen een tijd stabiel blijven onder adequate therapie, maar op termijn nemen de beschadiging en disfunctie van de hartspier toe.
Symptomen
Naar Samenvatting ›- Hartfalen leidt tot aspecifieke klachten (kortademigheid, verminderd inspanningsvermogen, moeheid) die het dagelijks functioneren beperken en in de loop van de tijd toenemen.
- De meer specifieke tekenen van hartfalen bij lichamelijk onderzoek komen meestal voort uit overvulling:
- longen: crepitaties, demping bij percussie en verminderd ademgeruis basaal, soms rhonchi en piepen
- verhoogde centraalveneuze druk (uitgezette halsvenen)
- oedeem van enkels en/of sacrum
- toegenomen buikomvang (vergrote lever, ascites)
- De klachten nemen toe bij exacerbaties
- Soms zijn er ook nachtelijke klachten:
- kortademigheid bij plat liggen, meerdere kussens nodig bij het slapen (orthopneu)
- nycturie
Prognose
Naar Samenvatting ›- De prognose is zeer variabel, afhankelijk van de ernst van de klachten, etiologie, leeftijd, comorbiditeit en reeds gebleken snelheid van progressie.
- Comorbiditeit (hypertensie, diabetes mellitus, coronairlijden, obesitas, COPD) draagt bij aan een onzeker ziektebeloop van afwisselende exacerbaties en stabiele periodes.
- Vroege diagnose en optimale behandeling verbeteren de prognose, maar het individuele effect is moeilijk te voorspellen.
- In de afgelopen 30 jaar zijn klachten, progressie, ernstige exacerbaties en overleving verbeterd door betere medicamenteuze behandeling.
- Het 1-jaarsrisico op ziekenhuisopname is 30-35%.
- De 5-jaarsmortaliteit na de diagnose ‘hartfalen’ is circa 35%.
- De 1-jaarsmortaliteit van patiënten op hartfalenpoliklinieken is circa 6% voor HFpEF en 9% voor HFrEF.
Tabel 3 toont factoren met een ongunstig effect op de prognose van hartfalen.
| Type factor | Ongunstige factoren |
|---|---|
| Demografisch | Hoge leeftijd, mannelijk geslacht, lage sociaal-economische status |
| Klinische verschijnselen | Hoge hartfrequentie in rust, lage bloeddruk, overvulling, cachexie, kwetsbaarheid |
| Beeldvormend onderzoek | Lage LVEF, dilatatie, ernstige diastolische linkerventrikeldisfunctie, ernstige klepgebreken, linkerventrikelhypertrofie, pulmonale hypertensie |
| Laboratoriumafwijkingen | Onder andere laag natrium, hoog (NT-pro)BNP |
| Genetica | Specifieke mutaties |
| Cardiovasculaire comorbiditeit | AF, ventriculaire aritmieën, niet-revasculariseerbaar coronairlijden, CVA in de voorgeschiedenis, perifeer vaatlijden |
| Overige comorbiditeit | Diabetes mellitus, anemie, ijzergebrek, COPD, nierfalen, leverfalen, slaapgerelateerde ademhalingsstoornissen, cognitieve stoornissen, depressie |
| Therapietrouw | Slechte therapietrouw |
| Klinische uitkomsten | Ziekenhuisopname voor hartfalen, status na reanimatie |
|
LVEF = linkerventrikelejectiefractie; (NT-)BNP = (N-terminaal) b-type natriuretisch peptide; AF = atriumfibrilleren; CVA = cerebrovasculair accident; COPD = chronic obstructive pulmonary disease. Bron: ESC-richtlijn. |
|
Overleving en kans op ziekenhuisopname
In een groot prospectief cohort is de mortaliteit geanalyseerd van patiënten (n = 9134) die zich presenteerden met HFrEF en HFpEF in verschillende Europese poliklinieken. De 1-jaarsmortaliteit van HFrEF was circa 9%, die van HFpEF circa 6%. Hoge leeftijd, NYHA-klasse III of IV en nierfalen voorspelden een slechtere overleving bij zowel HFrEF als HFpEF. Lage systolische bloeddruk en hoge hartfrequentie waren voorspellers voor mortaliteit bij HFrEF; atriumfibrilleren was een voorspeller voor mortaliteit bij HFpEF.
- In een eerder onderzoek bleek de 1-jaarsmortaliteit voor gehospitaliseerde patiënten 17% en voor poliklinische patiënten 7%. Het percentage ziekenhuis(her)opnames binnen 1 jaar was 44% voor gehospitaliseerde en 32% voor poliklinische patiënten.
- In het Rotterdam-onderzoek was de 5-jaarsmortaliteit na de diagnose ‘hartfalen’ 35% (zie Prevalentie van hartfalen).
Richtlijnen diagnostiek
Naar Samenvatting ›- Verricht laagdrempelig diagnostiek naar hartfalen bij aspecifieke klachten (kortademigheid, verminderd inspanningsvermogen, moeheid), in het bijzonder bij patiënten met de volgende risicofactoren:
- hogere leeftijd
- doorgemaakt myocardinfarct
- COPD
- diabetes mellitus type 2
- hypertensie
- anemie
- roken
- laag opleidingsniveau
- obesitas
- Denk ook laagdrempelig aan hartfalen bij patiënten die vanwege hun etnische achtergrond (Turks, Sub-Sahara Afrikaans, Hindoestaans, Aziatisch-Surinaams, Caraïbisch) een ongunstiger risicoprofiel voor hart- en vaatziekten hebben (zie NHG-Standaard Cardiovasculair risicomanagement).
Anamnese
Naar Samenvatting ›Breng de aard en ernst van de klachten in kaart en de omstandigheden waarin deze optreden, informeer naar mogelijke oorzaken.
Klachten
Naar Samenvatting ›- Verminderd inspanningsvermogen
- Kortademigheid bij geringe inspanning of in rust
- Vermoeidheid
- Orthopneu
- Aanvalsgewijze nachtelijke dyspneu
- Perifeer oedeem
- Nycturie
Cardiale problemen in de voorgeschiedenis
Naar Samenvatting ›- Myocardinfarct
- Coronaire bypassoperatie
- Percutane coronaire interventie
- Angina pectoris
- Congenitale hartziekte
- Kleplijden
Mogelijke uitlokkende factoren
Naar Samenvatting ›- Angineuze klachten zoals pijn op de borst (ischemie)
- Palpitaties of syncope (ritme- of geleidingsstoornis)
- Gebruik van toxische stoffen (alcohol, cocaïne, cytostatica)
- Gebruik van geneesmiddelen die kunnen leiden tot natrium- en vochtretentie (NSAID’s inclusief COX-2-remmers, corticosteroïden)
- Schildklierfunctiestoornis
- Anemie
Risicofactoren voor hart- en vaatziekten
Naar Samenvatting ›- Roken
- Hypertensie
- Diabetes mellitus type 2
- Overmatig alcoholgebruik
- Hypercholesterolemie
- Obesitas
- Chronische nierschade.
De ESC-richtlijn voor acuut en chronisch hartfalen geeft een overzicht van de kenmerkende en minder kenmerkende klachten.
Kenmerkende klachten van hartfalen
- Kortademigheid
- Orthopneu
- Aanvalsgewijze nachtelijke kortademigheid
- Verminderde inspanningstolerantie
- Vermoeidheid
- Zwelling van de enkels
Minder kenmerkende klachten van hartfalen
- Nachtelijk hoesten
- Piepende ademhaling
- Opgeblazen gevoel
- Verminderde eetlust
- Verwardheid (met name bij ouderen)
- Depressieve klachten
- Palpitaties
- Duizeligheid
- Syncope
- Kortademigheid bij vooroverbuigen
Lichamelijk onderzoek
Naar Samenvatting ›- Ademfrequentie
- Bloeddruk
- Pols (frequentie en ritme)
- Ausculteer het hart; let op hartgeruisen wijzend op klepafwijkingen (met name aortaklepstenose en mitralisklepinsufficiëntie)
- Palpeer de ictus cordis (passend bij hartfalen indien buiten de midclaviculairlijn in rugligging of heffend/verbreed in linker zijligging)
- Tekenen van overvulling:
- verhoogde centraalveneuze druk (uitgezette halsvenen)
- longen (crepitaties, demping en verminderd ademgeruis basaal, soms rhonchi en piepen)
- buik (vergrote lever, ascites)
- perifeer oedeem (enkels en sacrum)
- Voedingstoestand en gewicht:
- overgewicht geeft extra belasting voor het hart
- cachexie is prognostisch ongunstig
De ESC-richtlijn voor acuut en chronisch hartfalen geeft een overzicht van de specifieke en minder specifieke symptomen.
Specifieke symptomen
- Verhoogde centraalveneuze druk
- Derde harttoon (galopritme): kan aanwezig zijn bij zeer ernstig hartfalen.
- Heffende of verbrede ictus in linker zijligging
Minder specifieke symptomen
- Gewichtstoename (> 2 kg per week)
- Gewichtsverlies (bij ernstig hartfalen)
- Cachexie
- Hartgeruis (met name systolische souffle als gevolg van aortaklepstenose of mitralisklepinsufficiëntie)
- Perifeer oedeem in enkels en/of sacrum
- Pulmonale crepitaties
- Demping en verminderd ademgeruis (pleuravocht)
- Tachycardie
- Ascites
- Vergrote lever
- Oligurie
- Lage polsdruk
Aanvullend onderzoek
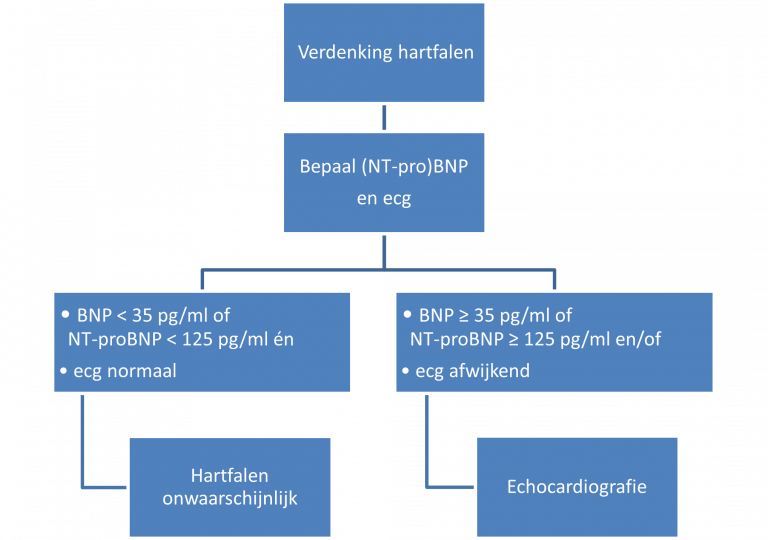
Naar Samenvatting ›Aanvullend onderzoek bij een vermoeden van hartfalen bestaat uit bepaling van het (NT-pro)BNP en een ecg (zie figuur 1).
(NT-pro)BNP
Naar Samenvatting ›Bepaal het B-type natriuretisch peptide (BNP) of het N-terminaal proBNP (NT-proBNP) en gebruik daarbij de volgende afkapwaarden, ook als het laboratorium andere referentiewaarden aanhoudt:
- BNP 35 pg/ml (komt overeen met 10 pmol/l)
- NT-proBNP 125 pg/ml (komt overeen met 15 pmol/l)
Interpretatie
- Bij een verhoogd (NT-pro)BNP is de kans dat de patiënt hartfalen heeft ≥ 40%; hoe hoger het (NT-pro)BNP, hoe groter deze kans.
- Een verhoogd (NT-pro)BNP kan ook andere oorzaken hebben (chronische nierschade, atriumfibrilleren, hoge leeftijd, ernstige infectie).
- Een normaal (NT-pro)BNP kan gevonden worden bij een minderheid van de patiënten met HFpEF, met name als er geen klachten zijn op het moment van bloedafname.
Aangezien de werkgroep veel belang hecht aan een hoge negatief voorspellende waarde van (NT-pro)BNP ligt het voor de hand om een laag afkappunt te gebruiken.
In de onderzoeken is de negatief voorspellende waarde ongeveer 95% of meer voor afkappunten tussen 30 en 80 pg/ml voor BNP en tussen 125 en 200 pg/ml voor NT-proBNP. Uit praktisch oogpunt kiest de werkgroep voor een afkappunt van BNP van 35 pg/ml en voor NT-proBNP van 125 pg/ml, omdat dit de afkappunten zijn die zowel in de vorige versie van de NHG-Standaard als in de ESC-richtlijn worden gehanteerd. Boven deze waarde volgt verwijzing voor echocardiografie. Ook bij patiënten met BNP > 400 pg/ml of NT-proBNP > 2000 pg/ml, bij wie vrijwel zeker is dat er sprake is van hartfalen, is een verwijzing nodig om vast te stellen welk type hartfalen het betreft en om de mogelijke oorzaken na te gaan.
Hoewel regionale laboratoria vaak andere afkappunten gebruiken, adviseert de werkgroep nadrukkelijk de afkappunten 35 pg/ml (ongeveer 10 pmol/l) voor BNP en 125 pg/ml (ongeveer 15 pmol/l) voor NT-proBNP te gebruiken. Omdat de meeste Nederlandse laboratoria de uitslag van het (NT-pro)BNP weergeven in pg/ml gebruiken, zullen wij deze eenheid in de NHG-Standaard gebruiken.
Behalve hartfalen kunnen ook andere cardiale en niet-cardiale condities leiden tot verhoogde bloedspiegels van (NT-pro)BNP, zoals chronische nierschade, atriumfibrilleren (of andere ritmestoornissen), hoge leeftijd, ernstige infectie, linkerventrikel hypertrofie en levercirrose.
Voor- en nadelen
Op basis van de testeigenschappen lijkt het niet mogelijk een voorkeur uit te spreken voor BNP of NT-proBNP.
Kwaliteit van bewijs
De kwaliteit van bewijs voor de diagnostische testeigenschappen van zowel BNP als NT-proBNP varieerde van zeer laag tot hoog. In het bereik dat overeenkomt met een negatief voorspellende waarde groter dan ongeveer 95%, varieerde de kwaliteit van bewijs van laag tot hoog.
Waarden en voorkeuren van patiënten
Patiënten geven de voorkeur aan een ‘overbodige’ verwijzing voor echocardiografie, waarbij geen hartfalen wordt gediagnosticeerd, boven een ten onrechte niet uitgevoerde echo waardoor mogelijk de diagnose ‘hartfalen’ wordt gemist (aanname van de werkgroep).
Kosten
Zowel BNP als NT-proBNP kost ongeveer € 15 per bepaling.
Aanvaardbaarheid en haalbaarheid
Het bepalen van BNP of NT-proBNP is voor zowel patiënten als huisartsen een aanvaardbare en haalbare test.
Overige overwegingen
Afkapwaarde
Sommige laboratoria geven de concentraties BNP en NT-proBNP weer in pg/ml of ng/l, andere laboratoria geven de waarde weer in pmol/l. Ook hanteren veel laboratoria hun eigen regionale referentiewaarden, die niet overeenkomen met de landeljike richtlijnen. Dit komt omdat ze deze waarden hebben bepaald door een combinatie van naar het ziekenhuis verwezen patiënten (wegens acute kortademigheid met vermoeden van hartfalen) en patiënten bij wie de huisarts denkt dat er mogelijk sprake is van hartfalen (chronische kortademigheid).
HFpEF
Patiënten met HFpEF hebben gemiddeld lagere concentraties (NT-pro)BNP dan patiënten met HFrEF, en kunnen zelfs niet-afwijkende concentraties in rust hebben. Na forse inspanning kunnen bij patiënten met HFpEF wel pieksgewijs hoge waarden worden vastgesteld. De verklaring hiervoor is dat de concentratie (NT-pro)BNP in het bloed verhoogd is bij verhoogde wandspanning van de linker ventrikel. Dit is doorlopend het geval bij een gedilateerd hart zoals bij HFrEF, maar niet bij een klein concentrisch hart (toegenomen wanddikte) zoals bij HFpEF. Bij HFpEF is het (NT-pro)BNP wel verhoogd na lichamelijk inspanning, omdat bij inspanning de wandspanning in de linker kamer abrupt toeneemt door een tekortschietende relaxatie van de kamer. De afkapwaarde voor HFpEF is hetzelfde als voor HFrEF, omdat zowel patiënten met HFpEF als met HFrEF waren geïncludeerd in de beschreven onderzoeken. Daarnaast is ervoor gekozen om een lage afkapwaarde voor het (NT-pro)BNP te kiezen om zo weinig mogelijk patiënten met hartfalen te missen.
Andere factoren van invloed op (NT-pro)BNP-waarde
Er bestaat een biologische variatie in de waarde van biomarkers zoals BNP en NT-proBNP. Behalve hartfalen kunnen ook andere cardiale en niet-cardiale condities leiden tot verhoogde bloedspiegels van (NT-pro)BNP, zoals chronische nierschade, atriumfibrilleren (of andere ritmestoornissen), hoge leeftijd, ernstige infectie, linkerventrikel hypertrofie en levercirrose. Obesitas, West-Afrikaanse of Afrikaans-Caraïbische oorsprong, behandeling met diuretica, ACE-remmers, angiotensinereceptorblokkers, bètablokkers of aldosteronantagonisten kan leiden tot lagere bloedspiegels van (NT-pro)BNP. Daarnaast hebben mannen gemiddeld lagere bloedspiegels dan vrouwen.
De werkgroep heeft gekozen voor niet-leeftijdsspecifieke en niet-geslachtsspecifieke afkappunten, omdat dit voor het uitsluiten van hartfalen nauwelijks effect heeft. Bovendien zou dit het diagnostische schema te complex maken.
Aanbevelingen
- Verwijs een patiënt met vermoeden van hartfalen en BNP ≥ 35 pg/ml (≥ 10 pmol/l) of NT-proBNP ≥ 125 pg/ml (≥ 15 pmol/l) voor echocardiografie.
- Gebruik geen andere afkappunten die individuele laboratoria mogelijk vermelden.
Achtergrond
Naast een mechanische functie heeft het hart ook een endocriene functie. Myocyten produceren in reactie op rek natriuretische peptiden. Deze vasoactieve hormonen worden dus extra aangemaakt bij toegenomen wandspanning ten gevolge van druk- en volumeoverbelasting. De atria produceren voornamelijk atriaal natriuretisch peptide (ANP). De ventrikels produceren B-type natriuretisch peptide (BNP) en het niet-actieve afsplitsingsproduct N-terminaal b-type natriuretisch peptide (NT-proBNP). De bepaling van BNP en NT-proBNP wordt in de praktijk gebruikt om hartfalen uit te sluiten of waarschijnlijker te maken. De voorafkans op hartfalen voor een patiënt die zich bij de huisarts presenteert met klachten passend bij hartfalen ligt rond de 30%.
Uitgangsvraag
Is bepaling van BNP of NT-proBNP aan te bevelen voor de beslissing om mensen bij wie op klinische gronden chronisch hartfalen wordt vermoed al dan niet te verwijzen voor echocardiografie of verder diagnostisch onderzoek? Welke afkapwaarde is dan het meest geschikt?
Diagnostische testeigenschappen
De werkgroep heeft vooraf besloten om, in lijn met de ESC-richtlijn hartfalen, vooral belang te hechten aan zo weinig mogelijk foutnegatieve testuitslagen.
Bij een foutnegatieve (NT-pro)BNP-bepaling wordt de diagnose ‘hartfalen’ gemist omdat de patiënt niet voor echocardiografie wordt verwezen. Gevolgen zijn dat de patiënt niet of vertraagd wordt behandeld, dat mogelijk andere (belastende) diagnostiek wordt ingezet en wellicht dat ten onrechte een andere diagnose gesteld wordt, bijvoorbeeld ‘COPD’. Hartfalen zelf geeft, als het leidt tot pulmonale overvulling, bij spirometrie een obstructief (en restrictief) beeld. Eenmaal gediagnosticeerd met COPD, denken zowel de patiënt als huisarts vaak niet meer aan hartfalen, ook niet bij toename van klachten.
Ingeval van een foutpositieve (NT-pro)BNP-bepaling wordt de patiënt ten onrechte verwezen voor echocardiografie. Dit gaat weliswaar gepaard met kosten en ongemak, maar hoeft niet te leiden tot belangrijke vertraging in het stellen van andere diagnoses, zoals ‘COPD’.
Voor mogelijke gevolgen op basis van het doorredeneren vanuit diagnostische testeigenschappen, zie de Totstandkoming.
Methode
Voor het beantwoorden van de uitgangsvraag is de clinical evidence review gebruikt behorend bij de NICE-Guideline Chronic heart failure in adults (NG106). De resultaten en conclusies van deze review zijn in de NHG-werkgroep besproken en op basis daarvan is de aanbeveling geformuleerd. De clinical evidence review bevatte literatuur tot december 2017 over de diagnostische accuratesse van BNP en NT-proBNP voor chronisch hartfalen bij verschillende afkappunten. Een aanvullende literatuursearch in november 2018 leverde geen nieuwe relevante artikelen op (zie Totstandkoming).
Resultaten
Resultaat zoekactie
NICE includeerde 8 diagnostische accuratesse-onderzoeken. Er zijn geen systematische literatuuronderzoeken of RCT’s geïncludeerd.
Onderzoekskarakteristieken
Van de 8 onderzoeken, uitgevoerd in Nederland, Denemarken, Ierland, Spanje, Zwitserland en het Verenigd Koninkrijk, includeerden er 7 patiënten met klachten bij wie de huisarts op basis van anamnese en/of lichamelijk onderzoek hartfalen vermoedde; 1 onderzoek includeerde patiënten met dyspneu van wie een deel reeds de klinische diagnose ‘hartfalen’ had maar die niet allemaal verdacht werden van hartfalen. De gemiddelde leeftijd was 65-74 jaar en 31-64% was man;de referentie was in de meeste onderzoeken de ESC-richtlijn (klachten/verschijnselen passend bij hartfalen plus structurele of functionele afwijkingen bij echocardiografie in rust). De prevalentie van hartfalen was in 6 van de 8 onderzoeken 24-34%, in 1 onderzoek 58% (dit onderzoek rapporteerde geen bruikbare 2 × 2-tabellen, dus is hier niet meegenomen) en in 1 onderzoek 66% (uitkomsten afgewaardeerd wegens indirect bewijs).
Kwaliteit van bewijs
De kwaliteit van bewijs varieerde van zeer laag tot hoog. Sommige onderzoeken zijn afgewaardeerd vanwege onnauwkeurigheid, indirect bewijs, inconsistentie of kans op vertekening (zie tabel 4 en tabel 5).
|
Afkappunt (pg/ml) |
Sensitiviteit (95%-BI) |
Aantal patiënten met hartfalen (onderzoeken) |
Specificiteit (95%-BI) |
Aantal patiënten zonder hartfalen (onderzoeken) |
Berekend aantal uitkomsten per 1000 fictieve patiënten (95%-BI)* |
Kwaliteit van bewijs |
||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| TP | FN | TN | FP | PVW* | NVW* | |||||||
|
30 † |
0,95 (0,89 tot 0,98) |
102 (1) |
0,35 (0,29 tot 0,42) |
199 (1) |
285 (267 tot 294) |
15 (6 tot 33) |
245 (203 tot 294) |
455 (406 tot 497) |
39% |
94% |
⨁⨁⨁⨁ HOOG |
|
|
65 † |
0,87 (0,79 tot 0,93) |
102 (1) |
0,57 (0,50 tot 0,64) |
198 (1) |
261 (237 tot 279) |
39 (21 tot 63) |
399 (350 tot 448) |
301 (252 tot 350) |
46% |
91% |
⨁⨁⨁⨁ HOOG |
|
|
77 ‡ |
0,97 (0,83 tot 1) |
31 (1) |
0,84 (0,74 tot 0,91) |
75 (1) |
291 (249 tot 300) |
9 (0 tot 51) |
588 (518 tot 637) |
112 (63 tot 182) |
72% |
98% |
⨁⨁◯◯ LAAG §,** |
|
|
100 † |
0,79 (0,7 tot 0,87) |
101 (1) |
0,72 (0,65 tot 0,78) |
199 (1) |
237 (210 tot 261) |
63 (39 tot 90) |
504 (455 tot 546) |
196 (154 tot 245) |
54% |
89% |
⨁⨁⨁⨁ HOOG |
|
|
178** |
0,47 (0,33 tot 0,62) |
49 (1) |
0,92 (0,74 tot 0,99) |
25 (1) |
141 (99 tot 186) |
159 (114 tot 201) |
644 (518 tot 693) |
56 (7 tot 182) |
72% |
80% |
⨁◯◯◯ ZEER LAAG §,**,†† |
|
|
400 ‡‡ |
0,08 (0,01 tot 0,21) |
51 (1) |
1 (0,97 tot 1) |
121 (1) |
24 (3 tot 36) |
276 (237 tot 297) |
700 (679 tot 700) |
0 (0 tot 21) |
100% |
72% |
⨁⨁⨁⨁ HOOG |
|
|
TP = terecht positief; Fn = foutnegatief; Tn = terecht negatief; FP = foutpositief. PVW = positief voorspellende waarde; NVW = negatief voorspellende waarde. |
||||||||||||
|
Afkappunt (pg/ml) |
Sensitiviteit (bereik) |
Aantal patiënten met hartfalen (onderzoeken) |
Specificiteit (bereik) |
Aantal patiënten zonder hartfalen (onderzoeken) |
Berekend aantal uitkomsten per 1000 fictieve patiënten (95% BI)* |
Kwaliteit van bewijs |
|||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| TP | FN | TN | FP | PVW* | NVW* | ||||||
|
125 †,‡,§ |
0,96 (0,72 tot 1) |
244 (3) |
0,48 (0,18 tot 0,80) |
582 (3) |
288 (216 tot 300) |
12 (0 tot 84) |
336 (126 tot 560) |
364 (140 tot 574) |
44% |
97% |
⨁⨁⨁◯ REDELIJK § |
|
166 † |
0,96 (0,90 tot 0,99) |
103 (1) |
0,43 (0,36 tot 0,50) |
199 (1) |
288 (270 tot 297 |
12 (3 tot 30) |
301 (252 tot 350) |
399 (350 tot 448) |
42% |
96% |
⨁⨁⨁⨁ HOOG |
|
280 †,‡,§ |
0,89 (0,41 tot 0,99) |
244 (3) |
0,75 (0,38 tot 0,94) |
582 (3) |
267 (123 tot 297) |
33 (3 tot 177) |
525 (266 tot 658) |
175 (42 tot 434) |
60% |
94% |
⨁⨁⨁◯ REDELIJK § |
|
400 †,‡,§ |
0,79 (0,42 tot 0,96) |
244 (3) |
0,81 (0,49 tot 0,95) |
582 (3) |
237 (126 tot 288) |
63 (12 tot 174) |
567 (343 tot 665) |
133 (35 tot 357) |
64% |
90% |
⨁⨁⨁◯ REDELIJK § |
|
2000* * |
0,02 (0 tot 0,1) |
51 (1) |
1 (0,97 tot 1) |
121 (1) |
6 (0 tot 30) |
294 (270 tot 300) |
700 (679 tot 700) |
0 (0 tot 21) |
100% |
70% |
⨁⨁⨁⨁ HOOG |
|
TP = terecht positief; Fn = foutnegatief; Tn = terecht negatief; FP = foutpositief. PVW = positief voorspellende waarde; NVW = negatief voorspellende waarde. |
|||||||||||
Directe gevogen van de test (belasting voor de patiënt en kosten)
De test heeft weinig directe gevolgen voor de patiënt, behalve bloedafname. Zowel BNP als NT-proBNP kosten ongeveer € 15 per bepaling.
Consequenties van de testuitslag
Wel of geen verwijzing voor echocardiografie.
Conclusie
Hoewel er enige onzekerheid is over de diagnostische testeigenschappen van (NT-pro)BNP in de eerste lijn bij chronisch hartfalen is de grote lijn dat bij een hoger afkappunt de sensitiviteit afneemt en de specificiteit toeneemt, en dat parallel daaraan de positief voorspellende waarde toeneemt en de negatief voorspellende waarde afneemt. Deze associatie is echter niet vloeiend omdat de afkappunten afkomstig zijn uit verschillende onderzoeken.
Bij een priorkans van 30% is, grofweg gesproken, de negatief voorspellende waarde van BNP < 30-80 pg/ml of NT-proBNP < 125-200 pg/ml circa 95% (kwaliteit van bewijs laag tot hoog) en de positief voorspellende waarde van BNP > 400 pg/ml of NT-proBNP > 2000 pg/ml 100%. Een duidelijk verschil in voorspellende waarde tussen BNP en NT-proBNP komt niet naar voren.
Ecg
Naar Samenvatting ›Verricht een elektrocardiogram, desgewenst met interpretatie door een cardioloog.
Bij vermoeden van hartfalen wordt naast de bepaling van het (NT-pro)BNP ook een routinematig elektrocardiogram (ecg) aanbevolen. Het ecg heeft een hoge sensitiviteit voor hartfalen (89%) en daarmee een hoge negatief voorspellende waarde, wat het een geschikt instrument maakt om hartfalen uit te sluiten. Het ecg is echter niet geschikt om hartfalen aan te tonen vanwege de grote kans op een afwijkend ecg terwijl er geen sprake is van hartfalen.
Het (NT-pro)BNP heeft bij de geadviseerde afkapwaarden een hoge negatief voorspellende waarde. Als daarbij ook het ecg normaal is, is hartfalen zeer onwaarschijnlijk.
Overig laboratoriumonderzoek
Naar Samenvatting ›- Overweeg het laboratoriumonderzoek uit te breiden met Hb, glucose en TSH ter uitsluiting van een andere oorzaak voor de klachten en eventuele comorbiditeit.
- Bepaal alvast natrium, kalium, eGFR en creatinine bij sterk vermoeden van hartfalen en mogelijk starten van medicatie.
Predictieregel
Naar Samenvatting ›Het gebruik van een predictieregel bij patiënten met een vermoeden van hartfalen wordt niet aanbevolen.
De werkgroep is van mening dat het niet zinvol is een predictieregel te gebruiken waarvan (NT-pro)BNP deel uitmaakt. De huisarts vraagt al een (NT-pro)BNP-bepaling aan bij het eerste vermoeden van hartfalen, en aanvullend onderzoek als het (NT-pro)BNP boven de drempelwaarde is. Een predictieregel gebruiken ná de (NT-pro)BNP-bepaling heeft geen consequenties voor het beleid.
Dit advies is in lijn met de huidige internationale richtlijnen, die eveneens adviseren bij iedere patiënt met vermoeden van hartfalen een (NT-pro)BNP te bepalen [ESC 2016, NICE 2018]. De aanbeveling uit oudere versies van de NICE-richtlijn om bij mensen met een myocardinfarct in de voorgeschiedenis direct een echo te doen, is in 2018 komen te vervallen. In theorie kunnen sommige patiënten op basis van de MICE-predictieregel direct worden doorgestuurd voor echografie, maar omdat huisartsen bij de meeste patiënten met hartfalen toch een (NT-pro)BNP -bepaling zullen aanvragen en de kosten daarvan gering zijn, lijkt het de werkgroep beter het diagnostische algoritme simpel te houden: bepaal bij iedereen met een vermoeden van hartfalen laagdrempelig een (NT-pro)BNP.
Aanbeveling
We bevelen het gebruik van een predictieregel bij een vermoeden van hartfalen niet aan.
Uitgangsvraag
Welke predictieregels zijn voorhanden om de kans op hartfalen in te schatten? Is een predictieregel aan te bevelen bij een vermoeden van hartfalen?
Methode
In november 2018 is in PubMed een literatuursearch uitgevoerd naar systematische literatuuronderzoeken, RCT’s en observationeel onderzoek.
Resultaten
De literatuursearch leverde 12 artikelen op waarin predictieregels voor hartfalen werden beschreven; via de sneeuwbalmethode werden nog 3 artikelen gevonden.
Deze 12 artikelen beschreven 8 predictieregels voor hartfalen, inclusief de regel uit voorgaande versies van de NICE-richtlijn. NT-proBNP maakte deel uit van 4 predictieregels, waarvan 1 in een latere publicatie werd uitgebreid, NT-ANP was opgenomen in 1 predictieregel, 1 predictieregel had een versie mét en een versie zónder NT-proBNP en in 1 regel waren natriuretische peptiden niet onderzocht.
In 2 predictieregels kon in welomschreven gevallen de (NT-pro)BNP-bepaling worden overgeslagen en direct echografie worden aangevraagd. In de voorgaande versie van de NICE-richtlijn (2010) kon dit bij patiënten met symptomen van hartfalen en een myocardinfarct in de voorgeschiedenis. De MICE-regel (male, infarction, crepitations, edema) adviseerde de (NT-pro)BNP-bepaling over te slaan bij ≥ 1 van de volgende kenmerken: myocardinfarct, basale crepitaties en mannen met oedeem.
In 1 systematisch literatuuronderzoek werden 4 predictieregels extern gevalideerd in een nieuw cohort. De predictieregels presteerden in het externe validatiecohort even goed als in de cohorten waarin ze ontworpen waren, maar alleen een (NT-pro)BNP-bepaling presteerde meestal even goed en soms zelfs beter dan de volledige predictieregel. Voor geen van de predictieregels was een impactonderzoek beschikbaar, zodat de effecten op de zorg, het gedrag van de arts of de kosten onbekend zijn.
Echocardiografie
Naar Samenvatting ›- Indicaties voor echocardiografie (zie figuur 1):
- vermoeden van hartfalen en
- verhoogd (NT-pro)BNP en/of
- afwijkend ecg
- Verwijs voor echocardiografie naar de cardioloog. Soms is eerstelijns echocardiografie met beoordeling door een cardioloog voorhanden, gevolgd door een advies de patiënt wel of niet te verwijzen.
Echocardiografie levert informatie op over de anatomie van het hart (volumes, vorm en wanddiktes), wandbewegingen, vullingsdynamiek, pompfunctie en klepfunctie. Echocardiografie kan helpen bij het vaststellen van een aantal oorzaken van hartfalen zoals klepgebreken, cardiomyopathie en septumdefecten.
Met echocardiografie kan ook de linkerventrikelejectiefractie (LVEF) worden bepaald, de meest gebruikte maat voor de linkerventrikelfunctie. De LVEF is normaal 67%; bij een LVEF < 40% spreekt men van HFrEF, bij LVEF 41-50% van HFmrEF en bij LVEF > 50% van HFpEF. Een beperking is dat de LVEF afhankelijk is van de vulling en de vorm van het hart. Een gedilateerd hart met een toegenomen einddiastolisch volume van de linker ventrikel kan bij goede vulling met geringe pompkracht toch voldoende output geven, ondanks een lage LVEF. Sommige mensen met een LVEF < 30% zijn daardoor toch nog in staat tot relatief grote lichamelijke inspanning. Anderzijds zal een hypertrofisch hart met een klein einddiastolisch volume bijna altijd een normale LVEF hebben, maar kan het slagvolume toch ernstig tekortschieten. De wanden van zo’n hypertrofisch hart zijn namelijk niet alleen verdikt, maar ook fibrotisch en daardoor stugger geworden. De linker ventrikel kan minder goed relaxeren, met als gevolg beperkte vulmogelijkheid tijdens de diastole en dus een geringer slagvolume. In dat geval spreekt men van diastolische disfunctie, waarbij sprake is van HFpEF.
Verder onderzoek naar de oorzaak
Naar Samenvatting ›- Op basis van anamnese, lichamelijk onderzoek, laboratoriumonderzoek, ecg en echocardiogram kan worden vastgesteld of er sprake is van hartfalen, wat de mogelijke oorzaak is (bijvoorbeeld cardiomyopathie of kleplijden) en kan de ernst van het hartfalen worden ingeschat.
- De diagnose ‘hartfalen’ zal in de meeste gevallen worden gesteld door de cardioloog. Verder onderzoek naar de oorzaak en het opstarten van de behandeling zullen dan plaatsvinden in de tweede lijn.
Aanvullend onderzoek indien geen verwijzing naar de tweede lijn
Naar Samenvatting ›- Overweeg in het bijzonder bij oudere patiënten met een vermoeden van HFpEF (bijvoorbeeld op basis van hypertensie of het ontbreken van een myocardinfarct in de voorgeschiedenis) om verwijzing naar de tweede lijn achterwege te laten; dit in overleg met de patiënt.
- Ook comorbiditeit of kwetsbaarheid, waarbij het wenselijk is de zorg zo gecentraliseerd en gecoördineerd mogelijk te leveren, kan een reden zijn om niet te verwijzen.
- Vericht een (NT-pro)BNP-bepaling en eventueel een ecg.
- Laat bij verhoogd (NT-pro)BNP en/of afwijkend ecg desgewenst eerstelijns echocardiografie uitvoeren, indien beschikbaar in de regio.
- Overweeg de volgende onderzoeken om andere oorzaken of eventuele comorbiditeit aan te tonen of uit te sluiten:
- bloedonderzoek (Hb, glucose, TSH)
- X-thorax (pulmonale en intrathoracale pathologie zoals pneumonie of longmaligniteit)
- spirometrie (astma, COPD)
Nota bene Bij onbehandeld hartfalen kan spirometrie een obstructief beeld laten zien door vocht rondom de bronchioli. Verricht spirometrie daarom niet eerder dan na 3 maanden behandeling van het hartfalen, wanneer de patiënt stabiel is.
Een systematisch literatuuronderzoek concludeerde in 1996 dat pulmonale redistributie en cardiomegalie (cardiothoracale ratio > 0,50) de beste röntgenologische parameters zijn voor hartfalen, maar latere onderzoekers konden geen duidelijk verband vinden tussen afwijkingen op de thoraxfoto en systolische disfunctie (LVEF < 40%). Op de thoraxfoto is overvulling soms duidelijk zichtbaar, maar soms wordt bij patiënten met vergevorderd hartfalen geen enkele afwijking op de thoraxfoto gevonden. Een thoraxfoto met afwijkingen kan dus bijdragen aan het stellen van de diagnose ‘hartfalen’, maar een thoraxfoto zonder afwijkingen sluit hartfalen niet uit. Een X-thorax heeft beperkte waarde bij een vermoeden van nieuw ontstaan hartfalen, maar kan wel helpend zijn om hartfalen te differentiëren van eventuele pulmonale oorzaken.
Evaluatie
Naar Samenvatting ›- Bij een verhoogd (NT-pro)BNP en/of een afwijkend ecg is echocardiografie geïndiceerd. Verwijs hiervoor naar een cardioloog of verricht eerstelijns echocardiografie met beoordeling door een cardioloog.
- Bij een normaal (NT-pro)BNP en ecg is hartfalen onwaarschijnlijk en moeten alternatieve diagnoses worden overwogen.
Diagnose ‘hartfalen’ na echocardiografie
Naar Samenvatting ›De cardioloog stelt de diagnose op basis van onderstaande criteria.
HFpEF
- Klachten passend bij hartfalen
- Verhoogd (NT-pro)BNP
- Afwijkend echocardiogram:
- LVEF ≥ 50%
- aanwijzingen voor structurele veranderingen (linkerventrikelhypertrofie of een gedilateerd linker atrium) en/of
- aanwijzingen voor diastolische disfunctie.
HFmrEF
- Klachten passend bij hartfalen
- Verhoogd (NT-pro)BNP
- Afwijkend echocardiogram:
- LVEF 40-49%
- aanwijzingen voor structurele veranderingen (linkerventrikelhypertrofie of een gedilateerd linker atrium) en/of
- aanwijzingen voor diastolische disfunctie.
HFrEF
- Klachten passend bij hartfalen
- Afwijkend echocardiogram: LVEF < 40%
Oorzaak
Bij vastgesteld hartfalen wordt de meest waarschijnlijke oorzaak opgespoord; belangrijke oorzaken zijn hypertensie, ischemische hartziekte, ritme- en geleidingsstoornissen en klepafwijkingen.
De gouden standaard voor het stellen van de diagnose ‘HFpEF’ of ‘HFmrEF’ is invasieve meting van de vullingsdrukken in het hart. Omdat dit niet altijd mogelijk is, zeker niet in de huisartsenpraktijk, gebruiken we surrogaatparameters (anamnese, (NT-pro)BNP en echocardiogram), die een goede inschatting geven van de waarschijnlijkheid van HFpEF of HFmrEF. Uiteraard is dit model niet 100% sensitief of specifiek. Een (klein) gedeelte van de mensen met HFpEF of HFmrEF zal geen verhoogd (NT-pro)BNP of afwijkende echoparameters hebben.
Bij blijvend vermoeden van HFpEF of HFmrEF kan de cardioloog verder onderzoek doen om de diagnose definitief te stellen of te verwerpen. Voor de criteria van de verschillende typen hartfalen, zie de ESC-richtlijn.
Inschatting hartfalen zonder echocardiografie
Naar Samenvatting ›Als echocardiografie geen optie is, maak dan een inschatting van het type hartfalen op basis van risicofactoren.
- HFpEF komt vaker voor bij:
- hoge leeftijd
- vrouwelijk geslacht
- obesitas
- hypertensie
- COPD
- atriumfibrilleren
- diabetes mellitus type 2
- voorgeschiedenis zónder myocardinfarct
- HFrEF komt vaker voor bij:
- voorgeschiedenis mét myocardinfarct
NYHA-classificatie
Naar Samenvatting ›Maak een inschatting van de NYHA-klasse op basis van de ernst van de klachten bij inspanning (zie tabel 1).
Richtlijnen beleid
Naar Samenvatting ›Voorlichting
Naar Samenvatting ›- Geef onderstaande voorlichting en adviezen aan alle patiënten met HFpEF, HFmrEF en HFrEF.
- Laat de voorlichting zoveel mogelijk aansluiten bij de wensen, gewoonten, mogelijkheden en gezondheidsvaardigheden van de patiënt.
Voorlichting over de aandoening
Naar Samenvatting ›- Leg uit dat de pompfunctie van het hart verminderd is, waardoor klachten ontstaan zoals kortademigheid, vermoeidheid en dikke onderbenen.
- Bespreek wat de oorzaak is en of deze te behandelen is.
- Leg uit dat de klachten bij hartfalen in het algemeen geleidelijk toenemen en dat de achteruitgang vaak onvoorspelbaar verloopt met exacerbaties.
- Check regelmatig, eventueel door middel van de terugvraagmethode, of de patiënt alles heeft begrepen en of herhaalde voorlichting nodig is.
- Vraag zo nodig of een naaste van de patiënt wil meeluisteren, meedenken en meepraten.
- Start bij hartfalen NYHA-klasse III-IV tijdig gesprekken over advance care planning (zie Advance care planning); verwijs zo nodig naar de informatie op Thuisarts.nl.
Voorlichting over medicatie
Naar Samenvatting ›- Medicijnen verlichten het werk dat het hart moet leveren en kunnen zo de pompfunctie verbeteren.
- Klachten nemen door het gebruik van medicijnen meestal af, evenals de kans op exacerbaties en overlijden.
- De medicijnen zijn vaak levenslang nodig.
- Het is belangrijk om medicijnen elke dag in te nemen volgens voorschrift, ook indien de patiënt geen verschil merkt na inname
- Enige klachten van duizeligheid en licht gevoel in het hoofd komen bij aanvang vaak voor en worden vaak vanzelf minder.
- Adviseer de patiënt tijdig contact op te nemen bij hoge koorts, fors braken en/of forse diarree, omdat dit kan leiden tot dehydratie waardoor mogelijk dosisaanpassing van de medicatie nodig is.
- Wijs op de gevaren van NSAID’s (zelfmedicatie) en ontraad het gebruik ervan (zie NHG-Standaard Pijn).
De schattingen van therapietrouw bij hartfalen lopen uiteen. Een meta-analyse van de relatie tussen leeftijd en therapietrouw bij chronisch hartfalen vond een algemene therapietrouw van circa 70%, met een grote spreiding (40-95%) tussen de geïncludeerde onderzoeken. De grote spreiding kwam door verschillen in de manier waarop therapietrouw werd gemeten: dit variëerde van directe meting van digoxinespiegels in het bloed tot zelfrapportage door de patiënt. De meeste onderzoeken vonden dat leeftijd niet van invloed was op therapietrouw.
In een analyse van meerdere interviewonderzoeken werd beschreven dat het niet-innemen van pillen vaak geen bewuste keuze is. Veel patiënten bleken hun medicatie niet regelmatig in te nemen omdat ze het vergaten of omdat de pillen op waren. Sommige patiënten namen bewust geen medicatie op bepaalde momenten, bijvoorbeeld omdat ze bij iemand op bezoek gingen of omdat ze een reis maakten. Andere redenen om de medicatie niet in te nemen waren ten eerste dat men het vervelend of vermoeiend vond om iedere dag zoveel pillen te moeten innemen, en ten tweede de gedachte dat men de pillen niet iedere dag nodig had.
Voorlichting over zelfzorg en flexibel diureticumbeleid
Naar Samenvatting ›- Adviseer de patiënt zich met enige regelmaat te wegen (bijvoorbeeld 2 × per week).
- Instrueer de patiënt tijdig contact op te nemen en tijdelijk extra diuretica in te nemen (flexibel diureticumbeleid) bij tekenen van extra vocht vasthouden:
- toename van kortademigheid of dikke onderbenen
- gewichtstoename ≥ 2 kg binnen 3 dagen
- Een flexibel diureticumbeleid komt meestal neer op verdubbeling van de dosering gedurende 2-7 dagen bij tekenen van vocht vasthouden.
De klachten bij verslechtering van hartfalen kunnen sterk uiteenlopen. Desondanks moeten patiënten, familie en hulpverleners tekenen van verslechterend hartfalen kunnen herkennen en er de juiste consequenties aan leren verbinden, zoals het inwinnen van medisch advies. De aanbeveling om de patiënt te adviseren actie te ondernemen bij tekenen van extra vocht vasthouden (bijvoorbeeld toename van (nachtelijke) kortademigheid, dikkere onderbenen, nycturie en/of gewichtstoename ≥ 2 kg of meer in < 3 dagen) is tot stand gekomen op basis van consensus van de werkgroep en sluit aan bij de ESC-richtlijn.
Flexibel diureticumbeleid
Het instellen van een flexibel diureticumbeleid kan als zelfzorg worden aanbevolen indien de patiënt voldoende kennis van de aandoening heeft. De patiënt verhoogt of verlaagt tijdelijk de dosis diuretica binnen een tevoren afgesproken dosisgebied, gebaseerd op klachten en eventuele bekende of voorspelbare problemen met de vochtbalans (extra doseren bij snel toegenomen lichaamsgewicht of overmatige natriuminname, minder doseren bij diarree, braken, koorts, warm weer enzovoort). Meestal komt dit neer op een verdubbeling dan wel halvering van de dosering gedurende 2-7 dagen. De patiënt moet zich realiseren dat ook zonder gewichtstoename een verslechtering van hartfalen kan optreden die dosisaanpassing noodzakelijk maakt.
Mits de oorzaak kan worden weggenomen, is dosisaanpassing meestal niet langer nodig dan de ontregeling duurt. In de regel is dat binnen 1 week of eerder, als de patiënt weer voelt ‘euvolemisch’ (niet overvuld en ook niet ondervuld) te zijn en weer op het oude gewicht is.
Zelfmanagementinterventies
Een recente meta-analyse met data van individuele patiënten liet zien dat interventies gericht op betere kennis en vaardigheden op het gebied van zelfmanagement, zoals medicatie-inname, leefstijlaanpassing en het adequaat herkennen van tekenen van verergering, een gunstig effect hadden op een aantal eindpunten, waaronder tijd tot hartfalengerelateerde ziekenhuisopname en sterfte door alle oorzaken. De interventies hadden ook een klein positief effect op kwaliteit van leven. Het effect op sterfte door alle oorzaken was onzeker. In de subgroep met een matige tot ernstige depressie werd van zelfmanagementinterventies juist een negatief effect op sterfte gevonden.
Overige voorlichting
Naar Samenvatting ›- Adviseer de jaarlijkse griepvaccinatie.
- Seksuele activiteit is in het algemeen goed mogelijk; in NYHA-klasse III of IV is het risico op decompensatie licht verhoogd, deze patiënten kunnen eventueel profylactisch nitroglycerine (sublinguaal) gebruiken.
- Autorijden (rijbewijs A, B, BE of T):
- NYHA-klasse I en II: toegestaan
- NYHA-klasse III: toegestaan met rapport van een medisch specialist
- NYHA-klasse IV: niet toegestaan
- Vrachtwagen of autobus besturen (rijbewijs C, CE, D of DE):
- NYHA-klasse I en II: toegestaan met rapport van een medisch specialist
- NYHA-klasse III en IV: niet toegestaan
- Vliegen: patiënten met hartfalen mogen per vliegtuig reizen.
- Ontraad aan niet geheel klachtenvrije patiënten verblijf op grote hoogte (kortdurend > 2000 m of langerdurend > 1500 m) en reizen naar zeer warme en vochtige gebieden.
Voor de actuele tekst van de Regeling eisen geschiktheid 2000 zie https://wetten.overheid.nl/BWBR0011362.
Seksuele disfunctie komt veel voor bij patiënten met cardiovasculaire ziekten en wordt met name veroorzaakt door bijwerkingen van geneesmiddelen, psychologische factoren, vermoeidheid en depressieve klachten. Er is weinig onderzoek verricht naar de risico’s of mogelijke gunstige effecten van seksuele activiteit bij patiënten met hartfalen. Wel is een licht verhoogd risico op decompensatie na seksuele activiteit gerapporteerd bij hartfalen NYHA-klasse III en IV. In zeldzame gevallen kunnen klachten optreden zoals kortademigheid, palpitaties of angina pectoris terwijl van zulke klachten geen sprake is bij niet-seksuele inspanning van een vergelijkbaar niveau. Profylactisch gebruik van nitroglycerine sublinguaal kan dan worden overwogen. Aan patiënten met hartfalen kunnen fosfodiësterase-5-remmers worden voorgeschreven, tenzij zij nitraten gebruiken.
De cabinedruk in een vliegtuig komt overeen met de luchtdruk op ongeveer 2000 m hoogte. Omdat de reisduur meestal beperkt is, er geen lichamelijke inspanning gevraagd wordt en er zo nodig altijd direct zuurstof beschikbaar is, is vliegen verantwoord. Bij patiënten met chronische hypoxemie wordt speciaal onderzoek aangeraden.
Een kortdurend verblijf op 2000 m hoogte is voor patiënten met hartfalen waarschijnlijk geen probleem. Wel wordt geadviseerd op lagere hoogte te overnachten en in alle gevallen goed te acclimatiseren.
In een warm of vochtig klimaat moeten in verband met de kans op extra vochtverlies de vochtbeperking en de dosering diuretica en/of vaatverwijders worden aangepast.
Verblijf op grote hoogte (> 1500 m) en reizen naar zeer warme en vochtige gebieden zou aan niet geheel klachtenvrije patiënten met hartfalen ontraden moeten worden.
Bedrijfsarts
Naar Samenvatting ›Adviseer patiënten zo nodig een bedrijfsarts te consulteren als zij vragen hebben omtrent werk of re-integratie.
Thuisarts
Naar Samenvatting ›- Verwijs naar de informatie op Thuisarts.nl. De informatie op Thuisarts.nl is gebaseerd op deze NHG-Standaard.
- Wijs de patiënt ook op informatie van de Harteraad of de Hartstichting.
Niet-medicamenteuze behandeling
Naar Samenvatting ›Vocht- en zoutbeperking
Naar Samenvatting ›- Adviseer geen zout toe te voegen bij de maaltijdbereiding en de inname te beperken van producten die veel zout bevatten.
- Ontraad het gebruik van zoutvervangende producten die kalium bevatten.
- Adviseer patiënten in NYHA-klasse III en IV de vochtinname te beperken tot 1,5-2 l per dag.
- Verwijs de patiënt zo nodig naar een diëtist voor begeleiding.
Door gebrek aan onderzoek is onduidelijk of een vocht- en/of zoutbeperking effectief is. Op pathofysiologische gronden acht de werkgroep het raadzaam om overmatig vocht- en zoutgebruik in algemene zin te vermijden en om specifiek piekinnames te vermijden. Het ligt voor de hand dat een patiënt die (ineens) te veel vocht of zout tot zich neemt meer diuretica nodig heeft om overvulling tegen te gaan. Deze aanbeveling is tot stand gekomen op basis van consensus en sluit aan bij de vigerende richtlijnen.
Voor- en nadelen
Geen onderzoek.
Kwaliteit van bewijs
Geen onderzoek.
Waarden en voorkeuren van patiënten
Enerzijds zijn er mogelijk patiënten die onbewust veel drinken of veel zout eten; zij kunnen baat hebben bij algemene adviezen hierover. Anderzijds is niet bekend hoe patiënten denken over een strikte vocht- en/of zoutbeperking. In een focusgroeponderzoek met 13 hartfalenpatiënten (gemiddelde leeftijd 65 jaar), georganiseerd door de Harteraad in 2019, bleek dat patiënten het volhouden van een zoutbeperking lastig vinden. Een aantal patiënten vertelde er desondanks wel actief mee aan de slag te zijn gegaan. Tijdens de focusgroep werden tips uitgewisseld over het bezoeken van een diëtist en over boeken met adviezen over kruiden in plaats van zout. Sommige patiënten gaven aan dat ze meer vocht vasthielden en meer diuretica nodig hadden als zij hun vocht- en/of zoutbeperking loslieten, bijvoorbeeld door uit eten te gaan, maar ze bleven wel uit eten gaan omdat ze dat belangrijk vonden.
Het is niet bekend of patiënten de voorkeur geven aan minder strenge vocht- en zoutbeperking als ze daarvoor in de plaats wel meer diuretica moeten gebruiken. Of, andersom, of bepaalde patiëntengroepen (bijvoorbeeld kwetsbare ouderen) een vochtbeperking prefereren boven hogere dosering diuretica waardoor ze vaker moeten plassen.
Kosten
Niet van toepassing.
Haalbaarheid/aanvaardbaarheid
Patiënten gaven in de focusgroep aan dat zij een zoutbeperking lastig vol te houden vonden. Sommigen kregen hulp van een hartfalenverpleegkundige of diëtist, de ervaring en het resultaat was wisselend. Meerdere patiënten gaven aan dat het opvolgen van een zoutbeperking moeilijk is omdat aan producten in de supermarkt veel zout is toegevoegd. Ook gaven patiënten aan dat het makkelijker zou zijn als het hele gezin zou meedoen met de zoutbeperking.
Aanbevelingen
- Adviseer enige mate van natriumbeperking bij hartfalen; raad de patiënt aan piekinnames te vermijden.
- Overweeg een maximale vochtinname van 1,5-2 l per dag bij patiënten met ernstig hartfalen (NYHA-klasse III en IV).
Achtergrond
Er bestaat al langere tijd discussie over het nut en de haalbaarheid van (strenge) vocht- en/of zoutbeperking bij patiënten met hartfalen. Voor sommigen, bijvoorbeeld kwetsbare ouderen, kan een vocht- en/of zoutbeperking prettiger zijn dan een (hogere dosis) diureticum. Voor anderen kan een streng regime de kwaliteit van leven verminderen of moeilijk vol te houden zijn.
Uitgangsvraag
Is vochtbeperking en/of zoutbeperking aan te bevelen bij patiënten met hartfalen?
| Patiënten | Patiënten met hartfalen |
|---|---|
| Interventie | Programma’s voor of advies over vochtbeperking en/of zoutbeperking (≥ 6 maanden studieduur) |
| Vergelijking | Geen advies |
| Uitkomstmaten | Sterfte, alle oorzaken Kwaliteit van leven Progressie van hartfalen Ongeplande ziekenhuisopname Bijwerkingen: progressie naar ernstig nierfalen/ongeplande dialyse, elektrolytstoornissen, nierfunctieverslechtering, hypotensie, aritmie, bradycardie, dorst(gevoel)/vaak naar de wc moeten |
Methode
Voor het beantwoorden van deze vraag is gebruikgemaakt van de zoekactie uit de NICE-richtlijn. Vervolgens is in juni 2020 een aanvullende literatuursearch uitgevoerd vanaf de einddatum van de NICE-zoekactie.
Resultaten
De zoekactie leverde geen RCT’s op die voldeden aan de in- en exclusiecriteria die door de werkgroep waren opgesteld.
Conclusie
Er is geen onderzoek dat een regime van vochtbeperking en/of zoutbeperking vergelijkt met geen regime.
Het gebruik van zoutvervangende producten die kalium bevatten kan leiden tot hyperkaliëmie. De kans is vooral verhoogd bij patiënten die een combinatie van een RAS-remmer met een aldosteronantagonist gebruiken en daarbij grote hoeveelheden zoutvervangende producten innemen. Veel patiënten met hartfalen gebruiken de genoemde combinatie; om verwarring te voorkomen wordt daarom het gebruik van zoutvervangende producten voor alle patiënten met hartfalen ontraden.
Beweging
Naar Samenvatting ›- Ga na hoeveel de patiënt beweegt en wat eventuele belemmeringen zijn.
- Adviseer patiënten die stabiel zijn regelmatig te bewegen voor zover de klachten dat toelaten; houd rekening met de mogelijkheden en wensen van de patiënt.
- Overweeg verwijzing naar:
- multidisciplinaire hartrevalidatie (via de cardioloog, zie Consultatie en verwijzing)
- een gespecialiseerde fysio- of oefentherapeut voor beweegadviezen en begeleiding.
Achtergrond
Bij hartfalen is lichaamsbeweging in het algemeen gunstig. Hartrevalidatie is een mogelijkheid om op een gestructureerde manier conditietraining aan te bieden. Regelmatige duur- en krachttraining kan oxidatieve stress doen verminderen en heeft een gunstig effect op autonome zenuwfuncties, spierkracht, vaatwand- en endotheelfunctie. Fysieke training wordt aanbevolen voor patiënten in NYHA-klasse II en III die optimaal zijn ingesteld met medicatie (zie Multidisciplinaire richtlijn Hartrevalidatie).
Onderzoeken
ACTION-HF, een gerandomiseerd onderzoek onder 2331 patiënten met hartfalen (gemiddelde leeftijd 59 jaar, < 30% vrouwen) toonde een lichte verbetering (ongeveer 10%) op de gecombineerde primaire uitkomst ‘sterfte en ziekenhuisopname’ in de groep die actief begeleid werd met een trainingsprogramma ten opzichte van de controlegroep die gebruikelijke zorg ontving. Van de secundaire uitkomsten was ‘cardiovasculaire sterfte en ziekenhuisopname’ ook ongeveer 10% verbeterd ten opzichte van de controlegroep. Statistische significantie werd alleen bereikt na correctie voor prognostische variabelen.
Een cochranereview over hartrevalidatie gebaseerd op beweging includeerde 44 RCT’s bij vooral mannen met HFrEF, gepubliceerd tot 1 januari 2019. Er werd weinig of geen verschil gevonden in mortaliteit door alle oorzaken op korte termijn (< 1 jaar; 27 trials, 2596 deelnemers): de mortaliteit in de interventiearm was 67/1302 (5,1%), versus 75/1294 (5,8%) in de controlearm (risk ratio (RR) 0,89; 95%-BI 0,66 tot 1,21. Mogelijk is er verschil in mortaliteit op lange termijn (> 1 jaar; 6 trials, 2845 deelnemers): de mortaliteit in de interventiearm was 244/1418 (17,2%) versus 280/1427 (19,6%) in de controlearm (RR 0,88; 95%-BI 0,75 tot 1,02). Er waren geen gegevens over mortaliteit als gevolg van hartfalen. Hartrevalidatie verminderde waarschijnlijk het aantal ziekenhuisopnames voor alle oorzaken (21 trials, 2182 deelnemers): het aantal zoekenhuisopnames was in de interventiearm 180/1093 (16,5%) versus 258/1089 (23,7%) in de controlearm (RR 0,70; 95%-BI 0,60 tot 0,83; NNT 14). Mogelijk resulteert hartrevalidatie ook in een verbetering in kwaliteit van leven: het gemiddelde verchil op de Minnesota Living With Heart Failure Questionnaire (17 trials, 1995 deelnemers) was –7,11 punten (95%-BI –10,49 tot –3,73).
Conclusie
Uit de beschikbare literatuur lijkt naar voren te komen dat hartrevalidatie mogelijk leidt tot een verminderd risico op ziekenhuisopname en verbetering van de kwaliteit van leven. Er is weinig onderzoek gedaan onder ouderen, vrouwen en patiënten met HFpEF, en naar bewegen in de thuissituatie.
Focusgroeponderzoek
In een focusgroeponderzoek met 13 hartfalenpatiënten (gemiddelde leeftijd 65 jaar), georganiseerd door de Harteraad in 2019, vertelden patiënten dat zij voldoende bewegen het moeilijkste onderdeel van de hartfalenbehandeling vonden om vol te houden. Sommigen gaven aan dat zij de revalidatie als positief ervaarden, maar de overgang naar vervolgens zelf bewegen groot vonden. Belemmerende factoren die werden genoemd, waren overige lichamelijke klachten (reumatoïde artritis, artrose, darmklachten); grote vermoeidheid voor of na het bewegen; niet de beweging kunnen doen die men vroeger leuk vond en geen plezier beleven aan bijvoorbeeld wandelen of fitness; niet kunnen meekomen met de rest van de groep. Het lijkt belangrijk om een vorm van bewegen te vinden die bij de patiënt past.
Leefstijl
Naar Samenvatting ›- Bij onbedoeld gewichtsverlies van > 5% in ≤ 6 maanden of > 10% in > 6 maanden: schenk aandacht aan de voedingstoestand en ga na of de patiënt voldoende calorieën binnenkrijgt; verwijs zo nodig naar een diëtist.
- Bij ernstige obesitas (BMI > 35 kg/m2): adviseer de patiënt af te vallen; verwijs zo nodig naar een diëtist.
- Er is onvoldoende bewijs om het gebruik van omega-3-vetzuren aan te bevelen als aanvulling op de standaardbehandeling voor hartfalen.
- Voor overige leefstijladviezen (roken, voeding, alcohol), zie:
Cachexie komt voor bij patiënten met ernstig hartfalen. Men spreekt van cachexie bij onbedoeld gewichtsverlies > 5% in ≤ 6 maanden of > 10% in > 6 maanden (na correctie voor over- of onderhydratie), veroorzaakt door een chronische ziekte met inflammatie. De pathofysiologie van cachexie bij hartfalen is complex en nog niet geheel duidelijk. Verminderde voedselinname (ondervoeding), malabsorptie door veneuze stuwing van het maag-darmkanaal, gestoorde stofwisseling, chronische ontsteking, hormoonresistentie, neurohormonale ontregeling en verminderde anabole stofwisseling zijn van invloed. Het effect van dieetsupplementen en eetlustbevorderende farmacotherapie is niet onderzocht.
Cachexie bij hartfalen is een belangrijke negatieve prognostische factor.
Er is geen bewijs dat gewichtsreductie bij overgewicht leidt tot een betere prognose of minder symptomen van hartfalen. Wel is bekend dat afvallen bij obese hartfalenpatiënten kan leiden tot afname van de klachten en verbetering van de kwaliteit van leven. Ook kan gewichtsvermindering bij deze patiënten leiden tot vermindering van slaapapneu. Bij matig en ernstig hartfalen wordt afvallen niet routinematig geadviseerd omdat ongewild gewichtsverlies en anorexie veel voorkomen bij verdere progressie van hartfalen. In aansluiting op de ESC-richtlijn wordt gewichtsreductie pas aanbevolen bij een BMI ≥ 35 kg/m2.
Omega-3-vetzuren kunnen worden ingenomen in de vorm van supplementen of in de vorm van vette vis. Een systematische review vond 1 onderzoek naar het effect van omega-3-vetzuren bij patiënten met hartfalen. GISSI-HF was een dubbelblind gerandomiseerd onderzoek waarin de deelnemers (n = 6975; > 90% met HFrEF) n-3-meervoudig onverzadigde vetzuren in capsulevorm kregen, dan wel placebo. De onderzoekers vonden een voordeel voor de groep die n-3-meervoudig onverzadigde vetzuren gebruikte: voor de uitkomstmaat ‘totale sterfte’ was het relatief risico (RR) 0,91 (95%-BI 0,83-0,99), voor ‘sterfte of ziekenhuisopname wegens cardiovasculaire aandoening’ was het RR 0,92 (95%-BI 0,85-0,99). De werkgroep acht de bewijskracht laag (slechts 1 onderzoek, het geschatte effect ligt buiten het klinisch relevante effect met een betrouwbaarheidsinterval net < 1). Dagelijks gebruik van omega-3-vetzuurcapsules van 1000 mg kost bij de apotheek circa € 30 per maand.
Individueel zorgplan
Naar Samenvatting ›- Bespreek met de patiënt de wenselijkheid om samen een individueel zorgplan (IZP) op te stellen, dat tot doel heeft:
- de zorg af te stemmen op de doelen, behoeften en wensen van de patiënt
- inzicht te krijgen in de betrokkenheid van andere zorgverleners
- Stel het IZP op samen met de patiënt en diens mantelzorgers of naasten.
- Breng eerst de ervaren problemen in kaart op een probleemlijst; hiervoor bestaan diverse modellen.
- Inventariseer vervolgens welke problemen prioriteit hebben en welke bijbehorende doelen de patiënt wil behalen.
- Leg in het IZP vast:
- de doelen die de patiënt wil behalen
- de acties om deze doelen te bereiken en wie die acties uitvoert
- een evaluatiedatum
- wie de zorg coördineert (zie Organisatie van de zorg)
Bij patiënten met ingewikkelde problematiek, en vooral wanneer daarbij meerdere zorgverleners betrokken zijn, kan het helpen om samen met de patiënt en diens naasten of mantelzorgers de problemen in kaart te brengen met een probleemlijst. Deze lijst vormt vervolgens de basis voor een individueel zorgplan (IZP) waarin de doelen, wensen en behoeften van de patiënt en diens naasten, plus de daarover gemaakte afspraken met de betrokken zorgverleners, worden vastgelegd. Het IZP geeft een overzicht over alles wat er speelt en dient als leidraad voor het zorgproces voor de komende maanden. Dit helpt om samenhangende en proactieve persoonsgerichte zorg te kunnen bieden.
Probleemlijst
Er zijn verschillende modellen voor het opstellen van een probleemlijst, 2 voorbeelden zijn het SFMPC-model en het 4-domeinenmodel. Met behulp van deze modellen kunnen de problemen die spelen inzichtelijk worden gemaakt, maar ook hoe de problemen elkaar onderling beïnvloeden en wat hun invloed is op de gezondheidsbeleving van de patiënt. De probleemlijst fungeert als kapstok voor het op te stellen zorgplan.
SFMPC-model
Dit model brengt een prioritering aan in beperkingen en problemen op verschillende levensgebieden: welke zijn het urgentst voor de oudere zelf en voor de hulpverlening? Zie Protocollaire Ouderenzorg en Kaart probleeminventarisatie/zorgbehandelplan.
- Somatisch
- Functioneel
- Maatschappelijk: zowel het sociale netwerk (microcultuur) als participatie in de maatschappij (macrocultuur)
- Psychisch
- Communicatie: bijvoorbeeld horen en zien
Het 4 Domeinenmodel
Dit model is gebaseerd op integraal, biopsychosociaal denken en handelen, en wordt samen met de betrokkene ingevuld (zie www.overvechtgezond.nl).
- Lichaam: ziektes, letsel, beperkingen.
- Geest: ziektes, cognities/gevoelens, karakter, life-events, religie/cultuur.
- Maatschappelijk: (vrijwilligers)werk, wonen, financiën.
- Sociaal: gezin/familiesysteem, informele ondersteuning, relatie met het zorgsysteem
Individueel zorgplan
Zie ook Protocollaire ouderenzorg (2015).
- Probeer in gesprek met de patiënt, diens naasten en eventuele andere betrokken zorgverleners te weten te komen wat belangrijk is in het leven van de patiënt en wat diens behoeften en wensen zijn:
- Wat vindt u belangrijk in het leven?
- Welke ideeën en gedachten heeft u over de toekomst?
- Wat maakt uw leven zinvol?
- Welke problemen wegen het zwaarst en waarom?
- Wat zou u daaraan willen doen? Wilt u hulp daarbij en van wie?
- Inventariseer vervolgens welke problemen prioriteit hebben en welke doelen de patiënt wil behalen.
- Besluit samen met de patiënt en diens naasten welke acties worden ondernomen om de doelen te bereiken. Dit kunnen acties of interventies zijn door de patiënt zelf, door een naaste of mantelzorger, of door een professionele zorgverlener.
- Leg in het zorgplan vast wie deze acties coördineert en wanneer ze worden opgevolgd en geëvalueerd.
Medicamenteuze behandeling
Naar Samenvatting ›Hoofddoelen
Naar Samenvatting ›- Klachten, functioneren en kwaliteit van leven verbeteren
- Ziekenhuisopname voorkomen
- Mortaliteit verminderen
Indicaties
Naar Samenvatting ›- In principe is de cardioloog degene die de medicatie ter behandeling van hartfalen start.
- Bij patiënten die naar de cardioloog zijn verwezen wegens een sterk vermoeden van hartfalen kan de huisarts ervoor kiezen de medicatie alvast te starten.
- Bij patiënten die niet naar het ziekenhuis kunnen of willen, kan de huisarts de medicatie instellen ook zonder dat de cardioloog de diagnose ‘hartfalen’ heeft gesteld.
- Bij HFpEF kan de huisarts de patiënt doorgaans zelf behandelen en begeleiden.
Medicamenteuze behandeling van HFpEF
Naar Samenvatting ›- Streef naar symptoomverlichting en verbetering van de kwaliteit van leven; geen enkele behandeling heeft een aangetoond effect op de morbiditeit en mortaliteit van HFpEF.
- Behandel cardiovasculaire en niet-cardiovasculaire morbiditeit conform de betreffende richtlijnen.
- Behandel hypertensie volgens de NHG-Standaard Cardiovasculair risicomanagement, maar vermijd calciumantagonisten met een niet-dihydropiridinestructuur (diltiazem en verapamil) vanwege hun negatief inotrope effect.
- Geef bij tekenen van overvulling een lisdiureticum (zie tabel 9); verlaag de dosis als de patiënt voldoende ontwaterd is tot de laagste effectieve dosering of staak tijdelijk.
Zowel bij HFrEF als bij HFpEF is er een pompfunctiestoornis van het hart, maar de pathofysiologie verschilt en daarmee de behandeling. Karakteristiek voor HFpEF is toegenomen stijfheid van het myocard, waardoor het einddiastolisch volume van de linkerventrikel onvoldoende is. In tegenstelling tot bij HFrEF zijn de behandelmogelijkheden voor HFpEF vooralsnog teleurstellend voor wat btreft het mortaliteit en morbiditeit. Wel is goede symptomatische behandeling mogelijk.
Symptomatische behandeling
- Optimale titratie van lisdiuretica bij overvulling. Indien de overvulling is verdwenen, moet de dosering worden verlaagd of gestaakt om ondervulling te voorkomen. Het probleem bij HFpEF is vooral gebrekkige relaxatie tijdens de diastole, waardoor bij een laag volumeaanbod ondervulling van de linker ventrikel kan optreden.
- Optimale bloeddrukbehandeling; er zijn aanwijzingen dat er mogelijk sprake is van enige reductie van de mortaliteit door aldosteronantagonisten.
- Leefstijl- en medicamenteuze interventies gericht op cardiovasculaire en niet-cardiovasculaire comorbiditeit.
Aldosteronantagonisten
Het TOPCAT-onderzoek includeerde 3445 patiënten met hartfalen en LVEF ≥ 45%, die behandeld werden met spironolacton of placebo. Spironolacton gaf geen reductie van de primaire samengestelde uitkomstmaat ‘mortaliteit als gevolg van cardiovasculaire oorzaak, overleving na hartstilstand en ziekenhuisopname wegens hartfalen’. Alleen de enkele uitkomstmaat ‘ziekenhuisopname wegens hartfalen’ kwam minder vaak voor in de spironolactongroep (206 (12,0%) versus 245 (14,2%); HR 0,83; 95%-BI 0,69 tot 0,99; p = 0,04). Opvallend in dit onderzoek waren echter de grote verschillen tussen Noord- en Zuid-Amerikaanse landen enerzijds en Oost-Europese landen anderzijds. Om te beginnen verschilden bijna alle baselinegegevens. De patiënten uit Oost-Europa waren bijvoorbeeld jonger, hadden minder vaak atriumfibrilleren en diabetes mellitus type 2, en vaker een myocardinfarct of opname wegens hartfalen in de voorgeschiedenis. Bij Amerikaanse deelnemers had spironolacton een gunstig effect op de primaire samengestelde uitkomstmaat (HR 0,82; 95%-BI 0,69 tot 0,98) en nam de mortaliteit als gevolg van een cardiovasculaire oorzaak af (HR 0,74; 95%-BI 0,57 tot 0,97), evenals ziekenhuisopnames wegens hartfalen (HR 0,82; 95%-BI 0,67 tot 0,99). Bij de Oost-Europese deelnemers was spironolacton effectief op geen enkele uitkomstmaat en kwamen zowel in de spironolactongroep als in de placebogroep beduidend minder cardiovasculaire gebeurtenissen voor dan bij de Amerikaanse deelnemers (8,9 versus 29,5% had ≥ 1 cardiovasculaire gebeurtenis). Tenslotte werd bij Amerikaanse deelnemers die spironolacton slikten vaker een stijging van kalium en creatinine gezien dan bij Oost-Europese deelnemers.
In Aldo-DHF, een onderzoek onder 422 patiënten met hartfalen en LVEF ≥ 50%, resulteerde spironolacton slechts in een lichte echocardiografische verbetering zonder verbeterde inspanningscapaciteit of klachtenreductie.
Conclusie
Behandel bij patiënten met HFpEF cardiovasculaire en niet-cardiovasculaire comorbiditeit ter verbetering van symptomen, kwaliteit van leven en prognose. Aangezien een klein gunstig effect van spironolacton alleen wordt gezien in een subgroep van Amerikaanse patiënten gaat de voorkeur vooralsnog niet uit naar een aldosteronantagonist voor de behandeling van hypertensie. De werkgroep adviseert hypertensie te behandelen volgens de NHG-Standaard Cardiovasculair risicomanagement.
Bij klachten of klinische tekenen van overvulling wordt optimale titratie van lisdiuretica geadviseerd. Na het verdwijnen van de overvulling moet het lisdiureticum worden verlaagd of gestaakt om ondervulling te voorkomen.
Medicamenteuze behandeling van HFrEF en HFmrEF
Naar Samenvatting ›- Behandel patiënten met HFmrEF hetzelfde als patiënten met HFrEF; volg daarbij het Stappenplan hartfalenmedicatie.
- Pas bij HFrEF en HFmrEF naast lisdiuretica RAS-remmers, bètablokkers en aldosteronantagonisten toe conform het stappenplan. RAS-remmers (antagonisten van het renine-angiotensinesysteem) zijn angiotensineconverterendenzymremmers (ACE-remmers) of angiotensinereceptorblokkers (ARB’s).
- Streef naar maximale dosering van RAS-remmers, bètablokkers en aldosteronantagonisten, want patiënten die hoge doseringen verdragen, hebben de beste prognose.
- Voor doseringen, zie tabel 9 (lisdiuretica) en tabel 10 (RAS-remmers, bètablokkers en aldosteronantagonisten).
Stappenplan hartfalenmedicatie
Naar Samenvatting ›- Controleer voor aanvang van de behandeling of eGFR plus creatinine, natrium en kalium recent bepaald zijn; overleg zo nodig met de cardioloog bij afwijkende waarden.
- Start een RAS-remmer (een ACE-remmer of indien deze niet wordt verdragen een ARB) in lage dosering. Start bij tekenen van overvulling een lisdiureticum.
- Voeg bij patiënten die met RAS-remmer en diureticum klinisch stabiel zijn (geen duidelijke tekenen van overvulling hebben) een bètablokker toe in lage dosering.
- Verhoog de dosering van de RAS-remmer en bètablokker (bijvoorbeeld per 2 weken) tot de maximale dosis die wordt verdragen, met inachtneming van de maximale dosering. Verhoog de bètablokker niet bij tekenen van exacerbatie, hypotensie of bradycardie.
- Verlaag de dosering van het lisdiureticum als de patiënt voldoende ontwaterd is en continueer de laagste effectieve dosering.
- Overweeg toevoeging van een aldosteronantagonist bij patiënten die klachten houden ondanks adequate instelling op RAS-remmer, diureticum en bètablokker:
- aldosteronantagonisten worden in principe aanbevolen bij een LVEF < 35%, maar voor patiënten bij wie echocardiografie niet mogelijk of wenselijk is, kan de huisarts een aldosteronantagonist toevoegen op basis van de klachten
- overweeg de dosis van de aldosteronantagonist te verdubbelen indien het hartfalen na 4-8 weken niet is verbeterd, de nierfunctie niet verslechtert en het kalium < 5 mmol/l blijft.
Patiënten met HFmrEF hebben een LVEF van 40-49%. In de literatuur zijn er steeds meer aanwijzingen dat patiënten met HFmrEF over het algemeen ‘mild’ HFrEF hebben en goed reageren op de medicatie zoals aanbevolen voor HFrEF: ACE-remmer of angiotensinereceptorblokker, bètablokker en eventueel aldosteronantagonist. De werkgroep adviseert daarom patiënten met HFmrEF te behandelen zoals bij HFrEF.
Het is van belang patiënten met hartfalen te blijven indelen op basis van de oorspronkelijke ejectiefractie. Als een patiënt bijvoorbeeld een LVEF van 30% had, maar deze met medicatie gestegen is naar 52%, is er nog steeds sprake van HFrEF.
De meeste huisartsen zien slechts enkele nieuwe patiënten met HFrEF per jaar en hebben daardoor weinig ervaring met de behandeling hiervan. Om die reden zullen zij patiënten met HFrEF meestal verwijzen. Het stappenplan kan worden gebruikt door huisartsen die de behandeling toch zelf willen instellen, bijvoorbeeld omdat de patiënt niet meer naar het ziekenhuis kan of wil, en die zich voldoende bekwaam voelen.
Stappenplan bij medicamenteuze behandeling van HFrEF en HFmrEF door de huisarts
Er zijn geen grote wijzigingen in de medicamenteuze aanbevelingen ten opzichte van de vorige versie van deze standaard, behalve dat digoxine niet langer wordt aanbevolen en ook de beperkte indicatie voor thiazidediuretica is vervallen. Reden hiervoor is dat beide middelen een beperkte meerwaarde hebben ten opzichte van de aanbevolen medicatie in het stappenplan, maar wel (ernstige) bijwerkingen kunnen veroorzaken. Het stappenplan volgt de geldende ESC-richtlijn.
Patiënten met hartfalen die hoge doseringen hartfalenmedicatie verdragen, hebben de beste prognose. Daarom luidt het advies bij hartfalen te streven naar maximale dosering, dit in tegenstelling tot bijvoorbeeld hypertensie, waarbij dezelfde soorten geneesmiddelen gebruikt worden maar geadviseerd wordt de dosis te verhogen totdat de gewenste bloeddruk bereikt is. Er is bij hartfalen geen harde ondergrens te geven tot waar de systolische bloeddruk mag zakken, zolang de patiënt er maar niet te veel last van heeft.
Bij hartfalenmedicatie is maatwerk van belang en moet in samenspraak met de patiënt de afweging gemaakt worden in hoeverre bepaalde bijwerkingen opwegen tegen een betere overleving. Daarbij hoort ook een inschatting hoe kwetsbaar de patiënt is, want bijvoorbeeld (orthostatische) hypotensie met duizeligheid kan een valpartij tot gevolg hebben. Deze afweging zal per patiënt verschillen en indien zowel de cardioloog als de huisarts betrokken zijn bij de behandeling zal onderlinge afstemming noodzakelijk zijn.
RAS-remmers
ACE-remmers verminderen de klachten en de kans op ziekenhuisopnames wegens acute verslechtering van hartfalen, en verlengen de verwachte overleving. In 2 grote klinische onderzoeken bij patiënten met mild tot ernstig systolisch hartfalen (n = 2800) is het effect van enalapril vergeleken met placebo. De meeste patiënten werden ook behandeld met een diureticum en digoxine, ongeveer 10% kreeg daarnaast een bètablokker.
In het CONSENSUS-onderzoek werden patiënten met ernstig hartfalen geïncludeerd, van wie 53% ook spironolacton gebruikte, in SOLVD-Treatment hadden de deelnemers met mild of matig hartfalen. In beide onderzoeken deed de ACE-remmer de mortaliteit afnemen: de relatieve risicoreductie (RRR) was 27% in CONSENSUS en 16% in SOLVD-Treatment. Bij mild of matig hartfalen (SOLVD-Treatment) zorgde de ACE-remmer voor een absolute risicoreductie (ARR) van mortaliteit van 4,5%, hetgeen overeenkomt met een number needed to treat (NNT) van 22 over een periode van 41 maanden. Bij ernstig hartfalen (CONSENSUS) was de ARR 14,6% en het NNT 7 over een periode van 6 maanden. In SOLVD-Treatment daalde ook het aantal ziekenhuisopnames wegens verslechterend hartfalen met 26% bij behandeling met een ACE-remmer.
In het ATLAS-onderzoek werden 3164 patiënten met matig tot ernstig hartfalen geïncludeerd en gerandomiseerd naar een lage of hoge dosis lisinopril. De relatieve risicoreductie (RRR) voor de gecombineerde uitkomst ‘dood of ziekenhuisopname wegens hartfalen’ bedroeg 15% in het voordeel van hooggedoseerd lisinopril.
Diuretica
Ontwatering met diuretica geeft verlichting van de symptomen bij pulmonale en systemische veneuze stuwing (overvulling). Diuretica kunnen echter als tegenreactie het RAS-systeem activeren, met als gevolg juist weer vergroting van het bloedvolume en stijging van de bloeddruk, wat een negatief effect heeft op het hartfalen. Daarom is het gebruikelijk diuretica te combineren met een RAS-remmer. Bij optimale instelling op RAS-remmers en bètablokkers kan vaak worden volstaan met een lage dosis diuretica of zelfs met intermitterend gebruik op geleide van tekenen van vochtretentie.
Bètablokkers
Behandeling met een bètablokker verlengt de verwachte overleving en vermindert de klachten, evenals de kans op ziekenhuisopnames wegens acute verslechtering van hartfalen. Naar de effecten van bètablokkers bij hartfalen is meer klinisch onderzoek gedaan dan naar de effecten van RAS-remmers. In 3 grote onderzoeken werden bijna 9000 patiënten met mild tot ernstig hartfalen gerandomiseerd naar placebo of een bètablokker (bisoprolol, carvedilol of metoprololsuccinaat met vertraagde afgifte). Van de deelnemers gebruikte > 90% al een RAS-remmer en een diureticum, en > 50% digoxine. In alle 3 de onderzoeken daalden < 1 jaar jaar na de start van de bètablokker de mortaliteit (RRR 34%) en het aantal ziekenhuisopnames wegens verslechterend hartfalen (RRR 28-36%). In 2 onderzoeken verbeterde ook de kwaliteit van leven. De absolute risicoreductie (ARR) op overlijden na 1 jaar behandeling was 4,3% (NNT 23) bij mild tot matig ernstig hartfalen en 7,1% (NNT 14) bij ernstig hartfalen.
Het SENIORS-onderzoek, een gerandomiseerde trial onder 2128 ouderen (gemiddeld 70 jaar, 36% met een LVEF < 35%), ondersteunt deze bevindingen. Behandeling met nebivolol gaf een RRR van 14% op de primaire uitkomst ‘dood of ziekenhuisopname wegens een cardiovasculaire indicatie’ .
Bovengenoemde bevindingen worden ook gesteund door ouder onderzoek, door meta-analyses van kleinere onderzoeken en door een placebogecontroleerd post-myocardinfarctonderzoek onder 1959 patiënten met een LVEF ≤ 40%. In laatstgenoemd onderzoek werd met carvedilol een sterftereductie (RRR) bereikt van 23% tijdens een follow-up van gemiddeld 1,3 jaar. Een groot gerandomiseerd onderzoek met bucindolol toonde geen significante sterftereductie, maar de trend van de bevindingen kwam wel overeen met die in de bovengenoemde onderzoeken.
In het COMET-onderzoek werd aangetoond dat carvedilol qua sterftereductie effectiever was dan metoprololtartraat (in het eerder genoemde MERIT-HF onderzoek was langwerkend metoprololsuccinaat-retard gebruikt).
Aldosteronantagonisten
Overweeg toevoeging van een aldosteronantagonist bij patiënten die klachten houden ondanks adequate instelling op een RAS-remmer, diureticum en bètablokker. In principe geldt dat aldosteronantagonisten worden aanbevolen voor patiënten met een LVEF < 35%. Echter, voor die patiënten die niet naar de tweede lijn kunnen of willen en een echocardiogram niet in eigen beheer van de huisarts kan worden aangevraagd, kan de huisarts overwegen om op basis van klachten een aldosteronantagonist toe te voegen.
- Spironolacton heeft de voorkeur vanwege de aanzienlijk lagere kosten. Daarmee sluit deze standaard aan op de Praktische handleiding bij de NHG-Standaard CVRM (2019).
- Spironolacton kan anti-androgene of antiprogestagene bijwerkingen geven, zoals pijnlijke borsten, gynaecomastie of stemverlaging. In dat geval kan spironolacton worden vervangen door eplerenon, aangezien deze bijwerkingen minder vaak voorkomen bij eplerenon.
- Een nadeel van eplerenon is de mogelijke interactie met matig sterke CYP3A4-remmers (eytromycine, fluconazol, saquinavir, verapamil, diltiazem, amiodaron); bij gelijktijdig gebruik is de maximale dosering van eplerenon lager.
- Vermijd gelijktijdig gebruik van aldosteronantagonisten met sterke CYP3A4-remmers (ketoconazol, itraconazol, claritromycine) en sterke CYP3A4-inductoren.
Achtergrond
De vorige versie van deze Standaard (2010) adviseerde het toevoegen van een aldosteronantagonist of een angiotensinereceptorblokker (ARB) als er ernstige klachten bleven bestaan ondanks adequate instelling op een ACE-remmer, diureticum en bètablokker. Toevoeging van een ARB aan een ACE-remmer leidt echter in feite tot dubbelblokkade van het RAAS-systeem, wat in theorie een verhoogd risico op bijwerkingen geeft. Daarom is de vraag of het niet beter is om alleen een aldosteronantagonist bij te starten en géén ARB als de basisbehandeling onvoldoende werkt.
Het heeft sterk de voorkeur om de ejectiefractie te bepalen alvorens een aldosteronantagonist te starten, zodat de effectiviteit kan worden ingeschat.
Uitgangsvraag 1
Is een aldosteronantagonist aan te bevelen als aanvulling indien de behandeling met ACE-remmer, diureticum en bètablokker onvoldoende werkt?
| Patiënten | Patiënten met hartfalen (met gereduceerde ejectiefractie) in de eerste lijn bij wie de behandeling met ACE-remmer, diureticum en bètablokker onvoldoende werkt |
|---|---|
| Interventie | Aldosteronantagonisten als aanvulling op de behandeling |
| Vergelijking | Placebo als aanvulling op de behandeling |
| Uitkomstmaten | Sterfte, alle oorzaken Kwaliteit van leven Ongeplande ziekenhuisopname Bijwerkingen: progressie naar ernstig nierfalen/ongeplande dialyse, elektrolytstoornissen, nierfunctieverslechtering, hypotensie, aritmie, bradycardie |
Uitgangsvraag 2
Is een ARB aan te bevelen als aanvulling op ACE-remmer, diureticum en bètablokker indien dit onvoldoende werkt?
| Patiënten | Patiënten met hartfalen (met gereduceerde ejectiefractie) in de eerste lijn bij wie de behandeling met ACE-remmer, diureticum en bètablokker onvoldoende werkt |
|---|---|
| Interventie | ARB als aanvulling op behandeling |
| Vergelijking | Placebo als aanvulling op behandeling |
| Uitkomstmaten | Sterfte, alle oorzaken Kwaliteit van leven Ongeplande ziekenhuisopname Bijwerkingen: progressie naar ernstig nierfalen/ongeplande dialyse, electrolytstoornissen, nierfunctieverslechtering, hypotensie, aritmie, bradycardie |
Methode
In juni 2020 is in PubMed en Embase een systematische literatuursearch uitgevoerd naar systematische reviews en RCT’s.
Resultaten
Resultaat zoekactie
De literatuursearch leverde 1 systematische review op naar de effecten en bijwerkingen van aldosteronantagonisten en ARB’s bij patiënten met hartfalen, bij wie behandeling met ACE-remmer, diureticum en bètablokker niet goed genoeg werkt.
Onderzoekskarakteristieken
De reviewers onderzochten welke farmacologische behandeling het effectiefst en het veiligst is voor patiënten met hartfalen bij wie behandeling met ACE-remmer, diureticum en bètablokker niet goed genoeg werkt. Zij includeerden 16 RCT’s met in totaal 31.429 patiënten; de gemiddelde leeftijd was 63 jaar (SD 11) en de gemiddelde LVEF was 31% (SD 7%). Vergeleken werden placebo, ARB’s (6 RCT’s) en aldosteronantagonisten (8 RCT’s). De meeste RCT’s vergeleken placebo met 1 middel (canrenon, candesartan, valsartan, telmisartan, eplerenon en spironolacton), maar ook werden combinaties van middelen vergeleken met 1 ander middel (enalapril + candesartan versus enalapril; captopril + valsartan versus captopril). Geanalyseerd werden de effectiviteit op sterfte en ziekenhuisopname (door hartfalen) en de bijwerkingen hyperkaliëmie, nierfalen en hypotensie.
Effectiviteit en bijwerkingen
Voor effectiviteit en bijwerkingen van aldosteronantagonisten en ARB’s, zie tabel 6 en tabel 7.
|
Uitkomsten |
Relatief effect (95%-BI) |
Aantal deelnemers (onderzoeken) |
Kwaliteit van bewijs (GRADE) |
Samenvatting |
|---|---|---|---|---|
|
Sterfte, alle oorzaken |
Rate ratio 0,79 (0,66 tot 0,98) |
– (8) |
⨁⨁◯◯ LAAG*,† |
Een aldosteronantagonist vermindert mogelijk de kans op sterfte aan alle oorzaken |
|
Kwaliteit van leven |
Niet gepoold |
0 (0) |
– |
– |
|
Ongeplande ziekenhuisopname |
Rate ratio 0,74 (0,55 tot 0,94) |
– (8) |
⨁⨁◯◯ LAAG*,† |
Een aldosteronantagonist vermindert mogelijk de kans op ongeplande ziekenhuisopname |
|
Nierfalen |
Rate ratio niet gerapporteerd (0,67 tot 3,87) |
– (8) |
⨁◯◯◯ ZEER LAAG*,‡ |
Het is onzeker of een aldosteronantagonist de kans op nierfalen vergroot |
|
Hyperkaliëmie |
Rate ratio 2,10 (1,29 tot 4,14) |
– (8) |
⨁⨁⨁◯ REDELIJK* |
Een aldosteronantagonist vergroot waarschijnlijk de kans op hyperkaliëmie |
|
Hypotensie |
Rate ratio 1,35 (0,78 tot 2,41) |
– (8) |
⨁◯◯◯ ZEER LAAG*,‡ |
Het is onzeker of een aldosteronantagonist de kans op hypotensie vergroot |
|
Andere bijwerkingen (bradycardie, aritmie, elektrolytstoornis, progressie naar ernstig nierfalen/ongeplande dialyse) |
Niet gepoold |
0 (0) |
– |
– |
|
* Heterogeniteit: artikel heeft niet gerapporteerd over inconsistentie in de resultaten. |
||||
|
Uitkomsten |
Relatief effect (95%-BI) |
Aantal deelnemers (onderzoeken) |
Kwaliteit van bewijs (GRADE) |
Samenvatting |
|---|---|---|---|---|
|
Sterfte, alle oorzaken |
Rate ratio 0,96 (0,80, 1,17) |
– (8) |
⨁◯◯◯ ZEER LAAG*,† |
Het is onzeker of een ARB sterfte kan verminderen |
|
Kwaliteit van leven |
Niet gepoold |
0 (0) |
– |
– |
|
Ongeplande ziekenhuisopname |
Rate ratio 0,74 (0,68, 1,04) |
– (8) |
⨁◯◯◯ ZEER LAAG*,† |
Het is onzeker of een ARB ongeplande ziekenhuisopname kan verminderen |
|
Nierfalen |
Rate ratio 2,26 (1,14, 6,51) |
– (8) |
⨁⨁⨁◯ REDELIJK* |
Een ARB vergroot waarschijnlijk de kans op nierfalen |
|
Hyperkaliëmie |
Rate ratio 2,38 (1,20, 5,26) |
– (8) |
⨁⨁⨁◯ REDELIJK* |
Een ARB vergroot waarschijnlijk de kans op hyperkaliëmie |
|
Hypotensie |
Rate ratio 1,63 (1,30, 2,62) |
– (8) |
⨁⨁⨁◯ REDELIJK* |
Een ARB vergroot waarschijnlijk de kans op hypotensie |
|
Andere bijwerkingen (bradycardie, aritmie, elektrolytstoornis, progressie naar ernstig nierfalen/ongeplande dialyse) |
Niet gepoold |
0 (0) |
– |
– |
|
* Heterogeniteit: artikel heeft niet gerapporteerd over inconsistentie in de resultaten. |
||||
Conclusies
Voor beide uitgangsvragen geldt dat niet bekend is of er een verschil in effect is op kwaliteit van leven, bradycardie en aritmie. Conclusies over de andere uitkomsten worden per vergelijking gegeven.
Aldosteronantagonist versus placebo
- Een aldosteronantagonist vermindert mogelijk de kans op sterfte en ongeplande ziekenhuisopname.
- Een aldosteronantagonist vergroot waarschijnlijk de kans op hyperkaliëmie.
- Het is onzeker of een aldosteronantagonist de kans op nierfalen en hypotensie vergroot.
ARB versus placebo
- Het is onzeker of een ARB de kans op sterfte en ongeplande ziekenhuisopname vermindert.
- Een ARB vergroot waarschijnlijk de kans op hyperkaliëmie, nierfalen en hypotensie.
Van bewijs naar aanbeveling
Voor- en nadelen
- Het toevoegen van een aldosteronantagonist heeft mogelijk positieve effecten op sterfte en ongeplande ziekenhuisopname in vergelijking met placebo.
- Een aldosteronantagonist vergroot waarschijnlijk de kans op hyperkaliëmie in vergelijking met placebo; voor andere bijwerkingen is dat onzeker.
- Het is onzeker of het toevoegen van een ARB in vergelijking met placebo positieve effecten heeft op sterfte en ongeplande ziekenhuisopname.
- Een ARB vergroot waarschijnlijk de kans op hyperkaliëmie, nierfalen en hypotensie in vergelijking met placebo.
Kwaliteit van bewijs
De kwaliteit van bewijs varieerde van zeer laag tot redelijk. De RCT’s geïncludeerd in de meta-analyse zijn bijna allemaal goed uitgevoerd. Bij alle uitkomsten is echter onduidelijk hoe heterogeen de resultaten zijn en een gedeelte van de resultaten is (zeer) onnauwkeurig.
Waarden en voorkeuren van patiënten
De patiënt geeft de voorkeur aan het middel met de beste werking en de minste bijwerkingen. Toevoeging van een aldosteronantagonist lijkt te leiden tot beter effect en minder bijwerkingen dan toevoeging van een ARB, en daarom zullen de meeste patiënten voor een aldosteronantagonist kiezen.
Waarom deze aanbeveling?
In theorie leidt toevoegen van een ARB aan een ACE-remmer tot meer bijwerkingen dan toevoegen van een aldosteronantagonist. Er is helaas geen onderzoek dat de directe vergelijking tussen een ARB en een aldosteronantagonist heeft onderzocht. Uit vergelijkingen met placebo lijken aldosteronantagonisten een betere optie omdat zij mogelijk meer voordelen hebben (positief effect op sterfte en ziekenhuisopname) dan ARB’s, terwijl een ARB waarschijnlijk een grotere kans op nierfalen en hypotensie geeft.
Aanbeveling
- Verwijs patiënten die ondanks adequate instelling op een ACE-remmer, diureticum en bètablokker klachten houden of krijgen naar de cardioloog voor beoordeling van de ejectiefractie en eventuele start van behandeling met een aldosteronantagonist.
- De werkgroep raadt af om een ARB te starten als de patiënt al een ACE-remmer gebruikt.
De voorkeursmiddelen per geneesmiddelgroep zijn geselecteerd op basis van:
- afweging van de mate van bewijs uit gepubliceerde RCT’s in aansluiting op de ESC-richtlijn Hartfalen
- registratie voor de indicatie hartfalen
- aansluiting bij NHG-Standaard Cardiovasculair risicomanagement en NHG-Standaard Stabiele angina pectoris
- kosten (zie tabel 8)
Uitgangspunten
- Alle geneesmiddelen binnen een geneesmiddelgroep zijn gelijkwaardig wat betreft effectiviteit, veiligheid, bijwerkingen en toepasbaarheid, behalve als ze onderling duidelijk van elkaar verschillen in bijvoorbeeld farmacokinetiek of farmacodynamiek.
- Binnen de geneesmiddelgroepen die geregistreerd zijn voor hartfalen (ACE-remmers, angiotensinereceptorblokkers, bètablokkers) zijn er geen relevante onderlinge verschillen tussen geneesmiddelen.
- De voorkeursmiddelen in de ESC-richtlijn zijn niet als enige leidend geweest bij het selecteren van voorkeursmiddelen. In de ESC-richtlijn worden alleen geneesmiddelen aanbevolen waarvan effectiviteit aangetoond is in grote RCT’s, maar dit betekent niet dat andere geneesmiddelen uit dezelfde geneesmiddelgroepen niet effectief zijn. Het feit dat geneesmiddelen geregistreerd zijn voor hartfalen is voldoende om uit te gaan van aangetoonde effectiviteit.
- Een deel van de patiënten met hartfalen komt ook in aanmerking voor cardiovasculair risicomanagement of heeft behandeling nodig vanwege hartklachten zoals angina pectoris. Het is handig om waar mogelijk de voorkeursmiddelen voor hypertensie en angina pectoris ook als voorkeursmiddel voor hartfalen aan te wijzen.
- Door overlap in voorkeursmiddelen kan de huisarts ervaring opdoen met een beperkt aantal geneesmiddelen uit een groep.
- Geneesmiddelen die 3 dd ingenomen moeten worden (captopril), vallen af vanwege het beperkte gebruiksgemak.
Kosten
Voor de kostenvergelijking zijn de kosten per 30 dagen berekend op basis van www.medicijnkosten.nl (geraadpleegd op 12 oktober 2020).
| Geneesmiddel | Voorkeur ESC richtlijn Hartfalen | Voorkeur CVRM/angina pectoris* | Geschatte gemiddelde onderhoudsdosering en maximumdosering | Kosten gemiddelde onderhoudsdosering per 30 dagen (€) |
|---|---|---|---|---|
| ACE-remmers | ||||
| benazepril |
Nee | Nee | n.v.t. (aanbevolen dosering bij hartfalen met beschikbare doseereenheid (20 mg) niet beschikbaar) | |
| captopril |
Ja | Nee | n.v.t. (vanwege 3 dd doseren geen optie) | |
| enalapril | Ja | Ja (CVRM) | 2 dd 10 mg 2 dd 20 mg |
1,20 1,80 |
| fosinopril |
Nee | Nee | 1 dd 20 mg 1 dd 40 mg |
2,70 5,40 |
| lisinopril | Ja | Ja (CVRM) | 1 dd 20 mg 1dd 40 mg |
0,60 1,20 NB: kosten bij 1 dd 30 mg € 15,90! |
| perindopril-tertbutylamine |
Nee | Ja (CVRM) | 1 dd 4 mg 1 dd 8 mg |
0,90 1,20 |
| quinapril |
Nee | Nee | 1 dd 20 mg / 2 dd 10 mg 2 dd 20 mg |
4,20 / 7,80 8,40 |
| ramipril |
Ja | Ja (CVRM) | 2 dd 2,5 mg 2 dd 5 mg |
3,00 (tablet)/7,20 (capsule) 3,00 (tablet)/7,20 (capsule) |
| trandolapril | Ja | Nee | Niet beschikbaar als monopreparaat | |
| Angiotensinereceptorblokkers (ARB’s)† | ||||
| candesartan | Ja | Ja (CVRM) | 1 dd 16 mg 1 dd 32 mg |
1,20 2,40 |
| losartan | Ja | Ja (CVRM) | 1 dd 50 mg 1 dd 150 mg |
0,60 1,80 |
| valsartan | Ja | Ja (CVRM) | 2 dd 80 mg 2 dd 160 mg |
5,40 7,80 |
| Bètablokkers | ||||
| bisoprolol | Ja | Ja (CVRM en AP) | 1 dd 5 mg 1 dd 10 mg |
0,60 0,90 |
| carvedilol | Ja | Nee | 2 dd 12,5 mg 2 dd 25 mg |
3,60 2,40 |
| metoprolol succinaat mga | Ja | Ja (CVRM en AP) | 1 dd 100 mg 1 dd 200 mg |
0,90 1,80 |
| nebivolol | Ja | Nee | 1 dd 5 mg 1 dd 10 mg |
1,50 3,00 |
| * Zie Praktische handleiding bij de NHG-Standaard CVRM (2019) en NHG-Standaard Stabiele angina pectoris. † Telmisartan en eprosartan zijn niet geregistreerd voor hartfalen, maar kunnen vanwege het ontbreken van een tetrazoolring een alternatief zijn in geval van problemen door vervuiling van sartanen met nitrosamides. |
||||
De doseringen zijn bepaald op basis van het advies in de ESC-richtlijn in combinatie met het advies van de KNMP Kennisbank (gebaseerd op het advies in de SmPC-tekst).
| Geneesmiddel | Gebruikelijke dagdosering (afhankelijk van de ernst van de klachten)* |
|---|---|
| Furosemide | 40-240 mg in 1-3 doses |
| Bumetanide | 1-6 mg in 1-2 doses |
| *Bij verminderde nierfunctie is een hogere dosering nodig. | |
| Geneesmiddel(groep) | Startdosis | Maximale dagdosering* | Dagdosering bij verminderde nierfunctie |
|---|---|---|---|
| ACE-remmers | |||
| enalapril | 2 dd 2,5 mg | 2 dd 20 mg | eGFR 30-50: startdosis 2 dd 2,5 mg; maximale dosis 2 dd 5 mg eGFR 10-30: startdosis 1 dd 2,5 mg; maximale dosis 2 dd 2,5 mg |
| lisinopril | 1 dd 2,5 mg | 1dd 40 mg | Geen aanpassing |
| perindopril† | 1 dd 2 mg | 1 dd 8 mg | eGFR 30-50: maximale dosis 2 mg eGFR 10-30: maximale dosis 2 mg om de dag |
| ramipril tablet | 1 dd 1,25 mg | 2 dd 5 mg | eGFR 10-50: maximale dosis 2 dd 2,5 mg |
| ARB’s | |||
| candesartan | 1 dd 4 mg | 1 dd 32 mg | Geen aanpassing |
| losartan‡ | 1 dd 12,5 mg | 1 dd 150 mg | Geen aanpassing |
| valsartan | 2 dd 40 mg | 2 dd 160 mg | Geen aanpassing |
| Bètablokkers | |||
| bisoprolol‡ | 1 dd 1,25 mg | 1 dd 10 mg | eGFR 10-30: startdosis halve tablet van 1,25 mg |
| metoprololsuccinaat mga |
1 dd 12,5-25 mg | 1 dd 200 mg | Geen aanpassing |
| Aldosteronantagonisten | |||
| spironolacton | 1 dd 12,5-25 mg | 1 dd 50 mg | Geen aanpassing. eGFR 10-50: bepaal eGFR + creatinine en kalium binnen 1 week na aanvang (eGFR < 30: overweeg consultatie cardioloog vanwege risico op hyperkaliëmie en afname nierfunctie) |
| ACE = angiotensineconverterendenzymremmer; ARB = angiotensinereceptorblokker; eGFR = geschatte glomerulaire filtratiesnelheid; mga = met gereguleerde afgifte. * Streef naar de maximale dosis die de patiënt verdraagt. † Voorkeursmiddel perindopril-tertbutylamine (laagste kosten). ‡ Voorkeursmiddel (laagste kosten). |
|||
Dosisverhoging bètablokker
Naar Samenvatting ›- Bij sommige patiënten geven bètablokkers in de beginfase tijdelijk verergering van de klachten. Verhoog de dosering dan langzaam tot de maximaal getolereerde dosis.
- Verhoog de dosering bètablokker niet bij:
- tekenen van exacerbatie (meer vochtretentie)
- symptomatische hypotensie (bijvoorbeeld duizeligheid bij opstaan)
- bradycardie (< 50/min)
Controles na aanvang of aanpassing medicatie
Naar Samenvatting ›- Vraag naar klachten (inspanningsvermogen) en mogelijke bijwerkingen van de medicatie.
- Meet bloeddruk, pols en gewicht.
- Bij asymptomatische lage bloeddruk en sinusbradycardie is aanpassing van de medicatie meestal niet nodig.
- Bepaal 1-2 weken na start of aanpassing van diureticum, RAS-remmer of aldosteronantagonist eGFR plus creatinine, natrium en kalium:
- bij afwijkende laboratoriumuitslagen, zie Beleid bij laboratoriumafwijkingen.
- bij goede instelling op de medicatie, zie Controles in de stabiele fase.
Maximale dosering voor vrouwen en mannen
Naar Samenvatting ›De maximale doseringen van medicatie voor hartfalen verschillen niet tussen mannen en vrouwen.
In 2019 verscheen een post-hocanalyse van BIOSTAT-CHF, een prospectief onderzoek naar de dosering hartfalenmedicatie bij mannen en vrouwen enerzijds en overlijden en ziekenhuisopname wegens hartfalen anderzijds. BIOSTAT-CHF onderzocht patiënten met HFrEF (LVEF < 40%) in 11 Europese landen. De post-hocanalyse betrof in totaal 1308 mannen en 402 vrouwen bij wie RAS-remmers en bètablokkers waren gestart en/of werden opgetitreerd volgens protocol. De vrouwen waren gemiddeld ouder (74 versus 70 jaar), lichter (72 versus 85 kg) en kleiner (162 versus 174 cm), maar de gemiddelde BMI was gelijk aan die van de mannen. Het percentage mannen dat de streefdosering bereikte van RAS-remmers (25%) en bètablokkers (14%) was vrijwel gelijk aan het percentage vrouwen (respectievelijk 23 en 13%). Bij mannen was het risico op overlijden of ziekenhuisopname als gevolg van hartfalen het kleinst bij 100% van de streefdosering, bij vrouwen was dit risico het kleinst bij 50% van de streefdoserin en nam het niet verder af bij verder ophogen. Dit suggereert dat in de behandeling van HFrEF bij vrouwen een lagere dosering RAS-remmers en bètablokkers volstaat dan bij mannen. In de praktijk gebruiken vrouwen vaak al lagere doseringen omdat de middelen over het algemeen individueel worden gedoseerd op basis van bloeddruk, pols, gewicht en bijwerkingen.
De beschreven post-hocanalyse was retrospectief en geeft geen uitsluitsel over een causale relatie tussen de hoogte van de dosering en overlijden of ziekenhuisopname. Prospectief onderzoek is nodig om te onderzoeken of de streefdosis RAS-remmers en bètablokkers bij vrouwen inderdaad lager zou moeten zijn dan bij mannen.
Verdere aandachtspunten bij het voorschrijven van medicatie
Naar Samenvatting ›Lisdiuretica
Naar Samenvatting ›- Overweeg bij een hoge dosering furosemide over te stappen op bumetanide vanwege het gebruiksgemak en mogelijke bevordering van de therapietrouw; er is geen bewijs voor verschil in effectiviteit tussen beide middelen.
- Bij onvoldoende respons kan de dosering verdeeld worden over meerdere innamemomenten op de dag (vermijd inname na 18:00 uur om nachtelijke mictie te voorkomen).
Er is geen bewijs dat furosemide dan wel bumetanide beter werkt bij patiënten met ernstig hartfalen en bij patiënten met hartfalen en chronische nierschade: .
Voor de effectiviteit van wisselen van lisdiureticum bij patiënten met hartfalen en lisdiureticaresistentie is geen bewijs. Wisselen naar bumetanide biedt praktisch voordeel bij hoge doseringen omdat dan met minder tabletten kan worden volstaan. De sterkste beschikbare reguliere tablet furosemide is 40 mg (equivalent aan 1 mg bumetanide); van bumetanide zijn tabletten van 1, 2 en 5 mg beschikbaar.
Nota bene: Er is een tablet furosemide 500 mg beschikbaar, maar deze dosering is in de eerste lijn zeer ongebruikelijk.
Voor- en nadelen
Het is onduidelijk of furosemide meer voor- of nadelen oplevert dan bumetanide.
Kwaliteit van bewijs
Het verschil in effectiviteit tussen furosemide en bumetanide is onzeker. Dit komt omdat de kwaliteit van het bewijs voor patiënten met ernstig hartfalen zeer laag is (de onderzoeken bevatten bias, zijn klein en daardoor onnauwkeurig, en de patiëntengroep komt niet helemaal overeen met de doelgroep van de uitgangsvraag). Er is geen onderzoek gevonden bij personen met hartfalen en chronische nierschade, en geen trials die onderzoeken of wisselen van lisdiureticum zin heeft bij lisdiureticaresistentie.
Waarden en voorkeuren van patiënten
Geen bijzonderheden.
Kosten
Furosemide kost € 0,90 per maand bij een dagelijkse dosis van 40 mg en bumetanide kost €0,90 per maand bij een dagelijkse dosis van 1 mg (www.medicijnkosten.nl, geraadpleegd 5 november 2020.
Haalbaarheid en aanvaardbaarheid
Sommige artsen hebben de indruk dat wisselen van lisdiureticum soms meer symptoomverlichting geeft. Bumetanide heeft als voordeel dat het beschikbaar is in tabletten met krachtiger doseringen dan furosemide.
Aanbeveling
- De werkgroep kan geen aanbeveling geven over welk lisdiureticum (furosemide of bumetanide) effectiever is bij patiënten met ernstig hartfalen of bij patiënten met hartfalen en chronische nierschade.
- De werkgroep kan geen aanbeveling doen over het wisselen van lisdiureticum bij patiënten met hartfalen en lisdiureticaresistentie.
- Overweeg bumetamide bij patiënten die een hoge dosis lisdiureticum nodig hebben om het gebruiksgemak en daarmee de therapietrouw te bevorderen.
- Verwijs de patiënt als deze onvoldoende reageert op ophogen van diuretica bij verergering van de klachten.
Achtergrond
In de praktijk bestaat de indruk dat de lisdiuretica furosemide en bumetanide allebei goede opties zijn voor de behandeling van overvulling bij hartfalen. Het effect van furosemide en bumetanide bij personen met ernstig hartfalen en personen met hartfalen en chronische nierschade is echter onduidelijk. De werkgroepleden merken dat in de praktijk bij artsen de indruk bestaat dat bumetanide beter zou werken bij deze subgroepen. In de praktijk wordt soms gewisseld van het ene naar het andere lisdiureticum als één van beide lisdiuretica ook in hoge dosering onvoldoende werkt (lisdiureticumresistentie). Het is echter onduidelijk of wisselen van lisdiureticum effectief is.
Uitgangsvragen
A Gaat de voorkeur uit naar bumetanide of naar furosemide in de behandeling van patiënten met ernstig hartfalen?
B Is bumetanide of furosemide aan te bevelen bij patiënten met hartfalen en chronische nierschade?
| Patiënten | A Volwassenen met ernstige klachten van hartfalen in de eerste lijn B Volwassenen met klachten van hartfalen in de eerste lijn en chronische nierschade |
|---|---|
| Interventie | Bumetanide |
| Vergelijking | Furosemide |
| Uitkomstmaten | Sterfte, alle oorzaken Kwaliteit van leven Ongeplande ziekenhuisopname Lisdiureticaresistentie Bijwerkingen: progressie naar ernstig nierfalen/ongeplande dialyse, elektrolytstoornissen, nierfunctieverslechtering, hypotensie, aritmie, bradycardie |
C Gaat de voorkeur uit naar behandeling met bumetanide of furosemide bij patiënten met hartfalen bij wie lisdiuretica in aanzienlijke dosis (> 80 g furosemide of > 2 g bumetanide per dag) onvoldoende respons geven (lisdiureticaresistentie)?
| Patiënten | Volwassenen met hartfalen en lisdiureticaresistentie (> 80 g furosemide of > 2 g bumetanide per dag) |
|---|---|
| Interventie | Bumetanide |
| Vergelijking | Furosemide |
| Uitkomstmaten | Sterfte, alle oorzaken Kwaliteit van leven Ongeplande ziekenhuisopname Bijwerkingen: progressie naar ernstig nierfalen/ongeplande dialyse, elektrolytstoornissen, nierfunctieverslechtering, hypotensie, aritmie, bradycardie |
Methode
In juni 2020 zijn systematische literatuursearches uitgevoerd in PubMed en Embase (RCT’s en SR’s voor vraag A en B, alle onderzoeksopzetten voor C).
Resultaten
Resultaat zoekactie
De zoekactie leverde 2 RCT’s op voor onderzoeksvraag A.
Voor vraag B en C werden geen geschikte onderzoeken gevonden.
Onderzoekskarakteristieken
Uitgangsvraag A
Dixon 1981 was een RCT waarin een groep volwassenen met chronisch hartfalen en oedeem (n = 28) verdeeld werd in een groep die 24 weken lang bumetanide kreeg (1-10 mg per dag) en een groep die furosemide kreeg (40-400 mg per dag). Patiënten met nierfalen werden geëxcludeerd. Naast sterfte werden onder andere ook bijwerkingen gemeten.
Konecke 1981 betrof een RCT (n = 42) waarin volwassenen met chronisch hartfalen en oedeem 24 weken lang bumetanide kregen (1-12 mg per dag) dan wel furosemide (40-160 mg per dag). Patiënten met nierfalen werden geëxcludeerd. Naast sterfte werden onder andere ook bijwerkingen gemeten.
Omdat we geen meta-analyse vonden, hebben we deze verricht voor de uitkomstmaat ‘sterfte aan alle oorzaken’. Voor bijwerkingen en uitval uit onderzoek was het aantal events zo laag dat het niet zinnig was om er een meta-analyse op uit te voeren, deze uitkomsten worden narratief beschreven. Voor de andere uitkomstmaten waren geen resultaten beschikbaar.
Uitgangsvragen B en C
Voor vraag B en C zijn geen onderzoeken gevonden.
Effectiviteit en bijwerkingen
Voor effectiviteit en bijwerkingen van bumetanide versus furosemide bij ernstig hartfalen, zie tabel 11.
| Uitkomsten (follow-up) | Absolute effecten (95%-BI) | Relatief effect (95%-BI) |
Aantal deelnemers (onderzoeken) |
Kwaliteit van bewijs (GRADE) |
Samenvatting | |
|---|---|---|---|---|---|---|
| Risico met furosemide | Risico met bumetanide | |||||
| Sterfte, alle oorzaken (24 weken) |
56 per 1000 | 137 per 1000 (27 tot 701) |
RR 2,47 (0,48 tot 12,61) |
70 (2) | ⨁◯◯◯ ZEER LAAG*,†,‡ |
We zijn onzeker of er verschil in sterfte is |
| Kwaliteit van leven, ongeplande ziekenhuisopname, nierfunctie | Niet gerapporteerd | Niet gerapporteerd | Niet gerapporteerd | 0 (0) | – | Er is geen onderzoek gevonden |
| Bijwerkingen (24 weken) |
Dixon 1981:
furosemide (n = 7) versus bumetanide (n = 21):
|
70 (2) | ⨁◯◯◯ ZEER LAAG*,†,§ |
We zijn onzeker of er verschil in bijwerkingen is | ||
|
* Kans op vertekening: door slechte rapportage is veel onduidelijk. De kans op vertekening is daarom niet goed in te schatten. |
||||||
Conclusies
- Uitgangsvraag A
- We zijn onzeker of er een verschil is tussen bumetanide en furosemide voor het sterfterisico en het risico op bijwerkingen bij patiënten met ernstig hartfalen.
- Het is niet bekend of er een verschil is tussen bumetanide en furosemide voor kwaliteit van leven, ongeplande ziekenhuisopname en nierfunctie bij patiënten met ernstig hartfalen.
- Uitgangsvraag B
- Er is geen onderzoek gevonden waarin het effect van bumetanide is vergeleken met furosemide bij patiënten met hartfalen en chronische nierschade.
- Uitgangsvraag C
- Er is geen onderzoek gevonden waarin het effect van bumetanide is vergeleken met furosemide bij patiënten met hartfalen en lisdiureticaresistentie.
Thiazidediuretica
Naar Samenvatting ›- Thiazidediuretica worden soms toegevoegd door de cardioloog bij diureticaresistentie.
- Er is geen indicatie meer voor behandeling met thiazidediuretica door de huisarts.
Bètablokkers
Naar Samenvatting ›- Stoppen met een bètablokker moet zoveel mogelijk vermeden worden, mede gezien de reflextachycardie die daardoor ontstaat.
- Een tweede- of derdegraads AV-blok is een contra-indicatie voor een bètablokker. Bij een eerstegraads AV-blok is voorzichtigheid geboden vanwege de kans op progressie van het AV-blok
Een tweede- of derdegraads AV-blok is een contra-indicatie voor bètablokkers, en bij een eerstegraads AV-blok is voorzichtigheid met bètablokkers geboden.
In de tweede lijn heeft de cardioloog bij het optitreren van bètablokkers bij elke controle een ecg-uitslag voorhanden. Indien de patiënt bekend is met een eerstegraads AV-blok kan worden gecontroleerd of het AV-blok niet progressief is. Aangezien het instellen van medicatie voor hartfalen in de eerste lijn meestal beperkt is tot patiënten die niet meer naar het ziekenhuis kunnen of willen, acht de werkgroep herhaalde ecg’s in de eerste lijn in principe niet geïndiceerd.
Aldosteronantagonisten
Naar Samenvatting ›Vervang spironolacton door eplerenon indien de patiënt last heeft van anti-androgene of antiprogestagene bijwerkingen (gynecomastie, pijnlijke borsten, stemverlaging).
- Spironolacton heeft de voorkeur vanwege de aanzienlijk lagere kosten. Daarmee sluit deze standaard aan op de Praktische handleiding bij de NHG-Standaard CVRM (2019).
- Spironolacton kan anti-androgene of antiprogestagene bijwerkingen geven, zoals pijnlijke borsten, gynaecomastie of stemverlaging. In dat geval kan spironolacton worden vervangen door eplerenon, aangezien deze bijwerkingen minder vaak voorkomen bij eplerenon.
- Een nadeel van eplerenon is de mogelijke interactie met matig sterke CYP3A4-remmers (eytromycine, fluconazol, saquinavir, verapamil, diltiazem, amiodaron); bij gelijktijdig gebruik is de maximale dosering van eplerenon lager.
- Vermijd gelijktijdig gebruik van aldosteronantagonisten met sterke CYP3A4-remmers (ketoconazol, itraconazol, claritromycine) en sterke CYP3A4-inductoren (zie Medicamenteuze behandeling van HFrEF en HFmrEF).
Digoxine en orale anticoagulantia
Naar Samenvatting ›- Er is in de eerste lijn geen plaats voor digoxine in de behandeling van patiënten met hartfalen zonder atriumfibrilleren.
- Voor de behandeling met orale anticoagulantia van patiënten met hartfalen en atriumfibrilleren zie NHG-Standaard Atriumfibrilleren.
Digoxine wordt niet langer aanbevolen omdat het middel een beperkte meerwaarde heeft ten opzichte van de aanbevolen medicatie in het stappenplan, maar wel (ernstige) bijwerkingen kan veroorzaken. Het stappenplan volgt de geldende ESC-richtlijn (zie Medicamenteuze behandeling van HFrEF en HFmrEF).
Cardiovasculair risicomanagement
Naar Samenvatting ›- Stel de indicatie voor lipidenverlagende medicatie of antitrombotica op basis van comorbiditeit (bijvoorbeeld coronairlijden of atriumfibrilleren); de diagnose ‘hartfalen’ alleen is onvoldoende indicatie voor gebruik van deze middelen.
- Houd er bij de risicoschatting rekening mee dat er bij hartfalen heel vaak sprake is van een onderliggende ischemische cardiovasculaire aandoening en dat de patiënt in dat geval een zeer hoog risico heeft op nieuwe hart- en vaatziekten (zie NHG-Standaard Cardiovasculair risicomanagement).
Diltiazem en verapamil
Naar Samenvatting ›- Staak calciumantagonisten met een niet-dihydropiridinestructuur (diltiazem en verapamil) vanwege het negatief inotrope effect.
- Ga afhankelijk van de behandelindicatie na of vervanging mogelijk is door een geneesmiddel uit een andere groep.
- Sluit bij vervanging zoveel mogelijk aan op de middelen die worden aanbevolen in het Stappenplan hartfalenmedicatie.
SGLT-2-remmers
Naar Samenvatting ›- Overweeg een SGLT-2-remmer bij patiënten met diabetes mellitus type 2 en hartfalen omdat deze middelen de kans op exacerbaties van hartfalen bij deze patiënten verlagen.(zie NHG-Standaard Diabetes mellitus type 2).
- Het starten van een SGLT-2-remmer ter behandeling van hartfalen bij patiënten zonder diabetes mellitus type 2 wordt niet aanbevolen.
Achtergrond
Er zijn sterke aanwijzingen dat geneesmiddelen die de natrium-glucosecotransporter-2 remmen (SGLT-2 -remmers) bij patiënten met diabetes mellitus type 2 niet alleen het bloedglucose verlagen, maar ook bijdragen aan de preventie en verbetering van hartfalen. SGLT-2-remmers blokkeren de opname van glucose in de proximale renale tubulus, waardoor meer glucose en natrium worden uitgescheiden in de urine en de bloedglucosewaarde daalt. Het mechanisme achter de mogelijke positieve invloed van SGLT-2-remmers op hartfalen is tot op heden niet opgehelderd. Mogelijke factoren zijn osmotische diurese, reductie van arteriële stijfheid en reductie van de bloeddruk. De vraag is of SGLT-2-remmers moeten worden aanbevolen voor de behandeling van patiënten met diabetes mellitus type 2 en hartfalen.
Uitgangsvraag
Is een SGLT-2-remmer aan te bevelen als aanvulling op de standaardbehandeling van patiënten met diabetes mellitus type 2 en hartfalen?
| Patiënten |
Patiënten met diabetes mellitus type 2 (diabetes mellitus type 2) en hartfalen, subgroepen:
|
|---|---|
| Interventie | SGLT-2-remmer in combinatie met standaardbehandeling voor diabetes mellitus type 2 en hartfalen |
| Vergelijking | Placebo in combinatie met standaardbehandeling voor diabetes mellitus type 2 en hartfalen |
| Uitkomstmaten | Sterfte, alle oorzaken Sterfte, cardiovasculaire oorzaak Kwaliteit van leven Ongeplande ziekenhuisopname wegens hartfalen Nierfunctie Bijwerkingen: progressie naar ernstig nierfalen/dialyse, major adverse cardiac event (myocardinfarct, CVA), noodzaak tot starten of ophogen van medicatie voor hartfalen, elektrolytenstoornis, hypotensie, aritmie, bradycardie. Safety parameters: amputaties, gangreen van Fournier |
Methode
In juli 2019 is een systematische literatuursearch uitgevoerd naar systematische literatuuronderzoeken en RCT’s in PubMed en Embase. Om geen recente onderzoeken te missen werd het literatuuronderzoek herhaald in juni 2020.
Resultaten
Resultaat zoekactie
Tijdens de literatuursearch zijn 4 post-hocanalyses gevonden met betrekking tot de effecten van SGLT-2-remmers bij patiënten met hartfalen en diabetes mellitus type 2. Het betrof subgroepen binnen 3 RCT’s (CANVAS, DECLARE-TIMI 58 en EMPA-REG OUTCOME) naar de cardiovasculaire veiligheid van SGLT-2-remmers bij mensen met diabetes mellitus type 2.
Tijdens de update van de literatuursearch werd een subgroepanalyse gevonden van DAPA-HF voor patiënten met zowel hartfalen als diabetes mellitus type 2.
Onderzoekskarakteristieken
CANVAS
In deze RCT werden het effect en de veiligheid van canagliflozine versus placebo onderzocht bij 10.142 patiënten met diabetes mellitus type 2 en hoog cardiovasculair risico.
In een post-hocanalyse van een subgroep met hartfalen (14,4% van alle deelnemers; gemiddeld 63,8 jaar; 44,4% vrouw) werden de effecten en bijwerkingen van SGLT-2-remmers geanalyseerd gedurende gemiddeld 188 weken. In het oorspronkelijke onderzoek waren patiënten in NYHA-klasse IV geëxcludeerd.
DECLARE-TIMI 58
In de deze RCT werden het effect en de veiligheid van dapagliflozine versus placebo onderzocht bij 17.160 patiënten met diabetes mellitus type 2 en (risico op) atherosclerotische hart- en vaatziekten. De post-hocanalyse betrof effecten en bijwerkingen van SGLT-2-remmers gedurende mediaan 4,2 jaar in een subgroep met HFrEF (3,9% van alle deelnemers; gemiddeld 63 jaar; 15,8% vrouw) of HFpEF (7,7% van alle deelnemers; gemiddeld 65 jaar; 42,8% vrouw). In het oorspronkelijke onderzoek waren patiënten in NYHA-klasse IV geëxcludeerd.
EMPA-REG OUTCOME
In deze RCT werden het effect en de veiligheid van empagliflozine versus placebo onderzocht bij 7020 patiënten met diabetes mellitus type 2 en hoog cardiovasculair risico. In een subgroep met hartfalen (10% van het totaal aantal deelnemers, gemiddeld 63 jaar, 39,5% vrouw) zijn 2 post-hocanalyses uitgevoerd naar de effecten van SGLT-2-remmers op ziekenhuisopname en sterfte en nierfunctie gedurende mediaan 2,6 jaar. In het oorspronkelijke onderzoek waren patiënten met alle NYHA-klassen geïncludeerd.
DAPA-HF
Deze RCT betrof het effect en de veiligheid van dapagliflozine (1 dd 10 mg) versus placebo in aanvulling op bestaande hartfalenmedicatie gedurende mediaan 18,2 maanden bij patiënten met HFrEF (LVEF ≤ 40%, n = 4744). Vooraf was bepaald dat er een subgroepanalyse zou worden verricht bij deelnemers met diabetes mellitus type 2 (n = 2139; gemiddeld 66,5 jaar (SD 9,9); 22,3% vrouw). Het merendeel van de patiënten had NYHA-klasse II (n = 1362) of III (n = 786), slechts weinigen hadden klasse IV (n = 22).
Effectiviteit en bijwerkingen
De resultaten van de hierboven beschreven post-hocanalyses worden gepresenteerd in tabel 12 (hartfalen en diabetes mellitus type 2) en tabel 13 (HFrEF of HFpEF en diabetes mellitus type 2).
De subgroepanalyses van de DAPA-HF RCT zijn niet gepoold met deze resultaten, maar komen er in grote lijnen mee overeen (zie voetnoot bij tabel 13).
|
Uitkomsten |
Relatief effect (95%-BI) |
Aantal deelnemers (onderzoeken) |
Kwaliteit van bewijs (GRADE) |
Samenvatting |
|---|---|---|---|---|
|
Sterfte, alle oorzaken |
HR 0,74 (0,59 tot 0,93) |
4154 (3 post-hocanalyses) |
⨁⨁◯◯ LAAG* |
Een SGLT-2-remmer lijkt de kans op sterfte aan alle oorzaken bij patiënten met diabetes mellitus type 2 en hartfalen te verminderen |
|
Ziekenhuisopname door hartfalen |
HR 0,65 (0,53 tot 0,80) |
4154 (3 post-hocanalyses) |
⨁⨁◯◯ LAAG* |
Een SGLT-2-remmer lijkt de kans op ziekenhuisopname door hartfalen bij patiënten met diabetes mellitus type 2 en hartfalen te verminderen |
|
Kwaliteit van leven – niet gemeten |
– |
– |
– |
|
|
Sterfte, cardiovasculair |
HR 0,73 (0,56 tot 0,96) |
4154 (3 post-hocanalyses) |
⨁◯◯◯ ZEER LAAG*,† |
Het is onzeker, maar een SGLT-2-remmer lijkt de kans op cardiovasculaire sterfte bij patiënten met diabetes mellitus type 2 en hartfalen te verminderen |
|
Major cardiovasculair event |
HR 0,84 (0,67 tot 1,05) |
3448 (2 post-hocanalyses) |
⨁◯◯◯ ZEER LAAG*,‡ |
Het is onzeker of een SGLT-2-remmer de kans op ernstige cardiovasculaire incidenten bij patiënten met diabetes mellitus type 2 en hartfalen vermindert |
|
Amputations (hartfalen en HFrEF) |
HR 1,98 (1,07 tot 3,65) |
2132 (2 post-hocanalyses) |
⨁◯◯◯ ZEER LAAG*,§ |
Het is onzeker, maar een SGLT-2-remmer lijkt de kans op amputaties bij patiënten met diabetes mellitus type 2 en hartfalen te doen toenemen |
|
(Niet-)fataal CVA |
HR 0,84 (0,51 tot 1,39) |
1461 (1 post-hocanalyse) |
⨁◯◯◯ ZEER LAAG*,¶ |
Het is onzeker of een SGLT-2-remmer de kans op (niet-)fataal CVA bij patiënten met diabetes mellitus type 2 en hartfalen vergroot |
|
Ernstig nierfalen |
HR 0,55 (0,39 tot 0,78) |
1461 (2 post-hocanalyses) |
⨁⨁◯◯ LAAG* |
Een SGLT-2-remmer lijkt de kans op ernstig nierfalen bij patiënten met diabetes mellitus type 2 en hartfalen te verminderen |
|
Acuut nierfalen (hartfalen en HFrEF) |
HR 0,55 (0,33 tot 0,92) |
1461 (3 post-hocanalyses) |
⨁◯◯◯ ZEER LAAG*,‡ |
Het is onzeker, maar een SGLT-2-remmer lijkt de kans op acuut nierfalen bij patiënten met diabetes mellitus type 2 en hartfalen te verminderen |
|
Hypotensie |
RR 1,23 (0,57 tot 2,65) |
706 (1 post-hocanalyse) |
⨁◯◯◯ ZEER LAAG*,¶ |
Het is onzeker of een SGLT-2-remmer de kans op hypotensie bij patiënten met diabetes mellitus type 2 en hartfalen vergroot |
|
Noodzaak tot starten of ophogen van medicatie voor hartfalen, bradycardie, aritmie of gangreen van Fournier – niet gemeten |
– |
– |
– |
|
|
* Overig/publicatiebias: funding door de fabrikant van het middel (zowel onderzoeken als een gedeelte van de auteurs). Hier is niet voor afgewaardeerd omdat GRADE voor post-hocanalyses (observationeel onderzoek) al zeer streng is. |
||||
|
Uitkomsten (follow-up) |
Absolute effecten |
Relatief effect (95%-BI)* |
Aantal deelnemers (onderzoeken) |
Kwaliteit van bewijs (GRADE) |
Samenvatting |
|
|---|---|---|---|---|---|---|
|
Risico met placebo |
Risico met SGLT-2-remmer |
|||||
|
Sterfte, alle oorzaken – HFrEF (4,2 jaar) |
193 per 1000 |
119 per 1000 |
HR 0,59 (0,40 tot 0,88)1 |
671 (1 post-hocanalyses) |
⨁◯◯◯ ZEER LAAG†,‡ |
Het is onzeker, maar een SGLT-2-remmer lijkt de kans op sterfte aan alle oorzaken bij patiënten met diabetes mellitus type 2 en HFrEF te verminderen |
|
Sterfte, alle oorzaken – HFpEF (4,2 jaar) |
124 per 1000 |
127 per 1000 |
HR 1,02 (0,75 tot 1,38) |
1316 (1 post-hocanalyse) |
⨁◯◯◯ ZEER LAAG†,¶ |
Het is onzeker, er zijn vooralsnog geen aanwijzingen dat een SGLT-2-remmer de kans op sterfte bij mensen met diabetes mellitus en HFpEF vermindert |
|
Ziekenhuisopname door HFrEF (4,2 jaar) |
178 per 1000 |
129 per 1000 |
HR 0,64 (0,43 tot 0,95)2 |
671 (1 post-hocanalyse) |
⨁◯◯◯ ZEER LAAG†,§ |
Het is onzeker, maar een SGLT-2-remmer lijkt de kans op ziekenhuisopname door hartfalen bij patiënten met diabetes mellitus type 2 en HFrEF te verminderen |
|
Ziekenhuisopname door HFpEF (4,2 jaar) |
102 per 1000 |
77 per 1000 |
HR 0,72 (0,50 tot 1,04) |
1316 (1 post-hocanalyse) |
⨁◯◯◯ ZEER LAAG†,§ |
Het is onzeker, maar een SGLT-2-remmer lijkt de kans op ziekenhuisopname door hartfalen bij patiënten met diabetes mellitus type 2 en HFpEF te verminderen |
|
Sterfte, cardiovasculair (HFrEF) (4,2 jaar) |
133 per 1000 |
79 per 1000 |
HR 0,55 (0,34 tot 0,90)3 |
671 (1 post-hocanalyse) |
⨁◯◯◯ ZEER LAAG†,‡ |
Het is onzeker, maar een SGLT-2-remmer lijkt de kans op cardiovasculaire sterfte bij patiënten met diabetes mellitus type 2 en HFrEF te verminderen |
|
Sterfte, cardiovasculair (HFpEF) (4,2 jaar) |
83 per 1000 |
57 per 1000 |
HR 1,41 (0,93 tot 2,13) |
1316 (1 post-hocanalyse) |
⨁◯◯◯ ZEER LAAG†,¶ |
Het is onzeker of een SGLT-2-remmer de kans op cardiovasculaire sterfte bij patiënten met diabetes mellitus type 2 en HFpEF vermindert |
|
Kwaliteit van leven (HFrEF) – niet gemeten |
– |
– |
–4 |
– |
– |
|
|
Major cardiovasculair event (HFrEF) (4,2 jaar) |
238 per 1000 |
192 per 1000 |
HR 0,75 (0,54 tot 1,05) |
671 (1 post-hocanalyse) |
⨁◯◯◯ ZEER LAAG†,§ |
Het is onzeker of een SGLT-2-remmer de kans op ernstige cardiovasculaire incidenten bij patiënten met diabetes mellitus type 2 en HFrEF vermindert |
|
Major cardiovasculair event (HFpEF) (4,2 jaar) |
142 per 1000 |
157 per 1000 |
HR 1,11 (0,84 tot 1,47) |
1316 (1 post-hocanalyse) |
⨁◯◯◯ ZEER LAAG†,¶ |
Het is onzeker of een SGLT-2-remmer de kans op ernstige cardiovasculaire incidenten bij patiënten met diabetes mellitus type 2 en HFpEF vergroot |
|
Amputatie bij HFrEF (4,2 jaar) |
20 per 1000 |
35 per 1000 |
HR 1,59 (0,62 tot 4,09)5 |
671 (1 post-hocanalyse) |
⨁◯◯◯ ZEER LAAG†,¶ |
Het is onzeker of een SGLT-2-remmer de kans op amputaties bij patiënten met diabetes mellitus type 2 en HFrEF vergroot |
|
Acuut nierfalen bij HFrEF (4,2 jaar) |
113 per 1000 |
72 per 1000 |
HR 0,57 (0,34 tot 0,96)6 |
1316 (1 post-hocanalyse) |
⨁◯◯◯ ZEER LAAG†,§ |
Het is onzeker, maar een SGLT-2-remmer lijkt de kans op acuut nierfalen bij patiënten met diabetes mellitus type 2 en HFrEF te verminderen |
|
Noodzaak tot starten of ophogen van medicatie voor hartfalen, hypotensie, bradycardie, aritmie of gangreen van Fournier (HFrEF of HFpEF) – niet gemeten |
– |
– |
– |
– |
– |
|
|
* Voor de resultaten van DAPA-HF, zie onderstaande genummerde noten. DAPA-HF
|
||||||
Bijwerkingen, ander bewijs
SGLT-2-remmers verhogen de kans op genitale mycotische infecties. Een verhoogd risico op urineweginfecties is niet uit te sluiten. Daarnaast is er nog geen volledige duidelijkheid over de kans op ernstige bijwerkingen, bijvoorbeeld ketoacidose, noodzaak tot amputaties aan de onderste ledematen (vooral tenen) en fracturen (zie NHG-Standaard Diabetes mellitus type 2).
Tussen 1 maart 2013 en 31 januari 2019 is gangreen van Fournier gerapporteerd bij 55 patiënten met diabetes mellitus type 2 die SGLT-2-remmers gebruikten. Ter vergelijking: gangreen van Fournier werd tussen 1984 en 31 januari 2019 als bijwerking gerapporteerd bij 19 patiënten die antiglykemische medicatie gebruikten (metformine (n = 8), insuline glargine (n = 6), kortwerkende insuline (n = 2), sitagliptine plus metformine (n = 2), dulaglutide (n = 1)). De auteurs adviseren artsen zich bewust te zijn van deze mogelijke bijwerking, ook al is er (nog) geen causaal verband aangetoond.
Conclusies
Patiënten met diabetes mellitus type 2 en hartfalen
- Een SGLT-2-remmer lijkt de kans op sterfte aan alle oorzaken, ziekenhuisopname door hartfalen en ernstig nierfalen te verminderen.
- Het is onzeker, maar een SGLT-2-remmer lijkt de kans op cardiovasculaire sterfte te verminderen.
- Het is onzeker, maar een SGLT-2-remmer lijkt de kans op noodzaak voor amputatie bij patiënten met diabetes mellitus type 2 en hartfalen te vergroten.
- Het is onzeker wat het effect is van een SGLT-2-remmer op ernstige cardiovasculaire incidenten, (niet-)fatale beroerte en risico op hypotensie.
- Patiënten met diabetes mellitus type 2 en HFrEF:
- Het is onzeker, maar een SGLT-2-remmer lijkt de kans op sterfte (alle oorzaken en cardiovasculair), ziekenhuisopname door hartfalen en acuut nierfalen bij patiënten met diabetes mellitus type 2 en HFrEF te verminderen.
- Het is onzeker wat het effect is van een SGLT-2-remmer op ernstige cardiovasculaire incidenten en noodzaak voor amputatie.
Patiënten met diabetes mellitus type 2 en HFpEF:
- Het is onzeker, maar een SGLT-2-remmer lijkt de kans op ziekenhuisopname door hartfalen bij patiënten met diabetes mellitus type 2 en HFpEF te verminderen.
- Het is onzeker wat het effect is van een SGLT-2-remmer op sterfte (alle oorzaken en cardiovasculair) en ernstige cardiovasculaire incidenten.
Niet gemeten uitkomsten
Het is onbekend of de SGLT-2-remmers effect hebben op noodzaak tot starten of ophogen van medicatie voor hartfalen, bradycardie, aritmie of gangreen van Fournier.
Van bewijs naar aanbeveling
Voor- en nadelen
- Het lijkt erop dat een behandeling met SGLT-2-remmers na 2,6 tot 4,2 jaar de kans op sterfte aan alle oorzaken, ziekenhuisopname door hartfalen en ernstig nierfalen verlaagt bij patiënten met diabetes mellitus type 2 en hartfalen. Verder zijn er aanwijzingen dat SGLT-2-remmers de kans op cardiovasculaire sterfte en acuut nierfalen verminderen.
- SGLT-2-remmers zijn tamelijk nieuw, ze zijn pas sinds 2013 geregistreerd voor de behandeling van diabetes mellitus type 2. Er is nog geen volledige duidelijkheid over de veiligheid, met name wat betreft ernstige bijwerkingen zoals gangreen van Fournier, ernstige ketoacidose, amputaties en fracturen.
Kwaliteit van bewijs
De kwaliteit van het bewijs is zeer laag tot laag. Ten eerste zijn de meeste analyses post-hoc uitgevoerd in een subgroep, wat inhoudt dat de effecten van SGLT-2-remmers achteraf geanalyseerd zijn bij patiënten die naast diabetes mellitus type 2 (de onderzoeksgroep) ook hartfalen hadden. Bij een dergelijke analyse kan vertekening van het effect optreden omdat de 2 groepen (interventie versus placebo) niet als gerandomiseerd kunnen worden beschouwd en dus observationeel zijn. Ten tweede zijn de onderzoeken gefinancierd door de fabrikant van de betreffende SGLT-2-remmer en hebben de auteurs voor diverse werkzaamheden ook geld ontvangen van de fabrikant. Desondanks zijn de resultaten hoopgevend en er zijn inmiddels verschillende RCT’s gestart naar het effect van SGLT-2-remmers op hartfalen bij patiënten met en zonder diabetes mellitus type 2.
Waarden en voorkeuren van patiënten
Hartfalen is een chronische progressieve aandoening waarvoor weinig behandelopties beschikbaar zijn. Patiënten met diabetes mellitus type 2 zullen geen bezwaar hebben om glucoseverlagende medicatie te nemen in de vorm van een SGLT-2-remmer als deze een gunstig neveneffect heeft op hartfalen. Een mogelijk nadeel voor patiënten is dat er nog onvoldoende bekend is over potentiële ernstige bijwerkingen.
Kosten
De kosten van de verschillende SGLT-2-remmers zijn nagenoeg gelijk, rond de € 50 per maand (www.medicijnkosten.nl, geraadpleegd maart 2020):
- dapagliflozine kost € 48,67 per maand bij een standaarddosering van 10 mg per dag (€ 1,60)
- empagliflozine kost € 49,58 per maand bij een standaarddosering van 10 mg per dag (€ 1,63) en € 51,10 per maand bij 25 mg per dag (€ 1,68).
- canagliflozine kost € 48,67 per maand bij een standaarddosering van 100 mg per dag (€ 1,60) en € 60,83 per maand bij 300 mg per dag (€ 2,00).
SGLT-2-remmers worden anno 2020 alleen vergoed voor de behandeling van diabetes mellitus type 2 indien de patiënt geen insuline gebruikt en niet behandeld kan worden met de combinatie van metformine en een sulfonylureumderivaat (wetten.overheid.nl/BWBR0018715, geraadpleegd 14 oktober 2020).
Aanvaardbaarheid en haalbaarheid
- SGLT-2-remmers zijn sinds 2013 geregistreerd voor de behandeling van patiënten met diabetes mellitus type 2.
- Patiënten in NYHA-klasse IV werden niet toegelaten tot 2 van de 3 RCT’s.
Waarom deze aanbeveling?
Hartfalen is een chronische progressieve aandoening met weinig behandelopties. Behandeling van diabetes mellitus type 2 met SGLT-2-remmers lijkt een positieve invloed te hebben op hartfalen, aangezien er aanwijzingen zijn dat SGLT-2-remmers de kans op sterfte en ziekenhuisopname wegens hartfalen verlagen. Omdat het merendeel van de patiënten met diabetes mellitus type 2 wordt behandeld met een bloedglucoseverlagend middel, lijken SGLT-2-remmers een geschikte behandeloptie voor deze groep. Er is nog enige onduidelijkheid over de veiligheid van SGLT-2-remmers op lange termijn. Om die reden is het van belang de voor- en nadelen van een eventuele behandeling te bespreken met de patiënt. Daarnaast is waakzaamheid geboden voor potentiële ernstige bijwerkingen.
Aanbeveling
Overweeg een SGLT-2-remmer voor de behandeling van diabetes mellitus type 2 bij patiënten met diabetes mellitus type 2 en hartfalen, en bespreek daarbij de voor- en nadelen (zwak voor).
Achtergrond
Er zijn aanwijzingen dat SGLT-2-remmers bij patiënten met diabetes mellitus type 2 niet alleen een glucoseverlagend effect hebben, maar ook een positief effect hebben op hartfalen. SGLT-2-remmers blokkeren de opname van glucose in de proximale niertubuli, waardoor deze meer glucose en natrium uitscheiden in de urine en de bloedglucosewaarde daalt. Het mechanisme achter de mogelijke positieve invloed van SGLT-2-remmers op hartfalen is tot op heden niet opgehelderd. Mogelijke factoren zijn osmotische diurese, reductie in arteriële stijfheid en reductie in bloeddruk. In een aantal post-hocanalyses zijn aanwijzingen gevonden dat SGLT-2-remmers een gunstige invloed hebben op hartfalen bij patiënten die zowel hartfalen als diabetes mellitus type 2 hebben. De vraag is nu of SGLT-2-remmers moeten worden aanbevolen voor de behandeling van hartfalen, ongeacht de aanwezigheid van diabetes mellitus type 2.
Uitgangsvraag
Zijn remmers van de natrium-glucose-cotransporter 2 (SGLT-2-remmers) aan te bevelen als aanvulling op de standaardbehandeling van patiënten met hartfalen?
|
Patiënten |
Patiënten met hartfalen Subgroepen:
|
|---|---|
|
Interventie |
SGLT-2-remmer in combinatie met standaardbehandeling voor hartfalen |
|
Vergelijking |
Placebo in combinatie met standaardbehandeling voor hartfalen |
|
Uitkomstmaten |
Sterfte, alle oorzaken Sterfte, cardiovasculaire oorzaak Kwaliteit van leven Ongeplande ziekenhuisopname wegens hartfalen Nierfunctie Bijwerkingen: progressie naar ernstig nierfalen/dialyse, major adverse cardiac event (myocardinfarct, CVA), noodzaak tot starten of ophogen van medicatie voor hartfalen, elektrolytstoornis, hypotensie, aritmie, bradycardie. Veiligheidsparameters: amputaties, gangreen van Fournier |
Methoden
In juli 2019 is in PubMed en Embase een systematische search uitgevoerd naar systematische literatuuronderzoeken en RCT’s. Om geen recente onderzoeken te missen werd de zoekactie herhaald in juni 2020.
Resultaten
Resultaat zoekactie
Tijdens de literatuursearch werden 2 artikelen gevonden waarin de resultaten zijn gepresenteerd van 2 RCT’s naar het effect van SGLT-2-remmers bij patiënten met hartfalen ongeacht de aanwezigheid van diabetes mellitus type 2.
Na onze zoekactie werden de resultaten gepubliceerd van de EMPEROR-Reduced Trial. Deze RCT onderzocht het effect van empagliflozine (1 dd 10 mg) bij patiënten met hartfalen. Omdat deze resultaten in lijn zijn met de beschreven resultaten en geen invloed hebben op onze aanbeveling, worden ze hier verder niet beschreven.
Onderzoekskarakteristieken
DAPA-HF
In DAPA-HF werden het effect en de veiligheid van dapagliflozine vergeleken met placebo bij 4744 patiënten met ≥ 2 maanden HFrEF (LVEF ≤ 40%, NYHA II-IV, NT-proBNP ≥ 600 pg/ml). De deelnemers waren gemiddeld 66 jaar, 76% was man en 45% had naast hartfalen ook diabetes mellitus type 2. Deelnemers in de interventiearm kregen dapagliflozine 1 dd 10 mg gedurende mediaan 18,2 maanden.
DEFINE-HF
DEFINE-HF vergeleek de kwaliteit van leven ( overall summary score en clinical summary score ) bij dapagliflozine (1 dd 10 mg gedurende mediaan 8 maanden) met placebo bij 263 patiënten met HFrEF (LVEF ≤ 40%, NYHA II-III). De deelnemers waren gemiddeld 61 jaar, 73% was man en 63% had naast hartfalen ook diabetes mellitus type 2. De auteurs rapporteren een paar ziekenhuisopnames voor hartfalen, deze worden hier niet meegenomen omdat het gaat om een laag aantal.
Effectiviteit en bijwerkingen
Zie tabel 14 voor de samenvatting van de resultaten.
|
Uitkomsten (follow-up) |
Absolute effecten (95%-BI) |
Relatief effect (95%-BI) |
Aantal deelnemers (onderzoeken) |
Kwaliteit van bewijs (GRADE) |
Samenvatting |
|
|---|---|---|---|---|---|---|
|
Risico met placebo |
Risico met SGLT-2-remmer |
|||||
|
Sterfte, alle oorzaken (mediaan 18,2 maanden) |
139 per 1000 |
117 per 1000 (101 tot 135) |
HR 0,83 (0,71 tot 0,97) |
4744 (1 RCT) |
⨁⨁◯◯ LAAG*,† |
Een SGLT-2-remmer leidt mogelijk tot minder sterfte aan alle oorzaken |
|
Ziekenhuisopname door hartfalen (mediaan 18,2 maanden) |
134 per 1000 |
96 per 1000 (81 tot 113) |
HR 0,70 (0,59 tot 0,83) |
4744 (1 RCT) |
⨁⨁⨁◯ REDELIJK† |
Een SGLT-2-remmer leidt waarschijnlijk tot minder ziekenhuisopnames vanwege verslechterd hartfalen |
|
Kwaliteit van leven (8 maanden) |
Gemiddelde kwaliteit van leven 3,3 |
MD 2,8 (1,72 tot 3,88) |
– |
4744 (1 RCT) |
⨁⨁⨁◯ REDELIJK† |
Een SGLT-2-remmer heeft waarschijnlijk geen effect op de kwaliteit van leven (follow-up 8 maanden) |
|
Kwaliteit van leven ≥ 5-punten verbetering (3 maanden) |
OS 32,5% |
OS 42,9% |
OR 1,73 (0,98 tot 3,05) |
263 (1 RCT) |
⨁⨁◯◯ LAAG*,‡ |
Een SGLT-2-remmer lijkt de kwaliteit van leven te verhogen (follow-up 3 maanden) |
|
CS 31,7% |
CS 46,8% |
OR 2,4 (1,31 tot 42,0) |
||||
|
Sterfte, cardiovasculair (mediaan 18,2 maanden) |
115 per 1000 |
95 per 1000 (81 tot 113) |
HR 0,82 (0,69 tot 0,98) |
4744 (1 RCT) |
⨁⨁◯◯ LAAG*,† |
Een SGLT-2-remmer leidt mogelijk tot minder cardiovasculaire sterfte |
|
Hypotensie (systolische bloeddruk) (mediaan 18,2 maanden) |
Gemiddeld –0,38 mmHg |
MD 1,54 lager (2,4 lager tot 0,68 lager) |
– |
4744 (1 RCT) |
⨁⨁⨁◯ REDELIJK† |
Een SGLT-2-remmer heeft waarschijnlijk geen effect op de systolische bloeddruk |
|
Acuut nierfalen (mediaan 18,2 maanden) |
19 per 1000 |
10 per 1000 (6 tot 16) |
RR 0,50 (0,30 tot 0,82) |
4736 (1 RCT) |
⨁⨁◯◯ LAAG†,‡ |
Een SGLT-2-remmer leidt mogelijk tot minder acuut nierfalen |
|
Gangreen van Fournier (mediaan 18,2 maanden) |
0 per 1000 |
0 per 1000 (0 tot 0) |
Niet te berekenen |
4739 (1 RCT) |
⨁◯◯◯ ZEER LAAG†,§ |
Het is onzeker of een SGLT-2-remmer leidt tot Fournier gangreen |
|
Amputatie (mediaan 18,2 maanden) |
5 per 1000 |
5 per 1000 (3 tot 12) |
RR 1,08 (0,50 tot 2,37) |
4736 (1 RCT) |
⨁◯◯◯ ZEER LAAG†,§ |
Het is onzeker of een SGLT-2-remmer leidt tot amputaties |
|
Aritmie (mediaan 18,2 maanden) |
3 per 1000 |
1 per 1000 (0 tot 4) |
RR 0,25 (0,05 tot 1,18) |
4736 (1 RCT) |
⨁◯◯◯ ZEER LAAG†,§ |
Het is onzeker of een SGLT-2-remmer leidt tot aritmie |
|
Bradycardie (mediaan 18,2 maanden) |
3 per 1000 |
1 per 1000 (0 tot 4) |
RR 0,29 (0,06 tot 1,37) |
4736 (1 RCT) |
⨁◯◯◯ ZEER LAAG†,§ |
Het is onzeker of een SGLT-2-remmer leidt tot bradycardie |
|
Ernstig nierfalen (mediaan 18,2 maanden) |
3 per 1000 |
2 per 1000 (1 tot 6) |
RR 0,50 (0,15 tot 1,66) |
4736 (1 RCT) |
⨁◯◯◯ ZEER LAAG †,§ |
Het is onzeker of een SGLT-2-remmer leidt tot ernstig nierfalen |
|
(Niet-)fataal CVA (mediaan 18,2 maanden) |
2 per 1000 |
3 per 1000 (1 tot 9) |
RR 1,40 (0,44 tot 4,40) |
4736 (1 RCT) |
⨁◯◯◯ ZEER LAAG†,§ |
Het is onzeker of een SGLT-2-remmer leidt tot (niet-)fataal CVA |
|
Major cardiovasculair event, noodzaak tot starten of ophogen van medicatie voor hartfalen – niet gemeten |
– |
– |
– |
– |
– |
Geen onderzoek gevonden |
|
MD = mean difference; HR = hazardratio; OR = oddsratio; RR = relatief risico; OS = overall summary score; CS = clinical summary score; CVA = cerebrovasculair accident. |
||||||
Bijwerkingen, ander bewijs
SGLT-2-remmers verhogen de kans op genitale mycotische infecties. Een verhoogd risico op urineweginfecties is niet uit te sluiten. Daarnaast is er nog geen volledige duidelijkheid over de kans op ernstige bijwerkingen, bijvoorbeeld ketoacidose, noodzaak tot amputaties aan de onderste ledematen (vooral tenen) en fracturen (zie NHG-Standaard Diabetes mellitus type 2).
Bij patiënten met diabetes mellitus type 2 die SGLT-2-remmers gebruikten is een toegenomen aantal gevallen van gangreen van Fournier gerapporteerd, maar een causaal verband is niet aangetoond. De auteurs adviseren artsen zich bewust te zijn van deze mogelijke bijwerking.
Conclusies
- SGLT-2-remmers leiden waarschijnlijk tot minder ziekenhuisopnames vanwege HFrEF en hebben waarschijnlijk geen effect op systolische bloeddruk.
- SGLT-2-remmers lijken een kortetermijneffect te hebben op de kwaliteit van leven, maar op de middellange termijn is er waarschijnlijk geen effect.
- SGLT-2-remmers leiden mogelijk tot minder sterfte (alle oorzaken en cardiovasculair) en tot minder acuut nierfalen.
- Het is onzeker of SGLT-2-remmers van invloed zijn op gangreen van Fournier, amputaties, artimie, bradycardie, ernstig nierfalen, en (niet-)fatale beroerte.
Niet gemeten uitkomsten en subgroepen
- Het is niet bekend of het gebruik van SGLT-2-remmers effect heeft op de noodzaak tot starten of ophogen van hartfalenmedicatie en op de kans op ernstige cardiovasculaire incidenten.
- Omdat alleen patiënten met HFrEF zijn geïncludeerd, kunnen geen uitspraken worden gedaan over de groep met HFpEF.
Van bewijs naar aanbeveling
Voor- en nadelen
- Patiënten met HFrEF die ruim 1,5 jaar met dapagliflozine worden behandeld in aanvulling op de standaardbehandeling voor hartfalen, hebben waarschijnlijk minder kans op een ziekenhuisopname wegens hartfalen dat patiënten die alleen standaardbehandeling krijgen. Ook zijn er aanwijzingen dat behandeling met dapagliflozine leidt tot minder sterfte (alle oorzaken en cardiovasculair) en tot minder acuut nierfalen.
- De werkzaamheid van SGLT-2-remmers is in patiënten met HFpEF is onduidelijk, aangezien in de onderzoeken alleen patiënten met HFrEF werden geïncludeerd.
- In DAPA-HF waren de uitkomsten op het primaire samengestelde eindpunt ‘sterfte en ziekenhuisopname wegens hartfalen’ vrijwel gelijk in de subgroep met alleen hartfalen en de subgroep met hartfalen en diabetes mellitus type 2.
- SGLT-2-remmers zijn tamelijk nieuw, ze zijn pas sinds 2013 geregistreerd voor de behandeling van diabetes mellitus type 2. Er is nog geen volledige duidelijkheid over de veiligheid, met name wat betreft ernstige bijwerkingen zoals gangreen van Fournier, ernstige ketoacidose, amputaties en fracturen.
Kwaliteit van bewijs
De kwaliteit van bewijs voor de werking is laag tot redelijk, voor de bijwerkingen zeer laag. Er is afwaardering van het bewijs voor alle uitkomsten aangezien DAPA-HF gesponsord werd door de fabrikant. Daarnaast is er voor een aantal uitkomsten sprake van onnauwkeurigheid waardoor het onduidelijk is of er een klinisch relevant effect is.
Waarden en voorkeuren van patiënten
- Hartfalen is een chronische progressieve aandoening waarvoor weinig behandelopties beschikbaar zijn. Indien SGLT-2-remmers daadwerkelijk een gunstig effect hebben op hartfalen, zullen patiënten geen bezwaar hebben om deze medicatie te slikken. Daar staat tegenover dat patiënten wel een extra tablet moeten slikken.
- Een mogelijk nadeel voor patiënten is dat er nog enige onduidelijk bestaat over potentiële ernstige bijwerkingen.
Kosten
- De kosten van dapagliflozine zijn ongeveer € 48,67 per maand bij een standaarddosering van 10 mg per dag (€ 1,60; www.medicijnkosten.nl , geraadpleegd maart 2020)
- SGLT-2-remmers worden anno 2020 alleen vergoed voor de behandeling van diabetes mellitus type 2 indien de patiënt geen insuline gebruikt en niet behandeld kan worden met de combinatie van metformine en een sulfonylureumderivaat ( wetten.overheid.nl/BWBR0018715 , geraadpleegd 14 oktober 2020).
Aanvaardbaarheid en haalbaarheid
SGLT-2-remmers zijn sinds 2013 geregistreerd voor patiënten met diabetes mellitus type 2. Sinds oktober 2020 is dapagliflozine geregistreerd voor de behandeling van HFrEF.
Waarom deze aanbeveling?
- Toediening van dapagliflozine voor hartfalen leidt waarschijnlijk tot minder ziekenhuisopnames wegens hartfalen en mogelijk tot minder sterfte en acuut nierfalen.
- Dapagliflozine is pas sinds oktober 2020 geregistreerd voor de indicatie HFrEF; er is weinig ervaring met deze en andere SGLT-2-remmers in de behandeling van hartfalen en hun plaats ten opzichte van andere hartfalenmedicatie moet zich nog uitkristalliseren.
- Om deze redenen wordt het starten van een SGLT-2-remmer voor de behandeling van hartfalen in de eerste lijn vooralsnog niet aanbevolen.
Aanbeveling
We bevelen het starten van een SGLT-2-remmer door de huisarts voor de behandeling van HFrEF niet aan.
ARNI en ivabradine
Naar Samenvatting ›Geef in de eerste lijn geen angiotensinereceptor-neprilysineremmer (ARNI) of ivabradine.
Achtergrond
Angiotensinereceptor-neprilysineremmers (ARNI’s) zijn nieuwe middelen die naast de angiotensinereceptoren ook de neprilysinereceptoren blokkeren. Neprilysine is het enzym dat verantwoordelijk is voor de afbraak van biologische ACE-remmers. ARNI’s verminderen dus de vasoconstrictie en de natriumretentie. Cardiologen gebruiken een ARNI in plaats van een ACE-remmer als patiënten die al een ACE-remmer, diureticum, bètablokker en aldosteronantagonist gebruiken nog steeds klachten houden.
Uitgangsvraag
Is het aan te bevelen om de ACE-remmer te vervangen door een ARNI als patiënten met chronisch hartfalen klachten houden ondanks het gebruik van een ACE-remmer, diureticum, bètablokker en aldosteronantagonist?
| Patiënten | Patiënten met hartfalen (gereduceerde ejectiefractie) die met het gebruik van een ACE-remmer, diureticum, bètablokker en aldosteronantagonist klachten houden |
|---|---|
| Interventie | ARNI (sacubitril/valsartan) in plaats van de ACE-remmer als aanvulling op gebruikelijke zorg |
| Vergelijking | ACE-remmer plus gebruikelijke zorg |
| Uitkomstmaten | Sterfte, alle oorzaken Kwaliteit van leven Ongeplande ziekenhuisopname Bijwerkingen: progressie naar ernstig nierfalen/ongeplande dialyse, elektrolytstoornissen, nierfunctieverslechtering, hypotensie, aritmie, bradycardie |
Methoden
Voor het beantwoorden van de uitgangsvraag is de clinical evidence review gebruikt behorend bij de NICE-Guideline Chronic heart failure in adults (NG106).
Resultaten
Resultaat zoekactie
De literatuursearch van NICE leverde 1 RCT op. De zoekactie is niet herhaald voor nadien verschenen literatuur, omdat onze aanbeveling daardoor niet zou veranderen.
Onderzoekskarakteristieken
PARADIGM-HF was een RCT waarin 8399 volwassenen (49% ≥ 65 jaar; 22% vrouw) met hartfalen (LVEF < 35-40%; NYHA-klasse II-IV; BNP ≥ 150 pg/ml of NT-proBNP ≥ 600 pg/ml of recente ziekenhuisopname) gedurende 27 maanden werden behandeld met een ACE-remmer (enalapril 2 dd 10 mg) of een ARNI (sacubitril/valsartan 2 dd 97/103 mg). De patiënten slikten al een bètablokker, aldosteronantagonist en/of diuretica indien dat geïndiceerd was en verdragen werd. Het onderzoek stopte eerder dan de geplande 40 maanden vanwege mortaliteitswinst in de interventiegroep. Voorafgaand aan de randomisatie kregen deelnemers in een geblindeerde proefperiode 2 weken enalapril en daarna/daarvoor 4-6 weken een ARNI; 12% van de patiënten verdroeg de middelen niet en werd geëxcludeerd. De resultaten worden gepresenteerd in tabel 15.
|
Uitkomsten (follow-up) |
Absolute effecten (95%-BI) |
Relatief effect (95%-BI) |
Aantal deelnemers (onderzoeken) |
Kwaliteit van bewijs (GRADE) |
Samenvatting |
|
|---|---|---|---|---|---|---|
|
Risico met ACE-remmer |
Risico met ARNI |
|||||
|
Sterfte, alle oorzaken (27 maanden) |
165 per 1000 |
141 per 1000 (130 tot 156) |
RR 0,84 (0,76 tot 0,93) |
8399 (1 RCT) |
⨁⨁⨁◯ REDELIJK* |
Een ARNI leidt waarschijnlijk tot minder sterfte aan alle oorzaken dan een ACE-remmer |
|
Ziekenhuisopnames wegens hartfalen (27 maanden) |
198 per 1000 |
160 per 1000 (145 tot 179) |
HR 0,79 (0,71 tot 0,89) |
8399 (1 RCT) |
⨁⨁⨁◯ REDELIJK* ,‡ |
Een ARNI leidt waarschijnlijk tot minder ziekenhuisopnames wegens hartfalen dan een ACE-remmer |
|
Bijwerking hypotensie (27 maanden) |
92 per 1000 |
136 per 1000 (118 tot 157) |
RR 1,48 (1,28 tot 1,70) ¶ |
8399 (1 RCT) |
⨁⨁⨁◯ REDELIJK* |
Een ARNI resulteert waarschijnlijk in meer hypotensie dan een ACE-remmer |
|
Bijwerking hyperkaliëmie (27 maanden) |
45 per 1000 |
33 per 1000 |
RR 0,82 (0,68 tot 0,99) ¶ |
8399 (1 RCT) |
⨁⨁◯◯ LAAG*,† |
Een ARNI leidt mogelijk tot minder hyperkaliëmie dan een ACE-remmer |
|
Bijwerking angio-oedeem (27 maanden) |
2 per 1000 |
0 per 1000 (0 tot 0) |
Niet te berekenen |
8399 (1 RCT) |
⨁◯◯◯ ZEER LAAG*,§ |
Het is onzeker of er een verschil is tussen een ARNI en een ACE-remmer op angio- oedeem |
|
Bijwerking nierfunctiestoornis (27 maanden) |
56 per 1000 |
43 per 1000 (0 tot 0) |
RR 0,66 (0,52 tot 0,83) ¶ |
8399 (1 RCT) |
⨁⨁⨁◯ REDELIJK* |
Een ARNI resulteert waarschijnlijk in minder nierfunctiestoornissen dan een ACE-remmer |
|
Bijwerkingen bradycardie en aritmie – niet gemeten |
– |
– |
Geen onderzoek gevonden |
|||
|
Kwaliteit van leven – niet gemeten |
– |
– |
Geen onderzoek gevonden |
|||
|
* Indirect bewijs : patiënten die bijwerkingen kregen in de aanlooppperiode (6-8 weken) zijn geëxcludeerd (12% van de deelnemers), en personen met angio-oedeem in de voorgeschiedenis werden niet toegelaten tot de trial. Verder is de populatie jonger en bestaat uit meer mannen dan de gemiddelde eerstelijnspopulatie. |
||||||
Conclusies
- Een ARNI leidt waarschijnlijk tot minder sterfte en minder ziekenhuisopnames dan een ACE-remmer.
- Een ARNI vergroot waarschijnlijk de kans op hypotensie in vergelijking met een ACE-remmer.
- Een ARNI resulteert waarschijnlijk in minder nierfunctiestoornissen en mogelijk tot minder hyperkaliëmie dan een ACE-remmer.
- Het is onzeker of een ARNI de kans op angio-oedeem vergroot in vergelijking met een ACE-remmer.
- Er is geen onderzoek gedaan naar de effecten van een ARNI in vergelijking met een ACE-remmer op kwaliteit van leven en de bijwerkingen bradycardie en aritmie.
Van bewijs naar aanbeveling
Voor- en nadelen
ARNI leidt waarschijnlijk tot een vermindering van ziekenhuisopnamen en sterfte. Hier staan wel bijwerkingen tegenover, vooral in de vorm van hypotensie. Voor deelnemers aan PARADIGM-HF was dit echter geen reden om eerder met de behandeling te stoppen.
Een ander nadeel is dat de effecten en bijwerkingen op lange termijn niet bekend zijn; de personen die deelnamen aan de onderzoek gebruikten het middel 27 maanden.
Kwaliteit van bewijs
De onderzoeksgroep waarop het bewijs is gebaseerd, is niet geheel representatief voor de klinische populatie, want relatief jong. Bovendien werden personen geëxcludeerd als zij in het verleden last hadden van angio-oedeem of bijwerkingen kregen tijdens de proefperiode.
Waarden en voorkeuren van patiënten
Aangezien hartfalen een hoge morbiditeit en mortaliteit heeft, wordt verondersteld dat patiënten extra medicatie willen slikken om de ziektelast en kans op sterfte te verlagen. Het nadeel van eventuele hypotensie of een andere bijwerking zal per individuele patiënt afgewogen moeten worden tegen de potentiële voordelen van het middel.
Kosten
- Sacubitril/valsartan kost € 4,67 per dag in de onderzochte dosering van 2 dd 97/103 mg.
- Enalapril is beduidend goedkoper; dit kost € 0,06 per dag in de onderzochte dosering van 2 dd 10 mg. (www.medicijnkosten.nl, geraadpleegd 20 oktober 2020)
Aanvaarbaarheid en haalbaarheid
Er is in de eerste lijn weinig ervaring met ARNI en er bestaat een kans op bijwerkingen. Daarom zal behandeling met een ARNI in de eerste lijn voor de meeste patiënten en huisartsen niet aanvaardbaar zijn.
Waarom deze aanbeveling?
- Er is geen plaats voor ARNI in de eerste lijn. De redenen zijn dat er weinig ervaring mee is, de meerwaarde klein is en er onzekerheid is over de bijwerkingen.
- Een ARNI vermindert waarschijnlijk sterfte en ziekenhuisopnames, maar heeft ook bijwerkingen. De cardioloog kan afwegen of een ARNI geïndiceerd is als aanvulling op de basisbehandeling van hartfalen.
Aanbeveling
Geef geen ARNI in de eerste lijn. Verwijs patiënten die klachten krijgen ondanks adequate instelling op een ACE-remmer, diureticum, bètablokker en aldosteronantagonist naar de cardioloog voor eventuele behandeling met een ARNI.
Achtergrond
Ivabradine vertraagt de hartfrequentie door remming van de spontane diastolische depolarisatie in de sinusknoop. Het middel kan alleen worden gebruikt bij patiënten met een normaal sinusritme.
Uitgangsvraag
Is toevoeging van ivabradine aan te bevelen bij patiënten met hartfalen bij wie de basisbehandeling onvoldoende werkt?
| Patiënten | Patiënten met HFrEF bij wie de basisbehandeling met ACE-remmer + bètablokker + aldosteronantagonist (+diureticum) onvoldoende werkt |
|---|---|
| Interventie | Ivabradine als aanvulling op gebruikelijke zorg |
| Vergelijking | (Placebo plus) gebruikelijke zorg |
| Uitkomstmaten | Sterfte, alle oorzaken Kwaliteit van leven Ongeplande ziekenhuisopname Bijwerkingen: progressie naar ernstig nierfalen/ongeplande dialyse, elektrolytstoornissen, nierfunctieverslechtering, hypotensie, aritmie, bradycardie, atriumfibrilleren, visusproblemen. |
Methode
Voor het beantwoorden van de uitgangsvraag is de clinical evidence review gebruikt behorend bij de NICE-Guideline Chronic heart failure in adults (NG106).
Resultaten
Resultaat zoekactie
De literatuursearch van NICE leverde 1 RCT op. De zoekactie is niet herhaald vanaf het moment van verschijnen van de NICE-richtlijn, omdat nieuwe literatuur onze aanbeveling niet zou veranderen.
Onderzoekskarakteristieken
In SHIFT kregen 6558 volwassenen met hartfalen (symptomatische HFrEF en LVEF ≤ 35%) en een verhoogde hartslag in rust (≥ 70/min) ivabradine of placebo gedurende 18-28 maanden als aanvulling op hun standaardbehandeling met bètablokker, ACE-remmer (of angiotensinereceptorblokker) en aldosteronantagonist. Na 2 weken werd gecontroleerd of de dosis ivabradine (2 dd 5 mg) moest worden aangepast.
Effectiviteit en bijwerkingen
Zie tabel 16 voor de samenvatting van de resultaten.
|
Uitkomsten (follow-up) |
Absolute effecten (95%-BI) |
Relatief effect (95%-BI) |
Aantal deelnemers (onderzoeken) |
Kwaliteit van bewijs (GRADE) |
Samenvatting |
|
|---|---|---|---|---|---|---|
|
Risico met placebo |
Risico met ivabradine |
|||||
|
Sterfte, alle oorzaken (18-28 maanden) |
169 per 1000 |
154 per 1000 |
HR 0,90 |
6505 |
⨁⨁⨁◯ REDELIJK* |
Ivabradine vermindert sterfte aan alle oorzaken waarschijnlijk niet |
|
Ziekenhuisopnames, alle oorzaken (18-28 maanden) |
415 per 1000 |
380 per 1000 (356 tot 403) |
HR 0,89 |
6505 |
⨁⨁⨁◯ REDELIJK* |
Ivabradine vermindert ziekenhuisopnames waarschijnlijk enigszins |
|
Kwaliteit van leven – niet gerapporteerd |
– |
– |
– |
– |
– |
Geen onderzoek gevonden |
|
Bijwerking bradycardie symptomatisch (18-28 maanden) |
10 per 1000 |
60 per 1000 |
RR 6,14 |
6492 |
⨁⨁⨁⨁ HOOG |
Ivabradine resulteert in meer bradycardie (symptomatisch) dan placebo |
|
Bijwerking bradycardie asymptomatisch (18-28 maanden) |
15 per 1000 |
59 per 1000 |
RR 4,01 |
6492 |
⨁⨁⨁⨁ HOOG |
Ivabradine resulteert in meer bradiecardie (asymptomatisch) dan placebo |
|
Bijwerking atriumfibrilleren (18-28 maanden) |
77 per 1000 |
95 per 1000 |
RR 1,23 |
6492 |
⨁⨁⨁◯ REDELIJK* |
Ivabradine resulteert waarschijnlijk in meer atriumfibrilleren dan placebo |
|
Bijwerking visusproblemen (18-28 maanden) |
5 per 1000 |
28 per 1000 |
RR 5,31 |
6492 |
⨁⨁⨁◯ REDELIJK† |
Ivabradine resulteert waarschijnlijk in meer visusproblemen dan placebo |
|
* Onnauwkeurigheid : het betrouwbaarheidsinterval overschrijdt de marge van een klinisch relevant verschil (voordeel/nadeel?). |
||||||
Conclusies
- Ivabradine vermindert sterfte aan alle oorzaken waarschijnlijk niet en vermindert ziekenhuisopnames waarschijnlijk enigszins.
- Ivabradine resulteert in meer bradycardie (symptomatisch en asymptomatisch).
- Ivabradine resulteert waarschijnlijk in meer atriumfibrilleren en visusproblemen.
Van bewijs naar aanbeveling
Voor- en nadelen
- Ivabradine leidt waarschijnlijk tot verlaging van het risico op ongeplande ziekenhuisopname, maar vermindert sterfte niet bij patiënten met symptomatisch hartfalen en sinusritme ≥ 70/min in rust (die onvoldoende baat hebben bij basisbehandeling). In een subgroepanalyse van het onderzoekdata werden sterke effecten van ivabradine gevonden op ziekenhuisopname bij patiënten met sinusritme ≥ 70/min in rust, maar een sterk effect op sterfte was pas aanwezig vanaf ≥ 75/min in rust. Mede op basis hiervan heeft de EMA een registratie afgegeven voor patiënten met sinusritme ≥ 75/min in rust.
- Nadelen zijn kans op atriumfibrilleren, bradycardie en visusproblemen.
- Verder nadeel is dat de effecten van het middel op lange termijn niet bekend zijn; de personen die deelnamen aan de onderzoek kregen het middel 18-28 maanden.
Kwaliteit van bewijs
De kwaliteit van bewijs was redelijk tot hoog voor zowel effectiviteit als bijwerkingen. Bij sommige uitkomsten was er wel sprake van een onnauwkeurige schatting.
Waarden en voorkeuren van patiënten
Voor de meeste patiënten zullen de onzekerheden over het optreden van (ernstige) bijwerkingen niet opwegen tegen de mogelijke voordelen die het middel biedt.
Kosten
Bij een startdosering ivabradine 2 dd 5 mg zijn de kosten per dag € 0,58 (www.medicijnkosten.nl, geraadpleegd 20 oktober 2020).
Aanvaarbaarheid en haalbaarheid
Er is weinig ervaring met ivabradine in de eerste lijn. Daarnaast is er een kans op bijwerkingen. Daarom zal de interventie voor de meeste patiënten en huisartsen niet aanvaardbaar zijn.
Waarom deze aanbeveling?
- Er is geen plaats voor ivabridine in de eerste lijn. De redenen zijn dat er weinig ervaring mee is, de meerwaarde ervan klein is en er onzekerheid is over de bijwerkingen.
- Mogelijk vermindert ivabridine het aantal ziekenhuisopnames, maar het heeft ook bijwerkingen. De cardioloog kan afwegen of het starten van ivabridine in plaats van een ACE-remmer bij patiënten die al basisbehandeling krijgen, geïndiceerd is of niet.
- Dit advies sluit aan bij de vigerende richtlijnen.
Aanbeveling
Verwijs patiënten die bij adequate instelling op een ACE-remmer, diureticum, bètablokker en aldosteronantagonist klachten krijgen, voor mogelijke behandeling met ivabradine indien zij een polsfrequentie van > 70/min hebben. Geef geen ivabradine in de eerste lijn.
Bij voorkeur te vermijden geneesmiddelen
Naar Samenvatting ›- NSAID’s inclusief COX-2 remmers
- Verapamil en diltiazem
- Pioglitazon en saxagliptine (orale bloedglucoseverlagende middelen voor de behandeling van diabetes mellitus type 2)
- Voeg geen ARB toe als de patiënt al een ACE-remmer gebruikt.
Beleid bij laboratoriumafwijkingen
Naar Samenvatting ›Nierfunctiedaling na starten of ophogen van een RAS-remmer
Naar Samenvatting ›- eGFR 30-60 ml/min/1,73 m2: enige daling van de eGFR is normaal, een daling < 20% van de uitgangswaarde, met 30 ml/min/1,73 m2 als ondergrens, is acceptabel.
- eGFR 15-30 ml/min/1,73 m2: halveer de dosis en controleer eGFR na 2 weken.
- eGFR < 15 ml/min/1,73 m2 stop de RAS-remmer en controleer eGFR na 2 weken.
- eGFR aanhoudend laag (< 30 ml/min/1,73 m2): consulteer of verwijs naar een cardioloog of internist-nefroloog.
Nierfunctiedaling na starten of ophogen van een aldosteronantagonist
Naar Samenvatting ›- eGFR 15-44 ml/min/1,73 m2: halveer de dosis en controleer eGFR na 2 weken.
- eGFR < 15 ml/min/1,73 m2: stop de aldosteronantagonist en controleer eGFR na 2 weken.
- eGFR aanhoudend laag (< 30 ml/min/1,73 m2): consulteer of verwijs naar een cardioloog of internist-nefroloog.
Hyperkaliëmie
Naar Samenvatting ›- Overweeg de kaliumbepaling ongestuwd te herhalen (waarde kan verhoogd zijn als gevolg van gestuwde bloedafname).
- Adviseer kaliumbevattende voedingsmiddelen (bijvoorbeeld zoutvervangende producten) of supplementen te staken.
- Kalium < 5,5 mmol/l is acceptabel; controleer het kalium na 2 weken om verdere stijging van het kalium uit te sluiten.
- Kalium 5,5-6,0 mmol/l:
- bij gebruik van triamtereen of amiloride (sterk kaliumsparende diuretica): stop het middel en controleer het kalium na 2 weken
- bij gebruik van een aldosteronantagonist (spironolacton, eplerenon): halveer de dosering en controleer het kalium na 2 weken
- bij gebruik van een RAS-remmer en onvoldoende daling van de kaliumspiegel na dosisaanpassing of stoppen van bovengenoemde kaliumsparende diuretica: halveer de dosering van de RAS-remmer en controleer het kalium na 2 weken.
- overleg met de cardioloog indien het kalium niet daalt.
- Kalium > 6,0 mmol/l: stop de aldosteronantagonist en/of RAS-remmer en overleg met de cardioloog over het vervolgbeleid.
Hypokaliëmie
Naar Samenvatting ›- Kalium 3,0-3,5 mmol/l: verhoog indien mogelijk de dosering van een eventuele RAS-remmer en/of voeg een aldosteronantagonist toe en/of geef kaliumsupplementen; controleer het kalium na 2 weken.
- Kalium < 3,0 mmol/l: overleg met de cardioloog of internist.
Hyponatriëmie
Naar Samenvatting ›Overleg zo nodig met de cardioloog of internist over het beleid met betrekking tot diuretica, zoutinname en eventuele vochtbeperking.
Controles
Naar Samenvatting ›- De instelfase op medicatie vindt veelal plaats in de tweede lijn. De huisarts kan, afhankelijk van regionale afspraken, de controles doen bij:
- patiënten voor wie behandeling in de tweede lijn niet wenselijk is, bijvoorbeeld vanwege comorbiditeit en/of kwetsbaarheid
- patiënten met HFpEF
- patiënten met HFrEF die stabiel zijn
- Controles vinden soms plaats in een combinatie van eerste- en tweedelijnszorg.
Controles in de stabiele fase
Naar Samenvatting ›Frequentie
- Controleer patiënten die de maximaal verdragen dosering van de medicatie hebben bereikt na 3 en na 6 maanden, en daarna jaarlijks zo lang het hartfalen stabiel is.
- Controleer op indicatie vaker, bijvoorbeeld bij variatie in klachten, bij ernstige nierfunctiestoornis (eGFR < 30 ml/min/1,73 m2), bij kwetsbare ouderen en bij patiënten met in het verleden nierfunctie- of elektrolytenafwijkingen met deze medicatie.
Aandachtspunten bij controles
- Vraag naar klachten, onder andere inspanningsvermogen.
- Informeer naar therapietrouw en mogelijke bijwerkingen van de medicatie.
- Meet bloeddruk, polsfrequentie en gewicht.
- Bepaal eGFR plus creatinine, natrium en kalium.
- Breid het laboratoriumonderzoek zo nodig uit bij patiënten die aanmerking komen voor cardiovasculair risicomanagement (zie NHG-Standaard Cardiovasculair risicomanagement).
- Besteed steeds opnieuw aandacht aan de voorlichting (zie Voorlichting).
- Wees alert op (langzame) verergering van het hartfalen. Pas zo nodig de medicatie aan volgens het Stappenplan hartfalenmedicatie of overleg met de cardioloog.
- Overweeg telemonitoring alleen indien de patiënt dit wenst.
- Er zijn geen onderzoeken beschikbaar naar telemonitoring voor hartfalen in de eerste lijn die van toepassing zijn op de Nederlandse situatie. Onderzoeken in de tweede lijn laten een tendens zien in het voordeel van telemonitoring, maar op dit moment is telemonitoring voor patiënten met hartfalen in de eerste lijn niet beschikbaar. Mogelijk zal in de toekomst wel zo zijn, gezien de opkomst van digitale zelfzorg.
- Het is daarom van belang eerst meer ervaring op te doen en met grootschalige implementatie te wachten totdat duidelijk is welke patiënten in aanmerking komen voor e-healthtoepassingen zoals telemonitoring, en wat de effecten zijn. Om die reden geeft de werkgroep een zwakke aanbeveling voor telemonitoring.
Voor- en nadelen
Er zijn aanwijzingen dat telemonitoring gunstige effecten zou kunnen hebben op sterfte, ziekenhuisopnames en kwaliteit van leven, maar omdat de algehele kwaliteit van de bewijs zeer laag is, zijn we onzeker over deze effecten. Een nadeel is dat de veiligheid van telemonitoring onvoldoende is onderzocht.
Kwaliteit van bewijs
De kwaliteit van bewijs was zeer laag tot laag.
Waarden en voorkeuren van patiënten
- Patiënten denken verschillend over telemonitoring (aanname van de werkgroep).
- In een kwalitatief onderzoek gaf een deel van de patiënten met hartfalen aan dat ze prettig vonden op afstand in de gaten te worden gehouden. Dit gaf hen een gevoel van veiligheid.
- Andere patiënten zullen juist moeite hebben met het gebruik van de techniek en zullen persoonlijk contact op prijs stellen.
Kosten
De kosten zijn niet onderzocht. De e-Vita-onderzoekers schatten dat de kosten van dagelijkse telemonitoring van bloeddruk, hartslag en gewicht op € 110 per maand (niet-gepubliceerde data).
Haalbaarheid
Het is nog onvoldoende duidelijk of en onder welke condities telemonitoring haalbaar is in de huisartsenpraktijk. Wel is er een maatschappelijke wens om telemonitoring uit te bouwen.
Aanvaardbaarheid
De effectiviteit en veiligheid van telemonitoring zijn onvoldoende onderzocht, wat de aanvaardbaarheid in de weg staat. Telemonitoring zou er in theorie toe kunnen leiden dat patiënten bij klachten te laat aan de bel trekken omdat ze denken dat het versturen van de waarden voldoende is. Daarom is een randvoorwaarde dat patiënten duidelijke instructie krijgen over wanneer ze contact moeten opnemen met de huisarts.
Aanbeveling
Overweeg telemonitoring alleen indien de patiënt dit wenst en de mogelijkheid hiervoor bestaat.
Achtergrond
- Telemonitoring is een overkoepelende term voor het volgen van de patiënt op afstand. Vitale gegevens zoals bloeddruk, pols en gewicht worden digitaal verstuurd en verwerkt zodat interventies in een vroeg stadium kunnen worden ingezet. De frequentie van het meten en versturen van gegevens is afhankelijk van de ernst en (in)stabiliteit van het hartfalen.
- Het is onduidelijk of telemonitoring in de huisartsenpraktijk meerwaarde heeft bij de behandeling van hartfalen.
- Bij het beantwoorden van de vraag hebben wij ons gericht op niet-invasieve vormen van telemonitoring die in de eerste lijn zouden kunnen worden toegepast.
Uitgangsvraag
Is telemonitoring (vergeleken met gebruikelijke zorg) aan te bevelen bij patiënten met hartfalen in de huisartsenpraktijk?
Methoden
Voor het beantwoorden van de uitgangsvraag is de clinical evidence review gebruikt behorend bij de NICE-Guideline Chronic heart failure in adults (NG106).
| Patiënten | Patiënten met hartfalen, onder behandeling van de huisarts |
|---|---|
| Interventie |
|
| Vergelijking | Gebruikelijke zorg |
| Uitkomstmaten | Sterfte aan alle oorzaken Ziekenhuisopname Kwaliteit van leven |
Resultaten
Resultaat zoekactie
Voor de NICE-richtlijn is een systematische literatuursearch met betrekking tot telemonitoring bij hartfalenpatiënten uitgevoerd tot december 2017. In juni 2020 leverde een zoekactie naar aanvullende literatuursearch van later datum 7 aanvullende RCT’s op.
Onderzoekskarakteristieken
In de literatuursearch door NICE werd een cochranereview gevonden van 41 RCT’s. De NICE-reviewers hebben 2 daarvan uitgesloten en vervolgens 5 recentere RCT’s ingesloten. De resultaten zijn dus gebaseerd op 44 RCT’s. In de NICE-review is onderscheid gemaakt tussen patiënten die recentelijk ontslagen waren uit het ziekenhuis (‘ziekenhuispopulaties’) en patiënten geworven in een outpatient clinic or community care setting (‘eerstelijnspopulaties’). Daarnaast waren er onderzoeken met gemengde populaties, waartoe ook artikelen zijn gerekend waarvan niet duidelijk was hoe en waar de deelnemers waren geworven.
De resultaten van 6 in onze aanvullende search gevonden artikelen hebben geen invloed op de sterkte of richting van de aanbeveling en worden daarom niet apart beschreven.
We vonden in de aanvullende search 1 artikel dat specifiek over de Nederlandse situatie gaat: de e-Vita trial. In deze RCT werden op 9 Nederlandse hartfalenpoliklinieken 450 patiënten met stabiel hartfalen geïncludeerd (gemiddelde leeftijd 67 jaar (SD 11), 74% man, 79% classificeerde zichzelf aan het begin van het onderzoek als NYHA-klasse I of II). De patiënten werden gerandomiseerd over 3 behandelarmen van elk 150 deelnemers: ten eerste gebruikelijke zorg (gemiddeld 4 routineafspraken per jaar, waarvan 3 met de hartfalenverpleegkundige en 1 met de cardioloog), ten tweede gebruikelijke zorg plus toegang tot de website www.heartfailurematters.org en ten derde een aangepast zorgpad waarin de routineafspraken op de polikliniek werden vervangen door dagelijkse telemonitoring van bloeddruk, hartslag en gewicht. Het onderzoek duurde 12 maanden. We laten hier de tweede behandelarm buiten beschouwing.
Effectiviteit
In tabel 17 tot en met tabel 22 zijn de effecten van gestructureerde telefonische ondersteuning en van telemonitoring weergegeven voor de verschillende populaties (eerstelijns, ziekenhuis, gemengd). Deze gegevens zijn afkomstig uit de NICE-review.
|
Uitkomsten (follow-up) |
Absolute effecten (95%-BI) |
Relatief effect (95%-BI) |
Aantal deelnemers (onderzoeken) |
Kwaliteit van bewijs (GRADE) |
Samenvatting |
|
|---|---|---|---|---|---|---|
|
Risico met gebruikelijke zorg |
Risico met gestructureerde ondersteuning per telefoon |
|||||
|
Sterfte aan alle oorzaken (3-24 maanden) |
103 per 1000 |
91 per 1000 (76 tot 109) |
RR 0,88 (0,73 tot 1,05) |
4495 (9 RCT’s) |
⨁◯◯◯ ZEER LAAG*,†,‡ |
We zijn onzeker over het effect op sterfte aan alle oorzaken |
|
Ziekenhuisopnames (3-24 maanden) |
398 per 1000 |
322 per 1000 (290 tot 354) |
RR 0,81 (0,73 tot 0,89) |
2694 (6 RCT’s) |
⨁⨁◯◯ LAAG*,‡,§ |
Mogelijk leidt gestructureerde ondersteuning per telefoon tot een afname in ziekenhuisopnames |
|
Kwaliteit van leven – MLHFQ (3-24 maanden) |
Niet gerapporteerd |
Gemiddelde MLHFQ-score 4,28 lager (6,43 lager tot 2,14 lager) |
– |
2103 (4 RCT’s) |
⨁⨁◯◯ LAAG*,¶ |
Mogelijk is er geen verschil in kwaliteit van leven |
|
RR = relatief risico; MLHFQ = Minnesota Living with Heart Failure Questionnaire (schaalbereik 0-105, lager is beter; ≥ 5 punten verschil is klinisch relevant). |
||||||
|
Uitkomsten (follow-up) |
Absolute effecten (95%-BI) |
Relatief effect (95%-BI) |
Aantal deelnemers (onderzoeken) |
Kwaliteit van bewijs (GRADE) |
Samenvatting |
|
|---|---|---|---|---|---|---|
|
Risico met gebruikelijke zorg |
Risico met gestructureerde ondersteuning per telefoon |
|||||
|
Sterfte aan alle oorzaken (3-24 maanden) |
128 per 1000 |
107 per 1000 (92 tot 125) |
RR 0,84 (0,72 tot 0,98) |
4754 (14 RCT’s) |
⨁◯◯◯ ZEER LAAG*,†,‡,§ |
We zijn onzeker over het effect op sterfte aan alle oorzaken |
|
Ziekenhuisopnames (3-24 maanden) |
433 per 1000 |
433 per 1000 (407 tot 463) |
RR 1,00 (0,94 tot 1,07) |
4549 (11 RCT’s) |
⨁◯◯◯ ZEER LAAG*,†,§,¶ |
We zijn onzeker over het effect op ziekenhuisopnames |
|
Kwaliteit van leven – MLHFQ (6 maanden) |
Gemiddelde MLHFQ-score 12,9 |
Gemiddelde MLHFQ-score 0,80 lager (6,48 lager tot 4,88 hoger) |
– |
134 (1 RCT) |
⨁⨁◯◯ LAAG†,** |
Mogelijk is er geen verschil in kwaliteit van leven |
|
RR = relatief risico; MLHFQ = Minnesota Living with Heart Failure Questionnaire (schaalbereik 0-105, lager is beter; ≥ 5 punten verschil is klinisch relevant). |
||||||
|
Uitkomsten (follow-up) |
Absolute effecten (95%-BI) |
Relatief effect (95%-BI) |
Aantal deelnemers (onderzoeken) |
Kwaliteit van bewijs (GRADE) |
Samenvatting |
|
|---|---|---|---|---|---|---|
|
Risico met gebruikelijke zorg |
Risico met gestructureerde ondersteuning per telefoon |
|||||
|
Sterfte aan alle oorzaken (11,6 maanden) |
56 per 1000 |
74 per 1000 (29 tot 194) |
RR 1,32 (0,51 tot 3,44) |
254 (1 RCT) |
⨁◯◯◯ ZEER LAAG*,†,‡ |
We zijn onzeker over het effect op sterfte aan alle oorzaken |
|
Ziekenhuisopnames (3-24 maanden) |
300 per 1000 |
363 per 1000 (252 tot 516) |
RR 1,21 (0,84 tot 1,72) |
254 (1 RCT) |
⨁◯◯◯ ZEER LAAG*,†,§ |
We zijn onzeker over het effect op ziekenhuisopnames |
|
Kwaliteit van leven –MLHFQ (6 maanden) |
Gemiddeld verschil op MLHFQ 1,4 |
Gemiddeld verschil op MLHFQ 20,76 lager (23,78 lager tot 17,74 lager) |
– |
50 (1 RCT) |
⨁◯◯◯ ZEER LAAG*,†,¶ |
We zijn onzeker over het effect op kwaliteit van leven |
|
RR = relatief risico; MLHFQ = Minnesota Living with Heart Failure Questionnaire (schaalbereik 0-105, lager is beter; ≥ 5 punten verschil is klinisch relevant). |
||||||
|
Uitkomsten (follow-up) |
Absolute effecten (95%-BI) |
Relatief effect (95% CI) |
Aantal deelnemers (onderzoeken) |
Kwaliteit van bewijs (GRADE) |
Samenvatting |
|
|---|---|---|---|---|---|---|
|
Risico met gebruikelijke zorg |
Risico met telemonitoring |
|||||
|
Sterfte aan alle oorzaken (12 maanden) |
300 per 1000 |
201 per 1000 (42 tot 951) |
RR 0,67 (0,14 tot 3,17) |
20 (1 RCT) |
⨁◯◯◯ ZEER LAAG*,†,‡ |
We zijn onzeker over het effect op sterfte aan alle oorzaken |
|
Ziekenhuisopnames – niet gemeten |
– |
– |
– |
– |
– |
Het effect op ziekenhuisopnames is niet onderzocht |
|
Kwaliteit van leven – MLHFQ niet gemeten |
– |
– |
– |
– |
– |
Het effect op kwaliteit van leven is niet onderzocht |
|
RR = relatief risico; MLHFQ = Minnesota Living with Heart Failure Questionnaire (schaalbereik 0-105, lager is beter; ≥ 5 punten verschil is klinisch relevant). |
||||||
|
Uitkomsten (follow-up) |
Absolute effecten (95%-BI) |
Relatief effect (95%-BI) |
Aantal deelnemers (onderzoeken) |
Kwaliteit van bewijs (GRADE) |
Samenvatting |
|
|---|---|---|---|---|---|---|
|
Risico met gebruikelijke zorg |
Risico met telemonitoring |
|||||
|
Sterfte aan alle oorzaken (3-24 maanden) |
147 per 1000 |
82 per 1000 (62 tot 109) |
RR 0,56 (0,42 tot 0.74) |
1480 (9 RCT’s) |
⨁◯◯◯ ZEER LAAG*,†,‡ |
We zijn onzeker over het effect op sterfte aan alle oorzaken |
|
Ziekenhuisopnames (3-24 maanden) |
611 per 1000 |
495 per 1000 (403 tot 598) |
RR 0,81 (0,66 tot 0,98) |
1400 (8 RCT’s) |
⨁◯◯◯ ZEER LAAG*,†,‡,§,¶ |
We zijn onzeker over het effect op ziekenhuisopnames |
|
Kwaliteit van leven – MLHFQ (3-6 maanden) |
Niet gerapporteerd** |
Gemiddeld verschil op MLHFQ 3,01 lager (6,88 lager tot 0,87 hoger)** |
– |
370 (2 RCT’s)** |
⨁◯◯◯ ZEER LAAG*,†,†† |
We zijn onzeker over het effect op kwaliteit van leven |
|
RR = relatief risico; MLHFQ = Minnesota Living with Heart Failure Questionnaire (schaalbereik 0-105, lager is beter; ≥ 5 punten verschil is klinisch relevant). |
||||||
|
Uitkomsten (follow-up) |
Absolute effecten (95%-BI) |
Relatief effect (95- CI) |
Aantal deelnemers (onderzoeken) |
Kwaliteit van bewijs (GRADE) |
Samenvatting |
|
|---|---|---|---|---|---|---|
|
Risico met gebruikelijke zorg |
Risico met telemonitoring |
|||||
|
Sterfte aan alle oorzaken (3-24 maanden) |
137 per 1000 |
131 per 1000 (108 tot 159) |
RR 0,96 (0,79 tot 1,16) |
2360 (8 RCT’s) |
⨁◯◯◯ ZEER LAAG*,†,‡,§ |
We zijn onzeker over het effect op sterfte aan alle oorzaken |
|
Ziekenhuisopnames (3-24 maanden) |
449 per 1000 |
458 per 1000 (395 tot 530) |
RR 1,02 (0,88 tot 1,18) |
2052 (6 RCT’s) |
⨁◯◯◯ ZEER LAAG†,§,¶,** |
We zijn onzeker over het effect op ziekenhuisopnames |
|
Kwaliteit van leven – MLHFQ (6-12 maanden |
Gemiddelde MLHFQ-score 32,6 |
Gemiddeld verschil op MLHFQ 5,98 lager (11,37 lager tot 0,58 lager) |
– |
285 (2 RCTs) |
⨁◯◯◯ ZEER LAAG*,†,†† |
We zijn onzeker over het effect op kwaliteit van leven |
|
RR = relatief risico; MLHFQ = Minnesota Living with Heart Failure Questionnaire (schaalbereik 0-105, lager is beter; ≥ 5 punten verschil is klinisch relevant). |
||||||
Resultaten uit e-Vita
- Sterfte aan alle oorzaken: in de controlegroep, die gebruikelijke zorg kreeg, overleden 4 patiënten; in de telemonitoringgroep overleden 8 patiënten (HR 2,06; 95%-BI 0,62 tot 6,84).
- Ziekenhuisopnames: in de controlegroep werden 66 patiënten opgenomen; in de telemonitoringgroep 57 (HR 0,85; 95%-BI 0,21 tot 5,11).
- Kwaliteit van leven: na 3 maanden was de mediane score op de MLHFQ in de controlegroep 22,8 versus 19,0 in de telemonitoringgroep (verschil -3,8; 95%-BI –9,76 tot –0,53). Dit verschil was niet klinisch relevant en nam in de loop van het onderzoek af: na 12 maanden was de mediane MLHFQ-score in de controlegroep 26,5 versus 25,5 in de telemonitoringgroep (verschil -1; 95%-BI –7,90 tot 1,81).
- Participatiegraad: van de 1988 patiënten die in aanmerking kwamen, wilden er 1538 niet deelnemen. De participatie bedroeg daarmee 23% en is laag, maar vergelijkbaar met andere onderzoeken.
Conclusies
We zijn onzeker over het effect van gestructureerde telefonische ondersteuning en telemonitoring op sterfte aan alle oorzaken, ziekenhuisopnames en kwaliteit van leven.
Beleid bij exacerbaties
Naar Samenvatting ›- Bij acuut hartfalen (ontstaan of verergerd in de loop van enkele uren, ABCDE instabiel): zie Acuut hartfalen.
- Bij exacerbatie hartfalen (ontstaan of verergerd in de loop van enkele dagen, ABCDE stabiel): zie hieronder.
- Besteed aandacht aan uitlokkende factoren zoals:
- infecties
- NSAID-gebruik
- extra zout- of vochtinname
- onjuist toepassen van de therapie of therapieontrouw
- Verdubbel de dosering van het diureticum gedurende 3 dagen.
- Overweeg tijdelijke halvering van de bètablokker:
- indien verdubbeling van het diureticum onvoldoende effect heeft
- bij hartfrequentie < 50/min in combinatie met toename van de symptomen
- Ga na of de patiënt correct is ingesteld op de hartfalenmedicatie (zie Stappenplan hartfalenmedicatie) en pas deze zo nodig aan (in overleg met de cardioloog).
- Laat de patiënt zich dagelijks wegen en houd nauw contact tot de patiënt weer stabiel is.
Preventie van dehydratie bij intercurrente infecties
Naar Samenvatting ›- Overweeg laboratoriumdiagnostiek (eGFR plus creatinine, kalium, natrium) afhankelijk van de ernst van het klinische beeld en de tijd tot uitslag
- Verwijs de patiënt bij ernstige klachten (zie Consultatie en verwijzing).
- Het beleid is afhankelijk van het klinische beeld en eventuele laboratoriumuitslagen.
- Overweeg tijdelijk de RAS-remmer en/of aldosteronantagonist te halveren, en het diureticum te halveren (bij ook chronische nierschade) of te staken.
- Bij gebruik NSAID’s: staak deze in ieder geval tijdelijk en zo mogelijk permanent.
- Ook voor andere medicatie geldt dat aanpassing aangewezen kan zijn, bijvoorbeeld het staken van metformine gedurende enkele dagen vanwege het risico op lactaatacidose (zie NHG-Standaard Acute diarree).
De informatie in dit detail is overgenomen uit de LESA Rationeel aanvragen van laboratoriumdiagnostiek en uit de NHG-Standaard Chronische nierschade.
Patiënten met hartfalen die diuretica en RAS-remmers gebruiken, hebben een verhoogd risico op dehydratie bij intercurrente infecties. Zeker indien ze naast hartfalen ook chronisch nierfalen hebben of (al dan niet tegen medisch advies in) NSAID’s gebruiken, kan daarbij een acute nierfunctieverslechtering of elektrolytstoornis optreden. Vooral tijdens warme zomerdagen is alertheid geboden. Het RAS-systeem beïnvloedt de bloeddrukregulatie en de nierperfusie. Bij dehydratie leidt dit tot vasoconstrictie, reabsorptie van natrium en retentie van water, en daarmee tot een toename van het circulerend volume en bloeddrukstijging. RAS-remmers onderdrukken de beschermende werking van het RAS-systeem op de glomerulaire filtratie bij ondervulling, wat kan leiden tot acute nierschade. Gebruik van NSAID’s verhoogt het risico op afname van de glomerulaire filtratiesnelheid.
Een relevant deel van de ongeplande ziekenhuisopnames blijkt het gevolg te zijn van geneesmiddelbijwerkingen. Dit blijkt onder meer uit de resultaten van 2 observationele onderzoeken naar ziekenhuisopnames ten gevolge van geneesmiddelbijwerkingen: Integrated Primary Care Information (IPCI) en Hospital Admissions Related to Medication (HARM). Deze resultaten zijn later bevestigd.
Een deel van de geneesmiddelgerelateerde ziekenhuisopnames blijkt veroorzaakt te zijn door achteruitgang van de nierfunctie of afwijkende natrium- en kaliumspiegels. Anticoagulantia, trombocytenaggregatieremmers en NSAID’s gaven het frequentst aanleiding tot een potentieel vermijdbare bijwerking (gastro-intestinale en andere bloedingen; dit betrof 84 van de 367 potentieel vermijdbare opnames). Diuretica en RAS-remmers gaven in 30 van de 367 potentieel vermijdbare opnames aanleiding tot elektrolytstoornissen of dehydratie. Potentieel vermijdbare ziekenhuisopnames worden vooral op hogere leeftijd gezien: 66% van bovenstaande ziekenhuisopnames had betrekking op patiënten > 80 jaar.
Consultatie en verwijzing
Naar Samenvatting ›Cardioloog
Naar Samenvatting ›Overleg in de volgende situaties laagdrempelig met de cardioloog, met name bij kwetsbare patiënten of patiënten die zijn terugverwezen naar de huisarts.
Redenen voor consultatie of (terug)verwijzing
Naar Samenvatting ›- Verwijs naar de cardioloog bij vermoeden van hartfalen op basis van afwijkend ecg en/of verhoogd (NT-pro)BNP:
- start bij een sterk vermoeden of lange wachttijd alvast leefregels en medicatie (zie Stappenplan hartfalenmedicatie)
- overweeg verwijzing achterwege te laten bij kwetsbare patiënten voor wie diagnostiek en behandeling in de tweede lijn niet wenselijk zijn
- Verwijs naar de cardioloog bij geleidelijke progressie van hartfalen ondanks ophoging van de diuretica; met name voor:
- beoordeling van de ejectiefractie in verband met eventuele toevoeging van een aldosteronantagonist (zie Stappenplan hartfalenmedicatie)
- eventuele behandeling met een ARNI of ivabradine (zie ARNI en ivabradine)
- Exacerbatie hartfalen: bij ernstige of aanhoudende klachten ondanks behandeling.
- Dehydratie: bij ernstige of aanhoudende klachten ondanks behandeling.
Redenen voor overleg
Naar Samenvatting ›- Achteruitgang van de nierfunctie of elektrolytstoornissen (zie Beleid bij laboratoriumafwijkingen)
- Persisterende hypertensie ondanks adequate instelling op hartfalenmedicatie
- Onvoldoende controle van angina pectoris met hartfalenmedicatie
- Patiënt is mogelijk gebaat bij multidisciplinaire hartrevalidatie (leren omgaan met hartfalen en verbetering van de lichamelijke conditie, zie Multidisciplinaire richtlijn Hartrevalidatie)
Organisatie van de zorg
Naar Samenvatting ›Algemeen
- Leg in het dossier vast wie de hoofdbehandelaar is en daarmee het aanspreekpunt voor het coördineren van de zorg.
- Zorg ervoor dat het voor de patiënt en de zorgverleners op ieder moment duidelijk is wie hoofdbehandelaar en aanspreekpunt is, en ga na of de patiënt beschikt over de contactgegevens.
- Betrek zo nodig andere disciplines bij het beleid, bijvoorbeeld fysio- of oefentherapeut, diëtist, maatschappelijk werker of psycholoog met expertise op het gebied van hartfalen.
- Inventariseer of de mogelijkheid bestaat een kaderhuisarts hart- en vaatziekten te consulteren.
- Start tijdig met advance care planning (ACP):
- bespreek met enige regelmaat de doelen en voorkeuren van de patiënt met betrekking tot toekomstige zorg, en documenteer deze
- communiceer de de doelen en voorkeuren van de patiënt met de tweede lijn indien deze daar ook onder behandeling is
- Bespreek met de patiënt de mogelijkheid om het dossier te delen met de huisartsenpost.
- Zorg ervoor dat de gemaakte afspraken bekend zijn bij de huisartsenpost en andere zorgverleners in geval van verwachte ontregeling, opname in een ziekenhuis of verpleeghuis of in de terminale fase.
Regionale afspraken
Maak met de betrokken cardiologen in de regio afspraken over:
- het diagnostische traject
- multidisciplinaire samenwerking en de rol van de hartfalenverpleegkundige
- welke huisartsen de behandeling van patiënten met hartfalen eventueel willen overnemen van de tweede lijn
- wie de controles uitvoert
- de wijze van consultatie, verwijzing en terugverwijzing
- communicatie tussen de cardioloog en huisarts over wijzigingen van het toestandsbeeld en/of de medicatie (zie Richtlijn Informatie-uitwisseling tussen huisarts en specialist)
- wie het aanspreekpunt is in geval van verslechtering
- hoe patiënten worden opgevangen bij exacerbaties in ANW-uren.
Overdracht hoofdbehandelaarschap
- Bij het instellen op medicatie na een verwijzing is de cardioloog hoofdbehandelaar.
- De cardioloog kan de patiënt (eventueel na verloop van tijd) terugverwijzen als deze:
- optimaal (medicamenteus of niet-medicamenteus) behandeld is en stabiel is
- zich in de terminale levensfase bevindt
- Na de terugverwijzing is de huisarts hoofdbehandelaar.
- Indien de cardioloog alleen diagnostiek heeft uitgevoerd, moet deze bij de overdracht aan de huisarts de volgende gegevens verstrekken:
- wie de hoofdbehandelaar is
- welke diagnose gesteld is
- behandeladvies en vervolgbeleid
- De tekst over organisatie van zorg is gebaseerd op de LTA Hartfalen uit 2015.
- Voor protocollen met regionale samenwerkingsafspraken, zie www.nvvcconnect.nl.
Palliatieve zorg bij hartfalen
Naar Samenvatting ›Levensverwachting
Naar Samenvatting ›- De levensverwachting is moeilijk in te schatten, gezien het vaak grillige beloop van hartfalen.
- Aanwijzingen voor een beperkte levensverwachting zijn:
- frequente heropnames voor exacerbaties
- persisterende symptomen ondanks optimale behandeling
- cachexie
- afhankelijkheid van anderen bij ADL-activiteiten
- ernstige comorbiditeit
- negatief antwoord op de vraag: ‘Zou het mij verbazen als deze patiënt < 12 maanden overlijdt?’
- De meeste patiënten met hartfalen overlijden uiteindelijk aan een andere aandoening of aan plotse hartdood.
De informatie over palliatieve zorg bij hartfalen is gebaseerd op de multidisciplinaire Richtlijn Palliatieve zorg bij hartfalen NYHA-klasse III en IV (2018).
Er zijn geen geschikte modellen om de levensverwachting bij hartfalen NYHA-klasse III en IV te kunnen inschatten. De in deze standaard genoemde criteria voor een beperkte levensverwachting zijn gebaseerd op de SPICT-criteria, aangevuld met 2 RADPAC-criteria.
Een Nederlands retrospectief onderzoek onder hartfalenpatiënten in de eerste lijn liet zien dat de meesten niet aan progressief hartfalen overlijden: bij 23% was de doodsoorzaak progressief hartfalen, bij 28% plotse hartdood (inclusief longembolie) en bij 49% was de doodsoorzaak een andere.
Advance care planning
Naar Samenvatting ›- Start tijdig gesprekken over ACP bij patiënten in NYHA-klasse III of IV en beperkte levensverwachting.
- Bespreek huidige en te verwachten symptomen, en de eventuele angst om te stikken.
- Besteed aandacht aan wat voor de patiënt belangrijk is in het leven.
- Formuleer samen met de patiënt en eventueel diens naasten zinvolle en haalbare doelen voor huidige en toekomstige zorg en behandeling.
- Bespreek de voor- en nadelen van de behandelingsopties.
- Bespreek de voorkeuren voor specifieke behandelingen rond het levenseinde.
- Documenteer de gemaakte afspraken in een IZP en zorg dat andere hulpverleners op de hoogte zijn van de gemaakte afspraken (zie Individueel zorgplan).
- Herhaal de gesprekken met enige regelmaat om te controleren of de gemaakte afspraken actueel zijn of bijstelling behoeven.
Medicatie
Naar Samenvatting ›- Leg uit dat in de laatste levensfase (arbitrair < 3 maanden voor het overlijden) medicamenteuze behandeling hoofdzakelijk of uitsluitend gericht is op verlichting van klachten.
- Als het levenseinde duidelijk in zicht is:
- stop de controles van gewicht, bloeddruk, nierfunctie en elektrolyten of beperk ze tot een minimum
- overweeg morfine en eventueel sedatie ter verlichting van de klachten
- Als het levenseinde niet duidelijk in zicht of gewenst is:
- titreer de medicatie op geleide van hartfalensymptomen, bloeddruk, nierfunctie en elektrolyten, met als doel symptoomverlichting
- maak bij medicatie en (laboratorium)controles steeds de afweging tussen doorgaan en beperken of staken
Diuretica
Naar Samenvatting ›- Pas de dosis aan op geleide van de klinische toestand; streef naar de laagst mogelijke effectieve dosis.
- Overweeg flexibel diureticumbeleid; met name ouderen drinken minder door verminderd dorstgevoel en zullen een lage dosering diuretica nodig hebben.
- Continueer diuretica bij aanwijzingen voor overvulling, totdat:
- orale inname niet meer mogelijk is
- de patiënt geen medicatie meer wenst
- systolische bloeddruk < 90 mmHg persisteert ondanks halveren of staken van de overige antihypertensiva.
Overige hypertensiva
Naar Samenvatting ›- Staak of verminder bètablokkers, RAS-remmers en/of aldosteronantagonisten indien:
- de patiënt de medicatie niet meer kan of wenst in te nemen
- bijwerkingen de kwaliteit van leven negatief beïnvloeden
- Staak in principe eerst de bètablokker (bij voorkeur afbouwen gezien de kans op reflextachycardie) en daarna de RAS-remmer en/of aldosteronantagonist.
- Indien de patiënt vanwege klachten zoals angina pectoris of ritmestoornissen meer gebaat is bij een bètablokker, staak dan eerst de RAS-remmer en/of aldosteronantagonist.
- RAS-remmers en/of aldosteronantagonisten:
- halveer bij symptomatische (orthostastische) hypotensie, systolische bloeddruk < 90 mmHg en/of eGFR < 30 ml/min/1,73m2
- staak bij eGFR < 20 ml/min/1,73m2
- Bètablokkers:
- halveer bij symptomatische (orthostatische) hypotensie, systolische bloeddruk < 90 mmHg en/of bradycardie < 50/min
- overweeg verlaging of staken bij extreme moeheid of andere bijwerkingen
Morfine bij persisterende dyspneu
Naar Samenvatting ›- Start morfine met vertraagde afgifte, 10 mg 2 dd oraal, beoordeel het effect na 24 uur en verhoog bij onvoldoende effect in stappen van 25-50%.
- Of geef snelwerkende morfine, 2,5 mg zo nodig of om de 4 uur, beoordeel het effect na 4 uur en verhoog bij onvoldoende effect in stappen van 25-50%.
- Geef bij dyspneu-aanvallen die naar verwachting > 30 minuten aanhouden daarnaast snelwerkende morfine, 1/6 van de dagdosis (afgerond naar het dichtstbijzijnde veelvoud van 5 mg).
- Kies bij eGFR < 50 ml/min/1,73m2 voor intermitterende toediening van morfine (zo nodig), of eventueel voor fentanyl transdermaal of hydromorfon als onderhoudsbehandeling.
De informatie over dyspneu in de palliatieve fase is gebaseerd op de multidisciplinaire Richtlijn Dyspneu in de palliatieve fase (2015).
ICD en pacemaker
Naar Samenvatting ›- Deactiveer een ICD in de palliatieve fase of bij euthanasie om te voorkomen dat deze impulsen afgeeft tijdens het overlijden.
- Een functionerende pacemaker zal het overlijdensproces niet verstoren en is belangrijk voor het comfort van de patiënt.
Zie de multidicsiplinaire Richtlijn ICD/pacemaker in de laatste levensfase.
ICD
- Een functionerende implanteerbare cardioverter-defibrillator (ICD) kan het overlijdensproces verstoren door het afgeven van shocks en moet daarom worden gedeactiveerd in de palliatieve fase of bij euthanasie. Deactivering geeft geen toename van cardiale klachten.
- Reguliere deactivering van de ICD vindt plaats in het ziekenhuis. Indien de patiënt niet meer in staat is om naar het ziekenhuis te komen, kan deactivering alleen nog plaatsvinden via een noodprocedure waarbij een ziekenhuismedewerker ter plaatse de ICD komt deactiveren. Dit kan echter veelal niet direct plaatsvinden.
- Bij spoed kan een sterke magneet op de huid ter plaatse van de ICD worden gelegd (eventueel te fixeren met tape). Zolang deze aanwezig is, is de ICD-functie gedeactiveerd. Een dergelijke magneet is aanwezig in een ambulance en in sommige regio’s ook in de auto’s van de huisartsenpost.
Pacemaker
- Deactivering van een pacemaker kan toename van cardiale klachten geven en is daarom niet wenselijk.
- Een functionerende pacemaker zal het overlijdensproces niet verstoren en is belangrijk voor het comfort van de patiënt.
Acuut hartfalen
Naar Samenvatting ›- Kenmerk van acuut hartfalen is een snel begin of snelle toename van klachten.
- Behandel ernstig acuut hartfalen (asthma cardiale) als ABCDE instabiel (zie NHG-Behandelrichtlijn Geneesmiddelen en zuurstof in spoedeisende situaties).
Klinische tekenen
Naar Samenvatting ›- (Half)zittende houding, angstige blik, reutelende/versnelde ademhaling, bleek/grauwe kleur, transpireren, klamme koude huid
- Verhoogde ademfrequentie, vergrote ademarbeid, verlaagde saturatie
- Pols meestal snel en zwak
- Bloeddruk soms verlaagd
- Auscultatie hart: hartgeruis, aritmie of extra toon
- Auscultatie longen: tweezijdig crepiteren, veelal ook rhonchi, soms piepen (bij acute exacerbatie van chronisch hartfalen mogelijk ook demping en nauwelijks of geen ademgeruis basaal, passend bij pleuravocht)
- Oedeem, gestuwde halsvenen (verhoogde centraalveneuze druk).
Beleid
Naar Samenvatting ›Bij telefonisch contact
- Adviseer de patiënt rechtop te zitten met afhangende benen.
- Adviseer alvast een dosis nitroglycerine 0,4 mg of isosorbidedinitraat 5 mg sublinguaal in te nemen (indien beschikbaar), ongeacht of er pijn op de borst is.
- Adviseer geen nitroglycerine of isosorbidedinitraat als de patiënt bekend is met een lage bloeddruk.
- Laat een ambulance met A1-indicatie bellen en maak een visite.
In aanwezigheid van de patiënt
- Bel een ambulance met A1-indicatie.
- Geef zuurstof indien beschikbaar, 10-15 l/min via een non-rebreathing masker.
- Plaats de patiënt in zittende houding.
- Bij systolische bloeddruk > 90 mmHg: geef elke 5 minuten nitroglycerine 0,4 mg sublinguaal, 1-2 sprays tot de klachten voldoende verbeteren of de systolische bloeddruk daalt < 90 mmHg.
- Contra-indicatie voor nitroglycerine: recent gebruik van een fosfodiësterase-5-remmer (avanafil, sildenafil, tadalafil, vardenafil).
- Breng een infuusnaald in en spuit door met NaCl 0,9% 2 ml .
- Geef bij dyspneu met aanwijzingen voor vochtretentie furosemide 40 mg intraveneus in 2-3 min of bumetanide 1 mg intraveneus (maximaal 4 mg). Doseer hoger bij eGFR < 30 ml/min/1,73m2.
- Wees terughoudend met morfine:
- uitsluitend bij persisterend hevige onrust, dyspneu, angst of pijn op de borst
- geen morfine bij patiënten met ernstig COPD
- overweeg morfine 2,5-5 mg intraveneus langzaam in 4-5 min; herhaal zo nodig na 10-20 min
Referenties
- Nielen MM, Hek K, Schermer TR. Jaarcijfers aandoeningen: incidenties en prevalenties. Utrecht: NIVEL, 2020. www.nivel.nl/nl/nivel-zorgregistraties-eerste-lijn, geraadpleegd 20 oktober 2020. Ga naar bron: Nielen MM, Hek K, Schermer TR. Jaarcijfers aandoeningen: incidenties en prevalenties. Utrecht: NIVEL, 2020. www.nivel.nl/nl/nivel-zorgregistraties-eerste-lijn, geraadpleegd 20 oktober 2020.
- Hartstichting. Hart- en vaatziekten in Nederland 2018: cijfers over risicofactoren, hartinterventies, ziekte en sterfte. Den Haag: Hartstichting, 2018. www.hartstichting.nl , geraadpleegd oktober 2020.
- Bleumink GS, Knetsch AM, Sturkenboom MC, et al. Quantifying the heart failure epidemic: prevalence, incidence rate, lifetime risk and prognosis of heart failure: The Rotterdam Study. Eur Heart J 2004;25:1614-9.
- Van Riet EE, Hoes AW, Limburg A, Landman MA, Kemperman H, Rutten FH. Extended prediction rule to optimise early detection of heart failure in older persons with non-acute shortness of breath: a cross-sectional study. BMJ Open 2016;6:e008225.
- Brouwers FP, De Boer RA, Van der Harst P, et al. Incidence and epidemiology of new onset heart failure with preserved vs. reduced ejection fraction in a community-based cohort: 11-year follow-up of PREVEND. Eur Heart J 2013;34:1424-31.
- ESC. Guidelines for the diagnosis and treatment of acute and chronic heart failure 2012: Addenda. European Society of Cardiology, 2012. www.escardio.org, geraadpleegd oktober 2020. Ga naar bron: ESC. Guidelines for the diagnosis and treatment of acute and chronic heart failure 2012: Addenda. European Society of Cardiology, 2012. www.escardio.org, geraadpleegd oktober 2020.
- Yancy CW, Lopatin M, Stevenson LW, De Marco T, Fonarow GC. Clinical presentation, management, and in-hospital outcomes of patients admitted with acute decompensated heart failure with preserved systolic function: a report from the Acute Decompensated Heart Failure National Registry (ADHERE) Database. J Am Coll Cardiol 2006;47:76-84.
- Rutten FH, Grobbee DE, Hoes AW. Differences between general practitioners and cardiologists in diagnosis and management of heart failure: a survey in every-day practice. Eur J Heart Fail 2003;5:337-44.
- Rossignol P, Hernandez AF, Solomon SD, Zannad F. Heart failure drug treatment. Lancet 2019;393:1034-44.
- Lindenfeld J, Krause-Steinrauf H, Salerno J. Where are all the women with heart failure? J Am Coll Cardiol 1997;30:1417-9.
- Burch D. Heart failure: gaps in knowledge and failures in treatment. PLoS Med 2014;11:e1001702.
- Rutten FH, Cramer MJ, Grobbee DE, et al. Unrecognized heart failure in elderly patients with stable chronic obstructive pulmonary disease. Eur Heart J 2005a;26:1887-94.
- Boonman-de Winter LJ, Rutten FH, Cramer MJ, et al. High prevalence of previously unknown heart failure and left ventricular dysfunction in patients with type 2 diabetes. Diabetologia 2012;55:2154-62.
- Van Riet EE, Hoes AW, Limburg A, Landman MA, Van der Hoeven H, Rutten FH. Prevalence of unrecognized heart failure in older persons with shortness of breath on exertion. Eur J Heart Fail 2014;16:772-7.
- Van Mourik Y, Bertens LC, Cramer MH, et al. Unrecognized heart failure and chronic obstructive pulmonary disease (COPD) in frail elderly detected through a near-home targeted screening strategy. J Am Board Fam Med 2014;27:811-21.
- Ponikowski P, Voors AA, Anker SD; ESC Scientific Document Group. 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure. European Society Cardiology. Eur Heart J 2016;37:2129-200.
- He J, Ogden LG, Bazzano LA, Vupputuri S, Loria C, Whelton PK. Risk factors for congestive heart failure in US men and women: NHANES I epidemiologic follow-up study. Arch Intern Med 2001;161:996-1002.
- Kannel WB, Ho K, Thom T. Changing epidemiological features of cardiac failure. Br Heart J 1994;72:S3-9.
- Bibbins-Domingo K, Pletcher MJ, Lin F, Vittinghoff E, Gardin JM, Arynchyn A, Lewis CE, Williams OD, Hulley SB. Racial differences in incident heart failure among young adults. N Engl J Med 2009 Mar 19;360:1179-90.
- Chioncel O, Lainscak M, Seferovic PM, et al. Epidemiology and one-year outcomes in patients with chronic heart failure and preserved, mid-range and reduced ejection fraction: an analysis of the ESC Heart Failure Long-Term Registry. Eur J Heart Fail 2017;19:1574-85.
- Maggioni AP, Dahlström U, Filippatos G, et al. EURObservational Research Programme: regional differences and 1-year follow-up results of the Heart Failure Pilot Survey (ESC-HF Pilot). Eur J Heart Fail 2013;15:808-17.
- Rutten FH, Cramer MJ, Paulus WJ. Hartfalen met gepreserveerde ejectiefractie: diastolisch hartfalen. Ned Tijdschr Geneeskd 2012b;156:A5315.
- Meijers WC, Van der Velde AR, Muller Kobold AC, et al. Variability of biomarkers in patients with chronic heart failure and healthy controls. Eur J Heart Fail 2017;19:357-65.
- Van Kimmenade R, Van Dielen F, Bakker J, et al. Is brain natriuretic peptide production decreased in obese subjects? J Am Coll Cardiol 2006;47:886-7.
- Suthahar N, Meijers WC, Ho JE, et al. Sex-specific associations of obesity and N-terminal pro-B-type natriuretic peptide levels in the general population. Eur J Heart Fail 2018;20:1205-14.
- Mueller C, Laule-Kilian K, Scholer A, et al. Use of B-type natriuretic peptide for the management of women with dyspnea. Am J Cardiol 2004;94:1510-4.
- Kelder JC, Cramer MJ, Van Wijngaarden J, et al. The diagnostic value of physical examination and additional testing in primary care patients with suspected heart failure. Circulation 2011;124:2865-73.
- NICE. Guideline Chronic heart failure in adults: Diagnosis and management (NG106). London: National Institute for Health and Care Excellence 2018. https://www.nice.org.uk/guidance/ng106, geraadpleegd oktober 2020. Ga naar bron: NICE. Guideline Chronic heart failure in adults: Diagnosis and management (NG106). London: National Institute for Health and Care Excellence 2018. https://www.nice.org.uk/guidance/ng106, geraadpleegd oktober 2020.
- Cowie MR, Struthers AD, Wood DA, et al. Value of natriuretic peptides in assessment of patients with possible new heart failure in primary care. Lancet 1997;350:1349-53.
- Nielsen LS, Svanegaard J, Klitgaard NA, Egeblad H. N-terminal pro-brain natriuretic peptide for discriminating between cardiac and non-cardiac dyspnoea. Eur J Heart Fail 2004;6:63-70.
- Zaphiriou A, Robb S, Murray-Thomas T, et al. The diagnostic accuracy of plasma BNP and NT-pro-BNP in patients referred from primary care with suspected heart failure: results of the UK natriuretic peptide study. Eur J Heart Fail 2005;7:537-41.
- Zuber M, Cuculi F, Attenhofer et al. Value of brain natriuretic peptides in primary care patients with the clinical diagnosis of chronic heart failure. Scand Cardiovasc J 2009;43:324-9.
- O'Shea P, Daly R, Kasim S, Tormey WP. B-type natriuretic peptide in the cardiology department. Ir Med J 2012;105:341-3.
- Verdú JM, Comín-Colet J, Domingo M, et al. Rapid point-of-care NT-pro-BNP optimal cut-off point for heart failure diagnosis in primary care. Rev Esp Cardiol (Engl Ed) 2012;65:613-9.
- Taylor CJ, Roalfe AK, Iles R, et al.; REFER investigators. Primary care REFerral for EchocaRdiogram (REFER) in heart failure: a diagnostic accuracy study. Br J Gen Pract 2017b;67:e94-102.
- Mant J, Doust J, Roalfe A, et al. Systematic review and individual patient data meta-analysis of diagnosis of heart failure, with modelling of implications of different diagnostic strategies in primary care. Health Technol Assess 2009;13:32.
- Gallagher J, McCormack D, Zhou S, et al. A systematic review of clinical prediction rules for the diagnosis of chronic heart failure. ESC Heart Fail 2019;6:499-508.
- Kievit RF, Gohar A, Hoes AW, et al; Queen of Hearts and RECONNECT consortium. Efficient selective screening for heart failure in elderly men and women from the community: A diagnostic individual participant data meta-analysis. Eur J Prev Cardiol 2018;25:437-46.
- Taylor CJ, Monahan M, Roalfe AK, Barton P, Iles R, Hobbs FD. The REFER (REFer for EchocaRdiogram) study: a prospective validation and health economic analysis of a clinical decision rule, NT-pro-BNP or their combination in the diagnosis of heart failure in primary care. Southampton (UK): NIHR Journals Library, 2017a.
- Monahan M, Barton P, Taylor CJ, et al.; REFER investigators. MICE or NICE? An economic evaluation of clinical decision rules in the diagnosis of heart failure in primary care. Int J Cardiol 2017;241:255-61.
- Smeets M, Degryse J, Janssens S, et al. Diagnostic rules and algorithms for the diagnosis of non-acute heart failure in patients 80 years of age and older: a diagnostic accuracy and validation study. BMJ Open 2016;6:e012888.
- Tait L, Roalfe AK, Mant J, et al. The REFER (REFer for EchocaRdiogram) protocol: a prospective validation of a clinical decision rule, NT-pro-BNP, or their combination, in the diagnosis of heart failure in primary care. Rationale and design. BMC Cardiovasc Disord 2012;12:97.
- Roalfe AK, Mant J, Doust JA, et al. Development and initial validation of a simple clinical decision tool to predict the presence of heart failure in primary care: the MICE (Male, Infarction, Crepitations, Edema) rule. Eur J Heart Fail 2012;14:1000-8.
- Rutten FH, Walma EP, Kruizinga GI, Bakx HCA, Van Lieshout J. NHG-Standaard Hartfalen, eerste herziening. Huisarts Wet 2005b;48:64-77. www.henw.org, geraadpleegd oktober 2020. Ga naar bron: Rutten FH, Walma EP, Kruizinga GI, Bakx HCA, Van Lieshout J. NHG-Standaard Hartfalen, eerste herziening. Huisarts Wet 2005b;48:64-77. www.henw.org, geraadpleegd oktober 2020.
- Oudejans I, Mosterd A, Bloemen JA, et al. Clinical evaluation of geriatric outpatients with suspected heart failure: value of symptoms, signs, and additional tests. Eur J Heart Fail 2011;13:518-27.
- Fahey T, Jeyaseelan S, McCowan C, et al. Diagnosis of left ventricular systolic dysfunction (LVSD): development and validation of a clinical prediction rule in primary care. Fam Pract 2007;24:628-35.
- Nielsen OW, Hansen JF, Hilden J, Larsen CT, Svanegaard J. Risk assessment of left ventricular systolic dysfunction in primary care: cross sectional study evaluating a range of diagnostic tests. BMJ 2000;320:220-4.
- NICE. Guideline Chronic heart failure in adults: Diagnosis and management (CG108). London: National Institute for Health and Care Excellence 2010. www.nice.org.uk Ga naar bron: NICE. Guideline Chronic heart failure in adults: Diagnosis and management (CG108). London: National Institute for Health and Care Excellence 2010. www.nice.org.uk
- Badgett RG, Mulrow CD, Otto PM, Ramirez G. How well can the chest radiograph diagnose left ventricular dysfunction? J Gen Intern Med 1996;11:625-34.
- Krueger K, Botermann L, Schorr SG, Griese-Mammen N, Laufs U, Schulz M. Age-related medication adherence in patients with chronic heart failure: A systematic literature review. Int J Cardiol 2015;184:728-35.
- Riegel B. I Forgot: Memory and Medication Adherence in Heart Failure. Circ Heart Fail. 2016 Dec;9:e003642.
- Ekman I, Cleland JG, Swedberg K, Charlesworth A, Metra M, Poole-Wilson PA. Symptoms in patients with heart failure are prognostic predictors: insights from COMET. J Card Fail 2005;11:288-92.
- Patel H, Shafazand M, Schaufelberger M, Ekman I. Reasons for seeking acute care in chronic heart failure. Eur J Heart Fail. 2007;9:702-8.
- Lewin J, Ledwidge M, O'Loughlin C, McNally C, McDonald K. Clinical deterioration in established heart failure: what is the value of BNP and weight gain in aiding diagnosis? Eur J Heart Fail 2005;7:953-7.
- Jonkman NH, Westland H, Groenwold RH, et al. Do self-management interventions work in patients with heart failure? An individual patient data meta-analysis. Circulation 2016;133:1189-98.
- Kostis JB, Jackson G, Rosen R, et al. Sexual dysfunction and cardiac risk (the Second Princeton Consensus Conference). Am J Cardiol 2005;96:85M-93M.
- NVVC. Multidisciplinaire richtlijn Hartrevalidatie. Utrecht: Nederlandse Vereniging voor Cardiologie, 2011. www.nvvc.nl, geraadpleegd oktober 2020. Ga naar bron: NVVC. Multidisciplinaire richtlijn Hartrevalidatie. Utrecht: Nederlandse Vereniging voor Cardiologie, 2011. www.nvvc.nl, geraadpleegd oktober 2020.
- Flynn KE, Pina IL, Whellan DJ, et al. Effects of exercise training on health status in patients with chronic heart failure: HF-ACTION randomized controlled trial. JAMA 2009;301:1451-9.
- O'Connor CM, Whellan DJ, Lee KL, et al. Efficacy and safety of exercise training in patients with chronic heart failure: HF-ACTION randomized controlled trial. JAMA 2009;301:1439-50.
- Whellan DJ, O'Connor CM, Lee KL, et al. Heart failure and a controlled trial investigating outcomes of exercise training (HF-ACTION): design and rationale. Am Heart J 2007;153:201-11.
- Long L, Mordi IR, Bridges C. et al. Exercise-based cardiac rehabilitation for adults with heart failure. Cochrane Database Syst Rev 2019;1:CD003331.
- Cederholm T, Jensen GL, Correia MITD, et al.; GLIM Core Leadership Committee, GLIM Working Group. GLIM criteria for the diagnosis of malnutrition - a consensus report from the global clinical nutrition community. J Cachexia Sarcopenia Muscle 2019;10:207-17.
- Anker SD, Ponikowski P, Varney S, et al. Wasting as independent risk factor for mortality in chronic heart failure. Lancet 1997;349:1050-3.
- Anker SD, Negassa A, Coats AJ, et al. Prognostic importance of weight loss in chronic heart failure and the effect of treatment with angiotensin-converting-enzyme inhibitors: an observational study. Lancet 2003;361:1077-83.
- Springer J, Filippatos G, Akashi YJ, Anker SD. Prognosis and therapy approaches of cardiac cachexia. Curr Opin Cardiol 2006;21:229-33.
- Von Haehling S, Doehner W, Anker SD. Nutrition, metabolism, and the complex pathophysiology of cachexia in chronic heart failure. Cardiovasc Res 2007;73:298-309.
- Alpert MA, Terry BE, Mulekar M, et al. Cardiac morphology and left ventricular function in normotensive morbidly obese patients with and without congestive heart failure, and effect of weight loss. Am J Cardiol 1997;80:736-40.
- Mariotti R, Castrogiovanni F, Canale ML, Borelli G, Rondinini L. Weight loss and quality of life in chronic heart failure patients. J Cardiovasc Med (Hagerstown) 2008;9:576-80.
- Nicklas BJ, Cesari M, Penninx BW, et al. Abdominal obesity is an independent risk factor for chronic heart failure in older people. J Am Geriatr Soc 2006;54:413-20.
- Siscovick DS, Barringer TA, Fretts AM, et al. Omega-3 polyunsaturated fatty acid (fish oil) supplementation and the prevention of clinical cardiovascular disease: a science advisory from the American Heart Association. Circulation 2017;135:e867-84.
- Tavazzi L, Maggioni AP, Marchioli R, et al. Effect of rosuvastatin in patients with chronic heart failure (the GISSI-HF trial): a randomised, double-blind, placebo-controlled trial. Lancet 2008;372:1231-9.
- Pitt B, Pfeffer MA, Assmann SF, et al. Spironolactone for heart failure with preserved ejection fraction. N Engl J Med 2014;370:1383-92.
- Pfeffer MA, Claggett B, Assmann SF, et al. Regional variation in patients and outcomes in the Treatment of Preserved Cardiac Function Heart Failure With an Aldosterone Antagonist (TOPCAT) trial. Circulation 2015;131:34-42.
- Edelmann F, Wachter R, Schmidt AG, et al. Effect of spironolactone on diastolic function and exercise capacity in patients with heart failure with preserved ejection fraction: the Aldo-DHF randomized controlled trial. JAMA 2013;309:781-91.
- CONSENSUS Trial Study Group. Effects of enalapril on mortality in severe congestive heart failure. Results of the Cooperative North Scandinavian Enalapril Survival Study (CONSENSUS). N Engl J Med 1987;316:1429-35.
- SOLVD Investigators, Yusuf S, Pitt B, Davis CE, Hood WB, Cohn JN. Effect of enalapril on survival in patients with reduced left ventricular ejection fractions and congestive heart failure. N Engl J Med 1991;325:293-302.
- Packer M, Poole-Wilson PA, Armstrong PW, et al. Comparative effects of low and high doses of the angiotensin-converting enzyme inhibitor, lisinopril, on morbidity and mortality in chronic heart failure. ATLAS Study Group. Circulation 1999;100:2312-8.
- CIBIS-II. The Cardiac Insufficiency Bisoprolol Study II (CIBIS-II): a randomised trial. Lancet 1999;353:9-13.
- MERIT-HF. Effect of metoprolol CR/XL in chronic heart failure: Metoprolol CR/XL Randomised Intervention Trial in Congestive Heart Failure (MERIT-HF). Lancet 1999;353:2001-7.
- Packer M, Fowler MB, Roecker EB, et al. Effect of carvedilol on the morbidity of patients with severe chronic heart failure: results of the carvedilol prospective randomized cumulative survival (COPERNICUS) study. Circulation 2002;106:2194-9.
- Hjalmarson A, Goldstein S, Fagerberg B, et al. Effects of controlled-release metoprolol on total mortality, hospitalizations, and well-being in patients with heart failure: the Metoprolol CR/XL Randomized Intervention Trial in congestive heart failure (MERIT-HF). MERIT-HF Study Group. JAMA 2000;283:1295-302.
- Flather MD, Shibata MC, Coats AJ, et al. Randomized trial to determine the effect of nebivolol on mortality and cardiovascular hospital admission in elderly patients with heart failure (SENIORS). Eur Heart J 2005;26:215-25.
- Cohn JN, Fowler MB, Bristow MR, et al. Safety and efficacy of carvedilol in severe heart failure. The U.S. Carvedilol Heart Failure Study Group. J Card Fail 1997;3:173-9.
- Packer M, Coats AJ, Fowler MB, et al; Carvedilol Prospective Randomized Cumulative Survival Study Group. Effect of carvedilol on survival in severe chronic heart failure. N Engl J Med. 2001;344:1651-8.
- Eichhorn EJ, Domanski MJ, Krause-Steinrauf H, Bristow MR, Lavori PW. A trial of the beta-blocker bucindolol in patients with advanced chronic heart failure. N Engl J Med 2001;344:1659-67.
- Poole-Wilson PA, Swedberg K, Cleland JG, et al. Comparison of carvedilol and metoprolol on clinical outcomes in patients with chronic heart failure in the Carvedilol Or Metoprolol European Trial (COMET): randomised controlled trial. Lancet 2003;362:7-13.
- Bangalore S, Kumar S , Messerli, FH. When conventional heart failure therapy is not enough: angiotensin receptor blocker, direct renin inhibitor, or aldosterone antagonist? Congest Heart Fail 2013;19:107-15.
- KNMP. Kennisbank. Den Haag: Koninklijke Nederlandse Maatschappij ter bevordering der Pharmacie, 2020. www.knmp.nl, geraadpleegd oktober 2020. Ga naar bron: KNMP. Kennisbank. Den Haag: Koninklijke Nederlandse Maatschappij ter bevordering der Pharmacie, 2020. www.knmp.nl, geraadpleegd oktober 2020.
- Santema BT, Ouwerkerk W, Tromp J, et al. Identifying optimal doses of heart failure medications in men compared with women: a prospective, observational, cohort study. Lancet 2019;394:1254-63.
- Dixon DW, Barwolf-Gohlke C, Gunnar RM. Comparative efficacy and safety of bumetanide and furosemide in long‐term treatment of edema due to congestive heart failure. J Clin Pharmacol 1981;21:680-7.
- Konecke LL. Clinical trial of bumetanide versus furosemide in patients with congestive heart failure. J Clin Pharmacol 1981;21:688-90.
- Fitchett D, Butler J, Van de Borne P, et al. Effects of empagliflozin on risk for cardiovascular death and heart failure hospitalization across the spectrum of heart failure risk in the EMPA-REG OUTCOME(R) trial. Eur Heart J 2018;39:363-70.
- Kato ET, Silverman MG, Mosenzon O, et al. Effect of dapagliflozin on heart failure and mortality in type 2 diabetes mellitus. Circulation 2019;139:2528-36.
- Rådholm K, Figtree G, Perkovic V, et al. Canagliflozin and heart failure in type 2 diabetes mellitus: results from the CANVAS program. Circulation 2018;138:458-68.
- Fitchett D, Zinman B, Wanner C, et al. Heart failure outcomes with empagliflozin in patients with type 2 diabetes at high cardiovascular risk: results of the EMPA-REG OUTCOME(R) trial. Eur Heart J 2016;37:1526-34.
- Butler J, Zannad F, Fitchett D, et al. empagliflozin improves kidney outcomes in patients with or without heart failure. Circ Heart Fail 2019;12:e005875.
- McMurray JJV, Solomon SD, Inzucchi SE, et al. Dapagliflozin in patients with heart failure and reduced ejection fraction. N Engl J Med 2019;381:1995-2008.
- Petrie MC, Verma S, Docherty KF, et al. Effect of dapagliflozin on worsening heart failure and cardiovascular death in patients with heart failure with and without diabetes JAMA 2020;323:1353-68.
- Neal B, Perkovic V, Mahaffey KW, et al.; CANVAS Program Collaborative Group. Canagliflozin and cardiovascular and renal events in type 2 diabetes. N Engl J Med 2017;377:644-57.
- Wiviott SD, Raz I, Bonaca MP, et al; DECLARE–TIMI 58 Investigators. dapagliflozin and cardiovascular outcomes in type 2 diabetes. N Engl J Med 2019;380:347-57.
- Zinman B, Wanner C, Lachin JM, et al. Empagliflozin, cardiovascular outcomes, and mortality in type 2 diabetes. N Engl J Med 2015;373:2117-28.
- Bersoff-Matcha SJ, Chamberlain C, Cao C, Kortepeter C, Chong WH. Fournier gangrene associated with sodium-glucose cotransporter-2 inhibitors: a review of spontaneous postmarketing cases. Ann Intern Med 2019;170:764-9.
- Nassif ME, Windsor SL, Tang F, et al. Dapagliflozin effects on biomarkers, symptoms, and functional status in patients with heart failure with reduced ejection fraction: the DEFINE-HF Trial. Circulation 2019;140:1463-76.
- Packer M, Anker SD, Butler J, et al.; EMPEROR-Reduced Trial Investigators. Cardiovascular and renal outcomes with empagliflozin in heart failure. N Engl J Med 2020;383:1413-24.
- Wesseling E. ARNi's: nieuwe medicatie bij hartfalen? Huisarts Wet 2015;58:446.
- McMurray JJ, Packer M, Desai AS, et al. Angiotensin-neprilysin inhibition versus enalapril in heart failure. N Engl J Med 2014;371:993-1004.
- Edwards SJ, Crawford F, Osei-Assibey G, Bacelar M, Berardi A, Salih F. Sacubitril valsartan for treating chronic heart failure: a single technology appraisal. London: BMJ Technology Assessment Group, 2015.
- Swedberg K, Komajda M, Bohm M, et al. Ivabradine and outcomes in chronic heart failure (SHIFT): a randomised placebo-controlled study. Lancet 2010;376:875-85.
- Bohm M, Swedberg K, Komajda M, et al. Heart rate as a risk factor in chronic heart failure (SHIFT): the association between heart rate and outcomes in a randomised placebo-controlled trial. Lancet 2010;376:886-94.
- EMA. Assessment report: Procoralan ivabradine. London: European Medicines Agency, 2012. www.ema.europa.eu, geraadpleegd oktober 2020.
- Strijbis AM, Nederend I. Mensen met hartfalen: een app helpt bij het volhouden van de behandeling! Den Haag: Harteraad, 2019. harteraad.nl, geraadpleegd oktober 2020. Ga naar bron: Strijbis AM, Nederend I. Mensen met hartfalen: een app helpt bij het volhouden van de behandeling! Den Haag: Harteraad, 2019. harteraad.nl, geraadpleegd oktober 2020.
- Jayaram NM, Khariton Y, Krumholz HM, et al. Impact of telemonitoring on health status. Circ Cardiovasc Qual Outcomes 2017;10:e004148.
- Kotooka N, Kitakaze M, Nagashima K, et al.; HOMES-HF study investigators. The first multicenter, randomized, controlled trial of home telemonitoring for Japanese patients with heart failure: home telemonitoring study for patients with heart failure (HOMES-HF). Heart Vessels 2018;33:866-76.
- Olivari Z, Giacomelli S, Gubian L, et al. The effectiveness of remote monitoring of elderly patients after hospitalisation for heart failure: The renewing health European project. Int J Cardiol 2018;257:137-42.
- Wagenaar KP, Broekhuizen BD, Jaarsma T, et al. Effectiveness of the European Society of Cardiology/Heart Failure Association website 'heartfailurematters.org' and an e-health adjusted care pathway in patients with stable heart failure: results of the 'e-Vita HF' randomized controlled trial. Eur J Heart Fail 2019 ;21:238-46.
- Cichosz SL, Udsen FW, Hejlesen O. The impact of telehealth care on health-related quality of life of patients with heart failure: Results from the Danish TeleCare North heart failure trial. J Telemed Telecare 2020;26:452-61.
- Negarandeh R, Zolfaghari M, Bashi N, Kiarsi M. Evaluating the effect of monitoring through telephone (tele-monitoring) on self-care behaviors and readmission of patients with heart failure after discharge. Appl Clin Inform 2019;10:261-8.
- Yanicelli LM, Goy CB, González VDC, Palacios GN, Martínez EC, Herrera MC. Non-invasive home telemonitoring system for heart failure patients: A randomized clinical trial. J Telemed Telecare 2020;1357633X19899261.
- Inglis SC, Clark RA, Dierckx R, Prieto-Merino D, Cleland JG. Structured telephone support or non-invasive telemonitoring for patients with heart failure. Cochrane Database Syst Rev 2015:CD007228.
- Scherpbier ND, De Grauw WJ, Wetzels JF, Vervoort GM. Acute nierinsufficiëntie bij combinatie RAAS-remmer en dehydratie. Ned Tijdschr Geneeskd 2010;154:A1548.
- VWS. Harm-Wrestling: Een voorstel van de expertgroep medicatieveiligheid met betrekking tot concrete interventies die de extramurale medicatieveiligheid op korte termijn kunnen verbeteren. Den Haag: Ministerie van VWS, 2009. www.gims-foundation.org, geraadpleegd oktober 2020. Ga naar bron: VWS. Harm-Wrestling: Een voorstel van de expertgroep medicatieveiligheid met betrekking tot concrete interventies die de extramurale medicatieveiligheid op korte termijn kunnen verbeteren. Den Haag: Ministerie van VWS, 2009. www.gims-foundation.org, geraadpleegd oktober 2020.
- VWS. Eindrapport: vervolgonderzoek medicatieveiligheid. Den Haag: Ministerie van VWS 2017. www.rijksoverheid.nl, geraadpleegd oktober 2020. Ga naar bron: VWS. Eindrapport: vervolgonderzoek medicatieveiligheid. Den Haag: Ministerie van VWS 2017. www.rijksoverheid.nl, geraadpleegd oktober 2020.
- Te Biesebeke E, Horstik I, Makkes N, Van Riet J, Van Wezel P. Het 4Domeinen model. Utrecht: Stichting Overvecht Gezond, 2019. www.overvechtgezond.nl, geraadpleegd oktober 2020
- Highet G, Crawford D, Murray SA, Boyd K. Development and evaluation of the Supportive and Palliative Care Indicators Tool (SPICT): a mixed-methods study. BMJ Support Palliat Care 2014;4:285-90.
- Thoonsen B, Engels Y, Van Rijswijk E, et al. Early identification of palliative care patients in general practice: development of RADboud indicators for PAlliative Care Needs (RADPAC). Br J Gen Pract 2012;62:e625-31.
- Rutten FH, Heddema WS, Daggelders GJA, Hoes AW. Primary care patients with heart failure in the last year of their life. Fam Pract 2012a;29:36-42.
- NVVC. Richtlijn ICD/pacemaker in de laatste levensfase. Utrecht: Nederlandse Vereniging voor Cardiologie, 2013. www.nvvc.nl, geraadpleegd oktober 2020.