Chronische nierschade
Richtlijnen diagnostiek
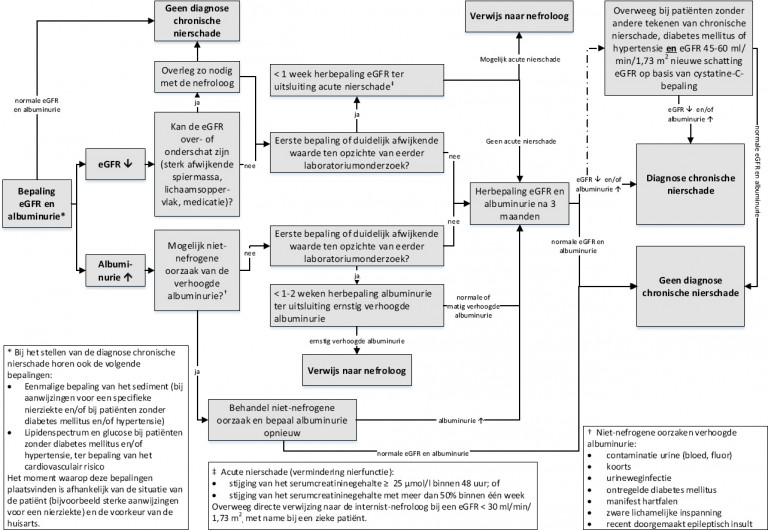
Naar Volledige tekst ›Ga na of er sprake is van acute of chronische nierschade of een niet-nefrogene oorzaak bij patiënten bij wie een verminderde nierfunctie en/of verhoogde albuminurie gevonden is in het kader van cardiovasculair risico-management, diabetes mellitus, medicatiebewaking (zie Kader medicatiebewaking) of bij oriënterend onderzoek.
Anamnese
Naar Volledige tekst ›Ga (aanwijzingen voor) mogelijk etiologische factoren na:
- diabetes mellitus en/of een verhoogde bloeddruk
- primaire nierziekte: bekende nierziekte, recidiverende pyelonefritis en vesico-ureterale reflux, nefrectomie of auto-immuunziekte in de voorgeschiedenis
- familiaire nierziekten (bijvoorbeeld ziekte van Alport, cystenieren)
- medicatiegebruik (bijvoorbeeld NSAID’s en RAS-remmers)
Aanvullend onderzoek
Naar Volledige tekst ›- Bepaal eGFR en albumine-creatinineratio (ACR) (zie Stroomschema Diagnostiek chronische nierschade):
- < 1 week bij eerste of duidelijk afwijkende bepaling ter uitsluiting acute nierschade én (als dit niet het geval is)
- na 3 maanden ter bevestiging van de diagnose chronische nierschade.
- Op indicatie: urinesediment, lipidenspectrum, glucose, eGFR op basis van serumcystatine-C-gehalte.
Bij vermoeden niet-nefrogene oorzaak verhoogde albuminurie: op indicatie aanvullend laboratoriumonderzoek.
Evaluatie
Naar Volledige tekst ›Maak onderscheid tussen:
- acute nierschade: verwijs met spoed naar de internist-nefroloog;
- geen nierschade: onderschatting GFR of niet-nefrogene oorzaak verhoogde albuminurie;
- chronische nierschade: ≥ 3 maanden verminderde nierfunctie en/of verhoogde albuminurie en/of specifieke sedimentsafwijkingen.
Bij chronische nierschade:
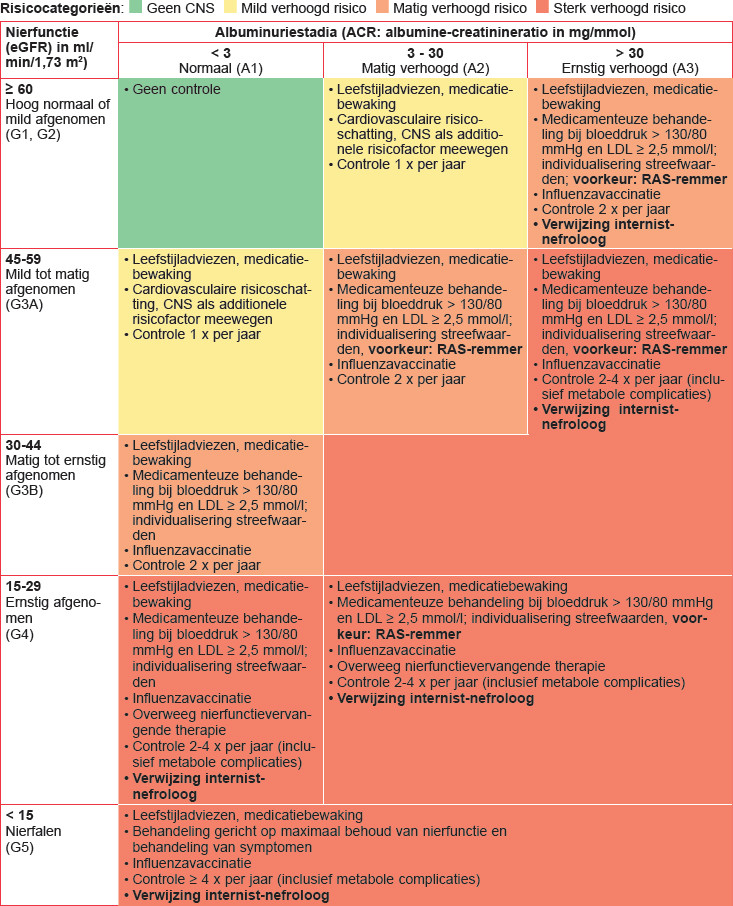
- bepaal het stadium van de eGFR en de albuminurie;
- bepaal de risicocategorie (zie tabel 1);
- evalueer de oorzaken van de nierschade;
- evalueer het beloop van de nierschade;
- weeg bij een beperkte levensverwachting en/of uitgebreide comorbiditeit samen met de patiënt voor- en nadelen van een strikte (medicamenteuze) behandeling af.
Richtlijnen Beleid
Naar Volledige tekst ›Voorlichting
Naar Volledige tekst ›Licht de patiënt voor over:
- aard en normale beloop chronische nierschade, verhoogd cardiovasculair risico
- belang gezonde leefstijl
- nefrotoxische geneesmiddelen en zelfzorgmiddelen (zoals NSAID's)
- dosisaanpassing bekende/nieuwe medicatie
- beleid bij dreigende dehydratie (hoge koorts, fors braken of forse diarree, met name bij gebruik RAS-remmers, diuretica en/of NSAID’s)
- het doorgeven van de nierfunctie aan apotheker
- jaarlijkse influenzavaccinatie (met name bij een matig of sterk verhoogd risico, zie tabel 1)
- controleafspraken
Niet-medicamenteuze behandeling
Naar Volledige tekst ›Geef de volgende leefstijladviezen: streef naar gezond lichaamsgewicht, beweegadvies conform de Norm Gezond Bewegen, stop roken en beperk zoutinname tot maximaal 6 gram (keukenzout (NaCl)) per dag.
Beleid bij (dreigende) dehydratie:
- Overweeg controle van de patiënt en bepaling eGFR, kalium, natrium.
- Overweeg op grond van het klinisch beeld (en eventuele laboratoriumuitslagen):
- (tijdelijk) diuretica te staken en de dosering van RAS-remmers te halveren;
- bij patiënten met hartfalen: de dosering van diuretica én RAS-remmers (tijdelijk) te halveren;
- bij gebruik van NSAID’s: staak deze in ieder geval tijdelijk maar zo mogelijk helemaal.
Medicamenteuze behandeling
Naar Volledige tekst ›- Cardiovasculair risicomanagement (zie tabel 1):
- (zeer) hoog risico (oranje/rood): leefstijladviezen en medicamenteuze behandeling bij bloeddruk > 130/80 mmHg en/of LDL > 2,5 mmol/l
- matig verhoogd risico (geel): leefstijladviezen en schatting cardiovasculair risico met chronische nierschade als additionele risicofactor (één risicocategorie omhoog in de CVRM-risicotabel: zie NHG-Standaard CVRM)
- Behandeling verhoogde bloeddruk:
- streefwaarde bloeddruk: ≤ 130/80 mmHg
- individualiseer de streefwaarden met name op basis van leeftijd, aard nierziekte en comorbiditeit
- bij matig/sterk verhoogde albuminurie: voorkeur RAS-remmer, controle kalium en eGFR na 1-2 weken
Kader Medicatiebewaking
Naar Volledige tekst ›Bij patiënten met chronische nierschade
- Maak bij een eGFR < 60 ml/min/1,73 m2 een ICPC-code aan voor nierinsufficiëntie en activeer de medicatiebewaking in het HIS.
- Geef de actuele eGFR door aan de apotheker bij het voorschrijven van medicatie.
- Pas zo nodig de dosering aan van bekende en nieuwe medicatie.
- Bij het voorschrijven of gebruik van medicatie die de nierfunctie negatief kan beïnvloeden:
- heroverweeg de noodzaak van gebruik van medicatie die de nierfunctie negatief kan beïnvloeden;
- voorkom het gebruik van nefrotoxische medicatie, zoals NSAID’s.
Medicatiebewaking bij ouderen bij wie geen (recente) nierfunctie bekend is
- Bepaal de nierfunctie bij patiënten ouder dan 70 jaar bij wie de nierfunctie onbekend is of langer dan 1 jaar geleden bepaald is, én:
- medicatie wordt voorgeschreven die bij een verminderde nierfunctie gecontra-indiceerd is of aanpassing behoeft, óf
- medicatie wordt voorgeschreven die achteruitgang van de nierfunctie kan veroorzaken.
Controles
Naar Volledige tekst ›Evalueer het beloop van de nierschade (controlefrequentie zie tabel 1)
- Besteed aandacht aan:
- mate van nierschade: eGFR en ACR
- cardiovasculair risicoprofiel, waaronder bloeddrukmeting
- niet-medicamenteuze adviezen, zoals leefstijladviezen en medicatiegebruik, ook zelfzorgmiddelen
- bij gebruik RAS-remmer of diureticum: minimaal jaarlijkse controle kalium
Consultatie en verwijzing
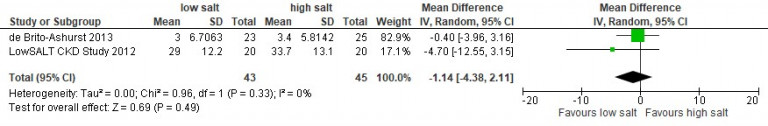
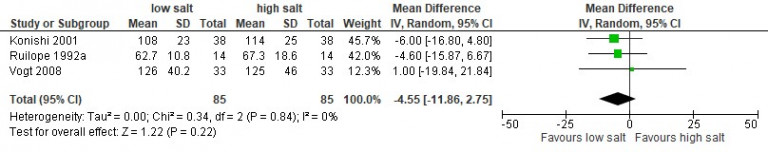
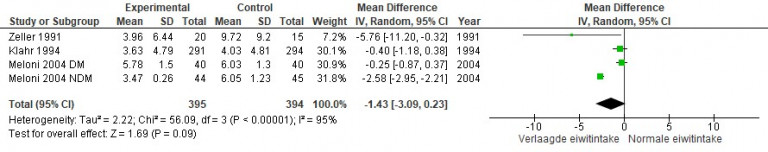
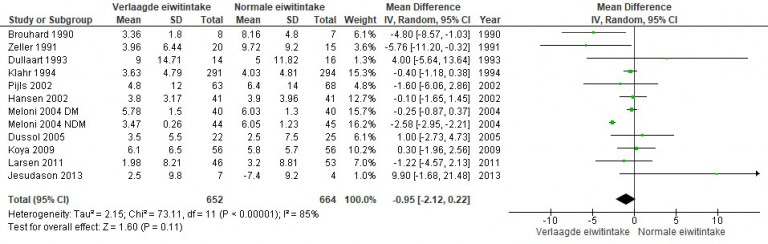
Naar Volledige tekst ›Overweeg verwijzing naar de diëtist bij therapieresistente hypertensie en/of gebruik van een RAS-remmer voor evaluatie en beperking van de zoutinname.
Verwijs naar de internist-nefroloog bij:
- (vermoeden) acute nierschade
- vermoeden onderliggende specifieke nierziekte
- ernstig verhoogde albuminurie: ACR > 30 mg/mmol
- chronische nierschade met sterk verhoogd risico (rode risicocategorie)
- progressie chronische nierschade:
- een bevestigde daling van de eGFR van 25% ten opzichte van de eerste meting in de afgelopen vijf jaar, in combinatie met een verslechtering in stadium van nierschade, of:
- daling van de eGFR ≥ 5 ml/min/1,73 m2/jaar, vastgesteld met ≥ 3 metingen in één jaar
Overweeg niet te verwijzen bij beperkte levensverwachting en/of uitgebreide comorbiditeit.
Kernboodschappen
Naar Samenvatting ›- Bij patiënten met een verminderde nierfunctie of verhoogde albuminurie is vervolgdiagnostiek nodig om de diagnose chronische nierschade te bevestigen en om uit te sluiten dat de uitslag het gevolg is van acute nierschade of verstorende factoren.
- Onder chronische nierschade wordt verstaan: een verlaagde eGFR en/of verhoogde albuminurie en/of specifieke sedimentafwijkingen die gedurende ten minste 3 maanden aanwezig zijn.
- Patiënten met chronische nierschade hebben een verhoogd risico op:
- hart- en vaatziekten (vergelijkbaar met patiënten met diabetes mellitus) en
- eindstadium nierfalen
- De standaard bevat het advies om bij alle patiënten met een eGFR < 60 ml/min/1,73 m2:
- de medicatiebewaking in het HIS te activeren
- de actuele eGFR door te geven aan de apotheker
- de dosering van bekende en nieuwe medicatie zo nodig aan te passen
- Bij patiënten met chronische nierschade gaat veel aandacht naar de behandeling van hypertensie. Bij een indicatie voor bloeddrukverlagende behandeling hebben RAS-remmers bij patiënten met chronische nierschade en verhoogde albuminurie de voorkeur.
Belangrijkste wijzigingen
Naar Samenvatting ›- Chronische nierschade wordt gedefinieerd en gestadieerd met behulp van de nierfunctie en albuminurie.
- Voor het bepalen van de mate van albuminurie heeft de albumine-creatinineratio de voorkeur boven de albumineconcentratie.
- De termen micro- en macroalbuminurie zijn vervangen door matig verhoogde en ernstig verhoogde albuminurie. De nierfunctie wordt geschat (eGFR) met de CKD-EPI-formule.
- Op basis van de eGFR, in combinatie met de mate van albuminurie, wordt een risicostratificatie gemaakt voor het risico op cardiovasculaire schade, progressie van nierschade en mortaliteit. Er wordt geen leeftijdscriterium meer gehanteerd.
- Progressie van achteruitgang van de nierfunctie en acute nierschade zijn gedefinieerd.
- We bevelen screening op metabole complicaties van chronische nierschade alleen nog aan bij patiënten met een sterk verhoogd risico op cardiovasculaire aandoeningen of eindstadium nierfalen die bij de huisarts onder controle zijn. Hierbij bevelen we bepaling van het parathormoon (PTH) en behandeling met actief vitamine D bij een verhoogde PTH-spiegel niet meer aan.
- Er zijn aangepaste samenwerkingsafspraken met internist-nefrologen opgenomen, die nieuwe verwijsindicaties bevatten. Ook zijn samenwerkingsafspraken met diëtisten, apothekers en laboratoriumspecialisten klinische chemie opgenomen.
- De adviezen over medicatiebewaking en het voorkómen van acute nierschade bij dreigende dehydratie zijn uitgebreider beschreven.
Inleiding
Naar Samenvatting ›Scope
Naar Samenvatting ›- Richtlijnen voor de diagnostiek en het beleid bij volwassenen met chronische nierschade. De standaard betreft patiënten bij wie een verminderde nierfunctie en/of een verhoogde albuminurie is gevonden in het kader van cardiovasculair risicomanagement, diabetes mellitus, medicatiebewaking of bij oriënterend onderzoek.
- Signaleren van acute nierschade en het voorkómen hiervan bij patiënten met chronische nierschade en dreigende dehydratie.
Buiten de scope
Naar Samenvatting ›- Patiënten met eindstadium nierfalen
- Patiënten met niertransplantatie in de voorgeschiedenis
- Specifieke nierziekten
- Acute nierschade
- Nierschade optredend tijdens de zwangerschap
Samenwerking en afstemming
Naar Samenvatting ›Deze standaard:
- Vervangt de Landelijke Transmurale Afspraak (LTA) Chronische nierschade uit 2009. Belangrijk verschil met de LTA is dat het leeftijdscriterium voor het beleid is komen te vervallen.
- Het nieuwe classificatiesysteem is gebaseerd op de prognose. Nierschade wordt hierbij onafhankelijk van de leeftijd geclassificeerd. Dit betekent dat het cardiovasculaire risico en het risico op eindstadium nierfalen doorslaggevend zijn voor de behandeling.
- Het kan wel zo zijn dat in overleg met de patiënt bij veel comorbiditeit of een korte levensverwachting wordt besloten minder strenge streefwaarden voor behandeling te hanteren. Het vaststellen van chronische nierschade hoeft daarom niet automatisch consequenties voor het beleid te hebben.
- Een afwijkende waarde van de nierfunctie is wel altijd aanleiding om medicatiebewaking te starten, ongeacht eerdergenoemde factoren.
- Is op initiatief van het NHG en de Nederlandse Internisten Vereniging (NIV) tegelijkertijd met de multidisciplinaire richtlijn Chronische nierschade ontwikkeld. De richtlijnen zijn inhoudelijk op elkaar afgestemd, waarbij ook samenwerkingsafspraken zijn vastgelegd (zie bijlage 2).
- Sluit aan op andere richtlijnen op het gebied van chronische nierschade (richtlijn Nierfunctievervangende behandeling en richtlijn Palliatieve zorg bij eindstadium nierfalen) en op NHG-Standaard Cardiovasculair risicomanagement, NHG-Standaard Hartfalen en NHG-Standaard Diabetes mellitus type 2.
Achtergronden
Naar Samenvatting ›Begrippen
Naar Samenvatting ›eGFR
Geschatte nierfunctie (estimated Glomerular Filtration Rate)
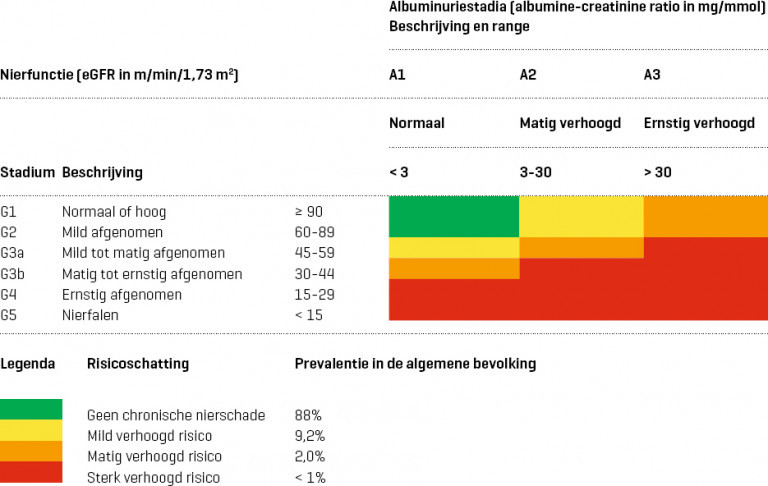
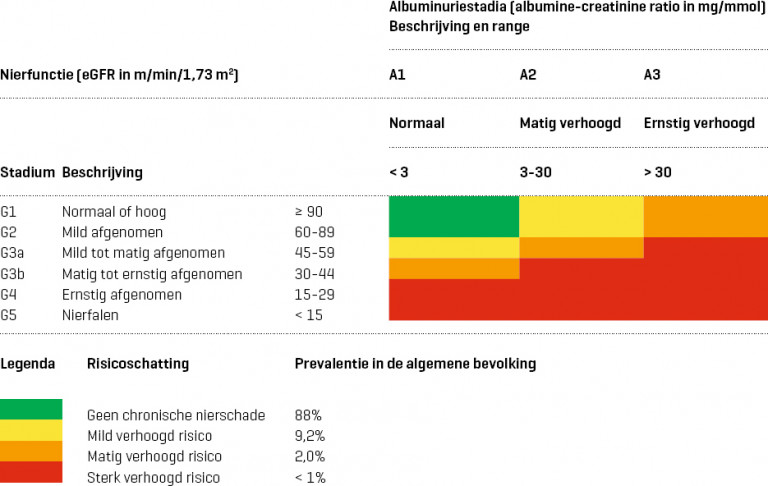
- Verminderde nierfunctie: eGFR < 60 ml/min/1,73 m2
- Eindstadium nierfalen: eGFR < 15 ml/min/1,73 m2
Albuminurie:
Verlies van albumine in de urine, bepaald met de albumine-creatinineratio (ACR) (zie Details):
- normaal: < 3 mg/mmol
- matig verhoogd: 3-30 mg/mmol
- ernstig verhoogd: > 30 mg/mmol
Acute nierschade (vermindering nierfunctie):
(Zie ook Details)
- Stijging van het serumcreatininegehalte ≥ 25 micromol/l binnen 48 uur, of
- Stijging van het serumcreatininegehalte met meer dan 50% binnen 1 week
Chronische nierschade
- ≥ 3 Maanden verminderde nierfunctie en/of verhoogde albuminurie, en/of
- Specifieke sedimentafwijkingen (zie Details)
Progressie van nierfunctieverlies:
- Een bevestigde daling van de eGFR van 25% ten opzichte van de 1e meting in de afgelopen 5 jaar, in combinatie met een verslechtering in stadium van nierschade (zie tabel 1), of
- Daling van de eGFR van ten minste 5 ml/min/1,73 m2/jaar, vastgesteld met ten minste 3 metingen in 1 jaar
Metabole complicaties:
Stoornissen in de stofwisseling (onder andere die van calcium en fosfaat en de erytrocytenaanmaak) veroorzaakt door chronische nierschade
In de multidisciplinaire richtlijn Chronische nierschade is een bredere definitie opgenomen dan in de volledige tekst van deze standaard. Het wordt aanbevolen de diagnose chronische nierschade te stellen bij patiënten met afwijkingen in de nierstructuur of nierfunctie die gedurende meer dan drie maanden aanwezig zijn. Hiervoor worden de criteria in tabel 4 aangehouden.
| Verlaagde nierfunctie en/of | eGFR < 60 ml/min/1,73 m2 | |
|---|---|---|
| Eén of meer markers van nierschade |
|
|
| ACR: albumine-creatinineratio; AER: albumin excretion rate, albumine-excretiesnelheid, te meten door albumine-uitscheiding in 24-uurs urine te bepalen; eGFR: geschatte (estimated) GFR; GFR: glomerular filtration rate, glomerulaire filtratiesnelheid | ||
De diagnose chronische nierschade wordt gesteld door een arts.
Enkele markers van nierschade betreffen onderzoek dat niet door de huisarts uitgevoerd wordt (nierbiopt, beeldvormend onderzoek). In de hoofdtekst van deze standaard is ervoor gekozen alleen de voor de huisartsen relevante elementen uit bovenstaande definitie te noemen: verlaagde eGFR en/of verhoogde albuminurie en/of sedimentsafwijkingen. Gebruikelijk wordt van een verminderde nierfunctie gesproken indien de eGFR < 60 ml/min/1,73 m2 is. De nierfunctie neemt echter geleidelijk met de leeftijd af. Dit betekent bijvoorbeeld dat een eGFR van 68 bij iemand van 32 jaar als afwijkend beschouwd moet worden of dat bij patiënten met hypertensie of diabetes mellitus jonger dan 60 jaar bij een eGFR van < 90 ml/min/1,73 m2 een secundaire oorzaak voor de hypertensie moet worden overwogen.
Onderzoek van het sediment wordt aanbevolen, omdat afwijkingen in het sediment een aanwijzing voor een specifieke nierziekte kunnen zijn. De aanwezigheid van dysmorfe erytrocyten en erytrocytencilinders wijst op een glomerulaire oorsprong van een hematurie. Deze diagnose wordt waarschijnlijker wanneer men ook andere cilinders (vet- en/of hemoglobinecilinders) vindt. Vindt men monomorfe erytrocyten, dan wijst dit op een bloeding in de afvoerende urinewegen. Ziet men in het sediment < 40% dysmorfe erytrocyten en geen erytrocytencilinders (bij ten minste 20 erytrocyten/µl), dan is de sensitiviteit voor een bloeding (oorzaak) in de lagere urinewegen 100% en de specificiteit 66,7%. Voor een optimale beoordeling van het sediment op dysmorfe erytrocyten en celcilinders is fasecontrastmicroscopie nodig, en de beoordeling van het sediment is niet eenvoudig. De werkgroep meent daarom dat het onderzoek van het sediment op specifieke afwijkingen in een laboratorium plaats moet vinden. Voor het beoordelen van het sediment wordt een tweede ochtendurine (met een verblijfsduur van circa twee tot vier uur in de blaas) aanbevolen. Houdt er bij verwijzing naar het laboratorium rekening mee dat de urine zo snel mogelijk na productie (maar bij voorkeur binnen een uur) beoordeeld dient te worden. Op perifere bloedafnamelocaties is dit niet altijd mogelijk. Bij patiënten met diabetes mellitus en hypertensie hoeft het urinesediment alleen bepaald te worden indien er aanwijzingen zijn voor een nierziekte in de anamnese (met name indien er in de familie nierziekten bekend zijn). Zijn er geen afwijkingen van het urinesediment dan hoeft deze bepaling in de toekomst alleen herhaald te worden als er (nieuwe) aanwijzingen zijn voor een specifieke nieraandoening.
De termen normo-albuminurie, micro-albuminurie en macro-albuminurie zijn vervangen door normale (ACR < 3 mg/mmol), matig verhoogde (ACR 3 tot 30 mg/mmol) en ernstig verhoogde (ACR > 30 mg/mmol) albuminurie.
Deze terminologie sluit aan bij internationale ontwikkelingen op dit gebied. De reden van deze wijziging is dat de termen micro- en macro-albuminurie suggereren dat het om kleine of grote eiwitten zou gaan, terwijl het gaat om een kwantitatief verschil. Voorheen was het gebruikelijk geslachtsafhankelijke afkapwaarden voor verhoogde albuminurie te hanteren. Dit onderscheid is verlaten, vanwege complexiteit, onzekerheid in de precisie van de diagnostiek, en beïnvloedende effecten van andere factoren zoals dieet en constitutie op de creatinine-uitscheiding in de urine (en daarmee ACR), zodat is gekozen voor eenvoudiger afkappunten.
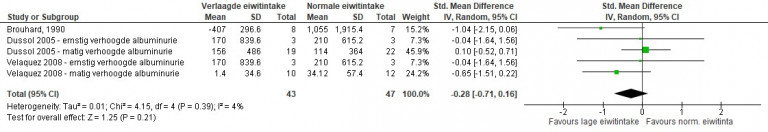
Er bestaat een goede correlatie tussen de albumineconcentratie in één portie urine en de totale uitscheiding in de 24-uurs urine (correlatiecoëfficiënt: 0,86 tot 0,90). Een albumineconcentratie in de urine van > 20 mg/l heeft een sensitiviteit van 82 tot 97% en een specificiteit van 74 tot 97% om een albumine-uit-scheiding van > 30 mg in de 24-uurs urine te voorspellen. De berekening van de albumineconcentratie naar de creatinine-uitscheiding in de urine (de albumine-creatinineratio) resulteert in een iets nauwkeuriger voorspelling van patiënten met een verhoogde albumine-uitscheiding. Deze ratio corrigeert voor concentratie- en verdunningseffecten van de urine. Een albumine-creatinineratio > 3,5 mg/mmol heeft een sensitiviteit van 88 tot 100% en een specificiteit van 95 tot 99% (zie ook Details Aanvullend onderzoek).
| Ochtendurine albumine-creatinine ratio, ACR (mg/mmol) | Ochtendurine albumine (mg/l) | 24-uurs albumine, (mg/24 uur) | |
|---|---|---|---|
| Normaal (A1) | < 3 | < 20 | < 30 |
| Matig verhoogd (A2) | 3-30 | 20-200 | 30-300 |
| Ernstig verhoogd (A3) | > 30 | > 200 | > 300 |
Deze definitie is afgeleid van de internationale KDIGO-richtlijn. Uit praktische overwegingen is de hoogte van de stijging van het serumcreatininegehalte binnen 48 uur hierbij afgerond op 25 µmol/l. In deze richtlijn is ook verminderde urineproductie (urinevolume < 0,5 ml/kg/uur gedurende 6 uur) een criterium voor acute nierschade. De definitie impliceert dat de eGFR binnen 48 uur herhaald moet worden om acute nierschade vast te kunnen stellen. Dit is in de huisartsenpraktijk niet gebruikelijk. De werkgroep meent dat de termijn van herhalen van de nierfunctie afhankelijk is van het klinisch beeld, maar in ieder geval binnen één week moet plaatsvinden. Wanneer er onverwacht een voor de leeftijd zeer lage nierfunctie wordt gevonden (arbitrair < 30 ml/min/1,73 m2) of sprake is van een zieke patiënt, is directe verwijzing naar de internist-nefroloog aangewezen.
Epidemiologie
Naar Samenvatting ›- Chronische nierschade komt in Nederland voor bij ongeveer 12% van de bevolking en gaat gepaard met een verhoogd risico op (zie Details):
- overlijden
- hart- en vaatziekten
- acute nierschade
- eindstadium nierfalen
- Van de algemene bevolking heeft ongeveer 9% chronische nierschade met een mild, 2% met een matig en minder dan 1% met een sterk verhoogd risico op hart- en vaatziekten en eindstadium nierfalen.
- In de huisartsenpraktijk is een percentage patiënten met chronische nierschade van 5,7% gevonden (zie Details). Van de patiënten met chronische nierschade heeft ongeveer de helft een verminderde nierfunctie en de andere helft een verhoogde albuminurie.
Inleiding
Chronische nierschade is een belangrijke risicofactor voor cardiovasculaire schade. De grootte van het absolute risico op cardiovasculaire eindpunten in verschillende stadia van chronische nierschade is niet precies bekend. De Europese richtlijn voor Cardiovasculair Risicomanagement noemt chronische nierschade als onafhankelijke risicofactor voor cardiovasculaire schade.
Uitgangsvraag
Chronische nierschade draagt bij aan een verhoging van het cardiovasculaire risico. Op welke wijze dient dit gewogen te worden bij de risico-inschatting?
Methode
Voor een antwoord op deze uitgangsvraag is gebruikgemaakt van beschikbare systematische reviews en is afstemming gezocht met de richtlijnwerkgroep die de multidisciplinaire richtlijn en NHG-Standaard Cardiovasculair risicomanagement (CVRM) herziet. De richtlijnwerkgroep gaat bij de herziening uit van de recent gepubliceerde Europese richtlijnen voor de preventie van cardiovasculaire aandoeningen.
Resultaten
In een meta-analyse van het Chronic Kidney Disease Prognosis Consortium (KDIGO) uit 2010 is de relatie tussen de eGFR en albuminurie met totale en cardiovasculaire mortaliteit in de algemene populatie onderzocht. In dit onderzoek werden 21 studies met ten minste 1000 deelnemers geïncludeerd (totaal: 1.234.182). Bij een verlaagde nierfunctie (eGFR < 60 ml/ min/1,73 m2) en/of verhoogde albuminurie was het risico op overlijden verhoogd; dat geldt zowel voor de totale als voor de cardiovasculaire mortaliteit (tabel 6). Deze relatie werd gevonden, waarbij gecorrigeerd is voor leeftijd, etnische origine, geslacht, cardiovasculaire aandoeningen in de voorgeschiedenis, systolische bloeddruk, diabetes, roken en totale cholesterolconcentratie. Gansevoort et al. onderzochten in een meta-analyse het risico van verlaagde nierfunctie en verhoogde albuminurie op nierschade.
In deze studie werden 9 prospectieve cohortonderzoeken onder de algemene bevolking geïncludeerd (totaal 845.125 personen) en 8 prospectieve cohortonderzoeken met hoogrisicopatiënten (totaal 173.892 personen).
Als uitkomstmaten werd gekeken naar eindstadium nierfalen (nierfunctievervangende behandeling of mortaliteit vanwege nierschade), acuut nierfalen en progressie van chronische nierschade (gemiddelde daling eGFR van ten minste 2,5 ml/min/1,73 m2 per jaar in combinatie met eGFR < 45 ml/min/1,73 m2). Een lagere eGFR bleek geassocieerd met een hoger risico op eindstadium nierfalen in de algemene populatie: de hazardratio’s (en 95%-BI) bij een eGFR van 60, 45 en 15 ml/min/1,73 m2 waren 3,69 (95%-BI 2,36 tot 5,76), 29,3 (95%-BI 19,5 tot 44,1) en 454,9 (95%-BI 112,4 tot 1840,2), vergeleken met een normale nierfunctie. Vergelijkbare resultaten werden gezien in de relatie tussen de al-bumine-creatinineratio en het optreden van eindstadium nierfalen: vergeleken met een albumine-creatinineratio van 5 mg/g was de hazardratio (en 95%-BI) verhoogd bij 30 (HR 4,87; 95%-BI 2,30 tot 10,3), 300 (HR 13,4; 95%-BI 5,49 tot 32,7) en 1000 mg/g (HR 28,4; 95%-BI 14,9 tot 54,2). Combinatie van een verlaagde eGFR en een verhoogde albumine-creatinineratio (of positieve urine dipstick) was geassocieerd met een ernstig verhoogde kans op eindstadium nierfalen, acuut nierfalen en progressie van nierschade (tabel 7). In deze associaties is gecorrigeerd voor leeftijd, geslacht en cardiovasculaire risicofactoren.
Van der Velde et al. onderzochten de relatie tussen nierfunctie en albuminurie met totale en cardiovasculaire mortaliteit in een meta-analyse van cohortonderzoeken onder populaties met een hoog risico. In dit onderzoek werden 10 prospectieve cohortonderzoeken met ten minste 1000 deelnemers geïncludeerd (totaal 266.975 personen). Patiënten in deze studies hadden een verhoogd risico op chronische nierschade, vanwege hypertensie, diabetes mellitus of cardiovasculaire aandoeningen. Vergeleken met een normale nierfunctie en normale albumine-creatinineratio was er een verhoogd risico op mortaliteit (zowel totaal als cardiovasculair) bij patiënten met een verlaagde nierfunctie en/of verhoogde albuminurie, waarbij gecorrigeerd werd voor albuminurie respectievelijk eGFR en cardiovasculaire risicofactoren tabel 8.
Matsushita et al. voerden een meta-analyse uit met individuele patiëntgegevens om de toegevoegde waarde van eGFR en albuminurie in het voorspellen van cardiovasculaire uitkomsten te onderzoeken. In dit onderzoek werden gegevens van 637.315 patiënten uit 24 prospectieve cohortstudies geïncludeerd. Er werd gekeken naar de uitkomstmaten cardiovasculaire mortaliteit (sterfte vanwege myocardinfarct, beroerte, hartfalen of acute hartdood), coronaire hartziekten (myocardinfarct, fatale coronaire hartziekten, coronaire revascularisatie), beroerte (ischemische en hemorragisch) en hartfalen (hospitalisatie en sterfte). Patiënten in de cohortonderzoeken hadden geen cardiovasculaire aandoeningen in de voorgeschiedenis. De gemiddelde follow-up was 8,9 jaar (sd 4,6). Uit deze studie bleek dat het toevoegen van eGFR en albumine-creatinineratio aan ‘traditionele’ risicofactoren een betere voorspelling gaf van cardiovasculaire uitkomsten in de algemene populatie. Met name de albumine-creatinineratio bleek hierbij discriminerend. Het toevoegen van deze renale waarden bleek bovendien vooral onderscheidend te zijn wanneer naar de uitkomsten cardiovasculaire mortaliteit en hartfalen werd gekeken, en minder onderscheidend voor de uitkomsten coronaire hartziekten en beroerte. Vooral bij patiënten met diabetes mellitus of hypertensie was het toevoegen van eGFR en de albumine-creatinineratio aan het prognostische model zinvol, maar ook bij patiënten zonder deze aandoeningen bleek de albumine-creatinineratio waardevol wanneer gekeken werd naar de uitkomsten cardiovasculaire mortaliteit en hartfalen. Bij patiënten met chronische nierschade bleek de combinatie van eGFR en albumine-creatinineratio een betere voorspeller van het cardiovasculaire risico dan elke andere (beïnvloedbare) ‘traditionele’ risicofactor.
Het risico op coronaire hartziekten bij patiënten met chronische nierschade is onderzocht en vergeleken met datzelfde risico bij patiënten met diabetes mellitus in een cohortstudie van Tonelli et al. In dit onderzoek werden 1.268.029 mensen geïncludeerd van wie 1% met een myocardinfarct in het ziekenhuis werd opgenomen. Bij patiënten zonder myocardinfarct in de voorgeschiedenis was het risico op een myocardinfarct bij patiënten met chronische nierschade (eGFR < 60 ml/ min/1,73 m2) hoger (6,9 per 1000 persoonsjaren; 95%-BI 6,6 tot 7,2) dan bij patiënten met diabetes mellitus (5,4 per 1000 persoonsjaren; 95%-BI 5,2 tot 5,7; p < 0,0001). Na correctie voor verstorende variabelen is het risico op mortaliteit bij patiënten met diabetes mellitus vergelijkbaar met dat bij patiënten met chronische nierschade.
| ACR | Urine dipstick | |||||||
|---|---|---|---|---|---|---|---|---|
| < 1,1 mg/mmol | 1,1-3,3 mg/ mmol | 3,4-33,8 mg/ mmol | ≥ 33,9 mg/mmol | Negatief | Spoor | 1+ | 2+ of meer | |
| Totale mortaliteit | ||||||||
| ≥ 105 ml/min/1,73m2 | 1,14 (1,02-1,27) | 1,52 (1,28-1,81) | 2,32 (2,00-2,70) | 5,26 (2,80-9,85) | 1,35 (0,94-1,92) | 2,34 (1,17-4,69) | 2,59 (1,32-5,07) | 4,40 (2,79-6,93) |
| 90-104 ml/min/1,73m2 | Referentie | 1,48 (1,29-1,69) | 1,61 (1,39-1,87) | 3,65 (2,13-6,27) | Referentie | 1,47 (1,09-2,00) | 1,88 (1,27-2,77) | 2,44 (1,53-3,89) |
| 75-89 ml/min/1,73m2 | 1,00 (0,91-1,09) | 1,40 (1,26-1,55) | 1,78 (1,58-2,01) | 2,50 (1,89-3,31) | 0,81 (0,65-1,01) | 1,44 (1,31-1,57) | 1,69 (1,50-1,89) | 2,43 (1,94-3,04) |
| 60-74 ml/min/1,73 m2 | 1,02 (0,92-1,15) | 1,49 (1,34-1,66) | 1,95 (1,67-2,27) | 3,09 (2,56-3,72) | 0,81 (0,59-1,10) | 1,27 (1,17-1,37) | 1,53 (1,32-1,78) | 1,88 (1,56-2,25) |
| 45-59 ml/min/1,73 m2 | 1,28 (1,05-1,57) | 1,95 (1,73-2,20) | 2,51 (2,16-2,90) | 4,10 (3,39-4,95) | 0,94 (0,66-1,32) | 1,38 (1,06-1,78) | 1,71 (1,52-1,92) | 2,41 (1,77-3,29) |
| 30-44 ml/min/1,73 m2 | 1,97 (1,59-2,43) | 2,65 (2,19-3,22) | 3,66 (2,91-4,60) | 5,08 (4,20-6,15) | 1,47 (0,97-2,22) | 1,94 (1,26-2,98) | 2,35 (1,66-3,33) | 2,86 (1,88-4,36) |
| 15-29 ml/min/1,73 m2 | 5,39 (3,30-8,80) | 3,66 (2,43-5,50) | 4,85 (3,26-7,21) | 6,96 (5,28-9,19) | 2,30 (1,61-3,29) | 4,37 (2,29-8,36) | 3,21 (2,00-5,13) | 5,98 (3,59-9,97) |
| Cardiovasculaire mortaliteit | ||||||||
| ≥ 105 ml/min/1,73 m2 | 0,93 (0,74-1,16) | 1,33 (1,04-1,72) | 2,46 (1,88-3,23) | 2,69 (1,36-5,32) | 0,96 (0,72-1,29) | 2,13 (1,22-3,74) | 3,27 (1,50-7,09) | 3,70 (1,17-11,68) |
| 90-104 ml/min/1,73 m2 | Referentie | 1,63 (1,20-2,19) | 1,82 (1,36-2,45) | 4,77 (3,16-7,22) | Referentie | 1,88 (1,32-2,69) | 1,68 (0,82-3,43) | 3,63 (1,58-8,32) |
| 75-89 ml/min/1,73 m2 | 1,03 (0,85-1,24) | 1,48 (1,23-1,78) | 1,73 (1,29-2,32) | 4,01 (2,62-6,14) | 0,82 (0,69-0,97) | 1,78 (1,33-2,37) | 2,08 (1,40-3,09) | 2,38 (1,40-4,04) |
| 60-74 ml/min/1,73 m2 | 1,09 (0,92-1,29) | 1,58 (1,31-1,91) | 2,18 (1,58-3,02) | 4,23 (2,95-6,06) | 0,99 (0,84-1,17) | 1,43 (1,13-1,82) | 1,84 (1,15-2,95) | 2,01 (1,26-3,19) |
| 45-59 ml/min/1,73 m2 | 1,52 (1,18-1,97) | 2,38 (1,91-2,96) | 3,13 (2,32-4,22) | 4,97 (3,70-6,66) | 1,38 (1,16-1,65) | 1,89 (1,47-2,44) | 2,40 (1,73-3,33) | 2,67 (1,58-4,50) |
| 30-44 ml/min/1,73 m2 | 2,40 (1,80-3,21) | 3,07 (1,73-5,44) | 4,12 (2,84-5,98) | 6,10 (4,08-9,10) | 2,42 (1,92-3,05) | 2,99 (2,13-4,20) | 2,73 (1,83-4,08) | 3,06 (2,00-4,70) |
| 15-29 ml/min/1,73 m2 | 13,51 (4,89-37,35) | 7,99 (1,95-32,81) | 5,60 (3,66-8,57) | 9,49 (4,97-18,10) | 3,29 (1,72-6,31) | 4,25 (2,28-7,93) | 7,66 (1,24-47,22) | 5,72 (1,66-19,73) |
| eGFR: estimated glomerular filtration rate; ACR: albumine/creatinine ratio. * Gecorrigeerd voor leeftijd, etnische origine, geslacht, cardiovasculaire aandoeningen in de voorgeschiedenis, systolische bloeddruk, diabetes, roken en totale cholesterolconcentratie. |
||||||||
Conclusies
- Verlaagde eGFR en/of verhoogde albuminurie zijn zowel in de algemene populatie, als bij populaties met een hoog risico op chronische nierschade en cardiovasculaire morbiditeit, onafhankelijke risicofactoren voor cardiovasculaire en totale mortaliteit en voor progressie van chronische nierschade, acuut nierfalen en eindstadium nierfalen.
- De combinatie van (verlaagde) eGFR en (verhoogde) albumine-creatinineratio in de urine is bij patiënten met chronische nierschade een betere voorspeller van cardiovasculaire uitkomsten dan afzonderlijke traditionele beïnvloedbare risicofactoren.
- De verhoging van het risico op cardiovasculaire aandoeningen bij patiënten met chronische nierschade is ten minste vergelijkbaar met die van patiënten met diabetes mellitus.
| Albumine-creatinineratio (mg/g) of urine dipstick (klasse) | |||||
|---|---|---|---|---|---|
| < 10 (negatief) | 10-29 (spoor) | 30-299 (1+) | ≥ 300 (≥ 2+) | Totaal | |
| Eindstadium nierfalen | |||||
| ≥ 105 ml/min/1,73 m2 | Referentie | 7,8 (1,7-35,9) | 18,1 (4,3-75,9) | Referentie | |
| 90-104 ml/min/1,73 m2 | 11,3 (2,7-47,7) | 19,7 (5,8-66,5) | |||
| 75-89 ml/min/1,73 m2 | 3,8 (1,2-12,3) | 48,1 (28,1-82,3) | |||
| 60-74 ml/min/1,73 m2 | 7,4 (3,6-15,2) | 67,2 (40,1-113) | |||
| 45-59 ml/min/1,73 m2 | 5,2 (3,3-8,0) | 21,8 (12,0-39,6) | 40,3 (23,5-69,2) | 147 (98,7-219) | 9,6 (7,0-13,2) |
| 30-44 ml/min/1,73 m2 | 55,5 (36,0-85,6) | 74,1 (29,3-187) | 293 (199-433) | 763 (563-1035) | 98,1 (61,8-156) |
| 15-29 ml/min/1,73 m2 | 433 (239-787) | 1044 (524-2077) | 1056 (572-1948) | 2286 (1114-4695) | 573 (241-1362) |
| Totaal | Referentie | 12,0 (7,9-18,1) | 72,1 (43,0-121) | ||
| Acuut nierfalen | |||||
| ≥ 105 ml/min/1,73 m2 | Referentie | 2,7 (0,9-8,5) | 8,4 (5,1-13,8) | Referentie | |
| 90-104 ml/min/1,73 m2 | 2,4 (1,1-5,2) | 5,8 (3,7-9,2) | |||
| 75-89 ml/min/1,73 m2 | 2,5 (1,9-3,4) | 4,1 (2,8-5,9) | |||
| 60-74 ml/min/1,73 m2 | 3,3 (2,6-4,1) | 6,4 (5,0-8,2) | |||
| 45-59 ml/min/1,73 m2 | 2,2 (2,0-2,5) | 4,9 (3,3-7,3) | 6,3 (4,8-8,4) | 5,9 (2,4-14,5) | 2,6 (2,2-3,1) |
| 30-44 ml/min/1,73 m2 | 7,3 (6,5-8,2) | 10,2 (5,9-17,5) | 12,4 (10,2-15,2) | 19,6 (16,5-23,2) | 7,9 (7,1-8,7) |
| 15-29 ml/min/1,73 m2 | 16,8 (14,0-20,2) | 16,8 (11,3-25,1) | 21,4 (16,5-27,8) | 28,8 (23,7-35,1) | 16,7 (14,7-18,9) |
| Totaal | Referentie | 2,5 (1,7-3,7) | 6,0 (4,5-8,0) | ||
| Progressie chronische nierschade | |||||
| ≥ 105 ml/min/1,73 m2 | Referentie | 0,7 (0,7-0,8) | 3,0 (0,4-23,7) | Referentie | |
| 90-104 ml/min/1,73 m2 | 0,9 (0,4-2,1) | 3,3 (0,5-23,3) | |||
| 75-89 ml/min/1,73 m2 | 1,9 (0,6-5,6) | 5,0 (0,9-27,1) | |||
| 60-74 ml/min/1,73 m2 | 3,2 (1,4-7,5) | 8,1 (5,2-12,8) | |||
| 45-59 ml/min/1,73 m2 | 3,1 (1,6-6,0) | 4,0 (1,9-8,8) | 9,4 (3,7-23,7) | 56,6 (4,2-767,6) | 3,9 (1,9-7,8) |
| 30-44 ml/min/1,73 m2 | 3,0 (1,2-7,5) | 19,1 (19,0-19,2) | 14,9 (2,8-78,5) | 22,2 (4,8-103,6) | 3,7 (1,1-12,3) |
| 15-29 ml/min/1,73 m2 | 4,0 (3,9-4,0) | 11,7 (11,6-11,9) | 21,0 (4,5-99,5) | 7,7 (2,9-20,6) | 7,9 (3,0-21,2) |
| Totaal | Referentie | 3,1 (2,5-3,8) | 11,2 (5,8-21,5) | ||
Van bewijs naar aanbeveling
Het kwaliteitsinitiatief KDIGO, een mondiaal kwaliteitsinitiatief, heeft een richtlijn gemaakt voor de diagnose en classificatie van chronische nierschade. Aangezien verminderde (e)GFR en toegenomen albuminurie de meest voorkomende renale afwijkingen zijn en beide in meta-analyses onafhankelijk sterk geassocieerd bleken met het risico op optreden van mortaliteit, cardiovasculaire eindpunten, progressieve nierfunctie-achteruitgang, acute nierinsufficiëntie en terminaal nierfalen, is deze classificatie gebaseerd op de hoogte van de albuminurie en de geschatte glomerulaire filtratiesnelheid. Naast deze classificatie heeft het KDIGO ook een globale indeling gemaakt in drie stadia van chronische nierschade, die gerelateerd is aan prognose wat betreft renale en cardiovasculaire uitkomsten. De werkgroep onderschrijft het belang van deze indeling in globale risicostadia, omdat het streven is om alle patiënten in te delen op basis van prognose. Een beslissing over (vaak preventieve) behandeling moet uitgaan van het totale risico op toekomstige morbiditeit en mortaliteit. De absolute bijdrage van verschillende stadia van chronische nierschade op het cardiovasculaire risico staat niet vast. Toch is er voldoende reden om chronische nierschade te betrekken in het bepalen van het cardiovasculaire risico, net als bijvoorbeeld diabetes mellitus. De richtlijnwerkgroep stelt voor om aan te sluiten bij de risicocategorieën voor hart- en vaatziekten, zoals die gehanteerd worden in de ESC-richtlijn (tabel 5 in ESC-richtlijn Cardiovasculair risicomanagement 2016). Deze indeling vormt de basis voor de nog te verschijnen multidisciplinaire richtlijn Cardiovasculair risicomanagement (MDR CVRM, naar verwachting 2018). De risicocategorieën zijn leidend voor de intensiteit van het niet-medicamenteuze beleid, de afweging voor het starten van medicamenteuze behandeling en de streefwaarden van behandeling. Hierbij wordt uitgegaan van vier risicocategorieën. Aan personen met een laag cardiovasculair risico (tienjaarsrisico op cardiovasculaire mortaliteit < 1%) worden leefstijladviezen aanbevolen om het risico niet verder te verhogen. Dit geldt ook voor personen met een matig verhoogd cardiovasculair risico (tienjaarsrisico op cardiovasculaire mortaliteit 1 tot 5%). Aan personen met een hoog risico (bijvoorbeeld tienjaarsrisico op cardiovasculaire mortaliteit tussen 5 en 10%, of ernstig verhoogde individuele risicofactoren, bijvoorbeeld bloeddruk ≥ 180/110 mmHg) worden stringente leefstijladviezen aanbevolen en mogelijk medicatie. Patiënten met een zeer hoog risico (bijvoorbeeld tienjaarsrisico op cardiovasculaire mortaliteit ≥ 10%, aanwezige hart- en vaatziekten, diabetes mellitus met eindorgaanschade, ernstige chronische nierschade) komen over het algemeen in aanmerking voor medicamenteuze behandeling.
| ACR | Urine dipstick | |||||||
|---|---|---|---|---|---|---|---|---|
| < 10 mg/g | 10-29 mg/g | 30-299 mg/g | ≥ 300 mg/g | Negatief | Spoor | 1+ | ≥ 2+ | |
| Totale mortaliteit | ||||||||
| ≥ 105 ml/min/1,73 m2 | 1,26 (0,97-1,60) | 1,31 (1,07-1,60) | 1,51 (1,23-1,84) | 2,97 (2,19-4,04) | 1,08 (0,91-1,27) | 1,16 (0,69-1,97) | 2,10 (1,33-3,32) | 1,86 (0,63-5,46) |
| 90-104 ml/min/1,73 m2 | Referentie | 1,26 (1,05-1,51) | 1,63 (1,37-1,95) | 2,72 (2,08-3,56) | Referentie | 1,09 (0,90-1,32) | 1,63 (1,20-2,21) | 3,86 (1,44-10,36) |
| 75-89 ml/min/1,73 m2 | 0,88 (0,70-1,11) | 1,12 (0,85-1,48) | 1,58 (1,36-1,84) | 2,91 (2,28-3,73) | 0,82 (0,75-0,90) | 1,02 (0,86-1,20) | 1,35 (0,88-2,05) | 3,22 (1,59-6,52) |
| 60-74 ml/min/1,73 m2 | 0,82 (0,64-1,05) | 1,18 (0,89-1,56) | 1,63 (1,28-2,07) | 2,67 (1,76-4,04) | 0,81 (0,73-0,89) | 0,93 (0,79-1,11) | 1,41 (0,85-2,35) | 2,29 (1,32-3,98) |
| 45-59 ml/min/1,73 m2 | 1,16 (0,77-1,73) | 1,39 (0,97-1,98) | 1,96 (1,57-2,43) | 3,58 (2,54-5,05) | 0,88 (0,75-1,03) | 1,05 (0,82-1,36) | 2,25 (1,55-3,25) | 2,40 (1,13-5,12) |
| 30-44 ml/min/1,73 m2 | 1,54 (1,11-2,13) | 2,06 (1,42-2,97) | 2,84 (1,98-4,06) | 3,99 (2,73-5,83) | 1,18 (0,68-2,06) | 1,87 (1,30-2,68) | 2,51 (1,78-3,54) | 5,50 (3,56-8,50) |
| 15-29 ml/min/1,73 m2 | 2,73 (1,87-3,97) | 3,52 (2,18-5,69) | 3,73 (2,90-4,80) | 5,43 (3,94-7,49) | 3,12 (1,53-6,37) | 4,25 (2,11-8,58) | 3,49 (2,26-5,41) | 7,14 (4,64-10,99) |
| Cardiovasculaire mortaliteit | ||||||||
| ≥ 105 ml/min/1,73 m2 | 1,20 (0,89-1,62) | 1,62 (1,10-2,39) | 2,04 (1,40-2,95) | 3,55 (1,80-7,01) | 0,96 (0,73-1,26) | 1,07 (0,62-1,83) | 3,05 (0,60-15,40) | 1,18 (0,29-4,75) |
| 90-104 ml/min/1,73 m2 | Referentie | 1,56 (1,12-2,17) | 1,95 (1,44-2,65) | 4,12 (2,50-6,77) | Referentie | 1,10 (0,81-1,50) | 2,07 (1,24-3,46) | 2,28 (1,07-4,86) |
| 75-89 ml/min/1,73 m2 | 1,02 (0,82-1,26) | 1,34 (1,03-1,76) | 1,82 (1,42-2,34) | 4,76 (3,32-6,81) | 0,87 (0,75-1,00) | 1,03 (0,85-1,26) | 1,03 (0,72-1,48) | 2,82 (1,03-7,70) |
| 60-74 ml/min/1,73 m2 | 1,00 (0,81-1,23) | 1,54 (1,16-2,04) | 2,01 (1,55-2,59) | 4,00 (2,83-5,66) | 0,86 (0,75-1,00) | 1,05 (0,72-1,54) | 1,29 (0,91-1,82) | 1,91 (0,96-3,79) |
| 45-59 ml/min/1,73 m2 | 1,42 (1,14-1,77) | 2,06 (1,60-2,66) | 2,56 (2,03-3,22) | 5,58 (3,19-9,79) | 0,89 (0,79-1,15) | 1,04 (0,65-1,66) | 2,70 (1,29-5,68) | 1,62 (0,80-3-31) |
| 30-44 ml/min/1,73 m2 | 2,27 (1,72-3,01) | 3,74 (2,06-6,78) | 3,95 (3,02-5,18) | 6,00 (4,40-8,18) | 0,55 (0,13-2,31) | 1,07 (0,23-5,05) | 3,06 (0,81-11,56) | 3,45 (1,01-11,76) |
| 15-29 ml/min/1,73 m2 | 3,93 (2,10-7,35) | 5,60 (2,34-13,73) | 6,06 (3,89-9,45) | 7,21 (4,33-11,99) | Onvoldoende data | Onvoldoende data | Onvoldoende data | Onvoldoende data |
| eGFR: estimated glomerular filtration rate; ACR: albumine-creatinineratio. * Gecorrigeerd voor leeftijd, etnische origine, geslacht, cardiovasculaire aandoeningen in de voorgeschiedenis, systolische bloeddruk, diabetes, roken en totale cholesterolconcentratie. |
||||||||
In de ESC-richtlijn worden daarnaast effectmodificatoren genoemd, op basis waarvan patiënten mogelijk in een hogere of lagere risicoklasse geclassificeerd kunnen worden (zie tabel 4 in ESC-richtlijn Cardiovasculair risicomanagement 2016). Voorbeelden van effectmodificatoren zijn een familiaire belasting met premature hart- en vaatziekten en obesitas.
Voor de invulling van de ESC-risicocategorieën stelt de richtlijnwerkgroep van deze standaard en de MDR Chronische nierschade een aanpassing voor op grond van bovenstaande evidence. Dit heeft een betere en genuanceerdere risicoprofilering van het risico op hart- en vaatziekten bij patiënten met chronische nierschade tot gevolg, met een afname van het aantal mensen dat onnodig behandeld wordt.
Aanbeveling
Het cardiovasculair risico van patiënten met chronische nierschade is verhoogd, vergelijkbaar met patiënten met diabetes mellitus, en dient als zodanig gekwantificeerd te worden:
- Chronische nierschade categorie rood en oranje in de chronische nierschade stadiërings- en risicotabel (tabel 1): deze categorie patiënten hebben een (zeer) hoog cardiovasculair risico. Leefstijladviezen worden aanbevolen. Daarnaast wordt bij deze patiënten medicamenteuze behandeling aanbevolen conform de adviezen in de richtlijnen cardiovasculair risicomanagement om zo het cardiovasculair risico te verlagen.
- Chronische nierschade categorie geel in chronische nierschade stadiëringsen risicotabel (tabel 1) : deze categorie patiënten hebben een matig verhoogd cardiovasculair risico. Leefstijladviezen worden aanbevolen. Bij de schatting van het cardiovasculaire risico dient bij deze patiënten gecorrigeerd te worden voor de aanwezigheid van chronische nierschade.
Deze aanbeveling wordt geactualiseerd zodra de nieuwe richtlijnen voor cardiovasculair risicomanagement verschijnen.
Vanuit het Groningse PREVEND-onderzoek is bekend wat de prevalentie van chronische nierschade in de algemene populatie in Nederland is. Deze prevalentiecijfers zijn ongeveer vergelijkbaar met die in andere Europese landen en de Verenigde Staten. Slechts een beperkt deel van de patiënten met chronische nierschade heeft een sterk verhoogd risico op mortaliteit, cardiovasculaire schade, acute nierschade en eindstadium nierfalen (ongeveer 10%) (zie ook bovenstaand detail).
In een retrospectieve studie naar de kwaliteit van het beleid bij patiënten met chronische nierschade werd gebruikgemaakt van de data uit een clustergerandomiseerde studie naar het effect van teleconsultatie op het verwijsbeleid van huisartsen (de CONTACT-studie). De 47 praktijken omvatten een populatie van 207.469 patiënten, waarvan 162.562 patiënten ouder dan 18 jaar. Van 31% van de patiënten waren data over de nierfunctie en/of albuminurie beschikbaar. 9288 patiënten voldeden aan de criteria voor chronische nierschade, wat resulteerde in een prevalentie van chronische nierschade van 5,7%. Hierbij moet wel de kanttekening gemaakt worden dat het een minimale prevalentie betreft, aangezien van twee derde van de patiënten geen gegevens over nierfunctie of albuminurie beschikbaar waren.
Etiologie en prognose
Naar Samenvatting ›- Vroeger was chronische nierschade vooral het gevolg van klassieke nierziekten, vaak in het kader van:
- een auto-immuunaandoening (zoals glomerulonefritis, vasculitis en interstitiële nefritis)
- diabetes mellitus type 1
- Tegenwoordig zijn veroorzakers van chronische nierschade en eindstadium nierfalen (zie Details) vooral:
- hypertensie
- diabetes mellitus type 2
- atherosclerotisch vaatlijden
- een enkele keer (zeldzaam voorkomende) erfelijke nierziekten (zie Details)
- Een verlaagde eGFR en een verhoogde albuminurie zijn onafhankelijke risicofactoren en voorspellers voor cardiovasculaire en totale mortaliteit en voor progressie van chronische nierschade en eindstadium nierfalen (zie Details Epidemiologie).
- Het risico op cardiovasculair overlijden bij personen met chronische nierschade ten opzichte van personen zonder chronische nierschade is verhoogd:
- met een factor 1,5 tot 2,2 in geval van chronische nierschade met een mild verhoogd risico (geel in tabel 1)
- met een factor 2,2 tot 4 in geval van chronische nierschade met een matig verhoogd risico (oranje in tabel 1)
- met een factor > 4 in geval van chronische nierschade met een sterk verhoogd risico (rood in tabel 1)
- Voor het risico op het optreden van eindstadium nierfalen is er een verhoging:
- met een factor 4 tot 20 in geval van chronische nierschade met een mild verhoogd risico (geel in tabel 1)
- met een factor 20 tot 80 in geval van chronische nierschade met een matig verhoogd risico (oranje in tabel 1)
- met een factor > 80 in geval van chronische nierschade met een sterk verhoogd risico (rood in tabel 1)
- Patiënten met chronische nierschade die RAS-remmers, diuretica of NSAID’s gebruiken (inclusief zelfmedicatie), hebben ook een verhoogd risico op een acute verslechtering van de nierfunctie en hyperkaliëmie bij dreigende dehydratie (zie Details). Ouderen en patiënten met hartfalen of uiting van atherosclerotisch vaatlijden lopen extra risico.
Het aantal mensen dat eindstadium nierfalen bereikt neemt als gevolg van klassieke nierziekten in absolute zin af, terwijl het aantal mensen dat eindstadium nierfalen bereikt als gevolg van diabetes mellitus type 2, hypertensie of atherosclerotisch vaatlijden toeneemt. (Tabel 9) laat een verdeling van deze risicofactoren in verschillende nierfunctiecategorieën zien. Ook metabool syndroom (OR 1,55; 95%-BI 1,34 tot 1,80) en obesitas (OR 1,23 per sd hogere BMI; 95%-BI 1,08 tot 1,41) blijken geassocieerd te zijn met een verhoogde kans op een eGFR < 60 ml/ min/1,73 m2.
Polycysteuze nierziekten
Polycysteuze nieren kunnen autosomaal-dominant en autosomaal-recessief overerven. Klinische symptomen zijn pijn in de rug en/of de flank, de aanwezigheid van een abdominale massa, macroscopische hematurie, urineweginfecties en hypertensie. Op 70-jarige leeftijd is er in 50 tot 75% van de gevallen eindstadium nierfalen ontstaan.
Ziekte van Alport
Meestal is er sprake van een X-gebonden overervend ziektebeeld berustend op een afwijking van de α-keten van collageen IV. Hierdoor wordt de glomerulaire basale membraan aangetast. Klinische symptomen zijn microscopische hematurie, gehoorverlies en oogafwijkingen (lensafwijkingen en stippeling van de retina). De nierfunctie neemt af vanaf het tiende levensjaar.
Ziekte van Fabry
In zeldzame gevallen kan persisterende verhoogde albuminurie, zonder bijkomende hypertensie, veroorzaakt worden door de ziekte van Fabry. Dit is een stapelingsziekte, waarbij er een deficiëntie is van het lysosomale enzym a-galactosidase. De ziekte erft X-gebonden over. Klinische verschijnselen zijn pijn aan de extremiteiten, angiohematomen op de romp en een stippeling van de cornea. Op jongvolwassen leeftijd kunnen hematurie en milde proteïnurie ontstaan. Rond het vijftigste levensjaar is er meestal een eindstadium nierfalen ontstaan. De ziekte kan behandeld worden met het toedienen van humaan α-galactosidase.
Veel patiënten met chronische nierschade gebruiken renine-angiotensine-systeemremmers (RAS-remmers), zoals ACE-remmers en angiotensine-II-antagonisten. Bij (dreigende) dehydratie (bijvoorbeeld bij koorts, braken en diarree) kan dit leiden tot een acute nierfunctieverslechtering. Vooral tijdens warme zomerdagen is alertheid geboden. Het RAS-systeem beïnvloedt de bloeddrukregulatie en nierperfusie. Bij dehydratie leidt dit tot vasoconstrictie, reabsorptie van natrium en retentie van water en daarmee tot een toename van het circulerend volume. Hierdoor stijgt de bloeddruk. RAS-remmers onderdrukken de beschermende werking van het RAS-systeem op de glomerulaire filtratie bij ondervulling, wat kan leiden tot acute nierschade. Gebruik van NSAID’s verhoogt het risico op afname van de glomerulaire filtratiesnelheid.
In een retrospectief cohortonderzoek onder 2398 patiënten op een spoedeisende hulp bleek er bij 89 patiënten sprake van serumcreatinine ≥ 200 µmol/l. Negen van deze patiënten waren dialysepatiënten, van de overige patiënten gebruikten er 30 (38%) een ACE-remmer. Van deze patiënten gaven er 6 aan last te hebben (gehad) van diarree en braken. In deze groep was de mediane creatinineconcentratie 135 µmol/l (range 111 tot 209) voor opname, 292 (216 tot 724) µmol/l bij het contact op de spoedeisende hulp en 134 (94 tot 219) µmol/l na stoppen van de behandeling met ACE-remmers en vloeistoftoediening.
Patiënten met chronische nierschade hebben bij een (dreigende) dehydratie ook een verhoogd risico op hyperkaliemie. Zie voor aanvullende informatie de NHG-Standaard Acute diarree. Overweeg op grond van het klinisch beeld (en eventuele laboratoriumuitslagen) tijdelijk diuretica en NSAID’s te staken en de dosering van RAS-remmers te halveren. Bij patiënten met hartfalen wordt geadviseerd de dosering van diuretica en RAS-remmers te halveren. Ook voor andere medicatie geldt dat aanpassing van de medicatie aangewezen kan zijn. Metformine kan bijvoorbeeld enkele dagen gestaakt worden vanwege het risico op lactaatacidose.
| Hypertensie (door patiënt gerapporteerd) | Diabetes mellitus (door patiënt gerapporteerd) | Manifeste harten vaatziekten | |
|---|---|---|---|
| Geen chronische nierschade | 23,3% | 4,9% | 5,8% |
| eGFR ≥ 90 ml/min/1,73 m2, | 35,8% | 19,8% | 7,7% |
| ernstig verhoogde albuminurie | |||
| eGFR 60-89 ml/min/1,73 m2 | 48,1% | 22,2% | 18,4% |
| eGFR 30-59 ml/min/1,73 m2 | 58,8% | 17,8% | 31,4% |
| eGFR < 30 ml/min/1,73 m2 | 84,1% | 36,0% | 62,8% |
Pathofysiologie
Naar Samenvatting ›- Een belangrijke functie van de nier is de uitscheiding van endogene afvalstoffen (bijvoorbeeld creatinine en ureum) en exogene afvalstoffen (bijvoorbeeld geneesmiddelen). De klaring van een stof is de snelheid waarmee een stof uit het lichaam verdwijnt.
- De nier kan stoffen uitscheiden door:
- glomerulaire filtratie
- tubulaire secretie (actief en passief)
- een combinatie daarvan
- De glomerulaire filtratiesnelheid (GFR) is de hoeveelheid plasma die per tijdseenheid het glomerulaire filter passeert (ook wel voorurine genoemd, uitgedrukt in ml/min). Van stoffen die worden gefiltreerd en die geen secretie of terugresorptie ondergaan, komt de klaring overeen met de filtratiesnelheid.
- Creatinine wordt gedeeltelijk actief uitgescheiden. Dit betekent dat de klaring van creatinine circa 15% hoger ligt dan de glomerulaire filtratiesnelheid.
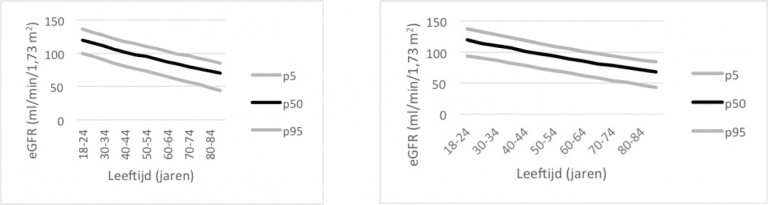
- Op 40-jarige leeftijd is de eGFR gemiddeld circa 80 ml/min/1,73 m2. Vanaf deze leeftijd neemt de nierfunctie geleidelijk af met ongeveer 0,4 ml/min/1,73 m2 per jaar. Een eGFR < 90 ml/min/1,73 m2 bij een jong iemand kan dus voor de leeftijd abnormaal zijn, terwijl bij veel gezonde mannen en vrouwen > 70 jaar een eGFR < 60 ml/min/1,73 m2 wordt gevonden.
- Een verminderd vermogen van het lichaam om afvalstoffen via de nieren te klaren kan veroorzaakt worden door een nierziekte (primair of secundair aan een systemische aandoening), maar kan ook het gevolg zijn van vasculaire veranderingen die samenhangen met diabetes mellitus, hypertensie of veroudering.
- Het verhoogde cardiovasculaire risico bij patiënten met chronische nierschade is gedeeltelijk te verklaren door de hoge prevalentie van traditionele risicofactoren, zoals hypertensie en diabetes. De associatie tussen een verminderde nierfunctie en een verhoogde albuminurie met het cardiovasculaire risico is echter onafhankelijk van deze traditionele risicofactoren. Dus: niet-traditionele, nierspecifieke mechanismen leveren een aanzienlijke bijdrage aan het cardiovasculaire risico (zie Details).
Chronische nierschade en hart-en vaatziekten delen een aantal risicofactoren voor progressie, zoals roken, hypertensie, hyperlipidemie en diabetes. Als de nierfunctie waarden < 60 ml/min/1,73 m2 of de albuminurie waarden > 3 mg/mmol bereikt, komt er een aantal risicofactoren voor hart- en vaatziekten bij die specifiek zijn voor patiënten met chronische nierschade, zoals afwijkingen in het calcium-fosfaatmetabolisme, anemie, metabole acidose, systemische inflammatie, toegenomen sympathische activiteit, activatie van specifieke hormonale systemen (zoals het renine-angiotensine-aldosteronsysteem), up-regulatie van pro-fibrotische intracellulaire mechanismen en afgifte van vaso-actieve stoffen. Bovendien is er een stapeling van uremische toxines, die leiden tot toegenomen atherosclerose. Deze mechanismen maken dat patienten met een verminderde nierfunctie een specifiek, en sterk verhoogd risico hebben op hart- en vaatziekten.
Metabole complicaties
Naar Samenvatting ›Bij een verminderde nierfunctie kunnen metabole veranderingen optreden.
- De calcium- en de fosfaathuishouding kunnen verstoord raken. In de nieren wordt vitamine D omgezet in zijn actieve vorm (1,25-dihydroxycholecalciferol). Onder invloed van actief vitamine D wordt in de darm calcium opgenomen. Als bij een verminderde nierfunctie het serumcalciumgehalte daalt, is dit een stimulans voor de bijschildklieren om het parathormoon (PTH) uit te scheiden. Op zijn beurt stimuleert PTH de osteoclasten in het bot, waardoor calcium en fosfaat uit het bot worden gemobiliseerd. Dit laatste veroorzaakt uiteindelijk renale osteodystrofie.
- Bij een eGFR < 30 ml/min/1,73 m2 kunnen ontstaan:
- een normocytaire anemie (door een verminderde erytropoëtineproductie in de nieren)
- metabole acidose (door een verminderde capaciteit van de nier om zuur uit te scheiden)
- jeuk
- jicht
- Bij een eGFR < 15 ml/min/1,73 m2 kunnen ontstaan:
- gastro-intestinale klachten (misselijkheid en verminderde eetlust) bij een verhoogd ureumgehalte
- tekenen van ondervoeding
- Bij een eGFR < 10 ml/min/1,73 m2 kunnen ontstaan:
- verschijnselen van overvulling
- hyperkaliëmie
- een verhoogde bloedingsneiging
- vermoeidheid
- een verhoogde vatbaarheid voor infecties
- pericarditis
- polyneuropathie
- slaapstoornissen
- mentale veranderingen
Nierfunctie
Naar Samenvatting ›- In de dagelijkse praktijk wordt met de nierfunctie de glomerulaire filtratiesnelheid (GFR) bedoeld, als maat voor de hoeveelheid functionerend nierweefsel. Afname van de glomerulaire filtratiesnelheid gaat gepaard met een afname van de (creatinine)klaring en/of een stijging van het serumcreatininegehalte.
- De nierfunctie wordt geschat door een berekening van de glomerulaire filtratiesnelheid aan de hand van het serumcreatininegehalte, de leeftijd en het geslacht. We bevelen aan hiervoor de CKD-EPI-formule (Chronic Kidney Disease Epidemiology Collaboration) te gebruiken (zie Details). Deze formule schat de nierfunctie voor volwassen patiënten met een gemiddelde spiermassa voor hun lengte, gewicht, geslacht en leeftijd, bij een min of meer stabiele nierfunctie. De geschatte nierfunctie – e(stimated) GFR – is dus een schatting naar leeftijd bij personen met een normaal postuur.
- Bij grote afwijkingen van de spiermassa en het lichaamsoppervlak kan er sprake zijn van een over- dan wel onderschatting van de nierfunctie, die relevant kan zijn voor bijvoorbeeld de dosering van medicatie.
- Bij patiënten met te weinig spiermassa, bijvoorbeeld als gevolg van spieratrofie (bij bedlegerigheid, rolstoelgebruik, bepaalde spierziekten en anorexie) of amputatie, wordt de GFR overschat.
- Bij patiënten met spierhypertrofie (bijvoorbeeld bij bodybuilders en zware spierarbeid ) wordt de GFR onderschat. Verder kan de nierfunctie onderschat worden door een ‘vals’ verhoogd serumcreatininegehalte bij gebruik van bepaalde geneesmiddelen (cimetidine, trimethoprim en cotrimoxazol).
- Deze verstorende factoren inzake over- en onderschatting kunnen niet tot in detail gekwantificeerd worden.
- Bepaling van de nierfunctie kent ook een variatie als gevolg van biologische variatie en als gevolg van de meting zelf. Bij afname van de eGFR met meer dan 15% ten opzichte van de voorafgaande waarde bij een (verder stabiele) patiënt is deze toe te schrijven aan een achteruitgang van de nierfunctie (zie Details).
- De CKD-EPI-formule is bij een GFR > 90 ml/min/1,73 m2 minder betrouwbaar (een dergelijke eGFR wordt daarom soms vermeld als > 90 ml/min/1,73 m2).
In de dagelijkse praktijk wordt met de nierfunctie de glomerulaire filtratiesnelheid (GFR) bedoeld, als maat voor de hoeveelheid functionerend nierweefsel. De gouden standaard voor het meten van de GFR is het berekenen van de klaring van een stof die ongehinderd het glomerulaire filter passeert en niet in de niertubulus wordt teruggeresorbeerd of uitgescheiden. Voorbeelden van deze stoffen zijn inuline, iothalamaat en DTPA. GFR-metingen met deze stoffen zijn tijdrovend en kostbaar. In de dagelijkse praktijk wordt daarom voor de schatting van de GFR gebruikgemaakt van het serum- of plasmacreatininegehalte. In deze standaard wordt consequent alleen de term serumcreatinine gehanteerd. Creatinine is een afbraakproduct uit het spiermetabolisme. Het passeert ongehinderd de glomerulaire filter en wordt niet gereabsorbeerd in de niertubuli, maar wordt wel gedeeltelijk actief uitgescheiden door de proximale niertubuli.
De productie van creatinine is vrij constant en vooral afhankelijk van de spiermassa, die per patiënt varieert. Daarom is de productie afhankelijk van geslacht, leeftijd en lichaamsbouw.
De LTA Chronische nierschade adviseerde de MDRD-formule te gebruiken voor het schatten van de GFR. De later gepubliceerde CKD-EPI-formule is nauwkeuriger dan de MDRD-formule om de GFR te schatten en is sterker geassocieerd met renale en cardiovasculaire uitkomsten dan de MDRD-formule. Internationale richtlijnen adviseren daarom het gebruik van de CKD-EPI-formule, waarbij creatinine selectief wordt bepaald, om de GFR te schatten. Anno 2018 hebben veel Nederlandse laboratoria voor klinische chemie de MDRD-formule vervangen door de CKD-EPI-formule. Het gebruik van de methode van Jaffé om de creatinineconcentratie te bepalen wordt afgeraden.
Bij een eGFR tot 60 ml/min/1,73 m2 kan er enkele ml/min/1,73 m2 verschil liggen tussen de eGFR-uitslagen berekend met de CKD-EPI-formule en die met de MDRD-formule. Bij een hogere eGFR (die bij gebruik van de MDRD vaak niet kwantitatief werd weergegeven) kan dit verschil aanzienlijk groter zijn. Dit kan een knelpunt geven bij het volgen van de patiënt in de tijd. De werkgroep is echter van mening dat beide waarden in de praktijk wel met elkaar vergeleken kunnen worden.
De data van onder meer Van den Brand et al. laten zien dat de CKD-EPI-vergelijking een ander leeftijdsafhankelijk beloop met zich meebrengt, met hogere eGFR-waarden in de jongere leeftijdsgroep (tot 70 jaar) en lagere eGFR-waarden bij ouderen (> 70 jaar). Op populatieniveau ontstaan hogere schattingen van de nierfunctie; in de klinische praktijk met overwegend ouderen is het tegenovergestelde het geval.
Serumcreatinine is de eerste keuze voor het evalueren van de nierfunctie in ieder klinisch-chemisch laboratorium in Nederland. Dankzij uitgebreide standaardisatie-inspanningen op nationaal en internationaal niveau ligt zelfs de interlaboratoriumvariabiliteit in Nederland ver onder de 10%. Belangrijke verbetering in de creatinine-assay was destijds de IDMS-standaardisatie. Als resultaat van voortdurende verbeteringen in de creatinine-assays, zijn nu methoden beschikbaar waarmee selectief creatinine kan worden gemeten, met een hoge reproduceerbaarheid en kleine variatie. Op basis van de lage analytische (< 2%) en biologische variabiliteit (4 tot 7%), is de creatininemeting op dit moment de geschiktste test om de nierfunctie te beoordelen. Door de hoge reproduceerbaarheid en lage variabiliteit is de serumcreatininetest geschikt om minimale veranderingen te detecteren gedurende de behandeling, om de nierfunctie te bewaken na niertransplantatie of na het toedienen van contrastmiddel, en om eventuele ziekteprogressie te monitoren.
Het laboratorium hanteert brede referentiewaarden voor het serumcreatininegehalte en de eGFR. Om te bepalen of een verandering tussen twee metingen van de nierfunctie klinisch relevant is, is het belangrijk om te weten in hoeverre er sprake kan zijn van een toevallige verandering van de meting als gevolg van analytische en biologische variatie. Op basis van een analytische en biologische variatie van respectievelijk 2 en 5% (zie boven), wordt een betekenisvol (oftewel kritisch) verschil met 95% zekerheid gedetecteerd (Z-waarde 1,96, betekenisvol verschil (%) = 1,96 * √(2) * √((CVa)2 + (CVw)2) ) als de twee opeenvolgende creatininemetingen minimaal 15% verschillen, bijvoorbeeld als een uitslag van 100 µmol/L tot minstens 115 µmol/L toeneemt of een uitslag van 150 µmol/L tot minstens 173 µmol/L. Bij een eGFR van maximaal 90 ml/min/1,73 m2 (bij ouderen > 65 jaar maximaal 60 ml/min/1,73 m2) kan ook voor de eGFR (CKD-EPI) in principe een kritisch verschil van 15% worden gehanteerd. Zo leidt een toename in creatinine van 150 naar 173 µmol/L (+ 15%) bij een vrouw van 55 jaar tot een afname van de eGFR (CKD-EPI) van 33 naar 28 ml/min/1,73 m2, oftewel - 15%. Bij zeer hoge creatininewaarden (> 250 µmol/L) is sprake van een (zeer) lage eGFR en heeft een procentuele toename van creatinine nog slechts een klein effect op de eGFR; in die situatie kan voor de eGFR niet worden uitgegaan van het genoemde kritisch verschil van 15%.
Richtlijnen diagnostiek
Naar Samenvatting ›- Een verminderde nierfunctie of verhoogde albuminurie kan in de huisartsenpraktijk gevonden worden bij:
- patiënten met diabetes mellitus
- patiënten bij wie het cardiovasculaire risicoprofiel opgesteld wordt of die gecontroleerd worden in het kader van cardiovasculair risicomanagement
- patiënten bij wie bij oriënterend onderzoek de nierfunctie of albuminurie bepaald is
- patiënten ≥ 70 jaar bij wie medicatie wordt voorgeschreven waarbij de nierfunctie van belang is
- De diagnostiek is erop gericht om op grond van anamnese, lichamelijk onderzoek en aanvullend (laboratorium)onderzoek na te gaan of er sprake is van chronische nierschade, wat de oorzaak hiervan is en welk beleid aangewezen is.
Anamnese
Naar Samenvatting ›Ga door anamnese en in het dossier na:
- bij nierfunctievermindering of er sprake is van:
- een eventuele over- of onderschatting van de eGFR (te weinig spiermassa of spierhypertrofie)
- eerdere bepalingen van de nierfunctie en het eventuele beloop – een significante daling (> 15%) van de nierfunctie in korte tijd kan wijzen op acute nierschade
- bij verhoogde albuminurie of er sprake is van een niet-nefrogene oorzaak: contaminatie van de urine (met bloed of fluor), koorts, urineweginfectie, ontregelde diabetes mellitus, manifest hartfalen, zware lichamelijke inspanning, recentelijk doorgemaakt epileptisch insult
- (aanwijzingen voor) mogelijk etiologische factoren:
- diabetes mellitus en/of een verhoogde bloeddruk
- een bekende nierziekte, recidiverende pyelonefritis en vesico-ureterale reflux, nefrectomie of een auto-immuunziekte in de voorgeschiedenis (zie Details)
- familiaire nierziekten (bijvoorbeeld de ziekte van Alport, cystenieren) (zie Details Etiologie en prognose)
- medicatiegebruik dat mogelijk nierschade geeft of de nierfunctie kan verminderen (bijvoorbeeld NSAID’s en RAS-remmers)
- dehydratie
Vraag voor het opstellen van het cardiovasculaire risicoprofiel (indien dit nog niet bekend is) naar leefstijlfactoren en de familieanamnese (conform de NHG-Standaard Cardiovasculair risicomanagement).
De belangrijkste auto-immuunziekten die tevens een nierziekte (glomerulonefritis) veroorzaken zijn: systemische lupus erythematodes, reumatische ziekten (mixed connective tissue disease, reumatoïde artritis, de ziekte van Sjögren en sclerodermie) en cryoglobulinemie.
Lichamelijk onderzoek
Naar Samenvatting ›- Meet de bloeddruk (indien niet recentelijk bepaald).
- Meet de lengte en bepaal het gewicht (indien niet onlangs bepaald) om de body mass index (BMI) te berekenen.
Aanvullend onderzoek
Naar Samenvatting ›Vraag het volgende laboratoriumonderzoek aan (zie stroomschema).
- Hernieuwde bepaling van de eGFR en/of de albumine-creatinineratio in de (1e) ochtendurine binnen 1 week (ter uitsluiting van acute nierschade) indien het een 1e bepaling betrof of indien de waarde duidelijk afwijkend is ten opzichte van eerder laboratoriumonderzoek (zie Details en Begrippen). Overweeg directe verwijzing naar de internist-nefroloog bij een eGFR < 30 ml/min/1,73 m2, vooral bij een zieke patiënt.
- Hernieuwde bepaling van de eGFR en de albumine-creatinineratio in de (1e) ochtendurine na 3 maanden (ter bevestiging van de diagnose chronische nierschade).
- Bij vermoeden van een niet-nefrogene oorzaak van verhoogde albuminurie: vraag op indicatie aanvullend laboratoriumonderzoek aan (bijvoorbeeld nitrietbepaling bij klachten passend bij een urineweginfectie en glucose bij mogelijk ontregelde diabetes mellitus).
Voor de diagnostiek van verhoogde albuminurie gaat de voorkeur uit naar het bepalen van de albumine-creatinineratio boven het bepalen van de albumineconcentratie in de urine, omdat deze een betere diagnostische accuratesse heeft dan bepaling van alleen het albuminegehalte. Omdat de testeigenschappen van de bepaling in de ochtendurine vergelijkbaar zijn met die van de bepaling in 24-uurs urine wordt, op grond van het gemak voor de patiënt, aanbevolen de bepaling in de ochtendurine te verrichten. De albumine-uitscheiding in de urine varieert gedurende de dag en van dag tot dag. Een eenmalige vaststelling van verhoogde albuminurie is daarom onvoldoende betrouwbaar.
De stroken die doorgaans in de huisartsenpraktijk worden gebruikt, zijn onvoldoende nauwkeurig en worden daarom niet geadviseerd. Zij worden pas bij ernstig verhoogde albuminurie positief. Er bestaan ook teststroken die veel lagere concentraties albumine meten (vanaf 10 à 20 mg/l). Ook deze teststroken worden niet geadviseerd: zij geven slechts semikwantitatieve resultaten en zijn gevoelig voor interferenties en onpraktisch, omdat ze koel moeten worden bewaard, enkele uren voor gebruik uit de koelkast moeten worden gehaald en tijdsafhankelijk moeten worden afgelezen.
Overig aanvullend onderzoek
Naar Samenvatting ›Urinesediment
Naar Samenvatting ›- Overweeg beoordeling van het urinesediment op (dysmorfe) erytrocyten en/of celcilinders bij:
- patiënten die niet bekend zijn met hypertensie en/of diabetes mellitus
- aanwijzingen voor een specifieke nierziekte
- Verwijs de patiënt hiervoor naar het laboratorium (de beoordeling van het sediment is niet eenvoudig).
- Voor het beoordelen bevelen we een 2e ochtendurine aan (met een verblijfsduur van circa 2 tot 4 uur in de blaas). Houd er bij verwijzing naar het laboratorium rekening mee dat de urine zo snel mogelijk na productie (maar bij voorkeur binnen 1 uur) beoordeeld dient te worden. Op perifere bloedafnamelocaties is dit meestal niet mogelijk.
- Dysmorfe erytrocyten en celcilinders in het urinesediment wijzen op een specifieke nierziekte. Verwijs de patiënt in dit geval naar de internist-nefroloog.
Lipidenspectrum en glucose
Naar Samenvatting ›Bij patiënten die niet bekend zijn met hypertensie en/of diabetes mellitus: vraag aanvullend het lipidenspectrum en het glucosegehalte aan om het cardiovasculaire risico te bepalen. Uit praktische overwegingen bevelen we aan dit gelijktijdig met herhaling van de eGFR en de albumine-creatinineratio te doen.
Schatting van de nierfunctie op basis van cystatine C
Naar Samenvatting ›- Bij patiënten met een eGFR tussen 45 en 60 ml/min/1,73 m2 en zonder andere tekenen van chronische nierschade, diabetes mellitus of hypertensie kan schatting van de nierfunctie op basis van cystatine C overwogen worden om de diagnose chronische nierschade met meer zekerheid te bevestigen of te verwerpen. Er is namelijk geen verhoogd risico op overlijden, hart- en vaatziekten en eindstadium nierfalen bij mensen met een normale eGFR, geschat op basis van cystatine C (zie Details). Dit is het geval bij 1/3 van de mensen met een eGFR 45-60 ml/min/1,73 m2, geschat op basis van het serumcreatininegehalte.
- De cystatine C-bepaling is niet overal beschikbaar. Bepaling van de creatinineklaring in 24 uursurine is in dit geval een alternatief (zie Details). Ook kan een internist-nefroloog geconsulteerd worden over het verdere diagnostische beleid (bijvoorbeeld met teleconsultatie) (zie Details).
Cystatine C is een eiwit dat door alle kernhoudende cellen wordt geproduceerd (in tegenstelling tot creatinine, dat alleen door spiercellen wordt geproduceerd). Dit eiwit wordt ongehinderd glomerulair gefiltreerd en vervolgens tubulair teruggeresorbeerd en aldaar volledig afgebroken. In tegenstelling tot creatinine vindt er geen tubulaire secretie van cystatine C plaats. Een schatting van de nierfunctie op basis van cystatine C (eGFRcys) is in meerdere studies vergeleken met een schatting van de nierfunctie op basis van creatinine (eGFRcreat) bij mensen met een eGFR < creat 60 ml/min/1,73 m2. De groep mensen waarbij zowel de eG-FRcreat als de eGFRcys < 60 ml/min/1,73 m2 is (bij circa twee derde van de groep), heeft een verhoogd risico op overlijden, hart- en vaatziekten en eindstadium nierfalen in vergelijking met personen met een eGFRcreat > 60 ml/min/1,73 m2. De internationale KDIGO-richtlijn voor chronische nierschade beschouwt in deze groep de diagnose chronische nierschade als bevestigd. Echter, de groep waarbij de eGFRcreat < 60 ml/min/1,73 m2maar de eGFRcys> 60 ml/min/1,73 m2 was, heeft een vergelijkbaar risico als de groep personen met een eGFRcreat > 60 ml/min/1,73 m2. De KDIGO-richtlijn stelt dat deze groep mensen geen chronische nierschade heeft, ervan uitgaand dat er geen andere tekenen van nierschade zijn, zoals verhoogde albuminurie. Dit geldt ook voor de nieuw ontwikkelde CKD-EPI eGFRcreat-cys.
De CKD-EPI-formule, die gebruikmaakt van cystatine C, is in principe gelijkwaardig aan de CKD-EPI-formule met behulp van creatinine, en mogelijk accurater bij patiënten met een afwijkende spiermassa. De formule die gebruikmaakt van zowel creatinine als cystatine C is accurater dan de aparte formules. Verdere verbetering van de schattingsformules is een wens voor de toekomst; deze vereist onder meer een statistische vergelijking van eGFR’s met de werkelijke gemeten GFR.
Anno 2018 zijn er in Nederland slechts enkele laboratoria die de cystatine-C-bepaling uitvoeren. De overige laboratoria kunnen wel de bepaling door een van deze laboratoria laten uitvoeren. In dit geval kan het enkele weken duren voor de uitslag binnen is. Spreek regionaal af hoe dit praktisch in te richten.
Een 24-uurs urineverzameling kent veel praktische bezwaren. Veel patiënten ervaren het als belastend om de urine te verzamelen en eventuele verzamelfouten geven aanleiding tot foutief (fors) afwijkende uitslagen.
Bovendien moet er bij de interpretatie van de 24-uurs creatinineklaring rekening gehouden worden met de tubulaire secretie van creatinine. Hierdoor is deze bepaling niet alleen een maat voor de glomerulaire filtratiesnelheid, maar ook voor de additionele tubulaire secretie van creatinine. Dit betekent dat de klaring van creatinine bij 24-uurs urinebepaling circa 15% hoger ligt dan de glomerulaire filtratiesnelheid; bij een lagere filtratiesnelheid neemt de tubulaire creatinine secretie disproportioneel toe en kan de klaring zelfs bijna twee keer zo hoog uitvallen als de GFR. Tevens is de eenheid waarin de eGFR wordt uitgedrukt anders dan die van de creatinineklaring. De eenheid van eGFR is ml/min/1,73 m2, terwijl de eenheid van de 24-uurs creatinineklaring ml/ min is. Beide maten kunnen dus niet een-op-een vergeleken worden, ook niet als er al gecorrigeerd is voor de tubulaire secretie. Om een vergelijking te maken moet de creatinineklaring ook uitgedrukt worden per 1,73 m2 (creatinine klaring*[1,73/daadwerkelijke BSA])
Uitgangsvraag
Wanneer is inzet van teleconsultatie aangewezen?
Methode
Om deze uitgangsvraag te beantwoorden is gebruikgemaakt van inhoudelijke expertise in de richtlijnwerkgroep, waarbij achtergrondartikelen als basis zijn gebruikt, gericht op consensus.
Overwegingen
De werkgroep is van mening dat gedeelde zorg tussen eerste en tweede lijn kan bijdragen aan tijdige verwijzing van patiënten met een verhoogd risico. Ook kunnen patiënten voor wie verwijzing niet strikt noodzakelijk is op deze manier profiteren van de tweedelijns expertise. Bij telenefrologie (een webbased consultatiesysteem) kunnen huisartsen laagdrempelig een internist-nefroloog consulteren over een patiënt met chronische nierschade. Hierbij worden patiëntengegevens uitgewisseld op basis waarvan de internist-nefroloog een advies kan formuleren. In een Nederlands observationeel prospectief onderzoek is dit geëvalueerd, waarin 122 consulten zijn betrokken. Indien er geen telenefrologie beschikbaar zou zijn, zou de huisarts 35% van deze patiënten verwijzen, terwijl de internist-nefroloog dit maar bij 14% nodig achtte. De huisarts zou 65% van de patiënten zelf hebben behandeld, terwijl de internist-nefroloog verwijzing nuttig vond bij 8%. Een effect op het aantal verwijzingen is niet aangetoond. Tevredenheid van deelnemende professionals lijkt positief, maar een belangrijke voorwaarde voor implementatie is eenvoudige toepasbaarheid, waarbij ten minste de beschikking bestaat over een elektronisch patiëntendossier met uitwisselmogelijkheid.
Ander onderzoek laat zien dat het aanbieden van specifieke tools aan huisartsen en nefrologen om het herkennen van patiënten met chronische nierschade, de communicatie en gedeelde zorg te faciliteren, de zorg voor deze groep patiënten kan verbeteren. Consultatie van de nefroloog gebaseerd op risico lijkt een effectieve manier om de zorg voor patiënten met chronische nierschade in de eerste lijn te verbeteren en efficiënt gebruik te maken van nefrologische expertise.
Het inzetten van telenefrologie gaat gepaard met kosten (bijvoorbeeld voor gestructureerde data-uitwisseling), die het eigen risico van de patiënt belasten. De kosten van een verwijzing zijn echter veel hoger en kunnen ook consequenties hebben voor het eigen risico van de patiënt.
Er zijn overigens landelijk verschillende initiatieven voor overleg tussen huisarts en internist-nefroloog, waarvan teleconsultatie slechts één vorm is.
Aanbeveling
Voordat teleconsultatie wordt uitgevoerd, is toestemming van de patiënt vereist, mede gezien de potentiële belasting van het eigen risico.
Point-of-care-creatininebepaling
Naar Samenvatting ›Point-of-care-creatininebepaling door de huisarts wordt niet aanbevolen vanwege de beperkte diagnostische accuratesse (zie Details).
Er is weinig goed onderzoek naar de diagnostische accuratesse van point-of-care creatininebepalingen voor het opsporen van chronische nierschade bij patiënten met onbekende nierfunctie, om patiënten te identificeren bij wie de medicatie vanwege een afwijkende nier-functie moet worden aangepast. Point-of-care bepalingen kunnen bijvoorbeeld nuttig zijn als spoed vereist is en de voorschrijver niet bereikbaar is voor overleg. Indien in een dergelijke uitzonderingssituatie toch gebruik wordt gemaakt van point-of-care testing, dient zo snel mogelijk confirmatie van de nierfunctie via de voorschrijver op de gebruikelijke wijze plaats te vinden. Vooralsnog is onvoldoende bekend in hoeverre de creatinine-uitslagen verkregen met de momenteel toegepaste point-of-care bepalingen uitwisselbaar zijn met die van IDMS-traceerbare laboratoriumbepalingen. Het is van belang dat de eGFR zodanig betrouwbaar wordt bepaald dat met voldoende zekerheid wordt vastgesteld of de voorgeschreven medicatie in een gegeven dosering veilig kan worden verstrekt aan een patiënt met een verlaagde nierfunctie. Het is zinvol om de prestaties van point-of-care apparatuur systematisch in kaart te brengen; daarbij zal naar verwachting van de werkgroep verbetering van de analytische prestaties een aanzienlijke impact hebben op de klinische bruikbaarheid van point-of-care bepalingen.
Voor achtergrondinformatie wordt verwezen naar de richtlijn Point of Care Testing (POCT) in de huisartsenzorg.
Aanbeveling
Vanwege de beperkte diagnostische accuratesse wordt point-of-care creatininebepaling, met als doel afwijkende nierfuncties op te sporen waarbij de medicatie moet worden aangepast, niet aanbevolen. Indien in uitzonderingssituaties toch gebruik wordt gemaakt van point-of-care creatininebepaling, dient zo snel mogelijk confirmatie van de nierfunctie via de voorschrijver op de gebruikelijke wijze plaats te vinden.
Achtergrond
Uitgangsvraag
Wat is de betrouwbaarheid van een point-of-care creatininebepaling? Wat is er bekend over de toegevoegde waarde in het diagnostisch of begeleidingsproces?
Methode
Om een antwoord te vinden op deze uitgangsvraag is op 8 februari 2016 gezocht naar literatuur in PubMed. Dit leverde 61 abstracts op, die niet goed bleken aan te sluiten bij de uitgangsvraag. Daarom is de search verbreed en is op 17 februari 2016 opnieuw gezocht in PubMed. Dit leverde 104 abstracts op. Deze abstracts zijn geselecteerd op onderwerp (sluit het artikel aan bij de uitgangsvraag en komt de onderzoekspopulatie enigszins overeen met de doelgroep van deze richtlijn) en onderzoeksopzet (geen narratief onderzoek of case reports). Dit selectieproces resulteerde in 7 artikelen, die volledig zijn beoordeeld.
Resultaten
Geerts et al. onderzochten de haalbaarheid van point-of-care creatininetesten in openbare apotheken om de medicamenteuze behandeling van ambulante oudere patiënten te controleren. In dit onderzoek werden 3 openbare apotheken en 5 huisartsenpraktijken in 2 Nederlandse steden geincludeerd. Alle patiënten ≥ 70 jaar die medicatie voor diabetes mellitus en/of cardiovasculaire aandoeningen gebruikten die door de nieren geklaard worden, werden geïdentificeerd. Patiënten bij wie de nierfunctie niet bekend was, konden geïncludeerd worden in de studie. Creatininemeting werd gedaan in bloed dat via een vingerprik was verkregen, met i-STAT apparatuur. De eGFR werd geschat met de MDRD-formule. Als de eGFR binnen 10% van de aanpassingsdrempelwaarde voor een bepaald medicament was, werd de patiënt gevraagd na een week opnieuw een bepaling te laten doen. De medicatie werd beoordeeld in relatie tot de bepaalde nierfunctie, waarbij er een alertmelding volgde als de eGFR onder de medicatiespecifieke drempelwaarde kwam. Dit werd beoordeeld door de apotheker en zo nodig werd het behandelplan in overleg met de huisarts aangepast. Patiënten, huisartsen en apothekers beoordeelden de haalbaarheid van het onderzoek met behulp van een vragenlijst. Aan het onderzoek namen 44 patiënten deel (uit een totale groep van 338 patiënten). Van deze groep kwamen 24 patiënten in aanmerking voor medicatie-aanpassing vanwege de gevonden verminderde nierfunctie. Bij 3 patiënten was een hertest na een week nodig. Patiënten, huisartsen en apothekers bleken over het algemeen tevreden over de haalbaarheid, waarbij huisartsen de efficiëntie wat lager waardeerden. De auteurs concluderen dat point-of-care testing bij oudere patiënten in openbare apotheken haalbaar en acceptabel is, maar dat voor goede diagnostiek goed getraind personeel en supervisie van een klinisch chemisch laboratorium noodzakelijk is.
Shephard et al. onderzochten de testeigenschappen van een point-of-care creatininetest voor de screening op chronische nierschade, waarbij werd vergeleken met een enzymatische creatininebepaling.
In dit onderzoek werden 63 patiënten die een nierkliniek of dialysecentrum bezochten en 37 gezonde vrijwilligers geïncludeerd. De point-of-care bepaling werd gedaan in 1,2µl capillair bloed, waarbij een tweevoudige bepaling werd gedaan. De creatininewaarden (bepaald met referentiemethode) varieerden van 46 tot 962 µmol/l. De waarden bepaald met de point-of-care test lagen gemiddeld genomen lager (gemiddeld verschil 47,3 µmol/l). Bij 7 van de 53 patiënten die met de referentietest een eGFR < 60 ml/min/1,73 m2 hadden, werd die als fout-negatief (dus > 60 ml/min/1,73 m2) getest met de point-of-care test. Er waren geen fout-positieve resultaten. De beide point-of-care bepalingen bleken relatief veel te variëren (-35 tot 34 µmol/l). De auteurs concluderen dat verbetering van de testeigenschappen noodzakelijk is.
Kosack et al. voerden een prospectieve patiënt-controle-evaluatie uit van de diagnostische accuratesse van een point-of-care creatininetest vergeleken met een referentiestandaard in een klinisch chemisch laboratorium van een Nederlands ziekenhuis. In het onderzoek zijn geen patiëntendata opgenomen, zodat interpretatie van de verkregen data niet goed mogelijk is. De auteurs vinden goede overeenkomsten tussen de point-of-care test en de referentietest, behalve bij hoge creatininewaarden. De creatinineklaring kon niet berekend worden vanwege gebrek aan patiëntengegevens.
Avila et al. onderzochten diverse eigenschappen van een microchip voor eenmalig gebruik als point-of-care creatininebepaling voor de diagnose van nierziekten. In dit onderzoek is echter niet de diagnostische accuratesse ten opzichte van een referentietest (gouden standaard) beschreven. Hierbij werden samples van poliklinische patiënten, medewerkers en dialysepatiënten bestudeerd.
Lomakin et al. publiceerden een systematische review over de testeigenschappen van een point-of-care creatininebepaling om patiënten at risk voor contrastnefropathie te herkennen. In deze review werden 13 studies opgenomen met in totaal 3.185 patiënten. Bij de meeste van deze studies was de uiteindelijke prevalentie van nierschade (eGFR < 60 ml/min/1,73 m2) niet vermeld. Vanwege heterogeniteit was er geen pooling van de gevonden data. De sensitiviteit en specificiteit konden in slechts 4 studies bepaald worden. De sensitiviteit varieerde tussen 16 en 97%; de specificiteit tussen 84 en 100%. De correlatie tussen point-of-care metingen en referentiestandaarden was slechter bij lagere nierfunctie. De studies van Haneder et al. en Morita et al. waren geïncludeerd in de review van Lomakin en worden hier daarom niet nader besproken. Voor wat betreft de interpretatie van deze studies moet aangegeven worden dat deze studies bij een andere populatie gedaan zijn (bijvoorbeeld patiënten met verdenking maligniteit) dan de patiënten die voor deze richtlijn relevant zijn. De testeigenschappen kunnen daardoor variëren.
Conclusies
De huidige point-of-care creatininebepalingen halen niet de diagnostische accuratesse die nodig is voor het opsporen van patiënten met chronische nierschade.
Opsporing van metabole complicaties
Naar Samenvatting ›- Laboratoriumonderzoek ter opsporing van metabole complicaties van chronische nierschade bevelen we niet meer aan, omdat de prevalentie van metabole complicaties met therapeutische consequenties bij een eGFR > 30 ml/min/1,73 m2 laag is. Uitzondering hierop zijn patiënten die ondanks een verwijsindicatie bij de huisarts onder controle zijn (zie paragraaf Controle). Bepaal in dit geval het serumfosfaat-, kalium-, calcium- en hemoglobinegehalte.
- We bevelen de bepaling van het parathormoon niet meer standaard aan (zie Details).
De LTA Chronische nierschade beval aan in het kader van preventie van metabole complicaties naast de genoemde bepalingen tevens het parathormoon (PTH) te bepalen. Het is echter niet goed bekend wat de optimale waarde voor het PTH-gehalte is bij patiënten met chronische nierschade en een sterk verhoogd risico. Bovendien is er geen bewijs voor de effectiviteit van behandeling van PTH door middel van (actief) vitamine D op verlaging van het risico op metabole complicaties. Jaarlijkse bepaling van het PTH en behandeling met actief vitamine D (alfacalcidol of calcitriol) bij een verhoogd PTH wordt daarom in de huisartsenpraktijk niet meer aanbevolen. Suppletie van ‘gewoon’ vitamine D (colecalciferol) conform de adviezen van de Gezondheidsraad (onder andere alle vrouwen ≥ 50 jaar, mannen ≥ 70 jaar en bewoners van verpleeg- of verzorgingshuizen) kan natuurlijk wel aangewezen zijn.
Echografie
Naar Samenvatting ›- Verricht echografie van de nieren en urinewegen bij vermoeden van (zie Details):
- een retentieblaas
- hydronefrose bij nefrolithiasis
- cystenieren (bijvoorbeeld bij een positieve familieanamnese)
- Licht patiënten met cystenieren voorafgaand aan echografie voor dat een eventuele diagnose mogelijk consequenties kan hebben voor het afsluiten van verzekeringen.
De huisarts kan bij positieve familieanamnese van cystenieren in eigen beheer echografie aanvragen. Bij personen van 40 jaar en ouder kunnen cystenieren worden uitgesloten indien er geen of een cyste wordt gevonden (negatief voorspellende waarde 100%). Bij personen van 30 tot 39 jaar kunnen cysten worden uitgesloten indien er geen cysten worden gevonden (percentage fout-negatieve uitslagen 2%). Bij personen jonger dan 30 jaar kunnen cystenieren niet met zekerheid worden uitgesloten met echografie. Zie tabel 10 voor de testeigenschappen voor het aantonen van cystenieren.
Patiënten die bekend zijn met cystenieren ervaren problemen met het afsluiten van bijvoorbeeld een levensverzekering of hypotheek.
| Leeftijd (jaren) | Criteria | Sensitiviteit | Specificiteit | PVW |
|---|---|---|---|---|
| 15 - 29 | 3 uni- of laterale cysten | 82% | 100% | 100% |
| 30 - 39 | 3 uni- of laterale cysten | 96% | 100% | 100% |
| 40-59 | ≥ 2 cysten in beide nieren | 90% | 100% | 100% |
| > 60 | ≥ 4 cysten in beide nieren | 100% | 100% | 100% |
Evaluatie
Naar Samenvatting ›Evalueer de uitkomsten van de diagnostiek. Er zijn 3 mogelijke uitkomsten.
- Er is sprake van acute nierschade. Verwijs bij een abrupte nierfunctiedaling met spoed naar de internist-nefroloog (zie Begrippen) (zie Details Aanvullend onderzoek).
- Er is geen sprake van chronische nierschade. De verminderde nierfunctie en/of de verhoogde albuminurie is/zijn het gevolg van een verstorende factor (over- of onderschatting eGFR of niet-nefrogene oorzaak van de verhoogde albuminurie). Overleg bij twijfel (bijvoorbeeld bij een sterk afwijkende spiermassa of een sterk afwijkend lichaamsoppervlak) met de internist-nefroloog in hoeverre de verstorende factor de afwijkende waarde kan verklaren.
- Er is sprake van chronische nierschade bij een verminderde nierfunctie en/of verhoogde albuminurie en/of specifieke sedimentafwijkingen die gedurende ten minste 3 maanden aanwezig zijn.
Wanneer er sprake is van chronische nierschade:
- Bepaal het stadium van de eGFR en de albuminurie aan de hand van tabel 1 (zie Details). Er zijn 6 stadia van de nierfunctie en 3 stadia van albuminurie. Verwijs patiënten met een ernstig verhoogde albuminurie naar de internist-nefroloog.
- De stadia van de eGFR en albuminurie bepalen gezamenlijk het risico op cardiovasculaire schade, progressie van nierschade en mortaliteit. Dit risico telt 3 categorieën: mild (geel), matig (oranje) of sterk (rood) verhoogd. Bepaal het risico en verwijs patiënten met een sterk verhoogd risico (rood in tabel 1).
- Evalueer oorzaken van de chronische nierschade, zoals diabetes mellitus of hypertensie, of medicatie. Overweeg teleconsultatie met de internist-nefroloog bij onvoldoende duidelijkheid over de oorzaak, bijvoorbeeld wanneer deze niet bekend is of de mate van nierschade niet correspondeert met de ernst van de onderliggende aandoening. Verwijs bij vermoeden van een specifieke nierziekte.
- Evalueer het beloop van de nierschade als er eerdere laboratoriumwaarden beschikbaar zijn. Verwijs bij progressie van chronische nierschade (zie Begrippen).
- Bij patiënten met een beperkte levensverwachting en/of bij uitgebreide comorbiditeit is een afweging van voor- en nadelen van een strikte (medicamenteuze) behandeling noodzakelijk. Zo kan bijvoorbeeld voor patiënten met een levensverwachting < 10 jaar en voor patiënten met een laag cardiovasculair risico een minder strikt beleid worden nagestreefd. Maak deze afweging samen met de patiënt. Het kan betekenen dat ervoor gekozen wordt de patiënt, ondanks een verwijsindicatie, toch onder controle van de huisarts te houden. Bij een verminderde nierfunctie is medicatiebewaking wel altijd aangewezen.
In de multidisciplinaire richtlijn Chronische nierschade is een iets uitgebreidere tabel met stadia van chronische nierschade opgenomen dan in de volledige tekst van deze standaard.
De kleurcodering in tabel 11 is gebaseerd op het relatieve risico op overlijden, cardiovasculaire eindpunten, het optreden van acute nierschade en eindstadium nierfalen. De percentages in de legenda bij de kleurcoderingen geven de prevalentie in de algemene bevolking weer (zoals gevonden in het PREVEND-onderzoek).
Richtlijnen beleid
Naar Samenvatting ›- De behandeling van chronische nierschade is erop gericht het verhoogde risico op cardiovasculaire morbiditeit/mortaliteit te verminderen en progressie van nierschade te voorkómen of beperken.
- De huisarts kan een groot deel van de patiënten zelf begeleiden. Dit betreft in elk geval de patiënten met een:
- eGFR ≥ 30 ml/min/1,73 m2 in combinatie met normale albuminurie
- eGFR ≥ 45 ml/min/1,73 m2 in combinatie met matig verhoogde albuminurie
- Bepaal het beleid aan de hand van:
- de risicocategorie
- de oorzaak en het beloop van de chronische nierschade
- factoren als leeftijd en comorbiditeit
- Een afweging van voor- en nadelen van strikte (medicamenteuze) behandeling is noodzakelijk, vooral bij patiënten met een beperkte levensverwachting en/of uitgebreide comorbiditeit. Maak deze afweging samen met de patiënt.
- Behandel in voorkomende gevallen desgewenst zelf patiënten met een sterk verhoogd risico (rood in tabel 1) die wegens een beperkte levensverwachting en/of uitgebreide comorbiditeit niet naar de internist-nefroloog verwezen zijn. Bij deze patiënten ligt de nadruk op het signaleren en ‒ meestal in overleg met de internist-nefroloog ‒ medicamenteus behandelen van metabole complicaties (zie paragraaf Controle).
- Voor een samenvatting van het beleid naar risicocategorie, zie bijlage 1.
Voorlichting
Naar Samenvatting ›Licht voor over (zie Details):
- de aard en het normale beloop van chronische nierschade
- het verhoogde cardiovasculaire risico
- het belang van een gezonde leefstijl (zie Leefstijladviezen)
- geneesmiddelen die nierschade veroorzaken, met speciale aandacht voor zelfzorgmiddelen (zoals NSAID’s)
- het belang van dosisaanpassing bij bekende en nieuwe medicatie en bij dreigende dehydratie
- het doorgeven van de nierfunctie door de arts aan de apotheker
- de rol die de patiënt zelf heeft om ervoor te zorgen dat diens zorgverleners op de hoogte zijn van de nierfunctie
- de jaarlijkse influenzavaccinatie
- controleafspraken (en de eventuele rol van de praktijkondersteuner en apotheker)
Uitgangsvraag
Hoe moeten patiënten worden voorgelicht over chronische nierschade en gevolgen daarvan voor het medicatiegebruik?
Methode
Voor de beantwoording van deze vraag heeft de werkgroep zich gebaseerd op eigen ervaringen en groepsdiscussie, gericht op consensus. Hierbij is gebruikgemaakt van bestaand voorlichtingsmateriaal.
Overwegingen
De werkgroep vindt het belangrijk dat patiënten de juiste informatie krijgen over nieuwe medicatie en medicatie die nierschade veroorzaakt. Voorlichtingsmateriaal moet goed op elkaar afgestemd zijn. Voorlichtingsmateriaal is beschikbaar op www.thuisarts.nl en www.apotheek.nl. Ook de Nierstichting/ Nierpatiënten Vereniging Nederland beschikt over actuele voorlichtingsfolders.
Het is wettelijk verplicht dat de zorgverlener die een recept uitschrijft bij een patiënt met chronische nierschade op het recept een eGFR-waarde vermeld bij een eGFR-waarde < 50 ml/min/1,73 m2.
Aanbeveling
Patiënten dienen ten minste geïnformeerd te worden over:
- medicatie (nieuwe medicatie en medicijnen die nierschade veroorzaken, met speciale aandacht voor vrij verkrijgbare medicijnen (zoals NSAID’s)), en wanneer dosisaanpassing nodig is (bijvoorbeeld bij vermindering van de nierfunctie en dreigende dehydratie);
- wettelijke verplichting van de arts om de nierfunctie aan de apotheker door te geven, en de rol die de patiënt zelf heeft om ervoor te zorgen dat zijn zorgverleners op de hoogte zijn van de nierfunctie van de patiënt.
Thuisarts
Naar Samenvatting ›Verwijs naar de informatie over chronische nierschade op thuisarts.nl, die is gebaseerd op deze NHG-Standaard. Verwijs daarnaast desgewenst patiënten met chronische nierschade voor ondersteuning bij problemen in het dagelijks leven naar de Nierpatiënten Vereniging Nederland (www.nvn.nl).
Zelfmanagement
Naar Samenvatting ›- De behandeling van chronische nierschade valt vaak binnen de geprotocolleerde zorg voor patiënten met diabetes mellitus en/of een verhoogd cardiovasculair risico. Binnen deze programma’s is er veel aandacht voor zelfmanagement. Voor patiënten met chronische nierschade kan bij deze programma’s worden aangesloten (zie Details).
- Belangrijke elementen van zelfmanagement zijn:
- patiëntgerichtheid
- gezamenlijke besluitvorming over de aanpak
- een coachende rol van de huisarts
- een individueel zorgplan
- Bij patiënten met chronische nierschade zijn leefstijlaspecten een belangrijk onderdeel van de behandeling (zie ook Leefstijladviezen, hierna). Maak desgewenst gebruik van de Praktijkhandleiding Leefstijlbegeleiding om de patiënt hierbij te ondersteunen.
- Daarnaast kunnen afspraken worden gemaakt over zelfzorgmiddelen (onder andere: geen NSAID’s, maar paracetamol bij pijn) en het beleid bij dreigende dehydratie. Huisarts en patiënt kunnen afspreken dat de patiënt zelfstandig tijdelijk de medicatie vermindert of stopt in geval van braken en/of diarree.
Uitgangsvraag
Op welke wijze kan zelfmanagement bij patiënten met chronische nierschade worden gestimuleerd?
Methode
Voor de beantwoording van deze vraag is uitgegaan van de Generieke module Zelfmanagement en de Praktijkhandleiding Leefstijlbegeleiding, waarbij is gekeken in hoeverre deze toepasbaar is voor patiënten met chronische nierschade, en in hoeverre aanvullende aanbevelingen nodig zijn. Daarbij is ook achtergrondinformatie uit een NIVEL-rapport gebruikt.
Overwegingen
Mensen met chronische ziekten hebben zelf een belangrijke rol in het dagelijks omgaan met hun ziekte(n), bijvoorbeeld door medicijnen te gebruiken, zelf hun bloedwaarden en bloeddruk te controleren en gezond te leven. Maar ook door samen met hun zorgverleners te bepalen welke behandeling het beste bij hen past of hoe ze de benodigde ondersteuning kunnen organiseren. Vaak moeten zij ook leren omgaan met de onzekerheid die het leven met een chronische ziekte met zich meebrengt en de gevolgen ervan voor hun sociaal en maatschappelijk leven. Dit alles bij elkaar wordt zelfmanagement of eigen regie genoemd.
Het is belangrijk daarbij extra alert te zijn bij mensen met chronische nierschade. Uit Nederlands onderzoek bij mensen met een eGFR tussen 20 en 45 ml/min/1,73 m2 bleek dat zij vaak al fysieke, sociale, maatschappelijke en psychologische klachten ervaren. Daaronder vallen met name vermoeidheid, de worsteling met de erkenning van hun klachten, problemen met het werk en de wens om hun ziekte te controleren. Over het algemeen ervaren deze mensen echter ook dat zorgverleners hun klachten en problemen niet voldoende serieus nemen.
Hoge verwachtingen over het resultaat van zelfmanagement kunnen maar gedeeltelijk worden ingelost. Er is bewijs voor betere gezondheidsuitkomsten bij ondersteuning van zelfmanagement bij patiënten met diabetes mellitus, astma, COPD en hart- en vaatziekten. Met name interventies gericht op gedragsverandering laten hierbij een positief effect zien. Bij patiënten met hartfalen, astma of diabetes mellitus kan meer zelfmanagement de zorgconsumptie verminderen. Er is echter geen eenduidig bewijs voor de effectiviteit van zelfmanagement op de ervaren kwaliteit van zorg en de kwaliteit van leven. Dit is beperkt onderzocht. Er kan op basis van de huidige evidence geen uitspraak worden gedaan over de kosteneffectiviteit van zelfmanagement in het algemeen. De effecten van zelfmanagement specifiek bij patiënten met chronische nierschade zijn niet onderzocht.
Om te komen tot een goed besluit rond zelfmanagement, bijvoorbeeld het wel of niet aanpassen van de leefstijl of het aanpakken van ervaren knelpunten in werk, studie of gezin, is gedeelde besluitvorming (shared decision making) een belangrijk uitgangspunt. Op deze manier wordt de patiënt actief betrokken bij diens eigen rol in de behandeling.
Het driefasenmodel van Elwyn geeft daarbij een praktisch kader: het moet voor de patiënt allereerst duidelijk zijn dat er een keuze is, waarna de verschillende mogelijkheden, inclusief voor- en nadelen, aan de patiënt moeten worden uitgelegd. Vervolgens wordt nagegaan of de keuze haalbaar en toepasbaar is in het dagelijks leven. In overleg met de behandelaar kan de patiënt dan tot een besluit komen over het beleid. Indien een patiënt besluit tot aanpassing van het beleid, is het belangrijk daarbij na te gaan of professionele begeleiding gewenst is.
Volgens de module zelfmanagement, een multidisciplinair ontwikkelde module die tot doel heeft zelfmanagement van mensen met een chronische aandoening te versterken door te beschrijven hoe dit binnen de zorgverlening ondersteund kan worden, kan zelfmanagement bij patiënten ondersteund worden door (5 A’s):
- achterhalen: vraag de patiënt om ervaringen en behoeften te noemen;
- adviseren: verklaar deze ervaringen en behoeften en geef informatie op maat;
- afspreken: help bij het stellen van haalbare doelen en neem gezamenlijk besluiten;
- assisteren: help bij persoonlijke barrières en ga na of er behoefte is aan extra ondersteuning;
- arrangeren: maak samen een specifiek plan voor (vervolg)ondersteuning.
Patiënten hebben vaardigheden nodig om te kunnen participeren in zelfmanagement:
- probleemoplossend vermogen
- besluitvaardigheid
- inzet van hulpbronnen (bijvoorbeeld lotgenoten-/patiëntenverenigingen, informatiebronnen op internet en gemeentelijke voorzieningen)
- vormgeven aan de relatie met de zorgverlener (samenwerkingsrelatie)
- actievaardigheid
- self tailoring (gedrag aanpassen en flexibel inzetten vaardigheden)
Een integraal zorgplan kan faciliterend werken voor het zelfmanagement door de patiënt.
De Nierpatiënten Vereniging Nederland (NVN) geeft advies over problemen die patienten met chronische nierschade in het dagelijks leven tegenkomen.
De NVN doet dat op haar website, in brochures en met behulp van sociaal raadslieden die telefonisch vragen beantwoorden. Zij kunnen patiënten ook doorverwijzen naar andere instanties. Zelfmanagement kan bij patiënten met chronische nierschade concreet gemaakt worden door advies te geven over het hanteren van medicatie bij dreigende dehydratie.
Aanbevelingen
De werkgroep adviseert bij patiënten met chronische nierschade gebruik te maken van de Zorgmodule Zelfmanagement voor ondersteuning van de patiënt bij zelfmanagement om het optreden van hart- en vaatziekten en progressief nierfunctieverlies te voorkomen.
Pas gedeelde besluitvorming toe wanneer een besluit moet worden genomen over het toepassen van zelfmanagement bij patiënten met chronische nierschade. Gebruik hiervoor bijvoorbeeld het driefasenmodel van Elwyn, of drie goede vragen om tot een gezamenlijk besluit van zorgverlener(s) met de patiënt te komen.
Wanneer het besluit is genomen tot bijvoorbeeld het aanpassen van de leefstijl, hanteer dan de vijf A’s om de patiënt met chronische nierschade te ondersteunen bij het uitvoeren van die aanpassingen of verwijs eventueel door naar andere professionele hulpverleners.
Daarnaast kunnen afspraken worden gemaakt over het beleid bij dreigende dehydratie. Arts en patiënt kunnen afspreken dat de patiënt zelfstandig tijdelijk medicatie vermindert of stopt in geval van braken en/of diarree. Daarnaast kunnen afspraken gemaakt worden over zelfzorgmiddelen (bijvoorbeeld pijnstilling).Wees er alert op dat patiënten met een eGFR lager dan 45 ml/min/1,73 m2 vaak al fysieke, sociale, maatschappelijke en psychologische klachten ervaren.
Niet-medicamenteuze behandeling
Naar Samenvatting ›Leefstijladviezen
Naar Samenvatting ›- Stimuleer om:
- een gezond lichaamsgewicht na te streven (≤ 70 jaar: BMI 20-25 kg/m2 en > 70 jaar: BMI 22-28 kg/m2)
- lichamelijke inspanning te leveren in overeenstemming met adviezen uit de Nederlandse Norm Gezond Bewegen (NNGB)
- met roken te stoppen
- de zoutinname te beperken tot maximaal 6 gram (keukenzout (NaCl)) per dag (zie Details)
- Zie hiervoor ook de Praktijkhandleiding Leefstijlbegeleiding.
- Het advies over een beperkte zoutinname bestaat uit:
- geen zout toevoegen bij de voedselbereiding
- het gebruik van industrieel bereide voedingsmiddelen beperken of vermijden
- Bij patiënten die bij de huisarts onder controle zijn, is een eiwitbeperkt dieet niet geïndiceerd (zie Details).
- Overweeg in geval van therapieresistente hypertensie en/of gebruik van een RAS-remmer te verwijzen naar een diëtist voor evaluatie en beperking van de zoutinname. RAS-remmers zijn minder effectief bij hoge zoutinname.
Uitgangsvraag
Is er bewijs om bij patiënten met chronische nierschade een gezonde leefstijl na te streven, dat wil zeggen een gezond lichaamsgewicht, voldoende lichamelijke inspanning, stoppen met roken en zout te beperken, om progressie van chronische nierschade te voorkomen?
Methode
Voor een antwoord op deze vragen is op 8 februari 2016 systematisch naar literatuur gezocht in PubMed. Dit leverde 82 abstracts op. Aanvullend is gezocht naar literatuur over stoppen met roken bij patiënten met chronische nierschade op 19 februari 2016. Dit leverde 42 abstracts op. Deze abstracts zijn op onderwerp (sluit het artikel aan bij de uitgangsvraag?) en op onderzoeksopzet (systematische reviews) geselecteerd, wat resulteerde in 16 artikelen, die volledig zijn beoordeeld. De evidence is volgens de principes van de GRADE-methodiek beoordeeld.
Resultaten
Gewichtsverlies (dieet en fysieke inspanning)
Van Huffel et al. publiceerden in 2014 een systematische review over dieetbeperkingen en inspanning voor patiënten met diabetes mellitus en chronische nierschade.
In deze studie werden RCT’s en observationele onderzoeken opgenomen met diverse interventies (bijvoorbeeld 500 kcal reductie in calorieëninname, driemaal per week 45 minuten training) bij patiënten met diabetes mellitus en chronische nierschade stadium 3 tot 5. De geïncludeerde studies waren van lage tot matige kwaliteit (bijvoorbeeld door gebrek aan blindering en onduidelijkheden in randomisatie) en vanwege heterogene populaties en interventies was meta-analyse van de resultaten niet mogelijk. De systematische review kon op basis van de gegevens uit de individuele studies geen uitspraak doen over de relatie tussen gewichtsverlies en/of lichamelijke inspanning en mortaliteit en/of cardiovasculaire events. Een aantal van de geïncludeerde studies geven wel resultaten op het gebied van nierfunctie. Zo wordt in één van de geïncludeerde studies (Morales et al., 2003, in Huffel, 2014) onder 30 patiënten met een BMI > 27 kg/m2 een verschil van 11 ml/ min/1,73 m2 in eGFR gevonden tussen de interventie- en controlegroep, waarbij de interventiegroep een dieet volgde met 500 kcal reductie gedurende 5 maanden (p < 0,05). De BMI was na deze interventie gemiddeld 31,6 kg/m2 in de interventie- en 35 kg/m2 in de controlegroep (p < 0,05). Een hypocalorisch dieet (1410 kcal) gedurende 12 maanden werd prospectief onderzocht bij 24 patiënten met chronische nierschade, diabetes mellitus en obesitas, waarbij de eGFR met 12 ml/min/1,73 m2 (p = 0,01) verbeterde en de BMI met 7,3 kg/ m2 afnam.
De auteurs geven hierbij aan dat dit waarschijnlijk te verklaren is door verminderde eiwitintake en spierafbraak. Een laatste onderzoek bestudeerde het effect van viermaal per week een laagcalorisch dieet (740 tot 940 kcal) bij patiënten met diabetische nefropathie met overgewicht (BMI gemiddeld 30,4 kg/m2), waarbij geen significant resultaat op de nierfunctie werd gevonden.
De duur van de interventie is hierbij niet weergegeven. De BMI van deze patiënten nam met gemiddeld 2,2 kg/m2 af.
Bolignano et al. publiceerden in 2013 een systematische review over het effect van gewichtsvermindering op de nierfunctie bij obese patiënten met chronische nierschade.
In deze systematische review werden 31 randomized controlled trials en observationele onderzoeken geïncludeerd, gericht op gewichtsvermindering, door middel van dieet, inspanning, medicatie en bariatrische chirurgie. Ook in deze systematische review konden geen data gepoold worden in een meta-analyse en ook hier waren de geïncludeerde studies van lage tot matige kwaliteit. Ten opzichte van de review van Van Huffel et al. zijn aanvullende resultaten te melden. In een prospectief onderzoek onder 37 obese patiënten met chronische nierschade liet een dieet van 4 weken met 500 kcal vermindering een significante reductie van ernstig verhoogde albuminurie (p < 0,001) en albuminurie (p = 0,01) zien in de groep patiënten met diabetes mellitus (n = 24); de grootte van het effect en de aanwezigheid van gewichtsverlies zijn niet weergegeven.
In een ander prospectief onderzoek onder 17 vrouwen met matig verhoogde albuminurie en obesitas resulteerde een interventie van drie maanden met dieet en inspanning bij 8/17 vrouwen in normale albuminurie.
Effect op de eGFR werd niet gevonden; de BMI nam significant af (grootte van het effect niet vermeld). Een derde prospectief onderzoek onder 63 obese patiënten met ernstig verhoogde albuminurie evalueerde het effect van 24 maanden dieet met 500 kcal reductie en aerobe inspanning gedurende 3 keer per week (Shen et al., 2010 in Bolignano, 2013).
Na 6 maanden werd 35% reductie van ernstig verhoogde albuminurie en 8,3% reductie van de BMI gezien en na 24 maanden 51 respectievelijk 9,2% (p < 0,00001). Een RCT onder 13 patiënten met chronische nierschade stadium 2 tot 4 en obesitas en diabetes mellitus liet geen verschil in eGFR en lichaamsgewicht zien bij vergelijking van 18 weken driemaal per week aerobe training met standaardzorg of met de situatie voor de training.
De systematische review van Sah et al. bleek geen uitspraken te doen over renale en cardiovasculaire uitkomsten als effect van fysieke inspanning door patiënten met chronische nierschade.
Datzelfde geldt voor de systematische review van Heiwe et al., die zich met name richt op inspanningsvermogen, en die van Barcellos et al., die weliswaar als secundaire uitkomst kijkt naar progressie van chronische nierschade, maar hier eigenlijk geen uitspraak over doet.
De review van Painter et al. ten slotte bleek een narratieve in plaats van een systematische review te zijn.
Deze artikelen zijn daarom niet verder geanalyseerd.
Stoppen met roken
Elihimas et al. onderzochten de relatie tussen roken en chronische nierschade in een systematische review.
In deze review zijn 5 patiënt-controleonderzoeken en 7 cohortonderzoeken geïncludeerd. Zes van de geïncludeerde studies laten een relatie zien tussen roken en progressie van chronische nierschade. Vijf van de geïncludeerde studies laten een dosis-effectrelatie zien tussen roken en de progressie van chronische nierschade. In de review zijn geen studies opgenomen die het effect van stoppen met roken bij patiënten met nierschade evalueren.
Clase beschreef de evidence rondom diverse medicamenteuze en leefstijlinterventies bij patiënten met chronische nierschade.
Uit deze systematische review blijkt dat er geen RCT’s zijn die het effect van stoppen met roken bij patiënten met chronische nierschade onderzocht hebben.
Johnson komt in een systematische review in 2004 tot dezelfde conclusie, maar beschrijft wel een patiënt-controleonderzoek dat laat zien dat (huidig) roken een onafhankelijke risicofactor is voor ernstig verhoogde albuminurie en afname van de nierfunctie (Bleyer et al., 2000, in Johnson, 2004).
Uit dezelfde studie bleek dat ex-rokers dit verhoogde risico niet hadden, wat suggereert dat stoppen met roken geassocieerd zou zijn met een verminderd risico op progressie van nierschade. Uit een andere studie in deze review kwam naar voren dat stoppen met roken geassocieerd is met een vermindering van albumine-excretie en progressie van nierschade bij patiënten met diabetes mellitus.
Zoutbeperking
In 2015 verscheen een Cochrane-review over gewijzigde zoutinname bij patiënten met chronische nierschade. In deze goed opgezette systemati- sche review werden 8 RCT’s geïncludeerd. De onderliggende studies waren van wis- selende kwaliteit, vanwege bijvoorbeeld problemen met randomisatie en blindering. Ook was er sprake van heterogeni- teit in populatie en interventies en waren de studies vaak van relatief korte duur. In de review zijn diverse (vooraf vastgestel- de) uitkomstmaten bestudeerd; voor deze richtlijn is met name gekeken naar de eGFR en endogene creatinineklaring op basis van de 24-uurs urine. De resultaten, bij een beperkt aantal patiënten, zijn weergegeven in figuur 1 en figuur 2.
Beide vergelijkingen laten geen statistisch significant effect zien. In de review zijn geen gepoolde resultaten opgenomen voor wat betreft vermindering van albuminurie, maar de auteurs beschrijven dat de geïncludeerde studies reductie van albuminurie laten zien bij zoutrestrictie.
Het onderzoek van Ash et al., een systematische review over voedingsadviezen bij patiënten met chronische nierschade, rapporteerde geen effecten van zoutrestrictie op renale uitkomstmaten.
Conclusies (niveau van bewijs: laag)
Gewichtsverlies (door dieet of fysieke inspanning) is niet aantoonbaar van invloed op de nierfunctie.
Roken leidt waarschijnlijk tot progressie van de nierschade. Het staat echter niet evident vast dat stoppen met roken de nierfunctie van patiënten met chronische nierschade verbetert.
Zoutbeperking leidt waarschijnlijk niet tot een verbetering van de nierfunctie, maar mogelijk wel tot vermindering van de mate van albuminurie.
Van bewijs naar aanbeveling
De kwaliteit van het bewijs is laag tot matig en de effecten zijn niet bewezen of beperkt. Toch zijn er goede argumenten die pleiten voor een gezonde leefstijl, bijvoorbeeld met betrekking tot algeheel welbevinden, cardiovasculaire en pulmonale effecten. Ook lijkt roken te zijn geassocieerd met progressie van nierschade.
Aanbeveling
Patiënten met chronische nierschade moeten worden gestimuleerd om:
- een gezond lichaamsgewicht na te streven (BMI 18,5 tot 24,9 kg/m2)
- lichamelijke inspanning te leveren in overeenstemming met de adviezen vanuit de Norm Gezond Bewegen
- te stoppen met roken
- zoutinname te beperken tot maximaal 6 gram (keukenzout (natriumchloride)) per dag
Voor specifieke voedingsadviezen wordt verwezen naar de richtlijnen goede voeding van de Gezondheidsraad.
Uitgangsvraag
Eiwitbeperking van 0,8 g/kg ideaal lichaamsgewicht per dag wordt geadviseerd bij een eGFR < 30 ml/min/1,73 m2. Moet een dergelijke dieetinterventie niet al geadviseerd worden aan patiënten met chronische nierschade met een eGFR ≥ 30 ml/min/1,73 m2, met name indien zij ook verhoogde albuminurie hebben?
Methode
Voor een antwoord op deze vraag is op 12 februari 2016 naar literatuur gezocht in Medline. Dit leverde (ontdubbeld) 133 abstracts op. Deze abstracts zijn op onderwerp (sluit het artikel aan bij de uitgangsvraag?) en onderzoeksopzet (systematische reviews) geselecteerd, wat resulteerde in 5 artikelen, die volledig zijn beoordeeld. Na beoordeling door experts in de werkgroep werd een extra systematische review toegevoegd. Deze review was niet eerder geselecteerd, vanwege de beschikbaarheid van recentere reviews, maar bleek toch belangrijke informatie over patiëntrelevante uitkomsten te bevatten.
Resultaten
Het artikel van Kopple bleek bij bestudering van de volledige tekst in plaats van het abstract geen origineel onderzoek te beschrijven, maar een editorial te zijn en is daarom alsnog geëxcludeerd.
Het artikel van Kaysen et al. bleek bij bestudering van de volledige tekst in plaats van het abstract een narratieve in plaats van systematische review te beschrijven en is daarom alsnog geëxcludeerd.
Rughooputh et al. publiceerden een systematische review van RCT’s, inclusief meta-analyse, over het effect van eiwitbeperking op de nierfunctie (eGFR) bij patiënten met chronische nierschade.
In deze review werden trials geïncludeerd met een studieduur van 12 maanden (om permanente wijzigingen in de eGFR te kunnen aantonen). Inclusie van trials liep tot september 2014. De literatuursearch voor deze richtlijn leverde geen aanvullende trials op na die publicatiedatum. In de review werden 14 RCT’s geïncludeerd, gepubliceerd tussen 1989 en 2013, met in totaal 1965 patiënten. De systematische review, inclusief meta-analyse, is goed uitgevoerd; in de onderliggende studies is enig risico op bias geconstateerd met name ten aanzien van allocation concealment, maar het totale risico op bias wordt laag geschat.
In de review is een subgroepanalyse gemaakt voor patiënten met een eGFR ≥ 60 ml/min/1,73 m2 (gebaseerd op de gemiddelde baseline eGFR van de studie). In deze subgroepanalyse werden de resultaten van 8 studies, met in totaal 618 patiënten, betrokken. De geplande eiwitinname in de interventiegroepen bedroeg hierbij over het algemeen 0,6 tot 0,8 g/kg/dag en in de controlegroepen 1,0 tot 1,2 g/kg/dag. De werkelijke eiwitinname (gemeten met urine-analyse) bedroeg in de interventiegroepen 0,8 tot 1,1 g/kg/dag en in de controlegroepen 1,0 tot 1,1 g/kg/dag. Er werd een effect van lage eiwitinname op de eGFR gevonden van -0,35 ml/min/1,73 m2 per jaar. Het 95%-BI was -1,40 tot 0,70; dit effect was niet statistisch significant. Voor de ontwikkeling van deze richtlijn werd een nieuwe meta-analyse gedaan van de studies met een gemiddelde baseline eGFR tussen 30 en 60 ml/ min/1,73 m2. Hierin werden 4 studies uit de review van Rughooputh et al. geincludeerd, met in totaal 789 patiënten. De geplande eiwitintake in de interventiegroepen bedroeg hierbij over het algemeen 0,6 tot 0,8 g/kg/dag en in de controlegroepen 1,0 tot 1,3 g/kg/dag. De werkelijke eiwitinname (gemeten met urine-analyse) bedroeg in de interventiegroepen 0,7 tot 0,9 g/kg/dag en in de controlegroepen 1,1 tot 1,5 g/kg/dag. Bij patiënten met een gemiddelde baseline eGFR tussen 30 en 60 ml/min/1,73 m2 was de achteruitgang in nierfunctie in de groep met verlaagde eiwitinname 1,43 ml/min/1,73 m2 per jaar gunstiger dan in de groep met normale eiwitinname (gedurende follow-up van 12 tot 35 maanden). Het 95%-BI liep van -3,09 tot 0,23; het verschil was niet statistisch significant (figuur 3). In de meta-analyse geïncludeerde studies van Zeller et al. en de beide studies van Meloni et al. hadden de patiënten naast een verlaagde nierfunctie ook ernstig verhoogde albumine-excretie (gemiddeld respectievelijk 3625, 2500 en 1999 mg/24 uur). In de studie van Klahr et al. staat dit niet vermeld. Exclusie van de studie van Klahr uit de meta-analyse levert een gemiddeld verschil op tussen verlaagde en normale eiwitinname van 1,93 ml/ min/1,73 m2 (95%-BI -4,09 tot 0,22; niet significant).
Ook werd een nieuwe meta-analyse uitgevoerd, waarbij beide groepen zijn gecombineerd. Bij patiënten met een gemiddelde baseline eGFR ≥ 30 ml/ min/1,73 m2 was de achteruitgang in nierfunctie in de groep met verlaagde eiwitinname 0,95 ml/min/1,73 m2 per jaar gunstiger dan in de groep met normale eiwitinname (gedurende follow-up van 12 tot 60 maanden). Het 95%-BI liep van -2,12 tot 0,22; het verschil was niet statistisch significant (figuur 4).
Nezu et al. voerden eveneens een systematische review, met meta-analyse, uit over het effect van een dieet met weinig eiwit op de nierfunctie bij patiënten met diabetische nefropathie.
De geïncludeerde RCT’s vertonen grote overeenkomsten met die van Rughooputh et al., waarbij studies onder patiënten zonder diabetische nefropathie uiteraard niet zijn geïncludeerd, en een viertal studies met een looptijd van 3 tot 6 maanden wel. De auteurs van deze studie vonden een statistisch significant resultaat van een eiwitbeperkt dieet op de eGFR (gemiddeld verschil 5,82; 95%-BI 2,30 tot 9,33). Het verschil met de studie van Rughooputh is geheel te verklaren door de inclusie van de studies met een looptijd korter dan 1 jaar. Vanwege het gegeven dat het effect van eiwitbeperking pas consequenties heeft na langdurige toepassing, is besloten de resultaten van het onderzoek van Nezu et al. niet separaat mee te nemen. De Cochrane-review van Robertson et al. over eiwitrestrictie bij patiënten met diabetes mellitus en nierschade bevatte geen andere RCT’s dan die van Nezu et al. en Rughooputh et al. en richtte zich ook niet op andere uitkomstmaten.
Deze review is daarom ook niet verder geanalyseerd.
Met de studies in de review van Nezu et al. is een meta-analyse gedaan voor de subpopulatie van patiënten met een eGFR 30 tot 60 ml/min/1,73 m2 en verhoogde albuminurie. Hierin werden drie studies geïncludeerd met in totaal 90 patiënten. De studieduur varieerde van 4 tot 24 maanden. Als uitkomstmaat werd gekeken naar het effect op ernstig verhoogde albuminurie. Het gestandaardiseerd gemiddeld verschil bedroeg -0,28 (95%-BI -0,71 tot 0,16; niet significant) (zie figuur 5).
Fouque et al. schreven een Cochranereview waarin zij het effect van een eiwitbeperkt dieet op het vertragen van de tijd tot nierfunctievervangende therapie onderzochten.
In deze review includeerden zij 10 studies met in totaal 2000 patiënten, van wie er 1002 een eiwitbeperkt dieet volgden. Patiënten hadden matige tot ernstige nierschade en werden ten minste één jaar gevolgd, waarbij werd gekeken naar eindstadium nierfalen (gedefinieerd als noodzaak tot starten van dialyse, niertransplantatie of mortaliteit). Het relatieve risico op nierfalen was 0,68 (95%-BI 0,55 tot 0,84) bij het volgen van een eiwitbeperkt dieet. De NNT om bij één patiënt nierfalen te voorkomen was 2 tot 56 bij het gedurende een jaar volgen van een eiwitbeperkt dieet. Op basis van de beschikbare data uit de geïncludeerde studies kon hierbij geen onderscheid gemaakt worden in stadia van chronische nierschade, of aanwezigheid van verhoogde albuminurie.
De kwaliteit van het gevonden bewijs is matig, vanwege enige beperkingen in de opzet van de onderliggende onderzoeken (allocation concealment) en omdat de gemiddelde eiwitinname in de interventiegroep van een enkele geïncludeerde studie hoger was dan 0,8 g/kg.
Conclusie (niveau van bewijs: matig)
Meta-analyses over het effect op achteruitgang van nierfunctie laten geen statistisch significant en klinisch relevant voordeel zien van het beperken van de eiwitinname van 0,8 g/kg ideaal lichaamsgewicht per dag bij patiënten met chronische nierschade met eGFR ≥ 30 ml/min/1,73 m2, ook niet bij patiënten met verhoogde albuminurie.
Van bewijs naar aanbeveling
De kwaliteit van het bewijs is matig; voor een deel is dit te wijten aan een wat hogere eiwitinname dan gepland in een interventiegroep. Het is mogelijk dat strikte toepassing van het eiwitbeperkte dieet tot 0,8 g/kg wel tot statistisch significante verschillen zou leiden. Overigens is het dan de vraag of dit statistisch significante verschil ook een klinisch relevant verschil zou betekenen. Naast mogelijke voordelen van een eiwitbeperkt dieet op de nierfunctie en cardiovasculaire of renale eindpunten, gaat deze interventie ook gepaard met nadelen. Het volgen van een strikt eiwitbeperkt dieet vereist waarschijnlijk aanpassingen in het dagelijks leven van de patiënt, ten aanzien van consumptie. Dit kan invloed hebben op de door de patiënt ervaren kwaliteit van leven. Bovendien bestaat bij het volgen van een eiwitbeperkt dieet het gevaar van een slechtere voedingstoestand door te weinig calorieëninname, met name bij oudere patiënten.
Voor begeleiding bij een eiwitbeperkt dieet en het voorkomen van een slechte voedingstoestand is een dieetbehandeling door een diëtist (nierziekten) aangewezen. Daarnaast is eiwitbeperking niet zinvol bij patiënten met een beperkte levensverwachting.
De werkgroep vindt het verstandig een hoge eiwitinname (> 1,3 g/kg ideaal lichaamsgewicht per dag) te vermijden bij patiënten met chronische nierschade.
Aanbeveling
Eiwitbeperking van 0,8 g/kg ideaal lichaamsgewicht per dag wordt niet aanbevolen voor patiënten met chronische nierschade en een eGFR ≥ 30 ml/ min/1,73 m2.
Eiwitbeperking van 0,8 g/kg ideaal lichaamsgewicht per dag wordt, conform eerdere richtlijnen, wel aanbevolen voor patiënten met chronische nierschade en een eGFR < 30 ml/min/1,73 m2.
Beleid bij patiënten met dreigende dehydratie
Naar Samenvatting ›- Instrueer patiënten met chronische nierschade die RAS-remmers, diuretica en/of (ondanks contra-indicatie) NSAID’s gebruiken contact op te nemen met de huisartsenpraktijk in geval van hoge koorts, fors braken of forse diarree.
- Overweeg bij aanwijzingen voor (dreigende) dehydratie controle van de patiënt en aanvullend laboratoriumonderzoek (eGFR, kalium, natrium) (zie Details Etiologie en prognose).
- Overweeg op grond van het klinisch beeld (en eventuele laboratoriumuitslagen) tijdelijk diuretica te staken en de dosering van RAS-remmers te halveren.
- Bij gebruik van NSAID’s: staak deze in elk geval tijdelijk, maar ga ook na of deze geheel gestaakt kunnen worden.
- Bij patiënten met hartfalen kan het staken van RAS-remmers leiden tot afname van de cardiale output. Geadviseerd wordt bij deze patiënten tijdelijk de dosering van diuretica en RAS-remmers te halveren.
- Ook voor andere medicatie geldt dat aanpassing van de medicatie aangewezen kan zijn (zie NHG-Standaard Acute diarree). Metformine kan bijvoorbeeld enkele dagen gestaakt worden vanwege het risico op lactaatacidose.
Vaccinatieadviezen
Naar Samenvatting ›- De Gezondheidsraad adviseert influenzavaccinatie voor patiënten met chronische nierschade (nierfalen), analoog aan patiënten met diabetes mellitus en COPD. Hierbij is het nut het grootst bij patiënten met chronische nierschade en een matig of sterk verhoogd risico op mortaliteit en morbiditeit (rood en oranje in tabel 1).
- Conform het advies van de Gezondheidsraad bevelen we pneumokokkenvaccinatie bij patiënten met chronische nierschade niet aan (zie Details).
De evidence voor de effectiviteit van influenzavaccinatie bij patiënten is van zeer lage kwaliteit. De review van Remschmidt et al. richt zich bovendien alleen op patiënten met eindstadium nierfalen, terwijl de doelpopulatie van deze uitgangsvraag alle patiënten met chronische nierschade betreft. Het bewijs voor de effectiviteit van pneumococcenvaccinatie bij kwetsbare patiënten is zelfs afwezig.
Adviezen van de Gezondheidsraad zijn als volgt:
- Bij nierziekten, en ook bij hemodialyse, is pneumokokkenvaccinatie te overwegen. Daarbij wordt aangegeven dat met name het nefrotisch syndroom bij kinderen een extra risico vormt voor infecties en morbiditeit.
- In het advies wordt aangegeven dat infecties een belangrijke rol spelen bij de morbiditeit van patiënten met nierinsufficiëntie, maar dat er slechts één publicatie (opgenomen in een review uit 1998) bestaat waarbij pneumokokken, in 20% van de gevallen, als verwekker van bacteriëmie wordt gemeld.
- Griepvaccins zijn met name van belang voor mensen met een medische risicofactor en ouderen die bij griep een verhoogd risico lopen op complicaties en sterfte. Het gaat om personen van 60 jaar en ouder, patiënten met afwijkingen en functiestoornissen van de luchtwegen en longen, patiënten met een chronische stoornis van de hartfunctie, patiënten met diabetes mellitus, patiënten met chronische nierinsufficiëntie (nierfalen), patiënten die recent een beenmergtransplantatie hebben ondergaan, personen die geïnfecteerd zijn met hiv, kinderen van 6 maanden tot 18 jaar die langdurig salicylaten gebruiken, personen met een verstandelijke handicap die verblijven in intramurale voorzieningen, personen met verminderde weerstand tegen infecties en verpleeghuisbewoners. Voor deze doelgroepen overtuigen de aanwijzingen dat griepvaccinatie gezondheidsschade kan voorkomen of beperken. Aanbieden in het kader van een nationaal programma is bovendien kosteneffectief (bestendiging van het advies uit 2007, bestendiging van het advies uit 1998/1999).
Chronische nierschade (en chronische nierinsufficiëntie (nierfalen)) is niet gespecifieerd (bijvoorbeeld in concretisering van de nierfunctie) in de adviezen van de Gezondheidsraad.
Voor influenzavaccinaties geldt dat veel patiënten die vanwege chronische nierschade in aanmerking zouden komen, hier ook al vanwege een andere indicatie voor in aanmerking zouden komen (bijvoorbeeld op basis van leeftijd en/of diabetes mellitus).
Ondanks het feit dat het KDIGO (eenmalige) pneumokokkenvaccinatie bij patiënten met chronische nierschade en sterk verhoogd risico aanbeveelt, en een snellere revaccinatie bij patiënten met mild verhoogd risico, is de werkgroep van mening dat er momenteel onvoldoende bewijs is om dit standaard voor iedere patiënt in te voeren. Dit kan wel overwogen worden bij patiënten die dialysebehandeling krijgen en andere bepaalde hoogrisicopatiënten (bijvoorbeeld degenen met chronisch longlijden of patiënten die immunosuppressieve medicatie gebruiken, zoals patiënten met een niertransplantaat). Dit valt echter buiten het bestek van de MDR Chronische nierschade. Overigens wordt pneumokokkenvaccinatie sinds 2006 aangeboden via het Rijksvaccinatieprogramma aan kinderen geboren vanaf 1 april 2006.
De Gezondheidsraad adviseert vaccinatie voor mensen met een medische risicofactor en ouderen die bij griep een verhoogd risico lopen op complicaties en sterfte, waaronder mensen > 60 jaar, mensen met COPD, diabetes mellitus en chronische nierschade. De studies naar de effectiviteit van influenzavaccinatie bij patiënten met chronische nierschade zijn van matige kwaliteit, en maken geen onderscheid in het stadium van nierschade. Toch conformeert de werkgroep zich aan het advies van de Gezondheidsraad om patiënten met chronische nierinsufficiëntie (nierfalen) te laten vaccineren, analoog aan patiënten met diabetes mellitus en COPD, waarbij bij patiënten met chronische nierschade en het hoogste risico op mortaliteit en morbiditeit (rood en oranje in tabel 1) het nut mogelijk het grootste zou zijn.
Aanbeveling
Pneumokokkenvaccinatie wordt niet routinematig aanbevolen.
De Gezondheidsraad adviseert influenzavaccinatie voor patiënten met chronische nierschade (nierfalen), analoog aan patiënten met diabetes mellitus en COPD. Hierbij is het nut het grootst bij patiënten met chronische nierschade en een matig of sterk verhoogd risico op mortaliteit en morbiditeit (rood en oranje in tabel 1; eGFR < 45 ml/ min/1,73 m2 en eGFR < 60 ml/min/1,73 m2 in
Achtergrond
Uitgangsvraag
De KDIGO-richtlijn adviseert:
- alle patiënten met chronische nierschade (dus eGFR < 60 ml/min/1,73 m2 en/of albuminurie > 3 mg/mmol) te vaccineren met influenzavaccin.
- alle patiënten met chronische nierschade met een eGFR < 30 ml/ min/1,73 m2 en alle patiënten met chronische nierschade met een hoog risico op een pneumococceninfectie (bijvoorbeeld met een nefrotisch syndroom, diabetes mellitus en patiënten die immuunsuppressieve behandeling krijgen) te vaccineren met polyvalent pneumokokkenvaccin.
Zijn deze adviezen rationeel?
Methode
Voor een antwoord op deze uitgangsvraag is op 8 april 2016 naar literatuur gezocht in Medline. Dit leverde (ontdubbeld) 117 abstracts op. Deze abstracts zijn op onderwerp (sluit het artikel aan bij de uitgangsvraag?) en onderzoeksopzet (systematische reviews, RCT’s, prospectieve cohortonderzoeken) geselecteerd, wat resulteerde in 16 artikelen, die volledig zijn beoordeeld. Als cruciale uitkomstmaten werden benoemd: mortaliteit, cardiovasculaire en renale eindpunten.
Resultaten
Bij bestudering van de artikelen bleken een aantal studies narratieve (en dus geen systematische) reviews te zijn [Abraham 2015, Choudhury 2008, Dalrymple 2008, Grzegorzewska 2015, Mastalerz-Migas 2013 a, Mathew 2014, Principi 2015, Soni 2013]. Deze zijn niet nader meegenomen in de analyse. De artikelen van Mahmoodi et al., Mastalerz-Migas et al. en Watcharananan et al. rapporteerden niet op patiëntrelevante uitkomsten en zijn daarom geëxcludeerd [Mahmoodi 2009, Watcharananan 2014, Mastalerz-Migas 2013b]. Het artikel van Snyder et al. ging over preventieve zorg bij patiënten met chronische nierschade in het algemeen en ging niet specifiek in op het nut van vaccinatie en is geëxcludeerd [Snyder 2009]. Het cohortonderzoek van Wang et al. is opgenomen in de review van Remschmidt et al. en is daarom niet separaat geanalyseerd [Wang 2013]. Voor de beoordeling van de evidence is de GRADE-methodiek gevolgd.
Pneumokokkenvaccinatie
Vandecasteele et al. publiceerden een systematische review over pneumokokkeninfecties en -vaccinaties bij patiënten met chronische nierschade [Vandecasteele 2015]. In de review zijn geen meta-analyses opgenomen, en de resultaten zijn meer in de beschrijvende sfeer opgenomen. De kwaliteit van de review is beperkt, bijvoorbeeld omdat geen kwaliteitsbeoordeling en geen beschrijving van de geïncludeerde studies zijn opgenomen. Er is geen directe evidence voor de effectiviteit en veiligheid van pneumokokkenvaccinatie bij immuungecompromitteerde patiënten met chronische nierschade voorhanden. Circumstantial evidence laat zien dat vaccinatie bij patiënten met verminderde afweer mogelijk minder effectief is. Bij patiënten met een niertransplantatie leek de serologische respons vergelijkbaar met die van de algemene bevolking, al was de titer lager, en het verval van de titer sneller. Bij patiënten met het nefrotisch syndroom zijn alleen data over kinderen beschikbaar, waarbij werd gezien dat vaccinatie veilig was en een goede korte termijn serologische respons liet zien, tenzij immuunmodulerende medicatie werd gebruikt. Er zijn geen goede data over het effect van pneumokokkenvaccinatie op patiëntrelevante uitkomstmaten bij patiënten met eindstadium nierfalen en dialyse. Uit retrospectief onderzoek bleek een hazardratio van 0,84 voor patiënten met een pneumokokkenvaccinatie en van 0,94 voor combinatie van pneumokokken- en influenzavaccinatie wanneer gekeken werd naar overleving gedurende een tot twee jaar (significantie niet vermeld). Op basis hiervan mag echter geen causale relatie worden verondersteld. In andere onderzoeken werd wel een serologische respons gezien na pneumokokkenvaccinatie bij patiënten met eindstadium nierfalen.
Influenzavaccinatie
Remschmidt et al. voerden een systematische review uit over het effect van influenzavaccinatie bij dialysepatiënten [Remschmidt 2014]. Zij includeerden vijf cohortonderzoeken met in totaal 174.663 patiënten, waarbij werd gekeken naar bijvoorbeeld mortaliteit, ziekenhuisopnames, IC-opnames en cardiovasculaire sterfte. De kwaliteit van de review is goed, maar de kwaliteit van de geïncludeerde studies is zeer laag, vanwege de observationele opzet en bijvoorbeeld problemen met ontbreken van data en confounding. De mortaliteit in het influenzaseizoen was lager in de gevaccineerde groepen (gecorrigeerde OR 0,68; 95%-BI 0,41 tot 0,59), net als het aantal ziekenhuisopnames vanwege influenza of pneumonie gedurende het influenzaseizoen (gecorrigeerde OR 0,86; 95%-BI 0,80 tot 0,93). Ook de cardiovasculaire sterfte (gecorrigeerde OR 0,84; 95%-BI 0,71 tot 0,98) en het aantal opnames op de IC (gecorrigeerde OR 0,19; 95%-BI 0,14 tot 0,27) waren lager in de gevaccineerde groep. Er waren geen statistisch significante verschillen tussen de gevaccineerde en niet-gevaccineerde groepen wanneer gekeken werd naar mortaliteit vanwege een infectie, ziekenhuisopnames, ziekenhuisopnames vanwege sepsis en ziekenhuisopnames vanwege een respiratoire infectie. De auteurs concluderen dat de evidence voor effectiviteit van influenzavaccinatie beperkt en van zeer lage kwaliteit is en dat er geen data zijn over de veiligheid van vaccinatie. Chen et al. onderzochten in een cohortonderzoek de relatie tussen influenzavaccinatie en het optreden van een acuut coronair syndroom bij patiënten met chronische nierschade in Taiwan [Chen 2016]. In dit onderzoek werden patiënten van 55 jaar en ouder zonder cardiovasculaire aandoeningen geïncludeerd. De follow-up varieerde van 12 maanden tot 10 jaar. Er werden 2206 gevaccineerde en 2200 niet-gevaccineerde patiënten geïncludeerd. De gevaccineerde groep was gemiddeld ouder en de niet-gevaccineerde groep had vaker comorbiditeit, zoals diabetes mellitus en hypertensie. Ziekenhuisopname vanwege acuut coronair syndroom was lager in de gevaccineerde groep (gecorrigeerde HR 0,35; 95%-BI 0,30 tot 0,42). Er was een relatie tussen het aantal vaccinaties en minder optreden van ziekenhuisopname vanwege acuut coronair syndroom.
Conclusies (niveau van bewijs: zeer laag)
De effectiviteit van pneumokokkenvaccinatie bij kwetsbare patiënten met chronische nierschade op patiëntrelevante uitkomstmaten is niet bekend [Vandecasteele 2015].
Influenzavaccinatie is mogelijk effectief bij patiënten met chronische nierschade in het voorkomen van ziekenhuisopnames en mortaliteit vanwege cardiovasculaire events, maar bewijs van goede kwaliteit voor deze associatie ontbreekt [Remschmidt 2014, Chen 2016].
Medicamenteuze behandeling
Naar Samenvatting ›Zie kader Medicatiebewaking voor de medicatiebewaking bij patiënten met chronische nierschade.
Kader Medicatiebewaking
Naar Samenvatting ›Medicatiebewaking bij patiënten met chronische nierschade
- Bij het voorschrijven van voornamelijk door de nier geklaarde geneesmiddelen aan patiënten met een verminderde nierfunctie is minder geneesmiddel nodig om een werkzame spiegel te bereiken. Om (ernstige) toxiciteit te voorkomen moeten daarom bij het voorschrijven van een aantal geneesmiddelen de (start)dosering en/of het doseerinterval aangepast worden (bijvoorbeeld bij lithium, metformine, digoxine, sotalol, amoxicilline/clavulaanzuur, rosuvastatine en allopurinol).
- Bij geneesmiddelen die toxisch voor de nieren zijn, kan een acute verslechtering van de nierfunctie ontstaan. De kans op acute nierschade is veel groter bij een verminderde nierfunctie. Deze geneesmiddelen zijn daarom gecontra-indiceerd (bijvoorbeeld NSAID’s).
- Sinds 1 augustus 2013 zijn voorschrijvers wettelijk verplicht een bekende afwijkende nierfunctie (< 50 ml/min/1,73 m2) door te geven aan de apotheker van de patiënt. De apotheker dient deze gegevens te betrekken bij de medicatiebewaking (zie Details).
- De doseringsadviezen bij een verminderde nierfunctie in het HIS zijn ingedeeld in categorieën, waarbij de afkapwaarde voor de medicatiebewaking bij een GFR van 50 ml/min. Om praktische redenen is er in deze standaard voor gekozen te adviseren om al bij een eGFR < 60 ml/min/1,73 m2 de medicatiebewaking te activeren (zie Details).
- Verricht bij het voorschrijven in het kader van de medicatiebewaking daarom de volgende acties.
- Maak bij het vaststellen van chronische nierschade met een eGFR < 60 ml/min/1,73 m2 een ICPC-code aan voor nierinsufficiëntie en activeer de medicatiebewaking in het HIS.
- Pas zo nodig de dosering aan van bekende en nieuwe medicatie op grond van de adviezen in het HIS. Overleg zo nodig met de internist-nefroloog en/of apotheker.
- Geef bij het voorschrijven van medicatie de actuele eGFR door aan de apotheker in verband met medicatiebewaking en de mogelijke noodzaak tot aanpassing van medicatie. Geef aan als er naar verwachting sprake is van een substantiële over- of onderschatting van de nierfunctie op basis van sterk afwijkende spiermassa. Overleg zo nodig met de apotheker of dit consequenties heeft voor de voorgeschreven medicatie.
- Bij het voorschrijven of gebruik van medicatie die de nierfunctie negatief kan beïnvloeden, geldt:
- heroverweeg de noodzaak tot gebruik en overleg daarover eventueel met de internist-nefroloog en/of apotheker
- voorkom het gebruik van nefrotoxische medicatie, zoals NSAID’s
Medicatiebewaking bij ouderen bij wie geen (recente) nierfunctie bekend is
- Bepaal de nierfunctie bij patiënten > 70 jaar bij wie de nierfunctie onbekend is of langer dan 1 jaar geleden bepaald is én:
- bij wie medicatie wordt voorgeschreven die bij een verminderde nierfunctie gecontra-indiceerd is of aanpassing behoeft, óf
- bij wie medicatie wordt voorgeschreven waarvan bekend is dat die achteruitgang van de nierfunctie kan veroorzaken
- In de meeste situaties kan de nierfunctie zonder spoed bepaald worden (zie Details).
Uitgangsvragen
Hoe kunnen voorschrijvers en apothekers het beste samenwerken ten aanzien van de medicatiebewaking bij patiënten met een verminderde nierfunctie?
Wat zijn goede adviezen voor communicatie tussen voorschrijvers en apothekers over patiënten met chronische nierschade?
Methode
Voor de beantwoording van deze uitgangsvraag heeft de werkgroep zich gebaseerd op eigen ervaringen en groepsdiscussie, gericht op consensus.
Overwegingen
Naast onderstaande overwegingen en aanbevelingen zijn andere richtlijnen op dit gebied van toepassing. Het gaat om de richtlijn Overdracht van medicatiegegevens in de keten en de richtlijn Informatie-uitwisseling tussen huisarts en specialist bij verwijzingen, zie Leidraad Overdracht van Medicatiegegevens.
Sinds 1 augustus 2013 zijn voorschrijvers wettelijk verplicht om een bekende afwijkende nierfunctiewaarde (eGFR < 50 ml/min/1,73 m2) door te geven aan de apotheker van de patiënt. De apotheker dient deze gegevens te betrekken bij de medicatiebewaking.
De multidisciplinaire KNMP-werkgroep Geneesmiddelen bij verminderde nierfunctie geeft adviezen over het voorschrijven van geneesmiddelen bij een verminderde nierfunctie op basis van de creatinineklaring. Voor het toepassen van de doseringsadviezen in de dagelijkse praktijk worden de GFR en de creatinineklaring als equivalent beschouwd. De doseeradviezen zijn bedoeld voor patiënten met een stabiele nierfunctie. De adviezen ondersteunen de zorgverlener bij de afweging of een dosering moet worden aangepast op basis van de nierfunctie. De adviezen zijn vastgelegd in de G-Standaard die verwerkt is in de huisarts- en apothekersinformatiesystemen.
Bij medicatieadviezen wordt uitgegaan van een afwijkende nierfunctie die op grond van onder meer lichaamsoppervlakte wordt geschat. Hierbij wordt een standaard aangehouden van 1,73 m2 lichaamsoppervlak. In geval van patienten die een beduidend groter dan wel kleiner lichaamsoppervlak hebben dan normaal, wordt de nierfunctie, die met de CKD-EPI-formule is geschat, respectievelijk te laag en te hoog ingeschat. Om doseringsfouten te voorkomen kan bij sterk afwijkend postuur een correctie (bijvoorbeeld met de formules van DuBois & DuBois of Mosteller) worden toegepast. Arbitrair kan worden aangehouden dat een lichaamsoppervlak van < 1,50 m2 en > 2,00 m2 sterk afwijkend is. Dit zal in de praktijk met name van belang zijn bij gemeten nierfuncties rond de 30 ml/min/1,73 m2.
De voorschrijver bepaalt de nierfunctie bij patiënten ouder dan 70 jaar bij wie de nierfunctie onbekend is of langer dan éé één jaar geleden bepaald is, en bij wie hij geneesmiddelen voorschrijft waarbij de nierfunctie van belang kan zijn.
Bij voorkeur start de patiënt pas met de medicatie nadat de nierfunctie bepaald is. In de alledaagse praktijk, met name bij acute aandoeningen, is dit niet altijd mogelijk. In deze situaties moet de voorschrijver het risico van starten van de medicatie bij een onbekende nierfunctie afwegen tegen de noodzaak van snelle start met de behandeling.
De apotheker beoordeelt het risico en overlegt zo nodig met de voorschrijver wanneer de nierfunctie niet bekend is of langer dan één jaar geleden bepaald is bij het afleveren van medicatie in de volgende situaties:
- geneesmiddelen waarbij bij een eGFR < 80 ml/min/1,73 m2 al aanpassing nodig is
- geneesmiddelen met een smalle therapeutische breedte waarbij bij een eGFR < 50 ml/min/1,73 m2 aanpassing nodig is
- patiënten met polyfarmacie (chronisch gebruik van ≥ 5 geneesmiddelen op ATC-3-niveau; deze patiënten hebben gemiddeld een lagere nierfunctie, zie de MDR Polyfarmacie bij ouderen
Aanbeveling
De voorschrijver moet een afwijkende nierfunctie (< 50 ml/min/1,73 m2) doorgeven aan de apotheker.
Voor communicatie door de voorschrijver naar de apotheker is er bij voorkeur een koppeling tussen het informatiesysteem van de voorschrijvend arts en de apotheker. Indien dat niet geldt, wordt de volgende handelswijze aanbevolen:
- De voorschrijver geeft op het recept de eGFR door zoals deze verschaft wordt door het laboratorium.
- Als de voorschrijver of de apotheker oordeelt dat de eGFR geen correcte nierfunctie voor de betreffende patient weerspiegelt, kan de voorschrijver of apotheker (in overleg met de voorschrijver) een correctie toepassen of een andere manier van nierfunctieschatting gebruiken (bijvoorbeeld schatting van de nierfunctie op basis van cystatine C of 24-uurs creatinineklaring). De voorschrijver vermeldt dan op het recept dat deze waarde afwijkt van de door het laboratorium gegeven eGFR-waarde.
Huisarts en apotheker hanteren de adviezen van de multidisciplinaire KNMP-werkgroep Geneesmiddelen bij verminderde nierfunctie zoals vastgelegd in de G-Standaard en in het HIS en AIS. Er kan ook gebruik worden gemaakt van het Farmacotherapeutisch Kompas.
De voorschrijver bepaalt de nierfunctie bij patiënten ouder dan 70 jaar bij wie de nierfunctie onbekend is of langer dan één jaar geleden bepaald is, en bij wie hij medicatie voorschrijft waarbij de nierfunctie van belang kan zijn.
De apotheker overlegt bij patiënten ouder dan 70 jaar in risicovolle situaties met de voorschrijver bij patiënten bij wie de nierfunctie bij de apotheker niet bekend is of langer dan één jaar geleden bepaald is.
Voorschrijvers en apothekers maken (op lokaal niveau) samenwerkingsafspraken hoe dit in de praktijk praktisch in te richten.
De multidisciplinaire KNMP-werkgroep Geneesmiddelen bij verminderde nierfunctie volgt in de advisering de indeling in categorieën zoals vastgelegd op Europees niveau in 2004. Grenswaarden voor de categorieën zijn een creatinineklaring van 80, 50, 30 en 10 ml/min. In 2014 is deze EMA-richtlijn gereviseerd, waarbij de categorieën aangepast zijn aan de klinische indeling op prognose. Geadviseerde grenswaarden zijn een GFR van > 90, 60-89, 30-59, 15-29 en < 15 ml/min/1,73 m2. De KNMP-werkgroep die de adviezen opstelt, heeft besloten de ‘oude’ Europese indeling te blijven volgen en niet de door EMA in 2014 aangepaste indeling, omdat de aanpassing van de indeling geen klinisch relevante gevolgen voor het toepassen van de doseringsadviezen heeft. Voor het toepassen van de doseringsadviezen in de dagelijkse praktijk worden de GFR en de creatinineklaring als equivalent beschouwd.
In de eerste lijn worden geen geneesmiddelen voorgeschreven waarbij er al bij een creatinineklaring < 80 ml/ min aanpassingen in de dosering wordt geadviseerd. Omdat de grenswaarde voor de medicatiebewaking van 50 ml/ min dicht bij de grenswaarde voor het vaststellen van een verminderde nierfunctie ligt heeft de standaardwerkgroep er uit praktische overwegingen voor gekozen te adviseren het toekennen van de ICPC-code nierinsufficiëntie en het activeren van de contra-indicatie nierinsufficiëntie gelijktijdig uit te voeren.
Uitgangsvraag
Moet de voorschrijver de nierfunctie bepalen bij ouderen van wie geen actuele nierfunctie bekend is en aan wie hij medicatie voorschrijft waarbij een verminderde nierfunctie van belang is?
Methode
Voor de beantwoording van deze uitgangsvraag heeft de werkgroep zich gebaseerd op eigen ervaringen en groepsdiscussie, gericht op consensus.
Overwegingen
Om (ernstige) toxiciteit te voorkomen moet bij het voorschrijven van een aantal geneesmiddelen de (start)dosering en/of het doseerinterval aangepast worden (bijvoorbeeld bij lithium, metformine, digoxine, sotalol, amoxicilline/clavulaanzuur, rosuvastatine, en allopurinol). Bij geneesmiddelen die toxisch voor de nieren zijn kan een acute verslechtering van de nierfunctie ontstaan. De kans op acute nierschade is veel groter bij een verminderde nierfunctie. Deze geneesmiddelen zijn daarom gecontra-indiceerd (bijvoorbeeld NSAID’s).
Uit onderzoek blijkt dat er een behoorlijke spreiding is in eGFR, waarbij een deel van de bevolking zonder bekende aandoeningen een afwijkende nierfunctie heeft, waarbij mogelijk aanpassing van de medicatie nodig is (figuur 6, naar Van den Brand, 2011). Bij personen ouder dan 70 jaar komt een verminderde nierfunctie vaker voor. Op basis van consensus is gekozen voor een afkappunt van 70 jaar voor het bepalen van de nierfunctie van patiënten bij wie de nierfunctie onbekend is.
De G-Standaard geeft adviezen over het voorschrijven van medicatie bij een verminderde nierfunctie. Het voorschrijven op basis van een actuele nierfunctie draagt bij aan het veilig voorschrijven van geneesmiddelen. Op basis van consensus wordt een actuele nierfunctie gedefinieerd als een nierfunctiewaarde die niet langer dan één jaar geleden is bepaald. In voorkomende gevallen (bijvoorbeeld bij een bekende snel dalende nierfunctie) kan een recentere waarde van de nierfunctie nodig zijn. Veelal is er geen indicatie voor spoedbepaling
Aanbeveling
De nierfunctie wordt bepaald:
- bij patiënten ouder dan 70 jaar bij wie de nierfunctie onbekend is of langer dan één jaar geleden bepaald is, én:
- medicatie wordt voorgeschreven die bij een verminderde nierfunctie gecontra-indiceerd is of aanpassing behoeft, óf
- medicatie wordt voorgeschreven waarvan bekend is dat die achteruitgang van de nierfunctie kan veroorzaken.
In de meeste situaties kan hierbij de nierfunctie zonder spoed bepaald worden.
Beleid ten aanzien van het verhoogde cardiovasculaire risico
Naar Samenvatting ›Het cardiovasculaire risico van patiënten met chronische nierschade is verhoogd, vergelijkbaar met dat van patiënten met diabetes mellitus, en dient als zodanig gekwantificeerd te worden.
- Chronische nierschade, risicocategorie rood (zie tabel 1): deze patiënten hebben een zeer hoog cardiovasculair risico (in MDR/NHG-Standaard Cardiovasculair risicomanagement: ernstige chronische nierschade, risicocategorie rood). Medicamenteuze behandeling is meestal aangewezen.
- Chronische nierschade, risicocategorie oranje (zie tabel 1): deze patiënten hebben een hoog cardiovasculair risico (in MDR/NHG-Standaard Cardiovasculair risicomanagement: matige chronische nierschade, risicocategorie oranje). We bevelen aan bij deze patiënten medicamenteuze behandeling te overwegen. In geval van aanvullende risicofactoren, zoals een positieve familieanamnese voor hart- en vaatziekten en psychosociale risicofactoren, kan er sprake zijn van een zeer hoog cardiovasculair risico.
- Chronische nierschade, risicocategorie geel (zie tabel 1): deze patiënten hebben een matig verhoogd cardiovasculair risico, dat geschat kan worden door het SCORE-risico volgens de risicotabel in de MDR/NHG-Standaard Cardiovasculair risicomanagement met 1,5 te vermenigvuldigen (zie NHG-Standaard Cardiovasculair risicomanagement).
Patiënten met chronische nierschade en diabetes mellitus
Naar Samenvatting ›Voor het beleid bij patiënten met chronische nierschade en diabetes mellitus (streefwaarden HbA1c), zie NHG-Standaard Diabetes mellitus type 2 (zie Details)
De werkgroep merkt op dat deze streefwaarde van de KDIGO-richtlijn lager is dan de streefwaarden in de algemene richtlijnen voor behandeling van ouderen met diabetes mellitus type 2. De NHG-Standaard Diabetes mellitus type 2 adviseert bijvoorbeeld bij patiënten met diabetes mellitus type 2 die ouder zijn dan 70 jaar een HbA1c-streefwaarde aan te houden van ≤ 58 mmol/mol indien zij behandeld worden met meer dan alleen metformine monotherapie en de ziekteduur korter dan 10 jaar is. Een HbA1c-streefwaarde van ≤ 64 mmol/ mol wordt aanbevolen bij een ziekteduur langer dan 10 jaar (zie de NHG-Standaard Diabetes mellitus type 2). Er is namelijk geen bewijs dat intensieve glycemische behandeling bij kwetsbare ouderen met diabetes mellitus type 2 zinvol is, terwijl een dergelijke behandeling wel het risico op hypoglycemieën verhoogt. De werkgroep ondersteunt deze redenering en heeft dan ook additioneel aan de KDIGO-richtlijnen een specifieke aanbeveling over deze groep opgenomen conform de NHG-Standaard Diabetes mellitus type 2.
Vermeld dient te worden dat sommige orale glucose verlagende geneesmiddelen, zoals metformine, aangepast dienen te worden aan nierfunctie, dan wel gecontra-indiceerd zijn bij verminderde nierfunctie.
Aanbeveling
Bij patiënten met diabetes mellitus:
- Streef een HbA1c-waarde van ≤ 53 mmol/mol na om progressie van de microvasculaire complicaties van diabetes, zoals diabetische nierschade, te voorkomen dan wel af te remmen, behalve bij patiënten met een hoog risico op hypoglycemie, andere comorbiditeit of een beperkte levensverwachting.
- Bij patiënten ouder dan 70 jaar, die meer behandeling ontvangen dan uitsluitend leefstijladviezen of metformine monotherapie, is de streefwaarde ≤ 58 mmol/mol in geval van een diabetesduur < 10 jaar. In geval van een diabetesduur ≥ 10 jaar geldt ≤ 64 mmol/mol als streefwaarde.
Uitgangsvraag
Dient in geval van chronische nierschade een scherpe diabetesregulatie nagestreefd te worden (een HbA1c van 53 mmol/mol)?
Methode
Bij deze vraag is uitgegaan van de evidence uit de KDIGO-richtlijn en aanbevelingen uit de NHG-Standaard Diabetes mellitus type 2.
Resultaten
Tabel 12 toont de effecten van een betere HbA1c-controle op het opnieuw ontwikkelen van een matig verhoogde albuminurie (ACR 3 tot 30 mg/mmol; A2) en op de progressie van matig tot ernstig verhoogde albuminurie (ACR > 30 mg/mmol; A3) in de Action in Diabetes and Vascular Disease (ADVANCE), de Action to Control Cardiovascular Risk in Diabetes (ACCORD) en Veterans Affairs Diabetes Trial (VADT) studies.
De drie studies toonden een significant gunstig effect op albuminurieprogressie. Zij toonden geen significant gunstig effect van betere glycemische controle op eGFR-verandering. In de Diabetes Control and Complications Trial (DCCT) en in de Epidemiology of Diabetes Interventions and Complications (EDIC) vervolgstudie (type 1) ontwikkelden echter significant minder mensen een serumcreatinine > 177 µmol/l in de intensieve versus de conventionele controlegroep (1,4 versus 3,6%; p = 0,01), en startten minder mensen met nierfunctievervangende behandeling. In de United Kingdom Prospective Diabetes Study (UKPDS) bij patiënten met diabetes mellitus type 2 was intensieve diabetesbehandeling geassocieerd met een 67% risicovermindering op het eindpunt verdubbeling van serumcreatinine (0,71% in de intensieve versus 1,76% in de conventionele controlegroep; p = 0,027).
| Studie | Target HbA1c (mmol/mol) | %-afname (relatief) nieuwe ACR 3-30 mg/mmol | %-afname (relatief) progressie ACR van < 30 tot > 30 mg/mmol |
|---|---|---|---|
| ADVANCE | 47 versus 56 | 9 | 30 |
| ACCORD | 45 versus 59 | 21 | 32 |
| VADT | 51 versus 68 | 32 | 37 |
Conclusie
Gezien deze bevindingen wordt geadviseerd om bij patiënten met diabetes mellitus (type 1 en 2) en chronische nierschade goede diabetesregulatie na te streven, met een HbA1c-streefwaarde van < 53 mmol/mol.
Patiënten met chronische nierschade en verhoogde bloeddruk
Naar Samenvatting ›- Bij patiënten met chronische nierschade gaat veel aandacht naar de behandeling van hypertensie (zie Details).
- Meet de bloeddruk en stel een verhoogde bloeddruk vast conform de aanbevelingen in de NHG-Standaard Cardiovasculair risicomanagement.
- Behandel patiënten met een bloeddruk ≥ 130/80 mmHg met bloeddrukverlagende therapie (zie Details). We bevelen medicamenteuze behandeling aan bij patiënten uit risicocategorie rood (zie tabel 1). Overweeg medicamenteuze behandeling bij patiënten met chronische nierschade uit risicocategorie oranje. Schat bij patiënten met chronische nierschade uit risicocategorie geel (zie tabel 1) het cardiovasculaire risico door het SCORE-risico in de MDR/NHG-Standaard Cardiovasculair risicomanagement met 1,5 te vermenigvuldigen. De indicatie voor medicamenteuze behandeling dient op basis van deze SCORE-uitkomst bepaald te worden. De streefwaarde van de bloeddruk is < 130/80 mmHg.
- We bevelen aan samen met de patiënt de streefwaarden voor de bloeddruk te individualiseren, vooral op basis van leeftijd, aard van de nierziekte en comorbiditeit. Zo kan voor patiënten met een levensverwachting < 10 jaar en voor patiënten met een laag cardiovasculair risico een minder strikt beleid worden nagestreefd en voor jonge patiënten met ernstig verhoogde albuminurie of een specifieke nierziekte juist een strikter beleid.
- Wees alert op houdingsafhankelijke duizeligheid en pas zo nodig het beleid aan.
De keuze van het bloeddrukverlagende middel:
- We bevelen behandeling met een RAS-remmer aan bij matig of ernstig verhoogde albuminurie (ACR ≥ 3 mg/mmol).
- Bij het starten van een RAS-remmer bij patiënten met een eGFR < 60 ml/min/1,73 m2 bevelen we aan: controleer na 1-2 weken het serumkalium en de eGFR. Een daling van de eGFR van maximaal 20% is acceptabel.
- Voor de voorkeursmedicatie bij andere comorbide aandoeningen of condities bevelen we aan de NHG-Standaard Cardiovasculair risicomanagement te volgen.
Uitgangsvraag
Wat is de streefwaarde van de bloeddruk bij patiënten met chronische nierschade en hypertensie en hoe moeten deze patiënten worden behandeld?
Methode
Bij deze vraag is uitgegaan van de evidence uit de KDIGO-richtlijn. Na publicatie van die richtlijn verschenen twee grote meta-analyses die zijn opgenomen als aanvullend bewijs. Een recente RCT over bloeddrukstreefwaarden werd daarnaast nog geïncludeerd. Voor deze uitgangsvraag is geen systematisch literatuuronderzoek gedaan, vanwege de beschikbaarheid van de evidence in de KDIGO-richtlijn. De werkgroep is van mening de nieuwste evidence van hoge kwaliteit te hebben toegevoegd.
Resultaten
Streefwaarde bloeddruk
Bloeddruk en albuminurie
De KDIGO-richtlijn uit 2013 stelt dat bij patiënten met chronische nierschade zonder verhoogde albuminurie (ACR > 3 mg/mmol; A1) de streefbloeddruk 140/90 mmHg of lager is. Voor patiënten met matig verhoogde ACR (3 tot 30 mg/mmol; A2) of ernstig verhoogde albuminurie (> 30 mg/mmol; A3) ongeacht de aanwezigheid van diabetes mellitus wordt een bloeddrukstreefwaarde van 130/80 mmHg geadviseerd voor zowel de grens waarboven therapie moet starten als ook het behandeldoel.
Bloeddruk zo laag mogelijk?
In de UKPDS (UK Prospective Diabetes Study) werd gevonden dat streven naar een bloeddruk < 150/85 mmHg betere uitkomsten gaf dan streven naar een bloeddruk < 180/105 mmHg. In de HOT-studie werd gevonden dat streven naar een diastolische bloeddruk ≤ 80 mmHg beter was dan naar hogere diastolische bloeddrukwaarden, maar gegevens over albuminurie ontbraken. In de ABCD-studie werd gerandomiseerd tussen een diastolische bloeddruk < 75 mmHg en een diastolische bloeddruk van 80-89 mmHg. Er was minder sterfte in de laagste bloeddrukgroep en geen verschil tussen renale en cardiovasculaire uitkomsten. Omdat in deze studie patiënten met normotensie en chronische nierschade geïncludeerd waren maar geen patienten met hypertensie en chronische nierschade, kunnen de gegevens niet betrouwbaar geëxtrapoleerd worden naar de gehele populatie met chronische nierschade. In de ACCORD-studie (n = 4730, 40% met verhoogde albuminurie) werd gerandomiseerd tussen een systolische bloeddruk < 140 en < 120 mmHg. Er werd geen verschil gevonden in de primaire uitkomstmaat (cardiovasculaire sterfte, niet-fataal hartinfarct, niet-fataal CVA). In de lage bloeddrukgroep kregen minder patienten een CVA, maar meer patiënten nierfunctieverslechtering. Observationele studies tonen een verband tussen lagere bloeddruk en een lager risico op cardiovasculaire uitkomsten. Geen van deze studies geeft bewijs voor causaliteit. Verder zijn veel posthoc analyses van RCT’s verschenen (IDNT, UKPDS, INVEST, ADVANCE ), waaruit onder meer naar voren kwam dat patiënten die een betere bloeddruk bereikten (130/85 in plaats van 140/90 mmHg), een lager risico op cardiovasculaire schade hadden dan patiënten die een hoge bloeddruk hielden. Ook dit geeft geen bewijs voor causaliteit. Het is immers voorstelbaar dat degenen die een lagere bloeddruk bereiken minder ver voortgeschreden vaatwandsclerose hebben en/of een betere therapietrouw vertonen. In de Steno-2-studie werd een groep intensief behandelde diabetespatiënten met matig verhoogde albuminurie, waarbij een bloeddrukdoel van 140/85 en later 130/80 mmHg werd nagestreefd, vergeleken met een conventionele arm van patiënten bij wie < 160/95 en later 135/85 mmHg werd nagestreefd. Intensieve behandeling hield ook in dat er onder meer dieet- en inspanningsadvies werd gegeven, lipidenverlagende medicatie werd gestart, en intensieve glycemische controle werd nagestreefd. De intensieve behandeling was geassocieerd met een verminderd risico op cardiovasculaire ziekten, nefropathie, retinopathie en autonome neuropathie. Het is aannemelijk dat lagere bloeddrukdoelen hebben bijgedragen aan de gunstige resultaten bij de intensief behandelde patiënten. Twee recente meta-analyses laten zien dat een afname van cardiovasculaire morbiditeit en mortaliteit ontstaat bij een afname van bloeddruk < 130/80 mmHg bij patiënten met een hoog cardiovasculair risico, diabetes mellitus en/of chronische nierschade. Ettehad et al. voerden een systematische review met meta-analyses uit, waarin zij de relatie tussen verlaging van de bloeddruk en cardiovasculaire aandoeningen en sterfte onderzochten. In deze studie werden 123 RCT’s met ten minste 1000 patiëntjaren in elke onderzoeksarm geïncludeerd, met in totaal 613.815 patiënten. In deze studie werd een verband aangetoond tussen elke 10 mmHg-daling van de systolische bloeddruk en verlaging van het risico op cardiovasculaire eindpunten en mortaliteit (tabel 13). Hoe lager de systolische bloeddruk, hoe lager het relatief risico, maar de absolute risicoreductie was beperkt, zodat veel mensen behandeld moeten worden om één event te vermijden. Deze studie liet geen statistisch significante relatie zien tussen verlaging van de bloeddruk en nierfalen. In de studie werd geen onderscheid gemaakt tussen patiënten met en zonder chronische nierschade.
| Eindpunt | RR [95%-BI] | NNT* |
|---|---|---|
| Major cardiovasculair event | 0,80 (0,77-0,83) | 71 |
| Coronaire hartziekten | 0,83 (0,78-0,88) | 174 |
| Beroerte | 0,73 (0,68–0,77) | 127 |
| Hartfalen | 0,72 (0,67-0,78) | 152 |
| Nierfalen | 0,95 (0,84-1,07) | Geen statistisch significant risicoverschil |
| Totale mortaliteit | 0,87 (0,84-0,91) | 156 |
| * NNT: number-needed-to-treat: aantal personen dat behandeld moet worden om 1 event te voorkomen. | ||
Xie et al. voerden eveneens een systematische review met meta-analyses uit, met als doel de associatie tussen intensieve bloeddrukverlaging en cardiovasculaire en renale uitkomsten te bestuderen.
In deze studie werden 19 trials geïncludeerd, waarin intensieve met minder intensieve bloeddrukverlaging werd vergeleken, bij in totaal 44.989 patiënten. De verschillen in bereikte systolische bloeddruk tussen de onderzoeksarmen waren over het algemeen beperkt voor de totale groep. Er is in deze analyse echter ook naar subgroepen gekeken. Wanneer werd gekeken naar de uitkomst major cardiovasculair event, werd voor patiënten met chronische nierschade geen voordeel gevonden van intensieve bloeddrukverlaging ten opzichte van minder intensieve bloeddrukverlaging. Hierbij was sprake van imprecisie van het gevonden resultaat. Veel van de studies die in deze metaanalyse waren geïncludeerd, waren van matige kwaliteit, bijvoorbeeld vanwege niet-geblindeerde opzet.
In 2015 verscheen een grote RCT over bloeddrukregulatie bij patiënten met een systolische bloeddruk ≥ 130 mmHg en verhoogd cardiovasculair risico zónder diabetes mellitus. In deze studie werden 9361 patiënten gerandomiseerd tussen twee groepen: systolische bloeddruk streefwaarde < 140 mmHg (standaardbehandeling) en systolische bloeddruk streefwaarde < 120 mmHg (intensieve behandeling). De mediane follow-up was 3,26 jaar (de studie werd vervroegd gestopt vanwege significante resultaten in de primaire uitkomst (optreden van myocardinfarct, acuut coronair syndroom, beroerte, hartfalen of cardiovasculaire mortaliteit). De gemiddelde bloeddruk in de intensieve behandelgroep was 121,4 mmHg na één jaar, in de standaard behandelgroep was dat 136,2 mmHg. Na het eerste jaar bleef de bloeddruk stabiel. Het risico op de primaire uitkomst was lager in de intensieve behandelgroep (5,2%) in vergelijking met de standaard behandelgroep (6,8%) (HR 0,75; 95%-BI 0,64 tot 0,89). De NNT was 61. Op de secundaire uitkomstmaten myocardinfarct, acuut coronair syndroom en beroerte werd geen statistisch significant resultaat gezien. Wel hadden personen in de intensieve behandelgroep een lager risico op hartfalen (HR 0,62; 95%-BI 0,45 tot 0,84), cardiovasculaire sterfte (HR 0,57; 95%-BI 0,38 tot 0,85) en totale sterfte (HR 0,73; 95%-BI 0,60 tot 0,90). Een vooraf geplande subgroepanalyse van de SPRINT-trial toont voor de populatie met chronische nierschade soortgelijke bevindingen, hoewel de meeste niet statistisch significant bleken. Dit wordt verklaard vanwege de kleinere aantallen in de subgroepen en de vroegtijdige beëindiging van de SPRINT-trial vanwege de behaalde eindpunten.
Van bewijs naar aanbeveling
In tegenstelling tot de internationale richtlijnen adviseren de Nederlands multidisciplinaire richtlijn CVRM en NHG-Standaard CVRM alleen systolische bloeddrukwaarden te hanteren om afwijkende waarden en streefniveaus aan te geven. Reden hiervoor was de bevinding dat voor de indicatie cardiovasculair risicomanagement het zelden voorkomt dat een patiënt een normale systolische, maar afwijkende diastolische bloeddruk heeft. In de internationale richtlijnen worden wel diastolische bloeddrukwaarden gebruikt, omdat een normale systolische bloeddruk niet altijd gepaard gaat met een normale diastolische bloeddruk. Dit kan het geval zijn bij jongere patiënten met chronische nierschade (vaak op basis van primaire nierziekten).
De bloeddrukwaarden die genoemd zijn als streefniveau, zijn bloeddrukwaarden zoals gemeten in de spreekkamer. In geval van twijfel of de zo gemeten bloeddruk representatief is, kan overwogen worden om 24-uurs bloeddrukmeting te laten verrichten, dan wel de patiënt te instrueren thuis de bloeddruk te meten. Men dient daarbij te beseffen dat zowel voor een 24-uurs bloeddrukmeting als voor een thuisbloeddrukmeting lagere waarden worden aangenomen om hypertensie en streefniveau van bloeddrukregulatie te definiëren. Voor de exacte waarden en protocollaire wijze van bloeddrukmeting wordt verwezen naar de MDR CVRM en de NHG-Standaard CVRM. In de SPRINT-studie is gebruikgemaakt van automatische bloeddrukmeting zonder aanwezigheid van een persoon. De richtlijnwerkgroep onderschrijft de resultaten van de SPRINT-studie, maar merkt op dat bij spreekkamermeting van de bloeddruk, die in Nederland gebruikelijk is, een systolische bloeddruk streefwaarde < 120 mmHg te strikt kan zijn. Vanwege het hoge cardiovasculaire risico bij patiënten met chronische nierschade en de gunstige effecten van intensievere bloeddrukverlaging op dit risico, wordt aanbevolen om voor alle patiënten met chronische nierschade (gele, oranje en rode risicogroepen in tabel 1) als streefwaarde voor de bloeddruk ≤ 130/80 mmHg te hanteren. Individualisering van de streefwaarden voor de bloeddruk kan verstandig zijn op basis van leeftijd, aard van de nierziekte en comorbiditeit. Zo kan bijvoorbeeld voor patiënten ouder dan 80 jaar en voor patiënten met een laag cardiovasculair risico een minder strikt beleid en voor jonge patiënten met ernstig verhoogde albuminurie of een specifieke nierziekte juist een strikter beleid worden nagestreefd. Bij patiënten met erfelijke cystenieren wordt hierover laagdrempelig overleg geadviseerd tussen huisarts en nefroloog.
Er is uitgebreid bewijs uit de klinische praktijk dat veel patiënten de bloeddrukdoelen uit richtlijnen in werkelijkheid niet bereiken; de bereikte waarden hebben vaak een normale verdeling rond het bloeddrukdoel. Het nut van goede bloeddrukbehandeling is zo groot dat geadviseerd wordt om te starten met behandeling als bij herhaling de streefwaarde wordt overschreden. De discussie ‘The-lower-the-better versus the J-shaped curve’ is ook bij patiënten met chronische nierschade actueel. Belangrijk is zich te realiseren dat het concept ‘“the lower the SBP and DBP achieved, the better the outcome’ met name is gebaseerd op observationeel onderzoek onder miljoenen gezonde personen die geen cardiovasculaire ziekte hadden aan het begin van de observatieperiode. Deze groep is dan ook niet representatief voor patiënten die deelnemen aan hypertensie RCT’s en zeker niet voor patiënten met chronische nierschade. Bovendien betekent een associatie niet automatisch een oorzakelijk verband. De J-shaped curve staat voor het concept dat het reduceren van SBP of DBP tot extreem lage waarden een kleiner voordeel heeft dan het reduceren tot minder lage waarden. Uit studies naar chronische nierschade komt naar voren dat het streven naar zeer lage bloeddrukwaarden vaker leidt tot nierfunctieverlies.
Bloeddrukstreefwaarden bij ouderen
Het meten en behandelen van hoge bloeddruk in de oudere patiëntencategorie wordt bemoeilijkt door het frequent voorkomen van atriumfibrilleren (bij 25% van de mensen > 70 jaar, CRIC-studie), door het optreden van orthostase en door een toegenomen vaatwandstijfheid, resulterend in een hoge polsdruk. Bij ouderen voorspelt de systolische bloeddruk beter een toekomstige achteruitgang in nierfunctie dan diastolische bloeddruk, polsdruk of mean arterial pressure (SHEP-studie). Het doel van bloeddrukbehandeling bij ouderen is anders dan bij jongere patiënten: er moet vooral gekeken worden naar cardiovasculaire en minder naar renale uitkomsten. Bij zeer oude patiënten moet de balans gezocht worden tussen het behandelen van hoge bloeddruk en het optreden van bijwerkingen als orthostase en andere factoren die de kwaliteit van leven beïnvloeden. Daarom wordt expliciet aangeraden de behandeling te individualiseren. In een Cochrane-review werden 15 RCT’s beoordeeld, verricht bij patiënten > 60 jaar, waarbij actieve behandeling werd vergeleken met placebo. Er was een reductie in totale mortaliteit (RR 0,90) en ook in gecombineerde cardiovasculaire mortaliteit en morbiditeit (RR 0,72). Bij patiënten ≥ 80 jaar was er geen reductie in mortaliteit, maar wel in gecombineerde cardiovasculaire mortaliteit en morbiditeit (RR 0,75). Deze gegevens worden bevestigd in observationeel onderzoek. Er zijn vier RCT’s waarin behandeling naar verschillende bloeddrukdoelen deel uitmaakte van het ontwerp van de studie en waarin ook oudere patiënten waren betrokken. Hierin zijn alleen patiënten geïncludeerd met een eGFR > 30-40 ml/min/1,73 m2. Deze studies lieten geen verschil in primaire uitkomsten zien tussen het lage en het hoge bloeddrukdoel. Samenvattend kan er geen specifiek bloeddrukdoel gegeven worden voor patiënten ouder dan 70 jaar. Het lijkt redelijk hetzelfde bloeddrukdoel te hanteren als voor jongere patiënten, al moet men zich realiseren dat het bereiken hiervan gepaard kan gaan met ongunstige effecten. In elk geval wordt geadviseerd om bij ouderen die behandeld worden met antihypertensiva specifiek te vragen of zij last hebben van houdingsafhankelijke duizeligheid.
Keuze bloeddrukverlagend middel
Bij patiënten zonder verhoogde albuminurie wordt geen specifiek advies gegeven over het middel van keuze voor de behandeling van de hypertensie. Voor patiënten met matig verhoogde albuminurie (ACR 3 tot 30 mg/mmol) wordt als antihypertensieve behandeling een ACE-remmer of ARB gesuggereerd, en voor mensen met een ernstig verhoogde albuminurie (ACR > 30 mg/ mmol) wordt een ACE-remmer of ARB aanbevolen. Voorkeursbehandeling met ACE-remmers en ARB’s bij matig tot ernstig verhoogde albuminurie is gebaseerd op het feit dat gerandomiseerde studies hebben laten zien dat ACE-remmers en ARB’s progressie van chronische nierschade tegengaan, en wellicht ook een verbetering geven van cardiovasculaire uitkomstmaten. Wel gaat het in de meeste studies om subanalyses van de groep patiënten met chronische nierschade uit de algemene populatie, dus niet om studies die primair bij chronische nierschade verricht zijn.
Betreffende de keuze tussen ACE-remmers en ARB’s is er geen bewijs dat één van deze klassen betere uitkomsten geeft en lijken deze middelen even effectief in het verbeteren van de uitkomsten bij patiënten met diabetes mellitus en verhoogde albuminurie. Men kan zich in de keuze dan ook laten leiden door het bewijs dat er voor elke klasse bestaat (meer studies met ACE-remmers bij diabetes mellitus type 1 en meer studies met ARB’s bij diabetes mellitus type 2), door bijwerkingen en door kostenoverwegingen. In geval van bijwerking van ACE-remmers (met name kriebelhoest) kunnen ARB’s worden gebruikt.
Bij patiënten met een matig (ACR 3 tot 30 mg/mmol; A2) of sterk (ACR > 30 mg/ mmol; A3) verhoogde albuminurie gaat de voorkeur uit naar een ACE-remmer of ARB. In de praktijk echter zijn vaak drie of meer antihypertensiva nodig. Hierbij dient opgemerkt te worden dat na de start van een ACE-remmer of ARB meestal een lichte daling van de GFR kan worden waargenomen. Dit berust op een fysiologische intrarenale hemodynamische aanpassing. De initiële daling van de nierfunctie gaat daarna gepaard met een minder snelle achteruitgang van de nierfunctie. Omdat bij chronische nierschade een verlies van renale autoregulatie optreedt, kan bloeddrukverlaging met elk antihypertensivum maar vooral met blokkers van het RAAS-systeem gepaard gaan met achteruitgang van de GFR. Een sterke stijging van het serumcreatininegehalte wordt met name gezien bij patiënten met een significante dubbelzijdige nierarteriestenose (of een nierarteriestenose bij een (functionele) mononier). Bij het starten van RAAS-blokkade (ACE-remmers, A2-antagonisten en aldosteron antagonisten) bij patiënten met eGFR < 60 ml/min/1,73 m2 wordt daarom na een tot twee weken controle van het serumkalium en de eGFR aanbevolen. Een daling van de eGFR van maximaal 20% na start van de behandeling wordt geaccepteerd. Bij een daling van de eGFR van meer dan 20% na start van de behandeling wordt de behandeling gestaakt en de eGFR na een tot twee weken opnieuw gemeten. Verwijzen naar de tweede lijn wordt aanbevolen ter diagnostiek en advies over de behandeling. Bij tussentijdse doseringsverhoging of bij langdurig gebruik van al ingestelde RAAS-blokkade is geen extra controle van eGFR of kalium nodig.
Bij onvoldoende respons op een ACE-remmer of ARB dient eerst nagegaan te worden of de betrokken patiënt wel een zoutbeperkt dieet volgt. Bij persisterende onvoldoende respons wordt geadviseerd een thiazidediureticum toe te voegen. Natriumdepletie versterkt de werking van ACE-remmers en ARB’s en, andersom, antagoneert het gebruik van te veel zout de werking van deze middelen grotendeels. Bij de meeste patiënten blijkt behandeling met een combinatie van bloeddrukverlagende middelen in combinatie met zoutbeperking noodzakelijk te zijn om de streefbloeddruk te bereiken.
Het nut van gecombineerde blokkade van het RAAS door ACE-remmers samen met ARB’s te geven, is tot nu toe niet bewezen voor belangrijke cardiovasculaire uitkomstmaten noch voor uitkomstmaten van nierfunctie. Wel zijn er nadelige effecten beschreven van CVA, hypotensie, hyperkaliëmie en nierfunctieverslechtering. Daarom wordt geadviseerd zeer terughoudend te zijn met het combineren van deze middelen en dit alleen in de tweede lijn toe te passen.
Aanbeveling
Streefwaarde bloeddruk
- De werkgroep gaat uit van de in de spreekkamer gemeten bloeddruk.
- Behandel patiënten met chronische nierschade bij een bloeddruk > 130/80 mmHg met leefstijladvies en, afhankelijk van hun risicoklasse en hun geschatte cardiovasculaire risico (waarbij chronische nierschade extra meetelt), met bloeddrukverlagende therapie. De streefwaarde is daarbij ≤ 130/80 mmHg.
- Individualiseren van de streefwaarden voor de bloeddruk wordt aanbevolen in samenspraak met de patiënt, met name op basis van leeftijd, aard van de nierziekte en comorbiditeit. Zo kan bijvoorbeeld voor patiënten met een levensverwachting < 10 jaar en voor patiënten met een laag cardiovasculair risico een minder strikt beleid en voor jonge patiënten met ernstig verhoogde albuminurie of een specifieke nierziekte juist een strikter beleid worden nagestreefd.
- Wees alert op houdingsafhankelijke duizeligheid en pas zo nodig het beleid aan.
De keuze van het bloeddruk verlagende middel
- Behandeling met een ACE-remmer of ARB wordt aanbevolen in geval van matig of ernstig verhoogde albuminurie (ACR ≥ 3 mg/mmol).
- Bij het starten van een ACE-remmer of ARB bij patiënten met eGFR < 60 ml/min/1,73 m2 wordt na een tot twee weken controle van het serumkalium en de eGFR aanbevolen. Een daling van de eGFR van maximaal 20% wordt geaccepteerd.
- Voor de voorkeursmedicatie bij andere comorbide aandoeningen of condities wordt aanbevolen de multidisciplinaire richtlijn en NHG-Standaard CVRM te volgen
In de aanbevelingen staat zowel de systolische als diastolische bloeddruk vermeld. In de Nederlandse multidisciplinaire richtlijn CVRM en NHG-Standaard CVRM wordt bij de behandeling en streefwaarden uitgegaan van alleen de systolische bloeddruk. De reden hiervoor is dat een geïsoleerde verhoogde diastolische bloedruk zelden voorkomt. Bij patiënten met chronische nierschade kan de diastolische bloeddruk soms wel een rol spelen, onder andere bij patiënten met een specifieke nierziekte. Deze patiënten worden over het algemeen in de tweede lijn behandeld. In de huisartsenpraktijk kan de systolische bloeddruk als uitgangspunt worden genomen.
| Uitkomstmaat | RR [95%-BI] | Mediane follow-up | NNT per jaar behandeling |
|---|---|---|---|
| Totale mortaliteit | 0,81 [0,74-0,88] | 3,9 jaar | 200 |
| Cardiovasculaire mortaliteit | 0,78 [0,68-0,89] | 4,2jaar | 333 |
| Cardiovasculaire events | 0,76 [0,73-0,80] | 4,5 jaar | 200 |
| Uitkomstmaat | Mean Difference (95%-BI) |
|---|---|
| GFR | 2,89 ml/min (-0,58 tot 6,36) |
| Proteïne-excretie | -0,32 g/24 uur (-0,61 tot -0,03) |
Patiënten met een LDL ≥ 2,6 mmol/l
Naar Samenvatting ›Bij patiënten met een LDL ≥ 2,6 mmol/l en chronische nierschade uit risicocategorie:
- rood (zie tabel 1): we bevelen behandeling met een statine aan (voor keuze van het middel en de dosering, zie NHG-Standaard Cardiovasculair risicomanagement) (zie Details)
- oranje (zie tabel 1): overweeg behandeling met een statine
Dislipidemie komt veel voor bij patiënten met een verminderde nierfunctie. Bij nieuwe patiënten wordt het lipidenspectrum geëvalueerd. Het standaard volgen van het lipidenprofiel wordt afgeraden, omdat er onvoldoende bewijs is dat het nastreven van een bepaald LDL-doel een gunstig effect heeft op het cardiovasculair risico bij chronische nierschade. Daarbij staat de grote variatie in de meting een betrouwbare follow-up in de weg. Bij patiënten met een BMI < 28 kg/m2 en/of een totaal cholesterol lager dan 5,5 mmol/L kan overwogen worden om af te zien van medicamenteuze cholesterolverlaging. Gebleken is dat bij deze groepen patiënten met chronische nierschade er geen relatieve risicoreductie is op cardiovasculaire events. Hierin wordt afgeweken van het advies in de KDIGO-richtlijn. Ten slotte is het voor de behandelindicatie relevant om zich te realiseren dat de mortaliteit van een cardiovasculair event bij patiënten met chronische nierschade hoger is dan in de algemene populatie. Systematische reviews bleken voor de behandeling van patiënten met chronische nierschade met ezetimibe niet voorhanden. Wel is er een grote placebogecontroleerde RCT over de behandeling van patiënten met chronische nierschade met simvastatine in combinatie met ezetimibe als cholesterolverlager. In de SHARP-studie werden 9270 patiënten met matige tot ernstige chronische nierschade (een derde betrof patiënten met dialyse) zonder myocardinfarct of coronaire revascularisatie in de voorgeschiedenis gerandomiseerd tussen simvastatine 20 mg in combinatie met ezetimibe 10 mg of placebo. De primaire uitkomstmaat was een major atherosclerotisch event. De mediane follow-up bedroeg 4,9 jaar, waarbij de gemiddelde LDL-cholesterol in de interventiegroep 0,85 mmol/L lager was dan in de placebogroep. In de simvastatine plus ezetimibegroep had 11, 3% een atherosclerotisch event, in de placebogroep was dit 13,4%. Het relatieve risico was 0,83 (95%-BI 0,74 tot 0,94). De NNT is 48.
Aanbeveling
Bij volwassenen met chronische nierschade wordt aangeraden eenmalig een lipidenprofiel (totaal cholesterol, LDL cholesterol, HDL cholesterol, triglyceriden) te bepalen.
Bij patiënten met chronische nierschade is routinematig meten van het lipidenprofiel tijdens medicamenteuze behandeling niet noodzakelijk.
Patiënten met chronische nierschade en matig of sterk verhoogd risico (oranje en rode risicocategorieën) hebben een (zeer) hoog cardiovasculair risico. Behandeling met een statine of combinatie statine/ezetimibe ter preventie van cardiovasculaire ziekte wordt aanbevolen. Bij patiënten met chronische nierschade en mild verhoogd risico (gele risicocategorie) wordt behandeling met een statine overwogen, afhankelijk van de schatting van het cardiovasculair risico, waarbij chronische nierschade als additionele risicofactor moet worden meegenomen.
Achtergrond
Uitgangsvraag
Is bij patiënten met chronische nierschade behandeling met een statine (en/of ezetimibe) aangewezen om het risico op cardiovasculaire en renale eindpunten en mortaliteit te verlagen?
Methode
Voor een antwoord op deze uitgangsvraag is op 14 oktober 2016 naar literatuur gezocht in Medline. Dit leverde 227 abstracts op. Deze abstracts zijn op onderwerp (sluit het artikel aan bij de uitgangsvraag?) en onderzoeksopzet (systematische reviews) geselecteerd, wat resulteerde in 14 artikelen, die volledig zijn beoordeeld.
Resultaten
De studie van Athyros et al. bleek geen systematisch opgezet onderzoek te betreffen en is daarom geëxcludeerd. De studie van Erickson et al. bleek geen review naar de effectiviteit van statines te betreffen en viel daarom ook af. De overgebleven studies bleken systematische reviews en meta-analyses. Daarbij was er een grote overlap in de trials die in deze meta-analyses zijn geïncludeerd. Besloten is om een mix van artikelen te kiezen waarin alle geïncludeerde studies zijn opgenomen en deze volledig te bestuderen. De overige systematische reviews vielen daarbij af, vanwege volledige overlap qua relevante geïncludeerde studies. Voor alle reviews geldt dat deze adequaat zijn uitgevoerd en dat er geen belangrijke inconsistentie of imprecisie is gedetecteerd. Ook zijn er geen aanwijzingen voor publicatiebias. Toch is de kwaliteit van de evidence beperkt. Dat heeft te maken met beperkingen in de studie-opzet van de in de systematische reviews geïncludeerde trials (risk of bias ten aanzien van bijvoorbeeld randomisatie, blindering, selectieve rapportage, en beperkte follow-up).
Palmer et al. publiceerden een systematische review over de voor- en nadelen van statines bij patiënten met chronische nierschade. Hierbij bestudeerden zij onder meer mortaliteit, cardiovasculaire mortaliteit en cardiovasculaire events, eindstadium nierfalen, nierfunctie en proteïnurie. In de studie werden 89 trials met in totaal 56.857 personen geïncludeerd. Voor deze richtlijn is alleen gekeken naar patiënten met chronische nierschade, die geen dialyse ondergingen (48 trials met in totaal 39.820 personen). De resultaten uit de meta-analyses van Palmer et al. staan in tabel 14 en tabel 15.
| Uitkomstmaat | RR [95%-BI] | Mediane follow-up | NNT per jaar behandeling |
| Totale mortaliteit | 0,81 [0,74-0,88] | 3,9 jaar | 200 |
| Cardiovasculaire mortaliteit | 0,78 [0,68-0,89] | 4,2jaar | 333 |
| Cardiovasculaire events | 0,76 [0,73-0,80] | 4,5 jaar | 200 |
Er werden geen significante verschillen gevonden in nadelige effecten, zoals kanker, myalgie, verhoogde creatininekinase, rhabdomyolyse, abnormale leverfunctie of voortijdig staken van behandeling.
Sanguankeo et al. publiceerden een systematische review met meta-analyse over de effecten van statines op renale uitkomsten bij patiënten met chronische nierschade. In deze review werden 10 studies (9 clinical trials en één prospectief cohortonderzoek) geïncludeerd met in totaal 18.126 patienten met chronische nierschade (eGFR 15 tot 9 ml/min/1,73 m2). De studieduur varieerde van 12 tot 63 maanden. Wanneer gekeken werd naar de verandering van de eGFR per jaar werd er een significant gemiddeld verschil gevonden van 0,10 ml/min/1,73 m2 (95%-BI 0,09 tot 0,12) in het voordeel van de groep die statines gebruikten, maar wanneer er gekeken werd naar de totale eGFR-verandering na een follow-up variërend van 12 tot 58 maanden was dit niet significant (gemiddeld verschil 1,78 ml/ min/1,73 m2; 95%-BI -0,26 tot 3,81). Bij deze laatste vergelijking was sprake van heterogeniteit. Er was eveneens geen statistisch significant verschil voor de uitkomstmaten proteïnurie (gemiddeld verschil 0,19 g/dag; 95%-BI -0,02 tot 0, 40), eindstadium nierfalen (RR 0,97; 95%-BI 0,90 tot 1,06) en 50% reductie van eGFR (RR 0,93; 95%-BI 0,86 tot 1,01) . Een subanalyse voor groepen met hoog-intensieve statinebehandeling (LDL-C-reductie 34 tot 40%) liet een groter verschil in eGFR-verandering zien (gemiddeld verschil 3,35 ml/ min/1,73 m2; 95%-BI 0,91 tot 5,79). Bij matig intensieve en laag intensieve behandeling werd geen statistisch significant verschil gevonden tussen behandeling met statines en controles.
Su et al. publiceerden een systematische review met meta-analyses over het effect van statines op renale uitkomsten. In deze studie werden zowel trials bij patiënten met als bij patiënten zonder chronische nierschade geïncludeerd. In deze literatuurreview worden alleen de resultaten bij patiënten met chronische nierschade gerapporteerd. In 27 studies met in totaal 17.230 patiënten met chronische nierschade werd gekeken naar de verandering van nierfunctie (eGFR). Dit gemiddelde verschil was 0,15 ml/ min/1,73 m2 in het voordeel van statinegebruikers (95%-BI 0,08 tot 0,22). De follow-up in deze studies varieerde van 6 maanden tot 6 jaar. Het gemiddelde verschil in albuminurie was bij patiënten met chronische nierschade -0,62 g/dag (95%-BI -1,10 tot -0,17). Er was geen statistisch significant verschil tussen statinegebruikers en controles qua risico op nierfalen (OR 0,92; 95%-BI 0,83 tot 1,02). Het risico op het krijgen van een major cardiovasculair event was lager in de groepen patiënten met chronische nierschade die statines gebruikten dan bij controles (OR 0,70; 95%-BI 0,62-0,79) met een NNT van 25, wat vergelijkbaar is met de vermindering van het risio in populaties met personen met coronaire hartziekten.
Over behandeling van patiënten met chronische nierschade met ezetimibe en het effect op cardiovasculaire of renale uitkomsten zijn geen systematische reviews beschikbaar. Wel is ezetimibe gebruikt naast simvastatine in de SHARP-trial. Deze studie heeft bij patiënten met chronische nierschade aangetoond dat de combinatie simvastatine-ezetimibe (20/10 mg) het risico op cardiovasculaire events vermindert, zonder toename van ernstige bijwerkingen.
Geen van de studies gebruikte een streefwaarde voor cholesterol.
Conclusies (kwaliteit van bewijs: matig)
Gebruik van statines door patiënten met chronische nierschade is geassocieerd met een verlaging van het risico op mortaliteit en cardiovasculaire aandoeningen, maar de absolute risicoreductie is beperkt.
Er is geen eenduidig bewijs dat statinegebruik leidt tot betere renale uitkomsten, hoewel kleine positieve effecten op afname eGFR en albuminurie zijn aangetoond.
Er is geen bewijs dat behandeling met statines bij patiënten met chronische nierschade is geassocieerd met ernstige bijwerkingen.
Er is geen bewijs in systematische reviews gevonden over de effecten van ezetimibe op cardiovasculaire of renale uitkomstmaten.
Patiënten met bekende hart- en vaatziekten
Naar Samenvatting ›Voor de indicaties voor het voorschrijven van plaatjesaggregatieremmers in het kader van secundaire preventie bij patiënten met chronische nierschade die ook een hart- en vaatziekte hebben, zie de NHG-Standaarden op het gebied van hart- en vaatziekten (zie Details).
De werkgroep verwijst naar de NHG-Standaarden Acuut coronair syndroom, Atriumfibrilleren, Beroerte, Diepveneuze trombose en longembolie, Hartfalen, Perifeer arterieel vaatlijden, Stabiele angina pectoris en Varices.
Uitgangsvraag
Komen patiënten met chronische nierschade met hart- en vaatziekten in aanmerking voor secundaire preventie van hart- en vaatziekten (in de chronische fase) met extra trombocytenaggregatieremmers naast behandeling met acetylsalicylzuur?
Methode
Voor een antwoord op deze uitgangsvraag is op 8 april 2016 naar literatuur gezocht in Medline. Dit leverde (ontdubbeld) 186 abstracts op. Deze abstracts zijn op onderwerp (sluit het artikel aan bij de uitgangsvraag?) en onderzoeksopzet (systematische reviews, randomised controlled trials, en cohortstudies) geselecteerd, wat resulteerde in tien artikelen, die volledig zijn beoordeeld. Als cruciale uitkomstmaten werden benoemd: mortaliteit, cardiovasculaire mortaliteit, myocardinfarct, herseninfarct, bloedingen en eindstadium nierfalen. Ook zijn passages uit de NFN-richtlijn (concept, vervallen bij publicatie van de MDR) gebruikt ter onderbouwing.
Resultaten
Uit de KDIGO-richtlijn
Over het nut van acetylsalicylzuur als primaire en secundaire preventie zijn bij patiënten met chronische nierschade slechts beperkt gegevens beschikbaar. Cardiovasculaire protectie is aangetoond met acetylsalicylzuur en andere plaatjesaggregatieremmers in secundaire preventietrials. Aangezien patiënten met chronische nierschade een sterk verhoogd cardiovasculair risico hebben, zou aangenomen kunnen worden dat deze patiëntengroep ook voordeel zou hebben van een dergelijke behandeling. Anderzijds hebben patiënten met verminderde nierfunctie ook een afwijkende trombocytenfunctie, wat tot een verhoogd risico op bloedingen kan leiden.
In een aantal artikelen is aangetoond dat na een myocardinfarct aan patiënten met chronische nierschade minder vaak acetylsalicylzuur wordt voorgeschreven dan aan patiënten zonder chronische nierschade.
Wel is aangetoond dat patiënten met chronische nierschade eenzelfde voordeel van deze behandeling hebben als patiënten zonder chronische nierschade.
Geconcludeerd kan worden dat patiënten met chronische nierschade als secundaire preventie ook met acetylsalicylzuur behandeld moeten en kunnen worden.
Uit search
De studies van Harmon et al., Basra et al. en Jain et al. bleken narratieve reviews te zijn.
Deze zijn niet meegenomen in de analyse. De systematische review van Palmer et al. uit 2012 is een deel van de Cochrane-review van dezelfde auteurs uit 2013 en is daarom ook niet geanalyseerd.
De studies van Chen et al., Leng et al. en Lin et al. werden geëxcludeerd omdat de populaties niet overeenkwamen met de populatie in deze richtlijn.
Palmer et al. publiceerden een Cochrane-review over de effectiviteit van trombocytenaggregatieremmers bij patiënten met chronische nierschade.
In deze review werden RCT’s geïncludeerd waarin patiënten met chronische nierschade en het effect van plaatjesaggregatieremmers werden geanalyseerd. Als eindpunten werd onder meer gekeken naar myocardinfarct, beroerte, mortaliteit, bloedingen en eindstadium nierfalen. In deze review werden vijftig studies opgenomen met in totaal 27.139 patiënten. Voor deze richtlijn zijn nieuwe meta-analyses gedaan met inclusie van de studies met patiënten met hart- en vaatziekten (status na acuut coronair syndroom of coronaire hartziekte of PTCA), waarbij plaatjesaggregatieremmers werden vergeleken met placebo (n = 8). Deze geïncludeerde studies waren over het algemeen van goede kwaliteit met weinig risk of bias. De follow-up van deze studies varieerde van zes maanden tot een jaar. In vrijwel alle studies werd standaard acetylsalicylzuur gegeven, waarbij dus de toevoeging van een tweede middel aan de standaardbehandeling is onderzocht. De kwaliteit van het gevonden bewijs varieerde van laag tot zeer laag, waarbij de kwaliteit van het bewijs verlaagd werd vanwege imprecisie van de gevonden resultaten en indirectheid van het gevonden bewijs (vanwege de korte looptijd van de studies).
Er kon geen verband worden aangetoond tussen toevoeging van een tweede trombocytenaggregatieremmer en mortaliteit bij patiënten met chronische nierschade, ook niet ten aanzien van cardiovasculaire mortaliteit (figuren 7 en 8).
Ook voor cardiovasculaire events kon geen additief effect van het toevoegen van een tweede plaatjesaggregatieremmer (naast standaardbehandeling met acetylsalicylzuur) aangetoond worden (figuren 9, 10, 11, 12, 13); geen enkel resultaat was statistisch significant.
Voor de uitkomstmaat eindstadium nierfalen, verdubbeling serumcreatinine en ernstig verhoogde albuminurie zijn geen data beschikbaar voor de groep patiënten met chronische nierschade en hart- en vaatziekten over het effect van behandeling met additionele plaatjesaggregatieremmers naast acetylsalicylzuur.
Conclusies (kwaliteit van bewijs: laag tot zeer laag)
Het is niet bekend of behandeling van patiënten met chronische nierschade met hart- en vaatziekten met plaatjesaggregatieremmers eindstadium nierfalen, nierfunctie verslechtering of ernstig verhoogde albuminurie voorkomt.
Er is geen voordeel aangetoond van behandeling van patiënten met chronische nierschade met hart- en vaatziekten met een tweede plaatjesaggregatieremmer toegevoegd aan acetylsalicylzuur voor secundaire preventie van hart- en vaatziekten.
Het is niet aangetoond dat behandeling met een tweede plaatjesaggregatieremmer toegevoegd aan acetylsalicylzuur in het kader van secundaire preventie leidt tot een hoger risico op bloedingen bij patiënten met chronische nierschade met hart- en vaatziekten.
Van bewijs naar aanbeveling
Er is geen additioneel voordeel aangetoond van het toevoegen van een tweede plaatjesaggregatieremmer aan behandeling met acetylsalicylzuur voor secundaire preventie van hart- en vaatziekten bij patiënten met chronische nierschade, waarbij het bewijs van lage tot zeer lage kwaliteit is.
Aanbeveling
Behandel patiënten met chronische nierschade met hart- en vaatziekten in het kader van secundaire preventie met plaatjesaggregatieremmers volgens de geldende richtlijnen voor hart- en vaatziekten.
Voor antistolling in de acute fase na een cardiovasculair event wordt verwezen naar de desbetreffende richtlijnen.
Controle
Naar Samenvatting ›De controlefrequentie is afhankelijk van de risicocategorie:
- jaarlijks bij patiënten met een mild verhoogd risico (geel in tabel 1) (zie Details)
- 2 keer per jaar bij patiënten met een matig verhoogd risico (oranje in tabel 1)
- pas de controlemomenten voor monitoring van de nierschade bij patiënten met hypertensie en/of diabetes mellitus in bij de desbetreffende periodieke controle
Controleer (conform individueel zorgplan) en besteed aandacht aan de volgende aspecten:
- mate van nierschade:
- eGFR en albumine-creatinineratio in de urine; geef de actuele eGFR door aan de apotheek
- ga na of er een verandering van het stadium van de nierfunctie of albuminurie is, evalueer eventuele oorzaken hiervan (zoals medicatie, dehydratie of een postrenale oorzaak) en pas zo nodig het beleid aan; verwijs bij progressie (zie Begrippen)
- cardiovasculair risicoprofiel (inclusief meting van de bloeddruk)
- niet-medicamenteuze adviezen (leefstijladviezen)
- medicatiegebruik (waaronder zelfzorgmiddelen, zoals NSAID’s)
- bij gebruik van een RAS-remmer of diureticum:
- bepaal minimaal jaarlijks tevens de serumkalium- en natriumconcentratie
- bij eventuele bijwerkingen, zoals houdingsafhankelijke duizeligheid; pas zo nodig het beleid aan (zie NHG-Standaard Duizeligheid)
- overweeg (jaarlijkse) medicatiebeoordeling (zie de multidisciplinaire richtlijn Polyfarmacie bij ouderen) (zie Details)
Onder de patiënten met chronische nierschade met een mild verhoogd risico vallen ook de patiënten met een geïsoleerde verhoogde albuminurie. Medicamenteuze behandeling is bij deze patiënten niet nodig. Jaarlijkse controle wel. Bij persisterende toename van de albuminurie (klasseverschuiving naar een ernstig verhoogde albuminurie) wordt verwijzing naar de internist-nefroloog aanbevolen.
Uitgangsvraag
Hoe moet omgegaan worden met polyfarmacie en chronische nierschade?
Methode
Voor de beantwoording van deze vraag heeft de werkgroep zich gebaseerd op eigen ervaringen en groepsdiscussie, gericht op consensus.
Overwegingen
In de multidisciplinaire richtlijn Polyfarmacie bij ouderen uit 2012 wordt een verminderde nierfunctie als risicofactor genoemd voor complicaties als gevolg van medicatiegebruik. Daarbij wordt verminderde nierfunctie gedefinieerd als een eGFR < 50 ml/ min/1,73 m2. Deze grens wordt gebruikt voor de medicatiebewaking; echter in de stadiëring van chronische nierschade wordt deze afkapwaarde niet gehanteerd en gaat men uit van chronische nierschade bij een eGFR < 60 ml/min/1,73 m2.
In de MDR Polyfarmacie bij ouderen wordt jaarlijkse beoordeling van de medicatie aanbevolen bij patiënten ouder dan 65 jaar die vijf of meer geneesmiddelen (ATC-3-niveau: geneesmiddelen uit een gelijke therapeutische subgroep tellen als één geneesmiddel) chronisch gebruiken en een eGFR < 50 ml/ min/1,73 m2 hebben.
De werkgroep benadrukt dat er een verschil kan bestaan tussen de afkapwaarde die behandelaars hanteren, bijvoorbeeld met betrekking tot de prognose, en de grens waaronder aanpassing van de medicatie nodig is.
Daarnaast vindt de werkgroep het van belang dat er een actuele nierfunctie bekend is bij patiënten met polyfarmacie.
Aanbeveling
Overweeg (jaarlijkse) medicatiebeoordeling (zie de MDR Polyfarmacie bij ouderen).
Metabole complicaties
Naar Samenvatting ›- Regelmatig onderzoek naar metabole complicaties is aangewezen bij patiënten met een sterk verhoogd risico op cardiovasculaire aandoeningen of eindstadium nierfalen, die toch bij de huisarts onder controle zijn (rood in tabel 1). Om deze te diagnosticeren bevelen we aan bij deze patiënten (afhankelijk van de periodieke controles) 2 tot 4 keer per jaar fosfaat, kalium, calcium en hemoglobine te bepalen (zie Details).
- De bepaling van het parathormoon en behandeling met actief vitamine D bevelen we niet meer standaard aan (zie Details Opsporing van metabole complicaties).
- Overleg bij afwijkingen met de internist-nefroloog over het te volgen beleid.
Ondertaande adviezen zijn ontleend aan de MDR Chronische nierschade.
Calcium- en fosfaathuishouding
Bij patiënten met een GFR < 60 ml/ min/1,73 m2 is een verhoogd serumfosfaatgehalte geassocieerd met toegenomen mortaliteit. De MDR Chronische nierschade beveelt daarom aan het fosfaatgehalte binnen de norm te houden. Bij een verhoogd serumfosfaatgehalte adviseert de richtlijn in eerste instantie aan de fosfaatbelasting in het dieet te analyseren en zo nodig te verlagen. Eiwitrijke voeding als vlees, vis, melkproducten, chocolade en noten bevatten tevens veel fosfaat.
Ook in plantaardig voedsel kan veel fosfaat zitten, maar omdat daar de biologische beschikbaarheid veel lager van is, is de gastro-intestinale opname van plantaardig fosfaat veel lager. Veel kant-en-klaar of bewerkte producten bevatten fosfaatadditieven vanwege smaak- en/of conserveringsmaatregelen. In geval van hyperfosfatemie bij chronische nierscha-de is begeleiding op fosfaatinname in het dieet door een gespecialiseerde diëtist dan ook aan te raden.
Indien na eventuele dieetaanpassingen het serumfosfaatgehalte te hoog blijft, is behandeling met fosfaatbinders nodig. De MDR Chronische nierschade spreekt geen voorkeur uit voor de nieuwere niet-calciumhoudende fosfaatbinders en ijzerhoudende fosfaatbinders boven de ‘klassieke’ calciumhoudende fosfaat-binders.
Hyperkaliëmie
Hyperkaliëmie is een beruchte complicatie bij chronische nierschade en kan leiden tot fatale ritmestoornissen. Het serumkaliumgehalte blijft doorgaans binnen normale grenzen tot de eGFR < 15 ml/min/1,73 m2 daalt of oligurie optreedt. Hyperkaliëmie kan eerder optreden bij metabole acidose, bij patiënten met diabetes mellitus en tubulo-interstitiële aandoeningen, en bij gebruik van bepaalde medicamenten (onder andere kaliumsparende diuretica inclusief aldosteronreceptor antagonisten, ACE-remmers, angiotensinereceptorblokkers, directe renineremmers, NSAID’s, ß-blokkers, trimethoprim, calcineurineremmers).
Ten aanzien van de behandeling van hyperkaliëmie bestaan de opties uit het verlagen van de kaliuminnname met het dieet tot 2000-3000 mg of 50-75 mmol per dag door dieetadvies, het behandelen van een metabole acidose en het aanpassen van kaliumverhogende medicatie (zie hierboven voor een opsomming). Eventueel kan het gebruik van kationenwisselaars worden overwogen. Calciumpolystyreensulfonaat heeft de voorkeur boven natriumpolystyreensulfonaat vanwege de natriumbelasting van dit laatste middel. Beide werken na een uur en de werking houdt ongeveer zes uur aan. Bijwerkingen van deze middelen komen frequent voor, met name van gastro-intestinale aard (misselijkheid, braken, diarree of obstipatie) en de meeste patiënten ervaren een vieze, zanderige smaak.
Overleg bij een serumkaliumgehalte > 5,5 mmol/L over het te volgen beleid met de internist-nefroloog.
Anemie
Renale anemie komt veel voor bij patienten met een eGFR < 30 ml/min/1,73 m2. Omdat er geen overtuigend bewijs is voor een gunstig effect van erytropoetine op mortaliteit, cardiovasculaire en renale eindpunten en kwaliteit van leven bij patiënten met chronische nierschade en anemie en omdat het gebruik van erytropoëtine kan leiden tot meer beroertes, adviseert de MDR Chronische nierschade terughoudend te zijn met het voorschrijven van erytropoëtine.
Geadviseerd wordt eerst na te gaan of er andere dan renale oorzaken zijn voor het bestaan van de anemie. Volg hiervoor de adviezen over diagnostiek en beleid conform de NHG-Standaard Anemie. Blijft de anemie bestaan ondanks adequate behandeling, consulteer of verwijs dan naar de internist-nefroloog ter overweging van behandeling met erytropoëtine.
De MDR Chronische nierschade adviseert behandeling met erytropoëtine af te stemmen op de situatie van de individuele patiënt op basis van criteria zoals de voorgeschiedenis (diabetes mellitus, status na CVA, maligniteit), aanwezigheid van ischemische hartziekte, de hoogte van het hemoglobinegehalte en de snelheid van verandering in het hemoglobine, de respons op ijzertherapie, de risico’s van een eventuele bloedtransfusie, de kwaliteit van leven, erytropoëtinegerelateerde risico’s (bijvoorbeeld hypertensie, CVA), alsook de wens van de patiënt. Bij hoogrisicopatiënten (patiënten met diabetes mellitus, cardiovasculair lijden inclusief CVA of een maligniteit) beveelt de richtlijn aan een behandeling te overwegen bij een Hb ≤ 6,2 mmol/L. Bij laagrisicopatiënten (jong, zonder veel comorbiditeit) of bij patiënten bij wie een duidelijke verbetering in kwaliteit van leven te verwachten is, stelt de richtlijn dat al eerder behandeling kan worden overwogen (Hb ≤ 7,4).
Beleid bij eindstadium nierfalen
Naar Samenvatting ›- Voor uitgebreide aanbevelingen over besluitvorming ten aanzien van nierfunctievervangende behandeling, zie de multidisciplinaire richtlijn Nierfunctievervangende behandeling. Voor de zorg is het van belang dat:
- samenwerking tussen de 1e en 2e lijn, met laagdrempelig overleg in geval van twijfel, kan plaatsvinden voor een goede besluitvorming, samen met de patiënt, over het al dan niet starten van nierfunctievervangende behandeling
- leeftijd geen, maar comorbiditeit wél een criterium is voor het al dan niet voorstellen van nierfunctievervangende behandeling
- tijdige verwijzing (eGFR < 30 ml/min/1,73 m2) naar de 2e lijn de uitkomsten van nierfunctievervangende behandeling verbetert
- patiënten met ernstig nierfunctieverlies (eGFR < 30 ml/min/1,73 m2) informatie krijgen over de verschillende vormen van behandeling van eindstadium nierfalen (nierfunctievervangende behandeling door dialyse of niertransplantatie en conservatieve behandeling), inclusief de voor- en nadelen van de interventies
- Maak bij het gesprek met de patiënt desgewenst gebruik van de consultkaarten Mogelijkheden voor een nierfunctievervangende behandeling en Nierfunctievervangende behandeling of conservatieve behandeling?.
- Indien wordt overwogen af te zien van nierfunctievervangende behandeling, is het belangrijk dat de patiënt en diens familie weten wat conservatieve behandeling inhoudt. Hiermee wordt bedoeld dat patiënten weliswaar geen nierfunctievervangende behandeling krijgen, maar wel zo goed mogelijk behandeld worden, gericht op maximaal behoud van nierfunctie en de behandeling van symptomen.
- Patiënten en familie kunnen terughoudend zijn in het afzien van nierfunctievervangende behandeling, omdat ze het gevoel hebben dan te kiezen voor ‘geen behandeling’. De huisarts kan, consultatief ondersteund door de internist-nefroloog, bij deze behandeling en later in de palliatieve fase een belangrijke rol vervullen (voor verdere informatie, zie de richtlijn Palliatieve zorg bij eindstadium nierfalen) (zie Details).
In Nederland hebben ruim één miljoen mensen chronische nierschade. Bij ruim 16.000 mensen werken de nieren zo slecht dat ze afhankelijk zijn van een nierfunctievervangende therapie in de vorm van dialyse of een niertransplantatie. Met de toename van oudere patiënten met eindstadium nierfalen ontstaat er ook een steeds grotere groep patiënten die er bewust voor kiest om niet te gaan dialyseren. Voor de groep die geen dialyse start, bestaat de behandeling zowel uit therapie, gericht op maximaal behoud van nierfunctie, als uit behandeling van symptomen. Afhankelijk van de leeftijd, de mate van achteruitgang van nierfunctie in voorgaande periode, en comorbiditeit, kan deze fase van ‘maximaal conservatieve therapie’ maanden tot jaren duren.
De mortaliteit van dialysepatiënten is hoog: de helft van de patiënten die tussen hun 45e en 65e levensjaar start met dialyseren, overlijdt binnen vijf jaar. Daarnaast zien we ook dat het aantal kwetsbare oudere patiënten met ernstig nierfalen toeneemt. In deze groep is de palliatieve zorgbehoefte groot. Binnen een jaar na start van dialyse is 58% van de meest kwetsbare ouderen overleden, of functioneert slechter dan vóór start van dialyse. 5 tot 10% van de kwetsbare ouderen besluit zelf binnen zes maanden na start te willen stoppen met dialyse. Zowel conservatieve therapie als dialyse kan gepaard gaan met veel bijwerkingen en complicaties van de behandeling (medicatie en dialyse). Dit beperkt de kwaliteit van leven in hoge mate. De ervaren symptoomlast van patiënten met nierfalen (eGFR < 15 ml/min/1,73 m2) is hoog en vergelijkbaar met die van veel kankerpatiënten. De richtlijn Palliatieve zorg bij eindstadium nierfalen geeft aanbevelingen voor de organisatie van de zorg (met aandacht voor psychosociale en spirituele behoeften van patiënten, vragen rondom beëindigen van dialyse en ondersteuning van mantelzorg) en de behandeling van frequent optredende symptomen (slaapstoornissen, pijn, dyspnoe, jeuk, restless legs, delier en depressie).
Consultatie en verwijzing
Naar Samenvatting ›Verwijs naar de internist-nefroloog bij:
- (vermoeden van) acute nierschade
- vermoeden van een onderliggende specifieke nierziekte:
- sedimentafwijkingen
- een bekende auto-immuunziekte, recidiverende pyelonefritis, vesico-ureterale reflux, nefrectomie
- vermoeden van een erfelijke nierziekte of erfelijke nierziekte in de familie
- een ernstig verhoogde albuminurie (zie tabel 1), ACR > 30 mg/mmol
- chronische nierschade met sterk verhoogd risico (rood in tabel 1)
- progressie van chronische nierschade:
- daling van de eGFR van 25% ten opzichte van de 1e meting in de afgelopen 5 jaar, in combinatie met een verslechtering in stadium van de eGFR (zie tabel 1), of
- daling van de eGFR van ten minste 5 ml/min/1,73 m2/jaar, vastgesteld met ten minste 3 metingen
Overwegingen om ‒ in overleg met de patiënt ‒ niet te verwijzen zijn voornamelijk:
- een beperkte levensverwachting en/of
- uitgebreide comorbiditeit
Overweeg consultatie van de internist-nefroloog voor behandeladviezen bij patiënten die ondanks een verwijsindicatie een voorkeur hebben voor behandeling door de huisarts. Deze vragen kunnen onder meer gaan over:
- de progressie van nierschade
- therapieresistente hypertensie (hypertensie die niet voldoende reageert op behandeling met 3 of meer middelen)
- afwijkende laboratoriumuitslagen, wijzend op metabole complicaties
Overweeg verwijzing naar een diëtist bij:
- therapieresistente hypertensie en/of
- gebruik van een RAS-remmer voor evaluatie en beperking van de zoutinname
Zie bijlage 2 voor samenwerkingsafspraken over consultatie, verwijzing en terugverwijzing
Bijlage 1 Beleid bij chronische nierschade afhankelijk van stadiëring
Naar Samenvatting ›Referenties
- Wetzels JF, Kiemeney LA, Swinkels DW, Willems HL, Den Heijer M. Age- and gender-specific reference values of estimated GFR in Caucasians: the Nijmegen biomedical study. Kidney Int 2007;72:632-7.
- Crop MJ, De Rijke YB, Verhagen PCMS, Cransberg K, Zietse R. Diagnostic value of urinary dysmorphic erythrocytes in clinical practice. Nephron Clin Pract 2010;115:c203-12.
- Van der Snoek BE, Hoitsma AJ, Van Weel C, Koene RA. Dysmorfe erytrocyten in het urinesediment bij het onderscheiden van urologische en nefrologische oorzaken van hematurie. Ned Tijdschr Geneeskd 1994;138:721-6.
- ECLM. European urinalysis guidelines. Scan J Clin Lab Invest 2000:1-96.
- Delanghe J, Speeckaert M. Preanalytical requirements of urinalysis. Biochem Med (Zagreb) 2014;24:89-104.
- Hooijkaas H, Mohrmann K, Souverijn JHM, Smeets L. Handboek medische laboratoriumdiagnostiek. Houten: Prelum Uitgevers, 2013.
- KDIGO. Kidney disease improving global outcomes. KDIGO 2012 clinical practice guideline for the evaluation and management of chronic kidney disease. Kidney International 2013;3:S1-150.
- Bakker AJ. Screening op microalbuminurie: aanbevelingen voor urineverzameling, conservering en analyse. Ned Tijdschr Klin Chem 1998;23:129-37.
- De Grauw WJC, Kaasjager HAH, Bilo HJG, Faber EF, Flikweert S†, Gaillard CAJM, et al. Landelijke Transmurale Afspraak Chronische nierschade. Huisarts Wet 2009;52:586-97.
- Matsushita K, Van der Velde M, Astor BC, Woodward M, Levey AS, De Jong PE, et al. Association of estimated glomerular filtration rate and albuminuria with all-cause and cardiovascular mortality in general population cohorts: a collaborative meta-analysis. Lancet 2010;375:2073-81.
- Astor BC, Matsushita K, Gansevoort RT, Van der Velde M, Woodward M, Levey AS, et al. Lower estimated glomerular filtration rate and higher albuminuria are associated with mortality and end-stage renal disease. A collaborative meta-analysis of kidney disease population cohorts. Kidney Int 2011;79:1331-40.
- European Society of Cardiology. European Guidelines on cardiovascular disease prevention in clinical practice (2016). Eur Heart J 2016; 37:2315-81.
- Gansevoort RT, Matsushita K, Van der Velde M, Astor BC, Woodward M, Levey AS, et al. Lower estimated GFR and higher albuminuria are associated with adverse kidney outcomes. A collaborative meta-analysis of general and high-risk population cohorts. Kidney Int 2011;80:93-104.
- Van der Velde M, Matsushita K, Coresh J, Astor BC, Woodward M, Levey A, et al. Lower estimated glomerular filtration rate and higher albuminuria are associated with all-cause and cardiovascular mortality. A collaborative meta-analysis of high-risk population cohorts. Kidney Int 2011;79:1341-52.
- Matsushita K, Coresh J, Sang Y, Chalmers J, Fox C, Guallar E, et al. Estimated glomerular filtration rate and albuminuria for prediction of cardiovascular outcomes: a collaborative meta-analysis of individual participant data. Lancet Diabetes Endocrinol 2015;3:514-25.
- Tonelli M, Muntner P, Lloyd A, Manns BJ, Klarenbach S, Pannu N, et al. Risk of coronary events in people with chronic kidney disease compared with those with diabetes: a population-level cohort study. Lancet 2012;380:807-14.
- De Zeeuw D, Hillege HL, De Jong PE. The kidney, a cardiovascular risk marker, and a new target for therapy. Kidney Int Suppl 2005:S25-9.
- Coresh J, Astor BC, Greene T, Eknoyan G, Levey AS. Prevalence of chronic kidney disease and decreased kidney function in the adult us population: third national health and nutrition examination survey. Am J Kidney Dis 2003;41:1-12.
- Levey AS, De Jong PE, Coresh J, El Nahas M, Astor BC, Matsushita K, et al. The definition, classification, and prognosis of chronic kidney disease: a KDIGO controversies conference report. Kidney Int 2011;80:17-28.
- Van Gelder VA, Scherpbier-De Haan ND, De Grauw WJ, Vervoort GM, Van Weel C, Biermans MC, et al. Quality of chronic kidney disease management in primary care: a retrospective study. Scand J Prim Health Care 2016;34:73-80.
- Foley RN, Collins AJ. End-stage renal disease in the United States: an update from the United States renal data system. J Am Soc Nephrol 2007;18:2644-8.
- Gansevoort RT, Van der Heij B, Stegeman CA, De Charro FT, Nieuwenhuizen MG, De Zeeuw D, et al. Trends in the incidence of treated end-stage renal failure in The Netherlands: hope for the future? Kidney Int Suppl 2004:S7-10.
- Stengel B, Billon S, Van Dijk PC, Jager KJ, Dekker FW, Simpson K, et al. Trends in the incidence of renal replacement therapy for end-stage renal disease in Europe, 1990-1999. Nephrol Dial Transplant 2003;18:1824-33.
- Van Dijk PC, Jager KJ, Stengel B, Gronhagen-Riska C, Feest TG, Briggs JD. Renal replacement therapy for diabetic end-stage renal disease: data from 10 registries in Europe (1991-2000). Kidney Int 2005;67:1489-99.
- Tanner RM, Brown TM, Muntner P. Epidemiology of obesity, the metabolic syndrome, and chronic kidney disease. Curr Hypertens Rep 2012;14:152-9.
- Scherpbier ND, De Grauw WJ, Wetzels JF, Vervoort GM. Acute nierinsufficiëntie bij combinatie raas-remmer en dehydratie. Ned Tijdschr Geneeskd 2010;154:A1548.
- Stirling C, Houston J, Robertson S, Boyle J, Allan A, Norrie J, et al. Diarrhoea, vomiting and ACE inhibitors: an important cause of acute renal failure. J Hum Hypertens 2003;17:419-23.
- Foley RN. Clinical epidemiology of cardiovascular disease in chronic kidney disease. J Ren Care 2010;36 Suppl 1:4-8.
- Gansevoort RT, Correa-Rotter R, Hemmelgarn BR, Jafar TH, Heerspink HJ, Mann JF, et al. Chronic kidney disease and cardiovascular risk: epidemiology, mechanisms, and prevention. Lancet 2013;382:339-52.
- Wanner C, Amann K, Shoji T. The heart and vascular system in dialysis. Lancet 2016;388:276-84.
- Levey AS, Stevens LA, Schmid CH, Zhang YL, Castro AF, 3rd, Feldman HI, et al. A new equation to estimate glomerular filtration rate. Ann Intern Med 2009;150:604-12.
- Matsushita K, Mahmoodi BK, Woodward M, Emberson JR, Jafar TH, Jee SH, et al. Comparison of risk prediction using the CKD-EPI equation and the MDRD study equation for estimated glomerular filtration rate. Jama 2012;307:1941-51.
- Van Gelder VA, Scherpbier-De Haan ND, De Grauw WJ, O’Callaghan CA, Wetzels JF, Lasserson DS. Impact on cardiovascular risk follow-up from a shift to the CKD-EPI formula for EGFR reporting: a cross-sectional population-based primary care study. BMJ Open 2013;3:e003631.
- Van den Brand JA, Van den Boekel GA, Willems HL, Kiemeney LA, Den Heijer M, Wetzels F. Introduction of the CKD-EPI equation to estimate glomerular filtration rate in a Caucasian population. Nephrol Dial Transplant 2011:3176-81.
- Levey AS, Coresh J, Greene T, Stevens LA, Zhang YL, Hendriksen S, et al. Using standardized serum creatinine values in the modification of diet in renal disease study equation for estimating glomerular filtration rate. Ann Intern Med 2006;145:247-54.
- Fraser CG. Reference change values. Clin Chem Lab Med 2012;50:807-12.
- Bakker AJ, De Grauw WJ. Methoden van urineverzameling voor het bepalen van microalbuminurie: tijd voor consensus. Ned Tijdschr Geneeskd 2004;148:2012-5.
- De Grauw WJ, Van de Lisdonk EH, Van de Hoogen HJ, Van Gerwen WH, Van den Bosch WJ, Willems JL, et al. Screening for microalbuminuria in type 2 diabetic patients: the evaluation of a dipstick test in general practice. Diabet Med 1995;12:657-63.
- Filler G, Bokenkamp A, Hofmann W, Le Bricon T, Martinez-Bru C, Grubb A. Cystatin c as a marker of GFR: history, indications, and future research. Clin Biochem 2005;38:1-8.
- Inker LA, Schmid CH, Tighiouart H, Eckfeldt JH, Feldman HI, Greene T, et al. Estimating glomerular filtration rate from serum creatinine and cystatin c. N Engl J Med 2012;367:20-9.
- Levey AS, Inker LA, Coresh J. GFR estimation: from physiology to public health. Am J Kidney Dis 2014;63:820-34.
- Scherpbier-De Haan ND, Van Gelder VA, Van Weel C, Vervoort GM, Wetzels JF, De Grauw WJ. Initial implementation of a web-based consultation process for patients with chronic kidney disease. Ann Fam Med 2013;11:151-6.
- Van Gelder VA, Scherpbier-De Haan ND, Van Berkel S, Akkermans RP, De Grauw IS, Adang EM, et al. Web-based consultation between general practitioners and nephrologists: a cluster randomized controlled trial. Fam Pract 2017;34:430-6.
- Haley WE, Beckrich AL, Sayre J, McNeil R, Fumo P, Rao VM, et al. Improving care coordination between nephrology and primary care: a quality improvement initiative using the renal physicians association toolkit. Am J Kidney Dis 2015;65:67-79.
- Lee BJ, Forbes K. The role of specialists in managing the health of populations with chronic illness: the example of chronic kidney disease. BMJ 2009;339:b2395.
- Geerts AF, De Koning FH, De Vooght KM, Egberts AC, De Smet PA, Van Solinge WW. Feasibility of point-of-care creatinine testing in community pharmacy to monitor drug therapy in ambulatory elderly patients. J Clin Pharm Ther 2013;38:416-22.
- Shephard M, Peake M, Corso O, Shephard A, Mazzachi B, Spaeth B, et al. Assessment of the nova statsensor whole blood point-of-care creatinine analyzer for the measurement of kidney function in screening for chronic kidney disease. Clin Chem Lab Med 2010;48:1113-9.
- Kosack CS, De Kieviet W, Bayrak K, Milovic A, Page AL. Evaluation of the Nova StatSensor®Xpress(TM) creatinine point-of-care handheld analyzer. PLoS One 2015;10:e0122433.
- Avila M, Floris A, Staal S, Rios A, Eijkel J, Van den Berg A. Point of care creatinine measurement for diagnosis of renal disease using a disposable microchip. Electrophoresis 2013;34:2956-61.
- Lomakin FM, Tobar C. Accuracy of point-of-care serum creatinine devices for detecting patients at risk of contrast-induced nephropathy: a critical overview. Crit Rev Clin Lab Sci 2014;51:332-43.
- Haneder S, Gutfleisch A, Meier C, Brade J, Hannak D, Schoenberg SO, et al. Evaluation of a handheld creatinine measurement device for real-time determination of serum creatinine in radiology departments. World J Radiol 2012;4:328-34.
- Morita S, Suzuki K, Masukawa A, Ueno E. Assessing renal function with a rapid, handy, point-of-care whole blood creatinine meter before using contrast materials. Jpn J Radiol 2011;29:187-93.
- Pei Y, Obaji J, Dupuis A, Paterson AD, Magistroni R, Dicks E, et al. Unified criteria for ultrasonographic diagnosis of ADPKD. J Am Soc Nephrol 2009;20:205-12.
- CBO. Zorgmodule zelfmanagement 1.0 (2014). Ga naar bron: CBO. Zorgmodule zelfmanagement 1.0 (2014).
- NIVEL. Zelfmanagement door mensen met chronische ziekten. Kennissynthese van onderzoek en implementatie in Nederland (2015). Ga naar bron: NIVEL. Zelfmanagement door mensen met chronische ziekten. Kennissynthese van onderzoek en implementatie in Nederland (2015).
- Elwyn G, Frosch D, Thomson R, Joseph-Williams N, Lloyd A, Kinnersley P, et al. Shared decision making: a model for clinical practice. J Gen Intern Med 2012;27:1361-7.
- Schipper K, Van der Borg WE, De Jong-Camerik J, Abma TA. Living with moderate to severe renal failure from the perspective of patients. BMC Nephrol 2016;17:48.
- Van Huffel L, Tomson CR, Ruige J, Nistor I, Van Biesen W, Bolignano D. Dietary restriction and exercise for diabetic patients with chronic kidney disease: a systematic review. PLoS One 2014;9:e113667.
- Morales E, Valero MA, Leon M, Hernandez E, Praga M. Beneficial effects of weight loss in overweight patients with chronic proteinuric nephropathies. Am J Kidney Dis 2003;41:319-27.
- Solerte SB, Fioravanti M, Schifino N, Ferrari E. Effects of diet-the-rapy on urinary protein excretion albuminuria and renal haemodynamic function in obese diabetic patients with overt nephropathy. Int J Obes 1989;13:203-11.
- Saiki A, Nagayama D, Ohhira M, Endoh K, Ohtsuka M, Koide N, et al. Effect of weight loss using formula diet on renal function in obese patients with diabetic nephropathy. Int J Obes (Lond) 2005;29:1115-20.
- Vasquez B, Flock EV, Savage PJ, Nagulesparan M, Bennion LJ, Baird HR, et al. Sustained reduction of proteinuria in type 2 (non-insulin-dependent) diabetes following diet-induced reduction of hyperglycaemia. Diabetologia 1984;26:127-33.
- Gilardini L, Zulian A, Girola A, Redaelli G, Conti A, Invitti C. Predictors of the early impairment of renal disease in human obesity. Int J Obes (Lond) 2010;34:287-94.
- Shen WW, Chen HM, Chen H, Xu F, Li LS, Liu ZH. Obesity-related glomerulopathy: body mass index and proteinuria. Clin J Am Soc Nephrol 2010;5:1401-9.
- Leehey DJ, Moinuddin I, Bast JP, Qureshi S, Jelinek CS, Cooper C, et al. Aerobic exercise in obese diabetic patients with chronic kidney disease: a randomized and controlled pilot study. Cardiovasc Diabetol 2009;8:62.
- Bolignano D, Zoccali C. Effects of weight loss on renal function in obese CKD patients: a systematic review. Nephrol Dial Transplant 2013;28 Suppl 4:iv82-98.
- Sah SK, Siddiqui MA, Darain H. Effect of progressive resistive exercise training in improving mobility and functional ability of middle adulthood patients with chronic kidney disease. Saudi J Kidney Dis Transpl 2015;26:912-23.
- Heiwe S, Jacobson SH. Exercise training in adults with CKD: a systematic review and meta-analysis. Am J Kidney Dis 2014;64:383-93.
- Barcellos FC, Santos IS, Umpierre D, Bohlke M, Hallal PC. Effects of exercise in the whole spectrum of chronic kidney disease: a systematic review. Clin Kidney J 2015;8:753-65.
- Painter P, Roshanravan B. The association of physical activity and physical function with clinical outcomes in adults with chronic kidney disease. Curr Opin Nephrol Hypertens 2013;22:615-23.
- Elihimas UF, Jr., Elihimas HC, Lemos VM, Leao Mde A, Sa MP, Franca EE, et al. Smoking as risk factor for chronic kidney disease: Systematic review. J Bras Nefrol 2014;36:519-28.
- Clase C. Renal failure (chronic). BMJ Clin Evid 2011.
- Bleyer AJ, Shemanski LR, Burke GL, Hansen KJ, Appel RG. Tobacco, hypertension, and vascular disease: risk factors for renal functional decline in an older population. Kidney Int 2000;57:2072-9.
- Sawicki PT, Didjurgeit U, Muhlhauser I, Bender R, Heinemann L, Berger M. Smoking is associated with progression of diabetic nephropathy. Diabetes Care 1994;17:126-31.
- Johnson DW. Evidence-based guide to slowing the progression of early renal insufficiency. Intern Med J 2004;34:50-7.
- McMahon EJ, Campbell KL, Bauer JD, Mudge DW. Altered dietary salt intake for people with chronic kidney disease. Cochrane Database Syst Rev 2015;2:Cd010070.
- Ash S, Campbell KL, Bogard J, Millichamp A. Nutrition prescription to achieve positive outcomes in chronic kidney disease: a systematic review. Nutrients 2014;6:416-51.
- Gezondheidsraad. Richtlijnen goede voeding 2015. Den Haag: Gezondheidsraad, 2015; publicatienr. 2015/24. Ga naar bron: Gezondheidsraad. Richtlijnen goede voeding 2015. Den Haag: Gezondheidsraad, 2015; publicatienr. 2015/24.
- Kopple JD. Do low-protein diets retard the loss of kidney function in patients with diabetic nephropathy? Am J Clin Nutr 2008;88:593-4.
- Kaysen GA, Odabaei G. Dietary protein restriction and preservation of kidney function in chronic kidney disease. Blood Purif 2013;35:22-5.
- Rughooputh MS, Zeng R, Yao Y. Protein diet restriction slows chronic kidney disease progression in non-diabetic and in type 1 diabetic patients, but not in type 2 diabetic patients: a meta-analysis of randomized controlled trials using glomerular filtration rate as a surrogate. PLoS One 2015;10:e0145505.
- Nezu U, Kamiyama H, Kondo Y, Sakuma M, Morimoto T, Ueda S. Effect of low-protein diet on kidney function in diabetic nephropathy: meta-analysis of randomised controlled trials. BMJ Open 2013;3.
- Robertson L, Waugh N, Robertson A. Protein restriction for diabetic renal disease. Cochrane Database Syst Rev 2007:CD002181.
- Fouque D, Laville M. Low protein diets for chronic kidney disease in non diabetic adults. Cochrane Database Syst Rev 2009:Cd001892.
- Abraham G, Ghosh S. Role of pneumococcal vaccination in renal diseases. J Assoc Physicians India 2015;63:36-7.
- Choudhury D, Luna-Salazar C. Preventive health care in chronic kidney disease and end-stage renal disease. Nat Clin Pract Nephrol 2008;4:194-206.
- Dalrymple LS, Go AS. Epidemiology of acute infections among patients with chronic kidney disease. Clin J Am Soc Nephrol. 2008;3(5):1487–1493. doi:10.2215/CJN.01290308
- Grzegorzewska AE. Prophylactic vaccinations in chronic kidney disease: current status. Hum Vaccin Immunother 2015;11:2599-605.
- Mastalerz-Migas A, Steciwko A, Brydak LB. Immune response to influenza vaccine in hemodialysis patients with chronic renal failure. Adv Exp Med Biol 2013;756:285-90.
- Mathew R, Mason D, Kennedy JS. Vaccination issues in patients with chronic kidney disease. Expert Rev Vaccines 2014;13:285-98.
- Principi N, Esposito S. Influenza vaccination in patients with end-stage renal disease. Expert Opin Drug Saf 2015;14:1249-58.
- Soni R, Horowitz B, Unruh M. Immunization in end-stage renal disease: opportunity to improve outcomes. Semin Dial 2013;26:416-26.
- Mahmoodi M, Aghamohammadi A, Rezaei N, Lessan-Pezeshki M, Pourmand G, Mohagheghi MA, et al. Antibody response to pneumococcal capsular polysaccharide vaccination in patients with chronic kidney disease. Eur Cytokine Netw 2009;20:69-74.
- Watcharananan SP, Thakkinstian A, Srichunrasmee C, Chuntratita W, Sumethkul V. Comparison of the immunogenicity of a monovalent influenza A/H1N1 2009 vaccine between healthy individuals, patients with chronic renal failure, and immunocompromised populations. Transplant Proc 2014;46:328-31.
- Snyder JJ, Collins AJ. Association of preventive health care with atherosclerotic heart disease and mortality in CKD. J Am Soc Nephrol 2009;20:1614-22.
- Wang IK, Lin CL, Lin PC, Liang CC, Liu YL, Chang CT, et al. Effectiveness of influenza vaccination in patients with end-stage renal disease receiving hemodialysis: a population-based study. PLoS One 2013;8:e58317.
- Vandecasteele SJ, Ombelet S, Blumental S, Peetermans WE. The ABC of pneumococcal infections and vaccination in patients with chronic kidney disease. Clin Kidney J 2015;8:318-24.
- Remschmidt C, Wichmann O, Harder T. Influenza vaccination in patients with end-stage renal disease: systematic review and assessment of quality of evidence related to vaccine efficacy, effectiveness, and safety. BMC Med 2014;12:244.
- Chen CI, Kao PF, Wu MY, Fang YA, Miser JS, Liu JC, et al. Influenza vaccination is associated with lower risk of acute coronary syndrome in elderly patients with chronic kidney disease. Medicine (Baltimore) 2016;95:e2588.
- Gezondheidsraad. Vaccinatie tegen pneumokokken bij ouderen en risicogroepen (2003). Ga naar bron: Gezondheidsraad. Vaccinatie tegen pneumokokken bij ouderen en risicogroepen (2003).
- Gezondheidsraad. Briefadvies Vaccinatie tegen seizoensgriep. Den Haag: Gezondheidsraad, 2011; publicatienr. 2011/21. Ga naar bron: Gezondheidsraad. Briefadvies Vaccinatie tegen seizoensgriep. Den Haag: Gezondheidsraad, 2011; publicatienr. 2011/21.
- HASP. Richtlijn informatie-uitwisseling tussen huisarts en specialist (2017). Ga naar bron: HASP. Richtlijn informatie-uitwisseling tussen huisarts en specialist (2017).
- FMS. Leidraad overdracht van medicatiegegevens. Ga naar bron: FMS. Leidraad overdracht van medicatiegegevens.
- EMA. Note for guidance of the evaluation of the pharmokinetics of medicinal productin patients with impaired renal function (2004). Ga naar bron: EMA. Note for guidance of the evaluation of the pharmokinetics of medicinal productin patients with impaired renal function (2004).
- Patel A, MacMahon S, Chalmers J, Neal B, Billot L, Woodward M, et al. Intensive blood glucose control and vascular outcomes in patients with type 2 diabetes. N Engl J Med 2008;358:2560-72.
- Ismail-Beigi F, Craven T, Banerji MA, Basile J, Calles J, Cohen RM, et al. Effect of intensive treatment of hyperglycaemia on micro-vascular outcomes in type 2 diabetes: an analysis of the accord randomised trial. Lancet 2010;376:419-30.
- Duckworth W, Abraira C, Moritz T, Reda D, Emanuele N, Reaven PD, et al. Glucose control and vascular complications in veterans with type 2 diabetes. N Engl J Med 2009;360:129-39.
- Nathan DM, Zinman B, Cleary PA, Backlund JY, Genuth S, Miller R, et al. Modern-day clinical course of type 1 diabetes mellitus after 30 years’ duration: the diabetes control and complications trial/ epidemiology of diabetes interventions and complications and Pittsburgh epidemiology of diabetes complications experience (1983-2005). Arch Intern Med 2009;169:1307-16.
- UKPDS. Intensive blood-glucose control with sulphonylureas or insulin compared with conventional treatment and risk of complications in patients with type 2 diabetes (UKPDS 33). UK Prospective Diabetes Study Group. Lancet 1998;352:837-53.
- Ettehad D, Emdin CA, Kiran A, Anderson SG, Callender T, Emberson J, et al. Blood pressure lowering for prevention of cardiovascular disease and death: a systematic review and meta-analysis. Lancet 2016;387:957-67.
- Xie X, Atkins E, Lv J, Bennett A, Neal B, Ninomiya T, et al. Effects of intensive blood pressure lowering on cardiovascular and renal outcomes: updated systematic review and meta-analysis. Lancet 2016;387:435-43.
- The SPRINT Research Group. A randomized trial of intensive versus standard blood-pressure control. New Engl J Med 2015; 373;2103-16.
- Anonymus. Tight blood pressure control and risk of macrovascular and microvascular complications in type 2 diabetes: UKPDS 38. Uk prospective diabetes study group. BMJ 1998;317:703-13.
- Hansson L, Zanchetti A, Carruthers SG, Dahlof B, Elmfeldt D, Julius S, et al. Effects of intensive blood-pressure lowering and low-dose aspirin in patients with hypertension: principal results of the Hypertension Optimal Treatment (HOT) randomised trial. Hot study group. Lancet 1998;351:1755-62.
- Cushman WC, Evans GW, Byington RP, Goff DC, Jr., Grimm RH, Jr., Cutler JA, et al. Effects of intensive blood-pressure control in type 2 diabetes ong patients with chronic kidney disease. Clin J Am Soc Nephrol 2008;3:1487-93.
- Schrier RW, Estacio RO, Mehler PS, Hiatt WR. Appropriate blood pressure control in hypertensive and normotensive type 2 diabetes mellitus: a summary of the ABCD trial. Nat Clin Pract Nephrol 2007;3:428-38.
- Berl T, Hunsicker LG, Lewis JB, Pfeffer MA, Porush JG, Rouleau JL, et al. Impact of achieved blood pressure on cardiovascular outcomes in the irbesartan diabetic nephropathy trial. J Am Soc Nephrol 2005;16:2170-9.
- Adler AI, Stratton IM, Neil HA, Yudkin JS, Matthews DR, Cull CA, et al. Association of systolic blood pressure with macrovascular and microvascular complications of type 2 diabetes (UKPDS 36): prospective observational study. BMJ 2000;321:412-9.
- Pepine CJ, Handberg EM, Cooper-DeHoff RM, Marks RG, Kowey P, Messerli FH, et al. A calcium antagonist vs a non-calcium antagonist hypertension treatment strategy for patients with coronary artery disease. The international verapamil-trando-lapril study (INVEST): a randomized controlled trial. JAMA 2003;290:2805-16.
- Patel A, MacMahon S, Chalmers J, Neal B, Woodward M, Billot L, et al. Effects of a fixed combination of perindopril and indapamide on macrovascular and microvascular outcomes in patients with type 2 diabetes mellitus (the ADVANCE trial): a randomised controlled trial. Lancet 2007;370:829-40.
- Gaede P, Lund-Andersen H, Parving HH, Pedersen O. Effect of a multifactorial intervention on mortality in type 2 diabetes. N Engl J Med 2008;358:580-91.
- Cheung AK, Rahman M, Reboussin DM, Craven TE, Greene T, Kimmel PL, et al. Effects of intensive BP control in CKD. J Am Soc Nephrol 2017;28:2812-23.
- NICE. Chronic kidney disease. Early identification and management of chronic kidney disease in adults in primary and secondary care (2015). Ga naar bron: NICE. Chronic kidney disease. Early identification and management of chronic kidney disease in adults in primary and secondary care (2015).
- Chobanian AV, Bakris GL, Black HR, Cushman WC, Green LA, Izzo JL, Jr., et al. The seventh report of the joint national committee on prevention, detection, evaluation, and treatment of high blood pressure: the JNC 7 report. JAMA 2003;289:2560-72.
- Mancia G, Fagard R, Narkiewicz K, Redon J, Zanchetti A, Bohm M, et al. 2013 ESH/ESC guidelines for the management of arterial hypertension: the task force for the management of arterial hypertension of the European Society of Hypertension (ESH) and of the European Society of Cardiology (ESC). Eur Heart J 2013;34:2159-219.
- Soliman EZ, Prineas RJ, Go AS, Xie D, Lash JP, Rahman M, et al. Chronic kidney disease and prevalent atrial fibrillation: the chronic renal insufficiency cohort (CRIC). Am Heart J 2010;159:1102-7.
- Young JH, Klag MJ, Muntner P, Whyte JL, Pahor M, Coresh J. Blood pressure and decline in kidney function: findings from the systolic hypertension in the elderly program (SHEP). J Am Soc Nephrol 2002;13:2776-82.
- Musini VM, Tejani AM, Bassett K, Wright JM. Pharmacotherapy for hypertension in the elderly. Cochrane Database Syst Rev 2009:Cd000028.
- Hallan SI, Ritz E, Lydersen S, Romundstad S, Kvenild K, Orth SR. Combining GFR and albuminuria to classify CKD improves prediction of ESRD. J Am Soc Nephrol 2009;20:1069-77.
- Wachtell K, Ibsen H, Olsen MH, Borch-Johnsen K, Lindholm LH, Mogensen CE, et al. Albuminuria and cardiovascular risk in hypertensive patients with left ventricular hypertrophy: the LIFE study. Ann Intern Med 2003;139:901-6.
- Mann JF, Gerstein HC, Pogue J, Bosch J, Yusuf S. Renal insufficiency as a predictor of cardiovascular outcomes and the impact of ramipril: the HOPE randomized trial. Ann Intern Med 2001;134:629-36.
- Mann JF, Gerstein HC, Yi QL, Lonn EM, Hoogwerf BJ, Rashkow A, et al. Development of renal disease in people at high cardiovascular risk: results of the hope randomized study. J Am Soc Nephrol 2003;14:641-7.
- Rahman M, Pressel S, Davis BR, Nwachuku C, Wright JT, Jr., Whelton PK, et al. Renal outcomes in high-risk hypertensive patients treated with an angiotensin-converting enzyme inhibitor or a calcium channel blocker vs a diuretic: a report from the antihypertensive and lipid-lowering treatment to prevent heart attack trial (ALLHAT). Arch Intern Med 2005;165:936-46.
- Rahman M, Pressel S, Davis BR, Nwachuku C, Wright JT Jr., Whelton PK, et al. Cardiovascular outcomes in high-risk hypertensive patients stratified by baseline glomerular filtration rate. Ann Intern Med 2006;144:172-80.
- Apperloo AJ, De Zeeuw D, De Jong PE. A short-term antihypertensive treatment-induced fall in glomerular filtration rate predicts long-term stability of renal function. Kidney Int 1997;51:793-7.
- Buter H, Hemmelder MH, Navis G, De Jong PE, De Zeeuw D. The blunting of the antiproteinuric efficacy of ace inhibition by high sodium intake can be restored by hydrochlorothiazide. Nephrol Dial Transplant 1998;13:1682-5.
- Van der Kleij FG, Schmidt A, Navis GJ, Haas M, Yilmaz N, De Jong PE, et al. Angiotensin converting enzyme insertion/deletion polymorphism and short-term renal response to ACE inhibition: role of sodium status. Kidney Int Suppl 1997;63:S23-6.
- Vogt L, Waanders F, Boomsma F, De Zeeuw D, Navis G. Effects of dietary sodium and hydrochlorothiazide on the antiproteinuric efficacy of losartan. J Am Soc Nephrol 2008;19:999-1007.
- Mann JF, Schmieder RE, McQueen M, Dyal L, Schumacher H, Pogue J, et al. Renal outcomes with telmisartan, ramipril, or both, in people at high vascular risk (the ONTARGET study): a multicentre, randomised, double-blind, controlled trial. Lancet 2008;372:547-53.
- Yusuf S, Teo KK, Pogue J, Dyal L, Copland I, Schumacher H, et al. Telmisartan, ramipril, or both in patients at high risk for vascular events. N Engl J Med 2008;358:1547-59.
- Athyros VG, Katsiki N, Karagiannis A, Mikhailidis DP. Statins can improve proteinuria and glomerular filtration rate loss in chronic kidney disease patients, further reducing cardiovascular risk. Fact or fiction? Expert Opin Pharmacother 2015;16:1449-61.
- Erickson KF, Japa S, Owens DK, Chertow GM, Garber AM, Goldhaber-Fiebert JD. Cost-effectiveness of statins for primary cardiovascular prevention in chronic kidney disease. J Am Coll Cardiol 2013;61:1250-8.
- Geng Q, Ren J, Song J, Li S, Chen H. Meta-analysis of the effect of statins on renal function. Am J Cardiol 2014;114:562-70.
- Zhang Z, Wu P, Zhang J, Wang S, Zhang G. The effect of statins on microalbuminuria, proteinuria, progression of kidney function, and all-cause mortality in patients with non-end stage chronic kidney disease: a meta-analysis. Pharmacol Res 2016;105:74-83.
- Barylski M, Nikfar S, Mikhailidis DP, Toth PP, Salari P, Ray KK, et al. Statins decrease all-cause mortality only in CKD patients not requiring dialysis therapy: a meta-analysis of 11 randomized controlled trials involving 21,295 participants. Pharmacol Res 2013;72:35-44.
- Yan YL, Qiu B, Wang J, Deng SB, Wu L, Jing XD, et al. High-intensity statin therapy in patients with chronic kidney disease: a systematic review and meta-analysis. BMJ Open 2015;5:e006886.
- Upadhyay A, Earley A, Lamont JL, Haynes S, Wanner C, Balk EM. Lipid-lowering therapy in persons with chronic kidney disease: a systematic review and meta-analysis. Ann Intern Med 2012;157:251-62.
- Zhang YF, He F, Ding HH, Dai W, Zhang Q, Luan H, et al. Effect of uric-acid-lowering therapy on progression of chronic kidney disease: a meta-analysis. J Huazhong Univ Sci Technolog Med Sci 2014;34:476-81.
- Savarese G, Musella F, Volpe M, Paneni F, Perrone-Filardi P. Effects of atorvastatin and rosuvastatin on renal function: a meta-analysis. Int J Cardiol 2013;167:2482-9.
- Hou W, Lv J, Perkovic V, Yang L, Zhao N, Jardine MJ, et al. Effect of statin therapy on cardiovascular and renal outcomes in patients with chronic kidney disease: a systematic review and meta-analysis. Eur Heart J 2013;34:1807-17.
- Galvao TF, Araujo ME, Penha AP, Silva MT. Statins for early stage chronic kidney disease: an overview of reviews. Cardiovasc Hematol Disord Drug Targets 2014;14:205-11.
- Navaneethan SD, Pansini F, Perkovic V, Manno C, Pellegrini F, Johnson DW, et al. HMG CoA reductase inhibitors (statins) for people with chronic kidney disease not requiring dialysis. Cochrane Database Syst Rev 2009:Cd007784.
- Nikolic D, Banach M, Nikfar S, Salari P, Mikhailidis DP, Toth PP, et al. A meta-analysis of the role of statins on renal outcomes in patients with chronic kidney disease. Is the duration of therapy important? Int J Cardiol 2013;168:5437-47.
- Palmer SC, Craig JC, Navaneethan SD, Tonelli M, Pellegrini F, Strippoli GF. Benefits and harms of statin therapy for persons with chronic kidney disease: a systematic review and meta-analysis. Ann Intern Med 2012a;157:263-75.
- Sanguankeo A, Upala S, Cheungpasitporn W, Ungprasert P, Knight EL. Effects of statins on renal outcome in chronic kidney disease patients: a systematic review and meta-analysis. PLoS One 2015;10:e0132970.
- Baigent C, Landray MJ, Reith C, Emberson J, Wheeler DC, Tomson C, et al. The effects of lowering LDL cholesterol with simvastatin plus ezetimibe in patients with chronic kidney disease (study of heart and renal protection): a randomised placebo-controlled trial. Lancet 2011;377:2181-92.
- Su X, Zhang L, Lv J, Wang J, Hou W, Xie X, et al. Effect of statins on kidney disease outcomes: a systematic review and meta-analysis. Am J Kidney Dis 2016;67:881-92.
- Kasiske BL. Hyperlipidemia in patients with chronic renal disease. Am J Kidney Dis 1998;32:S142-56.
- Hayward RA, Krumholz HM. Three reasons to abandon low-density lipoprotein targets: an open letter to the adult treatment panel IV of the National Institutes of Health. Circ Cardiovasc Qual Outcomes 2012;5:2-5.
- Glasziou PP, Irwig L, Heritier S, Simes RJ, Tonkin A. Monitoring cholesterol levels: measurement error or true change? Ann Intern Med 2008;148:656-61.
- Takahashi O, Glasziou PP, Perera R, Shimbo T, Suwa J, Hiramatsu S, et al. Lipid re-screening: what is the best measure and interval? Heart 2010;96:448-52.
- Weigert AL, Schafer AI. Uremic bleeding: pathogenesis and therapy. Am J Med Sci 1998;316:94-104.
- Berger AK, Duval S, Krumholz HM. Aspirin, beta-blocker, and angiotensin-converting enzyme inhibitor therapy in patients with end-stage renal disease and an acute myocardial infarction. J Am Coll Cardiol 2003;42:201-8.
- Krause MW, Massing M, Kshirsagar A, Rosamond W, Simpson RJ, Jr. Combination therapy improves survival after acute myocardial infarction in the elderly with chronic kidney disease. Ren Fail 2004;26:715-25.
- McCullough PA, Sandberg KR, Borzak S, Hudson MP, Garg M, Manley HJ. Benefits of aspirin and beta-blockade after myocardial infarction in patients with chronic kidney disease. Am Heart J 2002;144:226-32.
- Parikh NI, Hwang SJ, Larson MG, Meigs JB, Levy D, Fox CS. Cardiovascular disease risk factors in chronic kidney disease: overall burden and rates of treatment and control. Arch Intern Med 2006;166:1884-91.
- Basra SS, Tsai P, Lakkis NM. Safety and efficacy of antiplatelet and antithrombotic therapy in acute coronary syndrome patients with chronic kidney disease. J Am Coll Cardiol 2011;58:2263-9.
- Harmon JP, Zimmerman DL, Zimmerman DL. Anticoagulant and antiplatelet therapy in patients with chronic kidney disease: risks versus benefits review. Curr Opin Nephrol Hypertens 2013;22:624-8.
- Jain N, Hedayati SS, Sarode R, Banerjee S, Reilly RF. Antiplatelet therapy in the management of cardiovascular disease in patients with CKD: what is the evidence? Clin J Am Soc Nephrol 2013;8:665-74.
- Palmer SC, Di Micco L, Razavian M, Craig JC, Perkovic V, Pellegrini F, et al. Effects of antiplatelet therapy on mortality and cardiovascular and bleeding outcomes in persons with chronic kidney disease: a systematic review and meta-analysis. Ann Intern Med 2012b;156:445-59.
- Chen JJ, Lin LY, Yang YH, Hwang JJ, Chen PC, Lin JL. Anti-platelet or anti-coagulant agent for the prevention of ischemic stroke in patients with end-stage renal disease and atrial fibrillation: a nation-wide database analyses. Int J Cardiol 2014;177:1008-11.
- Leng WX, Ren JW, Cao J, Cong YL, Cui H, Hu GL, et al. Chronic kidney disease: is it a true risk factor of reduced clopidogrel efficacy in elderly patients with stable coronary artery disease? Thromb Res 2013;131:218-24.
- Lin TH, Lai WT, Hsin HT, Li AH, Wang CL, Kuo CT, et al. Effects of clopidogrel on mortality, cardiovascular and bleeding outcomes in patients with chronic kidney disease - data from Taiwan acute coronary syndrome full spectrum registry. PLoS One 2013;8:e71917.
- Lin L, Wang H, Chen YF, Lin WW, Wang CL, Lin CH. High maintenance dose of clopidogrel in patients with high on-treatment platelet reactivity after a percutaneous coronary intervention: a meta-analysis. Coron Artery Dis 2015;26:386-95.
- Palmer SC, Di Micco L, Razavian M, Craig JC, Perkovic V, Pellegrini F, et al. Antiplatelet agents for chronic kidney disease. Cochrane Database Syst Rev 2013;2:Cd008834.
- Couchoud C, Labeeuw M, Moranne O, Allot V, Esnault V, Frimat L, et al. A clinical score to predict 6-month prognosis in elderly patients starting dialysis for end-stage renal disease. Nephrol Dial Transplant 2009;24:1553-61.
- Kurella Tamura M, Covinsky KE, Chertow GM, Yaffe K, Landefeld CS, McCulloch CE. Functional status of elderly adults before and after initiation of dialysis. N Engl J Med 2009;361:1539-47.